Способ получения 3-гидрокси-3-метилмасляной кислоты из ацетона и ацетил-соа - RU2573389C2
Код документа: RU2573389C2
Чертежи




Описание
Изобретение относится к способу получения 3-гидрокси-3-метилмаслянной кислота (также упоминаемая как бета-гидроксиизовалерат или ГИВ) из ацетона и соединения, которое обеспечивает активированную ацетильную группу, включающему ферментное превращение ацетона и соединения, которое обеспечивает активированную ацетильную группу, в 3-гидрокси-3-метилмаслянную кислоту. Превращение использует фермент, который способен катализировать образование ковалентной связи между атомом углерода оксо-группы (то есть, С=0) ацетона и метильной группой соединения, которое обеспечивает активированную ацетильную группу. Предпочтительно, фермент, используемый в процессе, является ферментом с активностью HMG СоА синтазы (ЕС 2.3.3.10) и/или PksG протеин и/или фермент с активностью лиазы расщепления/конденсации С-С связи, такой как HMG СоА лиаза (ЕС 4.1.3.4). Представленное изобретение также относится к организмам способным продуцировать 3-гидрокси-3-метилмаслянную кислоту из ацетона и соединения, которое обеспечивает активированную ацетильную группу, и использованию вышеупомянутых ферментов и организмов для продуцирования 3-гидрокси-3-метилмаслянной кислоты. В заключение, представленное изобретение относится к использованию ацетона для получения 3-гидрокси-3-метилмаслянной кислоты.
3-Гидрокси-3-метилмаслянная кислота (также упоминаемая как бета-гидроксиизовалерат или ГИВ; смотри Фигуру 1) является метаболитом незаменимой аминокислоты лейцина и синтезируется в организме человека. Она может быть найдена в малых количествах в грейпфруте, люцерне и соме. Известно, что она также встречается при некоторых метаболических расстройствах катаболизма лейцина, то есть гиповалериановая ацидемия. Показано, что 3-гидрокси-3-метилмаслянная кислота может оказывать действие на увеличение мышечной массы и силы (Nissen et al., J. Appl. Physiol. 81 (1996), 2095-2104). Wilson et al. (Nutrition & Metabolism 5 (2008)) предлагает, как механизм действия, следующее:
- повышение сарколеммальной целостности путем превращения HMG СоА рекуктазой
- увеличение синтеза белка посредством mTOR пути
- снижение разрушения белка вследствие ингибирования убиквитинного пути. Предполагается, что 3-гидрокси-3-метилмаслянная кислота содействует сопротивлению мышц расщеплению белка, способствует восстановлению мышц и поддерживает повышение выносливости. Описано, что она помогает пациентам с хроническим обструктивным заболеванием легких в отделениях интенсивной терапии в больницах, с истощением мышц, связанным с ВИЧ и раком, и пострадавшим от травмы с тяжелыми повреждениями. Таким образом, она представляет коммерческий интерес из-за ее применения как мышечного усилителя для бодибилдинга и как лекарственного средства для избегания истощения мышц.
Патент Соединенных Штатов 7026507 описывает процесс изготовления твердых композиций натрия 3-гидрокси-3-метилбутирата, в котором на первой стадии процесса, 4,4-диметилоксетан-2-он подвергают взаимодействию с водным раствором натрия гидроксида для образования раствора натрия 3-гидрокси-3-метилбутирата, и потом, если необходимо, после концентрации раствор используют на следующей стадии процесса синтетического диоксида кремния, на которой полученный в результате продукт, если необходимо, сушат.
Желательно обеспечить процесса получения 3-гидрокси-3-метилбутирата, который не зависел бы от неорганических стадий производства и который мог бы быть осуществлен в живых организмах, в связи с этим, был бы экологически безопасным и недорогим. В этом контексте, Lee и др. (Appl. Environ. Microbiol. 63 (1997), 4191-4195) описывают способ получения 3-гидрокси-3-метилбутирата путем превращения 3-метилмаслянной кислоты в 3-гидрокси-3-метилмаслянную кислоту, используя микроорганизм Galactomyces reessii. Однако, хотя этот процесс позволил получение 3-гидрокси-3-метилбутирата, существует необходимость обеспечить альтернативные эффективные и экономически эффективные пути получения 3-гидрокси-3-метилбутирата, в особенности, посредством биологических процессов.
Представленное изобретение соответствует данному требованию для альтернативного процесса получения 3-гидрокси-3-метилбутирата и предусматривает способ, который основывается на биологических источниках и позволяет получать 3-гидрокси-3-метилбутират in vitro или in vivo в микроорганизме или других видах.
В частности, представленное изобретение относится к способу получения 3-гидрокси-3-метилмаслянной кислоты (также упоминаемой как бета-гидроксиизовалерат или ГИВ) из ацетона и соединения, которое обеспечивает активированную ацетильную группу, включающему ферментное превращение ацетона и соединения, которое обеспечивает активированную ацетильную группу, в 3-гидрокси-3-метилмаслянную кислоту.
Ацетон представляют следующей формулой: СН3-(С=О)-СНз. В предпочтительном варианте осуществления соединение, которое обеспечивает активированную ацетильную группу, изображают следующей формулой (I):
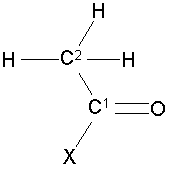
в которой X выбран из группы, состоящей из: S-CH2-CH2-NH-CO-CH2-CH2-NH-CO-CH(OH)-C(CH3)2-CH2-O-PO2H-C10H13N5O7P (кофермент A), S-CH2-CH2-NH-CO-CH2-CH2-NH-CO-CH(OH)-C(CH3)2-CH2-О-PO2H-полипептид (ацильный носитель протеина), S-CH2-CH2-NH-CO-CH2-CH2-NH-CO-CH(OH)-C(CH3)2-СН2-ОН (пантетеин), S-CH2-CH2-NH-CO-CH3 (N-ацетилцистамин), S-CH3 (метантиол), S-CH2-CH(NH2)-CО2H (цистеин), S-CH2-CH2-CH(NH2)-CО2H (гомоцистеин), S-CH2-CH(NH-C5H8N03)-CO-NH-CH2-C02H (глутатион), S-CH2-CH2-SO3H (кофермент М) и ОН (уксусная кислота).
Превращение использует фермент, который способен катализировать образование ковалентной связи между атомом углерода оксо-группы (то есть С=О) ацетона и атомом углерода (С2) соответствующей метильной группы соединения, которое обеспечивает активированную ацетильную группу, в соответствии с формулой (I). В соответствии с данной схемой реакции оксо-группа ацетона реагирует, как электрофил, а метильная группа соединения, которое обеспечивает активированную ацетильную группу в соответствии с формулой (I) реагирует, как нуклеофил. Общая реакция превращения ацетона и соединения, которое обеспечивает активированную ацетильную группу в соответствии с формулой (I), показана на фигуре 5.
Реакция может происходить в одну стадию, то есть 3-гидрокси-3-метилбутират может быть напрямую получен реакцией, катализированной описанным выше ферментом. Альтернативно, реакция может включать две стадии, в особенности в случае, когда используют ацетил СоА как соединение, которое обеспечивает активированную ацетильную группу, в смысле, что сначала получают аддукт 3-гидрокси-3-метилбутирата и соединения, которое обеспечивает активированную ацетильную группу, например, 3-гидрокси-3-метилбутират-СоА, который впоследствии гидролизуют, например, до 3-гидрокси-3-метилбутирата и СоА. Таким образом, в первом альтернативном случае, фермент катализирует полную реакцию как показано на фигуре 5. Во втором альтернативном случае, фермент катализирует образование ковалентной связи между атомом углерода оксо-группы (то есть С=О) ацетона и атомом углерода (С2) соответствующей метильной группы соединения, которое обеспечивает активированную ацетильную группу, но X остается в молекуле. Затем, X удаляют в последствии из молекулы гидролизом. Представленное изобретение впервые демонстрирует, что существует возможность получить 3-гидрокси-3-метилбутират, используя фермент, который может переносить активированную ацетильную группу к ацетону. В уровне техники описывается получение 3-гидрокси-3-метилбутирата из изовалериановой кислоты путем биопревращения, используя грибок Galactomyces reessii. Однако принимая во внимание, что изовалериановую кислоту получают из лейцина путем декарбоксилирования, и что лейцин сам получается при метаболизме из полной конденсации двух молекул пирувата и одной молекулы ацетила СоА, этот процесс получения является энергетически невыгодным. Процесс представленного изобретения лишен этого недостатка. В общем, в контексте представленного изобретения мог бы быть использован какой-либо фермент, который связывает соединение, обеспечивающее активированную ацетильную группу, как определено выше, как один субстрат, а также субстрат, который содержит как компонент группу ацетона. В одном предпочтительном варианте осуществления ферментом является фермент, который связывает ацетил СоА как субстрат.Примерами таких ферментов являются HMG СоА синтаза, HMG СоА лиаза или другие лиазы расщепления/конденсации С-С связи. Однако, как будет также объяснено ниже, ферменты, которые обычно используют в реакции, которую они катализируют в природе, ацетил-донор отличный от ацетила СоА, могут использовать ацетил СоА или ему аналогичный, например, PksG протеин.
В другом предпочтительном варианте осуществления ферментом является фермент, который связывает как субстрат соединение, которое обеспечивает активированную ацетильную группу, в соответствии с формулой (I), в которой X является протеином ацил-носителем, таким как ацетил-S-AcpK протеин, кодированный pksX клатсром генов для продуцирования бациллина в Bacillus subtilis. Примером такого фермента является PksG протеин. PksG протеин является одним из протеинов, кодированных pksX кластером генов из Bacillus subtilis. PksG протеин способен катализировать перенос карбоксиметильной группы -СН2-СО2Н от ацетил-S-AcpK к сложному р-кетотиоэфиру поликетидного промежуточного вещества, соединенного с одним из тиолированных доменов PksL протеина, в реакции, которая аналогична той, что катализирована HMG СоА синтазой. Однако, в контексте представленного изобретения показано, что PksG протеин также может использовать ацетил СоА вместо ацетил-S-AcpK протеина как донора активированной ацетильной группы.
В одном предпочтительном варианте осуществления соединение, которое обеспечивает активированную ацетильную группу, является ацетилом СоА. Ацетил СоА (также известный как ацетил кофермента А) по химической структуре является сложным тиоэфиром кофермента А (тиол) и уксусной кислоты.
В другом предпочтительном варианте осуществления соединение, которое обеспечивает активированную ацетильную группу, имеет формулу (I), в которой X является протеином ацил-носителем, таким как ацетил-S-AcpK протеин, кодированный pksX кластером генов для продуцирования бациллина в Bacillus subtilis.
Предпочтительно, фермент, использованный в процессе, является ферментом с активностью HMG СоА синтазы (ЕС 2.3.3.10) и/или PksG протеином, и/или ферментом с активностью лиазы расщепления/конденсации С-С связи, такой как HMG СоА лиаза (ЕС 4.1.3.4).
В одном предпочтительном варианте осуществления способ в соответствии с представленным изобретением включает ферментное превращение ацетона и ацетил СоА в 3-гидрокси-3-метилбутират с ферментом, который способен катализировать образование ковалентной связи между атомом углерода оксо-группы (то есть С=О) ацетона и атомом углерода С2 ацетил СоА в соответствии с формулой (I).
В предпочтительном варианте осуществления фермент, использованный в процессе в соответствии с изобретением, является ферментом, который имеет активность HMG СоА синтазы (ЕС 2.3.3.10), или ферментом, который имеет активность PksG протеина, или ферментом, который имеет активность лиазы расщепления/конденсации С-С связи, такой как HMG СоА лиаза (ЕС 4.1.3.4).
В частности, в контексте представленного изобретения показано, что HMG СоА синтаза может связывать ацетон вместо обычного ацетоацетил-СоА субстрата, в связи с этим, позволяет превращение ацетил-СоА (или соединения в соответствии с формулой (I)) и ацетона в 3-гидрокси-3-метилбутират.Более того, в контексте представленного изобретения показано, что PksG протеин может использовать ацетил СоА как субстрат вместо Ac-S-AcpK протеина, и может катализировать реакцию, которая обычно катализируется HMG СоА синтазой. Таким образом, предполагается, что также PksG протеин, который катализирует реакцию аналогичную реакции HMG СоА синтазы, будет способен катализировать превращение ацетона и соединения формулы (I) в 3-гидрокси-3-метилбутират.Более того, предполагается, что лиазы расщепления/конденсации С-С связи, такие как HMG СоА лиаза, могут катализировать превращение ацетил-СоА и ацетона в 3-гидрокси-3-метилбутирил-СоА, который, в свою очередь, может быть гидролизован до 3-гидрокси-3-метилбутирата и СоА.
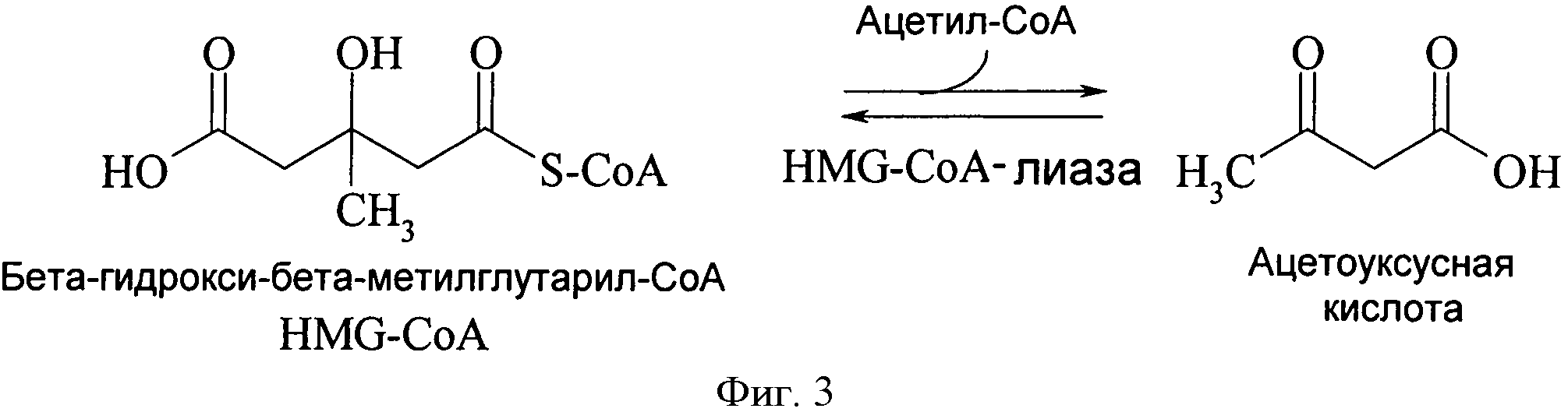
В контексте представленной заявки термин "HMG СоА синтаза" или "протеин/фермент, имеющий активность HMG СоА синтазы" относится к какому-либо ферменту, который классифицируется в ЕС нумерации ЕС 2.3.3.10 (ранее, HMG-CoA синтаза классифицировалась как ЕС 4.1.3.5, но была переведена в ЕС 2.3.3.10), в частности, он относится к какому-либо ферменту, который способен катализировать реакцию, в которой ацетил-СоА конденсируется с ацетоацетил-СоА, чтобы образовать 3-гидрокси-3-метилглутарил-СоА (HMG-СоА) (смотри фигуру 2) и термин также относится к какому-либо ферменту, который получен из такой HMG СоА синтазы и, которая способна катализировать превращение ацетона и соединения, которое обеспечивает активированную ацетильную группу, как определено выше, предпочтительно ацетил СоА, в 3-гидрокси-3-метилбутират.
Ферментная активность конденсирующей ацетил-СоА с ацетоацетил-СоА для образования 3-гидрокси-3-метилглутарил-СоА (HMG-CoA) может быть измерена способом, хорошо известным с уровня техники. Одно возможное и предпочтительно используемое исследование описано, например, в Clinkenbeard et al. (J. Biol. Chem. 250 (1975), 3108-3116). В этом исследовании активность синтазы HMG-CoA измеряют путем мониторинга понижения абсорбции при 303 нм, которое сопровождает исчезновение ацетил-СоА-зависимой енолятной формы ацетоацетил-СоА. Прпедпочтительно активность HMG СоА синтазы исследовали как описано в примнрн 3.
HMG СоА синтаза является частью мевалонатного пути. Два пути определены для синтеза изопентилпирофосфата (IПФ), то есть мевалонатный путь и глицеральдегид 3-фосфат-пируватный путь. HMG СоА синтаза катализирует биологическую конденсацию Кляйзена (Claisen) ацетил-СоА с ацетоацетил-СоА и является представимелем суперсемейства ацил-конденсирующих ферментов, которое включает бета-кетотиолазы, синтазы жирных кислот (синтаза протеина бета-кетоацильного носителя) и синтазы поликетида. HMG СоА синтаза описана для различных организмов. К тому же, доступны аминокислотные последовательности и последовательности нуклеиновых кислот, кодирующие HMG СоА синтазы, из многочисленных источников. Обычно, последовательности совместно используют только небольшую степень из полной идентичности последовательностей. Например, ферменты из Staphylococcus или Streptococcus демонстрируют только около 20% идентичности к тем, что у человека и птичьей HMG СоА синтазе. В некоторых источниках описано, что бактериальные HMG СоА синтазы и их животные аналоги демонстрируют только около 10% всеобщей идентичности последовательностей (Sutherlin et al., J. Bacteriol. 184 (2002), 4065-4070). Однако, аминокислотные остатки, участвующие в реакциях ацетилирования и конденсации, сохраняются среди бактериальных и эукариотических HMG СоА синтаз (Campobasso et al., J. Biol. Chem. 279 (2004), 44883-44888). Определяли трехмерную структуру ферментов HMG СоА синтазы, и ключевые аминокислоты для ферментной реакции, в принципе, являются хорошо описанными (Campobasso et al., loc. cit.; Chun et al., J. Biol.Chem. 275 (2000), 17946-17953; Nagegowda et al., Biochem. J. 383 (2004), 517-527; Hegardt, Biochem. J. 338 (1999), 569-582). У эукариотов существует две формы HMG СоА синтазы, то есть цитозольная и митохондральная форма. Цитозольная форма играет ключевую роль в продуцировании холестерина и других изопреноидов, и митохондральная форма вовлечена в продуцирование кетоновых тел.
В принцепе, какой-либо фермент HMG СоА синтазы может быть использован в контексте представленного изобретения, в частности из прокариотических или эукариотических организмов.
Описаны прокариотические HMG СоА синтазы, например, из Staphylococcus aureus (Campobasso et al., loc. cit.; Uniprot номер доступа Q9FD87), Staphylococcus epidermidis (Uniprot номер доступа Q9FD76), Staphylococcus haemolyticus (Uniprot номер доступа Q9FD82), Enterococcus faecalis (Sutherlin et al., loc. cit.; Unirprot номер доступа Q9FD7), Enterococcus faecium (Uniprot номер доступа Q9FD66), Streptococcus pneumonia (Uniprot номер доступа Q9FD56), Streptococcus pyogenes (Uniprot номер доступа Q9FD61) и Methanobacterium thermoautotrophicum (номер доступа AE000857), Borrelia burgdorferi (NCBI номер доступа BB0683).
Более того, в следующей таблице А перечислено некоторые известные HMG СоА синтазы от прокариотов:
Описаны эукариотические HMG СоА синтазы, например, из грибов, таких как Schizosaccharomyces pombe (номера доступа U32187 и Р54874), Saccharomyces cerevisiae (номер доступа Р54839), растений, таких как резуховидная таля (Arabidopsis thaliana) (номера доступа Х83882 и Р54873), сосна обыкновенная (Pinus sylvestris) (номер доступа Х96386) и животных, таких как Caenorhabditis elegans (номер доступа Р54871), домовая мышь (Mus musculus) (митохондральная; номер доступа Р54869 и Hegardt, Biochem. J. 338 (1999), 569-582), серая крыса (Rattus norvegicus) (митохондральная: номер доступа Р22791 и Hegardt, Biochem. J. 338 (1999); цитозольная: номер доступа Р17425), 569-582), китайский хомячок (Chinese hamster) (Cricetulus griseus: номер доступа Р13704), домашняя свинья (Sus scrofa) (митохондральная; номер доступа U90884 и Hegardt, Biochem. J. 338 (1999), 569-582), человек разумный {Homo sapiens) (митохондральная: номер доступа Р54868 и Hegardt, Biochem. J. 338 (1999), 569-582; цитозольная: номер доступа Q01581), рыжий таракан (Blattella germanica) (цитозольная форма 1; номер доступа Р54961), рыжий таракан (Blattella germanica) (цитозольная форма 2; номер доступа Р54870) и банкивская джунглевая курица (Gallus gallus) (цитозольная; номер доступа Р23228).
Примеры HMG СоА синтаз из различных организмов даны в SEQ ID NO: 1 до 14. SEQ ID NO: 1 показывает последовательность цитоплазматической HMG СоА синтазы Caenorhabditis elegans (Р54871, банк генов F25B4.6), SEQ ID NO: 2 показывает последовательность цитоплазматической HMG СоА синтазы of Schizosaccharomyces pombe (делящиеся дрожжи; Р54874), SEQ ID NO: 3 показывает последовательность цитоплазматической HMG СоА синтазы Saccharomyces cerevisiae (пекарские дрожжи; Р54839, банк генов САА65437.1), SEQ ID NO: 4 показывает последовательность цитоплазматической HMG СоА синтазы резуховидной тали (Arabidopsis thaliana) (кресс «мышиное-ухо»; Р54873), SEQ ID NO: 5 показывает последовательность цитоплазматической HMG СоА синтаза Dictyostelium discoideum (слизевой гриб; Р54872, банк генов L2114), SEQ ID NO: 6 показывает последовательность цитоплазматической HMG СоА синтаза Blattella germanica (рыжий таракан; Р54961, банк генов Х73679), SEQ ID NO: 7 показывает последовательность цитоплазматической HMG СоА синтазы Gallus gallus (курица; Р23228, банк генов CHKHMGCOAS), SEQ ID NO: 8 показывает последовательность цитоплазматической HMG СоА синтазы Homo sapiens (человек; Q01581, банк генов Х66435), SEQ ID NO: 9 показывает последовательность митохондральной HMG СоА синтазы Homo sapiens (человек; Р54868, банк генов Х83618), SEQ ID NO: 10 показывает последовательность митохондральной HMG СоА синтазы Dictyostelium discoideum (слизевой гриб; Q86HL5, банк генов ХМ_638984), SEQ ID NO: 11 показывает последовательность HMG СоА синтазы Staphylococcus epidermidis (Q9FD76), SEQ ID NO: 12 показывает последовательность HMG СоА синтазы Lactobacillus fermentum (B2GBL1), SEQ ID NO: 13 показывает последовательность HMG СоА синтазы Hyperthermus butylicus (A2BMY8), SEQ ID NO: 14 показывает последовательность HMG СоА синтазы Chloroflexus aggregans (B8G795), SEQ ID NO: 24 показывает последовательность HMG СоА синтазы Lactobacillus delbrueckii (Q1GAH5) и SEQ ID NO: 25 показывает последовательность HMG СоА синтазы Staphylococcus haemolyticus Q4L958 (I98>V различие по сравнению с протеином дикого типа).
В предпочтительном варианте осуществления представленного изобретения HMG СоА синтаза является ферментом, содержащем аминокислотную последовательность, выбранную из группы, которая состоит из SEQ ID NO: от 1 до 14 или последовательность, которая является, по меньшей мере, на п % идентичной к какой-либо из SEQ ID NO: от 1 до 14 и, которая имеет активность HMG СоА синтазы с n, которое является целым числом между 10 и 100, предпочтительно 10, 15, 20, 25, 30, 35, 40, 45, 50, 55, 60, 65, 70, 75, 80, 85, 90, 91, 92, 93, 94, 95, 96, 97, 98 или 99.
Предпочтительно, степень идентичности определяют сравнением соответствующей последовательности с аминокислотной прследовательностью какой-либо одной из вышеупомянутых SEQ ID NO. Когда последовательности, которые сравнивают, не имеют одинаковую длину, степень идентичности, предпочтительно, или относится к процентному содержанию аминокислотных остатков в более короткой последовательности, которая является идентичной аминокислотным остаткам в более длинной последовательности, или к процентному содержанию аминокислотных остатков в более длинной последовательности, которая является идентичной аминокислотным остаткам в более короткой последовательности. Степень идентичности последовательности может быть определена в соответствии со способами, хорошо известными с уровня техники, используя, предпочтительно, приемлемые компьютерные алгоритмы, такой как CLUSTAL. Когда, используя способ анализу Clustal для определения одной конкретной последовательности из двух является, например, на 80% идентичной контрольной последовательности, параметры, установленные по умолчанию могут быть использованы или исходные параметры являются предпочтительно следующими: матрица: blosum 30; открытый штраф за пропуск в последовательности: 10,0; штраф за продолжение делеции: 0,05; дивергентное запаздывание: 40; пространственная изоляция разрыва: 8 для сравнений аминокислотных последовательностей. Для сравнений нуклеотидных последовательностей штраф за продолжение делеции предпочтительно составляет до 5,0.
Предпочтительно, степень идентичности рассчитывают сверх полной длины последовательности.
HMG СоА синтаза, использованная в прцессе в соответствии с изобретением, может быть встечающейся в природе HMG СоА синтазой или она может быть HMG СоА синтазой, которую получают из встречающейся в природе HMG СоА синтазы, например, введением мутаций или других альтераций которые, например, изменяют или улучшают ферментную активность, стабильность, и т.д.
Термин "HMG СоА синтаза" или "протеин/фермент, имеющий активность HMG СоА синтазы" в контексте представленной заявки также охватывает ферменты, которые получают из HMG СоА синтазы, которая способна к продуцированию 3-гидрокси-3-метилбутирата путем ферментного превращения ацетона и соединения, которое обеспечивает активированную ацетильную группу, как определено выше, предпочтительно ацетил-СоА, но, который только имеет низкую аффинность к ацетоацетил-СоА, как субстрату, или делает уже не приемлемым ацетоацетил-СоА, как субстрат.Такая модификация предпочтительного субстрата HMG СоА синтазы позволяет улучшить превращение ацетона в 3-гидрокси-3-метилбутират и понизить продуцирование побочного продукта, например, HMG-CoA. Способы модифицирования и/или улучшения ожидаемых ферментных активностей протеинов хорошо известны квалифицированному специалисту с уровня техники и включает, например, неспецифический мутагенез или сайт-направленный мутагенез, и является результатом отбора ферментов, имеющих ожидаемые свойства или подходы так-называемого "направленного развития".
Например, для генной инженерии в прокариотических клетках, молекула нуклеиновой кислоты, кодирующая HMG СоА синтазу, может быть введена в плазмиды, которые разрешают мутагенез или модификацию последовательности рекомбинацией последовательностей ДНК. Стандартные способы (смотри Sambrook and Russell (2001), Molecular Cloning: A Laboratory Manual, CSH Press, Cold Spring Harbor, NY, USA) позволяют основные обмены, для осуществления или природных, или синтетических последовательностей, которые будут добавлены. ДНК фрагменты могут быть связаны друг с другом путем использования адаптеров и линкеров к фрагментам. Более того, могут быть использованы инженерно-технические мероприятия, которые обеспечивают приемлемые сайты рестрикции или удаление остатка ДНК или сайтов рестрикции. В тех случаях, в которых внедрения, удаления или замещения являются возможными, могут быть использованы in vitro мутагенез, "первичная репарация", рестрикция или сшивание. В основном, анализ последовательности, анализ рестрикции и другие способы биохимии и молекулярной биологии выполняются как способы анализа. Полученные в результате варианты HMG СоА синтазы далее исследуют на их ферментную активность и, в частности, на их способность предпочитать как субстрат ацетон, больше чем ацетоацетил-СоА. Исследование для измерения способности HMG СоА синтазы для использования ацетона как субстрата описано в примере 5. Образование 3-гидрокси-3-метилбутирата может быть обнаружено путем сравнения со стандартным соединением, например, после разделения тонкослойной хроматографией, ЖХ/МС и колориметрическим анализом после его дериватизации или масс-спектрометрией.
В частности, реакция происходит в реакционной смеси, содержащей 40 мМ Трис-HCI рН 8, от 5 до 50 мМ ацетил-СоА, от 100 до 500 мМ ацетона, 1 MgCI2 (за исключением митохондрия HMG-CoA синтазы), 0,5 мМ DTT и фермент, варирующий в диапазоне от 0,2 до 8 мг/мл. Контрольные реакции проводили в отсутствии фермента и одного из субстратов.
Прохождение синтеза сопровождается анализом аликвот, взятых после увеличения периода инкубации при 30 или 37°C. Как правило, аликвоту 50 мкл отбирают после 48 часов инкубации, нагревают в течение 1 минуты при 100°C, чтобы удалить протеины, центрифугируют и супернатант переносят в чистую виалу для определения ГИВ посредством масс-спектрометрии. Раствор 3-гидрокси-3-метилбутирата получают в 40 мМ Трис-HCI рН 8, 1 мМ MgCI2, 0,5 мМ DTT, нагревают, как описано выше, и используют как стандартный образец.
Образцы анализируют на РЕ SCIEX API 2000 тройном квадрупольном масс-спектрометре в режиме отрицательных ионов с раствором Н20/ацетонитрил=60/40, содержащей 0,1% триэтиламина в качестве подвижной фазы, скорость потока составляла 40 мкл/мин. 10 мкл каждого супернатанта смешивают с равным количеством подвижной фазы и напрямую впрыскивают в массспектрометр. Контролируют присутствие [3-гидрокси-3-метилбутират-Н]" иона. Синтез 3-гидрокси-3-метилбутирата также могут проводить в присутствии меченного радиоизотопом [2-14С] ацетона. Образование продукта анализируют после разделения реакционной смеси путем ТСХ или ВЭЖХ.
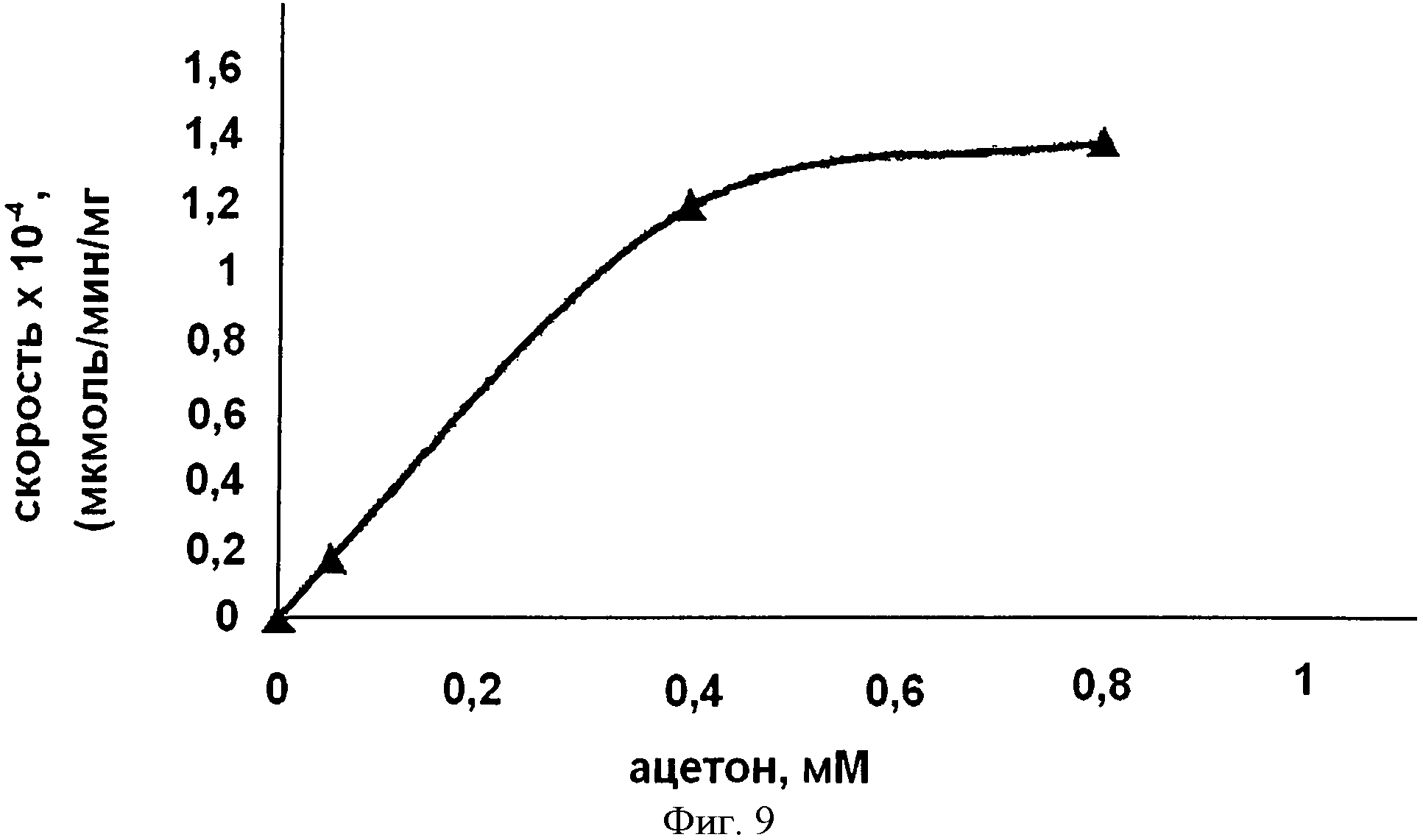
В предпочтительном вариант осуществления HMG СоА синтаза, использованная в представленном изобретении, является ферментом, которая имеет Км значение для ацетона 300 мМ или ниже, предпочтительно 250 мМ или ниже, даже более предпочтительно 200 мМ или ниже и особенно предпочтительно 150 мМ или ниже. Предпочтительно Км значение определяют при условиях, описанных в примере 7. В другом предпочтительном варианте осуществления HMG СоА синтаза, использованная в представленном изобретение, имеет kcat значение для описанной реакции, по меньшей мере, 0,1×10-4 сек-1, предпочтительно, по меньшей мере, 0,2×10-4 сек-1, даже более предпочтительно, по меньшей мере, 0,5×10-4 сек-1 и особенно предпочтительно, по меньшей мере, 1×10-4 сек-1, по меньшей мере, 2×10-4 сек-1, по меньшей мере, 3×10-4 сек-1 или, по меньшей мере, 5×10-4 сек-1. Предпочтительно, kcat значение определяют при условиях, описанных в примере 7.
С уровня техники известно, что His264 птичей HMG СоА синтазы играет роль во взаимодействии фермента с ацетоацетил-СоА и, что Ala264 разновидность испытывает недостаток взаимодействия с кислородом остатка сложного тиоэфира ацетоацетил-СоА (Misraa et al., Biochem. 35 (1996), 9610-9616). Таким образом, в целях разработки вариантов предположим, что HMG СоА синтаза, которая демонстрирует более низкую восприимчивость ацетоацетил-СоА как субстрата, но которая принимает ацетон как субстрат, систематически мутирует в HMG СоА синтазу гистидинового остатка, который соответствует His264 птичьей HMG СоА синтазы, описанной в Misraa et al. (цит.месте), для того чтобы уменьшить или блокировать восприятие ацетоацетил-СоА как субстрата. В дополнение, варианты HMG СоА синтазы могут предусматривать те, которые демонстрируют повышенную активность. Steussy et al. (Biochemistry 45 (2006), 14407-14414), например, описали мутанта Enterococcus faecalis HMG СоА синтазы, в котором А1а110 изменился до Gly110 и, который демонстрирует повышение 140-изгибов всей скорости реакции.
Способы определения вариантов с улучшенными ферментными свойствами, поскольку это касается получения 3-гидрокси-3-метилбутирата, также могут осуществлять в присутствии кофактора, который позволяет стерическую и/или электронную комплементацию в каталитическом сайте ферменте/ферментов вследствие того, что субстратный ацетон короче, чем природный субстратный ацетоацетил-СоА HMG СоА синтазы. Одним примером такого кофактора был бы кофермент А или структурно близкородственная молекула, такая как S-нитрозо-СоА.
Модифицированная версия HMG СоА синтазы, воспринимающая ацетон как субстрат, но, имеющая низкую аффинность к ацетоацетил-СоА как субстрату или не длинее, воспринимающей ацетоацетил-СоА как субстрат, может быть получен из встречающейся в природе HMG СоА синтазы или из уже модифицированной, оптимизированной или синтетически синтезированной HMG СоА синтазы.
Другим примером протеина, который может быть использован в способе в соответствии с изобретением, является PksG протеин. В контексте представленной заявки термин "PksG протеин" или "протеин/фермент, имеющий активность PksG протеина" относится к какому-либо ферменту, который способен катализировать реакцию, которая в природе катализируется посредством PksG протеина, то есть перенос -СН2СОО- от ацетил-S-AcpK (Ас-S-AcpK) до сложного р-кетотиоэфирного поликетидного промежуточного соединения, присоединенного к одному из тиолированных доменов PksL протеина. Это - реакция, которая является аналогичной к той, что катализирована HMG СоА синтазой с тем отличием, что ацетил-сложный тиоэфир фосфопантетеильного остатка присоединяется к протеину-носителю вместо того, чтобы к части кофермента А. Хотя PksG протеин в реакции, которую он катализирует в природе, переносит ацетильную группу от ацетил-S-АсрК к акцептору, в контексте представленного изобретения показано, что PksG протеин, кроме того, может осуществлять реакцию, которая обычно катализируется HMG СоА синтазой, то есть синтез HMG СоА, начинающийся с ацетоацетила СоА и ацетила СоА (смотри пример 3, в котором в таблице 1 показано, что фермент из Mycobacterium marinum (B2HGT6) может действовать на ацетоацетил СоА и ацетил СоА).
Ферментная активность PksG протеина может быть измерена способами, известными с уровня техники. Одно возможное и предпочтительно использованное исследование описано, например, в Calderone et al. (Proc. Natl. Acad. Sci. USA 103 (2006), 8977-8982). В этом иисследовании ацетоацетил (Acac)-S-PksL-T2 используют как модельный субстракт и инкубируют вместе с Ac-S-AcpK и PksG протеином. Образование HMG-S-PksL-T2 демонстрирует, что PksG протеин способен переносить карбоксиметильную группу -СН2-CO2H от Ac-S-AcpK к (Acac)-S-PksL-T2. Образование HMG-S-PksL-T2 может быть определено или путем электроспрей ионизации (ESI)-FTMS или путем авторадиографии. В предпочтительном варианте осуществления соответствующие исследования выполняют, как описано на странице 8982 Calderone et al. (Proc. Natl. Acad. Sci. USA 103 (2006), 8977-8982). PksG протеин является частью pksX пути в Bacillus subtilis, который кодирует ферменты, несущие ответственность за биосинтез бациллина (Butcher et al., Proc. Natl. Acad. Sci. USA 104 (2007), 1506-1509). Кодированными протеинами являются AcpK, PksC, PksL, PksF, PksG, PksH и Pksl. В соответствии с Calderone et al. (Proc. Natl. Acad. Sci. USA 103 (2006), 8977-8982) эти ферменты действуют, чтобы ввести ацетатное производное р-метильной ветки на ацетоацетил-8-носитель протеина.
В предпочтительном варианте осуществления представленного изобретения PksG протеин является ферментос, содержащим аминокислотную последовательность, как показано в SEQ ID NO: 15 или 16, или последовательность, которая является, по меньшей мере, на п % идентичной к SEQ ID NO: 15 или 16 и, имеющая активность PksG протеина с п, которое является целым числом между 10 и 100, предпочтительно 10, 15, 20, 25, 30, 35, 40, 45, 50, 55, 60, 65, 70, 75, 80, 85, 90, 91, 92, 93, 94, 95, 96, 97, 98 или 99. SEQ ID NO: 15 показывает аминокислотную последовательность PksG протеина Bacillus subtilis (Р40830) и SEQ ID NO: 16 показывает аминокислотную последовательность PksG протеина Mycobacterium marinum (B2HGT6).
Поскольку это касается определения степени идентичности последовательности, то используется такое же, как изложено выше применительно к HMG СоА синтазе.
PksG протеин, использованный в процессе в соответствии с изобретением, может быть встречающимся в природе PksG протеином или он может быть PksG протеином, который получают из встречающегося в природе PksG протеина, например, путем введения мутаций или других альтераций, которые, например, изменяют или улучшают ферментную активность, стабильность и т.д.
Термин "PksG протеин" или "протеин/фермент, имеющий активность PksG протеина" в контексте представленной заявки, кроме того, предусматривает феременты, которые получены из PksG протеина, который способен продуцировать 3-гидрокси-3-метилбутират путем ферментного превращения ацетона и соединения, которое обеспечивает активированную ацетильную группу, как определено выше, предпочтительно ацетил-СоА, но который имеет только низкую аффинность к их природному субстрату или делает больше не восприимчивым к их природному субстрату. Такая модификация предпочтительного субстрата PksG потеина позволяет улучшить превращение ацетона в 3-гидрокси-3-метилбутират и понизить выход нежелательных побочных продуктов. Способы модификации и/или улучшения желаемых ферментных активностей протеинов хорошо известны квалифицированному специалисту с уровня техники и описаны выше. Полученные в результате варианты PksG протеина далее исследовали на их ферментную активность и в особенности на их способность отдавать предпочтение ацетону как субстрату. Исследование измерения способности PksG протеина использовать ацетон как субстрат описано в примере 5 для HMG-CoA синтазы. Образование 3-гидрокси-3-метилбутирата может быть обнаружено, как описано выше. Такие способы идентификации вариантов с улучшенными ферментными свойствами с точки зрения получения 3-гидрокси-3-метилбутирата могут также быть осуществлены в присутствии кофактора, который позволяет стерическую и/или электронную комплементацию в каталитическом сайте фермента/ферментов в связи с тем фактом, что субстрат ацетона короче чем природный субстрат PksG протеина.
Модифицированная версия PksG протеина, воспринимающая ацетон как субстрат, но имеющая низкую аффинность к или не длинее, природно воспринимающего субстрата, может быть получена из встречающегося в природе PksG протеина или из уже модифицированного, оптимизированного или синтетически синтезированного PksG протеина.
В контексте представленного изобретения термин "лиаза расщепления/конденсации С-С связи" или "протеин/фермент, имеющий активность лиазы расщепления/конденсации С-С связи" относится к ферменту, который способен к расщеплению или образованию путем конденсации С-С связи и который содержит так называемый TIM (триозофосфат изомераза) цилиндровый домен. Этот TIM цилиндровый домен находят в ряде пируват связанных ферментов и ацетил-СоА зависимых ферментах (Forouhar et al. J. Biol. Chem. 281 (2006), 7533-7545). TIM цилиндровый домен имеет классификационную линию дифференцировки 3.20.20.150 в САТН классификационной базе данных протеинов (www.cathdb.info/cathnode/3.20.20.150). Термин "лиазы расщепления/конденсации С-С связи", в частности, включает ферменты, которые классифицируют как синтазу изопропилмалата (ЕС 2.3.3.13), как синтазу гомоцитрата (ЕС 2.3.3.14) или как альдолазу 4-гидрокси-2-кетовалерата (ЕС 4.1.3.39). Синтаза изопропилмалата катализирует следующую реакцию: ацетил-СоА+3-метил-2-оксобутаноат+H2O↔(2S)-2-изопропилмалат+СоА. Примерами таких ферментов являются соответствующий фермент из Brucella abortus (штамм 2308; Q2YRT1) и соответствующий фермент из Hahella chejuensis (штамм КСТС 2396; Q2SFA7).
Синтаза гомоцитрата (ЕС 2.3.3.14) является ферментом, который катализирует химическую реакцию ацетил-СоА+H2O+2-оксоглутарат↔(R)-2-
гидроксибутан-1,2,4-трикарбоксилат+СоА. Альдолаза 4-гидрокси-2-кетовалерата катализирует химическую реакцию 4-гидрокси-2↔оксопентаноат ацетальдегид+пируват.
В контексте представленного изобретения термин "HMG СоА лиаза" или "протеин/фермент, имеющий активность HMG СоА лиазы" относится к какому либо ферменту, который классифицирован в ЕС под номером ЕС 4.1.3.4, в частности, он относится к какому-либо ферменту, который способен катализировать расщепление HMG СоА до ацетила СоА и ацетоацетата (смотри фигуру 3) или противоположное направление этой реакции, то есть получение HMG СоА путем конденсации ацетил СоА и ацетоацетата, и термин, кроме того, относится к какому-либо ферменту, который получают из такой HMG СоА лиазы и который способен катализировать превращение ацетона и соединения, обеспечивающего активированную ацетильную группу, как определено выше, предпочтительно ацетил СоА, в 3-гидрокси-3-метилбутирил-СоА. В контексте представленного изобретения полученный 3-гидрокси-3-метилбутирил-СоА далее может быть гидролизован, чтобы получить 3-гидрокси-3-метилбутират.Это могло быть достигнуто мероприятиями, известными квалифицированному специалисту с уровня техники, например, путем использования ацил-СоА гидролазы (ЕС 3.1.2.20) или ацил-СоА трансферазы (ЕС 2.8.3.8).
Ферментная активность HMG СоА лиазы может быть измерена способами, хорошо известными с уровня техники. Описано одно возможное исследование, например, у Mellanby et al. (Methods of Enzymatic Analysis; Bergmeyer Ed. (1963), 454-458). В частности, ферментную активность измеряют путем спектрофотометрического исследования, используя NADH-зависимое восстановление ацетоацетата посредством 3-гидроксибутират дегидрогеназы. Предпочтительно активность HMG СоА лиазы исследуют, как описано в примере 4. В таком исследовании реакционная смесь (1 мл) содержит 40 мМ Трис-HCI рН 8, 1 мМ MgCI2, 0,5 мМ DTT, 0,4 мМ HMG-CoA, 0,2 мМ NADH, 5 единиц 3-гидроксибутират дегидрогеназы и инкубируют в течение 5 мин, перед тем как добавить 0,005 мг/мл HMG-CoA лиазы и затем мониторили протекание реакции посредством понижения абсорбции при 340 нм.
Реакция, которую катализирует HMG СоА лиаза, описана в некоторых примерах и требует присутствие двувалентного катиона, такого как Mg2+ или Mg2+. Таким образом, преимущественно, что исследование по определению активности HMG СоА лиазы включает такие двувалентные катионы и, что способ в соответствии с изобретением получения 3-гидрокси-3-метилмаслянной кислоты, если он использует HMG СоА лиазу, осуществляют в присутствии таких катионов.
HMG СоА лиаза является частью кетогенеза печени. Она катализирует терминальную реакцию в кетогенезе печени, которая является ключевой стадией этого пути. Реакция также является важной стадией в лейциновом катаболизме.
HMG СоА лиаза описана для различных организмов. Аминокислотные последовательности и последовательности нуклеиновых кислот, кодирующие HMG СоА лиазы, являются доступными с многочисленных источников. Как правило, последовательности только совместно используют промежуточную степень идентичности всей последовательности. Например, ферменты из Bacillus subtilis или Brucella melitensis демонстрируют только около 45% идентичности к той HMG СоА лиазе, что у человека (Forouhar et al., J. Biol. Chem. 281 (2006), 7533-7545). Определяют трехмерную структуру различных ферментов HMG СоА лиазы, и ключевые аминокислоты для ферментной реакции являются, в принципе, хорошо охарактеризованными (Forouhar et al., цит.место; Fu et al., J. Biol. Chem. 281 (2006), 7526-7532). В эукариотах HMG СоА лиаза расположена в митохондральной матрице.
В принципе, какой-либо фермент HMG СоА лиазы может быть использован в контексте представленного изобретения, в частности, из прокариотических или эукариотических организмов.
Описаны прокариотические HMG СоА лиазы, например, из Brucella abortus (UniProt номера доступа Q2YPL0 и B2S7S2), Bacillus subtilis (UniProt номер доступа 034873), Bacillus licheniformis (Fu et al., цит.месте), Pseudomonas syringae (UniProt номера доступа Q4ZTL2 и Q4ZRW6), Pseudomonas mevalonii (UniProt номер доступа P13703), Shewanella piezotolerans (UniProt номер доступа B8CRY9), Cellvibrio japonicus (UniProt номер доступа B3PCQ7), Azotobacter vinelandii (UniProt номера доступа C1DJK8 и C1DL53), Herminiimonas arsenicoxydans (UniProt номер доступа A4G1F2) и Burkholderia cenocepacia (UniProt номер доступа A2VUW7).
Кроме того, в следующей Таблице В перчислены некоторые известные HMG СоА лиазы из прокариотов:
Описаны эукариотические HMG СоА лиазы, например, из растений, таких как редис (Raphanus sativus) и кукуруза обыкновенная (номер доступа B6U7B9, банк генов ACG45252) и животных, таких как человек (Homo sapiens; UniProt номер доступа Р35914), макак-крабоед (UniProt номер доступа Q8XZ6), суматранский орангутанг (Pongo abelii; UniProt номер доступа Q5R9E1), крыса (Rattus norvegicus; UniProt номер доступа Р97519; Fu et al., цит.месте), домовая мышь (UniProt номер доступа Р38060), утка (Anas spec), крупный рогатый скот (Bos taurus; UniProt номер доступа Q29448), коза (Capra hircus), голубь (Columba livia), курица (Gallus gallus; UniProt номер доступа Р35915), овца (Ovis aries), свинья (Sus scrofa), Данио-рерио (брахиданио-рерио (Brachydanio rerio); A8WG57, банк генов ВС154587) и из простейших Tetrahymena pyriformis. Примеры HMG СоА лиаз из различных организмов представлены в SEQ ID NO: от 17 до 23. SEQ ID NO: 17 показывает последовательность HMG СоА лиазы кукурузы обыкновенной (номер доступа B6U7B9, банк генов ACG45252), SEQ ID NO: 18 показывает последовательность HMG СоА лиазы Данио-рерио (Brachydanio rerio; A8WG57, банк генов ВС154587), SEQ ID NO: 19 показывает последовательность HMG СоА лиазы коровы (Uniprot номер доступа Q29448) и SEQ ID NO: 20 показывает последовательность HMG СоА лиазы Homo sapiens (митохондральная, Uniprot номер доступа Р35914, банк генов HUMHYMEGLA), SEQ ID NO: 21 показывает последовательность HMG СоА лиазы Pseudomonas putida (Q88H25), SEQ ID NO: 22 показывает последовательность HMG СоА лиазы Acinetobacter baumannii (B7H4C6) и SEQ ID NO: 23 показывает последовательность HMG СоА лиазы Thermus thermophilus (Q72IH0). В предпочтительном варианте осуществления представленного изобретения HMG СоА лиаза является ферментом, содержащим аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: с 17 по 23 или последовательности, которая является, по меньшей мере, на п % идентичной к какой-либо из SEQ ID NO: с 17 по 23 и имеющей активность HMG СоА лиазы с п, которая является целым числом между 10 и 100, предпочтительно 10, 15, 20, 25, 30, 35, 40, 45, 50, 55, 60, 65, 70, 75, 80, 85, 90, 91, 92, 93, 94, 95, 96, 97, 98 или 99.
Поскольку это касается определения степени идентичности последовательности, то используется такое же, как изложено выше применительно к HMG СоА синтазе.
HMG СоА лиаза, использованная в процессе в соответствии с изобретением, может быть втсречающейся в природе HMG СоА лиазой, или она может быть HMG СоА лиазой, которая получена из встречающейся в природе HMG СоА лиазы, например, путем введения мутаций или других альтераций, которые, например, изменяют или улучшают ферментную активность, стабильность и Т-Д-
Термин "HMG СоА лиаза" или "протеин/фермент, имеющий активность HMG СоА лиазы" в контексте представленной заявки, кроме того, предусматривает ферменты, которые получают из HMG СоА лиазы, которые способны продуцировать 3-гидрокси-3-метилбутирил-СоА путем конденсации ацетона и соединения, которое обеспечивает активированную ацетильную группу, как определено выше, предпочтительно ацетил-СоА, но который только имеет низкую аффинность к ацетоацетату, как субстрату, или не длинее, воспринимающей ацетоацетат, как субстрат.Такая модификация предпочтительного субстрата HMG СоА лиазы позволяет улучшить преврвщение ацетона в 3-гидрокси-3-метилбутирил-СоА и понизить продуцирование побочного продукта HMG-CoA. Способы модифицирования и/или улучшения желательных ферментных активностей протеинов хорошо известны квалифицированному специалисту с уровня техники и описаны выше. Способность представленного фермента катализировать продуцирование 3-гидрокси-3-метилбутирил-СоА может быть определена в исследовании, как описано в примере 6.
Модифицированная версия HMG СоА лиазы, воспринимающая ацетон, как субстрат, но имеющая низкую аффинность к ацетоацетату, как субстрату, или не длинее воспринимающей ацетоацетат, как субстрат, может быть получена из встречающейся в природе HMG СоА лиазы или из уже модифицированной, оптимизированной или синтетически синтезированной HMG СоА лиазы.
В процессе в соответствии с изобретением, возможно, использовать только один фермент, как определено выше, например, только HMG СоА синтазу или только HMG СоА лиазу, или только PksG протеин. Однако, конечно, также возможно использовать более чем одну активность, то есть различные ферменты, в частности, какую-либо комбинацию HMG СоА синтазы и HMG СоА лиазы, и PksG протеина. Например, в случае способа in vitro, больше чем одна активность фермента может быть добавлена к реакционной смеси, или одновременно, или последовательно в каком либо возможном порядке. В способе in vivo, в котором используются организмы, в частности, микроорганизмы, является, например, возможным использовать организм, в частности, микроорганизм, экспрессирующий фермент, как определено выше. Однако, кроме того, предполагается использовать организм/микроорганизм, экспрессирующий какую-либо возможную комбинацию из вышеупомянутых ферментов. Более того, также является возможным использовать смесь из двух или более типов организмов/микроорганизмов с одним типом, экспрессирующим один фермент и другим, экспрессирующим другой фермент.Эти различные типы далее могут быть совмесно культивированными.
Фермент, например, HMG СоА синтаза, и/или PksG протеин, и/или лиаза расщепления/конденсации С-С связи, такая как HMG СоА лиаза, использованная в процессе в соответствии с представленным изобретением, может быть природным вариантом протеина или синтетическим протеином, а также протеином, который химически синтезирован или получен в биологической системе или рекомбинантными процессами. Фермент, например, HMG СоА синтаза и/или PksG протеин и/или лиаза расщепления/конденсации С-С связи, такая как HMG СоА лиаза, кроме того, могут быть химически модифицированными, например, с целью улучшения его/их стабильности, устойчивости, например, к температуре, для облегчения его/их очистки или его иммобилизации на подложку. Фермент/ферменты могут использовать в выделенной форме, очищенной форме, иммобилизированной форме, как сырой или частично очищенный экстракт, полученный из клеток, синтезирующих фермент/ферменты, как химически синтезированный(е) фермент(ы), как рекомбинантно полученный(е) фермент(ы), в форме микроорганизмов, продуцирующих их, т.д.
Процесс в соответствии с представленным изобретением может быть осуществлен in vitro или in vivo. Подразумевается, что реакцией in vitro является реакция, в которой клетки не используются, то есть бесклеточная реакция. Для проведения процесса in vitro субстраты для реакции и фермент/ферменты инкубируют при условиях (буфер, температура, кофакторы и т.д.), которые позволяют ферменту/ферментам быть активными и осуществить ферментное превращение. Реакция может продолжаться в течение времени достаточно для получения 3-гидрокси-3-метилбутирата. Продуцирование 3-гидрокси-3-метилбутирата и/или 3-гидрокси-3-метилбутирил-СоА может быть обнаружено путем сравнения со стандартным соединением после разделения тонкослойной хроматографией, ЖХ/МС и колориметрическим анализом после его дериватизации.
Фермент/ферменты могут быть в какой-либо приемлемой форме, прозволяющей прохождение ферментной реакции. Он/они могут быть очищенными или частично очищенными, или в форме сырых клеточных экстрактов, или частично очищенных экстрактов. Кроме того, является возможным, что фермент/ферменты иммобилизируют на приемлемый носитель.
Так как субстрат ацетона, как правило, короче, чем природный субстрат, используемый ферментом, например, ацетоацетил-СоА/ацетоацетат, используемый HMG СоА синтазой и HMG СоА лиазой, соответственно, то может быть полезно добавлять в его реакционную смесь кофактор, который предусматривает стерическую и/или электронную комплементацию в каталитическом сайте фермента/ферментов. Одним примером такого кофактора, в случае HMG СоА синтазы, был бы кофермент А или структурно близко родственная молекула, такая как S-нитрозо-СоА.
Для проведения процесса in vivo используют приемлемый(е) организм/микроорганизм(ы), которые способны предоставлять субстраты, то есть ацетон и соединение, которое обеспечивает активированную ацетильную группу, как определено выше, и фермент, который способен катализировать образование ковалентной связи между атомом углерода оксо-группы (то есть С=O) ацетона и атомом углерода (С2) соответствующей метильной группы соединения, которое обеспечивает активированную ацетильную группу. В предпочтительном варианте осуществления упомянутым ферментом является HMG СоА синтаза, и/или PksG протеин, и/или лиаза расщепления/конденсации С-С связи, такая как HMG СоА лиаза.
Таким образом, в случае этого варианта осуществления в соответствии с изобретением способ характеризуется тем, что превращение ацетона и соединения, которое обеспечивает активированную ацетильную группу, осуществляют в присутствии организма, предпочтительно микроорганизма способного продуцировать ацетон и экспрессировать фермент, который способен образовывать ковалентную связь между атомом углерода оксо-группы (то есть С=O) ацетона и атомом углерода (С2) соответствующей метильной группы соединения, которое обеспечивает активированную ацетильную группу, предпочтительно экспрессирующий фермент с активностью HMG СоА синтазы (ЕС 2.3.3.10), и/или экспрессирующий PksG протеин, и/или экспрессирующий фермент с активностью лиазы расщепления/конденсации С-С связи, такой как HMG СоА лиаза (ЕС 4.1.3.4).
Термин "который способен продуцировать ацетон" в контексте представленного изобретения означает, что организм/микроорганизм имеет способность продуцировать ацетон в клетке благодаря присутствию ферментов, обеспечивающие ферментные активности, позволяющие продуцирование ацетона из метаболических предшественников.
Ацетон продуцируется определенными микроорганизмами, такими как Clostridium acetobutylicum, Clostridium beijerinckii, Clostridium cellulolyticum, Bacillus polymyxa и Pseudomonas putida. Синтез ацетона наилучше охарактеризован в Clostridium acetobutylicum. Он начинается с реакции (стадия 1 реакции), в которой две молекулы ацетил-СоА конденсируются в ацетоацетил-СоА. Эта реакция катализируется ацетил-СоА ацетилтрансферазой (ЕС 2.3.1.9). Ацетоацетил-СоА затем превращают в ацетоацетат реакцией с уксусной кислотой или масляной кислотой, приводящей в результате, кроме того, к продуцированию ацетил-СоА или бутирил-СоА (стадия 2 реакции). Эта реакция катализируется, например, ацетоацетилСоА трансферазой (ЕС 2.8.3.8). АцетоацетилСоА трансфераза известна из различных организмов, например, из Е. coli, в котором она кодируется atoAD геном, или из Clostridium acetobutylicum, в котором она кодируется ctfAB геном. Однако, также другие ферменты могут катализировать эту реакцию, например, 3-оксокислота СоА трансферазы (ЕС 2.8.3.5) или сукцинат СоА лигазы (ЕС 6.2.1.5).
В конечном счете, ацетоацетат превращают в ацетон на стадии декарбоксилирования (стадия 3 реакции), которая катализируется ацетоацетат декарбоксилазой (ЕС 4.1.1.4).
Описанные выше стадии 1 и 2 реакции, и ферменты, катализирующие их, не охарактеризованы для синтеза ацетона и могут быть найдены в различных организмах. Напротив, стадия 3 реакции, которая катализируется ацетоацетат декарбоксилазой (ЕС 4.1.1.4), обнаружена только в тех организмах, которые способны продуцировать ацетон.
В одном предпочтительном варианте осуществления организм, использованный в способе в соответствии с изобретением, является организмом, предпочтительно микроорганизмом, который в природе имеет способность продуцировать ацетон. Таким образом, предпочтительно микроорганизм принадлежит к роду Clostridium, Bacillus или Pseudomonas, более предпочтительно к виду Clostridium acetobutylicum, Clostridium beijerinckii, Clostridium cellulolyticum, Bacillus polymyxa или Pseudomonas putida.
В следующем предпочтительном варианте осуществления организм, использованный в способе в соответствии с изобретением, является организмом, предпочтительно микроорганизмом, который в природе имеет способность продуцировать ацетон, и который является рекомбинантным в том смысле, что он, кроме того, является генетически модифицированным, таким образом, чтобы экспрессировать фермент, как описано выше. Термин "рекомбинантный" в одном варианте осуществления означает, что организм генетически модифицирован таким образом, чтобы содержать молекулу чужеродной нуклеиновой кислоты, кодирующей фермент, как определено выше. В предпочтительном варианте осуществления организм генетически модифицирован таким образом, чтобы содержать молекулу чужеродной нуклеиновой кислоты, кодирующей фермент, как определено выше, например, HMG СоА синтаза, лиаза расщепления/конденсации С-С связи, такая как HMG СоА лиаза, или. PksG протеин, или последовательность чужеродной нуклеиновой кислоты, кодирующая какую-либо возможную комбинацию таких протеинов. Термин "чужеродная" в этом контексте означает, что молекула нуклеиновой кислоты в природе не встречается в упомянутом организме/микроорганизме. Это означает, что она не встречается в такой же структуре или в том же местоположении в организме/микроорганизме. В одном предпочтительном варианте осуществления молекула чужеродной нуклеиновой кислоты является рекомбинантной молекулой, содержащей промотор и кодирующую последовательность, которая кодирует соответствующий фермент, например, HMG СоА синтазу и/или лиазу расщепления/конденсации С-С связи, такую как HMG СоА лиаза, и/или PksG протеин, в котором промотор движущий экспрессией кодирующей последовательности является гетерологичным в отношении кодирующей последовательностью. Гетерологичный в этом контексте означает, что промотор не является по природе промотором, движущим экспрессию упомянутой кодирующей последовательности, но является по природе промотором, движущим экспрессию отличающейся кодирующей последовательности, то есть ее получают от другого гена, или является синтетическим промотором, или химерным промотором. Предпочтительно, промотором является промотор гетерологичный к организму/микроорганизму, то есть промотор, который не встречается в природе в соответствующем организме/микроорганизме. Еще более предпочтительно, промотором является индуцированный промотор. Промотори для передачи экспрессии в разных типах организмов, в частности микроорганизмов, хорошо известны квалифицированному специалисту с уровня техники.
В другом предпочтительном варианте осуществления молекула нуклеиновой кислоты является чужеродной к организму/микроорганизму, в котором кодированный(е) фермент(ы), например, HMG СоА синтаза и/или кодированная лиаза расщепления/конденсации С-С связи, такая как HMG СоА лиаза, и/или PksG протеин, не является эндогенной к организму/микроорганизму, то есть не является экспрессированной в природе организмом/микроорганизмом, когда он не является генетически модифицированным. Другими словами, кодированная HMG СоА синтаза, и/или кодированная лиаза расщепления/конденсации С-С связи, такая как HMG СоА лиаза, и/или PksG протеин является гетерологичным по отношению к организму/микроорганизму.
Термин "рекомбинантный" в другом варианте осуществления означает, что организм генетически модифицирован в регуляторной области, контролирующей экспрессию фермента, как определено выше, которая встречается в природе в организме, таким образом, что приводит к возрастанию экспрессии соответствующего фермента по сравнению с негенно модифицированным организмом. Значение термина высокой "повышенной экспрессии" описано также ниже.
Такая модификация регуляторной области может быть достигнута способами, известными квалифицированному специалисту с уровня техники. Одним примером является замена встречающегося в природе промотора на промотор, который обеспечивает повышенную экспрессию или модифицирует втречающийся в природе промотор таким образом, чтобы показать повышенную экспрессию. Таким образом, в этом варианте осуществления организм содержит в регуляторной области гена, кодирующего фермент, как определено выше, молекулу чужеродной нуклеиновой кислоты, которая в природе не встречается в организме и которая приводик к повышенной экспрессии фермента по сравнению с соответствующим негенетически модифицированным организмом.
Молекула чужеродной нуклеиновой кислоты может присутствовать в организме/микроорганизме в экстрахромосомальной форме, например, как плазмид, или стабильно интегрированная в хромосому. Стабильная интеграция является предпочтительной.
В следующем предпочтительном варианте осуществления организм/микроорганизм характеризуется как такой, в котором экспрессия/активность фермента, как определено выше, например, HMG СоА синтаза и/или лиаза расщепления/конденсации С-С связи, такая как HMG СоА лиаза, и/или PksG протеин, повышена в организме/микроорганизме, генетически модифицированном молекулой чужеродной нуклеиновой кислоты, по сравнению с соответстующим негенетически модифицированным организмом/микроорганизмом. "Повышенная" экспрессия/активность означает, что экспрессия/активность фермента, в частности HMG СоА синтазы и/или лиазы расщепления/конденсации С-С связи, такой как HMG СоА лиазы, и/или PksG протеина, в генетически модифицированном микроорганизме является, по меньшей мере, на 10%, предпочтительно, по меньшей мере, на 20%, более предпочтительно, по меньшей мере, на 30% или 50%, еще более предпочтительно, по меньшей мере, на 70% или 80% и особенно предпочтительно, по меньшей мере, на 90% или 100% выше, чем в соответствующем негенетически модифицированном организме/микроорганизме. В еще более предпочтительном варианте осуществления возрастание экспрессии/активности может быть, по меньшей мере, на 150%, по меньшей мере, на 200% или, по меньшей мере, на 500%. В особенно предпочтительном варианте осуществления экспрессия является, по меньшей мере, в 10 раз, более предпочтительно, по меньшей мере, в 100 раз и еще более предпочтительно, по меньшей мере, в 1000 раз выше, чем у соответствующего негенетически модифицированного организма/микроорганизма.
Термин "повышенная" экспрессия/активность также предусматривает ситуацию, в которой соответствующий негенетически модифицированный организм/микроорганизм не экспрессирует соответствующий фермент, например, HMG СоА синтазу и/или лиазу расщепления/конденсации С-С связи, такую как HMG СоА лиаза, и/или PksG протеин, так, что соответствующая экспрессия/активность в негенетически модифицированном организме/микроорганизме равняется нулю.
Способы измерения уровня экспрессии предоставленного протеина в клетке хорошо известны квалифицированному специалисту с уровня техники. В одном варианте осуществления измерение уровня экспрессии выполняют измерением количества соответствующего протеина. Соответствующие способы хорошо известны квалифицированному специалисту с уровня техники и включают вестерн-блоттинг, ELISA и т.д. В другом варианте осуществления измерение уровня экспрессии выполняют измерением количества соответствующей РНК. Соответствующие способы хорошо известны квалифицированному специалисту с уровня техники и включают, например, нозерн-блоттинг.Способы измерения ферментной активности вышеупомянутых ферментов, в частности, HMG СоА синтазы и/или лиазы расщепления/конденсации С-С связи, такой как HMG СоА лиазы, и/или PksG протеина, соответственно, хорошо известны квалифицированному специалисту с уровня техники и уже описаны выше.
В другом предпочтительном варианте осуществления, организм, использованный в способе в соответствии с изобретением, является генетически модифицированным организмом, предпочтительно микроорганизмом, полученным из организма/микроорганизма, который в природе не продуцирует ацетон, но который генетически модифицируют так, чтобы продуцировать ацетон, то есть путем введения гена(ов) необходимых для разрешения продуцирования ацетона в организме/микроорганизме. В принципе любой микроорганизм может быть генетически модифицированным таким способом. Ферменты ответственные за синтез ацетона описаны выше. Гены, кодирующие соответствующие ферменты, хорошо известны с уровня техники и могут быть использованы для генетического модифицирования предоставленного микроорганизма, для того чтобы продуцировать ацетон. Как описано выше стадии 1 и 2 реакции синтеза ацетона происходят в природе в большинстве организмов. Однако, стадия 3 реакции является характерной и ключевой для синтеза ацетона. Таким образом, в предпочтительном варианте осуществления генетически модифицированный организм/микроорганизм, полученный из организма/микроорганизма, который в природе не продуцирует ацетон, является модифицированным, так, чтобы содержать нуклеотидную последовательность, кодирующую фермент, который катализирует превращение ацетоацетата в ацетон путем декарбоксилирования, например, ацетоацетат-декарбоксилаза (ЕС 4.1.1.4). Нуклеотидные последовательности из различных организмов, кодирующие этот фермент известны с уровня техники, например, adc ген из Clostridium acetobutylicum (Uniprot номера доступа Р23670 и Р23673), Clostridium beijerinckii (Clostridium MP; Q9RPK1), Clostridium pasteurianum (Uniprot номер доступа P81336), Bradyrhizobium sp.(штамм ВТАИ / ATCC BAA-1182; Uniprot номер доступа A5EBU7), Burkholderia mallei (ATCC 10399 A9LBS0), Burkholderia mallei (Uniprot номер доступа АЗМАЕЗ), Burkholderia mallei FMH A5XJB2, Burkholderia cenocepacia (Uniprot номер доступа A0B471), Burkholderia ambifaria (Uniprot номер доступа Q0b5P1), Burkholderia phytofirmans (Uniprot номер доступа B2T319), Burkholderia spec. (Uniprot номер доступа Q38ZU0), Clostridium botulinum (Uniprot номер доступа B2TLN8), Ralstonia pickettii (Uniprot номер доступа B2UIG7), Streptomyces nogalater (Uniprot номер доступа Q9EYI7), Streptomyces avermitilis (Uniprot номер доступа Q82NF4), Legionella pneumophila (Uniprot номер доступа Q5ZXQ9), Lactobacillus salivarius (Uniprot номер доступа Q1WVG5), Rhodococcus spec. (Uniprot номер доступа Q0S7W4), Lactobacillus plantarum (Uniprot номер доступа Q890G0), Rhizobium leguminosarum (Uniprot номер доступа Q1M911), Lactobacillus casei (Uniprot номер доступа Q03B66), Francisella tularensis (Uniprot номер доступа Q0BLC9), Saccharopolyspora erythreae (Uniprot номер доступа A4FKR9), Korarchaeum cryptofilum (Uniprot номер доступа B1L3N6), Bacillus amyloliquefaciens (Uniprot номер доступа A7Z8K8), Cochliobolus heterostrophus (Uniprot номер доступа Q8NJQ3), Sulfolobus islandicus (Uniprot номер доступа C3ML22) и Francisella tularensis subsp.holarctica (штамм OSU18).
Более предпочтительно организм, преимущественно микроорганизм, является генетически модифицированным для того, чтобы трансформировать молекулу нуклеиновой кислоты, кодирующую фермент, способный катализировать упомянутую выше стадию 2 реакции синтеза ацетона, то есть превращение ацетоацетила СоА в ацетоацетат.
Еще более предпочтительно, организм, преимущественно микроорганизм, является генетически модифицированным для того, чтобы трансформировать молекулу нуклеиновой кислоты, кодирующую фермент, способный катализировать упомянутую выше стадию 1 реакции синтеза ацетона, то есть конденсацию двух молекул ацетила СоА в ацетоацетил СоА. В особенно предпочтительном варианте осуществления организм/микроорганизм является генетически модифицированным для того, чтобы трансформировать молекулу нуклеиновой кислоты, кодирующую фермент, способный катализировать упомянутую выше стадию 1 реакции синтеза ацетона и молекулу нуклеиновой кислоты, кодирующую фермент, способный катализировать упомянутую выше стадию 2 реакции синтеза ацетона или молекулу нуклеиновой кислоты, кодирующую фермент, способный катализировать упомянутую выше стадию 1 реакции синтеза ацетона и молекулу нуклеиновой кислоты, кодирующую фермент, способный катализировать упомянутую выше стадию 3 реакции синтеза ацетона или молекулу нуклеиновой кислоты, кодирующую фермент, способный катализировать упомянутую выше стадию 2 реакции синтеза ацетона и молекулу нуклеиновой кислоты, кодирующую фермент, способный катализировать упомянутую выше стадию 3 реакции синтеза ацетона или молекулу нуклеиновой кислоты, кодирующую фермент, способный катализировать упомянутую выше стадию 1 реакции синтеза ацетона и молекулу нуклеиновой кислоты, кодирующую фермент, способный катализировать упомянутую выше стадию 2 реакции синтеза ацетона и молекулау нуклеиновой кислоты, кодирующую фермент, способный катализировать упомянутую выше стадию 3 реакции синтеза ацетона. Способы получения упомянутого выше генетически модифицированного организма, преимущественно микроорганизмы, хорошо известны с уровня техники. Таким образом, как правило, организм/микроорганизм трансформируют ДНК конструкцией, разрешающей экспрессию соответствующего гена в микроорганизме. Такую конструкцию обычно содержит кодирующая последовательность, о которой идет речь, связанная с регуляторными последовательностями, що позволяет транскрипцию и трансляцию в соответствующей клетке-хозяине, например, промотор и/ген-усилитель, и/или терминатор транскрипции, и/или рибосомосвязывающие сайты и т.д. Уровень техники еще описывает микроорганизмы, которые генетически модифицированы для того, чтобы быть способными продуцировать ацетон. В частности, гены от, например, Clostridium acetobutylicum, вводили в Е. coli, таким образом, позволяя синтез ацетона в Е. coli, бактерии, которая в природе не продуцирует ацетон (Bermejo et al., Appl. Environ. Microbiol. 64 (1998); 1079-1085; Hanai et al., Appl. Environ. Microbiol. 73 (2007), 7814-7818). В частности Hanai и др. (цит.месте) показывает, что достаточным является введение последовательности нуклеиновой кислоты, кодирующей ацетоацетат декарбоксилазу (такую как та, что из Clostridium acetobutylicum) для того, чтобы достичь продуцирование ацетона в Е. coli, свидетельствующее, что эндогенные ферменты в Е. coli, которые катализируют вышеупомянутые стадии 1 и 2 реакции (то есть продукты экспрессии Е. coli atoB и atoAD генов), являются достаточными для того, чтобы обеспечить субстрат для продуцирования ацетона.
В особенно предпочтительном варианте осуществления организм, преимущественно микроорганизм, использованный в способе в соответствии с изобретением, является рекомбинантным организмом/микроорганизмом, полученным из организма/микроорганизма, который в природе не продуцирует ацетон, но который генетически модифицирован, как описано выше, для того, чтобы продуцировать ацетон, и который экспрессирует фермент, который способен катализировать образование ковалентной связи между атомом углерода оксо-группы (то есть С=O) ацетона и атомом углерода (С2) соответствующей метильной группы соединения, которое обеспечивает активированную ацетильную группу, как описано выше. Термин '"рекомбинантный" в этом контексте преимущественно означает, что организм является рекомбинантным в смысле, что дальше его генетически модифицировали для того, чтобы экспрессировать фермент, как определено выше. Термин "рекомбинантный" в одном варианте осуществления означает, что организм генетически модифицирован для того, чтобы содержать молекулу чужеродной нуклеиновой кислоты, кодирующую фермент, как определено выше, например, HMG СоА синтаза или лиаза расщепления/конденсации С-С связи, такая как HMG СоА лиаза, или PksG протеин, или молекула чужеродной нуклеиновой кислоты, кодирующая какую-либо возможную комбинацию определенных выше ферментов.
Что касается определения термина "молекула чужеродной нуклеиновой кислоты", то применяют то же самое, что уже изложено выше.
Термин "рекомбинантный" в другом варианте осуществления означает, что организм является генетически модифицированным в регуляторной области, контролирующей экспрессию фермента, как определено выше, который в природе встречается в организме, так, чтобы привести к возрастанию экспрессии соответствующего фермента по сравнению с соответствующим негенетически модифицированным организмом. Значение термина высокая "повышенная экспрессия" описано также ниже.
Такая модификация регуляторной области может быть достигнута способами известными квалифицированному специалисту с уровня техники. Одним примером является замена промотора, который встречается в природе, на промотор, который позволит повышенную экспрессию, или модифицирование встречающегося в природе промотора так, чтобы продемонстрировать повышенную экспрессию. Таким образом, в этом варианте осуществления организм содержит в регуляторной области гена, кодирующий фермент, как определено выше, молекулу чужеродной нуклеиновой кислоты, которая в природе не встречается в организме, и которая приводит к повышенной экспрессии фермента по сравнению с соответствующим негенетически модифицированным организмом.
Предпочтительно, такой организм/микроорганизм характеризуется тем, что экспрессия/активность упомянутого фермента, например, HMG СоА синтазы и/или лиазы расщепления/конденсации С-С связи, такой как HMG СоА лиаза, и/или PksG протеина, выше в рекомбинантном организме/микроорганизме по сравнению с соответствующим негенетически модифицированным организмом/микроорганизмом. "Повышенная" экспрессия/активность означает, что экспрессия/активность фермента, например, HMG СоА синтазы и/или лиазы расщепления/конденсации С-С связи, такой как HMG СоА лиаза, и/или PksG протеина, в генетически модифицированном организме/микроорганизме является, по меньшей мере, на 10%, предпочтительно, по меньшей мере, на 20%, более предпочтительно, по меньшей мере, на 30% или 50%, еще более предпочтительно, по меньшей мере, на 70% или 80% и особенно предпочтительно, по меньшей мере, на 90% или 100% выше, чем в соответствующем негенетически модифицированном организме/микроорганизме. В еще более предпочтительном варианте осуществления возрастание экспрессии/активности может быть, по меньшей мере, на 150%, по меньшей мере, на 200% или, по меньшей мере, на 500%. В особенно предпочтительном варианте осуществления экспрессия является, по меньшей мере, в 10 раз, более предпочтительно, по меньшей мере, в 100 раз и еще более предпочтительно, по меньшей мере, в 1000 раз выше, чем в соответствующем негенетически модифицированном организме/микроорганизме.
Термин "повышенная" экспрессия/активность также предусматривает ситуацию, в которой соответствующий негенетически модифицированный организм/микроорганизм не экспрессирует упомянутый фермент, например, HMG СоА синтазу и/или лиазу расщепления/конденсации С-С связи, такую как HMG СоА лиаза, и/или PksG протеин, так, что соответствующая экспрессия/активность в негенетически модифицированном организме/микроорганизме равняется нулю.
Что касается способов измерения уровня экспрессии или активности, то применяют те же самые, которые уже изложены выше.
Термин "организм", как использовано в контексте представленного изобретения, относится, как правило, к какому-либо возможному типу организма, в частности, эукариотическим организмам, прокариотическим организмам и архибактериям. Термин включает животные, растения, грибы, бактерии и архибактерии. Термин, кроме того, включает изолированные клетки или клетки-агрегаты таких организмов, подобные тканям или мозолям. В одном предпочтительном варианте осуществления организм является микроорганизмом. Термин "микроорганизм" в контексте представленного изобретения относится к прокариотическим клеткам, в частности, бактериям, а также грибам, таким как дрожжевидные грибы, и также водорослям и архибактериям. В одном предпочтительном варианте осуществления микроорганизм является бактерией. В принципе может быть использована какая-либо бактерия. Предпочтительной бактерией, которая используется в процессе в соответствии с изобретением, является бактерия рода Bacillus, Clostridium, Pseudomonas или Escherichia. В особенно предпочтительном варианте осуществления бактерия принадлежит к роду Escherichia и еще более предпочтительном к виду Escherichia coli.
В другом предпочтительном варианте осуществления микроорганизмом является гриб, более предпочтительно гриб рода Saccharomyces, Schizosaccharomyces, Aspergillus или Trichoderma и еще более предпочтительно вида Saccharomyces cerevisiae, Schizosaccharomyces pombe, Aspergillus nigermvt вида Trichoderma reesei.
В еще другом предпочтительном варианте осуществления микроорганизмом является фотосинтетически активный микроорганизм, такой как бактерии, которые способны выполнять фотосинтез, или микроводоросли.
В особенно предпочтительном варианте осуществления микроорганизмом является водоросль, более предпочтительно водоросли, принадлежащие к diatomeae.
Если микроорганизм используется в контексте способа представленного изобретения, то, кроме того, является возможным осуществить способ в соответствии с изобретением, до известной степени, в котором используют две разновидности микроорганизмов, то есть одна разновидность, которая продуцирует ацетон, и одна разновидность, которая использует ацетон, продуцированный первой разновидностью микроорганизмов, чтобы превратить его с помощью фермента как определено выше в данном документе.
Когда процесс в соответствии с изобретением осуществляют in vivo путем использования микроорганизмов, которые обеспечивают соответствующую ферментную активность/активности, микроорганизмы культивируют в приемлемых для культуры условиях, позволяющих осуществление ферментной(ых) реакции(й). Специфические для культуры условия зависят от особенности использованного микроорганизма, но хорошо известны квалифицированному специалисту с уровня техники. Условия для культуры, как правило, выбирают таким способом, что они разрешают экспрессию генов, кодирующих ферменты для соответствующих реакций. Различные способы известны квалифицированному специалисту с уровня техники для того, чтобы улучшить и точно подобрать экспрессию определенных генов на определенных стадиях культуры, такие как введение экспрессии гена с помощью химического индуктора или путем сдвига температуры.
В другом предпочтительном варианте осуществления организм, использованный в способе в соответствии с изобретением, является организмом, который способен к фотосинтезу, таким как растение или микроводоросли. В принципе, может быть использовано какое-либо возможное растение, то есть однодольное растение или двудольное растение. Предпочтительным является использование растения, которое может быть вырощено в сельскохозяйственно-значимых масштабах, и которое позволит продуцировать большие количества биомассы. Примерами являются травы, такие как плевел, зерновые культуры, такие как рожь, ячмень, овес, просо, кукуруза, другие крахмал запасающие растения, такие как картофель, или сахар запасающие растения, такие как сахарный тросник или сахарная свекла. Возможным является также использование табака или овощных растений, таких как помидор, перец, огурец, баклажан и т.д. Другой возможностью является использование масло запасающих растений, таких как рапсовое семя, маслина и т.д. Кроме того, является возможным использование деревьев, в частности, быстро растущих деревьев, таких как эвкалипт, тополь или каучуковое дерево (Hevea brasiliensis).
Представленное изобретение также относится к организму, предпочтительно микроорганизму, который характеризуется следующими особенностями:
(a) он способен продуцировать ацетон; и
(b) он экспрессирует фермент, который способен катализировать образование ковалентной связи между атомом углерода оксо-группы (то есть С=O) ацетона и атомом углерода (С2) соответствующей метильной группы соединения, которое обеспечивает активированную ацетильную группу, как определено выше, предпочтительно, фермент с активностью HMG СоА синтазы (ЕС 2.3.3.10), и/или фермент с активностью лиазы расщепления/конденсации С-С связи, такой как HMG СоА лиаза (ЕС 4.1.3.4), и/или PksG протеин.
Что касается источника, природы, свойств, последовательности и т.д. фермента, в частности, HMG СоА синтазы, лиазы расщепления/конденсации С-С связи, такой как HMG СоА лиаза, и/или PksG протеина, экспрессированного в организме в соответствии с изобретением, применяют те же самые, которые уже изложены выше в связи со способом в соответствии с изобретением.
В одном предпочтительном варианте осуществления организм в соответствии с изобретением является организмом, предпочтительно микроорганизмом, который в природе имеет способность продуцировать ацетон, то есть, характерная черта (а) упомянутая выше является характерной чертой, которую организм, преимущественно микроорганизм, демонстрирует в природе. Таким образом, предпочтительно организм является микроорганизмом, который принадлежит роду Clostridium, Bacillus или Pseudomonas, более предпочтительно к виду Clostridium acetobutylicum, Clostridium beijerinckii, Clostridium cellulolyticum, Bacillus polymyxa или Pseudomonas putida.
В другом предпочтительном вариант осуществления, организм, преимущественно микроорганизм, в соответствии с изобретением является генетически модифицированным организмом/микроорганизмом, полученным из организма/микроорганизма, который в природе не продуцирует ацетон, но который генетически модифицированным таким образом, чтобы продуцтровать ацетон, то есть путем введения гена(ов) необходимых для разрешения продуцирования ацетона в организме/микроорганизме. В принципе какой-либо организм/микроорганизм может быть генетически модифицированным таким способом. Ферменты ответственные за синтез ацетона описаны выше. Гены, кодирующие соответствующие ферменты, известны с уровня техники и могут быть использованы для генетического модифицирования предоставленного организма, предпочтительно микроорганизма, таким образом, чтобы продуцировать ацетон.
В предпочтительном варианте осуществления, генетически модифицированный организм/микроорганизм, полученный из организма/микроорганизма, который в природе не продуцирует ацетон, модифицируют, таким образом, чтобы содержать нуклеотидную последовательность, кодирующую фермент, который катализирует превращение ацетоацетата в ацетон путем декарбоксилирования, например, ацетоацетат декарбоксилазой (ЕС 4.1.1.4). Нуклеотидные последовательности из различных организмов, кодирующие этот фермент, известны с уровня техники, например, adc ген из Clostridium acetobutylicum.
Более предпочтительно, организм/микроорганизм является генетически модифицированным таким образом, чтобы быть трансформированным молекулой нуклеиновой кислоты, кодирующей фермент, способный катализировать упомянутую выше стадию 2 реакции синтеза ацетона, то есть превращение ацетоацетила СоА в ацетоацетат.
Еще более предпочтительно, организм/микроорганизм является генетически модифицированным таким образом, чтобы быть трансформированным молекулой нуклеиновой кислоты, кодирующей фермент, способный катализировать упомянутую выше стадию 1 реакции синтеза ацетона, то есть конденсацию двух молекул ацетил-СоА в ацетоацетил СоА.
В особенно предпочтительном варианте осуществления организм/микроорганизм является генетически модифицированным таким образом, чтобы быть трансформированным молекулой нуклеиновой кислоты, кодирующей фермент, способный катализировать упомянутую выше стадию 1 реакции синтеза ацетона, и молекулой нуклеиновой кислоты, кодирующей фермент, способный катализировать упомянутую выше стадию 2 реакции синтеза ацетона, или молекулой нуклеиновой кислоты, кодирующей фермент, способный катализировать упомянутую выше стадию 1 реакции синтеза ацетона, и молекулой нуклеиновой кислоты, кодирующей фермент, способный катализировать упомянутую выше стадию 3 реакции синтеза ацетона, или молекулой нуклеиновой кислоты, кодирующей фермент, способный катализировать упомянутую выше стадию 2 реакции синтеза ацетона, и молекулой нуклеиновой кислоты, кодирующей фермент, способный катализировать упомянутую выше стадию 3 реакции синтеза ацетона, или молекулой нуклеиновой кислоты, кодирующей фермент, способный катализировать упомянутую выше стадию 1 реакции синтеза ацетона, и молекулой нуклеиновой кислоты, кодирующей фермент, способный катализировать упомянутую выше стадию 2 реакции синтеза ацетона, и молекулой нуклеиновой кислоты, кодирующей фермент, способный катализировать упомянутую выше стадию 3 реакции синтеза ацетона. Способы получения упомянутых выше генетически модифицированных организмов/микроорганизмов хорошо известны с уровня техники. Таким образом, как правило, организм/микроорганизм трансформируют ДНК конструкциями, разрешающими экспрессию соответствующего фермента в организм/микроорганизм. Такая конструкция обычно содержит кодирующую последовательность, до известной степени, связанную с регуляторными последовательностями, позволяющими транскрипцию и трансляцию в соответствующей клетке-хозяине, например, промотор и/ген-усилитель, и/или терминатор транскрипции, и/или рибосомосвязывающие сайты и т.д. В уровне техники уже описаны организмы, в частности, микроорганизмы, которые были генетически модифицированными, таким образом, чтобы быть способными продуцировать ацетон. В частности, гены из, например, Clostridium acetobutylicum вводили в Е. coli, таким образом, разрешая синтез ацетона в Е. coli, бактерии, которая в природе не продуцирует ацетон (Bermejo et al., Appl. Environ. Microbiol. 64 (1998); 1079-1085; Hanai et al., Appl. Environ. Microbiol. 73 (2007), 7814-7818). В частности Hanai и др. (цит.месте) показывает, что достаточным является введение последовательности нуклеиновой кислоты, кодирующей ацетоацетат декарбоксилазу (такую как та, что из Clostridium acetobutylicum) для того, чтобы достичь продуцирование ацетона в Е. coli, свидетельствующее, что эндогенные ферменты в Е. coli, которые катализируют вышеупомянутые стадии 1 и 2 реакции (то есть продукты экспрессии Е. coli atoB и atoAD генов), являются достаточными для того, чтобы обеспечить субстрат для продуцирования ацетона.
В следующем предпочтительном варианте осуществления организм, предпочтительно микроорганизм, в соответствии с изобретением является генетически модифицированным таким образом, чтобы экспрессировать фермент, который способен катализировать образование ковалентной связи между атомом углерода оксо-группы (то есть С=O) ацетона и атомом углерода (С2) соответствующей метильной группы соединения, которое обеспечивает активированную ацетильную группу. В этом контексте, термин "рекомбинантный" означает в первом аспекте, что организм содержит молекулу чужеродной нуклеиновой кислоты, кодирующей фермент, который способен катализировать образование ковалентной связи между атомом углерода оксо-группы (то есть С=O) ацетона и атомом углерода (С2) соответствующей метильной группы соединения, которое обеспечивает активированную ацетильную группу, предпочтительно молекулу чужеродной нуклеиновой кислоты, кодирующей HMG СоА синтазу, или молекулу чужеродной нуклеиновой кислоты, кодирующую лиазу расщепления/конденсации С-С связи, такую как HMG СоА лиаза, или молекулу чужеродной нуклеиновой кислоты, кодирующую PksG протеин, или молекулу чужеродной нуклеиновой кислоты, кодирующую какую-либо возможную комбинацию ферментов, которые имеют вышеупомянутое свойство. Термин "чужеродный" в этом контексте означает, что молекула нуклеиновой кислоты в природе не встречается в упомянутом организме/микроорганизме. Это означает, что она не встречается в такой же структуре или в том же местоположении в организме/микроорганизме. В одном предпочтительном варианте осуществления, молекула чужеродной нуклеиновой кислоты является рекомбинантной молекулой, содержащей промотор и кодирующую последовательность, которая кодирует упомянутый фермент, например, HMG СоА синтазу и/илди лиазу расщепления/конденсации С-С связи, такую как HMG СоА лиаза, и/или PksG протеин, в котором промотор движущий экспрессией кодирующей последовательности является гетерологичным по отношению к кодирующей последовательности. Гетерологичный в этом контексте означает, что промотор не является по природе промотором, движущим экспрессией упомянутой кодирующей последовательности, но является по природе промотором, движущим экспрессией отличающейся кодирующей последовательности, то есть, полученной с другого гена, или является синтетическим промотором, или химерным промотором. Предпочтительно, промотором является промотор гетерологичный к организму/микроорганизму, то есть промотором, который в природе не встречается в соответствующем организме/микроорганизме. Еще более предпочтительно, промотором является индуцируемый промотор. Промоторы, движущие экспрессией в различных типах организмов, в частности микроорганизмах, хорощо известны квалифицированному специалисту с уровня техники.
В другом предпочтительном варианте осуществления молекула нуклеиновой кислоты является чужеродной к организму/микроорганизму, в котором кодированный фермент(ы), например, HMG СоА синтаза, и/или кодированная лиаза расщепления/конденсации С-С связи, такая как HMG СоА лиаза, и/или кодированный PksG протеин, не является/являются эндогенными к организму/микроорганизму, то есть в природе не являются экспрессированными организмом/микроорганизмом, когда она является негенетически модифицированной. Другими словами, кодированный фермент(ы), например, HMG СоА синтаза и/или кодированная лиаза расщепления/конденсации С-С связи, такая как HMG СоА лиаза, и/или кодированный PksG протеин, является/являются гетерологичным(и) по отношению к организму/микроорганизму.
Термин "рекомбинантный" в другом аспекте означает, что организм является генетически модифицированным в регуляторной области, контролирующей экспрессию фермента, как определено выше, который встречается в природе в организме, для того чтобы привести к росту экспрессии соответствующего фермента по сравнению с соответствующим негенетически модифицированным организмом. Значение термина высокая "повышенная экспрессия" описано также ниже.
Такая модификация регуляторной области может быть достигнута способами, известными квалифицированному специалисту с уровня техники. Одним примером является замена встречающегося в природе промотора на промотор, который предусматривает повышенную экспрессию, или модифицирование встречающегося в природе промотора, таким образом, чтобы продемонстрировать повышенную экспрессию. Таким образом, в этом варианте осуществления организм в регуляторной области содержит ген, кодирующий фермент, как определено выше, молекулу чужеродной нуклеиновой кислоты, которая в природе не встречается в организме, и которая приводит к повышенной экспрессии фермента по сравнению с соответствующим негенетически модифицированным организмом.
В следующем предпочтительном варианте осуществления организм/микроорганизм характеризуют тем, что экспрессия/активность упомянутого фермента, например, HMG СоА синтазы и/или лиазы расщепления/конденсации С-С связи, такой как HMG СоА лиаза, и/или PksG протеина, выше в организме/микроорганизме, генетически модифицированном молекулой чужеродной нуклеиновой кислоты, по сравнению с соответствующим негенетически модифицированным организмом/микроорганизмом.
"Повышенная" экспрессия/активность означает, что экспрессия/активность фермента, например, HMG СоА синтазы и/или лиазы расщепления/конденсации С-С связи, такой как HMG СоА лиаза, и/или PksG протеина, в генетически модифицированном организме/микроорганизме является, по меньшей мере, на 10%, предпочтительно, по меньшей мере, на 20%, более предпочтительно, по меньшей мере, на 30% или 50%, еще более предпочтительно, по меньшей мере, на 70% или 80% и особенно предпочтительно, по меньшей мере, на 90% или 100% выше, чем в соответствующем негенетически модифицированном
организме/микроорганизме. В еще более предпочтительном варианте осуществлений возрастание экспрессии/активности может быть, по меньшей мере, на 150%, по меньшей мере, на 200% или, по меньшей мере, на 500%. В особенно предпочтительном варианте осуществлений экспрессия является, по меньшей мере, в 10 раз, более предпочтительно, по меньшей мере, в 100 раз и еще более предпочтительно, по меньшей мере, в 1000 раз выше, чем в соответствующем негенетически модифицированном организме/микроорганизме.
Термин "повышенная" экспрессия/активность, кроме того, предусматривает ситуацию, в которой соответствующий негенетически модифицированный организм/микроорганизм не экспрессирует соответствующий фермент, например, HMG СоА синтазу и/или лиазу расщепления/конденсации С-С связи, такую как HMG СоА лиаза, и/или PksG протеин так, что соответствующая экспрессия/активность в негенетически модифицированном организме/микроорганизме равняется нулю.
Способы измерения уровня экспрессии предоставленного протеина в клетке хорошо известно квалифицированному специалисту с уровня техники. В одном варианте осуществления измерение уровня экспрессии выполняют путем измерения количества соответствующего протеина. Соответствующие способы хорошо известны квалифицированному специалисту с уровня техники и включают вестерн-блоттинг, ELISA и т.д. В другом варианте осуществления измерение уровня экспрессии выполняют путем измерения количества соответствующей РНК. Соответствующие способы хорошо известны квалифицированному специалисту с уровня техники и включают, например, нозерн-блоттинг.
Способы измерения ферментной активности вышеупомянутого фермента, в частности, HMG СоА синтазы, и/или HMG СоА лиазы, и/или PksG протеина, соответственно, известны с уровня техники и уже описаны выше.
Термин "организм", как использовано в контексте представленного изобретения, относится, как правило, к каким-либо возможным разновидностям организма, в частности, эукариотическим организмам, прокариотическим организмам и архибактериям. Термин включает животных, растения, грибы, бактерии и архибактерии. Термин, кроме того, включает изолированные клетки или клетки-агрегаты, таких организмов, подобные тканям или мозолям.
В одном предпочтительном варианте осуществления организм является микроорганизмом. Термин "микроорганизм" в контексте представленного изобретение относится к прокариотическим клеткам, в частности, бактериям, а также грибам, таким как дрожжевидные грибы, и также водорослям и архибактериям. В одном предпочтительном варианте осуществления, микроорганизм является бактерией. В принципе может быть использована любая бактерия. Предпочтительными бактериями, что используют в процессе в соответствии с изобретением, являются бактерии рода Bacillus, Clostridium, Pseudomonas или Escherichia. В особенно предпочтительном варианте осуществления бактерия принадлежат к роду Escherichia и еще более предпочтительно к виду Escherichia coli.
В другом предпочтительном варианте осуществления микроорганизмом является гриб, более предпочтительно гриб рода Saccharomyces, Schizosaccharomyces, Aspergillus или Trichoderma, и еще более предпочтительно вида Saccharomyces cerevisiae, Schizosaccharomyces pombe, Aspergillus niger или вида Trichoderma reesei.
В еще другом предпочтительном варианте осуществления микроорганизмом является фотосинтетически активный микроорганизм, такой как бактерии, которые способны осуществлять фотосинтез, или микроводоросли. В особенно предпочтительном варианте осуществления микроорганизмом является водоросли, более предпочтительно водоросли рода, который принадлежит к diatomeae.
В другом предпочтительном варианте осуществления организмом в соответствии с изобретением является организм, который способен к фотосинтезу, такой как растение или микроводоросль. В принципе, он может быть каким-либо возможным растением, то есть однодольным растением или двудольным растением. Предпочтительным является использование растения, которое может быть вырощено в сельскохозяйственно-значимых масштабах, и которое позволит продуцировать большие количества биомассы. Примерами являются травы, такие как плевел, зерновые культуры, такие как рожь, ячмень, овес, просо, кукуруза, другие крахмал запасающие растения, такие как картофель, или сахар запасающие растения, такие как сахарный тросник или сахарная свекла. Возможным является также использование табака или овощных растений, таких как помидор, перец, огурец, баклажан и т.д. В другом предпочтительном варианте осуществления растение является масло запасающим растением, таким как рапсовое семя, маслина и т.д. Кроме того, является возможным использование деревьев, в частности, быстро растущих деревьев, таких как эвкалипт, тополь или каучуковое дерево (Hevea brasiliensis).
Представленное изобретение также относится к использованию организма, предпочтительно микроорганизма, который характеризуется следующими признаками:
(a) он способен продуцировать ацетон; и
(b) он экспрессирует фермент, который способен катализировать образование ковалентной связи между атомом углерода оксо-группы (то есть С=O) ацетона и атомом углерода (С2) соответствующей метильной группы соединения, которое обеспечивает активированную ацетильную группу, как определено выше в данном документе, предпочтительно фермент с активностью HMG СоА синтазы (ЕС 2.3.3.10), и/или фермент с активностью лиазы расщепления/конденсации С-С связи, такой как HMG СоА лиаза (ЕС 4.1.3.4), и/или PksG протеин
для продуцирования 3-гидрокси-3-метилмаслянной кислоты. То есть, представленное изобретение также относится к использованию организма/микроорганизма в соответствии с изобретением для продуцирования 3-гидрокси-3-метилмаслянной кислоты.
Представленное изобретение также относится к композиции, содержащей организм в соответствии с представленным изобретением.
Более того, представленное изобретение также относится к композиции, содержащей (i) ацетон; и (ii) соединение, которое обеспечивает активированную ацетильную группу, как определено выше в данном документе; и (iii) фермент, который способен катализировать образование ковалентной связи между атомом углерода оксо-группы (то есть С=O) ацетона и атомом углерода (С2) соответствующей метильной группы соединения, которое обеспечивает активированную ацетильную группу, как определено выше в данном документе.
Для предпочтительного варианта осуществлений фермента применяют то же самое, что уже изложено выше в связи со способом и организмом в соответствии с изобретением.
Более того, представленное изобретение также относится к использованию фермента, который способен катализировать образование ковалентной связи между атомом углерода оксо-группы (то есть С=O) ацетона и атомом углерода (С2) соответствующей метильной группы соединения, которое обеспечивает активированную ацетильную группу, как определено выше в данном документе, для продуцирования 3-гидрокси-3-метилмаслянной кислоты. Для предпочтительного варианта осуществлений фермента применяют то же самое, что уже изложено выше в связи со способом и организмом в соответствии с изобретением.
В заключение, представленное изобретение также относится к использованию ацетона для получения 3-гидрокси-3-метилмаслянной кислоты, которое включает ферментное превращение ацетона и соединения, которое обеспечивает активированную ацетильную группу, как определено выше в данном документе. В предпочтительном варианте осуществления ферментное превращение достигается с помощью фермента, как описано выше в связи со способом в соответствии с изобретением, более предпочтительно с ферментом, имеющим ферментную активность HMG СоА синтазы, и/или с ферментом, имеющим ферментную активность лиазы расщепления/конденсации С-С связи, такой как HMG СоА лиаза, и/или PksG протеином, и наиболее предпочтительно превращение достигают путем использования организма в соответствии с изобретением.
Фигура 1: Химическая структура 3-гидрокси-3-метилмаслянной кислоты (также упоминаемая как бета-гидроксиизовалерат)
Фигура 2: Реакционная схема реакции, катализируемой HMG-CoA синтазой
Фигура 3: Реакционная схема реакции, катализируемой HMG-CoA лиазой
Фигура 4: Реакционные схемы реакций pksX пути, включая реакции, катализируемые PksG протеином
Фигура 5: Реакционная схема реакции превращения ацетона и соединения, содержащего активированную ацетильную группу, в 3-гидрокси-3-метилмаслянную кислоту
X означает S-CH2-CH2-NH-CO-CH2-CH2-NH-CO-CH(OH)-C(CH3)2-CH2-O-PO2H-C10H13N5O7P (кофермент A), S-CH2-CH2-NH-CO-СН2-СН2-ГМН-СО-СН(ОН)-С(СНЗ)2-СН2-0-Р02Н-полипептид (протеин ацил-носитель), S-CH2-CH2-NH-CO-CH2-CH2-NH-CO-СН(ОН)-С(СНЗ)2-СН2-ОН (пантетеин), S-CH2-CH2-NH-CO-CH3 (N-ацетил-цистамин), S-CH3 (метантиол), S-CH2-CH(NH2)-C02H (цистеин), S-CH2-CH2-CH(NH2)-C02H (гомоцистеин), S-CH2-CH(NH-C5H8N03)-CO-NH-CH2-C02H (глутатион), S-CH2-CH2-SO3H (кофермент М) и ОН (уксусная кислота).
Фигура 6: Масс-спектр коммерчески доступного 3-гидрокси-3-метилбутирата.
Фигура 7: Масс-спектр образования 3-гидрокси-3-метилбутирата из ацетил-СоА и ацетона в присутствии Hmg-CoA синтазы из Gallus gallus (Р23228).
Фигура 8: Масс-спектр контрольного исследования без фермента.
Фигура 9: Диаграмма Михаэлиса - Ментена реакции с HMG СоА синтазой S. Epidermidis, которая описанна в примере 7
Следующие примеры служат для иллюстрации изобретения.
Пример 1
Биоинформационный способ, использованный для создания базы данных HMG-CoA синтаз и HMG-CoA лиаз
Панель из 12 HMG-CoA синтаз и 8 HMG-CoA лиаз были отобраны для создания основного блока набора протеинов, стремясь представить разнообразие этих классов ферментов, как найдено в параллели эукариотических организмов. Эти протеины были идентифицированы путем выполнения многократных поисков основанных на последовательности и текстовых поисков в Универсальной базе данных протеиновых ресурсов Uniprot (Universal Protein Resource Database Uniprot) (http://www.uniprot.org/). Они все содержат уникальные признаки, такие как консервативные области белка и фрагмент характерный для интересующего класса ферментов. С целью эффективного покрытия разнообразия последовательностей, без надлежащего отбора большой серии протеинов, начальный пул ферментов был сужен путем группирования их в кластеры последовательностей с большей чем 85% гомологичностью и далее отбирая одного единственного кандидата последовательности представителя каждого кластера. Идентичность последовательности белка находится в пределах от 30% до 80% и от 50% до 80% между какими-либо двумя протеинами из панели HMG-CoA синтаз и панели лиаз, соответственно. Такой же подход применяли к отбору HMG-CoA синтаз и HMG-CoA лиаз из прокариотических организмов. Созданные серии, содержавшие 50 гомологов протеинов HMG-CoA синтаз, включая pksG протеины, и 59 гомологов протеинов HMG-CoA лиаз.
Пример 2
Клонирование, экспрессия и очистка совокупности HMG-CoA лиаз и HMG-CoA синтаз
Клонирование гена:
Последовательности нуклеиновых кислот, кодирующие HMG-CoA синтазу и лиазу из эукариотического организма, оптимизировали преимущественно для кодона E.coli, и гены были получены посредством химического синтеза (GeneArt).
Гены, кодирующие HMG-CoA синтазы и лиазы из прокариотических организмов, клонировали из геномной ДНК из различных исходных материалов с помощью рутинных рекомбинантных методик. Дальше эти гены вводили в гистидиновый тэг (His-tag), содержащий рЕТ 25b и рЕТ 22b вектора (Novagen), соответственно, для эукариотических и прокариотических организмов. Надэкспрессия в Е. coli:
Плазмиды электропорировали в Е. coli BL21 бактерии (Novagen), далее это распространяли на ампициллин, содержащий LB-arap на чашках Петри. Культуры выращивали при 30°C в ТВ среде, содержащей 0,5 М сорбита, 5 мМ бетаина, 100 мкг/мл ампициллина при умеренном встряхивании. Когда OD (600 нм) достигло 0,8, добавляли IPTG до конечной концентрации 1 мМ, и экспрессия проходила в течение 16 часов при 20°C при умеренном встряхивании. Дальше клетки бактерий собирали центрифугированием при 4°C, 10000 об./мин., 20 минут и замораживали при - 80°C.
Приготовление экстракта клеток:
Экстракты клеток готовят ресуспендированием 1,6 г пеллетов клеток в 5 мл 50 мМ Na2HPO4 буфера, содержащего 300 мМ NaCI, 5 мМ MgCI2, 1 мМ DTT рН 8. Затем добавляют 20 мкл Lysonase (Novagen) к препаратам, которые инкубируют в течение 10 минут при комнатной температуре и 20 минут на льду. Клеточный лизис доводят до конца тройной обработкой ультразвуком по 5 минут в ульразвуковой водяной бане на льду и гомогенизацией экстракта между каждым импульсом. Сырые экстракты затем осветляют центрифугированием при 4°C, 10.000 об./мин., 20 минут.
Очистка протеина:
Прозрачные супернатанты загружают в PROTINO-1000 Ni-IDA колонку (Macherey-Nagel) которая дает возможность специфической иммобилизации протеинов, несущих 6-гистидиновые хвосты. Колонки промывают, и ферменты элюируют 4 мл 50 мМ Na2HPO4 буфера, содержащего 300 мМ NaCI, 5 мМ MgCI2 г, 1 мМ DTT, 250 мМ имидазола рН 8. Фермент, содержащий фракции затем концентрируют и обессоливают на Amicon Ultra-4 10 кДа фильтрующем блоке (Millipore) и ресуспендируют в 250 мкл 40 мМ Трис-HCI рН8, содержащем 0,5 мМ DTT. Концентрацию протеина определяют способом Брэдфорда. Гомогенность очищенных ферментов варьировала от 20% до 75%.
Пример 3
Измерение активности HMG-CoA синтазы, используя природные субстраты ацетоацетил-СоА и ацетил-СоА
Активность HMG-CoA синтазы измеряли в соответствии с Clinkenbeard et al. (J. Biol.Chem. 250 (1975), 3108-3116). Стандартная смесь среды исследования для HMG-CoA синтаз содержит 40 мМ Трис-HCI рН 8, 1 мМ MgCI2, 100 мкМ ацетоацетил-СоА, 200 мкМ ацетил-СоА, 0,5 мМ DTT в общем объеме 1 мл. Митохондриальные HMG-CoA синтазы исследуют при отсутствии MgCI2 во избежание ингибирования, наблюдаемого для этого фермента (Reed et al., J. Biol.Chem. 250 (1975), 3117-3123). Реакцию инициализируют добавлением 0,02 мг/мл фермента.
Контрольное исследование проводят при отсутствии фермента. Активность HMG-CoA синтазы измеряют путем мониторинга понижения абсорбции на 303 нм, что сопровождается исчезновением ацетил-СоА-зависимой енолятной формы ацетоацетил-СоА. Для объяснения неспецифического исчезновения ацетоацетил-СоА, результаты, полученные в контрольном исследовании в отсутствие фермента, были вычтены из результатов, полученных при исследовании образцов. Видимый коэффициент поглощения для ацетоацетил-СоА при условиях исследования составлял 5600 М-1.
Пример 4
Измерение активности HMG-CoA лиазы, используя природный субстрат HMG-CoA
Активность HMG-CoA лиазы измеряют в соответствии с Mellanby J et al. (Methods of Enzymatic Analysis; Bergmeyer Ed. (1963), 454-458). Полную реакционную смесь (1 мл), содержащую 40 мМ Трис-HCI рН 8, 1 мМ MgCI2, 0,5 мМ DTT, 0,4 мМ HMG-CoA, 0,2 мМ NADH, 5 единиц 3-гидроксибутират-дегидрогеназы, инкубируют в течение 5 минут, после чего добавляют 0,005 мг/мл HMG-CoA лиазы, и далее протекание реакции мониторят понижением абсорбции на 340 нм. Контрольное исследование проводят при отсутствии фермента.
Для объяснения неспецифического исчезновения NADH, результаты, полученные в контрольном исследовании в отсутствие фермента, вычитают из результатов, полученных при исследовании образцов. Специфические активности рассчитывали как Дмкмоль NADH/мин·мг протеина.
Пример 5
Получение 3-гидрокси-3-метилбутирата
Полная реакционная смесь для синтеза 3-гидрокси-3-метилбутирата включала 40 мМ Трис-HCI рН 8, от 5 до 50 мМ ацетил-СоА, от 100 до 500 мМ ацетона, 1 MgCI2 (за исключением митохондриальной HMG-CoA синтазы), 0,5 мМ DTT и фермент, варьирующий в диапазоне от 0,2 до 8 мг/мл. Контрольные реакции проводили при отсутствии фермента и одного из субстратов.
За протеканием синтеза следили путем анализа аликвот, взятых после периода возрастания инкубации при 30 или 37°C. Обычно, аликвоту 50 мкл отбирали спустя 48 ч инкубации, нагревали в течение 1 минуты при 100°C для удаления протеинов, центрифугировали и супернатант переносили в чистую виалу для обнаружения ГИВ, используя масс-спектрометрию. Раствор 3-гидрокси-3-метилбутирата готовили в 40 мМ Трис-HCI рН 8, 1 мМ MgCI2, 0,5 мМ DTT, нагревали, как описано ранее, и использовали как референтный.
Образцы анализировали на РЕ SCIEX API 2000 тройном квадрупольном масс-спектрометре в режиме отрицательных ионов с раствором Н2О/ацетонитрил=60/40, содержащим 0,1% триэтиламина в качестве подвижной фазы, скорость потока составляла 40 мкл/мин. 10 мкл каждого супернатанта смешивали с равным количеством подвижной фазы и напрямую впрыскивали в масс-спектрометр. Контролировали присутствие [3-гидрокси-3-метилбутират-Н]- иона.
Пик, соответствующий 3-гидрокси-3-метилбутирату наблюдали для следующих ферментов:
Blattella germanica (рыжего таракана) Р54961 (SEQ ID NO: 6)
Gallus gallus (курицы) P23228 (SEQ ID NO: 7)
Homo sapiens (человека) Q01581 (SEQ ID NO: 8)
Arabidopsis thaliana P54873 (CAA58763) (SEQ ID NO: 4)
Caenorhabditis elegans P54871 (SEQ ID NO: 1)
Schizosaccharomyces pombe (делящихся дрожжей) P54874 (SEQ ID NO: 2)
Saccharomyces cerevisiae (пекарских дрожжей) P54839 (SEQ ID NO: 3)
Dictyostelium discoideum (слизевого гриба) Q86HL5 (SEQ ID NO: 10)
Leuconostoc mesenteroides Q03WZ0 (SEQ ID NO:)
Staphylococcus epidermidis Q8CN06 (SEQ ID NO: 11)
Lactobacillus delbrueckii Q1GAH5 (SEQ ID NO: 24)
Staphylococcus haemolyticus Q4L958 (I98>V различие по сравнению с протеином дикого типа) (SEQ ID NO: 25)
Фигуры 6-8 демонстрируют достоверные результаты для коммерчески доступного 3-гидрокси-3-метилбутирата, для реакции, используя HMG СоА синтазау из Gallus gallus (Р23228) и для контрольного исследования без фермента.
Пример 6
Получение 3-гидрокси-3-метилбутирил-СоА, используя лиазы
Синтез 3-гидрокси-3-метилбутирил-СоА проводят в присутствии ацетона с радиоизотопной меткой [2-14С]. Полная реакция смесь для синтеза 3-гидрокси-3-метилбутирил-СоА включает 40 мМ Трис-HCI рН 8, от 5 до 50 мМ ацетил-СоА, от 100 до 500 мМ ацетона, от 1 до 10 мМ MgCI2, 0,5 мМ DTT и фермент, варьирующий в диапазоне от 0,5 до 7 мг/мл. Образование продукта анализируют после разделения реакционной смеси путем ТСХ или ВЭЖХ. Кроме того, 3-гидрокси-3-метилбутирил-СоА анализируют способом ТСХ (Stadtman E.R., J. Biol. Chem. 196 (1952), 535-546). Аликвоту реакционной смеси помещают в целлюлозную пластину и хроматографируют в следующей системе растворителей: этанол/0,1 М натрия ацетат рН 4,5 (1/1). Со-А и ацетил-СоА используют как внутренние стандарты. Rf, описанное для 3-гидрокси-3-метилбутирил-СоА составляет 0,88.
Пример 7
Кинетические параметры для ферментной реакции между ацетил-СоА и ацетоном в случае HMG синтаз
Кинетические параметры измеряли, используя переменную концентрацию ацетона и постоянную концентрацию ацетил-СоА (10 мМ) при следующих условиях:
40 мМ Трис-HCI рН 8
2 мМ MgCI2
0-1 М ацетона
Конечное значение рН доводили до 8.
Реакцию инициировали добавлением 3 мг очищенного фермента к 1 мл реакционной смеси. Затем смесь инкубировали без встряхивания при 37°C в течение 40 ч.
Анализ продуцирования 3-гидрокси-3-метилбутирата
Применяют термохимические условия, которые приводят к разложению 3-гидрокси-3-метилбутирата до изобутена (Pressman et al., JACS, 1940, 2069-2080): рН реакционных смесей доводили сначала до уровня рН 4, используя 6N HCI, и затем образцы переносили в виалы для газовой хроматографии (Interchim). Виалы запаивали и инкубировали при 110°C в течение 4 часов, таким образом, приводя к разложению 3-гидрокси-3-метилбутират до изобутена.
Калибровочную кривую строили при тех же условиях, используя коммерческий 3-гидрокси-3-метилбутират.
Один миллилитр газового пространства над образцом собирали и впрыскивали в НР5890 газовый хроматограф (HP), оснащенный FID детектором и CP SilicaPlot колонкой (Varian). Коммерческий изобутен исользовали как референтный образец. По сигналу изобутена рассчитывали количество 3-гидрокси-3-метилбутирата изначально присутствующего в образце. Параметры кинетики для нескольких изученных HMG-CoA синтаз представлены в следующей таблице.
Для фермента из S. epidermidis Фигура 9 демонстрирует соответствующую диаграмму Михаэлиса - Ментена.
Реферат
Изобретение относится к области химического синтеза и микробиологии. Предложен способ получения 3-гидрокси-3-метилмаслянной кислоты из ацетона и соединения, которое обеспечивает активированную ацетильную группу. Также предложены соответствующие рекомбинантный организм, его применение, композиция, применение фермента с активностью HMG CoA синтазы и применение ацетона для получения 3-гидрокси-3-метилмаслянной кислоты. 7 н. и 6 з. п. ф-лы, 9 ил., 4 табл., 7 пр.
Формула

в которой X является S-CH2-CH2-NH-CO-CH2-CH2-NH-CO-CH(OH)-C(CH3)2-СН2-O-РО2Н-O-PO2H-C10H13N5O7P (кофермент А),
с помощью фермента, который способен катализировать образование ковалентной связи между атомом углерода оксо-группы (то есть С=O) ацетона и атомом углерода (С2) соответствующей метильной группы соединения формулы (I), и где упомянутый фермент является ферментом, имеющим активность HMG СоА синтазы ЕС 2.3.3.10.
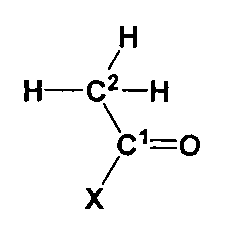
в которой X является S-CH2-CH2-NH-CO-CH2-CH2-NH-CO-CH(OH)-C(CH3)2-СН2-O-РO2Н-O-PO2H-C10H13N5O7P (кофермент А).
а. ацетон;
б. соединение, которое обеспечивает активированную ацетильную группу, представленное следующей формулой (I):

в которой X является S-CH2-CH2-NH-CO-CH2-CH2-NH-CO-CH(OH)-C(CH3)2-СН2-O-PO2H-O-PO2H-C10H13N5O7P (кофермент А), и
в. фермент, который способен катализировать образование ковалентной связи между атомом углерода оксо-группы (то есть С=O) ацетона и атомом углерода (С2) соответствующей метильной группы упомянутого соединения, определенного в (б), и где упомянутый фермент является ферментом, имеющим активность HMG СоА синтазы ЕС 2.3.3.10.

в которой X является S-CH2-CH2-NH-CO-CH2-CH2-NH-CO-CH(OH)-C(CH3)2-СН2-O-PO2H-O-PO2H-C10H13N5O7P (кофермент А).
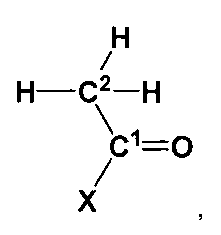
в которой X является S-CH2-CH2-NH-CO-CH2-CH2-NH-CO-CH(OH)-C(CH3)2-СН2-O-PO2H-O-PO2H-C10H13N5O7P (кофермент А), где ферментное превращение осуществляют с помощью фермента, имеющего ферментную активность HMG СоА синтазы ЕС 2.3.3.10.

Комментарии