Новые гены атф:цитратлиазы - RU2534560C2
Код документа: RU2534560C2
Чертежи
















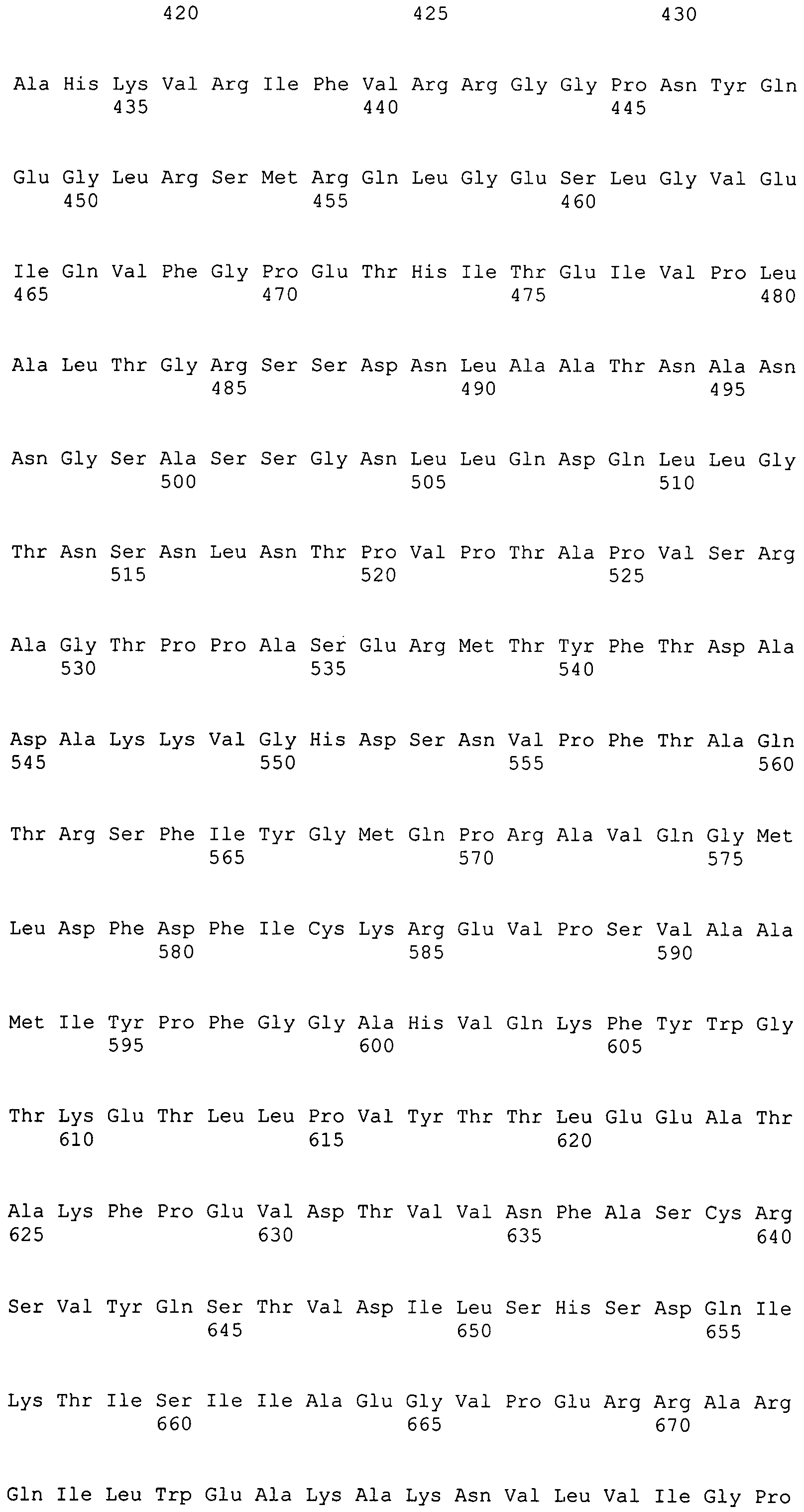


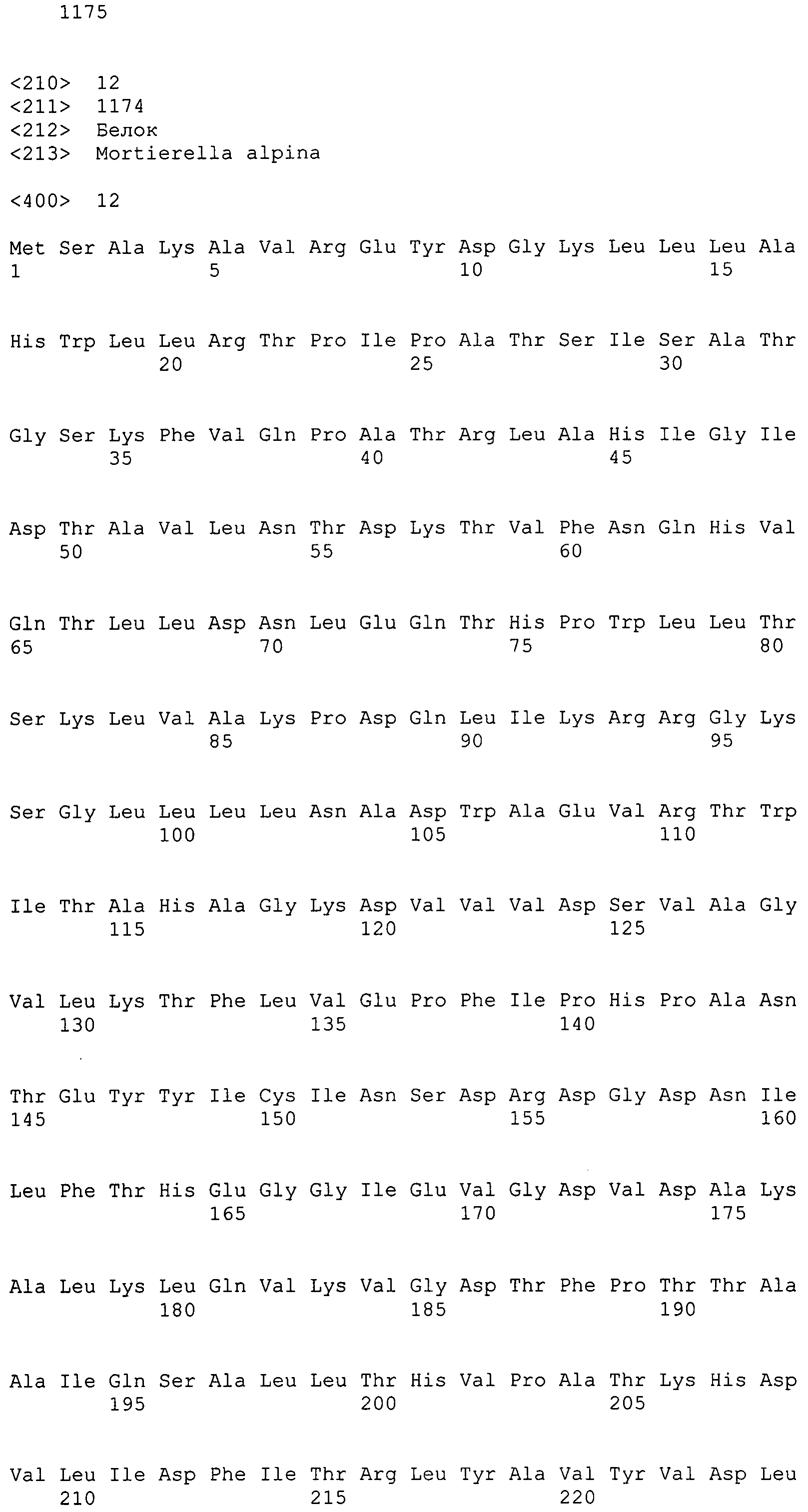















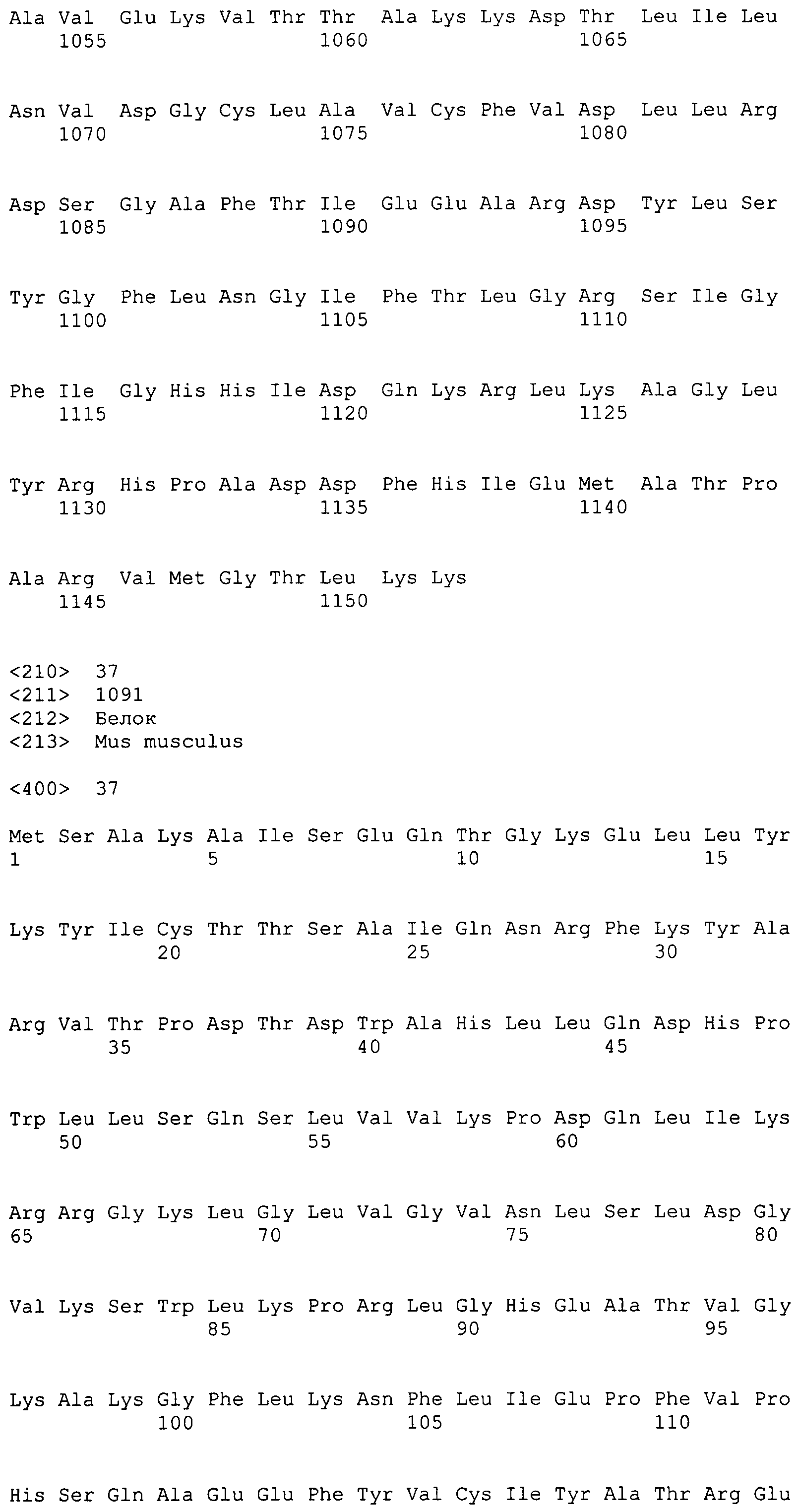
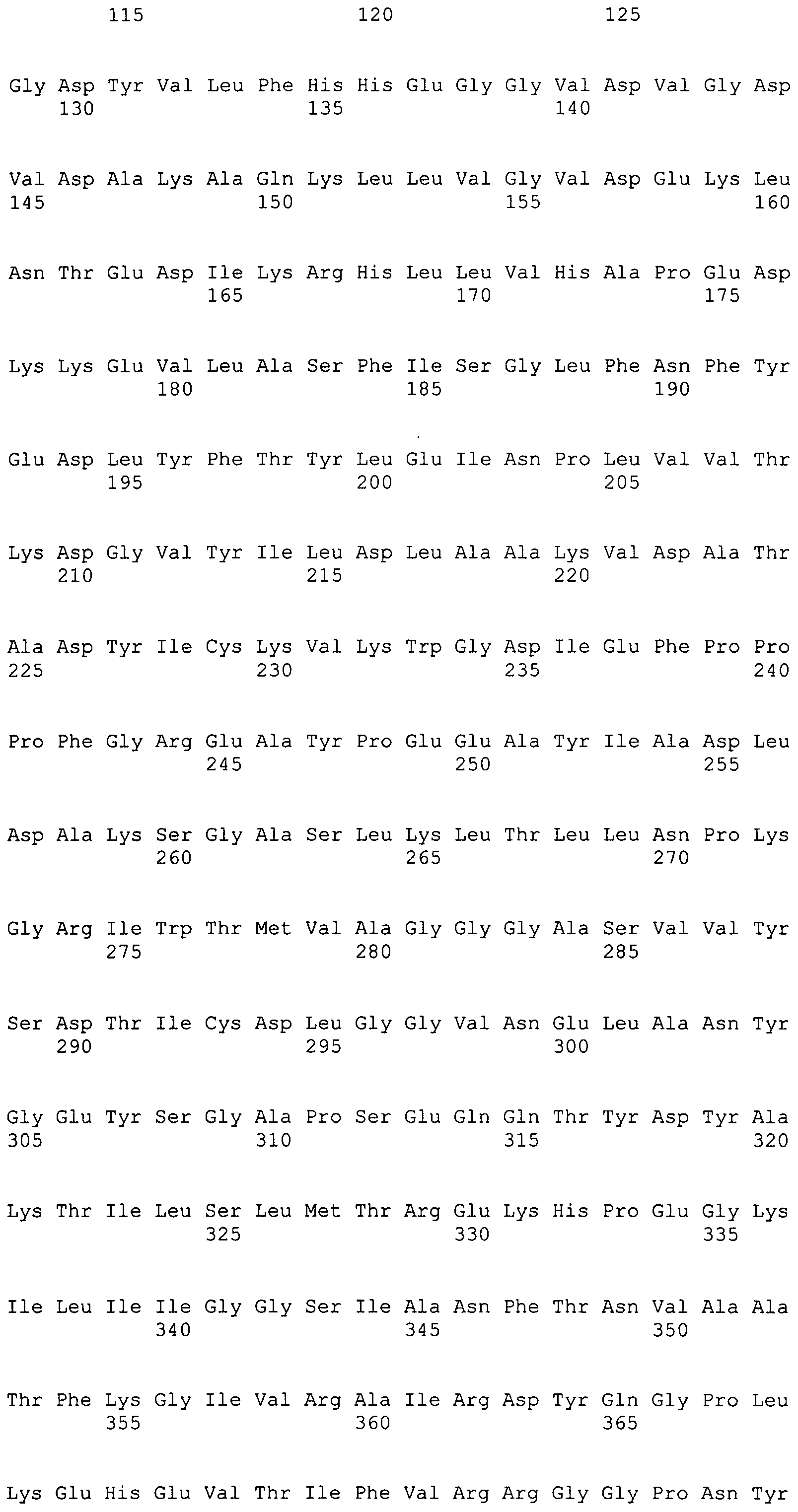


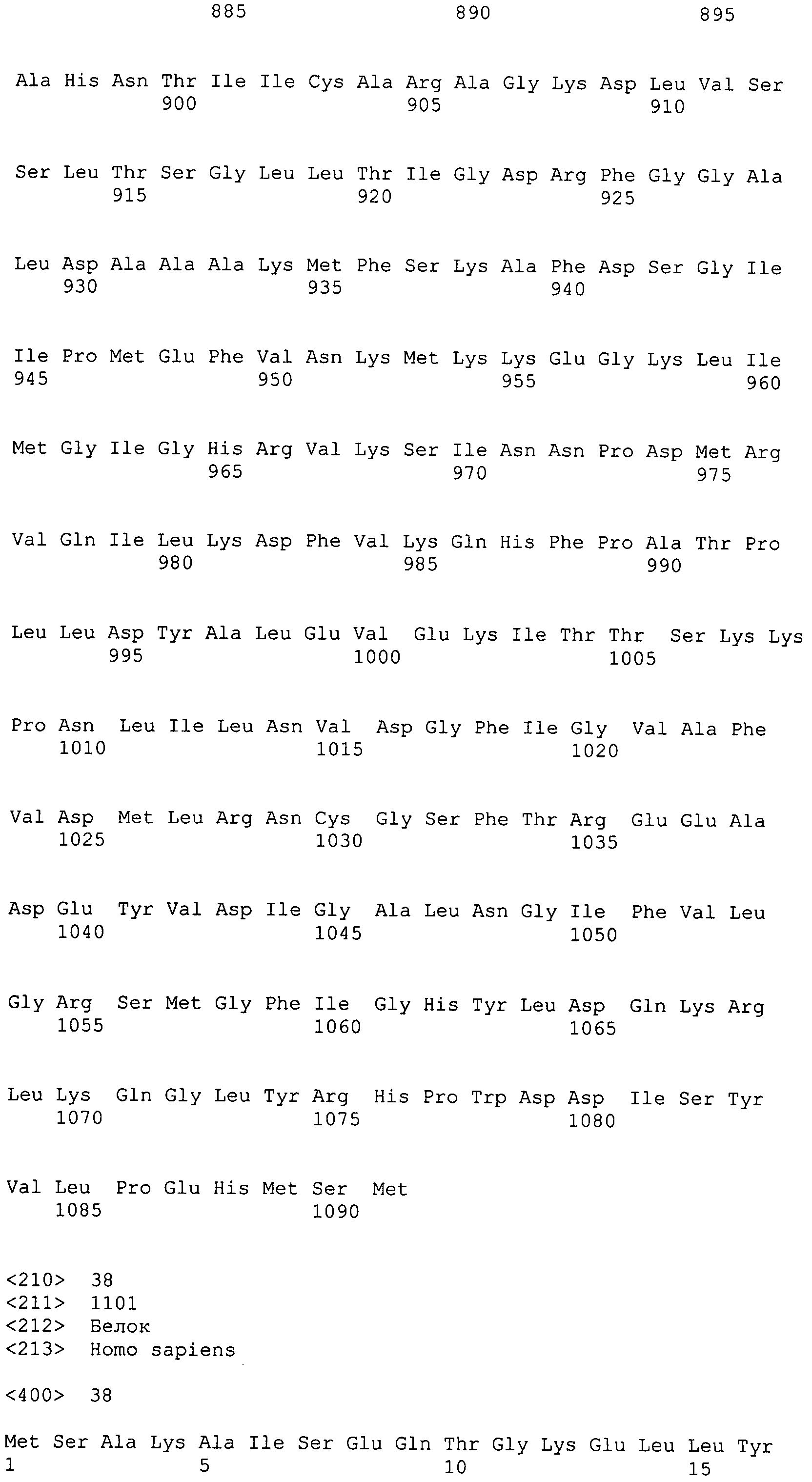

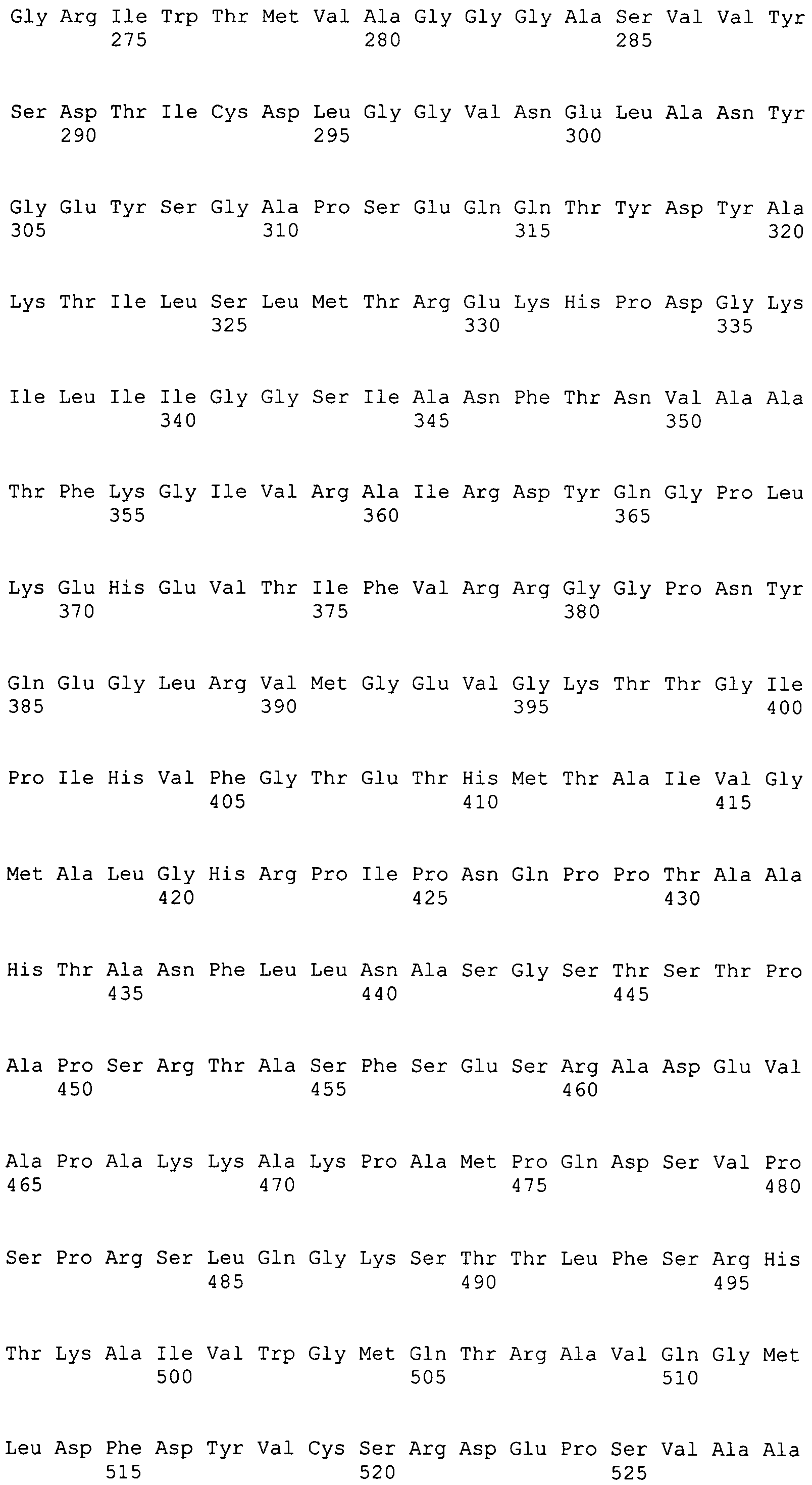





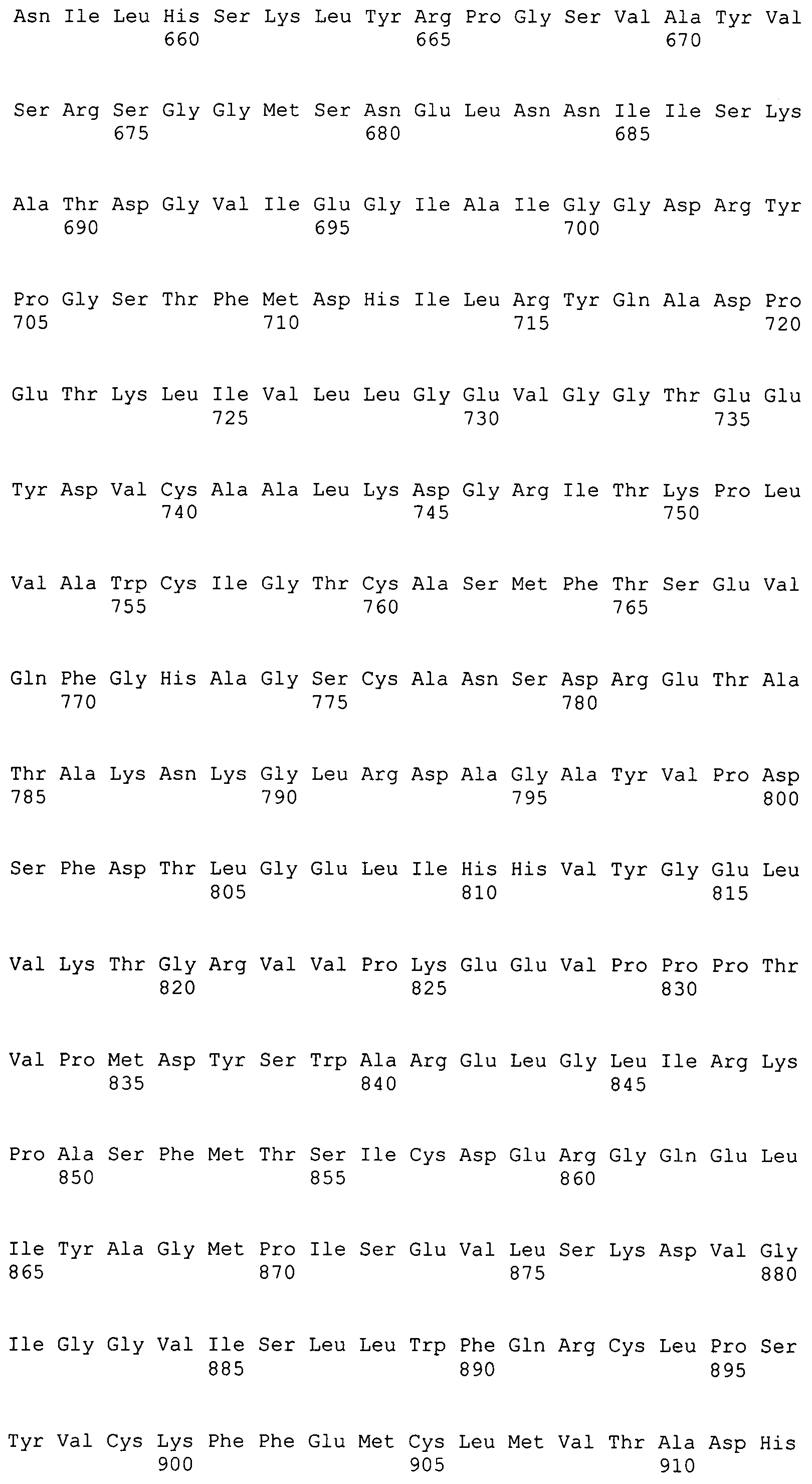
















Описание
ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Данное изобретение относится к новым генам для АТФ:цитратлиазы.
УРОВЕНЬ ТЕХНИКИ
Жирные кислоты являются важными компонентами липидов, таких как фосфолипиды и триацилглицерины. Жирные кислоты, содержащие две или более ненасыщенных связей, совокупно называют полиненасыщенными жирными кислотами (PUFA) и известно, что они включают арахидоновую кислоту, дигомо-γ-линоленовую кислоту, эйкозапентаеновую кислоту и докозагексаеновую кислоту. Различные физиологические активности сообщались для этих жирных кислот (непатентный документ 1). Ожидается, что эти полиненасыщенные жирные кислоты применяются в различных областях, но некоторые из них не могут синтезироваться в организме животного. Таким образом, были разработаны микробные способы для получения полиненасыщенных жирных кислот культивированием различных микроорганизмов. Были предприняты другие попытки получения полиненасыщенных жирных кислот в растениях. Известно, что в этих случаях полиненасыщенные жирные кислоты накапливаются, например, в виде компонентов липидов, таких как триацилглицерины, в клетках микроорганизмов или семенах растений.
Синтез таких новых жирных кислот у животных, в растениях и микроорганизмах опосредуется синтетазой жирных кислот с использованием в качестве исходных веществ ацетил-CoA и малонил-CoA, который генерируется из ацетил-CoA под действием ацетил-CoA-карбоксилазы (ACC). Известно, что эти реакции имеют место в цитоплазме животных или микроорганизмов и в хлоропластах растений.
Ацетил-CoA, который служит в качестве материала-источника этих жирных кислот и холестерина, синтезируемых de novo в цитоплазме, восполняется из цитрата под действием АТФ:цитратлиазы (E.C. 2.3.3.8 далее называемой в описании также ACL).
ACL является ферментом, катализирующим следующую реакцию.
Формула 1
Цитрат + АТФ + CoA ⇆ ацетил-CoA + оксалоацетат + АДФ + Pi
Этот фермент широко распространен в эукариотических организмах, включая животных, растения и грибы, и его внутриклеточная локализация обнаружена в цитоплазме (непатентный документ 2). О генах ACL сообщалось до сих пор в нескольких организмах. Например, что касается генов ACL животных, были клонированы эти гены, полученные из Homo sapiens и Rattus norvegicus (непатентный документ 3, непатентный документ 4). Что касается генов ACL растений, были клонированы ACLA-1, -2, -3 и ACLB-1, -2, полученные из Arabidopsis (экотипа Columbia) (непатентный документ 5). В случае мицелиальных грибов были клонированы гены ACLA и ACLB, полученные из Sordaria macrospora (непатентный документ 6).
Что касается Mortierella alpina (далее в описании называемой также “M. alpina”), которая является липидпродуцирующим грибом, сообщалось, что цитоплазматическая фракция имеет АТФ:цитратлиазную активность (непатентный документ 7).
До сих пор эти известные гены ACL использовали в попытке увеличения содержания общих жирных кислот в хозяевах, например, высокой экспрессией полученного из Sordaria macrospore гена ACL вместе с синтетазой жирных кислот (FAS) в клетках дрожжей (патентный документ 1) или высокой экспрессией полученного из Rattus norvegicus гена ACL в растениях (непатентный документ 8).
Патентный документ 1: публикация патента США № 2006/0051847
Непатентный документ 1: Lipids., 39, pp. 1147 (2004)
Непатентный документ 2: Adv Appl Microbiol., 51, pp. 1-51 (2002)
Непатентный документ 3: Eur J Bio Chem., 204, pp. 491-499 (1992)
Непатентный документ 4: J Bio chem., 265, pp. 1430-1435 (1990)
Непатентный документ 5: Plant Physiology., 130, pp. 740-756 (2002)
Непатентный документ 6: Curr. genet., 37, pp. 189-93 (2000)
Непатентный документ 7: Microbiology., 146, pp. 2325-2331 (2000)
Непатентный документ 8: Plant Physiology., 122, pp. 1231-1238 (2000)
ОПИСАНИЕ ИЗОБРЕТЕНИЯ
ПРОБЛЕМЫ, ПОДЛЕЖАЩИЕ РЕШЕНИЮ ЭТИМ ИЗОБРЕТЕНИЕМ
Однако гены ACL, о которых сообщалось ранее, не являются достаточными, например, потому, что невозможно проверить, оказывают ли сами эти гены действие при введении в клетки-хозяева или при экспрессии в клетках-хозяевах, или потому что ограничен диапазон хозяев, доступных для использования при экспрессии таких генов. По этой причине имеется потребность идентификации нового гена, который отличается от известных до сих пор генов и позволяет увеличивать содержание общих жирных кислот или липидов в хозяевах.
СРЕДСТВА ДЛЯ РЕШЕНИЯ ЭТИХ ПРОБЛЕМ
Целью данного изобретения является обеспечение белка или нуклеиновой кислоты, которые позволяют увеличивать содержание жирных кислот или липидов, экспрессируемых в клетках-хозяевах или вводимых в клетки-хозяева.
Для достижения вышеуказанной цели авторы данного изобретения приложили экстенсивные и интенсивные усилия. Сначала выполняли анализ EST на липидпродуцирующем грибе, Mortierella alpina, для экстракции последовательностей, имеющих высокую идентичность с известными генами ACL. Для получения полной открытой рамки считывания (ORF), кодирующей ACL, гены дополнительно клонировали скринингом кДНК-библиотеки или при помощи ПЦР. Эти гены экспрессировали в Saccharomyces cerevisiae, не имеющем гена ACL, с последующим измерением активности ACL для подтверждения ACL-активности вышеуказанных генов.
Кроме того, в результате попытки введения и высокой экспрессии этих генов в клетках-хозяевах (например, липидпродуцирующем грибе Mortierella alpina) для достижения посредством этого продуцирования высокого уровня общих жирных кислот, авторы данного изобретения сумели клонировать новый ген, родственный ACL, который позволяет увеличивать содержание общих жирных кислот по сравнению с хозяевами, экспрессирующими обычный уровень ACL. Это привело к завершению данного изобретения. А именно, данное изобретение представляет собой следующее:
(1) Нуклеиновая кислота, содержащая нуклеотидную последовательность, показанную в любом из подпунктов (а)-(е) ниже:
(a) нуклеотидную последовательность, которая кодирует белок, состоящий из аминокислотной последовательности с делецией, заменой или добавлением одной или нескольких аминокислот в аминокислотной последовательности, показанной в SEQ ID NO:11 или SEQ ID NO:12, и имеющий АТФ:цитратлиазную активность;
(b) нуклеотидную последовательность, которая может гибридизоваться в строгих условиях с нуклеиновой кислотой, состоящей из нуклеотидной последовательности, комплементарной нуклеотидной последовательности, состоящей из SEQ ID NO:9 или SEQ ID NO:10, и которая кодирует белок, имеющий АТФ:цитратлиазную активность;
(c) нуклеотидную последовательность, которая состоит из нуклеотидной последовательности, имеющей идентичность 70% или более с нуклеотидной последовательностью, состоящей из SEQ ID NO:9 или SEQ ID NO:10, которая кодирует белок, имеющий АТФ:цитратлиазную активность;
(d) нуклеотидную последовательность, которая кодирует аминокислотную последовательность, имеющую идентичность 70% или более с аминокислотной последовательностью, состоящей из SEQ ID NO:11 или SEQ ID NO:12, и которая кодирует белок, имеющий АТФ:цитратлиазную активность; или
(e) нуклеотидную последовательность, которая может гибридизоваться в строгих условиях с нуклеиновой кислотой, состоящей из нуклеотидной последовательности, комплементарной нуклеотидной последовательности, кодирующей белок, состоящий из аминокислотной последовательности, показанной в SEQ ID NO:11 или 12, и которая кодирует белок, имеющий АТФ:цитратлиазную активность.
(2) Нуклеиновая кислота по пункту (1) выше, которая содержит нуклеотидную последовательность, показанную в любом из подпунктов (а)-(с) ниже:
(a) нуклеотидную последовательность, которая кодирует белок, состоящий из аминокислотной последовательности с делецией, заменой или добавлением 1-10 аминокислот в аминокислотной последовательности, показанной в SEQ ID NO:11 или SEQ ID NO:12, и имеющий АТФ:цитратлиазную активность;
(b) нуклеотидную последовательность, которая может гибридизоваться в строгих условиях 2 × SSC при 50°C с нуклеиновой кислотой, состоящей из нуклеотидной последовательности, комплементарной нуклеотидной последовательности, состоящей из SEQ ID NO:9 или SEQ ID NO:10, и которая кодирует белок, имеющий АТФ:цитратлиазную активность; или
(c) нуклеотидную последовательность, которая кодирует аминокислотную последовательность, имеющую идентичность 90% или более с аминокислотной последовательностью, состоящей из SEQ ID NO:11 или SEQ ID NO:12, и которая кодирует белок, имеющий АТФ:цитратлиазную активность.
(3) Нуклеиновая кислота, содержащая нуклеотидную последовательность, показанную в любом из подпунктов (а)-(с) ниже, или ее фрагмент:
(a) нуклеотидную последовательность, показанную в SEQ ID NO:9 или SEQ ID NO:10;
(b) нуклеотидную последовательность, кодирующую белок, состоящий из аминокислотной последовательности, показанной в SEQ ID NO:11 или SEQ ID NO:12; или
(c) нуклеотидную последовательность, показанную в SEQ ID NO:5 или SEQ ID NO:6.
(4) Белок, показанный в подпунктах (a) или (b) ниже:
(a) белок, который состоит из аминокислотной последовательности с делецией, заменой или добавлением одной или нескольких аминокислот в SEQ ID NO:11 или SEQ ID NO:12 и который имеет АТФ:цитратлиазную активность; или
(b) белок, который состоит из аминокислотной последовательности, имеющей идентичность 70% или более с аминокислотной последовательностью, состоящей из SEQ ID NO:11 или SEQ ID NO:12, и который имеет АТФ:цитратлиазную активность.
(5) Белок, состоящий из аминокислотной последовательности, показанной в SEQ ID NO:11 или SEQ ID NO:12.
(6) Рекомбинантный вектор, содержащий нуклеиновую кислоту, по любому из пунктов (1)-(3) выше.
(7) Трансформант, несущий нуклеиновую кислоту по любому из пунктов (1)-(3) выше.
(8) Трансформант, трансформированный рекомбинантным вектором по пункту (6) выше.
(9) Трансформант по пункту (8) выше, способность которого продуцировать жирные кислоты, улучшается введением вектора по пункту (6) выше.
(10) Трансформант по любому из пунктов (7)-(9) выше, где этот трансформант является липидпродуцирующим грибом.
(11) Трансформант по пункту (10) выше, где этим липидпродуцирующим грибом является Mortierella alpina.
(12) Способ получения жирной кислоты или липида, который предусматривает сбор жирной кислоты или липида из культивируемого продукта, полученного культивированием трансформанта по любому из пунктов (7)-(11) выше.
(13) Жирная кислота или липид, получаемые с использованием способа по пункту (12) выше.
(14) Пищевой продукт, содержащий жирную кислоту или липид по пункту (13) выше.
ПРЕИМУЩЕСТВА ИЗОБРЕТЕНИЯ
ACL данного изобретения позволяет улучшать способность продуцирования жирных кислот и/или липидов и, следовательно, является предпочтительной в качестве средства для улучшения продуктивности полиненасыщенных жирных кислот в микроорганизмах и растениях. В результате ACL данного изобретения делает возможным обеспечение полезных липидов при меньшей стоимости, чем в общепринятых случаях, и является полезной в качестве применимого компонента в пищевых продуктах, косметике, фармацевтических веществах, мылах и т.д.
КРАТКОЕ ОПИСАНИЕ ФИГУР
Фигура 1-1. На фигуре 1 показана кДНК-последовательность MaACL1, согласно данному изобретению, вместе с ее расшифрованной аминокислотной последовательностью.
Фигура 1-2. На фигуре 1 показана кДНК-последовательность MaACL1, согласно данному изобретению, вместе с ее расшифрованной аминокислотной последовательностью.
Фигура 2-1. На фигуре 2 показана кДНК-последовательность MaACL2, согласно данному изобретению, вместе с ее расшифрованной аминокислотной последовательностью.
Фигура 2-2. На фигуре 2 показана кДНК-последовательность MaACL2, согласно данному изобретению, вместе с ее расшифрованной аминокислотной последовательностью.
Фигура 3-1. На фигуре 3 показано сравнение ДНК-последовательностей между CDS-областями MaACL1 и MaACL2.
Фигура 3-2. На фигуре 3 показано сравнение ДНК-последовательностей между CDS-областями MaACL1 и MaACL2.
Фигура 4. На фигуре 4 показано сравнение расшифрованных аминокислотных последовательностей между MaACL1 и MaACL2.
Фигура 5-1. На фигуре 5 показаны расшифрованные аминокислотные последовательности MaACL1p и MaACL2p в сравнении с известными аминокислотными последовательностями.
Фигура 5-2. На фигуре 5 показаны расшифрованные аминокислотные последовательности MaACL1p и MaACL2p в сравнении с известными аминокислотными последовательностями.
Фигура 6. Фигура 6 представляет собой график, показывающий зависимость MaACL1 от концентрации Mg2+.
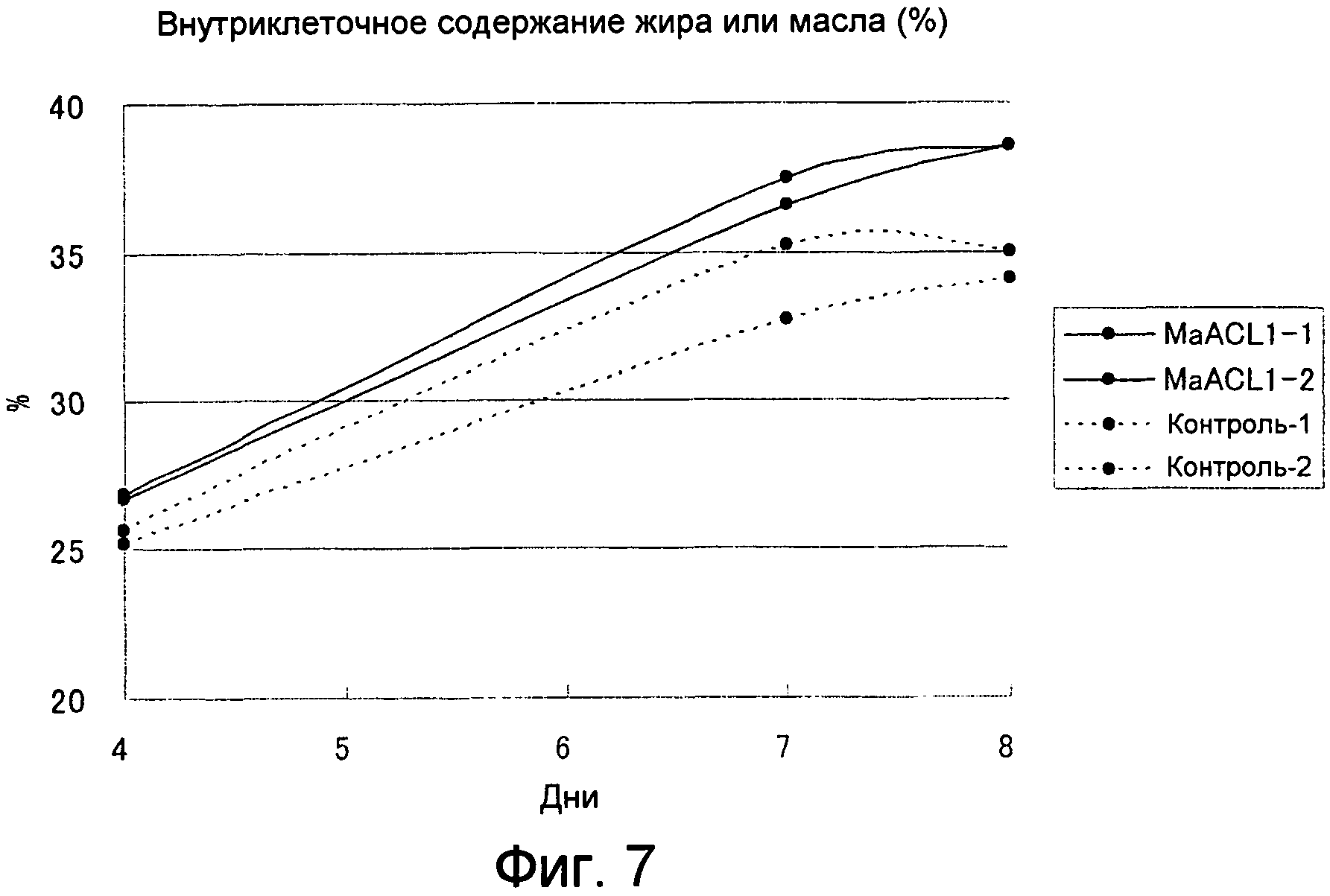
Фигура 7. На фигуре 7 показан временной ход содержания внутриклеточного жира или масла в сравнении между трансформантами MaACL1 (MaACL1-1, -2) и не-трансформантами (Ctrl-1, -2) в культуре.
НАИЛУЧШИЙ СПОСОБ ВЫПОЛНЕНИЯ ИЗОБРЕТЕНИЯ
Данное изобретение относится к новым генам для АТФ:цитратлиазы, полученным из рода Mortierella, характеризующегося генерированием ацетил-CoA, оксалоацетата, АДФ и Pi из АТФ, цитрата и CoA.
В случае эукариотических организмов, имеющих внутриклеточные компартменты, отделенные органеллами, ацетил-CoA согласно данному изобретению генерируется прежде всего в митохондриях под действием пируватдегидрогеназы или β-окислением. Однако ацетил-CoA не может проникать через митохондриальную мембрану и подаваться в виде цитрата в цитоплазму. Ацетил-CoA, обеспечиваемый цитоплазме из этого цитрата под действием ACL, служит в качестве материала-источника для жирных кислот и холестерина, de novo синтезируемых в цитоплазме.
Нуклеиновые кислоты данного изобретения, кодирующие АТФ:цитратлиазу
АТФ:цитратлиаза (ACL) в данном изобретении включает MaACL1 и MaACL2. Соответствие между кДНК, CDS, ORF и аминокислотной последовательностью суммировано в таблице 1 ниже для каждой из нуклеиновых кислот, кодирующих MaACL1 и MaACL2.
Таким образом, последовательности, родственные MaACL1 данного изобретения, включают SEQ ID NO:11 (аминокислотную последовательность), SEQ ID NO:9 (последовательность, представляющую ORF-область MaACL1), SEQ ID NO:7 (последовательность, представляющую CDS-область MaACL1) и SEQ ID NO:5 (нуклеотидную последовательность кДНК для MaACL1). Среди них SEQ ID NO:7 соответствует нуклеотидам 178-3717 SEQ ID NO:5, тогда как SEQ ID NO:9 соответствует нуклеотидам 178-3714 SEQ ID NO:5 или нуклеотидам 1-3537 SEQ ID NO:7.
Подобным образом последовательности, родственные MaACL2, включают SEQ ID NO:12 (аминокислотную последовательность MaACL2), SEQ ID NO:10 (последовательность, представляющую ORF-область MaACL2), SEQ ID NO:8 (последовательность, представляющую CDS-область MaACL2) и SEQ ID NO:6 (нуклеотидную последовательность кДНК для MaACL2). Среди них SEQ ID NO:8 соответствует нуклеотидам 21-3545 SEQ ID NO:6, тогда как SEQ ID NO:10 соответствует нуклеотидам 21-3542 SEQ ID NO:6 или нуклеотидам 1-3522 SEQ ID NO:8.
Нуклеиновые кислоты данного изобретения включают одноцепочечные и двухцепочечные ДНК, а также их комплементарные РНК, которые могут быть либо природными, либо полученными искусственно. ДНК включают, но не ограничиваются ими, геномные ДНК, кДНК, соответствующие этим геномным ДНК, химически синтезированные ДНК, ПЦР-амплифицированные ДНК, а также их комбинации и гибриды ДНК-РНК.
Предпочтительные варианты нуклеиновых кислот данного изобретения включают (а) нуклеотидную последовательность, показанную в SEQ ID NO:9 или SEQ ID NO:10, (b) нуклеотидную последовательность, кодирующую белок, состоящий из аминокислотной последовательности, показанной в SEQ ID NO:11 или 12, и (c) нуклеотидную последовательность, показанную в SEQ ID NO:5 или 6.
Вышеуказанная нуклеотидная последовательность, показанная в SEQ ID NO:9 или SEQ ID NO:10, нуклеотидная последовательность, кодирующая белок, состоящий из аминокислотной последовательности, показанной в SEQ ID NO:11 или 12, и нуклеотидная последовательность, показанная в SEQ ID NO:5 или 6, представлены в таблице 1.
Для получения этих нуклеотидных последовательностей данные EST нуклеотидных последовательностей или геномные ДНК из организмов, имеющих АТФ:цитратлиазную активность (далее в описании называемую как ACL-активность), могут быть использованы для поиска нуклеотидной последовательности, кодирующей белок, имеющий высокую идентичность с известными белками, обладающими ACL-активностью. Предпочтительными организмами, обладающими ACL-активностью, являются липидпродуцирующие грибы, включая, но не ограничиваясь этим, M. alpina.
Для EST-анализа сначала получают кДНК-библиотеку. Что касается способов получения кДНК-библиотеки, может быть сделана ссылка на “Molecular Cloning, A Laboratory Manual 3rd ed.” (Cold Spring Harbor Press (2001)). Альтернативно, может быть использован коммерчески доступный набор для получения кДНК-библиотеки. Способами получения кДНК-библиотеки, подходящими для данного изобретения, являются, например, следующие, а именно, подходящий штамм M. alpina, липидпродуцирующего белка, инокулируют в подходящую среду и предварительно культивируют в течение подходящего периода времени. Условия культивирования, подходящие для этого предварительного культивирования, включают, например, состав среды: 1,8% глюкоза, 1% дрожжевой экстракт и рН 6,0, период культивирования 3 дня и температуру культивирования 28°C. Затем этот предварительно культивированный продукт подвергают основному культивированию в подходящих условиях. Состав среды, подходящий для основного культивирования, может быть, например, следующим: 1,8% глюкоза, 1% соевый порошок, 0,1% оливковое масло, 0,01% Адеканол, 0,3% KH2PO4, 0,1% Na2SO4, 0,05% CaCl2·2H2O, 0,05% MgCl2·6H2O и pH 6,0. Условиями культивирования, подходящими для основного культивирования, могут быть, например, аэробная вращающаяся культура при 300 об/мин, 1 об/об/мин, 26°C в течение 8 дней. В процессе культивирования может быть добавлено подходящее количество глюкозы. В подходящие моменты времени в процессе основного культивирования берут пробы культивируемого продукта, из которых затем собирают клетки для получения общей РНК. Для получения общей РНК можно использовать любой известный способ, такой как способ с гидрохлоридом гуанидина/CsCl. Полученная общая РНК может быть обработана с использованием коммерчески доступного набора для очистки поли(A)+РНК. Дополнительно, кДНК-библиотека может быть получена с использованием коммерчески доступного набора. Затем любой клон из полученной таким образом кДНК-библиотеки определяют на его нуклеотидную последовательность с использованием праймеров, которые конструируют на векторе для возможности определения нуклеотидной последовательности вставки. В результате могут быть получены EST. Например, при использовании набора ZAP-cDNA GigapackIII Gold Cloning Kit (STRATAGENE) для получения кДНК-библиотеки может быть выполнено направленное клонирование.
Идентичность нуклеотидных последовательностей между CDS MaACL1 и MaACL2 данного изобретения равна 79,1%. Подобным образом идентичность аминокислотных последовательностей между MaACL1 и MaACL2 равна 87,1%. Следует отметить, что при анализе с использованием BLASTP аминокислотные последовательности MaACL1 и MaACL2 данного изобретения имеют идентичность 61,6% и 61,9%, соответственно, с полученным из Ustilago maydis 521 предположительным белком (фигура 5) (UM01005.1, GB accession No. EAK82015, gi46096782), имеющим самую низкую E-величину.
Данное изобретение включает также нуклеиновые кислоты, функционально эквивалентные нуклеиновой кислоте, содержащей приведенную выше нуклеотидную последовательность, показанную в SEQ ID NO:9 или 10 (в описании далее называемую также “нуклеотидной последовательностью данного изобретения”), или нуклеотидную последовательность, кодирующую белок, состоящий из аминокислотной последовательности, показанной в SEQ ID NO:11 или 12 (в описании далее называемую также “аминокислотной последовательностью данного изобретения”). Фраза “функционально эквивалентный” означает, что белок, кодируемый нуклеотидной последовательностью данного изобретения, или белок, состоящий из аминокислотной последовательности данного изобретения, имеет ACL-активность или, альтернативно, означает наличие не только ACL-активности, но также свойства активности фермента, равных таковым белка, кодируемого нуклеотидной последовательностью данного изобретения, или белка, состоящего из аминокислотной последовательности данного изобретения. Свойства активности фермента включают все свойства, такие как изменения активности в ответ на изменения температуры, рН, концентрации соли или концентрации субстрата в условиях реакции фермента, величины Km, субстратную специфичность и т.д.
ACL данного изобретения катализирует реакцию, в которой ацетил-CoA, оксалоацетат, АДФ и Pi генерируются из АТФ, цитрата и CoA. “ACL-активность” фермента может быть измерена известным способом. Например, может быть сделана ссылка на следующий документ: Plant Physiol., 2002, 130, 740-56.
“ACL-активность” в настоящем изобретении может быть измерена, например, следующим образом. Получают цитоплазматическую фракцию из клеток дрожжей (не имеющих эндогенного гена ACL), которые трансформированы для экспрессии MaACL1 или MaACL2 данного изобретения, как описано, например, в Plant Physiol., 2002, 130, 740-56. К реакционному раствору, содержащему 20 мМ MgCl2, 1 мМ DTT, 10 мМ АТФ, 10 мМ цитрат, 0,2 мМ CoA, 6 единиц малатдегидрогеназы и 0,1 мМ NADH в 10 мМ Трис-HCl (pH 8,4), добавляют вышеуказанную цитоплазматическую фракцию, и реакцию проводят при 28°C в течение подходящего периода времени, а затем измеряют на изменения в A340 (уменьшение уровней NADH) с использованием абсорбциометра для количественного определения тем самым ”ACL-активности”.
Используемая в настоящем описании фраза ”имеющий ACL-активность” означает имеющий активность 1,0 нмоль·мин-1·мг-1 или более, хотя без какого-либо ограничения, пока уменьшение уровней NADH может быть определено в описанном выше анализе.
Кроме того, было подтверждено, что ACL-активность MaACL1 данного изобретения (SEQ ID NO:11) зависит от концентрации Mg2+. Более конкретно активность достигала пика при концентрации Mg2+ 5-10 мМ, а затем уменьшалась с увеличениями концентрации Mg2+ (фигура 6). Было обнаружено, что MaACL1 также проявляет максимальную активность при отношении АТФ:цитрат:Mg2+ приблизительно 1:1:1.
Такие нуклеиновые кислоты, которые являются функционально эквивалентными нуклеиновым кислотам данного изобретения, включают нуклеиновую кислоту, содержащую нуклеотидную последовательность, показанную в любой нуклеотидной последовательности подпунктов (а)-(е) ниже. Следует отметить, что при использовании для описания нуклеотидных последовательностей, перечисленных ниже, предполагается, что фраза “приведенная выше активность данного изобретения” означает “имеющая ACL-активность и/или свойства активности фермента, равные ACL-активности и/или свойствам активности фермента белка, кодируемого нуклеотидной последовательностью данного изобретения, или белка, состоящего из аминокислотной последовательности данного изобретения”, определенной выше.
(a) Нуклеотидная последовательность, которая кодирует белок, состоящий из аминокислотной последовательности с делецией, заменой или добавлением одной или нескольких аминокислот в аминокислотной последовательности, показанной в SEQ ID NO:11 или SEQ ID NO:12, и имеющий активность данного изобретения.
Нуклеотидные последовательности, содержащиеся в нуклеиновых кислотах данного изобретения, включают нуклеотидную последовательность, которая кодирует белок, состоящий из аминокислотной последовательности с делецией, заменой или добавлением одной или нескольких аминокислот в аминокислотной последовательности, показанной в SEQ ID NO:11 или SEQ ID NO:12, и имеющий вышеуказанную активность данного изобретения.
Более конкретно, эта последовательность является нуклеотидной последовательностью, которая кодирует белок, состоящий из:
(i) аминокислотной последовательности с делецией одной или более (предпочтительно одной или нескольких (например, 1-350, 1-300, 1-250, 1-200, 1-150, 1-100, 1-50, 1-30, 1-25, 1-20, 1-15, 1-10, более предпочтительно 1-5)) аминокислот в аминокислотной последовательности, показанной в SEQ ID NO:11 или 12;
(ii) аминокислотной последовательности с заменой другими аминокислотами одной или более (предпочтительно одной или нескольких (например, 1-350, 1-300, 1-250, 1-200, 1-150, 1-100, 1-50, 1-30, 1-25, 1-20, 1-15, 1-10, более предпочтительно 1-5)) аминокислот в аминокислотной последовательности, показанной в SEQ ID NO:11 или 12;
(iii) аминокислотной последовательности с добавлением других одной или более (предпочтительно одной или нескольких (например, 1-350, 1-300, 1-250, 1-200, 1-150, 1-100, 1-50, 1-30, 1-25, 1-20, 1-15, 1-10, более предпочтительно 1-5)) аминокислот в аминокислотной последовательности, показанной в SEQ ID NO:11 или 12; или
(iv) аминокислотной последовательности с любой комбинацией (i)-(iii), описанных выше,
и имеющий описанную выше активность данного изобретения.
Среди приведенных выше модификаций замена является предпочтительно консервативной, что означает замену определенного аминокислотного остатка другим остатком, имеющим сходные физические и химические характеристики. Эта замена может быть любой заменой, пока она по существу не изменяет структурные характеристики исходной последовательности. Например, возможна любая замена, пока эта замененная аминокислота не разрушает спираль, присутствующую в исходной последовательности, или не разрушает любой другой тип вторичной структуры, характеризующей исходную последовательность.
Консервативную замену обычно вводят путем синтеза в биологических системах или химического пептидного синтеза, предпочтительно химического пептидного синтеза. В этом случае заместители могут включать неприродные аминокислотные остатки, а также пептидомиметики и обращенные или инвертированные формы аминокислотных последовательностей, в которых незамещенные области являются обращенными или инвертированными.
Аминокислотные остатки классифицированы и перечислены ниже в группах взаимозаменяемых членов, но не ограничиваемых ими, следующим образом:
Группа A: лейцин, изолейцин, норлейцин, валин, норвалин, аланин, 2-аминобутановая кислота, метионин, O-метилсерин, трет-бутилглицин, трет-бутилаланин и циклогексилаланин;
Группа B: аспарагиновая кислота, глутаминовая кислота, изоаспарагиновая кислота, изоглутаминовая кислота, 2-аминоадипиновая кислота и 2-аминосубериновая кислота;
Группа C: аспарагин и глутамин;
Группа D: лизин, аргинин, орнитин, 2,4-диаминобутановая кислота и 2,3-диаминопропионовая кислота;
Группа E: пролин, 3-гидроксипролин и 4-гидроксипролин;
Группа F: серин, треонин и гомосерин; и
Группа G: фенилаланин и тирозин.
Неконсервативная замена может включать замену члена одного из приведенных выше классов членом из другого класса. В этом случае, для цели сохранения биологических функций белков данного изобретения, предпочтительно учитывать индекс гидрофобности аминокислот (индекс гидрофобных аминокислот) (Kyte et al., J. Mol. Biol., 157:105-131(1982)).
В случае неконсервативной замены, аминокислотные замены могут быть также выполнены на основе гидрофильности.
В этом описании и на фигурах данной заявки нуклеотиды, аминокислоты и их аббревиатуры соответствуют нуклеотидам, аминокислотам и их аббревиатурам, установленным Комиссией IUPAC-IUB по биохимической номенклатуре или обычно используемым в данной области, например, как описано в Immunology--A Synthesis (second edition, edited by E.S. Golub and D.R. Gren, Sinauer Associates, Sunderland, Massachusetts (1991)). Кроме того, предполагается, что аминокислоты, которые могут иметь оптические изомеры, представляют их L-изомер, если нет другого указания.
Стереоизомеры (например, D-аминокислоты) вышеуказанных аминокислот, неприродные аминокислоты, такие как α,α-дизамещенные аминокислоты, N-алкиламинокислоты, молочная кислота и другие нетрадиционные аминокислоты, могут быть также членами, составляющими белки данного изобретения.
Следует отметить, что в обозначении белка, используемом в описании, левое направление является амино-концевым направлением, а правое направление является карбокси-концевым направлением в соответствии со стандартным применением и соглашением.
Подобным образом, если не указано другое, левый конец одноцепочечных полинуклеотидных последовательностей является 5'-концом и левое направление двухцепочечных полинуклеотидных последовательностей называют 5'-направлением.
Квалифицированные специалисты в данной области будут способны сконструировать и получить подходящие мутанты описанных в данном документе белков, используя известные в данной области способы. Например, при нацеливании на область, которая является, по-видимому, менее важной для биологической активности белка данного изобретения, можно идентифицировать подходящую область в молекуле белка, структура которого может быть изменена без нарушения биологической активности белка данного изобретения. Можно также идентифицировать остатки или области в этой молекуле, которые являются консервативными между сходными белками. Кроме того, можно также вводить консервативные аминокислотные замены в область, которая является, по-видимому, важной для биологической активности или структуры белка данного изобретения, без нарушения биологической активности и без вредного действия на полипептидную структуру этого белка.
Например, MaACL1 и MaACL2 данного изобретения имеют идентичность аминокислотных последовательностей приблизительно 62% с предположительным полученным из базидиомицета U. maydis ACL-подобным белком (gi46096782), а также имеют определенную идентичность с полученными у животных предположительными ACL- или ACL-подобными белковыми последовательностями, включающими последовательности мыши (gi_29293809), человека (gi_38569421), Drosophila (gi_28372804) и нематоды (gi_17551266) (фигура 5). В качестве примера возможных аминокислотных остатков, которые могут быть мутированы, остатки, отличные от консервативных остатков, среди всех 7 последовательностей, показанных на фигуре 5, могут быть определены как возможные аминокислотные остатки для образования мутаций, или альтернативно, остатки, отличные от консервативных остатков, среди по меньшей мере 4, 5 или 6 последовательностей из этих 7 последовательностей могут быть определены как возможные аминокислотные остатки образования мутаций.
Альтернативно, три подчеркнутые области, указанные, соответственно, сплошной, пунктирной и двойной линиями на фигуре 5, являются особенно важными участками для АТФ:цитратлиазы/сукцинил-CoA-лиазы (PROSITE PS01216, PS00399 и PS01217, соответственно, от N-концевой стороны). А именно, мутанты по данному изобретению не ограничиваются никаким образом, пока вышеуказанные участки являются консервативными. Таким образом, в качестве другого примера возможных аминокислотных остатков, которые могут быть мутированы, аминокислотные остатки, отличные от остатков этих трех подчеркнутых областей, показанных на фигуре 5, могут быть определены как возможные аминокислотные остатки для образования мутаций.
Кроме того, MaACL1 и MaACL2 данного изобретения имеют аминокислотную идентичность 87,1% друг с другом (фигура 4). В качестве еще одного примера возможных аминокислотных остатков, которые могут быть мутированы, остатки, которые не являются консервативными между MaACL1 и MaACL2, могут быть определены как возможные аминокислотные остатки, которые могут быть мутированы.
Квалифицированные специалисты в данной области смогут проводить так называемое исследование структуры-функции, при котором идентифицируют остатки, в белке данного изобретения и в его сходном пептиде, которые являются важными для биологической активности или структуры, и сравнивать аминокислотные остатки между этими двумя пептидами, предсказывая, тем самым, какие остатки в белке, сходном с белком данного изобретения, являются аминокислотными остатками, соответствующими аминокислотным остаткам, важным для биологической активности или структуры. Кроме того, химически сходные аминокислотные замены могут быть выбраны для предсказанных таким образом аминокислотных остатков, для отбора тем самым мутанта, который сохраняет биологическую активность белка данного изобретения. Подобным образом квалифицированные специалисты в данной области смогут также анализировать трехмерную структуру и аминокислотную последовательность этого белкового мутанта. Полученные таким образом результаты данного анализа могут быть дополнительно использованы для предсказания сопоставления аминокислотных остатков относительно этой трехмерной структуры данного белка. Поскольку аминокислотные остатки, предсказанные как остатки, находящиеся на поверхности белка, могут участвовать в важных взаимодействиях с другими молекулами, квалифицированные специалисты в данной области смогут получить мутант, который не вызывает изменения в этих аминокислотных остатках, которые, как предсказано, находятся на поверхности данного белка, на основе результатов анализов, упомянутых выше. Кроме того, квалифицированные специалисты в данной области смогут также получить мутант, имеющий единственную аминокислотную замену для любого из аминокислотных остатков, составляющих белок данного изобретения. Эти мутанты могут быть подвергнуты скринингу любым известным анализом для сбора информации об индивидуальных мутантах, которая, в свою очередь, позволяет оценивать применимость индивидуальных аминокислотных остатков, составляющих белок данного изобретения, для проведения сравнения со следующим случаем, в котором мутант, имеющий замену конкретного аминокислотного остатка, проявляет более низкую биологическую активность, чем активность белка данного изобретения, в котором такой мутант не проявляет биологической активности, или в котором такой мутант проявляет неподходящую активность в ингибировании биологической активности белка данного изобретения. Кроме того, на основе информации, собранной из таких рутинных экспериментов, квалифицированные специалисты в данной области могут легко анализировать аминокислотные замены, нежелательные для мутантов белка данного изобретения, либо отдельно, либо в комбинации с другими мутациями.
Как описано выше, белок, состоящий из аминокислотной последовательности с делецией, заменой или добавлением одной или нескольких аминокислот в аминокислотной последовательности, показанной в SEQ ID NO:11 или 12, может быть получен в соответствии с такими способами, как сайт-направленный мутагенез, описанный в “Molecular Cloning, A Laboratory Manual 3rd ed.” (Cold Spring Harbor Press (2001)), “Current Protocols in Molecular Biology” (John Wiley & Sons (1987-1997), Kunkel (1985) Proc. Natl. Acad. Sci. USA 82: 488-92 и Kunkel (1988) Method. Enzymol. 85: 2763-6. Получение мутанта с такой мутацией, включающей делецию, замену или добавление, может быть выполнено, например, с использованием известных процедур, таких как способ Кункеля или способ Gapped duplex с использованием набора для введения мутации на основе сайт-направленного мутагенеза, такого как набор QuikChange™ для сайт-направленного мутагенеза (Stratagene), система GeneTailor™ для сайт-направленного мутагенеза (Invitrogen) или система для сайт-направленного мутагенеза TaKaRa (например, Mutan-K, Mutan-Super Express Km; Takara Bio Inc., Japan).
Способы для возможности получения делеции, замены или добавления одной или нескольких аминокислот в аминокислотных последовательностях белков при сохранении их активности включают вышеупомянутый сайт-направленный мутагенез, а также другие способы, такие как способы обработки гена мутагеном, и способы, в которых ген селективно извлекают для удаления, замены или добавления выбранных нуклеотида или нуклеотидов, а затем лигируют.
Одной предпочтительной нуклеотидной последовательностью, содержащейся в нуклеиновых кислотах данного изобретения, является нуклеотидная последовательность, которая кодирует белок, состоящий из аминокислотной последовательности с делецией, заменой или добавлением 1-10 аминокислот в аминокислотной последовательности, показанной в SEQ ID NO:11 или 12, и имеющий ACL-активность.
Не существует ограничений в отношении количества или сайтов аминокислотных мутаций или модификаций в белке данного изобретения, пока полученный мутант сохраняет ACL-активность или свойства активности фермента, равные активности белка, кодируемого нуклеотидной последовательностью данного изобретения, или белка, состоящего из аминокислотной последовательности данного изобретения.
(b) Нуклеотидная последовательность, которая может гибридизоваться в строгих условиях с нуклеиновой кислотой, состоящей из нуклеотидной последовательности, комплементарной нуклеотидной последовательности, состоящей из SEQ ID NO:9 или SEQ ID NO:10, и которая кодирует белок, имеющий вышеуказанную активность данного изобретения.
Нуклеотидные последовательности, содержащиеся в нуклеиновых кислотах данного изобретения, включают нуклеотидную последовательность, которая может гибридизоваться в строгих условиях с нуклеиновой кислотой, состоящей из нуклеотидной последовательности, комплементарной нуклеотидной последовательности, состоящей из SEQ ID NO:9 или SEQ ID NO:10, и которая кодирует белок, имеющий вышеуказанную активность данного изобретения.
SEQ ID NO:9 или SEQ ID NO:10 и вышеуказанная активность данного изобретения являются такими, как описано выше.
Для получения вышеуказанной нуклеотидной последовательности может быть получен подходящий зонд способом, известным квалифицированным специалистам в данной области, и этот зонд может быть использован в известных способах гибридизации, таких как гибридизация колоний, гибридизация бляшек или блоттинг по Саузерну, для получения нуклеотидной последовательности из кДНК-библиотеки, геномной библиотеки или т.п.
Что касается подробных процедур для способов гибридизации, может быть сделана ссылка на “Molecular Cloning, A Laboratory Manual 3rd ed.” (Cold Spring Harbor Press (2001), в частности разделы 6-7), “Current Protocols in Molecular Biology” (John Wiley & Sons (1987-1997), в частности разделы 6.3-6.4), “DNA Cloning 1: Core Techniques, A Practical Approach 2nd ed.” (Oxford University (1995), в частности раздел 2.10, для условий гибридизации).
Сила гибридизации определяется прежде всего условиями гибридизации, более предпочтительно условиями гибридизации и условиями промывания. Термин “строгие условия”, используемый в данном описании, включает умеренно строгие условия и условия высокой строгости.
Более конкретно, умеренно строгие условия включают, например, условия гибридизации 1 × SSC - 6 × SSC при 42°C-55°C, более предпочтительно 1 × SSC - 3 × SSC при 45°C-50°C и наиболее предпочтительно 2 × SSC при 50°C. В некоторых случаях, например, когда раствор для гибридизации содержит приблизительно 50% формамид, используют температуру, которая на 5°C-15°C ниже, чем вышеуказанная температура. Условиями промывания могут быть 0,5 × SSC - 6 × SSC при 40°C -60°C. В процессе гибридизации и промывания обычно может быть добавлен 0,05%-0,2% SDS (ДСН), предпочтительно приблизительно 0,1% ДСН.
Условия высокой строгости (в высокой степени строгие условия) включают гибридизацию и/или промывание при более высокой температуре и/или более низкой концентрации соли по сравнению с умеренно строгими условиями. Например, условиями гибридизации могут быть 0,1 × SSC - 2 × SSC при 55°C-65°C, более предпочтительно 0,1 × SSC - 1 × SSC при 60°C-65°C и наиболее предпочтительно 0,2 × SSC при 63°C. Условиями промывания могут быть 0,2 × SSC - 2 × SSC при 50°C-68°C и более предпочтительно 0,2 × SSC при 60°C-65°C.
Условия гибридизации, особенно применимые в данном изобретении, включают, но не ограничиваются ими, предварительную гибридизацию в 5 × SSC, 1% ДСН, 50 мМ Трис-HCl (pH 7,5) и 50% формамиде при 42°C, инкубацию в течение ночи при 42°C в присутствии зонда для образования гибридов и последующие три промывки в 0,2 × SSC, 0,1% ДСН при 65°C в течение 20 минут.
Можно также использовать коммерчески доступный набор для гибридизации, в котором применяется нерадиоактивное вещество в качестве зонда. Конкретные примеры включают гибридизацию с набором DIG для детектирования нуклеиновых кислот (Roche Diagnostics) или с системой прямого электрохемилюминесцентного (ECL) мечения и детектирования (Amersham).
Предпочтительной нуклеотидной последовательностью, включенной в данное изобретение, является нуклеотидная последовательность, которая может гибридизоваться в условиях 2 × SSC при 50°C с нуклеиновой кислотой, состоящей из нуклеотидной последовательности, комплементарной нуклеотидной последовательности, состоящей из SEQ ID NO:9 или SEQ ID NO:10, и которая кодирует белок, имеющий ACL-активность.
(c) Нуклеотидная последовательность, которая состоит из нуклеотидной последовательности, имеющей идентичность 70% или более с нуклеотидной последовательностью, состоящей из SEQ ID NO:9 или SEQ ID NO:10, и которая кодирует белок, имеющий вышеуказанную активность данного изобретения.
Нуклеотидные последовательности, содержащиеся в нуклеиновых кислотах данного изобретения, включают нуклеотидную последовательность, которая состоит из нуклеотидной последовательности, имеющей идентичность 70% или более с нуклеотидной последовательностью, состоящей из SEQ ID NO:9 или SEQ ID NO:10, и которая кодирует белок, имеющий вышеуказанную активность данного изобретения.
Предпочтительные примеры включают нуклеиновые кислоты, содержащие нуклеотидную последовательность, которая имеет идентичность по меньшей мере 75%, более предпочтительно 80%, даже более предпочтительно 85% (например, 90%, 95%, более предпочтительно 98% или 99%) с последовательностью нуклеиновой кислоты, показанной в SEQ ID NO:9 или 10, и которая кодирует белок, имеющий вышеуказанную активность данного изобретения. Как описано выше, идентичность между MaACL1 (SEQ ID NO:9) и MaACL2 (SEQ ID NO:10) равна 79,1%. Нуклеиновые кислоты данного изобретения включают нуклеиновые кислоты, являющиеся по меньшей мере на 80% или более последовательностью нуклеиновой кислоты, показанной в SEQ ID NO:9 или 10, и являющиеся сходными с этими двумя последовательностями.
Процентная идентичность между двумя последовательностями нуклеиновых кислот может быть определена визуальным исследованием и математическим расчетом или, более предпочтительно, с использованием компьютерной программы для сравнения информации последовательности между двумя нуклеиновыми кислотами. Компьютерные программы для сравнения последовательностей включают, например, программу BLASTN (Altschul et al. (1990) J. Mol. Biol. 215: 403-10) версию 2.2.7, доступную для применения через Web-сайт National Library of Medicine: http://www.ncbi.nlm.nih.gov/blast/bl2seq/bls.html, или алгоритм WU-BLAST 2.0. Стандартные установки параметров по умолчанию для WU-BLAST 2.0 описаны в следующем сайте Интернета: http://blast.wustl.edu.
(d) Нуклеотидная последовательность, которая кодирует аминокислотную последовательность, имеющую идентичность 70% или более с аминокислотной последовательностью, состоящей из SEQ ID NO:11 или SEQ ID NO:12, и которая кодирует белок, имеющий вышеуказанную активность данного изобретения.
Нуклеотидные последовательности, содержащиеся в нуклеиновых кислотах данного изобретения, включают нуклеотидную последовательность, которая кодирует аминокислотную последовательность, имеющую идентичность 70% или более с аминокислотной последовательностью, состоящей из SEQ ID NO:11 или SEQ ID NO:12, и которая кодирует белок, имеющий вышеуказанную активность данного изобретения. Белки, кодируемые нуклеиновыми кислотами данного изобретения, могут быть также белками, имеющими идентичность с аминокислотной последовательностью MaACL1 или MaACL2, пока они являются функционально эквивалентными белкам, имеющим вышеуказанную активность данного изобретения.
Конкретные примеры включают аминокислотные последовательности, имеющие идентичность 75% или более, предпочтительно 85% или более, более предпочтительно 88% (например, 90%, 85%, 98%, более предпочтительно 99%) или более с аминокислотной последовательностью, показанной в SEQ ID NO:11 или SEQ ID NO:12. Как описано выше, идентичность аминокислотных последовательностей между MaACL1 (SEQ ID NO:11) и MaACL2 (SEQ ID NO:12) равна 87,1%. Белки, кодируемые нуклеиновыми кислотами данного изобретения, включают белки, являющиеся по меньшей мере на 88% или более аминокислотной последовательностью, показанной в SEQ ID NO:11 или 12, и являющиеся сходными с этими двумя последовательностями.
Предпочтительной нуклеотидной последовательностью, содержащейся в нуклеиновых кислотах данного изобретения, является нуклеотидная последовательность, которая кодирует аминокислотную последовательность, имеющую идентичность 90% или более с аминокислотной последовательностью, состоящей из SEQ ID NO:11 или SEQ ID NO:12, и которая кодирует белок, имеющий вышеуказанную активность данного изобретения. Более предпочтительной является нуклеотидная последовательность, которая кодирует аминокислотную последовательность, имеющую идентичность 95% или более с аминокислотной последовательностью, состоящей из SEQ ID NO:11 или SEQ ID NO:12, и которая кодирует белок, имеющий вышеуказанную активность данного изобретения.
Процентная идентичность между двумя аминокислотными последовательностями может быть определена визуальным исследованием и математическим расчетом. Альтернативно, процентная идентичность может быть определена с использованием компьютерной программы. Примеры такой компьютерной программы включают, например, программу BLAST, FASTA (Altschul et al., J. Mol. Biol., 215:403-410 (1990)) и ClustalW. В частности, различные условия (параметры) для поиска идентичности с программой BLAST описаны Altschul et al. (Nucl. Acids. Res., 25, p.3389-3402, 1997) и публично доступны через Web-сайт Национального Центра Информации по Биотехнологии (NCBI) или банк данных ДНК Японии (DDBJ) (BLAST Manual, Altschul et al., NCB/NLM/NIH Bethesda, MD 20894; Altschul et al.). Можно также использовать такую программу, как программа обработки генетической информации GENETYX Ver.7 (Genetyx Corporation, Japan), DINASIS Pro (Hitachisoft, Japan) или Vector NTI (Infomax) для определения процентной идентичности.
Некоторые схемы сопоставления для выстраивания аминокислотных последовательностей могут также приводить к спариванию специфической короткой области этих последовательностей, и можно также детектировать область с очень высокой идентичностью последовательностей в такой малой сопоставленной области, даже когда нет существенного родства между используемыми полноразмерными последовательностями. Кроме того, алгоритм BLAST использует матрицу оценивания аминокислот BLOSUM62, и необязательными параметрами, которые могут быть использованы, являются следующие: (A) включение фильтра для маскировки сегментов запрашиваемой последовательности, которые имеют низкую композиционную комплексность (определенную программой SEG Wootton и Federhen (Computers and Chemistry, 1993); см. также Wootton and Federhen, 1996, “Analysis of compositionally biased regions in sequence databases,” Methods Enzymol., 266: 554-71), или сегментов, состоящих из внутренних повторов короткой периодичности (определенных при помощи программы XNU Claverie and States (Computers and Chemistry, 1993)), и (B) порог статистической значимости для сообщения спариваний против последовательностей базы данных, или Е-оценки (для ожидаемой вероятности спариваний, обнаруживаемых только случайно, в соответствии со стохастической моделью Karlin and Altschul, 1990; если статистическая значимость, приписываемая паре, больше, чем этот порог Е-оценки, эта пара не будет сообщаться).
(e) Нуклеотидная последовательность, которая может гибридизоваться в строгих условиях с нуклеиновой кислотой, состоящей из нуклеотидной последовательности, комплементарной нуклеотидной последовательности, кодирующей белок, состоящий из аминокислотной последовательности, показанной в SEQ ID NO:11 или 12, и которая кодирует белок, имеющий вышеуказанную активность данного изобретения.
Нуклеотидные последовательности, содержащиеся в нуклеиновых кислотах данного изобретения, включают нуклеотидную последовательность, которая может гибридизоваться в строгих условиях с нуклеиновой кислотой, состоящей из нуклеотидной последовательности, комплементарной нуклеотидной последовательности, кодирующей белок, состоящий из аминокислотной последовательности, показанной в SEQ ID NO:11 или 12, и которая кодирует белок, имеющий вышеуказанную активность данного изобретения.
Такой белок, состоящий из аминокислотной последовательности, показанной в SEQ ID NO:11 или 12, и условия гибридизации являются такими же, как описано выше.
Нуклеиновые кислоты данного изобретения включают также нуклеиновую кислоту, которая содержит нуклеотидную последовательность с делецией, заменой или добавлением одного или нескольких нуклеотидов в нуклеотидной последовательности, состоящей из SEQ ID NO:9 или SEQ ID NO:10 и кодирующей белок, имеющий вышеуказанную активность данного изобретения. Более конкретно, можно также использовать нуклеиновую кислоту, которая содержит нуклеотидную последовательность, выбранную из:
(i) нуклеотидной последовательности с делецией одного или более (предпочтительно одного или нескольких (например, 1-1050, 1-750, 1-700, 1-650, 1-600, 1-550, 1-500, 1-450, 1-400, 1-350, 1-300, 1-250, 1-200, 1-150, 1-100, 1-50, 1-30, 1-25, 1-20, 1-15, 1-10, более предпочтительно 1-5)) нуклеотидов в нуклеотидной последовательности, показанной в SEQ ID NO:9 или 10;
(ii) нуклеотидной последовательности с заменой другими нуклеотидами одного или более (предпочтительно одного или нескольких (например, 1-1050, 1-750, 1-700, 1-650, 1-600, 1-550, 1-500, 1-450, 1-400, 1-350, 1-300, 1-250, 1-200, 1-150, 1-100, 1-50, 1-30, 1-25, 1-20, 1-15, 1-10, более предпочтительно 1-5)) нуклеотидов в нуклеотидной последовательности, показанной в SEQ ID NO:9 или 10;
(iii) нуклеотидной последовательности с добавлением одного или более (предпочтительно одного или нескольких (например, 1-1050, 1-750, 1-700, 1-650, 1-600, 1-550, 1-500, 1-450, 1-400, 1-350, 1-300, 1-250, 1-200, 1-150, 1-100, 1-50, 1-30, 1-25, 1-20, 1-15, 1-10, более предпочтительно 1-5)) нуклеотидов в нуклеотидной последовательности, показанной в SEQ ID NO:9 или 10; или
(iv) нуклеотидной последовательности с любой комбинацией (i)-(iii), приведенных выше,и кодирующей белок, имеющий вышеуказанную активность данного изобретения.
Предпочтительные варианты нуклеиновых кислот данного изобретения включают также нуклеиновую кислоту, содержащую нуклеотидную последовательность, показанную в любом из подпунктов (a)-(c), приведенных ниже, или ее фрагмент:
(a) нуклеотидную последовательность, показанную в SEQ ID NO:9 или SEQ ID NO:10;
(b) нуклеотидную последовательность, кодирующую белок, состоящий из аминокислотной последовательности, показанной в SEQ ID NO:11 или SEQ ID NO:12; или
(c) нуклеотидную последовательность, показанную в SEQ ID NO:5 или SEQ ID NO:6.
Приведенные выше (a) нуклеотидная последовательность, показанная в SEQ ID NO:9 или SEQ ID NO:10, (b) нуклеотидная последовательность, кодирующая белок, состоящий из аминокислотной последовательности, показанной в SEQ ID NO:11 или 12, и (c) нуклеотидная последовательность, показанная в SEQ ID NO:5 или 6, представлены в таблице 1. Фрагменты этих последовательностей могут быть либо природными, либо искусственно полученными, включающими области, содержащиеся в приведенных выше нуклеотидных последовательностях, т.е. ORF, CDS, биологически активную область, область, используемую в качестве праймера, как описано далее, и область, которая может служить в качестве зонда.
Белки АТФ:цитратлиазы данного изобретения
Белки данного изобретения, которые могут быть либо природными, либо искусственно полученными, включают белок, состоящий из аминокислотной последовательности, показанной в SEQ ID NO:11 или 12, и белки, функционально эквивалентные этому белку. Такой белок, состоящий из аминокислотной последовательности, показанной в SEQ ID NO:11 или 12, является таким, как белок, описанный выше. “Белки, функционально эквивалентные” означают белки, имеющие “вышеуказанную активность данного изобретения”, как объяснено в разделе “Нуклеиновые кислоты данного изобретения, кодирующие АТФ:цитратлиазу”, описанном выше.
В данном изобретении белки, функционально эквивалентные белку, состоящему из аминокислотной последовательности, показанной в SEQ ID NO:11 или 12, включают белок, показанный в подпунктах (a) или (b) ниже:
(a) белок, который состоит из аминокислотной последовательности с делецией, заменой или добавлением одной или нескольких аминокислот в SEQ ID NO:11 или SEQ ID NO:12 и который имеет вышеуказанную активность данного изобретения; или
(b) белок, который состоит из аминокислотной последовательности, имеющей идентичность 70% или более с аминокислотной последовательностью, состоящей из SEQ ID NO:11 или SEQ ID NO:12, и который имеет вышеуказанную активность данного изобретения.
Среди описанного выше, аминокислотная последовательность с делецией, заменой или добавлением одной или нескольких аминокислот в SEQ ID NO:11 или 12, или аминокислотная последовательность, имеющая идентичность 70% или более с аминокислотной последовательностью, состоящей из SEQ ID NO:11 или SEQ ID NO:12, является последовательностью, объясненной в разделе “Нуклеиновые кислоты данного изобретения, кодирующие АТФ:цитратлиазу”, описанном выше. Предполагается, что фраза “белок, который имеет вышеуказанную активность данного изобретения”, включает также мутанты белка, кодируемого нуклеиновой кислотой, содержащей нуклеотидную последовательность SEQ ID NO:9 или SEQ ID NO:10, или мутированные белки с различными модификациями, такими как замена, делеция или добавление одной или нескольких аминокислот в аминокислотной последовательности, показанной в SEQ ID NO:11 или 12, а также их модифицированные белки, боковые цепи аминокислот которых или т.п. являются модифицированными, и их слитые с другими белками белки, пока эти белки имеют ACL-активность.
Белки данного изобретения могут быть также получены искусственно способами химического синтеза, такими как Fmoc-способ (флуоренилметилоксикарбонильный способ) и tBoc-способ (трет-бутилоксикарбонильный способ). Кроме того, для химического синтеза могут быть использованы пептидные синтезаторы, доступные от Advanced ChemTech, Perkin Elmer, Pharmacia, Protein Technology Instrument, Synthecell-Vega, PerSeptive, Shimadzu Corporation (Japan) или от других производителей.
Клонирование нуклеиновых кислот ACL
Нуклеиновые кислоты ACL данного изобретения могут быть клонированы, например, скринингом из кДНК-библиотеки с использованием подходящего зонда. Они могут быть также клонированы ПЦР-амплификацией с подходящими праймерами и последующим лигированием с подходящим вектором. Затем полученные таким образом клоны субклонируют в другой вектор.
Например, можно использовать коммерчески доступные плазмидные векторы, включая pBlue-Script™ SK(+) (Stratagene), pGEM-T (Promega), pAmp (TM: Gibco-BRL), p-Direct (Clontech) и pCR2.1-TOPO (Invitrogen). В случае использования ПЦР-амплификации праймерами могут быть любые области нуклеотидной последовательности, показанной, например, в SEQ ID NO:5 или 6. Затем выполняют ПЦР на кДНК, полученной из клеток M. Alpina, с вышеуказанными праймерами и ДНК-полимеразой или т.п. Хотя эта процедура может быть легко выполнена квалифицированными специалистами в данной области в соответствии, например, с “Molecular Cloning, A Laboratory Manual 3rd ed.” (Cold Spring Harbor Press (2001)), условия ПЦР в данном изобретении могут быть установлены, например, следующим образом:
Температура денатурации: 90-95°C
Температура отжига: 40-60°C
Температура удлинения: 60-75°C
Число циклов: 10 или более циклов.
Полученные продукты ПЦР могут быть очищены известным способом, например, с использованием набора (например, GENECLEAN (Funakoshi Co., Ltd., Japan), наборов для очистки ПЦР QIAquick (QIAGEN), ExoSAP-IT (GE Healthcare Bio-Sciences)), DEAE-целлюлозного фильтра или диализной пробирки. В случае использования агарозного геля продукты ПЦР подвергают разделению электрофорезом на агарозном геле, и фрагменты нуклеиновых кислот вырезают из этого агарозного геля с последующей очисткой, используя наборы GENECLEAN (Funakoshi Co., Ltd., Japan) или наборы для экстракции гелей QIAquick (QIAGEN), или путем замораживания-сдавливания и т.д.
Нуклеотидные последовательности этих клонированных нуклеиновых кислот могут быть определены с использованием секвенатора нуклеотидов.
Конструирование вектора для экспрессии ACL и получения трансформантов
Данное изобретение обеспечивает также рекомбинантный вектор, содержащий нуклеиновую кислоту, кодирующую MaACL1 или MaACL2 данного изобретения. Кроме того, данное изобретение обеспечивает трансформант, трансформированный указанным рекомбинантным вектором.
Такие рекомбинантный вектор и трансформант могут быть получены следующим образом. А именно, плазмиду, несущую нуклеиновую кислоту, кодирующую ACL данного изобретения, расщепляют рестрикционными ферментами. После этого расщепления может следовать затупление концов полимеразой Т4. Расщепленный ДНК-фрагмент очищают электрофорезом в агарозном геле. Этот ДНК-фрагмент может быть интегрирован в экспрессирующий вектор известным способом с получением вектора для экспрессии ACL. Этот экспрессирующий вектор вводят в хозяина с получением трансформанта, который затем используют для экспрессии желаемого белка.
В этом случае типы экспрессирующего вектора и хозяина никоим образом не ограничиваются, пока они позволяют экспрессию желаемого белка. Примеры хозяина включают грибы, бактерии, растения, животных или их клетки. Грибы включают мицелиальные грибы, такие как липидпродуцирующий M. alpina, и штаммы дрожжей, такие как Saccharomyces cerevisiae. Бактерии включают Escherichia coli (E. coli) и Bacillus subtilis. Подобным образом, растения включают масличные растения, такие как рапс, соя, хлопчатник, сафлор и лен.
В качестве липидпродуцирующих штаммов могут быть использованы штаммы, которые можно найти в MYCOTAXON, Vol. XLIV, NO. 2, pp. 257-265 (1992). Конкретные примеры включают микроорганизмы, принадлежащие к роду Mortierella, например микроорганизмы, принадлежащие к подроду Mortierella, такому как Mortierella elongata IFO8570, Mortierella exigua IFO8571, Mortierella hygrophila IFO5941, Mortierella alpina IFO8568, ATCC16266, ATCC32221, ATCC42430, CBS 219.35, CBS224.37, CBS250.53, CBS343.66, CBS527.72, CBS528.72, CBS529.72, CBS608.70, CBS754.68, а также микроорганизмы, принадлежащие к подроду Micromucor, такие как Mortierella isabellina CBS194.28, IFO6336, IFO7824, IFO7873, IFO7874, IFO8286, IFO8308, IFO7884, Mortierella nana IFO8190, Mortierella ramanniana IFO5426, IFO8186, CBS112.08, CBS212.72, IFO7825, IFO8184, IFO8185, IFO8287, Mortierella vinacea CBS236.82. Особенно предпочтительным является Mortierella alpina.
При использовании гриба в качестве хозяина желательно, чтобы нуклеиновая кислота данного изобретения была самореплицируемой в этом хозяине или имела структуру, встраиваемую в хромосому гриба. В то же время предпочтительно, чтобы она дополнительно содержала промотор и терминатор. При использовании M. alpina в качестве хозяина примеры экспрессирующего вектора включают pD4, pDuraSC и pDura5. Может быть использован любой промотор, пока он позволяет экспрессию в этом хозяине, и примеры включают промоторы, полученные из M. alpina, такие как промотор гена histonH4.1, промотор гена GAPDH (глицеральдегид-3-фосфатдегидрогеназы) и промотор гена TEF (фактора элонгации трансляции)
Способы введения рекомбинантного вектора в мицелиальные грибы (например, M. alpina) включают электропорацию, способы с использованием сферопластов и доставки частиц, а также прямую микроинъекцию ДНК в ядра. В случае применения ауксотрофного штамма-хозяина, штаммы, растущие на селективной среде, лишенной нутриентов, необходимых для этого штамма-хозяина, могут быть отобраны для получения тем самым трансформированных штаммов. Альтернативно, в случае, когда для трансформации используют маркерный ген устойчивости к лекарственному средству, культивирование может быть проведено с селективной средой, содержащей лекарственное средство, с получением посредством этого клеточных колоний, устойчивых к этому лекарственному средству.
При использовании дрожжей в качестве хозяина примеры экспрессирующего вектора включают pYE22m. Альтернативно, могут быть также использованы коммерчески доступные экспрессирующие векторы дрожжей, такие как pYES (Invitrogen) и pESC (STRATAGENE). Хозяева-дрожжи, подходящие для данного изобретения, включают, но не ограничиваются ими, штамм Saccharomyces cerevisiae EH13-15 (trp1, MATα). Примеры промотора, доступного для применения, включают промоторы, полученные из дрожжей, или т.п., такие как промотор GAPDH, промотор gal1 и промотор gal10.
Способы введения рекомбинантного вектора в клетки дрожжей включают способ с использованием ацетата лития, электропорацию и сферопластные способы, а также опосредованную декстраном трансфекцию, осаждение фосфатом кальция, polybrene-опосредованную трансфекцию, слияние протопластов, инкапсулирование полинуклеотида (полинуклеотидов) в липосомы и прямую микроинъекцию ДНК в ядра.
При использовании бактерии, такой как E. coli, в качестве хозяина примеры экспрессирующего вектора включают pGEX и pUC18, доступные от Pharmacia. Примеры промотора, доступного для применения, включают промоторы, полученные из E. coli, фага или т.п., такие как промотор trp, промотор lac, промотор PL и промотор PR. Способы введения рекомбинантного вектора в бактерии включают электропорацию и кальцийхлоридный способ.
Способ данного изобретения для получения жирных кислот или липидов
Данное изобретение предусматривает способ получения жирных кислот или липидов из вышеуказанного трансформанта, т.е. способ получения жирных кислот или липидов из культивируемого продукта, полученного культивированием вышеуказанного трансформанта, более конкретно, как описано ниже. Однако способ данного изобретения не ограничивается описанным ниже и может быть выполнен любым другим известным общепринятым способом.
Для культивирования организмов, трансформированных для экспрессии ACL, может быть использована любая среда, пока она является культуральным раствором (культуральной средой), имеющей подходящие рН и осмотическое давление, а также содержащей нутриенты, требуемые для роста каждого хозяина, микроэлементы и биоматериалы, такие как сыворотка или антибиотики. Например, в случае M. Alpina, трансформированного для экспрессии ACL, может быть использована среда, имеющая состав, показанный ниже, или подобный состав, без ограничения этим составом:
(1) 1,8% глюкоза, 1% соевый порошок, 0,1% оливковое масло, 0,01% Адеканол, 0,3% KH2PO4, 0,1% Na2SO4, 0,05% CaCl2·2H2O, 0,05% MgCl2·6H2O (pH 6,0); или
(2) среда GY (2,0% глюкоза, 1,0% дрожжевой экстракт).
Могут быть использованы любые условия культивирования, пока они пригодны для роста хозяина и являются достаточными для сохранения генерированного фермента в стабильном состоянии. Более конкретно, отдельные условия можно корректировать, включая степень анаэробности, период культивирования, температуру, влажность, стационарную культуру или встряхиваемую культуру. Культивирование можно выполнять при одних и тех же условиях (одностадийная культура) или с помощью так называемой двухстадийной или трехстадийной культуры с использованием двух или более различных условий культивирования. Для крупномасштабной культуры предпочтительной является двухстадийная или содержащая больше стадий культура вследствие высокой эффективности такой культуры.
С целью объяснения подробных процедур для способа получения жирных кислот данного изобретения ниже будет проиллюстрирована в качестве примера культура, в которой в качестве хозяина используется M. alpina. А именно, трансформированный штамм, несущий MaACL1 или MaACL2 данного изобретения, инокулируют в среду GY и встряхиваемую культуру инициируют при 28°C. Затем в день 3 культивирования к культуральному раствору добавляют 20% раствор глюкозы в объеме 1/20 и встряхиваемую культуру выдерживают в течение 8 дней или более в целом.
Жирные кислоты или липиды данного изобретения могут быть экстрагированы следующим образом. Однако способ данного изобретения не ограничивается описанным ниже и может быть выполнен любым другим известным общепринятым способом. Более конкретно, жирные кислоты или липиды данного изобретения могут быть экстрагированы следующим образом из микробных клеток, которые были трансформированы в соответствии с данным изобретением. Трансформированный штамм организма (например, липидпродуцирующего гриба или дрожжей) культивируют и затем обрабатывают рутинным образом, например центрифугированием или фильтрованием, с получением культивированных клеток. Эти клетки хорошо промывают водой и предпочтительно дополнительно высушивают. Высушивание может быть выполнено путем лиофилизации, сушки на воздухе и т.д. Высушенные клетки необязательно разрушают с использованием Dynomil или ультразвуком и затем экстрагируют органическим растворителем предпочтительно в токе азота. Примеры органического растворителя, доступного для применения, включают эфир, гексан, метанол, этанол, хлороформ, дихлорметан, петролейный эфир и т.д. Альтернативно, хорошие результаты могут быть также получены чередующейся экстракцией метанолом и петролейным эфиром или экстракцией однофазной системой растворителя хлорофом-метанол-вода. При дистилляции органического растворителя из этого экстракта при пониженном давлении могут быть получены содержащие жирные кислоты липиды.
Кроме того, жирные кислоты могут быть выделены в состоянии смешанных жирных кислот или смешанных эфиров жирных кислот из вышеуказанных, содержащих жирные кислоты липидов концентрированием и выделением рутинным образом (например, добавлением мочевины, отделением при охлаждении, колоночной хроматографией).
Способ получения липидов или жирных кислот данного изобретения позволяет эффективно получать жирные кислоты за счет увеличенного содержания жирных кислот в микробных клетках.
В качестве реального примера способа получения жирных кислот данного изобретения, с использованием M. alpina в качестве хозяина для создания трансформированного штамма, несущего MaACL1 или MaACL2 данного изобретения, из которого затем действительно экстрагировали жирные кислоты, было обнаружено, что содержание жирных кислот в этих микробных клетках увеличивалось приблизительно в 1,1 раза по сравнению с контрольным штаммом, который не был трансформирован ACL.
Жирные кислоты или липиды данного изобретения
Данное изобретение обеспечивает жирные кислоты и липиды в клетках, экспрессирующих MaACL1 или MaACL2 данного изобретения. Жирные кислоты могут быть свободными жирными кислотами или могут быть триглицеридами, фосфолипидами или т.п.
Используемый в данном описании термин “жирная кислота” относится к линейной (нормальной) или разветвленной монокарбоновой кислоте углевода с длинной цепью, представленной формулой ROOH (где R означает алкильную группу). Примеры включают, но не ограничиваются ими, миристиновую кислоту (тетрадекановую кислоту) (14:0), миристоленовую кислоту (тетрадеценовую кислоту) (14:1), пальмитиновую кислоту (гексадекановую кислоту) (16:0), пальмитоленовую кислоту (9-гексадеценовую кислоту) (16:1), стеариновую кислоту (октадекановую кислоту) (18:0), олеиновую кислоту (цис-9-окстадеценовую кислоту) (18:1(9)), вакценовую кислоту (11-октадеценовую кислоту) (18:1(11)), линолевую кислоту (цис,цис-9,12-октадекадиеновую кислоту) (18:2(9,12)), α-линоленовую кислоту (9,12,15-октадекатриеновую кислоту) (18:3(9,12,15)), γ-линоленовую кислоту (6,9,12-октадекатриеновую кислоту) (18:3(6,9,12)), стеаридоновую кислоту (6,9,12,15-октадекатетраеновую кислоту) (18:4(6,9,12,15)), арахиновую кислоту (икозановую кислоту) (20:0), (8,11-икозадиеновую кислоту) (20:2(8,11)), mead кислоту (5,8,11-икозатриеновую кислоту) (20:3(5,8,11)), дигомо-γ-линоленовую кислоту (8,11,14-икозатриеновую кислоту) (20:3(8,11,14)), арахидоновую кислоту (5,8,11,14-икозатетраеновую кислоту) (20:4(5,8,11,14)), эйкозатетраеновую кислоту (8,11,14,17-икозатетраеновую кислоту) (20:4(8,11,14,17)), эйкозапентаеновую кислоту (5,8,11,14,17-икозапентаеновую кислоту) (20:5(5,8,11,14,17)), бегеновую кислоту (докозановую кислоту) (22:0), (7,10,13,16-докозатетраеновую кислоту) (22:4(7,10,13,16)), (7,10,13,16,19-докозапентаеновую кислоту) (22:5(7,10,13,16,19)), (4,7,10,13,16-докозапентаеновую кислоту) (22:5(4,7,10,13,16)), (4,7,10,13,16,19-докозагексаеновую кислоту) (22:6(4,7,10,13,16,19)), лигноцериновую кислоту (тетрадокозановую кислоту) (24:0), нервоновую кислоту (цис-15-тетрадокозановую кислоту) (24:1) и церотовую кислоту (гексадокозановую кислоту) (26:0). Следует отметить, что вышеуказанные названия веществ являются обычными названиями, определенными биохимической номенклатурой IUPAC, и их систематические названия даются в скобках с цифрами, обозначающими число атомов углерода и положения двойных связей.
Используемый в настоящем описании термин “липид” означает простой липид, включающий соединение (например, глицерид), которое состоит из жирной кислоты и спирта, присоединенного через эфирную связь, или его аналог (например, эфир холестерина); комплексный липид, который генерируют из такого простого липида частичной модификацией фосфорной кислотой, аминокислотой (аминокислотами), сахаридом (сахаридами) или т.п.; или дериватизованный липид, который является гидролизатом вышеуказанного липида и не растворяется в воде.
Композиция жирных кислот данного изобретения может быть составлена из любого числа и любого типа жирных кислот, пока эта композиция является комбинацией одной или нескольких жирных кислот, выбранных из перечисленных выше жирных кислот.
Пищевые или другие продукты, содержащие жирные кислоты или липиды данного изобретения
Данное изобретение обеспечивает также пищевой продукт, содержащий вышеуказанные жирные кислоты или липиды. Жирные кислоты или липиды данного изобретения могут быть использованы рутинным образом для таких целей, как получение пищевых продуктов, содержащих жиры и масла, а также получения промышленных сырьевых материалов (сырьевых материалов для косметических изделий, фармацевтических препаратов (например, наружных препаратов для кожи), мыл и т.д. Косметические изделия (косметические композиции) или фармацевтические препараты (фармацевтические композиции) могут быть приготовлены в виде любой лекарственной формы, включая, но ими не ограничиваясь, растворы, пасты, гели, твердые вещества или порошки. Подобным образом, возможные формы пищевых продуктов включают фармацевтические препаративные формы, такие как капсулы, а также переработанные пищевые продукты, такие как обычные жидкие диеты, полурасщепленные усиленные питательные диеты, элементные диеты, годные для питья препараты или парентеральные питательные препараты, которые содержат жирные кислоты или липиды данного изобретения в смеси с белками, жирами, микроэлементами, витаминами, эмульгаторами, ароматизаторами и т.д.
Кроме того, примеры пищевого продукта данного изобретения включают, но не ограничиваются ими, питательные пищевые добавки, диетические пищевые продукты, функциональные пищевые продукты, продукты для детей, модифицированное молоко для детского питания, модифицированное молоко для недоношенных детей и пищевые продукты для пожилых людей. Термины “пища” или “пищевой продукт” используются в описании в качестве общего названия годных в пищу продуктов в форме твердых веществ, текучих сред, жидкостей или их смесей.
Термин “питательные пищевые добавки” относится к пищевым продуктам, обогащенным конкретными питательными ингредиентами. Термин “диетические пищевые продукты” относится к пищевым продуктам, которые являются полезными или хорошими для здоровья и включают питательные пищевые добавки, природные пищевые продукты и диетические пищевые продукты. Термин ”функциональные пищевые продукты” относится к пищевым продуктам, восполняющим питательные ингредиенты, которые усиливают регуляторные функции организма. Функциональные пищевые продукты являются синонимами пищевых продуктов для указанного диетического применения. Термин “продукты для детей” относится к пищевым продуктам, предоставляемым детям приблизительно до 6 лет. Термин “продукты для пожилых людей” относится к пищевым продуктам, обработанным для облегчения пищеварения и абсорбции по сравнению с необработанными пищевыми продуктами. Термин “модифицированное молоко для детского питания” относится к модифицированному молоку, предназначенному для детей до одного года. Термин “модифицированное молоко для недоношенных детей” относится к модифицированному молоку, которое дается недоношенным детям приблизительно до 6 месяцев после рождения.
Эти пищевые продукты включают природные пищевые продукты (обработанные жирами и маслами), такие как мясо, рыба и орехи; пищевые продукты, дополненные жирами и маслами во время приготовления (например, китайские пищевые продукты, китайская лапша, супы); пищевые продукты, приготовленные с использованием жиров и масел в качестве теплоносителей (например, рыба и овощи, запеченные в тесте (темпура), (обжаренные в масле рыба и овощи), обжаренные в масле пищевые продукты, обжаренный соевый творог, китайский обжаренный рис, пончики, японские обжаренные булочки (каринто)); пищевые продукты на основе жира и масла или подвергшиеся обработке пищевые продукты, дополненные жирами и маслами во время обработки (например, масло, маргарин, майонез, заправка, шоколад, быстро разваривающаяся лапша, карамель, бисквиты, печенье, кекс, мороженое); и продукты, опрыскиваемые или покрываемые жирами и маслами после окончательного приготовления (например, рисовые крекеры, твердое печенье, сладкие палочки из бобового теста). Однако пищевой продукт данного изобретения не ограничивается пищевыми продуктами, содержащими жиры и масла, и другие примеры включают сельскохозяйственные пищевые продукты, такие как хлебобулочные изделия, лапша, вареный рис, сладости (например, конфеты, жевательные резинки, камеди, таблетки, японские сладости), соевый творог и их подвергнутые обработке продукты; ферментированные пищевые продукты, такие как японское рисовое вино (сакэ), медицинские настойки, сладкая водка (мирин), уксус, соевый соус и мисо (ферментированная соевая паста из вареных соевых бобов и риса); пищевые продукты, получаемые от сельскохозяйственных животных, такие как йогурт, ветчина, бекон и сосиски; морские продукты, такие как рыбный брикет (камабоко), обжаренный во фритюре рыбный брикет (агетен) и взбитый рыбный брикет (ханпен); а также фруктовые напитки, безалкогольные напитки, спортивные напитки, алкогольные напитки и чай.
Способ оценивания или отбора штаммов с использованием ACL-кодирующей нуклеиновой кислоты или белка ACL данного изобретения
Настоящее изобретение предусматривает также способ оценивания или отбора липидпродуцирующего штамма с использованием ACL-кодирующей нуклеиновой кислоты или белка ACL данного изобретения. Подробности приводятся ниже.
(1) Способ оценивания
Одним из вариантов осуществления данного изобретения является способ оценивания липидпродуцирующего штамма с использованием ACL-кодирующей нуклеиновой кислоты или белка ACL данного изобретения. В качестве первого примера вышеуказанного способа оценивания данного изобретения липидпродуцирующие тест-штаммы оценивают на вышеуказанную активность данного изобретения, используя праймеры или зонды, сконструированные на основе нуклеотидной последовательности данного изобретения. Общие процедуры для такого оценивания известны и могут быть найдены, например, в международной публикации патента № WO 01/040514 или JP 8-205900 A. Ниже приведено краткое объяснение этого оценивания.
Сначала получают геном тестируемого штамма (тест-штамма). Для получения генома можно использовать любой известный способ, такой как способ Hereford или калий-ацетатный способ (см., например, Methods in Yeast Genetics, Cold Spring Harbor Laboratory Press, p.130 (1990)).
Праймеры или зонды конструируют на основе нуклеотидной последовательности данного изобретения, предпочтительно SEQ ID NO:9 или 10. Эти праймеры или зонды могут быть любыми областями нуклеотидной последовательности данного изобретения и могут быть использованы известные процедуры для их конструирования. Количество нуклеотидов в полинуклеотиде, используемом в качестве праймера, обычно составляет 10 нуклеотидов или более, предпочтительно 15-25 нуклеотидов. Подобным образом, количество нуклеотидов, подходящее для области, которая должна фланкироваться праймерами, обычно составляет 300-2000 нуклеотидов.
Праймеры или зонды, полученные, как описано выше, используют для испытания, содержит ли геном вышеуказанного тест-штамма последовательность, специфическую для нуклеотидной последовательности данного изобретения. Последовательность, специфическая для нуклеотидной последовательности данного изобретения, может быть детектирована с использованием известных процедур. Например, полинуклеотид, содержащий часть последовательности или всю последовательность, специфическую для нуклеотидной последовательности данного изобретения, или полинуклеотид, содержащий нуклеотидную последовательность, комплементарную вышеуказанной нуклеотидной последовательности, используют в качестве одного праймера, а полинуклеотид, содержащий часть последовательности или всю последовательность, расположенную слева или справа от этой последовательности, или полинуклеотид, содержащий нуклеотидную последовательность, комплементарную вышеуказанной нуклеотидной последовательности, используют в качестве другого праймера для амплификации нуклеиновых кислот из тест-штамма с помощью ПЦР или других способов, с последующим определением присутствия или отсутствия продуктов амплификации, молекулярной массы продуктов амплификации и т.д.
Условия ПЦР, подходящие для способа данного изобретения, не ограничиваются никоим образом и могут быть установлены, например, следующим образом:
Температура денатурации: 90-95°C
Температура отжига: 40-60°C
Температура удлинения: 60-75°C
Число циклов: 10 или более циклов.
Полученные продукты реакции (т.е. ДНК-фрагменты) могут быть разделены электрофорезом на агарозном геле или т.п. для определения молекулярной массы продуктов амплификации. Затем каждый продукт амплификации проверяют в отношении того, является ли его размер достаточным для включения молекулы нуклеиновой кислоты, соответствующей области, специфической для нуклеотидной последовательности данного изобретения, посредством чего этот тест-штамм может быть предсказан или оценен в отношении вышеуказанной активности данного изобретения. Кроме того, если вышеуказанные продукты амплификации анализируют в отношении их нуклеотидных последовательностей, как описано выше, вышеуказанная активность данного изобретения может быть предсказана или оценена с большей точностью. Следует отметить, что процедуры для оценивания вышеуказанной активности данного изобретения являются процедурами, описанными выше.
В качестве другого примера для вышеуказанного способа оценивания данного изобретения, тест-штамм культивируют и измеряют уровень экспрессии ACL, кодируемой нуклеотидной последовательностью данного изобретения (например, SEQ ID NO:9 или 10), посредством чего этот тест-штамм может быть оценен в отношении вышеуказанной активности данного изобретения. Следует отметить, что уровень экспрессии ACL может быть измерен культивированием тест-штамма при подходящих условиях и количественным измерением мРНК или белка ACL. Количественное определение мРНК или белка может быть выполнено с использованием известных процедур, например Нозерн-гибридизации или количественной ОТ-ПЦР для количественного определения мРНК и Вестерн-блоттинга для количественного определения белка (Current Protocols in Molecular Biology, John Wiley & Sons 1994-2003). Для оценивания вышеуказанной активности можно также измерять долю определенной жирной кислоты в составе жирных кислот, продуцируемых ACL данного изобретения. Процедуры измерения доли определенной жирной кислоты в составе жирных кислот описаны выше.
(2) Способ отбора
Другим вариантом осуществления данного изобретения является способ отбора липидпродуцирующего штамма с использованием ACL-кодирующей нуклеиновой кислоты или белка ACL данного изобретения. В качестве примера вышеуказанного способа отбора данного изобретения тест-штаммы культивируют и измеряют в отношении уровня экспрессии ACL, кодируемой нуклеотидной последовательностью данного изобретения (например, SEQ ID NO:9 или 10), для отбора штамма с желаемым уровнем экспрессии, посредством чего может быть выбран штамм, имеющий желаемую активность. Альтернативно, предварительно определяют типовой штамм и этот типовой штамм и каждый из тест-штаммов культивируют и измеряют в отношении вышеуказанного уровня экспрессии с последующим сравнением уровня экспрессии между типовым штаммом и каждым тест-штаммом, посредством чего может быть отобран желаемый штамм. Более конкретно, например, типовой штамм и тест-штаммы культивируют при подходящих условиях и измеряют в отношении их уровней экспрессии для отбора тест-штамма, проявляющего более высокую или более низкую экспрессию, чем экспрессия типового штамма, посредством чего может быть отобран штамм, имеющий желаемую активность. Примеры желаемой активности включают уровень экспрессии ACL и содержание общих жирных кислот, продуцируемых ACL, которые могут быть измерены, как описано выше.
В качестве другого примера способа отбора данного изобретения тест-штаммы культивируют для отбора штамма, в котором вышеуказанная активность данного изобретения является высокой или низкой, посредством чего может быть отобран штамм, имеющий желаемую активность. Примеры желаемой активности включают уровень экспрессии ACL и содержание общих жирных кислот, продуцируемых ACL, которые могут быть измерены, как описано выше.
Примеры тест-штамма или типового штамма, доступные для применения, включают, но не ограничиваются ими, штамм, трансформированный вышеуказанным вектором данного изобретения, штамм, модифицированный для подавления экспрессии вышеуказанной нуклеиновой кислоты данного изобретения, штамм, модифицированный мутагенезом, и штамм, имеющий природную мутацию (природные мутации). Следует отметить, что активность ACL в данном изобретении может быть измерена, например, процедурами, описанными в разделе “Нуклеиновые кислоты данного изобретения, кодирующие АТФ:цитратлиазу”. Мутагенез может быть выполнен, без ограничения ими, физическими способами, включающими облучение ультрафиолетом или радиоактивное облучение, или химическими способами, включающими обработку таким агентом, как EMS (этилметансульфонат) или N-метил-N-нитрозогуанидин (см., например, Yasuji Oshima ed., Biochemistry Experiments vol. 39, Experimental Protocols for Yeast Molecular Genetics, pp. 67-75, Japan Scientific Societies Press).
Штаммы, используемые в данном изобретении в качестве типовых штаммов и тест-штаммов, включают, но не ограничиваются ими, вышеуказанные липидпродуцирующие штаммы или штаммы дрожжей. Более конкретно, типовой штамм или тест-штамм могут быть комбинацией любых штаммов, принадлежащих к различным родам или видам, и могут быть использованы одновременно один или несколько тест-штаммов.
Данное изобретение будет теперь описано более подробно посредством следующих примеров, которые не предназначены для ограничения объема данного изобретения.
Пример 1
(1) EST-анализ
Штамм M. alpina 1S-4 инокулировали в 100 мл среды (1,8% глюкоза, 1% дрожжевой экстракт, pH 6,0) и предварительно культивировали в течение 3 дней при 28°C. Культуральный сосуд на 10 л (Able Co., Tokyo) загружали пятью литрами среды (1,8% глюкоза, 1% соевый порошок, 0,1% оливковое масло, 0,01% Адеканол, 0,3% KH2PO4, 0,1% Na2SO4, 0,05% CaCl2·2H2O, 0,05% MgCl2·6H2O, pH 6,0) и инокулировали всем количеством предварительно культивированного продукта, с последующим культивированием в центрифуге при условиях 300 об/мин, 1 об/об/мин и 26°C в течение 8 дней. В дни 1, 2 и 3 культивирования добавляли глюкозу в количестве, соответствующем 2%, 2% и 1,5%, соответственно. Клетки собирали на каждой стадии культивирования (день 1, 2, 3, 6 или 8) для получения общей РНК способом с гидрохлоридом гуанидина/CsCl. С использованием набора для очистки мРНК Oligotex-dT30
(2) Поиск на гомологи АТФ:цитратлиазы
Нуклеотидные последовательности, полученные с помощью EST-анализа, подвергали поиску против аминокислотных последовательностей, зарегистрированных в GENEBANK, с использованием программы поиска гомологии, BLASTX, для экстракции гомологов гена АТФ:цитратлиазы. В результате были найдены четыре последовательности гомологов ACL (SEQ ID NO:1, 2, 3 и 4). SEQ ID NO:1 и 3 были гомологичны друг другу и обнаруживали совпадение с одной и той же областью в полученном из Neurospora crassa предположительном белке, подобном субъединице 1 АТФ:цитратлиазы, тогда как SEQ ID NO:2 и 4 были также гомологичны друг другу и обнаруживали совпадение с одной и той же областью в полученном из Sordaria macrospora предположительном белке, подобном субъединице 1 АТФ:цитратлиазы. А именно этот штамм имел по меньшей мере два или более возможных гомолога АТФ:цитратлиазы. В таблице 2 показан ряд клонов, каждый из которых содержит последовательность, относящуюся к исходным библиотекам, из которых были получены эти клоны.
Пример 2
(1) Клонирование гомологов ACL
SEQ ID NO:1-4 не содержат CDS, явствующих о том, что они кодируют ACL. Таким образом, для клонирования кДНК, кодирующих полную длину этих генов, праймеры получали на основе каждой последовательности следующим образом.
Праймеры, сконструированные на основе SEQ ID NO:2:
Праймер 422-1: GATACCGTCGTCAACTTTGCCTC (SEQ ID NO:18)
Праймер 422-2: CATCTTGCAGTTGGGGTCCCGCT (SEQ ID NO:19)
Праймеры, сконструированные на основе SEQ ID NO:4:
Праймер 424-1: GTTGACACCGTGGTGAACTTTGCC (SEQ ID NO:20)
Праймер 424-2: GCATCTTGCACCCGGATCCTTCTC (SEQ ID NO:21)
Используя эти праймеры, выполняли ПЦР с ExTaq (Takara Bio Inc., Japan) с использованием кДНК-библиотеки, содержащей EST, составляющие SEQ ID NO:2 или 4, в качестве матрицы. Полученные ДНК-фрагменты ТА-клонировали с набором для клонирования TOPO-TA (INVITROGEN CORPORATION) для определения нуклеотидной последовательности для каждой вставки.
Эти результаты подтвердили, что ДНК-фрагменты, включающие нуклеотиды 3-443 SEQ ID NO:2 и нуклеотиды 6-449 SEQ ID NO:4, каждый, были клонированы. Эти плазмиды были названы pCR-422-P и pCR-424-P, соответственно.
Затем каждую из этих плазмид использовали в качестве матрицы для выполнения ПЦР с вышеуказанными праймерами. В ПЦР использовали ExTaq (Takara Bio Inc., Japan), но прилагаемую смесь dNTP заменяли смесью для мечения ПЦР (Roche Diagnostics) для мечения амплифицируемых ДНК дигоксигенином (DIG), получая посредством этого зонды для использования в скрининге кДНК-библиотек. Эти зонды использовали для скрининга кДНК-библиотек, из которых EST, составляющие эти индивидуальные последовательности, были получены с помощью EST-анализа.
Условия гибридизации устанавливали следующим образом.
Буфер: 5 × SSC, 1% ДСН, 50 мМ Трис-HCl (pH 7,5), 50% формамид
Температура: 42°C (в течение ночи)
Промывание: в 0,2 × SSC, 0,1% ДСН при 65°C в течение 20 минут (повторяемое три раза)
Детектирование выполняли с использованием набора для детектирования DIG-нуклеиновой кислоты (Roche Diagnostics). Из фаговых клонов, полученных с помощью скрининга, вырезали плазмиды in vivo-вырезанием для определения нуклеотидной последовательности каждой вставки. Плазмиды, каждая из которых несла самую длинную вставку, полученную скринингом с каждым зондом, были названы pB-ACL1 и pB-ACL2, соответственно. Нуклеотидные последовательности этих вставок в pB-ACL1 и pB-ACL2 показаны в SEQ ID NO:5 и 6, соответственно, и на фигурах 1 и 2, соответственно. Было обнаружено, что SEQ ID NO:5 содержит CDS 3540 п.н. (SEQ ID NO:7), тогда как SEQ ID NO:6 содержит CDS 3525 п.н. (SEQ ID NO:8), таким образом позволяя предположить, что для каждого случая получали кДНК, кодирующую полную длину гомолога АТФ:цитратлиазы. Эти гены были названы MaACL1 и MaACL2, соответственно. Расшифрованные аминокислотные последовательности белков, кодируемых этими генами (MaACL1p и MaACL2p), показаны в SEQ ID NO:11 и SEQ ID NO:12, соответственно.
(2) Анализ последовательностей
Ген MaACL1 и ген MaACL2 являются гомологичными друг другу, и было обнаружено, что они имеют идентичность 79,1% в их CDS (фигура 3). Подобным образом было обнаружено, что они имеют идентичность 87,1% в их расшифрованных аминокислотных последовательностях (фигура 4). С другой стороны, поиск Blast против базы данных (nr) последовательностей белков NCBI показал, что наивысшая идентичность наблюдалась с полученным из базидиомицета U. maydis ACL-подобным предположительным белком (gi_46096782), который имеет идентичность аминокислотной последовательности 61,6% с MaACL1 и 61,9% с MaACL2. Кроме того, было обнаружено, что MaACL1 и MaACL2 также имеют определенную, но более низкую, идентичность с последовательностями полученных у животных предположительных ACL-белков или ACL-подобных белков, включающих белок мыши (gi_29293809), человека (gi_38569421), Drosophila (gi_28372804) и нематоды (gi_17551266) (фигура 5).
Пример 3
(1) Конструирование экспрессирующих векторов дрожжей
Для экспрессии MaACL1 и MaACL2 в клетках дрожжей экспрессирующие векторы дрожжей конструировали следующим образом. Сначала плазмиду pB-ACL1 использовали в качестве матрицы для выполнения ПЦР с ExTaq (Takara Bio Inc., Japan) с применением праймеров ACL1F-EX и ACL1R-HS.
Праймер ACL1F-EX: GAATTCTCTAGAATGTCTGCTAAAGCCGTTCGCG (SEQ ID NO:22)
Праймер ACL1R-HS: AAGCTTGTCGACTTAGGCCTTCTTGTTGATCG (SEQ ID NO:23)
Продукт ПЦР расщепляли рестрикционными ферментами EcoRI и HindIII. Полученный ДНК-фрагмент вставляли в сайт EcoRI-HindIII вектора pUC18 с получением плазмиды pUC-ACL1. Ее расщепляли рестрикционными ферментами EcoRI и SalI с получением ДНК-фрагмента приблизительно 3,5 т.п.н., который затем вставляли в сайт EcoRI-SalI вектора pYE22m (Biosci. Biotech. Biochem., 59, pp. 1221-1228 (1995)) с получением плазмиды pYEMaACL1. С другой стороны, плазмиду pB-ACL2 расщепляли рестрикционными ферментами NotI и SalI или расщепляли рестрикционными ферментами SalI и KpnI с получением ДНК-фрагмента приблизительно 2,7 т.п.н. или приблизительно 1 т.п.н., соответственно. pYE22m расщепляли рестрикционным ферментом EcoRI и концы затупляли с использованием набора для затупления концов ДНК (Takara Bio Inc., Japan), с последующей вставкой линкера NotI linker (pd(GCGGCCGC)), получая вектор pYE22mN. Этот вектор pYE22mN расщепляли рестрикционными ферментами NotI и KpnI и связывали с NotI-SalI- и SalI-KpnI-фрагментами ACL2, полученными, как описано выше, с получением плазмиды pYEMaACL2.
(2) Трансформация дрожжей
Плазмиду pYE22m, pYEMaACL1 или pYEMaACL2 использовали для трансформации штамма дрожжей Saccharomyces cerevisiae EH13-15 (trp1, MATα) (Appl. Microbiol. Biotechnol., 30, 515-520 (1989)) литий-ацетатным способом. Трансформированные штаммы подвергали скринингу на способность расти на среде SC-Trp-агар (2% агар), содержащей, на литр, 6,7 г азотистого основания дрожжей без аминокислот (DIFCO), 20 г глюкозы и 1,3 г порошка аминокислот (смеси 1,25 г сульфата аденина, 0,6 г аргинина, 3 г аспарагиновой кислоты, 3 г глутаминовой кислоты, 0,6 г гистидина, 1,8 г лейцина, 0,9 г лизина, 0,6 г метионина, 1,5 г фенилаланина, 11,25 г серина, 0,9 г тирозина, 4,5 г валина, 6 г треонина и 0,6 г урацила).
Пример 4
(1) Культура дрожжей
Среди трансформированных штаммов, полученных с каждым вектором, любые два штамма (штаммы с-1 и с-2, штаммы MaACL1-1 и MaACL1-2 или штаммы MaACL2-1 и MaACL2-2) отбирали и культивировали при следующих условиях. А именно, на стадии предварительного культивирования петлю каждого штамма дрожжей инокулировали из чашки в среду SC-Trp (10 мл) и культивировали со встряхиванием при 30°C в течение 2 дней. На стадии основного культивирования этот предварительно культивированный раствор (1 мл) добавляли в среду SC-Trp (100 мл) и культивировали со встряхиванием при 30°C в течение 1 дня.
(2) Приготовление растворов ферментов
Каждый культивируемый раствор центрифугировали для сбора клеток, которые затем промывали 1/2 объемами стерилизованной воды. Клетки суспендировали в 5 мл буфера для экстракции (50 мМ Трис-HCl (pH 8,0), 1 мМ ЭДТА, 10 мМ ДТТ, 1 мМ PMSF) и гомогенизировали при 16 кПа с использованием френч-пресса, с последующим центрифугированием при 20000 × g при 4°C в течение 10 минут для сбора супернатанта. Супернатант наносили на колонку PD-10 (GE Healthcare Bio-Sciences), наполненную Shehadex G-25, и элюировали буфером для элюирования (10 мМ фосфат натрия (pH 7,4), 1 мМ MgCl2, 0,1 мМ ЭДТА, 1 мМ ДТТ) с получением раствора фермента.
(3) Измерение активности ACL
Активность ACL определяли измерением количества оксалоацетата, генерированного в процессе показанной ниже ACL-катализируемой реакции, которое определяли из уменьшения уровней NADH (измеренных в виде изменения A340 (6,22 мМ-1см-1)), вызываемого катализируемой малатдегидрогеназой реакцией.
Формула 2
ACL-катализируемая реакция
Цитрат + CoA + АТФ → оксалоацетат + АДФ + Pi + ацетил-CoA
Катализируемая малатдегидрогеназой реакция
Оксалоацетат + NADH → малат + NAD+
Готовили реакционный раствор в общем объеме 1 мл, содержащий 10 мМ Трис-HCl (pH 8,4), 10 мМ MgCl2, 1 мМ ДТТ, 10 мМ АТФ, 10 мМ цитрат, 0,2 мМ CoA, 6 единиц малатдегидрогеназы, 0,1 мМ NADH и 50 мкл раствора фермента. Реакцию инициировали добавлением CoA. Эту реакцию выполняли при 28°C.
Полученные результаты показаны в таблице 3. При сравнении со штаммами c-1 и c-2 было обнаружено, что штаммы MaACL1-1 и MaACL1-2 или штаммы MaACL2-1 и MaACL2-2 проявляют более высокую активность ACL, позволяя предположить, что продукты генов MaACL1 и MaACL2 имели активность ACL.
Далее, MaACL1 исследовали в отношении его зависимости от концентрации Mg2+. А именно, вышеуказанный реакционный раствор ACL модифицировали, получая концентрации MgCl2 5 мМ, 10 мМ, 20 мМ или 40 мМ, и активность измеряли тем же самым образом. На фигуре 6 показана относительная активность, принимая, что активность при концентрации MgCl2 10 мМ была установлена как 1.
Как показано на фигуре 6, ACL1 обнаруживал максимальную активность при отношении АТФ:цитрат:Mg2+ приблизительно 1:1:1.
Пример 5
(1) Конструирование геномной библиотеки Mortierella
Штамм M. alpina 1S-4 инокулировали в 100 мл жидкой среды (1% глюкоза, 0,5% дрожжевой экстракт, pH 6,0) и культивировали при встряхивании при 28°C в течение 4 дней. Клетки собирали фильтрованием с использованием фильтра и обрабатывали по способу CTAB для экстракции геномной ДНК.
Полученную геномную ДНК (приблизительно 200 мкг) частично расщепляли рестрикционным ферментом Sau3AI, так что расщепленные ДНК имели распределение, центр которого был расположен около 20 т.п.н. Полученные ДНК-фрагменты подвергали центрифугированию в 10-40% градиенте плотности сахарозы (ротор SW28 (Beckman), 25000 об/мин, 10°C, 24 часа) и фракционировали в виде 1 мл аликвот с использованием AUTOMATIC LIQUID CHARGER (ADVANTEC) и MICRO TUBE PUMP (EYELA). Фракцию, имеющую распределение, центр которого находился около 20 т.п.н., очищали. Полученные таким образом геномные ДНК-фрагменты обрабатывали с использованием набора с вектором λBlueSTAR/BamHI (NOVAGEN), получая геномную библиотеку.
(2) Клонирование геномной ДНК URA5
Для применения гена URA5 Mortierella в качестве маркерного гена, его геномную ДНК, включающую области промотора и терминатора, клонировали следующим образом. А именно, готовили зонд на основе кДНК-последовательности гена URA5 Mortierella (Biosci Biotechnol Biochem., 68, pp. 277-285 (2004)) и использовали его для скрининга геномной библиотеки Mortierella с целью идентификации нуклеотидной последовательности приблизительно 2,1 т.п.н., включающей этот ген (SEQ ID NO:13).
(3) Клонирование геномной ДНК гомолога GAPDH
Для конститутивной и высокой экспрессии трансгена в клетках Mortierella клонировали ген гомолога глицеральдегид-3-фосфатдегидрогеназы (GAPDH), который, как известно, конститутивно и высоко экспрессируется во многих организмах. На основе последовательности гомолога GAPDH (SEQ ID NO:14), обнаружено среди EST, полученных, как описано в примере 1, готовили праймеры ATGACCATCAAGATCGGCATCA (SEQ ID NO:24) и TTAAGCATGATCCTTCTTGGCC (SEQ ID NO:25). Эти праймеры использовали для получения зонда таким же образом, как показано в примере 2, используя кДНК Mortierella в качестве матрицы, с последующим скринингом из геномной библиотеки для идентификации нуклеотидной последовательности приблизительно 3 т.п.н., включающей гомолог GAPDH (SEQ ID NO:15).
Пример 6
Конструирование экспрессирующих векторов Mortierella
Область 0,9 т.п.н. слева от структурного гена GAPDH M. alpina амплифицировали путем ПЦР с праймерами:
AAGCTTGATCACGTCGGGTGATGAGTTGCTGTTGAC (SEQ ID NO:26); и
GAATTCGATGTTGAATGTGTGGTGTG (SEQ ID NO:27)
и область 0,5 т.п.н. справа от структурного гена GAPDH M. alpina амплифицировали путем ПЦР с праймерами:
TCTAGATAAGAAAAGGGAGTGAATCG (SEQ ID NO:28); и
GCGGCCGCGATCCATGCACGGGTCCTTC (SEQ ID NO:29)
для клонирования промотора GAPDH (SEQ ID NO:16) и терминатора GAPDH (SEQ ID NO:17). Их расщепляли в сайтах рестрикционных ферментов, добавленных на этих праймерах, т.е. в сайтах HindIII и EcoRI и в сайтах XbaI и NotI, соответственно, а затем вставляли в сайт HindIII/EcoRI и сайт XbaI/NotI на pBluescriptII SK- (Stratagene), соответственно. Эту плазмиду дополнительно затупляли на концах в сайте ApaI, в который затем интегрировали рДНК 18S (0,9 т.п.н.), которую получали из плазмиды pD4 (Appl Environ Microbiol., 66, pp. 4655-4661 (2000)) расщеплением с использованием XbaI и HindIII и последующим затуплением концов, с получением плазмиды pBGptR. Расщепленный SalI фрагмент (2,1 т.п.н.), полученный из геномной ДНК гена URA5 M. alpina, включающий промотор и терминатор, вставляли в сайт XhoI pBGptR с получением вектора pH001. Далее, для вставки сайта множественного клонирования, который облегчает введение нужного гена для продуцирования PUFA, между промотором и терминатором GAPDH, pH001 расщепляли в сайте HindIII слева (5') от промотора GAPDH и в сайте NotI справа (3') от терминатора GAPDH соответствующими рестрикционными ферментами, а затем затупляли на концах с последующим самолигированием для разрушения сайтов HindIII и NotI в двух стадиях, с конструированием посредством этого вектора pH002. Олигонуклеотиды для получения сайта множественного клонирования:
SC/MCS-F2: 5'-ctagcgcggccgcctcgagaagcttcccggggcatgcctgcagtctagag (SEQ ID NO:30); и
SC/MCS-R2: 5'-aattctctagactgcaggcatgccccgggaagcttctcgaggcggccgcg (SEQ ID NO:31)
комплементарно отжигали друг с другом с образованием выступа EcoRI/NheI, а затем вставляли в сайт EcoRI/XbaI pH002 для конструирования вектора pH003. В векторе pH003 участок EcoRI/XbaI/PstI/SphI/SmaI/HindIII/XbaI/NotI был доступен для использования в качестве сайта множественного клонирования. Затем два сайта для распознающего октануклеотид рестрикционного фермента AscI вводили вне сайтов EcoRI и HindIII pUC19 для конструирования вектора pUCAA, из которого вставка может быть вырезана в ее полном виде расщеплением с использованием AscI. Этот вектор pUCAA расщепляли с использованием EcoRI/HindIII и затем затупляли на концах, в него встраивали вставку с затупленными концами (4,4 т.п.н.), полученную из pH003 частичным расщеплением при помощи BssHII, с получением вектора pH004. pH004 частично расщепляли EcoRI и затем затупляли на концах и дополнительно лигировали для разрушения сайта EcoRI, смежного с BssHII, получая посредством этого вектор pDuraSC, который служит в качестве базового вектора для самоклонирования.
Для высокой экспрессии MaACL1 и MaACL2 в клетках Mortierella экспрессирующие векторы Mortierella конструировали следующим образом. Плазмиду pUC-ACL1 расщепляли рестрикционными ферментами XbaI и HindIII с получением ДНК-фрагмента приблизительно 3,5 т.п.н. Этот ДНК-фрагмент вставляли в сайт XbaI-SalI вектора pDuraSC с конструированием плазмиды pDuraSC-ACL1. С другой стороны, вектор pDuraSC расщепляли рестрикционным ферментом EcoRI, затупляли с использованием набора для затупления концов и затем расщепляли XhoI, тогда как плазмиду pB-ACL2 расщепляли рестрикционным ферментом NotI, затупляли с использованием набора для затупления и затем частично расщепляли XhoI с получением фрагмента приблизительно 3,5 т.п.н. Полученные фрагменты лигировали друг с другом для конструирования плазмиды pDuraSC-ACL2.
Пример 7
Трансформация Mortierella
Урацил-ауксотрофный штамм Δura-3, полученный из M. alpina, как описано в патентном документе (WO 2005/019437, озаглавленном “Способ разведения липидпродуцирующего гриба”), использовали в качестве хозяина и трансформировали плазмидой pDuraSC-ACL1 или pDuraSC-ACL2 способом доставки частиц. Для скрининга трансформированных штаммов использовали среду с SC-агаром (0,5% азотистое основание дрожжей без аминокислот и сульфата аммония (Difco), 0,17% сульфат аммония, 2% глюкоза, 0,002% аденин, 0,003% тирозин, 0,0001% метионин, 0,0002% аргинин, 0,0002% гистидин, 0,0004% лизин, 0,0004% триптофан, 0,0005% треонин, 0,0006% изолейцин, 0,0006% лейцин, 0,0006% фенилаланин и 2% агар).
Пример 8
Оценивание трансформантов Mortierella
(1) Трансформированные штаммы, полученные с плазмидой pDuraSC-ACL1
Каждый из полученных штаммов инокулировали в 4 мл среды GY (2% глюкоза, 1% дрожжевой экстракт) и культивировали при встряхивании при 28°C в течение 3 или 4 дней. Клетки собирали фильтрованием и РНК экстрагировали с использованием набора RNeasy plant kit (QIAGEN). Для синтеза кДНК использовали систему первой цепи SuperScript для ОТ-ПЦР (Invitrogen), с последующей ОТ-ПЦР с праймерами GCGTCATCCCCACCACTGTT (SEQ ID NO:32) и GCTGGCGGGAGGAGTGCCAGCACG (SEQ ID NO:33).
В результате, среди отдельных трансформированных штаммов отбирали штаммы с высокими уровнями экспрессии ACL1. Каждый из этих штаммов инокулировали в жидкую среду (2% глюкоза, 1% дрожжевой экстракт) и культивировали при встряхивании при 28°C. В день 3 культивирования к этому культуральному раствору добавляли 20% раствор глюкозы в объеме 1/20. В дни 4, 6, 7 и 8 культивирования часть клеток собирали и лиофилизировали. Жирные кислоты в этих клетках превращали в их соответствующие метиловые эфиры и затем экстрагировали гексаном. После дистилляции гексана жирные кислоты анализировали методом газовой хроматографии для количественного определения содержания жирных кислот на клетку. Полученные результаты показаны на фигуре 7.
Как показано выше, штаммы Mortierella, трансформированные для высокой экспрессии гена MaACL1, позволяли увеличивать внутриклеточное содержание жира или масла на поздней стадии культивирования по сравнению со штаммами дикого типа.
(2) Трансформированные штаммы, полученные с плазмидой pDuraSC-ACL2
Каждый из полученных трансформированных штаммов субкультивировали на среде с агаром SC для отбора 9 штаммов, обнаруживающих хороший рост. Затем каждый из вышеуказанных отобранных штаммов инокулировали в 4 мл среды GY (2% глюкоза, 1% дрожжевой экстракт) и культивировали при встряхивании при 28°C в течение 4 дней. Клетки собирали фильтрованием и лиофилизировали. Часть (приблизительно 10-20 мг) высушенных клеток обрабатывали по способу с хлористоводородной (соляной) кислотой/метанолом для превращения жирных кислот в этих клетках в соответствующие метиловые эфиры, с последующей экстракцией гексаном. После дистилляции гексана жирные кислоты анализировали методом газовой хроматографии. В результате, штаммы, имеющие более высокое внутриклеточное содержание жирных кислот и более высокую долю арахидоновой кислоты в общих жирных кислотах, отбирали и обозначали как MaACL2#1 и MaACL2#2, соответственно.
Каждый из этих штаммов инокулировали в 4 мл среды GY и культивировали при встряхивании при 28°C в течение 4 дней. Клетки собирали фильтрованием и РНК экстрагировали с использованием набора RNeasy plant kit (QIAGEN). Для синтеза кДНК использовали систему первой цепи SuperScript для ОТ-ПЦР (Invitrogen) (Invitrogen). Для подтверждения экспрессии каждого гена из введенной конструкции вышеуказанную кДНК использовали в качестве матрицы для выполнения ПЦР с ExTaq (Takara Bio Inc., Japan) в 25 циклах 94°C в течение 30 секунд, 55°C в течение 30 секунд и 72°C в течение 1 минуты с использованием комбинации следующих праймеров:
Праймер MaGAPDHpfw: CACACCACACATTCAACATC (SEQ ID NO:34); и
Праймер ACL2-R5: CGAAGCCGGCAAAGGCGGCAGTCG (SEQ ID NO:35).
В результате было подтверждено, что эти штаммы экспрессировали ген MaACL2 из введенной конструкции.
Кроме того, эти два штамма и штамм 1S-4, каждый, инокулировали в 4 мл среды GY (n=3) и культивировали при встряхивании при 28°C при 125 об/мин. В день 3 культивирования добавляли 20% глюкозу и культивирование продолжали дополнительно до дня 6. В день 6 все клетки собирали фильтрованием и лиофилизировали. Часть (приблизительно 10-20 мг) этих высушенных клеток обрабатывали по способу с хлористоводородной (соляной) кислотой/метанолом для превращения жирных кислот в этих клетках в соответствующие метиловые эфиры, с последующей экстракцией гексаном. После дистилляции гексана жирные кислоты анализировали методом газовой хроматографии. Внутриклеточное содержание жирных кислот и продуцирование арахидоновой кислоты на среду суммированы в таблицах 4 и 5, соответственно.
Как показано выше, штаммы Mortierella, трансформированные для высокой экспрессии гена MaACL2, позволяли увеличивать внутриклеточное содержание как жирных кислот, так и арахидоновой кислоты на среду по сравнению со штаммом дикого типа.
ПРОМЫШЛЕННАЯ ПРИМЕНИМОСТЬ
Гены ACL данного изобретения позволяют улучшить способность продуцирования жирных кислот и/или липидов и, следовательно, являются предпочтительными в качестве средства для улучшения продуцирования полиненасыщенных жирных кислот в микроорганизмах и растениях. В результате, гены ACL данного изобретения позволяют обеспечивать эффективные жирные кислоты или липиды при более низкой стоимости, чем в общепринятых случаях, и пригодны в качестве генов, применимых для пищевых продуктов, косметических средств, фармацевтических веществ, мыл и т.д.
СПИСОК ПОСЛЕДОВАТЕЛЬНОСТЕЙ В ВИДЕ СВОБОДНОГО ТЕКСТА
SEQ ID NO:18: праймер
SEQ ID NO:19: праймер
SEQ ID NO:20: праймер
SEQ ID NO:21: праймер
SEQ ID NO:22: праймер
SEQ ID NO:23: праймер
SEQ ID NO:24: праймер
SEQ ID NO:25: праймер
SEQ ID NO:26: праймер
SEQ ID NO:27: праймер
SEQ ID NO:28: праймер
SEQ ID NO:29: праймер
SEQ ID NO:30: праймер
SEQ ID NO:31: праймер
SEQ ID NO:32: праймер
SEQ ID NO:33: праймер
SEQ ID NO:34: праймер
SEQ ID NO:35: праймер
Реферат
Изобретение относится к области молекулярной биологии и генетической инженерии. Предложена нуклеиновая кислота, которая кодирует белок с АТФ:цитратлиазной активностью, а также соответствующие белок, вектор, трансформант и способ получения жирной кислоты и липида. Изобретение позволяет увеличить содержание жирных кислот и липидов в клетках-хозяевах. 8 н.п. ф-лы, 7 ил., 5 табл., 8 пр.
Формула
(a) нуклеотидная последовательность, представленная в SEQ ID NO:9 или SEQ ID NO:10;
(b) нуклеотидная последовательность, кодирующая белок, состоящий из аминокислотной последовательности, представленной в SEQ ID NO:11 или SEQ ID NO:12; или
(c) нуклеотидная последовательность, представленная в SEQ ID NO:5 или SEQ ID NO:6.

Комментарии