Экспрессия промотора синтазы ацетооксикислот в интродуцированных генах растений - RU2197527C2
Код документа: RU2197527C2
Чертежи




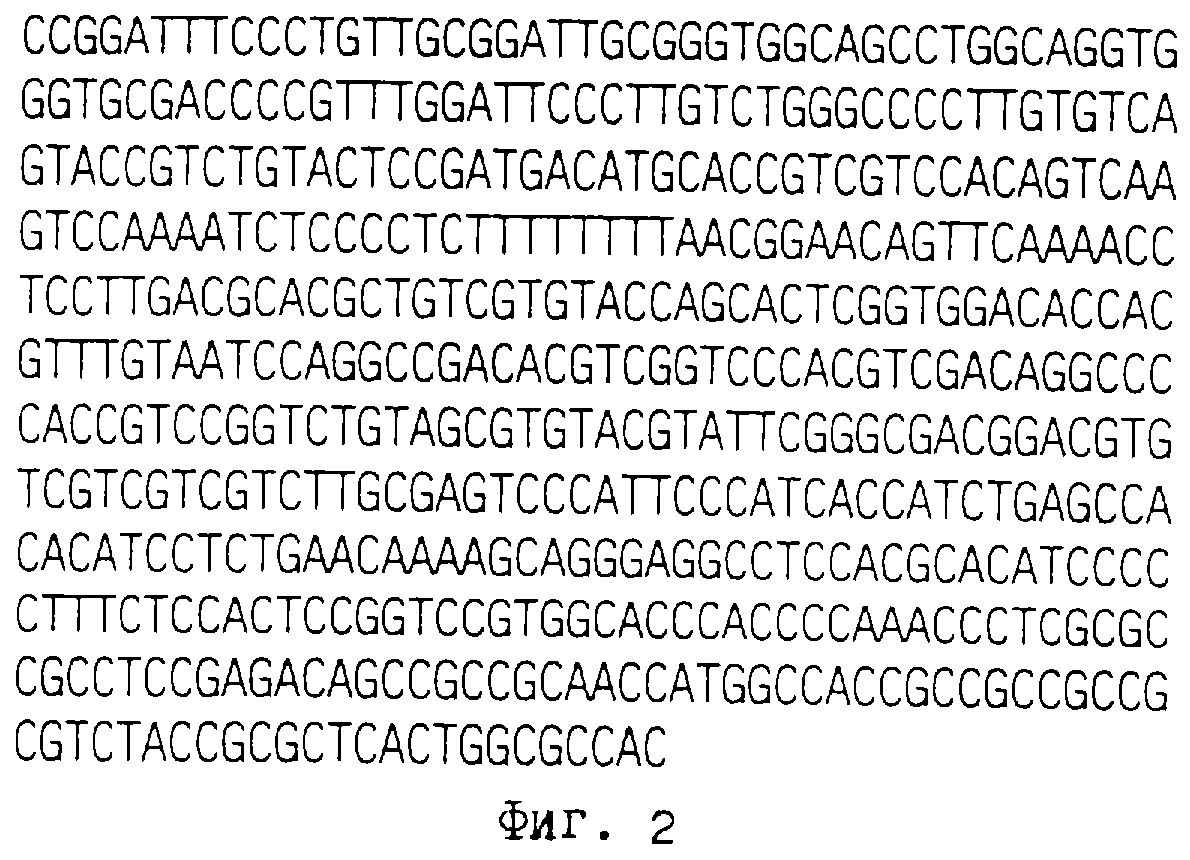

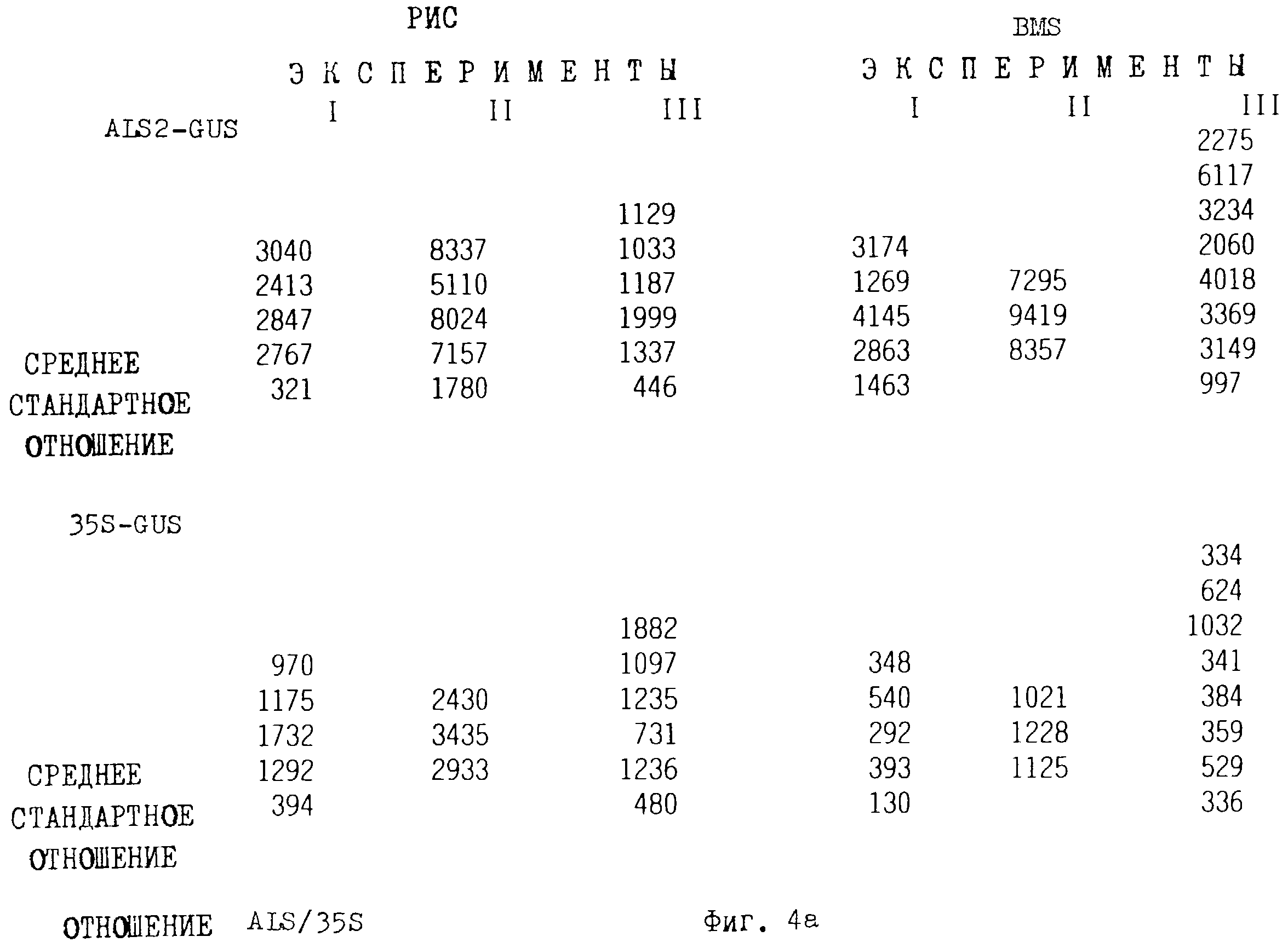


Описание
Отрасль техники
Настоящее изобретение
относится к изолированным некодирующим нуклеотидным последовательностям, используемым в качестве промоторов для экспрессии гетерологичных генов у растений. Настоящее изобретение также относится к
векторам и клеткам растений, включающим эти изолированные нуклеотидные последовательности.
Уровень техники
Царство растений подразделяется на два типа - моховидные Bryophyta и
сосудистые растения Tracheophyta. Тип Tracheophyta включает свыше 266000 видов, сгруппированных в четыре подтипа. Подтип Pteropsida включает класс покрытосеменные Angiospermae. Этот класс делится на
два подкласса - двудольные и однодольные.
Поскольку однодольные включают многие важные пищевые и фуражные культуры, генетики растений остро заинтересованы в том, чтобы иметь возможность создавать трансгенные однодольные. Известно около 50000 видов однодольных. Они включают лилии, пальмы, орхидеи, ирисы, тюльпаны, осоки и злаки. Злаки включают кукурузу, пшеницу, рис и все прочие злаковые зерновые. К сожалению, однодольные чрезвычайно тяжело поддаются генноинженерным манипуляциям, так что большинство работ с растениями проводится с двудольными.
Двудольные больше по числу видов из этих двух групп, приблизительно известно 200000 их видов. Лютик, львиный зев, гвоздика, магнолия, мак, капуста, роза, горох, пуансеттия (молочай красивейший, Euphorbia pulcherrima - декоративный кустарник, произрастающий в тропических лесах Мексики; очень популярен в озеленении на юге США), хлопчатник, кактус, морковь, черника, мята, томат, подсолнечник, вяз, дуб и клен представляют 19 из 250 семейств двудольных.
Генетическая информация, заключенная в молекуле ДНК, обычно служит матрицей для синтеза большого количества более коротких молекул РНК, большинство которых в свою очередь служат матрицами для синтеза специфических цепей полипептидов. Особые сегменты нуклеотидов, называемые часто промоторами, распознаются молекулами РНК-полимеразы как сигнал к синтезу РНК. По окончании транскрипции функциональной цепи РНК второй класс сигналов приводит к прекращению синтеза РНК и к отделению молекул РНК-полимеразы от соответствующих им матриц ДНК.
В настоящее время имеется ряд общих промоторов, которые используются для управления экспрессией гетерологичных генов у однодольных растений.
David McElroy и др. (1990) отмечали, что испытания временной экспрессии в конструкции, где промотор гена актина 1 риса (Асt1) был присоединен к бактериальному гену β-глюкуронидазы (GUS) в трансформированных протопластах риса, показали, что промотор актина управляет высокими уровнями генной экспрессии. Эта экспрессия 6-кратно превосходила таковую с геном-промотором алкогольдегидрогеназы 1 кукурузы (Adh1) и зависела от присутствия интактного интрона Act1.
David McElroy и др. (1991) отмечали, что оптимизированные векторы для трансформации однодольных были сконструированы при использовании либо промотора 35S вируса мозаичности цветной капусты /Cauliflower Mosaic Virus/ (CaMV), либо промотора Act1. Испытания временной экспрессии были выполнены на трансформированных протопластах как риса, так и кукурузы. Добавление интрона Act1 и оптимизированного сайта инициализации трансляции GUS к любой промоторной последовательности значительно увеличивало генную экспрессию. Так же, как неопубликованный результат, отмечалось, что промотор актина обнаруживает способность к управлению экспрессией GUS в кратковременных испытаниях на протопластах пшеницы, овса, ячменя и сорго.
Wanggen Zhang и др. (1991) отмечали, что исследования по гибридизации in situ растений трансгенного риса, выполненные с Act1-GUS слиянием, показали что, промотор Act1 имеет базовый тип экспрессии как в вегетативной, так и репродуктивной ткани.
Jun Cao и др. (1992) отмечали, что растения трансгенного риса были отобраны на устойчивость к биалофосу после трансформации bar-гена, экспрессируемого под контролем либо CaMV 35S промотора, либо промотора Act1 риса.
Alan H. Christensen и др. (1992) отмечали, что протопласты кукурузы, трансформированные слиянием гена Ubi-1-CAT кукурузы, в испытаниях временной экспрессии обнаружили приблизительно 10-кратно повышенные уровни CAT активности, по сравнению с клетками кукурузы, трансформированными путем слияния гена CaMV-35S-GUS. Нозерн-блот анализ уровней Ubi-1 и Ubi-1 транскриптов, проводимый вслед за тепловым шоком сеянцев кукурузы, продемонстрировал, что оба гена достаточно хорошо экспрессируются при 25oС, но индуцируются вслед за тепловым шоком.
Seiichi Toki и др. (1992) отмечали, что стабильно трансформированные трансгенные растения риса были получены после электропоратически опосредованной трансформации bar-гена, экспрессируемого под контролем промотора Ubi-1 кукурузы и селекции на биалофос. Этот результат демонстрирует, что промотор Ubi-1 может быть использован для достаточно эффективного управления высокими уровнями генной экспрессии у риса, позволяя проводить селекцию и регенерацию фертильных трансгенных растений риса.
J. Troy и др. (1993) отмечали, что стабильно трансформированные растения пшеницы были получены после бомбардировки каллусов, выращенных из незрелых эмбрионов как с bar-геном, так и с GUS, каждый при этом экспрессировался под контролем промотора Ubi-1 кукурузы, за этим следовала селекция на биалофос. Этот результат демонстрирует, что промотор Ubi-1 может быть использован для достаточно эффективного управления высокими уровнями генной экспрессии у пшеницы, позволяя проводить селекцию и регенерацию фертильных трансгенных растений.
Yuechun Wan и Peggy G. Lemaux (1994) отмечали, что стабильно трансформированные фертильные растения ячменя были получены после микропроекционной бомбардировки двумя генами: bar-геном и GUS, тканей эмбрионов ячменя под контролем промотора Ubi-1 кукурузы, за которой следовала селекция на биалофос. Этот результат демонстрирует, что промотор Ubi-1 может быть использован для достаточно эффективного управления высокими уровнями генной экспрессии у ячменя, позволяя проводить селекцию и регенерацию фертильных трансгенных растений. Эксперимент, включающий бомбардировку небольшого количества растений либо с Ubi-полосой, либо с CaMV 35S-полосой показал, что нет существенного различия в полученном количестве трансформантов.
Junkon Kyozuka и др. (1991) отмечали, что слияние промотор Adh1 кукурузы - GUS было введено в протопласты риса с целью получения трансгенных растений риса. Активность GUS у трансгенных растений определяли для выяснения способа экспрессии GUS. Было обнаружено, что промотор Adh1 кукурузы способен промотировать базовую экспрессию во всех частях исследованных растений. Как было предварительно продемонстрировано для экспрессии Adh1 у кукурузы, управляемая Adh1 экспрессия GUS индуцировалась в корнях в анаэробных условиях.
D. I. Last и др. (1991) отмечали, что промотор Adh1 кукурузы был модифицирован добавлением мультиплетных копий анаэробного элемента гена Adh1 кукурузы и элементов ocs гена октопин синтазы Agrobacterium tumefacience (pEmu). В тестах по временной экспрессии в протопластах различных видов однодольных, трансформированных pEmu-GUS, он был лучшим составляющим, дающим 10-15-кратное увеличение уровней экспрессии по сравнению с промотором CaMV 35S у пшеницы, кукурузы, риса, пшеницы-однозернянки Triticum monococcum и плевела многоцветкового Lolium multiflorum.
Robert Bower и Robert G. Birch (1992) отмечали, что стабильные трансформанты были получены при трансформации эмбриогенного каллуса сахарного тростника геном неомицин фосфотрансферазы под контролем Emu промотора.
D. A. Chamberlain и др. (1994) отмечали, что промотор Emu использовался для управления экспрессией четырех различных выбираемых маркерных генов (неомицин фосфотрансферазы, гидромицин фосфотранс-феразы, фофинотриицин N-ацетилтрансферазы и мутантной ацетолактат синтазы, дающей сопротивляемость гербицидам), которые были трансформированы как в пшеницу, так и в рис. Каллус пшеницы и трансформированные растения риса были получены после селекции трансформантов, демонстрируя, что этот промотор может быть использован для управления экспрессией выбираемых маркерных генов при получении трансформированных злаков.
Обзор промоторных элементов, используемых для контроля экспрессии чужеродного гена у трансгенных злаков, был недавно опубликован, и здесь мы на него ссылаемся (McElroy and Brettel, 1994).
Ряд промоторов в настоящее время используется для трансформации двудольных растений. Эти промоторы происходят из различных источников. Одна группа широко используемых промоторов была выделена из Agrobacterium tumefaciens, где их функция состоит в управлении экспрессией генов опин синтазы, переносящих сегмент Т-ДНК, который интегрируется в геном растения во время инфекции. Эти промоторы включают промотор октопин синтазы (ocs)(L. Comai et al., 1985; C. Waldron et al., 1985), промотор маннопин синтазы (mas)(L. Comai et al. , 1985; K.E. McBride and K.R. Summerfelt, 1990) и промотор нопалин синтазы (nos) (M. W. Bevan et al.. 1983; Herrera-Estrella et al., 1983; R.T. Fraley et al. , 1983; M.De Block et al., 1984; R. HaIn et al., 1985). Эти промоторы активны в разнообразных растительных тканях.
Для управления экспрессией гетерологичных генов двудольных используется также несколько вирусных промоторов (J.C. Kridl and R.M. Goodman, 1986). Промотор 35S вируса мозаичности цветной капусты - один из промоторов, которые чаще других используются для трансформации двудольных, потому что он дает высокие уровни генной экспрессии почти во всех тканях (J. Odell et al., 1985; D. W. Ow et al., 1985; D.W. Ow et al., 1986; D.M. Shah et al., 1986). Используются также и модификации этого промотора, включая конфигурацию с двумя тандемными 35S промоторами (R. Kay et al., 1987) и mas-35S промотор (L. Comai et al., 1990), который состоит из промотора маннопин синтазы в тандеме с 35S промотором. Оба эти промотора управляют даже более высокими уровнями генной экспрессии по сравнению с единичной копией 35S промотора. Другие вирусные промоторы, которые использовались, включают промотор 19S вируса мозаичности цветной капусты ( J. Paszkowski et al., 1984; E. Balazs et al. , 1985) и 34S промотор вируса мозаичности норичника Scrophularia (M. Sanger et al., 1990).
Изучение экспрессии АHAS (синтаза ацетооксикислот) у ряда растений показывает, что AHAS экспрессируется во всех растительных тканях. Gail Schmitt и Bijay K. Singh (1990) отмечали, что энзиматические тесты, выполненные на различных тканях лимской фасоли Phaseolus limensis, продемонстрировали, что активность AHAS проявлялась во всех тестируемых тканях, включая листья, стебли, корни, цветки, стручки и меристемы. Активность AHAS обнаруживалась фактически постоянной в стеблях, но уменьшалась в листьях, корнях и меристемах с увеличением возраста тканей.
Sharon J. Kheeler и др. (1993) отмечали, что табак содержит два гена, кодирующие синтазу ацетооксикислот, SurA и SurB. По-видимому, оба гена экспрессируются во всех типах тканей с приблизительно 4-кратным варьированием уровня экспрессии в различных тканях. Развивающиеся органы имеют наивысшие уровни экспрессии. Исследования гибридизации in situ продемонстрировали, что наивысшие уровни экспрессии наблюдались в метаболически активных или интенсивно делящихся клетках. Уровни экспрессии SurB были выше, чем у SurA для всех исследованных тканей.
Therese Ouellet и др. (1992) отмечали, что виды Brassica содержат мультигенные семейства, кодирующую синтазу ацетооксикислот. В Brassica napus были идентифицированы четыре из пяти генов-AHAS. Тесты с РНКазной защитой с использованием геноспецифических зондов проводились для определения типов экспрессии различных членов семейства генов у различных видов Brassica. Обнаружено, что два из этих генов, AHAS1 и AHAS3 хорошо экспрессируются во всех исследованных тканях. Транскрипты AHAS2 обнаруживались только в репродуктивных органах и экстраэмбриональной ткани семян. Транскрипты, кодируемые четвертым геном, AHAS4, не были обнаружены, и поэтому предположили, что он представляет собой псевдоген.
Dale L. Shaner и N. Moorthy Mallipudi (1991) отмечали, что сравнение активности AHAS в молодых листьях и клетках кукурузы BMS, выращиваемых в суспензионной культуре, показало, что активность клеток BMS на грамм сырого веса была приблизительно в 5.8 раз выше по сравнению с образцами листьев. Поскольку клетки BMS являются активно делящимися, этот результат согласуется с результатами предыдущих исследований табака и лимской фасоли Phaseolus limensis, которые продемонстрировали, что более молодые активно делящиеся ткани обладают большей активностью AHAS по сравнению со старыми.
Сущность изобретения
Промоторы AHAS из кукурузы используются для экспрессии
интродуцированных генов на высоком уровне и в различных тканях растений. Промоторы из генов als1 и als2 клонируются и секвенируются (фиг.1, фиг.2, фиг. 3), и промоторные регионы из этих генов затем
интродуцируются в плазмиду 5' к гену-репортеру β-глюкуронидазы (GUS). Оба промоторных фрагмента происходят от линии кукурузы XI12. Промоторный фрагмент als1 приблизительно длиной 1400 пар
оснований, в то время как промоторный фрагмент als2 содержит 819 пар оснований. Чтобы определить активность промоторов AHAS, для анализа уровней кратковременной экспрессии химерные плазмиды были затем
перенесены в протопласты кукурузы "Black Mexican Sweet"/черная мексиканская сладкая/ и протопласты риса. Для сравнения протопласты были также трансформированы плазмидой с промотором CaMV 35S,
управляющим геном-репортером GUS. Экспрессия химерных плазмид в клетках кукурузы определялась путем анализа ферментативной активности GUS. Активность промотора als2 была равной или превосходила
активность промотора CaMV 35S в обоих типах клеток (фиг.4). Фиг.5 показывает результаты β-глюкуронидазных тестов, выполненных на клеточных линиях BMS кукурузы, стабильно трансформированных либо
pCD221B (als2-GUS-ocs терминаторная плазмида), либо рАС400 (CaMV 35S-GUS-ocs термина-торная плазмида). Анализ распределения AHAS мРНК путем гибридизации in situ радиоактивномеченных РНК-зондов в
растительную ткань показывает, что промоторы AHAS кукурузы активны в большинстве частей растения (фиг.6, фиг.7, фиг.8).
Активность промотора AHAS анализировалась у растений арабидопсиса Arabidopsis, которые были стабильно трансформированы с использованием Agrobacterium tumefaciens. Входной промоторный регион гена AHAS арабидопсиса присоединяли к гену-репортеру GUS, вставленному в бинарный вектор pBINl9 и далее использовали для трансформации арабидопсиса. Анализы трансформированных растений показывают, что при этом происходит экспрессия GUS (судя по активности промотора) в большинстве частей растения.
Краткое описание схем
Фиг. 1 раскрывает последовательность als1 промотора AHAS кукурузы ХА17.
Фиг. 2 раскрывает последовательность als2 промотора AHAS кукурузы ХА17.
Фиг. 3 раскрывает последовательность als2 промотора AHAS кукурузы XI12.
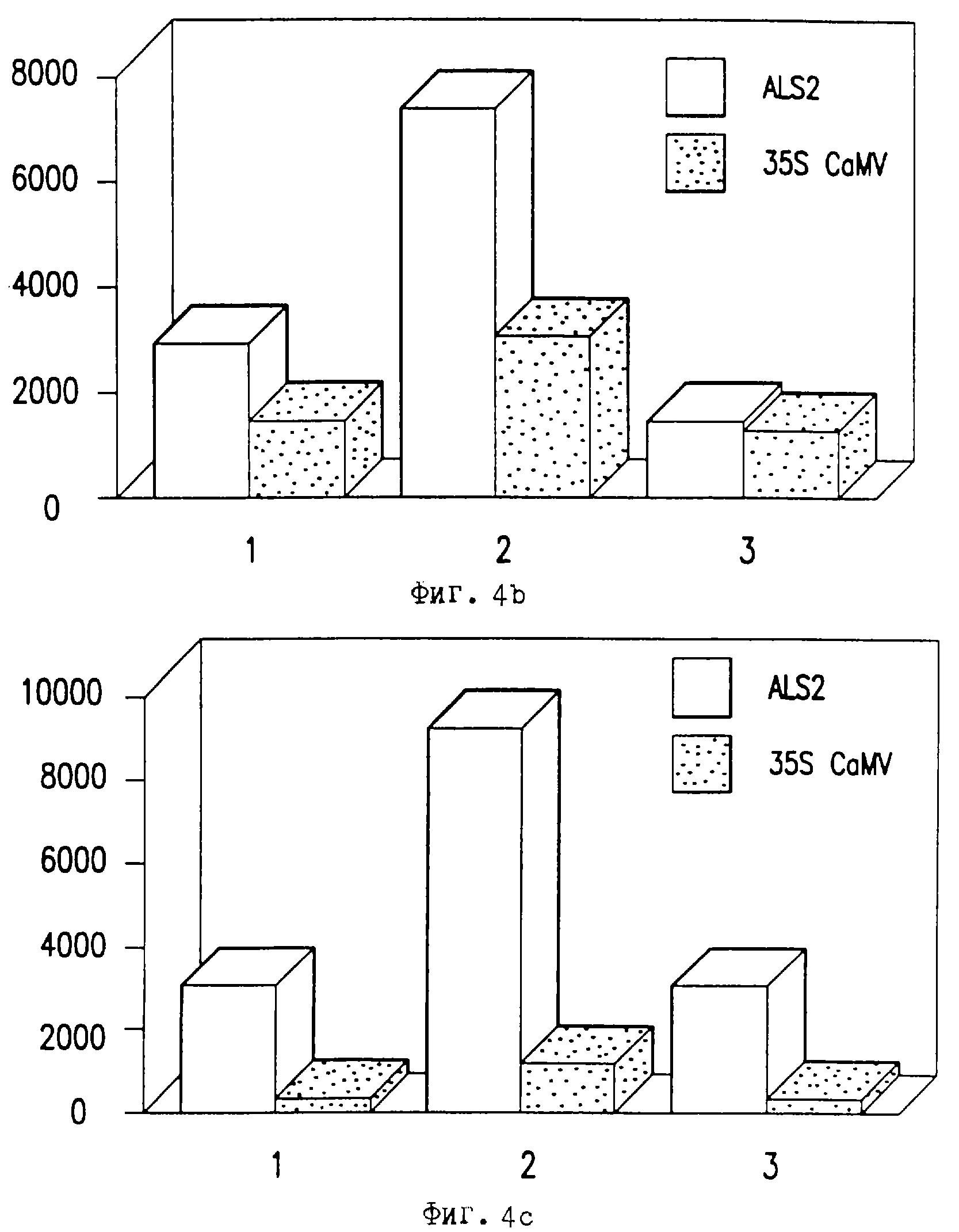
Фиг. 4 является столбчатой диаграммой, представляющей β-глюкуронидазную активность во временных тестах на протопластах клеток кукурузы "Black Mexican Sweet" или клетках риса в суспензионной культуре после трансформации pCD221B (als2-промотор-GUS-ocs терминаторная плазмида) или рАС400 (СаМV 35S-GUS-ocs терминаторная плазмида. Активность GUS рассчитывали как пмоль/мин/мГ протеина представлены результаты трех независимых экспериментов (а, b, с).
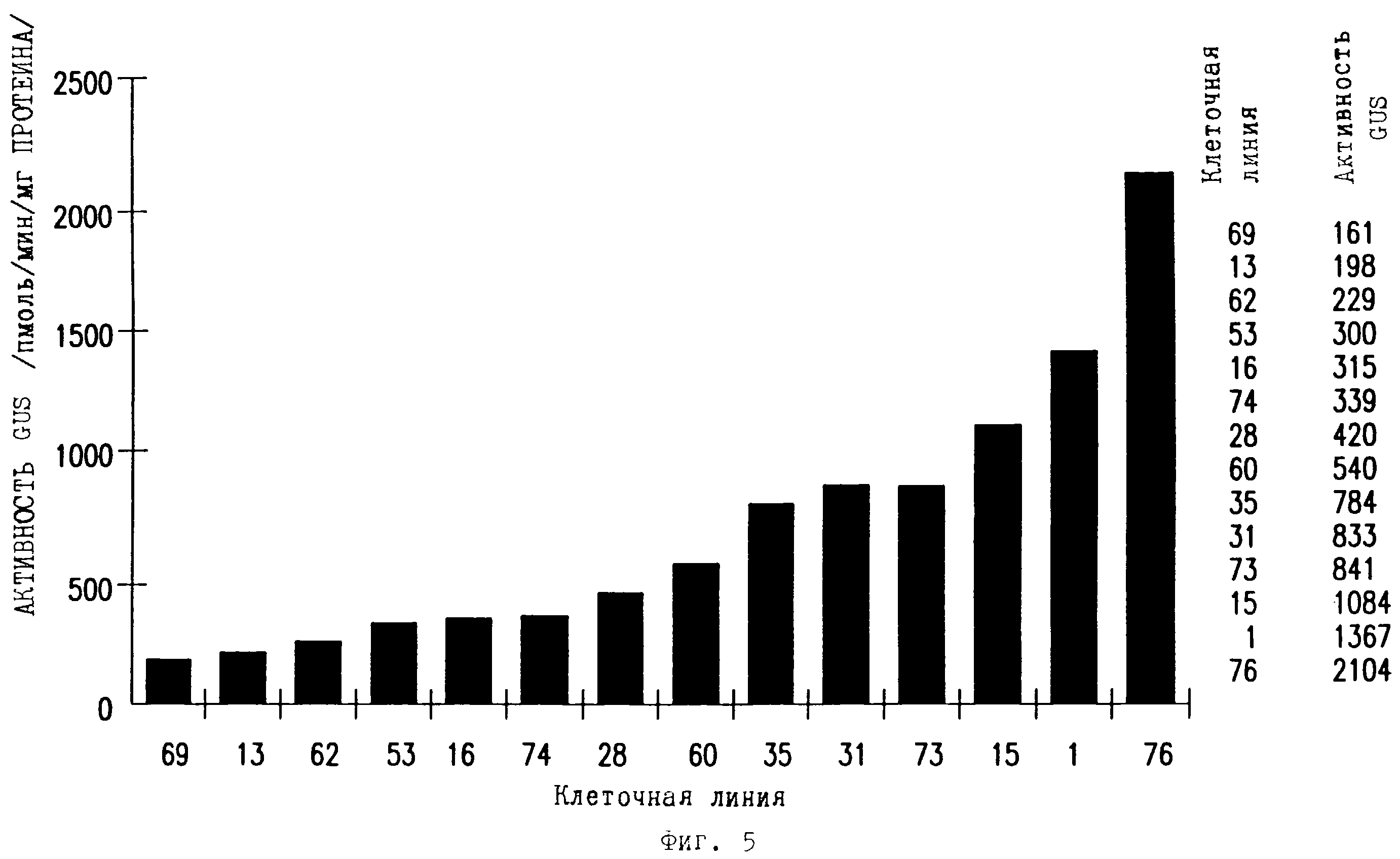
Фиг. 5 является столбчатой диаграммой, представляющей β-глюкуронидазную активность в стабильно трансформированных клеточных линиях кукурузы "Black Mexican Sweet" после трансформации pCD221B (als2-npoMomop-GUS-ocs терминатор) или рАС400 (CaMV 35S-GUS-ocs терминатор). "СК" обозначает нетрансформированную контрольную ткань. Активность GUS рассчитывалась в пмоль/мин/мг протеина.
Фиг. 6 - исследования по гибридизации in situ в листовой мутовке двухнедельных сеянцев кукурузы с использованием радиоактивно помеченных РНК-зондов. Срезы тканей были препарированы и гибридизированы с РНК-зондами, кодирующими либо AHAS смысловую полосу (AHAS-), либо AHAS антисмысловую полосу (AHAS+). Для сравнения, в качестве зондов использовали SSU (малая субъединица RUBISCO) смысловая полоса (SSU-) или SSU антисмысловая полоса (SSU+). В каждом случае ожидалось, что только антисмысловая полоса (+) будет вступать в гибридизацию с мРНК, присутствующей в ткани: а) SSU+зонд; b) SSU-зонд; с) AHAS+зонд; d) AHAS-зонд.
Фиг. 7 - исследования по гибридизации in situ в сердцевине зародыша кукурузы спустя 12 суток после опыления. Образцы подготовлены так же, как и на фиг. 6.
a) эмбрион и суспензорий, AHAS+зонд;
b) эмбрион и суспензорий, AHAS-зонд;
c) перикарп, алейроновый слой и
эндосперм, AHAS-зонд;
d) перикарп, алейроновый слой и эндосперм, AHAS+зонд.
Фиг. 8 - исследования по гибридизации in situ в апикальк меристеме молодых растений кукурузы. Образцы подготовлены так же, как и на фиг. 6. а) и b) AHAS+зонд; с) и d) AHAS-зонд.
Характеристики изолированных нуклеотидных последовательностей, включающих промотор синтазы ацетооксикислот для экспрессии генов у растений, представлены на страницах: - 18-19 SEQ. ID 1, - 19-20 SEQ. ID 2, - 20-21 SEQ. ID 3.
Подробное описание изобретения
Ученые
исследуют способы применения генетической модификации для придания растениям желательных свойств. Методики генной инженерии, используемые для улучшения характеристик, таких как вкус, структура, размер,
устойчивость к вредителям и сопротивление воздействию гербицидов, цвет, кислотность или сахаристость растений употребляемых в пищу, развиваются как более быстрая стратегия, чем традиционные методы
скрещивания-селекции.
Настоящее изобретение относится к промоторам AHAS кукурузы и арабидопсиса, и к векторам, и к растительным клеткам, включающим эти промоторы. Применительно к данной заявке, промотор определяется как нуклекотидная последовательность, находящаяся в начале гена, которая действует как сигнал для связывания с РНК-полимеразой. Гены als1 и als2 кукурузы клонируются и секвенируются, и промоторные регионы из этих генов затем интродуцируются в плазмиду 5' к гену-репортеру GUS. Применительно к данной заявке, ген-репортер определяется как нуклеотидная последовательность, которая присоединена в конец интересующего промотора, так что транскрипты, инициализирующиеся с этим промотором, затрагивают ген-репортер. Гены-репортеры обычно кодируют ряд легко определяемых по своей активности ферментов, например в настоящем изобретении экспрессия химерных плазмид в клетках кукурузы определяется анализом активности фермента β-глюкуронидазы (GUS).
Работающий в данной области должен знать, что промоторы AHAS обладают высокой активностью во многих растительных тканях различного происхождения, и их можно использовать для экспрессии новых генов у разнообразных растений. Новые гены включают, но не сводятся к ним, гены устойчивости к гербицидам, детоксикации и сопротивляемости растительным патогенам.
Заявляемые промоторы могут использоваться для экспрессии гетерологичных генов у однодольных, включая, но не ограничиваясь такими видами, кукурузу, рис, пшеницу, ячмень, сорго, овес, рожь и просо. Работающий в данной области также должен знать, что заявляемые промоторы будут также управлять экспрессией у двудольных, хотя экспрессия промоторов однодольных у двудольных, по-видимому, характеризуется более низкими уровнями, по сравнению с ее протеканием у однодольных.
Работающий в данной области должен знать, что промотор als2 кукурузы можно использовать для управления генной экспрессией у других видов однодольных. Например, промотор Act1 риса управляет генной экспрессией в протопластах кукурузы, промотор Еmu кукурузы использовался для селекции трансгенных пшеницы, ячменя и риса, а промотор AHAS арабидопсиса, промотор двудольного, использовали для управления экспрессией гена AHAS у трансгенных табака и картофеля. Упомянутый als2 кукурузы лучше всего функционирует в кукурузе, но также управляет экспрессией генов у другого однодольного. На основе исследований, выполненных на кукурузе и других видах, следует заключить, что этот промотор будет управлять базовой экспрессией гена у растения везде. Наиболее высокие уровни экспрессии наблюдаются либо в активно делящихся, либо в метаболически активных тканях.
Для трансформации однодольных культур использовались разнообразные методики, хорошо известные работающим в данной области, которые однако не ограничиваются микропроективной бомбардировкой, ПЭГ-опосредованной трансформацией, электропорацией и силиконовыми волокнами. Все эти методики включают использование векторов ДНК для доставки нуклеотидных последовательностей, подлежащих трансформации. Векторы, пригодные для использования в настоящем изобретении, включают, но не ограничиваются ими, векторы, переносящие маркерные гены, используемые для селекции трансгенного материала, включая гены, придающие устойчивость к гигромицину, канамицину, биалофосу и гербицидам, производным имидазолинона и сульфонил-мочевины.
Следующий пример служит только для иллюстрации данного изобретения и не может быть истолкован как любым образом ограничивающий это изобретение.
Пример
Эффективность промоторов als1 и als2 оценивается путем измерения активности GUS в протопластах кукурузы и риса или клеточных линиях
кукурузы с конструкциями, в которых эти последовательности промотора присоединены к гену GUS. Приготовление векторов и протокол трансформации описаны ниже.
Конструкции, содержащие
химерные гены CaMV 35S-GUS, als1-GUS и als2-GUS
Плазмида рАС400 является pUC19-основной плазмидой, образованной слиянием 418 пар оснований фрагмента EcoRI-XbaI промотора CaMV 35S,
клонированного у головы 1.7-kb фрагмента XbaI-PstI, содержащего ген GUS, и 700 пар оснований фрагмента PstI-BamHI, содержащего терминатор октопин синтазы. Гены als1 и als2 получены путем скрининга
библиотеки генома, приготовленной из кукурузы линии XI12. Фрагмент EcoRI-NcoI, содержащий 1400 пар оснований последовательности у головы кодона ATG инициализации гена als1, субклонирован в рАС400 на
место CaMV 35S промотора для образования pCD223B. Фрагмент PstI-NcoI, содержащий 819 пар оснований у головы ATG гена als2, был субклонирован спереди того же самого GUS-ocs терминатора связывания в
pBluescript® KS- (Stratagene) для образования pCD221B. Последовательность промотора als2 кукурузы XI12 представлена на фиг.3.
Трансформация и оценка протопластов риса
и кукурузы
Протопласты были выделены из клеток в суспензионной культуре риса (Nortai) или кукурузы (Black Mexican Sweet, BMS) в суспензионной культуре и трансформированы плазмидами рАС221В
или рАС400 в соответствии с протоколами ПЭГ-опосредованной трансформации по L.A. Lyznik et al. (1989) и J.Y. Peng et al. (1990). Во временных тестах трансформированные протопласты риса распределялись
по поверхности миллипоровских фильтров, помещенных поверх среды, содержащей фидерные клетки, и трансформированные протопласты BMS культивировались в 3 мл жидкой среды. Спустя двое суток после
трансформации культуры протопластов были собраны и экстрагированы буфером для извлечения GUS. Активность GUS измерялась флюориметрически в соответствии с протоколом R.A. Jefferson (1987).
Для обнаружения стабильных трансформантов в культуре кукурузы BMS, протопласты были котрансформированы pFF19K (содержащей выбираемый маркерный ген, кодирующий неомицин фосфотрансферазу) и pCD221B или рАС400. После трансформации протопласты культивировались на миллипоровских фильтрах, помещенных поверх среды, содержащей фидерные клетки. Спустя неделю протопласты переносили на среду, содержащую фидерные клетки и 100 мг/л канамицина. Культуры протопластов переносили на свежую среду Мурасиге-Скуга с 100 мг/л канамицина до тех пор, пока резистентные каллусы не стали видимыми. Каллусы, резистентные к канамицину, собирали и выращивали отдельно в течение двух-трех недель в присутствии канамицина. Каллус, резистентный к канамицину, окрашивали X-Gluc или тестировали MUG по протоколу R.A. Jefferson (1987) с целью скрининга GUS-позитивного каллуса. Каллус, идентифицированный как экспрессирующий GUS, измельчали в экстракционном буфере и тестировали, активность GUS измеряли флюориметрически.
Данные этих экспериментов представлены на фиг.4 и фиг.5.
Мутантный ген AHAS кукурузы, ответственный за резистентность к гербицидам группы имидазолинона, и управляемый промотором als2 кукурузы, использовался в качестве выбираемого маркера для получения трансгенного каллуса после трансформации как BMS, так и А188хВ73 клеток и клеток риса. Этот результат подтверждает идет, что промотор als2 эффективно управляет высокими уровнями экспрессии, что дает ему возможность управлять экспрессией маркерного гена.
Гибридизация in
situ
Препараты на предметных стеклах готовились в основном по J.A. Langdale et al. (1988). Ткань фиксировали в 4%-ном формалине, обезвоживали в этиловом спирте, очищали в ксилоле и заключали
в парафиновую пленку. Из ткани готовили срезы 8-10 мкм и помещали на предметные стекла, покрытые поли-L-лизином. Парафин удаляли ксилолом и ткань повторно регидратировали (обратная проводка)
промыванием этанолом и споласкиванием в воде. РНК-зонды готовили из обеих лент (+ и -) 172-х нуклеотидного фрагмента региона, кодирующего als2, и 392-х нуклеотидного фрагмента региона, кодирующего SSU,
используя набор Ambion Maxiscript®. Препараты на предметных стеклах подвергали гибридизации согласно протоколу Meyerowitz et al. (1988) при 50oС на ночь в разбавлении 1:4
SPB [100 мкл 10-кратных солей (3 М NaCl, 10 мМ Tris pH 6.8, 50 мМ DTA) ; 400 мкл формамида; 200 кл 50% сульфата декстрана; 40 мкл 10 мг/мл тРНК; 10 мкл 1 MDTT; 50 мкл 10 мг/мл poly А /полиаденилат/] с
зондом, денатурированном в 50%-ном формалине и 10 мМ DTT при 80oС в течение 30 секунд. Препараты на предметных стеклах промывали дважды по 15 мин в промывном буфере (однократные соли,
50%-ный формамид, 10 мМ Tris pH 8, 1 мМ EDTA, 10 мМ DTT) при 50oС, обрабатывали РНКазой А (20 мкг/мл в NTE_) в течение 30 мин при 37oС, промывали пятикратно в NTE буфере при
37oС за 1 час, дважды промывали по 30 мин в промывном буфере при 50oС, обезвоживали в этаноле и высушивали на воздухе. Препараты на предметных стеклах авторадиографировали путем
погружения в эмульсию, предварительно нагретую до 37oС в темноте, высушивали в течение 30 мин - 1 ч и хранили в темноте при 4oС до проявления. Препараты проявляли в течение 2 мин,
ополаскивали в воде, фиксировали в течение по крайней мере 5 мин и снова ополаскивали в воде. Ткань окрашивали с помощью Alcien Blue (синий краситель) и обесцвечивали в этаноле и ксилоле. После
установки в предметный столик Permount ткань просматривали с использованием микроскопа темного поля.
Данные экспериментов по гибридизации in situ на фиг.6-8 показывают, что ген в эмбрионе кукурузы экспрессируется везде.
Оказывается возможным оценить экспрессию промотора AНAS путем:
1) конструирования гена связывания als2-GUS и определения структуры
активности GUS у трансгенных растений кукурузы или риса. Предыдущие исследования с использованием промотора кукурузы продемонстрировали пригодность оценки экспрессии промотора кукурузы у риса (Junko
Kyozuka et al., 1991). После селекции траясгенных растений с целью определения как специфичности по ткани, так и по типу клеток были выполнены гистохимические анализы растительных тканей на различных
стадиях развития. Этот способ обычно используется для оценки активности промотора как у однодольных, так и у двудольных;
2) тесты по временной экспрессии проведены на протопластах, полученных
от различных видов растений после трансформации конструкций als2-GUS. Этот подход используется дли оценки способности различных промоторов функционировать у гетерологичных видов. Протопласты
трансформировали с помощью соответствующей конструкции и выдерживали для того, чтобы интродуцированный ген экспрессировался и накопился соответствующий протеин. После такой выдержки клетки
тестировались на присутствие протеина, кодируемого трансгеном для определения эффективности управляемой промотором трансгенной экспрессии.
Источники информации
1. David
McElroy et al. (1990). Изоляция эффективного актин промотора для использования в трансформации риса. The Plant Cell 2: 163-171.
2. David McElroy et al. (1991). Конструкция векторов экспрессии, основанных на региональном актин 1 (Act1) риса для использования в трансформации однодольных растений. Mol. Gen Genet. 231: 150-160.
3. Wanggen Zhang et al. (1991). Анализ активности Acti 5' региона в трансгенезе растений риса. The plant Cell 3: 1155-1165.
4. Jun Cao et al. (1992). Регенерация гербицидной резистентности трансгенеза растений риса в связи с промежуточной трансформацией суспензионной культуры клеток. Plant Cell Reports II: 586-591.
5. Alan H. Christensen et al. (1992). Полиубиквитин гены кукурузы: структура, термальная пертурбация экспрессии и транскрипция сплайсинга, и активность промотора, следующая за передачей к протопластам путем электропорации. Plant Molecular Biology 18: 675-689.
6. Seiichi Toki et al. (1992). Экспрессия убиквитин генетического промотора кукурузы - бар химерного гена в трансгенезе растений риса. Plant Physiol. 100: 1503-1507.
7. J. Troy et al. (1993). Ускоренное продуцирование со сложной структурой, независимых линий фертильной трансгенной пшеницы, (Triticum aestivum). Plant Physiol. 102: 1077-1084.
8. Yucchun Wan and Peggy G. Lemaux (1994). Генерация большого числа независимо трансформированных растений ячменя. Plant Physiol. 104: 37-48.
9. Junko Kyozuka et al. (1991). Анаэробная индукция и тканеспецифичная экспрессия Adhi промотора кукурузы в трансгенные растения риса и их потомство. Mol. Gen. Genet. 228: 40-48.
10. D.I. Last et al. (1991) рЕmu: улучшенный промотор для экспрессии гена в клетках злаковых. Theor. Appi. Genet. 81: 581-588.
11. Robert Bower and Robert G. Birch (1992). Трансгенные растения сахарного тростника, полученные путем микропроекционной бомбардировки. The Plant Journal 2 (3): 409-416.
12. D. A. Chamberlain et al. (1994). Использование Emu промотора с антибиотической и гербицидной резистентностью генов для селекции каллуса растений трансгенной пшеницы и риса. Aust. J. Plat. Physiol., 21: 95-112.
13. L. Comai et al. (1985). Экспрессия в растениях мутанта аrоА гена из Salmonella typhimurium сравнивается с толерантностью к глифосфату. Nature 317: 741-744.
14. С. Waldron et al. (1985). Резистентность к гидромицину В: новый маркер для изучения трансформации растений. Plant Mol. Biol. 5: 103-108.
15. Kevin E. McBride, Kristin R. Summerfelt (1990). Улучшенные бинарные векторы для трансформации Agrobacterium-mediated растений. Plant Mol. Biol. 14: 269-276.
16. Michael Bevan et al. (1983). Химерный ген с антибиотической резистентностью в качестве пригодного для селекции маркера для трансформации растительной клетки. Nature 304: 184-187.
17. Luis Herrera-Estrella et al. (1983). Экспрессия химерных генов, трансформированных в клетки растений путем использования Ti-плазмид-разветвленного вектора. Nature 304: 209-213.
18. Robert T. Fraley et al. (1983). Экспрессия бактериальных генов в клетках растений. P.N.A.S. 80: 4803-4807.
19. Marc De Block et al. (1984). Экспрессия инородных генов в регенерированных растениях и их потомстве. EMBO J.3: 1681-1689.
20. R. Hain et al. (1985). Ввод, интеграция, экспрессия и генетическая трансмиссия пригодных для отбора химерных генов протопластов растений. Mol. Gen. Genet. 199: 161-168.
21. J.C. Kridi and Robert M. Goodman (1986). Транскрипциональные регуляторные последовательности, полученные из вирусов растений. Bio Essays 4:4-8.
22. Joan T. Odell et al. (1985). Идентификация ДНК последовательностей, необходимых для активации 35S промотора вируса мозаики цветной капусты. Nature 313: 810-812.
23. David W. Ow et al. (1986). Временная и устойчивая экспрессия гена люциферазы светляков в клетках растений и трансгенных растений. Science 234: 856-959.
24. D.M. Shah et al. (1986). Инженерия гербицидной толерантности в трансгенных растениях. Science 233: 478-481.
25. Robert Kay et al. (1987). Дупликация CaMV последовательностей 35S промотора создает сильный энхансер для растительных генов. Science 236: 1299-1302.
26. L. Comai et al. (1990). Новые и полезные свойства химерного растительного промотора в комбинации CaMV 35S и MAS элементов. Plant Mol. biol. 15: 373-381.
27. J. Pazskowski et al. (1984). Прямая передача гена в растения, plants. EMBOJ. 3: 2717-2722.
28. Ervin Balazs et al. (1985). Конструкция химерного вектора для трансформации высших растений. Gene 40: 343-348.
29. Margaret Sanger et al. (1990). Характеристики сильного промотора для вируса мозаичности норичника шишковатого. Сравнение с аналогами 35S промотора для вируса мозаичности цветной капусты и промотора маннопин синтазы. Plant Mol. Biol. 14:433-443.
30. Gail Schmidt and Bijay К. Singh (1990). Активность тканевого распределения синтазы ацетооксикислот на различных стадиях развития фасоли лима. Pesticide Sci. 30 (4): 418-419.
31. Sharon J. Kheeler et al. (1993). Экспрессия регуляции гена актиолактат синтазы табака. Plant Physiol. 102: 1009-1018.
32. Therese Ouellet et al. (1992). Органы синтазы ацетооксикислот мультигенного семейства Brassica napus имеют различные паттерны экспрессии. The Plant Journal 2: 321-330.
33. Dale L. Shaner and N. Moorthy Mallipudi (1991).
Взаимодействия синтазы имадозолинон-ацетооксикислот. Imidazolinone Herbicides ed. Dale L. Shaner and Susan L. O' Connor CRC Press (Boca Raton, FL.)
34. R. A. Jefferson (1987). Анализ химерных
генов в растениях: система слияния GUS генов. Plant Mol. Biol. Rept 5: 387-405.
35. L. A. Lyznik et al. (1989). Стабильная трансформация протопластов кукурузы с gusA и nео генами. Plant Mol biol 13: 151-161.
36. J.Y. Peng et al. (1990). Ко-трансформация протопластов риса indica с nео и gusA генами. Plant Cell Kept 9: 168-172.
37. J. A. Langdale et al. (1988). Экспрессия клеточных паттернов фотосинтетического гена в развивающихся листьях кукурузы. Gene Dev. 2:106-115.
38. Е. Meyerowitz et al. (1988). Гибридизация "на месте" в растительных клетках РНК. Plant Mol. Bio. Kept., 5: 242-250 SEQUENCE LISTING.
Реферат
Изобретение относится к генной инженерии и может быть использовано в селекции растений. Введение в клетки растения нуклеотидной последовательности промотора из генов als1 и als2 кукурузы обеспечивает высокоуровневую экспрессию гетерологичного гена в растении. В качестве гетерологичного гена может быть использован мутантный ген синтазы ацетооксикислот (AHAS). Это позволяет получать растения, устойчивые к гербицидам, в частности к имидазолинонам. 5 c. и 6 з.п. ф-лы, 8 ил.


Комментарии