Конъюгат мирнк и способ его получения - RU2571218C2
Код документа: RU2571218C2
Чертежи














Описание
Область техники, к которой относится изобретение
Настоящее изобретение относится к конъюгату, в котором полимерное соединение, улучшающее доставку миРНК, используемой в генной терапии онкологических заболеваний и других инфекционных заболеваний, конъюгировано с миРНК посредством расщепляемой или нерасщепляемой связи, к способу получения указанного конъюгата и к способу доставки миРНК с использованием указанного конъюгата.
Уровень техники
Интерференция РНК означает механизм, который представляет собой посттранскрипционное подавление генов, индуцированное двухцепочечной РНК (дцРНК) специфичным для последовательности нуклеотидов способом в процессе экспрессии генов, и этот механизм впервые был обнаружен у круглого червя и обычно встречается у растений, плодовой мушки дрозофилы и позвоночных животных (Fire и др., Nature, 1998 г., т.391, с.806-811; Novina & Sharp, Nature, 2004 г., т.430, с.161-164). Как известно, интерференция РНК происходит таким образом, что дцРНК 19-25 п.о. при входе в клетку образует связь с РИКП (РНК-индуцированный комплекс подавления), и лишь антисмысловая (направляющая) цепь связана с мРНК так, что является комплементарной последовательности нуклеотидов мРНК, расщепляя тем самым мишеневую мРНК доменами эндонуклеазы, существующими в РИКП (Rana, T.M., Nat. Rev. Mol. Cell BioL, 2007 г., т.8, с.23-36; Tomari, Y. & Zamore, P.D., Genes Dev., 2005 г., т.19, с.517-529).
Когда дцРНК попадает в клетку, она образует специфическую связь с мишеневой последовательностью мРНК, чтобы разложить мРНК, и поэтому ее рассматривают в качестве нового инструмента, способного регулировать экспрессию генов. Однако в случае человека было трудно получить эффект интерференции РНК вследствие воздействия транспорта интерферона на введение дцРНК в клетки человека. В 2001 г. Elbashir, Tuschi и др. обнаружили, что введение малой дцРНК длиной в 21 нт.(нуклеотид) в клетки человека не привело к транспорту интерферона, но специфически разрушило целевую мРНК (Elbashir, S.M., Harborth, J, Lendeckel, W., Yalcin, A., Weber, K., Tuschi, Т., Nature, 2001 г., т.411, с.494-498; Elbashir, S.M., Lendeckel, W., Tuschi, Т., Genes & Dev., 2001 г., т.15, с.188-200; Elbashir, S.M., Martinez, J., Patkaniowska, A., Lendeckel, W., Tuschi, Т., EMBO J., 2001 г., т.20, с.6877-6888). Впоследствии дцРНК длиной в 21 нт. приняли как инструмент новой функциональной геномики и назвали термином «малая интерферирующая РНК» (миРНК).
Малая интерферирующая РНК представляет собой вещество, привлекающее большой интерес в качестве средства генной терапии с тех пор, как был показан ее поразительный эффект ингибирования экспрессии определенных генов в клетках животных. Фактически, вследствие ее высокой активности и точной генной селективности, ожидают, что миРНК станет лекарственным средством, альтернативным антисмысловому олигодеоксинуклеотиду (ОДН), который в настоящее время используют в качестве лекарственного средства, в результате двадцатилетних исследований (Dana J. Gary и др., Journal of Controlled Release, 2007 г., т.121, с.64-73,). Применение миРНК в методах лечения имеет большие преимущества, которые заключаются в ее легком конструировании по сравнению с другими лекарственными средствами, и высокой селективностью к мишени и свойством ингибирования экспрессии определенного гена. Кроме того, миРНК менее токсична, потому что интерференция РНК подавляет экспрессию генов с использованием механизма, который естественным образом существует в живой системе. Бевасираниб (Bevasiranib), недавно разработанный компанией ОРКО Inc. в качестве средства лечения влажной формы возрастной макулодистрофии, представляет собой миРНК, которая селективно воздействует на фактор роста эндотелия сосудов (ФРЭС), включая неоваскуляризацию, для ингибирования экспрессии ФРЭС, и в настоящее время проходит трехфазное клиническое исследование (DejnekaN.S. и др., Mol. Vis., 2008 г., т.28, №14, с.997-1005). Кроме того, недавно были разработаны лекарственные средства, включающие миРНК и нацеленные на различные гены (Ryan P. Million, Nature Reviews Drug Discovery, 2008, т.7, с.115-116).
Несмотря на разнообразные результаты, показывающие, что специфическое ингибирование экспрессии индуцируется в живом организме посредством интерференции РНК, в живом организме доставка миРНК требует решения многочисленных проблем, включая разрушение ферментами крови, взаимодействие с компонентами крови и неспецифическую доставку в клетки (Shigeru Kawakami & Mitsuru Hashida, Drug Metab. Pharmacokinet, 2007 г., т.22, №3, с.142-151). Предпринимаются попытки решения этих проблем, в частности, путем использования устойчивых к нуклеазе аналогов нуклеозидов или усовершенствованием способов доставки.
Примеры усовершенствованных способов доставки включают способы доставки генов с использованием вирусов, в том числе аденовирусов, ретровирусов и т.д., и способы доставки генов невирусными носителями с использованием липосом, катионных липидов и катионных полимерных соединений. Однако с вирусными носителями связана проблема безопасности, потому что доставленные гены могут внедриться в хромосомы хозяина и создать аномалии в нормальном функционировании генов хозяина и активации онкогенов, и кроме того, могут вызывать аутоиммунные заболевания вследствие последующей экспрессии вирусных генов в малых количествах или могут не приводить к эффективному защитному иммунитету в том случае, когда модифицированная вирусная инфекция вызвана вирусными носителями. При этом невирусные носители являются менее эффективными, чем вирусные носители, но имеют преимущества низкого уровня побочных эффектов и недорогого производства, принимая во внимание безопасность для живого организма и экономическую осуществимость (Lehrman S., Nature, 1999 г., т.401, №6753, с.517-518). Кроме того, невирусные способы доставки требуют эффективной защиты от ферментативного или неферментативного разложения, для того, чтобы доставлять молекулы РНК, включая миРНК, причем один из способов заключается в использовании экспрессионной плазмиды ДНК, кодирующей короткие образующие шпильки РНК (кшРНК). Преимущество системы с участием ДНК заключается в экспрессии миРНК только при наличии вектора экспрессии. Кроме того, в недавнем исследовании химической модификации миРНК был предложен способ повышения устойчивости к нуклеазам и снижения внутриклеточного поглощения (Shigeru Kawakami & Mitsuru Hashida, Drug Metab. Pharmacokinet, 2007 г., т.22, №3, с.142-151).
В одном из типов химической модификации миРНК фосфордиэфирную связь, которая представляет собой часть, разлагаемую нуклеазой, модифицировали фософоротиоатной связью или части 2′ пентозы модифицировали 2′-O-меРНК, 2′-деокси-2′-флуоридином или закрытой нуклеиновой кислотой (ЗНК), образованной связыванием части 2′ и части 4′, и в результате повысилась устойчивость сыворотки (Braasch D. А. и др., Bioorg. Med. Chem. Lett., 2003 г., т.14, с.1139-1143; Chiu Y.L. & Rana T.M., RNA, 2003 г., т.9, с.1034-1048; Amarzguioui M. и др., Nucleic Acid Res., 2003 г., т.31, с.589-595). При химической модификации другого типа функциональная группа связана с концевой областью З′-смысловой (с противоположным направлением) цепи, приводя у улучшению фармакокинетических характеристик по сравнению с контролем, и высокая эффективность индуцируется во время использования в живом организме посредством баланса гидрофильности и гидрофобности миРНК (Soutschek J. и др., Nature, 2004 г., т.432, с.173-178).
Однако приведенные выше способы все же оставляют желать лучшего в отношении защиты миРНК от нуклеаз и повышения эффективности проницаемости клеточной мембраны.
По этой причине авторы настоящего изобретения обнаружили, что конъюгат, в котором гидрофильное или гидрофобное полимерное соединение конъюгировано с миРНК с использованием расщепляемой или нерасщепляемой связи, повышает устойчивость в живом организме миРНК, и на этом основании было создано настоящее изобретение.
Описание
Техническая задача
Целью настоящего изобретения является конъюгат, в котором гидрофильное или гидрофобное полимерное соединение, которое представляет собой биосовместимое полимерное соединение, конъюгировано к концу смысловой цепи или антисмысловой цепи миРНК с использованием расщепляемой или нерасщепляемой связи, для улучшения эффективности внутриклеточной доставки миРНК.
Другой целью настоящего изобретения является твердая подложка, содержащая полимерное соединение, в частности, полимерное соединение, устойчивость которого доказана при введении в организм человека, например, полиэтиленгликоль (ПЭГ), и способ эффективного получение олигонуклеотида, включающего РНК, ДНК, химеру РНК-ДНК и их аналог, в котором ПЭГ связан с его концом 3′ с использованием подложки.
Еще одной целью настоящего изобретения является способ получения конъюгата миРНК и способ доставки миРНК с использованием конъюгата миРНК.
Техническое решение
Для достижения перечисленных выше задач, в первом пункте настоящего изобретения предложен конъюгат миРНК и полимерного соединения, имеющий следующую структуру:
A-X-R-Y-B
(где А и В независимо представляют собой гидрофильное полимерное или гидрофобное полимерное соединение; Х и Y независимо представляют собой простую ковалентную связь или ковалентную связь через промежуточный линкер; и R представляет собой миРНК).
Во втором пункте настоящего изобретения предложен конъюгат миРНК и полимерного соединения, имеющий следующую структуру:
A-X-R
(где А представляет собой гидрофобное полимерное соединение; Х представляет собой простую ковалентную связь или ковалентную связь через промежуточный линкер; и R представляет собой миРНК).
В третьем пункте настоящего изобретения предложен конъюгат, в котором одинарная цепь миРНК (R) включает от 19 до 31 нуклеотида.
В четвертом пункте настоящего изобретения предложен конъюгат, в котором гидрофобное полимерное соединение (А) имеет молекулярную массу от 250 до 1000.
В пятом пункте настоящего изобретения предложен конъюгат, в котором гидрофобное полимерное соединение (А) представляет собой углеводород C16-C50 или холестерин.
В шестом пункте настоящего изобретения предложен конъюгат, в котором ковалентная связь (X, Y) представляет собой нерасщепляемую связь или расщепляемую связь.
В седьмом пункте настоящего изобретения предложен конъюгат, в котором нерасщепляемая связь представляет собой амидную связь или фосфатную связь.
В восьмом пункте настоящего изобретения предложен конъюгат, в котором расщепляемая связь выбрана из дисульфидной связи, расщепляемой кислотой связи, сложноэфирной связи, ангидридной связи, биорасщепляемой связи и расщепляемой ферментом связи.
В девятом пункте настоящего изобретения предложен конъюгат, в котором гидрофильное полимерное соединение (А или В) представляет собой неионное полимерное соединение, имеющее молекулярную массу от 1000 до 10000.
В десятом пункте настоящего изобретения предложен конъюгат, в котором гидрофильное полимерное соединение выбрано из группы, в которую входят полиэтиленгликоль (ПЭГ), поливинилпирролидон и полиоксазолин.
В одиннадцатом пункте настоящего изобретения предложена связанная с полиэтиленгликолем твердая подложка, имеющая следующую структуру:
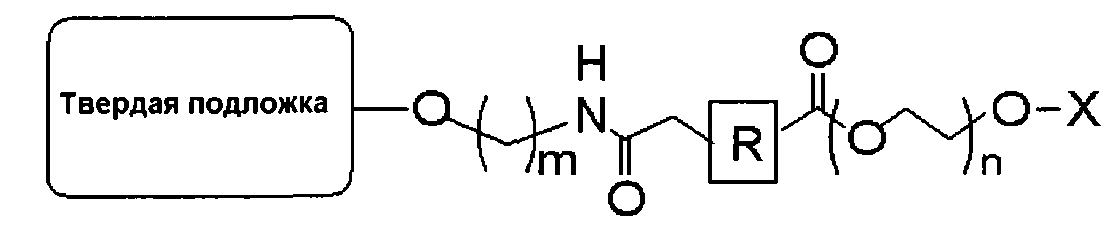
(где R представляет собой алкил, алкенил, алкинил, арил, арилалкил, гетероалкил или гетероарил; m представляет собой целое число от 2 до 18; n представляет собой целое число от 5 до 120; и Х представляет собой атом водорода, 4-монометокситритил, 4,4′-диметокситритил или 4,4′,4"-триметокситритил).
В двенадцатом пункте настоящего изобретения предложена связанная с полиэтиленгликолем твердая подложка, где твердая подложка представляет собой стекло с контролируемым размером пор (СКП).
В тринадцатом пункте настоящего изобретения предложена связанная с полиэтиленгликолем твердая подложка, в которой СКП имеет диаметр от 40 до 180 мкм и размер пор от 500 до 3000 А.
В четырнадцатом пункте настоящего изобретения предложена связанная с полиэтиленгликолем твердая подложка, в которой связанная с полиэтиленгликолем твердая подложка представляет собой соединение 3′-ПЭГ(полиэтиленгликоль)-СКП, имеющее следующую структурную формулу IV:
[Структурная формула IV]

В пятнадцатом пункте настоящего изобретения предложен способ получения соединения 3′-ПЭГ-СКП, имеющего следующую структурную формулу IV, причем способ предусматривает:
1) реакцию СКП с 3-аминопропилтриэтоксисиланом, в которой образуется соединение длинноцепного алкиламина и стекла с контролируемым размером пор (ДЦАА-СКП);
2) реакцию полиэтиленгликоля с 4,4′-диметокситритилхлоридом, в которой образуется 2-[бис-(4-диметокситритил)полиэтиленгликоль];
3) реакцию соединения, полученного на стадии (2), с соединением, имеющим следующую химическую формулу 1, в которой образуется соединение, имеющее следующую структурную формулу I;
4) реакцию полученного соединения, имеющего следующую структурную формулу I, с 4-нитрофенилхлорформиатом, в которой образуется соединение, имеющее следующую структурную формулу II;
5) реакцию соединения, имеющего следующую структурную формулу I и полученного на стадии (3), с N-сукцинимидилтрифторуксусной кислотой, в которой образуется соединение, имеющее следующую структурную формулу III; и
6) реакцию соединения ДЦАА-СКП, полученного на стадии (1), с соединениями, имеющими следующие структурные формулы I, II и III, соответственно, и полученными на стадиях (3)-(5), соответственно.
[Химическая формула 1]

[Структурная формула I]

[Структурная формула II]

[Структурная формула III]

[Структурная формула IV]

(где R представляет собой алкил, алкенил, алкинил, арил, арилалкил, гетероалкил или гетероарил; и n представляет собой целое число, составляющее не менее чем 5 и не более чем 120).
В шестнадцатом пункте настоящего изобретения предложен способ получения конъюгата миРНК, причем способ предусматривает:
1) получение миРНК против гена-мишени с использованием связанной с полиэтиленгликолем твердой подложки согласно одиннадцатому пункту настоящего изобретения; и
2) соединение концевой группы миРНК и полиэтиленгликоля ковалентной связью.
В семнадцатом пункте настоящего изобретения предложена наночастица, состоящая из конъюгатов миРНК согласно первому или второму пункту настоящего изобретения.
В восемнадцатом пункте настоящего изобретения предложен способ генной терапии, причем способ предусматривает:
1) получение наночастиц согласно семнадцатому пункту настоящего изобретения; и
2) введение наночастиц в организм животного.
В девятнадцатом пункте настоящего изобретения предложен способ генной терапии, в котором наночастицы вводят в организм путем перорального приема или внутривенной инъекции.
В двадцатом пункте настоящее изобретение относится к фармацевтической композиции, содержащей фармацевтически эффективное количество конъюгатов миРНК согласно первому или второму пунктам настоящего изобретения.
В двадцать первом пункте настоящее изобретение относится к фармацевтической композиции, содержащей фармацевтически эффективное количество наночастиц согласно семнадцатому пункту настоящего изобретения.
Далее настоящее изобретение будет описано подробно.
Настоящее изобретение относится к конъюгату миРНК и полимерного соединения, имеющему следующую структуру:
A-X-R-Y-B.
В описании заявки А и В независимо представляют собой гидрофильное полимерное или гидрофобное полимерное соединение; Х и Y независимо представляют собой простую ковалентную связь или ковалентную связь через промежуточный линкер; и R представляет собой миРНК.
Кроме того, настоящее изобретение относится к конъюгату миРНК и полимерного соединения, имеющему следующую структуру:
A-X-R.
В описании заявки А представляет собой гидрофобное полимерное соединение; Х представляет собой простую ковалентную связь или ковалентную связь через промежуточный линкер; и R представляет собой миРНК.
В конъюгате по настоящему изобретению олигонуклеотидная цепь миРНК может содержать от 19 до 31 нуклеотида. Любую миРНК, полученную из генов, которую используют или могут использовать для генной терапии или исследования, можно использовать в качестве миРНК, подходящей для настоящего изобретения.
Гидрофобное полимерное соединение может представлять собой гидрофобное полимерное соединение, имеющее молекулярную массу от 250 до 1000. Примеры гидрофобного полимерного соединения могут включать углеводород, предпочтительно, углеводород C16-C50, и холестерин. В данном документе гидрофобное полимерное соединение не ограничено только углеводородом и холестерином.
Гидрофобное полимерное соединение заставляет функционировать гидрофобное взаимодействие, в котором образуется мицелла, состоящая из конъюгатов миРНК и гидрофобного полимерного соединения. Среди гидрофобных полимерных соединений, в частности, насыщенный углеводород имеет преимущество в том, что он может быть легко конъюгирован к миРНК в процессе производства миРНК, и, таким образом, он является в высокой степени подходящим для получения конъюгатов по настоящему изобретению.
Кроме того, ковалентная связь (т.е. X, Y) может представлять собой одну из нерасщепляемой или расщепляемой связи. В данном случае может существовать амидная связь или фосфатная связь в качестве нерасщепляемой связи, и может существовать дисульфидная связь, расщепляемая кислотой связь, сложноэфирная связь, ангидридная связь, биорасщепляемая связь и расщепляемая ферментом связь в качестве расщепляемой связи. Однако нерасщепляемая или расщепляемая связь не ограничена перечисленными выше примерами.
Линкер, посредством которого образуется связь, ковалентно связывает гидрофильный полимер (или гидрофобный полимер) и конец остатка, полученного из миРНК, и не ограничен определенным образом при том условии, что он может обеспечивать расщепляемую связь в определенной среде по мере необходимости. Следовательно, линкер может включать любое соединение, которое может быть связано с миРНК и/или гидрофильным полимером (или гидрофобным полимером), для их активации в процессе получения конъюгата.
Кроме того, гидрофильное полимерное соединение может представлять собой неионное полимерное соединение, имеющее молекулярную массу от 1000 до 10000. Например, гидрофильное полимерное соединение может включать неионное гидрофильное полимерное соединение, в том числе полиэтиленгликоль, поливинилпирролидон, полиоксазолин и подобные соединения, но не ограничивается ими.
Функциональная группа гидрофильного полимерного соединения может быть замещена другой функциональной группой по мере необходимости. Среди гидрофильных полимерных соединений, в частности, ПЭГ является весьма подходящим для получения конъюгатов по настоящему изобретению, так как он имеет различные значения молекулярной массы, способен к концевому введению функциональных групп, обладает превосходной биосовместимостью, не вызывает иммунные реакции и повышает растворимость в воде, что улучшает эффективность доставки генов в живом организме.
Кроме того, настоящее изобретение относится к связанной с полиэтиленгликолем твердой подложке, имеющей следующую структуру:

В данном случае твердая подложка включает, например, СКП, полистирол, силикагель, целлюлозную бумагу и т.д., но не обязательно ограничивается этими материалами; R представляет собой алкил, алкенил, алкинил, арил, арилалкил, гетероалкил или гетероарил; m представляет собой целое число от 2 до 18; n представляет собой целое число от 5 до 120 (молярная масса 282-5300); и Х представляет собой 4-монометокситритил, 4,4′-диметокситритил или 4,4′,4"-триметокситритил и удаляется после обработки кислотой с замещением атомом водорода. В том случае, если твердая подложка представляет собой СКП, она может иметь диаметр от 40 до 180 мкм и размер пор от 500 до 3000 А.
Кроме того, настоящее изобретение относится к связанной с полиэтиленгликолем твердой подложке, с которой связано соединение 3′-ПЭГ-СКП, имеющее следующую структурную формулу IV:
[Структурная формула IV]
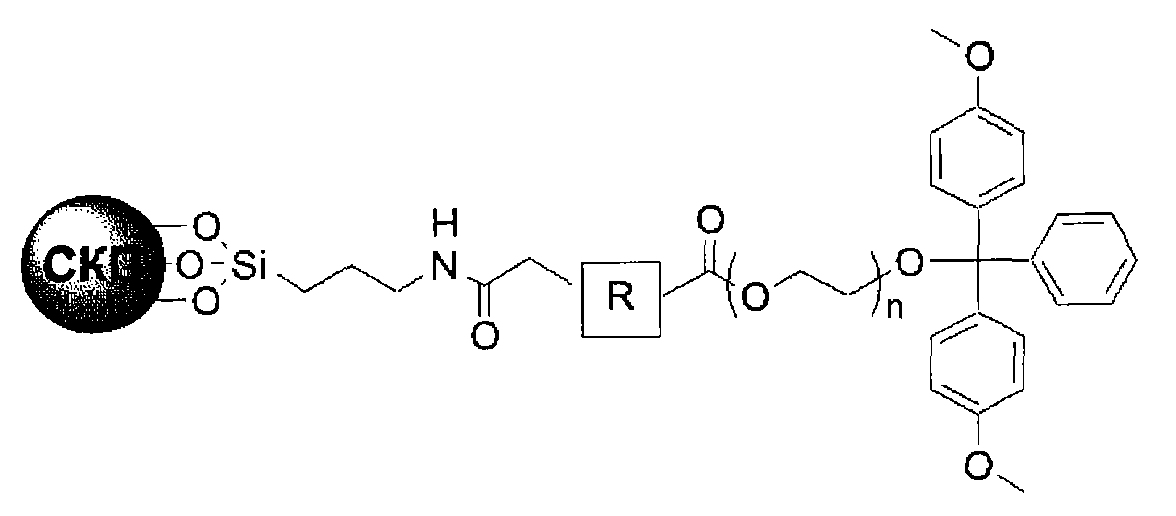
Кроме того, настоящее изобретение относится к способу получения 3′-ПЭГ-СКП со следующей структурной формулой IV, имеющей следующую структурную формулу IV, причем способ предусматривает:
1) реакцию СКП с 3-аминопропилтриэтоксисиланом, в которой образуется соединение длинноцепного алкиламина и стекла с контролируемым размером пор (ДЦАА-СКП);
2) реакцию полиэтиленгликоля с 4,4′-диметокситритилхлоридом, в которой образуется 2-[бис-(4-диметокситритил)полиэтиленгликоль];
3) реакцию соединения, полученного на стадии (2), с соединением, имеющим следующую химическую формулу 1, в которой образуется соединение, имеющее следующую структурную формулу I;
4) реакцию полученного соединения, имеющего следующую структурную формулу I, с 4-нитрофенилхлорформиатом, в которой образуется соединение, имеющее следующую структурную формулу II;
5) реакцию соединения, имеющего следующую структурную формулу I и полученного на стадии (3), с N-сукцинимидилтрифторуксусной кислотой, в которой образуется соединение, имеющее следующую структурную формулу III; и
6) реакцию соединения ДЦАА-СКП, полученного на стадии (1), с соединениями, имеющими следующие структурные формулы I, II и III, соответственно, и полученными на стадиях (3)-(5), соответственно.
[Формула 1]

[Структурная формула I]
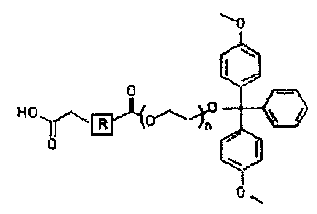
[Структурная формула II]

[Структурная формула III]

[Структурная формула IV]

(где R представляет собой алкил, алкенил, алкинил, арил, арилалкил, гетероалкил или гетероарил; и n представляет собой целое число, составляющее не менее чем 5 и не более чем 120).
Кроме того, настоящее изобретение относится к способу получения конъюгата, включающего миРНК и ПЭГ с использованием связанной с полиэтиленгликолем твердой подложки. Более конкретно, предложен способ получения конъюгата миРНК, который предусматривает:
1) получение миРНК против гена-мишени с использованием связанной с полиэтиленгликолем твердой подложки по одиннадцатому пункту настоящего изобретения;и
2) соединение концевой группы миРНК и полиэтиленгликоля ковалентной связью.
Таким способом можно эффективно получать олигонуклеотиды, включая РНК, ДНК, химеру РНК-ДНК и их аналог.
Согласно предпочтительному варианту осуществления настоящего изобретения, миРНК можно получать путем формирования фосфордиэфирных связей, строящих основную структуру РНК, с использованием β-цианоэтилфосфорамидита (Shina и др., Nucleic Acids Research, 1984 г., т.12, с.4539-4557). Например, ряд процедур, в число которых входят разблокирование, соединение, окисление и кэппирование, повторно проводили на твердой подложке, к которой был прикреплен нуклеотид, с использованием синтезатора РНК, чтобы получить реагент, содержащий РНК желательной длины. Однако настоящее изобретение не ограничено перечисленным выше.
Кроме того, настоящее изобретение относится к наночастице, состоящей из конъюгатов миРНК.
Конъюгаты миРНК и полимерного соединения по настоящему изобретению могут образовывать структуру из наночастиц посредством взаимодействия между собой, и конъюгат миРНК и полимерного соединения и наночастицы, состоящие из полученных таким образом конъюгатов миРНК и полимерного соединения, улучшают внутриклеточную доставку миРНК, и их можно использовать для лечения модельных заболеваний. Получение конъюгатов, а также характеристики и внутриклеточная эффективная доставка и действие наночастиц, состоящих из конъюгатов, будут подробно описаны в приведенных ниже примерах.
Кроме того, настоящее изобретение относится к способу генной терапии с использованием наночастиц.
Более конкретно, способ генной терапии включает получение наночастиц, каждая из которых состоит из конъюгатов миРНК и полимерного соединения, и введение наночастиц в организм животного.
Кроме того, настоящее изобретение относится к фармацевтической композиции, содержащей фармацевтически эффективное количество наночастиц, каждая из которых состоит из конъюгатов миРНК.
Композицию по настоящему изобретению можно получить, включая один или более фармацевтически приемлемых носителей, помимо описанных выше активных компонентов, для приема. Фармацевтически приемлемый носитель должен быть совместимым с активными компонентами по настоящему изобретению. Фармацевтически приемлемый носитель можно использовать путем смешивания с физиологическим раствором, стерилизованной водой, раствором Рингера (Ringer), содержащим буфер физиологическим раствором, раствором декстрозы, раствором мальтодекстрина, глицерином и этанолом, и одним или более данных растворов, а также, по мере необходимости, можно вводить другие обычные добавки, в том числе антиоксиданты, буферные растворы, препятствующие размножению бактерий вещества или подобные вещества. Кроме того, можно дополнительно вводить разбавители, диспергаторы, поверхностно-активные вещества, связующие вещества и смазочные материалы, чтобы получать составы для инъекций, в том числе водные растворы, суспензии, эмульсии или подобные составы. Кроме того, композицию по настоящему изобретению можно предпочтительно составлять в зависимости от определенных заболеваний или компонентов, используя соответствующие способы, известные в технике, или способы, описанные в фармацевтическом справочнике Remington′s Pharmaceutical Science (издательство Mack, Истон, штат Пенсильвания).
Фармацевтическую композицию по настоящему изобретению могут определить специалисты в данной области техники на основании синдромов и тяжести заболеваний пациентов. Кроме того, фармацевтическую композицию по настоящему изобретению можно составлять в различных формах, включая порошки, таблетки, капсулы, жидкости, средства для инъекций, мази, сиропы и т.п., и можно выпускать в содержащем одну дозу или много доз контейнере, например, в запаянной ампуле, флаконе и т.п.
Фармацевтическая композиция по настоящему изобретению может быть предназначена для перорального или парентерального применения. Путь введения фармацевтической композиции по настоящему изобретению может включать, но не ограничивается этим, пероральное, внутривенное, внутримышечное, интрамедуллярное, внутриоболочечное, внутрисердечное, кожное, подкожное, внутрибрюшинное, энтеральное, подъязычное или местное применение.
Для клинического применения фармацевтическую композицию по настоящему изобретению можно составлять в соответствующих формах, используя известные в технике способы. Дозировка композиции по настоящему изобретению имеет различные пределы в зависимости от веса, возраста, пола, состояния здоровья, диеты, срока и способа приема, скорости выделения и степени заболевания пациента, и ее могут легко определять специалисты в данной области техники.
Полезные эффекты
Наночастица, состоящая из конъюгатов миРНК и полимерного соединения по настоящему изобретению, может повышать устойчивость миРНК в живом организме в целях эффективной доставки лечебной миРНК в клетки и может оказаться очень полезной в основном исследовании в области биотехнологии и медицинской промышленности в качестве нового типа системы доставки миРНК, а также в качестве носителя миРНК для лечения онкологических заболеваний и других инфекционных заболеваний, потому что она способна проявлять активность миРНК в относительно низкой концентрации дозировки даже без трансфекционных реагентов (трансформирующих клетки вирусной ДНК).
Описание чертежей
Фиг.1 представляет структурную формулу полученного соединения 3′-ПЭГ-СКП;
фиг.2 представляет данные ЯМР 1H соединения, полученного в примере 1;
фиг.3 представляет данные ЯМР1Н соединения А, которое представляет собой реагент 3′-ПЭГ для соединения с ДЦАА-СКП в примере 1;
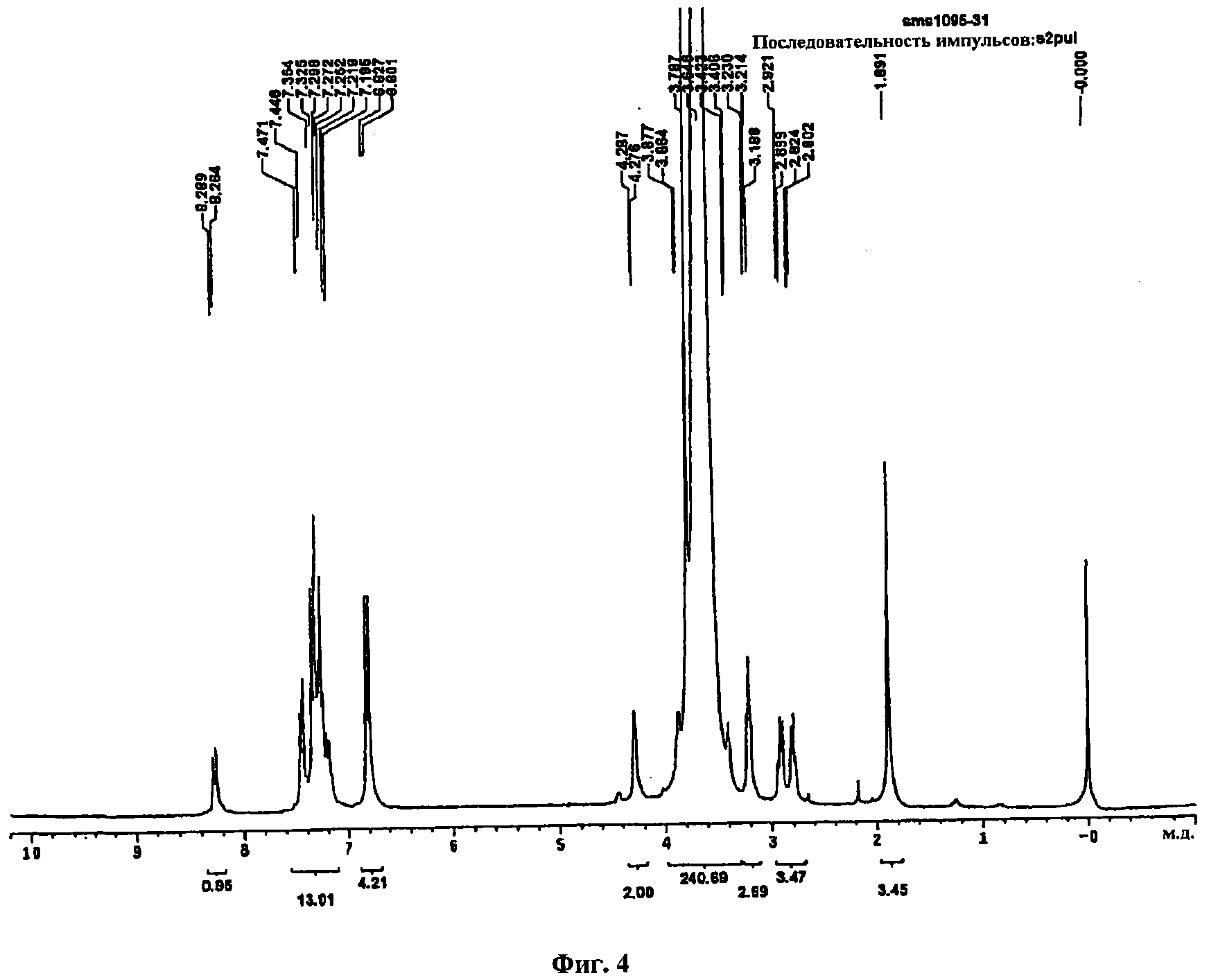
фиг.4 представляет данные ЯМР1Н соединения В, которое представляет собой реагент 3′-ПЭГ для соединения с ДЦАА-СКП в примере 1;
фиг.5 представляет данные ЯМР1H соединения С, которое представляет собой реагент 3′-ПЭГ для соединения с ДЦАА-СКП в примере 1;
фиг.6 представляет полученные методом масс-спектрометрии МАЛДИВП данные о молекулярной массе после получения соединения 3′-ПЭГ-СКП и олигонуклеотида (миРНК) в примере 1-3;
фиг.7 представляет полученные методом масс-спектрометрии МАЛДИВП данные о молекулярной массе после получения соединения 3′-ПЭГ-СКП и олигонуклеотида (миРНК) в примере 1-4;
фиг.8 представляет электрофоретическую фотографию неконъюгированной миРНК, в которой ни одно из полимерных соединений не конъюгировано, и конъюгатов миРНК и полимерного соединения, в которых гидрофильное или гидрофобное полимерное соединение конъюгировано (миРНК означает неконъюгированную миРНК, и соответствующие конъюгаты представляют конъюгаты миРНК и полимерного соединения, представленные в таблице 1; кроме того, 19 мер, 23 мер, 27 мер и 31 мер означают миРНК, состоящие из 19, 23, 27 и 31 нуклеотида, соответственно, и их использовали для получения конъюгатов миРНК и полимерного соединения в структуре конъюгата миРНК 4);
фиг.9 представляет электрофоретическую фотографию, отражающую степени разложения миРНК в зависимости от времени в присутствии сывороточного белка, чтобы оценить устойчивость в крови неконъюгированной миРНК, в которой не конъюгировано ни одно из полимерных соединений, и конъюгатов миРНК и полимерного соединения, в которых конъюгировано гидрофильное полимерное соединение, а именно ПЭГ;
фиг.10 представляет схематичное изображение наночастицы, образованной конъюгатами миРНК и полимерного соединения;
фиг.11 представляет распределение по размерам наночастиц, состоящих из неконъюгированных миРНК, в которых не конъюгированы полимерные соединения, согласно результатам, полученным с использованием прибора для измерения ζ-потенциала;
фиг.12 представляет распределение по размерам наночастиц, каждая из которых состоит из конъюгатов миРНК и полимерного соединения 9, согласно результатам, полученным с использованием прибора для измерения ζ-потенциала;
фиг.13 представляет распределение по размерам наночастиц, каждая из которых состоит из конъюгатов миРНК и полимерного соединения 10, согласно результатам, полученным с использованием прибора для измерения ζ-потенциала;
фиг.14 представляет распределение по размерам наночастиц, каждая из которых состоит из конъюгатов миРНК и полимерного соединения 11, согласно результатам, полученным с использованием прибора для измерения ζ-потенциала;
фиг.15 представляет распределение по размерам наночастиц, каждая из которых состоит из конъюгатов миРНК и полимерного соединения 12, согласно результатам, полученным с использованием прибора для измерения ζ-потенциала;
фиг.16 представляет распределение по размерам наночастиц, каждая из которых состоит из конъюгатов миРНК и полимерного соединения 13, согласно результатам, полученным с использованием прибора для измерения ζ-потенциала;
фиг.17 представляет график сравнения степеней экспрессии мРНК гена сурвивина после трансфекции вместе с осуществляющим трансфекцию реагентом, чтобы проанализировать эффекты интерференции РНК для неконъюгированной миРНК и соответствующих конъюгатов миРНК и полимерного соединения, в которых конъюгировано гидрофильное полимерное соединение, а именно ПЭГ;
фиг.18 представляет график сравнения степеней экспрессии мРНК гена сурвивина после трансфекции вместе с осуществляющим трансфекцию реагентом, чтобы проанализировать эффекты интерференции РНК для неконъюгированной миРНК и соответствующих обладающих длинной последовательностью миРНК, преобразованных в конъюгат миРНК и полимерного соединения 4; и
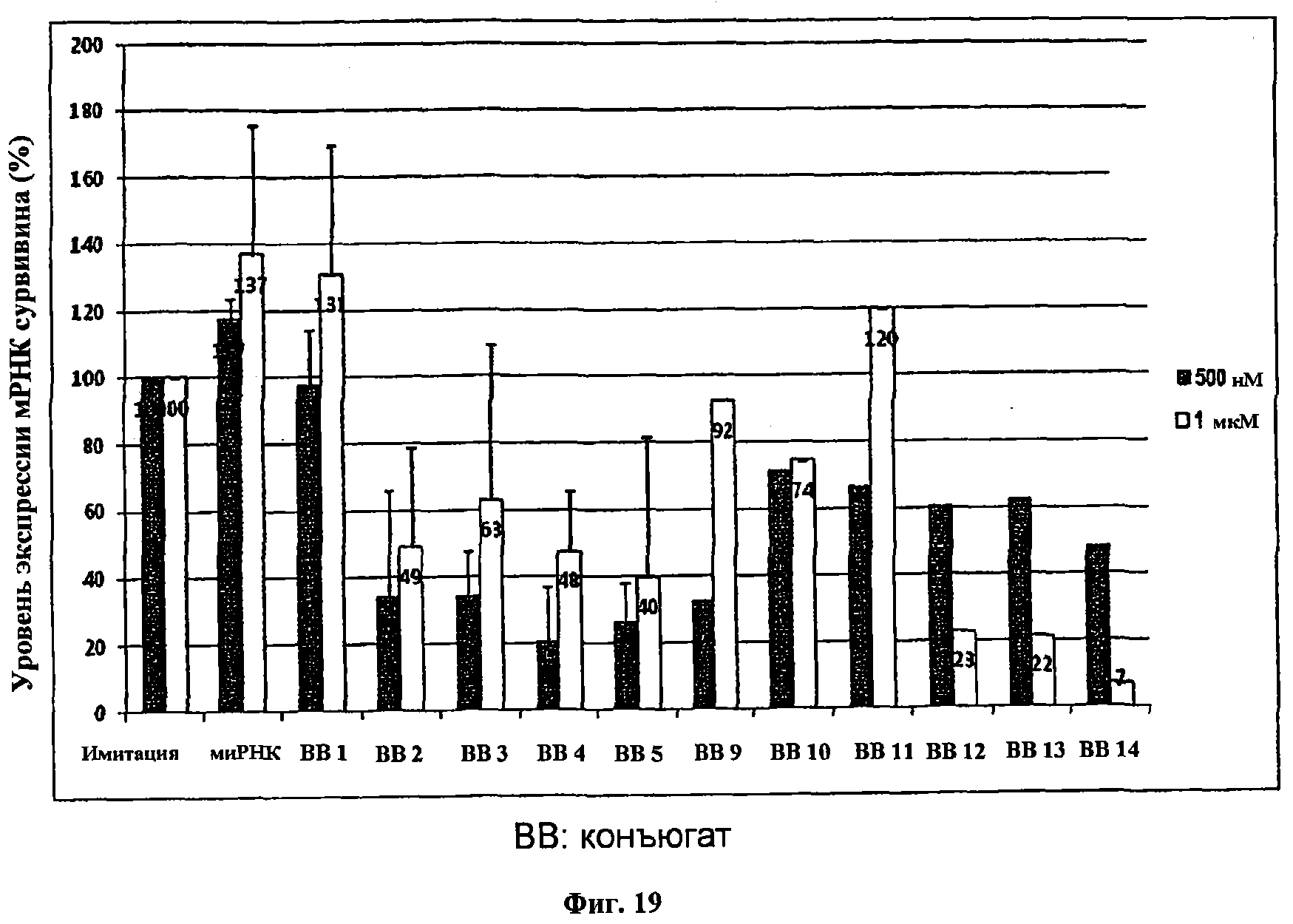
фиг.19 представляет график сравнения степеней экспрессии мРНК гена сурвивина после трансфекции при отсутствии осуществляющего трансфекцию реагента, чтобы проанализировать эффекты интерференции РНК для неконъюгированной миРНК и конъюгатов миРНК и полимерного соединения 1-5 и 9-14.
Наилучший вариант осуществления
Далее будут подробно описаны примерные варианты осуществления настоящего изобретения. Однако следующие примерные варианты осуществления описывают настоящее изобретение лишь посредством примера, но не ограничивают его.
Пример 1. Получение твердой подложки для получения олигонуклеотида 3′-ПЭГ
Пример 1-1. Получение реагентов 3′-ПЭГ (соединения А, В и С) для соединения с ДЦАА-СКП
В следующем примере 3′-ПЭГ-СКП получали таким способом, как показывает следующая схема реакции.

Пример 1-1-1. Получение 2-[бис-(4-диметокситритил)полиэтиленгликоля]
Растворяли 30 г (15 ммоль) полиэтиленгликоля 2000 (Alfa Aesar GmbH & Co. KG, Германия) в качестве исходного материала в 270 мл пиридина (Sigma Aldrich, США), затем добавляли 3,55 мл (25,5 ммоль) триэтиламина (Sigma Aldrich, США) и 7,12 г (21 ммоль) 4,4′-диметокситритилхлорида (GL Biochem, Китай) и после этого полученное вещество реагировало при комнатной температуре в течение 20 часов. Реакционную смесь после завершения реакции концентрировали и экстрагировали 450 мл этилацетата и 450 мл воды, затем путем упаривания в вакууме с последующей вакуумной сушки получали 2-[бис-(4-диметокситритил)полиэтиленгликоль] в количестве 23 г (66%).
Данные ЯМР 1Н соединения приведены на фиг. 2,
ЯМР 1H (δ, CDCl3): 1,93 (ш, 1, ОН), 3,20-3,80 (м, 186, ПЭГ, ДМТ-ОСН3), 6,80-6,83 (м, 4, ДМТ), 7,19-7,47 (м, 9, ДМТ).
Пример 1-1-2. Получение соединения янтарной кислоты и 2-[бис-(4-диметокситритил)полиэтиленгликоль] [соединение А]
Растворяли 3,9 г (1,672 ммоль) 2-[бис-(4-диметокситритил)полиэтиленгликоля], полученного в примере 1-1-1, в 20 мл пиридина и затем охлаждали до 0°C. К раствору реагента добавляли 351 мг (3,512 ммоль) ангидрида янтарной кислоты (Acros Organics, США) и 42,5 мг (0,334 ммоль) ДМАП (4-диметиламинопиридин, Sigma Aldrich, США) и перемешивали при 50°C в течение 3 суток, и тогда реакция завершалась. Реакционную смесь после завершения реакции упаривали в вакууме и получали соединение янтарной
кислоты и 2-[бис-(4-диметокситритил)полиэтиленгликоля] [соединение А] в виде белого твердого вещества в количестве 3,65 г (90%).
Данные ЯМР 1Н соединения приведены на фиг. 3.
ЯМР 1H (δ, CDCl3): 2,65 (м, 2, СН2СО), 3,20-3,88 (м, 186, ПЭГ, ДМТ-ОСН3), 4,25 (м, 2, СН2СО), 6,80-6,82 (м, 4, ДМТ), 7,19-7,47 (м, 9, ДМТ).
Пример 1-1-3. Получение соединения пара-нитрофенилянтарной кислоты и 2-[бис-(диметокситритил)полиэтиленгликоля] [соединение В]
Растворяли 1 г (0,411 ммоль) соединения, полученного в примере 1-1-2, в 20 мл метиленхлорида (DaeYeon Chemicals, Co. Ltd., Корея) и охлаждали до 0°C. К раствору реагента добавляли 143 мкл (1,03 ммоль) триэтиламина и 149 мг (0,740 ммоль) 4-нитрофенилхлорформиата. Затем температуру повышали до комнатной температуры и полученное вещество перемешивали в течение 4 часов, после чего реакция закончилась. Реакционную смесь после завершения реакции однократно промывали 20 мл насыщенного водного раствора NaHCO3 и 20 мл 1 М раствора лимонной кислоты (Sigma Aldrich, США), который охлаждали до 0-4°C, и после этого сушили над Na2SO4 (Samchum Chemical Co., Корея). Полученное вещество отфильтровывали, используя колбу для фильтрования, воронку Бюхнера (Buchner) или аспиратор, после чего путем упаривания в вакууме получали соединение пара-нитрофенилянтарной кислоты и 2-[бис-(4-диметокситритил)полиэтиленгликоля] [соединение В] в виде кремового твердого вещества в количестве 1,0 г (94%. Данные ЯМР 1Н соединения приведены на фиг. 4. ЯМР 1Н (δ, CDCl3): 2,80-2,90 (м, 2, СН2СО), 3,20-3,87 (м, 186, ПЭГ, ДМТ-ОСН3), 4,25 (м, 2, СН2СО), 6,80-6,82 (м, 4, ДМТ), 7,19-7,47 (м, 9, ДМТ).
Пример 1-1-4. Получение соединения 2,5-диоксопирролидин-1-илэфира янтарной кислоты и 2-[бис-(4-диметокситритил)(полиэтиленгликоля] [соединение С]
Растворяли 500 мг (0,206 ммоль) соединения, полученного в примере 1-1-2, в 10 мл метиленхлорида и затем добавляли 83,14 мкл (1,03 ммоль) пиридина. К раствору реагента добавляли 165 мг (0,781 ммоль) N-сукцинимидилтрифторуксусной кислоты (Sigma Aldrich, США) и перемешивали при комнатной температуре в течение 7 часов, после чего реакция заканчивалась. Реакционную смесь после завершения реакции упаривали в вакууме и получали соединение 2,5-диоксопирролидин-1-илэфир янтарной кислоты и 2-[бис-(4-диметокситритил)полиэтиленгликоля] [соединение С] в виде белого твердого вещества в количестве 490 мг (94%). Данные ЯМР 1Н соединения приведены на фиг. 5. ЯМР 1Н (δ, CDCl3): 2,72-2,97 (м, 6, СН2СО, СН2СН2), 3,20-3,87 (м, 186, ПЭГ, ДМТ-ОСН3), 4,27-4,28 (м, 2, СН2СО), 6,80-6,83 (м, 4, ДМТ), 7,20-7,47 (м, 9, ДМТ).
Пример 1-2. Соединение ДЦАА-СКП и реагента 3′-ПЭГ (соединение А)
В следующем примере получали соединение СКП и реагента 3′-ПЭГ, как показывает следующая схема реакции.

Пример 1-2-1. Получение соединения ДЦАА-СКП (2000 Å)
Равномерно перемешивали 10 г СКП (Silicycle Inc., Канада) с диаметром частиц 40-75 мкм и размером нанопор 2000 Å и смачивали 100 мкл толуола, и затем добавляли 2 мл 3-аминопропилтриэтоксисилана (TCI Org. Chem., Япония). После этого полученное вещество при перемешивании реагировало при комнатной температуре в течение 8 часов. После завершения реакции смесь отфильтровывали и промывали метанолом, водой и метиленхлоридом в указанном порядке, затем путем вакуумной сушки получали 10 г соединения ДЦАА-СКП (2000 Å).
Пример 1-2-2. Получение соединения 3′-ПЭГ-СКП (2000 Å) с использованием соединения янтарной кислоты и 2-[бис-(4-диметокситритил)полиэтиленгликоля] [соединение А]
Смачивали 2 г соединения ДЦАА-СКП (2000 Å), полученного в примере 1-2-1, в 20 мл метиленхлорида. Кроме того, раствор ДЦАА-СКП (2000 Å) равномерно перемешивали с раствором, который содержал 80 мг соединения А, 14 мкл ТЭА (триэтиламин, Sigma Aldrich, США). Растворяли 15 мг БОФ (гексафторфосфат бензотриазол-1-илокситрис(диметиламино)фосфония, TCI Org. Chem., Япония) и 5 мг ГОБТ (безводный 1-гидроксибензотриазол, TCI Org. Chem., Япония) в 2 мл метиленхлорида. Полученное вещество реагировало при нагревании с дефлегматором в течение 8 часов, и затем смесь после завершения реакции отфильтровывали и промывали метанолом, водой и метиленгликолем в указанном порядке, затем следовала вакуумная сушка.
Смачивали 1 г полученного вещества 10 мл пиридина и затем добавляли 1 мл 1-метилимидазола (Sigma Aldrich, США) и 1,6 мл уксусного ангидрида (Sigma Aldrich, США). Полученное вещество при равномерном перемешивании реагировало при
комнатной температуре в течение 8 часов. Полностью кэппированное СКП после завершения реакции промывали метанолом, водой, метанолом и метиленхлоридом в указанном порядке, затем путем вакуумной сушки получали 1 г соединения 3′-ПЭГ-СКП.
Пример 1-3. Соединение ДЦАА-СКП (2000 Å) и реагента 3′-ПЭГ (соединение В)

Получение соединения 3′-ПЭГ-СКП (2000 Å) осуществляли с использованием соединения В.
В частности, 1 г соединения ДЦАА-СКП (2000 Å), полученного в примере 1-2-1, смачивали в достаточной степени в 8 мл пиридина. Кроме того, раствор, содержащий 205 мг (2 экв.) соединения В и 55 мкл триэтиламина в 2 мл пиридина, равномерно перемешивали с раствором ДЦАА-СКП. Полученное вещество реагировало при 50-60°C в течение 8 часов, и затем смесь отфильтровывали после завершения реакции. Отфильтрованное соединение СКП промывали метанолом, водой и метиленхлоридом в указанном порядке с последующей вакуумной сушкой. После завершения сушки смачивали 1 г соединения СКП в 10 мл пиридина и затем добавляли 500 мкл 1-метилимидазола и 800 мкл уксусного ангидрида. Полученное вещество равномерно перемешивали, и затем оно реагировало при комнатной температуре в течение 8 часов. Смесь после завершения реакции отфильтровывали, и затем соединение СКП промывали метанолом, водой и метиленхлоридом в указанном порядке, и после сушки в вакууме получали 3′-ПЭГ-СКП в количестве 1 г.
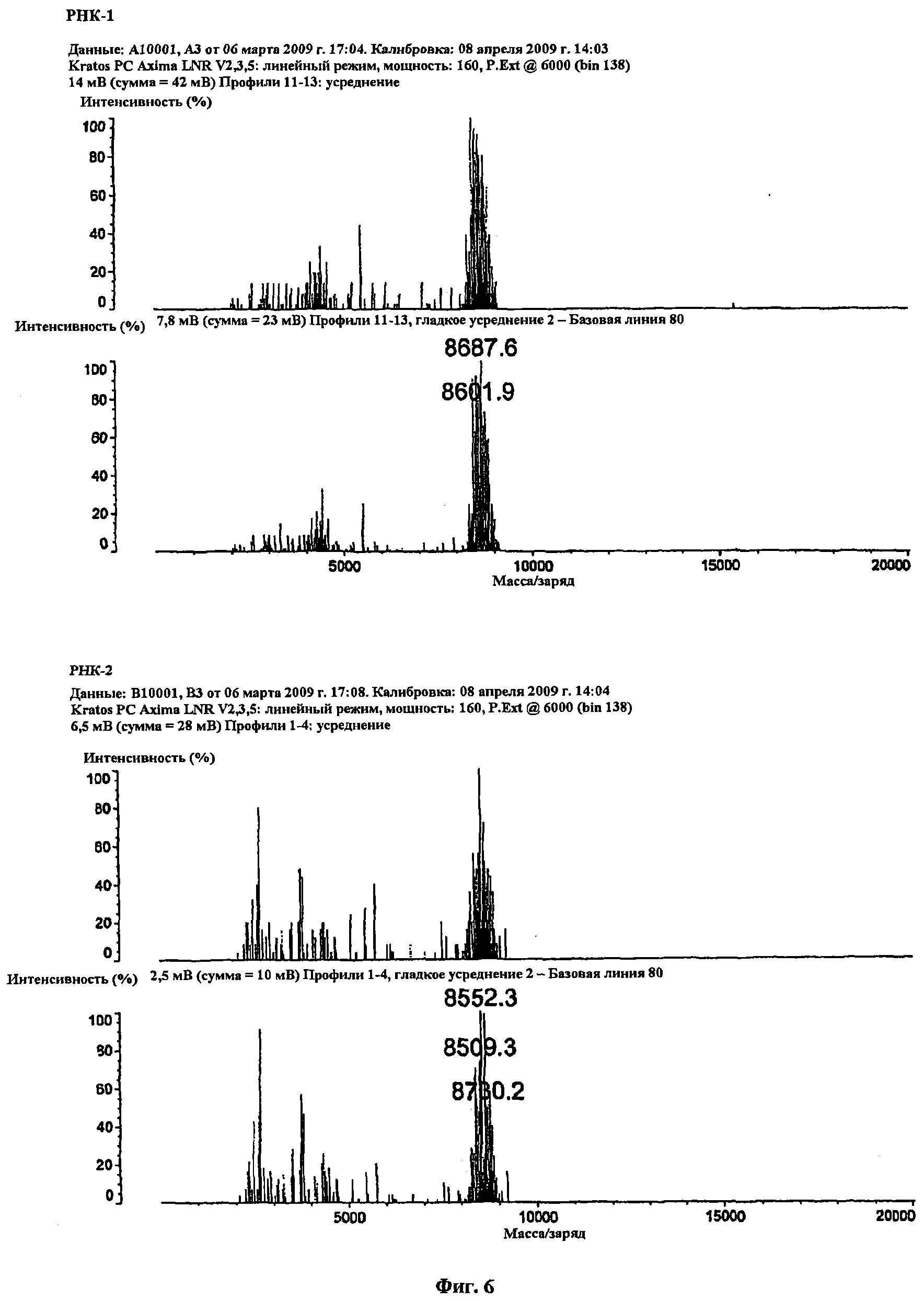
Фиг. 6 представляет полученные методом МАЛДИВП масс-спектрометрии данные о распределении молекулярной массы образцов миРНК, полученных с использованием 3′-ПЭГ-СКП в качестве исходного материала, как показано в описанном далее примере 2.
Последовательность получения 3′-ПЭГ-СКП:
смысловая 5′-AAGGAGAUCAACAUUUUCA(dTdT)-ПЭГ (6664,96 Да+2000 Да)
(последовательность №1)
антисмысловая 5′-UGAAAAUGUUGAUCUCCUU(dTdT)-ПЭГ (6592,84 Да+2000 Да) (последовательность №5)
Можно обнаружить, что измеренная методом МАЛДИВП молекулярная масса увеличилась на молекулярную массу ПЭГ (2000 Да).
Пример 1-4. Соединение ДЦАА-СКП (2000 Å) и реагента 3′-ПЭГ (соединение С)

Получение 3′-ПЭГ-СКП (2000 Å) осуществляли с использованием соединения С.
В частности, 1 г соединения ДЦАА-СКП (2000 Å), полученного в примере 1-2-1, смачивали в достаточной степени в 8 мл пиридина. Кроме того, раствор, содержащий 200 мг соединения С и 55 мкл триэтиламина в 2 мл пиридина, равномерно перемешивали с раствором ДЦАА-СКП. Полученное вещество реагировало при 50-60°C в течение 8 часов, и затем смесь после завершения реакции отфильтровывали. Отфильтрованное соединение СКП промывали метанолом, водой и метиленхлоридом в указанном порядке и сушили в вакууме. После завершения сушки 1 г соединения СКП смачивали в 10 мл пиридина, и затем к нему добавляли 500 мкл 1-метилимидазола и 800 мкл уксусного ангидрида. Полученное вещество равномерно перемешивали, и затем оно реагировало при комнатнойтемпературе в течение 8 часов. Полностью кэппированное соединение СКП после завершения реакции промывали метанолом, водой и метиленхлоридом в указанном порядке, и после вакуумной сушки получали 3′-ПЭГ-СКП в количестве 1 г.
Фиг.7 представляет данные образцов миРНК, полученных с использованием 3′-ПЭГ-СКП в качестве исходного материала, как показано в описанном далее примере 2.
Последовательность получения 3′-ПЭГ-СКП:
смысловая 5′-AAGGAGAUCAACAUUUUCA(dTdT)-ПЭГ (6664,96 Да+2000 Да) (последовательность №1)
антисмысловая 5′-UGAAAAUGUUGAUCUCCUU(dTdT)-ПЭГ (6592,84 Да+2000 Да) (последовательность №5)
Можно обнаружить, что измеренная методом МАЛДИВП молекулярная масса увеличилась на молекулярную массу ПЭГ (2000 Да).
Пример 2. Получение конъюгатов миРНК и полимерного соединения
В следующих примерах миРНК сурвивина использовали для подавления сурвивина. Сурвивин представляет собой белок, обычно проявляющий экспрессию в большинстве исследованных до настоящего времени неопластических опухолей или трансформированных клеточных линий, и, таким образом, предположено, что он станет важной мишенью в противораковом лечении (Abbrosini G. и др., Nat. Med., 1997 г., т.3, №8, с.917-921). Последовательность миРНК сурвивина по настоящему изобретению, когда она содержит 19 нуклеотидов, состоит из смысловой цепи последовательности №1 и антисмысловой цепи, имеющей последовательность, которая является комплементарной к смысловой цепи, и, кроме того, когда она содержит 23, 27 или 31 нуклеотида, имеет последовательность оснований, соответствующую последовательности №2, 3 или 4.
(Последовательность №1) 5′-AAGGAGAUCAACAUUUUCA-3′
(Последовательность №2) 5′-AGGAAAGGAGAUCAACAUUUUCA-3′
(Последовательность №3) 5′-AGGAAAGGAGAUCAACAUUUUCAAAUU-3′
(Последовательность №4) 5′-AAAGGAGAUCAACAUUUUCAAAUUAGAUGUU-3′
Получение миРНК осуществляли образованием фосфордиэфирных связей, создающих основную структуру РНК, с использованием β-цианоэтилфосфорамидита (Shina и др., Nucleic Acids Research, 1984 г., т.12, с.4539-4557). В частности, ряд процедур, в число которых входят разблокирование, соединение, окисление и кэппирование, повторно выполняли на твердой подложке, к которой был прикреплен нуклеотид, с использованием синтезатора РНК (384 Synthesizer, BIONEER, Корея), чтобы получить реагент, содержащий РНК желательной длины.
Кроме того, конъюгат миРНК и полимерного соединения получали присоединением ПЭГ к концевой области 5′ или насыщенного углеводорода гексадекана (С16) или октадекана (С18) к концевой области 5′ с использованием додеканового линкера, который представляет собой гидрофобное полимерное соединение. Кроме того, вышеупомянутую реакцию осуществляли с использованием полученного в примере 1 3′ПЭГ-СКП в качестве подложки, чтобы получить конъюгат миРНК и полимерного соединения, в котором ПЭГ присоединен к концевой области 3′.
Было определено, что реагирующие вещества соответствовали получаемой последовательности нуклеотидов, отделением РНК от реагирующих веществ с использованием высокоэффективной жидкостной хроматографии (ВЭЖХ) (жидкостной хроматограф LC-20A Prominence фирмы SHIMADZU, Япония) и измерением молекулярной массы методом МАЛДИВП (масс-спектрометр MALDI TOF-MS, SHIMADZU, Япония). После этого смысловую цепь РНК и антисмысловую цепь РНК смешивали в равных количествах и помещали в гибридизационный буфер IX (30 мМ ГЭПЭС, 100 мМ ацетата калия, 2 мМ ацетата магния, рН 7,0-7,5). Полученное вещество реагировало на бане при постоянной температуре 90°С в течение 3 минут, и затем оно снова реагировало при 37°С, чтобы получить конъюгат двухцепочечной миРНК и полимерного соединения. Полученные конъюгаты миРНК и полимерного соединения имеют структуры, представленные в таблице 1. Гибридизацию полученных конъюгатов миРНК и полимерного соединения подтверждали с использованием электрофоретических фотографий (фиг.8).
Пример 3. Оценка устойчивости конъюгатов миРНК и полимерного соединения в условиях живого организма
Было определено, имели ли конъюгаты миРНК и полимерного соединения, полученные и выделенные в примере 2, повышенную устойчивость по сравнению с неконъюгированной миРНК, к которой не присоединено полимерное соединение. Неконъюгированную миРНК без модификации и конъюгаты миРНК и полимерного соединения 1-5, полученные в примере 2, инкубировали в течение 0, 1, 3, 6, 9, 12, 24, 36 или 48 часов в культуральной среде, содержащей 10% эмбриональной телячьей сыворотки (ЭТС), которая имитирует условия живого организма, и затем оценивали степени разложения миРНК с использованием электрофореза.
Результаты показали, что конъюгаты миРНК и полимерного соединения, содержащие внедренный ПЭГ, проявляли устойчивость миРНК до 48 часов (фиг.9). Устойчивость иРНК проявлялась в течение от 12 часов до 24 часов даже в условиях 100% сыворотки.
Пример 4. Измерение размеров наночастиц конъюгатов миРНК и гидрофобного полимерного соединения
В каждом случае конъюгатов миРНК и полимерного соединения 9-14 наночастица, состоящая из конъюгатов миРНК и полимерного соединения, то есть, скажем, мицелла, образуется посредством гидрофобного взаимодействия между гидрофобными полимерными соединениями, прикрепленными к концам миРНК (фиг.10). Размеры наночастиц определяли с использованием прибора для измерения ζ-потенциала. Измеряли размеры наночастиц, состоящих из соответствующих конъюгатов миРНК и полимерного соединения 9-13, полученных в примере 2, и миРНК.
В частности, 2 нмоль миРНК и конъюгатов миРНК и полимерного соединения растворяли в 1 мл дистиллированной воды и затем гомогенизировали их наночастицы (200 Вт, 40 кГц, 5 с) с использованием ультразвукового гомогенизатора Wiseclean от фирмы DAIHAN (Корея). Размеры гомогенизированных наночастиц определяли с использованием прибора для измерения ζ-потенциала Nano-ZS от фирмы MALVERN (Великобритания). Здесь показатель преломления и показатель поглощения для материалов устанавливали на уровне 1,454 и 0,001, соответственно, и вводили температуру воды в качестве растворителя на уровне 25°С, а также ее вязкость и показатель преломления. Единовременное измерение состояло из 20 повторных измерений размеров, и это измерение проводили три раза.
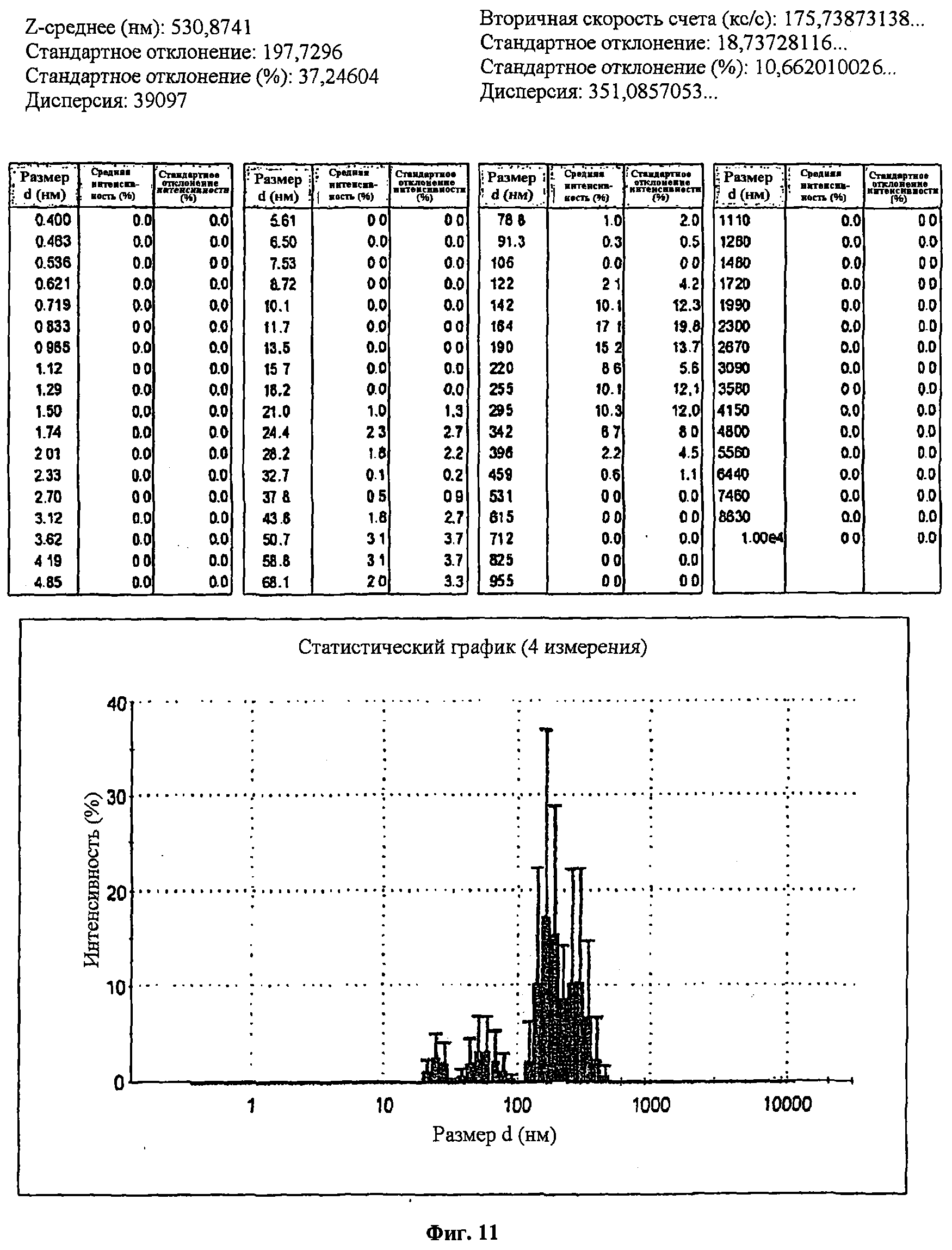
Фиг.11 представляет распределение по размерам наночастиц, содержащих неконъюгированную миРНК, согласно результатам, полученным с использованием прибора для измерения ζ-потенциала. Показано, что размеры от 142 до 295 нм (точка максимума: 164 нм) соответствовали 73,5% полного количества наночастиц, каждая из которых состояла из миРНК.
Фиг.12 представляет распределение по размерам наночастиц, каждая из которых состояла из конъюгата миРНК и полимерного соединения 9, согласно результатам, полученным с использованием прибора для измерения ζ-потенциала. Показано, что размеры от 4,19 до 7,53 нм (точка максимума: 6,50 нм) соответствовали 59,1% полного количества наночастиц, каждая из которых состояла из конъюгата миРНК и полимерного соединения 9.
Фиг.13 представляет распределение по размерам наночастиц, каждая из которых состояла из конъюгата миРНК и полимерного соединения 10, согласно результатам, полученным с использованием прибора для измерения ζ-потенциала. Показано, что размеры от 5,61 до 10,1 нм (точка максимума: 8,72 нм) соответствовали 58,9% полного количества наночастиц, каждая из которых состояла из конъюгата миРНК и полимерного соединения 10.
Фиг.14 представляет распределение по размерам наночастиц, каждая из которых состояла из конъюгата миРНК и полимерного соединения 11, согласно результатам, полученным с использованием прибора для измерения ζ-потенциала. Показано, что размеры от 5,61 до 10,1 нм (точка максимума: 8,72 нм) соответствовали 45,6% полного количества наночастиц, каждая из которых состояла из конъюгата миРНК и полимерного соединения 11.
Фиг.15 представляет распределение по размерам наночастиц, каждая из которых состояла из конъюгата миРНК и полимерного соединения 12, согласно результатам, полученным с использованием прибора для измерения ζ-потенциала. Показано, что размеры от 4,85 до 5,61 нм соответствовали 23,6%, размеры от 21,0 до 32,7 нм соответствовали 23,5%, и размеры от 68,1 до 78,8 нм соответствовали 23,1% полного количества наночастиц, каждая из которых состояла из конъюгата миРНК и полимерного соединения 12.
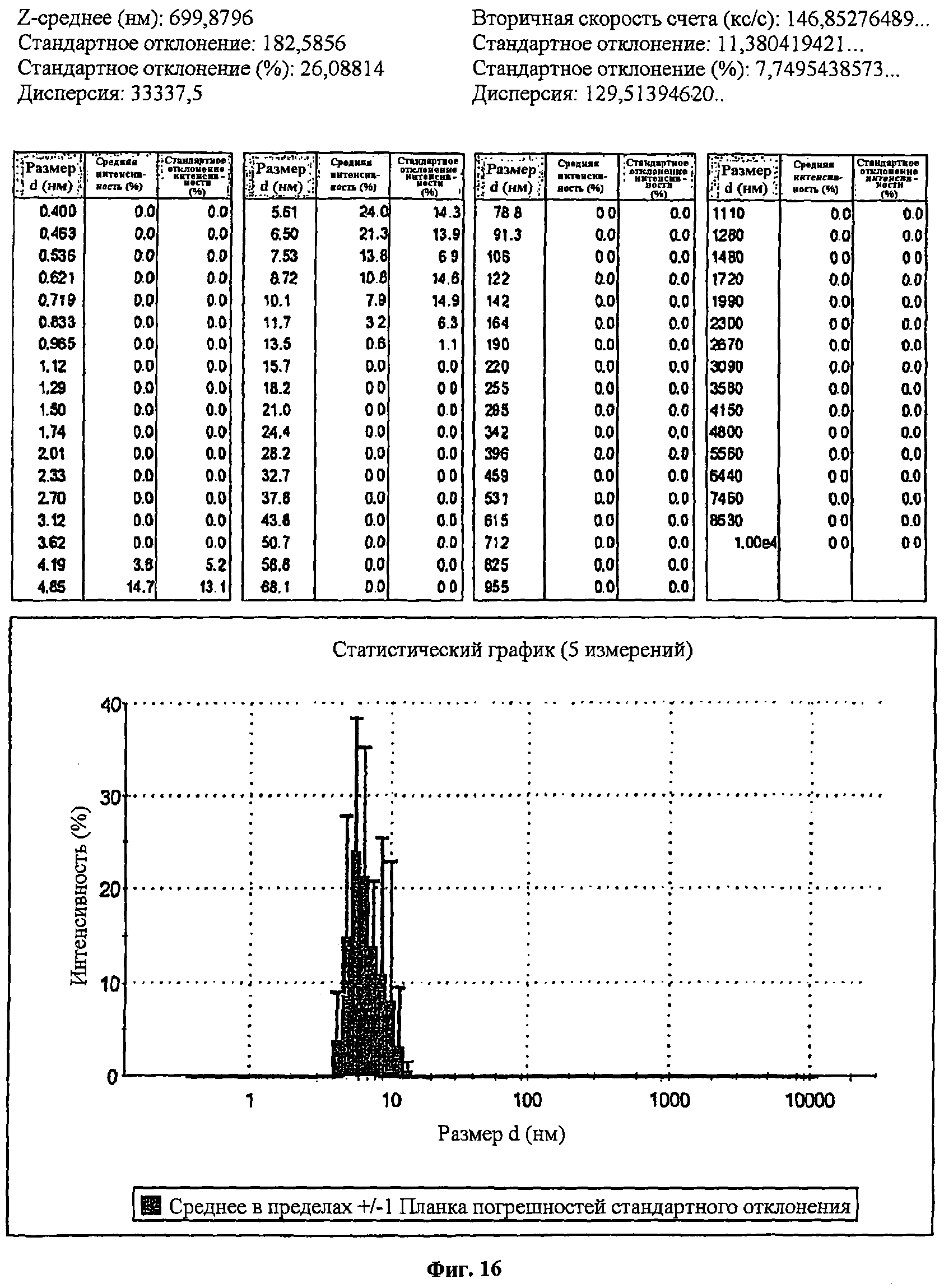
Фиг.16 представляет распределение по размерам наночастиц, каждая из которых состояла из конъюгата миРНК и полимерного соединения 13, согласно результатам, полученным с использованием прибора для измерения ζ-потенциала. Показано, что размеры от 4,85 до 8,72 нм (точка максимума: 5,61 нм) соответствовали 84,6% полного количества наночастиц, каждая из которых состояла из конъюгата миРНК и полимерного соединения 13.
В случаях конъюгатов миРНК и полимерного соединения 9-13, за исключением конъюгата миРНК и полимерного соединения 12, размеры наночастиц составляли, главным образом от 4 до 8 нм. В случае конъюгата миРНК и полимерного соединения 12 определенные размеры наночастиц различались, причиной чего считали агрегацию соответствующих наночастиц с течением времени в процессе измерения, даже несмотря на то, что гомогенизацию осуществляли с использованием ультразвукового гомогенизатора. Как показано на фиг.12-16, определенные размеры наночастиц, каждая из которых состояла из конъюгатов миРНК, составляли 100 нм или менее, что представляет собой достаточные размеры для эндоцитоза в клетки посредством пиноцитоза (Kenneth A. Dawson и др., Nature Nanotechnology, 2009 г., т.4, с.84-85).
Пример 5. Ингибирование экспрессии генов-мишеней в линиях опухолевых клеток с использованием конъюгатов миРНК и полимерного соединения с трансфекционными реагентами
Линии клеток рака шейки матки человека, которые представляют собой линии опухолевых клеток, подвергали, соответственно, трансфекции конъюгатами миРНК и полимерного соединения 1-8, полученными в примере 2, и анализировали уровни экспрессии гена сурвивина в подвергнутых трансфекции линиях опухолевых клеток.
Пример 5-1. Культура линий опухолевых клеток
Клетки опухоли шейки матки человека (HeLa), полученные из американской коллекции типовых культур (АКТП), культивировали в культуральной среде RPMI 1640 (GIBCO, Invitrogen, США), в которую добавляли 10 об.% эмбриональной телячьей сыворотки, 100 ед/мл пенициллина и 100 мкг/мл стрептомицина при 37°С в атмосфере, содержащей 5 об.% CO2.
Пример 5-2. Ингибирование экспрессии гена-мишени с использованием конъюгатов миРНК и полимерного соединения
Линии опухолевых клеток HeLa подвергали трансфекции конъюгатами миРНК и полимерного соединения 1-8 последовательности №1, полученными в примере 2, и анализировали уровни экспрессии гена сурвивина в подвергнутых трансфекции линиях опухолевых клеток.
Пример 5-2-1. Трансфекция линий опухолевых клеток с использованием конъюгатов миРНК и полимерного соединения
Культивировали 1,3·105 линий опухолевых клеток, культивированных в примере 5-1, в среде RPMI 1640 на 6-луночном планшете при 37°С в течение 18 часов в атмосфере, содержащей 5 об.% CO2, затем удаляли среду и в каждую лунку добавляли по 800 мкл среды Opti-MEM (GIBCO, США).
Одновременно смешивали 2 мкл липофектамина (Lipofectamine™ 2000 от фирмы Invitrogen, США) и 198 мкл среды Opti-MEM, которые затем реагировали между собой при комнатной температуре в течение 5 минут, после чего добавляли 0,8 или 4 мкл соответствующих конъюгатов миРНК и полимерного соединения (25 пмоль/мкл), полученных в примере 2 (конечная обработка при 20 или 100 нМ). После этого полученное вещество снова реагировало при комнатной температуре в течение 20 минут для приготовления раствора.
После этого по 200 мкл раствора для трансфекции поместили в каждую из лунок, в которые была помещена среда Opti-MEM, и опухолевые клетки культивировали в течение 6 часов с последующим удалением среды Opti-MEM. В лунки помещали по 2,5 мкл культуральной среды RPMI 1640, и затем опухолевые клетки культивировали при 37°С в атмосфере, содержащей 5 об.% CO2, в течение 24 часов.
Пример 5-2-2. Относительный количественный анализ мРНК гена сурвивина
Все количество РНК экстрагировали из линии клеток, подвергнутых трансфекции в примере 5-2-1, чтобы получить кДНК, и затем относительное количество мРНК гена сурвивина определяли с использованием ПЦР в реальном времени.
Пример 5-2-2-1. Отделение РНК и получение кДНК из подвергнутых трансфекции клеток
Все количество РНК экстрагировали из линии клеток, подвергнутых трансфекции в примере 5-2-1, с использованием набора для экстракции РНК (набор для полной экстракции РНК AccuPrep Cell фирмы BIONEER, Корея), и кДНК получали из экстрагированной РНК с использованием обратной транскриптазы РНК (AccuPower CycleScript RT Premix/dT20 от фирмы BIONEER, Корея) следующим образом.
В частности, по 1 мкг экстрагированной РНК помещали в каждую из пробирок Эппендорфа (Eppendorf) объемом 0,25 мл, содержащих обратную транскриптазу AccuPower CycleScript RT Premix/dT20 от фирмы BIONEER (Корея), и дистиллированную воду, обработанную диэтилпирокарбонатом (ДЭПК), добавляли, чтобы довести полный объем до 20 мкл. С использованием прибора ПЦР с блоком термического градиента MyGenie™ 96 Gradient Thermal Block от фирмы BIONEER (Корея) две стадии гибридизации затравки РНК при 30°С в течение 1 минуты и синтеза кДНК при 52°С в течение 4 минут повторяли шесть раз. Затем инактивацию фермента осуществляли при 95°С в течение 5 минут, чтобы завершить реакцию амплификации.
Пример 5-2-2-2. Относительный количественный анализ мРНК гена сурвивина
Относительное количество мРНК гена сурвивина определяли методом ПЦР в реальном времени с использованием кДНК, полученной в примере 5-2-2-1, в качестве матрицы следующим образом.
В частности, кДНК, полученную в примере 5-2-2-1, разбавляли в отношении 1/5 дистиллированной водой в каждой лунке 96-луночного планшета и затем добавляли по 3 мкл разбавленной кДНК, 10 мкл основного раствора для ПЦР 2xGreenStar™ PCR от фирмы BIONEER (Корея), 6 мкл дистиллированной воды и 1 мкл затравки кПЦР сурвивина (10 пмоль/мкл) от фирмы BIONEER (Корея), получая жидкую смесь, чтобы проанализировать уровень экспрессии сурвивина. С другой стороны, при использовании ГМБС (гидроксиметилбилансинтаза), ГФРТ1 (гипоксантинфосфорибозилтрансфераза 1), UBC (убиквитин С) и YWHAZ (ζ-полипептид белка активации тирозин-3-монооксигеназы/триптофан-5-монооксигеназы), которые представляют собой «гены домашнего хозяйства» (далее сокращенно называются «гены ДХ»), в качестве эталонного гена, чтобы нормировать уровень экспрессии мРНК, полученную в примере 5-2-2-1 кДНК разбавляли в отношении 1/5 и затем вводили по 3 мкл разбавленной кДНК, 10 мкл основного раствора для ПЦР 2xGreenStar™ PCR от фирмы BIONEER (Корея), 6 мкл дистиллированной воды и 1 мкл затравки кПЦР каждого гена ДХ (10 пмоль/мкл, BIONEER, Корея), чтобы приготовить жидкую смесь для анализа методом ПЦР в реальном времени каждого гена ДХ в каждой лунке 96-луночного планшета. Следующую реакцию осуществляли на 96-луночном планшете, содержащем жидкую смесь, с использованием прибора Exicycler™ 96 с термическим блоком для количественного анализа в реальном времени от фирмы BIONEER (Корея).
Активацию фермента и вторичную структуру кДНК устраняли в процессе реакции при 95°С в течение 15 минут. После этого четыре стадии, включая денатурирование при 94°С в течение 30 секунд, гибридизацию при 58°С в течение 30 секунд, растяжение при 72°С в течение 30 секунд и сканирование с красителем SYBR Green, повторно осуществляли 42 раза и затем осуществляли окончательное растяжение при 72°С в течение 3 минут. После этого температуру поддерживали на уровне 55°С в течение 1 минуты и анализировали кривую плавления в интервале 55-95°С.
После окончания ПЦР полученные значения порогового цикла Ct сурвивина соответственно исправляли с использованием значений мРНК (нормировочный множитель NF), нормированных по генам ДХ, и затем получали значения ΔCt разности между значением Ct контрольной группы, обработанной только одним реагентом для трансфекции, и исправленными значениями Ct. Скорости экспрессии мРНК сурвивина сравнивали друг с другом, используя значения ΔCt и расчетное уравнение 2(-ΔCt)·100 (фиг.17). На фиг.17 имитация означает контрольную группу, обработанную только реагентом для трансфекции.
В результате, как показано на фиг.17, эффект интерференции РНК миРНК изменялся в зависимости от типов концевых модификаций конъюгатов миРНК и полимерного соединения, в которых было конъюгировано гидрофильное полимерное соединение, а именно ПЭГ. В частности, каждый из конъюгатов 6-8, имеющий тип концевой модификации, в котором ПЭГ конъюгирован к конечной области 3′, проявлял степени ингибирования экспрессии, аналогичные тем, которые проявляет неконъюгированная миРНК. Следовательно, ожидается, что конъюгаты 6-8 будут создавать небольшое стерическое препятствие при образовании комплекса с РНК-индуцированным комплексом подавления (РИКП) в механизме интерференции РНК с участием миРНК. Кроме того, большинство конъюгатов миРНК-ПЭГ проявляли более высокую степень ингибирования экспрессии гена-мишени мРНК в условиях обработки при низкой концентрации (20 нМ), чем в условиях обработки при высокой концентрации (100 нМ), и, таким образом, ожидается, что будет предотвращено связывание миРНК с РИКП благодаря ПЭГ в условиях повышенной концентрации конъюгата миРНК-ПЭГ.
Пример 5-3. Ингибирование экспрессии гена-мишени с использованием конъюгатов имеющей длинную последовательность миРНК и полимерного соединения
Когда клетки подвергали трансфекции конъюгатами миРНК и гидрофильного полимерного соединения вместе с реагентом для трансфекции, анализировали ингибирование экспрессии гена-мишени мРНК. Здесь использовали миРНК, в которых концевую модификацию в структуре конъюгата миРНК и полимерного соединения 4 индуцировали для каждой последовательности оснований миРНК (последовательности №№1-4).
Пример 5-3-1. Трансфекция линий опухолевых клеток с использованием конъюгатов миРНК и полимерного соединения
Культивировали 1,3·105 линий опухолевых клеток, культивированных в примере 5-1, в среде RPMI 1640 на 6-луночном планшете при 37°С в течение 24 часов в атмосфере, содержащей 5 об.% CO2, затем удаляли среду и в каждую лунку добавляли по 800 мкл среды Opti-MEM.
Одновременно смешивали 2 мкл липофектамина (Lipofectamine™ 2000) и 198 мкл среды Opti-MEM, которые затем реагировали между собой при комнатной температуре в течение 5 минут, после чего добавляли 0,8 или 4 мкл соответствующих конъюгатов миРНК и полимерного соединения (25 пмоль/мкл), полученных в примере 2 (конечная обработка при 20 или 100 нМ). После этого полученное вещество снова реагировало при комнатной температуре в течение 20 минут для приготовления раствора.
После этого по 200 мкл раствора для трансфекции поместили в каждую из лунок, в которые была помещена среда Opti-MEM, и опухолевые клетки культивировали в течение 6 часов с последующим удалением среды Opti-MEM. В лунки помещали по 2,5 мкл культуральной среды RPMI 1640, и затем опухолевые клетки культивировали при 37°С в атмосфере, содержащей 5 об.% CO2, в течение 24 часов.
Пример 5-3-2. Относительный количественный анализ мРНК гена сурвивина
Все количество РНК экстрагировали из линии клеток, подвергнутых трансфекции в примере 5-3-1, чтобы получить кДНК, и затем относительное количество мРНК гена сурвивина определяли с использованием ПЦР в реальном времени.
Пример 5-3-2-1. Отделение РНК и получение кДНК из подвергнутых трансфекции клеток
Все количество РНК экстрагировали из линии клеток, подвергнутых трансфекции в примере 5-3-1, с использованием набора для экстракции РНК (набор для полной экстракции РНК AccuPrep Cell фирмы BIONEER, Корея), и кДНК получали из экстрагированной РНК с использованием обратной транскриптазы РНК (AccuPower CycleScript RT Premix/dT20 от фирмы BIONEER, Корея) следующим образом.
В частности, по 1 мкг экстрагированной РНК помещали в каждую из пробирок Эппендорфа (Eppendorf) объемом 0,25 мл, содержащих обратную транскриптазу AccuPower CycleScript RT Premix/dT2o от фирмы BIONEER (Корея), и дистиллированную воду, обработанную диэтилпирокарбонатом (ДЭПК) добавляли, чтобы довести полный объем до 20 мкл. С использованием прибора ПЦР с блоком термического градиента MyGenie™ 96 Gradient Thermal Block от фирмы BIONEER (Корея) две стадии гибридизации затравки РНК при 30°С в течение 1 минуты и синтеза кДНК при 52°С в течение 4 минут повторяли шесть раз. Затем инактивацию фермента осуществляли при 95°С в течение 5 минут, чтобы завершить реакцию амплификации.
Пример 5-3-2-2. Относительный количественный анализ мРНК гена сурвивина
Относительное количество мРНК гена сурвивина определяли методом ПЦР в реальном времени с использованием кДНК, полученной в примере 5-2-2-1, в качестве матрицы следующим образом.
В частности, кДНК, полученную в примере 5-3-2-1, разбавляли в отношении 1/5 дистиллированной водой в каждой лунке 96-луночного планшета, и затем добавляли по 3 мкл разбавленной кДНК, 10 мкл основного раствора для ПЦР 2xGreenStar™ PCR от фирмы BIONEER (Корея), 6 мкл дистиллированной воды и 1 мкл затравки кПЦР сурвивина (10 пмоль/мкл) от фирмы BIONEER (Корея), получая жидкую смесь, чтобы проанализировать уровень экспрессии сурвивина. С другой стороны, при использовании ГМБС, ГФРТ1, UBC и YWHAZ, которые представляют собой гены ДХ, в качестве эталонного гена, чтобы нормировать уровень экспрессии мРНК, полученную в примере 5-3-2-1 кДНК разбавляли в отношении 1/5 и затем вводили по 3 мкл разбавленной кДНК, 10 мкл основного раствора для ПЦР 2xGreenStar™ PCR от фирмы BIONEER (Корея), 6 мкл дистиллированной воды и 1 мкл затравки кПЦР каждого гена ДХ (10 пмоль/мкл, BIONEER, Корея), чтобы приготовить жидкую смесь для анализа методом ПЦР в реальном времени каждого гена ДХ в каждой лунке 96-луночного планшета. Следующую реакцию осуществляли на 96-луночном планшете, содержащем жидкую смесь, с использованием прибора Exicycler™ 96 с термическим блоком для количественного анализа в реальном времени от фирмы BIONEER (Корея).
Активацию фермента и вторичную структуру кДНК устраняли в процессе реакции при 95°С в течение 15 минут. После этого четыре стадии, включая денатурирование при 94°С в течение 30 секунд, гибридизацию при 58°С в течение 30 секунд, растяжение при 72°С в течение 30 секунд и сканирование с красителем SYBR Green, повторно осуществляли 42 раза и затем осуществляли окончательное растяжение при 72°С в течение 3 минут. После этого температуру поддерживали на уровне 55°С в течение 1 минуты и анализировали кривую плавления в интервале 55-95°С.
После окончания ПЦР полученные значения порогового цикла Ct сурвивина соответственно исправляли с использованием значений мРНК (нормировочный множитель NF), нормированных по генам ДХ, и затем получали значения ΔCt разности между значением Ct контрольной группы, обработанной только одним реагентом для трансфекции, и исправленными значениями Ct. Скорости экспрессии мРНК сурвивина сравнивали друг с другом, используя значения ΔCt и расчетное уравнение 2(-ΔCt)·100 (фиг.18). На фиг.18 имитация означает контрольную группу, обработанную только реагентом для трансфекции, и 19 мер, 23 мер, 27 мер, и 31 мер представляют последовательности №№1-4, соответственно. 5′Р+Р представляет структуру конъюгата миРНК и полимерного соединения 4. Клетки обрабатывали при концентрации 20 нМ и 100 нМ, соответственно, и степени ингибирования экспрессии генов-мишеней сравнивали друг с другом.
В результате, как показано на фиг.18, длинноцепные неконъюгированные миРНК, преобразованные в форму конъюгатов миРНК и полимерного соединения 4, проявляли меньшую разность степеней ингибирования экспрессии мРНК генов-мишеней по сравнению с неконъюгированной миРНК. Следовательно, можно обнаружить, что трансформированная длинноцепная миРНК уменьшает явление стерического затруднения, обусловленное ПЭГ, по сравнению с короткоцепной миРНК.
В частности, в случае длинноцепной миРНК, миРНК расщепляется в структуру 19+2 под действием расщепляющего фермента (дайсера) в механизме действия интерференции РНК, и расщепленная миРНК присоединяется к комплексу РИКП, приводя в действие механизма интерференции РНК. По этой причине длинноцепная миРНК, в которой ПЭГ прикреплен к обеим концевым областям, приводит к существованию большого количества миРНК без прикрепления ПЭГ и, таким образом, имеет относительно высокую степень взаимодействия с комплексом РИКП по сравнению с последовательностью №1, которую считают поддерживающей эффект индуцирования интерференции РНК.
Пример 6. Ингибирование экспрессии гена-мишени в линиях опухолевых клеток с использованием только конъюгатов миРНК и полимерного соединения без реагентов для трансфекции
Линии опухолевых клеток HeLa подвергали трансфекции конъюгатами миРНК и полимерного соединения 1-14, полученными в примере 2, и анализировали экспрессию гена сурвивин подвергнутых трансфекции линий опухолевых клеток.
Пример 6-1. Культура линий опухолевых клеток
Клетки опухоли шейки матки человека (HeLa), полученные из американской коллекции типовых культур (АКТП), культивировали в культуральной среде RPMI 1640 (GIBCO/Invitrogen, США), в которую добавляли 10 об.% эмбриональной телячьей сыворотки, 100 ед/мл пенициллина и 100 мкг/мл стрептомицина при 37°С в атмосфере, содержащей 5 об.% СО2.
Пример 6-2. Трансфекция линий опухолевых клеток с использованием конъюгатов миРНК и полимерного соединения
Культивировали 1,3·105 линий опухолевых клеток, культивированных в примере 6-1, в среде RPMI 1640 на 6-луночном планшете при 37°С в течение 24 часов в атмосфере, содержащей 5 об.% СО2, затем удаляли среду и в каждую лунку добавляли по 900 мкл среды Opti-MEM.
Одновременно смешивали 100 мкл среды Opti-MEM, 5 или 10 мкл соответствующих конъюгатов миРНК и полимерного соединения 1-5 (1 пмоль/мкл), полученных в примере 2 (конечная обработка при 500 нМ или 100 мкМ), и полученное вещество снова реагировало при комнатной температуре в течение 20 минут для приготовления раствора.
Одновременно 100 мкл среды Opti-MEM, 5 или 10 мкл соответствующих конъюгатов миРНК и полимерного соединения 9-14 (1 пмоль/мкл), полученных в примере 2 (конечная обработка при 500 нМ или 100 мкМ) и мицеллы, состоящие из конъюгатов миРНК и гидрофобного полимерного соединения, гомогенизировали под действием ультразвука для приготовления раствора.
После этого по 100 мкл раствора для трансфекции помещали в каждую из лунок, в которых находилась среда Opti-MEM, и опухолевые клетки культивировали в течение 24 часов с последующим добавлением 1 мл среды RPMI 1640, содержащей 20% ЭТС. Клетки далее культивировали при 37°С в течение 24 часов в атмосфере, содержащей 5 об.% СО2, обрабатывали конъюгатами миРНК и полимерного соединения и затем культивировали всего 48 часов.
Пример 6-3. Относительный количественный анализ мРНК гена сурвивина
Все количество РНК экстрагировали из линии клеток, подвергнутых трансфекции в примере 6-2, чтобы получить кДНК, и затем относительное количество мРНК гена сурвивина определяли с использованием ПЦР в реальном времени.
Пример 6-3-1. Отделение РНК и получение кДНК из подвергнутых трансфекции клеток
Все количество РНК экстрагировали из линии клеток, подвергнутых трансфекции в примере 6-2, с использованием набора для экстракции РНК (набор для полной экстракции РНК AccuPrep Cell фирмы BIONEER, Корея), и кДНК получали из экстрагированной РНК с использованием обратной транскриптазы РНК (AccuPower CycleScript RT Premix/dT20 от фирмы BIONEER, Корея) следующим образом.
В частности, по 1 мкг экстрагированной РНК помещали в каждую из пробирок Эппендорфа (Eppendorf) объемом 0,25 мл, содержащих обратную транскриптазу AccuPower CycleScript RT Premix/dT20 от фирмы BIONEER (Корея), и дистиллированную воду, обработанную диэтилпирокарбонатом (ДЭПК), добавляли, чтобы довести полный объем до 20 мкл. С использованием прибора ПЦР с блоком термического градиента MyGenie™ 96 Gradient Thermal Block от фирмы BIONEER (Корея) две стадии гибридизации затравки РНК при 30°С в течение 1 минуты и синтеза кДНК при 52°С в течение 4 минут повторяли шесть раз. Затем инактивацию фермента осуществляли при 95°С в течение 5 минут, чтобы завершить реакцию амплификации.
Пример 6-3-2. Относительный количественный анализ мРНК гена сурвивина
Относительное количество мРНК гена сурвивина определяли методом ПЦР в реальном времени с использованием кДНК, полученной в примере 6-3-1, в качестве матрицы следующим образом.
В частности, кДНК, полученную в примере 6-3-1, разбавляли в отношении 1/5 дистиллированной водой в каждой лунке 96-луночного планшета и затем добавляли по 3 мкл разбавленной кДНК, 10 мкл основного раствора для ПЦР 2xGreenStar™ PCR от фирмы BIONEER (Корея), 6 мкл дистиллированной воды и 1 мкл затравки кПЦР сурвивина (10 пмоль/мкл) от фирмы BIONEER (Корея), получая жидкую смесь, чтобы проанализировать уровень экспрессии сурвивина. С другой стороны, при использовании ГМБС (гидроксиметилбилансинтаза), ГФРТ1 (гипоксантинфосфорибозилтрансфераза 1), UBC (убиквитин С) и YWHAZ (ζ-полипептид белка активации тирозин-3-монооксигеназы/триптофан-5-монооксигеназы), которые представляют собой «гены домашнего хозяйства» (далее сокращенно называются «гены ДХ»), в качестве эталонного гена, чтобы нормировать уровень экспрессии мРНК, полученную в примере 5-2-2-1 кДНК разбавляли в отношении 1/5 и затем вводили по 3 мкл разбавленной кДНК, 10 мкл основного раствора для ПЦР 2xGreenStar™ PCR от фирмы BIONEER (Корея), 6 мкл дистиллированной воды и 1 мкл затравки кПЦР каждого гена ДХ (10 пмоль/мкл, BIONEER, Корея), чтобы приготовить жидкую смесь для анализа методом ПЦР в реальном времени каждого гена ДХ в каждой лунке 96-луночного планшета. Следующую реакцию осуществляли на 96-луночном планшете, содержащем жидкую смесь, с использованием прибора Exicycler™ 96 с термическим блоком для количественного анализа в реальном времени от фирмы BIONEER (Корея).
Активацию фермента и вторичную структуру кДНК устраняли в процессе реакции при 95°С в течение 15 минут. После этого четыре стадии, включая денатурирование при 94°С в течение 30 секунд, гибридизацию при 58°С в течение 30 секунд, растяжение при 72°С в течение 30 секунд и сканирование с красителем SYBR Green, повторно осуществляли 42 раза и затем осуществляли окончательное растяжение при 72°С в течение 3 минут. После этого температуру поддерживали на уровне 55°С в течение 1 минуты и анализировали кривую плавления в интервале 55-95°С.После окончания ПЦР полученные значения порогового цикла Ct сурвивина соответственно исправляли с использованием значений мРНК (нормировочный множитель NF), нормированных по генам ДХ, и затем получали значения ΔCt разности между значением Ct контрольной группы, обработанной только одним реагентом для трансфекции, и исправленными значениями Ct. Скорости экспрессии мРНК сурвивина сравнивали друг с другом, используя значения ΔCt и расчетное уравнение 2(-ΔCt)·100 (фиг.19).
В результате, как показано на фиг.17, конъюгаты миРНК-ПЭГ 2-5 в более высокой степени ингибируют уровень экспрессии мРНК сурвивина по сравнению с конъюгатом миРНК и полимерного соединения 1, в отличие от результата в том случае, где трансфекцию осуществляли посредством реагента для трансфекции. Конъюгаты миРНК и полимерного соединения 1-5 проявляли в более высокой степени эффект интерференции РНК в низкой концентрации (500 нМ), чем в высокой концентрации. Кроме того, конъюгаты миРНК и гидрофобного полимерного соединения 9-14 проявляли меньшую степень ингибирования уровня экспрессии мРНК гена сурвивина по сравнению с конъюгатами миРНК 1-5 в случае обработки при такой же концентрации (500 нМ). Однако в случае обработки в условиях высокой концентрации (1 нМ), в частности, концевая модификация конъюгата миРНК и полимерного соединения 14 приводит к высокой степени эффекта ингибирования уровня экспрессии мРНК сурвивина.
СПИСОК ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> BIONEER Corporation
<120> siRNA Conjugate and Method of Preparing the Same
<130> 2010-opa-4495
<140> 13319885
<141> 2011-11-10
<150> KR 10-2009-0042297
<151> 2009-05-14
<160> 5
<170> KopatentIn 1.71
<210> 1
<211> 19
<212> RNA
<213> Artificial Sequence
<220>
<223> siRNA
<400> 1
aaggagauca acauuuuca 19
<210> 2
<211> 23
<212> RNA
<213> Artificial Sequence
<220>
<223> siRNA
<400> 2
aggaaaggag aucaacauuu uca 23
<210> 3
<211> 27
<212> RNA
<213> Artificial Sequence
<220>
<223> siRNA
<400> 3
aggaaaggag aucaacauuu ucaaauu 27
<210> 4
<211> 31
<212> RNA
<213> Artificial Sequence
<220>
<223> siRNA
<400> 4
aaaggagauc aacauuuuca aauuagaugu u 31
<210> 5
<211> 19
<212> RNA
<213> Artificial Sequence
<220>
<223> antisense sequence of the siRNA of SEQ. ID. No. 1
<400> 5
ugaaaauguu gaucuccuu 19
Реферат
Настоящее изобретение относится к биохимии и раскрывает твердую подложку, к которой присоединено содержащее полиэтиленгликоль соединение (3'-ПЭГ-СКП), а также способ получения указанного соединения. Способ предусматривает реакцию СКП с 3-аминопропилтриэтоксисиланом с образованием длинноцепочеченого алкиламина и стекла с контролируемым размером пор (ДЦАА-СКП), затем реакцию полиэтиленгликоля с 4,4'-диметокситритилхлоридом с образованием 2[бис-(4-диметокситритил)полиэтиленгликоля)] и еще ряд стадий. Настоящее изобретение позволяет получать 3'-ПЭГ-СКП с высоким выходом. 2 н. и 1 з.п. ф-лы, 1 табл., 6 пр.
Формула

где R представляет собой алкил, алкенил, алкинил, арил, арилалкил, гетероалкил или гетероарил; n представляет собой целое число от 5 до 120.
1) реакцию СКП с 3-аминопропилтриэтоксисиланом, с образованием соединения длинноцепочечного алкиламина и стекла с контролируемым размером пор (ДЦАА-СКП);
2) реакцию полиэтиленгликоля с 4,4′-диметокситритилхлоридом, в которой образуется 2-[бис-(4-диметокситритил)полиэтиленгликоль)];
3) реакцию соединения, полученного на стадии (2), с соединением, имеющим следующую формулу 1, с образованием соединения, имеющего следующую структурную формулу I;
4) реакцию полученного соединения, имеющего следующую структурную формулу I, с 4-нитрофенилхлорформиатом, с образованием соединения, имеющего следующую структурную формулу II;
5) реакцию соединения, имеющего следующую структурную формулу I и полученного на стадии (3), с N-сукцинимидилтрифторуксусной кислотой, с образованием соединения, имеющего следующую структурную формулу III; и
6) реакцию соединения ДЦАА-СКП, полученного на стадии (1), с соединениями, имеющими следующие структурные формулы I, II или III соответственно и полученными на стадиях (3)-(5) соответственно.
[Формула 1]

[Структурная формула I]

[Структурная формула II]

Структурная формула III]
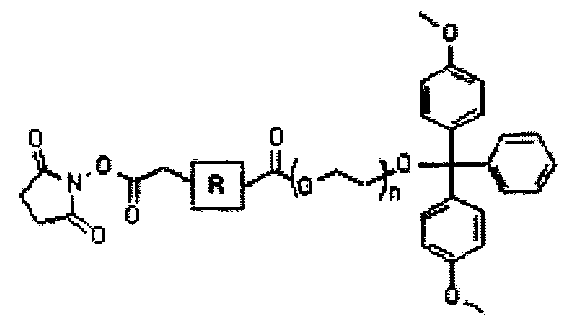
[Структурная формула IV]

(где R представляет собой алкил, алкенил, алкинил, арил, арилалкил, гетероалкил или гетероарил и n представляет собой целое число, составляющее не менее чем 5 и не более чем 120).

Комментарии