Способ обработки целлюлозного материала и используемые в нем ферменты - RU2458128C2
Код документа: RU2458128C2
Чертежи



































































































































































































Описание
Область изобретения
Настоящее изобретение относится к получению гидролизатов сахаров из целлюлозного материала. Более конкретно изобретение относится к получению ферментируемых сахаров из лигноцеллюлозного материала посредством ферментативной конверсии. Ферментируемые сахара используются, например, при получении биоэтанола или для других целей. В частности изобретение направлено на способ обработки целлюлозного материала с помощью целлобиогидролазы, эндоглюканазы, бета-глюкозидазы и, при необходимости, ксиланазы, а также к ферментным препаратам и их применениям. Изобретение также направлено на новые целлюлолитические полипептиды, кодирующие их полинуклеотиды и на векторы и хозяйские клетки, содержащие полинуклеотиды. Кроме того, изобретение направлено на применения полипептидов и на способ их получения.
Предшествующий уровень техники
Гидролизаты сахаров могут быть использованы для микробного получения множества химических соединений или биополимеров, таких как органические кислоты, например, молочная кислота, или этанола и других спиртов, например, n-бутанола, 1,3-пропандиола, или полигидроксиалконатов (PHAs). Гидролизаты сахаров могут также служить в качестве сырья для других немикробных способов, например для обогащения, выделения и очистки высокомолекулярных сахаров или различных способов полимеризации. Одно из главных применений гидролизатов сахаров заключается в получении биотоплива. Получение биоэтанола и/или других химических соединений может происходить в интегрированном процессе при биоочистке (Wyman, 2001).
Ограниченные ресурсы ископаемого топлива и повышенное количество освобождающегося из него CO2, вызывающее парниковый эффект, повысили потребность в использовании биомассы как возобновляемого и чистого источника энергии. Одной из обещающих альтернативных технологий является производство биотоплива, т.е. этанола, из целлюлозных материалов. В транспортной отрасли в настоящее время биотопливо является единственным выбором, который мог бы уменьшить выход CO2 посредством регламентирования его величины. Этанол можно использовать в существующих транспортных средствах и распределительных системах, а следовательно, не требуется дорогостоящих вложений в инфраструктуру. Сахара, полученные из возобновляемого лигноцеллюлозного сырья, можно также использовать в качестве сырья для множества химических продуктов, которые могут заменить химические продукты на основе нефти.
Большинство углеводородов в растениях находятся в форме лигноцеллюлозы, которая в основном представлена целлюлозой, гемицеллюлозой, пектином и лигнином. В процессе лигноцеллюлоза-этанол лигноцеллюлозный материал предварительно обрабатывают либо физическими, либо химическими методами, чтобы сделать целлюлозную фракцию более доступной гидролизу. После этого целлюлозную фракцию гидролизуют, чтобы получить сахара, которые с помощью дрожжей можно ферментировать в этанол. В качестве главного попутного продукта получают лигнин, который можно использовать в качестве твердого топлива.
Стоимость производства биоэтанола высока, а выход энергии низок, поэтому постоянно продолжаются попытки сделать этот процесс более экономичным. Ферментативный гидролиз рассматривается в качестве наиболее обещающей технологии превращения целлюлозной биомассы в ферментируемые сахара. Однако в промышленных масштабах гидролиз используют ограниченно, и особенно эта технология является неудовлетворительной, когда используется сильно лигнифицированный материал, такой как отходы деревообработки или сельского хозяйства. Стоимость ферментативной стадии является одним из главных экономических факторов процесса. Производились попытки улучшить эффективность ферментативного гидролиза целлюлозного материала (Badger, 2002).
В US 2002/0192774 A1 описывается непрерывный процесс конверсии твердой лигноцеллюлозной биомассы в горючие топливные продукты. После предварительной обработки посредством влажного окисления или разрыва паром биомасса частично разделяется на целлюлозу, гемицеллюлозу и лигнин, а затем подвергается частичному гидролизу с помощью одного или более карбогидразных ферментов (EC 3.2). В качестве примера приводится коммерческий продукт Celluclast™ фирмы Novo Nordisk A/S, обладающий целлюлазной и ксиланазной активностями.
В US 2004/000 5674 A1 описываются новые смеси ферментов, которые могут быть использованы непосредственно на лигноцеллюлозном субстрате, при этом можно избежать получения токсичных отходов, образующихся во время предварительной обработки, и можно сэкономить энергию. Синергетическая смесь ферментов содержит целлюлазу и дополнительный фермент, такой как целллюлаза, ксиланаза, ксиланаза, лигниназа, амилаза, протеаза липидаза или глюкуронидаза, или их любая комбинация. Подразумевается, что целлюлаза включает эндоглюканазу (EG), бета-глюкозидазу (BG) и целлобиогидролазу (CBH). Примеры иллюстрируют использование смеси препаратов ксиланазы и целлюлазы Trichoderma.
Kurabi et al. (2005) исследовали ферментативный гидролиз разорванного паром и предварительно обработанной органическим этанольным растворителем дугласии с помощью новых и коммерческих грибковых целлюлаз. Они тестировали два коммерческих целлюлазных препарата Trichoderma reesei и два новых препарата, продуцируемых мутантными штаммами Trichoderma sp. и Penicillum sp. Препарат из Trichoderma sp. показал значительно лучшие характеристики, чем другие препараты. Предполагалось, что лучшие характеристики, по меньшей мере, частично, обусловлены значительно более высокой бета-глюкозидазной активностью, которая ослабляет продукты, ингибирующие действие целлобиогидролазы и эндоглюканазы.
US 2004/005 3373 A1 относится к способу превращения целлюлозы в глюкозу путем обработки предварительно подготовленного лигноцеллюлозного субстрата смесью ферментов, включающей целлюлазу и модифицированную целлобиогидролазу I (CBHI). CBHI модифицировали инактивацией ее целлюлозо-связывающего домена (CBD). Преимущества модификации CBHI заключаются, например, в лучшем восстановлении и более высокой скорости гидролиза при высокой концентрации субстрата. Целлюлазу выбирают из группы, состоящей из EG, CBH и BG. CBHI предпочтительно получают из Trichoderma.
В US 2005/0164355 A1 описывается способ деградирования лигноцеллюлозного материала с помощью одного или более целлюлолитических ферментов в присутствии, по крайней мере, одного суфрактанта. Могут использоваться также вспомогательные ферменты, такие как гемицеллюлазы, эстераза, пероксидаза, протеаза, лакказа или их смеси. Присутствие суфрактанта усиливает деградацию лигноцеллозного материала по сравнению с отсутствием суфрактанта. Целлюлолитические ферменты могут быть любыми ферментами, включенными в деградацию лигноцеллюлозы, включая CBH, EG и BG.
Имеется большое количество публикаций, раскрывающих различные целлюлазы и гемицеллюлазы.
Например, в WO 03/000 941 раскрываются целлобиогидролазы (CBHs), которые относятся к CBHI-ферментам, получаемым из грибков. Не приводится никаких физиологических свойств этих ферментов, никаких примеров их применения. Hong et al. (2003b) характеризуют CBHI из Thermoascus aurantiacus, продуцируемую в дрожжах. Применения фермента не описаны. Tuohy et al. (2002) описывают три формы целлобиогидролазы из Talaromyces emersonii.
Эндоглюканазы семейства cel5 (EGs fam 5) описываются, например, в WO 03/062 409, которая относится к композициям, включающим, по крайней мере, два термостабильных фермента дли применения в пищевых отраслях. Hong et al. (2003а) описывают продуцирование термостабильной эндо-β-1,4-глюканазы из T.aurantiacus в дрожжах. Никаких применений не указывается. WO 01/70998 относится к β-глюканазам из Talaromyces emersonii. Обсуждаются применения для производства пищевых продуктов, кормов, напитков, пивоварения и детергентов. Лигноцеллюлозный гидролиз не упоминается. В WO 98/06 858 описывается бета-1,4-эндоглюказаназа из Aspergillus niger и обсуждается применение этого фермента в производстве продуктов питания и кормов. WO 97/13853 описывает методы скринирования ДНК-фрагментов, кодирующих ферменты в кДНК-библиотеках. кДНК-библиотека имеет дрожжевое или грибковое происхождение предпочтительно из Aspergillus. Фермент предпочтительно является целлюлазой. Van Petegen et al. (2002) описывают 3D-структуру эндоглюканазы cel5-семейства из Thermoascus aurantiacus. Parry et al. (2002) описывают принцип действия эндоглюканазы cel5-семейства из Thermoascus aurantiacus.
Эндоглюканазы семейства cel7 (EGs fam 7) раскрываются, например, в US 5,912,157, которая относится к эндоглюканазе Myceliphthora и ее гомологам и их применениям при производстве детергентов, в текстильной и целлюлозной промышленности. US 6,071,735 описывает целлюлазы, обнаруживающие высокую эндоглюканазную активности в щелочной среде. Обсуждаются применения в качестве детергента, целлюлозно-бумажной и текстильной промышленности. Биоэтанол не упоминается. US 5,763,254 раскрывает ферменты, деградирующие целлюлозу/гемицеллюлозу и имеющие консервативные аминокислотные остатки в CBD.
Эндоглюканазы семейства cel45 (EGs fam 45) раскрываются, например, в US 6,001,639, которая относится к ферментам, имеющим эндоглюканазную активность и содержащим две корсервативные аминокислотные последовательности. Обсуждаются в целом применения для текстильной промышленности, в качестве детергента и в целлюлозно-бумажной промышленности, обработка лигноцеллюлозного материала упоминается, но никаких примеров не приводится. WO 2004/053039 направлена на применение эндоглюканаз в качестве детергента. В US 5,958,082 раскрывается применение эндоглюканазы, особенно из Thielavia terrestris, в текстильной промышленности. EP 0495258 относится к детергентным композициям, содержащим целлюлазу Humicola. В US 5,948,672 описывается препарат целлюлазы, содержащий эндоглюканазу, особенно из Humicola, и его применение в текстильной и целлюлозной промышленности. Гидролиз лигноцеллюлозы не упоминается.
Небольшое количество бета-глюкозидазы (BG) усиливает гидролиз биомассы до глюкозы посредством расщепления целлобиозы, продуцируемой целлобиогидролазами. Конверсия целлобиозы в глюкозу обычно является главной лимитирующей скорость стадией. Бета-глюкозидазы раскрываются, например, в US 2005/021 4920, которая относится к BG из Aspergiilus fumigatus. Этот фермент продуцируется в Aspergiilus oryzae и Trichoderma reesei. В целом обсуждается применение фермента при деградации биомассы и в качестве детергента, однако примерами не иллюстрируется. В WO 02/095 014 описывается фермент из Aspergiilus oryzae, имеющий целлобиазную активность. Применение в производстве этанола из биомассы в целом обсуждается, но примеров не приводится. WO 2005/074656 раскрывает полипептиды, имеющие повышенную целлюлолитическую активность, происходящие, например, из T. aurantiacus; A. fumigatus; T. terrestris и T. aurantiacus. В WO 02/26879 раскрывается ферментативная обработка растительного материала. В US 6,022,725 раскрываются клонирование и амплификация бета-глюкозидазного гена Trichoderma reesei, а в US 6,103,464 описывается способ обнаружения ДНК, кодирующей бета-глюкозидазу из волокнистого грибка. Никаких примеров применения не приводится.
Ксиланазы описываются, например, в FR2786784, которая относится к термоустойчивой ксиланазе, полезной, например, в обработке корма для животных и в хлебопечении. Фермент происходит из волокнистого грибка, в частности рода Thermoascus.
В US 6,197,564 описываются ферменты, имеющие ксиланазную активность и полученные из Aspergillus aculeatus. Иллюстрируется их применение в хлебопечении. WO 02/24926 относится к ксиланазам из Talaromyces. Приводятся примеры применения в производстве кормов и хлебопечении. В WO 01/42433 раскрывается термоустойчивая ксиланаза из Talaromyces emersonii для использования в пищевой промышленности и производстве кормов.
Наиболее исследованные и широко применяемые целлюлолитические ферменты грибкового происхождения происходят из Trichoderma reesei (анаморфа Hypocrea jecorina). Соответственно большинство коммерчески доступных грибковых целлюлаз происходят из Trichoderma reesei. Однако большинство целлюлаз из менее известных грибков еще не применялось в практически значимых процессах, таких как деградация целлюлозного материала, включая лигноцеллюлозу.
Имеется постоянная потребность в новых методах деградации целлюлозных субстратов, в частности лигноцеллюлозных субстратов, и в новых ферментах и смесях ферментов, которые увеличивают эффективность деградации. Имеется также потребность в способах и ферментах, которые работают при высоких температурах, что дает возможность использования биомасс с высокой плотностью и ведет к высоким концентрациям сахаров и этанола. Этот подход может привести к значительной экономии в энергии и инвестиционных затратах. Высокая температура, кроме того, уменьшает риск заражения во время гидролиза. Цель настоящего изобретения состоит в том, чтобы удовлетворить, по крайней мере, часть этих потребностей.
Краткое описание изобретения
Это удивительно, но было обнаружено, что целлюлолитические ферменты, и особенно целлобиогидролазы, полученные из Thermoascus aurantiacus, Acremonium thermophilum или Chaetomium thermophilum, чрезвычайно полезны в гидролизе целлюлозного материала. Кроме целлобиогидролаз эти грибки также содержат эндоглюканазы, бета-глюкозидазы и ксиланазы, которые очень подходят для деградирования целлюлозного материала. Эти ферменты кинетически весьма эффективны в широком интервале температур, и хотя они имеют высокую активность при высокой температуре, они также весьма эффективны при стандартных температурах гидролиза. Это делает их исключительно хорошо подходящими для различных процессов гидролиза целлюлозных субстратов, проводимых как при традиционных температурах, так и при повышенных температурах.
Настоящее изобретение прелагает способ обработки целлюлозного материала с помощью целлобиогидролазы, эндоглюканазы и бета-глюкозидазы, при этом упомянутая целлобиогидролаза включает аминокислотную последовательность, имеющую, по меньшей мере, 80%-ную идентичность SEQ ID NO: 2, 4, 6 или 8, либо ее ферментативно активный фрагмент.
Изобретение далее предлагает ферментный препарат, включающий целлобиогидролазу, эндоглюканазу и бета-глюкозидазу, где упомянутая целлобиогидролаза включает аминокислотную последовательность, имеющую, по меньшей мере, 80%-ную идентичность SEQ ID NO: 2, 4, 6 или 8, либо ее ферментативно активный фрагмент.
Предлагается также применение упомянутого ферментного препарата для деградирования целлюлозного материала, а также применение упомянутого способа в процессе получения этанола из целлюлозного материала.
Изобретение также направлено на полипептид, включающий фрагмент, имеющий целлюлолитическую активность, выбираемый из группы, состоящей из:
a) полипептида, включающего аминокислотную последовательность, имеющую, по меньшей мере, 66%-ную идентичность SEQ ID NO:4, 79%-ную идентичность SEQ ID NO:6, 78%-ную идентичность SEQ ID NO:12, 68%-ную идентичность SEQ ID NO:14, 72%-ную идентичность SEQ ID NO:16, 68%-ную идентичность SEQ ID NO:20, 74%-ную идентичность SEQ ID NO:22 или 24, или 78%-ную идентичность SEQ ID NO:26;
b) варианта а), включающего фрагмент, имеющий целлюлолитическую активность; и
с) фрагмента а) или b), имеющего целлюлолитическую активность.
Еще одним объектом изобретения является выделенный полинуклеотид, выбранный из группы, состоящей из:
a) нуклеотидной последовательности SEQ ID NO: 3, 5, 11, 13, 15, 19, 21, 23 или 25, или последовательности, кодирующей полипептид по п.35 притязаний;
b) нити, комплементарной a);
c) фрагмента a) или b), включающего, по меньшей мере, 20 нуклеотидов; и
d) последовательности, которая является вырожденной, как результат генетического кода, относительно любой из последовательностей, представленных в a), b) или c).
Далее изобретение также предлагает вектор, который включает упомянутый полинуклеотид в качестве гетерологичной последовательности, и хозяйскую клетку, включающую упомянутый вектор. Штаммы Escherichia coli, имеющие номера доступа DSM 16728, DSM 16729, DSM 17324, DSM 17323, DSM 17729, DSM 16726, DSM 16725, DSM 17325 или DSM 17667, также включены в изобретение.
Другими целями изобретения являются ферментные препараты, включающие, по меньшей мере, новые полипептиды, и применение этих полипептидов или ферментных препаратов в топливной, текстильной, целлюлозно-бумажной, пищевой промышленности, в производстве детергентов, кормов и напитков.
Далее предлагается способ получения полипептида, включающего фрагмент, имеющий целлюлолитическую активность, при этом полипептид выбран из группы, состоящей из:
a) полипептида, включающего аминокислотную последовательность, имеющую, по меньшей мере, 66%-ную идентичность SEQ ID NO:4, 79%-ную идентичность SEQ ID NO:6, 78%-ную идентичность SEQ ID NO:12, 68%-ную идентичность SEQ ID NO:14, 72%-ную идентичность SEQ ID NO:16, 68%-ную идентичность SEQ ID NO:20, 74%-ную идентичность SEQ ID NO:22 или 24, или 78%-ную идентичность SEQ ID NO:26;
b) варианта а), включающего фрагмент, имеющий целлюлолитическую активность; и
c) фрагмента а) или b), имеющего целлюлолитическую активность; и
причем указанный способ включает трансформацию хозяйской клетки вектором, кодирующим упомянутый полипептид, и культивирование упомянутой хозяйской клетки в условиях, обеспечивающих экспрессию этого полипептида, и, при необходимости, выделение и очистку получаемого полипептида.
предлагается также способ обработки целлюлозного материала с помощью отработанной культуральной среды, по крайней мере, одного микроорганизма, способного продуцировать полипептид, как он охарактеризован выше, где способ включает реагирование целлюлозного материала с отработанной средой культивирования, чтобы получить гидролизованный целлюлозный материал.
Варианты воплощения изобретения представлены в зависимых пунктах формулы.
Другие цели, особености и преимущества настоящего изобретения станут очевидными из последующих чертежей, подробного описания и примеров.
Краткое описание чертежей
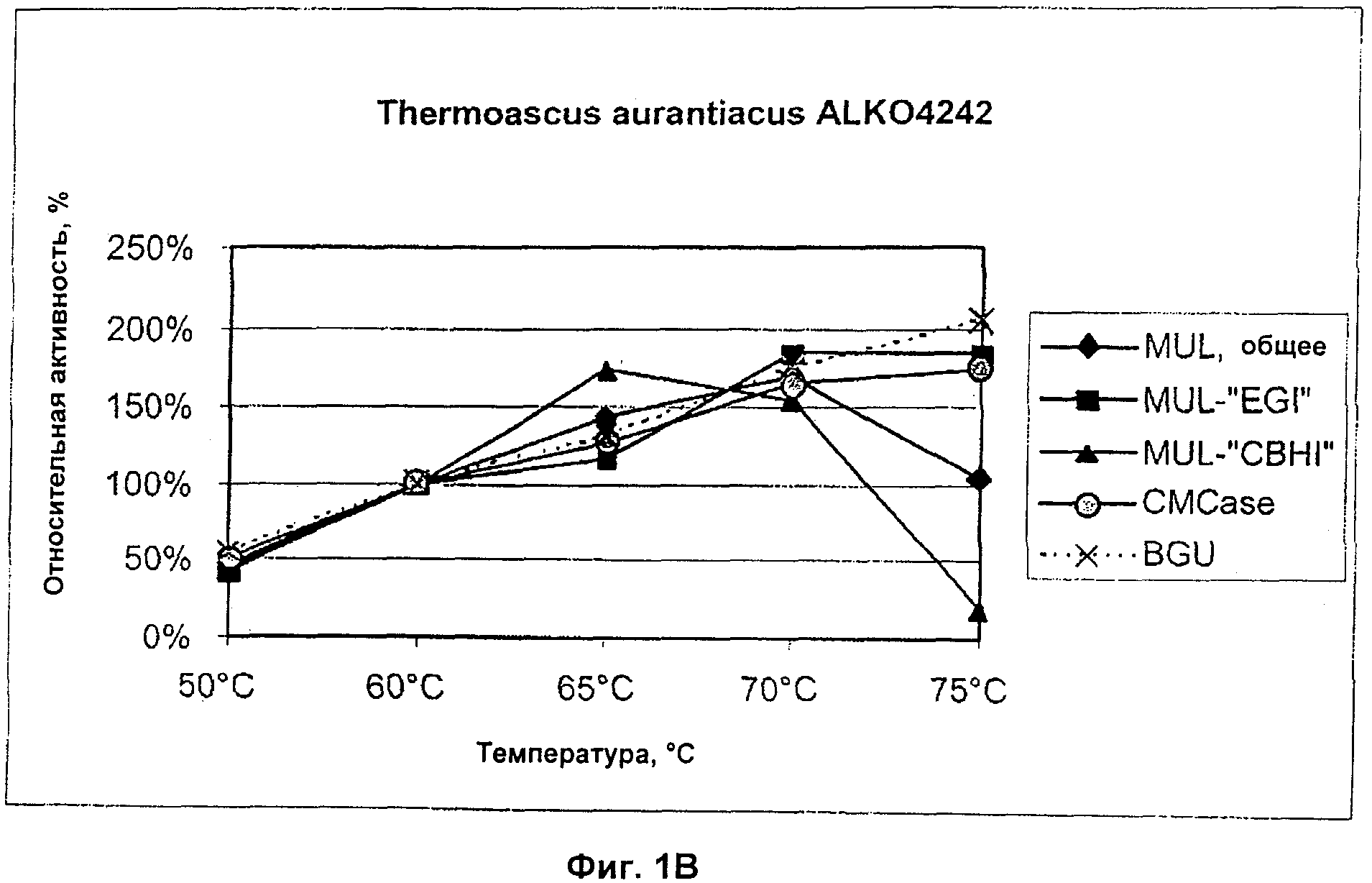
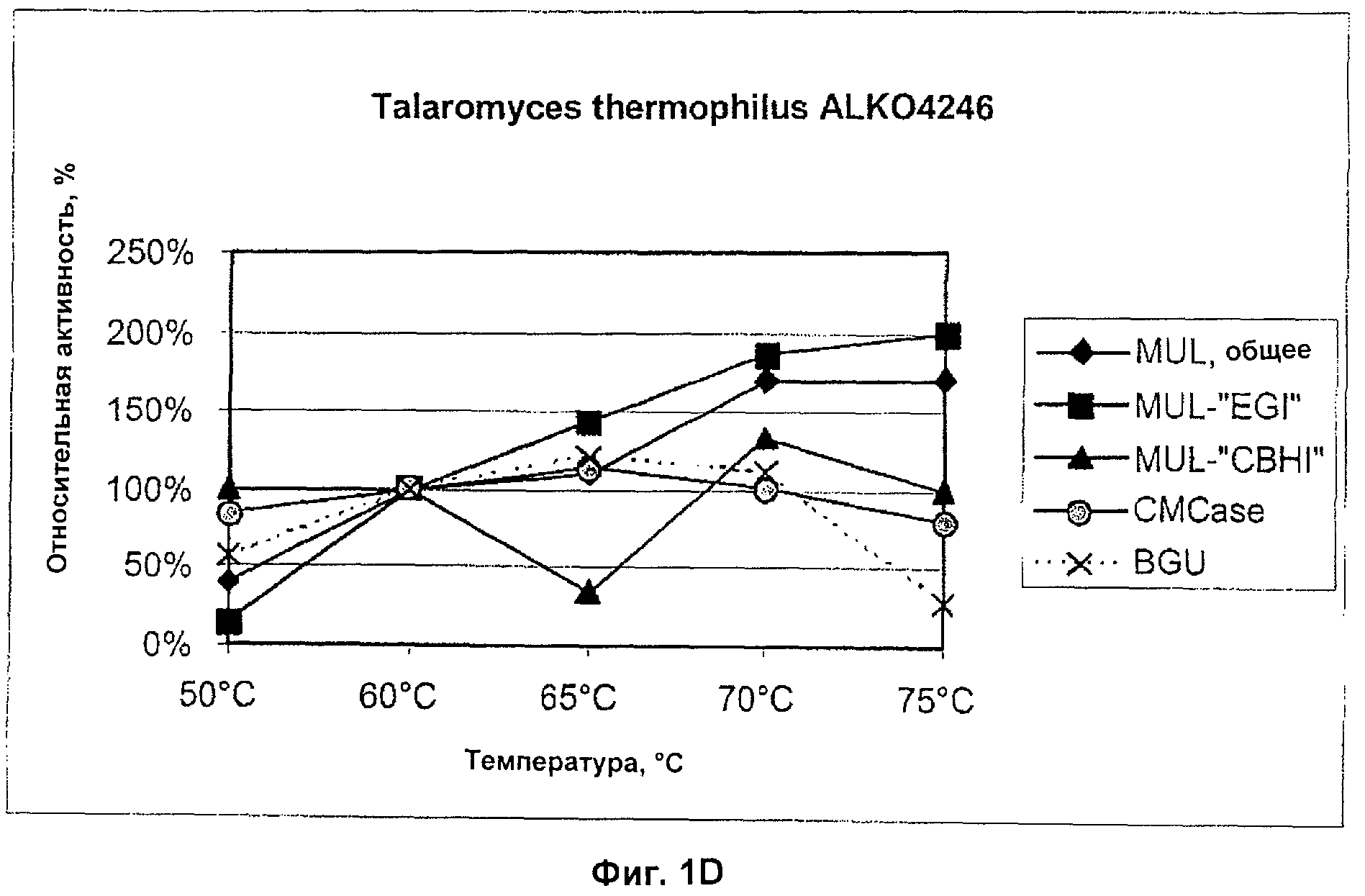
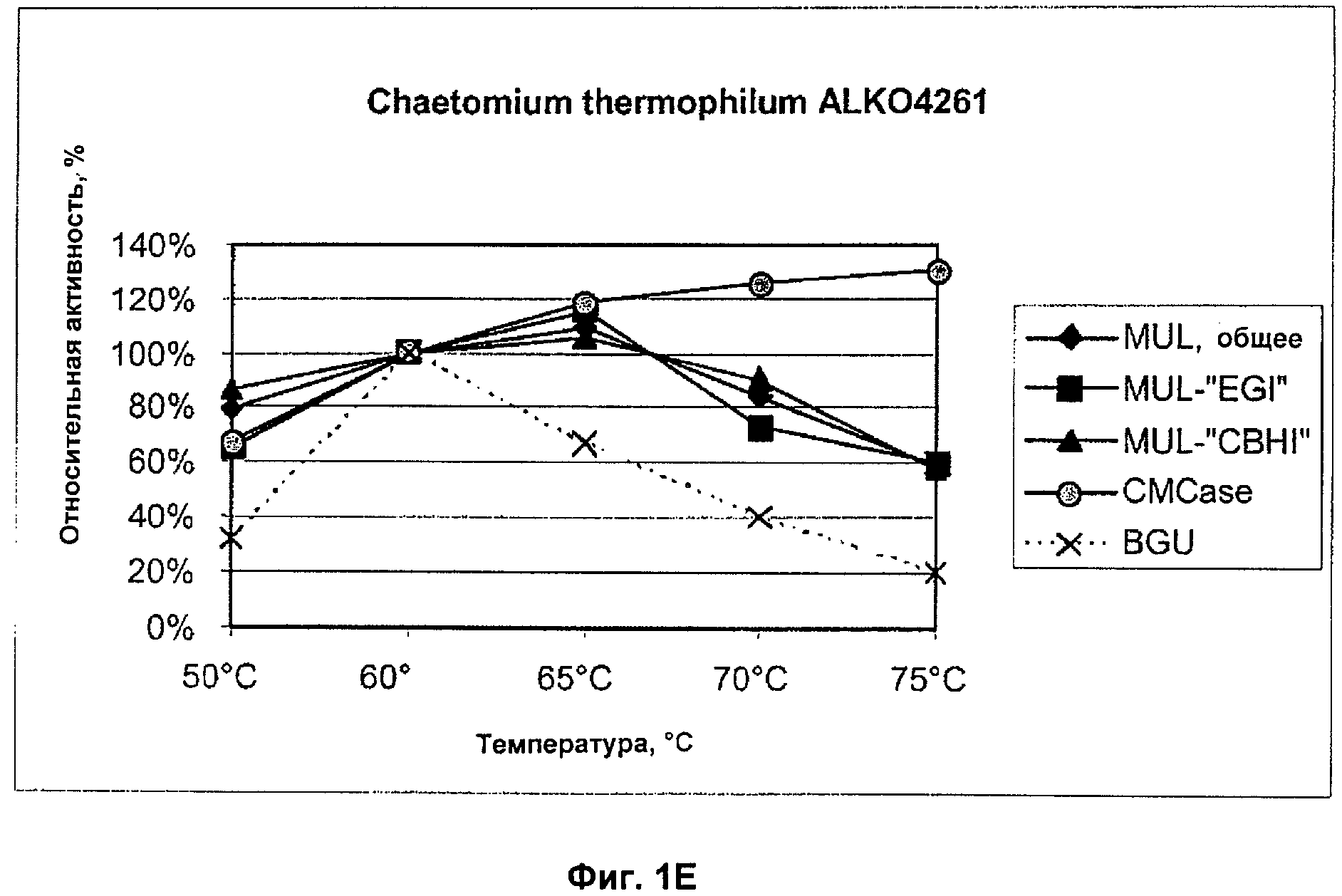
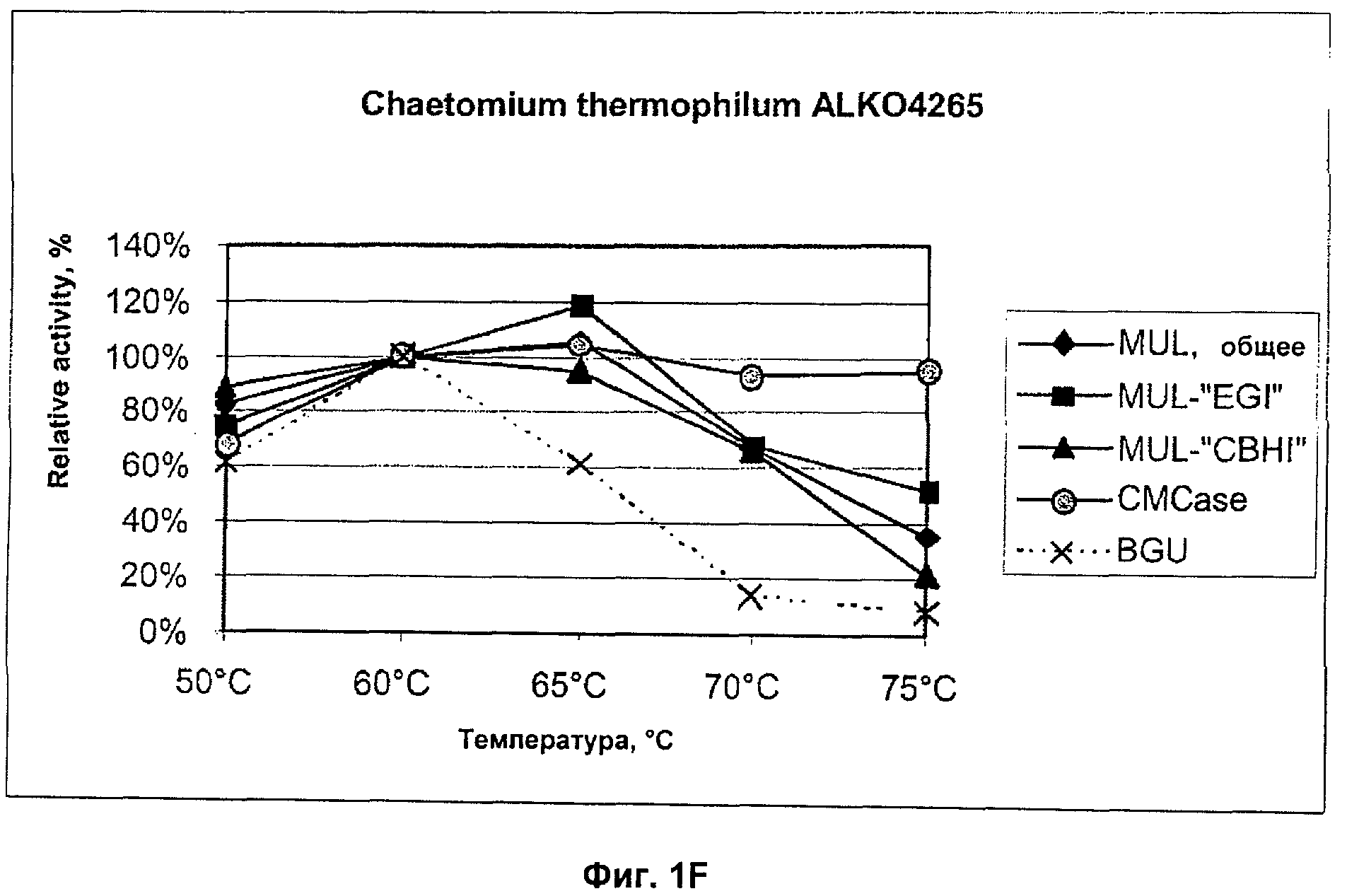
Фигура 1. Температурные зависимости целлюлазной и бета-глюкозидазной активностей в супернатантах шести тестированных грибковых штаммах. Время инкубирования в данном анализе было 60 мин при данной температуре, анализ pH был 5.0 (MUL-активность) или 4.8 (CMCase или BGU). Активность, полученная при 60оС, представлена как относительная активность от 100%. A) Thermoascus aurantiacus ALKO4239, B) Thermoascus aurantiacus ALKO4242, C) Acremonium thermophilum ALKO4245, D) Talaromyces thermophilus ALKO4246, E) Chaetomium thermophilum ALKO4261, F) Chaetomium thermophilum ALKO4265.
Фигура 2. Схематическое изображение экспрессионных кассет, используемых при трансформации протопластов Trichoderma reecei для продуцирования рекомбинантных грибковых протеинов. Рекомбинантные гены находились под управлением T. reecei cbh1 (cel7A) промотора (cbh1 prom), а терминация транскрипции гарантировалась использованием терминаторной последовательности T. reecei cbh1 (cbh1-term). В качестве маркера трансформации был включен amdS-ген.
Фигура 3. A) pH-оптимумы препаратов рекомбинантного протеина CBH/Cel7 из Thermoascus aurantiacus ALKO4242, Chaetomium thermophilum ALKO4265 и Acremonium thermophilum ALKO4245, определенные по 4-метилумбеллиферил-β-D-лактозиду (MUL) при 50оС за 10 мин. Результаты приведены как средние (±SD) из трех отдельных измерений. B) Термальная устойчивость препаратов рекомбинантного протеина CBH/Cel7 из Thermoascus aurantiacus ALKO4242, Chaetomium thermophilum ALKO4265 и Acremonium thermophilum ALKO4245, определенные по 4-метилумбеллиферил-β-D-лактозиду (MUL) при оптимуме pH в течение 10 мин. Результаты приведены как средние (±SD) из трех отдельных измерений. Обе реакции содержали BSA (100 мкг/мл) в качестве стабилизатора.
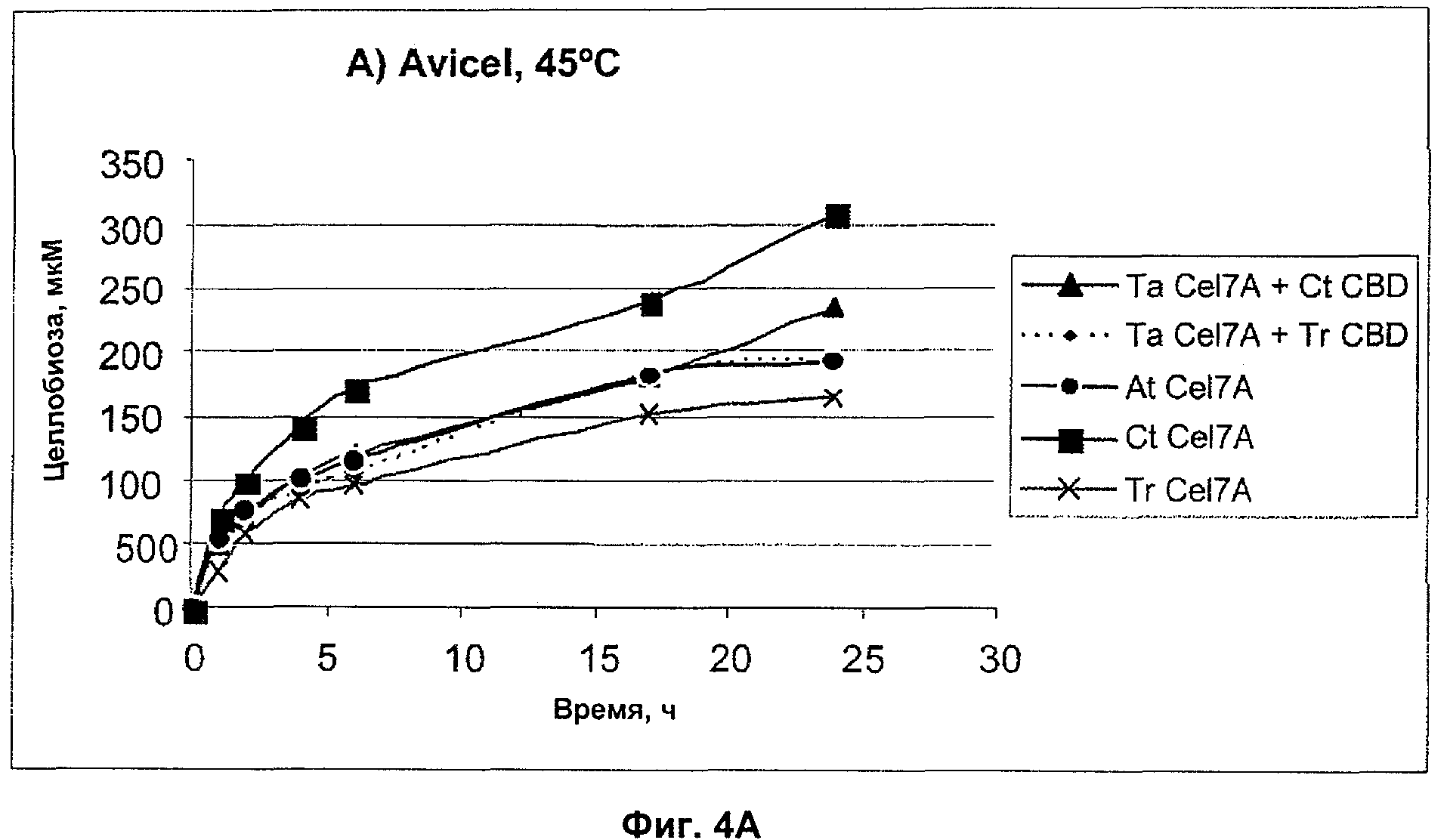
Фигура 4. Гидролиз кристаллической целлюлозы (Avicel) с помощью очищенных рекомбинантных целлобиогидролаз при 45оС. Концентрация субстрата 1% (вес/об), pH 5.0, концентрация фермента 1,4 мкМ. A) целлобиогидролазы, содержащие CBD, B) целлобиогидролазы (кор) без CBD.
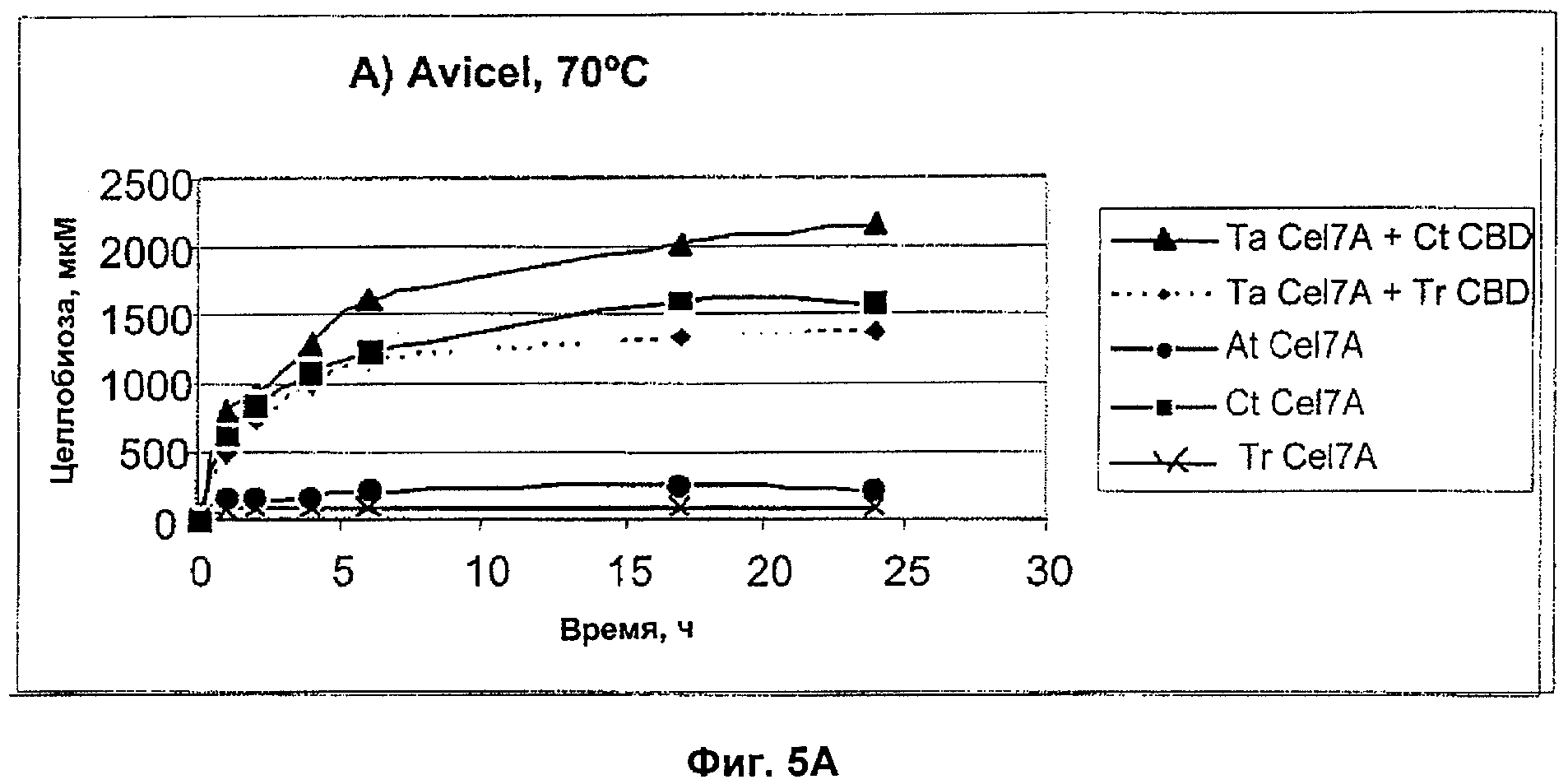
Фигура 5. Гидролиз кристаллической целлюлозы (Avicel) с помощью очищенных рекомбинантных целлобиогидролаз при 70оС. Концентрация субстрата 1% (вес/об), pH 5.0, концентрация фермента 1,4 мкМ. A) целлобиогидролазы, содержащие CBD, B) целлобиогидролазы (кор) без CBD.
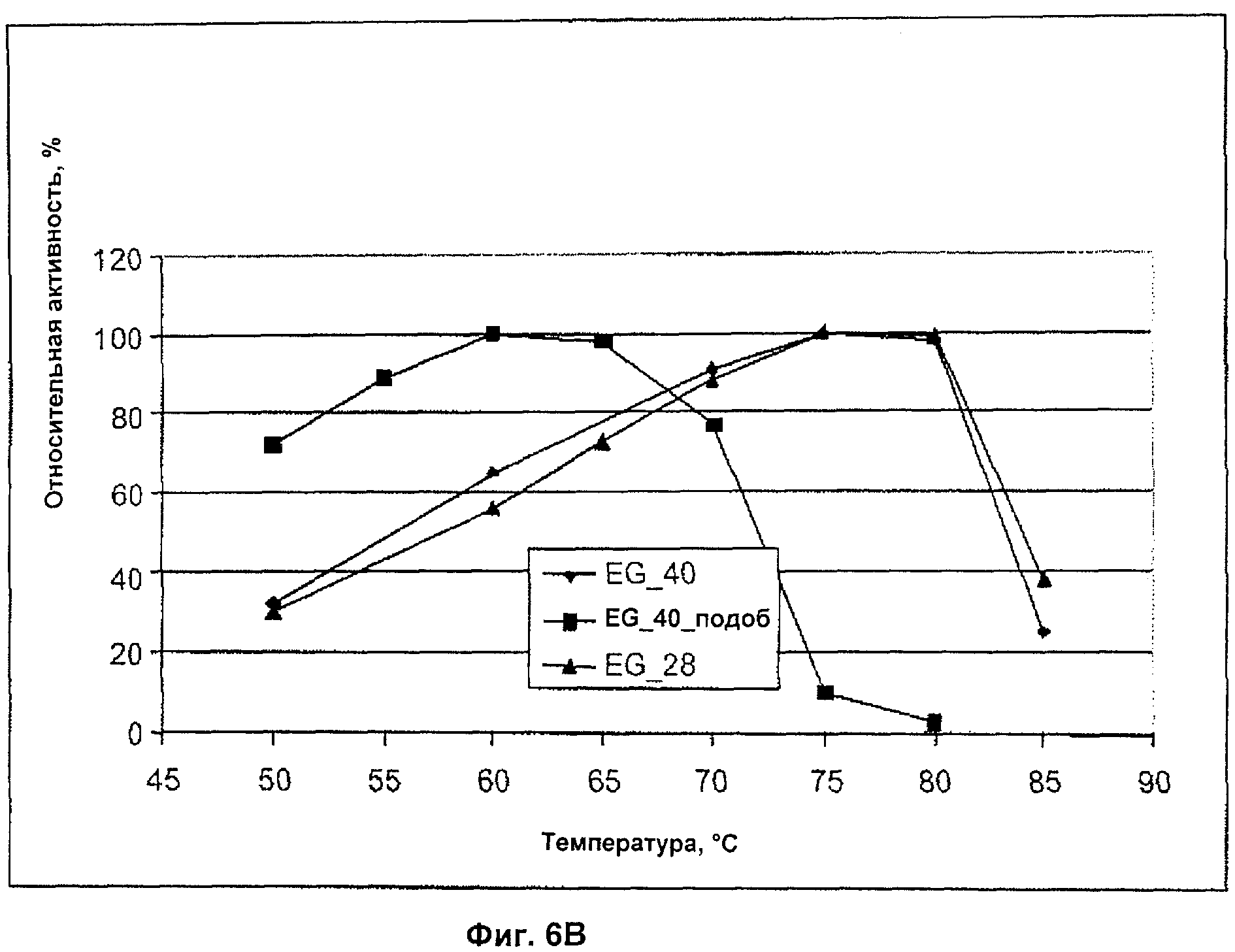
Фигура 6. A) pH-зависимость активности гетерологично произведенных Acremonium EG_40/Cel45A, EG_40_подобной/Cel45B и Thermoascus EG_28/Cel5A определялась с помощью CMC-субстрата в течение 10-минутной реакции при 50оС. B) Температурный оптимум Acremonium EG_40/Cel45A, EG_40_подобной/Cel45B и Thermoascus EG_28/Cel5A определялся при pH 5.5, 4.8 и 6.0, соответственно. Реакция с участием CMC в качестве субстрата проводилась в течение 60 мин, кроме EG_28/Cel5A, которую проводили в течение 10 мин. В качестве стабилизатора добавляли BSA (100 мкг/мл).
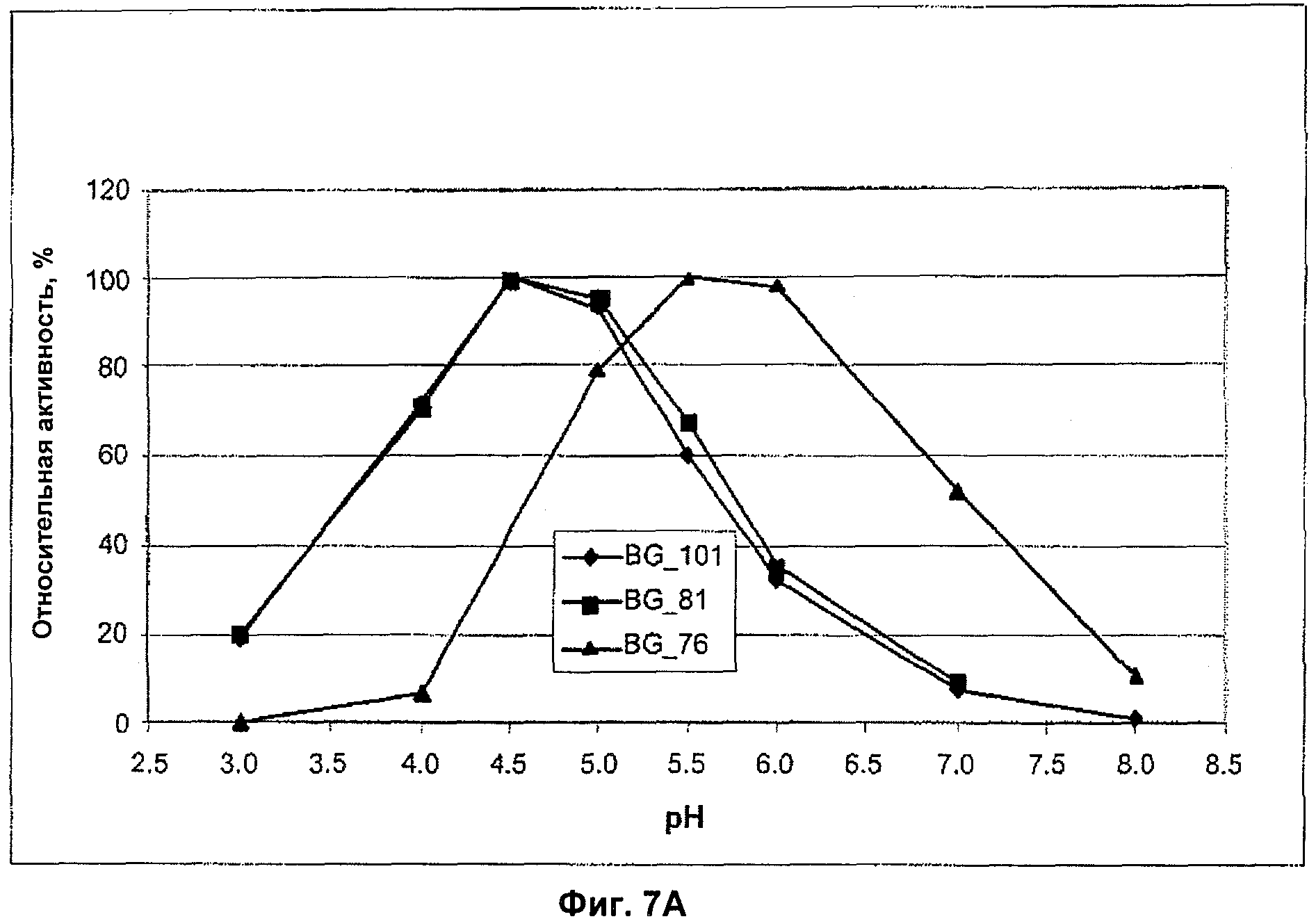
Фигура 7. A) pH-зависимость активности гетерологично произведенных Acremonium BG_101/Cel3A, Chaetomium BG_76/Cel3A и Thermoascus BG_81/Cel3A определялась с помощью 4-нитрофенил-β-D-глюкопиранозидного субстрата в течение 10-минутной реакции при 50оС. B) Температурный оптимум Acremonium EG_40/Cel45A, EG_40_ подобной/Cel45B и Thermoascus EG_28/Cel5A определялся при pH 4.5, 5.5 и 4.5, соответственно. Реакция с участием 4-нитрофенил-β-D-глюкопиранозида в качестве субстрата проводилась в течение 60 мин, в качестве стабилизатора добавляли BSA (100 мкг/мл).
Фигура 8. A) pH-зависимость ксиланазной активности гетерологично произведенной Thermoascus XYN_30/Xyn10A определялась с помощью субстрата из ксилана березы в течение 10-минутной реакции при 50оС. B) Температурный оптимум XYN_30/Xyn10A определялся при pH 5.3 во время 60-минутной реакции, в качестве стабилизатора добавляли BSA (100 мкг/мл).
Фигура 9. Гидролиз промытого разорванного паром волокна ели (10 мг/мл) со смесью термофильных ферментов (СМЕСЬ 1) и ферментов из T. reesei при 55 и при 60оС. Дозировка ферментов дана в FPU (единицах фильтровальной бумаги)/г сухого вещества субстрата, FPU анализировали при 50оС, pH 5. Гидролиз проводили в течение 72 ч при pH 5, с помешиванием. Результаты даны как среднее (±SD) из трех отдельных измерений.
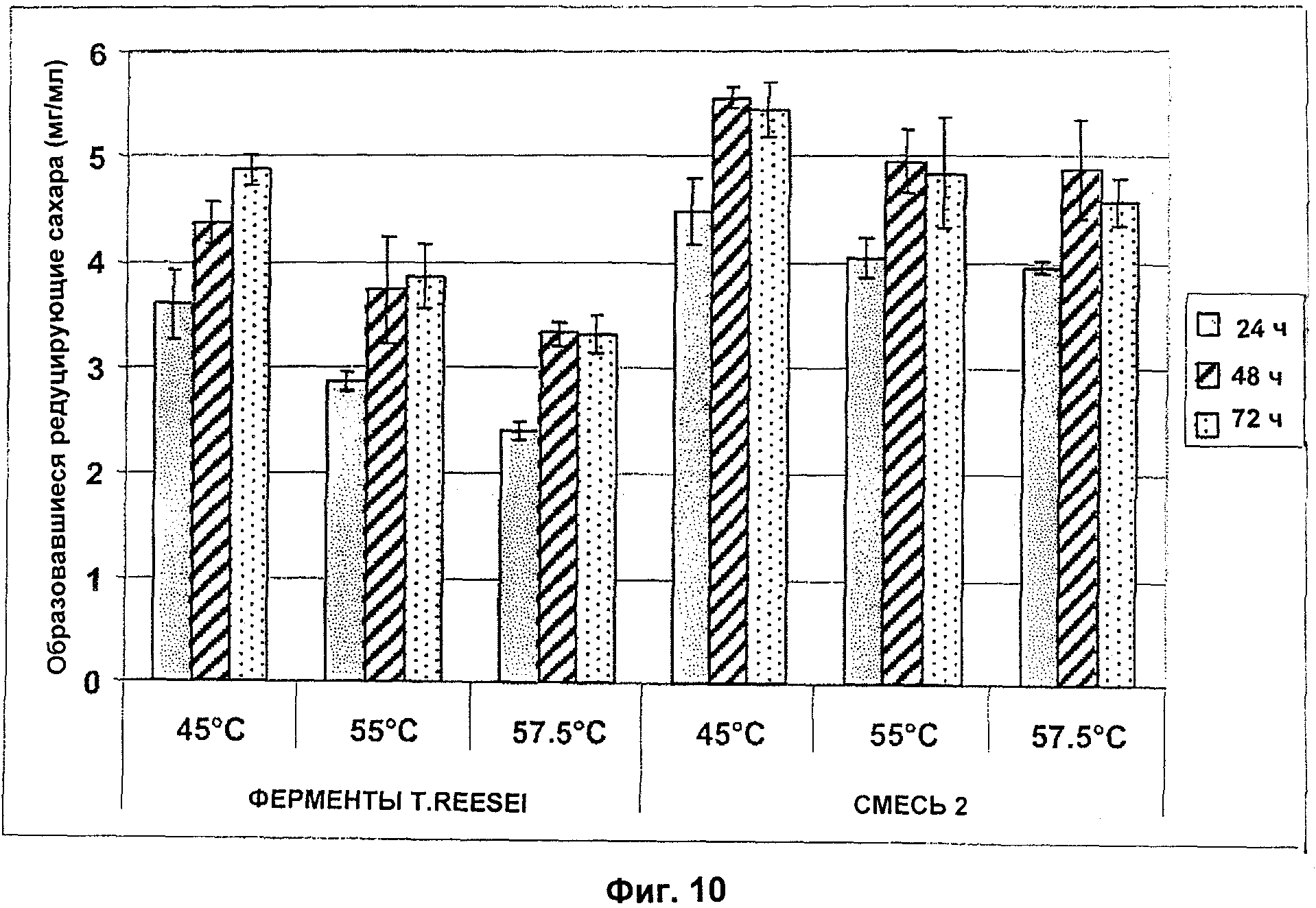
Фигура 10. Гидролиз промытой разорванной паром кукурузной соломы (10 мг/мл) со смесью термофильных ферментов (СМЕСЬ 2) и ферментов из T. reesei при 45, 55 и 57,5оС. Дозировка ферментов для «СМЕСИ 2» была 5 FPU/г сухого вещества субстрата, а для ферментов из T. reesei - 5 FPU/г сухого вещества Celluclast, дополненного 100 нкат/г сухого вещества Novozym 188 (активность фильтровальной бумаги анализировалась при 50оС, pH 5). Гидролиз проводили в течение 72 ч при pH 5, с помешиванием. Результаты даны как среднее (±SD) из трех отдельных измерений. Субстрат содержал растворимые восстановленные сахара (около 0,7 мг/мл). Это фоновое содержание сахаров вычиталось из от содержания восстановленных сахаров, образованных во время гидролиза.
Фигура 11. Гидролиз промытой разорванной паром кукурузной соломы (10 мг/мл) со смесью термофильных ферментов, содержащей новую термофильную ксиланазу из Thermoascus aurantiacus (СМЕСЬ 3) и ферментов из T. reesei при 45, 55 и 60оС. Дозировка ферментов для «СМЕСИ 3» была 5 FPU/г сухого вещества субстрата, а для ферментов из T. reesei - 5 FPU/г сухого вещества Celluclast, дополненного 100 нкат/г сухого вещества Novozym 188 (активность фильтровальной бумаги анализировалась при 50оС, pH 5). Гидролиз проводили в течение 72 ч при pH 5, с помешиванием. Результаты даны как среднее (±SD) из трех отдельных измерений. Субстрат содержал растворимые восстановленные сахара (около 0,7 мг/мл). Это фоновое содержание сахаров вычиталось из от содержания восстановленных сахаров, образованных во время гидролиза.
Фигура 12. Гидролиз промытого разорванного паром волокна ели (10 мг/мл) со смесью термофильных ферментов, содержащей новую термофильную ксиланазу XYN_30/Xyn10A из Thermoascus aurantiacus (СМЕСЬ 3) и ферментов из T. reesei при 45, 55 и 60оС. Дозировка ферментов для «СМЕСИ 3» была 5 FPU/г сухого вещества субстрата, а для ферментов из T. reesei - 5 FPU/г сухого вещества Celluclast, дополненного 100 нкат/г сухого вещества Novozym 188 (активность фильтровальной бумаги анализировалась при 50оС, pH 5). Гидролиз проводили в течение 72 ч при pH 5, с помешиванием. Результаты даны как среднее (±SD) из трех отдельных измерений.
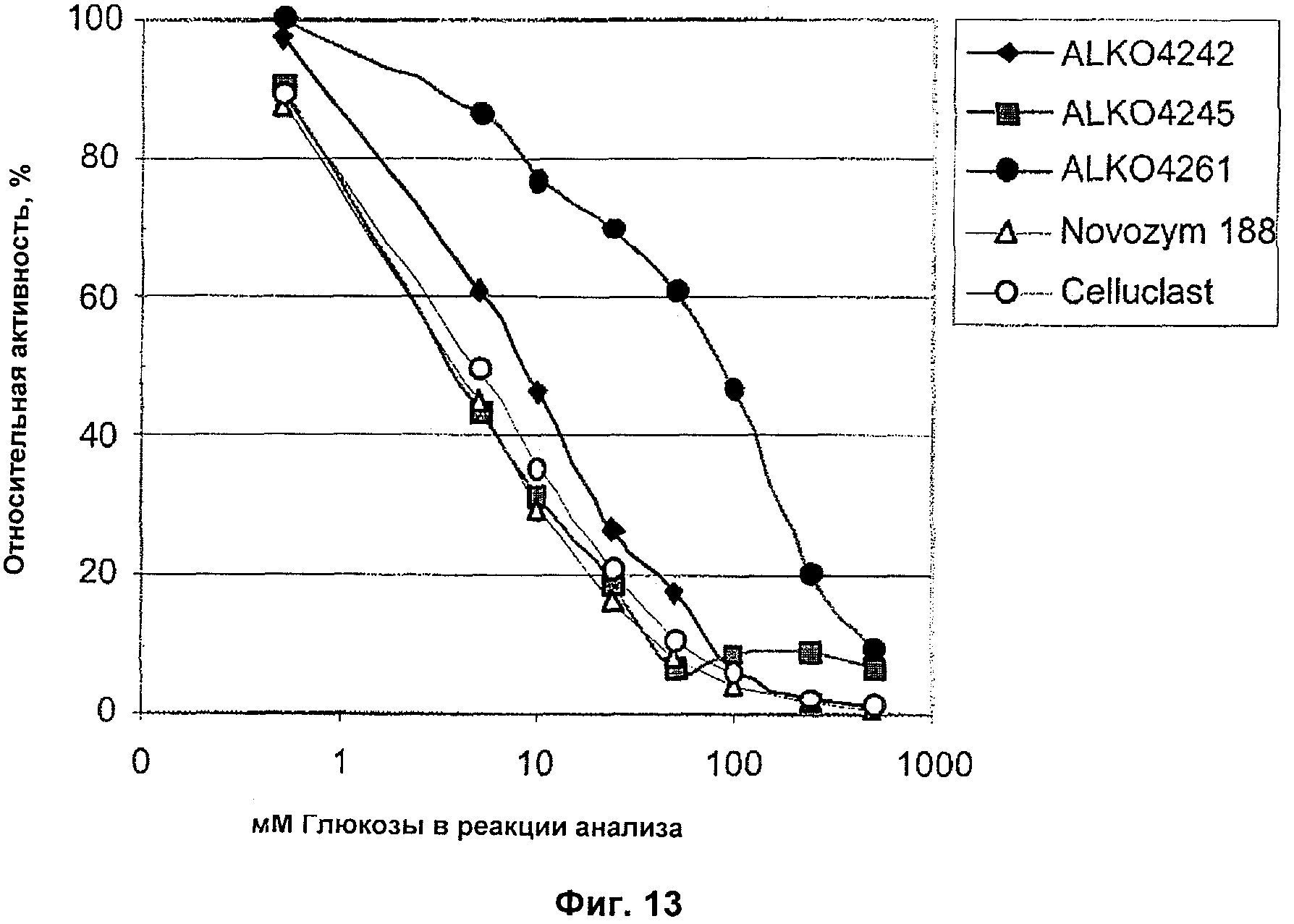
Фигура 13. Влияние глюкозы на активность различных β-глюкозидазных препаратов. Стандартный анализ с использованием p-нитрофенил-β-D-глюкопиранозида в качестве субстрата проводили в присутствии глюкозы в анализируемой смеси.
Фигура 14. FPU-активности смесей ферментов при температурах от 50 до 70оС, представленные как процентное значение активности при стандартных условиях (50оС, 1 ч).
Фигура 15. Относительная целлюлазная активность двух различных штаммов T. reesei, выращенных в средах, содержащих необработанную Nutriose (N0) или BG_81/Cel3A, предварительно обработанную Нутриозой (NBG81), в качестве источника углерода.
Подробное описание изобретения
Целлюлоза является главным структурным компонентом высших растений. Она обеспечивает клетки растений высокой напрягающей силой, помогающей им сопротивляться механическому стрессу и осмотическому давлению. Целлюлоза представляет собой β-1,4-глюкан, построенный из линейных цепочек остатков глюкозы, соединенных β-1,4-гликозидными связями. Целлобиоза является самой маленькой повторяющейся единицей целлюлозы. В клеточных стенках целлюлоза упакована в различно ориентированные слои, которые внедрены в матрикс гемицеллюлозы и лигнина. Гемицеллюлоза представляет собой разнородную группу углеводородных полимеров, содержащую, главным образом, различные глюканы, ксиланы и маннаны. Гемицеллюлоза состоит из линейного каркаса из β-1,4-связанных остатков с замещенными короткими боковыми цепями, обычно содержащими ацетил, глюкуронил, арабинозил и галактозил. Гемицеллюлоза может быть химически перекрестно-связанной с лигнином. Лигнин представляет собой сложный сшитый поперечными связями полимер различно замещенных р-гидроксифенилпропановых единиц, который обеспечивает силу клеточной стеки противостоять механическому стрессу, а также предохраняет целлюлозу от ферментативного гидролиза.
Лигноцеллюлоза представляет собой комбинацию целлюлозы и гемицеллюлозы и полимеров фенол-пропаноловых единиц и лигнина. Она физически твердая, плотная и непроницаемая и является самым распространенным биохимическим материалом в биосфере. Содержащими лигноцеллюлозу материалами являются: например, твердая и мягкая стружка древесины, мезга, опилки, отходы лесной и деревообрабатывающей промышленности; сельскохозяйственная биомасса, такая как солома злаков, ботва сахарной свеклы, солома и початки кукурузы, жом сахарного тростника, стебли, листья, пустые стручки, лузга и т.п.; твердые бытовые отходы, газеты и выброшенная офисная бумага, отходы от измельчения, например, зерна; отдающие энергию культуры (например, ива, тополь, просо, тростниковая канареечная трава и т.п.). Предпочтительными примерами являются кукурузная солома, просо, солома злаков, жом сахарного тростника и происходящие из древесины материалы.
«Целлюлозный материал», как этот термин здесь используется, относится к любому материалу, включающему целлюлозу, гемицеллюлозу и/или лигноцеллюлозу в качестве существенного компонента. «Лигноцеллюлозный материал» означает любой материал, включающий лигноцеллюлозу. Такие материалы являются, например, растительными материалами, такими как древесина, включая мягкую древесину и твердую древесину, травяные сельскохозяйственные культуры, остатки сельскохозяйственных культур, мезга и остатки бумаги, бумажные отходы, отходы пищевой и кормовой промышленности и т.д. Текстильные волокна, такие как хлопковые, волокна, происходящие из хлопка, льна, конопли, джута и сделанные человеком волокна, такие как модаль, вискоза, лиоцель, являются характерными примерами целлюлозных материалов.
В природе целлюлозный материал деградируется рядом различных организмов, включая бактерии и грибки. В типичном случае целлюлоза деградируется различными целлюлазами, действующими последовательно или одновременно. Для биологической конверсии целлюлозы в глюкозу обычно требуются три типа гидролитических ферментов: (1) Эндоглюканазы, которые разрезают внутренние бета-1,4-глюкозидные связи; (2) Экзоцеллобиогидролазы, которые отрезают дисахаридную целлобиозу от конца целлобиозной полимерной цепи; (3) Бета-1,4-глюкозидазы, которые гидролизуют целлобиозу и другие короткие целло-олигосахариды в глюкозу. Другими словами, тремя главными группами целлюлаз являются целлобиогидролазы (CBH), эндоглюканазы (EG) и бета-глюкозидазы (BG).
Для деградации более сложных целлюлозосодержащих субстратов требуется широкий круг различных ферментов. Например, лигноцеллюлоза деградируется гемицеллюлазами, а также ксиланазами и манназами. Гемицеллюлаза является ферментом, гидролизующим гемицеллюлозу.
«Целлюлолитическими ферментами» являются ферменты, имеющие «целлюлолитическую активность», что означает, что они способны гидролизовать целлюлозные субстраты или их производные на менее крупные сахариды. Целлюлолитические ферменты, таким образом, включают как целлюлазы, так и гемицеллюлазы. Целлюлазы, как этот термин здесь используется, включают целлобиогидролазы, эндоглюканазы и бета-глюкозидазы.
T. reesei имеет хорошо известную и эффективную целлюлазную систему, содержащую две CBH-азы, две главных и несколько менее значимых EG-аз и BG-аз. CBHI (Cel7A) T. reesei расщепляет сахар с редуцирующего конца целлюлозной цепи, содержит C-концевой целлюлозосвязывающий домен (CBD) и может составлять до 60% общего секретируемого протеина. CBHII (Cel6A) T. reesei расщепляет сахар с не-редуцирующего конца целлюлозной цепи, содержит N-концевой целлюлозосвязывающий домен и может составлять до 20% общего секретируемого протеина. Эндоглюканазы EGI (Cel7B) и EGV (Cel45A) имеют CBD на своем C-конце, EGII (Cel5A) имеет CBD на N-конце, а EGIII вообще не содержит целлюлозосвязывающего домена. CBHI, CBHII, EGI и EGII являются так называемыми «главными целлюлазами» Trichoderma, включающими вместе 80-90% общих секретируемых протеинов. Специалистам в данной области техники известно, что фермент может быть активным на нескольких субстратах, и ферментативные активности можно измерить, используя различные субстраты, методы и условия. Идентифицирование различных целлюлолитических активностей обсуждается, например, у van Tilbeurgh et al., 1988.
Помимо каталитического домена/кора, выражающего целлюлолитическую активность, целлюлолитические ферменты могут включать один или более связывающих доменов (CBDs), называемых также карбогидрат-связывающими доменами/модулями (CBD/CBM), которые могут быть расположены либо на N-, либо на C-конце каталитического домена. CBDs имеют карбогидрат-связывающую активность и опосредуют связывание целлюлазы с кристаллической целлюлозой, но имеют слабую или неэффективную целлюлазную активность фермента на растворимых субстратах. Имеются два домена, в типичном случае связанных через гибкую и высокогликозилированную линкерную область.
«Целлобиогидролаза» или «CBH», как этот термин используются здесь, относится к ферментам, которые расщепляют целлюлозу с конца глюкозной цепи и производят, главным образом, целлобиозу. Их также называют 1,4-бета-D-глюкан целлобиогидролазами или целлюлозо-1,4-бета-целлобиозидазами. Они гидролизуют 1,4-бета-D-глюкозидные связи с редуцирующего или нередуцирующего конца полимера, содержащего упомянутые связи, такого как целлюлоза, при этом освобождается целлобиоза. Две разные CBHs были выделениы из Trichoderma reesei, CBHI и CBHII. Они имеют модульную структуру, состоящую из каталитического домена, сцепленного с целлюлозо-связывающим доменом (CBD). В природе встречаются также целлобиогидролазы, у которых CBD отсутствует.
«Эндоглюказана» или «EG» относится к ферментам, которые разрезают внутренние гликозидные связи в целлюлозной цепи. Они классифицируются как EC 3.2.1.4. Они являются 1,4-бета-D-глюкан 4-глюканогидролазами и катализируют эндогидролиз 1,4-бета-D-гликозидных связей в полимерах глюкозы, таких как целлюлоза и ее производные. Некоторые встречающиеся в природе эндоглюканазы имеют целлюлозо-связывающий домен, в то время как другие его не имеют. Некоторые эндоглюканазы имеют также ксиланазную активность (Bailey et al., 1993).
«Бета-глюкозидаза» или «BG», или «βG» относится к ферментам, которые деградируют мало растворимые олигосахариды, включая целлобиозу, до глюкозы. Они классифицируются как EC 3.2.1.21. Они являются бета-D-глюкозид глюкогидролазами, которые типически катализируют гидролиз концевых нередуцирующих остатков бета-D-глюкозы. Эти ферменты распознают олигосахариды глюкозы. Типичными субстратами являются целлобиоза и целлотриоза. Целлобиоза является ингибитором целлобиогидролаз, по этой причине деградация целлобиозы является важной для преодоления конечного продукта ингибирования целлобиогидролаз.
Ксиланазы являются ферментами, которые способны распознавать гидролизовать гемицеллюлозу. Они включают как экзогидролитические, так и эндогидролитические ферменты. В типичном случае они имеют эндо-1,4-бета-ксиланазную (EC 3.2.1.8) или бета-D-ксилозидазную (EC 3.2.1.37) активность, которая расщепляет гемицеллюлозу до ксилозы. «Ксиланаза» или «Xyn» в связи с настоящим изобретением относится в особенности к ферменту, классифицируемому как EC 3.2.1.8, гидролизующему ксилозные полимеры лигноцеллюлозного субстрата или очищенного ксилана.
В дополнение к отмеченному целлюлазы можно классифицировать по разным гликозилгидролазным семействам в соответствии с их первичной последовательностью, подтвержденной анализом трехмерной структуры некоторых членов семейства (Henrissat 1991, Henrissat and Bairoch 1993, 1996). Некоторые гликозилгидролазы являются многофункциональными ферментами, которые содержат каталитические домены, принадлежащие к различным гликозилгидролазным семействам. Семейство 3 состоит из бета-глюкозидаз (EC 3.2.1.21), таких как описываемые здесь Ta BG_81, At BG_101 и Ct BG_76. Семейство 5 (ранее известное как celA) состоит, главным образом, из эндоглюканаз (EC 3.2.1.4), таких как описываемая здесь Ta EG_28. Семейство 7 (ранее целлюлазное семейство celC) содержит эндоглюканазы (EC 3.2.1.4) и целлобиогидролазы (EC 3.2.1.91), такие как описываемые здесь Ct EG_54, Ta CBH, At CBH_A, At CBH_C и Ct CBH. Семейство 10 (ранее celF) состоит, главным образом, из ксиланаз (EC 3.2.1.8), таких как описываемые здесь Ta XYN_30 и At XYN_60. Семейство 45 (ранее celK) содержит эндоглюканазы (EC 3.2.1.4), такие как описываемые здесь At EG_40 и At EG_40_подобная.
Целлюлолитические ферменты, полезные для гидролизации целлюлозного материала, получают из Thermoascus aurantiacus, Acremonium thermophilum или Chaetomium thermophilum. «Получают из» означает, что они могут быть получены из упомянутых видов, но это не исключает возможности получения их из других источников. Другими словами, они могут происходить из любого организма, включая растения. Предпочтительно они происходят из микроорганизмов, например, бактерий или грибков. Бактерии могут быть, например, из рода, выбранного из Bacillus, Azospirillum и Streptomyces. Более предпочтительно они происходят из грибков (включая филаментные грибки и дрожжи), например, из рода, выбранного из группы, состоящей из Thermoascus, Acremonium, Chaetomium, Achaetomium, Thielavia, Aspergillus, Botritis, Chrysosporium, Collibia, Fomes, Fusarium, Humicola, Hypocrea, Lentinus, Melanocarpus, Myceliophthora, Myriococcum, Neurospora, Penicillium, Phanerochaete, Phlebia, Pleurotus, Podospora, Polyporus, Rhizoctonia, Scytalidium, Pycnoporus, Trametes и Trichoderma.
В соответствии с предпочтительным вариантом воплощения изобретения ферменты получают из штамма ALKO4242 Thermoascus aurantiacus, депонированного как CBS 116239, штамма ALKO4245, депонированного как CBS 116240 и классифицируемого в настоящее время как Acremonium thermophilium, или штамма ALKO4265 Chaetomium thermophilum, депонированного как CBS 730.95.
Целлобиогидролаза предпочтительно включает аминокислотную последовательность, имеющую, по меньшей мере, 80%-ную идентичность SEQ ID NO: 2, 4, 6 или 8, или ее ферментативно активный фрагмент.
Эти CBHs имеют более выгодную константу целлюлозного ингибирования по сравнению с соответствующей константой CBH Trichoderma reesei, и они показывают лучшие результаты гидролиза при тестировании разных целлюлозных субстратов. SEQ ID NO: 2 и 4 не включают CBD. Особенно повышенные результаты гидролиза можно получить, когда целлюлозо-связывающий домен (CBD) присоединен к CBH, который не имеет своего собственного CBD. CBD может быть получен, например, из видов Trichoderma или Chaetomium, и предпочтительно он присоединен к CBH посредством линкера. Результирующий слитый протеин, содержащий CBH-коровую область, присоединенную к CBD посредством линкера, может включать аминокислотную последовательность, имеющую, по меньшей мере, 80%-ную идентичность SEQ ID NO: 28 или 30. Такие слитые протеины кодируются полинуклеотидами, включающими последовательность SEQ ID NO: 27 или 29.
Эндоглюканаза может включать аминокислотную последовательность, имеющую, по меньшей мере, 80%-ную идентичность SEQ ID NO: 10, 12, 14 или 16, или ее ферментативно активный фрагмент. Эти эндоглюканазы имеют хорошую термоустойчивость.
Бета-глюкозидаза может включать аминокислотную последовательность, имеющую, по меньшей мере, 80%-ную идентичность SEQ ID NO: 22, 24 или 26, или ее ферметативно активный фрагмент. Эти бета-глюкозидазы имеют хорошую устойчивость к глюкозному ингибированию, которая выгодно позволяет избежать ингибирования конечного продукта во время ферментативного гидролиза целлюлозного материала. Бета-глюкозидазы могут быть также использованы при получении софорозы, целлюлазного индуктора, используемого при культивировании T. reesei.
Ксиланаза может включать аминокислотную последовательность, имеющую, по меньшей мере, 80%-ную идентичность SEQ ID NO: 18 или 20, или ее ферметативно активный фрагмент.
Термин «идентичность» здесь означает общую идентичность между двумя аминокислотными последовательностями, сравниваемыми одна с другой, от первой аминокислоты, кодируемой соответствующим геном, до последней аминокислоты. Идентичность последовательностей полной длины измеряется, используя программу общего выравнивания Needleman-Wunsch с программным пакетом EMBOSS (European Molecular Biology Open Software Suite; Rice et al., 2000), версия 3.0.0, со следующими параметрами: EMBLOSU62, штраф за пробел 10.0, штраф расширения 0.5. Алгоритм описан у Needleman and Wunsch (1970). Специалист в данной области техники осведомлен о том, что результаты, использующие алгоритм Needleman-Wunsch, сравнимы только в том случае, когда выравниваются соответственные домены последовательности. Следовательно, сравнение, например, целлюлазных последовательностей, включающих CBD или сигнальные последовательности, с последовательностями, у которых отсутствуют эти элементы, не может быть выполнено.
В соответствии с одним вариантом воплощения изобретения используется целлюлолитический полипептид, который имеет, по меньшей мере, 80, 85, 90, 95 или 99%-ную идентичность с SEQ ID NO: 2, 4, 6, 8, 10, 12, 14, 16, 18, 20, 22, 24 или 26, или с их ферментативно активным фрагментом.
Термин «ферментативно активный фрагмент» означает любой фрагмент определенной последовательности, который имеет целлюлолитическую активность. Другими словами, ферментативно активный фрагмент может быть частью зрелого протеина определенной последовательности или он может быть только фрагментом части зрелого протеина, при условии, что он все еще имеет целлобиогидролазную, эндоглюканазную, бета-глюкозидазную или ксиланазную активность.
Целлюлолитические ферменты, предпочтительно, являются рекомбинантными ферментами, которые могут быть получены общеизвестным методом. Выделяют полинуклеотидный фрагмент, включающий ген фермента, этот ген встраивают под управлением сильного промотора в экспрессионный вектор, вектор вводят в подходящие хозяйские клетки и культивируют эти хозяйские клетки в условиях, способствующих образованию фермента. Способ получения протеина с помощью рекомбинантной технологии в различных системах хозяев хорошо известен в данной области техники (Sambrook et al., 1989; Coen, 2001; Gellissen, 2005). Предпочтительно ферменты продуцируются как внеклеточные ферменты, которые секретируются в культуральную среду, из которой он могут быть легко восстановлены и выделены. Может быть использована отработанная культуральная среда производящего хозяина как таковая, или хозяйские клетки могут быть извлечены из среды, и/или ее можно отконцентрировать, профильтровать и фракционировать. Ее можно также высушить.
Выделенный полипептид в данном контексте может просто означать, что клетки и клеточный дебрис удалены из культуральной среды, содержащей этот полипептид. Удобно выделять полипептиды, например, добавляя анионные и/или катионные полимеры в отработанную культуральную среду, чтобы усилить выпадение в осадок клеток, клеточного дебриса и некоторых ферментов, которые имеют нежелательные побочные активности. Среду затем фильтруют, используя неорганический фильтрующий агент и фильтр, чтобы удалить образовавшийся осадок. После этого фильтрат обрабатывают, используя полупроницаемую мембрану, для удаления избытка солей, сахаров и метаболических продуктов.
В соответствии с одним вариантом воплощения изобретения гетерологичный полинуклеотид включает ген, подобный тому, который включен в микроорганизм, имеющий номер доступа DSM 16723, DSM 16728, DSM 16729, DSM 16727, DSM 17326, DSM 17324, DSM 17323, DSM 17729, DSM 16724, DSM 16726, DSM 16725, DSM 17325 или DSM 17667.
Производящая клетка может быть любым организмом, способным экспрессировать целлюлолитический фермент. Предпочтительно хозяйская клетка является микробной клеткой, более предпочтительно - грибком. Более предпочтительно хозяином является филаментный грибок. Предпочтительно рекомбинантный хозяин модифицирован для экспрессии и секретирования целлюлолитических ферментов как его главной активности или одной из главных активностей. Это может быть сделано путем делетирования главных гомологичных секретируемых генов, например, четырех главных целлюлаз Trichoderma и направлением гетерологичных генов в локус, который модифицирован, для обеспечения высоких уровней экспрессии и продуцирования. Предпочтительными хозяевами для продуцирования целлюлолитическими ферментами являются, в частности, штаммы из рода Trichoderma или Aspergillus.
Ферменты, необходимые для гидролиза целлюлозного материала, в соответствии с изобретением могут добавляться в ферметативно эффективном количестве либо одновременно, например, в форме ферментной смеси, или последовательно, либо как часть одновременной сахарификации и ферментации (SSF). Любая комбинация целлобиогидролаз, включающая аминокислотную последовательность, имеющую, по меньшей мере, 80%-ную идентичность SEQ ID NO: 2, 4, 6 или 8, или ее ферментативно активный фрагмент, может быть использована совместно с любой комбинацией эндоглюканаз и бета-глюкозидаз. Если целлюлозный материал включает гемицеллюлозу, гемицеллюлозы, для деградации, предпочтительно, дополнительно используются ксиланазы. Эндоглюканазы, бета-глюкозидазы и ксиланазы могут быть выбраны из тех, которые описываются здесь, но не ограничиваются ими. Они могут быть также, например, коммерчески доступными препаратами ферментов. Кроме целлюлаз и, если необходимо, гемицеллюлаз, можно использовать один или более других ферментов, например протеазы, амилазы, лактазы, липазы, пектиназы, эстеразы и/или пероксидазы. Обработку других ферментов можно производить до, во время или после целлюлазной обработки.
Термин «ферментный препарат» относится к композициям, включающим, по крайней мере, один из желаемых ферментов. Препарат может содержать ферменты в, по крайней мере, частично очищенной и выделенной форме. Альтернативно препарат может являться отработанной культуральной средой или фильтратом, содержащим один или более целлюлолитических ферментов. Помимо целлюлолитической активности препарат может содержать добавки, такие как медиаторы, стабилизаторы, буферы, консерванты, суфрактанты и/или компоненты среды культивирования. «Отработанная среда культивирования» относится к среде культивирования хозяина, включая производимые ферменты. Предпочтительно хозяйские клетки отделяют от упомянутой среды после продуцирования ферментов.
В соответствии с одним вариантом воплощения изобретения ферментный препарат включает смесь CBH, EG и BG, при необходимости совместно с ксиланазой и/или другими ферментами. CBH включает аминокислотную последовательность, имеющую, по меньшей мере, 80%-ную идентичность SEQ ID NO: 2, 4, 6 или 8, или ее ферментативно активный фрагмент, которая может быть получена из Thermoascus aurantiacus, Acremonium thermophilium или Chaetomium thermophilum, в то время как EG, BG и ксиланаза могут имеет любое происхождение, включая из упомянутых организмов. Другими ферментами, которые могли бы быть представлены в препарате, являются, например, протеазы, амилазы, лакказы, липазы, пектиназы, эстеразы и/или пероксидазы.
Для того чтобы соответствовать различным условиям процесса, могут быть использованы различные ферментные смеси и комбинации. Например, если процесс деградации должен производиться при высокой температуре, выбираются термоустойчивые ферменты. Комбинация CBH семейства 7 с эндоглюканазой семейства 45, при необходимости в комбинации с BG семейства 3 и/или ксиланазой семейства 10, имели превосходные результаты гидролиза как при 45оС, так и при повышенных температурах.
Целлюлолитические ферменты Trichoderma reesei традиционно используются в гидролизе при температурах в интервале около 40-50оС и при 30-40оС в SSF. CBH, EG, BG и Xyn, получаемые из Thermoascus aurantiacus, Acremonium thermophilium или Chaetomium thermophilum, также эффективны при этих температурах, но кроме того, большинство из них также функционируют исключительно хорошо при температурах между 50 и 70оС или даже до 80 и 85оС, таких как между 55 и 70оС, например, между 60 и 65оС. Ферментные смеси, инкубируемые в течение коротких периодов времени, функциональны даже до 85оС, в то время как для завершения гидролиза обычно используются более низкие температуры.
Способ обработки целлюлозного материала с помощью CBH, EG, BG и Xyn особенно подходит для продуцирования ферментируемых сахаров из лигноцеллюлозного материала. Ферментируемые сахара могут быть ферментированы дрожжами в этанол и использоваться в качестве топлива. Они могут также быть использованы в качестве посредников или сырья для производства разных химикатов или строительных блоков в процессах химической промышленности, например, в так называемой биоочистке. Лигноцеллюлозный материал может быть предварительно обработан перед ферментативным гидролизом, чтобы разрушить волоконную структуру целлюлозных субстратов и сделать целлюлозную фракцию более доступной для целлюлолитических ферментов. Известные в настоящее время предварительные обработки включают механические, химические или термальные процессы и их комбинации. Например, материал может быть предварительно обработан паровым разрывом или кислотным гидролизом.
В Thermoascus aurantiacus, Acremonium thermophilium и Chaetomium thermophilum был найден ряд новых целлюлолитических полипептидов. Новые полипептиды могут включать фрагмент, имеющий целлюлолитическую активность, и могут быть выбраны из группы, состоящей из полипептида, включающего аминокислотную последовательность, имеющую, по меньшей мере, 66%-ную, предпочтительно 70%-ную или 75%-ную, идентичность SEQ ID NO: 4, 79%-ную идентичность SEQ ID NO: 6, 78%-ную идентичность SEQ ID NO: 12, 68%-ную, предпочтительно 70%-ную или 75%-ную, идентичность SEQ ID NO: 14, 72%-ную, предпочтительно 75%-ную, идентичность SEQ ID NO: 16, 68%-ную, предпочтительно 70%-ную или 75%-ную, идентичность SEQ ID NO: 20, 74%-ную идентичность SEQ ID NO: 22 или 24, или 78%-ную идентичность SEQ ID NO: 26.
Новые полипептиды могут также быть вариантами упомянутых полипептидов. «Вариантом» может быть полипептид, который встречается в природных условиях, например, как аллельный вариант в пределах того же самого штамма, вида или рода, или он мог быть образован посредством мутагенеза. Он может включать аминокислотные заместители, делеции или инсерции, но все еще функционирует по существу сходным образом с ферментами, определенными выше, т.е. он включает фрагмент, имеющий целлюлолитическую активность.
Целлюлолитические полипептиды обычно продуцируются в клетке как незрелые полипептиды, включающие сигнальную последовательность, которая отщепляется во время секретирования протеина. Они также далее могут быть процессированы во время секретирования как на N-конце, так и/или на С-конце с образованием зрелого, ферментативно активного протеина. Полипептид, «включающий фрагмент, имеющий целлюлолитическую активность», следовательно, означает, что этот полипептид может находиться либо в незрелой, либо в зрелой форме, предпочтительно, он находится в зрелой форме, т.е. процессинг имел место.
Новые полипептиды также могут быть, как упомянуто выше, «фрагментом полипептидов или вариантами». Фрагмент может быть зрелой формой упомянутых выше протеинов или он может быть только ферментативно активной частью зрелого протеина. В соответствии с одним вариантом воплощения изобретения полипептид имеет аминокислотную последовательность, имеющую, по меньшей мере, 80, 85, 90, 95 или 99%-ную идентичность SEQ ID NO: 4, 6, 12, 14, 16, 20, 22, 24 или 26, или их целлюлолитически активным фрагментом. Он также может быть их вариантом или фрагментом, имеющим целлобиогидролазную, эндоглюканазную, ксиланазную или бета-глюкозидазную активность. В соответствии с другим вариантом воплощения изобретения полипептид состоит из особенно целлилолитически активного фрагмента последовательности SEQ ID NO: 4, 6, 12, 14, 16, 20, 22, 24 или 26.
Новые полинуклеотиды могут включать нуклеотидную последовательность SEQ ID NO: 3, 5, 11, 13, 15, 19, 21, 23 или 25 или последовательность, кодирующую новый полипептид, как определено выше, включая комлементарные им нити. Полинуклеотид, как этот термин здесь используется, относится как к РНК, так и ДНК, и он может быть однонитевым или двунитевым. Полинуклеотид также может быть фрагментом упомянутых полинуклеотидов, включающим, по меньшей мере, 20 нуклеотидов, например, по меньшей мере, 25, 30 или 40 нуклеотидов. В соответствии с одним вариантом воплощения изобретения он имеет длину, по меньшей мере, 100, 200 или 300 нуклеотидов. Далее полинуклеотид может быть вырожденным как результат генетического кода относительно любой из последовательностей, как они определены выше. Это означает, что одну и ту же аминокислоту могут кодировать разные кодоны.
В соответствии с одним вариантом воплощения изобретения полинуклеотид является «включенным в» SEQ ID NO: 3, 5, 11, 13, 15, 19, 21, 23 или 25, что означает, что эта последовательность содержит, по крайней мере, часть упомянутой последовательности. В соответствии с другим вариантом воплощения изобретения полинуклеотид включает ген, подобный тому, который включен в микроорганизм, имеющий номер доступа DSM 16728, DSM 16729, DSM 17324, DSM 17323, DSM 17729, DSM 16726, DSM 16725, DSM 17325, DSM 17667.
Новые протеины/полипептиды могут быть приготовлены, как описано выше. Новые полинуклеотиды могут быть встроены в вектор, который способен экспрессировать полипептид, кодируемый гетерологичной последовательностью, а вектор может быть встроен в хозяйскую клетку, способную экспрессировать упомянутый полипептид. Хозяйская клетка, предпочтительно, относится к роду Trichoderma или Aspergillus.
Гетерологичный ген, кодирующий новые полипептиды, вводят в плазмиду или в штамм Escherichia coli, имеющий номер доступа DSM 16728, DSM 16729, DSM 17324, DSM 17323, DSM 17729, DSM 16726, DSM 16725, DSM 17325, DSM 17667.
Новые ферменты могут быть компонентами ферментного препарата. Ферментный препарат может включать один или более новых полипептидов, и он может быть, например, в форме отработанной культуральной среды, порошка, гранул или жидкости. В соответствии с одним вариантом воплощения изобретения он включает целлобиогидролазную, эндоглюканазную, бета-глюкозидазную и, при необходимости, ксиланазную активность и/или другие ферментативные активности. Он также может включать любые традиционные добавки.
Новые ферменты могут быть применены в любом процессе, включающем целлюлолитические ферменты, таком как топливная, текстильная, детергентная, целлюлозно-бумажная, пищевая кормовая промышленность и производство напитков, и в особенности при гидролизе целлюлозного материала для производства биотоплива, включая этанол. В целлюлозно-бумажной промышленности они могут использоваться для модификации целлюлозного волокна, например, при обработке крафт-целлюлозы, механической целлюлозы или утилизированной бумаги.
Изобретение иллюстрируется следующими не ограничивающими объем изобретения примерами. Также должно быть понятно, что варианты воплощения изобретения, приведенные выше в описании и в примерах, предназначены лишь для иллюстративных целей, и в пределах объема изобретения возможны различные изменения и модификации.
Примеры
Пример 1. Скрининг штаммов, проявляющих целлюлолитическую активность, и их культивирование для очистки
Около 25 штаммов грибков из коллекции культур Roal Oy тестировались на целлюлолитическую активность, включая бета-глюкозидазную. После предварительного скрининга для дальнейших исследований были выбраны 6 штаммов. Это были Thermoascus aurantiacus ALKO4239 и ALKO4242, Acremonium thermophilium ALKO4245, Talaromyces thermophilius ALKO4246 и Chaetomium thermophilum ALKO4261 и ALKO4265.
Штаммы ALKO4239, ALKO4242 и ALKO4246 культивировали во встряхиваемых колбах при 42оС в течение 7 д в среде 3 х В, которая содержит, г/литр: Solka Floc целлюлоза 18, барда от отработанного зерна 18, ксилан обмолоченного овса 9, CaCO3 2, мука из соевых бобов 4,5, (NH4)HPO4 4,5, пшеничные отруби 3,0, KH2PO4 1,5, MgSO4·H2O 1,5, NaCl 0,5, камедь из бобов акации 9,0, раствор микроэлементов #1 0,5, раствор микроэлементов #2 0,5 и противовспениватель Struktol (Stow, OH, США) 0,5 мл; pH регулировался до 6,5. Раствор микроэлементов #1 содержит, г/литр: MnSO41,6, ZnSO4·7H2O 3,45 и CoCl2·6H2O 2,0; раствор микроэлементов #2 содержит, г/литр: FeSO4·7H2O 5,0 с двумя каплями концентрированной H2SO4.
Штамм ALKO4261 культивировали во встряхиваемых колбах в среде 1×В, которая содержит одну треть каждого из составляющих среды 3 х В (выше), исключая то, что она имеет такую же самую концентрацию CaCO3, NaCl и микроэлементов. Штамм культивировали при 45оС в течение 7 д.
Штамм ALKO 4265 культивировали во встряхиваемых колбах в следующей среде, г/л: Solka Floc целлюлоза 40, Pharmamedia™ (Traders Protein, Memphis, TN, США) 10, замоченный порошок кукурузы 5, (NH4)2SO4 5 и KH2PO4 15; pH регулировался до 6,5. Штамм культивировали при 45оС в течение 7 д.
После культивирования клетки и другие твердые образования осаждали центрифугированием и восстанавливали супернатант. Во время культивирований во встряхиваемых колбах добавляли протеазные ингибиторы PMSF (фенилметил-сульфорнилфторид) и пепстатин А по 1 мМ и 10 мкг/мл, соответственно. Если препараты не использовали сразу же, их хранили в аликвотах при -20оС.
Для оценки термоактивности ферментов были проведены анализы препаратов, культивированных во встряхиваемых колбах при 50, 60, 65, 70 и 75оС в течение 1 ч в присутствии 100 мкг бычьего сывороточного альбумина (BSA) /мл в качестве стабилизатора. Предварительные анализы проводились при 50 и 65оС при двух разных значениях pH (4,8/5,0 или 6,0), чтобы выяснить, какой pH был более подходящим для анализа термоактивности.
Все супернатанты встряхиваемых колб анализировались на следующие активности:
Целлобиогидролаза I-подобная активность («CBHI») и эндоглюканаза I-подобная активность («EGI»):
Они измерялись в 50 мМ Na-ацетатном буфере с 0,5 мМ MUL (4-метилумбеллиферил-бета-D-лактозид) в качестве субстрата. Для ингибирования какой-либо вмешивающейся бета-глюкозидазной активности добавляли глюкозу (100 мМ). Освободившийся 4-метилумбеллиферил измеряли при 370 нм. «CBHI»- и «EGI»-активности различались посредством измерения активности в присутствии и отсутствие целлобиозы (5 мМ). Активность, которая не ингибируется целлобиозой, представляет «EGI»-активность, а остающаяся MUL-активность представляет «CBHI»-активность (van Tilbeurgh et al., 1988). Анализ проводился при pH 5,0 или 6,0 (см. ниже).
Эндоглюканазная (CMCазная) активность:
Она анализировалась с помощью 2% (в/об) карбоксиметилцеллюлозы (CMC) в качестве субстрата в 50 мМ цитратном буфере, конкретно, как описано Bailey and Nevalainen 1981; Haakana et al. 2004. Редуцируемые сахара измерялись с помощью DNS-реагента. Анализ проводился при pH 4,8 или 6,0 (см. ниже).
Бета-глюкозидазная (BGU) активность:
Она анализировалась с помощью 4-нитрофенил-β-D-глюкопиранозида (1 мМ) в 50 мМ цитратном буфере, как описано Bailey and Nevalainen 1981. Освободившийся 4-нитрофенол измеряли при 400 нм. Анализ проводился при pH 4,8 или 6,0 (см. ниже).
Относительные активности ферментов показаны на Фигуре 1. Относительные активности представляли установлением активности при 60оС как 100% (Фигура 1). Все штаммы продуцировали ферменты, которые имели высокую активность при высоких температурах (65-75оС).
Относительно очистки протеинов. ALKO4242 выращивали в 2-литровом биореакторе (Braun Biostat® B, Braun, Melsungen, Германия) в следующей среде, г/литр: Solka Floc целлюлоза 40, мука из соевых бобов 10, NH4NO3 5, KH2PO4 5, MgSO4·7H2O 0,5, CaCl2·H2O 0,05, раствор микроэлементов #1 0,5, раствор микроэлементов #2 0,5. Аэрация была 1 vvm, с контролем антивспенивания с помощью Struktol, при размешивании 200-800 об/мин и температуре 47оС. Проводили две группы экспериментов, одну при pH 4,7±0,2 (NH3/H2SO4) и другую с начальным pH 4,5. Время культивирования составляло 7 д. После культивирования клетки и другие твердые образования удаляли центрифугированием.
Штамм ALKO4245 выращивали в 2-литровом биореакторе (Braun Biostat® B, Braun, Melsungen, Germany) в следующей среде, г/литр: Solka Floc целлюлоза 40, замоченный порошок кукурузы 15, барда от отработанного зерна 5, ксилан обмолоченного овса 3, камедь из стручков акации 3, (NH4)2SO4 5 и KH2PO4 5. Интервал pH составлял 5,2±0,2 (NH3 / H2SO4), аэрация 1 vvm при размешивании 300-600 об/мин с контролем антивспенивания с помощью Struktol и температуре 47оС. Время культивирования составляло 7 д. После культивирования клетки и другие твердые образования удаляли центрифугированием.
Для очистки фермента ALKO4261 выращивали в 10-литровом биореакторе (Braun Biostat® B, Braun, Melsungen, Германия) в следующей среде, г/литр: Solka Floc целлюлоза 30, барда от отработанного зерна 10, ксилан обмолоченного овса, CaCO3 2, мука из соевых бобов 10, пшеничные отруби 3,0, (NH4)2SO4 5, KH2PO4 5, MgSO4·7H2O 0,5, NaCl 0,5, KNO3 0,3, раствор микроэлементов #1 0,5, раствор микроэлементов #2 0,5. Интервал pH составлял 5,2±0,2 (NH3 / H2SO4), аэрация 1 vvm при размешивании 300-600 об/мин с контролем антивспенивания с помощью Struktol и температуре 42оС. Время культивирования составляло 5 д. Вторую группу выращивали при сходных условиях за исключение того, что Solka Floc добавляли до 40 г/л, а отработанное зерно до 15 г/л. Супернатант восстанавливали центрифугированием и фильтрованием через Seitz-K 150- и EK-фильтры (Pall SeitzSchenk Filtersystems GmbH, Bad Kreuznach, Germany). Затем супернатант концентрировали примерно в десять раз, используя ультрафильтрационную систему Pellicon-мини (фильтр NMWL 10 кДа; Millipore, Billerica, MA, США).
Для очистки фермента ALKO4265 также выращивали в 10-литровом биореакторе (Braun Biostat® B, Braun, Melsungen, Германия) в такой же самой среде, что упомянута выше, за исключением того, что KH2PO4 добавляли до 2,5 г/л. Интервал pH составлял 5,3±0,3 (NH3 / H2SO4), аэрация 0,6 vvm при размешивании 500 об/мин с контролем антивспенивания с помощью Struktol и температуре 43оС. Время культивирования составляло 7 д. Супернатант восстанавливали центрифугированием и фильтрованием через Seitz-K 150- и EK-фильтры (Pall SeitzSchenk Filtersystems GmbH, Bad Kreuznach, Германия). Затем супернатант концентрировали примерно в двадцать раз, используя ультрафильтрационную систему Pellicon-мини (фильтр NMWL 10 кДа; Millipore, Billerica, MA, США).
Пример 2. Очистка и характеризация целлобиогидролаз из Acremonium thermophilium ALKO4245 и Chaetomium thermophilum ALKO4265
Acremonium thermophilium ALKO4245 и Chaetomium thermophilum ALKO4265 выращивали, как описано в Примере 1. Главные целлобиогидролазы очищали, используя основанную на р-аминобензил 1-тио-β-целлобиозиде аффинной колонке, приготовленной как описано Tomme et al., 1988.
Супернатанты культур сначала буферизовали в 50 мМ натрий-ацетатного буфера PH 5,0, содержащем 1 мМ δ-глюконолактона и 0,1 М глюкозы, чтобы замедлить лигандный гидролиз при наличии β-глюкозидаз. Целлобиогидролазы элюировали 0,1 М лактозы и окончательно очищали гель-фильтрационной хроматографией, используя колонки Superdex 200 HR 10/30 в ÄKTA-системе (Amersham Pharmacia Biotech). При гель-фильтрации использовался натрий-фосфатный буфер pH 7,0, содержащий 0,15 мМ хлористого натрия.
Очищенные целлобиогидролазы анализировали с помощью электрофореза на SDS-полиакриламидном геле и определяли молекулярную массу обоих протеинов приблизительно в 70 кДа, оцененную на основании стандартов молекулярных масс (Набор для калибровки низких молекулярных весов, Amersham Biosciences). Очищенные целлобиогидролазы Acremonium и Chaetomium обозначили как At Cel7A и Ct Cel7A, соответственно, следуя схеме, приведенной у Henrissat et al. (1998) (Henrissat, 1991; Henrissat and Bairoch, 1993).
Специфическую активность препаратов определяли, используя в качестве субстрата 4-метилумбеллиферил-β-D-лактозид (MUL), 4-метилумбеллиферил-β-D-целлобиозид (MUG2) или 4-метилумбеллиферил-β-D-целлотриозид (MUG3) (van Tilbeurgh et al., 1988) в 0,05 М натрий-цитратного буфера pH 5 при 50оС в течение 10 мин. Эндоглюканазную и ксиланазную активности измеряли по стандартным процедурам (в соответствии с IUPAC, 1987), используя карбоксиметилцеллюлозу (CMC) и глюкуроноксилан березы (Bailey et al., 1992) в качестве субстратов. Специфическую активность против Avicel вычисляли на основе редуцирующих сахаров, образовавшихся в течение 24-часовой реакции при 50оС, pH 5,0, с 1% субстрата и дозе фермента 0,25 мкМ. Содержание протеина в очищенных препаратах ферментов измеряли согласно Lowry et al., 1951. Для того чтобы охарактеризовать конечные продукты гидролиза, растворенные сахара, выделившиеся в 24-часовом гидролизном эксперименте, как описано выше, анализировали HPLC (Dionex). Очищенную целлобиогидролазу I (CBHI/Cel7A) из Trichoderma reesei использовали в качестве контроля.
Специфические активности очищенных ферментов и фермента CBHI/Cel7A T. reesei представлены в Таблице 1. Очищенные целлобиогидролазы At Cel7A и Ct Cel7A обладают более высокими специфическими активностями против малых синтетических субстратов по сравнению с CBHI/Cel7A T. reesei. Специфическая активность против Avicel у раскрытых здесь ферментов была отчетливо выше. Низкие активности препаратов очищенных ферментов против ксилана и CMC, вероятно, обусловлены либо свойствами самих этих протеинов, либо, по крайней мере, частично оставшимися небольшими количествами загрязняющих ферментов. Главным конечным продуктом целлюлозного гидролиза с помощью все очищенных ферментов была целлобиоза, что является типичным для целлобиогидролаз.
Термальную устойчивость очищенных целлобиогидролаз измеряли при различных температурах. Реакцию проводили в присутствии 0,1% BSA при pH 5,0 в течение 60 мин, используя в качестве субстрата 4-метилумбеллиферил-β-D-лактозид. C. thermophilum ALKO4265 CBH/Cel7A и A. thermophilum ALKO4245 CBH/Cel7A были стабильными до 50 и 60оС, соответственно. Контрольный фермент из T. reesei (CBH/Cel7A) сохранял 100%-ную активность до 55оС.
Пример 3. Очистка и характеризация эндоглюканазы из Acremonium thermophilum ALKO4245
Acremonium thermophilum ALKO4245 выращивали, как описано в Примере 1. Супернатант культуры инкубировали при 70оС в течение 24 часов, после чего его концентрировали ультрафильтрацией. Чистую эндоглюканазу получали последовательной очисткой с помощью гидрофобного взаимодействия и катион-обменной хроматографии с последующей гель-фильтрацией. Эндоглюканазную активность фракций, собранных во время очистки, определяли, используя в качестве субстрата карбоксиметилцеллюлозу (CMC) (процедура по IUPAC 1987). Содержание протеина измеряли Набором для анализа BioRad (Bio-Rad Laboratories), используя бычий сывороточный альбумин в качестве стандарта.
Концентрированный супернатант культуры наносили на колонку гидрофобного взаимодейсвия HiPrep 16/10 Butyl FF, уравновешенную 20 мМ калий-фосфатного буфера pH 6,0, содержащего 1 М (NH4)2SO4. Связавшиеся протеины элюировали посредством линейного градиента от упомянутого выше буфера до 5 мМ фосфата калия, pH 6,0. Собирали фракции и измеряли эндоглюканазную активность, как описано выше. Эндоглюканазная активность снималась в широком диапазоне проводимости 120 - 15 мСм/см.
Смешанные фракции наносили на катион-обменную колонку HiTrap SP XL, уравновешенную 8 мМ ацетата натрия, pH 4,5. Связавшиеся протеины элюировали посредством линейного градиента от 0 до 0,25 М NaCl в равновесном буфере. Протеин, имеющий эндоглюканазную активность, элюировали на площади проводимости 3-7 мS/см. Катион-обменную хроматографию повторяли, и протеиновый элюат концентрировали посредством лиофилизации.
Растворенный образец нагружали на гель-фильтрационную колонку Superdex 75 HR 10/30, уравновешенную 20 мМ натрий-фосфатного буфера pH 7,0, содержащего 0,15 М NaCl. Главную протеиновую фракцию элюировали с колонки с фиксированным объемом 13,3 мл. О чистоте протеинового элюата судили по электрофорезу на SDS-полиакриламидном геле, и оценили молекулярный вес как 40 кДа. Специфическая активность очищенного протеина, обозначенного как At EG_40, при 50оС определили как 450 нкат/мг (процедура по IUPAC 1987, при использовании в качестве субстрата CMC).
Термальную устойчивость очищенной эндоглюканазы измеряли при различных температурах. Реакцию проводили в присутствии 0,1 мг/мл BSA при pH 5,0 в течение 60 мин, используя в качестве субстрата карбоксиметилцеллюлозу. А. thermophilum EG-40/Cel5A была стабильной до 80, до 50 и до 60оС соответственно. Контрольные ферменты из T. reesei EGI (Cel7B) и EGII (Cel5A) сохраняли 100%-ную активность до 60 и 65оС соответственно.
Пример 4. Очистка эндоглюканазы из Chaetomium thermophilum ALKO4261
Chaetomium thermophilum ALKO4261 выращивали, как описано в Примере 1. Чистую эндоглюканазу получали последовательной очисткой с помощью гидрофобного взаимодействия и катион-обменной хроматографии с последующей гель-фильтрацией. Эндоглюканазную активность фракций, собранных во время очистки, определяли, используя в качестве субстрата карбоксиметилцеллюлозу (CMC) (процедура по IUPAC 1987).
В супернатант культуры добавляли сульфат аммония для достижения такой же самой проводимости, что и при 20 мМ фосфата калия pH 6,0, содержащего 1 М (NH4)2SO4. Образец нагружали на колонку гидрофобного взаимодействия HiPrep 16/10 Phenyl FF, уравновешенную 20 мМ калий-фосфатного буфера pH 6,0, содержащего 1 М (NH4)2SO4. Элюирование выполняли посредством линейного градиента от 20 до 0 мМ фосфата калия, pH 6,0, с последующими 5 мМ фосфата калия, pH 6,0 и водой. Связавшиеся протеины элюировали посредством линейного градиента от 0 до 8 М мочевины. Фракции собирали и анализировали эндоглюканазную активность, как описано выше. Протеин, имеющий эндоглюканазную активность, элюировался в начале градиента мочевины.
Смешанные фракции уравновешивали 16 мМ Tris-HCl pH 7,5 (I=1,4 мСм/см) с помощью 10DG-колонки (Bio-Rad) и применяли HiTrap DEAE FF анион-обменную колонку, уравновешенную 20 мМ Tris-HCl, pH 7,5. Связавшиеся протеины элюировали посредством линейного градиента от 0 до 1 М NaCl в равновесном буфере. Фракции собирали и анализировали на эндоглюканазную активность, как описано выше. Протеин элюировали в интервале 10-20 мСм/см.
Образец уравновешивали до 15 мМ ацетата натрия, pH 4,5, с помощью 10DG-колонки (Bio-Rad) и применяли HiTrap SP XL катион-обменную колонку, уравновешенную 20 мМ ацетата натрия, pH 4,5. Протеин элюировали посредством линейного градиента от 0 до 0,4 М ацетата натрия, pH 4,5. Эндоглюканазную активность снимали в интервале 1-10 мСм/см. Собранный образец лиофилизировали.
Этот образец затем растворяли в воде и наносили на гель-фильтрационную колонку Superdex 75 HR 10/30, уравновешенную 20 мМ фосфата натрия, pH 6,0, содержащего 0,15 М NaCl. Собирали фракции и те их них, которые имели эндоглюканазную активность, смешивали. О чистоте протеинового элюата судили по электрофорезу на SDS-полиакриламидном геле, а молекулярную массу оценили на основе стандартов молекулярных масс (стандарты по окрашиванию SDS-PAGE, Broad Range, Bio-Rad) как 54 кДа. pI очищенного протеина, обозначенного как Ct EG_54, определили с помощью PhastSystem (Pharmacia) как приблизительно 5,5.
Пример 5. Очистка эндоглюканазы из Thermoascus aurantiacus ALKO4242
Thermoascus aurantiacus ALKO4242 выращивали, как описано в Примере 1. Чистую эндоглюканазу получали последовательной очисткой посредством гидрофобного взаимодействия и анион-обменной хроматографии с последующей гель-фильтрацией. Эндоглюканазную активность фракций, собранных во время очистки, определяли, используя в качестве субстрата карбоксиметилцеллюлозу (CMC) (процедура по IUPAC 1987). Содержание протеина измеряли с помощью Набора для анализа BioRad (Bio-Rad Laboratories), используя в качестве стандарта бычий сывороточный альбумин.
Супернатант культуры наносили на колонку гидрофобного взаимодейсвия HiPrep 16/10 Butyl, уравновешенную 20 мМ калий-фосфатного буфера pH 6,0, содержащего 0,7 М (NH4)2SO4. Связавшиеся протеины элюировали с помощью 0,2 М (NH4)2SO4 (I=39 мСм/см). Фракции, имеющие эндоглюканазную активность, смешивали и концентрировали ультрафильтрацией.
Образец обессоливали на колонках 10DG (Bio-Rad) и наносили на HiTrap DEAE FF анион-обменную колонку, уравновешенную 15 мМ Tris-HCl, pH 7,0. Связавшиеся протеины элюировали посредством линейного градиента от 0 до 0,4 М NaCl в равновесном буфере. Протеин, имеющий эндоглюканазную активность, элюировали на площади проводимости 15-21 мСм/см. Собранные фракции смешивали и концентрировали, как описано выше.
Образец наносили на Sephacril S-100 HR 26/60 гель-фильтрационную колонку, уравновешенную 50 мМ натрий-ацетатного буфера, pH 5,0, содержащего 0,05 М NaCl. Протеиновую фракцию, имеющую эндоглюканазную активность, элюировали с колонки с объемом удерживания, соответствующим молекулярному весу 16 кДа. Собранные фракции смешивали, концентрировали и повторяли гель-фильтрацию. О чистоте протеинового элюата судили по электрофорезу на SDS-полиакриламидном геле, и молекулярный вес был оценен как 28 кДа. pI очищенного протеина, обозначенного как Ta EG_28, определили на IEF-геле (PhastSystem, Pharmacia) как 4290 нкат/мг (процедура IUPAC 1987, с использованием CMC в качестве субстрата).
Пример 6. Очистка и характеризация β-глюкозидазы из Acremonium thermophilum ALKO4245
Acremonium thermophilum ALKO4245 выращивали, как описано в Примере 1. Чистую β-глюкозидазу получали последовательной очисткой посредством гидрофобного взаимодействия и анион-обменной хроматографии с последующей гель-фильтрацией. β-глюкозидазную активность фракций, собранных во время очистки, определяли используя 4-нитрофенил-β-D-глюкопиранозид в качестве субстрата (Bailey and Linko, 1990). Содержание протеина измеряли с помощью Набора для анализа BioRad (Bio-Rad Laboratories), используя в качестве стандарта бычий сывороточный альбумин.
Супернатант культуры наносили на HiPrep 16/10 Phenyl Sepharose FF колонку гидрофобного взаимодействия, уравновешенную 20 мМ фосфата калия, pH 6,0, содержащего 1 М (NH4)2SO4. Связавшиеся протеины элюировали посредством линейного градиента от равновесного буфера до 5 мМ фосфата калия в поле проводимости 137-16 мСм/см. Собранные фракции смешивали и концентрировали ультрафильтрацией.
Образец обессоливали в 10DG-колонках (Bio-Rad) и наносили на HiTrap DEAE FF анион-обменную колонку, уравновешенную 10 мМ фосфата калия, pH 7,0. Связавшиеся протеины элюировании посредством линейного градиента от равновесного буфера до этого же самого буфера, содержащего 0,25 М NaCl в поле проводимости 1,5-12 мСм/см. Анион-обменную хроматографию повторяли, как описано выше, за исключением того, что использовали 4 мМ калий-фосфатного буфера, pH 7,2. Протеины элюировали в поле проводимости 6-9 мСм/см. Фракции, имеющие β-глюкозидазную активность, собирали, смешивали и концентрировали.
Активный материал с анион-обменной хроматографии наносили на колонку Sephacril S-300 HR 26/60, уравновешенную 20 мМ фосфата калия, pH 6,5, содержащего 0,15 М NaCl. Протеин с β-глюкозидазной активностью элюировали с объемом удержания, соответствующим молекулярному весу 243 кДа. Протеин считался чистым по результатам электрофореза на SDS-полиакриламидном геле. pI очищенного протеина, обозначенного At βG_101, определяли на IEF-геле (PhastSystem, Pharmacia) в поле 5,6-4,9. Специфическую активность At βG_101 при 50оС определили в 1100 нкат/мг (используя 4-нитрофенил-β-D-глюкопиранозид в качестве субстрата) (Bailey and Linko, 1990).
Термальную устойчивость очищенной β-глюкозидазы определяли при разных температурах. Реакцию проводили в присутствии 0,1 мг/мл BSA при pH 5,0 в течение 60 мин, 4-нитрофенил-β-D-глюкопиранозид в качестве субстрата. A. thermophilum βG_101 оставался стабильным до 70оС.Контрольный фермент Aspergilus (Novozym 188) сохранял 100-ную активность до 60оС.
Пример 7. Очистка β-глюкозидазы из Chaetomium thermophilum ALKO4261
Chaetomium thermophilum ALKO4261 выращивали, как описано в Примере 1. Чистую β-глюкозидазу получали последовательной очисткой посредством гидрофобного взаимодействия анион- и катион-обменной хроматографии с последующей гель-фильтрацией. β-глюкозидазную активность фракций, собранных во время очистки, определяли, используя 4-нитрофенил-β-D-глюкопиранозид в качестве субстрата (Bailey and Linko, 1990).
Супернатант культуры наносили на HiPrep 16/10 Phenyl Sepharose FF колонку гидрофобного взаимодействия, уравновешенную 20 мМ фосфата калия, pH 6,0, содержащего 0,8 М (NH4)2SO4. Элюирование выполняли посредством линейного градиента от равновесного буфера до 3 мМ фосфата калия, pH 6,0, с последующим элюированием водой и 6 М мочевины. Первые фракции с β-глюкозидазной активностью элюировали в поле проводимости 80-30 мСм/см. Вторую фракцию с β-глюкозидазной активностью, элюированную мочевиной, собирали и обессоливали на 10DG-колонках (Bio-Rad), уравновешенных 10 мМ Tris-HCl, pH 7,0.
После обессоливания образец наносили на HiTrap DEAE FF анион-обменную колонку, уравновешенную 15 мМ Tris-HCl, pH 7,0. Протеин не связывался с колонкой и элюировался во время подачи образца. Эту проточную фракцию обессоливали на 10DG-колонках (Bio-Rad), уравновешенных 7 мМ ацетата Na, pH 4,5.
Образец с анион-обменной хроматографии наносили на HiTrap DEAE FF катион-обменную колонку, уравновешенную 10 мМ ацетата натрия, pH 4,5. Связавшиеся протеины элюировании посредством линейного градиента от 10 до 400 мМ ацетата натрия, pH 4,5. Фракции с β-глюкозидазной активностью, элюированные в поле проводимости 6,5-12 мСм/см, собирали, обессоливали на 10DG-колонках (Bio-Rad), уравновешенных 7 мМ ацетата натрия, pH 4,5, и лиофилизировали.
Лиофилизированный образец разводили до 100 мкл водой и наносили на гель-фильтрационную колонку Superdex 75 HF 10/30, уравновешенную 20 мМ фосфата натрия, pH 4,5, содержащего 0,15 NaCl. β-глюкозидазная активность элюировалась при объеме удержания 13,64 мл. Собранные фракции смешивали, лиофилизировали и растворяли в воде. О чистоте протеина судили по электрофорезу на SDS-полиакриламидном геле, и молекулярный вес был оценен как 76 кДа. Протеин обозначили как Ct βG_76.
Пример 8. Очистка и характеризация β-глюкозидазы из Thermoascus aurantiacus ALKO4242
Thermoascus aurantiacus ALKO4242 выращивали, как описано в Примере 1. Чистую β-глюкозидазу получали последовательной очисткой посредством гидрофобного взаимодействия, анион- и катион-обменной хроматографии с последующей гель-фильтрацией. β-глюкозидазную активность фракций, собранных во время очистки, определяли, используя 4-нитрофенил-β-D-глюкопиранозид в качестве субстрата (Bailey and Linko, 1990). Содержание протеина измеряли с помощью Набора для анализа BioRad (Bio-Rad Laboratories), используя в качестве стандарта бычий сывороточный альбумин.
Супернатант культуры наносили на колонку гидрофобного взаимодейсвия HiPrep 16/10 Fenyl Sepharose FF, уравновешенную 20 мМ фосфата калия, pH 6,0, содержащего 0,7 М (NH4)2SO4. Связавшиеся протеины элюировали посредством линейного градиента от 0,2 М (NH4)2SO4 до 5 мМ фосфата калия, pH 6,0. β-глюкозидазную активность элюировали в течение градиента в поле проводимости 28,0-1,1 мСм/см. Фракции смешивали и концентрировали ультрафильтрацией.
Образец обессоливали на колонках 10DG (Bio-Rad) и наносили на HiTrap DEAE FF анион-обменную колонку, уравновешенную 20 мМ Tris-HCl, pH 7,0. Протеин элюировали посредством линейного градиента от 0 до 0,2 М NaCl в равновесном буфере и с задержанным элюированием с помощью 20 мМ Tris-HCl, содержащего 0,4 М NaCl. Образец, элюированный в поле проводимости примерно 10-30 мСм/см, концентрировали ультрафильтрацией и обессоливали с помощью 10DG-колонки (Bio-Rad).
Образец наносили на HiTrap SP XL катион-обменную колонку, уравновешенную 9 мМ ацетата натрия, pH 4,5. Фермент элюировали посредством линейного градиента от 10 до 400 мМ NaAc и с помощью задержанного элюирования, используя 400 мМ NaAc, pH 4,5. Протеины с β-глюкозидазной активностью элюировали в течение линейного градиента в поле проводимости 5,0-11,3 мСм/см.
Активный материал с катион-обменной хроматографии наносили на колонку Sephacril S-300 HR 26/60, уравновешенную 20 мМ фосфата натрия, pH 7,0, содержащего 0,15 М NaCl. Протеин с β-глюкозидазной активностью элюировали с объемом удержания, соответствующим молекулярному весу 294 кДа. Собранные фракции смешивали, лиофилизировали и растворяли в воде. О чистоте протеина судили по электрофорезу на SDS-полиакриламидном геле, и молекулярный вес был оценен как 81 кДа, представляя, весьма вероятно, мономентрическую форму протеина. Изоэлектрическое фокусирование (IEF) проводили, используя 3-9 pI-гель. После окрашивания серебром в дополнение к узкой полосе, соответствующей pI 4,55, окрасилась также обширная площадь выше pI 5,85. Специфическую активность окрашенного протеина, обозначенного как Ta βG_81, при 50оС определили как 600 нкат/мг, используя 4-нитрофенил-β-D-глюкопиранозид в качестве субстрата (Bailey and Linko, 1990).
Термальную устойчивость очищенной β-глюкозидазы определяли при разных температурах. Реакцию проводили в присутствии 0,1 мг/мл BSA при pH 5,0 в течение 60 мин, используя в качестве субстрата 4-нитрофенил-β-D-глюкопиранозид. T. aurantiacus βG_81 был устойчивым до 75оС. Контрольный фермент Aspergilus (Novozym 188) сохранял 100%-ную активность до 60оС.
Пример 9. Очистка ксиланазы из Acremonium thermophilum ALKO4245
Acremonium thermophilum ALKO4245 выращивали, как описано в Примере 1. Супернатант культуры инкубировали при 70оС в течение 24 часов, после чего его концентрировали ультрафильтрацией. Чистую ксиланазу получали последовательной очисткой посредством гидрофобного взаимодействия и катион-обменной хроматографии с последующей гель-фильтрацией. Ксиланазную активность определяли, используя ксилан березы в качестве субстрата (процедура IUPAC 1987). Протеин анализировали с помощью Набора для анализа BioRad (BioRad Laboratories), используя в качестве контроля бычий сывороточный альбумин.
Концентрированный супернатант культуры наносили на колонку гидрофобного взаимодействия HiPrep 16/10 Бутил FF, уравновешенную 20 мМ калий-фосфатного буфера, pH 6,0, содержащего 1 М (NH4)2SO4. Связавшиеся протеины элюировали посредством линейного градиента от упомянутого выше буфера до 5 мМ фосфата калия, pH 6,0. Протеиновую фракцию элюировали в широком поле проводимости 5,0-11,3 мСм/см.
Образец с колонки гидрофобного взаимодействия наносили на HiTrap SP XL катион-обменную колонку, уравновешенную 8 мМ ацетата натрия, pH 4,5. Протеин не связывался с этой колонкой и элюировался в потоке во время нагружения образца. Элюат концентрировали ультрафильтрацией. Гидрофобную хроматографию повторяли, как описано выше. Несвязавшиеся протеины собирали и лиофилизировали.
Растворенный образец нагружали на гель-фильтрационную колонку Superdex 75 HR 10/30, уравновешенную 20 мМ натрий-фосфатным буфером, pH 7,0, содержащим 0,15 NaCl. Протеин, элюированный с колонки с объемом удержания 11,2 мл, расценивался как чистый с помощью гель-электрофореза на SDS-полиакриламидном геле. Молекулярная масса очищенного протеина оценивалась на основе стандартов молекулярных масс (стандарты по окрашиванию SDS-PAGE, Broad Range, Bio-Rad) как 60 кДа. Специфическую активность протеина, обозначенного как At XYN_60, при 50оС определили в 1800 нкат/мг (процедура IUPAC 1987, с использованием ксилана березы в качестве субстрата). Относительная активность увеличивалась от 1,2 раза при 60оС до 1,6 раза при 70оС по сравнению с 50оС. Специфическая активность против MUG2 (4-метилумбеллиферил-β-D-целлобиозид), MUL (4-метилумбеллиферил-бета-D-лактозид) и MUG3 (4-метилумбеллиферил-β-D-целлотриозид) составляла 54, 33 и 78 нкат/мг (50оС, pH 5,0, в течение 10 мин), соответственно. Это согласуется с тем фактом, что семейство 10 ксиланаз также показывает активность против арилглюкопиранозидов (Biely et al., 1997).
Пример 10. Очистка ксиланазы из Thermoascus aurantiacus ALKO4242
Thermoascus aurantiacus ALKO4242 выращивали, как описано в Примере 1. Чистую ксиланазу получали последовательной очисткой посредством гидрофобного взаимодействия анион- и катион-обменной хроматографии с последующей гель-фильтрацией. Ксиланазную активность определяли, используя ксилан березы в качестве субстрата (процедура IUPAC 1987). Протеин анализировали с помощью Набора для анализа BioRad (Bio-Rad Laboratories), используя в качестве контроля бычий сывороточный альбумин.
Супернатант культуры наносили на колонку гидрофобного взаимодействия HiPrep 16/10 Phenyl Sepharose FF, уравновешенную 20 мМ калий-фосфатного буфера, pH 6,0, содержащего 0,7 М (NH4)2SO4. Связавшиеся протеины элюировали посредством двухстадийной процедуры. Элюирование проводили понижением солевой концентрации сначала до 0,2 М (NH4)2SO4, а затем посредством линейного градиента от 20 мМ фосфата калия, pH 6,0, содержащего 0,2 М (NH4)2SO4 до 5 мМ фосфата калия, pH 6,0. Протеин элюировали с помощью 0,2 М (NH4)2SO4 (I=39 мСм/см).
Образец обессоливали на колонках 10DG (Bio-Rad) и наносили на HiTrap DEAE FF анион-обменную колонку, уравновешенную 15 мМ Tris-HCl, pH 7,0. Протеин не связывался с анион-обменной колонкой и элюировался в потоке. Проводимость образца регулировали в соответствии с проводимостью 20 мМ ацетата натрия, pH 4,5, добавляя воду, а pH регулировали до 4,5 во время концентрирования с помощью ультрафильтрации.
Образец наносили на HiTrap SP XL катион-обменную колонку, уравновешенную 20 мМ ацетата натрия, pH 4,5. Связавшиеся протеины элюировали посредством линейного градиента от равновесного буфера до того же самого буфера, содержащего 1 М NaCl. Фермент элюировали в поле проводимости 1-7 мСм/см. Образец лиофилизировали и после этого растворяли в воде.
Лиофилизированный образец растворяли в воде и наносили на гель-фильтрационную колонку Superdex 75 HR 10/30, уравновешенную 20 мМ натрий-фосфата, pH 7,0, содержащим 0,15 NaCl. Протеин элюировали с колонки с объемом удержания, соответствующим молекулярному весу 26 кДа. Протеин расценивался как чистый с помощью гель-электрофореза на SDS-полиакриламидном геле. Молекулярная масса чистого протеина оценивалась на основе стандартов молекулярных масс (стандарты по окрашиванию SDS-PAGE, Broad Range, Bio-Rad). pI очищенного протеина, обозначенного как Ta XYN_30, определили с помощью PhastSystem (Pharmacia), как равную приблизительно 6,8. Специфическую активность Ta XYN_30 при 50оС определили равной 4800 нкат/мг (процедура IUPAC 1987, с использованием ксилана березы в качестве субстрата).
Пример 11. Внутреннее аминокислотное секвенирование
Внутренние пептиды секвенировали с помощью электрораспылительной ионизации, сочетающейся с тандемной масс-спектрометрией (ESI-MS/MS), используя прибор Q-TOF1 (Micromass). Протеин сначала алкилировали и расщепляли на триптические пептиды. Полученные пептиды обессоливали и частично разделяли с помощью жидкостной нанохроматографии (обращенная фаза) перед применением прибора Q-TOF1. Внутренние последовательности пептидов Chaetomium thermophilum и Acremonium thermophilum показаны в Таблице 2. Пептиды из Chaetomium CBH были получены после того, как соответствующий cbh-ген был клонирован. Пептиды, полученные из Acremonium CBH, не использовались при клонировании соответствующего гена.
Внутренние последовательности очищенных эндоглюканаз, β-глюкозидаз и ксиланаз Acremonium thermophilum ALKO4245, Chaetomium thermophilum ALKO4261 и Thermoascus aurantiacus ALKO4242 приведены в Таблицах 3-5.
Пример 12. Конструкции геномных библиотек для Thermoascus aurantiacus, Chaetomium thermophilum и Acremonium thermophilum
Геномную библиотеку Chaetomium thermophilum ALKO4265 и Acremonium thermophilum ALKO4245 создавали в векторе Lambda DAS®II (Stratagene, USA) в соответствии с инструкциями от поставщика. Хромосомные ДНК, выделенные методом Raeder and Broda (1985), частично расщепляли с помощью Sau3A. Расщепленные ДНК фракционировали по размеру и фрагменты выбранного размера (≈5-23 т.п.о.) лигировали с BamHI-плечами расщепленного лямбда-вектора. Лигированные смеси упаковывали, используя упаковочные экстракты Gigapack III Gold в соответствии с инструкциями производителя (Stratagene, USA). Титры геномных библиотек Chaetomium thermophilum и Acremonium thermophilum составляли 3,6×106 бое (бляшкообразующих единиц)/мл и 3,7×105 бое/мл, а титры их амплифицированных библиотек - 6,5×1010 бое/мл и 4,2×108 бое/мл, соответственно.
При конструировании геномных библиотек Thermoascus aurantiacus ALKO4242 и Chaetomium thermophilum ALKO4261 использовался Набор Lambda FIX® II/Xpo I Partial Fill-In Vector (Stratagene, USA) в соответствии с инструкциями от поставщика. Хромосомные ДНК, выделенные методом Raeder and Broda (1985), частично расщепляли с помощью Sau3A. Расщепленные ДНК фракционировали по размеру и фрагменты выбранного размера (≈ 6-23 т.п.о.) вставляли и лигировали с XhoI-плечами расщепленного Lambda FIX II-вектора. Лигированные смеси упаковывали, используя упаковочные экстракты Gigapack III Gold в соответствии с инструкциями производителя (Stratagene, USA). Титры геномных библиотек Thermoascus aurantiacus ALKO4242 и Chaetomium thermophilum ALKO4261 составляли 0,2×106 бое/мл и 0,3×106 бое/мл, а титры их амплифицированных библиотек - 1,8×109 бое/мл и 3,8×109 бое/мл, соответственно.
Пример 13. Клонирование генов целлобиогидролаз (cbh/cel7) из Thermoascus aurantiacus, Chaetomium thermophilum и Acremonium thermophilum
При выделении и обработке ДНК (плазмид, фрагментов ДНК) ферментами, при трасформировании E.coli и т.д. использовали стандартные методы молекулярной биологии. Основные использованные методы описаны в стандартных руководствах по молекулярной биологии, например, Sambrook et al. (1989) и Sambrook and Russel (2001).
Зонды для скрининга геномных библиотек, которые конструировались, как описано в Примере 12, амплифицировали посредством ПЦР, используя в реакции в качестве матриц геномные ДНК Thermoascus aurantiacus ALKO4242, Chaetomium thermophilum ALKO4265 и Acremonium thermophilum ALKO4245. В соответствии с опубликованной нуклеотидной последовательностью (WO 03/000941, Hong et al., 2003b) было сконструировано несколько праймеров, протестированных в ПЦР-реакциях. ПЦР-реакционные смеси содержали 50 мМ Tris-HCl, pH 9,0, 15 мМ (NH4)2SO4, 0,1 Triton X-100, 1,5 мМ MgCl2, 0,2 мМ dNTPs, 5 мкМ каждого праймера и 1 единицу Dynazyme EXT ДНК-полимеразы (Finnzymes, Finland), и ≈0,5-1 мкг геномной ДНК. Условия ПЦР-реакций были следующие: 5 мин начальной денатурации при 95оС, затем 30 циклов по 1 мин при 95оС либо по 1 мин отжига при 62оС (перепад ±8оС) для матриц Thermoascus ALKO4242 и Chaetomium ALKO4265, или 1 мин отжига при 58оС (перепад ±6оС) для матрицы Acremonium ALKO4245, удлинение в течение 2 мин при 72оС и заключительное удлинение при 72оС в течение 10 мин.
ДНК-продукты ожидаемых размеров (вычисленных из опубликованных cbh-последовательностей) были получены из всех использованных матриц. ДНК-фрагменты ожидаемых размеров были выделены из наиболее специфичных ПЦР-реакций и клонированы в вектор pCR® Blunt-TOPO® (Invitrogen, USA). Вставки были охарактеризованы секвенированием и проведением Southern блот-гибридизаций с геномными ДНК, расщепленными несколькими рекстрикционными ферментами. ПЦР-фрагменты, которые были выбраны для использования в качестве зондов для скринирования геномных библиотек Thermoascus aurantiacus, Chaetomium thermophilum и Acremonium thermophilum, представлены в Таблице 6.
Выведенные из всех этих зондов аминокислотные последовательности имели гомологию с несколькими опубликованными CBH-последовательностями (программа BLAST, версия 2.2.9 в NCBI, Национальном Центре Биотехнологической Информации; Altschul et al., 1990) гликозидгидролаз семейства 7 (Henrissat, 1991; Henrissat and Bairoch, 1993).
Вставки из плазмид, перечисленных в Таблице 6, метили дигоксигенином в соответствии с инструкциями поставщика (Roche, Germany), и амплифицированные геномные библиотеки (бляшки 2×105-3×105) скринировали мечеными зондовыми фрагментами. Температура гибридизации на фильтрах была 68оС, и фильтры промывали 2×5 мин на RT, используя 2×SSC - 0,1% SDS с последующими 2×15 мин при 68оС, используя 0,1×SSC - 0,1% SDS посредством гомологичных зондов. От каждой гибридизации было получено несколько положительных бляшек. При скринировании геномных библиотек Acremonium ALKO4245 некоторые из положительных бляшек сильно гибридизовались с испробуемым зондом, но, кроме того, было некоторое количество бляшек, которые слабее гибридизовались с зондами. Предполагалось, что в геноме возможно присутствовал(-и) другой(-ие) целлобиогидролазный(-ые) ген(-ы), вызывающий(-ие) перекрестную реакцию. При скринировании геномных библиотек Thermoascus ALKO4242 и Chaetomium ALKO4265 очищали от четырех до пяти сильно гибридизовавшихся бляшек. В случае Acremonium ALKO4245 четыре из пяти очищенных бляшек были слабо гибридизованы используемым зондом. Фаговые ДНК выделяли и характеризовали с помощью Southern блот-гибридизаций. Выбранные рестрикционные фрагменты, гибридизовавшиеся с зондом, субклонировали в вектор pBluescript II KS+, и релевантные области клонов были секвенированы.
В итоге были клонированы четыре cbh/cel7-гена; один из Thermoascus aurantiacus ALKO4242, один из Chaetomium thermophilum ALKO4265 и два из Acremonium thermophilum ALKO4245 (на ранней стадии работ они имели обозначения At_cbh_C и At_cbh_A, а потом переобозначены как At cel/7A и At cel/7B, соответственно). В Таблице 7 суммированы сведения о зондах, использованных для скрининга генов, фаговые клоны, из которых были выделены гены, выбранные рестрикционные фрагменты, содержащие гены полной длины с их промоторными и терминаторными областями, названия плазмид и депозитарные номера DSM для штаммов E.coli, несущих эти плазмиды.
Релевантная информация по генам и выведенным протеиновым последовательностям (SEQ ID NO: 1-8) суммирована в Таблице 8 и 9, соответственно.
Пептидные последовательности очищенных CBH-протеинов из Chaetomium thermophilum ALKO4265 и Acremonium thermophilum ALKO4245 (Таблица 2) были найдены из выведенных аминокислотных последовательностей клонов, содержащих Ct cel7A- и At cel7A-гены. Таким образом, можно заключить, что гены, кодирующие очищенные CBH/Cel7-протеины из Chaetomium thermophilum и Acremonium thermophilum, были клонированы.
Выведенные аминокислотные последовательности Thermoascus aurantiacus Cel7A и Acremonium thermophilum Cel7A (кор, без CBD) были весьма гомологичны одна другой (анализировалось общим выравниванием по Needleman-Wunsch, EMBOSS 3.0.0 Needle c матриксом EBLOSUM62, штраф за пропуск 10,0 и штраф расширения 0,5; Needleman ans Wunsch, 1970). Кроме того, выведенная последовательность Cel7A Acremonium thermophilum имела более низкую идентичность с выведенной последовательностью Cel7A Chaetomium thermophilum. Acremonium thermophilum Cel7 В довольно отличался от CBH/Cel7-последовательностей по изобретению.
Выведенная последовательность Cel7A Chaetomium обладала самой высокой идентичностью (анализировалось общим выравниванием по Needleman-Wunsch, EMBOSS Needle, см. выше) с полипептидами CBHI Chaetomium thermophilum, Scytalidium thermophilum и Thielavia australiensis, описанными в WO 03/000941. Аналогично выведенная последовательность Cel7A Thermoascus aurantiacus была высоко идентичной опубликованной CBHI Thermoascus aurantiacus (WO 03/000941, Hong et al., 2003b). Cel7 В Acremonium thermophilum имела значительно более низкую идентичность ранее опубликованным последовательностям, будучи более близко связанной с CBHI-полипептидом из Oryza sativa. Самые высокие гомологии у выведенной последовательности Cel7A Acremonium thermophilum были с Exidia gladulosa и CBHI-полинуклеотидами Acremonium thermophilum (WO 03/000941). Выравнивание указывает, что клонированные последовательности ALKO4242 Thermoascus aurantiacus, ALKO4265 Chaetomium thermophilum и ALKO4245 Acremonium thermophilum кодируют CBH-протеины, имеющие высокую гомологию с полипептидами гликозидгидролазы семейства 7, которые по этой причине получили обозначение Cel7A или Cel7 В (Henrissat et al., 1998).
Сравнение выведенных последовательностей cbh/cel7-генов из Thermoascus aurantiacus ALKO4242, Chaetomium thermophilum ALKO4265 и Acremonium thermophilum ALKO4245 одна с другой и далее с последовательностями, найденными в базах данных, показано в Таблице 10.
Пример 14. Продуцирование рекомбинантных CBH/Cel7-протеинов в Trichoderma reesei
Экспрессионные плазмиды конструировали для получения рекомбинантных CBH/Cel7-протеинов из Thermoascus aurantiacus (Ta Cel7A), Chaetomium thermophilum (Ct Cel7A) и Acremonium thermophilum (At Cel7A, At Cel7B; на ранней стадии работ эти протеины имели временные обозначения At CBH_C и At CBH_A, соответственно). Сконструированные экспрессионные плазмиды перечислены в Таблице 11. Рекомбинантные cbh/cel7-гены, включая их собственные сигнальные последовательности, были точно слиты с T. reesei cbh1 (cel7A)-промотором посредством ПЦР. Терминация транскрипции обеспечивалась T. reesei cel7A-терминатором, а для селекции трансформантов использовался A. nidulans amdS-маркерный ген, как описано у Paloheimo et al. (2003). Линеаризованные экспрессионные кассеты (Фиг.2) выделяли из векторных каркасов после расщепления EcoRI и трансформировали в T. reesei А96- и А98-протопласты (в обоих штаммах были делетированы гены, кодирующие четыре главные целлюлазы CBHI/Cel7A, CBHII/Cel6A, EGI/Cel7B и EGII/Cel5A). Трансформации осуществляли как у Penttilä et al. (1987) с модификациями, описанными у Karhunen et al. (1993), проводя селекцию с ацетамидом в качестве единственного источника азота. Трансформанты очищали на селекционных чашках через единичные конидии до их споруляции на PD.
CBH/Cel7 продуцирование трансформантов анализировали по супернатантам культур, культивируемых во встряхиваемых колбах (50 мл). Трансформанты выращивали в течение 7 дней при 28оС в комплексной основанной на лактозе индуцирующей целлюлазу среде (Joutsjoki et al. (1993), буферированной 5% KH2PO4. Целлобиогидролазную активность анализировали, используя 4-метилумбеллиферил-β-D-лактозидный (MUL) субстрат в соответствии с van Tilbeurgh et al., 1988. Генотипы выбранных трансформантов подтверждали, используя Southern-блоты, в которые было включено несколько геномных гидролизаторов, и соответствующую экспрессионную кассету использовали в качестве зонда. Гетерологичную экспрессию Ta Cel7A-, Ct Cel7A-, At Cel7A- и At Cel7B-протеинов анализировали с помощью SDS-PAGE с последующим окрашиванием Кумасси. Обнаружение того, что никакой целлобиогидролазной активности или продуцирования гетерологичного протеина при SDS-PAGE не обнаружено, предполагает, что при использовании описанного экспериментального метода At Cel7B продуцируется в Trichoderma ниже уровней обнаружения.
Препараты рекомбинантных CBH/Cel7-ферментов характеризовали в терминах pH-оптимума и термальной стабильности. pH-оптимум рекомбинантных CBH/Cel7-протеинов из Thermoascus aurantiacus, Chaetomium thermophilum и Acremonium thermophilum определяли в универсальном буфере Маклвейна в интервале pH 3,0-8,0, используя 4-метилумбеллиферил-β-D-лактозид (MUL) в качестве субстрата (Фиг.3A). pH-оптимум для Ct Cel7A и At Cel7A составляет 5,5, выше которого активность начинает постепенно падать. pH-оптимум рекомбинантного сырого Ta Cel7A - 5,0 (Фиг.3A). Термальную стабильность рекомбинантных Cel7-ферментов определяли измерением MUL-активности в универсальном буфере Маклвейна при оптимуме pH с временем реакции 1 ч. Как показали результаты, Ta Cel7A и Ct Cel7A сохраняли более 60% своей активности при 70оС, в то время как At Cel7A показывал явно меньшую стабильность при более высоких температурах (≥65оС) (Фиг.3В).
Выбранные CBH/Cel7-трансформанты культивировали в лабораторных биореакторах при 28оС в указанной выше среде в течение 3-4 дней с pH-контролем 4,4±0,2 (NH3/H3PO4), чтобы получить материал для тестов по применению. Супернатанты восстанавливали центрифугированием и фильтрацией через Seitz-K 150- и EK-фильтры (Pall SeitzSchenk Filtersystem GmbH, Bad Kreuznach, Германия).
Пример 15. Продуцирование рекомбинантных Thermoascus aurantiacus Cel7A+CBD протеинов слияния в T. reesei
Thermoascus aurantiacus Cel7A (AF478686, Hong et al., 2003b; SEQ ID NO: 1) сливали с линкером и CBD Trichoderma reesei CBHI/Cel7A (AR088330, Srisodsuk et al., 1993) (= Tr CBD) с последующим получением протеина слияния (SEQ ID NO:28, соответствующая нуклеиновая кислота - SEQ ID NO:27) в T. reesei, как описано в FI20055205/US 11/119,526; поданной 29 апреля 2005. Кроме того, Thermoascus aurantiacus Cel7A сливали с линкером и CBD Chaetomium thermophilum Cel7A (SEQ ID NO:7) (Ct CBD). С этой целью кодирующую последовательность линкера и CBD Chaetomium thermophilum Cel7A синтезировали посредством ПЦР, используя следующие праймеры:
5'-TAAACATATGTTATCTACTCCAACATCAAGGTCGGACCCATCGGC-TCGACCGTCCCTGGCCTTGAC-3' (прямая последовательность)
и
5'-TATATGCGGCCGCAAGCTTTACCATCAAGTTACTCCAGCAAATCA-GGGAACTG-3' (обратная последовательность).
ПЦР-реакционная смесь содержала 1 × DyNAzyme™ EXT-реакционного буфера (Finnzyme, Finland), 15 мМ Mg2+, 0,2 мМ dNTPs, 2 мкМ каждого праймера, 0,6 единиц DyNAzyme™ EXT ДНК-полимеразы (Finnzyme, Finland) и приблизительно 75 нг/30 мкл матричной ДНК, содержащей cel7A-ген полной длины из Chaetomium thermophilum. Условия ПЦР-реакции были следующие: 2 мин начальной денатурации при 98оС, затем 30 циклов по 30 сек при 98оС, 30 сек отжига при 68оС (перепад ±4оС), удлинение в течение 30 сек при 72оС и заключительное удлинение при 72оС в течение 10 мин. Специфический ДНК-фрагмент в ПЦР-реакции был получен при температуре отжига в диапазоне от 64 до 68,5оС. Синтезированный CBD-фрагмент Chaetomium thermophilum был лигирован после Thermoascus aurantiacus cel7A-гена, что произвело точку соединения GPIGST между доменами. ПЦР-амплифицированный фрагмент в плазмиде был подтвержден секвенированием (SEQ ID:29). Сконструированный слитый cel7A-ген был точно слит с T. reesei cbh1 (cel7)-промотором. Терминация транскрипции обеспечивалась T. reesei cel7A-терминатором, а для селекции трансформантов использовался A. nidulans amdS-маркерный ген, как описано у Paloheimo et al. (2003).
Линеаризованную экспрессионную кассету выделяли из векторного каркаса после расщепления NotI и трансформировали в T. reesei А96-протопласты. Трансформации осуществляли как у Penttilä et al. (1987) с модификациями, описанными у Karhunen et al. (1993), проводя селекцию с ацетамидом в качестве единственного источника азота. Трансформанты очищали на селекционных чашках через единичные конидии до их споруляции на PD.
Продуцирование трансформантов Thermoascus aurantiacus Cel7A+CBD (SEQ ID: 28 и 30) анализировали по супернатантам культур, культивируемых во встряхиваемых колбах (50 мл). Трансформанты выращивали в течение 7 дней в комплексной индуцирующей целлюлазу среде (Joutsjoki et al. (1993), буферированной 5% KH2PO4 при pH 5,5. Целлобиогидролазную активность анализировали, используя 4-метилумбеллиферил-β-D-лактозидный (MUL) субстрат в соответствии с van Tilbeurgh et al., 1988. Генотипы выбранных трансформантов подтверждали, используя Southern-блоты, в которые было включено несколько геномных гидролизаторов, и соответствующую экспрессионную кассету использовали в качестве зонда. SDS-PAGE-анализы показали, что рекомбинантные ферменты Thermoascus aurantiacus Cel7A+CBD продуцировались как стабильные протеины слияния в T. reesei.
Выбранный трансформант, продуцирующий Ta Cel7+Tr CBD-протеин слияния (SEQ ID: 28), также культивировали в 2-литровом биореакторе при 28оС в указанной выше среде в течение 3-4 дней с pH-контролем 4,4±0,2 (NH3/H3PO4), чтобы получить материал для тестов по применению. Супернатанты восстанавливали центрифугированием и фильтрацией через Seitz-K 150- и EK-фильтры (Pall SeitzSchenk Filtersystem GmbH, Bad Kreuznach, Германия).
Пример 16. Сравнение констант Михаэлиса-Ментена и ингибирования целлобиозы очищенных рекомбинантных целлобиогидролаз
Константы Михаэлиса-Ментена и ингибирования целлобиозы определяли по целлобиогидролазам, гетерологично продуцированным в T. reesei (Примеры 14 и 15). Ферменты очищали, как описано в Примере 2. Концентрации протеинов в очищенных ферментах измеряли по их поглощению при 280 нм, используя теоретический коэффициент молярной экстинкции, который вычисляли по аминокислотным последовательностям (Gill and von Hippel, 1989).
Кинетические константы (значения Km и kcat) и константу ингибирования целлобиозы (Ki) для Tr CBHI/Cel7A, Ta CBH/Cel7A, At CBH/Cel7A и Ct CBH/Cel7A измеряли, используя CNPLac (2-хлоро-4-нитрофенил-β-D-лактозид) в качестве субстрата при температуре окружающей среды (22оС) в 50 мМ натрий-фосфатном буфере, pH 5,7. Для определения константы ингибирования (Ki) измеряли восемь различных концентраций субстрата (31-4000 мкМ) в присутствии диапазона из пяти концентраций ингибитора (0-100 мкМ или 0-400 мкМ), где в скобке значение Ki. Все эксперименты были поставлены в микротитровальных чашках, и общий реакционный объем составлял 200 мкл. Начальные скорости в каждом случае измеряли непрерывным мониторингом высвобождения хлоро-нитрофенолатного иона (CNP, 2-хлоро-4-нитрофенолата) посредством измерений при 405 нм, используя микротитровальный планшетный считыватель Varioscan (Thermolabsystem). Результаты вычисляли по кривой стандартной SNP (от 0 до 100 мкМ). Использованные концентрации ферментов составляли: Tr CBHI/Cel7A 2,46 мкМ, Ta CBH/Cel7A 1,58 мкМ, Ct CBH/Cel7A 0,79 мкМ и At CBH/Cel7A 3 мкМ. Константы Km и kcat вычисляли из соответствующего уравнения Михаэлиса-Ментена, используя программу Origin. Для различения конкурентного и смешанного типа ингибирования и определения констант ингибирования (Ki) использовали диаграммы Лайнуивер-Берка, обратные диаграммы (относительно LWB-склона [GIc2; целлобиоза]) и диаграммы Хейнса.
Результаты кинетических измерений показаны в Таблице 12 и 13. Как можно увидеть, Ct CBH/Cel7A отчетливо имеет более высокое число оборотов (kcat) на CNPLac, а также более высокую константу специфичности (kcat/Km) по сравнению с CBHI/Cel7A T. reesei. Целлобиоза (Glc2) является конкурентным ингибитором для всех измеряемых целлюлаз, и Tr CBHI/Cel7A (использованный в качестве контроля) сильнее всего ингибировался (т.е. имел самое низкое значение Ki) целлобиозой. At CBHI/Cel7A имел более чем в 7 раз более высокую константу ингибирования по сравнению с таковой Tr CBHI/Cel7A. Эти результаты указывают, что все три новых целлобиогидролазы могли бы работать лучше в целлюлозном гидролизе благодаря пониженному целлобиозному ингибированию по сравнению с целлобиогидролазой I Trichoderma reesei Cel7A.
Пример 17. Гидролиз кристаллической целлюлозы (Avicel) рекомбинантными целлобиогидролазами
Очищенные рекомбинантные целлобиогидролазы Ct Cel7A, Ta Cel7A, Ta Cel7A+Tr CBD, Ta Cel7A+Ct CBD, At Cel7A, а также коровый вариант Ct Cel7A (см. ниже) тестировали в эквимолярных количествах в гидролизе кристаллической целлюлозы при двух температурах, 45оС и 70оС; очищенный Tr Cel7A T. reesei и его коровый вариант (см. ниже) использовали для сравнения. Анализ гидролиза кристаллической целлюлозы (Ph 101, Avicel; Fluka, Швейцария) выполняли в 1,5 мл пробирке 50 мМ ацетата натрия, pH 5,0. Avicel встряхивали при 45 или 70оС с раствором фермента (1,4 мкМ), и конечный объем реакционной смеси составлял 325 мкл. После гидролиза в течение 24 часов следовал отбор образцов в шести разных временных точках, и реакцию прекращали, добавляя 163 мкл останавливающего реагента, содержащего 9 объемов этанола и 1 объем 1 М глицина (pH 11). Раствор фильтровали через Millex GV 13 0,22 мкм фильтрационный блок (Millipore, Billerica, MA, США). Образование растворимых редуцирующих сахаров в супернатанте определяли пара-гидроксибензоик-ацетамидным (PAHBAH) методом (Lever, 1972), используя стандартную целлобиозную кривую (50-1600 мкМ целлобиозы). В свежеприготовленный 0,1 PAHBAH (Sigma-Aldrich, St. Lous, Mo, США) в 0,5 М NaOH (100 мкл) раствор добавляли 150 мкл фильтрованного образца и кипятили в течение 10 минут, после чего раствор охлаждали на льду. Поглощение образцов измеряли при 405 нм.
Коровые варианты целлобиогидролаз, содержащих CBD в их нативной форме, получали следующим образом: Ct Cel7A и Tr Cel7A подвергали протеолитическому расщеплению, чтобы удалить целлюлозо-связывающий домен. Расщепление папаином (Papaya Latex, 14 Ед/мг, Sigma) нативных целлобиогидролаз выполняли при 37оС в течение 24 ч в реакционной смеси, составленной из 10 мМ L-цистеина и 2 мМ EDTA в 50 мМ натрий-ацетатного буфера (pH 5,0) с добавлением папаина (тестировали две концентрации папаина: одна пятая и одна десятая количества папаина от общего количества Cel7A в реакционной смеси). Полученный коровый протеин очищали с помощью DEAE Sepharose FF (Farmacia, Uppsala, Швеция) анион-обменной колонки, как описано выше. Продукт анализировали на SDS-PAGE.
Результаты гидролиза при 45оС и 70оС показаны на Фигуре 4 и 5, соответственно. Результаты ясно показывают, что все целлобиогидролазы обнаруживают более быстрый и более полный гидролиз при обеих температурах по сравнению с целлобиогидролазой Cel7A T. reesei уровня техники. При 70оС термостабильные целлобиогидролазы из Thermoascus aurantiacus ALKO4242 и Chaetomium thermophilum ALKO4265 превосходят T. reesei Cel7A, а также в случае, когда Thermoascus Cel7A-кор сцеплен с CBD T. reesei Cel7A (Ta Cel7A+Tr CBD). Было удивительным, что целлобиогидролазы, выделенные и клонированные в этом исследовании, превосходят, когда содержат CBD, по скорости и образованию продукта в гидролизе кристаллической целлюлозы целлобиогидролазу Cel7A T. reesei (CBD) уровня техники при традиционной температуре гидролиза 45оС при такой же самой концентрации фермента. Эти результаты также согласуются с теми ферментными препаратами (At Cel7A и Ct Cel7A), которые были очищены из оригинальных хозяев и протестированы в Avicel-гидролизе (50оС, 24 ч) (Пример 2, Таблица 1).
Пример 18. Клонирование эндоглюканазных генов из Acremonium thermophilum ALKO4245, Chaetomium thermophilum ALKO4261 и Thermoascus aurantiacus ALKO4242
Использовали стандартные методы молекулярной биологии, как описано в Примере 13. Конструкции геномных библиотек Acremonium, Chaetomium и Thermoascus были описаны в Примере 12.
Пептиды, происходившие из очищенных эндоглюканаз Acremonium и Chaetomium, имели гомологию с несколькими эндоглюканазами семейства 45 гликозилгидролаз, такими как эндоглюканаза Cel45A Melanocarpus albomyces (AJ515703) и эндоглюканаза Humicola insolens (A35275), соответственно. Пептиды, происходившие из эндоглюканазы Thermoascus, имели почти 100%-ную идентичность с опубликованной последовательностью эндоглюканазы EG1 Thermoascus aurantiacus (AF487830). Чтобы амплифицировать зонд для скринирования геномных библиотек Acremonium и Chaetomium, на основе пептидных последовательностей конструировали вырожденные праймеры. Порядок пептидов в последовательностях протеинов и соответствующий смысловой и антисмысловой характер праймеров выводили из сравнения с гомологичными опубликованными эндоглюканазами. Праймерные последовательности и соответствующие пептиды перечислены в Таблице 14. Благодаря почти 100%-ной идентичности пептидов Thermoascus с опубликованной последовательностью эндоглюканазный ген амплифицировали ПЦР непосредственно из геномной ДНК.
Специфичный зонд к гену cel45A Acremonium thermophilum для скринирования геномной библиотеки амплифицировали с помощью прямого (TAYTGGGAYTGYTGYAARCC) и обратного (RTTRTCNGCRTTYTGRAACCA) праймеров, используя геномную ДНК в качестве матрицы. ПЦР-реакционная смесь содержала 50 мМ Tris-HCl, pH 9,0, 15 мМ (NH4)2SO4, 0,1% Triton X-100, 1,5 мМ MgCl2, 0,1 мМ dNTPs, 0,5 мкг каждого праймера, 1 единицу Dynazyme EXT ДНК-полимеразы (Finnzymes, Финляндия) и приблизительно 0,5 мкг геномной ДНК Acremonium. Условия ПЦР-реакций были следующими: 5 мин начальной денатурации при 95оС, затем 30 циклов по 1 мин при 95оС, 1 мин отжига при 50-60оС, 2 мин удлинения при 72оС и конечное удлинение при 72оС в течение 10 мин. Для амплификации специфичного зонда к cel7B-гену Chaetomium thermophilum (кодирующему Ct EG_54) использовали прямой праймер GGAATTCGAYCARACNGARCARTA и обратный праймер GCAAGCTTCGRCARAARTCRTCRTT. ПЦР-реакционная смесь содержала 10 мМ Tris-HCl, pH 8,8, 50 мМ KCl, 0,1% Triton X-100, 1,5 мМ MgCl2, 0,2 мМ dNTPs, 250 пмол каждого праймера, 2 единицы Dynazyme II ДНК-полимеразы (Finnzymes, Финляндия) и приблизительно 2 мкг геномной ДНК Chaetomium. Условия ПЦР-реакций были такими, как описано выше, за исключением того, что отжиг проводили при 45-50оС.
Из ПЦР-реакции Acremonium были получены два продукта. ДНК-фрагменты около 0,6 т.п.о. и 0,8 т.п.о. выделяли из агарозного геля и клонировали в pCR4-TOPO® TA-вектор (Invitrogen, США), получая плазмиды pALK1710 и pALK1711, соответственно. ДНК-продукты характеризовали секвенированием и проводя Southern-блот-гибридизацию с геномной ДНК Acremonium, расщепленной несколькими рестрикционными ферментами. Рисунки гибридизации, полученные для двух фрагментов в строгих условиях промывки, позволили предположить, что из геномной библиотеки Acremonium могли бы быть скринированы два предполагаемых эндоглюканазных гена. Выведенные аминокислотные последовательности обоих ПЦР-продуктов имеют гомологию с несколькими опубликованными эндоглюканазными последовательностями гликозилгидролаз семейства 45 (программа BLAST, Национальный Центр Биотехнологической Информации; Altschul et al., 1990).
Один ПЦР-продукт ожидаемого размера (по оценке из гомологичной эндоглюканазной последовательности Humicola insolens, A35275), был получен из ПЦР-реакции Chaetomium. ДНК-фрагмент около 0,7 т.п.о. клонировали в pCR4-TOPO® TA-вектор (Invitrogen, США) с получением плазмиды pALK2005 и анализировали, как описано выше. Выведенная аминокислотная последовательность ПЦР-продукта имела гомологию с несколькими опубликованными целлюлазными последовательностями гликозилгидролаз семейства 7 (программа BLAST, версия 2.2.9 в NCBI, Национальный Центр Биотехнологической Информации; Altschul et al., 1990).
Вставку из плазмид pALK1710, pALK1711 и pALK2005 выделяли посредством расщепления рекстрикционными ферментами и метили дигоксигенином в соответствии с инструкциями поставщика (Roche, Германия). Скринировали бляшки размером около 1-2×105 из амплифицированной геномной библиотеки Acremonium или Chaetomium. Температура гибридизации составляла 68оС, а фильтры промывали 2 х 5 мин на RT, используя 2 × SSC - 0,1% SDS, и затем 2×15 мин при 68оС, используя 0,1 × SSC - 0,1% SDS. Было получено несколько позитивных бляшек, из которых от каждого скрининга было очищено пять - шесть сильно гибридизовавшихся бляшек. Фаговые ДНК выделяли и анализировали посредством Southern-блот-гибридизации. Рестрикционные фрагменты, гибридизующиеся с зондом, субклонировали в вектор pBluescript II KS+(Stratagene, США), и релевантные части секвенировали. Во всех случаях субклонированный фаговый фрагмент содержал представляющий интерес ген полной длины. Таблица 15 дает итоговые сведения о зондах, использованных для скрининга эндоглюканазных генов, фаговых клонах, из которых эти гены были выделены, выбранных рестрикционных фрагментах, содержащих гены полной длины с их промоторными и терминаторными областями, наименованиях плазмид, содержащих субклонированный фаговый фрагмент, и депозитарных номерах в Немецкой Коллекции Микроорганизмов и Клеточных Культур (DSM) для штаммов E.coli, несущих эти плазмиды.
Ген cel5A Thermoascus aurantiacus (кодирующий EG_28) (SEQ ID NO: 9) амплифицировали непосредственно из выделенной геномной ДНК посредством ПЦР-реакции. Прямой (ATTAACCGCGGACTGCGCATCATGAAGCTCGGCTCTCTCGTGCTC) и обратный (AACTGAGGCATAGAAACTGACGTCATATT) праймеры, которые использовали для амплификации, конструировали на основе опубликованного гена eg1 T. aurantiacus (AF487830). ПЦР-реакционные смеси содержали 1 х Phusion HF буфер, 0,3 мМ dNTPs, 0,5 мкМ каждого праймера, 2 единицы PhusionTM ДНК-полимеразы (Finnzymes, Финляндия) и приблизительно 0,25 мкг геномной ДНК Thermoascus. Условия ПЦР-реакций были следующие: 5 мин начальной денатурации при 95оС, затем 25 циклов по 30 с при 95оС, 30 с отжиг при 57-67оС, 2,5 мин удлинение при 72оС и заключительное удлинение при 72оС в течение 5 мин. Амплифицированный продукт 1,3 т.п.о., содержащий точный ген (от СТАРТ- до СТОП-кодона), клонировали как SacII-PstI-фрагмент в вектор pBluescript II KS+. Два независимых клона секвенировали и один клон был отобран и обозначен как pALK1926. Депозитарный номер штамма E.coli, содержащего pALK1926, в Немецкой Коллекции Микроорганизмов и Клеточных Культур - DSM 17326.
Релевантные сведения о генах и выведенных протеиновых последовательностях (SEQ ID NO: 9-16) приведены в Таблице 16 и 17, соответственно. Пептидные последовательности очищенных эндоглюканаз Acremonium EG_40 (ген At cel45A), Chaetomium EG_54 (ген Ct cel7B) и Thermoascus EG_28 (ген Ta cel5A) были обнаружены в соответствующих выведенных аминокислотных последовательностях клонированных генов, подтвердив, что были клонированы соответствующие гены.
Выведенные протеиновые последовательности эндоглюканаз Acremonium EG_40 (At cel45A) и EG_40_подобной (At cel45B), Chaetomium EG_54 (Ct cel7B) и Thermoascus EG_28 (Ta cel5A) имеют гомологию с целлюлазами гликозилгидролаз семейства 45 (Acremonium), семейства 7 (Chaetomium) и семейства 5 (Thermoascus), поэтому выделенные гены идентифицируются как члены этих генных семейств. Ближайшими гомологами эндоглюканаз EG_40/Cel45A и EG_40_подобной/Cel45B Acremonium являются эндоглюканазы Thielavia terrestris (CQ827970, 77,3% идентичности) и Myceliophthora thermophila (AR094305, 66,9% идентичности), соответственно (Таблица 18). Две выделенные эндоглюканазы семейства 45 Acremonium идентичны одна другой всего лишь на 53,7%. Из этих ферментов только EG_40/Cel45A содержит целлюлозо-связывающий домен (CBD).
Самая близкая гомология для предсказанной протеиновой последовательности эндоглюканазы EG_54/Cel7 В Chaetomium обнаруживается в целлюлазной последовательностью (AJ515704) Cel7A Melanocarpus albomyces. Идентичность между этими двумя протеиновыми последовательностями составляет 70,6%.
Протеиновая последовательность выделенной эндоглюканазы Thermoascus aurantiacus полностью идентична опубликованной последовательности EGI T. aurantiacus (AF487830, Таблица 18). Наиболее близкая гомология была обнаружена у последовательности β-глюканазы Talaromyces emersonii (AX254752, 71,1% идентичности).
Пример 19. Продуцирование рекомбинантных эндоглюканаз в Trichoderma reesei
Для продуцирования рекомбинантных протеинов Acremonium EG_40/Cel45A и EG_40_подобной/Cel45B и Thermoascus EG_28/Cel5A были сконструированы экспрессионные плазмиды, как описано в Примере 14. Линеаризованные экспрессионные кассеты (Таблица 19) выделяли из векторного каркаса посредством расщепления рестрикционными ферментами, трансформировали в T. reesei А96 и трансформанты очищали, как описано в Примере 14.
Продуцирование эндоглюканаз трансформантами анализировали по супернатантам культур, культивируемых во встряхиваемых колбах (50 мл). Трансформанты выращивали, как в Примере 14, и ферментативную активность рекомбинантного протеина измеряли по супернатанту культуры, как высвобождение редуцирующих сахаров из карбоксиметилцеллюлозы (2% (в/об) CMC) при 50оС в 50 мМ цитратного буфера, pH 4,8, по существу как описано у Bailey and Nevalainen, 1981; Haakana et al., 2004. Продуцирование рекомбинантых протеинов определяли также по супернатантам культур с помощью SDS-полиакриламидного гель-электрофореза. Acremonium EG_40-специфические поликлональные антитела получали в кроликах (Университет Хельсинки, Финляндия). Экспрессию EG_40 проверяли Western-блот-анализом с помощью анти- EG_40 антител, используя систему ProtoBlot Western blot AP (Promega). Генотипы выбранных трансформантов анализировали Southern-блоттингом, используя в качестве зонда экспрессионную кассету.
pH-оптимум гетерологично произведенных эндоглюканаз определяли в универсальном буфере Маклвейна в интервале pH 4,0-8,0, используя карбоксиметилцеллюлозу в качестве субстрата. Как показано на Фигуре 6А, самый широкий интервал pH (4,-6,0) относится к протеину EG_40/Cel45A Acremonium с оптимумом при pH 5,5. pH-оптимумы для других гетерологично произведенных эндоглюканаз составляют 5,0-5,5 и 6,0 для Acremonium EG_40_подобной/Cel45B и Thermoascus EG_28/Cel5A, соответственно. Оптимальную температуру для ферментативной активности этих эндоглюканаз определяли в температурном диапазоне 50-85оС, как описано выше. Было определено, что самая высокая активность ферментов проявляется при 75, 60 и 75оС для Acremonium EG_40/Cel45A, EG_40_подобной/Cel45B и Thermoascus EG_28/Cel5A, соответственно (Фигура 6В).
Выбранные трансформанты культивировали, как описано в Примере 14 в 2-литровом биореакторе в течение четырех дней (28оС, pH 4,2), чтобы получить материал для тестов по применению.
Пример 20. Клонирование бета-глюкозидазных генов Acremonium thermophilum ALKO4245, Chaetomium thermophilum ALKO4261 и Thermoascus aurantiacus ALKO4242
Использовали стандартные методы молекулярной биологии, как описано в Примере 13. Конструкции геномных библиотек Acremonium, Chaetomium и Thermoascus были описаны в Примере 12.
Пептиды, происходящие из очищенных β-глюкозидаз Acremonium, Chaetomium и Thermoascus, имели гомологию с несколькими β-глюкозидазами гликозилгидролаз семейства 3, такими как β-глюкозидазы Acremonium cellulolyticus (BD168028), Ttichoderma viride (AY368687) и Talaromyces emersonii (AY072918), соответственно. Для амплификации зонда для скринирования геномных библиотек Acremonium, Chaetomium и Thermoascus на основе пептидных последовательностей были сконструированы вырожденные праймеры. Порядок пептидов в протеиновой последовательности и соответствующий смысловой или антисмысловой характер праймеров выводили из сравнения с гомологичными опубликованными β-глюкозидазами. Праймерные последовательности и соответствующие пептиды перечислены в Таблице 20.
Зонды для скринирования сконструированных геномных библиотек амплифицировали с помощью комбинаций перечисленных праймеров (Таблица 20), используя геномные ДНК Acremonium, Chaetomium и Thermoascus в качестве матриц. ПЦР-реакционные смеси содержали 50 мМ Tris-HCl, pH 9,0, 15 мМ (NH4)2SO4, 0,1% Triton X-100, 1,5 мМ MgCl2, 0,1-0,2 мМ dNTPs, 0,25 мкг каждого праймера, 1 единицу Dynazyme EXT ДНК-полимеразы (Finnzymes, Финляндия) и приблизитеьно 0,5 мкг геномной ДНК. Условия ПЦР-реакций были следующие: 5 мин начальной денатурации при 95оС, затем 30 циклов по 1 мин при 95оС, 1 мин отжига при 40оС (ДНК Acremonium в качестве матрицы), при 50оС (ДНК Chaetomium в качестве матрицы) или при 63оС (ДНК Thermoascus в качестве матрицы), 2-3 мин удлинения при 72оС и заключительное удлинение при 72оС в течение 5-10 мин.
Специфические ПЦР-продукты ожидаемого размера (оцененного по гомологичным β-глюкозидазным последовательностям BD168028, AY072918 и AY368687) выделяли из агарозного геля. ДНК-фрагменты размером около 1,8 т.п.о. (Acremonium), 1,5 т.п.о. (Chaetomium) и 1,52 т.п.о. (Thermoascus) клонировали в вектор pCR4-TOPO® TA (Invitrogen, США) с получением плазмид pALK1924, pALK1935 и pALK1713, соответственно. ДНК-продукты характеризовали секвенированием и проведением Southern-блот-гибридизации с геномной ДНК, расщепленной несколькими рестрикционными ферментами. Рисунки гибридизации в строгих условиях промывки позволяют считать, что из геномной библиотеки Acremonium, Chaetomium и Thermoascus мог быть выделен один предполагаемый β-глюкозидазный ген. Выведенные аминокислотные последовательности всех трех ПЦР-продуктов имеют гомологию с несколькими опубликованными β-глюкозидазными последовательностями гликозилгидролаз семейства 3 (программа BLAST, Национальный Центр Биотехнологической Информации; Altschul et al., 1990).
Вставку из плазмид pALK1924, pALK1935 и pALK1713 выделяли посредством расщепления рестрикционными ферментами и метили диоксигенином в соответствии с инструкциями поставщика (Roche, Германия). Около 1-2×105 бляшек из геномных библиотек Acremonium, Chaetomium и Thermoascus скринировали, как описано в Примере 18. Было получено несколько позитивных бляшек, из которых от каждого скринирования очищали пять-шесть сильно гибридизовавшихся. Фаговые ДНК выделяли и анализировали посредством Southern-блот-гибридизации. Рестрикционные фрагменты, гибридизовавшиеся с зондом, субклонировали в вектор pBluescript II KS+(Stratagene, США) и релевантные части секвенировали. Во всех случаях субклонированный фаговый фрагмент содержал являющийся предметом интереса ген полной длины. В Таблице 21 суммированы данные по зондам, использованным для скрининга β-глюкозидазных генов, фаговым клонам, из которых были выделены гены, выбранные рестрикционные фрагменты, содержащие гены полной длины с их промоторными и терминаторными областями, наименованиям плазмид, содержащих субклонированный фаговый фрагмент и депозитарные номера в Немецкой Коллекции Микроорганизмов и Клеточных Культур (DSM) штаммов E.coli, несущих эти плазмиды.

Релевантные сведения о генах и выведенных протеиновых последовательностях (SEQ ID NO: 21-26) суммированы в Таблице 22 и 23, соответственно. Пептидные посделовательности очищенных протеинов Acremonium βG_101 (At Cel3A), Chaetomium βG_76 (Ct Cel3A) и Thermoascus βG_81 (Ta Cel3A) были обнаружены в соответствующих выведенных аминокислотных последовательностях клонированных генов, подтверждая, что были клонированы соответствующие гены.
Выведенные протеиновые последовательности β-глюкозидаз Acremonium βG_101/Cel3A, Chaetomium βG_76/Cel3A и Thermoascus βG_81/Cel3A имеют гомологию с ферментами гликозилгидролазного семейства 3, идентифицируя, тем самым, принадлежность выделенных генов к этому генному семейству. Ближайшими аналогами β-глюкозидаз Acremonium, Chaetomium и Thermoascus являются таковые из Magnaporthe grisea (β-глюкозидаза, AY849670), Neurospora crassa (гипотетический, XM_324308) и Talaromyces emersonii (β-глюкозидаза, AY072918), соответственно (Таблица 24). Самая высокая обнаруженная идентичность последовательностей (73,2%) была у C. thermophilum βG_76/Cel3A с гипотетическим протеином N. Crassa, что подтверждало, что новые гены были клонированы.
Пример 21. Продуцирование рекомбинантных бета-глюкозидаз в Trichoderma reesei
Для продуцирования рекомбинантных протеинов Acremonium βG_101/Cel3A, Chaetomium βG_76/Cel3A и Thermoascus βG_81/Cel3A были сконструированы экспрессионные плазмиды, как описано в Примере 14. Линеаризованные экспрессионные кассеты (Таблица 25) выделяли из векторного каркаса посредством расщепления рестрикционными ферментами, трансформировали в T. reesei А96 или А33 (в обоих штаммах делетированы гены, кодирующие четыре главные целлюлазы CBHI/Cel7A, CBHII/Cel6A, EGI/Cel7B и EGII/Cel5A), и трансформанты очищали, как описано в Примере 14.
Продуцирование β-глюкозидаз трансформантами анализировали по супернатантам культур, культивируемых во встряхиваемых колбах (50 мл). Трансформанты выращивали, как в Примере 14, и ферментативную активность рекомбинантного протеина измеряли по супернатанту культуры, используя 4-нитрофенил-β-D-глюкопиранозидный субстрат, как описано у Bailey and Nevalainen, 1981. Продуцирование рекомбинантых протеинов определяли также по супернатантам культур с помощью SDS-полиакриламидного гель-электрофореза. Кроме того, экспрессию Thermoascus βG_81 проверяли Western-блот-анализом с помощью анти- βG_81 антител, как описано в Примере 19. Генотипы выбранных трансформантов анализировали Southern-блоттингом, используя в качестве зонда экспрессионную кассету.
pH-оптимум гетерологично произведенных β-глюкозидаз определяли в универсальном буфере Маклвейна в интервале pH 3,0-8,0, используя 4-нитрофенил-β-D-глюкопиранозид в качестве субстрата. pH-оптимумы для Acremonium βG_101, Chaetomium βG_76 и Thermoascus βG_81 составляют 4,5, 5,5 и 4,5, соответственно (Фигура 7А). Оптимальную температуру для ферментативной активности этих β-глюкозидаз определяли в температурном диапазоне 50-85оС, как описано выше. Было определено, что самая высокая активность ферментов проявляется при 70, 65 и 75оС для Acremonium βG_101/Cel3A, Chaetomium βG_76/Cel3A и Thermoascus βG_81/Cel3A, соответственно (Фигура 7В).
Выбранные трансформанты культивировали, как описано в Примере 14 в 2-литровом биореакторе в течение четырех дней (28оС, pH 4,2), чтобы получить материал для тестов по применению.
Пример 22. Клонирование ксиланазных генов Acremonium thermophilum ALKO4245 и Thermoascus aurantiacus ALKO4242
Использовали стандартные методы молекулярной биологии как описано в Примере 13. Конструкция геномной библиотеки Acremonium была описана в Примере 12.
Пептиды, происходящие из очищенной ксиланазы Acremonium, имели гомологию с ксиланазами гликозилгидролаз семейства 10, такими как Humicola grisea XYNI (AB001030). Все пептиды, происходящие из ксиланазы Thermoascus, были полностью идендичны с опубликованной последовательностью XYNI Thermoascus aurantiacus (AJ132635), идентифицируя, тем самым, очищенный протеин как тот же самый фермент. Благодаря этому ксиланазный ген Thermoascus был амплифицирован посредством ПЦР из геномной ДНК.
Для амплификации зонда для скрининга ксиланазного гена Acremonium из геномной библиотеки на основе пептидных последовательностей были сконструированы вырожденные праймеры (Пример 11, Таблица 5). Порядок пептидов в протеиновой последовательности и соответствующий смысловой или антисмысловой характер праймеров выводили из сравнения с гомологичной последовательностью XYNI Humicola insolens (AB001030). Смысловая праймерная последовательность (GAYGGYGAYGCSACYTAYATG) основана на Пептиде 3 (аминокислоты 2-8), а антисмысловой праймер (YTTYTGRTCRTAYTCSAGRTTRTA) - на Пептиде 1 (аминокислоты 4-11).
Из реакции был получен ПЦР-продукт ожидаемого размера (оцененного по гомологичной последовательности XYNI Humicola insolens AB001030). ДНК-фрагмент около 0,7 т.п.о. клонировали в вектор pCR4-TOPO® TA (Invitrogen, США), получая плазмиду pALK1714, и характеризовали секвенированием. Выведенная аминокислотная последовательность ПЦР-продукта имела гомологию с несколькими опубликованными ксиланазными последовательностями гликозилгидролазного семейства 10 (программа BLAST, Национальный Центр Биотехнологической Информации; Altschul et al., 1990).
Вставку из плазмиды pALK1714 выделяли посредством расщепления рестрикционными ферментами и метили диоксигенином в соответствии с инструкциями поставщика (Roche, Германия). Около 1-2×105 бляшек из амплифицированной геномной библиотеки скринировали, как описано в Примере 18. Было получено несколько позитивных бляшек, из которых пять, сильно гибридизовавшихся, очищали. Фаговые ДНК выделяли и анализировали посредством Southern-блот-гибридизации. Рестрикционный фрагмент 3,5 т.п.о. XbaI, гибридизовавшиеся с зондом, субклонировали в вектор pBluescript II KS+(Stratagene, США), производя плазмиду pALK1725. Релевантные части pALK1725 секвенировали и нашли, что она содержит ген xyn10A Acremonium thermophilum полной длины (SEQ ID NO: 19). Депозитарный номер штамма E.coli, содержащего pALK1725 в Немецкой Коллекции Микроорганизмов и Клеточных Культур (DSM) 16726.
Ген xyn10A Thermoascus aurantiacus (SEQ ID NO: 17) был амплифицирован непосредственно из выделенной геномной ДНК посредством ПЦР-реакции. Прямой (TTATACCGCGGGAAGCCATGGTTCGACCAACGATCCTAC) и обратный (TTATAGGATCCACCGGTCTATACTCACTGCTGCAGGTCCTG) праймеры, которые использовались в амплификации генов, конструировали на основе опубликованного гена xynA T. aurantiacus (AJ132635). ПЦР-реакционные смеси содержали 50 мМ Tris-HCl, pH 9,0, 15 мМ (NH4)2SO4, 0,1% Triton X-100, 1,5 мМ MgCl2, 0,3 мМ dNTPs, 1 мкМ каждого праймера, 1 единицу Dynazyme EXT ДНК-полимеразы (Finnzymes, Финляндия) и приблизительно 0,5 мкг геномной ДНК Thermoascus. Условия ПЦР-реакций были следующие: 5 мин начальной денатурации при 95оС, затем 30 циклов по 1 мин при 95оС, 1 мин отжига при 60-66оС, 3 мин удлинения при 72оС и заключительное удлинение при 72оС в течение 10 мин. Амплифицированный продукт 1,9 т.п.о., содержащий точный ген (от СТАРТ- до СТОП-кодона), был клонирован как ScaII-BamHI-фрагмент в вектор pBluescript II KS+. Были секвенированы три независимых клона, и один клон был отобран и обозначен как pALK1715. Депозитарный номер штамма E.coli, содержащего pALK1715, в Немецкой Коллекции Микроорганизмов и Клеточных Культур (DSM) - 16724.
Депозитарный номер штамма E.coli, содержащего pALK1725, в Немецкой Коллекции Микроорганизмов и Клеточных Культур (DSM) 16726.
Релевантные данные о генах и выведенных протеиновых последовательностях (SEQ ID NO: 17-20) суммированы в Таблице 26 и 27, соответственно. Пептидные последовательности очищенных протеинов XYN_60 Acremonium и XYN_30 Thermoascus были обнаружены в соответствующих выведенных аминокислотных последовательностях клонированных генов (At xyn10A и Ta xyn10A, соответственно), подтверждая, что соответствующие гены были клонированы.
Выведенные протеиновые последовательности ксиланаз Acremonium и Thermoascus имеют гомологию с несколькими ферментами гликозилгидролазного семейства 10, идентифицируя соответствующие гены как члены семейства 10 ксиланаз. Ближайшим обнаруженным аналогом XYN_60/Xyn10A Acremonium является XYLI Humicola grisea (AB001030), показывающий 67,1%-ную идентичность с XYN_60 (Таблица 28). Предсказанная протеиновая последовательность выделенной ксиланазы XYN_30/Xyn10A Thermoascus aurantiacus полностью идентична последовательности, опубликованной XYNA T. aurantiacus (Р23360, Таблица 28). Самая высокая гомология была обнаружена у ксиланазной последовательности Aspergillus niger (A62445, 69,7% идентичности).
Пример 23. Продуцирование рекомбинантных ксиланаз в Trichoderma reesei
Для продуцирования рекомбинантных протеинов Acremonium XYN_60/Xyn10A и Thermoascus XYN_30/Xyn10A были сконструированы экспрессионные плазмиды, как описано в Примере 14. Линеаризованные экспрессионные кассеты (Таблица 29) выделяли из векторного каркаса посредством расщепления рестрикционными ферментами, трансформировали в T. reesei А96, и трансформанты очищали, как описано в Примере 14.
Продуцирование ксиланаз трансформантами анализировали по супернатантам культур, культивируемых во встряхиваемых колбах (50 мл). Трансформанты выращивали, как в Примере 14, и ферментативную активность рекомбинантного протеина измеряли по супернатанту культуры, как вывобождение редуцирующих сахаров из ксилана березы (1% в/об) при 50оС в 50 мМ цитратного буфера, pH 5,3 как описано у Bailey and Poutanen, 1989. Продуцирование рекомбинантного протеина определяли также по супернатанту культуры с помощью SDS-полиакриламидного гель-электрофореза. Кроме того, экспрессию обеих ксиланаз определяли Western-блот-анализом с помощью анти-XYN_30 или анти-XYN_60 антител, как описано в Примере 19. Генотипы выбранных трансформантов анализировали Southern-блоттингом, используя в качестве зонда экспрессионную кассету.
Thermoascus XYN_30/Xyn10A производили в T. reesei, и определяли pH-оптимум гетерологично произведенного протеина в универсальном буфере Маклвейна в интервале pH 3,0-8,0, используя ксилан березы в качестве субстрата (Фигура 8А). Оптимальный pH был определен как 4,5. Температурный оптимум для ферментативной активности XYN_30 был определен как 75оС (Фигура 8В).
Выбранные трансформанты культивировали, как описано в Примере 14, в 2-литровом биореакторе в течение четырех дней (28оС, pH 4,2), чтобы получить материал для тестов по применению.
Пример 24. Действие рекомбинантных целлобиогидролаз при гидролизе
Действие очищенных рекомбинантных целлобиогидролаз оценивали в исследованиях гидролиза с очищенными ферментами T. reesei. Гидролиз выполняли с контрольными смесями очищенных ферментов на нескольких предварительно обработанных субстратах. Фильтраты культур T. reesei, содержащих различные клоны CBH/Cel7A-ферментов, получали, как описано в Примерах 14 и 15, и CBH-ферменты очищали аффинной хроматографией, как описано в Примере 2. Кроме того, в ферментных смесях использовали чистые целлюлазы T. reesei (очищенные как описано Suurnäkki et al., 2000). В эксперименте использовались следующие целлобиогидролазы:
Thermoascus aurantiacus ALKO4242 CBH (Ta Cel7A)
Thermoascus aurantiacus ALKO4242 CBH (Ta Cel7A) с генетически присоединенным CBD Trichoderma reesei (Ta Cel7A+Tr CBD)
Thermoascus aurantiacus ALKO4242 CBH (Ta Cel7A) с генетически присоединенным CBD Chaetomium thermophilum (Ta Cel7A+Ct CBD)
Acremonium thermophilum ALKO4245 CBH (At Cel7A)
Chaetomium thermophilum ALKO4265 CBH (Ct Cel7A).
Каждый CBH/Cel7, который должен был тестироваться (дозировка 14,5 мг/г сухого вещества субстрата), использовали либо вместе с EGII/Cel5A T. reesei (3,6 мг/г), либо в смеси, содержащей EGI/Cel7B T. reesei (1,8 мг/г), EGII/Cel5A (1,8 мг/г), ксиланазу pI 9 (Tenkanen et al., 1992) (5000 нкат/г) и ацетил ксилан эстеразу (AXE) (Sundberg and Poutanen, 1991) (250 нкат/г). Все смеси дополняли β-глюкозидазой из коммерческого ферментного препарата Novozym 188 (176 нкат/г сух. вес.). В трех экземплярах пробирки, содержащие ферментную смесь и 10 мг (сухого вещества)/мл субстрата, суспендированного в 0,05 М ацетата натрия, инкубировали при помешивании с помощью магнитной мешалки при 45оС в течение 48 ч. Приготавливали и контрольные образцы с инактивированными ферментами и соответствующими субстратами. Высвобождение гидролизных продуктов измеряли, как редуцирующие сахара, посредством DNS-метода, используя глюкозу в качестве стандарта (Таблица 30).
В этом эксперименте использовали следующие субстраты:
Кристаллическую целлюлозу (Avicel);
Промытое предварительно обработанное паром волокно ели (импрегнированное 3% в/в SO2 в течение 20 мин, затем предобработка паром при 215оС в течение 5 мин), сухого материала 25,9% (SPRUCE);
Промытое сырое оксидированное волокно кукурузной соломы (WOCS);
Промытое предварительно обработанное паром волокно ивы (предобработка в течение 14 мин при 210оС), сухого вещества 23,0% (WILLOW).
В Таблице 30 различные целлобиогидролазы сравниваются на основе одной и той же дозы протеина в гидролизе. Результаты показывают, что на целлюлозных субстратах (Avicel и волокно ели) Cel7A Thermoascus aurantiacus с генетически присоединенным CBD показал отчетливо более высокий гидролиз, чем T. reesei CBHI/Cel7A. Без CBD T. aurantiacus Cel7A был менее эффективным на этих субстратах. Действие целлобиогидролаз Acremonium thermophilum и Chaetomium thermophilum было также лучше, чем действие T. reesei CBHI/Cel7A на нескольких субстратах; в частности C. thermophilum Cel7A показал высокую эффективность на чистой целлюлозе (Avicel).
В случае субстратов, содержащих значительные количества гемицеллюлозы (ива и кукурузная солома), CBH/Cel7-ферменты ясно нуждались дополнительно как в гемицеллюлазах, так и эндоглюканазах, чтобы действовать эффективно. Если дополнительные гемицеллюлазы не присутствовали, Cel7A T. aurantiacus с генетически присоединенным CBD снова показывал высочайший гидролиз. С самыми важными гемицеллюзо-деградирующими ферментами (ксиланазой, ацетилксилан эстеразой и EGI) Cel7A T. aurantiacus с генетически присоединенным CBD снова действовал с высочайшей эффективностью. A. thermophilum Cel7A был более эффективным, чем фермент T. reesei, а C. thermophilum производил гидролизные продукты на таком же уровне, что и T. reesei CBHI/Cel7A. Целлюлозо-связывающий домен T. reesei, по-видимому, дает слегка лучшую эффективность в гидролитическом действии T. aurantiacus Cel7A, чем CBD C. thermophilum, хотя разница была довольно маленькой.
Можно заключить, что когда CBHI/Cel7A был замещен в смеси ферментов Trichoderma произведенными здесь целлобиогидролазами, гидролизная эффективность, судя по экспериментальным данным, была ясно улучшенной в случае T. aurantiacus Cel7A с гетенически присоединенным CBD, а также улучшенной в случае A. thermophilum Cel7A и C. thermophilum Cel7A. Если принять во внимание также лучшую температурную стабильность произведенных здесь целлобиогидролаз, результаты указывают, что действие смесей целлюлазных ферментов при температурах, более высоких чем 45оС, можно явно улучшить при использовании произведенных здесь целлобиогидролаз.
Пример 25. Действие рекомбинантных эндоглюканаз при гидролизе
Препараты, содержащие эндоглюканазы, сравнивали в гидролизных исследованиях смешанными с очищенными ферментами CBH/Cel7 и CBH/Cel6 на нескольких предварительно обработанных субстратах. Фильтраты культур T. reesei, содержащих различные клоны эндоглюканазных ферментов, получали, как описано в Примере 19. Ферменты обогащали, удаляя термолабильные протеины из смесей путем температурной обработки (60оС, 2 ч, pH 5), и супернатант использовали для гидролизных исследований. Кроме того, в ферментативных смесях использовали чистые целлюлазы T. reesei (очищенные, как описано Suurnäkki et al., 2000). В эксперименте использовались следующие эндоглюканазы:
Эндоглюканаза Acremonium thermophilum ALKO4245 At EG_40/Cel45A (ALKO4245 EG_40);
Эндоглюканаза Acremonium thermophilum ALKO4245 At EG_40_подобная/Cel45B (ALKO4245 EG_40_подобная);
Эндоглюканаза Thermoascus aurantiacus ALKO4242 Ta EG_28/Cel5A (ALKO4242 EG_28).
В этом эксперименте использовали следующие субстраты:
Промытое предварительно обработанное паром волокно ели (импрегнированное 3% SO2 в течение 20 мин, затем предобработка паром при 215оС в течение 5 мин), сухого материала 25,9% (SPRUCE);
Разорванное паром волокно кукурузной соломы (SECS);
Эндоглюканазы, подлежащие тестированию (в дозе 840 нкат/г сухого вещества, основываясь на эндоглюканазной активности против HEC в соответствии с IUPAC, 1987), использовали либо с целлобиогидролазами T. reesei (CBHI/Cel7A, 8,1 мг/г сух. вещ. и CBHII/Cel6A, 2,0 мг/г сух. вещ.), либо с Thermoascus aurantiacus Cel7A с генетически присоединенным CBD T. reesei (10,1 мг/г сух. вещ.). Для сравнения в эксперименты были также включены очищенные (Suurnäkki et al., 2000) EGI (Cel7B) и EGII (Cel5A) T. reesei. Все смеси дополняли β-глюкозидазой Novozym 188 (чтобы сделать общую дозу β-глюкозидазы 500 нкат/г сух. вес.; относительно высокую дозу использовали, чтобы компенсировать разницу в фоновых активностях различных EG-препаратов). В трех экземплярах пробирки инкубировали при помешивании при 45оС в течение 48 ч и приготовляли контрольные образцы с инактивированными ферментами и соответствующими субстратами. Высвобождение гидролизных продуктов измеряли, как редуцирующие сахара посредством DNS-метода, используя глюкозу в качестве стандарта (Таблица 31).
В Таблице 31 различные эндоглюканазы сравниваются на основе одной и той же дозы активности в гидролизе. Возможно, здесь завышено действие ферментов с низкой специфической активностью против субстрата (гидроксиэтил целлюлоза), использованного в анализе, и недооценена эффективность ферментов с высокой специфической активностью против гидроксиэтил целлюлозы. В любом случае результаты показывают, что эндоглюканазы Acremonium thermophilum работают очень хорошо в гидролизе, когда действуют вместе с обеими целлобиогидролазами, используемыми в смеси. Эндоглюканазы A. thermophilum имеют действие, подобное действию T. reesei EGI/Cel7B, который является очень эффективным ферментом на гемицеллюлозо-содержащем субстрате из кукурузной соломы благодаря его сильной побочной ксиланазной активности. Эндоглюканаза Cel5A T. aurantiacus (ALKO4242 EG_28) показала более низкий гидролиз, чем ферменты T. reesei.
Можно сделать вывод, что эндоглюканазы из A. thermophilum действуют со сравнительной или повышенной эффективностью по сравнению с соответствующими ферментами Trichoderma в гидролизе, если судить по данному эксперименту. Если принять во внимание также температурную стабильность произведенных здесь эндоглюканаз, результаты указывают, что действие смесей целлюлазных ферментов при температурах, более высоких, чем 45оС, можно улучшить при использовании описанных здесь эндоглюканаз.
Пример 26. Гидролиз предварительно обработанных паром волокон ели при высоких температурах
Промытое вспученное паром волокно ели (импрегнированное 3% в/в SO2 в течение 20 мин, затем предобработка паром при 215оС в течение 5 мин) с содержанием сухого материала 25,9% суспендировали в 5 мл 0,05 М натрий-ацетатного буфера в концентрации 10 мг/мл. Этот субстрат гидролизовали, используя различные ферментные смеси в тестовых пробирках при помешивании с помощью магнитной мешалки в водяной бане с регулируемой температурой в течение 72 ч. Для каждого образца тестовые пробирки в трех экземплярах изымали из гидролиза, кипятили в течение 10 мин, чтобы завершить ферментный гидролиз, центрифугировали и супернатант анализировали на продукты реакции гидролиза. Пустые образцы, содержащие только субстрат (только буфер, добавленный вместо ферментов), также инкубировали при соответствующих условиях.
Смесь термофильных целлюлаз приготовляли, используя следующие компоненты:
Термофильный препарат CBH/Cel7, содержащий Thermoascus aurantiacus ALKO4242 Cel7A c генетически присоединенным CBD T. reesei CBHI/Cel7A. Протеиновый препатат производили, как описано в Примере 15, и очищали в соответствии с Примером 2, получая очищенный препарат Ta Cel7A+Tr CBD с содержанием протеина 5,6 мг/мл;
Препарат термофильной эндоглюканазы, содержащий эндоглюканазу At EG_40 Acremonium thermophilum 4245. Протеин получали T. reesei, как описано в Примере 19. Чтобы обогатить термофильные компоненты, среду отработанной культуры обрабатывали нагреванием (60оС в течение 2 часов). Полученный препарат, содержал 4,9 мг/мл протеина, и его эндоглюканазная активность составляла (согласно IUPAC, 1987) 422 нкат/мл;
Препарат термофильной β-глюкозидазы, приготовленный, как описано в Примере 21, содержащий β-глюкозидазу Ta βG_81/Cel3A Thermoascus aurantiacus ALKO4242. Чтобы обогатить термофильные компоненты, ферментативный бульон обрабатывали нагреванием (65оС в течение 2 часов). Полученный препарат содержал 4,3 мг/мл протеина, и его эндоглюканазная активность составляла (согласно Bailey and Linko, 1990) 6270 нкат/мл.
Эти ферментные препараты комбинировали следующим образом (на 10 мл смеси): CBH/Cel7-препарат 4,51 мл, эндоглюканазный препарат 5,19 мл и β-глюкозидазный препарат 0,29 мл. Эту смесь использовали, как «СМЕСЬ 1» термофильных ферментов.
Для сравнения и контроля была составлена известная из уровня техники смесь коммерческих ферментов Trichoderma reesei, включающая (на 10 мл): 8,05 мл Celluclast 1,5 L FG (от Novozymes A/S). Она была обозначена как «T. REESEI ФЕРМЕНТЫ».
Ферменты дозировали на основе FPU-активности смесей: «СМЕСЬ 1», используя дозировку 5,5 FPU на 1 грамм сухого вещества в субстрате волокон ели, а «T. REESEI ФЕРМЕНТЫ», используя 5,8 FPU на 1 грамм сухого вещества в субстрате волокон ели.
Образцы отбирали из гидролиза после 24, 48 и 72 ч и обрабатывали, как описано выше. Продукты гидролиза квантифицировали, используя анализ по редуцирующим сахарам (Bernfeld, 1955), используя глюкозу в качестве стандарта. Количество гидролизных продуктов, как редуцирующих сахаров, представлено на Фигуре 9.
Результаты ясно показывают лучшее действие описанных здесь ферментов по сравнению с известными из уровня техники ферментами Trichoderma при 55 и 60оС на еловом субстрате. На основании HPCL-анализа максимальный выход сахаров из субстрата составил бы 5,67 мг на 10 мг сухого елового субстрата. Из-за относительно низкой дозировки фермента окончательный выход сахаров был отчетливо пониженным. Для термостабильных ферментов выход сахаров на основании анализа редуцирующих сахаров составлял 66 и 57% от теоретического при 55 и 60оС, соответственно. Для известных из уровня техники ферментов Trichoderma он составлял только 31 и 11% при 55 и 60оС, соответственно.
Пример 27. Гидролиз предварительно обработанных паром волокон кукурузной соломы при высоких температурах
Разорванное паром волокно кукурузной соломы (обработка при 195оС в течение 5 мин) с содержанием сухого вещества 45,3% суспендировали в 5 мл 0,05 М натрий-ацетатного буфера в концентрации 10 мг/мл. Обработки и измерения производили, как описано в Примере 26.
Смесь описываемых здесь термофильных целлюлаз приготовляли, используя следующие компоненты:
Термофильный препарат CBH, содержащий Thermoascus aurantiacus ALKO4242 Cel7A c генетически присоединенным CBD T. reesei (CBHI/Cel7A Ta Cel7A+Tr CBD, Пример 15). Содержание протеина в препарате составляло 31 мг/мл;
Препарат термофильной эндоглюканазы, содержащий эндоглюканазу At EG_40/Cel45A Acremonium thermophilum 4245, получали как описано в Примере 19. Концентрированный ферментный препарат имел эндоглюканазную активность (согласно IUPAC, 1987) 2057 нкат/мл;
Препарат термофильной β-глюкозидазы, содержащий β-глюкозидазу Ta βG_81/Cel3A Thermoascus aurantiacus ALKO4242, получали, как описано в Примере 21, он имел β-глюкозидазную активность (согласно Bailey and Linko, 1990) 11500 нкат/мл;
Термофильный ксиланазный продукт, содержащий ксиланазу AM24, происходящий из Novomuraea flexuosa DSM43186. Этот продукт приготовляли, используя рекомбинантный штамм Trichoderma reesei, который был трансформирован экспрессионной кассетой pALK1502, как описано в WO 2005/100557. Твердый продукт растворяли в воде, чтобы сделать 10%-ный раствор, и получали ферментный препарат с ксиланазной активностью (анализировалось по Bailey et al., 1992) 208000 нкат/мл.
Эти ферментные препараты комбинировали следующим образом (на 10 мл смеси): CBH/Cel7-препарат 7,79 мл, эндоглюканазный препарат 0,96 мл и β-глюкозидазный препарат 1,14 мл. Эту смесь использовали как «СМЕСЬ 2» термофильных ферментов.
Для сравнения и контроля была составлена известная из уровня техники смесь коммерческих ферментов Trichoderma reesei, включающая (на 10 мл): 8,05 мл Celluclast 1,5 L FG (от Novozymes A/S) и 1,95 мл Novozyme 188 (от Novozymes A/S). Она была обозначена как «T. REESEI ФЕРМЕНТЫ».
Образцы отбирали из гидролиза после 24, 48 и 72 ч и обрабатывали, как описано выше. Продукты гидролиза квантифицировали, используя анализ по редуцирующим сахарам (Bernfeld, 1955), используя глюкозу в качестве стандарта. Результаты от пустых субстратов вычитались из образцов с ферментами, и концентрация гидролизных продуктов, как редуцирующих сахаров, представлена на Фигуре 10.
Результаты ясно показывают лучшее действие описанных здесь ферментов по сравнению с известными из уровня техники ферментами Trichoderma. При 45оС смесь термофильных ферментов показала более эффективный гидролиз по сравнению с ферментами T. reesei: гидролиз шел быстрее и, кроме того, был получен более высокий выход сахаров. На основе HPLC-анализа максимальный выход сахаров (включая свободные растворимые сахара в непромытом субстрате, который использовался) из субстрата составил бы 5,73 мг на 10 мг сухого субстрата. Таким образом, гидролиз с помощью ферментов СМЕСИ 2 был почти полным в пределах 48 часов. При 55 и 60оС описанные здесь термофильные ферменты также показали отчетливо лучшее действие в гидролизе по сравнению с известными из уровня техники ферментами Trichoderma.
Пример 28. Гидролиз предварительно обработанных при высоких температурах волокон кукурузной соломы с использованием смеси с термостабильной ксиланазой
Повторяли процедуру, описанную в Примере 27, за исключением того, что ксиланазный продукт XT 02026A3 был заменен препаратом термостабильной ксиланазы, содержащим ксиланазу Ta XYN_30/Xyn10A Thermoascus aurantiacus ALKO4242, произведенную в T. reesei. Ферментный бульон, полученный, как описано в Примере 23, имел ксиланазную активность 132000 нкат/мл (анализировалось по Bailey et al., 1992).
Эти ферментные препараты комбинировали следующим образом (на 10 мл смеси): CBH/Cel7-препарат 7,64 мл, эндоглюканазный препарат 0,96 мл, β-глюкозидазный препарат 1,15 мл и ксиланазный препарат 0,25 мл. Эту смесь использовали как «СМЕСЬ 3» термофильных ферментов.
Для сравнения и контроля была составлена известная из уровня техники смесь коммерческих ферментов Trichoderma reesei, включающая (на 10 мл): 8,05 мл Celluclast 1,5 L FG (от Novozymes A/S) и 1,95 мл Novozyme 188 (от Novozymes A/S). Она была обозначена как «T. REESEI ФЕРМЕНТЫ».
Образцы отбирали из гидролиза после 24, 48 и 72 ч и обрабатывали, как описано выше. Продукты гидролиза квантифицировали, используя анализ по редуцирующим сахарам (Bernfeld, 1955), используя глюкозу в качестве стандарта. Результаты от пустых субстратов вычитались из образцов с ферментами, и концентрация гидролизных продуктов, как редуцирующих сахаров, представлена на Фигуре 11.
Результаты ясно показывают лучшее действие описанных здесь ферментов по сравнению с известными из уровня техники ферментами Trichoderma. При 45оС смесь термофильных ферментов показала более эффективный гидролиз по сравнению с ферментами T. reesei. При 55 и 60оС описанные здесь термофильные ферменты также показали отчетливо лучшее действие в гидролизе по сравнению с известными из уровня техники ферментами Trichoderma. Действие новой ферментой смеси при 60оС было на таком же самом уровне, что и действие известных из уровня техники ферментов при 45оС.
Пример 29. Гидролиз предварительно обработанных при высоких температурах волокон ели с использованием смеси с термостабильной ксиланазой
Процедуру, как она описана в Примере 28, повторяли с промытым вспушенным паром волокном ели (импрегнированное 3% в/в SO2 в течение 20 мин, затем предобработка паром при 215оС в течение 5 мин, с содержанием сухого вещества 25,9%) в качестве субстрата, используя температуры гидролиза 45, 55 и 60оС. Образцы изымались из гидролиза после 24, 48 и 72 ч и обрабатывались, как описано выше. Продукты гидролиза квантифицировали, применяя анализ по редуцирующим сахарам (Bernfeld, 1955), используя глюкозу в качестве стандарта. Результаты от пустых субстратов вычитались из образцов с ферментами, и концентрация гидролизных продуктов, как редуцирующих сахаров, представлена на Фигуре 12.
Результаты ясно показывают лучшее действие смеси описанных здесь ферментов по сравнению с известными из уровня техники ферментами Trichoderma при исследуемых температурах. При 45оС смесь термофильных ферментов показала более эффективный гидролиз по сравнению с ферментами T. reesei, очевидно, вследствие более высокой стабильности при длительном времени гидролиза. При 55оС эффективность смеси описанных здесь ферментов была все еще на таком же уровне, что и при 45оС, в то время как известная из уровня техники смесь была неэффективной с субстратом, использованным при этой температуре. При 60оС описанные здесь термофильные ферменты показали пониженный гидролиз, хотя гидролиз был почти на таком же уровне, как и действие известных из уровня техники ферментов при 45оС.
Пример 30. Оценка глюкозного ингибирования β-глюкозидаз из Acremonium thermophilum, ALKO4245, Chaetomium thermophilum ALKO4261 и Thermoascus aurantiacus ALKO4242
Фильтраты культур, производимых штаммами Acremonium thermophilum, ALKO4245, Chaetomium thermophilum ALKO4261 и Thermoascus aurantiacus ALKO4242, описаны в Примере 1. β-глюкозидазные активности (измеренные в соответствии с Bailey and Linko, 1990) этих препаратов составили 21,4, 5,6 и 18,6 нкат/мл, соответственно. Для сравнения в эксперимент были также включены коммерческие ферменты Celluclast 1,5 L (β-глюкозидаза 534 нкат/мл) и Novozyme 188 (β-глюкозидаза 5840 нкат/мл).
Для того чтобы оценить чувствительность различных β-глюкозидаз к глюкозному ингибированию, стандартную процедуру анализа активности выполняли в присутствии различных концентраций глюкозы. Субстратные растворы (p-нитрофенил-β-D-глюкопиранозид) для анализа β-глюкозидазной активности дополняли глюкозой таким образом, чтобы концентрация глюкозы в аналитической смеси была отрегулирована до величин от 0 до 0,5 М. За исключением этого добавления глюкозы анализ выполняли, используя стандарную процедуру (Bailey and Linko, 1990). Активности в присутствии изменяющихся концентраций глюкозы как процент от активности без глюкозы представлены на Фигуре 13.
Результаты показывают, что β-глюкозидазы из C. thermophilum и T. aurantiacus были менее подвержены ингибированию глюкозой, чем β-глюкозидазы, присутствующие в коммерческих ферментах: происходящая из Aspergillus β-глюкозидаза в Novozyme 188 или происходящая из Trichoderma β-глюкозидаза в Celluclast 1,5 L. Фермент A. thermophilum показал поведение, сравнимое с ферментом T. reesei Celluclast. Особенно фермент C. thermophilum был отчетливо менее эффективным при высокой концентрации глюкозы. Таким образом, данные результаты указывают, что учет глюкозного ингибирования при использовании новых β-глюкозидаз, особенно из штаммов Acremonium thermophilum ALKO4242 и Chaetomium thermophilum ALKO4261, дал бы ясное преимущество в гидролизе в промышленных условиях с высокой концентрацией глюкозы.
Пример 31. Активность фильтровальной бумаги в ферментных смесях при высоких температурах
Активность фильровальной бумаги в ферментных препаратах измеряли согласно методу IUPAC (1987), как описано в протоколе за исключением того, что ферментативную реакцию проводили при температурах от 50 до 70оС. Вычисленная FPU-активность основывается на количестве фермента, необходимом для гидролиза 4% субстрата из фильтровальной бумаги в течение 1 ч в условиях эксперимента. Считается, что FPU-активность представляет общую активность всех целлюлаз ферментного препарата.
Использовали ферментные смеси: СМЕСЬ 2, приготовленную как описано в Примере 27, СМЕСЬ 3, приготовленную как описано в Примере 28, и СМЕСЬ 4. СМЕСЬ 4 приготовляли, комбинируя ферментные препараты, описанные в Примере 27, следующим образом (на 10 мл смеси): CBH/Cel7-препарат 7,84 мл, эндоглюканазный препарат 0,99 мл и β-глюкозидазный препарат 1,17 мл.
В качестве контроля использовали следующие ферментные смеси, представляющие смеси, известные из уровня техники:
«T. REESEI ФЕРМЕНТЫ А», приготовленную как препарат «T. REESEI ФЕРМЕНТЫ», описанный в Примере 26;
«T. REESEI ФЕРМЕНТЫ В», составленную комбинацией (на 10 мл) 8,05 Econase CE (коммерческий препарат целлюлазы T. reesei от AB Enzymes Oy, Rajamäki, Финляндия) и 1,95 мл Novozyme 188 (от Novozymes A/S).
FPU-активности ферментных препаратов, измеренные при различных температурах, представлены на Фигуре 14, как процент от активности в стандартных (IUPAC, 1987) условиях (при 50оС).
Результаты ясно показывают, что смеси согласно изобретению обнаруживают более высокую общую целлюлазную активность при повышенных (60-70оС) температурах по сравнению с известными из уровня техники смесями, основанными на ферментах из Trichoderma или Aspergillus.
Пример 32. Применение новых бета-глюкозидаз для приготовления софорозы
Смесь с высокой концентрацией крахмального гидролизата (Nutriose 74/968, Roquette) обрабатывали βG_81/Cel3A Thermoascus aurantiacus, обогащенной ферментным препаратом, произведенным, как описано в Примере 21, чтобы получить смесь сахаров, содержащую ощутимые количества целлюлазного индуктора (софорозы) для преодоления глюкозной репрессии.
Обогащенный Ta βG_81/Cel3A ферментный препарат добавляли к 70%-ному (в/в) раствору Нутриозы до конечной концентрации 1 г общего протеина/литр. Контейнер со смесью инкубировали на водяной бане при 65оС в течение 3 дней при постоянном помешивании и использовали в качестве источника углерода в среде встряхиваемой колбы для двух разных Trichoderma-штаммов (A47 и Rut-C30). Эффект ферментативной обработки измеряли, как эндоглюканазную активность, сформировавшуюся в течение 7 дней культивирования во встряхиваемой колбе. В качестве контроля культивирование выполняли при тех же самых условиях с необработанной Нутриозой в качестве источника углерода. При культивировании во встряхиваемых колбах, поставленном на Ta βG_81/Cel3A с предварительно обработанной тестированными штаммами Нутриозной средой, было получено более чем двукратное увеличение активности. Результаты показаны на Фигуре 15.
Перечень депонированных организмов
Литература
Altschul S., Gish W., Miller W., Myers E.W. and Lipman D.J. (1990) Basic local alignment search tool. J. Mol. Biol. 215: 403-410.
Badger, P.C. (2002) Ethanol from cellulose: a general review. In Trends in new crops and new uses. J. Janick and A. Whipkey (eds.). ASHS Press, Alexandria, VA, USA, pp.17-21.
Bailey M.J. and K.M.H.Nevalainen (1981) Induction, isolation and testing of stable Trichoderma reesei mutants with improved production of solu-10 bilizing cellulase. Enz Microbiol Technol. 3: 153-157.
Bailey, M.J., Biely, P. and Poutanen, K. (1992) Interlaboratory testing for assay of xylanase activity. J Biotechnol. 23:257-270.
Bailey, M.J. and Linko, M. (1990) Production of (3-galactosidase by Aspergillus oryzae in submerged bioreactor cultivation. J. Biotechnol. 16:57-15 66.
Bailey M.J. and Poutanen K. (1989) Production of xylanases by strains of Aspergillus. Appl. Microbiol. Biotechnol. 30:5-10.
Bailey M., Siika-aho M., Valkeajarvi A. and Penttila M. (1993) Hydrolytic properties of two cellulases of Trichoderma reesei expressed in yeast. 20 Biotehnol. Appl. Biochem 17: 65-76.
Bendtsen J.D., Nielsen H., von Heijne G. and Brunak S. (2004) Improved prediction of signal peptides: SignalP 3.0. J. Mot. Biol. 340: 783-795.
Bernfeld, B. (1955) Amylases, a and 13. In: Methods in Enzymology, vol. 1, Eds. Colowick, S.P. and Kaplan, N.O. Academic Press, New York, pp.149-158.
Biely P., Vrsanska M., Tenkanen M., Kluepfel D. (1997) Endo-beta-1,4-xylanase families: differences in catalytic properties. Journal of Biotechnology 57: 151-166.
Coen, D.M. (2001) The polymerase chain reaction. In: Ausubel, 30 F.M., Brent, R., Kingston, R.E., More, D.D., Seidman, J.G., Smith, K. and Struhl, K. (eds.) Current protocols in molecular biology. John Wiley & Sons. Inc., Hoboken, USA.
Gasteiger, E., Gattiker A., Hoogland C., Ivanyi I., Appel R. D. and Bairoch A. (2003) ExPASy: the proteiomics server for in-depth protein knowl-35 edge and analysis. Nucleic Acids Res. 31: 3784-3788.
Gellissen, G. (ed.) (2005) Production of recombinant proteins. Novel microbial and eukaryotic expression systems. Wiley-VCH Verlag Gmbh&Co. Weinheim, Germany.
Gill, S.C, and von Hippel, P.H. (1989) Calculation of protein extinction coefficients from amino acid sequence data. Anal. Biochem. 182: 319-326.
Gupta, R., E. Jung and S. Brunak. (2004) Prediction of N-glycosylation sites in human proteins, In preparation. www.cbs.dtu.dk/services/NetNGlyd
Haakana H., Miettinen-Oinonen A., Joutsjoki V., Mantyla A., Suominen P, and Vehmaanpera J. (2004) Cloning of cellulase genes from Melano carpus albomyces and their efficient expression in Trichoderma reesei. Enz. Microbiol. Technol. 34: 159-167.
Henrissat B. (1991) A classification of glycosyl hydrolases based on amino acid sequence similarities. Biochem. J. 280: 309-316.
Henrissat B. and Bairoch A. (1993) New families in the classification glycosyl hydrolases based on amino acid sequence similarities. Biochem. J. 293: 781-788.
Henrissat B. and Bairoch A. (1996).Updating the sequence-based classification of glycosyl hydrolases. Biochem. J. 316: 695-696
Henrissat B., Teeri T. T. and Warren R. A. J. (1998) A scheme for 20 designating enzymes that hydrolyse the polysaccharides in the cell wall of plants. FEBS Letters 425: 352-354.
Hong J., H. Tamaki, K. Yamamoto, and Kumagai H. (2003a) Cloning of a gene encoding a thermo-stabile endo-f3-1,4-glucanase from Thermoascus aurantiacus and its expression in yeast. Biotech. Letters 25: 657-661.
Hong J., Tamaki H., Yamamoto K. and Kumagai H. (2003b) Cloning of a gene encoding thermostable cellobiohydrolase from Thermoascus aurantiacus and its expression in yeast. Appl. Microbiol. Biotechnol. 63: 42-50.
IUPAC (International Union of Pure and Applied Chemistry) (1987).
Measurement of cellulase activities. Pure and Appl. Chem. 59: 257-268.
Joutsjoki, V.V., Torkkeli T.K. and Nevalainen K.M.H. (1993) Trans-formation of Trichoderma reesei with the Hormoconis resinae glucoamylase P (gamP) gene: production of a heterologous glucoamylase by Trichoderma reesei. Curr. Genet. 24: 223-228.
Karhunen T., Mantyla A., Nevalainen K.M.H. and Suominen P.L. 35 (1993) High frequency one-step gene replacement in Trichoderma reesei. I. Endoglucanase I overproduction. Mol. Gen. Genet. 241: 515-522.
Kurabi A., Berlin A, Gilkes N., Kilburn D., Markov A., Skomarovsky A., Gusakov A., Okunev O., Sinitsyn A., Gregg D. Xie D. and Saddler J. (2005) Enzymatic hydrolysis of steam-exploded and ethanol organosolv-pretreated Douglas-Fir by novel and commercial fungal cellulases. Appl. Biochem and Biotech n. Vol 121-124: 219-229.
Lever, M. (1972) A new reaction for colorimetric determination of carbohydrates. Anal. Biochem., 47: 276-279.
Lo Leggio, L., Kalogiannis S., Bhat M.K., and Pickersgill R.W. (1999) High resolution structure and sequence of the T. aurantiacus xylanase I: implications for evolution of thermostability in family 10 xylanases and enzymes with (beta) alpha-barrel architecture. Proteins 36(3): 295-306.
Lowry, O., Rosenbrough, N., Farr, A. and Randall, R. (1951) Protein measuremen with the Folin phenol reagent. J. Biol. Chem. 193: 265-275.
Needleman S. and Wunsch C. (1970) A general method applicable to the search for similarities in the amino acid sequence of two proteins. Journal of Molecular Biology 48, 443-453.
Nielsen H., Engelbrecht J., Brunak S. and von Heijne G. (1997) Identification of prokaryotic and eykaryotic signal peptides and prediction of their cleavage sites. Protein Engineering 10: 1-6.
Paloheimo M., Mantyla A., Kallio J., and Suominen P. (2003) High-yield production of a bacterial xylanase in the filamentous fungus Trichoderma reesei a carrier polypeptide with an intact domain structure. Appl. Env. Microbiol. 69: 7073-7082.
Parry N., Beever D., Owen E., Nerinckx W. Claeyssens M, Van Beeumen J. and Bhat M. (2002) Biochemical characterization and mode of action of a thermostable endoglucanase purified from Thermoascus aurantiacus, Arch. of Biochem. and Biophys. 404: 243-253.
Penttila M., Nevalainen H., Rat-to M., Salminen E. and Knowles J. (1987) A versatile transformation system for the cellulolytic filamentous fungus 30 Trichoderma reesei. Gene 61:155-164.
Raeder U. and Broda P. (1985) Rapid preparation of DNA from filamentous fungi. Left. Appl. Microbiol. 1: 17-20.
Rice P, Longden I and Bleasby A. (2000). EMBOSS: The European Molecular Biology Open Software Suite. Trends in Genetics 16:276-277.
Sambrook J., Fritsch E. F. and Maniatis T. (1989) Molecular cloning, a laboratory manual. Cold Spring Harbor Laboratory, New York, US.
Sambrook J. and Russell D. W. (2001) Molecular cloning, a laboratory manual. Cold Spring Harbor Laboratory, New York, US.
Srisodsuk M, Reinikainen T, Penttila M and Teeri T. (1993) Role of the interdomain linker peptide of Trichoderma reesei cellobiohydrolase I in its interaction with crystalline cellulose. J. Biol. Chem. Oct 5; 268(28): 20756-61.
Sundberg, M., and Poutanen, K. (1991) Purification and properties of two acetylxylan esterases of Trichoderma reesei. Biotechnol. Appl. Biochem. 13:1-11.
Suurnakki, A., Tenkanen M., Siika-aho, M., Niku-Paavola, M.-L., Vii kari, L. and Buchert, J. (2000) Trichoderma reesei cellulases and their core domains in the hydrolysis and modification of chemical pulp.Cellulose 7: 189-209.
Tenkanen, M., Puls, J. and Poutanen, K (1992) Two major xylanases of Trichoderma reesei. Enzyme Microbiol. Technol. 14: 566-574.
Tomme, P. McRae, S., Wood, T. and Claeyssens, M. (1988) Chromatographic separation of cellulolytic enzymes. Methods in Enzymol. 160: 187-192.
Tuohy M., Walsh J., Murray P., Claeyssens M., Cuffe M., Savage A. and Coughan M. (2002) Kinetic parameters and mode of action of cellobiohy drolases produced by Talaromyces emersonii. Biochem. Biophys. Acta 1596: 366-380 (abstract).
Van Petegem et al (2002) Atomic resolution structure of major endoglucanase from Thermoascus aurantiacus, Biochem. and Biophys. Res. Comm. 296, pp.161-166.
Van Tilbeurgh, H., Loonties, F., de Bruyne, C. and Claeyssens, M. (1988) Fluorogenic and chromogenic glycosides as substrates and ligands of carbohydrases. Methods Enzymol. 160:45-59.
Wyman, C.E. (2001) Twenty years of trials, tribulations, and research progress in bioethanol technology. Applied Biochemistry and Biotech-30 nology 91-93: 5-21.
Реферат
Настоящее изобретение относится к области биотехнологии и касается новых целлюлотических полипептидов и их применения. Представленный полипептид целлобиогидролазы выбирают из группы, состоящей из: ! a) полипептида, включающего аминокислотную последовательность, имеющую, по меньшей мере, 95%-ную идентичность SEQ ID NO:6 и обладающую целлобиогидролазной активностью и ! b) фрагмента а), имеющего целлобиогидролазную активность. Такие полипептиды могут быть получены с помощью рекомбинантной технологии при использовании подходящих полинуклеотидов, экспрессирующих векторов и клеток-хозяев. Представленное изобретение может быть использовано при получении ферментируемых сахаров и биоэтанола из лигноцеллюлозного материала посредством ферментативной конверсии. 11 н. и 21 з.п. ф-лы, 15 ил., 31 табл., 32 пр.
Формула
a) полипептида, включающего аминокислотную последовательность, имеющую, по меньшей мере, 95%-ную идентичность SEQ ID NO:6 и обладающую целлобиогидролазной активностью, и
b) фрагмента а), имеющего целлобиогидролазную активность.
a) аминокислотную последовательность, имеющую, по меньшей мере, 99%-ную идентичность SEQ ID NO:6; или
b) фрагмент а), имеющий целлобиогидролазную активность.
а) нуклеотидной последовательности SEQ ID NO:5 и последовательности, кодирующей полипептид по п.1.

Комментарии