Глюкоамилаза trichoderma reesei и ее гомологи - RU2394101C2
Код документа: RU2394101C2
Чертежи





























Описание
РОДСТВЕННЫЕ ЗАЯВКИ
По настоящей заявке испрашивается приоритет международной патентной заявки PCT/US05/18214, поданной 24 мая 2005, по которой испрашивается приоритет предварительной патентной заявки c серийным номером 60/647925, поданной 28 января 2005, международной патентной заявки PCT/US04/041276, поданной 9 декабря 2004; международной заявки PCT/US04/040040, поданной 30 ноября 2004; предварительной заявки с серийным номером 60/605437, поданной 30 августа 2004, в настоящее время оставленной без движения, и предварительной заявки с серийным номером 60/575175, поданной 27 мая 2004, в настоящее время оставленной без движения, и испрашивается приоритет международной патентной заявки PCT/US05/0018212, поданной 24 мая 2005, по которой испрашивается приоритет предварительных заявок с серийным номером 60/647925, поданной 28 января 2005, серийным номером 60/605437, поданной 30 августа 2004, в настоящее время оставленной без движения, и серийным номером 60/575175, поданной 27 мая 2004, в настоящее время оставленной без движения, и международной заявки PCT/US04/040040, поданной 30 ноября 2004.
ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Настоящее изобретение относится к новым глюкоамилазам, пригодным для получения глюкозы и других конечных продуктов из крахмала. Глюкоамилазы пригодны для применения в разных процессах и являются, в частности, пригодными для применения в условиях общепринятой высокотемпературной переработки крахмала и в условиях без тепловой обработки или низкотемпературной переработки крахмала.
ПРЕДПОСЫЛКИ ИЗОБРЕТЕНИЯ
Глюкоамилазные ферменты (α-1,4-глюкан-глюкогидролазы, E.C.3.2.1.3.) являются карбогидразами экзодействия, гидролизующими крахмал. Глюкоамилазы катализируют удаление последовательных глюкозных единиц с невосстанавливающих концов крахмала или родственных олиго- и полисахаридных молекул и могут гидролизовать как линейные, так и разветвленные глюкозидные звенья крахмала (амилозу и амилопектин).
Глюкоамилазы продуцируются многочисленными штаммами бактерий, грибов, дрожжей и растений. В частности, интересными глюкоамилазами являются ферменты грибов, которые продуцируются внеклеточно, например, штаммами Aspergillus (Boel et al, (1984) EMBO J. 3:1097-1102; Hayashida et al (1989) Agric. Biol. Chem. 53:923-929; USP 5024941; USP 4794175 и WO 88/09795), Talaromyces (USP 4247637; USP 6255084 и USP 6620924), Rhizopus (Ashikari et al. (1986) Agric. Biol. Chem. 50:957-964; Ashikari et al. (1989) App. Microbiol. and Biotech. 32:129-133 и USP 4863864), Humicola (WO 05/052148 и USP 4618579) и Mucor (Houghton-Larsen et al., (2003) Appl. Microbiol. Biotechnol., 62:210-217). Многие из генов, которые кодируют данные ферменты, клонировали и экспрессировали в клетках дрожжей и грибов.
Коммерчески глюкоамилазы являются очень важными ферментами, которые применяют в широком спектре приложений, требующих гидролиза крахмала. Глюкоамилазы применяют для гидролиза крахмала для получения большого количества фруктозных подсластителей кукурузы, и подсластители кукурузы охватывают свыше 50% рынка подсластителей в США. Как правило, способы гидролиза крахмала включают использование альфа-амилаз для гидролиза крахмала до декстринов и глюкоамилаз для гидролиза декстринов до глюкозы. Глюкозу затем превращают во фруктозу другими ферментами, такими как глюкозоизомеразы. Глюкозу, продуцируемую глюкоамилазами, можно также кристаллизовать или использовать в брожениях для получения других конечных продуктов, таких как лимонная кислота, аскорбиновая кислота, глутаминовая кислота, 1,3-пропандиол и другие. Глюкоамилазы применяют в производстве алкоголя, таком как получение пива и получение сакэ. Глюкоамилазы также находят применение в получении этанола для топлива и для потребления. В последнее время глюкоамилазы применяют в низкотемпературном способе гидролиза гранулированного (без тепловой обработки) крахмала. Глюкоамилазы также применяют в получении кормов для животных в качестве пищевых добавок или в качестве жидких компонентов пищи для домашних животных.
Хотя глюкоамилазы успешно применяют в течение многих лет, все еще существует потребность в новых полезных глюкоамилазах. Настоящее изобретение основано на открытии новых глюкоамилаз, пригодных для применения в разнообразных приложениях и, в частности, способах гидролиза крахмала.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Изобретение относится к выделенной последовательности ДНК, кодирующей глюкоамилазу, обладающую, по меньшей мере, 80% идентичности с SEQ ID NO: 4.
В другом варианте осуществления изобретение относится к ферменту, обладающему глюкоамилазной активностью, содержащему аминокислотную последовательность SEQ ID NO: 4 или последовательности, существенно ей гомологичные, и ее аллельные варианты и биологически функциональные фрагменты.
В другом варианте осуществления изобретение относится к выделенной последовательности ДНК, кодирующей глюкоамилазу Trichoderma reesei, включающей последовательность нативного гена и его биологически функциональные фрагменты.
В другом варианте осуществления изобретение относится к векторам, содержащим последовательность ДНК, кодирующую глюкоамилазы, относящиеся к изобретению.
В другом варианте осуществления изобретение относится к стабильно трансформированным грибным клеткам-хозяевам, в частности клеткам-хозяевам Trichoderma и Aspergillus, и способам экспрессии в них глюкоамилазы.
В другом варианте осуществления изобретение относится к культуральной среде, содержащей глюкоамилазу, относящуюся к изобретению, и ферментным препаратам, полученным из биомассы или культуры трансформированных хозяев, и применению ферментных препаратов.
В другом варианте осуществления изобретение относится к способам гидролиза крахмала с использованием ферментных препаратов по изобретению. В некоторых вариантах осуществления глюкоамилазу будут применять в способе гидролиза крахмала или частично гидролизованного крахмала в сироп, содержащий декстрозу. В других вариантах осуществления глюкоамилазу будут применять в способе получения специализированных сиропов. В дополнительных вариантах осуществления глюкоамилазу будут применять в брожении для получения конечных продуктов, таких как спирты и, в частности, этанол.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
На фиг.1A-B показана последовательность геномной ДНК (SEQ ID NO: 1), кодирующая глюкоамилазу Trichoderma reesei фиг. 3.
На фиг.2A-B показана безинтронная последовательность ДНК (SEQ ID NO: 2), кодирующая глюкоамилазу Trichoderma reesei фиг. 3.
На фиг.3A показана выведенная аминокислотная последовательность (SEQ ID NO: 3) глюкоамилазы Trichoderma reesei, имеющая 632 аминокислоты, в которой
сигнальная последовательность (SEQ ID NO: 38) выделена полужирным шрифтом и представлена положениями остатков 1-20;
пропоследовательность (SEQ ID NO: 39) выделена полужирным шрифтом и подчеркнута, и представлена положениями остатков 21-33;
каталитический домен (SEQ ID NO: 40) представлен положениями остатков 34-486;
линкерная область (SEQ ID NO: 41) выделена курсивом и представлена положениями остатков 487-523; и
крахмал-связывающий домен (SEQ ID NO: 42) выделен курсивом и подчеркнут, и представлен положениями остатков 524-632.
N-концевой аминокислотный остаток зрелого белка, представленный положением остатка 34, является серином.
На фиг.3B показана выведенная последовательность зрелого белка (SEQ ID NO: 4) глюкоамилазы Trichoderma reesei фиг. 3A. Последовательность зрелого белка содержит каталитический домен, который подчеркнут (SEQ ID NO: 40), линкерную область (SEQ ID NO: 41) и крахмал-связывающий домен (SEQ ID NO: 42).
На фиг.4 показана последовательность геномной ДНК, обладающая 2154 п.н. (SEQ ID NO: 5), кодирующая глюкоамилазу Hypocrea citrinavar. americana (GA102) (SEQ ID NO: 6).
На фиг.5 показана последовательность геномной ДНК, обладающая 2152 п.н. (SEQ ID NO: 7), кодирующая глюкоамилазу Hypocrea vinosa (GA104) (SEQ ID NO: 8).
На фиг.6 показана последовательность геномной ДНК, обладающая 2158 п.н. (SEQ ID NO: 9), кодирующая глюкоамилазу Trichoderma sp. (GA105) (SEQ ID NO: 10).
На фиг.7 показана последовательность геномной ДНК, обладающая 2144 п.н. (SEQ ID NO: 11), кодирующая глюкоамилазу Hypocrea gelatinosa (GA 107) (SEQ ID NO: 12).
На фиг.8 показана последовательность геномной ДНК, обладающая 2127 п.н. (SEQ ID NO: 13), кодирующая глюкоамилазу Hypocrea orientalis (GA108) (SEQ ID NO: 14).
На фиг.9 показана последовательность геномной ДНК, обладающая 2139 п.н. (SEQ ID NO: 15), кодирующая глюкоамилазу Trichoderma konilangbra (GA109) (SEQ ID NO: 16).
На фиг.10 показана последовательность геномной ДНК, обладающая 2088 п.н. (SEQ ID NO: 28), кодирующая глюкоамилазу Trichoderma sp. (GA113) (SEQ ID NO: 29).
На фиг.11 показана последовательность геномной ДНК, обладающая 2141 п.н. (SEQ ID NO: 30), кодирующая глюкоамилазу Trichoderma harzianum (GA103) (SEQ ID NO: 31).
На фиг.12 показана последовательность геномной ДНК, обладающая 2131 п.н. (SEQ ID NO: 32), кодирующая глюкоамилазу Trichoderma longibrachiatum (GA124) (SEQ ID NO: 33).
На фиг.13 показана последовательность геномной ДНК, обладающая 2151 п.н. (SEQ ID NO: 34), кодирующая глюкоамилазу Trichoderma asperellum (GA127) (SEQ ID NO: 35).
На фиг.14 показана последовательность геномной ДНК, обладающая 2142 п.н. (SEQ ID NO: 36), кодирующая глюкоамилазу Trichoderma strictipilis (GA128) (SEQ ID NO: 37).
На фиг.15A-I показаны предположительные аминокислотные последовательности глюкоамилаз, кодируемых последовательностями ДНК SEQ ID NO: 5, 7, 9, 11, 13, 15, 28, 30, 32, 34 и 36, которые соответствуют аминокислотным последовательностям SEQ ID NO: 6, 8, 10, 12, 14, 16, 29, 31, 33, 35 и 37 соответственно, в которых лидерный пептид выделен полужирным шрифтом, и пропоследовательность подчеркнута и выделена полужирным шрифтом для каждого белка. Последовательность зрелого белка, которая не включает лидерную и пропоследовательность для каждого белка, также представлена как SEQ ID NO: 17 для (1) GA102; SEQ ID NO: 18 для (2) GA104; SEQ ID NO: 19 для (3) GA105; SEQ ID NO: 20 для (4) GA107; SEQ ID NO: 21 для (5) GA108; SEQ ID NO: 22 для (6) GA109; SEQ ID NO: 43 для (7) GA113; SEQ ID NO: 44 для (8) GA103; SEQ ID NO: 45 для (9) GA124; SEQ ID NO: 46 для (10) GA127 и SEQ ID NO: 47 для (11) GA128.
На фиг.16 изображен гель SDS-PAGE, используемый для определения молекулярного веса очищенного TrGA, в котором на дорожке 1 представлен TrGA и на дорожке 2 представлен маркер молекулярного веса SeeBlue Plus 2 (Invitrogen).
Фиг.17A представляет собой плазмидную карту экспрессирующего вектора pTrex3g T. reesei.
Фиг.17B представляет собой плазмидную карту, которая содержит экспрессирующий вектор pNSP23 T. reesei, в котором ген TrGA клонирован в pTrex3g.
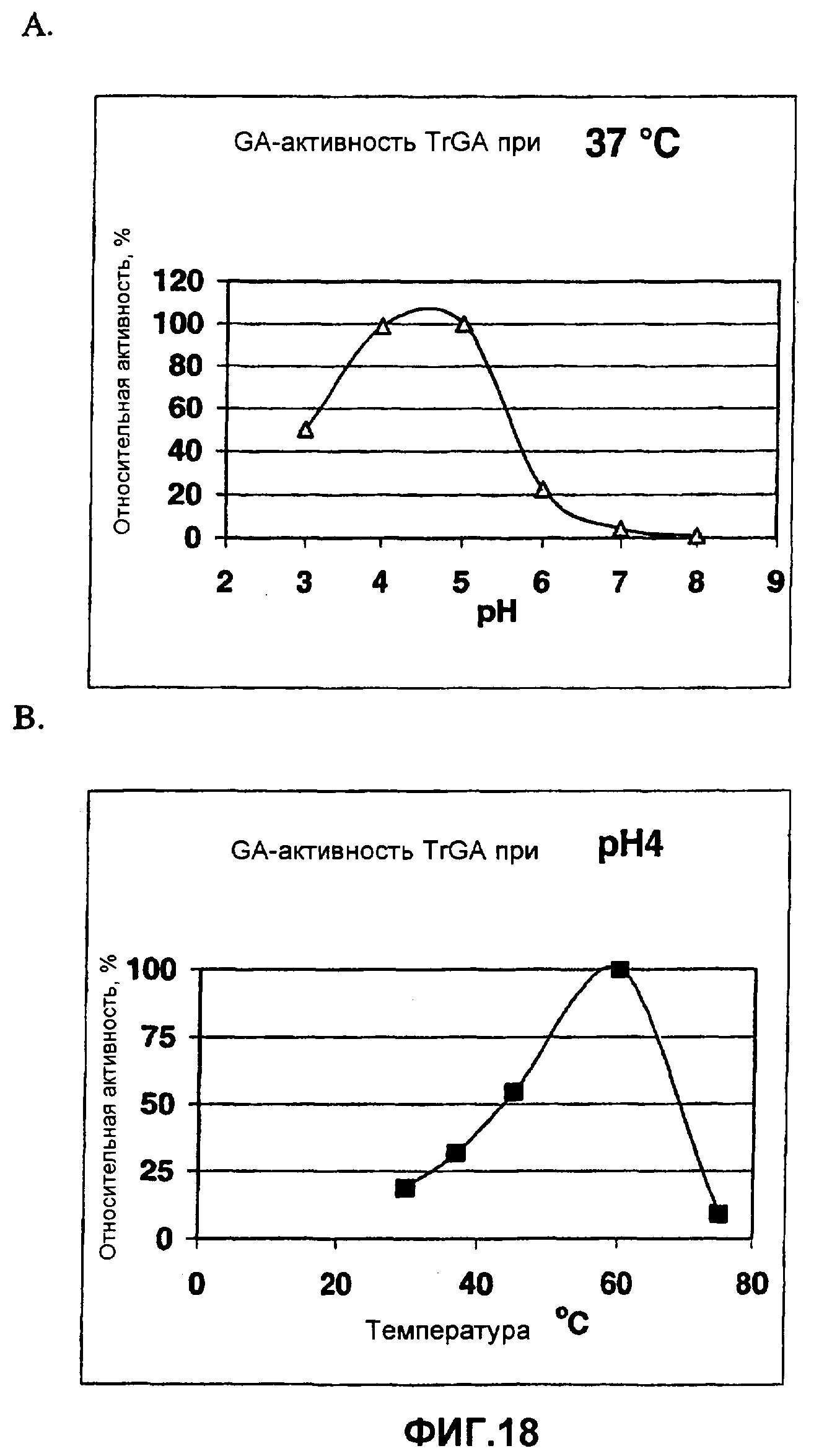
На фиг.18 показан (A) % относительной GA'-активности TrGA при 37°C при pH 3-8 и (B) % относительной GA-активности TrGA при pH 4,0 от 25°C до 78°C и сделана ссылка на пример 4.
На фиг.19 изображен гель SDS-PAGE, используемый для определения секреции по существу гомологичных глюкоамилаз в штамме-хозяине Trichoderma (1A52), в котором полоса приблизительно 62 кДа представляет собой глюкоамилазу, и дорожка 1 представляет собой GA104; дорожка 2 представляет собой GA105; дорожка 3 представляет собой GC107; дорожка 4 представляет собой GA109; дорожка 5 представляет собой TrGA; дорожка 6 представляет собой контрольный штамм-хозяин Trichoderma reesei (1A52) и дорожка 7 представляет собой стандартный маркер молекулярного веса.
На фиг.20 (A) изображена аминокислотная последовательность (SEQ ID NO: 26) глюкоамилазы Aspergillus niger, которая содержит лидерную последовательность. N-концевой аминокислотный остаток зрелого белка представлен положением остатка 25, A (аланин); линкерная область подчеркнута, и крахмал-связывающий домен выделен курсивом. На (B) изображена аминокислотная последовательность альфа-амилазы Aspergillus kawachi (SEQ ID NO: 27), которая содержит лидерную последовательность, где лидерная последовательность выделена полужирным шрифтом и подчеркнута, и представлена аминокислотными остатками 1-21; линкерная область подчеркнута, и крахмал-связывающий домен выделен курсивом. Зрелый белок содержит каталитический домен, линкер и крахмал-связывающий домен.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
В некоторых аспектах настоящее изобретение основано на общепринятых методиках и способах, применяемых в области генной инженерии и молекулярной биологии. Следующие источники содержат описания общей методологии, пригодной в соответствии с изобретением: Sambrook et al. Eds., MOLECULE CLONING: A LABORATORY MANUAL (3rd Ed. 2000); Kriegler M. Ed., GENE TRANSFER AND EXPRESSION: A LABORATORY MANUAL (1990); и Ausubel et al. Eds., SHORT PROTOCOLS IN MOLECULAR BIOLOGY (5th Ed. 2002). Хотя в применении или тестировании по изобретению можно применять любые способы и материалы, аналогичные или эквивалентные тем, которые здесь описаны, ниже описаны предпочтительные способы и материалы.
Если здесь не определено по-другому, все технические и научные термины, используемые здесь, обладают таким же значением, как обычно понимает рядовой специалист в данной области, к которой относится изобретение. Singleton et al., DICTIONARY OF MICROBIOLOGY AND MOLECULAR BIOLOGY 2nd Ed, John Wiley and Sons, NY (1994) и Hale and Margham, THE HARPER COLLINS DICTIONARY OF BIOLOGY (1991) Addison Wesley Pub. Co. снабжает специалиста в данной области словарями со многими из терминов, используемых в описании данного изобретения.
Изобретение сейчас будет подробно описано посредством ссылки только с использованием следующих определений и примеров. Все патенты и публикации, включая все последовательности, описанные в таких упоминаемых здесь патентах и публикациях, явным образом приведены в качестве ссылки.
Формы единственного числа включают ссылки на множественное число, если только содержанием ясно не предписано обратное. Таким образом, например, ссылка на композицию, содержащую «соединение» включает смесь из двух или более соединений. Следует указать, что термин «или», как правило, употребляют в смысле, включающем «и/или», если только содержанием ясно не предписано обратное.
Числовые диапазоны включают числа из диапазонов.
Если не указано иначе, нуклеиновые кислоты написаны слева направо в ориентации от 5' к 3'; аминокислотные последовательности написаны слева направо в ориентации от N-конца к C-концу соответственно.
Заголовки, приведенные здесь, не ограничивают различные аспекты или варианты осуществления изобретения, которые можно получить посредством ссылки на описание в целом.
Определения
Термин «глюкоамилаза» относится к ферментам класса амилоглюкозидаз (E.C.3.2.1.3, глюкоамилаза, 1,4-альфа-D-глюкан-глюкогидролаза). Данные ферменты отщепляют глюкозильные остатки с невосстанавливающих концов молекул амилозы и амилопектина.
Фраза «обладающий активностью гидролизовать гранулярный крахмал» относится к ферменту, способному гидролизовать крахмал в гранулярной форме.
Фраза «группа семейства Trichoderma/Hypocrea» относится к члену семейства Hypocreaceae, включая некоторых анаморф, таких как Trichoderma и Gliocladium, подкласса Hypocreales, типа Ascomycota, и ссылается на главу 12, Alexopoulos, C.J., et al, в INTRODUCTORY MYCOLOGY 4th Edition, John Wiley & Sons, NY 1996.
Термины «последовательность нуклеиновой кислоты» и «полинуклеотид» можно здесь использовать взаимозаменяемо. Термин относится к геномной ДНК, безинтронной ДНК, синтетическим точкам начала репликации или их сочетаниям.
Термин «интрон» означает прерывающую последовательность ДНК, которая транскрибируется, но удаляется из транскрипта посредством совместного сплайсинга последовательностей, кодирующих зрелый белок.
Термин «выделенная последовательность нуклеиновой кислоты» означает последовательность нуклеиновой кислоты, которая по существу свободна от других последовательностей нуклеиновой кислоты.
Термин «биологически функциональные фрагменты последовательности» (например, биологически функциональные фрагменты SEQ ID NO: 4) означает полипептид, обладающий глюкоамилазной активностью и одним или несколькими аминокислотными остатками, удаленными с N- и/или C-конца аминокислотной последовательности.
Термин «вектор» означает полинуклеотидную последовательность, сконструированную для введения нуклеиновых кислот в клетки одного или нескольких типов.
Термин «экспрессирующий вектор» означает конструкцию ДНК, содержащую последовательность нуклеиновой кислоты, которая функционально связана с подходящей управляющей последовательностью, способную к эффективной экспрессии последовательности нуклеиновой кислоты в подходящем хозяине. Подходящие управляющие последовательности включают промоторы для осуществления транскрипции, операторные последовательности, последовательности, кодирующие подходящие участки связывания с рибосомой на мРНК, энхансеры и/или терминаторные последовательности.
Термин «промотор» означает регуляторную последовательность, вовлеченную в связывание с РНК-полимеразой для инициации транскрипции гена.
Термин «функционально связанный» относится к смежному расположению, при котором элементы находятся в расположении, позволяющим им являться функционально связанными. Например, промотор функционально связан с кодирующей последовательностью, если он управляет транскрипцией последовательности.
Термин «выделенный полипептид» означает полипептид, который по существу свободен от других неглюкоамилазных полипептидов. Выделенный полипептид может обладать, по меньшей мере, 20% чистоты, по меньшей мере, 40% чистоты, по меньшей мере, 60% чистоты, по меньшей мере, 70% чистоты, по меньшей мере, 80% чистоты, по меньшей мере, 90% чистоты, по меньшей мере, 95% чистоты при определении посредством SDS-PAGE.
Термин «сигнальная последовательность» означает последовательность аминокислот, связанную с N-концевой частью белка, которая облегчает секрецию зрелой формы белка из клетки. Определение сигнальной последовательности является функциональным. Зрелая форма внеклеточного белка утрачивает сигнальную последовательность, которая отщепляется в ходе процесса секреции. Термины «сигнальная последовательность», «сигнальный пептид» и «лидерный пептид» можно использовать здесь взаимозаменяемо. Как правило, «сигнальная последовательность» относится к нуклеотидной последовательности, и термин «лидерный пептид» относится к аминокислотной последовательности.
Термины «белок» и «полипептид» здесь используются взаимозаменяемо. Здесь используется общепринятый однобуквенный или трехбуквенный код для аминокислотных остатков.
Термин «каталитический домен» относится к структурной области полипептида, которая содержит активный участок для гидролиза субстрата.
Термин «линкер» относится к короткой аминокислотной последовательности, как правило, содержащей от 3 до 40 аминокислотных остатков, которая ковалентно связывает аминокислотную последовательность, содержащую крахмал-связывающий домен, с аминокислотной последовательностью, содержащей каталитический домен.
Термин «крахмал-связывающий домен» относится к аминокислотной последовательности, которая связывается предпочтительно с крахмальным субстратом.
Термин «аллельные варианты» означает любую из двух или более альтернативных форм гена, занимающих один и тот же хромосомный локус. Аллельное разнообразие возникает естественным образом посредством мутации и может приводить к полиморфизму между популяциями. Аллельный вариант полипептида представляет собой полипептид, кодируемый аллельным вариантом гена.
Термин «клетка-хозяин» или «штамм-хозяин» означает подходящего хозяина для экспрессирующего вектора или конструкции ДНК, содержащей полипептид, кодирующий глюкоамилазу, относящейся к изобретению. Подходящие клетки-хозяева успешно используют в рекомбинантном получении глюкоамилаз, относящихся к изобретению.
Как применяют здесь, термин «полученный из», используемый в связи с полинуклеотидом или полипептидом, означает полипептид или полинуклеотид, являющийся природным для микроорганизма.
Термин «гетерологичный» по отношению к полинуклеотиду или белку относится к полинуклеотиду или белку, который в природе не встречается в клетке-хозяине.
Термин «эндогенный» по отношению к полинуклеотиду или белку относится к полинуклеотиду или белку, который в природе встречается в клетке-хозяине.
Термин «экспрессия» означает процесс, посредством которого получается полипептид на основе последовательности нуклеиновой кислоты гена.
Термин «сверхэкспрессия» означает процесс экспрессии полипептида клеткой-хозяином, где полинуклеотид введен в клетку-хозяина.
Термин «введенный» в контексте введения последовательности нуклеиновой кислоты в клетку означает трансфекцию, трансформацию или трансдукцию и включает ссылку на включение последовательности нуклеиновой кислоты в клетку-хозяина.
Термин «гранулярный крахмал» относится к необработанному сырому крахмалу (например, гранулярному крахмалу, который не подвергали желатинизации).
Термин «крахмал» относится к любому веществу, содержащему сложные полисахаридные углеводы растений, содержащие амилозу и амилопектин с формулой (C6H10O5)x, где х может являться любым числом.
Термин «желатинизация» означает солюбилизацию молекулы крахмала при тепловой обработке с формированием вязкой суспензии. Фраза «ниже температуры желатинизации» относится к температуре ниже температуры, при которой начинается желатинизация.
Термин «культивирование» относится к выращиванию популяции микробных клеток в подходящих условиях в жидкой или твердой среде. В одном из вариантов осуществления культивирование относится к бродильной биоконверсии крахмального субстрата в конечный продукт (как правило, в котле или реакторе). Брожение представляет собой ферментативное и анаэробное расщепление органических веществ микроорганизмами с получением более простых органических соединений. Хотя брожение происходит в анаэробных условиях, не предполагается, что термин строго ограничен исключительно анаэробными условиями, поскольку брожение также происходит в присутствии кислорода.
Термин «конечный продукт» относится к молекулярному продукту, происходящему из любого источника углерода, который ферментативно получают из крахмального субстрата.
Термин «ферментативное превращение» относится к модификации субстрата под действием фермента.
Термин «удельная активность» означает единицу активности фермента, определенную как число молей субстрата, превращенного в продукт препаратом фермента за единицу времени в определенных условиях. Удельную активность выражают в единицах (ЕА)/мг белка.
Термин «моносахарид» означает мономерную единицу полимера, такого как крахмал, в котором степень полимеризации (DP) равна 1 (например, глюкоза, манноза, фруктоза и галактоза).
Термин «дисахарид» означает соединение, которое содержит две ковалентно связанные единицы моносахарида (DP2). Термин охватывает в качестве неограничивающих примеров такие соединения, как сахароза, лактоза и мальтоза.
Термин «DP>3» означает полимеры со степенью полимеризации больше 3.
Термин «олигосахарид» означает соединение, обладающее 2-10 единицами моносахарида, соединенными гликозидными связями.
Термин «полисахарид» означает соединение, обладающее многими единицами моносахарида, соединенными в линейную или разветвленную цепь. В некоторых вариантах осуществления термин относится к длинным цепям с сотнями или тысячами единиц моносахарида. Типичными примерами полисахаридов являются крахмал, целлюлоза и гликоген.
Как применяют здесь, термин «содержание твердых веществ (DS или ds)» относится к общему количеству твердых веществ в суспензии в % от массы сухого вещества.
Термин «измельчение» относится к разрушению зерен злаков на более мелкие частицы. В некоторых вариантах осуществления термин используют взаимозаменяемо с перемалыванием.
Термин «сухое измельчение» относится к измельчению сухого цельного зерна, при котором специально не удаляют такие фракции зерна, как зародыш и отруби.
Как применяют здесь, термины «высушенные вещества барды (DDG)» и «высушенные растворимые вещества барды (DDGS)» относятся к используемым побочным продуктам процессов брожения зерна.
Термин «DE» или «декстрозный эквивалент» является промышленным стандартом для измерения суммарной концентрации восстанавливающих сахаров, вычисляемым как количество D-глюкозы от массы сухого вещества. Негидролизованный гранулярный крахмал обладает DE, который равен по существу 0, и D-глюкоза обладает DE, равным 100.
Термин «сахарный сироп» относится к водной композиции, содержащей растворимые углеводы. В одном из вариантов осуществления сахарный сироп представляет собой сироп, содержащий глюкозу.
Аминокислотные последовательности глюкоамилазы Trichoderma reesei
Глюкоамилазу, полученную из Trichoderma reesei QM6a (ATCC, инвентарный № 13631), клонировали, как далее подробно описано в примере 1. Согласно изобретению полноразмерная глюкоамилаза, полученная из Trichoderma reesei, изображена на фиг.3 и обладает аминокислотной последовательностью SEQ ID NO: 3. Последовательность зрелого белка глюкоамилазы Trichoderma reesei (SEQ ID NO: 4) представлена аминокислотными остатками 34-632 на фиг.3.
Изобретение относится к выделенному ферменту, обладающему глюкоамилазной активностью, содержащему последовательность, показанную на SEQ ID NO: 4, или ферменту с глюкоамилазной активностью, являющейся по существу ей гомологичной.
В некоторых вариантах осуществления изобретение относится к глюкоамилазе, содержащей последовательность, показанную на SEQ ID NO: 3 или ферменту с глюкоамилазной активностью, являющейся по существу ей гомологичной. Глюкоамилаза SEQ ID NO: 3 содержит сигнальную последовательность глюкоамилазы, полученной из Trichoderma reesei.
В некоторых вариантах осуществления изобретение относится к полипептиду, обладающему глюкоамилазной активностью, содержащему каталитический домен глюкоамилазы SEQ ID NO: 4, который также представлен на SEQ ID NO: 40.
В других вариантах осуществления изобретение относится к крахмал-связывающему домену, идентичному, по меньшей мере, на 90%, по меньшей мере, на 95%, по меньшей мере, на 97% и, по меньшей мере, на 98% последовательности крахмал-связывающего домена глюкоамилазы, изображенной на SEQ ID NO: 4. В некоторых вариантах осуществления крахмал-связывающий домен содержит последовательность от положения остатка 524 до положения остатка 632 SEQ ID NO: 4, представленный на SEQ ID NO: 42.
В других вариантах осуществления крахмал-связывающий домен является фрагментом крахмал-связывающего домена SEQ ID NO: 4. Предпочтительно фрагмент будет содержать, по меньшей мере, 90, по меньшей мере, 80 или, по меньшей мере, 70 аминокислотных остатков крахмал-связывающего домена SEQ ID NO: 4.
Гомология последовательности белка
Гомологию между двумя глюкоамилазами можно определить как степень идентичности между аминокислотными последовательностями двух последовательностей белка. То, что полипептид или полинуклеотид обладает определенной процентной долей идентичности с другой последовательностью (т.е. 80%, 90% и 95%), означает, что при выравнивании эти процентные доли оснований или аминокислотных остатков являются одинаковыми при сравнении двух последовательностей. Это выравнивание и процентную долю гомологии или идентичности можно определить с использованием любого подходящего программного обеспечения, известного в данной области. Например, подходящие программы описаны в CURRENT PROTOCOLS IN MOLECULAR BIOLOGY (Ausubel et al., eds 1995, глава 19). Предпочтительные программы включают программу GCG Pileup (Wisconsin Package, версия 8.1 и 10.0), FASTA, BLAST и TFASTA. Другой предпочтительной программой для выравнивания является ALIGN или ALIGN Plus (Dayhoff (1978) в ATLAS OF PROTEIN SEQUENCE AND STRUCTURE 5: Suppl. 3 (National Biomedical Research Foundation)). Можно использовать другие алгоритмы BLASTP, BLASTN и BLASTX (Altschul et al., (1990) J. Mol. Biol. 215:403-410). Другие полезные способы включают ClustralW (Thompson et al., (1997) Nucleic Acid Research 25:4876-4882) с использованием программного обеспечения, предоставленного DNASTAR (Madison WI). Также ссылки сделаны на Needleman et al., (1970) J. Mol. Biol. 48:443, Smith et al., (1981) Adv. Appl. Math. 2:482, Smith et al., (1997) Meth. Mol. Biol. 70:173-187 и Pearson et al., (1988) Proc. Natl. Acad. Sci. 85:24444.
Согласно изобретению «по существу гомологичная» аминокислотная последовательность демонстрирует глюкоамилазную активность и, по меньшей мере, идентичность на 80%, по меньшей мере, на 83%, по меньшей мере, на 85%, по меньшей мере, на 87%, по меньшей мере, на 90%, по меньшей мере, на 93%, по меньшей мере, на 95%, по меньшей мере, на 97%, по меньшей мере, на 98% и, по меньшей мере, идентичность на 99% с последовательностью, изображенной на SEQ ID NO: 4, или последовательностью, изображенной на SEQ ID NO: 3. Особенно предпочтительными, по существу гомологичными последовательностями глюкоамилазы являются последовательности зрелого белка, как показано на фиг.15, и которые соответствуют SEQ ID NO: 17, 18, 19, 20, 21, 22, 43, 44, 45, 46 и 47. Кроме того, предпочтительными, по существу гомологичными последовательностями глюкоамилазы являются последовательности, показанные на фиг.15, которые соответствуют SEQ ID NO: 6, 8, 10, 12, 14, 16, 29, 31, 33, 35 и 37 и содержат лидерную последовательность. Другие по существу гомологичные полипептиды включают аллельные варианты и природные мутанты, обладающие глюкоамилазной активностью.
Глюкоамилазы по настоящему изобретению, включающие по существу гомологичные полипептиды и биологически функциональные фрагменты, обладают, по меньшей мере, 20%, по меньшей мере, 40%, по меньшей мере, 50%, по меньшей мере, 60%, по меньшей мере, 70%, по меньшей мере, 80%, по меньшей мере, 90%, по меньшей мере, 95% и, по меньшей мере, 100% глюкоамилазной активности зрелого белка, полученного из Trichoderma reesei, обладающего последовательностью, изображенной на фиг.3 (SEQ ID NO: 4). В некоторых предпочтительных вариантах осуществления изобретения удельная активность глюкоамилаз, тестируемых в, по существу, одинаковых условиях, будет равна, по меньшей мере, 90%, по меньшей мере, 100%, по меньшей мере, 125%, по меньшей мере, 150%, по меньшей мере, 175% и также, по меньшей мере, 200% удельной активности зрелого белка, полученного из Trichoderma reesei, обладающего последовательностью, изображенной на фиг.3 (SEQ ID NO: 4). В некоторых вариантах осуществления удельную активность можно измерять у растворимого крахмального субстрата, и в других вариантах осуществления удельную активность можно измерять у гранулярного крахмального субстрата.
В некоторых вариантах осуществления аминокислотная последовательность, обладающая, по меньшей мере, 80% идентичности последовательности с последовательностью SEQ ID NO 3 или SEQ ID NO: 4, будет содержать консервативные аминокислотные замены с использованием L-аминокислот, где одна из аминокислот замещена другой биологически сходной аминокислотой. Консервативными аминокислотными заменами являются те, которые сохраняют суммарный заряд, гидрофобность/гидрофильность и/или пространственный размер замещаемой аминокислоты. Неограничивающие примеры консервативных замен включают замены между следующими группами: Gly/Ala, Val/Ile/Leu, Lys/Arg, Asn/Gln, Glu/Asp, Ser/Cys/Thr и Phe/Trp/Tyr. Другие консервативные замены можно получить из таблицы ниже.
В других вариантах осуществления аминокислотные замены не будут являться консервативными заменами.
В некоторых вариантах осуществления предполагается, что глюкоамилаза по изобретению будет получена из мицелиального штамма гриба и, в частности, по существу гомологичные последовательности будут получены из штаммов рода Aspergillus spp., Rhizopus spp., Humicola spp., Fusarium spp., Mucor spp., Trichoderma spp. и т.п. В предпочтительном варианте осуществления по существу гомологичные последовательности, обладающие глюкоамилазной активностью, будут получены из штаммов группы семейства Trichoderma/Hypocrea. Некоторые из этих видов включают T. stromaticum, H. citrina var. americana, H. citrina, H. lactea, H. hunua, T. fertile, T. tomentosum, H. vinosa, T. harzianum, T. inhamatum, T. oblongisporum, T. cf. aureoviride, T. cf. harzianum, T. fasciculatum, H. tawa, T. crassum, T. flavovirens, T. virens, T. longipilis, T. spirale, T. strictipilis, H. pilulifera, T. polysporum, T. croceum, T. minutisporum, T. hamatum, T. asperellum, T. atroviride, T. koningii, T. viride, H. gelatinosa, T. strigosum, T. pubescens, H. novazelandiae, T. saturnisporum, T. longibrachiatum, H. orientalis, T. citrinoviride, T. reesei, T. ghanense, T. pseudokonimgii, H. andinensis и H. aureoviride. Особенно предпочтительные штаммы рода Trichoderma и родственного Hypocrea spp. включают H. citrina var. americana, H. citrina, H. lactea, H. vinosa, T. harzianum, T. atroviride, T. koningii, T. viride, H. gelatinosa, T. saturnisporum, T. longibrachiatum, H. orientalis, T. citrinoviride, T. reesei и T. konilangbra.
Некоторые штаммы видов, описанных выше, общедоступны из коллекций культур, таких как American Type Culture Collection (ATCC) P. O. Box 1549, Manassas, VA 20108; Deutsche Sammlung von Mikroorganismen und Zellkulturen GmbH (DSM); Agricultural Research Service Plant Culture Collection, Northern Regional Research Center (NRRL); the Centraalbureau voor Schimmelcultures (CBS), P. O. Box 85167, 3508 AD Utrecht, Нидерланды; Plant Research Institute, Department of Agriculture, Mycology, Ottawa, (DAOM) Канада, и International Mycological Institute (IMI), Genetic Resources Collection, Egham, Великобритания.
Биологически функциональные фрагменты глюкоамилазы
В некоторых вариантах осуществления изобретение относится к биологически функциональным фрагментам глюкоамилазы, показанным на SEQ ID NO: 3, SEQ ID NO: 4 или по существу гомологичным им последовательностям. В некоторых вариантах осуществления биологически функциональный фрагмент будет содержать каталитический домен глюкоамилазы, относящейся к изобретению. В других вариантах осуществления биологически функциональные фрагменты будут содержать, по меньшей мере, 400 аминокислотных остатков, по меньшей мере, 425 аминокислотных остатков, по меньшей мере, 450 аминокислотных остатков, и также, по меньшей мере, 460 аминокислотных остатков.
В некоторых предпочтительных вариантах осуществления фрагмент будет содержать, по меньшей мере, часть аминокислотной последовательности, представленной положениями остатков от 1 до 453 SEQ ID NO: 4, и в других вариантах осуществления фрагмент будет содержать положения от 1 до 453 SEQ ID NO: 4. В других предпочтительных вариантах осуществления фрагмент будет содержать аминокислотную последовательность, представленную положениями остатков от 1 до 453 SEQ ID NO: 17; положениями остатков от 1 до 452 SEQ ID NO: 18; положениями остатков от 1 до 454 SEQ ID NO: 19; положениями остатков от 1 до 452 SEQ ID NO: 20; положениями остатков от 1 до 453 SEQ ID NO: 21; положениями остатков от 1 до 453 SEQ ID NO: 22; положениями остатков от 1 до 452 SEQ ID NO: 43; положениями остатков от 1 до 452 SEQ ID NO: 44; положениями остатков от 1 до 453 SEQ ID NO: 45; положениями остатков от 1 до 452 SEQ ID NO: 46; или положениями остатков от 1 до 453 SEQ ID NO: 47.
Биологически функциональные фрагменты глюкоамилазы, относящиеся к изобретению, можно получить способом, известным в данной области.
Глюкоамилазы, обладающие, по меньшей мере, 85%, по меньшей мере, 90%, по меньшей мере, 93%, по меньшей мере, 95%, по меньшей мере, 97%, по меньшей мере, 98% и, по меньшей мере, 99% идентичности последовательности с фрагментом, который содержит аминокислотные остатки от 1 до 453 SEQ ID NO: 4, также относятся к изобретению.
В других вариантах осуществления биологически функциональные фрагменты будут содержать каталитический домен и линкерную последовательность глюкоамилазы, показанной на SEQ ID NO: 4.
Биологически функциональные фрагменты могут также содержать слитые полипептиды или расщепляемые слитые полипептиды, в которых другой полипептид слит с N-концом и/или C-концом полипептида. Способы получения слитых полипептидов известны в данной области.
Последовательности ДНК, клонированные из Trichoderma reesei, и по существу гомологичные
Изобретение также относится к клонированной последовательности ДНК, кодирующей полипептид, проявляющий глюкоамилазную активность по изобретению; где указанная последовательность ДНК содержит
a) последовательность ДНК, показанную на SEQ ID NO: 1;
b) последовательность ДНК, показанную на SEQ ID NO: 2;
c) последовательность ДНК, кодирующую глюкоамилазу, обладающую, по меньшей мере, 80%, по меньшей мере, 83%, по меньшей мере, 85%, по меньшей мере, 87%, по меньшей мере, 90%, по меньшей мере, 93%, по меньшей мере, 95%, по меньшей мере, 97%, по меньшей мере, 98% и, по меньшей мере, 99% идентичности с последовательностью SEQ ID NO: 3;
d) последовательность ДНК, кодирующую глюкоамилазу, обладающую, по меньшей мере, 80%, по меньшей мере, 83%, по меньшей мере, 85%, по меньшей мере, 87%, по меньшей мере, 90%, по меньшей мере, 93%, по меньшей мере, 95%, по меньшей мере, 97%, по меньшей мере, 98% и, по меньшей мере, 99% идентичности с последовательностью SEQ ID NO: 4;
e) последовательность ДНК, кодирующую фермент, обладающий глюкоамилазной активностью, где фермент обладает, по меньшей мере, 95%, по меньшей мере, 96%, по меньшей мере, 97%, по меньшей мере, 98% и, по меньшей мере, 99% идентичности последовательности с любой из последовательностей, показанных на SEQ ID NO: 17, 18, 19, 20, 21, 22, 43, 44, 45, 46 и 47;
f) последовательность ДНК, кодирующую биологически функциональный фрагмент последовательности, обладающий, по меньшей мере, 85%, по меньшей мере, 90%, по меньшей мере, 95%, по меньшей мере, 96%, по меньшей мере, 97% и, по меньшей мере, 98% идентичности с положениями аминокислотных остатков от 1 до 453 последовательности, показанной на SEQ ID NO: 4;
g) последовательность ДНК, кодирующую фермент, обладающий глюкоамилазной активностью, содержащий аминокислотную последовательность, обладающую, по меньшей мере, 90%, по меньшей мере, 95%, по меньшей мере, 97% и, по меньшей мере, 98% идентичности последовательности с любой из следующих последовательностей:
a. положения аминокислотных остатков от 1 до 453 SEQ ID NO: 17;
b. положения аминокислотных остатков от 1 до 452 SEQ ID NO: 18;
c. положения аминокислотных остатков от 1 до 454 SEQ ID NO: 19;
d. положения аминокислотных остатков от 1 до 452 SEQ ID NO: 20;
e. положения аминокислотных остатков от 1 до 453 SEQ ID NO: 21;
f. положения аминокислотных остатков от 1 до 453 SEQ ID NO: 22;
g. положения аминокислотных остатков от 1 до 452 SEQ ID NO: 43;
h. положения аминокислотных остатков от 1 до 452 SEQ ID NO: 44;
i. положения аминокислотных остатков от 1 до 453 SEQ ID NO: 45;
j. положения аминокислотных остатков от 1 до 452 SEQ ID NO: 46;
k. положения аминокислотных остатков от 1 до 453 SEQ ID NO: 47.
h) ДНК, которая, по меньшей мере, на 80%, по меньшей мере, на 85%, по меньшей мере, на 90%, по меньшей мере, на 93%, по меньшей мере, на 95%, по меньшей мере, на 97% и, по меньшей мере, на 99% идентична последовательности, показанной на SEQ ID NO: 1 или SEQ ID NO: 2, где указанная последовательность ДНК кодирует фермент, обладающий глюкоамилазной активностью; или
i) последовательность ДНК, которая гибридизуется в условиях высокой жесткости с зондом из нуклеиновой кислоты, соответствующей последовательности ДНК SEQ ID NO: 2 или ее фрагменту, обладающему, по меньшей мере, 20, по меньшей мере, 30, по меньшей мере, 40, по меньшей мере, 50, по меньшей мере, 60, по меньшей мере, 70, по меньшей мере, 100, по меньшей мере, 150 последовательными нуклеотидами.
Изобретение, кроме того, относится к клонированной последовательности ДНК, кодирующей фермент, обладающий глюкоамилазной активностью и, по меньшей мере, 95%, по меньшей мере, 96%, по меньшей мере, 97%, по меньшей мере, 98% и, по меньшей мере, 99% идентичности последовательности с любой из аминокислотных последовательностей SEQ ID NO: 6, 8, 10, 12, 14, 16, 29, 31, 33, 35 и 37.
Вследствие вырожденности генетического кода более одного кодона можно использовать для кодирования конкретной аминокислоты. Таким образом, разные последовательности ДНК могут кодировать полипептид, обладающий точно такой же аминокислотной последовательностью, как полипептид, например, SEQ ID NO: 4. Настоящее изобретение относится к полинуклеотидам, которые кодируют один и тот же полипептид. Последовательности ДНК, которые кодируют глюкоамилазы, относящиеся к изобретению, могут включать или не включать интроны.
Гомологию последовательностей ДНК определяют как степень идентичности между двумя последовательностями ДНК. Гомологию можно определять с использованием компьютерных программ, как описано выше, для определения гомологии последовательности белка.
Нуклеиновую кислоту гибридизуют с другой нуклеиновой кислотой, при этом одноцепочечная форма нуклеиновой кислоты может отжигаться на другую нуклеиновую кислоту в подходящих условиях температуры и ионной силы раствора. Условия гибридизации и отмывки хорошо известны в данной области для гибридизации в условиях низкой, средней, средней/высокой, высокой и очень высокой жесткости (см., например, Sambrook et al., выше, в частности, главы 9 и 11). Как правило, гибридизация включает нуклеотидный зонд и гомологичную последовательность ДНК, которые формируют стабильные двухцепочечные гибриды посредством протяженного спаривания оснований комплементарных полинуклеотидов (см., глава 8, GeneCloning, An Introduction, T.A. Brown, (1995) Chapman and Hall, London).
Фильтр с зондом и гомологичной последовательностью отмывают в 2x хлориде натрия/цитрате натрия (SSC), 0,5% SDS, приблизительно при 60°C (средняя жесткость), 65°C (средняя/высокая жесткость), 70°C (высокая жесткость) и приблизительно 75°C (очень высокая жесткость).
Векторы
Согласно одному из вариантов осуществления изобретения конструкцию ДНК, содержащую последовательность нуклеиновой кислоты, кодирующей глюкоамилазу, относящуюся к изобретению, и функционально связанную с последовательностью промотора, собирают для введения в клетку-хозяина. Конструкцию ДНК можно вводить в клетку-хозяина с использованием вектора. Вектор может являться любым вектором, который при введении в клетку-хозяина интегрируется в геном клетки-хозяина и реплицируется. Векторы включают векторы для клонирования, экспрессирующие векторы, челночные векторы, плазмиды, фаговые частицы, кассеты и т.п. В некоторых предпочтительных вариантах осуществления вектор представляет собой экспрессирующий вектор, который содержит регуляторные последовательности, функционально связанные с последовательностью, кодирующей глюкоамилазу.
Примеры подходящих векторов для экспрессии и/или интеграции представлены в Sambrook et al., (1989) выше, и Ausubel (1987) выше, и van den Hondel et al. (1991) в Bennett and Lasure (Eds.) MORE GENE MANIPULATIONS IN FUNGI, Academic Press pp. 396-428, и патенте США № 5874276. Ссылка также сделана на Fungal Genetics Stock Center Catalogue of Strains (FGSC,
В некоторых предпочтительных вариантах осуществления промотор, для которого показана транскрипционная активность в грибной клетке-хозяине, можно получить из генов, кодирующих белки, как гомологичные, так и гетерологичные для клетки-хозяина. Промотор может являться мутантным, усеченным и гибридным промотором. Предпочтительно промотор пригоден для хозяина Trichoderma или Aspergillus. Типичные промоторы включают промоторы T. reeseicbh1, cbh2, egl1, egl2, eg5, xln1 и xln2. Другие примеры пригодных промоторов включают промоторы из генов глюкоамилазы A. awamori и A. niger (glaA) (см. Nunberg et al, (1984) Mol. Cell Biol. 4:2306-2315 и Boel et al., (1984) EMBO J. 3:1581-1585), генов ацетамидазы Aspergillus nidulans и генов липазы Rhizomucor miehei.
В одном из вариантов осуществления промотор является природным для клетки-хозяина. Например, если T. reesei является хозяином, промотор является природным промотором T. reesei.
В другом варианте осуществления промотор является гетерологичным для грибной клетки-хозяина.
В предпочтительном варианте осуществления промотор является cbh1 T. reesei, который представляет собой индуцибельный промотор и хранится в GenBank под инвентарным № D86235.
«Индуцибельный промотор» является промотором, активность которого регулируется окружающей средой или развитием. В некоторых вариантах осуществления конструкция ДНК включает нуклеиновые кислоты, кодирующие сигнальную последовательность, которая является аминокислотной последовательностью, связанной с N-концом полипептида, которая направляет кодируемый полипептид в секреторный путь клетки. 5'-конец кодирующей последовательности у последовательности нуклеиновой кислоты может естественным образом содержать кодирующую область сигнального пептида, которая естественным образом связана в трансляционной рамке считывания с сегментом последовательности, кодирующей глюкоамилазу, которая кодирует секретируемую глюкоамилазу, или 5'-конец кодирующей последовательности у последовательности нуклеиновой кислоты может содержать сигнальный пептид, который является чужеродным для кодирующей последовательности. В некоторых предпочтительных вариантах осуществления конструкция ДНК содержит сигнальную последовательность, которая естественным образом ассоциирована с экспрессирующимся геном глюкоамилазы. Эффективные сигнальные последовательности могут включать сигнальные последовательности, полученные из глюкоамилаз клеток других мицелиальных грибов, таких как Humicola, Aspergillus и Rhizopus.
В предпочтительных вариантах осуществления нуклеиновая кислота конструкции ДНК кодирует сигнальную последовательность, обладающую, по меньшей мере, 95%, по меньшей мере, 96%, по меньшей мере, 97%, по меньшей мере, 98% и, по меньшей мере, 99% идентичности последовательности с сигнальной последовательностью, изображенной на фиг. 3.
В дополнительных вариантах осуществления конструкция ДНК или вектор, содержащий сигнальную последовательность и последовательность промотора для введения в грибную клетку-хозяина, происходят из одного источника. Например, в некоторых вариантах осуществления сигнальная последовательность является сигнальной последовательностью cbh1, которая функционально связана с промотором cbh1. В других предпочтительных вариантах осуществления будет использована природная сигнальная последовательность глюкоамилазы члена группы семейства Trichoderma/Hypocrea.
В некоторых вариантах осуществления экспрессирующий вектор также содержит терминаторную последовательность. Любую терминаторную последовательность, функциональную в клетке-хозяине, можно применять по настоящему изобретению. В одном из вариантов осуществления терминаторная последовательность и последовательность промотора происходят из одного источника. В другом варианте осуществления терминаторная последовательность гомологична для клетки-хозяина. Особенно подходящей терминаторной последовательностью является cbh1, полученная из штамма Trichoderma и, в частности, T. reesei. Другие пригодные терминаторы из грибов включают терминатор из генов глюкоамилазы A. niger или A. awamori (Nunberg et al. (1984) выше, и Boel et al., (1984) выше), генов антранилатсинтазы Aspergillus nidulans, генов TAKA-амилазы Aspergillus oryzae или trpC A. nidulans (Punt et al., (1987) Gene 56:117-124).
В некоторых вариантах осуществления экспрессирующий вектор содержит селектируемый маркер. Примеры предпочтительных селектируемых маркеров включают те, которые придают противомикробную устойчивость (например, гигромицин и флеомицин). Трофические селективные маркеры также находят применение по настоящему изобретению, включая маркеры, которые известны в данной области, такие как amdS, argB и pyr4. Маркеры, пригодные в векторных системах для трансформации Trichoderma, известны в данной области (см., например, Finkelstein, глава 6 в BIOTECHNOLOGY OF FILAMENTOUS FUNGI, Finkelstein et al. Eds. Butterworth-Heinemann, Boston, MA (1992), Chap. 6.; и Kinghorn et al. (1992) APPLIED MOLECULAR GENETICS OF FILAMENTOUS FUNGI, Blackie Academic and Professional, Chapman and Hall, London). В предпочтительном варианте осуществления селективный маркер является геном amdS, который кодирует фермент ацетамидазу, позволяющую трансформированным клеткам расти на ацетамиде, как источнике азота. Применение гена amdS A. nidulans в качестве селективного маркера описано в Kelley et al., (1985) EMBO J. 4:475-479 и Penttila et al., (1987) Gene 61:155-164.
Способы, используемые для лигирования конструкции ДНК, содержащей последовательность нуклеиновой кислоты, кодирующую глюкоамилазу, промотор, терминатор и другие последовательности, и для вставки их в подходящий вектор, хорошо известны в данной области. Соединение обычно осуществляют лигированием в подходящие участки рестрикции. Если такие участки не существуют, используют синтетические олигонуклеотидные линкеры в соответствии с общепринятой практикой. (См. Sambrook (1989) выше, и Bennett and Lasure, MORE GENE MANIPULATIONS IN FUNGI, Academic Press, San Diego (1991) pp 70-76.) Кроме того, векторы можно конструировать с использованием известных способов рекомбинации (например, Invitrogen Life Technologies, Gateway Technology).
Клетки-хозяева
Настоящее изобретение также относится к клеткам-хозяевам, содержащим последовательность нуклеиновой кислоты, кодирующую глюкоамилазу по изобретению, которые применяют в получении глюкоамилаз по изобретению. Предпочтительными клетками-хозяевами согласно изобретению являются клетки мицелиальных грибов, и термин «клетка-хозяин» включает как клетки, потомки клеток, так и протопласты, полученные из клеток штаммов мицелиальных грибов.
Термин «мицелиальные грибы» относится ко всем мицелиальным формам подотдела Eumycotina (см. Alexopoulos, C.J. (1962), INTRODUCTORY MYCOLOGY, Wiley, New York). Данные грибы характеризуются вегетативным мицелием с клеточной стенкой, состоящей из хитина, целлюлозы и других сложных полисахаридов. Мицелиальные грибы по настоящему изобретению морфологически, физиологически и генетически отличны от дрожжей. Вегетативный рост мицелиальных грибов представляет собой вытягивание гиф, и катаболизм углерода является облигатно аэробным. По настоящему изобретению родительская клетка мицелиального гриба может являться клеткой видов в качестве неограничивающих примеров Trichoderma (например, Trichoderma reesei, бесполая форма Hypocrea jecorina, T. longibrachiatum, Trichoderma viride, Trichoderma koningii, Trichoderma harzianum), Penicillium sp., Humicola sp. (например, H. insolens, H. lanuginosa и H. grisea), Chrysosporium sp. (например, C. lucknowense), Gliocladium sp., Aspergillus sp. (например, A. oryzae, A. niger, A. nidulans и A. awamori), Fusarium sp.(например, F. graminum и F. venenatum), Neurospora sp., Hypocrea sp., Mucor и Emericella sp. (См. также Innis et al., (1985) Sci. 228:21-26). Термин «Trichoderma» или «Trichoderma sp.» относится к любому роду грибов ранее или в настоящее время классифицированного как Trichoderma. В некоторых вариантах осуществления клетка-хозяин будет генетически модифицированной клеткой-хозяином, в которой природные гены инактивированы, например, делецией. При необходимости получить грибную клетку-хозяина, содержащую один или несколько инактивированных генов, можно использовать известные способы (например, способы, описанные в патенте США № 5246853, патенте США № 5475101 и WO 92/06209). Инактивацию гена можно осуществить посредством полной или частичной делеции, инактивацией вставкой или любыми другими средствами, которые делают ген нефункциональным для намеченной цели (так, что предотвращается экспрессия гена в виде функционального белка). Любой ген из Trichoderma sp. или другого мицелиального грибного хозяина, который клонировали, можно делетировать. В некоторых предпочтительных вариантах осуществления, где клеткой-хозяином является клетка Trichoderma и, в частности, клетки-хозяева T. reesei, гены cbh1, cbh2, egl1 и egl2 будут инактивированы и предпочтительно делетированы. Особенно предпочтительные клетки-хозяева Trichoderma reesei, обладающие четырьмя делетированными белками, предложены и описаны в USP 5847276 и WO 05/001036.
Трансформация клеток-хозяев
Ведение конструкции ДНК или вектора в клетку-хозяина включает способы, такие как трансформация, электропорация, ядерная микроинъекция, трансдукция, трансфекция (например, трансфекция, опосредованная липофекцией и опосредованная DEAE-декстрином), инкубация с преципитатом фосфата кальция-ДНК, высокоскоростное обстреливание микропулями, покрытыми ДНК, и слияние протоплатов. Основные способы трансформации известны в данной области (см., например, Ausubel et al., (1987), выше, глава 9; и Sambrook (1989) выше, и Campbell et al., (1989) Curr. Genet. 16:53-56). Экспрессия гетерологичного белка в Trichoderma описана в USP 6022725; USP 6268328; Harkki et al. (1991), Enzyme Microb. Technol. 13:227-233; Harkki et al., (1989) Bio Technol. 7:596-603; EP 244234; EP 215594; и Nevalainen et al, «The Molecular Biology of Trichoderma and its Application to the Expression of Both Homologous and Heterologous Genes», in MOLECULAR INDUSTRIAL MYCOLOGY, Eds. Leong and Berka, Marcel Dekker Inc., NY (1992) pp. 129-148). Ссылка также сделана на Cao et al, (2000) Sci. 9:991-1001 и EP 238023 для трансформации штаммов Aspergillus и WO 96/00787 для трансформации штаммов Fusarium.
Предпочтительно генетически стабильные трансформанты получают посредством векторных систем, в результате чего нуклеиновая кислота, кодирующая глюкоамилазу, стабильно встраивается в хромосому штамма-хозяина. Трансформанты затем отбирают известными способами. В одном из неограничивающих примеров стабильные трансформанты, содержащие маркер amdS, отличаются от нестабильных трансформантов по более высокой скорости роста и формированию округлых колоний с гладким, а не шероховатым, контуром на твердой культуральной среде, содержащей ацетамид. Кроме того, в некоторых случаях проводят дополнительный тест на стабильность выращиванием трансформантов на твердой неселективной среде (т.е. (NH4)2SO4 (5 мг/мл) в качестве источника азота), собиранием спор с данной культуральной среды и определением процентной доли этих спор, которые затем прорастают и растут на селективной среде, содержащей 10 мМ ацетамида в качестве единственного источника азота. Альтернативно можно использовать другие способы, известные в данной области, для селекции трансформантов.
В одном из конкретных вариантов осуществления получение Trichoderma sp. для трансформации включает получение протопластов из грибных мицелиев (см. Campbell et al, (1989) Curr. Genet. 16:53-56). Также известна трансформация мицелиальных грибов посредством вызывания опухолей агробактериумом (см. de Groot et al., (1998) Nat. Biotechnol. 16:839-842).
В некоторых вариантах осуществления мицелии получают из прорастающих вегетативных спор. Мицелии обрабатывают ферментом, который переваривает клеточную стенку, давая в результате протопласты. Протопласты затем защищают присутствием осмотического стабилизатора в среде для суспендирования. Данные стабилизаторы включают сорбит, маннит, хлорид калия, сульфат магния и т.п. Как правило, концентрация данных стабилизаторов варьирует между 0,8 M и 1,2 M. Предпочтительно использовать приблизительно 1,2 M раствор сорбита в среде для суспендирования. Поглощение ДНК штаммом-хозяином Trichoderma sp. зависит от концентрации ионов кальция. Как правило, в растворе для поглощения используют приблизительно между 10 мМ CaCl2 и 50 мМ CaCl2. Также сделана ссылка на USP 6022725 и USP 6268328 для способов трансформации, используемых для мицелиальных грибных хозяев.
Настоящее изобретение относится к способам рекомбинантного получения глюкоамилазы, включающим экспрессию полинуклеотида, кодирующего глюкоамилазу по изобретению в мицелиальной грибной клетке-хозяине, и культивирование клетки-хозяина в условиях, подходящих для продукции глюкоамилазы и, не обязательно, выделения глюкоамилазы.
В способах экспрессии и продукции по настоящему изобретению клетки грибов культивируют в подходящих условиях культивирования в колбах при качании, мелкомасштабных или крупномасштабных ферментациях (включая ферментации непрерывные, периодические и периодические с подпиткой) в лабораторных или промышленных ферментерах, в подходящей среде, содержащей физиологические соли и питательные вещества (см., например, Pourquie, J. et al., BIOCHEMISTRY AND GENETICS OF CELLULOSE DEGRADATION, eds. Aubert, J.P. et al., Academic Press, pp. 71-86, 1988 и Ilmen, M. et al., (1997) Appl. Environ. Microbiol. 63:1298-1306). Общеприятые коммерчески получаемые среды (например, среда с дрожжевым и солодовым экстрактом (YM), среда Луриа Бертани (LB) и среда Сабуро с глюкозой (SD)) находят применение в настоящем изобретении. Предпочтительные условия культивирования для данного мицелиального гриба известны в данной области, и их можно найти в научной литературе и/или от поставщика грибов, такого как American Type Culture Collection и Fungal Genetics Stock Center. В случаях, где последовательность, кодирующая глюкоамилазу, находится под управлением индуцибельного промотора, в среду добавляют индуцирующее вещество (например, сахар, соль металла или противомикробное средство) в концентрации, эффективной для индукции экспрессии глюкоамилазы.
В некоторых вариантах осуществления с целью оценки экспрессии глюкоамилазы линией клеток, которую трансформировали полинуклеотидом, кодирующим глюкоамилазу, относящуюся к изобретению, проводят анализы уровня белка, уровня РНК и/или используют функциональные биоанализы, специфические для активности и/или продукции глюкоамилазы. Некоторые из этих анализов включают нозерн-блоттинг, дот-блоттинг (анализ ДНК или РНК), RT-ПЦР (полимеразную цепную реакцию с обратной транскрипцией), или гибридизацию in situ с использованием соответствующим образом меченого зонда (на основе кодирующей последовательности нуклеиновой кислоты) и общепринятый саузерн-блоттинг и авторадиографию.
Кроме того, продукцию и/или экспрессию глюкоамилазы можно измерять непосредственно в образце, например, с помощью анализов, непосредственно измеряющих восстанавливающие сахара, такие как глюкозу, в культуральной среде, и с помощью анализов для измерения активности, экспрессии и/или продукции глюкоамилазы. В частности, глюкоамилазную активность можно анализировать способом с использованием 3,5-динитросалициловой кислоты (DNS) (см. Goto et al., (1994) Biosci. Biotechnol. Biochem. 58:49-54). В дополнительных вариантах осуществления экспрессию белка оценивают иммунологическими способами, такими как иммуногистохимическое окрашивание клеток, срезов тканей или иммуноанализ тканевой культуральной среды (например, посредством вестерн-блоттинга или ELISA). Такие иммуноанализы можно использовать для качественной и количественной оценки экспрессии глюкоамилазы. Подробности таких способов известны специалистам в данной области и коммерчески доступны многие реагенты для осуществления таких способов.
Глюкоамилазы по настоящему изобретению можно выделять или очищать из культуральных сред множеством способов, известных в данной области, включая центрифугирование, фильтрацию, экстракцию, осаждение и т.п.
Применения и композиции
Настоящее изобретение также относится к композициям, содержащим глюкоамилазы по изобретению, и способам применения глюкоамилаз в промышленных и коммерческих приложениях. Неограничивающие примеры, которые включают применение глюкоамилаз, относящихся к изобретению, в промышленных и коммерческих приложениях кратко описаны ниже.
Глюкоамилазы можно применять в гидролизе крахмала и осахаривающих композициях, очищающих и детергентных композициях (например, детергентах для стирки белья, детергентах для мытья посуды и композициях для очищения твердых поверхностей), и в композициях корма для животных. Далее, глюкоамилазы можно применять в приложениях к хлебопекарному производству, таких как изготовление хлеба и тортов, приложениях к пивоварению, здравоохранению, текстильной промышленности, процессам переработки отходов, загрязняющих окружающую среду, биологическому размягчению древесины и переработке биомассы.
В частности, глюкоамилазы могут быть использованы для процессов конверсии крахмала и, в частности, в производстве декстрозы для фруктозных сиропов, специальных сахаров и в алкогольном и другом производстве конечного продукта (например, органической кислоты, аскорбиновой кислоты и аминокислот) в результате ферментации крахмалсодержащих субстратов (G.M.A. van Beynum et al., Eds. (1985) Starch Conversion Technology, Marcel Dekker Inc. NY). Декстрины, получаемые с использованием глюкоамилазных композиций согласно изобретению, могут приводить к выходам глюкозы по меньшей мере 80%, по меньшей мере 85%, по меньшей мере 90%, по меньшей мере 95%. Производство спирта ферментацией крахмальных субстратов с использованием глюкоамилаз, охватываемое изобретением, может включать производство топливного спирта или портативного спирта.
В одном из предпочтительных вариантов осуществления глюкоамилазы по изобретению найдут применение в гидролизе крахмала из разнообразных субстратов растительного происхождения, которые используют для получения спирта. В некоторых предпочтительных вариантах осуществления субстраты растительного происхождения будут включать кукурузу, пшеницу, ячмень, рожь, сорго, рис, сахарный тростник и их сочетания. В некоторых вариантах осуществления субстрат растительного происхождения будет фракционированным растительным материалом, например зерном злаков, таких как кукуруза, который фракционируют на компоненты, такие как волокно, зародыш, белок и крахмал (эндосперм) (USP 6254914 и USP 6899910). Способы спиртовых брожений описаны в THE ALCOHOL TEXTBOOK, A REFERENCE FOR THE BEVERAGE, FUEL AND INDUSTRIAL ALCOHOL INDUSTRIES, 3rd Ed., Eds K.A. Jacques et al., 1999, Nottingham University Press, UK. В некоторых предпочтительных вариантах осуществления спиртом будет этанол. В частности, способы получения спиртового брожения характеризуются как способы влажного измельчения или сухого измельчения. В некоторых вариантах осуществления глюкоамилазу будут применять в способе брожения с влажным измельчением, и в других вариантах осуществления глюкоамилаза найдет применение в способе сухого измельчения.
Измельчение сухого зерна включает ряд основных стадий, которые обычно включают: перемалывание, тепловую обработку, разжижение, осахаривание, брожение и разделение жидкости и твердых веществ для получения спирта и других побочных продуктов. Растительный материал и, в частности, цельные зерна злаков, таких как кукуруза, пшеница или рожь, перемалывают. В некоторых случаях зерно можно сначала фракционировать на составные части. Перемолотый растительный материал можно измельчать до получения крупных или мелких частиц. Перемолотый растительный материал смешивают с жидкостью в резервуаре для суспензии. Суспензию подвергают воздействию высоких температур в трубчатом разварнике вместе с разжижающими ферментами (например, альфа-амилазами) до растворения и гидролизуют крахмал злаков до декстринов. Смесь охлаждают и далее обрабатывают осахаривающими ферментами, такими как глюкоамилазы, относящиеся по настоящему изобретению, для получения глюкозы. Сусло, содержащее глюкозу, затем сбраживают в течение приблизительно от 24 до 120 часов в присутствии сбраживающих микроорганизмов, таких как микроорганизмы, вырабатывающие этанол, и, в частности, дрожжи (Saccharomyces spp). Твердые вещества сусла отделяют от жидкой фазы и получают спирт, такой как этанол, и полезные побочные продукты, такие как вещества барды.
В некоторых вариантах осуществления стадию осахаривания и стадию брожения объединяют, и способ обозначают как одновременное осахаривание и брожение или одновременное осахаривание, размножение дрожжей и брожение.
В других вариантах осуществления стадию тепловой обработки или воздействие на крахмалсодержащий субстрат температур выше температуры желатинизации крахмала в субстрате можно элиминировать. Данные способы брожения в некоторых вариантах осуществления включают измельчение зерна злаков или фракционирование зерна и объединение перемолотого зерна злаков с жидкостью для формирования суспензии, которую затем смешивают в одном сосуде с глюкоамилазой согласно изобретению и, не обязательно, другими ферментами, такими как, в качестве неограничивающих примеров, альфа-амилазы, другие глюкоамилазы и ферменты, обладающие гидролизирующей активностью по отношению к гранулярному крахмалу, и дрожжами для получения этанола и других побочных продуктов (USP 4514496, WO 04/081193 и WO 04/080923).
В некоторых вариантах осуществления изобретение относится к способу осахаривания жидкого крахмального раствора, который включает стадию ферментативного осахаривания с использованием глюкоамилазы по изобретению.
В некоторых вариантах осуществления композицию ферментов, включающую глюкоамилазу, относящуюся к изобретению и полученную в культуральных средах или выделенную и очищенную от культуральной среды, будут по желанию применять в сочетании с любым одним из или сочетанием следующих ферментов - альфа-амилазами, протеазами, пуллуланазами, изоамилазами, целлюлазами, гемицеллюлазами, ксиланазами, циклодекстрингликотрансферазами, липазами, фитазами, лакказами, оксидазами, эстеразами, кутиназами, ксиланазами, ферментом, гидролизующим гранулярный крахмал, и другими глюкоамилазами.
В некоторых особенно предпочтительных композициях глюкоамилазы по изобретению будут сочетать с альфа-амилазами, такими как альфа-амилазы грибов (например, из Aspergillus sp.) или бактериальными альфа-амилазами (например, из Bacillus sp., такого как B. stearothermophilus, B. amyloliquefaciens и B. licheniformis) и их вариантами. В некоторых вариантах осуществления альфа-амилаза будет альфа-амилазой, обладающей, по меньшей мере, 90%, 93%, 95%, 96%, 97%, 98% и 99% идентичности последовательности с последовательностью зрелого белка SEQ ID NO: 27. Коммерчески доступные альфа-амилазы, предусматриваемые для применения в композициях по изобретению, известны и включают GZYME G997, SPEZYME FRED, SPEZYME EHTYL (Genencor International Inc.), и TERMAMYL 120-L и SUPRA (Novozymes, Biotech.).
В других, особенно предпочтительных вариантах осуществления глюкоамилазы по изобретению будут сочетать с другими глюкоамилазами. В некоторых вариантах осуществления глюкоамилазы по изобретению будут сочетать с одной или несколькими глюкоамилазами, полученными из штаммов Aspergillus или их вариантов, таких как A. oryzae, A. niger (например, последовательность зрелого белка на фиг.20(A)), A. kawachi и A. awamori; глюкоамилазами, полученными из штаммов Humicola или их вариантов, в частности H. grisea, такими как глюкоамилаза, обладающая, по меньшей мере, 90%, 93%, 95%, 96%, 97%, 98% и 99% идентичности последовательности SEQ ID NO: 3, описанной в WO 05/052148; глюкоамилазами, полученными из штаммов Talaromyces или их вариантов, в частности T. emersonii; и глюкоамилазами, полученными из штаммов Athelia и, в частности, A. rolfsii.
МАТЕРИАЛЫ И МЕТОДЫ
В описании и экспериментальном разделе, который следует, используют следующие сокращения:
TrGA (композиция глюкоамилазы Trichoderma reesei, зрелый белок, обладающий аминокислотной последовательностью SEQ ID NO: 4); AkAA (композиция альфа-амилазы Aspergillus kawachi, которая обладает последовательностью зрелого белка SEQ ID NO: 27); AnGA (ДИСТИЛЛАЗА, содержащая GA из Aspergillus niger (Genencor International Inc.,)); GA (глюкоамилаза); GAU (единица активности глюкоамилазы); AAU (единица активности альфа-амилазы); мас.% (массовое процентное содержание); °C (градусы Цельсия); об/мин (обороты в минуту); H2O (вода); dH2O (деионизованная вода); dIH2O (деионизованная вода, фильтрация Milli-Q); ак или АК (аминокислота); п.н. (пара оснований); т.п.н. (тысяча пар оснований); кД или кДа (килодальтоны); г (граммы); мкг (микрограммы); мг (миллиграммы); мкл (микролитры); мл (миллилитры); мм (миллиметры); мкм (микрометр); M (молярный); мМ (миллимолярный); мкМ (микромолярный); Ед (единицы активности); В (вольты); MW (молекулярный вес); сек (секунды); мин (минута/минуты); час (час/часы); DO (растворенный кислород) и EtOH (этанол).
Следующие анализы и способы использовали в примерах, приведенных ниже.
1) Анализ GA - анализ глюкоамилазы
Глюкоамилазную активность измеряли с использованием хорошо известного анализа, основанного на способности глюкоамилазы катализировать гидролиз п-нитрофенил-альфа-D-глюкопиранозида (pNPG) до глюкозы и п-нитрофенола. При щелочном pH нитрофенол дает желтое окрашивание, которое пропорционально активности глюкоамилазы, и его измеряют при 400 нм и сравнивают с ферментным стандартом, измеряемым в GAU (Elder, M. T. and Montgomery R.S., Glucoamylase activity in industrial enzyme preparations using colorimetric enzymatic method, Journal of AOAC International, vol. 78(2), 1995).
Одну GAU определяют как количество фермента, который будет давать 1 г восстанавливающего сахара, вычисляемого как количество глюкозы в час из растворимого крахмального субстрата (4% ds) при pH 4,2 и 60°C.
2) Праймеры и протокол ПЦР для амплификации генов из штаммов Trichoderma/Hypocrea:
Что касается программы ПЦР, начальная денатурация составляла 2 мин при 94°C для 1 цикла; денатурация 30 с при 94°C, отжиг 30 с при 55°C и элонгация 2 мин при 68°C для 30 циклов, и заключительная стадия элонгации 7 мин при 68°C.
3) Определения этанола и углеводов
Содержание этанола и углеводов в образце определяли с использованием способа ВЭЖХ, как здесь описано:
a) центрифужную пробирку Eppendorf на 1,5 мл наполняли зрелой бражкой и охлаждали на льду 10 мин;
b) пробирку с образцом центрифугировали 1 мин в настольной центрифуге Eppendorf;
c) 0,5 мл образца супернатанта переносили в пробирку для тестирования, содержащую 0,05 мл останавливающего раствора (1,1 н. H2SO4), и оставляли на 5 мин;
d) добавляли 5,0 мл воды в пробирку для тестирования и затем фильтровали во флакон для ВЭЖХ через 0,45 мкм фильтр Nylon Syringe;
e) фракционировали посредством ВЭЖХ.
Условия ВЭЖХ:
a) Система для этанола: колонка: колонка для органических кислот Phenomenex Rezex (RHM-Monosaccharide) №00H 0132-KO (эквивалентна Bio-Rad 87H); температура колонки: 60°C; подвижная фаза: 0,01 н. H2SO4; скорость элюции: 0,6 мл/мин; детектор: RI; и объем впрыскивания: 20 мкл.
b) Система для углеводов: колонка: Phenomenex Rezex для углеводов (RCM-Monosaccharide) №00H-0130-KO (эквивалентна Bio-Rad 87H); температура колонки: 70°C; подвижная фаза: Nanopure DI H2O; скорость элюции: 0,8 мл/мин; детектор: RI; объем впрыскивания: 10 мкл (вещество с 3% DS).
На колонке фракционируют на основе молекулярного веса сахаров, которые обозначают как DP-1 (моносахариды), DP-2 (дисахариды), DP-3 (трисахариды) и DP>3 (олигосахаридные сахара, обладающие степенью полимеризации выше 3).
4) Иодный тест на остаточный крахмал
Образец бражки (бродильной среды) центрифугировали в пластиковых центрифужных пробирках на 2 мл. Супернатант удаляли и пробирку, содержащую осадок, помещали в ледяную баню. Добавляли несколько капель 0,025 н. раствора иода (0,1 н. иод от VWR кат.№ VW3207-1, разведенный в 4X) к осадку и смешивали. Положительный тест (+) на крахмал выражается в цветовом диапазоне от синего до пурпурного, и интенсивность окраски прямо пропорциональна концентрации крахмала. При отрицательном результате (-) цвет остается желтоватым.
5) Определение общего содержания крахмала
Способ фермент-ферментного разжижения крахмала и осахаривания (двойной ферментный способ) использовали для определения общего содержания крахмала. В типичном анализе помещали 2 г сухого образца в колбу Кольрауша на 100 мл и добавляли 45 мл буфера MOPS, pH 7,0. Суспензию хорошо перемешивали в течение 30 мин. Добавляли 1,0 мл SPEZYME FRED (разведенного в воде 1:50) и нагревали до кипения в течение 3-5 мин. Колбу помещали в автоклав при поддерживании 121°C в течение 15 мин. После автоклавирования колбу помещали в водяную баню на 95°C и добавляли 1 мл SPEZYME FRED в разведении 1:50, и инкубировали 45 мин. pH доводили до pH 4,2 и температуру уменьшали до 60°C. После этого добавляли 20 мл ацетатного буфера, pH 4,2. Осахаривание осуществляли добавлением 1,0 мл OPTIDEX L-400 (глюкоамилаза от Genencor International Inc.) в разведении 1:100 и продолжали инкубацию 18 час при 60°C. Ферментативную реакцию останавливали нагреванием до 95°C в течение 10 мин. Общий состав сахаров определяли анализом ВЭЖХ с использованием глюкозы в качестве стандарта. Растворимый гидролизат крахмала после водной экстракции образца при комнатной температуре без ферментативной обработки отнимали от общего сахара.
6) Анализ общего белка: Общий азот (N) в препаратах образцов определяли с использованием способа Къельдаля (American Assoc. Cereal Chemists (AACC), (1983), Methods 22B60 8th Ed. St Paul, MN). Содержание белка вычисляли, как 6,25 X общий N.
ПРИМЕРЫ
Следующие примеры приведены, чтобы продемонстрировать и дополнительно проиллюстрировать определенные предпочтительные варианты осуществления и аспекты настоящего изобретения, и их не следует истолковывать как ограничивающие его объем.
Пример 1 - Выделение и клонирование TrGA
Хромосомную ДНК Trichoderma reesei QM6a выделяли из массы мицелия из жидкой культуры в картофельно-декстрозном бульоне (Difco™ кат.№ 254920) с использованием системы BIO101 Fast Prep® согласно способу, описанному поставщиком (Qbiogene). ДНК очищали с использованием колонки Quick Spin (Qiagen кат.№ 28106). Ген глюкоамилазы выделяли с использованием праймеров с последовательностями, специфичными к GA, NSP232R (SEQ ID NO: 24) и NSP233F (SEQ ID NO: 25), сконструированных согласно предположительной нуклеотидной последовательности в геномной базе данных Trichoderma reesei, Department of Energy (DOE) Joint Genome Institute. Праймеры фланкированы с 5'-конца последовательностями Gateway® attB (Invitrogen). В качестве матрицы использовали хромосомную ДНК T. reesei QM6a.
Смесь для ПЦР содержала следующие компоненты: прямой праймер (10 мкМ) 4 мкл, обратный праймер (10 мкМ) 4 мкл, матричную ДНК (500 нг/мкл) 1 мкл, смесь dNTP (10 мМ) 2 мкл, 10x буфер Cx 10 мкл и ДНК-полимеразу PfuTurbo® Cx Hotstart 0,5 мкл (Stratagen кат.№ 600410). Деионизованную воду добавляли до общего объема 100 мкл.
Протокол ПЦР являлся следующим: начальная денатурация 30 с при 98°C, денатурация, отжиг и элонгация в 30 циклах 10 с при 98°C, 30 с при 68°C, 45 с при 72°C соответственно и заключительная стадия элонгации 10 мин при 72°C.
ПЦР-фрагменты анализировали электрофорезом в 1% агарозе. Фрагменты ожидаемого размера выделяли с использованием набора Gel-Extraction Purification (Qiagene кат.№ 28706). ПЦР-фрагменты клонировали в вектор Gateway® Entry pDONR201 и трансформировали им клетки E.coli DH5alpha Max Efficiency (Invitrogen кат.№ 18258012). Определяли нуклеотидную последовательность встроенной ДНК, на основе которой установили последовательность геномной ДНК гена TrGA (фиг. 1 (SEQ ID NO: 1)).
Пример 2 - Трансформация T. reesei и ферментация/экспрессия TrGA
Векторную ДНК, содержащую правильную последовательность гена GA, переклонировали в экспрессирующий вектор pTrex3g T. reesei (фиг. 17).
Вектор pTrex3g основан на векторе pSL1180 E. coli (Pharmacia Inc., Piscataway, NJ), который является вектором, основанным на фагемиде pUC118 (Brosius, J. (1989), DNA 8:759), с увеличенным участком для множественного клонирования, содержащего 64 гексамерные последовательности для узнавания ферментами рестрикции. Его сконструировали как направляющий вектор Gateway (Hartley et al., (2000) Genome Research 10:1788-1795), чтобы сделать возможной вставку с использованием технологии Gateway (Invitrogen) любой требуемой открытой рамки считывания между промоторной и терминаторной областями гена cbh1 T. reesei. Он также содержит ген amdS Aspergillus nidulans для использования в качестве селективного маркера при трансформации T. reesei. Подробности строения вектора pTrex3g являются следующими (фиг.17A). Вектор обладает размером 10,3 т.п.н. В область полилинкера pSL1180 вставлены следующие фрагменты ДНК: a) фрагмент ДНК 2,2 т.п.н. из промоторной области гена cbh1 T. reesei; b) рамка считывания Gateway 1,7 т.п.н. (кассета, приобретенная от Invitrogen, которая включает участки рекомбинации attR1 и attR2 с любого конца, фланкирующего ген устойчивости к хлорамфениколу (CmR) и ген ccdB); c) фрагмент ДНК 336 п.н. из области терминатора гена cbh1 T. reesei; и d) фрагмент ДНК 2,7 т.п.н., содержащий ген amdS Aspergillus nidulans со своими природными промоторными и терминаторными областями.
Экспрессирующий вектор pNSP23, содержащий ген GA T. reesei (фиг. 17), трансформировали в штамм-хозяин T. reesei, происходящий из RL-P37 (IA52) и обладающий различными делециями генов (Δcbh1, Δcbh2, Δeg1, Δeg2) с использованием обстреливания частицами системы PDS-1000/Helium (BioRad кат.№ 165-02257). Протокол изложен ниже, и также сделана ссылка на примеры 6 и 11 WO 05/001036.
Получали суспензию спор (приблизительно 5x108 спор/мл) из штамма T. reesei с четырьмя делециями. 100 мкл - 200 мкл суспензии спор размазывали в центре чашек с минимальной средой (MM) с ацетамидом (среда MM с ацетамидом обладала следующим составом: 0,6 г/л ацетамида, 1,68 г/л CsCl, 20 г/л глюкозы, 20 г/л KH2PO4, 0,6 г/л CaCl2 2H2O, 1 мл/л 1000X раствора микроэлементов, 20 г/л очищенного агара и pH 5,5. 1000X раствор микроэлементов содержал 5,0 г/л FeSO4 7H2O, 1,6 г/л MnSO4, 1,4 г/л ZnSO4 7H2O и 1,0 г/л CoCl2 6H2O). Суспензии спор дали возможность высохнуть на поверхности среды MM с ацетамидом.
Трансформацию проводили согласно инструкции производителей. Коротко, 60 мг вольфрамовых частиц M10 помещали в микроцентрифужную пробирку. Добавляли 1 мл этанола и оставляли на 15 секунд. Частицы центрифугировали при 15000 об/мин 15 секунд. Этанол удаляли и частицы промывали три раза стерильной dH2O перед добавлением 250 мкл 50% (об./об.) стерильного глицерина. 25 мкл суспензии вольфрамовых частиц помещали в микроцентрифужную пробирку. При непрерывном встряхивании добавляли следующие компоненты: 5 мкл (100 - 200 нг/мкл) плазмидной ДНК, 25 мкл 2,5 М CaCl2 и 10 мкл 0,1 М спермидина. Частицы центрифугировали в течение 3 секунд. Супернатант удаляли и частицы промывали 200 мкл 100% этанола и центрифугировали 3 секунды. Супернатант удаляли, добавляли 24 мкл 100% этанола и перемешивали с помощью пипетки, затем отбирали по 8 мкл аликвоты частиц и помещали в центр дисков макроносителя, которые выдерживали в сушильном аппарате. Как только раствор вольфрам/ДНК высыхал, диск макроносителя помещали в камеру для обстреливания вместе с чашкой с MM с ацетамидом, содержащей споры, и процесс обстреливания осуществляли согласно инструкциям производителей. После обстреливания спор на чашке частицами вольфрам/ДНК чашки инкубировали при 30°C. Трансформированные колонии переносили на свежие чашки со средой MM с ацетамидом и инкубировали при 30°C.
Пример 3 - Демонстрация активности GA у экспрессируемой TrGA в трансформированных клетках
После 5 суток роста на чашках с MM с ацетамидом трансформанты, демонстрирующие стабильную морфологию, инокулировали во встряхиваемые колбы на 250 мл, содержащие 30 мл среды Proflo. (Среда Proflo содержала: 30 г/л α-лактозы, 6,5 г/л (NH4)2SO4, 2 г/л KH2PO4, 0,3 г/л MgSO4 7H2O, 0,2 г/л CaCl2, 1 мл/л 1000X раствора солей микроэлементов, 2 мл/л 10% Tween-80, 22,5 г/л муки из семян хлопчатника ProFlo (Traders protein, Memphis, TN), 0,72 г/л CaCO3.) После двух суток роста при 28°C и 140 об/мин 10% культуры Proflo переносили во встряхиваемую колбу на 250 мл, содержащую 30 мл сред определенного состава с лактозой. Состав сред определенного состава с лактозой являлся следующим: 5 г/л (NH4)2SO4, 33 г/л буферов PIPPS, 9 г/л казаминовых кислот, 4,5 г/л KH2PO4, 1,0 г/л MgSO4 7H2O, 5 мл/л антивспенивателя Mazu DF60-P (Mazur Chemicals, IL), 1000X раствор микроэлементов, pH 5,5; 40 мл/л 40% (мас./об.) раствора лактозы добавляли к среде после стерилизации. Встряхиваемые колбы со средой определенного состава с лактозой инкубировали при 28°C, 140 об/мин 4-5 суток.
Мицелий удаляли центрифугированием и супернатант анализировали на общий белок (BCA Protein Assay Kit, Pierce Кат.№ 23225) и активность GA с использованием pNPG в качестве субстрата (Sigma N-1377).
Образцы супернатанта культуры смешивали с подходящим объемом 2X буфера для нанесения образца с восстанавливающим агентом, и профиль белка определяли полиакриламидным гель-электрофорезом с додецилсульфатом натрия (SDS-PAGE) с использованием геля NuPAGE® Novex c 10% бис-Трис в электродном буфере с MES и SDS. Гели окрашивали SimplyBlue™ SafeStain (Invitrogen, Carlsbad, CA, USA).
В анализе посредством SDS-PAGE белковую полосу, которую не наблюдали в супернатанте из штамма с четырьмя делециями, наблюдали в супернатанте некоторых трансформантов с вектором pTrex3g, содержащим открытую рамку считывания глюкоамилазы (фиг. 16). Эта новая белковая полоса обладала кажущимся молекулярным весом приблизительно 64 кДа. Данный результат подтверждает, что TrGA секретируется в среду.
Пример 4 - Биохимическая характеристика продукта гена GA
Трансформанты, продуцирующие GA, выращивали в объеме 4 л. Фильтрат культуры концентрировали с использованием приспособления для ультрафильтрации с номинальным пределом молекулярного веса 10000 Да (Pall Omega Centramate OS010c10). Неочищенный препарат фермента очищали 2-стадийным способом с использованием системы AKTA explorer 100 FPLC (Amersham Biosciences). Колонку HiPrep 16/10 FF Q-Sepharose (Amersham BioSciences Кат.№ 17-5190-01) уравновешивали 25 мМ Трис pH 8,0 и белок элюировали с колонки 100 мМ NaCl в 25 мМ Трис pH 8,0. Вторую стадию аффинной хроматографии осуществляли с использованием смолы Cbind 200 (Novagen Кат.№ 701212-3) и 50 мМ Трис pH 7,0, содержащего 500 мМ NaCl в качестве буфера для элюции (фиг. 16). N-конец продукта гена (Ser-Val-Asp-Asp-Phe-Ile) (SEQ ID NO: 38) определяли деградацией по Эдману (Edman, P. (1956) Acta Chem Scand 10:761-768).
Профили активности глюкоамилазы продукта гена в зависимости от pH и температуры определяли с использованием 4-нитрофенил-α-D-глюкопиранозида в качестве субстрата (Elder, M.T. and Montgomery R.S., Glucoamylase activity in industrial enzyme preparations using colorimetric enzymatic method; Collaborative study Journal of AOAC International, vol. 78(2), 1995) (фиг. 18).
Пример 5 - Выделение/клонирование гомологов глюкоамилазы из штаммов группы семейства Trichoderma/Hypocrea
Препараты хромосомной ДНК штаммов (GA102) - Hypocrea citrina var. americana (CBS976.69), (GA104) - Hypocrea vinosa (CBS960.68), (GA105) - Trichoderma sp., (GA107) - Hypocrea gelatinosa (CBS254.62), (GA108) - Hypocrea orientalis (ATCC 90550), (GA109) - Trichoderma konilangbra, (GA103) - Trichoderma harzianum (CBS433.95), (GA113) - Trichoderma sp., (GA124) - Trichoderma longibrachiatum, (GA127) - Trichoderma asperellum (ATCC 28020) и (GA128) - Trichoderma strictipilis (CBS 347.93) выделяли, как описано в примере 1. Полноразмерные гены GA клонировали, как описано в примере 1, с использованием праймеров NSP231F (SEQ ID NO: 23) и NSP232R (SEQ ID NO: 24), специфичных к гену TrGA. Нуклеотидные последовательности для штаммов приведены на фиг. 4 для GA102 (SEQ ID NO: 5), фиг. 5 для GA104 (SEQ ID NO: 7), фиг. 6 для GA105 (SEQ ID NO: 9), фиг. 7 для GA107 (SEQ ID NO: 11), фиг. 8 для GA108 (SEQ ID NO: 13), фиг. 9 для GA109 (SEQ ID NO: 15), фиг. 10 для GA113 (SEQ ID NO: 28), фиг. 11 для GA103 (SEQ ID NO: 30), фиг. 12 для GA124 (SEQ ID NO: 32), фиг. 13 для GA127 (SEQ ID NO: 34) и фиг. 14 для GA128 (SEQ ID NO: 36). Соответствующие аминокислотные последовательности показаны на фиг. 15. В таблице 2 приведена процентная доля идентичности аминокислотных последовательностей зрелого белка глюкоамилазы T. reesei (фиг. 3B, SEQ ID NO: 4) с гомологами глюкоамилазы из группы Hypocrea/Trichoderma.
Штаммы T. reesei, сверхэкспрессирующие GA, получали, как описано в примере 2. Неочищенные препараты фермента получали, как описано в примере 3, и на фиг. 19 изображены гели, полученные для некоторых гомологов. На таблице 3 приведена активность глюкоамилазы из некоторых гомологов.
Пример 6 - Получение глюкозы с использованием TrGA
Суспензию с 32% DS крахмала от Cargill из мешков готовили на воде, очищенной обратным осмосом. pH суспензии доводили до pH 5,8. Суспензию фильтровали через сито в 100 меш и дозировали по 4,0 AAU/г ds с использованием SPEZYME® ETHYL, (Genencor International, Inc.). Суспензию затем выпускали струей при 107,3°C в течение 5 мин (первичное разжижение). Ферментативную активность определяли по скорости гидролиза крахмала, которая выражается в скорости уменьшения интенсивности окрашивания йодом. Одна единица AAU активности бактериальной альфа-амилазы представляет собой количество фермента, необходимое для гидролиза 10 мг крахмала в минуту в определенных условиях. После первичного разжижения продукт разжижения собирали и помещали в водяную баню при 95°C на 120 мин (вторичное разжижение). Образцы отбирали на 30, 60, 90 и 120 мин и проверяли на DE с использованием общепринятого способа Schoorl восстановления сахара от Corn Refiners Association. Продукт разжижения разделяли на аликвоты количеством по 100 г в банки с закручивающимися крышками, pH доводили до pH 4,5 и уравновешивали до 60°C в течение 15 минут перед дозированием. Фермент TrGA разводили так, чтобы добавлять 0,2 мл разведенного фермента в банку из расчета 0,22 GAU/г ds. После дозирования продукт разжижения разделяли на аликвоты в 7 пробирок с закручивающимися крышками, каждая содержала приблизительно 10 мл вещества, и возвращали к указанной температуре. Пробирки вынимали через выбранные интервалы времени (18, 24, 30, 42, 50 и 55 часов) и анализировали состав сахаров посредством системы ВЭЖХ для углеводов: колонка: Phenomenex Rezex для углеводов (RCM-Monosaccharide) №00H-0130-KO (эквивалентна Bio-Rad 87H); температура колонки: 70°C; подвижная фаза: Nanopure DI H2O; скорость элюции: 0,8 мл/мин; детектор: RI; объем впрыскивания: 10 мкл (вещество с 3% DS).
Пример 7 - Получение этанола с использованием TrGA по способу с одновременным осахариванием и брожением (SSF)
Получали образец жидкости кукурузного сусла от местного производителя этанола и разводили до 29% DS с использованием фильтрата барды. pH суспензии доводили до pH 4,3 с использованием 6 н. серной кислоты. Аликвоту сусла в 300 г помещали в водяную баню на 31°C и давали возможность уравновеситься. TrGA добавляли к образцу (0,4 GAU/г ds, что равно 1,08 кг/MT ds). После добавления фермента, добавляли к каждому образцу 1 мл раствора дрожжей Red Star Red (Lesaffre yeast Corp. Milwaukee, WI) в DI-воде, 15 г в 45 мл. Образцы отбирали на 18, 26, 41 и 53 час и анализировали посредством колонки ВЭЖХ: колонка для органических кислот Phenomenex Rezex (RHM-Monosaccharide) №00H-0132-KO (эквивалентна Bio-Rad 87H); температура колонки: 60°C; подвижная фаза: 0,01 н. NH2SO4; скорость элюции: 0,6 мл/мин; детектор: RI; объем впрыскивания: 20 мкл.
Пример 8 - Способ без тепловой обработки для получения этанола с использованием TrGA
Как правило, 33% суспензию кукурузной муки (Azure Standard Farms) получали на DI H2O, к которой добавляли 400 ppm мочевины. pH доводили до 4,5. Брожения осуществляли в колбах на 125 мл, содержащих 100 г сусла и разные внесения TrGA, GAU/г. Получали 20% суспензию сухих дрожжей Fali в воде и смешивали в водяной бане на 32°C один час перед инокуляцией ферментеров добавлением 0,2 мл суспензии дрожжей. Колбы помещали в водяную баню на 32°C и осторожно перемешивали сусло. В ходе брожений отбирали образцы для анализа ВЭЖХ. Брожения останавливали после 72 часов. Выход соединений, включающих сахара, молочную кислоту, глицерин и этанол, в разные моменты взятия образца показаны ниже в разных таблицах. Сусло сушили при 60°C для получения DDGS, и содержание крахмала в DDGS определяли способом с двумя ферментами.
A. Все условия являлись, как описано выше: обработка включала 1,2 GAU/г TrGA.
B. Все условия являлись, как описано выше: обработки включали 0,75 GAU/г GA107 и 0,75 GAU/г GA104.
C. Все условия являлись, как описано выше: обработки включали a) GA A. niger 0,75 GAU/г + 2,25 SSU AkAA и b) TrGA 0,75 GAU/г + 2,25 SSU AkAA. Остаточный крахмал при обработке AnGA + AkAA, как определили, равнялся 5,26%, и остаточный крахмал при обработке TrGA + AkAA, как определили, равнялся 8,71%.
Измерение альфа-амилазной активности для AkAA основано на степени гидролиза растворимого картофельного крахмального субстрата (4% ds) аликвотой образца фермента при pH 4,5, 50°C. Содержание восстанавливающего сахара измеряли с использованием способа DNS, как описано в Miller, G.L. (1959) Anal. Chem. 31:426-428. Одна единица ферментативной активности (SSU, единица растворимого крахмала) эквивалентна восстанавливающей способности 1 мг глюкозы, реализуемой за минуту в определенных условиях инкубации.
D. Все условия являлись, как описано выше: обработки включали a) TrGA 0,695 GAU/г + 2,25 SSU AkAA, и b) TrGA 0,695 GAU/г + 2,25 SSU AKAA + 2 ASPU/г пуллуланазы. Одну единицу активности кислотоустойчивой пуллуланазы (ASPU) определяют как количество фермента, которое высвобождает один эквивалент восстанавливающей способности, как у глюкозы, за минуту из пуллулана при pH 4,5 и температуре 60°C.
E. Все условия являлись, как описано выше: обработки включали TrGA 0,695 GAU/г и следующие обработки посредством AkAA: a) 3 SSU AkAA, b) 10 SSU AkAA и c) 30 SSU AkAA.
СПИСОК ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> Dunn-Coleman, Nigel
Neefe-Kruithof, Paulien
Pilgrim, Craig E.
Van Solingen, Piet
Ward, Donald E.
<120> Глюкоамилаза Trichoderma reesei и ее гомологи
<130> GC886-PCT
<140> PCT/US2005/036307
<141> 2005-10-07
<150> US 11/136,244
<151> 2005-05-24
<150> US 60/647,925
<151> 2005-01-28
<150> US 60/575,175
<151> 2004-05-27
<150> US 60/605,437
<151> 2004-08-30
<150> PCT/US04/41276
<151> 2004-12-09
<150> PCT/US04/40040
<151> 2004-11-30
<150> PCT/US05/18212
<151> 2005-05-24
<160> 47
<170> PatentIn version 3.2
<210> 1
<211> 2147
<212> ДНК
<213> Trichoderma reesei
<400> 1
atgcacgtcc tgtcgactgc ggtgctgctc ggctccgttg ccgttcaaaa ggtcctggga 60
agaccaggat caagcggtct gtcgacgtca ccaagaggtc tgttgacgac ttcatcagca 120
ccgagacgcc tattgcactg aacaatcttc tttgcaatgt tggtcctgat ggatgccgtg 180
cattcggcac atcagctggt gcggtgattg catctcccag cacaattgac ccggactgta 240
agttggcctt gatgaaccat atcatatatc gccgagaagt ggaccgcgtg ctgagactga 300
gacagactat tacatgtgga cgcgagatag cgctcttgtc ttcaagaacc tcatcgaccg 360
cttcaccgaa acgtacgatg cgggcctgca gcgccgcatc gagcagtaca ttactgccca 420
ggtcactctc cagggcctct ctaacccctc gggctccctc gcggacggct ctggtctcgg 480
cgagcccaag tttgagttga ccctgaagcc tttcaccggc aactggggtc gaccgcagcg 540
ggatggccca gctctgcgag ccattgcctt gattggatac tcaaagtggc tcatcaacaa 600
caactatcag tcgactgtgt ccaacgtcat ctggcctatt gtgcgcaacg acctcaacta 660
tgttgcccag tactggtcag tgcttgcttg ctcttgaatt acgtctttgc ttgtgtgtct 720
aatgcctcca ccacaggaac caaaccggct ttgacctctg ggaagaagtc aatgggagct 780
cattctttac tgttgccaac cagcaccgag gtatgaagca aatcctcgac attcgctgct 840
actgcacatg agcattgtta ctgaccagct ctacagcact tgtcgagggc gccactcttg 900
ctgccactct tggccagtcg ggaagcgctt attcatctgt tgctccccag gttttgtgct 960
ttctccaacg attctgggtg tcgtctggtg gatacgtcga ctccaacagt atgtcttttc 1020
actgtttata tgagattggc caatactgat agctcgcctc tagtcaacac caacgagggc 1080
aggactggca aggatgtcaa ctccgtcctg acttccatcc acaccttcga tcccaacctt 1140
ggctgtgacg caggcacctt ccagccatgc agtgacaaag cgctctccaa cctcaaggtt 1200
gttgtcgact ccttccgctc catctacggc gtgaacaagg gcattcctgc cggtgctgcc 1260
gtcgccattg gccggtatgc agaggatgtg tactacaacg gcaacccttg gtatcttgct 1320
acatttgctg ctgccgagca gctgtacgat gccatctacg tctggaagaa gacgggctcc 1380
atcacggtga ccgccacctc cctggccttc ttccaggagc ttgttcctgg cgtgacggcc 1440
gggacctact ccagcagctc ttcgaccttt accaacatca tcaacgccgt ctcgacatac 1500
gccgatggct tcctcagcga ggctgccaag tacgtccccg ccgacggttc gctggccgag 1560
cagtttgacc gcaacagcgg cactccgctg tctgcgcttc acctgacgtg gtcgtacgcc 1620
tcgttcttga cagccacggc ccgtcgggct ggcatcgtgc ccccctcgtg ggccaacagc 1680
agcgctagca cgatcccctc gacgtgctcc ggcgcgtccg tggtcggatc ctactcgcgt 1740
cccaccgcca cgtcattccc tccgtcgcag acgcccaagc ctggcgtgcc ttccggtact 1800
ccctacacgc ccctgccctg cgcgacccca acctccgtgg ccgtcacctt ccacgagctc 1860
gtgtcgacac agtttggcca gacggtcaag gtggcgggca acgccgcggc cctgggcaac 1920
tggagcacga gcgccgccgt ggctctggac gccgtcaact atgccgataa ccaccccctg 1980
tggattggga cggtcaacct cgaggctgga gacgtcgtgg agtacaagta catcaatgtg 2040
ggccaagatg gctccgtgac ctgggagagt gatcccaacc acacttacac ggttcctgcg 2100
gtggcttgtg tgacgcaggt tgtcaaggag gaacctggca gtcgtaa 2147
<210> 2
<211> 1899
<212> ДНК
<213> Trichoderma reesei
<400> 2
atgcacgtcc tgtcgactgc ggtgctgctc ggctccgttg ccgttcaaaa ggtcctggga 60
agaccaggat caagcggtct gtccgacgtc accaagaggt ctgttgacga cttcatcagc 120
accgagacgc ctattgcact gaacaatctt ctttgcaatg ttggtcctga tggatgccgt 180
gcattcggca catcagctgg tgcggtgatt gcatctccca gcacaattga cccggactac 240
tattacatgt ggacgcgaga tagcgctctt gtcttcaaga acctcatcga ccgcttcacc 300
gaaacgtacg atgcgggcct gcagcgccgc atcgagcagt acattactgc ccaggtcact 360
ctccagggcc tctctaaccc ctcgggctcc ctcgcggacg gctctggtct cggcgagccc 420
aagtttgagt tgaccctgaa gcctttcacc ggcaactggg gtcgaccgca gcgggatggc 480
ccagctctgc gagccattgc cttgattgga tactcaaagt ggctcatcaa caacaactat 540
cagtcgactg tgtccaacgt catctggcct attgtgcgca acgacctcaa ctatgttgcc 600
cagtactgga accaaaccgg ctttgacctc tgggaagaag tcaatgggag ctcattcttt 660
actgttgcca accagcaccg agcacttgtc gagggcgcca ctcttgctgc cactcttggc 720
cagtcgggaa gcgcttattc atctgttgct ccccaggttt tgtgctttct ccaacgattc 780
tgggtgtcgt ctggtggata cgtcgactcc aacatcaaca ccaacgaggg caggactggc 840
aaggatgtca actccgtcct gacttccatc cacaccttcg atcccaacct tggctgtgac 900
gcaggcacct tccagccatg cagtgacaaa gcgctctcca acctcaaggt tgttgtcgac 960
tccttccgct ccatctacgg cgtgaacaag ggcattcctg ccggtgctgc cgtcgccatt 1020
ggccggtatg cagaggatgt gtactacaac ggcaaccctt ggtatcttgc tacatttgct 1080
gctgccgagc agctgtacga tgccatctac gtctggaaga agacgggctc catcacggtg 1140
accgccacct ccctggcctt cttccaggag cttgttcctg gcgtgacggc cgggacctac 1200
tccagcagct cttcgacctt taccaacatc atcaacgccg tctcgacata cgccgatggc 1260
ttcctcagcg aggctgccaa gtacgtcccc gccgacggtt cgctggccga gcagtttgac 1320
cgcaacagcg gcactccgct gtctgcgctt cacctgacgt ggtcgtacgc ctcgttcttg 1380
acagccacgg cccgtcgggc tggcatcgtg cccccctcgt gggccaacag cagcgctagc 1440
acgatcccct cgacgtgctc cggcgcgtcc gtggtcggat cctactcgcg tcccaccgcc 1500
acgtcattcc ctccgtcgca gacgcccaag cctggcgtgc cttccggtac tccctacacg 1560
cccctgccct gcgcgacccc aacctccgtg gccgtcacct tccacgagct cgtgtcgaca 1620
cagtttggcc agacggtcaa ggtggcgggc aacgccgcgg ccctgggcaa ctggagcacg 1680
agcgccgccg tggctctgga cgccgtcaac tatgccgata accaccccct gtggattggg 1740
acggtcaacc tcgaggctgg agacgtcgtg gagtacaagt acatcaatgt gggccaagat 1800
ggctccgtga cctgggagag tgatcccaac cacacttaca cggttcctgc ggtggcttgt 1860
gtgacgcagg ttgtcaagga ggacacctgg cagtcgtaa 1899
<210> 3
<211> 632
<212> PRT
<213> Trichoderma reesei
<400> 3
Met His Val Leu Ser Thr Ala Val Leu Leu Gly Ser Val Ala Val Gln
1 5 10 15
Lys Val Leu Gly Arg Pro Gly Ser Ser Gly Leu Ser Asp Val Thr Lys
20 25 30
Arg Ser Val Asp Asp Phe Ile Ser Thr Glu Thr Pro Ile Ala Leu Asn
35 40 45
Asn Leu Leu Cys Asn Val Gly Pro Asp Gly Cys Arg Ala Phe Gly Thr
50 55 60
Ser Ala Gly Ala Val Ile Ala Ser Pro Ser Thr Ile Asp Pro Asp Tyr
65 70 75 80
Tyr Tyr Met Trp Thr Arg Asp Ser Ala Leu Val Phe Lys Asn Leu Ile
85 90 95
Asp Arg Phe Thr Glu Thr Tyr Asp Ala Gly Leu Gln Arg Arg Ile Glu
100 105 110
Gln Tyr Ile Thr Ala Gln Val Thr Leu Gln Gly Leu Ser Asn Pro Ser
115 120 125
Gly Ser Leu Ala Asp Gly Ser Gly Leu Gly Glu Pro Lys Phe Glu Leu
130 135 140
Thr Leu Lys Pro Phe Thr Gly Asn Trp Gly Arg Pro Gln Arg Asp Gly
145 150 155 160
Pro Ala Leu Arg Ala Ile Ala Leu Ile Gly Tyr Ser Lys Trp Leu Ile
165 170 175
Asn Asn Asn Tyr Gln Ser Thr Val Ser Asn Val Ile Trp Pro Ile Val
180 185 190
Arg Asn Asp Leu Asn Tyr Val Ala Gln Tyr Trp Asn Gln Thr Gly Phe
195 200 205
Asp Leu Trp Glu Glu Val Asn Gly Ser Ser Phe Phe Thr Val Ala Asn
210 215 220
Gln His Arg Ala Leu Val Glu Gly Ala Thr Leu Ala Ala Thr Leu Gly
225 230 235 240
Gln Ser Gly Ser Ala Tyr Ser Ser Val Ala Pro Gln Val Leu Cys Phe
245 250 255
Leu Gln Arg Phe Trp Val Ser Ser Gly Gly Tyr Val Asp Ser Asn Ile
260 265 270
Asn Thr Asn Glu Gly Arg Thr Gly Lys Asp Val Asn Ser Val Leu Thr
275 280 285
Ser Ile His Thr Phe Asp Pro Asn Leu Gly Cys Asp Ala Gly Thr Phe
290 295 300
Gln Pro Cys Ser Asp Lys Ala Leu Ser Asn Leu Lys Val Val Val Asp
305 310 315 320
Ser Phe Arg Ser Ile Tyr Gly Val Asn Lys Gly Ile Pro Ala Gly Ala
325 330 335
Ala Val Ala Ile Gly Arg Tyr Ala Glu Asp Val Tyr Tyr Asn Gly Asn
340 345 350
Pro Trp Tyr Leu Ala Thr Phe Ala Ala Ala Glu Gln Leu Tyr Asp Ala
355 360 365
Ile Tyr Val Trp Lys Lys Thr Gly Ser Ile Thr Val Thr Ala Thr Ser
370 375 380
Leu Ala Phe Phe Gln Glu Leu Val Pro Gly Val Thr Ala Gly Thr Tyr
385 390 395 400
Ser Ser Ser Ser Ser Thr Phe Thr Asn Ile Ile Asn Ala Val Ser Thr
405 410 415
Tyr Ala Asp Gly Phe Leu Ser Glu Ala Ala Lys Tyr Val Pro Ala Asp
420 425 430
Gly Ser Leu Ala Glu Gln Phe Asp Arg Asn Ser Gly Thr Pro Leu Ser
435 440 445
Ala Leu His Leu Thr Trp Ser Tyr Ala Ser Phe Leu Thr Ala Thr Ala
450 455 460
Arg Arg Ala Gly Ile Val Pro Pro Ser Trp Ala Asn Ser Ser Ala Ser
465 470 475 480
Thr Ile Pro Ser Thr Cys Ser Gly Ala Ser Val Val Gly Ser Tyr Ser
485 490 495
Arg Pro Thr Ala Thr Ser Phe Pro Pro Ser Gln Thr Pro Lys Pro Gly
500 505 510
Val Pro Ser Gly Thr Pro Tyr Thr Pro Leu Pro Cys Ala Thr Pro Thr
515 520 525
Ser Val Ala Val Thr Phe His Glu Leu Val Ser Thr Gln Phe Gly Gln
530 535 540
Thr Val Lys Val Ala Gly Asn Ala Ala Ala Leu Gly Asn Trp Ser Thr
545 550 555 560
Ser Ala Ala Val Ala Leu Asp Ala Val Asn Tyr Ala Asp Asn His Pro
565 570 575
Leu Trp Ile Gly Thr Val Asn Leu Glu Ala Gly Asp Val Val Glu Tyr
580 585 590
Lys Tyr Ile Asn Val Gly Gln Asp Gly Ser Val Thr Trp Glu Ser Asp
595 600 605
Pro Asn His Thr Tyr Thr Val Pro Ala Val Ala Cys Val Thr Gln Val
610 615 620
Val Lys Glu Asp Thr Trp Gln Ser
625 630
<210> 4
<211> 599
<212> PRT
<213> Trichoderma reesei
<400> 4
Ser Val Asp Asp Phe Ile Ser Thr Glu Thr Pro Ile Ala Leu Asn Asn
1 5 10 15
Leu Leu Cys Asn Val Gly Pro Asp Gly Cys Arg Ala Phe Gly Thr Ser
20 25 30
Ala Gly Ala Val Ile Ala Ser Pro Ser Thr Ile Asp Pro Asp Tyr Tyr
35 40 45
Tyr Met Trp Thr Arg Asp Ser Ala Leu Val Phe Lys Asn Leu Ile Asp
50 55 60
Arg Phe Thr Glu Thr Tyr Asp Ala Gly Leu Gln Arg Arg Ile Glu Gln
65 70 75 80
Tyr Ile Thr Ala Gln Val Thr Leu Gln Gly Leu Ser Asn Pro Ser Gly
85 90 95
Ser Leu Ala Asp Gly Ser Gly Leu Gly Glu Pro Lys Phe Glu Leu Thr
100 105 110
Leu Lys Pro Phe Thr Gly Asn Trp Gly Arg Pro Gln Arg Asp Gly Pro
115 120 125
Ala Leu Arg Ala Ile Ala Leu Ile Gly Tyr Ser Lys Trp Leu Ile Asn
130 135 140
Asn Asn Tyr Gln Ser Thr Val Ser Asn Val Ile Trp Pro Ile Val Arg
145 150 155 160
Asn Asp Leu Asn Tyr Val Ala Gln Tyr Trp Asn Gln Thr Gly Phe Asp
165 170 175
Leu Trp Glu Glu Val Asn Gly Ser Ser Phe Phe Thr Val Ala Asn Gln
180 185 190
His Arg Ala Leu Val Glu Gly Ala Thr Leu Ala Ala Thr Leu Gly Gln
195 200 205
Ser Gly Ser Ala Tyr Ser Ser Val Ala Pro Gln Val Leu Cys Phe Leu
210 215 220
Gln Arg Phe Trp Val Ser Ser Gly Gly Tyr Val Asp Ser Asn Ile Asn
225 230 235 240
Thr Asn Glu Gly Arg Thr Gly Lys Asp Val Asn Ser Val Leu Thr Ser
245 250 255
Ile His Thr Phe Asp Pro Asn Leu Gly Cys Asp Ala Gly Thr Phe Gln
260 265 270
Pro Cys Ser Asp Lys Ala Leu Ser Asn Leu Lys Val Val Val Asp Ser
275 280 285
Phe Arg Ser Ile Tyr Gly Val Asn Lys Gly Ile Pro Ala Gly Ala Ala
290 295 300
Val Ala Ile Gly Arg Tyr Ala Glu Asp Val Tyr Tyr Asn Gly Asn Pro
305 310 315 320
Trp Tyr Leu Ala Thr Phe Ala Ala Ala Glu Gln Leu Tyr Asp Ala Ile
325 330 335
Tyr Val Trp Lys Lys Thr Gly Ser Ile Thr Val Thr Ala Thr Ser Leu
340 345 350
Ala Phe Phe Gln Glu Leu Val Pro Gly Val Thr Ala Gly Thr Tyr Ser
355 360 365
Ser Ser Ser Ser Thr Phe Thr Asn Ile Ile Asn Ala Val Ser Thr Tyr
370 375 380
Ala Asp Gly Phe Leu Ser Glu Ala Ala Lys Tyr Val Pro Ala Asp Gly
385 390 395 400
Ser Leu Ala Glu Gln Phe Asp Arg Asn Ser Gly Thr Pro Leu Ser Ala
405 410 415
Leu His Leu Thr Trp Ser Tyr Ala Ser Phe Leu Thr Ala Thr Ala Arg
420 425 430
Arg Ala Gly Ile Val Pro Pro Ser Trp Ala Asn Ser Ser Ala Ser Thr
435 440 445
Ile Pro Ser Thr Cys Ser Gly Ala Ser Val Val Gly Ser Tyr Ser Arg
450 455 460
Pro Thr Ala Thr Ser Phe Pro Pro Ser Gln Thr Pro Lys Pro Gly Val
465 470 475 480
Pro Ser Gly Thr Pro Tyr Thr Pro Leu Pro Cys Ala Thr Pro Thr Ser
485 490 495
Val Ala Val Thr Phe His Glu Leu Val Ser Thr Gln Phe Gly Gln Thr
500 505 510
Val Lys Val Ala Gly Asn Ala Ala Ala Leu Gly Asn Trp Ser Thr Ser
515 520 525
Ala Ala Val Ala Leu Asp Ala Val Asn Tyr Ala Asp Asn His Pro Leu
530 535 540
Trp Ile Gly Thr Val Asn Leu Glu Ala Gly Asp Val Val Glu Tyr Lys
545 550 555 560
Tyr Ile Asn Val Gly Gln Asp Gly Ser Val Thr Trp Glu Ser Asp Pro
565 570 575
Asn His Thr Tyr Thr Val Pro Ala Val Ala Cys Val Thr Gln Val Val
580 585 590
Lys Glu Asp Thr Trp Gln Ser
595
<210> 5
<211> 2154
<212> ДНК
<213> Hypocrea citrina var. americana
<400> 5
atgcacgtcc tgtcgacggc tgtgttgctc ggcttggtgg ccgttcaaaa ggttctggga 60
aggccagggc tgaatggcgt acccgacgtc acaaaacggt ccgttgacga cttcatcagc 120
aatgagtctc ctattgcact gaacaacctc ctgtgcaatg tcggccctga tggatgccgc 180
gcctttggcg catcggcagg cactgtcgct gcctcgccca gcacaaccga cccagactgt 240
aagtgtatac gagacaatcc atgagatgag gccctctacg tgtattgcac actaacacag 300
atattgacgc ggattactac atgtggacgc gagacagtgc tctcatcttc aagaccgttg 360
tcgacaggtt cacccagaac tacgatgcta gcctgcagaa gcgcattgag cagtacattg 420
ctgctcaggc cacgcttcag gggatttcca acccatcggg ctctctagca gatgggtccg 480
gtctcggcga gcccaagttc gagctgaccc tgaatcagtt caccggccac tggggccgac 540
cacagcggga cggtccagct ctgcgagcca ttgccttgat cggctattcg aagtggctca 600
tcgacaacaa ctaccagtcg actgtgtccg acatcatctg gcccattctg cggaatgatc 660
tcaactacgt agcgcagtac tggtatgtgt tgcttactgt tttgctccgt tgagaatggt 720
ccgtttctaa cctttaaact gtaggaacca aaccggtttt gacttgtggg aggaagttga 780
aggaagctca ttctttaccg ttgctaacca gcaccgaggt acggaacacg actcaggtca 840
actgacgaga ggcgctgcta acacgcttca cagcccttgt cgagggcgct acgcttgctg 900
ctatccttgg ccagtcggga agcagctatt ctgctgttgc tccccagatt ctgtgcttcc 960
tccaaaaatt ttgggtgtct tccggcggat acgtgaactc caacagtgcg tctatgtgtg 1020
cgctctgtga gctctgatga agcggatgct aacagtttat ctgtaatagt caacagtgat 1080
atcaacagaa ccggaaagga tgccaactct cttctcgcct ctatccacac attcgatcct 1140
agcattggct gtgaccccgc taccttccag ccctgcagtg ataaggccct ttccaacctc 1200
aagtccgtcg tcgattcatt ccgctccatc tacggcgtca accagggcat ctctgctggc 1260
tctgccgtgg ccatcggccg atactccgag gacgtctact tcaacggaaa cccctggtac 1320
ctggccacat ttgccgccgc cgagcagctg tacgactccc tgtacgtgtg gaagcagacg 1380
ggctcgatca cggtgacggc catccctctg gccttcttcc aggagctcgt gcccggcgtg 1440
gccgccggca cgtacctcag cagccagtct acgttcacca gcatcgtcaa cgccgtctca 1500
gcctacgcgg acggcttcct aaacgaggcg gccaagtacg tcccctccga tggctcgctc 1560
gccgagcagt ttgacaagaa caacggcacg cctctgtcgg ccgtgcacct gacctggtcg 1620
tatgcctcct ttttgacggc gaccgcgcgt cgagctggtt ctgtgcctcc gtcgtgggcc 1680
aatagcaacg caacctcgat tccgacggcc tgctctggaa cgtcggtggt tggatcatac 1740
tcgagtccca cagccacgtc attccctccc tcccagacgc ccaaagttgg caagccaacg 1800
ggcacgccct tcacgcccat tccctgcgcc acgccaacct ccgtggccgt caccttccac 1860
gagctcccaa cgacgcagtt tggccagacc atcaaattgg ctggcagcgc tgaggccctg 1920
ggcaactgga gcaccggtgc cgccgtgggc ctcgacgccg ccaactatgc gtccaaccac 1980
ccgttgtggt ttggcacgct caacctccag gccggcgatg tcatcgagta caagtacatc 2040
aacgtgggca aggacggctc cgtgacgtgg gagagcgacc ccaaccacac gtacaccgtt 2100
cctgcggtgg cgtgtgtcac cgaggtggtc aaggaggaca cctggcagtc gtaa 2154
<210> 6
<211> 632
<212> PRT
<213> Hypocrea citrina var. americana
<400> 6
Met His Val Leu Ser Thr Ala Val Leu Leu Gly Leu Val Ala Val Gln
1 5 10 15
Lys Val Leu Gly Arg Pro Gly Leu Asn Gly Val Pro Asp Val Thr Lys
20 25 30
Arg Ser Val Asp Asp Phe Ile Ser Asn Glu Ser Pro Ile Ala Leu Asn
35 40 45
Asn Leu Leu Cys Asn Val Gly Pro Asp Gly Cys Arg Ala Phe Gly Ala
50 55 60
Ser Ala Gly Thr Val Ala Ala Ser Pro Ser Thr Thr Asp Pro Asp Tyr
65 70 75 80
Tyr Tyr Met Trp Thr Arg Asp Ser Ala Leu Ile Phe Lys Thr Val Val
85 90 95
Asp Arg Phe Thr Gln Asn Tyr Asp Ala Ser Leu Gln Lys Arg Ile Glu
100 105 110
Gln Tyr Ile Ala Ala Gln Ala Thr Leu Gln Gly Ile Ser Asn Pro Ser
115 120 125
Gly Ser Leu Ala Asp Gly Ser Gly Leu Gly Glu Pro Lys Phe Glu Leu
130 135 140
Thr Leu Asn Gln Phe Thr Gly His Trp Gly Arg Pro Gln Arg Asp Gly
145 150 155 160
Pro Ala Leu Arg Ala Ile Ala Leu Ile Gly Tyr Ser Lys Trp Leu Ile
165 170 175
Asp Asn Asn Tyr Gln Ser Thr Val Ser Asp Ile Ile Trp Pro Ile Leu
180 185 190
Arg Asn Asp Leu Asn Tyr Val Ala Gln Tyr Trp Asn Gln Thr Gly Phe
195 200 205
Asp Leu Trp Glu Glu Val Glu Gly Ser Ser Phe Phe Thr Val Ala Asn
210 215 220
Gln His Arg Ala Leu Val Glu Gly Ala Thr Leu Ala Ala Ile Leu Gly
225 230 235 240
Gln Ser Gly Ser Ser Tyr Ser Ala Val Ala Pro Gln Ile Leu Cys Phe
245 250 255
Leu Gln Lys Phe Trp Val Ser Ser Gly Gly Tyr Val Asn Ser Asn Ile
260 265 270
Asn Ser Asp Ile Asn Arg Thr Gly Lys Asp Ala Asn Ser Leu Leu Ala
275 280 285
Ser Ile His Thr Phe Asp Pro Ser Ile Gly Cys Asp Pro Ala Thr Phe
290 295 300
Gln Pro Cys Ser Asp Lys Ala Leu Ser Asn Leu Lys Ser Val Val Asp
305 310 315 320
Ser Phe Arg Ser Ile Tyr Gly Val Asn Gln Gly Ile Ser Ala Gly Ser
325 330 335
Ala Val Ala Ile Gly Arg Tyr Ser Glu Asp Val Tyr Phe Asn Gly Asn
340 345 350
Pro Trp Tyr Leu Ala Thr Phe Ala Ala Ala Glu Gln Leu Tyr Asp Ser
355 360 365
Leu Tyr Val Trp Lys Gln Thr Gly Ser Ile Thr Val Thr Ala Ile Pro
370 375 380
Leu Ala Phe Phe Gln Glu Leu Val Pro Gly Val Ala Ala Gly Thr Tyr
385 390 395 400
Leu Ser Ser Gln Ser Thr Phe Thr Ser Ile Val Asn Ala Val Ser Ala
405 410 415
Tyr Ala Asp Gly Phe Leu Asn Glu Ala Ala Lys Tyr Val Pro Ser Asp
420 425 430
Gly Ser Leu Ala Glu Gln Phe Asp Lys Asn Asn Gly Thr Pro Leu Ser
435 440 445
Ala Val His Leu Thr Trp Ser Tyr Ala Ser Phe Leu Thr Ala Thr Ala
450 455 460
Arg Arg Ala Gly Ser Val Pro Pro Ser Trp Ala Asn Ser Asn Ala Thr
465 470 475 480
Ser Ile Pro Thr Ala Cys Ser Gly Thr Ser Val Val Gly Ser Tyr Ser
485 490 495
Ser Pro Thr Ala Thr Ser Phe Pro Pro Ser Gln Thr Pro Lys Val Gly
500 505 510
Lys Pro Thr Gly Thr Pro Phe Thr Pro Ile Pro Cys Ala Thr Pro Thr
515 520 525
Ser Val Ala Val Thr Phe His Glu Leu Pro Thr Thr Gln Phe Gly Gln
530 535 540
Thr Ile Lys Leu Ala Gly Ser Ala Glu Ala Leu Gly Asn Trp Ser Thr
545 550 555 560
Gly Ala Ala Val Gly Leu Asp Ala Ala Asn Tyr Ala Ser Asn His Pro
565 570 575
Leu Trp Phe Gly Thr Leu Asn Leu Gln Ala Gly Asp Val Ile Glu Tyr
580 585 590
Lys Tyr Ile Asn Val Gly Lys Asp Gly Ser Val Thr Trp Glu Ser Asp
595 600 605
Pro Asn His Thr Tyr Thr Val Pro Ala Val Ala Cys Val Thr Glu Val
610 615 620
Val Lys Glu Asp Thr Trp Gln Ser
625 630
<210> 7
<211> 2152
<212> ДНК
<213> Hypocrea vinosa
<400> 7
atgcacgtgc tgtcgactgc tgtgctactt ggctcagttg ccgtccaaaa ggttctggga 60
agaccaggat caaacggtct atccggcgtc acaaaacgat ctgtggatga ctttatcaac 120
acacagactc ccattgcact aaacaacctt ctttgcaatg ttggccctga tggatgccgt 180
gcctttggta catcggccgg tgccgtgatt gcatctccga gcacaactga cccagactgt 240
aagtttgact tatacgggct tatctcctga tatgtcaagt ttcatatgct aacacgaggg 300
taattaatca gactactaca tgtggacgcg agatagtgct cttgtcttca agaacattgt 360
agaccgcttc actcagcagt atgatgccgg cctgcagcgc cgcatcgagc agtacatttc 420
tgcccaggtc actcttcagg gcatctcaaa cccctctggc tctctctcgg acgggtccgg 480
tcttggtgaa cccaagtttg agttgacctt gagccagttc actggcaact ggggtcgccc 540
gcagcgcgac ggcccagctc tccgagccat tgccttgatt ggttattcga agtggctcat 600
caacaacaac taccagtcaa cggtgtcaaa tatcatctgg cccatcgtac ggaatgacct 660
caactatgtt gcccaatact ggtaagtaca agctcgccgt cttttcgtct tgttatgact 720
aattccaaca ccttcacttt aggaaccaaa ccggtttcga cctgtgggag gaagtcaatg 780
gtagctcgtt ctttaccgtt gccaaccagc accgaggtat gtatcaacat ctcatgtgca 840
atttttagtt ggaaataaac aatgctgacg agttctccag ctcttgttga gggcgccaca 900
cttgctgcta ccctcggcca gtcgggaagc acctattcct cagttgcgcc tcagatcctg 960
tgcttcctcc aaagattctg ggtgtcgggt ggatatattg actctaatag taagtctact 1020
agtaccatat gctttgatga agggcgatac taaacagctt gccatagtca ataccaacga 1080
aggcaggact ggaaaagatg ccaactctct tctcgcatct atccacacgt tcgatcctag 1140
cctcggctgt gacgcctcta ccttccagcc ttgcagtgac aaagctctct ccaacctcaa 1200
ggttgttgta gactccttcc gctccatcta cggtgtcaac aagggcattc ctgctggctc 1260
tgctgtcgcc atcggcagat accccgaaga tgtgtacttt aacggaaacc cttggtacct 1320
cgccacgttc gctgctgccg agcaacttta cgactccgtc tatgtctgga agaagacagg 1380
ctccatcaca gtgacttcca cttcttcggc cttcttccag gagctcgttc ccggcgtcgc 1440
agctgggact tactccagca gccagtctac cttcacaagc atcatcaacg ccatctcgac 1500
atatgctgat ggattcctca gcgaggctgc caagtacgtc cccgctgatg gttcgctcgc 1560
cgagcagttt gatcgcaaca ccggcacacc tctgtcagcc gttcacctga cctggtctta 1620
cgcctcgttt ctcaccgccg cggcccgtcg ggctggcgtt gtccccccct cgtgggccag 1680
cagcggcgct aatacagttc cttcaagctg ctcgggagct tctgtggttg gatcctactc 1740
gcgtcctaca gccacgtcat tcccaccatc gcagaccccc aagcctggcg ttccttctgg 1800
tactcccttc actcccattc cctgtgctac cccgacttcc gttgccgtca ctttccacga 1860
gcttgccaca acccagtttg gtcagactat caaggtcgct ggtagcgctc ccgagctggg 1920
caactggagc acgagcgcgg ccattgctct ggatgccgtc aactatgcca ctaaccaccc 1980
cttgtggatt ggatcggtca atctggaagc cggagatgtt atcgagtaca agtacattaa 2040
cgtgggccag gatggttccg tcacctggga gagcgatcct aaccacacct acactgttcc 2100
tgcggtggca tgtgttaccg aggtggttaa ggaggacacc tggcagtcgt aa 2152
<210> 8
<211> 631
<212> PRT
<213> Hypocrea vinosa
<400> 8
Met His Val Leu Ser Thr Ala Val Leu Leu Gly Ser Val Ala Val Gln
1 5 10 15
Lys Val Leu Gly Arg Pro Gly Ser Asn Gly Leu Ser Gly Val Thr Lys
20 25 30
Arg Ser Val Asp Asp Phe Ile Asn Thr Gln Thr Pro Ile Ala Leu Asn
35 40 45
Asn Leu Leu Cys Asn Val Gly Pro Asp Gly Cys Arg Ala Phe Gly Thr
50 55 60
Ser Ala Gly Ala Val Ile Ala Ser Pro Ser Thr Thr Asp Pro Asp Tyr
65 70 75 80
Tyr Tyr Met Trp Thr Arg Asp Ser Ala Leu Val Phe Lys Asn Ile Val
85 90 95
Asp Arg Phe Thr Gln Gln Tyr Asp Ala Gly Leu Gln Arg Arg Ile Glu
100 105 110
Gln Tyr Ile Ser Ala Gln Val Thr Leu Gln Gly Ile Ser Asn Pro Ser
115 120 125
Gly Ser Leu Ser Asp Gly Ser Gly Leu Gly Glu Pro Lys Phe Glu Leu
130 135 140
Thr Leu Ser Gln Phe Thr Gly Asn Trp Gly Arg Pro Gln Arg Asp Gly
145 150 155 160
Pro Ala Leu Arg Ala Ile Ala Leu Ile Gly Tyr Ser Lys Trp Leu Ile
165 170 175
Asn Asn Asn Tyr Gln Ser Thr Val Ser Asn Ile Ile Trp Pro Ile Val
180 185 190
Arg Asn Asp Leu Asn Tyr Val Ala Gln Tyr Trp Asn Gln Thr Gly Phe
195 200 205
Asp Leu Trp Glu Glu Val Asn Gly Ser Ser Phe Phe Thr Val Ala Asn
210 215 220
Gln His Arg Ala Leu Val Glu Gly Ala Thr Leu Ala Ala Thr Leu Gly
225 230 235 240
Gln Ser Gly Ser Thr Tyr Ser Ser Val Ala Pro Gln Ile Leu Cys Phe
245 250 255
Leu Gln Arg Phe Trp Val Ser Gly Gly Tyr Ile Asp Ser Asn Ile Asn
260 265 270
Thr Asn Glu Gly Arg Thr Gly Lys Asp Ala Asn Ser Leu Leu Ala Ser
275 280 285
Ile His Thr Phe Asp Pro Ser Leu Gly Cys Asp Ala Ser Thr Phe Gln
290 295 300
Pro Cys Ser Asp Lys Ala Leu Ser Asn Leu Lys Val Val Val Asp Ser
305 310 315 320
Phe Arg Ser Ile Tyr Gly Val Asn Lys Gly Ile Pro Ala Gly Ser Ala
325 330 335
Val Ala Ile Gly Arg Tyr Pro Glu Asp Val Tyr Phe Asn Gly Asn Pro
340 345 350
Trp Tyr Leu Ala Thr Phe Ala Ala Ala Glu Gln Leu Tyr Asp Ser Val
355 360 365
Tyr Val Trp Lys Lys Thr Gly Ser Ile Thr Val Thr Ser Thr Ser Ser
370 375 380
Ala Phe Phe Gln Glu Leu Val Pro Gly Val Ala Ala Gly Thr Tyr Ser
385 390 395 400
Ser Ser Gln Ser Thr Phe Thr Ser Ile Ile Asn Ala Ile Ser Thr Tyr
405 410 415
Ala Asp Gly Phe Leu Ser Glu Ala Ala Lys Tyr Val Pro Ala Asp Gly
420 425 430
Ser Leu Ala Glu Gln Phe Asp Arg Asn Thr Gly Thr Pro Leu Ser Ala
435 440 445
Val His Leu Thr Trp Ser Tyr Ala Ser Phe Leu Thr Ala Ala Ala Arg
450 455 460
Arg Ala Gly Val Val Pro Pro Ser Trp Ala Ser Ser Gly Ala Asn Thr
465 470 475 480
Val Pro Ser Ser Cys Ser Gly Ala Ser Val Val Gly Ser Tyr Ser Arg
485 490 495
Pro Thr Ala Thr Ser Phe Pro Pro Ser Gln Thr Pro Lys Pro Gly Val
500 505 510
Pro Ser Gly Thr Pro Phe Thr Pro Ile Pro Cys Ala Thr Pro Thr Ser
515 520 525
Val Ala Val Thr Phe His Glu Leu Ala Thr Thr Gln Phe Gly Gln Thr
530 535 540
Ile Lys Val Ala Gly Ser Ala Pro Glu Leu Gly Asn Trp Ser Thr Ser
545 550 555 560
Ala Ala Ile Ala Leu Asp Ala Val Asn Tyr Ala Thr Asn His Pro Leu
565 570 575
Trp Ile Gly Ser Val Asn Leu Glu Ala Gly Asp Val Ile Glu Tyr Lys
580 585 590
Tyr Ile Asn Val Gly Gln Asp Gly Ser Val Thr Trp Glu Ser Asp Pro
595 600 605
Asn His Thr Tyr Thr Val Pro Ala Val Ala Cys Val Thr Glu Val Val
610 615 620
Lys Glu Asp Thr Trp Gln Ser
625 630
<210> 9
<211> 2158
<212> ДНК
<213> Trichoderma sp.
<400> 9
atgcacgtcc tgtcgactgc ggtgctgctt ggctccgttg ccgttcaaaa ggtcctggga 60
agaccaggat caagcgggct atatgacgtc accaagagat ccgtcgacga cttcatcagc 120
accgaaactc ctattgcact gaacaacctt ctctgcaatg ttggtcctga tggatgtcgt 180
gcatttggca cgtcagctgg tgcggtgatt gcatctccca gcacgaccga cccagactgt 240
aagttgaaat tccagcgcta catctcacat atcgccgagc agtcgacagc gtgctaatat 300
cgagacagac tattacatgt ggacgcggga tagtgctctt gtcttcaaaa accttgtcga 360
ccgcttcacc gaagagtacg atgctggcct gcagcgccgc attgagcagt acatcactgc 420
ccaggtcact ctccagggcc tcaccaaccc atcgggttcc ctctcggacg ggtctggtct 480
gggcgagccc aagtttgagt tgaccctgca gccattcact ggcaactggg gtcggccgca 540
gcgggatggc ccagctctgc gagccattgc cttgattggc tatgcgaagt ggcttatcaa 600
caacaactat cagtccactg tgtccagcgt catctggccc attgtgcgca acgacctcaa 660
ctacgttgct caatactggt tagtgacggc ttgccctcga atcacatctt tgcttgtgtg 720
tctaacgtct tcacttcagg aaccaaaccg gctttgacct ctgggaggaa gtcgatggaa 780
gctcattctt cactgttgcc aaccagcacc gaggtatgaa gcaaaccgtc cacactcgct 840
gttactgtat gtgaccattg ttactgacca gctctccagc acttgttgag ggtgccacgc 900
ttgttgccac gcttggccag tcgggagaca catattcatc cgttgctccc caagtcttgt 960
gcttccttca gcgattctgg gtgtcgtccg gtggatacat cgactccaac agtatgtttt 1020
gcactggtca tgaatgttga taacgacaat ggctaatcgc tctcctttag tcaacaccaa 1080
cgagggcagg actggaaagg atgccaactc gattctcact tccatccaca cctttgaccc 1140
caatcttggc tgcgatgcag gcaccttcca gccatgcagt gacaaagcgc tctccaacct 1200
caaggtcgtt gtcgactcct tccgctccat ctacagcttg aacaagggca ttcccgctgg 1260
tgctgccgtc gccattggca gatatccaga ggatgtgtac ttcaacggaa acccttggta 1320
ccttgccacg tttgctgctg ctgagcagct gtacgatgcc gtctacgtct ggaaggagac 1380
gggctccatc acggtgaccg ccacctccct ggccttcttc caggagcttg ttcccggcgt 1440
gacagctggg acctactcca gcagctcgtc gtcgaccttt accaccatca tcaacgccgt 1500
ctcgacgtac gccgatggct tcctcagcga ggctgccaag tacgtccccg ccgacggttc 1560
gctggcagag cagttcgacc gcaacaacgg cactgcgctg tccgcccgtc acctgacgtg 1620
gtcgtacgcc tccttcttga cagccacggc ccgtcgtgct ggcgtcgtgc ccccttcgtg 1680
ggcaaacagc agcgccagca cgattccctc gacgtgctcc ggcgcgtccg tggtcggctc 1740
ctactcgcgt cccacagcca cgtcattccc tccgtcgcag acgcccaagc ctggcgttcc 1800
gtccggcact ccctacacgc ccctgccctg cgctacccca acgtccgtgg ccgtcacctt 1860
ccacgagctc gtgtcgacac agtttggcca gacggtcaag gtcgcgggca gcgctcaggc 1920
cctgggcaac tggagcacga gcgccgctgt ggctctggat gccgtcaact acgccgataa 1980
ccatcccctg tggatcggaa cggttaacct cgaggccgga gacgttgtgg agtacaagta 2040
catcaatgtc ggtcaggatg gctccgtgac ctgggagagt gaccccaacc acacttacac 2100
ggttcctgcg gtggcttgtg tgacgcaggt tgtcaaggag gacacctggc agtcgtaa 2158
<210> 10
<211> 633
<212> PRT
<213> Trichoderma sp.
<400> 10
Met His Val Leu Ser Thr Ala Val Leu Leu Gly Ser Val Ala Val Gln
1 5 10 15
Lys Val Leu Gly Arg Pro Gly Ser Ser Gly Leu Tyr Asp Val Thr Lys
20 25 30
Arg Ser Val Asp Asp Phe Ile Ser Thr Glu Thr Pro Ile Ala Leu Asn
35 40 45
Asn Leu Leu Cys Asn Val Gly Pro Asp Gly Cys Arg Ala Phe Gly Thr
50 55 60
Ser Ala Gly Ala Val Ile Ala Ser Pro Ser Thr Thr Asp Pro Asp Tyr
65 70 75 80
Tyr Tyr Met Trp Thr Arg Asp Ser Ala Leu Val Phe Lys Asn Leu Val
85 90 95
Asp Arg Phe Thr Glu Glu Tyr Asp Ala Gly Leu Gln Arg Arg Ile Glu
100 105 110
Gln Tyr Ile Thr Ala Gln Val Thr Leu Gln Gly Leu Thr Asn Pro Ser
115 120 125
Gly Ser Leu Ser Asp Gly Ser Gly Leu Gly Glu Pro Lys Phe Glu Leu
130 135 140
Thr Leu Gln Pro Phe Thr Gly Asn Trp Gly Arg Pro Gln Arg Asp Gly
145 150 155 160
Pro Ala Leu Arg Ala Ile Ala Leu Ile Gly Tyr Ala Lys Trp Leu Ile
165 170 175
Asn Asn Asn Tyr Gln Ser Thr Val Ser Ser Val Ile Trp Pro Ile Val
180 185 190
Arg Asn Asp Leu Asn Tyr Val Ala Gln Tyr Trp Asn Gln Thr Gly Phe
195 200 205
Asp Leu Trp Glu Glu Val Asp Gly Ser Ser Phe Phe Thr Val Ala Asn
210 215 220
Gln His Arg Ala Leu Val Glu Gly Ala Thr Leu Val Ala Thr Leu Gly
225 230 235 240
Gln Ser Gly Asp Thr Tyr Ser Ser Val Ala Pro Gln Val Leu Cys Phe
245 250 255
Leu Gln Arg Phe Trp Val Ser Ser Gly Gly Tyr Ile Asp Ser Asn Ile
260 265 270
Asn Thr Asn Glu Gly Arg Thr Gly Lys Asp Ala Asn Ser Ile Leu Thr
275 280 285
Ser Ile His Thr Phe Asp Pro Asn Leu Gly Cys Asp Ala Gly Thr Phe
290 295 300
Gln Pro Cys Ser Asp Lys Ala Leu Ser Asn Leu Lys Val Val Val Asp
305 310 315 320
Ser Phe Arg Ser Ile Tyr Ser Leu Asn Lys Gly Ile Pro Ala Gly Ala
325 330 335
Ala Val Ala Ile Gly Arg Tyr Pro Glu Asp Val Tyr Phe Asn Gly Asn
340 345 350
Pro Trp Tyr Leu Ala Thr Phe Ala Ala Ala Glu Gln Leu Tyr Asp Ala
355 360 365
Val Tyr Val Trp Lys Glu Thr Gly Ser Ile Thr Val Thr Ala Thr Ser
370 375 380
Leu Ala Phe Phe Gln Glu Leu Val Pro Gly Val Thr Ala Gly Thr Tyr
385 390 395 400
Ser Ser Ser Ser Ser Ser Thr Phe Thr Thr Ile Ile Asn Ala Val Ser
405 410 415
Thr Tyr Ala Asp Gly Phe Leu Ser Glu Ala Ala Lys Tyr Val Pro Ala
420 425 430
Asp Gly Ser Leu Ala Glu Gln Phe Asp Arg Asn Asn Gly Thr Ala Leu
435 440 445
Ser Ala Arg His Leu Thr Trp Ser Tyr Ala Ser Phe Leu Thr Ala Thr
450 455 460
Ala Arg Arg Ala Gly Val Val Pro Pro Ser Trp Ala Asn Ser Ser Ala
465 470 475 480
Ser Thr Ile Pro Ser Thr Cys Ser Gly Ala Ser Val Val Gly Ser Tyr
485 490 495
Ser Arg Pro Thr Ala Thr Ser Phe Pro Pro Ser Gln Thr Pro Lys Pro
500 505 510
Gly Val Pro Ser Gly Thr Pro Tyr Thr Pro Leu Pro Cys Ala Thr Pro
515 520 525
Thr Ser Val Ala Val Thr Phe His Glu Leu Val Ser Thr Gln Phe Gly
530 535 540
Gln Thr Val Lys Val Ala Gly Ser Ala Gln Ala Leu Gly Asn Trp Ser
545 550 555 560
Thr Ser Ala Ala Val Ala Leu Asp Ala Val Asn Tyr Ala Asp Asn His
565 570 575
Pro Leu Trp Ile Gly Thr Val Asn Leu Glu Ala Gly Asp Val Val Glu
580 585 590
Tyr Lys Tyr Ile Asn Val Gly Gln Asp Gly Ser Val Thr Trp Glu Ser
595 600 605
Asp Pro Asn His Thr Tyr Thr Val Pro Ala Val Ala Cys Val Thr Gln
610 615 620
Val Val Lys Glu Asp Thr Trp Gln Ser
625 630
<210> 11
<211> 2144
<212> ДНК
<213> Hypocrea gelatinosa
<400> 11
atgcacgtgc tgtcgactgc tgtgctactc ggctcagttg ccgtccagaa ggtcctggga 60
agaccaggat caaacggcct ttccggcgtc acaaaacgat ctgtggatga cttcatcaac 120
acacagactc ccattgcgct aaacaacctc ctttgcaatg ttggccctga tggatgccgt 180
gcctttggca catcggccgg tgctgtgatt gcatctccga gcacaactga cccagattgt 240
aagtttgact tataccggca tattcttgag atgtcaagtt tcacatacta acacgggggt 300
aattgatcag actactacat gtggacgcga gacagtgctc ttgtcttcaa gaacattgtc 360
gaccgtttca ctcaacagta cgatgccggc ctgcagcgcc gcatcgagca gtacatttct 420
gcccaggtca ctctccaggg gccctcaaac ccctctggct ctctctcgga cgggtccggt 480
cttggtgaac ccaagtttga gctgactttg agtcagttca ctggaaactg gggtcgtccg 540
cagcgcgatg gcccagctct tcgagctatt gccttaatag gctattcgaa gtggctcatc 600
aacaacaact accagtcaac tgtatcaagt atcatctggc ccattgtacg aaatgatctc 660
aactatgttg cccagtactg gttagtacca actcgctgtc tcttcgtctt gtttaagact 720
atctctaata cattcacttc aggaaccaaa ctggtttcga cctgtgggag gaagtcaatg 780
gtagctcgtt ctttactgtt gccaaccagc atcgaggtat gtatcaacaa ctcatacatt 840
aattggaaat aaaaaatgct gacaagttcc ttagctcttg ttgagggtgc cacacttgcc 900
gctaccctcg gccagtcagg aagcacctat tcctctgttg ctcctcaaat cctgtgcttc 960
ctccagagat tttgggtgtc gggaggatac attgactcca acagtaagtc tatcagcact 1020
atgcctggat gaagaccaat actaaacagc tcgttatagt caacagcaac gatggcagga 1080
ctggcaaaga tgccaactct cttctcgcat ctatccacac cttcgatcct agcctgggct 1140
gcgacgcctc caccttccag ccttgcagtg acaaagctct ctccaatctc aaggttgttg 1200
tagactcctt ccgctccatc tacggcgtca acaaaggtat ttctgctggc tctgctgttg 1260
ccatcggcag ataccccgaa gatgtgtact ttaacggaaa cccctggtat cttgccacgt 1320
tcgctgctgc tgagcaactt tacgactccg tctatgtctg gaagaagaca ggctccatca 1380
cggtgacttc cacctctttg gccttcttcc aggagcttgt ccccggtgtc gcggctggaa 1440
cttactccag cagccagtct accttcacga gcatcgtcaa cgccgtctcg acatatgctg 1500
atggattcct cagcgaggct gccaagtacg tccctgctga tggttcgctc gccgagcagt 1560
tcgatcgaaa caccggaacg cctctgtcag ccgttcacct gacctggtca tacgcctcgt 1620
ttttcaccgc tgcggcccgt cggtctggcg ttgtcccccc atcgtgggcc agcagcggcg 1680
ctaactcaat ccctgcaacc tgctccggag cgtctgtggt tggatcctac tcgagtccta 1740
cagccacgtc attcccacca tcgcagaccc ccaagcctgg cgttccttct ggtactccct 1800
tcactcccct tccctgcgct accccgactt ccgttgccgt cactttccat gagcttgcca 1860
caacccagtt tggccagaat atcaaggtcg ccggcagcgc tcccgagctg ggcaactgga 1920
gcacgagcgc ggccattgct ctggatgccg tcaactatgc cactaaccat cccctgtgga 1980
ttggatcggt caatctggaa gccggagacg tcattgagta caagtacatc aacgtgggtc 2040
aggatggttc cgtcacctgg gagagcgacc ccaaccacac ctacactgtt ccagcggttg 2100
cctgtgtcac tgaggtggtt aaggaggaca cctggcagtc gtaa 2144
<210> 12
<211> 631
<212> PRT
<213> Hypocrea gelatinosa
<400> 12
Met His Val Leu Ser Thr Ala Val Leu Leu Gly Ser Val Ala Val Gln
1 5 10 15
Lys Val Leu Gly Arg Pro Gly Ser Asn Gly Leu Ser Gly Val Thr Lys
20 25 30
Arg Ser Val Asp Asp Phe Ile Asn Thr Gln Thr Pro Ile Ala Leu Asn
35 40 45
Asn Leu Leu Cys Asn Val Gly Pro Asp Gly Cys Arg Ala Phe Gly Thr
50 55 60
Ser Ala Gly Ala Val Ile Ala Ser Pro Ser Thr Thr Asp Pro Asp Tyr
65 70 75 80
Tyr Tyr Met Trp Thr Arg Asp Ser Ala Leu Val Phe Lys Asn Ile Val
85 90 95
Asp Arg Phe Thr Gln Gln Tyr Asp Ala Gly Leu Gln Arg Arg Ile Glu
100 105 110
Gln Tyr Ile Ser Ala Gln Val Thr Leu Gln Gly Pro Ser Asn Pro Ser
115 120 125
Gly Ser Leu Ser Asp Gly Ser Gly Leu Gly Glu Pro Lys Phe Glu Leu
130 135 140
Thr Leu Ser Gln Phe Thr Gly Asn Trp Gly Arg Pro Gln Arg Asp Gly
145 150 155 160
Pro Ala Leu Arg Ala Ile Ala Leu Ile Gly Tyr Ser Lys Trp Leu Ile
165 170 175
Asn Asn Asn Tyr Gln Ser Thr Val Ser Ser Ile Ile Trp Pro Ile Val
180 185 190
Arg Asn Asp Leu Asn Tyr Val Ala Gln Tyr Trp Asn Gln Thr Gly Phe
195 200 205
Asp Leu Trp Glu Glu Val Asn Gly Ser Ser Phe Phe Thr Val Ala Asn
210 215 220
Gln His Arg Ala Leu Val Glu Gly Ala Thr Leu Ala Ala Thr Leu Gly
225 230 235 240
Gln Ser Gly Ser Thr Tyr Ser Ser Val Ala Pro Gln Ile Leu Cys Phe
245 250 255
Leu Gln Arg Phe Trp Val Ser Gly Gly Tyr Ile Asp Ser Asn Ile Asn
260 265 270
Ser Asn Asp Gly Arg Thr Gly Lys Asp Ala Asn Ser Leu Leu Ala Ser
275 280 285
Ile His Thr Phe Asp Pro Ser Leu Gly Cys Asp Ala Ser Thr Phe Gln
290 295 300
Pro Cys Ser Asp Lys Ala Leu Ser Asn Leu Lys Val Val Val Asp Ser
305 310 315 320
Phe Arg Ser Ile Tyr Gly Val Asn Lys Gly Ile Ser Ala Gly Ser Ala
325 330 335
Val Ala Ile Gly Arg Tyr Pro Glu Asp Val Tyr Phe Asn Gly Asn Pro
340 345 350
Trp Tyr Leu Ala Thr Phe Ala Ala Ala Glu Gln Leu Tyr Asp Ser Val
355 360 365
Tyr Val Trp Lys Lys Thr Gly Ser Ile Thr Val Thr Ser Thr Ser Leu
370 375 380
Ala Phe Phe Gln Glu Leu Val Pro Gly Val Ala Ala Gly Thr Tyr Ser
385 390 395 400
Ser Ser Gln Ser Thr Phe Thr Ser Ile Val Asn Ala Val Ser Thr Tyr
405 410 415
Ala Asp Gly Phe Leu Ser Glu Ala Ala Lys Tyr Val Pro Ala Asp Gly
420 425 430
Ser Leu Ala Glu Gln Phe Asp Arg Asn Thr Gly Thr Pro Leu Ser Ala
435 440 445
Val His Leu Thr Trp Ser Tyr Ala Ser Phe Phe Thr Ala Ala Ala Arg
450 455 460
Arg Ser Gly Val Val Pro Pro Ser Trp Ala Ser Ser Gly Ala Asn Ser
465 470 475 480
Ile Pro Ala Thr Cys Ser Gly Ala Ser Val Val Gly Ser Tyr Ser Ser
485 490 495
Pro Thr Ala Thr Ser Phe Pro Pro Ser Gln Thr Pro Lys Pro Gly Val
500 505 510
Pro Ser Gly Thr Pro Phe Thr Pro Leu Pro Cys Ala Thr Pro Thr Ser
515 520 525
Val Ala Val Thr Phe His Glu Leu Ala Thr Thr Gln Phe Gly Gln Asn
530 535 540
Ile Lys Val Ala Gly Ser Ala Pro Glu Leu Gly Asn Trp Ser Thr Ser
545 550 555 560
Ala Ala Ile Ala Leu Asp Ala Val Asn Tyr Ala Thr Asn His Pro Leu
565 570 575
Trp Ile Gly Ser Val Asn Leu Glu Ala Gly Asp Val Ile Glu Tyr Lys
580 585 590
Tyr Ile Asn Val Gly Gln Asp Gly Ser Val Thr Trp Glu Ser Asp Pro
595 600 605
Asn His Thr Tyr Thr Val Pro Ala Val Ala Cys Val Thr Glu Val Val
610 615 620
Lys Glu Asp Thr Trp Gln Ser
625 630
<210> 13
<211> 2127
<212> ДНК
<213> Hypocrea orientalis
<400> 13
atgcacgtcc tgtcgactgc ggtgctgctc ggctccgttg ccgttcagaa ggtcctggga 60
agaccaggat caagcggtct ttctgacgta accaagagat ccgttgacga cttcatcagc 120
accgagaccc ccattgcact gaacaacctt ctctgcaatg ttggtcctga tggatgtcgt 180
gcatttggca catcagccgg tgcggtgatt gcatctccca gcacaattga cccggactgt 240
aagttggatc aataccgttg atctatgttt accgcatact gagacggaaa cagactatta 300
catgtggacg cgagacagcg ctcttgtttt caagaacctc gtcgaccgct tcaccgaaac 360
gtacgatgct ggcctgcagc gccgcattga gcagtacatc actgcccagg tcactctcca 420
gggcctctcc aacccatcgg gatcccttac ggacgggtct ggtctgggcg agcccaagtt 480
tgagctgacc ctgcagccct tcaccggcaa ctggggtcga ccgcagcgcg atggcccagc 540
tctgcgagcc attgccttga ttggatactc caagtggctc atcaacaaca actatcagtc 600
aactgtgtcc aacgtcatct ggccgattgt gcgcaacgac ctcaactacg ttgctcaata 660
ctggttagtg acacttgccc tcgaactact gcttgcgtct aacctcttca tcgtaggaac 720
cagactggct ttgacctgtg ggaggaagtg aaaggtagct cgttctttac cattgccaac 780
cagcaccgag gtatgaagca caacgtccat actcgccgtc attactttga gcattactga 840
ccacctctcc agcacttgtc gagggtgcta ctcttgccgc tactcttggc cagtcgggaa 900
gcacttattc atctgttgct ccccagatct tgtgcttcct ccaacgattc tgggtgtcgt 960
cgggcggata tgtcgactcc aatagtatgt cttccaaggc tcgtatgatt gttaaagaca 1020
agtactaaca gctggcctct agtcaacacc aacgagggca ggactggcaa ggatgtcaac 1080
tccatcctga cctccatcca caccttggat cccaaccttg gctgtgatgc aggcaccttc 1140
cagccatgca gtgacaaggc gctctccaat ctcaaggttg ttgtcgactc cttccgctcc 1200
atctacggtg tgaacaaggg cattcctgcc ggtgctgccg tcgccattgg ccgatatgca 1260
gaggatgtct acttcaacgg taacccttgg tatcttgcca cgtttgctgc cgccgaacag 1320
ctgtacgatg ccgtctatgt ctggaagaag acgggctcca tcacggttac tgccacctcc 1380
ctggccttct tccaggagct tgttcccggc gtggcggccg ggacctacgc cagcagctcg 1440
tcgaccttta cgaacatcat caacgccgtc tcaacatacg ccgatggctt ccttagcgag 1500
gctgccaagt acgttcccgc cgacggttcg ctggccgagc agtttgaccg caacagcggc 1560
actccgctgt ccgcccttca cctgacgtgg tcgtacgcct cgttcctgac agccacggcc 1620
cgtcgggctg gcatcgtgcc cccatcgtgg gcaaacagca gcgccagcac gattccctcg 1680
acgtgctccg gcgcgtccgt ggtcggatcc tactcgcgtc ccacagccac gtcattccct 1740
ccgtcgcaga cgcccaagcc tggcgttccc tccggtacgc cctacactcc cctgccctgc 1800
gccactccaa cgtccgtggc cgtcaccttc cacgagctcg tgtcgacgca gcttggccag 1860
acggtcaagg tcgcgggcaa cgctccggcc ctgggcaact ggagcacgag cgccgccgtg 1920
gctctcgatg ccgtcaacta tgccgacaac cacccgctgt ggatcggaac ggttgacctc 1980
gaggctggag atgtcgtcga gtacaagtac atcaatgtcg gccaggatgg ctccgtgacc 2040
tgggagagtg atcccaatca cacttacacg gttcctgcgg tggcttgtgt gacgcaggtt 2100
gtcaaggagg acacctggca gtcgtaa 2127
<210> 14
<211> 632
<212> PRT
<213> Hypocrea orientalis
<400> 14
Met His Val Leu Ser Thr Ala Val Leu Leu Gly Ser Val Ala Val Gln
1 5 10 15
Lys Val Leu Gly Arg Pro Gly Ser Ser Gly Leu Ser Asp Val Thr Lys
20 25 30
Arg Ser Val Asp Asp Phe Ile Ser Thr Glu Thr Pro Ile Ala Leu Asn
35 40 45
Asn Leu Leu Cys Asn Val Gly Pro Asp Gly Cys Arg Ala Phe Gly Thr
50 55 60
Ser Ala Gly Ala Val Ile Ala Ser Pro Ser Thr Ile Asp Pro Asp Tyr
65 70 75 80
Tyr Tyr Met Trp Thr Arg Asp Ser Ala Leu Val Phe Lys Asn Leu Val
85 90 95
Asp Arg Phe Thr Glu Thr Tyr Asp Ala Gly Leu Gln Arg Arg Ile Glu
100 105 110
Gln Tyr Ile Thr Ala Gln Val Thr Leu Gln Gly Leu Ser Asn Pro Ser
115 120 125
Gly Ser Leu Thr Asp Gly Ser Gly Leu Gly Glu Pro Lys Phe Glu Leu
130 135 140
Thr Leu Gln Pro Phe Thr Gly Asn Trp Gly Arg Pro Gln Arg Asp Gly
145 150 155 160
Pro Ala Leu Arg Ala Ile Ala Leu Ile Gly Tyr Ser Lys Trp Leu Ile
165 170 175
Asn Asn Asn Tyr Gln Ser Thr Val Ser Asn Val Ile Trp Pro Ile Val
180 185 190
Arg Asn Asp Leu Asn Tyr Val Ala Gln Tyr Trp Asn Gln Thr Gly Phe
195 200 205
Asp Leu Trp Glu Glu Val Lys Gly Ser Ser Phe Phe Thr Ile Ala Asn
210 215 220
Gln His Arg Ala Leu Val Glu Gly Ala Thr Leu Ala Ala Thr Leu Gly
225 230 235 240
Gln Ser Gly Ser Thr Tyr Ser Ser Val Ala Pro Gln Ile Leu Cys Phe
245 250 255
Leu Gln Arg Phe Trp Val Ser Ser Gly Gly Tyr Val Asp Ser Asn Ile
260 265 270
Asn Thr Asn Glu Gly Arg Thr Gly Lys Asp Val Asn Ser Ile Leu Thr
275 280 285
Ser Ile His Thr Leu Asp Pro Asn Leu Gly Cys Asp Ala Gly Thr Phe
290 295 300
Gln Pro Cys Ser Asp Lys Ala Leu Ser Asn Leu Lys Val Val Val Asp
305 310 315 320
Ser Phe Arg Ser Ile Tyr Gly Val Asn Lys Gly Ile Pro Ala Gly Ala
325 330 335
Ala Val Ala Ile Gly Arg Tyr Ala Glu Asp Val Tyr Phe Asn Gly Asn
340 345 350
Pro Trp Tyr Leu Ala Thr Phe Ala Ala Ala Glu Gln Leu Tyr Asp Ala
355 360 365
Val Tyr Val Trp Lys Lys Thr Gly Ser Ile Thr Val Thr Ala Thr Ser
370 375 380
Leu Ala Phe Phe Gln Glu Leu Val Pro Gly Val Ala Ala Gly Thr Tyr
385 390 395 400
Ala Ser Ser Ser Ser Thr Phe Thr Asn Ile Ile Asn Ala Val Ser Thr
405 410 415
Tyr Ala Asp Gly Phe Leu Ser Glu Ala Ala Lys Tyr Val Pro Ala Asp
420 425 430
Gly Ser Leu Ala Glu Gln Phe Asp Arg Asn Ser Gly Thr Pro Leu Ser
435 440 445
Ala Leu His Leu Thr Trp Ser Tyr Ala Ser Phe Leu Thr Ala Thr Ala
450 455 460
Arg Arg Ala Gly Ile Val Pro Pro Ser Trp Ala Asn Ser Ser Ala Ser
465 470 475 480
Thr Ile Pro Ser Thr Cys Ser Gly Ala Ser Val Val Gly Ser Tyr Ser
485 490 495
Arg Pro Thr Ala Thr Ser Phe Pro Pro Ser Gln Thr Pro Lys Pro Gly
500 505 510
Val Pro Ser Gly Thr Pro Tyr Thr Pro Leu Pro Cys Ala Thr Pro Thr
515 520 525
Ser Val Ala Val Thr Phe His Glu Leu Val Ser Thr Gln Leu Gly Gln
530 535 540
Thr Val Lys Val Ala Gly Asn Ala Pro Ala Leu Gly Asn Trp Ser Thr
545 550 555 560
Ser Ala Ala Val Ala Leu Asp Ala Val Asn Tyr Ala Asp Asn His Pro
565 570 575
Leu Trp Ile Gly Thr Val Asp Leu Glu Ala Gly Asp Val Val Glu Tyr
580 585 590
Lys Tyr Ile Asn Val Gly Gln Asp Gly Ser Val Thr Trp Glu Ser Asp
595 600 605
Pro Asn His Thr Tyr Thr Val Pro Ala Val Ala Cys Val Thr Gln Val
610 615 620
Val Lys Glu Asp Thr Trp Gln Ser
625 630
<210> 15
<211> 2139
<212> ДНК
<213> Trichoderma konilangbra
<400> 15
atgcacgtcc tgtcgactgc ggtgctgctc ggctccgttg ccgtccagaa ggttctggga 60
agaccggggt caagcggcct ctccgacgtc accaagagat ctgtcgacga tttcatcagc 120
acccagacgc ccatcgcact gaacaacctc ctctgcaatg ttggccctga cggatgccgt 180
gcatttggca catcagctgg tgcggttatt gcatcgccca gcacaactga cccagactgt 240
aagttgggct tgtaccagta tatctacgag agttgtactg cataggtact gatatcgata 300
cagattatta catgtggacg cgagacagtg ctcttgtctt caagaacctt gtcgaccgct 360
tcactgaaac gtacgatgcg ggcctgcagc gccgcatcga gcagtacatt gctgcccagg 420
tcactctcca gggcctcacc aatccatctg gttctctctc agacgggtct ggtcttggcg 480
agcccaagtt tgagttaacc ctgaagccct tcactggcaa ctggggtcga ccgcagcggg 540
atggcccagc tctgcgggcc attgccttga ttggctactc aaagtggctc atcaacaaca 600
actatcagtc aaccgtgtcc agcctcatct ggcctattgt gcgcaacgac ctcaactatg 660
ttgcgcagta ctggtcagtg gttgcttgct cttgttaaca cttgtgtcta acgtcttcac 720
ttcaggaacc aaaccggctt tgacctgtgg gaggaagtta atggaagctc attctttacc 780
actgccaacc agcaccgagg tatgaagccc gacggctaaa cttgccatcg ctgtatatga 840
gaattacgga ctagctctcc agcacttgtt gagggcgcca cccttgctgc cactctcagc 900
cagccggcaa gcacttattc ttctgttgct ccccaaatct tgtgcttcct ccagcgatat 960
tgggtgtcgt ccggtggata cgtcgactcc aacagtatgt ctcttcatgc tcgtgggttt 1020
tcgagaaaga caatcactaa tagcttgcgc ctagtcaaca ccaacgaggg taggactgga 1080
aaggatgcca actccattct cgctgctatc cacacctttg atcccaatct tggccgtgat 1140
gcaggcacct tccagccatg cagcgacaaa gctctctcca acctcaaggt cgttgtcgac 1200
tccttccgct ccatctacgg cgtgaacaag ggcattcccg ctggtgctgc cgccgccgtt 1260
ggcagatatc cagaggacgt gtacttcaac ggaaaccctt ggtaccttgc aacttttgct 1320
gctgctgagc agttgtacga tgccatctac gtctggaaga agacaggctc catcacagtg 1380
actgccatct ctctggcctt cttccaggag cttgttcccg gtgtggcagc tgggacctac 1440
tccagcagcc agtcgacctt tacgaacatc atcaacgccg tgtccactta cgccgatggc 1500
ttcatcagcg aggccgccaa gtacgtcccc gccgacggtt cgctggccga gcagttcgac 1560
cgcaacaacg gcactcctct gtccgccctc cacctgacgt ggtcgtacgc ctcgttcttg 1620
acagccacgg cccgccgggc tggcatcgtg cccccctcgt gggcaaacag cagcgccagc 1680
tcgattcctt cgacatgctc cggcgcgtcc gtggtcggat cctattcacg tcccacagcc 1740
acgtcattcc ctccctcgca aacgcccaag cccggcgttc cttccggtac tccctacacg 1800
cccctgccct gcgctacccc agcgtccgtg gccgtcacct tccacgagct cgtgtcgacg 1860
cagcttggcc agacggtcaa agttgcgggc agcgccccgg ccctgggcaa ctggagcacg 1920
agcgccgctg tcgctctgga cgccgtcaac tacgccgata accatcccct gtggattggg 1980
tcggtcgaac ttgaggctgg agatgtcgtt gaatacaagt acatcaatgt gggtcaggat 2040
ggttccgtga cctgggagag tgaccccaac cacacttaca cggttcctgc ggtggcttgt 2100
gtgacgcagg tcgtcaagga ggacacctgg cagtcgtaa 2139
<210> 16
<211> 632
<212> PRT
<213> Trichoderma konilangbra
<400> 16
Met His Val Leu Ser Thr Ala Val Leu Leu Gly Ser Val Ala Val Gln
1 5 10 15
Lys Val Leu Gly Arg Pro Gly Ser Ser Gly Leu Ser Asp Val Thr Lys
20 25 30
Arg Ser Val Asp Asp Phe Ile Ser Thr Gln Thr Pro Ile Ala Leu Asn
35 40 45
Asn Leu Leu Cys Asn Val Gly Pro Asp Gly Cys Arg Ala Phe Gly Thr
50 55 60
Ser Ala Gly Ala Val Ile Ala Ser Pro Ser Thr Thr Asp Pro Asp Tyr
65 70 75 80
Tyr Tyr Met Trp Thr Arg Asp Ser Ala Leu Val Phe Lys Asn Leu Val
85 90 95
Asp Arg Phe Thr Glu Thr Tyr Asp Ala Gly Leu Gln Arg Arg Ile Glu
100 105 110
Gln Tyr Ile Ala Ala Gln Val Thr Leu Gln Gly Leu Thr Asn Pro Ser
115 120 125
Gly Ser Leu Ser Asp Gly Ser Gly Leu Gly Glu Pro Lys Phe Glu Leu
130 135 140
Thr Leu Lys Pro Phe Thr Gly Asn Trp Gly Arg Pro Gln Arg Asp Gly
145 150 155 160
Pro Ala Leu Arg Ala Ile Ala Leu Ile Gly Tyr Ser Lys Trp Leu Ile
165 170 175
Asn Asn Asn Tyr Gln Ser Thr Val Ser Ser Leu Ile Trp Pro Ile Val
180 185 190
Arg Asn Asp Leu Asn Tyr Val Ala Gln Tyr Trp Asn Gln Thr Gly Phe
195 200 205
Asp Leu Trp Glu Glu Val Asn Gly Ser Ser Phe Phe Thr Thr Ala Asn
210 215 220
Gln His Arg Ala Leu Val Glu Gly Ala Thr Leu Ala Ala Thr Leu Ser
225 230 235 240
Gln Pro Ala Ser Thr Tyr Ser Ser Val Ala Pro Gln Ile Leu Cys Phe
245 250 255
Leu Gln Arg Tyr Trp Val Ser Ser Gly Gly Tyr Val Asp Ser Asn Ile
260 265 270
Asn Thr Asn Glu Gly Arg Thr Gly Lys Asp Ala Asn Ser Ile Leu Ala
275 280 285
Ala Ile His Thr Phe Asp Pro Asn Leu Gly Arg Asp Ala Gly Thr Phe
290 295 300
Gln Pro Cys Ser Asp Lys Ala Leu Ser Asn Leu Lys Val Val Val Asp
305 310 315 320
Ser Phe Arg Ser Ile Tyr Gly Val Asn Lys Gly Ile Pro Ala Gly Ala
325 330 335
Ala Ala Ala Val Gly Arg Tyr Pro Glu Asp Val Tyr Phe Asn Gly Asn
340 345 350
Pro Trp Tyr Leu Ala Thr Phe Ala Ala Ala Glu Gln Leu Tyr Asp Ala
355 360 365
Ile Tyr Val Trp Lys Lys Thr Gly Ser Ile Thr Val Thr Ala Ile Ser
370 375 380
Leu Ala Phe Phe Gln Glu Leu Val Pro Gly Val Ala Ala Gly Thr Tyr
385 390 395 400
Ser Ser Ser Gln Ser Thr Phe Thr Asn Ile Ile Asn Ala Val Ser Thr
405 410 415
Tyr Ala Asp Gly Phe Ile Ser Glu Ala Ala Lys Tyr Val Pro Ala Asp
420 425 430
Gly Ser Leu Ala Glu Gln Phe Asp Arg Asn Asn Gly Thr Pro Leu Ser
435 440 445
Ala Leu His Leu Thr Trp Ser Tyr Ala Ser Phe Leu Thr Ala Thr Ala
450 455 460
Arg Arg Ala Gly Ile Val Pro Pro Ser Trp Ala Asn Ser Ser Ala Ser
465 470 475 480
Ser Ile Pro Ser Thr Cys Ser Gly Ala Ser Val Val Gly Ser Tyr Ser
485 490 495
Arg Pro Thr Ala Thr Ser Phe Pro Pro Ser Gln Thr Pro Lys Pro Gly
500 505 510
Val Pro Ser Gly Thr Pro Tyr Thr Pro Leu Pro Cys Ala Thr Pro Ala
515 520 525
Ser Val Ala Val Thr Phe His Glu Leu Val Ser Thr Gln Leu Gly Gln
530 535 540
Thr Val Lys Val Ala Gly Ser Ala Pro Ala Leu Gly Asn Trp Ser Thr
545 550 555 560
Ser Ala Ala Val Ala Leu Asp Ala Val Asn Tyr Ala Asp Asn His Pro
565 570 575
Leu Trp Ile Gly Ser Val Glu Leu Glu Ala Gly Asp Val Val Glu Tyr
580 585 590
Lys Tyr Ile Asn Val Gly Gln Asp Gly Ser Val Thr Trp Glu Ser Asp
595 600 605
Pro Asn His Thr Tyr Thr Val Pro Ala Val Ala Cys Val Thr Gln Val
610 615 620
Val Lys Glu Asp Thr Trp Gln Ser
625 630
<210> 17
<211> 599
<212> PRT
<213> Hypocrea citrina var. americana
<400> 17
Ser Val Asp Asp Phe Ile Ser Asn Glu Ser Pro Ile Ala Leu Asn Asn
1 5 10 15
Leu Leu Cys Asn Val Gly Pro Asp Gly Cys Arg Ala Phe Gly Ala Ser
20 25 30
Ala Gly Thr Val Ala Ala Ser Pro Ser Thr Thr Asp Pro Asp Tyr Tyr
35 40 45
Tyr Met Trp Thr Arg Asp Ser Ala Leu Ile Phe Lys Thr Val Val Asp
50 55 60
Arg Phe Thr Gln Asn Tyr Asp Ala Ser Leu Gln Lys Arg Ile Glu Gln
65 70 75 80
Tyr Ile Ala Ala Gln Ala Thr Leu Gln Gly Ile Ser Asn Pro Ser Gly
85 90 95
Ser Leu Ala Asp Gly Ser Gly Leu Gly Glu Pro Lys Phe Glu Leu Thr
100 105 110
Leu Asn Gln Phe Thr Gly His Trp Gly Arg Pro Gln Arg Asp Gly Pro
115 120 125
Ala Leu Arg Ala Ile Ala Leu Ile Gly Tyr Ser Lys Trp Leu Ile Asp
130 135 140
Asn Asn Tyr Gln Ser Thr Val Ser Asp Ile Ile Trp Pro Ile Leu Arg
145 150 155 160
Asn Asp Leu Asn Tyr Val Ala Gln Tyr Trp Asn Gln Thr Gly Phe Asp
165 170 175
Leu Trp Glu Glu Val Glu Gly Ser Ser Phe Phe Thr Val Ala Asn Gln
180 185 190
His Arg Ala Leu Val Glu Gly Ala Thr Leu Ala Ala Ile Leu Gly Gln
195 200 205
Ser Gly Ser Ser Tyr Ser Ala Val Ala Pro Gln Ile Leu Cys Phe Leu
210 215 220
Gln Lys Phe Trp Val Ser Ser Gly Gly Tyr Val Asn Ser Asn Ile Asn
225 230 235 240
Ser Asp Ile Asn Arg Thr Gly Lys Asp Ala Asn Ser Leu Leu Ala Ser
245 250 255
Ile His Thr Phe Asp Pro Ser Ile Gly Cys Asp Pro Ala Thr Phe Gln
260 265 270
Pro Cys Ser Asp Lys Ala Leu Ser Asn Leu Lys Ser Val Val Asp Ser
275 280 285
Phe Arg Ser Ile Tyr Gly Val Asn Gln Gly Ile Ser Ala Gly Ser Ala
290 295 300
Val Ala Ile Gly Arg Tyr Ser Glu Asp Val Tyr Phe Asn Gly Asn Pro
305 310 315 320
Trp Tyr Leu Ala Thr Phe Ala Ala Ala Glu Gln Leu Tyr Asp Ser Leu
325 330 335
Tyr Val Trp Lys Gln Thr Gly Ser Ile Thr Val Thr Ala Ile Pro Leu
340 345 350
Ala Phe Phe Gln Glu Leu Val Pro Gly Val Ala Ala Gly Thr Tyr Leu
355 360 365
Ser Ser Gln Ser Thr Phe Thr Ser Ile Val Asn Ala Val Ser Ala Tyr
370 375 380
Ala Asp Gly Phe Leu Asn Glu Ala Ala Lys Tyr Val Pro Ser Asp Gly
385 390 395 400
Ser Leu Ala Glu Gln Phe Asp Lys Asn Asn Gly Thr Pro Leu Ser Ala
405 410 415
Val His Leu Thr Trp Ser Tyr Ala Ser Phe Leu Thr Ala Thr Ala Arg
420 425 430
Arg Ala Gly Ser Val Pro Pro Ser Trp Ala Asn Ser Asn Ala Thr Ser
435 440 445
Ile Pro Thr Ala Cys Ser Gly Thr Ser Val Val Gly Ser Tyr Ser Ser
450 455 460
Pro Thr Ala Thr Ser Phe Pro Pro Ser Gln Thr Pro Lys Val Gly Lys
465 470 475 480
Pro Thr Gly Thr Pro Phe Thr Pro Ile Pro Cys Ala Thr Pro Thr Ser
485 490 495
Val Ala Val Thr Phe His Glu Leu Pro Thr Thr Gln Phe Gly Gln Thr
500 505 510
Ile Lys Leu Ala Gly Ser Ala Glu Ala Leu Gly Asn Trp Ser Thr Gly
515 520 525
Ala Ala Val Gly Leu Asp Ala Ala Asn Tyr Ala Ser Asn His Pro Leu
530 535 540
Trp Phe Gly Thr Leu Asn Leu Gln Ala Gly Asp Val Ile Glu Tyr Lys
545 550 555 560
Tyr Ile Asn Val Gly Lys Asp Gly Ser Val Thr Trp Glu Ser Asp Pro
565 570 575
Asn His Thr Tyr Thr Val Pro Ala Val Ala Cys Val Thr Glu Val Val
580 585 590
Lys Glu Asp Thr Trp Gln Ser
595
<210> 18
<211> 598
<212> PRT
<213> Hypocrea vinosa
<400> 18
Ser Val Asp Asp Phe Ile Asn Thr Gln Thr Pro Ile Ala Leu Asn Asn
1 5 10 15
Leu Leu Cys Asn Val Gly Pro Asp Gly Cys Arg Ala Phe Gly Thr Ser
20 25 30
Ala Gly Ala Val Ile Ala Ser Pro Ser Thr Thr Asp Pro Asp Tyr Tyr
35 40 45
Tyr Met Trp Thr Arg Asp Ser Ala Leu Val Phe Lys Asn Ile Val Asp
50 55 60
Arg Phe Thr Gln Gln Tyr Asp Ala Gly Leu Gln Arg Arg Ile Glu Gln
65 70 75 80
Tyr Ile Ser Ala Gln Val Thr Leu Gln Gly Ile Ser Asn Pro Ser Gly
85 90 95
Ser Leu Ser Asp Gly Ser Gly Leu Gly Glu Pro Lys Phe Glu Leu Thr
100 105 110
Leu Ser Gln Phe Thr Gly Asn Trp Gly Arg Pro Gln Arg Asp Gly Pro
115 120 125
Ala Leu Arg Ala Ile Ala Leu Ile Gly Tyr Ser Lys Trp Leu Ile Asn
130 135 140
Asn Asn Tyr Gln Ser Thr Val Ser Asn Ile Ile Trp Pro Ile Val Arg
145 150 155 160
Asn Asp Leu Asn Tyr Val Ala Gln Tyr Trp Asn Gln Thr Gly Phe Asp
165 170 175
Leu Trp Glu Glu Val Asn Gly Ser Ser Phe Phe Thr Val Ala Asn Gln
180 185 190
His Arg Ala Leu Val Glu Gly Ala Thr Leu Ala Ala Thr Leu Gly Gln
195 200 205
Ser Gly Ser Thr Tyr Ser Ser Val Ala Pro Gln Ile Leu Cys Phe Leu
210 215 220
Gln Arg Phe Trp Val Ser Gly Gly Tyr Ile Asp Ser Asn Ile Asn Thr
225 230 235 240
Asn Glu Gly Arg Thr Gly Lys Asp Ala Asn Ser Leu Leu Ala Ser Ile
245 250 255
His Thr Phe Asp Pro Ser Leu Gly Cys Asp Ala Ser Thr Phe Gln Pro
260 265 270
Cys Ser Asp Lys Ala Leu Ser Asn Leu Lys Val Val Val Asp Ser Phe
275 280 285
Arg Ser Ile Tyr Gly Val Asn Lys Gly Ile Pro Ala Gly Ser Ala Val
290 295 300
Ala Ile Gly Arg Tyr Pro Glu Asp Val Tyr Phe Asn Gly Asn Pro Trp
305 310 315 320
Tyr Leu Ala Thr Phe Ala Ala Ala Glu Gln Leu Tyr Asp Ser Val Tyr
325 330 335
Val Trp Lys Lys Thr Gly Ser Ile Thr Val Thr Ser Thr Ser Ser Ala
340 345 350
Phe Phe Gln Glu Leu Val Pro Gly Val Ala Ala Gly Thr Tyr Ser Ser
355 360 365
Ser Gln Ser Thr Phe Thr Ser Ile Ile Asn Ala Ile Ser Thr Tyr Ala
370 375 380
Asp Gly Phe Leu Ser Glu Ala Ala Lys Tyr Val Pro Ala Asp Gly Ser
385 390 395 400
Leu Ala Glu Gln Phe Asp Arg Asn Thr Gly Thr Pro Leu Ser Ala Val
405 410 415
His Leu Thr Trp Ser Tyr Ala Ser Phe Leu Thr Ala Ala Ala Arg Arg
420 425 430
Ala Gly Val Val Pro Pro Ser Trp Ala Ser Ser Gly Ala Asn Thr Val
435 440 445
Pro Ser Ser Cys Ser Gly Ala Ser Val Val Gly Ser Tyr Ser Arg Pro
450 455 460
Thr Ala Thr Ser Phe Pro Pro Ser Gln Thr Pro Lys Pro Gly Val Pro
465 470 475 480
Ser Gly Thr Pro Phe Thr Pro Ile Pro Cys Ala Thr Pro Thr Ser Val
485 490 495
Ala Val Thr Phe His Glu Leu Ala Thr Thr Gln Phe Gly Gln Thr Ile
500 505 510
Lys Val Ala Gly Ser Ala Pro Glu Leu Gly Asn Trp Ser Thr Ser Ala
515 520 525
Ala Ile Ala Leu Asp Ala Val Asn Tyr Ala Thr Asn His Pro Leu Trp
530 535 540
Ile Gly Ser Val Asn Leu Glu Ala Gly Asp Val Ile Glu Tyr Lys Tyr
545 550 555 560
Ile Asn Val Gly Gln Asp Gly Ser Val Thr Trp Glu Ser Asp Pro Asn
565 570 575
His Thr Tyr Thr Val Pro Ala Val Ala Cys Val Thr Glu Val Val Lys
580 585 590
Glu Asp Thr Trp Gln Ser
595
<210> 19
<211> 600
<212> PRT
<213> Trichoderma sp.
<400> 19
Ser Val Asp Asp Phe Ile Ser Thr Glu Thr Pro Ile Ala Leu Asn Asn
1 5 10 15
Leu Leu Cys Asn Val Gly Pro Asp Gly Cys Arg Ala Phe Gly Thr Ser
20 25 30
Ala Gly Ala Val Ile Ala Ser Pro Ser Thr Thr Asp Pro Asp Tyr Tyr
35 40 45
Tyr Met Trp Thr Arg Asp Ser Ala Leu Val Phe Lys Asn Leu Val Asp
50 55 60
Arg Phe Thr Glu Glu Tyr Asp Ala Gly Leu Gln Arg Arg Ile Glu Gln
65 70 75 80
Tyr Ile Thr Ala Gln Val Thr Leu Gln Gly Leu Thr Asn Pro Ser Gly
85 90 95
Ser Leu Ser Asp Gly Ser Gly Leu Gly Glu Pro Lys Phe Glu Leu Thr
100 105 110
Leu Gln Pro Phe Thr Gly Asn Trp Gly Arg Pro Gln Arg Asp Gly Pro
115 120 125
Ala Leu Arg Ala Ile Ala Leu Ile Gly Tyr Ala Lys Trp Leu Ile Asn
130 135 140
Asn Asn Tyr Gln Ser Thr Val Ser Ser Val Ile Trp Pro Ile Val Arg
145 150 155 160
Asn Asp Leu Asn Tyr Val Ala Gln Tyr Trp Asn Gln Thr Gly Phe Asp
165 170 175
Leu Trp Glu Glu Val Asp Gly Ser Ser Phe Phe Thr Val Ala Asn Gln
180 185 190
His Arg Ala Leu Val Glu Gly Ala Thr Leu Val Ala Thr Leu Gly Gln
195 200 205
Ser Gly Asp Thr Tyr Ser Ser Val Ala Pro Gln Val Leu Cys Phe Leu
210 215 220
Gln Arg Phe Trp Val Ser Ser Gly Gly Tyr Ile Asp Ser Asn Ile Asn
225 230 235 240
Thr Asn Glu Gly Arg Thr Gly Lys Asp Ala Asn Ser Ile Leu Thr Ser
245 250 255
Ile His Thr Phe Asp Pro Asn Leu Gly Cys Asp Ala Gly Thr Phe Gln
260 265 270
Pro Cys Ser Asp Lys Ala Leu Ser Asn Leu Lys Val Val Val Asp Ser
275 280 285
Phe Arg Ser Ile Tyr Ser Leu Asn Lys Gly Ile Pro Ala Gly Ala Ala
290 295 300
Val Ala Ile Gly Arg Tyr Pro Glu Asp Val Tyr Phe Asn Gly Asn Pro
305 310 315 320
Trp Tyr Leu Ala Thr Phe Ala Ala Ala Glu Gln Leu Tyr Asp Ala Val
325 330 335
Tyr Val Trp Lys Glu Thr Gly Ser Ile Thr Val Thr Ala Thr Ser Leu
340 345 350
Ala Phe Phe Gln Glu Leu Val Pro Gly Val Thr Ala Gly Thr Tyr Ser
355 360 365
Ser Ser Ser Ser Ser Thr Phe Thr Thr Ile Ile Asn Ala Val Ser Thr
370 375 380
Tyr Ala Asp Gly Phe Leu Ser Glu Ala Ala Lys Tyr Val Pro Ala Asp
385 390 395 400
Gly Ser Leu Ala Glu Gln Phe Asp Arg Asn Asn Gly Thr Ala Leu Ser
405 410 415
Ala Arg His Leu Thr Trp Ser Tyr Ala Ser Phe Leu Thr Ala Thr Ala
420 425 430
Arg Arg Ala Gly Val Val Pro Pro Ser Trp Ala Asn Ser Ser Ala Ser
435 440 445
Thr Ile Pro Ser Thr Cys Ser Gly Ala Ser Val Val Gly Ser Tyr Ser
450 455 460
Arg Pro Thr Ala Thr Ser Phe Pro Pro Ser Gln Thr Pro Lys Pro Gly
465 470 475 480
Val Pro Ser Gly Thr Pro Tyr Thr Pro Leu Pro Cys Ala Thr Pro Thr
485 490 495
Ser Val Ala Val Thr Phe His Glu Leu Val Ser Thr Gln Phe Gly Gln
500 505 510
Thr Val Lys Val Ala Gly Ser Ala Gln Ala Leu Gly Asn Trp Ser Thr
515 520 525
Ser Ala Ala Val Ala Leu Asp Ala Val Asn Tyr Ala Asp Asn His Pro
530 535 540
Leu Trp Ile Gly Thr Val Asn Leu Glu Ala Gly Asp Val Val Glu Tyr
545 550 555 560
Lys Tyr Ile Asn Val Gly Gln Asp Gly Ser Val Thr Trp Glu Ser Asp
565 570 575
Pro Asn His Thr Tyr Thr Val Pro Ala Val Ala Cys Val Thr Gln Val
580 585 590
Val Lys Glu Asp Thr Trp Gln Ser
595 600
<210> 20
<211> 598
<212> PRT
<213> Hypocrea gelatinosa
<400> 20
Ser Val Asp Asp Phe Ile Asn Thr Gln Thr Pro Ile Ala Leu Asn Asn
1 5 10 15
Leu Leu Cys Asn Val Gly Pro Asp Gly Cys Arg Ala Phe Gly Thr Ser
20 25 30
Ala Gly Ala Val Ile Ala Ser Pro Ser Thr Thr Asp Pro Asp Tyr Tyr
35 40 45
Tyr Met Trp Thr Arg Asp Ser Ala Leu Val Phe Lys Asn Ile Val Asp
50 55 60
Arg Phe Thr Gln Gln Tyr Asp Ala Gly Leu Gln Arg Arg Ile Glu Gln
65 70 75 80
Tyr Ile Ser Ala Gln Val Thr Leu Gln Gly Pro Ser Asn Pro Ser Gly
85 90 95
Ser Leu Ser Asp Gly Ser Gly Leu Gly Glu Pro Lys Phe Glu Leu Thr
100 105 110
Leu Ser Gln Phe Thr Gly Asn Trp Gly Arg Pro Gln Arg Asp Gly Pro
115 120 125
Ala Leu Arg Ala Ile Ala Leu Ile Gly Tyr Ser Lys Trp Leu Ile Asn
130 135 140
Asn Asn Tyr Gln Ser Thr Val Ser Ser Ile Ile Trp Pro Ile Val Arg
145 150 155 160
Asn Asp Leu Asn Tyr Val Ala Gln Tyr Trp Asn Gln Thr Gly Phe Asp
165 170 175
Leu Trp Glu Glu Val Asn Gly Ser Ser Phe Phe Thr Val Ala Asn Gln
180 185 190
His Arg Ala Leu Val Glu Gly Ala Thr Leu Ala Ala Thr Leu Gly Gln
195 200 205
Ser Gly Ser Thr Tyr Ser Ser Val Ala Pro Gln Ile Leu Cys Phe Leu
210 215 220
Gln Arg Phe Trp Val Ser Gly Gly Tyr Ile Asp Ser Asn Ile Asn Ser
225 230 235 240
Asn Asp Gly Arg Thr Gly Lys Asp Ala Asn Ser Leu Leu Ala Ser Ile
245 250 255
His Thr Phe Asp Pro Ser Leu Gly Cys Asp Ala Ser Thr Phe Gln Pro
260 265 270
Cys Ser Asp Lys Ala Leu Ser Asn Leu Lys Val Val Val Asp Ser Phe
275 280 285
Arg Ser Ile Tyr Gly Val Asn Lys Gly Ile Ser Ala Gly Ser Ala Val
290 295 300
Ala Ile Gly Arg Tyr Pro Glu Asp Val Tyr Phe Asn Gly Asn Pro Trp
305 310 315 320
Tyr Leu Ala Thr Phe Ala Ala Ala Glu Gln Leu Tyr Asp Ser Val Tyr
325 330 335
Val Trp Lys Lys Thr Gly Ser Ile Thr Val Thr Ser Thr Ser Leu Ala
340 345 350
Phe Phe Gln Glu Leu Val Pro Gly Val Ala Ala Gly Thr Tyr Ser Ser
355 360 365
Ser Gln Ser Thr Phe Thr Ser Ile Val Asn Ala Val Ser Thr Tyr Ala
370 375 380
Asp Gly Phe Leu Ser Glu Ala Ala Lys Tyr Val Pro Ala Asp Gly Ser
385 390 395 400
Leu Ala Glu Gln Phe Asp Arg Asn Thr Gly Thr Pro Leu Ser Ala Val
405 410 415
His Leu Thr Trp Ser Tyr Ala Ser Phe Phe Thr Ala Ala Ala Arg Arg
420 425 430
Ser Gly Val Val Pro Pro Ser Trp Ala Ser Ser Gly Ala Asn Ser Ile
435 440 445
Pro Ala Thr Cys Ser Gly Ala Ser Val Val Gly Ser Tyr Ser Ser Pro
450 455 460
Thr Ala Thr Ser Phe Pro Pro Ser Gln Thr Pro Lys Pro Gly Val Pro
465 470 475 480
Ser Gly Thr Pro Phe Thr Pro Leu Pro Cys Ala Thr Pro Thr Ser Val
485 490 495
Ala Val Thr Phe His Glu Leu Ala Thr Thr Gln Phe Gly Gln Asn Ile
500 505 510
Lys Val Ala Gly Ser Ala Pro Glu Leu Gly Asn Trp Ser Thr Ser Ala
515 520 525
Ala Ile Ala Leu Asp Ala Val Asn Tyr Ala Thr Asn His Pro Leu Trp
530 535 540
Ile Gly Ser Val Asn Leu Glu Ala Gly Asp Val Ile Glu Tyr Lys Tyr
545 550 555 560
Ile Asn Val Gly Gln Asp Gly Ser Val Thr Trp Glu Ser Asp Pro Asn
565 570 575
His Thr Tyr Thr Val Pro Ala Val Ala Cys Val Thr Glu Val Val Lys
580 585 590
Glu Asp Thr Trp Gln Ser
595
<210> 21
<211> 599
<212> PRT
<213> Hypocrea orientalis
<400> 21
Ser Val Asp Asp Phe Ile Ser Thr Glu Thr Pro Ile Ala Leu Asn Asn
1 5 10 15
Leu Leu Cys Asn Val Gly Pro Asp Gly Cys Arg Ala Phe Gly Thr Ser
20 25 30
Ala Gly Ala Val Ile Ala Ser Pro Ser Thr Ile Asp Pro Asp Tyr Tyr
35 40 45
Tyr Met Trp Thr Arg Asp Ser Ala Leu Val Phe Lys Asn Leu Val Asp
50 55 60
Arg Phe Thr Glu Thr Tyr Asp Ala Gly Leu Gln Arg Arg Ile Glu Gln
65 70 75 80
Tyr Ile Thr Ala Gln Val Thr Leu Gln Gly Leu Ser Asn Pro Ser Gly
85 90 95
Ser Leu Thr Asp Gly Ser Gly Leu Gly Glu Pro Lys Phe Glu Leu Thr
100 105 110
Leu Gln Pro Phe Thr Gly Asn Trp Gly Arg Pro Gln Arg Asp Gly Pro
115 120 125
Ala Leu Arg Ala Ile Ala Leu Ile Gly Tyr Ser Lys Trp Leu Ile Asn
130 135 140
Asn Asn Tyr Gln Ser Thr Val Ser Asn Val Ile Trp Pro Ile Val Arg
145 150 155 160
Asn Asp Leu Asn Tyr Val Ala Gln Tyr Trp Asn Gln Thr Gly Phe Asp
165 170 175
Leu Trp Glu Glu Val Lys Gly Ser Ser Phe Phe Thr Ile Ala Asn Gln
180 185 190
His Arg Ala Leu Val Glu Gly Ala Thr Leu Ala Ala Thr Leu Gly Gln
195 200 205
Ser Gly Ser Thr Tyr Ser Ser Val Ala Pro Gln Ile Leu Cys Phe Leu
210 215 220
Gln Arg Phe Trp Val Ser Ser Gly Gly Tyr Val Asp Ser Asn Ile Asn
225 230 235 240
Thr Asn Glu Gly Arg Thr Gly Lys Asp Val Asn Ser Ile Leu Thr Ser
245 250 255
Ile His Thr Leu Asp Pro Asn Leu Gly Cys Asp Ala Gly Thr Phe Gln
260 265 270
Pro Cys Ser Asp Lys Ala Leu Ser Asn Leu Lys Val Val Val Asp Ser
275 280 285
Phe Arg Ser Ile Tyr Gly Val Asn Lys Gly Ile Pro Ala Gly Ala Ala
290 295 300
Val Ala Ile Gly Arg Tyr Ala Glu Asp Val Tyr Phe Asn Gly Asn Pro
305 310 315 320
Trp Tyr Leu Ala Thr Phe Ala Ala Ala Glu Gln Leu Tyr Asp Ala Val
325 330 335
Tyr Val Trp Lys Lys Thr Gly Ser Ile Thr Val Thr Ala Thr Ser Leu
340 345 350
Ala Phe Phe Gln Glu Leu Val Pro Gly Val Ala Ala Gly Thr Tyr Ala
355 360 365
Ser Ser Ser Ser Thr Phe Thr Asn Ile Ile Asn Ala Val Ser Thr Tyr
370 375 380
Ala Asp Gly Phe Leu Ser Glu Ala Ala Lys Tyr Val Pro Ala Asp Gly
385 390 395 400
Ser Leu Ala Glu Gln Phe Asp Arg Asn Ser Gly Thr Pro Leu Ser Ala
405 410 415
Leu His Leu Thr Trp Ser Tyr Ala Ser Phe Leu Thr Ala Thr Ala Arg
420 425 430
Arg Ala Gly Ile Val Pro Pro Ser Trp Ala Asn Ser Ser Ala Ser Thr
435 440 445
Ile Pro Ser Thr Cys Ser Gly Ala Ser Val Val Gly Ser Tyr Ser Arg
450 455 460
Pro Thr Ala Thr Ser Phe Pro Pro Ser Gln Thr Pro Lys Pro Gly Val
465 470 475 480
Pro Ser Gly Thr Pro Tyr Thr Pro Leu Pro Cys Ala Thr Pro Thr Ser
485 490 495
Val Ala Val Thr Phe His Glu Leu Val Ser Thr Gln Leu Gly Gln Thr
500 505 510
Val Lys Val Ala Gly Asn Ala Pro Ala Leu Gly Asn Trp Ser Thr Ser
515 520 525
Ala Ala Val Ala Leu Asp Ala Val Asn Tyr Ala Asp Asn His Pro Leu
530 535 540
Trp Ile Gly Thr Val Asp Leu Glu Ala Gly Asp Val Val Glu Tyr Lys
545 550 555 560
Tyr Ile Asn Val Gly Gln Asp Gly Ser Val Thr Trp Glu Ser Asp Pro
565 570 575
Asn His Thr Tyr Thr Val Pro Ala Val Ala Cys Val Thr Gln Val Val
580 585 590
Lys Glu Asp Thr Trp Gln Ser
595
<210> 22
<211> 599
<212> PRT
<213> Trichoderma konilangbra
<400> 22
Ser Val Asp Asp Phe Ile Ser Thr Gln Thr Pro Ile Ala Leu Asn Asn
1 5 10 15
Leu Leu Cys Asn Val Gly Pro Asp Gly Cys Arg Ala Phe Gly Thr Ser
20 25 30
Ala Gly Ala Val Ile Ala Ser Pro Ser Thr Thr Asp Pro Asp Tyr Tyr
35 40 45
Tyr Met Trp Thr Arg Asp Ser Ala Leu Val Phe Lys Asn Leu Val Asp
50 55 60
Arg Phe Thr Glu Thr Tyr Asp Ala Gly Leu Gln Arg Arg Ile Glu Gln
65 70 75 80
Tyr Ile Ala Ala Gln Val Thr Leu Gln Gly Leu Thr Asn Pro Ser Gly
85 90 95
Ser Leu Ser Asp Gly Ser Gly Leu Gly Glu Pro Lys Phe Glu Leu Thr
100 105 110
Leu Lys Pro Phe Thr Gly Asn Trp Gly Arg Pro Gln Arg Asp Gly Pro
115 120 125
Ala Leu Arg Ala Ile Ala Leu Ile Gly Tyr Ser Lys Trp Leu Ile Asn
130 135 140
Asn Asn Tyr Gln Ser Thr Val Ser Ser Leu Ile Trp Pro Ile Val Arg
145 150 155 160
Asn Asp Leu Asn Tyr Val Ala Gln Tyr Trp Asn Gln Thr Gly Phe Asp
165 170 175
Leu Trp Glu Glu Val Asn Gly Ser Ser Phe Phe Thr Thr Ala Asn Gln
180 185 190
His Arg Ala Leu Val Glu Gly Ala Thr Leu Ala Ala Thr Leu Ser Gln
195 200 205
Pro Ala Ser Thr Tyr Ser Ser Val Ala Pro Gln Ile Leu Cys Phe Leu
210 215 220
Gln Arg Tyr Trp Val Ser Ser Gly Gly Tyr Val Asp Ser Asn Ile Asn
225 230 235 240
Thr Asn Glu Gly Arg Thr Gly Lys Asp Ala Asn Ser Ile Leu Ala Ala
245 250 255
Ile His Thr Phe Asp Pro Asn Leu Gly Arg Asp Ala Gly Thr Phe Gln
260 265 270
Pro Cys Ser Asp Lys Ala Leu Ser Asn Leu Lys Val Val Val Asp Ser
275 280 285
Phe Arg Ser Ile Tyr Gly Val Asn Lys Gly Ile Pro Ala Gly Ala Ala
290 295 300
Ala Ala Val Gly Arg Tyr Pro Glu Asp Val Tyr Phe Asn Gly Asn Pro
305 310 315 320
Trp Tyr Leu Ala Thr Phe Ala Ala Ala Glu Gln Leu Tyr Asp Ala Ile
325 330 335
Tyr Val Trp Lys Lys Thr Gly Ser Ile Thr Val Thr Ala Ile Ser Leu
340 345 350
Ala Phe Phe Gln Glu Leu Val Pro Gly Val Ala Ala Gly Thr Tyr Ser
355 360 365
Ser Ser Gln Ser Thr Phe Thr Asn Ile Ile Asn Ala Val Ser Thr Tyr
370 375 380
Ala Asp Gly Phe Ile Ser Glu Ala Ala Lys Tyr Val Pro Ala Asp Gly
385 390 395 400
Ser Leu Ala Glu Gln Phe Asp Arg Asn Asn Gly Thr Pro Leu Ser Ala
405 410 415
Leu His Leu Thr Trp Ser Tyr Ala Ser Phe Leu Thr Ala Thr Ala Arg
420 425 430
Arg Ala Gly Ile Val Pro Pro Ser Trp Ala Asn Ser Ser Ala Ser Ser
435 440 445
Ile Pro Ser Thr Cys Ser Gly Ala Ser Val Val Gly Ser Tyr Ser Arg
450 455 460
Pro Thr Ala Thr Ser Phe Pro Pro Ser Gln Thr Pro Lys Pro Gly Val
465 470 475 480
Pro Ser Gly Thr Pro Tyr Thr Pro Leu Pro Cys Ala Thr Pro Ala Ser
485 490 495
Val Ala Val Thr Phe His Glu Leu Val Ser Thr Gln Leu Gly Gln Thr
500 505 510
Val Lys Val Ala Gly Ser Ala Pro Ala Leu Gly Asn Trp Ser Thr Ser
515 520 525
Ala Ala Val Ala Leu Asp Ala Val Asn Tyr Ala Asp Asn His Pro Leu
530 535 540
Trp Ile Gly Ser Val Glu Leu Glu Ala Gly Asp Val Val Glu Tyr Lys
545 550 555 560
Tyr Ile Asn Val Gly Gln Asp Gly Ser Val Thr Trp Glu Ser Asp Pro
565 570 575
Asn His Thr Tyr Thr Val Pro Ala Val Ala Cys Val Thr Gln Val Val
580 585 590
Lys Glu Asp Thr Trp Gln Ser
595
<210> 23
<211> 22
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Праймер
<400> 23
atgcccgcct tcgccatgga cc 22
<210> 24
<211> 22
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Праймер
<400> 24
ttacgactgc caggtgtcct cc 22
<210> 25
<211> 22
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Праймер
<400> 25
atgcacgtcc tgtcgactgc gg 22
<210> 26
<211> 640
<212> PRT
<213> Aspergillus niger
<400> 26
Met Ser Phe Arg Ser Leu Leu Ala Leu Ser Gly Leu Val Cys Thr Gly
1 5 10 15
Leu Ala Asn Val Ile Ser Lys Arg Ala Thr Leu Asp Ser Trp Leu Ser
20 25 30
Asn Glu Ala Thr Val Ala Arg Thr Ala Ile Leu Asn Asn Ile Gly Ala
35 40 45
Asp Gly Ala Trp Val Ser Gly Ala Asp Ser Gly Ile Val Val Ala Ser
50 55 60
Pro Ser Thr Asp Asn Pro Asp Tyr Phe Tyr Thr Trp Thr Arg Asp Ser
65 70 75 80
Gly Leu Val Leu Lys Thr Leu Val Asp Leu Phe Arg Asn Gly Asp Thr
85 90 95
Ser Leu Leu Ser Thr Ile Glu Asn Tyr Ile Ser Ala Gln Ala Ile Val
100 105 110
Gln Gly Ile Ser Asn Pro Ser Gly Asp Leu Ser Ser Gly Ala Gly Leu
115 120 125
Gly Glu Pro Lys Phe Asn Val Asp Glu Thr Ala Tyr Thr Gly Ser Trp
130 135 140
Gly Arg Pro Gln Arg Asp Gly Pro Ala Leu Arg Ala Thr Ala Met Ile
145 150 155 160
Gly Phe Gly Gln Trp Leu Leu Asp Asn Gly Tyr Thr Ser Thr Ala Thr
165 170 175
Asp Ile Val Trp Pro Leu Val Arg Asn Asp Leu Ser Tyr Val Ala Gln
180 185 190
Tyr Trp Asn Gln Thr Gly Tyr Asp Leu Trp Glu Glu Val Asn Gly Ser
195 200 205
Ser Phe Phe Thr Ile Ala Val Gln His Arg Ala Leu Val Glu Gly Ser
210 215 220
Ala Phe Ala Thr Ala Val Gly Ser Ser Cys Ser Trp Cys Asp Ser Gln
225 230 235 240
Ala Pro Glu Ile Leu Cys Tyr Leu Gln Ser Phe Trp Thr Gly Ser Phe
245 250 255
Ile Leu Ala Asn Phe Asp Ser Ser Arg Ser Gly Lys Asp Ala Asn Thr
260 265 270
Leu Leu Gly Ser Ile His Thr Phe Asp Pro Glu Ala Ala Cys Asp Asp
275 280 285
Ser Thr Phe Gln Pro Cys Ser Pro Arg Ala Leu Ala Asn His Lys Glu
290 295 300
Val Val Asp Ser Phe Arg Ser Ile Tyr Thr Leu Asn Asp Gly Leu Ser
305 310 315 320
Asp Ser Glu Ala Val Ala Val Gly Arg Tyr Pro Glu Asp Thr Tyr Tyr
325 330 335
Asn Gly Asn Pro Trp Phe Leu Cys Thr Leu Ala Ala Ala Glu Gln Leu
340 345 350
Tyr Asp Ala Leu Tyr Gln Trp Asp Lys Gln Gly Ser Leu Glu Val Thr
355 360 365
Asp Val Ser Leu Asp Phe Phe Lys Ala Leu Tyr Ser Asp Ala Ala Thr
370 375 380
Gly Thr Tyr Ser Ser Ser Ser Ser Thr Tyr Ser Ser Ile Val Asp Ala
385 390 395 400
Val Lys Thr Phe Ala Asp Gly Phe Val Ser Ile Val Glu Thr His Ala
405 410 415
Ala Ser Asn Gly Ser Met Ser Glu Gln Tyr Asp Lys Ser Asp Gly Glu
420 425 430
Gln Leu Ser Ala Arg Asp Leu Thr Trp Ser Tyr Ala Ala Leu Leu Thr
435 440 445
Ala Asn Asn Arg Arg Asn Ser Val Val Pro Ala Ser Trp Gly Glu Thr
450 455 460
Ser Ala Ser Ser Val Pro Gly Thr Cys Ala Ala Thr Ser Ala Ile Gly
465 470 475 480
Thr Tyr Ser Ser Val Thr Val Thr Ser Trp Pro Ser Ile Val Ala Thr
485 490 495
Gly Gly Thr Thr Thr Thr Ala Thr Pro Thr Gly Ser Gly Ser Val Thr
500 505 510
Ser Thr Ser Lys Thr Thr Ala Thr Ala Ser Lys Thr Ser Thr Ser Thr
515 520 525
Ser Ser Thr Ser Cys Thr Thr Pro Thr Ala Val Ala Val Thr Phe Asp
530 535 540
Leu Thr Ala Thr Thr Thr Tyr Gly Glu Asn Ile Tyr Leu Val Gly Ser
545 550 555 560
Ile Ser Gln Leu Gly Asp Trp Glu Thr Ser Asp Gly Ile Ala Leu Ser
565 570 575
Ala Asp Lys Tyr Thr Ser Ser Asp Pro Leu Trp Tyr Val Thr Val Thr
580 585 590
Leu Pro Ala Gly Glu Ser Phe Glu Tyr Lys Phe Ile Arg Ile Glu Ser
595 600 605
Asp Asp Ser Val Glu Trp Glu Ser Asp Pro Asn Arg Glu Tyr Thr Val
610 615 620
Pro Gln Ala Cys Gly Thr Ser Thr Ala Thr Val Thr Asp Thr Trp Arg
625 630 635 640
<210> 27
<211> 640
<212> PRT
<213> Aspergillus kawachi
<400> 27
Met Arg Val Ser Thr Ser Ser Ile Ala Leu Ala Val Ser Leu Phe Gly
1 5 10 15
Lys Leu Ala Leu Gly Leu Ser Ala Ala Glu Trp Arg Thr Gln Ser Ile
20 25 30
Tyr Phe Leu Leu Thr Asp Arg Phe Gly Arg Thr Asp Asn Ser Thr Thr
35 40 45
Ala Thr Cys Asn Thr Gly Asp Gln Ile Tyr Cys Gly Gly Ser Trp Gln
50 55 60
Gly Ile Ile Asn His Leu Asp Tyr Ile Gln Gly Met Gly Phe Thr Ala
65 70 75 80
Ile Trp Ile Ser Pro Ile Thr Glu Gln Leu Pro Gln Asp Thr Ser Asp
85 90 95
Gly Glu Ala Tyr His Gly Tyr Trp Gln Gln Lys Ile Tyr Asn Val Asn
100 105 110
Ser Asn Phe Gly Thr Ala Asp Asp Leu Lys Ser Leu Ser Asp Ala Leu
115 120 125
His Ala Arg Gly Met Tyr Leu Met Val Asp Val Val Pro Asn His Met
130 135 140
Gly Tyr Ala Gly Asn Gly Asn Asp Val Asp Tyr Ser Val Phe Asp Pro
145 150 155 160
Phe Asp Ser Ser Ser Tyr Phe His Pro Tyr Cys Leu Ile Thr Asp Trp
165 170 175
Asp Asn Leu Thr Met Val Gln Asp Cys Trp Glu Gly Asp Thr Ile Val
180 185 190
Ser Leu Pro Asp Leu Asn Thr Thr Glu Thr Ala Val Arg Thr Ile Trp
195 200 205
Tyr Asp Trp Val Ala Asp Leu Val Ser Asn Tyr Ser Val Asp Gly Leu
210 215 220
Arg Ile Asp Ser Val Glu Glu Val Glu Pro Asp Phe Phe Pro Gly Tyr
225 230 235 240
Gln Glu Ala Ala Gly Val Tyr Cys Val Gly Glu Val Asp Asn Gly Asn
245 250 255
Pro Ala Leu Asp Cys Pro Tyr Gln Lys Tyr Leu Asp Gly Val Leu Asn
260 265 270
Tyr Pro Ile Tyr Trp Gln Leu Leu Tyr Ala Phe Glu Ser Ser Ser Gly
275 280 285
Ser Ile Ser Asn Leu Tyr Asn Met Ile Lys Ser Val Ala Ser Asp Cys
290 295 300
Ser Asp Pro Thr Leu Leu Gly Asn Phe Ile Glu Asn His Asp Asn Pro
305 310 315 320
Arg Phe Ala Ser Tyr Thr Ser Asp Tyr Ser Gln Ala Lys Asn Val Leu
325 330 335
Ser Tyr Ile Phe Leu Ser Asp Gly Ile Pro Ile Val Tyr Ala Gly Glu
340 345 350
Glu Gln His Tyr Ser Gly Gly Asp Val Pro Tyr Asn Arg Glu Ala Thr
355 360 365
Trp Leu Ser Gly Tyr Asp Thr Ser Ala Glu Leu Tyr Thr Trp Ile Ala
370 375 380
Thr Thr Asn Ala Ile Arg Lys Leu Ala Ile Ser Ala Asp Ser Asp Tyr
385 390 395 400
Ile Thr Tyr Ala Asn Asp Pro Ile Tyr Thr Asp Ser Asn Thr Ile Ala
405 410 415
Met Arg Lys Gly Thr Ser Gly Ser Gln Ile Ile Thr Val Leu Ser Asn
420 425 430
Lys Gly Ser Ser Gly Ser Ser Tyr Thr Leu Thr Leu Ser Gly Ser Gly
435 440 445
Tyr Thr Ser Gly Thr Lys Leu Ile Glu Ala Tyr Thr Cys Thr Ser Val
450 455 460
Thr Val Asp Ser Asn Gly Asp Ile Pro Val Pro Met Ala Ser Gly Leu
465 470 475 480
Pro Arg Val Leu Leu Pro Ala Ser Val Val Asp Ser Ser Ser Leu Cys
485 490 495
Gly Gly Ser Gly Asn Thr Thr Thr Thr Thr Thr Ala Ala Thr Ser Thr
500 505 510
Ser Lys Ala Thr Thr Ser Ser Ser Ser Ser Ser Ala Ala Ala Thr Thr
515 520 525
Ser Ser Ser Cys Thr Ala Thr Ser Thr Thr Leu Pro Ile Thr Phe Glu
530 535 540
Glu Leu Val Thr Thr Thr Tyr Gly Glu Glu Val Tyr Leu Ser Gly Ser
545 550 555 560
Ile Ser Gln Leu Gly Glu Trp Asp Thr Ser Asp Ala Val Lys Leu Ser
565 570 575
Ala Asp Asp Tyr Thr Ser Ser Asn Pro Glu Trp Ser Val Thr Val Ser
580 585 590
Leu Pro Val Gly Thr Thr Phe Glu Tyr Lys Phe Ile Lys Val Asp Glu
595 600 605
Gly Gly Ser Val Thr Trp Glu Ser Asp Pro Asn Arg Glu Tyr Thr Val
610 615 620
Pro Glu Cys Gly Ser Gly Ser Gly Glu Thr Val Val Asp Thr Trp Arg
625 630 635 640
<210> 28
<211> 2088
<212> ДНК
<213> Trichoderma sp.
<400> 28
atgcatgtct tgtcaacggc cgtcctgctc ggctcggttg ccgtccaaaa ggtcctggga 60
agacctggcg catccgacat tacaaaacga gccgttactg acttcatcaa ctcggaaact 120
cccattgccc tgaacaatct gatttgcaat gttggtcctg acggatgccg tgcttttggc 180
acatcgatcg gcgctgtagt tgcgtcgcca agcacaactg acccagactg taagctagtt 240
tttgcattat acttccacta tcgtatatac aatctatata tacagtgcgc taacacgaat 300
ctaaacaaag acttttacat gtggactcga gatagtgctc ttgttttcaa gacgcttgtt 360
gatcggttca cacagaacta cgatgcaggc ctgcagcgcc gcatcgagca gtacattgct 420
gctcaggtca ctcttcaggg catctcaaac ccatctggtt ccctctcaga cgggtctggc 480
cttggcgagc ccaagttcga gcttaccttg agccagttca ctggcaactg gggccgcccg 540
cagcgtgatg gtccagctct tcgagccatt gccttgattg gctattcaaa gtggctcatt 600
agcaacaact accagtcgac agtgtcgaac atcatttggc ccattgtgcg aaatgatctc 660
aactacgttg cccagtactg gtcagtgatt gcttgttttc ttgcccgcta ttcactggtt 720
ctttgctaac cttgactttt aggaaccaaa ctggatttga cctgtgggag gaggtcaacg 780
gcagctcatt cttcgctgta gccaaccagc accgagcact tgttgagggt gctacccttg 840
ccactactct tggccagtcg ggaagcagct attccactgt tgctcctcag attctctgct 900
tccttcaaaa gttctggtcg ccatccggat atgtcatctc caacagtaag ctatcaatgc 960
agaccaattt tgtagatgaa tgcgtatgct aacactagtc ggcgcagtca acagcaacga 1020
cggcaggact ggaaaggatt ccaactccat tcttacatct attcacactt tcgatcccag 1080
cattggctgc gatgccgcca ctttccagcc ttgcagtgac aaggctcttt caaacctcaa 1140
ggtctacgtc gactccttcc gctccatcta tggcgtcaac tcgggcattc ctgctggcac 1200
tgctgttgcc gttggtagat acccagagga cgtctacttt aacggaaacc cctggtatct 1260
ttctaccttt gctgttgctg agcagctgta cgacgccctg tatgtctgga agaagactgg 1320
ctccatcacc gtcacttcca cctctctggc ttcttccaag agctcgtccc cagcgtgaca 1380
gccggaacct acgccagcag ctcgtctacc ttcaccagca tcgtcaacgc cgtatccacc 1440
tacgccgatg gattcgtcag cgaggcggcc aagtacgtcc cctctgatgg ttctctctcc 1500
gagcagttcg acaagaacac cggcactcct ctctccgccg ttcacctgac ctggtcgtat 1560
gcctccttcc tgactgccac gacccgtcgc gctggcattg tccctccttc atggattagc 1620
agcggcgcca acaccgttcc ctcgtcctgc tccggcacga cagtggctgg ttcctactca 1680
agtcccacag ccacgtcatt ccctccgtca cagactccca agactgcggc tactggtacc 1740
agcttcactc ccattgcctg cgctacccca acttccgtgg ctgtgacctt ccacgagctt 1800
gctacgaccg tccccggcca gacaatcaag gtcgttggca atgcccaggc cctgggcaac 1860
tggagcacca gcgccggtgt tgccctgaac gccgtcaact gtgcttccaa ccaccctctg 1920
tggatcggac ccgtcaatct caaggccgga gacgtcgtcg agtacaagta tatcaacgtg 1980
ggctcagacg gctccgtgac ttgggaggcc gaccccaacc acacttacac tgtccctgca 2040
gtggcctgtg ttaccgcagt tgttaaggag gacacctggc agtcgtaa 2088
<210> 29
<211> 627
<212> PRT
<213> Trichoderma sp.
<400> 29
Met His Val Leu Ser Thr Ala Val Leu Leu Gly Ser Val Ala Val Gln
1 5 10 15
Lys Val Leu Gly Arg Pro Gly Ala Ser Asp Ile Thr Lys Arg Ala Val
20 25 30
Thr Asp Phe Ile Asn Ser Glu Thr Pro Ile Ala Leu Asn Asn Leu Ile
35 40 45
Cys Asn Val Gly Pro Asp Gly Cys Arg Ala Phe Gly Thr Ser Ile Gly
50 55 60
Ala Val Val Ala Ser Pro Ser Thr Thr Asp Pro Asp Tyr Phe Tyr Met
65 70 75 80
Trp Thr Arg Asp Ser Ala Leu Val Phe Lys Thr Leu Val Asp Arg Phe
85 90 95
Thr Gln Lys Tyr Asp Ala Gly Leu Gln Arg Arg Ile Glu Gln Tyr Ile
100 105 110
Ala Ala Gln Val Thr Leu Gln Gly Ile Ser Asn Pro Ser Gly Ser Leu
115 120 125
Ser Asp Gly Ser Gly Leu Gly Glu Pro Lys Phe Glu Leu Thr Leu Ser
130 135 140
Gln Phe Thr Gly Asn Trp Gly Arg Pro Gln Arg Asp Gly Pro Ala Leu
145 150 155 160
Arg Ala Ile Ala Leu Ile Gly Tyr Ser Lys Trp Leu Ile Ser Asn Asn
165 170 175
Tyr Gln Ser Thr Val Ser Asn Ile Ile Trp Pro Ile Val Arg Asn Asp
180 185 190
Leu Asn Tyr Val Ala Gln Tyr Trp Asn Gln Thr Gly Phe Asp Leu Trp
195 200 205
Glu Glu Val Asn Gly Ser Ser Phe Phe Ala Val Ala Asn Gln His Arg
210 215 220
Ala Leu Val Glu Gly Ala Thr Leu Ala Thr Thr Leu Gly Gln Ser Gly
225 230 235 240
Ser Ser Tyr Ser Thr Val Ala Pro Gln Ile Leu Cys Phe Leu Gln Lys
245 250 255
Phe Trp Ser Pro Ser Gly Tyr Val Ile Ser Asn Ile Asn Ser Asn Asp
260 265 270
Gly Arg Thr Gly Lys Asp Ser Asn Ser Ile Leu Thr Ser Ile His Thr
275 280 285
Phe Asp Pro Ser Ile Gly Cys Asp Ala Ala Thr Phe Gln Pro Cys Ser
290 295 300
Asp Lys Ala Leu Ser Asn Leu Lys Val Tyr Val Asp Ser Phe Arg Ser
305 310 315 320
Ile Tyr Gly Val Asn Ser Gly Ile Pro Ala Gly Thr Ala Val Ala Val
325 330 335
Gly Arg Tyr Pro Glu Asp Val Tyr Phe Asn Gly Asn Pro Trp Tyr Leu
340 345 350
Ser Thr Phe Ala Val Ala Glu Gln Leu Tyr Asp Ala Leu Tyr Val Trp
355 360 365
Lys Lys Thr Gly Ser Ile Thr Val Thr Ser Thr Ser Leu Ala Phe Phe
370 375 380
Gln Glu Leu Val Pro Ser Val Thr Ala Gly Thr Tyr Ala Ser Ser Ser
385 390 395 400
Ser Thr Phe Thr Ser Ile Val Asn Ala Val Ser Thr Tyr Ala Asp Gly
405 410 415
Phe Val Ser Glu Ala Ala Lys Tyr Val Pro Ser Asp Gly Ser Leu Ser
420 425 430
Glu Gln Phe Asp Lys Asn Thr Gly Thr Pro Leu Ser Ala Val His Leu
435 440 445
Thr Trp Ser Tyr Ala Ser Phe Leu Thr Ala Thr Thr Arg Arg Ala Gly
450 455 460
Ile Val Pro Pro Ser Trp Ile Ser Ser Gly Ala Asn Thr Val Pro Ser
465 470 475 480
Ser Cys Ser Gly Thr Thr Val Ala Gly Ser Tyr Ser Ser Pro Thr Ala
485 490 495
Thr Ser Phe Pro Pro Ser Gln Thr Pro Lys Thr Ala Ala Thr Gly Thr
500 505 510
Ser Phe Thr Pro Ile Ala Cys Ala Thr Pro Thr Ser Val Ala Val Thr
515 520 525
Phe His Glu Leu Ala Thr Thr Val Pro Gly Gln Thr Ile Lys Val Val
530 535 540
Gly Asn Ala Gln Ala Leu Gly Asn Trp Ser Thr Ser Ala Gly Val Ala
545 550 555 560
Leu Asn Ala Val Asn Cys Ala Ser Asn His Pro Leu Trp Ile Gly Pro
565 570 575
Val Asn Leu Lys Ala Gly Asp Val Val Glu Tyr Lys Tyr Ile Asn Val
580 585 590
Gly Ser Asp Gly Ser Val Thr Trp Glu Ala Asp Pro Asn His Thr Tyr
595 600 605
Thr Val Pro Ala Val Ala Cys Val Thr Ala Val Val Lys Glu Asp Thr
610 615 620
Trp Gln Ser
625
<210> 30
<211> 2141
<212> ДНК
<213> Trichoderma harzianum
<400> 30
atgcatgtgc tgtcgactgc tgtgctgctt ggctcagttg ccgtccaaaa ggttctggga 60
aggccaggat cgaacggcct gtccggcgtc acaaaacgat ccgtggatga ctccatcaac 120
acacagactc ccattgcact aaacaacctc ctttgcaatg ttggccctga tgggtgccgt 180
gcctttggta catcggccgg tgctgtgatt gcatctccga gcacaactga cccagactgt 240
aagtttgact tatagcggca tattcctgac atgtcaaatt tcacatacta atacgagggt 300
aattgatcag actactacat gtggacgcga gacagtgctc ttgtcttcaa gaacattgta 360
gaccgcttca ctgagcagta tgatgctggc ctgcagcgcc gcatcgagca gtatatttct 420
gcccaggtca ctcttcaggg gatctcaaac ccctctggtt ctctctcgga tgggtctggt 480
cttggtgaac ccaagtttga gttgaccttg agccagttca ctggcaactg gggtcgcccg 540
cagcgcgatg gcccagctct ccgagccatt gccttgattg gctattcaaa gtggctcatc 600
aacaacaact accagtcaac ggtgtcaaac atcatctggc ccattgtgcg gaatgatctc 660
aactatgttg cccagtactg gttagtacaa gctcgctgtc tcttcgtctt gtttatgact 720
aattctaaca ccttcacctt aggaatcaaa ccggtttcga cctgtgggag gaagtcaatg 780
gtagttcgtt ctttaccgtt gccaaccagc accgaggtat gtatcaatat ctcatgtgtt 840
tttagttgtc aatgctgacg agtcccccag ctcttgttga gggcgccaca cttgccgcta 900
ccctcggcca gtcgggaagc acctattcct ctgttgctcc tcagatcctg tgcttcctcc 960
aaagattctg ggtgtcgggt ggatacattg actccaacag taagtacacc agcaccacat 1020
gctttgatga agagcgatac taaacagctt gtcatagtca acaccaacga gggcaggact 1080
ggaaaagatg ccaactctct tctcgcatct atccacacgt tcgatcccag ccttggctgt 1140
gacgcctcta ccttccagcc ttgcagtgac aaggctctct ccaacctcaa ggttgttgtg 1200
gactccttcc gctccatcta cagtgtcaac aagggcattc ccgctggcgc tgctgttgcc 1260
gtcggcagat accccgaaga cgtgtacttt aacggaaacc cctggtatct cgccacgttc 1320
gctgctgccg agcaattgta cgactccgtc tatgtctgga agaagacagg ctccatcacg 1380
gtgacttcca cttctttggc cttcttccag gagctcgttc ccggcgtcgc ggctggaact 1440
tactccagca gccagtctac ctttacgagc atcatcaacg ccgtctcgac atatgctgat 1500
ggattcctca gcgaggctgc caagtacgtc cccgctgatg gttcgctcgc cgagcagttc 1560
gatcgcaaca ccggcacgcc tctgtcagcc gttcacctga cctggtcgta cgcctcgttt 1620
ctcaccgccg cggcccgtcg ggctggcgtt gtgcccccct cgtgggccag cagcggcgct 1680
aactcagtcc cttcaagctg ctcgggagct tctgtggttg gatcctactc gcgtcctaca 1740
gccacgtcat tcccaccgtc gcagaccccc aagcctggcg ctccttctgg tgctcccttc 1800
actcccattc cctgtgctac cccggcctcc gttgccgtta ccttccacga gcttgccaca 1860
acccaatttg gccagacaat caaggtcgct ggtagcgccc ccgagctggg caactggagc 1920
acgagcgcgg ccattgctct ggatgccgtc aactatgcca ctaaccatcc cctgtggatt 1980
ggatcggtca atctggaggc cggagacgtc atcgagtaca agtacatcag cgtgggccag 2040
gatggttccg tcacctggga gagcgacccc aaccacacct acactgttcc tgcggtggcc 2100
tgtgtcaccg aggtggttaa ggaggacacc tggcagtcgt a 2141
<210> 31
<211> 631
<212> PRT
<213> Trichoderma harzianum
<400> 31
Met His Val Leu Ser Thr Ala Val Leu Leu Gly Ser Val Ala Val Gln
1 5 10 15
Lys Val Leu Gly Arg Pro Gly Ser Asn Gly Leu Ser Gly Val Thr Lys
20 25 30
Arg Ser Val Asp Asp Ser Ile Asn Thr Gln Thr Pro Ile Ala Leu Asn
35 40 45
Asn Leu Leu Cys Asn Val Gly Pro Asp Gly Cys Arg Ala Phe Gly Thr
50 55 60
Ser Ala Gly Ala Val Ile Ala Ser Pro Ser Thr Thr Asp Pro Asp Tyr
65 70 75 80
Tyr Tyr Met Trp Thr Arg Asp Ser Ala Leu Val Phe Lys Asn Ile Val
85 90 95
Asp Arg Phe Thr Glu Gln Tyr Asp Ala Gly Leu Gln Arg Arg Ile Glu
100 105 110
Gln Tyr Ile Ser Ala Gln Val Thr Leu Gln Gly Ile Ser Asn Pro Ser
115 120 125
Gly Ser Leu Ser Asp Gly Ser Gly Leu Gly Glu Pro Lys Phe Glu Leu
130 135 140
Thr Leu Ser Gln Phe Thr Gly Asn Trp Gly Arg Pro Gln Arg Asp Gly
145 150 155 160
Pro Ala Leu Arg Ala Ile Ala Leu Ile Gly Tyr Ser Lys Trp Leu Ile
165 170 175
Asn Asn Asn Tyr Gln Ser Thr Val Ser Asn Ile Ile Trp Pro Ile Val
180 185 190
Arg Asn Asp Leu Asn Tyr Val Ala Gln Tyr Trp Asn Gln Thr Gly Phe
195 200 205
Asp Leu Trp Glu Glu Val Asn Gly Ser Ser Phe Phe Thr Val Ala Asn
210 215 220
Gln His Arg Ala Leu Val Glu Gly Ala Thr Leu Ala Ala Thr Leu Gly
225 230 235 240
Gln Ser Gly Ser Thr Tyr Ser Ser Val Ala Pro Gln Ile Leu Cys Phe
245 250 255
Leu Gln Arg Phe Trp Val Ser Gly Gly Tyr Ile Asp Ser Asn Ile Asn
260 265 270
Thr Asn Glu Gly Arg Thr Gly Lys Asp Ala Asn Ser Leu Leu Ala Ser
275 280 285
Ile His Thr Phe Asp Pro Ser Leu Gly Cys Asp Ala Ser Thr Phe Gln
290 295 300
Pro Cys Ser Asp Lys Ala Leu Ser Asn Leu Lys Val Val Val Asp Ser
305 310 315 320
Phe Arg Ser Ile Tyr Ser Val Asn Lys Gly Ile Pro Ala Gly Ala Ala
325 330 335
Val Ala Val Gly Arg Tyr Pro Glu Asp Val Tyr Phe Asn Gly Asn Pro
340 345 350
Trp Tyr Leu Ala Thr Phe Ala Ala Ala Glu Gln Leu Tyr Asp Ser Val
355 360 365
Tyr Val Trp Lys Lys Thr Gly Ser Ile Thr Val Thr Ser Thr Ser Leu
370 375 380
Ala Phe Phe Gln Glu Leu Val Pro Gly Val Ala Ala Gly Thr Tyr Ser
385 390 395 400
Ser Ser Gln Ser Thr Phe Thr Ser Ile Ile Asn Ala Val Ser Thr Tyr
405 410 415
Ala Asp Gly Phe Leu Ser Glu Ala Ala Lys Tyr Val Pro Ala Asp Gly
420 425 430
Ser Leu Ala Glu Gln Phe Asp Arg Asn Thr Gly Thr Pro Leu Ser Ala
435 440 445
Val His Leu Thr Trp Ser Tyr Ala Ser Phe Leu Thr Ala Ala Ala Arg
450 455 460
Arg Ala Gly Val Val Pro Pro Ser Trp Ala Ser Ser Gly Ala Asn Ser
465 470 475 480
Val Pro Ser Ser Cys Ser Gly Ala Ser Val Val Gly Ser Tyr Ser Arg
485 490 495
Pro Thr Ala Thr Ser Phe Pro Pro Ser Gln Thr Pro Lys Pro Gly Ala
500 505 510
Pro Ser Gly Ala Pro Phe Thr Pro Ile Pro Cys Ala Thr Pro Ala Ser
515 520 525
Val Ala Val Thr Phe His Glu Leu Ala Thr Thr Gln Phe Gly Gln Thr
530 535 540
Ile Lys Val Ala Gly Ser Ala Pro Glu Leu Gly Asn Trp Ser Thr Ser
545 550 555 560
Ala Ala Ile Ala Leu Asp Ala Val Asn Tyr Ala Thr Asn His Pro Leu
565 570 575
Trp Ile Gly Ser Val Asn Leu Glu Ala Gly Asp Val Ile Glu Tyr Lys
580 585 590
Tyr Ile Ser Val Gly Gln Asp Gly Ser Val Thr Trp Glu Ser Asp Pro
595 600 605
Asn His Thr Tyr Thr Val Pro Ala Val Ala Cys Val Thr Glu Val Val
610 615 620
Lys Glu Asp Thr Trp Gln Ser
625 630
<210> 32
<211> 2131
<212> ДНК
<213> Trichoderma longibrachiatum
<400> 32
atgcacgtcc tgtcgactgc ggtgctgctc ggttccgttg ccgttcagaa ggtcctggga 60
aggccaggat caagcggtct atctgacgta accaagagat ctgttgacga cttcatcagc 120
accgagactc ctattgcact gaacaacctt ctctgcaatg ttggtcctga tggatgtcgt 180
gcatttggca catcagctgg tgcggtgatt gcatctccca gcacaattga cccggactgt 240
aagtgtatca ataccgttga tctatgttta tcgcatgctg agacggggac agactattac 300
atgtggacgc gagacagcgc tcttgtcttc aagaacctcg tcgaccgctt caccgaaacg 360
tacgatgctg gcctgcagcg ccgcattgag cagtacatca ctgcccaggt cactctccag 420
ggcctctcca acccatcggg ttcccttacg gacggatctg gcctgggcga gcccaagttt 480
gagctgaccc tgaagccatt caccggcaac tggggtcgac cgcagcgcga cggcccagct 540
ctgcgagccg ttgccttgat tggatactcc aagtggctca tcaacaacaa ctatcagtca 600
actgtgtcca acgtcatctg gccgattgtg cgcaacgacc tcaactacgt tgctcagtac 660
tggttagtga ttacttgctc ttgaattact gcttgcatct gacctcttta tcgtaggaac 720
cagacyggct ttgacctgtg ggaggaagtg aatggaagct cgttctttac catggccaac 780
cagcaccgag gtatgaagca caacgtctat actcgccgtc attacatgtg agcattactg 840
accggctatc cagcacttgt cgagggtgct actcttgctg ccactcttgg ccagtcggga 900
agcacttatt catctgttgc tccccagatc ttgtgcttcc tccaacgatt ctgggtgtcg 960
tcgggcggat atgtcgactc caacagtatg tcttccacgg ctcgtatgat tgttgacaat 1020
gacaagtact aacagctcgc ttctagtcaa caccaacgag ggcaggactg gcaaggatgt 1080
caactccgtt ctgacttcca tccacacctt tgatcccaac cttggctgtg atgcagccac 1140
cttccagcca tgcagtgaca aggcgctctc caatctcaag gttgttgtcg actccttccg 1200
ctccatctac ggcgtgaaca agggcattcc tgccggtgct gccgtcgcca ttggccgata 1260
tgcagaggat gtgtacttca acggtaaccc ttggtatctt gccacgtttg ctgccgccga 1320
acagctgtac gatgccatct atgtctggaa gaagacgggc tctatcacgg ttactgccac 1380
ctccctggcc ttcttccagg agcttgttcc cggcgtggcg gccgggacct acgccagcag 1440
ctcgtcgacc tttacgaaca tcatcaacgc cgtctcgaca tacgccgatg gcttcctcag 1500
cgaggcagcc aagtacgttc ccgccgacgg ttcgctggcc gagcagtttg accgcaacag 1560
cggcactccg ctgtccgccc ttcacctgac gtggtcgtac gcctcgttcc tgacagccac 1620
ggcccgtcgg gctggcatcg tgcccccctc gtgggcaaac agcagcgcca gcacgatccc 1680
ctccacgtgc tccggcgcgt ccgtggtcgg atcctactcg cgtcccacag ccacgtcatt 1740
ccctccgtcg cagacgccca agcctggcgt tccctccggt acgccctaca ctcccctgcc 1800
ctgcgccacc ccaacgtccg tggccgtcac cttccacgag ctcgtgtcga cacagtttgg 1860
ccagacggtc aaggtcgcgg gcaacgctcc ggccctcggc aactggagcg caagcgccgc 1920
cgtggctctc gatgccatca actatgccga caaccacccg ctgtggatcg gaacggtcga 1980
cctcgaggct ggggatgtcg tcgagtacaa gtacatcaat gtcggccagg atggctccgt 2040
gacctgggag agtgacccca accacactta cacggttcct gcggtggcct gtgtgacgca 2100
ggttgtcaag gaggacacct ggcagtcgta a 2131
<210> 33
<211> 632
<212> PRT
<213> Trichoderma longibrachiatum
<400> 33
Met His Val Leu Ser Thr Ala Val Leu Leu Gly Ser Val Ala Val Gln
1 5 10 15
Lys Val Leu Gly Arg Pro Gly Ser Ser Gly Leu Ser Asp Val Thr Lys
20 25 30
Arg Ser Val Asp Asp Phe Ile Ser Thr Glu Thr Pro Ile Ala Leu Asn
35 40 45
Asn Leu Leu Cys Asn Val Gly Pro Asp Gly Cys Arg Ala Phe Gly Thr
50 55 60
Ser Ala Gly Ala Val Ile Ala Ser Pro Ser Thr Ile Asp Pro Asp Tyr
65 70 75 80
Tyr Tyr Met Trp Thr Arg Asp Ser Ala Leu Val Phe Lys Asn Leu Val
85 90 95
Asp Arg Phe Thr Glu Thr Tyr Asp Ala Gly Leu Gln Arg Arg Ile Glu
100 105 110
Gln Tyr Ile Thr Ala Gln Val Thr Leu Gln Gly Leu Ser Asn Pro Ser
115 120 125
Gly Ser Leu Thr Asp Gly Ser Gly Leu Gly Glu Pro Lys Phe Glu Leu
130 135 140
Thr Leu Lys Pro Phe Thr Gly Asn Trp Gly Arg Pro Gln Arg Asp Gly
145 150 155 160
Pro Ala Leu Arg Ala Val Ala Leu Ile Gly Tyr Ser Lys Trp Leu Ile
165 170 175
Asn Asn Asn Tyr Gln Ser Thr Val Ser Asn Val Ile Trp Pro Ile Val
180 185 190
Arg Asn Asp Leu Asn Tyr Val Ala Gln Tyr Trp Asn Gln Thr Gly Phe
195 200 205
Asp Leu Trp Glu Glu Val Asn Gly Ser Ser Phe Phe Thr Met Ala Asn
210 215 220
Gln His Arg Ala Leu Val Glu Gly Ala Thr Leu Ala Ala Thr Leu Gly
225 230 235 240
Gln Ser Gly Ser Thr Tyr Ser Ser Val Ala Pro Gln Ile Leu Cys Phe
245 250 255
Leu Gln Arg Phe Trp Val Ser Ser Gly Gly Tyr Val Asp Ser Asn Ile
260 265 270
Asn Thr Asn Glu Gly Arg Thr Gly Lys Asp Val Asn Ser Val Leu Thr
275 280 285
Ser Ile His Thr Phe Asp Pro Asn Leu Gly Cys Asp Ala Ala Thr Phe
290 295 300
Gln Pro Cys Ser Asp Lys Ala Leu Ser Asn Leu Lys Val Val Val Asp
305 310 315 320
Ser Phe Arg Ser Ile Tyr Gly Val Asn Lys Gly Ile Pro Ala Gly Ala
325 330 335
Ala Val Ala Ile Gly Arg Tyr Ala Glu Asp Val Tyr Phe Asn Gly Asn
340 345 350
Pro Trp Tyr Leu Ala Thr Phe Ala Ala Ala Glu Gln Leu Tyr Asp Ala
355 360 365
Ile Tyr Val Trp Lys Lys Thr Gly Ser Ile Thr Val Thr Ala Thr Ser
370 375 380
Leu Ala Phe Phe Gln Glu Leu Val Pro Gly Val Ala Ala Gly Thr Tyr
385 390 395 400
Ala Ser Ser Ser Ser Thr Phe Thr Asn Ile Ile Asn Ala Val Ser Thr
405 410 415
Tyr Ala Asp Gly Phe Leu Ser Glu Ala Ala Lys Tyr Val Pro Ala Asp
420 425 430
Gly Ser Leu Ala Glu Gln Phe Asp Arg Asn Ser Gly Thr Pro Leu Ser
435 440 445
Ala Leu His Leu Thr Trp Ser Tyr Ala Ser Phe Leu Thr Ala Thr Ala
450 455 460
Arg Arg Ala Gly Ile Val Pro Pro Ser Trp Ala Asn Ser Ser Ala Ser
465 470 475 480
Thr Ile Pro Ser Thr Cys Ser Gly Ala Ser Val Val Gly Ser Tyr Ser
485 490 495
Arg Pro Thr Ala Thr Ser Phe Pro Pro Ser Gln Thr Pro Lys Pro Gly
500 505 510
Val Pro Ser Gly Thr Pro Tyr Thr Pro Leu Pro Cys Ala Thr Pro Thr
515 520 525
Ser Val Ala Val Thr Phe His Glu Leu Val Ser Thr Gln Phe Gly Gln
530 535 540
Thr Val Lys Val Ala Gly Asn Ala Pro Ala Leu Gly Asn Trp Ser Ala
545 550 555 560
Ser Ala Ala Val Ala Leu Asp Ala Ile Asn Tyr Ala Asp Asn His Pro
565 570 575
Leu Trp Ile Gly Thr Val Asp Leu Glu Ala Gly Asp Val Val Glu Tyr
580 585 590
Lys Tyr Ile Asn Val Gly Gln Asp Gly Ser Val Thr Trp Glu Ser Asp
595 600 605
Pro Asn His Thr Tyr Thr Val Pro Ala Val Ala Cys Val Thr Gln Val
610 615 620
Val Lys Glu Asp Thr Trp Gln Ser
625 630
<210> 34
<211> 2151
<212> ДНК
<213> Trichoderma asperellum
<400> 34
atgcacgtcc tgtcgactgc ggtgctactt ggctcagttg ccgtccaaaa ggttctggga 60
agaccaggat caaacggcct gtccggcgtc acaaaacgat ctgtggatga ctttatcaac 120
acacagactc ccattgcttt aaacaacctt ctttgcaatg ttggccctga tggatgccgt 180
gcctttggta catcggccgg tgctgtgatt gcatctccga gcacaactga cccagactgt 240
aagtttgacc tatactggca tattcctgat atgtcaaagt tcatatacta acacgagggt 300
aattaatcag actactacat gtggacgcga gatagtgctc ttgtcttcaa gaacattgtc 360
gaccgcttca ctcagcagta tgatgccggc ctgcagcgcc gcatcgagca gtacatttct 420
gcccaggtca ctcttcaggg catctcaaac ccctctggct ctctctcgga cggatccggt 480
cttggtgaac ccaagtttga gttgaccttg agccagttca ctggcaactg gggtcgcccg 540
cagcgcgatg gcccagctct ccgagccatt gccttgattg gttattcgaa gtggctcatc 600
aacaacaact accagtcaac ggtgtcaaat atcatctggc ccattgtgcg gaatgacctc 660
aactatgttg ctcaatactg gttagtacaa gctcgctgtc ttttcgttcg tttatgattg 720
attctaacat cttcacttca ggaaccaaac cggattcgat ctgtgggagg aagttaatgg 780
tagctcgttc tttaccgttg ccaaccagca ccgaggtatg tatcaacatc tcatgtgcaa 840
tttttagttg gaaataaaca atactgacga gttctccagc tcttgttgag ggcgccacac 900
ttgctgccac cctcggccag tcgggaagca cctattcctc agttgcgcct cagatcctgt 960
gcttcctcca gaggttctgg gtgtcgggtg gatacattga ctccaacagt aagtccacca 1020
gcaccatatg ctttgatgaa gggcgatact aaacagcttg ctatagtcaa caccaacgag 1080
ggcaggactg gaaaagatgc caactctctt ctcgcatcta tccacacgtt cgatcctagc 1140
cttggctgtg acgcctccac cttccagcct tgcagtgaca aagccctctc caacctcaag 1200
gtcgttgtag actccttccg ctccatctac ggtgtcaaca agggcattcc cgctggctct 1260
gctgtcgcca tcggcagata ccccgaagac gtgtacttta acggaaaccc ctggtatctc 1320
gctacgttcg ctgctgccga gcaactttac gactccgtct atgtctggaa gaagacaggc 1380
tccatcacgg tgacttccac ttctttggcc ttcttccagg agctcgttcc cggcgtcgcg 1440
gctggaactt actccagcag ccagtctacc ttcacgagca tcatcaacgc cgtctcgaca 1500
tatgctgatg gattcctcag cgaggctgcc aagtacgtcc ccgctgatgg ttcgctcgcc 1560
gagcagttcg atcgcaacac cggcacacct ctgtcagccg ttcacctgac ctggtcgtac 1620
gcctcgtttc tcaccgccgc ggcccgtcgg gctggcgttg tccccccctc atgggccagc 1680
agcggcgcta actcagttcc ttcaagctgc tcgggagctt ctgtggttgg atcctactcg 1740
cgtcctacag ccacgtcatt cccaccatcg cagaccccca agcctggcgt tccttctggt 1800
actcccttca ctcccattcc ctgtgctacc ccgacttccg ttgctgtcac tttccacgag 1860
cttgccacaa cgcagtttgg tcagactatc aaggtcgctg gtagcgctcc cgagctgggc 1920
aactggagca cgagcgcggc cattgctctg gatgccgtca actatgccac taaccaccct 1980
ctgtggattg gatcagtcag tctggaggcc ggagacgtta tcgagtacaa gtacatcaac 2040
gtgggccagg atggttccgt cacctgggag agcgatccca accacaccta cactgtccct 2100
gcggtggcct gtgtcactga ggtggttaag gaggacacct ggcagtcgta a 2151
<210> 35
<211> 631
<212> PRT
<213> Trichoderma asperellum
<400> 35
Met His Val Leu Ser Thr Ala Val Leu Leu Gly Ser Val Ala Val Gln
1 5 10 15
Lys Val Leu Gly Arg Pro Gly Ser Asn Gly Leu Ser Gly Val Thr Lys
20 25 30
Arg Ser Val Asp Asp Phe Ile Asn Thr Gln Thr Pro Ile Ala Leu Asn
35 40 45
Asn Leu Leu Cys Asn Val Gly Pro Asp Gly Cys Arg Ala Phe Gly Thr
50 55 60
Ser Ala Gly Ala Val Ile Ala Ser Pro Ser Thr Thr Asp Pro Asp Tyr
65 70 75 80
Tyr Tyr Met Trp Thr Arg Asp Ser Ala Leu Val Phe Lys Asn Ile Val
85 90 95
Asp Arg Phe Thr Gln Gln Tyr Asp Ala Gly Leu Gln Arg Arg Ile Glu
100 105 110
Gln Tyr Ile Ser Ala Gln Val Thr Leu Gln Gly Ile Ser Asn Pro Ser
115 120 125
Gly Ser Leu Ser Asp Gly Ser Gly Leu Gly Glu Pro Lys Phe Glu Leu
130 135 140
Thr Leu Ser Gln Phe Thr Gly Asn Trp Gly Arg Pro Gln Arg Asp Gly
145 150 155 160
Pro Ala Leu Arg Ala Ile Ala Leu Ile Gly Tyr Ser Lys Trp Leu Ile
165 170 175
Asn Asn Asn Tyr Gln Ser Thr Val Ser Asn Ile Ile Trp Pro Ile Val
180 185 190
Arg Asn Asp Leu Asn Tyr Val Ala Gln Tyr Trp Asn Gln Thr Gly Phe
195 200 205
Asp Leu Trp Glu Glu Val Asn Gly Ser Ser Phe Phe Thr Val Ala Asn
210 215 220
Gln His Arg Ala Leu Val Glu Gly Ala Thr Leu Ala Ala Thr Leu Gly
225 230 235 240
Gln Ser Gly Ser Thr Tyr Ser Ser Val Ala Pro Gln Ile Leu Cys Phe
245 250 255
Leu Gln Arg Phe Trp Val Ser Gly Gly Tyr Ile Asp Ser Asn Ile Asn
260 265 270
Thr Asn Glu Gly Arg Thr Gly Lys Asp Ala Asn Ser Leu Leu Ala Ser
275 280 285
Ile His Thr Phe Asp Pro Ser Leu Gly Cys Asp Ala Ser Thr Phe Gln
290 295 300
Pro Cys Ser Asp Lys Ala Leu Ser Asn Leu Lys Val Val Val Asp Ser
305 310 315 320
Phe Arg Ser Ile Tyr Gly Val Asn Lys Gly Ile Pro Ala Gly Ser Ala
325 330 335
Val Ala Ile Gly Arg Tyr Pro Glu Asp Val Tyr Phe Asn Gly Asn Pro
340 345 350
Trp Tyr Leu Ala Thr Phe Ala Ala Ala Glu Gln Leu Tyr Asp Ser Val
355 360 365
Tyr Val Trp Lys Lys Thr Gly Ser Ile Thr Val Thr Ser Thr Ser Leu
370 375 380
Ala Phe Phe Gln Glu Leu Val Pro Gly Val Ala Ala Gly Thr Tyr Ser
385 390 395 400
Ser Ser Gln Ser Thr Phe Thr Ser Ile Ile Asn Ala Val Ser Thr Tyr
405 410 415
Ala Asp Gly Phe Leu Ser Glu Ala Ala Lys Tyr Val Pro Ala Asp Gly
420 425 430
Ser Leu Ala Glu Gln Phe Asp Arg Asn Thr Gly Thr Pro Leu Ser Ala
435 440 445
Val His Leu Thr Trp Ser Tyr Ala Ser Phe Leu Thr Ala Ala Ala Arg
450 455 460
Arg Ala Gly Val Val Pro Pro Ser Trp Ala Ser Ser Gly Ala Asn Ser
465 470 475 480
Val Pro Ser Ser Cys Ser Gly Ala Ser Val Val Gly Ser Tyr Ser Arg
485 490 495
Pro Thr Ala Thr Ser Phe Pro Pro Ser Gln Thr Pro Lys Pro Gly Val
500 505 510
Pro Ser Gly Thr Pro Phe Thr Pro Ile Pro Cys Ala Thr Pro Thr Ser
515 520 525
Val Ala Val Thr Phe His Glu Leu Ala Thr Thr Gln Phe Gly Gln Thr
530 535 540
Ile Lys Val Ala Gly Ser Ala Pro Glu Leu Gly Asn Trp Ser Thr Ser
545 550 555 560
Ala Ala Ile Ala Leu Asp Ala Val Asn Tyr Ala Thr Asn His Pro Leu
565 570 575
Trp Ile Gly Ser Val Ser Leu Glu Ala Gly Asp Val Ile Glu Tyr Lys
580 585 590
Tyr Ile Asn Val Gly Gln Asp Gly Ser Val Thr Trp Glu Ser Asp Pro
595 600 605
Asn His Thr Tyr Thr Val Pro Ala Val Ala Cys Val Thr Glu Val Val
610 615 620
Lys Glu Asp Thr Trp Gln Ser
625 630
<210> 36
<211> 2142
<212> ДНК
<213> Trichoderma strictipilis
<400> 36
atgcacgtcc tgtcgactgc ggtgctgctc ggctccgttg ccgttcaaaa ggtcctggga 60
agaccgggat caagcggtct atctgacatc accaagagat ccgtcgacga cttcatcagc 120
acccagactc ctattgcact gaacaacctt ctctgcaatg ttggtcccga tggatgtcgt 180
gcatttggca catccgctgg tgcggttatt gcatccccca gcacaactga ccccgactgt 240
aagttggaac tgttaccggc ataaacccac aggatgtgta tcgcatactg agatcgagac 300
agactattac atgtggacgc gagacagcgc tcttgtcttc aagaaccttg tcgaccgctt 360
caccgaaacg tacgatgctg gcctgcagcg ccgcatcgag cagtacatta ctgcccaggt 420
cactctccag ggcctcacca acccatcagg ttccctcgcg gacgggtctg gccttggcga 480
gcccaagttt gagttgaccc tgagtccttt caccggcaac tggggtcgac cgcagcggga 540
tggcccagct ctgcgagcca ttgccttgat tggctattcg aaatggctta tcaacaacaa 600
ctatcagtca accgtgtcca acgtcatctg gcctattgtg cgcaacgacc tcagctacgc 660
tgctcagtac tggttagtga cagcttaccc tcgaattacg gctcgtgtct aacgtcttca 720
ctacaggaac cagaccggct ttgatctgtg ggaagaggtt agcggaagct ctttttttac 780
tgttgccaac cagcaccgag gtatgaagca aaacgtccac actcactgtc actgtatatg 840
aacgctactg accagctccc cagctcttgt tgagggtgcc acgcttgctg ccacgctcgg 900
ccagtcggga agcacttatt catctgttgc tccccaaatc ttgtgctttc tccaacgatt 960
ctgggtgtcg tccggtggat acgtcgactc caacagtatg tccttcgctg ctcatggatt 1020
tggaaagttt ctgttactaa tgccagctcg cctctagtca acacgaatga gggtaggact 1080
ggaaaggatg tcaactccat tctcacttcc atccacacct tcgatcccaa ccttggctgt 1140
gacgcaggca ccttccagcc atgcagtgac aaagccctct ccaacttcaa ggttgttgtc 1200
gactccttcc gctccatcta cggcgtgaac aacggcattc ctgctggtgc tgccgtcgcc 1260
attggcagat atccagagga tgtgtacttc aacgggaacc cttggtacct tgccacgttt 1320
gctgctgctg agcagctgta cgacgccatc tacgtctgga agaagacggg ctccatcaca 1380
gtgactgcca tctctctcgc cttcttccag gagcttgttc ccggcgtgac agctgggacc 1440
tactccagca gccagtcgac tttcaccaac atcatcaacg ctgcctcgac atacgccgat 1500
ggcttcgtca ccgaggctgc caagtacgtt cccaccgacg gttcgctggc cgagcagttc 1560
gaccgcaaca acggcactcc gctgtccgcc cttcacctga cgtggtcgta cgcctcgttc 1620
ttgactgctt cggcccgtcg ggctggcgtc gtgcccccct cgtgggcaaa cagcagtgcc 1680
agctcgattt cttcgacgtg ctccggcgcg tccgtggtcg gatcctactc gagtcccaca 1740
gccacgtcat tccctccgtc gcagacgccc aagcccggcg ttccttccgg taccccctac 1800
acgcccctgc cctgcgctac cccaacgtcc gtggccgtca ccttccacga gctcgtgtcg 1860
acacagtttg gccagacggt caaggccgcg ggcagcgctc cggccctggg caactggagc 1920
acgagcgcgg ctgtcggtct ggacgccgtc aactacgccg ataaccaccc cctgtggatt 1980
gggacggtcg agctggaggc tggagacgtc gttgagtaca agtacatcaa tgtgggtcag 2040
gatggctccg tgacctggga gagtgacccc aaccacactt acacggttcc tgcggtggct 2100
tgtgtgacgg aggtcgtcaa ggaggacacc tggcagtcgt aa 2142
<210> 37
<211> 632
<212> PRT
<213> Trichoderma strictipilis
<400> 37
Met His Val Leu Ser Thr Ala Val Leu Leu Gly Ser Val Ala Val Gln
1 5 10 15
Lys Val Leu Gly Arg Pro Gly Ser Ser Gly Leu Ser Asp Ile Thr Lys
20 25 30
Arg Ser Val Asp Asp Phe Ile Ser Thr Gln Thr Pro Ile Ala Leu Asn
35 40 45
Asn Leu Leu Cys Asn Val Gly Pro Asp Gly Cys Arg Ala Phe Gly Thr
50 55 60
Ser Ala Gly Ala Val Ile Ala Ser Pro Ser Thr Thr Asp Pro Asp Tyr
65 70 75 80
Tyr Tyr Met Trp Thr Arg Asp Ser Ala Leu Val Phe Lys Asn Leu Val
85 90 95
Asp Arg Phe Thr Glu Thr Tyr Asp Ala Gly Leu Gln Arg Arg Ile Glu
100 105 110
Gln Tyr Ile Thr Ala Gln Val Thr Leu Gln Gly Leu Thr Asn Pro Ser
115 120 125
Gly Ser Leu Ala Asp Gly Ser Gly Leu Gly Glu Pro Lys Phe Glu Leu
130 135 140
Thr Leu Ser Pro Phe Thr Gly Asn Trp Gly Arg Pro Gln Arg Asp Gly
145 150 155 160
Pro Ala Leu Arg Ala Ile Ala Leu Ile Gly Tyr Ser Lys Trp Leu Ile
165 170 175
Asn Asn Asn Tyr Gln Ser Thr Val Ser Asn Val Ile Trp Pro Ile Val
180 185 190
Arg Asn Asp Leu Ser Tyr Ala Ala Gln Tyr Trp Asn Gln Thr Gly Phe
195 200 205
Asp Leu Trp Glu Glu Val Ser Gly Ser Ser Phe Phe Thr Val Ala Asn
210 215 220
Gln His Arg Ala Leu Val Glu Gly Ala Thr Leu Ala Ala Thr Leu Gly
225 230 235 240
Gln Ser Gly Ser Thr Tyr Ser Ser Val Ala Pro Gln Ile Leu Cys Phe
245 250 255
Leu Gln Arg Phe Trp Val Ser Ser Gly Gly Tyr Val Asp Ser Asn Ile
260 265 270
Asn Thr Asn Glu Gly Arg Thr Gly Lys Asp Val Asn Ser Ile Leu Thr
275 280 285
Ser Ile His Thr Phe Asp Pro Asn Leu Gly Cys Asp Ala Gly Thr Phe
290 295 300
Gln Pro Cys Ser Asp Lys Ala Leu Ser Asn Phe Lys Val Val Val Asp
305 310 315 320
Ser Phe Arg Ser Ile Tyr Gly Val Asn Asn Gly Ile Pro Ala Gly Ala
325 330 335
Ala Val Ala Ile Gly Arg Tyr Pro Glu Asp Val Tyr Phe Asn Gly Asn
340 345 350
Pro Trp Tyr Leu Ala Thr Phe Ala Ala Ala Glu Gln Leu Tyr Asp Ala
355 360 365
Ile Tyr Val Trp Lys Lys Thr Gly Ser Ile Thr Val Thr Ala Ile Ser
370 375 380
Leu Ala Phe Phe Gln Glu Leu Val Pro Gly Val Thr Ala Gly Thr Tyr
385 390 395 400
Ser Ser Ser Gln Ser Thr Phe Thr Asn Ile Ile Asn Ala Ala Ser Thr
405 410 415
Tyr Ala Asp Gly Phe Val Thr Glu Ala Ala Lys Tyr Val Pro Thr Asp
420 425 430
Gly Ser Leu Ala Glu Gln Phe Asp Arg Asn Asn Gly Thr Pro Leu Ser
435 440 445
Ala Leu His Leu Thr Trp Ser Tyr Ala Ser Phe Leu Thr Ala Ser Ala
450 455 460
Arg Arg Ala Gly Val Val Pro Pro Ser Trp Ala Asn Ser Ser Ala Ser
465 470 475 480
Ser Ile Ser Ser Thr Cys Ser Gly Ala Ser Val Val Gly Ser Tyr Ser
485 490 495
Ser Pro Thr Ala Thr Ser Phe Pro Pro Ser Gln Thr Pro Lys Pro Gly
500 505 510
Val Pro Ser Gly Thr Pro Tyr Thr Pro Leu Pro Cys Ala Thr Pro Thr
515 520 525
Ser Val Ala Val Thr Phe His Glu Leu Val Ser Thr Gln Phe Gly Gln
530 535 540
Thr Val Lys Ala Ala Gly Ser Ala Pro Ala Leu Gly Asn Trp Ser Thr
545 550 555 560
Ser Ala Ala Val Gly Leu Asp Ala Val Asn Tyr Ala Asp Asn His Pro
565 570 575
Leu Trp Ile Gly Thr Val Glu Leu Glu Ala Gly Asp Val Val Glu Tyr
580 585 590
Lys Tyr Ile Asn Val Gly Gln Asp Gly Ser Val Thr Trp Glu Ser Asp
595 600 605
Pro Asn His Thr Tyr Thr Val Pro Ala Val Ala Cys Val Thr Glu Val
610 615 620
Val Lys Glu Asp Thr Trp Gln Ser
625 630
<210> 38
<211> 20
<212> PRT
<213> Trichoderma reesei
<400> 38
Met His Val Leu Ser Thr Ala Val Leu Leu Gly Ser Val Ala Val Gln
1 5 10 15
Lys Val Leu Gly
20
<210> 39
<211> 13
<212> PRT
<213> Trichoderma reesei
<400> 39
Arg Pro Gly Ser Ser Gly Leu Ser Asp Val Thr Lys Arg
1 5 10
<210> 40
<211> 453
<212> PRT
<213> Trichoderma reesei
<400> 40
Ser Val Asp Asp Phe Ile Ser Thr Glu Thr Pro Ile Ala Leu Asn Asn
1 5 10 15
Leu Leu Cys Asn Val Gly Pro Asp Gly Cys Arg Ala Phe Gly Thr Ser
20 25 30
Ala Gly Ala Val Ile Ala Ser Pro Ser Thr Ile Asp Pro Asp Tyr Tyr
35 40 45
Tyr Met Trp Thr Arg Asp Ser Ala Leu Val Phe Lys Asn Leu Ile Asp
50 55 60
Arg Phe Thr Glu Thr Tyr Asp Ala Gly Leu Gln Arg Arg Ile Glu Gln
65 70 75 80
Tyr Ile Thr Ala Gln Val Thr Leu Gln Gly Leu Ser Asn Pro Ser Gly
85 90 95
Ser Leu Ala Asp Gly Ser Gly Leu Gly Glu Pro Lys Phe Glu Leu Thr
100 105 110
Leu Lys Pro Phe Thr Gly Asn Trp Gly Arg Pro Gln Arg Asp Gly Pro
115 120 125
Ala Leu Arg Ala Ile Ala Leu Ile Gly Tyr Ser Lys Trp Leu Ile Asn
130 135 140
Asn Asn Tyr Gln Ser Thr Val Ser Asn Val Ile Trp Pro Ile Val Arg
145 150 155 160
Asn Asp Leu Asn Tyr Val Ala Gln Tyr Trp Asn Gln Thr Gly Phe Asp
165 170 175
Leu Trp Glu Glu Val Asn Gly Ser Ser Phe Phe Thr Val Ala Asn Gln
180 185 190
His Arg Ala Leu Val Glu Gly Ala Thr Leu Ala Ala Thr Leu Gly Gln
195 200 205
Ser Gly Ser Ala Tyr Ser Ser Val Ala Pro Gln Val Leu Cys Phe Leu
210 215 220
Gln Arg Phe Trp Val Ser Ser Gly Gly Tyr Val Asp Ser Asn Ile Asn
225 230 235 240
Thr Asn Glu Gly Arg Thr Gly Lys Asp Val Asn Ser Val Leu Thr Ser
245 250 255
Ile His Thr Phe Asp Pro Asn Leu Gly Cys Asp Ala Gly Thr Phe Gln
260 265 270
Pro Cys Ser Asp Lys Ala Leu Ser Asn Leu Lys Val Val Val Asp Ser
275 280 285
Phe Arg Ser Ile Tyr Gly Val Asn Lys Gly Ile Pro Ala Gly Ala Ala
290 295 300
Val Ala Ile Gly Arg Tyr Ala Glu Asp Val Tyr Tyr Asn Gly Asn Pro
305 310 315 320
Trp Tyr Leu Ala Thr Phe Ala Ala Ala Glu Gln Leu Tyr Asp Ala Ile
325 330 335
Tyr Val Trp Lys Lys Thr Gly Ser Ile Thr Val Thr Ala Thr Ser Leu
340 345 350
Ala Phe Phe Gln Glu Leu Val Pro Gly Val Thr Ala Gly Thr Tyr Ser
355 360 365
Ser Ser Ser Ser Thr Phe Thr Asn Ile Ile Asn Ala Val Ser Thr Tyr
370 375 380
Ala Asp Gly Phe Leu Ser Glu Ala Ala Lys Tyr Val Pro Ala Asp Gly
385 390 395 400
Ser Leu Ala Glu Gln Phe Asp Arg Asn Ser Gly Thr Pro Leu Ser Ala
405 410 415
Leu His Leu Thr Trp Ser Tyr Ala Ser Phe Leu Thr Ala Thr Ala Arg
420 425 430
Arg Ala Gly Ile Val Pro Pro Ser Trp Ala Asn Ser Ser Ala Ser Thr
435 440 445
Ile Pro Ser Thr Cys
450
<210> 41
<211> 37
<212> PRT
<213> Trichoderma reesei
<400> 41
Ser Gly Ala Ser Val Val Gly Ser Tyr Ser Arg Pro Thr Ala Thr Ser
1 5 10 15
Phe Pro Pro Ser Gln Thr Pro Lys Pro Gly Val Pro Ser Gly Thr Pro
20 25 30
Tyr Thr Pro Leu Pro
35
<210> 42
<211> 109
<212> PRT
<213> Trichoderma reesei
<400> 42
Cys Ala Thr Pro Thr Ser Val Ala Val Thr Phe His Glu Leu Val Ser
1 5 10 15
Thr Gln Phe Gly Gln Thr Val Lys Val Ala Gly Asn Ala Ala Ala Leu
20 25 30
Gly Asn Trp Ser Thr Ser Ala Ala Val Ala Leu Asp Ala Val Asn Tyr
35 40 45
Ala Asp Asn His Pro Leu Trp Ile Gly Thr Val Asn Leu Glu Ala Gly
50 55 60
Asp Val Val Glu Tyr Lys Tyr Ile Asn Val Gly Gln Asp Gly Ser Val
65 70 75 80
Thr Trp Glu Ser Asp Pro Asn His Thr Tyr Thr Val Pro Ala Val Ala
85 90 95
Cys Val Thr Gln Val Val Lys Glu Asp Thr Trp Gln Ser
100 105
<210> 43
<211> 597
<212> PRT
<213> Trichoderma sp.
<400> 43
Ala Val Thr Asp Phe Ile Asn Ser Glu Thr Pro Ile Ala Leu Asn Asn
1 5 10 15
Leu Ile Cys Asn Val Gly Pro Asp Gly Cys Arg Ala Phe Gly Thr Ser
20 25 30
Ile Gly Ala Val Val Ala Ser Pro Ser Thr Thr Asp Pro Asp Tyr Phe
35 40 45
Tyr Met Trp Thr Arg Asp Ser Ala Leu Val Phe Lys Thr Leu Val Asp
50 55 60
Arg Phe Thr Gln Lys Tyr Asp Ala Gly Leu Gln Arg Arg Ile Glu Gln
65 70 75 80
Tyr Ile Ala Ala Gln Val Thr Leu Gln Gly Ile Ser Asn Pro Ser Gly
85 90 95
Ser Leu Ser Asp Gly Ser Gly Leu Gly Glu Pro Lys Phe Glu Leu Thr
100 105 110
Leu Ser Gln Phe Thr Gly Asn Trp Gly Arg Pro Gln Arg Asp Gly Pro
115 120 125
Ala Leu Arg Ala Ile Ala Leu Ile Gly Tyr Ser Lys Trp Leu Ile Ser
130 135 140
Asn Asn Tyr Gln Ser Thr Val Ser Asn Ile Ile Trp Pro Ile Val Arg
145 150 155 160
Asn Asp Leu Asn Tyr Val Ala Gln Tyr Trp Asn Gln Thr Gly Phe Asp
165 170 175
Leu Trp Glu Glu Val Asn Gly Ser Ser Phe Phe Ala Val Ala Asn Gln
180 185 190
His Arg Ala Leu Val Glu Gly Ala Thr Leu Ala Thr Thr Leu Gly Gln
195 200 205
Ser Gly Ser Ser Tyr Ser Thr Val Ala Pro Gln Ile Leu Cys Phe Leu
210 215 220
Gln Lys Phe Trp Ser Pro Ser Gly Tyr Val Ile Ser Asn Ile Asn Ser
225 230 235 240
Asn Asp Gly Arg Thr Gly Lys Asp Ser Asn Ser Ile Leu Thr Ser Ile
245 250 255
His Thr Phe Asp Pro Ser Ile Gly Cys Asp Ala Ala Thr Phe Gln Pro
260 265 270
Cys Ser Asp Lys Ala Leu Ser Asn Leu Lys Val Tyr Val Asp Ser Phe
275 280 285
Arg Ser Ile Tyr Gly Val Asn Ser Gly Ile Pro Ala Gly Thr Ala Val
290 295 300
Ala Val Gly Arg Tyr Pro Glu Asp Val Tyr Phe Asn Gly Asn Pro Trp
305 310 315 320
Tyr Leu Ser Thr Phe Ala Val Ala Glu Gln Leu Tyr Asp Ala Leu Tyr
325 330 335
Val Trp Lys Lys Thr Gly Ser Ile Thr Val Thr Ser Thr Ser Leu Ala
340 345 350
Phe Phe Gln Glu Leu Val Pro Ser Val Thr Ala Gly Thr Tyr Ala Ser
355 360 365
Ser Ser Ser Thr Phe Thr Ser Ile Val Asn Ala Val Ser Thr Tyr Ala
370 375 380
Asp Gly Phe Val Ser Glu Ala Ala Lys Tyr Val Pro Ser Asp Gly Ser
385 390 395 400
Leu Ser Glu Gln Phe Asp Lys Asn Thr Gly Thr Pro Leu Ser Ala Val
405 410 415
His Leu Thr Trp Ser Tyr Ala Ser Phe Leu Thr Ala Thr Thr Arg Arg
420 425 430
Ala Gly Ile Val Pro Pro Ser Trp Ile Ser Ser Gly Ala Asn Thr Val
435 440 445
Pro Ser Ser Cys Ser Gly Thr Thr Val Ala Gly Ser Tyr Ser Ser Pro
450 455 460
Thr Ala Thr Ser Phe Pro Pro Ser Gln Thr Pro Lys Thr Ala Ala Thr
465 470 475 480
Gly Thr Ser Phe Thr Pro Ile Ala Cys Ala Thr Pro Thr Ser Val Ala
485 490 495
Val Thr Phe His Glu Leu Ala Thr Thr Val Pro Gly Gln Thr Ile Lys
500 505 510
Val Val Gly Asn Ala Gln Ala Leu Gly Asn Trp Ser Thr Ser Ala Gly
515 520 525
Val Ala Leu Asn Ala Val Asn Cys Ala Ser Asn His Pro Leu Trp Ile
530 535 540
Gly Pro Val Asn Leu Lys Ala Gly Asp Val Val Glu Tyr Lys Tyr Ile
545 550 555 560
Asn Val Gly Ser Asp Gly Ser Val Thr Trp Glu Ala Asp Pro Asn His
565 570 575
Thr Tyr Thr Val Pro Ala Val Ala Cys Val Thr Ala Val Val Lys Glu
580 585 590
Asp Thr Trp Gln Ser
595
<210> 44
<211> 598
<212> PRT
<213> Trichoderma harzianum
<400> 44
Ser Val Asp Asp Ser Ile Asn Thr Gln Thr Pro Ile Ala Leu Asn Asn
1 5 10 15
Leu Leu Cys Asn Val Gly Pro Asp Gly Cys Arg Ala Phe Gly Thr Ser
20 25 30
Ala Gly Ala Val Ile Ala Ser Pro Ser Thr Thr Asp Pro Asp Tyr Tyr
35 40 45
Tyr Met Trp Thr Arg Asp Ser Ala Leu Val Phe Lys Asn Ile Val Asp
50 55 60
Arg Phe Thr Glu Gln Tyr Asp Ala Gly Leu Gln Arg Arg Ile Glu Gln
65 70 75 80
Tyr Ile Ser Ala Gln Val Thr Leu Gln Gly Ile Ser Asn Pro Ser Gly
85 90 95
Ser Leu Ser Asp Gly Ser Gly Leu Gly Glu Pro Lys Phe Glu Leu Thr
100 105 110
Leu Ser Gln Phe Thr Gly Asn Trp Gly Arg Pro Gln Arg Asp Gly Pro
115 120 125
Ala Leu Arg Ala Ile Ala Leu Ile Gly Tyr Ser Lys Trp Leu Ile Asn
130 135 140
Asn Asn Tyr Gln Ser Thr Val Ser Asn Ile Ile Trp Pro Ile Val Arg
145 150 155 160
Asn Asp Leu Asn Tyr Val Ala Gln Tyr Trp Asn Gln Thr Gly Phe Asp
165 170 175
Leu Trp Glu Glu Val Asn Gly Ser Ser Phe Phe Thr Val Ala Asn Gln
180 185 190
His Arg Ala Leu Val Glu Gly Ala Thr Leu Ala Ala Thr Leu Gly Gln
195 200 205
Ser Gly Ser Thr Tyr Ser Ser Val Ala Pro Gln Ile Leu Cys Phe Leu
210 215 220
Gln Arg Phe Trp Val Ser Gly Gly Tyr Ile Asp Ser Asn Ile Asn Thr
225 230 235 240
Asn Glu Gly Arg Thr Gly Lys Asp Ala Asn Ser Leu Leu Ala Ser Ile
245 250 255
His Thr Phe Asp Pro Ser Leu Gly Cys Asp Ala Ser Thr Phe Gln Pro
260 265 270
Cys Ser Asp Lys Ala Leu Ser Asn Leu Lys Val Val Val Asp Ser Phe
275 280 285
Arg Ser Ile Tyr Ser Val Asn Lys Gly Ile Pro Ala Gly Ala Ala Val
290 295 300
Ala Val Gly Arg Tyr Pro Glu Asp Val Tyr Phe Asn Gly Asn Pro Trp
305 310 315 320
Tyr Leu Ala Thr Phe Ala Ala Ala Glu Gln Leu Tyr Asp Ser Val Tyr
325 330 335
Val Trp Lys Lys Thr Gly Ser Ile Thr Val Thr Ser Thr Ser Leu Ala
340 345 350
Phe Phe Gln Glu Leu Val Pro Gly Val Ala Ala Gly Thr Tyr Ser Ser
355 360 365
Ser Gln Ser Thr Phe Thr Ser Ile Ile Asn Ala Val Ser Thr Tyr Ala
370 375 380
Asp Gly Phe Leu Ser Glu Ala Ala Lys Tyr Val Pro Ala Asp Gly Ser
385 390 395 400
Leu Ala Glu Gln Phe Asp Arg Asn Thr Gly Thr Pro Leu Ser Ala Val
405 410 415
His Leu Thr Trp Ser Tyr Ala Ser Phe Leu Thr Ala Ala Ala Arg Arg
420 425 430
Ala Gly Val Val Pro Pro Ser Trp Ala Ser Ser Gly Ala Asn Ser Val
435 440 445
Pro Ser Ser Cys Ser Gly Ala Ser Val Val Gly Ser Tyr Ser Arg Pro
450 455 460
Thr Ala Thr Ser Phe Pro Pro Ser Gln Thr Pro Lys Pro Gly Ala Pro
465 470 475 480
Ser Gly Ala Pro Phe Thr Pro Ile Pro Cys Ala Thr Pro Ala Ser Val
485 490 495
Ala Val Thr Phe His Glu Leu Ala Thr Thr Gln Phe Gly Gln Thr Ile
500 505 510
Lys Val Ala Gly Ser Ala Pro Glu Leu Gly Asn Trp Ser Thr Ser Ala
515 520 525
Ala Ile Ala Leu Asp Ala Val Asn Tyr Ala Thr Asn His Pro Leu Trp
530 535 540
Ile Gly Ser Val Asn Leu Glu Ala Gly Asp Val Ile Glu Tyr Lys Tyr
545 550 555 560
Ile Ser Val Gly Gln Asp Gly Ser Val Thr Trp Glu Ser Asp Pro Asn
565 570 575
His Thr Tyr Thr Val Pro Ala Val Ala Cys Val Thr Glu Val Val Lys
580 585 590
Glu Asp Thr Trp Gln Ser
595
<210> 45
<211> 599
<212> PRT
<213> Trichoderma longibrachiatum
<400> 45
Ser Val Asp Asp Phe Ile Ser Thr Glu Thr Pro Ile Ala Leu Asn Asn
1 5 10 15
Leu Leu Cys Asn Val Gly Pro Asp Gly Cys Arg Ala Phe Gly Thr Ser
20 25 30
Ala Gly Ala Val Ile Ala Ser Pro Ser Thr Ile Asp Pro Asp Tyr Tyr
35 40 45
Tyr Met Trp Thr Arg Asp Ser Ala Leu Val Phe Lys Asn Leu Val Asp
50 55 60
Arg Phe Thr Glu Thr Tyr Asp Ala Gly Leu Gln Arg Arg Ile Glu Gln
65 70 75 80
Tyr Ile Thr Ala Gln Val Thr Leu Gln Gly Leu Ser Asn Pro Ser Gly
85 90 95
Ser Leu Thr Asp Gly Ser Gly Leu Gly Glu Pro Lys Phe Glu Leu Thr
100 105 110
Leu Lys Pro Phe Thr Gly Asn Trp Gly Arg Pro Gln Arg Asp Gly Pro
115 120 125
Ala Leu Arg Ala Val Ala Leu Ile Gly Tyr Ser Lys Trp Leu Ile Asn
130 135 140
Asn Asn Tyr Gln Ser Thr Val Ser Asn Val Ile Trp Pro Ile Val Arg
145 150 155 160
Asn Asp Leu Asn Tyr Val Ala Gln Tyr Trp Asn Gln Thr Gly Phe Asp
165 170 175
Leu Trp Glu Glu Val Asn Gly Ser Ser Phe Phe Thr Met Ala Asn Gln
180 185 190
His Arg Ala Leu Val Glu Gly Ala Thr Leu Ala Ala Thr Leu Gly Gln
195 200 205
Ser Gly Ser Thr Tyr Ser Ser Val Ala Pro Gln Ile Leu Cys Phe Leu
210 215 220
Gln Arg Phe Trp Val Ser Ser Gly Gly Tyr Val Asp Ser Asn Ile Asn
225 230 235 240
Thr Asn Glu Gly Arg Thr Gly Lys Asp Val Asn Ser Val Leu Thr Ser
245 250 255
Ile His Thr Phe Asp Pro Asn Leu Gly Cys Asp Ala Ala Thr Phe Gln
260 265 270
Pro Cys Ser Asp Lys Ala Leu Ser Asn Leu Lys Val Val Val Asp Ser
275 280 285
Phe Arg Ser Ile Tyr Gly Val Asn Lys Gly Ile Pro Ala Gly Ala Ala
290 295 300
Val Ala Ile Gly Arg Tyr Ala Glu Asp Val Tyr Phe Asn Gly Asn Pro
305 310 315 320
Trp Tyr Leu Ala Thr Phe Ala Ala Ala Glu Gln Leu Tyr Asp Ala Ile
325 330 335
Tyr Val Trp Lys Lys Thr Gly Ser Ile Thr Val Thr Ala Thr Ser Leu
340 345 350
Ala Phe Phe Gln Glu Leu Val Pro Gly Val Ala Ala Gly Thr Tyr Ala
355 360 365
Ser Ser Ser Ser Thr Phe Thr Asn Ile Ile Asn Ala Val Ser Thr Tyr
370 375 380
Ala Asp Gly Phe Leu Ser Glu Ala Ala Lys Tyr Val Pro Ala Asp Gly
385 390 395 400
Ser Leu Ala Glu Gln Phe Asp Arg Asn Ser Gly Thr Pro Leu Ser Ala
405 410 415
Leu His Leu Thr Trp Ser Tyr Ala Ser Phe Leu Thr Ala Thr Ala Arg
420 425 430
Arg Ala Gly Ile Val Pro Pro Ser Trp Ala Asn Ser Ser Ala Ser Thr
435 440 445
Ile Pro Ser Thr Cys Ser Gly Ala Ser Val Val Gly Ser Tyr Ser Arg
450 455 460
Pro Thr Ala Thr Ser Phe Pro Pro Ser Gln Thr Pro Lys Pro Gly Val
465 470 475 480
Pro Ser Gly Thr Pro Tyr Thr Pro Leu Pro Cys Ala Thr Pro Thr Ser
485 490 495
Val Ala Val Thr Phe His Glu Leu Val Ser Thr Gln Phe Gly Gln Thr
500 505 510
Val Lys Val Ala Gly Asn Ala Pro Ala Leu Gly Asn Trp Ser Ala Ser
515 520 525
Ala Ala Val Ala Leu Asp Ala Ile Asn Tyr Ala Asp Asn His Pro Leu
530 535 540
Trp Ile Gly Thr Val Asp Leu Glu Ala Gly Asp Val Val Glu Tyr Lys
545 550 555 560
Tyr Ile Asn Val Gly Gln Asp Gly Ser Val Thr Trp Glu Ser Asp Pro
565 570 575
Asn His Thr Tyr Thr Val Pro Ala Val Ala Cys Val Thr Gln Val Val
580 585 590
Lys Glu Asp Thr Trp Gln Ser
595
<210> 46
<211> 598
<212> PRT
<213> Trichoderma asperellum
<400> 46
Ser Val Asp Asp Phe Ile Asn Thr Gln Thr Pro Ile Ala Leu Asn Asn
1 5 10 15
Leu Leu Cys Asn Val Gly Pro Asp Gly Cys Arg Ala Phe Gly Thr Ser
20 25 30
Ala Gly Ala Val Ile Ala Ser Pro Ser Thr Thr Asp Pro Asp Tyr Tyr
35 40 45
Tyr Met Trp Thr Arg Asp Ser Ala Leu Val Phe Lys Asn Ile Val Asp
50 55 60
Arg Phe Thr Gln Gln Tyr Asp Ala Gly Leu Gln Arg Arg Ile Glu Gln
65 70 75 80
Tyr Ile Ser Ala Gln Val Thr Leu Gln Gly Ile Ser Asn Pro Ser Gly
85 90 95
Ser Leu Ser Asp Gly Ser Gly Leu Gly Glu Pro Lys Phe Glu Leu Thr
100 105 110
Leu Ser Gln Phe Thr Gly Asn Trp Gly Arg Pro Gln Arg Asp Gly Pro
115 120 125
Ala Leu Arg Ala Ile Ala Leu Ile Gly Tyr Ser Lys Trp Leu Ile Asn
130 135 140
Asn Asn Tyr Gln Ser Thr Val Ser Asn Ile Ile Trp Pro Ile Val Arg
145 150 155 160
Asn Asp Leu Asn Tyr Val Ala Gln Tyr Trp Asn Gln Thr Gly Phe Asp
165 170 175
Leu Trp Glu Glu Val Asn Gly Ser Ser Phe Phe Thr Val Ala Asn Gln
180 185 190
His Arg Ala Leu Val Glu Gly Ala Thr Leu Ala Ala Thr Leu Gly Gln
195 200 205
Ser Gly Ser Thr Tyr Ser Ser Val Ala Pro Gln Ile Leu Cys Phe Leu
210 215 220
Gln Arg Phe Trp Val Ser Gly Gly Tyr Ile Asp Ser Asn Ile Asn Thr
225 230 235 240
Asn Glu Gly Arg Thr Gly Lys Asp Ala Asn Ser Leu Leu Ala Ser Ile
245 250 255
His Thr Phe Asp Pro Ser Leu Gly Cys Asp Ala Ser Thr Phe Gln Pro
260 265 270
Cys Ser Asp Lys Ala Leu Ser Asn Leu Lys Val Val Val Asp Ser Phe
275 280 285
Arg Ser Ile Tyr Gly Val Asn Lys Gly Ile Pro Ala Gly Ser Ala Val
290 295 300
Ala Ile Gly Arg Tyr Pro Glu Asp Val Tyr Phe Asn Gly Asn Pro Trp
305 310 315 320
Tyr Leu Ala Thr Phe Ala Ala Ala Glu Gln Leu Tyr Asp Ser Val Tyr
325 330 335
Val Trp Lys Lys Thr Gly Ser Ile Thr Val Thr Ser Thr Ser Leu Ala
340 345 350
Phe Phe Gln Glu Leu Val Pro Gly Val Ala Ala Gly Thr Tyr Ser Ser
355 360 365
Ser Gln Ser Thr Phe Thr Ser Ile Ile Asn Ala Val Ser Thr Tyr Ala
370 375 380
Asp Gly Phe Leu Ser Glu Ala Ala Lys Tyr Val Pro Ala Asp Gly Ser
385 390 395 400
Leu Ala Glu Gln Phe Asp Arg Asn Thr Gly Thr Pro Leu Ser Ala Val
405 410 415
His Leu Thr Trp Ser Tyr Ala Ser Phe Leu Thr Ala Ala Ala Arg Arg
420 425 430
Ala Gly Val Val Pro Pro Ser Trp Ala Ser Ser Gly Ala Asn Ser Val
435 440 445
Pro Ser Ser Cys Ser Gly Ala Ser Val Val Gly Ser Tyr Ser Arg Pro
450 455 460
Thr Ala Thr Ser Phe Pro Pro Ser Gln Thr Pro Lys Pro Gly Val Pro
465 470 475 480
Ser Gly Thr Pro Phe Thr Pro Ile Pro Cys Ala Thr Pro Thr Ser Val
485 490 495
Ala Val Thr Phe His Glu Leu Ala Thr Thr Gln Phe Gly Gln Thr Ile
500 505 510
Lys Val Ala Gly Ser Ala Pro Glu Leu Gly Asn Trp Ser Thr Ser Ala
515 520 525
Ala Ile Ala Leu Asp Ala Val Asn Tyr Ala Thr Asn His Pro Leu Trp
530 535 540
Ile Gly Ser Val Ser Leu Glu Ala Gly Asp Val Ile Glu Tyr Lys Tyr
545 550 555 560
Ile Asn Val Gly Gln Asp Gly Ser Val Thr Trp Glu Ser Asp Pro Asn
565 570 575
His Thr Tyr Thr Val Pro Ala Val Ala Cys Val Thr Glu Val Val Lys
580 585 590
Glu Asp Thr Trp Gln Ser
595
<210> 47
<211> 599
<212> PRT
<213> Trichoderma strictipilis
<400> 47
Ser Val Asp Asp Phe Ile Ser Thr Gln Thr Pro Ile Ala Leu Asn Asn
1 5 10 15
Leu Leu Cys Asn Val Gly Pro Asp Gly Cys Arg Ala Phe Gly Thr Ser
20 25 30
Ala Gly Ala Val Ile Ala Ser Pro Ser Thr Thr Asp Pro Asp Tyr Tyr
35 40 45
Tyr Met Trp Thr Arg Asp Ser Ala Leu Val Phe Lys Asn Leu Val Asp
50 55 60
Arg Phe Thr Glu Thr Tyr Asp Ala Gly Leu Gln Arg Arg Ile Glu Gln
65 70 75 80
Tyr Ile Thr Ala Gln Val Thr Leu Gln Gly Leu Thr Asn Pro Ser Gly
85 90 95
Ser Leu Ala Asp Gly Ser Gly Leu Gly Glu Pro Lys Phe Glu Leu Thr
100 105 110
Leu Ser Pro Phe Thr Gly Asn Trp Gly Arg Pro Gln Arg Asp Gly Pro
115 120 125
Ala Leu Arg Ala Ile Ala Leu Ile Gly Tyr Ser Lys Trp Leu Ile Asn
130 135 140
Asn Asn Tyr Gln Ser Thr Val Ser Asn Val Ile Trp Pro Ile Val Arg
145 150 155 160
Asn Asp Leu Ser Tyr Ala Ala Gln Tyr Trp Asn Gln Thr Gly Phe Asp
165 170 175
Leu Trp Glu Glu Val Ser Gly Ser Ser Phe Phe Thr Val Ala Asn Gln
180 185 190
His Arg Ala Leu Val Glu Gly Ala Thr Leu Ala Ala Thr Leu Gly Gln
195 200 205
Ser Gly Ser Thr Tyr Ser Ser Val Ala Pro Gln Ile Leu Cys Phe Leu
210 215 220
Gln Arg Phe Trp Val Ser Ser Gly Gly Tyr Val Asp Ser Asn Ile Asn
225 230 235 240
Thr Asn Glu Gly Arg Thr Gly Lys Asp Val Asn Ser Ile Leu Thr Ser
245 250 255
Ile His Thr Phe Asp Pro Asn Leu Gly Cys Asp Ala Gly Thr Phe Gln
260 265 270
Pro Cys Ser Asp Lys Ala Leu Ser Asn Phe Lys Val Val Val Asp Ser
275 280 285
Phe Arg Ser Ile Tyr Gly Val Asn Asn Gly Ile Pro Ala Gly Ala Ala
290 295 300
Val Ala Ile Gly Arg Tyr Pro Glu Asp Val Tyr Phe Asn Gly Asn Pro
305 310 315 320
Trp Tyr Leu Ala Thr Phe Ala Ala Ala Glu Gln Leu Tyr Asp Ala Ile
325 330 335
Tyr Val Trp Lys Lys Thr Gly Ser Ile Thr Val Thr Ala Ile Ser Leu
340 345 350
Ala Phe Phe Gln Glu Leu Val Pro Gly Val Thr Ala Gly Thr Tyr Ser
355 360 365
Ser Ser Gln Ser Thr Phe Thr Asn Ile Ile Asn Ala Ala Ser Thr Tyr
370 375 380
Ala Asp Gly Phe Val Thr Glu Ala Ala Lys Tyr Val Pro Thr Asp Gly
385 390 395 400
Ser Leu Ala Glu Gln Phe Asp Arg Asn Asn Gly Thr Pro Leu Ser Ala
405 410 415
Leu His Leu Thr Trp Ser Tyr Ala Ser Phe Leu Thr Ala Ser Ala Arg
420 425 430
Arg Ala Gly Val Val Pro Pro Ser Trp Ala Asn Ser Ser Ala Ser Ser
435 440 445
Ile Ser Ser Thr Cys Ser Gly Ala Ser Val Val Gly Ser Tyr Ser Ser
450 455 460
Pro Thr Ala Thr Ser Phe Pro Pro Ser Gln Thr Pro Lys Pro Gly Val
465 470 475 480
Pro Ser Gly Thr Pro Tyr Thr Pro Leu Pro Cys Ala Thr Pro Thr Ser
485 490 495
Val Ala Val Thr Phe His Glu Leu Val Ser Thr Gln Phe Gly Gln Thr
500 505 510
Val Lys Ala Ala Gly Ser Ala Pro Ala Leu Gly Asn Trp Ser Thr Ser
515 520 525
Ala Ala Val Gly Leu Asp Ala Val Asn Tyr Ala Asp Asn His Pro Leu
530 535 540
Trp Ile Gly Thr Val Glu Leu Glu Ala Gly Asp Val Val Glu Tyr Lys
545 550 555 560
Tyr Ile Asn Val Gly Gln Asp Gly Ser Val Thr Trp Glu Ser Asp Pro
565 570 575
Asn His Thr Tyr Thr Val Pro Ala Val Ala Cys Val Thr Glu Val Val
580 585 590
Lys Glu Asp Thr Trp Gln Ser
595
Реферат
Изобретение относится к биотехнологии и представляет собой молекулу ДНК, кодирующую фермент, обладающий активностью глюкоамилазы, обладающую по меньшей мере 80% идентичности последовательности с глюкоамилазой из Trichoderma, обладающей последовательностью SEQ ID NO: 4. Изобретение также относится к векторам и клеткам-хозяевам со встроенными последовательностями ДНК, ферментным композициям и способам применения глюкоамилаз в различных приложениях. Изобретение позволяет расширить арсенал глюкоамилаз. 11 н. и 34 з.п. ф-лы, 20 ил., 10 табл.
Формула
а) контактирование субстрата, содержащего гранулярный крахмал, с глюкоамилазой, обладающей, по меньшей мере, 80% идентичности последовательности с SEQ ID NO:4 или являющейся биологически функциональным фрагментом последовательности, обладающей, по меньшей мере, 90% идентичности с SEQ ID NO:4, при температуре ниже температуры желатинизации, при pH приблизительно от 4 до 7,0 в течение периода времени для получения композиции, содержащей глюкозу,
b) контактирование глюкозы со сбраживающим организмом в подходящих условиях брожения для получения продукта брожения.

Комментарии