Способы получения сахарной цепи, содержащей сиаловую кислоту - RU2597975C2
Код документа: RU2597975C2
Чертежи








Описание
Область техники, к которой относится изобретения
Настоящее изобретение относится к способу синтеза сахарной цепи, что может найти применение при получении лекарственных средств, таких как, гликопротеины, эталонов для аналитических приборов, научных реагентов, наборов сахарных цепей и т.д.
Предшествующий уровень техники
Большое количество предыдущих исследований показали, что структуры из сахарных цепей, связанные с белками, играют важную функциональную роль в биологической активности белков. Сахарную цепь также называют "лицом клетки". Известно, что сахарная цепь, экспрессированная на поверхности клетки, участвует во взаимодействии клетка-клетка или сигналировании, развитии или дифференциации, оплодотворении, раковом метастазировании и т.д. Что касается модификации сахарными цепями у млекопитающих, то хорошо известно, что в основном, это Asn-связанное гликозилирование, гликозилирование муцинового типа, гликозилирование протеогликанового типа и другие. Эти виды модификации дают соответствующие уникальные структуры сахарных цепей посредством различающихся путей биосинтеза. Известно, что сахара, такие как, фукоза или сиаловая кислота, присоединяются к невосстанавливающим концам таких структур сахарных цепей.
Сиаловая кислота это обобщенное название для аминозамещенных или гидроксизамещенных производных нейраминовой кислоты, которая является особой нонозой, имеющей амино- и карбоксигруппы. N-ацетилнейраминовая кислота (Neu5Ac), имеющая ацетилированную аминогруппу в положении 5, вероятно, является наиболее преобладающей формой в природе. Также известны различные структуры, такие как, N-гликолилнейраминовая кислота, имеющая гликолил-модифицированную аминогруппу в положении 5, или дезаминонейраминовая кислота KDN.
По имеющимся сведениям, сахарная цепь, содержащая сиаловую кислоту, встречается не только у млекопитающих, включая людей и мышей, но и у иных позвоночных, иглокожих и даже одноклеточных организмов, а также у некоторых грамотрицательных бактерий. Эта сахарная цепь, содержащая сиаловую кислоту, образуется с помощью сиалилтрансферазы. Сиалилтрансфераза использует сиаловую кислоту, присоединенную к цитидинмонофосфату (СМР), в качестве субстрата-донора для переноса сиаловой кислоты в, например, положение 3 или 6 галактозы, положение 6 N-ацетилгалактозамина или положение 8 других сиаловых кислот при посредстве альдегидной группы, имеющейся в положении 2 донора сиаловой кислоты. Например, фермент, переносящий сиаловую кислоту в положение 3 галактозы, называется α-2,3-сиалилтрансфераза; фермент, переносящий сиаловую кислоту в положение 6 галактозы или N-ацетилгалактозамина, называется α-2,6-сиалилтрансфераза; и фермент, переносящий сиаловую кислоту в положение 8 другой сиаловой кислоты, называется α-2,8-полисиалилтрансфераза. Из этих ферментов, α-2,6-сиалилтрансфераза известна как ферменты ST6Gal-I и ST6Gal-II, переносящие сиаловую кислоту в положение 6 галактозы, и ферменты ST6GalNAc-I, ST6GalNAc-II, ST6GalNAc-III, и ST6GalNAc-IV, переносящие сиаловую кислоту в положение 6 N-ацетилгалактозамина в организме человека.
ST6Gal-I распознает структуру N-ацетиллактозамина (Galβ1-4GlcNAc), которая представляет собой N-ацетилглюкозамин, имеющий галактозу, присоединенную в положении 4, в качестве субстрата-акцептора и поэтому модифицирует структуры невосстанавливающих концов некоторых гликолипидов или N-связанных сахарных цепей. Его специфичность по отношению к субстрату-акцептору в основном анализировали с применением биантеннарых или триантеннарых N-связанных сахарных цепей. Согласно сообщению, сиаловая кислота обычно переносится на лактозамин, на антенну α1,3-связанной маннозы (см. Непатентная Литература, 1). Что касается получения биантеннарых или триантеннарых N-связанных сахарных цепей, эти сахарные цепи сложно успешно получить в значительном количестве, потому что, например: субстраты гликозилтрансферазы редко выделяют из природных продуктов; и крупномасштабный способ получения с применением этого фермента пока не был разработан.
Между тем, реакция переноса α2,6-сиаловой кислоты для тетраантеннарых N-связанных сахарных цепей была изучена с применением ST6Gal-I быка. Из четырех структур N-ацетиллактозамина в сахарной цепи, N-ацетиллактозаминная структура, β1,2-связанная с α1,3-связанной маннозой, является наиболее восприимчивой к переносу сиаловой кислоты, сопровождающемуся β1,4-связыванием N-ацетиллактозаминной структуры с α1,3-связанной маннозой, а затем присоединением любой из двух N-ацетиллактозаминных структур к α1,6-связанной маннозе, хотя никакого продукта, содержащего четыре молекулы сиаловой кислоты, не было обнаружено (см. Непатентная Литература, 2). Было сообщение о том, что ST6Gal-I человека, а также ST6Gal-II, обладают субстратной специфичностью (см. Непатентная Литература, 3 и 4). Однако не было сделано никакого исследования сиалирования с тетраантеннарыми N-связанными сахарными цепями в качестве акцепторных субстратов.
Согласно сообщениям, ингибирование ST6Gal-I продуктом СМР является 49% ингибированием (см. Непатентная Литература, 5) или 71% ингибированием (см. Непатентная Литература, 6) с помощью 0,25 мм СМР.
Между тем, имеются сообщения о Photobacterium damsela JT0160 (см. Непатентная Литература, 7), Photobacterium leiognathi JTPET-SHIZ-145 (см. Непатентная Литература, 8), и т.п., как о α2,6-сиалилтрансферазах бактериального происхождения. Однако ни для одной из них не было изучено сиалирование с тетраантеннарыми N-связанными сахарными цепями в качестве акцепторных субстратов.
Что касается реакции переноса α2,3-сиаловой кислоты на тетраантеннарые N-связанные сахарные цепи, тетраантеннарые N-связанные сахарные цепи, содержащие четыре α2,3-связанные молекулы сиаловой кислоты, присоединяются к гликопротеинам, таким как, эритропоэтин (ЕРО) (см. Непатентная Литература, 9). Согласно сообщению, такое сиалирование вносит вклад в устойчивость гликопротеинов крови (см. Непатентная Литература, 10). Хотя эти структуры также встречаются в природе, не было случая, чтобы сообщали о реальном получении в больших количествах тетраантеннарых N-связанных сахарных цепей, содержащих четыре α2,3-связанные молекулы сиаловой кислоты. Это имеет место потому, что применяемое в качестве исходного материала ЕРО или подобное, сложно недорого получить в больших количествах; и асиало-тетраантеннарые N-связанные сахарные цепи, применяемые в качестве акцепторов в ферментативном синтезе, также сложно недорого получить из других природных продуктов. Также известно, что гликопротеин ЕРО имеет, например, тетраантеннарые N-связанные сахарные цепи, содержащие α2,3 и α2,6-связи вместе (см. Непатентная Литература, 11).
Было сообщение относительно паттерна связывания сиаловой кислоты, связанной с сахарными цепями N-типа в лекарственных препаратах антител или гликопротеиновых лекарственным препаратах, таких как, цитокины, о том, что белки, имеющие α2,6-связанную сиаловую кислоту, исчезают из крови быстрее, чем белки, имеющие α2,3-связанную сиаловую кислоту. Для высвобождения из крови, гликопротеины включаются в клетки путем in vivo связывания с молекулами лектина и окончательно метаболизируются. Таким образом, можно ожидать, что гликопротеины, имеющие α2,6-связанную сиаловую кислоту, соединяются по органоспецифическому типу через связывание с конкретной молекулой лектина, и также используются в доставке лекарственных средств. Также, известно, что гликопротеины выделяются в мочу в почке, в зависимости от молекулярных размеров. По имеющимся сведениям, видимый молекулярный размер эритропоэтина возрастает с увеличением количества антенн в его сахарной цепи, что приводит к медленному высвобождению из крови. Таким образом, можно ожидать, что синтез сахарных цепей, имеющих α2,3-связанную и/или α2,6-связанную сиаловую кислоту, в частности, тетраантеннарых сахарных цепей N-типа, имеющих четыре молекулы α2,3-связанной и/или α2,6-связанной сиаловой кислоты, применим для производства гликопротеиновых лекарственных средств, различающихся по эффективности усвоения в органе.
Вирус гриппа человека распознает, для ее заражения, α2,6-связанную сиаловую кислоту в сахарных цепях, экспрессированных на поверхности клетки, в то время как вирус гриппа птицы распознает α2,3-связанную сиаловую кислоту для ее заражения. Многие вирусы, также включая вирус гриппа, начинают заражать клетки путем распознавания сахарных цепей структур клеток, подлежащих заражению. В этой связи, специфичность связывания этих вирусов необходимо изучать с использованием различных сахарных цепей. Таким образом, сахарные цепи, имеющие α2,3-или α2,6-связанную сиаловую кислоту, могут служить в качестве материала для исследования на специфичность связывания таких вирусов и применяться, например, для детектирования вирусов.
Список цитируемой литературы
Непатентная Литература
Непатентная Литература 1: van den Eijnden DH et al., Biochem Biophys Res Commun., 92 (3), 839-45 (1980)
Непатентная Литература 2: Joziasse et al., JBC, 262, 2025-2033 (1987)
Непатентная Литература 3: Takashima et al., JBC, 277, 45719-45728 (2002)
Непатентная Литература 4: Krzewinski-Recchi et al., EJB, 270, 950-961 (2003)
Непатентная Литература 5: Miyazaki Т et al., Glycobiology, 18, 187-194 (2008)
Непатентная Литература 6: Kleineidam et al., Glycoconj. J., 14, 57-66 (1997)
Непатентная Литература 7: Yamamoto Т et al., BBB, 62, 210-214 (1998)
Непатентная Литература 8: Yamamoto T et al., Glycobiology, 17, 1167-1174 (2007)
Непатентная Литература 9: Takeuchi et al., J. Biol. Chem., 263 (8), 3657-63 (1988)
Непатентная Литература 10: Tsuda et al., Eur J Biochem., 188 (2), 405-11 (1990)
Непатентная Литература 11: Takeuchi et al., J. Biol. Chem., 263 (8), 3657-63 (1988)
Краткое изложение сущности изобретения
Техническая задача
Известно важное значение сахарных цепей, имеющих α2,3-или α2,6-связанную сиаловую кислоту на их невосстанавливающихся концах. Хотя эти компоненты сахарных цепей могут встречаться в природе, требуется их промышленное производство из-за проблем их выделения из природных продуктов, такими как, редкость, труднодоступность и безопасность природных продуктов. В частности, производство лекарственных препаратов антител или гликопротеиновых лекарственных препаратов, таких как, цитокины, или исследование специфичности связывания вирусов или т.п., неизбежно требует производства в значительном количестве сахарных цепей, имеющих гомогенные структуры путем контролирования паттерна присоединения (α2,6-связь или α2,3-связь) сиаловой кислоты. В частности, считается сложным синтезировать химическим путем триантеннарную или тетраантеннарную комплексную сахарную цепь N-типа, имеющую сиаловую кислоту на каждом их своих невосстанавливающих концов. Не имеется сообщения, раскрывающего что, например, тетраантеннарная комплексная сахарная цепь N-типа, имеющая α2,6-связанную сиаловую кислоту на каждом из своих невосстанавливающих концов, была синтезирован химическим путем. Более того, эти сиалированные триантеннарые или тетраантеннарые цепочки сахара сложно успешно получить ферментативным путем.
Решение задачи
Настоящие изобретатели недавно обнаружили активность сиалилтрансферазы в расщеплении сиаловой кислоты в продукте реакции в присутствии СМР, и также обнаружили, что образующийся СМР можно разлагать ферментативным путем с успешным получением, посредством этого, сахарной цепи, содержащей сиаловую кислоту. Настоящие изобретатели, кроме того, обнаружили, что даже тетраантеннарную сахарную цепь N-типа, имеющую четыре α2,6-связанные молекулы сиаловой кислоты, которую раньше было сложно синтезировать, можно получать с высокими выходами в однореакторном синтезе, содержащем реакцию удлинения биантеннарной сахарной цепи, используемой в качестве исходного материала без осуществления очистки после каждой ферментативной реакции.
Конкретно, настоящее изобретение относится к способу получения сиалированной второй сахарной цепи или ее производного, содержащему взаимодействие первой сахарной цепи или ее производного с СМР-сиаловой кислотой в присутствии сиалилтрансферазы и фосфатазы для переноса сиаловой кислоты на невосстанавливающийся конец первой сахарной цепи или ее производного.
В контексте данного изобретения, согласно одному воплощению способа получения сиалированной второй сахарной цепи или ее производного по настоящему изобретению, первая сахарная цепь или ее производное представляет собой триантеннарную или тетраантеннарную N-связанную комплексную сахарную цепь или ее производное.
Согласно одному воплощению способа получения сиалированной второй сахарной цепи или ее производного по настоящему изобретению, первая сахарная цепь или ее производное представляет собой соединение, представленное следующей формулой:
Формула 1

где Gn представляет собой N-ацетилглюкозамин, Man представляет собой маннозу, и Gal представляет собой галактозу (то же самое распространяется на все описание изобретения; в настоящем описании изобретения N-ацетилглюкозамин именуется также GlcNAc) или его производное.
Согласно одному воплощению способа получения сиалированной второй сахарной цепи или ее производного по настоящему изобретению, сиалированная вторая сахарная цепь или ее производное представляет собой триантеннарную или тетраантеннарную N-связанную комплексную сахарную цепь, где сахарная цепь представляет собой соединение, имеющее сиаловую кислоту на каждом из своих невосстанавливающих концов или его производное.
Согласно одному воплощению способа получения сиалированной второй сахарной цепи или ее производного по настоящему изобретению, сиалированная вторая сахарная цепь или ее производное представляет собой соединение, представленное следующей формулой
Формула 2

Формула 3

где Gn представляет собой N-ацетилглюкозамин, Man представляет собой маннозу, Gal представляет собой галактозу, и Sia представляет собой сиаловую кислоту (то же самое распространяется все описание изобретения; в настоящем описании изобретения, N-ацетилглюкозамин именуется также GlcNAc) или его производное.
Альтернативный объект настоящего изобретения относится к способу получения сиалированной сахарной цепи или ее производного, содержащий следующие стадии:
(а) однократное или многократное проведение стадии взаимодействия сахарной цепи, представленной следующей формулой:
Формула 4

или ее производного с UDP-сахаром, служащим в качестве субстрата гликозилтрансферазы в присутствии гликозилтрансферазы; и
(b) взаимодействие продукта стадии (а) с СМР-сиаловой кислотой в присутствии сиалилтрансферазы и фосфатазы.
Дополнительный альтернативный объект настоящего изобретения относится к способу получения сахарной цепи, сиалированной на ее невосстанавливающем конце или ее производного, содержащему следующие стадии:
(a) взаимодействие агалакто-биантеннарной комплексной сахарной цепи или ее производного с UDP-GlcNAc в присутствии MGAT4 и MGAT5;
(b) взаимодействие продукта стадии (а) с UDP-Gal в присутствии β4GalT1; и
(c) взаимодействие продукта стадии (b) с СМР-сиаловой кислотой в присутствии сиалилтрансферазы и фосфатазы.
Согласно одному воплощению способа получения сиалированной сахарной цепи или ее производного по настоящему изобретению, сиалилтрансфераза представляет собой α2,6-сиалилтрансферазу.
Согласно одному воплощению способа получения сиалированной сахарной цепи или ее производного по настоящему изобретению, сиалилтрансфераза представляет собой сиалилтрансферазу человека.
Согласно одному воплощению способа получения сиалированной сахарной цепи или ее производного по настоящему изобретению, сиалилтрансфераза представляет собой ST6Gal-I.
Согласно одному воплощению способа получения сиалированной сахарной цепи или ее производного по настоящему изобретению, СМР-сиаловая кислота представляет собой CMP-Neu5Ac.
Согласно одному воплощению способа получения сиалированной сахарной цепи или ее производного по настоящему изобретению, фосфатаза представляет собой щелочную фосфатазу.
Согласно одному воплощению способа получения сиалированной сахарной цепи или ее производного по настоящему изобретению, фосфатаза представляет собой щелочную фосфатазу из Е.coli.
Дополнительный альтернативный объект настоящего изобретения относится к соединению, имеющему сиаловую кислоту на каждом из своих невосстанавливающих концов тетраантеннарной N-связанной комплексной сахарной цепи или ее производного.
Дополнительный альтернативный объект настоящего изобретения относится к соединению, имеющему α2,6-связанную сиаловую кислоту на каждом из своих невосстанавливающих концов тетраантеннарной N-связанной комплексной сахарной цепи или ее производного.
Дополнительный альтернативный объект настоящего изобретения относится к соединению, представленному следующей формулой:
Формула 5

Полезные эффекты изобретения
По способу настоящего изобретения можно более успешно получать сахарные цепи, содержащие сиаловую кислоту, с применением сиалилтрансферазы, чем когда-либо прежде. В частности, по способу настоящего изобретения можно успешно получать даже триантеннарную или тетраантеннарную комплексную сахарную цепь, содержащую сиаловую кислоту (включая гликоаминовые кислоты и гликопептиды), в которой сиаловая кислота связана с каждым из невосстанавливающих концов антенн, которую ранее было сложно получить. В дополнение, по способу настоящего изобретения можно добиться удобного получения с высокими выходами путем однореакторной реакции синтеза, и можно достичь также получение этих сахарных цепей в большом количестве, что ранее было сложно осуществить.
Краткое описание чертежей
На фигуре 1 показаны ВЭЖХ-хроматограммы каждого продукта реакции, полученные через 0 часов, 1 час, 6 часов или 24 часа (снизу вверх) реакции при 37°С после прибавления ST6Gal-1 к раствору, содержащему NA4-Fmoc в качестве тетраантеннарной комплексной сахарной цепи и CMP-NeuAc, или после дополнительного прибавления CMP-NeuAc и ST6Gal-1 к раствору спустя 24 часа и последующей 24-часовой реакции (самая верхняя хроматограмма). Термины "тетрасиало-", "трисиало-", "дисиало-" и "моносиало", указанные в верхней части хроматограмм, показывают времена удерживания (мин) (α2,6)тетрасиало-NA4-Fmoc, (α2,6)трисиало-NA4-Fmoc, (α2,6)дисиало-NA4-Fmoc, и (α2,6)моносиало-NA4-Fmoc, соответственно, в ВЭЖХ-хроматограммах.
На фигуре 2 показано относительное содержание (α2,6)тетрасиало-NA4-Fmoc и (α2,6)трисиало-NA4-Fmoc после реакции (α2,6)тетрасиало-NA4-Fmoc при 37°С в течение 15 часов в присутствии или в отсутствие CMP-Neu5Ac и в присутствии или в отсутствие сиалилтрансферазы. На диаграмме, "+Донор" показывает результаты реакции в присутствии 2 мМ CMP-Neu5Ac; "-Донор" показывает результаты реакции в отсутствие CMP-Neu5Ac; "+Донор, подвергшийся кипячению" показывает результаты реакции в присутствии 2 мМ CMP-Neu5Ac после нагревания при 100°С в течение 5 минут; и "-Фермент" показывает результаты реакции в отсутствие сиалилтрансферазы.
На левой диаграмме фигуры 3 показано относительное содержание (α2,6)тетрасиало-NA4-Fmoc и (α2,6)трисиало-NA4-Fmoc после реакции тетрасиало-NA4-Fmoc с сиалилтрансферазой ST6Gal1 при 37°С в течение 15 часов в присутствии или в отсутствие CMP-Neu5Ac или СМР. На правой диаграмме фигуры 3 показано относительное содержание (α2,3)тетрасиало-NA4-Fmoc и (α2,3)трисиало-NA4-Fmoc после реакции (α2,3)тетрасиало-NA4-Fmoc с сиалилтрансферазой (ST6Gal-I или ST3Gal-III) при 37°С в течение 15 часов в присутствии или в отсутствие CMP-Neu5Ac.
На фигуре 4 показано относительное содержание СМР после инкубирования CMP-Neu5Ac при 37°С, 33°С, 30°С или 25°С в течение 2 часов, 8 часов, или 24 часов.
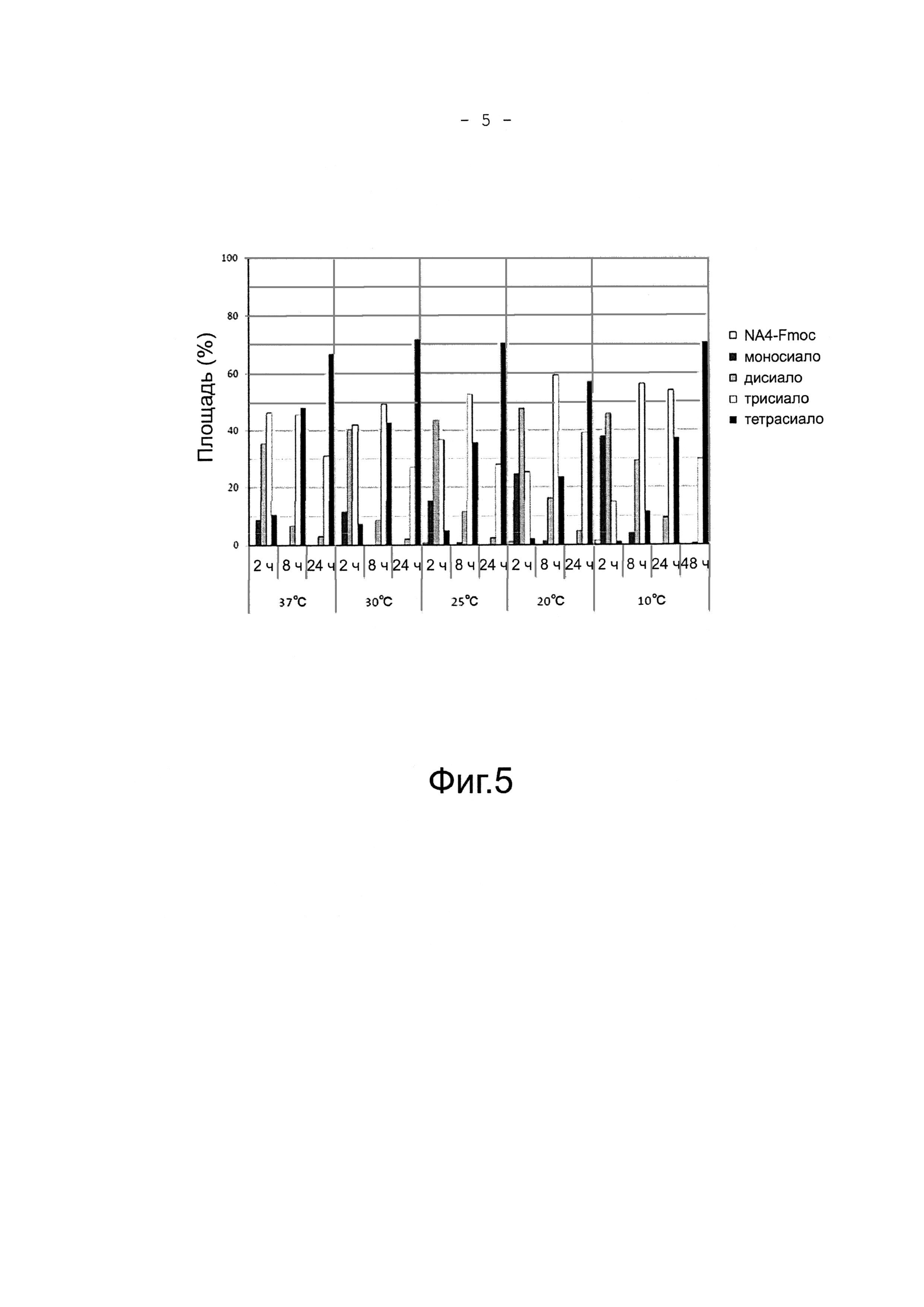
На фигуре 5 показано относительное содержание (α2,6)тетрасиало-NA4-Fmoc, (α2,6)трисиало-NA4-Fmoc, (α2,6)дисиало-NA4-Fmoc и (α2,6)моносиало-NA4-Fmoc после реакции NA4-Fmoc с сиалилтрансферазой ST6Gal1 при 37°С, 30°С, 25°С, 20°С или 10°С в течение 2 часов, 8 часов, или 24 часов в присутствии CMP-Neu5Ac.
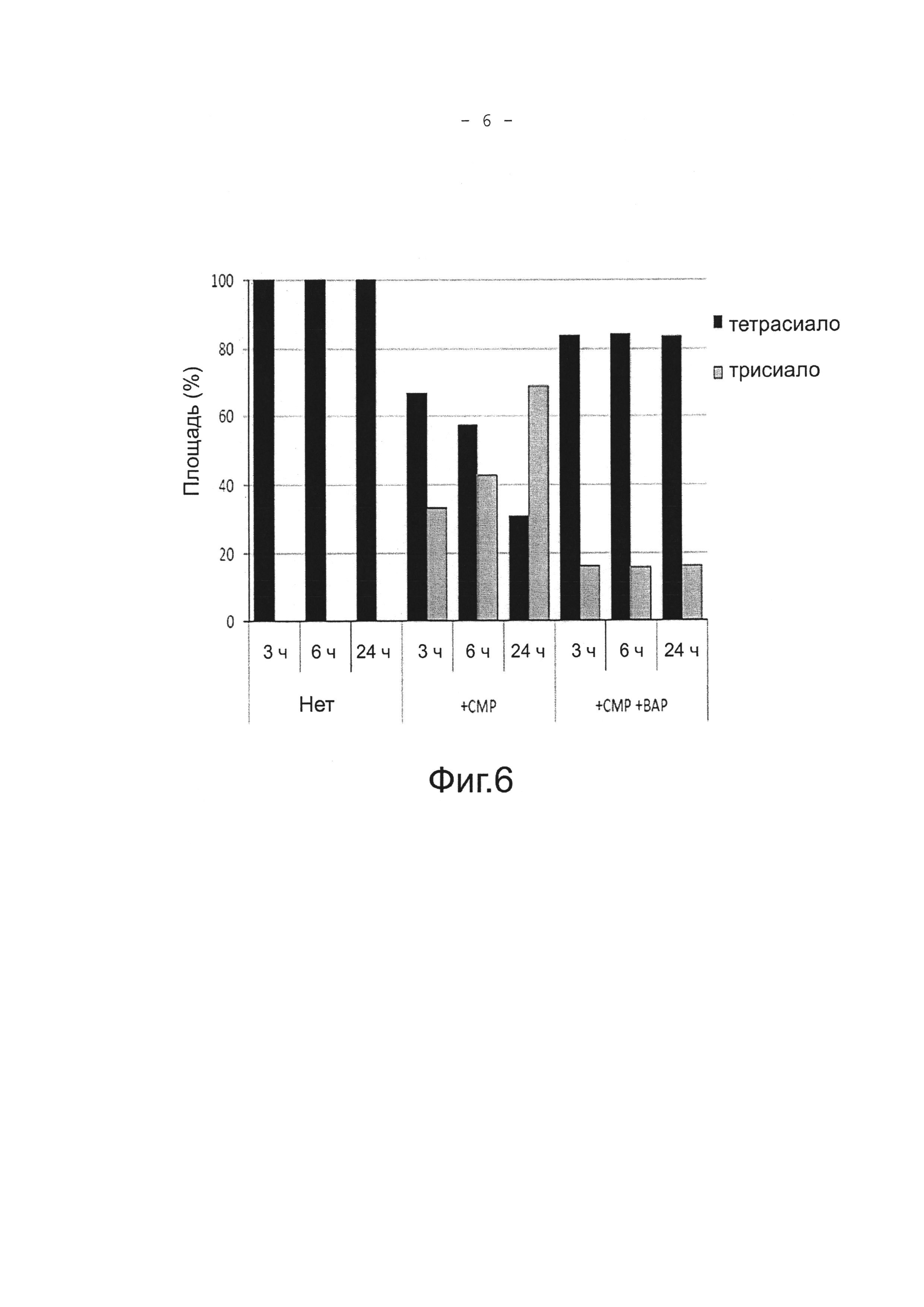
На фигуре 6 показано относительное содержание (α2,6)тетрасиало-NA4-Fmoc и (α2,6)трисиало-NA4-Fmoc после реакции (α2,6)тетрасиало-NA4-Fmoc с сиалилтрансферазой ST6Gal1 при 37°С в течение 3 часов, 6 часов, или 24 часов в отсутствие СМР и ВАР, в качестве контроля, в присутствии СМР или в присутствии СМР и ВАР.
На фигуре 7 приведена схема технологического процесса однореакторной реакции синтеза (α2,6)тетрасиало-NA4-Fmoc, описанную в разделе (7) примеров.
На фигуре 8 схематично показана реакция гликозилирования с использованием структурной формулы в однореакторной реакции синтеза (α2,6)тетрасиало-NA4-Fmoc, описанную в разделе (7) примеров.
Изображение на фигуре 9 относится к способу однореакторного синтеза (α2,6)тетрасиало-NA4-Fmoc, описанному в разделе (7) примеров. На диаграмме верхняя ВЭЖХ-хроматограмма, обозначенная как "+ST6Gall", представляет собой ВЭЖХ-хроматограмму продукта реакции; а нижняя ВЭЖХ-хроматограмму, обозначенная как "NGA2-Fmoc", представляет собой ВЭЖХ-хроматограмму исходного материала реакции.
Описание воплощений
В настоящем описании изобретения, «сиаловая кислота" представляет собой обобщенное обозначение для семейства производных нейраминовой кислоты, замещенных аминогруппой или гидроксигруппой. В этом контексте "нейраминовая кислота" представляет собой специальную нонозу, имеющую внутримолекулярные амино- и карбоксильную группы, и представлена следующей формулой:
Формула 6

В структуре сиаловой кислоты как известно аминогруппы в описанной выше нейраминовой кислоте замещают ацетилированием, гликолилированием или т.п. аминогруппы. В дополнение, как известно возможно, например, дезаминирование (элиминирование аминогруппы). Ацетилирование, метилирование, фосфорилирование, лактилирование или т.п. как известно, замещают гидроксигруппы, хотя замещение по настоящему изобретению не ограничено этим.
В настоящем описании изобретения, сиаловая кислота, предназначенная для переноса, представляет собой, предпочтительно, N-ацетилнейраминовую кислоту (Neu5Ac), которая наиболее часто встречается в природе, или N-гликолилнейраминовую кислоту (Neu5Gc), которая является второй по распространенности в природе, с точки зрения получения природных гликопротеинов или их сахарных цепей. N-ацетилнейраминовая кислота является более предпочтительной, в частности, с точки зрения получения природных гликопротеинов, таких как гликопротеины человека или их сахарные цепи.
В настоящем описании изобретения, "СМР-сиаловая кислота" означает цитидин-5′-монофосфо-сиаловую кислоту и относится к соединению, имеющему структуру, в которой гидроксигрупа в положении 2 сиаловой кислоты дегидратирована-конденсирована с фосфатной группой цитидинмонофосфата (СМР). Примеры СМР-сиаловой кислоты с более конкретно определенной сиаловой кислотой включают CMP-N-ацетилнейраминовую кислоту (CMP-Neu5Ac) и CMP-N-гликолилнейраминовую кислоту (CMP-Neu5Gc). В настоящем описании изобретения СМР-сиаловая кислота, применяемая в настоящем изобретении, представляет собой, предпочтительно, CMP-N-ацетилнейраминовую кислоту (CMP-Neu5Ac) или CMP-N-гликолилнейраминовую кислоту (CMP-Neu5Gc), с точки зрения получения природных гликопротеинов или их сахарных цепей, более предпочтительно, CMP-N-ацетилнейраминовую кислоту (CMP-Neu5Ac), в частности, с точки зрения получения природных гликопротеинов, таких как, гликопротеины человека или их сахарные цепи.
В настоящем описании изобретения, «сиалилтрансфераза" представляет собой один тип гликозилтрансфераз и относится к ферменту, который катализирует реакцию, посредством которой остаток сиаловой кислоты переносится из СМР-сиаловой кислоты, служащей в качестве сахара-донора (также называемого донорный субстрат) к структуре сахарной цепи, служащей в качестве сахара-акцептора (также называемого акцепторный субстрат) (в дальнейшем в этом документе эта реакция называется "реакция переноса сиаловой кислоты"). Известно, что сиалилтрансфераза переносит сиаловую кислоту на невосстанавливающий конец сахарной цепи. Реакцию переноса сиаловой кислоты можно представить реакционной схемой, показанной ниже. В случае применения производного сахарной цепи вместо сахарной цепи, сахарную цепь в схеме можно заменить производным сахарной цепи.
запись 1
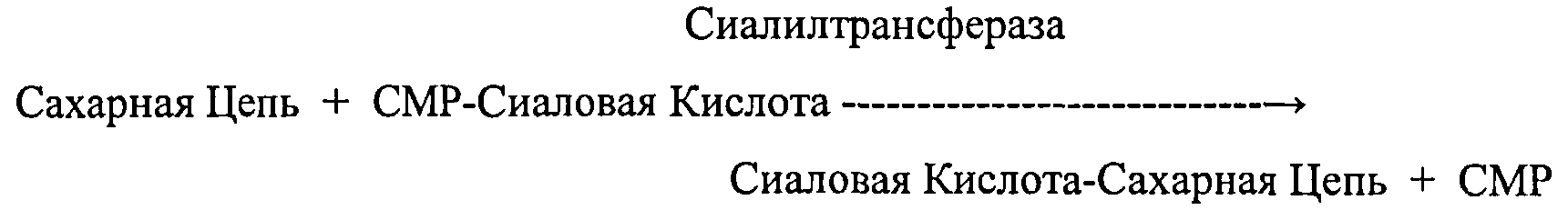
где сиаловая кислота-сахарная цепь представляет собой соединение, имеющее сиаловую кислоту, связанную посредством гликозидной связи с невосстанавливающим концом сахарной цепи.]
Известно, что сиалилтрансфераза переносит сиаловую кислоту в, например, положение 3 или 6 галактозы, положение 6 N-ацетилгалактозамина или положение 8 другой сиаловой кислоты на невосстанавливающем конце сахарной цепи. Например, фермент, переносящий сиаловую кислоту в положение 3 галактозы, называется α-2,3-сиалилтрансфераза; фермент, переносящий сиаловую кислоту в положение 6 галактозы или N-ацетилгалактозамина, называется α-2,6-сиалилтрансфераза; и фермент, переносящий сиаловую кислоту в положение 8 другой сиаловой кислоты, называется α-2,8-полисиалилтрансфераза.
Например, известна сиалилтрансфераза бактериального происхождения, а также сиалилтрансфераза радужной форели или сиалилтрансфераза млекопитающих. Также, в растениях был обнаружен белок, имеющей сиалилтрансфераза-подобную активность. Сиалилтрансфераза млекопитающих является предпочтительной, в частности, с точки зрения получения природных гликопротеинов, таких как гликопротеины млекопитающих или их сахарные цепи. Сиалилтрансфераза человека является более предпочтительной, с точки зрения получения природных гликопротеинов таких как, гликопротеины человека или их сахарные цепи.
α-2,6-сиалилтрансфераза человека известна как, например, ферменты ST6Gal-I (также называемых ST6Gal1; то же самое распространяется на описание ниже) и ST6Gal-II, переносящие сиаловую кислоту в положение 6 галактозы и ферменты ST6GalNAc-I, ST6GalNAc-II, ST6GalNAc-III и ST6GalNAc-IV, переносящие сиаловую кислоту в положение 6 N-ацетилгалактозамина.
α-2,3-сиалилтрансфераза человека известна как, например, ферменты ST3Gal-I - ST3Gal-VI, переносящие сиаловую кислоту в положение 3 галактозы.
Сиалилтрансфераза представляет собой, предпочтительно, ST6Gal-I, ST6Gal-II, ST3Gal-I, ST3Gal-II, ST3Gal-III, ST3Gal-IV, ST3Gal-VI, ST6GalNAc-I, ST6GalNAc-II, ST6GalNAc-III, ST6GalNAc-IV, ST8Sia-II, ST8Sia-III или ST8Sia-IV, в частности, с точки зрения получения природных гликопротеинов или их сахарных цепей. Альтернативно, ST6Gal-I, ST6Gal-II, ST3Gal-III, ST3Gal-IV, ST3Gal-VI, ST8Sia-II, ST8Sia-III или ST8Sia-IV являются предпочтительными, с точки зрения получения N-связанных сахарных цепей.
В настоящем описании изобретения, «сахарная цепь" относится к соединению, имеющему связь двух или более структурных единиц сахара(ов) (моносахаридов и/или их производных). В случае сахарной цепи, имеющей связь двух или более структурных единиц сахара, структурные единицы сахара связаны путем дегидратации - конденсации через гликозидную связь между ними. Примеры такой сахарной цепи включают, но не ограничиваются ими, моносахариды и полисахариды (глюкозу, галактозу, маннозу, фукозу, ксилозу, N-ацетилглюкозамин, N-ацетилгалактозамин, сиаловую кислоту и их комплексы и производные) содержащиеся in vivo, и широкий круг других сахарных цепей, таких как, разложившиеся полисахариды и сахарные цепи, отщепленные от или порожденные комплексными биомолекулами, включая гликопротеины, протеогликаны, гликозаминогликаны и гликолипиды. Сахарная цепь может быть линейной или разветвленной.
В настоящем описании изобретения «сахарная цепь" также включает соединение, имеющее модифицированный заместитель сахарной цепи. Примеры этого включают, но не ограничиваются ими, сахарные цепи, такие как, сахарные цепи, состоящие из сахаров, имеющих карбоксильную группу (например, альдоновую кислоту (например, D-глюконовую кислоту, продукт окисления D-глюкозы), которые представляют собой карбоновую кислоту, образующуюся путем окисления в положении С-1, и уроновую кислоту (например, D-глюкуроновую кислоту, продукт окисления D-глюкозы), которая представляет собой карбоновую кислоту, образующуюся путем окисления терминального атома углерода), сахара, имеющие аминогруппу или производное аминогруппы (например, ацетилированную аминогруппу) (например, N-ацетил-D-глюкозамин и N-ацетил-В-галактозамин), сахара, имеющие как амино, так и карбоксильную группы (например, N-ацетилнейраминовую кислоту (сиаловую кислоту) и N-ацетилмурамовую кислоту), дезоксидированные сахара (например, 2-дезокси-D-рибозу), сульфированные сахара, содержащие сульфатную группу, и фосфорилированные сахара, содержащие фосфатную группу.
В настоящем описании изобретения сахарная цепь представляет собой предпочтительно, сахарную цепь, которая находится в форме гликоконъюгата (гликопептида (или гликопротеина), протеогликана, гликолипида и т.д.) in vivo, предпочтительно, сахарную цепь, связанную с пептидом (или белком) с образованием гликопептида (или гликопротеина) in vivo, например, N-связанную сахарную цепь или O-связанную сахарную цепь, с точки зрения получения гликопротеинов, служащих в качестве лекарственных средств. N-связанная сахарная цепь представляет собой обобщенное обозначение для сахарных цепей, паттерн связывания которых с белком представляет собой связь между аномерной гидроксигруппой в N-ацетилглюкозамине на восстанавливающем конце сахарной цепи и аминогруппой (-NH2) боковой цепи аспарагина путем дегидратации-конденсации. O-связанная сахарная цепь представляет собой обобщенное обозначение для сахарных цепей, паттерн связывания которых с белком представляет собой связь между аномерной гидроксигруппой на восстанавливающем конце сахарной цепи и гидроксигруппой (-ОН) боковой цепи серина или треонина путем дегидратирования-конденсации.
N-связанную сахарную цепь также называют аспарагин-связанная сахарная цепь, сахарная цепь N-типа или т.п. N-связанная сахарная цепь представляет собой группу сахарных цепей, имеющих Man3-GlcNAc-GlcNAc в качестве ядра. Известно, что в зависимости от структуры сахарных цепей, связанных с Man в ядре, N-связанная сахарная цепь имеет определенную структуру сахарной цепи, называемую высокоманнозная, комплексная или гибридного типа. Также известна мультиантеннарная структура, такая как, биантеннарого типа, триантеннарого типа или тетраантеннарого типа, как разветвленная структура N-связанной сахарной цепи. Эти структуры сахарных цепей также описаны, например, в Seikagaku Jiten (Encyclopedia Biochemistry in English), 3rd ed., issued Tokyo Kagaku Dojin Co., Ltd.
В настоящем описании изобретения первая сахарная цепь или производное, т.е., сахарная цепь или ее производное, служащая в качестве сахара-акцептора в присутствии сиалилтрансферазы и фосфатазы, никак конкретно не ограничивается при условии, что сахарная цепь или производное имеет на своем невосстанавливающем конце структуру сахарной цепи, служащую в качестве субстрата сиалилтрансферазы. Известно, что многие природные гликопротеины содержат разветвленную(ые) сахарную(ая) цепь(и), имеющую(ие) структуру(ы) в которой(ых) сиаловая кислота связана с невосстанавливающим концом N-связанной сахарной цепи комплексного или гибридного типа. Первая сахарная цепь или ее производное представляет собой, предпочтительно, N-связанную комплексную сахарную цепь или N-связанную гибридную сахарную цепь, более предпочтительно, N-связанную комплексную сахарную цепь, способную иметь сиаловую кислоту на каждом из своих невосстанавливающих концов, с точки зрения получения этих сахарных цепей. Разветвленная структура, представляет собой, предпочтительно, N-связанную триантеннарную или тетраантеннарную сахарную цепь, которую ранее было сложно получить. N-связанная триантеннарная или тетраантеннарная комплексная сахарная цепь является более предпочтительной.
В настоящем описании "первая сахарная цепь или ее производное" относится к сахарной цепи или ее производному, которое применяют в качестве исходного материала (также называемого исходным соединением) в реакции переноса сиаловой кислоты, и также относится к сахарной цепи, имеющей, по меньшей мере, на одном невосстанавливающем конце структуру сахарной цепи, служащую в качестве субстрата сиалилтрансферазы. "Первую сахарную цепь или ее производное", применяемые в реакции переноса сиаловой кислоты, именуют также "сахар-акцептор" или "акцепторный субстрат", в то время как "СМР-сиаловая кислота" именуют также "сахар-донор" или "донорный субстрат". Применяемая "первая сахарная цепь или ее производное" представляет собой, предпочтительно, например, соединение, имеющее структуру субстрата сиалилтрансферазы на каждом невосстанавливающем конце разветвленной сахарной цепи, или, иными словами, соединение, имеющее структуру, полностью дефицитную по сиаловой кислоте, относительно "сиалированной второй сахарной цепи или ее производного", как целевого соединения. В настоящем описании изобретения такую сахарную цепь именуют также "асиало-сахарная цепь", "асиало-форма" или "асиало".
В настоящем описании изобретения, асиало-сахарная цепь является предпочтительно, например, тетраантеннарной сахарной цепью, представленной формулой, показанной ниже, или ее производным.
В настоящем описании изобретения, асиало-тетраантеннарная N-связанная комплексная сахарная цепь или ее производное является, предпочтительно, например, сахарной цепью, представленной следующей формулой:
Формула 7

или ее производным.
В настоящем описании изобретения, асиало-триантеннарная N-связанная комплексная сахарная цепь или ее производное является, предпочтительно, например, сахарной цепью, представленной следующей формулой:
Формула 8

или ее производным.
В настоящем описании изобретения, асиало-биантеннарная N-связанная комплексная сахарная цепь или ее производное является, предпочтительно, например, сахарной цепью, представленной следующей формулой:
Формула 9

или ее производным.
В дополнение к этим сахарным цепям, сахарная цепь, имеющая сиаловую кислоту, связанную посредством гликозидной связи с одним или более положением(ями) на невосстанавливающих концах каждой сахарной цепи, или ее производное, может быть использована в качестве сахара-акцептора в реакции переноса сиаловой кислоты по настоящему изобретению. Обычные способы редко приводят к получению мультиантеннарной сахарной цепи, имеющей сиаловую кислоту на каждом из своих невосстанавливающих концов сахарной цепи. Даже такую сахарную цепь, полученную обычным способом, можно превратить в сахарную цепь, имеющую сиаловую кислоту на каждом из своих невосстанавливающих концов, с помощью реакции переноса сиаловой кислоты по настоящему изобретению. Примеры сахарной цепи, полученной обычными способами, включают соединения, представленные следующими формулами:
Формула 10

Эти соединения можно получить обычными способами, или можно также получить путем изменения времени реакции в способе настоящего изобретения.
Сахарная цепь, имеющая сиаловую кислоту, связанную посредством гликозидной связи с одним или более положением(ями) на ее невосстанавливающих концах, или ее производное могут быть использованы в качестве первой сахарной цепи или ее производного, тогда как может быть использована сиалилтрансфераза, которая образует гликозидную связь, иную, чем связь сиаловой кислоты в соединении. В таком случае можно получить соединение, имеющее различные типы гликозидной связи остатков сиаловой кислоты.
В настоящем описании "производное сахарной цепи" также включает соединение, имеющее дополнительное соединение, связанное с восстанавливающим концом сахарной цепи посредством дегидратации-конденсации или т.п. "Производным сахарной цепи" является, например, соединение, дополнительно имеющее R, связанный с N-ацетилглюкозамином на восстанавливающем конце сахарной цепи, представленное следующей формулой:
Формула 11

Это производное сахарной цепи приведено только в целях иллюстрации, и можно также привести производные других сахарных цепей: сахарные цепи плюс -R на восстанавливающих концах сахарных цепей.
Производное сахарной цепи также включает сахарную цепь, содержащую аминокислоту, пептид, белок, линкер, флуоресцентную группу, липид, низкомолекулярное соединение, радиоактивное соединение или т.п., как фрагмент R на восстанавливающем конце. "Аминокислота" включает не только природные аминокислоты, но и неприродные аминокислоты, такие как, вариантные аминокислоты и производные аминокислот. Аминокислота, пептид, белок или т.п. могут быть защищены защитной группой по некоторым или по всем функциональным группам, таким как, гидрокси-, амино-, и карбоксильная группы. Примеры защитной группы для гидроксигруппы могут включать группы: метил, бензил, бензоил, ацетил, триметилсилил (TMS), триэтилсилил (TES), и трет-бутилдиметилсилил (TBS или TBDMS). Примеры защитной группы для аминогруппы могут включать липидорастворимые защитные группы, включая карбонатную или амидную защитные группы, такие как, 9-флуоренилметоксикарбонильная (Fmoc), трет-бутилоксикарбонильная (Boc), бензильная, аллилоксикарбонильная и ацетильная группы. В случае введения липидорастворимой защитной группы, например, группы Fmoc, эту группу можно вводить с помощью реакции путем прибавления 9-флуоренилметил-N-сукцинимидилкарбоната и карбоната натрия.
Примеры защитных групп для карбоксильной группы могут включать бензильную, аллильную, и дифенилметильную группы. Эти защитные группы приведены только в целях иллюстрации, и защитные группы по настоящему изобретению не ограничиваются ими. Поскольку сиалилтрансфераза действует на невосстанавливающий конец сахарной цепи, любой аддукт можно использовать для восстанавливающего конца сахарной цепи, если аддукт не оказывает большого влияния на реакцию переноса в сахаре. Линкер является полезным для присоединения полученной сахарной цепи к аминокислоте, белку, или т.п. Примеры этого могут включать, но не ограничиваются, -NH-(CO)-(CH2)a-CH2- (где а является любым целым числом, без ограничений, если функции линкера, представляющие интерес, не ингибируются, и предпочтительно, является целым числом от 0 до 4), C1-10-полиметилен-, и -СН2-R1- (где R1 представляет собой группу, образующуюся путем элиминирования одного атома водорода из групп, выбранных из группы, состоящей из алкильной, замещенной алкильной, алкенильной, замещенной алкенильной, алкинильной, замещенной алкинильной, арильной, замещенной арильной, карбоциклической групп, замещенной карбоциклической группы, гетероциклической группы, и замещенной гетероциклической группы). Флуоресцентная группа является полезной для применения в очистке полученной сахарной цепи, исследовании сахарной цепи и т.д. Примеры таковых могут включать данзильную, пиридиламиновую (РА), 2-аминобензамидную (2-АВ) группы, 2-аминобензойную кислоту (2-АА) и 9-аминопирен-1,4,6-трисульфоновую кислоту (APTS). Альтернативно, производное сахарной цепи может содержать в любом порядке два или более аддуктов, таких как, сахарная цепь-аминокислота и дополнительный линкер, присоединенный к нему, или сахарную цепь и аминокислоту, связанные при посредстве линкера.
В настоящем описании изобретения, производное сахарной цепи представляет собой, предпочтительно, сахарная цепь-аминокислота, гликозилированный пептид или гликозилированный белок, более предпочтительно, сахарная цепь-аспарагин (также обозначаемый сахарная цепь-Asn), с точки зрения получения сахарных цепей природных гликопротеинов. Соединение, содержащее защитную группу, связанную с сахарная цепь-аспарагин (также обозначаемое сахарная цепь-Asn-R2, где R2 представляет собой защитную группу), является предпочтительным, с точки зрения применения полученного сахарная цепь-аспарагин в твердофазном синтезе. В дополнение к липидорастворимым защитным группам, представленным в качестве примера выше, защитные группы, широко известные специалистам в данной области, можно применять в качестве защитных групп. Например, сахарная цепь-аспарагин-Fmoc (сахарная цепь-Asn-Fmoc) или сахарная цепь-аспарагин-Вос (сахарная цепь-Asn-Boc), которые представляют собой сахарная цепь-аспарагин, имеющий липидорастворимые защитные группы Fmoc или Boc или т.п., является предпочтительными.
В настоящем описании изобретения «сиалированная вторая сахарная цепь или ее производное" относится к сахарной цепи или ее производному, которое представляет собой продукт реакции переноса сиаловой кислоты, и относится к сахарной цепи, имеющей сиаловую кислоту на, по меньшей мере, одном невосстанавливающем конце, или ее производному. "Сиалированная вторая сахарная цепь или ее производное" представляет собой, предпочтительно, сахарную цепь, имеющую сиаловую кислоту на каждом из своих невосстанавливающих концов, имеющую структуру субстрата сиалилтрансферазы среди невосстанавливающих концов, или ее производное. "Сиалированная вторая сахарная цепь или ее производное" является более предпочтительно, сахарной цепью, имеющей сиаловую кислоту на каждом из своих невосстанавливающих концов или ее производным.
В настоящем описании изобретения, Сиалированная сахарная цепь или ее производное может быть определено в терминах количества молекул сиаловой кислоты, связанных в единую молекулу сахарной цепи. Сиалированная сахарная цепь или ее производное называется "тетрасиало-", когда 4 молекулы сиаловой кислоты связаны с 1 молекулой сахарной цепи, "трисиало-", когда 3 молекулы сиаловой кислоты связаны с 1 молекулой сахарной цепи, "дисиало-", когда 2 молекулы сиаловой кислоты связаны с 1 молекулой сахарной цепи, и "моносиало-", когда 1 молекула сиаловой кислоты связана с 1 молекулой сахарной цепи. Альтернативно, такую сиалированную сахарную цепь или ее производное называют также "тетрасиало-сахарная цепь", "тетрасиало-форма" или т.п. Например, соединение, имеющее 4 молекулы сиаловой кислоты, связанные с 1 тетраантеннарой молекулой сахарной цепи, можно назвать "тетрасиалотетраантеннарная" сахарная цепь; соединение, имеющее 3 молекулы сиаловой кислоты, связанные с 1 тетраантеннарной молекулой сахарной цепи, можно назвать "трисиалотетраантеннарная" сахарная цепь; и соединение, имеющее 3 молекулы сиаловой кислоты, связанные с 1 триантеннарной молекулой сахарной цепи, можно назвать "трисиалотриантеннарная" сахарная цепь.
В настоящем описании изобретения, термин "тетрасиало-" включает любое соединение, имеющее 4 молекулы сиаловой кислоты, связанные с 1 молекулой сахарной цепи, независимо от типа гликозидной связи между каждой сиаловой кислотой и сахарной цепью, например, соединение, имеющее все гликозидной связи в виде (α2,6)-связей, соединение, имеющее все гликозидной связи в виде (α2,3)-связей, и соединение, имеющее некоторые гликозидные связи в виде (α2,6)-связей, а другие гликозидные связи в виде (α2,3)-связей. Однако термин "(α2,6)тетрасиало-", в настоящем описании изобретения, относится к соединению, в котором все 4 молекулы сиаловой кислоты связаны посредством (α2,6)-связей с сахарной цепью. Термин "(α2,3)тетрасиало-", в настоящем описании изобретения, относится к соединению, в котором все 4 молекулы сиаловой кислоты связаны посредством (α2,3)-связей с сахарной цепью. На паттерн гликозидной связи, образующейся между сиаловой кислотой и невосстанавливающим концом "первой сахарной цепи или ее производного" с помощью сиалилтрансферазы, не накладывается конкретных ограничений и она представляет собой, предпочтительно, α2,6, α2,3 или α2,8-связь. Когда «сиалированная вторая сахарная цепь или ее производное" имеет множество молекул сиаловой кислоты на невосстанавливающих концах сахарной цепи, гликозидные связи, образующиеся между молекулами сиаловой кислоты и невосстанавливающими концами "первой сахарной цепи или ее производного", могут иметь один или различные паттерны.
В настоящем описании изобретения, «сиалированная вторая сахарная цепь или ее производное", как продукт реакции переноса сиаловой кислоты, является предпочтительно, например, сахарной цепью, представленной формулой, показанной ниже, или ее производным.
Тетраантеннарная N-связанная комплексная сахарная цепь, имеющая сиаловую кислоту на каждом из своих невосстанавливающих концов второй сахарной цепи (в настоящем описании изобретения также называемая тетрасиалотетраантеннарная N-связанная комплексная сахарная цепь), в качестве «сиалированной второй сахарной цепи или ее производного" является предпочтительно, например, сахарной цепью, представленной следующей формулой:
Формула 12

Альтернативно, триантеннарная N-связанная комплексная сахарная цепь, имеющая сиаловую кислоту на каждом из своих невосстанавливающих концов второй сахарной цепи (в настоящем описании изобретения, также называемая трисиалотриантеннарная N-связанная комплексная сахарная цепь), в качестве «сиалированной второй сахарной цепи или ее производного" является предпочтительно, например, сахарной цепью, представленной следующей формулой:
Формула 13

Альтернативно, биантеннарная N-связанная комплексная сахарная цепь, имеющая сиаловую кислоту на каждом из своих невосстанавливающих концов второй сахарной цепи (в настоящем описании изобретения, также называемая дисиалобиантеннарная N-связанная комплексная сахарная цепь), в качестве «сиалированной второй сахарной цепи или ее производного" является предпочтительно, например, сахарной цепью, представленной следующей формулой:
Формула 14

В контексте данного изобретения известно, что N-связанная комплексная сахарная цепь также встречается в форме соединения, имеющего Fuc или Gn, связанные с любой из сахарных цепей, описанных выше. Такое соединение также включено в объем настоящего изобретения. Более конкретно, известно, что: Fuc является α1,6-связанным с Gn на восстанавливающем конце; Gn является β1,4-связанным в положении 4 Man, связанной с Gn на восстанавливающем конце; и Fuc является α1,3- или α1,4-связанным с Gn на разветвляющем фрагменте. Соединение, имеющее Gn(β1,4)Man или Gn(β1,2)Man вместо Gn(β1,6)Man, как паттерн связывания на разветвляющем фрагменте любой из сахарных цепей описанных, выше; соединение, имеющее Gn(β1,2)Man вместо Gn(β1,4)Man там же, и сахарная цепь, имеющая гликозидные связи, отличающиеся по паттерну связывания, такая как, соединение, имеющее Sia(α2,3)Gal вместо некоторых фрагментов со связанной сиаловой кислотой Sia(α2,6)Gal, или соединение, имеющее Sia(α2,6)Gal вместо некоторых фрагментов Sia(α2,3)Gal, также включены в объем настоящего изобретения.
В настоящем описании изобретения, "фосфатаза" относится к ферменту, который катализирует реакцию, посредством которой эфир фосфорной кислоты гидролизуется. На фосфатазу не накладывается конкретных ограничений при условии, что фосфатаза проявляет активность в гидролизе эфира фосфорной кислоты в СМР в условиях реакции для гликозилтрансферазы. Например, в качестве фосфатаз известны щелочная фосфатаза, которая является активной в щелочных условиях, или кислая фосфатаза, которая является активной в кислотных условиях. Известно, что щелочная фосфатаза широко распространена повсюду в организме, включая печень, почки, костеобразующие клетки, плаценту, и тонкий кишечник. Известно, что кислая фосфатаза накапливается в лизосомах, и ее также обнаруживают в различных органах или плазме. Например, известна фосфатаза бактерий, фосфатаза Е.coli, фосфатаза креветок или млекопитающих. Например, известны щелочная фосфатаза Е.coli (ВАР), щелочная фосфатаза быка (CIP, CAP или CIAP) и щелочная фосфатаза креветок (SAP).
Реакция переноса сиаловой кислоты в настоящем описании изобретения будет описана.
Применяемая сиалилтрансфераза может представлять собой коммерчески доступный продукт (α2,3-(N)-Сиалилтрансферазу Крысы, Рекомбинантную, S.frugiperda, α2,3-(O)-Сиалилтрансферазу Крысы, Рекомбинантную, S.frugiperda, α2,6-(N)-Сиалилтрансферазу Человека, Рекомбинантную S.frugiperda, Рекомбинантную бета-галактозид-альфа-2,3-сиалилтрансферазу, Рекомбинантную бета-галактозид-альфа-2,6-сиалилтрансферазу и т.д.) или ее можно получить путем получения гена с применением ПЦР-амплификации, или химического синтеза генна на основе общеизвестной генной последовательности или аминокислотной последовательности; введения полученного гена в вектор экспрессии, такой как плазмида; и получения фермента, как рекомбинанта, при использовании системы экспрессии Е.coli, дрожжей, клеток насекомых, клеток растений, клеток животных, или т.п. Альтернативно, сиалилтрансферазу можно выделить из биологического образца, такого как, ткань тонкого кишечника быка или культивированные клетки животных, и использовать в настоящем изобретении. Специалисты в данной области, могут получать сиалилтрансферазу при использовании любого из способов, описанных в настоящем описании изобретения, или соответствующих модификаций этих способов.
Применяемая фосфатаза может также быть коммерчески доступным продуктом, например, Бактериальной Щелочной Фосфатазой (Е.coli), Щелочной Фосфатазой кишечника Теленка (CIP) или Щелочной Фосфатазой из Креветки (SAP) или ее можно получать соответствующим образом.
Применяемая СМР-сиаловая кислота может также быть коммерчески доступным продуктом, например, цитидин-5′-монофосфо-N-ацетилнейраминовой кислотой (динатрий-) или ее можно получать соответствующим образом.
На реакционный растворитель, применяемый в реакции в сиалилтрансферазы, не накладывается конкретных ограничений при условии, что растворитель допускает условия, при которых активность сиалилтрансферазы сохраняется. Стабилизатор (например, белок бычьей сыворотки), поверхностно-активное вещество или т.п. можно добавить к реакционному растворителю. Например, можно применять водный раствор, содержащий 0,1 М Трис-HCl (рН 7,5), 1 мМ MnCl2, и 0,1% Тритона Х-100. Специалисты в данной области, могут соответствующим образом модифицировать реакционный растворитель для использования.
На рН реакционного растворителя не накладывается конкретных ограничений внутри диапазона, в котором сохраняется активность сиалилтрансферазы. Оптимальный диапазон рН для сиалилтрансферазы составляет, предпочтительно, порядка 5-10, более предпочтительно, порядка 7-8. Реакционный растворитель можно приготовить при слабощелочном рН или кислотном рН, предпочтительнее, чем при нейтральном, с учетом диапазона, в котором сохраняется активность применяемой фосфатазы.
На температуру реакции не накладывается конкретных ограничений при условии, что температура допускает условия, при которых активность сиалилтрансферазы сохраняется. Оптимальная температура для фермента составляет, предпочтительно, около 37°С. Температура реакции составляет, предпочтительно, 10°С-40°С, более предпочтительно, 20°С-37°С, еще более предпочтительно, 25°С-37°С. 25°С-30°С является предпочтительной с точки зрения предотвращения разложения СМР-сиаловой кислоты сиалилтрансферазой.
На время реакции не накладывается конкретных ограничений при условии, что время является достаточным для осуществления реакции переноса сиаловой кислоты. Специалисты в данной области, могут соответствующим образом определять время реакции. В частности, в случае переноса сиаловой кислоты на каждый невосстанавливающий конец мультиантеннарной сахарной цепи, можно задать время реакции, предпочтительно, 8 часов - 48 часов, более предпочтительно, 16-24 часа.
Во время реакции, сахар-донор СМР-сиаловой кислоты, а также фосфатазу или сиалилтрансферазу можно добавлять после начала реакции в течение заданного времени, с последующим взаимодействием. Их можно добавлять одновременно или можно добавлять по отдельности с соответствующим временным интервалом. Например, после 24 часов реакции, СМР-сиаловую кислоту и сиалилтрансферазу можно добавлять для дополнительного взаимодействия в течение 24 часов.
В настоящем описании изобретения, применяемую первую сахарную цепь или ее производное можно очищать и выделять из природного продукта, выделять из гликопротеина, синтезированного в системе экспрессии, синтезировать химическим путем или ферментативным путем или т.п. Альтернативно, эти продукты можно дополнительно подвергать, например, реакции удлинения сахарной цепи и затем применять в реакции по настоящему изобретению. Реакция удлинения сахарной цепи может включать: в соответствии с паттерном гликозидной связи целевой структуры сахарной цепи, выбор фермента, который катализирует образование гликозидной связи; и удлинение сахарной цепи последовательно, в соответствии с порядком связывания сахаров, составляющих сахарную цепь, для получения сахарной цепи, представляющей интерес.
Согласно одному объекту настоящего изобретения, мультиантеннарная N-связанная комплексная сахарная цепь, используемая в качестве сахарной цепи, служащей в качестве сахара-акцептора в реакции переноса сиаловой кислоты или ее производного, образуется посредством реакции удлинения сахарной цепи, с сахарной цепью, представленной следующей формулой (в дальнейшем в этом документе, называемой агалакто-биантеннарной сахарной цепью) или ее производным в качестве исходного материала:
Формула 15

Например, агалакто-биантеннарую сахарную цепь-Asn-Fmoc, представленную следующей формулой, можно использовать в качестве производного вышеописанной сахарной цепи:
Формула 16

Согласно одному объекту настоящего изобретения, тетраантеннарную N-связанную комплексную сахарную цепь, используемую в качестве первой сахарной цепи или ее производного, можно получать с помощью стадий:
(a) взаимодействия агалакто-биантеннарной сахарной цепи, представленной вышеописанной формулой, или ее производного с UDP-GlcNAc в присутствии N-ацетилглюкозаминилтрансферазы; и
(b) взаимодействия продукта стадии (а) с UDP-Gal в присутствии галактозилилтрансферазы.
N-ацетилглюкозаминилтрансфераза может быть выбрана, в соответствии с гликозидной связью, которая образуется между сахарной цепью и сахаром, подлежащим переносу. Например, фермент, который катализирует образование β1-6-связи, может быть выбран, когда гликозидной связью, представляющей интерес, является β1-6-связь. Альтернативно, фермент, который катализирует образование β1-4-связи, может быть выбран, когда гликозидной связью, представляющей интерес, является β1-4-связь. Примеры фермента, который катализирует образование β1-6-связи (β1,6-N-ацетилглюкозаминилтрансфераза), могут включать MGAT5 человека и GnTPET-V быка. Примеры фермента, который катализирует образование β1-4-связи (β1,4-N-ацетилглюкозаминилтрансфераза), могут включать MGAT4a человека, MGAT4b человека, и GnTPET-Iva быка.
Галактозилилтрансфераза может быть выбрана, в соответствии с гликозидной связью, которая образуется между сахарной цепью и сахаром, подлежащим переносу. Фермент, который катализирует образование β1-4-связи, может быть выбран, когда гликозидной связью, представляющей интерес, является β1-4-связь. Примеры фермента могут включать β4GalT1, β4GalT2 и β1,4-галактозилилтрансферазу из Helicobacter pylori.
В случае получения тетраантеннарной сахарной цепи, представленной следующей формулой:
Формула 17
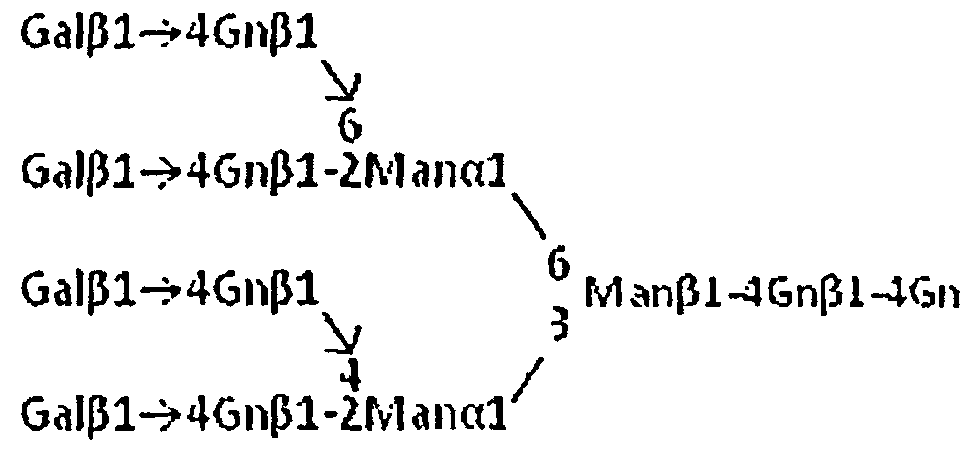
или ее производного сахарную цепь или производное можно получать, например, с применением MGAT4a и MGAT5 в качестве N-ацетилглюкозаминилтрансферазы на стадии (а) и β4GalT1 в качестве галактозилилтрансферазы на стадии (b). Ферменты в этом сочетании можно заменить ферментами, приведенными в пример выше, и т.д., для получения сахарной цепи, представляющей интерес.
Согласно одному объекту настоящего изобретения, триантеннарную N-связанную комплексную сахарную цепь, используемую в качестве первой сахарной цепи или ее производного, можно также получать тем же способом, что и тетраантеннарную сахарную цепь.
В случае получения триантеннарной сахарной цепи, представленной следующей формулой:
Формула 18

или ее производного сахарную цепь или производное можно получать, например, с применением MGAT4a в качестве N-ацетилглюкозаминилтрансферазы на стадии (а) и β4GalT1 в качестве галактозилилтрансферазы на стадии (b).
Альтернативно, в случае получения триантеннарной сахарной цепи, представленной следующей формулой:
Формула 19

или ее производного, сахарную цепь или производное можно получать, например, с применением MGAT5 в качестве N-ацетилглюкозаминилтрансферазы на стадии (а) и β4GalT1 в качестве галактозилилтрансферазы на стадии (b). Ферменты в этом сочетании можно заменить ферментами, приведенными в пример выше, и т.д., для получения сахарной цепи, представляющей интерес.
Согласно одному объекту настоящего изобретения, биантеннарную N-связанную комплексную сахарную цепь, используемую в качестве первой сахарной цепи, или ее производное можно получать с помощью стадии:
(b) взаимодействия агалакто-биантеннарной сахарной цепи, представленной вышеописанной формулой, с UDP-Gal в присутствии галактозилилтрансферазы.
Галактозилилтрансфераза является той же самой, что и в случае тетраантеннарной N-связанной комплексной сахарной цепи.
Согласно одному объекту настоящего изобретения, первая сахарная цепь или ее производное может представлять собой соединение, содержащее тетраантеннарную N-связанную комплексную сахарную цепь или ее производное, и дополнительно содержащее фукозу или N-ацетилглюкозамин, присоединенные к ней. В таком случае, этот сахар можно присоединять с использованием фукозилтрансферазы или N-ацетилглюкозаминилтрансферазы.
Согласно одному объекту настоящего изобретения, первую сахарную цепь или ее производное можно получать посредством реакции удлинения сахарной цепи с вышеописанной агалакто-биантеннарной сахарной цепью в качестве исходного материала или можно также получать путем необходимой реакции удлинения сахарной цепи, например, с гликопептидом из желтка куриного яйца, содержащим агалакто-биантеннарную сахарную цепь или РА-агалакто-биантеннарную сахарную цепь (продает Takara Bio Inc.), в качестве исходного материала.
Согласно одному аспекту настоящего изобретения, первую сахарную цепь или ее производное можно получать посредством реакции удлинения сахарной цепи, которая включает выделение и очистку сахарной цепи или ее производного в качестве продукта реакции удлинения сахарной цепи, после каждой реакции удлинения сахарной цепи; и, затем, применение образовавшейся сахарной цепи или ее производного в следующей реакции удлинения сахарной цепи.
Согласно одному аспекту настоящего изобретения, реакцию переноса сиаловой кислоты осуществляют как однореакторную реакцию синтеза, следующую за реакцией удлинения сахарной цепи, для получения сахарной цепи, сиалированной на ее невосстанавливающем конце, или ее производного.
В настоящем описании изобретения, однореакторный синтез относится к способу синтеза целевого соединения без выделения или очистки промежуточных соединений во время процесса, что приводит к синтезу целевого соединения. Однореакторную реакцию синтеза для производства сахарной цепи, представляющей интерес, можно осуществлять с помощью стадий:
(a) однократного или многократного осуществления стадии взаимодействия исходного материала (соединения) с UDP-сахаром, служащим в качестве субстрата гликозилтрансферазы в присутствии гликозилтрансферазы; и
(b) взаимодействия продукта стадии (а) с СМР-сиаловой кислотой в присутствии сиалилтрансферазы и фосфатазы.
В этом способе реакция стадии (а) может включать, например, стадию получения биантеннарной - тетраантеннарной N-связанной комплексной сахарной цепи, описанную выше.
В однореакторной реакции синтеза перед началом реакции переноса сахара на стадии (а) (или каждой реакции переноса сахара в случае осуществления множества реакций переноса сахара на стадии (а)) или реакции переноса сиаловой кислоты на стадии (b), как например, в случае стадии (а), готовят концентрированный раствор гликозилтрансферазы и концентрированный раствор UDP-caxapa, служащего для нее в качестве субстрата, и небольшие количества этих растворов можно прибавлять для осуществления реакции.
В однореакторной реакции синтеза, термообработку можно осуществлять после реакции переноса сахара на стадии (а) (или после каждой реакции переноса сахара и перед началом следующей реакции переноса сахара в случае осуществления множества реакций переноса сахара на стадии (а)) чтобы, тем самым, остановить катализируемую гликозилтрансферазой реакцию переноса сахара в реакционной системе. В результате выход продукта реакции можно дополнительно увеличить. Также, такую термообработку можно осуществлять после завершения стадии (b).
На условия термообработки не накладывается особенных ограничений при условии, что фермент инактивируется в этих условиях. Термообработку можно осуществлять, например, путем инкубирования в течение заданного времени при температуре, равной или выше, чем 90°С. Предпочтительно, термообработку можно осуществлять при приблизительно 90°С-100°С в течение приблизительно 5-10 минут. Условия термообработки могут быть изменены соответствующим образом лицами, квалифицированным в данной области.
Согласно одному аспекту настоящего изобретения, сахарную цепь, полученную таким образом, можно очищать с помощью хорошо известного способа (например, ВЭЖХ). Условия ВЭЖХ можно задавать, например, согласно условиям, описанным в Примерах настоящего описания изобретения или можно изменять соответствующим образом лицам, квалифицированным в данной области, в соответствии со структурой сахарной цепи.
Термины в настоящем описании изобретения использованы для иллюстрации конкретных воплощений и не предназначены для ограничения изобретения.
Термин "содержащий", применяемый в настоящем описании изобретения, означает, что присутствуют описываемые позиции (члены, стадии, факторы, количества и т.д.), и не исключено присутствие других позиций (членов, стадий, факторов, количеств и т.д.), если только из контекста с очевидностью не следует иное.
Все термины (включая технические термины и научные термины), применяемые здесь, имеют те же самые значения, что и термины, доступные для понимания в широком смысле специалистам в данной области, к которой настоящее изобретение принадлежит, если не дано иное определение. Термины, применяемые здесь, следует интерпретировать, как имеющие значения, соответствующие значениям в настоящем описании изобретения и смежных областях техники, и не следует интерпретировать в идеализированном или чрезмерно формальном смысле, если не дано иное определение.
Воплощения по настоящему изобретению могут быть описаны со ссылкой на схематический чертеж. Однако такой схематический чертеж может быть увеличен с целью ясной иллюстрации.
Термины, такие как, "первый" или "второй" используют для выражения различных факторов. Однако подразумевается, что эти факторы не ограничены этими терминами. Эти термины используют только для разграничения одного фактора от другого фактора. Например, первый фактор может быть описан, как второй фактор, и, наоборот, без выхода за пределы объема настоящего изобретения.
В дальнейшем в этом документе, настоящее изобретение будет описано более подробно со ссылкой на Примеры. Однако настоящее изобретение можно воплотить в различных объектах. Таким образом, подразумевается, что настоящее изобретение никоим образом не ограничено Примерами, описанными здесь.
Примеры
(1) Экспрессия ST6Gal-I
иРНК-последовательность ST6Gal-I человека зарегистрирована под Номером Доступа Х62822 в общедоступной базе данных GenBank. Ее аминокислотная последовательность зарегистрирована под Номером Доступа Р15907 в GenBank. На основе этой аминокислотной последовательности, синтезировали соответствующим образом полный ген, с частотой использования кодонов Ogataea minuta. Ген синтезировали таким образом, что ST6Gal-I человека была экспрессирована в форме включающей цитоплазматический домен и трансмембранный участок, но без 48 N-терминальных аминокислот. Синтезированный ген был фланкирован сайтами рестрикционного фермента BamHI для того, чтобы облегчить его введение в вектор экспрессии. Его последовательность представлена в SEQ ID NO:1. Участок, содержащий эту последовательность, отщепляли с помощью BamHI, и затем вводили в сайт BamHI вектора экспрессии pOMEA1-10H3F дрожжей Ogataea minuta, потребляющих метанол, для получения pOMEA1-10H3F-ST6Gal-I. Эту плазмиду pOMEA1-10H3F-ST6Gal-I расщепляли с помощью NotI. Затем, штамм Ogataea minuta TK-10-1-2 (Δoch1Δрер4Δprb1Δura3Δade1, WO2003/091431) трансформировали образовавшимся фрагментом. Трансформирование осуществляли с помощью электропорации. Трансформированный штамм инокулировали в среду SD-Ade (2% глюкозы, 0,17% Дрожжевой Азотистой Основы без аминокислот (производство Difco Laboratories, Inc.), смеси (20-400 мг/Л) нуклеиновых оснований, кроме аденина и аминокислот) и культивировали при 30°С в течение 2 дней с получением трансформантов. Хромосомную интеграцию подтверждали с помощью простой ПЦР, включающей диссоциацию трансформантов от подложки и суспендирование их в растворе реакции ПЦР. Полученный трансформант был охарактеризован как штамм YTY-1.
После этого для того, чтобы дополнительно повысить уровни экспрессии в штамм вводили ген шаперона. Вектор OnaP11007, содержащий гены для конструктивной экспрессии OmPDI1, OmERO1 и OmKAR2, описанный в Патентной заявке Японии No. 2009-539162 расщепляли с помощью NotI, и YTY-1 трансформировали образовавшимся фрагментом. Трансформирование осуществляли с помощью электропорации. Трансформированный штамм инокулировали в среду SD-Ura (2% глюкозы, 0,17% Дрожжевой Азотистой Основы без аминокислот (производство Difco Laboratories, Inc.), смеси (20-400 мг/Л) нуклеиновых оснований, кроме урацила и аминокислот) и культивировали при 30°С в течение 2 дней с получением трансформантов. Хромосомную интеграцию подтверждали путем простой ПЦР, включающей диссоциацию трансформантов от подложки и суспендирование их в растворе реакции ПЦР. Полученный трансформант был охарактеризован как штамм YTY-2.
Полученный штамм YTY-2 культивировали для экспрессии ST6Gal-I. Конкретнее, штамм инокулировали в 5 мл среды YPAD+KCl (2% полипептона, 1% экстракта дрожжей, 2% глюкозы, аденина (40 мг/Л), 0,3 М KCl) и прокультивировали в течение ночи при 30°С. После этого 1 мл прекультивированного раствора инокулировали в 150 мл среды YPAD+KCl и культивировали при 30°С в течение 48 часов. Штамм собирали, затем ресуспендировали в 100 мл среды ВММУ+2% казаминовой кислоты (1% экстракта дрожжей, 2% полипептона, 1,34% Дрожжевой Азотистой Основы без аминокислот (производство Difco Laboratories, Inc.), 0,1 М KPi (pH 6.0), 2% казаминовой кислоты, 0,5% метанола), и культивировали при 20°С в течение 96 часов. Для этой культуры метанол прибавляли каждые 12 часов до достижения концентрации 0,5%. После завершения культивирования, штамм удаляли путем центрифугирования с получением сырого ферментного раствора.
Сырой ферментный раствор диализовали против SP-буфера (25 мМ ацетата натрия (pH 5,5), 0,1% Тритона Х-100) и затем наносили на HiTrap SP HP (5 мл) уравновешенный SP-буфером. Колонку промывали SP-буфером, с последующим элюированием SP-буфером, содержащим 1 М NaCl. Фракцию, которая проявляла ST6Gal-I - активность, собирали и диализовали против реакционного буфера (25 мМ MOPS, pH 7,3) для получения частично очищенного образца.
Ферментативную активность анализировали следующим образом: 2 мкл сырого ферментного раствора прибавляли к 18 мкл реакционного раствора (0,1 М MOPS (pH 7,3), 5 мМ CMP-Neu5Ac, 50 мкМ РА-Лакто-N-неотетраозы (LNnT-PA)) для начала реакции. Реакцию осуществляли при 37°С в течение 30 минут, и затем завершали путем кипячения. Образец анализировали с помощью ВЭЖХ. Применяемая колонка представляла собой Asahipak NH2P-50 (4,6×250 мм; Shodex, Showa Denko K.K.). Применяемая подвижная фаза представляла собой 0,2 М триэтиламин-уксусную кислоту (pH 7.0) (раствор А) и ацетонитрил (раствор В). Колонку уравновешивали с раствор А:раствор В=30:70. После введения образца, соотношение раствор А:раствор В линейно изменяли до 50:50 в течение 20 минут для градиентного элюирования. Флуоресцентный детектор (Ех: 315 нм, Em: 380 нм) применяли для детектирования. Элюирование субстрата LNnT-PA имело место на 9 минуте, в то время как элюирование продукта реакции 6′-Сиалил-LNnT-PA имело место на 18,5 минуте. Количество полученного продукта вычисляли по площади пика для определения активности (Ед). В контексте этого изобретения, 1 Ед определяют как количество фермента, которое производит 1 мкмоль продукта реакции в течение 1 минуты.
(2) Получение асиало-тетраантеннарной комплексной сахарной цепи
Соединение, представленное следующей формулой (в дальнейшем в этом документе, называемое NA4-Fmoc) получали в качестве одного типа производного асиало-тетраантеннарной комплексной сахарной цепи с помощью способа, показанного ниже:
Формула 20

Соединение, представленное следующей формулой (в дальнейшем в этом документе, называемое NGA2-Fmoc):
Формула 21
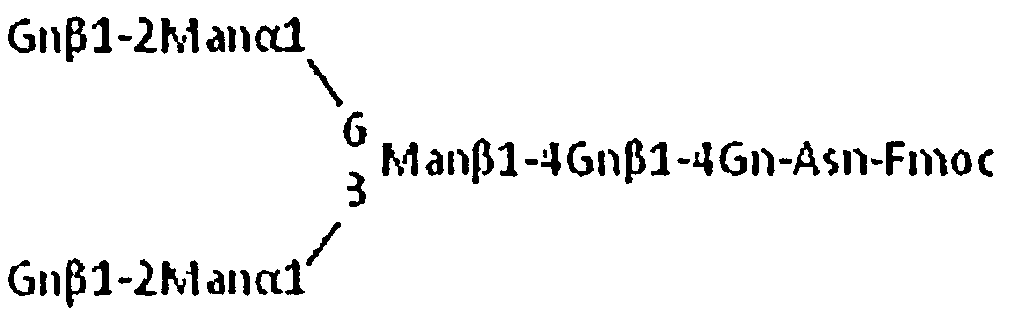
т.е. соединение, в котором агалакто-биантеннарная комплексная сахарная цепь связана с боковой цепью остатка аспарагина, и аминогруппа остатка аспарагина модифицирована Fmoc, применяли в качестве акцепторного субстрата для реакции переноса сахара. 0,3 mU MGAT4a и MGAT5 прибавляли к 0,15 мл реакционного раствора А (0,1 М MOPS (pH 7,3), 40 мМ UDP-GlcNAc, 6,7 мМ NGA2-Fmoc, 10 мМ MnCl2, 5 мг/мл белка бычьей сыворотки (BSA), 1 мМ PMSF), и проводили реакцию смеси при 37°С в течение 16 часов. Образовавшуюся реакционную смесь подвергали термообработке при 100°С в течение 5 минут для инактивации фермента. К этому раствору прибавляли эквивалентный объем (0,15 мл) реакционного раствора В (0,1 М MOPS (pH 7,3), 30 мМ UDP-Gal, 10 мМ MnCl2, 10 мг/мл BSA, 8 мМ AMP), затем прибавляли 5 mU β4GalT1, и проводили реакцию смеси при 37°С в течение 16 часов. Образовавшуюся реакционную смесь подвергали термообработке при 100°С в течение 5 минут для инактивации фермента.
Сахарную цепь (NA4-Fmoc), представляющую интерес, выделяли из полученного реакционного раствора. Применяемая колонка представляла собой Kromasil 100-5С18 (4,6×250 мм; Eka Chemicals Inc.). Применяемая подвижная фаза представляла собой 25 мм ацетат аммония (раствор А) и ацетонитрил (раствор В). Колонку уравновешивали с раствор А:раствор. В=82:18. После введения образца, сахарную цепь собирали в 20 минут. Флуоресцентный детектор (Ех: 265 нм, Em: 315 нм) применяли для детектирования. Субстрат NGA2-Fmoc элюировали в виде монопика на 14 минуте, в то время как продукт реакции NA4-Fmoc элюировали в виде монопика на 8 минуте. Продукт реакции сахарную цепь собирали и использовали в качестве NA4-Fmoc в последующих экспериментах.
(3) Получение α2,6-сиалированной тетраантеннарной комплексной сахарной цепи
Соединение, представленное следующей формулой (в дальнейшем в этом документе, называемое (α2,6)тетрасиало-NA4-Fmoc):
Формула 22

получали в качестве одного типа производного α2,6-сиалированной тетраантеннарной комплексной сахарной цепи следующим образом: готовили реакционный раствор С (0,1 М Трис-HCl (рН 7,5), 1 мМ MnCl2, 0,1% Тритона Х-100, 2 мМ CMP-Neu5Ac), содержащий 50 мкМ NA4-Fmoc в качестве исходного материала. 160 µЕд ST6Gal-I, полученного в разделе (1), прибавляли к 20 мкл этого реакционного раствора С, и проводили реакцию смеси при 37°С в течение 24 часов. После 0 часов, 1 часа, 6 часов или 24 часов реакции каждый реакционный раствор анализировали с помощью ВЭЖХ. Результаты показаны в Фигуре 1. Реакция протекала не полностью даже за 24 часа, и сахарную цепь, имеющую 3 молекулы сиаловой кислоты (в дальнейшем в этом документе, называемая (α2,6)трисиало-NA4-Fmoc; обозначаемая сокращением "трисиало-" в Фигуре 1) детектировали в качестве основного пика. Поэтому 160 µЕД ST6Gal-I и 5 мкл CMP-Neu5Ac (конечная концентрация: 2 мМ) дополнительно прибавляли к реакционному раствору для осуществления реакции. Однако целевое соединение, т.е., сахарную цепь, имеющую 4 молекулы сиаловой кислоты ((α2,6)тетрасиало-NA4-Fmoc; обозначаемая сокращением "тетрасиало-" в Фигуре 1), выделяли на уровне приблизительно 40%.
Пик, соответствующий сахарной цепи, имеющей 4 молекулы сиаловой кислоты, собирали и использовали в качестве (α2,6)тетрасиало-NA4-Fmoc в последующих экспериментах.
(4) Анализ активности ST6Gal-I в разложении сиаловой кислоты
Никакого роста выхода продукта реакции увеличением количества фермента не наблюдали, что говорит о возможности разложения продукта реакции. Поэтому проводили следующий эксперимент для того, чтобы определить разлагается ли продукт реакции.
Готовили реакционный раствор D (0,1 М Трис-HCl (рН 7,5), 1 мМ MnCl2, 0,1% Тритона Х-100) содержащий 50 пмоль сахарной цепи (α2,6)тетрасиало-NA4-Fmoc. 5 мкл 50 µЕД ST6Gal-I прибавляли к 5 мкл реакционного раствора D, и смесь инкубировали при 37°С в течение 17 часов. Также аналогично готовили реакционный раствор с добавлением 50 µЕД ST6Gal-I и 5 мкл CMP-Neu5Ac (конечная концентрация: 2 мМ). Кроме того, аналогично готовили реакционный раствор с добавлением 50 µЕД ST6Gal-I и CMP-Neu5Ac (конечная концентрация: 2 мМ), термообработанный при 100°С в течение 5 минут. Эти растворы также аналогично инкубировали при 37°С в течение 17 часов. Каждый продукт реакции нагревали при 100°С в течение 5 минут и затем анализировали с помощью ВЭЖХ тем же образом, что и в способе, показанном в разделе (2). Результаты показаны в Фигуре 2. Элиминирование сиаловой кислоты редко наблюдали в отсутствие субстрата-донора CMP-Neu5Ac. Напротив, приблизительно 30% (α2,6)тетрасиало-NA4-Fmoc превращалось в (α2,6)трисиало-NA4-Fmoc в присутствии CMP-Neu5Ac, показывая элиминирование сиаловой кислоты. Более того, прибавление обработанной нагреванием CMP-Neu5Ac вызывало 58% превращение в (α2,6)трисиало-NA4-Fmoc.
Напротив, прибавление ST6Gal-I, как показано в Фигуре 3, не оказывало никакого разлагающего воздействия на (α2,3)тетрасиало-NA4-Fmoc. При прибавлении α2,3-сиалилтрансферазы ST3 Gal-III не было разложения (α2,3)тетрасиало-NA4-Fmoc. Это говорит о том, что элиминирование сиаловой кислоты с помощью ST6Gal-I является специфичным для α2,6-связанной сиаловой кислоты.
(5) Устойчивость CMP-Neu5Ac
Для того чтобы подтвердить, образуется ли СМР путем разложения субстрат-донора CMP-Neu5Ac, 5 мМ CMP-Neu5Ac/0,1 M MOPS (pH 7,3) инкубировали при 25°С, 30°С, 33°С, или 37°С, и количество образующегося СМР измеряли. Измерение осуществляли с помощью ВЭЖХ с использованием колонки TSKgel SuperQ-5PW (7,5×75 мм; Tosoh Corp.) и 50 мМ KPi (pH 8.0) в качестве растворителя. УФ-детектор (длина волны детектора: 254 нм) применяли для детектирования. На долю образования СМР указывало отношение: [Площадь пика СМР]/[Площадь пика СМР + Площадь пика CMP-Neu5Ac]×100 (%). Результаты показаны на Фигуре 4. Через 24 часа, 45% СМР образовывалось при 37°С, в то время как 21% СМР образовывалось при 30°С, что составляло около половины того, что образовывалось при 37°С. Это говорило о том, что реакция ST6Gal-I при более низкой температуре могла подавлять СМР-зависимую активность отщепления сиаловой кислоты.
Затем, для того, чтобы оценить долю образования α2,6-сиалированной тетраантеннарной комплексной сахарной цепи, готовили реакционный раствор Е (0,1 М MOPS (pH 7,3), 5 мМ MnCl2, 5 мг/мл белка бычьей сыворотки, 5 мМ CMP-Neu5Ac) содержащий 50 мкМ NA4-Fmoc. 100 µU ST6Gal-I, полученной в разделе (1) прибавляли к 10 мкл реакционного раствора Е, и проводили реакцию смеси при 10°С, 20°С, 25°С, 30°С или 37°С в течение 24 часов. Как показано в Фигуре 5, выход сахарной цепи (α2,6)тетрасиало-NA4-Fmoc, представляющей интерес, был высоким после 24 часов реакции при 25°С и 30°С. Эта говорило о том, что реакция при 25°С-30°С, которая лежит за пределами температуры, оптимальной для сиалилтрансферазы, была предпочтительной для увеличения выхода (α2,6)тетрасиало-NA4-Fmoc.
(6) Установление способа подавления разложения α2,6-сиалированной тетраантеннарной комплексной сахарной цепи ((α2,6)тетрасиало-NA4-Fmoc)
Так как СМР образуется не только путем разложения субстрата-донора CMP-Neu5Ac, но и в качестве побочного продукта реакции синтеза, была сделана попытка разложения этой СМР, чтобы, тем самым, подавить реакцию элиминирования сиаловой кислоты сиалилтрансферазой. Готовили реакционный раствор Е (0,1 М Трис-HCl (рН 7,5), 1 мМ MnCl2, 0,1% Тритона Х-100) содержащий 25 пмоль (α2,6)тетрасиало-NA4-Fmoc и 2,5 нмоль СМР. 25 µU ST6Gal-I прибавляли к 10 мкл этого реакционного раствора Е, и смесь инкубировали при 37°С в течение 17 часов. Также готовили реакционный раствор с добавлением 25 µЕд ST6Gal-I и 50 µЕд щелочной фосфатазы из Е.coli (ВАР) (Takara Bio Inc.) и инкубировали так же, как указано выше. Каждый продукт реакции нагревали при 100°С в течение 5 минут и затем анализировали с помощью способа, показанного в разделе (3). Результаты показаны на Фигуре 6. Через 24 часа приблизительно 70% (α2,6)тетрасиало-NA4-Fmoc превращалось в (α2,6)трисиало-NA4-Fmoc в присутствии СМР, что демонстрировало элиминирование сиаловой кислоты. Напротив, разложение (α2,6)тетрасиало-NA4-Fmoc редко наблюдали в присутствии щелочной фосфатазы из Е.coli (ВАР). Это показало, что СМР можно разлагать с помощью фосфатазы в 5′-цитидиловую кислоту, тем самым, подавляя активность ST6Gal-I в отношении элиминирования сиаловой кислоты из тетрасиало-сахарной цепи.
(7) Установление способа однореакторного синтеза α2,6-сиалированной тетраантеннарной комплексной сахарной цепи
Готовили 150 мкл реакционного раствора F (0,1 М MOPS (рН 7,3), 40 мМ UDP-GlcNAc (6 мкмоль), 6,7 мМ NGA2-Fmoc (1 мкмоль), 0,3 мЕд MGAT4a, 0,3 мЕд MGAT5, 5 мг/мл BSA, 1 мМ PMSF) и проводили реакцию при 37°С в течение 16 часов. Реакцию завершали путем инкубирования при 100°С в течение 5 минут. Затем 250 мкл реакционного раствора G (0,1 М MOPS (рН 7,3), 24 мМ UDP-Gal (6 мкмоль), 4,8 мЕд β4GalT1, 8 мМ MnCl2, 5 мг/мл BSA, 4 мМ AMP) прибавляли к реакционному раствору F, и проводили реакцию смеси при 37°С в течение 16 часов. Реакцию завершали путем инкубирования при 100°С в течение 5 минут, с последующим высушиванием при пониженном давлении. 250 мкл реакционного раствора Н (40 мМ CMP-Neu5Ac (10 мкмоль), 3 мЕд ST6Gal-I, 15 мЕд ВАР) прибавляли в эту пробирку и проводили реакцию при 30°С в течение 16 часов. Туда же дополнительно прибавляли 5 мкл CMP-Neu5Ac (20 мМ CMP-Neu5Ac) и проводили реакции при 30°С в течение 16 часов. Образовавшуюся реакционную смесь подвергали термообработке при 100°С в течение 5 минут для завершения реакции. Схема технологического процесса этой серии однореакторных реакций синтеза показана на Фигуре 7. Реакция гликозилирования в этой серии однореакторных реакций синтеза схематично показана на Фигуре 8 с помощью структурной формулы.
Исходный материал реакции и продукт реакции анализировали с помощью ВЭЖХ для определения количества (α2,6)тетрасиало-NA4-Fmoc. Что касается условий анализа ВЭЖХ: применяемая колонка представляла собой Amido-80 (3 мкМ, 4,6×150 мм; Tosoh Corp.); применяемая подвижная фаза представляла собой ацетонитрил (раствор А) и 0,2 М ТЕАА (рН 7.0) (раствор В); и колонку уравновешивали с раствор А:раствор В=75:25. После введения образца, сахарную цепь собирали на 35 минуте. Флуоресцентный детектор (Ех: 265 нм, Em: 315 нм) применяли для детектирования. Результаты показаны на Фигуре 9. Исходный материал реакции NGA2-Fmoc элюировали в качестве монопика приблизительно на 16-ой минуте, в то время как продукт реакции (α2,6)тетрасиало-NA4-Fmoc элюировали в качестве монопика приблизительно на 30-й минуте. Площадь пика полученной (α2,6)тетрасиало-NA4-Fmoc составляла 90% по отношению к площади пика исходного материала реакции NGA2-Fmoc, что продемонстрировало, что сахарную цепь, представляющую интерес, можно синтезировать с очень высокими выходами в однореакторном синтезе.
Промышленная применимость
Способом настоящего изобретения можно более успешно, чем когда-либо прежде, с помощью сиалилтрансферазы получать сахарные цепи, содержащие сиаловую кислоту. В частности, способом настоящего изобретения можно успешно получать триантеннарную или тетраантеннарную комплексную сахарную цепь, содержащую сиаловую кислоту, в которой сиаловая кислота связана с каждым из невосстанавливающих концов антенн, или ее производное, которое ранее было сложно получить. В дополнение, согласно способу получения по настоящему изобретению, можно добиться удобного получения с высокими выходами посредством однореакторной реакции синтеза и можно добиться даже количественного получения этих сахарных цепей (в частности, (α2,6)тетрасиало-тетраантеннарых комплексных сахарных цепей, и т.д.), что ранее было труднодостижимо. Эти сахарные цепи можно применять в качестве сахарных цепей, имеющих новую функцию или в качестве одного типа сахарной цепи в лекарственных средствах, таких как гликопротеины, эталоны для аналитических приборов, научных реагентов и наборы сахарных цепей.
Реферат
Группа изобретений относится к биотехнологии. Предложены способы получения сиалированной сахарной цепи. Осуществляют взаимодействие сахарной цепи с СМР-сиаловой кислотой в присутствии ST6Gal-I и фосфатазы при температуре от 20°C до 37°C в течение 8-48 часов с получением триантеннарной или тетраантеннарной N-связанной сиалированной сахарной цепи, содержащей сиаловую кислоту на каждом из своих невосстанавливающих концов. В другом варианте перед указанной стадией осуществляют взаимодействие сахарной цепис UDP-сахаром в присутствии гликозилтрансферазы. В третьем варианте осуществляют взаимодействие агалакто-биантеннарной комплексной сахарной цепи с UDP-GlcNAc в присутствии MGAT4 и MGAT5. Полученный продукт взаимодействует с UDP-Gal в присутствии β4GalT1, затем с СМР-сиаловой кислотой в присутствии ST6Gal-I и фосфатазы. Изобретения позволяют получать триантеннарные и тетраантеннарные α2,6-сиалированные на каждом из своих невосстанавливающих концов сахарные цепи с высокими выходами в однореакторном синтезе. 3 н. и 12 з.п. ф-лы, 9 ил.
Формула
взаимодействие сахарной цепи или сахарной цепи, содержащей аминокислоту, пептид, белок, линкер, флуоресцентную группу, липид, низкомолекулярное соединение или радиоактивное соединение на своем восстанавливающем конце, с СМР-сиаловой кислотой в присутствии ST6Gal-I и фосфатазы при температуре от 20°C до 37°C при условии, что температура ниже 37°C, в течение 8-48 часов для переноса сиаловой кислоты на невосстанавливающий конец сахарной цепи,
где указанная сиалированная сахарная цепь представляет собой триантеннарную или тетраантеннарную N-связанную комплексную сахарную цепь или триантеннарную или тетраантеннарную N-связанную комплексную сахарную цепь, содержащую аминокислоту, пептид, белок, линкер, флуоресцентную группу, липид, низкомолекулярное соединение или радиоактивное соединение на своем восстанавливающем конце, где сиалированная сахарная цепь содержит сиаловую кислоту на каждом из своих невосстанавливающих концов.
Формула 1
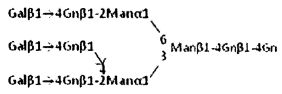
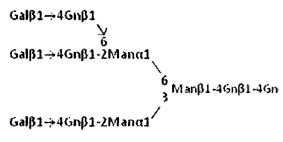

или вышеуказанное соединение, содержащее аминокислоту, пептид, белок, линкер, флуоресцентную группу, липид, низкомолекулярное соединение или радиоактивное соединение на своем восстанавливающем конце.
Формула 2


Формула 3

или вышеуказанное соединение, содержащее аминокислоту, пептид, белок, линкер, флуоресцентную группу, липид, низкомолекулярное соединение или радиоактивное соединение на своем восстанавливающем конце.
(а) однократное или многократное проведение стадии взаимодействия сахарной цепи, представленной следующей формулой:
Формула 4
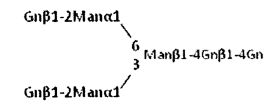
или указанной сахарной цепи, содержащей аминокислоту, пептид, белок, линкер, флуоресцентную группу, липид, низкомолекулярное соединение или радиоактивное соединение на своем восстанавливающем конце с UDP-сахаром, служащим в качестве субстрата гликозилтрансферазы в присутствии гликозилтрансферазы; и
(b) взаимодействие продукта стадии (а) с СМР-сиаловой кислотой в присутствии ST6Gal-I и фосфатазы при температуре от 20°C до 37°C при условии, что температура ниже 37°C, в течение 8-48 часов,
где указанная сиалированная сахарная цепь представляет собой триантеннарную или тетраантеннарную N-связанную комплексную сахарную цепь или триантеннарную или тетраантеннарную N-связанную комплексную сахарную цепь, содержащую аминокислоту, пептид, белок, линкер, флуоресцентную группу, липид, низкомолекулярное соединение или радиоактивное соединение на своем восстанавливающем конце, где сиалированная сахарная цепь содержит сиаловую кислоту на каждом из своих невосстанавливающих концов.
(a) взаимодействие агалакто-биантеннарной комплексной сахарной цепи или агалакто-биантеннарной комплексной сахарной цепи, содержащей аминокислоту, пептид, белок, линкер, флуоресцентную группу, липид, низкомолекулярное соединение или радиоактивное соединение на своем восстанавливающем конце, с UDP-GlcNAc в присутствии MGAT4 и MGAT5;
(b) взаимодействие продукта стадии (а) с UDP-Gal в присутствии β4GalT1; и
(c) взаимодействие продукта стадии (b) с СМР-сиаловой кислотой в присутствии ST6Gal-I и фосфатазы при температуре от 20°C до 37°C при условии, что температура ниже 37°C, в течение 8-48 часов,
где указанная сиалированная сахарная цепь представляет собой триантеннарную или тетраантеннарную N-связанную комплексную сахарную цепь или триантеннарную или тетраантеннарную N-связанную комплексную сахарную цепь, содержащую аминокислоту, пептид, белок, линкер, флуоресцентную группу, липид, низкомолекулярное соединение или радиоактивное соединение на своем восстанавливающем конце, где сиалированная сахарная цепь содержит сиаловую кислоту на каждом из своих невосстанавливающих концов.
Формула 5


Комментарии