Комбинация термостабильных биокатализаторов для синтеза нуклеозидов - RU2569110C2
Код документа: RU2569110C2
Чертежи









Описание
Область изобретения
Изобретение относится к области биотехнологии.
Предпосылки создания изобретения
(Дезокси)нуклеозиды представляют собой гликозиламины, состоящие из основания, такого как пурин или пиримидин, соединенного с сахаром - рибозой или дезоксирибозой, которые представляют собой циклические пентозы. Примеры (дезокси)нуклеозидов включают цитидин, уридин, аденозин, гуанозин, тимидин и инозин. Аналоги нуклеозидов широко применяются в качестве противовирусных и противоопухолевых препаратов благодаря их способности выступать в качестве ингибиторов обратной транскриптазы или терминаторов роста цепи в синтезе РНК или ДНК [1].
Химический синтез аналогов нуклеозидов осуществляют стереоселективно, но с применением дорогих реактивов или загрязняющих веществ [2], и такой синтез включает многоступенчатый процесс, который может занимать много времени. Биокаталитические способы представляют собой хорошую альтернативу химическому синтезу нуклеозидов, поскольку биокатализируемые реакции являются регио- и стереоселективны и позволяют снизить содержание побочных продуктов. Особый интерес среди биокаталитических способов синтеза представляет ферментативное трансгликозилирование между нуклеозидом, который представляет собой донор сахарного остатка и акцепторным основанием с помощью ферментов, которые катализируют общие обратимые реакции [3], как показано на Фигурах 1 и 2.
Нуклеозидфосфорилазы представляют собой трансферазы, широко распространенные в клетках млекопитающих и бактерий, и они играют центральную роль в метаболическом пути реутилизации нуклеозидов. Они имеют двойственную функцию. С одной стороны, они катализируют обратимое расщепление гликозидной связи рибо- или дезоксирибонуклеозидов в присутствии неорганического фосфата с образованием основания и рибозы- или дезоксирибозы-1-фосфата. Такие ферментативные реакции с участием фосфорилаз пуриновых нуклеозидов и фосфорилаз пиримидиновых нуклеозидов показаны на Фигуре 1. С другой стороны, эти ферменты катализируют фосфат-зависимый перенос пентозы между пуриновыми или пиримидиновыми основаниями и нуклеозидами, т.е. реакции трансгликозилирования, с получением нуклеозидов с различными основаниями. На Фигуре 2 показан пример одностадийного синтеза с применением нуклеозидфосфорилазы.
При применении фосфорилаз пиримидиновых и пуриновых нуклеозидов в комбинации возможен перенос сахара от донорного пиримидинового нуклеозида к акцепторному пуриновому или пиримидиновому основанию, а также от донорного пуринового нуклеозида к акцепторному пиримидиновому или пуриновому основанию, в зависимости от используемых исходных веществ [4]. Поэтому фосфорилазы нуклеозидов из различных источников, главным образом бактериальных, стали применять в качестве средств для ферментативного синтеза аналогов нуклеозидов.
В природе такие ферменты были описаны в различных штаммах микроорганизмов, в частности, в термофильных бактериях (например, бактериях, размножающихся при температуре от 45°C до 80°C), которые применяли в качестве источников нуклеозидфосфорилаз в многочисленных работах для получения модифицированных нуклеозидов путем ферментативного трансгликозилирования. Однако, хотя в таких исследованиях выход целевого продукта был достаточно высоким, количество и соотношение ферментативной активности, необходимой для трансгликозилирования, не было оптимальным [5]. Требуется либо значительное увеличение времени реакции (вплоть до нескольких дней) или увеличение используемой бактериальной биомассы для достижения необходимой степени преобразования.
Кроме того, при разработке способа трансгликозилирования возникает другая проблема: трудности с растворением большого количества субстратов и продуктов, многие из которых трудно растворимы в водной среде при комнатной температуре. Эта проблема может быть решена за счет применения более высоких температур, но для этого необходимы ферменты, достаточно стабильные при таких более жестких условиях реакции.
Архей представляют собой группу одноклеточных микроорганизмов, которые представляют собой один из трех доменов жизни, наряду с доменами Bacteria и Eukarya. Ранее эту группу называли архебактериями Archaebacteria в составе таксона Bacteria, но в настоящее время их рассматривают как самостоятельный и обладающий отличительными признаками таксон. Домен архей в настоящее время разделяют на две основные филы, Euryarchaeota и Crenarchaeota. Euryarchaeota включает различных метаногенов, экстремальных галофилов, термоацидофилов и некоторых гипертермофилов. В отличие от этого, Crenarchaeota включает только гипертермофилов. Гипертермофилы представляют собой организмы, обитающие в очень горячей среде, от 60°C и выше, оптимально выше 80°C.
Cacciapuoti с соавторами [6-8] описывает две фосфорилазы пуриновых нуклеозидов (ПНФазы, англ. PNPases) из гипертермофильных архей, в частности, описывает ферменты 5′-дезокси-5′-метилтиоаденозин фосфорилазу II (SsMTAPII, ЕС 2.4.2.28) из Sulfolobus solfataricus и фосфорилазу пуриновых нуклеозидов (PfPNP) из Pyrococcus furiosus. Фермент Pyrococcus furiosus был впервые аннотирован как MTAPII, но затем переименован в PNP, поскольку он не способен расщеплять метилтиоаденозин. Sulfolobus solfataricus принадлежит Crenarchaeota, a Pyrococcus furiosus относится к Euryarchaeota. Код ЕС, указанный выше, соответствует общепринятой номенклатуре ферментов, предусмотренной Международным союзом биохимии и молекулярной биологии, которая классифицирует ферменты на основании тех реакций, которые они катализируют.
Большинство ферментов, описанных у гипертермофилов, обладают оптимальной активностью при температуре, близкой к оптимальной температуре роста организма-хозяина. При клонировании и экспрессии в мезофильных организмах-хозяевах, таких как Escherichia coli, гипертермофильные ферменты обычно сохраняют свои термические свойства. Иногда ферменты оптимально активны при температуре, значительно превышающей оптимальную температуру роста организма-хозяина [9]. В других случаях описанные ферменты оптимально активны при температуре, которая от 10°C до 20°C ниже оптимальной температуры роста организма-хозяина [10-11]. Однако, 5′-метилтиоаденозин фосфорилаза из Sulfolobus solfataricus (гексамерный фермент, содержащий шесть межсубъединичных дисульфидных мостиков) при экспрессии в мезофильных организмах-хозяевах образует неправильным образом расположенные дисульфидные мостики и является менее стабильной и менее термофильной, чем нативный фермент [12].
Thermoprotei представляют собой гипертермофильный класс Crenarchaeota. Среди всех проанализированных и доступных геномных последовательностей для архей класса Thermoprotei было выявлено только три последовательности фосфорилаз пуриновых нуклеозидов (ЕС 2.4.2.1) и только три последовательности уридинфосфорилаз (ЕС 2.4.2.3). Шесть этих белков были введены, соответственно, в базу UniProtKB/TrEMBL с номерами доступа: A1RW90 (A1RW90_THEPD), для гипотетического белка Thermofilum pendens (штамм Hrk 5); Q97Y30 (Q97Y30_SULSO), для гипотетического белка из Sulfolobus solfataricus; A3DME1 (A3DME1 STAMF), для гипотетического белка из Staphylothermus marinus (штамм АТСС 43588/DSM 3639/F1); Q9YA34 (Q9YA34_AERPE), для гипотетического белка из Aeropyrum pernix; A2BJ06 (A2BJ06_HYPBU) для гипотетического белка из Hyperthermus butylicus (штамм DSM 5456/JCM 9403), а также D9PZN7 (D9PZN7_ACIS3) для гипотетического белка из Acidilobus saccharovorans (штамм DSM 16705/ВКМ В-2471/345-15). Статус всех этих последовательностей аннотирован как «непроверенный», это означает, что их присутствие в археях было проверено только с помощью компьютера.
Хотя многие гены могут успешно экспрессироваться в клетках Escherichia coli с высоким выходом, некоторые белки гипертермофильных бактерий экспрессируются на низком уровне или вовсе не экспрессируются, что, отчасти, обусловлено использованием редких кодонов. Действительно, насколько нам известно, ни одна из исследовательских групп до сих пор не преуспела в экспрессии какого-либо из генов, упомянутых выше.
В свете ограничений, описанных выше, принимая во внимание технические трудности, авторам настоящего изобретения неожиданно удалось получить жизнеспособные рекомбинантные векторы, и, главное, получить рекомбинантные фосфорилазы с оптимальной активностью при температуре выше 60°C. Термостабильные и химически стабильные катализаторы согласно настоящему изобретению представляют собой фосфорилазу пуриновых нуклеозидов (ПНФазу, ЕС 2.4.2.1) и уридинфосфорилазу (УФазу, ЕС 2.4.2.3), происходящие из архей класса Thermoprotei, при этом ПНФаза происходит из Sulfolobus solfataricus (SEQ ID NO. 7), а УФаза происходит из Aeropyrum pernix (SEQ ID NO. 8).
В частности, неожиданно было обнаружено, что рекомбинантные нуклеозидфосфорилазы, происходящие из гипертермофильных Thermoprotei обладают уникальными структурно-функциональными свойствами, такими как повышенная термостабильность, высокая каталитическая эффективность и оптимальная ферментативная активность при температуре около или выше 100°C. Такие рекомбинантные ферменты можно успешно применять для проведения реакции трансгликозилирования, в форме клеточного лизата и в форме неочищенного или очищенного экстракта, для промышленного производства природных и модифицированных аналогов нуклеозидов. В частности, такие ферменты являются универсальными, поскольку они могут катализировать реакции трансгликозилирования в водной среде, в органических растворителях, при температуре от 60°C и 120°C, или при комбинации этих параметров, что позволяет получать многие и разнообразные типы нуклеозидов с приемлемым выходом, временем реакции и применением экономических количеств фермента. Важно отметить, что биокатализаторы, описанные в настоящем изобретении, можно применять для реакции биоконверсии, которые требуют наличия органических растворителей, температуры выше 60°C, или обоих условий, которые обеспечивают возможность растворения субстратов или продуктов реакции. Такие фосфорилазы идеально подходят для реакций с применением нерастворимых в воде субстратов. Еще одно преимущество таких фосфорилаз состоит в том, что они устойчивы к органическим растворителям, и в том, что их можно повторно применять в ходе нескольких циклов реакции.
Преимущество настоящего изобретения состоит в том, что оно предлагает комбинацию нуклеозидфосфорилаз из Thermoprotei, которые применимы для одностадийного синтеза нуклеозидов. Такие ферменты можно применять для получения природных нуклеозидов или аналогов в одностадийных (в одном реакционном сосуде) или двухстадийных способах синтеза. При одностадийном синтезе фосфорилазы пиримидиновых нуклеозидов и фосфорилазы пуриновых нуклеозидов применяют в одном реакционном сосуде для замены одного основания, соединенного с сахарным остатком, на другое по выбору. При двухстадийном способе фосфорилазы пиримидиновых нуклеозидов применяют для высвобождения сахарного остатка из пиримидинового нуклеозида, после чего 1-фосфат-сахар выделяют, и позже, в другом сосуде, пуриновое основание соединяют с сахарным остатком с помощью фосфорилазы пуринового нуклеозида.
Краткое описание изобретения
Настоящее изобретение относится к рекомбинантному экспрессионному вектору, включающему: а) последовательность, кодирующую фосфорилазу пуриновых нуклеозидов (ПНФазу, ЕС 2.4.2.1), б) последовательность, кодирующую уридинфосфорилазу (УФазу, ЕС 2.4.2.3), в) или обе последовательности; при этом каждая из последовательностей функционально связана с одной или более регуляторной последовательностью, которая контролирует образование указанной фосфорилазы в подходящем для экспрессии хозяине, при этом указанная последовательность происходит из архей класса Thermoprotei, при этом ПНФаза происходит из Sulfolobus solfataricus (SEQ ID NO 7.), а УФаза - из Aeropyrum pernix (SEQ ID NO. 8).
Кроме того, настоящее изобретение относится к способу трансгликозилирования между нуклеозидом, который представляет собой донор сахара и акцепторным основанием в присутствии фосфат-ионов, отличающемуся тем, что указанный способ включает применение уридинфосфорилазы (УФазы) из Aeropyrum pernix (ссылка на последовательность в Национальном центре биотехнологической информации (NCBI): NC_000854.2), фосфорилазы пуриновых нуклеозидов (ПНФаза) из Sulfolobus solfataricus (ссылка на последовательность в NCBI: NC_002754.1), или их комбинации.
Описание чертежей
На Фигуре 1 показан пример двух ферментативных реакций, катализируемых нуклеозидфосфорилазами. Первая реакция сверху представляет собой фосфоролиз, который проходит по SN1-подобному механизму через оксоний-подобное промежуточное соединение с образованием α-рибозы-1-фосфата. Вторая реакция происходит по механизму SN2, где фосфат замещается основанием, предоставляемым β-нуклеозидом [13]. В этой схеме фосфорилаза уридиновых нуклеозидов катализирует фосфоролитическое расщепление C-N гликозидной связи уридина с образованием рибозы-1-фосфата и урацила. Фосфорилаза пуриновых нуклеозидов (фосфорилаза аденозинового нуклеозида) катализирует расщепление гликозидной связи в присутствии неорганического фосфата (Pi) в качестве второго субстрата с образованием пуринового основания и рибозы(дезоксирибозы)-1-фосфата. Для природных субстратов реакции являются обратимыми.
Фигура 2. Схема одностадийного синтеза с применением ферментов нуклеозидфосфорилаз.
На Фигуре 3 показана генетическая карта исходного экспрессионного вектора pET102/D-ТОРО® до клонирования. Длина вектора из 6315 нуклеотидов. Промотор Т7: основания 209-225; область праймера к промотору Т7: основания 209-228; lac-оператор (lacO): основания 228-252; сайт связывания рибосомы (ribosome binding site, RBS): основания 282-288; ORF (открытая рамка считывания) тиоредоксина с His-пэтчем (His-patch, HP): основания 298-627; сайт связывания прямого праймера TrxFus: основания 607-624; сайт узнавания ЭК: основания 643-657; сайт узнавания ТОРО® 1: основания 670-674; выступающий конец: основания 675-678; сайт узнавания ТОРО® 2: основания 679-683; эпитоп V5: основания 700-741; полигистидиновая последовательность (6xHis): основания 751-768; обратный праймер Т7: основания 822-841; область терминации транскрипции Т7: основания 783-911; промотор bla: основания 1407-1505; ген устойчивости к ампициллину (bla) (ORF): основания 1506-2366; точка инициации репликации (ориджин) pBR322: основания 2511-3184; ORF ROP: основания 3552-3743 (комплементарная цепь); ORF lad: основания 5055-6146 (комплементарная цепь).
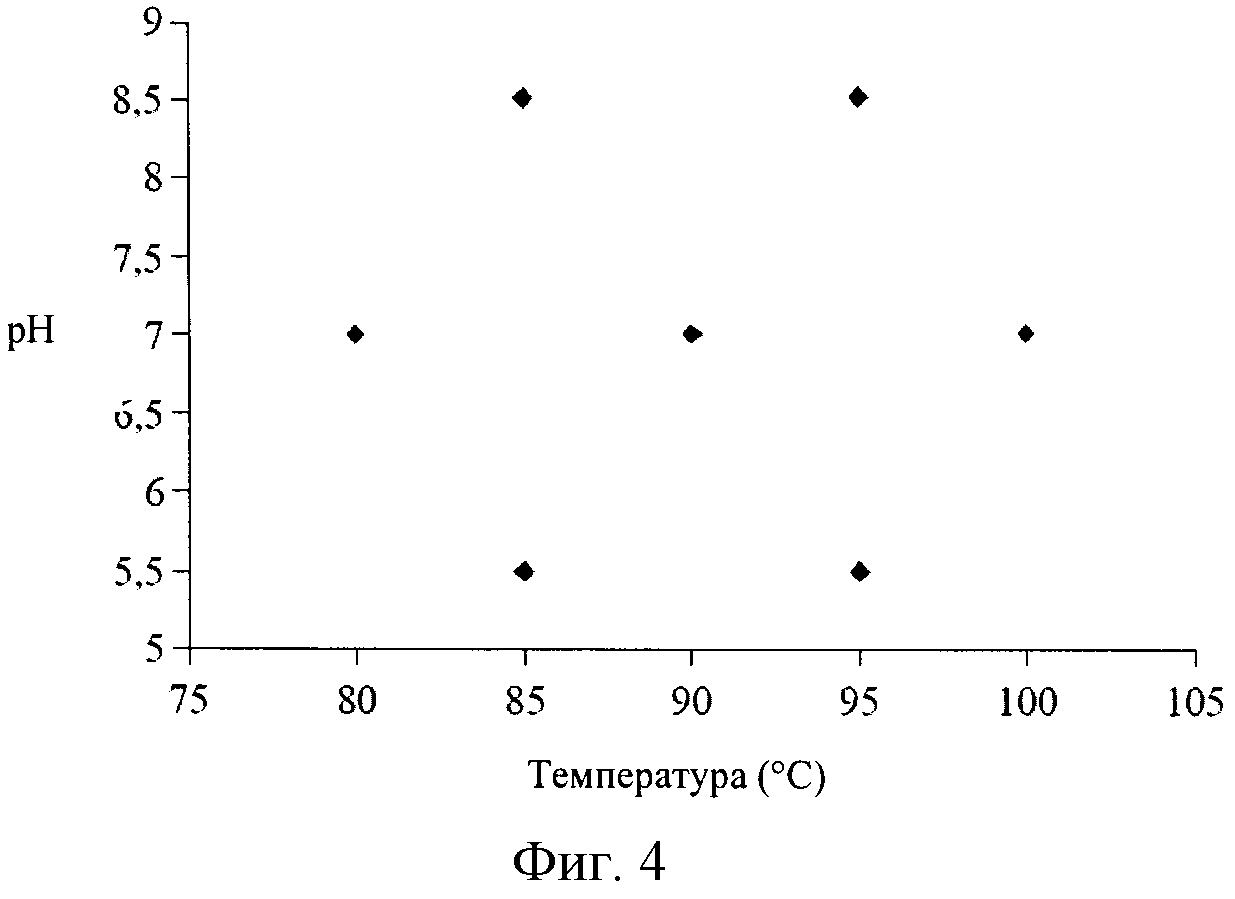
На Фигуре 4 представлена «матрица Doehlert», в которой пять температур скомбинированы с тремя значениями pH, в результате чего образуется семь комбинаций температуры и pH.
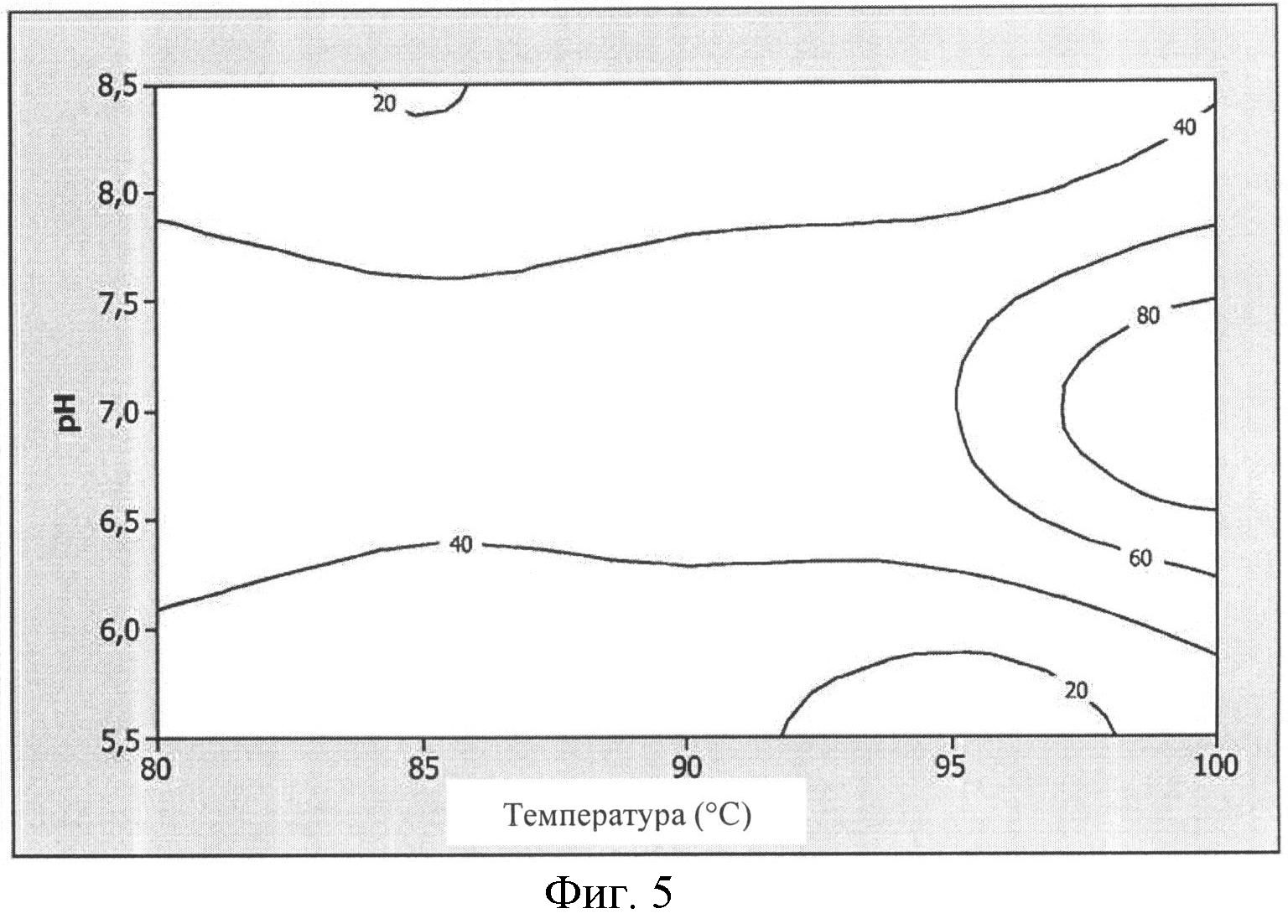
Фигура 5. Контурный график, показывающий интерактивный эффект pH и температуры на активность УФазы (уридинфосфорилазы, англ. UPase). Данные были проанализированы статистически с помощью методологии поверхности отклика (Response Surface Methodology, RSM) с использованием программы «Minitab». Фермент оказался высоко термофильным, его активность резко возросла при максимальной анализируемой температуре (100°C) и отчетливый оптимум активности наблюдали при значении pH, близкому к нейтральному (6,5-7,5), предпочтительно 7,0.
Фигура 6. Контурный график, показывающий интерактивный эффект pH и температуры на активность ПНФазы (фосфорилазы пуриновых нуклеозидов, англ. PNPase). Данные были проанализированы статистически с помощью методологии поверхности отклика (Response Surface Methodology, RSM) с использованием программы «Minitab». Фермент оказался высоко термофильным, его активность резко возросла при максимальной анализируемой температуре (100°C) и отчетливый оптимум активности наблюдали при значении pH, близкому к нейтральному (6,5-7,0).
На Фигуре 7 показана последовательность ДНК (SEQ ID NO. 7) кодирующей области фосфорилазы пуриновых нуклеозидов (ПНФазы) от Sulfolobus solfataricus, также известной как ген deoD.
На Фигуре 8 приведена последовательность ДНК (SEQ ID NO. 8) кодирующей области уридинфосфорилазы (УФазы) из Aeropyrum pernix, также известной как ген udp.
Описание изобретения
Настоящее изобретение относится к рекомбинантному вектору для экспрессии, включающему: а) последовательность, кодирующую фосфорилазу пуриновых нуклеозидов (ПНФазу, ЕС 2.4.2.1), б) последовательность, кодирующую уридинфосфорилазу (УФазу, ЕС 2.4.2.3), в) или обе указанные последовательности, при этом каждая из указанных последовательностей функционально связана с одной или более регуляторной последовательностью, которая контролирует продукцию указанной фосфорилазы в подходящем для экспрессии хозяине, при этом указанные последовательности происходят из архей класса Thermoprotei, причем ПНФаза получена от Sulfolobus solfataricus (SEQ ГО NO 7), а УФаза получена от Aeropyrum pernix (SEQ ID NO. 8).
Aeropyrum pernix и Sulfolobus solfataricus представляют собой гипертермофильные архей, способные расти при высоких температурах более 90°C. Архей представляют собой организмы, относящихся к третьей группе организмов, отличающейся от эукариот и прокариот. Они, как полагают, являются потомками предковых организмов, и представляют собой особую группу организмов, которые не эволюционировали и не адаптировались к обычным температурным условиям.
Ферменты УФаза и ПНФаза в характерных для них природных внутриклеточных условиях не позволяют синтезировать нуклеозиды или аналоги нуклеозидов с высоким выходом, который необходим при промышленном производстве. Чтобы преодолеть это серьезное ограничение, авторы настоящего изобретения применили технологию рекомбинантной ДНК для разработки экспрессионного вектора, включающего гены udp и deoD и соответствующих элементы для экспрессии на повышенном уровне фосфорилаз нуклеозидов в выбранных хозяевах, таких как бактерии. Сконструированные векторы для экспрессии также облегчают солюбилизацию и очистку различных фосфорилаз.
Векторы согласно настоящему изобретению включают нуклеотидную последовательность, кодирующую различные фосфорилазы нуклеозидов, и нуклеотидные последовательности для селектируемой и автономной репликации указанного вектора в клетке-хозяине.
Конструирование рекомбинантного экспрессионного вектора осуществляют с применением обычных технологий рекомбинантной ДНК, т.е. процедур, позволяющих объединять фрагменты ДНК в бесклеточной системе.
Термин «вектор» относится к молекуле ДНК, полученной на основе вируса, плазмиды или клетки высшего организма, в которую может быть встроен (клонирован) другой фрагмент ДНК соответствующего размера без потери способности вектора к саморепликации. Примерами векторов являются плазмиды, космиды и дрожжевые искусственные хромосомы. Векторы часто представляют собой рекомбинантные молекулы, содержащие последовательности ДНК различного происхождения. Термин «экспрессионный вектор» означает, что вектор дополнительно содержит необходимые управляющие или регуляторные последовательности для обеспечения транскрипции и трансляции клонированного гена или генов. В настоящем изобретении можно применять кольцевые или линеаризированные ДНК-векторы.
Для обеспечения селективной и автономной репликации вектора согласно настоящему изобретения в клетках-хозяевах, выбранный вектор должен быть совместим с выбранными клетками-хозяевами. В предпочтительном варианте реализации, нуклеотидная последовательность, которая позволяет указанному вектору селектируемо и автономно реплицироваться в клетках Escherichia coli, представляет собой промотор Т7-кодируемый ген, что позволяет РНК-полимеразе Т7 из выбранного штамма Escherichia coli связываться с промотором. Термин «селектируемо» означает, что вектор остается стабильным в последующих поколениях бактерий. Селекция достигается за счет жестких условий среды в соответствии с введенным селективным маркерным геном в экспрессионный вектор, что позволяет идентифицировать клетки, трансформированные вектором. Селективный маркерный ген часто представляет собой ген устойчивости к антибиотикам. Предпочтительный в настоящем изобретении селективный маркерный ген представляет собой ген устойчивости к канамицину, тетрациклину, карбенициллину и более предпочтительно, ампициллину.
Настоящее изобретение также относится к клетке-хозяину, включающей один из рекомбинантных экспрессионных векторов, упомянутых выше, или оба рекомбинантных экспрессионных вектора в пределах одной клетки-хозяина.
Термин «клетка-хозяин» относится к клетке, трансформированной рекомбинантным экспрессионным вектором, который включает нуклеотидную последовательность, кодирующую ПНФазу или УФазу. В другом аспекте рекомбинантный ДНК-вектор делает возможным продукцию в указанной клетке-хозяине фосфорилазы нуклеозидов, и при подходящих условиях среды указанная фосфорилаза нуклеозидов катализирует образование нуклеозидов. В конкретном варианте реализации настоящего изобретения в указанный экспрессионный ДНК-вектор введены гены, кодирующие ПНФазу и УФазу, из Sulfolobus solfataricus и Aeropyrum pernix, соответственно. На Фигуре 7 и Фигуре 8 приведены последовательности нуклеиновых кислот и аминокислотные последовательности, относящиеся к настоящему изобретению, а именно последовательность нуклеиновых кислот Sulfolobus solfataricus deoD (SEQ ID NO. 7) и последовательность нуклеиновых кислот Aeropyrum pernix udp (SEQ ID NO. 8), соответственно.
Специалисты в данной области смогут выбрать подходящую экспрессионную систему, включающую исходный вектор и штамм клетки-хозяина, для увеличения продукции нуклеозидов до максимального уровня.
В одном варианте реализации клетка-хозяин представляет собой Escherichia coli.
В конкретном варианте реализации Escherichia coli принадлежит к бактериальному штамму BL21. Подходящие экспрессионные векторы для Escherichia coli BL21 представляют собой, например, векторы рЕТ, векторы trcHis и векторы pUB (все от компании Invitrogen), а также векторы pGEX и векторы GST (от Amersham). Также в соответствии с настоящим изобретением можно применять бактериальный штамм DH5-альфа Escherichia coli в сочетании с векторами PUC, а также Escherichia coli F′ в сочетании с векторами PSL, векторами PEZZ или векторами М13 (все от компании Amersham).
В одном варианте реализации клетки-хозяева переработаны или находятся в форме лизатов.
Настоящее изобретение, кроме того, относится к способу трансгликозилирования между нуклеозидом, который представляет собой донор сахара и акцепторным основанием в присутствии фосфат-ионов, отличающемуся тем, что указанный способ включает применение уридинфосфорилазы (УФазы) из Aeropyrum pernix (NC_000854.2), фосфорилазы пуриновых нуклеозидов (ПНФазы) из Sulfolobus solfataricus (NC_002754.1), или их комбинации.
Термин «нуклеозид, который представляет собой донор сахара» относится к гликозиламину, состоящему из нуклеинового основания (часто упоминается просто как «основание»), связанного с сахаром рибозой или дезоксирибозой с помощью бета-гликозидной связи. Примеры «нуклеозидов-доноров сахара» включают, без ограничений, цитидин, уридин, аденозин, гуанозин, тимидин и инозин, а также природные или модифицированные нуклеозиды, содержащие D-рибозу или 2′-дезоксирибозу, нуклеозиды, содержащие рибозу, модифицированную по положениям 2′, 3′ и/или 5′, и нуклеозиды, в которых сахар представляет собой бета-D-арабинозу альфа-L-ксилозу 3′-дезоксирибозу, 3′,5′-дидезоксирибозу, 2′,3′-дидезоксирибозу 5′-дезоксирибозу, 2′,5′--дидезоксирибозу 2′-амино-2′-дезоксирибозу, 3′-амино-3′-дезоксирибозу или 2′-фтор-2′-дезоксирибозу.
Термин «акцепторное основание» относится к нуклеиновому основанию, нуклеотидному основанию, азотистому основанию или просто к «основанию». В природе основания являются частью ДНК или РНК. Основными нуклеиновыми основаниями являются цитозин, гуанин, аденин (ДНК и РНК), тимин (ДНК) и урацил (РНК), сокращенно С, G, А, Т и U, соответственно. Термин «акцепторное основание» в настоящем изобретении включает также модифицированные основания и аналоги нуклеиновых оснований. В ДНК наиболее распространенным модифицированным основанием является 5-метилцитидин (5mC). В РНК встречаются различные модифицированные основания, в том числе псевдоуридин (ψ), дигидроуридин (D), инозин (I), риботимидин (RT) и 7-метилгуанозин (m7G). Гипоксантин и ксантин представляют собой два из многих оснований, которые образуются при наличии мутагенов. Другие примеры акцепторных оснований включают природные или замещенные пиримидиновые и пуриновые основания, пуриновые основания, замещенные по одному или более из положений 1, 2, 6; пиримидиновые основания, замещенные по одному или более из положений 3, 5, и пурин, 2-азапурин, 8-азапурин, 1-деазапурин (имидазопиридин), 3-деазапурин, 7-деазапурин, 2,6-диаминопурин, 5-фторурацил, 5-трифторметилурацил, транс-зеатип, 2-хлор-6-метиламинопурин, 6-диметиламинопурин, 6-меркаптопурин.
Указанный способ трансгликозилирования можно применять для получения нуклеозидов, аналогов нуклеозидов и, в частности, активных фармацевтических ингредиентов (АФИ), включающих, содержащих или состоящих из нуклеозидов или их аналогов. Под АФИ понимают любое вещество или смесь веществ, предназначенных для применения в производстве фармацевтических продуктов (лекарственных), которые при применении в производстве лекарственных препаратов становятся активным ингредиентом лекарственного препарата. Такие вещества обеспечивают фармакологическую активность или другой эффект при диагностике, излечении, ослаблении, в лечении или профилактике заболевания, или влияют на структуру и функции организма. (Eudralex, Part П of volume 4 EU Guidelines to Good Manufacturing Practice).
Комбинация уридинфосфорилазы (УФазы, EC 2.4.2.3) и фосфорилазы пуриновых нуклеозидов (ПНФазы, ЕС 2.4.2.1) эффективно осуществляет перенос остатка сахара от донорного нуклеозида на акцепторное основание.
Когда пиримидиновые нуклеозиды получают из других пиримидиновых нуклеозидов и пиримидиновых оснований в качестве исходных веществ, то применение одной только УФазы является достаточным, но применение обоих ферментов, ПНФазы и УФазы, является предпочтительным, поскольку ПНФаза может также обеспечивать этап фосфоролиза. В свою очередь, когда пуриновые нуклеозиды получают из других пуриновых нуклеозидов и пуриновых оснований в качестве исходных веществ, то применение как ПНФазы, так и УФазы также является предпочтительным. С другой стороны, применение обоих ферментов ПНФазы и УФазы гораздо более эффективно, если реакцию проводят на основе пиримидина с получением пуринового нуклеозида, например, из уридина с образованием 2,6 диаминопурина рибозида, по сравнению с применением каждого типа фермента в отдельности.
Предпочтительно в способе трансгликозилирования применяют комбинацию УФазы и ПНФазы. Неочищенный лизат клеток или осветленный раствор неочищенного фермента могут быть смешаны в разных пропорциях с получением оптимизированного биокатализатора для конкретной реакции трансгликозилирования.
В одном из вариантов в способе трансгликозилирования согласно настоящему изобретению УФаза из Aeropyrum pernix и ПНФаза из Sulfolobus solfataricus продуцируются клеткой-хозяином согласно любому из вариантов реализации, описанных в данном документе выше и ниже.
В одном из вариантов реализации в способе трансгликозилирования согласно настоящему изобретению УФазу, ПНФазу или их комбинацию применяют в виде лизата.
В одном варианте реализации способ трансгликозилирования включает следующие этапы: (I) культивирование клетки-хозяина в подходящей питательной среде; (II) экспрессию на высоком уровне (сверхэкспрессию) УФазы, ПНФазы или обоих ферментов, (III) при необходимости, приготовление клеточного лизата, (IV), добавление нуклеозида-донора сахара, акцепторного основания и фосфат-ионов, и (V) извлечение нуклеозидов из реакционной смеси.
В конкретном варианте реализации трансформанты Escherichia coli, включающих вектор, можно выращивать в культуральной среде, содержащей триптон, дрожжевой экстракт, хлорид натрия и антибиотик, выбран из группы, включающей канамицин, тетрациклин, карбенициллин и ампициллин, предпочтительно при температуре 37°C до оптической плотности между 0,5-0,8 при длине волны около 600 нм. Затем в культуру можно добавлять изопропил-бета-D-тиогалактопиранозид (ИПТГ) до конечной концентрации 100 мг/л, и может быть осуществлена индукция при 37°C от 6 до 12 часов. Клетки затем могут быть собраны путем центрифугирования при 4°C, и осадок клеток можно лизировать путем трех циклов замораживания-оттаивания. Рекомбинантные клетки-хозяева могут быть разрушены с помощью стандартных методик, известных специалистам в данной области. Образующийся клеточный лизат непосредственно применяют в качестве биокатализатора или центрифугируют для удаления остатков клеток и получения осветленного раствора неочищенного фермента. Применяемый в настоящей заявке термин «биокатализатор» обозначает любую биологическую молекулу, способную катализировать превращение субстрата в продукт, в данном случае, биотрансформацию нуклеозида.
В одном из вариантов реализации в способе трансгликозилирования настоящего изобретения нуклеозид, который представляет собой донор сахара выбран из природных или модифицированных нуклеозидов, содержащих D-рибозу и 2′-дезоксирибозу нуклеозидов, содержащих рибозу, модифицированную по 2′, 3′ и/или 5′-положению, и нуклеозиды, в которых сахар представляет собой бета-D-арабинозу, альфа-L-ксилозу 3′-дезоксирибозу, 3′,5′-дидезоксирибозу, 2′,3′-дидезоксирибозу, 5′-дезоксирибозу, 2′,5′-дидезоксирибозу, 2′-амино-2′-дезоксирибозу, 3′-амино-3′-дезоксирибозу 2′-фтор-2′-дезоксирибозу.
В одном из вариантов реализации в способе трансгликозилирования согласно настоящему изобретению акцепторное основание выбрано из природного или замещенного пиримидинового и пуринового основания, пуринового основания, замещенного по 1, 2, 6 положения, или их комбинации из пуринового кольца; пиримидинового основания, замещенного по 3, 5 положениям, или их комбинации из пиримидинового кольца, например, пуринов, 2-азапурина, 8-азапурина, 1-деазапурина (имидазопиридина), 3-деазапурина, 7-деазапурина, 2,6-диаминопурина, 5-фторурацила, 5-трифторметилурацила, транс-зеатина, 2-хлор-6-метиламинопурина, 6-диметиламинопурина, 6-меркаптопурина.
В одном из вариантов реализации в способе трансгликозилирования согласно настоящему изобретению образующийся аналог нуклеозида представляет собой активный фармацевтический ингредиент (АФИ), как известно в данной области.
В одном варианте реализации способа трансгликозилирования согласно настоящему изобретению указанный способ осуществляют при температуре от 60 до 100°C.
В одном варианте реализации способ трансгликозилирования согласно настоящему изобретению осуществляют в водной среде, или в системе апротонного полярного сорастворителя.
В одном варианте реализации система апротонного полярного сорастворителя выбрана из диметилсульфоксида, тетрагидрофурана, 2 - метилтетрагидрофурана, диметилформамида или любой их комбинации.
В одном из вариантов реализации в способе трансгликозилирования согласно настоящему изобретению нуклеозид-донор сахара выбран из уридина и 2′-дезоксиуридина, а акцепторное основание представляет собой 2,6-диаминопурин.
В одном варианте реализации настоящее изобретение относится к одностадийному ферментативному синтезу нуклеозидов с применением уридина или 2′-дезоксиуридина в качестве донора остатка сахара, поскольку рекомбинантный фермент УФаза согласно настоящему изобретению является наиболее специфичным в отношении этих субстратов. Тем не менее, этот фермент можно применять с любым донором остатка сахара, потому что он не способен различать уридин, 2′-дезоксиуридин и другие пиримидиновые нуклеозиды, что, к сожалению происходит у многих низших организмов, например, у В. stearothermophilus [14].
В одном из вариантов реализации в способе трансгликозилирования согласно настоящему изобретению нуклеозид, который представляет собой донор сахара выбран из уридина и 2′-дезоксиуридина, а акцепторное основание представляет собой 5-фторурацил.
В одном из вариантов реализации в способе трансгликозилирования согласно настоящему изобретению нуклеозид, который представляет собой донор сахара выбран из уридина и 2′-дезоксиуридина, а акцепторное основание представляет собой 5-трифторметилурацил.
В одном из вариантов реализации в способе трансгликозилирования согласно настоящему изобретению нуклеозид, который представляет собой донор сахара выбран из уридина и 2′-дезоксиуридина, а акцепторное основание представляет собой транс-зеатии.
В одном из вариантов реализации в способе трансгликозилирования согласно настоящему изобретению нуклеозид, который представляет собой донор сахара выбран из уридина и 2'′-дезоксиуридина, а акцепторное основание представляет собой 2-хлор-6-метиламинопурин.
В одном из вариантов реализации в способе трансгликозилирования согласно настоящему изобретению нуклеозид, который представляет собой донор сахара выбран из уридина и 2′-дезоксиуридина, а акцепторное основание представляет собой 6-диметиламинопурин.
В одном из вариантов реализации в способе трансгликозилирования согласно настоящему изобретению нуклеозид, который представляет собой донор сахара выбран из уридина и 2′-дезоксиуридина, а акцепторное основание представляет собой 6-меркаптопурин.
Термин «термостабильные нуклеозидфосфорилазы» относится к ферментам, которые устойчивы к нагреванию, являются термостойкими и сохраняют активность нуклеозидфосфорилазы, достаточную для осуществления другой реакции и не денатурируются необратимо (не инактивируются) при воздействии высоких температур в течение времени, необходимого для осуществления реакции трансгликозилирования.
Примеры, приведенные ниже, представлены только для иллюстрации настоящего изобретения и не ограничивают область его применения.
Примеры
Как указано выше, реакции трансгликозилирования согласно настоящему изобретению проводят с помощью ферментов УФазы и ПНФазы, полученных из клеток, продуцирующих УФазы или ПНФазы. Такие клетки предпочтительно представляют собой генетически модифицированные клетки Escherichia coli, способные экспрессировать значительное количество УФазы или ПНФазы. Способы получения таких клеток, ферменты и их характеристики, а также производство некоторых аналогов нуклеозидов приведены в прилагаемых примерах, изложенных ниже.
Пример 1
Конструирование Escherichia coli deoD
Последовательность фосфорилазы пуриновых нуклеозидов (ПНФазы) Sulfolobus solfataricus находится в Gen Bank под номером АЕ 006766. Ген амплифицировали путем ПЦР с использованием 2 единиц фермента Platinum Pfx (Invitrogen), 1 мМ MgSO4 и 1x буфера для амплификации, 200 мкМ дНТФ и 0,3 мкМ каждого праймера, включающего олигонуклеотиды 5′-caccgtgccatttttagaaaatggttcc-3′ (Sulfolobus solfataricus deoD прямой, SEQ ID NO 1) и 5′-aatcagttttaagaatcttaaggtaat-3′ (Sulfolobus solfataricus deoD обратный, SEQ ID NO 2) из Sulfolobus solfataricus P2 [15]. ПЦР проводили при первоначальной денатурации при 94°C в течение 30 минут, а затем с помощью 36 температурных циклов, включающих этап денатурации при 94°C в течение 1 мин, и этап отжига/элонгации при 60°C в течение 1,5 мин и 68°C в течение 1 минуты. После 36 циклов пробу выдерживали при 68°C в течение 10 минут и, в заключение, при 4°C. Продукт ПЦР анализировали с помощью электрофореза в агарозном геле, и полоску ДНК очищали из геля с помощью набора S.N.A.P.™ UV-Free Gel Purification Kit, Invitrogen. Амплифицированный фрагмент клонировали в полилинкерной области вектора pUC18, несущего ген устойчивости к ампициллину [17]. Клонированный фрагмент полностью секвенировали, и было показано, что он полностью идентичен последовательности из базы данных.
Пример 2
Конструирование Escherichia coli udp
Последовательность фосфорилазы пиримидиновых нуклеозидов (УФазы) Aeropyrum pernix находится в GenBank под номером NC_000854.2. Ген амплифицировали путем ПЦР с использованием 2 единиц фермента Platinum Pfx (Invitrogen), 1 мМ MgSO4 и lx буфера для амплификации, 200 мкМ дНТФ и 0,3 мкМ каждого праймера, включающего олигонуклеотиды 5′-caccgtggcccgctacgttctcctc-3′ (Aeropyrum pernix udp прямой; SEQ ГО NO. 3) и 5'-gaattcctatgtgcgtctgcacgccagg-3′ (Aeropyrum pernix обратный; SEQ ID NO. 4) из Aeropyrum pernix K1 [16]. ПЦР проводили при первоначальной денатурации при 94°C в течение 30 минут, а затем с помощью 36 температурных циклов, включающих этап денатурации при 94°C в течение 1 мин, и этап отжига/элонгации при 60°C в течение 1,5 мин и 68°C в течение 1 минуты. После 36 циклов пробу выдерживали при 68°C в течение 10 минут и, в заключение, при 4°C. Продукт ПЦР анализировали с помощью электрофореза в агарозном геле, и полоску ДНК очищали из геля с помощью набора S.N.A.P.™ UV-Free Gel Purification Kit, Invitrogen. Амплифицированный фрагмент клонировали в полилинкерной области вектора pUC18, несущего ген устойчивости к ампициллину [17]. Клонированный фрагмент полностью секвенировали, и было показано, что он полностью идентичен последовательности из базы данных.
Пример 3
Клонирование в вектор рЕТ102/Р-ТОРО® и трансформация клеток
Фрагменты ДНК, содержащие последовательность гена Aeropyrum pernix udp и последовательность гена Sulfolobus sulfactaricus deoD, клонировали в вектор pET102/D-ТОРО® (из набора рЕТ102 Directional ТОРО® Expression Kit, Invitrogen), который включает в себя ориджин pBR322ori для репликации плазмиды, ген устойчивости к ампициллину, промотор Т7, делающий возможным связывание РНК-полимеразы Т7, lac-оператор, обеспечивающий ингибирование экспрессии в отсутствие изопропилтиогалактопиранозида (ИПТГ), сайт связывания рибосомы для трансляции РНК, His-пэтч-тиоредоксин для увеличения растворимости гибридного белка и полигистидиновую последовательность (6xHis) для детекции и очистки гибридного белка (Фигура 3). Вектор вводили с помощью теплового шока в клетки Escherichia coli BL21 (из набора рЕТ102 Directional ТОРО® Expression Kit, Invitrogen), коммерческий штамм, который применяют для регулируемой экспрессии гетерологичных генов. Этот штамм содержит ген, кодирующий РНК-полимеразу Т7, которая делает штамм совместимым с применением векторов рЕТ, содержащих промотор Т7 для сверхэкспрессии рекомбинантных белков при использовании ИПТГ.
Полученные рекомбинантные векторы анализировали путем рестрикции ДНК с использованием 10 единиц фермента Hindlll. Положительный клон секвенировали с использованием праймеров: прямого
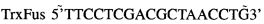

Пример 4
Ферментация рекомбинантных штаммов
Рекомбинантные штаммы, относящиеся к настоящему изобретению, выращивали в отдельности при периодическом культивировании при pH=7, на триптиказо-соевой твердой среде с ампициллином. Одну колонию культуры высевали в питательную среду n° 2 (Oxoid), содержащую порошок Lab-lemco 10 г/л, пептон 10 г/л и NaCl 5 г/л с добавлением 200 мг/л ампициллина. Инкубировали при 37°C при энергичном встряхивания (200 об./мин.). Штаммы Escherichia coli, несущих экспрессионные плазмиды выращивали до оптической плотности, составляющей 0,6 при 600 нм, затем добавляли ИПТГ (до 100 мг/л), и культивирование продолжали в течение дополнительных 8 часов. После завершения ферментации, культуральную среду центрифугировали, осадок клеток промывали в 30 мМ фосфатном буфере, pH 7. Полученную биомассу хранили при -20°C до применения.
Пример 5
Частичная очистка УФазы и ПНФазы (подготовка клеточного лизата) Для частичной очистки белка клеточную суспензию, полученную путем центрифугирования или микрофильтрации из культуры рекомбинантного штамма, экспрессирующего фермент УФазу или ПНФазу, лизировали путем добавления 160 мг лизоцима и инкубирования при 0°C в течение одного часа с последующим тремя циклами сверхбыстрого замораживания-оттаивания (-80°C/37°C) и заключительного этапа для снижения вязкости с добавлением 1000 единиц дезоксирибонуклеазы I.
Пример 6
Определение ферментативной активности фермента УФазы
Сто микролитров центрифугированного клеточного лизата, включающего суспензию клеток, экспрессирующих УФазу, разводили 1:100 (объем/объем) в калий-фосфатном буфере при pH 7,0, добавляли 800 мкл 75 мМ раствора уридина в 100 мМ фосфатном буфере при pH 7.0, инкубировали при 30°C. Через 5 минут реакцию фосфоролиза останавливали добавлением 1 мл 2Н НС1. Аликвоту реакционной смеси анализировали с помощью высокоэффективной жидкостной хроматографии (ВЭЖХ), оснащенной колонкой Kromasil 100-5С18 (Akzo Nobel) размером 250×4,6 мм. Элюирование осуществляли с помощью 4% раствора метанол-вода. Ферментативную активность клеточного лизата выражали в единицах на мл (микроМоль урацила × мин-1 × мл-1) и рассчитывали относительно стандартного раствора урацила, элюированного в тех же условиях. Было получено около 590 единиц на мл центрифугированного лизата клеток.
Пример 7
Определение ферментативной активности фермента ПНФазы
Сто микролитров центрифугированного клеточного лизата, включающего суспензию клеток, экспрессирующих ПНФазу, разводили 1:100 (объем/объем) в калий-фосфатном буфере при pH 7,0, добавляли 800 мкл 60 мМ раствора инозина в 100 мМ фосфатном буфере при pH 7,0, инкубировали при 30°C. Ровно через 10 минут реакцию фосфоролиза останавливали добавлением 1 мл 2Н НС1. Аликвоту реакционной смеси анализировали с помощью высокоэффективной жидкостной хроматографии (ВЭЖХ), оснащенной колонкой Kromasil 100-5С18 (Akzo Nobel) размером 250×4,6 мм. Элюирование осуществляется с помощью раствора 4% метанол-вода. Ферментативную активность клеточного лизата выражали в единицах на мл (микроМоль гипоксантина × мин-1 × мл-1) и рассчитывали по отношению к стандартному раствору гипоксантина, элюированного в тех же условиях. Было получено около 310 единиц на мл центрифугированного лизата клеток.
Пример 8
Определение каталитической активности трансгликозилирования
Для определения каталитической активности трансгликозилирования смесь клеточных лизатов, содержащих как УФазу, так и ПНФазу, получали в результате смешивания лизатов с получением соотношения ферментативной активности УФазы: ПНФазы примерно 1:1, определенной, как описано в Примерах 6 и 7. Реакцию трансгликозилирования проводили при аналитической шкале в следующих условиях: 250 мкл клеточных лизатов (эквивалентно 14 единицам ферментативной активности каждого из ферментов УФазы и ПНФазы) добавляли к 10 мл раствора, имеющего следующий состав: 4 мМ 1-β-D-рибофуранозилурацил (уридиновый нуклеозид), 4 мМ адениновое основание, 30 мМ калий-фосфатный буфер pH 7 при регулируемой температуре 60°C. Через 1,5 часа при 60°C реакцию останавливали путем разбавления смеси 1:5 и охлаждения на льду Долю биоконверсии аденинового основания в 9-β-D-рибофуранозиладенин (аденозиновый нуклеозид) определяли путем анализа аликвоты реакционной смеси с помощью высокоэффективной жидкостной хроматографии (ВЭЖХ) с использованием колонки Kromasil 100-5С18 (Akzo Nobel) размером 250×4,6 мм, и элюировали 4% раствором метанол-вода. Каталитическую активность трансгликозилирования выражали в единицах на мл (мкмоль Ara-А, образованного за 1,5 часа·мл-1 смеси клеточных лизатов) или в единицах на г влажной смолы (мкмоль D-рибофуранозиладенина, образованного за 1,5 часа·мл-1 клеточного лизата) и рассчитывали относительно стандартного раствора D-рибофуранозиладенина, элюированного при ВЭЖХ в тех же условиях. В таких условиях было получено около 55 процентов аденозинового нуклеозида (около 9 единиц на мл клеточного лизата).
Пример 9
Влияние температуры и pH на активность нуклеозидфосфорилазы
Влияние pH и температуры на производительность нуклеозидфосфорилазы исследовали с помощью «метода планирования эксперимента». Различные значения температуры комбинировали с различными значениями pH для выявления условий, которые обуславливают максимальную ферментативную активность. Область экспериментальных значений составляла 80°C-100°C и pH 5,5-8,5. Как показано на Фигуре 4, пять значений температуры комбинировали с тремя значениями pH в соответствии с матрицей Doehlert, в результате чего получали семь комбинаций температуры и pH. Субстраты инкубировали в выбранном реакционном растворе и при выбранной температуре без фермента, а затем добавляли фермент и инкубировали при выбранных условиях. Образцы обрабатывали, как описано выше, для определения ферментативной активности ферментов ПНФазы или УФазы. Определяли значения активности, выраженные в процентах от соответствующих максимальных значений (100%). Результаты приведены на Фигурах 5 и 6, соответственно.
Пример 10
Термостабильность
Термостабильность ферментов определяли при 80°C. Готовили аликвоты фермента, включающие от 100 до 200 мкл суспензии клеток, экспрессирующих УФазу и/или ПНФазу (клеточный лизат), разбавленных 1:100 или 1:1000 объем/объем калий-фосфатным буфером при pH 7,0-7,2. Биокатализаторы инкубировали при 80°C в течение различных периодов времени. После нагревания, растворы сразу же помещали на лед, и проводили измерение активности нуклеозидфосфорилазы, как описано в Примерах 6 и 7. После инкубации в течение 10 ч при температуре 80°C не наблюдали какой-либо потери активности нуклеозидфосфорилазы.
Влияние растворителей на активность нуклеозидфосфорилазы
Органические сорастворители широко применяют в реакциях, и изолированные ферменты должны сохраняться в условиях относительно высоких концентраций сорастворителя. Эксперименты проводили в присутствии органических растворителей, таких как метанол (протонный полярный растворитель) и диметилсульфоксид (апротонный полярный растворитель). Ферменты нуклеозидфосфорилазы согласно настоящему изобретению были устойчивы к органическим растворителям, демонстрируя активность в буферном растворе, содержащем 5 и 10% от общего объема органического растворителя.

aОтносительную активность клеточного лизата, включающего фермент ПНФазу, определяли с помощью стандартного анализа, описанного в Примере 7, с использованием двух концентрации органических растворителей, и его относительную активность сравнивали с активностью клеточного лизата, включающего фермент ПНФазу, но не содержащего органического растворителя. ДМСО: диметилсульфоксид, МеОН: метанол.

bОтносительную активность клеточного лизата, включающего фермента УФазу, определяли с помощью стандартного анализа, описанного в Примере 6, с использованием двух концентрации органических растворителей, и его относительную активность сравнивали с активностью клеточного лизата, включающего фермент УФазу, но не содержащего органического растворителя. ДМСО: диметилсульфоксид, МеОН: метанол.
Пример 11
Общие способы биоконверсии
Одностадийные реакции трансгликозилирования проводили при выбранных значениях температуры и pH реакции, в реакционных сосудах при слабом перемешивании. Каталитическая активность трансгликозилирования для используемой смеси клеточного лизата составляла около 12 единиц на мл (как определено в Примере 8). Нуклеозиды получали с применением смеси клеточного лизата, включающего ферменты ПНФазу: УФазу в соотношении активностей 1:1. Субстраты:
1) природные 2′-дезоксирибонуклеозиды или рибонуклеозиды, которые действуют как доноры 2′-дезоксирибозы-1-фосфата или рибозы-1-фосфата;
2) вторичное природное или синтетическое пуриновое или пиримидиновое основание, соединенное с положением 1 сахарного остатка.
В конце реакции реакционную смесь центрифугировали, а затем фильтровали с помощью устройства для ультрафильтрации Amicon Ultrafiltration device (мембрана YM-3), после чего продукты разделяли в соответствии с протоколом, предоставляемым производителем. Биокатализаторы можно повторно применять для последовательных реакций (обычно 3-5 раз) при добавлении вновь приготовленных реакционных смесей. Фильтрованные растворы анализировали с помощью высокоэффективной жидкостной хроматографии (ВЭЖХ) при таких же условиях, как описано выше. Выход биоконверсии рассчитывали на основании исходной концентрации аналога основания.
Пример 12
Получение 2,6-диаминопуриновых нуклеозидов
Получение пуриновых нуклеозидов являются более трудным вследствие низкой растворимости этих оснований в водной среде. В настоящем изобретении для решения этой проблемы авторы использовали преимущественные свойства фермента. Эта стратегия, которую использовали авторы настоящего изобретения, включает применение органических сорастворителей и/или высоких температур для увеличения растворимости субстратов.
12.1 Получение 2,6-диаминопуриновых нуклеозидов с применением сорастворителей Анализ проводили в 5 и 10% апротонных дипольных сорастворителей при 60°C, двенадцать единиц/мл клеточного лизата добавляли к 150 мл раствора при регулируемой температуре 60°C, при этом субстратные растворы имели следующий состав:
1) 15 мМ уридин/2′-дезоксиуридин,
2) 5 мМ 2,6-диаминопурин и
3) 30 мМ калий-фосфатный буфер, pH 7.
После 5 часов, реакционную смесь фильтровали центрифугированием при 2000 × g в течение 30 минут при 4°C, через центрифужный фильтр Amicon ultra-4 (Millipore, Bedford, MA) с пороговым значением 3000 Да, и извлекали фильтрат. В Таблице 3 показан выход продукции 2,6-диаминопуриновых нуклеозидов, которые были получены в присутствии сорастворителей. Полученные 2,6-диаминопуриновые нуклеозиды (2,6-диаминопуринрибозид или 2,6-диаминопуриндезоксирибозид) анализировали с помощью высокоэффективной жидкостной хроматографии. В этих реакциях был получен высокий выход продукта (более 80%).

12.2. Получение 2,6-диаминопуриновых нуклеозидов без применения сорастворителя Получение 2,6-диаминопуриновых нуклеозидов без сорастворителей может быть осуществлено только при температуре выше 80°C в связи с ограниченной растворимостью в воде этого пуринового основания. Анализ проводили при различных температурах (80, 90 и 100°C). Двенадцать единиц/мл лизата клеток добавляли к 150 мл раствора при термостатически регулируемой температуре выбранного значения, при этом субстратные растворы имели следующий состав:
1) 15 мМ уридин/2′-дезоксиуридин,
2) 5 мМ 2,6-диаминопурин и
3) 30 мМ калий-фосфатный буфер, pH 7.
После 5 часов, реакционную смесь фильтровали центрифугированием при 2000 × g в течение 30 минут при 4°C, через центрифужный фильтр Amicon ultra-4 (Millipore, Bedford, MA) с пороговым значением 3000 Да, и извлекали фильтрат. В Таблице 3 показан выход продукции 2,6-диаминопуриновых нуклеозидов, которые были получены в присутствии сорастворителей. Полученные 2,6-диаминопуриновые нуклеозиды (2,6-диаминопурин рибозид или 2,6-диаминопурин дезоксирибозид) анализировали с помощью высокоэффективной жидкостной хроматографии. В Таблице 4 показан выход продукции 2,6-диаминопуриновых нуклеозидов, которые были получены без применения органических растворителей. Выход продукта биоконверсии в реакции составил около 80% при всех анализируемых значениях температуры.

Пример 13
Получение других нуклеозидов:
Реакции трансгликозилирования проводили с применением различных акцепторных оснований. Реакции проводили при 80°C в течение различных периодов времени с применением 10% ДМСО в качестве сорастворителя для пуриновых оснований и без применения сорастворителя для пиримидинового акцепторного основания. Процент биоконверсии рассчитывали по отношению к исходной концентрации акцепторного основания и определяли путем анализа методом ВЭЖХ реакционной смеси.
13.1 Получение трифторметилурациловых нуклеозидов
Один мл катализатора (клеточный лизат) с активностью трансгликозилирования около 12 ед./мл клеточного лизата добавляли к 150 мл раствора при термостатически регулируемой температуре 80°C, имеющего следующий состав:
7,5 мМ уридин/2′-дезоксиуридин,
2,5 мМ Трифторметилурацил, и
20 мМ калий-фосфатный буфер, pH 7.
После инкубации в течение 3 часов при 80°C реакционную смесь фильтровали центрифугированием при 2000 × g в течение 30 мин при 4°C через центрифужный фильтр Amicon ultra-4 (Millipore, Bedford, MA) с порогом 3000 Да и извлекали фильтрат. Выход реакции биоконверсии составил более 60%. Полученные трифторметилурациловые нуклеозиды (трифторметилуридин или 2′-дезокситрифторметилуридин) анализировали с помощью ВЭЖХ.
13.2 Получение 5-фторурациловых нуклеозидов
5-Фторурациловые нуклеозиды получали, как ранее описано выше. Один мл катализатора (клеточный лизат) с активностью трансгликозилирования около 12 ед./мл клеточного лизата добавляли к 150 мл раствора при термостатически регулируемой температуре 80°C, имеющего следующий состав:
7,5 мМ уридин/2′-дезоксиуридин,
2,5 мМ 5-фторурацил и
20 мМ калий-фосфатный буфер, pH 7.
После инкубации в течение 3 часов при 80°C реакционную смесь фильтровали центрифугированием при 2000 × g в течение 30 мин при 4°C через центрифужный фильтр Amicon ultra-4 (Millipore, Bedford, MA) с порогом 3000 Да и извлекали фильтрат. Выход реакции биоконверсии составил более 50%. Полученные 5-фторурациловые нуклеозиды (5-фторуридин или 5-фтор-2′-дезоксиуридин) анализировали с помощью ВЭЖХ.
13.3 Получение транс-зеатиновых нуклеозидов
транс-зеатиновые нуклеозиды были получены, как описано выше. Один мл катализатора (клеточный лизат) с активностью трансгликозилирования около 12 ед./мл клеточного лизата добавляли к 150 мл раствора при термостатически регулируемой температуре 80°C, имеющего следующий состав:
7,5 мМ уридин/2′-дезоксиуридин,
2,5 мМ транс-зеатин и
20 мМ калий-фосфатный буфер, pH 7.
Анализ проводили в 10% (об./об.) ДМСО в качестве сорастворителя с использованием условий, описанных выше. Через 5 часов при 80°C реакционную смесь фильтровали центрифугированием при 2000 × g в течение 30 минут при 4°C через центрифужный фильтр Amicon ultra-4 (Millipore, Bedford, MA) с порогом 3000 Да и извлекали фильтрат. Выход реакции биоконверсии составил более 80%. Полученные транс-зеатиновые нуклеозиды (транс-зеатин рибозид и транс-зеатин дезоксирибозид) анализировали с помощью ВЭЖХ.
13.4 Способ получения 2-хлор-6-метиламинопуриновых нуклеозидов
2-хлор-6-метиламинопурина нуклеозиды были получены, как описано выше. Один мл катализатора (клеточный лизат) с активностью трансгликозилирования около 12 ед./мл клеточного лизата добавляли к 150 мл раствора при термостатически регулируемой температуре 80°C, имеющего следующий состав:
15 мМ уридин/2′-дезоксиуридин,
5 мМ 2-хлор-6-метиламинопурин и
30 мМ калий-фосфатный буфер, pH 7.
Анализ проводили в 10% (об./об.) ДМСО в качестве сорастворителя с использованием условий, описанных выше. Через 5 часов при 80°C реакционную смесь фильтровали центрифугированием при 2000 × g в течение 30 минут при 4°C через центрифужный фильтр Amicon ultra-4 (Millipore, Bedford, MA) с порогом 3000 Да, и извлекали фильтрат. Выход реакции биоконверсии составил более 80%. Полученные 2-хлор-6-метиламинопуриновых нуклеозиды (2-хлор-6-метиламинопурин рибозид и 2-хлор-6-метиламинопурин дезоксирибозид) анализировали с помощью ВЭЖХ.
13.5 Получение 6-диметиламинопуриновых нуклеозидов
6-Диметиламинопуриновые нуклеозиды получали, как описано выше. Один мл катализатора (клеточный лизат) с активностью трансгликозилирования около 12 ед./мл клеточного лизата добавляли к 150 мл раствора при термостатически регулируемой температуре 80°C, имеющего следующий состав:
15 мМ уридин/2′-дезоксиуридин,
5 мМ 6-диметиламинопурин и
30 мМ калий-фосфатный буфер, pH 7.
Анализ проводили в 10% (об./об.) ДМСО в качестве сорастворителя с использованием условий, описанных выше. Через 5 часов при 80°C реакционную смесь фильтровали центрифугированием при 2000 × g в течение 30 минут при 4°C через центрифужный фильтр Amicon ultra-4 (Millipore, Bedford, MA) с порогом 3000 Да и извлекали фильтрат. Выход реакции биоконверсии составил более 80%. Полученные 6-диметиламинопуриновые нуклеозиды (6-диметиламинопурин рибозид и 6-диметиламинопурин дезоксирибозид) анализировали с помощью ВЭЖХ.
13.6 Получение 6-меркаптопуриновых нуклеозидов
6-Меркаптопуриновые нуклеозиды получали, как описано выше. Один мл катализатора (клеточный лизат) с активностью трансгликозилирования около 12 ед./мл клеточного лизата добавляли к 150 мл раствора при термостатически регулируемой температуре 80°C, имеющего следующий состав:
15 мМ уридин/2′-дезоксиуридин,
5 мМ 6-меркаптопурин и
30 мМ калий-фосфатный буфер, pH 7.
Анализ проводили в 10% (об./об.) ДМСО в качестве сорастворителя с использованием условий, описанных выше. Через 5 часов при 80°C реакционную смесь фильтровали центрифугированием при 2000 × g в течение 30 минут при 4°C через центрифужный фильтр Amicon ultra-4 (Millipore, Bedford, MA) с порогом 3000 Да и извлекали фильтрат. Выход реакции биоконверсии составил более 50%. Полученные 6-меркаптопуриновые нуклеозиды (6-меркаптопурин рибозид и 6-меркаптопурин дезоксирибозид) анализировали с помощью ВЭЖХ.
Все публикации, патенты и патентные заявки, приведенные в настоящем документе, включены посредством ссылки в полном объеме, как если бы каждый из них был включен посредством ссылки в отдельности.


Реферат
Изобретение относится к области биотехнологии и раскрывает рекомбинантный экспрессионный вектор, включающий: либо последовательность, кодирующую фосфорилазу пуриновых нуклеозидов (ПНФазу из Sulfolobus solfataricus), либо последовательность, кодирующую уридинфосфорилазу (УФазу из Aeropyrum pernix), либо обе указанные последовательности. Каждая из указанных последовательностей функционально связана с одной или более регуляторной последовательностью, которая контролирует продукцию указанных фосфорилаз в хозяине (E.coli). Настоящее изобретение также раскрывает клетку-хозяина, содержащую указанный экспрессионный вектор, а также лизат, полученный путем лизирования указанной клетки-хозяина. Настоящее изобретение раскрывает способ трансгликозилирования между нуклеозидом, который является донором сахара и акцепторным основанием в присутствии фосфат-ионов и любого из указанных ферментов или их комбинации. Настоящее изобретение позволяет получать новые рекомбинантные нуклеозидфосфорилазы с повышенной термостабильностью, высокой каталитической эффективностью, которые можно использовать для проведения реакции трансгликозилирования. 4 н. и 9 з.п. ф-лы, 8 ил., 4 табл., 13 пр.

Комментарии