Растения пшеницы с повышенной устойчивостью к имидазолиноновым гербицидам - RU2337532C2
Код документа: RU2337532C2
Чертежи



Описание
ПЕРЕКРЕСТНАЯ ССЫЛКА НА РОДСТВЕННЫЕ ЗАЯВКИ
Данная заявка испрашивает приоритет на основании предварительной заявки США с регистрационным номером 60/311180, поданной 9 августа 2001 года.
ОБЛАСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится в целом к растениям с повышенной устойчивостью к имидазолиноновым гербицидам. Более конкретно, данное изобретение относится к растениям пшеницы, полученным мутагенезом, кроссбридингом и трансформацией, которые обладают повышенной устойчивостью к имидазолиноновым гербицидам.
ПРЕДПОСЫЛКИ ИЗОБРЕТЕНИЯ
Синтаза ацетогидроксикислоты (AHAS; EC 4.1.3.18) является первым ферментом, катализирующим биохимический синтез валина, лейцина и изолейцина в аминокислотах с разветвленной цепью (Singh B.K., 1999, Biosynthesis of valine, leucine and isoleucine in: Singh B.K. (Ed) Plant amino acids. Marcel Dekker Inc. New York, New York, p. 227-247). На AHAS воздействуют четыре разных в структурном отношении семейства гербицидов, включающих сульфонилмочевины (LaRossa RA and Falco SC, 1984, Trends Biotechnol. 2:158-161), имидазолиноны (Shaner et al., 1984, Plant Physiol., 76:545-546), триазолопиримидины (Subramanian and Gerwick, 1989, Inhibition of acetolactate synthase by triazolopyrimidines in (ed) Whitaker JR, Sonnet PE, Biocatalysis in agricultural biotechnology. ACS Symposium Series, American Chemical Society, Washington, D.C., p. 277-288) и пиримидилоксибензоаты (Subramanian et al., 1990, Plant Physiol. 94: 239-244). Гербициды на основе имидазолинона и сульфонилмочевины широко применяются в современном сельском хозяйстве благодаря их эффективности при очень низких уровнях внесения и относительной нетоксичности для животных. Подавляя активность AHAS, указанные семейства гербицидов предотвращают дальнейший рост и развитие восприимчивых к ним растений, включая многие виды сорняков. Несколькими примерами промышленно производимых имидазолиноновых гербицидов являются PURSUIT® (имазетапир), SCEPTER® (имазахин) и ARSENAL® (имазапир). Примеры гербицидов на основе сульфонилмочевины включают хлорсульфурон, метсульфуронметил, сульфометуронметил, хлоримуронэтил, тифенсульфуронметил, трибенуронметил, бенсульфуронметил, никосульфурон, этаметсульфуронметил, римсульфурон, трифлусульфуронметил, триасульфурон, примисульфуронметил, циносульфурон, амидосульфурон, флузасульфурон, имазосульфурон, пиразосульфуронэтил и галогенсульфурон.
Благодаря высокой эффективности и низкой токсичности имидазолиноновые гербициды применяют для опрыскивания растительности на больших площадях. Возможность опрыскивания гербицидом растительности на больших площадях сокращает затраты, связанные с возделыванием и содержанием сельскохозяйственных культур, и уменьшает потребность в подготовке участка к использованию таких химикатов. Кроме того, опрыскивание желательных устойчивых видов растений позволяет максимально увеличить урожайность требуемых культур благодаря отсутствию конкурирующих видов. Однако возможность применения таких методов опрыскивания зависит от наличия устойчивых к имидазолинону видов растительности на опрыскиваемом участке.
Среди главных сельскохозяйственных культур некоторые бобовые культуры, такие как соя, обладают природной устойчивостью к имидазолиноновым гербицидам благодаря их способности быстро метаболизировать гербицидные соединения (Shaner and Robinson, 1985, Weed Sci., 33:469-471). Другие сельскохозяйственные культуры, такие как кукуруза (Newhouse et al., 1992, Plant Physiol., 100:882-886) и рис (Barrette et al., 1989, Crop Safeners for Herbicides, Academic Press, Nes York, p. 195-220) в некоторой степени восприимчивы к воздействию имидазолиноновых гербицидов. Различная восприимчивость к имидазолиноновым гербицидам зависит от химической природы конкретного гербицида и разного превращения соединения из токсичной в нетоксичную форму, происходящего в каждом растении в процессе обмена веществ (Shaner et al., 1984, Plant Physiol., 76:545-546; Brown et al., 1987, Pestic. Biochim. Physiol., 27:24-29). Другие физиологические различия растений, такие как поглощение и передвижение веществ, также имеют важное значение для восприимчивости к определенным веществам (Shaner and Robinson, 1985 Weed Sci. 33:469-471).
Сорта сельскохозяйственных культур, устойчивые к имидазолинонам, сульфонилмочевинам и триазолопиримидинам, успешно получены при помощи мутагенеза семян, микроспор, пыльцы и каллюсов в таких видах, как Zea mays, Arabidopsis thaliana, Brassica napus, Glycine max и Nicotiana tabacum (Sebastian et al., 1989, Crop Sci. 29:1403-1408; Swanson et al., 1989, Theor. Appl. Genet., 78:525-530; Newhouse et al., 1991, Theor. Appl. Genet. 83:65-70; Sathasivan et al., 1991, Plant Physiol., 97: 1044-1050; Mourand et al., 1993, J. Heredity, 84:91-96). Во всех случаях устойчивость вызывает один частично доминантный ядерный ген. В результате мутагенеза семян Triticum aestivum L. сорта Fidel (Newhouse et al., 1992, Plant Physiol., 100:882-886) ранее были выделены четыре вида растений пшеницы, устойчивых к имидазолинону. Исследования наследственности подтвердили, что устойчивость придает один, частично доминантный ген. В результате исследования аллелей авторы пришли к выводу, что мутации в четырех идентифицированных линиях расположены в одном и том же локусе. Один из генов устойчивости в сорте Fidel получил название FS-4 (Newhouse et al., 1992, Plant Physiol., 100:882-886).
Компьютерное моделирование трехмерной структуры комплекса AHAS-ингибитор позволяет прогнозировать наличие нескольких аминокислот в предлагаемом "кармане" связывания ингибитора в качестве сайтов, где индуцированные мутации, по-видимому, вызывают избирательную устойчивость к имидазолинонам (Ott et al., 1996, J. Mol. Biol., 263:359-368). Растения пшеницы, полученные в результате некоторых из указанных рационально программируемых мутаций на предлагаемых сайтах связывания фермента AHAS, действительно обладают специфической устойчивостью к одному классу гербицидов (Ott et al., 1996, J. Mol. Biol., 263:359-368).Устойчивость растений к имидазолиноновым гербицидам описана также в ряде патентов. В патентах США № 4761373, 5331107, 5304732, 6211438, 6211439 и 6222100 дано общее описание применения измененного гена AHAS для создания растений, устойчивых к гербицидам, и, в частности, рассмотрены некоторые сорта зерновых культур, устойчивые к имидазолинону. В патенте США № 5013659 описаны растения с устойчивостью к гербицидам, которые имеют мутации, по меньшей мере, одной аминокислоты в одной или более консервативных областях. Мутации, описанные в вышеуказанном патенте, кодируют перекрестную устойчивость к имидазолинонам и сульфонилмочевинам или специфическую устойчивость к сульфонилмочевине, но в данном патенте не рассмотрена специфическая устойчивость к имидазолинону. Кроме того, в патентах США № 5731180 и 5767361 описан выделенный ген с заменой одной аминокислоты в аминокислотной последовательности AHAS однодольных растений дикого типа, который определяет специфическую устойчивость к имидазолинону.
До настоящего времени не были известны устойчивые к имидазолинону растения пшеницы, имеющие более одного измененного гена AHAS. В научной литературе ранее также не были описаны устойчивые к имидазолинону растения пшеницы, имеющие мутации в геномах, не являющихся геномом, из которого выделен ген FS-4. Поэтому необходимо идентифицировать гены устойчивости к имидазолинону из дополнительных геномов. Кроме того, необходимо получить растения пшеницы, обладающие повышенной устойчивостью к гербицидам, таким как имидазолинон, и содержащие более одного измененного гена AHAS. Существует потребность также в способах борьбы с сорняками, произрастающими рядом с такими растениями пшеницы. Такие композиции и способы позволяют применять методы опрыскивания при внесении гербицидов на участки, засеянные пшеницей.
КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к растениям пшеницы, содержащим нуклеиновые кислоты IMI, которые обладают повышенной устойчивостью к имидазолиноновому гербициду по сравнению с сортом растения дикого типа. Растения пшеницы могут содержать одну, две, три или большее число нуклеиновых кислот IMI. В одном варианте осуществления изобретения растение пшеницы включает множество нуклеиновых кислот IMI, расположенных в разных геномах. Нуклеиновые кислоты IMI предпочтительно кодируют белки, включающие мутацию в консервативной аминокислотной последовательности, выбираемой из группы, состоящей из домена А, домена В, домена С, домена D и домена Е. Более предпочтительно мутация находится в консервативном домене Е или консервативном домене С. Кроме того, настоящее изобретение относится к частям растения и семенам растения, полученным из описанных растений пшеницы. В другом варианте осуществления изобретения растение пшеницы включает нуклеиновую кислоту IMI, которая не является нуклеиновой кислотой Imi1. Например, нуклеиновая кислота IMI может быть нуклеиновой кислотой Imi2 или Imi3.
Нуклеиновые кислоты IMI по настоящему изобретению могут включать нуклеотидную последовательность, выбираемую из группы, состоящей из полинуклеотида SEQ ID NO: 1; полинуклеотида, содержащего, по меньшей мере, 60 последовательно расположенных нуклеотидов SEQ ID NO: 1; и полинуклеотида, комплементарного SEQ ID NO: 1.
Растения по настоящему изобретению могут быть трансгенными или нетрансгенными. Примеры нетрансгенных растений пшеницы с повышенной устойчивостью к имидазолиноновым гербицидам включают растение пшеницы, представленное под идентификационным номером патентного депозитария АТСС РТА-4113; или мутантное, рекомбинантное или генетически сконструированное производное растения, представленного под идентификационным номером патентного депозитария АТСС РТА-4113; или любое потомство растения, представленного под идентификационным номером патентного депозитария АТСС РТА-4113; или растение, являющееся потомством любого из указанных растений.
Помимо композиций в объем настоящего изобретения входят несколько способов. В данной заявке на патент описаны способы модификации устойчивости растения к имидазолиноновому гербициду, включающие модификацию экспрессии нуклеиновой кислоты IMI в растении. Кроме того, в данной заявке описаны способы получения трансгенного растения с повышенной устойчивостью к имидазолиноновому гербициду, включающие трансформацию растительной клетки экспрессирующим вектором, содержащим одну или более нуклеиновых кислот IMI, и выращивание растения из растительной клетки. Данное изобретение далее относится к способу борьбы с сорняками, произрастающими рядом с растениями пшеницы, который включает нанесение имидазолинонового гербицида на сорняки и растение пшеницы, при этом растение пшеницы обладает повышенной устойчивостью к имидазолиноновому гербициду по сравнению с сортом растения дикого типа пшеницы, при этом растение содержит одну или более нуклеиновых кислот IMI. В некоторых предпочтительных вариантах осуществления указанных способов растения содержат множество нуклеиновых кислот IMI, находящихся в разных геномах пшеницы.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
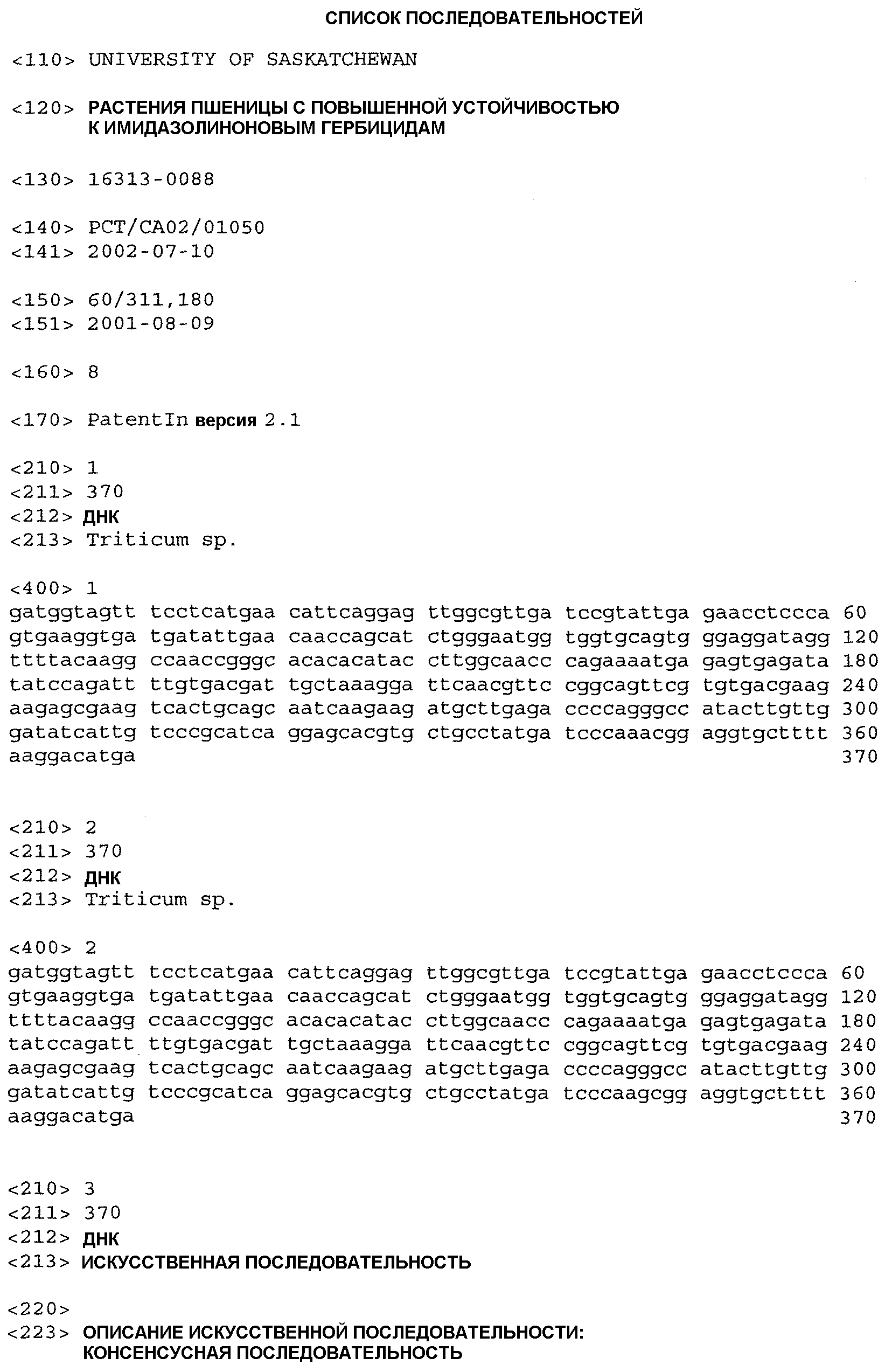
На фиг.1 показана частичная кДНК-последовательность Einkorn IMI3 (SEQ ID NO:1).
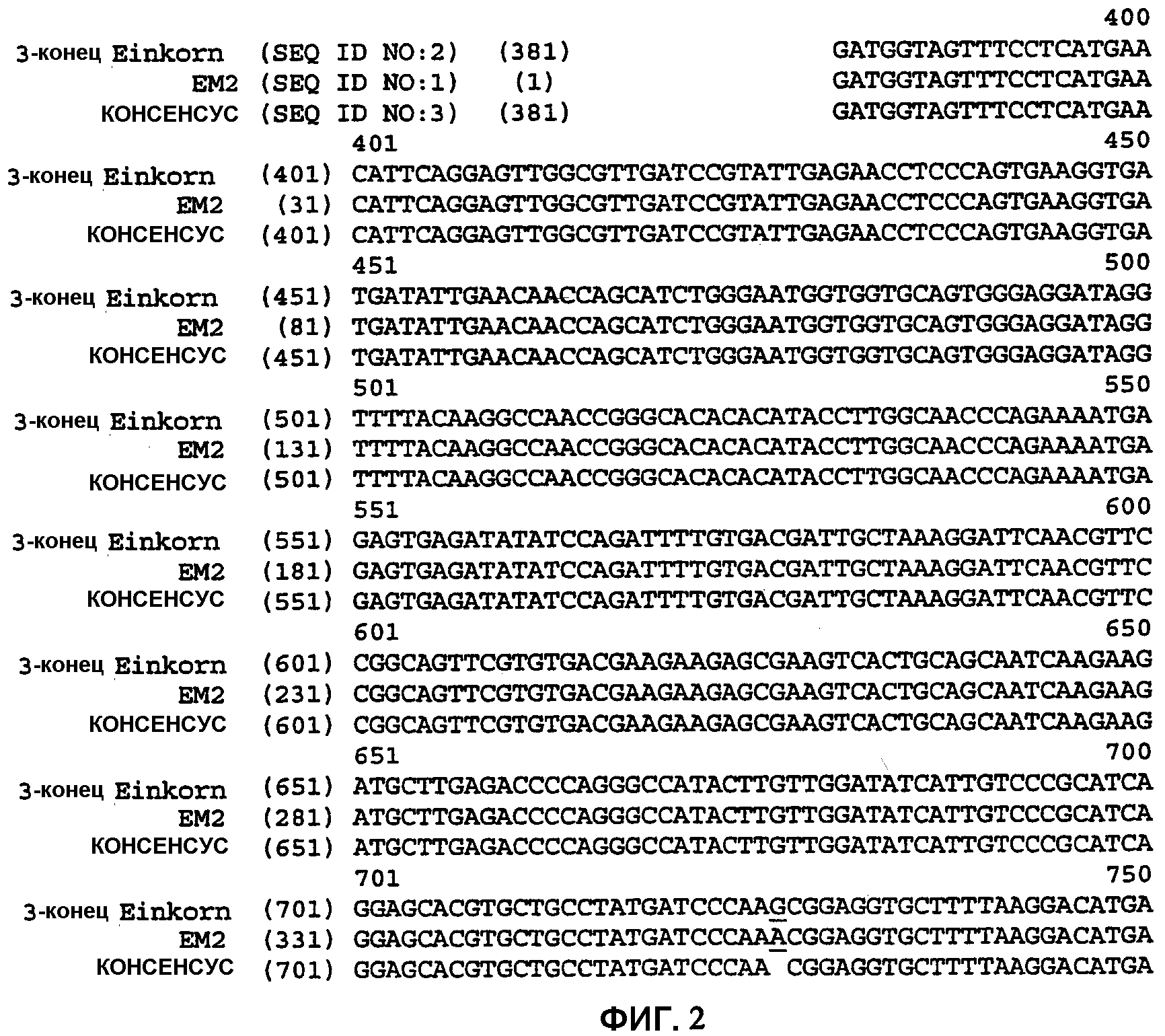
На фиг.2 показана частичная кДНК-последовательность Einkorn IMI3 в сравнении с последовательностью Einkorn дикого типа (SEQ ID NO:2) и консенсусной последовательностью (SEQ ID NO:3).
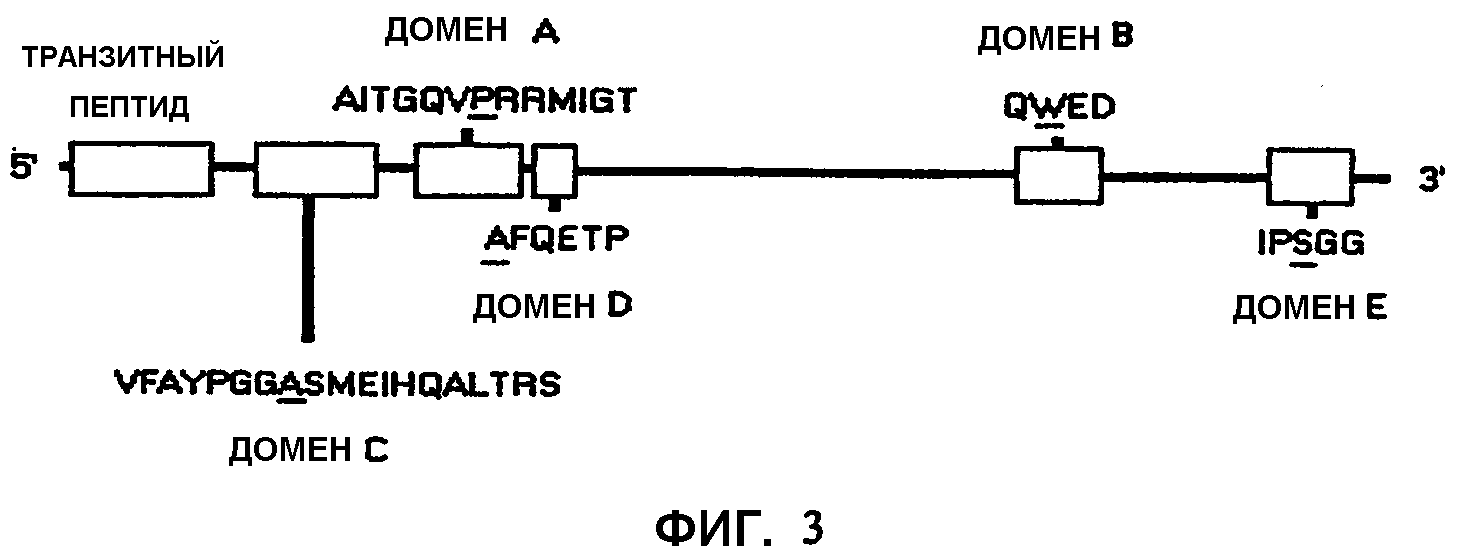
Фиг.3 является схематическим представлением консервативных аминокислотных последовательностей в генах AHAS, предположительно участвующих в устойчивости к различным ингибиторам AHAS. Специфический аминокислотный сайт, ответственный за устойчивость, показан подчеркиванием. (Модифицировано из Devine, M.D. and Eberlein, C.V., 1997, Physiological, biochemical and molecular aspects of herbicide resistance based on altered target sites in Herbicide Activity: Toxicity, Biochemistry, and Molecular Biology, IOS Press Amsterdam, p. 159-185).
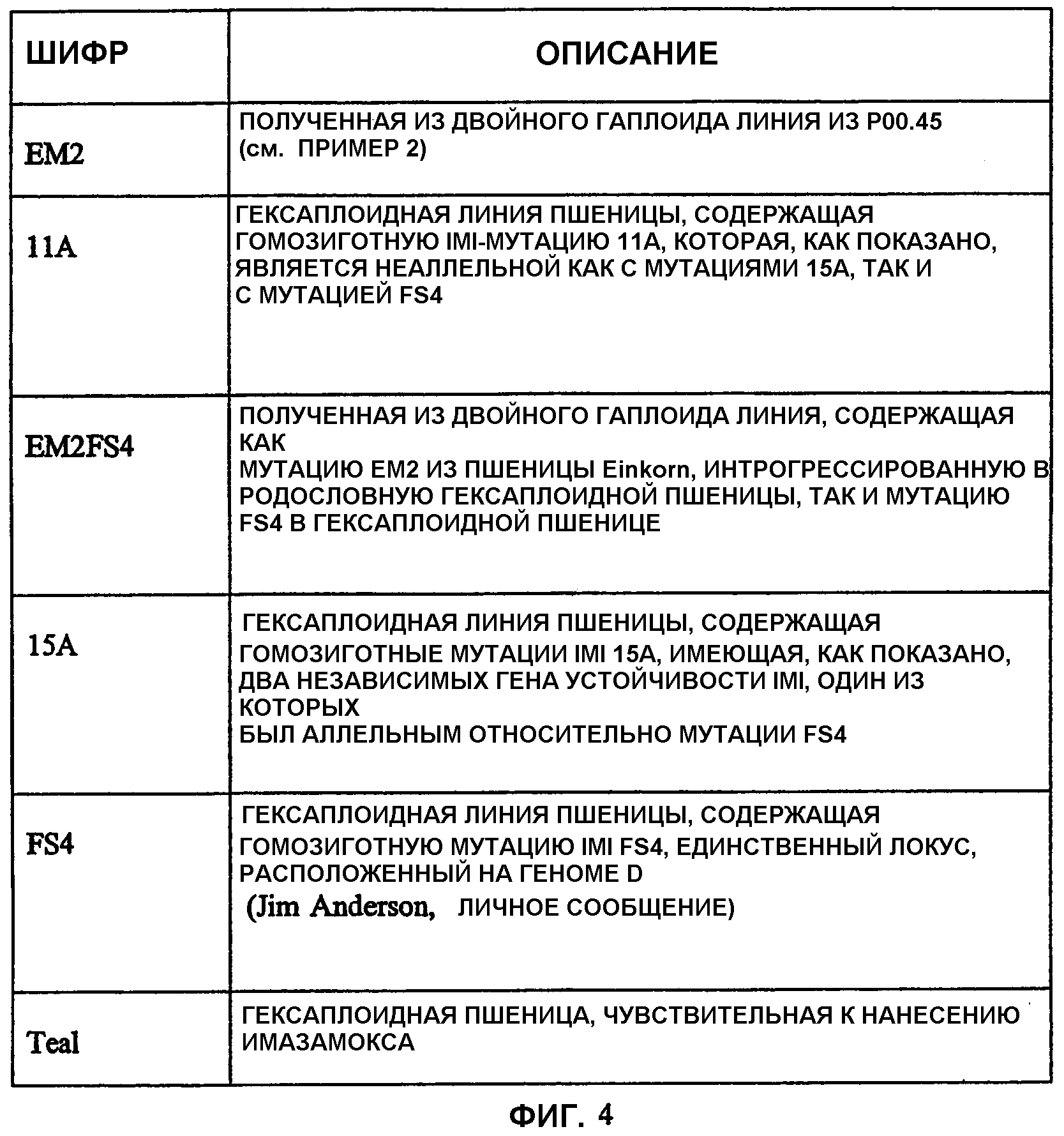
Фиг.4 является таблицей, показывающей родительские линии пшеницы, используемые для определения аллельных взаимоотношений среди генов IMI.
Фиг.5 является таблицей, показывающей данные по расщеплению F2, демонстрирующие локализацию мутации ЕМ2 на геноме А.
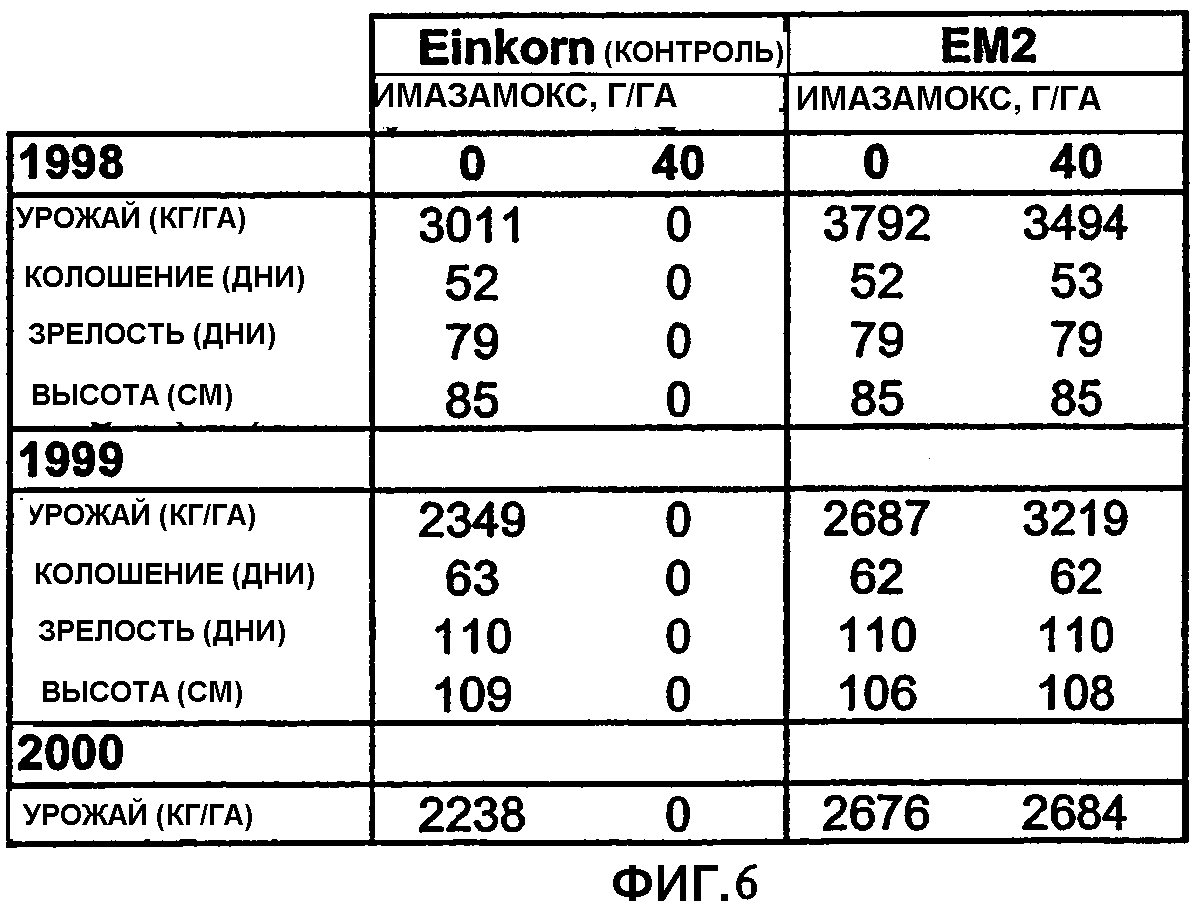
Фиг.6 является таблицей, показывающей различные агрономические характеристики, на которые могло бы влиять повреждение гербицидом, как в контрольных растениях Einkorn, так и в растениях ЕМ2.
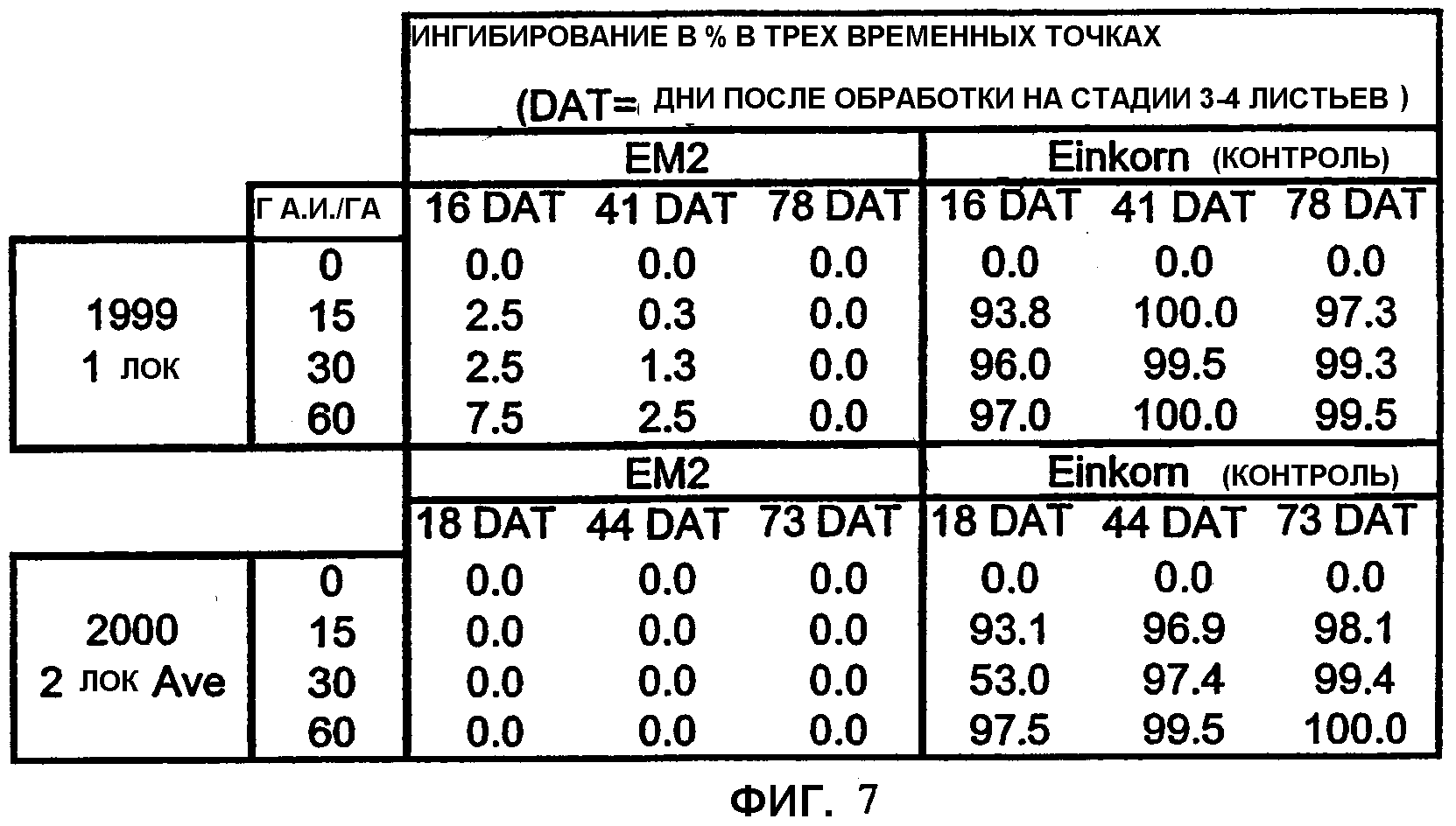
Фиг.7 является таблицей, показывающей оценку контрольных растений Einkorn и растений ЕМ2 на общее повреждение посева при трех уровнях имазамокса.
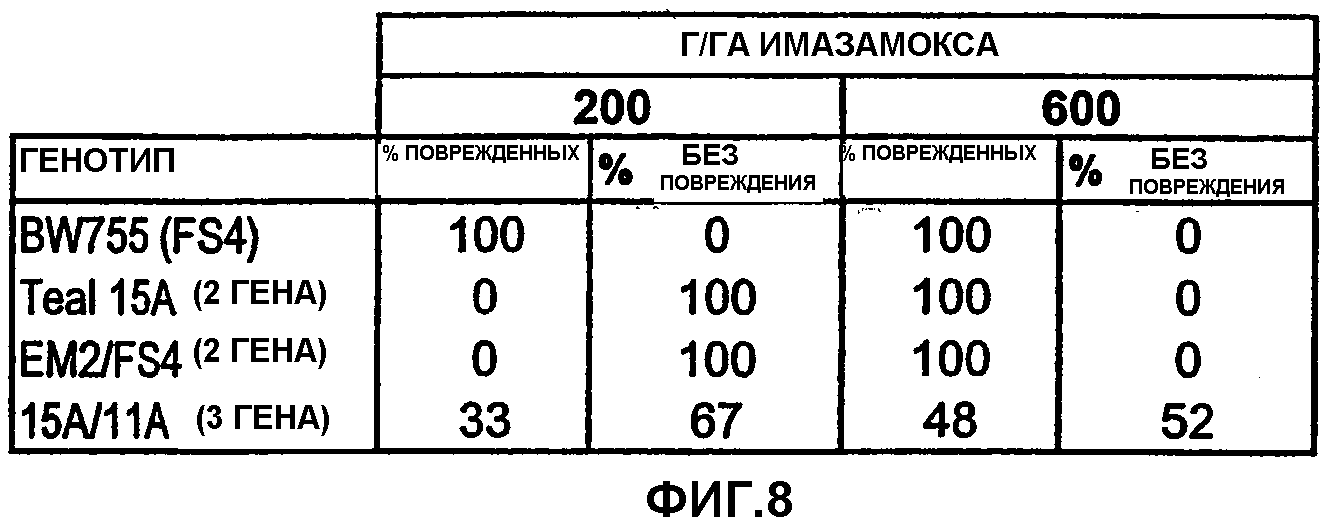
Фиг.8 является таблицей, показывающей повышенную устойчивость к имидазолиноновым гербицидам в сортах пшеницы после стекинга нуклеиновых кислот IMI.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к растениям пшеницы, частям и клеткам растений пшеницы, обладающим повышенной устойчивостью к имидазолиноновым гербицидам. В объем настоящего изобретения входят также семена, продуцируемые растениями пшеницы, и способы борьбы с сорняками, произрастающими рядом с описанными растениями пшеницы. Следует понимать, что в данном описании изобретения и формуле изобретения используемый в единственном числе термин в зависимости от контекста, так, например, ссылка на клетку, означает, что может использоваться, по меньшей мере, одна клетка.
В используемом здесь значении термин "растение пшеницы" означает растение, относящееся к роду Triticum. Растения пшеницы по настоящему изобретению могут быть членами рода Triticum, включающего, не ограничиваясь ими, T. aestivum, T. turgidum, T. timopheevii, T. monococcum, T. zhukovskyi, T. urartu и их гибриды. Примерами подвидов T. aestivum, входящих в объем настоящего изобретения, являются aestivum (пшеница обыкновенная), compactum (пшеница плотная), macha (пшеница мача), vavilovi (пшеница вавилонская) spelta и sphaecrococcum (пшеница карликовая). Примерами подвидов T. turgidum, входящих в объем настоящего изобретения, являются turgidum, carthlicum, dicoccon, durum, paleocolchicum, polonicum, turanicum и dicoccoides. Примерами подвидов T. monococcum, входящих в объем настоящего изобретения, являются monococcum (пшеница однозернянка) и aegilopoides. В одном варианте осуществления настоящего изобретения растение пшеницы относится к виду Triticum aestivum и, в частности, представляет культурный сорт Einkorn.
Термин "растение пшеницы" охватывает растения пшеницы на любой стадии зрелости или развития, а также любые ткани или органы (части растения), полученные из любого такого растения, за исключением особо оговоренных случаев. Части растения включают, не ограничиваясь ими, стебли, корни, цветки, семяпочки, тычинки, листья, завязи, меристематические области, каллюсную ткань, пыльники, гаметофиты, спорофиты, пыльцу, микроспоры, протопласты и тому подобные. В объем настоящего изобретения входят также семена, полученные из растений пшеницы по настоящему изобретению. В одном варианте осуществления изобретения семена используют для истинной селекции для получения повышенной устойчивости к имидазолиноновому гербициду по сравнению с семенами сорта дикого типа пшеницы.
В настоящем изобретении описано растение пшеницы, содержащее одну или более нуклеиновых кислот IMI, которое обладает повышенной устойчивостью к имидазолиноновому гербициду по сравнению с сортом растения дикого типа. В используемом здесь значении термин "нуклеиновая кислота IMI" означает нуклеиновую кислоту, мутированную из нуклеиновой кислоты AHAS в растении пшеницы дикого типа, которая придает повышенную устойчивость к имидазолинону растению, в котором она транскрибирована. В одном варианте осуществления изобретения растение пшеницы включает множество нуклеиновых кислот IMI. При использовании для описания нуклеиновых кислот IMI термин "множество" относится к нуклеиновым кислотам IMI, имеющим разные нуклеотидные последовательности, а не к простому увеличению числа одной нуклеиновой кислоты IMI. Например, нуклеиновые кислоты IMI могут отличаться вследствие того, что они получены из разных геномов или находятся в разных геномах пшеницы.
Растения пшеницы по настоящему изобретению могут иметь множество нуклеиновых кислот IMI из разных геномов, так как указанные растения могут содержать более одного генома. Например, растение пшеницы Triticum aestivum имеет три генома, которые иногда определяют как геномы А, В и D. Так как AHAS является необходимым метаболическим ферментом, можно предположить, что каждый геном имеет, по меньшей мере, один ген, кодирующий фермент AHAS, обычно обнаруживаемый вместе с другими метаболическими ферментами в картированной гексаплоидной пшенице. Нуклеиновая кислота AHAS в каждом геноме может и обычно отличается своей нуклеотидной последовательностью от нуклеиновой кислоты AHAS в другом геноме. Специалист в данной области может определить геном происхождения каждой нуклеиновой кислоты AHAS методами генетического скрещивания и/или секвенирования или расщепления экзонуклеазой, известными в данной области. В соответствии с целями данного изобретения нуклеиновые кислоты IMI, полученные из геномов А, В или D, получили названия нуклеиновых кислот Imi1, Imi2 или Imi3. В данном описании изобретения не утверждается, что какой-либо определенный класс нуклеиновых кислот Imi связан с каким-либо определенным геномом А, В или D. Например, здесь не утверждается того, что нуклеиновые кислоты Imi1 связаны с нуклеиновыми кислотами генома А, что нуклеиновые кислоты Imi2 связаны с нуклеиновыми кислотами генома В и т.д. Названия Imi1, Imi2 и Imi3 просто показывают, что нуклеиновые кислоты IMI в каждом таком классе не расщепляются независимо, в то время как две нуклеиновые кислоты IMI из разных классов расщепляются независимо и поэтому могут быть получены из разных геномов пшеницы.
Класс нуклеиновых кислот Imi1 включает ген FS-4, описанный Newhouse et al. (1992, Plant Physiol. 100:882-886). Класс нуклеиновых кислот Imi2 включает рассматриваемый ниже ген Einkorn IMI3. Каждый класс Imi может включать члены из разных видов пшеницы. Поэтому каждый класс Imi включает нуклеиновые кислоты IMI, которые отличаются своей нуклеотидной последовательностью, но, тем не менее, происходят или находятся в одном и том же геноме пшеницы, о чем свидетельствуют результаты исследований наследственности, приведенные в нижеследующих примерах и известные специалистам в данной области.Таким образом, в объем настоящего изобретения входит растение пшеницы, включающее одну или более нуклеиновых кислот IMI, которое обладает повышенной устойчивостью к имидазолиноновому гербициду по сравнению с сортом растения дикого типа и в котором одна или более нуклеиновых кислот IMI выбраны из группы, состоящей из нуклеиновой кислоты Imi1, Imi2 и Imi3. В одном варианте осуществления изобретения растение включает нуклеиновую кислоту Imi3. В предпочтительном варианте осуществления изобретения нуклеиновая кислота Imi3 включает полинуклеотидную последовательность, представленную SEQ ID NO: 1. В другом варианте осуществления изобретения указанное растение включает нуклеиновую кислоту Imi1 или Imi2.
При использовании применительно к нуклеиновым кислотам термин "полученная из" относится к нуклеиновой кислоте, "расположенной в" определенном геноме или "полученной из" определенного генома. Термин "расположенный в" относится к нуклеиновой кислоте, находящейся в пределах данного определенного генома. При использовании применительно к геному термин "полученный из" относится к нуклеиновой кислоте, которая извлечена или выделена из генома. Термин "выделенный" более подробно рассматривается ниже.
В другом варианте осуществления изобретения растение пшеницы включает нуклеиновую кислоту IMI, которая не является нуклеиновой кислотой Imi1. Термин "не является Imi1" означает нуклеиновую кислоту IMI, которая не относится к вышеописанному классу нуклеиновых кислот Imi1. Один пример нуклеиновой кислоты, не являющейся Imi1, показан в SEQ ID NO: 1. Поэтому в предпочтительном варианте осуществления изобретения растение пшеницы включает нуклеиновую кислоту IMI, включающую полинуклеотидную последовательность, представленную SEQ ID NO: 1.
Настоящее изобретение включает растения пшеницы, содержащие одну, две, три или большее число нуклеиновых кислот IMI, которые обладают повышенной устойчивостью к имидазолиноновому гербициду по сравнению с сортом растения дикого типа. Нуклеиновые кислоты IMI могут включать нуклеотидную последовательность, выбираемую из группы, состоящей из полинуклеотида SEQ ID NO: 1, полинуклеотида, содержащего, по меньшей мере, 60 последовательно расположенных нуклеотидов SEQ ID NO: 1, и полинуклеотида, комплементарного SEQ ID NO: 1.
Имидазолиноновые гербициды включают, не ограничиваясь ими, PURSUIT® (имазетапир), CADRE® (имазапик), RAPTOR® (имазамокс), SCEPTER® (имазахин), ASSERT® (имазетабенз), ARSENAL® (имазапир), производное любого вышеуказанного гербицида или смесь двух или большего числа вышеуказанных гербицидов, например, имазапир/имазамокс (ODYSSEY®). Более конкретно имидазолиноновые гербициды включают, не ограничиваясь ими, 2-(4-изопропил)-4-метил-5-оксо-2-имидазолин-2-ил)никотиновую кислоту, 2-(4-изопропил)-4-метил-5-оксо-2-имидазолин-2-ил)-3-хинолинкарбоновую кислоту, 5-этил-2-(4-изопропил-4-метил-5-оксо-2-имидазолин-2-ил)никотиновую кислоту, 2-(4-изопропил-4-метил-5-оксо-2-имидазолин-2-ил)-5-(метоксиметил)никотиновую кислоту, 2-(4-изопропил-4-метил-5-оксо-2-имидазолин-2-ил)-5-метилникотиновую кислоту и смесь метил 6-(4-изопропил-4-метил-5-оксо-2-имидазолин-2-ил)-м-толуата и метил 2-(4-изопропил-4-метил-5-оксо-2-имидазолин-2-ил)-п-толуата. 5-Этил-2-(4-изопропил-4-метил-5-оксо-2-имидазолин-2-ил)никотиновая кислота и 2-(4-изопропил-4-метил-5-оксо-2-имидазолин-2-ил)-5-(метоксиметил)никотиновая кислота являются предпочтительными для использования. 2-(4-Изопропил-4-метил-5-оксо-2-имидазолин-2-ил)-5-(метоксиметил)никотиновая кислота является особенно предпочтительной для использования.
В одном варианте осуществления изобретения растение пшеницы включает две нуклеиновые кислоты IMI, полученные из или находящиеся в разных геномах пшеницы. Одна из двух нуклеиновых кислот предпочтительно является нуклеиновой кислотой Imi3. Более предпочтительно нуклеиновая кислота Imi3 включает полинуклеотидную последовательность SEQ ID NO: 1. В другом варианте осуществления изобретения растение пшеницы включает одну нуклеиновую кислоту IMI, которая включает одну полинуклеотидную последовательность SEQ ID NO: 1. В другом варианте осуществления изобретения растение пшеницы включает три или более нуклеиновых кислот IMI, которые получены из разных геномов. По меньшей мере, одна из трех нуклеиновых кислот IMI предпочтительно включает полинуклеотидную последовательность, показанную в SEQ ID NO: 1.
В предпочтительном варианте осуществления настоящего изобретения одна или более нуклеиновых кислот IMI, содержащихся в растении, кодируют аминокислотную последовательность, включающую мутацию в домене, который является консервативным для нескольких белков AHAS. Указанные консервативные домены определяются как домен А, домен В, домен С, домен D и домен Е. На фиг.2 показано общее расположение каждого домена в белке AHAS. В используемом здесь значении домен А содержит аминокислотную последовательность AITGQVPRRMIGT (SEQ ID NO: 4). Домен В содержит аминокислотную последовательность QWED (SEQ ID NO: 5). Домен С содержит аминокислотную последовательность VFAYPGGASMEIHQALTRS (SEQ ID NO: 6). Домен D содержит аминокислотную последовательность AFQETP (SEQ ID NO: 7). Домен Е содержит аминокислотную последовательность IPSGG (SEQ ID NO: 8). Настоящее изобретение также предполагает, что консервативные домены могут иметь незначительные вариации, например, в растениях куколя посевного остаток серина в домене Е заменен остатком аланина.
Таким образом, настоящее изобретение включает растения пшеницы, включающие нуклеиновую кислоту IMI, кодирующую аминокислотную последовательность с мутацией в консервативном домене, выбираемом из группы, состоящей из домена А, домена В, домена С, домена D и домена Е. В одном варианте осуществления изобретения растение пшеницы включает нуклеиновую кислоту IMI, кодирующую аминокислотную последовательность с мутацией в домене Е. В других предпочтительных вариантах осуществления изобретения мутации в консервативных доменах, локализованы на подчеркнутых участках: AITGQVPRRMIGT (SEQ ID NO: 4); QWED (SEQ ID NO: 5); VFAYPGGASMEIHQALTRS (SEQ ID NO: 6); AFQETP (SEQ ID NO: 7) и IPSGG (SEQ ID NO: 8). Одной предпочтительной заменой является замена серина аспарагином в домене Е (SEQ ID NO: 8).Рассматриваемые растения пшеницы могут быть трансгенными или нетрансгенными растениями пшеницы. В используемом здесь значении термин "трансгенный" относится к любому растению, растительной клетке, каллюсу, растительной ткани или части растения, которые содержат, по меньшей мере, один полный или частичный рекомбинантный полинуклеотид. Во многих случаях осуществляют стабильную интеграцию полного или частичного рекомбинантного полинуклеотида в хромосому или в стабильный внехромосомный элемент, так чтобы он передавался последующим поколениям. В соответствии с целями данного изобретения термин "рекомбинантный полинуклеотид" означает полинуклеотид, который изменен, перестроен или модифицирован методами генной инженерии. Примеры указанного полинуклеотида включают любой клонированный полинуклеотид или полинуклеотиды, связанные или присоединенные к гетерологичным последовательностям. Термин "рекомбинантный" не относится к изменениям полинуклеотидов, возникающим в результате природных явлений, таких как спонтанные мутации, или неспонтанного мутагенеза последующим селекционным размножением. Растения, имеющие мутации, возникающие вследствие неспонтанного мутагенеза и селекционного размножения, определяются в данном описании изобретения как нетрансгенные растения и входят в объем настоящего изобретения. В вариантах осуществления изобретения, где растение пшеницы является трансгенным и включает множество нуклеиновых кислот IMI, нуклеиновые кислоты могут быть получены из разных геномов или из одного генома. Альтернативно, в вариантах осуществления изобретения, где растение пшеницы является нетрансгенным и включает множество нуклеиновых кислот IMI, нуклеиновые кислоты находятся в разных геномах.
Примером нетрансгенного растения пшеницы, включающего одну нуклеиновую кислоту IMI, является сорт, депонированный в АТСС под идентификационным номером патентного депозитария РТА-4113 и определяемый здесь как сорт пшеницы Einkorn IMI. Сорт пшеницы Einkorn IMI содержит нуклеиновую кислоту Imi3. Частичная нуклеотидная последовательность, соответствующая гену Einkorn IMI, представлена в SEQ ID NO: 1.
В Американскую коллекцию типовых культур, Manassas, Virginia, 4 марта 2002 г. было отдельно депонировано 2500 семян сортов пшеницы Einkorn IMI. Депозит создан в соответствии с нормами и правилами Будапештского договора о депонировании микроорганизмов. Депонирование было осуществлено на срок не менее тридцати лет и, по меньшей мере, на пять лет после последнего запроса к АТСС о предоставлении образца из хранилища. Депонированные семена представлены под идентификационным номером патентного депозитария РТА-4113.
В объем настоящего изобретения входит растение пшеницы, представленное под идентификационным номером патентного депозитария РТА-4113; мутантное, рекомбинантное или генетически сконструированное производное растения, представленного под идентификационным номером патентного депозитария РТА-4113; любое потомство растения, представленного под идентификационным номером патентного депозитария РТА-4113; и растение, являющееся потомством любого из указанных растений. В предпочтительном варианте осуществления изобретения растение пшеницы по настоящему изобретению дополнительно имеет характеристики устойчивости к гербицидам, присущие растению, представленному под идентификационным номером патентного депозитария РТА-4113.
В объем настоящего изобретения входят также гибриды сортов пшеницы Einkorn IMI и других сортов пшеницы. Другие сорта пшеницы включают, не ограничиваясь ими, T. aestivum L. сорта Fidel и любой сорт пшеницы, содержащий мутантный ген FS-1, FS-2, FS-3 или FS-4. (См. патент США № 6339184 и заявку на патент США № 08/474832.)
Термины "культурный сорт" и "сорт" означают группу растений одного вида, обладающих общим набором характеристик или признаков, которые признаны специалистами в данной области достаточными для отличия одного сорта или культурного сорта от другого сорта или культурного сорта. Ни один из терминов не предполагает, что все растения любого данного сорта или культурного сорта являются генетически идентичными в отношении всего гена или на молекулярном уровне, либо что любое данное растение является гомозиготным во всех локусах. Сорт или культурный сорт считается результатом "истинной селекции" определенного признака, если у самоопыляющегося сорта или культурного сорта все потомство имеет указанный признак. В настоящем изобретении признак возникает в результате мутации гена AHAS растения или семени пшеницы.
Помимо растений пшеницы настоящее изобретение относится к выделенным белкам и нуклеиновым кислотам IMI. Нуклеиновые кислоты включают полинуклеотид, выбираемый из группы, состоящей из полинуклеотида SEQ ID NO: 1, полинуклеотида, содержащего, по меньшей мере, 60 последовательно расположенных нуклеотидов SEQ ID NO: 1, и полинуклеотида, комплементарного SEQ ID NO: 1. В предпочтительном варианте осуществления изобретения нуклеиновая кислота IMI включает полинуклеотидную последовательность SEQ ID NO: 1.
Термин "белок AHAS" означает белок-синтазу ацетогидроксикислот, и термин "белок IMI" означает любой белок AHAS, который мутировал из белка AHAS дикого типа и придает повышенную устойчивость к имидазолинону растению, растительной клетке, части растения, семени растения или растительной ткани, в которых он экспрессирован. В предпочтительном варианте осуществления изобретения белок IMI включает полипептид, кодируемый полинуклеотидом SEQ ID NO: 1. В используемом здесь значении термины "нуклеиновая кислота" и "полинуклеотид" означают РНК или ДНК, которая является линейной или разветвленной, одноцепочечной или двухцепочечной, или их гибрид. Данный термин также означает гибриды РНК/ДНК. Указанные термины означают также нетранслируемую последовательность, находящуюся как у 3'-конца, так и у 5'-конца кодирующей области гена: по меньшей мере, около 1000 нуклеотидов последовательности выше 5'-конца кодирующей области и, по меньшей мере, около 200 нуклеотидов последовательности ниже 3'-конца кодирующей области гена. Реже встречающиеся основания, такие как инозин, 5-метилцитозин, 6-метиладенин, гипоксантин и другие, могут быть также использованы для антисмыслового дцРНК и рибозимного спаривания. Например, установлено, что полинуклеотиды, содержащие С-5 пропиновые аналоги уридина и цитидина, могут связываться с РНК с высокой степенью сродства и являются сильнодействующими антисмысловыми ингибиторами экспрессии генов. Можно также произвести другие модификации, такие как изменение фосфодиэфирного скелета или 2'-гидроксильной группы в рибозосахарной группе РНК. Антисмысловые полинуклеотиды и рибозимы могут полностью состоять из рибонуклеотидов или могут содержать смесь рибонуклеотидов и дезоксирибонуклеотидов. Полинуклеотиды по данному изобретению можно получить любыми способами, включая геномные препараты, препараты кДНК, синтез in vitro, ОТ-ПЦР и транскрипцию in vitro или in vivo.
"Выделенная" молекула нуклеиновой кислоты представляет такую молекулу, которая по существу отделена от других молекул нуклеиновой кислоты, присутствующих в природном источнике нуклеиновой кислоты (то есть последовательности, кодирующие другие полипептиды). "Выделенная" нуклеиновая кислота предпочтительно не имеет некоторых последовательностей, которые в естественных условиях фланкируют нуклеиновую кислоту (то есть последовательности, находящиеся у 5'-конца и 3'-конца нуклеиновой кислоты) в природном репликоне. Например, клонированная нуклеиновая кислота считается выделенной. В разных вариантах осуществления изобретения выделенная молекула нуклеиновой кислоты IMI может содержать нуклеотидные последовательности длиной менее примерно 5 т.п.о., 4 т.п.о., 3 т.п.о., 2 т.п.о., 1 т.п.о., 0,5 т.п.о. или 0,1 т.п.о, которые в естественных условиях фланкируют молекулу нуклеиновой кислоты в геномной ДНК клетки, из которой получена данная нуклеиновая кислота (например, клетка Triticum monococcum). Нуклеиновая кислота также считается выделенной, если она изменена в результате вмешательства человека или помещена в локус или участок, не являющийся ее природным сайтом, или если указанная нуклеиновая кислота внесена в клетку агроинфицированием или высокоскоростной биолистической трансфекцией. Кроме того, "выделенная" молекула нуклеиновой кислоты, такая как молекула кДНК, может не иметь некоторых других клеточных веществ, с которыми она обычно бывает связана, или культуральной среды при получении методами генной инженерии или химических предшественников, или других химических веществ в случае химического синтеза.
Из определения термина "выделенные нуклеиновые кислоты" особо исключаются природные хромосомы (такие как хромосомные препараты), библиотеки искусственных хромосом, геномные библиотеки и библиотеки кДНК, которые существуют в виде препаратов нуклеиновых кислот in vitro или в виде препаратов трансфицированных/трансформированных клеток-хозяев, где клетки-хозяева представляют собой гетерогенный препарат in vitro или культивируются в виде гетерогенной популяции отдельных колоний. Из определения выделенной нуклеиновой кислоты исключены также вышеуказанные библиотеки, в которых специфическая нуклеиновая кислота составляет менее 5% от общего числа вставок нуклеиновых кислот в векторных молекулах. Кроме того, из данного определения исключена геномная ДНК клетки или препараты РНК клетки (включая цельноклеточные препараты, подвергнутые механическому фрагментированию или ферментативному расщеплению). Далее из указанного определения особо исключены цельноклеточные препараты, представляющие препарат in vitro или гетерогенную смесь, разделенную электрофорезом, в которой нуклеиновая кислота по данному изобретению не отделена от гетерологичных нуклеиновых кислот в среде для электрофореза (например, путем вырезания одной полосы из гетерогенной популяции, полос, в агарозном геле или найлоновом блотте).
Молекулу нуклеиновой кислоты по настоящему изобретению, например молекулу нуклеиновой кислоты, содержащую нуклеотидную последовательность SEQ ID NO: 1 или ее часть, можно выделить стандартными методами, применяемыми в молекулярной биологии, и на основании информации о последовательностях, приводимой в данном описании изобретения. Например, кДНК IMI T. monococcum можно выделить из библиотеки T. monococcum, используя полную или частичную последовательность SEQ ID NO: 1. Кроме того, молекулу нуклеиновой кислоты, содержащую полную или частичную SEQ ID NO: 1, можно выделить при помощи полимеразной цепной реакции с использованием олигонуклеотидных затравок, созданных на основе данной последовательности. Например, мРНК можно выделить из растительных клеток (например, методом экстракции гуанидинтиоционатом, описанным Chirgwin et al., 1979, Biochemistry, 18: 5294-5299), и кДНК можно получить при помощи обратной транскриптазы (например, обратной транскриптазы Moloney MLV фирмы Gibco/BRL, Bethesda, MD; или обратной транскриптазы AMV фирмы Seikagaku America, Inc., St. Petersburg, FL). Синтетические олигонуклеотидные затравки для амплификации при помощи полимеразной цепной реакции можно создать на основе нуклеотидной последовательности, представленной в SEQ ID NO: 1. Молекулу нуклеиновой кислоты по данному изобретению можно амплифицировать, используя кДНК или альтернативно геномную ДНК в качестве матрицы и соответствующие олигонуклеотидные затравки, стандартными методами амплификации при помощи ПЦР. Амплифицированную таким образом молекулу нуклеиновой кислоты можно клонировать в соответствующий вектор и исследовать, выполняя анализ последовательности ДНК. Кроме того, олигонуклеотиды, соответствующие нуклеотидной последовательности IMI, можно получить стандартными методами синтеза, например, в автоматическом синтезаторе ДНК.
Нуклеиновые кислоты IMI по настоящему изобретению могут включать последовательности, кодирующие белок IMI (то есть "кодирующие области"), а также 5'-нетранслируемые последовательности и 3'-нетранслируемые последовательности. Альтернативно молекулы нуклеиновой кислоты по настоящему изобретению могут включать только кодирующие области гена IMI или могут содержать целые геномные фрагменты, выделенные из геномной ДНК. Кодирующая область указанных последовательностей определяется как "положение ORF". Кроме того, молекула нуклеиновой кислоты по данному изобретению может включать часть кодирующей области гена IMI, например фрагмент, который можно использовать в качестве зонда или затравки. Нуклеотидные последовательности, обнаруженные в результате клонирования генов IMI из T.monococcum, позволяют получить зонды и затравки, предназначенные для идентификации и/или клонирования гомологов IMI в других типах клеток и организмах, а также гомологов IMI из других растений пшеницы и родственных видов. Часть кодирующей области может также кодировать биологически активный фрагмент белка IMI.
В используемом здесь значении термин "биологически активная часть" белка IMI означает такую часть, как домен/мотив белка IMI, которая при продуцировании в растении повышает устойчивость данного растения к имидазолиноновому гербициду по сравнению с сортом растения дикого типа. Способы количественного определения повышенной устойчивости к имидазолиноновым гербицидам представлены в нижеследующих примерах. Биологически активные части белка IMI включают пептиды, кодируемые полинуклеотидными последовательностями, включающими SEQ ID NO: 1, которые содержат меньше аминокислот, чем полноразмерный белок IMI, и придают повышенную устойчивость к имидазолиноновому гербициду при экспрессии в растении. Биологически активные части (например, пептиды, имеющие длину, равную, например, 5, 10, 15, 20, 30, 35, 36, 37, 38, 39, 40, 50, 100 или более аминокислотам) обычно включают домен или мотив, характеризующийся, по меньшей мере, одной активностью белка IMI. Кроме того, методами генной инженерии можно получить другие биологически активные части, в которых делетированы другие области полипептида, и исследовать их на наличие одной или более описанных активностей. Биологически активные части белка IMI предпочтительно включают один или более консервативных доменов, имеющих мутацию, которые выбирают из группы, состоящей из домена А, домена В, домена С, домена D и домена Е.
Данное изобретение относится также к химерным или слитым полипептидам IMI. В используемом здесь значении термин "химерный полипептид" или "слитый полипептид" IMI включает полипептид IMI, функционально связанный с полипептидом, не являющимся IMI. Термин "полипептид, не являющийся IMI" означает полипептид, имеющий аминокислотную последовательность, которая по существу не идентична полипептиду IMI, например, полипептид, который не является изоферментом IMI, и который выполняет другую функцию по сравнению с полипептидом IMI. Применительно к слитому полипептиду термин "функционально связанный" означает, что полипептид IMI и полипептид, не являющийся IMI, слиты друг с другом таким образом, что обе последовательности выполняют функцию, свойственную используемой последовательности. Полипептид, не являющийся IMI, может быть слит с N-концом или С-концом полипептида IMI. Например, в одном варианте осуществления изобретения слитый полипептид представляет собой слитый полипептид GST-IMI, в котором последовательность IMI слита с С-концом последовательности GST. Такие слитые полипептиды могут облегчить очистку рекомбинантных полипептидов IMI. В другом варианте осуществления изобретения слитый полипептид является полипептидом IMI, содержащим гетерологичную сигнальную последовательность у N-конца. В некоторых клетках-хозяевах (например, клетках-хозяевах млекопитающих) экспрессию и/или секрецию полипептида IMI можно увеличить благодаря использованию гетерологичной сигнальной последовательности.
Выделенную молекулу нуклеиновой кислоты, кодирующую полипептид IMI, имеющий последовательность, идентичную последовательности полипептида, кодируемого полинуклеотидной последовательностью SEQ ID NO: 1, можно получить путем внесения одной или более замен, добавления или делеции нуклеотидов в нуклеотидную последовательность SEQ ID NO: 1 таким образом, что в кодируемый полипептид вносят одну или более аминокислотных замен, добавлений или делеций. Мутации можно внести в последовательность SEQ ID NO: 1 стандартными методами, такими как сайтнаправленный мутагенез и ПЦР-опосредуемый мутагенез. В консервативных аминокислотах замены предпочтительно производят в положении одного или более предполагаемых несущественных аминокислотных остатков.
Термин "консервативная аминокислотная замена" означает замену одного аминокислотного остатка другим аминокислотным остатком, имеющим подобную боковую цепь. В данной области определены семейства аминокислотных остатков, имеющих схожие боковые цепи. Такие семейства включают аминокислоты с основными боковыми цепями (например, лизин, аргинин, гистидин), кислотными боковыми цепями (например, аспарагиновая кислота, глутаминовая кислота), незаряженными полярными боковыми цепями (например, глицин, аспарагин, глутамин, серин, треонин, тирозин, цистеин), неполярными боковыми цепями (например, аланин, валин, лейцин, изолейцин, пролин, фенилаланин, метионин, триптофан), бета-разветвленными боковыми цепями (например, треонин, валин, изолейцин) и ароматическими боковыми цепями (например, тирозин, фенилаланин, триптофан, гистидин). Таким образом, предполагаемый несущественный аминокислотный остаток в полипептиде IMI предпочтительно заменяют другим аминокислотным остатком из семейства с такими же боковыми цепями. Альтернативно в другом варианте осуществления изобретения мутации могут быть произведены произвольно в любом месте всей или части кодирующей последовательности IMI, например, при помощи насыщающего мутагенеза, после чего полученные мутанты можно исследовать с целью выявления требуемой активности IMI для идентификации мутантов, сохраняющих активность IMI. После мутагенеза последовательности SEQ ID NO: 1 кодируемый полипептид может быть рекомбинантно экспрессирован, при этом активность полипептида можно определить, анализируя устойчивость к имидазолинону у растения, экспрессирующего полипептид, как это описано в нижеследующих примерах.
Для определения процента идентичности двух аминокислотных последовательностей их сопоставляют с целью оптимального сравнения (например, в последовательность одного полипептида могут быть введены гэпы (пробелы) для оптимального сопоставления с другим полипептидом). Затем сопоставляют аминокислотные остатки в соответствующих положениях аминокислот. Если в каком-либо положении одной последовательности находится такой же аминокислотный остаток, что и в соответствующем положении другой последовательности, то молекулы являются идентичными в данном положении. Подобным образом можно сравнить две последовательности нуклеиновых кислот. Процент идентичности последовательностей соответствует числу одинаковых положений в последовательностях (то есть процент идентичности последовательностей = число одинаковых положений/общее число положений × 100). В соответствии с целями данного изобретения процент идентичности двух нуклеотидных или полипептидных последовательностей определяют при помощи программного обеспечения Vector NTI 6.0 (РС) (InforMax, 7600 Wisconsin Ave., Bethesda, MD 20814). Для определения процента идентичности двух нуклеиновых кислот начисляют 15 штрафных очков за образование гэпа и 6,66 штрафного очка за удлинение гэпа. Для определения процента идентичности двух полипептидов начисляют 10 штрафных очков за образование гэпа и 0,1 штрафного очка за удлинение гэпа. Все другие параметры являются значениями, задаваемыми по умолчанию.
Следует отметить, что для определения идентичности последовательностей при сравнении последовательности ДНК с последовательностью РНК нуклеотид тимидин эквивалентен нуклеотиду урацилу. Предпочтительно, выделенные полипептиды IMI, входящие в объем настоящего изобретения, по меньшей мере, примерно на 50-60%, предпочтительно, по меньшей мере, примерно на 60-70%, более предпочтительно, по меньшей мере, примерно на 70-75%, 75-80%, 80-85%, 85-90% или 90-95% и наиболее предпочтительно, по меньшей мере, примерно на 96%, 97%, 98%, 99% или более процентов идентичны полной аминокислотной последовательности, кодируемой полинуклеотидной последовательностью, представленной SEQ ID NO: 1. В другом варианте осуществления изобретения выделенные полипептиды IMI, входящие в объем настоящего изобретения, по меньшей мере, примерно на 50-60%, предпочтительно, по меньшей мере, примерно на 60-70%, более предпочтительно, по меньшей мере, примерно на 70-75%, 75-80%, 80-85%, 85-90% или 90-95% и наиболее предпочтительно, по меньшей мере, примерно на 96%, 97%, 98%, 99% или более процентов идентичны полной аминокислотной последовательности, кодируемой нуклеиновой кислотой, включающей полинуклеотидную последовательность SEQ ID NO: 1.
Кроме того, можно создать оптимизированные нуклеиновые кислоты IMI. Оптимизированная нуклеиновая кислота IMI предпочтительно кодирует полипептид IMI, который модулирует устойчивость растения к имидазолиноновым гербицидам и более предпочтительно повышает устойчивость растения к имидазолиноновому гербициду при сверхэкспрессии в растении. В используемом здесь значении термин "оптимизированный" относится к нуклеиновой кислоте, генетически сконструированной для увеличения ее экспрессии в данном растении или животном. Для получения оптимизированных нуклеиновых кислот IMI в растении последовательность ДНК гена может быть модифицирована так, чтобы она 1) включала кодоны, предпочтительные для генов растений с высокой экспрессией; 2) включала такое содержание А+Т, которое, по существу, соответствует обнаруженному в растениях; 3) образовывала инициирующую последовательность в растениях; 4) не содержала последовательностей, вызывающих дестабилизацию, неадекватное полиаденилирование, деградацию и терминацию РНК, или последовательностей, образующих "шпильки" вторичной структуры или сайты сплайсинга РНК. Повышенная экспрессия нуклеиновых кислот IMI в растениях может быть достигнута благодаря частоте распределения используемых кодонов в растениях вообще или в определенном растении в частности. Способы оптимизации экспрессии нуклеиновых кислот в растениях описаны в ЕРА 0359472 и 0385962; заявке РСТ WO 91/16432; патентах США № 5380831 и 5436391; Perlack et al., 1991, Proc. Natl. Acad. Sci. USA, 88:3324-3328; и Murray et al., 1989, Nucleic Acids Res., 17:477-498.
В используемом здесь значении термин "частота предпочтительного использования кодонов" означает предпочтительное использование специфической клеткой-хозяином нуклеотидных кодонов для определения соответствующей аминокислоты. Чтобы определить частоту использования конкретного кодона в гене, количество повторов данного кодона в гене делят на общее количество повторов всех кодонов, определяющих одну и ту же аминокислоту в гене. Аналогичным образом частоту предпочтительного использования кодонов, характерную для клетки-хозяина, можно вычислить путем усреднения частоты предпочтительного использования кодонов в большом количестве генов, экспрессированных клеткой-хозяином. Желательно ограничить указанный анализ генами, высоко экспрессированными в клетке-хозяине. Процентное отклонение частоты предпочтительного использования кодона для синтетического гена от используемого клеткой-хозяином высчитывают, определяя сначала процентное отклонение частоты использования одного кодона от аналогичного кодона клетки-хозяина с последующим определением среднего отклонения для всех кодонов. В соответствии с определением такое вычисление относится к уникальным кодонам (то есть ATG и TGG). В общих чертах, общее среднее отклонение использования кодона оптимизированным геном от подобного кодона клетки-хозяина высчитывают при помощи уравнения 1А = n = 1 Z Xn - YnXn × 100 Z, где Xn - частота использования кодона n в клетке-хозяине; Yn - частота использования кодона n в синтетическом гене, n означает отдельный кодон, определяющий аминокислоту, и Z означает общее число кодонов. Общее отклонение частоты использования кодона А для всех аминокислот должно предпочтительно быть менее примерно 25% и более предпочтительно менее примерно 10%.
Следовательно, нуклеиновая кислота IMI может быть оптимизирована таким образом, чтобы частота распределения используемых кодонов отклонялась предпочтительно не более чем на 25% от аналогичного значения для генов растения, экспрессирующихся на высоком уровне, и, более предпочтительно, не более чем примерно на 10%. Кроме того, следует учитывать процентное содержание G+C в пропущенном третьем основании (в однодольных растениях в указанном положении предпочтительно находится G+C, что не характерно для двудольных растений). Также известно, что кодон XCG (где Х означает А, Т, С или G) является наименее предпочтительным кодоном в двудольных растениях, при этом кодон ХТА не используется ни в однодольных, ни в двудольных растениях. Оптимизированные нуклеиновые кислоты IMI по данному изобретению также предпочтительно имеют индексы избегания дублетов CG и ТА, предельно приближающиеся к показателям выбранного растения-хозяина (то есть Triticum monococcum). Более предпочтительно указанные индексы отклоняются от показателей хозяина не более чем примерно на 10-15%.
Помимо молекул нуклеиновой кислоты, кодирующих вышеописанные полипептиды IMI, другим объектом данного изобретения являются выделенные антисмысловые молекулы нуклеиновой кислоты. Считается, что антисмысловые полинуклеотиды ингибируют экспрессию гена полинуклеотида-мишени в результате специфического связывания с полинуклеотидом-мишенью, препятствуя транскрипции, сплайсингу, транспорту, трансляции и/или устойчивости полинуклеотида-мишени. Ранее были описаны способы направленной доставки антисмыслового полинуклеотида к хромосомной ДНК, первичному транскрипту РНК или процессированной мРНК. Области-мишени предпочтительно включают сайты сплайсинга, инициирующие трансляцию кодоны, терминирующие трансляцию кодоны и другие последовательности в открытой рамке считывания.
Термин "антисмысловая" в соответствии с целями данного изобретения относится к нуклеиновой кислоте, включающей полинуклеотид, который является достаточно комплементарным всему гену или его части, первичному транскрипту или процессированной мРНК для того, чтобы препятствовать экспрессии эндогенного гена. "Комплементарные" полинуклеотиды являются такими полинуклеотидами, которые способны обеспечивать спаривание оснований в соответствии со стандартными правилами комплементарности Уотсона-Крика. В частности, пурины образуют пару оснований с пиримидинами, в результате чего происходит спаривание гуанина с цитозином (G:C) и аденина с тимином (А:Т) в случае ДНК или аденина с урацилом (A:U) в случае РНК. Очевидно, что два полинуклеотида могут гибридизировать друг с другом, даже если они не являются полностью комплементарными друг другу, при условии, что каждый имеет, по меньшей мере, одну область, которая по существу комплементарна другой. Термин "антисмысловая нуклеиновая кислота" означает экспрессирующие кластеры одноцепочечной РНК и двухцепочечной ДНК, которые могут быть транскрибированы с образованием антисмысловой РНК. "Активные" антисмысловые нуклеиновые кислоты представляют антисмысловые молекулы РНК, способные избирательно гибридизировать с первичным транскриптом или мРНК, кодирующей полипептид, характеризующийся, по меньшей мере, 80% идентичностью последовательности с полипептидом, кодируемым нуклеиновой кислотой, включающей полинуклеотидную последовательность SEQ ID NO: 1.
Помимо вышеописанных нуклеиновых кислот и полипептидов IMI настоящее изобретение относится к нуклеиновым кислотам и полипептидам, присоединенным к части молекулы. Такие части включают, не ограничиваясь ими, части, обеспечивающие обнаружение, гибридизацию, очистку, доставку, взаимодействие, связывание и подобные функции. Типичная группа нуклеиновых кислот, имеющих присоединенные части, представляет зонды и затравки. Зонды и затравки обычно включают по существу выделенный олигонуклеотид. Олигонуклеотид обычно включает область нуклеотидной последовательности, которая гибридизирует в строгих условиях, по меньшей мере, примерно с 12, предпочтительно примерно с 25, более предпочтительно примерно с 40, 50 или 75 последовательно расположенными нуклеотидами смысловой цепи последовательности, приведенной в SEQ ID NO: 1, антисмысловой цепи последовательности, приведенной в SEQ ID NO: 1, или их природными мутантами. Затравки, созданные на основе нуклеотидной последовательности SEQ ID NO: 1, можно использовать при осуществлении реакций ПЦР для клонирования гомологов IMI. Зонды, созданные на основе нуклеотидных последовательностей IMI, можно использовать для обнаружения транскриптов или геномных последовательностей, кодирующих одинаковые или гомологичные полипептиды. В предпочтительных вариантах осуществления изобретения зонд дополнительно содержит присоединенную меченую группу, например, меченая группа может представлять радиоизотоп, флуоресцирующее соединение, фермент или ферментный кофактор. Такие зонды можно использовать в составе тест-набора, включающего геномный маркер, для идентификации клеток, экспрессирующих полипептид IMI, например, путем измерения содержания IMI-кодирующей нуклеиновой кислоты в образце клеток, например, для обнаружения уровней мРНК IMI или определения того, мутировал ген геномной IMI или был делетирован.
Данное изобретение далее относится к выделенному рекомбинантному экспрессирующему вектору, включающему вышеописанную нуклеиновую кислоту IMI, экспрессия которого в клетке-хозяине вызывает повышенную устойчивость к имидазолиноновому гербициду по сравнению с диким сортом клетки-хозяина. В используемом здесь значении термин "вектор" означает молекулу нуклеиновой кислоты, способную переносить другую нуклеиновую кислоту, с которой она связана. Одним типом вектора является "плазмида", которая представляет кольцевую двухцепочечную петлю ДНК, с которой лигированы дополнительные сегменты ДНК. Другим типом вектора является вирусный вектор, в котором дополнительные сегменты ДНК могут быть лигированы с вирусным геномом. Некоторые векторы способны автономно реплицироваться в клетке-хозяине, в которую они введены (например, бактериальные векторы, имеющие бактериальный механизм репликации, и эписомные векторы млекопитающих). Другие векторы (например, неэписомные векторы млекопитающих) встраивают в геном клетки-хозяина при введении в клетку-хозяин, в результате чего они реплицируют вместе с геномом хозяина. Кроме того, некоторые векторы способны направлять экспрессию генов, с которыми они функционально связаны. Такие векторы определяются как "экспрессирующие векторы". Как правило, экспрессирующие векторы, используемые при осуществлении методов рекомбинантных ДНК, часто находятся в форме плазмид. В данном описании изобретения термины "плазмида" и "вектор" имеют взаимозаменяемые значения, так как плазмида является наиболее широко используемой формой вектора. Однако в объем данного изобретения входят и другие формы экспрессирующих векторов, такие как вирусные векторы (например, ретровирусы с дефектом репликации, аденовирусы и аденоассоциированные вирусы), которые выполняют эквивалентные функции.
Рекомбинантные экспрессирующие векторы по данному изобретению включают нуклеиновую кислоту по данному изобретению в форме, пригодной для экспрессии нуклеиновой кислоты в клетке-хозяине, из чего следует, что рекомбинантные экспрессирующие векторы имеют одну или более регуляторных последовательностей, выбираемых в зависимости от клеток-хозяев, используемых для экспрессии, которые функционально связаны с экспрессируемой последовательностью нуклеиновой кислоты. Применительно к рекомбинантному экспрессирующему вектору термин "функционально связанный" означает, что представляющая интерес нуклеотидная последовательность связана с одной или более регуляторными последовательностями таким образом, что это делает возможной экспрессию нуклеотидной последовательности (например, в транскрипционной/трансляционной системе in vitro или в клетке-хозяине при введении вектора в клетку-хозяин). Термин "регуляторная последовательность" означает промоторы, энхансеры и другие элементы регуляции экспрессии (например, сигналы полиаденилирования). Такие регуляторные последовательности описаны, например, в издании Goeddel, Gene Expression Technology: Methods in Enzymology 185, Academic Press, San Diego, CA (1990) или Gruber and Crosby, in: Methods in Plant Molecular Biology and Biotechnology, eds. Glick and Thompson, Chapter 7, 89-108, CRC Press: Boca Raton, Florida, которые включены в данное описание изобретения в качестве ссылки. Регуляторными последовательностями являются такие последовательности, которые управляют структурной экспрессией нуклеотидной последовательности во многих типах клеток-хозяев и которые управляют экспрессией нуклеотидной последовательности только в определенных клетках-хозяевах или в определенных условиях. Специалистам в данной области должно быть известно, что конструкция экспрессирующего вектора может зависеть от таких факторов, как выбор трансформируемой клетки-хозяина, уровня экспрессии требуемого полипептида и т.д. Экспрессирующие векторы по данному изобретению можно вводить в клетки-хозяева для продуцирования полипептидов или пептидов, включая слитые полипептиды или пептиды, кодируемые описанными нуклеиновыми кислотами (например, полипептиды IMI, слитые полипептиды и т.д.).
В предпочтительном варианте осуществления настоящего изобретения полипептиды IMI экспрессированы в растениях и растительных клетках, таких как клетки одноклеточных растений (например, водоросли) (см. Falciatore et al., 1999, Marine Biotechnology 1(3):239-251 и приведенные в указанной статье ссылки) и растительные клетки высших растений (например, семенные растения, такие как сельскохозяйственные культуры). Полинуклеотид IMI может быть "введен" в растительную клетку любым способом, включая трансфекцию, трансформацию или трансдукцию, электропорацию, бомбардировку частицами, агроинфицирование, высокоскоростную биолистическую трансфекцию и тому подобные.
Другие приемлемые методы трансформации или трансфекции клеток-хозяев, включая растительные клетки, представлены в издании Sambrook, et al. (Molecular Cloning: A Laboratory Manual. 2nd, ed., Cold Spring Harbor Laboratory, Cold Spring Harbor Laboratory Press, Cold Spring Harbor, NY, 1989) и других лабораторных руководствах, таких как Methods in Molecular Biology, 1995, Vol.44, Agrobacterium protocols, ed: Gartland and Davey, Humana Press, Totowa, New Jersey. Так как повышенная устойчивость к имидазолиноновым гербицидам является общим признаком, желательно наследуемым рядом растений, таких как кукуруза, пшеница, рожь, овес, тритикале, рис, ячмень, соя, арахис, хлопок, рапс и канола, маниок, перец, подсолнечник и бархатцы, пасленовые культуры, такие как картофель, табак, баклажан и томат, вид Vicia, горох, люцерна, кустарниковые растения (кофе, какао, чай), вид Salix, деревья (гвинейская масличная пальма, кокосовая пальма), многолетние травы и фуражные культуры, указанные сельскохозяйственные культуры также являются предпочтительными растениями-мишенями, подлежащими модификации методами генетической инженерии, и представляют еще один вариант осуществления настоящего изобретения. Фуражные культуры включают, не ограничиваясь ими, пырей, канареечник канарский, костер, плевел, пырей жесткий, ежу сборную, люцерну, воробейник полевой, лядвенец рогатый, клевер гибридный, клевер луговой и донник.
В одном варианте осуществления настоящего изобретения трансфекция полинуклеотида IMI в растение достигается путем переноса гена, опосредуемого агробактериями. Один метод трансформации, известный специалистам в данной области, представляет погружение цветущего растения в раствор агробактерий, содержащих нуклеиновую кислоту IMI, с последуюшей селекцией трансформированных гамет. Опосредуемая агробактериями трансформация растения может быть произведена, например, при помощи штамма Agrobacterium tumefaciens GV3101 (pMP90) (Koncz and Schell, 1986, Mol. Gen. Genet., 204:383-396) или LBA4404 (Clontech). Трансформация может быть выполнена стандартными методами трансформации и регенерации (Deblaere et al., 1994, Nucl. Acids., Res. 13:4777-4788; Gelvin, Stanton B. and Schilperoort, Robert A, Plant Molecular Biology Manual, 2nd Ed. - Dordrecht: Kluwer Academic Publ., 1995. - in Sect., Ringbuc Zentrale Signatur: BT11-P ISBN 0-7923-2731-4; Glick, Bernard R. and Thompson, Johg E., Methods in Plant Molecular Biology and Biotechnology, Boca Raton: CRC Press, 1993, 360 S., ISBN 0-8493-5164-2). Например, рапс можно трансформировать путем трансформации семядоли или гипокотиля (Moloney et al., 1989, Plant cell Report 8:238-242; De Block et al., 1989, Plant Physiol. 91:694-701). Использование антибиотиков для выбора агробактерий и растений зависит от бинарного вектора и штамма агробактерий, используемого для трансформации. Селекцию рапса обычно проводят, используя канамицин в качестве селектируемого маркера растения. Опосредуемый агробактериями перенос гена в лен можно произвести, например, при помощи метода, описанного в статье Mlynarova et al., 1994, Plant Cell Report, 13:282-285. Кроме того, сою можно трансформировать, например, методом, описанным в европейском патенте № 0424047, патенте США № 5322783, европейском патенте № 0397687, патентах США № 5376543 или 5169770. Кукурузу можно трансформировать бомбардировкой частицами, поглощением ДНК, опосредуемым полиэтиленгликолем, или методом на основе карбидкремниевых волокон. (См., например, Freeling and Walbot "The maize handbook" Springer Verlag: New York (1993) ISBN 3-540-97826-7.) Типичный пример трансформации кукурузы приведен в патенте США № 5990387, и типичный пример трансформации пшеницы приведен в заявке РСТ WO 93/07256.
В соответствии с настоящим изобретением введенный полинуклеотид IMI может устойчиво сохраняться в растительной клетке, если он встроен во внехромосомный автономный репликон или хромосомы растения. Альтернативно введенный полинуклеотид IMI может находиться во внехромосомном нереплицирующем векторе, будучи временно экспрессированным или временно активным. В одном варианте осуществления изобретения может быть создан гомологичный рекомбинантный микроорганизм, в хромосому которого встроен полинуклеотид IMI, получен вектор, содержащий, по меньшей мере, часть гена AHAS с делецией, добавлением или заменой, предназначенными для изменения, например, функционального разрушения эндогенного гена AHAS и создания гена IMI. Для получения точковой мутации путем гомологичной рекомбинации можно использовать гибриды ДНК-РНК при осуществлении метода, известного как химеропластика (Cole-Strauss et al., 1999, Nucleic Acids Research 27(5):1323-1330 and Kmiec, 1999 Gene therapy American Scientist, 87(3):240-247). Другие методы гомологичной рекомбинации вида Triticum также известны в данной области и могут быть использованы в данном изобретении.
В векторе гомологичной рекомбинации ген IMI может быть фланкирован у 5'-конца и 3'-конца дополнительной молекулой нуклеиновой кислоты гена AHAS для обеспечения гомологичной рекомбинации между экзогенным геном IMI, переносимым вектором, и эндогенным геном AHAS в микроорганизме или растении. Дополнительная фланкирующая молекула нуклеиновой кислоты AHAS имеет длину, достаточную для успешной гомологичной рекомбинации с эндогенным геном. Обычно в вектор встраивают фланкирующую ДНК длиной от нескольких сотен до тысяч пар оснований (как у 5'-конца, так и у 3'-конца) (см., например, Thomas, K.R. and Capecchi, M.R., 1987, Cell 51:503 для ознакомлением с описанием векторов гомологичной рекомбинации или Strepp et al., 1998, PNAS, 95(8):4368-4373 для ознакомления с рекомбинацией на основе кДНК в Physcomitrella patens). Однако, поскольку ген IMI обычно отличается от гена AHAS незначительным числом аминокислот, фланкирующая последовательность не всегда является необходимой. Вектор гомологичной рекомбинации вводят в микроорганизм или растительную клетку (например, при помощи ДНК, опосредуемой полиэтиленгликолем), при этом клетки, в которых происходит гомологичная рекомбинация введенного гена IMI с эндогенным геном AHAS, выбирают методами, известными в данной области.
В другом варианте осуществления изобретения можно получить рекомбинантные микроорганизмы, содержащие выбранные системы, обеспечивающие регулируемую экспрессию введенного гена. Например, введение гена IMI в вектор, передающий функцию контроля lac-оперону, делает возможной экспрессию гена IMI только в присутствии IPTG. Такие регуляторные системы хорошо известны в данной области.
Полинуклеотид IMI, присутствующий во внехромосомном нереплицирующем векторе или векторе, встроенном в хромосому, предпочтительно находится в экспрессирующем кластере растения. Экспрессирующий кластер растения предпочтительно содержит регуляторные последовательности, способные регулировать экспрессию генов в растительных клетках, которые функционально связаны таким образом, что каждая последовательность может выполнять свою функцию, например терминацию транскрипции сигналами полиаденилирования. Предпочтительными сигналами полиаденилирования являются сигналы, формируемые тДНК Agrobacterium tumefaciens, например геном 3, известный как октопинсинтаза Ti-плазмиды pTiACH5 (Gielen et al., 1984, EMBO J., 3:835) или его функциональными эквивалентами, а также всеми другими терминаторами, функционально активными в растениях. Так как экспрессирующий ген растения очень часто не ограничен на транскрипционных уровнях, экспрессирующий кластер растения предпочтительно содержит другие функционально связанные последовательности, подобные энхансерам трансляции, такие как ускоряющая последовательность, содержащая 5'-нетранслируемую лидерную последовательность вируса мозаики табака, увеличивающую выход полипептида относительно РНК (Gallie et al., 1987, Nucl. Acids Research 15:8693-8711). Примеры экспрессирующих векторов растений включают векторы, подробно описанные в изданиях Becker, D. et al., 1992, New plant binary vectors with selectable markers located proximal to the left border, Plant Mol. Biol., 20:1195-1197; Bevan, M.W., 1984, Binary Agrobacterium vectors for plant transformation, Nucl. Acid. Res., 12:8711-8721; and Vectors for Gene Transfer in Higher Plants; in: Transgenic Plants, Vol.1, Engineering and Utilization, eds.; Kung and R. Wu, Academic Press, 1993, S. 15-38.
Экспрессирующий ген растения должен быть функционально связан с соответствующим промотором, вызывающим своевременную и специфическую для клетки или ткани экспрессию гена. Промоторы, используемые в экспрессирующих кластерах по данному изобретению включают любой промотор, способный инициировать транскрипцию в растительной клетке. Указанные промоторы включают, не ограничиваясь ими, такие промоторы, которые могут быть получены из растений, растительных вирусов и бактерий, содержащих гены, экспрессируемые в растениях, в частности Agrobacterium и Rhizobium.
Промотор может быть конститутивным, индуцируемым, специфическим для стадии развития, клетко-, ткане- или органспецифическим. Конститутивные промоторы являются активными в большинстве условий. Примеры конститутивных промоторов включают промоторы CaMV 19S и 35S (Odell et al., 1985, Nature, 313:810-812), промотор sX CaMV 35S (Kay et al., 1987, Science, 236:1299-1302), промотор Sep1, актиновый промотор риса (MsElroy et al., 1990, Plant Cell, 2:163-171), актиновый промотор Arabidopsis, убихитановый промотор (Christensen et al., 1989, Plant Molec Biol., 18:675-689); pEmu (Last et al., 1991, Theor Appl Genet, 81:581-588), промотор 35S вируса мозаики норичника шишковатого, промотор Smas (Velten et al., 1984, EMBO J., 3:2723-2730), промотор GRP1-8, промотор, представляющий (циннамилалкоголь)дегидрогеназу (патент США № 5683439), промоторы, полученные из Т-ДНК Agrobacterium, такие как маннопинсинтаза, нопалинсинтаза и октопинсинтаза, промотор, представляющий небольшую субъединицу рибулозобифосфаткарбоксилазы (ssuRUBISCO), и тому подобные.
Индуцируемые промоторы являются активными в определенных окружающих условиях, например, при наличии или отсутствии питательного вещества или метаболита, тепла или холода, света, воздействия патогенных микроорганизмов, анаэробных условий и тому подобных. Например, промотор hsp80, полученный из Brassica, индуцируется тепловым шоком, промотор PPDK индуцируется светом, промотор PR-1, полученных из табака, Arabidopsis, и кукурузы, индуцируется инфекцией, вызываемой патогенным микроорганизмом, и промотор Adh1 индуцируется гипоксией и стрессом, вызываемым холодом. Индуцируемый промотор может также облегчать экспрессию растительного гена (см. Gatz, 1997, Annu. Rev. Plant Physiol. Plant Mol. Biol., 48:89-108). Химически индуцируемые промоторы особенно пригодны в тех случаях, когда желательно, чтобы экспрессия гена происходила в зависимости от времени. Примерами таких промоторов являются промотор, индуцируемый салициловой кислотой (заявка РТС WO 95/19443), промотор, индуцируемый тетрациклином (Gatz et al., 1992, Plant J., 2:397-404) и промотор, индуцируемый этанолом (заявка РСТ WO 93/21334).
Промоторы, специфические для стадии развития, предпочтительно экспрессируются на определенных стадиях развития. Ткане- и органспецифические промоторы включают такие промоторы, которые предпочтительно экспрессируются в определенных тканях или органах, таких как листья, корни, семена или ксилема. Ткане- и органспецифические промоторы включают, не ограничиваясь ими, промоторы, специфические для плодов, семяпочки, мужской ткани, семени, наружного покрова, клубня, побега, околоплодника и листа, рыльца, пыльцы, пыльника, лепестка, чашелистика, цветоножки, стручка, стебля, корня и тому подобных. Семяспецифические промоторы предпочтительно экспрессируются во время развития и/или прорастания семени. Например, семяспецифические промоторы могут предпочтительно воздействовать на завязь, эндосперму и семенную оболочку. См. Thompson et al., 1989, BioEssays, 10:108. Примеры семяспецифических промоторов включают, не ограничиваясь ими, целлюлозосинтазу (celA), Cim1, гамма-зеин, глобулин-1, зеин кукурузы массой 19 кДа (cZ19B1) и тому подобные.
Другие подходящие ткане- или органспецифические промоторы включают промотор напин-гена, полученный из семян рапса (патент США № 5608152), USP-промотор, полученный из Vicia faba (Baeumlein et al., 1991, Mol Gen Genet., 225(3):459-67), олеозиновый промотор, полученный из Arabidopsis (заявка РСТ WO 98/45461), фазеолиновый промотор, полученный из Phaseolus vulgaris (патент США № 5504200), Все4-промотор, полученный из Brassica (заявка РСТ WO 91/13980) или промотор бобовых В4 (LeB4; Baeumlein et al., 1992, Plant Journal, 2(2): 233-9), а также промоторы, обеспечивающие семяспецифическую экспрессию в однодольных растениях, таких как кукуруза, ячмень, пшеница, рожь, рис и т.д. Подходящими промоторами является промотор lpt2 или lpt1-гена, полученный из ячменя (заявка РСТ WO 95/15389 и заявка РСТ WO 95/23230), или промоторы, описанные в заявке РСТ WO 99/16890 (промоторы, полученные из гена гордеина ячменя, гена глютелина риса, гена оризина риса, гена проламина риса, гена глиадина пшеницы, гена глютелина пшеницы, гена глютелина овса, гена казирина сорго и гена секалина ржи).
Другие промоторы, пригодные для использования в экспрессирующих кластерах по данному изобретению, включают, не ограничиваясь ими, промотор белка, связывающего основной хлорофилл a/b, гистоновые промоторы, промотор Ар3, конглициновый промотор, напиновый промотор, лектиновый промотор сои, промотор зеина кукурузы 15 кДа, промотор зеина 22 кДа, промотор зеина 27 кДа, промотор g-зеина, воскообразные промоторы, shrunken 1, shrunken 2 и бронзовые промоторы, промотор Zm13 (патент США № 5086169), полигалактуроназные промоторы кукурузы (PG) (патенты США № 5412085 и 5545546) и промотор SGB6 (патент США № 5470359), а также синтетические или другие природные промоторы.
Дополнительная гибкость при регулировании экспрессии гетерологичного гена в растениях может быть достигнута при использовании ДНК-связывающих доменов и чувствительных элементов, полученных из гетерологичных источников (то есть ДНК-связывающие домены из нерастительных источников). Примером такого гетерологичного ДНК-связывающего домена является ДНК-связывающий домен LexA (Brent and Prashne, Cell, 43:729-736 (1985)).
Другим объектом настоящего изобретения являются клетки-хозяева, в которые вводят рекомбинантный экспрессирующий вектор по данному изобретению. Термины "клетка-хозяин" и "рекомбинантная клетка-хозяин" являются взаимозаменяемыми. Следует отметить, что такие термины означают не только конкретную клетку, но и потомство или потенциальное потомство такой клетки. Так как в последующих поколениях могут возникать определенные модификации вследствие мутации или под воздействием окружающих условий, такое потомство фактически не может быть идентично родительской клетке, и все же такое потомство входит в определение используемого здесь термина. Клетка-хозяин может быть прокариотической или эукариотической клеткой. Например, полинуклеотид IMI может быть экспрессирован в бактериальных клетках, таких как C. glutamicum, клетках насекомых, клетках грибов или клетках млекопитающих (таких как клетки яичника китайского хомячка (СНО) или клетки COS), водорослях, ресничных, растительных клетках, грибах или других микроорганизмах, таких как C. glutamicum. В данной области известны другие приемлемые клетки-хозяева.
Клетка-хозяин по данному изобретению, в частности, прокариотическая или эукариотическая клетка-хозяин в культуре, может быть использована для продуцирования (то есть экспрессии) полинуклеотида IMI. Настоящее изобретение далее относится к способам продуцирования полипептидов IMI с использованием клеток-хозяев по данному изобретению. В одном варианте осуществления изобретения способ включают культивирование клетки-хозяина по данному изобретению (в которую введен рекомбинантный экспрессирующий вектор, кодирующий полипептид IMI, или в геном которой введен ген, кодирующий полипептид дикого типа или полипептид IMI) в приемлемой среде до продуцирования полипептида IMI. В другом варианте осуществления изобретения способ дополнительно включает выделение полипептидов IMI из среды или клетки-хозяина. Другим объектом настоящего изобретения являются выделенные полипептиды IMI и их биологически активные части. "Выделенный" или "очищенный" полипептид или его биологически активная часть не содержат клеточного вещества при продуцировании методами генной инженерии, химических предшественников или других химических веществ, образующихся в процессе химического синтеза. Термин "по существу не содержащий клеточного материала" относится к препаратам полипептида IMI, в которых полипептид отделен от клеточных компонентов клеток, в которых он продуцирован естественным путем или рекомбинантными методами. В одном варианте осуществления изобретения термин "по существу не содержащий клеточного материала" относится к препаратам полипептида IMI, содержащим менее примерно 30% (по сухой массе) вещества, не являющегося IMI (определяемого так же, как "загрязняющий полипептид"), более предпочтительно менее примерно 20% вещества, не являющегося IMI, еще предпочтительнее менее примерно 10% вещества, не являющегося IMI, и наиболее предпочтительно менее примерно 5% вещества, не являющегося IMI.
Полипептид IMI или его биологически активная часть, продуцируемые методами генной инженерии, также предпочтительно не содержат культуральной среды, то есть культуральная среда составляет менее примерно 20%, более предпочтительно менее примерно 10% и наиболее предпочтительно менее примерно 5% от объема полипептидного препарата. Термин "по существу не содержащий химических предшественников или других химических веществ" относится к препаратам полипептида IMI, в которых полипептид отделен от химических предшественников или других химических веществ, участвующих в синтезе полипептида. В одном варианте осуществления изобретения термин "по существу не содержащий химических предшественников или других химических веществ" относится к препаратам полипептида IMI, содержащим менее примерно 30% (по сухой массе) химических предшественников или химических веществ, не являющихся IMI, более предпочтительно менее примерно 20% химических предшественников или химических веществ, не являющихся IMI, еще предпочтительнее менее примерно 10% химических предшественников или химических веществ, не являющихся IMI, и наиболее предпочтительно менее примерно 5% химических предшественников или химических веществ, не являющихся IMI. В предпочтительных вариантах осуществления изобретения выделенные полипептиды или их биологически активные части не имеют загрязняющих полипептидов из того же организма, из которого был выделен полипептид IMI. Такие полипептиды обычно продуцируются путем рекомбинантной экспрессии, например, полипептид IMI Triticum monococcum в растениях, не являющихся Triticum monococcum, или в микроорганизмах, таких как C. glutamicum, ресничные, водоросли или грибы.
Полинуклеотидные и полипептидные последовательности IMI по настоящему изобретению имеют ряд применений. Нуклеотидные и аминокислотные последовательности по настоящему изобретению можно использовать для трансформации растений, в частности для модуляции устойчивости растения к имидазолиноновым гербицидам. Таким образом, данное изобретение относится к способу получения трансгенного растения с повышенной устойчивостью к имидазолиноновому гербициду, который включает (а) трансформацию растительной клетки одним или более экспрессирующими векторами, включающими одну или более нуклеиновых кислот IMI, и (b) получение из растительной клетки трансгенного растения с повышенной устойчивостью к имидазолиноновому гербициду по сравнению с сортом растения дикого типа. В одном варианте осуществления изобретения множество нуклеиновых кислот IMI выделяют из разных геномов. В объем настоящего изобретения входят способы получения трансгенного растения с повышенной устойчивостью к имидазолиноновому гербициду, включающие (а) трансформацию растительной клетки экспрессирующим вектором, содержащим нуклеиновую кислоту IMI, которая не является нуклеиновой кислотой Imi1, и (b) получение из растительной клетки трансгенного растения с повышенной устойчивостью к имидазолиноновому гербициду по сравнению с сортом растения дикого типа.
Настоящее изобретение относится к способам модификации устойчивости растения к имидазолиноновому гербициду, которые включают модификацию экспрессии одной или более нуклеиновых кислот IMI. Нуклеиновые кислоты предпочтительно находятся в разных геномах или получены из разных геномов. Устойчивость растения к имидазолиноновому гербициду можно повысить или понизить, что достигается соответственно увеличением или уменьшением экспрессии полинуклеотида IMI. Устойчивость растения к имидазолиноновому гербициду предпочтительно повышают, увеличивая экспрессию полинуклеотида IMI. Экспрессию полинуклеотида IMI можно модифицировать любым способом, известным специалистам в данной области. Способы увеличения экспрессии полинуклеотидов IMI применяют в зависимости от того, является растение трансгенным или нетрансгенным. Трансгенное растение можно трансформировать, например, при помощи вектора, содержащего любые из вышеописанных IMI-кодирующих нуклеиновых кислот, или промотора, регулирующего экспрессию эндогенных полинуклеотидов IMI в растении. В соответствии с данным изобретением такой промотор может быть тканеспецифическим или активируемым в зависимости от стадии развития. Альтернативно в нетрансгенных растениях экспрессия эндогенного полинуклеотида IMI может быть модифицирована путем индукции нативного промотора. Экспрессию полинуклеотидов, включающих SEQ ID NO: 1, в растения-мишени можно осуществлять с помощью одного из нижеследующих компонентов, не ограничиваясь ими: (а) конститутивного промотора, (b) химически индуцируемого промотора и (с) сконструированного промотора вместе с факторами транскрипции, например цинксодержащей пальцеобразной области (Greisman and Pabo, 1997, Science, 275:657).
В предпочтительном варианте осуществления изобретения транскрипцию полинуклеотида IMI модулируют при помощи факторов транскрипции цинксодержащей пальцеобразной области (ZFP), описанных в статье Greisman and Pabo, 1997, Science, 275:657 и созданных компанией Sangamo Biosciences, Inc. Указанные факторы ZFP содержат как домен распознавания ДНК, так и функциональный домен, вызывающий активацию или подавление нуклеиновой кислоты-мишени, такой как нуклеиновая кислота IMI. Таким образом могут быть получены активирующие или подавляющие факторы ZFP, которые специфически распознают вышеописанные промоторы полинуклеотидов IMI и могут быть использованы для увеличения или уменьшения экспрессии полинуклеотида IMI в растении, в результате чего изменяется устойчивость растения к гербициду.
Как более подробно описано выше, растения, получаемые способами по настоящему изобретению, могут быть однодольными или двудольными. Растения могут быть выбраны из таких растений, как кукуруза, пшеница, рожь, овес, тритикале, рис, ячмень, соя, арахис, хлопок, рапс, канола, маниок, перец, подсолнечник, бархатцы, пасленовые культуры, картофель, табак, баклажан, томат, вид Vicia, горох, люцерна, кофе, какао, чай, вид Salix, гвинейская масличная пальма, кокосовая пальма, многолетние травы и фуражные культуры. В предпочтительном варианте осуществления изобретения растение является растением пшеницы. Фуражные культуры включают, не ограничиваясь ими, пырей, канареечник канарский, костер, плевел, пырей жесткий, ежу сборную, люцерну, воробейник полевой, лядвенец рогатый, клевер гибридный, клевер луговой и донник. В предпочтительном варианте осуществления изобретения растение является растением пшеницы. Во всех вышеописанных способах растительная клетка включает, не ограничиваясь ими, протопласт, гаметаобразующую клетку и клетку, которая регенерирует с образованием целого растения. В используемом здесь значении термин "трансгенный" относится к любому растению, растительной клетке, каллюсу, растительной ткани или части растения, которые содержат, по меньшей мере, один полный или частичный рекомбинантный полинуклеотид. Во многих случаях осуществляют стабильную интеграцию полного или частичного рекомбинантного полинуклеотида в хромосому или стабильный внехромосомный элемент так, чтобы он передавался последующим поколениям.
Как описано выше, настоящее изобретение относится к композициям и способам увеличения устойчивости к имидазолинону у растения или семени пшеницы по сравнению с сортом растения или семени дикого типа. В предпочтительном варианте осуществления изобретения устойчивость к имидазолинону у растения или семени пшеницы увеличивается настолько, что растение или семя может выдерживать воздействие имидазолинонового гербицида, применяемого в количестве предпочтительно около 10-400 г а.и. (грамм активного ингредиента)/га, более предпочтительно 20-160 г а.и./га и наиболее предпочтительно 40-80 г а.и./га. В используемом здесь значении термин "выдерживать" воздействие имидазолинонового гербицида означает, что растение не гибнет или не повреждается в результате такого воздействия.
Кроме того, настоящее изобретение относится к способу борьбы с сорняками, произрастающими рядом с растением пшеницы, который включает нанесение имидазолинонового гербицида на сорняки и растение пшеницы, при этом растение пшеницы обладает повышенной устойчивостью к имидазолиноновому гербициду по сравнению с диким сортом пшеницы и при этом растение включает одну или более нуклеиновых кислот IMI. В одном варианте осуществления изобретения растение включает множество нуклеиновых кислот IMI, находящихся в разных геномах или полученных из разных геномов. В другом варианте осуществления изобретения растение содержит нуклеиновую кислоту, не являющуюся Imi1. Благодаря созданию пшеницы с повышенной устойчивостью к имидазолинону можно использовать разнообразные препараты для защиты растений пшеницы от сорняков, в результате чего усиливается рост растений и уменьшается конкуренция за питательные вещества. Имидазолиноновый гербицид можно использовать отдельно для довсходового, послевсходового, предпосевного и посевного уничтожения сорняков на участках, окружающих растения пшеницы, либо можно применять препарат имидазолинонового гербицида, содержащий другие добавки. Имидазолиноновый гербицид можно также использовать для обработки семян. Препарат имидазолинонового гербицида может содержать такие добавки, как другие гербициды, детергенты, адъюванты, распределяющие вещества, связывающие вещества, стабилизирующие вещества или тому подобные. Имидазолиноновый гербицид может быть мокрым или сухим препаратом и может включать, не ограничиваясь ими, текучие порошки, эмульгируемые концентраты и жидкие концентраты. Препараты, содержащие имидазолиноновый гербицид и другие гербициды, можно наносить известными методами, такими как опрыскивание, орошение, поливки или тому подобные.
В данном описании изобретения сделаны ссылки на разные публикации. Все вышеуказанные публикации и ссылки, приведенные в таких публикациях, полностью включены в данную заявку в качестве ссылки для более полного описания уровня техники в области, к которой относится настоящее изобретение.
Следует отметить, что все вышеизложенное относится к предпочтительным вариантам осуществления настоящего изобретения, в которые могут быть внесены многочисленные изменения, не выходящие за пределы объема данного изобретения. Изобретение далее проиллюстрировано нижеследующими примерами, которые никоим образом не ограничивают объем изобретения. Наоборот, совершенно очевидно, что специалисты в данной области могут предложить разные другие варианты осуществления изобретения, модификации и эквиваленты, не выходящие за пределы сущности настоящего изобретения и/или объема прилагаемой формулы изобретения.
ПРИМЕРЫ
ПРИМЕР 1
Мутагенез и отбор устойчивых линий пшеницы
Приблизительно 15000 яровых семян Triticum monococcum, доступ "TM23" обрабатывали ЭМС. Процедура используемого способа была следующей: (1) предварительное замачивание семян в воде в течение четырех часов, (2) обработка 0,3% ЭМС в течение 16 часов, (3) промывание водой в течение 8 часов, (4) высушивание на воздухе в течение четырех часов и (5) высаживание семян. Некоторые из собранных семян дополнительно увеличивали в количестве без отбора на устойчивость к имидазолиноновым гербицидам. Собранные семена высевали и обрабатывали 40 г/га имазамокса. В целом высевали 120 кг семян, что давало приблизительно 2,4 миллиона обработанных растений, с предположительным весом одного зерна 35 мг и 70% появлением всходов. Это поколение семян подвергали скринингу, с классификацией от М2 до М5, причем более 72% семян были, по меньшей мере, М3. Пять растений идентифицировали как устойчивые, обозначенные ЕМ1-ЕМ5, и их пересаживали в теплицу для получения семян. Количество ЕМ2 увеличивали при отборе с имидазолиноновым гербицидом перед начальным полевым испытанием (пример 4).
ПРИМЕР 2
Перенос ЕМ2 из диплоидного вида Triticum monococcum в гексаплоидный T. aestivum ssp aestivum и затем в тетраплоидный T. turgidum ssp durum
EMIMI является обозначением родителя-источника ЕМ2 T. monococcum. Crocus является обозначением используемого родителя T. aestivum ssp aestivum. 605 цветочков crocus опыляли пыльцой EMIMI с получением 84 семян F1. 38409 цветочков растений F1 опыляли с использованием пыльцы Crocus с получением 2 завязей, которые были спасенными завязями. Полученные растения ВС1F1 самоопылялись до ВС1F2 и их обрабатывали 20 г/га имазамокса. Из 24 обработанных таким образом растений 11 были полностью устойчивыми, 7 обнаружили некоторое повреждение и 6 были чувствительными. Устойчивые растения скрещивали с хлебопекарным сортом Teal, представляющим 3-ю дозу хлебопекарной пшеницы. Растения полученной линии, с родословной Crocus*2/EMIMI//CDC Teal/3/ скрещивали либо с АС Elsa, либо с AC Superb и зашифровывали соответственно 98РН8 (гибрид Elsa) и 98РН9 (гибрид Superb), 98РН8 скрещивали еще шесть раз с АС Elsa, а 98РН9 скрещивали еще шесть раз с АС Superb. Эти две популяции зашифровывали следующим образом:
Р00.35 = 98РН8/6*Elsa = Crocus*2/ЕМ2//CDC Teal/3/7*АС Elsa
Р00.45 = 98РН9/6*Superb = Crocus*2/ЕМ2//CDC Teal/3/7*АС Superb
Расщепление обратно скрещенных растений в обеих популяциях соответствует ожидаемой модели для единственного гена 1:1 устойчивые:чувствительные, когда обрабатывали 20 г/га имазомокса. Как ожидалось при этом уровне и единственном гетерозиготном геноме устойчивости в родословной хлебопекарной пшеницы, эти растения оценивали как устойчиво сохраняющие некоторое повреждение. Двойные гаплоиды получали из каждой популяции с использованием способа кукурузного опыления. Семь устойчивых линий DH получали из Р00.35 и 78 устойчивых линий DH получали из Р00.45. При использовании их в последующей работе было показано, что они были гомозиготными в отношении устойчивости к гербициду.
T. aestivum использовали в качестве переходного вида для переноса гена ЕМ2 из T. monococcum в T. turgidum. В каждом поколении растения обрабатывали, по меньшей мере, 20 г/га имазамокса перед отбором растений в качестве родителей. Промежуточное превращение T. aestivum с родословной "Crocus*2/EM2//CDC Teal/3/2*AC Superb", устойчивое к имазомоксу, скрещивали с твердой линией AC Avonlea. Полученные растения F1 самоопылялись с образованием популяции F2, из которой 52/390 растений идентифицировали как устойчивые (не было повреждения от нанесения гербицида). Некоторые из них использовали в качестве женских растений и скрещивали с АС Avonlea. Полученные растения ВС1F1 опять скрещивали с АС Avonlea. Для последующих двух поколений в качестве женских растений использовали AC Avonlea. Полученная линия была названа 00DIMI#17, и она имела родословную: АС Avonlea*2/3/Crocus*2/EM2//CDC Teal/3/2*AC Superb//3* AC Avonlea. Эта линия самоопылялась до F2, и растения F2 обрабатывали 40 г/га имазамокса. Устойчивые растения F2 переходили в поколение F4. Все 53 испытанные растения F4 выдерживали нанесение 80 г/га имазамокса. Через F4:5 линий не были обнаружены чувствительные растения из 124 растений, обработанных 80 г/га имазамокса, что свидетельствовало о стабильном встраивании гена ЕМ2 в твердую культуру.
ПРИМЕР 3
Результаты в отношении наследования генов IMI и аллельных взаимосвязей среди генов IMI
Во всем следующем обсуждении уровень нанесения имидазолинонового гербицида имазамокса, который использовали в исследованиях по наследованию, был 20 граммов на гектар. Этот уровень был достаточен для гибели чувствительных растений пшеницы. Используемый родительский материал показан на фиг.4. Во время процесса интрогрессии ген ЕМ2 расщеплялся, как ожидалось для единственного частично доминантного гена. Triticum monococcum, из которой была получена мутация ЕМ2, является диплоидной пшеницей, содержащей только геном А. Гексаплоидная пшеница имеет геном А, а также геном В и D. При допущении, что во время интрогрессии ген ЕМ2 включался гомологично в геном А гексаплоидной пшеницы, как следовало бы нормально ожидать, мутация ЕМ2 в родительских материалах «ЕМ2» и «ЕМ2FS4», описанных выше, должна была находиться на геноме А. Приведенная ниже таблица дает данные расщепления F2, которые помогают выяснить аллельные взаимосвязи среди различных мутантов. Ни один родительский материал, за исключением чувствительной линии Teal, не имел чувствительных растений при обработке имазамоксом; следовательно, эти данные не показаны.
Отсутствие расщепления в поколении F2 показывает, что родительские линии имеют, по меньшей мере, один общий аллель в конкретном локусе. Отношения расщепления F2 3:1, 15:1 и 63:1 указывают соответственно на один, два и три независимых локуса. Расщепление 15А при скрещивании с чувствительной линией Teal показало, что два независимых локуса участвовали в устойчивости к имазамоксу (фиг.5, линия 2). ЕМ2 находится в другом локусе, чем FS4 (фиг.5, линия 7). ЕМ2 имеет один общий локус с 15А (фиг.5, линия 3). FS4 имеет один общий локус с 15А (фиг.5, линия 4). Родитель ЕМ2+FS4, скрещенный с 15А, также не расщеплялся в F2 (фиг.5, линия 5). Оказалось, что FS4 находится в геноме D (Jim Anderson, личное сообщение). ЕМ2 должен быть в геноме А. Таким образом, два локуса, участвующие в устойчивости к имазамоксу в 15А, должны находиться на геномах А и D. Родитель 11А при скрещивании с чувствительной линией Teal расщеплялся в виде единственного локуса (фиг.5, линия 1). Он был независимым от локуса устойчивости в ЕМ2 (фиг.5, линия 6) и FS4 (фиг.5, линия 9). Как и ожидалось из отсутствия расщепления ЕМ2 и FS4 с 15А, 11А был также независимым от этих локусов в родителе 15А (фиг.5, линия 10) и родителе ЕМ2+FS4 (фиг.5, линия 8). Если предположить, что гены AHAS находятся в гомологичном наборе в гексаплоидной пшенице, имеются только три экспрессируемых гена AHAS и каждый из этих экспрессируемых генов находится в разных геномах, тогда 11А должен находиться на геноме В.
ПРИМЕР 4
Устойчивость к IMI-гербицидам, обеспечиваемая ЕМ2 в Einkorn, твердой и гексаплоидной пшенице, и увеличенная устойчивость при комбинировании с другими неаллельными генами устойчивости
Линию ЕМ2, устойчивую к имазамоксу (пример 1), оценивали в единственном полевом местоположении на различные агрономические характеристики, на которые могло бы влиять повреждение гербицида. Данные трех лет оценки показаны на фиг.6. Данные 1998 года являются средними величинами двух повторностей. Данные по урожаю 1999 года и 2000 года являются средними величинами четырех повторностей. Другие данные 1999 года являются средними величинами двух повторностей. Контроль Einkorn был чувствительным к 40 г имазамокса, т.е. погибали все растения. Мутация ЕМ2 в родословной Einkorn придает превосходную устойчивость к уровню 40 г/га. Линию ЕМ2 оценивали на общее повреждение посева при трех уровнях имазамокса, три раза во время вегетационного периода. Эти данные представлены на фиг.7. В 1999 году наблюдали первоначально только слабое повреждениие, и симптомы постепенно исчезали на протяжении вегетационного периода. В 2000 году в линии ЕМ2 не наблюдали повреждения, тогда как неустойчивый к гербициду контроль фактически весь погибал.
Была также показана устойчивость, придаваемая ЕМ2 в родословных твердой (тетраплоиде) и хлебопекарной пшеницы (гексаплоиде). История селекции этих линий была описана ранее (пример 2). Как показано в примере 2, при оценке линий F4:5 восстановления ЕМ2 твердой 00DIMI#17 на устойчивость к 80 г/га имазамокса все растения были устойчивыми, тогда как все растения чувствительной твердой линии, используемые в качестве контроля, погибали, что свидетельствует о том, что ЕМ2 придает устойчивость к гербицидам Imi-класса в твердой культуре. Полученная из двойного гаплоида линия Р00.45, состоящая из ЕМ2 в родословной гексаплоида, была устойчивой к 20 г/га имазамокса, как и родительский контроль в исследованиях аллелизма, описанных в примере 3; все растения этого чувствительного гексаплоидного контроля погибали при этом уровне.
Было продемонстрировано, что комбинирование более чем одного гена Imi-устойчивости усиливало устойчивость пшеницы к имидазолиноновым гербицидам. Четыре генотипа испытывали на устойчивость к двум разным уровням имазамокса. Генотипы включали только FS4 линию, BW755; Teal 15A, описанную ранее, имеющую два независимых локуса устойчивости к Imi-гербицидам; полученную из двойного гаплоида линию ЕМ2+FS4 и линию, полученную из скрещивания 15А и 11А посредством общепринятой массовой селекции большинства устойчивых растений на протяжении последовательных поколений при увеличивающихся уровнях имазамокса. Уровни имазамокса составляли 200 и 600 граммов на гектар. Повреждение проростков из 18-25 растений на одну обработку на генотип оценивали в расчете на растение с использованием пяти категорий в диапазоне от гибели до отсутствия повреждения. Эти данные суммированы на фиг.8.
Растения не погибали ни при каком уровне. Линия с единственным геном, BW755, содержащая FS4, была повреждена при обоих уровнях. Предыдущее исследование показало, что 11А и FS4 обеспечивают одинаковую устойчивость в хлебопекарной пшенице. Две линии с двумя генами, Teal 15A и EM2/FS4, реагировали одинаково. Не было повреждения при более низком уровне, что указывает на увеличенную устойчивость в сравнении с растением, имеющим один ген устойчивости, но все повреждались при более высоком уровне. Линия с тремя генами была все еще расщепляющейся, как показано некоторыми растениями, проявляющими повреждение при обоих уровнях, но приблизительно половина этих растений не имела повреждения при более высоком уровне, демонстрируя увеличенную устойчивость в сравнении с любой из содержащих эти два гена линий.
Реферат
Семена растения обрабатывают этилметансульфонатом в течение 16 часов, затем просушивают или проращивают. Полученные растения M1 самоопыляют, получают семена, из которых выращивают растения пшеницы М2. Растения М2 обрабатывают имазамоксом и отбирают обладающие повышенной устойчивостью к нему по сравнению с растениями дикого типа. В другом варианте растения трансформируют экспрессирующим вектором, содержащим одну или более нуклеиновых кислот IMI. Полученные растения обладают повышенной устойчивостью к имидазолинону и могут быть использованы в условиях борьбы с сорняками посредством гербицида. 16 н. и 28 з.п. ф-лы, 8 ил.


Комментарии