Композиции и способы получения изопрена - RU2545699C2
Код документа: RU2545699C2
Чертежи























































































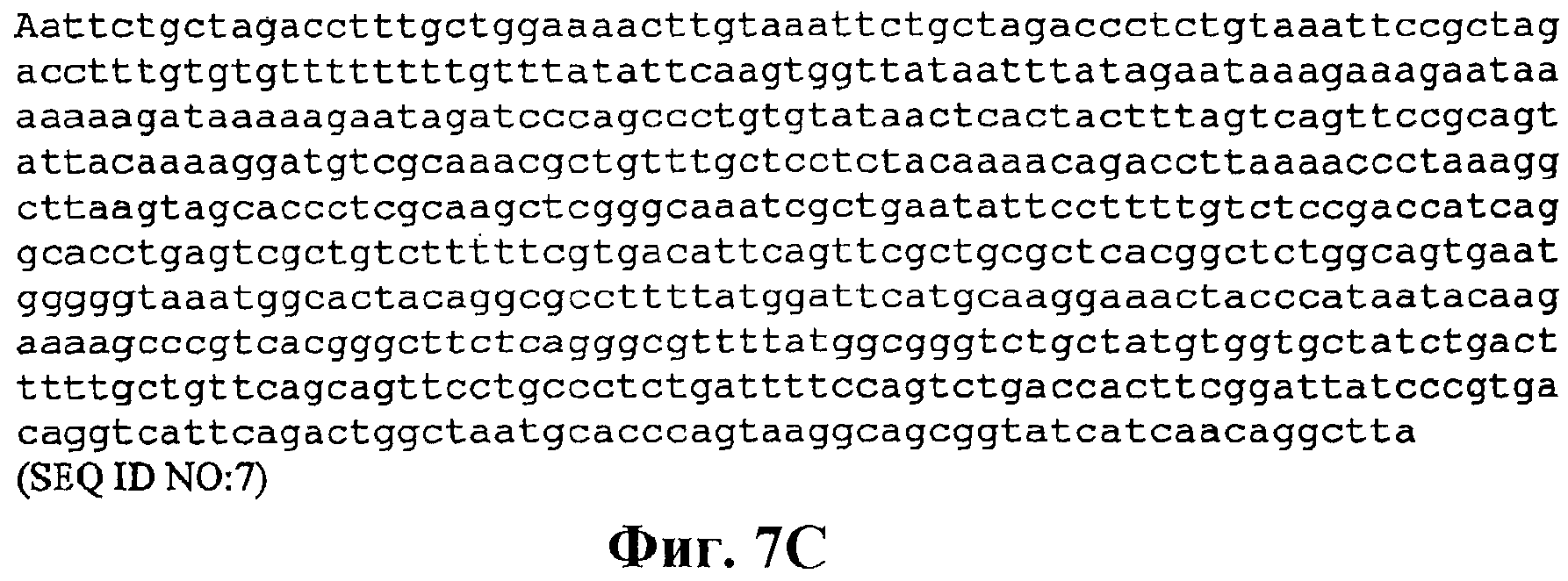








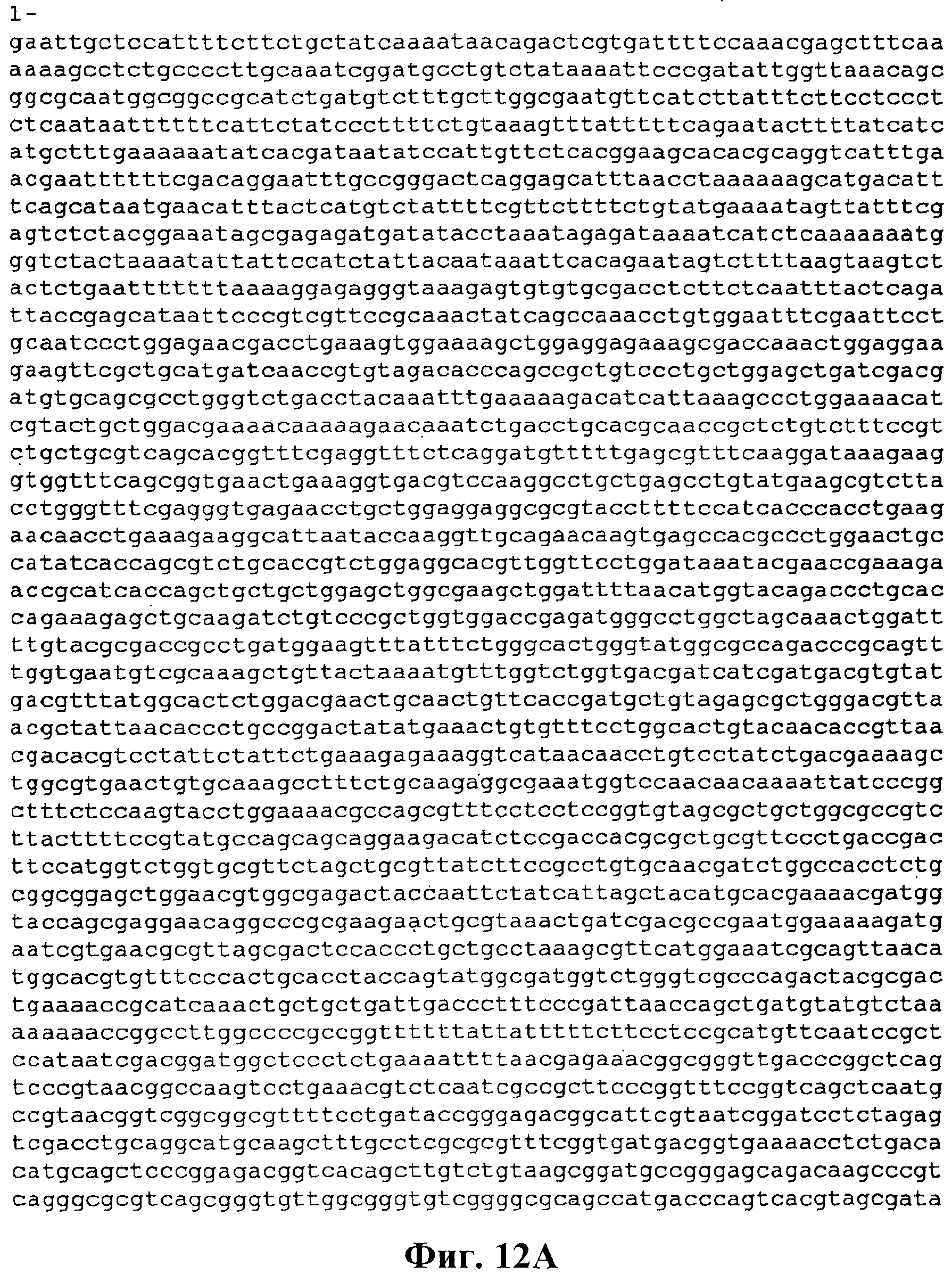

















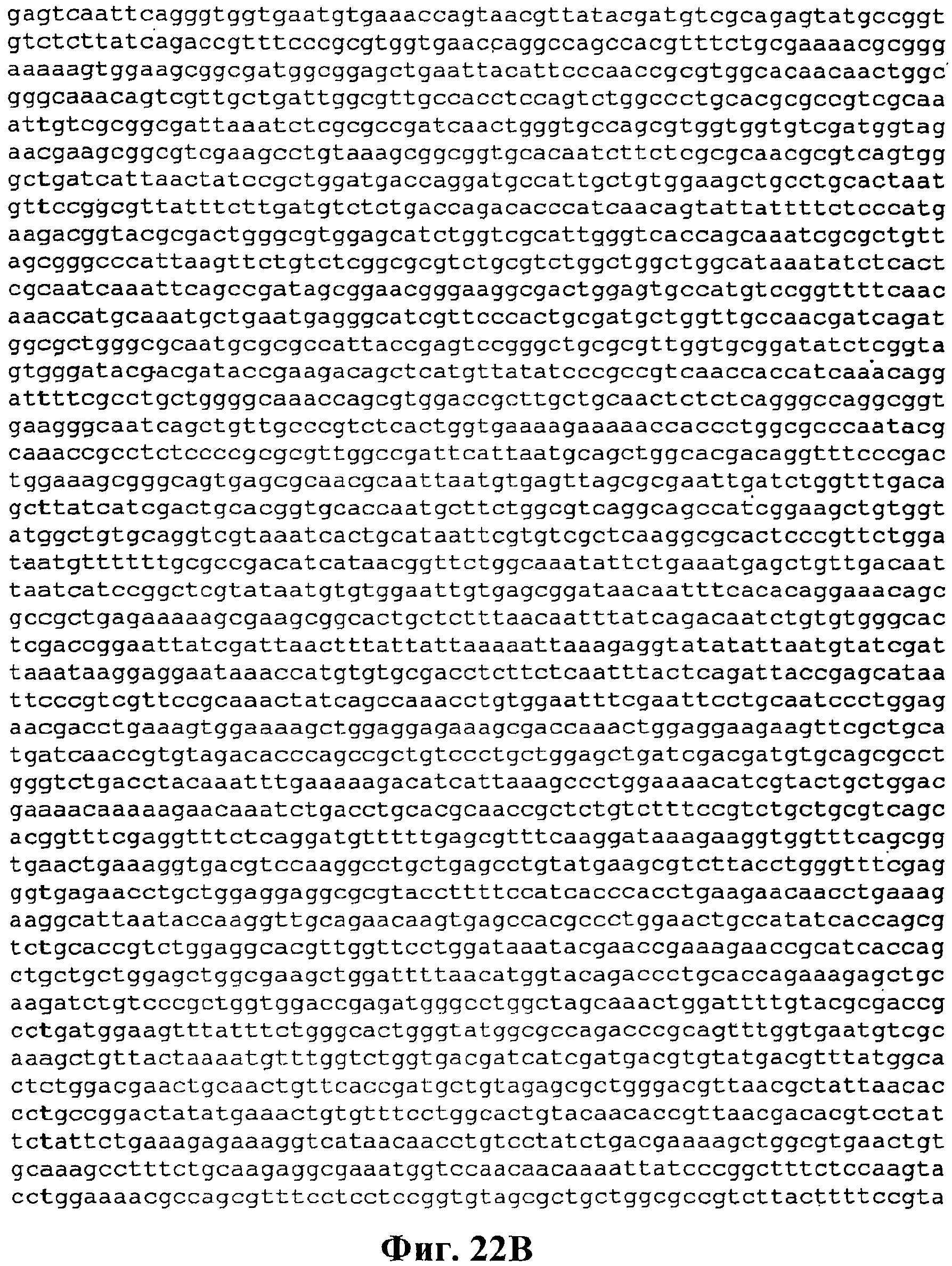










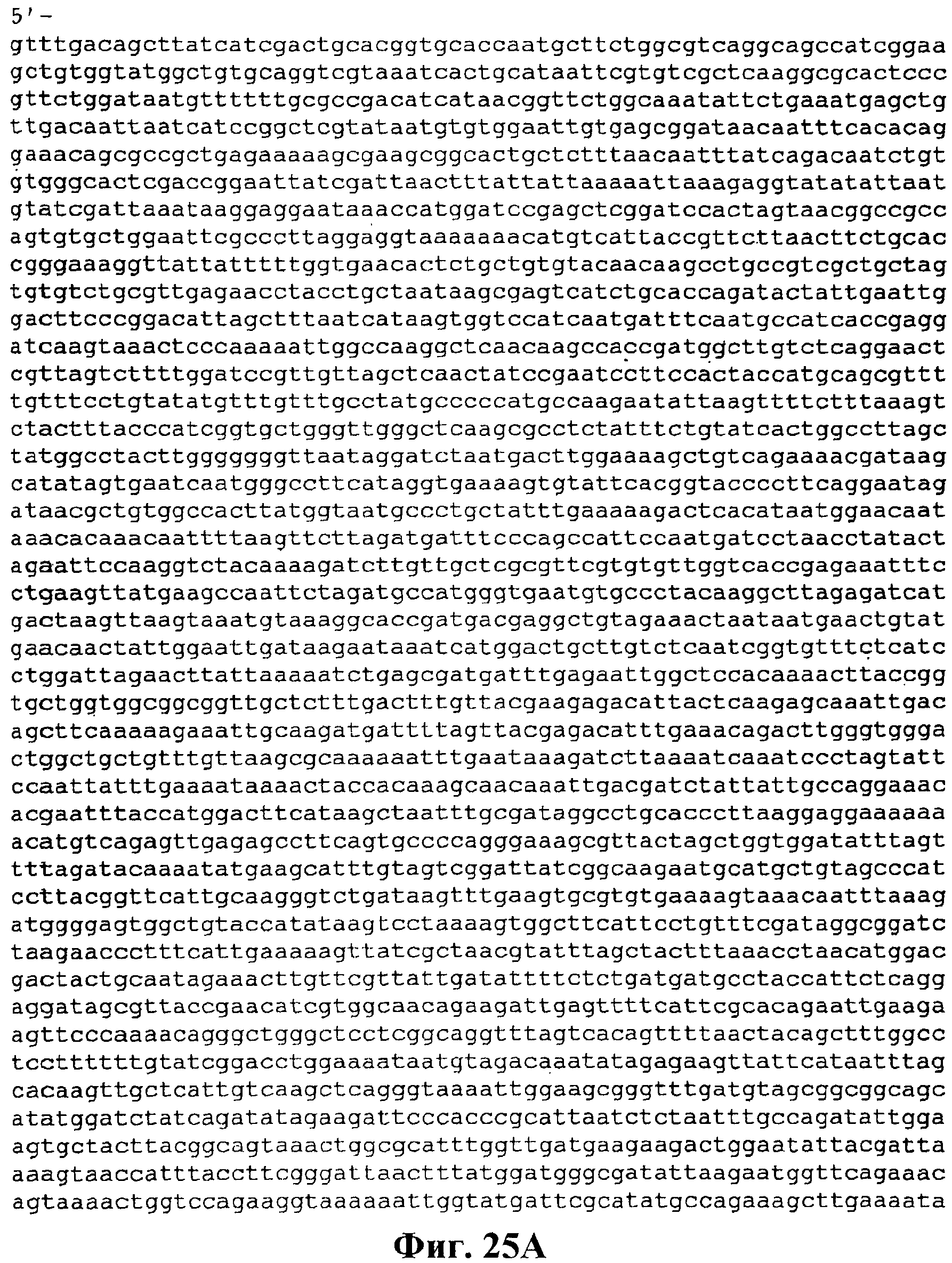
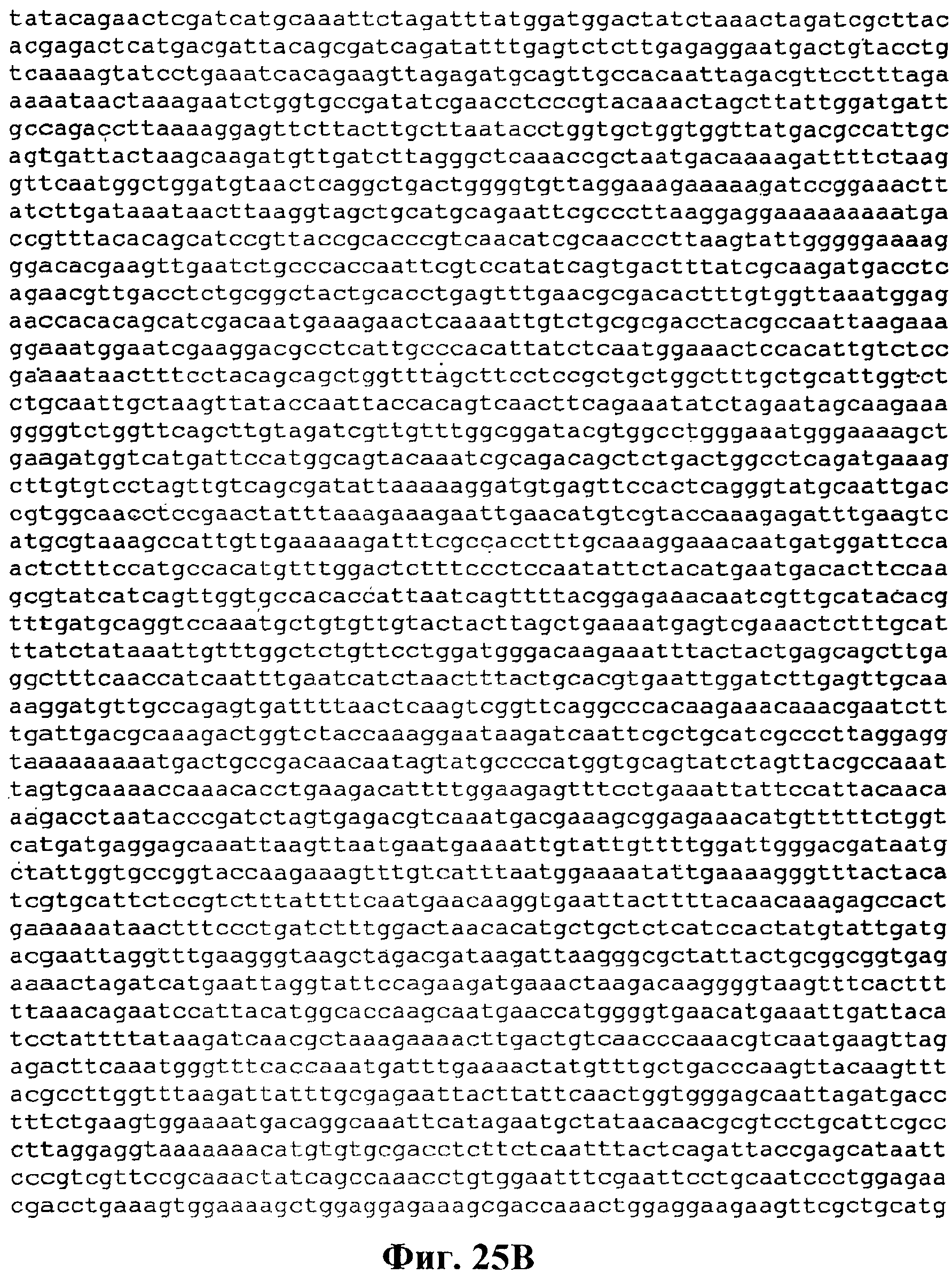




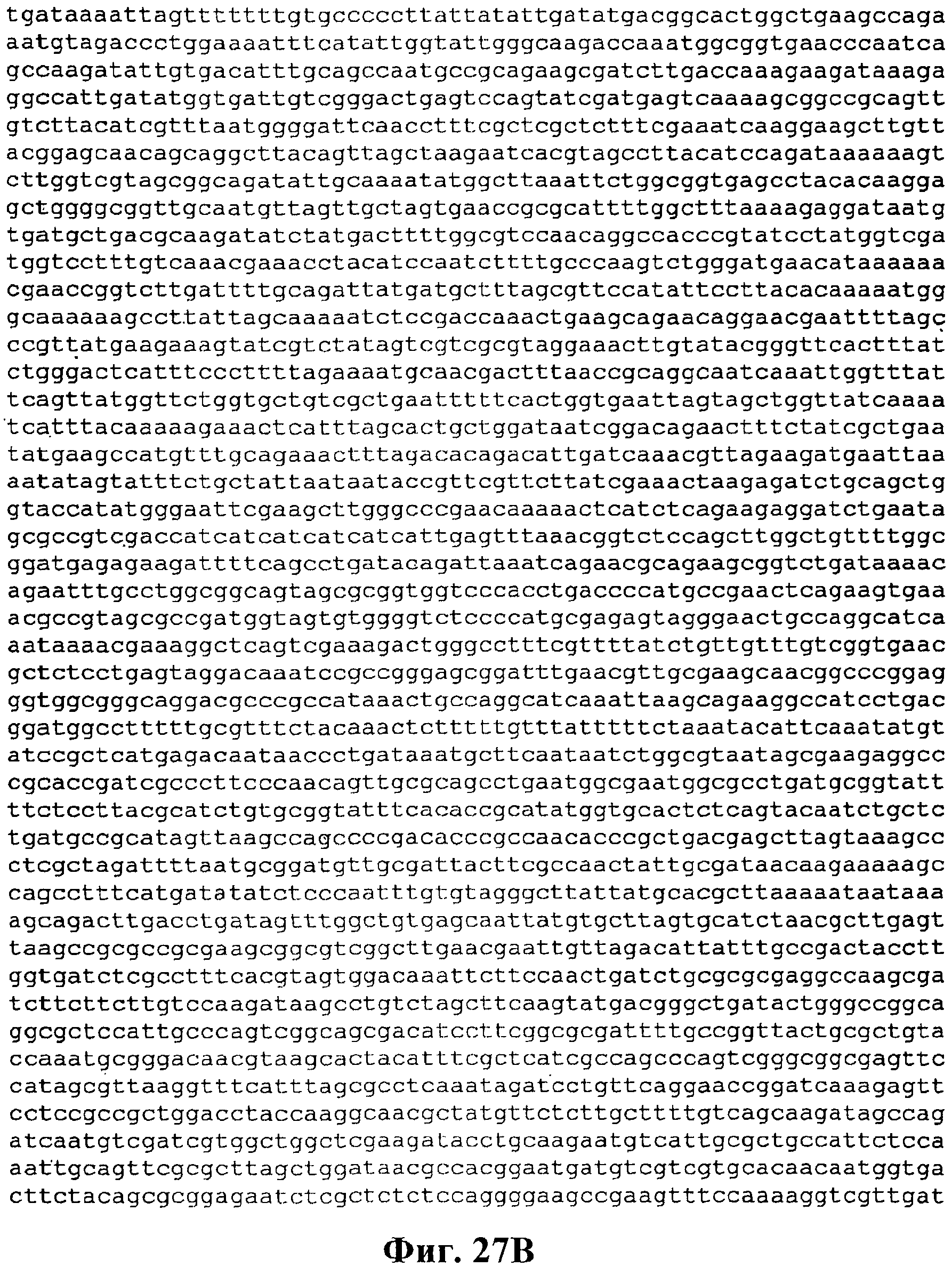

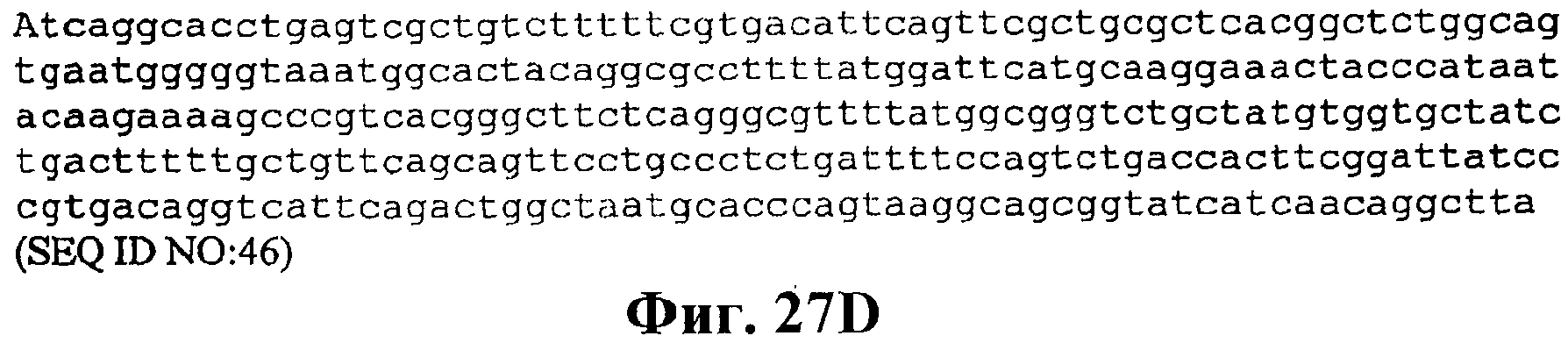































































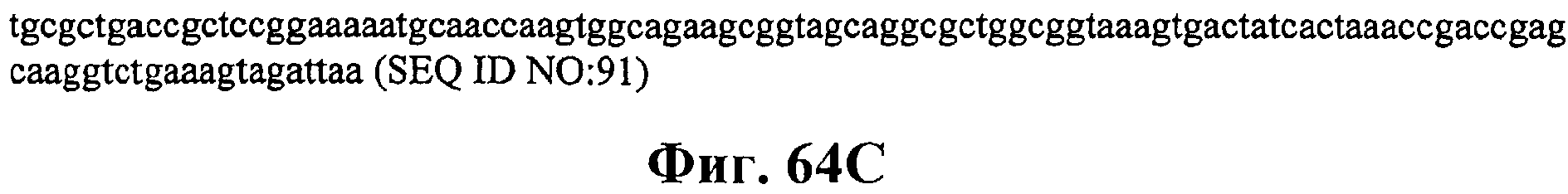





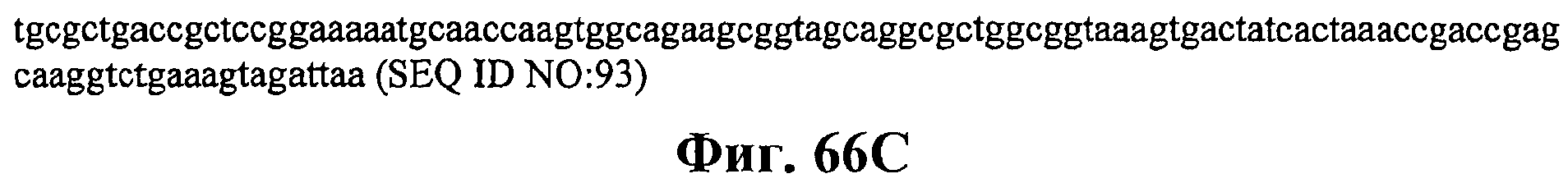

































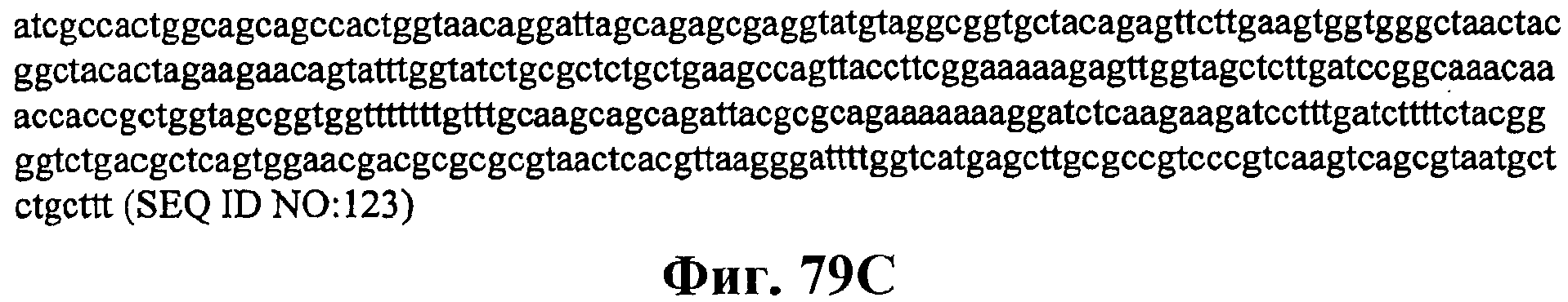
Описание
Родственные заявки
По настоящей заявке испрашивается приоритет предварительной заявки на патент США № 61/013574, поданной 13 декабря 2007 года. Содержание заявки приведено в настоящем описании в качестве ссылки в полном объеме.
Область техники, к которой относится изобретение
Настоящее изобретение в основном относится к способам получения изопрена из культивированных клеток и к композициям, содержащим эти культивированные клетки.
Уровень техники
Изопрен (2-метил-1,3-бутадиен) является основным исходным веществом для синтеза различных синтетических полимеров, из которых наибольшее значение имеют синтетические каучуки. В природных условиях изопрен продуцируется микроорганизмами, растениями и животными. В частности, установлено два пути биосинтеза изопрена: путь с участием мевалоната (MVA) и путь без участия мевалоната (DXP) (фигуры 19А и 19В). Однако получение изопрена из природных организмов в промышленном отношении является неэффективным. Ежегодно примерно 800000 тонн цис-полиизопрена получают полимеризацией изопрена; большую часть такого полиизопрена используют в производстве покрышек и каучука. Также изопрен подвергают сополимеризации для использования в качестве синтетического эластомера в других продуктах, таких как обувь, механические продукты, медицинские продукты, спортивные товары и латекс.
В настоящее время производство покрышек и каучука основано на применении природного и синтетического каучука. Природный каучук получают из молочного сока каучуковых деревьев или растений тропических лесов Африки. Синтетический каучук по существу состоит из бутадиеновых полимеров. Для таких полимеров бутадиен получают как сопродукт при производстве этилена и пропилена.
Несмотря на то, что изопрен можно получить фракционированием нефти, очистка нефти является дорогостоящей и трудоемкой. В результате крекинга нефти фракция С5 углеводородов дает только 15% изопрена. Таким образом, необходимы более экономичные способы получения изопрена. В частности, желательны способы получения изопрена, с помощью которых можно было бы получить изопрен с выходами, титрами и чистотой, которые отвечают требованиям интенсивного промышленного производства. Также желательны системы для получения изопрена из дешевых исходных веществ.
Сущность изобретения
В одном из аспектов изобретение относится к клеткам в культуре, продуцирующим изопрен. В некоторых вариантах осуществления изобретение относится к клеткам в культуре, которые продуцируют более чем 400 нмоль изопрена/г клеток на сырую клеточную массу/ч (нмоль/гскм/ч) изопрена. В некоторых вариантах осуществления клетки содержат гетерологичную нуклеиновую кислоту, которая (i) кодирует полипептид изопренсинтазы и (ii) функционально связана с промотором. В некоторых вариантах осуществления клетки культивируют в культуральной среде, которая содержит источник углерода, такой как, но ими не ограничиваясь, углевод (например, ксилоза или глюкоза), ацетат, глицерин, дигидроксиацетон, одноуглеродное соединение, масло, животный жир, животное масло, жирную кислоту, липид, фосфолипид, глицеролипид, моноглицерид, диглицерид, триглицерид, восстанавливаемый источник углерода (например, источник углерода на основе гидролизованной биомассы), полипептид (например, микробный или растительный белок или пептид), дрожжевой экстракт, компонент дрожжевого экстракта или комбинацию двух или более перечисленных источников.
В некоторых вариантах осуществления изобретение относится к клеткам в культуре, которые имеют среднюю объемную продуктивность изопрена более чем примерно 0,1 мг/лбульона/ч. В некоторых вариантах осуществления изобретение относится к клеткам в культуре, которые имеют максимальную объемную продуктивность изопрена более чем примерно 0,5 мг/лбульона/ч. В некоторых вариантах осуществления клетки содержат гетерологичную нуклеиновую кислоту, которая (i) кодирует полипептид изопренсинтазы и (ii) функционально связана с промотором. В некоторых вариантах осуществления клетки культивируют в культуральной среде, которая содержит источник углерода, такой как, не ограничиваясь этим, углевод (например, ксилоза или глюкоза), ацетат, глицерин, дигидроксиацетон, одноуглеродное соединение, масло, животный жир, животное масло, жирную кислоту, липид, фосфолипид, глицеролипид, моноглицерид, диглицерид, триглицерид, восстанавливаемый источник углерода (например, источник углерода на основе гидролизованной биомассы), полипептид (например, микробный или растительный белок или пептид), дрожжевой экстракт, компонент дрожжевого экстракта или комбинацию двух или более перечисленных источников.
В некоторых вариантах осуществления изобретение относится к клеткам в культуре, которые преобразуют более чем примерно 0,002% углерода в клеточной культуральной среде в изопрен. В некоторых вариантах осуществления клетки содержат гетерологичную нуклеиновую кислоту, которая (i) кодирует полипептид изопренсинтазы и (ii) функционально связана с промотором. В некоторых вариантах осуществления клетки культивируют в культуральной среде, которая содержит источник углерода, такой как, не ограничиваясь этим, углевод (например, ксилоза или глюкоза), ацетат, глицерин, дигидроксиацетон, одноуглеродное соединение, масло, животный жир, животное масло, жирную кислоту, липид, фосфолипид, глицеролипид, моноглицерид, диглицерид, триглицерид, восстанавливаемый источник углерода (например, источник углерода на основе гидролизованной биомассы), полипептид (например, микробный или растительный белок или пептид), дрожжевой экстракт, компонент дрожжевого экстракта или комбинацию двух или более перечисленных источников.
В некоторых вариантах осуществления изобретение относится к клеткам в культуре, которые содержат гетерологичную нуклеиновую кислоту, кодирующую полипептид изопренсинтазы. В некоторых вариантах осуществления клетки содержат гетерологичную нуклеиновую кислоту, которая (i) кодирует полипептид изопренсинтазы и (ii) функционально связана с промотором. В некоторых вариантах осуществления клетки культивируют в культуральной среде, которая содержит источник углерода, такой как, не ограничиваясь этим, углевод (например, ксилоза или глюкоза), ацетат, глицерин, дигидроксиацетон, одноуглеродное соединение, масло, животный жир, жирную кислоту, липид, фосфолипид, глицеролипид, моноглицерид, диглицерид, триглицерид, восстанавливаемый источник углерода (например, источник углерода на основе гидролизованной биомассы), полипептид (например, микробный или растительный белок или пептид), дрожжевой экстракт, компонент дрожжевого экстракта или комбинацию двух или более перечисленных источников.
В одном из аспектов изобретение относится к способам получения изопрена, таким как способы получения любых клеток, описанных в настоящем документе, для получения изопрена. В некоторых вариантах осуществления способ включает культивирование клеток в условиях, достаточных для получения более чем примерно 400 нмоль/гскм/ч изопрена. В некоторых вариантах осуществления способ также включает выделение изопрена, продуцированного клетками. В некоторых вариантах осуществления способ включает очистку изопрена, продуцированного клетками. В некоторых вариантах осуществления способ включает полимеризацию изопрена. В некоторых вариантах осуществления клетки содержат гетерологичную нуклеиновую кислоту, которая (i) кодирует полипептид изопренсинтазы и (ii) функционально связана с промотором. В некоторых вариантах осуществления клетки культивируют в культуральной среде, которая содержит источник углерода, такой как, не ограничиваясь этим, углевод (например, ксилоза или глюкоза), ацетат, глицерин, дигидроксиацетон, одноуглеродное соединение, масло, животный жир, жирную кислоту, липид, фосфолипид, глицеролипид, моноглицерид, диглицерид, триглицерид, восстанавливаемый источник углерода (например, источник углерода на основе гидролизованной биомассы), полипептид (например, микробный или растительный белок или пептид), дрожжевой экстракт, компонент дрожжевого экстракта или комбинацию двух или более перечисленных источников.
В одном из аспектов изобретение относится к способам получения изопрена, таким как способы, в которых используются любые клетки, описанные в настоящем документе, для получения изопрена. В некоторых вариантах осуществления способ включает культивирование клеток в условиях, обеспечивающих среднюю объемную продуктивность изопрена более чем примерно 0,1 мг/лбульона/ч. В некоторых вариантах осуществления способ включает культивирование клеток в условиях, обеспечивающих максимальную объемную продуктивность изопрена более чем примерно 0,5 мг/лбульона/ч. В некоторых вариантах осуществления способ также включает выделение изопрена, продуцированного клетками. В некоторых вариантах осуществления способ включает очистку изопрена, продуцированного клетками. В некоторых вариантах осуществления способ включает полимеризацию изопрена. В некоторых вариантах осуществления клетки содержат гетерологичную нуклеиновую кислоту, которая (i) кодирует полипептид изопренсинтазы и (ii) функционально связана с промотором. В некоторых вариантах осуществления клетки культивируют в культуральной среде, которая содержит источник углерода, такой как, не ограничиваясь этим, углевод (например, ксилоза или глюкоза), ацетат, глицерин, дигидроксиацетон, одноуглеродное соединение, масло, животный жир, жирную кислоту, липид, фосфолипид, глицеролипид, моноглицерид, диглицерид, триглицерид, восстанавливаемый источник углерода (например, источник углерода на основе гидролизованной биомассы), полипептид (например, микробный или растительный белок или пептид), дрожжевой экстракт, компонент дрожжевого экстракта или комбинацию двух или более перечисленных источников.
В некоторых вариантах осуществления способ включает культивирование клеток в условиях, достаточных для преобразования более чем примерно 0,002% углерода в клеточной культуральной среде в изопрен. В некоторых вариантах осуществления способ также включает выделение изопрена, продуцированного клетками. В некоторых вариантах осуществления способ включает очистку изопрена, продуцированного клетками. В некоторых вариантах осуществления способ включает полимеризацию изопрена. В некоторых вариантах осуществления клетки содержат гетерологичную нуклеиновую кислоту, которая (i) кодирует полипептид изопренсинтазы и (ii) функционально связана с промотором. В некоторых вариантах осуществления клетки культивируют в культуральной среде, которая содержит источник углерода, такой как, не ограничиваясь этим, углевод (например, ксилоза или глюкоза), ацетат, глицерин, дигидроксиацетон, одноуглеродное соединение, масло, животный жир, жирную кислоту, липид, фосфолипид, глицеролипид, моноглицерид, диглицерид, триглицерид, восстанавливаемый источник углерода (например, источник углерода на основе гидролизованной биомассы), полипептид (например, микробный или растительный белок или пептид), дрожжевой экстракт, компонент дрожжевого экстракта или комбинацию двух или более перечисленных источников.
В некоторых вариантах осуществления любого из аспектов изобретения клетки в культуре продуцируют изопрен более чем или примерно 400, 500, 600, 700, 800, 900, 1000, 1250, 1500, 1750, 2000, 2500, 3000, 4000, 5000, 10000, 12500, 20000, 30000, 40000, 50000, 75000, 100000, 125000, 150000, 188000 или более нмоль/гскм/ч изопрена. В некоторых вариантах осуществления клетки в культуре имеют среднюю объемную продуктивность изопрена более чем примерно или примерно 0,1, 1,0, 10, 25, 50, 100, 150, 200, 250, 300, 400, 500, 600, 700, 800, 900, 1000, 1100, 1200, 1300, 1400, 1500, 1600, 1700, 1800, 1900, 2000, 2100, 2200, 2300, 2400, 2500, 2600, 2700, 2800, 2900, 3000, 3100, 3200, 3300, 3400, 3500 или более мг изопрена/л бульона/ч (мг/лбульона/ч), где объем бульона включает объем клеток и клеточную среду). В некоторых вариантах осуществления клетки в культуре имеют максимальную объемную продуктивность изопрена более чем или примерно 0,5, 1,0, 10, 25, 50, 100, 150, 200, 250, 300, 400, 500, 600, 700, 800, 900, 1000, 1100, 1200, 1300, 1400, 1500, 1600, 1700, 1800, 1900, 2000, 2100, 2200, 2300, 2400, 2500, 2600, 2700, 2800, 2900, 3000, 3100, 3200, 3300, 3400, 3500, 3750, 4000, 4250, 4500, 4750, 5000, 5250, 5500, 5750, 6000, 6250, 6500, 6750, 7000, 7250, 7500, 7750, 8000, 8250, 8500, 8750, 9000, 9250, 9500, 9750, 10000, 12500, 15000 или более мг изопрена/л бульона/ч (мг/лбульона/ч), где объем бульона включает объем клеток и клеточную среду). В некоторых вариантах осуществления любого из аспектов изобретения клетки в культуре преобразуют более чем или примерно 0,002, 0005, 0,01, 0,02, 0,05, 0,1, 0,12, 0,14, 0,16, 0,2, 0,3, 0,4, 0,5, 0,6, 0,7, 0,8, 0,9, 1,0, 1,2, 1,4, 1,6, 2,0, 2,2, 2,4, 2,6, 3,0, 4,0, 5,0, 6,0, 7,0, 8,0, 9,0, 10,0, 11,0, 12,0, 13,0, 14,0, 15,0, 16,0, 17,0, 18,0, 19,0, 20,0, 21,0, 22,0, 23,0, 23,2, 23,4, 23,6, 23,8, 24,0, 25,0, 30,0, 31,0, 32,0, 33,0, 35,0, 37,5, 40,0, 45,0, 47,5, 50,0, 55,0, 60,0, 65,0, 70,0, 75,0, 80,0, 85,0, 90,0 мол.% или более углерода в клеточной культуральной среде в изопрен. В некоторых вариантах осуществления любого из аспектов изобретения клетки в культуре продуцируют изопрен более чем или примерно 1, 10, 25, 50, 100, 150, 200, 250, 300, 400, 500, 600, 700, 800, 900, 1000, 1250, 1500, 1750, 2000, 2500, 3000, 4000, 5000, 10000, 100000 или более нг изопрена/г клеток в пересчете на сырую клеточную массу/ч (нг/гскм/ч). В некоторых вариантах осуществления любого из аспектов изобретения клетки в культуре продуцируют кумулятивный титр (общее количество) изопрена более чем или примерно 1, 10, 25, 50, 100, 150, 200, 250, 300, 400, 500, 600, 700, 800, 900, 1000, 1250, 1500, 1750, 2000, 2500, 3000, 4000, 5000, 10000, 100000 или более мг изопрена/л бульона (мг/лбульона, где объем бульона включает объем клеток и клеточную среду). В настоящем документе раскрыты другие, приведенные в качестве примера выхода продукции изопрена и общие количества продукции изопрена.
В некоторых вариантах осуществления любого из аспектов изобретения клетки дополнительно содержат гетерологичную нуклеиновую кислоту, кодирующую полипептид IDI. В некоторых вариантах осуществления любого из аспектов изобретения клетки дополнительно содержат вставку копии эндогенной нуклеиновой кислоты, кодирующей полипептид IDI. В некоторых вариантах осуществления любого из аспектов изобретения клетки дополнительно содержат гетерологичную нуклеиновую кислоту, кодирующую полипептид DXS. В некоторых вариантах осуществления любого из аспектов изобретения клетки дополнительно содержат вставку копии эндогенной нуклеиновой кислоты, кодирующей полипептид DXS. В некоторых вариантах осуществления любого из аспектов изобретения клетки дополнительно содержат одну или более нуклеиновых кислот, кодирующих полипептид IDI и полипептид DXS. В некоторых вариантах осуществления любого из аспектов изобретения одна нуклеиновая кислота кодирует полипептид изопренсинтазы, полипептид IDI и полипептид DXS. В некоторых вариантах осуществления любого из аспектов изобретения один вектор кодирует полипептид изопренсинтазы, полипептид IDI и полипептид DXS. В некоторых вариантах осуществления вектор содержит селективный маркер, такой как нуклеиновая кислота, придающая резистентность к антибиотикам.
В некоторых вариантах осуществления любого из аспектов изобретения гетерологичная нуклеиновая кислота изопренсинтазы функционально связана с Т7-промотором, таким как Т7-промотор, находящийся в среде или высококопийной плазмиде. В некоторых вариантах осуществления любого из аспектов изобретения гетерологичная нуклеиновая кислота изопренсинтазы функционально связана с Trc-промотором, таким как Trc-промотор, находящийся в среде или высококопийной плазмиде. В некоторых вариантах осуществления любого из аспектов изобретения гетерологичная нуклеиновая кислота изопренсинтазы функционально связана с Lac-промотором, таким как промотор Lac, находящийся в низкокопийной плазмиде. В некоторых вариантах осуществления любого из аспектов изобретения гетерологичная нуклеиновая кислота изопренсинтазы функционально связана с эндогенным промотором, таким как эндогенный промотор щелочной серинпротеазы. В некоторых вариантах осуществления гетерологичная нуклеиновая кислота изопренсинтазы интегрирует в хромосому клеток без селективного маркера.
В некоторых вариантах осуществления любого из аспектов изобретения по меньшей мере часть клеток сохраняет гетерологичную нуклеиновую кислоту изопренсинтазы, по меньшей мере, или примерно на 5, 10, 20, 40, 50, 60, 65 или более клеточных делений в непрерывной культуре (такой как непрерывная культура без разведения). В некоторых вариантах осуществления любого из аспектов изобретения нуклеиновая кислота, содержащая нуклеиновую кислоту изопренсинтазы, IDI или DXS, также содержит селективный маркер, такой как нуклеиновая кислота, обеспечивающая резистентность к антибиотикам.
В некоторых вариантах осуществления любого из аспектов изобретения клетки дополнительно содержат гетерологичную нуклеиновую кислоту, кодирующую полипептид пути MVA (такой как полипептид пути MVA из Saccharomyces cerevisi, Methanosarcina mazei или Enterococcus faecalis). В некоторых вариантах осуществления любого из аспектов изобретения клетки дополнительно содержат вставку копии эндогенной нуклеиновой кислоты, кодирующей полипептид пути MVA (такой как полипептид пути MVA из Saccharomyces cerevisia, Methanosarcina mazei или Enterococcus faecalis). В некоторых вариантах осуществления любого из аспектов изобретения клетки содержат нуклеиновую кислоту изопренсинтазы, DXS и пути MVA. В некоторых вариантах осуществления любого из аспектов изобретения клетки содержат нуклеиновую кислоту изопренсинтазы, нуклеиновую кислоту DXS и нуклеиновую кислоту IDI, и нуклеиновую кислоту пути MVA (в дополнении к нуклеиновой кислоте IDI).
В некоторых вариантах осуществления любого из аспектов изобретения полипептид изопренсинтазы представляет природный полипептид из растения, такого как Pueraria (например, Pueraria montana) или Populus (например, Populus tremuloides, Populus alba (P. alba), Populus nigra, Populus trichocapra или гибрид Populus alba×Populus tremula).
В некоторых вариантах осуществления любого из аспектов изобретения клетки представляют собой бактериальные клетки, такие как грамположительные бактериальные клетки (например, клетки Bacillus, такие как клетки Bacillus subtilis или клетки Streptomyces, такие как клетки Streptomyces lividans, Streptomyces coelicolor, Streptomyces albus или Streptomyces griseus). В некоторых вариантах осуществления любого из аспектов изобретения клетки представляют собой грамотрицательные бактериальные клетки (например, клетки Escherichia, такие как Escherichia coli или клетки Pantoea, такие как клетки Pantoea citrea). В некоторых вариантах осуществления клетки E.coli представляют собой мутантные клетки E.coli FadR atoC. В некоторых вариантах осуществления клетки E.coli экспрессируют (например, конститутивно экспрессируют) ybhE (также известный как pgl). В некоторых вариантах осуществления любого из аспектов изобретения клетки представляют грибковые клетки, такие как клетки нитчатых грибов (например, клетки Trichoderma, такие как клетки Trichoderma reesei или клетки Aspergillus, такие как Aspergillus oryzae и Aspergillus niger) или дрожжевые клетки (например, клетки Yarrowia, такие как клетки Yarrowia lipolytica).
В некоторых вариантах осуществления любого из аспектов изобретения источник углерода микробного полипептида включает один или более полипептидов из дрожжей или бактерий. В некоторых вариантах осуществления любого из аспектов изобретения источник углерода растительного полипептида включает один или более полипептидов из сои, кукурузы, канолы, ятрофы, пальмы, арахиса, подсолнечника, кокосового ореха, горчицы, рапсового семени, семян хлопчатника, пальмового ядра, оливок, сафлора, кунжута или льняного семени.
В одном из аспектов изобретение относится к покрышке, содержащей полиизопрен. В некоторых вариантах осуществления полиизопрен получают (i) полимеризацией изопрена из любых композиций или способов, описанных в настоящем документе, или (ii) полимеризацией изопрена, выделенного из любых композиций или способов, описанных в настоящем документе. В некоторых вариантах осуществления полиизопрен содержит цис-1,4-полиизопрен.
В одном из аспектов изобретение относится к продукту (такому как покрышка), полученному с использованием любых композиций или способов по изобретению.
Очевидно, понятно, что один, некоторые или все признаки различных вариантов осуществления, описанных в настоящем документе, можно объединить с получением других вариантов осуществления настоящего изобретения. Эти и другие аспекты изобретения станут очевидными специалистам в данной области.
Краткое описание фигур
На фигуре 1 приведена нуклеотидная последовательность кодон-оптимизированного гена изопренсинтазы кудзу для экспрессии в E.coli (SEQ ID NO:1). Старт-кодон atg выделен курсивом, стоп-кодон - жирным шрифтом и добавленный сайт PstI - подчеркнут.
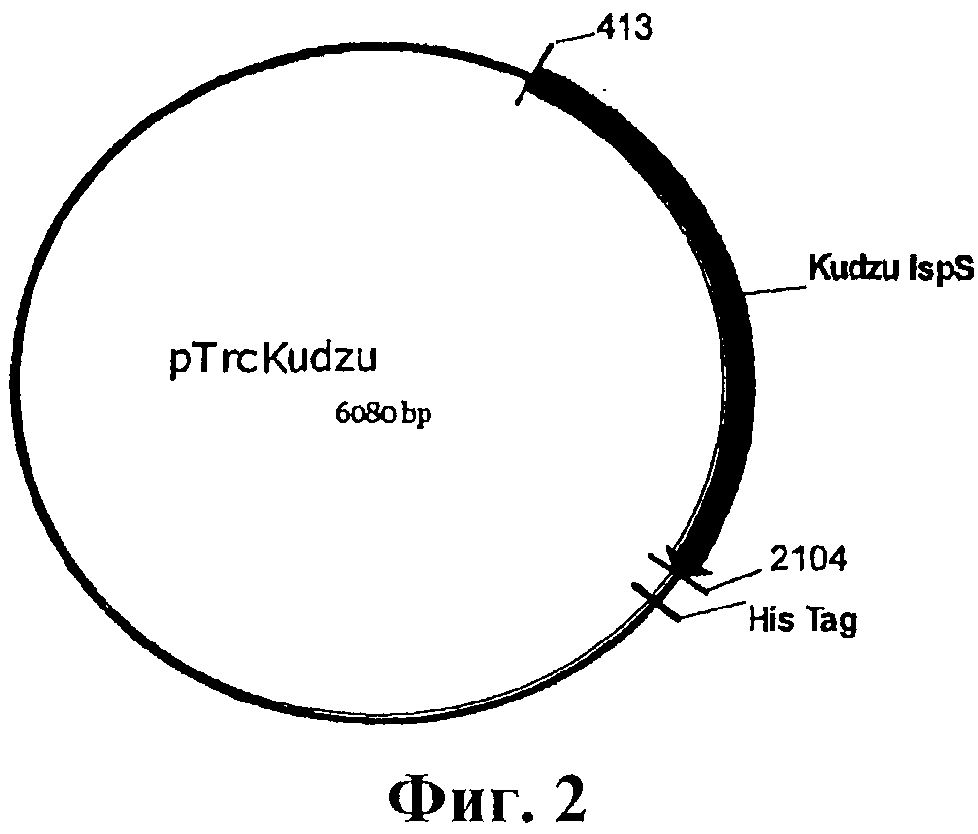
На фигуре 2 приведена карта pTrcKudzu.
На фигуре 3А-3С приведена нуклеотидная последовательность pTrcKudzu (SEQ ID NO:2). RBS подчеркнут, старт-кодон изопренсинтазы кудзу выделен жирными заглавными буквами и стоп-кодон - жирными заглавными буквами курсивом. Остовом вектора является pTrcHis2B.
На фигуре 4 приведена карта pETNHisKudzu.
На фигуре 5А-5С приведена нуклеотидная последовательность pETNHisKudzu (SEQ ID NO:5).
На фигуре 6 приведена карта pCL-lac-Kudzu.
На фигуре 7А-7С приведена нуклеотидная последовательность pCL-lac-Kudzu (SEQ ID NO:7).
На фигуре 8А приведен график, показывающий продукцию изопрена клетками E.coli BL21 без использования вектора.
На фигуре 8В приведен график, показывающий продукцию изопрена клетками E.coli BL21 с использованием pCL-lac-Kudzu.
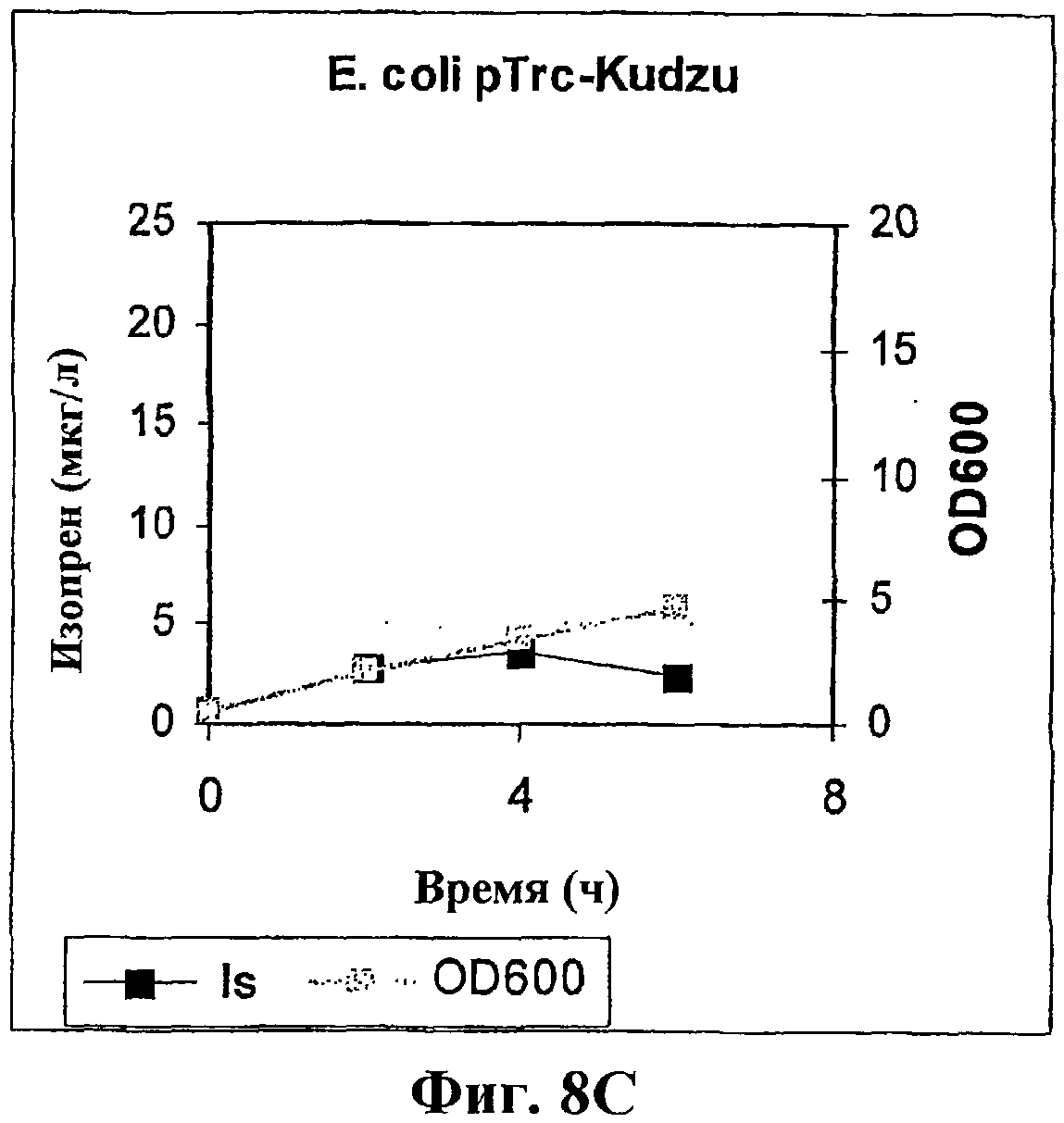
На фигуре 8С приведен график, показывающий продукцию изопрена клетками E.coli BL21 с использованием pTrcKudzu.
На фигуре 8D приведен график, показывающий продукцию изопрена клетками E.coli BL21 с использованием pETNHisKudzu.
На фигуре 9А приведен график, показывающий значение OD во время ферментации E.coli BL21/pTrcKudzu при периодической ферментации объемом 14 л.
На фигуре 9В приведен график, показывающий продукцию изопрена во время ферментации E.coli BL21/pTrcKudzu при периодической ферментации объемом 14 л.
На фигуре 10А приведен график, показывающий продукцию изопрена клетками Panteoa citrea. Контрольные клетки без рекомбинантной изопренсинтазы кудзу. Серые ромбики показывают изопренсинтазу, черные прямоугольники показывают OD600.
На фигуре 10В приведен график, показывающий продукцию изопрена клетками Panteoa citrea, экспрессирующими pCL-lac-Kudzu. Серые ромбики показывают изопренсинтазу, черные прямоугольники показывают OD600.
На фигуре 10С приведен график, показывающий продукцию изопрена клетками Panteoa citrea, экспрессирующими pTrcKudzu. Серые ромбики показывают изопренсинтазу, черные прямоугольники показывают OD600.
На фигуре 11 приведен график, показывающий продукцию изопрена клетками Bacillus subtilis, экспрессирующими рекомбинантную изопренсинтазу. BG3594comK представляет штамм B. subtilis без плазмиды (природная продукция изопрена). CF443-BG3594comK представляет штамм B. subtilis с pBSKudzu (рекомбинантная продукция изопрена). IS на оси y указывает изопрен.
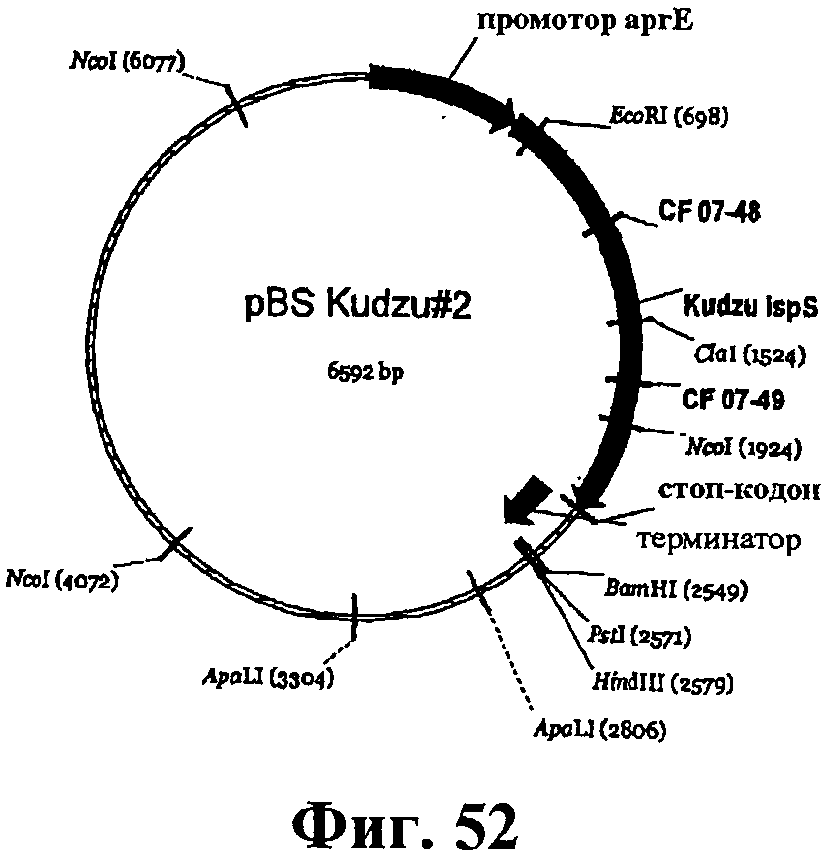
На фигуре 12А-12С приведена нуклеотидная последовательность pBS Kudzu #2 (SEQ ID NO:57).
На фигуре 13 приведена нуклеотидная последовательность кодон-оптимизированного гена изопренсинтазы кудзу для экспрессии в Yarrowia (SEQ ID NO:8).
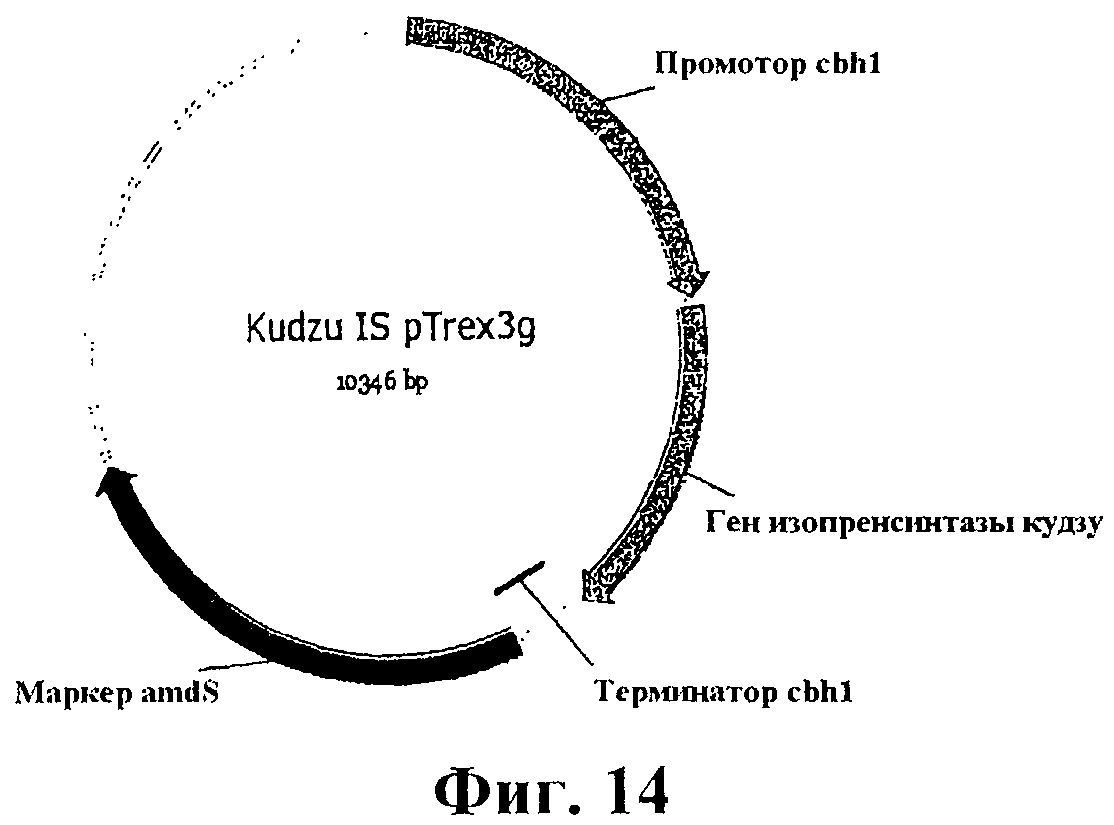
На фигуре 14 приведена карта pTrex3g, содержащая кодон-оптимизированный ген изопренсинтазы кудзу для экспрессии в Yarrowia.
На фигуре 15А-15С приведена нуклеотидная последовательность вектора pSPZ1 (MAP29Spb) (SEQ ID NO:11).
На фигуре 16 приведена нуклеотидная последовательность синтетического кодон-оптимизированного гена изопренсинтазы кудзу для экспрессии в Yarrowia (SEQ ID NO:12).
На фигуре 17 приведена нуклеотидная последовательность синтетического слитого гена изопренсинтазы тополя (Populus alba×Populus tremula) (SEQ ID NO:13). Старт-кодон ATG выделен жирным шрифтом и стоп-кодон подчеркнут.
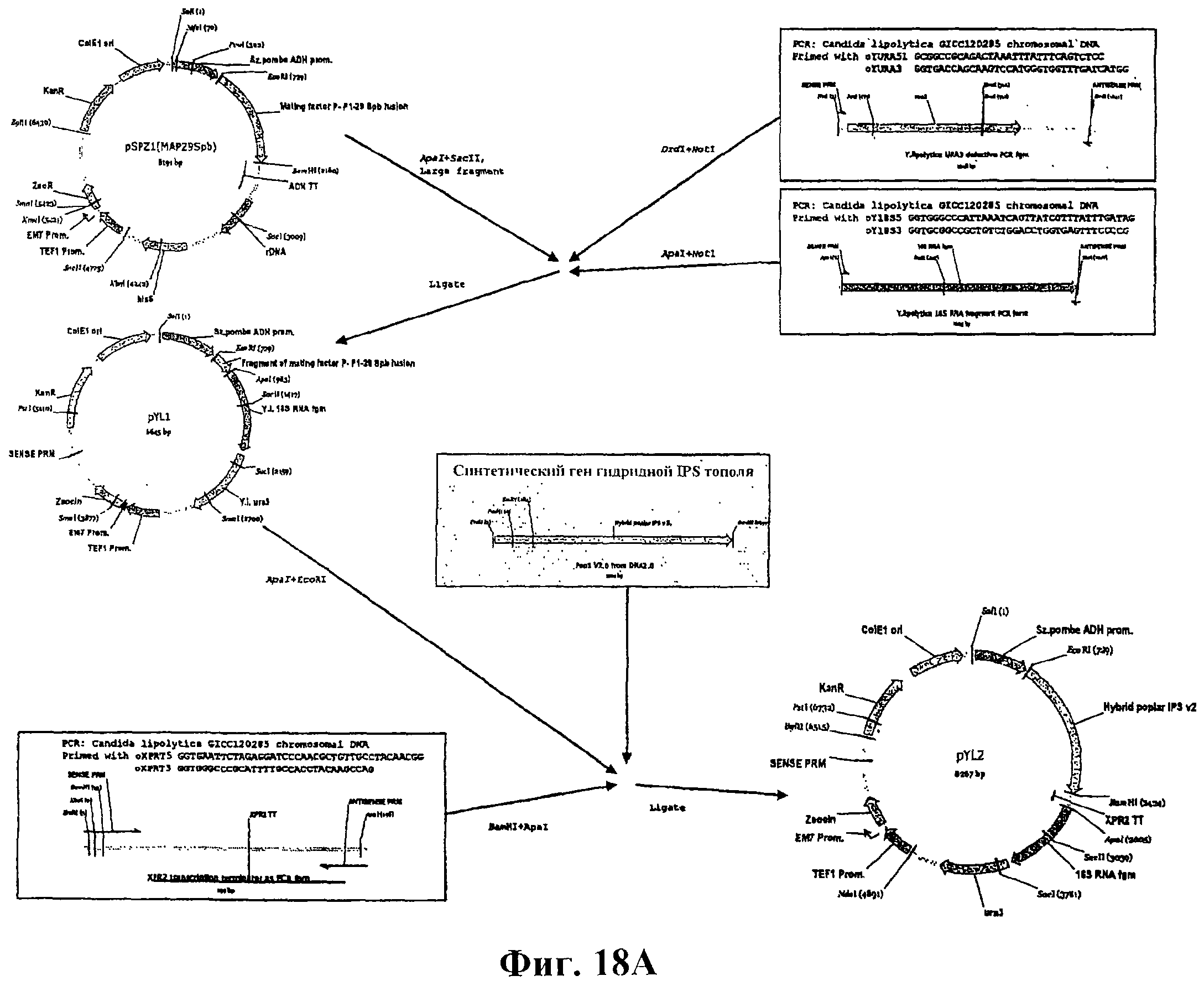
На фигуре 18А приведена схема конструирования векторов pYLA1, pYL1 и pYL2.
На фигуре 18В приведена схема конструирования вектора pYLA (POP1).
На фигуре 18С приведена схема конструирования вектора pYLA (KZ1).
На фигуре 18D приведена схема конструирования вектора pYLI (KZ1).
На фигуре 18Е приведена схема конструирования вектора pYLI (МАР29).
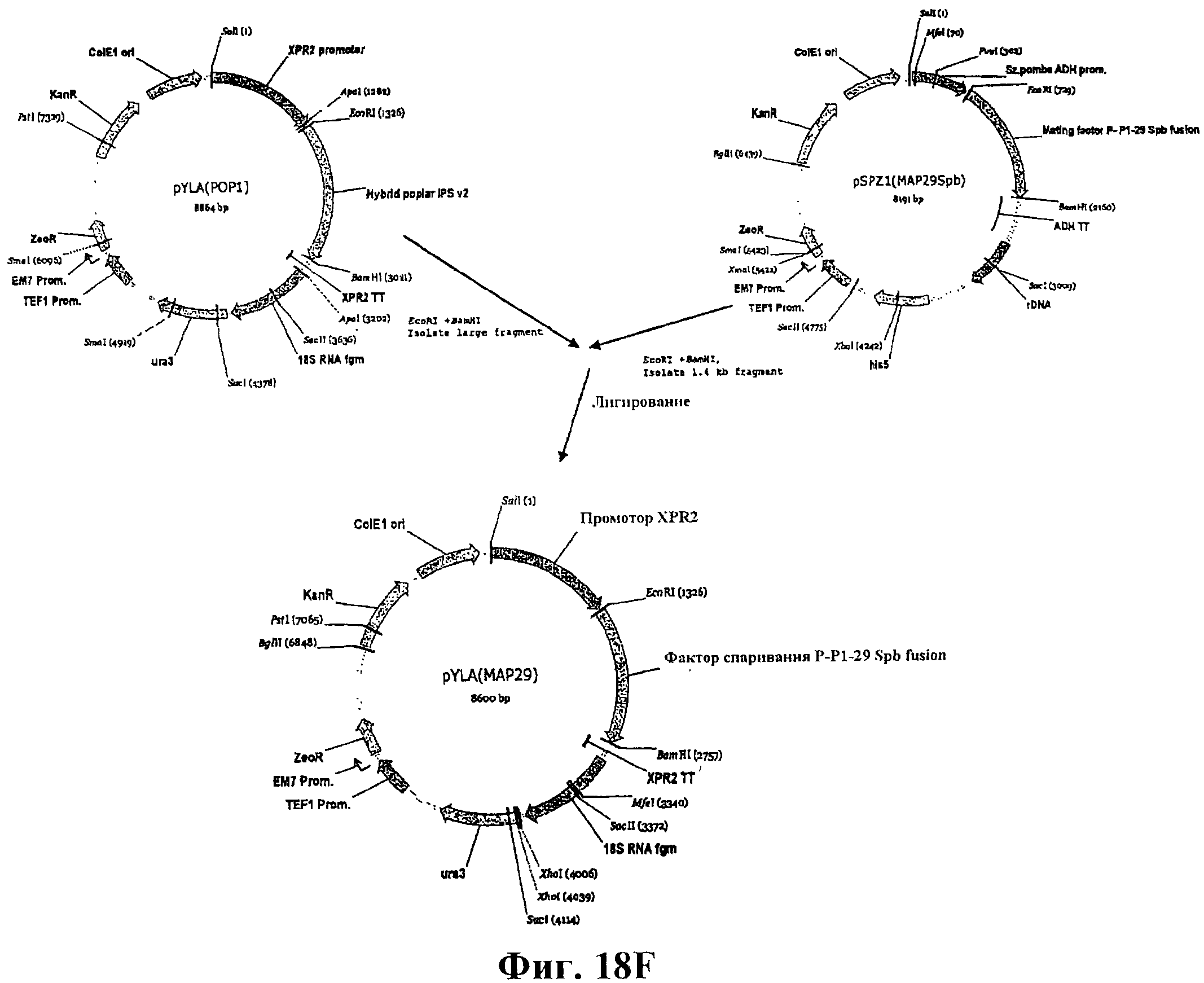
На фигуре 18F приведена схема конструирования вектора pYLA (МАР29).
На фигуре 19А показаны метаболические пути MVA и DXP для изопрена (на основе данных F.Bouvier et al., Progress in Lipid Res., 44:357-429, 2005). Следующее описание включает альтернативные названия каждого полипептида на путях и ссылки на источник, в котором раскрывается метод определения активности указанного полипептида (каждый из данных источников в полном объеме включен для сведения, в частности, в отношении методов анализа активности полипептидов на путях MVA и DXP). Путь с участием мевалоната: ААСТ; ацетил-СоА-ацетилтрансфераза, MvaE, EC 2.3.1.9. Метод: J. Bacteriol., 184:2116-2122, 2002; HMGS; гидроксиметилглутарил-СоА-синтаза, MvaS, EC 2.3.3.10. Метод: J. Bacteriol., 184:4065-4070, 2002; HMGR; 3-гидрокси-3-метилглутарил-СоА-редуктаза, MvaE, EC 1.1.1.34. Метод: J. Bacteriol., 184:2116-2122, 2002; MVK; мевалонаткиназа, ERG12, EC 2.7.1.36. Метод: Curr. Genet., 19:9-14, 1991; PMK, фосфомевалонаткиназа, ERG8, EC 2.7.4.2. Метод: Mol. Cell Biol., 11:620-631, 1991; DPMDC; дифосфомевалонатдекарбоксилаза, MVD1, EC 4.1.1.33. Метод: Biochemistry, 33:13355-13362, 1994; IDI; изопентенилдифосфат-дельта-изомераза, IDI1, EC 5.3.3.2. Метод: J. Biol. Chem., 264:19169-19175, 1989. Путь DXP: DXS; 1-дезоксиксилулоза-5-фосфатсинтаза, dxc, EC 2.2.1.7. Метод: PNAS, 94:12857-62, 1997; DXR; 1-дезокси-D-ксилулоза-5-фосфатредуктоизомераза, dxr, EC 2.2.1.7. Метод: Eur. J. Biochem., 269:4446-4457, 2002; MCT; 4-дифосфоцитидил-2С-метил-D-эритролсинтаза, IspD, EC 2.7.7.60. Метод: PNAS, 97:6451-6456, 2000; CMK; 4-дифосфоцитидил-2С-метил-D-эритролкиназа, IspE, EC 2.7.1.148. Метод: PNAS, 97:1062-1067, 2000; MCS; 2C-метил-D-эритритол-2,4-циклодифосфатсинтаза, IspF, EC 4.6.1.12. Метод: PNAS, 96:11758-11763, 1999; HDS; 1-гидрокси-2-метил-2-(Е)-бутенил-4-дифосфатсинтаза, IspG, EC 1.17.4.3. Метод: J. Org. Chem., 70:9168-9174, 2005; HDR; 1-гидрокси-2-метил-2-(Е)-бутенил-4-дифосфатредуктаза, IspH, EC 1.17.1.2. Метод: JACS, 126:12847-12855, 2004.
На фигуре 19В показаны классические и модифицированные пути MVA. 1, ацетил-СоА-ацетилтрансфераза (ААСТ); 2, HMG-СоА-синтаза (HMGS); 3, HMG-CoA-редуктаза (HMGR); 4, мевалонаткиназа (MVK); 5, фосфомевалонаткиназа (PMK); 6, дифосфомевалонатдекарбоксилаза (MVD или DPMDC); 7, изопентенилдифосфатизомераза (IDI); 8, фосфомевалонатдекарбоксилаза (PMDC); 9, изопентенилфосфаткиназа (IPK). Классический путь MVA протекает от реакции 1 до реакции 7 через реакции 5 и 6, в то время как модифицированный путь MVA протекает через реакции 8 и 9. Р и РР в структурных формулах представляют соответственно фосфат и пирофосфат. Данная фигура взята из Koga and Morii, Microbiology and Mol. Biology Reviews, 71:97-120, 2007, источник в полном объеме включен в настоящий документ для сведения, в частности, в отношении нуклеиновых кислот и полипептидов с модифицированного пути MVA. Модифицированный путь MVA имеется, например, в некоторых архебактериях, таких как Methanosarcina mazei.
На фигуре 20 приведен график, показывающий результаты анализа ГХ-МС продукции изопрена рекомбинантными штаммами Y. lipolytica (слева) и при участии гена изопренсинтазы кудзу (справа). Стрелки указывают время элюирования аутентичного стандарта изопрена.
На фигуре 21 приведена карта pTrcKudzu yIDI DXS Kan.
На фигуре 22А-22D приведена нуклеотидная последовательность pTrcKudzu yIDI DXS Kan (SEQ ID NO:20).
На фигуре 23А приведен график, показывающий продукцию изопрена из глюкозы клетками штамма BL21/pTrcKudzukan. Время 0 представляет время индукции IPTG (400 мкмоль). Ось Х представляет время после индукции; ось Y представляет OD600, и ось Y2 представляет общую продуктивность изопрена (мкг/л пространства над жидкостью или удельную продуктивность (мкг/л пространства над жидкостью/OD). Ромбики показывают OD600, кружки показывают общую продуктивность изопрена (мкг/л) и прямоугольники показывают удельную продуктивность изопрена (мкг/л/OD).
На фигуре 23В приведен график, показывающий продукцию изопрена из глюкозы клетками штамма BL21/pTrcKudzu yIDI kan. Время 0 представляет время индукции IPTG (400 мкмоль). Ось Х представляет время после индукции; ось Y представляет OD600, и ось Y2 представляет общую продуктивность изопрена (мкг/л пространства над жидкостью или удельную продуктивность (мкг/л пространства над жидкостью/OD). Ромбики показывают OD600, кружки показывают общую продуктивность изопрена (мкг/л) и прямоугольники показывают удельную продуктивность изопрена (мкг/л/OD).
На фигуре 23С приведен график, показывающий продукцию изопрена из глюкозы клетками штамма BL21/pTrcKudzu DXS kan. Время 0 представляет время индукции IPTG (400 мкмоль). Ось Х представляет время после индукции; ось Y представляет OD600, и ось Y2 представляет общую продуктивность изопрена (мкг/л пространства над жидкостью или удельную продуктивность (мкг/л пространства над жидкостью/OD). Ромбики показывают OD600, кружки показывают общую продуктивность изопрена (мкг/л) и прямоугольники показывают удельную продуктивность изопрена (мкг/л/OD).
На фигуре 23D приведен график, показывающий продукцию изопрена из глюкозы клетками штамма BL21/pTrcKudzu yIDI DXS kan. Время 0 представляет время индукции IPTG (400 мкмоль). Ось Х представляет время после индукции; ось Y представляет OD600, и ось Y2 представляет общую продуктивность изопрена (мкг/л пространства над жидкостью или удельную продуктивность (мкг/л пространства над жидкостью/OD). Ромбики показывают OD600, кружки показывают общую продуктивность изопрена (мкг/л) и прямоугольники показывают удельную продуктивность изопрена (мкг/л/OD).
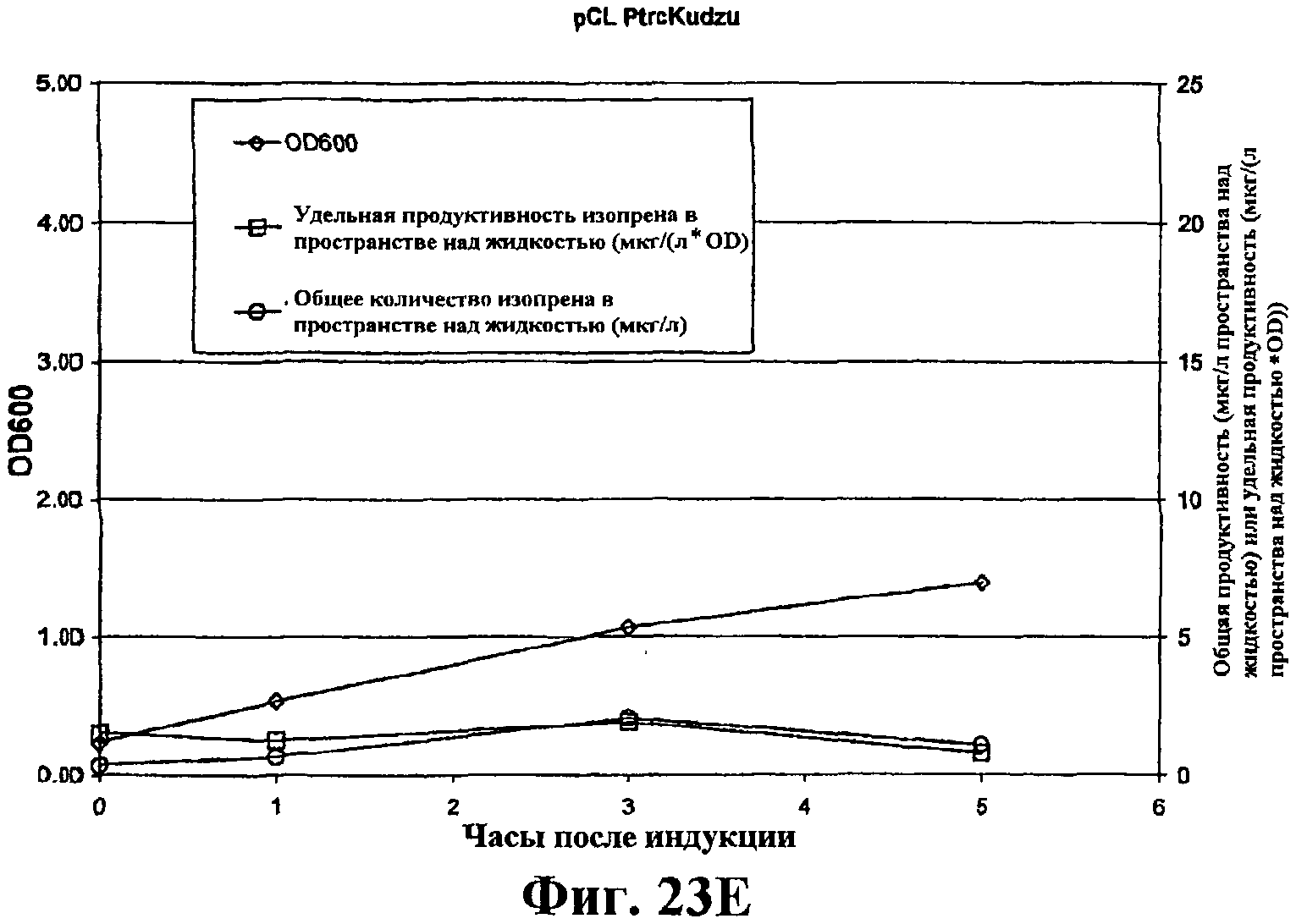
На фигуре 23Е приведен график, показывающий продукцию изопрена из глюкозы клетками штамма BL21/pCL PtrcKudzu. Время 0 представляет время индукции IPTG (400 мкмоль). Ось Х представляет время после индукции; ось Y представляет OD600, и ось Y2 представляет общую продуктивность изопрена (мкг/л пространства над жидкостью или удельную продуктивность (мкг/л пространства над жидкостью/OD). Ромбики показывают OD600, кружки показывают общую продуктивность изопрена (мкг/л) и прямоугольники показывают удельную продуктивность изопрена (мкг/л/OD).
На фигуре 23F приведен график, показывающий продукцию изопрена из глюкозы клетками штамма BL21/pCL PtrcKudzu yIDI. Время 0 представляет время индукции IPTG (400 мкмоль). Ось Х представляет время после индукции; ось Y представляет OD600, и ось Y2 представляет общую продуктивность изопрена (мкг/л пространства над жидкостью или удельную продуктивность (мкг/л пространства над жидкостью/OD). Ромбики показывают OD600, кружки показывают общую продуктивность изопрена (мкг/л) и прямоугольники показывают удельную продуктивность изопрена (мкг/л/OD).
На фигуре 23G приведен график, показывающий продукцию изопрена из глюкозы клетками штамма BL21/pCL PtrcKudzu DXS. Время 0 представляет время индукции IPTG (400 мкмоль). Ось Х представляет время после индукции; ось Y представляет OD600, и ось Y2 представляет общую продуктивность изопрена (мкг/л пространства над жидкостью или удельную продуктивность (мкг/л пространства над жидкостью/OD). Ромбики показывают OD600, кружки показывают общую продуктивность изопрена (мкг/л) и прямоугольники показывают удельную продуктивность изопрена (мкг/л/OD).
На фигуре 23H приведен график, показывающий продукцию изопрена из глюкозы клетками штамма BL21/pTrcKudzuIDIDXSkan. Стрелка указывает время индукции IPTG (400 мкмоль). Ось Х представляет время после индукции; ось Y представляет OD600, и ось Y2 представляет общую продуктивность изопрена (мкг/л пространства над жидкостью или удельную продуктивность (мкг/л пространства над жидкостью/OD). Черные ромбики показывают OD600, черные треугольники показывают продуктивность изопрена (мкг/л) и белые прямоугольники показывают удельную продуктивность изопрена (мкг/л/OD).
На фигуре 24 приведена карта pTrcKKDyIkIS kan.
На фигуре 25A-25D приведена нуклеотидная последовательность pTrcKKDyIkIS kan (SEQ ID NO:33).
На фигуре 26 приведена карта pCL Ptrcверхний путь.
На фигуре 27A-27D приведена нуклеотидная последовательность pCL Ptrcверхний путь (SEQ ID NO:46).
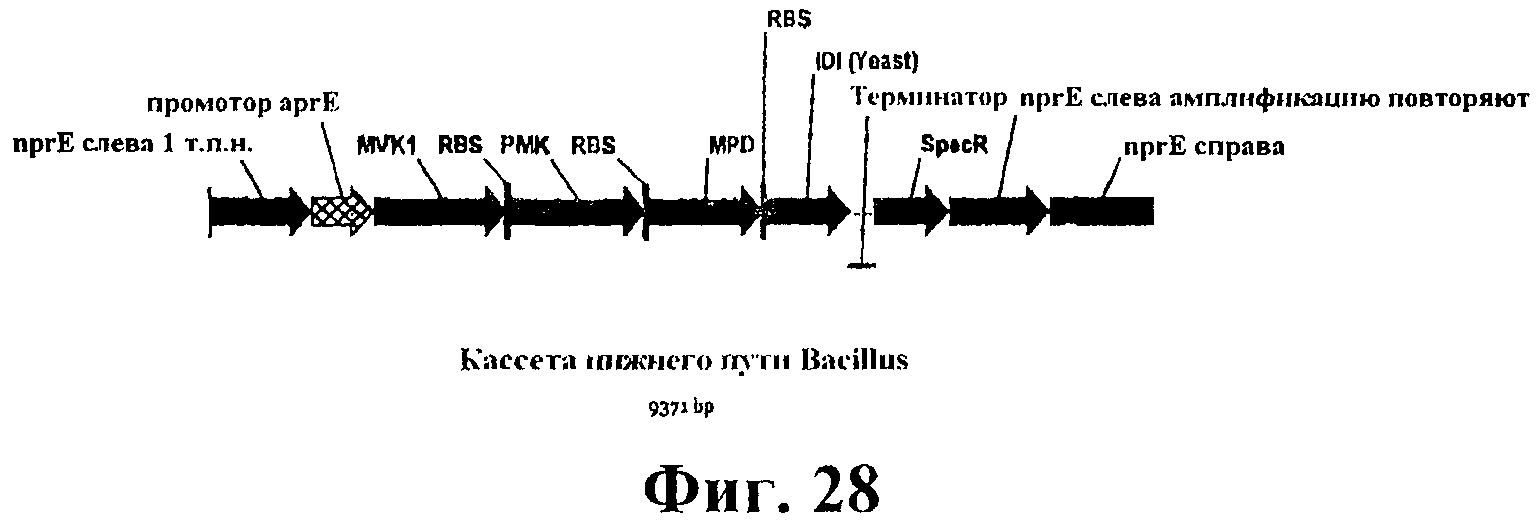
На фигуре 28 приведена карта кассеты, содержащей нижний путь MVA и дрожжевую idi для интеграции в хромосому B. subtilis в локусе nprE. nprE слева/справа указывает 1 т.п.н. каждой последовательности от локуса nprE для интеграции. Промотор aprE (промотор щелочной серинпротеазы) указывает промотор (-35, -10, +1 сайт старта транскрипции, RBS) гена aprE. MVK1 означает ген дрожжевой мевалонаткиназы. RBS-PMK означает ген дрожжевой фосфомевалонаткиназы с RBS Bacillus слева от сайта старта. RBS-MPD означает ген дрожжевой дифосфомевалонатдекарбоксилазы с RBS Bacillus слева от сайта старта. RBS-IDI означает ген дрожжевой idi с RBS Bacillus слева от сайта старта. Терминатор означает терминатор транскрипции щелочной серинпротеазы из B. amyliquefaciens. SpecR обозначает маркер резистентности к спектиномицину. «nprE повтор слева для амплификации» обозначает прямой повтор области слева, используемый для амплификации.
На фигуре 29A-29D приведена нуклеотидная последовательность кассеты, содержащей нижний путь MVA и дрожжевую idi, для интеграции в хромосому B. subtilis в локусе nprE (SEQ ID NO:47).
На фигуре 30 приведена карта p9796-poplar.
На фигуре 31A-31B приведена нуклеотидная последовательность p9796-poplar (SEQ ID NO:48).
На фигуре 32 приведена карта pTrcPoplar.
На фигуре 33A-33C приведена нуклеотидная последовательность pTrcPoplar (SEQ ID NO:49).
На фигуре 34 приведена карта pTrcKudzu yIDI Kan.
На фигуре 35A-35C приведена нуклеотидная последовательность pTrcKudzu yIDI Kan (SEQ ID NO:50).
На фигуре 36 приведена карта pTrcKudzuDXS Kan.
На фигуре 37A-37C приведена нуклеотидная последовательность pTrcKudzuDXS Kan (SEQ ID NO:51).
На фигуре 38 приведена карта pCL PtrcKudzu.
На фигуре 39A-39C приведена нуклеотидная последовательность pCL PtrcKudzu (SEQ ID NO:52).
На фигуре 40 приведена карта pCL PtrcKudzu A3.
На фигуре 41A-41C приведена нуклеотидная последовательность pCL PtrcKudzu A3 (SEQ ID NO:53).
На фигуре 42 приведена карта pCL PtrcKudzu yIDI.
На фигуре 43A-43C приведена нуклеотидная последовательность pCL PtrcKudzu yIDI (SEQ ID NO:54).
На фигуре 44 приведена карта pCL PtrcKudzu DXS.
На фигуре 45A-45D приведена нуклеотидная последовательность pCL PtrcKudzu DXS (SEQ ID NO:55).
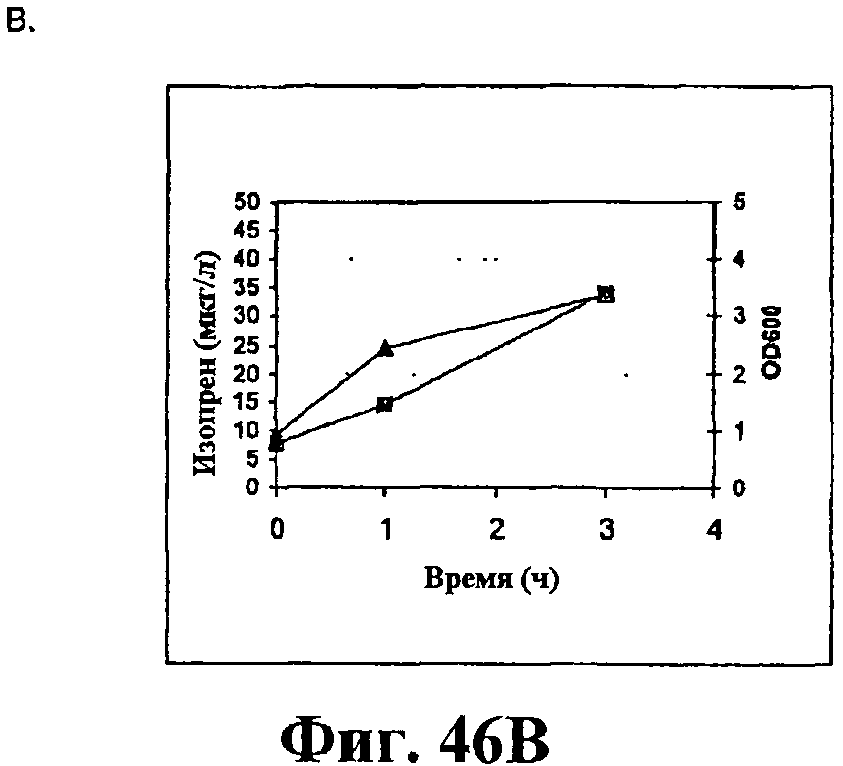
На фигуре 46 приведен график, показывающий продукцию изопрена из сырьевой биомассы. На панели А показана продукция изопрена из кукурузной соломы, на панели В показана продукция изопрена из жмыха, на панели С показана продукция изопрена из мягкой древесной пульпы, на панели D показана продукция изопрена из глюкозы, на панели E показана продукция изопрена клетками без внесения дополнительного сырья. Серые прямоугольники показывают значения OD600 культур в указанные интервалы времени после инокуляции и черные треугольники показывают продукцию изопрена в указанные интервалы времени после инокуляции.
На фигуре 47A приведен график, показывающий продукцию изопрена клетками штамма BL21 (λDE3) pTrcKudzu yIDI DXS (kan) в культуре без внесения глюкозы. Прямоугольники показывают значения OD600 и треугольники показывают продуцированный изопрен (мкг/мл).
На фигуре 47В приведен график, показывающий продукцию изопрена из сырья 1% глюкозы инвертированного сахара клетками штамма BL21 (λDE3) pTrcKudzu yIDI DXS (kan). Прямоугольники показывают значения OD600 и треугольники показывают продуцированный изопрен (мкг/мл).
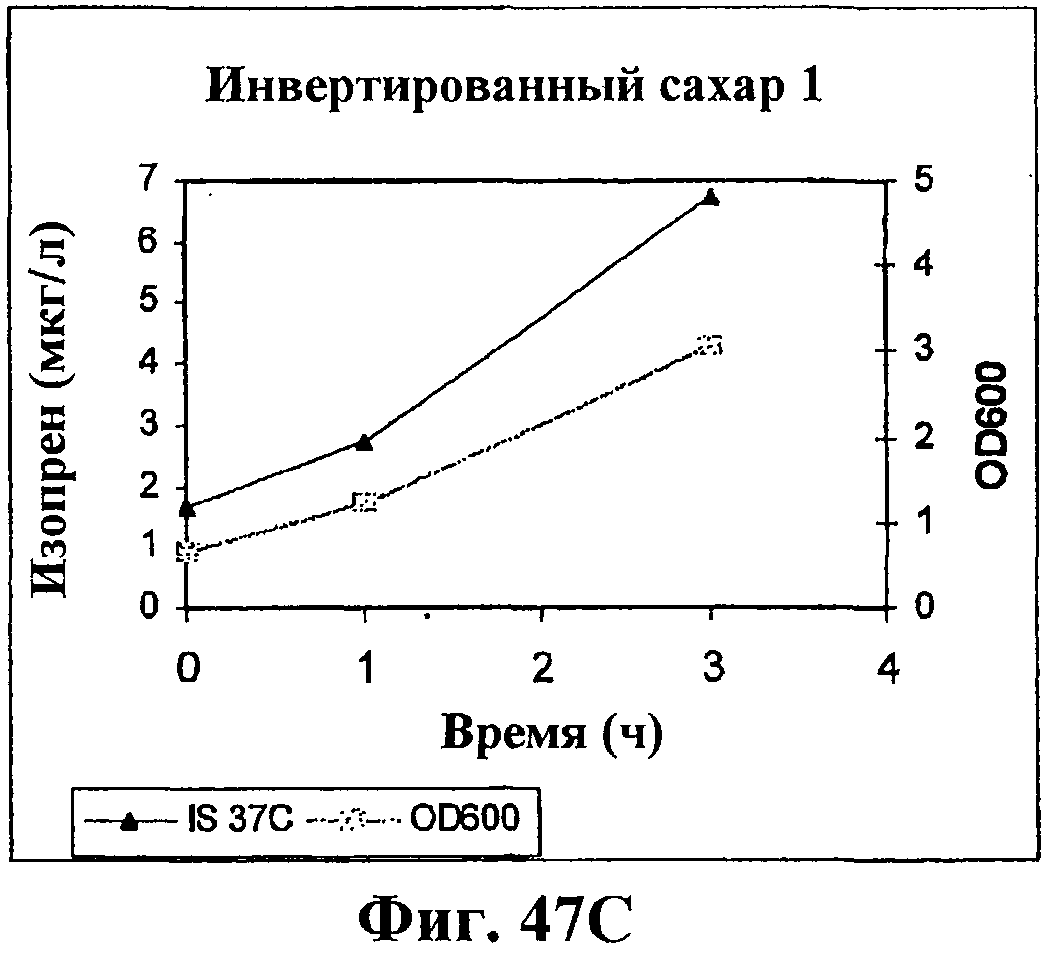
На фигуре 47С приведен график, показывающий продукцию изопрена из сырья 1% инвертированного сахара клетками штамма BL21 (λDE3) pTrcKudzu yIDI DXS (kan). Прямоугольники показывают значения OD600 и треугольники показывают продуцированный изопрен (мкг/мл).
На фигуре 47D приведен график, показывающий продукцию изопрена из сырья 1% обработанной AFEX кукурузной соломы клетками штамма BL21 (λDE3) pTrcKudzu yIDI DXS (kan). Прямоугольники показывают значения OD600 и треугольники показывают продуцированный изопрен (мкг/мл).
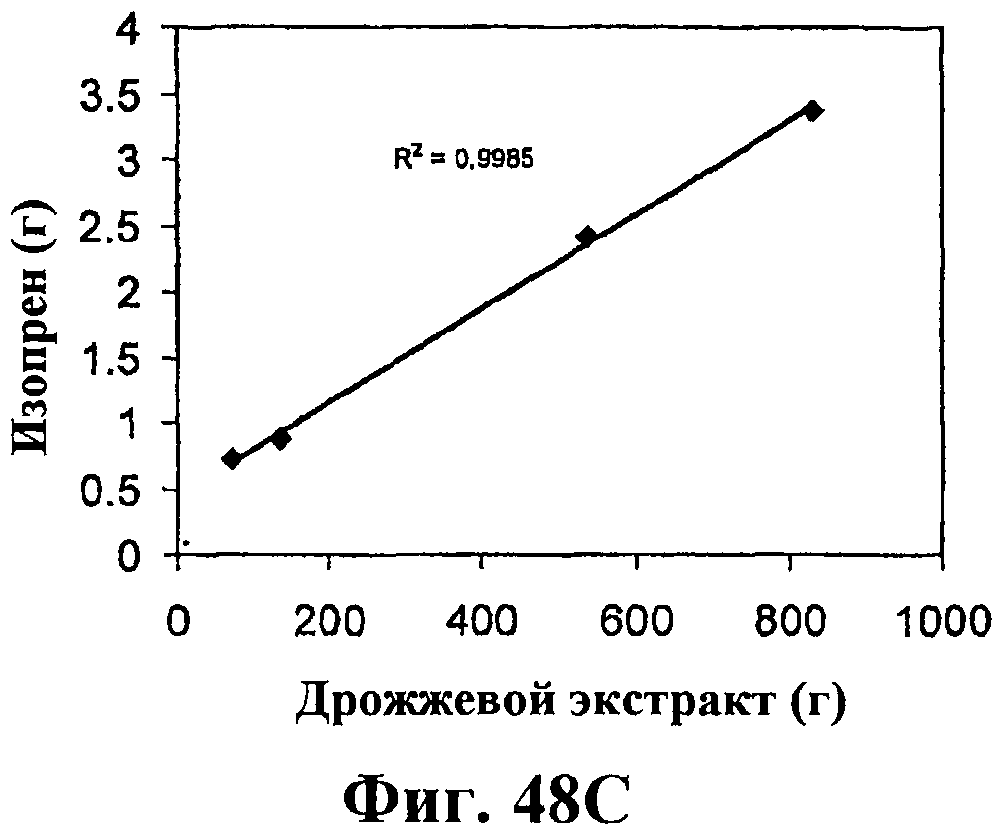
На фигуре 48 приведен график, показывающий влияние дрожжевого экстракта на продукцию изопрена. На панели А показана динамика изменения оптической плотности во времени в ферментере с подачей различных количеств дрожжевого экстракта. На панели В показана динамика изменения титра изопрена во времени в ферментере с подачей различных количеств дрожжевого экстракта. Титр определяется, как количество изопрена, продуцированного на литр ферментационного бульона. На панели С показано влияние дрожжевого экстракта на продукцию изопрена E.coli, культивированных в культуре с подпиткой.
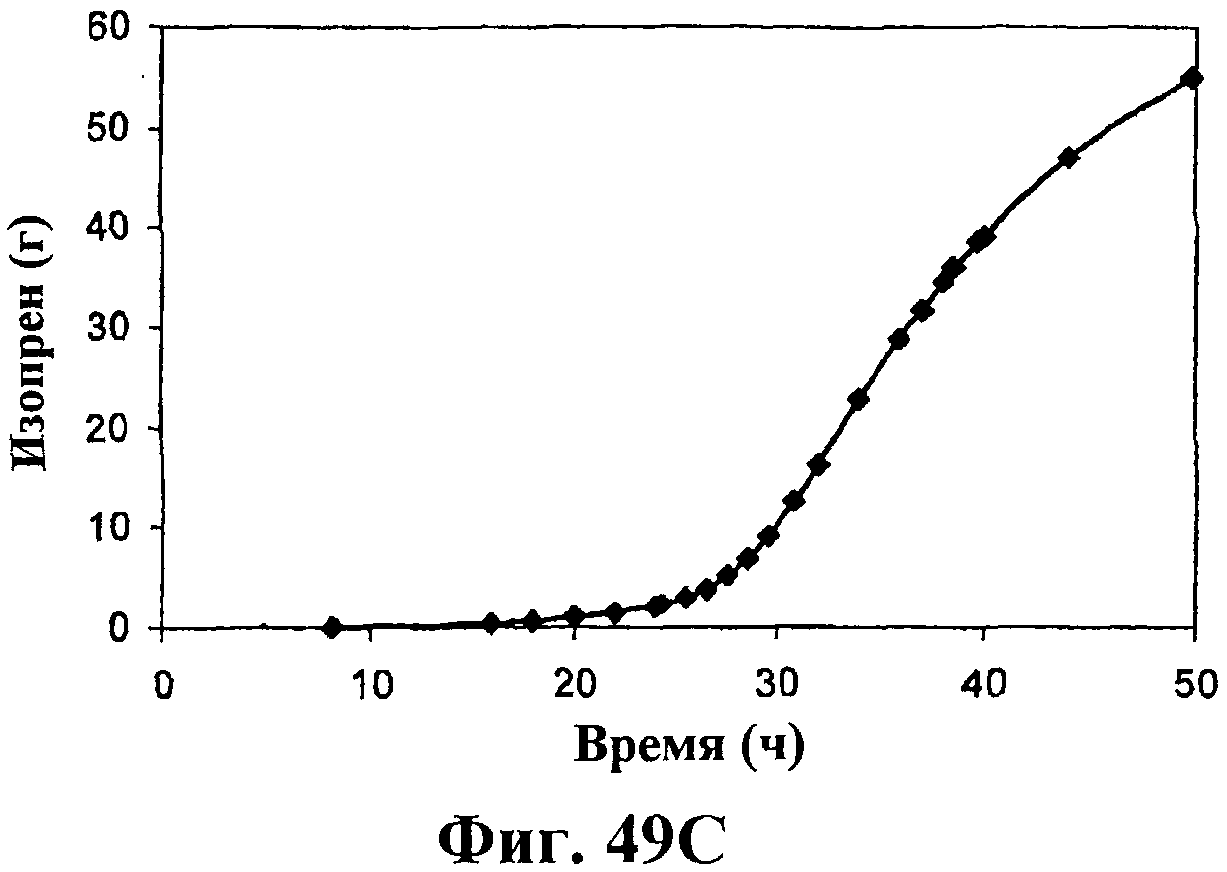
На фигуре 49 приведен график, показывающий продукцию изопрена в биореакторах емкостью 500 л клетками E.coli, содержащими плазмиду pTrcKudzu и yIDI и DXS. На панели А показана динамика изменения оптической плотности во времени в биореакторе емкостью 500 л с подачей глюкозы и дрожжевого экстракта. На панели В показана динамика изменения титра изопрена во времени в биореакторе емкостью 500 л с подачей глюкозы и дрожжевого экстракта. Титр определяется, как количество изопрена, продуцированного на литр ферментационного бульона. На панели С приведен временной график общего количества изопрена, продуцированного в биореакторе емкостью 500 л с подачей глюкозы и дрожжевого экстракта.
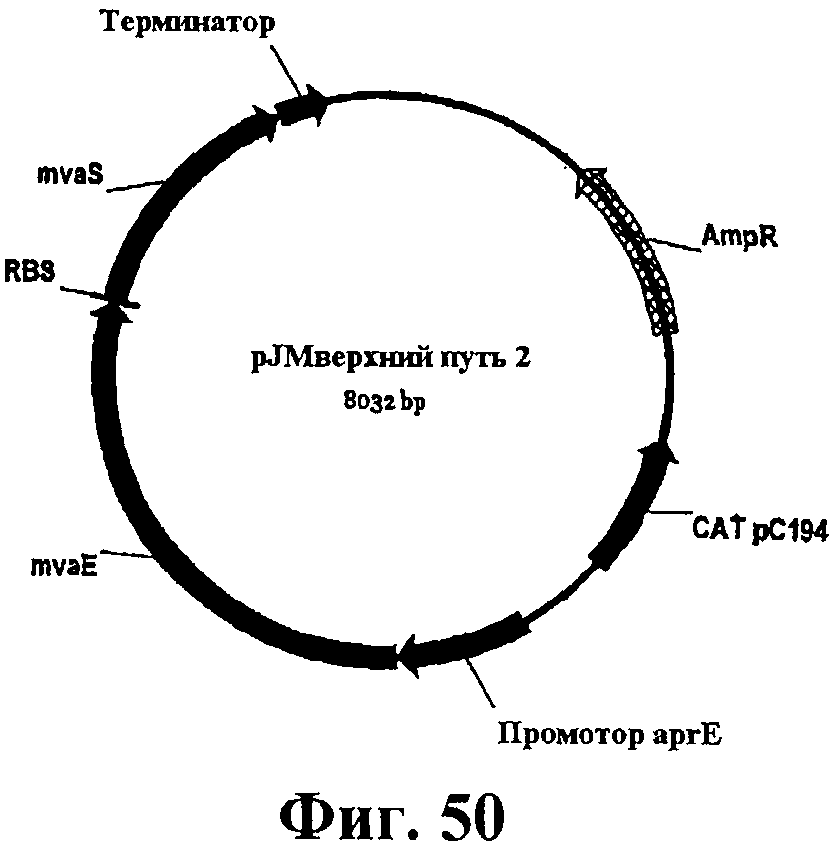
На фигуре 50 приведена карта pJMверхний путь 2.
На фигуре 51A-51C приведена нуклеотидная последовательность pJMверхний путь 2 (SEQ ID NO:56).
На фигуре 52 приведена карта pBS Kudzu#2.
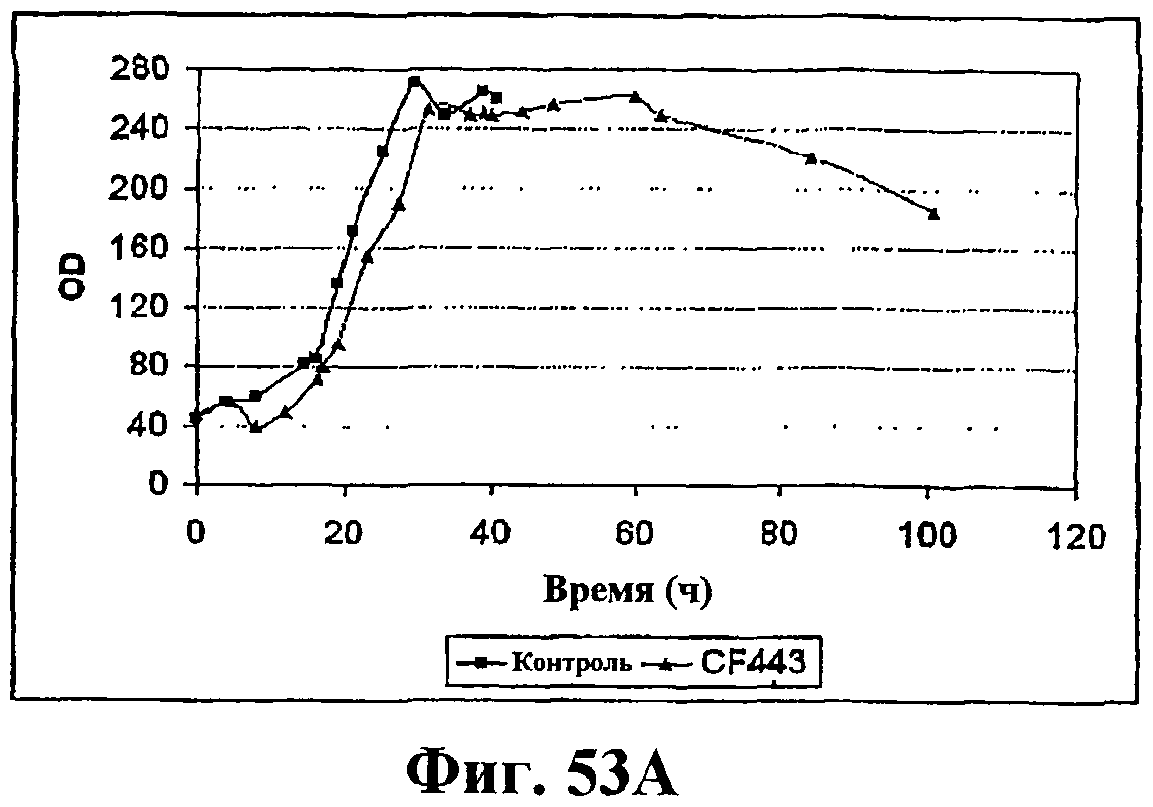
На фигуре 53А приведен график, показывающий рост во время ферментации клеток Bacillus, экспрессирующих рекомбинантную изопренсинтазу кудзу при ферментации объемом 14 л с подпиткой. Черные ромбы показывают контрольный штамм (BG359comK) без рекомбинантной изопренсинтазы (природная продукция изопрена) и серые треугольники показывают клетки Bacillus с pBSKudzu (рекомбинантная продукция изопрена).
На фигуре 53В приведен график продукцию изопрена во время ферментации клеток Bacillus, экспрессирующих рекомбинантную изопренсинтазу кудзу при ферментации объемом 14 л с подпиткой. Черные ромбы показывают контрольный штамм (BG359comK) без рекомбинантной изопренсинтазы (природная продукция изопрена) и серые треугольники показывают клетки Bacillus с pBSKudzu (рекомбинантная продукция изопрена).
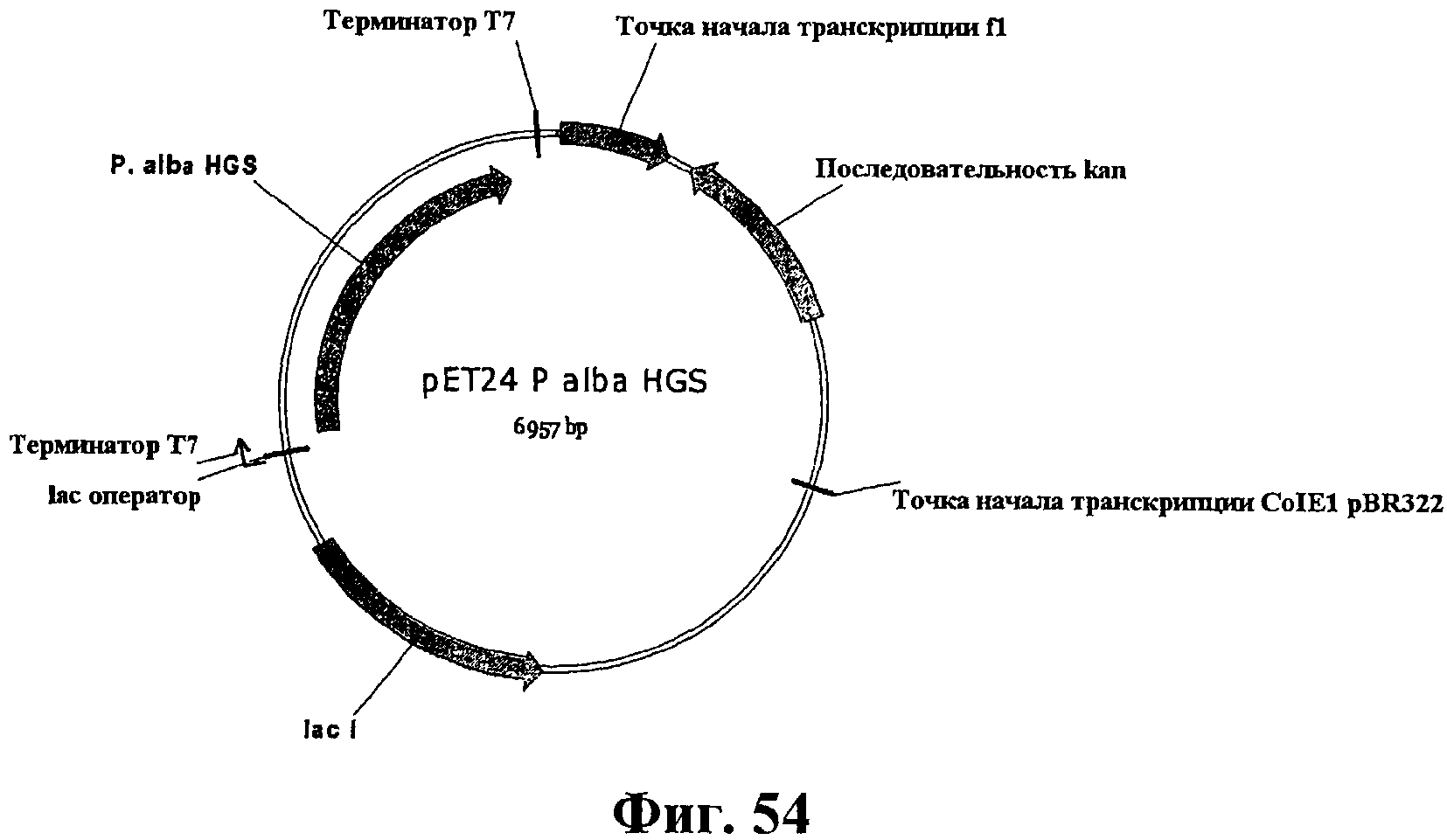
На фигуре 54 приведена карта плазмиды pET24P.alba HGS.
На фигурах 55А и 55В приведена нуклеотидная последовательность плазмиды pET24P.alba HGS (SEQ ID NO:87).
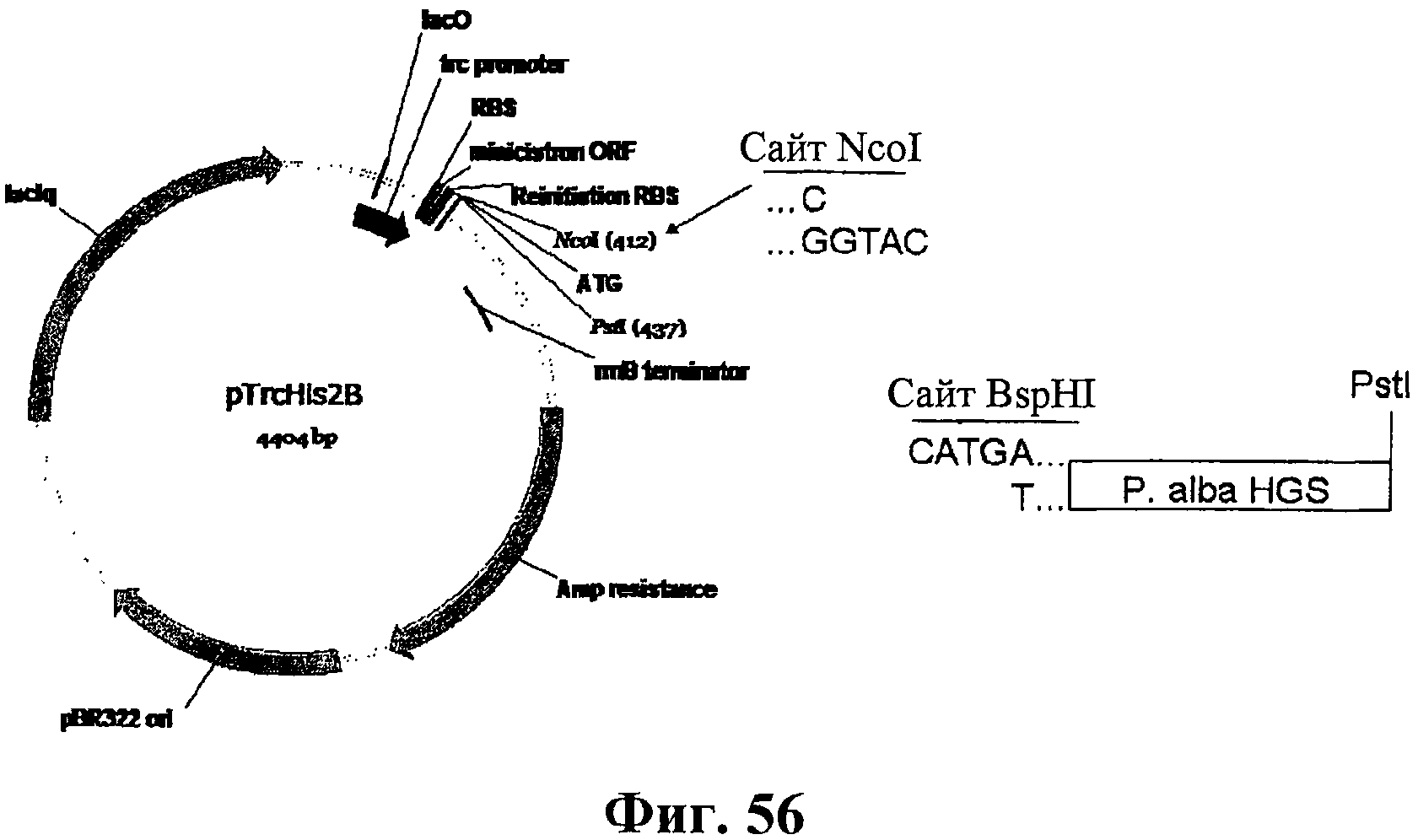
На фигуре 56 приведена схематичная диаграмма, показывающая сайты рестрикции для расщепления эндонуклеазами в целях конструирования плазмиды EWL230 и совместимые липкие концы между сайтами BspHI и NcoI.
На фигуре 57 приведена карта плазмиды EWL230.
На фигурах 58А и 58В приведена нуклеотидная последовательность плазмиды EWL230 (SEQ ID NO:88).
На фигуре 59 приведена схематичная диаграмма, показывающая сайты рестрикции для расщепления эндонуклеазами в целях конструирования плазмиды EWL244 и совместимые липкие концы между сайтами NsiI и PstI.
На фигуре 60 приведена карта плазмиды EWL244.
На фигурах 61А и 61В приведена нуклеотидная последовательность плазмиды EWL244 (SEQ ID NO:89).
На фигуре 62 приведена карта плазмид МСМ484-487.
На фигурах 63А-63С приведена нуклеотидная последовательность плазмиды МСМ484 (SEQ ID NO:90).
На фигурах 64А-64С приведена нуклеотидная последовательность плазмиды МСМ485 (SEQ ID NO:91).
На фигурах 65А-65С приведена нуклеотидная последовательность плазмиды МСМ486 (SEQ ID NO:92).
На фигурах 66А-66С приведена нуклеотидная последовательность плазмиды МСМ487 (SEQ ID NO:93).
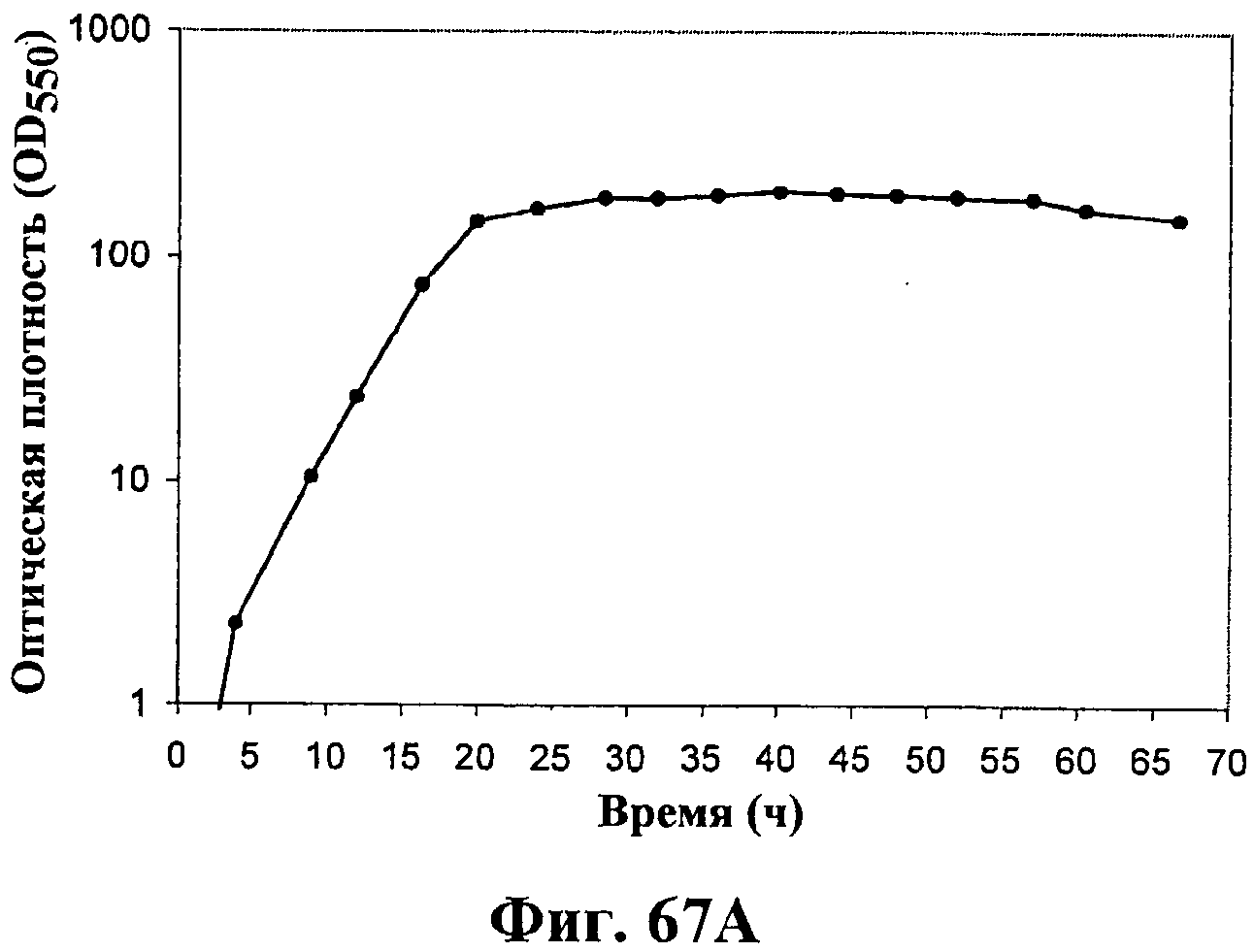
На фигурах 67А-67D приведены графики, показывающие продукцию изопрена клетками штамма E.coli (EWL256), экспрессирующими гены пути MVA и культивированными в культуре с подпиткой в объеме 15 л без подачи дрожжевого экстракта. На фигуре 67А показана динамика изменения оптической плотности во времени в биореакторе емкостью 15 л с подачей глюкозы. На фигуре 67В показана динамика изменения титра изопрена во времени в биореакторе емкостью 15 л с подачей глюкозы. Титр определяется, как количество изопрена, продуцированного на литр ферментационного бульона. На фигуре 67С приведен временной график общего количества изопрена, продуцированного в биореакторе емкостью 15 л, с подачей глюкозы. На фигуре 67D приведена общая скорость преобразования диоксида углерода (TCER) или профиль метаболической активности в биореакторе емкостью 15 л с подачей глюкозы.
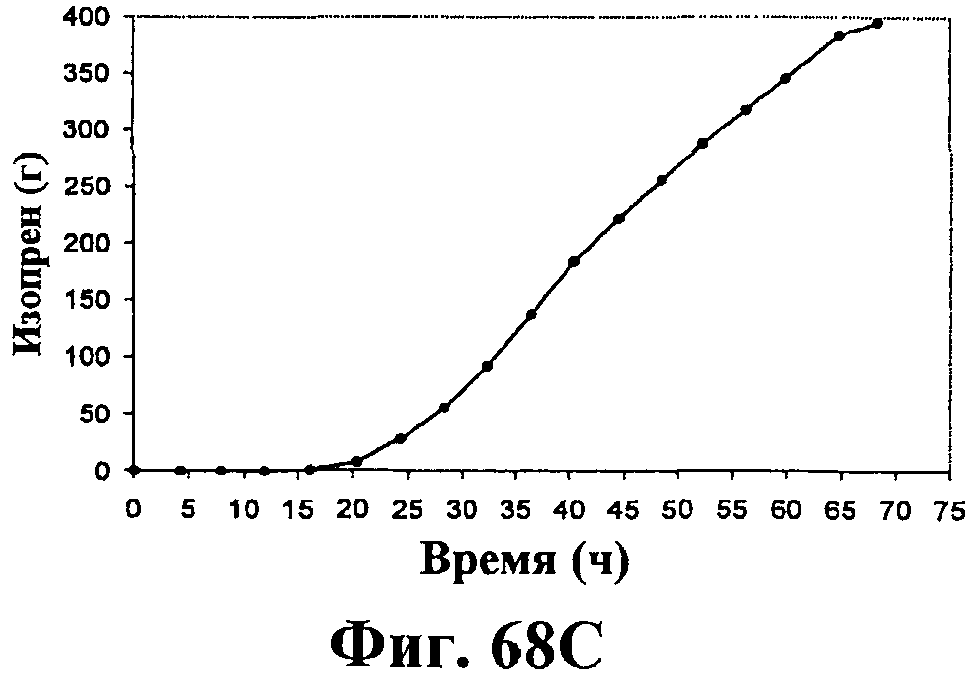
На фигурах 68А-68Е приведены графики, показывающие продукцию изопрена клетками штамма E.coli (EWL256), экспрессирующими гены пути MVA и культивированными в культуре с подпиткой в объеме 15 л с подачей дрожжевого экстракта. На фигуре 68А показана динамика изменения оптической плотности во времени в биореакторе емкостью 15 л с подачей глюкозы. На фигуре 68В показана динамика изменения титра изопрена во времени в биореакторе емкостью 15 л с подачей глюкозы. Титр определяется, как количество изопрена, продуцированного на литр ферментационного бульона. На фигуре 68С приведен временной график общего количества изопрена, продуцированного в биореакторе емкостью 15 л с подачей глюкозы. На фигуре 68D приведена объемная продуктивность в биореакторе емкостью 15 л с подачей глюкозы. Среднее значение 1,1 г/л/ч сохранялось в течение 40 ч (23-63 ч) с подачей дрожжевого экстракта. На фигуре 68Е приведена общая скорость преобразования диоксида углерода (CER) или профиль метаболической активности в биореакторе емкостью 15 л с подачей глюкозы.
На фигурах 69А-69D показана продукция изопрена из различных источников углерода через MVA (путь MVA). На фигуре 69А показан рост штамма EWL256 E.coli, который содержит путь MVA и изопренсинтазу, на глюкозе, гидролизате биомассы, глицерине или ацетате в качестве единственного источника углерода. Различные источники углерода вносили в среду в концентрации 1%. В опыт включали отрицательный контроль без внесения источника углерода. Рост оценивали по оптической плотности при длине волны 600 нМ. На фигуре 69В показана удельная продуктивность изопрена для клеток EWL256 E.coli, содержащих путь MVA и изопренсинтазу, при культивировании на глюкозе, гидролизате биомассы, глицерине или ацетате в качестве единственного источника углерода. Различные источники углерода вносили в среду в концентрации 1%. В опыт включали отрицательный контроль без внесения источника углерода. Пробы отбирали через 190 мин, 255 мин и 317 мин после инокуляции и продуцированный бактериями изопрен определяли с использованием ГХ-МС. На фигуре 69С показан рост клеток штамма EWL256 E.coli на глюкозе или ксилозе в качестве единственного источника углерода. Различные источники углерода вносили в среду в концентрации 1%. В опыт включали отрицательный контроль без внесения источника углерода. Рост оценивали по оптической плотности при длине волны 600 нМ. На фигуре 69D показана удельная продуктивность изопрена для клеток EWL256 E.coli при культивировании на глюкозе или ксилозе в качестве единственного источника углерода. Различные источники углерода вносили в среду в концентрации 1%. В опыт включали отрицательный контроль без внесения источника углерода. Пробы отбирали через 260 мин, 322 мин и 383 мин после инокуляции и продуцированный бактериями изопрен определяли с использованием ГХ-МС.
На фигурах 70А и 70В показана продукция изопрена клетками штаммов E.coli соответственно из глюкозы и жирных кислот. На фигуре 70А показано, что отбирали 11 колоний, полученных в результате трансформации WW4 плазмидой pMCM118, плазмидой, несущей нижний путь мевалоновой кислоты, для подтверждения присутствия нижнего пути. Клетки из колоний культивировали в среде ТМ3, содержащей 0,1% дрожжевого экстракта и 2% глюкозы. Аликвотные порции индуцированной культуры анализировали на продукцию изопрена через 4 ч после индукции. Все колонии демонстрировали синтез изопрена. Индуктор IPTG оказывал сильное ингибирующее действие на рост, поскольку, как оказалось, клеточная плотность снижалась в 3-4,6 раза по мере увеличения концентрации индуктора 50-900 мкМ (не приведены). На графике показано, что более сильная индукция приводила к более высокому специфическому титру изопрена. На фигуре 70В показано, что культуру получали из отмытой ночной культуры в разведении 1:10. Культуру культивировали в течение нескольких часов и индуцировали IPTG в концентрации 50 мкМ. Левый столбик показывает результаты определения изопрена через 4 ч после индукции с последующим анализом накопления изопрена в течение 1 ч. Средний столбик показывает нормализованное значение на 1 ч для той же культуры с тем же периодом индукции, но при проведении анализа на 12 ч накопления изопрена. Правый столбик показывает значение анализа накопление изопрена на 1 ч культуры, которую индуцировали в течение 13 ч.
На фигуре 71 приведена карта шаттл-вектора pUWL201PW E.coli-Streptomyces (6400 п.н.), использованного для клонирования изопренсинтазы из кудзу. Tsr, ген резистентности к тиострептону. Фигура взята у Doumith et al., Mol. Gen Genet., 264:477-485, 2000.
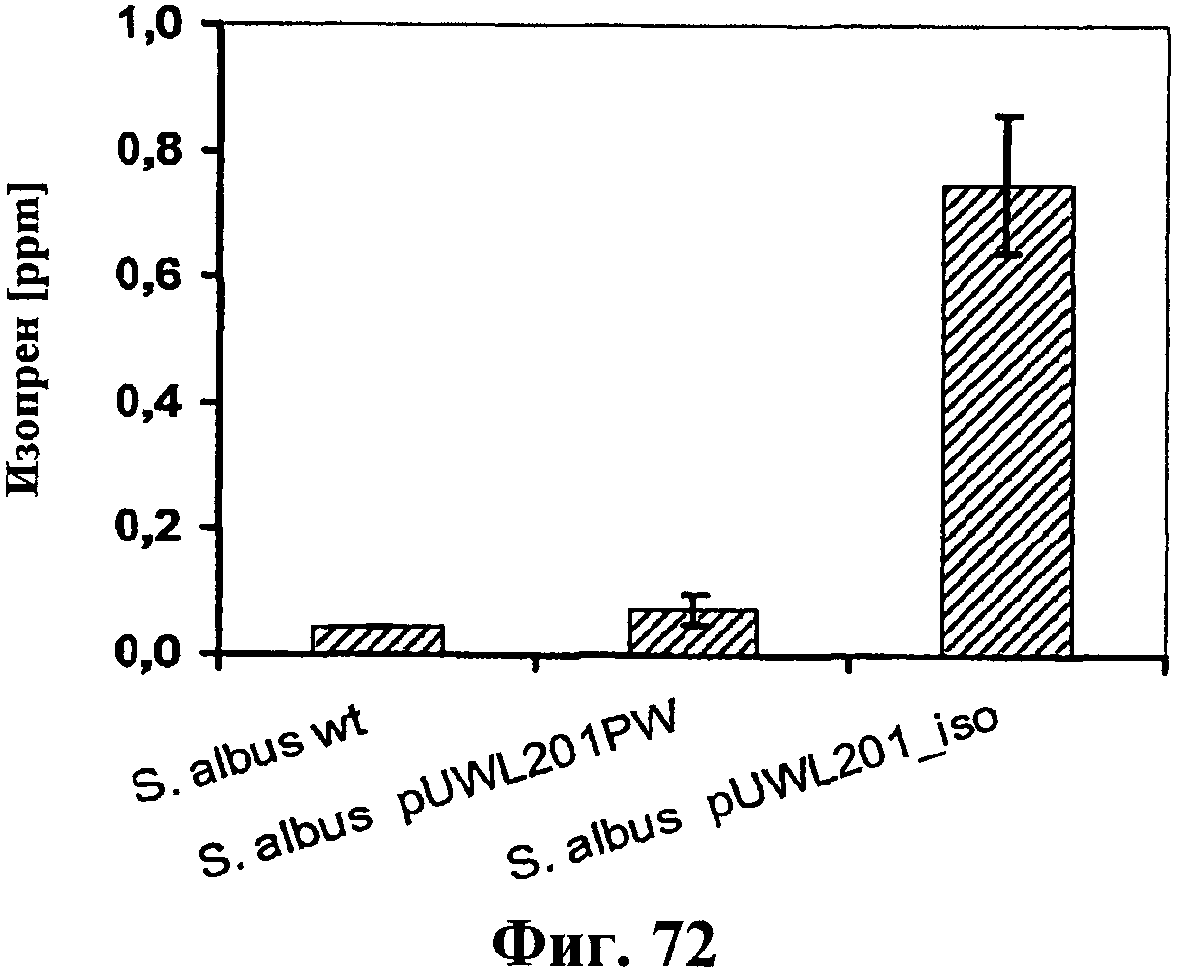
На фигуре 72 показана продукция изопрена клетками штамма дикого типа Streptomyces albus («wt») и штаммов, несущих плазмиду pUWL201PW (отрицательный контроль) или pUWL201_iso (кодирующая изопренсинтазу кудзу).
На фигуре 73А приведена карта оперона нижнего пути архебактерий M. mazei.
На фигурах 73В и 73С приведена нуклеотидная последовательность оперона нижнего пути архебактерий M. mazei (SEQ ID NO:113).
На фигуре 74А приведена карта MCM376-MVK из архебактерий M. mazei Lowerin pET200D.
На фигурах 74В и 74С приведена нуклеотидная последовательность MCM376-MVK из архебактерий M. mazei Lowerin pET200D (SEQ ID NO:114).
На фигурах 75А-75D показан рост и удельная продуктивность синтеза изопрена для штамма EWL256 по сравнению со штаммом RM11608-2. Рост (OD550) показан белыми ромбами; удельная продуктивность изопрена - сплошными столбцами. Ось х представляет время (ч) после индукции с IPTG в концентрации 200 (фигуры 75А и 75В) или 400 (фигуры 75С и 75D) мкМ. Ось Y-1 представляет продуктивность изопрена (мкг/OD/ч) и ось Y-2 представляет условные единицы оптической плотности при длине волны 550 значения OD550следует умножить на 6,66 для получения фактического значения ODкультуры.
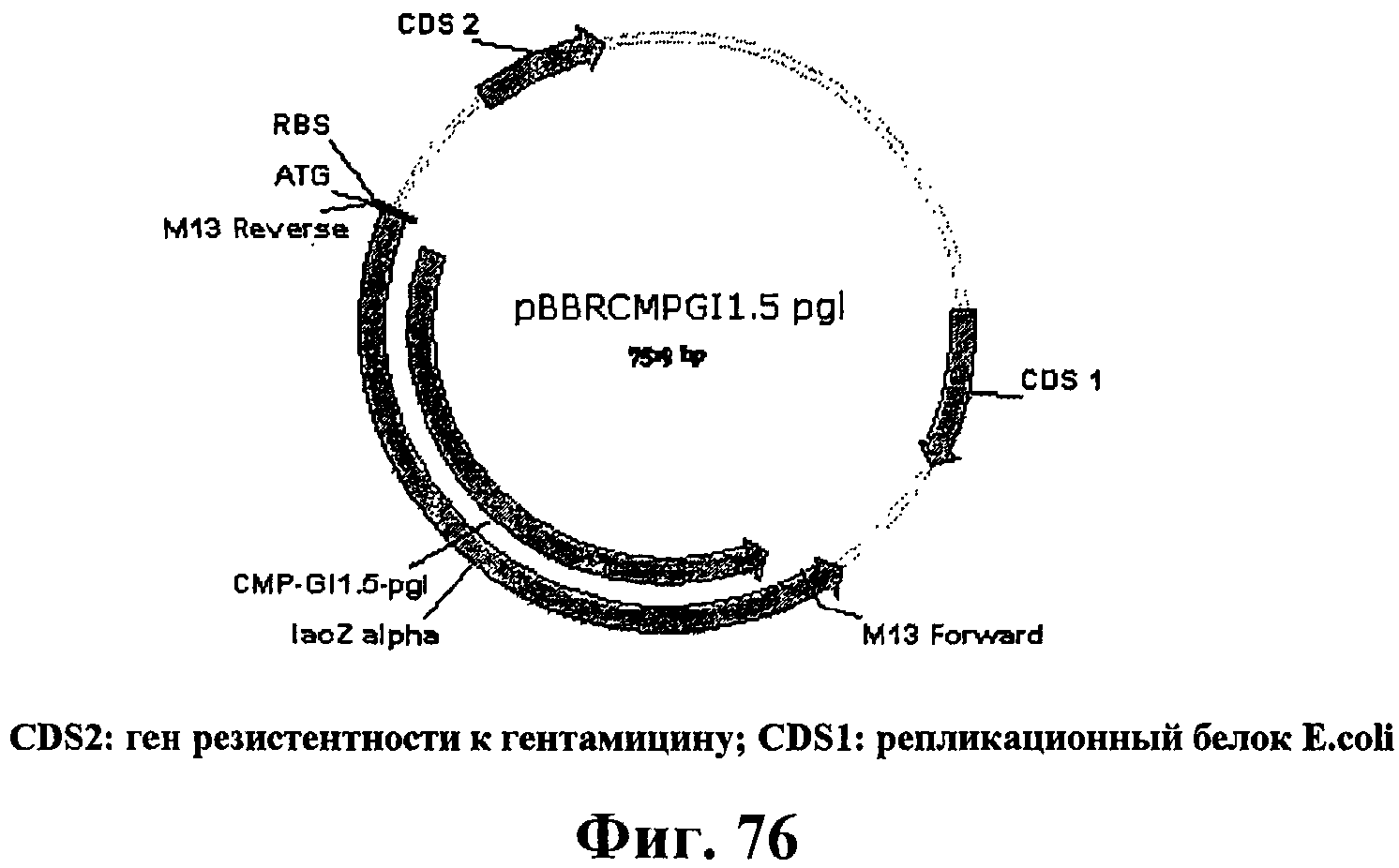
На фигуре 76 приведена карта плазмиды pBBRCMPGI1.5-pgl.
На фигурах 77А и 77В приведена нуклеотидная последовательность плазмиды pBBRCMPGI1.5-pgl (SEQ ID NO:122).
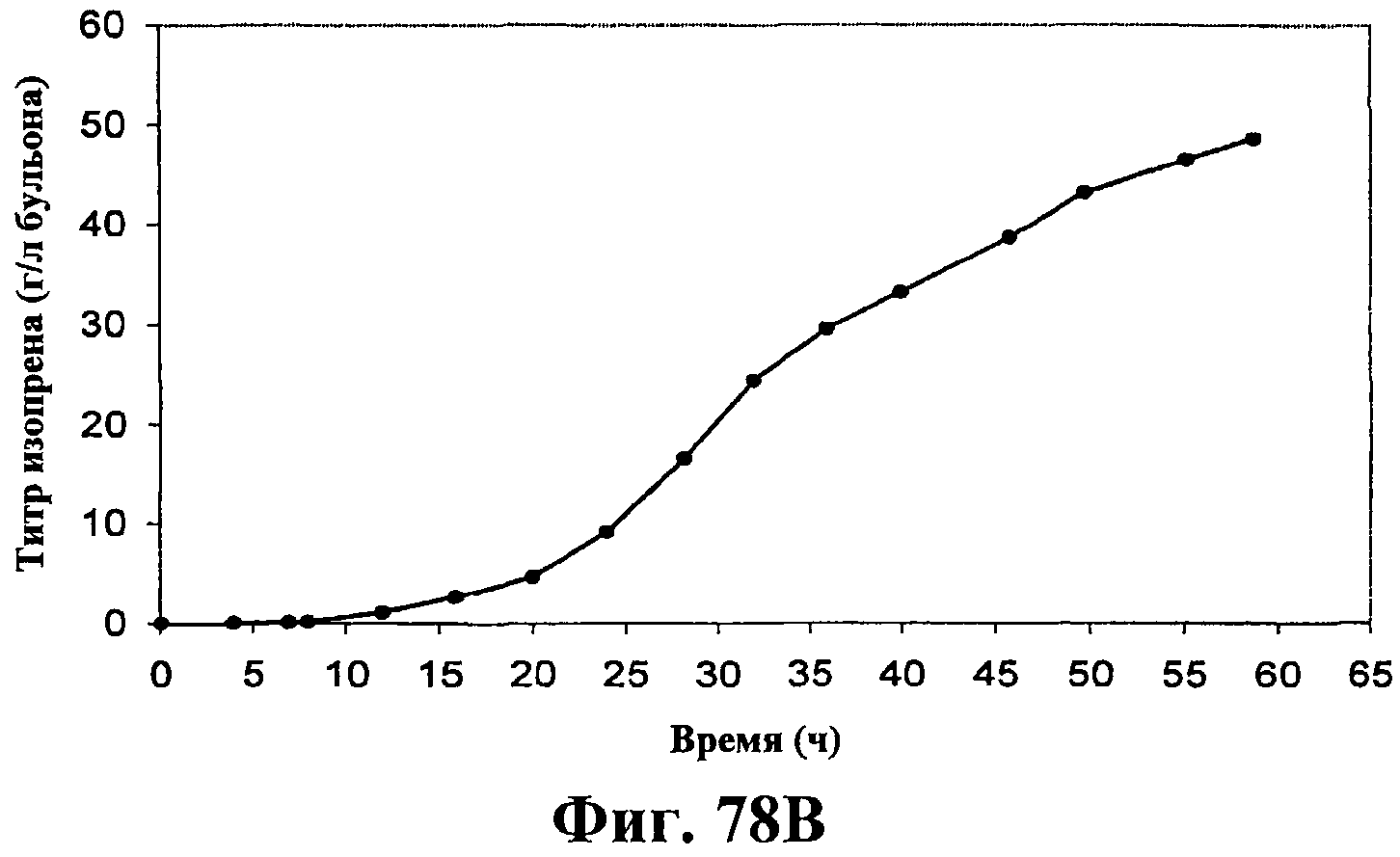
На фигурах 78А-78F приведены графики, показывающие продукцию изопрена клетками штамма E.coli, экспрессирующими мевалонаткиназу M. mazei, изопренсинтазу P. alba и pgl (RHM111608-2) и культивированными в культуре с подпиткой в объеме 15 л. На фигуре 78А показана динамика изменения оптической плотности во времени в биореакторе емкостью 15 л с подачей глюкозы. На фигуре 78В показана динамика изменения титра изопрена во времени в биореакторе емкостью 15 л с подачей глюкозы. Титр определяется, как количество изопрена, продуцированного на литр ферментационного бульона. Метод расчета количества изопрена: кумулятивный изопрен, продуцированный за 59 ч, г/объем ферментера на 59 ч, L [=]г/л бульона. На фигуре 78С приведен временной график титра изопрена, продуцированного в биореакторе емкостью 15 л с подачей глюкозы. Метод расчета количества изопрена: ∫(мгновенная скорость продукции изопрена, г/л/ч)dt от t = 0 до 59 ч[=]г/л бульона. На фигуре 78D приведен временной график общего количества продуцированного изопрена в биореакторе емкостью 15 л с подачей глюкозы. На фигуре 78Е приведена объемная продуктивность в биореакторе емкостью 15 л с подачей глюкозы. На фигуре 78F приведена общая скорость преобразования диоксида углерода (CER) или профиль метаболической активности в биореакторе емкостью 15 л с подачей глюкозы.
На фигуре 79А приведена карта плазмиды pJ201:19813.
На фигурах 79В и 79С приведена нуклеотидная последовательность pJ201:19813 (SEQ ID NO:123).
Подробное описание изобретения
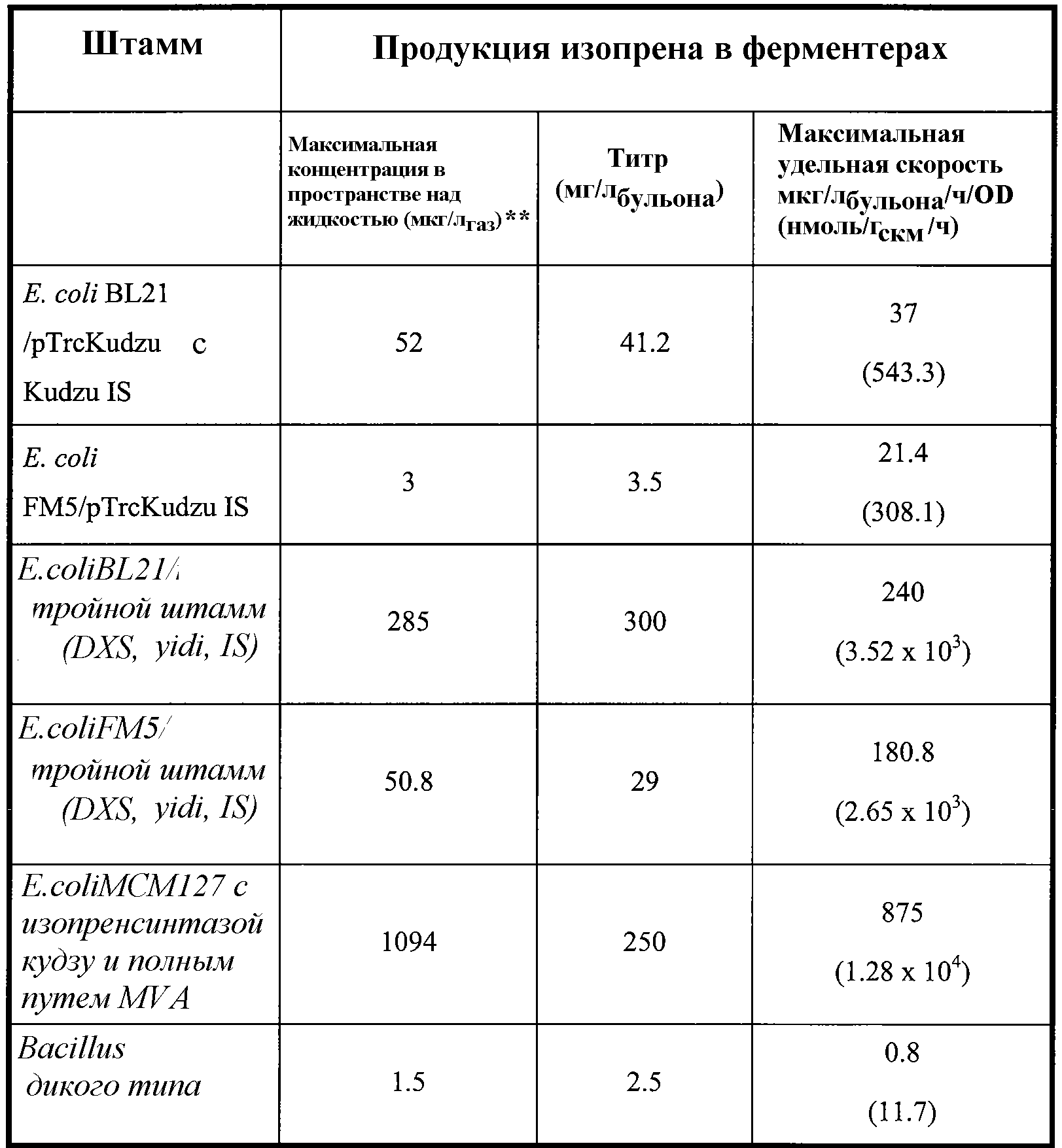
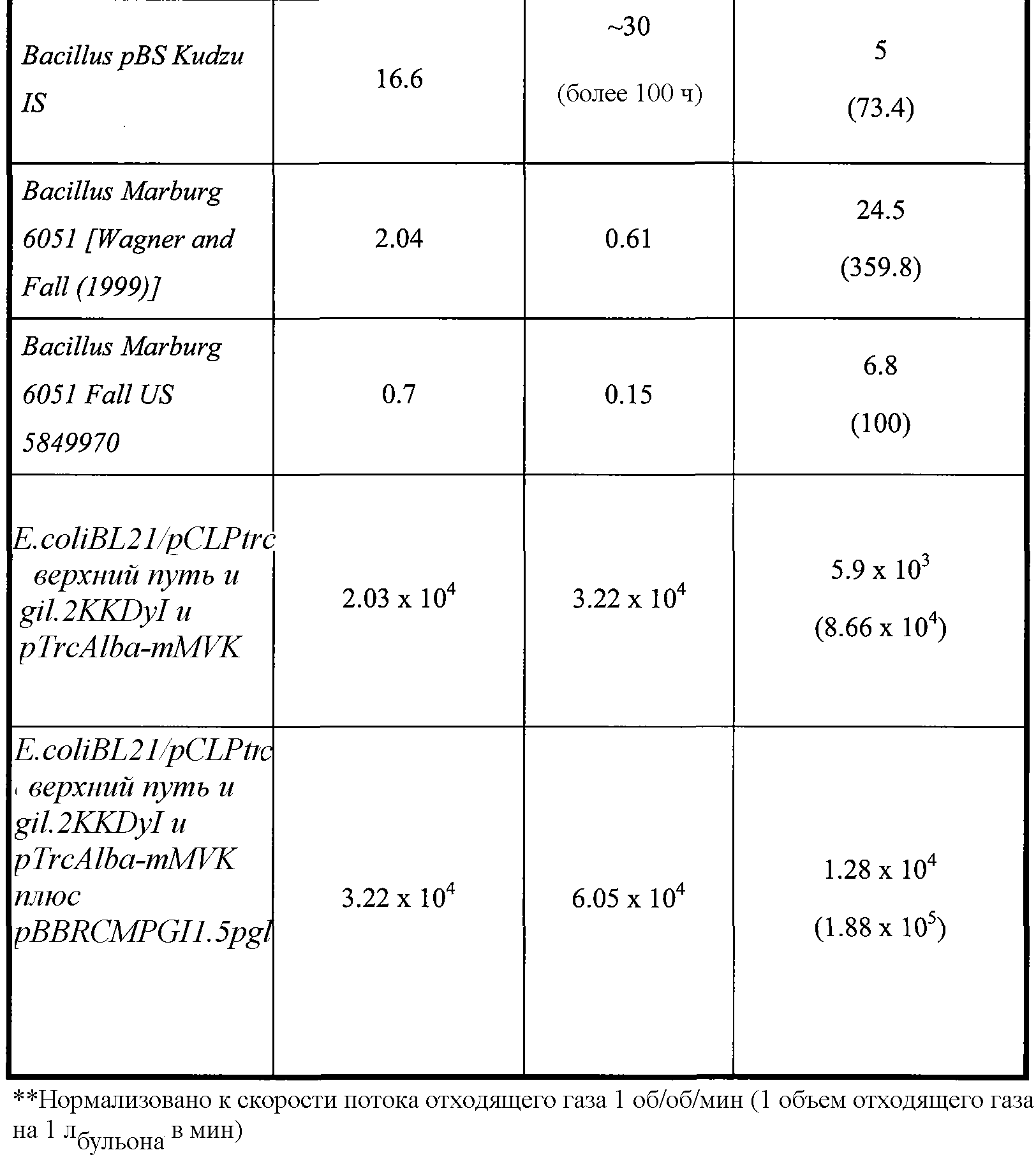
Изобретение относится к композициям и способам получения больших количеств изопрена. В частности, композиции и способы повышают скорость продукции изопрена и увеличивают общее количество изопрена, которое продуцируется. Например, были получены клеточные культуральные системы, которые продуцируют 4,8×104 нмоль/гскм/ч изопрена (таблица 1). Эффективность данных систем показана преобразованием углерода с выходом ≈23,6 мол.% (выход 10,7 вес.%), который клетки потребляют из среды клеточных культур, в изопрен (% выход углерода). Как показано в примерах и как приведено в таблице 2, было получено примерно 60,5 г изопрена на л бульона. Изопрен продуцировался с максимальной удельной скоростью 1,88×105 нммоль/OD/ч (1,88×105 нмоль/гскм/ч). Если желательно, то можно получить еще больше изопрена с использованием других условий, чем которые описаны в настоящем документе. В некоторых вариантах осуществления для получения изопрена используют восстанавливаемый источник углерода. Композиции и способы по настоящему изобретению желательны, поскольку они обеспечивают высокий выход изопрена на клетку, высокий выход углерода, высокую чистоту изопрена, высокую продуктивность, низкие затраты энергии, низкую производственную стоимость и вложения, и минимальные побочные реакции. Данный экономичный, объемный, биосинтетический способ получения изопрена обеспечивает источник изопрена для синтетического каучука на основе изопрена и обеспечивает желаемую дешевую альтернативу применению природного каучука.
Как дополнительно обсуждается ниже, количество изопрена, продуцированное клетками, можно существенно повысить введением гетерологичной нуклеиновой кислоты, кодирующей полипептид изопренсинтазы (например, полипептид растительной изопренсинтазы), в клетки. Полипептиды изопренсинтазы катализируют преобразование диметилаллилдифосфата (DMAPP) в изопрен. Как показано в примерах, гетерологичный полипептид изопренсинтазы Pueraria Montana (кудзу) или Populus alba (тополя серебристого) экспрессировали в различных клетках-хозяевах, таких как Escherichia coli, Panteoa citrea, Bacillus subtilis, Yarrowia lipolytica и Trichoderma reesei. Как показано в примерах, гетерологичную мевалонаткиназу (MVK) Methanosarcina mazei (M. mazei) экспрессировали в клетках-хозяевах, таких как Escherichia coli, для повышения продукции изопрена. Все клетки продуцировали больше изопрена по сравнению с соответствующими клетками без гетерологичного полипептида изопренсинтазы. Как показано в таблицах 1 и 2, с использованием способов, описанных в настоящем документе, продуцируются большие количества изопрена. Например, клетки B. subtilis с гетерологичным полипептидом изопренсинтазы продуцировали примерно в 10 раз больше изопрена в ферментере емкостью 14 л по сравнению с контрольными клетками B. subtilis без гетерологичной нуклеиновой кислоты (таблица 2). Продукция 60,5 г изопрена на л бульона (мг/л, где в объем бульона входит объем клеточной среды и объем клеток) E.coli и 30 мг/л B. subtilis в ферментерах указывает, что можно получать большие количества изопрена (таблица 2). Если желательно, то изопрен можно получить даже в большем объеме, или можно использовать другие условия, описанные в настоящем документе, в целях дополнительного увеличения количества изопрена. Векторы, приведенные в таблицах 1 и 2, и экспериментальные условия более подробно описаны ниже и в разделе примеров.
Таблица 1. Приведенные в качестве примера выходы изопрена из встряхиваемой колбы с использованием клеточных культур и способов по изобретению. Метод анализа продукции изопрена описан в примере 1, разделе II. Для проведения анализа отбирают образец на одной или более временных точек из встряхиваемой колбы и культивируют в течение 30 мин. Затем определяют количество продуцированного изопрена в данном образце. Значения концентрации в пространстве над жидкостью и удельной скорости продукции изопрена приведены в таблице 1 и описаны ниже в настоящем документе.


Таблица 2. Приведенные в качестве примера выходы изопрена в ферментере с использованием клеточных культур и способов по изобретению. Метод анализа продукции изопрена описан в примере 1, разделе II. Для проведения данного анализа отбирают образец отходящего газа из ферментера и определяют количество изопрена. Максимальная концентрация в пространстве над жидкостью (которая является наиболее высокой концентрацией в пространстве над жидкостью во время ферментации), титр (который представляет кумулятивное, общее количество изопрена, продуцированное в л бульона) и максимальная удельная скорость продукции изопрена (которая является наиболее высокой скоростью во время ферментации) приведены в таблице 2 и описаны ниже в настоящем документе.
Кроме того, продукцию изопрена клетками, содержащими гетерологичную нуклеиновую кислоту изопренсинтазы, можно повысить увеличением количества полипептида 1-дезокси-D-ксилулоза-5-фосфатсинтазы (DXS) и/или полипептида изопентенилдифосфатизомеразы (IDI), экспрессированными клетками. Например, в клетки можно ввести нуклеиновую кислоту DXS и/или нуклеиновую кислоту IDI. Нуклеиновая кислота DXS может представлять гетерологичную нуклеиновую кислоту или двойную копию эндогенной нуклеиновой кислоты. Аналогично нуклеиновая кислота IDI может представлять гетерологичную нуклеиновую кислоту или двойную копию эндогенной нуклеиновой кислоты. В некоторых вариантах осуществления количество полипептида DXS и/или IDI можно увеличить замещением эндогенных промоторов или регуляторных областей DXS и/или IDI на другие промоторы и/или регуляторные области, что приводит к более высокой транскрипции нуклеиновых кислот DXS и/или IDI. В некоторых вариантах осуществления клетки одновременно содержат гетерологичную нуклеиновую кислоту, кодирующую полипептид изопренсинтазы (например, нуклеиновую кислоту растительной изопренсинтазы), и двойную копию эндогенной нуклеиновой кислоты, кодирующей полипептид изопренсинтазы.
Кодированные полипептиды DXS и/или IDI являются частью пути биосинтеза изопрена с участием DXP (фигура 19А). Полипептид DXS катализирует преобразование пирувата и D-глицеральдегид-3-фосфата в 1-дезокси-D-ксилулоза-5-фосфат. Не намереваясь связываться с какой-либо теорией, полагается, что увеличение количества полипептида DXS повышает поток углерода по пути DXP, приводя к более высокой продукции изопрена. Полипептиды IDI катализируют взаимопреобразование изопентенилдифосфата (IPP) и диметилаллилдифосфата (DMAPP). Не намереваясь связываться с какой-либо теорией, было сделано предположение, что увеличение количества полипептида IDI в клетках повышает количество полипептида IPP, который преобразуется в DMAPP, который, в свою очередь, преобразуется в изопрен.
Например, ферментацию клеток E.coli с нуклеиновыми кислотами изопренсинтазы кудзу, IDI S. cerevisia и DXS E.coli, использовали для получения изопрена. Концентрация изопрена изменялась от 50 до 300 мкг/л в течение 15 ч (пример 7, раздел VII). В качестве другого примера: ферментацию E.coli с мевалонаткиназой M. mazei (MVK), изопренсинтазой P. alba, верхним путем MVA и интегрированным нижним путем MVA использовали для получения изопрена. Уровни изопрена изменялись от 32 до 35,6 г/л за период времени, составляющий 67 ч (пример 10, раздел III).
В еще одном примере ферментацию E.coli с мевалонаткиназой M. mazei (MVK), изопренсинтазой P. alba, сверхэкспрессированным pgl (RHM111608-2), верхним путем MVA и интегрированным нижним путем MVA использовали для получения изопрена. Концентрация изопрена варьировала от 33,2 до 40,0 г/л в течение 48 ч или от 48,6 г/л до 60,5 г/л в течение 59 ч (пример 13, раздел (ii)).
В некоторых вариантах осуществления одновременное присутствие гетерологичных или экстра-эндогенных нуклеиновых кислот изопренсинтазы, IDI и DXS стимулирует более интенсивный клеточный рост или позволяет сохранять клетки живыми в течение более длительного периода времени по сравнению с соответствующими клетками только с одной или двумя указанными гетерологичными или экстра-эндогенными нуклеиновыми кислотами. Например, клетки, содержащие гетерологичные нуклеиновые кислоты изопренсинтазы, IDI и DXS, росли лучше по сравнению с клетками только с гетерологичными нуклеиновыми кислотами изопренсинтазы и DXS или только с одной гетерологичной нуклеиновой кислотой изопренсинтазы. Также гетерологичные нуклеиновые кислоты изопренсинтазы, IDI и DXS эффективно функционально связывали с сильным промотором в высококопийной плазмиде, которую поддерживали в клетках E.coli, на основании чего можно предположить, что можно было синтезировать большие количества данных полипептидов в клетках, не вызывая проявления высокой токсичности для клеток. Не намереваясь связываться с какой-либо теорией, полагается, что присутствие гетерологичных или экстра-эндогенных нуклеиновых кислот изопренсинтазы и IDI может привести к снижению количества одного или более возможно токсичных промежуточных продуктов, которые иначе будут накапливаться, если в клетках будет находиться только гетерологичная или экстра-эндогенная нуклеиновая кислота DXS.
В некоторых вариантах осуществления продукция изопрена клетками, содержащими гетерологичную нуклеиновую кислоту изопренсинтазы, усиливается при повышении количества полипептида MVA, экспрессированного клетками (фигуры 19А и 19В). Приведенные в качестве примера полипептиды, участвующие в пути MVA, включают любой из следующих полипептидов: полипептиды ацетил-СоА-ацетилтрансферазы (АА-СоА-тиолазы), полипептиды 3-гидрокси-3-метилглутарил-СоА-синтазы (HMG-CoA-синтазы), полипептиды 3-гидрокси-3-метилглутарил-СоА-редуктазы (HMG-CoA-редуктазы), полипептиды мевалонаткиназы (MVK), полипептиды фосфомевалонаткиназы (PMK), полипептиды дифосфомевалонатдекарбоксилазы (MVD), полипептиды фосфомевалонатдекарбоксилазы (PMDC), полипептиды изопентенилфосфаткиназы (IPK), полипептиды IDI и полипептиды (например, слитые полипептиды), обладающие активностью двух или более полипептидов, принимающих участие в пути MVA. Например, в клетки можно ввести одну или более нуклеиновых кислот на пути MVA. В некоторых вариантах осуществления клетки имеют верхний путь MVA, который включает нуклеиновые кислоты АА-СоА-тиолазы, HMG-CoA-синтазы и HMG-CoA-редуктазы. В некоторых вариантах осуществления клетки имеют нижний путь MVA, который включает нуклеиновые кислоты MVK, PMK, MVD и IDI. В некоторых вариантах осуществления клетки имеют полный путь MVA, который включает нуклеиновые кислоты АА-СоА-тиолазы, HMG-CoA-синтазы и HMG-CoA-редуктазы, MVK, PMK, MVD и IDI. В некоторых вариантах осуществления клетки имеют весь путь MVA, который включает нуклеиновые кислоты АА-СоА-тиолазы, HMG-CoA-синтазы и HMG-CoA-редуктазы, MVK, PMDC, IPK и IDI. Нуклеиновые кислоты пути MVA могут представлять гетерологичные нуклеиновые кислоты или двойные копии эндогенных нуклеиновых кислот. В некоторых вариантах осуществления количество одного или более полипептидов пути MVA увеличивают замещением эндогенных промоторов или регуляторных областей нуклеиновых кислот пути MVA на другие промоторы и/или регуляторные области, что приводит к более высокой транскрипции нуклеиновых кислот на пути MVA. В некоторых вариантах осуществления клетки содержат гетерологичную нуклеиновую кислоту, кодирующую полипептид изопренсинтазы (например, нуклеиновую кислоту растительной изопренсинтазы) и двойную копию эндогенной нуклеиновой кислоты, кодирующей полипептид изопренсинтазы.
Например, клетки E.coli, содержащие нуклеиновую кислоту, кодирующую полипептид изопренсинтазы кудзу, и нуклеиновые кислоты, кодирующие полипептиды Saccharomyces cerevisia MVK, PMK, MVD и IDI, продуцировали изопрен со скоростью 6,67×104 нмоль/лбульонаOD600/ч (смотри пример 8). Кроме того, в ферментере емкостью 14 л клетки E.coli с нуклеиновыми кислотами, кодирующими полипептиды Enterococcus faecalis АА-СоА-тиолазы, HMG-CoA-синтазы и HMG-CoA-редуктазы, продуцировали 22 г мевалоновой кислоты (промежуточное соединение пути MVA). Во встряхиваемой колбе клетки продуцировали 2-4 г мевалоновой кислоты на литр. Полученные результаты указывают на то, что гетерологичные нуклеиновые кислоты пути MVA являются активными в клетках E.coli. Клетки E.coli, которые содержат нуклеиновые кислоты для обоих верхнего пути MVA и нижнего пути MVA, а также изопренсинтазы кудзу (штамм МСМ 127), продуцировали статистически больше изопрена (874 мкг/лбульона/ч/OD) по сравнению с клетками E.coli с нуклеиновыми кислотами только для нижнего пути MVA и изопренсинтазы кудзу (штамм МСМ 131) (смотри таблицу 3 и пример 8, раздел VIII).
В качестве другого примера можно привести тот факт, что клетки E.coli, содержащие нуклеиновую кислоту, кодирующую изопренсинтазу P. alba, и нуклеиновую кислоту, кодирующую полипептид MVK M. mazei, продуцировали 320,6 г (при максимальной удельной скорости 9,54×104 нмоль/лбульона/OD600/ч (т.е. 9,5×10-5 моль/лбульона/OD600/ч)) изопрена в течение 67 ч ферментации при отсутствии подачи дрожжевого экстракта или 395,5 г (при максимальной скорости 8,66×104 нмоль/лбульона/OD600/ч) в течение 68 ч ферментации при наличии подачи дрожжевого экстракта (смотри пример 10).
В некоторых вариантах осуществления по меньшей мере часть клеток сохраняет гетерологичную нуклеиновую кислоту изопренсинтазы, DXS, IDI или пути MVA по меньшей мере на 5, 10, 20, 50, 75, 100, 200, 300 или более клеточных делений в непрерывной культуре (такой как непрерывная культура без разведения). В некоторых вариантах осуществления любого из аспектов изобретения нуклеиновая кислота, содержащая гетерологичную или двойную копию эндогенной нуклеиновой кислоты изопренсинтазы, DXS, IDI и/или пути MVA, также включает селективный маркер, такой как нуклеиновая кислота резистентности к антибиотикам канамицину, ампициллину, карбенициллину, гентамицину, гигромицину, флеомицину, блеомицину, неомицину или хлорамфениколу.
Как описано в примере 7, разделе VI, количество продуцированного изопрена можно дополнительно повысить добавлением дрожжевого экстракта в среду клеточной культуры с использованием клеток E.coli с нуклеиновыми кислотами изопренсинтазы кудзу, IDI S. cerevisia и DXS E.coli для получения изопрена. В частности, количество продуцированного изопрена было прямо пропорционально количеству дрожжевого экстракта в клеточной среде для тестированной концентрации (фигура 48С). Кроме того, было получено примерно 0,11 г изопрена на литр бульона из клеточной среды с дрожжевым экстрактом и глюкозой (пример 7, раздел VIII). Увеличение количества дрожжевого экстракта в присутствии глюкозы приводит к большему количеству продуцированного изопрена по сравнению с повышением количества глюкозы в присутствии дрожжевого экстракта. Также увеличение количества дрожжевого экстракта позволило клеткам продуцировать изопрен на высоком уровне в течение более длительного периода времени и улучшить состояние клеток.
Также была оценена продукция изопрена с использованием трех типов гидролизованной биомассы (жмыха, кукурузной соломы и мягкой древесной пульпы) в качестве источника углерода (фигуры 46А-С и фигуры 69А и 69В). Клетки E.coli с нуклеиновыми кислотами изопренсинтазы кудзу, IDI S. cerevisia и DXS E.coli продуцировали такое же количество изопрена из данных гидролизованных биомасс, взятых в качестве источников углерода, как из эквивалентного количества глюкозы (например, 1% глюкоза мас./об.). Клетки E.coli, экспрессирующие изопренсинтазу P. alba и путь MVA, продуцировали изопрен с большей первоначальной скоростью роста из предварительно обработанной кукурузной соломы путем растяжения волокон под действием аммиака (AFEX) по сравнению с эквивалентным количеством глюкозы (фигуры 69А и 69В). Если желательно, то можно использовать любой другой источник углерода в виде биомассы в композициях и способах по изобретению. Источники углерода в виде биомассы желательны, поскольку они дешевле по сравнению со многими обычными культуральными средами, что обеспечивает экономичное получение изопрена.
Кроме того, было показано, что инвертированный сахар может использоваться в качестве источника углерода для получения изопрена (фигура 47D).
Дополнительно было показано, что ксилоза, ацетат и глицерин могут использоваться в качестве источника углерода для получения изопрена (фигуры 69А-69D). Например, клетки E.coli с нуклеиновыми кислотами изопренсинтазы и путем MVA P. alba, культивированные на ацетате, который был единственным источником углерода, имели удельную продуктивность изопрена примерно в два раза выше по сравнению с культивированием на глюкозе (пример 10, раздел IV; фигуры 69А и 69В).
В некоторых вариантах осуществления в культуральную среду вводили масло. Например, клетки B. subtilis с нуклеиновой кислотой изопренсинтазы кудзу продуцировали изопрен при культивировании в культуральной среде, содержащей масло и источник глюкозы (пример 4, раздел III). В качестве другого примера: мутантные клетки E.coli fadR atoC, содержащие верхний и нижний пути MVA плюс изопренсинтазу кудзу, продуцировали изопрен при их культивировании в клеточной среде, содержащей пальмовое масло и источник глюкозы (пример 12, раздел II). В некоторых вариантах осуществления в клеточную среду вводят более одного масла (например, 2, 3, 4, 5 или более масел). Не намереваясь связываться с какой-либо теорией, полагается, что (i) масло может повысить количество углерода в клетках, который доступен для преобразования в изопрен; (ii) масло может увеличить количество ацетил-СоА в клетках, повышая тем самым поток углерода через путь MVA и/или (iii) масло может обеспечить дополнительные питательные вещества для клеток, что желательно, поскольку большее количество углерода в клетках преобразуется в изопрен в большей степени, чем в другие продукты. В некоторых вариантах осуществления клетки, которые культивируют в клеточной среде, содержащей масло, в природных условиях используют путь MVA для продукции изопрена или являются генетически модифицированными с включением нуклеиновых кислот для полного пути с участием MVA. В некоторых вариантах осуществления масло частично или полностью гидролизуют перед внесением в среду клеточной культуры для облегчения использования масла клетками-хозяевами.
Приведенные в качестве примера полипептиды и нуклеиновые кислоты
В композициях и способах по изобретению можно использовать различные полипептиды и нуклеиновые кислоты изопренсинтазы, DXS, IDI и/или пути MVA.
В том смысле, в котором термин «полипептиды» используется в настоящем документе, он включает полипептиды, белки, пептиды, фрагменты полипептидов и слитые полипептиды, которые содержат фрагмент или весь первый полипептид (например, полипептид изопренсинтазы, DXS, IDI и/или пути MVA) или фрагмент или весь второй полипептид (например, пептид, который облегчает очистку или детектирование слитого полипептида, такой как His-метка). В некоторых вариантах осуществления слитый полипептид обладает активностью двух или более полипептидов, принимающих участие в пути MVA (таких как полипептиды АА-СоА-тиолазы и HMG-CoA-редуктазы). В некоторых вариантах осуществления полипептид представляет собой природный полипептид (такой как полипептид, кодированный нуклеиновой кислотой mvaE Enterococcus faecalis), который обладает активностью двух или более полипептидов пути MVA.
В различных вариантах осуществления полипептид содержит по меньшей мере или примерно 50, 100, 150, 175, 200, 250, 300, 350, 400 или более аминокислот. В некоторых вариантах осуществления фрагмент полипептида содержит по меньшей мере или примерно 25, 50, 75, 100, 150, 200, 300 или более смежных аминокислот из полноразмерного полипептида и обладает по меньшей мере 5%, 10%, 20%, 30%, 40%, 50%, 60%, 70%, 80%, 90%, 95% или 100% активностью соответствующего полноразмерного полипептида. В конкретных вариантах осуществления полипептид содержит сегмент или полную аминокислотную последовательность любого природного полипептида изопренсинтазы, DXS, IDI и/или пути MVA. В некоторых вариантах осуществления полипептид содержит одну или более мутаций по сравнению с последовательностью полипептида дикого типа (т.е. последовательностью, имеющейся в природе) изопренсинтазы, DXS, IDI и/или пути MVA.
В некоторых вариантах осуществления полипептид является выделенным полипептидом. В том смысле, в котором термин «выделенный полипептид» используется в настоящем документе, он не является частью библиотеки полипептидов, такой библиотеки, как библиотека из 2, 5, 10, 20, 50 или более различных полипептидов, и он отделен по меньшей мере от одного компонента, с которым он находится вместе в природе. Выделенный полипептид можно получить, например, экспрессией рекомбинантной нуклеиновой кислоты, кодирующей полипептид.
В некоторых вариантах осуществления полипептид является гетерологичным полипептидом. Под термином «гетерологичный полипептид» понимается полипептид, аминокислотная последовательность которого не идентична аминокислотной последовательности другого полипептида, экспрессированного в природных условиях в той же клетке-хозяине.
В том смысле, в котором термин «нуклеиновая кислота» используется в настоящем документе, он относится к двум или более дезоксирибонуклеотидам и/или рибонуклеотидам в одноцепочечной или двухцепочечной форме. В некоторых вариантах осуществления нуклеиновая кислота является рекомбинантной нуклеиновой кислотой. Под термином «рекомбинантная нуклеиновая кислота» понимается интересующая нуклеиновая кислота, которая не содержит одну или более нуклеиновых кислот (например, генов), которые в природном геноме организма, из которого выделена интересующая нуклеиновая кислота, фланкирует интересующую нуклеиновую кислоту. Следовательно, термин включает, например, рекомбинантную ДНК, которая введена в вектор, в автономно реплицирующуюся плазмиду или вирус, или в геномную ДНК прокариота или эукариота, или которая находится в виде отдельной молекулы (например, кДНК, фрагмента геномной ДНК или фрагмента кДНК, полученного ПЦР или расщеплением рестриктазами) независимо от других последовательностей. В некоторых вариантах осуществления нуклеиновая кислота изопренсинтазы, DXS, IDI и/или пути MVA функционально связана с другой нуклеиновой кислотой, которая кодирует весь или фрагмент другого полипептида, таким образом, что рекомбинантная нуклеиновая кислота кодирует слитый полипептид, содержащий полипептид изопренсинтазы, DXS, IDI и/или пути MVA и весь или фрагмент другого полипептида (например, пептида, который облегчает очистку или детектирование слитого полипептида, такого как His-метка). В некоторых вариантах осуществления фрагмент или вся нуклеиновая кислота синтезирована химическим путем.
В некоторых вариантах осуществления нуклеиновая кислота является гетерологичной нуклеиновой кислотой. Под термином «гетерологичная нуклеиновая кислота» понимается нуклеиновая кислота, последовательность нуклеиновой кислоты которой не идентична последовательности другой нуклеиновой кислоты, находящейся в той же клетке-хозяине в природных условиях.
В конкретных вариантах осуществления нуклеиновая кислота содержит сегмент или полную последовательность нуклеиновой кислоты любой природной нуклеиновой кислоты изопренсинтазы, DXS, IDI и/или пути MVA. В некоторых вариантах осуществления нуклеиновая кислота содержит по меньшей мере или примерно 50, 100, 150, 200, 300, 400, 500, 600, 700, 800 или более смежных нуклеотидов из природной нуклеиновой кислоты изопренсинтазы, DXS, IDI и/или пути MVA. В некоторых вариантах осуществления нуклеиновая кислота содержит одну или более мутаций по сравнению с последовательностью дикого типа (например, последовательностью, имеющейся в природе) нуклеиновой кислоты изопренсинтазы, DXS, IDI и/или пути MVA. В некоторых вариантах осуществления нуклеиновая кислота содержит одну или более мутаций (например, молчащую мутацию), которые усиливают транскрипцию или трансляцию нуклеиновой кислоты изопренсинтазы, DXS, IDI и/или пути MVA. В некоторых вариантах осуществления нуклеиновая кислота является вырожденным вариантом любой нуклеиновой кислоты, кодирующей полипептид изопренсинтазы, DXS, IDI и/или пути MVA.
Термин «вырожденность кода» относится к отклонению в генетическом коде, которое позволяет иметь место вариациям нуклеотидной последовательности без оказания влияния на аминокислотную последовательность кодированного полипептида. Очевидно, специалистам в данной области понятно, что «отклонение кодона», имеющееся в конкретной клетке-хозяине при использовании нуклеотидных кодонов для обозначения данной аминокислоты. Следовательно, при синтезе нуклеиновой кислоты для повышенной экспрессии в клетке-хозяине, желательно в некоторых вариантах осуществления конструировать нуклеиновую кислоту таким образом, чтобы частота использования кодонов приближалась к предпочтительной частоте использования кодонов в клетке-хозяине.
Инвентарные номера приведенных в качестве примера полипептидов и нуклеиновых кислот изопренсинтазы, DXS, IDI и/или пути MVA приведены в приложении 1 (инвентарные номера в приложении 1 и их соответствующие последовательности в полном объеме включены в настоящий документ для сведения, в частности, в отношении аминокислотных и последовательностей нуклеиновой кислоты полипептидов и нуклеиновых кислот изопренсинтазы, DXS, IDI и/или пути MVA). В базе данных Kegg также имеются аминокислотные и последовательности нуклеиновой кислоты многочисленных приведенных в качестве примера полипептидов и нуклеиновых кислот изопренсинтазы, DXS, IDI и/или пути MVA (смотри, например, всемирный сайт «genome.jp/kegg/pathway/map/map00100.html» и последовательности на нем, которые в полном объеме включены в настоящий документ для сведения, в частности, в отношении аминокислотных и последовательностей нуклеиновой кислоты полипептидов и нуклеиновых кислот изопренсинтазы, DXS, IDI и/или пути MVA). В некоторых вариантах осуществления один или более полипептидов и/или нуклеиновых кислот изопренсинтазы, DXS, IDI и/или пути MVA содержат последовательность, идентичную последовательности, опубликованной 12 декабря 2007 или 11 декабря 2008, такой как любая из последовательностей, соответствующих любому из инвентарных номеров в приложении 1 или любой из последовательностей, имеющейся в базе данных Kegg. Дополнительные приведенные в качестве примера полипептиды и нуклеиновые кислоты изопренсинтазы, DXS, IDI и/или пути MVA дополнительно описаны ниже.
Приведенные в качестве примера полипептиды и нуклеиновые кислоты изопренсинтазы
Как уже отмечалось выше, полипептиды изопренсинтазы катализируют преобразование диметилаллилдифосфата (DMAPP) в изопрен. Приведенные в качестве примера полипептиды изопренсинтазы включают полипептиды, фрагменты полипептидов, пептиды и слитые полипептиды, которые обладают по меньшей мере одной активностью полипептида изопренсинтазы. Можно использовать стандартные методы для определения того, насколько полипептид обладает активностью полипептида изопренсинтазы, по оценке способности полипептида катализировать преобразование DMAPP в изопрен в условиях in vitro, в клеточном экстракте, или в условиях in vivo. В приведенном в качестве примера методе клеточные экстракты готовят культивированием штамма (например, штамма E.coli/pTrcKudzu, описанного в настоящем документе) в методе во встряхиваемой колбе, как описано в примере 1. После окончания индукции примерно 10 мл клеток осаждают центрифугированием при 7000× g в течение 10 мин и ресуспендируют в 5 мл PEB без глицерина. Клетки лизируют с использованием френч-пресса для клеток согласно стандартному протоколу. Альтернативно клетки обрабатывают лизозимом (раствор лизозима Ready-Lyse; EpiCenre) после замораживания/размораживания при -80°С.
Активность полипептида изопренсинтазы в клеточном экстракте можно определить, например, как описано Silver et al., J. Biol. Chem., 270:13010-13016, 1995 и в цитированных там источниках, каждый из которых в полном объеме включен в настоящий документ для сведения, в частности, в отношении методов оценки активности полипептида изопренсинтазы. DMAPP (Sigma) выпаривают досуха в струе азота и регидратируют до концентрации 100 мМ в 100 мМ калиевом фосфатном буфере, рН 8,2 и хранят при -20°С. Для проведения теста добавляют 5 мкл 1М раствора MgCl2, 1 мМ (250 мкг/мл) DMAPP, 65 мкл буфера для растительного экстракта (РЕВ) (50 мМ Трис-HCl, рН 8,0, 20 мМ MgCl2, 5% глицерина и 2 мМ DTT) к 25 мкл клеточного экстракта во флаконе с пространством для жидкости емкостью 20 мл с металлической закручивающейся крышкой и покрытой силиконом тефлоновой прокладкой (Agilent Technologies) и культивируют при 37°С при встряхивании. Реакцию гасят добавлением 200 мкл 250 мМ ЭДТА и количественно определяют ГЗ/МС, как описано в примере 1, разделе II.
Приведенные в качестве примера нуклеиновые кислоты изопренсинтазы включают нуклеиновые кислоты, которые кодируют полипептид, фрагмент полипептида, пептид или слитый полипептид, который обладает по меньшей мере одной активностью полипептида изопренсинтазы. Приведенные в качестве примера полипептиды и нуклеиновые кислоты изопренсинтазы включают природные полипептиды и нуклеиновые кислоты из любых организмов-источников, описанных в настоящем документе, а также мутантные полипептиды и нуклеиновые кислоты, полученные из любых организмов-источников, описанных в настоящем документе.
В некоторых вариантах осуществления полипептид и нуклеиновая кислота изопренсинтазы происходят из семейства Fabaceae, такого как субсемейство Faboideae. В некоторых вариантах осуществления полипептид или нуклеиновая кислота изопренсинтазы представляют полипептид или нуклеиновую кислоту из Pueraria montana (кудзу) (Sharkey et al., Plant Physiology, 137:700-712, 2005), Pueraria lobata, тополя (такого как Populus alba, Populus nigra, Populus trichocarpa, Populus alba×tremula (CAC35696) или Populus alba (Sasaki et al., FEBS Letters, 579(11):2514-2518, 2005; Miller et al., Planta, 213:483-487, 2001), осины (такой как Populus tremuloides) (Silver et al., JBC, 270(22):13010-13016, 1995) или дуба обыкновенного (Quercus robur) (Zimmer et al., международная заявка WO 98/02550), каждый из этих источников в полном объеме включен в настоящий документ для сведения, в частности, отношении нуклеиновых кислот изопренсинтазы и экспрессии полипептидов изопренсинтазы. Подходящие изопренсинтазы включают, не ограничиваясь этим, изопренсинтазы, имеющие инвентарные номера в Genbank AY341431, AY316691, AY279379, AJ457070 и AY182241, каждый из которых в полном объеме включен в настоящий документ для сведения, в частности, в отношении последовательностей нуклеиновых кислот и полипептидов изопренсинтазы. В некоторых вариантах осуществления полипептид и нуклеиновая кислота изопренсинтазы не являются природными полипептидом или нуклеиновой кислотой из Quercus robur (т.е. полипептид и нуклеиновая кислота изопренсинтазы являются полипептидом и нуклеиновой кислотой иными, чем природные полипептид и нуклеиновая кислота из Quercus robur). В некоторых вариантах осуществления нуклеиновая кислота или полипептид изопренсинтазы представляют собой природные полипептид или нуклеиновую кислоту из тополя. В некоторых вариантах осуществления нуклеиновая кислота или полипептид изопренсинтазы не являются природными полипептидом или нуклеиновой кислотой из тополя.
Приведенные в качестве примера полипептиды и нуклеиновые кислоты DXS
Как уже отмечалось выше, полипептиды 1-дезокси-D-ксилулоза-5-фосфатсинтазы (DXS) катализируют преобразование пирувата и D-глицеральдегид-3-фосфата в 1-дезокси-D-ксилулоза-5-фосфат. Приведенные в качестве примера полипептиды DXS включают полипептиды, фрагменты полипептидов, пептиды и слитые полипептиды, которые обладают по меньшей мере одной активностью полипептида DXS. Можно использовать стандартные методы (например, описанные в настоящем документе) для определения того, насколько полипептид обладает активностью полипептида DXS, по оценке способности полипептида катализировать преобразование пирувата и D-глицеральдегид-3-фосфата в 1-дезокси-D-ксилулоза-5-фосфат в условиях in vitro, в клеточном экстракте, или в условиях in vivo. Приведенные в качестве примера нуклеиновые кислоты DXS включают нуклеиновые кислоты, которые кодируют полипептид, фрагмент полипептида, пептид или слитый полипептид, который обладает по меньшей мере одной активностью полипептида DXS. Приведенные в качестве примера полипептиды и нуклеиновые кислоты DXS включают природные полипептиды и нуклеиновые кислоты из любых организмов-источников, описанных в настоящем документе, а также мутантные полипептиды и нуклеиновые кислоты, полученные из любых организмов-источников, описанных в настоящем документе.
Приведенные в качестве примера полипептиды и нуклеиновые кислоты IDI
Полипептиды изопентенилдифосфатизомеразы (изопентенилдифосфат-дельта-изомеразы или IDI) катализируют взаимопреобразование изопентенилдифосфата (IPP) и диметилаллилдифосфата (DMAPP) (например, преобразование IPP в DMAPP и/или преобразование DMAPP в IPP). Приведенные в качестве примера полипептиды IDI включают полипептиды, фрагменты полипептидов, пептиды и слитые полипептиды, которые обладают по меньшей мере одной активностью полипептида IDI. Можно использовать стандартные методы (например, описанные в настоящем документе) для определения того, насколько полипептид обладает активностью полипептида IDI, по оценке способности полипептида катализировать взаимопреобразование IPP и DMAPP в условиях in vitro, в клеточном экстракте, или в условиях in vivo. Приведенные в качестве примера нуклеиновые кислоты IDI включают нуклеиновые кислоты, которые кодируют полипептид, фрагмент полипептида, пептид или слитый полипептид, который обладает по меньшей мере одной активностью полипептида IDI. Приведенные в качестве примера полипептиды и нуклеиновые кислоты IDI включают природные полипептиды и нуклеиновые кислоты из любых организмов-источников, описанных в настоящем документе, а также мутантные полипептиды и нуклеиновые кислоты, полученные из любых организмов-источников, описанных в настоящем документе.
Приведенные в качестве примера полипептиды и нуклеиновые кислоты пути MVA
Приведенные в качестве примера полипептиды пути MVA включают полипептиды ацетил-СоА-ацетилтрансферазы (AA-СоА-тиолазы), полипептиды 3-гидрокси-3-метилглутарил-СоА-синтазы (HMG-CoA-синтазы), полипептиды 3-гидрокси-3-метилглутарил-СоА-редуктазы (HMG-CoA-редуктазы), полипептиды мевалонаткиназы (MVK), полипептиды фосфомевалонаткиназы (PMK), полипептиды дифосфомевалонатдекарбоксилазы (MVD), полипептиды фосфомевалонатдекарбоксилазы (PMDC), полипептиды изопентенилфосфаткиназы (IPK), полипептиды IDI и полипептиды (например, слитые полипептиды), обладающие активностью двух или более полипептидов пути MVA. В частности, полипептиды пути MVA включают полипептиды, фрагменты полипептидов, пептиды и слитые полипептиды, которые обладают по меньшей мере одной активностью полипептида пути MVA. Приведенные в качестве примера нуклеиновые кислоты пути MVA включают нуклеиновые кислоты, которые кодируют полипептид, фрагмент полипептида, пептид и слитый полипептид, которые обладают по меньшей мере одной активностью полипептида пути MVA. Приведенные в качестве примера полипептиды и нуклеиновые кислоты пути MVA включают природные полипептиды и нуклеиновые кислоты из любых организмов-источников, описанных в настоящем документе, а также мутантные полипептиды и нуклеиновые кислоты, полученные из любых организмов-источников, описанных в настоящем документе.
В частности, полипептиды ацетил-СоА-ацетилтрансферазы (AA-СоА-тиолазы или ААСТ) катализируют преобразование двух молекул ацетил-СоА в ацетоацетил-СоА. Можно использовать стандартные методы (например, описанные в настоящем документе) для определения того, насколько полипептид обладает активностью полипептида AA-СоА-тиолазы, по оценке способности полипептида катализировать преобразование двух молекул ацетил-СоА в ацетоацетил-СоА в условиях in vitro, в клеточном экстракте, или в условиях in vivo.
Полипептиды 3-гидрокси-3-метилглутарил-СоА-синтазы (HMG-CoA-синтазы или HMGS) катализируют преобразование ацетоацетил-СоА в 3-гидрокси-3-метилглутарил-СоА. Можно использовать стандартные методы (например, описанные в настоящем документе) для определения того, насколько полипептид обладает активностью полипептида HMG-CoA-синтазы, по оценке способности полипептида катализировать преобразование ацетоацетил-СоА в 3-гидрокси-3-метилглутарил-СоА в условиях in vitro, в клеточном экстракте, или в условиях in vivo.
Полипептиды 3-гидрокси-3-метилглутарил-СоА-редуктазы (HMG-CoA-редуктазы или HMGR) катализируют преобразование 3-гидрокси-3-метилглутарил-СоА в мевалонат. Можно использовать стандартные методы (например, описанные в настоящем документе) для определения того, насколько полипептид обладает активностью полипептида HMG-CoA-редуктазы, по оценке способности полипептида катализировать преобразование 3-гидрокси-3-метилглутарил-СоА в мевалонат в условиях in vitro, в клеточном экстракте, или в условиях in vivo.
Полипептиды мевалонаткиназы (MVK) катализируют фосфорилирование мевалоната с образованием мевалонат-5-фосфата. Можно использовать стандартные методы (например, описанные в настоящем документе) для определения того, насколько полипептид обладает активностью полипептида MVK, по оценке способности полипептида катализировать преобразование мевалоната в мевалонат-5-фосфат в условиях in vitro, в клеточном экстракте, или в условиях in vivo.
Полипептиды фосфомевалонаткиназы (PMK) катализируют фосфорилирование мевалонат-5-фосфата с образованием мевалонат-5-дифосфата. Можно использовать стандартные методы (например, описанные в настоящем документе) для определения того, насколько полипептид обладает активностью полипептида PMK, по оценке способности полипептида катализировать преобразование мевалонат-5-фосфата в мевалонат-5-дифосфат в условиях in vitro, в клеточном экстракте, или в условиях in vivo.
Полипептиды дифосфомевалонатдекарбоксилазы (MVD или DPMDC) катализируют преобразование мевалонат-5-дифосфата в изопентенилдифосфат (IPP). Можно использовать стандартные методы (например, описанные в настоящем документе) для определения того, насколько полипептид обладает активностью полипептида MVD, по оценке способности полипептида катализировать преобразование мевалонат-5-дифосфата в IPP в условиях in vitro, в клеточном экстракте, или в условиях in vivo.
Полипептиды фосфомевалонатдекарбоксилазы (PMDC) катализируют преобразование мевалонат-5-фосфата в изопентенилфосфат (IP). Можно использовать стандартные методы (например, описанные в настоящем документе) для определения того, насколько полипептид обладает активностью полипептида PMDC, по оценке способности полипептида катализировать преобразование мевалонат-5-фосфата в IP в условиях in vitro, в клеточном экстракте, или в условиях in vivo.
Полипептиды изопентенилфосфаткиназы (IPK) катализируют фосфорилирование изопентенилфосфата (IP) с образованием изопентенилдифосфата (IPP). Можно использовать стандартные методы (например, описанные в настоящем документе) для определения того, насколько полипептид обладает активностью полипептида IPK, по оценке способности полипептида катализировать преобразование IP в IPP в условиях in vitro, в клеточном экстракте, или в условиях in vivo.
Приведенные в качестве примера полипептиды и нуклеиновые кислоты IDI описаны выше.
Приведенные в качестве примера методы выделения нуклеиновых кислот
Нуклеиновые кислоты изопренсинтазы, DXS, IDI и/или пути MVA можно выделить с использованием стандартных методов. Способы получения желаемых нуклеиновых кислот из интересующего организма-источника (такого как бактериальный геном) являются обычными и хорошо известными в области молекулярной биологии (смотри, например, международную заявку WO 2004/033646 и источники, цитированные в ней, каждый из которых в полном объеме включен в настоящий документ для сведения, в частности, в отношении выделения интересующих нуклеиновых кислот). Например, если последовательность нуклеиновой кислоты известна (в том числе, любая из известных нуклеиновых кислот, описанных в настоящем документе), то можно создать подходящие геномные библиотеки расщеплением рестриктазами и можно провести скрининг с использованием зондов, комплементарных желаемой последовательности нуклеиновой кислоты. После выделения последовательности ДНК можно амплифицировать с использованием обычных методов амплификации с направленными праймерами, таких как полимеразная цепная реакция (ПЦР) (патент США № 4683202, который в полном объеме включен в настоящий документ для сведения, в частности, в отношении методов ПЦР), с получением количеств ДНК, подходящих для трансформации с использованием соответствующих векторов.
Альтернативно нуклеиновые кислоты изопренсинтазы, DXS, IDI и/или пути MVA (например, любые нуклеиновые кислоты изопренсинтазы, DXS, IDI и/или пути MVA с известной последовательностью нуклеиновой кислоты) можно синтезировать химическим путем с использованием стандартных методов.
Дополнительные полипептиды и нуклеиновые кислоты изопренсинтазы, DXS, IDI и/или пути MVA, которые могут быть подходящими для использования в композициях и способах, описанных в настоящем документе, можно идентифицировать с применением стандартных методов. Например, можно сконструировать космидные библиотеки хромосомных ДНК организмов, о которых известно, что они продуцируют изопрен в природных условиях, в микроорганизмах, таких как E.coli, и затем подвергнуть скринингу в отношении продукции изопрена. В частности, можно создать космидные библиотеки, в которых крупные сегменты геномной ДНК (размером 35-45 т.п.н.) упаковывают в векторы и используют для трансформации подходящих хозяев. Космидные векторы являются уникальными в том плане, что они способны включать большие количества ДНК. Обычно космидные векторы содержат по меньшей мере одну копию cos-последовательности ДНК, которую требуется упаковать и провести последующую циклизацию гетерологичной ДНК. В дополнении к cos-последовательности векторы также содержат ориджин репликации, такой как ColEI, и маркеры резистентности к лекарственному препарату, такие как нуклеиновая кислота, придающая резистентность к ампициллину или неомицину. Способы использования космидных векторов для трансформации подходящих хозяев-бактерий подробно описаны Sambrook et al., Molecular Cloning: A Laboratory Manual, 2nd ed., Cold Spring Harbor, 1989, этот источник в полном объеме приведен в данном документе для сведения, в частности, в отношении методов трансформации.
Как правило, для клонирования космид гетерологичную ДНК выделяют с использованием соответствующих рестриктаз и лигируют со смежной cos-областью космидного вектора с использованием подходящих лигаз. Затем космидные векторы, содержащие линеаризованную гетерологичную ДНК, подвергают взаимодействию с носителем для упаковки ДНК, таким как бактериофаг. Во время процесса упаковки cos-сайты расщепляют и гетерологичную ДНК упаковывают в головной фрагмент вирусной частицы бактерий. Затем частицы используют для трансфекции подходящих клеток-хозяев, таких как E.coli. После инъекции в клетку гетерологичная ДНК циклизуется под влиянием липких cos-концов. Таким путем можно ввести в клетки-хозяева и экспрессировать в них крупные сегменты ДНК.
Дополнительные методы получения нуклеиновых кислот изопренсинтазы, DXS, IDI и/или пути MVA включают скрининг метагеномной библиотеки анализом (такой как метод анализа пространства над жидкостью, описанный в настоящем документе) или ПЦР с использованием праймеров, направленных к нуклеотидам, кодирующим длину консервативных аминокислот (например по меньшей мере 3 консервативные аминокислоты). Консервативные аминокислоты можно идентифицировать выравниванием аминокислотных последовательностей известных полипептидов изопренсинтазы, DXS, IDI и/или пути MVA. Консервативные аминокислоты для полипептидов изопренсинтазы можно идентифицировать на основе подвергшихся выравниванию последовательностей известных полипептидов изопренсинтазы. Организм, для которого установлено, что он в природных условиях продуцирует изопрен, можно подвергнуть стандартным методам очистки белков (которые хорошо известны в данной области) и полученный очищенный полипептид можно секвенировать с использованием стандартных методов. В литературе описаны другие методы (смотри, например, Julsing et al., Applied Microbiol. Biotechnol., 75:1377-84, 2007; Withers et al., Appl. Environ. Microbiol., 73(19):6277-83, 2007; каждый из этих источников в полном объеме включен в документ для сведения, в частности, в отношении идентификации нуклеиновых кислот, принимающих участие в синтезе изопрена).
Дополнительно можно использовать стандартные программы выравнивания последовательностей и/или предсказания структуры для идентификации дополнительных полипептидов и нуклеиновых кислот изопренсинтазы, DXS, IDI и/или пути MVA, основанные на сходстве их первичной и/или предсказанной вторичной структуры с известными полипептидами и нуклеиновыми кислотами изопренсинтазы, DXS, IDI и/или пути MVA. Также можно использовать стандартные базы данных, такие как база данных swissprot-trembl (всемирный сайт «expasy.org», Swiss Institute of Bioinformatics Swiss-Prot group CMU-1 rue Michel Servet CH-1211, Женева 4, Швейцария), для идентификации полипептидов и нуклеиновых кислот изопренсинтазы, DXS, IDI и/или пути MVA. Можно прогнозировать вторичную и/или третичную структуру полипептида изопренсинтазы, DXS, IDI и/или пути MVA с использованием дефолтов в стандартных прогностических программах, таких как PredictProtein (630 West, 168 Street, BB217, New York, N.Y. 10032, США). Альтернативно можно определить фактическую вторичную и/или третичную структуру полипептида изопренсинтазы, DXS, IDI и/или пути MVA с использованием обычных методов. Также можно идентифицировать дополнительные нуклеиновые кислоты изопренсинтазы, DXS, IDI и/или пути MVA посредством гибридизации с зондами, полученными из известных нуклеиновых кислот изопренсинтазы, DXS, IDI и/или пути MVA.
Приведенные в качестве примера промоторы и векторы
Любую из нуклеиновых кислот изопренсинтазы, DXS, IDI и/или пути MVA, описанных в настоящем документе, можно включить в один или более векторов. Следовательно, изобретение относится к векторам с одной или более нуклеиновых кислот, кодирующих любой из пептидов изопренсинтазы, DXS, IDI и/или пути MVA, описанных в настоящем документе. В том смысле, в котором термин «вектор» используется в настоящем документе, он означает конструкцию, которая способна доставлять и желательно экспрессировать одну или более интересующих нуклеиновых кислот в клетке-хозяине. Примеры векторов включают, не ограничиваясь этим, плазмиды, вирусные векторы, ДНК или РНК экспрессирующие векторы, космиды и фаговые векторы. В некоторых вариантах осуществления вектор содержит нуклеиновую кислоту под контролем регулирующей экспрессию последовательности.
В том смысле, в котором термин «регулирующая экспрессию последовательность» используется в настоящем документе, он означает последовательность нуклеиновой кислоты, которая регулирует транскрипцию интересующей нуклеиновой кислоты. Регулирующая экспрессию последовательность может представлять собой промотор, такой как конститутивный или индуцируемый промотор, или энхансер. «Индуцируемый промотор» представляет промотор, который становится активным под воздействием факторов окружающей среды или развития. Регулирующая экспрессию последовательность функционально связана с сегментом нуклеиновой кислоты, который транскрибируется.
В некоторых вариантах осуществления вектор содержит селективный маркер. Термин «селективный маркер» относится к нуклеиновой кислоте, способной экспрессироваться в клетке-хозяине, который позволяет легко отбирать клетки-хозяева, содержащие введенную нуклеиновую кислоту или вектор. Примеры подходящих селективных маркеров включают, не ограничиваясь этим, нуклеиновые кислоты, придающие резистентность к антибиотикам (например, канамицину, ампициллину, карбенициллину, гентамицину, гигромицину, флеомицину, блеомицину, неомицину или хлорамфениколу) и/или нуклеиновые кислоты, которые придают метаболическое преимущество, такое как питательное преимущество клетке-хозяину. Приведенные в качестве примера селективные маркеры включают маркеры, известные в данной области, такие как amdS, argB и pyr4. В данной области известны маркеры, подходящие для векторных систем в целях трансформации Trichoderma (смотри, например, Finkelstein, chapter 6 в Biotechnology of Filamentous Fungi, Finkelstein et al., Eds., Butterworth-Heinemann, Boston, MA, Chap. 6, 1992; и Kinghorn et al., Applied Molecular Genetics of Filamentous Fungi, Blackie Academic and Professional, Chapman and Hall, London, 1992, каждый из этих источников в полном объеме включен в настоящий документ для сведения, в частности, в отношении селективных маркеров). В некоторых вариантах осуществления селективный маркер представляет нуклеиновую кислоту amdS, которая кодирует фермент ацетамидазу, что позволяет трансформированным клеткам расти на ацетамиде в качестве источника азота. Применение нуклеиновой кислоты A. nidulans amdS в качестве селективного маркера описано Kelley et al., EMBO J., 4:475-479, 1985 и Penttila et al., Gene, 61:155-164, 1987 (каждый из этих источников в полном объеме включен в настоящий документ для сведения, в частности, в отношении селективных маркеров). В некоторых вариантах осуществления нуклеиновая кислота изопренсинтазы, DXS, IDI и/или пути MVA интегрирует в хромосому клеток без селективного маркера.
Подходящими векторами являются векторы, которые совместимы с используемой клеткой-хозяином. Подходящие векторы можно получить, например, из бактерии, вируса (такого как бактериофаг Т7 или М-13 фага), космиды, дрожжей или растения. В данной области известны протоколы получения и применения таких векторов (смотри, например, Sambrook et al., Molecular Cloning: A Laboratory Manual, 2nd ed., Cold Spring Harbor, 1989, этот источник в полном объем включен в настоящий документ для сведения, в частности, в отношении применения векторов).
В данной области хорошо известны промоторы. Любой промотор, который функционирует в клетке-хозяине, можно использовать для экспрессии нуклеиновой кислоты изопренсинтазы, DXS, IDI и/или пути MVA в клетке-хозяине. Области инициации регуляции или промоторы, подходящие для регуляции экспрессии нуклеиновых кислот изопренсинтазы, DXS, IDI и/или пути MVA в различных клетках-хозяевах, весьма многочисленны и известны специалистам в данной области (смотри, например, международную заявку WO 2004/033646 и цитированные в ней источники, каждый из которых в полном объеме включен в настоящий документ для сведения, в частности, в отношении векторов для экспрессии интересующих нуклеиновых кислот). В конечном итоге любой промотор, способный регулировать экспрессию данных нуклеиновых кислот, подходит для настоящего изобретения, включая, не ограничиваясь этим, CYC1, HIS3, GAL1, GAL10, ADH1, PGK, PHO5, GAPDH, ADCI, TRP1, URA3, LEU2, ENO и TPI (подходящие для экспрессии в Saccharomyces); AOX1 (подходящий для экспрессии в Pichia); и lac, trp, λPL, λPR, T7, tac и trc (подходящие для экспрессии в E.coli).
В некоторых вариантах осуществления используют промотор глюкозизомеразы (смотри, например, патент США № 7132527 и цитированные в нем источники, каждый из которых в полном объеме включен в настоящий документ для сведения, в частности, в отношении промоторов и плазмидных систем для экспрессии интересующих полипептидов). Можно использовать промотор мутантной глюкозизомеразы, о котором сообщалось в литературе, для изменения уровня экспрессии полипептида, кодированного нуклеиновой кислотой, функционально связанной с промотором глюкозизомеразы (патент США № 7132527). В различных вариантах осуществления промотор глюкозизомеразы находится в низко-, средне- или высококопийной плазмиде (патент США № 7132527).
В различных вариантах осуществления нуклеиновая кислота изопренсинтазы, DXS, IDI и/или пути MVA находится в низкокопийной плазмиде (например, плазмиде, которая поддерживается на уровне примерно от 1 до примерно 4 копий на клетку), среднекопийной плазмиде (например, плазмиде, которая поддерживается на уровне примерно от 10 до примерно 15 копий на клетку) или высококопийной плазмиде (например, плазмиде, которая поддерживается на уровне примерно от 50 или более копий на клетку). В некоторых вариантах осуществления гетерологичная или экстра-эндогенная нуклеиновая кислота изопренсинтазы, DXS, IDI и/или пути MVA функционально связана с Т7-промотором. В некоторых вариантах осуществления гетерологичная или экстра-эндогенная нуклеиновая кислота изопренсинтазы, DXS, IDI и/или пути MVA, функционально связанная с Т7-промотором, находится в средне- или высококопийной плазмиде. В некоторых вариантах осуществления гетерологичная или экстра-эндогенная нуклеиновая кислота изопренсинтазы, DXS, IDI и/или пути MVA функционально связана с Trc-промотором. В некоторых вариантах осуществления гетерологичная или экстра-эндогенная нуклеиновая кислота изопренсинтазы, DXS, IDI и/или пути MVA, функционально связанная с Trc-промотором, находится в средне- или высококопийной плазмиде. В некоторых вариантах осуществления гетерологичная или экстра-эндогенная нуклеиновая кислота изопренсинтазы, DXS, IDI и/или пути MVA функционально связана с Lac-промотором. В некоторых вариантах осуществления гетерологичная или экстра-эндогенная нуклеиновая кислота изопренсинтазы, DXS, IDI и/или пути MVA, функционально связанная с Lac-промотором, находится в низкокопийной плазмиде. В некоторых вариантах осуществления гетерологичная или экстра-эндогенная нуклеиновая кислота изопренсинтазы, DXS, IDI и/или пути MVA функционально связана с эндогенным промотором, таким как эндогенный промотор Escherichia, Panteoa, Bacillus, Yarrowia, Streptomyces или Trichoderma или эндогенным промотором щелочной серинпротеазы, изопренсинтазы, DXS, IDI и/или пути MVA. В некоторых вариантах осуществления гетерологичная или экстра-эндогенная нуклеиновая кислота изопренсинтазы, DXS, IDI и/или пути MVA, функционально связанная с эндогенным промотором, находится в высококопийной плазмиде. В некоторых вариантах осуществления вектор представляет собой реплицирующуюся плазмиду, которая не интегрирует в хромосому клеток. В некоторых вариантах осуществления часть или весь вектор интегрирует в хромосому клеток.
В некоторых вариантах осуществления вектор представляет любой вектор, который при введении в грибковую клетку-хозяин интегрирует в геном клетки-хозяина и реплицируется. Перечень таких векторов приведен в Fungal Genetics Stock Center Catalogue of Strains (FGSC, всемирный сайт «fgsc.net» и в цитированных на нем источниках, в частности, в отношении векторов). Дополнительные примеры подходящих экспрессирующих и/или интегрирующих векторов приведены у Sambrook et al., Molecular Cloning: A Laboratory Manual, 2nd ed., Cold Spring Harbor, 1989, Current Protocols in Molecular Biology (F.M. Ausubel et al. (eds), 1987, Supplement 30, section 7.7.18); van den Hondel et al., in Bennett and Lasure (Eds.) More Gene Manipulation in Fungi, Academic Press, pp. 396-428, 1991; и в патенте США № 5874276, каждый из этих источников в полном объеме включен в настоящий документ для сведения, в частности, в отношении векторов. Особенно подходящими векторами являются pFB6, pBR322, PUC18, pUC100 и pENTR/D.
В некоторых вариантах осуществления нуклеиновая кислота изопренсинтазы, DXS, IDI и/или пути MVA функционально связана с подходящим промотором, который проявляет транскрипционную активность в грибковой клетке-хозяине. Промотор можно получить из одной или более нуклеиновых кислот, кодирующих полипептид, который является эндогенным или гетерологичным для клетки-хозяина. В некоторых вариантах осуществления промотор подходит для хозяина Trichoderma. Подходящие, не ограничивающие примеры промоторов включают cbh1, cbh2, egl1, egl2, pepA, hfb1, hfb2, xyn1 и amy. В некоторых вариантах осуществления промотор представляет промотор, который является природным для клетки-хозяина. Например, в некоторых вариантах осуществления, если хозяином является T. reesei, то промотор является природным для T. reesei промотор. В некоторых вариантах осуществления промотор представляет cbh1 T. reesei, который представляет индуцируемый промотор и он находится в GenBank под инвентарным номером D86235, который в полном объеме включен в настоящий документ для сведения, в частности, в отношении промоторов. В некоторых вариантах осуществления промотор представляет промотор, который является гетерологичным для грибковой клетки-хозяина. Другие примеры подходящих промоторов включают промоторы генов глюкоамилазы родов A. awamori и A. niger (glaA) (Nunberg et al., Mol. Cell Biol., 4:2306-2315, 1984 и Boel et al., EMBO J., 3:1581-1585, 1984, каждый из этих источников в полном объеме включен в настоящий документ для сведения, в частности, в отношении промоторов); альфа-амилаз Aspergillus niger, ТАКА-амилазы Aspergillus oryzae, xln1 T. reesei и целлобиогидролазы 1 T. reesei (Европейский патент 137280, который в полном объеме включен в настоящий документ для сведения, в частности, в отношении промоторов).
В некоторых вариантах осуществления экспрессирующий вектор также включает последовательность терминации транскрипции. Регуляторные области терминации транскрипции также могут происходить из различных генов, природных для клетки-хозяина. В некоторых вариантах осуществления последовательность терминации транскрипции и промоторная последовательность получены из одного источника. В другом варианте осуществления последовательность терминации транскрипции является эндогенной для клетки-хозяина. Особенно подходящей последовательностью терминатора является последовательность cbh1 из штамма Trichoderma (такого как T. reesei). Другие подходящие грибковые терминаторы включают терминатор из нуклеиновой кислоты глюкоамилазы A. niger или A. awamori (Nunberg et al., Mol. Cell Biol., 4:2306-2315, 1984 и Boel et al., EMBO J., 3:1581-1585, 1984; каждый из этих источников в полном объеме включен в настоящий документ для сведения, в частности, в отношении грибковых терминаторов). Необязательно может быть включен сайт терминации транскрипции. Для эффективной экспрессии полипептидов ДНК, кодирующую полипептид, функционально связывают через кодоны инициации с выбранными регулирующими экспрессию областями таким образом, что экспрессия приводит к образованию соответствующей мРНК.
В некоторых вариантах осуществления промотор, кодирующая область и терминатор все происходят из нуклеиновой кислоты изопренсинтазы, DXS, IDI и/или пути MVA, предназначенной для экспрессии. В некоторых вариантах осуществления кодирующую область нуклеиновой кислоты изопренсинтазы, DXS, IDI и/или пути MVA вставляют в многоцелевой экспрессирующий вектор таким образом, что он находится под транскрипционным контролем промотора и терминатора в конструкции для экспрессии. В некоторых вариантах осуществления гены или их фрагмент вставляют справа от сильного промотора cbh1.
Нуклеиновую кислоту изопренсинтазы, DXS, IDI и/или пути MVA можно вставить в вектор, такой как экспрессирующий вектор, с использованием обычных методов (Sambrook et al., Molecular Cloning: A Laboratory Manual, 2nd ed., Cold Spring Harbor, 1982, этот источник в полном объеме включен в настоящий документ для сведения, в частности, в отношении скрининга подходящих последовательностей ДНК и конструирования векторов). Способы, используемые для лигирования конструкции ДНК, содержащей интересующую нуклеиновую кислоту (такую как нуклеиновая кислота изопренсинтазы, DXS, IDI и/или пути MVA), промотор, терминатор транскрипции и другие последовательности и их вставки в подходящий вектор, хорошо известны в данной области. Например, можно использовать рестриктазы для расщепления нуклеиновой кислоты изопренсинтазы, DXS, IDI и/или пути MVA и вектора. Затем совместимые концы расщепленной нуклеиновой кислоты изопренсинтазы, DXS, IDI и/или пути MVA и расщепленного вектора можно лигировать. Как правило, связывание проводят лигированием по соответствующим сайтам рестрикции. В том случае, когда такие сайты отсутствуют, то используют синтетические олигонуклеотидные линкеры в соответствии с принятой в таких случаях практикой (смотри Sambrook et al., Molecular Cloning: A Laboratory Manual, 2nd ed., Cold Spring Harbor, 1989 и Bennett and Lasure, More Gene Manipulations in Fungi, Academic Press, San Diego, pp. 70-76, 1991, каждый из этих источников в полном объеме включен в настоящий документ для сведения, в частности, в отношении олигонуклеотидных линкеров). Кроме того, векторы можно сконструировать с использованием известных методов рекомбинации (например, Invitrogen Life Technologies, Gateway Technology).
В некоторых вариантах осуществления может быть желательным сверхэкспрессировать нуклеиновые кислоты изопренсинтазы, DXS, IDI и/или пути MVA на уровнях, существенно превышающих таковые в клетках в природных условиях. Данного результата можно достичь селективным клонированием нуклеиновых кислот, кодирующих полипептиды, в многокопийные плазмиды или помещением данных нуклеиновых кислот под контролем сильного индуцируемого или конститутивного промотора. Способы сверхэкспрессии желаемых полипептидов являются обычными и хорошо известными в области молекулярной биологии и их примеры можно найти у Sambrook et al., Molecular Cloning: A Laboratory Manual, 2nd ed., Cold Spring Harbor, 1989, этот источник включен в настоящий документ для сведения, в частности, в отношении методов клонирования, в полном объеме.
Другие источники включают описание дополнительной общей методологии, подходящей для применения в изобретении: Kreigler, Gene Transfer and Expression; A Laboratory Manual, 1990 и Ausubel et al., Eds., Current Protocols in Molecular Biology, 1994, каждый из этих источников в полном объеме включен в настоящий документ для сведения, в частности, в отношении молекулярной биологии и методов клонирования.
Приведенные в качестве примера организмы-источники
Нуклеиновые кислоты изопренсинтазы, DXS, IDI и/или пути MVA (и кодированные ими полипептиды) можно получить из любого организма, который в природных условиях содержит нуклеиновые кислоты изопренсинтазы, DXS, IDI и/или пути MVA. Как уже указывалось выше, изопрен продуцируется в природных условиях различными организмами, такими как бактерии, дрожжи, растения и животные. Организмы включают путь MVA, путь DXP или оба пути MVA и DXP для продукции изопрена (фигура 19). Таким образом, нуклеиновые кислоты DXS можно получить, например, из любого организма, который включает путь DXP или включает оба пути MVA и DXP. Нуклеиновые кислоты IDI и изопренсинтазы можно получить, например, из организма, который содержит путь MVA, путь DXP или оба пути MVA и DXP. Нуклеиновые кислоты пути MVA можно получить, например, из организма, который содержит путь MVA или содержит оба пути MVA и DXP.
В некоторых вариантах осуществления последовательность нуклеиновой кислоты изопренсинтазы, DXS, IDI и/или пути MVA является идентичной последовательности нуклеиновой кислоты, которая продуцируется любым из следующих организмов в природе. В некоторых вариантах осуществления аминокислотная последовательность полипептида изопренсинтазы, DXS, IDI или пути MVA является идентичной последовательности полипептида, который продуцируется любым из следующих организмов в природе. В некоторых вариантах осуществления нуклеиновая кислота или полипептид изопренсинтазы, DXS, IDI и/или пути MVA представляют собой мутантную нуклеиновую кислоту или полипептид, полученные из любого из организмов, описанных в настоящем документе. В том смысле, в котором термин «полученный из» используется в настоящем документе, он относится к нуклеиновой кислоте или полипептиду, в которые введена одна или более мутаций. Например, полипептид, который «получен из растительного полипептида» относится к интересующему полипептиду, который получен в результате введения одной или более мутаций в последовательность дикого типа (т.е. последовательность, имеющуюся в природе) растительного полипептида.
В некоторых вариантах осуществления организм-источник представляет собой гриб, примерами которого являются виды Aspergillus, такие как A. oryzae и A. niger, виды Saccharomyces, такие как S. cerevisiae, виды Schizosaccharomyces, такие как S. pombe и виды Trichoderma, такие как T. reesei. В некоторых вариантах осуществления организм-источник представляет клетку нитчатого гриба. Термин «нитчатые грибы» относится ко всем нитчатым формам подгруппы Eumycotina (смотри, Alexopoulos C.J., 1962, Introductory Mycology, Wiley, New York). Грибы характеризуются наличием вегетативного мицелия с клеточной стенкой, состоящей из хитина, целлюлозы и других сложных полисахаридов. Нитчатые грибы по морфологии, физиологии и генетике отличаются от дрожжей. Вегетативный рост нитчатых грибов происходит за счет удлинения гифов и катаболизм углерода является обязательно аэробным. Родительская клетка нитчатого гриба может быть клеткой видов, не ограничиваясь этим, Trichoderma (например, Trichoderma reesei, неполовая форма Hypocrea jecorina, ранее классифицированная как T. longibrachiatum, Trichoderma viride, Trichoderma koningii, Trichoderma harzianum) (Sheir-Neirs et al., Appl. Microbiol. Biotechnol., 20:46-53, 1984; ATCC № 56765 и ATCC № 26921); Penicillium sp., Humicola sp. (например, H. insolens, H. lanuginose или H. grisea); Chrysosporium sp. (например, C. lucknowense), Gliocladium sp., Aspergillus sp. (например, A. oryzae, A. niger, A. sojae, A. japonicus, A. nidulans или A. awamori) (Ward et al., Appl. Microbiol. Biotechnolog., 39:7380743, 1993 и Goedegebuur et al., Genet., 41:89-98, 2002), Fusarium sp. (например, F. roseum, F. graminum, F. cerealis или F. venenatum), Neurospora sp. (например, N. crassa), Hypocrea sp., Mucor. sp. (например, M. miehei), Rhizopus sp. и Emericella sp. (смотри также Innis et al., Sci., 228:21-26, 1985). Термины «Trichoderma» или «Trichoderma sp.» или «Trichoderma spp.» относятся к любому роду грибов, ранее или в настоящее время отнесенных к Trichoderma.
В некоторых вариантах осуществления гриб представляет A. nidulans, A. awamori, A. oryzae, A. aculeatus, A. niger, A. japonicus, T. reesei, T. viridae, F. oxysporum или F. solani. Штаммы Aspergillus раскрыты Ward et al., Appl. Microbiol. Biotechnol., 39:738-743, 1993 и Goedergebuur et al., Curr. Gene, 41:89-98, 2002, каждый из этих источников в полном объеме включен в настоящий документ для сведения, в частности, в отношении грибов. В конкретных вариантах осуществления гриб представляет штамм Trichoderma, такой как штамм T. reesei. Штаммы T. reesei являются известными и не ограничивающие примеры данных штаммов включают АТСС № 13631, АТСС № 26921, АТСС № 56764, АТСС № 56765, АТСС № 56767 и NRRL 15709, каждый из этих источников в полном объеме включен в настоящий документ для сведения, в частности, в отношении штаммов T. reesei. В некоторых вариантах осуществления штамм-хозяин является производным RL-P37. Штамм RL-P37 раскрыт Sheir-Neiss et al., Appl. Microbiol. Biotechnol., 20:46-53, 1984, этот источник в полном объеме включен в настоящий документ для сведения, в частности, в отношении штаммов T. reesei.
В некоторых вариантах осуществления организм-источник представляет дрожжи, такие как Saccharomyces sp., Schizosaccharomyces sp., Pichia sp. или Candida sp.
В некоторых вариантах осуществления организм-источник представляет собой бактерию, такую как штаммы Bacillus, такие как B. lichenformis или B. subtilis, штаммы Pantoea, такие как P. citrea, штаммы Pseudomonas, такие как P. alcaligenes, штаммы Streptomyces, такие как S. albus, S. lividans или S. rubiginosus, или штаммы Escherichia, такие как E.coli.
В том смысле, в котором термин «род Bacillus» используется в настоящем документе, он включает все виды рода «Bacillus», известные специалистам в данной области, включая, не ограничиваясь этим, B. subtilis, B. licheniformis, B. lentus, B. brevis, B. stearothermophilus, B. alkalophilus, B. amyloliquefaciens, B. clausii, B. halodurans, B. megaterium, B. coagulans, B. circulans, B. lautus и B. thuringiensis. Известно, что род Bacillus продолжает подвергаться таксономической реорганизации. Таким образом, полагается, что род включает виды, классификация которых была пересмотрена, включая, не ограничиваясь этим, такие микроорганизмы, как B. stearothermophilus, которые в настоящее время называются «Geobacillus stearothermophilus». Полагается, что продукция резистентных эндоспор в присутствии кислорода является определяющим признаком рода Bacillus, хотя, данный признак и также относится к недавно названным Alicyclobacillus, Amphibacillus, Aneurinibacillus, Anoxybacillus, Brevibacillus, Filobacillus, Gracilibacillus, Halobacillus, Paenibacillus, Salibacillus, Thermobacillus, Ureibacillus и Virgibacillus.
В некоторых вариантах осуществления организм-источник представляет собой грамположительную бактерию. Не ограничивающие примеры включают штаммы Streptomyces (например, S. albus, S. lividans, S. coelicolor или S. griseus) и Bacillus. В некоторых вариантах осуществления организм-источник представляет грамотрицательную бактерию, такую как E.coli или Pseudomonas sp.
В некоторых вариантах осуществления организм-источник является растением, таким как растение из семейства Fabaceae, например, из подсемейства Faboideae. В некоторых вариантах осуществления организм-источник представляет кудзу, тополь (такой как Populus alba×tremula CAC35696 или Populus alba) (Sasaki et al., FEBS Letters, 579(11):2514-2518, 2005), осина (такая как Populus tremuloides) или английский дуб Quercus robur.
В некоторых вариантах осуществления организм-источник представляет собой водоросли, такие как зеленые водоросли, красные водороли, глаукофиты, хлорарахниофиты, эвглениды, хромисты или динофлагеллаты.
В некоторых вариантах осуществления организм-источник представляет собой цианобактерии, такие как цианобактерии, входящие в любую их следующих групп, где классификация основана на морфологии, Chroococales, Pleurocapsales, Oscillatoriales, Nostocales или Stigonematales.
Приведенные в качестве примера клетки-хозяева
Для экспрессии полипептидов изопренсинтазы, DXS, IDI и/или пути MVA и продукции изопрена в способах по заявленному изобретению можно использовать различные клетки-хозяева. Приведенные в качестве примера клетки-хозяева включают клетки любых организмов, перечисленных в предшествующем разделе под заголовком «Приведенные в качестве примера организмы-источники». Клетка-хозяин может представлять клетку, которая продуцирует изопрен в природных условиях, или клетку, которая не продуцирует изопрен в природных условиях. В некоторых вариантах осуществления клетка-хозяин продуцирует изопрен в природных условиях, используя путь DXP, и нуклеиновую кислоту изопренсинтазы, DXS и/или IDI добавляют в целях усиления продукции изопрена, используя данный путь. В некоторых вариантах осуществления клетка-хозяин продуцирует изопрен в природных условиях, используя путь MVA, и нуклеиновую кислоту изопренсинтазы и/или одну или более нуклеиновых кислот пути MVA добавляют в целях усиления продукции изопрена, используя данный путь. В некоторых вариантах осуществления клетка-хозяин продуцирует изопрен в природных условиях, используя путь DXP, и одну или более нуклеиновых кислот пути MVA добавляют для продукции изопрена, используя часть или весь путь MVA, а также путь DXP. В некоторых вариантах осуществления клетка-хозяин продуцирует изопрен в природных условиях, используя оба пути DXP и MVA, и одну или более нуклеиновых кислот изопренсинтазы, DXS, IDI или пути MVA добавляют в целях усиления продукции изопрена, используя один или оба данных путей.
Приведенные в качестве примера методы трансформации
Нуклеиновые кислоты изопренсинтазы, DXS, IDI и/или пути MVA и/или векторы, содержащие их, можно вставить в клетку-хозяин (например, растительную клетку, грибковую клетку, дрожжевую клетку или бактериальную клетку, описанные в настоящем документе) с использованием стандартных методов для экспрессии кодированного полипептида изопренсинтазы, DXS, IDI и/или пути MVA. Введение ДНК-конструкции или вектора в клетку-хозяин можно осуществить с использованием методов, таких как трансформация, электропорация, микроинъекция в ядро, трансдукция, трансфекция (например, метод липофекции или опосредованная DEAE-декстрином трансфекция, или трансфекция, при которой используется рекомбинантный фаговый вирус), инкубация с осадком ДНК в присутствии фосфата кальция, бомбардировка с высокой скоростью покрытых ДНК микропулями и слияние протопласта. В данной области известны общие способы трансформации (смотри, например, Current Protocols in Molecular Biology (F.M.Ausubel et al. (eds), Chapter 9, 1987; Sambrook et al., Molecular Cloning: A Laboratory Manual, 2nd ed., Cold Spring Harbor, 1989 и Campbell et al., Curr. Genet., 16:53-56, 1989, каждый из этих источников в полном объеме включен в настоящий документ для сведения, в частности, в отношении методов трансформации). Экспрессия гетерологичного полипептида в Trichoderma описана в патенте США № 6022725; патенте США № 6268328; патенте США № 7262041; международной заявке WO 2005/001036; Harkki et al., Enzyme Microb. Technol., 13:227-233, 1991; Harkki et al., Bio. Technol., 7:596-603, 1989; в Европейском патенте ЕР 244234; ЕР 215594 и Nevalainen et al., «The Molecular Biology of Trichoderma and its Application to the Expression of Both Homologous and Heterologous Genes» in Molecular Industrial Mycology, Eds., Leong and Berka, Marcel Dekker Inc., NY, pp. 129-148, 1992, каждый из этих источников в полном объеме включен в настоящий документ для сведения, в частности, в отношении методов трансформации и экспрессии). Также делается ссылка на Cao et al. (Sci. 9:991-1001, 2000; Европейский патент 238023 и Yelton et al., Proceedings Natl. Acad. Sci. USA, 81:1470-1474, 1984 (каждый из этих источников в полном объеме включен в настоящий документ для сведения, в частности, в отношении методов трансформации) для трансформации штаммов Aspergillus. Введенные нуклеиновые кислоты можно интегрировать в хромосомную ДНК или поддерживать в виде внехромосомных реплицирующихся последовательностей.
Для отбора трансформантов можно использовать любой метод, известный в данной области. В одном, не ограничивающем примере стабильные трансформанты, содержащие маркер amdS, отличают от нестабильных трансформантов по их более быстрому росту и образованию округлых колоний не с гладкими, в большей степени неровными краями, на твердой культуральной среде, содержащей ацетамид. Кроме того, в некоторых случаях проводят дополнительное тестирование стабильности культивированием трансформантов на твердой неселективной среде (например, на среде, в которой отсутствует ацетамид), сбором спор с данной культуральной среды и определением процента спор, которые затем будут развиваться и расти на селективной среде, содержащей ацетамид.
В некоторых вариантах осуществления грибковые клетки трансформируют методом, включающим образование протопластов и трансформацию протопластов с последующей регенерацией клеточной стенки известным способом. В одном конкретном варианте осуществления процесс приготовления Trichoderma sp. для трансформации включает получение протопластов из грибкового мицелия (смотри Campbell et al., Curr. Genet., 16:53-56, 1989, этот источник в полном объеме включен в настоящий документ для сведения, в частности, в отношении методов трансформации). В некоторых вариантах осуществления мицелий получают из развившихся вегетативных спор. Мицелий обрабатывают ферментом, который разрушает клеточную стенку, приводя к получению протопластов. Затем протопласты защищают с помощью осмотического стабилизатора в суспензионной среде. Стабилизаторы включают сорбит, маннит, хлорид калия, сульфат магния и тому подобнее. Обычно концентрация данных стабилизаторов варьирует в пределах от 0,8 М до 1,2 М. Желательно использовать примерно 1,2 М раствора сорбита в суспензионной среде.
Поглощение ДНК штаммом-хозяином Trichoderma sp. зависит от концентрации ионов кальция. Как правило, используют примерно от 10 мМ CaCl2 до примерно 50 мМ CaCl2 в растворе для поглощения. В дополнении к ионам кальция в раствор для поглощения включают другие соединения: буферную систему, такую как ТЕ буфер (10 мМ Трис, рН 7,4; 1 мМ ЭДТА) или 10 мМ буфер MOPS, рН 6,0 (морфолинпропансульфоновая кислота) и полиэтиленгликоль (ПЭГ). Не намереваясь связываться с какой-либо теорией, полагается, что полиэтиленгликоль функционирует с обеспечением слияния клеточных мембран, позволяя таким путем содержимому среды проникать в цитоплазму клеток штамма Trichoderma sp. и плазмидной ДНК переноситься в ядро. Часто данное слияние приводит к интеграции многочисленных копий плазмидной ДНК в хромосому хозяина.
Обычно суспензию, содержащую протопласты или клетки Trichoderma sp., которые подверглись обработке с целью усиления проницаемости с титром от 105 до 107/мл (например, 2×106/мл), используют для трансформации. Объем 100 мкл данных протопластов или клеток в соответствующем растворе (например, в 1,2 М растворе сорбита и 50 мМ CaCl2) смешивают с желаемой ДНК. Как правило, в раствор для поглощения добавляют ПЭГ в высокой концентрации. К суспензии протопластов можно добавить от 0,1 до 1 объема 25% ПЭГа 4000. В некоторых вариантах осуществления в суспензию протопластов вносят примерно 0,25 объемов. К раствору для поглощения также можно добавить такие дополнительные соединения, как диметилсульфоксид, гепарин, спермидин, хлорид кальция и тому подобное и способствовать трансформации. Имеются аналогичные методы для других грибковых клеток-хозяев (смотри, например, патенты США № 6022725 и 6268328, которые в полном объеме включены в настоящий документ для сведения, в частности, в отношении методов трансформации).
Затем обычно смесь культивируют при температуре примерно 0°С в течение примерно от 10 до 30 мин. Затем в смесь вносят дополнительное количество ПЭГа в целях дальнейшего усиления поглощения желаемой последовательности нуклеиновой кислоты. Как правило, 25% ПЭГ 4000 вносят в объеме, в 5-15 раз превышающем объем смеси для трансформации; однако могут быть подходящими большие или меньшие объемы. Желательно, чтобы объем 25% ПЭГа 4000 примерно в 10 раз превышал объем смеси для трансформации. После внесения ПЭГа смесь для трансформации культивируют при комнатной температуре или на льду перед внесением раствора сорбита и CaCl2. Затем суспензию протопластов вносят в алквотные порции расплавленной культуральной среды. В том случае, когда культуральная среда содержит ростовой маркер для отбора (например, ацетамид или антибиотик), то он позволяет расти только трансформантам.
Трансформацию бактериальных клеток можно проводить, следуя обычным методам, например, описанным Sambrook et al., Molecular Cloning: A Laboratory Manual, Cold Spring Harbor, 1982, этот источник в полном объеме включен в настоящий документ для сведения, в частности, в отношении методов трансформации.
Приведенные в качестве примера среды для клеточных культур
Также изобретение относится к клетке или популяции клеток в культуре, продуцирующим изопрен. Под термином «клетки в культуре» понимается две или более клеток в растворе (например, клеточной среде), которые позволяют клеткам проходить одно или более клеточных делений. Выражение «клетки в культуре» не включает растительные клетки, которые являются частью живого, многоклеточного растения, содержащего клетки, которые дифференцированы на ткани растения. В различных вариантах осуществления клеточные культуры содержат по меньшей мере или примерно 10, 20, 50, 100, 200, 500, 1000, 5000, 10000 или более клеток.
Для культивирования клеток-хозяев можно использовать любой источник углерода. Термин «источник углерода» относится к одному или более углеродсодержащим соединениям, способным метаболизироваться клеткой-хозяином или организмом. Например, культуральная среда, используемая для культивирования клеток-хозяев, может содержать любой источник углерода, подходящий для поддержания жизнеспособности или роста клеток-хозяев.
В некоторых вариантах осуществления источник углерода представляет собой углевод (такой как моносахарид, дисахарид, олигосахарид или полисахарид), инвертированный сахар (например, обработанный ферментом сироп сахарозы), глицерол, глицерин (например, побочный продукт глицерина, образующийся в производстве биотоплива или мыла), дигидроксиацетон, одноуглеродное соединение, масло (например, растительное масло или масло растений, такое как кукурузное, пальмовое или соевое масло), ацетат, животный жир, животное масло, жирную кислоту (например, насыщенную жирную кислоту, ненасыщенную жирную кислоту или полиненасыщенную жирную кислоту), липид, фосфолипид, глицеролипид, моноглицерид, диглицерид, триглицерид, полипептид (например, бактериальный или растительный белок или пептид), восстанавливаемый источник углерода (например, источник углерода на основе биомассы, такой как источник углерода на основе гидролизованной биомассы), дрожжевой экстракт, компонент дрожжевого экстракта, полимер, кислоту, спирт, альдегид, кетон, аминокислоту, сукцинат, лактат, ацетат, этанол или любую комбинацию двух или более перечисленных выше источников. В некоторых вариантах осуществления источник углерода представляет продукт фотосинтеза, включая, не ограничиваясь этим, глюкозу. В некоторых вариантах осуществления углевод представляет ксилозу или глюкозу.
Приведенные в качестве примера моносахариды включают глюкозу и фруктозу; приведенные в качестве примера олигосахариды включают лактозу и сахарозу; и приведенные в качестве примера полисахариды включают крахмал и целлюлозу. Приведенные в качестве примера углеводы включают С6-сахара (например, фруктозу, маннозу, галактозу или глюкозу) и С5-сахара (например, ксилозу или арабинозу). В некоторых вариантах осуществления клеточная среда содержит углевод, а также иной источник углерода, чем углевод (например, глицерол, глицерин, дигидроксиацетон, одноуглеродное соединение, масло, животный жир, животное масло, жирную кислоту, липид, фосфолипид, глицеролипид, моноглицерид, диглицерид, триглицерид, восстанавливаемый источник углерода или компонент дрожжевого экстракта). В некоторых вариантах осуществления культуральная среда содержит углевод, а также полипептид (например, микробный или растительный белок или пептид). В некоторых вариантах осуществления микробный полипептид представляет собой полипептид из дрожжей или бактерий. В некоторых вариантах осуществления растительный полипептид является полипептидом из сои, кукурузы, канолы, ятрофы, пальмы, арахиса, подсолнечника, кокосового ореха, горчицы, рапсового семени, семян хлопчатника, пальмового ядра, оливок, сафлора, кунжута или льняного семени.
В некоторых вариантах осуществления концентрация углевода составляет по меньшей мере или примерно 5 г на л бульона (г/л, где объем бульона включает объем клеточной среды и объем клеток), например по меньшей мере или примерно 10, 15, 20, 30, 40, 50, 60, 80, 100, 150, 200, 300, 400 или более г/л. В некоторых вариантах осуществления концентрация углевода находится в пределах примерно от 50 до примерно 400 г/л, например, в пределах примерно от 100 до примерно 360 г/л, примерно от 120 до примерно 360 г/л или примерно от 200 до примерно 300 г/л. В некоторых вариантах осуществления данная концентрация углевода включает общее количество углевода, которое вносят до и/или во время культивирования клеток-хозяев.
Приведенные в качестве примера липиды включают любое вещество, содержащее одну или более жирных кислот, которые являются С4 или выше жирными кислотами, которые представляют собой насыщенные, ненасыщенные или разветвленные жирные кислоты.
Приведенные в качестве примера масла представляют собой липиды, которые являются жидкими при комнатной температуре. В некоторых вариантах осуществления липиды содержат одну или более С4 или выше жирные кислоты (например, которые включают одну или более насыщенных, ненасыщенных или разветвленных жирных кислот с 4 или более атомами углерода). В некоторых вариантах осуществления масло получают из сои, кукурузы, канолы, ятрофы, пальмы, арахиса, подсолнечника, кокосового ореха, горчицы, рапсового семени, семян хлопчатника, пальмового ядра, оливок, сафлора, кунжута или льняного семени, маслянистых микробных клеток, китайского сала или любой комбинации двух или более перечисленных продуктов.
Приведенные в качестве примера жирные кислоты включают соединения формулы RCOOH, в которой «R» является углеводородом. Приведенные в качестве примера ненасыщенные жирные кислоты включают соединения, в которых «R» содержит по меньшей мере одну углерод-углеродную двойную связь. Приведенные в качестве примера ненасыщенные жирные кислоты включают, не ограничиваясь этим, олеиновую кислоту, вацценовую кислоту, линолевую кислоту, пальмитиновую кислоту и арахидоновую кислоту. Приведенные в качестве примера полиненасыщенные жирные кислоты включают соединения, в которых «R» содержит множество углерод-углеродных двойных связей. Приведенные в качестве примера насыщенные жирные кислоты включают соединения, в которых «R» представляет насыщенную алифатическую группу. В некоторых вариантах осуществления источник углерода включает одну или более С12-С22 жирных кислот, таких как С12 насыщенная жирная кислота, С14 насыщенная жирная кислота, С16 насыщенная жирная кислота, С18 насыщенная жирная кислота, С20 насыщенная жирная кислота или С22насыщенная жирная кислота. В приведенном в качестве примера варианте осуществления жирная кислота является пальмитиновой кислотой. В некоторых вариантах осуществления источником углерода является соль жирной кислоты (например, соль ненасыщенной жирной кислоты), производное жирной кислоты (например, производное ненасыщенной жирной кислоты) или соль производного жирной кислоты (например, соль производного ненасыщенной жирной кислоты). Подходящие соли включают, не ограничиваясь этим, соли лития, соли калия, соли натрия и тому подобное. Ди- и триглицериды представляют сложные эфиры жирных кислот глицерина.
В некоторых вариантах осуществления концентрация липида, масла, жира, жирной кислоты, моноглицерида, диглицерида или триглицерида составляет по меньшей мере или примерно 1 г на л бульона (г/л, где объем бульона включает объем клеточной среды и объем клеток), например по меньшей мере или примерно 5, 10, 15, 20, 30, 40, 50, 60, 80, 100, 150, 200, 300, 400 или более г/л. В некоторых вариантах осуществления концентрация липида, масла, жира, жирной кислоты, моноглицерида, диглицерида или триглицерида находится в пределах примерно от 10 до примерно 400 г/л, например, в пределах примерно от 25 до примерно 300 г/л, примерно от 60 до примерно 180 г/л или примерно от 75 до примерно 150 г/л. В некоторых вариантах осуществления концентрация включает общее количество липида, масла, жира, жирной кислоты, моноглицерида, диглицерида или триглицерида, которое вносят до и/или во время культивирования клеток-хозяев. В некоторых вариантах осуществления источник углерода включает (i) липид, масло, жир, жирную кислоту, моноглицерид, диглицерид или триглицерид и (ii) углевод, такой как глюкоза. В некоторых вариантах осуществления соотношение липида, масла, жира, жирной кислоты, моноглицерида, диглицерида или триглицерида к углеводу составляет примерно 1:1 на основе атома углерода (т.е. один атом углерода в липиде, масле, жире, жирной кислоте, моноглицериде, диглицериде или триглицериде приходится на один атом углерода в углеводе). В конкретных вариантах осуществления количество липида, масла, жира, жирной кислоты, моноглицерида, диглицерида или триглицерида находится в пределах примерно от 60 до 180 г/л, и количество углевода находится в пределах от 120 до 360 г/л.
Приведенные в качестве примера источники углерода на основе микробных полипептидов включают один или более полипептидов из дрожжей или бактерий. Приведенные в качестве примера источники углерода на основе растений включают один или более полипептидов из сои, кукурузы, канолы, ятрофы, пальмы, арахиса, подсолнечника, кокосового ореха, горчицы, рапсового семени, семян хлопчатника, пальмового ядра, оливок, сафлора, кунжута или льняного семени.
Приведенные в качестве примера восстанавливаемые источники углерода включают сырную молочную сыворотку, кукурузный экстракт, свекловичную мелассу, ячменный солод и компоненты любого из перечисленных выше продуктов. Приведенные в качестве примера восстанавливаемые источники углерода также включают ацетат, глюкозу, гексозу, пентозу и ксилозу, находящиеся в биомассе, такой как кукуруза, прутьевидное просо, сахарный тростник, клеточные отходы ферментационных процессов и белковые побочные продукты в производстве соевой, кукурузной или пшеничной муки. В некоторых вариантах осуществления источник углерода на основе биомассы представляет собой лигноцеллюлозу, гемицеллюлозу или целлюлозный материал, такой как, не ограничиваясь этим, трава, пшеница, пшеничная солома, жмых, жмых сахарного тростника, мягкая древесная пульпа, кукуруза, кукурузная смесь или шелуха, кукурузное ядро, волокна из кукурузных ядер, кукурузная солома, прутьевидное просо, рисовая шелуха или побочный продукт влажного или сухого дробления зерновых (например, кукурузы, сорго, риса, тритиката, ячменя, пшеницы и/или перегнанных зерновых). Приведенные в качестве примера целлюлозы включают дерево, бумагу и отходы пульпы, травяные растения и фруктовую пульпу. В некоторых вариантах осуществления источник углерода включает часть растений, такую как стебли, зерна, корни или клубни. В некоторых вариантах осуществления все растение или часть следующих растений используют в качестве источника углерода: кукурузу, пшеницу, рожь, сорго, тритикат, рис, просо, ячмень, маниоку, бобовые, такие как бобы и горох, картофель, батат, бананы, сахарный тростник и/или тапиоку. В некоторых вариантах осуществления источник углерода представляет гидролизат биомассы, такой как гидролизат биомассы, включающий ксилозу и глюкозу, или который содержит сахарозу и глюкозу.
В некоторых вариантах осуществления восстанавливаемые источники углерода (такие как биомасса) предварительно обрабатывают перед внесением в среду для клеточных культур. В некоторых вариантах осуществления предварительная обработка включает ферментативную предварительную обработку, химическую предварительную обработку или комбинацию обеих ферментативной или химической обработок (смотри, например, Farzaneh et al., Bioresouce Technology, 96(18):2014-2018, 2005; патент США № 6176176; патент США № 6106888; каждый из этих источников в полном объеме включен в настоящий документ для сведения, в частности, в отношении предварительной обработки восстанавливаемых источников углерода). В некоторых вариантах осуществления восстанавливаемый источник углерода частично или полностью гидролизуют перед внесением в среду для клеточных культур.
В некоторых вариантах осуществления восстанавливаемый источник углерода (такой как кукурузное сено) подвергается предварительной обработке растяжению волокон под действием аммиака (AFEX) перед тем, как его добавляют в среду клеточной культуры (смотри, например, Farzanech et al., Bioresource Technology, 96(18):2014-2018, 2005). Во время предварительной обработки AFEX восстанавливаемый источник углерода обрабатывают жидким безводным аммиаком при средней температуре (такой как в пределах примерно от 60°С до примерно 100°С) и высоком давлении (таком как в пределах примерно от 250 до примерно 300 фунт/кВ. дюйм) примерно в течение 5 мин. Затем давление быстро снижают. В данном способе объединенные химические и физические эффекты солюбилизации лигнина, гидролиза гемицеллюлозы, декристаллизации целлюлозы и большая площадь поверхности способствуют почти полному ферментативному преобразованию целлюлозы и гемицеллюлозы в ферментируемые сахара. Предварительная обработка AFEX имеет преимущество, заключающееся в том, что после нее можно извлечь и использовать повторно практически весь аммиак, в то время как оставшийся служит в качестве источника азота для микроорганизмов в последующих процессах. Также не требуется водного потока для предварительной обработки AFEX. Таким образом, извлечение сухого вещества после обработки AFEX по существу составляет 100%. AFEX в основном представляет собой высушивающий процесс. Обработанный восстанавливаемый источник углерода является стабильным в течение длительного периода времени и его можно подавать с очень высокими загрузками твердого вещества при ферментативном гидролизе или ферментации. Целлюлоза и гемицеллюлоза хорошо сохраняются при обработке AFEX при незначительном разложении или без него. Отсутствует необходимость в нейтрализации перед проведением ферментативного гидролиза восстанавливаемого источника углерода, который подвергается предварительной обработке AFEX. Ферментативный гидролиз обработанных AFEX источников углерода приводит к получению чистых потоков сахаров для последующего применения в ферментации.
В некоторых вариантах осуществления концентрация источника углерода (например, восстанавливаемого источника углерода) эквивалентна по меньшей мере или составляет примерно 0,1, 0,5, 1, 1,5, 2, 3, 4, 5, 10, 15, 20, 30, 40 или 50% глюкозы (мас./об.). Эквивалентное количество глюкозы можно определить с использованием обычных методов на основе ВЭЖХ с использованием глюкозы в качестве стандарта для определения количества глюкозы, полученной из источника углерода. В некоторых вариантах осуществления концентрация источника углерода (например, восстанавливаемого источника углерода) находится в пределах примерно от 0,1 до примерно 20% глюкозы, например, в пределах от 0,1 до примерно 10% глюкозы, примерно от 0,5 до примерно 10% глюкозы, примерно от 1 до примерно 10% глюкозы, примерно от 1 до примерно 5% глюкозы или примерно от 1 до примерно 2% глюкозы.
В некоторых вариантах осуществления источник углерода включает дрожжевой экстракт или один или более компонентов дрожжевого экстракта. В некоторых вариантах осуществления концентрация дрожжевого экстракта составляет по меньшей мере 1 г дрожжевого экстракта на литр бульона (г/л, где объем бульона включает объем клеточной среды и объем клеток), например по меньшей мере или примерно 5, 10, 15, 20, 30, 40, 50, 60, 80, 100, 150, 200, 300 или более г/л. В некоторых вариантах осуществления концентрация дрожжевого экстракта находится в пределах примерно от 1 до примерно 300 г/л, например, в пределах от 1 до примерно 200 г/л, примерно от 5 до примерно 200 г/л, примерно от 5 до примерно 100 г/л или примерно от 5 до примерно 60 г/л. В некоторых вариантах осуществления концентрация включает общее количество дрожжевого экстракта, которое добавляют до и/или во время культивирования клеток-хозяев. В некоторых вариантах осуществления источник углерода одновременно включает дрожжевой экстракт (один или более его компонентов) и другой источник углерода, такой как глюкоза. В некоторых вариантах осуществления соотношение дрожжевого экстракта к другому источнику углерода составляет примерно 1:5, примерно 1:10 или примерно 1:20 (мас./мас.).
Дополнительно источник углерода также может представлять одноуглеродные субстраты, такие как диоксид углерода или метанол. Сообщалось о синтезе глицерина из одноуглеродных соединений (например, метанола, формальдегида или формиата) у метилотрофных дрожжей (Yamada et al., Agric. Biol. Chem., 53(2), 541-543, 1989, этот источник в полном объеме включен в настоящий документ для сведения, в частности, в отношении источников углерода) и у бактерий (Hunter et al., Biochemistry, 24, 4148-4155, 1985, этот источник в полном объеме включен в настоящий документ для сведения, в частности, в отношении источников углерода). микроорганизмы могут ассимилировать одноуглеродные соединения, различающиеся по уровню окисления, от метана до формиата, и продуцировать глицерин. Путь ассимиляции углерода может проходить через рибулозомонофосфат, через серин или через ксилозамонофосфат (Gottschalk, Bacterial Metabolism, Second Edition, Springer-Verlag: New York, 1986, этот источник в полном объеме включен в настоящий документ для сведения, в частности, в отношении источников углерода). Путь через рибулозомонофосфат включает конденсацию формиата с рибулоза-5-фосфатом с образованием сахара с 6 атомами углерода, который затем преобразуется во фруктозу и в конечном итоге в продукт глицеральдегид-3-фосфат с 3 атомами углерода. Аналогично на пути с участием серина происходит ассимиляция одноуглеродного соединения в гликолитический путь через метилентетрагидрофолата.
В дополнении к субстратам с 1 или 2 атомами углерода известно, что метилотрофные микроорганизмы используют ряд других углеродсодержащих соединений, таких как метиламин, глюкозамин и различные аминокислоты для метаболической активности. Например, известно, что метилотрофные дрожжи используют углерод, входящий в состав метиламина, с образованием трегалозы или глицерина (Bellion et al., Microb. Growth Cl Compd., [Int. Symp.], 7th ed., 415-32. Editors: Murrell et al., Publisher: Intercept, Andover, UK, 1993, этот источник в полном объеме включен в настоящий документ для сведения, в частности, в отношении источников углерода). Аналогично различные виды Candida метаболизируют аланин или олеиновую кислоту (Sulter et al., Arch. Microbiol., 153(5), 485-9, 1990, этот источник в полном объеме включен в настоящий документ для сведения, в частности, в отношении источников углерода).
В некоторых вариантах осуществления клетки культивируют в обычной среде, содержащей физиологические соли и питательные вещества (смотри, например, Pourque J. et al., Biochemistry and Genetics of Cellulose Degradation, eds. Aubert et al., Academic Press, pp. 71-86, 1988 и Ilmen et al., Appl. Environ. Microbiol., 63:1298-1306, 1977, каждый из этих источников в полном объеме включен в настоящий документ для сведения, в частности, в отношении клеточной среды). Приведенные в качестве примера среды для роста являются обычными промышленно доступными средами, такими как бульон Луриа Бертани (LB), бульон с декстрозой Сабуро (SD) или дрожжевой культуральный бульон (YM). Также можно использовать другие определенные или синтетические среды для роста, и подходящая среда для роста конкретных клеток-хозяев известна специалистам в области микробиологии или ферментации.
В дополнение к подходящему источнику углерода желательно, чтобы клеточная среда содержала подходящие минеральные вещества, соли, кофакторы, буферы и другие компоненты, известные специалистам в данной области, как подходящие для роста культур или усиления продукции изопрена (смотри, например, международную заявку WO 2004/033646 и цитированные в ней источники, и международную заявку WO 96/35796 и цитированные в ней источники, каждый из которых в полном объеме включен в настоящий документ для сведения, в частности, в отношении условий культивирования клеток). В некоторых вариантах осуществления в том случае, когда нуклеиновая кислота изопренсинтазы, DXS, IDI и/или пути MVA находится под контролем индуцируемого промотора, то индуцирующее вещество (например, сахар, соль металла или противомикробное средство) желательно вносить в среду в концентрации, эффективной для индукции экспрессии полипептида изопренсинтазы, DXS, IDI и/или пути MVA. В некоторых вариантах осуществления клеточная среда содержит антибиотик (такой как канамицин), который соответствует нуклеиновой кислоте, придающей резистентность к антибиотикам (такой как нуклеиновая кислота, придающая резистентность к канамицину), в векторе, содержащем одну или более нуклеиновых кислот изопренсинтазы, DXS, IDI и/или пути MVA.
Приведенные в качестве примера условия культивирования клеток
Вещества и способы, подходящие для поддержания или роста бактериальных культур являются хорошо известными в данной области. Типичные методы можно найти в Manual of Methods for General Bacteriology Gerhardt et al., eds), American Society for Microbiology, Washington, D.C., 1994 или Brock in Biotechnology: A Textbook of Industrial Microbiology, Second Edition, 1989, Sinauer Associates, Inc., Sunderland, MA, каждый из этих источников в полном объеме включен в настоящий документ для сведения, в частности, в отношении методов культивирования клеток. В некоторых вариантах осуществления клетки культивируют в культуральной среде в условиях, обеспечивающих экспрессию одного или более полипептидов изопренсинтазы, DXS, IDI и/или пути MVA, кодированных нуклеиновой кислотой, вставленной в клетки-хозяева.
Для культивирования клеток можно использовать обычные условия культивирования клеток (смотри, например, международную заявку WO 2004/033646 и цитированные в ней источники, каждый из которых в полном объеме включен в настоящий документ для сведения, в частности, в отношении условий культивирования клеток и ферментации). Клетки культивируют и поддерживают при соответствующих температуре, газовой смеси и рН (таких, как примерно от 20 до примерно 37°С, примерно от 6% до примерно 84% СО2 и рН примерно от 5 до примерно 9). В некоторых вариантах осуществления клетки культивируют при 35°С в соответствующей среде для клеток. В некоторых вариантах осуществления, например, культуры культивируют примерно при 28°С в соответствующей среде во встряхиваемых культурах или ферментерах до достижения желаемой продукции изопрена. В некоторых вариантах осуществления значение рН при ферментации находится в пределах примерно от рН 5,0 до примерно рН 9,0 (например, примерно от рН 6,0 до примерно рН 8,0 или примерно от 6,5 до примерно 7,0). Реакции можно проводить в аэробных, аноксичных и анаэробных условиях, при этом выбор основывается на потребностях клеток-хозяев. Приведенные в качестве примера условия культивирования для конкретного нитчатого гриба известны в данной области и их можно найти в научной литературе и/или получить из источника грибов, такого Американская коллекция типовых культур и Центр генетики грибов.
В различных вариантах осуществления клетки культивируют с использованием любого известного способа ферментации, такого как периодический, с подпиткой или непрерывный процессы. В некоторых вариантах осуществления используют периодический способ ферментации. Классическая периодическая ферментация представляет собой закрытую систему, в которой состав среды устанавливают в начале ферментации, и она не подвергается искусственным изменениям во время ферментации. Таким образом, в начале ферментации в клеточную среду высевают желаемые клетки-хозяева и ферментацию проводят, ничего не добавляя в среду. Как правило, однако, «периодическая» ферментация представляет партию в отношении добавления источника углерода, и часто делаются попытки контролировать факторы, такие как рН и концентрация кислорода. В периодических системах состав метаболитов или биомассы системы постоянно изменяется до тех пор, пока ферментация не заканчивается. В периодических культурах клетки проходят от статической лог-фазы роста до лог-фазы активного роста и, наконец, до стационарной фазы, на которой скорость роста снижена или практически сведена к нулю. В некоторых вариантах осуществления клетки в лог-фазе ответственны за объем продукции изопрена. В некоторых вариантах осуществления клетки продуцируют изопрен в стационарной фазе роста.
В некоторых вариантах осуществления используют вариант стандартной периодической системы, такой как систему с подпиткой. Системы с подпиткой включают обычную порционную систему, за исключением того, что источник углерода вносят порциями по мере протекания ферментации. Системы с подпиткой пригодны в том случае, когда репрессия катаболитом подходит для ингибирования метаболизма клеток и когда желательно иметь ограниченные количества источника углерода в среде для клеток. Ферментации с подпиткой можно проводить с источником углерода (например, глюкозы) в ограниченном или избыточном количестве. Определение реальной концентрации источника углерода в системах с подпиткой является затруднительным и, следовательно, она устанавливается на основе изменений определяемых факторов, таких как рН, растворенный кислород, и парциальное давление газов-отходов, таких как СО2. Периодические ферментации и ферментации с подпиткой являются обычными процессами, и они хорошо известны в данной области, и их примеры можно найти у Brock, Biotechnology: A Textbook of Industrial Microbiology, Second Edition, (1989), Sinauer Associates, Inc., этот источник в полном объеме включен в настоящий документ для сведения, в частности, в отношении условий культивирования клеток и ферментации.
В некоторых вариантах осуществления используют способы непрерывной ферментации. Непрерывная ферментация представляет собой открытую систему, при которой в биореактор непрерывно добавляют среду для ферментации и одновременно такое же количество кондиционированной среды удаляют для обработки. Как правило, непрерывная ферментация поддерживает культуры на постоянной высокой плотности, где клетки в основном находятся в лог-фазе роста.
Непрерывная ферментация позволяет изменять один фактор или ряд факторов, оказывающих влияние на рост клеток или продукцию изопрена. Например, в одном способе поддерживается количество лимитирующего питательного вещества, такого как источник углерода или концентрация азота, на постоянном уровне, и все другие параметры находятся на среднем уровне. В других системах можно постоянно изменять ряд факторов, оказывающих влияние на рост, в то же время концентрация клеток (например, концентрация, определенная по мутности среды) сохраняется постоянной. Непрерывные системы обеспечивают поддержание условий для стабильного роста. Таким образом, потеря клеток, возникающая за счет сред, сбалансируется против скорости роста клеток при ферментации. Методы модуляции питательных веществ и факторов роста для непрерывной ферментации, а также методики обеспечения максимального уровня синтеза продукта хорошо известны в области промышленной микробиологии и различные методы подробно описаны Brock, Biotechnology: A Textbook of Industrial Microbiology, Second Edition, 1989, Sinauer Associates, Inc., Sunderland, MA, каждый из этих источников в полном объеме включен в настоящий документ для сведения, в частности, в отношении условий культивирования клеток и ферментации.
В некоторых вариантах осуществления клетки иммобилизуют на субстрате в виде катализаторов цельных клеток и подвергают воздействию условий ферментации для продукции изопрена.
В некоторых вариантах осуществления бутыли с жидкой культурой помещают в шейкеры для введения кислорода в жидкость и поддержания однородности культуры. В некоторых вариантах осуществления используют термостат для контроля температуры, влажности, скорости встряхивания и/или других условий, в которых растет культура. Наиболее простые термостаты снабжены коробками с регулируемым нагревателем, обычно до температуры ≈65°С. Для более усовершенствованных термостатов также характерна возможность снижения температуру (посредством охлаждения) или возможность регуляции влажности или концентрации СО2. Большинство термостатов снабжены таймером; в некоторых также можно запрограммировать цикл для изменения температуры, влажности и т.п. Термостаты могут различаться по размеру: от настольного прибора до размера небольших комнат.
Если желательно, то часть или всю клеточную среду можно менять для восполнения питательных веществ и/или предупреждения накопления потенциально вредных побочных продуктов метаболизма и погибших клеток. В случае суспензионных культур клетки можно отделить от среды центрифугированием или фильтрованием суспензионной культуры и затем ресуспендированием клеток в свежей среде. В случае прикрепляющихся культур среду можно удалить непосредственно аспирацией и заместить на новую порцию. В некоторых вариантах осуществления клеточная среда обеспечивает деление по меньшей мере для части клеток по меньшей мере или примерно 5, 10, 20, 40, 50, 60, 65 или более клеточных делений в непрерывной культуре (такой как непрерывная культура без разведения).
В некоторых вариантах осуществления используют конститутивный или промотор с неполным блокированием функций (такой как Trc-промотор) и тогда соединение (такое как IPTG) не вносят для индукции экспрессии нуклеиновой кислоты(т) изопренсинтазы, DXS, IDI и/или пути MVA, функционально связанной с промотором. В некоторых вариантах осуществления вносят соединение (такое как IPTG) для индукции экспрессии нуклеиновой кислоты(т) изопренсинтазы, DXS, IDI и/или пути MVA, функционально связанной с промотором.
Приведенная в качестве примера продукция изопрена
В некоторых вариантах осуществления клетки культивируют в культуральной среде в условиях, обеспечивающих продукцию изопрена клетками. Под выражением «максимальная абсолютная продуктивность» понимается максимальное абсолютное количество изопрена в отходящем газе, продуцированное во время культивирования клеток за определенный период времени (например, во время культивирования клеток за определенную ферментацию). Под выражением «временная точка максимальной абсолютной продуктивности» понимается временная точка во время ферментации, когда абсолютное количество изопрена в отходящем газе является максимальным во время культивирования клеток за определенный период времени (например, во время культивирования клеток за определенную ферментацию). В некоторых вариантах осуществления количество изопрена определяют на временную точку максимальной абсолютной продуктивности. В некоторых вариантах осуществления максимальная абсолютная продуктивность для клеток примерно равняется любому количеству изопрена, раскрытому в настоящем документе.
Под выражением «максимальная удельная продуктивность» понимается максимальное количество изопрена, продуцированное во время культивирования клеток за определенный период времени (например, во время культивирования клеток за определенную ферментацию). Под выражением «временная точка максимальной удельной продуктивности» понимается временная точка во время культивирования клеток за определенный период времени (например, во время культивирования клеток за определенную ферментацию), когда количество изопрена, продуцированное на клетку, является максимальным. Максимальная удельная продуктивность определяется делением общей продуктивности на количество клеток, которое, в свою очередь, определяют по оптической плотности при длине волны 600 нм (OD600). В некоторых вариантах осуществления количество изопрена определяют на временную точку максимальной удельной продуктивности. В некоторых вариантах осуществления максимальная удельная продуктивность для клеток примерно равняется любому количеству изопрена на клетку, раскрытому в настоящем документе.
Под выражением «максимальная объемная продуктивность» понимается максимальное количество изопрена, продуцированное на объем бульона (включающего объем клеток и объем клеточной среды) во время культивирования клеток за определенный период времени (например, во время культивирования клеток за определенную ферментацию). Под выражением «временная точка максимальной удельной объемной продуктивности» понимается временная точка во время культивирования клеток за определенный период времени (например, во время культивирования клеток за определенную ферментацию), когда количество изопрена, продуцированное на объем бульона, является максимальным. Максимальную удельную объемную продуктивность определяют делением общей продуктивности на объем бульона и количество времени. В некоторых вариантах осуществления количество изопрена определяют на временную точку максимальной удельной объемной продуктивности. В некоторых вариантах осуществления максимальная удельная объемная продуктивность для клеток примерно равняется любым количествам изопрена в пересчете на объем и на время, раскрытым в настоящем документе.
Под выражением «максимальная концентрация» понимается максимальное количество изопрена, продуцированное во время культивирования клеток за определенный период времени (например, во время культивирования клеток за определенную ферментацию). Под выражением «временная точка максимальной концентрации» понимается временная точка во время культивирования клеток за определенный период времени (например, во время культивирования клеток за определенную ферментацию), когда количество изопрена, продуцированное на клетку, является максимальным. В некоторых вариантах осуществления количество изопрена определяют на временную точку максимальной концентрации. В некоторых вариантах осуществления максимальная концентрация для клеток примерно равняется любому количеству изопрена, раскрытому в настоящем документе.
Под выражением «средняя объемная продуктивность» понимается среднее количество изопрена, продуцированное на объем бульона (включающего объем клеток и объем клеточной среды) во время культивирования клеток за определенный период времени (например, во время культивирования клеток за определенную ферментацию). Среднюю объемную продуктивность определяют делением общей продуктивности на объем бульона и количество времени. В некоторых вариантах осуществления средняя объемная продуктивность для клеток примерно равняется любым количествам изопрена в пересчете на объем и на время, раскрытым в настоящем документе.
Под выражением «кумулятивная общая продуктивность» понимается кумулятивное общее количество изопрена, продуцированное во время культивирования клеток за определенный период времени (например, во время культивирования клеток за определенную ферментацию). В некоторых вариантах осуществления определяют кумулятивное общее количество изопрена. В некоторых вариантах осуществления кумулятивная общая продуктивность для клеток примерно равняется любым количествам изопрена, раскрытым в настоящем документе.
В некоторых вариантах осуществления клетки в культуре продуцируют изопрен в количестве более чем или примерно 1, 10, 25, 50, 100, 200, 250, 300, 400, 500, 600, 700, 800, 900, 1000, 1250, 1500, 1750, 2000, 2500, 3000, 4000, 5000, 10000, 12500, 20000, 30000, 40000, 50000, 75000, 100000, 125000, 150000, 188000 или более нмоль изопрена/г клеток в пересчете на сырую клеточную массу/ч (нмоль/гскм/ч. В некоторых вариантах осуществления количество изопрена находится в пределах примерно от 2 до примерно 200000 нмоль/гскм/ч, например, в пределах примерно от 2 до примерно 100 нмоль/гскм/ч, примерно от 100 до примерно 500 нмоль/гскм/ч, примерно от 150 до примерно 500 нмоль/гскм/ч, примерно от 500 до примерно 1000 нмоль/гскм/ч, примерно от 1000 до примерно 2000 нмоль/гскм/ч, примерно от 2000 до примерно 5000 нмоль/гскм/ч, примерно от 5000 до примерно 10000 нмоль/гскм/ч, примерно от 10000 до примерно 50000 нмоль/гскм/ч, примерно от 50000 до примерно 100000 нмоль/гскм/ч, примерно от 100000 до примерно 150000 нмоль/гскм/ч, примерно от 150000 до примерно 200000 нмоль/гскм/ч. В некоторых вариантах осуществления количество изопрена находится в пределах примерно от 20 до примерно 200000 нмоль/гскм/ч, например, примерно от 100 до примерно 5000 нмоль/гскм/ч, примерно от 200 до примерно 2000 нмоль/гскм/ч, примерно от 200 до примерно 1000 нмоль/гскм/ч, примерно от 300 до примерно 1000 нмоль/гwcm/ч, примерно от 400 до примерно 1000 нмоль/гскм/ч, примерно от 1000 до примерно 5000 нмоль/гскм/ч, примерно от 2000 до примерно 20000 нмоль/гскм/ч, примерно от 5000 до примерно 50000 нмоль/гскм/ч, примерно от 10000 до примерно 100000 нмоль/гскм/ч, примерно от 20000 до примерно 150000 нмоль/гскм/ч или примерно от 20000 до примерно 200000 нмоль/гскм/ч.
Количество изопрена в единицах нмоль/гскм/ч можно определить, как раскрыто в патенте США № 5849970, который в полном объеме включен в настоящий документ для сведения, в частности, в отношении определения продукции изопрена. Например, 2 мл пространства над жидкостью (например, пространство из культуры, такое как 2 мл культуры, культивированной в герметично закрытых сосудах при 32°С при встряхивании со скоростью 200 об/мин примерно в течение 3 ч) анализировали на содержание изопрена с использованием обычной газовой хроматографии, такой как изотермическая система (85°С) с н-октаном/колонкой, заполненной порасилом С (Alltech Associates, Inc., Deerfield, Ill) и сопряженной с детектором на основе восстановления оксида ртути RGD2 (Trace Analytical, Menlo Park, CA) (смотри, например, Greenberg et al., Atmos. Environ., 27А:2689-2692; 1993; Silver et al., Plant Physiol., 97:1588-1591, 1991, каждый из этих источников в полном объеме включен в настоящий документ для сведения, в частности, в отношении анализа продукции изопрена). Единицы площади в газовой хроматографии переводят в нмоль изопрена с использованием стандартной калибровочной кривой концентрации изопрена. В некоторых вариантах осуществления значение на грамм клеток в пересчете на сырую клеточную массу рассчитывают при получении значения А600 для образца клеточной культуры и затем переводят значение А600 на грамм клеток с использованием калибровочной кривой в пересчете на сырую массу клеточных культур с известным значением А600. В некоторых вариантах осуществления граммы клеток определяют при допущении того, что литр бульона (включающего клеточную среду и клетки) со значением А600, равным 1, имеет сырую клеточную массу, равную 1 г. Также значение делят на количество часов инкубации культуры, например, 3 часа.
В некоторых вариантах осуществления клетки в культуре продуцируют изопрен в количестве более чем или примерно 1, 10, 25, 50, 100, 200, 250, 300, 400, 500, 600, 700, 800, 900, 1000, 1250, 1500, 1750, 2000, 2500, 3000, 4000, 5000, 10000, 100000, или более нг изопрена/г клеток в пересчете на сырую клеточную массу/ч (нг/гскм/ч). В некоторых вариантах осуществления количество изопрена находится в пределах примерно от 2 до примерно 5000 нг/гскм/ч, например, в пределах примерно от 2 до примерно 100 нг/гскм/ч, примерно от 100 до примерно 500 нг/гскм/ч, примерно от 500 до примерно 1000 нг/гскм/ч, примерно от 1000 до примерно 2000 нг/гскм/ч или примерно от 2000 до примерно 5000 нг/гскм/ч. В некоторых вариантах осуществления количество изопрена находится в пределах примерно от 20 до примерно 5000 нг/гскм/ч, примерно от 100 до примерно 5000 нг/гскм/ч, примерно от 200 до примерно 2000 нг/гскм/ч, примерно от 200 до примерно 1000 нг/гскм/ч, примерно от 300 до примерно 1000 нг/гскм/ч или примерно от 400 до примерно 1000 нг/гскм/ч. Количество изопрена в нг/гскм/ч можно рассчитать умножением значения продукции изопрена в единицах нмоль/гскм/ч, как уже обсуждалось выше, на 68,1 (как представлено в уравнении 5 ниже).
В некоторых вариантах осуществления клетки в культуре продуцируют кумулятивный титр (общее количество) изопрена более чем или примерно 1, 10, 25, 50, 100, 150, 200, 250, 300, 400, 500, 600, 700, 800, 900, 1000, 1250, 1500, 1750, 2000, 2500, 3000, 4000, 5000, 10000, 50000, 100000 или более мг изопрена/л бульона (мг/лбульона, где объем бульона включает объем клеток и клеточную среду). В некоторых вариантах осуществления количество изопрена находится в пределах примерно от 2 до примерно 5000 мг/лбульона, например, в пределах примерно от 2 до примерно 100 мг/лбульона, примерно от 100 до примерно 500 мг/лбульона, примерно от 500 до примерно 1000 мг/лбульона, примерно от 1000 до примерно 2000 мг/лбульона или примерно от 2000 до примерно 5000 мг/лбульона. В некоторых вариантах осуществления количество изопрена находится в пределах примерно от 20 до примерно 5000 мг/лбульона, примерно от 100 до примерно 5000 мг/лбульона, примерно от 200 до примерно 2000 мг/лбульона, примерно от 200 до примерно 1000 мг/лбульона, примерно от 300 до примерно 1000 мг/лбульона или примерно от 400 до примерно 1000 мг/лбульона.
Удельную продуктивность изопрена в мг изопрена/л пространства над жидкостью из встряхиваемой колбы или аналогичных культур можно определить отбором пробы объемом 1 мл из клеточной культуры при значении OD600, равном примерно 1,0, переносом пробы во флакон емкостью 20 мл, инкубированием в течение 30 мин и затем определением количества изопрена в пространстве над жидкостью (как описано, например, в примере I, раздел II). В том случае, если значение OD600 не равно 1,0, то тогда результаты анализа можно нормализовать к значению OD600, равному 1,0, делением на фактическое значение OD600. Значение мг изопрена/л пространства над жидкостью можно перевести в мг/лбульона/ч/OD600культурального бульона умножением на коэффициент, равный 38. Значение в единицах в мг/лбульона/ч/OD600 можно умножить на число часов и значение OD600 с получением кумулятивного титра в единицах - мг изопрена/л бульона.
В некоторых вариантах осуществления клетки в культуре имеют среднюю объемную продуктивность изопрена более чем примерно или примерно 0,1, 1,0, 10, 25, 50, 100, 150, 200, 250, 300, 400, 500, 600, 700, 800, 900, 1000, 1100, 1200, 1300, 1400, 1500, 1600, 1700, 1800, 1900, 2000, 2100, 2200, 2300, 2400, 2500, 2600, 2700, 2800, 2900, 3000, 3100, 3200, 3300, 3400, 3500 или более мг изопрена/л бульона/ч (мг/лбульона/ч, где объем бульона включает объем клеток и клеточную среду). В некоторых вариантах осуществления средняя объемная продуктивность изопрена находится в пределах примерно от 0,1 до примерно 3500 мг/лбульона/ч, например, в пределах примерно от 0,1 до примерно 100 мг/лбульона/ч, примерно от 100 до примерно 500 мг/лбульона/ч, примерно от 500 до примерно 1000 мг/лбульона/ч, примерно от 1000 до примерно 1500 мг/лбульона/ч, примерно от 1500 до примерно 2000 мг/лбульона/ч, примерно от 2000 до примерно 2500 мг/лбульона/ч, примерно от 2500 до примерно 3000 мг/лбульона/ч или примерно от 3000 до примерно 3500 мг/лбульона/ч. В некоторых вариантах осуществления средняя объемная продуктивность изопрена находится в пределах примерно от 10 до примерно 3500 мг/лбульона/ч, примерно от 100 до примерно 3500 мг/лбульона/ч, примерно от 200 до примерно 1000 мг/лбульона/ч, примерно от 200 до примерно 1500 мг/лбульона/ч, примерно от 1000 до примерно 3000 мг/лбульона/ч или примерно от 1500 до примерно 3000 мг/лбульона/ч.
В некоторых вариантах осуществления клетки в культуре имеют максимальную объемную продуктивность изопрена более чем или примерно 0,5, 1,0, 10, 25, 50, 100, 150, 200, 250, 300, 400, 500, 600, 700, 800, 900, 1000, 1100, 1200, 1300, 1400, 1500, 1600, 1700, 1800, 1900, 2000, 2100, 2200, 2300, 2400, 2500, 2600, 2700, 2800, 2900, 3000, 3100, 3200, 3300, 3400, 3500, 3750, 4000, 4250, 4500, 4750, 5000, 5250, 5500, 5750, 6000, 6250, 6500, 6750, 7000, 7250, 7500, 7750, 8000, 8250, 8500, 8750, 9000, 9250, 9500, 9750, 10000, 12500, 15000 или более мг изопрена/л бульона/ч (мг/лбульона/ч), где объем бульона включает объем клеток и клеточную среду). В некоторых вариантах осуществления максимальная объемная продуктивность изопрена находится в пределах примерно от 0,5 до примерно 15000 мг/лбульона/ч, например, в пределах примерно от 0,5 до примерно 10 мг/лбульона/ч, примерно от 1,0 до примерно 100 мг/лбульона/ч, примерно от 100 до примерно 500 мг/лбульона/ч, примерно от 500 до примерно 1000 мг/лбульона/ч, примерно от 1000 до примерно 1500 мг/лбульона/ч, примерно от 1500 до примерно 2000 мг/лбульона/ч, примерно от 2000 до примерно 2500 мг/лбульона/ч, примерно от 2500 до примерно 3000 мг/лбульона/ч, примерно от 3000 до примерно 3500 мг/лбульона/ч, примерно от 3500 до примерно 5000 мг/лбульона/ч, примерно от 5000 до примерно 7500 мг/лбульона/ч, примерно от 7500 до примерно 10000 мг/лбульона/ч, примерно от 10000 до примерно 12500 мг/лбульона/ч или примерно от 12500 до примерно 15000 мг/лбульона/ч. В некоторых вариантах осуществления максимальная объемная продуктивность изопрена находится в пределах примерно от 10 до примерно 15000 мг/лбульона/ч, примерно от 100 до примерно 2500 мг/лбульона/ч, примерно от 1000 до примерно 5000 мг/лбульона/ч, примерно от 2500 до примерно 7500 мг/лбульона/ч, примерно от 5000 до примерно 10000 мг/лбульона/ч, примерно от 7500 до примерно 12500 мг/лбульона/ч или примерно от 10000 до примерно 15000 мг/лбульона/ч.
Моментную скорость продукции изопрена в мг/лбульона/ч в ферментере можно определить отбором пробы отходящего газа из ферментера, анализом в ней количества изопрена (в таких единицах, как мг изопрена на лгаза), как описано, например, в примере I, разделе II, и умножением данного значения на скорость, с которой отходящий газ проходит через литр бульона (например, при 1 об/об/мин (объем воздуха/объем бульона/мин) это значение равно 60 лгазав ч). Таким образом, уровень отходящего газа, равный 1 мг/лгаза, соответствует моментной скорости продукции, равной 60 мг/лгаза/ч при потоке воздуха 1 об/об/мин. Если желательно, то значение в единицах мг/лгаза/ч можно разделить на значение OD600 c получением удельной скорости в единицах мг/лгаза/ч/OD. Среднее значение мг изопрена/лгаза можно перевести в общую продуктивность продукта (в г изопрена на литр ферментационного бульона, мг/лбульона) умножением данной средней концентрации изопрена в отходящем газе на общее количество отходящего газа на литр ферментационного бульона во время ферментации. Таким образом, средняя концентрация изопрена в отходящем газе, равная 0,5 мг/лбульона/ч в течение 10 ч при 1 об/об/мин, соответствует общей концентрации продукта, равной 300 мг изопрена/лбульона.
В некоторых вариантах осуществления клетки в культуре преобразуют более чем или примерно 0,0015, 0,002, 0,005, 0,01, 0,02, 0,05, 0,1, 0,12, 0,14, 0,16, 0,2, 0,3, 0,4, 0,5, 0,6, 0,7, 0,8, 0,9, 1,0, 1,2, 1,4, 1,6, 2,0, 2,2, 2,4, 2,6, 3,0, 4,0, 5,0, 6,0, 7,0, 8,0, 9,0, 10,0, 11,0, 12,0, 13,0, 14,0, 15,0, 16,0, 17,0, 18,0, 19,0, 20,0, 21,0, 22,0, 23,0, 23,2, 23,4, 23,6, 23,8, 24,0, 25,0, 30,0, 31,0, 32,0, 33,0, 35,0, 37,5, 40,0, 45,0, 47,5, 50,0, 55,0, 60,0, 65,0, 70,0, 75,0, 80,0, 85,0, или 90,0 мол.% углерода в клеточной культуральной среде в изопрен. В некоторых вариантах осуществления процент преобразования углерода в изопрен находится в пределах примерно от 0,002 до примерно 90,0 мол.%, например, примерно от 0,002% до примерно 0,005%, примерно от 0,005% до примерно 0,01%, примерно от 0,01% до примерно 0,05%, примерно от 0,05% до примерно 0,15%, примерно от 0,15% до примерно 0,2%, примерно от 0,2% до примерно 0,3%, примерно от 0,3% до примерно 0,5%, примерно от 0,5% до примерно 0,8%, примерно от 0,8% до примерно 1,0%, примерно от 1,0% до примерно 1,6%, примерно от 1,6% до примерно 3,0%, примерно от 3,0% до примерно 5,0%, примерно от 5,0% до примерно 8,0%, примерно от 8,0% до примерно 10,0%, примерно от 10,0% до примерно 15,0%, примерно от 15,0% до примерно 20,0%, примерно от 20,0% до примерно 25,0%, примерно от 25,0% до примерно 30,0%, примерно от 30,0% до примерно 35,0%, примерно от 35,0% до примерно 40,0%, примерно от 40,0% до примерно 45,0%, примерно от 45,0% до примерно 50,0%, примерно от 50,0% до примерно 55,0%, примерно от 55,0% до примерно 60,0%, примерно от 60,0% до примерно 65,0%, примерно от 65,0% до примерно 70,0%, примерно от 75,0% до примерно 80,0%, примерно от 80,0% до примерно 85,0% или примерно от 85,0% до примерно 90,0%. В некоторых вариантах осуществления процент преобразования углерода в изопрен находится в пределах примерно от 0,002 до примерно 0,4 мол.%, примерно от 0,002 до примерно 0,16 мол.%, примерно от 0,04 до примерно 0,16 мол.%, примерно от 0,005 до примерно 0,3 мол.%, примерно от 0,01 до примерно 0,3 мол.%, примерно от 0,05 до примерно 0,3 мол.%, примерно от 0,1 до примерно 0,3 мол.%, примерно от 0,3 до примерно 1,0 мол.%, примерно от 1,0 до примерно 5,0 мол.%, примерно от 2 до примерно 5,0 мол.%, примерно от 5,0 до примерно 10,0 мол.%, примерно от 7 до примерно 10,0 мол.%, примерно от 10,0 до примерно 20,0 мол.%, примерно от 12 до примерно 20,0 мол.%, примерно от 16 до примерно 20,0 мол.%, примерно от 18 до примерно 20,0 мол.%, примерно от 18 до примерно 23,2 мол.%, примерно от 18 до примерно 23,6 мол.%, примерно от 18 до примерно 23,8 мол.%, примерно от 18 до примерно 24,0 мол.%, примерно от 18,0 до примерно 25,0 мол.%, примерно от 20,0 до примерно 30,0 мол.%, примерно от 30,0 до примерно 40,0 мол.%, примерно от 30 до примерно 50,0 мол.%, примерно от 30 до примерно 60,0 мол.%, примерно от 30 до примерно 70,0 мол.%, примерно от 30 до примерно 80,0 мол.% или примерно от 30 до примерно 90,0 мол.%.
Процент преобразования углерода в изопрен (также относится к «% выходу углерода») можно определить делением молей углерода в продуцированном изопрене на моли углерода в источнике углерода (например, в виде молей углерода в периодических системах или системах с подпиткой глюкозой и дрожжевым экстрактом). Данное количество умножают на 100% с получением процентного значения (как показано в уравнении I).
Уравнение 1
% выход углерода = (моли углерода в продуцированном изопрене)/(моли углерода в источнике углерода) × 100
Для данного расчета можно допустить, что дрожжевой экстракт содержит 50% мас./мас. углерода. В качестве примера, для 500 л, описанных в примере 7, разделе VIII, процент преобразования углерода в изопрен можно рассчитать, как показано в уравнении 2.
Уравнение 2
% выход углерода = (39,1 г изопрена×1/68,1 моль/г×5С/моль)/[181221 г глюкозы×1/180 моль/г×6 С/моль)+(17789 г дрожжевого экстракта×0,5×1/12 моль/г)] × 100 = 0,042%
Для двух ферментаций объемом 500 литров, описанных в настоящем документе (в примере 7, разделах VII и VIII), процент преобразования углерода в изопрен составляет 0,04-0,06%. Выход углерода 0,11-0,16% был достигнут с использованием систем объемом 14 л, как описано в настоящем документе.
Специалист в данной области может легко перевести значения скорости продукции изопрена или количества продуцированного изопрена в любые другие единицы. Типичные уравнения приведены ниже для взаимопреобразования единиц друг в друга.
Единицы скорости продукции изопрена (общей и удельной)
Уравнение 3
1 г изопрена/лбульона/ч = 14,7 ммоль изопрена/лбульона/ч (общая объемная скорость)
Уравнение 4
1 нмоль изопрена/гскм/ч = 1 нмоль изопрена/лбульона/ч/OD600 (при данном преобразовании допускается, что один литр бульона со значением OD600, равным 1, имеет сырую клеточную массу, равную 1 г).
Уравнение 5
1 нмоль изопрена/гскм/ч = 68,1 нг изопрена/гскм/ч (с учетом молекулярной массы изопрена).
Уравнение 6
1 нмоль изопрена/лгаз О2/ч = 90 нмоль изопрена/лбульона/ч (при скорости потока О2, равной 90 л/ч на л культурального бульона).
Уравнение 7
1 мкг изопрена/лгаз изопрена в отходящем газе = 60 мкг изопрена/лбульона/ч при скорости потока 60 лгаз на лбульона (1 об/об/мин).
Единицы титра (общего и удельного)
Уравнение 8
1 нмоль изопрена/мг клеточного белка = 150 нмоль изопрена/лбульона/OD600 (при данном преобразовании допускается, что один литр бульона со значением OD600, равным 1, имеет общий клеточный белок, равный примерно 150 мг) (удельная продуктивность).
Уравнение 9
1 г изопрена/лбульона = 14,7 ммоль изопрена/лбульона (общий титр)
Если желательно, то уравнение 10 можно использовать для перевода любой из единиц, которые включают сырую клеточную массу, в соответствующие единицы, которые включают сухую клеточную массу.
Уравнение 10
Сухая клеточная масса = (сырая клеточная масса)/3,3
В некоторых вариантах осуществления, входящих в объем изобретения, клетка, содержащая гетерологичную нуклеиновую кислоту, кодирующую полипептид изопренсинтазы, продуцирует количество изопрена по меньшей мере или примерно в 2, 3, 5, 10, 25, 50, 100, 150, 200, 400 раз выше по сравнению с количеством изопрена, продуцированного соответствующей клеткой, культивированной по существу в тех же условиях, но без гетерологичной нуклеиновой кислоты, кодирующей полипептид изопренсинтазы.
В некоторых вариантах осуществления, входящих в объем изобретения, клетка, содержащая гетерологичную нуклеиновую кислоту, кодирующую полипептид изопренсинтазы и одну или более гетерологичных нуклеиновых кислот, кодирующих полипептид DXS, IDI и/или пути MVA, продуцирует количество изопрена по меньшей мере или примерно в 2, 3, 5, 10, 25, 50, 100, 150, 200, 400 раз выше по сравнению с количеством изопрена, продуцированного соответствующей клеткой, культивированной по существу в тех же условиях, но без гетерологичных нуклеиновых кислот.
Приведенные в качестве примера способы очистки
В некоторых вариантах осуществления любой из способов, описанных в настоящем документе, дополнительно включает выделение изопрена. Например, изопрен, продуцированный с использованием композиций и способов по изобретению, можно выделить с использованием обычных методов, таких как разделение газов, фракционирование, адсорбция/десорбция, диффузионное испарение, термическая или вакуумная десорбция изопрена из твердой фазы или экстракция изопрена, иммобилизованного или адсорбированного на твердой фазе растворителем (смотри, например, патенты США №№ 4703007 и 4570029, каждый из этих источников в полном объеме включен в настоящий документ для сведения, в частности, в отношении методов выделения и очистки изопрена). В некоторых вариантах осуществления выделение изопрена включает выделение изопрена в жидкой форме (например, в виде очищенного раствора изопрена или раствора изопрена в растворителе). Разделение газов включает удаление паров изопрена из потока отходящего газа ферментации в непрерывном режиме. Такое удаление можно обеспечить несколькими различными путями, включая, не ограничиваясь этим, адсорбцию на твердой фазе, распределение в жидкую фазу или прямую конденсацию. В некоторых вариантах осуществления обогащение мембраны потоком разбавленных паров изопрена выше точки орошения паров приводит к конденсации жидкого изопрена.
Выделение изопрена может включать одну стадию или несколько стадий. В некоторых вариантах осуществления удаление паров изопрена из отходящего газа ферментации и преобразование изопрена в жидкую фазу проводят одновременно. Например, изопрен можно непосредственно конденсировать из потока отходящего газа с получением жидкости. В некоторых вариантах осуществления удаление паров изопрена из отходящего газа ферментации и преобразование изопрена в жидкую фазу проводят последовательно. Например, вначале изопрен можно адсорбировать на твердой фазе и затем экстрагировать из твердой фазы растворителем.
В некоторых вариантах осуществления любой из методов, описанных в настоящем документе, дополнительно включает очистку изопрена. Например, изопрен, продуцированный с использованием композиций и способов по изобретению, можно очистить с применением стандартных методов. Очистка относится к способу, с использованием которого изопрен отделяют от одного или более компонентов, которые присутствуют, когда образуется изопрен. В некоторых вариантах осуществления изопрен получают в виде по существу чистой жидкости. Примеры методов очистки включают (i) дистилляцию из раствора в жидком экстрагенте и (ii) хроматографию. В том смысле, в котором термин «очищенный изопрен» используется в настоящем документе, он означает изопрен, который отделен от одного или более компонентов, которые находятся в среде, в которой продуцируется изопрен. В некоторых вариантах осуществления изопрен является по меньшей мере на 20% по массе, свободным от других компонентов, которые присутствуют, когда продуцируется изопрен. В различных вариантах осуществления изопрен составляет по меньшей мере или примерно 25%, 30%, 40%, 50%, 60%, 70%, 75%, 80%, 90%, 95% или 99% по массе чистого соединения. Чистоту можно определить с использованием любого подходящего метода, например, колоночной хроматографии, ВЭЖХ или ГХ-МС.
В некоторых вариантах осуществления любой из методов, описанных в настоящем документе, дополнительно включает полимеризацию изопрена. Например, можно использовать стандартные методы для полимеризации очищенного изопрена с образованием цис-полиизопрена или других образующихся затем продуктов с использованием стандартных методов.
Дополнительные методы и композиции описаны в предварительной заявке на патент США № 61/097186, поданной 15 сентября 2008 г., в предварительной заявке на патент США № 61/097189, поданной 15 сентября 2008 г. и в предварительной заявке на патент США № 61/097163, поданной 15 сентября 2008 г., которые все в полном объеме включены в настоящий документ для сведения, в частности, в отношении композиций и способов получения изопрена.
Примеры
В примерах, которые предназначены чисто для демонстрации изобретения и которые, следовательно, не следует рассматривать в качестве ограничивающих изобретение, также подробно описаны аспекты и варианты осуществления изобретения, обсужденного выше. Если не указано иначе, то температура выражена в градусах Цельсия и давление равно или близко к атмосферному давлению. Последующие примеры и подробное описание предлагаются для иллюстрации и не являются ограничивающими. Все публикации, заявки на патент и патенты, цитированные в данной заявке, включены в настоящий документ для сведения, как если бы каждая публикация, заявка на патент и патент конкретно и индивидуально были включены для сведения. В частности, все публикации, цитированные в настоящем документе, точно включены в настоящий документ в целях описания и раскрытия композиций и методологий, которые можно использовать по изобретению. Несмотря на то, что изобретение подробно описано ниже посредством иллюстрации и примеров в целях облегчения понимания, специалисты в данной области, очевидно, понимают, что в свете данного изобретения можно сделать определенные изменения и модификации, не отступая от сущности и объема прилагаемой формулы изобретения.
Пример 1: Продукция изопрена в E.coli, экспрессирующих рекомбинантную изопренсинтазу кудзу
I. Конструирование векторов для экспрессии изопренсинтазы кудзу в E.coli
Белковую последовательность гена изопренсинтазы кудзу (Pueraria montana) (IspS) получали из GenBank (AAQ84170). Ген изопренсинтазы кудзу, кодон-оптимизированный для E.coli, получали из DNA2.0(SEQ ID NO:1). Ген изопренсинтазы выделяли из полученной плазмиды расщеплением рестриктазой BspLU11I/PstI, очищали в геле и лигировали в плазмиду pTrcHis2B (Invirogen), которую расщепляли NcoI/PstI. Конструкцию готовили таким образом, чтобы стоп-кодон в гене изопренсинтазы находился 5' к сайту PstI. В результате, когда конструкцию экспрессировали, то His-метка не присоединялась к белку изопренсинтазы. Полученную плазмиду pTrcKudzu подтверждали секвенированием (фигуры 2 и 3).
Также ген изопренсинтазы клонировали в плазмиду pET16b (Novagen). В данном случае ген изопренсинтазы встраивали в pET16b таким образом, чтобы рекомбинантный белок изопренсинтазы содержал N-концевую His-метку. Ген изопренсинтазы амплифицировали из pTrcKudzu с помощью ПЦР с использованием праймера pET-His-Kudzu-2F: 5'-CGTGAGATCATATGTGTGCGACCTCTTCTCAATTTCA (SEQ ID NO:3) и pET-His-Kudzu-R: 5'-GGGTCGACGGATCCCTGCAGTTAGACATACATCAGCTG (SEQ ID NO:4). Праймеры добавляли соответственно в сайт NdeI в 5'-конце и сайт BamH1 в 3'-конце гена. Плазмиду pTrcKudzu, описанную выше, использовали в качестве ДНК-матрицы, полимеразу Herculase (Stratagene) согласно инструкциям изготовителя, и праймеры добавляли в концентрации 10 пмоль. ПЦР проводили в общем объеме, равном 25 мкл. Продукт ПЦР расщепляли NdeI/BamH1 и клонировали в плазмиду pET16b, расщепленную с использованием тех же ферментов. Смесь для лигирования трансформировали в E.coli Top10 (Invitrogen) и правильный клон отбирали секвенированием. Полученную плазмиду, в которой ген изопренсинтазы кудзу экспрессировался от Т7-промотора, обозначали как pETNHisKudzu (фигуры 4 и 5).
Также ген изопренсинтазы кудзу клонировали в низкокопийную плазмиду pCL19120. Для амплификации гена изопренсинтазы кудзу использовали праймеры из pTrcKudzu, описанной выше. Прямой праймер добавляли в сайт HindIII и консенсус RBS E.coli в 5'-конце. Сайт клонирования PstI уже имелся в pTrcKudzu непосредственно в 3' от стоп-кодона, таким образом, обратный праймер конструировали так, чтобы конечный продукт ПЦР содержал сайт PstI. Последовательности праймеров были следующими: HindIII-rbs-Kudzu F: 5'-CATATGAAAGCTTGTATCGATTAAATAAGGAGGAATAAACC (SEQ ID NO:6) и BamH1-Kudzu R: 5'-CGGTCGACGGATCCCTGCAGTTAGACATACATCAGCTG (SEQ ID NO:4).
Продукт ПЦР амплифицировали с использованием полимеразы Herculase с праймерами в концентрации 10 пмоль и 1 нг ДНК-матрицы (pTrcKudzu). Протокол амплификации включал 30 циклов (95°С в течение 1 мин, 60°С в течение 1 мин, 72°С в течение 2 мин). Продукт расщепляли HindIII и PstI и лигировали в плазмиду pCL1920, которую также расщепли HindIII и PstI. Смесь для лигирования трансформировали в E.coli Top10. Несколько трансформантов проверяли секвенированием. Полученную плазмиду обозначали, как pCL-lac-Kudzu (фигуры 6 и 7).
II. Определение продукции изопрена
Для культур во встряхиваемых колбах: 1 мл культуры переносили из встряхиваемых колб во флаконы емкостью 20 мл с пространством над жидкостью СТС (Agilent vial cat#51882753; cap cat#51882759). Крышку туго завинчивали, и флаконы инкубировали при одинаковой температуре при встряхивании со скоростью 250 об/мин. Через 30 мин флаконы удаляли из термостата и содержимое анализировали, как описано ниже (смотри таблицу 1 с опытными значениями, полученными в данном анализе).
В тех случаях, когда продукцию изопрена оценивали в ферментерах, то отбирали образцы отходящего газа из ферментера и их непосредственно анализировали, как описано ниже (смотри таблицу 2 с теми же опытными значениями, полученными в данном анализе).
Анализ проводили с использованием системы ГХ/МС Agilent 6890, сопряженной с автосамплером СТС Analytics (Швейцария) CombiPAL, предназначенным для пространства над жидкостью. Использовали колонку Agilent HP-5MS GC/MS (30×0,25 мм; пленка толщиной 0,25 мкм) для разделения анализируемых соединений. Самплер устанавливали для введения 500 мкл газа из пространства над жидкостью. При постановке ГХ/МС использовали гелий в качестве газа-носителя со скоростью потока 1 мл/мин. Температура инжектора равнялась 250°С с расщеплением потока, равным 50:1. Температуру термостата поддерживали при 37°С в течение 2 мин анализа. Масс селективный детектор Agilent 579N был установлен на режиме мониторинга единичных ионов (SIM) при m/z 67. Детектор переключали с 1,4 на 1,7 мин для элюирования постоянных газов. В данных условиях изопрен (2-метил-1,3-бутадиен) элюировал на 1,78 мин. Для количественного определения абсолютного количества изопрена использовали калибровочную таблицу и было установлено, что линейный диапазон сохранялся в пределах от 1 мкг/л до 200 мкг/л. Было установлено, что предел определения составлял 50-100 нг/л с использованием данного метода.
III. Продукция изопрена во встряхиваемых колбах, содержащих клетки E.coli, экспрессирующие рекомбинантную изопренсинтазу
Векторы, описанные выше, вводили в штамм BL21 E.coli (Novagen) для получения штаммов BL21/ptrcKudzu, BL21/pCL-lac-Kudzu и BL21/pETHisKudzu. Для выделения штаммы высевали на LA (агар Луриа) и карбенициллин (50 мкг/мл) и инкубировали в течение ночи при 37°С. Отдельные колонии инокулировали в разделенные перегородкой, встряхиваемые колбы емкостью 250 мл, содержащие 20 мл бульона Луриа Бертани (LB) и карбенициллин (100 мкг/мл). Культуры инкубировали в течение ночи при 20°С при встряхивании со скоростью 200 об/мин. Определяли OD600ночных культур и культуры разливали в разделенные перегородкой, встряхиваемые колбы емкостью 250 мл, содержащие 30 мл MagicMedia (Invitrogen) и карбенициллин (100 мкг/мл), до значения OD600≈0,05. Культуру инкубировали при 30°С при встряхивании со скоростью 200 об/мин. Когда значение OD600было равным ≈0,5-0,8, то вносили 400 мкМ IPTG и клетки инкубировали еще в течение 6 ч при 30°С при встряхивании со скоростью 200 об/мин. На 0, 2, 4 и 6 ч после индукции IPTG отбирали аликвотные порции культур объемом 1 мл, определяли значение OD600 и анализировали количество изопрена, как описано выше. Результаты приведены на фигуре 8.
IV. Продукция изопрена из BL21/ptrcKudzu при ферментации объемом 14 л
Продукцию изопрена в большом объеме клетками E.coli, содержащими ген рекомбинантной изопренсинтазы кудзу, оценивали в культуре с подпиткой. Состав ферментационной среды (ТМ2) на литр ферментационной среды был следующим: K2HPO4 13,6 г, KH2PO4 13,6 г, MgSO4·7H2O 2 г, лимонная кислота моногидрат 2 г, аммония железа (III) цитрат 0,3 г, (NH4)2SO4 3,2 г, дрожжевой экстракт 5 г, 1000× модифицированный раствор микроэлементов 1 мл. Все компоненты вносили вместе и растворяли в дистиллированной воде. Значение рН доводили до 6,8 гидроксидом калия (КОН) и доводили до конечного объема. Конечный продукт стерилизовали фильтрованием через фильтр с тонкостью фильтрования 0,22 мкм (только, без автоклавирования). Состав 1000× модифицированного раствора микроэлементов был следующим: лимонная кислота·Н2О 40 г, MnSO4·Н2О 30 г, NaCl 10 г, FeSO4·7H2O 1 г, CoCl2·6H2O 1 г, ZnSO4·7H2O 1 г, CuSO4·5H2O 100 мг, H3BO3 100 мг, NaMoO4·2H2O 100 мг. Каждый компонент последовательно растворяли в дистиллированной H2O, доводили рН до 3,0 смесью HCl/NaOH, затем доводили до конечного объема и стерилизовали фильтрованием через фильтр 0,22 мкм.
Данный опыт проводили в биореакторе емкостью 14 л с целью мониторинга образования изопрена из глюкозы при желаемой ферментации, рН 6,7 и температуре 34°С. Отбирали инокулюм штамма BL21/ptrcKudzu E.coli из замороженного флакона в среде соя-дрожжевой экстракт-глюкоза. После культивирования инокулюма до OD600 = 0,6, две колбы емкостью 600 мл центрифугировали и содержимое ресуспендировали в 70 мл супернатанта для переноса клеточного осадка (70 мл OD 3,1 вещества) в биореактор. Через различные периоды времени после инокулирования отбирали пробы и определяли количество продуцированного изопрена, как описано выше. Результаты приведены на фигуре 9.
Пример 2: Продукция изопрена в E.coli, экспрессирующими рекомбинантную изопренсинтазу тополя
Белковую последовательность изопренсинтазы тополя (Populus alba×Populus tremula) (Schnitzler J.P. et al., 2005, Planta, 222:777-786) получали из GenBank (CAC35696). Кодон-оптимизированный ген для E.coli, получали из DNA2.0 (p9796-тополь, фигуры 30 и 31). Ген изопренсинтазы извлекали из полученной плазмиды расщеплением рестриктазами BspLU11I/PstI, очищали в геле и лигировали в плазмиду pTrcHis2B, которую расщепляли NcoI/PstI. Конструкцию клонировали таким образом, чтобы стоп-кодон во вставке находился перед сайтом PstI, что приводило к получению конструкции, в которой His-метка не присоединялась к белку изопренсинтазы. Полученную плазмиду pTrcPoplar (фигуры 32 и 33) подтверждали секвенированием.
Пример 3: Продукция изопрена в Panteoa citrea, экспрессирующими рекомбинантную изопренсинтазу кудзу
Плазмиды pTrcKudzu и pCL-lac-Kudzu, описанные в примере 1, подвергали электропорации в P. citrea (патент США № 7241587). Трансформанты отбирали на LA, содержащем соответственно карбенициллин (200 мкг/мл) или спектиномицин (50 мкг/мл). Продукцию изопрена во встряхиваемых колбах и анализ количества продуцированного изопрена проводили, как описано в примере 1 для штаммов E.coli, экспрессирующих рекомбинантную изопренсинтазу кудзу. Результаты приведены на фигуре 10.
Пример 4: Продукция изопрена в Bacillus subtilis, экспрессирующими рекомбинантную изопренсинтазу кудзу
I. Конструирование B. subtilis реплицирующейся плазмиды для экспрессии изопренсинтазы кудзу
Ген изопренсинтазы кудзу экспрессировали в штамме aprEnprE Pxyl-comK Bacillus subtilis (BG3594comK)с использованием реплицирующейся плазмиды (pBS19 с кассетой резистентности к хлорамфениколу) под контролем промотора aprE. Ген изопренсинтазы, промотор aprE и терминатор транскрипции амплифицировали по отдельности и затем сливали с использованием ПЦР. Затем конструкцию клонировали в pBS19 и трансформировали в B. subtilis.
а) Амплификация промотора aprE
Промотор aprE амплифицировали из хромосомной ДНК Bacillus subtilis с использованием следующих праймеров:
CF 797(+) старт промотор aprE MfeI
5'-GACATCAATTGCTCCATTTTCTTCTGCTATA (SEQ ID NO:58)
CF 07-43(-)сливают промотор aprE с ispS кудзу
5'-ATTGAGAAGAGGTCGCACACACTCTTTACCCTCTCCTTTTA (SEQ ID NO:59)
b) Амплификация гена изопренсинтазы
Ген изопренсинтазы кудзу амплифицировали из плазмиды pTrcKudzu (SEQ ID NO:2). Ген был кодон-оптимизирован для экспрессии в E.coli и продуцировали с помощью DNA 2.0. Использовали следующие праймеры:
CF 07-42(+)сливают промотор aprE с изопренсинтазой кудзу (старт-кодон GTG)
5'-TAAAAGGAGAGGGTAAAGAGTGTGTGCGACCTCTTCTCAAT(SEQ ID NO:60)
CF 07-45(-)сливают 3'-конец изопренсинтазы кудзу с терминатором
5'-CCAAGGCCGGTTTTTTTTAGACATACATCAGCTGGTTAATC(SEQ ID NO:61)
c) Амплификация терминатора транскрипции
Терминатор из щелочной серинпротеазы Bacillus amyliquefaciens амплифицировали из ранее секвенированной плазмиды pJHPms382 с использованием следующих праймеров:
CF 07-44(+)сливают 3'-конец изопренсинтазы кудзу с терминатором
5'-GATTAACCAGCTGATGTATGTCTAAAAAAAACCGGCCTTGG(SEQ ID NO:62)
CF 07-46(-)конец терминатора B. Amyliquefaciens (Bam HI)
5'-GACATGACGGATCCGATTACGAATGCCGTCTC(SEQ ID NO:63)
Фрагмент кудзу сливали с фрагментом терминатора с использованием ПЦР со следующими праймерами:
CF 07-42(+)сливают промотор aprE с геном изопренсинтазы кудзу (старт-кодон GTG)
5'-TAAAAGGAGAGGGTAAAGAGTGTGTGCGACCTCTTCTCAAT(SEQ ID NO:61)
CF 07-46(-)конец терминатора B. amyliquefaciens (BamHI)
5'-GACATGACGGATCCGATTACGAATGCCGTCTC(SEQ ID NO:63)
Фрагмент терминатора кудзу сливали с фрагментом промотора с использованием ПЦР со следующими праймерами:
CF 797(+)старт промотор aprE MfeI
5'-GACATCAATTGCTCCATTTTCTTCTGCTATC (SEQ ID NO:64)
CF 07-46(-)конец терминатора B. amyliquefaciens (BamHI)
5'-GACATGACGGATCCGATTACGAATGCCGTCTC(SEQ ID NO:63)
Слитый ПЦР фрагмент очищали с использованием набора Qiagen и расщепляли рестриктазами MfeI и BamHI. Данный расщепленный фрагмент ДНК очищали в геле с использованием набора Qiagen и лигировали с вектором, известным как pBS19, который расщепляли EcoRI и BamHI и очищали в геле.
Смесь для лигирования трансформировали в клетки E.coli Top 10 и колонии отбирали на чашках с LA и 50 карбенициллина. В целом отбирали 6 колоний и культивировали в течение ночи на LA и 50 карбенициллина и затем плазмиды выделяли с использованием набора Qiagen. Плазмиды расщепляли EcoRI и BamHI для проверки вставок и три правильные плазмиды секвенировали со следующими праймерами:
CF 149(+) EcoRI старт промотора aprE
5'-GACATGAATTCCTCCATTTTCTTCTGC (SEQ ID NO:65)
CF 847(+) последовательность в pXX 049 (конец промотора aprE)
5'-AGGAGAGGGTAAAGAGTGAG (SEQ ID NO:66)
CF 07-45(-)сливают 3'-конец изопренсинтазы кудзу с терминатором
5'-CCAAGGCCGGTTTTTTTTAGACATACATCAGCTGGTTAATC(SEQ ID NO:61)
CF 07-48(+) секвенированный праймер для изопренсинтазы кудзу
5'-CTTTTCCATCACCCACCTGAAG (SEQ ID NO:67)
CF 07-49(+) секвенированный праймер для изопренсинтазы кудзу
5'-GGCGAAATGGTCCAACAACAAAATTATC (SEQ ID NO:68)
Плазмиду, обозначенную pBS Kudzu#2 (фигуры 52 и 12) проверяли секвенированием и трансформировали в штамм-хозяин BG 3594 comK Bacillus subtilis. Отбор проводили на чашках с LA и 5 хлорамфениколом. Отбирали трансформант и культивировали в виде единичных колоний на LA и 5 хлорамфениколе, затем культивировали на LA и 5 хлорамфениколе до достижения значения OD600, равного 1,5. Его хранили при замораживании во флаконе при -80°С в присутствии глицерина. Полученный штамм обозначали, как CF 443.
II. Продукция изопрена во встряхиваемых колбах, содержащих клетки B. subtilis, экспрессирующие рекомбинантную изопренсинтазу
Инокулировали ночные культуры с одной колонии CF443 на LA и хлорамфениколе (Cm, 25 мкг/мл). Культуры культивировали на LA и Cm при 37°С при встряхивании со скоростью 200 об/мин. Ночные культуры (1 мл) использовали для инокулирования в разделенные перегородкой, встряхиваемые колбы 250 мл, содержащие 25 мл среды Grants II и хлорамфеникол в концентрации 25 мкг/мл. Состав среды Grants II был следующим: 10 г сои, 3 мл 1М K2HPO4, 75 г глюкозы, 3,6 г мочевины, 100 мл 10Х MOPS, до 1 л Н2О, рН 7,2; состав 10Х MOPS был следующим: 83,72 г MOPS, 7,17 г трицина, 12 г гранул КОН, 10 мл 0,276 М раствора K2SO4, 10 мл 0,528 М раствора MgCl2, 29,22 г NaCl, 100 мл 100Х раствора микроэлементов, до 1 л Н2О; и состав 100Х раствора микроэлементов был следующим: 1,47 г CaCl2·2H2O, 0,4 г FeSO4·7H2O, 0,1 г MnSO4·H2O, 0,1 г ZnSO4·H2O, 0,05 г CuCl2·2H2O, 0,1 г CoCl2·6H2O, 0,1 г Na2MoO4·2H2O, до 1 л Н2О. Колбы встряхивали при инкубировании при 37°С и отбирали пробы на 18; 24 и 44 ч. На 18 ч отбирали образцы пространства над жидкостью для штамма CF443 и контрольного штамма. Это представляло 18 ч накопления изопрена. Количество изопрена определяли газовой хроматографией, как описано в примере 1. Продукция изопрена достоверно усиливалась при экспрессии рекомбинантной изопренсинтазы (фигура 11).
III. Продукция изопрена CF443 при ферментации объемом 14 л
Продукция изопрена в большом объеме клетками B. subtilis, содержащих ген рекомбинантной изопренсинтазы кудзу в реплицирующейся плазмиде, оценивали в культуре с подпиткой. Штамм CF443 Bacillus, экспрессирующий ген изопренсинтазы кудзу, или контрольный штамм, не экспрессирующий ген изопренсинтазы кудзу, культивировали в обычном ферментере с подпиткой на питательной среде, содержащей соевую муку (Cargill), фосфат натрия и калия, сульфат магния и раствор лимонной кислоты, хлорид железа (III) и хлорид магния. Перед ферментацией среду мацерировали в течение 90 мин с использованием смеси ферментов, включающей целлюлазы, гемицеллюлазы и пектиназы (смотри международную заявку WO95/04134). В ферментеры объемом 14 л подавали 60% раствор мас./мас. глюкозы (Cargill DE99 dextrose, ADM Versadex greens или Danisco invert sugar) и 99% раствор мас./мас. масла (Western Family соевое масло с 99% мас./мас. концентрацией перед внесением в среду клеточной культуры). Подачу начинали, когда глюкоза в партии не детектировалась. Скорость подачи снижали в течение нескольких часов и ее доводили для добавления масла на равной основе по углероду. Значение рН сохраняли на 6,8-7,4 с использованием 28% раствора гидроксида аммония (мас./об.). В случае вспенивания в среду добавляли противовспениватель. Температуру ферментации контролировали при 37°С и ферментационную культуру перемешивали со скоростью 750 об/мин. В течение всего процесса контролировали другие параметры, такие как рН, DO%, поток воздуха и давление. DO% поддерживали на значении 20. Образцы для анализа отбирали в течение 36 ч и оценивали рост клеток (по значению OD550) и продукцию изопрена. Результаты данных опытов приведены на фигурах 53А и 53В.
IV. Интеграция изопренсинтазы кудзу (ispS) в B. subtilis
Ген изопренсинтазы кудзу клонировали в интегрирующую плазмиду (pJH101-cmpR) под контролем промотора aprE. В тестированных условиях изопрен не детектировали.
Пример 5: Продукция изопрена в клетках Trichoderma
I. Конструирование векторов для экспрессии изопренсинтазы кудзу в Trichoderma reesei
Кодон-оптимизированный ген IS кудзу Yarrowia lipolytica синтезировали с помощью DNA 2.0 (SEQ ID NO:8) (фигура 13). Данная плазмида служила в качестве матрицы для следующей реакции амплификации с помощью ПЦР: 1 мкл плазмиды-матрицы (20 нг/мкл), 1 мкл праймера EL-945 (10 мкМ) 5'-GCTTATGGATCCTCTAGACTATTACACGTACATCAATTGG (SEQ ID NO:9), 1 мкл праймера EL-965 (10 мкл) 5'-CACCATGTGTGCAACCTCCTCCCAGTTTAC (SEQ ID NO:10), 1 мкл dNTP (10 мМ), 5 мкл 10× буфера для полимеразы PfuUltra Fusion DNA, 1 мкл полимеразы PfuUltra Fusion HS DNA, 40 мкл воды в общем объеме реакционной смеси 50 мкл. Прямой праймер содержал дополнительные 4 нуклеотида в 5'-конце, которые не соответствовали кодон-оптимизированному гену изопренсинтазы кудзу, но были необходимы для клонирования в вектор pENTR/D-TOPO. Обратный праймер содержал дополнительные 21 нуклеотид в 5'-конце, которые не соответствовали кодон-оптимизированному гену изопренсинтазы кудзу для Y. lipolytica, но были вставлены для клонирования в другие векторные основы. С использованием термоциклера MJ Research PTC-200 ПЦР проводили следующим образом: 95°С в течение 2 мин (только первый цикл), 95°С в течение 30 сек, 55°С в течение 30 сек, 72°С в течение 30 сек (повторяют 27 циклов), 72°С в течение 1 мин после последнего цикла. Продукт ПЦР анализировали на 1,2% Е-геле для подтверждения успешно проведенной амплификации кодон-оптимизированного гена изопренсинтазы кудзу Y. lipolytica.
Затем продукт ПЦР клонировали с использованием набора для клонирования TOPO pENTR/D-TOPO, следуя протоколу изготовителя: 1 мкл реакционной смеси для ПЦР, 1 мкл солевого раствора, 1 мкл вектора TOPO pENTR/D-TOPO и 3 мкл воды в общем объеме реакционной смеси 6 мкл. Реакционную смесь инкубировали в течение 5 мин. 1 мкл реакционной смеси ТОРО переносили в химически компетентные клетки ТОР10 E.coli. Трансформанты отбирали на чашках с LA и 50 мкг/мл канамицина. Отбирали несколько колоний и каждую инокулировали в пробирки 5 мл, содержащие LB и 50 мкг/мл канамицина, и культуры культивировали в течение ночи при 37°С при встряхивании со скоростью 200 об/мин. Плазмиды выделяли из пробирок с ночными культурами с использованием набора QIAprep Spin Miniprep, следуя протоколу изготовителя. Несколько плазмид секвенировали для подтверждения того, что последовательность ДНК была правильной.
Единичную плазмиду pENTR/D-TOPO, кодирующую кодон-оптимизированный ген изопренсинтазы кудзу для Y. lipolytica, использовали для клонирования Gateway в приготовленный по заказу вектор pTrex3g. Конструирование pTrex3g описано в международной заявке WO 2005/001036 А2. Реакцию проводили, следуя протоколу изготовителя в наборе Gateway LR Clonase II Enzyme (Invitrogen): 1 мкл кодон-оптимизированного гена изопренсинтазы кудзу для Y. lipolytica вектора-донора pENTR/D-TOPO, 1 мкл предназначенного вектора pTrex3g, 6 мкл буфера ТЕ, рН 8,0, в общем объеме реакционной смеси 8 мкл. Реакционную смесь инкубировали при комнатной температуре в течение 1 ч и затем вносили 1 мкл протеиназы К и инкубацию продолжали при 37°С в течение 10 мин. Затем 1 мкл реакционной смеси трансформировали в химически компетентные клетки ТОР10 E.coli. Трансформанты отбирали на чашках с LA и 50 мкг/мл карбенициллина. Отбирали несколько колоний и каждую инокулировали в пробирки, содержащие LB и 50 мкг/мл карбенициллина, и культуры культивировали в течение ночи при 37°С при встряхивании со скоростью 200 об/мин. Плазмиды выделяли из пробирок с ночными культурами с использованием набора QIAprep Spin Miniprep (Qiagen, Inc.), следуя протоколу изготовителя. Несколько плазмид секвенировали для подтверждения того, что последовательность ДНК была правильной.
Биолистическую трансформацию плазмид pTrex3g кодон-оптимизированным геном изопренсинтазы кудзу для Y. lipolytica (фигура 14) в штамм Trichoderma reesei с четырьмя делециями проводили с использованием системы для доставки частиц Biolistic PDS-1000/HE (смотри международную заявку WO 2005/001036 A2). Выделение стабильных трансформантов и оценку содержимого во встряхиваемых колбах проводили согласно протоколу, описанному в примере 11 патентной публикации заявки WO 2005/001036 A2.
II. Продукция изопрена рекомбинантными штаммами T. reesei
1 мл 15- и 36-часовых культур трансформантов по изопренсинтазе, описанных выше, переносили во флаконы с пространством над жидкостью. Флаконы герметично закрывали и инкубировали в течение 5 ч при 30°С. Газ в пространстве над жидкостью анализировали и изопрен идентифицировали методом, описанным в примере 1. Два трансформанта показывали наличие следов изопрена. Количество изопрена могло увеличиться при инкубации в течение 14 ч. Две положительные пробы демонстрировали наличие изопрена в концентрации примерно 0,5 мкг/л в течение 14 ч инкубации. Нетрансформированный контроль не показывал детектируемые количества изопрена. Результаты данного опыта свидетельствовали о том, что T. reesei способны продуцировать изопрен из эндогенного предшественника при обеспечении экстра-эндогенной изопренсинтазой.
Пример 6: Продукция изопрена в Yarrowia
I. Конструирование векторов для экспрессии изопренсинтазы кудзу в Yarrowia lipolytica
Начальной точкой процесса конструирования векторов для экспрессии гена изопренсинтазы кудзу в Yarrowia lipolytica служил вектор pSPZ1 (MAP29Spb). Полная последовательность данного вектора (SEQ ID NO:11) приведена на фигуре 15.
Следующие фрагменты амплифицировали с помощью ПЦР с использованием хромосомной ДНК штамма GICC 120285 Y. lipolytica в качестве матрицы: беспромоторный ген URA3, фрагмент гена 18S рибосомальной РНК, ген терминатора транскрипции XPR2 Y. lipolytica и два фрагмента ДНК, содержащие промоторы генов XPR2 и ICL1. Использовали следующие праймеры для ПЦР:
ICL1 3
5'-GGTGAATTCAGTCTACTGGGGATTCCCAAATCTATATATACTGCAGGTGAC (SEQ ID NO:69)
ICL1 5
5'-GCAGGTGGGAAACTATGCACTCC (SEQ ID NO:70)
XPR 3
5'-CCTGAATTCTGTTGGATTGGAGGATTGGATAGTGGG (SEQ ID NO:71)
XPR 5
5'-GGTGTCGACGTACGGTCGAGCTTATTGACC (SEQ ID NO:72)
XPRT 3
5'-GGTGGGCCCGCATTTTGCCACCTACAAGCCAG (SEQ ID NO:73)
XPRT 5
5'-GGTGAATTCTAGAGGATCCCAACGCTGTTGCCTACAACGG (SEQ ID NO:74)
Y18S 3
5'-GGTGCGGCCGCTGTCTGGACCTGGTGAGTTTCCCCG (SEQ ID NO:75)
Y18S 5
5'-GGTGGGCCCATTAAATCAGTTATCGTTTATTTGATAG (SEQ ID NO:76)
YURA3
5'-GGTGACCAGCAAGTCCATGGGTGGTTTGATCATGG (SEQ ID NO:77)
YURA 50
5'-GGTGCGGCCGCCTTTGGAGTACGACTCCAACTATG (SEQ ID NO:78)
YURA 51
5'-GCGGCCGCAGACTAAATTTATTTCAGTCTCC (SEQ ID NO:79)
Для амплификации ПЦР использовали полимеразу PfuUltraII (Stratagene), поставляемый изготовителем буфер и dNTP, 2,5 мкМ праймеров и указанную ДНК-матрицу, следуя инструкциям изготовителя. Амплификацию проводили с использованием следующего цикла: 95°С в течение 1 мин; 34× (95°С в течение 30 сек; 55°С в течение 30 сек; 72°С в течение 3 мин) и 10 мин при 72°С с последующей инкубацией при 4°С.
Молекулы синтетической ДНК, кодирующие кодон-оптимизированнный ген изопренсинтазы кудзу для экспрессии в Yarrowia, получали из DNA 2.0 (фигура 16; SEQ ID NO:12). Подробная схема конструирования плазмид pYLA(KZ1) и pYLI(KZ1), несущих ген синтетической изопренсинтазы кудзу под контролем соответственно промоторов XPR2 и ICL1, приведена на фигуре 18. Также конструировали контрольные плазмиды, в которые встраивали ген фактор спаривания (МАР29) вместо гена изопренсинтазы (фигура 18Е и 18F).
Аналогичное клонирование можно использовать для экспрессии гена изопренсинтазы тополя (Populus alba×Populus tremula). Последовательность изопренсинтазы тополя описана Miller B. et al., 2001, Planta, 213, 483-487 и показана на фигуре 17 (SEQ ID NO:13). Схема конструирования плазмид pYLA(POP1) и pYLI(POP1), несущих ген синтетической изопренсинтазы тополя под контролем соответственно промоторов XPR2 и ICL1, приведена на фигуре 18А и фигуре 18В.
II. Продукция изопрена рекомбинантными штаммами Y. lipolytica
Векторы pYLA(KZ1), pYLI(KZ1), pYLA(MAP29) и pYLI(MAP29) расщепляли SacII и использовали для трансформации штамма CLIB 122 Y. lipolytica с использованием стандартного метода со смесью ацетат лития/полиэтиленгликоль с воспроизведением уридиновой прототрофии. Вкратце, дрожжевые клетки культивировали в YEPD (1% дрожжевого экстракта, 2% пептина, 2% глюкозы) в течение ночи, собирали центрифугированием (4000 об/мин, 10 мин), один раз промывали стерильной водой и суспендировали в 0,1 М растворе ацетата лития, рН 6,0. Аликвотные порции клеточной суспензии объемом 200 мкл смешивали с раствором линеаризованной плазмидной ДНК (10-20 мкг), инкубировали в течение 10 мин при комнатной температуре и смешивали с 1 мл 50% ПЭГа 4000 в том же буфере. Суспензию дополнительно инкубировали в течение 1 ч при комнатной температуре, затем подвергали тепловому шоку при 42°С в течение 2 мин. Затем клетки высевали на чашки с SC his leu (0,67% азотистого основания дрожжей, 2% глюкозы, 100 мкг/л каждого из лейцина и гистидина). Трансформанты появлялись через 3-4 суток инкубации при 30°С.
Три изолята из трансформации pYLA(KZ1), три изолята из трансформации pYLI(KZ1), два изолята из трансформации pYLA(MAP29) и два изолята из трансформации pYLI(MAP29) культивировали в течение 24 ч на среде YEP7 (1% дрожжевого экстракта, 2% пептона, рН 7,0) при 30°С при встряхивании. Клетки из 10 мл культуры собирали центрифугированием, ресуспендировали в 3 мл свежей среды YEP7 и помещали во флаконы с завинчивающейся крышкой емкостью 15 мл. Флаконы инкубировали в течение ночи при комнатной температуре при мягком встряхивании (60 об/мин). Содержание изопрена в пространстве над жидкостью в данных флаконах определяли газовой хроматографией с использованием масс-спектрометрического детектора, как описано в примере 1. Все трансформанты, полученные с использованием pYLA(KZ1) и pYLI(KZ1), продуцировали отчетливо детектируемые количества изопрена (от 0,5 мкг/л до 1 мкг/л, фигура 20). Изопрен отсутствовал в пространстве над жидкостью контрольных штаммов, несущих ген фитазы, вместо гена изопренсинтазы.
Пример 7: Продукция изопрена в E.coli, экспрессирующими изопренсинтазу кудзу и idi или dxs, или idi и dxs
I. Конструирование векторов, кодирующих изопренсинтазу кудзу и idi или dxs, или idi и dxs для продукции изопрена в E.coli
i) Конструирование pTrcKudzuKan
Ген bla в pTrcKudzu (описана в примере 1) замещали на ген, придающий резистентность к канамицину. Для вырезания гена bla плазмиду pTrcKudzu расщепляли BspHI, обрабатывали щелочной фосфатазой Shrimp (SAP), разрушали нагреванием при 65°С, затем присоединяли к концу фрагмент Кленова и dNTP. Крупный фрагмент размером 5 т.п.н. выделяли из агарозного геля и лигировали с геном kanr, который амплифицировали с помощью ПЦР из pCR-Blunt-II-TOPO с использованием праймеров MCM22 5'-GATCAAGCTTAACCGGAATTGCCAGCTG (SEQ ID NO:14) и MCM23 5'-GATCCGATCGTCAGAAGAACTCGTCAAGAAGGC (SEQ ID NO:15), расщепляли HindIII и PvuI, и наполняли конец. Трансформант, несущий плазмиду, придающую резистентность к канамицину (pTrcKudzuKan), отбирали на LA с канамицином в концентрации 50 мкг/мл.
ii) Конструирование pTrcKudzu yIDI Kan
Плазмиду pTrcKudzuKan расщепляли PstI, обрабатывали SAP, разрушали тепловой обработкой и очищали в геле. Ее лигировали с продуктом ПЦР, кодирующим idi из S. cerevisiae, с помощью синтетического RBS. Праймерами для ПЦР были NsiI-YIDI 1 F 5'-CATCAATGCATCGCCCTTAGGAGGTAAAAAAAAATGAC (SEQ ID NO:16) и PstI-YIDI 1 R 5'-CCTTCTGCAGGACGCGTTGTTATAGC (SEQ ID NO:17); и матрицей служила геномная ДНК S. cerevisiae. Продукт ПЦР расщепляли с помощью NsiI и PstI и очищали в геле перед лигированием. Смесь для лигирования трансформировали в химически компетентные клетки ТОР10 и отбирали на LA, содержащем 50 мкг/мл канамицина. Выделяли несколько трансформантов, секвенировали и полученную плазмиду обозначали pTrcKudzu-yIDI(kan) (фигуры 34 и 35).
iii) Конструирование pTrcKudzu DXS Kan
Плазмиду pTrcKudzuKan расщепляли PstI, обрабатывали SAP, разрушали тепловой обработкой и очищали в геле. Ее лигировали с продуктом ПЦР, кодирующим dxs из E.coli, с помощью синтетического RBS. Праймерами для ПЦР были MCM13 5'-GATCATGCATTCGCCCTTAGGAGGTAAAAAAACATGAGTTTTGATATTGCCAAATACCCG (SEQ ID NO:18) и MCM14 5'-CATGCTGCAGTTATGCCAGCCAGGCCTTGAT (SEQ ID NO:19); и матрицей служила геномная ДНК E.coli. Продукт ПЦР расщепляли с помощью NsiI и PstI и очищали в геле перед лигированием. Полученную реакционную смесь для трансформации трансформировали в клетки ТОР10 и отбирали на LA, содержащем 50 мкг/мл канамицина. Выделяли несколько трансформантов, секвенировали и полученную плазмиду обозначали pTrcKudzu-DXS(kan) (фигуры 36 и 37).
iv) Конструирование pTrcKudzu-yIDI-dxs(kan)
Плазмиду pTrcKudzu-yIDI(kan) расщепляли PstI, обрабатывали SAP, разрушали тепловой обработкой и очищали в геле. Ее лигировали с продуктом ПЦР, кодирующим dxs из E.coli, с помощью синтетического RBS (праймеры MCM13 5'-GATCATGCATTCGCCCTTAGGAGGTAAAAAAACATGAGTTTTGATATTGCCAAATACCCG (SEQ ID NO:18) и MCM14 5'-CATGCTGCAGTTATGCCAGCCAGGCCTTGAT (SEQ ID NO:19); матрица клеток ТОР10), который расщепляли с помощью NsiI и PstI и очищали в геле. Конечную плазмиду обозначали pTrcKudzu-yIDI-dxs(kan) (фигуры 21 и 22).
v) Конструирование pCL PtrcKudzu
Фрагмент ДНК, содержащий промотор, структурный ген и терминатор, описанный в примере 1 выше, вырезали из pTrcKudzu с использованием SspI и очищали в геле. Его лигировали с pCL1920, которую расщепляли PvuII, обрабатывали SAP и разрушали тепловой обработкой. Полученную смесь для лигирования трансформировали в клетки ТОР10 и отбирали на LA, содержащем спектиномицин в концентрации 50 мкг/мл. Выделяли несколько клонов и отбирали два клона. pCL PtrcKudzu и pCL PtrcKudzu (А3) содержали вставку в противоположных направлениях (фигуры 38-41).
vi) Конструирование pCL PtrcKudzu yIDI
Вырезанный с помощью обработки NsiI-PstI, очищенный в геле ампликон ПЦР IDI, полученный как описано в п. (ii), лигировали с pCL PtrcKudzu, которую расщепляли PstI, обрабатывали SAP и разрушали тепловой обработкой. Смесь для лигирования трансформировали в клетки ТОР10 и отбирали на LA, содержащем спектиномицин в концентрации 50 мкг/мл. Выделяли несколько клонов, секвенировали и полученную плазмиду обозначали pCL PtrcKudzu yIDI (фигуры 42 и 43).
vii) Конструирование pCL PtrcKudzu DXS
Вырезанный с помощью обработки NsiI-PstI, очищенный в геле ампликон ПЦР DXS, полученный как описано в п. (iii), лигировали с pCL PtrcKudzu (А3), которую расщепляли PstI, обрабатывали SAP и разрушали тепловой обработкой. Смесь для лигирования трансформировали в клетки ТОР10 и отбирали на LA, содержащем спектиномицин в концентрации 50 мкг/мл. Выделяли несколько клонов, секвенировали и полученную плазмиду обозначали pCL PtrcKudzu DXS (фигуры 44 и 45).
II. Определение изопрена в пространстве над жидкостью из культур, экспрессирующих изопренсинтазу кудзу, idi и/или dxs при различном количестве копий
Культуры E.coli BL21 (λDE3), предварительно трансформированные плазмидами pTrcKudzu(kan)(A), pTrcKudzu-yIDI kan (B), pTrcKudzu-DXS kan (C), pTrcKudzu-yIDI-DXS kan (D) культивировали в LB с канамицином в концентрации 50 мкг/мл. Культуры pCL PtrcKudzu (E), pCL PtrcKudzu-yIDI (F) и pCL PtrcKudzu-DXS (G) культивировали в LB с канамицином в концентрации 50 мкг/мл. Культуры индуцировали 400 мкМ IPTG на 0 время (OD600 равно примерно 0,5) и отбирали пробы для анализа на содержание изопрена из пространства над жидкостью (смотри пример 1). Результаты приведены на фигурах 23А-23G.
Плазмиду pTrcKudzu-yIDI-DXS (kan) вводили в штамм BL21 E.coli посредством трансформации. Полученный штамм BL21/pTrcKudzu IDI DXS культивировали в течение ночи на LB, содержащем канамицин (50 мкг/мл), при 20°С и использовали для инокулирования во встряхиваемые колбы со средой ТМ3 (13,6 г K2PO4, 13,6 г KH2PO4, 2,0 г MgSO4·7H2O), 2,0 г лимонной кислоты моногидрата, 0,3 г аммония железа (III) цитрата, 3,2 г (NH4)2SO4, 0,2 г дрожжевого экстракта, 1,0 мл 1000× модифицированного раствора микроэлементов, доведенным до рН 6,8 и до конечного объема Н2О и стерилизовали фильтрованием), содержащей 1% глюкозы. Колбы инкубировали при 30°С до получения значения OD600, равного 0,8, и затем индуцировали 400 мкМ IPTG. Пробы отбирали на различные временные точки после индукции и определяли содержание изопрена в пространстве над жидкостью (смотри пример 1). Результаты приведены на фигуре 23Н.
III. Продукция изопрена из биомассы в E.coli/pTrcKudzu yIDI DXS
Штамм BL21/pTrcKudzu IDI DXS тестировали на его способность продуцировать изопрен из трех типов биомассы: жмыха, кукурузной соломы и мягкой древесной пульпы с глюкозой в качестве контроля. Гидролизаты биомассы готовили ферментативным гидролизом (Brown L. and Torget R., 1996, NREL standard method Lap-009 «Enzymatic of Lignocellulosic Biomass») и использовали при разведении, основанном на эквивалентных количествах глюкозы. В данном примере эквивалентные количества глюкозы были равны 1% глюкозы. Единичную колонию с чашки с только что трансформированными клетками BL21 (DE3)pTrcKudzu yIDI DXS (kan) использовали для инокулирования в 5 мл LB плюс канамицин (50 мкг/мл). Культуру инкубировали в течение ночи при 25°С при встряхивании. На следующий день ночные культуры разводили до значения OD600, равного 0,05 в 25 мл ТМ3 и 0,2% YE и 1% сырья. Сырье представляло собой кукурузную солому, жмых и мягкую древесную пульпу. Глюкозу использовали в качестве положительного контроля и вариант без глюкозы использовали в качестве отрицательного контроля. Культуры инкубировали при 30°С при встряхивании со скоростью 180 об/мин. Проводили наблюдение за ростом культуры по значению OD600, и когда значение данного показателя достигало ≈0,8, культуры анализировали на 1 и 3 ч на продукцию изопрена, как описано в примере 1. Культуры не индуцировали. Все культуры, содержащие добавленное сырье, синтезировали изопрен в количестве, эквивалентном положительному контролю, т.е. глюкозе. Опыты проводили в двух параллелях и результаты приведены на фигуре 46.
IV. Продукция изопрена из инвертированного сахара в E.coli/pTrcKudzu IDI DXS
Единичную колонию с чашки с только что трансформированными клетками BL21 (λDE3)/pTrcKudzu IDI DXS (kan) использовали для инокулирования в 5 мл LB плюс канамицин (50 мкг/мл). Культуру инкубировали в течение ночи при 25°С при встряхивании. На следующие сутки ночные культуры разводили до значения OD600, равного 0,05, в 25 мл ТМ3 и 0,2% YE и 1% сырья. Сырье представляло собой глюкозу, инвертированную глюкозу и кукурузную солому. Сырье в виде инвертированного сахара (Danisco Invert Sugar) готовили ферментативной обработкой сиропа сахарозы. Кукурузную солому с обработкой AFEX готовили, как описано ниже (раздел V). Клетки выращивали при 30°С и первую пробу анализировали, когда значение OD600 достигало ≈0,8-1,0 (0 ч). Все культуры анализировали на рост по значению OD600 и на продукцию изопрена, как описано в примере 1 на 0, 1 и 3 ч. Результаты приведены на фигуре 47.
V. Получение гидролизата из предварительно обработанной AFEX кукурузной соломы
Предварительно обработанную AFEX кукурузную солому получали из Мичиганского института биотехнологии. Условия предварительной обработки были следующими: 60% влажность, нагрузка аммиаком 1:1 и 90°С в течение 30 мин, затем высушивали на воздухе. Содержание влаги в предварительно обработанной AFEX кукурузной соломе составляло 21,27%. Содержание глюкана и ксилана в предварительно обработанной AFEX кукурузной соломе равнялось соответственно 31,7% и 19,1% (в пересчете на сухое вещество). Процесс сахарификации был следующим: 20 г предварительно обработанной AFEX кукурузной соломы вносили в колбу емкостью 500 мл с 5 мл 1М натриевого цитратного буфера, рН 4,8, 2,25 мл ацеллеразы 1000, 0,1 мл гриндамила H121 (ксиланаза Danisco, продукт Aspergillus niger для хлебопекарной промышленности) и 72,65 мл воды DI. Колбу помещали в орбитальный шейкер и инкубировали при 50°С на 96 ч. Одну пробу отбирали из шейкера и анализировали с использованием ВЭЖХ. Гидролизат содержал 38,5 г/л глюкозы, 21,8 г/л ксилозы и 10,3 г/л олигомеров глюкозы и/или ксилозы.
VI. Влияние дрожжевого экстракта на продукцию изопрена в E.coli, культивируемыми в культуре с подпиткой
Ферментацию проводили в объеме 14 л, как описано ранее для клеток E.coli, содержащих плазмиду pTrcKudzu yIDI DXS, описанную выше. Дрожжевой экстракт (Bio Springer, Montreal, Quebec, Канада) подавали с экспоненциальной скоростью. Общее количество дрожжевого экстракта, вносимого в ферментер, варьировало в пределах от 70 до 830 г в период 40-часовой ферментации. Оптическую плотность ферментационного бульона определяли при длине волны 550 нм. Конечная оптическая плотность в ферментерах была пропорциональна количеству внесенного дрожжевого экстракта (фигура 48А). Уровень изопрена в отходящем газе из ферментера определяли, как описано выше. Титр изопрена повышался в течение ферментации (фигура 48В). Количество продуцированного изопрена было прямо пропорционально количеству внесенного дрожжевого экстракта (фигура 48С).
VII. Продукция изопрена при ферментации объемом 500 л pTrcKudzu DXS yIDI
Ферментацию объемом 500 л клеток E.coli с нуклеиновыми кислотами изопренсинтазы кудзу, IDI S. cerevisiae и DXSE.coli (E.coli BL21 (λDE3)pTrcKudzu dxs yidi) использовали для получения изопрена. Концентрация изопрена варьировала от 50 до 300 мкг/л в течение 15 ч. На основе значений средней концентрации изопрена, среднего потока через устройство и степени проникновения внутрь изопрена рассчитывали количество собранного изопрена, которое составило примерно 17 г.
VIII. Продукция изопрена при ферментации объемом 500 л E.coli в культуре с подпиткой
Состав среды (на литр ферментационной среды):
K2HPO4 7,5 г, MgSO4·7H2O 2 г, лимонная кислота моногидрат 2 г, аммония железа (III) цитрат 0,3 г, дрожжевой экстракт 0,5 г, 1000× модифицированный раствор микроэлементов 1 мл. Все компоненты вносили вместе и растворяли в дистиллированной воде. Данный раствор автоклавировали. Значение рН доводили до 7,0 газообразным аммиаком (NH3) и доводили до конечного объема. После стерилизации и доведения рН добавляли глюкозу 10 г, тиамин·HCl 0,1 г и антибиотики.
Состав модифицированного раствора микроэлементов:
Лимонная кислота·Н2О 40 г, MnSO4·Н2О 30 г, NaCl 10 г, FeSO4·7H2O 1 г, CoCl2·6H2O 1 г, ZnSO4·7H2O 1 г, CuSO4·5H2O 100 мг, H3BO3 100 мг, NaMoO4·2H2O 100 мг. Каждый компонент последовательно растворяли в дистиллированной H2O, доводили рН до 3,0 смесью HCl/NaOH, затем доводили до конечного объема и стерилизовали фильтрованием через фильтр 0,22 мкм.
Ферментацию проводили в биореакторе емкостью 500 л с клетками E.coli, содержащими плазмиду pTrcKudzu yIDI DXS. Данный опыт проводили для оценки образования изопрена из глюкозы и дрожжевого экстракта при желаемых условиях ферментации, рН 7,0 и температуре 30°С. Отбирали инокулюм штамма E.coli из замороженного флакона в среде соя-дрожжевой экстракт-глюкоза. После культивирования инокулюма до значения OD 0,15 при длине волны 550 нм, использовали 20 мл для внесения в биореактор, содержащий среду соя-дрожжевой экстракт-глюкоза. Содержимое биореактора емкостью 2,5 л культивировали при 30°С до OD 1,0 и 2,0 л переносили в биореактор емкостью 500 л.
Дрожжевой экстракт (Bio Springer, Montreal, Quebec, Канада) и глюкозу подавали с экспоненциальными скоростями. Общее количество глюкозы и дрожжевого экстракта, внесенное в биореактор за 50 ч ферментации, равнялось соответственно 181,2 кг и 17,6 кг. Значения оптической плотности содержимого биореактора в течение времени приведено на фигуре 49А. Уровень изопрена в отходящем газе из биореактора определяли, как описано ранее. Титр изопрена повышался в течение ферментации (фигура 49В). Общее количество изопрена за 50 ч ферментации составило 55,1 г и время продукции приведено на фигуре 49С.
Пример 8: Продукция изопрена в E.coli, экспрессирующими гены изопренсинтазы кудзу и рекомбинантные гены пути мевалоновой кислоты
I. Клонирование нижнего пути MVA
Стратегия клонирования генов нижнего пути мевалоновой кислоты была следующей. Четыре гена пути биосинтеза мевалоновой кислоты: гены мевалонаткиназы (MVK), фосфомевалонаткиназы (PMK), дифосфомевалонатдекарбоксилазы (MVD) и изопентенилдифосфатизомеразы амплифицировали ПЦР из хромосомной ДНК S. cerevisiae и клонировали по отдельности в плазмиду pCR BluntII TOPO (Invitrogen). В некоторых случаях ген idi амплифицировали из хромосомной ДНК E.coli. Праймеры конструировали таким образом, что консенсус RBS E.coli (AGGAGGT (SEQ ID NO:80) или AAGGAGG (SEQ ID NO:81)) встраивали в 5'-конец, 8 п.о. слева от старт-кодона и сайт PstI добавляли в 3'-конец. Затем гены поочередно клонировали один за другим в вектор pTrcHis2B до сборки всего пути.
Хромосомную ДНК из S. cerevisiae S288C получали из АТСС (АТСС 204508D). Ген MVK амплифицировали из хромосомы S. cerevisiae с использованием праймеров MVKF (5'-AGGAGGTAAAAAAACATGTCATTACCGTTCTTAACTTCTGC, SEQ ID NO:21) и MVK-Pst1-R (5'-ATGGCTGCAGGCCTATCGCAAATTAGCTTATGAAGTCCATGGTAAATTCGTG, SEQ ID NO:22), используя полимеразу PfuTurbo согласно инструкциям изготовителя. Идентифицировали продукт ПЦР с правильным размером (1370 п.о.) с использованием электрофореза в 1,2% Е-геле (Invitrogen) и клонировали в pZeroBLUNT TOPO. Полученную плазмиду обозначали как pMVK1. Плазмиду pMVK1 расщепляли рестриктазами SacI и Taq1, фрагмент очищали в геле и лигировали в pTrcHis2D, расщепленную SacI и BstBI. Полученную плазмиду обозначали pTrcMVK1.
Второй ген на пути биосинтеза мевалоновой кислоты, PMK, амплифицировали ПЦР с использованием праймеров: PstI-PMK1 R (5'-GAATTCGCCCTTCTGCAGCTACC, SEQ ID NO:23) и BsiHKA I-PMK1 F (5'-CGACTGGTGCACCCTTAAGGAGGAAAAAACATGTCAG, SEQ ID NO:24). Реакцию ПЦР проводили с использованием полимеразы Pfu Turbo (Stratagene), следуя инструкциям изготовителя. Продукт с правильным размером (1387 п.о.) расщепляли с помощью PstI и BsiHKI и лигировали в плазмиду pTrcMVK1, расщепленную PstI. Полученную плазмиду обозначали pTrcKK. Гены MVD и idi клонировали аналогичным путем. ПЦР проводили с использованием пары праймеров PstI-MVD 1 R (5'-GTGCTGGAATTCGCCCTTCTGCAGC, SEQ ID NO:25) и Nsi-MVD 1 F (5'-GTAGATGCATGCAGAATTCGCCCTTAAGGAGG, SEQ ID NO:26) для амплификации гена MVD и PstI-YIDI 1 R (5'-CCTTCTGCAGGACGCGTTGTTATAGC, SEQ ID NO:27) и NsiI-YIDI 1 F (5'-CATCAATGCATCGCCCTTAGGAGGTAAAAAAAATGAC, SEQ ID NO:28) для амплификации гена yIDI. В некоторых случаях использовали ген изомеразы IPP, idi из E.coli. Для амплификации idi из хромосомной ДНК E.coli использовали следующие праймеры: PstI-CIDI 1 R (5'-GTGTGATGGATATCTGCAGAATTCG, SEQ ID NO:29) и NsiI-CIDI 1 F (5'-CATCAATGCATCGCCCTTAGGAGGTAAAAAAACATG, SEQ ID NO:30). ДНК-матрицей была хромосомная ДНК, выделенная с использованием обычных методов из E.coli FM5 (международные заявки WO 96/35796 и WO 2004/033646, каждая из которых в полном объеме включена в настоящий документ для сведения, в частности, в отношении выделения нуклеиновых кислот). Конечные плазмиды обозначали pKKDIy для конструкции, кодирующей ген дрожжевой idi, или pKKDIc для конструкции, кодирующей ген idi E.coli. Плазмиды трансформировали в клетки-хозяева штамма BL21 E.coli для последующего анализа. В некоторых случаях изопренсинтазу кудзу клонировали в pKKDIy с получением плазмиды pKKDIyIS.
Нижний путь MVA также клонировали в pTrc, содержащую маркер резистентности к антибиотику канамицину. Плазмиду pKTrcKKDIy расщепляли рестриктазами ApaI и PstI, фрагмент размером 5930 п.н. выделяли на 1,2% агарозном Е-геле и очищали с использованием набора для очистки Qiagen Gel Purification, следуя инструкциям изготовителя. Плазмиду pTrcKudzuKan, описанную в примере 7, расщепляли рестриктазами ApaI и PstI, фрагмент размером 3338 п.н., содержащий вектор, выделяли на 1,2% агарозном Е-геле с использованием набора для очистки Qiagen Gel Purification. Фрагмент вектора размером 3338 п.н. и фрагмент нижнего пути размером 5930 п.н. лигировали с использованием набора для лигирования Roche Quick Ligation. Смесь для лигирования трансформировали в клетки TOP10 E.coli и трансформанты культивировали при 37°С в течение ночи с последующим отбором на LA, содержащем канамицин (50 мкг/мл). Трансформанты подтверждали расщеплением рестриктазами и один замораживали в качестве маточного. Плазмиду обозначали pTrcKanKKDIy.
II. Клонирование гена изопренсинтазы кудзу в pTrcKanKKDIy
Ген изопренсинтазы кудзу амплифицировали ПЦР из pTrcKudzu, описанной в примере 1, используя праймеры MCM50 5'-GATCATGCATTCGCCCTTAGGAGGTAAAAAAACATGTGTGCGACCTCTTCTCAATTTACT (SEQ ID NO:31) и MCM53 5'-CGGTCGACGGATCCCTGCAGTTAGACATACATCAGCTG (SEQ ID NO:32). Полученный фрагмент ПЦР клонировали в pCR2.1 и трансформировали в клетки TOP10 E.coli. Данный фрагмент содержал кодирующую последовательность изопренсинтазы кудзу и выше область, содержащую RBS из E.coli. Трансформанты инкубировали в течение ночи при 37°С с отбором на LA, содержащем канамицин (50 мкг/мл). Правильную вставку фрагмента подтверждали секвенированием, и данный штамм обозначали MCM93.
Плазмиду из штамма MCM93 расщепляли рестриктазами NsiI и PstI для высвобождения вставки размером 1724 п.н., содержащей RBS и изопренсинтазу кудзу. Фрагмент размером 1724 п.н. выделяли на 1,2% агарозном Е-геле и очищали с использованием набора для очистки Qiagen Gel Purification, следуя инструкциям изготовителя. Плазмиду pTrcKanKKDIy расщепляли рестриктазой PstI, обрабатывали SAP в течение 30 мин при 37°С и очищали с использованием набора для очистки Qiagen PCR cleanup. Плазмиду и фрагмент ДНК, кодирующий изопренсинтазу кудзу, лигировали с использованием набора для лигирования Roche Quick Ligation. Смесь для лигирования трансформировали в клетки TOP10 E.coli и трансформанты культивировали при 37°С в течение ночи с отбором на LA, содержащем канамицин в концентрации 50 мкг/мл. Правильный трансформант подтверждали расщеплением рестриктазами и плазмиду обозначали pTrcKKDyIkISKan (фигуры 24 и 25). Данную плазмиду трансформировали в клетки BL21(λDE3) (Invitrogen).
III. Продукция изопрена из мевалоната в E.coli, экспресссирующими рекомбинантный нижний путь мевалоната и изопренсинтазу из кудзу
Штамм BL21/pTrcKKDyIkISKan культивировали в среде MOPS (Neidhardt et al., 1974, J. Bacteriology, 119:736-747), доведенной до рН 7,1 и с добавлением 0,5% глюкозы и 0,5% мевалоновой кислоты. Также готовили контрольную культуру в идентичных условиях, но без добавления 0,5% мевалоновой кислоты. Культуру получали из ночной культуры с 1% инокулюма и индуцировали 500 мкМ IPTG, когда значение OD600 достигало пределов 0,3-0,5. Культуры культивировали при 30°С при встряхивании со скоростью 250 об/мин. Продукцию изопрена анализировали через 3 ч после индукции с использованием метода анализа пространства над жидкостью, описанного в примере 1. Максимальная продукция изопрена составляла 6,67×104 нмоль/лбульона/OD600/ч, где лбульона представляет объем бульона и он включает объем клеточной среды и объем клеток. Контрольная культура без добавления мевалоновой кислоты не продуцировала детектируемый уровень изопрена.
IV. Клонирование верхнего пути MVA
Верхний путь биосинтеза мевалоната, включающий два гена, кодирующих три ферментативные активности, клонировали из Enterococcus faecalis. Ген mvaE кодирует белок с ферментативной активностью обоих ферментов ацетил-СоА-ацетилтрансферазы и 3-гидрокси-3-метилглутарил-СоА-редуктазы (HMG-CoA-редуктазы), которые представляют собой первый и третий белки на данном пути, и ген mvaS кодирует второй фермент на данном пути, HMG-CoA-синтазу. Ген mvaE аплифицировали из геномной ДНК E. faecalis (АТСС 700802D-5) с сайтом связывания рибосомы и спейсером E.coli впереди с использованием следующих праймеров:
CF 07-60(+)старт mvaE w/RBS + старт-кодон ATG SacI
5'-GAGACATGAGCTCAGGAGGTAAAAAAACATGAAAACAGTAGTTATTATTG (SEQ ID NO:34)
CF 07-62(-)сливают mvaE с mvaS с RBS между ними
5'-TTTATCAATCCCAATTGTCATGTTTTTTTACCTCCTTTATTGTTTTCTTAAATC (SEQ ID NO:35).
Ген mvaS амплифицировали из геномной ДНК E. faecalis (АТСС 700802D-5) с RBS и спейсером E.coli впереди с использованием следующих праймеров:
CF 07-61(+)сливают mvaE с mvaS с RBS между ними
5'-GATTTAAGAAAACAATAAAGGAGGTAAAAAAACATGACAATTGGGATTGATAAA (SEQ ID NO:36)
CF 07-102(-)конец гена mvaS BglII
5'-GACATGACATAGATCTTTAGTTTCGATAAGAACGAACGGT (SEQ ID NO:37).
Фрагменты ПЦР сливали друг с другом с помощью ПЦР с использованием следующих праймеров:
CF 07-60(+)старт mvaE w/RBS + старт-кодон ATG SacI
5'-GAGACATGAGCTCAGGAGGTAAAAAAACATGAAAACAGTAGTTATTATTG (SEQ ID NO:34)
CF 07-102(-)конец гена mvaS BglII
5'-GACATGACATAGATCTTTAGTTTCGATAAGAACGAACGGT (SEQ ID NO:37).
Слитый фрагмент ПЦР очищали с использованием набора Qiagen и расщепляли рестриктазами SacI и BglII. Данный расщепленный фрагмент ДНК очищали в геле с использованием набора Qiagen и лигировали в промышленно доступный вектор pTrcHis2A, который расщепляли SacI и BglII и очищали в геле.
Смесь для лигирования трансформировали в клетки TOP10 E.coli и колонии отбирали на чашках с LA и карбенициллином в концентрации 50 мкг/мл. В целом отобрали 6 колоний и культивировали на LB и 50 мкг/мл карбенициллина и плазмиды выделяли с использованием набора Qiagen. Плазмиды расщепляли SacI и BglII для проверки вставок и одну правильную плазмиду секвенировали с использованием следующих праймеров:
CF 07-58(+)старт гена mvaE
5'-ATGAAAACAGTAGTTATTATTGATGC (SEQ ID NO:38)
CF 07-59(-)конец гена mvaE
5'-ATGTTATTGTTTTCTTAAATCATTTAAAATAGC (SEQ ID NO:39)
CF 07-82(+)старт гена mvaS
5'-ATGACAATTGGGATTGATAAAATTAG (SEQ ID NO:40)
CF 07-83(-)конец гена mvaS
5'-TTAGTTTCGATAAGAACGAACGGT (SEQ ID NO:41)
CF 07-86(+)последовательность в mvaE
5'-GAAATAGCCCCATTAGAAGTATC (SEQ ID NO:42)
CF 07-87(+)последовательность в mvaE
5'-TTGCCAATCATATGATTGAAAATC (SEQ ID NO:43)
CF 07-88(+)последовательность в mvaE
5'-GCTATGCTTCATTAGATCCTTATCG (SEQ ID NO:44)
CF 07-89(+)последовательность mvaS
5'-GAAACCTACATCCAATCTTTTGCCC (SEQ ID NO:45).
В результате секвенирования было установлено, что плазмида pTrcHis2Aверхний путь#1 была правильной и ее трансформировали в промышленно доступный штамм BL21 E.coli. Отбор проводили на LA и 50 мкг/мл карбенициллина. Отбирали два трансформанта и культивировали на LB и 50 мкг/мл карбенициллина до достижения значения OD600, равного 1,5. Оба штамма замораживали во флаконе при -80°С в присутствии глицерина. Штаммы обозначали, как CF 449 для pTrcHis2Aверхний путь#1 в BL21, изолят #1 и CF 450 для pTrcHis2Aверхний путь#1 в BL21, изолят #2. Было установлено, что оба клона демонстрировали одинаковое поведение при анализе.
V. Клонирование верхнего пути MVA в pCL1920
Плазмиду pTrcHis2Aверхний путь расщепляли рестриктазой SspI с высвобождением фрагмента, содержащего pTrc-mvaT-mvaS-(His метка)-терминатор. В данном фрагменте his-метка не транслировалась. Данный фрагмент размером 4,5 т.п.н. с липким концом очищали в 1,2% Е-геле с использованием набора для очистки Qiagen Gel Purification. Готовили фрагмент размером 4,2 т.п.н. с дефосфорилированными липкими концами из pCL1920 расщеплением вектора рестриктазой PvuII, обрабатывали SAP и очищали в 1,2% Е-геле с использованием набора для очистки Qiagen Gel Purification. Два фрагмента лигировали с использованием набора для лигирования Roche Quick Ligation и трансформировали в химически компетентные клетки TOP10. Трансформанты отбирали на LA, содержащем спектиномицин (50 мкг/мл). Правильную колонию идентифицировали скринингом в присутствии вставки ПЦР. Плазмиду обозначали pCL Ptrcверхний путь (фигуры 26 и 27).
VI. Штаммы, экспрессирующие объединенные верхний и нижний пути мевалоновой кислоты
Для получения штамма с полным путем мевалоновой кислоты плюс изопренсинтазой кудзу обе плазмиды pTrcKKDyIkISkan и pCLpTrcверхний путь трансформировали в компетентные клетки BL21(λDE3) (Invitrogen) и трансформанты отбирали на LA, содержащем канамицин (50 мкг/мл) и спектиномицин (50 мкг/мл). Трансформанты проверяли с помощью наборов plasmid prep для гарантии того, что обе плазмиды находились в хозяине. Штамм обозначали MCM127.
VII. Продукция мевалоновой кислоты из глюкозы в E.coli/pUверхний путь
Единичные колонии BL21/pTrcHis2A-mvaE/mvaS или FM5/p pTrcHis2A-mvaE/mvaS инокулировали на LB с карбенициллином (100 мкг/мл) и культивировали в течение ночи при 37°С при встряхивании со скоростью 200 об/мин. Культуры разводили в 50 мл среды в 250 мл разделенных перегородкой колбах до значения OD600, равного 0,1. Средой была среда ТМ3, 1 или 2% глюкозы, карбенициллин (100 кг/мл) или среда ТМ3, 1% глюкозы, гидролизованное соевое масло и карбенициллин (100 кг/мл), или ТМ3 и биомасса (приготовленные жмых, кукурузная солома или прутьевидное просо). Культуры культивировали при 30°С при встряхивании со скоростью 200 об/мин примерно в течение 2-3 ч до достижения OD600, равного 0,4. На данной точке индуцировали экспрессию из конструкции mvaE mvaS добавлением IPTG (400 мкМ). Культуры инкубировали еще в течение 20-40 ч с отбором образцов до 6 ч с интервалом 2 ч после индукции и затем на 24; 36 и 48 ч, при необходимости. Отбор проб проводили удалением 1 мл культуры, определением OD600, центрифугированием клеток на микроцентрифуге, удалением супернатанта и его анализом на содержание мевалоновой кислоты.
При ферментации объемом 14 л клеток E.coli c нуклеиновыми кислотами, кодирующими полипептиды АА-СоА-тиолазы, HMG-CoA-синтазы и HMG-CoA-редуктазы Enterococcus faecalis, было получено 22 г мевалоновой кислоты в среде ТМ3 и 2% глюкозы в качестве культуральной среды. Во встряхиваемой колбе с данными клетками получали 2-4 г мевалоновой кислоты на л среды LB и 1% глюкозы в качестве культуральной среды. Продукция мевалоновой кислоты данными штаммами указывала на то, что путь MVA функционировал у E.coli.
VIII. Продукция изопрена из штамма BL21 E.coli, содержащего верхний и нижний пути MVA плюс изопренсинтазу кудзу
Получали следующие штаммы трансформацией различными комбинациями плазмид, содержащих гены верхнего и нижнего путей MVA плюс изопренсинтазы кудзу, описанными выше, и плазмидами, содержащими гены idi, dxs, dxr и изопренсинтазы, описанными в примере 7. Использованными клетками-хозяевами были химически компетентные клетки штамма BL21(λDE3) и трансформацию проводили обычными методами. Трансформанты отбирали на агаре L, содержащем канамицин (50 мкг/мл) или канамицин плюс спектиномицин (оба антибиотика в концентрации 50 мкг/мл). Чашки культивировали при 37°С. Полученные штаммы обозначали следующим образом:
культивированные на канамицине плюс спектиномицине (каждый в концентрации 50 мкг/мл)
MCM127 - pCL верхний путь MVA и pTrcKKDyIkIS (kan) в BL21(λDE3)
MCM131 - pCL1920 и pTrcKKDyIkIS (kan) в BL21(λDE3)
MCM125 - pCL верхний путь MVA и pTrcHis2B (kan) в BL21(λDE3)
культивированные на канамицине (в концентрации 50 мкг/мл)
MCM64 - pTrcKudzu yIDI DXS (kan) в BL21(λDE3)
MCM50 - pTrcKudzu (kan) в BL21(λDE3)
MCM123 - pTrcKudzu yIDI DXS DXR (kan) в BL21(λDE3)
Указанные выше штаммы высевали из замороженных маточных культур на LA с соответствующими антибиотиками и культивировали при 37°С. Единичную колонию с каждой чашки использовали для инокулирования во встряхиваемые колбы (25 мл LB и соответствующий антибиотик). Колбы инкубировали при 22°С в течение ночи при встряхивании со скоростью 200 об/мин. На следующее утро содержимое колб переносили в термостат при 37°С и культивировали еще в течение 4,5 ч при встряхивании со скоростью 200 об/мин. Культуры объемом 25 мл центрифугировали до получения клеточного клеток и клетки ресуспендировали в 5 мл среды LB с соответствующим антибиотиком. Затем культуры разводили в 25 мл LB, % глюкозы и соответствующем антибиотике до значения OD600, равного 0,1. Оставляли по две колбы с каждым штаммом, одну для индукции IPTG (800 мкМ) и вторую колбу оставляли без индукции. Культуры инкубировали при 37°С при встряхивании со скоростью 250 об/мин. Один ряд культур индуцировали через 1,5 ч (сразу же после отбора пробы на временную точку 1). На каждой временной точке отбора проб определяли значение OD600 и количество изопрена, как описано в примере 1. Результаты приведены в таблице 3. Количество изопрена приведено в виде количества в точке максимальной продукции для конкретного штамма.
IX. Анализ мевалоновой кислоты
Мевалонолактон (1,0 г, 7,7 ммоль) (CAS# 503-48-0) получали от Sigma-Aldrich (WI, США) в виде сиропа, который растворяли в воде (7,7 мл) и обрабатывали гидроксидом калия (7,7 ммоль) для получения соли мевалоновой кислоты калия. Преобразование в мевалоновую кислоту подтверждали1Н-ЯМР. Образцы для ВЭЖХ получали центрифугированием при 14000 об/мин в течение 5 мин для удаления клеток с последующим разведением 300 мкл супернатанта до 900 мкл Н2О. Затем добавляли хлорную кислоту (36 мкл 70% раствора) с последующим перемешиванием и охлаждением на льду в течение 5 мин. Затем образцы вновь центрифугировали (14000 об/мин в течение 5 мин) и супернатант переносили для проведения ВЭЖХ. Аналогично готовили стандарты мевалоновой кислоты (20; 10; 5; 1 и 0,5 г/л). Анализ мевалоновой кислоты (объем вводимой пробы 20 мкл) проводили ВЭЖХ с использованием колонки BioRad Aminex 87-H+ (300 мм×7,0 мм), элюируя 5 мМ раствором серной кислоты со скоростью 0,6 мл/мин по детектированию коэффициента рефракции (RI). В данных условиях мевалоновая кислота элюировала в виде лактона на 18,5 мин.
Пример 9. Конструирование верхнего и нижнего путей MVA для интеграции в Bacillus subtilis
I. Конструирование верхнего пути MVA в Bacillus subtilis
Верхний путь из Enterococcus faecalis интегрировали в B. subtilis под контролем промотора aprE. Верхний путь состоит из двух генов: mvaE, который кодирует AACT и HMGR, и mvaS, который кодирует HMGS. Два гена сливали вместе со стоп-кодоном между ними, сайтом RBS перед mvaS и под контролем промотора aprE. Терминатор находился после гена mvaE. Маркер резистентности к хлорамфениколу клонировали после гена mvaE и конструкцию встраивали в локус aprE с двойной ориентаций с использованием фланкирующих областей гомологии.
Четыре фрагмента ДНК амплифицировали ПЦР таким образом, что они содержали выступающие концы, которые позволяли им поддаваться слиянию с помощью ПЦР. Реакции амплификации ПЦР проводили с использованием полимеразы Herculase, следуя инструкциям изготовителя.
1: PaprE
CF 07-134(+)старт промотора aprE PstI
5'-GACATCTGCAGCTCCATTTTCTTCTGC (SEQ ID NO:82)
CF 07-94(-)сливают PaprE с mvaE
5'-CAATAATAACTACTGTTTTCACTCTTTACCCTCTCCTTTTAA (SEQ ID NO:83)
Матрица: хромосомная ДНК Bacillus subtilis
2: mvaE
CF 07-93(+)сливают mvaE c промотором aprE (старт-кодон GTG)
5'-TTAAAAGGAGAGGGTAAAGAGTGAAAACAGTAGTTATTATTG (SEQ ID NO:84)
CF 07-62(-)сливают mvaE с mvaS с RBS между ними
5'-TTTATCAATCCCAATTGTCATGTTTTTTTACCTCCTTTATTGTTTTCTTAAATC (SEQ ID NO:35)
Матрица: хромосомная ДНК Enterococcus faecalis (из АТСС)
3. mvaS
CF 07-61(+)сливают mvaE с mvaS с RBS между ними
5'-GATTTAAGAAAACAATAAAGGAGGTAAAAAAACATGACAATTGGGATTGATAAA (SEQ ID NO:36)
CF 07-124(-)сливают конец mvaS с терминатором
5'-CGGGGCCAAGGCCGGTTTTTTTTAGTTTCGATAAGAACGAACGGT (SEQ ID NO:85)
Матрица: хромосомная ДНК Enterococcus faecalis
4. Терминатор щелочной серинпротеазы B. amyliquefaciens
CF 07-123(+)сливают конец mvaS с терминатором
5'-ACCGTTCGTTCTTATCGAAACTAAAAAAAACCGGCCTTGGCCCCG (SEQ ID NO:86)
CF 07-46(-)конец терминатора B. amyliquefaciens BamHI
5'-GACATGACGGATCCGATTACGAATGCCGTCTC (SEQ ID NO:63)
Матрица: хромосомная ДНК Bacillus amyliquefaciens
Реакции слияния ПЦР
5. Сливают mvaE c mvaS
CF 07-93(+)сливают mvaE c промотором aprE (старт-кодон GTG)
5'-TTAAAAGGAGAGGGTAAAGAGTGAAAACAGTAGTTATTATTG (SEQ ID NO:84)
CF 07-124(-)сливают конец mvaS с терминатором
5'-CGGGGCCAAGGCCGGTTTTTTTTAGTTTCGATAAGAACGAACGGT (SEQ ID NO:85)
Матрица: #2 и #3, приведенные выше
6. Сливают mvaE-mvaS с промотором aprE
CF 07-134(+)старт промотора aprE PstI
5'-GACATCTGCAGCTCCATTTTCTTCTGC (SEQ ID NO:82)
CF 07-124(-)сливают конец mvaS с терминатором
5'-CGGGGCCAAGGCCGGTTTTTTTTAGTTCGATAAGAACGAACGGT (SEQ ID NO:85)
Матрица: #1 и #4, приведенные выше
7. Сливают PaprE-mvaE-mvaS с терминатором
CF 07-134(+)старт промотора aprE PstI
5'-GACATCTGCAGCTCCATTTTCTTCTGC (SEQ ID NO:82)
CF 07-46(-)конец терминатора B. amyliquefaciens BamHI
5'-GACATGACGGATCCGATTACGAATGCCGTCTC (SEQ ID NO:63)
Матрица: #4 и #6
Продукт расщепляли рестриктазами PstI/BamHI и лигировали с pJM102 (Perego M., 1963. Integrational vectors for genetic manipulation in Bacillus subtilis, p. 615-624. In A.L.Sonenshein, J.A. Hoch and R. Losick (ed.), Bacillus subtilis and other grampositive bacteria, biochemistry, physiology and molecular genetics. American Society for Microbiology, Washington, D.C.), которую расщепляли PstI/BamHI. Смесь для лигирования трансформировали в химически компетентные клетки TOP10 E.coli и трансформанты отбирали на LA, содержащем карбенициллин (50 мкг/мл). Правильную плазмиду идентифицировали секвенированием и обозначали pJMверхний путь 2 (фигуры 50 и 51). Очищенную плазмидную ДНК трансформировали в Bacillus subtilis aprEnprE Pxy1-comK и трансформанты отбирали на агаре L, содержащем хлорамфеникол (5 мкг/мл). Отбирали правильную колонию и последовательно высевали на агар L, содержащий хлорамфеникол в концентрации 10, 15 и 25 мкг/мл для амплификации ряда копий кассеты, содержащей верхний путь.
Полученный штамм тестировали на продукцию мевалоновой кислоты при культивировании на LB, содержащем 1% глюкозы и 1%. Культуры анализировали ГХ на продукцию мевалоновой кислоты.
Затем данный штамм использовали в качестве штамма-хозяина для интеграции нижнего пути мевалоновой кислоты.
Использовали следующие праймеры для последовательности различных конструкций, приведенных выше.
Секвенирующие праймеры:
CF 07-134(+)старт промотора aprE PstI
5'-GACATCTGCAGCTCCATTTTCTTCTGC (SEQ ID NO:82)
CF 07-58(+)старт с гена mvaE
5'-ATGAAAACAGTAGTTATTATTGATGC (SEQ ID NO:38)
CF 07-59(-)конец гена mvaE
5'-ATGTTATTGTTTTCTTAAATCATTTAAAATAGC (SEQ ID NO:39)
CF 07-82(+)старт с гена mvaS
5'-ATGACAATTGGGATTGATAAAATTAG (SEQ ID NO:40)
CF 07-83(-)конец гена mvaS
5'-TTAGTTTCGATAAGAACGAACGGT (SEQ ID NO:41)
CF 07-86(+)последовательность в mvaE
5'-GAAATAGCCCCATTAGAAGTATC (SEQ ID NO:42)
CF 07-87(+)последовательность в mvaE
5'-TTGCCAATCATATGATTGAAAATC (SEQ ID NO:43)
CF 07-88(+)последовательность в mvaE
5'-GCTATGCTTCATTAGATCCTTATCG (SEQ ID NO:44)
CF 07-89(+)последовательность mvaS
5'-GAAACCTACATCCAATCTTTTGCCC (SEQ ID NO:45).
Трансформанты отбирали на LA, содержащем хлорамфеникол в концентрации 5 мкг/мл. Для одной колонии подтверждали секвенированием, что она имеет правильную интеграцию и ее высевали на LA, содержащий хлорамфеникол в возрастающих концентрациях в течение нескольких суток до конечной концентрации 25 мкг/мл. Это привело к амплификации кассеты, содержащей интересующие гены. Полученный штамм обозначали CF 455: pJMверхний путь #1 X Bacillus subtilis aprEnprE Pxyl comK (амплифицировали для культивирования на LA, содержащем хлорамфеникол в концентрации 25 мкг/мл).
II. Конструирование нижнего пути MVA в Bacillus subtilis
Нижний путь MVA, состоящий из генов mvk1, pmk, mpd и idi объединяли в кассете, состоящий из фланкирующих областей ДНК из области nprE хромосомыB. subtilis (сайт интеграции), промотора aprE и маркера резистентности к спектиномицину (смотри фигуры 28 и 29). Данную кассету синтезировали DNA2.0 и интегрировали в хромосому B. subtilis, содержащую верхний путь MVA, интегрированный в локус aprE. Ген изопренсинтазы кудзу экспрессировали из реплицирующейся плазмиды, описанной в примере 4, и трансформировали в штамм с интегрированными верхним и нижним путями.
Пример 10: Продукция изопрена в E.coli, экспрессирующими мевалонаткиназу M. mazei и изопренсинтазу P. alba
I. Конструирование векторов и штаммов, кодирующих мевалонаткиназу M. mazei (MVK) и изопренсинтазу P. alba
(i) Конструирование штамма EWL210 (BL21, Cm-GI1.2-KKDyI)
Штамм BL21 E.coli (отделение Novagen, EMD Bioscieces, Inc.) представляет собой штамм-реципиент, трансдуцированный лизатом MCM331 P1 (лизатом, приготовленным по методу, описанному Ausubel et al., Current Protocols in Molecular Biology. John Wiley and Sons, Inc.). Трансдуктанты отбирали посевом клеток на агар L с 20 мкг/мл хлорамфеникола. Чашки инкубировали в течение ночи при 30°С. Результаты анализа трансдуктантов свидетельствовали об отсутствии колоний на контрольных чашках (вода+клетки с контрольных чашек для реверсии и вода и лизат P1 с контрольной чашки для проверки контаминации лизата).
Отбирали 4 трансдуктанта и использовали для инокулирования в 5 мл бульона L и 20 мкг/мл хлорамфеникола. Культуры культивировали в течение ночи при 30°С при встряхивании со скоростью 200 об/мин. Для приготовления препаратов геномной ДНК каждого из трансдуктантов для анализа ПЦР 1,5 мл ночной клеточной культуры центрифугировали. Клеточный осадок после центрифугирования ресуспендировали с 400 мкл буфера для ресуспендирования (20 мМ Трис, 1 мМ ЭДТА, 50 мМ NaCl, рН 7,5) и 4 мкл РНКазы, не содержащей ДНКазы (Roche). Пробирки культивировали при 37°С в течение 30 мин с последующим добавлением 4 мкл 10% SDS и 4 мкл маточного раствора протеинкиназы К с концентрацией 10 мг/мл (Sigma-Aldrich). Пробирки инкубировали при 37°С в течение 1 ч. Клеточный лизат переносили в пробирки 2 мл с гелем Phase Lock Light Gel (Eppendorf) и добавляли по 200 мкл насыщенного фенола рН 7,9 (Ambion Inc.) и хлороформа. Содержимое пробирок перемешивали и центрифугировали на микроцентрифуге в течение 5 мин. Вторую экстракцию проводили с 400 мкл хлороформа и водный слой переносили в новую пробирку Эпендорфа. Геномную ДНК осаждали добавлением 1 мл 10% этанола и центрифугировали в течение 5 мин. Осадок геномной ДНК промывали 1 мл 70% этанола. Этанол удаляли, и осадок геномной ДНК быстро высушивали на воздухе. Осадок геномной ДНК ресуспендировали в 200 мкл ТЕ.
С использованием ДНК-полимеразы Pfu Ultra II (Stratagene) и 200 нг/мкл геномной ДНК в качестве матрицы готовили 2 различных ряда пробирок с реакционной смесью для ПЦР, следуя протоколу изготовителя. Для первого ряда использовали праймеры MCM130 и GB Cm-Rev (таблица 4) для гарантии того, что трансдуктанты были успешно интегрированы в локус attTn7. Параметры ПЦР для ряда 1 были следующими: 95°С в течение 2 мин (только первый цикл), 95°С в течение 25 сек, 55°С в течение 25 сек, 72°С в течение 25 сек (повторяют стадии 2-4 для 28 циклов), 72°С в течение 1 мин. Для ряда 2 использовали праймеры MVD прямой и MVD обратный (таблица 4) для гарантии правильной интеграции оперона gi1.2-KKDyI. Параметры ПЦР для ряда 2 были следующими: 95°С в течение 2 мин (только первый цикл), 95°С в течение 25 сек, 55°С в течение 25 сек, 72°С в течение 10 сек (повторяют стадии 2-4 для 28 циклов), 72°С в течение 1 мин. Анализ ампликонов на 1,2% Е-геле (Invitrogen Corp.) показывал, что все 4 клона-трансдуктанта были правильными (выбирали один и обозначали, как штамм EWL201).
ii) Конструирование штамма EWL204 (BL21, выпетливание-GI1.2-KKDyI)
Маркер резистентности к хлорамфениколу выпетливали из штамма EWL201 с использованием плазмиды рСР20, как описано Datsenko and Wanner (2000) (Datsenko et al., Proc. Natl. Acad. Sci. USA, 97:6640-6645, 2000). One-step inactivation of chromosomal genes in Escherichia coli K-12 using PCR products (Datsenko et al., PNAS, 97:6640-6645, 2000). Клетки EWL201 культивировали в бульоне L до мид-лог-фазы роста и затем промывали три раза ледяной, стерильной водой. Аликвотную порцию клеточной суспензии объемом 50 мкл смешивали с 1 мкл pCP20 и смесь клеточной суспензии подвергали электропорации в кювете размером 2 мм (Invitrogen Corp.) при напряжении 2,5 В и 25 uFd с использованием электропоратора Gene Pulser Electroporator (Bio-Rad Inc.). Сразу же к клеткам добавляли 1 мл LB, затем переносили в пробирку из полипропилена емкостью 14 мл (Sarstedt) с металлической крышкой. Клеткам давали восстановиться при культивировании в течение 1 ч при 30°. Трансформанты отбирали на агаре L и 20 мкг/мкл хлорамфеникола и 50 мкг/мкл карбенициллина и инкубировали при 30°С в течение ночи. На следующие сутки единичный клон культивировали в 10 мл бульона L и 50 мкг/мкл карбенициллина при 30°С до достижения лог-фазы роста. Затем температуру растущей культуры повышали до 42°С в течение 2 ч. Делали серийные разведения, затем клетки высевали на чашки с LA (без отбора по резистентности к антибиотику) и инкубировали в течение ночи при 30°С. На следующие сутки отбирали 20 колоний и высевали на агар L (без антибиотиков) и чашки с LA и 20 мкг/мкл хлорамфеникола. Затем чашки инкубировали в течение ночи при 30°С. Полагали, что в клетках, способных расти на чашках с LA, но не на чашках с LA и 20 мкг/мкл хлорамфеникола, маркер резистентности к хлорамфениколу выпетливается (отбирали один и обозначали EWL204).
iii) Конструирование плазмиды pEWL230 (pTrc P. alba)
Создание синтетического гена, кодирующего изопренсинтазу Populus alba (Р. alba HGS) проводили DNA2.0 Inc. (Menlo Park, CA), основанном на методе кодон-оптимизации для экспрессии в E.coli. Синтетический ген клонировали обычным образом в плазмиду pET24a (отделение Novagen, EMD Biosciences, Inc.) и доставляли лиофилизованным (фигуры 54, 55А и 55В).
Проводили реакцию ПЦР для амплификации гена изопренсинтазы P. alba (P. alba HGS) с использованием pET24 P. alba HGS в качестве матрицы, праймеров МСМ182 и МСМ192 и ДНК-полимеразы Herculase II Fusion (Stratagene), следуя протоколу изготовителя. Условия ПЦР были следующими: 95°С в течение 2 мин (только первый цикл), 95°С в течение 25 сек, 55°С в течение 20 сек, 72°С в течение 1 мин, повторяют 25 циклов, с конечным наращением при 72°С в течение 3 мин. Продукт ПЦР изопренсинтазу P. alba очищали с использованием набора для очистки QIAquick PCR Purification (Qiagen Inc.).
Затем продукт ПЦР изопренсинтазу P. alba расщепляли в реакционной смеси объемом 20 мкл, содержащей 1 мкл эндонуклеазы BspHI (New England Biolabs) с 2 мкл 10× буфера 4 NEB. Реакционную смесь инкубировали в течение 2 ч при 37°С. Затем расщепленный фрагмент ПЦР очищали с использованием набора для очистки QIAquick PCR Purification. Второе расщеплением рестриктазами проводили в реакционной смеси объемом 20 мкл, содержащей 1 мкл эндонуклеазы PstI (Roche) с 2 мкл 10× буфера Н. Реакционную смесь инкубировали в течение 2 ч при 37°С. Затем расщепленный фрагмент ПЦР очищали с использованием набора для очистки QIAquick PCR Purification. Плазмиду pTrcHis2B (Invitrogen Corp.) расщепляли в реакционной смеси объемом 20 мкл, содержащей 1 мкл эндонуклеазы NcoI (Roche), 1 мкл эндонуклеазы PstI и 2 мкл 10× буфера Н. Реакционную смесь инкубировали в течение 2 ч при 37°С. Расщепленный вектор pTrcHis2B очищали в 1,2%Е-геле (Invitrogen Corp.) и экстрагировали с использованием набора для экстракции QIAquick Gel Extraction (Qiagen) (фигура 56). С использованием совместимых липких концов сайтов BspHI и NcoI проводили лигирование 20 мкл реакционной смеси с получением 5 мкл вставки изопренсинтазы P. alba, 2 мкл вектора pTrc, 1 мкл ДНК-лигазы Т4 (New England Biolabs), 2 мкл 10× буфера для лигазы и 10 мкл ddH2O. Смесь для лигирования инкубировали при комнатной температуре в течение 40 мин. Смесь для лигирования обессоливали помещением фильтра из нитроцеллюлозной мембраны 0,025 мкм (Millipore) в чашки Петри с ddH2O и осторожным нанесением смеси для лигирования на верхнюю часть фильтра из нитроцеллюлозной мембраны в течение 30 мин при комнатной температуре. Клетки МСМ446 (смотри раздел II) культивировали в LB до мид-лог-фазы роста и затем промывали три раза ледяной, стерильной водой. Аликвотную порцию клеточной суспензии объемом 50 мкл смешивали с 5 мкл обессоленной смеси для лигирования pTrc P.alba HGS. Смесь клеточной суспензии подвергали электропорации в кювете размером 2 мм при напряжении 2,5 В и 25 uFd с использованием электропоратора Gene Pulser Electroporator. Сразу же к клеткам добавляли 1 мл LB, затем переносили в пробирку из полипропилена емкостью 14 мл (Sarstedt) с металлической крышкой. Клеткам давали восстановиться при культивировании в течение 2 ч при 30°. Трансформанты отбирали на агаре L и 50 мкг/мкл карбенициллина и 10 мМ мевалоновой кислоты и инкубировали при 30°С. На следующие сутки отбирали 6 трансформантов и культивировали в пробирках с 5 мл бульона L и 50 мкг/мкл карбенициллина в течение ночи при 30°С. Приготовление плазмид проводили на ночных культурах с использованием набора QIAquick Spin Miniprep (Qiagen). В результате использования клеток BL21 для размножения плазмид в стандартный протокол изготовителя вносили модификацию, заключающуюся в промывании спин-колонок 5× буфером РВ и 3× буфером РЕ, для получения ДНК-плазмид высокого качества. Плазмиды расщепляли PstI в реакционной смеси объемом 20 мкл для обеспечения линейного фрагмента с правильным размером. Все 6 плазмид имели правильный размер и их транспортировали в Quintara Bisciences (Berkeley, CA) для секвенирования с праймерами МСМ65, МСМ66, EL1000 (таблица 4). Результаты секвенирования ДНК свидетельствовали о том, что все 6 плазмид были правильными. Отбирали одну и обозначали плазмиду, как EWL230 (фигуры 57, 58А и 58В).
iv) Конструирование плазмиды pEWL244 (pTrc P.alba-mMVK)
Проводили ПЦР для амплификации гена MVK Methanosarcina mazei (M. mazei) с использованием МСМ376 в качестве матрицы (смотри раздел v), праймеров МСМ165 и МСМ177 (смотри таблицу 4) и ДНК-полимеразы Pfu Ultra II Fusion (Stratagene), следуя протоколу изготовителя. Условия ПЦР были следующими: 95°С в течение 2 мин (только первый цикл), 95°С в течение 2 сек, 55°С в течение 25 сек, 72°С в течение 18 сек, повторяют 28 циклов, с конечным наращением при 72°С в течение 1 мин. Продукт ПЦР MVK M. mazei очищали с использованием набора для очистки QIAquick PCR Purification (Qiagen Inc.).
Затем продукт ПЦР MVK M. mazei расщепляли в реакционной смеси объемом 40 мкл, содержащей 8 мкл продукта ПЦР, 2 мкл эндонуклеазы PmeI (New England Biolabs), 4 мкл 10× буфера 4 NEB, 4 мкл 10× буфера NEB BSA и 22 мкл ddH2O. Реакционную смесь инкубировали в течение 3 ч при 37°С. Затем расщепленный фрагмент ПЦР очищали с использованием набора для очистки QIAquick PCR Purification. Второе расщепление рестриктазами проводили в реакционной смеси объемом 47 мкл, содержащей 2 мкл эндонуклеазы NsiI (Roche), 4,7 мкл 10× буфера Н и 40 мкл расщепленного PmeI фрагмента MVK M. mazei. Реакционную смесь инкубировали в течение 3 ч при 37°С. Затем расщепленный фрагмент ПЦР очищали с использованием 1,2% Е-геля и экстрагировали с использованием набора для экстракции QIAquick PCR Extraction. Плазмиду EWL230 расщепляли в реакционной смеси объемом 40 мкл, содержащей 10 мкл плазмиды, 2 мкл эндонуклеазы PmeI, 4 мкл 10× буфера 4 NEB, 4 мкл 10× буфера NEB BSA и 20 мкл ddH2O. Реакционную смесь инкубировали в течение 3 ч при 37°С. Затем расщепленный фрагмент ПЦР очищали с использованием набора для очистки QIAquick PCR Purification. Второе расщепление рестриктазами проводили в реакционной смеси объемом 47 мкл, содержащей 2 мкл эндонуклеазы PstI, 4,7 мкл 10× буфера Н и 40 мкл расщепленного PmeI линейного фрагмента EWL230. Реакционную смесь инкубировали в течение 3 ч при 37°С. Затем расщепленный фрагмент ПЦР очищали с использованием 1,2% Е-геля и экстрагировали с использованием набора для экстракции QIAquick Gel Extraction (фигура 59). С использованием совместимых липких концов сайтов NsiI и PstI готовили смесь для лигирования объемом 20 мкл, содержащую 8 мкл вставки MVK M. mazei, 3 мкл плазмиды EWL230, 1 мкл ДНК-лигазы Т4, 2 мкл 10× буфера для лигазы и 6 мкл ddH2O. Смесь для лигирования инкубировали в течение ночи при температуре 16°С. На следующие сутки смесь для лигирования обессоливали помещением фильтра из нитроцеллюлозной мембраны 0,025 мкм в чашки Петри с ddH2O и осторожным нанесением смеси для лигирования на верхнюю часть фильтра из нитроцеллюлозной мембраны в течение 30 мин при комнатной температуре. Клетки МСМ446 культивировали в LB до мид-лог-фазы роста и затем промывали три раза ледяной, стерильной водой. Аликвотную порцию клеточной суспензии объемом 50 мкл смешивали с 5 мкл обессоленной смеси для лигирования pTrc P.alba-mMVK. Смесь клеточной суспензии подвергали электропорации в кювете размером 2 мм при напряжении 2,5 В и 25 uFd с использованием электропоратора Gene Pulser Electroporator. Сразу же к клеткам добавляли 1 мл LB, затем клетки переносили в пробирку из полипропилена емкостью 14 мл с металлической крышкой. Клеткам давали восстановиться при культивировании в течение 2 ч при 30°C. Трансформанты отбирали на чашках с LA и 50 мкг/мкл карбенициллина и 5 мМ мевалоновой кислоты и инкубировали при 30°С. На следующие сутки отбирали 6 трансформантов и культивировали в пробирках с 5 мл LB и 50 мкг/мкл карбенициллина в течение ночи при 30°С. Приготовление плазмид проводили на ночных культурах с использованием набора QIAquick Spin Miniprep. В результате использования клеток BL21 для размножения плазмид в стандартный протокол изготовителя вносили модификацию, заключающуюся в промывании спин-колонок 5× буфером РВ и 3× буфером РЕ, для получения ДНК-плазмид высокого качества. Плазмиды расщепляли PstI в реакционной смеси объемом 20 мкл для обеспечения линейного фрагмента с правильным размером. Все 6 плазмид имели правильный размер и их транспортировали в Quintara Biosciences для секвенирования с праймерами МСМ65, МСМ66, EL1000, EL1003 и EL1006 (таблица 4). Результаты секвенирования ДНК свидетельствовали о том, что все 3 плазмиды были правильными. Отбирали одну и обозначали плазмиду, как EWL244 (фигуры 60 и 61А-В).
v) Конструирование плазмиды MCM376-MVK из нижнего пути архебактерий M. mazei в pET200D
MVK ORF из оперона нижнего пути архебактерий M. mazei (фигуры 73А-С) амплифицировали ПЦР с использованием праймеров МСМ161 и МСМ162 (таблица 4) с использованием смеси для ПЦР Invitrogen Platinum HiFi. 45 мкл смеси для ПЦР объединяли с 1 мкл матрицы, 1 мкл каждого праймера в концентрации 10 мкМ и 2 мкл воды. Реакцию проводили следующим образом: 94°С в течение 2:00 мин; 30 циклов при 94°С в течение 0:30 мин, 55°С в течение 0:30 мин и 68°С в течение 1:15 мин; и затем при 72°С в течение 7:00 мин и при 4°С до охлаждения. 3 мкл данной реакционной смеси ПЦР лигировали с плазмидой ET200D (Invitrogen), следуя протоколу изготовителя. 3 мкл данной смеси для лигирования вводили в клетки ТОР10 (Invitrogen) и трансформанты отбирали на LA/kan50. Выделяли плазмиду из трансформанта и вставку секвенировали с получением МСМ376 (фигуры 74А-С).
vi) Конструирование штамма EWL251 (BL21(DE3), Cm-GI1.2-KKDyI, pTrc Р.alba-mMVK)
Клетки МСМ331 (содержащие хромосомную конструкцию gi1.2KKDyI, кодирующую мевалонаткиназу, мевалонатфосфаткиназу, мевалонатпирофосфатдекарбоксилазу и IPP изомеразу S. cerevisiae) культивировали в LB до мид-лог-фазы роста и затем промывали три раза ледяной, стерильной водой. Смешивали 50 мкл клеточной суспензии с 1 мкл плазмиды EWL244. Смесь клеточной суспензии подвергали электропорации в кювете размером 2 мм при напряжении 2,5 В и 25 uFd с использованием электропоратора Gene Pulser Electroporator. Сразу же к клеткам добавляли 1 мл LB, затем клетки переносили в пробирку из полипропилена емкостью 14 мл с металлической крышкой. Клеткам давали восстановиться при культивировании в течение 2 ч при 30°. Трансформанты отбирали на чашках с LA и 50 мкг/мкл карбенициллина и 5 мМ мевалоновой кислоты и инкубировали при 37°С. Отбирали одну колонию и обозначали, как штамм EWL251.
vii) Конструирование штамма EWL256 (BL21(DE3), Cm-GI1.2-KKDyI, pTrc Р.alba-mMVK, pCL верхний путь MVA)
Клетки EWL251 культивировали в LB мид-лог-фазы роста и затем три раза промывали ледяной, стерильной водой. Смешивали 50 мкл клеточной суспензии с 1 мкл плазмиды МСМ82 (которая представляет pCL Ptrcверхний путь, кодирующая mvaE и mvaS E. faecalis). Смесь клеточной суспензии подвергали электропорации в кювете размером 2 мм при напряжении 2,5 В и 25 uFd с использованием электропоратора Gene Pulser Electroporator. Сразу же к клеткам добавляли 1 мл LB, затем клетки переносили в пробирку из полипропилена емкостью 14 мл с металлической крышкой. Клеткам давали восстановиться при культивировании в течение 2 ч при 30°C. Трансформанты отбирали на чашках с LA и 50 мкг/мкл карбенициллина и 50 мкг/мкл спектиномицина и инкубировали при 37°С. Отбирали одну колонию и обозначали, как штамм EWL256.


II. Конструирование МСМ442-449: BL21 и L21(DE3) с FRT-cmR-FRT-gi1.x-mKKDyI
i) Конструирование матрицы для рекомбинации
Кассеты для рекомбинации на основе FRT и плазмиды для Red-ET-опосредованной интеграции и выпетливания маркера резистентности к антибиотику получали от Gene Bridges GmbH (Германия). Методы с использованием данных материалов проводили согласно протоколам Gene Bridges. Использовали праймеры МСМ193 и МСМ195 для амплификации кассеты резистентности из матрицы FRT-gb2-Cm-FRT с использованием набора Stratagene Herculase II Fusion согласно протоколу изготовителя. Реакционную смесь объемом 50 мкл подвергали воздействию следующих условий: 95°С, 2 мин; (95°С, 20 сек, 55°С, 20 сек, 72°С, 1 мин) ×5, (95°С, 20 сек, 60°С, 20 сек, 72°С, 1 мин) ×25; 72°С, 3 мин; 4°С до охлаждения. Ампликон очищали на колонке Qiagen PCR, следуя протоколу изготовителя, и элюировали 30 мкл EB (буфер для элюирования). ДНК расщепляли NdeI и PciI в реакционной смеси объемом 20 мкл с 1× буфером Roche H и 0,5 мкл BSA. Плазмиду МСМ376 расщепляли в реакционной смеси объемом 10 мкл, содержащей по 1 мкл NdeI, NcoI и буфер Roche H. Реакции проводили в течение ночи при 37°С и затем ДНК очищали на колонке Qiagen PCR и элюировали 30 мкл EB. Продукт ПЦР лигировали в МСМ376 в реакционной смеси, содержащей 1 мкл вектора, 3 мкл продукта ПЦР, 1 мкл буфера 2 для лигазы Roche Quick, 5 мкл буфера 2 и 1 мкл лигазы. Реакцию проводили при комнатной температуре в течение 3 ч и затем 5 мкл трансформировали в клетки ТОР10 (Invitrogen) согласно протоколу изготовителя. Трансформанты отбирали на агаре L (LA) и хлорамфениколе (10 мкг/мл) при температуре 37°С в течение ночи.
Колонии трансформантов наносили на LA, содержащий хлорамфеникол (30 мкг/мл) и канамицин (50 мкг/мл) для поддержания и транспортировали в Quintara (Berkeley, CA) для проведения секвенирования. Было установлено, что четыре клона, каждый с четырьмя различными нуклеотидами в «N» в праймере МСМ195, имеет правильную последовательность для вставленного промотора. Клоны культивировали в 5 мл LB, содержащем хлорамфеникол (30 мкг/мл) и канамицин (50 мкг/мл) и использовали для приготовления плазмидной ДНК. Данную плазмиду повторно трансформировали в клетки ТОР10 и штаммы замораживали в виде:
ii) Создание рекомбинантных штаммов-мишеней МСМ349 и МСМ441
Маркер резистентности к хлорамфениколу (cmR) выпетливали из штамма МСМ331 с использованием плазмиды pGB706 (GeneBridges) согласно инструкциям изготовителя. Клетки МСМ331 культивировали до мид-лог-фазы роста в LB и три раза промывали ледяной, стерильной водой. Аликвотную порцию ДНК pGB706 объемом 1 мкл добавляли к 50 мкл клеточной суспензии и данную смесь подвергали электропорации в кювете размером 2 мм при напряжении 2,5 В и 25 uFd с немедленным восстановлением в 500 мкл LB в течение 1 ч при 30°С. Трансформанты отбирали на LB, содержащем тетрациклин (5 мкг/мл) при 30°С. На следующие сутки клон культивировали при 30°С в LB, содержащем тетрациклин (5 мкг/мл) до появления видимой мутности (OD600 равно ≈0,5-0,8). Данную культуру высевали в LB и культивировали в течение ночи при 37°С. Клон, который не был способен расти на LB, содержащем хлорамфеникол (10 мкг/мл) или LB, содержащем тетрациклин (5 мкг/мл), замораживали, обозначив МСМ348. Плазмиду МСМ356 (pRedET карбенициллин; Gene Bridges) подвергали электропорации, как описано выше, и трансформанты отбирали на LB, содержащем карбенициллин (50 мкг/мл) при 30°С. Клон культивировали в LB, содержащем карбенициллин (50 мкг/мл) при 30°С, и замораживали, обозначив как МСМ349.
Штамм МСМ441 получали электротрансформацией плазмиды МСМ356 в штамм EWL204, как описано выше.
iii) Рекомбинация FRT-cmR-FRT-gi1.x-mMVK в МСМ349 и МСМ441
Плазмиды МСМ484-487 использовали в качестве матрицы для амплификации ПЦР с праймерами МСМ120 и МСМ196 и набором Herculase II Fusion, следуя протоколу изготовителя. Проводили три реакции на матрицу с 0, 1 или 3 мкл ДМСО. Реакционную смесь объемом 50 мкл подвергали следующим циклам: 95°С, 2 мин; (95°С, 20 сек, 55°С, 20 сек, 72°С, 1,5 мин) в течение 5 циклов; (95°С, 20 сек, 60°С, 20 сек, 72°С, 1,5 мин) в течение 25 циклов; 72°С в течение 3 мин; 4°С в течение ночи. Три реакционных смеси от данной матрицы объединяли и очищали на колонке Qiagen PCR и элюировали 30 мкл EB при 60°С. 5 мкл ДНК расщепляли 1 мкл DpnI в 1× буфере А Roche в течение 3 ч при 37°С. Затем данную ДНК подвергали микродиализу против избытка воды в течение 30 мин.
Штаммы, растущие в 5 мл LB, содержащем карбенициллин (50 мкг/мл), из свежих посевов культивировали при 30°С до значения OD600, равного ≈0,5. Добавляли 40 мМ L-арабинозы и культуры инкубировали при 37°С в течение 1,5 ч. Клетки собирали и подвергали электропорации с 3 мкл диализованных ампликонов, указанных выше, и затем разводили в 500 мкл при 37°С в течение 1,5-3 ч. Трансформанты отбирали на чашках с LA, содержащих хлорамфеникол (5 мкг/мл) при 37°С.
Чувствительные к канамицину клоны подвергали скринингу с помощью ПЦР на наличие вставки ампликона. Продукты ПЦР из позитивных клонов секвенировали для подтверждения последовательности инсерцированной ДНК. Ампликоны совпадали с FRT-gi1.2-yKKDyI в attTn7 в МСМ441 и МСМ348, замещенные на FRT-cmR-FRT-gi1.x-mKKDyI (обозначения yK и mK относятся к мевалонаткиназе соответственно из Saccharomyces cerevisiae и Methanosarcina mazei).


III. Влияние дрожжевого экстракта на продукцию изопрена в E.coli, экспрессирующими гены пути мевалоновой кислоты и культивируемые в культуре с подпиткой в объеме 15 л
Состав среды (на литр ферментационной среды)
K2HPO4 7,5 г, MgSO4·7H2O 2 г, лимонная кислота моногидрат 2 г, аммония железа (III) цитрат 0,3 г, дрожжевой экстракт 0,5 г, 1000× модифицированный раствор микроэлементов 1 мл. Все компоненты вносили вместе и растворяли в дистиллированной воде. Данный раствор автоклавировали. Значение рН доводили до 7,0 гидроксидом аммония (30%) и доводили до конечного объема. Глюкозу 10 г, тиамин·HCl 0,1 г и антибиотики вносили после стерилизации и доведения рН.
1000Х Модифицированный раствор микроэлементов:
Лимонная кислота·Н2О 40 г, MnSO4·Н2О 30 г, NaCl 10 г, FeSO4·7H2O 1 г, CoCl2·6H2O 1 г, ZnSO4·7H2O 1 г, CuSO4·5H2O 100 мг, H3BO3 100 мг, NaMoO4·2H2O 100 мг. Каждый компонент последовательно растворяли в дистиллированной H2O, доводили рН до 3,0 смесью HCl/NaOH, затем доводили до конечного объема и стерилизовали фильтрованием через фильтр с тонкостью фильтрования 0,22 мкм.
Ферментацию проводили в биореакторе емкостью 15 л с клетками штамма BL12 (DE3) E.coli, содержащими верхний путь мевалоновой кислоты (MVA) (pCL верхний путь), интегрированный нижний путь MVA (gi1.2KKDyI) и имеющими высокую экспрессию мевалонаткиназы M. mazei и изопренсинтазы из P. alba (pTrcAlba-mMVK). Данный опыт проводили для оценки синтеза изопрена из глюкозы при желаемых условиях ферментации: значении рН 7,0 и температуре 30°С. Содержимое замороженного флакона со штаммом E.coli оттаивали и инокулировали в среду триптон-дрожжевой экстракт. После культивирования инокулюма до значения OD, равного 1,0, определенного при 550 нм, использовали 500 мл для инокулирования в биореактор емкостью 15 л, доводя до первоначального объема 5 л.
i) Продукция изопрена в E.coli (EL256), культивированного в культуре с подпиткой без подачи дрожжевого экстракта
Глюкозу подавали с экспоненциальной скоростью до достижения клетками стационарной фазы роста. После данного периода времени подачу глюкозы снижали до количеств, обеспечивающих метаболические потребности. Общее количество глюкозы, внесенное в биореактор за 67 ч ферментации, составляло 3,9 кг. Индукцию проводили добавлением изопропил-бета-D-1-тиогалактопиранозида (IPTG). Концентрацию IPTG доводили до 102 мкМ, когда оптическая плотность (OD550) достигала значения 9 при длине волны 550 нм. Концентрацию IPTG повышали до 192 мкМ, когда значение OD550 достигало 140. Профиль изменения значения OD550 в биореакторе приведен на фигуре 67А. Уровень изопрена в отходящем газе из биореактора определяли с использованием масс-спектрометра Hiden. Титр изопрена повышался в течение ферментации до конечного значения 35,6 г/л (фигура 67В). Общее количество изопрена, продуцированного за 67 ч ферментации, составляло 320,6 г и временной график продукции приведен на фигуре 67С. Профиль метаболической активности, по данным TCER, представлен на фигуре 67D. Молярный выход утилизированного углерода, вошедшего в состав изопрена во время ферментации, равнялся 17,9%. Массовый процентный выход изопрена из глюкозы составлял 8,1%.
Продукция изопрена в E.coli (EL256), культивированными в культуре с подпиткой с подачей дрожжевого экстракта
Глюкозу подавали с экспоненциальной скоростью до достижения клетками стационарной фазы роста. После данного периода времени подачу глюкозы снижали до количеств, обеспечивающих метаболические потребности. Общее количество глюкозы, внесенной в биореактор за 68 ч ферментации, составляло 7,1 кг. В целом также было подано 1,06 кг дрожжевого экстракта во время ферментации. Индукцию проводили добавлением IPTG. Концентрацию IPTG доводили до 208 мкМ, когда оптическая плотность достигала значения 7 при длине волны 550 нм (OD550). Концентрацию IPTG повышали до 193 мкМ, когда значение OD550 достигало 180. Профиль изменения значения OD550 в биореакторе приведен на фигуре 68А. Уровень изопрена в отходящем газе из биореактора определяли с использованием масс-спектрометра Hiden. Титр изопрена повышался в течение ферментации до максимального значения 32,2 г/л (фигура 68В). Общее количество изопрена, продуцированного за 68 ч ферментации, составляло 395,5 г и временной график продукции приведен на фигуре 68С. Временной профиль объемной продукции представлен на фигуре 68D и показано, что средняя скорость, равная 1,1 г/л/ч, поддерживалась в период между 23 и 63 ч. Профиль метаболической активности, по данным CER, приведен на фигуре 68Е. Молярный выход утилизированного углерода, вошедшего в состав изопрена во время ферментации, равнялся 10,3%. Массовый процентный выход изопрена из глюкозы составлял 5,2%.
IV. Продукция изопрена из различных источников углерода в E.coli, содержащими путь мевалоновой кислоты (MVA) и изопренсинтазу (EWL256)
Состав среды (на литр ферментационной среды)
K2HPO4 13,6 г, КН2РО4 13,6 г, MgSO4·7H2O 2 г, лимонная кислота моногидрат 2 г, аммония железа (III) цитрат 0,3 г, (NH4)2SO4 3,2 г, дрожжевой экстракт 0,2 г, 1000× модифицированный раствор микроэлементов 1 мл. Все компоненты последовательно растворяли в дистиллированной воде. Значение рН доводили до 6,8 гидроксидом аммония (30%) и доводили до конечного объема. Среду стерилизовали фильтрованием через фильтр с тонкостью фильтрования 0,22 мкм. Источник углерода вносили до конечной концентрации 1%. Необходимые антибиотики вносили после стерилизации и доведения рН.
1000Х раствор микроэлементов (на литр ферментационной среды):
Лимонная кислота·Н2О 40 г, MnSO4·Н2О 30 г, NaCl 10 г, FeSO4·7H2O 1 г, CoCl2·6H2O 1 г, ZnSO4·7H2O 1 г, CuSO4·5H2O 100 мг, H3BO3 100 мг, NaMoO4·2H2O 100 мг. Каждый компонент последовательно растворяли в дистиллированной H2O, доводили рН до 3,0 смесью HCl/NaOH, затем доводили до конечного объема и стерилизовали фильтрованием через фильтр с тонкостью фильтрования 0,22 мкм.
i) Приготовление гидролизата биомассы AFEX
Предварительно обработанную AFEX кукурузную солому гидролизовали для получения гидролизата биомассы, содержащей ксилозу, глюкозу и ацетат.
Использовали предварительно обработанную кукурузную солому, полученную от Michigan Biotechnology Institute. Условия предварительной обработки были следующими: 60% влажность, нагрузка аммиаком 1:1 и 90°С в течение 30 мин, затем высушивали на воздухе. Содержание влаги в предварительно обработанном AFEX кукурузном сене составляло 21,27%. Содержание глюкана и ксилана в предварительно обработанной AFEX кукурузной соломе составляло соответственно 31,7 и 19,1% (в пересчете на сухое вещество). Использованными ферментами были ацеллераза 1000, гриндамил H121 (ксиланаза Danisco, продукт Aspergillus niger для хлебопекарной промышленности).
Для сахарификации 20 г предварительно обработанной AFEX кукурузной соломы вносили в колбу емкостью 500 мл вместе с 5 мл 1М натриевого цитратного буфера, рН 4,8, 2,25 мл ацеллеразы 1000, 0,1 мл Гриндамила H121 и 72,65 мл DI воды. Колбу помещали в орбитальный шейкер и инкубировали при 50°С в течение 96 ч.
Для анализа одну пробу отбирали из шейкера и анализировали с использованием ВЭЖХ. Гидролизат содержал 37,2 г/л глюкозы и 24,3 г/л ксилозы и 7,6 г/л олигомеров глюкозы и/или ксилозы. Кроме того, гидролизат содержал 1,17 г/л ацетата.
ii) Схема опыта
Из замороженного флакона отбирали инокулюм штамма EWL256 E.coli, содержащий путь MVA и изопренсинтазу, и высевали на чашки с LB, содержащий спектиномицин (50 мкг/мл) и карбенициллин (50 мкг/мл) и инкубировали при 30°С в течение ночи. Единичную колонию высевали на среду ТМ3, содержащую глюкозу, ксилозу, глицерин, ацетат или биомассу в качестве единственного источника углерода и культивировали в течение ночи при 30°С. Клетки, культивированные на ацетате, достигали достоверно более низкой оптической плотности. Клетки, культивированные на глюкозе, глицерине, гидролизате биомассы или ацетате, разводили в 20 мл среды ТМ3, содержащей соответствующие источники углерода для достижения оптической плотности 0,1, определенной при длине волны 600 нМ. Отрицательный контроль, не содержащий какой-либо источник углерода, готовили из ночной культуры с глюкозой. Проводили отдельный опыт с глюкозой и ксилозой, в котором культуры разводили до оптической плотности 0,05. Все культуральные условия (за исключением ацетата и глицерина) тестировали в двух параллелях, и приведенные результаты представляют собой средние значения для данных культур. Продукцию изопрена индуцировали внесением 200 мкМ IPTG в начале опыта. Колбы инкубировали при 30°С в орбитальном шейкере (200 об/мин) и культивировали с последующим определением оптической плотности. После достижения оптической плотности, равной примерно 0,4, в культурах с подпиткой глюкозой пробы анализировали на синтез изопрена из всех тестированных источников углерода каждый час в течение 3 ч. Пробы объемом 100 мкл переносили в двух параллелях в стеклянные флаконы емкостью 2 мл, герметично закрывали и инкубировали в течение 30 мин при 30°С. Затем бактерии убивали тепловой обработкой при инкубации при температуре 80°С в течение 8 мин. Количество продуцированного изопрена определяли с использованием ГХ-МС и рассчитывали удельную продуктивность (мкг/л·ч).
iii) Результаты
Во время роста на всех источниках углерода отмечали высокую продукцию изопрена. Источники углерода представляют собой примеры обычных спиртов, органических кислот, сахаров, содержащих 5-6 атомов углерода (С5 или С6), и гидролизат биомассы.
Первоначальный рост бактерий на гидролизатебиомассыбыл сравним со скоростью ростанаглюкозе (фигура 69А). Первоначальная удельная продуктивность во время роста на гидролизате биомассы была достоверно выше по сравнению с ростом на глюкозе. Данный факт свидетельствует о том, что гидролизат биомассы можно использовать в качестве эффективного источника углерода для продукции изопрена. Удельная продуктивность снижалась спустя 255 минроста нагидролизате биомассы (фигура 69В). Бактерии имели более низкую скоростью роста, находясь на ксилозе в качестве единственного источника углерода, по сравнению с глюкозой (фигура 69С), но, тем не менее, наблюдали высокую удельную продуктивность изопрена (фигура 69D). Это показывает, что оба С5 и С6 сахара могут использоваться для синтеза изопрена через путь мевалоновой кислоты.
Удивительно, что бактерии, культивированные на ацетате в качестве единственного источника углерода, обладали удельной продуктивностью в отношении изопрена в 2 раза выше по сравнению с ростом на глюкозе (фигура 69А). Бактерии росли медленнее на ацетате по сравнению с глюкозой (фигура 69В), но результаты проведенного опыта показывают, что ацетат также можно использовать в качестве источника углерода для продукции изопрена. По данным ВЭЖХ ацетат также присутствует в гидролизате биомассы.
Бактерии интенсивно росли при использовании глицерина в качестве единственного источника углерода (фигура 69А) и при этом отмечали высокую продукцию изопрена (фигура 69В). Это демонстрирует, что обычные спирты также можно использовать для продукции изопрена через путь мевалоновой кислоты.
Пример 11: Экспрессия растительной изопренсинтазы из Streptomyces sp.
Ген изопренсинтазы кудзу получали из плазмиды pJ201:19813. Плазмида pJ201:19813 кодирует изопренсинтазу Pueraia lobata (растение кудзу) и кодон-оптимизирована для экспрессии в Pseudomonas fluerescens, Pseudomonas putida, Rhodopseudomonas palustris и Corynebacterium (фигуры 79А-79С (SEQ ID NO:123)). Расщепление плазмиды pJ201:19813 рестриктазами NdeI и BamHI высвобождало ген iso19813, который лигировали в шатл-вектор pUWL201PW Streptomyces-E.coli (Doumith et al., Mol. Gen. Genet., 264:477-485, 2000; фигура 71) с получением плазмиды pUWL201_iso. Успешное клонирование подтверждали рестрикционным анализом pUWL201_iso. Экспрессия изопренсинтазы iso19813 находилась под контролем erm-промотора, который обеспечивает конститутивную экспрессию в видах Streptomyces, но не оказывает влияние на экспрессию в E.coli.
PUWL201PW (без вставки) и pUWL201_iso вводили в Streptomyces albus J1074 (Sanchez et al., Chem Biol., 9:519-531, 2002) трансформацией протопластов, как описано Hopwood et al., The John innes foundation, Norwich, 1985.
Аликвотную порцию суспензии протопластов объемом 200 мкл трансформировали 1,9 мкг pUWL201PW или 2,9 мкг pUWL201_iso. После инкубации в течение ночи при 28°С на неселективных чашках с агаром R5, позитивные трансформанты отбирали дополнительной инкубацией в течение 4 суток в вернем слое агара R3, содержащем тиострептон (250 мкг/мл). Резистентные к тиострептону трансформанты исследовали на присутствие pUWL-плазмид приготовлением плазмид с использованием набора Plasmid Mini (Qiagen). Полученную ДНК-плазмиду повторно вводили в E.coli DH5α c получением достаточных количеств плазмидной ДНК для рестрикционного анализа. Позитивные трансформанты отбирали на содержащем ампициллин L-агаре и анализ вставки проводили расщеплением плазмидной ДНК с помощью эндонуклеаз NdeI и BamHI. Изопренсинтазу идентифицировали в виде фрагмента размером 1,7 т.п.н. в позитивных клонах pUWL201_iso, в то время как в контрольных штаммах (pUWL201PW) данный фрагмент не обнаруживали.
Штамм дикого типа и трансформанты S. albus, содержащие контрольную плазмиду pUWL201PW или pUWL201_iso, кодирующей изопренсинтазу, анализировали на синтез изопрена. Штаммы культивировали в двух параллелях на твердой среде (триптический соевый бульон агар, TSB; 2,5 мл) в присутствии и отсутствии тиострептона (200 мкг/мл) и инкубировали 4 дня при 28°С во флаконах с пространством над жидкостью (общий объем 20 мл). Пробы объемом 500 мкл из пространства над жидкостью (конечная точка определений) анализировали ГХ-МС в SIM-режиме и изопрен идентифицировали по времени удерживания и молекулярной массе (67 m/z). Изопрен, присутствующий в пространстве над жидкостью, определяли количественно по ранее построенным калибровочным кривым. Штамм дикого типа S. albus и контрольные штаммы, содержащие плазмиду pUWL201PW, продуцировали изопрен в концентрации чуть несколько выше предела определения (0,04-0,07 ppm), S. albus, содержащие плазмиду pUWL201_iso, продуцировали изопрен в концентрации по меньшей мере в 10 раз выше по сравнению с контролем (0,75 ppm; фигура 72). Результаты свидетельствовали о высокой экспрессии растительной изопренсинтазы в прокариотическом микроорганизме, относящемся к Actinomycetes.
Пример 12: Продукция изопрена или мевалоната из жирной кислоты или пальмового масла из E.coli fadR atoC LS5218, содержащими верхний или верхний и нижний пути мевалоновой кислоты плюс изопренсинтазу кудзу
Штамм LS5218 (#6966)Escherichia coli fadR atoC получали из Coli Genetic Stock Center. FadR кодирует репрессор транскрипции, который отрицательно регулирует экспрессию генов, кодирующих ферменты деградации жирных кислот (Campbell et al., J. Bacteriol., 183:5982-5990, 2001). AtoC является ответным регулятором в двухкомпонентной регуляторной системе с AtoS, регулирует метаболизм ацетолактата. Штамм fadR atoC обеспечивает конститутивную экспрессию генов деградации жирных кислот и включает длинноцепочечные жирные кислоты в длинноцепочечные полигидроксиалканоаты. В том случае, когда используют пальмовое масло в качестве источника углерода для продукции мевалоната или изопрена, то пальмовое масло преобразуют в глицерин плюс жирную кислоту. Способы для этого преобразования известны в данной области, и его можно провести ферментативным путем при инкубации с липазой (например, липазой из поджелудочной железы свиньи, липазой Candida rugosa или другой аналогичной липазой) или химическим путем при сапонификации основанием, таким как гидроксид натрия.
i) Штамм E.coli fadR atoC, экспрессирующий верхний путь мевалоновой кислоты
Штамм WW4 получали электропорацией плазмиды pCLPtrверхний путь в LS5218 с использованием стандартных методов (Sambrook et al., Molecular Cloning: A Laboratory Manual, 2nd, Cold Spring Harbor, 1989). Включение плазмиды было подтверждено продукцией мевалоновой кислоты (MVA), когда клетки культивировали в среде ТМ3 с добавлением С12 жирных кислот (FA) или пальмового масла в качестве источника углерода. Для демонстрации продукции MVA штаммом WW4 из жирных кислот клетки из ночной культуры разводили 1:100 в 5 мл модифицированной среды ТМ3 (ТМ3 без дрожжевого экстракта) с добавлением 0,25% С12 FA (Sigma cat#L9755). Первые признаки продукции MVA (24 мг/л) стали очевидными после инкубации индуцированной IPTG культуры в течение ночипри 30°С. Продукция возрастала в течение 3 суток до конечной концентрации 194 мг/л продуцированной MVA. Для демонстрации продукции MVA штаммом WW4 из масла клетки из ночной культуры разводили 1:100 в модифицированной среде ТМ3 с добавлением 200 мг расщепленного пальмового масла на 5 мл среды ТМ3. Первые признаки продукции MVA (50 мг/л) стали очевидными после инкубации в течение ночи индуцированной IPTG культуры при 30°С. Продукция увеличивалась в течение 3 суток с конечным уровнем 500 мг/л продуцированной MVA.
ii) Штамм E.coli fadR atoC, экспрессирующий верхний и нижний пути MVA плюс изопренсинтазу кудзу
Штамм WW4 Escherichia coli (LS5218 fadR atoC pCLPtrверхний путь) трансформировали pMCM118 [pTrcKKDyIkIS] с получением штамма WW10. Включение плазмиды было подтверждено продукцией изопрена, когда штамм культивировали на среде ТМ3 и глюкозе и индуцировали IPTG (в концентрации 100; 300 или 900 мкМ). Штамм был относительно чувствителен к IPTG и показывал интенсивный рост при концентрации IPTG, равной 100 мкМ. Результаты приведены на фигуре 70А.
Для анализа продукции изопрена из додекановой кислоты штамм WW10 культивировали в течение ночи на бульоне L, содержащем спектиномицин (50 мкг/мл) и канамицин (50 мкг/мл) при 37°С при встряхивании со скоростью 200 об/мин. Клетки промывали модифицированной средой ТМ3 при центрифугировании и ресуспендировали в первоначальном объеме культуры в данной среде. Отмытые и ресуспендированные клетки из данной стартовой культуры разводили 1:100 и 1:10 в 5 мл модифицированной среды ТМ3, содержащей 0,125% С12 FA (Sigma cat#L9755).
Для демонстрации продукции мевалоната из пальмового масла масло предварительно расщепляли липазой при 37°С и встряхивании при 250 об/мин в течение нескольких суток для высвобождения жирных кислот (признаки гидролиза проявлялись в виде пены, образующейся при встряхивании пробирок).
Кроме того, культуру получали разведением отмытых клеток 1:10 в модифицированной среде ТМ3, находящейся в пробирках с пальмовым маслом. Готовили дополнительную пробирку добавлением 0,125% C12 FA к остальной части (2,5 мл) отмытых клеток без дополнительного разведения (биоконверсия). Через 3,75 ч культивирования при 30°С при встряхивании со скоростью 250 об/мин культуру индуцировали добавлением 50 мкМ IPTG. Инкубацию продолжали в течение 4 ч, после чего аликвотные порции объемом 200 мкл каждой культуры анализировали на накопление изопрена с использованием модифицированного метода анализа пространства над жидкостью (1 ч накопления при 30°С при встряхивании со скоростью 500 об/мин). Дополнительный анализ изопрена проводили через 12 ч инкубации анализом смыва со стеклянного блока перед проведением ГХ/МС. Инкубацию индуцированных культур продолжали в течение ночи и на следующее утро аликвотные порции объемом 200 мкл вновь анализировали на содержание изопрена (1 ч, 30°С, встряхивание на шейкере Shel-Lab со скоростью 500 об/мин). Наиболее высокие уровни изопрена обнаруживали в культуре, которую высевали в разведении 1:10 из ночной стартовой культуры после инкубации и индукции в течение ночи. На основании данного результата можно предполагать, что данная культура продолжала расти и клеточная плотность возрастала. Результаты приведены на фигуре 70В. Клеточную плотность можно оценить непосредственно, поскольку суспензия жирных кислот является мутной. Следовательно, клеточную плотность данной культуры, определенную посевом аликвотных порций культуры, равнялась 8×107 колониеобразующих единиц. Это соответствует значению OD600 примерно 0,1. Тем не менее, данная культура обеспечивала значительную продукцию изопрена; изопрен не детектировали в аналогичных штаммах без данного пути, описанных в настоящем примере.
Пример 13: Повышение продукции изопрена конститутивной экспрессией ybhE в E.coli
В данном примере оценена продукция изопрена в штамме, конститутивно экспрессирующем ybhE (pgl) по сравнению с контрольным штаммом дикого типа ybhE. Ген ybhE (pgl) кодирует 6-фосфоглюконолактоназу, которая подавляет посттрансляционное глюконилирование гетерологичных экспрессированных белков и повышает растворимость и выход продукта, одновременно повышая выход и поток биомассы через пентозфосфатный путь (Aon et al., Applied and Environmental Microbiology, 74(4):950-958, 2008).
Штамм BL21 E coli, продуцирующий изопрен (EWL256), конструировали посредством конститутивной экспрессии гена ybhE в реплицирующейся плазмиде pBBR1MCS5 (гентамицин) (полученной от доктора K. Peterson, Louisiana State University).
Кассеты для рекомбинации на основе FRT и плазмиды для Red/ET-опосредованной интеграции и выпетливания маркера резистентности к антибиотикам получали от Gene Bridges GmbH (Германия). Методы с использованием данных материалов проводили согласно протоколам Gene Bridges. Использовали праймеры Pgl-F и PglGI1.5-R для амплификации кассеты резистентности из матрицы FRT-gb2-Cm-FRT с использованием набора Stratagene Herculase II Fusion согласно протоколу изготовителя. Реакционная смесь (с конечным объемом 50 мкл) содержала: 5 мкл буфера, 1 мкл ДНК-матрицы (FRT-gb2-Cm-F производства Gene Bridges), 10 пмоль каждого праймера и 1,5 мкл 25 мМ смеси dNTP, доводили до объема 50 мкл дистиллированной водой. Реакционную смесь подвергали воздействию следующим условиям: 1× 2 мин, 95°С, затем 95°С в течение 30 циклов (30 сек при 95°С; 30 сек при 63°С; 3 мин при 72°С).
Полученный продукт ПЦР очищали с использованием набора для очистки QIAquick PCR Purification (Qiagen) и подвергали электропорации в электрокомпетентные клетки MG1655, содержащие плазмиду pRed-ET, включающую рекомбиназу. Клетки получали культивированием в 5 мл бульона L до значения OD600, равного ≈0,6, при 30°С. Клетки индуцировали на экспрессию рекомбиназы добавлением 4% арабинозы и культивировали в течение 30 мин при 30°C с последующим культивированием в течение 30 мин при 37°С. Аликвотную порцию клеток объемом 1,5 мл 3-4 раза промывали охлажденной на льду дистиллированной водой. Конечный клеточный осадок ресуспендировали в 40 мкл охлажденной на льду дистиллированной воды и вносили 2-5 мкл продукта ПЦР. Проводили электропорацию в кюветах размером 1 мм при напряжении 1,3 кВ с использованием электропоратора Gene Pulser Electroporator (Bio-Rad Inc.). Клетки восстанавливали в течение 1-2 ч при 30°С и высевали на агар L, содержащий хлорамфеникол (5 мкг/мл). Пять трансформантов анализировали ПЦР и секвенировали с использованием праймеров, фланкирующих сайт интеграции (2 ряда праймеров: pgl и 49rev и 3'-EcoRV-pglstop; Bottom Pgb2 и Top GB's CMP(946)). Отбирали правильный трансформант и данный штамм обозначали, как MG1655 GI1.5-pgl::CMP.
Хромосомную ДНК штамма MG1655 GI1.5-pgl::CMP использовали в качестве матрицы для получения фрагмента ПЦР, содержащего конструкцию FRT-CMP-FRT-GI1.5-ybhE. Данную конструкцию клонировали в pBBR1MCS5 (гентамицин) следующим образом. Фрагмент, в данном случае CMP-GI1.5-pgl, амплифицировали с использованием 5'-праймера Pglconfirm-F и 3'-праймера 3'EcoRV-pglstop. Полученный фрагмент клонировали с использованием набора для клонирования TOPO-Blunt (Invitrogen) в плазмиду-вектор pCR-Blunt II-YOPO, как предложено изготовителем. Фрагмент NsiI, несущий фрагмент CMP-GI1.5-pgl, клонировали в сайт PstI плазмиды pBBR1MCS5 (гентамицин). Готовили 20 мкл смеси для лигирования, которая содержала 5 мкл вставки CMP-GI1.5-pgl, 2 мкл вектора pBBR1MCS5 (гентамицин), 1 мкл ДНК-лигазы Т4 (New England BioLabs), 2 мкл 10× буфера для лигазы и 10 мкл ddH2O. Смесь для лигирования инкубировали при комнатной температуре в течение 40 мин, затем 2-4 мкл подвергали электропорации в электрокомпетентные клетки Тор 10 клетки (Invitrogen) с использованием параметров, приведенных выше. Трансформанты отбирали на агаре L, содержащем 10 мкг/мл хлорамфеникола и 5 мкг/мл гентамицина. Определяли последовательность отобранного клона с использованием ряда праймеров, приведенных выше, а также собственных Т3 и обратных праймеров, предоставленных Sequetech, CA. Данную плазмиду обозначали pBBRCMPGI1.5-pgl (фигуры 77А-В и SEQ ID NO:122).
Плазмиду pBBRCMPGI1.5-pgl подвергали электропорации в клетки EWL256, как описано выше в примере 10, и трансформанты высевали на агар L, содержащий хлорамфеникол (10 мкг/мл), гентамицин (5 мкг/мл), спектиномицин (50 мкг/мл) и карбенициллин (50 мкг/мл). Отбирали один трансформант и обозначали RM11608-2.
Праймеры:
Pgl-F
5'-ACCGCCAAAAGACTAATTTTAGCTGTTACAGTCAGTTGAATTAACCCTCACTAAAGGGCGGCCGC-3' (SEQ ID NO:115)
PglgI1.5-R
5'-GCTGGCGATATAAACTGTTTGCTTCATGAATGCTCCTTTGGGTTACCTCCGGGAAACGCGGTTG ATTTGTTTAGTGGTTGAATTATTTGCTCAGGATGTGGCATAGTCAAGGGCGTGACGGCTCAAGG GCGTGACGGCTCGCTAATACGACTCACTATAGGGCTCGAG-3' (SEQ ID NO:116)
3'EcoRV-pglstop:
5'-CTT GAT ATC TTA GTG TGC GTT AAC CAC CAC (SEQ ID NO:117)
pgl+49 rev: CGTGAATTTGCTGGCTCTCAG (SEQ ID NO:118)
Bottom Pgb2: GGTTTAGTTCCTCACCTTGTC (SEQ ID NO:119)
Top GB's CMP(946): ACTGAAACGTTTTCATCGCTC (SEQ ID NO:120)
Pglconfirm-F
5'-ACCGCCAAAAGCGACTAATTTTAGCT-3' (SEQ ID NO:121)
i) Анализ в небольшом объеме
Состав среды (на литр ферментационной среды)
K2HPO4 13,6 г, КН2РО4 13,6 г, MgSO4·7H2O 2 г, лимонная кислота моногидрат 2 г, аммония железа (III) цитрат 0,3 г, (NH4)2SO4 3,2 г, дрожжевой экстракт 1 г, 1000× модифицированный раствор микроэлементов 1 мл. Все компоненты вносили вместе и растворяли в дистиллированной воде. Значение рН доводили до 6,8 гидроксидом аммония (30%) и доводили до конечного объема. Среды стерилизовали фильтрованием через фильтр с тонкостью фильтрования 0,22 мкм. Глюкозу 5,0 г и антибиотики вносили после стерилизации и доведения рН.
1000X Раствор микроэлементов (на литр ферментационной среды):
лимонная кислота·Н2О 40 г, MnSO4·Н2О 30 г, NaCl 10 г, FeSO4·7H2O 1 г, CoCl2·6H2O 1 г, ZnSO4·7H2O 1 г, CuSO4·5H2O 100 мг, H3BO3 100 мг, NaMoO4·2H2O 100 мг. Каждый компонент последовательно растворяли в дистиллированной H2O, доводили рН до 3,0 смесью HCl/NaOH, затем доводили до конечного объема и стерилизовали фильтрованием через фильтр с тонкостью фильтрования 0,22 мкм.
а) Схема опыта
Продукцию изопрена оценивали при культивировании штаммов в CelleratorTM производства MicroReactor Technologies, Inc. Рабочий объем в каждой из 24 лунок составлял 4,5 мл. Температуру поддерживали при 30°С, рН равнялся 7,0, поток кислорода равнялся 20 стандартизованных куб. см/мин и скорость перемешивания составляла 800 об/мин. Из замороженного флакона отбирали инокулюм штамма E.coli и высевали на чашку с бульоном агаром LB (с антибиотиками) и инкубировали при 30°С. Единичную колонию инокулировали на среду с антибиотиками и культивировали в течение ночи. Бактерии разводили в 4,5 мл среды с антибиотиками до достижения оптической плотности 0,05, определенной при длине волны 550 нм.
Анализ изопрена в отходящем газе проводили с использованием газового хроматографа-масс-спектрометра (ГХ-МС) (Agilent) в пространстве над жидкостью. Подготовка проб заключалась в следующем: 100 мкл цельного бульона помещали в герметично закрытый флакон для ГХ и инкубировали при 30°С в течение определенного периода времени, составляющего 30 мин. После стадии тепловой обработки в целях разрушения микроорганизмов при инкубации при 70°С в течение 5 мин образцы анализировали ГХ.
Оптическую плотность (OD) при длине волны 550 нм определяли с использованием ридера для микропланшетов (Spectramax) во время анализа. Удельную продуктивность определяли делением концентрации изопрена (мкг/л) на значение OD и время (ч).
Оценивали два штамма EWL256 и RM11608-2 при индукции 200 и 400 мкМ IPTG. Пробы анализировали на продукцию изопрена и рост клеток (OD550) через 1; 2,5; 4,75 и 8 ч после индукции. Анализ проб проводили в двух параллелях.
b) Результаты
Результаты опытов показывали, что при двух различных концентрациях IPTG для штамма, экспрессирующего ybhE(pgl), имело место выраженное 2-3-кратное повышение удельной продуктивности в отношении изопрена по сравнению с контрольным штаммом.
ii) Ферментация изопрена из E.coli, экспрессирующими мевалонаткиназу M. mazei, изопренсинтазу P. alba и со сверхэкспрессией pgl (RHM111608-2) и культивированными в культуре с подпиткой в объема 15 л
Состав среды (на литр ферментационной среды):
K2HPO4 7,5 г, MgSO4·7H2O 2 г, лимонная кислота моногидрат 2 г, аммония железа (III) цитрат 0,3 г, дрожжевой экстракт 0,5 г, 1000× модифицированный раствор микроэлементов 1 мл. Все компоненты вносили вместе и растворяли в дистиллированной воде. Данный раствор автоклавировали. Значение рН доводили до 7,0 гидроксидом аммония (30%) и доводили до конечного объема. После стерилизации и доведения рН добавляли глюкозу 10 г, тиамин·HCl 0,1 г и антибиотики.
Состав 1000Х модифицированного раствора микроэлементов:
Лимонная кислота·Н2О 40 г, MnSO4·Н2О 30 г, NaCl 10 г, FeSO4·7H2O 1 г, CoCl2·6H2O 1 г, ZnSO4·7H2O 1 г, CuSO4·5H2O 100 мг, H3BO3 100 мг, NaMoO4·2H2O 100 мг. Каждый компонент последовательно растворяли в дистиллированной H2O, доводили рН до 3,0 смесью HCl/NaOH, затем доводили до конечного объема и стерилизовали фильтрованием через фильтр с тонкостью фильтрования 0,22 мкм.
Ферментацию проводили в биореакторе емкостью 15 л с клетками штамма BL21 E.coli (DE3), содержащими верхний путь мевалоновой кислоты (MVA) (pCL верхний), интегрированный нижний путь MVA (gi1.2KKDyI), с высокой экспрессией мевалонаткиназы из M. mazei и изопренсинтазы из P. alba (pTrcAlba-mMVK) и высокой экспрессией pgl (pBBR-pgl). Данный опыт проводили для оценки синтеза изопрена из глюкозы при желаемых параметрах ферментации: рН 7,0 и температуре 34°С. Отбирали инокулюм штамма E.coli из замороженного флакона и высевали в среду триптон-дрожжевой экстракт. После инокулирования до значения OD 1,00, определенного при длине волны 550 нм, использовали 500 мл для внесения в биореактор емкостью 15 л с доведением первоначального объема до 5 л.
Глюкозу подавали с экспоненциальной скоростью до достижения стационарной фазы роста клеток. После данного периода времени подачу глюкозы снижали для покрытия метаболических потребностей. Общее количество глюкозы, внесенное в биореактор за 40 ч (59 ч) ферментации, равнялось 3,1 кг (4,2 кг за 59 ч). Индукцию проводили добавлением IPTG. Концентрацию IPTG доводили до 110 мкМ, когда значение оптической плотности при длине волны 550 нм (OD550) достигало 4. Концентрацию IPTG повышали до 192 мкМ, когда значение OD550становилось равным 150. Профиль изменения OD550 в биореакторе в течение времени приведен на фигуре 78А. Уровень изопрена в отходящем газе из биореактора определяли с использованием масс-спектрометра Hiden. Титр изопрена повышался в течение ферментации до максимального значения 33,2 г/л на 40 ч (48,6 г/л на 59 ч) (фигура 78В). Титр изопрена возрастал в течение ферментации до максимального значения 40,0 г/л на 40 ч (60,5 г/л на 59 ч) (фигура 78С). Общее количество изопрена, продуцированного за 40 ч (59 ч) ферментации, составляло 281,3 г (451,0 г на 59 ч) и временной график продукции приведен на фигуре 78D. Временной график объемной продукции приведен на фигуре 78Е и он показывает, что средняя скорость 1,0 г/л/ч сохранялась в период между 0 и 40 ч (1,4 г/л/ч в период между 19 и 59 ч). Профиль метаболической активности, по данным CER, приведен на фигуре 78F. Молярный выход утилизированного углерода, вошедшего в состав изопрена во время ферментации, равнялся 19,6% на 40 ч (23,6% на 59 ч). Массовый выход изопрена из глюкозы составлял 8,9% на 40 ч (10,7% на 59 ч).
Если не указано иначе, то значения всех технических и научных терминов, используемых в настоящем документе, представляют таковые, которое обычно понимаются специалистами в области, к которой относится данное изобретение. В таких источниках, как Singleton et al., Dictionary of Microbiology and Molecular Biology, 2nd ed., John Wiley and Sons, New York, 1994 и Hale&Marham, The Harper Collins Dictionary of Biology, Harper Perennial, N.Y., (1991), для специалистов в данной области приводится общий словарь многих терминов, которые используются в данном изобретении. Очевидно, понятно, что изобретение не ограничивается конкретными описанными методологиями, протоколами и реагентами, поскольку они могут варьировать. Также, специалистам в данной области, очевидно, понятно, что другие методы и вещества, аналогичные или эквивалентные описанным в настоящем документе, можно использовать для применения на практики или тестировании изобретения.
Заголовки в настоящем документе не ограничивают различные аспекты или варианты изобретения, которые имеют отношение к заявке в целом.
Применительно для данного документа, если четко не указано, то использование терминов «а», «an» и тому подобное относится к одному или более.
Выражение «примерно» применительно к значению или параметру включает (и описывает) варианты осуществления, которые направлены на само по себе значение или параметр. Например, выражение «примерно Х» включает описание «Х». Пределы чисел включают числа в данных пределах.
Очевидно, понятно, что аспекты и варианты осуществления изобретения, описанные в настоящем документе, включают выражения «включающие», «состоящие» и «состоящие в основном из» по отношению к аспектам или вариантам изобретения.
Приложение 1
Приведенные в качестве примера нуклеиновые кислоты и полипептиды 1-дезокси-D-ксилулоза-5-фосфатсинтазы













Приведенные в качестве примера нуклеиновые кислоты и полипептиды ацетил-СоА-ацетилтрансферазы













Приведенные в качестве примера нуклеиновые кислоты и полипептиды HMG-СоА-синтазы




Приведенные в качестве примера нуклеиновые кислоты и полипептиды гидроксиметилглутарил-СоА-редуктазы




Приведенные в качестве примера нуклеиновые кислоты и полипептиды мевалонаткиназы





Приведенные в качестве примера нуклеиновые кислоты и полипептиды фосфомевалонаткиназы



Приведенные в качестве примера нуклеиновые кислоты и полипептиды дифосфомевалонатдекарбоксилазы




Приведенные в качестве примера нуклеиновые кислоты и полипептиды изопентенилфосфаткиназы (IPK)

Приведенные в качестве примера нуклеиновые кислоты и полипептиды изопентенилдифосфат дельта-изомеразы (IDI)









Приведенные в качестве примера нуклеиновые кислоты и полипептиды изопренсинтазы

Реферат
Настоящее изобретение относится к биотехнологии и представляет собой способ получения изопрена и культуру рекомбинантных клеток, предназначенную для его осуществления. Рекомбинантные клетки содержат одну или несколько нуклеиновых кислот, кодирующих полипептид изопренсинтазы, полипептид изопентенилдифосфат-дельта-изомеразы (IDI) или полипептид 1-дезоксиксилулоза-5-фосфатазы (DXS) и/или один или несколько полипептидов пути мевалоната (MVA), при условии обязательного присутствия в клетке гетерологичной нуклеиновой кислоты, кодирующей изопренсинтазу. В качестве рекомбинантных клеток могут быть использованы клетки различных бактерий и грибов. Изобретение позволяет получить изопрен методом культивирования указанных рекомбинантных клеток с высоким выходом. 2 н. и 64 з.п. ф-лы, 79 ил., 6 табл., 13 пр.
Формула
(a) полипептид изопренсинтазы, где полипептид изопренсинтазы кодируется гетерологичной нуклеиновой кислотой,
(b) полипептид изопентенилдифосфат-дельта-изомеразы (IDI);
или
(c) (i) полипептид 1-дезоксиксилулоза-5-фосфатсинтазы (DXS)
и/или
(ii) один или несколько полипептидов пути мевалоната (MVA),
при условии обязательного присутствия в клетке гетерологичной нуклеиновой кислоты, кодирующей изопренсинтазу,
где: 1) клетки продуцируют более 400 нмоль/гсырая км/ч изопрена, 2) клетки преобразуют более 0,002 мол.% углерода, который клетки поглощают из клеточной культуральной среды, в изопрен, 3) клетки имеют среднюю объемную продуктивность изопрена более чем примерно 0,1 мг/лбульона/ч изопрена, и/или 4) клетки продуцируют по меньшей мере 0,0037 г изопрена на грамм сухой клеточный массы (гсухая км).
(с) (i) полипептид DXS и
(ii) один или несколько полипептидов пути МVА.
(с) (i) полипептид DXS и
(ii) полипептиды всего пути MVA.
(с) (i) полипептид DXS и
(ii) полипептиды нижнего пути MVA.
(а) культивирование рекомбинантных клеток по п.1 в условиях культивирования, подходящих для продукции изопрена, где клетки (i) продуцируют более чем примерно 400 нмоль/гсырая км/ч изопрена; (ii) преобразуют более чем примерно 0,002 мол.% углерода, который клетки поглощают из клеточной культуральной среды, в изопрен, или (iii) имеют среднюю объемную продуктивность изопрена более чем примерно 0,1 мг/лбульона/ч; и/или (iv) продуцируют по меньшей мере 0,0037 г изопрена на грамм сухой клеточной массы (гсухой км);
(b) продукцию изопрена, и
(с) выделение изопрена.

Комментарии