Способ получения ароматических спиртов - RU2654670C2
Код документа: RU2654670C2
Чертежи






























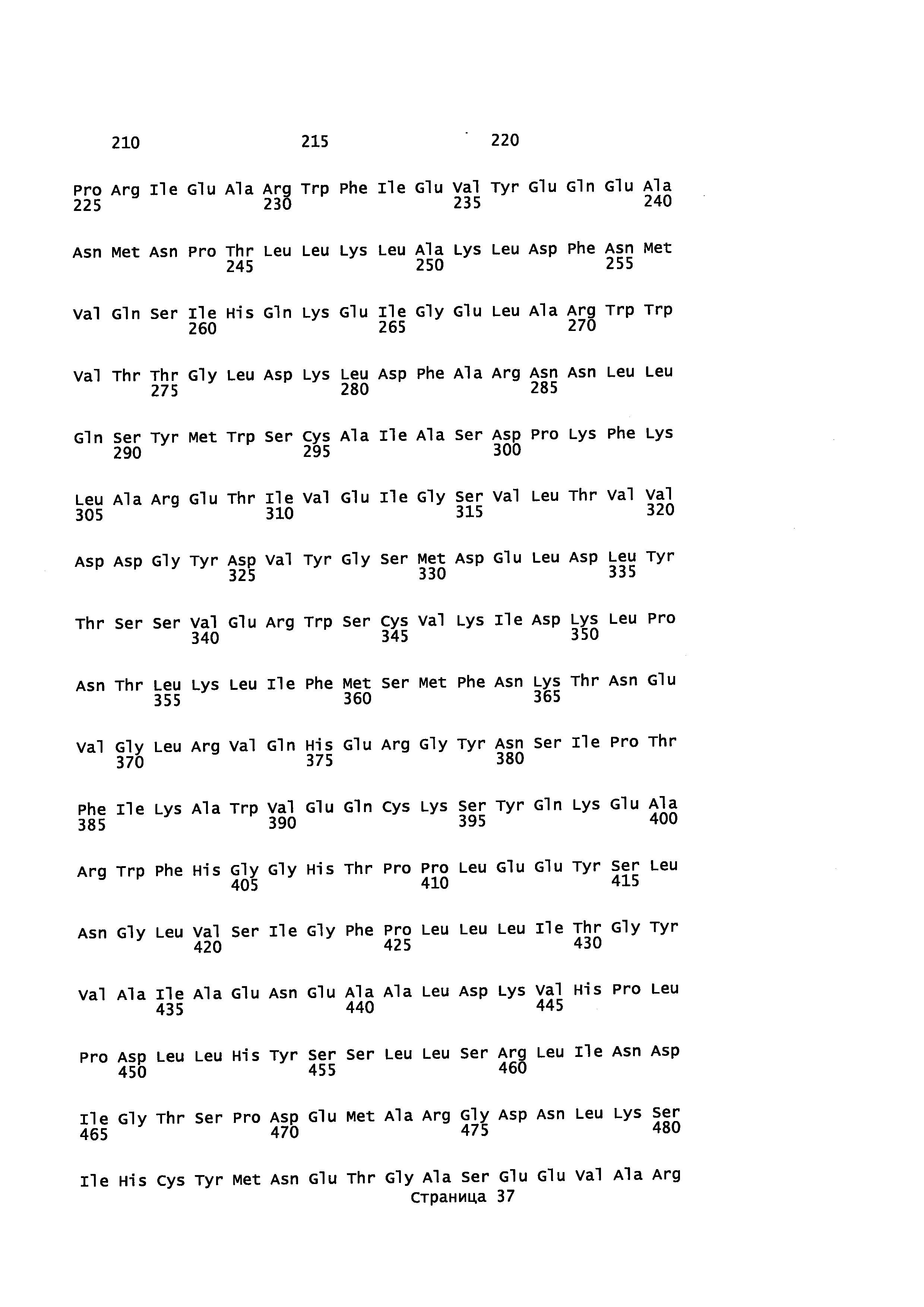

























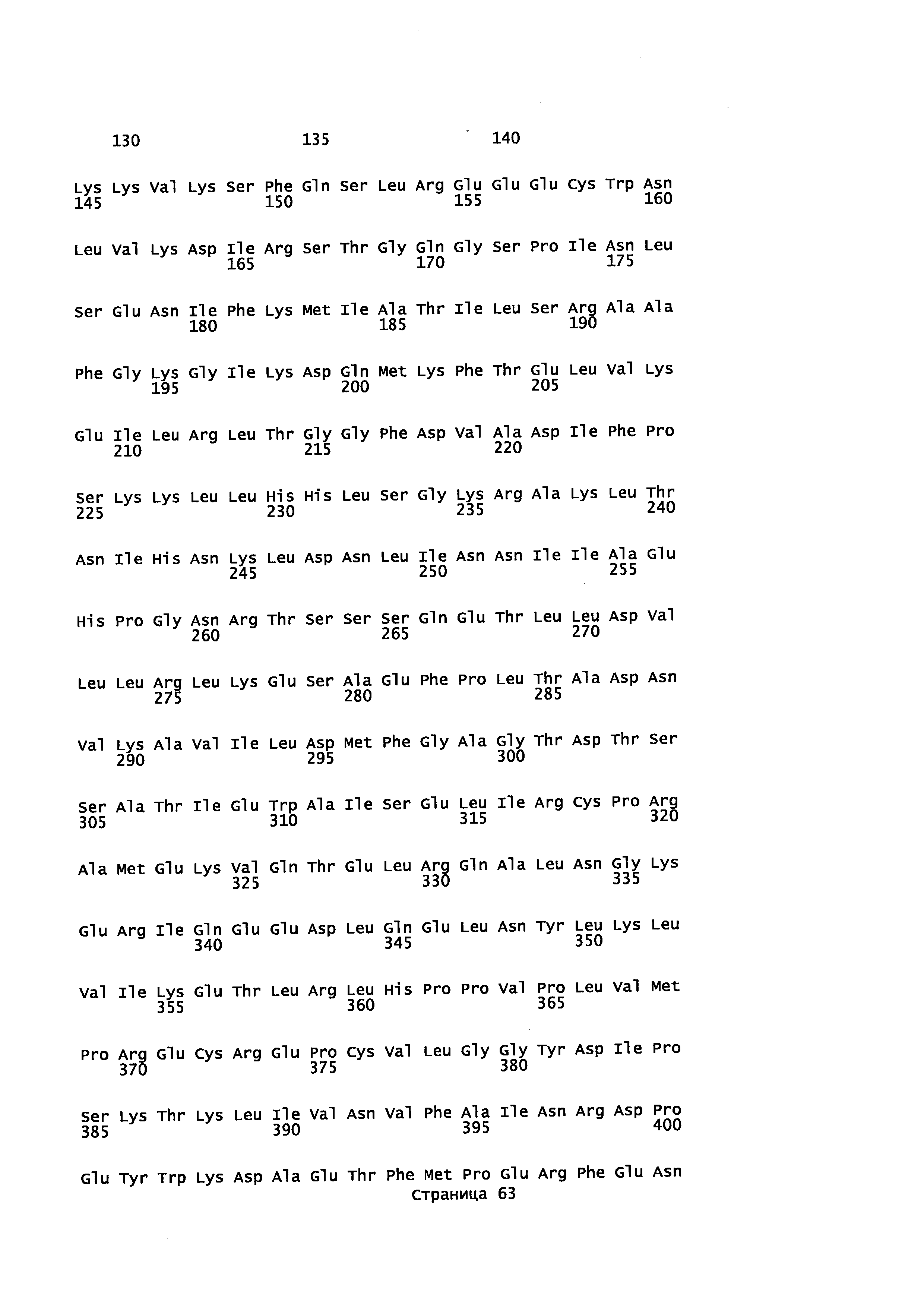





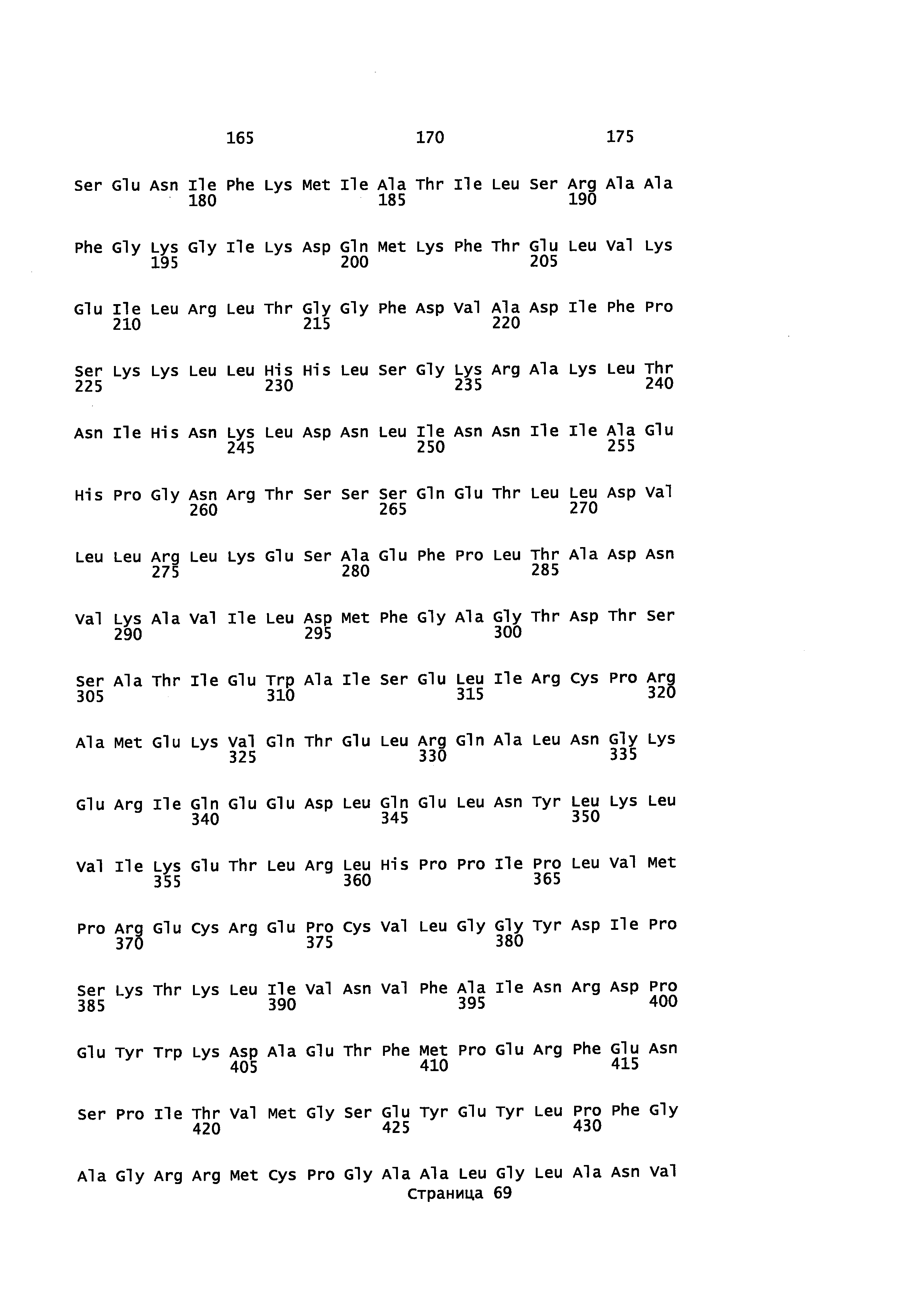











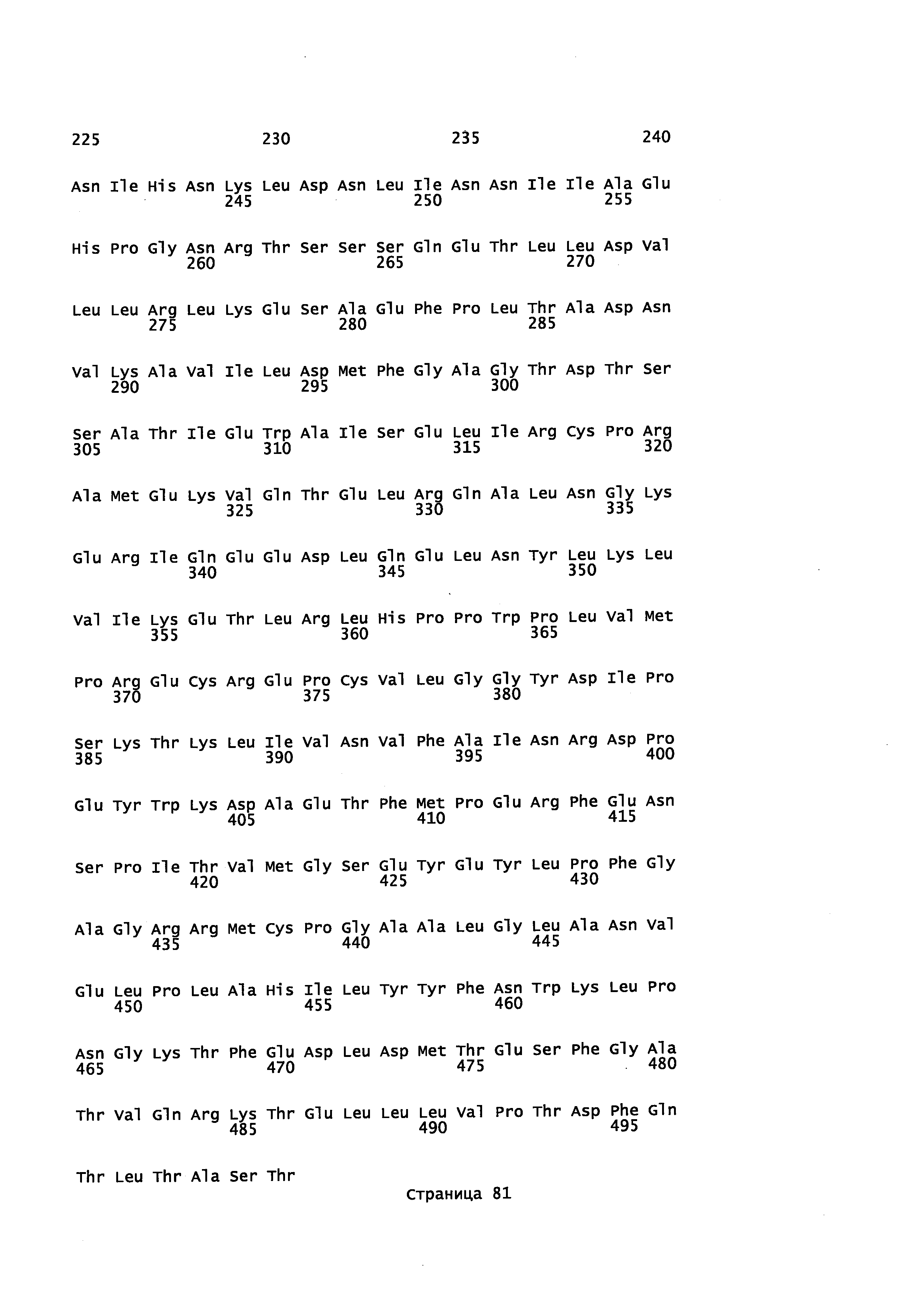

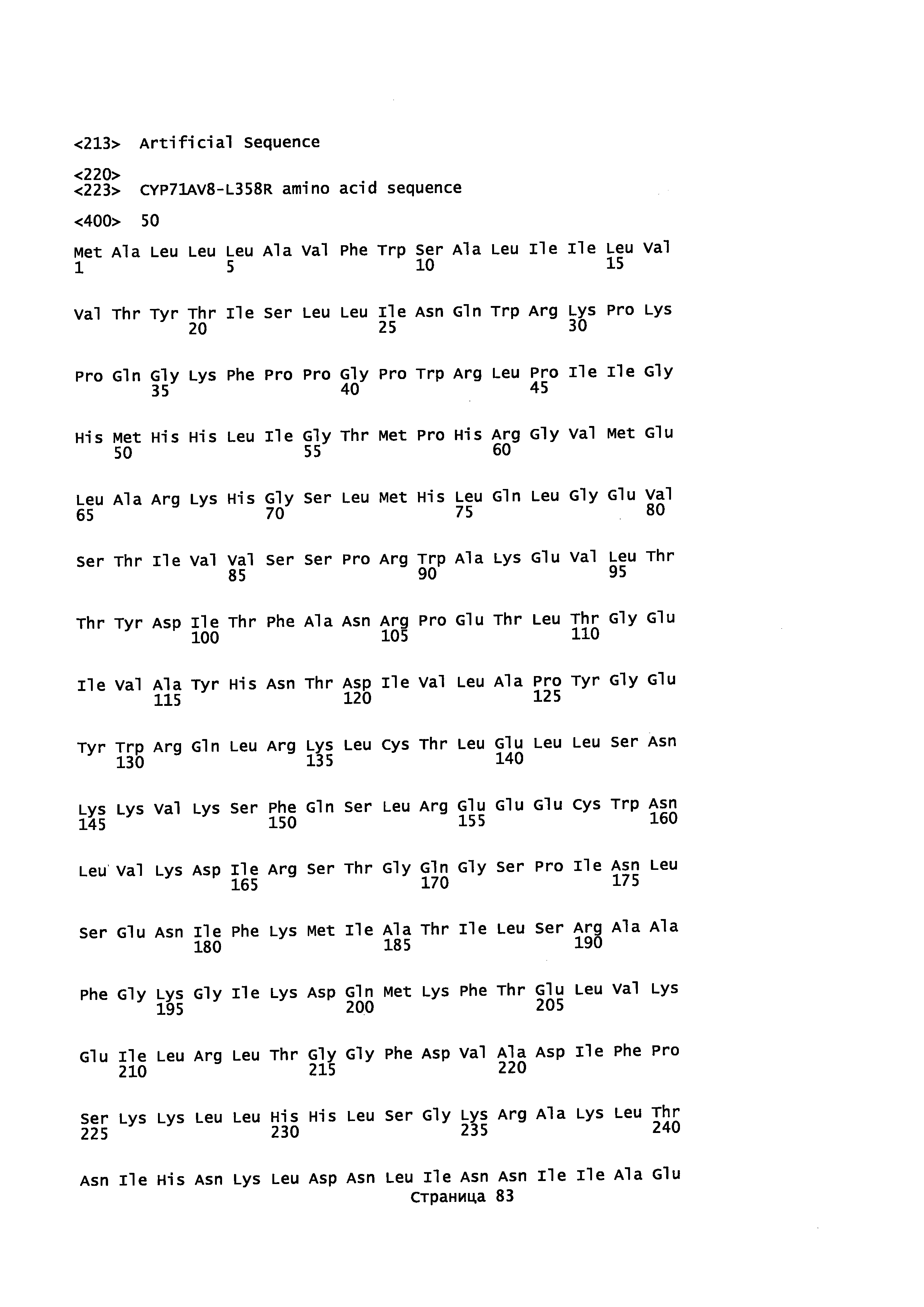





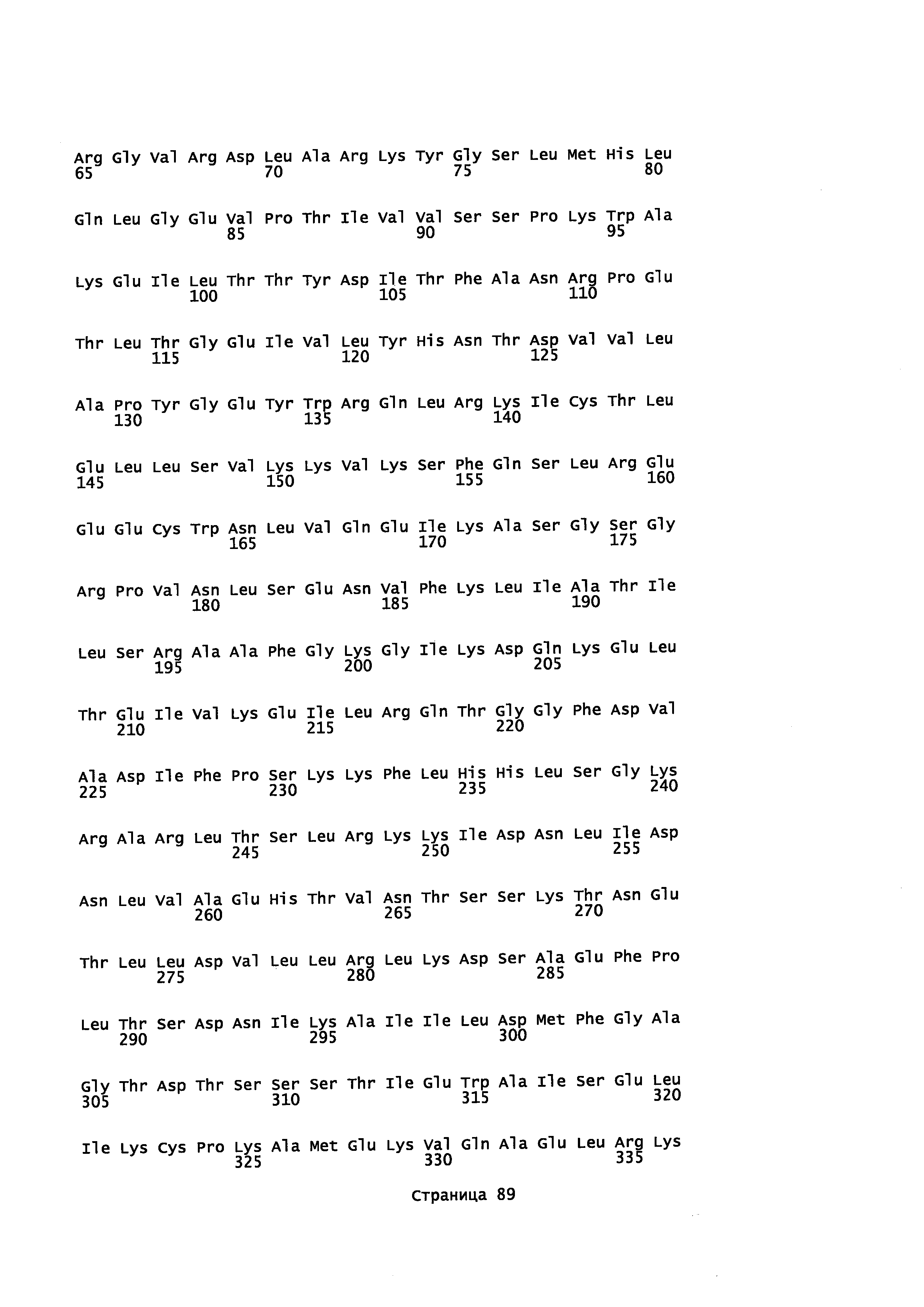


















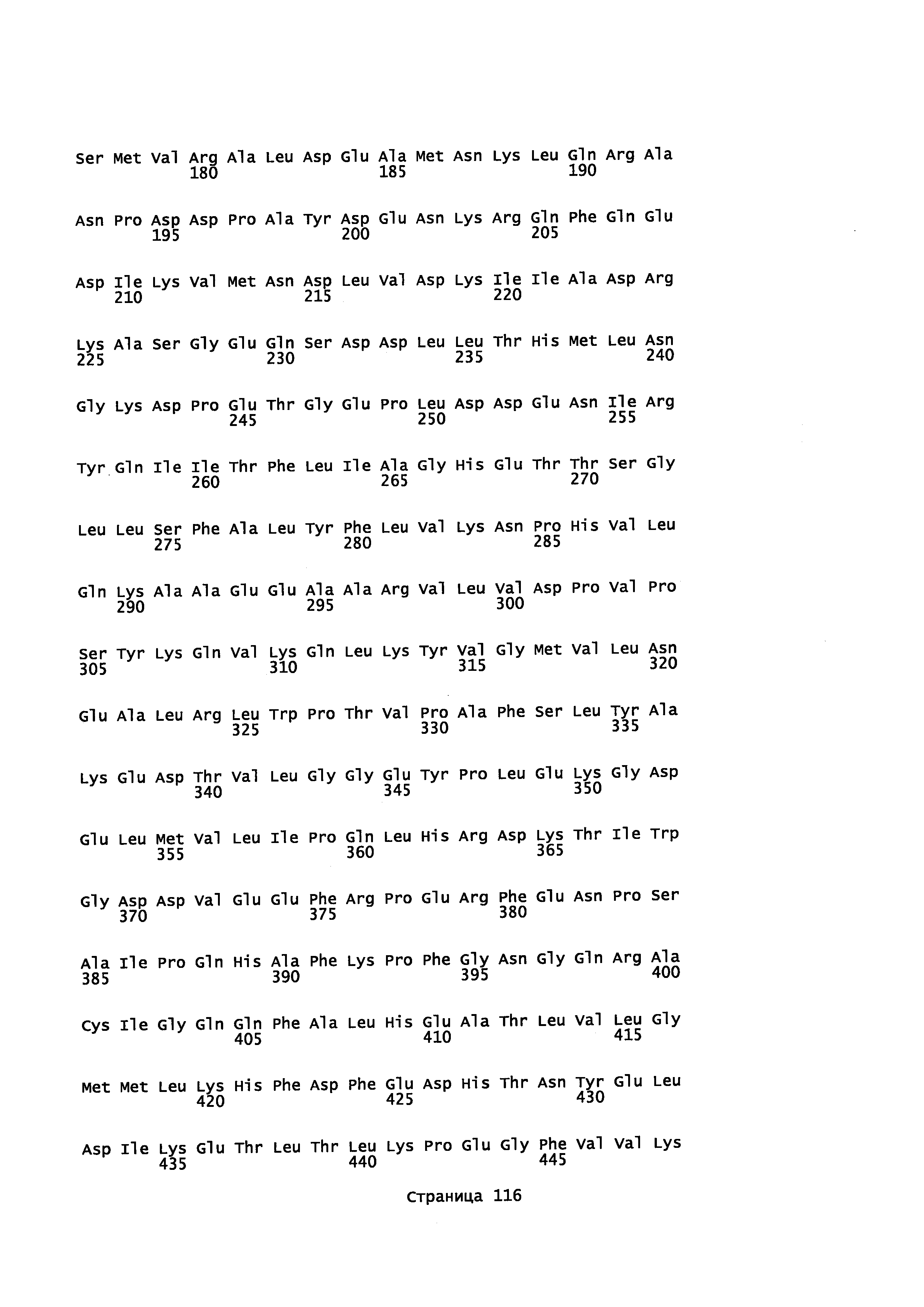
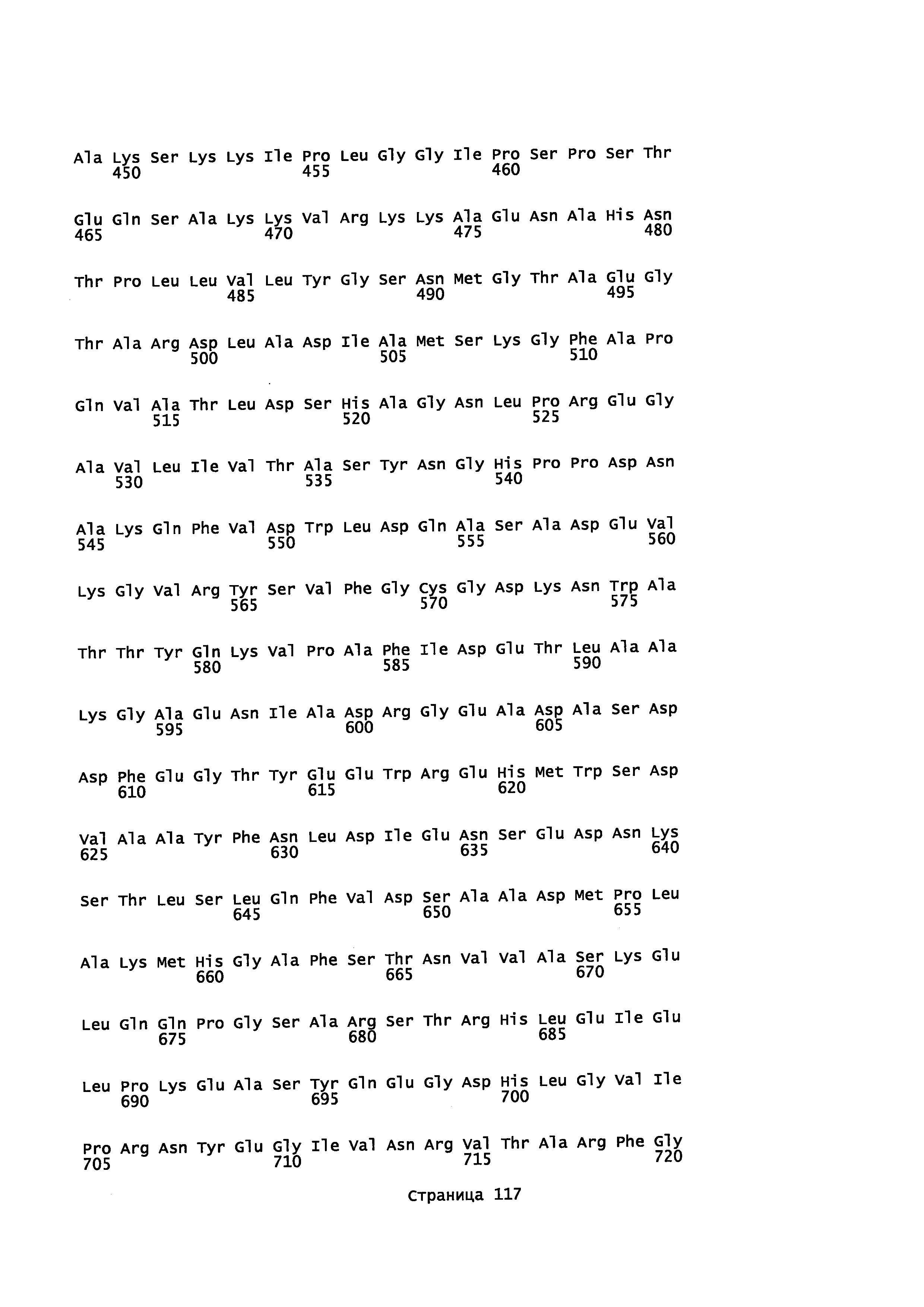



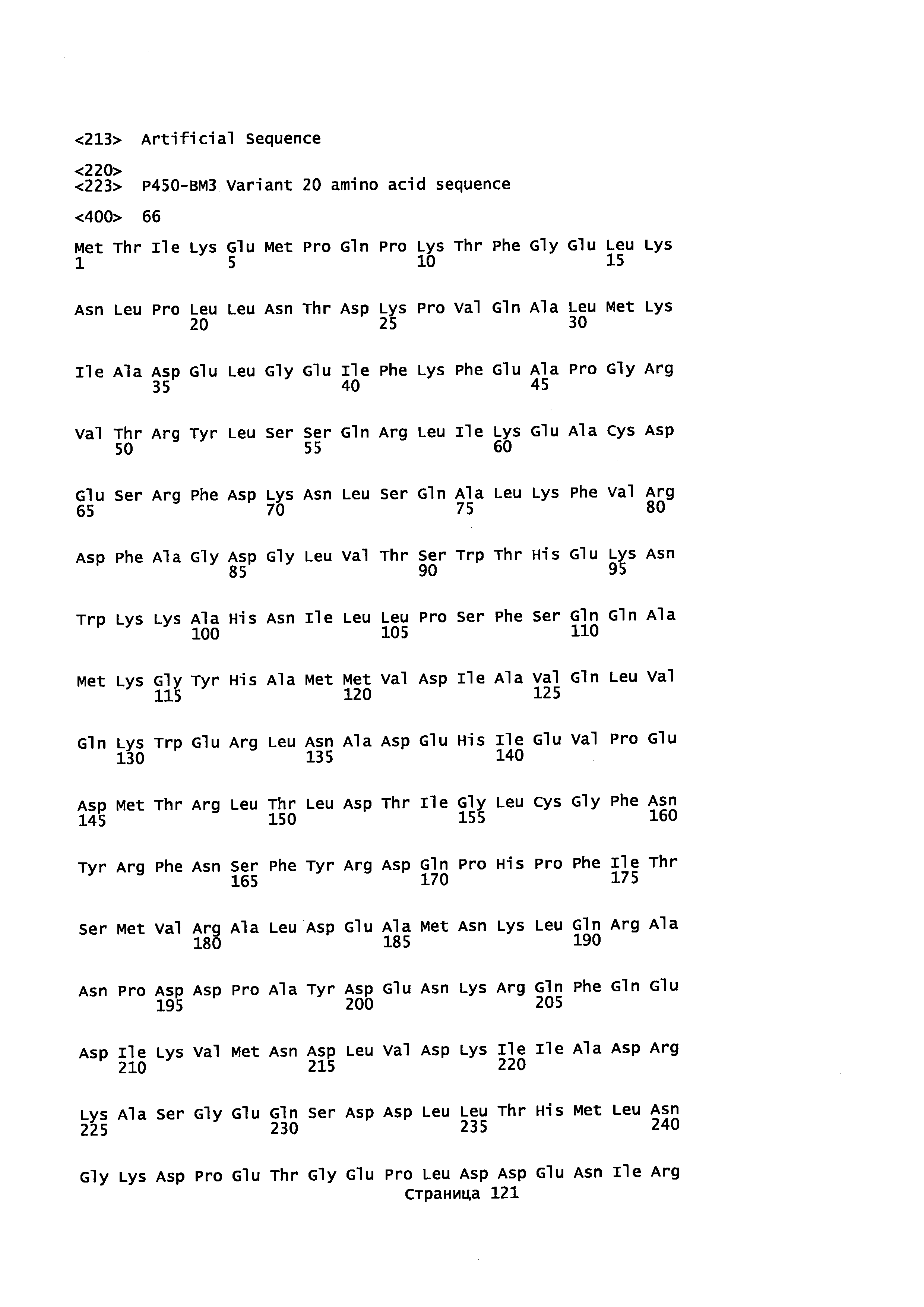
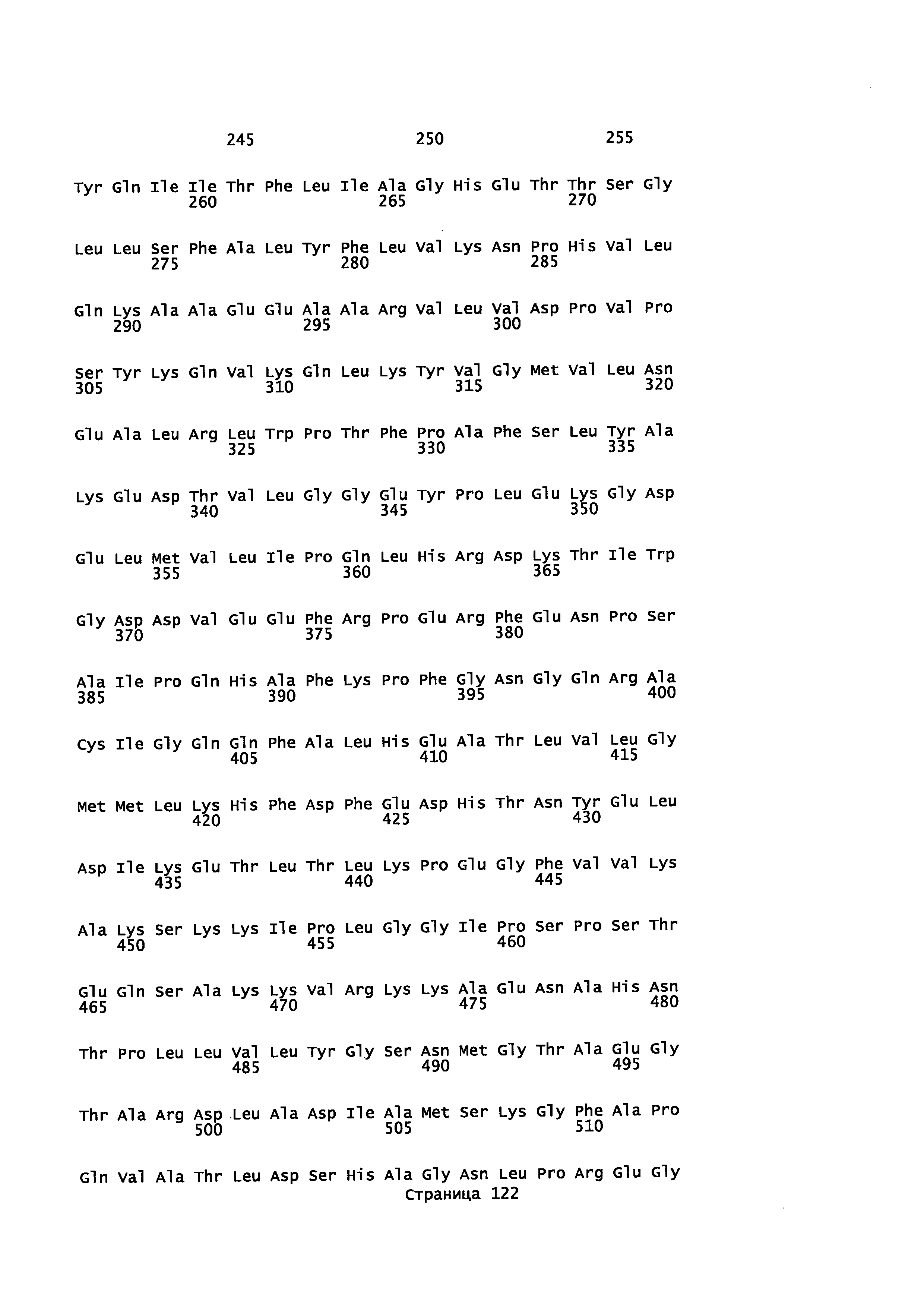






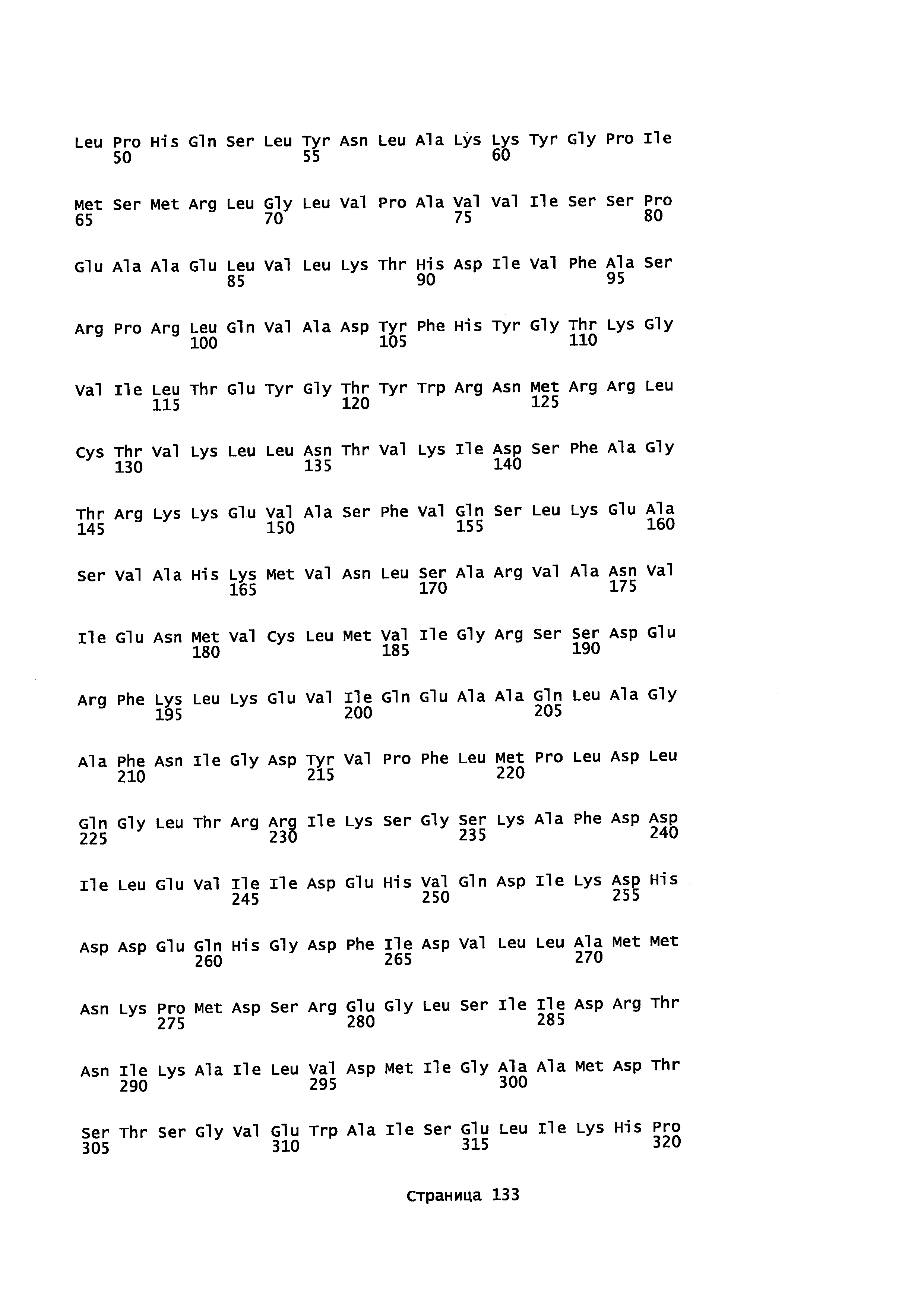


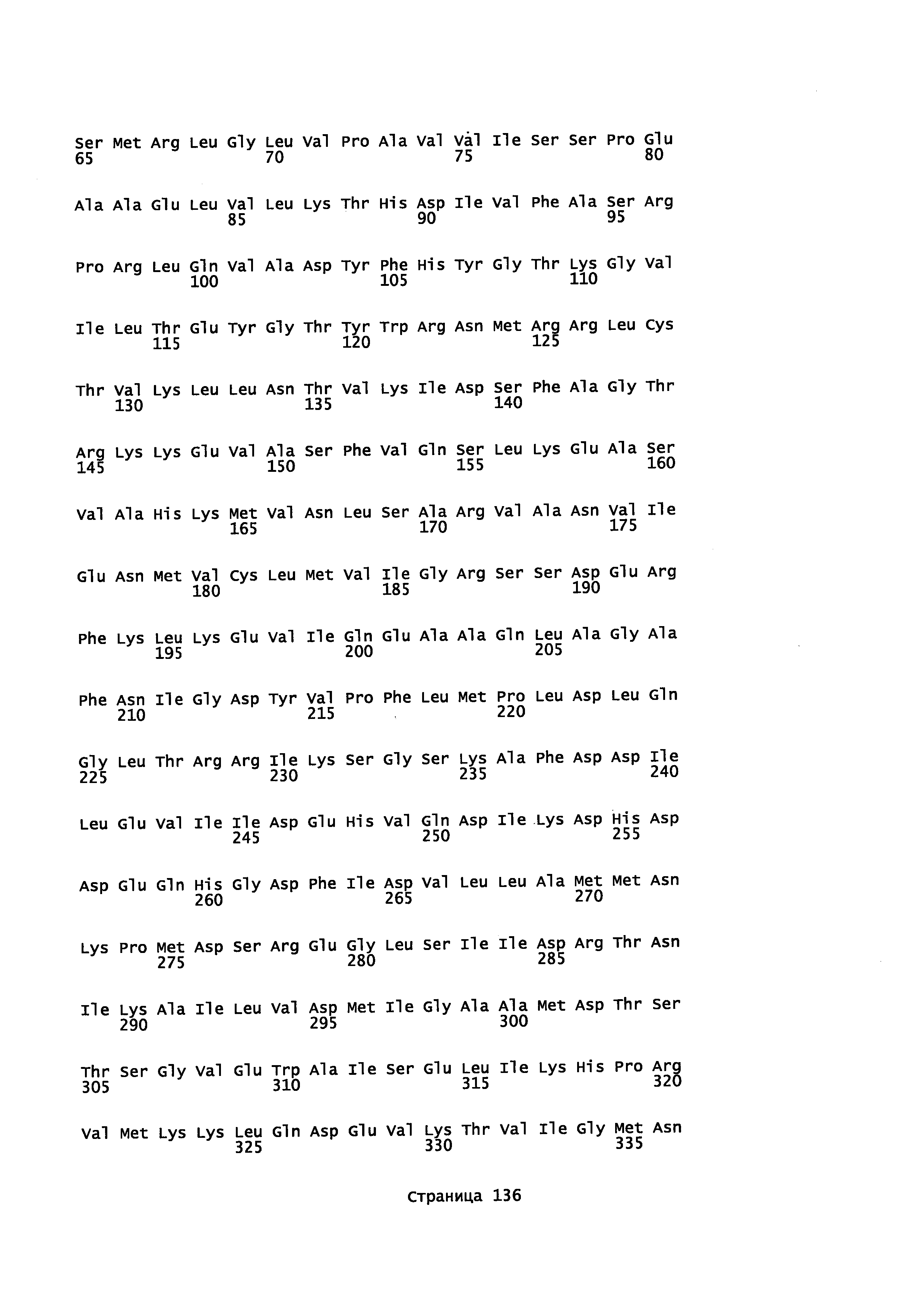














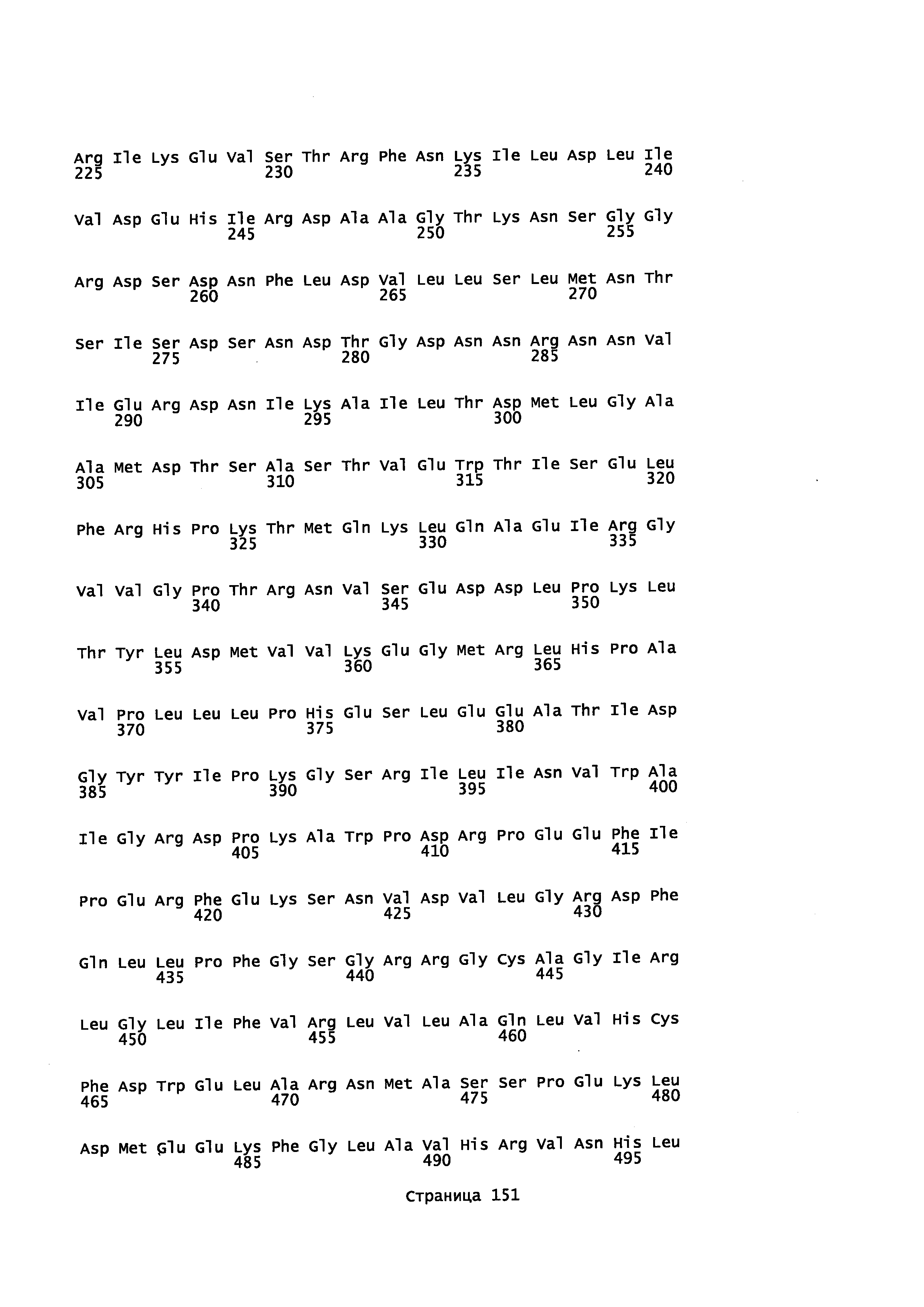


































Описание
Область техники
Область техники имеет отношение к цитохромам Р450 и их использованию для получения сесквитерпеновых спиртов.
Уровень техники
Терпеновые углеводороды, такие как альфа- и бета-санталены, вырабатываются посредством биохимических процессов, например, путем использования генетически модифицированных клеток. Эти терпены и полученный из них спирт являются основными компонентами масла сандалового дерева, при этом спирты являются важными парфюмерными ингредиентами, которые в промышленном масштабе обычно получают посредством дистилляции сердцевинной древесины видов Santalum (например, сандалового дерева). Примеры таких спиртов включают α-синенсол, β-синенсол, α-санталол, β-санталол, α-транс-бергамотол и эпи-β-санталол. Несмотря на то что для получения терпеновых углеводородов разработаны новые биохимические пути, включая созданные методами генетической инженерии клетки, желательно найти дополнительные биохимические пути производства спиртов, получаемых из санталенов. Кроме того, желательным является использование биохимического пути не только для получения таких спиртов, но также дополнительного селективного производства, посредством биохимического пути, цис-изомеров спиртов, таких как изо-α-синенсол, изо-β-синенсол, (Z)-α-санталол, (Z)-β-санталол, (Z)-α-транс-бергамотол и (Z)-эпи-β-санталол.
Цитохромы Р450 представляют семейство ферментов оксидаз. Цитохромы Р450 обычно катализируют реакцию монооксигеназы. Ферменты цитохромы Р450 подразделяются на семейства и подсемейства, исходя из гомологии аминокислотных последовательностей. Члены одного и того же подсемейства имеют идентичность аминокислотной последовательности свыше 55% и обычно обладают сходной ферментативной активностью (селективностью по субстрату и/или продукту). CYP71AV1 (учетный номер NCBI АВВ82944.1, SEQ ID NO 51 и 52) и CYP71AV8 (учетный номер NCBI ADM86719.1, SEQ ID NO 1 и 2) - два члена подсемейства CYP71AV, имеющие идентичность последовательности 78%. Ранее было показано, что CYP71AV1 окисляет аморфадиен (Teoh et al., FEBS letters 580 (2006) 1411-1416). Также ранее показано, что CYP71AV8 окисляет (+)-валенсен, гермакрен А и аморфадиен (Cankar et al., FEBS Lett. 585(1), 178-182 (2011)).
Сообщалось, что в процессах с применением сконструированных клеток используют терпеновые синтазы для катализирования выработки дитерпена или сесквитерпена. Дитерпены или сесквитерпены подвергались дополнительной обработке с использованием цитохром-Р450 полипептида с целью катализировать гидроксилирование, окисление, деметилирование или метилирование дитерпена или сесквитерпена, продуцированного данной клеткой.
Раскрытие изобретения
В описании предоставляется способ получения сесквитерпенового спирта, включающий:
i) контактирование терпена Формулы I:
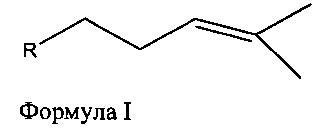
с полипептидом, содержащим аминокислотную последовательность, которая имеет идентичность последовательности не менее или по меньшей мере около 45% с полипептидом, выбранным из группы, состоящей из SEQ ID NO: 2, SEQ ID NO: 4, SEQ ID NO: 6, SEQ ID NO: 8, SEQ ID NO: 28, SEQ ID NO: 30, SEQ ID NO: 32, SEQ ID NO: 34, SEQ ID NO: 36, SEQ ID NO: 38, SEQ ID NO: 40, SEQ ID NO: 42, SEQ ID NO: 44, SEQ ID NO: 50, SEQ ID NO: 52, SEQ ID NO: 54, SEQ ID NO: 58, SEQ ID NO: 60, SEQ ID NO: 62, SEQ ID NO: 64, SEQ ID NO: 66, SEQ ID NO: 68, SEQ ID NO: 71, SEQ ID NO: 73, SEQ ID NO: 79, и SEQ ID NO: 81; и
ii) необязательно выделение спирта, в котором R является насыщенной, мононенасыщенной или полиненасыщенной алифатической группой, состоящей из 9 атомов углерода, и в котором R может представлять собой разветвленную цепь или состоит из одного или более неароматических колец.
Кроме того, в описании предоставляется способ получения сесквитерпена, в том числе α-синенсола, β-синенсола, α-санталола, β-санталола, α-транс-бергамотола, эпи-β-санталола, ланцелола и/или их смесей, включающий:
i) контактирование α-фарнезена, β-фарнезена, α-санталена, β-санталена, α-транс-бергамотена, эпи-β-санталена и/или β-бисаболена с полипептидом, имеющим аминокислотную последовательность, обладающую идентичностью последовательности не менее или по меньшей мере около 45% с полипептидом, выбранным из группы, состоящей из SEQ ID NO: 2, SEQ ID NO: 4, SEQ ID NO: 6, SEQ ID NO: 8, SEQ ID NO: 28, SEQ ID NO: 30, SEQ ID NO: 32, SEQ ID NO: 34, SEQ ID NO: 36, SEQ ID NO: 38, SEQ ID NO: 40, SEQ ID NO: 42, SEQ ID NO: 44, SEQ ID NO: 50, SEQ ID NO: 52, SEQ ID NO: 54, SEQ ID NO: 58, SEQ ID NO: 60, SEQ ID NO: 62, SEQ ID NO: 64, SEQ ID NO: 66, SEQ ID NO: 68, SEQ ID NO: 71, SEQ ID NO: 73, SEQ ID NO: 79 и SEQ ID NO: 81, с целью получения спирта; и
ii) необязательно выделение спирта.
Также предоставляется способ получения α-синенсола, β-синенсола, α-санталола, β-санталола, α-транс-бергамотола, эпи-β-санталола, ланцелола и/или их смесей, включающий контактирование α-фарнезена, β-фарнезена, α-санталена, β-санталена, α-транс-бергамотена и/или эпи-β-санталена с полипептидом, обладающим Р450 монооксигеназной активностью, при этом полученный сесквитерпеновый спирт содержит не менее или по меньшей мере около 36% цис-изомера.
Кроме того, в описании предоставляется изолированный, обладающий монооксигеназной активностью полипептид, содержащий аминокислотную последовательность, которая является идентичной не менее или по меньшей мере примерно на 45%, 50%, 55%, 50%, 65%, 70%, 80%, 90%, 95%, 98% или более с аминокислотной последовательностью, выбранной из группы, состоящей из SEQ ID NO 71 и SEQ ID NO 73.
Кроме того, в описании предоставляется изолированный, обладающий монооксигеназной активностью полипептид, содержащий аминокислотную последовательность, которая является идентичной не менее или по меньшей мере примерно на 45%, 50%, 55%, 50%, 65%, 70%, 80%, 90%, 95%, 98% или более с аминокислотной последовательностью, выбранной из группы, состоящей из SEQ ID NO: 79 и SEQ ID NO: 81.
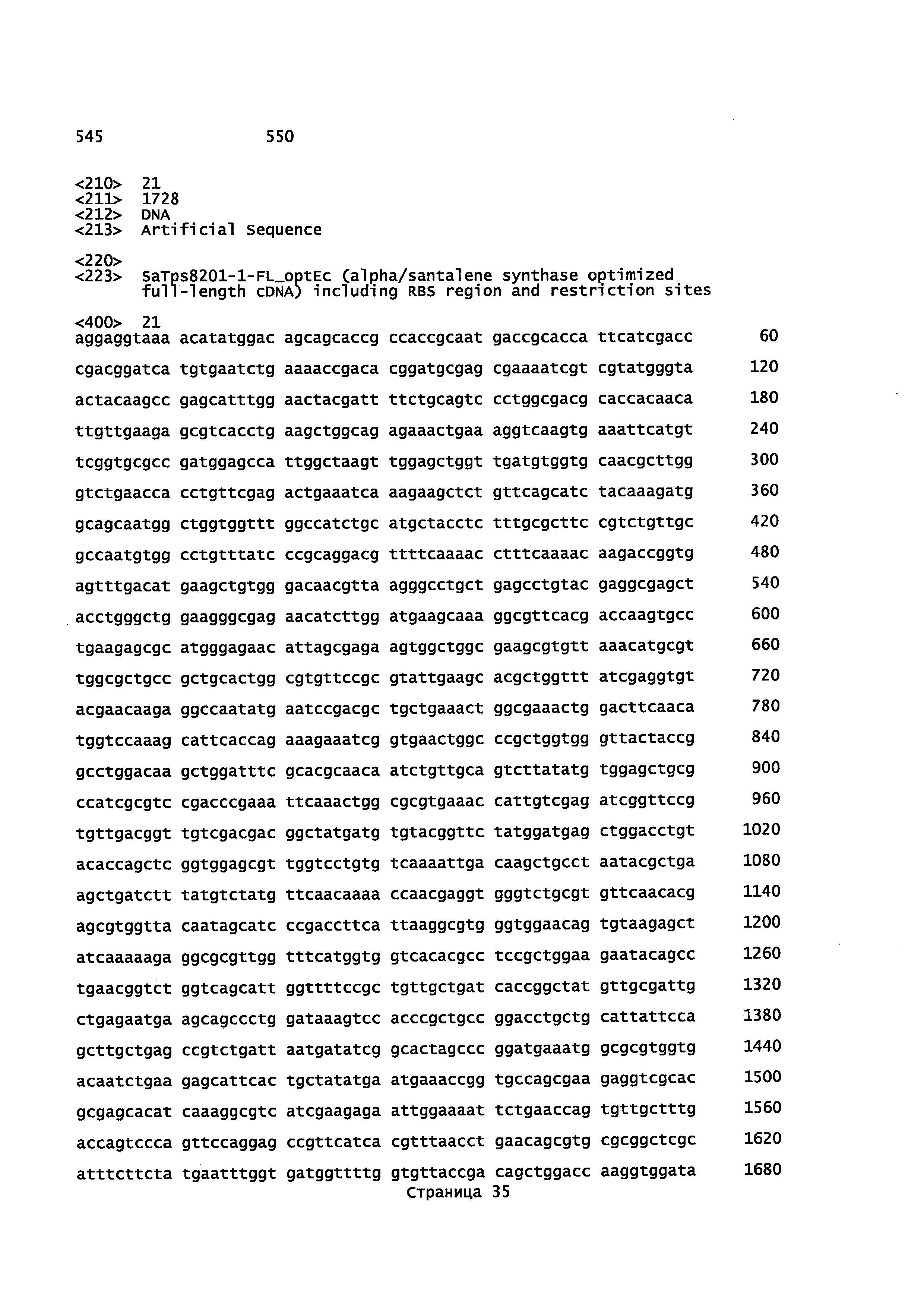
Также в описании предоставляется изолированный, обладающий монооксигеназной активностью, полипептид, содержащий аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: SEQ ID NO: 28, SEQ ID NO: 30, SEQ ID NO: 32, SEQ ID NO: 34, SEQ ID NO: 36, SEQ ID NO: 71, SEQ ID NO: 73 SEQ ID NO: 79 и SEQ ID NO: 81.
Кроме того, в описании предоставляется способ получения сесквитерпенового спирта, выбранного из группы, состоящей из α-синенсола, β-синенсола, α-санталола, β-санталола, α-транс-бергамотола, эпи-β-санталола и ланцелола или их смесей, включающий:
i) культивирование клеток при условиях, подходящих для выработки р450 полипептида, обладающего монооксигеназной активностью, при котором клетка: а) продуцирует пирофосфат, предшественник ациклических терпенов; b) экспрессирует Р450 редуктазу, с) экспрессирует полипептид, который имеет α-фарнезен, β-фарнезен, α-сантален, β-сантален, α-транс-бергамотен и/или эпи-β-сантален синтазную активность и продуцирует α-фарнезен, β-фарнезен, α-сантален, β-сантален, α-транс-бергамотен и/или эпи-β-сантален и d) экспрессирует полипептид с аминокислотной последовательностью, имеющей идентичность последовательности не менее или по меньшей мере около 45% с полипептидом, выбранным из группы, состоящей из SEQ ID NO: 2, SEQ ID NO: 4, SEQ ID NO: 6, SEQ ID NO: 8, SEQ ID NO: 28, SEQ ID NO: 30, SEQ ID NO: 32, SEQ ID NO: 34, SEQ ID NO: 36, SEQ ID NO: 38, SEQ ID NO: 40, SEQ ID NO: 42, SEQ ID NO: 44, SEQ ID NO: 50, SEQ ID NO: 52, SEQ ID NO: 54, SEQ ID NO: 58, SEQ ID NO: 60, SEQ ID NO: 62, SEQ ID NO: 64, SEQ ID NO: 66, SEQ ID NO: 68, SEQ ID NO: 71, SEQ ID NO: 73 SEQ ID NO: 79 и SEQ ID NO: 81; и
ii) необязательно выделение спирта из клетки.
Подробное описание чертежей
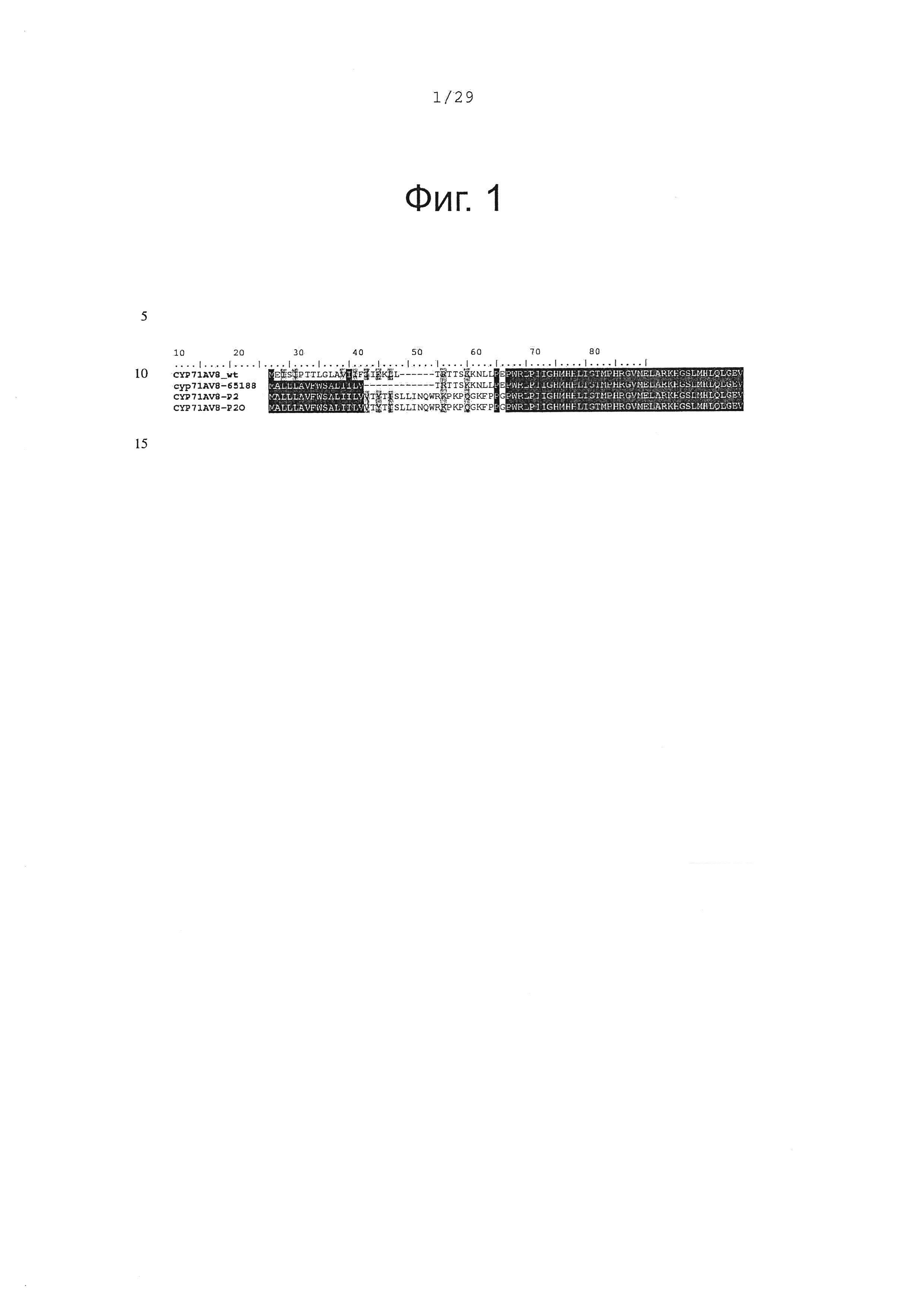
Фигура 1. Выравнивание аминокислотной последовательности N-концевого участка различных вариантов CYP71AV8.
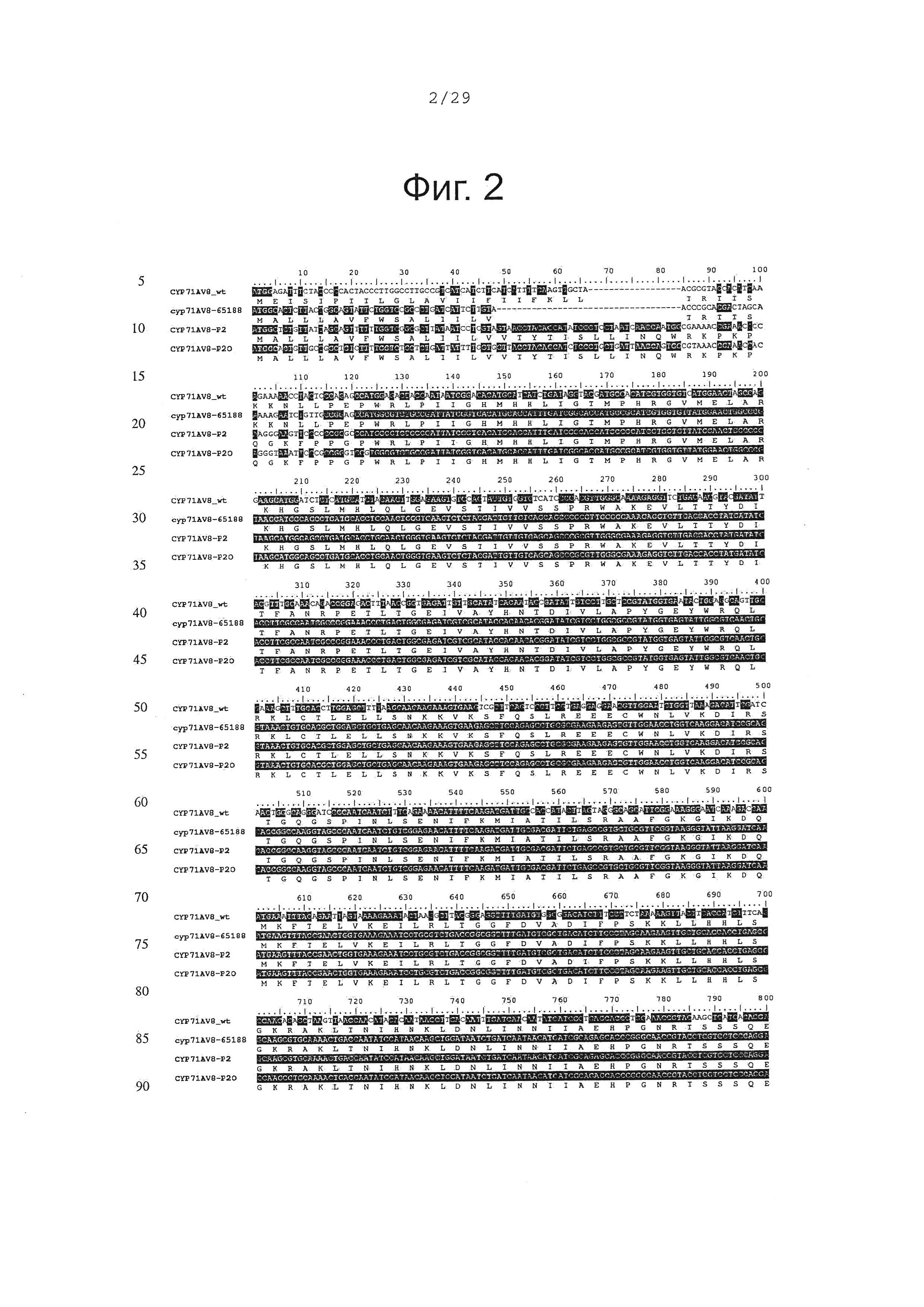
Фигура 2. Выравнивание последовательностей ДНК различных вариантов CYP71AV8. Закодированные аминокислотные последовательности показаны ниже каждой последовательности с помощью однобуквенного кода.
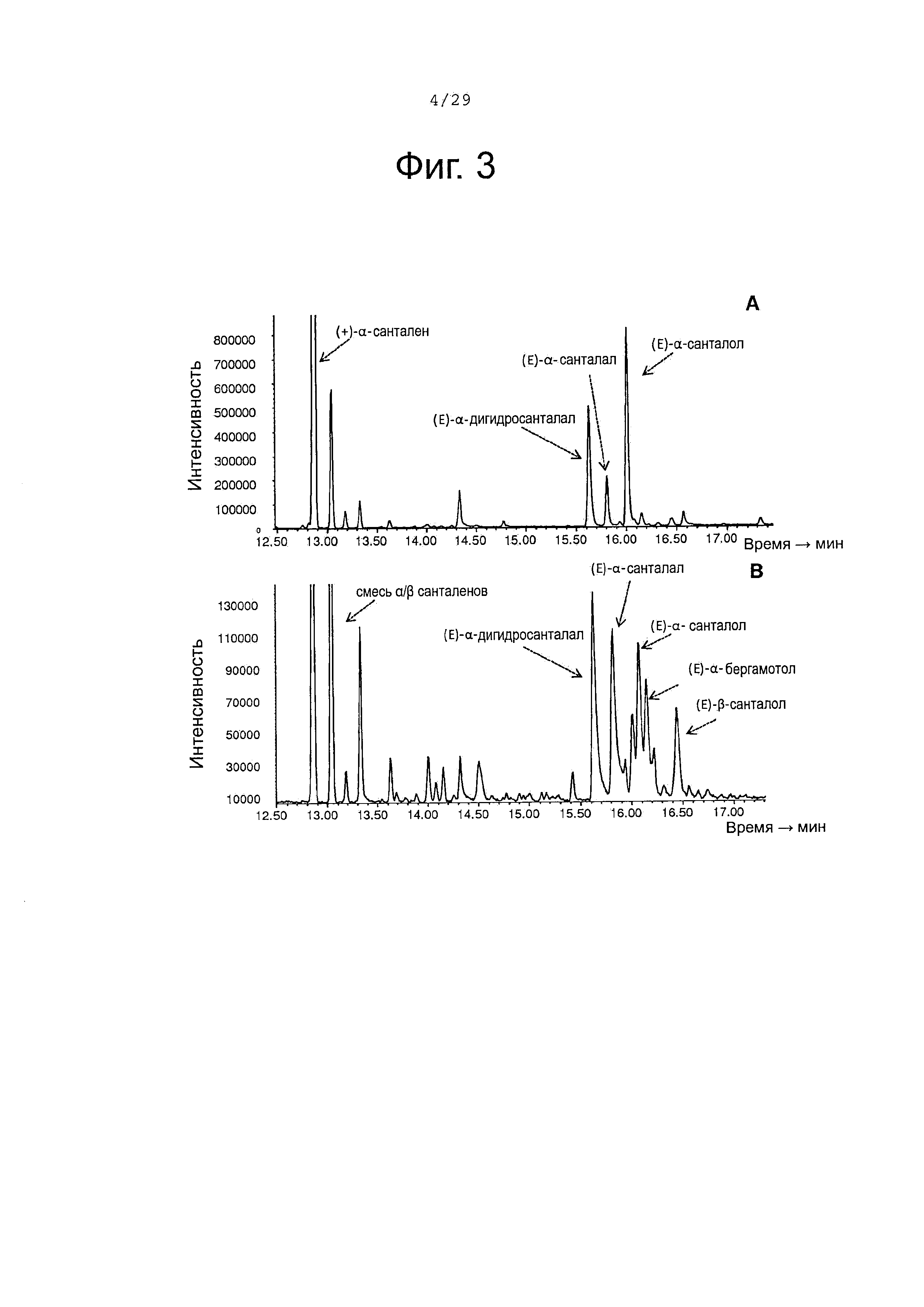
Фигура 3. GCMS-анализ (газовая хроматография и масс-спектроскопия) преобразования сесквитерпенов клетками Е. Coli, экспрессирующими белки CYP71AV8 и CPRm. А, биопреобразование (+)-альфа-санталена. В, биопреобразование смеси (+)-альфа-санталена/(-)-бета-сантален.
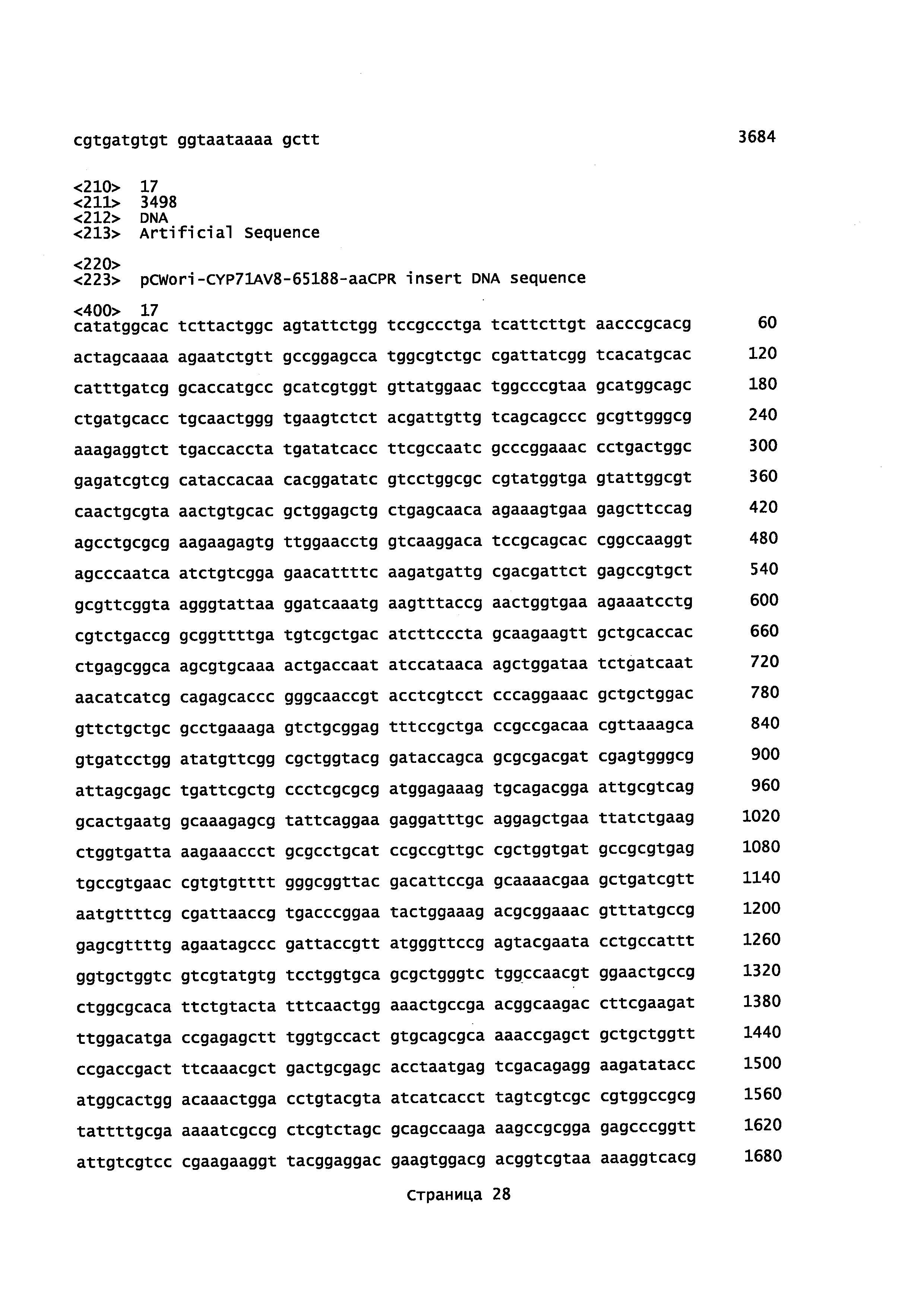
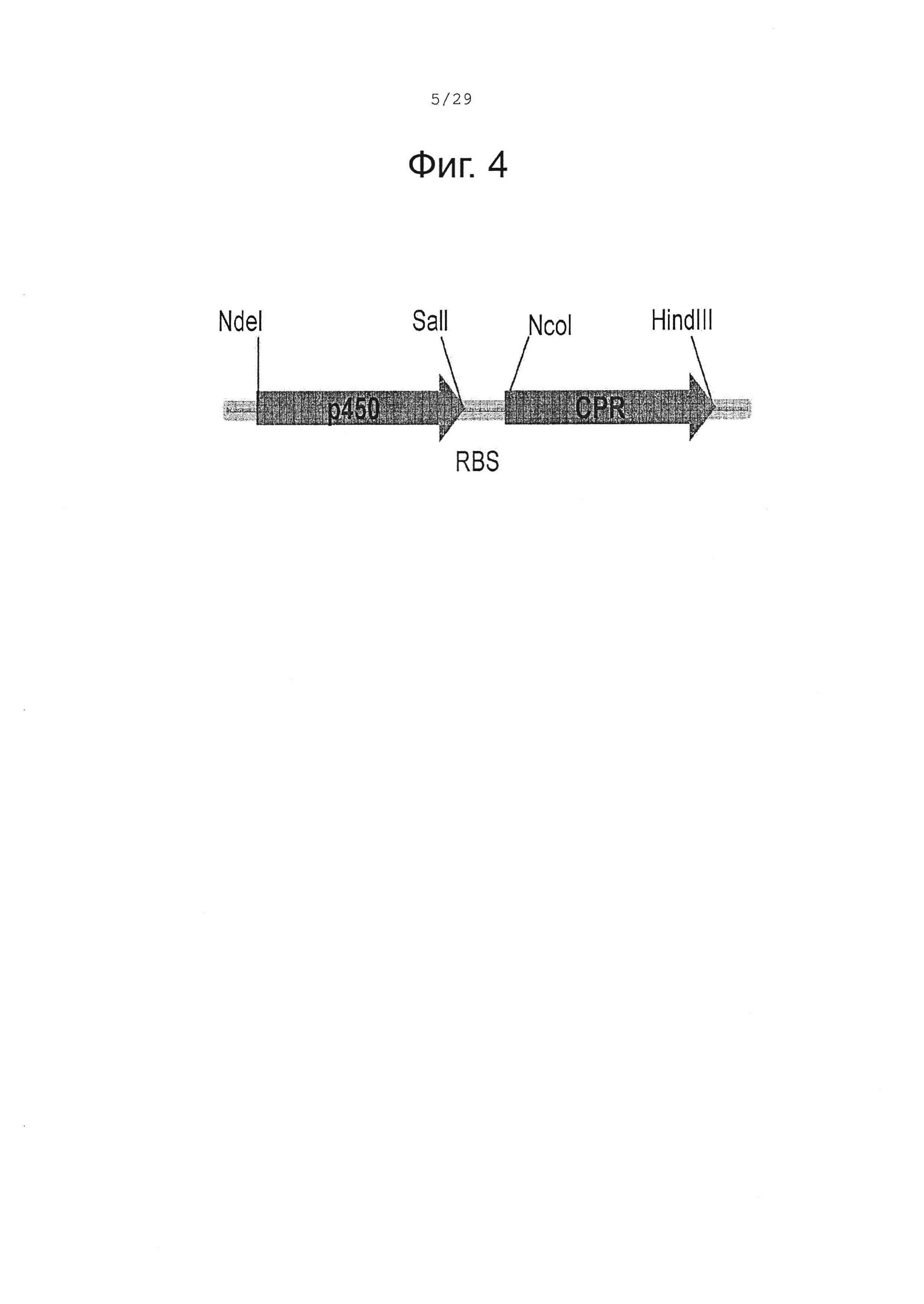
Фигура 4. Организация искусственного бицистронного оперона, содержащего кДНК Р450 и CPR.
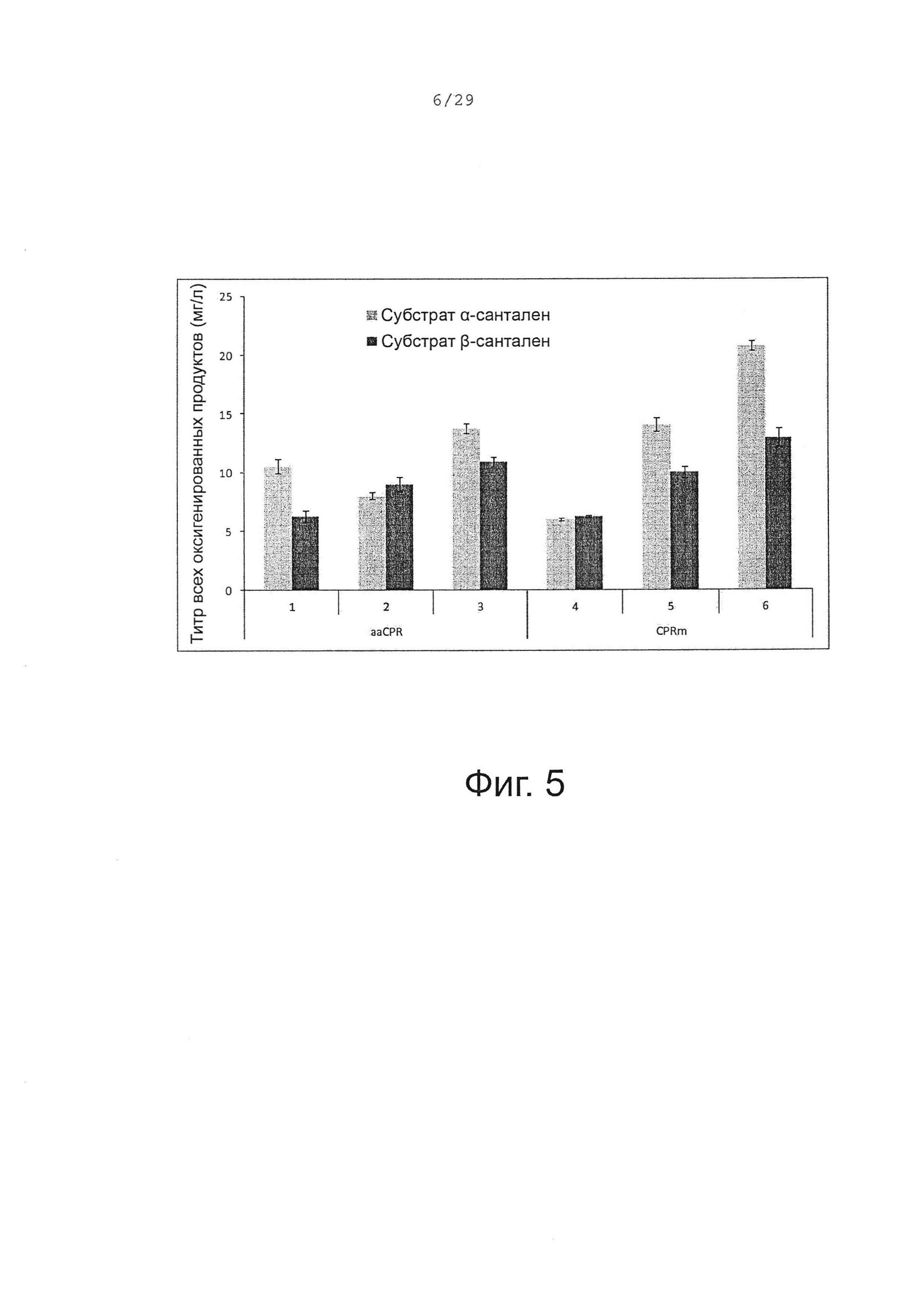
Фигура 5. Сравнение биопреобразования (+)-α-санталена и смеси α/β-санталена клетками Е. coli, трансформированными различными бицистронными оперонами, состоящими из Р450 и CPR кДНК. 1, CYP71AV8-65188 и aaCPR. 2, CYP71AV8-P2 и aaCPR. 3, CYP71AV8-P2O и aaCPR. 4, CYP71AV8-65188 и CPRm. 5, CYP71AV8-P2 и CPRm. 6, CYP71AV8-P2O и CPRm.
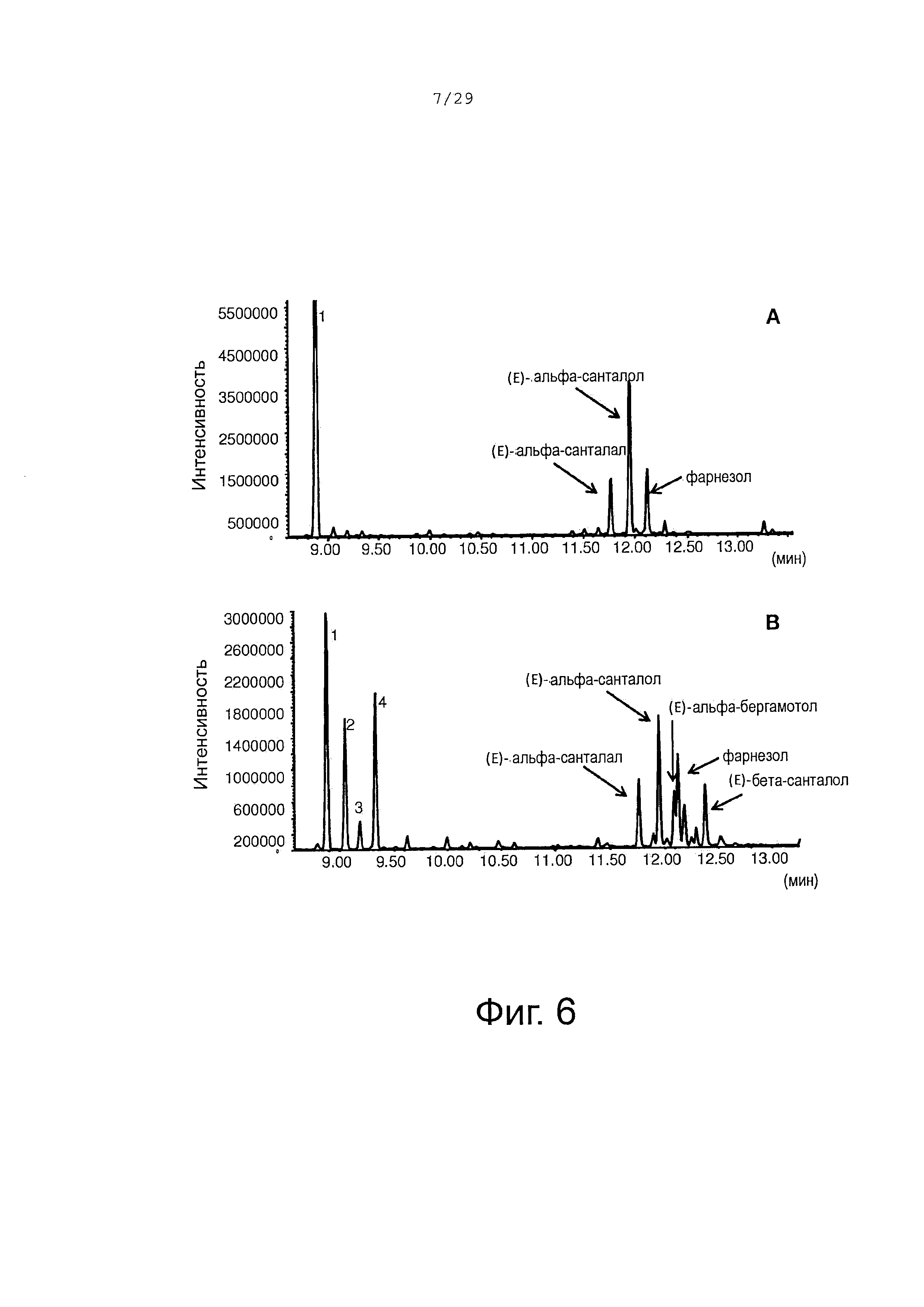
Фигура 6. GCMS-анализ сесквитерпеновых молекул, продуцируемых клетками Е. Coli, экспрессирующими CYP71AV8, CPRm, альфа-сантален синтазу (А) или альфа-сантален/бета-сантален синтазу (В) и ферменты мевалонатного пути. 1, (+)-α-сантален; 2 (-)-α-транс-бергамотен; 3, (+,)-эпи-β-сантален; 4, (-)-β-сантален.
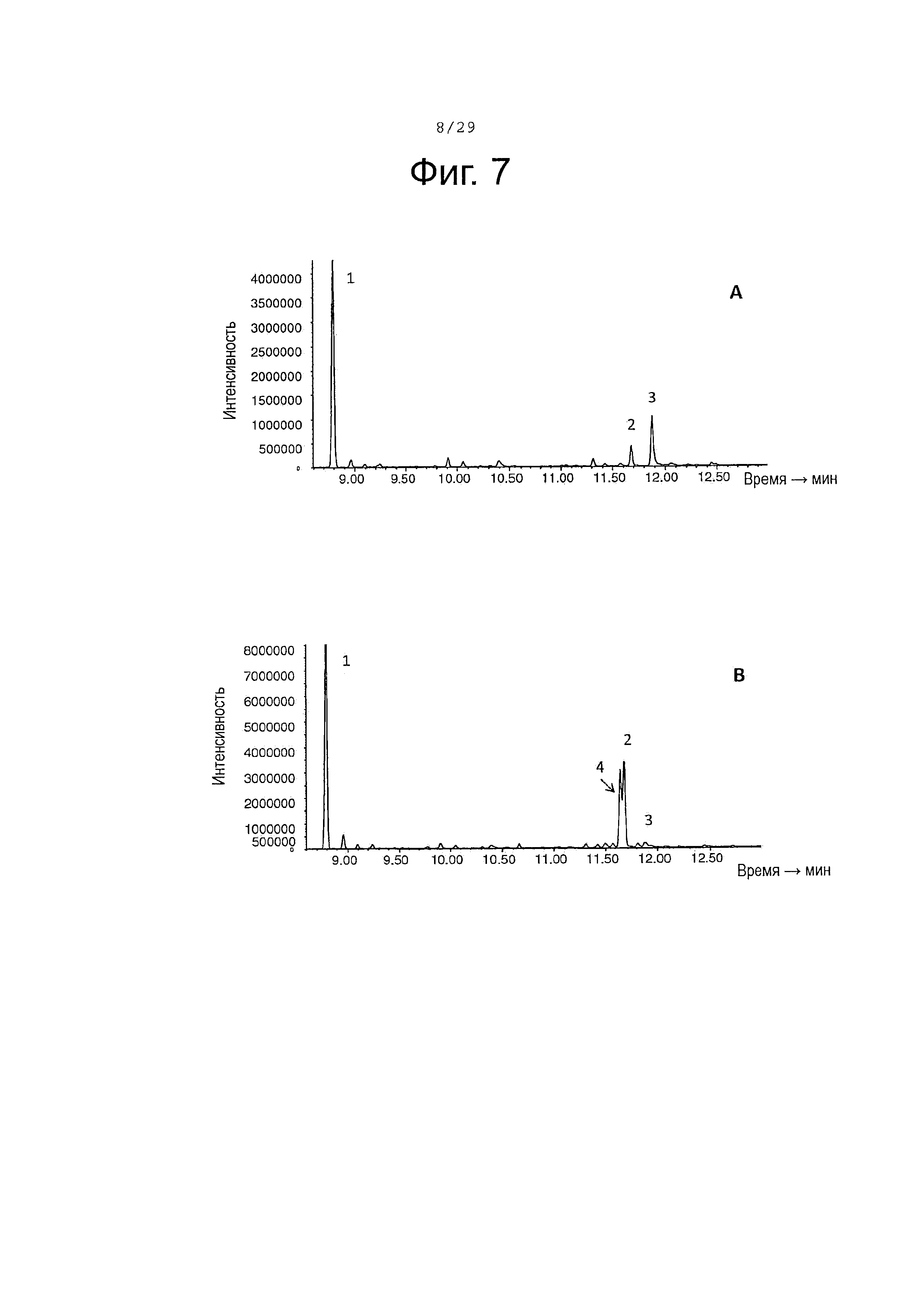
Фигура 7. Окисление (+)-α-санталена CYP71AV8 дикого типа (А) и мутантными L-358 (В). GC-MS профили сесквитерпеновых продуктов, продуцированных клетками Е. Coli KRX, экспрессирующими CPRm, ClASS, ферменты мевалонатного пути и CYP71AV8 (А) или CYP71AV8-L358F (В). Культивирование проводилось в среде ТВ, содержащей 3% глицерина в качестве источника углерода. Различные продукты были идентифицированы как α-сантален (1), (E)-α-санталал (2), (Z)-α-санталол (4) и (E)-α-санталол (3).
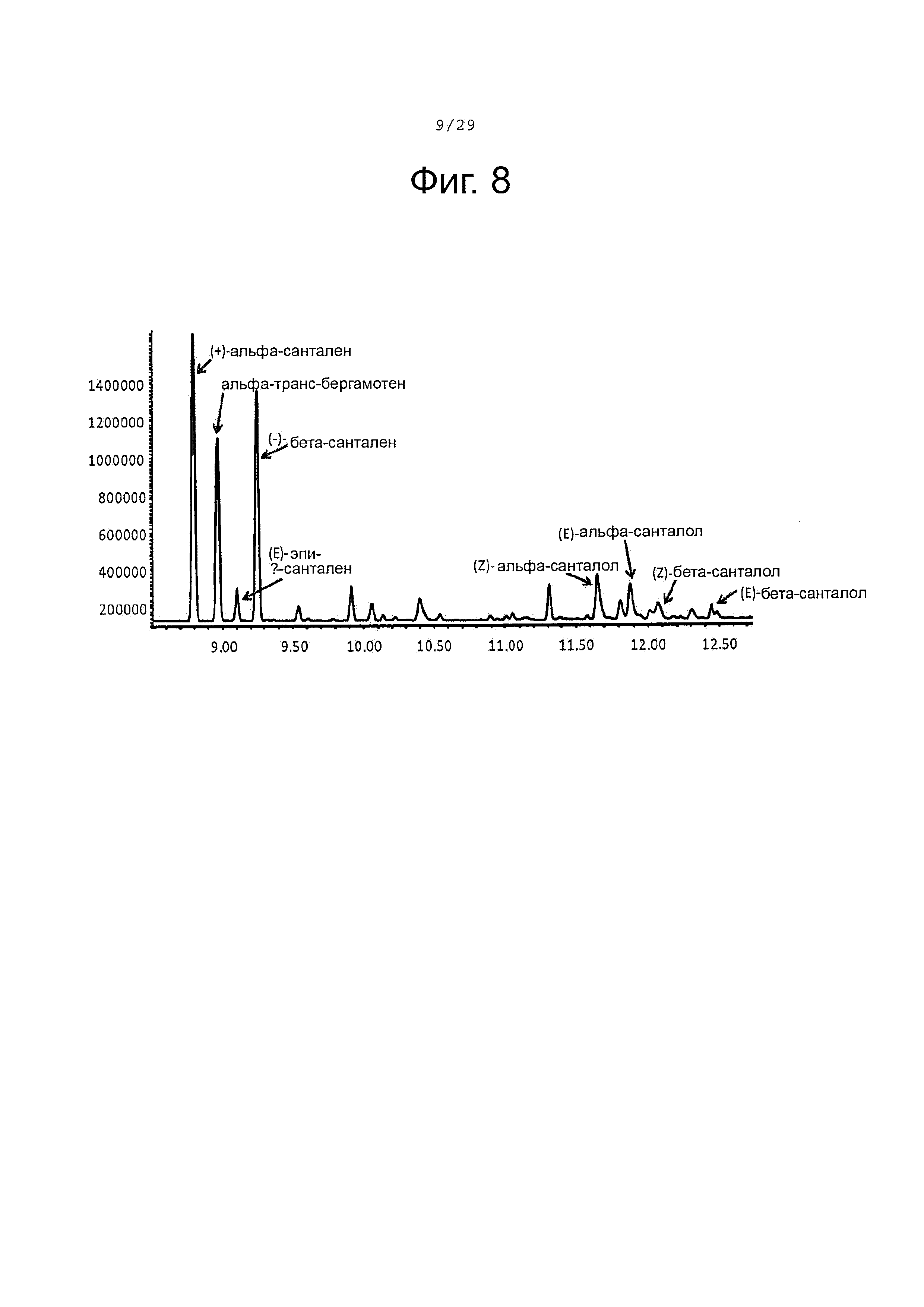
Фигура 8. GC-MS-профили сесквитерпеновых продуктов, продуцированных клетками Е. Coli KRX, экспрессирующими CPRm, SaSAS, ферменты мевалонатного пути и CYP71AV8-L358F. Культивирование проводилось в среде ТВ, содержащей 3% глицерина в качестве источника углерода. Различные продукты были идентифицированы с помощью масс-спектрального анализа.
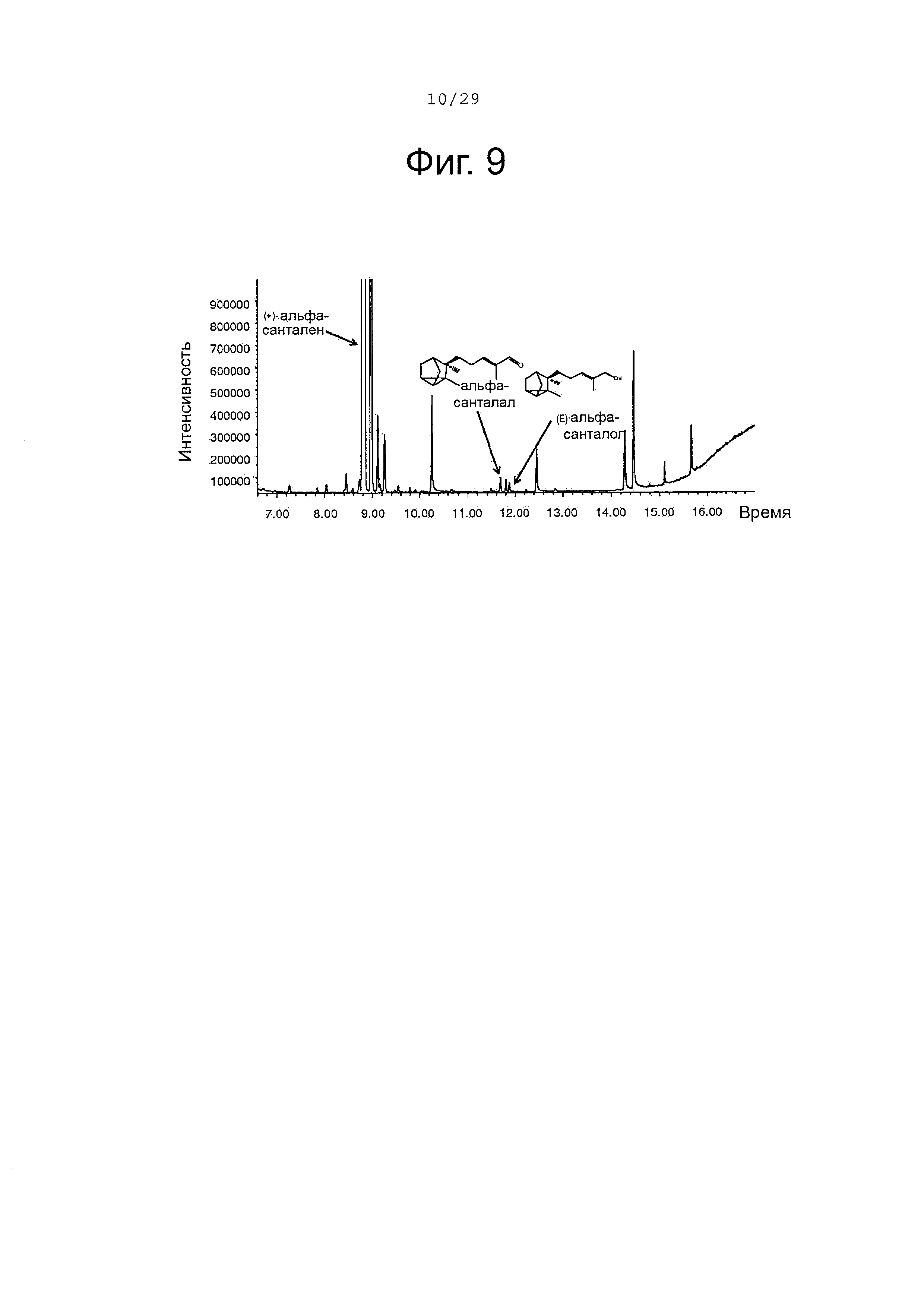
Фигура 9. GCMS-анализ преобразования (+)-α-санталена клетками Е. Coli, экспрессирующими белки CYP71AV1 и CPRm.
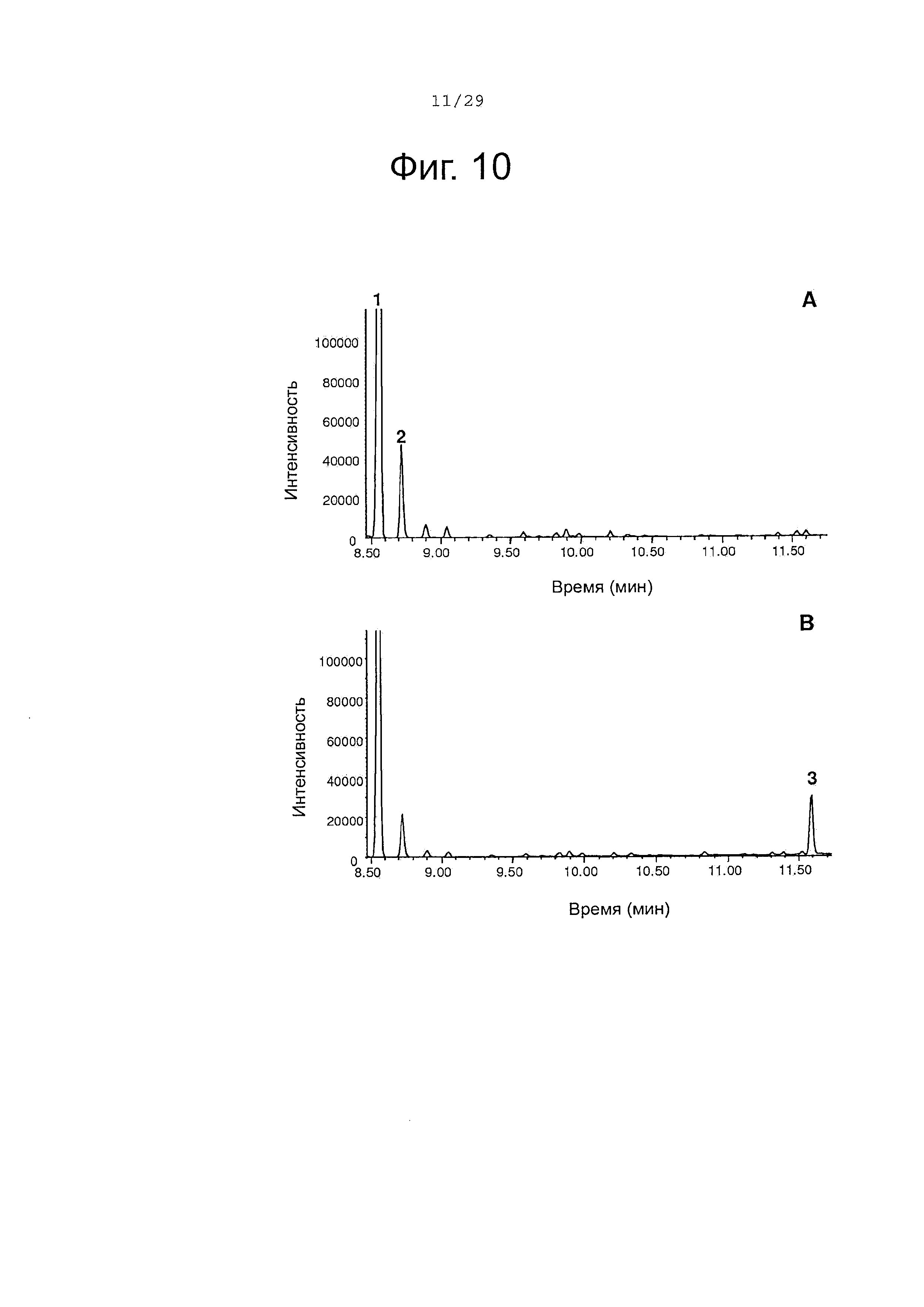
Фигура 10. GC-анализ in vivo преобразования (+)-α-санталена в (Z)-α-санталол двойным мутантом Р450-ВМ3 (вариант #17). Экстракты растворителем культур рекомбинантных клеток Е. coli, ко-экспрессирующих Clausena lansium α-сантален синтазу и либо Р450-ВМ3 дикого типа (А) либо Р450-ВМ3 вариант #17 (В), были исследованы, как описано в примере 11. 1, (+)-α-сантален; 2, (-)-α-транс-бергамотен; 3, (Z)-α-санталол; Хроматограммы показаны в режиме селективного детектирования ионов (M/Z 93).
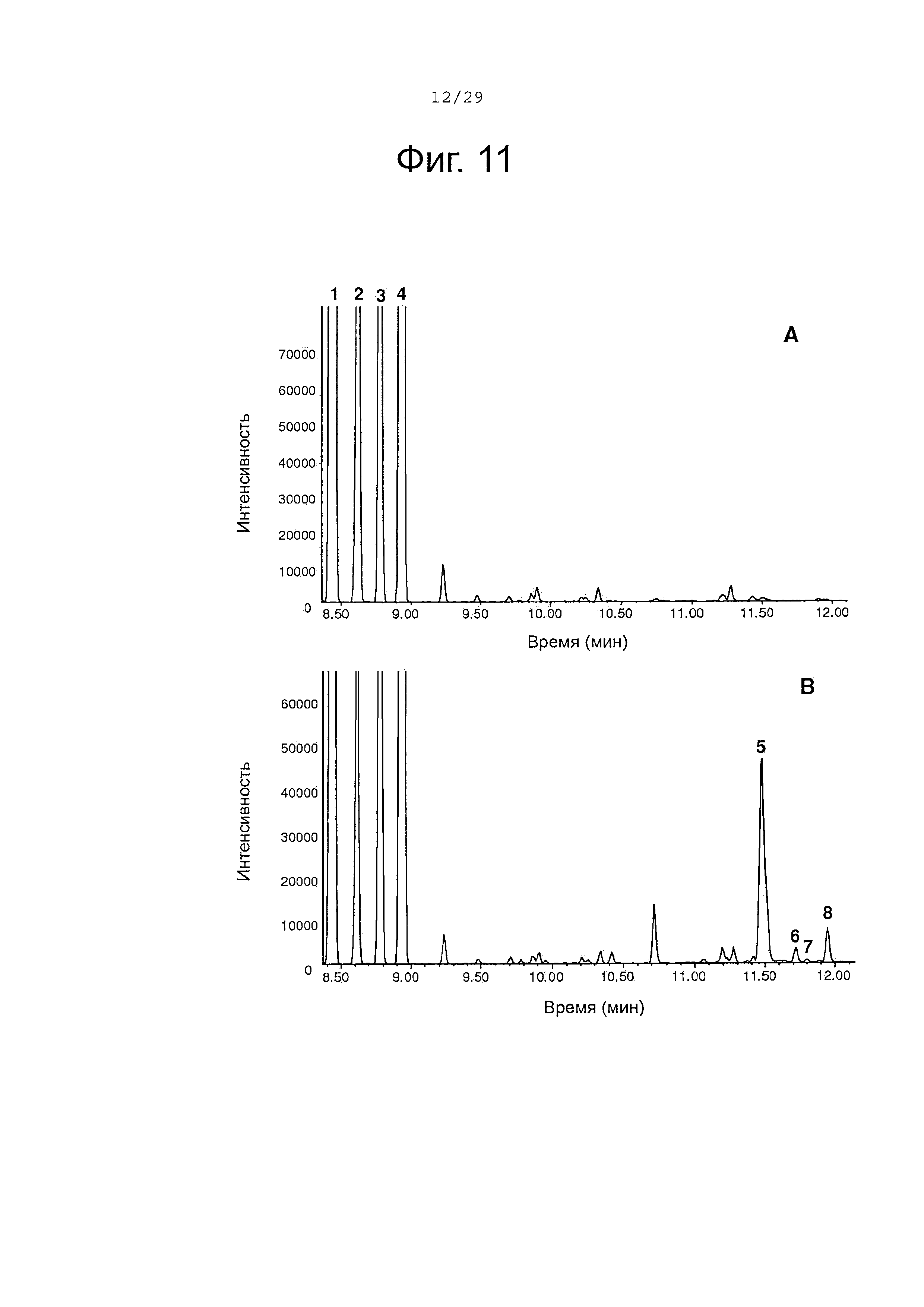
Фигура 11. GC-анализ in vivo преобразования (+)-α-санталена, (-)-β-санталена, (-)-α-транс-бергамотена и (+)-эпи-β-санталена двойным мутантом Р450-ВМ3. Экстракты растворителем культур рекомбинантных клеток Е. coli, ко-экспрессирующих альфа-сантален/бета-сантален синтазу, из Santalum album и либо Р450-ВМ3 дикого типа (А) или Р450-ВМ3 варианта #17 (В) были исследованы, как описано в примере 11. 1, (+)-α-сантален; 2, (-)-α-транс-бергамотен; 3, (+)-эпи-β-сантален; 4, (-)-β-сантален; 5, (Z)-α-санталол; 6, (Z)-α-транс-бергамотол; 7, (Z)-эпи-β-санталол; 8, (Z)-β-санталол. Хроматограммы представлены в режиме селективного детектирования ионов (M/Z 93).
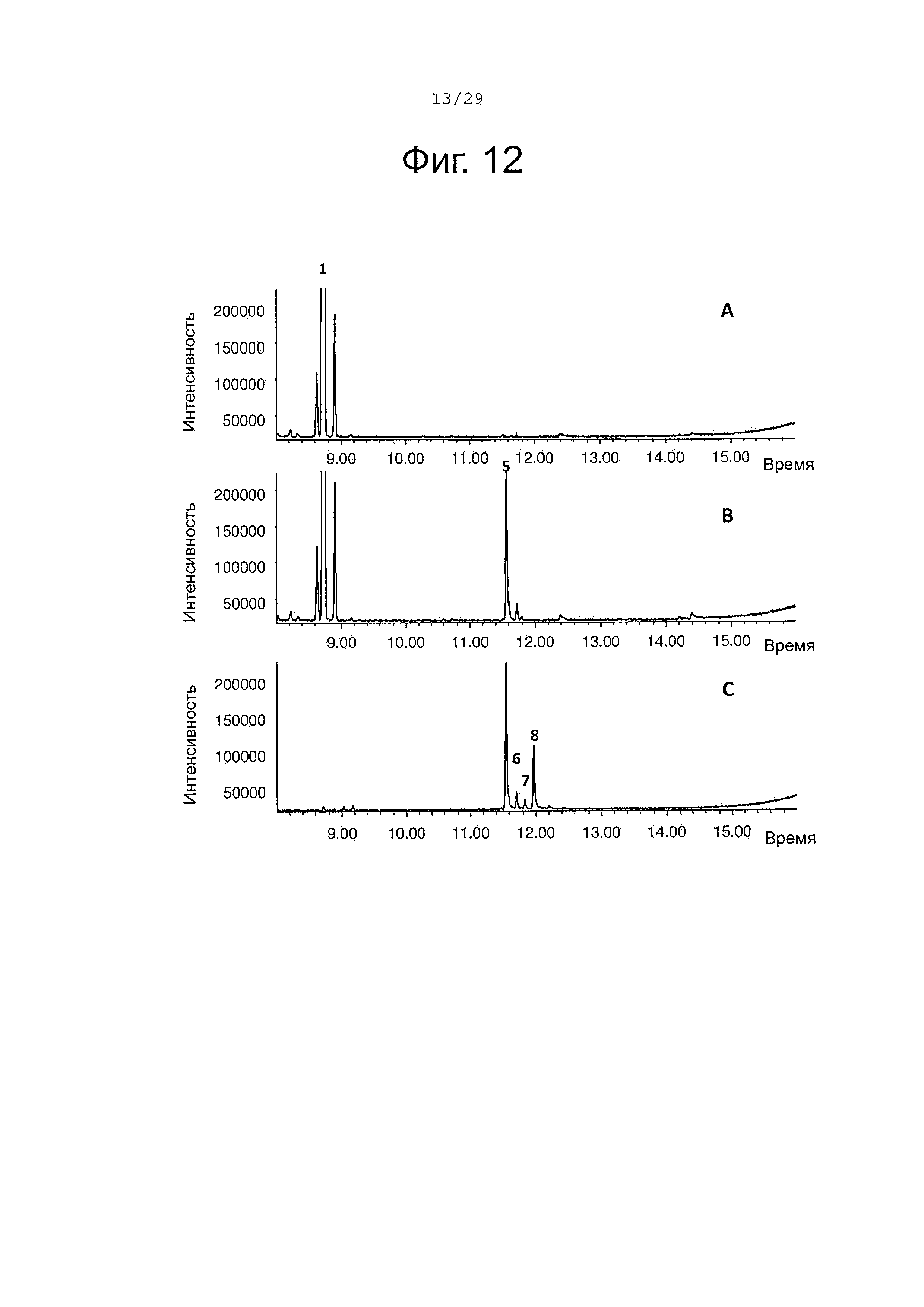
Фигура 12. GCMS-анализ преобразования (+)-α-санталена рекомбинантным ферментом SaCP816. А. Контроль без рекомбинантного Р450 фермента. В. Анализ экстракта неочищенного белка Е. coli, содержащего рекомбинантный белок SaCP816. С. Масло сандалового дерева для сравнения времени удерживания. Все исследования были проведены in vitro, как описано в примере 4. 1, (+)-α-сантален; 5, (Z)-α-санталол; 6, (Z)-α-транс-бергамотол; 7, (Z)-эпи-β-санталол; 8, (Z)-β-санталол. Идентичность сесквитерпеновых молекул была подтверждена совпадением масс-спектров с аутентичными стандартами.
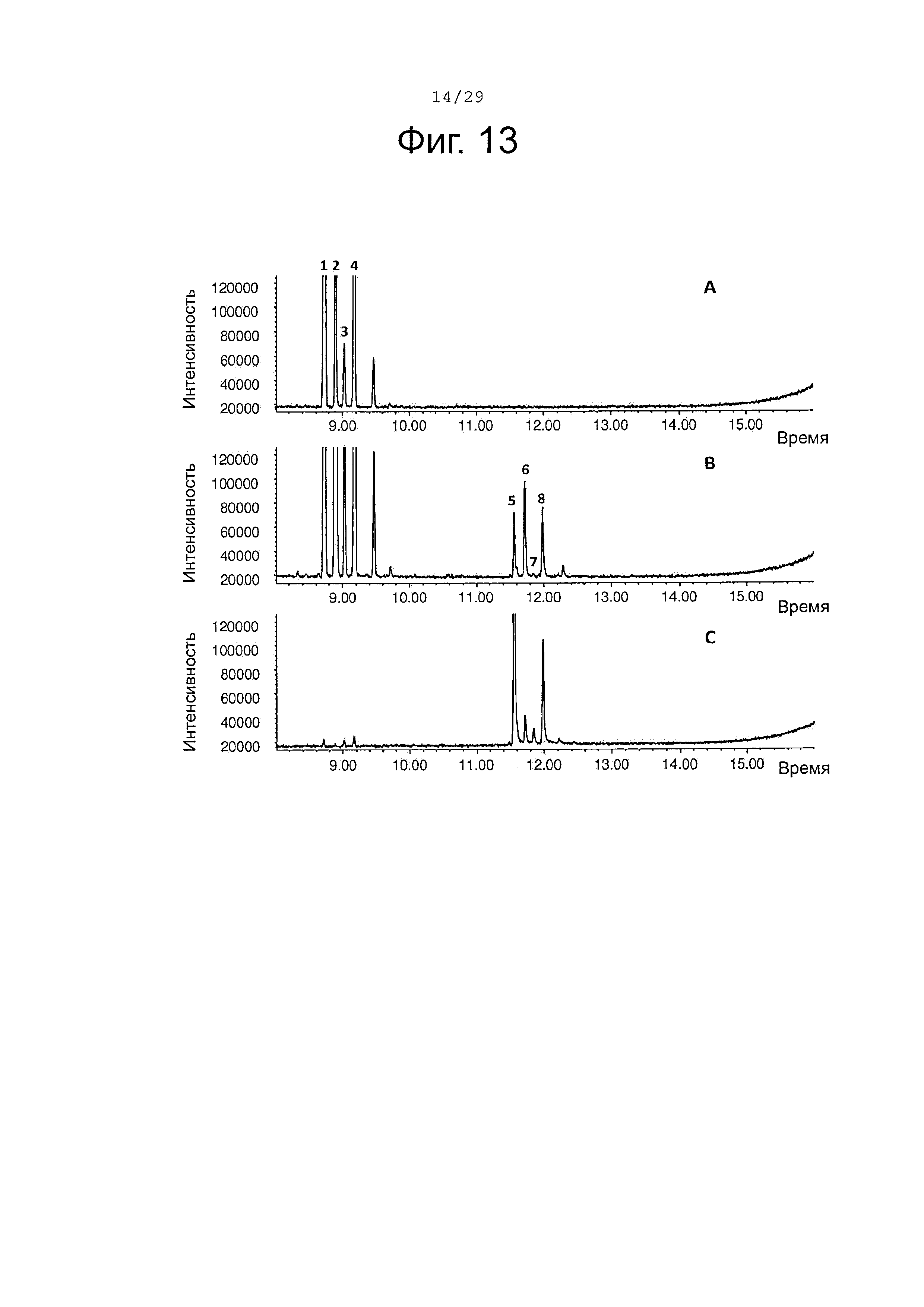
Фигура 13. GCMS-анализ преобразования (+)-α-санталена, (-)-β-санталена, (-)-α-транс-бергамотена и (+)-эпи-β-санталена рекомбинантным ферментом SaCP816. А. Контроль без рекомбинантного Р450 фермента. В. Анализ экстракта неочищенного белка Е. coli, содержащего рекомбинантный белок SaCP816. С. Масло сандалового дерева для сравнения времени удерживания. Все исследования были проведены in vitro, как описано в примере 4. 1, (+)-α-сантален; 2, (-)-α-транс-бергамотен 3, (+)-эпи-β-сантален 4, (-)-β-сантален; 5, (Z)-α-санталол; 6, (Z)-α-транс-бергамотол; 7, (Z)-эпи-β-санталол; 8, (Z)-β-санталол. Идентичность сесквитерпеновых молекул была подтверждена совпадением масс-спектров с аутентичными стандартами.
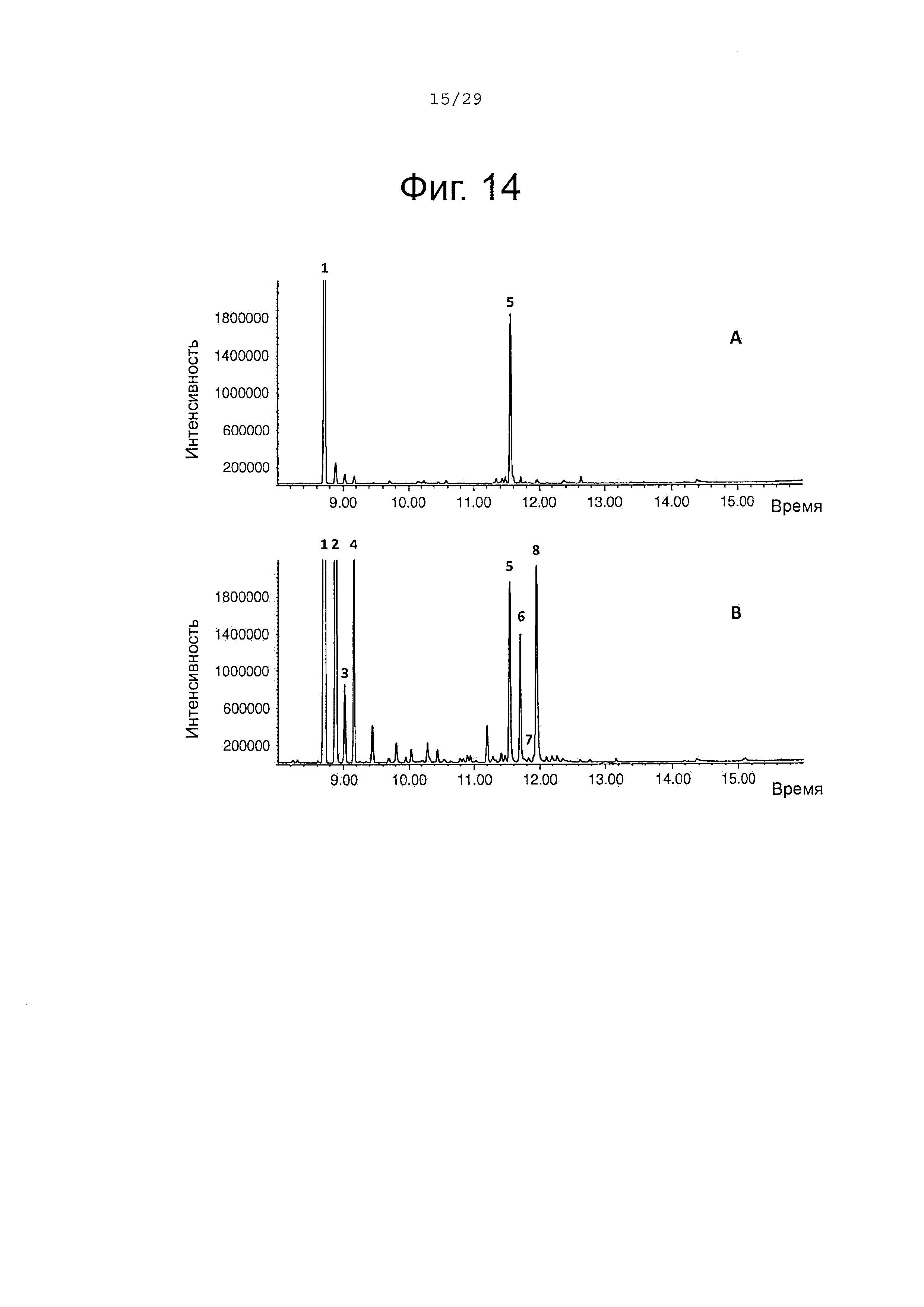
Фигура 14. GCMS-анализ молекул, продуцированных Е. Coli, созданными для выработки сесквитерпенов и экспрессирующих SaCP816, CPRm, альфа-сантален синтазу (ClASS) (А) или альфа-сантален/бета-сантален синтазу (SaSAS) (В). 1, (+)-α-сантален; 2, (-)-α-транс-бергамотен 3, (+)-эпи-β-сантален; 4, (-)-β-сантален 5, (Z)-α-санталол; 6, (Z)-α-транс-бергамотол; 7, (Z)-эпи-β-санталол; 8, (Z)-β-санталол (элюированный вместе с фарнезолом, получающимся из избыточного пула фарнезилдифосфата). Идентичность сесквитерпеновых молекул была подтверждена совпадением масс-спектров с аутентичными стандартами.
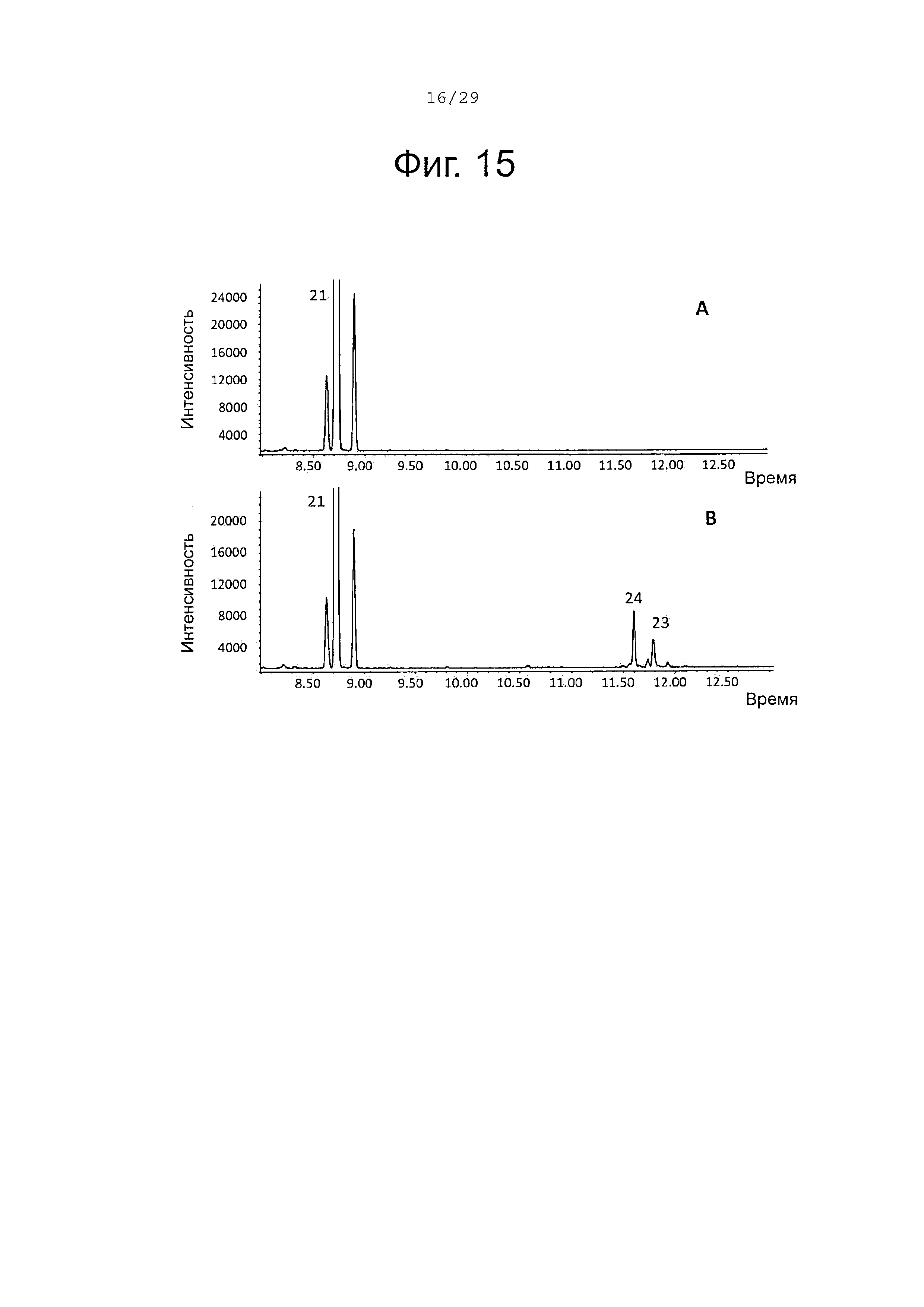
Фигура 15. GCMS-анализ преобразования (+)-α-санталена (21) рекомбинантным Р450 ферментом SaCP10374. А. Контроль без рекомбинантного Р450 фермента. В. Анализ экстракта неочищенного белка Е. coli, содержащего рекомбинантный белок SaCP10374. Числа, указанные на хроматограммах, относятся к структурам, представленным на фигуре 27.
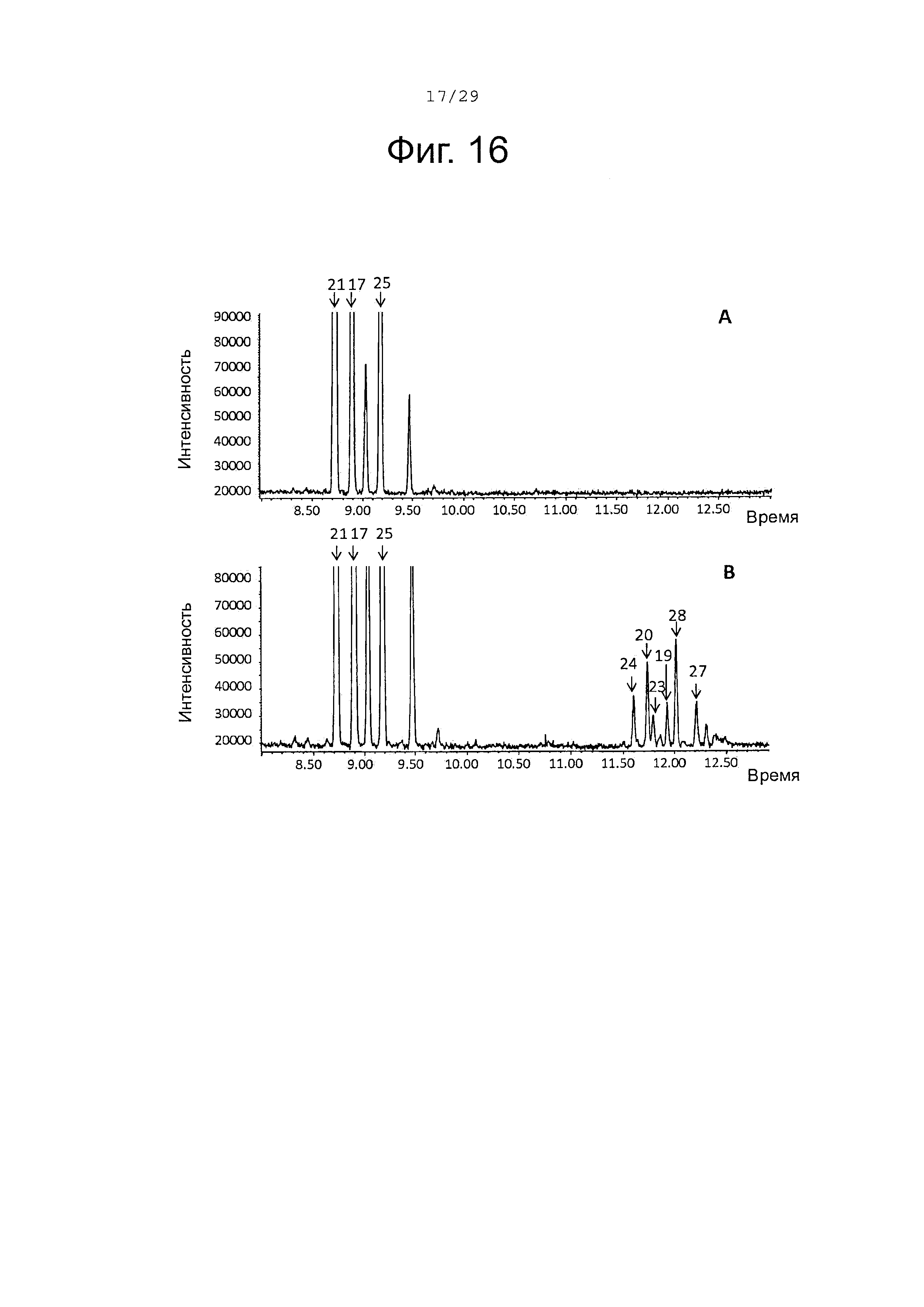
Фигура 16. GCMS-анализ преобразования смеси, состоящей из (+)-α-санталена (21), (-)-α-транс-бергамотена (17); (+)-эпи-β-санталена и (-)-β-санталена (25) (полученной с использованием рекомбинантного белка SaTp8201, пример 4), рекомбинантными SaCP10374 P450s ферментами. А. Контроль без рекомбинантного Р450 фермента. В. Анализ экстракта неочищенного белка Е. coli, содержащего рекомбинантный белок SaCP10374. Числа, указанные на хроматограммах, относятся к структурам, представленным на фигуре 27.
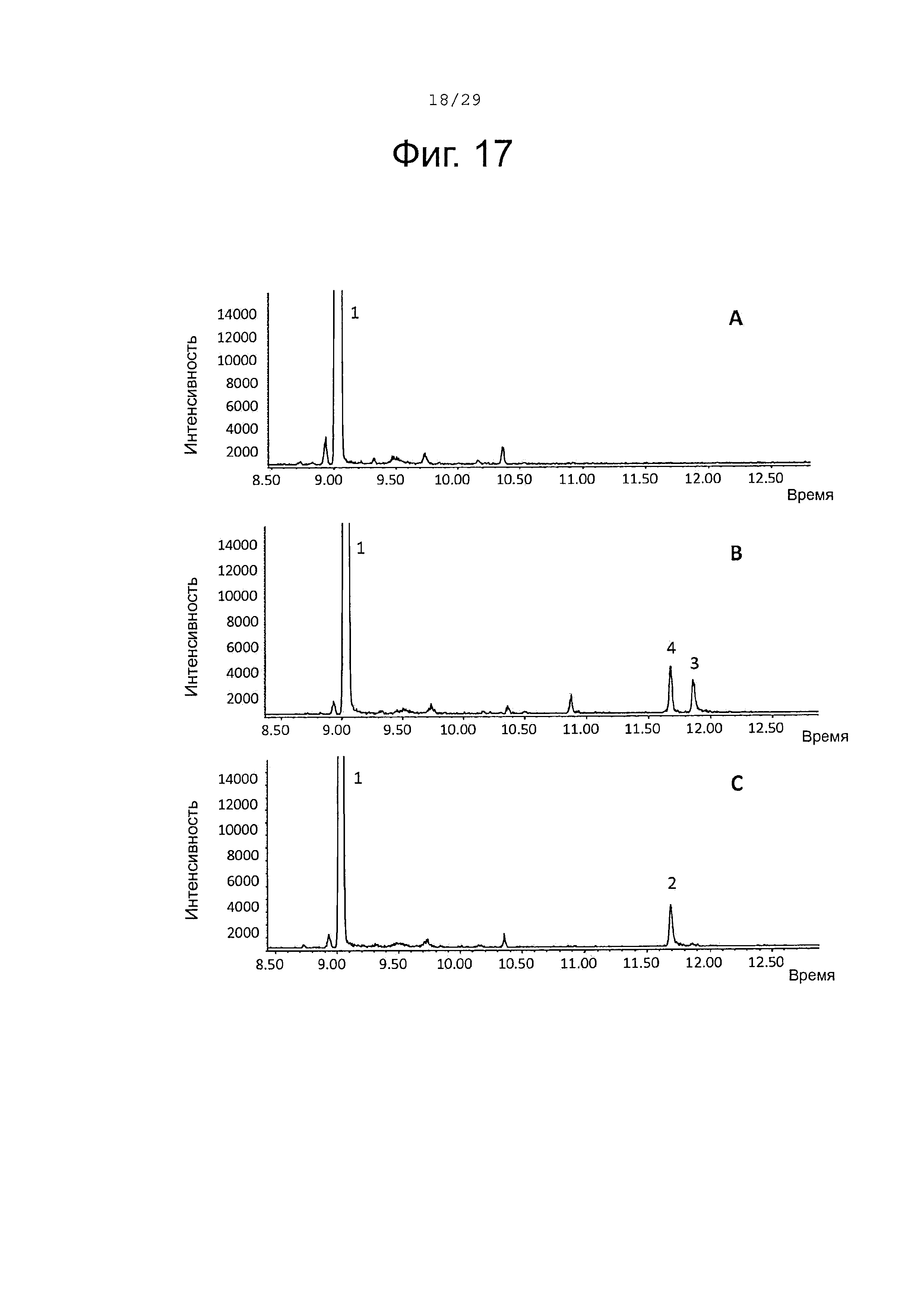
Фигура 17. GCMS-анализ преобразования β-фарнезена (1) рекомбинантными S. album P450s ферментами. А. Контроль без рекомбинантного Р450 фермента. В. Анализ экстракта неочищенного белка Е. coli, содержащего рекомбинантный белок SaCP10374. С. Анализ экстракта неочищенного белка Е. coli, содержащего рекомбинантный белок SaCP816. Числа, указанные на хроматограммах, относятся к структурам, представленным на фигуре 27.
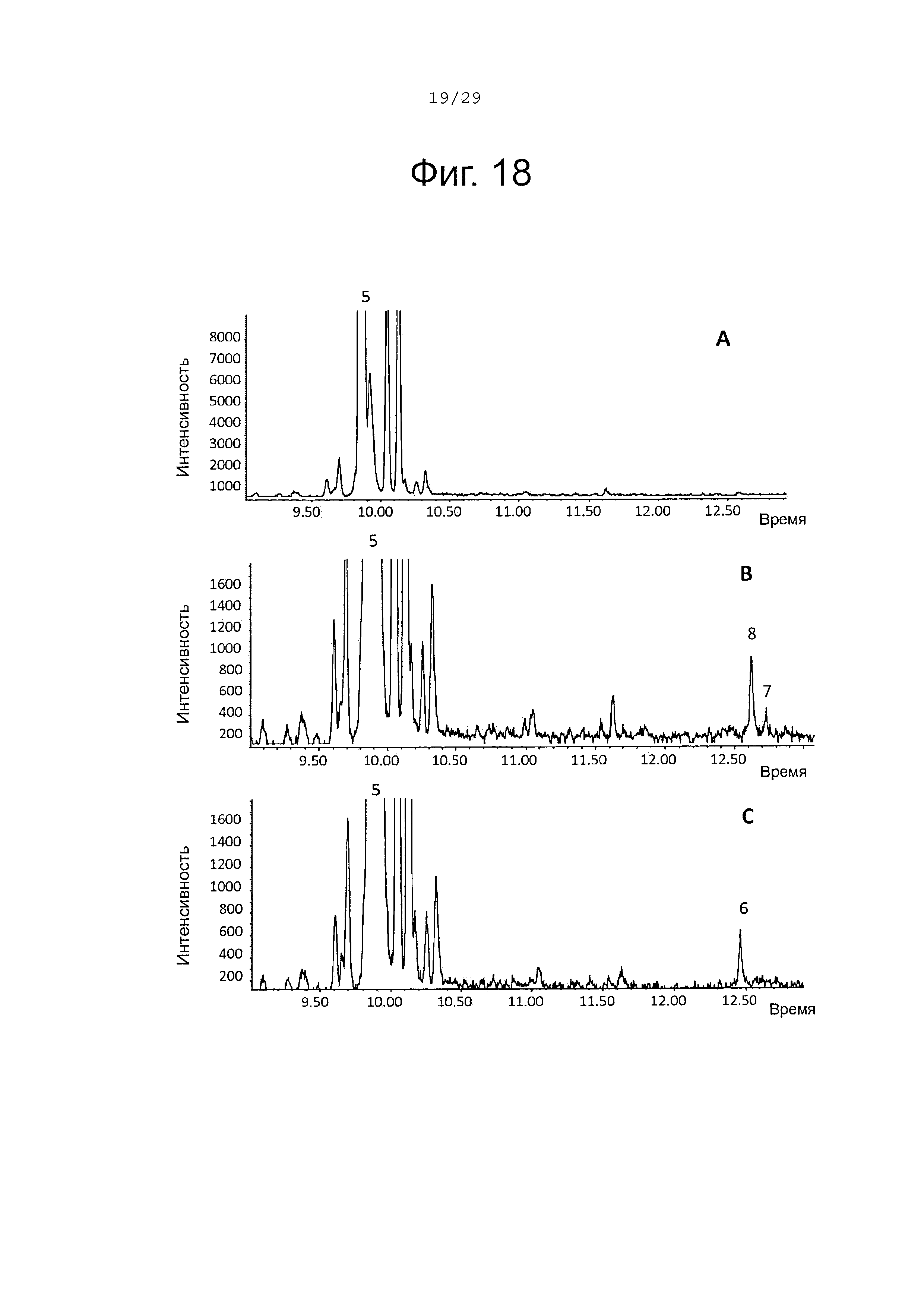
Фигура 18. GCMS-анализ преобразования α-фарнезена (5) рекомбинантными S. album P450s ферментами. А. Контроль без рекомбинантного Р450 фермента. В. Анализ экстракта неочищенного белка Е. coli, содержащего рекомбинантный белок SaCP10374. С. Анализ экстракта неочищенного белка Е. coli, содержащего рекомбинантный белок SaCP816. Числа, указанные на хроматограммах, относятся к структурам, представленным на фигуре 27.
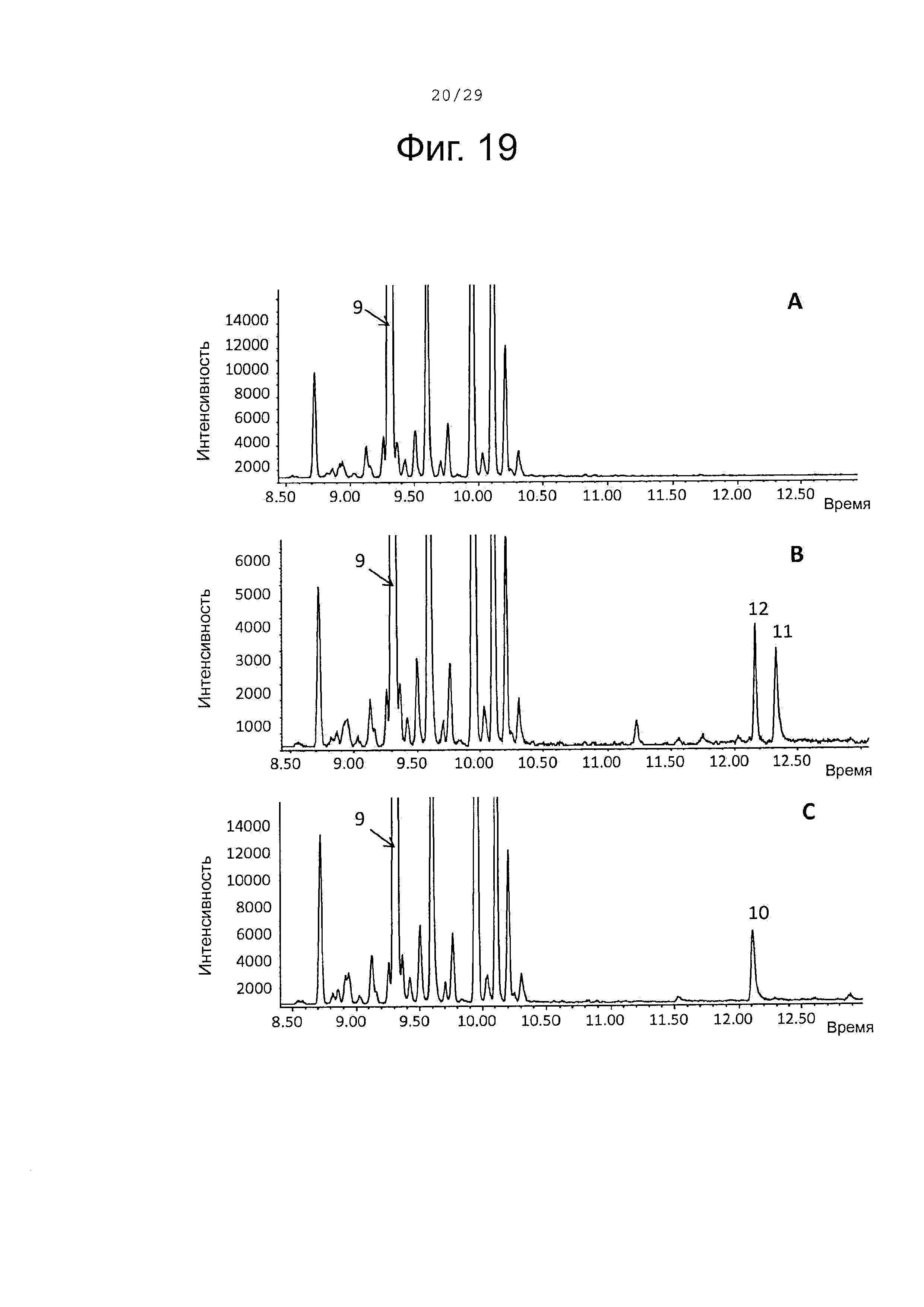
Фигура 19. GCMS-анализ преобразования (-)-сесквисабинена В (9) рекомбинантными S. album P450s ферментами. А. Контроль без рекомбинантного Р450 фермента. В. Анализ экстракта неочищенного белка Е. coli, содержащего рекомбинантный белок SaCP10374. С. Анализ экстракта неочищенного белка Е. coli, содержащего рекомбинантный белок SaCP816. Числа, указанные на хроматограммах, относятся к структурам, представленным на фигуре 27.
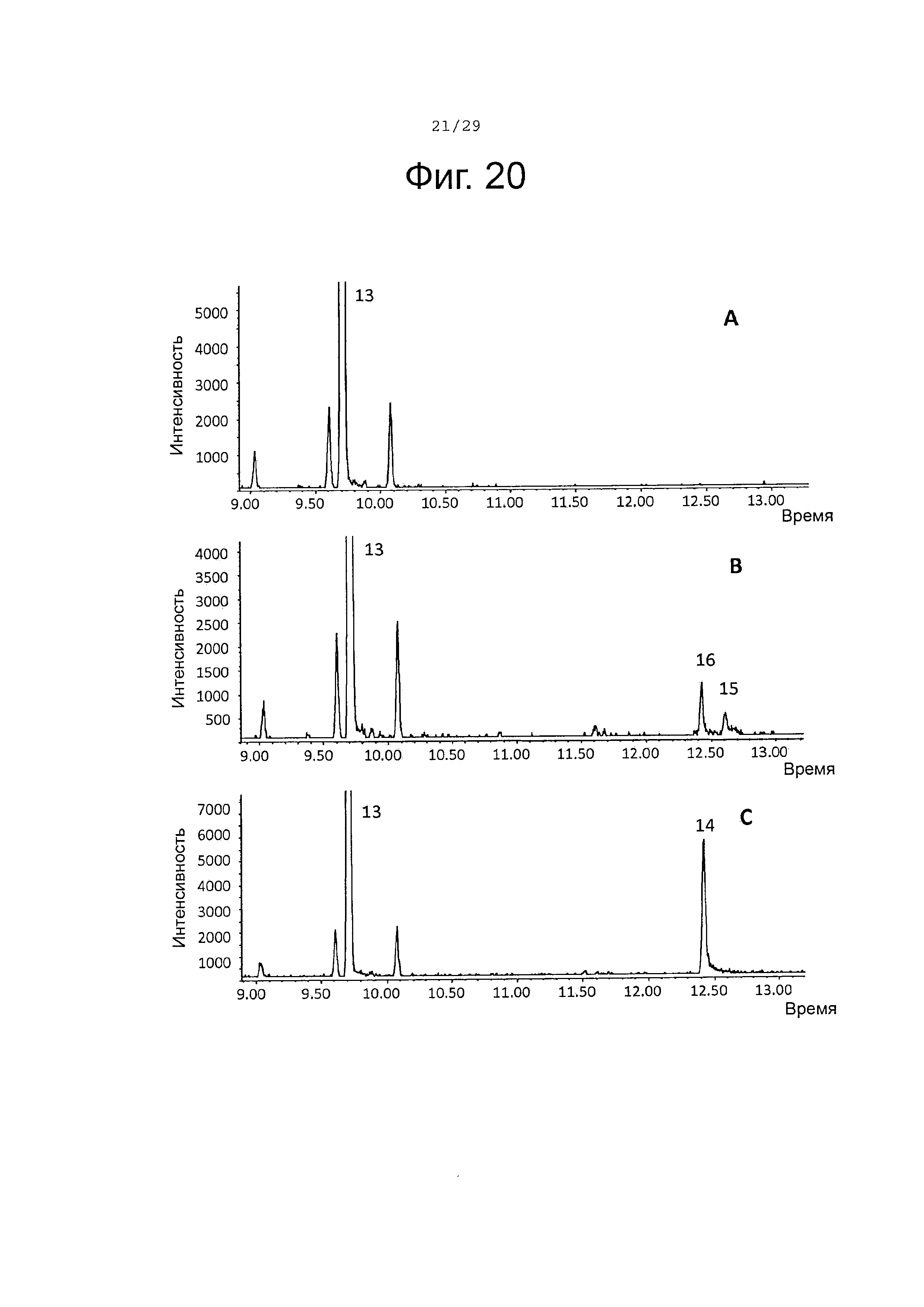
Фигура 20. GCMS-анализ преобразования (-)-β-бисаболена (13) рекомбинантными ферментами S. album P450s. А. Контроль без рекомбинантного фермента Р450. В. Анализ экстракта неочищенного белка Е. coli, содержащего рекомбинантный белок SaCP10374. С. Анализ экстракта неочищенного белка Е. coli, содержащего рекомбинантный белок SaCP816. Числа, указанные на хроматограммах, относятся к структурам, представленным на фигуре 27.
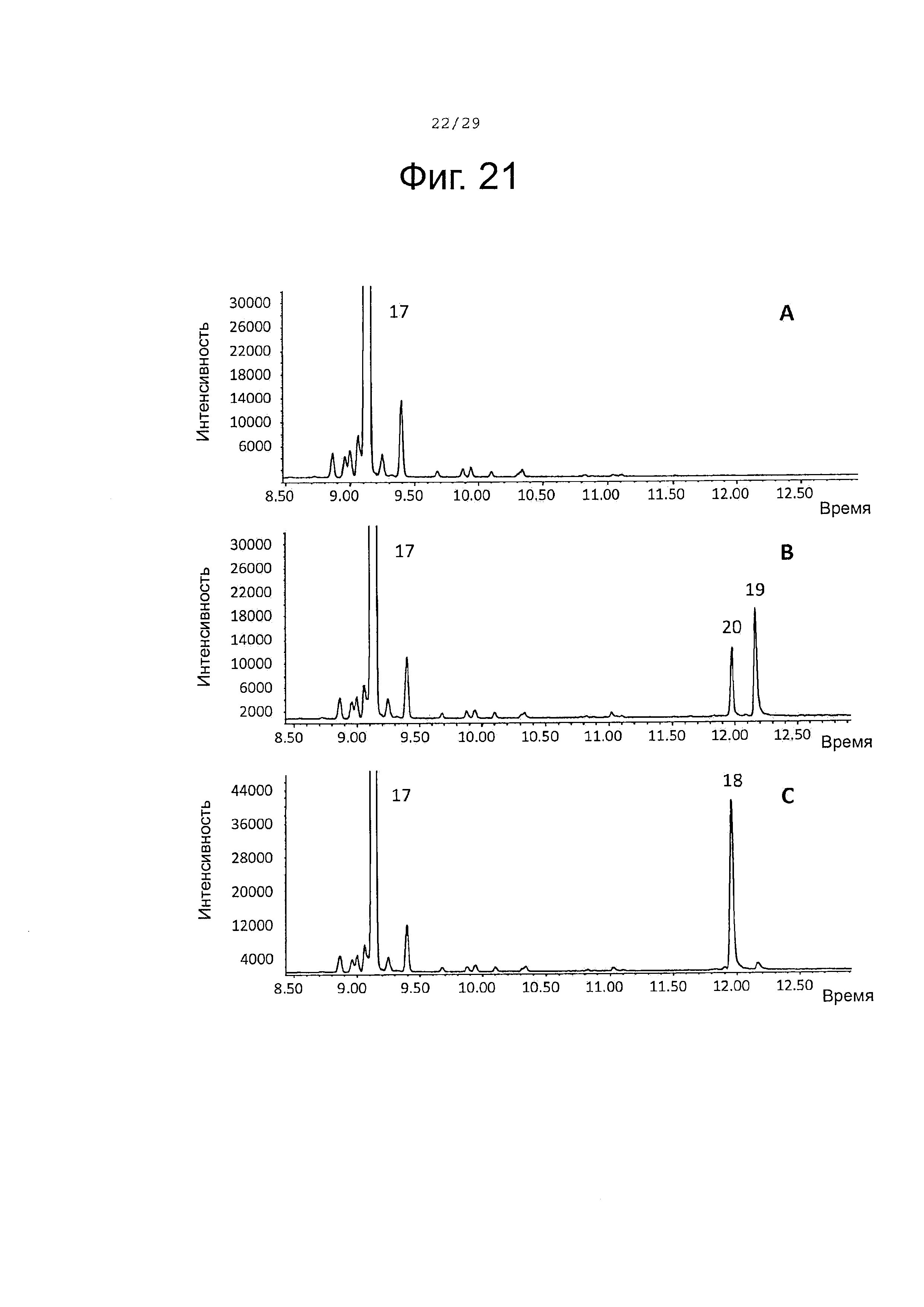
Фигура 21. GCMS-анализ преобразования (-)-α-бергамотена (17) рекомбинантными ферментами S. album P450s. А. Контроль без рекомбинантного Р450 фермента. В. Анализ экстракта неочищенного белка Е. coli, содержащего рекомбинантный белок SaCP10374. С. Анализ экстракта неочищенного белка Е. coli, содержащего рекомбинантный белок SaCP816. Числа, указанные на хроматограммах, относятся к структурам, представленным на фигуре 27.
Фигура 22. GCMS-анализ продуктов, произведенных in vivo, как описано в примере 23, клетками Е. Coli KRX, трансформированными плазмидами pACYC-29258-4506 и плазмидой pD444-SR-AaBFS (A), SaCP10374-CPRm-AaBFS-pCWori (В) или SaCP816-CPRm-AaBFS-pCWori (С). Хроматограммы демонстрируют образование (E)-β-фарнезена (1), а также окисленных производных (2-3) (соответствующие структуры смотри на фигуре 27).
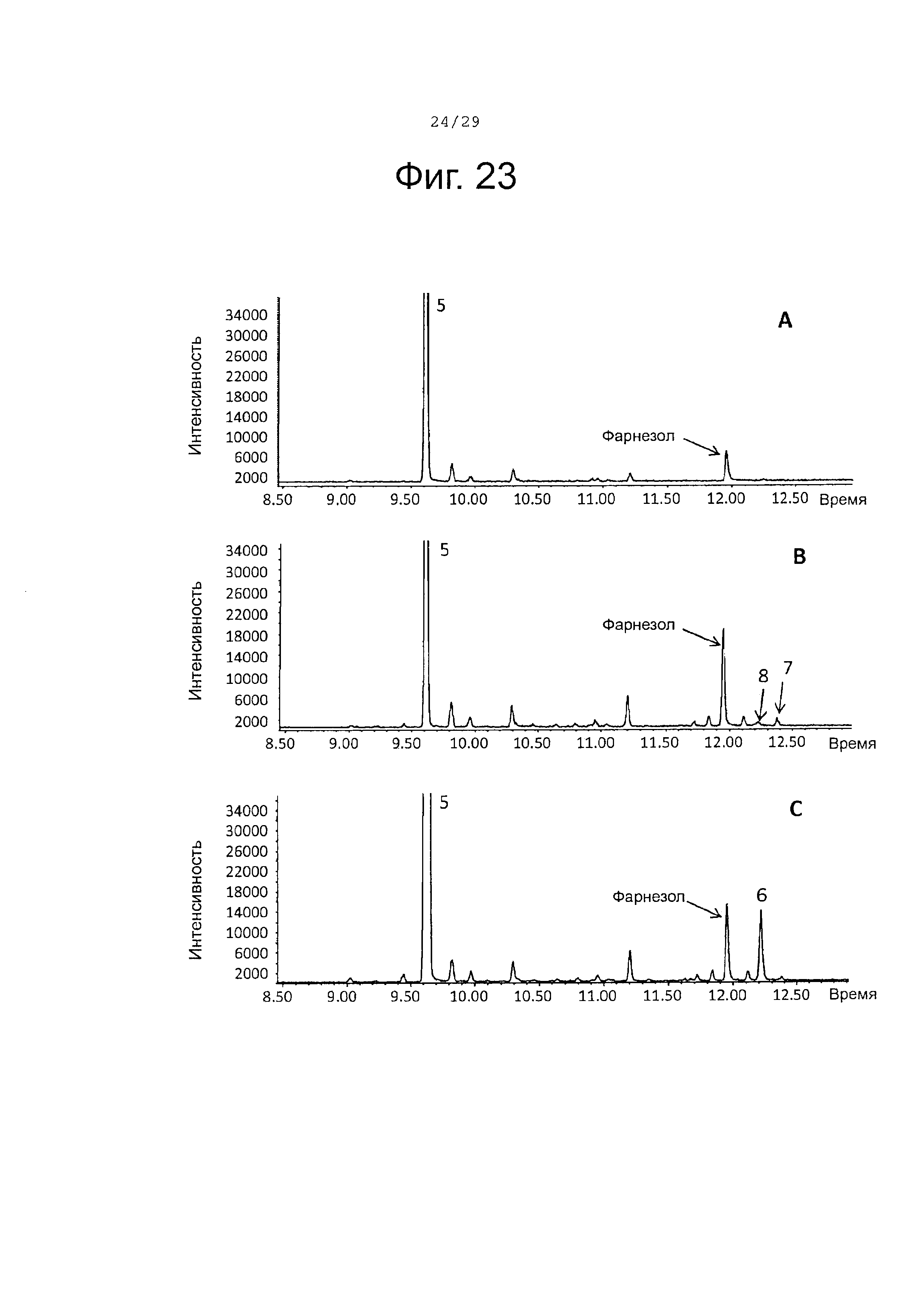
Фигура 23. GCMS-анализ продуктов, произведенных in vivo, как описано в примере 23, клетками Е. Coli KRX, трансформированными плазмидами pACYC-29258-4506 и плазмидой pD444-SR-PaBAFS (A), SaCP10374-CPRm-PaAFS-pCWori (В) или SaCP816-CPRm-PaAFS-pCWori (С). Хроматограммы демонстрируют образование (Е,Е)-α-фарнезена (5), а также окисленных производных (6-8) (соответствующие структуры смотри на фигуре 27). На каждой хроматограмме показан пик фарнезола, возникающего в результате гидролиза избытка FPP.
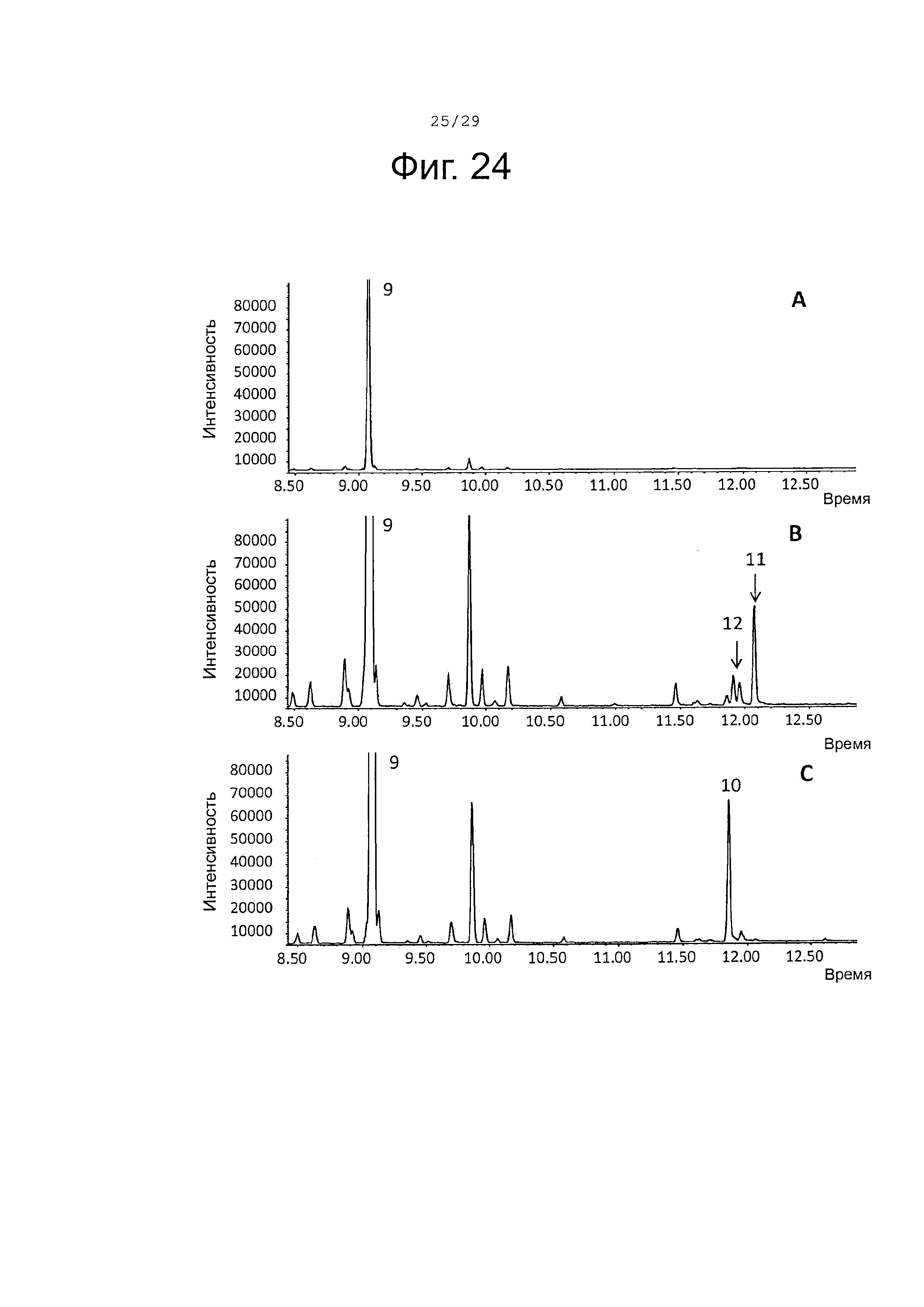
Фигура 24. GCMS-анализ продуктов, произведенных in vivo, как описано в примере 23, клетками Е. Coli KRX, трансформированными плазмидами pACYC-29258-4506 и плазмидой pETDuet-SaTps647 (A), SaCP10374-CPRm-SaTps647-pCWori (В), или SaCP816-CPRm-SaTPS647-pCWori (C). Хроматограммы демонстрируют образование (-)-сесквисабинена В (9), а также окисленных производных (10-12) (соответствующие структуры смотри на фигуре 27).
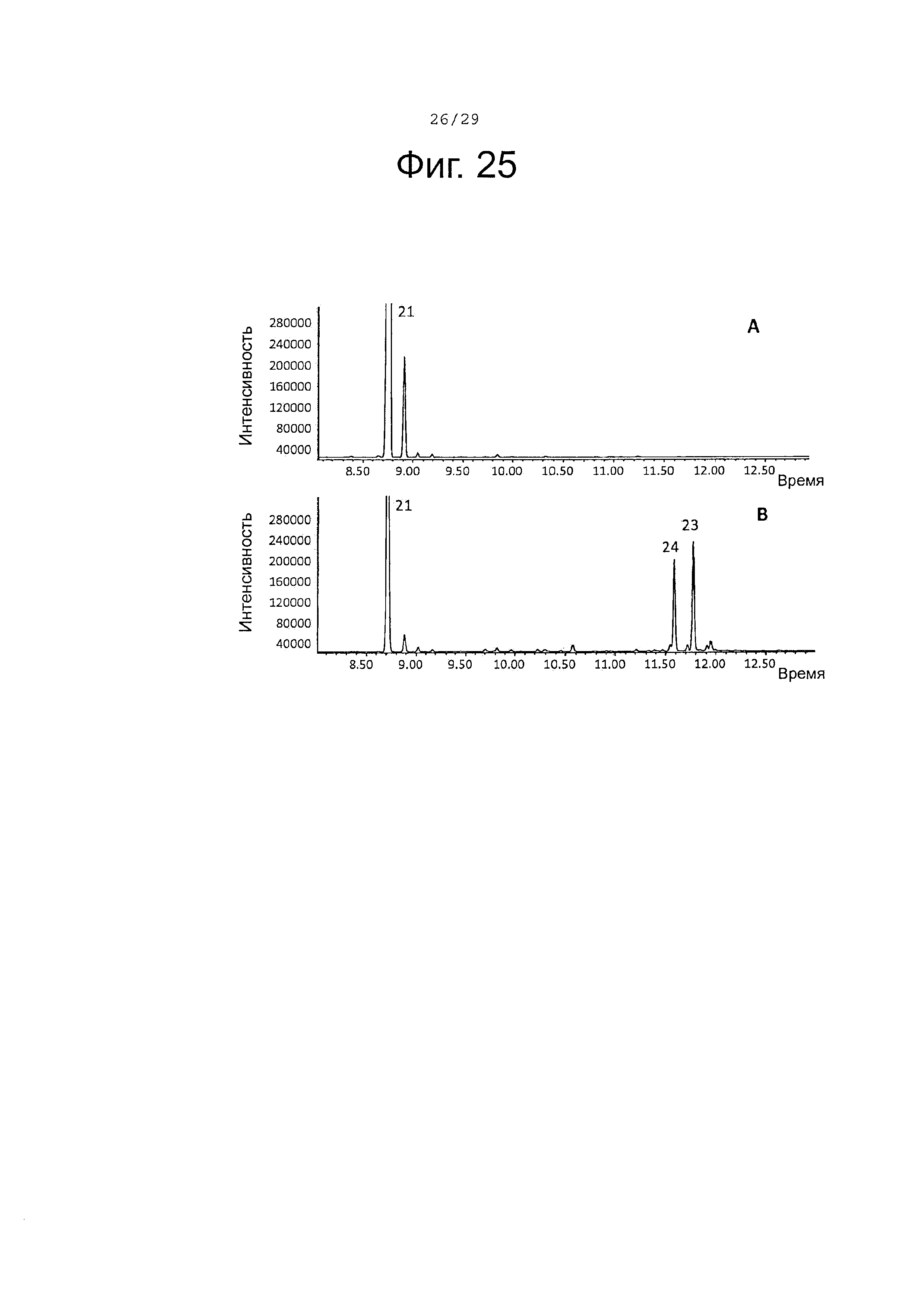
Фигура 25. GCMS-анализ продуктов, произведенных in vivo, как описано в примере 23, клетками Е. Coli KRX, трансформированными плазмидами pACYC-29258-4506 и плазмидой pETDuet-ClTps2 (А) или SaCP10374-CPRm-ClTps2-pCWori (В). Хроматограммы демонстрируют образование (+)-α-санталена (21), а также окисленных производных (23-24) (соответствующие структуры смотри на фигуре 27).
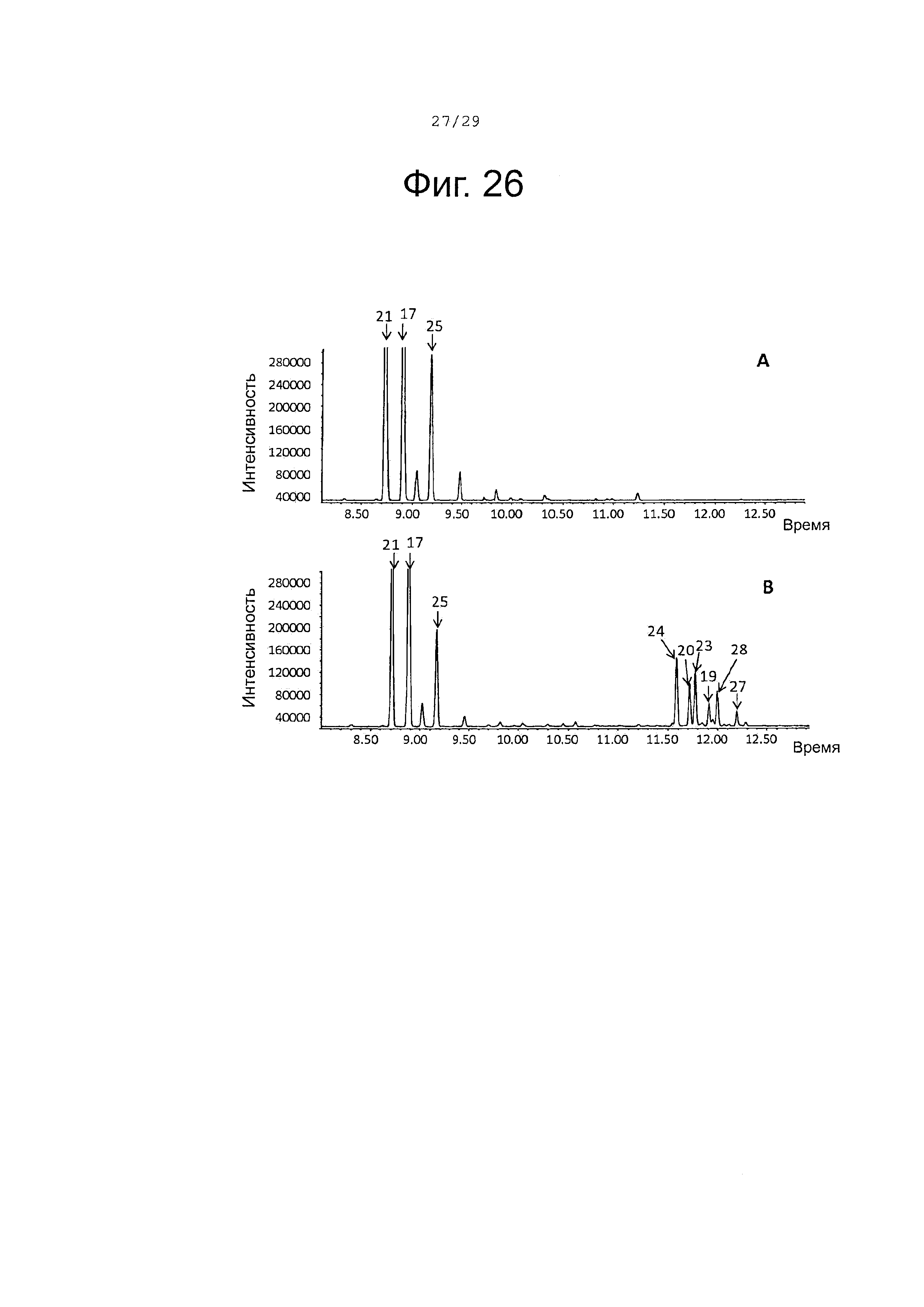
Фигура 26. GCMS-анализ продуктов, произведенных in-vivo, как описано в примере 23, клетками Е. Coli KRX, трансформированными плазмидами pACYC-29258-4506 и плазмидой pETDuet-SaTps8201 (А) или SaCP10374-CPRm-SaTps8201-pCWori (В). Хроматограммы демонстрируют образование (+)-α-санталена (21), (-)-β-санталена (25) и (-)-транс-α-бергамотена. (17), а также окисленных производных (19, 20, 23, 24, 27 и 28) (соответствующие структуры смотри на фигуре 27).
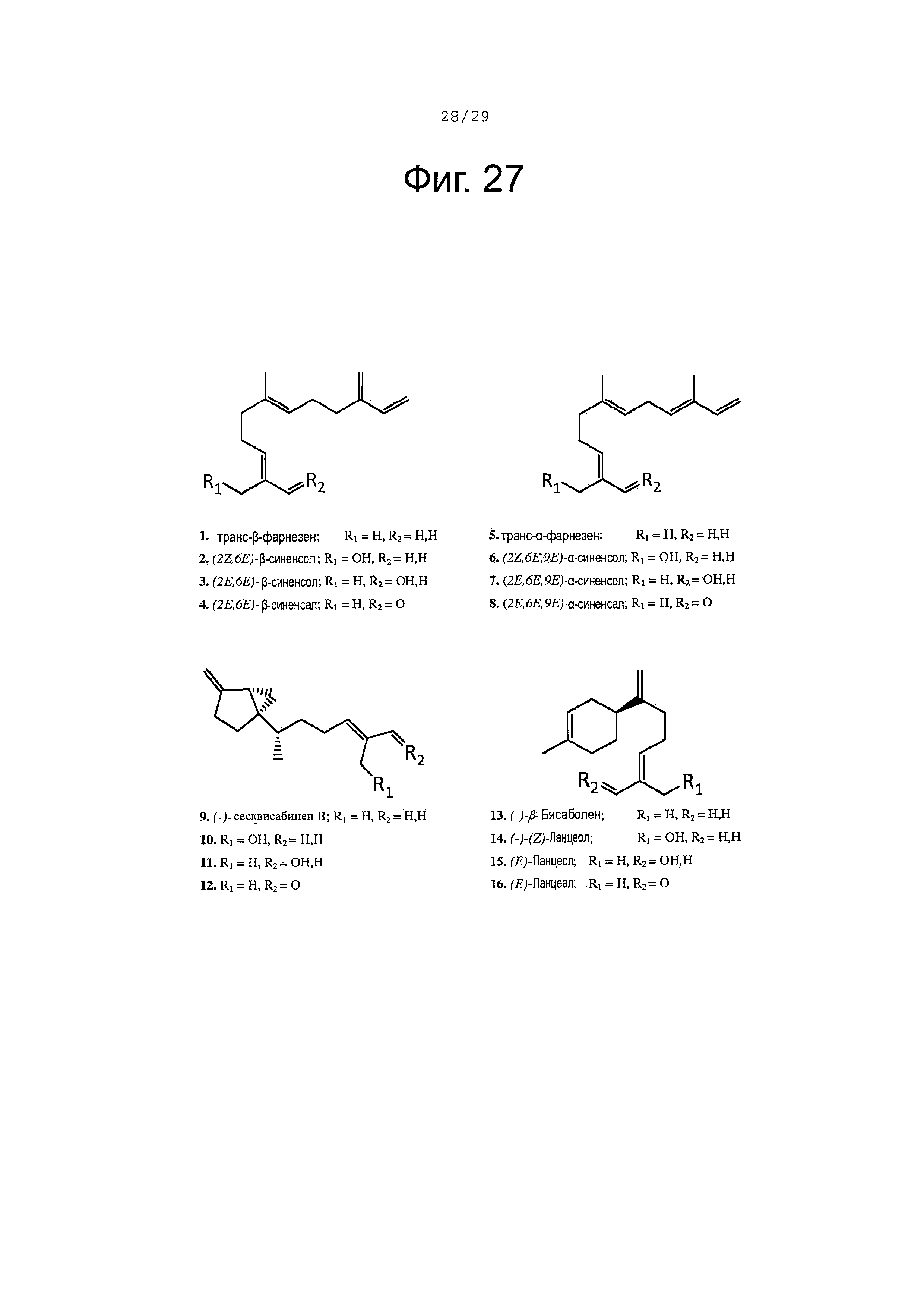
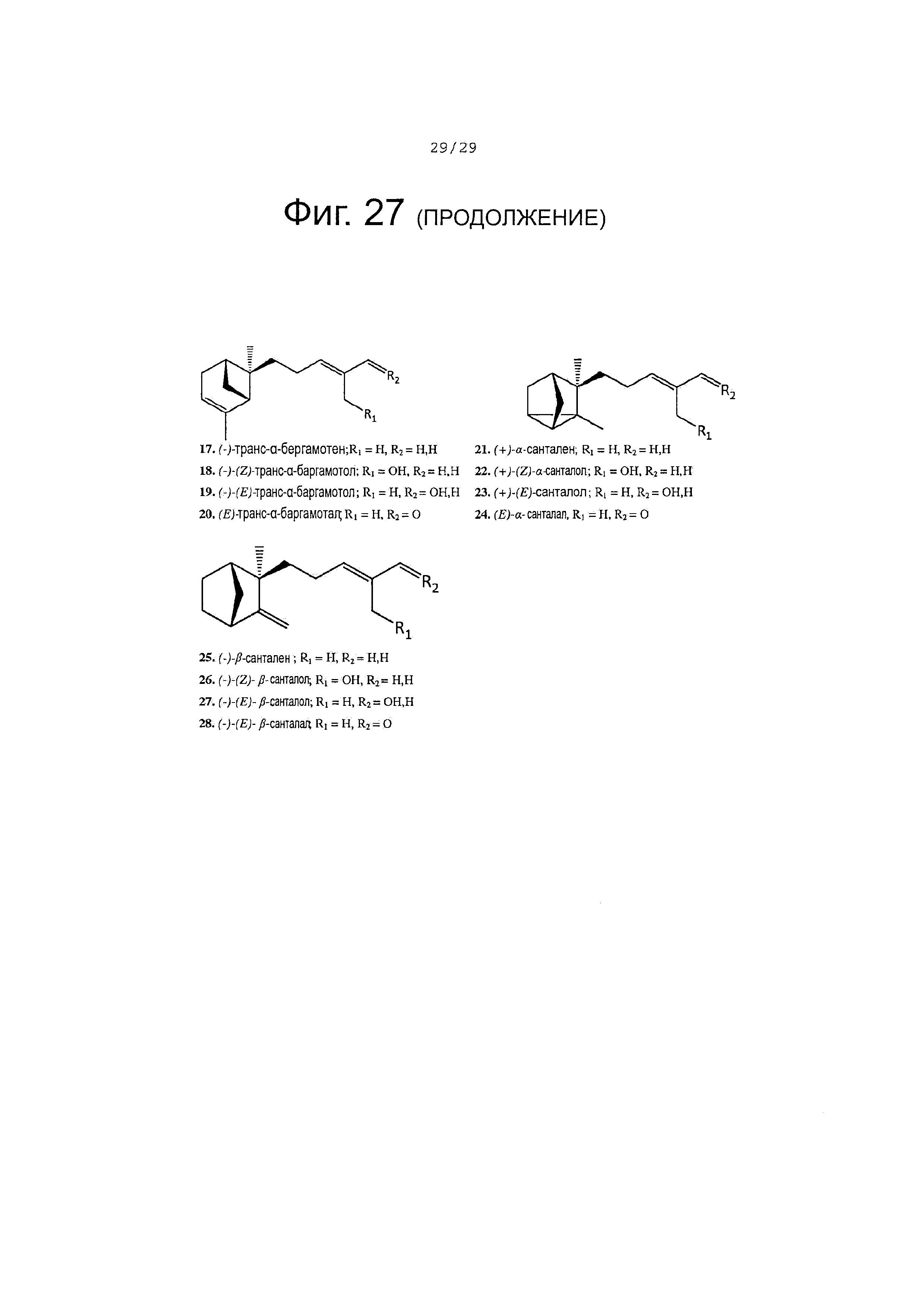
Фигура 27. Структура субстратов ферментов и продуктов обсуждается в тексте.
Подробное описание
В некоторых вариантах осуществления предоставляется способ получения сесквитерпена, в том числе α-синенсола, β-синенсола, α-санталола, β-санталола, α-транс-бергамотола, эпи-β-санталола и ланцелола и/или их смесей, включающий контактирование α-фарнезена, β-фарнезена, α-санталена, β-санталена, α-транс-бергамотена и/или эпи-β-санталена с полипептидом, содержащим аминокислотную последовательность, имеющую идентичность последовательности не менее или по меньшей мере около 45%, 50%, 55%, 60%, 65%, 70%, 80%, 90%, 95% или 98% с SEQ ID NO: 2. В отдельном варианте осуществления способ включает клетку, экспрессирующую данный полипептид.
В некоторых вариантах осуществления предоставляется способ получения α-синенсола, β-синенсола, α-санталола, β-санталола, α-транс-бергамотола, эпи-β-санталола, ланцелола и/или их смесей, включающий контактирование α-фарнезена, β-фарнезена, α-санталена, β-санталена, α-транс-бергамотена и/или эпи-β-санталена с полипептидом, содержащим аминокислотную последовательность, имеющую идентичность последовательности не менее или по меньшей мере около 45%, 50%, 55%, 60%, 65%, 70%, 80%, 90%, 95% или 98% с SEQ ID NO: 4. В отдельном варианте осуществления способ включает клетку, экспрессирующую данный полипептид.
В некоторых вариантах осуществления предоставляется способ получения α-синенсола, β-синенсола, α-санталола, β-санталола, α-транс-бергамотола, эпи-β-санталола, ланцелола и/или их смесей, включающий контактирование α-фарнезена, β-фарнезена, α-санталена, β-санталена, α-транс-бергамотена и/или эпи-β-санталена с полипептидом, содержащим аминокислотную последовательность, имеющую идентичность последовательности не менее или по меньшей мере около 45%, 50%, 55%, 60%, 65%, 70%, 80%, 90%, 95% или 98% с SEQ ID NO: 6. В отдельном варианте осуществления способ включает клетку, экспрессирующую данный полипептид.
В некоторых вариантах осуществления предоставляется способ получения α-синенсола, β-синенсола, α-санталола, β-санталола, α-транс-бергамотола, эпи-β-санталола, ланцелола и/или их смесей, включающий контактирование α-фарнезена, β-фарнезена, α-санталена, β-санталена, α-транс-бергамотена и/или эпи-β-санталена с полипептидом, содержащим аминокислотную последовательность, имеющую идентичность последовательности не менее или по меньшей мере около 45%, 50%, 55%, 60%, 65%, 70%, 80%, 90%, 95% или 98% с SEQ ID NO: 8. В отдельном варианте осуществления способ включает клетку, экспрессирующую данный полипептид.
В некоторых вариантах осуществления предоставляется способ получения α-синенсола, β-синенсола, α-санталола, β-санталола, α-транс-бергамотола, эпи-β-санталола, ланцелола и/или их смесей, включающий контактирование α-фарнезена, β-фарнезена, α-санталена, β-санталена, α-транс-бергамотена и/или эпи-β-санталена с полипептидом, содержащим аминокислотную последовательность, имеющую идентичность последовательности не менее или по меньшей мере около 45%, 50%, 55%, 60%, 65%, 70%, 80%, 90%, 95% или 98% с SEQ ID NO: 28. В отдельном варианте осуществления способ включает клетку, экспрессирующую данный полипептид.
В некоторых вариантах осуществления предоставляется способ получения α-синенсола, β-синенсола, α-санталола, β-санталола, α-транс-бергамотола, эпи-β-санталола, ланцелола и/или их смесей, включающий контактирование α-фарнезена, β-фарнезена, α-санталена, β-санталена, α-транс-бергамотена и/или эпи-β-санталена с полипептидом, содержащим аминокислотную последовательность, имеющую идентичность последовательности не менее или по меньшей мере около 45%, 50%, 55%, 60%, 65%, 70%, 80%, 90%, 95% или 98% с SEQ ID NO: 30. В отдельном варианте осуществления способ включает клетку, экспрессирующую данный полипептид.
В некоторых вариантах осуществления предоставляется способ получения α-синенсола, β-синенсола, α-санталола, β-санталола, α-транс-бергамотола, эпи-β-санталола, ланцелола и/или их смесей, включающий контактирование α-фарнезена, β-фарнезена, α-санталена, β-санталена, α-транс-бергамотена и/или эпи-β-санталена с полипептидом, содержащим аминокислотную последовательность, имеющую идентичность последовательности не менее или по меньшей мере около 45%, 50%, 55%, 60%, 65%, 70%, 80%, 90%, 95%, или 98% с SEQ ID NO: 32. В отдельном варианте осуществления способ включает клетку, экспрессирующую данный полипептид.
В некоторых вариантах осуществления предоставляется способ получения α-синенсола, β-синенсола, α-санталола, β-санталола, α-транс-бергамотола, эпи-β-санталола, ланцелола и/или их смесей, включающий контактирование α-фарнезена, β-фарнезена, α-санталена, β-санталена, α-транс-бергамотена и/или эпи-β-санталена с полипептидом, содержащим аминокислотную последовательность, имеющую идентичность последовательности не менее или по меньшей мере около 45%, 50%, 55%, 60%, 65%, 70%, 80%, 90%, 95% или 98% с SEQ ID NO: 34. В отдельном варианте осуществления способ включает клетку, экспрессирующую данный полипептид.
В некоторых вариантах осуществления предоставляется способ получения α-синенсола, β-синенсола, α-санталола, β-санталола, α-транс-бергамотола, эпи-β-санталола, ланцелола и/или их смесей, включающий контактирование α-фарнезена, β-фарнезена, α-санталена, β-санталена, α-транс-бергамотена и/или эпи-β-санталена с полипептидом, содержащим аминокислотную последовательность, имеющую идентичность последовательности не менее или по меньшей мере около 45%, 50%, 55%, 60%, 65%, 70%, 80%, 90%, 95% или 98% с SEQ ID NO: 36. В отдельном варианте осуществления способ включает клетку, экспрессирующую данный полипептид.
В некоторых вариантах осуществления предоставляется способ получения α-синенсола, β-синенсола, α-санталола, β-санталола, α-транс-бергамотола, эпи-β-санталола, ланцелола и/или их смесей, включающий контактирование α-фарнезена, β-фарнезена, α-санталена, β-санталена, α-транс-бергамотена и/или эпи-β-санталена с полипептидом, содержащим аминокислотную последовательность, имеющую идентичность последовательности не менее или по меньшей мере около 45%, 50%, 55%, 60%, 65%, 70%, 80%, 90%, 95% или 98% с SEQ ID NO: 38. В отдельном варианте осуществления способ включает клетку, экспрессирующую данный полипептид.
В некоторых вариантах осуществления предоставляется способ получения α-синенсола, β-синенсола, α-санталола, β-санталола, α-транс-бергамотола, эпи-β-санталола, ланцелола и/или их смесей, включающий контактирование α-фарнезена, β-фарнезена, α-санталена, β-санталена, α-транс-бергамотена и/или эпи-β-санталена с полипептидом, содержащим аминокислотную последовательность, имеющую идентичность последовательности не менее или по меньшей мере около 45%, 50%, 55%, 60%, 65%, 70%, 80%, 90%, 95% или 98% с SEQ ID NO: 40. В отдельном варианте осуществления способ включает клетку, экспрессирующую данный полипептид.
В некоторых вариантах осуществления предоставляется способ получения α-синенсола, β-синенсола, α-санталола, β-санталола, α-транс-бергамотола, эпи-β-санталола, ланцелола и/или их смесей, включающий контактирование α-фарнезена, β-фарнезена, α-санталена, β-санталена, α-транс-бергамотена и/или эпи-β-санталена с полипептидом, содержащим аминокислотную последовательность, имеющую идентичность последовательности не менее или по меньшей мере около 45%, 50%, 55%, 60%, 65%, 70%, 80%, 90%, 95% или 98% с SEQ ID NO: 42. В отдельном варианте осуществления способ включает клетку, экспрессирующую данный полипептид.
В некоторых вариантах осуществления предоставляется способ получения α-синенсола, β-синенсола, α-санталола, β-санталола, α-транс-бергамотола, эпи-β-санталола, ланцелола и/или их смесей, включающий контактирование α-фарнезена, β-фарнезена, α-санталена, β-санталена, α-транс-бергамотена и/или эпи-β-санталена с полипептидом, содержащим аминокислотную последовательность, имеющую идентичность последовательности не менее или по меньшей мере около 45%, 50%, 55%, 60%, 65%, 70%, 80%, 90%, 95% или 98% с SEQ ID NO: 44. В отдельном варианте осуществления способ включает клетку, экспрессирующую данный полипептид.
В некоторых вариантах осуществления предоставляется способ получения α-синенсола, β-синенсола, α-санталола, β-санталола, α-транс-бергамотола, эпи-β-санталола, ланцелола и/или их смесей, включающий контактирование α-фарнезена, β-фарнезена, α-санталена, β-санталена, α-транс-бергамотена и/или эпи-β-санталена с полипептидом, содержащим аминокислотную последовательность, имеющую идентичность последовательности не менее или по меньшей мере около 45%, 50%, 55%, 60%, 65%, 70%, 80%, 90%, 95% или 98% с SEQ ID NO: 50. В отдельном варианте осуществления способ включает клетку, экспрессирующую данный полипептид.
В некоторых вариантах осуществления предоставляется способ получения α-синенсола, β-синенсола, α-санталола, β-санталола, α-транс-бергамотола, эпи-β-санталола, ланцелола и/или их смесей, включающий контактирование α-фарнезена, β-фарнезена, α-санталена, β-санталена, α-транс-бергамотена и/или эпи-β-санталена с полипептидом, содержащим аминокислотную последовательность, имеющую идентичность последовательности не менее или по меньшей мере около 45%, 50%, 55%, 60%, 65%, 70%, 80%, 90%, 95% или 98% с SEQ ID NO: 52. В отдельном варианте осуществления способ включает клетку, экспрессирующую данный полипептид.
В некоторых вариантах осуществления предоставляется способ получения α-синенсола, β-синенсола, α-санталола, β-санталола, α-транс-бергамотола, эпи-β-санталола, ланцелола и/или их смесей, включающий контактирование α-фарнезена, β-фарнезена, α-санталена, β-санталена, α-транс-бергамотена и/или эпи-β-санталена с полипептидом, содержащим аминокислотную последовательность, имеющую идентичность последовательности не менее или по меньшей мере около 45%, 50%, 55%, 60%, 65%, 70%, 80%, 90%, 95% или 98% с SEQ ID NO: 54. В отдельном варианте осуществления способ включает клетку, экспрессирующую данный полипептид.
В некоторых вариантах осуществления предоставляется способ получения α-синенсола, β-синенсола, α-санталола, β-санталола, α-транс-бергамотола, эпи-β-санталола, ланцелола и/или их смесей, включающий контактирование α-фарнезена, β-фарнезена, α-санталена, β-санталена, α-транс-бергамотена и/или эпи-β-санталена с полипептидом, содержащим аминокислотную последовательность, имеющую идентичность последовательности не менее или по меньшей мере около 45%, 50%, 55%, 60%, 65%, 70%, 80%, 90%, 95% или 98% с SEQ ID NO: 58. В отдельном варианте осуществления способ включает клетку, экспрессирующую данный полипептид.
В некоторых вариантах осуществления предоставляется способ получения α-синенсола, β-синенсола, α-санталола, β-санталола, α-транс-бергамотола, эпи-β-санталола, ланцелола и/или их смесей, включающий контактирование α-фарнезена, β-фарнезена, α-санталена, β-санталена, α-транс-бергамотена и/или эпи-β-санталена с полипептидом, содержащим аминокислотную последовательность, имеющую идентичность последовательности не менее или по меньшей мере около 45%, 50%, 55%, 60%, 65%, 70%, 80%, 90%, 95% или 98% с SEQ ID NO: 60. В отдельном варианте осуществления способ включает клетку, экспрессирующую данный полипептид.
В некоторых вариантах осуществления предоставляется способ получения α-синенсола, β-синенсола, α-санталола, β-санталола, α-транс-бергамотола, эпи-β-санталола, ланцелола и/или их смесей, включающий контактирование α-фарнезена, β-фарнезена, α-санталена, β-санталена, α-транс-бергамотена и/или эпи-β-санталена с полипептидом, содержащим аминокислотную последовательность, имеющую идентичность последовательности не менее или по меньшей мере около 45%, 50%, 55%, 60%, 65%, 70%, 80%, 90%, 95% или 98% с SEQ ID NO: 62. В отдельном варианте осуществления способ включает клетку, экспрессирующую данный полипептид.
В некоторых вариантах осуществления предоставляется способ получения α-синенсола, β-синенсола, α-санталола, β-санталола, α-транс-бергамотола, эпи-β-санталола, ланцелола и/или их смесей, включающий контактирование α-фарнезена, β-фарнезена, α-санталена, β-санталена, α-транс-бергамотена и/или эпи-β-санталена с полипептидом, содержащим аминокислотную последовательность, имеющую идентичность последовательности не менее или по меньшей мере около 45%, 50%, 55%, 60%, 65%, 70%, 80%, 90%, 95% или 98% с SEQ ID NO: 64. В отдельном варианте осуществления способ включает клетку, экспрессирующую данный полипептид.
В некоторых вариантах осуществления предоставляется способ получения α-синенсола, β-синенсола, α-санталола, β-санталола, α-транс-бергамотола, эпи-β-санталола, ланцелола и/или их смесей, включающий контактирование α-фарнезена, β-фарнезена, α-санталена, β-санталена, α-транс-бергамотена и/или эпи-β-санталена с полипептидом, содержащим аминокислотную последовательность, имеющую идентичность последовательности не менее или по меньшей мере около 45%, 50%, 55%, 60%, 65%, 70%, 80%, 90%, 95% или 98% с SEQ ID NO: 66. В отдельном варианте осуществления способ включает клетку, экспрессирующую данный полипептид.
В некоторых вариантах осуществления предоставляется способ получения α-синенсола, β-синенсола, α-санталола, β-санталола, α-транс-бергамотола, эпи-β-санталола, ланцелола и/или их смесей, включающий контактирование α-фарнезена, β-фарнезена, α-санталена, β-санталена, α-транс-бергамотена и/или эпи-β-санталена с полипептидом, содержащим аминокислотную последовательность, имеющую идентичность последовательности не менее или по меньшей мере около 45%, 50%, 55%, 60%, 65%, 70%, 80%, 90%, 95% или 98% с SEQ ID NO: 68. В отдельном варианте осуществления способ включает клетку, экспрессирующую данный полипептид.
В некоторых вариантах осуществления предоставляется способ получения α-синенсола, β-синенсола, α-санталола, β-санталола, α-транс-бергамотола, эпи-β-санталола, ланцелола и/или их смесей, включающий контактирование α-фарнезена, β-фарнезена, α-санталена, β-санталена, α-транс-бергамотена и/или эпи-β-санталена с полипептидом, содержащим аминокислотную последовательность, имеющую идентичность последовательности не менее или по меньшей мере около 45%, 50%, 55%, 60%, 65%, 70%, 80%, 90%, 95% или 98% с SEQ ID NO: 71. В отдельном варианте осуществления способ включает клетку, экспрессирующую данный полипептид.
В некоторых вариантах осуществления предоставляется способ получения α-синенсола, β-синенсола, α-санталола, β-санталола, α-транс-бергамотола, эпи-β-санталола, ланцелола и/или их смесей, включающий контактирование α-фарнезена, β-фарнезена, α-санталена, β-санталена, α-транс-бергамотена и/или эпи-β-санталена с полипептидом, содержащим аминокислотную последовательность, имеющую идентичность последовательности не менее или по меньшей мере около 45%, 50%, 55%, 60%, 65%, 70%, 80%, 90%, 95% или 98% с SEQ ID NO: 73. В отдельном варианте осуществления способ включает клетку, экспрессирующую данный полипептид.
В некоторых вариантах осуществления предоставляется способ получения α-синенсола, β-синенсола, α-санталола, β-санталола, α-транс-бергамотола, эпи-β-санталола, ланцелола и/или их смесей, включающий контактирование α-фарнезена, β-фарнезена, α-санталена, β-санталена, α-транс-бергамотена и/или эпи-β-санталена с полипептидом, содержащим аминокислотную последовательность, имеющую идентичность последовательности не менее или по меньшей мере около 45%, 50%, 55%, 60%, 65%, 70%, 80%, 90%, 95% или 98% с SEQ ID NO: 79. В отдельном варианте осуществления способ включает клетку, экспрессирующую данный полипептид.
В некоторых вариантах осуществления предоставляется способ получения α-синенсола, β-синенсола, α-санталола, β-санталола, α-транс-бергамотола, эпи-β-санталола, ланцелола и/или их смесей, включающий контактирование α-фарнезена, β-фарнезена, α-санталена, β-санталена, α-транс-бергамотена и/или эпи-β-санталена с полипептидом, содержащим аминокислотную последовательность, имеющую идентичность последовательности не менее или по меньшей мере около 45%, 50%, 55%, 60%, 65%, 70%, 80%, 90%, 95% или 98% с SEQ ID NO: 81. В отдельном варианте осуществления способ включает клетку, экспрессирующую данный полипептид.
Приведенные в данном документе нуклеотидные последовательности, которые используются для продуцирования полипептида, предназначенного для выработки спирта, имеют нуклеиновокислотную последовательность, идентичную не менее или по меньшей мере примерно на 45%, 50%, 55%, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 95% или 98% последовательности, выбранной из группы, состоящей из SEQ ID NO: 1, SEQ ID NO: 3, SEQ ID NO: 5, SEQ ID NO: 7, SEQ ID NO: 27, SEQ ID NO: 29, SEQ ID NO: 31, SEQ ID NO: 33, SEQ ID NO: 35, SEQ ID NO: 37, SEQ ID NO: 39, SEQ ID NO: 41, SEQ ID NO: 43, SEQ ID NO: 49, SEQ ID NO: 51, SEQ ID NO: 53, SEQ ID NO: 57, SEQ ID NO: 59, SEQ ID NO: 61, SEQ ID NO: 63, SEQ ID NO: 65, SEQ ID NO: 67, SEQ ID NO: 70 SEQ ID NO: 72, SEQ ID NO: 78 и SEQ ID NO: 80. Нуклеотидные последовательности, приведенные в данном документе, являются гетерологичными в том смысле, что они обычно и при обычных условиях не продуцируются клеткой, в которой они экспрессируются здесь, и в большинстве случаев не являются эндогенными для клетки, в которую они вводятся, - обычно их получают из другой клетки или синтетическим путем.
В другом варианте осуществления предоставляется способ получения сесквитерпенового спирта, в том числе α-синенсола, β-синенсола, α-санталола, β-санталола, α-транс-бергамотола, эпи-β-санталола, ланцелола и/или их смесей, включающий контактирование транс-α-фарнезена, транс-β-фарнезена, α-санталена, β-санталена, α-транс-бергамотена, эпи-β-санталена и/или β-бисаболена с полипептидом, обладающим Р450 монооксигеназной активностью, при этом вырабатываемый спирт содержит не менее или по меньшей мере около 36% цис-изомера и при этом полипептид содержит аминокислотную последовательность, имеющую идентичность последовательности не менее или по меньшей мере около 45%, 50%, 55%, 60%, 65%, 70%, 80%, 90%, 95% или 98% с полипептидом, имеющим аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 28, SEQ ID NO: 30, SEQ ID NO: 58, SEQ ID NO: 60, SEQ ID NO: 62, SEQ ID NO: 64, SEQ ID NO: 66, SEQ ID NO: 68, SEQ ID NO: 71 и SEQ ID NO: 73.
В другом варианте осуществления предоставляется способ получения сесквитерпенового спирта, в том числе α-синенсола, β-синенсола, α-санталола, β-санталола, α-транс-бергамотола, эпи-β-санталола, ланцелола и/или их смесей, включающий контактирование транс-α-фарнезена, транс-β-фарнезена, α-санталена, β-санталена, α-транс-бергамотена, эпи-β-санталена и/или β-бисаболена с полипептидом, обладающим Р450 монооксигеназной активностью, при этом вырабатываемый спирт содержит не менее или по меньшей мере около 46% цис-изомера и при этом полипептид содержит аминокислотную последовательность, имеющую идентичность последовательности не менее или по меньшей мере около 45%, 50%, 55%, 60%, 65%, 70%, 80%, 90%, 95% или 98% с полипептидом, имеющим аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 30, SEQ ID NO: 58, SEQ ID NO: 60, SEQ ID NO: 62, SEQ ID NO: 66, SEQ ID NO: 68, SEQ ID NO: 71 и SEQ ID NO: 73.
В другом варианте осуществления предоставляется способ получения сесквитерпенового спирта, в том числе α-синенсола, β-синенсола, α-санталола, β-санталола, α-транс-бергамотола, эпи-β-санталола, ланцелола и/или их смесей, включающий контактирование транс-α-фарнезена, транс-β-фарнезена, α-санталена, β-санталена, α-транс-бергамотена, эпи-β-санталена и/или β-бисаболена с полипептидом, обладающим Р450 монооксигеназной активностью, при этом вырабатываемый спирт содержит не менее или по меньшей мере около 50% цис-изомера и при этом полипептид содержит аминокислотную последовательность, имеющую идентичность последовательности не менее или по меньшей мере около 45%, 50%, 55%, 60%, 65%, 70%, 80%, 90%, 95% или 98% с полипептидом, имеющим аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 58, SEQ ID NO: 60, SEQ ID NO: 62, SEQ ID NO: 68, SEQ ID NO: 71, и SEQ ID NO: 73.
В другом варианте осуществления предоставляется способ получения сесквитерпенового спирта, в том числе α-синенсола, β-синенсола, α-санталола, β-санталола, α-транс-бергамотола, эпи-β-санталола, ланцелола и/или их смесей, включающий контактирование транс-α-фарнезена, транс-β-фарнезена, α-санталена, β-санталена, α-транс-бергамотена, эпи-β-санталена и/или β-бисаболена с полипептидом, обладающим Р450 монооксигеназной активностью, при этом вырабатываемый спирт содержит не менее или по меньшей мере около 72% цис-изомера и при этом полипептид содержит аминокислотную последовательность, имеющую идентичность последовательности не менее или по меньшей мере около 45%, 50%, 55%, 60%, 65%, 70%, 80%, 90%, 95% или 98% с полипептидом, имеющим аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 58, SEQ ID NO: 60, SEQ ID NO: 62, SEQ ID NO: 68, SEQ ID NO: 71, и SEQ ID NO: 73.
В другом варианте осуществления предоставляется способ получения сесквитерпенового спирта, в том числе α-синенсола, β-синенсола, α-санталола, β-санталола, α-транс-бергамотола, эпи-β-санталола, ланцелола и/или их смесей, включающий контактирование транс-α-фарнезена, транс-β-фарнезена, α-санталена, β-санталена, α-транс-бергамотена, эпи-β-санталена и/или β-бисаболена с полипептидом, обладающим Р450 монооксигеназной активностью, при этом вырабатываемый спирт содержит не менее или по меньшей мере около 96% цис-изомера, и при этом полипептид содержит аминокислотную последовательность, имеющую идентичность последовательности не менее или по меньшей мере около 45%, 50%, 55%, 60%, 65%, 70%, 80%, 90%, 95% или 98% с полипептидом, имеющим аминокислотную последовательность, выбранную из группы, состоящей из ID №: 68, SEQ ID NO: 71 и SEQ ID NO: 73.
В другом варианте осуществления предоставляется способ получения сесквитерпенового спирта, в том числе α-синенсола, β-синенсола, α-санталола, β-санталола, α-транс-бергамотола, эпи-β-санталола, ланцелола и/или их смесей, включающий контактирование транс-α-фарнезена, транс-β-фарнезена, α-санталена, β-санталена, α-транс-бергамотена, эпи-β-санталена и/или β-бисаболена с полипептидом, обладающим Р450 монооксигеназной активностью, при этом вырабатываемый спирт содержит не менее или по меньшей мере около 100% цис-изомера, и при этом полипептид содержит аминокислотную последовательность, имеющую идентичность последовательности не менее или по меньшей мере около 45%, 50%, 55%, 60%, 65%, 70%, 80%, 90%, 95% или 98% с полипептидом, имеющим аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 71 и 73.
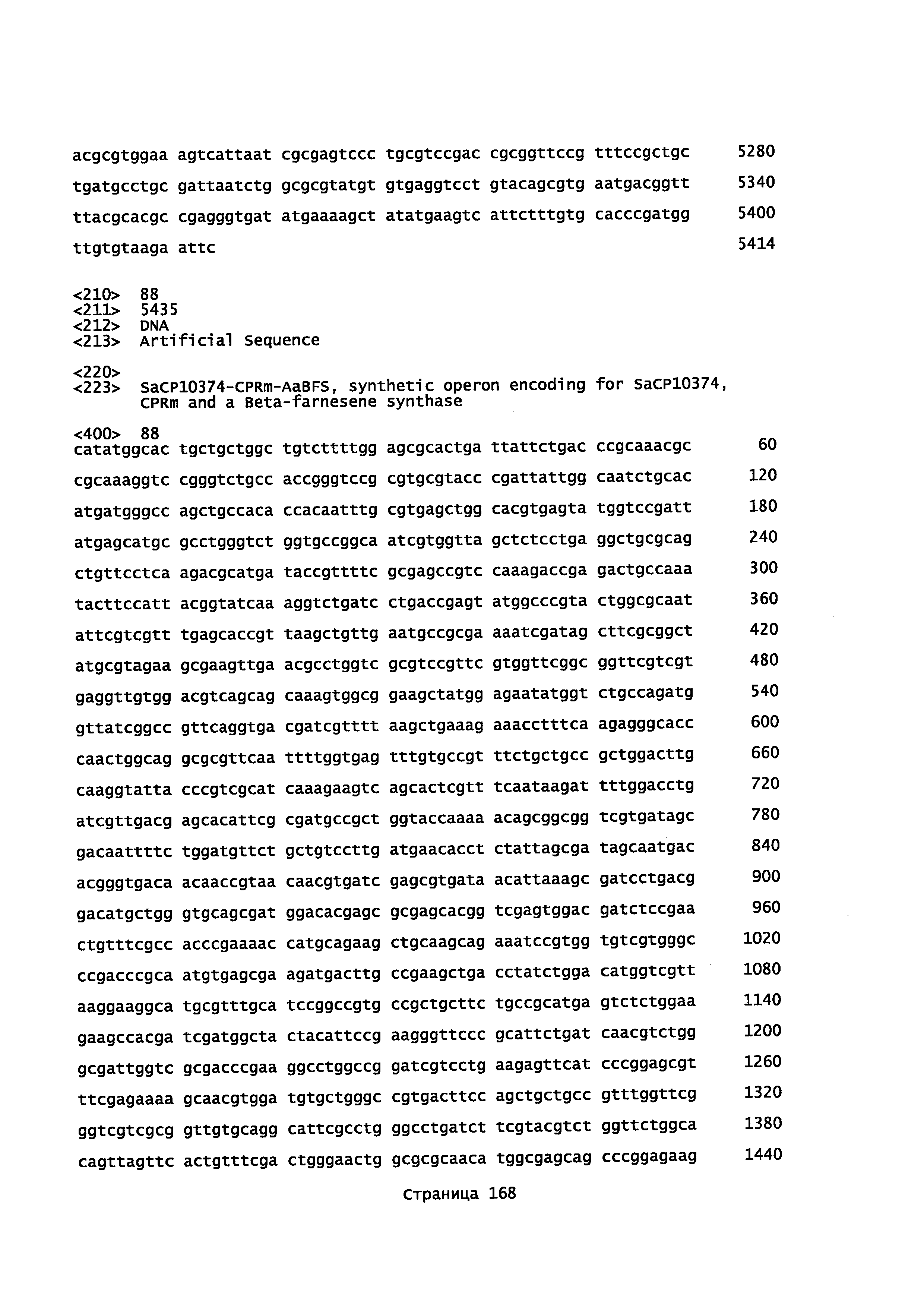
Также в описании предоставляется изолированная молекула нуклеиновой кислоты, выбранная из группы, состоящей из: i) нуклеиновой кислоты, имеющей нуклеиновокислотную последовательность, выбранную из группы, состоящей из SEQ ID. №: 70 и 72; и ii) молекулы нуклеиновой кислоты, которая кодирует полипептид, обладающий р450 монооксигеназной активностью, при этом полипептид содержит аминокислотную последовательность, идентичную не менее или по меньшей мере примерно на 45%, 50%, 55%, 50%, 65%, 70%, 80%, 90%, 95% или 98% или более аминокислотной последовательности, выбранной из группы, состоящей из SEQ ID NO: 71 и SEQ ID NO: 73. Конкретнее, закодированный полипептид имеет последовательность, выбранную из группы, состоящей из SEQ ID NO: 71 и SEQ ID NO: 73.
Также в описании предоставляется изолированная молекула нуклеиновой кислоты, выбранная из группы, состоящей из: i) нуклеиновой кислоты, имеющей нуклеиновокислотную последовательность, выбранную из группы, состоящей из SEQ ID. №: 78 и 80; и ii) молекулы нуклеиновой кислоты, кодирующей полипептид, обладающий р450 монооксигеназной активностью, при этом полипептид содержит аминокислотную последовательность, идентичную не менее или по меньшей мере примерно на 45%, 50%, 55%, 50%, 65%, 70%, 80%, 90%, 95% или 98% или более аминокислотной последовательности, выбранной из группы, состоящей из SEQ ID NO: 79 и SEQ ID NO: 82. Конкретнее, кодированный полипептид имеет последовательность, выбранную из группы, состоящей из SEQ ID NO: 79 и SEQ ID NO: 82.
Также в описании предоставляется изолированная молекула нуклеиновой кислоты, выбранная из группы, состоящей из: i) нуклеиновой кислоты, имеющей нуклеиновокислотную последовательность, выбранную из группы, состоящей из SEQ ID. №: 27, 29, 31, 33 и 35; и ii) молекулы нуклеиновой кислоты, кодирующей полипептид, обладающий р450 монооксигеназной активностью, при этом полипептид имеет последовательность, выбранную из группы, состоящей из SEQ ID NO: 28, SEQ ID NO: 30, SEQ ID NO: 32, SEQ ID NO: 34, SEQ ID NO: 36.
В другом варианте осуществления предоставляется способ получения полипептида, обладающего Р450 монооксигеназной активностью, включающий стадию трансформации клетки-хозяина или не относящегося к человеческому роду организма нуклеиновой кислотой, кодирующей полипептид, имеющий идентичность последовательности не менее или по меньшей мере около 45%, 50%, 55%, 50%, 65%, 70%, 80%, 90%, 95% или 98% с полипептидом, выбранным из группы, состоящей из SEQ ID NO: 71 и SEQ ID NO: 73, и стадию культивирования клетки-хозяина или организма при условиях, обеспечивающих выработку данного полипептида.
В следующем варианте осуществления предоставляется способ получения полипептида, обладающего Р450 монооксигеназной активностью, включающий стадии трансформации клетки-хозяина или не относящегося к человеческому роду организма нуклеиновой кислотой, кодирующей полипептид, имеющий последовательность, выбранную из группы, состоящей из SEQ ID NO: 71 и SEQ ID NO: 73, и культивирования клетки-хозяина или организма при условиях, обеспечивающих выработку данного полипептида.
В другом варианте осуществления предоставляется способ получения полипептида, обладающего Р450 монооксигеназной активностью, данный способ включает стадию трансформации клетки-хозяина или не относящегося к человеческому роду организма нуклеиновой кислотой, кодирующей полипептид, имеющий идентичность последовательности не менее или по меньшей мере около 45%, 50%, 55%, 50%, 65%, 70%, 80%, 90%, 95% или 98% с полипептидом, выбранным из группы, состоящей из SEQ ID NO: 79 и SEQ ID NO: 81, и стадию культивирования клетки-хозяина или организма при условиях, обеспечивающих выработку данного полипептида.
В еще одном варианте осуществления предоставляется способ получения полипептида, обладающего Р450 монооксигеназной активностью, включающий стадии трансформации клетки-хозяина или не относящегося к человеческому роду организма нуклеиновой кислотой, кодирующей полипептид, имеющий последовательность, выбранную из группы, состоящей из SEQ ID NO: 79 и SEQ ID NO: 81, и культивирования клетки-хозяина или организма при условиях, обеспечивающих выработку данного полипептида.
Спирты могут превращаться в альдегиды или кислоты, такие как, но без ограничения, синенсали, санталали, бергамотенали и ланцеали. Спирты, альдегиды или кислоты далее могут преобразовываться в их производные, такие как, но без ограничения, сложные эфиры, амиды, гликозиды, простые эфиры или ацетали.
Описанные в документе нуклеиновая кислота и полипептиды могут быть выделены из Cichorium intybus L., Bacillus megaterium, Santalum Album и Artemisia annua. CYP71AV8, P450-BM3 (CYP102A1) и CYP71AV1, включая варианты, описаны в данном документе.
CYP71AV8 из растения Cichorium intybus L. ранее был охарактеризован как Р450 монооксигеназа, способная регион-селективно окислять (+)-валенсен, продуцируя транс-нуткатол, цис-нуткатол и (+)-нуткатон. Также было обнаружено, что CYP71AV8 катализирует окисление гермакрена А и аморфа-4,11-диена в положении С-12 (Cankar et al., FEBS Lett. 585(1), 178-182 (2011)). Аминокислотная последовательность фермента дикого типа (учетный №NCBI ADM86719.1, SEQ ID NO 1 и 2) была использована для создания кДНК последовательности, оптимальной для экспрессии в Е. coli.
У эукариот Р450-моноооксигеназы являются мембраносвязанными белками, и N-концевая последовательность этих белков представляет собой «мембранный якорь», необходимый для локализации этих ферментов в мембране. Эта часть белка, обычно ограниченная обогащенным пролином доменом, не является существенной для контролирования специфичности ферментативной активности. Таким образом, этот участок может быть модифицирован делецией, вставкой или мутацией без воздействия на каталитическую активность. Однако было показано, что специфическая модификация N-концевого участка эукариотических P450s, включая P450s растений, оказывает положительное воздействие на уровни функциональных рекомбинантных белков, когда экспрессируется в микроорганизмах (Halkier et al., (1995) Arch. Biochem. Biophys. 322, 369-377; Haudenschield et al., (2000) Arch. Biochem. Biophys. 379, 127-136).
В P450 монооксигеназах распознавание и связывание субстрата контролируется некоторым количеством аминокислотных остатков, распределенных в различных участках вдоль белковых аминокислотных последовательностей. Эти участки, определенные как сайты распознавания субстрата (SRS), могут быть локализованы в аминокислотной последовательности любого Р450 с помощью простого выравнивания последовательности, исходя, например, из работы, выполненной Gotoh (Gotoh О (1992) J. Biol. Chem. 267(1), 83-90). Таким образом, остатки в белке CYP71AV8, которые взаимодействуют с субстратом и могут оказывать влияние на региоселективность реакции гидроксилирования, являются аминокислотами с Asn98 по Gly121, с Thr198 по Leu205, с Lys232 по Ile 240, с Asn282 по Ala300, с His355 по Arg367 и с Thr469 по Val 476. Модификация одного или более остатков в этих участках потенциально может изменить субстратную специфичность, стереохимию реакции или ее региоселективность. Один пример изменения региоселективности реакции, катализированной Р450, можно найти в Schalk et al., (2002) Proc. Natl. Acad. Sci. USA 97(22), 11948-11953. В данной публикации показано, что изменение одного остатка в растительных Р450 ферментах приводило к полному видоизменению региоспецифичности ферментативной реакции.
"Сесквитерпенсинтаза" или "полипептид, обладающий сесквитерпенсинтазной активностью" в целях настоящей заявки обозначает полипептид, способный катализировать синтез молекулы сесквитерпена или смеси сесквитерпеновых молекул из пирофосфата, предшественника ациклических терпенов, выбранного из группы, состоящей из геранилпирофосфата (GPP), фарнезилдифосфата (FPP) и геранилгеранилпирофосфата (GGPP).
Альфа сантален, бета-сантален, альфа-транс-бергамотен и/или эпи-бета-сантален могут быть получены с использованием синтаз, описанных, например, в патентной публикации США №2011-0008836, опубликованной 13 января 2011, и в патентной публикации США №2011-0281257, опубликованной 27 ноября 2011, которые полностью включаются в описание путем отсылки.
Согласно настоящему изобретению полипептиды также включают «укороченные» полипептиды, при условии, что они сохраняют Р450 монооксигеназную активность, как определено в любом из приведенных выше вариантов осуществления.
Процент идентичности между двумя пептидными или нуклеотидными последовательностями зависит от числа остатков аминокислот или нуклеотидов, которые являются идентичными в двух последовательностях при выравнивании этих двух последовательностей. Идентичными остатками называются остатки, являющиеся одинаковыми в двух последовательностях в данном положении при выравнивании. Процент идентичности последовательности, при использовании в описании, вычисляется на основании оптимального выравнивания, при этом число идентичных остатков между двумя последовательностями делят на общее количество остатков в более короткой последовательности и умножают на 100. Оптимальным выравниванием является выравнивание, при котором процент идентичности является максимально возможным. В одну или обе последовательности в одном или более положениях выравнивания могут быть введены «пропуски» с целью получения оптимального выравнивания. Затем эти «пропуски» учитываются как неидентичные остатки при вычислении процента идентичности последовательности.
Выравнивание с целью определения процента идентичности аминокислотной последовательности или последовательности нуклеиновых кислот может осуществляться различными способами с использованием компьютерных программ, например, общедоступных во всемирной компьютерной сети компьютерных программ. В частности, программа BLAST (Tatiana et al., FEMS Microbiol Lett., 1999, 174:247-250, 1999), использующая стандартные параметры, доступна от Национального центра биотехнологической информации (NCBI) на сайте http://www.ncbi.nlm.nih.gov/BLAST/bl2seq/wblast2.cgi и может использоваться для получения оптимального выравнивания пептидной или нуклеотидной последовательностей и вычисления процента идентичности последовательности.
Подразумевается, что конкретный организм или клетка является «способной продуцировать FPP» в том случае, когда она продуцирует FPP в естественных условиях или в том случае, когда она не продуцирует FPP в естественных условиях, но является трансформированной с целью продуцирования FPP, или перед трансформацией нуклеиновой кислотой, описанной в данном документе, или вместе с указанной нуклеиновой кислотой. Организмы или клетки, трансформированные с целью продуцирования повышенного количества FPP по сравнению с организмом или клеткой природного происхождения, также охватываются термином "организмы или клетки, способные продуцировать FPP". Методы трансформации организмов, например, микроорганизмов, для того, чтобы они продуцировали FPP, уже известны в данной области техники. Такие методы можно найти в литературе, например, в следующих публикациях: Martin, V.J., Pitera, D.J., Withers, S.T., Newman, J.D., и Keasling, J.D. Nat Biotechnol., 2003, 21(7), 796-802 (трансформация E. coli); Wu, S., Schalk, M., Clark, A., Miles, R.B., Coates, R., и Chappell, J., Nat Biotechnol, 2006, 24(11), 1441-1447 (трансформация растений); Takahashi, S., Yeo, Y., Greenhagen, В.Т., McMullin, Т., Song, L., Maurina-Brunker, J., Rosson, R., №el, J., Chappell, J., Biotechnology и Bioengineering, 2007, 97(1), 170-181 (трансформация дрожжей).
He принадлежащие к человеческому роду организмы-хозяева, подходящие для осуществления описанного в данном документе способа in vivo, могут быть любыми не принадлежащими к человеческому роду многоклеточными или одноклеточными организмами. В отдельном варианте осуществления не принадлежащим к человеческому роду организмом, используемым для осуществления изобретения in vivo, является растение, прокариот или гриб. Может использоваться любое растение, прокариот или гриб. Особенно подходящими являются растения, которые в естественных условиях продуцируют большие количества терпенов. В более конкретном варианте осуществления растение выбирают из семейства Solanaceae, Poaceae, Brassicaceae, Fabaceae, Malvaceae, Asteraceae или Lamiaceae. Например, растение выбирают из рода Nicotiana, Solanum, Sorghum, Arabidopsis, Brassica (рапс), Medicago (люцерна), Gossypium (хлопок), Artemisia, Salvia и Mentha. В частности, растение принадлежит к виду Nicotiana tabacum.
В более конкретном варианте осуществления не принадлежащим к человеческому роду организмом, используемым для осуществления способа изобретения in vivo, является микроорганизм. Может использоваться любой микроорганизм, однако согласно еще более конкретному варианту осуществления указанным микроорганизмом является бактерия или дрожжи. Конкретнее, указанная бактерия представляет собой Е. coli, а указанные дрожжи представляют собой Saccharomyces cerevisiae.
Некоторые из этих организмов не продуцируют FPP в естественных условиях. Чтобы быть пригодными для осуществления способа изобретения, эти организмы должны быть трансформированы так, чтобы они продуцировали указанный предшественник. Таким образом, они могут быть трансформированы или до модификации нуклеиновой кислотой, описанной соответственно вышеприведенным вариантам осуществления, или одновременно, как объяснялось выше.
Для осуществления способа изобретения in vivo вместо целых организмов в качестве хозяев также могут использоваться изолированные высшие эукариотические клетки. Подходящими эукариотическими клетками могут быть любые нечеловеческие клетки, в частности растительные и грибковые клетки.
При использовании в описании под полипептидом подразумевается полипептид или фрагмент полипептида, включающий аминокислотные последовательности, определенные в данном документе, а также укороченные полипептиды или варианты полипептидов, при условии, что они сохраняют свою Р450 монооксигеназную активность, определенную выше, и что они имеют по меньшей мере определенный процент идентичности с соответствующим полипептидом.
Примерами вариантов полипептидов являются природные белки, возникшие в результате событий альтернативного сплайсинга мРНК или протеолитического расщепления полипептидов, описанных в данном документе. Изменения, связанные с протеолизом, включают, например, различия в N- или С-концах в результате экспрессии в разных типах клеток-хозяев вследствие протеолитического удаления одной или более концевых аминокислот из полипептидов изобретения. Изобретение также рассматривает полипептиды, кодированные нуклеиновой кислотой, полученной в результате природной или искусственной мутации нуклеиновой кислоты изобретения, как описано в дальнейшем.
Варианты полипептидов, являющиеся результатом объединения с дополнительными пептидными последовательностями на амино- и карбоксильном концах, также могут использоваться в способах изобретения. В частности, такое объединение может увеличивать экспрессию полипептидов, может использоваться при очистке белка или улучшить ферментативную активность полипептида в желательной окружающей среде или экспрессирующей системе. Такие дополнительные пептидные последовательности могут быть, например, сигнальными пептидами. Соответственно, настоящее изобретение рассматривает способы, использующие варианты полипептидов, например, полученные путем «слияния» с другими олиго- или полипептидами и/или связанные с сигнальными пептидами. Полипептиды, полученные в результате «слияния» с другим функциональным белком, например, другим белком из пути биосинтеза терпенов, также могут успешно использоваться в способах изобретения.
При использовании в описании под полипептидом подразумевается полипептид или фрагмент полипептида, который содержит аминокислотную последовательность, определенную в данном документе, а также укороченные полипептиды или варианты полипептидов, при условии, что они сохраняют активность согласно вышеприведенному определению.
Примерами вариантов полипептидов являются природные белки, возникшие в результате событий альтернативного сплайсинга мРНК или протеолитического расщепления полипептидов, описанных в данном документе. Изменения, связанные с протеолизом, включают, например, различия в N- или С-концах в результате экспрессии в разных типах клеток-хозяев вследствие протеолитического удаления одной или более концевых аминокислот из полипептидов изобретения. Полипептиды, закодированные нуклеиновой кислотой, полученной в результате природной или искусственной мутации нуклеиновой кислоты изобретения, как описывается в дальнейшем, также рассматриваются изобретением.
Варианты полипептидов, являющиеся результатом объединения с дополнительными пептидными последовательностями на амино- и карбоксильном концах, также охватываются полипептидами изобретения. В частности, такое объединение может увеличивать экспрессию полипептидов, может использоваться при очистке белка или улучшить ферментативную активность полипептида в желательной окружающей среде или экспрессирующей системе также рассматриваются как полипептиды изобретения. Такие дополнительные пептидные последовательности могут быть, например, сигнальными пептидами. Соответственно, настоящее изобретение включает варианты полипептидов изобретения, например, полученные путем «слияния» с другими олиго- или полипептидами и/или связанные с сигнальными пептидами. Полипептиды, полученные в результате «слияния» с другим функциональным белком, например, другим белком из пути биосинтеза терпенов, также рассматриваются как полипептиды изобретения.
Нуклеиновая кислота изобретения может быть определена, как включающая дезоксирибонуклеотидные или рибонуклеотидные полимеры или в одно- или в двухцепочечной форме (ДНК и/или РНК). Термины "нуклеотидная последовательность" также следует понимать как содержащие молекулу полинуклеотида или молекулу олигонуклеотида в форме отдельного фрагмента или в качестве компонента более крупной нуклеиновой кислоты. Нуклеиновые кислоты изобретения также включают некоторые изолированные нуклеотидные последовательности, включая такие последовательности, которые практически не содержат загрязняющий эндогенный материал. Нуклеиновая кислота изобретения может быть укороченной, при условии, что она кодирует полипептид, рассматриваемый настоящим изобретением, как описано выше.
Другим важным средством трансформации организмов-хозяев или клеток, подходящим для осуществления способа изобретения in vivo, является вектор экспресии, содержащий нуклеиновую кислоту согласно любому варианту осуществления изобретения. Поэтому, такой вектор также является целью настоящего изобретения.
Использованный в описании термин "вектор экспрессии" включает любой линейный или круговой рекомбинантный вектор, включая, но не ограничиваясь этим, вирусные векторы, бактериофаги и плазмиды. Специалист способен выбрать подходящий вектор в соответствии с экспрессирующей системой. В одном варианте осуществления вектор экспресии включает нуклеиновую кислоту изобретения, функционально связанную по меньшей мере с одной регуляторной последовательностью, которая контролирует транскрипцию, трансляцию, инициацию и терминацию, такой как транскрипционный промотор, оператор или энхансер, или сайт связывания рибосомной мРНК и, необязательно, по меньшей мере один селективный маркер. Нуклеотидные последовательности являются "функционально связанными" в тех случаях, когда регуляторная последовательность функционально имеет отношение к нуклеиновой кислоте изобретения.
Векторы экспрессии настоящего изобретения могут использоваться в способах получения генетически трансформированного организма-хозяина и/или клетки, в организмах-хозяевах и/или клетках, содержащих нуклеиновые кислоты изобретения, и в методах создания полипептидов, обладающих Р450 монооксигеназной активностью, как раскрывается далее.
Рекомбинантные не принадлежащие к человеческому роду организмы-хозяева и клетки, трансформированные для того, чтобы содержать по меньшей мере одну нуклеиновую кислоту изобретения, дабы она гетерологично экспрессировала или сверх-экспрессировала по меньшей мере один полипептид изобретения, также являются весьма полезными средствами для осуществления способа изобретения. Вследствие этого такие не принадлежащие к человеческому роду организмы-хозяева и клетки являются другой целью настоящего изобретения.
Нуклеиновая кислота согласно любому из вышеперечисленных вариантов осуществления может быть использована для трансформирования не принадлежащих к человеческому роду организмов-хозяев и клеток, и экспрессированный полипептид может быть любым из вышеописанных полипептидов.
Не принадлежащие к человеческому роду организмы-хозяева изобретения могут быть любыми нечеловеческими многоклеточными или одноклеточными организмами. В отдельном варианте осуществления не принадлежащий к человеческому роду организм-хозяин является растением, прокариотом или грибом. Любое растение, прокариот или гриб подходит для осуществления трансформации согласно настоящему изобретению. Особенно подходящими являются те, которые естественным образом продуцируют большие количества терпенов. В более конкретном варианте осуществления растение выбирают из семейства Solanaceae, Poaceae, Brassicaceae, Fabaceae, Malvaceae, Asteraceae или Lamiaceae. Например, растение выбирают из рода Nicotiana, Solanum, Sorghum, Arabidopsis, Brassica (рапс), Medicago (люцерна), Gossypium (хлопок), Artemisia, Salvia и Mentha. В частности, растение может принадлежать к виду Nicotiana tabacum.
В более конкретном варианте осуществления не принадлежащий к человеческому роду организм-хозяин является микроорганизмом. Для целей настоящего изобретения пригоден любой микроорганизм, однако согласно еще более определенному варианту осуществления указанный микроорганизм является бактерией или дрожжами. В частности, указанная бактерия является Е. coli, и указанные дрожжи представляют собой Saccharomyces cerevisiae.
Вместо целых организмов также могут быть трансформированы изолированные высшие эукариотические клетки. В качестве высших эукариотических клеток мы подразумеваем в описании любые нечеловеческие эукариотические клетки, за исключением дрожжевых клеток. В частности, высшие эукариотические клетки являются растительными клетками или грибковыми клетками.
Термин "трансформированный" относится к тому факту, что «хозяин» был подвергнут генетической инженерии, чтобы иметь в своем составе одну, две или более копий каждой из нуклеиновых кислот, предусмотренных в любом из вышеописанных вариантов осуществления. В частности, термин "трансформированный" имеет отношение к «хозяевам», гетерологично экспрессирующим полипептиды, кодированные нуклеиновой кислотой, которой трансформированы «хозяева», а также к «хозяевам», сверхэкспрессирующим указанные полипептиды. Соответственно, в одном варианте осуществления настоящее изобретение предоставляет трансформированный организм, в котором полипептиды экспрессируются в большем количестве, чем в том же самом организме, не трансформированном указанным образом.
В данной области техники существует несколько известных способов создания трансгенных организмов- или клеток-хозяев, таких как растения, грибы, прокариоты или культуры высших эукариотических клеток. Клонирующие векторы или векторы экспрессии, подходящие для использования с бактериальными, грибковыми, дрожжевыми, растительными и клетками-хозяевами млекопитающих описаны, например, в Pouwels et al., Cloning Vectors: A Laboratory Manual, 1985, Elsevier, New York и Sambrook et al., Molecular Cloning: A Laboratory Manual, 2nd edition, 1989, Cold Spring Harbor Laboratory Press. В частности, специалисту доступны клонирующие векторы или векторы экспрессии для высших растений и/или растительных клеток. Смотри, например, Schardl et al. Gene 61:1-11, 1987.
Способы трансформации организмов- или клеток-хозяев с целью внесения трансгенных нуклеиновых кислот известны специалисту. Существующие в настоящее время методы создания, например, трансгенных растений включают электропорацию растительных протопластов, трансформацию, опосредованную липосомами, трансформацию, опосредованную агробактериями, трансформацию, опосредованную полиэтиленгликолем, бомбардировку частицами, микроинъекции растительных клеток и трансформацию с использованием вирусов.
В одном варианте осуществления трансформированная ДНК интегрируется в хромосому нечеловеческого организма-хозяина и/или клетки-хозяина, так что в результате получается устойчивая рекомбинантная система. Любой метод хромосомной интеграции, известный в данной области техники, может использоваться при осуществлении изобретения на практике, включая, но не ограничиваясь этим, опосредованный рекомбиназой кассетный обмен (RMCE), вирусные сайт-специфичные хромосомные вставки, аденовирусная и пронуклеарная инъекция.
"Вариант полипептида" в данном описании означает полипептид, обладающий описанной выше активностью и являющийся в большой степени гомологичным полипептиду согласно любому из вышеописанных вариантов осуществления, но имеющий аминокислотную последовательность, отличную от последовательности, кодированной любой из нуклеиновокислотных последовательностей изобретения по причине одной или более делеций, вставок или замен.
Варианты могут включать последовательности, содержащие консервативные замены, что означает, что данный аминокислотный остаток заменяется остатком, имеющим аналогичные физико-химические характеристики. Примеры консервативных замен включают замену одного алифатического остатка на другой, например, замену Ile, Val, Leu или Ala друг на друга, или замену одного полярного остатка на другой, например, замены между Lys и Arg; Glu и Asp; или Gln и Asn. Смотри Zubay, Biochemistry, 1983, Addison-Wesley Pub. Co. Воздействия таких замен могут быть вычислены с использованием матриц подсчета замен, таких как РАМ-120, РАМ-200 и РАМ-250 как обсуждается в Altschul, J. Mol. Biol., 1991, 219, 555-565. Хорошо известны другие подобные консервативные замены, например, замены целых областей, обладающих сходными характеристиками гидрофобности.
Варианты пептидов природного происхождения также рассматриваются изобретением. Примерами таких вариантов являются белки, возникшие в результате событий альтернативного сплайсинга мРНК или протеолитического расщепления полипептидов, описанных в данном документе. Изменения, связанные с протеолизом, включают, например, различия в N- или С-концах в результате экспрессии в разных типах клеток-хозяев, вследствие протеолитического удаления одной или более концевых аминокислот из полипептидов, кодированных последовательностями изобретения.
Варианты полипептидов изобретения могут использоваться для достижения, например, желательной повышенной или уменьшенной ферментативной активности, модифицированной региохимии или стереохимии, измененного расходования субстрата или распределения продукта, повышенного сродства к субстрату, улучшенной специфичности для продуцирования одного или более желательных соединений, повышенной скорости ферментативной реакции, более высокой активности или устойчивости в специфической окружающей среде (рН, температура, растворитель и т.д.) или повышенного уровня экспрессии в желательной экспрессирующей системе. Вариант или сайт-специфический мутант может быть получен с помощью любого метода, известного в данной области техники. Варианты и производные природных полипептидов могут быть получены путем изолирования существующих в природе вариантов или нуклеотидной последовательности вариантов, других или тех же самых линий или видов растений, например, растений вида Santalum, или путем искусственного программирования мутаций нуклеотидных последовательностей, кодирующих полипептиды изобретения. Изменения нативной аминокислотной последовательности могут быть осуществлены с помощью любого из целого ряда общепринятых методов.
Варианты полипептидов, являющиеся результатом объединения с дополнительными пептидными последовательностями на амино- и карбоксильном концах полипептидов изобретения, могут использоваться для увеличения экспрессии полипептидов, могут использоваться при очистке белка или для улучшения ферментативной активности полипептида в желательной окружающей среде или экспрессирующей системе. Такие дополнительные пептидные последовательности могут быть, например, сигнальными пептидами. Соответственно, настоящее изобретение рассматривает варианты полипептидов изобретения, например, полученные путем «слияния» с другими олиго- или полипептидами и/или связанные с сигнальными пептидами. Гибридные полипептиды, полученные в результате «слияния» с другими функциональными белками, например, другими белками из пути биосинтеза терпенов, также могут успешно использоваться в способах изобретения
Вырабатываемые спирты могут быть выделены путем экстракции, например, с помощью известных методов извлечения спиртов, продуцируемых в природе (например, экстракция из сандалового дерева). Спирты, полученные, как описано в данном документе, можно использовать в парфюмерии в качестве ароматических соединений.
Принятые сокращения
aaCPR Arthemisia annua цитохром Р450 редуктаза
по пара оснований
кб или тпо тысяча пар оснований
ДНК дезоксирибонуклеиновая кислота
кДНК комплементарная ДНК
ClASS Clausena lansium (+)-α-санталенсинтаза
CPRm Mentha piperita цитохром P450 редуктаза
DTT дитиотреитол
EDTA этилен-диамин-тетрауксусная кислота
FPP фарнезилпирофосфат
GC газовый хроматограф
IPTG изопропил-D-тиогалакто-пиранозид
LB лизогенный бульон
MS масс-спектрометр
МТВЕ метилтретбутиловый эфир
PCR полимеразная цепная реакция
RMCE опосредованный рекомбиназой кассетный обмен
РНК рибонуклеиновая кислота
мРНК матричная рибонуклеиновая кислота
SaSAS Santalum album (+)-α-сантален/(-)-β-сантален синтаза
Следующие примеры являются исключительно иллюстративными и не предназначаются для ограничения объема изобретения, установленного в разделах Раскрытие изобретения, Описание изобретения или в пунктах Формулы изобретения.
Примеры
Пример 1
Оптимизация кДНК последовательности CYP71AV8 для экспрессии в бактериях
Якорный участок мембраны CYP71AV8 был переконструирован для того, чтобы ввести модификации, подробно описанные ниже.
В оптимизированных последовательностях CYP71AV8 5'-конец был модифицирован, чтобы заменить первые аминокислоты мембранного якорного участка пептидной последовательностью, которая, как показано, улучшает гетерологичную экспрессию мембрано-связанньгх P450s в бактериальных клетках (Alkier, В.А. et al. Arch. Biochem. Biophys. 322, 369-377 (1995), Haudenschield, et al. Arch. Biochem. Biophys. 379, 127-136 (2000)). В дополнение к этому, для кДНК в целом, частота использования кодонов была приспособлена так, чтобы соответствовать частоте использования кодонов Е. Coli. Таким образом, было создано несколько кДНК для CYP71AV8 с различными 3'-концевыми модификациями и оптимизациями:
- CYP71AV8-65188: в этом конструкте 22 первых кодона были заменены последовательностью, кодирующей пептид MALLLAVFWSALIILV (SEQ ID NO 3 и 4).
- CYP71AV8-P2: вся якорь-кодирующая последовательность была заменена якорной последовательностью оптимизированной лимонен-гидроксилазы мяты (РМ2 в Haudenschield, et al. Arch. Biochem. Biophys. 379, 127-136 (2000)) (SEQ ID NO 5 и 6).
- CYP71AV8-P2O: этот конструкт кодирует тот же самый белок, как предыдущий, однако мембранный якорный участок был дополнительно кодон-оптимизирован (SEQ ID NO 7 и 8).
На фигуре 1 сравниваются аминокислотные последовательности N-концевых участков различных вариантов CYP71AV8, а на фигуре 2 сравниваются ДНК последовательности 3 конструктов. Три оптимизированных CYP71AV8 кДНК были синтезированы in vitro (DNA2.0, Menlo Park, CA, США) и клонированы как NdeI-HindIII фрагмент в pCWori+ экспрессионную плазмиду (Barnes, H.J. Method Enzymol. 272, 3-14; (1996)).
Пример 2
Функциональная экспрессия CYP71AV8 в бактериальных клетках
С целью гетерологичной экспрессии клетки JM109 Е. coli были трансформированы экспрессионными плазмидами CYP71AV8 (пример 1). Отдельные колонии трансформантов инокулировали (высевали) в 5 мл LB среды, содержащей 50 мкг/мл ампициллина. Клетки выращивали в течение 10-12 часов при 37°С. Затем культуры инокулировали в 250 мл ТВ среды (Terrific Broth) с добавлением 50 мкг/мл ампициллина и 1 мМ тиамина HCl. Культуры инкубировали при 28°С в течение 3-4 часов при умеренном встряхивании (200 об/мин) перед добавлением 75 мг/л δ-аминолевулиновой кислоты (sigma) и 1 мМ IPTG (изопропил β-D-1-тиогалактопиранозид), потом культуры поддерживали при 28°С в течение 24-48 час при встряхивании 200 об/мин.
Экспрессия Р450 ферментов может быть качественно и количественно оценена путем измерения спектра СО-связывания (Omura, Т. & Sato, R. (1964) J. Biol. Chem. 239, 2379-2387) во фракциях белка Е. coli. Для экстракции белка клетки центрифугировали (10 мин, 5000 g, 4°С) и ресуспендировали в 35 мл холодного как лед буфера 1 (100 мМ Трис-HCl рН 7.5, 20% глицерина, 0.5 мМ EDTA). Добавили один объем 0.3 мг/мл лизозима (Sigma-Aldrich) в воде и оставляли суспензию на 10-15 мин при 4°С при перемешивании. Суспензию центрифугировали 10 мин при 7000 g и 4°С, осадок ресуспендировали в 20 мл буфера 2 (25 мМ KPO4 рН 7.4, 0.1 мМ EDTA, 0.1 мМ DTT, 20% глицерин). Суспензию подвергали одному циклу замерзания-оттаивания при -80°С, добавили 0.5 мМ PMSF (фенилметилсульфонилфторид, Sigma-Aldrich) и обработали суспензию ультразвуком 3 раза по 20 сек. Суспензию центрифугировали 10 мин при 10000 g (чтобы удалить клеточный дебрис), супернатант восстановили и центрифугировали 2 часа при 100,000 g. Осадок (фракция мембранных белков) ресуспендировали в 2-3 мл буфера 3 (50 мМ Трис-HCl рН 7.4, 1 мМ EDTA, 20% глицерин). Чтобы измерить СО-спектр, белковую фракцию развели (1/10) в буфере 3 до окончательного объема 2 мл. Добавили несколько кристаллов натрия дитионита (Na2S2O4), образец разделили в две кюветы и зарегистрировали исходный уровень между 370 и 500 нм. Затем кювету с образцом пропитали монооксидом углерода и зарегистрировали разностный спектр. Концентрацию Р450 фермента можно вычислить, исходя из амплитуды пика при 450 нм с использованием коэффициента экстинкции восстановленного СО комплекса 91 мМ-1⋅см-1 (Omura, Т. & Sato, R. (1964) J. Biol. Chem. 239, 2379-2387).
Следуя этому методу, были измерены типичные СО-спектры с максимумом поглощения при 450 нм для рекомбинантного CYP71AV8, свидетельствуя о правильном свертывании в функциональных Р450 ферментах.
Пример 3
Ко-экспрессия CYP71AV8 и Р450-редуктазы в бактериях
Для воспроизведения активности растительных Р450 большое значение имеет присутствие второго мембранного белка. Этот белок, Р450-редуктаза (CPR), участвует в переносе электронов от кофактора NADPH (восстановленный никотинамидаденин динуклеотидфосфат) к активному центру Р450. Было показано, что CPR одного растения может дополнить активность Р450 фермента из другого растения (Jensen и Moller (2010) Phytochemsitry 71, 132-141). В литературе было описано несколько CPR-кодирующих ДНК последовательностей из разных растительных источников. Сначала мы выбрали CPR, ранее выделенную из Mentha piperita (CPRm, неопубликованные данные, SEQ ID NO 10), оптимизировали частоту использования кодонов кДНК полной длины (SEQ ID NO 9) и клонировали ее в NcoI и HindIII сайты рестрикции pACYCDuet-1 экспрессионной плазмиды (Novagen), получив плазмиду pACYC-CPRm.
CYP71AV8 и CPRm были ко-экспрессированы в клетках Е. Coli с использованием двух плазмид pCWori-CYP71AV8-65188 и pACYCDuet-CPRm. Клетки BL21 Star™(DE3) Е. coli (Invitrogen, Carlsbad, СА) были ко-трансформированы этими двумя плазмидами. Трансформированные клетки отбирали на LB-агарозных чашках с карбенициллином (50 мкг/мл) и хлорамфениколом (34 мкг/мл). Отдельные колонии инокулировали в 5 мл жидкой LB среды с добавлением подходящих антибиотиков. Культуру инкубировали в течение ночи при 37°С. На следующий день 0.2-2 мл выращенной в течение ночи культуры инокулировали в 2-250 мл ТВ среды с добавлением тех же самых антибиотиков. После 6 часов инкубации при 37°С культуры охладили до 28°С и добавили 1 мМ IPTG и 75 мг/л δ-аминолевулиновой кислоты. Через 16-24 часа клетки собирали в экспоненциальной фазе роста, центрифугировали и ресуспендировали в 0.5 объема калий-фосфатного буфера 50 мМ рН 7.0 с добавлением 5% глицерина или 3% глюкозы. Эти клетки использовали для оценки ферментативной активности Р450 ферментов.
Пример 4
Биопревращение (+)-α-санталена, (-)-β-санталена, (-)-α-транс-бергамотена и (+)-эпи-β-санталена с использованием клеток Е coli, экспрессирующих CYP71AV8
Различные сесквитерпеновые углеводороды, использованные в качестве субстратов в исследовании биопревращения, были получены, как описано ранее, с использованием клеток Е. coli, созданных для продуцирования фарнезил-дифосфата (FPP) из гетерологичного мевалонатного пути и экспрессирующих сесквитерпен-синтазу растительного происхождения. Конструирование и использование клеток-хозяев Е. coli было описано в патенте WO 2013064411 или в Schalk et a.l (2013) J. Am. Chem. Soc. 134, 18900-18903. Коротко, была создана экспрессионная плазмида, содержащая два оперона, состоящие из генов, кодирующих ферменты полного мевалонатного пути. Первый синтетический оперон, состоящий из генов Е. coli ацетоацетил-СоА тиолазы (atoB), Staphylococcus aureus HMG-CoA синтазы (mvaS), Staphylococcus aureus HMG-CoA редуктазы (mvaA) и Saccharomyces cerevisiae FPP синтазы (ERG20) был синтезирован in vitro (DNA2.0, Menlo Park, CA, USA) и лигирован в обработанный NcoI-BamHI pACYCDuet-1 вектор (Invitrogen), давая в результате pACYC-29258. Второй оперон, содержащий мевалонат киназу (MvaK1), фосфомевалонат киназу (MvaK2), мевалонат дифосфат декарбоксилазу (MvaD) и изопентенил дифосфат изомеразу (idi) был амплифицирован из геномной ДНК Streptococcus pneumoniae (АТСС ВАА-334) и лигирован во второй сайт множественного клонирования pACYC-29258, давая в результате плазмиду pACYC-29258-4506. Таким образом, эта плазмида содержит гены, кодирующие все ферменты биосинтетического пути, ведущие от ацетил-коэнзима А к FPP. Е. coli клетки (BL21 Star™(DE3), Invitrogen) были ко-трансформированы плазмидой pACYC-29258-4506 и либо плазмидой pET101-Cont2_1 (содержащей кДНК, кодирующую Clausena lansium (+)-α-сантален синтазу (ClASS), WO 2009109597) или плазмидой pETDuet-SCH10-Tps8201-opt (содержащей кДНК, кодирующую Santalum album (+)-α-сантален/(-)-β-сантален синтазу (SaSAS), WO 2010067309), и эти клетки использовали для продуцирования и выделения (+)-α-санталена или смеси (+)-α-санталена, (-)-β-санталена, (-)-α-транс-бергамотена и (+)-эпи-β-санталена.
Ферментативную активность CYP71AV8 оценивали по биопревращению в клетках Е. Coli с использованием перечисленных выше сесквитерпеновых молекул в качестве субстратов. Клетки BL21 Star™(DE3) Е. coli (Invitrogen), трансформированные плазмидами pACYCDuet- CPRm и pCWori-CYP71AV8-65188, культивировали и собирали, как описано в примере 3. Субстраты (сесквитерпеновые углеводороды) добавляли к клеточной суспензии до окончательной концентрации 0.5 мг/мл в виде смеси, состоящей из 10 мг Tween® 20 (sigma-Aldrich), 10 мг пеногасителя (Erol DF, PMC Ouvrie, Lesquin, Франция), 20 мг сесквитерпена и 1 мл воды. Превращение продолжалось в течение 24 часов при 20°С при умеренном встряхивании. Среды экстрагировали 2 объемами МТВЕ (метилтретбутиловый эфир, Sigma) и экстракты анализировали с помощью GCMS на системе Agilent 6890 Series GC, соединенной с масс-детектором Agilent 5975. GC был снабжен капиллярной колонкой 30m SPB-1 с внутренним диаметром 0.25 мм (Supelco, Bellefonte, РА). Газом-носителем был Не при постоянном потоке 1 мл/мин. Первоначальная температура в сушильном шкафу была 80°С (1 мин задержки) с последующим повышением 10°С/мин до 300°С. Идентификация продуктов основывалась на сравнении масс-спектров и индексов удерживания с внутренними стандартами и внутренними базами данных.
В этих условиях наблюдалось окисление (+)-α-санталена. Первичным продуктом превращения был (E)-α-санталол. Были обнаружены другие продукты, полученные в результате превращения (E)-α-санталола эндогенными ферментами Е. Coli: (E)-α-санталал (производимый алкоголь дегидрогеназой) и (E)-α-дигидросанталол (производимый эноат редуктазой) (фигура 3А). Аналогично, при использовании смеси (+)-α-санталена, (-)-β-санталена, (-)-α-транс-бергамотена и (+)-эпи-β-санталена в качестве субстрата наблюдалось образование (Е)-α-санталола, (Е)-β-санталола, (Е)-α-транс-бергамотола и (Е)-эпи-β-санталола, а также других метаболизированных продуктов (фигура 3В). Этот пример показывает, что CYP71AV8 может быть использован для конечного окисления (+)-α-санталена, (-)-β-санталена и структурно подобных молекул.
Пример 5
Создание синтетических оперонов для ко-экспрессии CYP71AV8 и CPR из отдельной плазмиды
Было создано несколько бицистронных оперонов для экспрессии Р450 фермента и CPR из одной плазмиды и под контролем единственного промотора. Три варианта оптимизированных CYP71AV8 кДНК (пример 1) были объединены с 2 CPR кДНК: кодон-оптимизированной CPRm кДНК (пример 2) и кодон-оптимизированной кДНК (SEQ ID NO 11), кодирующей Artemisia annua CPR (учетный №NCBI АВМ88789.1, SEQ ID NO 12). Таким образом, были созданы шесть конструктов (SEQ ID NO 13-18), каждый из которых содержал Р450 кДНК, за которой следует линкерная последовательность, включающая сайт связывания рибосом (RBS) и CPR кДНК (фигура 4). Эти конструкты были получены с помощью ПЦР: Р450 и CPR кДНКs были амплифицированы отдельно и с 5' и 3' липкими концами, подходящими для клонирования с использованием метода In-Fusion® (Clontech) в сайтах NdeI-HindIII плазмиды pCWori+.
Для того, чтобы оценить эффект различной N-концевой модификации, созданной на P450s, и соединение с CPRs, 6 плазмид были перенесены в клетки Е. Coli BL21 Star™(DE3), далее эти рекомбинантные клетки использовали в исследовании биопревращения, как описано в примере 4. В качестве субстратов использовали (+)-α-сантален и смесь (+)-α-санталена, (-)-β-санталена, (-)-α-транс-бергамотена и (+)-эпи-β-санталена, и оценивали количества всех оксигенированных сесквитерпеновых продуктов. Представленные на фигуре 5 результаты показывают, что все рекомбинантные бактериальные клетки, трансформированные одной из 6 плазмид, описанных выше, могут быть использованы для окисления (+)-α-санталена, (-)-β-санталена и структурно сходных молекул. Самый высокий титр был получен при использовании оперона, объединившего CYP71AV8-P20 кДНК и CPRm кДНК. Этот конструкт (плазмида pCWori-CYP71AV8-P2O-CPRm) использовали для следующих экспериментов.
Пример 6
Продуцирование оксигенированных сесквитерпенов в сконструированных клетках in vivo.
Окисленные продукты (+)-α-санталена и (+)-α-сантален, (-)-β-сантален, (-)-α-транс-бергамотен, (+)-эпи-β-сантален или другие структурно сходные молекулы также могут непосредственно продуцироваться в клетках Е. Coli, созданных для выработки сесквитерпенов из такого источника углерода, как глюкоза или глицерин. Были получены плазмиды, состоящие из pCWori+ плазмиды (Barnes H.J (1996) Method Enzymol. 272, 3-14), содержащей синтетический оперон, состоящий из Р450, CPR и терпенсинтазы. Для Р450 использовали CYP71AV8-P2 или CYP71AV8-P2O кДНК, а для терпенсинтазы использовали кДНК Clausena lansium (+)-α-сантален синтазы (ClASS) (WO 2009109597) или кДНК, кодирующую Santalum album (+)-α-сантален/(-)-β-сантален синтазу (SaSAS) (WO 2010067309). Таким образом, были созданы четыре плазмиды при помощи следующей методики. Была разработана кодон-оптимизированная версия ClASS кДНК (SEQ ID NO 19-20), синтезирована (DNA 2.0) и клонирована в сайты NdeI-KpnI плазмиды pETDUET-1 (Novagen), давая в результате плазмиду pETDuet-Tps2opt. Для SaSAS была разработана оптимизированная полноразмерная кДНК (SEQ ID NO 21-22), синтезирована и клонирована в pJexpress414 плазмиду (DNA2.0), давая в результате плазмиду pJ414-SaTps8201-l-FLopt. Для каждого конструкта были разработаны праймеры для клонирования с использованием метода In-Fusion® (Clontech, Takara Bio Europe). Оптимизированная ClASS кДНК и оптимизированная SaSAS кДНК были амплифицированы с использованием этих праймеров и плазмид pETDuet-Tps2opt и pJ414-SaTps8201-1-FLopt в качестве матрицы, соответственно. Два ПЦР-продукта были лигированы в плазмиды pCWori-CYP71AV8-P2-CPRm или pCWori-CYP71AV8-P2O-CPRm, обработанные HindIII ресрикционным ферментом, с использованием набора In-Fusion® Dry-Down PCR Cloning Kit (Clontech, Takara Bio Europe), что давало четыре новых плазмиды: pCWori-CYP71AV8-P2-CPRm-ClASS, pCWori-CYP71AV8-P2-CPRm-SaSAS, pCWori-CYP71AV8-P2O-CPRm-ClASS и pCWori-CYP71AV8-P2O-CPRm-SaSAS (SEQ ID NO 23-26).
Оценку продуктивности этих оперонов проводили в клетках Е. coli BL21 Star™(DE3) (Invitrogen), ко-трансформированных любой из 4 плазмид и плазмидой pACYC-29258-4506, несущей полный мевалонатный путь (пример 4). Трансформированные клетки отбирали на LB-агарозных чашках с карбенициллином (50 мкг/мл) и хлорамфениколом (34 мкг/мл). Отдельные колонии инокулировали в 5 мл жидкой LB среды с добавлением соответствующих антибиотиков. Культуры инкубировали в течение ночи при 37°С и 250 об/мин. На следующий день 200 мкл LB пред-культуры инокулировали в 2 мл ТВ-среды в стеклянных пробирках для культуры, содержащих 100 мкг/л карбенициллина и 17 мкг/л хлорамфеникола, и инкубировали при 37°С и 250 об/мин. Через 6 часов культивирования (или когда оптическая плотность культуры при 600 нм достигала значения 3) культуру охлаждали до 20°С, индуцировали экспрессию белков 0.1 мМ IPTG (изопропил β-D-1-тиогалактопиранозид) и добавляли 75 мкг/л δ-аминолевулиновой кислоты (sigma) и 2% (об./об.) декана. Через 48 часов инкубации при встряхивании 250 об/мин весь культуральный бульон экстрагировали 1 объемом МТВЕ и анализировали с помощью GCMS, как описано в примере 4.
Все полученные штаммы продуцировали сесквитерпеновые углеводороды, помимо того, что соответствующие окисленные продукты также наблюдались в экспериментах по биопревращению (Фигура 6). Этот эксперимент показывает, что при использовании сконструированных клеток, экспрессирующих CYP71AV8, могут продуцироваться сесквитерпены (Е)-α-санталол, (E)-β-санталол и другие структурно сходные молекулы.
Пример 7
Продуцирование (E)-α-санталола и (E)-β-санталола при использовании вариантов CYP71AV8
В предыдущих примерах мы продемонстрировали, что CYP71AV8 являлся высокоселективным в отношении «концевого транс-углерода» (+)-α-санталена и (-)-β-санталена и продуцировал исключительно (Е)-α-санталол, (Е)-β-санталол. В этом примере, мы описываем подход с использованием сайтнаправленного мутагенеза для модификации ферментативной активности CYP71AV8, для того, чтобы продуцировать (Z)-α-санталол и (Z)-β-санталол. Сначала был выбран L358 как остаток активного центра, контролирующий ферментативную активность. Целый ряд вариантов CYP71AV8 был получен путем замены кодона, кодирующего L358, кодонами, кодирующими другие аминокислоты. Мутация была введена в ходе двухстадийной ПЦР с использованием комбинации вырожденного кодона олигонуклеотида (содержащего NBT (N=A,C,G,T; B=C,G,T) вместо L358 кодирующего кодона) и специфических олигонуклеотидов. Эта комбинация олигонуклеотидов позволяет заменить L358 кодирующий кодон кодонами, кодирующими 12 других остатков, включая все аминокислоты с гидрофобной боковой цепью. Первая ПЦР был проведена, чтобы амплифицировать 5' участок кДНК с использованием мутагенеза обратного праймера AV8-L358-rev (5'-CACGCGGCATCACCAGCGGAVNCGGCGGATGCAGGCGCAGGGTTTCTTTAATC-3') и праймера AV8-pcw-fw (5'-CATCGATGCTTAGGAGGTCATATGGCTCTGTTATTAGCAG-3'). Второй ПЦР продукт был амплифицирован с использованием праймера AV8-L358-fw (5'-TCCGCTGGTGATGCCGCGTGAGTGC-3') и AV8-CPR-rev (5'-ATATATCTCCTTCTTAAAGTTAGTCGACTCATTAGGTG-3'). При проведении и той и другой амплификации в качестве матрицы использовали pCWori-CYP71AV8-P2-CPRm-ClASS. Второй «раунд» амплификации проводили с использованием двух вышеупомянутых ПЦР-продуктов в качестве матрицы и праймеров AV8-L358-fw + AV8-CPR-rev, что дало возможность амплифицировать полноразмерный CYP71AV8 вариант кДНК. Все ПЦР-реакции проводили с использованием PfuUltra II fusion HS ДНК полимеразы (Stratagene), следуя инструкциям производителя. Модифицированные кДНК лигировали в обработанную NdeI-SalI pCWori-CYP71AV8-P2-CPRm-ClASS с использованием Gibson Assembly Master Mix (New England Biolabs). Окончательные конструкции контролировали с помощью секвенирования, и один клон плазмиды был выбран для каждого желательного CYP71AV8 варианта. Таким образом, было получено двенадцать вариантов замены путем замены Leu358 на Ala, Phe, Thr, Ser, Val, Gly, Ile, Met, Pro, Tyr, Trp и Arg (SEQ ID NO 27-50).
Оценка каждого варианта CYP71AV8 была проведена с использованием метода in vivo продуцирования сесквитерпенов, описанного в примере 6. Коротко, pCWori + плазмида, содержащая один CYP71AV8 вариант кДНК, CPRm кДНК и ClASS кДНК была ко-трансформирована с pACYC-29258 плазмидой в клетках KRX Е. Coli (Promega). Трансформированные клетки отбирали, культивировали, и продукцию сесквитерпенов оценивали, как описано в примере 6. Как показано на фигуре 7, в отличие от фермента Р450 дикого типа некоторые из вариантов продуцировали (Z)-α-санталол в дополнение к транс-продуктам окисления. Для каждого варианта отношение цис к транс-окислению было вычислено путем деления общего количества продуцированного (Z)-α-санталола на общее количество оксигенированных производных α-санталена. Результаты этих вычислений для каждого варианта представлены в таблице 1 ниже:
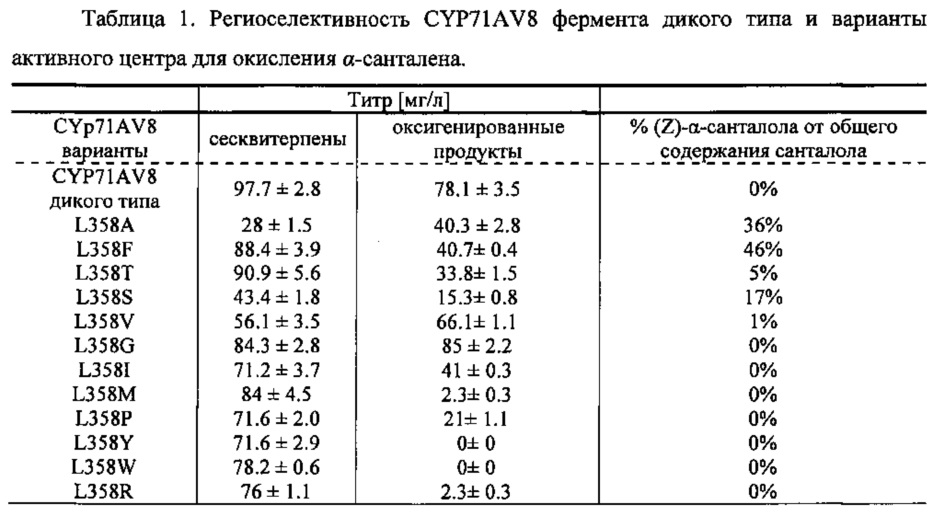
Представленные в таблице 1 (выше) результаты показывают, что CYP71AV8 может быть создан и использован для продуцирования (Z)-α-санталола. В частности, L358T, L358S, L358A и L358F варианты могут использоваться для терминального окисления (+)-α-санталена с селективностью в отношении цис-концевого углерода вплоть до 46%.
В рамках подобного метода были оценены варианты CYP71AV8 в отношении продуцирования (Z)-β-санталола. Новые плазмиды были получены путем замены ClASS кДНК в вышеупомянутой плазмиде на SaSAS кДНК. Таким образом, плазмида pCW-CYP71AV8-L358F-CPRm-ClASS была обработана рестрикционными ферментами HindIII и EcoRI, чтобы удалить ClASS кДНК. Одновременно, pCWori-CYP71AV8-P2-CPRm-SaSAS была обработана теми же самыми ферментами, чтобы восстановить SaSAS кДНК с совместимыми липкими концами. Линеаризированный вектор и обработанная вставка были лигированы с использованием Т4 ДНК лигазы (New England Biolabs). Полученную таким образом плазмиду использовали для получения in vivo оксигенированных сесквитерпенов в клетках Е. coli при тех же самых условиях, как описано выше. Фигура 8 предоставляет GCMS-профиль исследования продуктов, образованных CYP71AV8-L358F и показывает, что модифицированные CYP71AV8 ферменты также могут использоваться для продуцирования (Z)-β-санталола.
Пример 8
Оценка других членов семейства CYP71AV
CYP71AV1 (учетный №NCBI АВВ82944.1) был оценен в отношении окисления сесквитерпенов со скелетом санталена. Была получена плазмида с конфигурацией, подобной плазмидам, описанным в примере 5: был разработан бицистронный оперон, содержащий оптимизированную кДНК, кодирующую N-концевой модифицированный белок CYP71AV1 (SEQ ID NO 53 и 54), и aaCPR кДНК (пример 5), синтезирован in vitro (DNA2.0) и клонирован как бицистронный оперон в плазмиду pCWori+. Данную плазмиду использовали для трансформирования клеток KRX Е. Coli (Promega). Трансформированные клетки культивировали, и экспрессию белка индуцировали, как описано в примере 3. Эксперимент по биопревращению с использованием (+)-α-санталена в качестве субстрата был проведен, как описано в примере 4. Как показано на фигуре 9, были получены те же самые продукты, как при использовании CYP71AV8 (т.е. (Е)-α-санталол и (E)-α-санталал), показывая, что другие члены семейства CYP71AV Р450 могут использоваться для конечного окисления санталенов.
При использовании CYP71AV1, искусственного оперона, содержащего CYP71AV1 кДНК, была получена кДНК aaCPR и (+)-α-сантален синтазы (ClASS). Плазмида pCWori+, содержащая оперон CYP71AV8-P2-CPRm-ClASS (пример 6), была обработана NdeI и HindIII, чтобы вырезать кДНК, кодирующую Р450. Одновременно, CYP71AV1 кДНК была восстановлена из бицистронного оперона, описанного в предыдущем параграфе, путем обработки теми же самыми ферментами, и лигирована с использованием Т4 ДНК лигазы (New England Biolabs) в обработанную pCWori плазмиду, описанную выше, с получением в результате плазмиды pCWori-CYP71AV1-CPRm-ClASS. Эту плазмиду вместе с плазмидой pACYC-29258-4506 использовали для ко-трансформации клеток Е coli BL21 Star™(DE3) (Invitrogen). Рекомбинантные клетки культивировали в условиях, допускающих продуцирование сесквитерпеновых молекул, как описано в примере 6. GCMS-анализ полученного сесквитерпена подтвердил образование того же самого продукта, как в экспериментах по биопревращению. Этот эксперимент показывает, что CYP71AV1 также может использоваться для окисления санталеновых молекул и получения санталолов (фигура 9).
Пример 9
Создание библиотеки мутантов Р450-ВМ3 (CYP102A1)
Библиотека из 24 вариантов мутантов Р450-ВМ3 была создана путем последовательного комбинирования пяти гидрофобных аминокислот (аланина, валина, фенилаланина, лейцина и изолейцина) в двух положениях, расположенных близко к центру гемовой группы Р450-ВМ3. Было показано, что изменение размера боковой цепи этих двух аминокислот коренным образом изменяет форму связывающей субстрат полости в непосредственной близости от гемовой группы (Appl Microbiol Biotechnol 2006, 70:53; Adv Synth Catal 2006, 348:763). Известно, что первая «горячая точка» (Phe 87) изменяет субстратную специфичность и региоселективность, в то время как второе положение (Ala 328) взаимодействует со всеми субстратами во время окисления (ChemBiochem 2009, 10:853). Варианты Р450-ВМ3 были получены или с использованием набора для проведения сайт-направленного мутагенеза QuickChange™ (Invitrogen, Carlsbad, СА) или были химическим путем синтезированы с помощью DNA2.0 (Menlo Park, СА). Дикий тип и варианты Р450-ВМ3 были субклонированы в бактериальные экспрессирующие плазмиды pET22b, рЕТ28+, pETDuet-1 и pCDFDuet-1 (Novagen, Madison, WI) и были трансформированы в Escherichia coli BL21(DE3) или BL21Star™(DE3) (Invitrogen, Carlsbad, CA).
Пример 10
Альфа-сантален: in vitro скрининг P450-BM3 библиотеки
24 мутанта P450-BM3 и вариант фермента дикого типа были гетерологично экспрессированы в клетках Е. coli BL21(DE3), как сообщалось ранее (Adv. Synth. Catal. 2003, 345:802). Коротко, одну колонию трансформированных клеток использовали, чтобы инокулировать в 2 мл Luria-Bertani (LB) среды с добавлением 30 мкг/мл канамицина, выращивали при 37°С при круговом вращении (150 об/мин) до тех пор, пока OD578 не достигало значения 0.6-1.0. Эту пред-культуру использовали, чтобы инокулировать в 200 мл LB среды, содержащей 30 мкг/мл канамицина. Клетки росли при 37°С при круговом вращении 160 об/мин до значения OD578 0.8. Затем экспрессию белка индуцировали добавлением 0.35 мМ изопропил β-D-1-тиогалактопиранозида (IPTG). Через 6 часов роста при 30°С при постоянном перемешивании клетки собирали центрифугированием и лизировали ультразвуком.
Альфа-сантален, использованный в качестве субстрата в исследованиях по биопревращению, был получен, как описано в примере 4. Превращение проводили в 1 мл 50 мМ калий-фосфатного буфера, содержащего ~0.5 мкМ CYP фермента, 2% (об./об.) DMSO и 0.2 мМ μ-сантален субстрата. Реакцию начинали добавлением 0.1 мМ NADPH и проводили в течение 22 часов при комнатной температуре при умеренном встряхивании.
Затем образцы исследовали на приборе GC/MS QP-2010 (Shimadzu, Япония), снабженном колонкой FS-Supreme-5 (30 м×0.25 мм×0.25 мкм), газом-носителем был гелий (скорость потока: 0.68 мл/мин; линейная скорость: 30 см/сек). Масс-спектры получали с помощью ионизации электрораспылением. Температура инжектора бьша установлена 250°С. Термостат колонок был установлен на 50°С в течение 1 минуты, затем повышался до 170°С при 30°С/мин, затем повышался до 185°С при 5°С/мин, удерживал постоянную температуру в течение 3 мин, затем повышался до 200°С при 5°С/мин, затем повышался до 300°С при 30°С/ми и в конце удерживал постоянную температуру в течение 1 минуты.
Пример 11
Альфа-санталенх in vivo скрининг Р450-ВМ3 библиотеки
Был проведен скрининг библиотеки мутантов Р450-ВМ3 in vivo с использованием бактерильного штамма, созданного для продуцирования (+)-α-санталена из простого источника углерода. С этой целью, FPP-сверхпродуцирующий штамм, описанный в примере 4, был трансформирован pETDuet-1 плазмидой, содержащей кодон-оптимизированную версию (+)-α-сантален синтазы из Clausena lansium (ClASS) (WO 2009109597) (SEQ ID NO 19 и 20) и каждый из Р450-ВМ3 вариантов клонировали в первый и второй участки множественного клонирования (MCS) вектора, соответственно. Альтернативно, (+)-α-сантален синтаза кДНК бьша клонирована в рЕТ101 экспрессионную плазмиду (Novagen), а каждый из Р450-ВМ3 мутантов из библиотеки - в pCDFDuet-1 вектор (Novagen). Полученные в результате рекомбинантные векторы были ко-трансформированы в FPP-сверхпродуцирующий штамм.
Отдельные колонии трансформированных клеток использовали, чтобы инокулировать в 5 мл LB среды с добавлением соответствующих антибиотиков. Затем культуры инкубировали в течение ночи при 37°С и 250 об/мин. На следующий день 200 мкл выращенной в течение ночи культуры инокулировали в 2 мл Terrific Broth (ТВ) среды с добавлением 3% глицерина, 1 мМ тиамин-HCl (Sigma-Aldrich, St Louis, MI) и 75 мкг/л δ-аминолевулиновой кислоты (Sigma-Aldrich) и инкубировали при 37°С и 250 об/мин. После 6-8 часов культивирования (или когда оптическая плотность культуры при 600 нм достигала значения 2-3), культуры охладили до 28°С и индуцировали экспрессию белка 0.1 мМ IPTG. В это время 10% (об./об.) додекана добавили в ростовую среду. Через 48 часов инкубации при круговом вращении (250 об/мин) клеточную культуру дважды экстрагировали одним объемом метилтретбутилового эфира (МТВЕ) и экстракт растворителя анализировали с помощью GC/MS. GC/MS проводили на системе Agilent 6890 серия GC, снабженной DB1 колонкой (30 м × 0.25 мм × 0.25 мм толщина пленки; Agilent), а также на масс-спектрометре серии 5975. Газом-носителем был гелий при постоянном потоке 1 мл/мин. Использовали инжектор без деления потока, была установлена температура инжектора 250°С, а повышение температуры сушильной печи было запрограммировано в режиме от 50°С до 225°С при 10°С/мин и до 320°С при 20°С/мин. Идентичность продуктов была подтверждена, исходя из соответствия индексов удерживания масс-спектров аутентичных стандартов.
Скрининг in vitro (пример 10) и in vivo библиотеки мутантов Р450-ВМ3 дал сравнимые результаты, суммированные в таблице 2. В то время как Р450-ВМ3 дикого типа (SEQ ID NO 55 и 56) не проявляет какой-либо обнаружимой активности в отношении (+)-α-санталена, 6 Р450-ВМ3 вариантов были способны превращать α-сантален в желаемый α-санталол(ы). Эти варианты показали предпочтение в пределах от 45% до 96% в отношении окисления цис-концевого углерода (+)-α-санталена. Одинарный мутант #23 (A328V) (SEQ ID NO 67 и 68) и двойные мутанты #7 (F87I/A328I) (SEQ ID NO 57 и 58), #17 (F87V/A328I) (SEQ ID NO 59 и 60) и #18 (F87V/A328L) (SEQ ID NO 61 и 62) продемонстрировали самую высокую региоселективность в пределах от 72% до 96% (Таблица 2 и Фигура 10). Два дополнительных варианта #19 (F87V/A328V) (SEQ ID NO 63 и 64) и #20 (F87V/A328F) (SEQ ID NO 65 и 66) продемонстрировали меньшую селективность в отношении цис-гидроксилирования (в пределах 45%-50%) и продуцировали дополнительные продукты окисления.
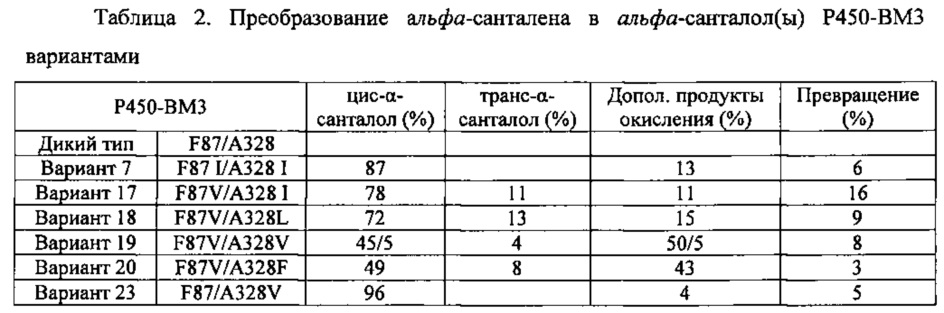
Эти результаты показывают, что Р450-ВМ3 мутации активных участков дают возможность связывания «неродного» субстрата (+)-α-санталена. Было показано, что выбранные Р450-ВМ3 варианты, включающие эти мутации, селективно гидроксилируют цис-концевой углерод (+)-α-санталена с образованием пахучего соединения (Z)-α-санталола (фигура 10).
Пример 12
In vivo продуцирование (Z)-α-санталола, (Z)-β-санталола, (Z)-α-транс-бергамотола и (Z)-эпи-β-санталола при использовании двойного мутанта Р450-ВМ3
Один из вариантов Р450-ВМ3, идентифицированный при скрининге α-санталена (вариант #17; таблица 2), был протестирован в отношении его способности окислять подобную маслу сандалового дерева смесь сесквитерпеновых углеводородов, состоящую из (+)-α-санталена, (-)-β-санталена, (-)-α-транс-бергамотена и (+)-эпи-β-санталена. С этой целью FPP-сверхпродуцирующий бактериальный штамм, описанный в примере 4, был трансформирован рекомбинантным pETDuet-1 экспрессионным вектором, содержащим кодон-оптимизированную кДНК, кодирующую Santalum album (+)-α-сантален/(-)-β-сантален синтазу (WO 2010067309) (SEQ ID NO 21 и 22) в первом MCS и Р450-ВМ3 вариант #17 во втором MCS. Клеточный рост, условия индукции, экстракцию культуры и анализ продукта проводили в основном, как описано в примере 11.
Как показано на фигуре 11, (+)-α-сантален, (-)-β-сантален, (-)-α-транс-бергамотен и (+)-эпи-β-сантален эффективно окислялись Р450-ВМ3 двойным мутантом с получением (Z)-α-санталола, (Z)-β-санталола, (Z)-α-транс-бергамотола и (Z)-эпи-β-санталола. Следует отметить, что при таких экспериментальных условиях были обнаружены только желательные цис-изомеры сесквитерпеновых спиртов. Эти данные показывают, что может быть сконструирован эффективный Bacillus megaterium CYP102A1 (Р450-ВМ3), предназначенный для селективного гидроксилирования цис-концевого углерода (+)-α-санталена, (-)-β-санталена и структурно сходных терпенов, таких как сесквитерпены с запахом бергамота, и для получения основных сесквитерпеновых спиртов, найденных в масле сандалового дерева.
Пример 13
Выделение кДНК, кодирующей SaCP816, цитохром Р450 из Santalum album
Семена S. album были получены от компании В&Т World Seeds (Aigues-Vives, Франция) и от компании Sandeman Seeds (Lalongue, Франция). Сначала поверхность семян простерилизовали в 2.5% хлорноватистой кислоте (HClO) в течение 120 мин, и промыли 3 раза в стерильной воде высшей степени очистки. Затем семена очистили и поместили на основную питательную среду MS (Murashige & Skoog, 1962, Physiologia Plantarum 15, 473-497) с добавлением 15 г/л сахарозы и 7.8 г/л агара, рН 5.7. Прорастание в большинстве случаев наблюдалось через 9-18 дней с выходом приблизительно 40%. Сеянцы Santalum album, полученные из семян, проросших в асептических условиях, были перенесены в почву через 5-10 недель после прорастания. Поскольку представители рода santalum являются корневыми полупаразитами, адаптация к почве проходила в тесном контакте с цитрусовыми растениями (Citrus sinensis) в возрасте от 6 месяцев до 1 года. Корни растений santalum собирали через 2-3 года после переноса в почву и отделяли от корней растения-хозяина. GC-MS анализ экстракта этих корней показал наличие характерных для сандалового дерева сесквитерпенов. Общую РНК извлекали из корней, используя реагент Concert™ Plant RNA Reagent (Invitrogen). Из 12 грамм ткани было выделено 640 микрограмм общей РНК.
Весь транскиптом был секвенирован с помощью оборудования Illumina Total RNA-Seq и секвенатора Illumina HiSeq 2000. В общей сложности 108.7 миллионов спаренных чтений 2×100 п.о. было образовано, «прочтения» были собраны при использовании программы сборки De №vo CLC-Bio Genomic Workbench (CLCBo, Дания). Всего 82'479 контигов со средним размером 683 п.о. было собрано. Поиск контигов проводили при помощи алгоритма tBlastn algorithm (Altschul et al., J. Mol. Biol. 215, 403-410, 1990), используя в качестве искомой последовательности известные Р450 аминокислотные последовательности, такие как последовательность CYP71AV1 (учетный №NCBI АВВ82944.1). Этот подход позволил идентифицировать несколько контигов, кодирующих белки с характерными мотивами цитохрома Р450. Один выбранный контиг, SCH37-Ct816 (SED ID №69), содержал открытую рамку считывания (ORF) (SEQ ID NO 70) длиной 1503 пар оснований, кодирующую белок из 500 аминокислот, SaCP816 (SEQ ID NO 71). Эта аминокислота продемонстрировала гомологию с известными последовательностями цитохрома Р450, ближайшей последовательностью является Р450 из Vitis vinifera, CYP71D10 (учетный №NCBI ААВ94588.1), имеющая 62% идентичности аминокислотной последовательности.
Пример 14
Гетерологичная экспрессия SaCP816 в бактериальных клетках
Для получения функциональной характеристики белка, кодированного SCH37-Ct816, этот белок гетерологично экспрессировался в клетках Е. coli. ORF-последовательность бьша модифицирована для улучшения экспрессии в Е. Coli: первые 17 кодонов были заменены кодонами, кодирующими MALLLAVFWSALIILV пептид и частота использования кодона полной ORF последовательности бьша модифицирована чтобы соответствовать частоте использования кодона Е. coli. Эта кДНК (SaCP120293 (SEQ ID NO 72), кодирующая модифицированный SaCP816 (SEQ ID NO 73), была синтезирована in vitro (DNA2.0) и клонирована в pJExpress404 плазмиду (DNA2.0). Гетерологичную экспрессию осуществляли, как описано в примере 2.
Пример 15
Ко-экспрессия SaCP816 и Р450-редуктазы в бактериях
Были созданы бицистронные опероны для экспрессии Р450 фермента и CPR из одной плазмиды и под контролем единственного промотора. Оптимизированная SaCP120293 кДНК была объединена с CPRm кДНК (SEQ ID NO 9, пример 3), чтобы получить бицистронный конструкт (SEQ ID NO 74), содержащий последовательно Р450 кДНК линкерную последовательность, включающую сайт связывания рибосом (RBS), и CPRm кДНК. Этот конструкт был получен с помощью ПЦР путем амплификации Р450 и CPR кДНКs отдельно и с 5' и 3' «липкими концами», пригодными для клонирования с использованием метода In-Fusion® (Clotech) в NdeI-HindIII сайтах pCWori+ плазмиды (Barnes H.J (1996) Method Enzymol. 272, 3-14), давая в результате плазмиду SaCP816-CPRm-pCWori (SEQ ID NO 74).
Клетки JM109 E.coli трансформировали SaCP816-CPRm-pCWori экспрессионной плазмидой. Выращивали трансформированные клетки и готовили бесклеточный экстракт, содержащий рекомбинантные белки, как описано в примере 2. Эту белковую фракцию использовали для оценки ферментативного превращения сесквитерпеновых молекул (пример 16).
Пример 16
In vitro преобразование (+)-α-санталена, (-)-β-санталена, (-)-α-транс-бергамотена и (+)-эпи-β-санталена с использованием рекомбинантного SaCP816 Р450 фермента
Различные сесквитерпеновые углеводороды, использованные в качестве субстратов в экспериментах по биопревращению, были получены, как описано в примере 4.
Неочищенный белковый экстракт из клеток Е. Coli, экспрессирующих рекомбинантные SaCP816 и CPRm белки (пример 15), был использован для окисления in vitro этих сесквитерпеновых молекул. Анализ проводили в 1 мл 100 мМ Трис-HCl рН 7.4 буфера, содержащего от 20 до 50 микролитров белкового экстракта, 500 микроМ NADPH (восстановленный никотинамиддинуклеотидфосфат), 5 микроМ FAD (флавинадениндинуклеотид), 5 микроМ FMN (флавинмононуклеотид) и 300 микроМ сесквитерпенов (или (α)-сантален или смесь (+)-α-санталена, (-)-β-санталена, (-)-α-транс-бергамотена и (-)-эпи-β-санталена). Через 2 часа инкубации в стеклянных пробирках с тефлоновым покрытием при осторожном перемешивании реакцию останавливали на льду и проводили экстракцию 1 объемом МТВЕ (метил-трет-бутиловый эфир, Sigma). Экстракты исследовали с помощью GCMS, как описано в примере 4.
При этих условиях наблюдалось окисление (+)-α-санталена, (-)-β-санталена, (-)-α-транс-бергамотена и (+)-эпи-β-санталена. Фигура 12 показывает, что окисление (+)-α-санталена SaCP816 дает (Z)-α-санталол. Фигура 13 показывает, что (+)-α-сантален, (-)-β-сантален, (-)-α-транс-бергамотен и (+)-эпи-β-сантален окислялись SaCP816 с образованием (Z)-α-санталола, (Z)-β-санталола, (Z)-α-транс-бергамотола и (Z)-эпи-β-санталола. Во всех анализах не наблюдалось обнаружимых количеств соответствующих транс-изомеров сесквитерпеновых спиртов (транс и цис изомеры любого сесквитерпенового спирта легко разделяются в условиях хроматографического разделения, использованных в данных анализах).
Эти эксперименты показывают, что цитохром Р450 ферменты, SaCP816, выделенные из Santalum album могут использоваться для селективного гидроксилирования цис-концевого углерода (+)-α-санталена, (-)-β-санталена и подобных сесквитерпеновых структур.
Пример 17
In vivo получение оксигенированных сесквитерпенов в сконструированных клетках с использованием рекомбинантного фермента SaCP816 Р450
Окисленные продукты (+)-α-санталена и (+)-α-сантален, (-)-β-сантален, (-)-α-транс-бергамотен, (+)-эпи-β-сантален или другие структурно сходные молекулы также могут продуцироваться непосредственно в клетках Е. Coli, созданных для продуцирования сесквитерпенов из таких источников углерода, как глюкоза или глицерин. Были изготовлены плазмиды, состоящие из pCWori+ плазмиды, содержащей искусственный оперон, состоящий из SaCP 120293 кДНК (SEQ ID NO 72), CPRm кДНК (SEQ ID NO 9) и кДНК, кодирующей терпенсинтазу. Для терпенсинтазы, была использована кДНК Clausena lansium (+)-α-санталенсинтазы (ClASS) (WO 2009109597) или кДНК, кодирующая Santalum album (+)-α-сантален /(-)-β-санталенсинтазу (SaSAS) (WO 2010067309).
Таким образом, были сконструированы две плазмиды с использованием метода, сходного с методом, описанным в примере 6. Кодон-оптимизированная кДНК (+)-α-санталенсинтазы (SEQ ID NO 19) и кДНК (+)-α-сантален/(-)-β-санталенсинтазы (SEQ ID NO 21) были амплифицированы, как описано в примере 6, и лигированы с использованием набора In-Fusion® Dry-Down PCR Cloning Kit (Clontech, Takara Bio Europe) в плазмиды SaCP816-CPRm-pCWori, обработанные HindIII рестрикционным ферментом, давая в результате две новые плазмиды SaCP816-CPRm-ClASS-pCWori (SEQ ID NO 75) и SaCP816-CPRm-SaSAS-pCWori (SEQ ID NO 76).
Оценка эффективности функционирования этих оперонов бьша проведена в клетках Е. coli XRX (Promega), ко-трансформированных любой из этих 2 плазмид и плазмидой pACYC-29258-4506, несущей полный мевалонатный путь (пример 4). Трансформированные клетки отбирали на LB-агарозных чашках с карбенициллином (50 мкг/мл) и хлорамфениколом (34 мкг/мл). Отдельные колонии использовали для инокулирования в 5 мл LB-среды с добавлением соответствующих антибиотиков. Культуры инкубировали в течение ночи при 37°С и 250 об/мин. На следующий день 200 мкл LB-пред-культуры инокулировали в 2 мл ТВ-среды в стеклянные пробирки для культуры, содержащие 100 мкг/л карбенициллина и 17 мкг/л хлорамфеникола, и инкубировали при 37°С и 250 об/мин. Через 6 часов культивирования (или когда оптическая плотность культуры при 600 нм достигала значения 3) культуру охлаждали до 20°С, индуцировали экспрессию белков 0.1 мМ IPTG (изопропил β-D-1-тиогалактопиранозид) и добавляли 75 мкг/л δ-аминолевулиновой кислоты (sigma) и 2% (об./об.) декана. Через 48 часов инкубации при встряхивании 250 об/мин весь культуральный бульон экстрагировали 1 объемом МТВЕ и анализировали с помощью GCMS, как описано в примере 4.
Все полученные штаммы продуцировали сесквитерпеновые углеводороды, а также соответствующие оксигенированные продукты, обнаруженные также в экспериментах in vitro (фигура 14). Этот эксперимент показывает, что при использовании сконструированных клеток, экспрессирующих SaCP816, могут продуцироваться сесквитерпены (Z)-α-санталол, (Z)-β-санталол и другие структурно сходные молекулы.
Пример 18
Выделение кДНК, кодирующей SaCP10374, цитохром Р450 из Santalum album
Как описано в примере 13, несколько Р450-кодирующих последовательностей контига были идентифицированы в транскриптоме из корней Santalum album. Кроме SCH37-Ct816, был отобран другой контиг: SCH37-Ct10374 (SEP ID №77), содержащий ORF длиной 1533 п.о. (SEQ ID NO 78), кодирующую белок, состоящий из 510 аминокислот, SaCP10374 (SEQ ID NO 79), демонстрирующий гомологию с известными последовательностями цитохрома Р450 и 58% идентичность с CYP71D10 из Vitis vinifera, CYP71D10.
Пример 19
Гетерологичная экспрессия SaCP10374 в бактериальных клетках и ко-экспрессия при помощи Р450-редуктазы в бактериях
Для получения функциональной характеристики ферментов, кодированных SCH37-Ct10374, данный белок гетерологично экспрессировался в клетках Е. coli. ORFs-последовательности были модифицированы, чтобы улучшить экспрессию в Е. Coli: 18 первых кодонов были заменены кодонами, кодирующими MALLLAVFWSALII пептид, при этом частота использования кодона полной ORF последовательности бьша оптимизирована. Новая кДНК, SaCP120292 (SEQ ID NO 80), кодирующая модифицированный SaCP10374 (SEQ ID NO 81), бьша синтезирована in vitro (DNA2.0) и клонирована в pJExpress404 плазмиду (DNA2.0).
Гетерологичная экспрессия проводилась, как описано в примере 2. Следуя данному методу, были измерены типичные СО-спектры с максимумом поглощения при 450 нм для этого нового рекомбинантного S. abum Р450, подтверждая правильное свертывание в функциональных Р450 ферментах.
С целью воссоздания активности этого Р450 фермента бьша ко-экспрессирована Р450 редуктаза (CPR). С этой целью были созданы бицистронные опероны, точно так же, как описано в примере 15, для экспрессии SaCP10374 и CPRm (Р450 редуктаза мяты) из одной плазмиды и под контролем единственного промотора. Оптимизированная SaCP12092 кДНК бьша объединена с CPRm кДНК, чтобы получить бицистронные конструкты (SEQ ID NO 82), содержащие последовательно линкерную последовательность Р450 кДНК, включающую сайт связывания рибосом (RBS) и CPRm кДНК. Этот конструкт был получен с помощью ПЦР, как описано в примере 15, и клонирован в pCWori+ плазмиду (Barnes H.J (1996) Method Enzymol. 272, 3-14), предоставляя плазмиду SaCP10374-CPRm-pCWori.
Клетки JM109 Е. coli были трансформированы этими бицистронными экспрессионными плазмидами. Трансформированные клетки выращивали, и готовили бесклеточный экстракт, содержащий рекомбинантные белки, как описано в примере 2. Фракции мембранных белков использовали для оценки ферментативного превращения сесквитерпеновых молекул (пример 21)
Пример 21
In vitro преобразование (+)-α-санталена, (-)-β-санталена и (-)-α-транс-бергамотена с использованием рекомбинантного фермента SaCP10374 Р450
Различные сесквитерпеновые углеводороды (или (α)-сантален или смесь (+)-α-санталена, (-)-β-санталена, (-)-α-транс-бергамотена и (+)-эпи-β-санталена), использованные в качестве субстратов в этом примере исследований по биопревращению, были получены, как описано в примере 4.
Неочищенный белковый экстракт из клеток Е. Coli, экспрессирующих рекомбинантные SaCP10374 и CPRm белки (пример 20), был использован для окисления in vitro этих сесквитерпеновых молекул. Анализ проводили, как описано в примере 16. Через 2 часа инкубации в стеклянных пробирках с тефлоновым покрытием при осторожном перемешивании реакцию останавливали на льду и проводили экстракцию 1 объемом МТВЕ (метил-трет-бутиловый эфир, Sigma). Экстракты исследовали с помощью GCMS, как описано в примере 4.
В этих условиях наблюдалось окисление (+)-α-санталена, (-)-β-санталена, (-)-α-транс-бергамотена и (+)-эпи-β-санталена SaCP10374. Фигура 15 и 16 показывает, что (+)-α-сантален, (-)-β-сантален, (-)-α-транс-бергамотен и (+)-эпи-β-сантален окислялись SaCP10374 с образованием (E)-α-санталола, (Е)-β-санталола, (Е)-α-транс-бергамотола и (Е)-эпи-β-санталола. Во всех анализах не наблюдалось обнаружимых количеств соответствующих цис-изомеров сесквитерпеновых спиртов (транс- и цис-изомеры любого сесквитерпенового спирта легко разделяются в условиях хроматографического разделения, использованных в данных анализах).
Эти эксперименты показывают, что фермент цитохром Р450 SaCP10374, выделенный из Santalum album, может использоваться для селективного гидроксилирования транс-концевого углерода (+)-α-санталена, (+)-β-санталена и структурно сходных сесквитерпеновых молекул.
Пример 22
In vitro превращение (Е)-β-фарнезена, (Е)-α-фарнезена, (-)-сесквисабинена В, (-)-β-бисаболена и (-)-α-транс-бергамотена при использовании рекомбинантного Р450 фермента SaCP816 и SaCP10374
С помощью метода, описанного в примере 4, были получены некоторые сесквитерпеновые углеводороды, структурно сходные с санталенами. (-)-Сесквисабинен В и (-)-β-бисаболен были получены при помощи pETDuet экспрессирующей плазмиды, содержащей или кДНК, кодирующую SaTps647, Santalum album (-)-сесквисабинен В синтазу (учетный №NCBI ADP37190.1) или кДНК, кодирующую SaTps30, Santalum album (-)-β-бисаболен синтазу (учетный №NCBI ADP37189.1), в комбинации с плазмидой pACYC-29258-4506, описанной в примере 4. β-фарнезен был получен от Bedoukian (Dambury, Ct, США), α-фарнезен от Treatt (Suffolk, UK) и (-)-α-транс-бергамотен был выделен из масла цитрусовых.
Неочищенные белковые экстракты из клеток Е. Coli, экспрессирующих рекомбинантный SaCP816 или SaCP10374 вместе с CPRm белками (примеры 15 и 20), были использованы для окисления in vitro этих сесквитерпеновых молекул. Анализы и идентификацию продуктов с помощью GCMS-анализа проводили, как описано в примере 16.
В этих условиях наблюдалось окисление (Е)-β-фарнезена, (Е)-α-фарнезена, (-)-сесквисабинена В, (-)-β-бисаболена и (-)-α-транс-бергамотена (фигуры 17-21). По отношению ко всем этим соединениям два S. album P450s являются региоселективными для одного из двух углеродов концевой гемм-диметиловой группы (R1 или R2 на фигуре 27): SaCP816 катализирует селективное окисление атома углерода метила в цис-положении относительно концевой двойной связи (R1 на фигуре 27), тогда как SaCP10374 катализирует окисление тех же самых субстратов исключительно на атоме углерода метальной группы в транс-положении относительно концевой двойной связи (R2 на фигуре 27). Транс- и цис-изомеры каждого сесквитерпенового спирта легко разделяются в условиях хроматографического разделения, использованных в этих анализах. Образование соответствующего альдегида в том случае, когда транс-метальная группа окисляется, связано с Е. coli активностью эндогенной алкогольдегидрогеназы.
Эти эксперименты показывают, что ферменты цитохром Р450, SaCP816 и SaCP10374, выделенные из Santalum album могут использоваться для селективного гидроксилирования цис-концевого и транс-концевого углерода, соответственно, различных сесквитерпеновых молекул, имеющих структурное сходство с β-фарнезеном, α-фарнезеном, (+)-α-санталеном, (-)-β-санталеном, (-)-α-транс-бергамотеном, (-)-сесквисабиненом В или (-)-β-бисаболеном.
Пример 23
In vivo продуцирование различных оксигенированных сесквитерпенов в сконструированных клетках с использованием рекомбинантного Р450 фермента SaCP816 или SaCP10374
Окисленные сесквитерпеновые молекулы, описанные в примерах 21 и 22, также могут быть получены непосредственно с использованием целых клеток, например, таких как клетки Е. coli, сконструированные для продуцирования сесквитерпенов из источника углерода, такого как глюкоза или глицерин. Были получены плазмиды, состоящие из pCWori+ плазмиды, содержащей искусственный оперон, состоящий из SaCP120293 кДНК (SEQ ID NO 72) или SaCP120292 (SEQ ID NO 80), CPRm кДНК (SEQ ID NO 9) и кодирующей терпенсинтазу кДНК (кодирующей одно из Artemisia annua β-фарнезенсинтазы кДНК (учетный №NCBI ААХ39387.1.1), Picea abies α-фарнезенсинтазы (учетный №NCBI AAS47697.1), S. album (-)-Сесквисабинен В (учетный №NCBI ADP37190.1), S. album (-)-β-бисаболенсинтазы (учетный №NCBI ADP37189.1), Clausena lansium α-санталенсинтазы (учетный №NCBI ADR71055.1) или S. album α-/β-санталенинтазы (учетный №NCBI ADP30867.1)).
Плазмиды, несущие различные комбинации искусственных оперонов, были получены с помощью следующего метода. Плазмида pD444-SR-AaBFS (содержащая оптимизированную кДНК, кодирующую AaBFS, Artemisia annua (Е)-β-фарнезен синтазу (учетный №NCBI ААХ39387.1), плазмида pD444-SR-PaAFS (содержащая оптимизированную кДНК, кодирующую PaAFS, Picea abies (Е)-α-фарнезен синтазу (учетный №NCBI AAS47697.1) были использованы для амплификации с помощью ПЦР кДНК (Е)-β-фарнезенсинтазы и (Е)-α-фарнезенсинтазы, соответственно. Плазмиды pETDuet-SaTps647 и pETDuet-SaTps30 (пример 22) были использованы в качестве матрицы для амплификации с помощью ПЦР кДНК сесквисабинен В синтазы и бисаболен синтазы, соответственно. Для каждого конструкта были созданы праймеры для клонирования с использованием метода In-Fusion® (Clontech, Takara Bio Europe). AaBFS кДНК была амплифицирована с использованием прямого праймера CPRm_aaBFS_Inf1 (TTACCTGCGTGATGTGTGGTAATAAAAGCTTAGGAGGTAAAAATGTCTACCCTGCCААТТТСТТС) и обратного праймера AaBFS_Inf2 (ATGTTTGACAGCTTATCATCGATAAGCTGAATTCTTACACAACCATCGGGTGCACAAAGAATG). PaAFS кДНК бьша амплифицирована с использованием прямого праймера CPRm_PaAFS_Inf1 (TTACCTGCGTGATGTGTGGTAATAAAAGCTTAGGAGGTAAAAATGGATCTGGCAGTGGAAATCGC) и обратного праймера PaAFS_Inf2 (CTCATGTTTGACAGCTTATCATCGATAAGCTGAATTCTTACATCGGGACCGGCTCCAGGACGGTGC). SaTps647 кДНк бьша амплифицирована с использованием прямого праймера CPRm_Tps647_inf1 (5'GCGTGATGTGTGGTAATAAAAGCTTAGGAGGTAAAAATGGCGACCGTTGTGGATGATTCT-3') и обратного праймера Tps647_Inf2 (GCTTATCATCGATAAGCTGAATTCTTACTCTTCATCCAGGGTAATCGGGTGGA). SaTps30 кДНК была амплифицирована с использованием прямого праймера CPRm_Tps30_Inf1- (GCGTGATGTGTGGTAATAAAAGCTTAGGAGGTAAAAATGGACGCATTCGCAACGAGCC) и обратного праймера Tps30_Inf2(GTGATGTGTGGTAATAAAAAGCTGAATTCTTAGTCCTCTTCATTCAGCGGGATCGGGTG).
ПЦР-продукты бьши лигированы в плазмиды SaCP816-CPRm-pCWori (SEQ ID NO 74) или SaCP10374-CPRm-pCWOri (SEQ ID NO 82), обработанные HindIII рестрикционным ферментом, при использовании набора In-Fusion® Dry-Down PCR Cloning Kit (Clontech, Takara Bio Europe), давая в результате новые плазмиды SaCP816-CPRm-SaTPS647-pCWori (SEQ ID NO 83), SaCP10374-CPRm-SaTPS647-pCWori (SEQ ID NO 84), SaCP816-CPRm-SaTPS30-pCWori (SEQ ID NO 85), SaCP10374-CPRm-SaTPS30-pCWori (SEQ ID NO 86), SaCP816-CPRm-AaBFS-pCWori (SEQ ID NO 87), SaCP10374-CPRm-AaBFS-pCWori (SEQ ID NO 88), SaCP816-CPRm-PaAFS-pCWori (SEQ ID NO 89), SaCP10374-CPRm-PaAFS-pCWori (SEQ ID NO 90), SaCP10374-CPRm-ClTps2-pCWori (SEQ ID NO 91) и SaCP10374-CPRm-SaTps8201-pCWori (SEQ ID NO 92).
Получение in vivo оксигенированных сесквитерпенов в клетках Е coli с использованием вышеупомянутых плазмид проводилось, как описано в примере 17. Все рекомбинантные бактериальные клетки, трансформированные этими плазмидами, продуцировали ожидаемые сесквитерпеновые углеводороды, а также в in vitro экспериментах были обнаружены соответствующие оксигенированные продукты (фигуры 22-26).
Реферат
Группа изобретений относится к биотехнологии, в частности к способу получения сесквитерпенового спирта, в том числе α-синенсола, β-синенсола, α-санталола, β-санталола, α-транс-бергамотола, эпи-β-санталола, ланцелола или их смеси. Осуществляют контактирование терпена формулы I:где R является насыщенной, мононенасыщенной или полиненасыщенной алифатической группой, состоящей из 9 атомов углерода, и где R может представлять собой разветвленную цепь или состоит из неароматического кольца, с полипептидом, обладающим P450 монооксигеназной активностью и содержащим аминокислотную последовательность, идентичную по меньшей мере 90% последовательности SEQ ID NO:71 или SEQ ID NO:73. Также предложены изолированный полипептид, обладающий Р450 монооксигеназной активностью, содержащий последовательность аминокислот, идентичную по меньшей мере на 90%, 95% или 98% или более с последовательностью SEQ ID NO:71 или SEQ ID NO:73, изолированная молекула нуклеиновой кислоты, кодирующая указанный полипептид, и экспрессионный вектор для производства полипептида, обладающего Р450 монооксигеназной активностью. 6 н. и 21 з.п. ф-лы, 27 ил., 23 пр.
Формула
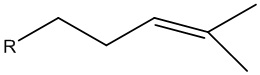

Комментарии