Новый полипептид системы цитохрома р450 с повышенной ферментной активностью - RU2677997C2
Код документа: RU2677997C2
Чертежи

Описание
Настоящее изобретение относится к цитохром-P450-зависимым монооксигеназам с повышенной ферментной активностью.
Митохондриальные P450 млекопитающих составляют небольшое семейство цитохромов, которые осуществляют специфические реакции в митохондриях и играют важную роль в метаболизме множества гидрофобных соединений. Например, P450c11-бета и P450c11AS (кодируемые генами CYP11B1 и CYP11B2) осуществляют соответственно конечную стадию биосинтеза глюкокортикоидов и минералокортикоидов. P450c11-бета представляет собой классическую стероид-11-бета-гидроксилазу, которая превращает 11-дезоксикортизол в гидрокортизон, тогда как P450c11AS катализирует преобразование дезоксикортикостерона в альдостерон в ходе трех последовательных стадий. CYP27A1 является другим примером P450 внутренней мембраны митохондрий, который представляет собой стерол-27-гидроксилазу и витамин D-25-гидроксилазу. И наконец, наиболее показательным митохондриальным P450 является P450scc (фермент, расщепляющий боковую цепь), кодируемый геном CYP11A1, который расщепляет боковую цепь холестерина, преобразуя, таким образом холестерин в прегненолон путем двух последовательных реакций гидроксилирования и конечного расщепления. P450scc осуществляет первую ключевую стадию биосинтеза стероидов путем преобразования стерола в стероид.
Способность P450 катализировать регио-, хемо- и стереоспецифическое окисление огромного количества субстратов отражает их биологические роли и делает их важными кандидатами для применения в биотехнологии. В частности, стероидные гормоны широко применяются в качестве противовоспалительных, контрацептивных и антипролиферативных лекарственных средств. У млекопитающих синтез данных стероидов начинается с реакции расщепления боковой цепи холестерина с превращением его в прегненолон. Прегненолон служит основой для дальнейшего получения стероидных гормонов, таких как гидрокортизон, и значительный интерес связан с его промышленным крупномасштабным превращением из недорогих субстратов, таких как холестерин и его аналоги растительного происхождения. Однако реакция расщепления боковой цепи холестерина с превращением его в прегненолон является лимитирующей стадией в общем процессе синтеза стероидов. У млекопитающих она катализируется мембраносвязанным ферментом CYP11A1.
Однако по множеству причин применение P450 в биотехнологии и в промышленности является затруднительным в плане реализации и не удовлетворяющим требованиям. Митохондриальный P450 использует специфическую цепь переносчиков электронов, образованную двумя белками, а именно ферредоксинредуктазой (FdxR) и ферредоксином (Fdx1), также называемыми адренодоксинредуктазой (AdR) и адренодоксином (Adx). В естественных условиях in vivo FdxR получает электрон от NADPH, а Fdx1 доставляет электрон от FdxR к митохондриальному P450. Была разработана система in vitro, где FdxR присутствует в каталитической концентрации (0,5 мкМ), а Fdx1 в насыщающей концентрации (10 мкМ). Для того, чтобы данная система in vitro была эффективной, электроны должны соответствующим образом переноситься к P450.
С целью устранения этих проблем некоторые авторы гибридизировали три пептида P450scc (или P450c11-бета), Fdx1 и FdxR с применением различных последовательностей шарнирных областей или линкерных последовательностей. Даже если в результате этой тройной гибридизации получают функциональный белок, его эффективность является низкой по сравнению с "истинным" полипептидом, и его нельзя применять в промышленном масштабе. Кроме того, в микробной рекомбинантной системе затруднительно имитировать митохондриальную среду. Например, полипептид P450scc можно соответствующим образом нацеливать на митохондрии дрожжей. Тем не менее, нацеливаемый полипептид не способен превращать стерол в прегненолон из-за отсутствия в митохондриях субстрата и/или из-за неправильного свертывания или нацеливания P450scc.
Для получения биосинтетического прегненолона из растительного стерола применяют различные рекомбинантные системы. К примеру, была разработана биосинтетическая система в дрожжах Saccharomyces cerevisiae. В данной системе P450scc вместе с FdxR и Fdx1 нацеливают за пределы митохондрий на плазматическую мембрану, а путь синтеза стеролов направляют на выработку стерола в мембране. Также P450c11-бета вместе с FdxR и Fdx1 можно нацеливать на митохондрии, где они могут превращать 11-дезоксикортизол в кортизол. Была разработана система превращения при помощи микроорганизмов в Bacillus megaterium. В данной системе холестерин можно превратить в прегненолон при помощи зрелых форм P450scc, Fdx1 и FdxR1. Биосинтез остается наиболее привлекательной технологией в промышленном масштабе, поскольку субстрат получают в виде растворимой молекулы из простого источника углерода при помощи хозяина, избегая таким образом обременительного применения детергентов.
Недавно были предприняты усилия для получения новых полипептидов P450scc с улучшенными свойствами. К примеру, был создан рекомбинантный мутант P450scc, несущий мутацию K193E. Данный мутант является более растворимым и, таким образом, менее склонным к агрегированию, чем рекомбинантный полипептид дикого типа. Следовательно, при использовании данного мутанта получают более высокий уровень экспрессии без изменения его ферментных характеристик. Однако по прежнему существует необходимость в улучшенных полипептидах P450scc с повышенной ферментной активностью, обеспечивающих оптимизированное получение стероидных гормонов, особенно подходящих для промышленных процессов.
Авторы настоящего изобретения разработали новый полипептид P450scc, несущий специфические мутации. Этот мутант неожиданно демонстрирует улучшенную ферментную активность относительно превращения субстрата в стероидные гормоны.
Таким образом, настоящее изобретение относится к новому выделенному ферменту P450, содержащему аминокислотную последовательность, которая по меньшей мере на 80% идентична SEQ ID NO: 1, или состоящему из нее, где указанная последовательность содержит треонин в положении, соответствующем положению 225, и/или мутацию по аспарагиновой кислоте в положении, соответствующем положению 289. В некоторых вариантах осуществления новый фермент P450 по меньшей мере на 85%, 90%, 95%, 98% или 99% идентичен SEQ ID NO:1.
Настоящее изобретение также относится к выделенной нуклеиновой кислоте, которая содержит нуклеотидную последовательность, кодирующую указанный фермент, или состоит из нее, к вектору, содержащему указанную нуклеиновую кислоту, которая функционально связана с последовательностями, контролирующими экспрессию, и к клетке-хозяину, содержащей указанную нуклеиновую кислоту или указанный вектор, при этом указанная клетка-хозяин представляет собой, например, микроорганизм.
В одном варианте осуществления настоящее изобретение предлагает микроорганизм, полученный при помощи генной инженерии, способный превращать субстрат в предшественника стероидных гормонов. Субстрат может представлять собой, например, полициклический ненасыщенный одноатомный спирт с алифатической боковой цепью, такой как холестерин, аналог холестерина или производное холестерина. Микроорганизм, полученный при помощи генной инженерии, содержит, например, нуклеиновую кислоту, кодирующую новый фермент P450, представленный в настоящем изобретении, и необязательно последовательность нуклеиновой кислоты, кодирующую адренодоксин (Adx), и/или последовательность нуклеиновой кислоты, кодирующую адренодоксинредуктазу (AdR).
В другом аспекте настоящее изобретение предлагает способ in vitro получения фермента P450, представленного в настоящем изобретении, при этом указанный способ включает стадии
a) культивирования клетки-хозяина в условиях, подходящих для достижения экспрессии фермента P450; и
b) извлечения экспрессируемого фермента.
В другом варианте осуществления фермент P450, представленный в настоящем изобретении, применяют для получения предшественника стероидных гормонов.
Настоящее изобретение дополнительно относится к способу получения предшественника стероидных гормонов, включающему стадии
a) получения микроорганизма, экспрессирующего фермент P450, представленный в настоящем изобретении,
b) культивирования указанного микроорганизма в условиях, обеспечивающих возможность экспрессии фермента P450,
c) приведения культуры микроорганизма, полученной на стадии b), в контакт с субстратом, выбранным из группы, состоящей из полициклических и ненасыщенных одноатомных спиртов с алифатической боковой цепью, таких как холестерин, аналог холестерина и производное холестерина, в условиях, обеспечивающих возможность получения предшественника стероидных гормонов из указанного субстрата при помощи микроорганизма, и
d) извлечения получаемого предшественника стероидных гормонов.
Настоящее изобретение также относится к способу, такому как способ in vitro, получения предшественника стероидных гормонов, включающему стадии
a) приведения фермента P450, представленного в настоящем изобретении, в контакт с выделенным полипептидом адренодоксином (Adx), выделенным полипептидом адренодоксинредуктазой (AdR) и субстратом, выбранным из группы, состоящей из полициклических и ненасыщенных одноатомных спиртов с алифатической боковой цепью, таких как холестерин, аналоги и производные холестерина, в условиях, обеспечивающих возможность преобразования указанного субстрата в предшественника стероидных гормонов, и
b) извлечения получаемого предшественника стероидных гормонов.
Стероидные гормоны широко применяются в качестве противовоспалительных, контрацептивных и антипролиферативных лекарственных средств. Настоящее изобретение является полезным для получения предшественника стероидных гормонов и обеспечивает синтез стероидных гормонов для применения у людей. Предшественник стероидных гормонов, такой как прегненолон, служит основой для дальнейшего получения стероидных гормонов, таких как гидрокортизон, и значительный интерес связан с его промышленным крупномасштабным превращением.
ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Ферменты
Под "выделенным" ферментом или полипептидом подразумевают, что фермент или полипептид уже не находится в своей природной среде в организме, в котором он изначально экспрессируется. Когда речь идет о ферменте или полипептиде, "очищенный" означает, что указанная молекула присутствует при фактическом отсутствии других биологических макромолекул такого же типа. Термин "очищенный", используемый в данном документе, означает, что присутствует по меньшей мере 75% по весу, по меньшей мере 85% по весу, по меньшей мере 95% по весу или по меньшей мере 98% по весу биологических макромолекул одного типа.
Термин "фермент системы цитохрома P450" или "фермент P450" относится к монооксигеназe, которая способна катализировать определенные реакции, как, например, рассматриваемые в Van Bogaert et al, 2011, FEBS J. 278(2): 206-221, или Urlacher and Girhard, 2011, Trends in Biotechnology 30(1): 26-36, или на веб-странице dmelson.uthsc.edu/CytochromeP450.html. В качестве примера такого фермента P450 дикого типа последовательность SEQ ID NO: 4 представляет зрелую форму CYP11A1 Bos taurus. Полная последовательность CYP11A1 Bos taurus, включающая в себя транзитный пептид, представлена как P00189 в базе данных UniProtKB/Swiss-Prot (последнее обновление последовательности: 21 июля 1986 г.).
Ферменты системы цитохрома P450, представленные в настоящем изобретении, могут быть мембраносвязанными (нерастворимыми) или цитоплазматическими (растворимыми) в их соответствующих исходных хозяевах. Например, P450scc (SEQ ID NO:4) катализирует реакцию расщепления боковой цепи полициклических и ненасыщенных одноатомных спиртов с алифатической боковой цепью, таких как холестерин, аналоги холестерина и его производные, с получением прегненолона или других предшественников и производных стероидных гормонов в качестве неограничивающего примера.
Авторы настоящего изобретения разработали новый фермент P450 с последовательностью SEQ ID NO: 1 с улучшенной ферментной активностью. По сравнению с SEQ ID NO: 4 (фермент scc дикого типа с R в положении 225 и N в положении 289) аминокислотная последовательность SEQ ID NO: 1 содержит две мутации: мутацию в виде замены аргинина на треонин в положении, соответствующем положению 225 в последовательности SEQ ID NO: 4, и мутацию в виде замены аспарагина на аспарагиновую кислоту в положении, соответствующем положению 289 в последовательности SEQ ID NO: 4.
В конкретном варианте осуществления новый фермент P450, представленный в настоящем изобретении, проявляет монооксигеназную активность, катализируя преобразование холестерина в прегненолон. В конкретном варианте осуществления новый фермент P450 проявляет по меньшей мере 80% или более, в частности, по меньшей мере 85%, 90%, 95%, 100%, 125%, 150%, 175%, 200%, 225%, 250%, 275%, более конкретно по меньшей мере 300% или более монооксигеназной активности фермента P450 с последовательностью SEQ ID NO: 4.
Выделенный фермент P450, представленный в настоящем изобретении, содержит аминокислотную последовательность, которая по меньшей мере на 80% идентична SEQ ID NO: 1, или состоит из нее, где указанная последовательность содержит треонин в положении, соответствующем положению 225, и/или аспарагиновую кислоту в положении, соответствующем положению 289. В некоторых вариантах осуществления новый фермент P450 по меньшей мере на 85%, 90%, 95%, 98% или 99% идентичен SEQ ID NO:1.
Изменения в аминокислотной последовательности можно вводить путем замены, делеции или вставки одного или нескольких кодонов в последовательности нуклеиновой кислоты, кодирующей фермент, что в результате приводит к изменению в аминокислотной последовательности фермента. Аминокислотные замены могут быть консервативными или неконсервативными. В некоторых вариантах осуществления замены представляют собой консервативные замены, при которых одна аминокислота заменена другой аминокислотой со сходными структурными и/или химическими свойствами.
"Консервативная аминокислотная замена" представляет собой замену, при которой аминокислотный остаток заменен другим аминокислотным остатком, содержащим R-группу боковой цепи со сходными химическими свойствами (например, зарядом или гидрофобностью). Как правило, консервативная аминокислотная замена практически не будет изменять функциональные свойства белка. Примеры групп аминокислот, которые содержат боковые цепи со сходными химическими свойствами, включают: 1) алифатические боковые цепи: глицин, аланин, валин, лейцин и изолейцин; 2) алифатические боковые цепи с гидроксильными группами: серин и треонин; 3) амидосодержащие боковые цепи: аспарагин и глутамин; 4) ароматические боковые цепи: фенилаланин, тирозин и триптофан; 5) основные боковые цепи: лизин, аргинин и гистидин; 6) кислые боковые цепи: аспарагиновая кислота и глутаминовая кислота; и 7) серосодержащие боковые цепи: цистеин и метионин. Группы консервативных аминокислотных замен представляют собой: валин-лейцин-изолейцин, фенилаланин-тирозин, лизин-аргинин, аланин-валин, глутамат-аспартат и аспарагин-глутамин.
Например, аминокислотная последовательность, которая по меньшей мере на 80% идентична SEQ ID NO: 1, может представлять собой полипептид по меньшей мере с одной заменой определенного аминокислотного остатка. В некоторых вариантах осуществления аминокислотная последовательность, которая по меньшей мере на 80% идентична SEQ ID NO: 1, характеризуется по меньшей мере приблизительно 80%, 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% идентичностью аминокислотной последовательности с последовательностью SEQ ID NO: 1. Идентичность аминокислотных последовательностей определяется как процент аминокислотных остатков в последовательности, которая по меньшей мере на 80% идентична SEQ ID NO: 1, которые идентичны аминокислотным остаткам в эталонной последовательности SEQ ID NO: 1, после выравнивания последовательностей и введения гэпов, если это необходимо, для достижения максимального процента идентичности, и без учета каких-либо консервативных замен как части идентичности последовательностей. Идентичность последовательностей можно определять по всей длине по меньшей мере на 80% идентичной последовательности, по всей длине эталонной последовательности или по всей длине их обеих. Процент идентичности аминокислотных последовательностей можно рассчитать путем проведения парного глобального выравнивания последовательностей на основе алгоритма выравнивания Нидлмана-Вунша для нахождения оптимального выравнивания (с учетом гэпов) двух последовательностей по всей их длине, например, с использованием Needle и с использованием матрицы BLOSUM62 со штрафом за открытие гэпа, составляющим 10, и штрафом за продолжение гэпа, составляющим 0,5.
В ферменте P450, содержащем аминокислотную последовательность, которая по меньшей мере на 80% идентична SEQ ID NO: 1, или состоящем из нее, аминокислотные модификации по сравнению с SEQ ID NO: 1, как правило, находятся в положениях таким образом, что они существенно не нарушают биологическую активность фермента. В действительности, аминокислотная последовательность цитохрома Р450, демонстрирующая по меньшей мере 80% идентичность с SEQ ID NO: 1, проявляет по меньшей мере такую же биологическую активность, как и полипептид с последовательностью SEQ ID NO: 1.
"Такая же биологическая активность" может означать такую же биологическую функцию. Следовательно, полипептид, обладающий по меньшей мере такой же биологической активностью, как и полипептид с последовательностью SEQ ID NO: 1, может, к примеру, представлять собой полипептид, обладающий монооксигеназной активностью. Методики определения монооксигеназной активности фермента хорошо известны специалисту в данной области. К примеру, полипептид, обладающий по меньшей мере такой же биологической активностью, как и полипептид с последовательностью SEQ ID NO: 1, может представлять собой полипептид, способный катализировать реакцию расщепления боковой цепи полициклических и ненасыщенных одноатомных спиртов с алифатической боковой цепью, таких как холестерин, аналоги и производные холестерина, с получением прегненолона или других предшественников и производных стероидных гормонов в качестве неограничивающего примера. В данном случае каталитическую активность соединения может легко оценить in vitro (что показано в Woods, S. T., J. Sadleir, et al. (1998) "Expression of catalytically active human cytochrome p450scc in Escherichia coli and mutagenesis of isoleucine-462."; Arch Biochem Biophys353(1): 109-15) или in vivo (что показано в Duport, C., R. Spagnoli, et al. (1998) "Self-sufficient biosynthesis of pregnenolone and progesterone in engineered yeast"; Nat Biotechnol16(2): 186-9) специалист в данной области, например, при помощи описанного в примере 1 протокола.
Как правило, каталитическую активность можно тестировать в анализепревращения in vitro, в котором 150 мМ буфер HEPES, доведенный до рН 7,4, содержащий 0,05% Tween-20 и 1 мМ MgCl2, можно использовать в качестве рабочего буферного раствора. В качестве системы восстановления NADPH может служить 1 единица глюкозо-6-фосфатдегидрогеназы с 5 мМ глюкозо-6-фосфата в качестве субстрата. Как правило, концентрации CYP11A1, Adx и AdR могут составлять соответственно 1 мкМ, 20 мкМ и 0,5 мкМ или 0,25 мкМ, 5 мкМ и 0,125 мкМ. В качестве субстрата для CYP11A1 могут служить 20 мкМ холестерина, растворенного в 45% 2-гидроксипропил-β-циклодекстрине. Как правило, образцы предварительно нагревают до 37°C, и реакцию начинают путем добавления NADPH до конечной концентрации 100 мкМ. Смеси можно инкубировать при 37°C с перемешиванием в течение 30 с. Реакцию можно остановить путем кипячения образцов в воде в течение 30 с. Для обеспечения возможности фотометрического детектирования при 240 нм стероиды можно подвергнуть превращению в их 3-кето-Δ4-производные с применением холестериноксидазы из Nocardia spec. Как правило, к образцам добавляют 20 мкл раствора холестериноксидазы (5 мг холестериноксидазы и 5 мг холата Na, растворенные в 5 мл 50 мМ буфера HEPES с pH 7, содержащего 0,05% Tween-20). После инкубирования при 37°C в течение 1 ч. в реакционные смеси в качестве внутреннего стандарта можно добавлять 11-дезоксикортикостерон (DOC) с последующим 2-кратным экстрагированием равными объемами этилацетата. После выпаривания экстракты можно растворить в смеси ацетонитрил/вода.
Каталитическую активность также можно тестировать в анализепревращения in vivo, в котором превращение 300 мкМ холестерина в прогестерон, как правило, оценивают при помощи HPLC через 24 ч. Bacillus megaterium можно культивировать в среде TB, содержащей 10 мкг/мл тетрациклина, при 37°C со встряхиванием при 180 об./мин. Экспрессию белка можно индуцировать путем добавления 0,25 г ксилозы, растворенной в 1 мл воды, с последующим дальнейшим добавлением субстрата, растворенного в 2‐гидроксипропил‐β‐циклодекстрине.
Можно провести выравнивание последовательности SEQ ID NO: 1 с аминокислотной последовательностью, которая по меньшей мере на 80% идентична SEQ ID NO: 1. Поскольку эти две последовательности имеют высокий процент идентичности, большинство их аминокислот являются идентичными. Следовательно, нумерацию аминокислот можно определить для обеих последовательностей таким образом, что по меньшей мере 80% аминокислот, присутствующих в положениях с одним и тем же номером в обеих последовательностях, являются идентичными (посредством введения гэпов, если это необходимо, для достижения максимального процента идентичности последовательностей). В данном контексте "положение, соответствующее положению X" в последовательности SEQ ID NO: 1 означает положение с указанным номером X в последовательности, которая по меньшей мере на 80% идентична SEQ ID NO: 1. Таким образом, последовательность SEQ ID NO: 1 может быть принята в качестве "эталонной последовательности" для нумерации положений аминокислот при выравнивании с аминокислотной последовательностью, которая по меньшей мере на 80% идентична SEQ ID NO: 1, таким образом, что по меньшей мере 80% аминокислот, присутствующих в "соответствующих положениях" в обеих выровненных последовательностях, являются идентичными.
В одном варианте осуществления выделенный фермент P450, представленный в настоящем изобретении, содержит аминокислотную последовательность, которая по меньшей мере на 80% идентична SEQ ID NO: 1, или состоит из нее, где указанная последовательность содержит как треонин в положении, соответствующем положению 225, так и аспарагиновую кислоту в положении, соответствующем положению 289.
В другом варианте осуществления фермент P450, представленный в настоящем изобретении, содержит последовательность, выбранную из группы, состоящей из SEQ ID NO: 1, SEQ ID NO: 2 и SEQ ID NO: 3, или состоит из нее.
В еще одном варианте осуществления фермент P450, представленный в настоящем изобретении, состоит из последовательности SEQ ID NO: 1.
Фермент, представленный в настоящем изобретении, может содержать одну или несколько меток, которые могут облегчать его очистку. Например, метка может представлять собой полигистидиновую (поли-His) метку.
Нуклеиновые кислоты, векторы, клетки-хозяева и способ получения фермента
В одном варианте осуществления в настоящем изобретении представлена выделенная нуклеиновая кислота, которая содержит последовательность, кодирующую фермент P450, представленный в настоящем изобретении, или состоит из нее.
Выделенные нуклеиновые кислоты, представленные в настоящем изобретении, называемые также полинуклеотидами, могут представлять собой молекулы ДНК или РНК, которые кодируют фермент P450, определенный в разделе "Ферменты", с учетом при этом вырожденности генетического кода. Выделенные нуклеиновые кислоты можно получить при помощи стандартных методик, хорошо известных специалистам в данной области, как, например, посредством амплификации или полимеризации ДНК in vitro, синтеза генов in vitro, лигирования олигонуклеотидов или с использованием комбинации данных методик.
Нуклеиновые кислоты в настоящем изобретении преимущественно представлены в выделенной или очищенной форме. Термины "очищенная" и "выделенная" имеют то же значение, что определено выше.
Специалисту в данной области будет понятно, что в ряде случаев преимущественным будет получение нуклеотидсодержащей молекулы, кодирующей полипептид, которая имеет кодоны, не встречающиеся в природе в природной нуклеотидсодержащей молекуле. Например, кодоны, предпочтительные для конкретного прокариотического или эукариотического хозяина, можно выбирать для повышения степени экспрессии рекомбинантного полипептида.
Нуклеиновая кислота, представленная в настоящем изобретении, может также содержать последовательности, кодирующие метки, белки-носители, сигнальные пептиды, или нетранскрибируемые или нетранслируемые последовательности, повышающие экспрессию или стабильность молекулы.
Нуклеиновые кислоты, представленные в настоящем изобретении, можно применять для получения рекомбинантного фермента P450 в подходящей системе экспрессии. Термин "система экспрессии" означает клетку-хозяина и совместимый вектор в подходящих условиях, например, для экспрессии белка, кодируемого чужеродной нуклеиновой кислотой, переносимой вектором и вводимой в клетку-хозяина.
Как правило, нуклеиновая кислота может быть включена в любой подходящий вектор.
Таким образом, в некоторых вариантах осуществления в настоящем изобретении представлены вектор, содержащий нуклеиновую кислоту, определенную выше, функционально связанную с элементами, контролирующими экспрессию, и клетка-хозяин, содержащая указанную нуклеиновую кислоту или указанный вектор.
Термины "вектор", "клонирующий вектор" и "вектор экспрессии" означают носитель, при помощи которого последовательность ДНК или РНК (например, чужеродного гена) можно вводить в клетку-хозяина для того, чтобы трансформировать хозяина и стимулировать экспрессию (например, транскрипцию и трансляцию) введенной последовательности.
Можно применять любой вектор экспрессии, такой как плазмида, космида, эписома, искусственная хромосома, фаг или вирусный вектор. Примеры плазмид включают реплицирующиеся плазмиды, содержащие точку начала репликации, или интегративные плазмиды, такие как, например, pUC, pcDNA, pBR и им подобные.
Другие примеры векторов включают векторы для клеток животных, такие как pAGE107 (Miyaji H et al. 1990), pAGE103 (Mizukami T et al. 1987), pHSG274 (Brady G et al. 1984), pKCR (O'Hare K et al. 1981), pSG1-бета-d2-4 (Miyaji H et al. 1990) и им подобные.
Примеры вирусных векторов включают векторы на основе аденовируса, ретровируса, вируса герпеса и AAV. Рекомбинантные вирусы можно получить при помощи методик, известных из уровня техники, как, например, при помощи трансфекции в упаковывающие клетки или посредством транзиентной трансфекции хелперными плазмидами или вирусами. Типичные примеры клеток, упаковывающих вирус, включают клетки PA317, клетки PsiCRIP, клетки GPenv+, клетки 293 и т. д. Подробные протоколы получения таких рекомбинантных вирусов, дефектных по репликации, можно, например, найти в WO 95/14785, WO 96/22378, US 5882877, US 6013516, US 4861719, US 5278056 и WO 94/19478.
Вектор экспрессии может содержать функциональную кассету экспрессии, такую как кассета экспрессии, содержащая последовательность нуклеиновой кислоты, кодирующую полипептид, представленный в настоящем изобретении, которая функционально связана с последовательностями, контролирующими экспрессию.
"Последовательность(последовательности), контролирующая(контролирующие) экспрессию" относится к элементу(элементам), необходимым для экспрессии полипептида и необязательно для ее регуляции. Последовательность(последовательности), контролирующая(контролирующие) экспрессию, может(могут), например, включать в себя промоторную последовательность, сигнальные последовательности для инициации и терминации трансляции, а также соответствующие участки для регуляции трансляции, такие как промотор, энхансер, терминатор и им подобные, вызывающие экспрессию указанного полипептида или управляющие ею.
В одном варианте осуществления вектор, представленный в настоящем изобретении, может также содержать маркерный ген, например, ген, обеспечивающий возможность выбора между трансформированным организмом и организмом, не содержащим трансфицирующую чужеродную ДНК. Маркерный ген может представлять собой ген, придающий устойчивость к антибиотику.
В соответствии с конкретным вариантом осуществления вектор, представленный в настоящем изобретении, может дополнительно содержать последовательность нуклеиновой кислоты, кодирующую адренодоксин (Adx), и/или последовательность нуклеиновой кислоты, кодирующую адренодоксинредуктазу (AdR). Adx и AdR являются партнерами ферментов P450 по окислительно-восстановительной системе.
"AdR" относится к адренодоксинредуктазе (EC: 1.18.1.6) или адренодоксин-NADP+-редуктазе, ферменту, известному в качестве первого компонента митохондриальной системы переноса электронов цитохрома P450, который вовлечен в биосинтез всех стероидных гормонов.
В конкретном варианте осуществления указанный фермент AdR выбран из группы, состоящей из AR (NADPH:адренодоксиноксидоредуктазы (EC=1.18.1.6), кодируемой геном arh1) из Schizosaccharomyces pombe или из Saccharomyces cerevisiae и FNR (ферредоксин-NADP-редуктазы (EC=1.18.1.2), кодируемой геном fpr) из Escherichia coli.
В конкретном варианте осуществления фермент AdR представляет собой AdR Bos taurus (представлен как P08165 в UniProtKB/Swiss-Prot, последнее обновление последовательности: 15 июля 1998 г.). В другом конкретном варианте осуществления последовательность указанного белка AdR представлена под SEQ ID NO: 7. В другом конкретном варианте осуществления последовательность указанного белка AdR представляет собой вариант SEQ ID NO: 7, при условии, что он сохраняет свою биологическую активность.
"Adx" означает адренодоксин или ферредоксин 1, белок, известный своей активностью переноса электронов от адренодоксинредуктазы к CYP11A1.
В конкретном варианте осуществления указанный белок Adx выбран из группы, состоящей из Fdx, происходящего от млекопитающего, Etp1fd из Schizosaccharomyces pombe и Yah1 из Saccharomyces cerevisiae.
В конкретном варианте осуществления белок Adx представляет собой Adx Bos taurus (представлен как P00257 в UniProtKB/Swiss-Prot, последнее обновление последовательности: 1 июля 1989 г.). В другом конкретном варианте осуществления последовательность указанного белка Adх представлена под SEQ ID NO: 8. В другом конкретном варианте осуществления последовательность указанного белка Adх представляет собой вариант SEQ ID NO: 8, при условии, что он сохраняет свою биологическую активность.
Вектор или нуклеиновая кислота, представленные в настоящем изобретении, можно применять для трансформации клеток-хозяев в соответствии с методиками, общеизвестными для специалистов в данной области. Встраивание указанного вектора в клетку-хозяина может быть транзиентным или стабильным.
Данный вектор может также содержать последовательности, кодирующие специфические сигнальные последовательности, запускающие секрецию транслируемого белка, или его нацеливание на компартменты или органеллы клетки. Данные различные контрольные сигнальные последовательности выбирают в соответствии с клеткой-хозяином, и их можно встраивать в векторы, которые самореплицируются в клетке-хозяине, или в векторы, которые интегрируются в геном указанного хозяина.
Клетки-хозяева могут быть прокариотическими или эукариотическими, включающими, без ограничений, клетки бактерий, дрожжей, клетки растений, клетки животных, клетки насекомых и клетки млекопитающих, в том числе линии клеток, которые являются коммерчески доступными. В некоторых вариантах осуществления клетки-хозяева для экспрессии представляют собой клетки Escherichia coli, Lactobacilli, Bacillus, в частности, Bacillus megaterium, пробиотических бактерий, Pichia pastoris, Saccharomyces cerevisiae, клетки насекомых, клетки растений, клетки COS и клетки CHO. В одном варианте осуществления клетка-хозяин представляет собой прокариотическую клетку, в частности, бактериальную клетку. В другом конкретном варианте осуществления клетка-хозяин представляет собой эукариотическую клетку, такую как дрожжевая клетка, такую как клетка Saccharomyces cerevisiae.
Стандартные системы экспрессии включают бактериальные клетки-хозяева и плазмидные векторы, клетки-хозяева насекомых и векторы на основе бакуловируса, а также клетки-хозяева млекопитающих и векторы для экспрессии у них. Конкретные примеры включают E. coli, B. megaterium, дрожжи Kluyveromyces или Saccharomyces, линии клеток млекопитающих (например, клетки Vero, клетки CHO, клетки 3T3, клетки COS и т. д.), а также первичные или устойчивые линии клеток млекопитающих (например, полученные из лимфобластов, фибробластов, эмбриональных клеток, эпителиальных клеток, нервных клеток, адипоцитов и т. д.). Примеры также включают клетки мышей SP2/0-Ag14 (ATCC CRL1581), клетки мышей P3X63-Ag8.653 (ATCC CRL1580), клетки CHO, в которых ген дигидрофолатредуктазы (именуемый также "геном DHFR") является дефектным (Urlaub G et al; 1980), клетки крыс YB2/3HL.P2.G11.16Ag.20 (ATCC CRL1662, именуемые также "клетками YB2/0") и им подобные.
В другом варианте осуществления в настоящем изобретении представлена клетка, которая была трансфицирована, инфицирована или трансформирована нуклеиновой кислотой и/или вектором, предложенными в данном документе. Соответственно, настоящее изобретение дополнительно относится к клетке-хозяину, содержащей нуклеиновую кислоту и/или вектор, описанные в данном документе, а также к потомству и/или производным таких клеток-хозяев. В одном варианте осуществления клетка-хозяин представляет собой микроорганизм, полученный при помощи генной инженерии.
Как используется в данном документе, "микроорганизм" может представлять собой Escherichia coli, Bacillus licheniformis, Bacillus megaterium, Bacillus subtilis, Kluyveromyces lactis, Saccharomyces cerevisiae или Schizosaccharomyces pombe.
Как показано в Woods, S. T., J. Sadleir, et al. (1998) (Expression of catalytically active human cytochrome p450scc in Escherichia coli and mutagenesis of isoleucine-462. Arch Biochem Biophys353(1): 109-15), осуществляли экспрессию зрелой формы P450scc человека в Escherichia coli для получения более подходящего источника человеческого фермента и для обеспечения проведения структурно-функциональных исследований с применением сайт-направленного мутагенеза. Эта система экспрессии обеспечивала получение больших количеств активного цитохрома, чем выделяли ранее из митохондрий плаценты. Экспрессируемый P450scc очищали до практически однородного состояния, и было показано, что он обладает каталитическими свойствами, сравнимыми со свойствами фермента, очищенного из плаценты человека. Также осуществляли экспрессию зрелой формы адренодоксина в E. coli, и она способствовала активности расщепления боковой цепи холестерина с такой же Vmax, которую наблюдали при применении бычьего адренодоксина, но с более высокой Km. Мутация замены Ile-462 на Leu в P450scc человека вызывала уменьшение константы скорости каталитической реакции (kcat) при использовании холестерина в качестве субстрата, повышала Km для 22R-гидроксихолестерина, но не влияла на кинетические константы для 20-альфа-гидроксихолестерина.
Как показано в Duport, C., R. Spagnoli, et al. (1998) (Self-sufficient biosynthesis of pregnenolone and progesterone in engineered yeast. Nat Biotechnol16(2): 186-9), первые две стадии пути стероидогенеза были воспроизведены в Saccharomyces cerevisiae. Инженерия биосинтеза стеролов посредством разрушения гена дельта-22-десатуразы и внедрения активности дельта-7-редуктазы Arabidopsis thaliana, а также посредством коэкспрессии бычьего цитохрома P450, расщепляющего боковую цепь, адренодоксина и адренодоксинредуктазы приводит к биосинтезу прегненолона из простого источника углерода. После дополнительной коэкспрессии человеческой 3-бета-гидроксистероиддегидрогеназы/изомеразы прегненолон далее превращался в процессе метаболизма в прогестерон. По-видимому, образование стероидов сопряжено с биосинтезом стеролов у дрожжей.
В Szczebara, F. M., C. Chandelier, et al. (2003) (Total biosynthesis of hydrocortisone from a simple carbon source in yeast; Nat Biotechnol 21(2): 143-9) сообщали о получении гидрокортизона, основного глюкокортикоидного гормона надпочечников у млекопитающих и важного промежуточного соединения в синтезе стероидных лекарственных средств, из простого источника углерода при помощи рекомбинантного штамма Saccharomyces cerevisiae. В одном штамме дрожжей формировали искусственный и полностью автономный путь биосинтеза, в который вовлечены 13 сконструированных генов, и осуществляли экспрессию этих генов. Эндогенный биосинтез стеролов перенаправляли на получение совместимых стеролов, которые служат в качестве субстратов для гетерологичной части пути. В биосинтез вовлечены восемь белков млекопитающих (зрелые формы CYP11A1, адренодоксина (ADX) и адренодоксинредуктазы (ADR); митохондриальные формы ADX и CYP11B1; 3-бета-HSD, CYP17A1 и CYP21A1). Оптимизация включала модулирование двух митохондриальных систем и препятствование нежелательным побочным реакциям, связанным с продуктами генов ATF2, GCY1 и YPR1. Основным получаемым стероидом являлся гидрокортизон. Данная работа демонстрирует практическую осуществимость переноса сложного пути биосинтеза от высших эукариот в микроорганизмы.
В конкретном варианте осуществления микроорганизмом является Bacillus megaterium, в частности, штамм, именуемый MS941 Bacillus megaterium. Выражение "штамм MS941 Bacillus megaterium" относится к штамму, упоминаемому в Wittchen and Meinhardt, 1995, Appl Microbiol Biotechnol. 42: 871-877 и происходящему от штамма DSM319 (Немецкая коллекция микроорганизмов и клеточных культур).
Ранее описанная система, в которой применяется E. сoli, исистема, в которой применяется B. megaterium, представляют собой две системы, которые способны осуществлять превращение стерола и производных стерола in vitro при помощи E. coli либо in cellulo при помощи B. megaterium. Данные технологии позволяют оценить способности совместного функционирования P450scc и субстратов. Обе технологии требуют эффективного способа растворения субстратов таким образом, чтобы они были доступны для фермента. Это растворение может быть затруднительным на промышленном уровне (большой объем) как в финансовом, так и в научном плане.
Третий организм - S.cerevisiae - является особенно предпочтительным организмом в этом отношении; хорошо освоена его ферментация в крупных масштабах, на уровнях кубических метров или более высоких, и он характеризуется значительной способностью к получению стероидов, таких как прегненолон, из простого источника углерода, такого как глюкоза и/или этанол, что позволяет, таким образом, избегать использования детергента или солюбилизирующего химического вещества, такого как бета-циклодекстрин (как указано выше: Duport, C., R. Spagnoli, et al. (1998); Szczebara, F. M., C. Chandelier, et al. (2003)). Для обеспечения синтеза стероидов in vivo биосинтез стеролов направляли на получение стерола, совместимого с P450scc.
Поскольку ферментация S. cerevisiae хорошо освоена в крупных масштабах, введение недавно описанной кДНК P450scc в подходящий S.cerevisiae, которое обеспечивало направление на кампестерин или другие описанные в качестве субстратов стеролы в присутствии соответствующего переносчика электронов, является средством для получения стероидов. Этот рекомбинантный организм можно применять для оценки новой кДНК P450scc, описанной выше.
Следовательно, в другом конкретном варианте осуществления микроорганизмом является Saccharomyces cerevisiae.
Термин "микроорганизм, полученный при помощи генной инженерии" относится к любому микроорганизму, который был модифицирован при помощи методик генной инженерии, известных в данной области техники для специалиста в данной области. Что касается способов, относящихся к конкретным микроорганизмам, то специалист в данной области может обратиться к справочным руководствам, таким как: "Methods in yeast genetics" - A laboratory course manual by M Rose, F Winston and P Hieter. pp 198. Cold Spring Harbor Laboratory Press, Cold Spring Harbor, New York. 1990. ISBN 0-87969-354-1.
Данные методики являются общепринятыми методиками, если не указано иное, в области биоинформатики, клеточной биологии, культур клеток, молекулярной биологии, трансгенной биологии, микробиологии, технологии рекомбинантных ДНК и иммунологии, которые находятся в пределах компетентности специалиста в данной области. Такие технологии в полной мере объясняются в литературе.
Как используется в данном документе, "методики генной инженерии" относятся к методикам, обеспечивающим возможность экспрессии или сверхэкспрессии гена, известного в данной области техники для специалиста в данной области. Экспрессии или сверхэкспрессии гена, представляющего интерес, можно достичь путем введения в клетку или микроорганизм экзогенной последовательности нуклеиновой кислоты, содержащей такой ген, представляющий интерес, при помощи любых методик трансформации, известных специалисту в данной области.
Термин "трансформация" или "трансфекция" означает введение "чужеродных" (т.е. гетерологичных) гена, последовательности ДНК или РНК в клетку-хозяина таким образом, чтобы клетка-хозяин экспрессировала введенные ген или последовательность с получением требуемого вещества, как правило, белка или фермента, кодируемого введенными геном или последовательностью. Трансфекцию клетки-хозяина можно осуществлять с использованием стандартной методики, такой как химическая трансформация, электропорация, осаждение фосфатом кальция или липофекция. Методики трансформации также включают, например, методику опосредованной PEG трансформации протопластов (Barg et al, 2005, Microbial Processes and Products 165-184).
"Экзогенная(экзогенные) последовательность(последовательности) нуклеиновой кислоты" относятся к последовательности(последовательностям) нуклеиновой кислоты, которые не экспрессируются изначально и/или в природе у рассматриваемого микроорганизма или таким образом, как это происходит у природного штамма микроорганизма (например, с точки зрения уровня экспрессии), и которую применяли для трансформации указанного микроорганизма с целью получения микроорганизма, полученного при помощи генной инженерии, упоминаемого выше. В конкретном варианте осуществления экзогенная последовательность нуклеиновой кислоты происходит от вида, отличного от рассматриваемого микроорганизма (например, другого вида микроорганизма или организма). В другом конкретном варианте осуществления экзогенная последовательность происходит от того же микроорганизма.
Указанная(указанные) экзогенная(экзогенные) последовательность(последовательности) нуклеиновой кислоты могут кодировать белки, представляющие интерес, такие как цитохром P450 и партнеры по окислительно-восстановительной системе AdR и Adx, и выражение "экзогенная ДНК" может обозначать каждую отдельную последовательность или охватывать целую последовательность, содержащую каждую отдельную последовательность. В качестве неограничивающего примера, указанные экзогенные последовательности нуклеиновых кислот интегрируют в геном указанного микроорганизма при помощи методик, известных в данной области техники, как, например, при помощи гомологичной рекомбинации.
В одном аспекте настоящее изобретение предлагает микроорганизм, полученный при помощи генной инженерии, способный превращать субстрат, выбранный из группы, состоящей из полициклических и ненасыщенных одноатомных спиртов с алифатической боковой цепью, таких как холестерин, аналоги и производные холестерина, в предшественника стероидных гормонов, где указанный микроорганизм содержит нуклеиновую кислоту, представленную в настоящем изобретении, и необязательно экзогенную последовательность нуклеиновой кислоты, кодирующую Adx, и/или экзогенную последовательность нуклеиновой кислоты, кодирующую AdR.
В конкретном варианте осуществления микроорганизмом, полученным при помощи генной инженерии, является Saccharomyces cerevisiae.
В другом конкретном варианте осуществления микроорганизмом, полученным при помощи генной инженерии, является Bacillus megaterium, в частности, штамм MS941 Bacillus megaterium.
Настоящее изобретение также относится к способу in vitro получения фермента P450, представленного в настоящем изобретении, при этом указанный способ включает стадии
a) культивирования клетки-хозяина в условиях, подходящих для достижения экспрессии фермента P450; и
b) извлечения экспрессируемого фермента.
"Условия, подходящие для достижения экспрессии фермента P450", хорошо известны специалисту в данной области. Как правило, для культивирования клеток-хозяев применяли среду LB (25 г/л), TB (24 г/л дрожжевого экстракта, 12 г/л триптона, 0,4% глицерина, 10 мМ калий-фосфатный буфер) либо среду с таблетками EnPresso™. Предварительное культивирование можно осуществлять посредством инокуляции клеток с чашки или из глицеринового маточного раствора в 50 мл среды, содержащей 10 мкг/мл тетрациклина. Основное культивирование затем можно осуществлять путем инокуляции 500 мкл образца предварительной культуры в 50 мл среды, содержащей 10 мкг/мл тетрациклина. Основную культуру, как правило, выращивают до достижения оптической плотности ~0,4. Экспрессию белка можно индуцировать после добавления 0,25 г ксилозы, растворенной в 1 мл дистиллированной воды.
Затем фермент P450 можно очистить посредством хорошо известных процедур очистки: его можно очистить из лизатов или клеточных экстрактов, телец-включений или из надосадочной жидкости культуры клеток при помощи таких методик, как HPLC-хроматография, иммуноаффинные методики с использованием специфических антител и им подобные.
В качестве альтернативы, экспрессию фермента P450 можно осуществлять in vitro при помощи бесклеточной системы транскрипции и трансляции с ДНК- или РНК-матрицы, содержащей требуемые элементы для его экспрессии, в клеточном лизате или в воспроизводимой системе (например, Rapid Translation System®, Roche Diagnostics или Retic Lysate IVT™, Ambion).
Способ получения предшественника стероидных гормонов
В примерах 2-4 показано, что авторы настоящего изобретения разработали новый фермент P450scc, несущий специфические мутации, который демонстрирует улучшенную ферментную активность относительно превращения субстрата в предшественника стероидных гормонов.
Следовательно, в другом аспекте настоящее изобретение относится к применению фермента P450, представленного в настоящем изобретении, для получения предшественника стероидных гормонов.
Настоящее изобретение дополнительно предлагает способы получения предшественника стероидных гормонов, описанные ниже.
Первый способ получения предшественника стероидных гормонов включает стадии
а) получения микроорганизма, как описано выше,
b) культивирования указанного микроорганизма в условиях, обеспечивающих возможность экспрессии фермента P450, представленного в настоящем изобретении,
c) приведения культуры микроорганизма, полученной на стадии b), в контакт с субстратом, выбранным из группы, состоящей из полициклических и ненасыщенных одноатомных спиртов с алифатической боковой цепью, таких как холестерин, аналог холестерина и производное холестерина, в условиях, обеспечивающих возможность получения предшественника стероидных гормонов из указанного субстрата при помощи микроорганизма, и
d) извлечения получаемого предшественника стероидных гормонов.
В соответствии с конкретным вариантом осуществления стадии b) и c) осуществляют одновременно. В данном случае способ получения предшественника стероидных гормонов включает стадии
a) получения микроорганизма, как описано выше,
b) культивирования указанного микроорганизма в присутствии субстрата, выбранного из группы, состоящей из полициклических и ненасыщенных одноатомных спиртов с алифатической боковой цепью, таких как холестерин, аналог холестерина и производное холестерина, в условиях, обеспечивающих возможность экспрессии фермента P450, представленного в настоящем изобретении, и обеспечивающих возможность получения при помощи микроорганизма предшественника стероидных гормонов из указанного субстрата, и
c) извлечения получаемого предшественника стероидных гормонов.
Второй способ получения предшественника стероидных гормонов включает стадии
a) приведения фермента P450, представленного в настоящем изобретении, в контакт с выделенным полипептидом Adx, выделенным полипептидом AdR, и субстратом, выбранным из группы, состоящей из полициклических и ненасыщенных одноатомных спиртов с алифатической боковой цепью, таких как холестерин, аналог холестерина и производное холестерина, в условиях, обеспечивающих возможность преобразования указанного субстрата в предшественника стероидных гормонов, и
b) извлечения получаемого предшественника стероидных гормонов.
Используемый в данном документе термин "субстрат" охватывает полициклические и ненасыщенные одноатомные спирты с алифатической боковой цепью, такие как фитостерин, получаемый из циклоартенола и ланостерина. Среди этих субстратов "холестерин, аналоги холестерина и его производные" относятся к перечню субстратов, выбранных из группы, состоящей из холестерина, брассикастерина, кампестерина, эргостадиенола, такого как эргоста-5,22-диенол, эргоста-5,24(28)-диенол, эргоста-5,24(28)-диен-3-бета-ол, эргоста-5,24(25)-диенол, эргостатриенола, такого как эргоста-5,22,24(25)-триенол, эргоста-5,22,24(28)-триенол, эргоста-5,7,22-триенол, эргостатетраенола, такого как эргоста-5,7,22,24(25) или эргоста-5,7,22,24(28), десмостерина, бета-ситостерина, генерола, смеси оксистеринов, стигмастерина, витамина D, 7-дегидрохолестерина и эргостерина. Применяемые в настоящее время в производственных процессах смеси стеринов также охвачены данным определением субстратов, как, например, генерол 100 и ADM90 (содержащие брассикастерин+кампестерин+стигмастерин+бета-ситостерин в разных соотношениях).
В конкретном варианте осуществления субстрат выбран из группы, состоящей из холестерина, кампестерина, десмостерина и эргоста-5,24(28)-диен-3-бета-ола. В конкретном варианте осуществления субстрат представляет собой эргостерин.
В конкретном варианте осуществления "предшественник стероидных гормонов" выбран из группы, состоящей из прегненолона, 7-дегидропрегненолона, гидроксиэргостерина и гидроксисигмастерина. В другом конкретном варианте осуществления указанный предшественник стероидных гормонов выбран из группы гидроксилированных аналогов холестерина и секостероидов (таких как витамины D2 и D3 в качестве производных аналогов холестерина 7-дегидрохолестерина и эргостерина). В конкретном варианте осуществления предшественник стероидного гормона представляет собой прегненолон.
"Культивирование микроорганизма в присутствии субстрата" означает физическое взаимодействие указанного микроорганизма с субстратом, который определен выше. Данное взаимодействие можно осуществлять в культуральной среде или вне ее. В конкретном варианте осуществления указанная культуральная среда содержит средства для пермеабилизации микроорганизма в соответствии с настоящим изобретением и/или для солюбилизации субстрата в соответствии с настоящим изобретением. Растворение субстрата в данных средствах можно осуществлять перед добавлением в культуру микроорганизма.
"Приведение фермента P450 в контакт с субстратом" означает физическое взаимодействие указанного фермента P450 с субстратом, который определен выше. Данное взаимодействие можно осуществлять в среде или вне ее. В конкретном варианте осуществления указанная среда содержит средства для солюбилизации субстрата в соответствии с настоящим изобретением. Растворение субстрата в данных средствах можно осуществлять перед добавлением в указанную среду.
Средства, применяемые для растворения субстрата, могут быть выбраны из группы, состоящей из этанола, Tween-80, тергитола, поливинилпирролидона (PVP), сапонинов (таких как сапонин из Quillaja, который, например, содержится в неочищенных экстрактах мыльного дерева Quillaja saponaria), циклодекстринов и их производных (например, 2-гидроксипропил-β-циклодекстрина). В другом конкретном варианте осуществления можно применять смеси этих средств, как, например, смесь этанола и Tween-80, смесь тергитола и этанола, смесь сапонинов (например, сапонины из Quillaja) и циклодекстринов, в качестве неограничивающих примеров. Можно применять производные циклодекстринов, такие как 2-гидроксипропил-β-циклодекстрин. В другом конкретном варианте осуществления субстраты совместно кристаллизуют с поливинилпирролидоном (PVP).
В другом варианте осуществления субстрат сперва растворяют в 2-гидроксипропил-β-циклодекстрине перед добавлением в культуру микроорганизма, где указанная культура содержит сапонин из Quillaja. В другом варианте осуществления субстраты растворяют в растворе, содержащем процентную долю 2-гидроксипропил-β-циклодекстрина, варьирующую в диапазоне от 10 до 60%, например, от 20 до 50%, например, от 40 до 50%, и процентную долю сапонина из Quillaja, варьирующую в диапазоне от 1 до 10%, например, от 2 до 8%, например, от 3 до 6%. В другом варианте осуществления субстраты растворяют в растворе, содержащем 45% 2-гидроксипропил-β-циклодекстрина и 4% сапонина из Quillaja.
В другом варианте осуществления конечная концентрация 2-гидроксипропил-β-циклодекстрина в культуре микроорганизма составляет от 1 до 4%, например, от 2 до 3%, как, например, 2,25%, как показано в примере 2. В другом варианте осуществления конечная концентрация сапонина из Quillaja в культуре микроорганизма составляет от 0,05 до 0,25%, например, от 0,075 до 0,225%, например, от 0,1 до 0,2%.
"Культивирование указанного микроорганизма в условиях, обеспечивающих возможность экспрессии указанных экзогенных последовательностей нуклеиновой кислоты" можно осуществлять согласно любому из хорошо известных в области биотехнологии способов культивирования и индуцирования, таких как описанные в Bleif et al. (Appl Microbiol Biotechnol (2012) 93:1135-1146) или Korneli et al.(Journal of Biotechnology 163 (2013) 87-96).
"Условия, обеспечивающие возможность преобразования указанного субстрата в предшественника стероидных гормонов" включают условия in vitro, такие как применяемые реагенты, концентрации реагентов, температура, применение перемешивания, продолжительность реакции или инкубирования и т. д., которые способствуют преобразованию указанного субстрата в предшественника стероидных гормонов. Эти условия можно определить и скорректировать при помощи способов, известных специалистам в данной области.
В качестве неограничивающего примера данную реакцию можно проводить в присутствии глюкозо-6-фосфатдегидрогеназы и глюкозо-6-фосфата, как правило, в 150 мМ буфере HEPES, например, доведенном до pH 7,4, содержащем, как правило, 0,05% Tween-20 и 1 мМ MgCl2. Концентрации фермента P450, Adx и AdR могут составлять, к примеру, соответственно 1 мкМ, 20 мкМ и 0,5 мкМ или 0,25 мкМ, 5 мкМ и 0,125 мкМ. Полициклические и ненасыщенные одноатомные спирты с алифатической боковой цепью, такие как холестерин, аналог холестерина или производное холестерина, можно растворять в 45% 2-гидроксипропил-β-циклодекстрине. Образцы можно предварительно нагревать до 37°C, и можно добавлять NADPH до конечной концентрации 100 мкМ. Смеси можно инкубировать при 37°C с перемешиванием.
В конкретном варианте осуществления предшественником стероидных гормонов, применяемым в любом способе получения предшественника стероидных гормонов, является прегненолон. Как используется в данном документе, "прегненолон" относится к стероидному гормону, также именуемому 3β-гидроксипрегн-5-ен-20-оном.
КРАТКОЕ ОПИСАНИЕ ПОСЛЕДОВАТЕЛЬНОСТЕЙ
Под SEQ ID NO: 1 показана аминокислотная последовательность CYP11A1, содержащая треонин в положении 225 и аспарагиновую кислоту в положении 289 (полипептид SA1).
Под SEQ ID NO: 2 показана аминокислотная последовательность CYP11A1, содержащая треонин в положении 225.
Под SEQ ID NO: 3 показана аминокислотная последовательность CYP11A1, содержащая аспарагиновую кислоту в положении 289.
Под SEQ ID NO: 4 показана аминокислотная последовательность CYP11A1 Bos taurus WT (полипептид SA4; P450scc WT).
Под SEQ ID NO: 5 показана последовательность плазмиды pSMF2.1_CYP11A1BYM, кодирующая SA1 с SEQ ID NO: 1.
Под SEQ ID NO: 6 показана аминокислотная последовательность полипептида SA6 (P450scc-I1A-K193E).
Под SEQ ID NO: 7 показана аминокислотная последовательность AdR.
Под SEQ ID NO: 8 показана аминокислотная последовательность Adx.
КРАТКОЕ ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
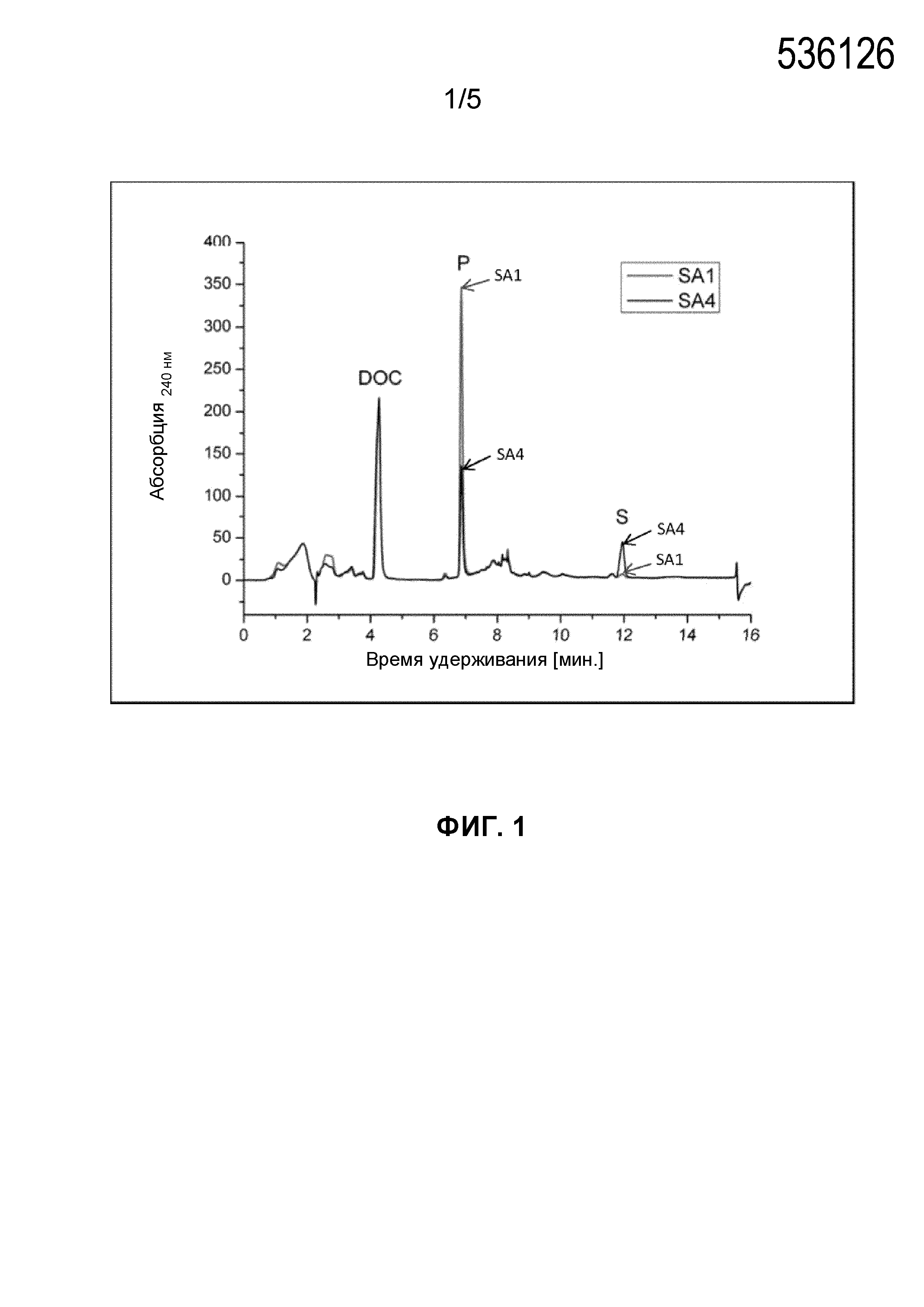
Фигура 1. HPLC‐хроматограмма, демонстрирующая превращение 20 мкМ холестерина in vitro посредством полипептидов системы цитохрома P450 SA1 (SEQ ID NO:1) и SA4 (контроль с последовательностью SEQ ID NO: 4). Условные обозначения: S: субстрат, P: основной продукт, DOC: 11‐дезоксикортикостерон.
Фигура 2. Количественное определение прегненолона по HPLC‐хроматограмме, демонстрирующей превращение различных субстратов в прегненолон in vivo посредством полипептида системы цитохрома P450 SA1 (SEQ ID NO:1).
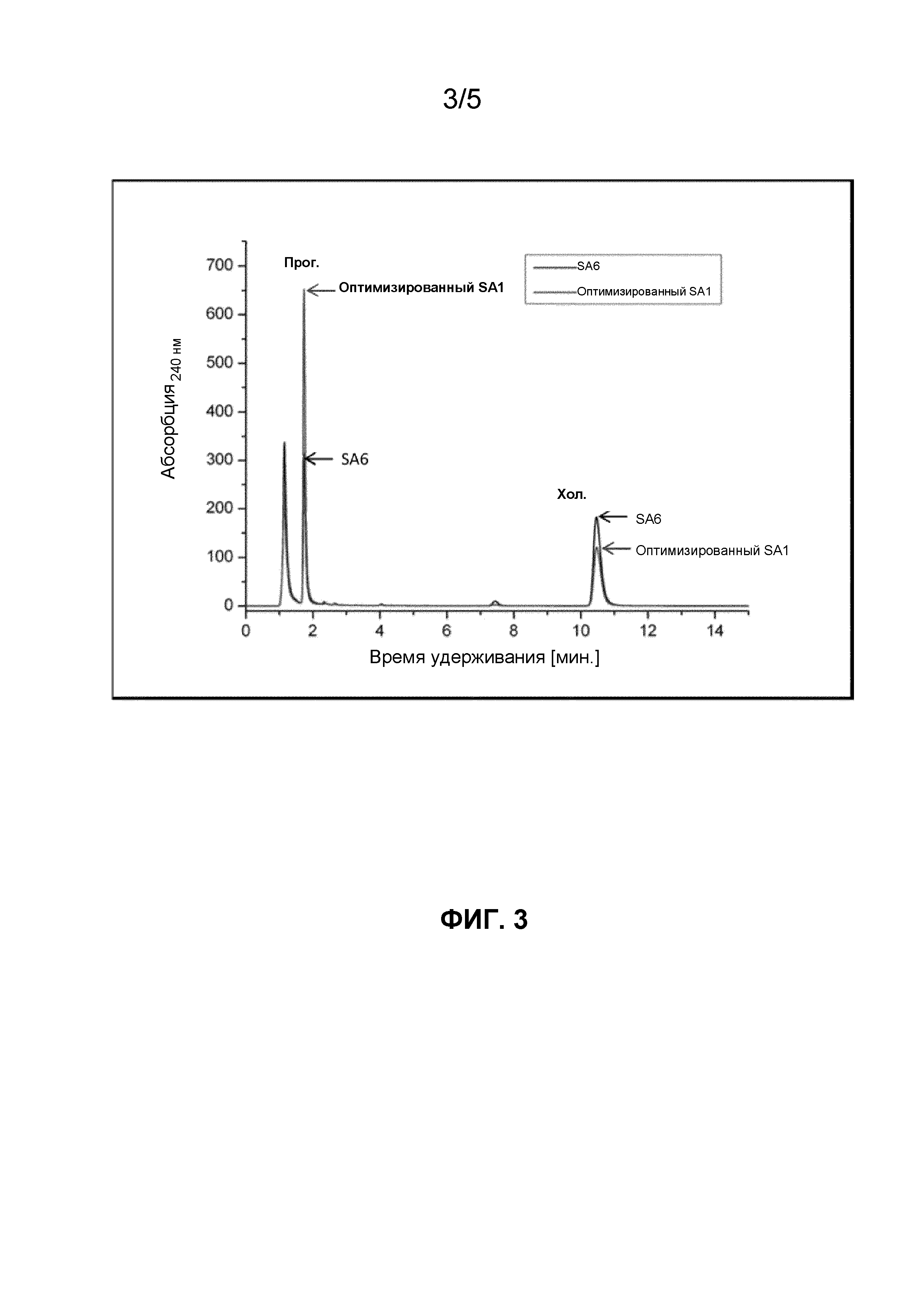
Фигура 3. HPLC‐хроматограмма, демонстрирующая превращение 300 мкМ холестерина in vivo посредством полипептидов системы цитохрома P450 SA1 (SEQ ID NO:1) и SA6 (контроль с последовательностью SEQ ID NO: 6) через 24 ч. Условные обозначения: хол.: холестерин, прег.: прегненолон.
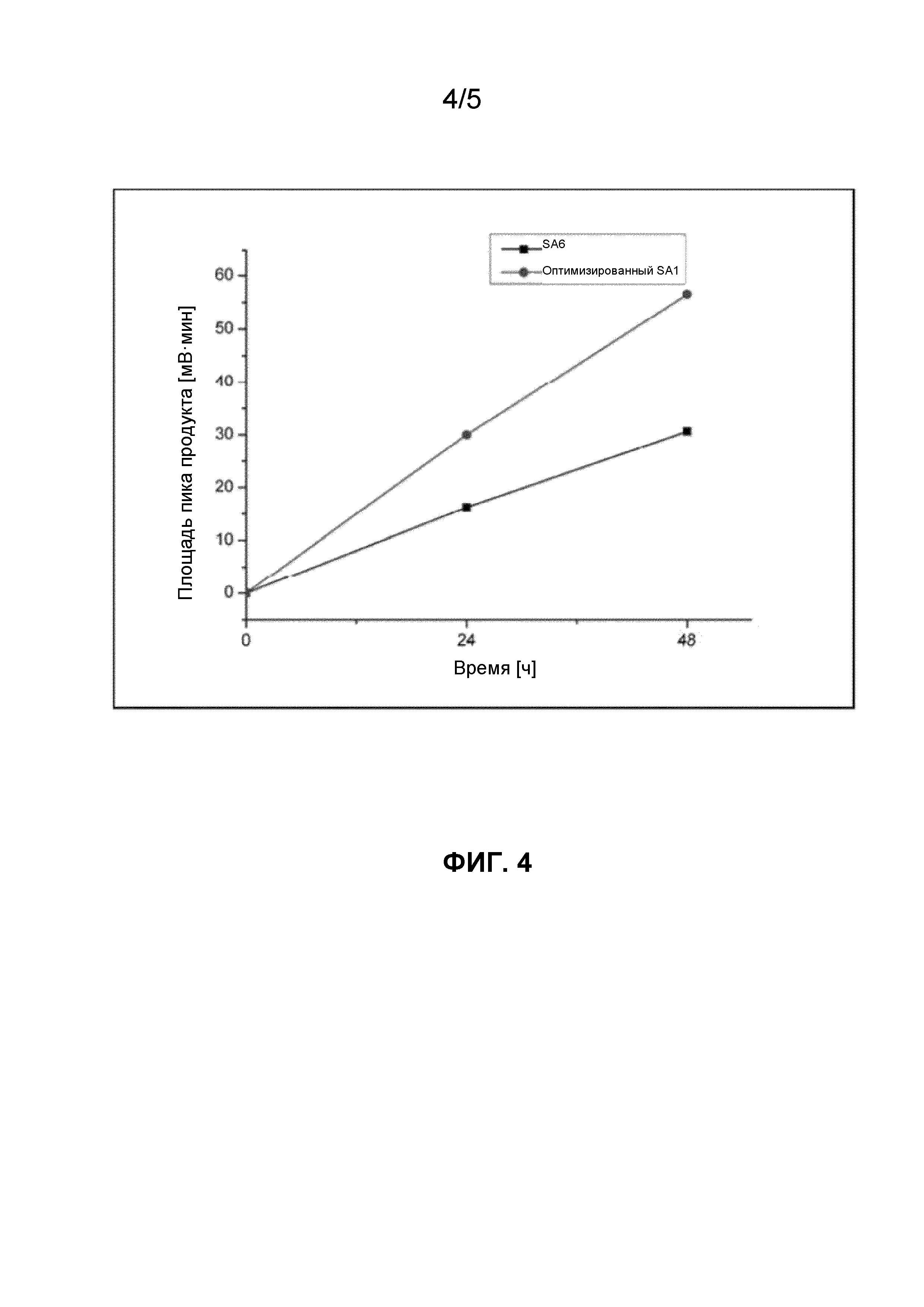
Фигура 4. Динамика превращения 300 мкМ холестерина in vivo посредством полипептидов системы цитохрома P450 SA1 (SEQ ID NO:1) и SA6 (контроль с последовательностью SEQ ID NO: 6).
Фигура 5. Карта вектора pSMF2.1_CYP11A1BYM, кодирующего SA1 (SEQ ID NO: 1).
ПРИМЕРЫ
Пример 1. Материалы и способы
Синтез белков
Варианты CYP11A1 получали при помощи синтеза генов и клонировали в pTRC99A, гибридизированный с меткой поли-His. Клетки C43DE3 E. coli совместно трансформировали каждым из вектора и кодирующей шаперон pGro12. Очистку проводили согласно описанному в Janocha et al. (Biochim Biophys Acta. (2011) Jan;1814(1):126-31). Чистоту оценивали при помощи SDS-PAGE. Концентрации очищенных белков определяли по CO-разностным спектрам после обработки дитионитом натрия и воздействия CO.
Adx и AdR очищали соответственно согласно Uhlmann et al. (Biochem. Biophys. Res. Commun., 188 (1992), pp. 1131-1138) и Sagara et al. (Biol. Pharm. Bull., 16 (1993), pp. 627-630).
Анализ превращения in vitro
Для анализов ферментов in vitro в качестве рабочего буферного раствора использовали 150 мМ буфер HEPES, доведенный до рН 7,4, содержащий 0,05% Tween-20 и 1 мМ MgCl2. В качестве системы восстановления NADPH служила 1 единица глюкозо-6-фосфатдегидрогеназы с 5 мМ глюкозо-6-фосфата в качестве субстрата.
Для P450scc WT (обозначен как "SA4", SEQ ID NO: 4) и P450scc-I1A-K193E (обозначен как "SA6", SEQ ID NO: 6) концентрации CYP11A1, Adx и AdR составляли 1 мкМ, 20 мкМ и 0,5 мкМ, а для P450scc-R225T-N289D (обозначен как "SA1", SEQ ID NO: 1) концентрации CYP11A1, Adx и AdR соответственно составляли 0,25 мкМ, 5 мкМ и 0,125 мкМ.
В качестве субстрата для CYP11A1 служили 20 мкМ холестерина, растворенного в 45% 2-гидроксипропил-β-циклодекстрине.
Образцы предварительно нагревали до 37°C, и реакцию начинали путем добавления NADPH до конечной концентрации 100 мкМ. Смеси инкубировали при 37°C с перемешиванием в течение 30 с. Реакцию останавливали путем кипячения образцов в воде в течение 30 с.
Для обеспечения возможности фотометрического детектирования при 240 нм стероиды подвергали превращению в их 3-кето-Δ4-производные с применением холестериноксидазы из Nocardia spec.
К образцам добавляли 20 мкл раствора холестериноксидазы (5 мг холестериноксидазы и 5 мг холата Na, растворенные в 5 мл 50 мМ буфера HEPES с pH 7, содержащего 0,05% Tween-20). После инкубирования при 37°C в течение 1 ч. в реакционные смеси в качестве внутреннего стандарта добавляли 11-дезоксикортикостерон (DOC) с последующим 2-кратным экстрагированием равными объемами этилацетата. После выпаривания экстракты растворяли в смеси ацетонитрил/вода.
Анализ превращения in vivo
Превращение in vivo 300 мкМ холестерина в прогестерон оценивали при помощи HPLC через 24 ч. Bacillus megaterium культивировали в среде TB, содержащей 10 мкг/мл тетрациклина, при 37°C со встряхиванием при 180 об./мин. Экспрессию белка индуцировали путем добавления 0,25 г ксилозы, растворенной в 1 мл воды, с последующим дальнейшим добавлением субстрата, растворенного в 2‐гидроксипропил‐β‐циклодекстрине.
Пример 2. Превращение холестерина in vitro посредством полипептидов системы цитохрома P450 SA1 (SEQ ID NO:1) и SA4 (контроль WT, SEQ ID NO:4)
После раннего оценивания концентрации каждого препарата P450scc SA1, SA4 и SA6 применяли в последующих анализах in vitro. Каждую из этих изоформ разбавляли при концентрации 1 мкМ в присутствии холестерина в качестве субстрата (20 мкМ) с насыщающими количествами Adx и AdR.
Хотя SA4 и SA6 продемонстрировали идентичную активность, SA1 продемонстрировал в 2-3 раза более высокую активность по сравнению с SA4 и SA6 (фиг. 1). Поскольку после периода инкубирования субстрат уже истощен, затруднительно оценить отличия между полипептидами SA1 и SA1/SA4 при более длительном периоде инкубирования.
Пример 3. Превращение холестерина in vivo посредством полипептидов системы цитохрома P450 SA1 (SEQ ID NO:1) и SA6 (контроль, SEQ ID NO:6)
Поскольку измеримых различий между SA4 и SA6 не наблюдали, авторы настоящего изобретения сосредоточили свое внимание на сравнении полипептидов SA1 и SA6. Недавно была разработана новая система, в которой холестерин превращается в процессе метаболизма в прегненолон при помощи рекомбинантной Bacillus megaterium, экспрессирующей P450scc, Fdx1 и FdxR в присутствии солюбилизированного холестерина. Соответствующие SA1 и SA6 кДНК оптимизировали по смещению частоты использования кодонов для Bacillus megaterium и переносили в плазмиду pSFM2.1 с применением соответствующих сайтов рестрикции. Обе плазмиды PSFM2.1, несущие соответственно кодон-оптимизированные SA1 и SA6, переносили в MS941 Bacillus megaterium с применением классического протокола трансформации протопластов.
Активность превращения холестерина in vivo оценивали через 24 ч. и 48 ч. для полипептидов SA1 и SA6, экспрессируемых в Bacillus megaterium.
В соответствии с экспериментами in vitro SA1 в данном случае продемонстрировал в 2 раза более высокую активность по сравнению с SA6 (фиг.3 и 4).
Пример 4. Превращение различных субстратов в прегненолон in vivo посредством полипептида системы цитохрома P450 SA1 (SEQ ID NO:1)
В заключение улучшенную систему применяли для тестирования способности полипептида SA1 к превращению различных субстратов, представляющих интерес в биотехнологии: кампестерина, десмостерина, эргоста-5,24(28)-диен-3β-ола и смеси разных 20,22-OH-оксистеринов.
Каждый субстрат превращали в один основной продукт при том же времени удерживания, что и для прогестерона, что указывает на то, что CYP11A1 был способен расщеплять боковую цепь каждого из этих субстратов с получением прегненолона.
Образование прегненолона определяли количественно для каждого субстрата (фиг. 2). Полярные оксистерины превращались со скоростью, сопоставимой с таковой для холестерина (~ 35 мг/л через 48 часов). Превращение более гидрофобных стеролов кампестерина, десмостерина и эргостадиенола происходило лишь примерно с 19% скоростью после 48 часов по сравнению с холестерином.
Данные результаты, взятые в совокупности, показывают, что все из тестируемых стероидов были способны проникать через клеточную мембрану Bacillus megaterium и превращались в прегненолон посредством мутантного SA1 CYP11A1.
Таким образом, авторы настоящего изобретения в данном документе сообщают о новом белке P450scc, называемом SA1, который демонстрирует повышенную активность превращения по отношению к различным стеролам, в том числе холестерину.
Реферат
Изобретение относится к области биотехнологии и биохимии, в частности к выделенному ферменту P450. Указанный фермент отличается тем, что он состоит из аминокислотной последовательности, которая по меньшей мере на 80% идентична SEQ ID NO: 1, которая содержит треонин в положении 225 и аспарагиновую кислоту в положении 289. Настоящее изобретение относится к клетке-хозяину для получения указанного фермента P450 и к микроорганизму, экспрессирующему этот фермент и предназначенному для получения предшественника стероидных гормонов. Изобретение также относится к способам получения предшественника стероидных гормонов. Изобретение позволяет получать фермент P450 с повышенной ферментной активностью для получения предшественника стероидных гормонов. 9 н. и 5 з.п. ф-лы, 5 ил., 4 пр.

Комментарии