Мутант пируватдегидрогеназы, микроорганизм, содержащий мутант, и способ получения l-аминокислоты с использованием микроорганизма - RU2683208C1
Код документа: RU2683208C1
Описание
ОБЛАСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к новому варианту пируватдегидрогеназы, полинуклеотиду, кодирующему указанный вариант пируватдегидрогеназы, микроорганизму рода Corynebacterium, обладающему способностью продуцировать L-аминокислоту, содержащему указанный вариант, и способу получения L-аминокислоты с использованием указанного микроорганизма.
ПРЕДШЕСТВУЮЩИЙ УРОВЕНЬ ТЕХНИКИ
Пируватдегидрогеназный мультиферментный комплекс (PDHC) представляет собой фермент, превращающий пируват, образованный при гликолизе, в ацетил-КоА, и является важным ферментом, определяющим включение углерода в цикл трикарбоновых кислот.PDHC состоит из пируватдегидрогеназы (Е1р), дигидролипоамидацетилтрансферазы (Е2р) и дигидролипоамиддегидрогеназы (Е3р). Среди них фермент Е1р кодирован геном асеЕ. Несмотря на известные изменения в продукции L-лизина штаммом-продуцентом L-лизина, вызванные делецией и ослаблением гена асеЕ (Blombach et al., Appl. Microbiol. Biotechnol., 76: 615, 2007; Buchholz J et al., Appl Environ Microbiol., 79 (18): 5566 - 75, 2013), сообщений о варианте E1p, который мог бы улучшать способности к продукции L-аминокислот, не было.
ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Техническая проблема
Авторы настоящего изобретения приложили значительные усилия для разработки варианта Е1р, который может быть использован в получении L-аминокислоты в высокой концентрации, и микроорганизма, в котором использован указанный вариант, и в результате разработали вариант Е1р и обнаружили, что L-аминокислота может быть получена с высоким выходом из микроорганизма, содержащего указанный вариант Е1р, завершив посредством этого настоящее изобретение.
Техническое решение
Задачей настоящего изобретения является обеспечение нового варианта пируватдегидрогеназы.
Другой задачей настоящего изобретения является обеспечение полинуклеотида, кодирующего указанный вариант пируватдегидрогеназы.
Другой задачей настоящего изобретения является обеспечение микроорганизма рода Corynebacterium, продуцирующего L-аминокислоту, содержащего указанный вариант пируватдегидрогеназы.
Еще одной задачей настоящего изобретения является обеспечение способа получения L-аминокислоты, включающего: (а) культивирование микроорганизма рода Corynebacterium, продуцирующего L-аминокислоту, содержащего указанный вариант пируватдегидрогеназы, в среде для получения L-аминокислоты; и (б) выделение L-аминокислоты из культивированного микроорганизма или среды.
Полезные эффекты настоящего изобретения
С использованием варианта пируватдегидрогеназы по настоящему изобретению может быт получен фермент с ослабленной активностью. Как таковой, микроорганизм, содержащий указанный вариант пируватдегидрогеназы с ослабленной активностью, позволяет получать L-аминокислоту более эффективным образом, чем микроорганизм, продуцирующий L-аминокислоту, содержащий белок пируватдегидрогеназу дикого типа. Кроме того, микроорганизм по настоящему изобретению позволяет эффективно получать L-аминокислоту, ингибируя при этом рост микроорганизма лишь в редких случаях, в отличие от микроорганизмов с делецией пируватдегидрогеназы. Например, лизин, незаменимую аминокислоту для кормов для животных, необходимо получать в больших, с точки зрения производства, масштабах. Таким образом, получение L-лизина с высокой эффективностью, как в настоящем изобретении, может снизить стоимость изготовления кормов для животных.
НАИЛУЧШИЙ ВАРИАНТ ОСУЩЕСТВЛЕНИЯ ИЗОБРЕТЕНИЯ
Согласно одному аспекту настоящего изобретения предложен вариант пируватдегидрогеназы, содержащий по меньшей мере одну аминокислотную замену в области аминокислот в положениях 190-205 или в области аминокислот в положениях 415-440 SEQ ID NO:1.
При использовании здесь термин «пируватдегидрогеназа» относится к одному из ферментов, составляющих пируватдегидрогеназный мультиферментный комплекс (PDHC), вовлеченный в превращение пирувата в ацетил-КоА. При использовании здесь пируватдегидрогеназа не ограничена каким-либо конкретным ферментом, при условии, что она обладает соответствующей активностью, и может представлять собой, без ограничения, пируватдегидрогеназу, имеющую происхождение из микроорганизма рода Corynebacterium, конкретно Corynebacterium glutamicum. Например, пируватдегидрогеназа может представлять собой аминокислотную последовательность SEQ ID NO:1 или аминокислотную последовательность, имеющую гомологию по меньшей мере 75%, конкретно по меньшей мере 80%, конкретнее 85%, и еще конкретнее 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или более, с аминокислотной последовательностью SEQ ID NO:1. Белок Е1р, имеющий аминокислотную последовательность SEQ ID NO:1, может быть кодирован геном асеЕ, имеющим, без ограничения, полинуклеотидную последовательность SEQ ID NO:2. Кроме того, если аминокислотная последовательность гомологична указанной выше последовательности и обладает по существу такой же биологической активностью, как белок SEQ ID NO:1, или биологической активностью, соответствующей белку SEQ ID NO:1, то очевидно, что такую аминокислотную последовательность с делецией, модификацией, заменой или присоединением/вставкой следует также включать в объем настоящего изобретения. В настоящем изобретении любая полинуклеотидная последовательность, кодирующая пируватдегидрогеназу, может быть включена в объем настоящего изобретения. Например, полинуклеотидная последовательность может представлять собой полинуклеотидную последовательность, которая имеет по меньшей мере 75%, конкретно, по меньшей мере 80%, конкретнее, 85%, и, еще конкретнее 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или более с аминокислотной последовательностью SEQ ID NO:2. Кроме того, ввиду вырожденности кодонов или с учетом предпочтительности кодонов для организмов, экспрессирующих белок, полинуклеотидная последовательность, кодирующая белок, может иметь различные варианты кодирующей области, без выхода за рамки объема изобретения и без изменения аминокислотной последовательности белка, экспрессируемого с кодирующей области.
Вариант пируватдегидрогеназы по настоящему изобретению может содержать по меньшей мере одну, по меньшей мере две, по меньшей мере три, по меньшей мере четыре, по меньшей мере пять, по меньшей мере шесть, по меньшей мере семь, по меньшей мере восемь, по меньшей мере девять или по меньшей мере 10 аминокислотных замен в области аминокислот в положениях 190-205 или 415-440 SEQ ID NO:1.
В частности, вариант пируватдегидрогеназы по настоящему изобретению может содержать по меньшей мере одну, по меньшей мере две, по меньшей мере три или по меньшей мере четыре аминокислотные замены в области аминокислот в положениях 190-205 SEQ ID NO:1. Конкретно, аминокислотная замена в области аминокислот в положениях 190-205 SEQ ID NO:1 может быть выбрана, без ограничения, из группы аминокислот в положениях 190, 195, 199 и 201.
Замена в области аминокислот в положениях 190-205 SEQ ID NO:1 может представлять собой, без ограничения, замену по меньшей мере одной аминокислоты в области аминокислот в положениях 190-205 аминокислотой другого типа, конкретнее, замену по меньшей мере одной аминокислоты в положениях 190, 195, 199 и 201 аминокислотой другого типа, и еще конкретнее, по меньшей мере одну замену, выбранную из группы, состоящей из замены глутаминовой кислоты в положении 190 на валин (E190V), замены глутамина в положении 195 на гистидин (Q195H), замены пролина в положении 199 на серии (P199S) и замены тирозина в положении 201 на аланин (Y201A).
Кроме того, вариант пируватдегидрогеназы по настоящему изобретению может содержать по меньшей мере одну, по меньшей мере две, по меньшей мере три, по меньшей мере четыре, по меньшей мере пять или по меньшей мере шесть аминокислотных замен в области аминокислот в положениях 415-440 SEQ ID NO:1. Конкретно, аминокислотная замена в области аминокислот в положениях 415-440 SEQ ID NO:1 может быть выбрана из группы, состоящей из аминокислот в положениях 418, 428, 432, 435 и 438.
Замена в области аминокислот в положениях 415-440 SEQ ID NO:1 может представлять собой, без ограничения, замену по меньшей мере одной аминокислоты в области аминокислот в положениях 415-440 аминокислотой другого типа, конкретнее, замену по меньшей мере одной аминокислоты в положениях 418, 428, 432, 435 и 438 аминокислотой другого типа, и еще конкретнее, по меньшей мере одну замену, выбранную из группы, состоящей из замены тирозина в положении 418 на гистидин (Y418H), замены аспарагина в положении 428 на аланин (N428A), замены глутамина в положении 432 на глутаминовую кислоту (Q432E), замены глутамина в положении 432 на аланин (Q432A), замены лизина в положении 435 на аланин (K435A) и замены лейцина на пролин (L438P).
Конкретнее, вариант пируватдегидрогеназы может содержать аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO:14-33.
Вариант пируватдегидрогеназы может включать не только белки, имеющие аминокислотные последовательности SEQ ID NO:14-33, но также варианты пируватдегидрогеназы, имеющие гомологию по меньшей мере 75% или более, конкретно, 80% или более, конкретнее 85% или более, и еще конкретнее 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или более с аминокислотными последовательностями SEQ ID NO:14-33, без ограничения, при условии, что их пируватдегидрогеназная активность существенно ослаблена по сравнению с пируватдегидрогеназной активностью дикого типа. Очевидно, что аминокислотные последовательности, обладающие по существу такой же биологической активностью, как белки, имеющие аминокислотные последовательности SEQ ID NO:14-33, или биологической активностью, соответствующей белкам, имеющим аминокислотные последовательности SEQ ID NO:14-33, следует также включать в объем настоящего изобретения, несмотря на то, что часть их аминокислотных последовательностей может иметь делецию, модификацию, замену или присоединение/вставку.
При использовании здесь термин «гомология» относится к проценту идентичности двух полинуклеотидных или полипептидных группировок. Гомология последовательностей одной группировки другой группировке может быть определена технологией, известной в данной области. Например, гомология может быть определена непосредственным сравнением информации о последовательностях двух полинуклеотидных молекул или двух полипептидных молекул с использованием легкодоступных компьютерных программ. Примеры компьютерных программ включают BLAST (NCBI), CLC Main Workbench (CLC bio), MegAlignTM (DNASTAR Inc.) и так далее. Кроме того, гомология полинуклеотидов может быть определена гибридизацией полинуклеотидов в условиях, в которых между гомологичными областями образуются стабильные двойные цепи, разъединением нуклеазой, специфичной в отношении одиночных цепей, с последующим определением размера разъединенных фрагментов.
Согласно одному аспекту настоящего изобретения предложен полинуклеотид, кодирующий вариант пируватдегидрогеназы.
Вариант пируватдегидрогеназы представляет собой такой же вариант, как объяснено выше. Конкретно, полинуклеотид, кодирующий вариант пируватдегидрогеназы, может быть включен в объем настоящего изобретения при условии, что полинуклеотид кодирует белки, имеющие аминокислотные последовательности SEQ ID NO:14-33. Кроме того, полинуклеотид может представлять собой любой полинуклеотид, имеющий гомологию по меньшей мере 75% или более конкретно 80%, или конкретнее 85% или более, и еще конкретнее 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или более, с указанной выше полинуклеотидной последовательностью.
При использовании здесь термин «полинуклеотид» относится к полимеру нуклеотидов, расположенных продольной цепью с ковалентными связями между нуклеотидными единицами, обычно к цепи ДНК или РНК определенной длины, и в настоящем изобретении он относится к полинуклеотиду, кодирующему вариант пируватдегидрогеназы. Ввиду вырожденности кодонов полинуклеотид может иметь различные нуклеотидные последовательности, кодирующие одну и ту же аминокислоту. Кроме того, кодоны в последовательности полинуклеотида могут быть оптимизированы для оптимизации экспрессии в соответствии с типом клеток-хозяев.
Согласно еще одному аспекту настоящего изобретения предложен микроорганизм рода Corynebacterium, продуцирующий L-аминокислоту, содержащий указанный вариант пируватдегидрогеназы.
Конкретно, присутствие варианта пируватдегидрогеназы в микроорганизме может быть результатом мутации, или микроорганизм может быть трансформирован вектором, содержащим полинуклеотид, кодирующий вариант пируватдегидрогеназы.
При использовании здесь термин «вектор» относится к любому носителю для клонирования и/или переноса оснований в клетку-хозяина. Вектор может представлять собой репликон, позволяющий проводить репликацию другого фрагмента (фрагментов) ДНК, соединенного с вектором. «Репликон» относится к любой генетической единице, действующей как единица репликации ДНК in vivo, то есть, к генетическим единицам (например, плазмидам, фагам, космидам, хромосомам и вирусам), способным к репликации посредством саморегуляции. При использовании здесь термин «вектор» не ограничен каким-либо конкретным вектором, при условии, что он может быть реплицирован у хозяина, и может быть использован любой вектор, известный в данной области. Вектор, используемый в конструировании рекомбинантного вектора, может быть в естественном состоянии или представлять собой плазмиды, космиды, вирусы и бактериофаги в рекомбинантном состоянии. Например, в качестве фагового вектора или космидного вектора могут быть использованы pWE15, М13, λEMBL3, λEMBL4, λFIXII, λDASHII, λZAPII, λgt10, λgt11, Charon4A, Charon21A и так далее, и в качестве плазмидного вектора могут быть использованы векторы на основе вектора pDZ, векторы pBR, pUC, pBluescriptll, pGEM, pTZ, pCL, pET и так далее. Векторы, которые могут быть использованы в настоящем изобретении, не ограничены какими-либо конкретными векторами, и может быть использован любой известный вектор экспрессии. Конкретно, но без ограничения, может быть использован вектор pDZ (патент Кореи №10-0924065 полностью включен в настоящее описание посредством ссылки).
При использовании здесь термин «трансформация» относится к процессу введения гена в клетку-хозяина, что позволяет экспрессировать ген в клетке-хозяине. Ген, вводимый при трансформации, может включать, без ограничения, любой ген, независимо от того, введен ли он в хромосому клетки-хозяина, будучи расположен в ней, или расположен вне хромосомы, при условии, что он может быть экспрессирован в клетке-хозяине. Полинуклеотид может быть введен в клетку-хозяина в форме экспрессионной кассеты, представляющей собой полинуклеотидную конструкцию, содержащую все обязательные элементы, необходимые для самостоятельной экспрессии. Обычно экспрессионная кассета может содержать промотор, функционально связанный с геном, сигнал терминации транскрипции, домен связывания рибосом и сигнал терминации трансляции. Экспрессионная кассета может быть представлена в форме вектора экспрессии, способного к самостоятельной репликации. Кроме того, полинуклеотид может, без ограничения, быть введен в клетку-хозяина сам по себе или в форме полинуклеотидной конструкции и функционально связан с последовательностью, необходимой для его экспрессии в клетке-хозяине.
Микроорганизм может представлять собой любой прокариотический или эукариотический микроорганизм, при условии, что указанный микроорганизм обладает активностью соответствующего варианта пируватдегидрогеназы или трансформирован для экспрессии соответствующего белка. Примеры микроорганизмов могут включать, без ограничения, микробные штаммы рода Escherichia, рода Erwinia, рода Serratia, рода Providencia, рода Enterobacteria, рода Salmonella, рода Streptomyces, рода Pseudomonas, рода Brevibacterium, рода Corynebacterium и так далее, конкретно, микроорганизм рода Corynebacterium, и, конкретнее, Corynebacterium glutamicum.
Кроме того, при введении варианта пируватдегидрогеназы по настоящему изобретению в микроорганизм, способный продуцировать L-аминокислоту, его способность продуцировать L-аминокислоту может быть значительно улучшена без существенного ингибирования роста клеток, по сравнению с микроорганизмом, содержащим пируватдегидрогеназу дикого типа.
При использовании здесь термин «L-аминокислота» относится ко всем L-аминокислотам, которые могут быть получены из различных источников углерода через пируват, и в частности может относиться к L-аминокислоте, путь биосинтеза которой не включает процесс превращения пирувата в ацетил-КоА. Конкретнее, L-аминокислота может включать L-лизин, L-треонин, L-метионин, L-изолейцин, L-валин, L-лейцин или L-аланин, и, еще конкретнее, L-лизин или L-валин.
Микроорганизм, продуцирующий L-аминокислоту, может включать как эукариотические, так и прокариотические микроорганизмы, способные продуцировать L-аминокислоту in vivo, и примеры таких микроорганизмов описаны выше. Микроорганизм, продуцирующий L-аминокислоту, может представлять собой любой микроорганизм, без ограничения, при условии, что микроорганизм обладает способностью продуцировать L-аминокислоту, включая как штаммы дикого типа, так и рекомбинантные штаммы.
Например, микроорганизм рода Corynebacterium, продуцирующий L-лизин, может быть модифицирован для придания резистентности к аналогу L-лизина или усиления активности белка, связанного с биосинтезом L-лизина, по сравнению с немодифицированным микроорганизмом. Конкретно, экспрессию по меньшей мере одного типа генов, связанных с биосинтезом L-лизина, улучшают, без ограничения, амплификацией генов, заменой или модификацией таких последовательностей, как промотор или старт-кодон, введением модификации для улучшения экспрессии и так далее.
Кроме того, примеры генов, связанных с биосинтезом L-лизина, могут включать гены, входящие в путь биосинтеза L-лизина, и в частности, без ограничения, ген синтазы дигидродипиколиновой кислоты (dapA), ген аспартокиназы (lysC), ген редуктазы дигидродипиколиновой кислоты (dapB), ген декарбоксилазы диаминопимелиновой кислоты (lysA), ген дегидрогеназы диаминопимелиновой кислоты (ddh), ген фосфоенолпируваткарбоксикиназы (ррс), ген аспартатполуальдегиддегидрогеназы (asd), ген аспартазы (aspB) и ген пируваткарбоксилазы (Рус). Кроме того, примеры генов, связанных с биосинтезом L-лизина, могут включать, без ограничения, транскетолазу (tkt) и тому подобное, входящие в пентозофосфатный путь.
В частности, без ограничения, микроорганизм рода Corynebacterium, продуцирующий L-лизин, может демонстрировать способность продуцировать L-лизин включением модификации, связанной с продукцией L-лизина, раскрытой в данной области.
Микроорганизм, продуцирующий L-треонин, может представлять собой, без ограничения, микроорганизм, которому необходим метионин, обладающий резистентностью к аналогам треоиниа, резистентностью к аналогам лизина, резистентностью к аналогам изолейцина и/или резистентностью к аналогам метионина. Аналоги метионина могут представлять собой по меньшей мере одно соединение, выбранное из группы, состоящей из D.L-этионина, норлейцина, α-метилметионина и L-метионин-D,L-сульфоксимина; аналоги треонина могут представлять собой по меньшей мере одно соединение, выбранное из группы, состоящей из α-амино-β-гидроксивалериановой кислоты и гидроксамата D,L-треонина; и аналоги лизина могут представлять собой по меньшей мере одно соединение, выбранное из группы, состоящей из S-(2-аминоэтил)-L-цистеина и δ-метил-L-лизина.
Кроме того, продуцирующий L-треонин, может включать, без ограничения, микроорганизм, у которого активность РскА, вовлеченного в превращение оксалоацетата (ОАА), являющегося промежуточным продуктом биосинтеза L-треонина, в фосфоенолпируват (PEP), ослаблена или устранена; или микроорганизм, у которого активность TyrR, ингибирующего ген lysC, вовлеченный в превращение оксалоацетата в аспартат, ослаблена или устранена; или микроорганизм, у которого активность GaIR, ингибирующего экспрессию гена gaIP, вовлеченного в транспорт глюкозы, ослаблена или устранена.
Микроорганизм, продуцирующий L-изолейцин, может представлять собой микроорганизм, обладающий резистентностью к L-изолейцину или его производным, или микроорганизм, генетически модифицированный для устранения ингибирования L-изолейцином или его производными по механизму обратной связи. Примеры производных L-изолейцина могут включать, без ограничения, 4-тиаизолейцин (тиаил (thiaile)) и гидроксамат изолейцина (ileHx).
Микроорганизм, продуцирующий L-валин, может представлять собой микроорганизм, обладающий резистентностью к L-валину или его производным, или микроорганизм, у которого генетически модифицирован фермент пути биосинтеза L-валина для устранения ингибирования L-валином или его производными по механизму обратной связи. Примеры такого микроорганизма могут включать, без ограничения, микроорганизм, содержащий вариант синтазы ацетогидроксикислоты, у которого устранено ингибирование L-валином по механизму обратной связи. Кроме того, микроорганизм может представлять собой микроорганизм, экспрессия оперона L-валина у которого модифицирована для ее усиления, и, например, микроорганизм может представлять собой микроорганизм, экспрессия оперона L-валина у которого усилена частичной или полной делецией полинуклеотидной последовательности, кодирующей лидерный пептид, в регуляторной области оперона L-валина (заявка на патент Кореи №10-2014-0111421, все описание которой может, без ограничения, быть включено посредством ссылки).
Согласно еще одному аспекту настоящего изобретения предложен способ получения L-аминокислоты, включающий: (а) культивирование микроорганизма рода Corynebacterium, продуцирующего L-аминокислоту, содержащего указанный вариант пируватдегидрогеназы, в среде для получения L-аминокислоты; и (б) выделение L-аминокислоты из культивированного микроорганизма или среды.
Микроорганизмы рода Corynebacterium, продуцирующие L-аминокислоту и тому подобное, являются такими же, как описано выше.
При использовании здесь термин «культивирование» относится к выращиванию микроорганизма в подходящих и искусственно контролируемых условиях окружающей среды. Способ культивирования по настоящему изобретению может быть осуществлен на основе подходящих культуральных сред и условий культивирования, известных в данной области. Конкретные условия, такие как температура культивирования, время культивирования, значение рН культуральной среды и так далее, могут быть определены на основе информации, хорошо известной специалисту в данной области, или обычным способом, известным в данной области, и могут быть надлежащим образом скорректированы в зависимости от обстоятельств. В частности, эти известные способы культивирования подробно описаны в литературе [Chmiel; Bioprozesstechnik 1. Einfuhrung indie Bioverfahrenstechnik (Gustav Fischer Verlag, Stuttgart, 1991), и Storhas; Bioreaktoren und periphere Einrichtungen (Vieweg Verlag, Braunschweig / Wiesbaden, 1994)]. Кроме того, способы культивирования могут включать периодическое культивирование, непрерывное культивирование, культивирование с подпиткой, и конкретно без ограничения, культивирование можно проводить непрерывно методикой культивирования с подпиткой или повторяющегося культивирования с подпиткой. Среда, используемая для культивирования, должна подходящим образом соответствовать требованиям для определенных штаммов. Примеры источников углерода для использования в указанной среде могут включать, без ограничения, сахара и углеводы, такие как глюкоза, сахароза, лактоза, фруктоза, мальтоза, крахмал и целлюлоза; масла и жиры, такие как соевое масло, подсолнечное масло, касторовое масло и кокосовое масло; жирные кислоты, такие как пальмитиновая кислота, стеариновая кислота и линолевая кислота; спирты, такие как глицерин и этанол; и органические кислоты, такие как уксусная кислота. Эти источники углерода могут быть использованы, без ограничения, по отдельности или в комбинации. Примеры источников азота для использования в указанной среде могут включать пептон, дрожжевой экстракт, мясной бульон, солодовый экстракт, жидкий кукурузный экстракт, соевую муку; и мочевину или неорганические соединения, такие как сульфат аммония, хлорид аммония, фосфат аммония, карбонат аммония и нитрат аммония. Эти источники азота могут также быть использованы, без ограничения, по отдельности или в комбинации. Примеры источников фосфора для использования в указанной среде могут включать, без ограничения, дигидрофосфат, гидрофосфат калия, соответствующие натрийсодержащие соли и так далее. Кроме того, среда может содержать соли металлов, такие как сульфат магния или сульфат железа, необходимые для роста. В завершение, помимо веществ, описанных выше, среда может также содержать вещества, обязательные для роста, такие как аминокислоты и витамины. Кроме того, могут быть использованы предшественники, подходящие для культуральной среды. Эти источники могут, без ограничения, быть подходящим образом добавлены в культуру во время культивирования по методике периодического культивирования или непрерывного культивирования.
Кроме того, во время культивирования показатель рН культуры можно корректировать, подходящим образом добавляя в культуру такое соединение, как гидроксид аммония, гидроксид калия, аммиак, фосфорная кислота и серная кислота. В периоде культивирования может быть добавлен пеногаситель, такой как полигликолевый эфир жирной кислоты, для предотвращения пенообразования. Кроме того, в культуру могут быть введены кислород или кислородсодержащий газ для поддержания аэробного состояния культуры, или могут быть введены азот, водород или диоксид углерода без введения газа для поддержания анаэробного или микроаэробного состояния культуры. Температура культуры может обычно входить в диапазон от 27°С до 37°С и, конкретно, от 30°С до 35°С. Культивирование можно продолжать до получения желаемого количества полезных веществ и, конкретно, от 10 часов до 100 часов. L-аминокислоты могут высвобождаться в культуральную среду, используемую для культивирования, или могут присутствовать в микроорганизмах.
Кроме того, что касается способа получения L-аминокислоты по настоящему изобретению, способ выделения L-аминокислоты из культивированного микроорганизма или культуры широко известен в данной области. Способы выделения L-аминокислот могут включать, без ограничения, фильтрацию, анионообменную хроматографию, кристаллизацию, высокоэффективную жидкостную хроматографию (ВЭЖХ) и так далее.
ВАРИАНТ ОСУЩЕСТВЛЕНИЯ ИЗОБРЕТЕНИЯ
Далее настоящее изобретение будет описано более подробно со ссылкой на Примеры. Тем не менее, эти Примеры приведены лишь в иллюстративных целях, и изобретение не следует ограничивать этими Примерами.
Пример 1: Конструирование библиотеки вариантов Е1р посредством
искусственного мутагенеза
В данном Примере конструировали векторную библиотеку для первичной перекрестной вставки в хромосому с целью получения вариантов Е1р способом, описанным ниже. Проводили полимеразную цепную реакцию (ПЦР) пониженной точности (error-prone PCR), амплифицируя ген асеЕ, имеющий происхождение от Corynebacterium glutamicum АТСС13032 (SEQ ID NO:2), кодирующий E1p (SEQ ID NO:1) и получая модифицированный ген асеЕ (2852 пары оснований (п.о.)) со случайными заменами оснований. ПЦР пониженной точности проводили с использованием набора для мутагенеза Genemorph II Random Mutagenesis Kit (Stratagene) и геномной ДНК Corynebacterium glutamicum ATCC13032 в качестве матрицы с парймером 1 (SEQ ID NO:3) и праймером 2 (SEQ ID NO:4).
Праймер 1 (SEQ ID NO:3): 5'-TGGGA CCGGG АААСС GGG-3'.
Праймер 2 (SEQ ID NO:4): 5'-GATTT ATCTG TCCCT TGA-3'.
В амплифицированных фрагментах гена заменяли основания в количестве от 0 до 3,5 на 1 тысячу пар оснований (т.п.о.) и ПЦР проводили на протяжении в общей сложности 30 циклов при следующих условиях: денатурация при 96°С в течение 30 с, отжиг при 53°С в течение 30 с и полимеризация при 72°С в течение 2 мин.
Амплифицированные фрагменты соединяли с вектором pCR2.1-TOPO (далее - «pCR2.1») с использованием набора для клонирования pCR2.1-TOPO ТА Cloning Kit (Invitrogen), трансформировали им Е. coli DH5α и высевали их на твердую среду LB, содержащую канамицин (25 мг/л). Отбирали 20 различных типов трансформированных колоний, после чего выделяли из них плазмиды. При анализе полинуклеотидных последовательностей плазмид было подтверждено, что модификации присутствовали в разных положениях с частотой 1,4 мутации на 1 т.п.о. Было получено приблизительно 20000 колоний трансформированных Е. coli, и их плазмиды были выделены и названы библиотекой «pCR2.1-aceE (mt)».
Кроме того, конструировали плазмиду, имеющую ген асеЕ дикого типа, для использования в качестве контрольного штамма. ПЦР проводили таким же образом, как описано выше, с использованием геномной ДНК Corynebacterium glutamicum АТСС13032 в качестве матрицы с парймером 1 (SEQ ID NO:3) и праймером 2 (SEQ ID NO:4). В качестве полимеразы использовали ДНК-полимеразу PfuUltra High-Fidelity DNA Polymerase (Stratagene), и сконструированная таким образом плазмида была названа «pCR2.1-aceE (WT)».
Пример 2: Конструирование штамма с делецией асеЕ
Штамм с делецией асеЕ конструировали для введения библиотеки pCR2.1-aceE (mt), используя штамм KCCM11016P (указанный выше микроорганизм был впервые опубликован как KFCC10881 и депонирован повторно признанным международным органом по депонированию согласно Будапештскому соглашению с присвоением регистрационного номера KCCM11016P; патент Кореи №10 0159812) в качестве исходного штамма.
Для конструирования вектора с делецией асеЕ проводили ПЦР с использованием хромосомы Corynebacterium glutamicum АТСС13032 дикого типа в качестве матрицы с праймером 3 (SEQ ID NO:5), праймером 4 (SEQ ID NO:6), праймером 5 (SEQ ID NO:7) и праймером 6 (SEQ ID NO:8).
Праймер 3 (SEQ ID NO:5): 5'-GCAGG TCGAC TCTAG ATGCG ATTCG CGTCA AACGT G-3'.
Праймер 4 (SEQ ID NO:6): 5'-GTCCC TTGAG GTGAT GTGAA TCCAT CCACT-3'.
Праймер 5 (SEQ ID NO:7): 5'-AGTGG ATGGA TTCAC ATCAC CTCAA GGGAC-3'.
Праймер 6 (SEQ ID NO:8): 5'-CCGGG GATCC TCTAG ACGAA GCGCC GTGAG CAATT C-3'.
ПЦР проводили в следующих условиях: денатурация при 95°С в течение 5 мин; 30 циклов денатурации при 95°С в течение 30 с, отжига при 55°С в течение 30 с и полимеризации при 72°С в течение 30 с; и полимеризация при 72°С в течение 7 мин.
В результате, были получены SEQ ID NO:9 (521 п. о.) и SEQ ID NO:10 (538 п. о.), содержащие 5'-конец и 3'-конец, соответственно.
ПЦР проводили с использованием амплифицированных последовательностей SEQ ID NO:9 и SEQ ID NO:10 в качестве матриц с парймером 3 (SEQ ID NO:5) и праймером 6 (SEQ ID NO:8).
ПЦР проводили в следующих условиях: денатурация при 95°С в течение 5 мин; 30 циклов денатурации при 95°С в течение 30 с, отжига при 55°С в течение 30 с и полимеризации при 72°С в течение 60 с; и полимеризация при 72°С в течение 7 мин.
В результате, была амплифицирована SEQ ID NO:11 размером 1029 п. о. (далее - ΔасеЕ), в которой были соединены 5'-конец и 3'-конец гена асеЕ.
Вектор pDZ (патент Кореи №10-0924065), неспособный к репликации в Corynebacterium glutamicum, и фрагмент ΔасеЕ обрабатывали рестриктазой Xbal, лигировали с использованием ДНК-лигазы и клонировали с получением плазмиды. Полученная плазмида была названа pDZ-ΔасеЕ.
Плазмидой pDZ-ΔасеЕ трансформировали Corynebacterium glutamicum KCCM11016P, являющийся штаммом, продуцирующим L-лизин, посредством электрического импульса (Appl. Microbiol. Biothcenol. (1999) 52: 541-545), и трансформированный штамм выделяли из селективной среды, содержащей канамицин (25 мг/л). Был получен штамм, в котором ген асеЕ был инактивирован посредством ΔасеЕ, фрагмента ДНК, введенного в геном вторичной рекомбинацией, и полученный штамм был назван KCCM11016PΔасеЕ.
Пример 3: Конструирование библиотеки искусственных вариантов Е1р и скрининг штаммов с усиленной способностью к продукции L-лизина
Конструированной библиотекой pCR2.1-aceE (mt) трансформировали штамм KCCM11016PΔасеЕ, который использовали в качестве исходного штамма, посредством гомологичной рекомбинации и проводили высев на сложную твердую среду, содержащую канамицин (25 мг/л), с получением приблизительно 10000 колоний, каждой из которых было присвоено название от «KCCM11016PΔасеЕ/pCR2.1-aceE (mt)-1» до «KCCM11016PΔасеЕ/pCR2.1-асеЕ (mt)-10000», соответственно.
Кроме того, штамм KCCM11016PΔасеЕ трансформировали конструированным вектором pCR2.1-aceE (WT) с получением контрольного штамма, названного «KССМ11016PΔасеЕ/pCR2.1-aceE (WT)».
Сложная твердая среда (рН 7,0)
Глюкоза, 10 г; пептон, 10 г; мясной экстракт, 5 г; дрожжевой экстракт, 5 г; сердечно-мозговой экстракт, 18,5 г; NaCl, 2,5 г; мочевина, 2 г; сорбит, 91 г; и агар, 20 г (на 1 л дистиллированной воды).
Полученные таким образом 10000 колоний высевали соответственно в селективную среду (300 мкл) и культивировали в глубоких 96-луночных планшетах при 32°С и 1000 об/мин в течение приблизительно 24 часов. Количество L-лизина, продуцируемого в культуре, анализировали нингидриновым методом (J. Вiоl. Сhem. 1948. 176: 367-388). По завершении культивирования 10 мкл культурального супернатанта и 190 мкл нингидринового реакционного раствора подвергали взаимодействию при 65°С в течение 30 минут. Оптическую плотность при 570 нм измеряли спектрофотометром, сравнивали с соответствующим показателем контрольного штамма KCCM11016PΔасеЕ/pCR2.1-aceE (WT) и отбирали 256 модифицированных штаммов с повышением оптической плотности по меньшей мере на 10%. Другие колонии продемонстрировали сходную или сниженную оптическую плотность по сравнению с контрольным штаммом.
Селективная среда (рН 8,0)
Глюкоза, 10 г; (NH4)2SO4, 5,5 г; MgSO4⋅7H2O, 1,2 г; KН2РO4, 0,8 г; K2НРO4, 16,4 г; биотин, 100 мкг; тиамин-HCl, 1000 мкг; кальций-пантотеновая кислота, 2000 мкг; и никотинамид, 2000 мкг (на 1 л дистиллированной воды).
Отобранные 256 штаммов анализировали нингидриновым методом так же, как описано выше, и отбирали 53 штамма с повышенной способностью к продукции L-лизина по сравнению со штаммом
KCCM11016PΔасеЕ/pCR2.1-aceE (WT).
Пример 4: Подтверждение способности штаммов, отобранных из
библиотеки искусственных вариантов Е1р, к продукции L-лизина
Для сравнения способности 53 различных штаммов, отобранных в Примере 3, продуцировать L-лизин, штаммы культивировали методом, описанным ниже, и анализировали компоненты полученных культур.
Каждый из штаммов высевали в колбы с угловыми перегородками (corner-baffle flasks) объемом 250 мл, содержащие 25 мл среды для получения посевной культуры, соответственно, и культивировали в шейкер-инкубаторе (200 об/мин) при 30°С в течение 20 часов. В каждую колбу с угловыми перегородками, содержащую 24 мл среды для получения L-лизина, вносили по 1 мл жидкой посевной культуры и культивировали в шейкер-инкубаторе (200 об/мин) при 30°С в течение 72 часов. Концентрацию L-лизина в каждой культуре анализировали посредством ВЭЖХ.
Среда для получения посевной культуры (рН 7,0)
Глюкоза (20 г), пептон (Юг), дрожжевой экстракт (5 г), мочевина (1,5 г), KН2РO4 (4 г), K2НРO4 (8 г), MgSO4⋅7H2O (0,5 г), биотин (100 мкг), тиамин-HCl (1000 мкг), кальций-пантотеновая кислота (2000 мкг), никотинамид (2000 мкг) (на 1 л дистиллированной воды).
Среда для получения L-лизина (рН 7,0)
Глюкоза (100 г), (NH4)2SO4 (40 г), соевый белок (2,5 г), сухой кукурузный экстракт (5 г), мочевина (3 г), КН2РO4 (1 г), MgSO4⋅7H20 (0,5 г), биотин (100 мкг), тиамин-HCl (1000 мкг), кальций-пантотеновая кислота (2000 мкг), никотинамид (3000 мкг) и СаСO3 (30 г) (на 1 л дистиллированной воды).
Из 53 различных штаммов отбирали 10 штаммов с наибольшими концентрациями L-лизина, и повторяли культивирование и анализ, описанные выше. Концентрации L-лизина, полученные при анализе, показаны в Таблице 1 ниже.

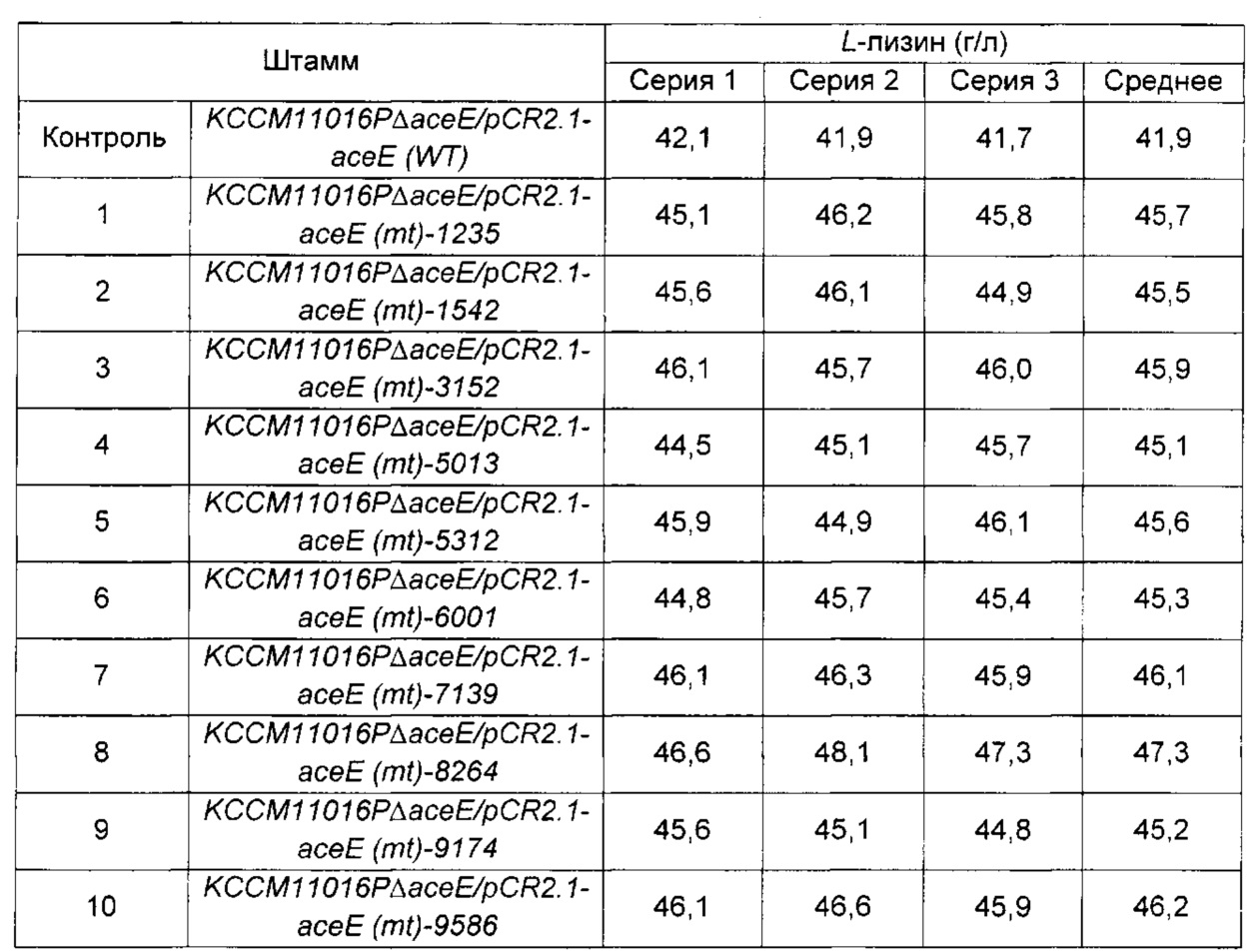
В результате анализа концентрации L-лизина было подтверждено, что выход L-лизина при использовании 10 отобранных штаммов продемонстрировал максимальное повышение на 22% по сравнению с контрольным штаммом KCCM11016PΔасеЕ/pCR2.1-aceE (WT).
Пример 5: Подтверждение модификации гена асеЕ в штаммах, отобранных из библиотеки искусственных вариантов Е1р
Для подтверждения замен, введенных в Е1р 10 штаммов, отобранных в Примере 4, анализировали полинуклеотидные последовательности модифицированного асеЕ. Для определения полинуклеотидных последовательностей проводили ПЦР с использованием праймера 1 (SEQ ID NO:3) и праймера 2 (SEQ ID NO:4).
Праймер 1 (SEQ ID NO:3): 5'-TGGGA CCGGG АААСС GGG-3'.
Праймер 2 (SEQ ID NO:4): 5'-GATTT ATCTG TCCCT TGA-3'.
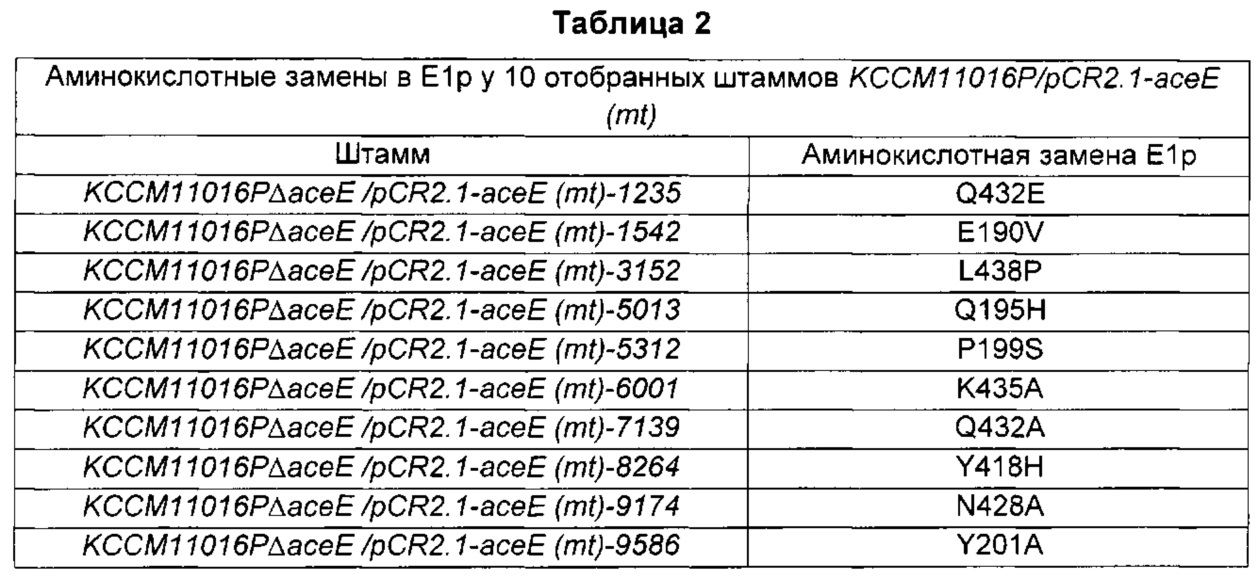
Полученные полинуклеотидные последовательности каждого модифицированного фрагмента гена асеЕ подтверждали анализом, сравнивали с полинуклеотидной последовательностью SEQ ID NO:2 и таким образом подтверждали аминокислотные последовательности вариантов Е1р. Информация о заменах в аминокислотных последовательностях Е1р отобранных штаммов показана в Таблице 2 ниже.
Пример 6: Конструирование вектора для введения варианта Е1р в хромосому
С целью подтверждения эффекта применения варианта Е1р, подтвержденного в Примере 5, конструировали вектор для введения указанного варианта в хромосому.
На основе указанных полинуклеотидных последовательностей, синтезировали праймер 9 (SEQ ID NO:12) с сайтом рестрикции Xbal на 5'-конце и праймер 10 (SEQ ID NO:13) с сайтом рестрикции Хbаl на 3'-конце. Фрагменты генов асеЕ (mt) 10 различных модифицированных штаммов амплифицировали посредством ПЦР с использованием хромосом 10 различных отобранных штаммов в качестве матриц, соответственно.
ПЦР проводили в следующих условиях: денатурация при 94°С в течение 5 мин; 30 циклов денатурации при 94°С в течение 30 с, отжига при 56°С в течение 30 с и полимеризации при 72°С в течение 2 мин; и полимеризация при 72°С в течение 7 мин.
Праймер 9 (SEQ ID NO:12): 5'-ААТСТ AGATG GGACC GGGAA ACCGG G-3'.
Праймер 10 (SEQ ID NO:13): б'-ААТСТ AGAGA ТТТАТ CTGTC CCTTG А-3'.
Фрагменты генов 10 различных штаммов, амплифицированные посредством ПЦР, обрабатывали Xbal с получением соответствующих фрагментов ДНК, фрагменты соединяли с вектором pDZ для введения в хромосомы, содержащие сайт рестрикции Хbаl, трансформировали им Е. coli DH5α и высевали их на твердую среду LB, содержащую канамицин (25 мг/л).
Колонии, трансформированные вектором, в который был введен целевой ген, отбирали посредством ПЦР и получали плазмиды общеизвестными методами выделения плазмид. В соответствии с модификацией, введенной в Е1р каждой плазмиды, плазмиды были названы pDZ-E1p (Q432E), pDZ-E1p (E190V), pDZ-E1p(L438P), pDZ-E1p (Q195H), pDZ-E1p (P199S), pDZ-E1p (K435A), pDZ-E1p(Q432A), pDZ-E1p (Y418H), pDZ-E1p (N428A) и pDZ-E1p (Y201A), соответственно.
Пример 7: Конструирование штаммов, имеющих происхождение из KCCM11016P, с введением вариантов Е1р и сравнение их способности
продуцировать L-лизин
Corynebacterium glutamicum KCCM11016P, штамм, продуцирующий L-лизин, трансформировали 2-стадийной рекомбинацией гомологичных хромосом с использованием 10 векторов для введения новых вариантов Е1р, полученных в Примере 6. Затем, анализируя полинуклеотидные последовательности, отбирали штаммы, в хромосомы которых были введены варианты Е1р, и они были названы KCCM11016P::Е1р (Q432E), KCCM11016P::E1р (E190V), KCCM11016P::E1р (L438P), KCCM11016P::Е1р (Q195H), KCCM11016P::E1р (P199S), KCCM11016P::Е1р (K435A), KCCM11016P::E1p (Q432A), KCCM11016P::Е1р (Y418H), KCCM11016P::E1р (N428A) и KССM11016Р::Е1р (Y201A) в соответствии с введенным вариантом Е1р.
Штаммы культивировали так же, как в Примере 4, и анализировали концентрации L-лизина в культурах. Для оценки скорости роста конструированных штаммов измеряли остаточную концентрацию глюкозы в культурах через 18 часов после начала культивирования (Таблица 3).

Новые 10 различных штаммов (то есть KCCM11016P::Е1р (Q432E), KCCM11016P::E1р (E190V), KCCM11016P::Е1р (L438P), KCCM11016P::E1р (Q195H), KCCM11016P::Е1р (P199S), KCCM11016P::E1р (K435A), KCCM11016P::Е1р (Q432A), KCCM11016P::Е1р (Y418H), KССМ11016Р::Е1р (Y201A) и KCCM11016P::Е1р (N428A)) продемонстрировали незначительное снижение скорости потребления глюкозы и в то же время максимальное повышение продукции лизина на 10% по сравнению с исходным штаммом.
В связи с этим авторы настоящего изобретения дали штамму KCCM11016P::E1р (N428A), репрезентативному штамму среди штаммов с улучшенной способностью к продукции L-лизина, название Corynebacterium glutamicum «СА01-2289», и депонировали этот штамм в Корейском центре культур микроорганизмов, являющемся признанным международным органом по депонированию согласно Будапештскому соглашению, 23 октября 2014 г. с присвоением ему регистрационного номера KССМ11590Р.
При исследовании было подтверждено, что варианты Е1р 10 различных штаммов (то есть E1p(Q432E) (SEQ ID NO:14), E1p(E190V) (SEQ ID NO:15), E1p(L438P) (SEQ ID NO:16), E1p(Q195H) (SEQ ID NO:17), E1p (P199S) (SEQ ID NO:18), E1p(K435A) (SEQ ID NO:19), E1p (Q432A) (SEQ ID NO:20), E1p(Y418H) (SEQ ID NO:21), E1p(Y201A) (SEQ ID NO:22) и E1p (N428A) (SEQ ID NO:23)) можно было распределить главным образом по двум группам (аминокислотные остатки в положениях 190-201 и аминокислоты в положениях 418-438).
Были синтезированы десять различных штаммов с комбинациями замен, принадлежащих к каждой группе (то есть (KCCM11016P::Е1р (E190V, Q195H), KCCM11016P::Е1р (E190V, P199S), KCCM11016P::Е1р (Q195H, P199S), KCCM11016P::Е1р (E190V, Y201A), KCCM11016P::Е1р (Q195H, Y201A), KCCM11016P::Е1р (P199S, Y201A), KCCM11016P::Е1р (N428A, Q432E), KCCM11016P::Е1р (N428A, K435A), KCCM11016P::Е1р (Y418H, K435A), KCCM11016P::Е1р (Y418H, Q432A)), и их способность продуцировать L-лизин измеряли так же, как описано выше (Таблица 4).


Как показано в Таблице выше, все 10 новых штаммов с комбинациями замен продемонстрировали незначительное снижение скорости потребления глюкозы и в то же время максимальное повышение способности продуцировать L-лизин на 15,6%. Эти результаты подтверждают, что штамм с комбинацией замен может демонстрировать лучшую способность продуцировать L-лизин, чем штамм с одной новой заменой.
Полученные результаты подтверждают, что 10 штаммов с новыми вариантами белка Е1р являются эффективными штаммами, которые могут существенно повысить способность продуцировать L-лизин без существенного снижения скорости потребления глюкозы по сравнению с исходным штаммом, и также подтверждают, что аминокислотные остатки в положениях 190-205 или 415-440 являются основными областями, которые могут демонстрировать описанные выше эффекты.
Пример 8: Измерение активности пируватдегидрогеназного комплекса (PDHC) у штаммов с вариантами Е1р
Активность PDHC у отобранных штаммов измеряли методом, описанным в литературе (Schreiner et al., J. Bacteriol. 187:6005, 2005). Контрольные штаммы KCCM11016P и KCCM11016PΔасеЕ и 10 отобранных штаммов (KCCM11016P::Е1р (Q432E), KCCM11016P::Е1р (E190V), KCCM11016P::Е1р (L438P), KCCM11016P::Е1р (Q195H), KCCM11016P::Е1р (P199S), KCCM11016P::Е1р (K435A), KCCM11016P::Е1р (Q432A), KCCM11016P::Е1р (Y418H), KCCM11016P::Е1р (Y201A) и KCCM11016P::Е1р (N428A)), высевали в 25 мл среды для получения посевной культуры, описанной в Примере 4, и культивировали до поздней логарифмической фазы.
Клетки собирали центрифугированием и отмывали два раза с использованием буферного раствора со 100 мМ трис-HCl (рН 7,2, 3 мМ L-цистеина, 10 мМ МgCl2), после чего суспендировали в 2 мл того же буферного раствора. Суспензию клеток подвергали физическому разрушению обычным методом, интенсивно перемешивая со стеклянными шариками в течение 10 минут, два раза отбирали супернатант после центрифугирования (13000 об/мин, 4°С, 30 мин) и использовали его в качестве неочищенного экстракта для измерения ферментативной активности PDHC. Для измерения ферментативной активности PDHC 0,05 мл неочищенного экстракта добавляли к 0,95 мл реакционного раствора для измерения ферментативной активности (10 мМ MgCl2, 3 мМ цистеин, 2 мМ NAD, 0.9 мМ дифосфата тиамина, 0,25 мМ хлорпромазина, 6 мМ пирувата, 0,2 мМ КоА в буфере с трис-HCl (рН 7,2)) и подвергали взаимодействию при 30°С.Единицу активности PDHC определяли как потребление 1 мкмоль NADH в минуту, и результаты измерения ферментативной активности показаны в Таблице 5 ниже.

Активность PDHC у штаммов с новыми вариантами составляла от 35% до 56% активности исходного штамма.
Пример 9: Сравнение способности продуцировать L-лизин со штаммом с делецией асеЕ
Для сравнительной оценки KCCM11016PΔасеЕ, штамма с делецией асеЕ, конструированного в Примере 2, и 10 отобранных штаммов (KCCM11016P::Е1р (Q432E), KCCM11016P::Е1р (E190V), KCCM11016P::Е1р (L438P), KCCM11016P::Е1р (Q195H), KCCM11016P::Е1р (P199S), KCCM11016P::Е1р (K435A), KCCM11016P::Е1р (Q432A), KCCM11016P::Е1р (Y418H), KCCM11016P::Е1р (Y201A) и KCCM11016P::Е1р (N428A)) штаммы культивировали так же, как в Примере 4, используя среды, содержащие ацетат аммония. Концентрацию L-лизина в полученных культурах анализировали посредством ВЭЖХ и для оценки скорости роста конструированных штаммов измеряли остаточную концентрацию глюкозы через 18 часов после начала культивирования (Таблица 6).
Среда для получения лизина, содержащая ацетат аммония (рН 7,0)
Глюкоза (100 г), CH3COONH3 (5 г), (NH4)2SO4 (40 г), соевый белок (2,5 г), сухой кукурузный экстракт (5 г), мочевина (3 г), КН2Р04 (1 г), MgSO4⋅7H2O (0,5 г), биотин (100 мкг), тиамин-HCl (1000 мкг), кальций-пантотеновая кислота (2000 мкг), никотинамид (3000 мкг) и СаСО3 (30 г) (на 1 л дистиллированной воды).


Штамм KCCM11016PΔасеЕ продемонстрировал повышение способности продуцировать L-лизин на 9,6%, но с существенным снижением скорости роста по сравнению с исходным штаммом. В отличие от этого, штаммы с заменами продемонстрировали повышение выхода лизина при скорости потребления глюкозы, сходной с культивированием без ацетата аммония.
Результаты показывают, что штаммы с вариантами асеЕ позволяют получать лизин с высоким выходом без заметного эффекта на скорость роста, в отличие от штамма с делецией асеЕ, который позволяет повысить выход лизина, но со значимым снижением скорости роста.
Пример 10: Конструирование штаммов, имеющих происхождение из KFCC10750, с введением вариантов Е1р и сравнение их способности продуцировать L-лизин
Для подтверждения эффектов введения 10 новых вариантов в другие штаммы Corynebacterium glutamicum, конструировали штаммы, вводя каждый из соответствующих 10 разных вариантов Е1р в Corynebacterium glutamicum KFCC10750 (указанный микроорганизм был впервые опубликован как KFCC10750 и депонирован повторно признанным международным органом по депонированию согласно Будапештскому соглашению с присвоением регистрационного номера KССМ11347Р; патент Кореи №10-0073610), штамм, продуцирующий L-лизин, таким же образом, как в Примере 7, и полученные штаммы были названы KFCC10750::E1p (Q432E), KFCC10750::E1p (E190V), KFCC10750::E1p (L438P), KFCC10750::E1p (Q195H), KFCC10750::E1p (P199S), KFCC10750::E1p (K435A), KFCC10750::E1p (Q432A), KFCC10750::E1p (Y418H), KFCC10750::E1p (Y201A) и KFCC10750::E1p (N428A). Эти одиннадцать штаммов, включая штамм KFCC10750 в качестве контрольного штамма, культивировали так же, как в Примере 4, и анализировали концентрацию L-лизина в культурах (Таблица 7).

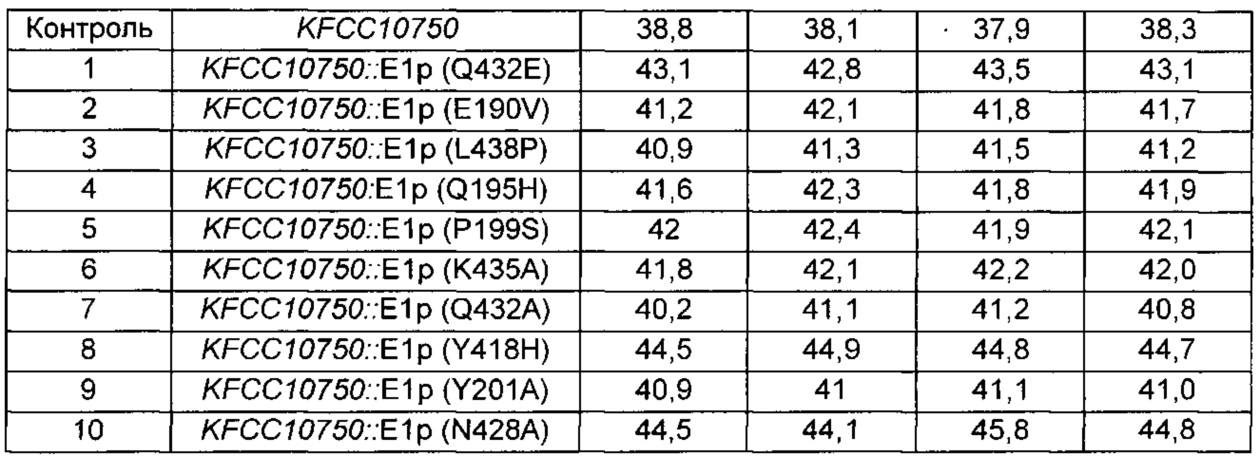
В результате, было подтверждено, что у 10 различных штаммов с новыми вариантами способность продуцировать L-лизин была максимально повышена на 17% по сравнению с исходным штаммом.
Пример 11: Конструирование штаммов, имеющих происхождение из KССМ10770Р, с введением вариантов Е1р и сравнение их способности продуцировать L-лизин
Для подтверждения эффектов введения 10 новых вариантов в другие штаммы Corynebacterium glutamicum, конструировали штаммы, вводя каждый вариант Е1р в Corynebacterium glutamicum KССМ10770Р (патент Кореи №10-0924065), штамм, продуцирующий L-лизин, таким же образом, как в Примере 7, и полученные штаммы были названы KССМ10770Р::Е1р (Q432E), KССМ10770Р::Е1р (E190V), KССМ10770Р::Е1р (L438P), KССМ10770Р::Е1р (Q195H), KССМ10770Р::Е1р (P199S), KССМ10770Р::Е1р (K435A), KССМ10770Р::Е1р (Q432A), KССМ10770Р::Е1р (Y418H), KССМ10770Р::Е1р (Y201A) и KССМ10770Р::Е1р (N428A). Эти штаммы, включая штамм KFCC10750 в качестве контрольного штамма, культивировали так же, как в Примере 4, и анализировали концентрацию L-лизина в культурах (Таблица 8).


В результате, было подтверждено, что у 10 штаммов с новыми вариантами способность продуцировать L-лизин была максимально повышена на 17% по сравнению с исходным штаммом.
Пример 12: Конструирование штаммов, имеющих происхождение из CJ3P, с введением вариантов Е1р и сравнение их способности продуцировать L-лизин
Для подтверждения эффектов введения вариантов Е1р в другие штаммы Corynebacterium glutamicum, конструировали штаммы, вводя каждый вариант Е1р в Corynebacterium glutamicum CJ3P (Binder et al., Genome Biology 2012, 13: R40), штамм, продуцирующий L-лизин, таким же образом, как в Примере 7, и полученные штаммы были названы CJ3P::E1p (Q432E), CJ3P::E1p (E190V), CJ3P::E1p (L438P), CJ3P::E1p (Q195H), CJ3P::E1p (P199S), CJ3P::E1p (K435A), CJ3P::E1p (Q432A), CJ3P::E1p (Y418H), CJ3P::E1p (Y201A) и CJ3P::E1p (N428A). Эти штаммы культивировали так же, как в Примере 4, и анализировали концентрацию L-лизина в культурах (Таблица 9).

В результате, было подтверждено, что у 10 различных штаммов с новыми вариантами способность продуцировать L-лизин была максимально повышена на 19,5% по сравнению с исходным штаммом.
Результаты показывают, что каждый из полученных новых 10 различных штаммов с вариантами Е1р (E1p (Q432E), E1p (E190V), E1p (L438P), Е1р (Q195H), Е1р (P199S), Е1р (K435A), Е1р (Q432A), Е1р (Y418H), Е1р (Y201A) и E1p (N428A)) демонстрирует отличный эффект с соответствующим повышением способности продуцировать L-лизин.
Пример 13: Конструирование штаммов, имеющих происхождение из KССМ11201Р, с введением вариантов Е1р и сравнение их способности продуцировать L-валин
Для подтверждения эффектов введения 10 отобранных вариантов Е1р в штаммы Corynebacterium glutamicum, продуцирующие другие аминокислоты, конструировали штаммы, вводя каждый вариант Е1р в Corynebacterium glutamicum KFCC11201P (патент Кореи №10-1117022), штамм, продуцирующий L-валин, таким же образом, как в Примере 7, и полученные штаммы были названы KССМ11201Р::Е1р (Q432E), KССМ11201Р::Е1р (E190V), KССМ11201Р::Е1р (L438P), KССМ11201Р::Е1р (Q195H), KССМ11201Р::Е1р (P199S), KССМ11201Р::Е1р (K435A), KССМ11201Р::Е1р (Q432A), KССМ11201Р::Е1р (Y418H), KССМ11201Р::Е1р (Y201A) и KССМ11201Р::Е1р (N428A).
Для оценки этих штаммов каждый из них высевали в колбы с угловыми перегородками объемом 250 мл, содержащие 25 мл среды для получения L-валина, описанной ниже, соответственно, и культивировали в шейкер-инкубаторе (200 об/мин) при 30°С в течение 20 часов. Концентрацию L-валина в каждой культуре анализировали посредством ВЭЖХ (Таблица 10).
Среда для получения валина (рН 7,2)
Глюкоза (50 г), (NH4)2S04 (20 г), кукурузный экстракт (20 г), КН2РO4 (1 г), MgSO4⋅7H2O (0,5 г), биотин (200 мкг) и СаСО3 (30 г) (на 1 л дистиллированной воды).
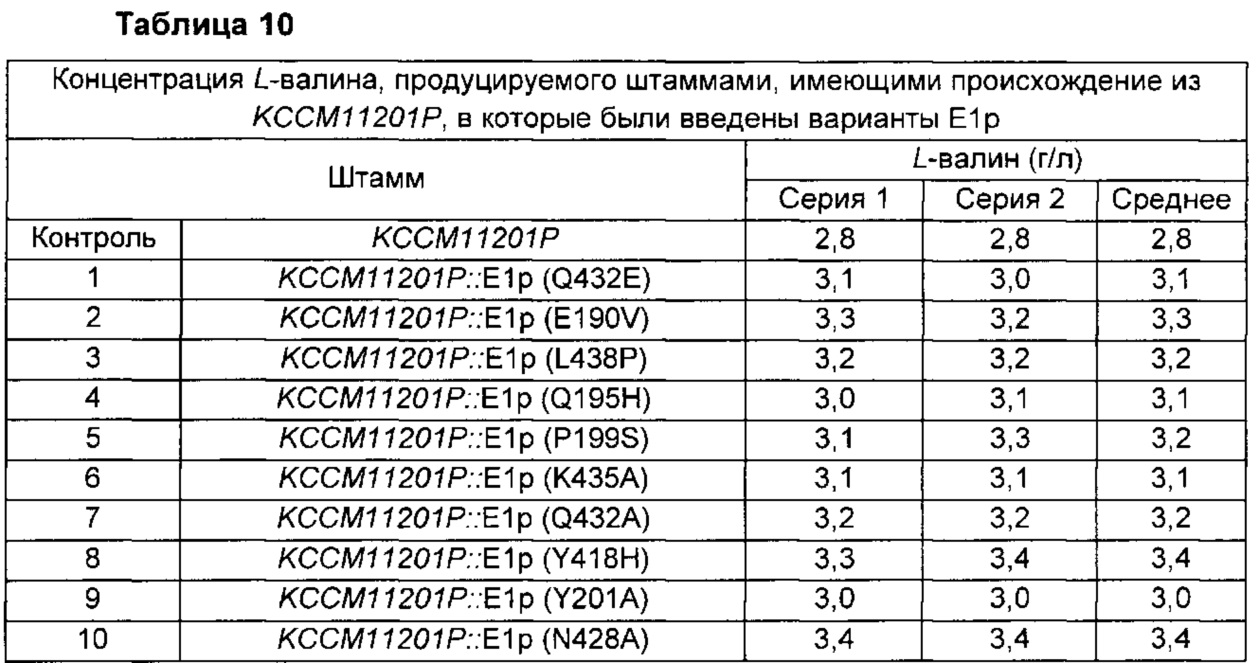
В результате, было подтверждено, что у 10 различных штаммов с новыми вариантами способность продуцировать L-валин была максимально повышена на 21% по сравнению с исходным штаммом.
Пример 14: Конструирование штаммов, имеющих происхождение из дикого типа, с вариантами Е1р и сравнение их способности продуцировать L-валин
Для повторного подтверждения способности четырех различных штаммов из 10 отобранных вариантов Е1р, продемонстрировавших эффект сильного повышения выхода L-валина, продуцировать L-валин конструировали штаммы, вводя каждый вариант Е1р в Corynebacterium glutamicum АТСС13032, таким же образом, как в Примере 7, и полученные штаммы были названы АТСС13032::Е1р (E190V), АТСС13032::Е1р (L438P), АТСС13032::Е1р (Y418H) и АТСС13032::Е1р (N428A).
Для подтверждения способности указанных выше штаммов продуцировать L-валин каждый из штаммов трансформировали pECCG117-DvaIS (заявка на патент Кореи №10-2014-0111421), являющимся вектором сверхэкспрессии для биосинтеза L-валина, электропорацией. Трансформированные штаммы получали из селективной среды, содержащей канамицин (25 мг/л), и они были названы АТСС13032::Е1р (E190V)_DvaIS, АТСС13032::Е1р (L438P)_DvaIS, АТСС13032::Е1р (Y418H)_DvaIS АТСС13032::Е1р (N428A)_DvaIS.
Эти штаммы культивировали так же, как в Примере 13, и анализировали концентрацию валина в каждой культуре (Таблица 11).
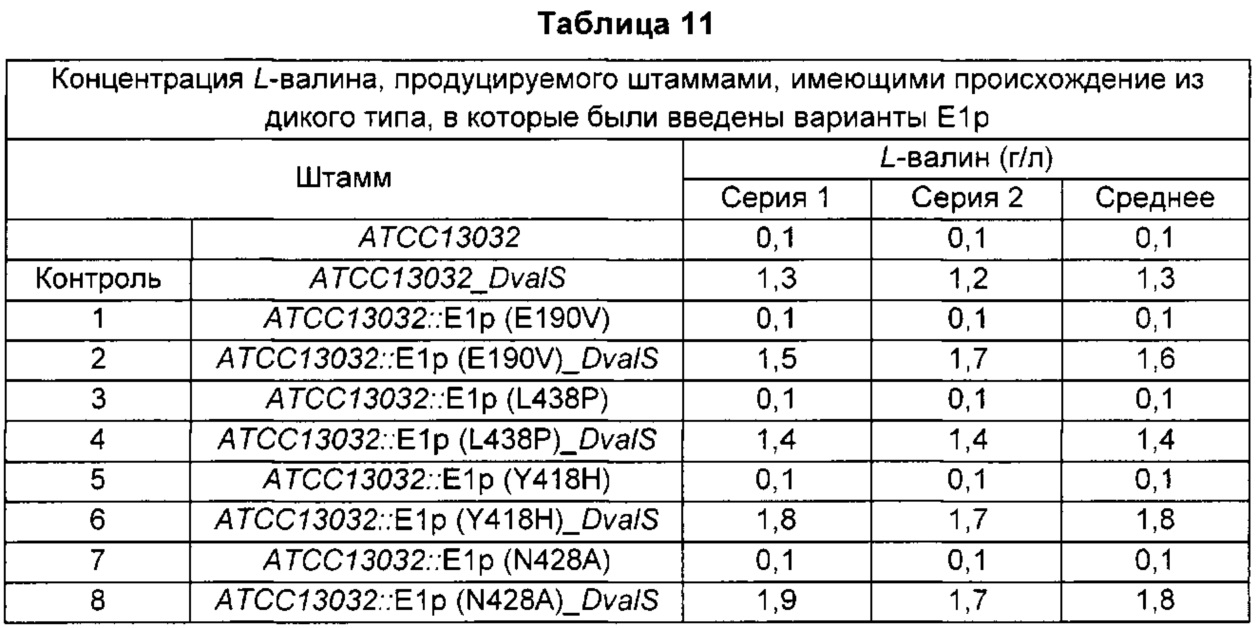
В результате, было подтверждено, что у четырех различных штаммов с новыми вариантами способность продуцировать L-валин была максимально повышена на 38% по сравнению с контрольным штаммом.
Исходя из изложенного выше, специалисту в области, к которой относится настоящее изобретение, будет ясно, что настоящее изобретение может быть воплощено в других конкретных формах без изменения технической концепции или существенных характеристик настоящего изобретения. В этом отношении, типичные воплощения раскрыты здесь исключительно в иллюстративных целях, и их не следует толковать как ограничение объема настоящего изобретения. Наоборот, подразумевают, что настоящее изобретение охватывает не только типичные воплощения, но также различные альтернативы, модификации, эквиваленты и другие воплощения, которые могут быть включены в сущность и объем настоящего изобретения, как определено приложенной формулой изобретения.
Реферат
Группа изобретений относится к области биотехнологии. Предложен вариант пируватдегидрогеназы, содержащий по меньшей мере одну аминокислотную замену в области аминокислот в положениях 190-205 или в области аминокислот в положениях 415-440 SEQ ID NO: 1. Предложен полинуклеотид, кодирующий указанный вариант пируватдегидрогеназы. Предложен микроорганизм рода Corynebacterium, продуцирующий L-аминокислоту, содержащий указанный вариант пируватдегидрогеназы. Предложен способ получения L-аминокислоты с использованием указанного микроорганизма рода Corynebacterium. Группа изобретений позволяет повысить способность продуцировать L-аминокислоту в модифицированном штамме по сравнению с контрольным штаммом. 4 н. и 6 з.п. ф-лы, 11 табл., 14 пр.

Комментарии