Способ получения ацетоина - RU2686614C2
Код документа: RU2686614C2
Чертежи



























































Описание
Область техники
Настоящее изобретение относится к микроорганизму, имеющему улучшенный метаболический путь ацетоина. Рекомбинантный микроорганизм модифицирован для улучшения получения ацетоина по сравнению с немодифицированным микроорганизмом. Изобретение также предоставляет способы применения такого микроорганизма для получения ацетоина.
Предшествующий уровень техники
Ацетоин, также известный как 3-гидроксибутанон или ацетил метил карбинол, образуется в бактериях из пирувата под действием двух ферментов, а именно α-ацетолактатсинтазы, которая катализирует конденсацию двух молекул пировиноградной кислоты с одним декарбоксилированием с получением α-ацетолактата и α-ацетолактатдекарбоксилазы, которая декарбоксилирует этот последний с образованием ацетоина (Juni, 1952).
Ацетоин представляет собой ароматизатор, обычно используемый в пищевой промышленности, где он заменяет диацетил, поскольку считается более безопасным (Huang, 2011). Ацетоин используют в качестве вкусового ингредиента в составах малина, клубника, ваниль, орех, ром, масло, баттерскотч, карамель, кокосовый орех, кофе и фруктовых отдушках. Ацетоин может быть добавлен в алкогольные и безалкогольные напитки, такие как крем-сода. Его маслянистый вкус хорошо подходит для мороженого, фруктового льда, конфет, хлебобулочных изделий, маргарина, желатиновых десертов, творога и кулинарного жира (шортенинга). Ацетоин также используется в косметической промышленности в парфюмерных изделиях, и духах, как носитель аромата. Наконец, ацетоин является одной из ведущих химических добавок в сигаретах и вкусоароматическим агентом в электронных сигаретах. Ацетоин является, кроме того, предшественником метилвинилкетона (MVK), который является полезным промежуточным соединением в химии.
Традиционный химический синтез ацетоина сталкивается с проблемой дефицита нефти и загрязнения окружающей среды, в то время как рынок ацетоина, как пищевой вкусоароматической добавки, в настоящее время по-прежнему растет от 5 до 5,5% в год и, как ожидается, достигнет $ 14 млрд. в 2018 году. Ожидается, что рынок ароматизаторов превысит $ 16 млрд. в 2018 году.
Многие химические вещества, которые в прошлом могли быть получены только с помощью традиционных химических процессов, теперь, потенциально, могут быть произведены биологически, с использованием возобновляемых ресурсов (Danner и Braun, 1999; Hatti-Kaul и др., 2007). Микробное получение ацетоина является одним из таких примеров. Интерес к этому биопроцессу заметно увеличился, потому что ацетоин имеет большое количество промышленных применений, как упомянутые выше, и микробное получение снизит зависимость от поставок нефти для получения базовых химикатов. Saccharomyces cerevisiae представляют собой особенно хорошо подходящую систему для таких биопроцессов (Nielsen 2013). Что касается микробного получения ацетоина, в большинстве исследований использовали такие микроорганизмы, как Candida glabrata, Bacillus subtilis для получения ацетоина (Shubo Li и др., Microbial Cell Factories 2014, 13:55; Silbersack J и др., Appl Microbiol Biotechnol, декабрь 2006; 73(4):895-903;
Таким образом, необходимо получение ацетоина с помощью микроорганизма GRAS (GRAS - Generally Recognized as Safe, т.е. в целом, признанного безопасным). В этом контексте, дрожжи, и более конкретно, Saccharomyces cerevisiae, являются подходящими микроорганизмами. S.cerevisiae, как известно, получают ацетоин естественным образом, но выход продукта и эффективность получения ацетоина невысоки. В действительности, наиболее очевидным препятствием для эффективного получения ацетоина в S.cerevisiae является получение этанола, потому что пируват, ключевой промежуточный продукт, преимущественно, используют для получения этанола, а не ацетоина.
Таким образом, по очевидным причинам, улучшение получения ацетоина посредством микробных процессов, и, более конкретно, превращение пирувата в ацетоин, остается постоянной целью. Более конкретно, по-прежнему существует потребность в стабильном рекомбинантном микроорганизме, имеющем повышенный выход ацетоина, особенно, совместимом с требованиями промышленного получения.
Краткое описание изобретения
Настоящее изобретение относится к рекомбинантным дрожжам с пониженной активностью пируватдекарбоксилазы, в геном которых была вставлена:
- одна или более нуклеиновых кислот, кодирующих ацетолактатсинтазу или ALS,
- одна или более нуклеиновых кислот, кодирующих ацетолактатдекарбоксилазу или ALD, и
- одна или более копий нуклеиновых кислот, кодирующих NADH-оксидазу (NOXE).
В соответствии с конкретным вариантом осуществления, рекомбинантные дрожжи по настоящему изобретению могут содержать одну или более ДНК-конструкций, выбранных из группы, включающей следующие формулы:

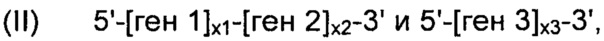
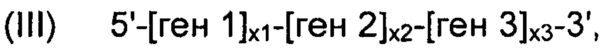
их комбинацию, где:
- "ген 1" означает нуклеиновую кислоту, выбранную из группы, включающей ALS, ALD или NOXE;
- "ген 2" означает нуклеиновую кислоту, выбранную из группы, включающей ALS, ALD или NOXE, но отличающуюся от гена 1;
- "ген 3" означает нуклеиновую кислоту, выбранную из группы, включающей ALS, ALD или NOXE, но отличающуюся от генов 1 и 2;
- "ALS" представляет собой нуклеиновую кислоту, кодирующую ацетолактатсинтазу;
- "ALD" представляет собой нуклеиновую кислоту, кодирующую ацетолактатдекарбоксилазу;
- "NOXE" представляет собой нуклеиновую кислоту, кодирующую NADH-оксидазу;
- каждое из "х1", "х2" и "х3", независимо друг от друга, представляет собой целое число в диапазоне от 0 до 50, предпочтительно от 0 до 20, и,
при условии, что указанные рекомбинантные дрожжи содержат, по меньшей мере, одну нуклеиновую кислоту, кодирующую каждую из ALS, ALD и NOXE.
Предпочтительно каждое из "х1", "х2" и "х3", независимо друг от друга, представляет собой целое число в диапазоне от 0 до 15, в том числе, от 0 до 12, более предпочтительно в диапазоне от 0 до 5, в частности, в диапазоне от 0 до 3, а еще лучше, представляет собой целое число, равное 1.
В соответствии с другим вариантом осуществления, рекомбинантные дрожжи по изобретению могут содержать по меньшей мере одну, предпочтительно по меньшей мере две ДНК-конструкции указанной выше формулы (II), идентичные или разные, где "ген 3" означает нуклеиновую кислоту, кодирующую NADH-оксидазу.
В соответствии с еще одним конкретным вариантом осуществления, рекомбинантные дрожжи по настоящему изобретению могут содержать по меньшей мере одну, предпочтительно по меньшей мере две ДНК-конструкции формулы (IIa), идентичные или разные, причем каждая формула (IIa), имеет следующую формулу:

где:
- ген 1, ген 2, ген 3, "х1", "х2" и "х3" являются такими, как определено выше;
- "х5" представляет собой целое число, равное 0 или 1;
- "у1", "у2", "z1" и "z2", каждое, независимо от других, представляет собой целое число, равное 0 или 1;
- когда указанные рекомбинантные дрожжи содержат, по меньшей мере, две ДНК-конструкции формулы (IIa), то "х1", "х2", "х3", "х5", "у1", "у2", "z1" и "z2" могут быть идентичными или разными;
- "пром1" представляет собой регуляторную последовательность, которая контролирует экспрессию последовательности, кодирующей ген 1;
- "пром2" представляет собой регуляторную последовательность, которая контролирует экспрессию последовательности, кодирующей ген 2;
- "пром3" представляет собой регуляторную последовательность, которая контролирует экспрессию последовательности, кодирующей ген 3;
- "пром 5" представляет собой регуляторную последовательность, которая контролирует экспрессию гена 1, указанный пром5 идентичен или отличается от пром1;
- "терм1" представляет собой последовательность терминатора транскрипции, который прекращает экспрессию последовательности, кодирующей ген 1;
- "терм2" представляет собой последовательность терминатора транскрипции, который прекращает экспрессию последовательности, кодирующей ген 2;
- "терм3" представляет собой последовательность терминатора транскрипции, который прекращает экспрессию последовательности, кодирующей ген 3;
- "терм5" представляет собой последовательность терминатора транскрипции, который прекращает экспрессию гена 1, указанный терм 5 идентичен или отличается от терм 1.
В соответствии с другим конкретным вариантом осуществления, рекомбинантные дрожжи по настоящему изобретению могут содержать по меньшей мере одну, предпочтительно по меньшей мере две ДНК-конструкции формулы (IIb), идентичные или разные, причем каждая формула (IIb) имеет следующую формулу:

где:
- ALS, ALD, NOXE; "х1", "х2", "х3", "Х5", "у1", "у2", "z1" и "z2" являются такими, как определено выше;
- когда указанные рекомбинантные дрожжи содержат по меньшей мере две ДНК-конструкции формулы (IIb), то "х1", "х2", "х3", "Х5", "у1", "у2", "z1" и "z2" могут быть идентичными или разными;
- "пром1" представляет собой регуляторную последовательность, которая контролирует экспрессию последовательности, кодирующей ацетолактатсинтазу;
- "пром2" представляет собой регуляторную последовательность, которая контролирует экспрессию последовательности, кодирующей ацетолактатдекарбоксилазу;
- "пром3" представляет собой регуляторную последовательность, которая контролирует экспрессию последовательности, кодирующей NADH-оксидазу;
- "пром5" представляет собой регуляторную последовательность, которая контролирует экспрессию последовательности, кодирующей ацетолактатсинтазу, указанный пром 5 идентичен или отличается от пром 1;
- "терм1" представляет собой последовательность терминатора транскрипции, который прекращает экспрессию последовательности, кодирующей ацетолактатсинтазу;
- "терм2" представляет собой последовательность терминатора транскрипции, который прекращает экспрессию последовательности, кодирующей ацетолактатдекарбоксилазу;
- "терм3" представляет собой последовательность терминатора транскрипции, который прекращает экспрессию последовательности, кодирующей NADH-оксидазу; а также
- "терм5" представляет собой последовательность терминатора транскрипции, который прекращает экспрессию последовательности, кодирующей ацетолактатсинтазу, указанный терм 5 идентичен или отличается от терм1.
В соответствии с другим вариантом осуществления, рекомбинантные дрожжи по изобретению могут содержать по меньшей мере две ДНК-конструкции формулы (II), (IIa) или (IIb), при условии, что все копии нуклеиновой кислоты NOXE расположены в одной из по меньшей мере двух ДНК-конструкций формулы (II), (IIa) или (IIb).
Согласно другому предпочтительному варианту осуществления, рекомбинантные дрожжи по изобретению могут содержать по меньшей мере две, предпочтительно строго две ДНК-конструкции следующих формул (IIc) и (IId):



где:
- ALS, ALD, NOXE; "пром1", "пром2", "пром3", "пром5", "терм1", "терм2", "терм3" и "терм5"; "х1”, "х2" и "х3"; и "х5", "у1", "у2", "z1" и "z2" являются такими, как определено выше;
- "х1" - "х3", "х5", "у1", "у2", "z1" и "z2" для каждой из формул (IIc) и (IId) являются идентичными или разными; а также
- "х6" и "х7" представляют собой целые числа от 0 до 50, предпочтительно от 0 до 20, предпочтительно от 0 до 12, более конкретно от 2 до 5, предпочтительно от 3 до 4, а еще лучше, равные 3, при условии, что одно из "х6" и "х7" представляет собой 0.
Настоящее изобретение также относится к применению рекомбинантных дрожжей по настоящему изобретению для получения ацетоина и/или его производных, которые включают метилвинилкетон.
Настоящее изобретение также относится к способу получения ацетоина, причем указанный способ включает стадии:
(а) культивирования рекомбинантных дрожжей по настоящему изобретению, в соответствующей культуральной среде; а также
(с) выделения ацетоина.
Предпочтительно указанная культуральная среда содержит источник углерода, предпочтительно выбранный из группы, содержащей глюкозу и сахарозу.
Описание графических материалов
На Фиг. 1 показан метаболический путь в рекомбинантном штамме дрожжей, чтобы заменить получение этанола на получение ацетоина.
Подробное описание изобретения
Определения
Термин "микроорганизм", используемый в настоящем документе, относится к дрожжам, которые не изменены искусственно. Микроорганизм может быть "донором", если он предоставляет генетический элемент, который будет интегрирован в микроорганизм "акцептора", который будет экспрессировать этот чужеродный генетический элемент, или если он используется в качестве инструмента для генетических конструкций или экспрессии белков. Микроорганизм по настоящему изобретению выбирают из дрожжей, экспрессирующих гены для биосинтеза ацетоина.
Термин "рекомбинантный микроорганизм" или "генетически модифицированный микроорганизм", или "рекомбинантные дрожжи", или "генетически модифицированные дрожжи", используемый в настоящем документе, относится к генетически модифицированным или генетически сконструированным дрожжам. Это означает, в соответствии с обычным значением этих терминов, что микроорганизм по изобретению не встречается в природе, и модифицирован или путем вставки, или путем удаления, или путем модификации генетических элементов из эквивалентного микроорганизма, встречающегося в природе. Он также может быть изменен усилением развития и эволюции новых метаболических путей с помощью комбинации направленного мутагенеза и эволюции под специфическим давлением отбора (например, WO 2004/076659).
Микроорганизм может быть изменен с целью экспрессии экзогенных генов, если эти гены вводят в микроорганизм со всеми элементами, обеспечивающими их экспрессию в микроорганизме-хозяине. Микроорганизм может быть изменен с целью модуляции уровня экспрессии эндогенного гена. Модификация или "трансформация" микроорганизма, такого как дрожжи, экзогенной ДНК является рутинной задачей для специалистов в данной области техники. В частности, генетическая модификация микроорганизма по изобретению, более конкретно, генетическая модификация(и) определенная в данном документе, может быть осуществлена с использованием системы CRISPR-Cas, как описано у DiCarlo и др., (Nucl. Acids Res., т. 41, No. 7, 2013: 4336-4343).
Термин "эндогенный ген" означает, что ген присутствовал в микроорганизме до любой генетической модификации, в штамме дикого типа. Эндогенные гены могут быть сверхэкспрессированы путем вставки гетерологичных последовательностей в дополнение к, или вместо эндогенных регуляторных элементов, или путем вставки одной или более дополнительных копий гена в хромосому или плазмиду. Эндогенные гены также могут быть модифицированы с целью модуляции их экспрессии и/или активности. Например, мутации могут быть введены в кодирующую последовательность, чтобы модифицировать генный продукт, или гетерологичные последовательности могут быть введены в дополнение к, или вместо эндогенных регуляторных элементов. Модуляция эндогенного гена может привести к усилению экспресии и/или усилению активности генного продукта, или, в качестве альтернативы, к снижению экспресии и/или ослаблению активности продукта эндогенного гена. Другим способом усиления экспрессии эндогенных генов является введение одного или более дополнительных копий гена в хромосому или плазмиду.
Термин "экзогенный ген" означает, что ген был вставлен в микроорганизм, с помощью средств, хорошо известных специалистам в данной области техники, в то время как этот ген от природы не присутствует в штамме микроорганизма дикого типа. Микроорганизм может экспрессировать экзогенные гены, если эти гены вводят в микроорганизм со всеми элементами, обеспечивающими их экспрессию в микроорганизме-хозяине. Трансформация микроорганизмов экзогенной ДНК является рутинной задачей для специалиста в данной области техники. Экзогенные гены могут быть интегрированы в хромосому хозяина, или могут быть экспрессированы экстра-хромосомно, из плазмид или векторов. Множество плазмид, различающихся точками начала (ориджинами) репликациии количеством их копий в клетке, известны в данной области техники. Последовательность экзогенных генов может быть адаптирована для их экспрессии в микроорганизме-хозяине. Действительно, специалисту в данной области техники известно понятие предпочтения кодонов и как адаптировать нуклеиновые последовательности для конкретного предпочтения кодонов без изменения получаемого белка.
Термин "гетерологичный ген" означает, что ген происходит из вида микроорганизма, отличного от экспрессирующего его микроорганизма-реципиента. Термин относится к гену, который от природы не присутствует в микроорганизме.
В настоящей заявке, все гены указаны с использованием их обычных названий и со ссылками на их нуклеотидные последовательности и, в случае возникновения вопросов, на их аминокислотные последовательности. Используя приведенные ссылки на номера доступа для известных генов, специалисты в данной области техники способны определить эквивалентные гены в других организмах, бактериальных штаммах, дрожжах, грибах, млекопитающих, растениях и т.д. Эту рутинную работу преимущественно осуществляют, используя консенсусные последовательности, которые могут быть определены путем проведения выравнивания последовательностей с генами, полученными из других микроорганизмов и конструирования вырожденных проб для клонирования соответствующего гена в другом организме.
Специалисту в данной области техники известны различные способы модулирования, и, в частности, усиления и ослабления экспресии эндогенных генов. Например, способом повышения экспрессии эндогенных генов является введение одной или более дополнительных копий гена в хромосому или плазмиду.
Другой способ заключается в замене эндогенного промотора гена более сильным промотором. Эти промоторы могут быть гомологичными или гетерологичными. Гомологичными промоторами, известными, как обеспечивающие высокий уровень экспрессии в дрожжах, являются те, которые выбраны из следующей группы; ADH1, GPDH, TEF1, процессированный НХТ7, PFK1, FBA1, PGK1 и TDH3 и тому подобное. Промоторы, особенно интересные в настоящем изобретении, определены более подробно далее в настоящем документе.
В дрожжах, экспрессионная конструкция на основе нуклеиновой кислоты, предпочтительно содержит регуляторные последовательности, такие как последовательности промотора и терминатора, которые функционально связаны с последовательностью нуклеиновой кислоты, кодирующей каждый из рассматриваемых генов, и, более конкретно, каждый из упомянутых выше ферментов ALS, ALD и NOXE по настоящему изобретению.
Экспрессионная конструкция на основе нуклеиновой кислоты может дополнительно включать в себя 5' и/или 3' распознающие последовательности и/или селективные маркеры.
Термин "сверхэкспрессия" означает, что экспрессия гена или фермента увеличивается по сравнению с немодифицированным микроорганизмом. Увеличение экспрессии фермента получают путем увеличения экспрессии гена, кодирующего указанный фермент. Увеличение экспрессии гена, может быть осуществлено с помощью всех методов, известных специалисту в данной области техники. В связи с этим, можно особенно назвать использование сильного промотора выше по цепи от нуклеиновой кислоты, предназначенной для сверхэкспресии, или вставку нескольких копий указанной нуклеиновой кислоты между промотором, особенно, сильным промотором и терминатором.
Термин "активность" фермента использован взаимозаменяемо с термином "функция" и обозначает, в контексте настоящего изобретения, способность фермента катализировать необходимую реакцию.
Термины "пониженная активность" или "ослабленная активность" фермента означают или уменьшенную удельную каталитическую активность белка, полученного в результате мутации в аминокислотной последовательности, и/или снижение концентрации белка в клетке, полученное в результате мутации нуклеотидной последовательности, или в результате делеции соответствующего когнатного гена.
Термин "повышенная активность" фермента обозначает или повышенную удельную каталитическую активность фермента, и/или повышенное количество/наличие данного фермента в клетке, полученное, например, путем сверхэкспрессии гена, кодирующего указанный фермент.
Термин "кодирование" относится к процессу, с помощью которого полинуклеотид, посредством механизмов транскрипции и трансляции, производит аминокислотную последовательность.
Ген(ы), кодирующий фермент(ы), рассмотренный в настоящем изобретении, может быть эндогенным или экзогенным.
"Ослабление" генов означает, что гены экспрессируются в меньшей степени, чем в немодифицированном микроорганизме. Ослабление может быть осуществлено с помощью средств и способов, известных специалистам в данной области техники, и включает делецию гена, осуществляемую путем гомологичной рекомбинации, ослабление гена путем вставки внешнего элемента в ген, или экспрессию гена под слабым промотором. Специалисту в данной области техники известны различные промоторы, которые демонстрируют различную силу, и какие промоторы можно использовать для слабой генной экспрессии.
Методы, использованные в настоящем изобретении, предпочтительно требуют использования одной или более хромосомных интеграционных конструкций для стабильного введения гетерологичной нуклеотидной последовательности в определенное место на хромосоме, или для функционального разрушения одного или более генов-мишеней в генетически-модифицированной микробной клетке. В некоторых вариантах осуществления, разрушение гена-мишени препятствует экспрессии соответствующего функционального белка. В некоторых вариантах осуществления, разрушение гена-мишени приводит к экспрессии нефункционального белка из разрушенного гена.
Параметры хромосомных интеграционных конструкций, которые могут быть изменены в практике настоящего изобретения, включают, но не ограничиваются ими, длины гомологичных последовательностей; нуклеотидную последовательность гомологичных последовательностей; длину интегрирующей последовательности; нуклеотидную последовательность интегрирующей последовательности; и нуклеотидную последовательность локуса-мишени. В некоторых вариантах осуществления, эффективный диапазон длины каждой гомологичной последовательности составляет от 20 до 5000 пар оснований, предпочтительно от 50 до 100 пар оснований. В конкретных вариантах осуществления, длина каждой гомологичной последовательности составляет, приблизительно, 50 пар оснований. Для получения дополнительной информации о длине гомологии, требуемой для направленного воздействия на ген, см. D. Burke и др. "Methods in yeast Genetics - A cold spring harbor laboratory course Manual" (2000).
В некоторых вариантах осуществления настоящего изобретения, разрушенный ген(ы) пируватдекарбоксилазы, в который должна быть вставлена вышеуказанная ДНК-конструкция(и), может преимущественно содержать один или более селективных маркеров, необходимых для отбора трансформированных микробных клеток. Предпочтительно указанный селективный маркер(ы) включен в ДНК-конструкцию(и) по настоящему изобретению.
В некоторых вариантах осуществления, селективный маркер представляет собой маркер устойчивости к антибиотику. Иллюстративные примеры маркеров устойчивости к антибиотикам, включают, но не ограничиваются ими, продукты генов NAT1, AURI-C, НРН, DSDA, KAN
В некоторых вариантах осуществления настоящего изобретения, маркер устойчивости к антибиотику удаляют после того, как генетически модифицированную микробную клетку по изобретению изолируют. Специалист в данной области техники способен выбрать подходящий маркер в определенном генетическом контексте.
В некоторых вариантах осуществления, селективный маркер исправляет ауксотрофию (например, питательную ауксотрофию) в генетически модифицированной микробной клетке. В таких вариантах осуществления, родительская микробная клетка содержит нарушение функции в одном или более продуктах генов, которые функционируют в аминокислотном или нуклеотидном пути биосинтеза, таких, например, как продукты генов HIS3, LEU2, LYS1, LYS2, МЕТ 15, TRP1, ADE2, и URA3 в дрожжах, которые делают родительские микробные клетки неспособными расти в среде без добавления одного или более питательных веществ (ауксотрофный фенотип). Ауксотрофный фенотип может затем быть исправлен путем трансформации родительской микробной клетки хромосомной интеграционной конструкцией, кодирующей функциональную копию продукта разрушенного гена (NB: функциональная копия гена может происходить из близких видов, таких как Kluveromyces, Candida и т.п.), и полученные генетически модифицированные микробные клетки могут быть отобраны на основании потери ауксотрофного фенотипа у родительской микробной клетки.
Для каждой из последовательностей нуклеиновых кислот, содержащих последовательность промотора, кодирующую последовательность (например, последовательность, кодирующую фермент), или последовательность терминатора, эталонные последовательности описаны в настоящем документе. Настоящее описнаие также включает последовательности нуклеиновых кислот, имеющие конкретные проценты идентичности нуклеиновых кислот с последовательностью эталонной нуклеиновой кислоты.
Для каждой из аминокислотных последовательностей, представляющих интерес, эталонные последовательности описаны в настоящем документе. Настоящее описание также охватывает аминокислотные последовательности (например, аминокислотные последовательности фермента), имеющие конкретные проценты идентичности аминокислот с эталонной аминокислотной последовательностью.
По очевидным причинам, во всем настоящем описании, конкретная последовательность нуклеиновой кислоты или конкретная аминокислотная последовательность, которая удовлетворяет требованиям, соответственно, рассмотренной нуклеотидной или аминокислотной идентичности, должна дополнительно приводить к получению белка (или фермента), который демонстрирует необходимую биологическую активность. Используемый в настоящем описании термин "процент идентичности" между двумя последовательностями нуклеиновых кислот или между двумя аминокислотными последовательностями определяют посредством сравнения обиех оптимально выровненных последовательностей через окно сравнения.
Часть нуклеотидной или аминокислотной последовательности в окне сравнения может, таким образом, включать в себя вставки или делеции (например, "пропуски") по сравнению с эталонной последовательностью (которая не включает в себя эти вставки или эти делеции), чтобы получить оптимальное выравнивание между обеими последовательностями.
Процент идентичности вычисляют путем определения числа положений, в которых идентичное нуклеиновое основание, или идентичный аминокислотный остаток можно отметить у обеих сравниваемых последовательностей, и затем путем деления числа положений, в которых можно наблюдать идентичность между обеими нуклеиновыми основаниями, или между обеими аминокислотными остатками, на общее число положений в окне сравнения, затем путем умножения результата на сто, чтобы получить процент нуклеотидной идентичности между двумя последовательностями, или процент идентичности аминокислот между двумя последовательностями.
Сравнение оптимального выравнивания последовательностей может быть выполнено на компьютере с использованием известных алгоритмов.
Наиболее предпочтительно процент идентичности последовательностей определяют с помощью программного обеспечения CLUSTAL W (версия 1.82), параметры установлены следующим образом:
(1) CPU MODE=ClustalW mp; (2) ALIGNMENT="full"; (3) OUTPUT FORMAT="aln w/numbers"; (4) OUTPUT ORDER="aligned"; (5) COLOR ALIGNMENT="no"; (6) KTUP (word size)="default"; (7) WINDOW LENGTH="default"; (8) SCORE TYPE="percent"; (9) TOPDIAG="default"; (10) PAIRGAP="default"; (11) PHYLOGENETIC TREE/TREE TYPE="none"; (12) MATRIX="default"; (13) GAP OPEN="default"; (14) END GAPS="default"; (15) GAP EXTENSION="default"; (16) GAP DISTANCES="default"; (17) TREE TYPE="cladogram" and (18) TREE GRAP DISTANCES="hide".
"Ферментацию" или "культивирование" обычно проводят в биореакторах с подходящей культуральной средой, адаптированной к культивируемым микроорганизмам, содержащей, по меньшей мере, один простой источник углерода, и, при необходимости косубстраты.
Микроорганизмы, описанные здесь, могут быть выращены в ферментационных средах для получения продукта из пирувата. Для максимального получения ацетоина, штаммы микроорганизмов, используемые в качестве организмов-хозяев, предпочтительно имеют высокую скорость утилизации углеводов. Эти характеристики могут быть получены с помощью мутагенеза и селекции, генной инженерии, или могут быть естественными. Ферментационная среда, или "культуральная среда" для настоящих клеток, может содержать, по меньшей мере, приблизительно 10 г/л глюкозы. Дополнительные углеродные субстраты могут включать, но не ограничиваются ими, моносахариды, такие как фруктоза, манноза, ксилоза и арабиноза; олигосахариды, такие как лактоза, мальтоза, галактоза, или сахароза; полисахариды, такие как крахмал или целлюлоза или их смеси и неочищенные смеси из возобновляемого сырья, такого как пермеат подсырной сыворотки, кукурузный настой, свекловичная патока (меласса из сахарной свеклы) и ячменный солод. Другие углеродные субстраты могут включать в себя глицерин.
Следовательно, предполагается, что источник углерода, используемый в настоящем изобретении, может включать в себя широкий спектр субстратов, содержащих углерод, и будет ограничен только выбором организма.
Несмотря на то, что предполагается, что все вышеуказанные субстраты углерода и их смеси пригодны в настоящем изобретении, предпочтительными углеродными субстратами являются глюкоза, фруктоза и сахароза, или их смеси с С5 сахарами, такими как ксилоза, и/или арабиноза для микроорганизмов, модифицированных для использования С5 сахаров, а более конкретно глюкозы.
Предпочтительным субстратом углерода является сахароза.
В соответствии с конкретным вариантом осуществления, углеродный субстрат по настоящему изобретению не содержит ксилозы.
В дополнение к подходящему источнику углерода, ферментационная среда может содержать подходящие минералы, соли, кофакторы, буферы и другие компоненты, известные специалистам в этой области техники, пригодные для выращивания культур и активации ферментативного пути, необходимого для получения требуемого продукта.
Кроме того, дополнительные генетические модификации, пригодные для роста рекомбинантных микроорганизмов по данному изобретению, могут быть рассмотрены.
Таким образом, чтобы предотвратить превращение ацетоина в 2,3-BDO, гены, которые участвуют в восстановлении ацетоина в 2,3-BDO, могут быть инактивированы. В связи с этим, можно упомянуть эндогенную бутандиолдегидрогеназу bdh1 и bdh2 (в частности, известную под номером ЕС 1.1.1.4.), а также эндогенную алкогольдегидрогеназу adh1, adh3 и adh4 (в частности, известную под номером ЕС 1.1.1.1). Инактивация указанных генов находится в области общих знаний специалиста в данной области техники.
Присутствие слабых кислот, как известно/является ограничением для роста и часто представлено в среде, полученной из целлюлозы или патоки.
Дополнительные генетические модификации, такие как разрушение гена JEN1 (или систематическое название: YKL217W, или номер доступа белка Р36035 (UniProtKB Swiss-Prot)) и/или сверхэкспрессия гена НАА-1 (систематическое название: YPR008W или номер доступа Q12753 (UniProtKB Swiss-Prot)) приводят к улучшению устойчивости штаммов к слабым кислотам в используемой культуральной среде.
Jen 1 представляет собой мембранный белок, ответственный за импорт лактата в клетку (Casal М., и др., (1999), J. Bacteriol, 181 (8): 2620-3).
НАА-1 представляет собой транскрипционный активатор, который контролирует экспрессию мембранных стрессовых белков, ответственных за устойчивость к слабым кислотам. Его сверхэкспрессия повышает устойчивость дрожжей к уксусным кислотам (Tanaka и др., (2012) Appl Environ Microbiol, 78(22): 8161-3).
Разрушение гена JEN1 и сверхэкспрессия гена НАА-1 относятся к общим знаниям специалиста в данной области техники и могут быть, в частности, осуществлены при помощи методов, продемонстрированных в настоящем документе.
Принимая во внимание далее в настоящем документе уравнение синтеза ацетоина в дрожжах, условия для рассмотрения в настоящем изобретении, являются обязательно аэробными условиями.
Термин "аэробные условия" относится к концентрациям кислорода в культуральной среде, достаточным для аэробного или факультативного анаэробного микроорганизма, чтобы использовать дикислород в качестве терминального акцептора электронов.
"Микроаэробное состояние" относится к культуральной среде, в которой концентрация кислорода меньше, чем в воздухе, то есть к концентрации кислорода до 6% O2.
Термин "соответствующая культуральная среда" обозначает среду (например, стерильную жидкую среду), содержащую питательные вещества, необходимые или полезные для поддержания и/или роста клеток, такие как источники углерода, или субстрат углерода, источники азота, например, пептон, дрожжевые экстракты, мясные экстракты, солодовые экстракты, мочевина, сульфат аммония, хлорид аммония, нитрат аммония и фосфат аммония; источники фосфора, например, монокалийфосфат или дикалийфосфат; микроэлементы (например, соли металлов), например, соли магния, соли кобальта и/или соли марганца, а также ростовые факторы, такие как аминокислоты, витамины, стимуляторы роста, и тому подобное. Термин "источник углерода" или "углеродный субстрат" или "источник углерода" в соответствии с настоящим изобретением, означает любой источник углерода, который может быть использован специалистами в этой области техники, чтобы поддерживать нормальный рост микроорганизма, включая гексозы (такие, как глюкоза, галактоза или лактоза), пентозы, моносахариды, олигосахариды, дисахариды (такие как сахароза, целлобиоза или мальтоза), мелассу, крахмал или его производные, целлюлозу, гемицеллюлозу и их комбинации.
Рекомбинантные дрожжи по изобретению
Как указано выше, настоящее изобретение относится к рекомбинантным дрожжам с пониженной активностью пируватдекарбоксилазы, в геном которых была вставлена:
- одна или более нуклеиновых кислот, кодирующих ацетолактатсинтазу или ALS,
- одна или более нуклеиновых кислот, кодирующих ацетолактатдекарбоксилазу или ALD, и
- одна или более копий нуклеиновых кислот, кодирующих NADH-оксидазу (или NOXE).
Как показано в примерах, приведенных в настоящем документе, авторы настоящего изобретения неожиданно обнаружили, что присутствие нуклеиновой кислоты, кодирующей NADH-оксидазу, преимущественно, присутствие множества ее копий в рекомбинантных дрожжах, в которых активность пируватдекарбоксилазы была снижена, и в которые были дополнительно интегрированы гены, обеспечивающие экспрессию ферментов ALS и ALD, необходимых для синтеза ацетоина, не только способствует стабилизации указанных рекомбинантных дрожжей, но также позволяет существенно увеличить рост этого штамма, а также выход продукции ацетоина.
Использование Крэбтри-положительных дрожжевых организмов, таких как Saccharomyces cerevisiae, и, в особенности рекомбинантных дрожжевых организмов, таких как Saccharomyces cerevisiae, для получения интересующих метаболитов является предпочтительным, так как, в отличие от бактерий, дрожжевые клетки обладают способностью осуществлять ферментацию в присутствии кислорода, при наличии достаточного количества сахара, такого как глюкоза или сахароза. В отличие от этого, бактерии осуществляют ферментацию только в анаэробных условиях. Кроме того, дрожжевые организмы не подвержены вирусной инфекции, в отличие от бактериофагов у бактерий. При этом далее, культура дрожжевых организмов редко подвергается заселению нежелательными микроорганизмами, такими как бактерии, так как дрожжевые клетки вызывают быстрое подкисление окружающей их среды до рН 4, например, культуральной среды, поддерживающей их рост. Более того, клетки дрожжей не выделяют ряд нежелательных метаболитов, таких как молочная кислота, присутствие которой в культуральной среде является реальным недостатком для последующей очистки требуемого метаболита(ов). При этом далее, дрожжи, в том числе рекомбинантные дрожжевые организмы имеют более высокую генетическую стабильность по сравнению с бактериями.
Уравнение для синтеза ацетоина в дрожжах представляет собой:

Указанное уравнение сохранения массы возможно в связи с тем, что S.cerevisiae может ферментировать даже в присутствии кислорода.
С учетом приведенного выше уравнения, максимальный теоретический выход ацетоина составит 97,78 г на ввод 200 г глюкозы.
Как показано в приведенных ниже примерах, эффективный выход ацетоина с рекомбинантными дрожжами по настоящему изобретению, является относительно близким к этому максимальному теоретическому выходу (до 83%). По сведениям изобретателя, никогда раньше до настоящего времени такого выхода в дрожжах еще не получали.
Таким образом, в рекомбинантных дрожжах по изобретению, успешно получают высокий выход ацетоина, что открывает путь для промышленного получения ацетоина в дрожжах.
Удивительно, но, как также показано в примерах, приведенных в настоящем документе, не наблюдается токсичность полученного ацетоина на клетках дрожжей, даже при высоких концентрациях синтезированного ацетоина. Более того, синтезированный ацетоин полностью экспортируется за пределы клетки, таким образом, существенно упрощая процесс очистки.
NADH-оксидаза (или NOXE), используемая в рекомбинантных дрожжах по изобретению, представляет собой очень специфический "NADH-зависимый" фермент, так как он не использует углеродный акцептор. По этой причине, выбранная NADH-оксидаза не мешает непосредственно углеродному метаболизму, но пополняет пул NAD+ в образующейся воде.
В связи с этим, NADH-оксидаза, используемая в рекомбинантных дрожжах по изобретению, в частности, отличается от "NADH-зависимого" фермента, описанного в указанных выше документах предшествующего уровня техники и, в особенности, в публикации США 2011/0124060 и WO 2013/076144.
В соответствии с некоторыми вариантами осуществления, рекомбинантные дрожжи могут содержать одну или более ДНК-конструкций, выбранных из группы, включающей следующие формулы:


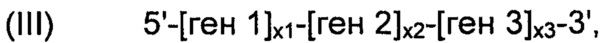
их комбинацию,
где:
- "ген 1" обозначает нуклеиновую кислоту, выбранную из группы, включающей ALS, ALD или NOXE;
- "ген 2" обозначает нуклеиновую кислоту, выбранную из группы, включающей ALS, ALD или NOXE, но отличающуюся от гена 1;
- "ген 3" обозначает нуклеиновую кислоту, выбранную из группы, включающей ALS, ALD или NOXE, но отличающуюся от генов 1 и 2;
- "ALS" представляет собой нуклеиновую кислоту, кодирующую ацетолактатсинтазу;
- "ALD" представляет собой нуклеиновую кислоту, кодирующую ацетолактатдекарбоксилазу;
- "NOXE" представляет собой нуклеиновую кислоту, кодирующую NADH-оксидазу;
- каждое из "х1", "х2" и "х3", независимо от других, представляет собой целое число в диапазоне от 0 до 50, предпочтительно от 0 до 20, и
при условии, что указанные рекомбинантные дрожжи содержат по меньшей мере одну нуклеиновую кислоту, кодирующую каждый из ALS, ALD и NOXE.
Предпочтительно каждое из "х1", "х2" и "х3", независимо друг от друга, представляет собой целое число в диапазоне от 0 до 10, а более конкретно, в диапазоне от 0 до 5, в частности, в диапазоне от 0 до 3, и еще лучше представляет собой целое число, равное 1.
Как и предполагалось в настоящем документе, каждое из х1, х2 и х3 может иметь значение, выбранное из группы, состоящей из 0, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49 и 50.
В некоторых вариантах осуществления, где в ДНК-конструкциях формул (I) - (III) указанных выше, одно или более из целых чисел "х1", "х2" и/или "х3", независимо от других, имеет значение два или больше, каждая из двух или более копий соответствующего гена, среди родственных гена 1, гена 2 и/или гена 3, могут быть идентичными или разными. Разные отличающиеся последовательности ALS, ALD и NOXE приведены в Табл. 1 в настоящем документе.
В иллюстративных вариантах осуществления, ДНК-конструкция, выбранная среди конструкций с формулами (I) - (III), где "х1" представляет собой целое число, равное 2, и ген 1 представляет собой нуклеиновую кислоту, кодирующую ацетолактатсинтазу (ALS), две ALS-кодирующих последовательности, содержащиеся в указанной ДНК-конструкции, могут быть одинаковыми или различными.
Например, в соответствии с этим конкретным вариантом осуществления, это означает, что первой копией нуклеиновой кислоты, кодирующей ацетолактатсинтазу, может быть нуклеиновая кислота, кодирующая ALS.Bs, а второй копией нуклеиновой кислоты, кодирующей ацетолактатсинтазу, может быть нуклеиновая кислота, кодирующая ALS.Pp.
В настоящих вариантах реализации рекомбинантных дрожжей по изобретению, где указанные рекомбинантные дрожжи содержат, по меньшей мере, две ДНК-конструкции, выбранные из группы, включающей ДНК-конструкции формул (I) - (III), каждая из ДНК-конструкций, и, более конкретно, каждый из генов среди родственных гена 1, гена 2 и/или гена 3, содержащихся в ней, могут быть идентичными или разными.
Далее в настоящем документе представлены некоторые иллюстративные варианты осуществления ДНК-конструкции, выбранной из группы, содержащей ДНК-конструкции формул (I), (II) и (III).
Рекомбинантные дрожжи, содержащие ДНК-конструкцию формулы (I):

Рекомбинантные дрожжи, содержащие ДНК-конструкцию формулы (I) указанной выше, имеют пониженную активность пируватдекарбоксилазы, и имеют четыре следующих ДНК-суб-конструкции (i) - (iii), которые были введены в их геном:
(i) ДНК-суб-конструкция, содержащая две нуклеиновые кислоты, идентичные или отличающиеся друг от друга, каждая нуклеиновая кислота кодирует ALS, указанную ДНК-суб-конструкцию вводят в первое местоположение в геноме указанных рекомбинантных дрожжей;
(ii) ДНК-суб-конструкция, содержащая две нуклеиновые кислоты, идентичные или отличающиеся друг от друга, каждая нуклеиновая кислота кодирует ALD, указанную ДНК-суб-конструкцию вводят во второе местоположение в геноме указанных рекомбинантных дрожжей, отличное от местоположения, куда была вставлена ДНК-суб-конструкция, содержащая нуклеиновые кислоты, кодирующие ALS; и
(iii) ДНК-суб-конструкция, содержащая три нуклеиновые кислоты, идентичные или отличающиеся друг от друга, каждая нуклеиновая кислота кодирует NOXE, указанную ДНК-суб-конструкцию вводят в третье местоположение в геноме указанных рекомбинантных дрожжей, отличное от первого и второго местоположений, куда были вставлены ДНК-суб-конструкция, содержащая нуклеиновые кислоты, кодирующие ALS, и ДНК-суб-конструкция, содержащая нуклеиновые кислоты, кодирующие ALD, соответственно.
В некоторых вариантах осуществления настоящего изобретения, требуемое снижение активности пируватдекарбоксилазы указанных специфических рекомбинантных дрожжей, может быть достигнуто путем вставки по меньшей мере одного из дрожжевых генов pdc, по меньшей мере, одной ДНК-суб-конструкции (I) - (III), или, в качестве альтернативы, их комбинации.
Рекомбинантные дрожжи, содержащие одну ДНК-конструкцию формулы (II):

Рекомбинантные дрожжи, содержащие ДНК-конструкцию формулы (II), указанной выше, обладают пониженной активностью пируватдекарбоксилазы, и имеют геном, в который были вставлены две следующие ДНК-суб-конструкции (А) и (В), а именно:
(А) первую ДНК-суб-конструкцию 5'-[ALS]2-[ALD]2-3', причем указанную первую ДНК-суб-конструкцию вводят в первое местоположение в геноме указанных рекомбинантных дрожжей, и указанная первая ДНК-суб-конструкция включает;
(i) две нуклеиновые кислоты, идентичные или отличающиеся друг от друга, каждая из которых кодирует ALS; и
(ii) две нуклеиновые кислоты, идентичные или отличающиеся друг от друга, каждая из которых кодирует ALD; и
(В) вторую ДНК-суб-конструкцию 5'-[NOXE]3-3', указанную ДНК-субконструкцию вводят во второе местоположение в геноме указанных рекомбинантных дрожжей, отличное от первого местоположения, в которое была вставлена первая ДНК-суб-конструкция, и указанная вторая ДНК-суб-конструкция, содержит (iii) три нуклеиновые кислоты, идентичные или отличающиеся друг от друга, каждая нуклеиновая кислота кодирует NOXE.
В некоторых вариантах осуществления настоящего изобретения, необходимое уменьшение активности пируватдекарбоксилазы указанных выше конкретных рекомбинантных дрожжей, может быть получено путем вставки по меньшей мере в один из генов pdc дрожжей первой ДНК-конструкции и/или второй ДНК-конструкции.
Рекомбинантные дрожжи, содержащие одну ДНК-конструкцию формулы (III):

Рекомбинантные дрожжи, содержащие ДНК-конструкцию формулы (III) указанной выше, имеют пониженную активность пируватдекарбоксилазы и имеют геном, в который была вставлена одна ДНК-конструкция, расположенная в требуемом месте в геноме указанных рекомбинантных дрожжей, причем указанная ДНК-конструкция, содержит;
(i) две нуклеиновые кислоты, идентичные или отличающиеся друг от друга, каждая нуклеиновая кислота кодирует ALS;
(ii) две нуклеиновые кислоты, идентичные или отличающиеся друг от друга, каждая нуклеиновая кислота кодирует ALD; а также
(iii) три нуклеиновые кислоты, идентичные или отличающиеся друг от друга, каждая нуклеиновая кислота кодирует NOXE.
В некоторых вариантах осуществления, необходимое уменьшение активности пируватдекарбоксилазы указанных конкретных рекомбинантных дрожжей, может быть получено путем вставки указанной ДНК-конструкции в, по меньшей мере, один из дрожжевых генов pdc.
Для каждого из этих трех указанных выше иллюстративных вариантов реализации рекомбинантных дрожжей по настоящему изобретению, и, как указано выше, когда "х1" - "х3", независимо друг от друга, представляет(ют) собой целое число, имеющее значение два и более:
- одна копия ALS в пределах одной ДНК-конструкции, может быть идентична другой копии ALS, содержащейся в указанной ДНК-конструкции, или может быть идентична всем остальным копиям ALS, содержащимся в указанной ДНК-конструкции или, альтернативно, указанная одна копия ALS может отличаться от других копий ALS, содержащихся в указанной ДНК-конструкции.
- одна копия ALD в пределах одной ДНК-конструкции, может быть идентична другой копии ALD, содержащейся в указанной ДНК-конструкции, или может быть идентичной всем остальным копиям ALD, содержащимся в указанной ДНК-конструкции или, альтернативно, указанная одна копия ALD может отличаться от других копий, содержащихся в указанной ДНК-конструкции.
- одна копия NOXE в пределах одной ДНК-конструкции, может быть идентична другой копии NOXE, содержащейся в указанной ДНК-конструкции или может быть идентична всем остальным копиям NOXE, содержащимся в указанной ДНК-конструкции или, альтернативно, указанная одна копия NOXE может отличаться от других копий, содержащихся в указанной ДНК-конструкции.
Рекомбинантные дрожжи, содержащие одну ДНК-конструкцию формулы (III) и одну ДНК-конструкцию формулы (I):


Полученные рекомбинантные дрожжи обладают пониженной активностью пируватдекарбоксилазы, и имеют геном, в который были вставлены две следующих ДНК-суб-конструкции (А) и (В), а именно:
(A) первая ДНК-суб-конструкция 5'-[ALS]1-[ALD]1-[NOXE]1-3', причем указанную первую ДНК-суб-конструкцию вводят в первое местоположение в геноме указанных рекомбинантных дрожжей, и указанная первая ДНК-субконструкция, содержит;
(i) одну нуклеиновую кислоту, кодирующую ALS;
(ii) одну нуклеиновую кислоту, кодирующую ALD; и
(iii) одну нуклеиновую кислоту, кодирующую, NOXE;
а также
(B) вторая ДНК-суб-конструкция 5'-[ALS]0-3' и 5'-[ALD]0-3' и 5'-[NOXE]12-3', указанную вторую ДНК-суб-конструкцию вводят во второе местоположение в геноме указанных рекомбинантных дрожжей, и указанная вторая ДНК-субконструкция, содержит:
(i) двенадцать нуклеиновых кислот, кодирующих NOXE.
Рекомбинантные дрожжи, содержащие две ДНК-конструкции формулы (III) и одну ДНК-конструкцию формулы (I):


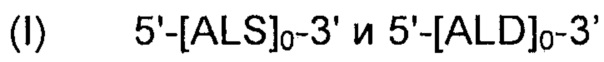

Полученные рекомбинантные дрожжи обладают пониженной активностью пируватдекарбоксилазы, и имеют геном, в который были вставлены две следующие ДНК-суб-конструкции (А), (В) и (С), а именно:
(A) первая ДНК-суб-конструкция 5'-[ALS]1-[ALD]1-[NOXE]1-3', причем указанную первую ДНК-суб-конструкцию вводят в первое местоположение в геноме указанных рекомбинантных дрожжей, и указанная первая ДНК-субконструкция содержит:
(i) одну нуклеиновую кислоту, кодирующую ALS;
(ii) одну нуклеиновую кислоту, кодирующую ALD; и
(iii) одну нуклеиновую кислоту, кодирующую NOXE;
(B) вторая ДНК-суб-конструкция 5'-[ALS]1-[ALD]1-[NOXE]1-3', причем указанную вторую ДНК-суб-конструкцию вводят во второе местоположение в геноме указанных рекомбинантных дрожжей, и вторая ДНК-суб-конструкция, содержит:
(i) одну нуклеиновую кислоту, кодирующую ALS;
(ii) одну нуклеиновую кислоту, кодирующую ALD; и
(iii) одну нуклеиновую кислоту, кодирующую NOXE; и
(C) третья ДНК-суб-конструкция 5'-[ALS]0-3' и 5'-[ALD]0-3' и 5'-[NOXE]12-3', указанную третью ДНК-суб-конструкцию вводят в третье местоположение в геноме указанных рекомбинантных дрожжей, и третья ДНК-суб-конструкция, содержит:
(i) двенадцать нуклеиновых кислот, кодирующих NOXE.
Рекомбинантные дрожжи, содержащие две ДНК-конструкции формулы (II) и одну ДНК-конструкцию формулы (I):



Полученные рекомбинантные дрожжи обладают пониженной активностью пируватдекарбоксилазы, и имеют геном, в который были вставлены три следующие ДНК-суб-конструкции (А), (В) и (С), а именно:
(А) первая ДНК-суб-конструкция 5'-[ALS]1-[ALD]1-3' и 5'-[NOXE]0-3', причем указанную первую ДНК-суб-конструкцию вводят в первое местоположение в геноме указанных рекомбинантных дрожжей, и первая ДНК-суб-конструкция, содержит;
(i) одну нуклеиновую кислоту, кодирующую ALS;
(ii) одну нуклеиновую кислоту, кодирующую ALD;
(B) вторая ДНК-суб-конструкция 5'-[ALS]1-[ALD]1-3' и 5'-[NOXE]0-3', причем указанную вторую ДНК-суб-конструкцию вводят во второе местоположение в геноме указанных рекомбинантных дрожжей, и вторая ДНК-суб-конструкция содержит:
(i) одну нуклеиновую кислоту, кодирующую ALS; и
(ii) одну нуклеиновую кислоту, кодирующую ALD; и
(C) третья ДНК-суб-конструкция 5'-[NOXE]12-3', указанную третью ДНК-субконструкцию вводят в третье местоположение в геноме указанных рекомбинантных дрожжей, отличное от первого местоположения, куда первая ДНК-суб-конструкция была вставлена, и указанная вторая ДНК-суб-конструкция, содержит;
(iii) двенадцать нуклеиновых кислот, идентичных или отличающихся друг от друга, кодирующих NOXE.
В некоторых вариантах осуществления настоящего изобретения, необходимое снижение активности пируватдекарбоксилазы указанных выше конкретных рекомбинантных дрожжей, может быть получено путем введения, по меньшей мере, в один из генов pdc дрожжей первой ДНК-суб-конструкции и/или второй ДНК-суб-конструкции.
В соответствии с некоторыми конкретными вариантами осуществления, рекомбинантные дрожжи по настоящему изобретению могут содержать, по меньшей мере, одну, предпочтительно по меньшей мере, две ДНК-конструкции указанной выше формулы (II), в которой "ген 3" обозначает нуклеиновую кислоту, кодирующую NADH-оксидазу (или NOXE).
В соответствии с этими конкретными вариантами осуществления, каждая нуклеиновая кислота из гена 1 и гена 2 обязательно означает нуклеиновую кислоту, выбранную из группы, включающей ALS и ALD. В этих вариантах осуществления, присутствует, по меньшей мере, одна копия вставленного ALS и ALD. В вариантах осуществления, в которых только одна конструкция формулы (II), вставлена в геном дрожжей, каждая нуклеиновая кислота из гена 1 и гена 2 обязательно означает нуклеиновую кислоту, выбранную из группы, включающей ALS и ALD, и присутствует одна копия каждой из ALS и ALD. В вариантах осуществления, где набор из двух или более конструкций формулы (II), вставлен в геном дрожжей, каждая нуклеиновая кислота из гена 1 и гена 2 обязательно означает нуклеиновую кислоту, выбранную из группы, включающей ALS и ALD и, по меньшей мере, одна копия каждого из ALS и ALD присутствует в указанном наборе из двух или более ДНК-конструкций формулы (II).
Кроме того, когда указанные рекомбинантные дрожжи по настоящему изобретению содержат, по меньшей мере, две ДНК-конструкции вышеуказанной формулы (II), указанные ДНК-конструкции упомянутой выше формулы (II), могут быть идентичными или разными.
В соответствии с предпочтительным вариантом осуществления, рекомбинантные дрожжи по настоящему изобретению могут содержать, по меньшей мере, одну, предпочтительно по меньшей мере, две ДНК-конструкции формулы (IIa), идентичные или разные, где каждая формула (IIa), имеет следующую формулу:

где:
- ген 1, ген 2 и ген 3, "х1", "х2" и "х3" являются такими, как определено выше;
- "х5" обозначает целое число, равное 0 или 1;
- "у1", "у2", "z1" и "z2", независимо друг от друга, представляют собой целое число, равное 0 или 1;
- когда указанные рекомбинантные дрожжи содержат, по меньшей мере, две ДНК-конструкции формулы (IIa), то "х1", "х2", "х3", "х5", "у1", "у2", "z1" и "z2" могут быть идентичными или разными;
- "пром1" представляет собой регуляторную последовательность, которая контролирует экспрессию последовательности, кодирующей ген 1;
- "пром2" представляет собой регуляторную последовательность, которая контролирует экспрессию последовательности, кодирующей ген 2;
- "пром3" представляет собой регуляторную последовательность, которая контролирует экспрессию последовательности, кодирующей ген 3;
- "пром5" представляет собой регуляторную последовательность, которая контролирует экспрессию гена 1, указанный пром5 может быть идентичным или отличаться от пром1;
- "терм1" представляет собой последовательность терминатора транскрипции, который прекращает экспрессию последовательности, кодирующей ген 1;
- "терм2" представляет собой последовательность терминатора транскрипции, который прекращает экспрессию последовательности, кодирующей ген 2;
- "терм3" представляет собой последовательность терминатора транскрипции, который прекращает экспрессию последовательности, кодирующей ген 3; и
- "терм5" представляет собой последовательность терминатора транскрипции, который прекращает экспрессию гена 1, указанный терм5 может быть идентичным или отличаться от терм1.
Для большей ясности в отношении характеристик "х5" и "у1", далее в настоящем документе представлены примеры, иллюстрирующие более подробно соответствующие конкретные варианты:
- когда "х5" представляет собой целое число, равное 1, и "у1" представляет собой целое число, равное 0, то это означает, что рассматриваемый ген 1 находится под контролем промотора гена рекомбинантных дрожжей, в который рассматриваемая ДНК-конструкция была вставлена; или
- когда "х5" представляет собой целое число, равное 1, и "у1" представляет собой целое число, равное 1, то это означает, что рассматриваемый ген 1 находится под контролем промотора "пром5". В связи с этим, последовательность промотора эндогенного гена, предпочтительно гена pdc, в который вставлена ДНК-конструкция, устранена, или, по меньшей мере, разрушена, так же как и последовательность его соответствующей кодирующей области.
Дополнительно, что касается, в частности, характеристик "у2" и "z2", далее в настоящем документе представлены примеры, иллюстрирующие более подробно, соответствующие конкретные варианты осуществления (конечно, в указанных далее в настоящем документе примерах, "х3" представляет собой целое число, равное 1 или больше):
- когда "у2" представляет собой целое число, равное 0, то это означает, что рассматриваемый ген 3 находится под контролем промотора гена рекомбинантных дрожжей, в который рассматриваемая ДНК-конструкция была вставлена; или
- когда "у2" представляет собой целое число, равное 1, то это означает, что рассматриваемый ген 3 находится под контролем промотора "пром3". В связи с этим, последовательность промотора эндогенного гена, в который вставлена ДНК-конструкция устранена, или, по меньшей мере, разрушена, также как и последовательность ее соответствующей кодирующей области.
- когда "z2" представляет собой целое число, равное 0, то это означает, что рассматриваемый ген 3 связан с терминатором транскрипции гена рекомбинантных дрожжей, в который рассматриваемая ДНК-конструкция была вставлена; или
- когда "z2" представляет собой целое число, равное 1, то это означает, что рассматриваемый ген 3 связан с терминатором транскрипции "терм3". В связи с этим, последовательность терминатора транскрипции эндогенного гена, в который вставлена ДНК-конструкция, устранена, или, по меньшей мере, разрушена, также как и последовательность ее соответствующей кодирующей области.
Что касается "z1", когда оно присутствует в формулах, описанных в настоящем описании, вышеупомянутое в отношении "z2" применяется mutatis mutandis.
В соответствии с другим предпочтительным вариантом осуществления, рекомбинантные дрожжи по настоящему изобретению могут содержать по меньшей мере одну, предпочтительно по меньшей мере две ДНК-конструкции следующей формулы (IIb):

где:
- ALS, ALD, NOXE, "x1", "x2", "х3", "x5", "y1", "y2", "z1" и " z2" являются такими, как определено выше;
- когда указанные рекомбинантные дрожжи содержат, по меньшей мере, две ДНК-конструкции формулы (IIb), то "х1", "х2", "х3", "х5", "у1", "у2", "z1" и "z2" могут быть идентичными или разными;
- "пром1" представляет собой регуляторную последовательность, которая контролирует экспрессию последовательности, кодирующей ацетолактатсинтазу;
- "пром 2" представляет собой регуляторную последовательность, которая контролирует экспрессию последовательности, кодирующей ацетолактатдекарбоксилазу;
- "пром3" представляет собой регуляторную последовательность, которая контролирует экспрессию последовательности, кодирующей NADH-оксидазу;
- "пром5" представляет собой регуляторную последовательность, которая контролирует экспрессию последовательности, кодирующей ацетолактатсинтазу, причем указанный пром5 может быть идентичным или отличаться от пром1;
- "терм1" представляет собой последовательность терминатора транскрипции, который прекращает экспрессию последовательности, кодирующей ацетолактатсинтазу;
- "терм2" представляет собой последовательность терминатора транскрипции, который прекращает экспрессию последовательности, кодирующей ацетолактатдекарбоксилазу;
- "терм3" представляет собой последовательность терминатора транскрипции, который прекращает экспрессию последовательности, кодирующей NADH-оксидазу; а также
- "терм5" представляет собой последовательность терминатора транскрипции, который прекращает экспрессию последовательности, кодирующей ацетолактатсинтазу, указанный терм5 может быть идентичным или отличаться от терм1.
В соответствии с другим предпочтительным вариантом осуществления, рекомбинантные дрожжи по настоящему изобретению могут содержать, по меньшей мере, две ДНК-конструкции формул (II), (IIa) или (IIb), при условии, что все копии нуклеиновой кислоты NOXE расположены на одной из, по меньшей мере, двух ДНК-конструкций формул (II), (IIa) или (IIb).
В соответствии с другим предпочтительным вариантом осуществления, рекомбинантные дрожжи по изобретению могут содержать по меньшей мере две, предпочтительно строго две ДНК-конструкции следующих формул (IIc) и (IId):


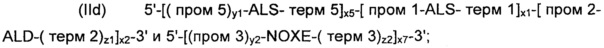
где:
- ALS, ALD, NOXE, "пром1", "пром2", "пром3", "пром5", "терм1", "терм2", "терм3", "терм5", "х1", "х2", "х3", "х5", "у1", "у2", "z1" и "z2" являются такими, как определено выше; и
- "х1" к "х3", "х5", "у1", "у2", "z1" и "z2" для каждой из формул (IIc) и (IId) могут быть идентичными или разными; и
- "х6" и "х7" представляют собой целые числа от 0 до 50, предпочтительно от 0 до 20, предпочтительно от 0 до 12, более конкретно от 2 до 5, предпочтительно от 3 до 4, а еще лучше, равны 3, при условии, что одно из "х6" и "х7" представляет собой 0.
Преимущественно, первый ген 1 в 5'-положении в ДНК-конструкции формулы (I) - (III), предпочтительно представляет собой ген, представленный нуклеиновой кислотой, кодирующей ALS, и, более конкретно, указанный первый ген 1 находится под контролем промотора гена рекомбинантных дрожжей, в которые была вставлена рассматриваемая ДНК-конструкция.
Более конкретно, это означает, что, для ДНК-конструкции формулы (IIa), (IIb), (IIc) или (IId), "х5" преимущественно представляет собой целое число, равное 1, и "у1" представляет собой целое число, равное 0.
Ввиду сложности вышеуказанных ДНК-конструкций и ДНК-суб-конструкций по настоящему изобретению, следует подчеркнуть, что:
- относительно одной ДНК-конструкции по настоящему изобретению, когда "х1", "х2" и/или "х3" представляют целое число, большее или равное 2, то:
- каждая копия для соответствующей нуклеиновой кислоты из гена 1, гена 2 и/или гена 3 может быть идентичной или разной; и/или
- промоторы и/или терминаторы для каждой копии соответствующей нуклеиновой кислоты среди гена 1, гена 2 и/или гена 3 могут быть идентичными или разными;
- когда рекомбинантные дрожжи содержат, по меньшей мере, две ДНК-конструкции, указанные, по меньшей мере, две ДНК-конструкции могут быть идентичными или разными в отношении:
(i) их общая формула в данной ДНК-конструкции, может быть охарактеризована формулой, выбранной из группы, состоящей из формул (I) - (III);
(ii) значения "х1" - "х3" и "х5" - "х7", "у1", "у2", "z1" и/или "z2";
(iii) характера промотора в отношении одного и того же гена;
(iv) характера терминатора в отношении одного и того же гена; и/или
(v) характера самого по себе гена в том, что ALS, ALD и NOXE могут происходить от организмов, принадлежащих к различным родам как, в частности, далее показано в Табл. 1.
Методы, использованные для реализации ДНК-конструкции, такие как определенные выше, относятся к общим знаниям специалиста в данной области техники.
В связи с этим, специалист в данной области техники может с успехом обратиться к методу, описанному у Shao и др., (Nucleic Acids Research, 2009, т. 37, No. 2: е16) и у Shao и др., (Methods in Enzymology, 2012 Elsevier Inc., т. 517: 203), в конечном счете, лишь с незначительными изменениями, а более конкретно, разработанному далее в настоящем документе после примеров.
СНИЖЕНИЕ АКТИВНОСТИ ПИРУВАТДЕКАРБОКСИЛАЗЫ
Активность эндогенной пируватдекарбоксилазы в дрожжах превращает пируват в ацетальдегид, который затем превращается в этанол или ацетил-СоА через ацетат.
Как было упомянуто выше, настоящее изобретение относится к рекомбинантным дрожжам со сниженной активностью пируватдекарбоксилазы, в геном которых была вставлена определенная ДНК-конструкция.
В соответствии с конкретным вариантом осуществления, рекомбинантные дрожжи характеризуются тем, что один или более генов, кодирующих эндогенную пируватдекарбоксилазу, может быть выключен.
Активность эндогенной пируватдекарбоксилазы рекомбинантных дрожжей по настоящему изобретению, может быть снижена всеми способами, известными специалисту в данной области техники.
В связи с этим, активность пируватдекарбоксилазы рекомбинантных дрожжей по настоящему изобретению может, например, быть снижена путем (i) разрушения, по меньшей мере, одного гена, кодирующего пируватдекарбоксилазу, путем вставки в указанный, по меньшей мере, один ген, кодирующий пируват-декарбоксилазу, по меньшей мере, одной экзогенной ДНК-конструкции, способами, известными специалисту в данной области техники, (ii) мутациями в регуляторных областях, снижающими транскрипцию пируватдекарбоксилазы, (iii) мутациями в старт-кодоне, в частности, путем замены AUG на GUG, и (iv) мутациями в кодирующих последовательностях, изменяющими активность, (v) мутациями, вставками или делециями в кодирующую последовательность, изменяющими стабильность белка, (vi) мутациями, изменяющими время полужизни мРНК пируватдекарбоксилазы.
Что касается первого варианта (i), ДНК-конструкцией, используемой для разрушения рассматриваемого гена pdc, может быть экзогенная ДНК-конструкция, отличающаяся от ДНК-конструкций по изобретению, описанных выше, ДНК-конструкция по изобретению, или их комбинации.
Кроме того, и как упомянуто выше, каждая из ДНК-конструкций по настоящему изобретению формулы (I) и (II), состоит из двух или больше ДНК-субконструкций.
Таким образом, в соответствии с конкретным вариантом реализации, активность пируватдекарбоксилазы рекомбинантных дрожжей по настоящему изобретению, может быть снижена путем разрушения, по меньшей мере, одного гена, кодирующего пируватдекарбоксилазу, путем вставки в указанный ген только, по меньшей мере, одной ДНК-суб-конструкции, по меньшей мере, одной ДНК-конструкции по изобретению формулы (I) и (II).
Предпочтительно активность эндогенной пируватдекарбоксилазы может быть снижена путем разрушения по меньшей мере одного гена pdc.
В самом деле, дрожжи могут иметь один или более генов, кодирующих пируватдекарбоксилазу. Например, есть один ген, кодирующий пируватдекарбоксилазу у Kluyveromyces lactis, в то время как у Saccharomyces cerevisiae есть три изофермента пируватдекарбоксилазы, кодируемые генами PDC1, PCD5 и PDC6, а также регуляторный ген PDC2 пируватдекарбоксилазы.
Предпочтительно и, как определено далее в настоящем документе, рекомбинантными дрожжами по изобретению могут быть рекомбинантные дрожжи рода Saccharomyces и, предпочтительно рекомбинантные дрожжи вида Saccharomyces cerevisiae.
В связи с этим, и согласно первому варианту, активность пируватдекарбоксилазы может быть снижена путем разрушения, по меньшей мере, одного гена pdc, предпочтительно по меньшей мере, двух генов pdc, и, более конкретно, только двух генов pdc.
Дополнительно, разрушенный ген(ы) pdc может быть выбран из группы, состоящей из pdc1, pdc5, pdc6 и их смеси, и, предпочтительно из pdc1 и pdc6.
Предпочтительно если рекомбинантные дрожжи принадлежат к роду Saccharomyces, то активность пируватдекарбоксилазы может быть снижена путем разрушения по меньшей мере двух генов pdc, предпочтительно выбранных из группы, состоящей из pdc1, pdc5, pdc6, и их комбинации, и, более конкретно, из группы, состоящей из pdc1 и pdc6.
Действительно, разрушение трех генов pdc в роде Saccharomyces, предпочтительно виде Saccharomyces cerevisiae, резко снижает рост штамма, что делает его несовместимым с любым промышленным применением.
Согласно конкретному варианту, в роде Saccharomyces, предпочтительно виде Saccharomyces cerevisiae, только гены pdc1 и pdc6 разрушены и экспрессия pdc5 ослаблена.
Способ, используемый для ослабления экспрессии специфического гена, относится к общим знаниям специалиста данной области техники.
В связи с этим, специалист в данной области техники может с успехом обратиться к любому способу, который хорошо известен в данной области техники.
Преимущественно, для ослабления экспрессии pdc 5, его транскрипция, может быть помещена под контроль слабого промотора, особенно, такого как RPLA1, URA3, МЕТ25, HIS3, TRP1, GAP1, NUP57 или TFC1, предпочтительно RPLA1 (=последовательность SEQ ID NO 37).
Метод, используемый для измерения уровня активности пируватдекарбоксилазы, относится к общим знаниям специалиста в данной области техники.
В связи с этим, специалист в данной области техники может с успехом обратиться к методу, описанному Wang и др., (Biochemistry, 2001, 40: 1755-1763).
АЦЕТОЛАКТАТСИНТАЗА
Фермент ацетолактатсинтаза (ALS), (также известный как ацетогидроксикислотсинтаза (AHAS), α-ацетогидроксикислотсинтетаза, α-ацетогидроксикислотсинтаза, α-ацетолактатсинтаза, α-ацетолактатсинтетаза, ацетогидроксикислотсинтетаза, ацетогидроксикислотсинтаза, ацетолактатпируватлиаза (карбоксилирующая), ацетолактатсинтетаза представляет собой белок, который катализирует первую стадию в синтезе аминокислот с разветвленной цепью (валин, лейцин и изолейцин).
ALS является ферментом, специфически участвующим в химической реакции, включающей превращение двух молекул пирувата в молекулу ацетолактата и молекулу диоксида углерода. Реакция использует тиаминпирофосфат для того, чтобы связать две молекулы пирувата.
Метод, используемый для измерения уровня активности ацетолактатсинтазы, относится к общим знаниям специалиста в данной области техники.
В этом отношении, специалист в данной области техники, может с успехом обратиться к методу, описанному у Poulsen и др., (Eur. J. Biochem. 185, 1989: 433-439).
Предпочтительная ацетолактатсинтаза в настоящем изобретении, известна под номером ЕС 2.2.1.6.
В соответствии с предпочтительным вариантом осуществления, нуклеиновая кислота(ы), кодирующая ацетолактатсинтазу или ALS, может быть нуклеиновой кислотой (ми), предпочтительно выбранной из группы, включающей Bacillus subtilis, Nicotiana tabacum, Paenibacillus polymyxa и их смесь, и, предпочтительно Nicotiana tabacum и Paenibacillus polymyxa.
Согласно еще предпочтительному варианту осуществления, нуклеиновой кислотой(ми), кодирующей ацетолактатсинтазу или ALS, может быть нуклеиновая кислота(ы), выбранная из группы, состоящей из последовательностей, имеющих, по меньшей мере, 65%, предпочтительно по меньшей мере, 80% идентичность нуклеиновой кислоты с последовательностью нуклеиновых кислот SEQ ID NO: 1, 3 и 5.
Как описано в настоящем документе, последовательность нуклеиновой кислоты, имеющая, по меньшей мере, 65% нуклеотидную идентичность с последовательностью эталонной нуклеиновой кислоты, включает последовательности нуклеиновых кислот, имеющих, по меньшей мере, 66%, 67%, 68%, 69%, 70%, 71%, 72%, 73%, 74%, 75%, 76%, 77%, 78%, 79%, 80%, 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% и 99% нуклеотидную идентичность с указанной последовательностью эталонной нуклеиновой кислоты.
Как описано в настоящем документе, последовательность нуклеиновой кислоты, имеющая, по меньшей мере, 80% идентичность с нуклеотидной последовательностью эталонной нуклеиновой кислоты, включает последовательности нуклеиновых кислот, имеющих, по меньшей мере, 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% и 99% нуклеотидную идентичность с указанной последовательностью эталонной нуклеиновой кислоты.
В соответствии с другим вариантом осуществления, нуклеиновой кислотой(ми), кодирующей ацетолактатсинтазу, может быть нуклеиновой кислота(ы), кодирующая аминокислотную последовательность, выбранную из группы, состоящей из последовательностей, имеющих, по меньшей мере, 65%, предпочтительно по меньшей мере, 80% идентичность с последовательностями SEQ ID NO: 2, 5 и 6.
Как описано в настоящем документе, аминокислотная последовательность, имеющая, по меньшей мере, 65% идентичность с эталонной аминокислотной последовательностью, включает в себя аминокислотные последовательности, имеющие, по меньшей мере, 66%, 67%, 68%, 69%, 70%, 71%, 72%, 73%, 74%, 75%, 76%, 77%, 78%, 79%, 80%, 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% и 99% аминокислотную идентичность с указанной эталонной аминокислотной последовательностью.
Как описано в настоящем документе, аминокислотная последовательность, имеющая, по меньшей мере, 80%-ную идентичность с последовательностью эталонной аминокислоты, включает в себя аминокислотные последовательности, имеющие, по меньшей мере, 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% и 99% аминокислотную идентичность с указанной последовательностью эталонной аминокислоты.
Как указано выше, уровень экспрессии ALS в настоящем изобретении, регулируется с помощью, по меньшей мере, одного промотора, и, по меньшей мере, одного терминатора, такого, как определено далее в деталях в настоящем документе, которые присутствуют соответственно в положениях 5' и 3' последовательности нуклеиновой кислоты, кодирующей ALS.
АЦЕТОЛАКТАТДЕКАРБОКСИЛАЗА
Фермент ацетолактатдекарбоксилаза (также известный как α-ацетолактатдекарбоксилаза, (S)-2-гидрокси-2-метил-3-оксобутаноаткарбоксилиаза, (S)-2-гидрокси-2-метил-3-оксобутаноаткарбоксилиаза [(R)-2-ацетоин-образующая] или (S)-2-гидрокси-2-метил-3-оксобутаноаткарбоксилиаза [(3R)-3-гидроксибутан-2-он-образующая]) принадлежит к семейству лиаз, в частности карбоксилиаз, которые расщепляют связи углерод-углерод, а также участвуют в метаболизме бутаноата и метаболизме С5-разветвленной двухосновной кислоты.
ALD представляет собой фермент, специфически участвующий в химической реакции, связанной с превращением молекулы α-ацетолактата в молекулу ацетоина и углекислого газа.
Метод, используемый для измерения уровня активности ацетолактатдекарбоксилазы, относится к общим знаниям специалиста в данной области техники.
В этом отношении, специалист в данной области техники может с успехом обратиться к методу, описанному у Dulieu и др., (Enzyme and Microbial Technology 25, 1999: 537-542).
Предпочтительная ацетолактатдекарбоксилаза в настоящем изобретении, известна под номером ЕС 4.1.1.5.
В соответствии с предпочтительным вариантом осуществления, нуклеиновой кислотой(ми), кодирующей ацетолактатдекарбоксилазу или ALD, может быть нуклеиновая кислота(ы), выбранная из группы, включающей Brevibacillus brevis, Enterobacter aerogenes, Lactococcus lactis, и их смесь, и, предпочтительно Brevibacillus brevis и Enterobacter aerogenes.
Согласно еще более предпочтительному варианту осуществления, нуклеиновой кислотой(ми), кодирующей ацетолактатдекарбоксилазу или ALD, может быть нуклеиновая кислота(ы), выбранная из группы, состоящей из последовательностей, имеющих, по меньшей мере, 36%, предпочтительно по меньшей мере, 80%, идентичность нуклеиновой кислоты с последовательностями нуклеиновых кислот SEQ ID NO: 7, 9 и 11.
Как описано в настоящем документе, последовательность нуклеиновой кислоты, имеющая, по меньшей мере, 36%-ную идентичность с нуклеотидной последовательностью эталонной нуклеиновой кислоты включает последовательности нуклеиновых кислот, имеющих, по меньшей мере, 37%, 38%, 39%, 40%, 41%, 42%, 43%, 44%, 45%, 46%, 47%, 48%, 49%, 50%, 51%, 52%, 53%, 54%, 55%, 56%, 57%, 58%, 59%, 60%, 61%, 62%, 63%, 64%, 65%, 66%, 67%, 68%, 69%, 70%, 71%, 72%, 73%, 74%, 75%, 76%, 77%, 78%, 79%, 80%, 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% и 99% нуклеотидную идентичность с указанной последовательностью эталонной нуклеиновой кислоты.
В соответствии с другим вариантом осуществления, нуклеиновой кислотой(ми), кодирующей ацетолактатдекарбоксилазу может быть нуклеиновая кислота(ы), кодирующая аминокислотную последовательность, выбранную из группы, состоящей из последовательностей, имеющих по меньшей мере 36%, предпочтительно по меньшей мере 80%-ную идентичность с последовательностями SEQ ID NO: 8, 10 и 12.
Как описано в настоящем документе, аминокислотная последовательность, имеющая, по меньшей мере, 36% аминокислотную идентичность с последовательностью эталонной аминокислоты, включает в себя аминокислотные последовательности, имеющие, по меньшей мере, 37%, 38%, 39%, 40%, 41%, 42%, 43%, 44%, 45%, 46%, 47%, 48%, 49%, 50%, 51%, 52%, 53%, 54%, 55%, 56%, 57%, 58%, 59%, 60%, 61%, 62%, 63%, 64%, 65%, 66%, 67%, 68%, 69%, 70%, 71%, 72%, 73%, 74%, 75%, 76%, 77%, 78%, 79%, 80%, 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% и 99% аминокислотную идентичность с указанной эталонной аминокислотной последовательностью.
Как указано выше, уровень экспрессии ALD в настоящем изобретении, регулируют по меньшей мере одним промотором, и по меньшей мере одним терминатором, таким, как определено далее в настоящем документе более подробно, которые присутствуют соответственно в положениях 5' и 3' последовательности нуклеиновой кислоты, кодирующей ALD.
NADH-ОКСИДАЗА
Инактивация или снижение активности по меньшей мере одного гена pdc инактивирует или ослабляет путь ферментации этанола в дрожжах. В результате, это вызывает состояние нарушения окислительно-восстановительного равновесия, которое не устраняется путем экспрессии ALS и ALD. Действительно, путь от глюкозы до 2 пируватов генерирует 2 NADH-эквивалента, в то время как преобразование 2 пируватов в ацетоин не перерабатывает NADH в NAD+(Фиг. 1).
Авторы настоящего изобретения обнаружили, что фермент бактериальная водообразующая NADH-оксидаза (также называемая в настоящем документе NOXE-оксидаза или NOXE), при определенном уровне экспрессии, может не только обеспечить уравновешивание окислительно-восстановительного состояния, которое обеспечивает усиление устойчивости этого штамма, но и обеспечивает усиление роста этого штамма и дальнейшее увеличение выхода ацетоина.
Бактериальная, водобразующая NADH-оксидаза представляет собой фермент, который катализирует следующую реакцию:
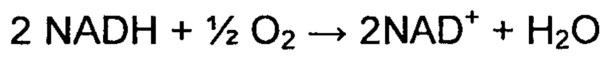
Предпочтительная водообразующая NADH-оксидаза в настоящем изобретении известна под номером ЕС 1.6.3.1 и 1.6.99.3 (также известна как NAD(P)H-оксидаза (Н(2)O(2) образующая), двойная оксидаза, NAD(P)H-оксидаза, ThOX, ТНОХ2, тиреоидная NADPH оксидаза, тиреоидная оксидаза, тиреоидная оксидаза 2 для ЕС 1.6.3.1 и NADH-дегидрогеназа, Бета-NADH-дегидрогеназа-динуклеотид, цитохром С редуктаза, диафораза, дигидрокодегидрогеназа I дегидрогеназа, дигидроникотинамидадениндинуклеотид дегидрогеназа, дифосфопириназа, DPNH-диафораза, NADH-диафораза, NADH-гидрогеназа, NADH-оксидоредуктаза, NADH-менадион-оксидоредуктаза, NADH:Цитохром С оксидоредуктаза, восстановленная дифосфопиридиннуклеотид диафораза, дегидрогеназа типа 1, дегидрогеназа типа I для ЕС 1.6.99.3).
Водообразующая NADH-оксидаза, которая может быть рассмотрена в настоящем изобретении, в частности, описана в публикации WO 2006/134277.
Метод, используемый для измерения уровня активности NADH-оксидазы в соответствии с настоящим изобретением, относится к общим знаниям специалиста в данной области техники.
В этом направлении, специалист в данной области техники может с успехом обратиться к методу, описанному у Lopez DE FELIPE и др., (International Daily Journal, 2001, т. 11: 37-44 (ISSN 0958-6946)).
В соответствии с предпочтительным вариантом осуществления, нуклеиновой кислотой(ми), кодирующей NADH-оксидазу или NOXE, может быть нуклеиновая кислота(ы), выбранная из группы, включающей Streptococcus pneumoniae, Lactococcus lactis, Enterococcus faecalis, Lactobacillus brevis и их смесь, и, предпочтительно Streptococcus pneumoniae.
В соответствии с другим предпочтительным вариантом осуществления, нуклеиновой кислотой(ми), кодирующей NADH-оксидазу или NOXE, может быть нуклеиновая кислота(ы), выбранная из группы, состоящей из последовательностей, имеющих по меньшей мере 78%, предпочтительно по меньшей мере 80%, идентичность нуклеиновой кислоты с последовательностями нуклеиновых кислот SEQ ID NO: 21, 23, 25 и 27.
Как описано в настоящем документе, последовательность нуклеиновой кислоты, имеющая по меньшей мере 78% нуклеотидную идентичность с последовательностью эталонной нуклеиновой кислоты, включает последовательности нуклеиновых кислот, имеющие по меньшей мере 79%, 80%, 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% и 99% нуклеотидную идентичность с указанной последовательностью эталонной нуклеиновой кислоты.
В соответствии с другим вариантом осуществления, нуклеиновой кислотой(ми), кодирующей NADH-оксидазу может быть нуклеиновая кислота(ы), кодирующая аминокислотную последовательность, выбранную из группы, состоящей из последовательностей, имеющих по меньшей мере 78%, предпочтительно по меньшей мере 80%-ную идентичность с последовательностями SEQ ID NO: 22, 24, 26 и 28.
Как описано в настоящем документе, аминокислотная последовательность, имеющая по меньшей мере 78% аминокислотную идентичность с эталонной аминокислотной последовательностью, включает в себя аминокислотные последовательности, имеющие по меньшей мере 79%, 80%, 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% и 99% аминокислотную идентичность с указанной эталонной аминокислотной последовательностью.
Как указано выше, уровень экспрессии NADH-оксидазы в настоящем изобретении, регулируется по меньшей мере одним промотором, и, по меньшей мере, одним терминатором, такими, как определено более подробно далее в настоящем документе, которые присутствуют соответственно в положениях 5'- и 3'- последовательности нуклеиновой кислоты, кодирующей NADH-оксидазу.
Кроме того, вышеуказанные предпочтительные технические эффекты связаны с уровнем экспрессии указанной NADH-оксидазы. В самом деле, и, как следует из приведенных ниже примеров, не только простое присутствие NADH-оксидазы является важным, но и уровень экспрессии NADH-оксидазы имеет также исключительную важность для получения ацетоина.
Как указано выше, рекомбинантные дрожжи по настоящему изобретению обладают пониженной активностью пируватдекарбоксилазы, и в их геном была вставлена, в частности, одна или больше копий нуклеиновой кислоты, кодирующей NADH-оксидазу или NOXE.
В связи с этим, рекомбинантные дрожжи по настоящему изобретению могут включать, в частности, от 1 до 20 копий нуклеиновой кислоты, кодирующей NADH-оксидазу.
Предпочтительно рекомбинантные дрожжи по настоящему изобретению могут содержать от 1 до 12, в частности, от 2 до 5, предпочтительно от 3 до 4, а еще лучше, 3 копии нуклеиновой кислоты, кодирующей NADH-оксидазу.
В соответствии с конкретным вариантом осуществления, ДНК-конструкция(и) формулы (I) - (III), содержащая, по меньшей мере, ген(ы) NOXE, может быть вставлена в эндогенный ген URA3 указанных рекомбинантный дрожжей.
С учетом вышеизложенного, каждая из нуклеиновых кислот, кодирующих ацетолактатсинтазу, ацетолактатдекарбоксилазу и NADH-оксидазу находится под контролем промотора и терминатора, с тем, чтобы избежать нежелательной регуляции, в частности, такой, как определено далее в настоящем документе.
ПРОМОТОР
По очевидным причинам, каждая из нуклеиновых кислот, кодирующих ацетолактатсинтазу, ацетолактатдекарбоксилазу и NADH-оксидазу, находится под контролем промоторов, идентичных или разных.
Указанные промоторы, идентичные или разные, обеспечивающие конститутивную сверхэкспрессию данного гена, можно найти в литературе (Velculescu и др., (1997) Cell 88, 243-251).
Промоторы, наиболее интересные в настоящем изобретении, могут быть выбраны из группы, включающей:
- pADH1 из гена, кодирующего алкогольдегидрогеназу (ген ADH1 = последовательность SEQ ID NO 32),
- pTDH3 из гена, кодирующего глицеральдегид-3-фосфат-дегидрогеназу (ген TDH3 = последовательность SEQ ID NO 39),
- pTEF2.KI из гена, кодирующего трансляционный фактор элонгации EF-1 альфа (ген TEF2=последовательность SEQ ID NO 30),
- pGPM1 из гена, кодирующего глицератфосфомутазу (ген GPM1 = последовательность SEQ ID NO 33),
- pPDC1 из гена, кодирующего пируватдекарбоксилазу (ген PDC1 = последовательность SEQ ID NO 35),
- pENO2 из гена, кодирующего энолазу II (ген ENO2 = последовательность SEQ ID NO 29),
- pTEF3 из гена, кодирующего гамма-субъединицу трансляционного фактора элонгации eEF1B (ген TEF3 = последовательность SEQ ID NO 31),
- pFBA1 из гена, кодирующего фруктозо-1,6-дифосфат альдолазу II (ген FBA1 = последовательность SEQ ID NO 34),
- pPGK1 из гена, кодирующего 3-фосфоглицераткиназу (ген PGK1 = последовательность SEQ ID NO 36),
- pPYK1 из гена, кодирующего пируват-киназу (ген PYK1=последовательность SEQ ID NO 49),
- pTPI1 из гена, кодирующего триозофосфатизомеразу (ген TPI1 = последовательность SEQ ID NO 50), или
- pTEF1 из гена, кодирующего трансляционный фактор элонгации EF-1 альфа (ген TEF1 = последовательность SEQ ID NO 38).
Кроме того, гомологичные промоторы из других близкородственных дрожжей могут быть также использованы в качестве промоторов дрожжей из рода Saccharomyces, или дрожжей из других родов, таких как Candida, Debaryomyces, Pichia или Kluveromyces.
Также могут быть использованы синтетические промоторы, как описано у Blazeck и Alper (2013) Biotechnol. J. 8 46-58.
Более конкретно, указанные промоторы, идентичные или разные, могут быть, предпочтительно охарактеризованы последовательностью нуклеиновых кислот, выбранных из группы, состоящей из последовательностей, имеющих по меньшей мере 80% идентичность нуклеиновой кислоты с последовательностями нуклеиновых кислот SEQ ID NO: 29-39, 49 и 50.
В соответствии с конкретным вариантом осуществления, каждая из нуклеиновых кислот, кодирующих ацетолактатсинтазу, ацетолактатдекарбоксилазу и NADH-оксидазу, находится под контролем терминаторов транскрипции, идентичных или разных, указанные терминаторы транскрипции характеризуются последовательностью нуклеиновой кислоты, выбранной из группы, состоящей из последовательностей, имеющих по меньшей мере 80% идентичность нуклеиновой кислоты с последовательностями нуклеиновой кислоты SEQ ID NO: 40-48.
ТЕРМИНАТОР
По очевидным причинам, каждая из нуклеиновых кислот, кодирующих ацетолактатсинтазу, ацетолактатдекарбоксилазу и NADH-оксидазу, связана с терминатором транскрипции (который также может быть назван "терминатор" в данном документе), идентичным или разным.
Указанные терминаторы транскрипции, идентичные или разные, можно найти в литературе Yamanishi и др., (2013) ACS synthetic biology 2, 337-347.
Терминаторы, наиболее интересные в настоящем изобретении, могут быть выбраны из группы, включающей:
- tTPI1 из гена, кодирующего триозофосфатизомеразу (ген ТРI1 = последовательность SEQ ID NO 44),
- tMET25 из гена, кодирующего О-ацетил гомосерин-О-ацетил-серин сульфидрилазу (ген МЕТ25 = последовательность SEQ ID NO 45),
- tADH1 из гена, кодирующего алкогольдегидрогеназу (ген ADH1 = последовательность SEQ ID NO 43),
- tENO2 из гена, кодирующего энолазу II (ген ENO2 = последовательность SEQ ID NO 46),
- tTDH2 из гена, кодирующего глицеральдегид-3-фосфат-дегидрогеназу, изофермент 2 (ген TDH2 = последовательность SEQ ID NO 40),
- tPGK1 из гена, кодирующего 3-фосфоглицераткиназу (PGK1 ген = последовательность SEQ ID NO 48),
- tCYC1 (= последовательность SEQ ID NO 41),
- tMET3 (= последовательность SEQ ID NO 47), и
- tTDH3 (= последовательность SEQ ID NO 42), и
- tDIT1 (= последовательность SEQ ID NO 43).
Более конкретно, указанный терминатор, идентичный или разный, может быть предпочтительно охарактеризван последовательностью нуклеиновой кислоты, выбранной из группы, состоящей из последовательностей, имеющих по меньшей мере 80% идентичность с последовательностями SEQ ID NO: 32-40 и 43.
РЕКОМБИНАНТНЫЕ ДРОЖЖИ
Как правило, дрожжи могут быстро расти, и могут быть выращены при более высокой плотности по сравнению с бактериями, и не требуют асептической среды в промышленных условиях. Кроме того, клетки дрожжей могут быть более легко отделены от культуральной среды по сравнению с бактериальными клетками, что значительно упрощает процесс экстракции и очистки продукта.
Предпочтительно дрожжи по изобретению, могут быть выбраны среди родов Saccharomyces, CandidaAshbya, Dekkera, Pichia (Hansenula), Debaryomyces, Clavispora, Lodderomyces, Yarrowia, Zigosaccharomyces, Schizosaccharomyces, Torulaspora, Kluyveromyces, Brettanomycces, Cryptococcus или Malassezia.
Более предпочтительно дрожжи могут быть Крэбтри-положительными дрожжами рода Saccharomyces, Dekkera, Schizosaccharomyces, Kluyveromyces, Torulaspora Zigosaccharomyces, или Brettanomycces.
Более предпочтительно дрожжи могут быть из видов Saccharomyces cerevisiae, Saccharomyces boulardii, Saccharomyces douglasii, Saccharomyces bayanus или Zigosaccharomyces bailii, Schizosaccharomyces pombe, Dekkera brucelensis, Dekkera intermedia, Brettanomycces custersii, Brettanomycces intermedius, Kluyveromyces themotolerens, Torulaspora globosa, Torulaspora glabrata.
Более предпочтительно рекомбинантные дрожжи могут принадлежать к роду Saccharomyces, и предпочтительно к виду Saccharomyces cerevisiae.
Как указано выше, рекомбинантные дрожжи по изобретению обладают активностью пируватдекарбоксилазы, которая снижена путем вставки, по меньшей мере, одной ДНК-конструкции(й), выбранной из группы, включающей формулы (I)-(III), и предпочтительно по меньшей мере, одной из указанных ДНК-конструкций, содержащих только, по меньшей мере, одну нуклеиновую кислоту(ы), кодирующую ALS и или ALD.
В соответствии с предпочтительным вариантом осуществления, рекомбинантными дрожжами могут быть рекомбинантные дрожжи Saccharomyces cerevisiae, и активность пируватдекарбоксилазы снижена в результате разрушения только двух генов pdc. Более предпочтительно разрушенный ген(ы) pdc может быть выбран из группы, состоящей из pdc1, pdc5, pdc6 и их смеси, и предпочтительно из pdc1 и pdc6.
Способы, используемые для вставки специфической ДНК-конструкции в ген, и, более конкретно, ген пируватдекарбоксилазы, относятся к общим знаниям специалиста в данной области техники. Похожий способ описан более подробно далее в настоящем документе, после примеров.
НАИБОЛЕЕ ПРЕДПОЧТИТЕЛЬНЫЕ ВАРИАНТЫ ОСУЩЕСТВЛЕНИЯ
Преимущественно, нуклеиновые кислоты, кодирующие ферменты, используемые в настоящем изобретении, предпочтительно выбирают из ALS.Bs, ALS.Pp, ALD.LI, ALD.Ea, NOXE.spn, NOXE. LI и их смесей.
В соответствии с предпочтительным вариантом осуществления, рекомбинантные дрожжи по настоящему изобретению могут быть охарактеризованы тем, что они принадлежит к роду Saccharomyces, в частности виду Saccharomyces cerevisiae, в которых активность эндогенной пируватдекарбоксилазы снижена путем разрушения, по меньшей мере, двух генов pdc, в частности, путем разрушения генов pdc 1 и pdc 6, где:
- один из генов pdc, предпочтительно ген pdc 1, разрушен путем вставки ДНК-конструкции формулы (IIe), приведенной ниже:

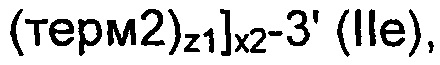
- по меньшей мере, другой ген pdc, отличный от указанного выше разрушенного гена pdc, и, предпочтительно ген pdc 6, разрушен путем вставки ДНК-конструкции формулы (IIf') ниже:

и где ДНК-конструкция следующей формулы (IIf"):

вставлена в ген URA3,
где:
- пром1, пром2, пром3, пром5, терм1, терм2, терм3, терм5, "у1", "у2", "z1" и "z2" являются такими, как определено выше и ALS.Bs, ALS.Pp, ALD.LI, ALD.Ea и NOXE.LI являются такими, как определено далее в Табл. 1,
- каждое из "х1", "х2" и "х3" независимо друг от друга представляет собой целое число в диапазоне от 0 до 50, предпочтительно от 0 до 20, предпочтительно от 0 до 10, более предпочтительно от 0 до 3, и, в частности, равное 1;
- "х3" представляет собой целое число в диапазоне от 0 до 50, предпочтительно от 0 до 20, предпочтительно от 0 до 12, более конкретно от 2 до 5, предпочтительно от 3 до 4, а еще лучше, равное 3,
при условии, что указанные рекомбинантные дрожжи содержат, по меньшей мере, одну нуклеиновую кислоту, кодирующую каждую ALS, ALD и NOXE, и, более конкретно, при условии, что каждая ДНК-конструкция формулы (IIe) and (IIf') включает в себя по меньшей мере одну нуклеиновую кислоту, кодирующую каждую ALS и ALD.
С учетом вышеизложенного, и, несмотря на то, что это неявно раскрыто, это указывает, что между каждой формулой (IIe) и (IIf'):
- "х1" - "х3", "х5","у1", "у2", "z1" и "z2"; и/или
- промотор и/или терминатор для каждой копии нуклеиновой кислоты для рассматриваемого гена, могут быть идентичными или разными.
В соответствии с конкретным предпочтительным вариантом осуществления, рекомбинантные дрожжи по настоящему изобретеню могут быть охарактеризованы тем, что они принадлежат к роду Saccharomyces, в частности виду Saccharomyces cerevisiae, где активность эндогенной пируватдекарбоксилазы снижена путем разрушения, по меньшей мере двух из генов pdc, в частности, путем разрушения генов pdc 1 и pdc 6, где:
- один из генов pdc, предпочтительно ген pdc 1, разрушен путем вставки ДНК-конструкции формулы (IIg), приведенной ниже:
- по меньшей мере, другой ген pdc, отличный от упомянутого выше разрушенного гена pdc, и, предпочтительно ген pdc 6, разрушен путем вставки ДНК-конструкции формулы (IIh') ниже:

и где ДНК-конструкция следующей формулы (IIh"):

вставлена в ген URA3,
где:
- ген "ALS.Bs" ДНК-конструкции формулы (IIg) находится под контролем промотора гена pdc, где указанная ДНК-конструкция формулы (IIg) вставлена,
- pENO2, pADH1, pTDH3, tTDH2, tCYC1, tDPI1, tMET25 и tPGK1 являются такими, как определено в настоящем описании, и, более конкретно, в нижеприведенном списке последовательностей,
- ALS.Bs, ALS.Pp, ALD.LI, ALD.Ea и NOXE. LI являются такими, как определено в Табл. 1 и, более конкретно, в приведенном ниже списке последовательностей.
В соответствии с конкретным вариантом осуществления, рекомбинантные дрожжи по изобретению, могут быть дополнительно модифицированы с целью оптимизации получения ацетоина.
Использование альтернативных источников сахара:
Прямое использование альтернативного источника сахара, такого как крахмал, в дальнейшем требует сверхэкспрессии в дрожжах экзогенной α-амилазы и глюкоамилазы (Buscke и др., Biosource technology, 2013).
Импорт сахара - улучшение импорта С5-сахаров
Импорт пентоз с помощью рекомбинантного микроорганизма является серьезной проблемой для промышленного процесса, поскольку С5-сахара являются основными составляющими гидролизованной лигноцеллюлозной биомассы. Природные штаммы S. cerevisiae, как и многие другие виды дрожжей, не могут использовать ксилозу или арабинозу в качестве ферментативных субстратов (Hahn-Hagerdal и др., 2007; Jin и др., 2004). Интересно, что они способны поглощать ксилозу, даже если сахар не является природным субстратом (Hamacher и др., 2002).
S.cerevisiae, GAL2, НХТ1, НХТ2, НХТ4, НХТ5 и НХТ7 катализируют поглощение ксилозы, потому что они имеют широкую субстратную специфичность (Hamacher и др., 2002; Saloheimo и др., 2007; Sedlak и Но 2004). Тем не менее, их сродство к ксилозе значительно ниже, чем сродство к глюкозе и поглощение ксилозы переносчиками сильно ингибировано глюкозой (Saloheimo и др., 2007).
Необходимы несколько изменений для получения штамма, способного расти и потреблять ксилозу и/или арабинозу. Эти различные модификации являются частью настоящего изобретения.
Сверхэкспрессия гетерологичных переносчиков ксилозы
Для улучшения поглощения ксилозы и арабинозы, рекомбинантный штамм-производитель ацетоина должен быть изменен, чтобы экспрессировать гетерологичные гены, кодирующие переносчики ксилозы или арабинозы. Например, гены GXF1, SUT1 и AT5g59250 из Candida intermedia, Pichia stipitis и Arabidopsis thaliana, соответственно, сверхэкспрессированы для улучшения использования ксилозы дрожжами (Runquist и др., 2010).
Сверхэкспрессия путей, участвующих в метаболизме ксилозы и арабинозы
Штаммы дрожжей способны поглощать ксилозу, даже если сахар не является естественным субстратом. Даже если гены для ассимиляции ксилозы присутствуют в S.cerevisiae, они не экспрессируются на достаточном уровне, чтобы обеспечить существенное усвоение сахара. Таким образом, необходимы генетические модификации для улучшения усвоения пентозных сахаров. Все ферменты, которые обеспечивают превращение ксилозы или арабинозы в ксилитол, должны быть улучшены, также как и ферменты, которые перерабатывают ксилит в ксилулозу, и ксилозу в ксилозу-5-фосфат. Либо, гомологичные гены из метаболических путей ксилозы и арабинозы должны быть сверхэкспрессированы, или гетерологичные гены из бактерий должны быть сверхэкспрессированы.
В одном из вариантов осуществления изобретения, поглощение ксилозы и ее усвоение штаммом улучшают путем сверхэкспрессии, например:
1) генов XYL1 или GRE3, кодирующих альдолаза-редуктазу P. stipitis и S. Cerevisiae, соответственно, связаных со сверхэкспрессией XYL2, кодирующего ксилитолдегидрогеназу из P. stipitis, в сочетании со сверхэкспрессией генов XKS 1 или XYL3, кодирующиих ксилулокиназу из S. cerevisiae и P. stipitis, соответственно,
2) гена xylA, кодирующего ксилозоизомеразу из бактерий или Piromyces, связанного со сверхэкспрессией генов XKS1 или XYL3, кодирующих ксилулокиназу из S.cerevisiae и P. Stipitis, соответственно.
В другом варианте осуществления настоящего изобретения, поглощение арабинозы и ее усвоение штаммом, улучшают путем сверхэкспрессии, например:
1) гомологичных генов XYL1 или GRE3, кодирующих альдолаза-редуктазу P. stipitis и S.cerevisiae, соответственно, связаных с ladl, кодирующим L-арабинитол 4-гидрогеназу и Ixrl, кодирующим L-ксилулозредуктазу из Trichoderma reesei, в комбинации со сверхэкспрессией XYL2, кодирующего ксилитолдегидрогеназу из P. stipitis, а кроме того, сверхэкспрессией генов XKS1 или XYL 3, кодирующих ксилулокиназу из S.cerevisiae и P. stipitis, соответственно,
2) гетерологичных генов araA и araB, кодирующих бактериальную арабинозоизомеразу и рибулозокиназу.
Оптимизация пентозофосфатного пути
Она может быть осуществлена путем сверхэкспресии по меньшей мере одного гена, принадлежащего к неокислительному пентозофосфатному пути; TALI, TKL1, RKL1 и RPE1 из штамма дрожжей.
Оптимизация доступности NAPDH-кофакторов, требуемых ферментами, участвующими в метаболизме С5-сахаров.
Она может быть осуществлена путем экспрессии трансгидрогеназ Е. coli в штамме дрожжей. Гены udhA или pntAB из E.coli будут сверхэкспрессированы в штамме-производителе.
Предотвращение потребления глюкозы для синтеза глицерина:
Это может быть осуществлено путем разрушения гена GPD1, кодирующего глицерол-3-фосфат-дегидрогеназу ЕС 1.1.1.8. (GPDH).
Настоящее изобретение в соответствии с этим вариантом осуществления интересно, особенно, с учетом выхода ацетоина, несмотря на то, что разрушение гена GPD1 приводит к прекращению активности фермента, который потребляет NADH в пользу NAD. Для уравновешивания редокс-дисбаланса, сформированного таким образом, штамм с разрушенным GPD1, может потребовать дополнительной экспрессии NOXE.
В соответствии с конкретным вариантом осуществления, рекомбинантный штамм по настоящему изобретению является таким, что он не включает в себя какой-либо генетической модификации(ий), которая имеет эффект снижения репрессии глюкозы, как это раскрыто в публикации WO 2011/041426 или Kim и др., (Bioresource Technology, т. 146, 2013: 274).
В соответствии с конкретным вариантом осуществления, рекомбинантный штамм по настоящему изобретению является таким, что он не включает в себя какой-либо генетической модификации(ий) для обеспечения экспрессии любых путей ассимиляции ксилозы, как описано у Kim и др., (Journal of Biotechnology, 2014).
УСЛОВИЯ КУЛЬТИВИРОВАНИЯ
Настоящее изобретение также относится к применению рекомбинантных дрожжей, таких, как определено выше, для получения ацетоина и/или его производных, в частности, метилвинилкетона (MVK).
Настоящее изобретение, дополнительно, относится к способу получения ацетоина, включающему следующие стадии:
- предоставление рекомбинантного микроорганизма, описанного выше, культивирование рекомбинантного микроорганизма в культуральной среде, содержащей источник углерода, и
- выделение ацетоина.
Как правило, микроорганизмы по данному изобретению выращивают при температуре в диапазоне от, приблизительно, 20°С до, приблизительно, 37°С, предпочтительно при температуре в диапазоне от 27°С до 34°С, в соответствующей культуральной среде.
Когда рекомбинантные дрожжи по изобретению относятся к виду S.cerevisiae, температура может, предпочтительно составлять от 27°С до 34°С в соответствующей культуральной среде.
Подходящими культуральными средами для дрожжей являются обычные, коммерчески доступные среды, такие как жидкая питательная среда, которая включает основу азотного агара для дрожжей, сульфат аммония и декстрозу в качестве источника энергии/углерода или среда YPD, смесь пептона, дрожжевого экстракта, и декстрозы в оптимальных пропорциях для наибольшего роста дрожжей.
Другие определенные или синтетические культуральные среды также могут быть использованы, и подходящая культуральная среда для роста конкретного микроорганизма будет известна специалисту в области микробиологии или ферментации.
Термин "соответствующая культуральная среда" определен выше.
Примеры известных культуральных сред для рекомбинантных дрожжей по настоящему изобретению, известны специалистам в данной области техники, и представлены в следующей публикации D. Burke и др., Methods in yeast Genetics - A cold spring harbor laboratory course Manual (2000).
Подходящие диапазоны pH для ферментации могут быть от рН 3,0 до рН 7,5, где диапазон от рН 4,5 до рН 6,5 предпочтителен в качестве начального условия.
Ферментации могут быть проведены в аэробных условиях или микроаэробных условиях.
Количество продукта в ферментационной среде, может быть определено с использованием ряда способов, известных в данной области техники, например, высокоэффективной жидкостной хроматографии (ВЭЖХ) или газовой хроматографии (ГХ).
Данный способ может использовать периодический способ ферментации. Классическая периодическая ферментация представляет собой закрытую систему, где состав среды установлен в начале ферментации, и не подлежит искусственным изменениям в процессе ферментации. То есть, в начале ферментации, среду засевают желаемым организмом или организмами, и ферментации позволяют происходить без добавления чего-либо в систему. Тем не менее, как правило, "периодическая" ферментация является периодической в отношении добавления источника углерода, и часто делают попытки контролировать такие факторы, как температура, рН и концентрация кислорода. В системах периодической ферментации, композиции метаболита и биомассы системы постоянно меняются до того момента, когда ферментация остановлена. В периодических культурах клетки проходят через статическую лаг-фазу до логарифмической фазы ускорения роста, и, наконец, до стационарной фазы, где скорость роста снижается или останавливается. При отсутствии вмешательства, клетки в стационарной фазе, в конечном счете, умрут. Клетки в логарифмической фазе, как правило, отвечают за основную часть получения конечного продукта или промежуточного продукта.
Система периодической ферментации с подпитыванием, также может быть использована в настоящем изобретении. Система периодической ферментации с подпитыванием, аналогична системе обычной периодической ферментации, за исключением того, что субстрат источника углерода добавляют поэтапно, по мере прохождения ферментации. Системы периодической ферментации с подпитыванием полезны, когда катаболитная репрессия (например, глюкозный эффект) склонен подавлять метаболизм клеток, и, когда желательно иметь ограниченные количества субстрата в среде. Измерение фактической концентрации субстрата в системах с подпитыванием затруднено и, таким образом, оценивается на основе изменений измеримых факторов, таких как рН, растворенный кислород и парциальное давление отработанных газов, таких как CO2.
Ферментации распространены и хорошо известны в данной области техники, и примеры могут быть найдены у Sunderland и др., (1992), включенного сюда в качестве ссылки. Хотя настоящее изобретение выполняется в периодическом режиме, предполагается, что этот способ адаптируем к непрерывной ферментации.
Непрерывная ферментация представляет собой открытую систему, где определенную ферментационную среду непрерывно добавляют в биореактор, и равное количество кондиционированных сред удаляют одновременно для обработки. Непрерывная ферментация, в целом, поддерживает культуры при постоянной высокой плотности, где клетки изначально находятся логарифмической фазе роста.
Непрерывная ферментация обеспечивает модуляцию одного фактора или любого количества факторов, которые влияют на клеточный рост или концентрацию конечного продукта. Например, один способ будет поддерживать лимитирующее питательное вещество, такое как источник углерода или уровень азота на фиксированном уровне, и позволять варьировать все другие параметры. В других системах, ряд факторов, влияющих на рост, может изменяться непрерывно, в то время как концентрация клеток, измеренная с помощью мутности среды, поддерживается на постоянном уровне. Непрерывные системы стремятся поддерживать условия устойчивого роста и, таким образом, потеря клеток, вследствие отвода среды, должна быть сбалансирована по отношению к скорости роста клеток в процессе ферментации. Способы модуляции питательных веществ и факторов роста для непрерывных процессов ферментации, а также методы для максимизации скорости образования продукта, хорошо известны в области промышленной микробиологии.
Предполагается, что настоящее изобретение может быть реализовано на практике с использованием или периодического, периодического с добавлением субстрата, или непрерывного процесса, и что любой известный способ ферментации будет подходящим. Кроме того, предполагается, что клетки для получения могут быть иммобилизованы на субстрате как на цельноклеточном катализаторе, и подвержены условиям ферментации.
С целью дальнейшего улучшения получения ацетоина, конкретный вариант осуществления изобретения может включать культивирование клеток рекомбинантных дрожжей в соответствующей культуральной среде, такой как указанная выше, где указанная культуральная среда содержит оптимальное количество источника углерода, особенно глюкозы.
Предпочтительно клетки культивируют в такой оптимальной культуральной среде в течение только части полной продолжительности культивирования. В некоторых вариантах осуществления, дрожжевые клетки инкубируют в указанной оптимальной культуральной среде 10 часов или больше после начала культивирования, что включает 11, 12, 13, 14, 15 или 16 часов или более после начала культивирования.
Предпочтительно клетки культивируют в такой оптимальной культуральной среде в течение периода времени от 5 часов до 15 часов, в том числе, от 6 часов до 10 часов, например, 8 часов после начала культивирования.
В предпочтительных вариантах осуществления настоящего изобретения, источник углерода, включенный в указанную оптимальную культуральную среду, состоит из глюкозы. В предпочтительных вариантах осуществления, указанная оптимальная культуральная среда содержит 12% масс./масс. или больше глюкозы, в том числе 15% масс./масс. или больше глюкозы. В предпочтительных вариантах осуществления, указанная оптимальная культуральная среда содержит не более 40% масс./масс глюкозы, в том числе не более 35% масс./масс. глюкозы.
Таким образом, в предпочтительных вариантах осуществления, описанных выше, способ получения ацетоина по настоящему изобретению может дополнительно включать, между стадиями (а) и (с), промежуточную стадию ((b), состоящую из культивирования дрожжевых клеток в указанной оптимальной культуральной среде.
ОЧИСТКА АЦЕТОИНА
В соответствии с конкретным аспектом настоящего изобретения, ферментативное получение ацетоина включает стадию выделения ацетоина из культуральной среды. Выделение ацетоина из культуральной среды является обычной задачей для специалиста в данной области техники. Оно может быть осуществлено с помощью ряда методов, хорошо известных в данной области техники, включая, но, не ограничиваясь ими, перегонку, отдувку газом, первапорацию или жидкостную экстракцию. Специалист в данной области техники знает, как адаптировать параметры каждого метода в зависимости от характеристик материала, который надо отделить.
Дрожжи как модель микроорганизма в настоящем изобретении, были сохранены, поскольку у них, синтезированный ацетоин полностью экспортируется за пределы клетки, таким образом, упрощая процесс очистки.
Синтезированный ацетоин может быть собран с помощью перегонки. Перегонка может включать дополнительный компонент, отличный от культуральной среды, с тем, чтобы облегчить выделение ацетоина путем формирования азеотропной смеси и, в частности с водой. Этот дополнительный компонент представляет собой органический растворитель, такой как циклогексан, пентан, бутанол, бензол, толуол, трихлорэтилен, октан, диэтиловый эфир или их смесь.
Отдувку газом осуществляют с помощью отдувочного газа, выбранного из гелия, аргона, диоксида углерода, водорода, азота, или их смеси.
Жидкостную экстракцию осуществляют с органическим растворителем, в качестве гидрофобной фазы, таким как пентан, гексан, гептан, додекан.
Начиная с ацетоина, который продуцируется клетками рекомбинантных дрожжей, описанных в настоящем описании, производные ацетоина, в том числе метилвинилкетон, могут быть получены с помощью различных методов, которые хорошо известны специалисту в данной области техники.
На протяжении всего описания, включая формулу изобретения, термин "включающий" следует понимать как синоним "включающий, по меньшей мере, один", если не указано иное.
Кроме того, выражение "формулы (I) - (III)", в соответствии с рассматриваемым контекстом и, в отсутствие противоположных указаний, означает ДНК-конструкции формул (I), (II) и (III), а также (IIa), (IIb), (IIc), (IId), (IIe), (IIf'), (IIf"), (IIg), (IIh') и/или (IIh").
Термины "между … и …" и "в диапазоне от … до …" следует понимать, как включая пределы, если не указано иное.
Примеры и фигуры, которые следуют ниже, представлены в качестве иллюстрации и не ограничивают объема изобретения.
ПРИМЕРЫ
а) Протокол получения рекомбинантного штамма Saccharomyces cerevisiae по изобретению
Все использованные далее в этом документе рекомбинантные штаммы Saccharomyces cerevisiae были получены из стандартного штамма W303 (Thomas и Rothstein (1989), Cell. 56, 619-630) с использованием стандартных методов молекулярной генетики дрожжей (Methods in yeast Genetics - A cold spring harbor laboratory course Manual (2000), D. Burke, D. Dawson, T. Stearns CSHL Press).
В этих штаммах, активность пируватдекарбоксилазы снижена путем разрушения, по меньшей мере, одного из генов pdc (pdc1, pdc5, pdc6) или путем замены их когнатного промотора транскрипции слабым промотором.
В наиболее эффективных штаммах, только pdc1 и pdc6 были удалены.
Ряд экзогенных ферментов был экспрессирован в рассматриваемых рекомбинантных штаммах Saccharomyces cerevisiae. Они были выбраны в соответствии с их ферментативными параметрами Михаэлиса-Ментен, при их наличии (см. в настоящем документе после Табл. 1). Высокая kcat (константа скорости ферментативной реакции) для высокой эффективности и разнообразие Km (константа Михаэлиса), чтобы покрыть разные концентрации в субстрате. Ферменты Paenibacillus Polymyxa были выбраны потому, что этот организм является естественным производителем 2,3-бутандиола, продукта непосредственно получаемого из ацетоина. Поэтому он имеет ферменты, которые эффективно катализируют синтез ацетоина.
Номенклатура генов, относящихся к используемым экзогенным ферментам ацетолактатсинтазе, ацетолактатдекарбоксилазе и водо-образующей NADH-оксидазе, показана далее в настоящем документе в Табл. 1.
Эти гены обозначены аббревиатурой фермента с последующей аббревиатурой организма происхождения следующим образом:
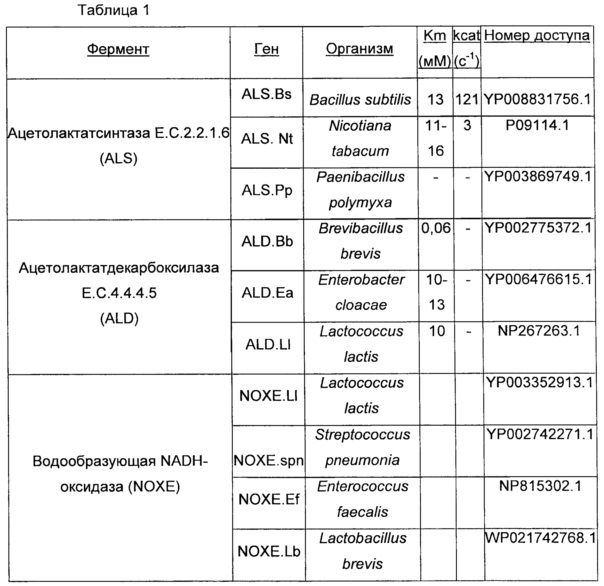
Кроме того, для лучшего понимания следующих генотипов:
- ade2, his3, leu2, trp1 и ura3 являются маркерными генами ауксотрофии.
- строчные буквы означают, что рассматриваемый ген неактивен, заглавные буквы обозначают активный ген.
- "::" следующее за названием гена означает, что ген прерван тем, что следует (если более чем один ген, вставлен, они указаны в квадратных скобках []). Прерывание гена сопровождается полной делецией кодирующей последовательности, но сохраняет промотор. Вследствие этого, ген с последующим "::" является неактивным и обозначается строчными буквами. Если не указано конкретно, транскрипция вставленного гена контролируется промотором разрушенного гена.
- "ген.KI" означает, что ген происходит из Kluyveromyces lactis.
- Промоторы транскрипции, обеспечивающие конститутивную сверхэкспрессию данного гена, найдены в литературе (Velculescu и др., (1997) Cell 88, 243-251). Промоторы, используемые в настоящем документе, обозначены "р", а затем названием их когнатного гена. Их соответствующий порядковый номер также упомянут далее.
- Терминаторы транскрипции также помещены после каждого гена. Чтобы избежать нежелательной регуляции, промоторы и терминаторы, обрамляющие один встроенный ген, не были взяты из одного и того же оригинального гена. Терминаторы, используемые в настоящем документе, обозначены "t" с последующим названием их когнатного гена. Далее упоминается их соответствующий порядковый номер.
Кластеры вышеуказанных генов были интегрированы в рекомбинантные дрожжи одновременно, используя способность дрожжей эффективно рекомбинировать свободные концы ДНК, имеющие гомологию последовательности.
Рекомбинантные дрожжи получали в соответствии с опубликованными способами, доступными специалисту в данной области техники. В частности, они могут повторять способ, описанный у Shao и др., (Nucleic Acids Research, 2009, т. 37, No. 2: е16) и Shao и др., (Methods in Enzymology, 2012 Elsevier Inc., т. 517: 203), в конечном счете, только с незначительными изменениями.
Более конкретно, кодирующие последовательности, предназначенные для клонирования, были искусственно синтезированы. Для получения гетерологичных последовательностей (недрожжевых), нуклеиновые последовательности были модифицированы с целью получения синонимичных кодирующих последовательностей, использующих частоту использования кодонов дрожжей.
С использованием рестрикционных ферментов и классического метода клонирования, каждую синтетическую последовательность клонировали между промотором транскрипции и терминатором транскрипции. Каждой последовательности промотора предшествует 50-200 нуклеотидная последовательность, гомологичная последовательности терминатора гена выше по последовательности. Точно так же, за терминатором каждого гена (гена, содержащего промотор - кодирующую последовательность - терминатор) сразу следуют последовательности, гомологичные гену. Так что каждый из блоков, предназначенных для интеграции, имеет 50-200 нуклеотидное перекрывание с блоком выше по последовательностии блоком ниже по последовательности. Для первого блока, промотору предшествуют 50-200 нуклеотидов, гомологичных нуклеотидам дрожжевой хромосомы из локуса, в который он будет интегрирован. Точно так же, для последнего блока, за терминатором следуют 50-200 нуклеотидов, гомологичных нуклеотидам дрожжевой хромосомы из локуса, в который он будет интегрирован.
Каждый блок затем амплифицируют с помощью ПЦР из плазмидных конструкций, с получением X блоков линейной ДНК, имеющей перекрывающиеся последовательности. Один из генов является ауксотрофным маркером, предназначенным для селекции рекомбинантов. Дрожжи трансформируют все линейные фрагменты одновременно, и рекомбинантные дрожжи выбирают по ауксотрофному фенотипу, связанному с использованным маркером. Целостность последовательности затем проверяют с помощью ПЦР и секвенирования.
b) Что касается ALS и ALD ферментов
Ферменты ALS и ALD были оценены не по отдельности, а в парах (ALS+ALD) через выход ацетоина. Три экзогенных ALD и ALS были выбраны в соответствии с их кинетическими параметрами: ALS.Nt, ALS.Pp, ALS.Bs и ALD.Bb, ALD.LI, ALD.Ea (см. выше).
Восемь из девяти возможных комбинаций ALS и ALD были совместно вставлены в хромосому штамма дрожжей ura3 между промоторами и одним терминатором.
Вставка этих двух генов разрушает ген pdc1. Маркерный ген URA3 одновременно вставляют для селекции трансформантов. ALS/ALD комбинацию вставляли в штамм YA747, а именно, производное W303, имеющее следующий генотип:
YA747: МАТ-а, ade2, bdh1::TRP1.KI, his3, leu2, pdc1::HIS5.Sp, pdc6::LEU2.KI, trp1, ura3.
Были сконструированы следующие штаммы:
YA768. МАТ-а, ade2, bdh1::TRP1.KI, his3, leu2, pdc1:: [-ALS.Bs-tTPI1, pTDH3-ALD.Ea-tMET25, URA3.KI], pdc6::LEU2.KI, trp1, ura3
NB: в этом случае ген "ALS.Bs" находится под контролем природного промотора pdc1, а именно промотора pPDC1.
YA769: MAT-a, ade2, bdh1::TRP1.KI, his3, leu2, pdc1:: [-ALS.Nt-tTPI1, pTDH3-ALD.Ea-tMET25, URA3.KI], pdc6::LEU2.KI, trp1, ura3
YA770: MAT-a, ade2, bdh1::TRP1.KI, his3, leu2, pdc1::[-ALS.Pp-tTPI1, pTDH3-ALD.Ea-tMET25, URA3.KI], pdc6::LEU2.KI, trp1, ura3
YA771: MAT-a, ade2, bdh1::TRP1.KI, his3, leu2, pdc1::[-ALS.Nt-tTPI1, pTDH3-ALD.Bb-tMET25, URA3.KI], pdc6::LEU2.KI, trp1, ura3
YA772: MAT-a, ade2, bdh1::TRP1.KI, his3, leu2, pdc1::[-ALS.Nt-tTPI1, pTDH3-ALD.LI-tMET25, URA3.KI], pdc6::LEU2.KI, trp1, ura3
YA773: MAT-a, ade2, bdh1::TRP1.KI, his3, leu2, pdc1::[-ALS.Pp-tTPI1, pTDH3-ALD.LI-tMET25, URA3.KI], pdc6::LEU2.KI, trp1, ura3
YA810: MAT-a, ade2, bdh1::TRP1.KI, his3, leu2, pdc1::[-ALS.Bs-tTPI1, pTDH3-ALD.Bb-tMET25, URA3.KI], pdc6::LEU2.KI, trp1, ura3
YA811: MAT-a, ade2, bdh1::TRP1.KI, his3, leu2, pdc1::[-ALS.Pp-tTPI1, pTDH3-ALD.Bb-tMET25, URA3.KI], pdc6::LEU2.KI, trp1, ura3
Все эти штаммы выращивали в течение 24 ч в среде YPA с 8% глюкозы (дрожжевой экстракт 1%, Бактопептон 2%, аденин 0,1 мМ, глюкоза 8%). Они были собраны и содержание ацетоина и этанола определяли в соответствии со стандартными способами, с особенностями адаптированными из Gonzales и др., (2010), Applied and environmental Microbiology 76 670-679.
Для некоторых штаммов, анализировали несколько клонов, последнее число после "-" это номер клона. Следует отметить, что, так как эндогенный фермент bdh разрушен, 2,3-BDO не продуцируется.
Получение этанола и ацетоина отслеживают в соответствии со стандартными способами и Gonzales и др., (2010), Applied and environmental Microbiology 76 670-679.
Результаты
В Табл. 2 далее в настоящем документе показано получение ацетоина из вышеуказанных протестированных штаммов.

Из этих результатов можно сделать вывод о том, что, взятые по отдельности, лучшие ферменты для повышения получения ацетоина, представляют собой ALS Рр, ALS Nt, ALD Еа и ALD Bb, который, на самом деле, кажется наиболее эффективным ферментом.
с) Преимущественное техническое действие фермента NOXE на выход ацетоина
Рекомбинантные дрожжи, соответствующие YA1609 были получены.
YA1609: МАТ-а, his3, leu2, pdc1::[-ALS.Bs-tTDH2- pENO2-ALD.LI- tCYC1, HIS5.Sp], pdc6::[pADH1-ALS.Pp-tDPI1, pTDH3-ALD.Ea-tMET25, LEU2.KI], trp1, ura3::[pENO2-NOXE.LI-tPGK1, URA3]×12
YA1609-1, YA1609-2 и YA1609-4 представляют собой различные клоны из этого штамма YA1609.
Замечено, что эти рекомбинантные дрожжи всегда имеют природную эндогенную активность ВНН.
Эти штаммы затем анализировали на предмет получения ацетоина в среде YPA с 16% глюкозой (дрожжевой экстракт 1%, Бактопептон 2%, аденин 0,1 мМ, глюкоза 8%) при тех же условиях, которые описаны выше.
Получение этанола и ацетоина отслеживали в соответствии со стандартными способами и Gonzales и др., (2010), Applied and environmental Microbiology 76 670-679.
Результаты
Результаты представлены в Табл. 3 ниже.
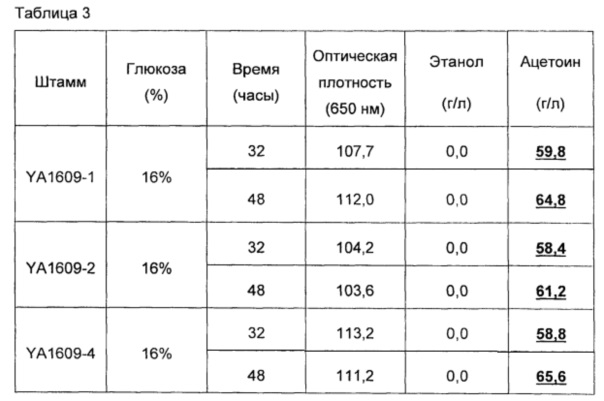
Эти результаты показывают, что присутствие NOXE приводит к очень существенному накоплению ацетоина.
YA1609-4 в настоящее время используют в той же культуральной среде, которая указана выше. Однако, настоящий анализ отличается следующими параметрами:
Среда: 0,5 л YPA, 16% глюкозы.
16 часов после начала культивирования клеток, клетки инкубировали в культуральной среде, содержащей конечную концентрацию 16% масс/масс, глюкозы в течение периода времени 8 часов.
Перемешивание: 800 оборотов в минуту (2 лопасти), 1,9 мс-1
Температура: 30°С
Воздух: 0,15 л/мин (0,3 об/об/мин)
Затем клетки анализировали на получение ацетоина. Получение этанола и ацетоина отслеживали в соответствии со стандартными способами и Gonzales и др., (2010), Applied and environmental Microbiology 76 670-679.
Результаты
Результаты представлены в Табл. 4 ниже.
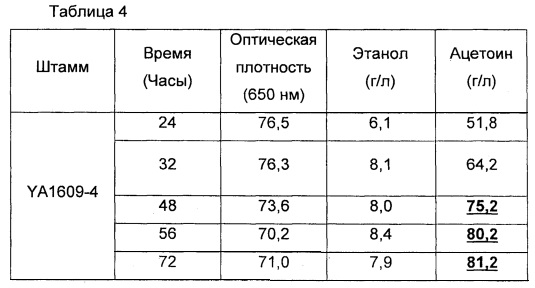
Эти результаты показывают, что рассматриваемые параметры культуры, могут также влиять на получение ацетоина.
d) Другие примеры рекомбинантных дрожжей, производящих ацетоин
Были получены другие рекомбинантные дрожжи, которые описаны ниже.
YA1573-4: МАТ-а, his3, leu2, pdc1::[-ALS.Bs-tTDH2, pENO2-ALD.LI-tCYC1, HIS5.Sp], pdc6::[pADH1-ALS.Pp-tDPI1, pTDH3-ALD.Ea-tMET25, pTEF2-TRP1.Sc-tADH1, pGMP1-BDH.Sc-tENO2], trp1, ura3::[pENO2-NOXE.LI-tPGK1, URA3]×12
YA1609-4: MAT-a, his3, leu2, pdc1::[-ALS.Bs-tTDH2, pENO2-ALD.LI-tCYC1, HIS5.Sp], pdc6::[pADH1-ALS.Pp-tTPI1, pTDH3-ALD.Ea-tMET25, LEU2.KI], trp1, ura3::[pENO2-NOXE.LI-tPGK1, URA3]×12
YA1661-2: MAT-a, his3, leu2, pdc1::[-ALS.Bs-tTDH2, pENO2-ALD.LI-tCYC1, HIS5.Sp], pdc6::[pADH1-ALS.Pp-tTPI1, pTDH3-ALD.Ea-tMET25, pENO2-NOXE.Spn-tPGK1], trp1, ura3::[pENO2-NOXE.LI-tPGK1, URA3]×12.
Отмечено, что эти рекомбинантные дрожжи всегда имеют естественную эндогенную активность ВНН.
Эти штаммы затем анализировали на получение ацетоина в среде YPA с 16% глюкозы (дрожжевой экстракт 1%, Бактопептон 2%, аденин 0,1 мМ, глюкоза 8%) при тех же условиях, которые описаны выше.
Получение этанола и ацетоина отслеживали в соответствии со стандартными способами и Gonzales и др. (2010), Applied and environmental Microbiology 76 670-679.
Результаты
Результаты представлены в Таблице 5 ниже.

Эти результаты Табл. 5 показывают, что присутствие множества нуклеиновых кислот, кодирующих NOXE в рекомбинантных дрожжах, приводит к увеличению накопления ацетоина, по сравнению с рекомбинантными дрожжами, трансформированными одной нуклеиновой кислотой, кодирующей NOXE.
e) Предотвращение превращения ацетоина в 2,3-BDO
По меньшей мере, один ген(ы) из следующих эндогенных генов bdh1, bdh2, adh1, adh3 и/или adh4 может быть инактивирован. В некоторых штаммах маркеры ауксотрофии были вновь введены, чтобы сделать их прототрофами. Все они имеют одинаковые промоторы и терминаторы, как YA1660:
YA1660-2. YA1660-3, YA1660-4, and YA1711-16C: МАТ-а, his3, leu2, pdc1::[-ALS.Bs-tTDH2, pENO2-ALD.LI-tCYC1, HIS5.Sp], pdc6::[pADH1-ALS.Pp-tTPI1, pTDH3-ALD.Ea-tMET25, pENO2-NOXE.Spn-tPGK1, LEU2.KI], trp1, ura3::[pENO2-NOXE.LI-tPGK1, URA3]×12.
YA1711-45C: Mat-α, his3, leu2, pdc1::[-ALS.Bs-tTDH2, pENO2-ALD.LI-tCYC1, HIS5.Sp], pdc6::[pADH1-ALS.Pp-tTPI1, pTDH3-ALD.Ea-tMET25, pENO2-NOXE.Spn-tPGK1, LEU2.KI], trp1, ura3::[pENO2-NOXE.LI-tPGK1, URA3]×12
YA1711-13A. YA1711-16B: Mat-a, bdh1::LEU2.KI, bdh2::HIS5.Sp, his3, leu2, pdc1::[ALS.Bs-ALD.LI-HIS5.Sp], pdc6::[ALS.Pp-ALD.Ea-NOXE.Spn-LEU2.KI], trp1, ura3::[NOXE.LI-URA3]×12
YA1711-19A and YA1711-46A: Mat-α, bdh1::LEU2.KI, bdh2::HIS5.Sp, his3, leu2, pdc1::[ALS.Bs-ALD.LI-HIS5.Sp], pdc6::[ALS.Pp-ALD.Ea-NOXE.Spn-LEU2.KI], trp1, ura3::[NOXE.LI-URA3]×12
YA1822-1 and YA1822-2: Mat-α, bdh1::LEU2.KI, bdh2::HIS5.Sp, his3, leu2, pdc1::[ALS.Bs-ALD.LI-HIS5.Sp], pdc6::[ALS.Pp-ALD.Ea-NOXE.Spn-LEU2.KI], trp1::TRP1, ura3::[NOXE.LI-URA3]×12
YA 1870-10A: Mat-a, adh3::TRP1.KI, bdh1::LEU2.KI, bdh2::HIS5.Sp, his3, leu2, pdc1::[ALS.Bs-ALD.LI-HIS5.Sp], pdc6::[ALS.Pp-ALD.Ea-NOXE.Spn-LEU2.KI], trp1, ura3::[NOXE.LI-URA3]×12
YA 1870-11B: Mat-α, adh3::TRP1.KI, bdh1::LEU2.KI, bdh2::HIS5.Sp, his3, leu2, pdc1::[ALS.Bs-ALD.LI-HIS5.Sp], pdc6::[ALS.Pp-ALD.Ea-NOXE.Spn-LEU2.KI], trp1, ura3::[NOXE.LI-URA3]×12
YA1870-10B: Mat-α, adh1::TRP1.KI, bdh1::LEU2.KI, bdh2::HIS5.Sp, his3, leu2, pdc1::[ALS.Bs-ALD.LI-HIS5.Sp], pdc6::[ALS.Pp-ALD.Ea-NOXE.Spn-LEU2.KI], trp1, ura3::[NOXE.LI-URA3]×12
YA1870-11A: Mat-α, adh1::TRP1.KI, bdh1::LEU2.KI, bdh2::HIS5.Sp, his3, leu2, pdc1::[ALS.Bs-ALD.LI-HIS5.Sp], pdc6::[ALS.Pp-ALD.Ea-NOXE.Spn-LEU2.KI], trp1, ura3::[NOXE.LI-URA3]×12
YA1870-2A and YA1870-3D: Mat-a, adh1::TRP1.KI, adh3::TRP1.KI, bdh1::LEU2.KI, bdh2::HIS5.Sp, his3, leu2, pdc1::[ALS.Bs-ALD.LI-HIS5.Sp-loxP], pdc6::[ALS.Pp-ALD.Ea-NOXE.Spn-LEU2.KI-loxP], trp1, ura3::[NOXE.LI-URA3]×12
Все описанные выше штаммы, а также YA1609-4 и YA1661-2 и двойную комбинацию этих штаммов, следует рассматривать в качестве штаммов, обладающих улучшенным выходом ацетоина.
f) Дальнейшие примеры, показывающие предотвращение превращения ацетоина в 2,3-BDO
Штамм YA1711-19A был выращен в ферментере 3l в дрожжевом экстракте 2%, сахарозе, 10%, от 0 до 24 часов, а затем 600 г глюкозы медленно добавляли (30 г/л в течение 20 часов)

Следующие штаммы, все из которых являются штаммами, в которые были введены экзогенные ALS, ALD и NOXE, инкубировали в 500 мл колбах Эрленмейера и встряхивали в течение 24 ч и 48 ч при 30°С в дрожжевом экстракте 2% и сахарозе 30%:
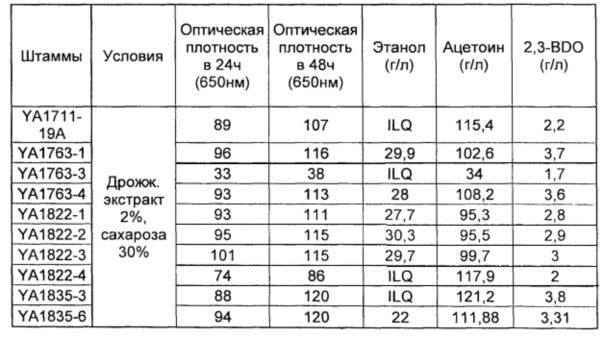
СПИСОК ПОСЛЕДОВАТЕЛЬНОСТЕЙ
SEQ ID NO 1 (=ADN ALS.Bs)

SEQ ID NO 2 (=Аминокислота ALS.Bs)

SEQ ID NO 3 (=ADN ALS.Nt)


SEQ ID NO 4 (=Аминокислота ALS.Nt)

SEQ ID NO 5 (=ADN ALS.Pp)


SEQ ID NO 6 (=Аминокислота ALS.Pp)


SEQ ID NO 7 (=ADN ALD.Bb)

SEQ ID NO 8 (=Аминокислота ALD.Bb)

SEQ ID NO 9 (=ADN ALD.Ea)


SEQ ID NO 10 (=Аминокислота ALD.Ea)

SEQ ID NO 11 (=ADN ALD.LI)

SEQ ID NO 12 (=Аминокислота ALD.LI)

SEQ ID NO 13 (=ADN NOXE.LI)

SEQ ID NO 14 (=Аминокислота NOXE.LI)

SEQ ID NO 15 (=ADN NOXE.spn)


SEQ ID NO 16 (=Аминокислота NOXE.spn)

SEQ ID NO 17 (=ADN NOXE.Ef)


SEQ ID NO 18 (=Аминокислота NOXE.Ef)

SEQ ID NO 19 (=ADN NOXE.Lb)


SEQ ID NO 20 (=Аминокислота NOXE.Lb)

SEQ ID NO 21 (=pENO2)

SEQ ID NO 22 (=pTEF2.KI)


SEQ ID NO 23 (=pTEF3)

SEQ ID NO 24 (=pADH1)

SEQ ID NO 25 (=pGPM1)


SEQ ID NO 26 (=pFBA1)

SEQ ID NO 27 (=pPDC1)


SEQ ID NO 28 (=pPGK1)

SEQ ID NO 29 (=pRPLA1)

SEQ ID NO 30 (=pTEF1)

SEQ ID NO 31 (=pTDH3)

SEQ ID NO 32 (=tTHD2)

SEQ ID NO 33 (=tCYC1)

SEQ ID NO 34 (=tTDH3)

SEQ ID NO 35 (=tADH1)

SEQ ID NO 36 (=tTPI1)

SEQ ID NO 37 (=tMET25)

SEQ ID NO 38 (=tENO2)

SEQ ID NO 39 (=tMET3)

SEQ ID NO40 (=tPGK1)

SEQ ID NO 41 (=pPYK1)


SEQ ID NO 42 (=pTPI1)

SEQ ID NO 43 (=tDIT1)

SEQ ID NO 44 (=loxP)

SEQ ID NO 45 (=нуклеиновая кислота НАА-1)


SEQ ID NO 46 (=аминокислота HAA-1)

SEQ ID NO 47 (=нуклеиновые кислоты LEU2.KI)


SEQ ID NO 48 (=аминокислота LEU2.KI)

SEQ ID NO 49 (=нуклеиновая кислота His 5)

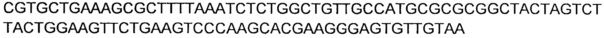
SEQ ID NO 50 (=аминокислота His 5)

SEQ ID NO 51 (=нуклеиновая кислота Trp1 kI)

SEQ ID NO 52 (=аминокислота Trp1 KI)

Реферат
Настоящее изобретение относится к рекомбинантным дрожжам, имеющим пониженную активность пируватдекарбоксилазы, в геном которых вставлена:- одна или более нуклеиновых кислот, кодирующих ацетолактатсинтазу или ALS,- одна или более нуклеиновых кислот, кодирующих ацетолактатдекарбоксилазу или ALD, и- одна или более копий нуклеиновых кислот, кодирующих NADH-оксидазу или NOXE.

Комментарии