Стабилизация дегидрогеназ стабильными коферментами - RU2499834C2
Код документа: RU2499834C2
Чертежи




























Описание
Группа изобретений относится к способу стабилизации фермента посредством хранения фермента в присутствии стабильного кофермента. Настоящее изобретение дополнительно относится к ферменту, стабилизированному стабильным коферментом, и к его применению в тестовых элементах для обнаружения анализируемых веществ.
Системы биохимического измерения являются важными составными частями клинически значимых методов анализа. Приоритетом в данной области является измерение анализируемых веществ, например метаболитов или субстратов, которые определяют непосредственно или опосредованно с помощью фермента. Анализируемые вещества в этом случае преобразуют с помощью фермент-коферментного комплекса и затем количественно оценивают. Это влечет за собой то, что анализируемое вещество, подлежащее определению, контактирует со стабильным ферментом и коферментом, причем фермент обычно используют в каталитических количествах. Кофермент изменяют, например окисляют или восстанавливают посредством ферментативной реакции. Этот процесс может быть обнаружен напрямую, или электрохимически, или фотометрически через медиатор. Калибровка обеспечивает прямую взаимосвязь между измерением и концентрацией анализируемого вещества, подлежащего определению.
Коферменты представляют собой органические молекулы, которые ковалентно или нековалентно связаны с ферментом и которые изменяются посредством преобразования анализируемого вещества. Видными примерами коферментов являются никотинамидадениндинуклеотид (NAD) и никотинамидадениндинуклеотидфосфат (NADP) соответственно из которых NADH и NADPH, соответственно, продуцируются посредством восстановления.
Системы для измерения, известные из предшествующего уровня техники, примечательны тем, что являются стабильными в течение ограниченного периода и при соблюдении определенных требований к окружающей среде, таких как охлаждение или хранение в сухом состоянии, для достижения этой стабильности. Для конкретных областей применения, например тестов, проводимых самим конечным пользователем, таких как, например, при самостоятельном мониторинге глюкозы в крови, следовательно, возможно получение неточных результатов вследствие некорректного, незамеченного неправильного хранения. Расходование осушителей вследствие того, что первоначальные упаковки являются открытыми слишком долго, в частности, может привести к ошибочным измерениям, которые при использовании некоторых систем с трудом могут быть идентифицированы пользователем.
Одной из известных мер, используемых для увеличения стабильности систем биохимического измерения, является применение стабильных ферментов, например применение ферментов, выделенных из термофильных организмов. Дополнительной возможностью является стабилизация ферментов путем химической модификации, например сшивки, или путем мутагенеза. Кроме того, могут быть также добавлены стабилизаторы ферментов, такие как, например, трегалоза, поливинилпирролидон и сывороточный альбумин, или ферменты могут быть защищены, например, посредством фотополимеризации в полимерных каркасах.
Были также сделаны попытки улучшения стабильности систем биохимического измерения за счет применения стабильных медиаторов. Таким образом, специфичность тестов возрастает и мешающее воздействие во время реакции устраняется в результате применения медиаторов с окислительно-восстановительным потенциалом, который является настолько низким, насколько возможно. Однако окислительно-восстановительные потенциалы фермент-коферментных комплексов создают более низкий предел для окислительно-восстановительного потенциала медиаторов. Ниже значений этих потенциалов реакция с медиаторами замедляется или даже останавливается.
Альтернативной возможностью является также применение систем биохимического измерения без медиаторов, в которых, например, происходит прямое обнаружение коферментов, например кофермента NADH. Одним из недостатков таких систем измерения является, однако, то, что такие коферменты, как NAD и NADP, являются нестабильными.
NAD и NADP являются основно-лабильными молекулами, пути деградации которых описаны в литературе (N.J. Oppenheimer in The Pyridine Nucleotide Coenzymes, Academic Press New York, London 1982, editors J. Everese, B. Anderson, K. You, Chapter 3, pages 56-65). Деградация NAD и NADP, соответственно, по существу приводит к АДФ(ADP)-рибозе в результате расщепления гликозильных связей между рибозой и пиридиновым остатком. Восстановленные формы NAD и NADP, с другой стороны, являются кислото-лабильными: например, эпимеризация представляет собой один из известных путей деградации. В обоих случаях нестабильность NAD/NADP и NADH/NADPH проистекает от лабильности гликозильной связи между единицей рибозы и остатком пиридина. Однако даже в условиях, которые не являются критическими, таких как, например, в водном растворе, коферменты NAD и NADP, соответственно, гидролизуются исключительно под воздействием окружающей влаги. Эта нестабильность может привести к неточностям при измерении анализируемых веществ.
Описан ряд производных NAD/NADP, например, в публикациях B.M. Anderson in The Pyridine Nucleotide Coenzymes, Academic Press New York, London 1982, editors J. Everese, B. Anderson, K. You, Chapter 4. Большинство этих производных, однако, не очень хорошо воспринимаются ферментами. Единственным производным, которое до настоящего времени поэтому использовали для диагностических тестов, является 3-ацетилпиридинадениндинуклеотид (ацетил NAD), который впервые был описан в 1956 г. (N.O. Kaplan, J. Biol. Chem. (1956), 221, 823). Также этот кофермент показывает слабые восприимчивость ферментами и изменение окислительно-восстановительного потенциала.
В WO 01/94370 описывается применение дополнительных производных NAD с модифицированной пиридиновой группой. Модификации никотинамидной группы оказывают, однако, как правило, прямое влияние на каталитическую реакцию. В большинстве случаев это влияние является негативным.
В другой идее стабилизации структурную единицу рибозы изменяли, чтобы, таким образом, влиять на стабильность гликозильной связи. Данная методика не оказывает непосредственного воздействия на каталитическую реакцию никотинамидной группы. Тем не менее, может иметь место косвенное воздействие, по мере того как фермент проявляет сильное и специфическое связывание с единицей рибозы. Kaufmann et al. раскрывают в этой связи в WO 98/33936, патенте США 5801006 и в WO 01/49247, соответственно, ряд производных тиорибозы-NAD. Связь между модификацией структурной единицы никотинамид-рибозы и активностью производных в ферментативных реакциях, однако, до настоящего времени еще не показана.
КарбаNAD, производное без гликозильной связи, было впервые описано в 1988 г. (J.T. Slama, Biochemstry 1989, 27, 183 и Biochemstry 1989, 28, 7688). Рибоза в нем заменена на структурную единицу карбоциклического сахара. Несмотря на то, что карбаNAD был описан как субстрат дегидрогеназ, его активность не была до настоящего времени продемонстрирована клинически в способах биохимического обнаружения.
Сходный подход был описан позже у G.M. Blackburn, Chem. Comm., 1996, 2765, с целью получения карбаNAD с метиленбисфосфонатным соединением вместо природного пирофосфата. Метиленбисфосфонат показывает увеличенную стабильность по отношению к фосфатазам и был использован в качестве ингибитора АДФ-рибозилциклазы. Увеличение гидролитической стабильности не являлось целью. (J.T. Slama, G.M. Blackburn).
В WO 2007/012494 и патенте США 11/460366 раскрываются стабильные производные NAD/NADH и NADP/NADPH, соответственно, ферментные комплексы этих производных и их применение в способах биохимического обнаружения и наборы реагентов.
Цель, на которой было основано настоящее изобретение, состояла в разработке способов стабилизации ферментов, особенно способов долговременной стабилизации ферментов.
Эта цель достигается способом стабилизации фермента, где фермент хранят в присутствии стабильного кофермента. Было неожиданно обнаружено, что долговременная стабилизация в течение нескольких недель или месяцев при высокой относительной влажности или даже в жидкой фазе и при повышенных температурах является возможной с помощью стабильного кофермента. Восприятие этого факта является удивительным, поскольку известно, что хотя ферменты обладают повышенной кратковременной стабильностью в течение нескольких часов в присутствии нативного кофермента (Bertoldi et al., Biochem J. 389, (2005), 885-898; van den Heuvel et al., (J. Biol. Chem. 280 (2005), 32115-32121; и Pan et al., (J. Chin. Biochem. Soc. Vol. 3 (1974), pp. 1-8), они показывают более низкую стабильность в течение более длительного периода (Nutrition Reviews 36 (1978), 251-254).
При сравнении восприятия этого факта по отношению к предшествующему уровню техники было удивительно, что фермент имеет отчетливо повышенную долговременную стабильность в присутствии стабильного кофермента, чем имеет фермент в присутствии нативного кофермента, особенно потому, что стабильные коферменты имеет более низкую константу связывания с ферментом, чем имеет нативный кофермент.
Фермент, стабилизированный способом по изобретению, представляет собой кофермент-зависимый фермент. Примерами подходящих ферментов являются дегидрогеназы, выбранные из глюкозодегидрогеназы (Е.С.1.1.1.47), лактатдегидрогеназы (Е.С.1.1.1.27, 1.1.1.28), малатдегидрогеназы (Е.С.1.1.1.37), глицериндегидрогеназы (Е.С.1.1.1.6), алкогольдегидрогеназы (Е.С.1.1.1.1), альфа-гидроксибутиратдегидрогеназы, сорбитдегидрогеназы или дегидрогеназы аминокислоты, например, дегидрогеназы L-аминокислоты (Е.С.1.4.1.5). Дополнительные подходящие ферменты представляют собой оксидазы, такие как, например, глюкозооксидаза (Е.С.1.1.3.4) или холестериноксидаза (Е.С.1.1.3.6), и аминотрансферазы, соответственно, такие как, например, аспартат- или аланинаминотрансфераза, 5'-нуклеотидаза или креатинкиназа. Фермент предпочтительно представляет собой глюкозодегидрогеназу.
Оказалось, что особенно предпочтительным в контексте способа по изобретению является использование глюкозодегидрогеназы, подвергнутой мутации. Термин “мутант”, как используется в контексте настоящей заявки, относится к генетически модифицированному варианту нативного фермента, который, в то время как число аминокислот является таким же, имеет аминокислотную последовательность, которая модифицирована по сравнению с ферментом дикого типа, т.е. отличается по меньшей мере на одну аминокислоту от фермента дикого типа. Введение мутации (мутаций) может происходить сайт-специфически или не-сайт-специфически, предпочтительно сайт-специфически, за счет использования рекомбинантных способов, известных в данной области, в то время как в соответствии с конкретными требованиями и условиями, в результате, по меньшей мере одна аминокислота обменивается в пределах аминокислотной последовательности нативного фермента. Мутант особенно предпочтительно обладает повышенной термической или гидролитической стабильностью по сравнению с ферментом дикого типа.
Подвергнутая мутации глюкозодегидрогеназа может в принципе содержать аминокислоту (аминокислоты), которая(ые) модифицирована(ы) по сравнению с соответствующей глюкозодегидрогеназой дикого типа по любому положению в ее аминокислотной последовательности. Подвергнутая мутации глюкозодегидрогеназа предпочтительно включает мутацию по меньшей мере по одному из положений 96, 170 и 252 аминокислотной последовательности глюкозодегидрогеназы дикого типа, с особенным предпочтением для мутантов с мутациями по положению 96 и положению 170 и мутациями по положению 170 и положению 252. Оказалось преимущественным, если подвергнутая мутации глюкозодегидрогеназа не содержит никаких дополнительных мутаций, кроме этих мутаций.
Мутации по положениям 96, 170 и 252 могут в принципе включать любой аминокислотный обмен, который приводит к стабилизации, например увеличению термической или гидролитической стабильности фермента дикого типа. Мутация по положению 96 предпочтительно включает аминокислотный обмен глутаминовой кислоты на глицин, в то время как в отношении положения 170 аминокислотный обмен глутаминовой кислоты на аргинин или лизин, в частности аминокислотный обмен глутаминовой кислоты на лизин является предпочтительным. В отношении мутации по положению 252 это предпочтительно включает аминокислотный обмен лизина на лейцин.
Подвергнутая мутации глюкозодегидрогеназа может быть получена посредством мутации глюкозодегидрогеназы дикого типа, полученной из любого биологического источника, где термин “биологический источник” включает в контексте данного изобретения как прокариоты, такие как, например, бактерии, так и эукариоты, такие как, например, млекопитающие и другие животные. Глюкозодегидрогеназу дикого типа предпочтительно получают из бактерий, с особым предпочтением для глюкозодегидрогеназы из Bacillus megaterium, Bacillus subtilis или Bacillus thuringiensis, особенно из Bacillus subtilis.
В особенно предпочтительном варианте осуществления настоящего изобретения подвергнутая мутации глюкозодегидрогеназа представляет собой глюкозодегидрогеназу, полученную посредством мутации глюкозодегидрогеназы дикого типа из Bacillus subtilis, которая имеет аминокислотную последовательность, представленную в SEQ ID NO:1 (GlucDH_E96G_E170K), или последовательность, представленную в SEQ ID NO:2 (GlucDH_E170K_K252L).
Стабильный кофермент представляет собой кофермент, который был химически модифицирован по сравнению с нативным коферментом и который имеет более высокую стабильность, чем нативный кофермент (например, гидролитическую стабильность). Стабильный кофермент предпочтительно является стабильным к гидролизу в условиях тестирования. По сравнению с нативным коферментом стабильный кофермент может иметь пониженную константу связывания с ферментом, например, константу связывания, сниженную в 2 раза или более.
Предпочтительными примерами стабильных коферментов являются стабильные производные никотинамидадениндинуклеотида (NAD/NADH), или никотинамидадениндинуклеотидфосфата (NADP/NADPH), или усеченные производные NAD, например, без AMP (АМФ) фрагмента или с ненуклеозидными остатками, например гидрофобными остатками. Также предпочтительным в качестве стабильного кофермента в контексте настоящего изобретения является соединение формулы (I)

Предпочтительные стабильные производные NAD/NADH и NADP/NADPH описаны в вышеупомянутых ссылках, раскрытие которых, таким образом, определенно включено путем ссылки. Особенно предпочтительные стабилизированные коферменты описаны в WO 2007/012494 или заявке США 11/460366, соответственно, раскрытие которых, таким образом, определенно включено путем ссылки. Стабильный кофермент особенно предпочтительно выбирают из соединений, имеющих общую формулу (II)

где A=аденин или его аналог,
T=в каждом случае независимо O, S,
U=в каждом случае независимо OH, SH, BH3-, BCNH2-,
V=в каждом случае независимо OH или фосфатная группа или две группы, образующие циклическую фосфатную группу;
W=COOR, CON(R)2, COR, CSN(R)2, где R=в каждом случае независимо Н или С1-С2-алкил,
Х2, Х2=в каждом случае независимо О, СН2, СНСН3, С(СН3)2, NH, NCH3,
Y=NH, S, O, CH2,
Z=линейный или циклический органический радикал, при условии, что Z и пиридиновый остаток не связаны посредством гликозидной связи, или его соль, или, где целесообразно, его восстановленная форма.
Z в соединениях формулы (II) предпочтительно представляет собой линейный радикал, имеющий 4-6 атомов C, предпочтительно 4 атома C, в котором 1 или 2 атома C необязательно замещены одним или несколькими гетероатомами, выбранными из O, S и N, или радикал, включающий циклическую группу, которая имеет 5 или 6 атомов C и которая необязательно содержит гетероатом, выбранный из O, S и N, и необязательно один или несколько заместителей, и радикал CR42, где CR42 связан с циклической группой и с Х2, где R4=в каждом случае независимо H, F, Cl, CH3.
Z особенно предпочтительно представляет собой насыщенное или ненасыщенное карбоциклическое или гетероциклическое 5-членное кольцо, в частности соединение общей формулы (III)

в которой одинарная или двойная связь может присутствовать между R5' и R5”, где
R4=в каждом случае независимо H, F, Cl, CH3,
R5=CR42,
где R5'=O, S, NH, NC1-C2-алкил, CR42, СНОН, СНОСН3, и
R5”=CR42, СНОН, СНОСН3, если существует одинарная связь между R5' и R5” и
где R5'=R5”=CR4, если существует двойная связь между R5' и R5”и
R6, R6'=в каждом случае независимо СН или ССН3.
В предпочтительном варианте осуществления соединения по изобретению включают аденин или аналоги аденина, такие как, например, С8- и N6-замещенный аденин, деазаварианты, такие как 7-деаза, азаварианты, такие как 8-аза, или комбинации, такие как 7-деаза или 8-аза, или карбоциклические аналоги, такие как формицин, в то время как 7-деазаварианты могут быть замещены в положении 7 галогеном, С1-С6-алкинилом, -алкенилом или -алкилом.
В дополнительном предпочтительном варианте осуществления соединения включают аналоги аденозина, которые, вместо рибозы, содержат, например, 2-метоксидезоксирибозу, 2'-фтордезоксирибозу, гекситол, алтритол и полициклические аналоги, соответственно, такие как бицикло-, LNA- и трицикло-сахара.
Возможно, в частности, в соединениях формулы (II), чтобы атомы кислорода (ди)фосфата были изотронно замещены так, как, например, O- на S- и BH3-, соответственно, O на NH, NCH3 и CH2, соответственно, и =O на =S.
W в соединениях формулы (II) по изобретению предпочтительно представляет собой CONH2 или COCH3.
R5 в группах формулы (III) предпочтительно представляет собой CH2. Дополнительно предпочтительным для R5' является то, что его выбирают из CH2, СНОН и NH. В особенно предпочтительном варианте осуществления R5' и R5” каждый представляет собой СНОН. В еще одном предпочтительном варианте осуществления R5' представляет собой NH и R5” представляет собой СН2. Конкретные примеры предпочтительных стабилизированных коферментов представлены на фигуре 1А и В.
В наиболее предпочтительном варианте осуществления стабильный кофермент представляет собой карбаNAD.
Способ по изобретению является особенно подходящим для долговременной стабилизации ферментов. Это означает, что фермент, стабилизированный стабильным коферментом, показывает при хранении, например, в виде сухого вещества, например, в течение периода по меньшей мере 2 недель, предпочтительно по меньшей мере 4 недель и особенно предпочтительно по меньшей мере 8 недель, снижение активности фермента предпочтительно менее чем 50%, особенно предпочтительно менее чем 30% и наиболее предпочтительно менее чем 20% по отношению к первоначальной активности фермента.
Способ по изобретению дополнительно включает хранение фермента, стабилизированного стабильным коферментом при повышенных температурах, например при температуре по меньшей мере 20°C, предпочтительно по меньшей мере 25°C и особенно предпочтительно по меньшей мере 30°C. Активность фермента в этом случае снижается предпочтительно менее чем на 50%, особенно предпочтительно менее чем на 30% и наиболее предпочтительно менее чем на 20% по отношению к ее первоначальному уровню.
Посредством стабилизации в соответствии с изобретением возможно хранить фермент, стабилизированный стабильным коферментом, даже без осушающего реагента в течение длительного времени, как указано выше, и/или при высоких температурах, как указано выше. Дополнительной возможностью является хранение стабилизированного фермента при высокой относительной влажности, например относительной влажности, составляющей по меньшей мере 50%, в случае которой активность фермента снижается предпочтительно менее чем на 50%, особенно предпочтительно менее чем на 30% и наиболее предпочтительно менее чем на 20% по отношению к ее первоначальному уровню.
Хранение фермента, стабилизированного стабильным коферментом, можно осуществлять, с одной стороны, в виде сухого вещества и, с другой стороны, в жидкой фазе. Хранение стабилизированного фермента предпочтительно осуществляют на или в тестовом элементе, подходящем для определения анализируемого вещества. Фермент, стабилизированный стабильным коферментом, в данном случае представляет собой составной элемент детекторного реагента, который может, где это необходимо, также содержать дополнительные составные элементы, такие как, например, соли, буферы и т.д. Детекторный реагент в данном случае не содержит медиатора.
Фермент, стабилизированный стабильным коферментом, может быть использован для обнаружения анализируемых веществ, например параметров жидкостей организма, таких как, например, кровь, сыворотка, плазма или моча, и в образцах сточных вод или пищевых продуктов, соответственно.
Анализируемые вещества, которые могут быть определены, представляют собой любые биологические или химические вещества, которые могут быть обнаружены посредством окислительно-восстановительной реакции, например, вещества, которые являются субстратами коферментзависимого фермента или сами по себе являются коферментзависимыми ферментами. Предпочтительные примеры анализируемых веществ представляют собой глюкозу, молочную кислоту, яблочную кислоту, глицерин, алкоголь, холестерин, триглицериды, аскорбиновую кислоту, цистеин, глутатион, пептиды, мочевину, аммоний, салицилат, пируват, 5'-нуклеотидазу, креатинкиназу (CK), лактатдегидрогеназу (LDH), диоксид углерода и т.д. Анализируемым веществом предпочтительно является глюкоза.
Другой вариант осуществления настоящего изобретения относится к применению соединения по изобретению или фермента, стабилизированного стабильным коферментом, в соответствии с изобретением для обнаружения анализируемого вещества в образце посредством ферментативной реакции. В этой связи обнаружение глюкозы с помощью глюкозодегидрогеназы (GlucDH) является особенно предпочтительным.
Изменение стабильного кофермента в результате реакции с анализируемым веществом может в принципе быть обнаружено любым способом. Возможно в принципе использовать здесь все способы, известные из предшествующего уровня техники, для обнаружения ферментативных реакций. Однако изменение в коферменте предпочтительно обнаруживают оптическими методами. Оптические методы обнаружения включают, например, измерение поглощения, флуоресценции, кругового дихроизма (CD), дисперсии оптического вращения (ORD), рефрактометрию и т.д.
Оптическим методом обнаружения, который предпочтительно используется в контексте настоящей заявки, является фотометрия. Фотометрическое измерение изменения в коферменте в результате реакции с анализируемым веществом требует, однако, дополнительного присутствия по меньшей мере одного медиатора, который увеличивает реакционную способность восстановленного кофермента и делает возможным перенос электронов к подходящему оптическому индикатору или оптической индикаторной системе.
Медиаторы, подходящие для целей настоящего изобретения, представляют собой, среди прочих, нитрозоанилины, такие как, например, гидрохлорид [(4-нитрозофенил)имино]диметанола, хиноны, такие как, например, фенантренхиноны, фенантролинхиноны или бензо[h]хинолинхиноны, феназины, такие как, например, трифторметансульфонат 1-(3-карбоксипропокси)-5-этилфеназиния, и/или диафоразу (ЕС 1.6.99.2). Предпочтительные примеры фенантролинхинонов включают 1,10-фенантролин-5,6-хиноны, 1,7-фенантролин-5,6-хиноны, 4,7-фенантролин-5,6-хиноны и их N-алкилированные и N,N'-диалкилированные соли, с предпочтением в качестве противоионов в случае N-алкилированных и N,N'-диалкилированных солей, соответственно, для галогенидов, трифторметансульфоната или других анионов, которые увеличивают растворимость.
В качестве оптического индикатора или оптической индикаторной системы возможно использовать любое вещество, которое является восстанавливаемым и при восстановлении испытывает обнаруживаемое изменение в своих оптических свойствах, таких как, например, цвет, флуоресценция, отражательная способность, светопропускание, поляризация и/или показатель преломления. Определение присутствия и/или количества анализируемого вещества в образце можно осуществлять невооруженным взглядом и/или с помощью детекторного устройства, используя фотометрический метод, который специалисту в данной области представляется подходящим.
Гетерополикислоты и, в частности, 2,18-фосфорномолибденовая кислота предпочтительно используются в качестве оптических индикаторов и восстанавливаются до соответствующего синего гетерополисоединения.
Изменение в коферменте особенно предпочтительно обнаруживают путем измерения флуоресценции. Измерение флуоресценции является высокочувствительным и делает возможным обнаружение даже низких концентраций анализируемого вещества в миниатюризированных системах.
Альтернативной возможностью является также обнаружение изменения в коферменте электрохимическим методом с использованием подходящего тестового элемента, такого как, например, полоски для электрохимического теста. Предварительное кондиционирование для этого представляет собой, в очередной раз, применение подходящих медиаторов, которые могут быть преобразованы с помощью восстановленного кофермента, путем переноса электронов, в восстановленную форму. Анализируемое вещество определяют путем измерения тока, который необходим для повторного окисления восстановленного медиатора и который коррелирует с концентрацией анализируемого вещества в образце. Примеры медиаторов, которые могут быть использованы для электрохимических измерений, включают, в частности, вышеупомянутые медиаторы, используемые для фотометрических измерений.
Для обнаружения анализируемого вещества возможно использовать тест в жидкости, в случае которого реагент находится, например, в виде раствора, или суспензии в водной или неводной жидкости, или в виде порошка или лиофилизата. Однако также возможно использовать сухой тест, в случае которого реагент наносится на подложку, тестовую полоску. Подложка может включать, например, тестовую полоску, включающую абсорбент и/или способный набухать материал, который увлажняется жидкостью образца, подлежащего исследованию.
Особенно предпочтительный формат теста включает использование фермента глюкозодегидрогеназы вместе со стабильным производным NAD для обнаружения глюкозы, и в этом случае образуется производное восстановленного кофермента NADH. NADH обнаруживают с использованием оптических методов, например, путем фотометрического или флуорометрического обнаружения после УФ-возбуждения. Особенно предпочтительная тестовая система описана в заявке США 2005/0214891, на которую в данном описании сделана прямая ссылка.
Настоящее изобретение дополнительно относится также к ферменту, стабилизированному стабильным коферментом, где стабилизированный фермент показывает при хранении предпочтительно в течение по меньшей мере 2 недель, особенно предпочтительно по меньшей мере 4 недель и наиболее предпочтительно по меньшей мере 8 недель, при температуре предпочтительно по меньшей мере 20°C, особенно предпочтительно по меньшей мере 25°C и наиболее предпочтительно по меньшей мере 30°C, где необходимо, при высокой влажности и без осушающего реагента, снижение активности фермента менее чем на 50%, предпочтительно менее чем на 30% и наиболее предпочтительно менее чем на 20% по сравнению с первоначальным уровнем.
Изобретение дополнительно относится также к детекторному реагенту для обнаружения анализируемого вещества, который содержит фермент, стабилизированный стабильным коферментом, как указано выше. Изобретение дополнительно относится к тестовому элементу, который содержит фермент, стабилизированный в соответствии с изобретением, и детекторный реагент, соответственно, согласно изобретению. Детекторный реагент и тестовый элемент, соответственно, могут быть пригодными для проведения сухого или жидкого тестов. Тестовый элемент предпочтительно представляет собой тестовую полоску для флуорометрического или фотометрического обнаружения анализируемого вещества. Такая тестовая полоска содержит фермент, стабилизированный стабильным коферментом и иммобилизованный на абсорбенте и/или на способном к набуханию материале, таком как, например, целлюлоза, пластики и т.д.
Изобретение будет пояснено более подробно с помощью следующих фигур и примеров:
Описание Фигур
Фигура 1А: изображение стабильного кофермента карба-NAD (cNAD).
Фигура 1В: изображение стабильного кофермента пирролидинил-NAD.
Фигура 2: изображение результатов кинетики фермента глюкозодегидрогеназы в присутствии NAD и в присутствии cNAD, соответственно, до и после хранения.
2А: кинетика GlucDH в присутствии NAD через 1 день.
2В: кинетика GlucDH в присутствии cNAD через 1 день.
2С: кинетика GlucDH в присутствии NAD после хранения при 32°C и относительной влажности 85% в течение 5 недель.
2D: кинетика GlucDH в присутствии cNAD после хранения при 32°C и относительной влажности 85% в течение 5 недель.
Фигура 3: сравнение значений холостого опыта для глюкозодегидрогеназы в присутствии NAD и для GlucDH в присутствии cNAD, соответственно, в течение периода вплоть до 5 недель при 32°C и 85% влажности.
Фигура 4: изображение различных графиков функциональной зависимости глюкозодегидрогеназы после хранения глюкозодегидрогеназы в присутствии NAD при 32°C и 85% влажности. Время хранения изменялось в интервале между 1 днем и 5 неделями.
Фигура 5: изображение различных графиков функциональной зависимости глюкозодегидрогеназы после хранения глюкозодегидрогеназы в присутствии cNAD при 32°C и 85% влажности. Время хранения изменялось в интервале между 1 днем и 5 неделями (фигура 5А) и между 1 днем и 24 неделями (фигура 5В), соответственно.
Фигура 6: отображение остаточного содержания NAD и cNAD после хранения глюкозодегидрогеназы в присутствии NAD и cNAD, соответственно, при 32°C и 85% влажности в течение 24 недель.
Фигура 7: отображение активности GlucDH после хранения глюкозодегидрогеназы в присутствии NAD и cNAD, соответственно, при 32°C и 85% влажности в течение 5 недель (фигура 7А) и 24 недель (фигура 7В), соответственно.
Фигура 8: отображение активности GlucDH после хранения глюкозодегидрогеназы (GlucDH-wt), двойного мутанта GlucDH_E96G_E170K(GlucDH-Mut1) и двойного мутанта GlucDH_E170K_K252L (GlucDH-Mut2) в присутствии NAD и cNAD, соответственно, при 32°C и 83% относительной влажности в течение периода 25 недель.
Фигура 9: анализ глюкозодегидрогеназы методом гель-электрофореза после хранения в присутствии NAD и cNAD, соответственно. Условия теста: ММ, маркеры 10-220 кДа; 1: GlucDH/NAD, 5 недель при 6°C; 2: GlucDH/NAD, 5 недель при 32°C/85% относительной влажности; 3: GlucDH/cNAD, 5 недель при 6°C; 4: GlucDH/cNAD, 5 недель при 32°C/85% относительной влажности.
Фигура 10: анализ глюкозодегидрогеназы методом гель-электрофореза после хранения при 50°C в присутствии NAD и cNAD, соответственно. Условия теста: ММ, маркеры 10-220 кДа; 1: GlucDH 8,5 мг/мл, NAD, 0 часов; 2: GlucDH 8,5 мг/мл, NAD, 22 часа; 3: GlucDH 8,5 мг/мл, NAD, 96 часов; 4: GlucDH 8,5 мг/мл, NAD, 118 часов; 5: GlucDH 8,5 мг/мл, NAD, 140 часов; 6: GlucDH 8,5 мг/мл, NAD, 188 часов; 7: GlucDH 8,5 мг/мл, NAD, 476 часов; 8: GlucDH 8,5 мг/мл, cNAD, 0 часов; 9: GlucDH 8,5 мг/мл, cNAD, 188 часов; 10: GlucDH 8,5 мг/мл, cNAD, 476 часов.
Фигура 11: отображение стабильности глюкозодегидрогеназы в присутствии NAD и cNAD, соответственно, в жидкой фазе при 50°C в течение периода 4 дней (фигура 11А) и 14 дней (фигура 11В), соответственно. Условия теста: GlucDH 10 мг/мл, NAD и cNAD, соответственно, 12 мг/мл; буфер: 0,1 М Трис, 1,2 М NaCl, рН 8,5; температура 50°C.
Фигура 12: анализ алкогольдегидрогеназы из дрожжей методом гель-электрофореза после хранения в присутствии NAD и cNAD, соответственно. Условия теста: ММ, маркеры 10-220 кДа; 1: ADH, 65 часов при 6°C; 2: ADH/cNAD, 65 часов при 6°C; 3: ADH/NAD, 65 часов при 6°C; 4: ADH, 65 часов при 35°C; 5: ADH/cNAD, 65 часов при 35°C; ADH/NAD, 65 часов при 35°C.
Фигура 13: анализ алкогольдегидрогеназы из дрожжей методом гель-электрофореза после хранения при 35°C в присутствии NAD и cNAD, соответственно. Условия теста: ММ, маркеры 10-220 кДа; 1: ADH/NAD, 0 дней; 2: ADH/NAD, 1 день; 3: ADH/NAD, 2 дня; 4: ADH/NAD, 3 дня; 5: ADH/NAD, 5 дней; 6: ADH/cNAD, 0 дней; 7: ADH/cNAD, 1 день; 8: ADH/cNAD, 2 дня; 9: ADH/cNAD, 3 дня; 10: 6: ADH/cNAD, 6 дней.
Фигура 14: отображение стабильности алкогольдегидрогеназы из дрожжей в присутствии NAD и cNAD, соответственно, в жидкой фазе при 35°C в течение периода 65 часов. Условия теста: ADH 5 мг/мл; NAD и cNAD, соответственно, 50 мг/мл; буфер: 75 мМ Na4P2O7, глицин, рН 9,0; температура 35°C.
Фигура 15: изображение различных графиков функциональной зависимости глюкозодегидрогеназы после хранения в присутствии NAD и различных медиаторов при комнатной температуре в течение 11 недель.
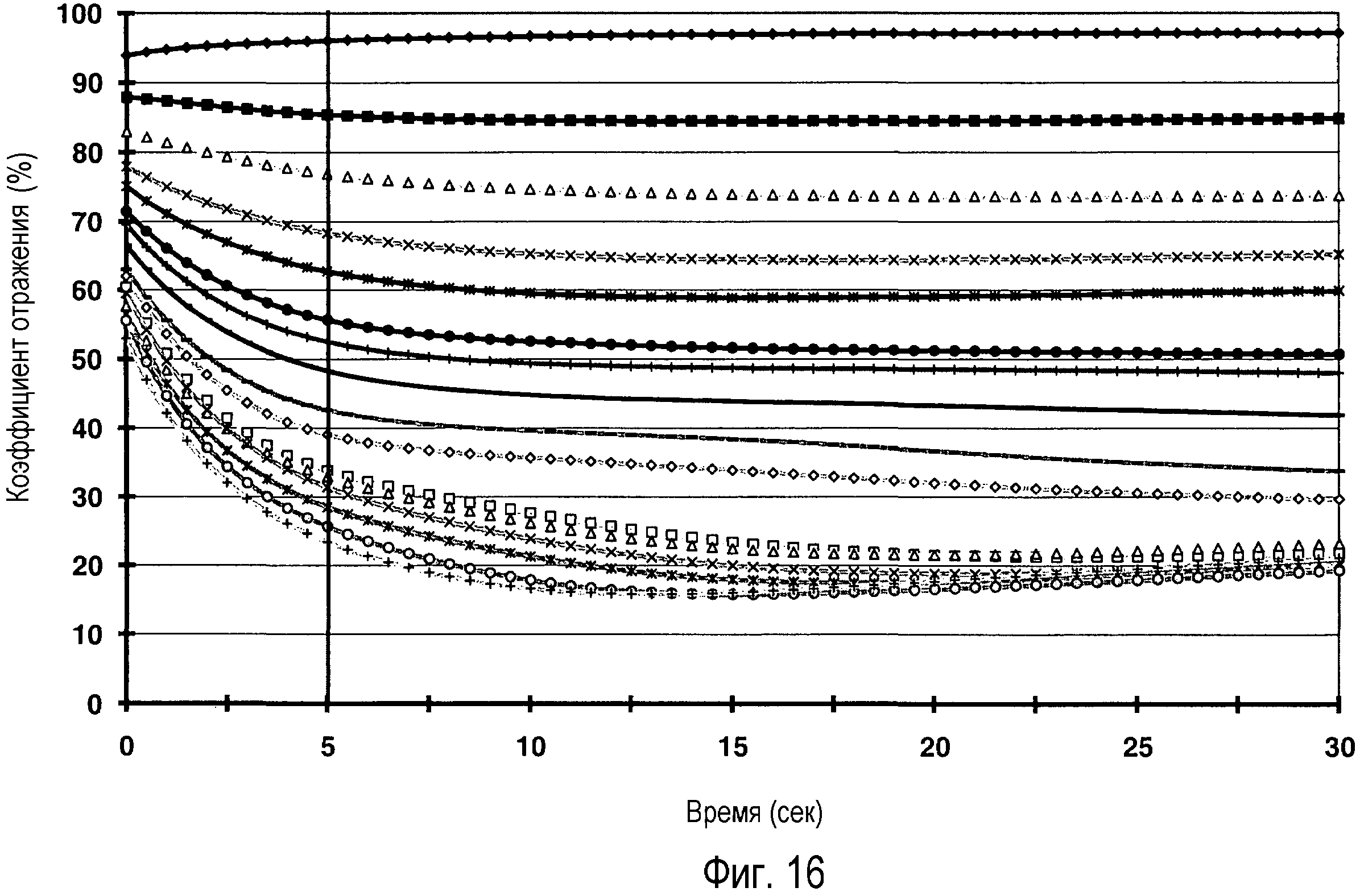
Фигура 16: отображение результатов ферментативной кинетики глюкозодегидрогеназы в присутствии NAD и трифторметансульфоната 1-(3-карбоксипропокси)-5-этилфеназиния при различных концентрациях глюкозы.
Фигура 17: диаграммное изображение обнаружения глюкозы с GlucDH в качестве фермента и диафоразы в качестве медиатора.
Фигура 18: изображение графиков функциональной зависимости глюкоза-краситель-оксидоредуктазы (GlucDOR) в присутствии пирролохинолинхинона (PQQ) и гидрохлорида [(4-нитрозофенил)имино]диметанола в качестве медиатора, и глюкозодегидрогеназы в присутствии NAD и диафоразы/гидрохлорида[(4-нитрозофенил)имино]диметанола в качестве медиатора, соответственно.
Фигура 19: отображение результатов ферментативной кинетики глюкозодегидрогеназы в присутствии NAD и диафоразы при различных концентрациях глюкозы.
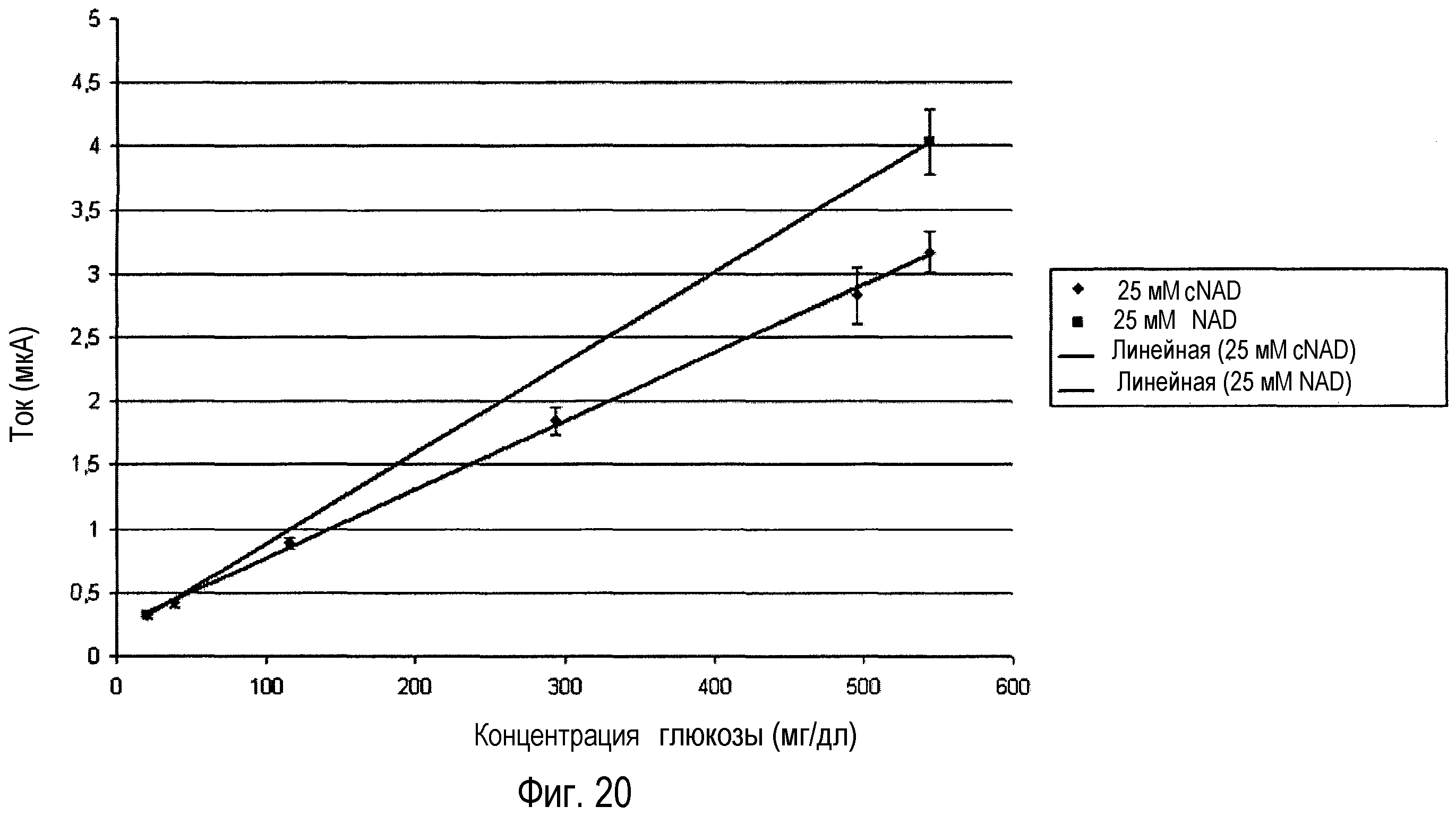
Фигура 20: отображение тока, измеренного как функция концентрации глюкозы при электрохимическом определении глюкозы, с использованием глюкозодегидрогеназы в присутствии NAD и cNAD, соответственно. Условия теста: 25 мМ NAD и cNAD, соответственно; 2,5 секунды задержки; время измерения 5 секунд.
Фигура 21: изображение аминокислотных последовательностей двойных мутантов глюкозодегидрогеназы GlucDH_E96G_E170K и GlucDH_E170K_K252L
Пример 1
Карба-NAD (фиг.1А) или NAD добавляли к глюкозо-специфическому GlucDH. Эти композиции в каждом случае наносили на пленку Pokalon (Lonza) и, после высушивания, хранили в теплых и влажных условиях (32°C, 85% относительной влажности). Кинетику реакции и функциональную зависимость последовательно определяли с регулярными интервалами. Параллельно для каждого значения времени измерения проводили анализ cNAD/NAD и определение остаточной активности фермента.
Графики зависимости кинетики для NAD (фигура 2А) и cNAD (фигура 2В), определенные в первый день, являются сравнимыми и также показывают сходное возрастание в зависимости от глюкозы. Однако четкое различие в графиках кинетики становится очевидным через 5 недель. В то время как кинетика для NAD (фигура 2С) значительно возрастает по своей динамике, кинетика фермента, стабилизированного cNAD, остается практически неизменной (фигура 2D).
Существует также четкое отличие по значениям холостого опыта (сухой холостой опыт перед нанесением образца крови), что очевидно из фигуры 3. Повышение значения в сухом холостом опыте для NAD может быть отнесено к образованию флуоресцентных частиц (Oppenheimer (1982), выше). Удивительно, что этого не происходит с cNAD.
Различающаяся стабильность глюкозодегидрогеназы в присутствии NAD и cNAD, соответственно, также является очевидной из сравнения фигур 4 и 5. Через 5 недель график функциональной зависимости для фермента, стабилизированного cNAD, все еще находится в связке с предыдущими измерениями (фигура 5А), в то время как график для фермента, обработанного NAD (фигура 4), показывает падение при более высоких концентрациях, что является типичным признаком того, что количества фермента/кофермента являются слишком низкими. На фигуре 5В показаны различные графики функциональной зависимости для глюкозодегидрогеназы, стабилизированной cNAD, в течение периода 24 недель. В этой связи ясно, что функция фермента лишь немного изменилась при высоких концентрациях глюкозы в течение всего периода и приблизительно соответствует через 24 недели значению, полученному через 5 недель.
Связь между структурой кофермента и его стабильностью в течение предварительно определенного периода времени является очевидной из фигуры 6. В соответствии с ней остаточное содержание cNAD в реагенте для обнаружения глюкозы после хранения (при 32°C и 85% относительной влажности) в течение 24 недель все еще составляло приблизительно 80% от начального уровня, в то время как содержание NAD в реагенте для обнаружения глюкозы, стабилизированном NAD, снижается только через 5 недель до приблизительно 35% от начального уровня и, при экстраполяции, снижается до нуля приблизительно через 17 недель.
Результат определения остаточной активности активного фермента GlucDH через 5 недель при 32°C и 85% относительной влажности (фигура 7А) является совершенно удивительным. Фермент, стабилизированный NAD, теперь показывает только крайне низкую ферментативную активность (0,5%), в то время как фермент, стабилизированный cNAD, все еще имеет остаточную активность 70% (в каждом случае при сравнении с образцами, хранимыми в холодильнике с осушителем). Через 24 недели при 32°C и 85% относительной влажности (фигура 7В) остаточная активность фермента при стабилизации cNAD все еще составляет приблизительно 25%.
Если вместо фермента дикого типа (из Bacillus subtilis) используют мутант, возможно даже дополнительно увеличить остаточную активность GlucDH. После хранения при 32°C и 85% относительной влажности в присутствии cNAD в течение 24 недель остаточная активность мутанта GlucDH_E96G_E170K с аминокислотными заменами глутаминовая кислота→глицин в положении 96 и глутаминовая кислота→лизин в положении 170 (GlucDH-Mut1) фермента дикого типа составляет приблизительно 70%, в то время как остаточная активность мутанта GlucDH_E170K_K252L с аминокислотными заменами глутаминовая кислота→лизин в положении 170 и лизин→лейцин в положении 252 (GlucDH-Mut2) составляет приблизительно 50% (фигура 8).
Анализ глюкозодегидрогеназы методом гель-электрофореза в SDS-геле (фигуры 9 и 10) также ясно показывает различие между хранением в присутствии NAD и cNAD, соответственно. В то время как фермент все еще может быть идентифицирован в виде полосы с ожидаемой подвижностью, после хранения в течение 5 недель при 32°C и 85% относительной влажности в присутствии cNAD, фермент, хранимый в присутствии NAD, полностью исчезает (фигура 9). В то же самое время из фигуры 10 очевидно, что полоса фермента, стабилизированного NAD и хранимого при 50°C, становится слабее, по мере того как увеличивается время хранения, и фактически исчезает через 476 часов, в то время как соответствующая полоса фермента, хранимого в присутствии cNAD, показывает только небольшое изменение по сравнению с полосой, обнаруженной в начале эксперимента.
Этот результат может также быть подтвержден при хранении в жидкой фазе (фигуры 11А и 11В). Через 95 часов при 50°C остаточная активность глюкозодегидрогеназы в присутствии нативного кофермента NAD составляет примерно 5%, в то время как остаточная активность GlucDH в присутствии искусственного кофермента cNAD составляет 75% (фигура 11А). После хранения при 50°C в течение 336 часов остаточная активность фермента, стабилизированного NAD, теперь составляла только приблизительно 1%; наблюдаемая остаточная активность фермента, хранимого в присутствии cNAD, все еще составляла приблизительно 70%. Соответствующие SDS-гели подобным образом показывают изменение в полосе GlucDH в присутствии нативного кофермента NAD: новые полосы появляются при более высоких молекулярных массах, и имеет место сдвиг в полосе 30 кДА.
В целом, крайне удивительным результатом является то, что стабилизация кофактора одновременно вызывает стабилизацию фермента, и не только вследствие совместного эффекта лучшей когезии фермента. Разложение кофактора NAD оказывает отрицательное действие на стабильность фермента GlucDH и, в действительности, ускоряет его инактивацию. Замена нативного NAD на искусственные аналоги позволяет обеспечить хранение GlucDH в стрессовых условиях (например, повышенной температуре) даже в присутствии кофактора.
С помощью такой системы возможно производить тестовые полоски для определения глюкозы в крови со значительно улучшенными свойствами стабильности, для которых возможной является индикация без осушителя.
Пример 2
cNAD или NAD добавляли к раствору для обнаружения алкоголя. Эти смеси хранили при 35°C. Стабильность фермента затем проверяли при регулярных интервалах и определяли остаточную активность фермента.
В очередной раз анализ методом гель-электрофореза в SDS-геле (фигуры 12 и 13) показывает различие между хранением в присутствии NAD и cNAD. Таким образом, полосы алкогольдегидрогеназы, стабилизированной cNAD, отличаются лишь незначительно после хранения при 6°C и 35°C, соответственно, в течение 65 часов, указывая на стабилизацию фермента искусственным коферментом. Напротив, полоса фермента, хранимого в присутствии NAD при 35°C, полностью исчезает (фигура 12).
Далее, из фигуры 13 ясно, что полоса фермента, стабилизированного NAD и хранимого при 35°C, становится слабее по мере увеличения времени хранения и почти полностью исчезает через 5 дней. Полоса фермента, стабилизированного cNAD, обнаруженная после хранения при 35°C в течение 6 дней, показывает отчетливо меньшее разложение фермента и, таким образом, повышенную стабильность.
Этот результат может быть подтвержден также при хранении в жидкой фазе (фигура 14). Через 65 часов при 35°C остаточная активность алкогольдегидрогеназы в присутствии нативного кофермента NAD составляет приблизительно 6%, в то время как остаточная активность фермента в присутствии искусственного кофермента cNAD все еще составляет приблизительно 60%.
Пример 3
Для определения глюкозы различные тест-системы, которые включали в каждом случае глюкозодегидрогеназу, NAD, медиатор и, где необходимо, оптический индикатор, измеряли фотометрически и электрохимически.
Для фотометрических измерений первоначально четыре тестовых элемента, которые в каждом случае хранились при комнатной температуре в течение 11 недель и содержали 2,18-фосфорномолибденовую кислоту, помимо глюкозодегидрогеназы, NAD и медиатора, исследовали с различными концентрациями глюкозы.
Как очевидно из фигуры 15, падение коэффициента отражения наблюдали при увеличении концентрации глюкозы для всех четырех используемых медиаторов, т.е. гидрохлорида [(4-нитрозофенил)имино]диметанола (Med А), трифторметансульфоната 1-метил-5,6-диокси-5,6-дигидро-1,10-фенантролиния (Med В), трифторметансульфоната 7-метил-5,6-диоксо-5,6-дигидро-1,7-фенантролиния (Med F) и трифторметансульфоната 1-(3-карбоксипропокси)-5-этилфеназиния (Med G), и, таким образом, вышеупомянутые медиаторы являются в принципе подходящими для определения глюкозы методом фотометрии.
При высоких концентрациях глюкозы в области 800 мг/дл коэффициент отражения измеряемого образца, при использовании гидрохлорида [(4-нитрозофенил)имино]диметанола и трифторметансульфоната 1-(3-карбоксипропокси)-5-этилфеназиния, соответственно, все еще составляет приблизительно 20%, что позволяет предположить, что эти два медиатора являются особенно подходящими для фотометрических измерений с использованием системы глюкозодегидрогеназа/NAD и, таким образом, также системы глюкозодегидрогеназа/cNAD. Кинетика конверсии глюкозы с использованием системы глюкозодегидрогеназы, NAD, трифторметансульфоната 1-(3-карбоксипропокси)-5-этилфеназиния и 2,18-фосфорномолибденовой кислоты при концентрациях глюкозы в диапазоне от 0 до 800 мг/дл изображены на фигуре 16.
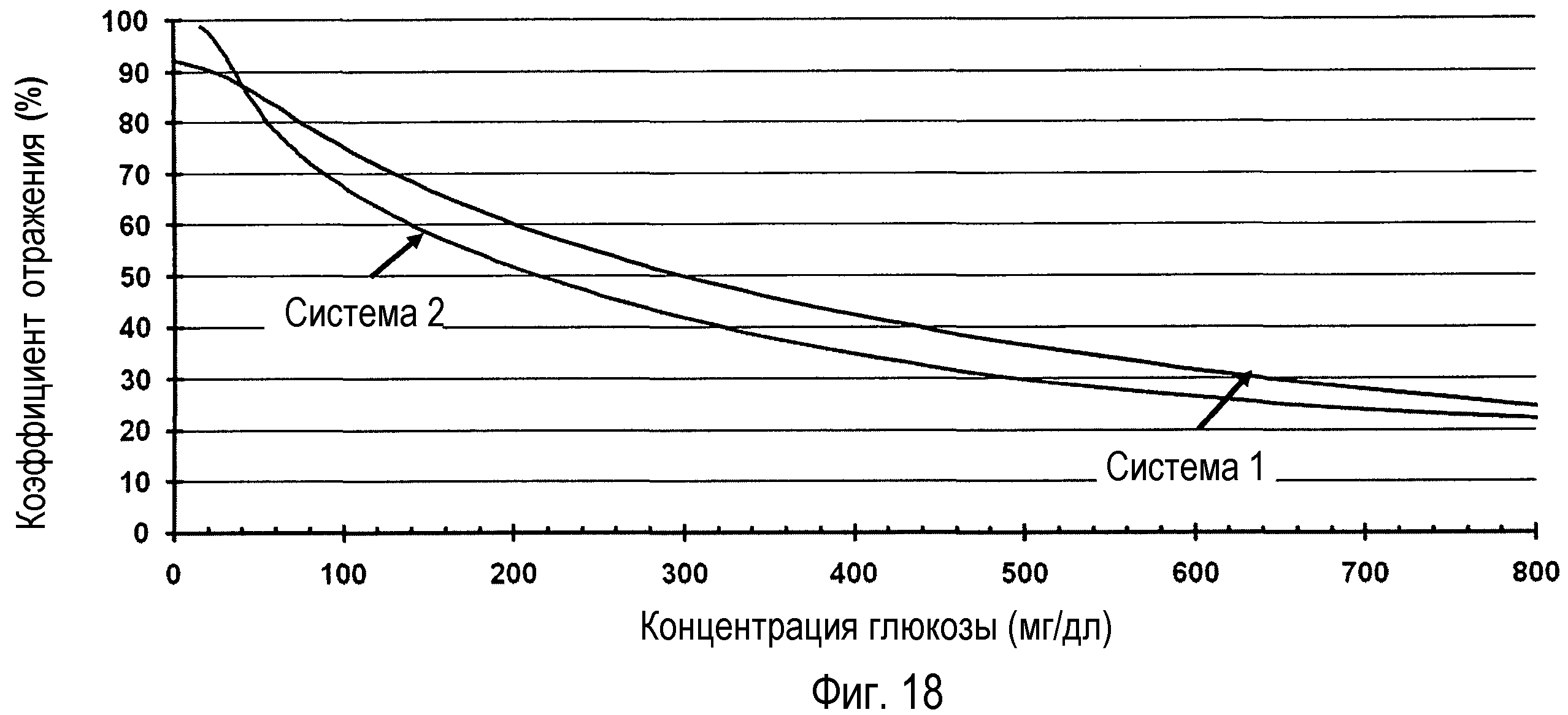
Как очевидно из диаграммного изображения на фигуре 17, фотометрическое определение глюкозы также можно осуществлять с (дополнительным) использованием диафоразы в качестве промежуточного медиатора. На фигуре 18 показано зависимое от концентрации снижение показателя отражения для системы глюкозодегидрогеназы, NAD, диафоразы, гидрохлорида [(4-нитрозофенил)имино]диметанола и 2,18-фосфорномолибденовой кислоты (система 1). Система, которая служила в качестве сравнения, представляла собой глюкоза-краситель-оксидоредуктазу, пирролохинолинхинон, гидрохлорид [(4-нитрозофенил)имино]диметанола и 2,18-фосфорномолибденовую кислоту (система 2), которая аналогично вызывает зависимое от концентрации снижение показателя отражения, но имеет недостатки вследствие низкой специфичности глюкоза-краситель-оксидоредуктазы. Кинетика конверсии глюкозы с использованием системы 1 при концентрациях глюкозы в диапазоне от 0 до 800 мг/дл изображена на фигуре 19.
В качестве альтернативы для фотометрии также возможно использовать электрохимическое измерение с целью определения анализируемых веществ. Таким образом, было обнаружено, что ток, требуемый для повторного окисления восстановленного медиатора, имеет линейную зависимость от концентрации глюкозы (фигура 20), как в случае тестового элемента, который помимо глюкозодегидрогеназы содержал NAD в качестве кофермента и трифторметансульфонат 1-(3-карбоксипропокси)-5-этилфеназиния в качестве медиатора, так и для соответствующей системы, которая включала стабилизированный кофермент cNAD вместо NAD.
Таким образом, было показано, что определение анализируемых веществ с использованием системы дегидрогеназа/стабильный кофермент также возможно путем электрохимического обнаружения и оценки с помощью еще одной длины волны, которая является независимой от кофермента. Общая композиция должна также быть дополнительно стабилизирована посредством применения стабильной пары фермент/кофермент.
Пример 4
Усеченные производные cNAD
Следующие структуры коммерчески доступны:

Влияние данной «усеченной производной NAD» на стабильность фермента GlucDH изучали по сравнению с соответствующей «усеченной производной cNAD».
Карба-Никотинамидмононуклеотид (с-NMN)

Оба субстрата были подвергнуты напряжению в растворе с ферментом GlucDH2 при 60°C в течение одного дня, и затем повторно исследовали остаточную активность фермента. Следующая диаграмма показывает результат:
Влияние NMN и cNMN на стабильность GlucDH2 (24 мг Lyo/мл) в стрессовых условиях (60°C, один день)

Как можно увидеть, активность фермента в присутствии NMN (производное NAD) решительно снижается, тогда как активность сохраняется на уровне 80% в присутствии cNMN. Так как остаточная активность фермента GlucDH2 без добавлений после одного дня хранения при температуре 60°C остается на уровне 75%. Следовательно, существует небольшой эффект стабилизации cNMN, тогда как производное NAD значительно дестабилизировало фермент.
Количество добавки обеспечивает только незначительно отличающиеся результаты: меньшее количество NMN дестабилизировало меньше, и меньшее количество cNMN стабилизировало слегка меньшее количество GlucDH2. Однако уровни оставались схожими.
Реферат
Группа изобретений относится к биотехнологии. Предложен способ стабилизации фермента, представляющего собой дегидрогеназу. Фермент хранят в присутствии стабильного кофермента, выбранного из стабильных производных никотинамидадениндинуклеотида (NAD/NADH) или соединений никотинамидадениндинуклеотидфосфата (NADP/NADPH), или усеченных производных NAD, или соединения (I), представленного в формуле. Также предложены фермент, стабилизированный стабильным коферментом, и детекторный реагент, содержащий его. Изобретение также относится к содержащему стабилизированный фермент или детекторный реагент тестовому элементу для обнаружения анализируемого вещества. Изобретение позволяет хранить стабилизированный фермент без осушающего реагента при температуре по меньшей мере 20°C или при высокой относительной влажности по меньшей мере 2 недели. Активность фермента в этих условиях снижается менее чем на 50% по сравнению с начальным уровнем. 4 н. и 18 з.п. ф-лы, 28 ил., 4 пр.
Формула



в которой
A=аденин или его аналог,
T=в каждом случае независимо O, S,
U=в каждом случае независимо OH, SH, BH3-, BCNH2-,
V=в каждом случае независимо OH или фосфатная группа или две группы, образующие циклическую фосфатную группу;
W=COOR, CON(R)2, COR, CSN(R)2, где R=в каждом случае независимо Н или С1-С2-алкил,
Х2, Х2=в каждом случае независимо О, СН2, СНСН3, С(СН3)2, NH, NCH3,
Y=NH, S, O, CH2,
Z выбран из
(i) линейного радикала, имеющего 4-6 атомов C, в которых 1 или 2 атома C необязательно замещены одним или несколькими гетероатомами, выбранными из O, S и N,
(ii) радикала, включающего циклическую группу, которая имеет 5 или 6 атомов C, которая необязательно содержит гетероатом, выбранный из O, S и N, и необязательно один или несколько заместителей, и
(iii) радикала CR42, где CR42 связан с циклической группой и с Х2, где R4=в каждом случае независимо H, F, Cl, CH3.
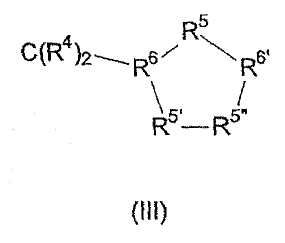
в которой одинарная или двойная связь может присутствовать между R5' и R5”, где
R4=в каждом случае независимо H, F, Cl, CH3,
R5=CR42,
где R5'=O, S, NH, NC1-C2-алкил, CR42, СНОН, СНОСН3, и
R5”=CR42, СНОН, СНОСН3, если существует одинарная связь между R5' и R5”,
где R5'=R5”=CR4, если существует двойная связь между R5' и R5”и R6, R6'=в каждом случае независимо СН или ССН3.

Комментарии