Способ получения растения brassica oleracea - RU2142013C1
Код документа: RU2142013C1
Чертежи

Описание
Изобретение в соответствии с основным положением формулы касается растения с цитоплазматической мужской стерильностью, Brassica oleracea, т.е. создания новых родительских линий такого растения. Кроме этого, изобретение касается способа получения указанного растения с мужской стерильностью, равно как и гибридных семян, полученных от новых родительских линий.
На протяжении столетий культуры Brassica выращивают в качестве пищевых культур, тогда как из их семян
получают различные пищевые продукты (растительное масло, горчицу и т.д.)
Гибридные семена различных овощных культур Brassica продаются с 1970 года. Эти семена дают гибридные растения Brassica,
которые, будучи продуктом скрещивания двух строго инбредных родительских линий, сочетают их генетические свойства. Если одна или обе родительских линии является (являются) (частично) само
опыляющимися, то для получения истинных гибридных растений Brassica необходимо принимать меры, предохраняющие от самоопыления. Одна из таких мер, препятствующих самоопылению, опирается на так
называемую самонесовместимость одной или обеих родительских линий. Таким способом предупреждают возможность созревания фертильной пыльцы в пестике специфических растений, включая пестик самих
производящих пыльцу растений Brassica. Недостатком данного метода является то, что в некоторых случаях самоопыление все-таки происходит. В результате этого урожай семян приобретает большой процент
инбредности. Другая мера, предупреждающая самоопыление той или другой родительской линии, основана на использовании цитоплазматической мужской стерильности (CMS). У редьки (Raphanus sativus) была
обнаружена цитоплазма, индуцирующая мужскую стерильность, данная цитоплазма также известна как Ogura CMS-цитоплазма. Посредством слияния протопластов митохондрии Ogura CMS-цитоплазмы вводят в растения
Brassica oleracea, в то время как ядра происходят от нормальных фертильных растений В. oleracea. Таким способом получают CMS В. oleraсеа-растения. Хлоропласты Ogura CMS-цитоплазмы, содержащие ДНК,
ответственную за чувствительность растений с этой цитоплазмой к холоду, отделяли в процессе слияний.
Задачей настоящего изобретения является получение растения В. oleracea с цитоплазматической мужской стерильностью, для которого были бы преодолены указанные выше недостатки, что явилось бы альтернативой использованию Ogura CMS-цитоплазмы, решение этой задачи предусматривает получение путем слияния протопластов цитоплазмы этого растения, содержащей митохондрии, имеющие ДНК, источником которой по меньшей мере частично является растение Brassica napus, и которая связана (свойством которой является) с мужской цитоплазматической стерильностью; иными словами, которая ответственна за цитоплазматическую мужскую стерильность в растении В. oleracea. Интенсивные исследования неожиданно показали, что, несмотря на то, что растения В. napus являются нормально фертильными, слияние протопластов может эффективно индуцировать цитоплазматическую мужскую стерильность у растения В. oleracea в результате использования надлежащей митохондриальной ДНК растения В. napus. Указанное выше слияние протопластов предпочтительно проводят, используя, с одной стороны, протопласты клеток листьев растения В. napus (донор), а с другой - протопласты клеток гипокотилей растения В. oleracea (акцептор).
В предпочтительном воплощении в соответствии с данным изобретением, кроме того, получают цитоплазму растения В. oleracea с видоспецифичным ядерным геномом, являющимся нормальным для этого растения. Это делает ее на 100% чистым продуктом.
В другом воплощении в соответствии с данным изобретением клетки включают видоспецифичные митохондрии из В. napus.
В следующем воплощении в соответствии с данным изобретением видоспецифичные митохондрии вводят посредством соматической гибридизации. При слиянии клеток кодируемая ядрами генетическая структура растения, получающего цитоплазму, остается неизменной (предпочтительно полностью). Так как цитоплазма, имеющая нужный состав, получается за один этап, то обратное скрещивание, следовательно, не является необходимым. На практике стало очевидным, что растения В. oleracea, полученные после слияния протопластов, часто являются тетраплоидными или анэуплоидными. Уровни плоидности могут посредством этого возрастать более чем в 10C раз, где C - гаплоидный геном. Растения с недиплоидным геномом характеризуются тем, что их рост различен, и тем, что у них имеет место как мужская, так и женская стерильность. Применение проточной цитометрии позволяет удалить все неявные диплоидные растения из популяции растений В. oleracea, полученной посредством слияния. После слияния диплоидные растения становятся объектом молекулярного анализа, в результате которого устанавливают, какие из растений содержат митохондриальную ДНК (или ее фрагмент), о которой известно, что она наиболее генетически близка к CMS.
В дальнейшем
воплощении в соответствии с данным изобретением растение В. oleracea выбирается из группы, состоящей из:
- капусты цветной (В. oleracea L. convar. botrytis (L.) Alef. var. botrytis L.);
- брокколи (В. oleracea L. convar. botrytis (L.) Alef. var. cymosa Duch. );
- романской (В. oleracea L. convar. botrytis (L.) Alef.var. botrytis L. );
- капусты брюссельской
(В. oleracea L. convar. oleracea (L.) Alef. var. gemnifera DC.);
- капусты огородной белокочанной (В. oleracea L. convar. capitata (L.) Alef. var. alba DC.);
- капусты
округлоконической или остроконечной формы (B. oleracea L. convar. capitata (L.) Alef. var. alba DC.);
- капусты огородной краснокочанной (В. oleracea L. convar. capitata (L.) Alef. var. rubra
DC.);
- капусты савойской (В. oleracea L. convar. capitata (L.) Alef. var. sabauda L.);
- капусты кольраби (В. oleracea L. convar. acephala (DC.) Alef. var. gongyloides);
- капусты листовой (В. oleracea L. convar. acephala (DC.) Alef. var. sabellica L.);
- капусты португальской (В. oleracea var. tronchuda syn. costata).
Данное изобретение также касается семян или частей растений по изобретению.
Данное изобретение, кроме того, касается клетки растения В. oleracea, в цитоплазму которой введены (через слияние протопластов) митохондрии, содержащие ДНК, источником которой по меньшей мере частично является растение В. napus, и которая связана (свойством которой является) с мужской цитоплазматической стерильностью (CMS) (т.е. которая ответственна за цитоплазматическую мужскую стерильность в растении В. oleracea). Гибридная клетка содержит митохондриальную ДНК, являющуюся носителем цитоплазматической мужской стерильности (CMS).
Данное изобретение также касается способа получения растения В. oleracea, включающего этап получения, посредством слияния протопластов, его цитоплазмы, содержащей митохондрии, имеющие ДНК, по меньшей мере частично происходящую из растения В. napus, и которая связана (свойством которой является) с мужской цитоплазматической стерильностью (CMS) (т.е. которая ответственна за цитоплазматическую мужскую стерильность в растении B. oleracea).
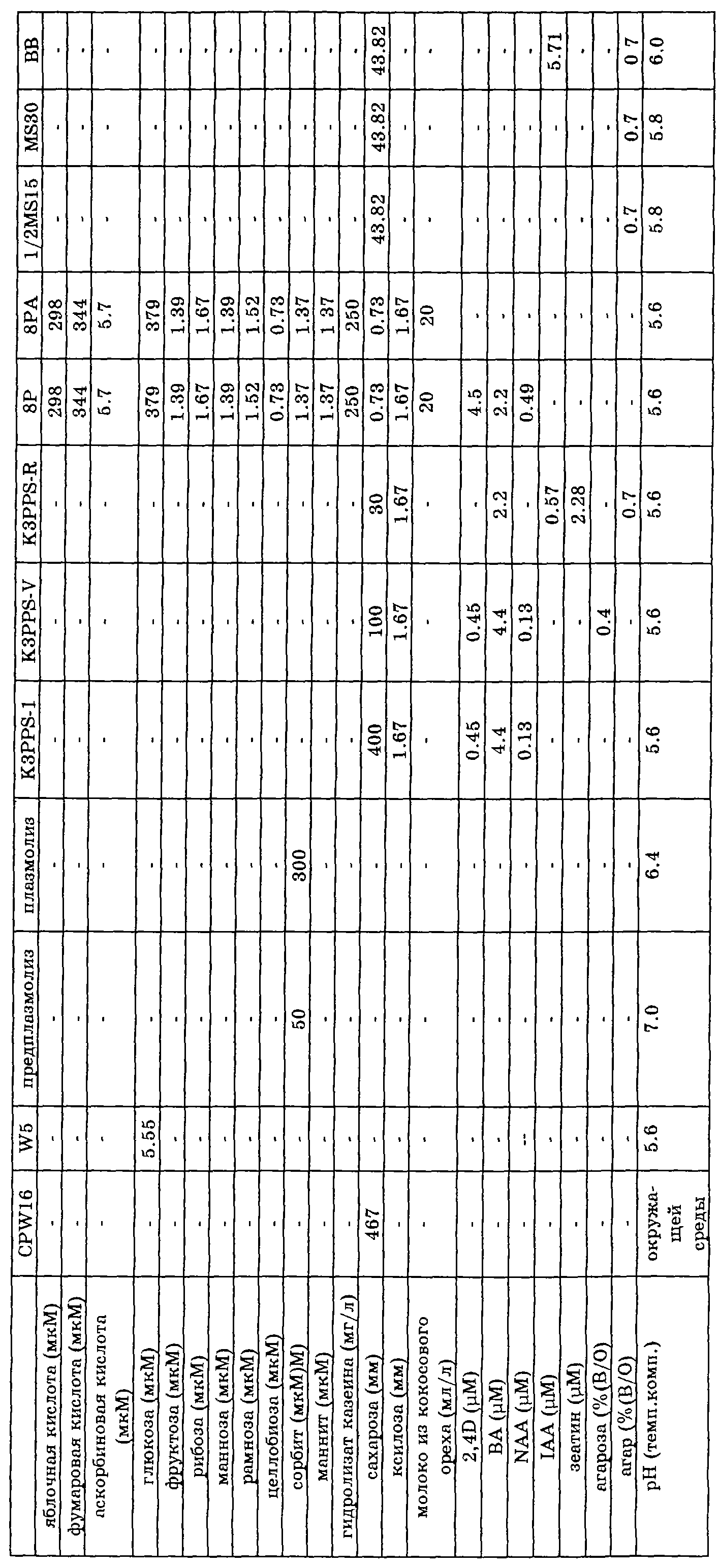
Семена обоих растений В. napus (донор) и В. oleracea (акцептор) стерилизуют и проращивают на среде MS30 или ей подобной; для донора это делается на свету, растения выдерживают в продолжение прорастания побегов и переносят их на свежую ростовую среду. Семена акцептора проращивают в темноте; используют гипокотиль из полученных этиолированных проростков. Протопласты получают обработкой материала листьев и/или гипокотилей ферментами, разрушающими клеточную стенку, такими как пектиназа и целлюлаза, после предплазмолиза, который проходит в плазмолитическом растворе. После фильтрации и центрифугирования протопласты донора облучают гамма-лучами. Протопласты акцептора обрабатывают 10A, после чего обе группы протопластов подвергают слиянию. В процессе слияния для усиления агглютинации используют PEG; существенным в процессе слияния является высокое значение pH. Во время слияния протопласты оставляют в покое, чтобы не мешать процессу. По окончании слияния раствор PEG отмывают и заменяют на среду для регенерации. Регенерацию протопластов проводят в этой среде, поэтому исключительно важным является наличие сахаров, например сахарозы и гормонов типа 2,4-D, BA и NAA и им подобным. Во время регенерации осмотическое давление среды для регенерации поэтапно снижают повторными добавлениями среды, содержащей более низкую концентрацию сахарозы. Развивающиеся микрокаллусы переносят на твердую среду для регенерации. Каждые две недели указанные каллусы переносят на свежую среду для регенерации. Вновь развившиеся побеги помещают на среду для корнеобразования, в которой корнеобразование усиливается с помощью фитогормона, подобного IAA. Регенерированные растения проверяют на их уровень плоидности путем отбора листовых образцов и определения относительного содержания ядерной ДНК на проточном цитометре. Растения, содержащие чистый диплоидный геном, сохраняют, остальные отбрасывают. Оставшиеся растения подвергают дальнейшему анализу с помощью молекулярно-биологических методик. Используя ДНК, выделенную из образцов листьев, и зонд, специфичный к митохондриальной ДНК, исследуют, нужные ли митохондрии присутствуют в растении. Растения, содержащие цитоплазму акцептора (считающиеся полученными за счет "утечки" материала), уничтожают. Оставшиеся растения размножают путем скрещивания и изучают на возможность их использования в тепличных и полевых условиях. Таким показателям, как стерильность, выход семян и качество растений, уделяют особое внимание.
Далее настоящее изобретение будет разъяснено посредством нижеследующих примеров, все из которых являются предпочтительными воплощениями изобретения.
Пример 1. Поверхностная
стерилизация семян
Семена капусты (В. oleracea) заворачивают в фильтровальную бумагу и погружают на 10 секунд в смесь, содержащую 70% этанола и 30% воды, с последующим погружением на 5 минут
в стерильную воду при 55oC. После этого следует обработка 0,3 % (в/о) NaOCl + Твин 80 в течение 20 минут; данный процесс проводят в шкафу с ламинарным потоком.
По окончании этой обработки пакет с семенами трижды промывают стерильной водой в течение 5, 5 и 10 минут соответственно.
Пример 2. Посев родительского (исходного) материала для получения
протопластов из гипокотилей
По окончании последнего этапа промывки пакет с семенами открывают и помещают в контейнер со средой 1/2 MS15. Контейнеры инкубируют в темноте при температуре 25oC. Приблизительно через 7 дней гипокотили могут быть использованы для выделения протопластов.
Пример 3. Посев родительского (исходного) материала для получения протопластов из
листьев
Стерилизованные семена высевают в соответствии с процедурой, описанной в примере 2. Контейнеры помещают на свет при температуре 25oC. Через 14-28 дней листья растений могут
быть использованы для получения протопластов; кончики побегов растений помещают в свежую ВВ; контейнеры хранят при 25oC на свету. Для выделения протопластов используют полностью
развернувшиеся листья.
Пример 4. Выделение протопластов
Материал листьев и гипокотилей разрезают на маленькие кусочки и помещают в стеклянные чашки Петри (диаметром 11 см) или
чашки Петри для культур тканей (ТС, диаметром 9 см), содержащие тонкий слой (12 мл) плазмолизирующего раствора. После этого к ним добавляют еще 12 мл плазмолизирующего раствора.
Чашки Петри заворачивают в алюминиевую фольгу и оставляют в шкафу с ламинарным потоком по меньшей мере на один час.
По истечении указанного часа плазмолизирующий раствор заменяют приблизительно на 24 мл свежеприготовленного ферментного раствора.
Препараты инкубируют в течение ночи в алюминиевой фольге при 25oC; ферментную смесь для получения протопластов гипокотилей помещают на качалку, а для получения протопластов листьев, наоборот, не помещают. Качалку устанавливают на 30 об/мин с амплитудой 15 мм.
По окончании инкубации суспензии фильтруют на тефлоновом фильтродержателе через два нейлоновых фильтра 110 мкм и 53 мкм соответственно. Фильтры повторно промывают 1/3 объема CPW16 (±8 мл).
Суспензии центрифугируют при 110•g в течение 5 минут.
Образовавшиеся слои, содержащие протопласты, отсасывают с помощью стерильной пастеровской пипетки и переносят в новую пробирку для центрифугирования. После аккуратного добавления 9 мл W5 суспензию протопластов центрифугируют при 75•g в течение 5 минут.
Протопласты листьев в дальнейшем обрабатывают следующим образом: выливают супернатант из различных центрифужных пробирок, а осадки тщательно ресуспендируют в 1-2 мл W5. Содержимое различных центрифужных пробирок объединяют и добавляют W5 до общего объема, равного 10 мл.
Центрифужную пробирку, содержащую протопласты (донор), закрывают с помощью Parafilm, заворачивают в алюминиевую фольгу и помещают на лед до проведения облучения в 50 кРад.
Протопласты гипокотилей обрабатывают следующим образом: выливают супернатант из различных центрифужных пробирок, а осадки тщательно ресуспендируют в 1-2 мл W5 + 2 мМ 10А (4oC). Содержимое различных центрифужных пробирок объединяют, доводят до общего объема, равного 10 мл, с помощью W5 + 2 мМ 10А и затем инкубируют в холодильнике при 4oC в течение 10 минут.
После этого суспензию центрифугируют при 75•g в течение 5 минут (таким образом, полное время инкубации с 10А составляет 15 минут).
Осадок ресуспендируют в 1-2 мл W5 и суспензию доводят до общего объема, равного 10 мл, с помощью W5, после чего содержимое переносят в стерильную колбу объемом 50 мл. Эту колбу, завернутую в алюминиевую фольгу, инкубируют при 25oC на качалке (приблизительно 30 об/мин; амплитуда 15 мм) в течение периода облучения протопластов. Вслед за этим содержимое колбы переносят в центрифужную пробирку.
Обе пробирки с протопластами листьев и гипокотилей центрифугируют при 75•g в течение 5 минут, после чего осадок ресуспендируют в 1-3 мл W5.
Плотность суспензий протопластов определяют с помощью гемоцитометра.
Пример 5. Слияние протопластов.
Протопласты из обеих суспензий объединяют до конечной - плотности 9•105 протопластов/мл для слияния.
С помощью микролитровой пипетки на чашки Петри переносят капли объемом 40 мкл:
11 капель по 40 мкл - на чашку Петри диаметром 6 см или 25 капель
по 40 мкл - на чашку Петри диаметром 9 см.
Чашки закрывают крышкой, после чего выключают освещение и отключают на 15 минут шкаф с ламинарным потоком, давая возможность протопластам прикрепиться к дну чашек Петри.
Снова включают шкаф с ламинарным потоком и к каждой капле протопластов добавляют по 60 мкл PEG- раствора.
Через 3-5 минут в чашки Петри
добавляют следующие количества SV 1:
4 мл в чашку диаметром 6 см,
9 мл в чашку диаметром 9 см.
Через 3-5 минут раствор отсасывают и в чашки добавляют SV II:
4 мл в чашку диаметром 6 см,
9 мл в чашку диаметром 9 см.
Через 3-5 минут раствор отсасывают и в чашки аккуратно добавляют 8p:
4 мл в чашку диаметром 6 см,
9
мл в чашку диаметром 9 см.
Важно добавлять 8p аккуратно для того, чтобы не допустить преждевременного отделения протопластов от дна чашки Петри.
Через 3-5 минут
8p-среду отсасывают и в чашки добавляют новую 8p-среду. Теперь протопласты могут сами отделяться от дна чашек Петри:
4 мл в чашку диаметром 6 см,
9 мл в чашку диаметром 9 см.
Чашки Петри запечатывают при помощи Parafilm и инкубируют при освещении приблизительно 500 люкс.
Пример 6. Регенерация
На восьмой день после слияния в чашки Петри
добавляют 8pA в количестве, увеличивающем в три раза исходный объем:
8 мл в чашку диаметром 6 см,
18 мл в чашку диаметром 9 см.
Чашки Петри помещают на свет.
На пятнадцатый день после слияния микрокаллусы, которые образовались на дне чашек, аккуратно отделяют с помощью стерильного шпателя. Содержимое чашек Петри распределяют в четыре центрифужных пробирки с помощью пипетки на 10 мл и центрифугируют при 75•g в течение 5 минут.
Тем временем 6 мл среды K3PPS-V вносят в четыре новых чашки Петри с помощью пипетки. По окончании центрифугирования супернатант выливают, а к осадку добавляют 6 мл среды K3PPS-V. Осадок состоит из делящихся клеток и микрокаллусов и может легко быть ресуспендирован в среде K3PPS-V. Среду и осадок отсасывают с помощью пипетки на 10 мл и переносят на чашки Петри. На 21-ый день после слияния образовавшиеся микрокаллусы из среды K3PPS-V инокулируют в среду K3PPS-R. Растущие (микро) каллусы переносят в свежую среду K3PPS-R каждые 2 недели.
Как только каллусы дадут побеги, их переносят в контейнеры с K3PPS-R-средой. Как только побеги становятся достаточно большими, их извлекают и помещают в среду для корнеобразования (BB-среду).
Пример 7. Измерения с помощью проточной
цитометрии
Отбирают необходимые для анализа образцы листьев растения p +/-1 см2 и помещают их в 2 мл раствора DAPI. Этот образец разрезают на маленькие кусочки острым лезвием
бритвы и фильтруют через 15 мкм фильтр. Измерения проводят на клеточном анализаторе Partec CA-II по методу De Laat et al. Относительное содержание ДНК в растениях определяют, сравнивая положения пиков
для растений, полученных в результате слияния, с пиками диплоидных растений.
Пример 8. Молекулярные исследования
Растения В. oleracea с цитоплазматической мужской
стерильностью, полученные посредством соматической гибридизации, отличают от растений В. oleracea с другой цитоплазмой (других видов капусты, включая содержащие цитоплазму ogura, anand или polima) с
помощью ДНК-зонда. Этот зонд состоит из фрагмента митохондриальной ДНК, выделенной из фенотипически стерильных растений (CMS), и после расщепления с помощью EcoRI клонированного в Escherichia coli.
Данный фрагмент характеризуется тем, что он может быть вырезан из плазмидной ДНК E. coli с помощью EcoRI и специфически гибридизован с митохондриальной ДНК из капусты (см. чертеж).
В пробирку для проведения реакции отбирают необходимый для анализа материал листьев растений в количестве 200 мг и замораживают в жидком азоте. В эти пробирки добавляют 750 мкл буфера для экстракции и материал гомогенизируют при помощи Potterstick. Образец центрифугируют при 13000•g в течение 10 минут, а супернатант, содержащий материал зеленого цвета, аккуратно сливают. К осадку добавляют 125 мкл буфера для экстракции, после ресуспендирования добавляют 135 мкл лизирующего буфера и 60 мкл раствора лаурилсаркозина. После краткого перемешивания смесь нагревают до 65oC в течение 20 минут. В пробу добавляют 375 мкл смеси хлороформ/изоамиловый спирт и встряхивают реакционную пробирку по меньшей мере 40 раз. Далее отцентрифугировать при 13000•g в течение 10 минут, перенести верхнюю фракцию в новый реакционный сосуд и при необходимости повторить еще раз этап обработки CHCl3/IAA. И наконец добавить 500 мкл изопропанола и встряхивать реакционные пробирки несколько раз. Отцентрифугировать при 13000•g в течение 5 минут. Осадок ресуспендировать в 500 мкл ТЕ-буфера.
Расщепление ДНК эндонуклеазой рестрикции проводят следующим образом: для RFLP- анализа (анализ полиморфизма рестрикционных фрагментов) необходимо приблизительно 4 мкг ДНК. Конечный раствор, в котором проходит рестрикция, состоит из 0,1 объема универсального буфера для рестрикции, подобного One-Phor-All Buffer PLUS (Pharmacia), 4 мкг ДНК, 4 мМ спермидина и 2-х единиц рестрикционного фермента. Инкубацию проводят при 37oC по меньшей мере в течение 3 часов.
Реакцию останавливают изменением концентрации EDTA до 10 мМ, используя концентрированный раствор. ДНК осаждают добавлением 0,1 объема 3 М NaAc и 2,5 объемов этанола при -20oC. Смесь выдерживают при -20oC в течение 2 часов; после центрифугирования при 10000•g в течение 10 минут осадок промывают охлажденной на льду смесью 70% этанол/вода, высушивают и растворяют в ТЕ буфере.
Электрофорез в агарозном геле фрагментов ДНК, которые надо разделить, проводят следующим образом: взвешивают 2 г агарозы и кипятят в 250 мл ТАЕ-буфера. После охлаждения до теплого состояния добавляют этидийбромид до конечной концентрации 0,5 мг/л. Гель выливают и охлаждают до тех пор, пока он не затвердеет. Образцы наносят в буфере для нанесения и разделяют фрагменты ДНК. Процесс электрофоретического разделения заканчивают, когда фронт красителя ВРВ (бромфенолового голубого) достигает приблизительно 1 см от верхнего края геля.
При подготовке к проведению блоттинга гель обрабатывают следующим образом.
5 минут в 0,25 М HCl (1x)
15 минут в 0,5 М NaOH/1,5 М NaCl
(2x)
10 минут в 1 М NH4Ac/20 мМ NaOH (2x)
Hybond-мембрану (Amersham) вырезают по размерам геля и смачивают, погружая на несколько секунд в 2•SSC, а затем в 1 М
NH4Ac/20 мМ NaOH. По этому размеру вырезают три куска фильтровальной бумаги Whatman 3ММ. Собирают устройство, в котором посредством передвижения жидкости ДНК переносится с геля на мембрану
в течение 4 часов. Перенос происходит в 1 М NH4Ac/20 мМ Nа-OH. После высушивания мембраны ДНК сшивают с мембраной облучением УФ-лучами в течение 1 минуты с обеих сторон.
Нужный ДНК-овый зонд метят следующим образом: перенесенную ДНК денатурируют нагреванием при 95oC в течение 10 минут и быстрым охлаждением на льду. В реакционном сосуде смешивают следующие
составляющие:
10 нг - 3 мкг ДНК
2 мкл гексануклеотидной смеси
2 мкл dNTP (с дигоксигенин-dUTP)
1 мкл полимеразы Кленова
После смешивания следует инкубация
в течение ночи при 37oC. ДНК осаждают добавлением 2 мкл 3 М NaAc и 44 мкл этанола (96%). Смесь выдерживают 30 минут при -20oC. После центрифугирования при 10000•g в
течение 15 минут осадок промывают 70%-ным этанолом в воде (о/о) и высушенный осадок растворяют в 50 мкл ТЕ.
Гибридизация меченых фрагментов с мембраной: мембрану помещают в 2• SSC на несколько секунд. После этого мембрану герметично закрывают в емкости, содержащей 20 мл предгибридизационной смеси. Мембрану инкубируют по меньшей мере в течение одного часа при температуре 60-65oC. Предгибридизационную смесь удаляют, заменяют 4-мя мл гибридизационной смеси и проводят инкубацию в течение ночи. По окончании инкубации мембрану промывают: 4 раза по 2 минуты в отмывающем растворе 1; 4 раза по 2 минуты в отмывающем растворе 2 и два раза по 15 минут в отмывающем растворе 3 (при 60-65oC).
Детектирование меченых зон проводят при комнатной температуре, блот ополаскивают в буфере для ополаскивания 1 и затем герметично закрывают в буфере для ополаскивания 2 (10 мл буфера 2 на 100 см2 мембраны). По окончании инкубации на качалке длительностью 30 минут буфер для ополаскивания 2 заменяют на анти-dig-pacтвоp (15 мл на 100 см2 мембраны). По окончании инкубации на качалке длительностью 30 минут мембрану промывают: 2- 3 раза в продолжение 10 минут в буфере для ополаскивания 2, 3-4 раза в продолжение 10 минут в буфере для ополаскивания 1 и один раз в буфере для ополаскивания 3. Мембрану инкубируют с раствором AMPPD (10 мл на 100 см2 мембраны) в течение 20 минут. Мембрану помещают в кассету с пленкой Polaroid вверху; после необходимой экспозиции пленки вынимают и обрабатывают.
Пример 9. Описание фенотипа цветка растения с цитоплазматической мужской стерильностью В. oleracea с митохондриями из Brassica napus
Цветорасположение: главная ось грозди направлена
вверх, иногда укорочена или собрана в пучки, часто разветвлена. Прицветники присутствуют редко, иногда повернуты и скручены. Черешки иногда укорочены или собраны в пучки.
Цветочный бутон: чаще закрыт, иногда открыт, стороны чашелистиков не соприкасаются друг с другом и остаются сложенными. Поверхность от гладкой до выпуклой, верхушка в основном скручена внутрь, иногда заострена. Пестик часто перерастает верхушку.
Цветок: чашелистики шириной 1-4 мм, длиной 4-12 мм, прямые, часто слегка повернуты, стороны иногда загнуты внутрь, верхушка загнута внутрь. Присутствуют нектарники. Лепестков 4, иногда много больше - до 40, ширина 4-7 мм, длина 11-19 мм. При количестве, равном 4, внутренние лепестки часто более короткие. Ноготок может на вид быть свернут в трубочку. Пластинка в основном не загнута назад, часто сильно повернута в сторону, иногда сильно закручена. Цвет верхней стороны белый или желтый RHS 2A-3A-2C-3C-4A-5A-5B-6A, нижняя сторона белая или желтая RHS 2A-2B-2C-3A-3C-4B-4C-4A, край верхушки часто ровный, иногда с зазубринами. Тычинок от 6-ти до 2-х, и в этом случае они иногда срастаются 2 на 2, длина до половины длины чашелистиков, иногда такой же длины, как чашелистики. Пыльники небольшие и треугольные, пыльца не присутствует. Пестик один, иногда до трех, один длиннее других, в основном прямой, без опыления часто вырастает длиной приблизительно 30 мм. Рыльце и пестик иногда изогнуты, иногда слабо набухшие. Завязь часто свернута и скручена.
Цветок на верхушке грозди иногда совсем без чашелистиков, лепестков и тычинок и с сильно скрученными и свернутыми завязями или по виду сросшийся 2 на 2; расщепление раскрыто вдоль шва срастания, напоминая лист на прицветнике с параллельным расположением жилок.
Дополнительные растворы для клеточной биологии:
раствор ферментов:
1% (в/о) целлюлаза R-10 в K3PPS-I
0,1% (в/о) пектиназа в K3
PPS-I
pH = 5,6
раствор PEG:
266,7 мМ PEG1500
300 мМ глюкоза
50 мМ CaCl2•2H2O
pH = 7,0
SV I:
50 мл
раствора PEG + 100 мл предплазмолизирующего раствора
SV II:
20 мл раствора PEG + 100 мл предплазмолизирующего раствора
IOA (иодацетамид)
2 мМ IOA в W5;
pH = 5,6
1%-ный раствор агарозы в MilliQ-воде.
Растворы для молекулярной биологии:
буфер для экстракции:
350 мМ сорбит
100 мМ Трис-основание
5 мМ EDTA
добавить свежеприготовленным: 20 мМ Na-бисульфит лизирующий буфер:
20 мМ Трис-основание
50 мM EDTA
2 М NaCl
2% (в/о) CTAB
N-лаурилсаркозина натриевая соль: 10 % (в/о)
хлороформ/изоамиловый спирт: 24:1 (о/о)
изопропанол
ТЕ: 10 мМ Трис-HCl; pH 8,0
1 мМ EDTA
4 мМ спермидин
Концентрированный раствор EDTA: 1 М
3 М NaAc
этанол 96%-ный
70% этанол/вода (о/о)
раствор этидийбромида: 10 мг/мл H2O
ТАЕ-буфер:
4,84 грамма Трис-основания/л
1,14 мл уксусной кислоты
10 мМ EDTA; pH 8,0
буфер для нанесения:
24% Ficoll 400
0,1% SDS
0,1% ксилолцианол
0,
1% бромфеноловый синий
0,25 M HCl
0,5 M NaOH/1,5 M NaCl
1 M NH4Ac/20 мМ NaOH
2•SSC:
30 мМ Na-цитрат•2H2O; pH 7,2
300 мМ NaCl
0,2•SSC: разбавленный в 10 раз 2•SSC
0,1•SSC: разбавленный в 20 раз 2•SSC гексануклеотидная смесь:
сконцентрированная в 10 раз
гексануклеотидная смесь от Boehringer Mannheim dNTP:
0,1 мМ dATP
0,1 мМ dCTP
0,1 мМ dGTP
0,65 мМ dTTP
0,35 мМ дигоксигенин-dUTP (Boehringer) блокирующий
реагент: Boehringer Mannheim; арт.# 1175041 предгибридизационная смесь:
75 мМ Na-цитрат
750 мМ NaCl
0,5% блокирующий реагент
0,1% N-лаурилсаркозин (в/о)
0,
2% SDS
гибридизационная смесь:
75 мМ Na-цитрат
750 мМ NaCl
0,5% блокирующий реагент
0,1% N-лаурилсаркозин
0,2% SDS
40-50 нг пробы
меченого дигоксигенин-dUTP/мл
отмывающий раствор 1: 2•SSC + 0,1% (в/о) SDS
отмывающий раствор 2: 0,2•SSC + 0,1% (в/о) SDS
отмывающий раствор 3: 0,1•SSC
+ 0,1% (в/о) SDS
буфер для ополаскивания 1:
100 мМ Трис-HCl pH 7,5
150 мМ NaCl
буфер для ополаскивания 2:
буфер для ополаскивания 1
0,5 %
блокирующий реагент (свежеприготовленный)
буфер для ополаскивания 3:
буфер для ополаскивания 1
50 мМ MgCl2
конъюгат анти-dig-AP: Boehringer Mannheim;
арт.# номер 1175041 раствор AMPPD: 10 мкл AMPPD в мл буфера 3 для ополаскивания (0,26 мкМ)
Используемые сокращения:
2,4D: 2,4-дихлорфеноксиуксусная кислота
AMPPD:
двузамещенный-3-(4-метоксиспиро{ 1,2-диоксетан- 3,2'-трицикло-[3.3.1.13,7]декан}-4-ил)фенилфосфат натрия
AP: кислая фосфатаза
BA: 6-бензиламинопурин,
ВРВ:
бромфеноловый голубой
CMS: цитоплазматическая мужская стерильность
DIG: дигоксигенин
dATP: дезоксиаденозинтрифосфат
dCTP: дезоксицитозинтрифосфат
dGTP:
дезоксигуанинтрифосфат
dNTP: дезоксинуклеотидтрифосфат
dTTP: дезокситиминтрифосфат
dUTP: дезоксиурацилтрифосфат
EDTA: этилендиаминтетрауксусная кислота
g:
ускорение свободного падения (9,8 м/с2)
IOA: иодацетамид
кРад: 1000 Рад, единица ионизирующего облучения
мкг: микрограмм
мкл: микролитр
мM:
миллимолярный
мкМ: микромолярный
M: молярный
MS: Murashige & Skoog
NAA: нафталинуксусная кислота
PEG: полиэтиленгликоль
pH: мера
кислотности
rpm: обороты в минуту
SSC: солевой раствор цитрата натрия
SDS: додецилсульфат натрия
TC: культура ткани
UV: ультрафиолет
o/o:
объем/объем
в/о: вес/объем
Практически для всех процедур может быть указано, в каких пределах необходимо поддерживать pH, концентрацию и т.д. и на каком уровне следует проводить
эксперименты на практике. Три уровня для этих растворов/процедур даны ниже:
среды для культур тканей:
1/2MS15, MS30 в BB:
сахар, например сахароза; концентрация 0,5-600 мМ,
как правило 200-400 мМ.
pH 5-10; обычно 5,5-6,0;
температура культивирования: 22-27oC, обычно 25oC;
облучение: 0-60 кРад; обычно 50 кРад;
температура, при которой проводят слияние: 20-25oC; обычно 22oC;
концентрации растительных гормонов: 0-10 мкМ; обычно 0-3 мкМ.
Необходимые растворы для слияния клеток приведены в таблице.
Фиг. представляет люминограмму с цитоплазмой из В. oleracea, В. napus в качестве фертильного донора, B. oleracea с цитоплазмой ogura, В. campestris с цитоплазмой anand, В. napus с цитоплазмой polima и В. oleracea с митохондриями из фертильного В. napus. Гибридизацию проводят с ДНК-зондом. Этот зонд состоит из фрагмента митохондриальной ДНК, выделенного из фенотипически стерильных растений (CMS), и после расщепления с помощью EcoRI, клонированного в Escherichia coli. Данный фрагмент характеризуется тем, что он может быть вырезан из плазмидной ДНК E. coli с помощью EcoRI и специфически гибридизован с митохондриальной ДНК из капусты.
линия 1: реперные ДНК с известными значениями молекулярных весов, сверху вниз:
21226 пн, 7421 пн-, 5804 пн, 5643 пн, 4878 пн 3530 пн λ ДНК:: Eco Rl; Boehringer Mannheim);
линия 2: фертильный В. napus в качестве донора;
линия 3: В. oleracea c. ogura;
линия 4: В. oleracea в качестве акцептора; верхняя зона в некоторых случаях, в зависимости от жесткости этапов отмывки, может отсутствовать;
линия 5: растение В. oleracea с CMS,
полученное слиянием с образцом донора, представленного на линии 2;
линия 6: растение В. oleracea с CMS, полученное слиянием с комбинированным образцом донора, представленного на линии 2, и
акцептора, представленного на линии 4. Такое растение является стерильным и, следовательно, обладает свойством CMS;
линия 7: B. campestris с цитоплазмой anand (из В. juncea);
линия
8: В. napus с цитоплазмой polima;
линия 9: В. oleracea с ogura (= линия 3);
линия 10: реперные ДНК с известными значениями молекулярных весов, сверху вниз; 21226 пн, 7421 пн, 5804 пн,
5643 пн, 4878 пн, 3530 пн (λ ДНК:: Eco RI; Boehringer Mannheim).
Реферат
Изобретение предназначено для сельского хозяйства. Новые растения В. oleracea получают методом слияния ее протопластов с протопластами В.napus. Использование протопластов В.napus, содержащих митохондриальную ДНК, обладающую свойством мужской цитоплазматической стерильности, обеспечивает получение В.oleracea с нормальным геномом с одновременным наличием мужской цитоплазматической стерильности. 5 з.п. ф-лы, 1 ил., 1 табл.


Комментарии