Биосинтетические системы проксимального канальца и способы использования - RU2620947C2
Код документа: RU2620947C2
Чертежи

Описание
ОТСЫЛКИ НА РОДСТВЕННЫЕ ЗАЯВКИ
Данная заявка испрашивает преимущества предварительной заявки на патент США № 61/490890, поданной 27 мая 2011 г., содержание которой полностью включено в настоящий документ путем отсылки.
ОБЛАСТЬ ПРИМЕНЕНИЯ ИЗОБРЕТЕНИЯ
Это изобретение в целом относится биосинтетическому устройству проксимального канальца, содержащему биологический каркас и одну или более прогениторных клеток (таких как, например, клетки, выделенные из почек млекопитающих), которые дифференцируются в монослой клеток проксимальных почечных канальцев на каркасе. Изобретение далее относится к способам приготовления и культивирования устройства в биореакторе. Также предлагаются способы применения устройства в исследованиях нефротоксичности в условиях in vitro и скрининговых исследований фармацевтических соединений.
ПРЕДПОСЫЛКИ СОЗДАНИЯ ИЗОБРЕТЕНИЯ
Хроническая болезнь почек (ХБП) и терминальная стадия почечной недостаточности (ТСПН) определяется как снижение почечной функции, преимущественно скорости клубочковой фильтрации. Это приводит к неспособности почки выводить токсичные продукты жизнедеятельности организма. В США, ХБП становится все более распространенной и связана с неблагоприятными последствиями для здоровья и высокими медицинскими расходами. По расчетам Национального почечного фонда 20 миллионов американцев страдают от ХБП, и дополнительно, по меньшей мере, по меньшей мере, у 20 миллионов людей существует риск развития ХБП. От ТСПН страдают более 500 000 пациентов, а количество людей в зоне риска развития ХБП достигает 1,5 миллиона пациентов. Общие расходы на лечение ХБП и ТСПН достигают почти 30% общих расходов на медицинское обслуживание, однако эти пациенты составляют только 8,1% от общего населения, получающего медицинское обслуживание (нефрологическая база данных США 2008, ежегодный отчет за 2008 г.). Частота развития ТСПН увеличилась более чем на 50% за последние 10 лет, и постоянно растет количество пациентов, находящихся в зоне риска развития ХБП. Соответственным образом, существует большая потребность в новых терапевтических решениях для восстановления поврежденных почек, а также для систем in vitro, которые могут определять нефротоксичность испытуемых соединений.
Многие ксенобиотики, или молекулы, являющиеся производными их разложения, выводятся из крови посредством активного переноса в фильтрат, направляемый в мочевой пузырь клетками проксимальных почечных канальцев. Вследствие осуществления этой важной функции, клетки проксимальных почечных канальцев часто повреждаются в результате токсичного действия этих соединений. Таким образом, испытания нефротоксичности сильнодействующих лекарственных соединений в системе in vitro, которые могут потенциально заменить испытания на животных, вызывают значительный интерес.
В существующих в настоящее время моделях на основе клеточных культур, предназначенных для испытания формирования и функционирования эпителиального монослоя клеток проксимальных почечных канальцев, используются первичные клетки или клетки, первично развившихся из устойчивых клеточных линий из различных источников, таких как например MDCK (клетки почки собаки Мадин-Дарби), LLC-PK1 (клетки почки свиньи с карциномой легкого Льюиса1) клетки HK-2, которые представляют собой линию клеток почки человека, иммортализованных трансдукцией с помощью генов 16 E6/E7 вируса папилломы человека. Системы анализа с помощью этих клеток обычно используют пористые фильтры (такие как, например, фильтры Transwell®), которые позволяют жидкости воздействовать на обе апикальную и базолатеральную сторону клеток, стимулируя эпителиальную дифференцировку.
Однако применение этих клеточных линий имеет несколько недостатков. Многие из этих клеточных линий трансформированы или выделены из опухоли, потенциально изменяющей их рост, дифференцировку и, в конечном счете, функциональные характеристики. Более того, многие из этих клеточных линий нечеловеческого происхождения. В связи с этим, могут иметься видоспецифические различия в функции и в реакции этих клеток на воздействие различных соединений. Использование первичных клеток является затруднительным, поскольку эти клетки обычно являются свежеизолированными и перед использованием в экспериментах минимально увеличиваются в объеме. Процесс изолирования может затрудняться в связи с загрязнением нежелательными клеточными популяциями. В дополнение, может иметься значимая вариабельность исходного донорского материала.
Другим общеизвестной проблемой является ограниченная продолжительность, в течение которой первичные клетки образуют интактный монослой; Это ограничивает применение клеток в исследованиях в условиях in vitro. Первичные клетки часто разрастаются, выступают над поверхностью и образуют 3-мерные агрегаты, требующие прибавления дополнительных факторов, таких как MEK-ингибиторы для сохранения контактного торможения (как раскрыто, например, в опубликованной заявке на патент США 2009/0209019). Хотя пористые фильтры (такие как, например, фильтры Transwell®), довольно эффективны, они выполнены из синтетических материалов и поэтому не воссоздают с высокой степенью точности лежащую в основе матрицу, с которой клетки почечных канальцев обычно взаимодействуют в условиях in vivo.
Другие описывают альтернативные способы скринингового исследования, которые основываются на образовании 3-мерных трубчатых структур, используя преимущества вышеупомянутого разрастания первичных клеток на твердых поверхностях (см. WO 2010/064995 A1), в 3D-гелях таких как, например, Matrigel™, или культивирования изолированных почечных канальцев животных. Последнее является проблематичным в связи с трудоемкой процедурой изолирования и различий видов, которые необходимо учитывать. Другим недостатком этих альтернативных вариантов является их способность оценивать перенос только ксенобиотических соединений, которые применяются в культуральных средах, в просвете почечных канальцев. Действие таких соединений на нормальные функции канальцев такое как, например, реабсорбция глюкозы или поглощение альбумина, невозможно оценить, поскольку отсутствует надежный способ введения меченых испытуемых веществ в просвет или отбора проб жидкости из просвета канальцев для проведения анализа. В дополнение, невозможно оценить влияние изменений в скорости потока и физиологических динамических условиях, которые могут произойти в различных ситуациях в условиях in vivo.
Поэтому в этой области существует потребность в разработке анализа биологических проб, который наилучшим образом отражает нормальную физиологию эпителия проксимальных почечных канальцев. Это, в конечном счете, сделает возможным разработку новых и более эффективных способов лечения заболеваний почек.
ИЗЛОЖЕНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
Эта заявка охватывает биосинтетические устройства проксимального канальца, имеющих биологический лишенный клеток матричный каркас, на котором образуется монослой клеток проксимальных почечных канальцев из клеток-предшественников (таких как, например, клетки млекопитающих (например, человека) выделенные из почек).
Настоящее изобретение описывает биосинтетическое устройство проксимального канальца, созданное с помощью приготовления лишенной клеток биологической матрицы, засева биологической матрицы клетками млекопитающих, выделенных из почек, и, дополнительно, эндотелиальными клетками млекопитающих. Затем устройство может культироваться в статических условиях или созревать с помощью культивирования в биореакторе, чтобы обеспечить дифференцировку почечных клеток в функционирующие клетки проксимальных канальцев. Получившееся устройство способно выполнять функции проксимальных канальцев, например, осуществлять перенос молекул с любой из сторон биологической мембраны к другой стороне. Настоящее изобретение также описывает различные способы изготовления и обеспечения созревания биосинтетических устройств проксимального канальца. Настоящее изобретение также описывает способы применения биосинтетических устройств проксимального канальца в исследованиях в условиях in vitro переноса клетками канальцев, токсического действия различных соединений или в скрининговых исследованиях лекарственных соединений.
В одном варианте осуществления, биосинтетическое устройство проксимального канальца содержит биологический лишенный клеток матричный каркас, засеянный одной или более клетками, дифференцируемыми в клетки почек (например, клетка-предшественник, которая может дифференцироваться в клетки почек) в условиях, достаточных для обеспечения дифференцировки этих клеток клетки проксимальных почечных канальцев, в которых дифференцированные клетки образуют эпителиальный монослой на каркасе. Биосинтетическое устройство проксимального канальца может, в качестве опции, дополнительно содержать клетки эндотелия сосудов.
В другом варианте осуществления, биосинтетическое устройство проксимального канальца содержит биологический лишенный клеток каркас, имеющий, по меньшей мере, две поверхности, причем, по меньшей мере, одна поверхность засеяна одной или более клетками, дифференцируемыми в клетки почек (например, клеткой-предшественником, которая может дифференцироваться в клетку почки) в условиях, достаточных для обеспечения дифференцировки клеток в клетки эпителия проксимальных почечных канальцев, в которых клетки образуют клеточный монослой на поверхности каркаса.
В другом варианте осуществления, биосинтетическое устройство проксимального канальца содержит биологический лишенный клеток каркас, полученный из ткани млекопитающих, имеющий одну или более поверхностей и монослой эпителия проксимального почечного канальца на поверхности каркаса, причем монослой эпителия образован с помощью засеивания поверхности одной или более клетками, полученными из клеток млекопитающих, в условиях, достаточных для обеспечения дифференцировки клеток, полученных из почки, в клетки проксимальных почечных канальцев и образования монослоя. Засев поверхности может проводиться в биореакторе. Такой биореактор может иметь верхний элемент корпуса, нижний элемент корпуса с площадью клеточного роста, и один или более патрубков.
Одна или более клеток, дифференцируемых в клетки почек (например, клетка-предшественник) могут быть первичными клетками эпителия почечных канальцев, индуцируемыми полипотентными стволовыми клетками или прогениторными клетками, дифференцированными в клетки почек или почечные клетки-предшественники, стволовыми клетками, изолированными из почек, или прогениторными клетками, изолированными из почек, и их смесями. В одном варианте осуществления, одна или более клеток, дифференцируемых в клетки почек, представляют собой клетки, выделенные из почек млекопитающих, таких как, например, почки человека. Эти клетки, выделенные из почек, могут быть получены из коркового вещества почки, мозгового вещества почки, подкапсульной зоны почки и их смесей.
Еще в одном варианте осуществления, биосинтетическое устройство проксимального канальца содержит лишенный клеток биологический каркас, имеющий, по меньшей мере, две поверхности, причем, по меньшей мере, одна поверхность засеяна одной или более клетками, выделенными из почек млекопитающих, в условиях, достаточных для обеспечения дифференцировки клеток, выделенных из почек, в клетки проксимальных почечных канальцев, где указанные клетки формируют эпителиальный монослой на поверхности каркаса. Млекопитающим может являться человек, и клетки могут быть получены из коркового вещества почки, мозгового вещества почки или подкапсульной зоны почки.
В некоторых вариантах осуществления, лишенный клеток биологический матричный каркас может быть получен из ткани млекопитающих. Каркас может быть получен из ткани млекопитающего, такой как, например, ткань свиньи. Например, каркас может быть получен из желудка, двенадцатиперстной кишки, тощей кишки, подвздошной кишки или толстой кишки млекопитающего. В варианте осуществления изобретения, каркас получен из подслизистой оболочки тонкого кишечника. В другом варианте осуществления, лишенная клеток биологическая матрица может быть получена из ткани слизистой оболочки или подслизистой основы.
В одном варианте осуществления изобретения, клетки, выделенные из почек, способны к самообновлению и размножению в культуре, являются положительными в отношении экспрессии одного или более Oct-4, Pax-2 и Rex-1 и отрицательными в отношении экспрессии одного или более Sox2, FGF4, hTert и Wnt-4. В другом варианте осуществления изобретения, клетки, выделенные из почек, способны к самообновлению и размножению в культуре, и являются положительными в отношении экспрессии одного или более Oct-4 и Pax-2 и отрицательными в отношении экспрессии одного или более Sox2, FGF4, hTert и Wnt-4.
В другом варианте осуществления изобретения, клетки, выделенные из почек, способны к самообновлению и размножению в культуре и являются положительными в отношении экспрессии по меньшей мере, одного из Eya1, Pax-2, WT1, FoxD1, BMP7, BMP2, GDF5, EpoR или Rex-1 и отрицательными в отношении экспрессии, по меньшей мере, одного из Sox2, FGF4, hTert или Wnt-4. В некоторых вариантах осуществления, клетки, выделенные из почек, могут также быть положительными в отношении, по меньшей мере, одного из маркеров клеточной поверхности HLA I, CD24, CD29, CD44, CD49c, CD73, CD90, CD166 или SSEA-4, и отрицательными в отношении, по меньшей мере, одного из маркеров клеточной поверхности HLA II, CD31, CD34, CD45, CD56, CD80, CD86, CD104, CD105, CD117, CD133, CD138, CD141 или E-кадгерина.
В некоторых вариантах осуществления, вторая поверхность каркаса может быть засеяна клетками эндотелия сосудов млекопитающего. Например, клетки эндотелия сосудов могут представлять собой линии эндотелиальных клеток, эндотелиальные прогениторные клетки, первичные эндотелиальные клетки, микрососудистые эндотелиальные клетки и их смеси.
Альтернативным вариантом осуществления изобретения является биосинтетическое устройство проксимального канальца, содержащее лишенный клеток биологический матричный каркас, засеянный одной или более клетками-предшественниками (т.е. клетками-предшественниками, которые могут дифференцироваться в клетки почек) в условиях, достаточных для обеспечения дифференцировки клеток-предшественников в клетки эпителия проксимальных почечных канальцев, где дифференцированные клетки формируют эпителиальный монослой на каркасе. Лишенный клеток биологический матричный каркас может быть получен из ткани млекопитающих (такой как, например, ткань свиньи), такой как ткань слизистой или подслизистой оболочки. В одном варианте осуществления, лишенный клеток биологический матричный каркас получен из пищеварительного тракта млекопитающего. В другом варианте осуществления, лишенный клеток биологический матричный каркас выполнен (например, получен) из желудка, двенадцатиперстной кишки, тощей кишки, подвздошной кишки или толстой кишки млекопитающего. Одна или более клеток-предшественников, выбраны из группы, состоящей из первичных клеток эпителия почечных канальцев, индуцируемых полипотентных стволовых клеток, дифференцированных в клетки почек или почечные прогениторные клетки, стволовых клеток, изолированных из почек, или прогениторных клеток, изолированных из почек, и их смесей. В одном варианте осуществления, прогениторные клетки представляют собой клетки, выделенные из почек человека. В одном варианте осуществления, клетки, выделенные из почек человека, способны к самообновлению и размножению в культуре и являются положительными в отношении экспрессии, по меньшей мере, одного из Oct-4, Rex-1, Pax-2, кадгерина-11, FoxD1, WT1, Eya1, HNF3B, CXC-R4, Sox-17, EpoR, BMP2, BMP7 или GDF5; и отрицательными в отношении экспрессии, по меньшей мере, одного из Sox2, FGF4, hTert, Wnt-4, SIX2, E-кадгерина и GATA-4. Дополнительно, эти клетки также являются положительными в отношении, по меньшей мере, одного из маркеров клеточной поверхности HLA-I, CD24, CD29, CD44, CD49c, CD73, CD90, CD166 или SSEA-4; или отрицательными в отношении, по меньшей мере, одного из маркеров клеточной поверхности HLA II, CD31, CD34, CD45, CD56, CD80, CD86, CD104, CD105, CD117, CD133, CD138 и CD141. В дополнение, клетки далее секретируют, по меньшей мере, один из трофических факторов FGF2, HGF, TGFα, TIMP-1, TIMP-2, MMP-2 или VEGF; и не секретируют, по меньшей мере, один из трофических факторов PDGF-bb или IL12p70.
Еще одним вариантом осуществления изобретения является биосинтетическое устройство проксимального канальца, содержащее лишенный клеток биологический каркас, имеющий, по меньшей мере, две поверхности, причем, по меньшей мере, одна поверхность засеяна одной или более клетками-предшественниками (т.е. клетками-предшественниками, которые могут дифференцироваться в клетку почки), в условиях, достаточных для обеспечения дифференцировки клеток в клетки эпителия проксимальных почечных канальцев, где указанные клетки образуют эпителиальный монослой на поверхности каркаса. Лишенный клеток биологический матричный каркас может быть получен из ткани млекопитающих (например, ткани свиньи). В одном варианте осуществления, лишенный клеток биологический матричный каркас получен из ткани слизистой оболочки или подслизистой основы. Альтернативным образом, лишенный клеток биологический матричный каркас получен из пищевода млекопитающего. В другом варианте осуществления, лишенный клеток биологический матричный каркас выполнен (например, получен) из желудка, двенадцатиперстной кишки, тощей кишки, подвздошной кишки или толстой кишки млекопитающего. Одна или более клеток-предшественников, выбраны из группы, состоящей из первичных клеток эпителия почечных канальцев, индуцируемых полипотентных стволовых клеток, дифференцированных в клетки почек или почечные прогениторные клетки, стволовых клеток, изолированных из почек, или прогениторных клетки, изолированных из почек, и их смесей. В одном варианте осуществления, прогениторными клетками являются клетки, выделенные из почек человека. В одном варианте осуществления, клетки, выделенные из почек человека, способны к самообновлению и размножению в культуре и являются положительными в отношении экспрессии, по меньшей мере, одного из Oct-4, Rex-1, Pax-2, кадгерина-11, FoxD1, WT1, Eya1, HNF3B, CXC-R4, Sox-17, EpoR, BMP2, BMP7 или GDF5; и отрицательными в отношении экспрессии, по меньшей мере, одного из Sox2, FGF4, hTert, Wnt-4, SIX2, E-кадгерина и GATA-4. Дополнительно, эти клетки также являются положительными в отношении, по меньшей мере, одного из маркеров клеточной поверхности HLA-I, CD24, CD29, CD44, CD49c, CD73, CD90, CD166 или SSEA-4; или отрицательными в отношении, по меньшей мере, одного из маркеров клеточной поверхности HLA II, CD31, CD34, CD45, CD56, CD80, CD86, CD104, CD105, CD117, CD133, CD138 и CD141. В дополнение, клетки далее секретируют, по меньшей мере, один из трофических факторов FGF2, HGF, TGFα, TIMP-1, TIMP-2, MMP-2 или VEGF; и не секретируют, по меньшей мере, один из трофических факторов PDGF-bb или IL12p70. В другом варианте осуществления, вторая поверхность каркаса засеяна клетками эндотелия сосудов млекопитающего. Эти клетки эндотелия сосудов могут быть выбраны из линий эндотелиальных клеток, эндотелиальных прогениторных клеток, первичных эндотелиальных клеток или микрососудистых эндотелиальных клеток.
Еще одним вариантом осуществления изобретения является способ применения устройств проксимального канальца. Соответственным образом, один вариант осуществления представляет собой способ дифференцировки одной или более клеток-предшественников в клетки почек, содержащий засеивание лишенного клеток биологического матричного каркаса (т.е. клеток-предшественников, которые могут дифференцироваться в клетки почек) одной или более клетками-предшественниками и культивирование клеток на каркасе в условиях, достаточных для обеспечения дифференцировки клетки-предшественника в эпителиальные клетки проксимальных почечных канальцев, где дифференцированные клетки формируют эпителиальный монослой на каркасе. Лишенный клеток биологический матричный каркас может иметь две поверхности. В одном варианте осуществления, лишенный клеток биологический матричный каркас может быть выполнен из ткани млекопитающих (например, ткани свиньи). Соответствующим образом, лишенный клеток биологический матричный каркас может быть выполнен (например, получен) из ткани слизистой оболочки или подслизистой основы. В другом варианте осуществления, лишенный клеток биологический матричный каркас выполнен из желудка, двенадцатиперстной кишки, тощей кишки, подвздошной кишки или толстой кишки млекопитающего Способы могут использовать одну или более клеток-предшественников, выбранных из группы, состоящей из первичных клеток эпителия почечных канальцев, индуцируемых полипотентных стволовых клеток, дифференцированных в клетки почек или почечные прогениторные клетки, стволовых клеток, изолированных из почек, или прогениторных клеток, изолированных из почек, и их смесей. В одном варианте осуществления, используемые в способах прогениторные клетки представляют собой клетки, выделенные из почек человека.
В одном варианте осуществления, используемые в способах клетки, выделенные из почек человека способны к самообновлению и размножению в культуре и являются положительными в отношении экспрессии, по меньшей мере, одного из Oct-4, Rex-1, Pax-2, кадгерина-11, FoxD1, WT1, Eya1, HNF3B, CXC-R4, Sox-17, EpoR, BMP2, BMP7 или GDF5; и отрицательными в отношении экспрессии, по меньшей мере, одного из Sox2, FGF4, hTert, Wnt-4, SIX2, E-кадгерина и GATA-4. В другом варианте осуществления, эти клетки также являются положительными в отношении, по меньшей мере, одного из маркеров клеточной поверхности HLA-I, CD24, CD29, CD44, CD49c, CD73, CD90, CD166 или SSEA-4; или отрицательными в отношении, по меньшей мере, одного из маркеров клеточной поверхности HLA II, CD31, CD34, CD45, CD56, CD80, CD86, CD104, CD105, CD117, CD133, CD138 и CD141. В другом варианте осуществления, клетки секретируют, по меньшей мере, один из трофических факторов FGF2, HGF, TGFα, TIMP-1, TIMP-2, MMP-2 или VEGF; и не секретируют, по меньшей мере, один из трофических факторов PDGF-bb или IL12p70.
Другой вариант осуществления изобретения представляет собой способ дифференцировки одной или более клеток, дифференцируемых в клетки почек, в эпителиальные клетки проксимальных почечных канальцев в условиях, достаточных для обеспечения дифференцировки, где дифференцированные клетки формируют эпителиальный монослой, и при этом к клеткам прикладывается натяжение. Способ может далее содержать этап засевания клеток на лишенный клеток каркас перед дифференцировкой клеток. Когда способ содержит этот этап, может быть использован способ для изготовления биосинтетического устройства по изобретению. Лишенный клеток биологический матричный каркас может быть выполнен из ткани млекопитающих (такой как, например, ткань свиньи), такой как ткань слизистой или подслизистой оболочки. В одном варианте осуществления, лишенный клеток биологический матричный каркас получен из пищевода млекопитающего. В другом варианте осуществления, лишенный клеток биологический матричный каркас выполнен из желудка, двенадцатиперстной кишки, тощей кишки, подвздошной кишки или толстой кишки млекопитающего. Одна или более клеток, дифференцируемых в клетки почек, выбраны из группы, состоящей из первичных клеток эпителия почечных канальцев, индуцируемых полипотентных стволовых клеток или прогениторных клеток, дифференцированных в клетки почек или почечные прогениторные клетки, дифференцируемые в клетки почек или почечные прогениторные клетки, стволовых клеток, изолированных из почек, или прогениторных клеток, изолированных из почек, и их смесей. В одном варианте осуществления, одна или более клеток, дифференцируемых в клетки почек, представляют собой клетки, выделенные из почек млекопитающих (таких как, например, клетки, выделенные из почек человека). Клетки, выделенные из почек млекопитающих, могут быть получены из коркового вещества почки, мозгового вещества почки, подкапсульной зоны почки и их смесей. В одном варианте осуществления, клетки, выделенные из почек, способны к самообновлению и размножению в культуре и являются положительными в отношении экспрессии одного или более Oct-4, Pax-2 и Rex-1 и отрицательными в отношении экспрессии одного или более Sox2, FGF4, hTert и Wnt-4. В другом варианте осуществления, клетки, выделенные из почек, способны к самообновлению и размножению в культуре и являются положительными в отношении экспрессии, по меньшей мере, одного из Eya1, Pax2, WT1, FoxD1, BMP7, BMP2, GDF5, EpoR или Rex-1 и отрицательными в отношении экспрессии, по меньшей мере, одного из Sox2, FGF4, hTert или Wnt-4. В еще одном варианте осуществления, клетки, выделенные из почек, являются также положительными в отношении, по меньшей мере, одного из маркеров клеточной поверхности HLA I, CD24, CD29, CD44, CD49c, CD73, CD166 или SSEA-4, и отрицательными в отношении, по меньшей мере, одного из маркеров клеточной поверхности HLA II, CD31, CD34, CD45, CD56, CD80, CD86, CD104, CD105, CD117, CD133, CD138, CD141 или E-кадгерина.
КРАТКОЕ ОПИСАНИЕ ФИГУР
Предшествующее краткое изложение сущности изобретения, а также последующее подробное описание изобретения, будут более понятными при рассмотрении вместе с прилагаемыми фигурами. В целях иллюстрирования изобретения, на фигурах показаны варианты осуществления настоящего изобретения. Необходимо понимать, однако, что изобретение не ограничивается показанными точными конструкциями, примерами и инструментарием.
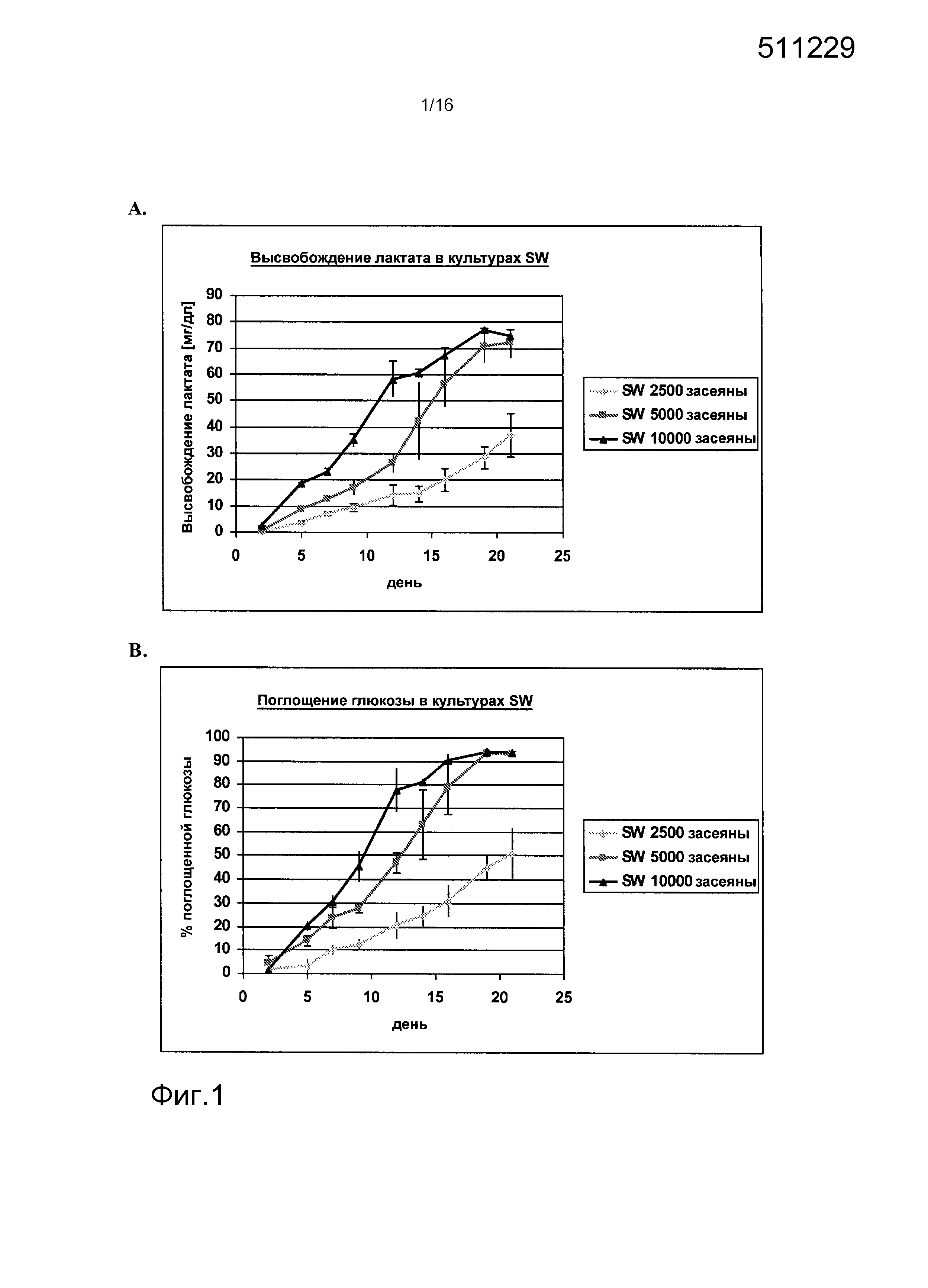
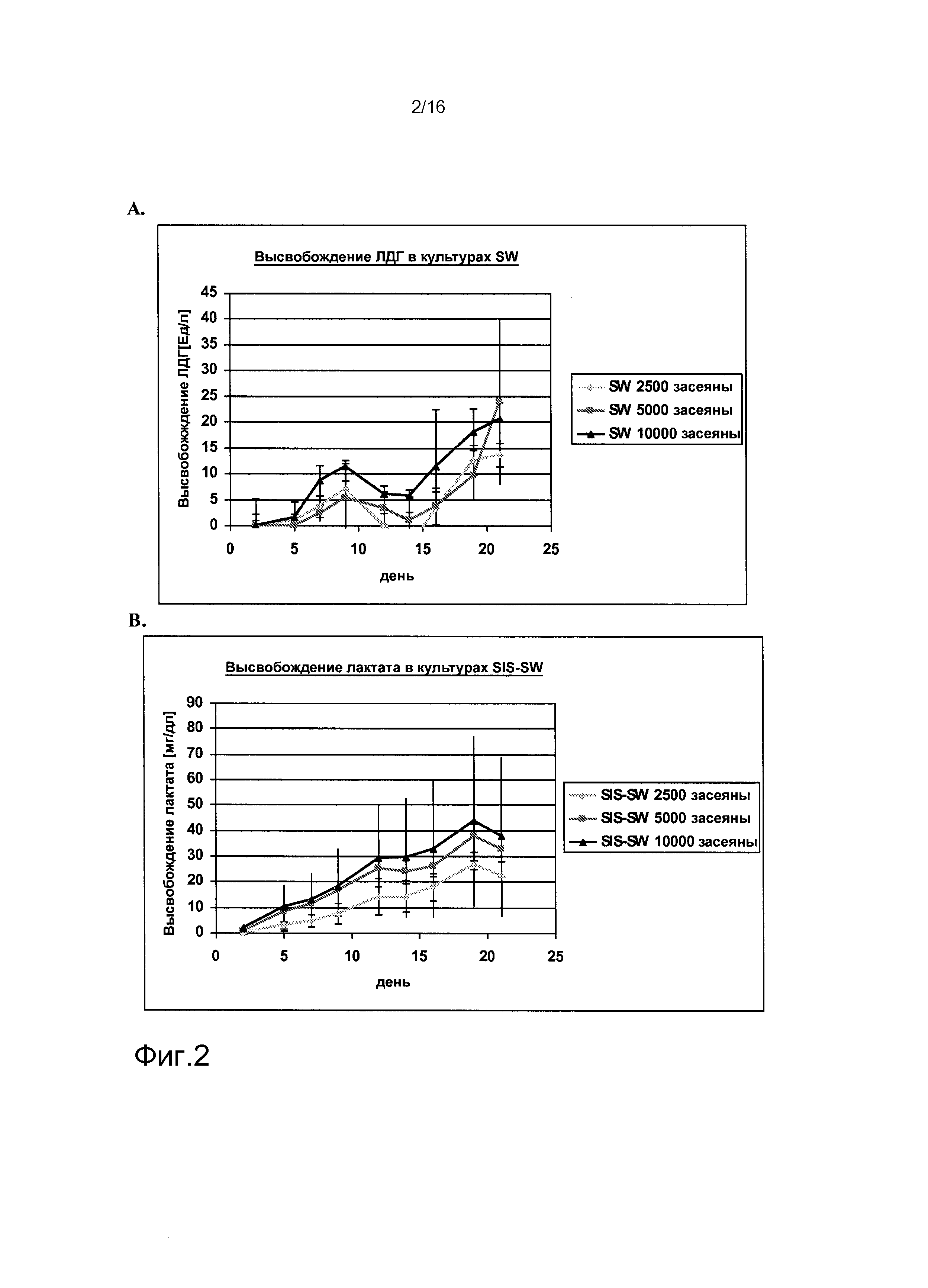
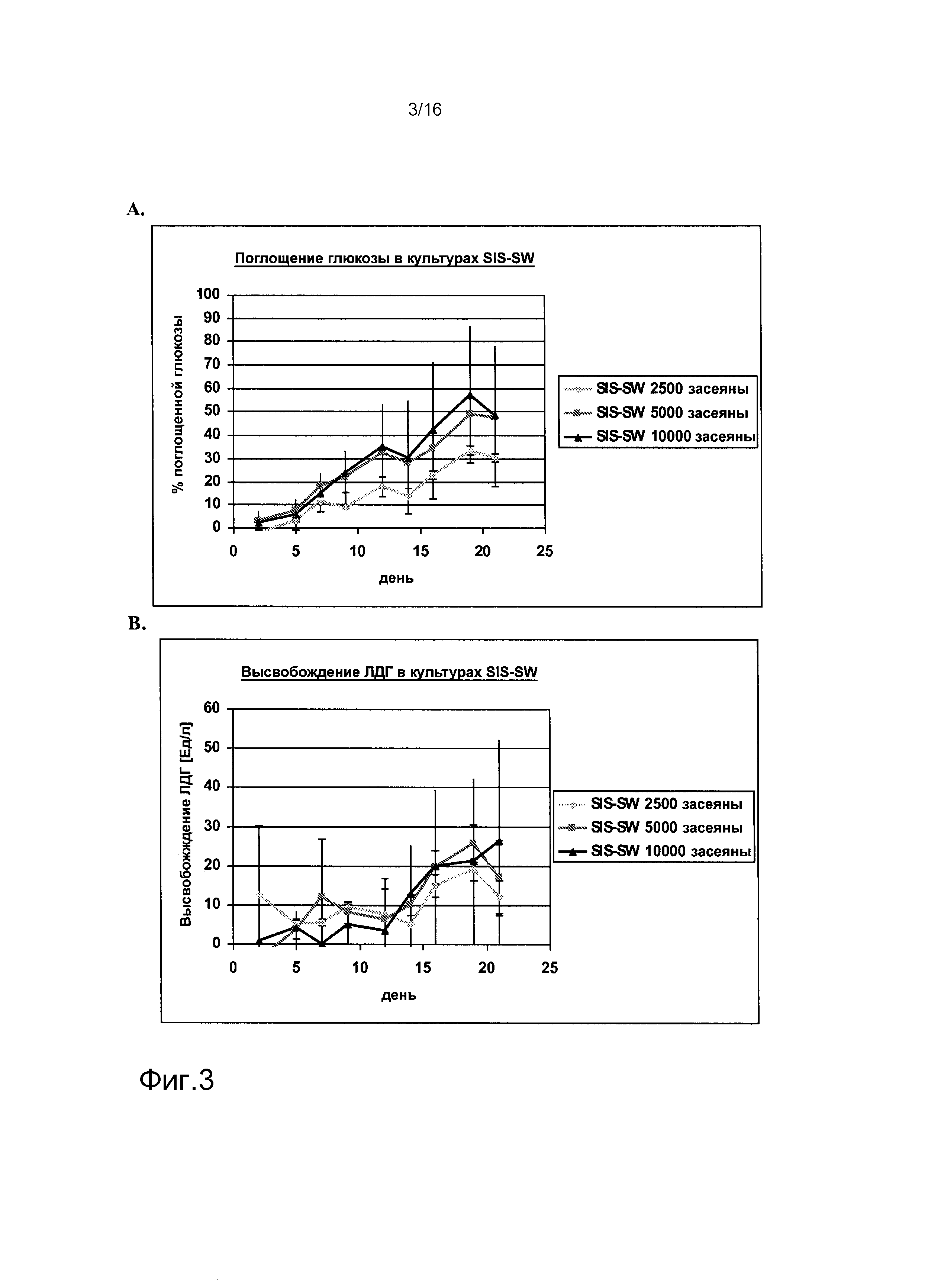
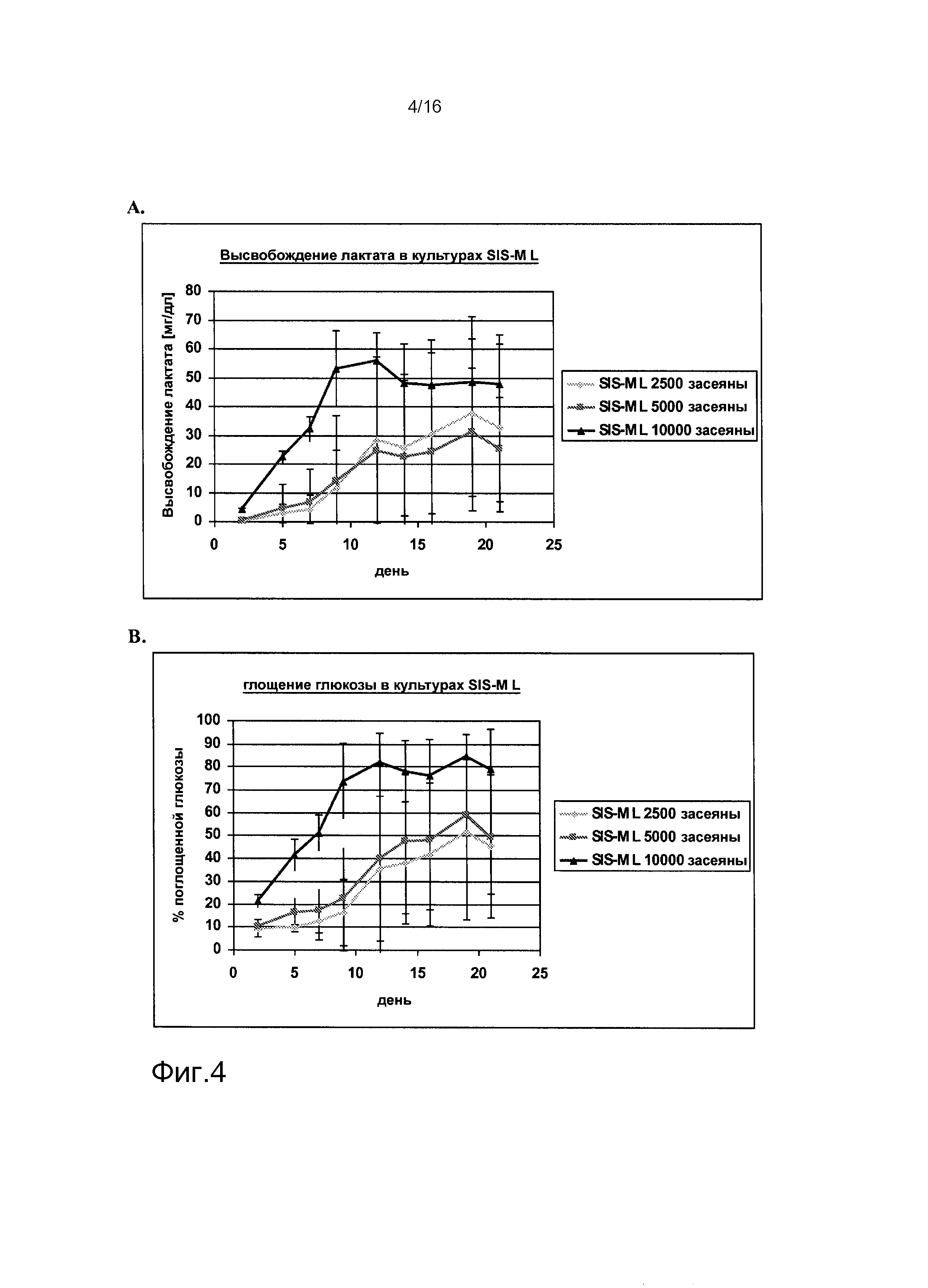
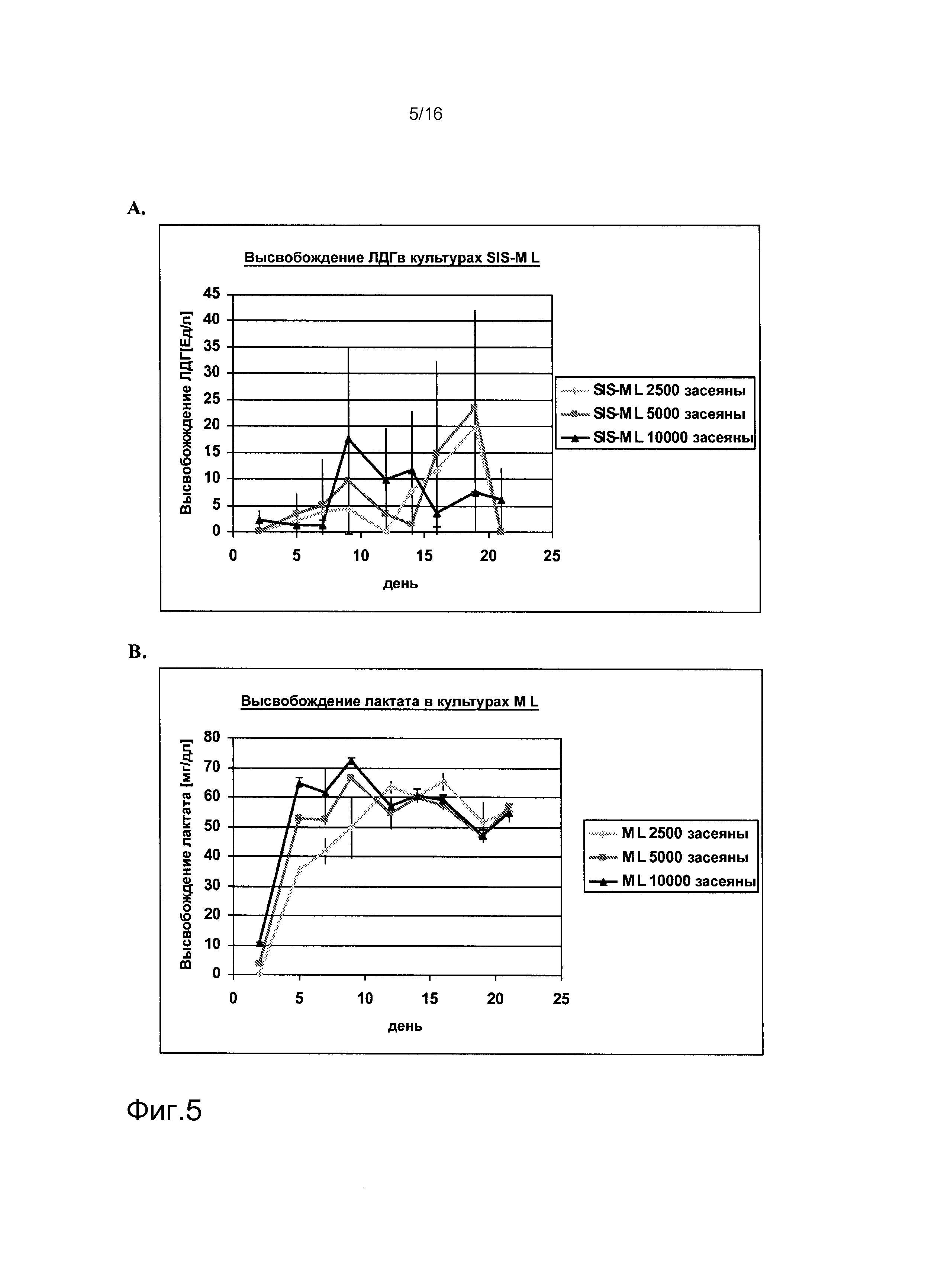
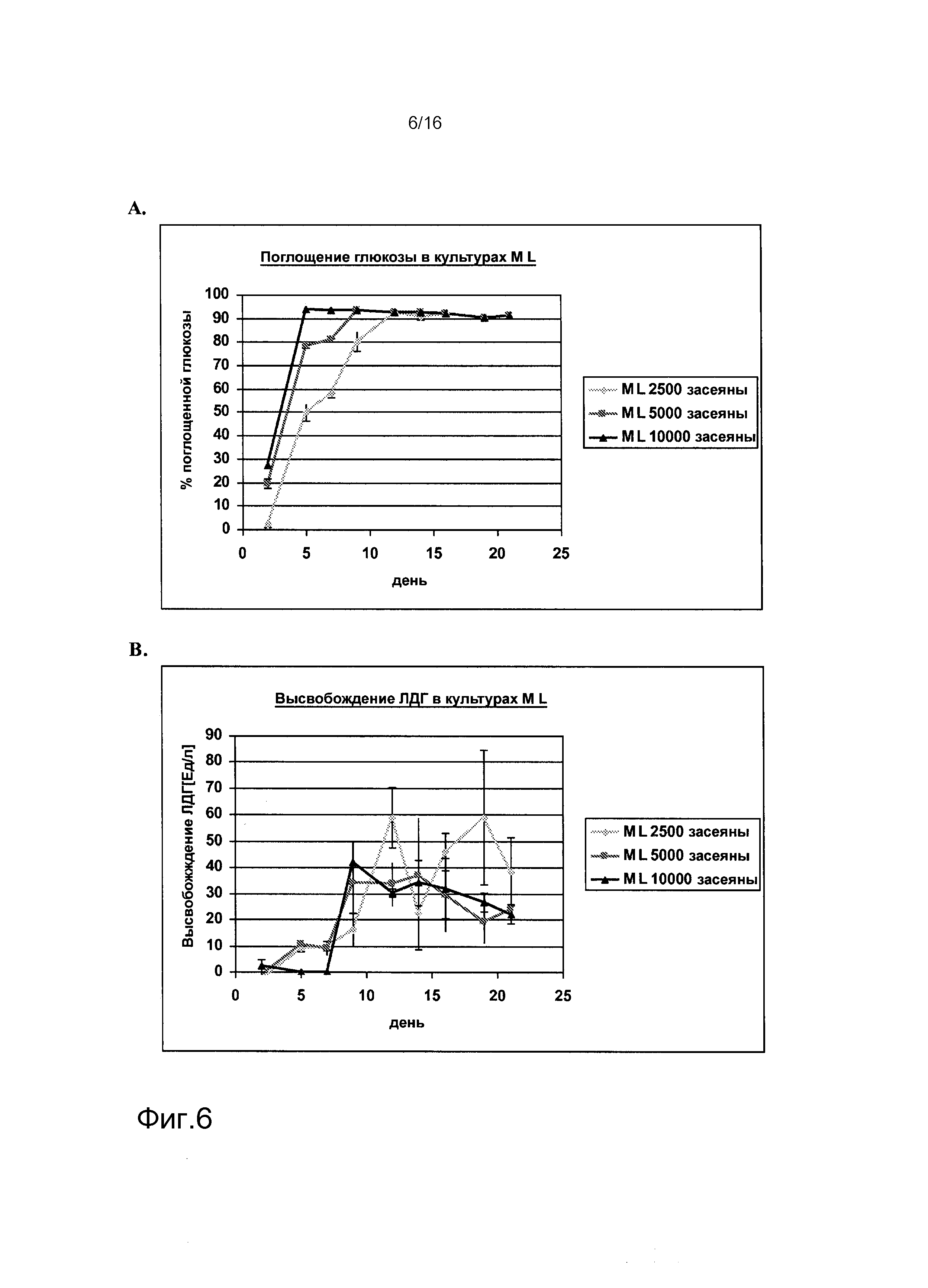
На фигурах 1-6 показаны результаты анализа метаболических параметров клеток, выделенных из почек человека. На фигуре 1A показано высвобождение лактата в культурах клеток, выделенных из почки человека («культуры SW»), как функция времени. На фигуре 1B показано потребление глюкозы в культурах SW как функция времени. На фигуре 2A показано высвобождение ЛДГ в культурах SW как функция времени. На фигуре 2B показано высвобождение лактата в клеточных культурах клеток, выделенных из почек человека, засеянных на лишенной клеток подслизистой тонкого кишечника (SIS) (культуры «SIS-SW»), как функция времени. На фигуре 3A показано потребление глюкозы в культурах SIS-SW как функция времени. На фигуре 3B показано высвобождение ЛДГ в культурах SIS-SW как функция времени. На фигуре 4A показано высвобождение лактата в монослоях, выращиваемых из клеток, выделенных из почек человека, которые засеяны на лишенной клеток подслизистой тонкого кишечника (SIS) (культуры “SIS-ML”) как функция времени. На фигуре 4B показано поглощение глюкозы в культурах SIS-ML как функция времени. На фигуре 5A показано высвобождение ЛДГв культурах SIS-ML как функция времени. На фигуре 5B показано высвобождение лактата в ML культурах как функция времени. На фигуре 6A показано поглощение глюкозы в ML культурах как функция времени. На фигуре 6B показано высвобождение ЛДГ в ML культурах как функция времени. На фигурах 1-6 n=3.
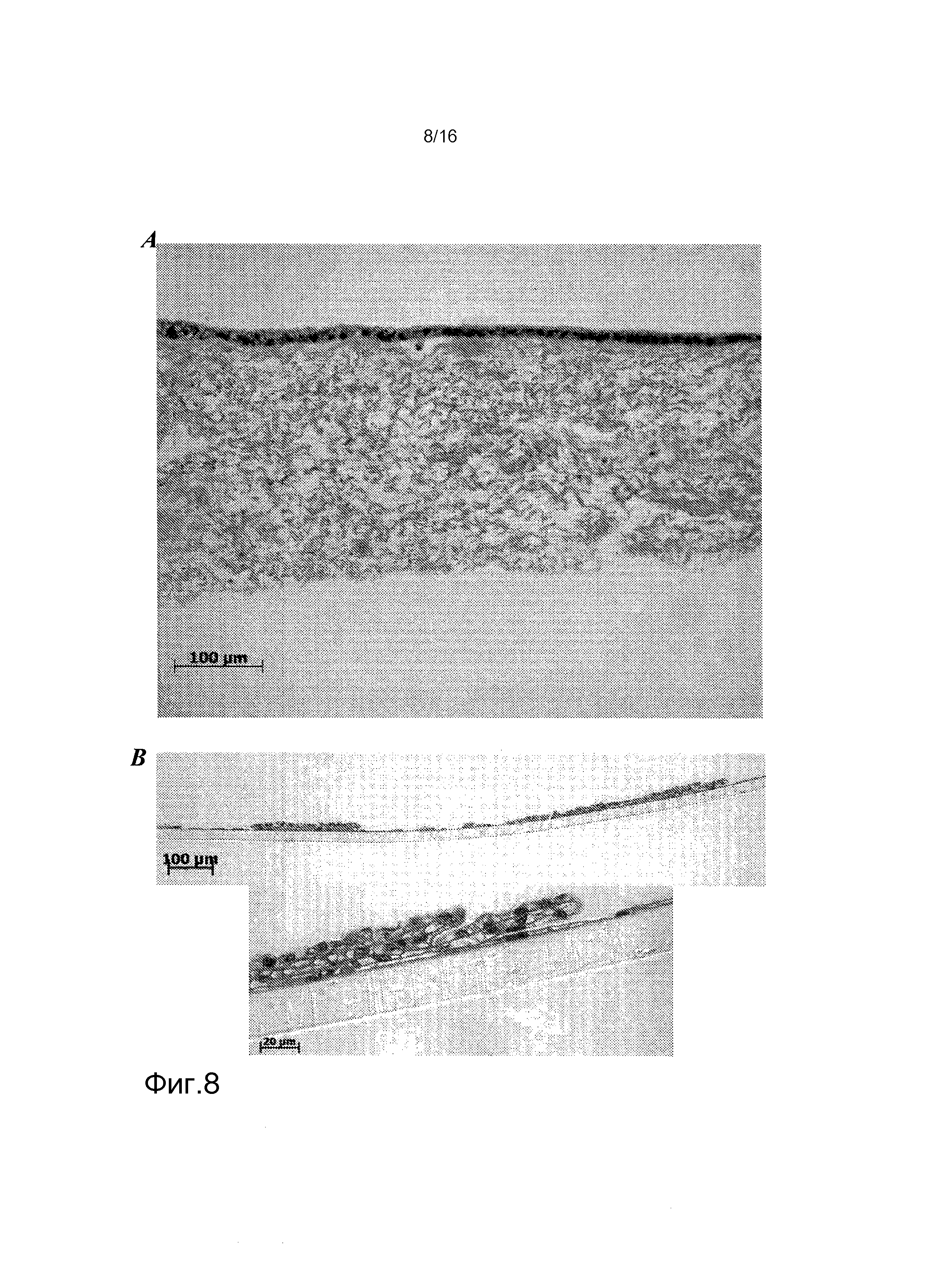
На фигурах 7 и 8 показано гистологическое окрашивание клеток, выделенные из почек человека (hKDCs) на внеклеточных (т.е. лишенных клеток) матричных каркасах. Клетки, выделенные из почек человека, были засеяны на трех различных конфигурациях каркаса в концентрации 2,5×103 клеток/каркас и культивировались в течение трех недель. Затем пробы фиксировали, и срезы окрашивали гематоксилином и эозином (Г&Э). На фигуре 7A показано гистологическое окрашивание культуры между двумя слоями коллагена. На фигуре 7B показано гистологическое окрашивание культуры лишенной клеток подслизистой тонкого кишечника (SIS) между двумя слоями коллагена. На фигуре 8A показано гистологическое окрашивание культуры SIS лишенного клеток монослоя. На фигуре 8B показано гистологическое окрашивание культуры, покрытой коллагеном, на вкладыше типа Transwell.
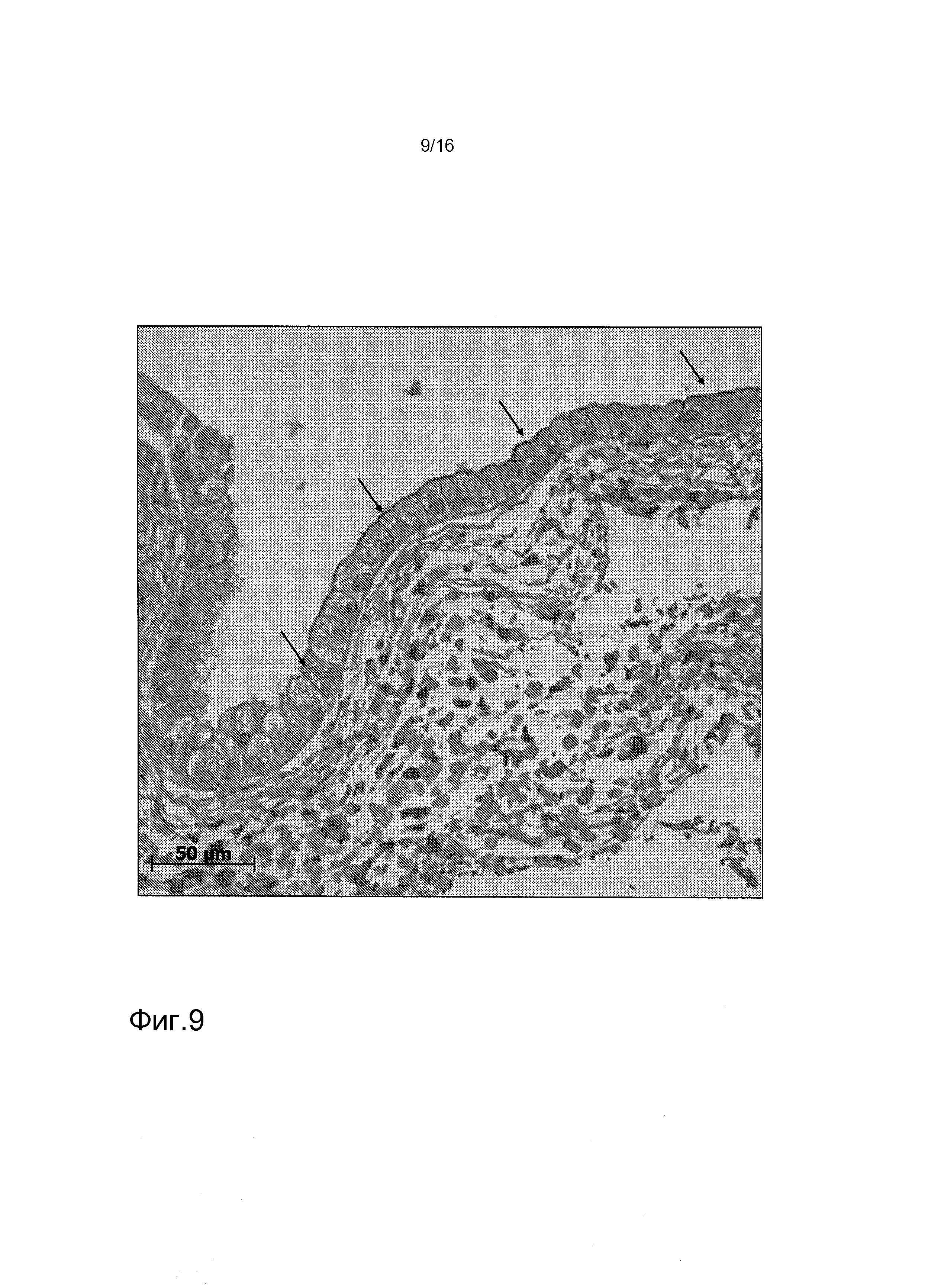
На фигуре 9 показано обнаружение иммуногистохимическим способом аквапорина-1 с помощью клеток hKDCs, высеянных на внеклеточных (лишенных клеток) матричных каркасах. Клетки, выделенные из почки человека, высеивали на лишенные клеток каркасы SIS и оставляли прикрепляться в течение ночи. Пробы культивировали в течение трех недель, затем фиксировали. В дальнейшем, для иммунохимического анализа использовали срезы толщиной 3 мкм с античеловеческим антителом аквапорин-1 (фирма «Abcam», Кембридж). Стрелки указывают на области апикального окрашивания клеток.
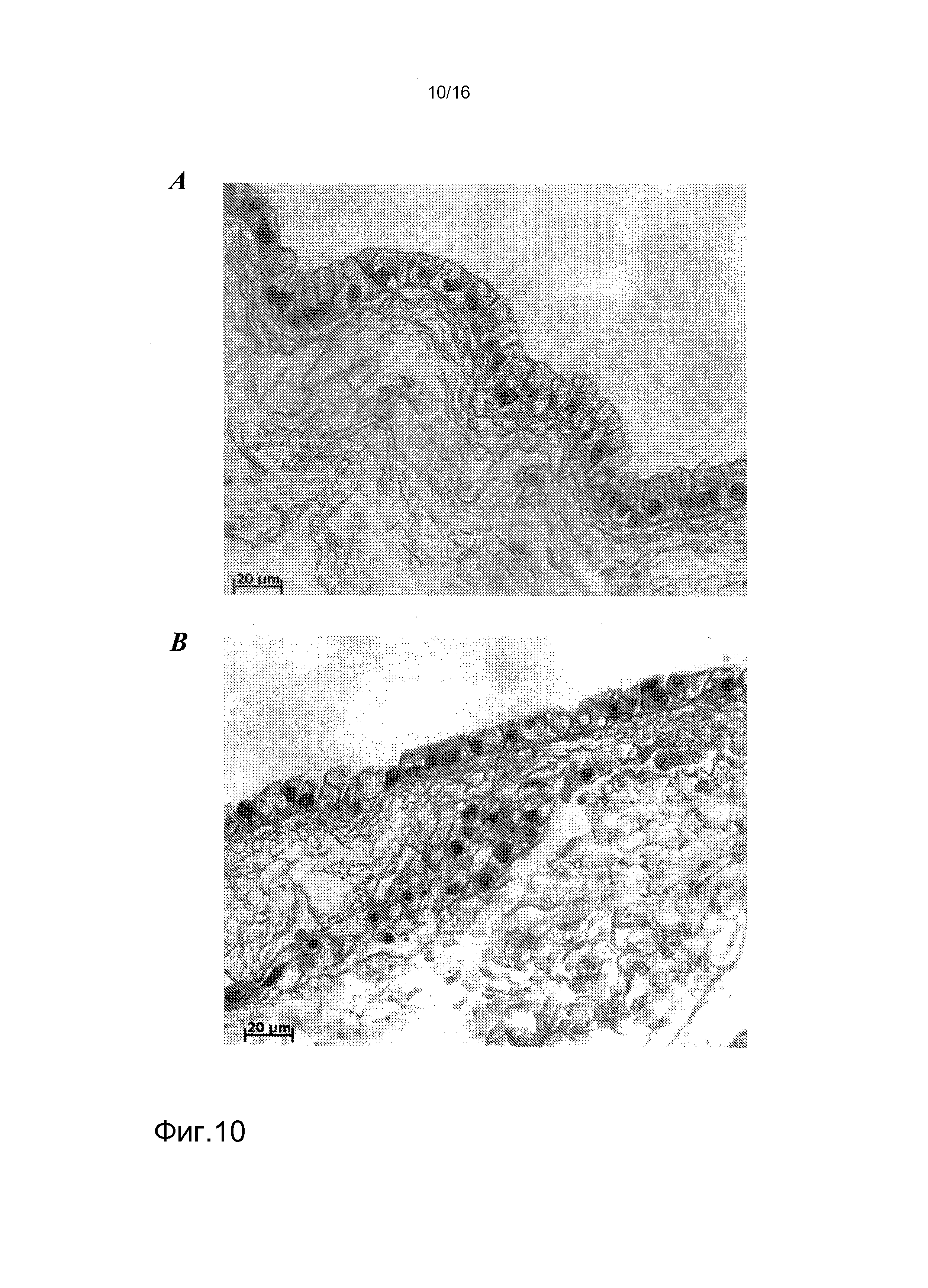
На фигуре 10 показано гистологическое окрашивание клеток hKDCs, засеянных на лишенных клеток каркасах. Клетки, выделенные из почек человека, засеивали на лишенные клеток каркасы SIS в двух различных клеточных концентрациях и культивировали в течение трех недель, затем фиксировали. Впоследствии, срезы толщиной 3 мкм окрашивали гематоксилином и эозином (Г&Э). На фигуре 10A показано окрашивание Г&Э пробы, засеянной с концентрацией 1×104 клеток. На фигуре 10B показано окрашивание Г&Э пробы, засеянной с концентрацией 5×104 клеток.
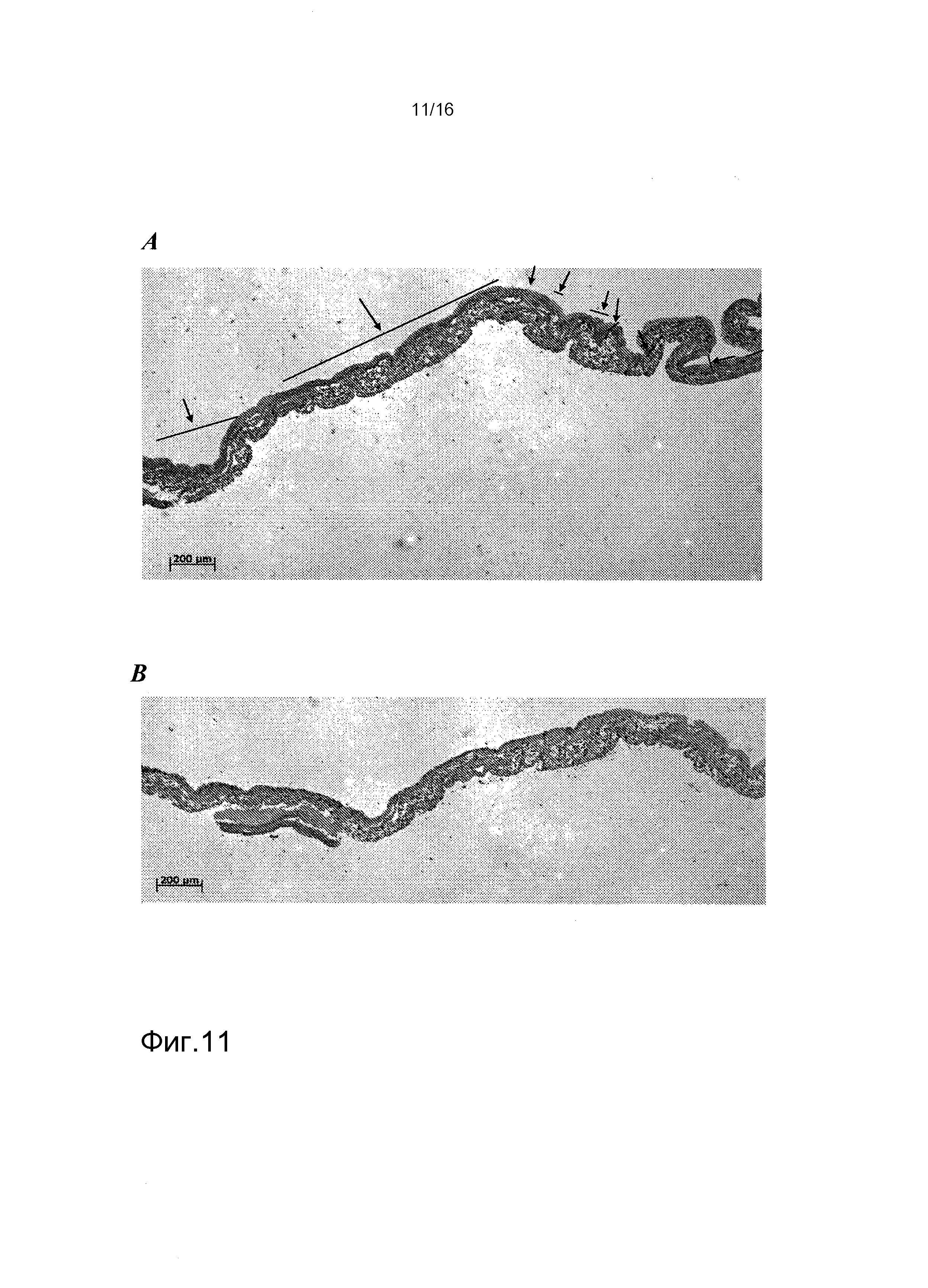
На фигуре 11 показано окрашивание лектином трехнедельных культур hKDC, засеянных на лишенные клеток каркасы. Клетки, выделенные из почек человека, засеивали на лишенные клеток каркасы SIS и культивировали в течение трех недель, затем фиксировали. Впоследствии, срезы толщиной 3 мкм окрашивали лектином из Lotus tetragonobulus (фигура 11A) агглютинином из Dolichos biflorus (фигура 11B). Стрелки и линии на фигуре 11A указывают области положительного окрашивания.
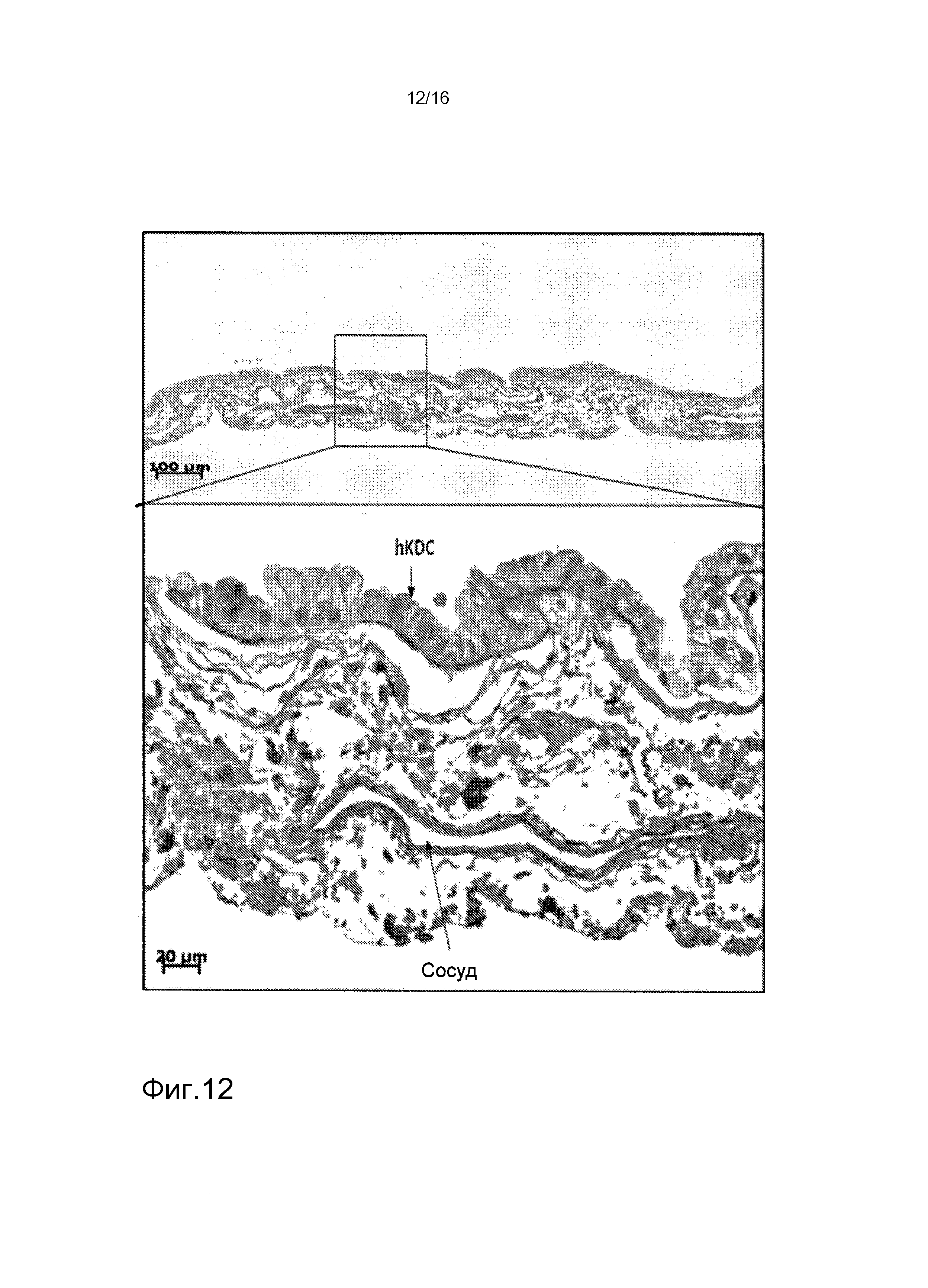
На фигуре 12 показано окрашивание коллагена IV типа клеток hKDC, засеянных на лишенные клеток каркасы. Клетки, выделенные из почек человека, засеивали на лишенные клеток каркасы SIS и культивировали в течение трех недель, затем фиксировали. Впоследствии срезы толщиной 3 мкм окрашивали антиколлагеновым антителом IV типа.
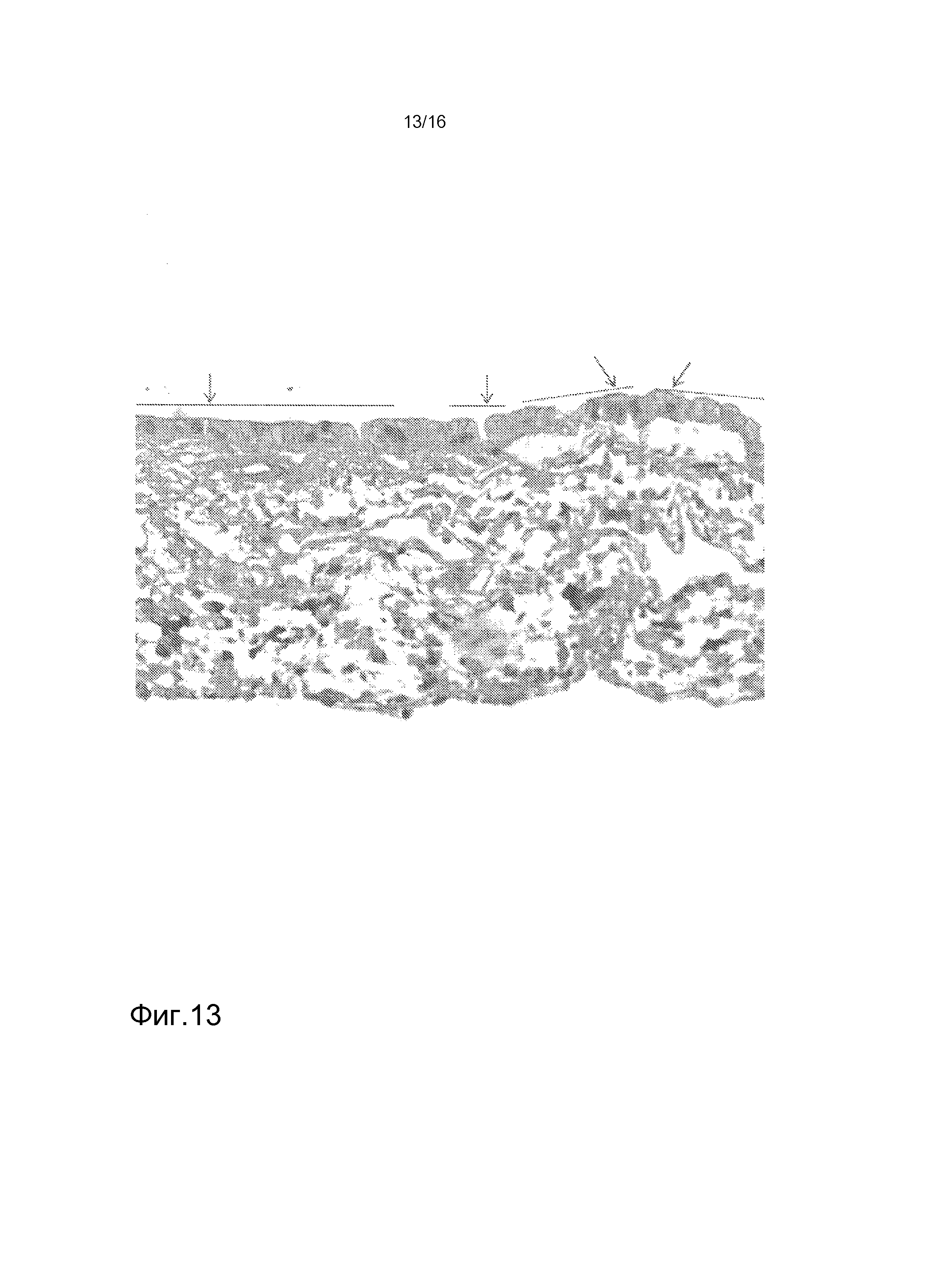
На фигуре 13 показано окрашивание P-гликопротеина-1 клеток hKDC, засеянных на лишенные клеток каркасы. Клетки, выделенные из почек человека, засеивали на лишенные клеток каркасы SIS и культивировали в течение трех недель, затем фиксировали. Впоследствии, срезы толщиной 3 мкм окрашивали античеловеческим антителом к P-гликопротеину-1.
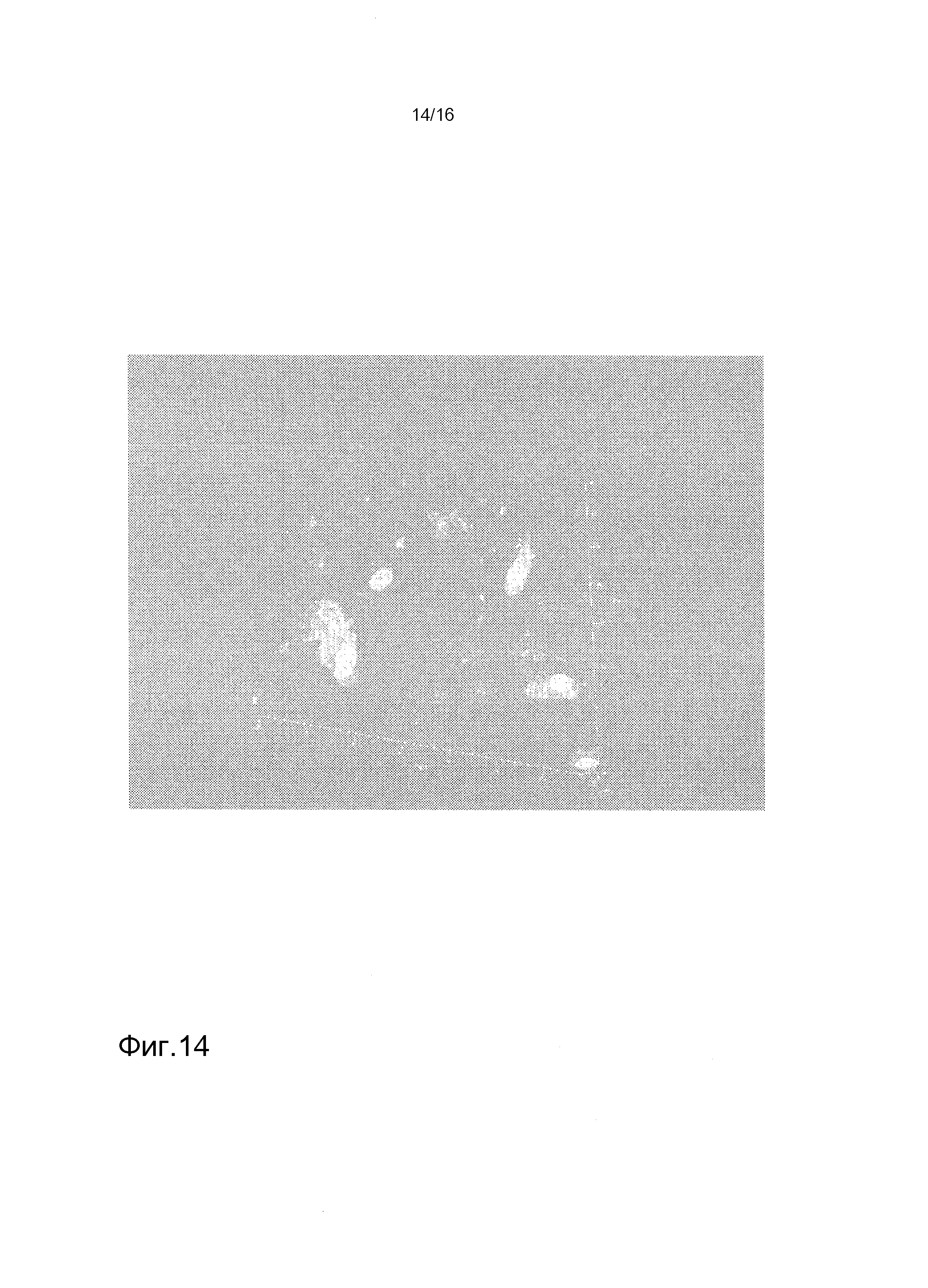
На фигуре 14 показано поглощение флуоресцентно меченого альбумина бычьей сыворотки (BSA-FITC) клетками hKDC, засеянными на лишенные клеток каркасы. Клетки, выделенные из почек человека, засеивали на лишенные клеток каркасы SIS, культивированные в течение двух недель, и затем культивировали в присутствии BSA-FITC в течение 1 часа. Впоследствии, клетки докрашивали DAPI (диамидино-2-фенилиндол) и получали их изображение.
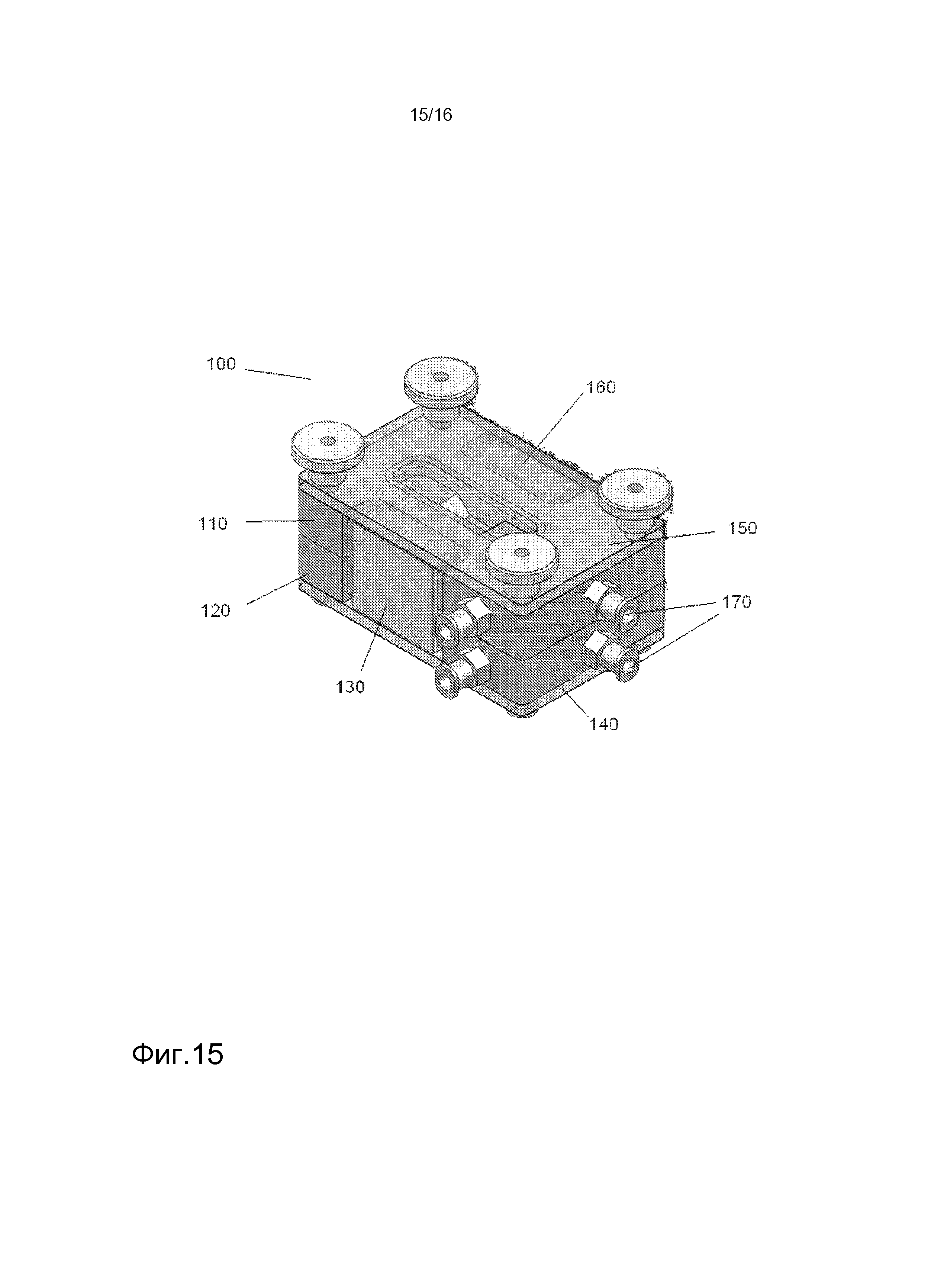
На фигуре 15 представлена схема биореактора для культивирования клеток, показывающая основные компоненты реактора.
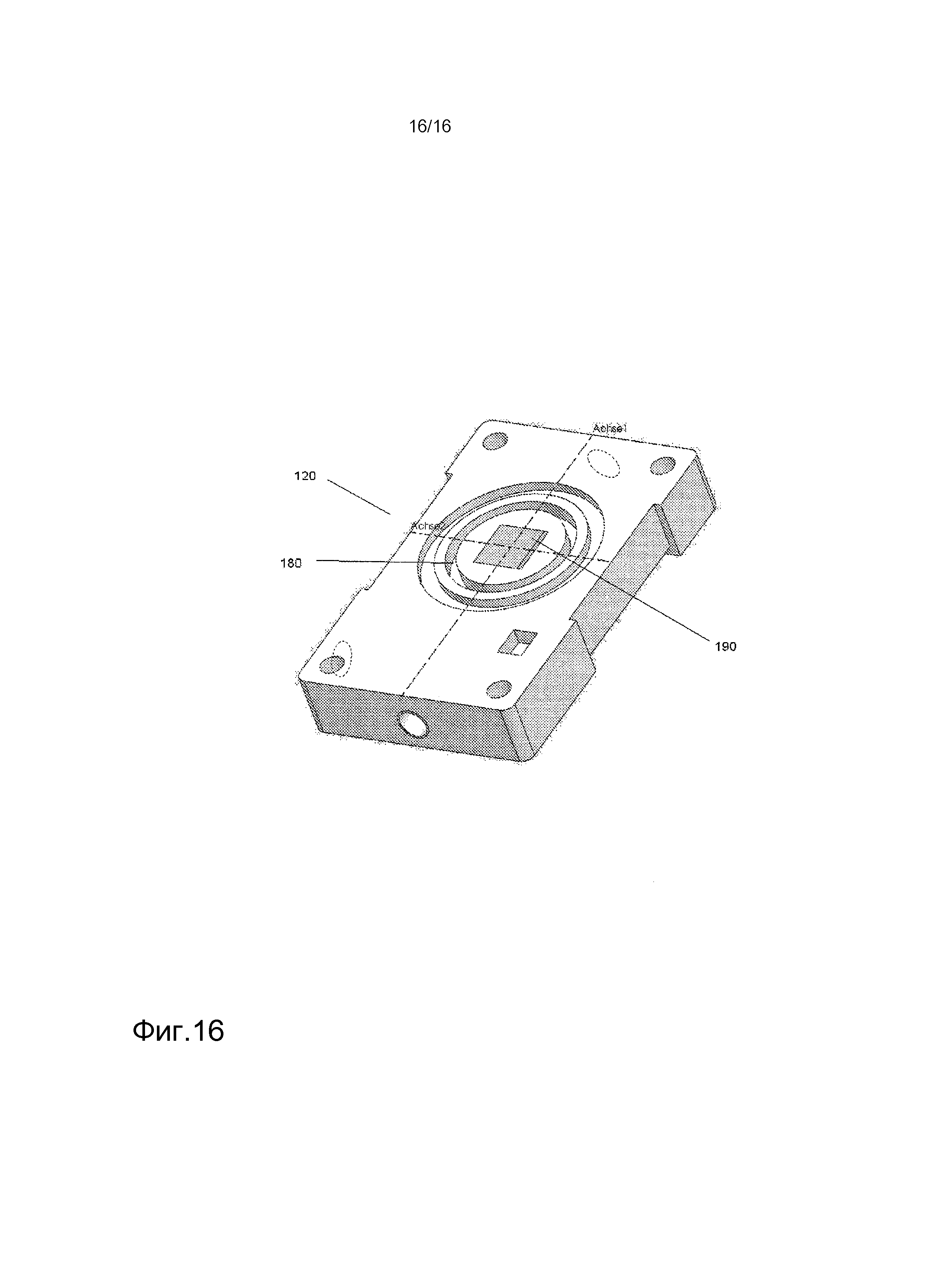
На фигуре 16 показано подробное изображение нижнего элемента корпуса биореактора.
ПОДРОБНОЕ ОПИСАНИЕ
Различные термины, относящиеся к устройству, способам применения устройства и другим аспектам изобретения, используются по всей спецификации и формуле изобретения. Такие термины должны иметь смысл, который они обычно имеют в этой области, если только не указано иное. Другие специально обозначенные термины, следует толковать в соответствии с определением, представленным в этом документе.
Это изобретение основано на открытии клеток-предшественников, которые могут дифференцировать в клетки почек (клетки, дифференцируемые в клетки почек) (таких как, например клетки, выделенные из почек), когда их засеивают на лишенный клеток биологический матричный каркас в условиях, обеспечивающих дифференцировку, формируют монослой эпителиальных клеток проксимальных почечных канальцев на поверхности каркаса.
Необходимо понимать, что это изобретение не ограничивается конкретными способами, реагентами, соединениями, композициями или биологическими системами, которые, конечно, могут варьироваться. Следует также иметь в виду, что применяемые в настоящем документе термины используются только в целях описания конкретных вариантов осуществления настоящего изобретения и не носят ограничительного характера. При использовании в этом описании и в прилагаемой формуле изобретения, формы единственного числа включают и множественное число, если только содержание текста ясно не указывает на иное. Так, например, обозначение «клетка» включает в себя сочетание двух или более клеток, и подобное.
При использовании в настоящем документе, термин «примерно», когда он относится к измеряемому значению, такому как количество, длительность времени и тому подобное, означает колебания в пределах ±20% или ±10%, более предпочтительно ±5%, еще более предпочтительно ±1%, и еще более предпочтительно ±0,1% от указанного значения, в зависимости от того, какие колебания подходят для осуществления раскрываемых способов.
Все технические и научные термины, используемые в настоящем документе, если не указано иное, имеют общепринятое значение, понятное любому специалисту в данной области, к которой имеет отношение настоящее изобретение. Хотя любые способы и материалы, подобные или эквивалентные тем, что описаны в этом документе, могут использоваться на практике для испытаний по настоящему изобретению, предпочтительные материалы и способы описаны в настоящем документе. При описании и изложении формулы настоящего изобретения будут использоваться следующие термины.
«Дифференцировка» представляет собой процесс, при помощи которого неспециализированная («некоммитированная») или менее специализированная клетка приобретает свойства специализированной клетки, такой как клетка почки. «Дифференцированная клетка или клетка с индуцированной дифференцировкой» представляет собой клетку, занявшую более специализированную («коммитированную») позицию в пределах клеточной линии. Термин «коммитированная» применительно к процессу дифференцировки обозначает клетку, развившуюся на пути дифференцировки до точки, в которой в нормальных условиях она продолжит дифференцировать в определенный тип клеток или подкласс типов клетки и не сможет в нормальных условиях дифференцировать в другой тип клетки или вернуться к прежнему менее дифференцированному типу клетки. «Дедифференцировка» обозначает процесс, в ходе которого клетка возвращается к менее специализированной (или коммитированной) позиции в клеточной линии дифференцировки. При использовании в настоящем документе термин ”клеточная линия дифференцировки" означает наследственность клетки, т.е. из каких клеток произошла данная клетка, и каким клеткам она может дать начало. В клеточной линии дифференцировки клетка помещается в наследственную схему развития и дифференцировки. «Дифференцировочный линиеспецифический маркер» обозначает характеристику, специфически ассоциированную с фенотипом клеток рассматриваемой клеточной линии дифференцировки, этот маркер может применяться для оценки дифференцировки некоммитированной клетки в клетки рассматриваемой клеточной линии дифференцировки.
В широком смысле, «прогениторная клетка» представляет собой клетку обладающую способностью создавать потомство клеток, которые будут более дифференцированными по сравнению с ней, и при этом сохранять способность к пополнению пула прогениторных клеток. По данному определению, сами стволовые клетки также представляют собой прогениторные клетки, поскольку являются ближайшими предшественниками окончательно дифференцированных клеток. При обозначении клеток, описываемых в этом документе, может использоваться это широкое определение «прогениторной клетки». Дифференцированная клетка может быть получена из полипотентной клетки, которая сама получена из полипотентной клетки и так далее. Поскольку каждая из этих полипотентных клеток может рассматриваться как стволовая клетка, ряд клеточных типов, которым каждая может дать начало, может значительно варьироваться. Некоторые дифференцированные клетки также имеют способность давать начало клеткам с более высоким потенциалом развития. Такая способность может быть природной или индуцированной искусственно при обработке различными факторами. «Пролиферация» обозначает увеличение количества клеток.
«Прогениторные клетки почки» при использовании в этом документе - это клетки, выделенные из почек млекопитающего (например, человека), которые могут дать начало клеткам, таким как адипоциты или остеобласты, или могут дать начало одному или более типам ткани, например, почечной ткани, в дополнение к продуцированию дочерних клеток эквивалентного потенциала. «Почечная прогениторная клетка или прогениторная клетка почки» - это полипотентная или плюрипотентная клетка, которая происходит по существу из взрослой или эмбриональной ткани почки. Известно, что эти клетки обладают признаками, характерными для плюрипотентных стволовых клеток, включая быструю пролиферацию и потенциал дифференцировки в другие клеточные линии дифференцировки. «Полипотентные» прогениторные клеткки почек могут давать начало множественным клеточным линиям дифференцировки, например, линиям дифференцировки почечных клеток, линиям дифференцировки адипоцитов или линиям дифференцировки остебластов. Прогениторные клетки почек демонстрируют профиль экспрессии генов по генным маркерам раннего развития, генным маркерам развития почки, метанефрическим мезенхимальным генным маркерам и генам, которые обеспечивают выживание метанефрической мезенхимы. Например, прогениторные клетки почек (например, клетки, выделенные из почек человека) демонстрируют профиль экспрессии генов, который является положительным в отношении экспрессии генов, включая, помимо прочего, Oct-4, Pax-2 и Rex-1, и отрицательным в отношении экспрессии генов, включая, помимо прочего, Sox2, FGF4, hTERT и Wnt-4.
«Ткань» обозначает группу или слой сходным образом специализированных клеток, которые совместно друг с другом осуществляют определенные специальные функции. «Орган» обозначает два или более смежных слоев ткани, причем эти слои ткани сохраняют некоторую форму взаимодействия «клетка-клетка» и/или «клетка-матрица» для формирования микроархитектуры.
«Почка» обозначает один или пару органов в брюшной полости. Почки удаляют продукты жизнедеятельности из крови (в виде мочи), производят эритропоэтин для стимуляции продукции эритроцитов и участвуют в регулировании артериального давления. Функцией почек является поддержание адекватного водно-электролитного баланса, регулирование кислотно-щелочного равновесия, фильтрацию крови от продуктов жизнедеятельности, которые затем выводятся с мочой.
«Первичная культура» обозначает смешанную клеточную популяцию клеток, которая делает возможным взаимодействие множественных различных типов клеток, изолированных из ткани. Слово «первичный» употребляется в своем обычном значении, принятом в области культуры ткани. «Способная к самообновлению и размножению в культуре» обозначает популяции клеток, выделенных из почек млекопитающего, которые растут и делятся в клеточной культуре и сохраняют по существу тот же фенотип, при измерении клеточными маркерами и секрецией трофических факторов, от материнской клетки к дочерней клетке. В определенной точке во время репликации популяции клеток, выделенных из почек млекопитающего, фенотип может измениться на более специализированное или дифференцированное состояние клетки, выделенной из почки.
Для описания клеток в культуре используются различные термины. «Клеточная культура» обозначает в целом клетки, отобранные из живого организма и выращенные в контролируемых условиях, например, «в культуре». «Первичная клеточная культура» - это культура клеток, тканей или органов, отобранных непосредственно из организмов, и перед первым пересевом. Клетки «размножаются» в культуре, когда их помещают в питательную среду в условиях, способствующих росту и/или делению клеток, что приводит к увеличению популяции клеток. При размножении клеток в культуре скорость пролиферации клеток иногда измеряют по количеству времени, которое необходимо клеткам для удвоения численности. Данное время называют «временем удвоения».
«Клеточная линия» представляет собой популяцию клеток, образованную одним или более пересевами из первичной клеточной культуры. Каждый цикл пересева называют пассажем. Когда клетки пересеиваются, их называют «пассированными». Определенная популяция клеток, или клеточная линия, иногда обозначается или характеризуется количеством раз, сколько она была пассирована. Например, пассированная 10 раз культивируемая популяция клеток может описываться как культура десятого пассажа, или культура «P10». Первичная культура, т.е. первая культура после изолирования клеток из ткани, обозначается P0. После первого пересева клетки описываются как вторичная культура (P1, или культура первого пассажа). После второго пересева клетки превращаются в третичную культуру (P2, или культура второго пассажа) и т.п. Специалистам в данной области будет понятно, что за период пассирования популяция клеток может многократно удваиваться; следовательно количество удвоений популяции в культуре обычно больше номера пассажа. Размножение клеток (т.е. количество удвоений популяции) за период времени между пассированиями, зависит от многих факторов, включая, помимо прочего, плотность высева, субстрат, среду и время между пассированиями.
В целом, «трофический фактор» определяют как вещество, способствующее выживанию, росту, пролиферации, созреванию, дифференцировке и/или поддерживанию стабильности клетки, или стимулирующее повышенную активность клетки. «Трофическая поддержка» при использовании в настоящем документе обозначает способность обеспечивать выживание, рост, пролиферацию, созревание, дифференцировку и/или поддержание стабильности клетки, или стимулировать повышенную активность клетки. Популяция клеток, выделенных из почек млекопитающего, по настоящему изобретению продуцирует трофические факторы, включая, помимо прочего, факторы роста, цитокины и факторы дифференцировки. Трофические факторы включают в себя, помимо прочего, FGF2, HGF, TGFα, TIMP-1, TIMP-2, VEGF, MMP-2 или их комбинации.
«Неиммуногенный» обозначает клетки или клеточные популяции, которые не вызывают повреждающего иммунного ответа у большинства особей млекопитающих, подвергнутых их воздействию, этот тот иммунный ответ, который нарушает здоровье особи млекопитающего, или тот, что мешает ответу на терапию у особи млекопитающего, подвергающемуся воздействию.
«Ген» обозначает последовательность полинуклеотидов, кодирующих генный продукт. Ген дополнительно содержит информацию о последовательности, необходимую для экспрессии гена (например, промоторы, энхансеры и т.д.). Термин «геномны» относится к геному организма.
«Данные экспрессии гена» обозначает один или более наборов данных, который содержат информацию, относящуюся к различным аспектам экспрессии гена. Набор данных дополнительно включает информацию в отношении: присутствия целевых транскриптов в клеточный или выделенных из клетки проб; уровней относительной и абсолютной представленности целевых транскриптов; способности различных типов обработки индуцировать экспрессию определенных генов; и способности различных типов обработки изменять экспрессию определенных генов до разных уровней.
«Профиль экспрессии гена» обозначает репрезентацию уровня экспрессии множества генов без участия (т.е. исходный или контрольный), или в ответ на выбранное условие экспрессии (например, инкубирование в присутствии стандартного соединения или испытуемого соединения в одну или несколько временных точек). Экспрессия гена может быть выражена в аспекте абсолютного качества мРНК, транскрибированной с каждого гена, как отношение мРНК, транскрибированной в испытуемой клетке по сравнению с контрольной клеткой и тому подобное. Это также относится к экспрессии отдельного гена и наборов отдельных генов в индивида.
«Изолированный» или «очищенный» обозначает измененный «рукой человека» из природного состояния, т.е. все, что происходит в природе определяется как изолированное, когда удаляется из своей природной окружающей среды, или и то и другое. «Изолированной» также называют композицию, например, популяцию клеток, выделенных из почек млекопитающего, которую отделяют от посторонних примесей (т.е. веществ, отличающихся от клетки). В одном аспекте, популяция или композиция клеток по существу свободна от клеток и материалов, с которыми может быть связана в природных условиях. «Изолированный» или «очищенный» или «по существу чистый», в отношении клеток, выделенных из почек млекопитающего, обозначает популяцию клеток, выделенных из почек млекопитающего, которые имеют чистоту, составляющую, по меньшей мере, примерно 50%, по меньшей мере, примерно 75%, предпочтительно, по меньшей мере, примерно 85%, более предпочтительно, по меньшей мере, примерно 90%, и наиболее предпочтительно, по меньшей мере, примерно 95%, относительно клеток, выделенных из почек млекопитающего, образующих общую клеточную популяцию. Другими словами, термин «по существу чистый» обозначает популяцию клеток, выделенных из почек млекопитающего по настоящему изобретению, которая содержит менее чем примерно 50%, предпочтительно, менее чем примерно 30%, предпочтительно, менее чем примерно 20%, более предпочтительно, менее чем примерно 10%, наиболее предпочтительно, менее чем примерно 5% коммитированных клеток почек клеточной линии дифференцировки в первоначальной неамплифицированной и изолированной популяции перед последующим культивированием и амплификацией. Чистоту популяции или композиции клеток можно оценить с помощью надлежащих способов, известных в данной области.
При использовании в настоящем документе термин «выделенные» будет также обозначать полученные. Так, например клетки, выделенные из почек человека, - это клетки, которые были изолированы или получены из ткани почки человека. Термин также охватывает клетки, полученные (например, изолированные) из ткани, а затем культивированные.
Это изобретение описывает устройство проксимального канальца, содержащее лишенный клеток биологический каркас и монослой эпителиальных клеток проксимального почечного канальца, образованный из клеток, дифференцируемых в клетки почки. Каркас и клетки совместно образуют многокомпонентное, двухмерное устройство проксимального канальца. Этот монослой эпителиальных клеток проксимального почечного канальца состоит из функционирующих клеток проксимального канальца.
Устройства проксимального канальца по этому изобретению оптимально способствуют функционированию природных регуляторных механизмов контактного ингибирования и формирования интактного монослоя без применения ингибиторов таких как, например, MEK-ингибиторы. С применением лишенного клеток биологического каркаса, устройства проксимального канальца по этому изобретению также успешно реализуют и/или имитируют лежащую в основе матрицу, с которой клетки почек обычно находятся во взаимодействии в условиях in vivo. Оптимальным образом, засев природного лишенного клеток каркаса позволяет клеткам дифференцироваться и образовывать эпителиальные монослои, которые отличаются более высокой стабильностью, чем те, что изготовлены с помощью традиционных способов.
Настоящее изобретение описывает двухмерное устройство проксимального канальца, которое можно использовать как систему для проведения испытаний в условиях in vitro в исследованиях переноса, скрининговых исследованиях токсичности или скринингового исследования действия лекарственных препаратов. В одном варианте осуществления, двухмерное биосинтетическое устройство проксимального почечного канальца выполнено с помощью засева лишенного клеток биологического каркаса прогениторными клетками почки, и дополнительно, в некоторых случаях также эндотелиальными клетками микрососудов, с последующим статическим культивированием или культивированием в биореакторе, чтобы обеспечить дифференцировку клеток почек в функционирующие клетки проксимальных канальцев и сохранения скомпонованного устройства для испытаний в условиях in vitro. Эти функционирующие клетки проксимального канальца формируют монослой на поверхности каркаса.
Настоящее изобретение также описывает использование лишенных клеток биологических каркасов как компонента описанного биосинтетического устройства проксимального канальца. Одна или более поверхностей лишенного клеток биологического каркаса могут быть засеяны клетками. В одном варианте осуществления, лишенный клеток каркас может быть получен из тканей млекопитающих, предпочтительно, частей пищеварительного тракта, наиболее предпочтительно, желудка, двенадцатиперстной кишки, тощей кишки, подвздошной кишки или толстой кишки. В одном варианте осуществления, ткань, из которой получен каркас, наиболее предпочтительно, является частью тощей кишки. В одном варианте осуществления, лишенный клеток биологический матричный каркас получен из ткани слизистой оболочки или подслизистой основы. В другом варианте осуществления, лишенный клеток биологический каркас получен из подслизистой основы тонкого кишечника млекопитающего. Лишенные клеток каркасы или их фрагменты, могут прикрепляться к устройствам, которые позволяют засевать каждую сторону поверхности каркаса.
Исходная ткань, используемая для создания лишенных клеток каркасов, может представлять собой любую ткань млекопитающего, включая, помимо прочего, ткань человека, примата, быка, овцы, свиньи или крысы. В одном варианте осуществления этого изобретения, ткань изолируют из млекопитающего. В другом варианте осуществления, лишенные клеток каркасы получены из клеточных культур млекопитающего. Еще в одном варианте осуществления, исходная ткань - это ткань свиньи. В предпочтительных вариантах осуществления, каркасы получены из тканей свиньи, изолированных из молодых животных, таких как, например молодых животных в возрасте моложе 6 месяцев или животных в возрасте моложе 3 месяцев. В более предпочтительных вариантах осуществления, каркасы получены из тканей свиньи, изолированных из молодых животных с массой тела, составляющей от примерно 10 до 25 кг, в ином случае, от примерно 10 до 20 кг, и еще в одном случае от примерно 15 до примерно 20 кг. В наиболее предпочтительном варианте осуществления, каркасы получены из тканей свиньи, изолированных из животных с массой тела, составляющей от примерно 10 до примерно 15 кг.
Для очистки ткани от клеток (например, децеллюляризации) можно использовать общепринятые способы. В одном варианте осуществления, структуры слизистой оболочки изолированной ткани стабилизируют во время изолирования. В предпочтительном варианте осуществления, структуры слизистой оболочки затем частично или полностью удаляются для присоединения клеток к подслизистому слою. В одном варианте осуществления изобретения, прогениторные клетки почек культивируют на структурах слизистой оболочки. Было отмечено, при культивировании на структурах подслизистой основы более высокий процент прогениторных клеток печени перенимает эпителиальную морфологию по сравнению со структурами слизистой оболочки. Соответственно, в другом варианте осуществления, прогениторные клетки почек оптимально культивируются на структурах подслизистой основы.
При использовании в этом документе, термин «клетки, дифференцируемые в клетки печени» обозначает клетку-предшественника, которая дифференцирует в клетки почек, например, любую прогениторную клетку, клетку-предшественника или первичную клетку, которая может дифференцировать в клетку почки. В одном варианте осуществления, клетки могут быть выбраны из первичных эпителиальных клеток почечного канальца, прогениторных (например, стволовых) клеток, дифференцированных в клетки почки или прогениторные клетки почки (такие как, например, индуцируемые полипотентные стволовые клетки), клетки, выделенные из почек человека, стволовые клетки, изолированные из почек, или прогениторные клетки, изолированные из почки, и их смеси. Могут быть использованы любые прогениторные (например, стволовые) клетки, которые могут быть дифференцированы в клетки почек или прогениторные клетки почек, включая, помимо прочего, например, эмбриональные стволовые клетки, индуцированные плюрипотентные стволовые клетки, клетки, выделенные из пуповины, клетки, выделенные из плаценты, или мезенхимальные стволовые клетки.
В одном варианте осуществления изобретения, дифференцируемые клетки - это клетки, выделенные из почек млекопитающего. Соответственно, один вариант осуществления настоящего изобретения представляет использование клеток, выделенных из почки млекопитающего, изолированного из почки млекопитающего (такой как, например, почка человека), в качестве компонента описанной биосинтетической почечной системы. Ранее было продемонстрировано, как описано в опубликованной заявке на патент США 2008/0112939, Colter и соавт., раскрытие которой полностью входит в настоящий документ путем отсылки, что прогениторные клетки могут быть получены из ткани почки человека, и эти клетки, выделенные из почек, могут самоорганизовываться в трубчатые структуры и могут использоваться для лечения больной почки.
Примеры технических приемов, используемых для изолирования, культивирования и характеризации клеток, выделенных из почек млекопитающего, описаны в опубликованной заявке на патент США 2008/0112939 Colter и соавт.l. Как описано в опубликованной заявке на патент США 2008/0112939, клетки, выделенные из почек человека, изолируют из почки человека, и они подходят для трансплантации органов. В одном варианте осуществления, перед изоляцией клеток из ткани почки удаляют кровь и продукты распада с помощью промывания любой подходящей средой или буфером, таким как забуференный фосфатом солевой раствор. Клетки, выделенные из почек, такие как, например клетки, выделенные из почек человека, затем изолируют из ткани почек млекопитающего посредством ферментативного переваривания. Для диссоциации клеток из ткани почек млекопитающего (например, человека) используют ферменты. В одном варианте осуществления, может быть использована диспаза. В альтернативном варианте, для диссоциации клеток из ткани почек млекопитающего (например, человека) используют комбинации нейтральной протеазы (например, диспазы), металлопротеазы (например, коллагеназы) и гиалуронидазы. Изолированные клетки затем переносят в стерильные сосуды для культур ткани, которые первоначально покрыты желатином. Клетки, выделенные из почек млекопитающего (например, человека) культивируются в любой питательной среде, способной поддерживать рост клеток, такой как, например, помимо прочего, REGM™ питательная среда для эпителия почек (фирма «Lonza», Уолкерсвилл, Мэриленд) или Advanced™ DMEM/F12 (фирма «Invitrogen»).
Клетки, дифференцируемые в клетки почек (например, клетки-предшественники, которые могут дифференцировать в клетки почек) или клетки, выделенные из почек млекопитающего, могут быть популяцией клеток. В одном варианте осуществления, используется популяция клеток, выделенных из почек человека. В другом варианте осуществления, популяция является однородной. В другом варианте осуществления, популяция является по существу однородной.
В некоторых вариантах осуществления, клетки, выделенные из почек млекопитающих, могут быть получены из коркового вещества почки, мозгового вещества почки или подкапсульной зоны почки и их смесей.
Клетки, выделенные из почек млекопитающего (например, человека), характеризуются фенотипическими характеристиками, например, морфологией, способностью к росту, фенотипом маркера поверхности, экспрессией гена раннего развития, экспрессией гена развития почки и секрецией трофического фактора. Фенотип маркера поверхности, экспрессии гена и секреции трофического фактора сохраняются после нескольких пассажей популяции клеток, выделенных из почки, в культуре.
В предпочтительных вариантах осуществления, изолированные клетки, выделенные из почек млекопитающего, (т.е. клеточные популяции) способны к самообновлению и размножению в культуре и обнаруживают уникальный профиль экспрессии, такой как те, что описаны ниже.
В другом варианте осуществления, клетки, выделенные из почек человека, являются положительными в отношении экспрессии, по меньшей мере, одного из Oct-4, Rex-1, Pax-2, кадгерина-11, FoxD1, WT1, Eya1, HNF3B, CXC-R4, Sox-17, EpoR, BMP2, BMP7 или GDF5. В еще одном варианте осуществления, клетки являются отрицательными в отношении экспрессии, по меньшей мере, одного из Sox2, FGF4, hTert, Wnt-4, SIX2 или GATA-4. В альтернативном варианте осуществления, клетки являются положительными в отношении экспрессии, по меньшей мере, одного из Oct-4, Rex-1, Pax-2, кадгеринаа-11, FoxD1, WT1, Eya1, HNF3B, CXC-R4, Sox-17, EpoR, BMP2, BMP7 или GDF5, и отрицательными в отношении экспрессии, по меньшей мере, одного из Sox2, FGF4, hTert, Wnt-4, SIX2 или GATA-4. В альтернативном варианте осуществления, клетка является положительной в отношении экспрессии, по меньшей мере, одного из Eya1, WT1, FoxD1, BMP7, BMP2, GDF5, EpoR или Rex-1. В еще одном альтернативном варианте осуществления, клетки являются отрицательными в отношении экспрессии, по меньшей мере, одного из Sox2, FGF4, hTert или Wnt-4. В альтернативном варианте осуществления, клетки являются положительными в отношении экспрессии, по меньшей мере, одного из Eya1, WT1, FoxD1, BMP7, BMP2, GDF5, EpoR или Rex-1 и отрицательными в отношении экспрессии, по меньшей мере, одного из Sox2, FGF4, hTert или Wnt-4. В одном варианте осуществления изобретения, клетки, выделенные из почек человека, являются также положительными в отношении, по меньшей мере, одного из маркеров клеточной поверхности HLA I, CD24, CD29, CD44, CD49c, CD73, CD166 или SSEA-4. В другом варианте осуществления, клетки, выделенные из почек человека, также являются отрицательными в отношении, по меньшей мере, одного из маркеров клеточной поверхности HLA II, CD31, CD34, CD45, CD56, CD80, CD86, CD104, CD105, CD117, CD133, CD138, CD141 или E-кадгерину. В альтернативном варианте осуществления, клетки, выделенные почек человека, являются также положительными в отношении, по меньшей мере, одного из маркеров клеточной поверхности HLA I, CD24, CD29, CD44, CD49c, CD73, CD166 или SSEA-4, и отрицательными в отношении, по меньшей мере, одного из маркеров клеточной поверхности HLA II, CD31, CD34, CD45, CD56, CD80, CD86, CD104, CD105, CD117, CD133, CD138, CD141 или E-кадгерина. В одном варианте осуществления, клетки, выделенные из почек человека, могут секретировать, по меньшей мере, один из трофических факторов FGF2, HGF, TGF-α, TIMP-1, TIMP-2, MMP-2 или VEGF. В предпочтительном варианте осуществления, клетки не секретируют, по меньшей мере, один из трофических факторов PDGFbb и IL12p70.
В альтернативном варианте осуществления, прогениторные клетки, используемые с биосинтетическим устройством проксимального канальца, являются клетками, выделенными из почек человека. Эти клетки, выделенные из почек человека, способны к самообновлению и размножению в культуре и являются положительными в отношении экспрессии, по меньшей мере, одного из Oct-4, Rex-1, Pax-2, кадгерина-11, FoxD1, WT1, Eya1, HNF3B, CXC-R4, Sox-17, EpoR, BMP2, BMP7 или GDF5; и отрицательными в отношении экспрессии, по меньшей мере, одного из Sox2, FGF4, hTert, Wnt-4, SIX2, E-кадгерина и GATA-4. Более того, клетки, выделенные из почек человека, могут быть также положительными в отношении, по меньшей мере, одного из маркеров клеточной поверхности- HLA I, CD24, CD29, CD44, CD49c, CD90, CD73, CD166 или SSEA-4; или отрицательными в отношении, по меньшей мере, одного из маркеров клеточной поверхности HLA II, CD31, CD34, CD45, CD56, CD80, CD86, CD104, CD105, CD117, CD133, CD138 и CD141. В дополнение, эти клетки дополнительно секретируют, по меньшей мере, один из трофических факторов FGF2, HGF, TGFα, TIMP-1, TIMP-2, MMP-2 или VEGF; и не секретируют, по меньшей мере, один из трофических факторов PDGF-bb или IL12p70.
В еще одном варианте осуществления, клетки, выделенные из почек человека, являются (1) положительными в отношении экспрессии Oct-4, Rex-1, Pax-2, кадгерина-11, FoxD1, WT1, Eya1, HNF3B, CXC-R4, Sox-17, EpoR, BMP2, BMP7 и GDF5, и (2) отрицательными в отношении экспрессии, по меньшей мере, одного из Sox2, FGF4, hTert, SIX2 и Gata-4. В альтернативном варианте осуществления, клетки, выделенные из почек, являются (1) положительными в отношении экспрессии Oct-4, Rex-1, Pax-2, кадгерина-11, FoxD1, WT1, Eya1, HNF3B, CXC-R4, Sox-17, EpoR, BMP2, BMP7 и GDF5; (2) отрицательными в отношении экспрессии, по меньшей мере, одного из Sox2, FGF4, hTert, SIX2 и Gata-4; (3) положительными в отношении маркеров клеточной поверхности HLA I, CD24, CD29, CD44, CD49c, CD73, CD166 и SSEA-4; и (4) отрицательными по HLA II, CD31, CD34, CD45, CD56, CD80, CD86, CD90, CD104, CD105, CD117, CD133, CD138, CD141 и E-кадгерину.
В другом варианте осуществления, клетки, выделенные из почек человека, способны к самообновлению и размножению в культуре, и являются положительными в отношении экспрессии маркеров клеточной поверхности HLA I и CD44, положительными в отношении экспрессии гена Oct-4, Pax-2 и WT1, отрицательными в отношении экспрессии маркеров клеточной поверхности CD133 и экспрессии гена Wtn-4. В одном варианте осуществления, клетки, выделенные из почек человека, дополнительно являются положительными в отношении экспрессии генов BMP7, BMP2, GDF4, EpoR и Rex-1, и отрицательными в отношении экспрессии генов Sox2, FGF4 и hTert.
В альтернативном варианте осуществления, клетки, выделенные из почек человека, являются: (1) способными к самообновлению и размножению в культуре; (2) положительными в отношении экспрессии HLA-I и, по меньшей мере, одного из Oct-4, Rex-1, Pax-2, кадгерина-11, FoxD1, WT1, Eya1, HNF3B, CXC-R4, Sox-17, EpoR, BMP2, BMP7 или GDF5; и (3) отрицательными в отношении экспрессии CD133 и, по меньшей мере, одного из SOX2, FGF4, hTertm Wnt-4, SIX2, E-кадгерина или GATA-4. Эти клетки могут далее быть (4) положительными в отношении, по меньшей мере, одного из маркеров клеточной поверхности CD24, CD29, CD44, CD49c, CD73, CD90, CD166A или SSEA-А и (5) отрицательными в отношении, по меньшей мере, одного из маркеров клеточной поверхности HLA II, CD31, CD34, CD45, CD56, CD80, CD86, CD104, CD105, CD117, CD133 и CD138, CD141 или E-кадгерина. Эти клетки могут также секретировать, по меньшей мере, один из трофических факторов FGF2, HGF, TGFα, TIMP-1, TIMP-2, MMP-2 или VEGF и не секретировать, по меньшей мере, один из трофических факторов PDGFbb или IL12p70. В альтернативном варианте осуществления, клетки, выделенные из почек человека, являются популяцией.
Клетки, выделенные из почек млекопитающего (например, человека) пассируют в отдельный сосуд для культивирования, содержащий свежую среду того же типа, что первоначально использованная среда, или среду другого типа, в которой популяция клеток может митотически размножаться. Клетки, выделенные из почек млекопитающего (например, человека) затем засеивают в биологическую матрицу и культивируют для обеспечения дифференцировки клеток, выделенных из почек, в функционирующие клетки почечных проксимальных канальцев. Клетки по настоящему изобретению можно использовать в любой точке от нулевого пассажа до старения. Клетки предпочтительно пассируют от примерно 3 до примерно 20 раз, от примерно 5 до примерно 10 раз, от примерно 15 до 20 раз, от примерно 5 до примерно 7 раз и предпочтительно от примерно 3 до примерно 7 раз.
В одном варианте осуществления настоящего изобретения, две или более поверхностей лишенного клеток биологического каркаса засеивают клетками. В одном варианте осуществления, сосудистые эндотелиальные клетки засеивают на одну поверхность каркаса, и другую поверхность засеивают клетками, выделенными из почек млекопитающего. Засеянный каркас затем культивируют для обеспечения дифференцировки клеток, выделенных из почек, в функционирующие клетки проксимального канальца и формирования сосудистого эндотелиального монослоя на противоположной поверхности.
В одном варианте осуществления, сосудистые эндотелиальные клетки человека, используемые для репопуляции каркаса, могут быть выбраны из эндотелиальных клеточных линий, клеток костного мозга или цельных эндотелиальных прогениторных клеток кровеносных сосудов, или первичных эндотелиальных или микрососудистых эндотелиальных клеток. Используемые сосудистые эндотелиальные клетки изолируют с помощью общепринятых способов. В предпочтительном варианте осуществления, клетки, используемые для репопуляции каркаса, являются первичными микрососудистыми эндотелиальными клетками. В одном варианте осуществления, используемые сосудистые эндотелиальные клетки могут быть изолированы из любого источника организма млекопитающего. В предпочтительном варианте осуществления, изолированные сосудистые эндотелиальные клетки имеют человеческое происхождение. В альтернативном предпочтительном варианте осуществления, сосудистые эндотелиальные клетки являются первичными микрососудистыми эндотелиальными клетками, изолированными из почки млекопитающего (человека).
В другом варианте осуществления этого изобретения представлен аппарат изготовления устройств проксимального канальца.
В одном варианте осуществления, засев лишенных клеток каркасов реализуется с помощью специально сконструированного аппарата («короны»), в который вставляется фрагмент лишенного клеток каркаса, так что его края помещаются между двумя фрагментами металла или пластика, которые эффективно уплотняют края для создания верхней и нижней лунки, разделенной каркасом. Корона также индуцирует некоторое удлинение и натяжение в лишенный клеток каркас. Клетки затем засевают в верхнюю лунку и отстаивают на лишенном клеток каркасе. Корону можно также перевернуть для обеспечения засева другой стороны каркаса, или корону можно разобрать, каркас перевернуть и вновь собрать в корону для засева противоположной поверхности. Клетки почек можно засеивать на каркасы с плотностью высева в диапазоне в примерно 500 клеток/см2 до примерно 350000 клеток/см2, альтернативным образом, от примерно 1000 клеток/см2 до примерно 100000 клеток/см2, альтернативно, от примерно 750 клеток/см2 до примерно 75000 клеток/см2, альтернативно, от примерно 10000 клеток/см2 до примерно 300000 клеток/см2, альтернативно, от примерно 7500 клеток/см2 до примерно 200000 клеток/см2 и предпочтительно, от примерно 5000 клеток/см2 до примерно 70000 клеток/см2.
Каркасы, засеянные клетками, с аппаратом затем культивируют с помощью общепринятых технических приемов, чтобы обеспечить дифференцировку клеток печени и формирование непрерывного эпителиального монослоя. Время культивирования может составлять от 1 до 6 недель культивирования, предпочтительно, от 2 до 4 недель культивирования, наиболее предпочтительно, от 3 до 4 недель. Получившееся в результате зрелое устройство проксимального канальца можно затем использовать в испытаниях переноса в почках, испытаний нефротоксичности или испытаний лекарственных препаратов с использованием общепринятых способов.
В другом варианте осуществления, культивирование клеток на засеянном каркасе, а также системы испытаний в условиях in vitro, обеспечиваются с помощью помещения каркасов в спроектированный по заказу биореактор, так что каркас создает барьер между двумя отсеками. Камера биореактора соединена с системой регулирования потока жидкости, которая обеспечивает поток жидкости по обеим поверхностям каркаса. С помощью изменения характеристик системы регулирования потока жидкости, таких как скорость потока, для каждой стороны каркаса можно создать специфические для клетки механические условия в отношении жидкости, в зависимости от типа засеянной клетки, например, для поддержки функциональности эндотелиальных клеток на базолатеральной стороне. Каркасы могут быть заранее засеяны клетки до их помещения в биореактор, или быть помещены в биореактор, а затем засеяны клетками внутри биореактора. В другом аспекте, биореактор сконструирован так, что натяжение, прикладываемое к лишенной клеток конструкции, помещенной в биореактор, может быть изменено как только возникнет необходимость в стимулировании засева и/или дифференцировки клеток.
В одном варианте осуществления, лишенный клеток каркас засеивается клетками с помощью аппарата, описанного для засеивания клеток почки, дополнительно, эндотелиальных клеток. Засеянные клетками каркасы затем извлекают из аппарата и переносят в камеру биореактора для культивирования или оценки, как описано ниже в примерах. Засеянные клетками каркасы могут культивироваться сначала в аппарате в течение периода, составляющего примерно от 0 до 4 недель перед переносом в камеру биореактора. Клетки печени можно засеивать на каркасы с плотностью высева в диапазоне, составляющем примерно от 500 клеток/см2 до примерно 350000 клеток/см2, предпочтительно, от примерно 5000 клеток/см2 до примерно 70000 клеток/см2. Условия культивирования, включая продолжительность инкубации в аппарате, могут варьироваться в зависимости от источника клетки и питательной среды.
В другом варианте осуществления, лишенные клеток каркасы сначала помещают в камеру биореактора, и затем каркасы засеивают посредством заливания клеточной суспензии в камеру биореактора и инкубирования в течение времени, достаточного для прикрепления клеток к лишенному клеток каркасу. Такой биореактор содержит верхний элемент корпуса и нижний элемент корпуса, имеющие площадь, предназначенную для роста каркаса.
Один пример биореактора, подходящего для использования в настоящем изобретении, показан на фигуре 15. Обращаясь к фигуре 15, компонентами биореактора 100 являются элементы основного корпуса, верхний элемент 110 корпуса и нижний элемент 120 корпуса, два зажима, передний зажим 130 и задний зажим 160, наружные закрывающие заслонки, нижняя наружная закрывающая заслонка 140 и верхняя наружная закрывающая заслонка 150 и патрубки 170. Верхний элемент 110 корпуса главного реактора и нижний элемент 120 корпуса биореактора 100 удерживаются вместе с помощью переднего зажима 130 и заднего зажима 160. Верхняя наружная заслонка 150 находится наверху верхнего элемента 110 корпуса. Нижняя наружная закрывающая заслонка 140 находится снизу нижнего элемента 120 корпуса. На фигуре 16 представлен вид нижнего элемента 120 корпуса биореактора, показывающий канавку 180, чья глубина может изменяться в пределах верхнего элемента корпуса для регулировки натяжения на лишенном клеток каркасе. Нижний элемент 120 корпуса также содержит площадь для клеточного роста 190.
В одном варианте осуществления, незасеянный каркас может быть расположен между верхним элементом 110 корпуса и нижним элементом 120 корпуса биореактора 100 (см. фигуру 15). Круглая рамная конструкция, которая прорезана в верхнем элементе 110 корпуса с соответствующей структурой канавки в нижнем элементе 120 корпуса, обеспечивает фиксацию каркаса относительно клеточных корон. Натяжение может регулироваться с помощью специально сконструированных комбинаций рамка/канавка, с различной глубиной канавки и шириной перемычки рамки. Расстояние, на которое рамка может входить в канавку 180 (см. фигуру 16), определяет натяжение каркаса, причем более длинное расстояние приводит к более высокому натяжению. Необходимо учитывать такие факторы, как диаметр каркаса и толщину каркаса. После размещения каркаса, передний зажим 130 и задний зажим 160 биореактора удерживают верхний элемент 110 корпуса и нижний элемент 120 корпуса вместе, и с конструкцией обращаются таким же образом, как с клеточной короной. Нижняя наружная створка 140 и верхняя наружная створка обеспечивают закрытие системы, и клеточную суспензию можно вводить к одной стороне каркаса через патрубки 170 биореактора. Клетки растут в области роста клеток 190. После периода времени, определяемого состоянием клеток, в течение которого засеянные клетки могут приклеиться, закрытый биореактор можно перевернуть, и второй или тот же тип клеток может быть засеян на другую сторону каркаса. В одном варианте осуществления, концентрации клеточных суспензий, используемых для засева, могут варьироваться от примерно 103 клеток/мл до примерно 107 клеток/мл. Чтобы избежать потерю жизнеспособности клеток, засеянных на первой стороне, отсек на первой стороне может быть заполнен средой. Если требуются статические условия, отсек может быть заполнен питательной средой для выращивания клеток. В ином случае, через патрубки 170 может быть инициирована перфузия среды при различных условиях течения.
После прикрепления клеток к каркасу, клетки могут культивироваться в статическом режиме, при этом в отсеки просто заливают среду и закрывают патрубки биореактора. Иным образом, трубки системы регулирования тока жидкости присоединяются к биореактору, и можно начать перфузию. Клетки засеивают на лишенные клеток каркасы в камерах биореактора, а затем их культивируют для обеспечения роста и дифференцировки клеток в функциональный монослой клеток почечных канальцев. Культивирование клеток может включать статическое культивирование, или более предпочтительно, культивирование в динамическом режиме, таком как линейный поток жидкости или пульсирующий поток жидкости. Скорость потока, давление и режим пульсации могут меняться, чтобы стимулировать рост и дифференцировку клеток в функциональные клетки почек. Средняя скорость потока среды в биореакторе может варьироваться от 1 до 25 мл/мин, в ином случае - от примерно 1 до примерно 10 мл/мин, альтернативным образом - от примерно 2,5 до примерно 10 мл/мин, альтернативно - от примерно 5 до 20 мл/мин. В предпочтительном варианте осуществления, средняя скорость потока может находиться в пределах от примерно 2,5 до 15 мл/мин. Период культивирования может варьироваться в пределах от примерно 1 до примерно 4 недель, в ином случае - от примерно 1 до примерно 2 недель, в ином случае - от примерно 1 до примерно 3 недель, в ином случае - от примерно 2 до примерно 4 недель. В предпочтительном варианте осуществления, период культивирования может варьироваться от, предпочтительно, примерно 2 до 3 недель. В течение этого времени, целостность клеточного слоя можно мониторировать с помощью технических приемов, хорошо известных в этой области. В одном варианте осуществления, целостность клеточного слоя можно мониторировать посредством измерения трансэпителиального электрического сопротивления с помощью электродов, интегрированных в каждый отсек биореактора, или посредством измерения протекания через монослой различных флуоресцентно меченых молекул, таких как, например, инулин или креатинин. В другом варианте осуществления, в каждой камере могут использоваться различные среды для культивирования клеток. В еще одном варианте осуществления, различные скорости потока, давление и режим пульсации могут быть использованы в каждой камере, чтобы обеспечить специфическое культивирование клеток через показатели текучести по напряжению сдвига. Описание биореактора также можно найти в заявке на патент № DE 102008056037.5-41 и EP 2184344, содержание которого полностью включено в настоящий документ путем отсылки.
Другой вариант осуществления настоящего изобретения представляет собой способ дифференцировки клеток, дифференцируемых в клетки почек (таких как, например, клетки, выделенные из почки млекопитающего (человека) в устойчивый монослой клеток проксимальных почечных канальцев посредством дифференцирования клеток при натяжении. Этот способ может далее содержать использование каркасов по настоящему изобретению для изготовления устройств проксимального канальца по этому изобретению.
Устройства проксимального канальца по настоящему изобретению могут применяться в качестве системы для проведения испытаний в условиях in vitro для скрининговых исследованиях токсичности или скринингового исследования действия лекарственных препаратов. В другом варианте осуществления, устройства могут быть использованы для мониторирования функции клеток канальцев, таких как функция переноса, во время или после воздействия соединения или частицы. Для обеспечения потока жидкости по каждой поверхности могут быть использованы разные составы среды, что позволяет исследовать перенос через клеточный слой и слой каркаса из одного отсека со средой в другой отсек. Одним примером приготовления такой среды будет поток среды эндотелиальных клеток в отсек, в котором засеяны многоядерные клетки mvECs, и поток среды, который имитирует клубочковый фильтрат в противоположном отсеке, который содержит отсек монослоя почечных клубочков.
Функции переноса монослоя почечных клубочков могут быть оценены с помощью стандартных технических приемов и использования меченых молекул, известных специалистам в данной области. Скрининговое исследование токсичности можно провести с помощью прибавления испытуемых соединений или частиц или в поток, направленный в сосудистый отсек, который обеспечивает питательными веществами и вступает в контакт с эндотелиальными клетками, или с помощью введения соединений или частиц в поток, направленный в канальцевый отсек, который обеспечивает питательными веществами и вступает в контакт с клетками почечных канальцев, имитируя внешний вид токсических ксенобиотических соединений в крови и моче, соответственно. Перенос соединений или частиц можно мониторировать с помощью анализа среды на одном или обоих направлениях потока. В дополнение, токсичность можно мониторировать с помощью анализа жизнеспособности клеток, их морфологии или действия на функции переноса после воздействия испытуемых соединений. Анализы, используемые для оценки токсичности или лекарственного действия соединений или частиц, не ограничиваются примерами, описанными выше.
Анализ терапевтических целей может производиться с помощью первоначального повреждения клеток, выделенных из почек, биосинтетического устройства и последующей их обработки испытуемыми лекарственными частицами. Повреждение может наноситься физическим или химическим способом, таким как, например, воздействие на клетки токсических соединений или частиц, таких как, например, цисплатина или стрептозоцина. Испытуемые лекарственные соединения или частицы могут вступать в контакт с клетками при прибавлении в поток, направленный в сосудистый отсек устройства, например, в концентрации, которая имитирует концентрацию при воздействии на клетки после внутривенного (в/в) введения лекарственного вещества. Затем может применяться мониторирование функции клеток почечных канальцев для определения степени эффективности примененных испытуемых лекарственных соединений.
Мониторинг функции канальцев включает, помимо прочего, обнаружение или оценку поглощения соединения или частицы клетками почечных канальцев, переноса соединения или частицы, поглощенной клетками, из одного отсека со средой устройства проксимального канальца в другой, действие ингибиторов на поглощение или перенос и изменения в экспрессии гена или белка клеток почечного канальца, его морфологии, экспрессии маркера поверхности, ферментной активности и выживания. Анализы, используемые для оценки токсичности или лекарственного действия соединений или частиц, не ограничиваются примерами, описанными выше.
Другой вариант осуществления настоящего изобретения представляет собой набор, содержащий биосинтетическое устройство проксимального канальца по настоящему изобретению. В одном варианте осуществления, набор содержит биосинтетическое устройство канальца листок-вкладыш.
Альтернативный вариант осуществления настоящего изобретения представляет собой композицию, содержащую биосинтетические устройства проксимального канальца по настоящему изобретению. В одном варианте осуществления, композиция содержит биосинтетическое устройство проксимального канальца по этому изобретению и фармацевтически приемлемый носитель.
Без более подробного описания предполагается, что любой специалист в данной области может, используя предыдущее описание и следующие иллюстративные примеры, реализовать и использовать настоящее изобретение и применять на практике заявленные способы. Следующие рабочие примеры, в связи с этим, специально указывают на предпочтительные варианты осуществления настоящего изобретения, и не должны быть истолкованы как ограничивающие каким-либо образом остальную часть раскрытия. В дополнение, используемые в следующих примерах и в другом месте в данном описании клетки, выделенные из почек («hKDC»), используемые в устройствах и способах по этому изобретению, могут быть изолированы и охарактеризованы в соответствии с раскрытием опубликованного патента США № 2008/0112939, полностью включенного в этот документ путем отсылки, поскольку он относится к описанию, изолированию и характеризации клеток hKDC.
ПРИМЕРЫ
Пример 1: Засев и дифференцировка клеток hKDC на лишенных клеток матричных каркасах
В этом эксперименте проводятся испытания прикрепления, роста и дифференцировки клеток, выделенных из почки человека («hKDC») на различных конфигурациях экстрацеллюлярных (т.е. лишенных клеток) матричных каркасах, а также при традиционном культивировании на вкладышах типа Трансвелл, покрытых коллагеном.
Клетки hKDC на пассаже 4 были засеяны на три разных конфигурации каркаса и на вкладыши типа Трансвелл (фирма «Corning», Корнинг, Нью-Йорк). Клетки культивировали в течение периода времени, составляющего три недели, со средой REGM™для роста эпителиальным клеток почек (фирма «Lonza», Уолкерсвилл, Мэриленд). Проводили испытания каждой конфигурации каркаса с тремя разными концентрациями клеток: 2,5×103, 5×103, и 1×104 клеток. Проводили испытания следующих конфигураций: 1) культивирование клеток между двумя слоями коллагена 2) культивирование SIS клеток между двумя слоями коллагена 3) культивирование монослоя SIS; и 4) вкладыши типа Трансвелл, покрытые коллагеном.
Культивирование клеток между двумя слоями коллагена
Клетки hKDC культивировали между двумя слоями коллагенового геля в 24-луночных планшетах. Подстилающий слой геля отливали, смешивая сначала холодный раствор для нейтрализации геля с коллагеном (тип 1, изолированный из сухожилий хвоста крысы, 6 мг/мл в 0,1% уксусной кислоте) в соотношении 1:2, а затем прибавляя по 500 мкл этого раствора в каждую лунку. Раствор желировали посредством инкубации при условиях 37°C/5% CO2 в течение 15 минут. После этого клетки высеивали в 1 мл среды в каждую лунку. Через 24 часа отливали покрывающий слой геля. Среду отсасывали, и 300 мкл раствора геля (приготовленного, как указано выше) переносили пипеткой в каждую лунку. Раствор желировали посредством инкубации в течение 15 минут в условиях 37°C/5% CO2. В завершение, 1 мл среды прибавляли в каждую лунку.
Культивирование монослоя подслизистой основы тонкого кишечника (SIS)
Каркасы готовили с помощью децеллюляризации сегментов подслизистой основы тонкого кишечника (SIS) традиционным способом. Вкратце, механически удаляли слизистую оболочку сегментов тонкого кишечника свиньи. После этого проводили децеллюляризацию с помощью инкубации сегментов кишечника в 3,4% натрия дезоксихолата в течение 1 часа при температуре 4 градуса по Цельсию при встряхивании. Лишенные клеток сегменты затем тщательно промывали ЗФР и стерилизовали при помощи гамма-излучении. Для культивирования монослоя SIS использовали 12-луночные планшеты. Лишенные клеток SIS натягивали на круглые металлические рамки и покрывали средой из расчета 1 мл на каждую лунку за сутки до засева клеток. Натянутая поверхность SIS примерно равна поверхности лунки в 24-луночном планшете. Для засева клеток на SIS, удаляли питательную среду для клеток и засеивали необходимое количество клеток в 1 мл среды в каждой лунке.
Культивирование SIS между двумя слоями коллагена
Каркасы SIS готовили и засеивали клетками hKDC в соответствии с указанным выше. После отстаивания в течение 24 часов для прикрепления клеток, покрывающий гель растягивали поверх клеток так же, как при культивировании между двумя слоями коллагена (см. выше).
Культивирование с вкладышами типа Трансвелл
Вкладыши типа Трансвелл переносили в 12-луночные планшеты, и каждый покрывали 200 мкл коллагена типа 1 (100 мкг/мл в 0,1% уксусной кислоты). Покрывающий раствор инкубировали в течение 20 минут при комнатной температуре, а затем отсасывали. Необходимое количество клеток засеивали в 1,5 мл среды в каждой лунке.
Некоторое количество проб культивировали в течение трех недель в каждом из условий, описанных выше. Затем пробы извлекали для гистологического анализа через одну, две и три недели. В дополнение, анализировали пробы сред с помощью клинического анализатора Randox RX Daytona™ для определения следующих метаболических параметров: концентрация глюкозы, уровень лактата и лактатдегидрогеназы. Пробы, отобранные для гистологического анализа, фиксировали с помощью фиксирующей смеси Буэна в течение 1 часа. Затем их промывали водой в течение, по меньшей мере, 4 часов и заливали парафином. Впоследствии готовили срезы толщиной 3 мкм. Срезы окрашивали гематоксилином и эозином (Г-Э) для оценки клеточной морфологии. Далее проводили иммуногистохимическое исследование (ИГХ), чтобы охарактеризовать дифференцировку клеток, с использованием следующих антител: анти-hPAX2, анти-hAQP1, анти-Ki67, анти hE-кадгерин и анти-hN-кадгерин (см. таблицу 1 ниже). Для иммуногистохимического исследования депарафинизировали срезы толщиной 3 мкм. Демаскировка достигалась или ферментативной обработкой с помощью протеиназы K, или нагреванием в цитратном буфере pH 6 (Dako, #S2369) или трис/ЭДТА буфере pH 9 (Dako, #S2367). Для блокирования эндогенной пероксидазы был включен блокирующий этап с использованием 3% перекиси водорода. Затем инкубировали первичные антитела в течение 1 часа с последующим детектированием с помощью набора, содержащего биотинилированные антимышиные иммуноглобулины, Envision™ Detection System Peroxidase/DAB Rabbit/Mouse (Dako, #K5007). Срезы были докрашены гематоксилином.
Результаты анализа метаболических параметров показывают, что клетки hKDCs были успешно засеяны и размножались во всех испытуемых условиях культивирования (см. фигуры 1-6). Гистологическое окрашивание Г-Э показало, что в обоих из условий культивирования между двумя слоями коллагена и условий культивирования SIS между двумя слоями коллагена клетки вырастали в почти двойные или множественные слои, которые развивались в трехмерные структуры, напоминающие канальцы или кисты. В противоположность этому, клетки, культивируемые на SIS, образовали сливающийся монослой, обнаруживающий в высшей степени призматическую морфологию, что указывает на эпителиальную дифференцировку (см. фигуры 7 и 8). Эту морфологию наблюдали через три недели культивирования, независимо от того, какая концентрация клеток первоначально использовалась при засеве. Клетки hKDC, культивированные на вкладышах типа Трансвелл с ПЭТ мембранами, показали плоскую морфологию, многослойное формирование и агломераты, которые отслаивались от поверхности, что приводило нарушению непрерывности клеточного слоя. Из-за этих наблюдаемых характеристик клеток hKDC на ПЭТ мембранах, покрытых коллагеном, они не подходят для анализа переноса. Похожую многослойность также обнаруживали при использовании вкладышей типа Трансвелл с мембранами из полиэстера и поликарбоната, что указывает на то, что такой эффект свойственен в целом мембранам из синтетических материалов, а не только конкретным мембранам, использованным в этом эксперименте. Такие свойства не наблюдались в культуре SIS, что подразумевает, что этот каркас способствует функционированию регуляторных механизмов контактного ингибирования и формирования интактного монослоя.
Результаты иммуногистохимического исследования с использованием антител Ki67 указывают, что клетки hKDCs размножаются на каждой из испытуемых конфигураций каркаса. Экспрессия фактора транскрипции Pax-2 почки была также положительной в течение всего периода культивирования. Кадгерины, как компоненты десмосов и адгезионных контактов, участвуют в контактах типа «клетка-клетка», и их экспрессия является маркером клеточной дифференциации. Они важны для поляризации клеток и, таким образом, для их функциональной активности. В почке, N-кадгерин экспрессируется клетками проксимальных канальцев, в то время как E-кадгерин превалирует в клетках дистальных канальцев. Результаты ИГХ показывают интенсивное иммунное окрашивание к N-кадгерину клеток hKDCs во всех конфигурациях каркаса. В противоположность этому, иммунное окрашивание к E-кадгерину почти отсутствовало, хотя отмечено несколько зон с чрезвычайно слабым окрашиванием.
Аквапорины катализируют перенос воды через клеточные мембраны, и, таким образом, они очень важны для функциональной активности почек. Аквапорин 1 экспрессируется клетками проксимальными почечных канальцев, в то время как аквапорин 2 преобладает в клетках дистальных канальцев. Экспрессия аквапорина 1 могла быть обнаружена через 2 и 3 недели культивирования, в то время как не отмечено экспрессии аквапорина 2. В некоторых зонах, окрашивание аквапорина-1 обнаруживалось только на апикальной стороне кубовидных клеток (см. фигуру 9), что еще раз указывает на дифференцировку преимущественно проксимальных клеток. Проводили также ИГХ ко-транспортера натрия глюкозы 1 (SGLT-1), который является транспортером, экспрессируемым клетками дистальных канальцев, но не смогли обнаружить никакой экспрессии маркера ни в одной из проб.
Этот пример свидетельствует, что клетки hKDCs могут дифференцировать в клетки проксимальных канальцев, и что эта дифференцировка зависит от состава субстрата, на который засевают клетки. Культивирование на плоской экстрацеллюлярной (т.е. лишенная клеток) матрице природного происхождения превосходит культивирование на каркасах из коллагена, SIS/коллагена, а также на стандартных вкладышах типа Трансвелл в отношении эпителиальной морфологии и дифференцировке клеток hKDC. Нетрансформированные клетки проксимальных канальцев (такие как первичные клетки) обычно продолжают расти, после того как достигнут слияния, что приводит к формированию трехмерных агрегатов на плоских поверхностях из синтетических материалов, таких как вкладыши типа Трансвелл. Засев природного лишенного клеток каркаса, такого как SIS, позволяет клеткам дифференцировать и образовывать эпителиальные монослои, которые отличаются более высокой стабильностью, чем те, что изготовлены с помощью традиционных способов.
Пример 2: Оптимизация концентраций клеток hKDC при засеивании на лишенные клеток каркасы
Пример 1 показывает, что клетки, засеянные на двухмерные лишенные клеток каркасы без коллагена, образовали сливающийся эпителиальный монослой, экспрессирующий маркеры проксимальных канальцев через три недели культивирования. Проводились следующие эксперименты для оптимизации плотности высева клеток и сокращения периода времени культивирования, необходимого для формирования монослоя.
Каркасы готовили с помощью децеллюляризации сегментов подслизистой основы тонкого кишечника (SIS), как описано в примере 1. Клетки на пассаже 4 засеивали на каркасы SIS в трех разных концентрациях (1×104, 5×104 и 1×105 клеток/лунка) и культивировали с течение трех недель и культивировали в течение трех недель с REGM™ - питательной средой для эпителия почек (фирма «Lonza», Уолкерсвилл, Мэриленд). Через две и три недели пробы извлекали для гистологического анализа и фиксировали в фиксирующей смеси Буэна в течение 1 часа. Затем их промывали водой в течение, по меньшей мере, 4 часов и заливали парафином. Впоследствии готовили срезы толщиной 3 мкм. Срезы окрашивали гематоксилином и эозином (Г-Э) для оценки клеточной морфологии. В дополнение, провели иммуногистохимическое исследование (ИГХ), как в примере 1, для характеризации дифференцировки клеток. Сначала депарафинизировали срезы толщиной 3 мкм. Демаскировка достигалась или ферментативной обработкой с помощью протеиназы K, или нагреванием в цитратном буфере pH 6 (Dako, #S2369) или нагреванием в трис/ЭДТА буфере pH 9 (Dako, #S2367). Для блокирования эндогенной пероксидазы был включен блокирующий этап с использованием 3% перекиси водорода. Затем инкубировали первичные антитела в течение 1 часа с последующим детектированием с помощью набора, содержащего биотинилированные антимышиные иммуноглобулины, Envision™ Detection System Peroxidase/DAB Rabbit/Mouse (Dako, #K5007). Срезы были докрашены гематоксилином.
Затем проводили окрашивание лектином для дальнейшей оценки дифференцировки клеток. Как описано выше, депарафинизировали срезы толщиной 3 мкм и блокировали перекисью водорода. Затем биотинилированные лектины, или лектин Lotus tetragonobolus (фирма "Biozol", #B-1325), или агглютинин Dolichos biflorus (фирма «Biozol», #B1035), инкубировали в течение 1 часа, после этого метили стрептавидином (фирма «Biogenex», #LP000-ULE) и проводили детектирование с помощью прибавления аминоэтилкарбазола в качестве хромогена (AEC) (фирма «Biogenex», #HK129-5KE). Срезы были докрашены гематоксилином.
Результаты окрашивания Г&Э показывают, что после двух недель культивирования ни при одной из испытуемых плотностей высева не удалось достигнуть 100% слияния. Однако через три недели культивирования клетки, засеянные с любой плотностью высева, формировали сливающийся монослой и имели зоны с развитием эпителиальных клеток типичной кубовидной морфологии, с ядрами, расположенными в нижней трети клетки. Клетки, засеянные с более высокой плотностью, также почти сливались, но морфология клеток была менее однородной, и они меньше напоминали эпителиальные по внешнему виду (см. фигуру 10).
Результаты иммуногистохимического исследования обобщены в таблице 2 ниже. ИГХ трехнедельных проб с более низкой плотностью высева обнаружила экспрессию маркеров проксимальных канальцев AQP-1 (40-50%) и N-кадгерина (~90%), в то время как экспрессия маркеров дистальных канальцев (AQP-2 и SGLT-1) не обнаруживалась или была очень слабой (E-кадгерин). Также, обнаруживалась экспрессия PAX-2 по всей пробе, и клаудин-2, маркер плотного контакта, был обнаружен на нескольких участках проб. Ki67, маркер пролиферации, был обнаружен только в зонах, где монослой не достигал полного слияния. Важно отметить, что базолатеральное окрашивание коллагена IV выявило белок базальной мембраны во многих зонах проб. Экспрессия коллагена IV указывала, что клетки ремоделировали каркас и образовывали новую базальную мембрану.
Окрашивание трехнедельных проб с более низкой плотностью засева биотинилированными лектинами, лектином Lotus tetragonobulus (LTL), маркером клеток проксимальных канальцев, и агглюттинином Dolichos biflorus (DBA), маркером клеток дистальных канальцев, также показало, что большая часть клеток дифференцировали а клетки проксимальных канальцев. Во многих зонах проб обнаружена экспрессия LTL, в то время как экспрессия DBA была рассеянной и слабой (см. фигуру 10).
Этот пример показывает, что степень дифференцировки клеток зависит от плотности засева. Однако, неожиданно, в противоположность тому, что можно было предположить в обычных обстоятельствах, более низкая плотность засева привела к более высокой степени дифференцировки.
Также проводили иммуногистохимического исследования пробы, засеянной с плотностью 1×104 клеток на лунку, для обнаружения экспрессии коллагена IV типа способом, описанным выше, с использованием антитела к античеловеческому коллагену IV типа («Dako», #M0785). Результаты, показанные на фигуре 11, показывают положительное окрашивание коллагена IV типа на базолатеральной поверхности клеток, указывая, что клетки активно секретировали компоненты эксрацеллюлярной матрицы на лишенный клеток каркас природного происхождения; демонстрируя, что интактные монослои могут быть развиты на лишенных клеток каркасах природного происхождения, которые являются более физиологически приемлемыми, чем синтетические каркасы, такие как вкладыши типа Тренавелл. Далее, это позволяет предположить, что плотность засева клеток оказывает прямое действие на дифференцировку клеток и формирование монослоя.
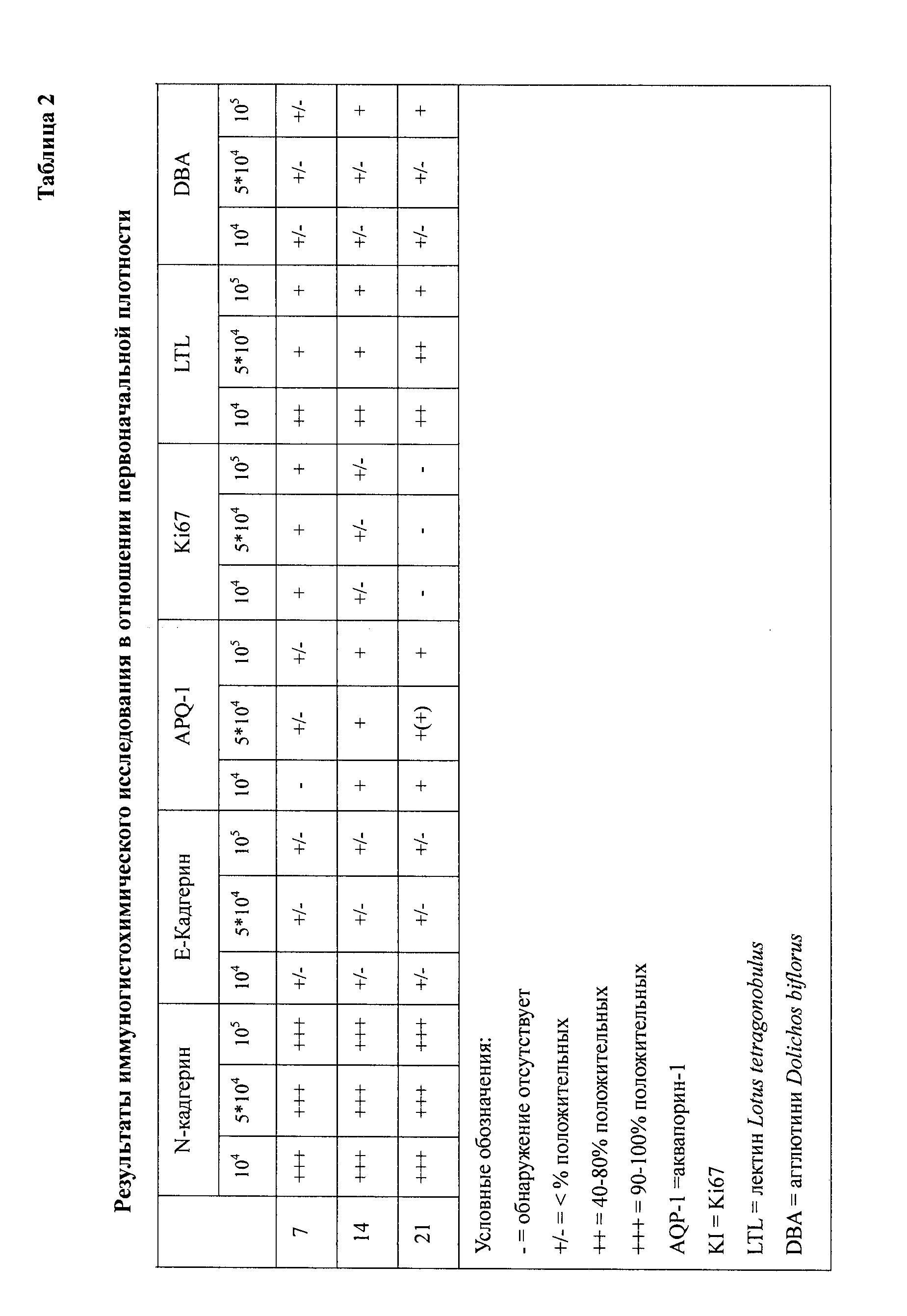
Пример 3: Иммуногистохимическое исследование p-гликопротеина-1
Каркасы готовили с помощью децеллюляризации сегментов подслизистой основы тонкого кишечника (SIS), как описано в примере 1. Клетки hKDC на пассаже 4 засеивали на каркасы SIS с плотностью 5×104 клеток/каркас и культивировали с течение трех недель и культивировали в течение трех недель с REGMTM - питательной средой для эпителия почек (фирма «Lonza» Уолкерсвилл, Мэриленд). Через три недели пробы извлекали для гистологического анализа и фиксировали в фиксирующей смеси Буэна в течение 1 часа. Затем их промывали водой в течение, по меньшей мере, 4 часов и заливали парафином. Впоследствии готовили срезы толщиной 3 мкм. Проводили иммуногистохимическое исследование (ИГХ) для подтверждения экспрессии p-гликопротеина-1 (pgp-1 aka MDR1), который является эффлюксным переносчиком, экспрессируемым клетками проксимальных канальцев. Демаскировка достигалась депарафинизированных срезов или ферментативной обработкой с помощью протеиназы K, или нагреванием в цитратном буфере pH 6 («Dako», #S2369) или нагреванием в трис/ЭДТА буфере pH 9 («Dako», #S2367). Для блокирования эндогенной пероксидазы был включен блокирующий этап с использованием 3% перекиси водорода. Затем инкубировали первичный античеловеский pgp-1 ("Biogenex", #AM-391-5M) в течение 1 часа последующим детектированием с помощью набора, содержащего биотинилированные антимышиные иммуноглобулины, Envision™ Detection System Peroxidase/DAB Rabbit/Mouse (Dako, #K5007). Срезы были докрашены гематоксилином.
Результаты показали положительное окрашивание pgp-1 на апикальных мембранах клеточного монослоя (см. фигуру 13), подтверждая экспрессию функционального маркера клеток проксимальных канальцев, далее указывая, что описанные каркас и способы высева обеспечивают дифференцировку клеток hKDCs в функционирующие клетки проксимальных канальцев.
Пример 4: Поглощение альбумина клетками hKDCs, засянными на лишенных клеток каркасах
Каркасы готовили с помощью децеллюляризации сегментов подслизистой основы тонкого кишечника (SIS), как описано в примере 1. Клетки hKDC на пассаже 4 засеивали на каркасы SIS с плотностью 5×104 клеток/каркас и культивировали с течение трех недель и культивировали в течение трех недель с REGM™ - питательной средой для эпителия почек (фирма «Lonza» Уолкерсвилл, Мэриленд). Для оценки поглощения альбумина, пробы, засеянные клетками, сначала предварительно инкубировали в бессывороточной среде (базальная среда REBM, «Lonza», Уолкерсвилл) в течение 1 часа. Среду затем заменяли на базальную среду REBM, содержащую 200 мкг/мл флуоресцентно меченый альбумин бычьей сыворотки (BSA-FITC) («Sigma», #A9771) и инкубировали в течение 30-60 минут. Затем пробы промывали ЗФР, докрашивали Dapi (диамидино-2-фенилиндол) и исследуют под флуоресцентным микроскопом.
Результаты показали, что клетки могут поглощать BSA-FITC (см. фигуру 14), функция клеток проксимальных канальцев. Эти результаты показали, что клетки hKDCs, засеянные на лишенные клеток каркасы, не только экспрессируют маркеры дифференцировки клеток проксимальных почечных канальцев, также и функционируют как эпителиальные клетки проксимальных канальцев.
Следующие далее примеры 5-9 являются примерами возможного использования, предназначенными для дальнейшего освещения свойств каркасов по этому изобретению. Анализы функциональной активности, такие как поглощение BSA-FITC, могут использоваться для оценки клеточного повреждения или нефротоксичности, а также эффективности лекарственных соединений в отношении восстановления функций переноса в почке.
Пример 5: Перенос органических анионов клетками hKDCs, засеянными на лишенных клеток каркасах
Этот пример представляет собой испытание функции переносчиков органических анионов, а также pgp-1, эффлюксного переносчика, с помощью анализа переноса флуоресцентых красителей, таких как родамин, люцеферовый желтый или карбоксифлуоресцеин. Перенос в клетку опосредован различными переносчиками органических анионов (OAT). Когда переносчик pgp-1 ингибируется верапамилом, останавливается перенос примененного красителя, такого как родамин, из клетки, что приводит к усилению клеточной флуоресценции.
Каркасы будут выполняться с помощью децеллюляризации сегментов подслизистой основы тонкого кишечника (SIS), как описано в примере 1. Клетки hKDC на пассаже 4 будут засеяны на каркасы SIS с плотностью 5×104 клеток/каркас и культивироваться с течение трех недель с REGMTM - питательной средой для эпителия почек (фирма «Lonza» Уолкерсвилл). Затем меняют среду в верхнем отсеке на среду, не содержащую фенолового красного, в которой содержатся различные концентрации красителей родамина, люцеферового желтого или карбоксифлуоресцеина. Будут также проводить предварительное инкубирование некоторых лунок с различными концентрациями верапамила в обоих отсеках перед прибавлением сред, содержащих флуоресцентный краситель (с дополнительным верапамилом в среде или без него), в верхний отсек. Затем лунки будут инкубировать в течение времени, составляющего от 30 до 120 минут. Пробы будут потом промывать ЗФР, фиксировать, докрашивать Dapi и исследовать под флуоресцентным микроскопом. В дополнение, будут отобраны пробы среды для количественного анализа содержания флуоресцентного красителя.
Пример 6: Засев и дифференцировка клеток hKDCs (с микрососудистыми эндотелиальными клетками или без них) на лишенных клеток каркасах в проточном биореакторе
Систему биореактора готовят в соответствии с описанным выше. Каркас помещают между верхним элементом 110 корпуса и нижним элементом 120 корпуса биореактора 100 и фиксируют с натяжением, сравнимым с клеточными коронами (см. фигуру 15). Натяжение на каркасе, размещенном в биореакторе, может быть изменено и будут проводиться эксперименты для определения пределов натяжения, достаточного для формирования монослоя клеток и последующей дифференцировки. Одна сторона каркаса будет засеяна клетками hKDCs, за чем последует подходящий период прикрепления (без потока). Другая сторона каркаса может быть засеяна эндотелиальными клетками. В качестве контроля будут также использоваться биореакторы, содержащие только одни тип клеток. После подходящего периода прикрепления клеток камеры биореактора префузируют. Скорость потока будут регулировать для соответствия условиям среды в почках, чтобы обеспечивать дифференцировку и формирование эпителиального монослоя. Формирование и целостность монослоя будет мониторироваться с помощью периодических измерений трансэпителиального электрического сопротивления (TEER), а также измерением протекания флуоресцентного FITC-инулина. В случаях, где используются оба типа клеток, условия потока будут регулироваться таким образом, чтобы соответствовать условиям, достаточным для поддержания состояния эпителиальных и эндотелиальных клеточных монослоев. В дополнение к мониторингу TEER и инулина, пробы будут фиксироваться через 1, 2 и 3 недель. Эпителиальная морфология и формирование монослоя будет оцениваться с помощью окрашивания гематоксилином и эозином.
Пример 7: Функциональный перенос глюкозы и реабсорбция других растворенных веществ клетками hKDCs (с микрососудистыми эндотелиальными клетками или без них), засеянными на каркасы SIS и культивирование в проточном биореакторе
Этот пример показывает функциональную дифференцировку клеток hKDCs в клетки проксимальных канальцев при засеве на каркасы SIS в проточном биореакторе с помощью анализа активного переноса глюкозы и других растворенных веществ из одного отсека для среды через засеянную клетками мембрану в другой отсек для среды.
Каркасы SIS будут готовиться в соответствии с процедурой, описанной в примере 1. Микрососудистые эндотелиальные клетки (mvEC), изолированные с применением стандартных способов, будут засеяны на одну сторону каркаса. Клетки hKDCs затем будут засеяны на другую сторону каркаса. Затем каркасы помещают в камеры биореактора, в которых обеспечивается поток среды через каждую сторону каркасов, и их культивируют для обеспечения формирования монослоя как в примере 6. Формирование монослоя будут мониторировать с помощью измерения TEER и протекания FITC-инулина как в примере 6. В этой точке, каждый отсек для среды замыкается в небольшую петлю, которая отделена только интактными клеточными монослоями на каркасе SIS. Для измерения глюкозы, среды, содержащие известные концентрации глюкозы, будут использоваться в различных отсеках для среды с прибавлением или без прибавления ингибитора переноса глюкозы, такого как, например, флоридзин. Будет обеспечиваться поток через монослои зрелых клеток в течение периода, составляющего примерно 48 часов, причем будет периодически проводиться отбор проб среды для измерения концентрации глюкозы с помощью колориметрического анализа. Будет проводиться некоторое количество экспериментов с разными концентрациями глюкозы в двух отсеках для изучения изменения концентрации глюкозы со временем. Результаты таких измерений будут использоваться для расчета величины относительного переноса глюкозы против потребления клетками с учетом времени. Аналогичные эксперименты можно проводить с другими растворенными веществами, которые могут быть подвергнуты или переносу, или поглощению, или деградации клетками, с такими веществами как, например, альбумин.
Пример 8: Активация витамина D
Активация витамина D является специфической функцией клеток проксимальных почечных канальцев. В связи с этим, этот пример представляет собой испытания активации витамина D с помощью исследования активности фермента 25-(OH)D3-12-гидроксилазы, который превращает неактивный предшественник 25-OH-D3 в его активную форму 1,25-(OH)2D3.
Для анализа активации витамина D, клетки hKDC будут засеяны на SIS, как описано в примере 1. Клетки hKDC на пассаже 4 будут засеяны на каркасы SIS с плотностью 5×104 клеток/каркас и культивироваться с течение трех недель с REGMTM - питательной средой для эпителия почек (фирма «Lonza» Уолкерсвилл).
Среду будут менять на среду, содержащую неактивный предшественник 25-OH-D3. После инкубирования в течение от примерно 15 минут до 2 частов, среду соберут и будут анализировать для определения количества обоих предшественника и активной формы 1,25-(OH)2D3 способом ВЭЖХ или ИФА. Время инкубирования может варьироваться в зависимости от состава и температуры среды инкубации. Преобразование может быть далее индуцироваться с помощью прибавления паратиреоидного гормона или ингибироваться с помощью прибавления форсфата.
Пример 9: Система клеток hKDC/SIS проксимального почечного канальца для испытаний нефротоксичности и применения при разработке лекарственных препаратов
В этом примере, на систему клеток hKDC/SIS модели проксимального почечного канальца будут воздействовать специфические нефротоксические вещества (например, цисплатин, винбластин) или ренопротективные реагенты. Для этого, клетки hKDCs будут засеяны на SIS, в статических условиях и/или условиях потока среды, и их оставят для роста и дифференцировки в эпителиальный монослой клеток проксимальных канальцев. Затем на систему hKDC/SIS будут воздействовать различные нефротоксические вещества, и будет оцениваться жизнеспособность клеток, их морфология и функциональная активность проксимальных канальцев. Параметры функциональной активности почек включают, например, перенос растворенных веществ, TEER, пропускание инулина, поглощение альбумина, синтез витамина D, продукция эритропоэтина и простагландина. В дополнение, будут проводиться испытания системы проксимального канальца из клеток hKDC в отношении ее способности обнаруживать действие различных ренопротективных и других цитопротективных реагентов.
Пример 10: Изолирование клеток, выделенных из почек человека
Нормальные почки человека были получены из некоммерческой организации "National Disease Research Interchange" (NDRI, Филадельфия, Филадельфия). Каждую клетку промывали модифицированной по способу Дульбекко средой Игла (DMEM-низкая глюкоза, фирма "Invitrogen", Карлсбад, Калифорния) или забуференным фосфатом физиологическим раствором (ЗФР, "Invitrogen") для удаления крови и продуктов распада. Ткань иссекали из наружного участка коркового вещества, внутреннего участка мозгового вещества и подкапсульной зоны почки. Затем ткань механически измельчали в планшетах для культивирования ткани до образования пульты. Затем ткань переносили в коническую пробирку, вместимостью 50 миллилитров. Затем ткань расщепляли или в смеси ферментов по Надлежащейт производственной практике (GMP), содержащей 0,25 единиц активности PZ/миллилитр коллагеназы (NB6, N0002779, фирма "Serva Electrophoresis GmbH", Хайдельберг, Германия), 2,5 единицы/миллилитр диспазы (Dispase II 165 859, фирма "Roche Diagnositics Corporation", Индианаполис, Индиана), 1 единица/миллилитр гиалуронидазы (фирма "Vitrase, ISTA Pharmaceuticals", Ирвайн, Ca), или смеси ферментов, не по GMP, содержащей 500 единиц/миллилитр коллагеназы (фирма "Sigma", Сент-Луис, Миссури), 50 единиц/миллилитр диспазы ("Invitrogen") и 5 единиц/миллилитр гиалуронидазы ("Sigma"). Клетки, выделенные из почек, были также изолированы с 50 единиц/миллилитр диспазы. Смесь ферментов комбинировали или с питательной средой для эпителия почек (REGM) (фирма "Cambrex", Уолкерсвилл, Мэрилень) или питательной средой для мезенхимальных стволовых клеток (MSCGM) ("Cambrex"). Конические пробирки, содержащие ткань, среду и расщепляющие ферменты, инкубировали при температуре 37°C в орбитальном шейкере на скорости 225 об/мин в течение 1 часа.
Продукт расщепления центрифугировали на скорости 150×g в течение 5 минут и отсасывали супенатант. Получившийся сгусток клеток суспендировали в 20 миллилитров REGM или MSCGM. Клеточную суспензию фильтровали через нейлоновый клеточный фильтр BD FALCON с размером поры 40 микрон (фирма "BD Biosciences", Сан-Хосе, Калифорния). Фильтрат повторно суспендировали в среде (общий объем 50 миллилитров) и центрифугировали на скорости 150×g в течение 5 минут. Супернатант отсасывали, и клеточный сгусток повторно суспендировали в 50 миллилитрах свежей питательной среды. Описанную процедуру повторили еще дважды.
После последнего центрифугирования супернатант отсасывали, и клеточный сгусток повторно суспендировали в 5 миллилитрах свежей питательной среды. Количество жизнеспособных клеток определяли на аппарате Guava (фирма "Guava Technologies", Хейуорд, Калифорния). Клетки затем высеивали с плотностью засева 5000 клеток/см2 на культуральную колбу, покрытую 2% желатином или ламинином, и культивировали или в атмосфере с низким содержанием кислорода (гипоксия), или нормальной атмосфере (нормоксия). В таблице 1 представлена информация о доноре и условиях роста, используемых для изолирования популяций клеток, выделенных из почек. Для получения клонов клеток почек, выделенных из одной клетки, применяли приемы ограниченного разведения. В целом, клетки изолировали с применением двадцати четырех разных условий, от четырех разных трупных доноров в возрасте 39, 46, 21 и 10 лет.
Пример 11: Морфология клеток, выделенных из почек человека
Через семь дней после изоляции, популяции клеток, выделенных из почек, исследовали под световым микроскопом и наблюдали морфологические характеристики клеток. Неизменно, все условия изоляции дали рост клеткам с эпителиальной морфологией (см. таблицу 11-1).
Эти данные демонстрируют, что клетки, выделенные из почек, могут быть изолированы у донора любого возраста или пола, а также могут быть изолированы с использованием питательных сред разного состава или в разных условиях культивирования. Простота и неизменность процедуры изолирования показывает, что клетки, выделенные из почек, являются ценным источником клеток для применения в лечении клеточными препаратами.
Пример 12: Потенциал роста клеток, выделенных из почек
Клетки, выделенные из почек, могут интенсивно размножаться в культуре и могут генерировать значительные количества клеток в течение короткого времени. Это является критерием для разработки способов аллогенной клеточной терапии.
Клетки, выделенные из почек, засеивали с плотностью 5 000 клеток/см2 на колбы T75 в среды REGM или MSCGM и культивировали при температуре 37°C в 5% двуокиси углерода. Клетки пассировали каждые 2-5 дней. На каждом пассаже, клетки пересчитывали и измеряли жизнеспособность на аппарате Guava ("Guava Technologies", Хейуорд, Калифорния). Клеточные популяции непрерывно пассировали в течение нескольких недель до достижения старения. Старение определяли, когда клетки не могли достичь более чем одного удвоения популяции в течение исследуемого интервала времени. Затем рассчитывали удвоение популяции [[ln(конечный выход клеток/начальное число засеянных клеток)/ln2].
Для анализа кариотипа, пассаж 4 и пассаж 10 клеток, выделенных из почек, из изоляций 22 и 23, засеивали в колбы T25 и оставляли на ночь для прикрепления. Колбы затем наполняли REGM и проводили анализ кариотипа.
Таблица 12-1 представляет собой обобщение данных по росту для испытуемых изоляций. Не отмечено заметного влияния на характеристики роста клеток возраста донора, источника ткани или ферментов, использованных для изолирования клеток.
Анализ кариотипа проводили на изоляциях 22 и 23 обоих пассажа 4 и пассажа 10. Обе показали нормальный кариотип на пассаже 4 и пассаже 10.
В среднем, удвоение популяции (УП) на уровне старения составляло 28,5, в то время как средняя жизнеспособность составляла 97,6%.
В целом, клетки, выделенные из почек, имеют потенциал устойчивого роста в культуре. Эти данные могут быть использованы для расчета общего числа клеток, полученных из одной целой почки человека. При обработке всей ткани почки и культивировании полученных в результате клеток на протяжении 31 удвоения популяции, одна целая почка человека по расчетам может дать всего 1,89×1016 клеток. Поэтому, с учетом того, что одна терапевтическая доза клеток составляет 1×108 клеток на человека, количество клеток, выделенных из почек, изолированных из одной будет достаточным для лечения 189 миллионов пациентов. В конечном счете, эти клетки являются в высшей степени увеличивающимся источником клеток для использования в аллогенной клеточной терапии.
Пример 13: Фенотип маркера поверхности клеток hKDC
Для определения фенотипа маркера поверхности использовали проточный цитометрический анализ клеток, выделенных из почек человека. Клетки и 9 изоляции в примере 11 размножались до пассажа 4 и пассажа 10 в REGM на колбах T75 в условиях 37°C и 5% двуокиси углерода. Адгезивные клетки промывали в ЗФР и отделяли с помощью TrypLE Select (фирма "Gibco", Гранд Айленд, Нью-Йорк). Клетки собирали, центрифугировали и повторно суспендировали в 3% (об/об) ЗФР при концентрации 2×105 клеток/миллилитр. К 100 миллилитров клеточной суспензии прибавляли специфическое антитело, и смесь инкубировали в темном месте в течение 30-45 минут при температуре 4°C. После инкубации клетки промывали ЗБФ и центрифугировали для удаления избытка антитела. Клетки повторно суспендировали в 500 микролитрах ЗФР и анализировали методом проточной цитометрии. Проточный цитометрический анализ проводили на аппарате Guava ("Guava Technologies", Хейуорд, Калифорния). Антитела, используемые для описания характеристик фенотипа маркера поверхности, показаны в таблице 13-1.
В таблице 13-2 показаны все обобщенные данные по фенотипу маркера поверхности. Все изоляции, подвергшиеся испытаниям, показали положительное окрашивание на CD24, CD29, CD44, CD49c, CD73, CD166, SSEA-4 и HLA I и отрицательное окрашивание на CD31, CD34, CD45, CD56, CD80, CD86, CD104, CD105, CD117, CD133, CD138, CD141, E-кадгерин и HLA II. В дополнение, все изоляции, по которым был проведен анализ, размножались на протяжении нескольких поколений (пассаж 10) и все еще сохраняли свой фенотип маркера поверхности.
Эти клетки экспрессировали HLA I, но не экспрессировали HLA II, CD80 или CD86. Эти характеристики клеточной экспрессии отражают способность клетки обходить иммунную систему хозяина. Такие данные демонстрируют, что клетки, выделенные из почек, являются неиммуногенными, и их введение пациенту не требует гистотипирования или супрессии иммунного ответа.
Подводя итог, эти данные показывают, что клетки, выделенные из почек нескольких доноров, могут быть изолированы в различных условиях (см. таблицу 11-1) и все равно сохранять свой фенотип маркера поверхности. В дополнение, они экспрессируют предполагаемые маркеры прогениторных клеток, такие как CD24 и SSEA-4, при этом не экспрессируют маркеры зрелых, коммитированных, дифференцируемых клеток, такие как E-кадгерин. Подводя окончательный итог, клетки, выделенные из почек, не являются иммунногенными и поэтому представляют собой привлекательный источник клеток для применения в аллогенной клеточной терапии.
Пример 14: Экспрессия гена клетки, выделенной из почек
Выделяли РНК из клеток из изоляций 1, 2 и 17-23 с помощью набора для выделения РНКRNA (RNeasy Mini Kit; фирма "Qiagen", Валенсия, Калифорния). РНК элюировали с 50 микролитрами обработанной DEPC воды и хранили при температуре -80°C. Обратную транскрипцию РНК проводили с использованием случайных гексамеров, применяя реагенты для обратной транскрипции TaqMan (фирма "Applied Biosystems", Фостер Сити, Калифорния) при температуре 25°C в течение 10 минут, температуре 37°C в течение 60 минут и температуре 95°C в течение 10 минут. Пробы хранили при температуре -20°C. С использованием праймеров, описанных в таблице 14-1, проводили исследование селектированных генов традиционным способом ПЦР (полимеразная цепная реакция). ПЦР проводили на пробах кДНК с помощью наборов праймеров для ПЦР RT2 (фирма "SuperArray Biosciences Corp", Фредерик, Мэриленд).
Праймеры смешивали с 1 микролитром кДНК и 2X ReactionReady™ SYBR Green PCR Master Mix ("SuperArray Biosciences") в соответствии с инструкциями производителя, и проводили ПЦР с помощью системы ABI Prism 7000 ("Applied Biosystems", Фостер Сити, Калифорния). Использовали следующие условия термоциклирования: сначала при температуре 50°C в течение 2 мин. и при температуре 95°C в течение 10 мин., затем 34 цикла при температуре 95°C в течение 15 сек. и при температуре 60°C в течение 1 мин. Для GAPDH, ПЦР проводили с помощью праймеров GAPDH, полученных из "Applied Biosystems" (номер по каталогу: 402869), 1 микролитр раствора кДНК и 1× буферный раствор для ПЦР - смесь AmpliTaq Gold universal mix ("Applied Biosystems", Фостер Сити, Калифорния) в соответствии с инструкциями производителя. Концентрация праймера в конечной реакции ПЦР составляла 0,5 микромоля для обоих из прямого и обратного праймера, зонд TaqMan probe не прибавляли. Пробы помещали на 2% (масса/об.) агарозный гель и окрашивали бромидом этидия (фирма "Sigma", Сент-Луис, Миссури). Изображения получали с использованием пленки 667 Universal Twinpack (фирма "VWR International", Саут-Плэйнфилд, Нью-Джерси) и фокусной камеры Polaroid™ (фирма "VWR International", Саут-Плэйнфилд, Нью-Джерси). Для каждого анализируемого гена, из геля выделяли конечный ПЦР-продукт и подтверждали ДНК-мишень посредством определением последовательности ДНК.
Анализ ПЦР с обратной транскрипцией
Все изоляты клеток показали постоянный и стабильный профиль экспрессии гена. Анализ ПЦР с обратной транскрипцией проводили на изоляциях 1, 2 и 17-23 для обнаружения экспрессии генных маркеров раннего развития (Oct-4, Rex-1, Sox2, FGF4, hTert), генных маркеров развития почки (Pax-2, WT-1, Eya-1, Wnt-4, BMP-7, кадгерин-11, FoxD1), метанефрических мезенхимальных генных маркеров (Pax-2, Eya-1, WT-1, Six2 и FoxD1) и генов, которые обеспечивают выживание метанефрической мезенхимы (BMP-7). В дополнение, проводили анализ экспрессии других генов развития, таких как эндодермальные гены (HNF3B, CXC-R4, Sox-17, GATA-4), а также генных маркеров, которые способствуют восстановлению почки или имеют терапевтическую ценность для лечения заболеваний почек (Epo, EpoR, BMP-7, BMP-2, GDF5).
Как показано в таблице 14-2, все изоляции показали положительную экспрессию по Oct-4 и Rex-1 и отрицательную экспрессию по Sox2, FGF4, hTERT и Wnt-4. Изоляции 17-23 показали положительную экспрессию по Pax-2, WT1, кадгерину-11 и FoxD1. Изоляции 22 и 23 показали положительную экспрессию по Eya-1, Sox-17 и CXCR-4 и отрицательную экспрессию по GATA-4. Изоляции 17-23 экспрессировали EpoR, но не экспрессировали Epo. Изоляции 17-22 экспрессировали BMP-2, BMP-7 и GDF5. В дополнение, все изоляции могут размножаться на протяжении многих поколений (пассаж 10) и все равно сохранять свой фенотип экспрессии гена.
Подводя итог, клетки, выделенные из почек, экспрессируют гены, участвующие в раннем развитии и развитии почки. Они экспрессируют маркеры метанефрической мезенхимы и маркеры прогениторных клеток почки. Они экспрессируют маркеры эндодермальных клеток, а также факторов, участвующих в восстановлении почек и тубулогенеза.
В целом, эти данные показывают, что клетки, выделенные из почек, являются источником предполагаемых прогениторных клеток почек, который может быть использован в клеточной терапии для защиты или восстановления поврежденных тканей почки.
Пример 15: Анализ секреции трофического фактора
Обнаружено, что клетки, выделенные из почек, постоянно продуцируют трофические факторы, которые защищают и восстанавливают почки. Поэтому эти клетки могут служить лекарственным средством для лечения заболеваний почек.
Пассаж клеток 3, из изоляциях 17-21 засеивали в концентрации 5000 клеток/см2 в одной колбе T75 на изоляцию, причем каждая содержит 15 миллилитров REGM. Клетки культивировали в условиях 37°C и 5% диоксида углерода. После культивирования в течение ночи, среду меняли на бессывороточную среду (DMEM с низким содержанием глюкозы ("Gibco"), 0,1% (масса/об.), альбумин бычьей сыворотки ("Sigma"), пенициллин (50 единиц/миллилитр) и стрептомицин (50 микрограмм/миллилитр) ("Gibco")) и культивировали далее в течение 8 часов. В конце инкубации кондиционированную бессывороточную среду собирали центрифугированием на скорости 14000×g в течение 5 минут и хранили при температуре -20°C.
Клетки промывали ЗФР, отделяли с использованием 4 миллилитров TrypLE Select ("Gibco") и подсчитывали на аппарате Guava ("Guava Technologies", Хэйуорд, Калифорния) для подсчета количества клеток в каждой колбе. С помощью набора протеома Searchlight Proteome Arrays (фирма "Pierce Biotechnology Inc"), проводили анализ проб способом ИФА на выявление следующих трофических факторов: тканевый ингибитор металлопротеиназы-1 (TIMP-1), тканевый ингибитор металлопротеиназы-2 (TIMP-2), тромбоцитарный эпителиальный фактор роста bb (PDGF-bb), кератиноцитарный фактор роста (KGF), гепатоцитарный фактор роста (HGF), основной фактор роста фибробластов (FGF2), фактор роста сосудистого эндотелия (VEGF), гепарин-связывающий фактор роста (HB-EGF), моноцитарный хемотаксический белок-1 (MCP-1), интерлейкин-6 (IL-6), интерлейкин-8 (IL-8), трансформирующий фактор роста альфа (TGFα), нейротрофический фактор головного мозга (BDNF), стромальный фактор роста 1b (SDF1b), цилиарный нейротрофный фактор (CNTF), основной фактор роста нервов (b-NGF), нейротрофин-3 (NT-3),онкоген, связанный с ростом опухоли-alpha (GRO-α), интерлейкин-1b (IL-1b), интерлейкин-12p40 (IL-12p40), интерлейкин-12p70 (IL-12p70), интерлейкин-11 (IL-11), интерлейкин-15 (IL-15), матричная металлопротеиназа-2 (MMP-2), матричная металлопротеиназа-9 (MMP-9), ангиопоэтин-2 (ANG-2) и человеческий гормон роста (HGH).
Анализ продукции трофических факторов
Проводили анализ секреции двадцати семи разных факторов роста и цитокинов на изоляциях 17-21. Результаты обобщены в таблице 15-1. Все изоляции секретировали TIMP-1, TIMP-2, VEGF и MMP-2 на уровне более 300 пикограмм/миллилитр /1×106 клеток/8 часов. Они секретировали 50-300 пикограмм/миллилитр/1×106 клеток/8 часов FGF2 и HGF, и 1-50 пикограмм/миллилитр/1×106 клеток/8 часов KGF, PDGF-bb, b-NGF, IL-12p40 и IL-11. Не обнаружены SDF-1, ANG-2, HGH и Il-12p70.
Подводя итог, эти данные показывают, что клетки, выделенные из почек, секретируют несколько трофических факторов для защиты и восстановления поврежденной ткани почки. Например, FGF2, HGF и TGFα непосредственно связаны с восстановлением почек. Клетки, выделенные из почек, секретируют эти факторы на высоком и постоянном уровне. Поэтому эти клетки являются ценным источником клеток для применения в способах лечения заболеваний почек.
Пример 16: Тубулогенез клеток, выделенных из почек в условиях In Vitro
Клетки, выделенные из почек, могут быть разморожены на пассаже 4 и пассаже 10, затем их растирают в суспензию отдельных клеток с концентрацией 4×104 клеток/миллилитр в растворе коллагена I типа, содержащего 66% Вирогена 100 (3 миллиграмм/миллилитр (фирма "Cohesion Technologies", Пало Альто, Калифорния). Клетки в суспензии могут высеиваться на лишенные клеток мембраны сальника. Смесь коллагена и клеток может затем инкубироваться в течение 30 минут в условиях 37°C, 5% CO2, 95% воздуха для достижения желирования коллагена, и затем прибавляют питательную среду. К клеткам прибавляли питательные вещества через каждый период времени, составляющий от 3 суток до 7 суток. На 7 сутки, культуры обрабатывают различными концентрациями гепатоцитарного фактора роста и далее продолжают культивировать пока не обнаруживается тубулогенез.
Эти наблюдения показывают, что клетки, выделенные из почек, могут самоорганизовываться в канальцевые структуры в условиях in vitro. Эти структуры представляют ценность как строительные блоки для восстановления почки, а также для скриннингового исследования и токсикологического анализа разрабатываемых лекарственных препаратов.
Пример 17: Тубулогенез клеток, выделенных из почек в условиях in vivo
Засеивали три пленки 35/65 PCL/PGA (диаметр 10 см × толщина 2 мм) клетками, выделенными из почек человека (10000 клеток/см2) и культивировали в REGM ("Cambrex") в условиях 37°C и 5% диоксида углерода в течение 8 дней. Готовили вспененный каркас 35/65 PCL/PGA в соответствии со способами, описанными в патенте США 6355699, содержание которого полностью включено в настоящий документ путем отсылки. Системы клетка/пленка затем извлекали из чашек из формованной пленки, складывали в три слоя и наносили на опору вспененного каркаса 35/65 PCL/PGA.. Эту конструкцию затем культивировали в течение дополнительных 24 часов, затем нарезали на квадратные куски 3×3 мм перед имплантацией. Затем импланты промывали ЗФР и переносили в 6-луночный планшет, заполненный ЗФР, для переноса.
Импланты имплантировали подкожно с двух сторон в спинной боковой торакально-поясничный участок мышей линии SCID. Самцы мышей линии SCID (вид Fox Chase SCID CB17SC) были закуплены у фирмы "Taconic Inc"., (Гудзон, Нью-Йорк) в возрасте 5 недель. В каждую мышь линии SCID помещали по два импланта. На коже спинки мыши выполняли два надреза длиной примерно 5 см каждый. Разрезы были размещены поперечно выше поясничной области примерно 5 мм краниально к пальпируемому гребню подвздошной кости, по одному на каждой стороне от срединной линии тела. Затем кожу отделяли от подстилающей соединительной ткани, чтобы образовать небольшой карман, и имплант помещали примерно 10 мм краниально к разрезу. Кожные разрезы закрывали металлическими клипсами для ушивания ран Reflex 7. Через 3 недели импланты извлекали из подкожного кармана, фиксировали в 10% формалине, заливали парафином, делали срезы, окрашивали гематоксилином и эозином (Г&Э), их оценку проводил патологоанатом с использованием способа светового микроскопирования.
Клетки, выделенные из почек, образовывали канальцеподобные структуры в слоях PCL/ PGA пленки. В этих канальцах обнаружены четко различимые эпителиальная стенка и свободный просвет. Клетки, выделенные из почек, проникали через вспененный каркас, откладывали экстрацеллюлярную матрицу и формировали плотную, тканеподобную структуру. В дополнение, клетки, выделенные из почек, внутри вспененного слоя стимулировали ангиогенез и формирование сосудистой сетки.
Подводя итог, клетки человека, специфичные для почек, образовали канальцевые структуры после воздействия микроокружения в условиях in vivo. Способность клеток, выделенных из почек, реагировать на сигналы микроокружения и передавать клеткам способность формировать канальцы, дополнительно демонстрирует, что эти клетки по природе представляют собой прогениторные клетки почки. В дополнение, клетки мигрировали во вспененные каркасы, образовывая тканеподобную структуру, которая способствовала ангиогенезу. Эти данные демонстрируют применение клеток, выделенных из почек, в качестве клеточных строительных блоков для восстановления канальцев почек и, в конечном счете, их использование в тканевой инженерии.
Хотя изобретение было описано и проиллюстрировано ссылками на различные конкретные материалы, процедуры и примеры, следует понимать, что изобретение не ограничивается конкретными комбинациями материалов и процедур, выбранными для этой цели. Многочисленные изменения, касающиеся таких деталей изобретения, будут очевидными для специалистов в данной области техники. Подразумевается, что все описания и примеры представлены только в качестве иллюстрации и находятся в пределах сущности и объема настоящего изобретения, что отражено в нижеприведенной формуле изобретения. Все ссылки, патенты и заявки на патенты, приведенные в этой заявке, полностью включены в этот документ путем отсылки.
Реферат
Изобретение относится к области биотехнологии, клеточным технологиям и медицине. Описано биосинтетическое устройство проксимального канальца. Устройство создано с помощью приготовления лишенной клеток биологической матрицы, засева биологической матрицы клетками, выделенными из почек млекопитающих, и, дополнительно, эндотелиальными клетками млекопитающих. Затем устройство может культивироваться в статических условиях или созревать с помощью культивирования в биореакторе, чтобы обеспечить дифференцировку почечных клеток в функционирующие клетки проксимальных канальцев. Устройство способно выполнять функции проксимального канальца. Также описаны различные способы изготовления устройств проксимального канальца и способы применения биосинтетических устройств проксимального канальца в исследованиях, например, в условияхпереноса клетками канальцев, токсического действия различных соединений или в скрининговых исследованиях лекарственных соединений. Предложенная группа изобретений может быть использована в фармацевтике. 4 н. и 14 з.п. ф-лы, 16 ил., 9 табл., 17 пр.
Формула
Документы, цитированные в отчёте о поиске
Примитивные и проксимальные печеночные стволовые клетки

Комментарии