Способ получения популяции клеток, экспрессирующих mafa (варианты) - RU2687378C1
Код документа: RU2687378C1
Чертежи















Описание
В рамках настоящего изобретения испрашивается приоритет заявки с серийным номером 61/110287, поданной 31 октября 2008 года.
ОБЛАСТЬ ИЗОБРЕТЕНИЯ
В настоящем изобретении предлагаются способы стимуляции дифференцирования плюрипотентных стволовых клеток. В частности, в настоящем изобретении предлагается способ увеличения экспрессии MAFA в клетках, экспрессирующих маркеры, характерные для линии панкреатических эндокринных клеток.
ПРЕДПОСЫЛКИ СОЗДАНИЯ ИЗОБРЕТЕНИЯ
Достижения в области заместительной клеточной терапии для лечения сахарного диабета 1 типа и нехватка островков Лангерганса для трансплантации заставили обратить внимание на разработку источников инсулин-продуцирующих клеток, или β-клеток, подходящих для трансплантации. Одним из подходов является формирование функциональных β-клеток из плюрипотентных стволовых клеток, таких как, например, эмбриональные стволовые клетки.
При эмбриональном развитии позвоночных плюрипотентные клетки дают начало группе клеток, формирующих три зародышевых листка (эктодерму, мезодерму и эндодерму) в ходе процесса, именуемого гаструляцией. Такие ткани, как, например, щитовидная железа, тимус, поджелудочная железа, кишечник и печень, будут развиваться из эндодермы через промежуточную стадию. Промежуточной стадией данного процесса является образование сформированной эндодермы. Клетки сформированной эндодермы экспрессируют ряд маркеров, таких как HNF-3 бета, GATA4, MIXL1, CXCR4 и SOX17.
Формирование поджелудочной железы происходит при дифференцировании сформированной эндодермы в панкреатическую эндодерму. Клетки панкреатической эндодермы экспрессируют ген панкреатическо-дуоденального гомеобокса, Pdx1. При отсутствии Pdx1 развитие поджелудочной железы не идет дальше формирования вентрального и дорзального зачатков. Таким образом, экспрессия Pdx1 характеризует критическую стадию органогенеза поджелудочной железы. Зрелая поджелудочная железа содержит, помимо других типов клеток, экзокринную ткань и эндокринную ткань. Экзокринная и эндокринная ткани образуются при дифференцировании панкреатической эндодермы.
По имеющимся данным, клетки, обладающие свойствами островковых клеток, были получены из эмбриональных клеток мыши. Например, в публикации Lumelsky et al. (Science 292:1389, 2001) сообщается о дифференцировании эмбриональных стволовых клеток мыши в инсулин-секретирующие структуры, сходные с островками поджелудочной железы. В публикации Soria et al. (Diabetes 49:157, 2000) сообщается, что инсулин-секретирующие клетки, полученные из эмбриональных стволовых клеток мыши, нормализовали гликемию у мышей с диабетом, вызванным стрептозотоцином.
В одном примере, в публикации Hori et al. (PNAS 99: 16105, 2002) описывается, что обработка мышиных эмбриональных стволовых клеток ингибиторами фосфоинозитид 3-киназы (LY294002) приводила к образованию клеток, сходных с β-клетками.
В другом примере, в публикации Blyszczuk et al. (PNAS 100:998, 2003), сообщается о получении инсулин-продуцирующих клеток из эмбриональных стволовых клеток мыши с конститутивной экспрессией Pax4.
В публикации Micallef et al. сообщается, что ретиноевая кислота может регулировать способность эмбриональных стволовых клеток формировать Pdx1-положительную панкреатическую эндодерму. Ретиноевая кислота с наибольшей эффективностью индуцирует экспрессию Pdx1 при добавлении в культуру на 4 день дифференцирования эмбриональных стволовых клеток в течение периода, соответствующего концу гаструляции эмбриона (Diabetes 54:301, 2005).
В публикации Miyazaki et al. сообщается о линии мышиных эмбриональных стволовых клеток со сверхэкспрессией Pdx1. Эти результаты показывают, что экспрессия экзогенного Pdx1 очевидно повышает экспрессию генов инсулина, соматостатина, глюкокиназы, нейрогенина 3, P48, Pax6 и HNF6 в образующихся дифференцированных клетках (Diabetes 53: 1030, 2004).
В публикации Skoudy et al. сообщается, что активин A (входящий в суперсемейство TGF-β) повышает экспрессию экзокринных панкреатических генов (p48 и амилаза) и эндокринных генов (Pdx1, инсулин и глюкагон) в эмбриональных стволовых клетках мыши. Максимальный эффект наблюдался при использовании активина A в концентрации 1 нМ. Также авторы наблюдали, что на уровень экспрессии мРНК инсулина и Pdx1 не влияла ретиноевая кислота; однако обработка раствором FGF7 с концентрацией 3 нM приводила к повышению уровня транскрипта Pdx1 (Biochem. J. 379: 749, 2004).
В работе Shiraki et al. изучались эффекты факторов роста, специфически ускоряющих дифференцирование эмбриональных стволовых клеток в Pdx1-положительные клетки. Авторы наблюдали, что TGF-β2 приводил к воспроизводимому увеличению доли Pdx1-положительных клеток (Genes Cells. 2005 Jun; 10(6): 503-16.).
В публикации Gordon et al. продемонстрирована индукция образования эндодермальных клеток brachyury+/HNF-3бета+ из эмбриональных стволовых клеток мыши в отсутствие сыворотки и в присутствии активина в сочетании с ингибитором сигнального пути Wnt (US 2006/0003446A1).
В публикации Gordon et al. (PNAS, Vol 103, page 16806, 2006) говорится: «Для образования передней первичной полоски требовались одновременно сигнальные пути Wnt и TGF-бета/Nodal/активин».
Однако модель развития эмбриональных стволовых клеток на мышах может не имитировать в точности программу развития у высших млекопитающих, например, у человека.
В работе Thomson et al. эмбриональные стволовые клетки выделяли из человеческих бластоцист (Science 282:114, 1998). Параллельно Gearhart и соавторы получили клеточные линии эмбриональных зародышевых клеток человека (hEG) из ткани половых желез эмбриона (Shamblott et al., Proc. Natl. Acad. Sci. USA 95:13726, 1998). В отличие от эмбриональных стволовых клеток мыши, воспрепятствовать дифференцированию которых можно путем простого культивирования с фактором торможения лейкемии (LIF), эмбриональные стволовые клетки человека должны культивироваться в очень специфических условиях (патенты США № 6200806; WO 99/20741; WO 01/51616).
D’Amour et al. описывают производство обогащенных культур сформированной эндодермы, производной от человеческих эмбриональных стволовых клеток, в присутствии высокой концентрации активина и низкой концентрации сыворотки (Nature Biotechnology 2005). Трансплантация этих клеток под почечную капсулу мышей привела к их дифференцированию в более зрелые клетки, обладающие характерными особенностями некоторых эндодермальных органов. Клетки сформированной эндодермы, производные от эмбриональных стволовых клеток человека, могут подвергаться дальнейшему дифференцированию в Pdx1-положительные клетки после добавления FGF-10 (US 2005/0266554A1).
В публикации D’Amour et al. (Nature Biotechnology - 24, 1392-1401 (2006)) говорится: «Мы разработали процесс дифференцирования, преобразующий человеческие эмбриональные стволовые клетки (чЭС) в эндокринные клетки, способные синтезировать гормоны поджелудочной железы, инсулин, глюкагон, соматостатин, панкреатический полипептид и грелин. Данный процесс имитирует органогенез поджелудочной железы in vivo, проводя клетки через стадии, напоминающие образование сформированной эндодермы, эндодермы кишечной трубки, панкреатической эндодермы и превращение предшественников эндокринных клеток в клетки, экспрессирующие эндокринные гормоны».
В другом примере, в публикации Fisk et al., сообщается о системе для производства островковых клеток поджелудочной железы из эмбриональных стволовых клеток человека (US2006/0040387A1). В данном случае процесс дифференцирования был разделен на три стадии. Сначала человеческие эмбриональные стволовые клетки были дифференцированы до эндодермы с помощью сочетания бутирата натрия и активина А. Далее клетки культивировали с антагонистами TGF-β, такими как Noggin, в сочетании с EGF или бетацеллюлином с получением Pdx1-положительных клеток. Окончательное дифференцирование запускалось никотинамидом.
В одном примере Benvenistry et al. сообщают: «Мы делаем вывод, что сверхэкспрессия Pdx1 увеличивала экспрессию панкреатических обогащенных генов, а для индукции экспрессии инсулина могут требоваться дополнительные сигналы, присутствующие только in vivo» (Benvenistry et al, Stem Cells 2006; 24:1923-1930).
Циклины задействованы в функциях бета-клеток. Например, в работе Lilja et al сообщается, что Cdk5 присутствует в секретирующей инсулин панкреатической β-клетке (J. Biol. Chem., Vol. 276, Issue 36, 34199-34205, 07 сентября 2001 г.). Lilja et al утверждают, что «Cdk5 присутствует в β-клетках и действует как положительный регулятор экзоцитоза инсулина».
В другом примере Marzo et al утверждают, что «мыши с вставкой гена Cdk4 имеют значительно более высокую массу бета-клеток и являются физиологически функциональными, и это показывает, что Cdk4 является потенциальной мишенью для восстановления массы панкреатических бета-клеток при диабетах 1 типа» (Diabetalogia, Vol. 47, Number 4, 686-694, 01 апреля 2004 г.).
В другом примере Ubeda et al сообщают, что ингибирование активности циклин-зависимой киназы 5 защищает панкреатические бета-клетки от глюкотоксичности (J. Biol. Chem., Vol. 281, Issue 39, 28858-28864, 29 сентября 2006 г.).
В другом примере в публикации Wei et al сообщается о Cdk5-зависимой регуляции стимулируемой глюкозой секреции инсулина (Nature Medicine 11, 1104-1108 (01 октября 2005 г.)).
В другом примере Vanderford et al утверждают, что «MafA является основным транскрипционным фактором с лейциновыми застежками, экспрессируемым в бета-клетках поджелудочной железы, и он необходим для поддержания нормального глюкозного гомеостаза, поскольку задействован в различных аспектах биологии бета-клеток. Известно, что концентрация белка MafA увеличивается в ответ на высокий уровень глюкозы посредством пока не до конца охарактеризованных механизмов. Мы провели исследование, чтобы определить, контролируется ли экспрессия MafA дискретными событиями внутриклеточной сигнализации. Мы обнаружили, что общий ингибитор киназ стауроспорин индуцирует экспрессию MafA, не влияя на стабильность этого белка. Ингибирование MAP-киназы JNK имитирует влияние стауроспорина на экспрессию MafA. Кальмодулиновая киназа и кальциевая сигнализация также играют важную роль при стимуляции экспрессии MafA высоким уровнем глюкозы. Однако стауроспорин, JNK и кальмодулиновая киназа оказывают различные эффекты на индукцию экспрессии инсулина. Эти данные показывают, что концентрации MafA жестко контролируются скоординированными влияниями нескольких киназных путей» (Archives of Biochemistry and Biophysics (2008), doi: 10.1016/j.abb.2008.10.001).
Таким образом, сохраняется значительная потребность в разработке способов дифференцирования плюрипотентных стволовых клеток в панкреатические эндокринные клетки, клетки, экспрессирующие панкреатические гормоны, или клетки, секретирующие панкреатические гормоны. В настоящем изобретении предлагаются способы увеличения экспрессии MAFA в клетках, экспрессирующих маркеры, характерные для линии панкреатических эндокринных клеток.
КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
В одном варианте осуществления настоящего изобретения предлагается способ увеличения экспрессии MAFA в клетках, экспрессирующих маркеры, характерные для линии панкреатических эндокринных клеток, включающий в себя этапы культивирования клеток, экспрессирующих маркеры, характерные для линии панкреатических эндокринных клеток, в среде, содержащей достаточное количество ингибитора циклин-зависимой киназы, чтобы вызвать увеличение экспрессии MAFA.
КРАТКОЕ ОПИСАНИЕ ФИГУР
На фиг.1, панель a, показано измеренное методом ПЦР в реальном времени влияние соединений из библиотеки ингибиторов киназ EMD Calbiochem на отношение экспрессии глюкагона к экспрессии инсулина в клетках, экспрессирующих маркеры, характерные для линии панкреатических эндокринных клеток. Буквенно-цифровое обозначение соответствует идентификатору соединения, показанному в Таблице 1. На панели b показано измеренное методом ПЦР в реальном времени влияние соединений из библиотеки ингибиторов киназ EMD Calbiochem на отношение экспрессии MAFA к экспрессии ARX4 в клетках, экспрессирующих маркеры, характерные для линии панкреатических эндокринных клеток. Буквенно-цифровое обозначение соответствует идентификатору соединения, показанному в Таблице 1.
На фиг.2 A) показана 4-кратная микрофотография клеток, обработанных в соответствии со способами, описанными в Примере 1, на 4 день обработки, соответствующей стадии 6. На панели B) показана 4-кратная микрофотография клеток, обработанных соединением PubChem № 5330812 в концентрации 0,5 мкM, на 4 день обработки. На панели C) показана 4-кратная микрофотография клеток, обработанных соединением PubChem № 5330812 в концентрации 1 мкM, на 4 день обработки. На панели D) показана 20-кратная микрофотография клеток, обработанных в соответствии со способами, описанными в Примере 1, на 6 день обработки, соответствующей стадии 6. На панели E) показана 20-кратная микрофотография клеток, обработанных 0,5 мкM соединения PubChem № 5330812, на 6 день обработки. На панели F) показана 20-кратная микрофотография клеток, обработанных соединением PubChem № 5330812 в концентрации 1 мкM, на 6 день обработки.
На фиг.3 показана экспрессия 23 обозначенных генов в клетках, экспрессирующих маркеры, характерные для линии панкреатических эндокринных клеток, и после пятидневной обработки соединением PubChem № 5330812 в концентрации 0,5 мкM (темные столбцы) или 1,0 мкM (светлые столбцы). Уровни экспрессии определяли в день 0, день 2 и день 5.
На фиг.4 показано влияние обработки CDK-ингибитором III на экспрессию маркеров, характерных для линии панкреатических эндокринных клеток, в клетках, прошедших обработку, соответствующую стадии 7 протокола дифференцирования, описанного в Примере 4.
На фиг.5 показано влияние обработки CDK-ингибитором III на окрашивание дитиазоном кластеров, подобных островкам поджелудочной железы.
На фиг.6 показана экспрессия инсулина, синаптофизина и глюкагона в инсулин-продуцирующих клетках, полученных в соответствии со способами, описанными в Примере 5. Экспрессию указанных белков определяли методом FACS.
На фиг.7 показана экспрессия инсулина, синаптофизина и глюкагона в инсулин-продуцирующих клетках, полученных в соответствии со способами, описанными в Примере 5. Экспрессию указанных белков определяли методом FACS.
На фиг.8 показана экспрессия MAFA (панель a) и инсулина (панель b) в инсулин-продуцирующих клетках, полученных способами, составляющими предмет настоящего изобретения. Образцы клеток для ПЦР-анализа отбирали в дни 1, 2, 3 и 4. После 4 дней обработки ингибитором CDK ингибитор CDK убирали из культуральной среды и клетки культивировали еще 4 дня в среде DMEM-F12 + 1% B27 + 20 нг/мл активина A. По истечении четырех дней отбирали в трех повторностях образцы для ПЦР-анализа.
На фиг.9 показано измеренное методом ПЦР в реальном времени влияние соединений из библиотеки ингибиторов I киназ EMD Calbiochem на экспрессию MAFA в клетках, экспрессирующих маркеры, характерные для линии панкреатических эндокринных клеток.
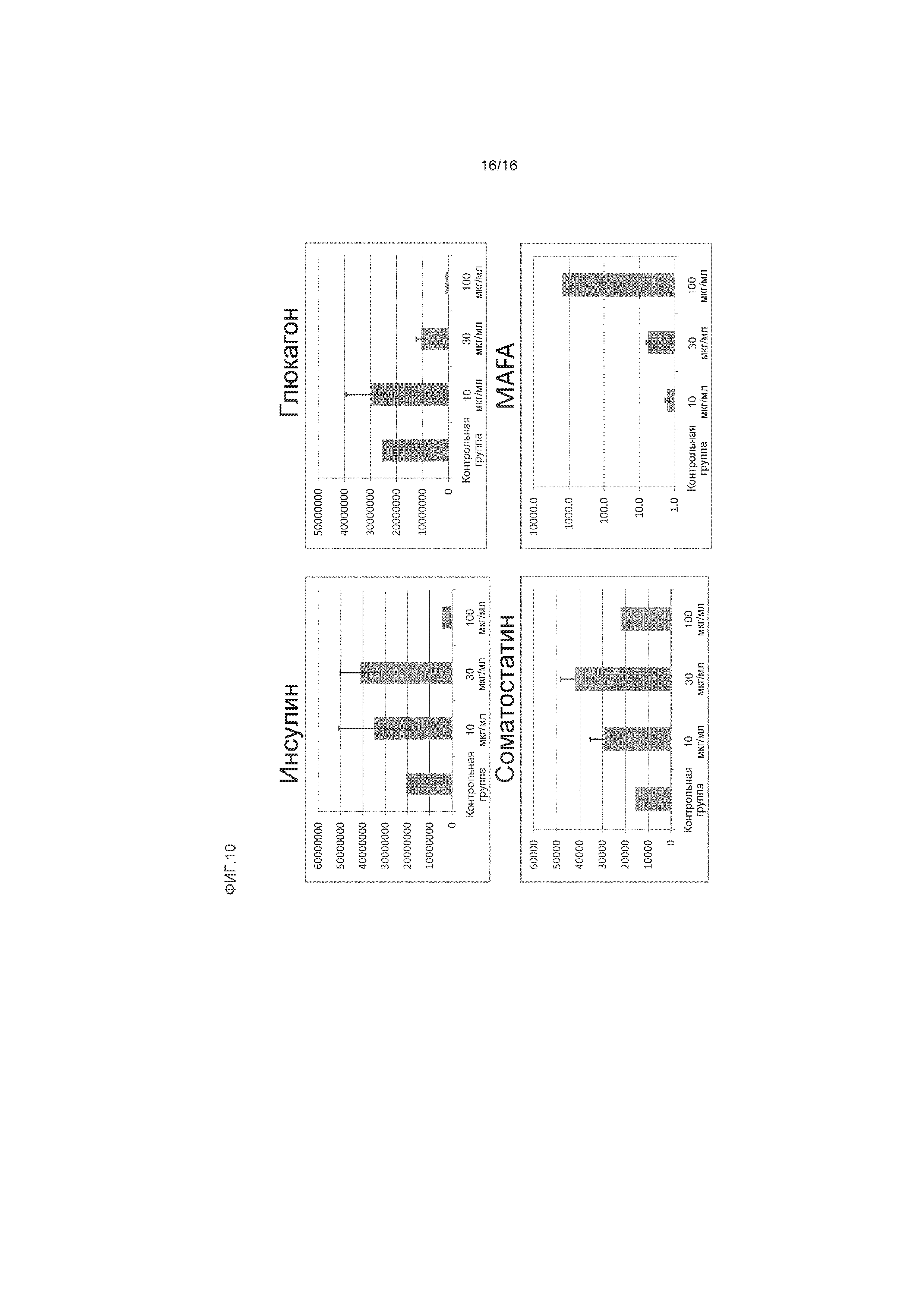
На фиг.10 показано измеренное методом ПЦР в реальном времени влияние генестеина на экспрессию мРНК инсулина, глюкагона, соматостатина и MAFA в клетках, экспрессирующих маркеры, характерные для линии панкреатических эндокринных клеток.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Для ясности описания, а не для ограничения изобретения, подробное описание изобретения разделено на следующие подразделы, описывающие или иллюстрирующие определенные особенности, варианты осуществления или области применения настоящего изобретения.
Определения
Стволовые клетки представляют собой недифференцированные клетки, определяемые по их способности на уровне единичной клетки как самообновляться, так и дифференцироваться с образованием клеток-потомков, таких как самообновляющиеся клетки-предшественники, необновляющиеся клетки-предшественники и окончательно дифференцированные клетки. Стволовые клетки также характеризуются способностью дифференцироваться in vitro в функциональные клетки различных клеточных линий дифференцирования из нескольких зародышевых листков (эндодермы, мезодермы и эктодермы), а также после трансплантации давать начало тканям, происходящим от нескольких зародышевых листков, и вносить существенный вклад в формирование большинства, если не всех, тканей после инъекции в бластоцисты.
По потенциалу развития стволовые клетки классифицируются следующим образом: (1) тотипотентные, т.е. способные давать начало всем эмбриональным и внеэмбриональным типам клеток; (2) плюрипотентные, т.е. способные давать начало всем эмбриональным типам клеток; (3) мультипотентные, т.е. способные давать начало группе клеточных линий дифференцирования в пределах конкретной ткани, органа или физиологической системы (например, гематопоэтические стволовые клетки (HSC) могут давать таких потомков, как HSC (самообновление), олигопотентные предшественники, ограниченные клетками крови, и все типы клеток и клеточных элементов (таких как тромбоциты), являющиеся нормальными компонентами крови); (4) олигопотентные, т.е. способные давать начало более ограниченному набору клеточных линий дифференцирования, чем мультипотентные стволовые клетки; и (5) унипотентные, т.е. способные давать начало единственной клеточной линии дифференцирования (например, сперматогенные стволовые клетки).
Дифференцирование представляет собой процесс, при помощи которого неспециализированная («некоммитированная») или менее специализированная клетка приобретает свойства специализированной клетки, например, нервной или мышечной клетки. Дифференцированная клетка или клетка с индуцированным дифференцированием представляет собой клетку, занявшую более специализированное («коммитированное») положение в линии дифференцирования клетки. Термин «коммитированная» применительно к процессу дифференцирования обозначает клетку, дошедшую в ходе процесса дифференцирования до стадии, от которой в нормальных условиях она продолжит дифференцироваться до определенного типа клеток или набора типов клеток и не сможет в нормальных условиях дифференцироваться в иной тип клеток или вернуться обратно к менее дифференцированному типу. Дедифференцированием называется процесс, в ходе которого клетка возвращается к менее специализированному (или коммитированному) положению в линии дифференцирования. Используемый в настоящей заявке термин «линия дифференцирования клетки» определяет наследственность клетки, то есть определяет, из какой клетки произошла данная клетка и каким клеткам она может дать начало. В линии дифференцирования клетка помещается в наследственную схему развития и дифференцирования. Маркером, специфичным для линии дифференцирования, называется характерная особенность, специфически ассоциированная с фенотипом клеток конкретной линии дифференцирования, которая может использоваться для оценки дифференцирования некоммитированных клеток в клетки данной линии дифференцирования.
Термин «β-клеточная линия дифференцирования» используется в настоящем документе для обозначения клеток, положительных по экспрессии гена транскрипционного фактора PDX-1 и по меньшей мере одного из следующих транскрипционных факторов: NGN3, NKX2.2, NKX6.1, NEUROD, ISL1, HNF3 бета, MAFA, PAX4 или PAX6. К клеткам, экспрессирующим маркеры, характерные для β-клеточной линии дифференцирования, относятся β-клетки.
Термин «клетки, экспрессирующие маркеры, характерные для линии сформированной эндодермы» в настоящем документе обозначает клетки, экспрессирующие по меньшей мере один из следующих маркеров: SOX17, GATA4, HNF3 бета, GSC, CER1, Nodal, FGF8, Brachyury, Mix-подобный гомеобоксовый белок, FGF4 CD48, эомезодермин (EOMES), DKK4, FGF17, GATA6, CXCR4, C-Kit, CD99 или OTX2. К клеткам, экспрессирующим маркеры, характерные для линии сформированной эндодермы, относятся клетки-предшественники первичной полоски, клетки первичной полоски, клетки мезэндодермы и клетки сформированной эндодермы.
Термин «клетки, экспрессирующие маркеры, характерные для линии панкреатической эндодермы» в настоящем документе обозначает клетки, экспрессирующие по меньшей мере один из следующих маркеров: PDX1, HNF1 бета, PTF1 альфа, HNF- или HB9. К клеткам, экспрессирующим маркеры, характерные для линии панкреатической эндодермы, относятся клетки панкреатической эндодермы, клетки первичной кишечной трубки и клетки поздней передней кишки.
Используемый в настоящей заявке термин «клетки, экспрессирующие маркеры, характерные для линии панкреатических эндокринных клеток» относится к клеткам, экспрессирующим по меньшей мере один из следующих маркеров: NGN3, NEUROD, ISL1, PDX1, NKX6.1, PAX4, NGN3 или PTF1 альфа. Клетки с экспрессией маркеров, характерных для линии панкреатических эндокринных клеток, включают в себя панкреатические эндокринные клетки, панкреатические клетки, экспрессирующие гормоны и панкреатические клетки, секретирующие гормоны, а также клетки β-клеточной линии дифференцирования.
Используемый в настоящей заявке термин «сформированная эндодерма» относится к клеткам, обладающим характерными особенностями клеток, происходящих в ходе гаструляции от эпибласта, и формирующим желудочно-кишечный тракт и его производные. Клетки сформированной эндодермы экспрессируют следующие маркеры: HNF3 бета, GATA4, SOX17, церберус, OTX2, гузекоид, C-Kit, CD99 или MIXL1.
Используемый в настоящей заявке термин «внеэмбриональная эндодерма» относится к популяции клеток, экспрессирующих по меньшей мере один из следующих маркеров: SOX7, AFP или SPARC.
Используемый в настоящей заявке термин «маркеры» обозначает молекулы нуклеиновых кислот или полипептидов с дифференциальной экспрессией в интересующих клетках. В данном контексте под дифференциальной экспрессией подразумевается повышение уровня экспрессии для положительного маркера и понижение уровня экспрессии для отрицательного маркера. Поддающийся обнаружению уровень маркерной нуклеиновой кислоты или полипептида в интересующих клетках оказывается значительно выше или ниже по сравнению с другими клетками, что позволяет идентифицировать интересующую клетку и отличить ее от других клеток с помощью любого из множества известных в данной области способов.
Используемый в настоящей заявке термин «мезэндодермальная клетка» относится к клеткам, экспрессирующим по меньшей мере один из следующих маркеров: CD48, эомезодермин (EOMES), SOX17, DKK4, HNF3 бета, GSC, FGF17 или GATA6.
Используемые в настоящей заявке термины «панкреатическая эндокринная клетка» или «клетка, экспрессирующая гормон поджелудочной железы» относятся к клетке, экспрессирующей по меньшей мере один из следующих гормонов: инсулин, глюкагон, соматостатин или панкреатический полипептид.
Используемый в настоящей заявке термин «клетка панкреатической эндодермы» относится к клеткам, способным к экспрессии по меньшей мере одного из следующих маркеров: NGN3, NEUROD, ISL1, PDX1, PAX4 или NKX2.2.
Используемый в настоящей заявке термин «клетка, продуцирующая гормон поджелудочной железы» относится к клетке, способной производить по меньшей мере один из следующих гормонов: инсулин, глюкагон, соматостатин или панкреатический полипептид.
Термин «клетка, секретирующая гормон поджелудочной железы» в настоящем документе обозначает клетку, способную секретировать по меньшей мере один из следующих гормонов: инсулин, глюкагон, соматостатин и панкреатический полипептид.
Используемый в настоящей заявке термин «клетка задней части передней кишки» относится к клеткам, способным к секреции по меньшей мере одного из следующих маркеров: PDX1, HNF1, PTF1 альфа, HNF6, HB9 или PROX1.
Используемый в настоящей заявке термин «клетка-предшественник клетки первичной полоски» относится к клеткам, экспрессирующим по меньшей мере один из следующих маркеров: Nodal и FGF8.
Термин «клетка первичной кишечной трубки» в настоящем документе обозначает клетку, способную секретировать по меньшей мере один из следующих маркеров: HNF1 или HNF4A.
Используемый в настоящей заявке термин «клетка первичной полоски» относится к клеткам, экспрессирующим по меньшей мере один из следующих маркеров: Brachyury, Mix-подобный гомеобоксовый белок или FGF4.
Выделение, размножение и культивирование плюрипотентных стволовых клеток
Характеристика плюрипотентных стволовых клеток
Плюрипотентные стволовые клетки могут экспрессировать один или несколько стадийно-специфичных эмбриональных антигенов (SSEA) 3 и 4, а также маркеры, определяемые антителами, обозначенными как Tra-1-60 и Tra-1-81 (Thomson et al., Science 282:1145, 1998). Дифференцирование плюрипотентных стволовых клеток in vitro приводит к утрате экспрессии SSEA-4, Tra-1-60 и Tra-1-81 (если имеются) и к увеличению экспрессии SSEA-1. В недифференцированных плюрипотентных стволовых клетках, как правило, активна щелочная фосфатаза, которая может быть обнаружена путем фиксации клеток с помощью 4% параформальдегида, с последующим обнаружением с помощью Vector Red, применяемого в качестве субстрата, в соответствии с инструкциями производителя (Vector Laboratories, Burlingame Calif.) Недифференцированные плюрипотентные стволовые клетки также, как правило, экспрессируют Oct-4 и TERT, обнаруживаемые способом ОТ-ПЦР (RT-PCR).
Другим желательным фенотипическим свойством выращенных плюрипотентных клеток является потенциал дифференцирования в клетки всех трех зародышевых листков: в эндодермальные, мезодермальные и эктодермальные ткани. Плюрипотентность плюрипотентных стволовых клеток может быть подтверждена, например, путем инъекции клеток мышам с тяжелым комбинированным иммунодефицитом (SCID), фиксирования образующихся тератом с помощью 4% параформальдегида и их гистологического исследования для получения доказательств наличия клеточных типов, происходящих от трех зародышевых листков. В качестве альтернативы плюрипотентность можно определить по созданию эмбриоидных телец и анализа их на предмет присутствия маркеров, ассоциирующихся с тремя зародышевыми листками.
Выращенные линии плюрипотентных стволовых клеток могут быть кариотипированы с применением стандартного способа окрашивания с использованием красителя Гимза (G-banding) и сравнения с опубликованными кариотипами соответствующих видов приматов. Желательно получить клетки, имеющие «нормальный кариотип», т.е. эуплоидные клетки, в которых все человеческие хромосомы присутствуют и не имеют видимых изменений.
Источники плюрипотентных стволовых клеток
К типам плюрипотентных стволовых клеток, которые можно использовать, относятся стабильные линии плюрипотентных клеток, получаемых из ткани, формирующейся после наступления беременности, в том числе из преэмбриональной ткани (например, бластоциста), эмбриональной ткани или ткани плода, взятой в любой момент в ходе беременности, как правило, но не обязательно, до срока приблизительно 10-12 недель беременности. Примерами, не ограничивающими настоящее изобретение, являются стабильные линии человеческих эмбриональных стволовых клеток или человеческих эмбриональных зародышевых клеток, например, клеточные линии человеческих эмбриональных стволовых клеток H1, H7 и H9 (WiCell). Также возможно использование описываемых в настоящей заявке составов в ходе первоначального установления или стабилизации таких клеток, в этом случае исходными клетками являются первичные плюрипотентные клетки, взятые напрямую из тканей-источников. Также соответствуют целям настоящего изобретения клетки, взятые из популяции плюрипотентных стволовых клеток, уже культивированных в отсутствие питающих клеток. Также соответствуют целям настоящего изобретения клетки мутантных линий эмбриональных стволовых клеток человека, таких как, например, BG01v (BresaGen, Атенс, Джорджия, США).
В одном из вариантов осуществления эмбриональные стволовые клетки человека готовят, как описано в следующих публикациях Thomson et al. (патент США № 5843780; Science 282:1145, 1998; Curr. Top. Dev. Biol. 38:133 ff., 1998; Proc. Natl. Acad. Sci. U.S.A. 92:7844, 1995).
Культивирование плюрипотентных стволовых клеток
В одном из вариантов осуществления плюрипотентные стволовые клетки, как правило, культивируют на слое питающих клеток, которые поддерживают плюрипотентные клетки в различных отношениях. Как вариант, плюрипотентные стволовые клетки культивируют в культуральной системе, по существу не содержащей питающих клеток, но, тем не менее, поддерживающей пролиферацию плюрипотентных стволовых клеток и не допускающей существенного дифференцирования. Рост плюрипотентных стволовых клеток в свободной от питающих клеток культуральной системе без дифференцирования поддерживается путем использования среды, кондиционированной посредством предварительного культивирования клеток иного типа. В качестве альтернативы рост плюрипотентных стволовых клеток в свободной от питающих клеток культуральной системе без дифференцирования поддерживается путем использования среды с химически определенным составом.
Например, в публикациях Reubinoff et al (Nature Biotechnology 18: 399-404 (2000)) и Thompson et al (Science 6 November 1998: Vol. 282. no. 5391, pp. 1145-1147) описано культивирование линий плюрипотентных стволовых клеток из человеческих бластоцист с применением слоя питающих клеток из мышиных эмбриональных фибробластов.
В публикации Richards et al, (Stem Cells 21: 546-556, 2003) анализировали набор из 11 различных слоев питающих клеток, полученных от взрослых, новорожденных и эмбрионов людей, по их способности осуществлять поддержку культуры человеческих плюрипотентных стволовых клеток. Richards et al. сообщают: «линии человеческих эмбриональных стволовых клеток, культивируемые на питающих слоях из фибробластов кожи взрослых людей, сохраняют морфологию, характерную для эмбриональных стволовых клеток, и остаются плюрипотентными».
В заявке на патент US20020072117 описываются линии клеток, продуцирующие среду, осуществляющую поддержку плюрипотентных стволовых клеток приматов в культуре, не содержащей питающих клеток. Использованные клеточные линии представляют собой мезенхимо- и фибробластоподобные линии, полученные из эмбриональной ткани или дифференцированные из эмбриональных стволовых клеток. В заявке на патент US20020072117 также описывается использование этих клеточных линий в качестве первичного слоя питающих клеток.
В другом примере Wang et al (Stem Cells 23: 1221-1227, 2005) описывают способы длительного выращивания человеческих плюрипотентных стволовых клеток на слоях питающих клеток, полученных из человеческих эмбриональных стволовых клеток.
В другом примере Stojkovic et al (Stem Cells 2005 23: 306-314, 2005) описывают систему питающих клеток, получаемую в результате спонтанного дифференцирования человеческих эмбриональных стволовых клеток.
В еще одном примере Miyamoto et al (Stem Cells 22: 433-440, 2004) описывают источник питающих клеток, получаемых из человеческой плаценты.
Amit et al (Biol. Reprod 68: 2150-2156, 2003) описывают слой питающих клеток, полученных из человеческой крайней плоти.
В другом примере Inzunza et al (Stem Cells 23: 544-549, 2005) описывают слой питающих клеток, полученных из человеческих постнатальных фибробластов крайней плоти.
В патенте US6642048 описывается среда, поддерживающая рост плюрипотентных стволовых клеток приматов (пПС) в среде, не содержащей питающих клеток, и клеточные линии, которые могут использоваться для производства такой среды. В патенте US6642048 говорится: «Данное изобретение включает мезенхимо- и фибробластоподобные клеточные линии, полученные из эмбриональной ткани или дифференцированные из эмбриональных стволовых клеток. В документе описываются и иллюстрируются способы получения таких клеточных линий, обработки среды и выращивания стволовых клеток с применением кондиционированной среды».
В другом примере, в заявке на патент WO2005014799, описывается кондиционированная среда для поддержания, пролиферации и дифференцирования клеток млекопитающих. В заявке на патент WO2005014799 говорится: «Культуральная среда, произведенная в соответствии с настоящим изобретением, кондиционируется при помощи секреторной активности клеток мыши, в частности, активности дифференцированных и иммортализованных трансгенных гепатоцитов, именуемых MMH (Met Murine Hepatocyte)».
В другом примере Xu et al (Stem Cells 22: 972-980, 2004) описывают кондиционированную среду, полученную из производных человеческих эмбриональных стволовых клеток, генетически модифицированных для увеличения экспрессии обратной транскриптазы человеческой теломеразы.
В другом примере, заявке на патент US20070010011, описывается культуральная среда определенного химического состава для поддержания плюрипотентных стволовых клеток.
В альтернативной культуральной системе используется не содержащая сыворотки среда, обогащенная факторами роста, способными стимулировать пролиферацию эмбриональных стволовых клеток. Например, Cheon et al (BioReprod DOI:10.1095/biolreprod.105.046870, 19 октября 2005 г.) описывают не содержащую питающих клеток и сыворотки культуральную систему, в которой эмбриональные стволовые клетки поддерживаются в некондиционированной, заменяющей сыворотку среде (SR), обогащенной различными факторами роста, способными запустить самообновление эмбриональных стволовых клеток.
В другом примере, Levenstein et al (Stem Cells 24: 568-574, 2006) описывают способы длительного культивирования человеческих эмбриональных стволовых клеток в отсутствие фибробластов или кондиционированной среды, с применением среды, обогащенной основным фактором роста фибробластов (bFGF).
В другом примере, в заявке на патент US20050148070, описывается способ культивирования человеческих эмбриональных стволовых клеток в среде с определенным составом без сыворотки и без питающих клеток-фибробластов, где данный способ включает: культивирование стволовых клеток в культуральной среде, содержащей альбумин, аминокислоты, витамины, минеральные вещества, по меньшей мере один трансферрин или заменитель трансферрина, по меньшей мере один инсулин или заместитель инсулина, культуральную среду, по существу не включающую эмбриональную сыворотку млекопитающих и содержащую по меньшей мере приблизительно 100 нг/мл фактора роста фибробластов, способного активировать сигнальный рецептор фактора роста фибробластов, причем фактор роста происходит из источника, отличного от просто слоя питающих клеток-фибробластов, среду, поддерживающую пролиферацию стволовых клеток в недифференцированном состоянии без слоя питающих клеток или кондиционированной среды.
В другом примере, в заявке на патент US20050233446, описывается среда с определенным составом, которая может быть использована при культивировании стволовых клеток, включая недифференцированные зародышевые стволовые клетки приматов. В растворе среда является по существу изотонической относительно культивируемых стволовых клеток. В данной культуре указанная среда содержит основную среду и количество bFGF, инсулина и аскорбиновой кислоты, достаточное для поддержки роста зародышевых стволовых клеток без существенного дифференцирования.
В другом примере, в заявке на патент US6800480, отмечается: «В одном варианте осуществления предлагается культуральная среда для выращивания зародышевых стволовых клеток приматов в по существу недифференцированном состоянии, содержащая основную среду с низким содержанием эндотоксина и низким осмотическим давлением, которая эффективно поддерживает рост зародышевых стволовых клеток приматов. Основная среда объединяется с питательной сывороткой, способной поддерживать рост зародышевых стволовых клеток приматов, и субстратом, выбираемым из группы, состоящей из питающих клеток и экстраклеточного матрикса, полученного из питающих клеток. Среда дополнительно содержит аминокислоты, не относящиеся к незаменимым, антиоксидант и первый фактор роста, выбираемый из группы, состоящей из нуклеозидов и соли-пирувата».
В другом примере, в заявке на патент US20050244962, говорится: «В одном аспекте в изобретении предлагается способ культивирования эмбриональных стволовых клеток приматов. Стволовые клетки культивируются в культуре, по существу свободной от эмбриональной сыворотки млекопитающих (предпочтительно также по существу свободной от сыворотки любых животных) и в присутствии фактора роста фибробластов, полученного из источника, отличного от просто слоя питающих фибробластов. В предпочтительной форме слой питающих фибробластов, ранее необходимый для поддержания культуры стволовых клеток, становится необязательным вследствие добавления достаточного количества фактора роста фибробластов».
В другом примере, в заявке на патент WO2005065354, описывается изотоническая культуральная среда определенного состава, по существу не содержащая питающих клеток и сыворотки, содержащая: a. базальную среду; b. количество bFGF, достаточное для поддержания роста по существу недифференцированных стволовых клеток млекопитающих; c. количество инсулина, достаточное для поддержания роста по существу недифференцированных стволовых клеток млекопитающих; и d. количество аскорбиновой кислоты, достаточное для поддержания роста по существу недифференцированных стволовых клеток млекопитающих.
В другом примере, в заявке на патент WO2005086845, описывается способ поддержания недифференцированных стволовых клеток, где упомянутый способ включает воздействие на стволовые клетки одним членом семейства белков трансформирующего ростового фактора-бета (TGF-β), одним членом семейства белков фактора роста фибробластов (FGF) или никотинамидом (NIC) в количестве, достаточном для поддержания клеток в недифференцированном состоянии в течение периода времени, достаточного для получения желаемого результата.
Плюрипотентные стволовые клетки могут быть высеяны на соответствующий культуральный субстрат. В одном из вариантов осуществления соответствующим культуральным субстратом является компонент внеклеточного матрикса, такой как, например, полученный из базальной мембраны или тот, который может участвовать в лиганд-рецепторном взаимодействии с участием молекулы адгезивного слоя. В одном из вариантов осуществления подходящим культуральным субстратом является MATRIGEL® (Becton Dickenson). MATRIGEL® представляет собой растворимый препарат из клеток опухоли Энгельбрета-Холма-Суорма, который при комнатной температуре превращается в гель и образует восстановленную базальную мембрану.
В качестве альтернативы можно использовать другие компоненты внеклеточного матрикса и смеси компонентов. В зависимости от типа пролиферирующих клеток, это может быть ламинин, фибронектин, протеогликан, энтактин, гепарансульфат и т.п., по отдельности или в различных сочетаниях.
Плюрипотентные стволовые клетки могут высеиваться на субстрат с соответствующим распределением по поверхности и в присутствии среды, поддерживающей выживание, размножение и сохранение требуемых характеристик клеток. Все эти характеристики улучшаются при тщательном подходе к распределению клеток при посеве и могут быть определены специалистом в данной области.
Подходящая культуральная среда может содержать следующие компоненты, например, модифицированную по способу Дульбекко среду Игла (DMEM), Gibco № 11965-092; модифицированную по способу Дульбекко среду Игла Knockout (KO DMEM), Gibco № 10829-018; базальную среду Хэма F12/50% DMEM; 200 мM L-глутамина, Gibco № 15039-027; раствор заменимых аминокислот, Gibco № 11140-050; β-меркаптоэтанол, Sigma № M7522; человеческий рекомбинантный основной фактор роста фибробластов (bFGF), Gibco № 13256-029.
Образование панкреатических продуцирующих гормоны клеток из плюрипотентных стволовых клеток
В одном из вариантов осуществления настоящего изобретения предлагается способ получения панкреатических продуцирующих гормоны клеток из плюрипотентных стволовых клеток, включающий:
a. Культивирование плюрипотентных стволовых клеток,
b. Дифференцирование плюрипотентных стволовых клеток в клетки, экспрессирующие маркеры, характерные для линии сформированной эндодермы,
c. Дифференцирование клеток, экспрессирующих маркеры, характерные для линии сформированной эндодермы, в клетки, экспрессирующие маркеры, характерные для линии панкреатической эндодермы, и
d. Дифференцирование клеток, экспрессирующих маркеры, характерные для линии дифференцирования в клетки панкреатической эндодермы, в клетки, экспрессирующие маркеры, характерные для линии дифференцирования в панкреатические эндокринные клетки.
Плюрипотентные стволовые клетки, соответствующие целям настоящего изобретения, включают, например, эмбриональные стволовые клетки человека линии H9 (код NIH: WA09), эмбриональные стволовые клетки человека линии H1 (код NIH: WA01), эмбриональные стволовые клетки человека линии H7 (код NIH: WA07) и эмбриональные стволовые клетки человека линии SA002 (Cellartis, Швеция). Также соответствуют целям настоящего изобретения клетки, которые экспрессируют по меньшей мере один из следующих маркеров, характерных для плюрипотентных клеток: ABCG2, крипто, CD9, FOXD3, коннексин43, коннексин45, OCT4, SOX2, NANOG, hTERT, UTF1, ZFP42, SSEA3, SSEA4, Tra1-60 или Tra1-81.
Маркеры, характерные для линии сформированной эндодермы, выбираются из группы, состоящей из SOX17, GATA4, HNF3 бета, GSC, CER1, NODAL, FGF8, Brachyury, Mix-подобного гомеобоксового белка, FGF4 CD48, эомезодермина (EOMES), DKK4, FGF17, GATA6, CXCR4, C-Kit, CD99 и OTX2. Подходит для использования в настоящем изобретении клетка, экспрессирующая по меньшей мере один из маркеров, характерных для линии сформированной эндодермы. В одном из аспектов настоящего изобретения клетка, экспрессирующая маркеры, характерные для линии сформированной эндодермы, представляет собой клетку-предшественник первичной полоски. В другом аспекте настоящего изобретения клетка, экспрессирующая маркеры, характерные для линии сформированной эндодермы, представляет собой мезэндодермальную клетку. В другом аспекте настоящего изобретения клетка, экспрессирующая маркеры, характерные для линии сформированной эндодермы, представляет собой клетку сформированной эндодермы.
Маркеры, характерные для линии панкреатической эндодермы, выбирают из группы, состоящей из PDX1, HNF1 бета, PTF1 альфа, HNF6, HB9 и PROX1. Подходит для использования в настоящем изобретении клетка, экспрессирующая по меньшей мере один из маркеров, характерных для линии панкреатической эндодермы. В одном из аспектов настоящего изобретения клетка, экспрессирующая маркеры, характерные для линии панкреатической эндодермы, представляет собой клетку панкреатической эндодермы.
Маркеры, характерные для линии панкреатических эндокринных клеток, выбирают из группы, состоящей из NGN3, NEUROD, ISL1, PDX1, NKX6.1, PAX4, NGN3 и PTF1 альфа. В одном из вариантов осуществления панкреатическая эндокринная клетка способна экспрессировать по меньшей мере один из следующих гормонов: инсулин, глюкагон, соматостатин и панкреатический полипептид. Соответствующей целям настоящего изобретения является клетка, экспрессирующая по меньшей мере один из маркеров, характерных для линии панкреатических эндокринных клеток. В одном из аспектов настоящего изобретения клетка, экспрессирующая маркеры, характерные для линии панкреатических эндокринных клеток, представляет собой панкреатическую эндокринную клетку. Панкреатическая эндокринная клетка может представлять собой панкреатическую экспрессирующую гормоны клетку. В качестве альтернативы панкреатическая эндокринная клетка может представлять собой панкреатическую секретирующую гормоны клетку.
В одном аспекте настоящего изобретения панкреатическая эндокринная клетка представляет собой клетку с экспрессией маркеров, характерных для линии дифференцирования β-клеток. Клетка, экспрессирующая маркеры, характерные для β-клеточной линии, экспрессирует Pdx1 и по меньшей мере один из следующих транскрипционных факторов: NGN3, NKX2.2, NKX6.1, NEUROD, ISL1, HNF3 бета, MAFA, PAX4 или PAX6. В одном аспекте настоящего изобретения клетка, экспрессирующая маркеры, характерные для β-клеточной линии, представляет собой β-клетку.
Образование клеток, экспрессирующих маркеры, характерные для линии сформированной эндодермы
Плюрипотентные стволовые клетки могут быть дифференцированы в клетки, экспрессирующие маркеры, характерные для линии сформированной эндодермы, с использованием любого известного специалистам способа или с использованием любого способа, предложенного в настоящем изобретении.
Например, плюрипотентные стволовые клетки могут быть дифференцированы в клетки, экспрессирующие маркеры, характерные для линии сформированной эндодермы, в соответствии со способами, описанными в публикации D’Amour et al, Nature Biotechnology 23, 1534-1541 (2005).
Например, плюрипотентные стволовые клетки могут быть дифференцированы в клетки, экспрессирующие маркеры, характерные для линии сформированной эндодермы, в соответствии со способами, описанными в публикации Shinozaki et al, Development 131, 1651-1662 (2004).
Например, плюрипотентные стволовые клетки могут быть дифференцированы в клетки, экспрессирующие маркеры, характерные для линии сформированной эндодермы, в соответствии со способами, описанными в публикации McLean et al, Stem Cells 25, 29-38 (2007).
Например, плюрипотентные стволовые клетки могут быть дифференцированы в клетки, экспрессирующие маркеры, характерные для линии сформированной эндодермы, в соответствии со способами, описанными в публикации D’Amour et al, Nature Biotechnology 24, 1392-1401 (2006).
Например, плюрипотентные стволовые клетки могут быть дифференцированы в клетки, экспрессирующие маркеры, характерные для линии сформированной эндодермы, путем культивирования плюрипотентных стволовых клеток в среде, содержащей активин A в отсутствие сыворотки, затем культивирования клеток с активином A и сывороткой, а затем культивирования клеток с активином A и сывороткой в другой концентрации. Пример данного способа описан в публикации Nature Biotechnology 23, 1534-1541 (2005).
Например, плюрипотентные стволовые клетки могут быть дифференцированы в клетки, экспрессирующие маркеры, характерные для линии сформированной эндодермы, путем культивирования плюрипотентных стволовых клеток в среде, содержащей активин А в отсутствие сыворотки, затем культивирования клеток с активином A и сывороткой в другой концентрации. Пример данного способа описан в публикации D’ Amour et al, Nature Biotechnology, 2005.
Например, плюрипотентные стволовые клетки могут быть дифференцированы в клетки, экспрессирующие маркеры, характерные для линии сформированной эндодермы, путем культивирования плюрипотентных стволовых клеток в среде, содержащей активин А и лиганд Wnt в отсутствие сыворотки, затем удаления лиганда Wnt и культивирования клеток с активином A и сывороткой. Пример использования данного способа приведен в публикации Nature Biotechnology 24, 1392-1401 (2006).
Например, плюрипотентные стволовые клетки могут быть дифференцированы в клетки, экспрессирующие маркеры, характерные для линии сформированной эндодермы, путем обработки плюрипотентных стволовых клеток в соответствии со способами, изложенными в заявке на патент США № 11/736908, принадлежащей LifeScan, Inc.
Например, плюрипотентные стволовые клетки могут быть дифференцированы в клетки, экспрессирующие маркеры, характерные для линии сформированной эндодермы, путем обработки плюрипотентных стволовых клеток в соответствии со способами, изложенными в заявке на патент США № 11/779311, принадлежащей LifeScan, Inc.
Например, плюрипотентные стволовые клетки могут быть дифференцированы в клетки, экспрессирующие маркеры, характерные для линии сформированной эндодермы, путем обработки плюрипотентных стволовых клеток в соответствии со способами, изложенными в заявке на патент США № 60/990529.
Например, плюрипотентные стволовые клетки могут быть дифференцированы в клетки, экспрессирующие маркеры, характерные для линии сформированной эндодермы, путем обработки плюрипотентных стволовых клеток в соответствии со способами, изложенными в заявке на патент США № 61/076889.
Например, плюрипотентные стволовые клетки могут быть дифференцированы в клетки, экспрессирующие маркеры, характерные для линии сформированной эндодермы, путем обработки плюрипотентных стволовых клеток в соответствии со способами, изложенными в заявке на патент США № 61/076900.
Например, плюрипотентные стволовые клетки могут быть дифференцированы в клетки, экспрессирующие маркеры, характерные для линии сформированной эндодермы, путем обработки плюрипотентных стволовых клеток в соответствии со способами, изложенными в заявке на патент США № 61/076908.
Например, плюрипотентные стволовые клетки могут быть дифференцированы в клетки, экспрессирующие маркеры, характерные для линии сформированной эндодермы, путем обработки плюрипотентных стволовых клеток в соответствии со способами, изложенными в заявке на патент США № 61/076915.
Дифференцирование клеток, экспрессирующих маркеры, характерные для линии сформированной эндодермы
Образование клеток, экспрессирующих маркеры, характерные для линии сформированной эндодермы, может быть выявлено путем проверки на наличие маркеров до и после выполнения конкретного протокола. Плюрипотентные стволовые клетки, как правило, не экспрессируют такие маркеры. Таким образом, дифференцирование плюрипотентных клеток определяется по началу экспрессии таких маркеров.
Эффективность дифференцирования может быть определена путем обработки популяции клеток агентом (например, антителом), специфически распознающим белковый маркер, экспрессированный клетками, экспрессирующими маркеры, характерные для линии сформированной эндодермы.
Способы оценки экспрессии маркеров белков и нуклеиновых кислот в культивированных или выделенных клетках являются стандартными для данной области. Сюда относятся количественная ревертазная полимеразная цепная реакция (ОТ-ПЦР), Нозерн-блоттинг, гибридизация in situ (см., например, Current Protocols in Molecular Biology (Ausubel et al., eds. 2001 supplement)) и иммунологические способы, такие как иммуногистохимический анализ среза материала, Вестерн-блоттинг, а для маркеров, доступных в интактных клетках, метод проточной цитометрии (FACS) (см., например, Harlow and Lane, Using Antibodies: A Laboratory Manual, New York: Cold Spring Harbor Laboratory Press (1998)).
Характеристики плюрипотентных стволовых клеток хорошо известны специалистам в данной области, и продолжается выявление дополнительных характеристик плюрипотентных стволовых клеток. К маркерам плюрипотентных стволовых клеток относится, например, экспрессия одного или нескольких из следующих факторов: ABCG2, крипто, FOXD3, коннексин43, коннексин45, OCT4, SOX2, NANOG, hTERT, UTF1, ZFP42, SSEA3, SSEA4, Tra1-60 или Tra1-81.
После обработки плюрипотентных стволовых клеток с применением способов, составляющих предмет настоящего изобретения, дифференцированные клетки могут быть выделены путем воздействия на популяцию клеток агентом (например, антителом), специфически распознающим белковый маркер, например CXCR4, экспрессируемый клетками, экспрессирующими маркеры, характерные для линии сформированной эндодермы.
Образование клеток, экспрессирующих маркеры, характерные для линии панкреатической эндодермы
Клетки, экспрессирующие маркеры, характерные для линии сформированной эндодермы, могут быть дифференцированы в клетки, экспрессирующие маркеры, характерные для линии панкреатической эндодермы, с использованием любого способа, известного специалистам в данной области, или с использованием способа, предложенного в настоящем изобретении.
Например, клетки, экспрессирующие маркеры, характерные для линии сформированной эндодермы, могут быть дифференцированы в клетки, экспрессирующие маркеры, характерные для линии панкреатической эндодермы, в соответствии со способами, описанными в публикации D’Amour et al, Nature Biotechnology 24, 1392-1401 (2006).
Например, клетки, экспрессирующие маркеры, характерные для линии сформированной эндодермы, далее дифференцируются в клетки, экспрессирующие маркеры, характерные для линии панкреатической эндодермы, путем обработки клеток, экспрессирующих маркеры, характерные для линии сформированной эндодермы, фактором роста фибробластов и ингибитором сигнального пути Hedgehog KAAD-циклопамином с последующим удалением содержащей фактор роста фибробластов и KAAD-циклопамин среды и культивированием клеток в среде, содержащей ретиноевую кислоту, фактор роста фибробластов и KAAD-циклопамин. Пример использования данного способа приведен в публикации Nature Biotechnology 24, 1392-1401 (2006).
В одном из аспектов настоящего изобретения клетки, экспрессирующие маркеры, характерные для линии сформированной эндодермы, далее дифференцируются в клетки, экспрессирующие маркеры, характерные для линии панкреатической эндодермы, путем обработки клеток, экспрессирующих маркеры, характерные для линии сформированной эндодермы, ретиноевой кислотой и по меньшей мере одним фактором роста фибробластов в течение периода времени, в соответствии со способами, описанными в заявке на патент США № 11/736908, принадлежащей LifeScan, Inc.
В одном из аспектов настоящего изобретения клетки, экспрессирующие маркеры, характерные для линии сформированной эндодермы, далее дифференцируются в клетки, экспрессирующие маркеры, характерные для линии панкреатической эндодермы, путем обработки клеток, экспрессирующих маркеры, характерные для линии сформированной эндодермы, ретиноевой кислотой и по меньшей мере одним фактором роста фибробластов в течение периода времени, в соответствии со способами, описанными в заявке на патент США № 11/779311, принадлежащей LifeScan, Inc.
В одном из аспектов настоящего изобретения клетки, экспрессирующие маркеры, характерные для линии сформированной эндодермы, далее дифференцируются в клетки, экспрессирующие маркеры, характерные для линии панкреатической эндодермы, путем обработки клеток, экспрессирующих маркеры, характерные для линии сформированной эндодермы, в соответствии со способами, описанными в заявке на патент США № 60/990529.
Обнаружение клеток, экспрессирующих маркеры, характерные для линии панкреатической эндодермы
Маркеры, характерные для линии панкреатической эндодермы, хорошо известны специалистам в данной области, и дополнительные маркеры, характерные для линии панкреатической эндодермы, продолжают выявляться. Такие маркеры могут использоваться для подтверждения того, что клетки, прошедшие обработку в соответствии с настоящим изобретением, дифференцировались и приобрели характерные особенности линии панкреатической эндодермы. К маркерам, характерным для линии панкреатической эндодермы, относится экспрессия одного или нескольких факторов транскрипции, таких как, например, HLXB9, PTF1 альфа, PDX1, HNF6 или HNF1 бета.
Эффективность дифференцирования может быть определена путем обработки популяции клеток агентом (например, антителом), специфически распознающим белковый маркер, экспрессированный клетками, экспрессирующими маркеры, характерные для линии панкреатической эндодермы.
Способы оценки экспрессии маркеров белков и нуклеиновых кислот в культивированных или выделенных клетках являются стандартными для данной области. Сюда относятся количественная ревертазная полимеразная цепная реакция (ОТ-ПЦР), Нозерн-блоттинг, гибридизация in situ (см., например, Current Protocols in Molecular Biology (Ausubel et al., eds. 2001 supplement)) и иммунологические способы, такие как иммуногистохимический анализ среза материала, Вестерн-блоттинг, а для маркеров, доступных в интактных клетках, метод проточной цитометрии (FACS) (см., например, Harlow and Lane, Using Antibodies: A Laboratory Manual, New York: Cold Spring Harbor Laboratory Press (1998)).
Создание клеток, экспрессирующих маркеры, характерные для линии панкреатических эндокринных клеток
Клетки, экспрессирующие маркеры, характерные для линии панкреатической эндодермы, могут быть дифференцированы в клетки, экспрессирующие маркеры, характерные для линии панкреатических эндокринных клеток, с использованием любого способа, известного специалистам в данной области, или с использованием способа, раскрываемого в настоящем изобретении.
Например, клетки, экспрессирующие маркеры, характерные для линии панкреатической эндодермы, могут быть дифференцированы в клетки, экспрессирующие маркеры, характерные для линии панкреатических эндокринных клеток, в соответствии со способами, описанными в публикации D’Amour et al, Nature Biotechnology 24, 1392-1401 (2006).
Например, клетки, экспрессирующие маркеры, характерные для линии панкреатической эндодермы, далее дифференцируются в клетки, экспрессирующие маркеры, характерные для линии панкреатических эндокринных клеток, путем культивирования клеток, экспрессирующих маркеры, характерные для линии панкреатической эндодермы, в среде, содержащей DAPT и экзендин-4, с последующим удалением содержащей DAPT и экзендин-4 среды и культивированием клеток в среде, содержащей экзендин-1, IGF-1 и HGF. Пример использования данного способа приведен в публикации Nature Biotechnology 24, 1392-1401 (2006).
Например, клетки, экспрессирующие маркеры, характерные для линии панкреатической эндодермы, далее дифференцируются в клетки, экспрессирующие маркеры, характерные для линии панкреатических эндокринных клеток, путем культивирования клеток, экспрессирующих маркеры, характерные для линии панкреатической эндодермы, в среде, содержащей экзендин-4, с последующим удалением содержащей экзендин-4 среды и культивированием клеток в среде, содержащей экзендин-1, IGF-1 и HGF. Пример использования данного способа приведен в публикации D’ Amour et al, Nature Biotechnology, 2006.
Например, клетки, экспрессирующие маркеры, характерные для линии панкреатической эндодермы, далее дифференцируются в клетки, экспрессирующие маркеры, характерные для линии панкреатических эндокринных клеток путем культивирования клеток, экспрессирующих маркеры, характерные для линии панкреатической эндодермы, в среде, содержащей DAPT и экзендин-4. Пример использования данного способа приведен в публикации D’ Amour et al, Nature Biotechnology, 2006.
Например, клетки, экспрессирующие маркеры, характерные для линии панкреатической эндодермы, далее дифференцируются в клетки, экспрессирующие маркеры, характерные для линии панкреатических эндокринных клеток путем культивирования клеток, экспрессирующих маркеры, характерные для линии панкреатической эндодермы, в среде, содержащей экзендин-4. Пример использования данного способа приведен в публикации D’ Amour et al, Nature Biotechnology, 2006.
В одном из аспектов настоящего изобретения клетки, экспрессирующие маркеры, характерные для линии панкреатической эндодермы, далее дифференцируются в клетки, экспрессирующие маркеры, характерные для линии панкреатических эндокринных клеток, путем обработки клеток, экспрессирующих маркеры, характерные для линии панкреатической эндодермы, фактором, ингибирующим сигнальный путь Notch, в соответствии со способами, описанными в заявке на патент США № 11/736,908, принадлежащей LifeScan, Inc.
В одном из аспектов настоящего изобретения клетки, экспрессирующие маркеры, характерные для линии панкреатической эндодермы, далее дифференцируются в клетки, экспрессирующие маркеры, характерные для линии панкреатических эндокринных клеток, путем обработки клеток, экспрессирующих маркеры, характерные для линии панкреатической эндодермы, фактором, ингибирующим сигнальный путь Notch, в соответствии со способами, описанными в заявке на патент США № 11/779311, принадлежащей LifeScan, Inc.
В одном из аспектов настоящего изобретения клетки, экспрессирующие маркеры, характерные для линии панкреатической эндодермы, далее дифференцируются в клетки, экспрессирующие маркеры, характерные для линии панкреатических эндокринных клеток, путем обработки клеток, экспрессирующих маркеры, характерные для линии панкреатической эндодермы, фактором, ингибирующим сигнальный путь Notch, в соответствии со способами, описанными в заявке на патент США № 60/953178, принадлежащей LifeScan, Inc.
В одном из аспектов настоящего изобретения клетки, экспрессирующие маркеры, характерные для линии панкреатической эндодермы, дифференцируются в клетки, экспрессирующие маркеры, характерные для линии панкреатических эндокринных клеток, путем обработки клеток, экспрессирующих маркеры, характерные для линии панкреатической эндодермы, в соответствии со способами, описанными в заявке на патент США № 60/990529.
В одном аспекте настоящего изобретения предлагается способ увеличения экспрессии маркеров, ассоциированных с линией панкреатических эндокринных клеток, включающий обработку клеток, экспрессирующих маркеры, характерные для линии панкреатических эндокринных клеток средой, содержащей достаточное количество агониста рецептора TGF-β, чтобы вызвать увеличение экспрессии маркеров, ассоциированных с линией панкреатических эндокринных клеток, в соответствии со способами, изложенными в заявке на патент США № 61/110278.
Обнаружение клеток, экспрессирующих маркеры, характерные для линии панкреатических эндокринных клеток
Маркеры, характерные для линии панкреатических эндокринных клеток, хорошо известны специалистам в данной области, и продолжается выявление дополнительных маркеров, характерных для линии панкреатических эндокринных клеток. Такие маркеры могут использоваться для подтверждения того, что клетки, прошедшие обработку в соответствии с настоящим изобретением, дифференцировались и приобрели характерные особенности линии панкреатических эндокринных клеток. К маркерам, характерным для линии панкреатических эндокринных клеток, относится экспрессия одного или нескольких факторов транскрипции, таких как, например, NGN3, NEUROD или ISL1.
Маркеры, характерные для линии β-клеток, хорошо известны специалистам в данной сфере, и дополнительные маркеры, характерные для линии β-клеток, продолжают выявляться. Такие маркеры могут использоваться для подтверждения того, что клетки, прошедшие обработку в соответствии с настоящим изобретением, дифференцировались и приобрели свойства, характерные для β-клеточной линии дифференцирования. К специфичным характеристикам β-клеточной линии дифференцирования относится экспрессия одного или нескольких факторов транскрипции, таких как, например, PDX1, NKX2.2, NKX6.1, ISL1, PAX6, PAX4, NEUROD, HNF1 бета, HNF6, HNF3 бета или MAFA. Такие факторы транскрипции широко используются в данной области для идентификации эндокринных клеток. См., например, обзор Edlund (Nature Reviews Genetics 3: 524-632 (2002)).
Эффективность дифференцирования может быть определена путем обработки популяции клеток агентом (например, антителом), специфически распознающим белковый маркер, экспрессированный клетками, экспрессирующими маркеры, характерные для линии панкреатических эндокринных клеток. В качестве альтернативы эффективность дифференцирования может быть определена путем обработки популяции клеток агентом (например, антителом), специфически распознающим белковый маркер, экспрессированный клетками, экспрессирующими маркеры, характерные для линии β-клеток.
Способы оценки экспрессии маркеров белков и нуклеиновых кислот в культивированных или выделенных клетках являются стандартными для данной области. Сюда относятся количественная ревертазная полимеразная цепная реакция (ОТ-ПЦР), Нозерн-блоттинг, гибридизация in situ (см., например, Current Protocols in Molecular Biology (Ausubel et al., eds. 2001 supplement)) и иммунологические способы, такие как иммуногистохимический анализ среза материала, Вестерн-блоттинг, а для маркеров, доступных в интактных клетках, метод проточной цитометрии (FACS) (см., например, Harlow and Lane, Using Antibodies: A Laboratory Manual, New York: Cold Spring Harbor Laboratory Press (1998)).
В одном из аспектов настоящего изобретения эффективность дифференцирования определяли путем измерения процентной доли инсулин-положительных клеток в данной клеточной культуре после обработки. В одном из вариантов осуществления способы, составляющие предмет настоящего изобретения, давали приблизительно 100% инсулин-положительных клеток в данной культуре. В альтернативном варианте осуществления способы, составляющие предмет настоящего изобретения, давали приблизительно 90% инсулин-положительных клеток в данной культуре. В альтернативном варианте осуществления способы, составляющие предмет настоящего изобретения, давали приблизительно 80% инсулин-положительных клеток в данной культуре. В альтернативном варианте осуществления способы, составляющие предмет настоящего изобретения, давали приблизительно 70% инсулин-положительных клеток в данной культуре. В альтернативном варианте осуществления способы, составляющие предмет настоящего изобретения, давали приблизительно 60% инсулин-положительных клеток в данной культуре. В альтернативном варианте осуществления способы, составляющие предмет настоящего изобретения, давали приблизительно 50% инсулин-положительных клеток в данной культуре. В альтернативном варианте осуществления способы, составляющие предмет настоящего изобретения, давали приблизительно 40% инсулин-положительных клеток в данной культуре. В альтернативном варианте осуществления способы, составляющие предмет настоящего изобретения, давали приблизительно 30% инсулин-положительных клеток в данной культуре. В альтернативном варианте осуществления способы, составляющие предмет настоящего изобретения, давали приблизительно 20% инсулин-положительных клеток в данной культуре. В альтернативном варианте осуществления способы, составляющие предмет настоящего изобретения, давали приблизительно 10% инсулин-положительных клеток в данной культуре. В альтернативном варианте осуществления способы, составляющие предмет настоящего изобретения, давали приблизительно 5% инсулин-положительных клеток в данной культуре.
В одном из аспектов настоящего изобретения эффективность дифференцирования определяли путем измерения стимулированной глюкозой секреции инсулина, определявшейся по количеству С-пептида, секретируемого клетками. В одном из вариантов осуществления клетки, полученные в соответствии со способами, составляющими предмет настоящего изобретения, производили приблизительно 1000 нг C-пептида/пг ДНК. В альтернативном варианте осуществления клетки, полученные в соответствии со способами, составляющими предмет настоящего изобретения, производили приблизительно 900 нг C-пептида/пг ДНК. В альтернативном варианте осуществления клетки, полученные в соответствии со способами, составляющими предмет настоящего изобретения, производили приблизительно 800 нг C-пептида/пг ДНК. В альтернативном варианте осуществления клетки, полученные в соответствии со способами, составляющими предмет настоящего изобретения, производили приблизительно 700 нг C-пептида/пг ДНК. В альтернативном варианте осуществления клетки, полученные в соответствии со способами, составляющими предмет настоящего изобретения, производили приблизительно 600 нг C-пептида/пг ДНК. В альтернативном варианте осуществления клетки, полученные в соответствии со способами, составляющими предмет настоящего изобретения, производили приблизительно 500 нг C-пептида/пг ДНК. В альтернативном варианте осуществления клетки, полученные в соответствии со способами, составляющими предмет настоящего изобретения, производили приблизительно 400 нг C-пептида/пг ДНК. В альтернативном варианте осуществления клетки, полученные в соответствии со способами, составляющими предмет настоящего изобретения, производили приблизительно 500 нг C-пептида/пг ДНК. В альтернативном варианте осуществления клетки, полученные в соответствии со способами, составляющими предмет настоящего изобретения, производили приблизительно 400 нг C-пептида/пг ДНК. В альтернативном варианте осуществления клетки, полученные в соответствии со способами, составляющими предмет настоящего изобретения, производили приблизительно 300 нг C-пептида/пг ДНК. В альтернативном варианте осуществления клетки, полученные в соответствии со способами, составляющими предмет настоящего изобретения, производили приблизительно 200 нг C-пептида/пг ДНК. В альтернативном варианте осуществления клетки, полученные в соответствии со способами, составляющими предмет настоящего изобретения, производили приблизительно 100 нг C-пептида/пг ДНК. В альтернативном варианте осуществления клетки, полученные в соответствии со способами, составляющими предмет настоящего изобретения, производили приблизительно 90 нг C-пептида/пг ДНК. В альтернативном варианте осуществления клетки, полученные в соответствии со способами, составляющими предмет настоящего изобретения, производили приблизительно 80 нг C-пептида/пг ДНК. В альтернативном варианте осуществления клетки, полученные в соответствии со способами, составляющими предмет настоящего изобретения, производили приблизительно 70 нг C-пептида/пг ДНК. В альтернативном варианте осуществления клетки, полученные в соответствии со способами, составляющими предмет настоящего изобретения, производили приблизительно 60 нг C-пептида/пг ДНК. В альтернативном варианте осуществления клетки, полученные в соответствии со способами, составляющими предмет настоящего изобретения, производили приблизительно 50 нг C-пептида/пг ДНК. В альтернативном варианте осуществления клетки, полученные в соответствии со способами, составляющими предмет настоящего изобретения, производили приблизительно 40 нг C-пептида/пг ДНК. В альтернативном варианте осуществления клетки, полученные в соответствии со способами, составляющими предмет настоящего изобретения, производили приблизительно 30 нг C-пептида/пг ДНК. В альтернативном варианте осуществления клетки, полученные в соответствии со способами, составляющими предмет настоящего изобретения, производили приблизительно 20 нг C-пептида/пг ДНК. В альтернативном варианте осуществления клетки, полученные в соответствии со способами, составляющими предмет настоящего изобретения, производили приблизительно 10 нг C-пептида/пг ДНК.
Увеличение экспрессии MAFA в клетках, экспрессирующих маркеры, характерные для линии панкреатических эндокринных клеток
В одном варианте осуществления настоящего изобретения предлагается способ увеличения экспрессии MAFA в клетках, экспрессирующих маркеры, характерные для линии панкреатических эндокринных клеток, включающий этапы культивирования клеток, экспрессирующих маркеры, характерные для линии панкреатических эндокринных клеток, в среде, содержащей достаточное количество ингибитора циклин-зависимой киназы, чтобы вызвать увеличение экспрессии MAFA.
Ингибитор циклин-зависимых киназ может ингибировать циклин-зависимую киназу 1. Как вариант, ингибитор циклин-зависимых киназ может ингибировать циклин-зависимую киназу 2. Как вариант, ингибитор циклин-зависимых киназ может ингибировать циклин-зависимую киназу 4. Как вариант, ингибитор циклин-зависимых киназ может ингибировать циклин-зависимую киназу 5. Как вариант, ингибитор циклин-зависимых киназ может ингибировать циклин-зависимую киназу 9. Как вариант, ингибитор циклин-зависимых киназ может ингибировать несколько изоформ циклин-зависимой киназы, в любом их сочетании.
Ингибитор циклин-зависимых киназ может представлять собой белок. Как вариант, ингибитор циклин-зависимых киназ может представлять собой пептид. Как вариант, ингибитор циклин-зависимых киназ может представлять собой малую молекулу. В одном варианте осуществления низкомолекулярный ингибитор циклин-зависимых киназ может быть выбран из группы, состоящей из 7-н-бутил-6-(4-гидроксифенил)[5H]пирроло[2,3-b]пиразина, 9-нитро-7,12-дигидроиндоло[3,2-d][1]бензазепин-6(5H)-она, 3-(6-оксо-9-нитро-5,6,7,12-тетрагидроиндоло[3,2-d][1]бензазепин-2-ил)пропионитрила, (2R)-2-((6-((3-амино-5-хлорфенил)амино)-9-(1-метилэтил)-9H-пурин-2-ил)амино)-3-метил-1-бутанола, аркириафлавина A, [6-бензиламино-2-(3-гидроксипропиламино)-9-изопропилпурина, бутиролактона I, (Z)-1-(3-этил-5-метокси-2,3-дигидробензотиазол-2-илиден)пропан-2-она, 2-(3-гидроксипропиламино)-6-(o-гидроксибензиламино)-9-изопропилпурина, 1-(2,6-дихлорфенил)-1,5-дигидро-6-((4-(2-гидроксиэтокси)фенил)метил)-3-(1-метилэтил)-4H-пиразоло[3,4-d]пиримидин-4-она, Cdk/циклин-ингибиторного пептида III, 3-(2-хлор-3-индолилметилен)-1,3-дигидроиндол-2-она, этил-(6-гидрокси-4-фенилбензо[4,5]фуро[2,3-b])пиридин-3-карбоксилата, RO-3306, N-(цис-2-аминоциклогексил)-N-(3-хлорфенил)-9-этил-9H-пурин-2,6-диамина, 6-циклогексилметокси-2-(4′-сульфамоиланилино)пурина, 5-амино-3-((4-(аминосульфонил)фенил)амино)-N-(2,6-дифторфенил)-1H-1,2,4-триазол-1-карботиоамида, 3-амино-1H-пиразоло[3,4-b]хиноксалина, Cdk2-ингибитора I, Cdk2-ингибитора II, 2(бис-(гидроксиэтил)амино)-6-(4-метоксибензиламино)-9-изопропилпурина, 4-(6-циклогексилметокси-9H-пурин-2-иламино)-N,N-диэтилбензамида, N4-(6-аминопиримидин-4-ил)-сульфаниламида, (4-(2-амино-4-метилтиазол-5-ил)пиримидин-2-ил)-(3-нитрофенил)амина, 2-бром-12,13-дигидро-5H-индоло[2,3-a]пирроло[3,4-c]карбазол-5,7(6H)-диона, 1,4-диметоксиакридин-9(10H)-тиона, 5-(N-(4-метилфенил)амино)-2-метил-4,7-диоксобензотиазола, 4-(3,5-диамино-1Hпиразол-4-илазо)-фенола, 2-(2-гидроксиэтиламино)-6-(3-хлоранилино)-9-изопропилпурина, фаскаплизина, индирубин-3′-моноксима, индирубин-3′-моноксима, 5-иодо-, индирубин-3′-моноксим-5-сульфоновой кислоты, изогранулатимида, 2-(2-гидроксиэтиламино)-6-бензиламино-9-метилпурина, 6-(2-гидроксибензиламино)-2-((1R)-(гидроксиметил)пропил)амино)-9-изопропилпурина, 5-бром-3-(2-(4-фторфенил)-2-оксоэтилидин)-1,3-дигидроиндо-2-она, N6,N6-диметиладенина, 2-(1R-изопропил-2-гидроксиэтиламино)-6-(3-хлоранилино)-9-изопропилпурина, рапамицина, 2-(R)-(1-этил-2-гидроксиэтиламино)-6-бензиамино-9-изопропилпурина, сцитонемина, 3-[1-(3H-имидазол-4-ил)-мет-(Z)-илиден]-5-метокси-1,3-дигидроиндо-2-она и 4-(3′-гидроксифенил)амино-6,7-диметоксихиназолин.
В одном варианте осуществления ингибитор циклин-зависимой киназы представляет собой этил-(6-гидрокси-4-фенилбензо[4,5]фуро[2,3-b])пиридин-3-карбоксилат. В одном варианте осуществления этил-(6-гидрокси-4-фенилбензо[4,5]фуро[2,3-b])пиридин-3-карбоксилат добавляют к клеткам, экспрессирующим маркеры, характерные для линии эндокринных клеток, в количестве от приблизительно 0,1 мкM до приблизительно 10 мкM на период от приблизительно одного до приблизительно семи дней.
В одном варианте осуществления клетки, экспрессирующие маркеры, характерные для линии эндокринных клеток, обрабатывают этил-(6-гидрокси-4-фенилбензо[4,5]фуро[2,3-b])пиридин-3-карбоксилатом в течение периода от приблизительно одного до приблизительно семи дней.
Настоящее изобретение далее иллюстрируется, помимо прочего, следующими примерами.
ПРИМЕРЫ
Пример 1
Дифференцирование человеческих эмбриональных стволовых клеток линии H1 в панкреатические эндокринные клетки в отсутствие эмбриональной бычьей сыворотки
Человеческие эмбриональные стволовые клетки линии H1, пассаж 52, культивировали на чашках, покрытых препаратом MATRIGEL® (разведение 1:30), и к ним применяли приведенный далее протокол дифференцирования для их дифференцирования в клетки, экспрессирующие маркеры, характерные для линии панкреатических эндокринных клеток.
a. Среда RPMI с добавлением 2% БСА (№ по каталогу 152401, MP Biomedical, Огайо) и 100 нг/мл активина A (R&D Systems, Миннесота), с добавлением 20 нг/мл WNT-3a (№ по каталогу 1324-WN-002, R&D Systems, Миннесота), с добавлением 8 нг/мл bFGF (№ по каталогу 100-18B, PeproTech, Нью-Джерси), в течение одного дня, с последующей обработкой средой RPMI с добавлением 2% БСА и 100 нг/мл активина A, с добавлением 8 нг/мл bFGF в течение еще двух дней (стадия 1), затем
b. среда DMEM/F12 + 2% БСА + 50 нг/мл FGF7 + 0,25 мкM KAAD-циклопамина (№ 239804, Calbiochem, Калифорния) в течение двух дней (стадия 2), далее
c. среда DMEM/F12 + 1% B27 (Invitrogen, Калифорния) + 50 нг/мл FGF7 + 0,25 мкM KAAD-циклопамина + 2 мкM ретиноевой кислоты (RA) (Sigma, Миссури) + 100 нг/мл Noggin (R & D Systems, Миннесота) в течение четырех дней (стадия 3), далее
d. среда DMEM/F12 + 1% B27 (Invitrogen, Калифорния) + 100 нг/мл Noggin + 1 мкM DAPT (ингибитор гамма-секретазы) (№ по кат. 565784, Calbiochem, Калифорния) + 1 мкM ALK5-ингибитора II (№ по кат. 616452, Calbiochem, Калифорния) + 100 нг/мл Netrin-4 (R&D Systems, Миннесота) в течение трех дней (стадия 4), далее
е. среда DMEM/F12 + 1% B27 (Invitrogen, Калифорния) + 1 мкM ALK5-ингибитора II (Calbiochem, Калифорния) в течение семи дней (стадия 5).
Среду заменяли ежедневно. На каждой стадии количество клеток подсчитывали с помощью гемоцитометра и для ПЦР-анализа отбирали образцы РНК. Все образцы отбирали в трех повторностях.
Пример 2
Скрининговое исследование влияния соединений из библиотеки ингибиторов II киназ EMD на клетки, обработанные в соответствии с протоколом дифференцирования, описанном в Примере 1
Клетки линии человеческих эмбриональных стволовых клеток H1, пассаж 44, культивировали на 24-луночных планшетах с покрытием MATRIGEL™ (разведение 1:30) и дифференцировали в соответствии со способами, описанными в Примере 1, до стадии 5. После этого клетки в течение четырех дней обрабатывали средой DMEM/F12 + 1% B27, содержащей соединение из библиотеки EMD Calbiochem (№ по кат. 539745, Calbiochem, Сан-Диего, Калифорния) в итоговом количестве 1 мкM. В качестве контрольной группы инкубировали лунки со средой. На всем протяжении выполнения протокола среду меняли ежедневно. Все образцы проходили обработку в двух повторностях. По завершении обработки отбирали РНК для ПЦР-анализа. Образцы анализировали методом ПЦР в реальном времени на экспрессию инсулина, глюкагона, MAFA и Arx4. Результаты, измеренные методом ПЦР в реальном времени, выражали в виде отношения инсулин/глюкагон (фиг.1, панель a) или отношения MAFA к ARX4 (фиг.1, панель b) в образцах, прошедших обработку, в сравнении с необработанной контрольной группой. В Таблице 1 приведены соответствующие идентификационные номера соединений для каждого номера лунки.
При обработке клеток, экспрессирующих маркеры, характерные для линии панкреатических эндокринных клеток, соединениями A6, B7, B8 или C2 в количестве 1 мкM отношение инсулин/глюкагон составляло приблизительно 3,0 или выше (см. фиг.1, панель a).
Далее исследовали влияние этих соединений на отношение MAFA/ARX4 и наблюдали, что при обработке клеток, экспрессирующих маркеры, характерные для линии панкреатических эндокринных клеток, некоторыми соединениями изменение отношения MAFA/ARX4 было значительно более сильным, чем при обработке другими протестированными соединениями из библиотеки: в клетках, обработанных соединением C2, наблюдаемое отношение MAFA/ARX4 составляло приблизительно 1000. При обработке клеток, экспрессирующих маркеры, характерные для линии панкреатических эндокринных клеток, соединением C2 соотношение MAFA/ARX4 составляло приблизительно 100 (см. фиг.1, панель b).
Пример 3
Влияние обработки ингибитором циклин-зависимых киназ на экспрессию инсулина и MAFA в клетках, обработанных в соответствии с протоколом дифференцирования, описанным в Примере 1
Некоторые из соединений, повышавших отношение экспрессии инсулин/глюкагон или экспрессии MAFA/ARX4 в Примере 2, представляли собой ингибиторы циклин-зависимых киназ. Одним таким соединением было соединение № 5330797 (5-амино-3-((4-(аминосульфонил)фенил)амино)-N-(2,6-дифторфенил)-1H-1,2,4-триазол-1-карботиоамид) (№ по каталогу 217714; Calbiochem, Сан-Диего, Калифорния). Для подтверждения этих наблюдений человеческие эмбриональные стволовые клетки линии H1, пассаж 42, культивировали в чашках площадью 10 см2, покрытых препаратом MATRIGEL®, и обрабатывали в соответствии со способами, описанными в Примере 1, до стадии 5. После стадии 5 клетки обрабатывали средой DMEM/F12 с добавлением 1% B27, содержащей соединение № 5330797 в количестве 1 мкM, в течение шести дней. Среду меняли через день. Образцы клеток отбирали для анализа методом ПЦР в реальном времени до обработки соединением и на второй и пятый дни обработки соединением.
На фиг.2 представлены характерные микрофотографии клеток на 4 и 6 день обработки соединением в сравнении с необработанными контрольными группами. Необработанные клетки расположены очень плотно (фиг.3, панели a и d), и различить отдельные клетки сложно. При этом после обработки соединением № 5330797 в количестве 0,5 мкM или 1 мкM в течение шести дней отдельные ядра становятся видимыми (фиг.2, панели e и f) в сравнении с необработанной контрольной группой (фиг.2, панель d), и это свидетельствует о том, что в популяции клеток происходит дифференцирование. Также это сопровождалось гибелью некоторого числа клеток, как отмечено пробелами в слоях клеток на фиг.2, панели b и c.
Обработка клеток соединением № 5330797 в разной степени приводила к увеличению экспрессии инсулина, глюкагона, MAFA, MAFB и соматостатина. На фиг.3, панели a-v, показана относительная индукция экспрессии генов в зависимости от обработки, в сравнении с днем 0 (до обработки). Клетки, экспрессирующие маркеры, характерные для линии панкреатических эндокринных клеток, которые подвергали обработке соединением № 5330797 в количестве 1 мкM, демонстрировали приблизительно 1,5-кратное увеличение экспрессии глюкагона через 48 часов обработки. Через 5 дней обработки указанная экспрессия снижалась до уровня меньшего, чем до обработки. Увеличение экспрессии глюкагона не наблюдалось при обработке соединением № 5330797 в количестве 0,5 мкM (см. фиг.3, панель a).
Клетки, экспрессирующие маркеры, характерные для линии панкреатических эндокринных клеток, которые обрабатывали соединением № 5330797 в количестве 1 мкM в течение пяти дней, демонстрировали приблизительно 1,5-кратное увеличение экспрессии инсулина (см. фиг.3, панель b).
Клетки, экспрессирующие маркеры, характерные для линии панкреатических эндокринных клеток, которые обрабатывали соединением № 5330797 в количестве 1 мкM в течение пяти дней, демонстрировали приблизительно 200-кратное увеличение экспрессии MAFA (см. фиг.3, панель d).
Клетки, экспрессирующие маркеры, характерные для линии панкреатических эндокринных клеток, которые обрабатывали соединением № 5330797 в количестве 0,5 мкM в течение пяти дней, демонстрировали приблизительно 1,5-кратное увеличение экспрессии MAFB (см. фиг.3, панель c). Наблюдали дозозависимое увеличение экспрессии соматостатина (фиг.3, панель e).
Не наблюдали изменений в экспрессии амилазы в клетках, экспрессирующих маркеры, характерные для линии панкреатических эндокринных клеток, которые обрабатывали соединением № 5330797 в течение пяти дней (см. фиг.3, панель f). Однако наблюдали снижение уровня экспрессии PAX4 (фиг.3, панель h), NKX6.1 (фиг.3, панель k), PDX1 (фиг.3, панель l), NEUROD (фиг.3, панель o) и BRN4 (фиг.3, панель q).
Пример 4
Обработка ингибитором циклин-зависимых киназ повышала экспрессию MAFA в кластерах, подобных островкам поджелудочной железы
Клетки линии человеческих эмбриональных стволовых клеток H1, пассаж 52, культивировали на чашках с покрытием MATRIGEL® (разведение 1:30) и дифференцировали в соответствии со способами, описанными в Примере 1. Была введена дополнительная стадия (стадия 6) для дальнейшего созревания клеток, экспрессирующих маркеры, характерные для линии панкреатических эндокринных клеток. Стадия 6 в данном примере включала семидневную обработку средой DMEM/F12 + 1% B27 (Invitrogen, Калифорния). Среду заменяли ежедневно.
После стадии 6 клетки обрабатывали в течение 5 минут при комнатной температуре 1X раствором аккутазы (Sigma, Миссури). Аккутазу удаляли и добавляли к клеткам среду DMEM/12 + 1% B27. Прикрепленные клетки снимали клеточным скребком, аккуратно ресуспендировали и пропускали через клеточный фильтр на 40 мкм. Клетки, оставшиеся на фильтре, снимали путем промывания базальной средой и культивировали в суспензии на сверхнизкопрофильных культуральных планшетах Ultra-Low (№ по кат. 3471, Corning, Массачусетс). Далее клетки проходили следующую обработку: клетки культивировали в среде DMEM/F12 + 1 % B27, содержащей 20 нг/мл активина A (AA), 1 мкм CDK-ингибитора III (№ по кат. 217714, Calbiochem, Калифорния) в течение 10 дней (стадия 7). В качестве контрольной группы использовали клетки, обработанные средой. В дни с 7 по 10 отбирали образцы для ПЦР-анализа и окрашивания дитизоном. Предполагалось, что клетки, культивированные в суспензии в соответствии со способами, описанными в данном примере, имели морфологию, сходную с кластерами в островках поджелудочной железы. Обработка CDK-ингибитором III, по-видимому, не влияла на морфологию кластеров, сходных с островками поджелудочной железы.
На фиг.4, панели a-i, показано влияние обработки CDK-ингибитором III на профиль экспрессии генов в клеточных кластерах. Обработка CDK-ингибитором III повышала экспрессию маркеров, ассоциированных с линией панкреатических эндокринных клеток и, в частности, повышала экспрессию проинсулинового транскрипционного фактора MAFA.
На фиг.5, панели a-b, показано влияние CDK-ингибитора III на окрашивание кластеров дитиазоном (DTZ). Клеточные кластеры, обработанные CDK-ингибитором и окрашенные DTZ, имели более красный характер окраски, чем кластеры, не обработанные CDK-ингибитором III.
Пример 5
Анализ методом FACS инсулин-продуцирующих клеток, получаемых способами, составляющими предмет настоящего изобретения
Эмбриональные человеческие стволовые клетки линии H1, пассаж 42, культивировали на планшетах, покрытых препаратом MATRIGEL®, и дифференцировали в инсулин-продуцирующие клетки с использованием следующего протокола:
a. среда RPMI с добавлением 2% БСА (№ по каталогу 152401, MP Biomedical, Огайо) и 100 нг/мл активина A (R&D Systems, Миннесота), с добавлением 20 нг/мл WNT-3a (№ по каталогу 1324-WN-002, R&D Systems, Миннесота), с добавлением 8 нг/мл bFGF (№ по каталогу 100-18B, PeproTech, Нью-Джерси), в течение одного дня, с последующей обработкой средой RPMI с добавлением 2% БСА и 100 нг/мл активина A, с добавлением 8 нг/мл bFGF в течение еще двух дней (стадия 1), затем
b. среда DMEM/F12 + 2% БСА + 50 нг/мл FGF7 + 0,25 мкM KAAD-циклопамина (№ 239804, Calbiochem, Калифорния) в течение двух дней (стадия 2), далее
c. среда DMEM/F12 + 1% B27 (Invitrogen, Калифорния) + 50 нг/мл FGF7 + 0,25 мкM KAAD-циклопамина + 2 мкM ретиноевой кислоты (RA) (Sigma, Миссури) + 100 нг/мл Noggin (R & D Systems, Миннесота) в течение четырех дней (стадия 3), далее
d. среда DMEM/F12 + 1% B27 (Invitrogen, Калифорния) + 100 нг/мл Noggin + 1 мкM DAPT (ингибитор гамма-секретазы) (№ по кат. 565784, Calbiochem, Калифорния) + 1 мкM ALK5-ингибитора II (№ по кат. 616452, Calbiochem, Калифорния) + 100 нг/мл Netrin-4 (R&D Systems, Миннесота) в течение трех дней (стадия 4), далее
e. среда DMEM/F12 + 1% B27 (Invitrogen, Калифорния) + 1 мкM ALK5-ингибитора II (Calbiochem, Калифорния) в течение семи дней (стадия 5), далее
f. среда DMEM/F12 + 1% B27 в течение семи дней (стадия 6), далее
g. обработка аккутазой в течение 5 минут, затем удаление скребком оставшихся прикрепленными клеток. Затем клеточную суспензию пропускали через клеточный фильтр 40 мкм. Клетки, оставшиеся на фильтре, извлекали путем смывания базальной средой и культивировали в суспензии на сверхнизкопрофильных культуральных планшетах в среде DMEM с высоким содержанием глюкозы (№ по кат. 11995-073, Invitrogen, Калифорния) + 1 % B27 + 20 нг/мл активина A (AA) и 1 мкМ CDK-ингибитора III (№ по кат. 217714, Calbiochem, Калифорния) в течение 5 дней (стадия 7).
Сходные с островками кластеры диспергировали на одиночные клетки с помощью реактива TrypLE Express (Invitrogen, Carlsbad, Калифорния) и отмывали холодным PBS. Для фиксации клетки ресуспендировали в 200-300 мкл буфера Cytofix/Cytoperm (BD 554722, BD, Калифорния) и инкубировали в течение 30 мин. при 4°C. Клетки дважды отмывали в 1 мл буферного раствора Perm/Wash (BD 554723) и ресуспендировали в 100 мкл раствора для окраски/блокировки, содержащем 2% нормальной козьей сыворотки в буфере Perm/Wash. Для анализа методом проточной цитометрии клетки окрашивали следующими первичными антителами: антителами к инсулину (кроличьи моноклональные антитела, Cell Signaling № C27C9; разведение 1:100); антителами к глюкагону (мышиные моноклональные антитела, Sigma № G2654, 1:100); антителами к синаптофизину (кроличьи поликлональные антитела, DakoCytomation № A0010, 1:50). Клетки инкубировали в течение 30 минут при 4°C, после чего дважды промывали буфером Perm/Wash, а затем в течение 30 минут инкубировали в подходящих вторичных антителах: козьих антикроличьих Alexa 647 (Invitrogen № A21246) или козьх антимышиных 647 (Invitrogen № A21235); козьих антикроличьих R-PE (BioSource № ALI4407). Все вторичные антитела применяли в разведении 1:200. Клетки отмывали по меньшей мере один раз в буфере Perm/Wash и анализировали с применением метода BD FACS. Для анализа фиксировали не менее 10000 событий. В качестве контрольной группы использовали недифференцированные клетки H1 и клетки линии β-TC (CRL-11506™ ATCC, Вирджиния).
На фиг.6, панели a-c, показана процентная доля инсулин-положительных, синаптофизин-положительных и глюкагон-положительных клеток среди клеток, подвергавшихся обработке, соответствующей стадии 7, в базовой среде. На фиг.7, панели a-c, показана процентная доля инсулин-положительных, синаптофизин-положительных и глюкагон-положительных клеток среди клеток, подвергавшихся обработке, соответствующей стадии 7, в среде, содержащей CDK-ингибитор III в количестве 1 мкM, в течение 5 дней. Количество клеток, положительных по одному гормону, инсулину, после обработки CDK-ингибитором увеличилось с 3% до 8%. Кроме того, процентная доля полигормональных (инсулин- и глюкагон-положительных) клеток после обработки CDK-ингибитором уменьшилась.
Пример 6
Кинетика экспрессии MAFA, индуцированной CDK-ингибитором
Эмбриональные человеческие стволовые клетки линии H1, пассаж 42, культивировали на планшетах, покрытых препаратом MATRIGEL®, и дифференцировали в инсулин-продуцирующие клетки с использованием следующего протокола:
a. среда RPMI с добавлением 2% БСА (№ по каталогу 152401, MP Biomedical, Огайо) и 100 нг/мл активина A (R&D Systems, Миннесота), с добавлением 20 нг/мл WNT-3a (№ по каталогу 1324-WN-002, R&D Systems, Миннесота), с добавлением 8 нг/мл bFGF (№ по каталогу 100-18B, PeproTech, Нью-Джерси), в течение одного дня, с последующей обработкой средой RPMI с добавлением 2% БСА и 100 нг/мл активина A, с добавлением 8 нг/мл bFGF в течение еще двух дней (стадия 1), затем
b. среда DMEM/F12 + 2% БСА + 50 нг/мл FGF7 + 0,25 мкM KAAD-циклопамина (№ 239804, Calbiochem, Калифорния) в течение двух дней (стадия 2), далее
c. среда DMEM/F12 + 1% B27 (Invitrogen, Калифорния) + 50 нг/мл FGF7 + 0,25 мкM KAAD-циклопамина + 2 мкM ретиноевой кислоты (RA) (Sigma, Миссури) + 100 нг/мл Noggin (R & D Systems, Миннесота) в течение четырех дней (стадия 3), далее
d. среда DMEM/F12 + 1% B27 (Invitrogen, Калифорния) + 100 нг/мл Noggin + 1 мкM DAPT (ингибитор гамма-секретазы) (№ по кат. 565784, Calbiochem, Калифорния) + 1 мкM ALK5-ингибитора II (№ по кат. 616452, Calbiochem, Калифорния) + 100 нг/мл Netrin-4 (R&D Systems, Миннесота) в течение трех дней (стадия 4), далее
e. среда DMEM/F12 + 1% B27 (Invitrogen, Калифорния) + 1 мкM ALK5-ингибитора II (Calbiochem, Калифорния) в течение семи дней (стадия 5), далее
f. среда DMEM/F12 + 1% B27 в течение семи дней (стадия 6), далее
g. обработка аккутазой в течение 5 минут, затем удаление скребком оставшихся прикрепленными клеток. Затем клеточную суспензию пропускали через клеточный фильтр 40 мкм. Клетки, оставшиеся на фильтре, извлекали путем смывания базальной средой и культивировали в суспензии на сверхнизкопрофильных культуральных планшетах в среде DMEM с высоким содержанием глюкозы (№ по кат. 11995-073, Invitrogen, Калифорния) + 1% B27 + 20 нг/мл активина A (AA) и 2 мкм CDK-ингибитора III (№ по кат. 217714, Calbiochem, Калифорния) в течение 1-8 дней (стадия 7).
Образцы отбирали для ПЦР-анализа в дни 1, 2, 3 и 4. После 4 дней обработки CDK-ингибитором CDK-ингибитор извлекали из культуральной среды и клетки культивировали еще 4 дня в среде DMEM-F12 + 1% B27 + 20 нг/мл активина A. По истечении четырех дней отбирали в трех повторностях образцы для ПЦР-анализа.
На фиг.8, панели a-b, показан характер экспрессии MAFA и инсулина в разные моменты времени стадии 7. Обработка ингибитором CDK приводила к значительному увеличению экспрессии MAFA и инсулина, и это увеличение росло с течением времени. Однако удаление CDK-ингибитора приводило к значительному падению экспрессии как MAFA, так и инсулина в образцах, взятых через четыре дня после прекращения использования данного соединения.
Пример 7
Скрининговое исследование влияния соединений из библиотеки ингибиторов киназ BIOMOL™ на клетки, обработанные в соответствии с протоколом дифференцирования, описанном в Примере 1
Клетки линии человеческих эмбриональных стволовых клеток H1, пассаж 51, сеяли на 24-луночные планшеты с покрытием MATRIGEL® (разведение 1:30) и дифференцировали в соответствии со способами, описанными в Примере 1, до стадии 5. После этого клетки выращивали в течение одного дня в среде DMEM/F12 + 1% B27, а затем обрабатывали в течение шести дней средой DMEM/F12 + 1% B27, содержащей соединение из библиотеки BIOMOL™ (№ по кат. 2832, BIOMOL, Plymouth Meeting, Пенсильвания) с итоговой концентрацией 4 мкM. В качестве контрольной группы инкубировали лунки со средой. В течение всего протокола обработки среду, содержащую базовые компоненты или соединение, меняли через день. Все образцы проходили обработку в двух повторностях. По завершении обработки отбирали РНК для ПЦР-анализа. Образцы анализировали методом ПЦР в реальном времени на экспрессию инсулина, глюкагона, MAFA и ARX4. Результаты, измеренные методом ПЦР в реальном времени, выражали в виде отношения инсулин/глюкагон (Таблица 2) или отношения MAF/Arx4 (Таблица 2) в образцах, прошедших обработку, относительно необработанной контрольной группы. В Таблице 3 указаны соответствующие № по кат., № CAS, название соединения или идентификационный номер для каждой обозначенной буквенно-цифровым кодом лунки.
При обработке клеток, экспрессирующих маркеры, характерные для линии панкреатических эндокринных клеток, соединениями C8 или F1 в количестве 4 мкM отношение экспрессий инсулин/глюкагон составило приблизительно 10,0 или выше. У клеток, обработанных соединением D9, отношение экспрессий инсулин/глюкагон составляло приблизительно 1840,0 (Таблица 2).
Далее исследовали влияние этих соединений на отношение MAFA/ARX4 и наблюдали, что при обработке клеток, экспрессирующих маркеры, характерные для линии панкреатических эндокринных клеток, некоторыми соединениями изменение отношения MAFA/ARX4 было значительно более сильным, чем при обработке другими протестированными соединениями из библиотеки: в клетках, обработанных соединением B6 или F1, отношение MAFA/ARX4 составляло приблизительно 10. При обработке клеток, экспрессирующих маркеры, характерные для линии панкреатических эндокринных клеток, соединением C8 соотношение MAFA/ ARX4 составляло приблизительно 84, а в клетках, обработанных соединением D9, отношение MAFA/ARX4 составило приблизительно 212 (Таблица 2).
Пример 8
Влияние ингибиторов циклин-зависимых киназ на экспрессию инсулина и MAFA в клетках, обработанных в соответствии с протоколом дифференцирования, описанным в Примере 1
Клетки линии человеческих эмбриональных стволовых клеток H1, пассаж 51, культивировали на 24-луночных планшетах с покрытием MATRIGEL™ (разведение 1:30) и дифференцировали в соответствии со способами, описанными в Примере 1, до стадии 5. Далее клетки выращивали в течение восьми дней в среде DMEM/F12 + 1% B27, а затем обрабатывали в течение четырех дней средой DMEM/F12 + 1% B27, содержащей ингибитор циклин-зависимых киназ с итоговой концентрацией 0,6125, 1,25 или 5,0 мкM. Были протестированы 6 ингибиторов: № 5330812 (№ по кат. EMD 217714), № 4566 (№ по кат. EMD 217713), № 5330797 (№ по кат. EMD 219476), № 73292 (№ по кат. EMD 341251), № 4592 (№ по кат. EMD 495620) и № 160355 (№ по кат. EMD 557360). В качестве контрольной группы инкубировали лунки со средой. В течение всего протокола обработки среду, содержащую базовые компоненты или соединение, меняли через день. Все образцы проходили обработку в двух повторностях. По завершению обработки отбирали РНК для ПЦР-анализа. Образцы анализировали методом ПЦР в реальном времени на экспрессию инсулина, глюкагона, MAFA и ARX4. Результаты выражались в виде измеренной методом ПЦР в реальном времени кратности изменения относительно контрольной группы, обработанной чистой средой.
Мы наблюдали, что соединения № 5330812, № 4566, № 5330797 и № 73292 в протестированных количествах стимулировали экспрессию MAFA (Таблица 4). Соединения № 4592 и № 160355 в протестированных количествах не стимулировали экспрессию MAFA (Таблица 4). Оказалось, что соединения № 5330812, № 4566, № 5330797, № 4592 и № 160355 стимулировали экспрессию инсулина (Таблица 4). Соединение № 5330797 снижало экспрессию глюкагона и Arx4 (Таблица 4), а также стимулировало экспрессию MAFA.
Пример 9
Дифференцирование человеческих эмбриональных стволовых клеток линии H1 в панкреатические эндокринные клетки с помощью среды DMEM, содержащей 25 мкM глюкозы (DMEM-HG) и не содержащей эмбриональной бычьей сыворотки
Человеческие эмбриональные стволовые клетки линии H1 культивировали на чашках, покрытых препаратом MATRIGEL® (разведение 1:30), и дифференцировали в клетки, экспрессирующие маркеры, характерные для линии панкреатических эндокринных клеток, с использованием следующего протокола:
a. среда RPMI с добавлением 2% БСА (№ по каталогу 152401, MP Biomedical, Огайо) и 100 нг/мл активина A (R&D Systems, Миннесота), с добавлением 20 нг/мл WNT-3a (№ по каталогу 1324-WN-002, R&D Systems, Миннесота), с добавлением 8 нг/мл bFGF (№ по каталогу 100-18B, PeproTech, Нью-Джерси), в течение одного дня, с последующей обработкой средой RPMI с добавлением 2% БСА и 100 нг/мл активина A, с добавлением 8 нг/мл bFGF в течение еще двух дней (стадия 1), затем
b. среда RPMI с добавлением 2% БСА + 50 нг/мл FGF7 + 0,25 мкM KAAD-циклопамина (№ 239804, Calbiochem, Калифорния) в течение двух дней (стадия 2), далее
c. среда DMEM-HG + 1% B27 (Invitrogen, Калифорния) + 50 нг/мл FGF7 + 0.25 мкM Cyclopamine- KAAD + 2 мкM ретиноевой кислоты (RA) (Sigma, Миссури) + 100 нг/мл Noggin (R & D Systems, Миннесота) в течение шести дней (стадия 3), далее
d. среда DMEM-HG + 1% B27 (Invitrogen, Калифорния) + 100 нг/мл Noggin + 1 мкM ALK5-ингибитора II (№ по кат. 616452, Calbiochem, Калифорния) в течение трех дней (стадия 4), далее
e. среда DMEM-HG + 1% B27 (Invitrogen, Калифорния) + 1 мкM ALK5-ингибитора II (Calbiochem, Калифорния) в течение семи дней (стадия 5).
Среду заменяли ежедневно. На каждой стадии количество клеток подсчитывали с помощью гемоцитометра и для ПЦР-анализа отбирали образцы РНК. Все образцы отбирали в трех повторностях.
Пример 10
Скрининговое исследование влияния соединений из библиотеки ингибиторов I киназ EMD на клетки, обработанные в соответствии с протоколом дифференцирования, описанным в Примере 9
Клетки линии человеческих эмбриональных стволовых клеток H1, пассаж 45, культивировали на 24-луночных планшетах с покрытием MATRIGEL® (разведение 1:30) и дифференцировали в соответствии со способами, описанными в Примере 9, до стадии 5. Далее клетки культивировали и обрабатывали в дни 1, 3 и 5 стадии 5 средой, содержащей DMEM-HG, 1% B27 (Invitrogen, Калифорния), 1 мкM ALK5-ингибитора II (Calbiochem, Калифорния) и соединение из библиотеки EMD Calbiochem 1, разведенное в DMSO (№ по кат. 539744, Calbiochem, Сан-Диего, Калифорния) с итоговой концентрацией при обработке 2,5 мкM. В качестве контрольной группы инкубировали лунки со средой. На всем протяжении протокола среду меняли ежедневно, за искючением стадии 5, когда среду меняли через день. Все образцы проходили обработку в двух повторностях.
По завершению обработки отбирали РНК для ПЦР-анализа. Образцы анализировали методом ПЦР в реальном времени на экспрессию MAFA. Результаты, измеренные методом ПЦР в реальном времени, выражали в виде кратности изменения экспрессии MAFA относительно необработанных человеческих эмбриональных стволовых клеток H1 (Таблица 5).
При обработке клеток, экспрессирующих маркеры, характерные для линии панкреатических эндокринных клеток, соединениями A4 (№ по кат. 124001, Akt-ингибитор IV), E8 (№ по кат. 527450, ингибитор PKR) и F9 (№ по кат. 539648, стауроспорин, N-бензоил-) в количестве 2,5 мкM экспрессия MAFA возросла по меньшей мере в 4 раза в сравнении с контрольной группой, обработанной средой (Таблица 5). При обработке соединением E6 (№ по кат. 521233, ингибитор IV тирозинкиназы рецептора PDGF) в количестве 2,5 мкM экспрессия MAFA возрастала по меньшей мере в 2,5 раза в сравнении с контрольной группой, обработанной средой (Таблица 5).
Пример 11
Скрининговое исследование влияния соединений из библиотеки ингибиторов II киназ EMD на клетки, обработанные в соответствии с протоколом дифференцирования, описанным в Примере 9
Клетки линии человеческих эмбриональных стволовых клеток H1, пассаж 46, культивировали на 24-луночных планшетах с покрытием MATRIGEL® (разведение 1:30) и дифференцировали в соответствии со способами, описанными в Примере 9, до стадии 5. Далее клетки культивировали и обрабатывали в дни 1, 3 и 5 стадии 5 средой, содержащей DMEM-HG, 1% B27 (Invitrogen, Калифорния), 1 мкM ALK5-ингибитора II (Calbiochem, Калифорния) и соединение из библиотеки EMD Calbiochem II, разведенное в DMSO (Таблицы 1 и 6, Calbiochem, Сан-Диего, Калифорния) с итоговой концентрацией при обработке 2,5 мкM. В качестве контрольной группы инкубировали лунки со средой. На всем протяжении протокола среду меняли ежедневно, за искючением стадии 5, когда среду меняли через день. Все образцы проходили обработку в двух повторностях.
По завершению обработки отбирали РНК для ПЦР-анализа. Образцы анализировались методом ПЦР в реальном времени на экспрессию MAFA. Показаны измеренные методом ПЦР в реальном времени результаты по соединениям, стимулировавшим экспрессию MAFA, выраженные в форме кратности увеличения экспрессии MAFA в сравнении с контрольными образцами (фиг.9).
При обработке клеток, экспрессирующих маркеры, характерные для линии панкреатических эндокринных клеток, любым из следующих соединений: алстерпауллоном, 2-цианоэтилом; SU9516; алстерпауллоном; Cdk1/2-ингибитором III; ингибитором казеинкиназы I, D4476; или MEK1/2-ингибитором, в количестве 2,5 мкM экспрессия MAFA увеличивалась в 4,5 раза относительно необработанной контрольной группы (Таблица 7).
Пример 12
Ингибирование смены фаз клеточного цикла в клетках, экспрессирующих маркеры, характерные для линии панкреатических эндокринных клеток, низкомолекулярными ингибиторами стимулирует экспрессию MAFA в клетках, экспрессирующих маркеры, характерные для линии панкреатических эндокринных клеток
Рост клеток, происходящий в результате смены фаз клеточного цикла, можно активировать и поддерживать, стимулируя клетки экстраклеточными ростовыми факторами. Ростовые факторы связываются с внеклеточными доменами рецепторов ростовых факторов и вызывают конформационное изменение внутриклеточного домена рецептора. Это изменение запускает димеризацию рецептора и активацию тирозинкиназ, расположенных на внутриклеточном домене рецептора, что ведет к фосфорилированию и активации нескольких нижележащих сериновых/треониновых киназ, и это в итоге приводит к продвижению клеток по фазам клеточного цикла и пролиферации клеток.
В нормальных физиологических условиях зрелые панкреатические бета-клетки, характеризующиеся экспрессией инсулина и транскрипционного фактора MAFA, находятся в состоянии покоя, оставаясь, как правило, в фазе G0 клеточного цикла. Тем не менее, для образования достаточного для формирования функционального органа количества клеток и удовлетворения потребностей зрелого организма животного, клетки, экспрессирующие маркеры, характерные для линии панкреатических эндокринных клеток, составляющие предмет изобретения, должны проходить через фазы клеточного цикла. Таким образом, в определенный момент эмбрионального развития клетки, экспрессирующие маркеры, характерные для линии панкреатических эндокринных клеток, составляющие предмет настоящего изобретения, дифференцируются в бета-клетки и переходят из состояния активно меняющей фазы цикла пролиферирующей клетки в состояние покоящейся клетки.
Наши данные свидетельствуют, что путем ингибирования смены фаз клеточного цикла в результате блокады сигнальных каскадов при помощи низкомолекулярных ингибиторов киназ можно заставить клетки, экспрессирующие маркеры, характерные для линии панкреатических эндокринных клеток, экспрессировать MAFA, маркер зрелых панкреатических бета-клеток. Ингибиторы киназ, нацеленные на рецептор ростовых факторов (ингибитор IV тирозинкиназ рецептора PDGF), или ингибиторы, нарушающие работу киназ, расположенных далее по каскаду от тирозинкиназных рецепторов (MEK1/2-ингибитор, PKR-ингибитор или Akt-ингибитор IV), нарушают работу пролиферативной сигнализации, связанной с ростовыми факторами и киназами, что приводит к остановке клеточного цикла и индукции экспрессии MAFA. Использование ингибиторов широкого спектра действия, таких как стауроспорин, позволяет эффективно индуцировать экспрессию MAFA, однако такой ингибитор в действующих количествах является цитотоксичным. Более специфические соединения, такие как ингибиторы циклин-зависимых киназ (алстерпауллон, 2-цианоэтил; SU9516; алстерпауллон или Cdk1/2-ингибитор III) индуцируют экспрессию MAFA и имеют меньшую цитотоксичность, чем ингибиторы широкого спектра действия, такие как стауроспорин.
Чтобы выяснить, способен ли ингибитор киназ широкого спектра действия индуцировать экспрессию MAFA и образование более зрелого фенотипа у клеток, экспрессирующих маркеры, характерные для линии панкреатических эндокринных клеток, составляющих предмет настоящего изобретения, мы провели дифференцирование человеческих эмбриональных стволовых клеток H1 в соответствии со способами, описанными в Примере 9, и обработали их в дни 1, 3 и 5 протеинтирозинкиназным ингибитором, генистеином, который, как было показано, индуцирует остановку фазы G2 в человеческих и мышиных клеточных линиях и ингибирует несколько киназ. При использовании доз 10 и 30 нг/мл наблюдался увеличенный уровень экспрессии эндокринных гормонов инсулина, соматостатина и транскрипционного фактора MAFA в сравнении с необработанной контрольной группой, тогда как при использовании дозы 10 нг/мл увеличивалась экспрессия эндокринного гормона глюкагона (фиг.10). При использовании дозы генистеина 100 нг/мл наблюдалась значительная токсичность, коррелировавшая с утратой экспрессии инсулина, глюкагона и соматостатина.
Эти данные показывают, что ингибируя смену фаз клеточного цикла путем блокирования сигнальных каскадов низкомолекулярными ингибиторами киназ, ориентированными на ингибирование трансдукции сигнала от тирозинкиназ рецепторов ростовых факторов, к ядру и циклин-зависимым киназам, можно заставить клетки, экспрессирующие маркеры, характерные для линии панкреатических эндокринных клеток, составляющие предмет изобретения, экспрессировать MAFA, маркер зрелых панкреатических бета-клеток.
Публикации, цитируемые в настоящем документе, в силу ссылки на них полностью включены в настоящий документ. Хотя различные аспекты изобретения иллюстрируются выше ссылками на примеры и предпочтительные варианты осуществления, подразумевается, что область изобретения ограничивается не упомянутым выше описанием, а следующими пунктами формулы изобретения, составленными в соответствии с принципами патентного законодательства.
Реферат
Изобретение относится к области биотехнологии, в частности к получению популяции клеток, экспрессирующих MAFA. Способ включает дифференцировку клеток человека, экспрессирующих маркеры, характерные для линии сформированной эндодермы, полученные из плюрипотентных стволовых клеток, которые представляют собой плюрипотентные стволовые клетки человека не эмбрионального происхождения, клетки из линии человеческих эмбриональных стволовых клеток H1, клетки из линии человеческих эмбриональных стволовых клеток H7, клетки из линии человеческих эмбриональных стволовых клеток H9, или клетки из линии человеческих эмбриональных стволовых клеток SA002, в клетки человека, экспрессирующие маркеры, характерные для линии панкреатической эндодермы. Затем осуществляют дифференцировку клеток человека, экспрессирующих маркеры, характерные для линии панкреатической эндодермы, в клетки человека, экспрессирующие маркеры, характерные для линии панкреатических эндокринных клеток, которые экспрессируют по меньшей мере один из NGN3, NEUROD, ISL1, PDX1, NKX6.1, PAX4 и PTF1-альфа; и обработку клеток человека, экспрессирующих маркеры, характерные для линии панкреатических эндокринных клеток, с ингибитором киназы, выбранным из группы, состоящей из алстерпауллона 2-цианоэтила; SU9516; алстерпауллона; Cdk1/2-ингибитора III; ингибитора казеинкиназы I; Akt-ингибитора IV; EGFR-ингибитора; MEK1/2-ингибитора; стауроспорин N-бензоил-, PKR-ингибитора и ингибитора IV тирозинкиназы рецептора PDGF. Изобретение позволяет расширить арсенал средств. 2 н. и 19 з.п. ф-лы, 16 ил., 7 табл., 9 пр.

Комментарии