Манипулирование ферментативной активностью протопорфириногеноксидазы у эукариот - RU2192468C2
Код документа: RU2192468C2
Чертежи









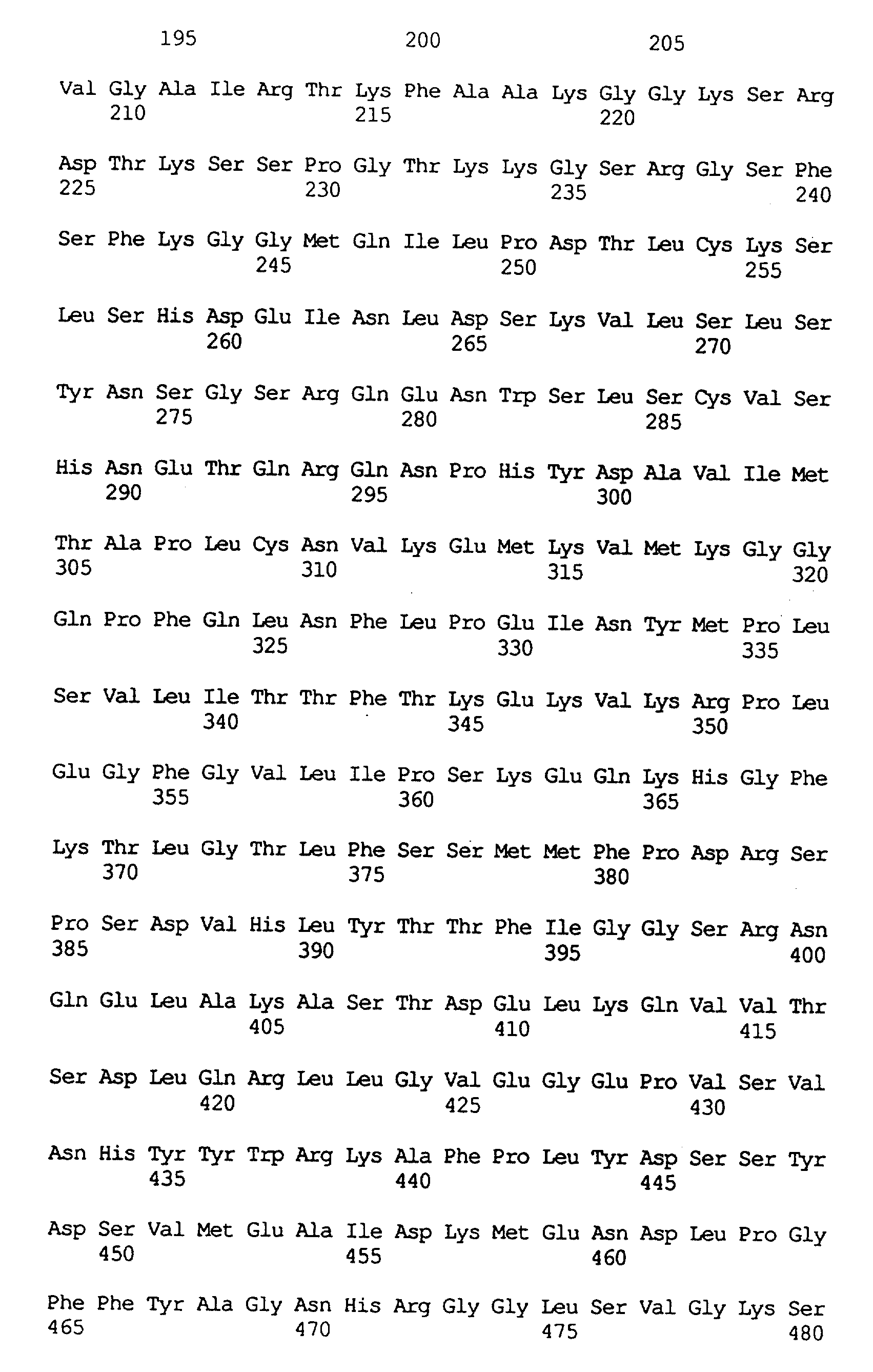






















Описание
Изобретение относится к манипулированию ферментативной активностью, ответственной за превращение протопорфириногена IX в протопорфирин IX в процессе биосинтеза, общего для всех эукариот. Один из предметов изобретения относится к развитию устойчивости к гербицидам у растений, тканей растений и семян. Другой предмет изобретения относится к разработке методов диагностики и лечения дефицита этой ферментативной активности у животных, в частности у людей.
Процессы биосинтеза, приводящие к производству хлорофилла и гема, включают ряд общих стадий. Хлорофилл представляет собой поглощающий свет пигмент, присутствующий во всех зеленых фотосинтезирующих организмах. Гем представляет собой кофактор гемоглобина, цитохромов, Р450-оксигеназ со смешанной функцией, пероксидаз и каталаз (см., например, у Lehninger, Biochemistry, Worth Publishers, New York (1975)) и, следовательно, является необходимым компонентом всех аэробных организмов.
Последней общей стадией биосинтеза хлорофилла и гема является окисление протопорфириногена IX в протопорфирин IX. Протопорфириногеноксидаза (обозначенная в данном описании как "протокс") представляет собой фермент, который катализирует эту последнюю стадию окисления (Matringe и др., Biochem. J. 260: 231 (1989)).
Фермент протокс был очищен полностью или частично из многочисленных организмов, включающих дрожжи Saccharomyces cerevisiae (Labbe-Bois и Labbe, Biosynthesis of Heme and Chlorophyll, E. H. Dailey, ред. McGraw Hill: New York, стр. 235-285 (1990)), этиопласты ячменя (Jacobs и Jacobs, Biochem. J. 244: 219 (1987)) и печень мыши (Dailey и Karr, Biochem. 26: 2697 (1987)). Гены, кодирующие протокс, были выделены из двух прокариот: Escherichia coli (Sasarman и др. , Can. J. Microbiol. 39: 1155 (1993)) и Bacillus subtilis (Dailey и др., J.Biol. Chem. 269: 813 (1994)). Эти гены не обладают сходной последовательностью; кодируемые ими протеиновые продукты не имеют каких-либо идентичных аминокислотных последовательностей. Протеин E. coli имеет массу приблизительно 21 кДа и связан с клеточной мембраной. Протеин В. subtilis имеет массу 51 кДА и является растворимым, активным в цитоплазме.
В настоящее время слишком мало известно о ферменте протоксе, чтобы получить возможность выделить кодирующие протокс гены из высших эукариот (т.е. животных, растений и всех других многоклеточных, имеющих ядро организмов, отличных от низших эукариотических микроорганизмов, таких как дрожжи, одноклеточные водоросли, простейшие и т.д.), используя известные подходы.
В частности многие стандартные методы выделения новых протеинов и генов базируются на предположении, что они обладают значительным сходством по первичной структуре (т. е. по аминокислотной последовательности и последовательности ДНК) с известными протеинами и генами, обладающими аналогичной функцией. Такие стандартные методы включают гибридизацию нуклеиновых кислот и амплификацию путем полимеразно-цепьевой реакции с использованием олигонуклеотидных праймеров, соответствующих мотивам консервативной аминокислотной последовательности. Не следует ожидать, что эти методы будут пригодны для выделения генов протокса эукариот при использовании современной информации о структуре, которая ограничена данными о генах протокса прокариот, поскольку не существует значительного структурного сходства даже между известными генами и протеинами протокса прокариот.
Другой подход, который был применен для выделения генов биосинтеза в других метаболических процессах из высших эукариот, представляет собой комплементацию в микробных мутантах дефицита представляющей интерес активности. Для этого подхода библиотеку кДНК из высших эукариот клонируют в векторе, который может управлять экспрессией кДНК в хозяине-микроорганизме. Затем вектор трансформируют или каким-либо иным образом вводят в мутантный микроорганизм и отбирают колонии, которые фенотипически больше не являются мутантами.
Эту стратегию применяли для выделения генов из высших эукариот, вовлеченных в несколько метаболических процессов, включая биосинтез гистидина (см., например, патент США 5290926 и WO 94/026909 на имя Ward и др., полностью включенных в настоящее описание в качестве ссылки), биосинтез лизина (см., например, Frish и др., Mol. Gen. Genet. 228: 287 (1991)), биосинтез пурина (см. , например, Aimi и др., J. Biol. Chem. 265: 9011 (1990)) и биосинтез триптофана (см., например, Niyogi и др., Plant Cell 5: 1011 (1993)). Однако несмотря на доступность микробных мутантов, у которых, вероятно, недостаточна активность протокса (например, Е. coli (Sasarman и др., J. Gen. Microbiol. 113: 297 (1979)), Salmonella typhimurium (Xu и др., J. Bacteriol. 174: 3953 (1992)) и Saccharomyces cerevisiae (Camadro и др., Biochem. Biophys. Res. Comm. 106: 724 (1982)), применение этого метода для выделения кДНК, кодирующих ферментативную активность протокса у эукариот, на основе доступной информации в основном непредсказуема.
Для этого есть несколько причин. Во-первых, последовательность кДНК протокса эукариот может не экспрессироваться с адекватными уровнями в мутантных микроорганизмах, например, вследствие применения кодона, не совместимого с обычно предпочтительными кодонами для хозяина-микроорганизма. Во-вторых, первичный продукт трансляции из клонированной кодирующей последовательности эукариот может не производить функциональный полипептид, например, если для пост-трансляционной модификации, такой как гликозилирование, необходима активность, которой микроорганизм не обладает. В-третьих, протеин эукариот может оказаться неспособным принимать свою активную конформацию в хозяине-микроорганизме, например, если протеин в норме ориентирован к мембранной системе конкретной органеллы, которой микробный хозяин лишен. Эта последняя возможность особенно вероятна для фермента протокса растений, который связан в клетке растения с органеллами, отсутствующим у микробных хозяев, применяемых в методе комплементации. В частности, фермент протокс растений связан как с оболочкой хлоропласта, так и с тилакоидными мембранами (Matringe и др. , J. Biol. Chem. 267: 4646 (1992)) и, вероятно, достигает указанных мембранных систем в результате пост-трансляционного механизма ориентации, включающего как N-концевую транзитную последовательность, так и внутренние свойства зрелого полипептида (см., например, у Kohorn и Tobin, Plant Cell 1: 159 (1989); Li и др., Plant Cell 3: 709 (1991); Li и др., J. Biol. Chem. 267: 18999 (1992)).
Известно, что фермент протокс играет определенную роль при некоторых болезненных состояниях человека. Пациенты, страдающие от смешанной порфирии, аутосомного доминантного расстройства, характеризующегося как нейропсихическими симптомами, так и повреждениями кожи, имеют пониженные уровни активности протокса (Brenner и Bloomer, New Engl. J. Med. 302: 765 (1980)). Вследствие отсутствия данных о ферменте протоксе человека и соответствующем ему гене возможности для диагностики и лечения этого расстройства в настоящее время весьма ограничены.
Применение гербицидов для борьбы с нежелательной растительностью, такой как сорняки или растения в сельскохозяйственных культурах, стало почти повсеместной практикой. Соответствующий рынок превышает миллиард долларов ежегодно. Несмотря на такое широкое применение борьба с сорняками остается для фермеров важной и дорогой проблемой.
Для эффективного применения гербицидов необходим достаточно жесткий контроль. Например, время и способ обработки и стадия развития сорного растения являются важным фактором для получения хороших результатов при борьбе с сорняками с помощью гербицидов. Поскольку различные виды сорняков устойчивы к гербицидам, важность получения эффективных гербицидов существенно возрастает.
К сожалению, гербициды, проявляющие более высокую эффективность, предназначенные для более широкого спектра сорняков и обладающие ускоренным разложением в почве, могут также обладать большей фитотоксичностью для культурных растений. Одним из решений этой проблемы была разработка культурных растений, устойчивых или толерантных к гербицидам. Гибриды или сорта культурных растений, устойчивые к гербицидам, позволяют применять гербициды без сопутствующего риска повредить культурное растение. Развитие устойчивости может дать возможность обрабатывать гербицидом культурное растение, где его применение ранее было исключено или ограничено (например, применение для предвсходовой обработки) вследствие чувствительности полезных растений к гербициду. Например, патент США 4761373 на имя Anderson и др. относится к устойчивости растений к различным гербицидам из классов имидазолинона или сульфонамида. Устойчивость обусловлена изменением фермента синтазы ацетооксикислоты (AHAS). В патенте США 4975374 на имя Goodman и др. описаны растительные клетки и растения, содержащие ген, кодирующий мутантную глутамин-синтетазу (GS), устойчивую к ингибированию гербицидами, для которых известна способность ингибировать GS, например, к фосфинотрицину и к метионинсульфоксимину. В патенте США 5013659 на имя Bedbrook и др. описаны растения, экспрессирующие мутантную ацетолактат-синтазу, что делает растения устойчивыми к ингибированию гербицидами из класса сульфонилмочевины. В патенте США 5162602 на имя Somers и др. описаны растения, толерантные к ингибированию гербицидами циклогександионом и арилоксифеноксипропановой кислотой. Эта толерантность обусловлена изменением ацетил-СоА-карбоксилазы (АККазы).
Фермент протокс служит в качестве мишени для различных гербицидных соединений. Гербициды, которые ингибируют протокс, включают многие различные по структуре классы молекул (Duke и др., Weed Sci. 39: 465 (1991); Nandihalli и др. , Pesticide Biochem. Physiol. 43: 193 (1992); Matringe и др., FEBS Lett. 245: 35 (1989); Yanase и Andoh, Pesticide Biochem. Physiol. 35: 70 (1989)). Эти гербицидные соединения включают дифениловые эфиры {например, ацифлуорфен, 5-[2-хлор-4-(трифторметил)фенокси]-2-нитробензойная кислота; ее метиловый эфир; или оксифлуорфен, 2-хлор-1-(3-этокси-4-нитрофенокси)-4-(трифторбензол)} , оксидиазолы (например, оксидиазон, 3-[2,4-дихлор-5-(1-метилэтокси)фенил]-5-(1,1-диметилэтил)-1,3,4-оксадиазол-2-(3Н)-он), циклические имиды (например, S-23142, N-(4-xлop-2-фтоp-5-пропаргилоксифенил)-3,4,5, 6-тетрагидрофталимид; хлорфталим, N-(4-хлорфенил)-3,4,5,6-тетрагидрофталимид), фенилпиразолы (например, ТНПП-этил, этил-2[1-(2,3,4-трихлорфенил)-4-нитропиразолил-5-окси] пропионат; М&В 39279), производные пиридина (например, LS 82-556) и фенопилат и его О-фенилпирролидино- и пиперидинкарбаматные аналоги. Многие из этих соединений конкурентно ингибируют нормальную реакцию, катализируемую ферментом, вероятно, выступая в качестве аналогов субстрата.
Вероятный механизм действия ингибирующих протокс гербицидов включает накопление в хлоропласте протопорфириногена IX. Это накопление, вероятно, приводит к проникновению протопорфириногена IX в цитозоль, где он окисляется с помощью пероксидазной активности в протопорфирин IX. При экспозиции светом протопорфирин IX может вызвать образование в цитозоле атомарного кислорода. Этот атомарный кислород в свою очередь может привести к образованию других реактивных видов кислорода, которые могут вызвать переокисление липидов и разрушение мембраны, что приводит к быстрой гибели клетки (Lee и др.. Plant Physiol. 102: 881 (1993)).
Не все ферменты протокса чувствительны к гербицидам, которые ингибируют ферменты протокса растений. Ферменты протокса, кодируемые генами, выделенными как из Escherichia coli (Sasarman и др.. Can. J. Microbiol. 39: 1155 (1993)), так и из Bacillus subtilis (Dailey и др., J.Biol. Chem. 269: 813 (1994), устойчивы к этим гербицидным ингибиторам. Кроме того, были описаны мутанты одноклеточной водоросли Chlamydomonas reinhardtii, устойчивые к фенилимидному гербициду S-23142 (Kataoka и др., J. Pesticide Sci. 15: 449 (1990); Shibata и др., Research in Photosynthesis, том III, N. Murata, ред. Kluwer: Netherlands, стр. 567-570 (1992)). По крайней мере один из этих мутантов, как полагают, имеет измененную активность протокса, который устойчив не только к гербицидному ингибитору, по которому проходил отбор этого мутанта, но также и к другим классам ингибиторов протокса (Oshio и др., Z. Naturforsch. 48с: 339 (1993); Sato и др., ACS Symposium on Porphyric Pesticides, S. Duke, ред. ACS Press: Washington, D.C. (1994)). Также есть данные о том, что мутантная линия клеток табака обладает устойчивостью к ингибитору S-21432 (Che и др., Z. Naturforsch. 48с: 350 (1993)).
Настоящее изобретение относится к выделенной молекуле ДНК, кодирующей фермент протопорфириноген-оксидазу (протокс) из эукариота, который предпочтительно представляет собой высший эукариот. В частности, настоящее изобретение относится к выделенным молекулам ДНК, кодирующим фермент протопорфириноген-оксидазу (протокс), источником которого явлется растение или человек.
В соответствии с изобретением предпочтительными являются выделенные молекулы ДНК, кодирующие фермент протопорфириноген-оксидазу (протокс) из двудольных растений, однако особенно предпочтительны таковые из растений р. Arabidopsis, такие как представленные в последовательностях SEQ ID NO: 1, 3 и 9.
Также предпочтительными являются выделенные молекулы ДНК, кодирующие фермент протопорфириноген-оксидазу (протокс) из однодольных растений, и наиболее предпочтительно из растений кукурузы, такие, как представленные в последовательностях SEQ ID NO: 5 и 7. Особенно предпочтительной согласно изобретению является выделенная молекула ДНК, кодирующая протеин фермента протопорфириноген-оксидазы (протокса) из двудольных растений, где указанный протеин имеет аминокислотную последовательность, выбранную из группы, состоящей из последовательностей SEQ ID NO: 2, 4 и 10. Также предпочтительной является выделенная молекула ДНК, кодирующая протеин фермента протопорфириноген-оксидазы (протокса) из однодольных растений, где указанный протеин имеет аминокислотную последовательность, выбранную из группы, состоящей из последовательностей SEQ ID NO: 6 и 8.
Используя информацию, предоставленную настоящим изобретеним, кодирующая последовательность ДНК для фермента протопорфириноген-оксидазы (протокса) из любого эукариота может быть получена с использованием стандартных методов. Таким образом, еще один предмет настоящего изобретенния относится к зондам, способным к специфичной гибридизации с эукариотической последовательностью ДНК, кодирующей протопорфириноген-оксидазную активность, или с соответствующей мРНК, и способам обнаружения указанных последовательностей ДНК в эукариотах с использованием зондов по изобретению.
Настоящее изобретение, кроме того, включает полигенные экспрессирующие кластеры и рекомбинантные векторы, содержащие эти полигенные экспрессирующие кластеры, которые главным образом содержат промотор, а именно промотор, активный в растении, действенным образом сцепленный с молекулой ДНК, кодирующей фермент протопорфириноген-оксидазу (протокс) из эукариота по изобретению. Полигенный экспрессирующий кластер по изобретению может в дополнение к этому также включать сигнальную последовательность, действенным образом сцепленную с молекулой ДНК, причем эта сигнальная последовательность способна направлять протеин, кодируемый молекулой ДНК, в хлоропласт или в митохондрию.
Кроме того, настоящее изобретение относится к растениям, клеткам растений, тканям растений и семенам растений с измененной активностью протокса, которые устойчивы или по крайней мере толерантны к ингибированию концентрациями гербицида, которые в норме ингибируют естественную активность протокса в растении. В частности одними из вариантов осуществления изобретения являются растения, у которых измененная активность протокса обусловлена сверхэкспрессией фермента протокса дикого типа или экспрессией молекулы ДНК, кодирующей толерантный к гербициду фермент протокс. Этот толерантный к гербициду фермент протокс может представлять собой модифицированную форму фермента протокса, которая в естественных условиях встречается в эукариоте или прокариоте, или модифицированную форму фермента протокса, которая в естественных условиях встречается в растении, или толерантный к гербициду фермент протокс может в естественных условиях встречаться в прокариоте. Растения, подпадающие под объем настоящего изобретения, включают однодольные и двудольные растения, но прежде всего гибридные растения. Предпочтительными являются такие растения, которые могут представлять собой потенциальные мишени для ингибирующих протокс гербицидов, в частности такие важные сельскохозяйственные культуры, как кукуруза и другие зерновые культуры, такие как пшеница, овес, рожь, сорго, рис, ячнень, просо, густой травяной покров (дерн или газонные травы), кормовые травы и т.п., а также хлопчатник, табак, сахарный тростник, сахарная свекла, масличный рапс и соя.
Кроме того, настоящее изобретение включает материал для размножения растений в соответствии с изобретением, предпочтительно семена растений, обработанные защитным покрытием и прежде всего защитным покрытием, содержащим препарат, выбранный из группы, состоящей из гербицидов, инсектицидов, фунгицидов, бактерицидов, нематоцидов, моллюскицидов или их смесей.
Настоящее изобретение, кроме того, относится к способам получения растений, клеток растений, тканей растений и семян растений и их трансгенного потомства, которые содержат фермент протокс, устойчивый или толерантный к ингибированию гербицидом в концентрации, которая ингибируют естественную активность протокса. Эта устойчивость или толерантность может быть получена путем экспрессии в трансгенных растениях любой молекулы ДНК, которая кодирует модифицированную форму фермента протокса, которая в естественных условиях встречается в эукариоте, или модифицированную форму фермента протокса, которая в естественных условиях встречается в растении, или фермент протокс, который может в естественных условиях встречаться в прокариоте, или фермент протокс, который представляет собой модифицированную форму протеина, который в естественных условиях встречается в прокариоте.
Конкретный вариант осуществления изобретения относится к получению трансгенных растений кукурузы, ткани кукурузы или семени кукурузы и их трансгенного потомства, которые стабильно трансформированы рекомбинантной молекулой ДНК, включающей пригодный промотор, функционирующий в растениях, действенным образом сцепленный со структурным геном, кодирующим немодифицированный фермент протокс прокариота, который устойчив к гербициду.
Кроме того, изобретение относится к получению трансгенных растений, клеток растений, тканей растений и семян растений и их трансгенного потомства, которые были стабильно трансформированы рекомбинантной молекулой ДНК, включающей пригодный промотор, функционирующий в растениях, действенным образом сцепленный со структурным геном, кодирующим немодифицированный фермент протокс эукариота. Это приводит к сверхэкспрессии немодифицированного протокса в растении в количестве, достаточном для преодоления ингибирования фермента гербицидом.
Настоящее изобретение также включает получение растений, которые экспрессируют измененный фермент протокс, толерантный к ингибированию гербицидом в концентрации, которая в нормальных условиях ингибирует активность неизмененного протокса дикого типа. В этом варианте осуществления растение может быть стабильно трансформировано рекомбинантной молекулой ДНК, содержащей структурный ген, кодирующий устойчивость протокса, или получено методами направленной селекции, с помощью которых устойчивые к гербициду линии выделяют, характеризуют и совершенствуют.
Кроме того, настоящее изобретение относится к способу борьбы с ростом нежелательной растительности, включающему обработку популяции растения с измененной активностью протокса, устойчивой к ингибированию гербицидом в концентрациях, которые обычно ингибируют встречающуюся в естественных условиях активность протокса в этом растении, эффективным количеством ингибирующего протокс гербицида. Растения, подлежащие защите описанным способом, прежде всего представляют собой таковые, которые могут быть потенциальными мишенями для ингибирующих протокс гербицидов, в частности такие важные сельскохозяйственные культуры, как, например, кукуруза и другие зерновые культуры, такие как пшеница, овес, рожь, сорго, рис, ячмень, просо, густой травяной покров (дерн или газонные травы), кормовые травы и т.п., а также хлопчатник, сахарный тростник, сахарная свекла, масличный рапс и соя. Гербициды, которые относятся к ингибиторам протокса, представляют собой таковые, выбранные из группы, состоящей из арилурацила, дифенилового эфира, оксидиазола, имида, фенилпиразола, производного пиридина, фенопилата и О-фенилпирролидин- и пиперидинкарбаматных аналогов этого фенопилата.
Настоящее изобретение также относится к получению фермента протокса рекомбинантным путем и способам применения полученного рекомбинантным путем протокса. Таким образом, изобретение дополнительно включает клетки-хозяева и прежде всего клетки, выбранные из группы, состоящей из клеток растений, клеток животных, бактериальных клеток, дрожжевых клеток и клеток насекомых, стабильно трансформированных рекомбинантной молекулой ДНК, содержащей пригодный промотор, функционирующий в соответствующей клетке-хозяине, действенным образом сцепленный со структурным геном, кодирующим немодифицированный или модифицированный фермент протокс эукариота, причем клетка-хозяин обладает способностью экспрессировать эту молекулу ДНК.
Настоящее изобретение, кроме того, относится к способам применения очищенного протокса для скрининга новых гербицидов, которые воздействуют на активность протокса, и для идентификации мутантов протокса, устойчивых к гербициду.
В частности, изобретение относится к способу тестирования химического соединения на его способность ингибировать активность
фермента протокса из растения, включающему:
(а) объединение фермента протокса и протопорфириногена IX в первой реакционной смеси в условиях, при которых фермент протокс обладает способностью
катализировать превращение протопорфириногена IX в протопорфирин IX;
(б) объединение химического соединения, фермента протокса и протопорфириногена IX во второй реакционной смеси в тех же
условиях, что и для первой реакционной смеси;
(в) возбуждение первой и второй реакционных смесей волнами длиной от приблизительно 395 до приблизительно 410 нм;
(г) сравнение
флуоресценции первой и второй реакционных смесей при длинах волн от приблизительно 622 до приблизительно 635 нм, причем химическое соединение обладает способностью ингибировать активность фермента
протокса, если флуоресценция второй реакционной смеси существенно меньше, чем флуоресценция первой реакционной смеси.
Кроме того, в изобретении предложен способ идентификации
модифицированного фермента протокса, устойчивого к ингибитору протокса, присутствующего в популяции клеток, включающий следующие стадии:
(а) культивирование популяции в присутствии ингибитора
протокса в количествах, которые ингибируют немодифицированную форму фермента протокса;
(б) отбор клеток, полученных на стадии (а), рост которых не был ингибирован и
(в) выделение и
идентификацию фермента протокса, присутствующего в клетках, отобранных на стадии (б).
Гены, кодирующие измененный протокс, могут применяться в качестве селектируемых маркеров в методах
трансформации растительной клетки. Таким образом, настоящее изобретение также включает способ селекции растений, тканей растения или клеток растения, трансформированных представляющим интерес
трансгеном из нетрансформированных растений, включающий стадии:
(а) трансформацию растения, ткани растения или клетки растения представляющим интерес трансгеном, способным экспрессироваться
растением, и геном, кодирующим измененный протокс, устойчивый к ингибитору протокса;
(б) перенос трансформированных таким образом растений или растительных клеток в питательную среду,
содержащую ингибитор протокса и
(в) отбор растений или растительных клеток, выживших в питательной среде.
Кроме того, настоящее изобретение относится к зондам и способам обнаружения присутствия и выявления формы гена протокса и количественной оценки уровней транскриптов протокса в организме. Эти способы могут применяться для диагностики болезненных состояний, связанных с измененной формой фермента протокса или с измененными уровнями экспрессии фермента протокса.
Один из предметов настоящего изобретения относится к выделеной молекуле ДНК, которая кодирует эукариотическую форму протопорфириноген-оксидазы (обозначенную в настоящем описании как "протокс"), т.е. фермента, который катализирует окисление протопорфириногена IX в протопорфирин IX. Кодирующие последовательности ДНК и соответствующие аминокислотные последовательности для ферментов протокса из Arabidopsis thaliana представлены в виде последовательностей SEQ ID NO: 1-4 и 9-10. Кодирующие последовательности ДНК и соответствующие аминокислотные последовательности для ферментов протокса кукурузы представлены в виде последовательностей SEQ ID NO: 5-8.
Любая требуемая эукариотическая ДНК, кодирующая фермент протокс, может быть выделена в соответствии с изобретением. Один способ, касающийся выделения последовательности, кодирующей протокс эукариота, представлен в примере 1. В этом способе клоны кДНК, кодирующей фермент протокс, определяют из библиотеки клонов кДНК, имеющей происхождение из представляющего интерес эукариота, основываясь на их способности придавать ферментативную активность протокса мутантному организму-хозяину, имеющему дефицит этой активности. Пригодными организмами-хозяевами для применения в этом способе являются таковые, которые могут быть использованы для скрининга библиотек экспрессии кДНК и для которых мутанты с дефицитом активности протокса либо доступны, либо могут быть получены традиционными способами. Такие организмы-хозяева включают, но не ограничены ими, E.coli (Sasarman и др., J. Gen. Microbiol. 113: 297 (1979)), Salmonella typhimurium (Xu и др., J. Bacteriol. 174: 3953 (1992)) и Saccharomyces cerevisiae (Camadro и др., Biochem. Biophys. Res. Comm. 106: 724 (1982)).
В другом варианте последовательности, кодирующие протокс эукариота, могут быть выделены в соответствии с хорошо известными способами, основанными на гомологии их последовательности с кодирующими протокс последовательностями по настоящему изобретению из Arabidopsis thaliana (SEQ ID NO: 1, 3 и 9) и из Zea mays (SEQ ID NO: 5 и 7). В этих способах всю или часть известной кодирующей протокс последовательности применяют в качестве зонда, который селективно гибридизируется с другими кодирующими протокс последовательностями, присутствующими в популяции клонированных фрагментов геномной ДНК или фрагментов кДНК (т.е. библиотек геномной или кДНК) из выбранного организма. Такие способы включают скрининг на основе гибридизации посеянных на пластинке библиотек ДНК (либо бляшек, либо колоний; см., например, у Sambrook и др. , ред. , Molecular Cloning, Cold Spring Harbor Laboratory Press, (1989)) и ПЦР-амплификацию с использованием олигонуклеотидных праймеров, соответствующих доменам последовательности, сохранившимся среди известных аминокислотных последовательностей протокса (см., например, у Innis и др., ред., PCR Protocols, A Guide to Methods and Applications, Academic Press (1990)). Эти способы наиболее пригодны для выделения кодирующих протокс последовательностей из организмов, родственных организму, из которого имеет происхождение последовательность зонда. Например, следует ожидать, что применение этих способов с использованием в качестве зонда кодирующей последовательности из Arabidopsis thaliana или из Zea mays будет особенно пригодно для выделения кодирующих протокс последовательностей из других видов растений.
Выделенные последовательности протокса эукариота по настоящему изобретению могут подвергаться манипуляциям в соответствии со стандартными методами генной инженерии для достижения любой поставленной цели. Например, полная последовательность протокса или ее части может применяться в качестве зондов, способных к специфической гибридизации с последовательностями, кодирующими протокс, и с матричными РНК. Для достижения специфической гибридизации в различных условиях такие зонды включают последовательности, которые являются уникальными среди кодирующих протокс последовательностей, и предпочтительно имеют длину по крайней мере 10 нуклеотидов и наиболее предпочтительно по крайней мере 20 нуклеотидов. Такие зонды могут применяться для амплификации и анализа кодирующих протокс последовательностей из выбранного организма путем хорошо известного процесса полимеразно-цепьевой реакции (ПЦР). Этот метод может быть пригоден для выделения дополнительных кодирующих протокс последовательностей из требуемого организма или в качестве диагностического метода для определения присутствия в организме кодирующих протокс последовательностей и для выявления взаимосвязи измененных кодирующих последовательностей с определенными вредными условиями, такими как аутосомное доминантное нарушение у имеющих пониженные уровни активности протокса людей, что характеризуется как нейропсихическими симптомами, так и повреждениями кожи (Brenner и Bloomer, New Engl. J. Med. 302: 765 (1980)).
Специфичные для протокса зонды гибридизации также могут быть использованы для картирования положения нативного(ных) гена(ов) протокса эукариота в геноме выбранного организма с использованием стандартных методов, основанных на селективной гибридизации зонда с геномными последовательностями протокса. Эти методы включают, но не ограничены ими, идентификацию полиморфизмов ДНК, выявленных или содержащихся внутри последовательности зонда для протокса, и применение таких полиморфизмов для последующего отщепления гена протокса от других маркеров с известным положением на карте в картируемой популяции, полученной в результате самооплодотворения гибрида двух полиморфных родительских линий (см. , например, у Helentjaris и др., Plant Mol. Biol. 5: 109 (1985); Sommer и др., Biotechniques 12: 82 (1992); D'Ovidio и др.. Plant. Mol. Biol. 15: 169 (1990)). Хотя можно ожидать, что любая последовательность протокса эукариота будет пригодна в качестве зонда для картирования генов протокса из любого эукариота, предпочтительными зондами являются такие последовательности протокса из организмов, которые наиболее близкородственны к выбранному организму, и наиболее предпочтительными зондами являются таковые последовательности протокса из выбранного организма. Можно ожидать, что картирование таким образом генов протокса будет наиболее целесообразным для целей селекции растений. Например, на основе знания о положении на генетической карте мутантного гена протокса, который обусловливает устойчивость к гербицидам, могут быть идентифицированы фланкирующие маркеры ДНК из соответствующей генетической карты (см., например, у Helentjaris, Trends Genet. 3: 217 (1987)). При интрогрессии признака устойчивости к гербицидам в новую селектируемую линию эти маркеры могут быть затем применены для мониторинга длины сцепленной с протоксом фланкирующей хромосомной ДНК, еще присутствующей в родительской форме, с которой гибрид скрещивают вновь после каждого круга обратного скрещивания.
Специфичные для протокса зонды гибридизации также могут применяться для количественной оценки уровней мРНК протокса в организме с использованием стандартных методов, таких как назерн-блоттинг. Этот метод может быть пригоден в качестве способа диагностики для обнаружения измененных уровней экспрессии протокса, что может быть связано с определенными вредными условиями, такими как аутосомное доминантное нарушение у людей, характеризующееся как нейропсихическими симптомами, так и повреждениями кожи, имеющих пониженные уровни активности протокса (Brenner и Bloomer, New Engl. J. Med. 302: 765 (1980)).
Для рекомбинантного получения фермента в организме хозяина кодирующая протокс последовательность может быть встроена в полигенный экспрессирующий кластер, сконструированный для выбранного хозяина и интродуцированный в хозяина, где его получают рекомбинантным образом. Выбор специфических регуляторных последовательностей, таких как промотор, сигнальная последовательность, 5' и 3'-нетранслируемые последовательности и энхансер, может быть осуществлен специалистом в данной области техники. Полученная молекула, содержащая отдельные элементы, сцепленные в соответствующей рамке считывания, может быть встроена в вектор, способный к трансформации в клетке-хозяине. Пригодные для этой цели вектры экспрессии и способы рекомбинантного получения протеина хорошо известны для организмов-хозяев, таких как E.coli (см., например, у Studier и Moffatt, J. Mol. Biol. 189: 113 (1986); Brosius, DNA, 8: 759 (989)), дрожжи (см., например, у Schneider и Guarente, Meth. Enzymol. 194: 373 (1991)) и клетки насекомых (см., например, у Luckow и Summers, Bio/Technol. 6: 47 (1988)). Конкретные примеры включают такие плазмиды, как Bluescript (фирма Stratagene, La Jolla, CA), pFLAG (фирма International Biotechnolosies, Inc., New Haven, CT), pTrcHis (фирма Invitrogen, La Jolla, CA) и бакуловирусные векторы экспрессии, например, имеющие происхождение из генома вируса ядерного полиэдроза Autographica californica (AcMNPV). Предпочтительной системой бакуловирус/насекомое являются клетки pVI11392/Sf21 (фирма Invitrogen, La Jolla, CA).
Полученный рекомбинантным путем эукариотический фермент протокс пригоден для различных целей. Например, он может применяться для обеспечения ферментативной активности протокса in vitro. Он также может применяться в анализе in vitro для скрининга новых соединений с гербицидной активностью, мишень для которых ранее не была выявлена, с целью определения, могут ли они ингибировать протокс. Такой анализ in vitro также может быть применен в качестве более общего скрининга для идентификации химических соединений, ингибирующих активность протокса, и, следовательно, являющихся потенциальными гербицидами. В другом варианте полученный рекомбинантным путем фермент протокс может применяться для дальнейшей характеризации его связи с известными ингибиторами, чтобы рационально сконструировать новые ингибирующие гербициды, а также толерантные к гербицидам формы фермента.
Обычно ингибирующее действие в отношении протокса определяют путем измерения флуоресценции при длинах волн от приблизительно 622 до 635 нм после возбуждения длинами волн от приблизительно 395 до 410 нм (см., например, у Jacobs и Jacobs, Enzyme 28:206 (1982); Sherman и др., Plant Physiol. 97: 280 (1991)). Этот анализ основан на том факте, что протопорфирин IX представляет собой флуоресцирующий пигмент, а протопорфириноген IX является нефлуоресцирующим. Экстракты протеина получают из выбранных субклеточных фракций, например из этиопластов, митохондрий, микросом или плазматических мембран путем дифференциального центрифугирования (см., например. Lee и др., Plant Physiol. 102: 881 (1993); Prado и др., Plant Physiol. 65: 956 (1979); Jackson и Мооге в Plant Organelles, Reid ред., стр. 1-12; Jacobs и Jacobs, Plant Physiol., 101: 1181 (1993)). Протопорфириноген получают путем восстановления протопорфирина амальгамой натрия, как описано у Jacobs и Jacobs (1982). Реакционные смеси обычно состоят из 100 мМ HEPES (N-2-гидроксиэтилпиперазин-N'-2-этансульфоновая кислота) (рН 7,5), 5 мМ ЭДТК, 2 мМ ДТТ (дитиотреитол), приблизительно 2 М протопорфириногена IX и приблизительно 1 мг/мл экстракта протеина. До начала ферментативной реакции к экстракту фермента добавляют растворы ингибитора в различных концентрациях, например в 1 мМ, 100 мкМ, 10 мкМ, 1 мкМ, 100 нМ, 10 нМ, 1 нМ, 100 пМ. После добавления экстракта протеина в течение нескольких минут регистрируют флуоресценцию и в области линейного изменения вычисляют тангенс угла наклона кривой (скорость реакции). Значение IC50 определяют путем сравнения тангенса угла наклона реакции в условиях ингибирования с таковым в контрольной реакции.
Другой вариант осуществления настоящего изобретения включает
применение протокса в анализе по выявлению устойчивых к ингибитору мутантов протокса. Типичный анализ включает следующие стадии:
(а) инкубирование первого образца протокса и его субстрата,
т.е. протопорфириногена IX, в присутствии второго образца, содержащего ингибитор протокса;
(б) измерение ферментативной активности протокса из стадии (а);
(в) инкубирование первого
образца мутированного протокса и его субстрата в присутствии второго образца, содержащего тот же самый ингибитор протокса;
(г) измерение ферментативной активности мутированного протокса из
стадии (в) и
(д) сравнение ферментативной активности мутированного протокса с таковой, обеспечиваемой немутированным протоксом.
Реакционная смесь и условия реакции являются теми же, что и для анализа по выявлению ингибиторов протокса (ингибиторный анализ) со следующими модификациями. Во-первых, мутант протокса, полученный аналогично описанному выше, заменяют в одной из реакционных смесей на протокс дикого типа в ингибиторном анализе. Во-вторых, ингибитор протокса дикого типа присутствует в обеих реакционных смесях. В-третьих, мутированную активность (ферментативная активность в присутствии ингибитора и мутированного протокса) и немутированную активность (ферментативная активность в присутствии ингибитора и протокса дикого типа) сравнивают для определения, наблюдается ли существенное увеличение ферментативной активности в мутированной активности по отношению к немутированной активности. Мутированная активность представляет собой любую меру ферментативной активности мутированного фермента протокса в присутствии пригодного субстрата и ингибитора. Немутированная активность представляет собой любую меру ферментативной активности фермента протокса дикого типа в присутствии пригодного субстрата и ингибитора. За достоверное увеличение принимают увеличение ферментативной активности, превышающее предел погрешности техники измерения, предпочтительно приблизительно двукратное увеличение по сравнению с активностью фермента дикого типа в присутствии ингибитора, более предпочтительно приблизительно пятикратное увеличение, наиболее предпочтительно увеличение более чем приблизительно в десять раз.
Гербициды, которые ингибируют протокс, включают многие различные по структуре классы молекул (Duke и др., Weed Sci. 39: 465 (1991); Nandihalli и др. , Pesticide Biochem. Physiol. 43: 193 (1992); Matringe и др., FEBS Lett. 245: 35 (1989); Yanase и Andoh, Pesticide Biochem. Physiol. 35: 70 (1989)), включая дифениловые эфиры {например, ацифлуорфен, 5-[2-хлор-4-(трифторметил)фенокси] -2-нитробензойная кислота; ее метиловый эфир; или оксифлуорфен, 2- хлор-1-(3-этокси-4-нитрофенокси)-4-(трифторбензол)} , оксидиазолы (например, оксидиазон, 3-[2,4-дихлор-5-(1-метилэтокси)фенил]-5-(1,1-диметилэтил)-1,3,4-оксадиазол-2-(3Н)-он), циклические имиды (например, S-23142, N-(4-хлор-2-фтор-5-пропаргилоксифенил)-3, 4,5,6-тетрагидрофталимид, хлорфталим, N-(4-хлорфенил)-3,4,5,6-тетрагидрофталимид), фенилпиразолы (например, ТНПП-этил, этил-2-[1-(2,3,4-трихлорфе-нил)-4-нитропиразолил-5-окси]пропионат; М&В 39279), производные пиридина (например, LS 82-556) и фенопилат и его O-фенилпирролидино- и пиперидинкарбаматные аналоги.
Наиболее важные дифениловые эфиры представляют собой таковые
общей формулы

где R обозначает -COONa (формула II), -CONHSO2CH3 (формула III) или -СООСН2СООС2Н5 (формула IV; см. у Maigrot и др., Brighton Crop Protection Conference-Weeds: 47-51 (1989)).
Дополнительными,
представляющими интерес дифениловыми эфирами являются таковые, где R обозначает

(см. у Hayashi и др., Brighton Crop Protection Conference-Weeds: 53-58 (1989)).
Дополнительным, представляющим интерес дифениловым эфиром является таковой формулы
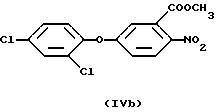
(бифенокс)
(см. Dest и др., Proc. Northeast Weed Sci. Conf. 27: 31 (1973)).
Также
важным является класс гербицидов, известных как амиды, имеющие общую формулу

где Q обозначает



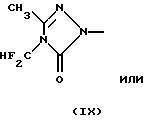


(см. у Hemper и др. (1995) в "Proceedings of the Eighth International Congress of Pesticide Chemistry", Ragdale и др., ред., Amer. Chem. Soc., Washington, D.C., стр. 42-48 (1994)),
и R1 обозначает Н, С1 или F, R2 обозначает С1 и R3 обозначает необязательно замещенный простой эфир, тиоэфир, сложный эфир, амино- или алкильную группу. В другом варианте R2 и R3 вместе могут образовывать 5- или 6-членное гетероциклическое кольцо. Примерами имидных гербицидов, представляющих особый интерес, являются
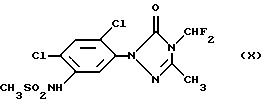

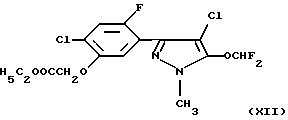
(см. у Miura и др., Brighton Crop Protection Conference-Weeds: 35-40 (1993)),

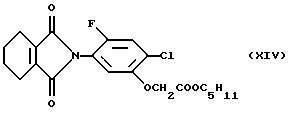


Гербицидная активность вышеуказанных соединений описана в Proceedings of 1991 Brighton Crop Protection Conference, Weeds (British Crop Protection Council) (формулы Х и XVI), Proceedings of 1993 Brighton Crop Protection Conference, Weeds (British Crop Protection Council) (формулы XII и XIII), в патенте США 4746352 (формула XI) и в Abstracts of the Weed Science Society of America, том. 33, стр. 9 (1993) (формула XIV).
Наиболее предпочтительными имидными гербицидами являются таковые, классифицированные как арилурацилы и имеющие общую формулу
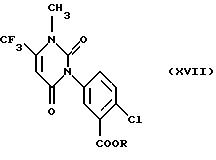
где R обозначает группу (С2-С6-алкенилокси)карбонил-С1-С4 -алкил, как описано в патенте США 5183492, включенном в настоящее описание в качестве ссылки.
Также важными являются гербициды, имеющие общую формулу

(тиадиазимин)
(см. у Weiler и др., Brighton Crop Protection Conference-Weeds: 29-34 (1993));
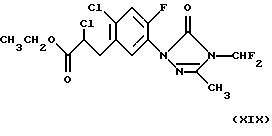
(карфентразон)
(см. у Van Saun и др., Brighton Crop Protection Conference-Weeds: 19-22 (1993));
N-замещенные пиразолы общей формулы
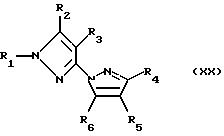
(см. публикации международных заявок WO 94/08999, WO 93/10100 и патент США 5405829, переданный фирме Schering);
N-фенилпиразолы, такие как

(нипираклофен)
(см. стр. 621 в "The Pesticide Manual", 9-е изд., ред. C.R. Worthing, British Crop Protection Council, Surrey (1991)),
и 3-замещенные-2-арил-4,5,6, 7-тетрагидроиндазолы (Lyga и др., Pesticide Sci. 42: 29-36 (1994)).
Уровни гербицида, которые обычно являются достаточными для ингибирования активности протокса, соответствуют нормам расхода, известным в данной области техники и частично зависящим от внешних факторов, таких как окружающая среда, время и способ обработки. Например, в случае имидных гербицидов, представленных формулами V-IX, в частности представленных формулами X-XVIII, интервал норм расхода составляет от 0,0001 до 10 кг/га, предпочтительно от 0,005 до 2 кг/га. Эта норма расхода или концентрация гербицида может различаться в зависимости от требуемого действия и конкретного используемого соединения и может быть определена способами, известными в данной области техники.
Настоящее изобретение, кроме того, относится к растениям, ткани растения и семенам растения, толерантным к гербицидам, которые ингибируют активность протокса, встречающуюся в этих растениях в естественных условиях, причем толерантность обусловлена измененной ферментативной активностью протокса. Характерные растения включают любые растения, которые обрабатывают этими гербицидами в соответствии с их обычным предназначением. Предпочтительными являются важные сельскохозяйственные культуры, т.е. важные представители покрытосемянных и голосемянных растений, такие как хлопчатник, соя, рапс, сахарная свекла, кукуруза, рис, пшеница, ячмень, овес, рожь, сорго, просо, густой травяной покров (дерн или газонные травы), кормовые травы, дернообразующие злаки и т.п.
Под "измененной ферментативной активностью протокса" понимают ферментативную активность протокса, отличную от таковой, которая встречается в растении в естественных условиях (т.е. активность протокса, которая встречается в естественных условиях в отсутствие прямого или косвенного воздействия человека на эту активность), устойчивую к гербицидам, которые ингибируют активность, встречающуюся в естественных условиях. Измененная ферментативная активность протокса может быть придана растению по изобретению путем увеличения экспрессии протокса дикого типа, чувствительного к гербицидам, экспрессии в растении измененного, толерантного к гербицидам эукариотического фермента протокса, экспрессии в растении немодифицированной или модифицированной бактериальной формы фермента протокса, которая является устойчивой к гербицидам, или комбинацией этих способов.
Получение измененной активности фермента протокса путем увеличения экспрессии приводит к достижению уровня протокса в клетке растения по крайней мере достаточного для преодоления ингибирования роста, вызываемого гербицидом. Уровень экспрессируемого протокса обычно по крайней мере в два раза, предпочтительно в пять раз, более предпочтительно по крайней мере в десять раз превышает количество, экспрессируемое в естественных условиях. Увеличенная экспрессия может быть обусловлена множественными копиями гена протокса дикого типа; множественным распространением кодирующей протокс последовательности внутри гена протокса (т.е. амплификацией гена) или мутацией в некодирующей регуляторной последовательности эндогенного гена протокса в клетке растения. Растения, обладающие такой измененной ферментативной активностью, могут быть получены направленной селекцией в растениях. Этот способ известен в данной области техники. См., например, патент США 5162602 на имя Somers и др. , патент США 4761373 на имя Anderson и др. и указанные в них ссылки. Эти растения также могут быть получены с помощью методов генной инженерии, известных в данной области техники.
Увеличенная экспрессия чувствительного к гербицидам протокса также может быть получена путем стабильной трансформации клетки растения рекомбинантной или химерной молекулой ДНК, содержащей промотор, способный стимулировать экспрессию связанного структурного гена в клетке растения, сцепленного с гомологичным или гетерологичным структурным геном, кодирующим протокс. Понятие "гомологичность" подразумевает, что ген протокса выделяют из организма, таксономически идентичного клетке растения-мишени. Понятие "гетерологичность" подразумевает, что ген протокса выделяют из организма, таксономически отличного от клетки растения-мишени. Гомологичные гены протокса могут быть получены путем комплементации бактериального или дрожжевого ауксотрофного мутанта библиотекой экспрессии кДНК из растения-мишени. См., например, пример 1 и у Snustad и др., Genetics 120: 1111-1114 (1988) (глутамин-синтаза кукурузы); у Delauney и др., Мо1. Genet. 221: 299-305 (1990) (пирролин-5-карбоксилатредуктаза сои); у Frisch и др., Mol. Genet. 228: 287-293 (1991) (дигидродипиколинат-синтаза кукурузы); у Eller и др.. Plant Mol. Biol. 18: 557-566 (1992) (3-изопропилмалат-дигидрогеназа хлоропласта рапса); в Proc. Natl Acad. Sci., USA 88: 1731-1735 (1991); у Minet и др.. Plant J. 2: 417-422 (1992) (дигидрооротат-дегидрогеназа) и ссылки, указанные в этих публикациях. Другие известные способы включают скрининг библиотек геномной или кДНК высших растений, например, в отношении последовательностей, которые перекрестно гибридизируются с зондами специфичных нуклеиновых кислот, или скрининг библиотек экспрессии для получения ферментов протокса, которые вступают в перекрестную реакцию со специфичными зондами-антителами. Предпочтительный способ включает комплементацию ауксотрофного мутанта hemG E. coli библиотекой кДНК кукурузы или Arabidopsis thaliana.
Примеры промоторов, способных функционировать в растениях или в клетках растений, т.е. таковых, способных стимулировать экспрессию связанных структурных генов, таких как протокса, в растительных клетках, включают промоторы 19S или 35S вируса мозаики цветной капусты (CaMV) и двойные промоторы CaMV; промоторы нопалин-синтазы; промоторы протеина, связанного с патогенезом (PR); промоторы малой субъединицы рибулозо-1,5-бифосфаткарбоксилазы (ssuRUBISCO) и т.п. Предпочтительными являются промотор актина риса (McElroy и др. , Mol. Gen. Genet. 231: 150 (1991)), промотор убикитина кукурузы (ЕР 0342926; Taylor и др. Plant Cell Rep. 12: 491 (1993)) и промотор Рr-1 из табака, Arabidopsis или кукурузы (см. международную заявку PCT/IB95/00002 на имя Ryals и др., полностью включенную в данное описание в качестве ссылки). Также предпочтительными являются промотор 35S и усиленный или двойной промотор 35S, такой, как описанный у Кау и др., Science 236: 1299-1302 (1987), и двойной промотор 35S, клонированный в pCGN2113, депонированный под номером АТСС 40587, которые описаны в европейской заявке ЕР-А 0392225, соответствующие данные из которой, относящиеся к настоящему изобретению, полностью включены в данное описание в качестве ссылки. Сами промоторы могут быть модифицированы в соответствии с известными в данной области техники методиками таким образом, чтобы манипулировать длиной промотора для повышения экспрессии протокса.
Сигнальные или транзитные пептиды могут быть слиты с последовательностью, кодирующей протокс, в химерных конструкциях ДНК по изобретению, чтобы направить транспорт экспрессируемого фермента протокса в требуемое место действия. Примеры сигнальных пептидов включают таковые, сцепленные в естественных условиях с протеинами, связанными с патогенезом, например PR-1, PR-2 и т.п. См., например, Рауnе и др., Plant Mol. Biol. 11: 89-94 (1988). Примеры транзитных пептидов включают транзитные пептиды хлоропласта, такие, как описанные у von Heijne и др.. Plant Mol. Biol. 9: 104-126 (1991); Mazur и др., Plant Physiol. 85: 1110 (1987); Vorst и др., Gene 65: 59 (1988), и транзитные пептиды митохондрий, такие, как описанные у Boutry и др., Nature 328: 340-342 (1987). Предполагают, что транзитные пептиды хлоропласта и митохондрий будут наиболее приемлемы для настоящего изобретения, так как ферментативная активность протокса обычно содержится в митохондриях и хлоропласте. Наиболее предпочтительными для применения являются транзитные пептиды хлоропласта, поскольку существует предположение, что ингибирование ферментативной активности протокса в хлоропластах является первичной основой действия ингибирующих протокс гербицидов (Witkowski и Hallihg, Plant Physiol. 87: 632 (1988); Lehnen и др., Pestic. Biochem. Physiol. 37: 239 (1990); Duke и др. , Weed Sci. 39: 465 (1991)). Сюда также включены последовательности, которые приводят к локализации кодируемого протеина в различных клеточных компартментах, таких как вакуоли. См. , например, у Neuhaus и др., Proc. Natl. Acad. Sci. USA 88: 10362-10366 (1991) и Chrispeels, Ann. Rev. Plant Physiol. Plant Mol. BioL 42: 21-53 (1991). Соответствующие данные из этих публикаций, относящиеся к настоящему изобретению, полностью включены в данное описание в качестве ссылки.
Химерная(ые) конструкция(и) ДНК по изобретению может(гут) содержать множественные копии промотора или множественные копии структурных генов протокса. Кроме того, конструкция(и) может(гут) включать кодирующие последовательности для маркеров и кодирующие последовательности для других пептидов, таких как сигнальные или транзитные пептиды, каждый в соответствующей рамке считывания с другими функциональными элементами в молекуле ДНК. Получение таких конструкций соответствует обычному уровню техники в данной области.
Пригодные маркеры включают пептиды, обусловливающие устойчивость к гербициду, антибиотику или лекарству, такие как обусловливающие, например, устойчивость к гигромицину, канамицину, G418, гентамицину, линкомицину, метотрексату, глифосфату, фосфинотрицину или т.п. Эти маркеры могут применяться для отделения клеток, трансформированных химерными конструкциями ДНК по изобретению, от нетрансформированных клеток. Другими пригодными маркерами являются пептидные ферменты, которые можно легко обнаружить с помощью реакции визуально, например с помощью цветной реакции, в их число входят луцифераза, β-глюкуронидаза или β-галактозидаза.
Измененную активность фермента протокса можно также получить путем генерирования или идентификации модифицированных форм выделенной эукариотической кодирующей протокс последовательности, имеющей по крайней мере одно аминокислотное замещение, дополнение или делецию, которые кодируют измененный фермент протокс, устойчивый к гербициду и ингибирующий неизмененную, встречающуюся в естественных условиях форму (т.е. формы, встречающиеся в естественных условиях в эукариоте, не подвергавшиеся манипуляциям со стороны человека либо непосредственно с помощью методологии рекомбинантной ДНК, либо косвенным путем с помощью избирательной селекции и т.д.). Гены, кодирующие такие ферменты, могут быть получены с помощью различных стратегий, известных в данной области техники. Первая общая стратегия включает технику прямого или непрямого мутагенеза микроорганизмов. Например, пригодный для генетических манипулиций микроорганизм, такой как Е. coli или S. cerevisiae, может быть подвергнут неспецифическому мутагенезу in vivo с помощью, например, УФ-излучения или этил- или метилметансульфоната. Методы мутагенеза описаны, например, у Miller, Experiments in Molecular Genetics, Cold Spring Harbor Laboratory, Cold Spring Harbor, NY (1972); Davis и др., Advanced Bacterial Genetics, Cold Spring Harbor Laboratory, Cold Spring Harbor, NY (1980); Sherman и др. . Methods in Yeast Genetics, Cold Spring Harbor Laboratory, Cold Spring Harbor, NY (1983), и в патенте США 4975374 (на имя Goodman и др. ). Микроорганизм, выбранный для мутагенеза, содержит эукариотический ген протокса с нормальной чувствительностью к гербицидам и зависит от активности протокса, обусловленной этим геном. Подвергнутые мутагенезу клетки выращивают в присутствии гербицида в концентрациях, которые ингибируют немодифицированный фермент протокс. Колонии подвергнутого мутагенезу микроорганизма, которые в присутствии ингибитора растут лучше, чем неподвергнутый мутагенезу микрорганизм (т.е. проявляющие устойчивость к ингибитору), отбирают для дальнейшего анализа. Гены протокса из этих колоний выделяют либо путем клонирования, либо с помощью амплификации с использованием полимеразно-цепьевой реакции и определяют их последовательности. Последовательности, кодирующие измененный фермент протокс, затем клонируют вновь в микроорганизме для подтверждения их способности обусловливать устойчивость к ингибитору.
Второй метод получения мутантных, несущих устойчивость к гербициду аллелей эукариотического фермента протокса, включает прямую селекцию в растениях. Например, воздействие ингибитора протокса, такого, как описан выше, на подавление роста растений, таких как Arabidopsis, соя или кукуруза, может быть выявлено путем помещения семян, стерилизованных с использованием известных в данной области техники методов, на чашки в простую минимальную солевую среду, содержащую возрастающие концентрации ингибитора. Такие концентрации составляют 0,001, 0,003, 0,01, 0,03, 0,1, 0,3, 1, 3, 10, 30, 110, 300, 1000 и 3000 частей на миллион (част./млн). Самую низкую дозу, при которой можно наблюдать воспроизводимое существенное ингибирование роста, применяют для последующих экспериментов.
Мутагенез растительного материала может быть использован для увеличения частоты, с которой устойчивые аллели
встречаются в выбранной популяции. Подвергнутый мутагенезу семенной материал может быть получен из различных источников, включая химический или физический мутагенез семян или химический или физический
мутагенез пыльцы (см. Neuffer, в Maize for Biological Research, Sheridan, изд. Univ. Press, Grand Forks, ND., стр. 61-64 (1982)), которую затем применяют для оплодотворения растений, после чего
собирают полученные мутантные семена М1. Обычно для Arabidopsis семена М2 (фирма Lehle Seeds, Tuscon, AZ), т. е. потомство семян растений, выращенных из семян, подвергнутых
мутагенезу с помощью химических соединений, таких как этилметансульфонат, или физических агентов, таких как гамма-излучение или быстрые нейтроны, высевают в чашки с плотностью до 10000 семян/чашку
(диаметром 10 см) на минимальную солевую среду, содержащую соответствующую концентрацию ингибитора для селекции на устойчивость. Проростки, которые продолжают расти и остаются зелеными в течение 7-20
дней после высевания, пересаживают в почву и выращивают до созревания и получения семян. Потомство этих семян тестируют на устойчивость к гербициду. Если признак устойчивости является доминантным,
растения, семена которых расщепляются в соотношении 3:1 (устойчивые : чувствительные), вероятно, являются гетерозиготными по гену устойчивости в поколении М2. Растения, все семена которых
обладают устойчивостью, вероятно, являются гомозиготными по гену устойчивости в поколении М2. Такой мутагенез интактных семян и скрининг семян их поколения М2 также может быть
осуществлен на других видах, например, на сое (см., например, патент США 5084082 (на имя Sebastian)). Мутантные семена, которые будут подвергнуты скринингу на
толерантность к гербициду, также
могут быть получены в результате оплодотворения пыльцой, подвергнутой мутагенезу химическим или физическим агентами.
Для подтверждения того, что генетической основой устойчивости является измененный ген протокса, могут быть использованы два подхода. Во-первых, аллели гена протокса из растений, проявивших устойчивость к ингибитору, могут быть выделены с помощью ПЦР с праймерами, основанными либо на консервативных областях в последовательностях кДНК протокса у Arabidopsis и кукурузы, приведенных ниже в SEQ ID NO: 1, 3, 5, 7, либо более предпочтительно на основе неизмененных последовательностей гена протокса из растения, использованного для получения устойчивых аллелей. После секвенирования аллелей для определения присутствия мутаций в кодирующей последовательности аллели могут быть тестированы на их способность обусловливать устойчивость к ингибитору в растениях, в которых были трансформированы предполагаемые, обусловливающие устойчивость аллели. Эти растения могут представлять собой либо растения р. Arabidopsis, либо любое другое растение, рост которого чувствителен к ингибиторам. Во-вторых, гены протокса могут быть картированы на основе известных полиморфизмов длин рестрикционных фрагментов (ПДРФ) (см., например, у Chang и др., Ргос. Natl. Аса. Sci. USA 85: 6856-6860 (1988); Nam и др., Plant Cell 1: 699-705 (1989)). Признак устойчивости может быть картирован независимо с использованием тех же маркеров. Если устойчивость является следствием мутации в гене протокса, признак устойчивости будет расположен на карте в положении, неотличимом от положения гена протокса.
Третий способ получения устойчивых к гербициду аллелей протокса представляет собой селекцию в культурах растительной клетки. Эксплантаты растительной ткани, например эмбрион, листовые диски и т.д., или активно растущий каллюс, или суспензию культур растения, представляющего интерес, выращивают на определенной среде с отсутствием гема в присутствии возрастающей концентрации ингибирующего гербицида или аналогов ингибитора, пригодных для применения в лабораторных условиях. В различных культурах получают различную интенсивность роста. В определенных культурах получают быстрорастущие варианты колоний, которые продолжают расти даже в присутствии концентраций ингибитора, вызывающих в норме подавление роста. Частота, с которой появляются такие быстрорастущие варианты, может быть увеличена путем обработки химическим или физическим мутагеном до воздействия на ткани или клетки гербицидом. Предполагаемые аллели гена протокса, придающие резистентность, выделяют и тестируют аналогично описанному в предшествующих абзацах. Аллели, которые идентифицированы как обусловливающие устойчивость к гербициду, затем могут быть сконструированы для оптимальной экспрессии и трансформированы в растении. В другом варианте растения могут быть регенерированы из тканевых или клеточных культур, содержащих эти аллели.
Четвертый способ включает мутагенез чувствительных к гербициду генов протокса дикого типа в бактериях или дрожжах с последующим культивированием микроорганизма в среде, лишенной гема, но содержащей ингибирующие концентрации ингибитора, и затем с отбором тех колоний, которые растут в присутствии ингибитора. Более конкретно кДНК растения, такую как кДНК, кодирующую протокс Arabidopsis или кукурузы, клонируют в микроорганизме, у которого первоначально отсутствует активность протокса. Примеры таких микроорганизмов включают ауксотрофных мутантов Е. coli, S. typhimurium и S. cerevisiae, в том числе штамм Е. coli SASX38 (Sasarman и др., J. Gen. Microbiol, 113: 297 (1979), штамм S. typhimurium TE2483 или ТТ13680 (Xu и др., J. Bacteriol, 174: 3953 (1992)) и мутант дрожжей heml4-l (Camadro и др., Biochem. Biophys. Res. Comm. , 106: 724 (1982)). Трансформированный микроорганизм затем подвергают мутагенезу in vivo, такому, как описанный непосредственно выше, или мутагенезу in vitro с помощью любого из нескольких химических или ферментативных методов, известных в данной области техники, например с помощью бисульфита натрия (Shotle и др., Methods Enzymol. 100: 457-468 (1983); метоксиламина (Kadonaga и др., Nucleic Acids Res., 13: 1733-1745 (1985); насыщенного сайт-направленного мутагенеза с использованием олигонуклеотидов (Hutchinson и др. , Proc. Natl. Acad. Sci USA, 83: 710-714 (1986); или с помощью различных стратегий, основанных на ошибке включения полимеразы (см., например, Shortle и др., Proc. Natl. Acad. Sci. USA, 79: 1588-1592 (1982); Shiraishi и др.. Gene, 64: 313-319 (1988); и у Leung и др., Technique, 1: 11-15 (1989)). Колонии, которые растут в присутствии концентраций ингибитора, подавляющих в нормальных условиях рост, отбирают и очищают путем повторных посевов штрихом. Их плазмиды очищают и тестируют на способность придавать устойчивость к ингибитору путем ретрансформации их в лишенном протокса микроорганизме. Затем определяют последовательности ДНК протокса кДНК-вставок из плазмид, прошедших этот тест.
Когда аллель устойчивого к гербициду протокса идентифицирован, он может быть сконструирован с помощью методов геннной инженерии для оптимальной экспрессии в культурном растении. Эта методика может включать изменение кодирующей последовательности устойчивого аллеля для оптимальной экспрессии в представляющем интерес виде культурного растения. Способы модификации кодирующих последовательностей для достижения оптимальной экспрессии в конкретных видах культурных растений хорошо известны (см., например, у Perlak и др., Proc. Natl. Acad. Sci. USA, 88: 3324 (1991); Koziel и др., Bio/Technol. 11: 194 (1993)). Генетическое конструирование аллеля протокса для оптимальной экспрессии может также включать сцепление действенным образом соответствующих регуляторных последовательностей (т.е. промотора, сигнальной последовательности, терминатора транскрипции). Предпочтительными промоторами будут те, которые обусловливают высокий уровень конститутивной экспрессии, или более предпочтительно те, которые обусловливают специфический высокий уровень экспрессии в тканях, чувствительных к повреждению гербицидом.
Рекомбинантные молекулы ДНК могут быть интродуцированы в растительную клетку многочисленными известными в данной области техники путями. Для специалиста в данной области техники очевидно, что выбор метода может зависеть от типа растения, предназначенного для трансформации, т.е. однольного или двудольного. Пригодные методы трансформации растительных клеток включают микроинъекцию (Crossway и др., BioTechniques 4: 320-334 (1986)), электропорацию (Riggs и др., Proc. Natl. Acad. Sci. USA, 83: 5602-5606 (1986); трансформацию, медиируемую Agrobacterium (Hinchee и др., Biotechnology 6: 915-921 (1988), прямой перенос гена (Paszkowski и др., ЕМВО J. 3: 2717-2722 (1984)) и баллистическую бомбардировку частицами с использованием приспособлений, поставляемых фирмами Agracetus, Inc. , Madison, Wisconsin и Dupont, Inc. Wilmington, Delaware (см., например, у Sanford и др., патент США 4945050, и МсСаbе и др., Biotechnology 6: 923-926 (1988)). См. также у Weissinger и др. , Annual Rev. Genet. 22: 421-477 (1988); Sanford и др., Particulate Science and Technology 5: 27-37 (1987) (лук); Christou и др., Plant Physiol. 87: 671-674 (1988) (соя); МсСаЬе и др., Bio/Technology 6: 923-926 (1988) (соя); Datta и др. , Bio/Technology 8: 736-740 (1990) (рис); Klein и др., Ргос. Natl. Acad. Sci. USA, 85: 4305-4309 (1988) (кукуруза); Klein и др., Bio/Technology 6: 559-563 (1988) (кукуруза); Klein и др., Plant Physiol. 91: 440-444 (1988) (кукуруза); Fromm и др., Bio/Technology 8: 833-839 (1990), и Gordon-Kamm и др., Plant Cell 2: 603-618 (1990) (кукуруза).
Под объем настоящего изобретения также подпадают трансгенные растения, в частности трансгенные фертильные растения, трансформированные с помощью вышеуказанных способов, и их бесполое и/или половое потомство, которое сохраняет устойчивость или по крайней мере толерантность к ингибированию гербицидом в концентрациях, которые в норме ингибируют встречающуюся в естественных условиях активность протокса в растении. Наиболее предпочтительными являются гибридные растения, которые устойчивы или по крайней мере толерантны к ингибированию гербицидом в концентрациях, которые в норме ингибируют встречающуюся в естественных условиях активность протокса в растении.
Трансгенное растение по изобретению может быть двудольным или однодольным растением. Предпочтительны однодольные растения семейства злаковых (Graminaceae), включающие растения p.p. Lolium, Zea, Triticum, Triticale, Sorghum, Saccharum, Bromus, Oryzae, Avena, Hordeum, Secale и Setaria.
Наиболее предпочтительными являются трансгенные кукуруза, пшеница, ячмень, сорго, рожь, овес, дернообразующие травы и рис.
Среди двудольных растений наиболее предпочтительными в контексте настоящего изобретения являются соя, хлопчатник, табак, сахарная свекла, масличный рапс и подсолнечник.
Термин "потомство" включает потомство трансгенных растений, полученное как "бесполым", так и "половым" путем. Под это понятие также подпадают все мутанты и сорта, получаемые с помощью известных способов, таких как, например, слияние клеток или селекция мутантов, и которые еще проявляют характерные свойства исходного трансформированного растения наряду со всеми продуктами скрещивания и слияния трансформированного растительного материала.
Еще один предмет изобретения относится к пролиферационному материалу трансгенных растений.
Под пролиферационным материалом трансгенных растений в контексте настоящего изобретения понимают любой растительный материал, который может быть размножен половым или бесполым путем in vivo или in vitro. Наиболее предпочтительными согласно настоящему изобретению являются протопласты, клетки, каллюсы, ткани, органы, семена, эмбрионы, пыльца, яйцеклетки и зиготы наряду с любым другим материалом для размножения, полученным из трансгенных растений.
Части растений, такие как, например, цветки, стебли, плоды, листья, корни, развившиеся у трансгенных растений или у их потомства, ранее трансформированных с помощью способа по изобретению и, следовательно, состоящие по крайней мере частично из трансгенных клеток, также являются предметом настоящего изобретения.
До поступления в продажу материала для размножения растений (плоды, клубни, зерна, семенной материал), прежде всего семенного материала, в качестве коммерческого продукта его обычно обрабатывают защитным покрытием, содержащим гербициды, инсектициды, фунгициды, бактерициды, нематоциды, моллюскициды или смеси нескольких этих препаратов, при необходимости вместе с дополнительными носителями, поверхностно-активными веществами или способствующими нанесению адьювантами, обычно применяемыми в технике получения препаративных форм для обеспечения защиты от повреждения, вызванного бактериями, грибами или насекомыми-вредителями.
Для обработки семенного материала защитное покрытие может быть нанесено на семенной материал либо путем пропитки клубней или зерен жидким составом, либо покрытием их сложной влажной или сухой композицией. Кроме того, в особых случаях возможно использование других способов обработки растений, например путем направленной обработки почек или плода.
Семенной материал растения по изобретению, содержащий последовательность ДНК, кодирующую протеин из эукариота, обладающего активностью протопорфириноген-оксидазы (протокc) по изобретению, может быть обработан защищающим семенной материал покрытием, содержащим соединение для обработки семенного материала, такое как, например, каптан, карбоксин, тирам (TMTD®), металаксил (Apron®) и пиримифос-метил (Actellic®), а также другие соединения, которые обычно применяют для обработки семенного материала.
Таким образом, еще один предмет настоящего изобретения относится к материалу для размножения растений, предназначенному для культивируемых растений, и прежде всего к семенному материалу растения, которое обрабатывают защищающим семенной материал покрытием, обычно применяемым для обработки семенного материала.
Если устойчивый к гербициду аллель протокса получают путем прямой селекции в культурном растении или в культуре растительной клетки, из которой может быть регенерировано культурное растение, он может быть перенесен в коммерческие сорта с использованием традиционных способов селекции для получения толерантной к гербициду культуры без необходимости генетического конструирования аллеля и его трансформации в растении. В другом варианте аллель устойчивости к гербициду может быть выделен, подвергнут генетическому конструированию для оптимальной экспрессии и затем трансформирован в требуемом сорте.
Гены, кодирующие измененный протокс, устойчивый к ингибитору протокса, также могут применяться в качестве селектируемых маркеров в способах трансформации растительной клетки. Например, растение, растительная ткань или растительные клетки, трансформированные трансгеном, могут также быть трансформированы геном, кодирующим измененный протокс, способный быть экспрессированным растением. Трансформированные таким образом клетки переносят в содержащую ингибитор протокса среду, в которой будут выживать только трансформированные клетки. Ингибиторы протокса, которые, вероятно, должны быть наиболее приемлемы в качестве селектирующих агентов, представляют собой дифениловые эфиры {например, ацифлуорфен, 5-[2-хлор-4-(трифторметил)фенокси] -2-нитробензойная кислота; ее метиловый эфир; или оксифлуорфен, 2-хлор-1-(3-этокси-4-нитрофенокси)-4-(трифторбензол)} , оксидиазолы (например, оксидиазон, 3-[2,4-дихлор-5-(1-метилэтокси)фенил] -5-(1, 1-диметилэтил)-1,3,4-оксадиазол-2-(3Н)-он), циклические имиды (например, S-23142, N-(4-хлор-2-фтор-5-пропаргилоксифенил)-3,4,5,6-тетрагидрофталимид; хлорфталим, N-(4-хлорфенил)-3,4,5, 6-тетрагидрофталимид), фенилпиразолы (например, ТНПП-этил, этил-2[1-(2,3,4-трихлорфенил)-4-нитропиразолил-5-окси]пропионат; М&В 39279), производные пиридина (например, LS 82-556) и фенопилат и его O-фенилпирролидино- и пиперидинкарбаматные аналоги. Способ применим к любой растительной клетке, способной быть трансформированной измененным геном, кодирующим протокс, и может быть применен для любого представляющего интерес трансгена. Экспрессия трансгена и гена протокса может стимулироваться одним и тем же промотором, функционирующим в растительных клетках, или различными промоторами.
Ниже изобретение более подробно поясняется на примерах. Эти примеры приведены только для иллюстрации и не ограничивают объем изобретения, если не указано иное.
Депонирование
Следующие молекулы векторов для целей процедуры патентования были депонированы в коллекции культур Службы сельскохозяйственных исследований (NRRL), Северный региональный
исследовательский центр (Nothern Regional Research Center, 1815 North University Street, Peoria, Illinois 61604, USA) в указанное ниже время.
Protox-1, в векторе pBluescript SK, был депонирован 5 апреля 1994 г. под обозначением pWDC-2 (NRRL В-21238).
Protox-2, в векторе pFL61, был депонирован 5 апреля 1994 г. под обозначением pWDC-1 (NRRL В-21237).
MzProtox-1, в векторе pBluescript SK, был депонирован 20 мая 1994 г. под обозначением pWDC-4 (NRRL В-21260) и представлен в последовательности SEQ ID NO: 5.
MzProtox-1, в векторе pBluescript SK, был повтороно депонирован 11 июля 1994 г. под обозначением pWDC-4 (NRRL В-21260N) и представлен в последовательности SEQ ID NO: 5.
MzProtox-2, в векторе pBluescript SK, был депонирован 20 мая 1994 г. под обозначением pWDC-3 (NRRL В-21259) и представлен в последовательности SEQ ID NO: 7.
Protox-3, в векторе pFL61, был депонирован 10 июня 1994 г. под обозначением pWDC-5 (NRRL В-21280).
pMzC-1VaI, в векторе pBluescript SK, был депонирован 30 сентября 1994 г. под обозначением pWDC-8 и получил каталожный номер NRRL 21340.
pAraC-2Cys, в векторе pFL61, был депонирован 14 ноября 1994 г. под обозначением pWDC-7 и получил каталожный номер NRRL 21339N.
Примеры
Стандартные рекомбинантные ДНК
и способы молекулярного клонирования, применяемые в настоящем исследовании, хорошо известны в данной области техники и описаны у Т. Maniatis, E.F. Fritsch и J. Sambrook в Molecular Cloning: A
Laboratory manual, Cold Spring Harbor Laboratory, Cold Spring Harbor, NY (1982), и у TJ. Silhavy, M.L. Berman и L.W. Enquist, Experiments with Gene Fusions, Cold Spring Harbor Laboratory, Cold Spring
Harbor, NY (1984).
Пример 1: Выделение кДНК Arabidopsis, кодирующих гены протокса путем функциональной комплементации мутанта Е. coli.
Получали и амплифицировали библиотеку кДНК Arabidopsis thaliana (фирма Landsberg) в плазмидном векторе pFL61 (Minet и др., Plant J. 2: 417-422 (1992)). Приобретали вторую библиотеку кДНК Arabidopsis (фирма Columbia) в векторе лямбда UniZap (фирма Stratagene) и амплифицировали в качестве плазмид pBluescript путем массового исключения in vivo исходного фага. Получали мутант hemG штамма Е. coli SASX38 (Sasarman и др., J. Gen. Microbiol. 113: 297 (1979)) и поддерживали на L-среде, содержащей 20 мг/мл гематина (фирма United States Biochemicals). Плазмидные библиотеки трансформировали в SASX38 путем электропорации с использованием прибора Bio-Rad Gene Pulser в условиях, рекомендованных производителем. Клетки высевали на L-arap, содержащий 100 мг/мл ампициллина, с плотностью приблизительно 500000 трансформантов/чашку диаметром 10 см. Клетки инкубировали при 37oС в течение 40 часов при слабой освещенности и отбирали на основе способности расти без добавления экзогенного гема. Гем-прототрофов выделяли из библиотеки pFL61 с частотой 400/107 и из библиотеки pBluescript с частотой 2/107. ДНК плазмиды выделяли из 24 колоний для анализа последовательности. Каждую из 24 колоний повторно трансформировали в SASX38 для проверки способности к комплементации.
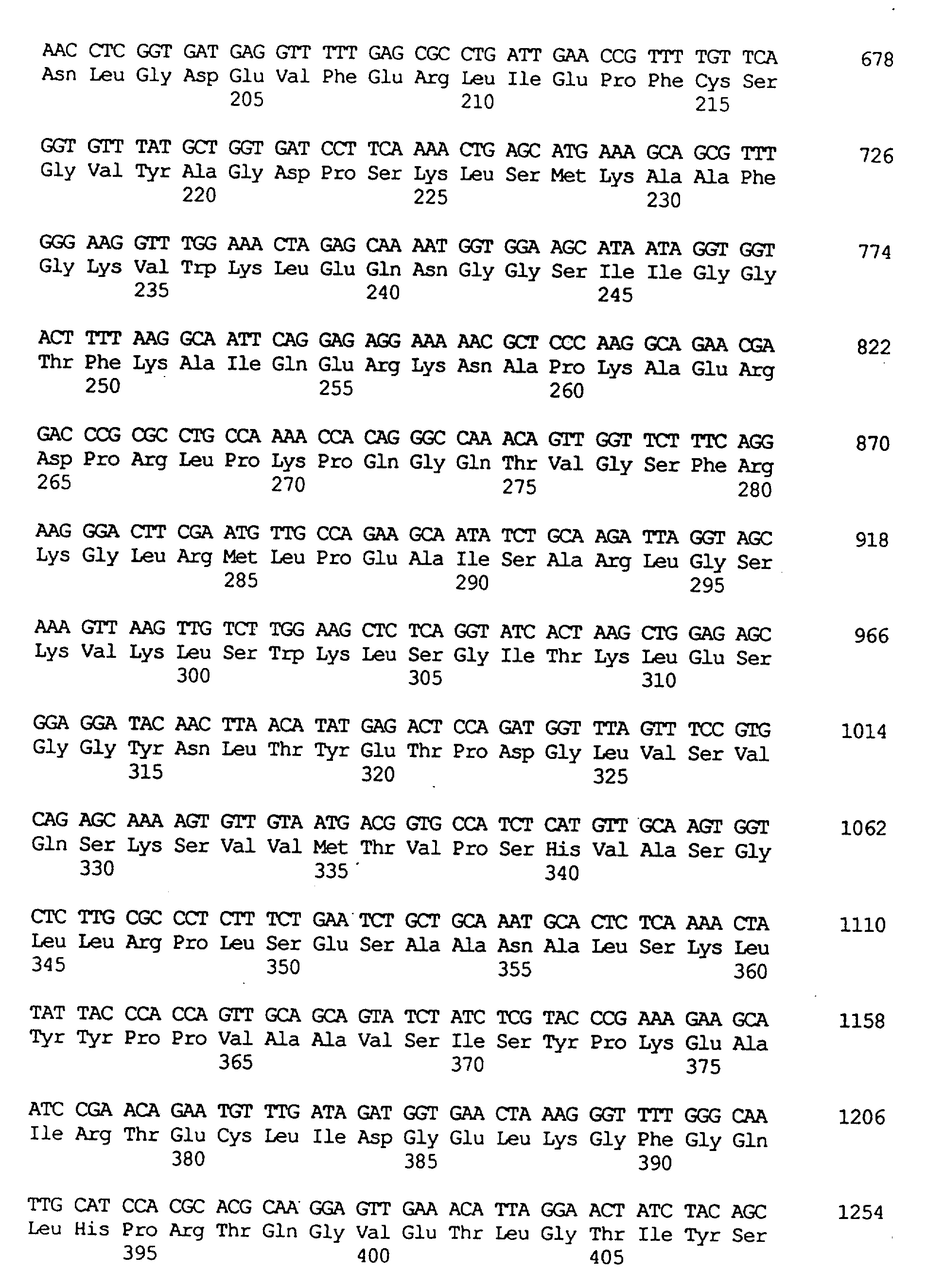
Анализ последовательности выявил наличие двух классов предполагаемых клонов протокса. Девять из них относились к типу, обозначенному "Protox-1". Каждый имел происхождение из одного и того же гена, а два представляли собой полноразмерные клоны. кДНК имеет длину 1719 пар оснований и кодирует протеин с молекулярной массой 57,7 кДа. N-концевая пептидная последовательность имеет признаки, характерные для транзитного пептида хлоропласта, состоящего из приблизительно 60 аминокислот. Исследование базы данных с помощью программы GAP (Deveraux и др., Nucleic Acids Res. 12: 387-395 (1984) выявило гомологию с протеином hemY (протокс) В. subtilis (Hansson и Hederstedt, 1992, Dailey и др., J. Biol. Chem. 269: 813 (1994)). Два протеина были подобны на 53% и идентичны на 31% с областями высокой гомологии, включая предполагаемый домен связывания динуклеотида протеина hemY (Dailey и др., J. Biol. Chem. 269: 813 (1994)).
Другие 15 клонов кДНК относились к типу, обозначенному "Protox-2". По-видимому, они также происходят от одного гена. Вероятно, полноразмерная кДНК имеет длину 1738 пар оснований и кодирует протеин с молекулярной массой 55,6 кДа. Конец, содержащий аминогруппу, в определенной мере характерен для митохондриального транзитного пептида. Протеин Protox-2 имеет ограниченную гомологию с Protox-1 (подобие на 53%, идентичность на 28%) и с протоксом В. subtilis (подобие на 50%, идентичность на 27%).
Protox-1, в векторе pBluescript SK, был депонирован 5 апреля 1994 г. под обозначением pWDC-2 (NRRL В-21238).
Protox-2, в векторе pFL61, был депонирован 5 апреля 1994 г. под обозначением pWDC-1 (NRRL В-21237).
кДНК Arabidopsis, кодирующие Protox-1, содержащийся в pWDC-2, и Protox-2, содержащийся в pWDC-1, приведены ниже в последовательностях SEQ ID NO: 1 и 3 соответственно.
Пример 2: Выделение кДНК кукурузы, кодирующих гены протокса, путем функциональной комплементации мутанта Е. coli.
У фирмы Stratagene приобретали библиотеку кДНК кукурузы Zea mays (имбредная линия В73) в векторе лямбда UniZap и превращали в библиотеку pBluescript путем массового исключения in vivo. Вторую библиотеку кДНК, сделанную по заказу в векторе UniZap, приобретали у фирмы Clontech и аналогичным образом превращали в плазмиды pBluescript. Выбор функциональных генов протокса из кукурузы осуществляли аналогично описанному выше в примере 1 для библиотек Arabidopsis.
Из библиотеки фирмы Stratagene выделяли два гем-прототрофа в 107 трансформантах, обладающих способностью к рекомплементации, и секвенировали. Эти кДНК были идентичными и оказались гомологичными Protox-1 Arabidopsis. Этот клон кукурузы, обозначенный как MzProtox-1, является неполным. кДНК имеет длину 1698 пар оснований и кодирует только предполагаемый зрелый фермент протокс; в ней нет последовательности транзитного пептида и нет кодона инициации метионина. Ген идентичен на 68% гену Protox-1 Arabidopsis на нуклеотидном уровне и идентичен на 78% (подобие на 87%) на аминокислотном уровне (см. таблицу 1).
Из библиотеки фирмы Clontech выделяли один гем-прототроф в 107 трансформантах, обладающий способностью к рекомплементации, и секвенировали. кДНК, по-видимому, является полной, имеет длину 2061 пар оснований и кодирует протеин с молекулярной массой 59 кДа. Этот клон является характерным для кукурузы гомологом Protox-2 Arabidopsis, и его обозначили как MzProtox-2. Ген идентичен на 58% гену Protox-2 Arabidopsis на нуклеотидном уровне и идентичен на 58% (подобие на 76%) на аминокислотном уровне (см. таблицу 2). Клон из кукурузы имеет N-концевую последовательность, которая на 30 аминокислот длиннее, чем таковая в клоне Arabidopsis. Так же, как и для клонов Arabidopsis, гомология между двумя генами протокса кукурузы довольно низка, идентичность между последовательностями двух протеинов составляет только 31%.
MzProtox-1, в векторе pBluescript SK, депонированный 20 мая 1994 г. под обозначением pWDC-4 (NRRL В-21260), представлен в последовательности SEQ ID NO: 5.
MzProtox-1, в векторе pBluescript SK, повторно депонированный 11 июля 1994 г. под обозначением pWDC-4 (NRRL В-21260N, представлен в последовательности SEQ ID NO: 5.
MzProtox-2, в векторе pBluescript SK, депонирован 20 мая 1994 г. под обозначением pWDC-3 (NRRL В-21259), представлен в последовательности SEQ ID NO: 7.
Пример 3: Выделение дополнительных генов протокса на основе гомологии последовательности с известными последовательностями, кодирующими протокc.
Библиотеку фага или плазмиды высевают с плотностью приблизительно 10000 бляшек на чашки Петри диаметром 10 см и после выращивания растений в течение ночи при 37oС осуществляют съем бляшек при помощи фильтра. Съемы бляшек зондируют с помощью одной из кДНК, представленных в SEQ ID NO: 1, 3, 5 или 7, меченной по32Р-дЦТФ методом рассеянной затравки с использованием набора PrimeTime (фирма International Biotechnologies, Inc. New Haven, CT). Применяют следующие условия гибридизации: 7%-ный додецилсульфат натрия (ДСН), 0,5 М NaPO4 с рН 7,0, 1 мМ ЭДТК при 50oС. После гибридизации в течение ночи фильтры промывают 2xSSC, 1%-ным ДСН. С помощью авторадиографии выявляют положительно гибридизирующиеся бляшки. После очистки до получения отдельных бляшек выделяют вставки кДНК и их последовательность определяют с помощью метода терминации цепи с использованием дидезокси-терминаторов, меченных флуоресцентными красителями (Applied Biosystems, Inc., Foster City, CA).
Стандартный протокол эксперимента, описанный выше, может быть использован специалистом в данной области техники для получения генов протокса с последовательностями, гомологичными известным последовательностям, кодирующим протокс, из любого другого эукариота, в частности из других видов высших растений.
Упорядоченное расположение предсказанных аминокислотных последовательностей соответствующих протеинов, кодируемых последовательностями, представленными в SEQ ID NO: 2 и 6, приведено в таблице 1. Упорядоченное расположение предсказанных аминокислотных последовательностей соответствующих протеинов, кодируемых последовательностями, представленными в SEQ ID NO: 4 и 8, приведено в таблице 2.
Идентичные остатки обозначены с помощью вертикальных черточек между двумя последовательностями. Упорядочивание осуществляют с помощью программы GAP, описанной у Deveraux и др., Nucleic Acids Res. 12: 387-395 (1984).
Пример 4: Выделение загрязненного дрожжами клона Protox из библиотеки кДНК Arabidopsis.
Для идентификации любых редких кДНК, обладающих активностью протокса, осуществляли второй скрининг библиотеки Arabidopsis в векторе pFL61 таким же образом, как это описано выше, получая вновь сотни комплементирующих клонов. Приблизительно 600 из них помещали индивидуально на сетчатые пластинки и инкубировали при 28oС в течение 18 часов. Осуществляли двукратные сьемы с фильтра на мембраны для скрининга колоний/бляшек (фирма NEN) в соответствии с инструкциями производителя. кДНК Protox-1 и Protox-2 удаляли из их векторов путем разложения с помощью EcoRI/XhoI и NotI соответственно. Вставки разделяли с помощью гель-электрофореза в 1,0%-ной легкоплавкой агарозе SeaPlaque GTG (фирма FMC), вырезали и метили по32P путем рассеянной затравки (Life Technologies). Один набор съемов гибридизировали с каждым зондом. Условия гибридизации и промывки соответствовали таковым, описанным у Church и Gilbert, 1984.
Колонии (~ 20), которые не проявили выраженную гибридизацию с Protox-1 или с Protox-2, амплифицировали в жидкой культуре и получали ДНК плазмиды. ДНК разлагали с помощью NotI, два экземпляра образцов разгоняли на 1%-ном агарозном геле и подвергали саузерн-блоттингу на фильтре типа Gene Screen Plus [фирма NEN (New England Nuclear)]. Зонды двух известных генов Protox метили и гибридизировали по описанной выше методике. Было обнаружено два идентичных клона, которые не представляли собой ни Protox-1, ни Protox-2. Было установлено, что такой клон рекомплементирует мутант SASX38, хотя он растет очень медленно, и он был обозначен как Protox-3.
Protox-3 в векторе pFL61 был депонирован 10 июня 1994 г. под обозначением pWDC-5 (NRRL В-21280). Было установлено, что эта кодирующая последовательность должна иметь происхождение из ДНК дрожжей, которые присутствуют в качестве побочного загрязнителя в библиотеке кДНК Arabidopsis. ДНК дрожжей, кодирующая Protox-3, входящая в pWDC-5, представлена ниже в виде SEQ ID NO: 9.
Пример 5: Демонстрация чувствительности клона протокса растения к ингибирующим протокс гербицидам в бактериальной системе.
Жидкие культуры Protox-l/SASX38, Protox-2/SASX38 и pBluescript/XLl-Blue выращивали в среде L amp100. Аликвоты объемом сто микролитров каждой культуры высевали в среду L amp100, содержащую различные концентрации (1,0 нМ-10 мМ) ингибитора протокса, а именно гербицида из класса арилурацила формулы XVII. Двойные наборы чашек инкубировали в течение 18 часов при 37oС либо при слабом освещении, либо в полной темноте.
Штамм Е. coli протокс+XL1-Blue не проявил чувствительности к гербициду при любой изученной концентрации, что согласуется с опубликованными данными об устойчивости нативного бактериального фермента к аналогичным гербицидам. Protox-l/SASX38 проявил выраженную чувствительность к гербициду, причем "газон" бактерии почти полностью уничтожался концентрациями ингибитора ниже 10 нМ. Protox-2/SASX38 также оказался чувствительным, но только к более высокой концентрации (10 мМ) гербицида. Воздействие гербицида на оба штамма протокса из растений было более сильным при слабой освещенности, но также проявлялось на чашках, содержавшихся в полной темноте. Токсичность гербицида полностью элиминировалась при добавлении в чашки 20 мг/мл гематина.
Различная толерантность к гербициду между двумя штаммами протокса из растений, вероятно, является скорее результатом различной экспрессии из этих двух плазмид, чем любым присущим ему различием в чувствительности фермента. Protox-l/SASX38 растет существенно медленнее, чем Protox-2/SASX38 в любой среде с дефицитом гема. Кроме того, штамм MzProtox-2/SASX38, сравнимый по скорости роста с Protox-l/SASX38 Arabidopsis, также является очень чувствительным к более низким концентрациям гербицида (10-100 нМ). Первичная характеризация клона Protox-3 дрожжей показала, что он также чувствителен к гербициду.
Пример 6: Селекция на устойчивость генов протокса растений к гербицидам-ингибиторам протокса в системе экспрессии Е. coli.
Ингибирование ферментов протоксов растений в бактериальной системе пригодно для крупномасштабного скрининга мутаций, обусловливающих устойчивость к гербициду в генах растений. Первичные эксперименты по выявлению зависимости доза - реакция, сделанные путем высевания жидких культур, дали появление высокой частоты "устойчивых" колоний даже к высоким концентрациям гербицида. Эта устойчивость не была обусловлена плазмидой, как показал анализ ретрансформации/чувствительности к гербициду. Плазмиды, трансформирующие протокс в мутанте SASX38 и высеянные непосредственно на чашки, содержащие гербицид, почти полностью устраняли эту фоновую проблему.
Плазмиды с протоксом растительного происхождения мутируют различными способами, используя опубликованные методы химического мутагенеза [например, с помощью бисульфита натрия (Shortle и др., Methods Enzymol. 100: 457-468 (1983)); метоксиламина (Kadonaga и др., Nucleic Acids Res. 13: 1733-1745 (1985)); насыщенного сайт-специфического мутагенеза (Hutchinson и др., Proc. Natl. Acad. Sci. USA, 83: 710-714 (1986)); или различных стратегий, основанных на ошибке включения полимеразы (см., например, у Shortle и др., Proc. Natl. Acad. Sci. USA, 79: 1588-1592 (1982); Shiraishi и др., Gene 64: 313-319 (1988), и у Leung и др., Technique 1: 11-15 (1989))]. Ожидаемые позитивные мутанты промотора вследствие мутагенеза всей плазмиды исключают путем повторного клонирования кодирующей последовательности в векторе дикого типа и повторного тестирования. Если предполагается, что более высокая экспрессия приведет к лучшему росту в отсутствие гербицида, то возможен также визуальный скрининг кодирующей последовательности мутантов.
Любые гены протокса растений, экспрессирующие устойчивость к гербициду в бактериальной системе, могут быть сконструированы для оптимальной экспрессии и трансформированы в растениях с применением стандартных методов, приведенных в данном описании. Затем полученные растения могут быть обработаны гербицидом для подтверждения и количественной оценки уровня устойчивости, обусловливаемого введенным геном протокса.
Пример 7: Конструкции для экспрессии в растениях устойчивого(вых) к гербициду гена(ов) протокса микроорганизма.
Кодирующие последовательности для гена протокса В. subtilis hemY (Hansson и Hederstedt, J. Bacteriol. 174: 8081 (1992); Dailey и др., J. Biol. Chem., 269: 813 (1994)) и для гена протокса Е. coli hemG (Sasarman и др. , Can. J. Microbiol. 39: 1155 (1993)) выделяли из лабораторных штаммов путем ПЦР-амплификации с применением стандартных условий и фланкирующих праймеров, сконструированных из опубликованных последовательностей. Известно, что эти гены кодируют устойчивые к гербициду формы фермента протокса.
Применяя стандартные методики перекрывающего ПЦР-слияния (Ausubel и др., Current Protocols in Molecular Biology, John Wiley & Sons, Inc. (1994)), оба бактериальных гена сливали с двумя различными последовательностями транзитного пептида хлоропласта Arabidopsis (CTP). Первый представлял собой СТР из синтазы ацетоксикислоты (AHAS, Mazur и др., Plant Physiol. 85: 1110 (1987)), который должен обеспечивать импорт в строму хлоропласта. Второй имел происхождение из гена пластоцианина Arabidopsis (Vorst и др.. Gene 65: 59 (1988)), который имеет состоящий из двух частей транзитный пептид. Аминоконцевая часть этого СТР ориентирует протеин в хлоропласт, где конец с карбоксильной группой направляет его в мембраны тилакоида. Все четыре гибридных гена клонировали за промотором 2X35S в бинарном векторе экспрессии, сконструированном для получения трансгенных растений путем трансформации агробактерии.
После выделения кДНК протокса Arabidopsis и кукурузы транзитный пептид хлоропласта из Protox-1 или MzProtox-1 также может быть слит с двумя бактериальными протеинами протокса способом, описанным выше.
Векторы, описанные выше, могут быть затем трансформированы в требуемых видах растений, а полученные трансформанты могут быть проанализированы в отношении увеличенной устойчивости к гербициду.
Пример 8: Смена домена генов Arabidopsis/B. subtilis для получения химерного, устойчивого к гербициду протокса.
Одним из способов, который может быть использован для получения гена протокса, как обладающего устойчивостью к гербициду, так и способного обеспечивать эффективную ферментативную активность протокса в растении, является слияние части(ей) бактериального и растительного генов протокса. Полученные химерные гены могут быть затем подвергнуты скринингу для выделения тех, которые способны обеспечить активность устойчивого к гербициду протокса в клетке растения. Например, последовательности пептида протокса Arabidopsis и В. subtilis (hemY) в достаточной степени колинеарны с областями высокой гомологии. Кодирующую последовательность hemY клонируют в pBluescript и тестируют на ее способность экспрессировать активность устойчивого к гербициду протокса в SASX38. Химерные гены Protox-1/hemY конструируют с применением методики слияния на основе ПЦР с последующим обратным лигированием в вектор pBluescript. Исходный обмен осуществляют приблизительно в середине протеинов. Эти гибриды тестируют на функционирование протокса путем комплементации и затем анализируют в отношении устойчивости к гербициду путем высевания в среду с гербицидом, применяя интактные Protox-1 и hemY в качестве контроля.
Пример 9: Получение толерантных к гербициду растений с помощью сверхэкспрессии генов протокса растения.
Для экспрессии протеина Arabidopsis или кукурузы в трансгенных растениях соответствующую полноразмерную кДНК встраивали в вектор экспресии pCGN1761ENX, имеющий происхождение из pCGN1761, следующим образом. pCGN1761 разлагали в его уникальном сайте EcoRI и лигировали с фрагментом двухцепочечной ДНК, включающим два олигонуклеотида, имеющих последовательности 5'-ААТ TAT GAC GTA ACG TAG GAA TTA GCG GCC CGC TCT CGA GT-3' (SEQ ID NO: 11) и 5'-AAT TAC TCG AGA GCG GCC GCG AAT TCC TAC GTT ACG TCA T-3' (SEQ ID NO: 11). Полученная плазмида pCGN1761ENX содержала уникльные сайты EcoRI, NotI и Xhol, расположенные между дублированным промотором 35S из вируса мозаики цветной капусты (Кау и др., Science 236: 1299-1302 (1987) и 3'-нетранслируемыми последовательностями гена tml Agrobacterium tumefaciens. Эту плазмиду разлагают и лигируют с фрагментом, образованным в результате разложения рестриктазой одной из плазмид, несущей кДНК протокса, так, чтобы она несла полную кДНК протокса. Из этой плазмиды вырезают фрагмент XbaI, содержащий кДНК протокса Arabidopsis, фланкируемую дублированным промотором 35S и 3'-нетранслируемыми последовательностями гена tml А. tumefaciens. Этот фрагмент XbaI встраивают в бинарный вектор рСIВ200 в его уникальном сайте XbaI, расположенном между пограничными последовательностями Т-ДНК. Полученную плазмиду, обозначенную как pCIB200protox, трансформируют в штамм A. tumefaciens CIB542. См., например, у Ukness и др., Plant Cell, 5: 159-169 (1993).
Листовые диски Nicotiana tabacum cv. Xanthi-nc заражают штаммом А. tumefaciens CIB542, несущим pCIB200IGPD, как описано у Hoersch и др., Science, 227: 1229 (1985). Устойчивые к канамицину проростки из 15 независимых листовых дисков переносят в среду для выращивания, затем пересаживают в почву и полученные растения выращивают в теплице до созревания. Семена от этих растений собирают и проращивают в агаровой среде MS, содержащей канамицин. Большое количество проростков, устойчивых к канамицину от каждого независимого первичного трансформанта выращивают в теплице до созревания и затем собирают их семена. Эти семена проращивают в агаровой среде MS, содержащей канамицин.
Линии растения, дающие проростки, обладающие исключительной устойчивостью к канамицину, являются гомозиготными по встроенному гену и их подвергают дальнейшему исследованию. Листовые диски каждой из 15 независимых трансгенных линий вырезают с помощью бумажного пуансона и помещают на агаровую среду MS, содержащую различные увеличивающиеся концентрации гербицида, ингибирующего протокс.
Через три недели два набора из 10 дисков от каждой линии взвешивали и регистрировали результаты. Трансгенные линии, более устойчивые к действию ингибитора, чем нетрансформированные растения дикого типа, отбирают для дальнейшего анализа.
Из листьев каждой из этих линий экстрагируют РНК. Общую ДНК из каждой независимой гомозиготной линии и из нетрансгенных контрольных растений разделяют с помощью электрофореза на агарозном геле в присутствии формальдегида (Ausubel и др. , Current Protocols in Molecular Biology, Wiley & Sons, New York (1987)). Гель наносят на найлоновую мембрану (Ausubel и др., выше) и гибридизируют с радиоактивно меченной кДНК протокса Arabidopsis. Условия гибридизации и смыва являются теми же, которые описаны у Church и Gilbert, Proc. Natl. Acad. Sci. USA, 81: 1991-1995 (1984). Остаток на фильтре подвергают авторадиографии и определяют интенсивные полосы РНК, соответствующие трансгену протокса, во всех толерантных к гербициду линиях трансгенных растений.
Для дальнейшей оценки устойчивости линий со сверхэкспрессией протокса растения выращивают в теплице и обрабатывают различными концентрациями ингибирующего протокс гербицида.
Пример 10: Выращивание суспензионных культур клеток табака.
Среда
МХ1: Эта среда состоит из среды Murashiga и Skoog ("MS", T. Murashiga и др. , Physiol. Plant. 15: 473-497, 1962), содержащей основные соли, побочные соли и
Fe-ЭДТК (фирма Gibco 500-1117; 4,3 г/л), 100 мг/л миоинозитола, 1 мг/л никотиновой кислоты, 1 мг/л пиридоксина-HCl, 10 мг/л тиамина-HCl, 2-3 г/л сахарозы, 0,4 мг/л 2,4-дихлорфеноксиуксусной кислоты и
0,04 мг/л кинетина, рН 5,8. Среду стерилизуют путем автоклавирования.
N6: Эта среда включает макроэлементы, микроэлементы и Fe-ЭДТК, как описано у С-С. Chu и др., Scientia Sinica, 18: 659 (1975), и следующие органические соединения: пиридоксин-HCl (0,5 мг/л), тиамин-HCL (0,1 мг/л), никотиновую кислоту (0,5 мг/л), глицин (2,0 мг/л) и сахарозу (30,0 мг/л). Раствор автоклавируют. Окончательное значение рН равно 5,6.
Примечание: макроэлементы готовят в виде маточного раствора 10-кратной концентрации, а микроэлементы в виде маточного раствора 1000-кратной концентрации. Маточный раствор витамина обычно готовят в 100-кратной концентрации.
Суспензию культивируемых клеток линии S3 Nicotiana tabacum (Harms и DiMaio, J. Plant PhysioL, 137: 513-519, 1991) выращивают в жидкой среде для культивирования МХ1. 25 мл среды МХ1, содержащейся в 100 мл колбах Эрленмейера, инокулируют 10 мл культуры клеток, предварительно выращенных в течение 7 дней. Клетки инкубируют при 25oС в темноте на вращающемся шейкере при 100 об/мин (с амплитудой 2 см). Клетки пересевают с 7-дневными интервалами путем инокулирования аликвотного образца в свежую среду с помощью декантирования или пипетирования приблизительно 90% суспензии клеток с последующим пополнением свежей средой для получения требуемого объема суспензии. В течение 10 дней роста после инокуляции 250-350 мг клеток получают 5-8 г сырой массы клеток.
Пример 11: Получение культур клеток табака, толерантных к гербицидным ингибиторам протокса, путем выращивания клеток на отвердевшей среде для селекции.
Клетки предварительно выращивают аналогично описанному в примере 10. Клетки собирают путем седиментации или путем кратковременного центрифугирования при 500xg и удаляют использованную среду. Затем клетки разбавляют свежей средой для культивирования для получения плотности клеток, достаточной для высевания клеток на чашках и составляющей приблизительно 10000 колониеобразующих единиц на 1 мл. Для высевания клетки в малом объеме среды (приблизительно 1 мл) равномерно распределяют по верхней поверхности отвердевшей среды для культивирования (МХ1, 0,8% агара), содержащей необходимую концентрацию ингибитора. Используют приблизительно 20-30 мл среды на чашку Петри диаметром 10 см. Пригодную концентрацию ингибитора определяют на основе кривой доза - реакция (пример 14), и она является по крайней мере в два раза выше, чем IC50 для чувствительных клеток дикого типа.
Чашки с культурой, содержащие клетки, распределенные на среде для селекции, инкубируют при нормальных условиях для роста при 25-28oС в темноте до образования колоний. Образовавшиеся колонии клеток переносят в свежую среду, содержащую ингибитор в необходимой концентрации.
В предпочтительной модификации описанного метода предварительно выращенную суспензию культивируемых клеток сначала распределяют в малом объеме жидкой среды по верхней поверхности отвердевшей среды. Добавляют равное количество теплой жидкой агаровой среды (1,2-1,6% агара), выдерживавшейся в расплавленном состоянии при приблизительно 40oС, и чашку сразу же осторожно приводят во вращение, чтобы равномерно распределить клетки по поверхности среды и смешать клетки и агаровую среду до того, как среда отвердеет.
В другом варианте клетки смешивают с расплавленной агаровой средой до распределения по поверхности среды для селекции. Этот метод имеет то преимущество, что клетки внедряются и иммобилизируются в тонком слое отвердевшей среды на верхней поверхности среды для селекции. Это дает возможность лучшей аэрации клеток по сравнению с клетками, внедренными в весь объем, составляющий 20-30 мл.
Пример 12: Получение культур клеток табака, толерантных к гербицидному ингибитору протокса, путем выращивания клеток в жидкой среде для селекции.
Клетки, выращенные аналогично описанному в примере 10, инокулируют в пригодной концентрации клеток в жидкую среду МХ1, содержащую необходимую концентрацию гербицидного ингибитора протокса. Клетки инкубируют и выращивают по описанной в примере 10 методике. Через 7-10 дней клетки пересевают соответствующим образом в зависимости от скорости роста, применяя свежую среду, содержащую необходимую концентрацию ингибитора.
В зависимости от концентрации ингибитора рост клеток может быть менее интенсивным, чем при отсутствии ингибитора.
Пример 13: Получение культур клеток табака с повышенными уровнями фермента протокса.
Для получения культур клеток или каллюса с повышенными уровнями фермента протокса суспензионые культуры клеток или каллюс поэтапно переносят в среду со все более высокими концентрациями гербицидного ингибитора протокса. В частности, осуществляют следующие этапы.
Колонии клеток, образовавшихся из высеянных клеток в соответствии с примером 11, переносят в жидкую среду МХ1, содержащую такую же концентрацию ингибитора протокса, которая была использована при селекции в соответствии с примером 11, чтобы образовать суспензионные культуры. В другом варианте отобранные суспензионные культуры клеток, полученные в соответствии с примером 12, пересевают в жидкую среду МХ1, содержащую такую же концентрацию ингибитора протокса, которая была использована для селекции в соответствии с примером 12.
Культуры пересевают 1-20 раз с недельными интервалами и затем пересевают в среду МХ1, содержащую следующую более высокую концентрацию гербицида. Клетки выращивают для получения 1-10 пассажей в среде, содержащей эту более высокую концентрацию гербицида. Затем клетки переносят в среду МХ1, содержащую следующую более высокую концентрацию гербицида.
В другом варианте кусочки отобранного каллюса в соответствии с примером 11 переносят в отвердевшую среду МХ1, дополненную до необходимой концентрации гербицида. Перенос в среду с более высокой концентрацией осуществляют в соответствии с методикой, описанной в предыдущем абзаце, за исключением того, что используют отвердевшую среду.
Пример 14: Измерение роста клеток в зависимости от дозы в суспензионных культурах.
Для получения кривой доза - реакция определяют рост клеток при различных концентрациях гербицида. Суспензионные культуры чувствительных к гербицидному ингибитору протокса клеток S3 табака дикого типа и толерантных к гербициду селектированных или трансгенных клеток S3 и толерантных к гербициду селектированных или трансгенных клеток предварительно выращивают в жидкой среде, как описано в примере 11, до высокой плотности клеток в течение 2-4 дней. Клетки отмывают от использованной среды и добавляют свежую среду без гербицида для получения необходимой плотности клеток (приблизительно 150 мг сырого веса (СВ) клеток на 1 мл суспензии). Затем образец суспензии клеток объемом 2,5 мл, содержащий приблизительно 250-300 мг СВ клеток, инокулируют в приблизительно 30 мл жидкой среды с необходимой концентрацией гербицида, содержащейся в колбе Эрленмейера объемом 100 мл. Предпринимают соответствующие меры, чтобы инокулировать одинаковое количество клеток в каждую колбу. Каждая колба содержит одинаковый объем среды. На одну концентрацию гербицида инокулируют 3-6 колб-дубликатов. Концентрацию гербицида выбирают из следующего ряда: ноль (= контроль), 0,1 част./млрд, 0,3 част./млрд, 1 част. /млрд, 3 част./млрд, 10 част./млрд, 30 част./млрд, 100 част./млрд, 300 част. /млрд, 1000 част./млрд, 3000 част./млрд и 10000 част./млрд. В момент инокуляции отбирают несколько образцов инокулированных клеток для определения массы клеток, инокулированных в одну колбу.
Затем клетки инкубируют для роста в контролируемых условиях при 28oС в темноте в течение 10 дней. Клетки собирают путем сливания содержимого каждой колбы на диск из фильтровальной бумаги, присоединенный к всасывающему устройству, для удаления всей жидкости и получения массы достаточно сухих свежих клеток. Определяют массу свежих клеток. Сухую массу образца можно определить после высушивания.
Определяют рост клеток, выражают в виде прироста клеток за 10 дней, а также в виде процента по отношению к росту клеток при отсутствии гербицида в соответствии со следующей формулой: (конечная масса клеток, выращенных с присутствием гербицида, минус масса инокулята х 100, деленная на конечную массу клеток, выращенных без гербицида, минус масса инокулята). Значения IC50 определяют из графика, построенного по этим данным (относительная масса клеток по отношению к концентрации гербицида). Значение IС50 представляет собой концентрацию гербицида, при которой рост клеток составляет 50% от роста клеток в контроле (клетки, выращенные в отсутствие гербицида).
В модификации этого метода несколько кусочков каллюса, полученных из культуры клеток, устойчивых к гербициду, как описано в примерах 11 и 13, переносят на отвердевшую среду для культивирования каллюса, содержащую различные концентрации гербицида. Относительный рост определяют после 2-6-недельного культивирования путем взвешивания кусочков каллюса и сравнения с ростом культуры в контроле в среде без гербицида. Однако метод с использованием суспензии более предпочтителен вследствие его более высокой точности.
Пример 15: Определение перекрестной толерантности.
Для определения степени, в которой клетки проявляют толерантность по отношению к аналогичным или другим гербицидам, повторяют описанную в примере 14 методику по выращиванию клеток во все возрастающих концентрациях выбранных гербицидов. Для цели сравнения для каждого гербицида определяют относительный рост клеток и его значение IC50.
Пример 16: Определение стабильности фенотипа толерантности к гербициду с течением времени.
Для определения, сохраняется ли со временем фенотип толерантности к гербициду культуры клеток, клетки переносят из среды, содержащей гербицид, в среду без гербицида. Клетки выращивают по описанной в примере 10 методике в отсутствие гербицида в течение 3 месяцев, применяя регулярный пересев через соответствующие интервалы времени (7-10 дней для суспензионных культур; 3-6 недель для культур каллюса). Затем определенные количества клеток переносят обратно в среду, содержащую гербицид, и культивируют в течение 10 дней (суспензионные культуры) или 4 недель (культуры каллюса). Относительный рост определяют согласно описанному в примере 14.
Пример 17: Индукция и культивирование эмбриогенного каллюса из ткани щитка кукурузы.
Початки растений самоопыляющейся кукурузы инбредной линии Funk 2717 собирают через 12-14 дней после опыления. Удаляют листовую обертку и початки стерилизуют в
течение 15 минут при встряхивании в 20%-ном растворе коммерчески доступного отбеливателя Chlorox с добавлением нескольких капель детергента для лучшего смачивания. Затем початки промывают несколько
раз стерильной водой. Все дальнейшие стадии осуществляют в асептических условиях в стерильном вытяжном шкафу с потоком воздуха. Эмбрионы длиной 1,5-2,5 мм удаляют из зерен с помощью шпателя и помещают,
направляя ось эмбриона вниз, в среду для культивирования MS, содержащую 2,4-дихлорфеноксиуксусную кислоту (2,4-Д) в концентрации 2 мг/л и 3%-ную сахарозу, отвержденную с помощью 0,24%-ного
Gelrite®.
Эмбриогенный каллюс образуется на ткани щитка эмбрионов в течение 2-4 недель роста культуры при 28oС в темноте. Каллюс удаляют из эксплантата и
переносят в свежую отвердевшую среду MS, содержащую 2,4-Д в концентрации 2 мг/л. Пересев эмбриогенного каллюса повторяют с недельными интервалами. Пересевают только части каллюса, имеющие
эмбрионогенную морфологию.
Пример 18: Селекция культур клеток кукурузы, толерантных к гербицидным ингибиторам протокса.
а) Селекция с применением эмбрионогенного каллюса.
Эмбрионогенный каллюс, полученный по методике из примера 17, переносят в среду для поддержания каллюса, состоящую из среды N6, содержащей 2,4-Д в концентрации 2 мг/л, 3%-ную сахарозу и ингибитор протокса в концентрации, достаточной для замедления роста, но которая не оказывает вредного воздействия на эмбрионогенность культуры, и отверждают с помощью Gelrite®. Для увеличения частоты мутаций, толерантных по отношению к гербициду, культуры предварительно обрабатывают до селекции химическим мутагеном, например этилметансульфонатом, или физическим мутагеном, например УФ-излучением, в концентрации, немного ниже той, для которой проявляется ингибирование роста, как описано в примере 14. Культуры инкубируют в темноте при 28oС. Через 14 дней роста каллюс переносят в свежую среду такого же состава. Пересевают только культуры, имеющие необходимую эмбрионогенную морфологию, известную как морфология типа II хрупкого эмбрионогенного каллюса. Культуры размножают путем пересева с недельными интервалами, пересевая от двух до десяти раз в свежую среду, причем пересевают только наиболее быстро растущие культуры. Затем быстро растущий каллюс переносят в среду для поддержания каллюса, содержащую ингибирующий протокс гербицид в требуемой концентрации, как описано в примере 11. Если каллюс растет хорошо при этой концентрации, обычно после приблизительно пяти-десяти еженедельных пересевов каллюс переносят в среду для поддержания каллюса, содержащую в три раза более высокую концентрацию ингибитора, и продолжают пересевание до получения хорошо растущей культуры. Это процесс повторяют, применяя среду, содержащую ингибитор протокса в концентрации, в 10 раз превышающей начальную пригодную концентрацию, а затем среды, содержащие в 20 и в 40 раз более высокие концентрации.
Когда получено достаточное количество каллюса, его переносят в среду для регенерации, пригодную для созревания эмбриона и регенерации растения. Эмбрионогенный каллюс, растущий при каждой из исследованных концентраций гербицида, переносят в среду для регенерации.
б) Селекция с применением эмбрионогенных
суспензионных культур
Эмбрионогенные суспензионные культуры инбредной линии 2717 кукурузы Funk создают аналогично методике из примера 24 и поддерживают путем пересева с недельными интервалами
в свежую жидкую среду N6, содержащую 2,4-Д в концентрации 2 мг/л. Для увеличения частоты мутаций, толерантных к гербициду, культуры в это время могут быть обработаны химическим мутагеном, например
этилметансульфонатом в концентрации немного ниже той, при которой проявляется ингибирование роста, как это указано в примере 14. Для селекции культуры переносят в жидкую среду N6, содержащую 2,4-Д в
концентрации 2 мг/л и ингибитор протокса в концентрации, достаточной для замедления роста, но которая не оказывает вредного воздействия на эмбрионогенность культуры. Культуры выращивают на шейкере при
120 об/мин при 28oС в темноте. С недельными интервалами среду удаляют и добавляют свежую. Культуры разбавляют средой для культивирования в соответствии с их ростом так, чтобы поддерживать
концентрацию, равную приблизительно 10 мл объема упакованных клеток в 50 мл среды. При каждом пересеивании культуры обследуют и сохраняют для дальнейшего культивирования только быстро растущие
культуры с необходимой рыхлой эмбрионогенной морфологией. После двух-десяти пересевов в среду, содержащую N6, культуры увеличиваются в объеме по крайней мере в два-три раза после каждого еженедельного
пересева. Затем культуры переносят в среду N6, содержащую 2,4-Д в концентрации 2 мг/л и дозу ингибитора, в три раза более высокую, чем та, которая применялась первоначально. Растущие культуры повторно
пересевают в эту среду еще два-десять раз, как описано выше. Для дальнейшего пересева отбирают быстро растущие культуры с необходимой рыхлой эмбрионогенной морфологией. Затем быстро растущие культуры
переносят в среду N6, содержащую 2,4-Д в концентрации 2 мг/л и дозу ингибитора, в десять раз более высокую, чем та, которая применялась превоначально, и процесс пересева растущих культур с требуемой
рыхлой эмбрионогенной морфологией повторяют от двух до десяти раз до тех пор, пока не будут получены быстро растущие культуры. Затем эти культуры переносят в среду N6, содержащую 2,4-Д в концентрации
2 мг/л и дозу ингибитора, в тридцать раз более высокую, чем та, которая применялась первоначально.
Для регенерации растений из каждой из эмбрионогенных суспензионных культур, селектированных определенным уровнем концентрации гербицида, культуры сначала переносят в среду N6, отвержденную с помощью Gelrite® и содержащую 2,4-Д в концентрации 2 мг/л и необязательно ингибитор в концентрации, при которой выращивали культуры, для получения эмбрионогенного каллюса. Эмбрионогенный каллюс пересевают в свежую среду для поддержания каллюса до тех пор, пока не будет получено необходимое для регенерации количество каллюса. Пересевают только культуры с требуемой рыхлой эмбрионогенной морфологией.
Пример 19: Регенерация растений кукурузы из селектированных каллюсных или суспензионных культур.
Растения регенерируют из селектированных культур эмбрионогенного каллюса, полученных аналогично примеру 13, путем переноса в свежую среду для регенерации. Применяемыми средами для регенерации являются: среда N60, состоящая из среды N6, в которой отсутствует 2,4-Д, либо N61, состоящая из среды N6, содержащей 2,4-Д в концентрации 0,25 мг/л и кинетин (6-фурфуриламинопурин) в концентрации 10 мг/л, либо N62, состоящая из среды N6, содержащей 2,4-Д в концентрации 0,1 мг/л и кинетин в концентрации 1 мг/л, все отверждаемые с помощью 0,24%-ного Gelrite®. Культуры выращивают при 28oС на свету (освещение белыми флуоресцентными лампами, дающими 10-100 мкэйнштейнов/м2c в течение 16 часов в день). Культуры пересевают в свежую среду каждые две недели. Проростки образуются на 3-8 неделях. Проростки высотой по крайней мере 2 см отделяют из прилипшего каллюса и переносят в среду, стимулирующую рост корней. Используют различные стимулирующие рост корней среды. Среда состоит из среды N6 или MS, в которой отсутствуют витамины и в которой содержится либо обычная концентрация солей, либо концентрация солей уменьшена наполовину, концентрация сахарозы уменьшена до 1 г/л и, кроме того, могут либо отсутствовать рострегулирующие соединения, либо содержаться α -нафталинуксусная кислота в концентрации 0,1 мг/л. Когда корни разовьются в достаточной мере, проростки переносят в смесь для горшечных культур, состоящую из вермикулита, мохового торфа и садовой почвы. При трансплантации весь оставшийся каллюс удаляют, весь агар смывают и листья обрезают наполовину. Проростки выращивают в теплице сначала закрытыми на несколько дней перевернутыми пластмассовыми чашками для сохранения влажности и выращивания в условиях затенения. После акклиматизации растения пересаживают в цветочные горшки и выращивают до созревания. Применяют удобрение Peters 20-20-20 (фирма Grace Sierra) для развития здоровых растений. После зацветания растения опыляют, предпочтительно путем самоопыления.
Пример 20: Конструирование векторов трансформации растения.
Для трансформации растения пригодны многие векторы трансформации, а гены по изобретению могут быть использованы в сочетании с любым из таких векторов. Выбор вектора для применения будет зависеть от предпочтительного способа трансформации и вида-мишени для трансформации. Для определенных видов-мишеней могут быть предпочтительны различные антибиотические или селективные в отношении гербицида маркеры. Маркеры селекции, обычно применяемые при трансформации, включают ген nptll, который придает устойчивость к канамицину и родственным антибиотикам (Messing & Vierra, Gene, 19: 259-268 (1982); Bevan и др., Nature 304: 184-187 (1983)), ген bar, который придает устойчивость к гербициду фосфинтрицину (White и др., Nucl. Acids Res., 18: 1062 (1990), Spencer и др. , Theor. Appl. Genet., 79: 625-631 (1990)), ген hph, который придает устойчивость к антибиотику гигромицину (Blochinger & Diggelmann, Mol. Cell BioL, 4: 2929-2931), и ген dhfr, который придает устойчивость к метотрексату (Bourouis и др., EMBO J., 2(7): 1099-1104 (1983)).
(1) Конструирование векторов, пригодных для трансформации Agrobacterium.
Для трансформации с применением Agrobacterium tumefaciens пригодны многие векторы. Они обычно несут по крайней мере одну пограничную последовательность Т-ДНК и включают такие векторы, как pBIN19 (Bevan, Nucl. Acids Res., (1984)). Ниже описано конструирование двух типичных векторов.
Конструирование векторов рСIВ200 и pCIB2001.
Бинарные векторы рСIВ200 и
рСIВ2001 используют для конструирования рекомбинантных векторов с применением Agrobacterium, их конструировали следующим образом. pTJS75kan создавали путем разложения pTJS75 (Schmidhauser &
Helinski, J. BacterioL, 164: 446-455 (1985)) с помощью NarI, позволяющей вырезать ген устойчивости к тетрациклину, с последующей инсерцией фрагмента Асс1 из pUC4K, несущей NPTII (Messing &
Vierra, Gene, 19: 259-268 (1982); Bevan и др. , Nature, 304: 184-187 (1983); McBridge и др., Plant Molecular Biology, 14: 266-276, (1990)). Линкеры XhoI лигировали с EcoRV-фрагментом плазмиды рС1В7,
содержащим левую и правую границы Т-ДНК, селектируемый в растении химерный ген nos/nptll и полилинкер pUC (Rothstein и др., Gene, 53: 153-161 (1987)), и клонировали фрагмент, разложенный с помощью
XhoI, в pTJS75, разложенном с помощью SalI, для создания рСIВ200 (см. также европейскую заявку ЕР 0332104, пример 19 [1338]). рСIВ200 содержит следующие уникальные полилинкерные сайты рестрикции:
EcoRI, SstI, Kpnl, BglII, XbaI и SalI. pCIB2001 представляет собой производное от рСIВ200, которое создано путем встраивания в полилинкер дополнительных сайтов рестрикции. Уникальными сайтами
рестрикции в полилинкере pCIB2001 являются EcoRI, SstI, Kpnl, BglII, Xbal, SalI, MluU, BslI, AvrII, ApaI, HpaI и StuI. В дополнение к тому, что pCIB2001 содержит эти
уникальные сайты
рестрикции, он также имеет избирательность по отношению к канамицину в растениях и бактериях, левую и правую границы Т-ДНК для трансформации, обусловленной Agrobacterium, функцию trfA, имеющую
происхождение из RK2, для мобилизации между Е.coli и другими хозяевами, и функции OriT и OriV, также имеющие происхождение из RK2. Полилинкер рСIВ2001 пригоден для клонирования полигенных
экспрессирующих кластеров, содержащих их собственные регуляторные сигналы.
Конструирование pCIB10 и ее производных на основе селекции гигромицином.
Бинарный вектор pCIB10 содержит ген, кодирующий устойчивость к канамицину для селекции в растениях, правую и левую пограничные последовательности Т-ДНК и включает последовательности из плазмиды pRK252 с широким спектром хозяев, что позволяет осуществлять репликацию как в Е.coli, так и в Agrobacterium. Его конструкция описана у Rothstein и др., Gene, 53: 153-161 (1987)). Были сконструированы различные производные pCIB10, которые включают ген устойчивости к гигромицин-В-фосфотрансферазе, описанные у Gritz и др., Gene, 25: 179-188 (1983)). Эти производные дают возможность осуществлять селекцию клеток трансгенных растений либо только по устойчивости к гигромицину, либо по устойчивости к гигромицину и канамицину (pCIB715, pCIB717) (Rothstein и др.. Gene, 53: 153-161 (1987)).
(2) Конструирование векторов, пригодных для трансформации без использования Agrobacterium.
Трансформация без использования Agrobacterium дает возможность обойти требование наличия последовательностей Т-ДНК в выбранном векторе трансформации, и, следовательно, векторы, в которых отсутствуют эти последовательности, могут быть использованы в дополнение к векторам, таким, как описанные выше, и которые содержат последовательности Т-ДНК. Способы трансформации, которые не основаны на использовании Agrobacterium, включают трансформацию с помощью бомбардировки частицами, поглощение протопласта (например, с помощью ПЭГ и электропорации) и микроинъекцию. Выбор вектора в значительной степени зависит от предпочтительного выбора трансформируемых видов. Ниже описаны конструкции некоторых типичных векторов.
Конструирование рСIВ3064.
рСIВ3064 представляет собой вектор, имеющий происхождение из pUC и пригодный для методов прямого переноса гена в сочетании с селекцией гербицидом basta (или фосфинотрицином). Плазмида рСIВ246 включает промотор 35S CaMV, действенным образом слитый с геном GUS Е.coli, и терминатор транскрипции 35S CaMV, и она описана в заявке WO 93/07278. Промотор 35S этого вектора содержит два кодона ATG 5' последовательности в сайте инициации. Эти сайты подвергали мутации с использованием стандартных ПЦР-методик таким образом, чтобы удалить кодоны ATG и образовать сайты рестрикции SspI и PvuII. Новые сайты рестрикции находились на расстоянии 96 и 37 пар оснований от уникального сайта SalI и на расстоянии 101 и 42 пар оснований от действительного сайта инициации. Полученное производное рСIВ246 обозначили как рСIВ3025. Затем ген GUS вырезали из рСIВ3025 путем разложения с помощью SalI и SacI, концы "затупляли" и повторно лигировали для образования плазмиды рСIВ3060. Плазмида рJI82 была получена из John Innes Center, Norwich, и из нее вырезали фрагмент SmaI длиной 400 пар оснований, содержащий ген bar из Streptomyces viridochromogenes, и встраивали в сайт НраI плазмиды pCIB3060 (Thompson и др. , EMBO J. , 6: 2519-2523 (1987)). Это позволяло получить плазмиду рСIВ3064, содержащую ген bar, находящийся под контролем промотора 35S CamV и терминатора для селекции гербицидом, ген fro устойчивости к ампициллину (для селекции в Е. coli) и полилинкер с уникальными сайтами SphI, PstI, HindIII и BamHI. Этот вектор пригоден для клонирования полигенных экспрессирующих кластеров растения, содержащих их собственные регуляторные сигналы.
Конструирование pSOG19 и pSOG35.
pSOG35 представляет собой вектор трансформации, который использует дигидрофолат-редуктазу (DHFR) Е. coli в качестве селектируемого маркера, придающего устойчивость к метотрексату. Применяли ПЦР для амплификации промотора 35S (~ 800 пар оснований), интрона 6 из гена кукурузы Adhl (-550 пар оснований) (Lou и др., Plant J., 3: 393-403, 1993; Dennis и др., Nucl. Acids Res., 12: 3983-4000, 1984) и 18 пар оснований нетранслируемой лидерной последовательности GUS из плазмиды pSOG10. Фрагмент длиной 250 пар оснований, кодирующий ген дигидрофолат-редуктазы типа II из Е.coli, также амплифицировали с помощью ПЦР и эти два ПЦР-фрагмента соединяли с фрагментом SacI-PstI из рВI221 (фирма Clontech), содержащим основной вектор pUC19 и терминатор нопалин-синтазы. Сборка этих фрагментов давала плазмиду pSOG19, содержащую промотор 35S, слитый с последовательностью интрона 6, лидером GUS, геном DHFR и терминатором нопалин-синтазы. Замена лидера GUS в pSOG19 на лидерную последовательность из вируса хлоротической пятнистости кукурузы (MCMV) давала вектор pSOG35. pSOG19 и pSOG35 несут ген pUC резистентности к ампициллину и имеют сайты HindIII, SphI, PstI и EcoRI, пригодные для клонирования чужеродных последовательностей.
pSOG10.
Данный вектор экспрессии β-глюкуронидазы (GUS) получали из плазмиды рВI121, поставляемой
фирмой Clonetech Laboratories, Palo Alto, California. Интрон 6 гена Adhl кукурузы амплифицировали с помощью ПЦР из плазмиды рВ428, описанной у Bennetzen и др. , Proc. Natl. Acad. Sci. USA, 81:
4125-4128 (1987), с применением олигонуклеотидных праймеров SON0003 и SON0004:
SON0003: 5'-CTCGGATCCAGCAGATTCGAAGAAGGTACAG-3',
SON0004: 5'-ACGGGATCCAACTTCCTAGCTGAAAAATGGG-3'.
Продукт ПЦР-реакции разлагали с помощью рестрикционной эндонуклеазы BamHI, расщепляющей сайт BamHI, добавленный на 5'-конце каждого ПЦР-праймера. Полученный фрагмент ДНК очищали на агарозном геле и лигировали в сайте BamHI плазмиды рВI121, который находится между промотором CaMV35S и геном GUS. Лигированную ДНК трансформировали в E.coli и путем рестрикционного разложения идентифицировали клоны с интроном 6 Adhl в той же ориентации, что и ген GUS.
pSOG19.
Данный вектор экспрессии дигидрофолат-редуктазы (DHFR) получали путем слияния
промотора 35S и интрона 6 гена Adhl плазмиды pSOGlO с геном DHFR из плазмиды рНСО, описанной у Bourouis и Jarry, EMBO J., 2: 1099-1104 (1983). Промотор 35S и интрон 6 гена Adhl получали путем
ПЦР-амплификации фрагмента из плазмиды pSOGlO с использованием праймеров SON0031 и SON0010:
SON0031: 5'-CATGAGGGACTGACCACCCGGGGATC-3',
SON0010: 5'-AGCGGATAACAATTTCACACAGGA-3'.
Полученные фрагменты разлагали с помощью рестрикционных эндонуклеаз PstI и BspHI и очищали на агарозном геле.
Кодирующие области DHFR получали с помощью ПЦР-амплификации
рНСО с использованием праймеров SON0016 и SON0017:
SON0016: 5'-GCTACCATGGCCACATAGAACACC-3',
SON0017: 5'-CGAGAGCTCGCACTTCAACCTTG-3'.
Полученный фрагмент разлагали с помощью рестрикционных эндонуклеаз NsoI и SacI и очищали на агарозном геле.
Два описанных выше фрагмента лигировали в фрагменте вектора, полученного из плазмиды рВI121 путем разложения с помощью рестрикционных эндонуклеаз PstI и SacI и очистки на агарозном геле фрагмента длиной 3 т.п.н., содержащего область терминатора Nos и область pUC19 плазмиды рВI121. Это тройное лигирование позволило слить промотор 35S, интрон 6 AdhI, ген DGFR и терминатор Nos в правильном порядке и ориентации для функциональной экспрессии в растениях.
pSOG30.
Данный вектор экспресии GUS получали из pSOG10 путем инсерции лидера вируса хлоротической пятнистости кукурузы (MCMV), описанного у Lommel и др., Virology, 181: 382-385 (1991), в нетранслируемую лидерную последовательность гена 35S-GUS с помощью тройного лигирования.
Синтезировали и отжигали обе цепочки лидерной последовательности капсидного протеина MCMV длиной 17 пар оснований плюс соответствующие сайты эндонуклеазной рестрикции. Полученный двухцепочечный фрагмент разлагали с помощью BamHI и NcoI и очищали на акриламидном геле.
Кодирующую область
гена GUS амплифицировали с помощью ПЦР с использованием праймеров SON0039 и SON0041 и плазмиды рВI121 в качестве матрицы:
SON0039: 5'-CGACATGGTACGTCCTGTAGAAACCCACA-3',
SON0041:
5'-ATCGCAAGACCGGCAACAGGATTC-3'.
Эти праймеры добавляли сайт NcoI к 5'-концу GUS и сайт SacI к 3'-концу GUS. Полученный фрагмент разлагали с помощью рестрикционных эндонуклеаз NcoI и SacI и очищали на агарозном геле.
Ген GUS удаляли из плазмиды pSOG10 путем разложения рестрикционной эндонуклеазой SacI и частичного разложения рестрикционной эндонуклеазой BamHI. Полученный вектор, который имел сайт BamHI и сайт SacI, в который повторно встраивают кодирующую область за промотором 35S-интроном 6 Adhl, очищали на агарозном геле.
Описанные выше три фрагмента лигировали путем тройного лигирования для получения гибридного гена, имеющего структуру: промотор 35S-интрон 6 Adhl-лидерная последовательность MCMV-GUS-терминатор Nos, все на основе вектора pUC19.
pSOG35.
DGFR-селектируемый вектор-маркер идентичен pUC19, за исключением того, что МСМV-лидера встраивают в нетранслируемый лидер гена DGFR для усиления трансляции. Эту операцию осуществляли в две стадии. Сначала кодирующую область гена GUS в pSOG32, векторе, идентичном pSOG30, за исключением того, что он чаще содержит модифицированный промотор Adh, чем 35S, замещали кодирующей областью DGFR из pUC19 путем эксцизии GUS с помощью NcoI и SacI и лигирования в DGFR в виде NcoI-SacI-фрагмента. Это привело к получению вектора pSOG33, который имеет генную структуру: промотор Adh-интрон 6 Adhl-лидерная последовательность MCMV-кодирующая область DGFR-терминатор Nos с сайтом BglII между промотором и интроном и с сайтом SacI между кодирующей областью и терминатором. Фрагмент NcoI-SacI выделяли с помощью разложения рестрикционной эндонуклеазой и очистки на агарозном геле и лигировали в сайты BamHI и SacI вектора pSOG30, замещая гибридную структуру интрон 6 Adhl-лидерная последовательность MCMV-кодирующая область GUS вектора pSOG30 на структуру интрон 6 Adhl-лидерная последовательность MCMV-кодирующая область DGFR вектора pSOG33.
Пример 21: Конструирование полигенных экспрессирующих кластеров растений.
Генные последовательности, предназначенные для экспрессии в трансгенных растениях, сначала объединяют в полигенные экспрессирующие кластеры за пригодным промотором и в обратном направлении по отношению к пригодному терминатору транскрипции. Эти полигенные экспрессирующие кластенры затем легко могут быть перенесены в векторы трансформации растений, описанные выше в примере 19.
Выбор промотора
Выбор промотора, используемого в полигенных экспрессирующих
кластерах, будет определять пространственную и временную схему экспрессии трансгена в трансгенном растении. Выбранные промоторы будут экспрессировать трансгены в oпределенных типах клеток (таких, как
эпидермальные клетки листа, мезофильные клетки, клетки коры корня) или в определенных тканях или органах (например, в корнях, листьях или цветках), и этот выбор должен отражать требуемую локализацию
экспрессии трансгена. В другом варианте выбранный промотор может стимулировать экспрессию гена под воздействием индуцируемого светом или регулируемого другими временными параметрами промотора. Еще
одним альтернативным вариантом является таковой, когда выбранный промотор представляет собой промотор, регулируемый химическими агентами. Это будет обеспечивать возможность индуцировать экспрессию
трансгена только тогда, когда требуется, и вызывать ее путем обработки химическим индуцирующим агентом.
Терминаторы транскрипции
Широкое разнообразие терминаторов
транскрипции доступно для применения в полигенных экспрессирующих кластерах. Они ответственны за прекращение транскрипции позади трансгена и его правильное полиаденилирование. Соответствующие
терминаторы транскрипции и те, которые, как известно, обладают способностью функционировать в растениях, включают терминатор 35S CaMV, терминатор tml, терминатор нопалин-синтаза, терминатор Е9 rbcS
гороха. Они могут применяться как в однодольных, так и в двудольных растениях.
Последовательности для усиления или регулирования экспрессии
Были обнаружены многочисленные
последовательности, усиливающие экспрессию гена внутри единицы транскрипции, и эти последовательности могут применяться в сочетании с генами по изобретению для усиления их экспрессии в трансгенных
растениях.
Было установлено, что различные интронные последовательности усиливают экспрессию, в частности, в клетках однодольных растений. Например, обнаружено, что интроны гена Adhl кукурузы значительно усиливают экспрессию гена дикого типа под воздействием родственного промотора при введении в клетки кукурузы. Было установлено, что интрон 1 является особенно эффективным и усиливает экспрессию в гибридных конструкциях с геном хлорамфеникол-ацетилтрансферазы (Callis и др. , Genes Develop. 1: 1183-1200 (1987)). В этой же экспериментальной системе интрон гена bronzel кукурузы обладал подобным действием в отношении усиления экспрессии (Callis и др., см. выше). В соответствии с принятой практикой интронные последовательности включали в векторы трансформации растения обычно внутри нетранслируемой лидерной последовательности.
Также известны многочисленные нетранслируемые лидерные последовательности, усиливающие экспрессию и имеющие происхождение из вирусов, и они являются особенно эффективными в клетках двудольных растений. В частности, было подтверждено, что лидерные последовательности из вируса мозаики табака (TMV, "W-последовательность"), из вируса хлоротической пятнистости кукурузы (MCMV) и из вируса мозаики люцерны (AMV) эффективны для усиления экспрессии (см. например, у Galliе и др. Nucl. Acids Res. 15: 8693-8711 (1987); Skuzeski и др., Plant Molec. Biol. 15: 65-79 (1990)).
Ориентация генного продукта внутри клетки
Известны различные существующие в растениях механизмы для ориентации генных продуктов, а
последовательности, контролирующие функционирование этих механизмов, охарактеризованы достаточно подробно. Например, ориентация генных продуктов к хлоропласту контролируется с помощью сигнальной
последовательности, которая обнаружена на содержащем аминогруппу конце различных протеинов и которую отщепляют во время импорта в хлоропласт, получая зрелый протеин (см. , например, у Comai и др., J.
Biol. Chem. 263: 15104-15109 (1988)). Эти сигнальные последовательности могут быть слиты с гетерологичными генными продуктами для осуществления импорта гетерологичных продуктов в хлоропласт (van den
Broeck и др., Nature 313: 358-363 (1985)). ДНК, кодирующая соответствующие сигнальные последовательности, может быть выделена из 5'-конца кДНК, кодирующих протеин RUBISCO, протеин CAB, фермент
EPSP-синтазу, протеин GS2 и целый ряд других протеинов, для которых известно, что они локализованы в хлоропласте.
Другие генные продукты локализованы в других органеллах, таких как митохондрия и пероксисома (см., например, у Unger и др., Plant Molec. Biol. 13: 411-418 (1989)). кДНК, кодирующие эти продукты, также могут быть подвергнуты манипуляциям для осуществления ориентации гетерологичных генных продуктов в эти органеллы. Примерами таких последовательностей являются кодируемые в ядре АТФазы и специфичные для митохондрий изоформы аспартатамино-трансферазы. Ориентация к клеточным протеиновым тельцам была описана у Rogers и др., в Proc. Natl. Acad Sci. USA 82: 6512-6516 (1985)).
Кроме того, были охарактеризованы, последовательности, приводящие к ориентации генных продуктов к другим клеточным компартментам.
Последовательности с концевой аминогруппой ответственны за ориентацию к эндоплазматическому ретикулюму (ЭР), апопласту и за экстраклеточную секрецию из алейронных клеток (Коеhlеr & Но, Plant Cell 2: 769-783 (1990)). Кроме того, последовательности с концевой аминогруппой в сочетании с последовательностями с концевой карбоксильной группой ответственны за ориентацию генных продуктов к вакуолям (Shinshi и др., Plant Molec. Biol. 14: 357-368 (1990)).
Путем слияния описанных выше соответствующих ориентирующих последовательностей с представляющими интерес трансгенными последовательностями возможно направлять трансгенный продукт к любой органелле или к любому компартменту клетки. Для ориентации, например, в хлоропласт сигнальную последовательность хлоропласта из гена RUBISCO, гена CAB, гена EPSP-синтазы или гена GS2 сливают в рамке с аминоконцевым кодоном ATG трансгена. Выбранная сигнальная последовательность должна включать известный сайт расщепления, а при конструировании гибридов следует учитывать любые аминокислоты после сайта расщепления, которые необходимы для расщепления. В некоторых случаях это требование может быть удовлетворено путем добавления небольшого количества аминокислот между сайтом расщепления и ATG трансгена или в альтернативном варианте путем замещения нескольких аминокислот внутри трансгенной последовательности. Гибриды, сконструированные для импорта в хлоропласт, могут быть оценены на эффективность поглощения хлоропластом путем трансляции in vitro транскрибируемых in vitro конструкций с последующем поглощением in vitro хлоропластом с использованием методов, описанных у Bartlett и др. (Edelmann и др. (ред. ) Methods in Chloroplast Molecular Biology, Elsevier. стр. 1081-1091 (1982)); Wasmann и др. (Mol. Gen. Genet. 205: 446-453 (1986)). Эти методы конструирования хорошо известны в данной области техники и одинаково пригодны и для митохондрий, и для пероксисом. Выбор ориентации, которая может требоваться для экспрессии трансгенов, будет зависеть от клеточной локализации предшественника, необходимого в качестве исходной точки для данного процесса. Эта локализация обычно бывает цитозольной или хлоропластной, хотя в некоторых случаях может быть митохондриальной или пероксомальной. Обычно не требуется, чтобы продукты экспрессии трансгена были ориентированы к ЭР, апопласту или вакуоли.
Вышеописанные механизмы для клеточной ориентации могут быть использованы не только в сочетании с их родственными промоторами, но также в сочетании с гетерологичными промоторами так, чтобы обеспечивать специфическую клеточную ориентацию к месту назначения под регуляцией транскрипции промотором, который имеет схему экспресии, отличную от таковой у промотора, который стимулирует ориентацию сигнала.
Пример 22: Трансформация двудольных растений.
Методы трансформации для двудольных растений хорошо известны в данной области техники и включают как таковые, основанные на применении Agrobacterium, так и методы, для которых не требуется использовать Agrobacterium. Методы, для которых не требуются Agrobacterium, включают поглощение экзогенного генетического материала непосредственно протопластами или клетками. Это может осуществляться с помощью ПЭГ или медиируемого электропорацией поглощения, доставки, медиируемой бомардировкой частицами, или путем микроинъекции. Примеры этих методов описаны у Paszkowski и др., EMBO J. 3:2717-2722 (1984), Potrykus и др. , Mol. Gen. Genet. 199: 169-177 (1985), Reich и др., Biotechnology 4: 1001-1004 (1986) и у Klein и др., Nature 327: 70-73 (1987). В каждом случае трансформированные клетки регенерируют до целых растений, используя стандартные методы, известные в данной области техники.
Трансформация, медиируемая Agrobacterium, является предпочтительным методом для трансформации двудольных вследствие высокой эффективности этой трансформации и ее широкой применимости для различных многочисленных видов. Многие культурные виды, которые обычно могут трансформироваться с помощью Agrobacterium, включают табак, томаты, подсолнечник, хлопчатник, масличный рапс, картофель, сою, люцерну и тополь (ЕР 0317511 (хлопчатник), ЕР 0249432 (томаты, на имя фирмы Calgene), WO 87/07299 (Brassica, на имя фирмы Calgene), патент США 4795855 (тополь)).
Трансформация с использованием Agrobacterium обычно включает перенос бинарного вектора, несущего чужеродную, представляющую интерес ДНК (например, рСIВ200 или рСIВ2001), в соответствующий штамм Agrobacterium, который может зависеть от комплемента генов vir, которые несет штамм-хозяин Agrobacterium, либо на ко-резидентной Ti-плазмиде, либо хромосомально (например, в штамм CIB542 для рСIВ200 и pCIB2001) (Uknes и др., Plant Cell 5: 159-169 (1993)). Перенос рекомбинантного бинарного вектора в Agrobacterium осуществляют методом трехпарентального (трехродительского) скрещивания с использованием Е.coli, несущей рекомбинантный бинарный вектор, штамм-хелпер Е. coli, который несет такую плазмиду, как pRK2013, и который способен подавать рекомбинантный бинарный вектор в штамм-мишень Agrobacterium. В другом варианте рекомбинантный бинарный вектор может быть перенесен в Agrobacterium путем трансформации ДНК (Hofgen & Willmitzer, NucL Acid. Res. 16: 9877 (1988)).
Трансформация видов растений-мишений рекомбинантной Agrobacterium обычно включает совместное культивирование Agrobacterium с эксплантатами из растения и осуществляется в соответствии с протоколами, хорошо известными в данной области техники. Трансформированную ткань регенирируют на селектируемой среде, несущей маркер устойчивости к антибиотику или гербициду, находящийся между границами бинарной плазмиды Т-ДНК.
Пример 23: Трансформация однодольных растений.
Трансформация большинства видов однодольных растений в настоящее время также стала традиционной. Предпочтительные методы включают непосредственный перенос гена в протопласты с использованием ПЭГ или электропорацию и бомбардировку частицами ткани каллюса. Трансформации могут быть осуществлены с одиночными видами ДНК или со множественными видами ДНК (т.е. путем котрансформации), и оба эти метода пригодны для использования по настоящему изобретению. Котрансформация может иметь то преимущество, что она позволяет избежать необходимости применения сложной векторной конструкции и дает возможность генерировать трансгенные растения с несцепленными локусами для представляющего интерес гена и селектируемого маркера, давая возможность удалить селектируемый маркер в последующих поколениях, если это считается необходимым. Однако недостатком при применении котрансформации является частота, составляющая менее 100%, с которой отдельные виды ДНК интегрируются в геном (Schocher и др. Biotechnology 4: 1093-1096 (1986)).
В описаниях европейских заявок ЕР 0292435 (на имя фирмы Ciba-Geigy), ЕР 0392225 (на имя фирмы Ciba-Geigy) и WO 93/072778 (на имя фирмы Ciba-Geigy) приведены способы получения каллюса и протопластов из элитной инбредной линии кукурузы, трансформации протопластов с использованием ПЭГ или электропорации и регенерации растений кукурузы из трансформированных протопластов. Gordon-Kamm и др. в Plant Cell 2: 603-618 (1990) и Fromm и др. в Biotechnology 8: 833-839 (1990)) опубликовали способы трансформации линии кукурузы, имеющей происхождение из А188, с использованием бомбардировки частицами. Кроме того, в международной заявке WO 93/07278 (на имя фирмы Ciba-Geigy) и у Koziel. и др. в Biotechnology 11: 194-200 (1993)) описаны способы трансформации элитных инбредных линий кукурузы путем бомбардировки частицами. Этот способ включает использование незрелых эмбрионов кукурузы длиной 1,5-2,5 мм, вырезанных из початка через 14-15 дней после опыления, и устройств для бомбардировки типа PDS-1000He Biolistics.
Трансформация риса также может быть осуществлена с использованием методов непосредственного переноса гена с применением протопластов или бомбардировки частицами. Медиируемая протопластом трансформация описана для японских и индийских типов риса (Zhang и др., Plant Cell Rep. 7: 379-384 (1988); Shimamoto и др., Nature 338: 274-277 (1989); Datta и др., Biotechnology 8: 736-740 (1990)). Оба типа также трансформируют стандартными методами с использованием бомбардировки частицами (Christou и др., Biotechnology 9: 957-962 (1991)).
В европейской заявке ЕР 0332581 (на имя фирмы Ciba-Geigy) описаны методы получения, трансформации и регенерации протопластов растений семейства мятликовых (Pooideae). Эти методы дают возможность трансформировать ежу (Dactylis spp.) и пшеницу. Кроме того, трансформация пшеницы описана у Vasil и др. , Biotechnology 10: 667-674 (1992), с использованием бомбардировки частицами в клетках типа С каллюса с продолжительным временем регенерации, а также у Vasil и др., Biotechnology 11: 1553-1558 (1993) и у Weeks и др., в Plant Physiol. 102:1077-1084 (1993) с использованием бомбардировки частицами незрелых эмбрионов и незрелого каллюса эмбрионального происхождения. Однако предпочтительный метод для трансформации пшеницы включает трансформацию пшеницы путем бомбардировки частицами незрелых эмбрионов и включает либо стадию высокого содержания сахарозы или высокого содержания мальтозы, предшествующую доставке гена. До бомбардировки любое количество эмбрионов (длиной 0,75-1 мм) помещают в MS-среду с добавлением 3%-ной сахарозы (Murashige & Skoog, Physiologia Plantarum 15: 473-497 (1962)) и 3 мг/л 2,4-Д для индукции соматических эмбрионов, что дает им возможность развиваться в темноте. В выбранный день бомбардировки эмбрионы удаляют из среды для индукции и помещают в осмотикум (т.е. в среду для индукции с добавлением сазарозы или мальтозы в требуемой концентрации, обычно 15%-ной). Эмбрионам дают возможность пройти плазмолиз в течение 2-3 ч и затем подвергают бомбардировке. В одной чашке-мишени обычно используют по 20 эмбрионов, хотя это количество не имеет решающего значения. Соответствующую несущую ген плазмиду (такую как рСIВ3064 или pSOG35) осаждают на золотые частицы размером порядка микрометра, используя стандартную методику. Каждую чашку с эмбрионами обстреливают с помощью устройства Biolistics на основе гелия фирмы DuPont с использованием давления залпа ~1000 фунтов/кв.дюйм и стандартного экрана с размером пор 80 меш. После бомбардировки эмбрионы помещают обратно в темноту для восстановления в течение приблизительно 24 ч (все еще в осмотикуме). Через 24 ч эмбрионы удаляют из осмотикума и помещают назад в среду для индукции, где они остаются в течение приблизительно месяца до регенерации. Приблизительно через один месяц эксплантаты эмбрионов с развитым эмбриогенным каллюсом переносят в среду для регенерации (MS + 1 мг/л NAA (α-нафтилуксусная кислота), 5 мг/л GA), содержащую, кроме того, соответствующий селектирующий агент (10 мг/л басты в случае рСIВ3064 и 2 мг/л метотрексата в случае pSOG35). Через приблизительно один месяц развившиеся ростки переносят в более крупные стерильные контейнеры, известные, как "GA7", содержащие MS с половинной крепостью, 2%-ную сахарозу и такую же концентрацию селектирующего агента. В заявке на патент 08/147161 приведены методы трансформации пшеницы, и эта заявка включена в настоящее описание в качестве ссылки.
Пример 24: Селекция генов протокса растений на устойчивость к ингибирующим протокс гербицидам в системе экспрессии Е. coli.
Плазмиду pWDC-4, кодирующую хлоропластный фермент протокс кукурузы, трансформируют в подвергнутом неспецифическому мутагенезу штамме XLl-Red (фирма Strategene, La Jolla, Ca). Трансформант высевают в L-среду, содержащую 50 г/мл ампициллина, и инкубируют в течение 48 часов при 37oС. Газоны трансформированных клеток экспортируют из чашек и получают ДНК плазмиды, используя набор Wizard Megaprep (фирма Promega, Madison, WI). ДНК плазмиды, выделенную из этого штамма-мутатора, вероятно, содержит приблизительно одно случайным образом измененное основание на 2000 нуклеотидов (см. Greener и др.. Strategies 7(2): 32-34 (1994)).
Мутированную плазмидную ДНК переносят в мутант hemG SASX38 (Sasarman и др., J. Gen. Microbiol. 113: 297 (1979) и высевают в L-среду, содержащую 100 г/мл ампициллина, и в такую же среду, содержащую различные концентрации ингибирующего протокс гербицида. Чашки инкубируют в течение 2-3 дней при 37oС. ДНК плазмиды выделяют из всех колоний, растущих в присутствии концентраций гербицида, которые эффективно вызывают гибель штамма дикого типа. Затем выделенную ДНК переносят в SASX38 и вновь высевают в среду с гербицидом для гарантиии того, что эта устойчивость обусловлена плазмидой.
Мутированную ДНК плазмиды pWDC-4 вновь выделяют из устойчивых колоний и вырезают кодирующую протокс последовательность путем разложения с помощью EcoRI и XhoI. Затем вырезанную кодирующую протокс последовательность повторно клонируют в неподвергнутом мутагенезу векторе pBluescript и повторно тестируют на устойчивость к ингибирующему протокс гербициду таким же образом, как описано выше.
Этот процесс удаляет мутации некодирующей последовательности, которые обусловливают устойчивость, например, положительных мутантов (т.е. мутантов, устойчивость которых является следствием мутаций, вызывающих повышенную экспрессию немодифицированного протокса), и оставляет только тех мутантов, устойчивость которых является следствием мутаций в кодирующей последовательности протокса. Определяют последовательность ДНК, идентифицированную с помощью этого процесса, для всех вероятных толерантных к гербициду генов протокса и выявляют мутации путем сравнения с последовательностью протокса дикого типа в pWDC-4.
С использованием описанной выше методики были идентифицированы мутации устойчивости, превращающие С в Т на нуклеотиде в положении 498 в последовательности в pWDC-4 (SEQ ID NO: 5). Плазмиду, несущую эту мутацию, обозначили как pMzC-lVal. Это изменение превращает кодон


Плазмида pMzC-lVal в векторе pBluescript SK для целей процедуры патентования была депонирована 30 сентября 1994 г. под обозначением pWDC-8 в коллекции культур Службы сельскохозяйственных исследований и она получила каталожный номер NRRL 21340.
Такую же стратегию применяли для скрининга устойчивых к гербициду форм гена Protox-1 Arabidopsis в различных векторах. Одна из модифицированных мутаций представляет собой замену С на Т в нуклеотиде в положении 689 в последовательности pWDC-2 (SEQ ID NO: 1); эту плазмиду обозначили как pAraC-lVal. Это идентично таковому в указанном выше мутанте pMzC-lVal, что ведет к превращению кодона


Второй ген устойчивости включает замену А на G в нуклеотиде в положении 1307 в последовательности pWDC-2 (SEQ ID NO: 1); эту плазмиду обозначили как pAraC-2Cys. Это изменение превращает кодон


Третий ген устойчивости имеет замену G на А в нуклеотиде в положении 691 в последовательности pWDC-2 (SEQ ID NO: 1); эту плазмиду обозначили как pAraC-3Ser. Это изменение превращает кодон

Все описанные выше мутации приводят к получению фермента протокса, который по крайней мере в 10 раз более устойчив к ингибирующему протокс гербициду в бактериальном тесте.
Плазмида pAraC-2Cys в векторе pFL61 для целей процедуры патентования была депонирована 14 ноября 1994 г. под обозначением pWDC-7 в коллекции культур Службы сельскохозяйственных исследований, и она получила каталожный номер NRRL 21339N.
Пример 25: Дополнительные замещения устойчивого к гербициду кодона в положениях, выявленных путем случайного скрининга.
Аминокислоты, выявленные в качестве сайтов устойчивости к гербициду путем случайного скрининга, замещают другими аминокислотами и тестируют на функциональность и на толерантность к гербициду в бактериальной системе. Сайт-специфический мутагенез с использованием олигонуклеотидов последовательности Protox-1 Arabidopsis осуществляют, применяя набор Transformer Site-Directed Mutagenesis Kit (фирма Clontech, Palo Alto, CA). После подтверждения аминокислотных изменений путем анализа последовательности мутантные плазмиды переносят в штамм SASX38 и высевают в среду L-amp100 для тестирования на функционирование и в различные концентрации ингибирующего протокс гербицида для тестирования на толерантность.
Эту методику применяли к кодону аланина в нуклеотидах 688-690 и к кодону тирозина в нуклеотидах 1306-1308 последовательности протокса Arabidopsis (SEQ ID NO: 1). Эти результаты показывают, что кодон аланина в нуклеотидах 688-690 может быть заменен на кодон валина, треонина, лейцина или цистеина, чтобы получить устойчивый к гербициду фермент протокс, который сохраняет свою функцию. Кроме того, эти результаты показывают, что кодон тирозина в нуклеотидах 1306-1308 может быть заменен на кодон цистеина, изолейцина, лейцина, валина или треонина с той целью, чтобы получить устойчивый к гербициду ферменит протокс, который сохраняет свою функцию.
Пример 26: Демонстрация перекрестной толерантности мутаций устойчивости к различным соединениям, ингибирующим протокс.
Устойчивые мутантные плазмиды, прошедшие селекцию на устойчивость к одному гербициду, тестируют в отношении спектра других ингибирующих протокс соединений. Штамм SASX38, содержащий плазмиду дикого типа, помещают в среду, содержащую определенный интервал концентраций каждого соединения для определения летальной концентрации каждого из них. Устойчивые мутантные плазмиды в SASX38 высевают и определяют способность выживать при концентрации каждого соединения, которая по крайней мере в 10 раз превышает концентрацию, являющуюся летальной для штамма SASX38, содержащего плазмиду дикого типа.
Результаты, полученные при определении перекрестной толерантности, показывают, что каждая из определенных мутаций обусловливает толерантность к различным ингибирующим протокс соединениям. В частности, результаты показывают, что: 1) мутация AraC-lVal обусловливает устойчивость к ингибиторам протокса, включающим соединения формул IV, XI, XIII, XIV, XV и XVII, но не обязательно ограниченных ими; 2) мутация AraC-2Cys обусловливает устойчивость к ингибиторам протокса, включающим соединения формул XI, XIII, XV и XVII, но не обязательно ограниченных ими; 3) мутация MzC-lVal обусловливает устойчивость к ингибиторам протокса, включающим соединения формул XI, XII, XIII, XIV, XV, XVI и XVII, но не обязательно ограниченных ими; 4) мутация pAraC-3Ser обусловливает устойчивость к ингибиторам протокса, включающим бифенокс и соединения формул IV, XII, XIII, XIV, XV и XVII, но не обязательно ограниченных ими.
Пример 27: Получение толерантных к гербицидам растений путем сверхэкспрессии генов протокса растений.
Последовательности, кодирующие Protox-1 Arabidopsis как дикого типа, так и из устойчивых мутантных генов AraC-lVal, вырезают путем частичного разложения с помощью EcoRI и XhoI и клонируют в плазмиде экспрессии растения pCGN1761ENX. Полигенные экспрессирующие кластеры, содержащие гибриды 2X35S-ген Protox, вырезают путем разложения с помощью XbaI и клонируют в бинарном векторе рСIВ200. Эти бинарные плазмиды с протоксом трансформируют путем электропорации в Agrobacterium и затем в Arabidopsis, используя метод вакуумной инфильтрации (Bechtold и др., 1993). Трансформантов селектируют канамицином и получают семенной материал Т2 из многочисленных независимых линий. Этот семенной материал помещают в среду GM, содержащую различные концентрации ингибирующего протокс гербицида, и оценивают прорастание и выживание. Полигенные трансгенные линии, обладающие способностью к сверхэкспрессии либо дикого типа, либо устойчивого мутанта протокса дают значительное количество зеленых проростков на концентрации гербицида, которая является летальной для пустого контрольного вектора.
Различные представленные в настоящем описании модификации изобретения должны быть очевидны для специалистов в данной области техники. Подразумевается, что такие модификации подпадают под объем прилагаемой формулы изобретения.
Реферат
Изобретение относится к генетической инженерии и может быть использовано, например, в селекции растений. Введение молекулы ДНК, кодирующей протопорфириногеноксидазу (протокc) в клетки растений, придает им устойчивость к гербицидам. Последовательности ДНК могут быть использованы также в качестве зондов для тестирования химических соединений на способность ингибировать активность протокса, для идентификации модифицированного протокса, а также для отбора растений, устойчивых к гербицидам. 9 с. и 36 з.п.ф-лы, 2 табл.
Формула

где Q обозначает


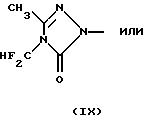


R1 обозначает Н, Сl или F;
R2 обозначает Сl;
R3 обозначает необязательно замещенный простой эфир, тиоэфир, сложный эфир, амино- или алкильную группу и где R2 и R3 вместе могут образовывать 5- или 6-членное гетероциклическое кольцо.








где R обозначает (С2-С6 алкенилокси)карбонил-С1-С4алкил.

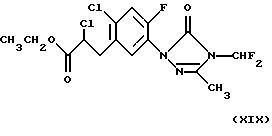
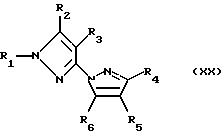

39. Способ тестирования химического соединения на его способность ингибировать активность фермента протокса из трансгенного растения или его потомства, причем это трансгенное растение трансформировано молекулой ДНК по любому из пп. 1-22 и получено способом по любому из пп. 23-30, включающий: (а) объединение фермента протокса и протопорфириногена IX в первой реакционной смеси в условиях, при которых фермент протокс обладает способностью катализировать превращение протопорфириногена IX в протопорфирин IX; (б) объединение химического соединения, фермента протокса и протопорфириногена IX во второй реакционной смеси в таких же условиях, как и для первой реакционной смеси; (в) возбуждение первой и второй реакционных смесей волнами длиной от приблизительно 395 до приблизительно 410 нм; (г) сравнение флуоресценции первой и второй реакционных смесей при длинах волн от приблизительно 622 до приблизительно 635 нм, причем химическое соединение обладает способностью ингибировать активность фермента протокса, если флуоресценция второй реакционной смеси существенно меньше, чем флуоресценция первой реакционной смеси.

Комментарии