Производные 7-фторо-8-хлоро-5н-дибензо[b, е][1, 4]диазепина и их применение - RU2610169C2
Код документа: RU2610169C2
Чертежи




Описание
Изобретение относится к области медицины, а именно к фармакологии и психиатрии, и может быть использовано для изготовления лекарственных средств для лечения терапевтически резистентных форм шизофрении.
Предшествующий уровень техники
В настоящее время психическое здоровье принадлежит к числу наиболее серьезных проблем, стоящих перед всеми странами, поскольку в тот или иной период жизни такие проблемы возникают, по крайней мере, у каждого четвертого человека. Показатели распространенности нарушений психического здоровья в Европейском регионе очень высоки. По данным ВОЗ (2006), из 870 млн человек, проживающих в Европейском регионе, около 4 млн страдают шизофренией; 4 млн - биполярными аффективными расстройствами и 4 млн - паническими расстройствами.
Психические расстройства - вторая (после сердечно-сосудистых заболеваний) по значимости причина бремени болезней. На их долю выпадает 19,5% всех лет жизни, утраченных в результате инвалидности (DALYs - годы жизни, утраченные в связи с болезнью и преждевременной смертью). Психическим расстройствам принадлежит также более 40% всех хронических заболеваний.
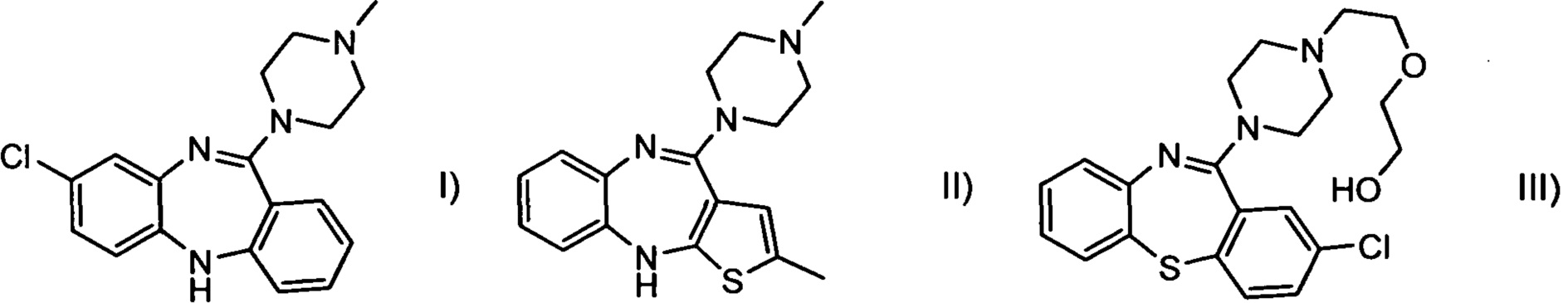
Первые препараты, применявшиеся для фармакотерапии шизофрении - типичные антипсихотики галоперидол, хлорпромазин и др., - характеризуются высокой частотой побочных эффектов со стороны центральной нервной системы (конвульсии, поздняя дискинезия, акатизия), а также со стороны сердечнососудистой (аритмия, ортостатическая гипотензия) и эндокринной системы (набор веса). Моторно-двигательные расстройства вследствие приема классических антипсихотиков зачастую несут необратимый характер, поэтому их применение для лечения шизофрении и биполярного расстройства ограничено, и необходимость уменьшения количества побочных эффектов послужила основной мотиваций для разработки антипсихотиков нового поколения. Первым из таких препаратов стал клозапин (I), разработанный в 1960-х годах, после чего в клинических исследованиях и на рынке появились другие атипичные антипсихотики: аналоги дибензодиазепина оланзапин (II) и кветиапин (III), а также соединения из других структурных классов: рисперидон (IV), зипрасидон (V), арипипразол (VI).


Однако, по данным различных авторов, от 5 до 30% больных шизофренией оказываются резистентными к применению стандартных нейролептиков, терапевтические возможности которых ограничены. Проблема терапевтической резистентности при шизофрении является одной из наиболее актуальных задач современной мировой психиатрии.
К терапевтически резистентным формам шизофрении относят случаи незначительного снижения тяжести продуктивных расстройств или полного отсутствия положительной динамики в состоянии больного после последовательного лечения двумя нейролептиками различных фармакологических групп в течение 6-8 недель в среднетерапевтических или максимально допустимых дозах (Lehman, A.F. et. al., Am J Psychiatry, 2004, 161, 1-56).
На основании анализа данных о клинических предикторах лекарственной резистентности ряду авторов принадлежит чрезвычайно важное с практической точки зрения описание ее различных видов. Предлагается различать: резистентность к антипсихотической терапии, которая наблюдается уже с самого начала ее проведения (прогнозируемая плохая курабельность, первичная резистентность), и резистентность, формирующуюся в процессе лечения (протезируемая недостаточная курабельность, адаптация к психотропным эффектам нейролептиков, вторичная резистентность). Современное переосмысление этого разделения позволяет считать, что первичная резистентность наблюдается при изначальной «злокачественности» течения эндогенного процесса (юношеские формы, непрерывное прогредиентное течение). Вторичная резистентность в большей степени имеет синдромологическую основу. В этом случае «устойчивость» к терапии связана не с особенностями протекания шизофрении, а с формированием хронических симптомокомплексов (хронический бред, различные продуктивные расстройства в структуре дефекта, дефицитарные симптомы).
Патофизиологические механизмы резистентности к антипсихотической терапии пока не определены. Это объясняется не только немногочисленностью, противоречивостью и разобщенностью полученных данных, но и отсутствием четкого представления о сложном патогенезе шизофрении. Обсуждается роль особенностей нарушений в разных звеньях нейромедиаторных систем в различных отделах головного мозга (фармакодинамический фактор), иммунологических и эндокринных факторов. Нельзя недооценивать значение особенностей индивидуальной фармакокинетики, например, снижения биодоступности, а значит и антипсихотической активности, нейролептика из-за индивидуальных особенностей процессов всасывания, метаболизма и выделения. Огромную роль в формировании резистентности играют генетические факторы, лежащие в основе фармакодинамических и фармакокинетических особенностей у резистентных больных. Например, обсуждается значение генов, ответственных за формирование и функционирование дофаминовых, серотониновых и других видов рецепторов; генов ферментов, разрушающих нейромедиаторы; генов ферментов цитохрома Р450; генов белков-переносчиков лекарств.
Выбор терапевтической тактики при резистентности к антипсихотической терапии чрезвычайно сложен. Предложены различные лекарственные и нелекарственные методы лечения терапевтически резистентных форм шизофрении. Это терапия клозапином, электросудорожная терапия, переход к терапии типичным нейролептиком, переход к терапии атипичным нейролептиком, использование высоких и сверхвысоких доз нейролептиков, временная отмена («обрыв») антипсихотической терапии, комбинация нескольких нейролептиков, сочетание антипсихотической и форсированной инсулинокоматозной терапии и другие методы.
Отдельного внимания заслуживают данные о высокой эффективности при лечении больных шизофренией, резистентных к антипсихотической терапии, атипичного нейролептика клозапина. Его эффективность было доказана уже в первых масштабных исследованиях (Kane, J. et. al., Arch Gen Psychiatry, 1988, 45, 789-96) и затем неоднократно подтверждалась. Она была доказана в строго спланированных исследованиях, методика проведения которых полностью соответствовала принципам доказательной медицины (Wahlbeck, К. et.al., Cochrane Database Syst Rev, 2000, CD 000059). Число больных со значительным улучшением состояния при приеме клозапина примерно вдвое превышает их количество при лечении традиционными нейролептиками. Считается, что терапия клозапином приводит к ослаблению продуктивной симптоматики у 30-60% пациентов, резистентных к типичным нейролептикам. Клозапин признан единственным антипсихотическим средством, эффективность которого в резистентных случаях болезни доказана. Существуют определенные разногласия в скорости наступления терапевтического эффекта при использовании клозапина в резистентных случаях шизофрении. По некоторым оценкам, состояние больных улучшается уже через несколько месяцев (Rosenheck, R. et. al., Schizophr Bull, 1999, 25, 709-19). Результаты других исследований свидетельствуют о большей отсроченности наступления терапевтического эффекта (Spina, E. et. al., Psychopharmacology (Berl), 2000, 148, 83-9). Так или иначе, клозапин является единственным нейролептиком, официально рекомендованным к применению при резистентности к другим антипсихотическим средствам. При этом обращает на себя внимание то, что клозапин рекомендован как при первичной, так и при вторичной формах резистентности.
При долговременном применении клозапин позволяет добиться улучшения состояния 60% пациентов с терапевтически резистентными формами шизофрении. Клозапин устраняет как позитивные симптомы шизофрении (бред, слуховые галлюцинации, расстройства мышления), так и негативные симптомы (уплощенный аффект, бедность речи) и когнитивные нарушения.
Основной недостаток клозапина, из-за которого препарат был отозван с рынков некоторых странах в 1975 г., - риск возникновения агранулоцитоза, опасного для жизни состояния, характеризующегося уменьшением количества лейкоцитов и нейтрофилов в крови. Вероятность возникновения агранулоцитоза у пациентов, принимающих клозапин, достигает 0.8% (Alvir, J. M. et. al., N EngI J Med, 1993, 329, 162-7), у 3-4% из них наступает смертельный исход. Применение клозапина для лечения некоторых форм шизофрении было вновь разрешено при условии еженедельного мониторинга количества лейкоцитов и нейтрофилов в крови. Из-за риска агранулоцитоза клозапин применяется только в тех случаях, когда использование других препаратов не приносит результатов. Кроме того, клозапин сложен в управлении вследствие частых случаев вегетативной дисфункции (тахикардия, ортостатизм, сиалорея, запоры), а также значительной седации.
Несмотря на многолетние попытки разработать более эффективное и безопасное средство для лечения шизофрении, превзойти первый в классе атипичный антипсихотик клозапин по эффективности не удалось. В то же время, риск возникновения тахикардии, ортостатизма, седации и агранулоцитоза накладывает существенные ограничения на возможность применения клозапина в клинике.
Сущность изобретения
Задачей настоящего изобретения является создание нового лекарственного средства для лечения терапевтически резистентных форм шизофрении, не уступающего по эффективности клозапину, но при этом не обладающего серьезными побочными эффектами.
Техническим результатом, достигаемым предлагаемым изобретением, является создание эффективного лекарственного средства, применение которого при лечении терапевтически резистентных форм шизофрении позволяет устранить как позитивные симптомы шизофрении (в том числе бред, слуховые галлюцинации, расстройства мышления), так ее и негативные симптомы (включая уплощенный аффект, бедность речи), а также когнитивные нарушения, и применение которого не вызывает серьезных побочных эффектов у пациентов, ограничивающих его применение, в том числе, таких как седация, тахикардия, ортостатизм, агранулоцитоз и сиалорея.
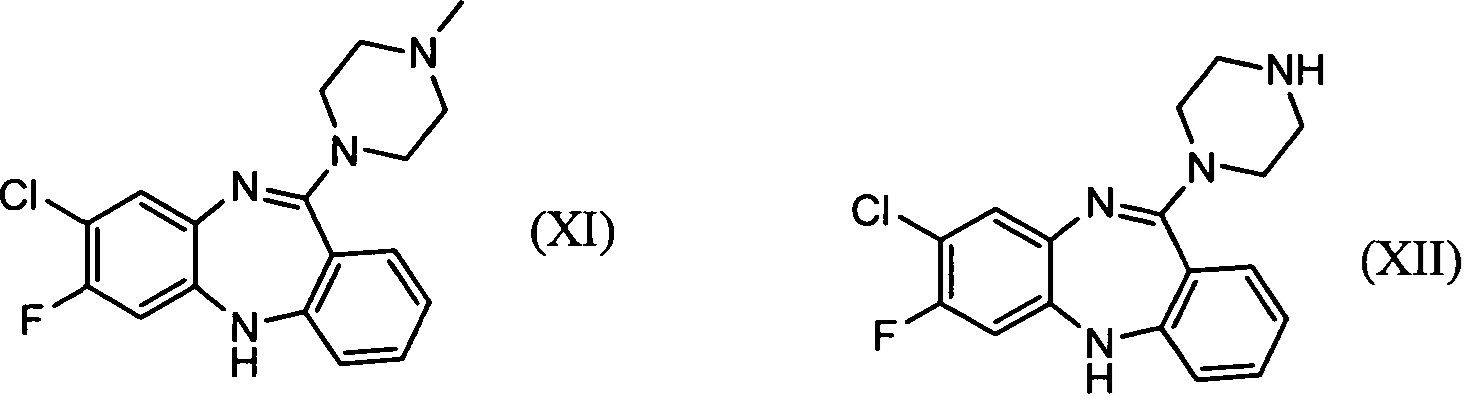
Указанный технический результат достигается путем применения для лечения терапевтически резистентных форм шизофрении 11-(4-метилпиперазин-1-ил)-7-фторо-8-хлоро-5Н-дибензо[b,е][1,4]-диазепина (далее - фторклозапина, FCbo, FC) или 11-(пиперазин-1-ил)-7-фторо-8-хлоро-5Н-дибензо[b,е][1,4]-диазепина (далее -дезметилфторкпозапина, dFClo, DMFC) или фармацевтически приемлемой соли, сольвата или гидрата одного из этих соединений.
Таким образом, согласно настоящему изобретению предлагается применение 11-(пиперазин-1-ил)-7-фторо-8-хлоро-5Н-дибензо[b,е][1,4]диазепина, 11-(4-метилпиперазин-1-ил)-7-фторо-8-хлоро-5Н-дибензо[b,е][1,4]диазепина или фармацевтически приемлемой соли, сольвата или гидрата одного из этих соединений для изготовления лекарственного средства для лечения терапевтически резистентных форм шизофрении.
Еще одним объектом изобретения является фармацевтическая композиция для лечения терапевтически резистентных форм шизофрении, содержащая в качестве активного компонента 11-(пиперазин-1-ил)-7-фторо-8-хлоро-5Н-дибензо[b,е][1,4]диазепин или 11-(4-метилпиперазин-1-ил)-7-фторо-8-хлоро-5Н-дибензо[b,е][1,4]диазепин или фармацевтически приемлемую соль, сольват или гидрат одного из указанных соединений в терапевтически эффективном количестве.
В некоторых вариантах осуществления изобретения фармацевтическая композиция содержит от 50 до 600 мг активного компонента.
В некоторых вариантах осуществления изобретения фармацевтическая композиция содержит в своем составе один или несколько компонентов из следующего списка:
- лактоза (молочный сахар);
- крахмал;
- поливинилпирролидон (повидон);
- кремния диоксид коллоидный (аэросил);
- магния стеарат;
- тальк;
- лауриновая кислота;
- гидроксианизол;
- масло растительное.
В некоторых вариантах осуществления изобретения фармацевтическая композиция содержит от 0,5 до 99,9% активного компонента.
Некоторые варианты осуществления изобретения относятся также к фармацевтическим композициям в форме таблетки, капсулы, раствора для инъекций, спрея, трансдермальной терапевтической системы или в виде свечей.
Краткое описание рисунков
Рис. 1. - Кривые зависимости расстояния, пройденного мышами (n=8) после приема различных доз клозапина (Clo), дезметилклозапина (dClo), фторклозапина (FClo) и дезметилфторклозапина (dFClo).
Рис. 2 - Кривые зависимости функционального отклика (относительного уровня вторичных мессенджеров в клетке) от концентрации испытуемых соединений (dFClo - дезметилфторклозапин, FClo - фторклозапин) в тестовой системе in vitro для рецептора М1.
Рис. 3 - Площадь под фармакокинетической кривой «концентрация-время» фторклозапина (FClo) и дезметилфторклозапина (dFClo) в тканях и органах (плазма, мозг, сердце, мышцы, печень, почки, кожа) крыс Sprague Dawley (n=6) после перорального однократного приема фторклозапина в дозе 10 мг/кг.
Рис. 4 - Действие клозапина (рис. 4А) и фторклозапина (рис. 4В) на вызванное приемом кетамина ингибирование предстимульного торможения. Зависимость процента ингибирования от интенсивности предстимула (в децибелах) для различных доз исследуемых препаратов, положительного контроля (Контроль) и отрицательного контроля (Кетамин).
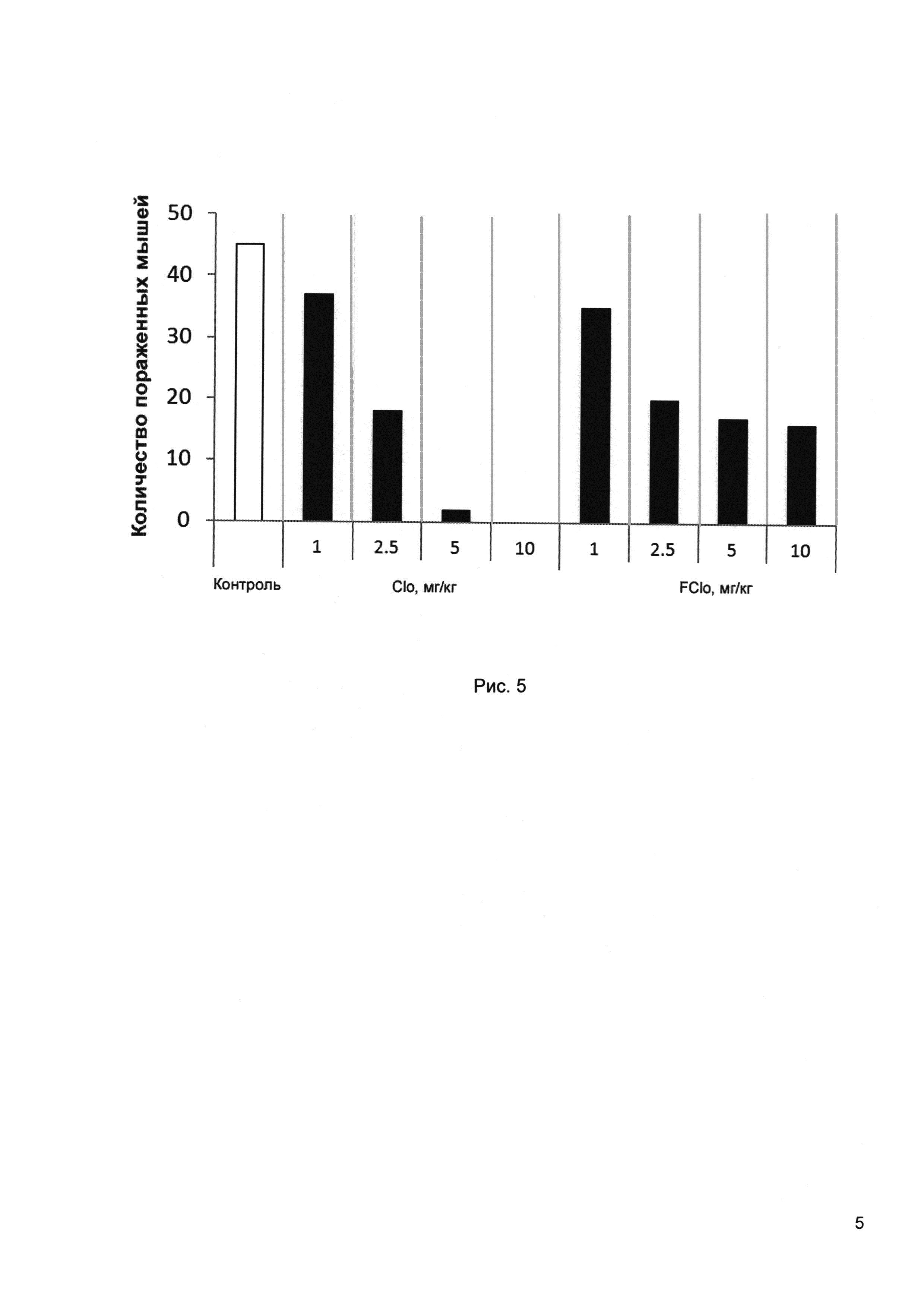
Рис. 5 - Общее количество животных со встряхиванием под воздействием 5-окситриптофана в экспериментах по антигаллюцинаторной активности для разных доз клозапина (Clo) и фторклозапина (FClo).
Термины и определения
Согласно изобретению, под терапевтически резистентными формами шизофрении (шизофренией, резистентной к антипсихотической терапии) понимаются случаи незначительного снижения тяжести продуктивных расстройств или полного отсутствия положительной динамики в состоянии больного после последовательного лечения двумя нейролептиками (антипсихотиками) различных фармакологических групп в течение 6-8 недель в среднетерапевтических или максимально допустимых дозах. При этом под такими нейролептиками (антипсихотиками), подразумеваются, в частности, лечение оланзапином, кветиапином, галоперидолом, рисперидоном, зуклопентиксолом, перфеназином.
Неограничивающими примерами типов и подтипов шизофрении, для лечения резистентных форм которых предназначено изобретение, являются параноидный, дезорганизованный, кататонический, недифференцированный и резидуальный типы шизофрении, шизофреноформное расстройство, шизоаффективное или шизотипическое расстройство.
Примерами резистентности, ограничивающей применение существующих антипсихотических препаратов, является резистентность, связанная с невозможностью сформировать ремиссию, или невозможностью получить ожидаемый терапевтический ответ, или с невозможностью достижения терапевтического ответа из-за наличия значимых побочных эффектов, в частности, когда применение антипсихотических препаратов ограничено из-за возникновения или обострения побочных эффектов, связанных с принимающимся лекарственным средством.
К побочным эффектам, ограничивающим применение антипсихотических препаратов, относятся агранулоцитоз, седация, когнитивные нарушения, такие как нарушение внимания, разных аспектов памяти, проявления вегетативной дисфункции, такие как тахисистолия, ортостатизм, нарушение аккомодации, нарушение функции ЖКТ, мочеиспускания, набор веса, поведенческая токсичность, такая как нарушение координации движений, рассеянность, эпизоды сонливости, слюнотечение.
Используемый в настоящем документе термин «фармацевтически приемлемые соли» включает соли активных соединений, которые получены с помощью относительно нетоксичных кислот или оснований. Примерами фармацевтически приемлемых нетоксичных солей могут служить соли, образованные неорганическими кислотами, такими как соляная, бромоводородная, фосфорная, серная и хлорная кислоты, или органическими кислотами, такими как уксусная, щавелевая, малеиновая, винная, янтарная, лимонная или малоновая кислоты, или полученные другими методами, используемыми в данной области, например, с помощью ионного обмена. К другим фармацевтически приемлемым солям относятся адипинат, альгинат, аскорбат, аспартат, бензолсульфонат, бензоат, бисульфат, борат, бутират, камфорат, камфорсульфонат, цитрат, циклопентанпропионат, диглюконат, додецилсульфат, этансульфонат, формиат, фумарат, глюкогептонат, глицерофосфат, глюконат, гемисульфат, гептанат, гексанат, гидройодид, 2-гидрокси-этансульфонат, лактобионат, лактат, лаурат, лаурил сульфат, малат, малеат, малонат, метансульфонат (мезилат), 2-нафталинсульфонат, никотинат, нитрат, олеат, оксалат, пальмитат, памоат, пектинат, персульфат, 3-фенилпропионат, фосфат, пикрат, пивалат, пропионат, полуфумарат, стеарат, сукцинат, сульфат, тартрат, тиоцианат, п-толуолсульфонат (тозилат), ундеканат, валериат и подобные.
Под «сольватом» понимается ассоциация или комплекс одного или нескольких молекул растворителя и соединения по изобретению. Примеры растворителей, образующих сольваты, включают, но ими не ограничиваются, воду, изопропанол, этанол, метанол, ДМСО, этилацетат, уксусную кислоту и этаноламин. Термин «гидрат» относится к комплексу, где молекулой растворителя является вода.
Изобретение также относится с фармацевтическим композициям, которые содержат, по меньшей мере, одно из описанных здесь соединений (или пролекарственную форму, фармацевтически приемлемую соль или другое фармацевтически приемлемое производное) и один или несколько фармацевтически приемлемых носителей, растворителей и/или наполнителей. Данные композиции также могут содержать один или несколько дополнительных терапевтических агентов. Кроме того, соединение данного изобретения может быть введено пациенту, нуждающемуся в соответствующей терапии, в комбинации с одним или более других терапевтических средств.
Фармацевтические композиции, заявляемые в данном изобретении, содержат соединения данного изобретения совместно с фармацевтически приемлемыми носителями, которые могут включать в себя любые растворители, разбавители, дисперсии или суспензии, поверхностно-активные вещества, изотонические агенты, загустители и эмульгаторы, консерванты, вяжущие вещества, смазочные материалы и т.д., подходящие для конкретной формы дозирования. За исключением таких случаев, когда среда обычных носителей несовместима с соединением изобретения, например, при появлении любых нежелательных биологических эффектов и иных нежелательных взаимодействий с любым другим компонентом (компонентами) фармацевтической композиции, использование таких композиций находится в рамках данного изобретения. Материалы, которые могут служить фармацевтически приемлемыми носителями, включают, но не ограничиваются, моно- и олигосахаридами, а также их производными; солодом, желатином; тальком; эксципиентами, такими как: какао-масло и воск для суппозиториев; масла, такие как арахисовое, хлопковое, сафроловое, кунжутное, оливковое, кукурузное и соевое масло; гликоли, такие как пропиленгликоль; сложные эфиры, такие как этилолеат и этиллаурат; агар; буферные вещества, такие как гидроксид магния и гидроксид алюминия; альгиновая кислота; апирогенная вода; изотонический раствор, раствор Рингера; этиловый спирт и фосфатные буферные растворы. Также в составе композиции могут быть другие нетоксичные совместимые смазочные вещества, такие как лаурилсульфат натрия и стеарат магния, а также красители, разделительные жидкости, пленкообразователи, подсластители, вкусовые добавки и ароматизаторы, консерванты и антиоксиданты.
Предметом данного изобретения являются также лекарственные формы - класс фармацевтических композиций, состав которых оптимизирован для определенного пути введения в организм в терапевтически эффективной дозе. Лекарственные композиции данного изобретения могут быть введены в организм орально, местно, ректально, внутриглазным способом, пульмональным, например, в виде ингаляционного спрея, или внутрисосудистым способом, интраназально, интраперитонально, подкожно, внутримышечно, интрастернально, трансдермально, а также инфузионным способом, в рекомендованных дозировках.
Лекарственная форма данного изобретения может содержать соединение описанной здесь формулы или его фармацевтически приемлемую соль, сольват или гидрат и любой фармацевтически приемлемый носитель, адъювант или растворитель. Термин «фармацевтически приемлемый носитель или адъювант» означает носитель или адъювант, который может быть введен в организм пациента совместно с соединением, составляющем суть данного изобретения, и который не разрушает фармакологической активности этого соединения, и является нетоксичным при введении в дозах, достаточных для доставки терапевтического количества соединения.
Лекарственные формы данного изобретения могут содержать составы, полученные методами использования липосом или микрокапсуляционные методы, методами приготовления наноформ препарата, и прочие примеры, известные в фармацевтике.
Подробное описание изобретения
По современным представлениям, основной причиной агранулоцитоза является образование токсичных метаболитов соединений под действием миелопероксидазы -фермента, продуцируемого активированными нейтрофилами во время воспалительной реакции, и отвечающего за образование хлорноватистой кислоты (Guest, I. et. al., Med Hypotheses, 1999, 53, 145-51). Ни клозапин (I), ни его основные стабильные метаболиты N-оксид клозапина (VIII) и N-дезметилклозапин (VII) сами по себе нетоксичны (Williams, D. Р. et. al., J Pharmacol Exp Ther, 1997, 283, 1375-82). Однако окисление клозапина под действием миелопероксидазы и перекиси водорода приводит к образованию нитрения клозапина (IX) - крайне реакционноспособного соединения, токсичность которого обусловлена способностью необратимо связываться с макромолекулами клетки (Liu, Z. С.et. al„ J Pharmacol Exp Ther, 1995, 275, 1476-83).

Точный механизм окисления клозапина не установлен: в присутствии насыщающих концентраций глутатиона наиболее реакционноспособными являются положения 6 и 9 бензольного цикла (Williams, D.P. et. al., J Pharmacol Exp Ther, 1997, 283, 1375-82). С другой стороны, исследования метаболитов клозапина, образующихся в организме человека, показали, что наиболее распространенные метаболические пути включают гидроксилирование по позиции 7 и образование соединений (X) (Dain, J.G. et. al., Drug Metab Dispos, 1997, 25, 603-9; Schaber, G. et. al., Drug Metab Dispos, 2001, 29, 923-31).
В соединениях фторклозапин (XI) и дезметилфторклозапин (XII), раскрытых в настоящем изобретении, водород при атоме С в положении 7 замещен на фтор.
В результате проведенных нами исследований неожиданно было обнаружено, что введение фтора в позицию 7 в молекулах клозапина и N-дезметилклозапина предотвращает образование их токсичных метаболитов в организме человека. Вероятнее всего, существенное снижение токсичности связано с тем, что введение фтора в позицию 7 предотвращает наиболее вероятный путь окисления бензодиазепинового ядра в организме человека. Кроме того, акцепторные свойства введенного заместителя уменьшают реакционную способность иона нитрения, и следовательно, приводят к уменьшению токсичности продуктов окисления соединений и их метаболитов по сравнению с клозапином и N-дезметилклозапином.
Применение эффективных атипичных антипсихотических препаратов, таких как клозапин, кветиапин, рисперидон, оланзапин и др., связано с риском возникновения нежелательных побочных эффектов, обусловленных способностью активных компонентов связываться с сигнальными рецепторами, не являющимися основными мишенями.
К побочным эффектам, вызванным связыванием с сигнальными рецепторами, относятся седация, когнитивные нарушения (нарушение внимания и разных аспектов памяти), проявления вегетативной дисфункции (тахисистолия, ортостатизм, нарушение аккомодации, нарушение функции ЖКТ, мочеиспускания), набор веса, поведенческая токсичность (нарушение координации движений, рассеянность, эпизоды сонливости).
Доклинические и клинические исследования селективных лигандов рецепторов, сопряженных с G-белком (GPCR), позволяют связать побочные эффекты с действием на отдельные рецепторы. В результате функциональных исследований, проведенных на рецепторной панели in vitro, нами было обнаружено, что введение атома фтора существенным образом изменяет взаимодействие с гистаминовыми, мускариновыми и допаминовыми рецепторами, что существенно снижает риск ряда прямых побочных эффектов, ограничивающих применение клозапина.
В то же время, проведенные исследования неожиданно показали, что введение атома фтора в положении 7 молекулы клозапина, а также его активного метаболита - дезметилклозапина - не оказывает отрицательного влияния на уникальную клиническую эффективность, присущую только клозапину, позволяющую использовать его при лечении терапевтически резистентных форм шизофрении, чего не удавалось достичь исследовательским группам, которые пытались модифицировать клозапин в других, зачастую сразу в нескольких, направлениях.
Возможность объективного проявления технического результата при использовании изобретения подтверждена достоверными данными, приведенными в примерах, содержащих сведения экспериментального характера, полученные в процессе проведения исследований по методикам, принятым в данной области. Сущность изобретения также поясняется рисунками.
Пример 1
Снижение риска агранулоцитоза
Положительный эффект от введения фтора наблюдался в доклинических исследованиях субхронической токсичности. В настоящее время не существует достоверных методов предсказать риск агранулоцитоза по гематологической токсичности in vitro; животной модели индуцированного клозапином агранулоцитоза также не существует. Известно, что введение клозапина кроликам приводит к увеличению выхода нейтрофилов из костного мозга и уменьшением времени их циркуляции в крови (Iverson, S. et. al., Chem Res Toxicol, 2010, 23, 1184-91). Этот эффект сходен с нейтропенией, проявляющейся в начале терапии у многих пациентов, принимающих клозапин, и в большинстве случаев не развивающейся до своей тяжелой формы - агранулоцитоза. Увеличение количества нейтрофилов наблюдалось в крысах после приема аминоглютетимида, который также характеризуется высоким риском возникновения агранулоцитоза (Ng, W. et. al., Chem Res Toxicol, 2013, 26, 1272-81). Таким образом изменения кинетики нейтрофилов после приема препарата могут служить биомаркером для предсказания риска агранулоцитоза.
В рамках сравнительных испытаний субхронической токсичности была изучена кинетика нейтрофилов. Исследования были проведены на крысах при внутрижелудочном введении субстанций в дозе 5 мг/кг. Исследуемые субстанции вводили ежедневно в течение 28 дней. Каждая экспериментальная группа содержала по 10 животных каждого пола.
Анализ показателей морфологического состава крови у животных из опытных групп показал существенное увеличение количества циркулирующих нейтрофилов в крови крыс, принимавших клозапин. Количество нейтрофилов в периферической крови крыс, принимавших фторклозапин и дезметилфторклозапин, существенно меньше отличалась от контрольной группы.
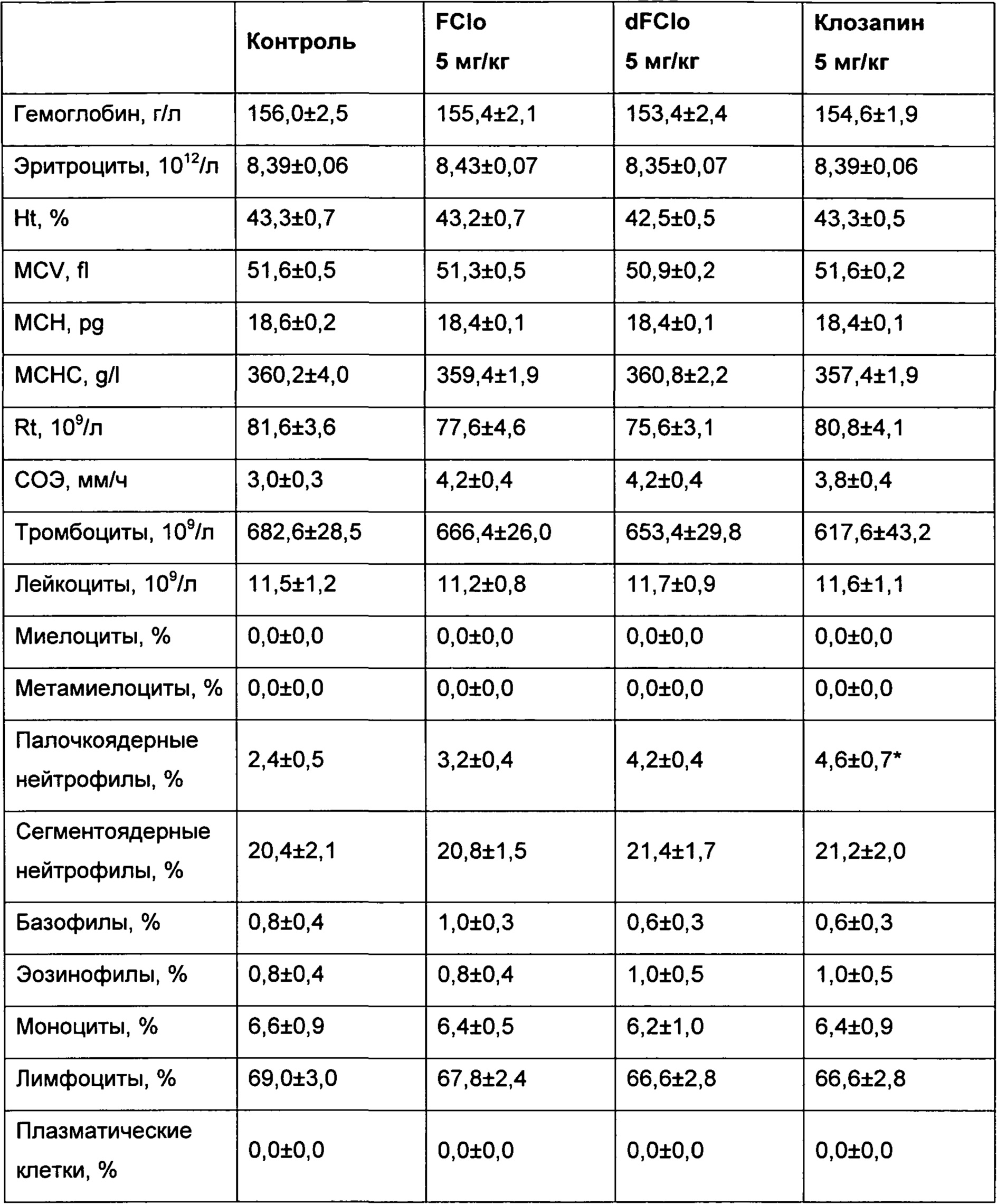
Таким образом, введение заместителя фтора в дибензодиазепиновое ядро приводит к снижению риска агранулоцитоза за счет блокирования путей, ведущих к образованию токсических метаболитов.
Пример 2
Уменьшение седации
Седация является общим побочным эффектом антигистаминов - антагонистов гистаминового рецептора Н1, проникающих через гематоэнцефалический барьер. Седативный эффект является причиной использования антигистаминов дифенгидрамина (димедрола) и доксиламина как средств против бессонницы. Седация, обусловленная действием на гистаминовые рецепторы, является побочным эффектом большинства антипсихотических препаратов. Так, прием клозапина увеличивает риск седации в 8.8 раз, прием оланзапина - в 3.3 раза, кветиапина - в 3.7 раз (Leucht, S. et. al., Lancet, 2013, 382, 951-62). Уменьшение связывания с рецепторами Н1 служило мотивацией для разработки новых антипсихотических препаратов (заявка PCT/IB 2003/003583, Ell Lilly And Company, опубл. 19.02.2004).
Из уровня техники известно, что соединение дезметилфторклозапин связывается с гистаминовыми рецепторами (заявка PCT/RU 2011/000869, ООО «Валентек», опубл. 16.05.2013). Однако сравнить прочность связывания клозапина, норклозапина и их фторированных аналогов по приведенным в заявке данным нельзя, поскольку уже в 1 рМ концентрации наблюдалось блокирование рецептора, близкое к 100%. Кроме того, раскрытые данные относились лишь к прочности взаимодействия молекул лиганда и рецептора, и не позволяли сделать каких-либо выводов о том, к какому клеточному ответу приводит такое взаимодействие. Так, известно, что, связываясь с рецептором, лиганд в одних условиях может вызывать активацию сигнального пути, либо не активировать рецептор и поэтому блокировать действие эндогенного активатора, либо активировать сигнальный путь, отличающийся от активируемого эндогенным лигандом.
В функциональных экспериментах было изучено взаимодействие фторклозапина (FClo), дезметилфторклозапина (dFClo), клозапина (Clo) и дезметилклозапина (dClo) с гистаминовыми рецепторами. Функциональная активность соединений на рецепторе Н4 определялась по изменению проводимости клетки, вызванному перераспределением внутриклеточного кальция. Для рецептора Н1 активность определялась по флуоресценции добавленного в клетки индикатора Fluo-4 NW, вызванной изменением концентрации ионов Са2+ в цитозоле.
Функциональные эксперименты выполняли в постановке агонизма и антагонизма. В постановке агонизма исследуемое вещество добавлялось непосредственно к клеткам, экспрессирующим рецептор и определялась зависимости интенсивности отклика от концентрации вещества. Мерой активности агонистов служила концентрация, при которой достигалась половина максимального отклика (ЕС50).
В постановке антагонизма оценивалась способность исследуемых веществ блокировать действие агонистов. Для этого клетки инкубировались с испытуемыми веществами, после этого в систему добавлялись референсные агонисты, и определялся функциональный отклик. Мерой активности антагонистов служила концентрация, при которой отклик на агонист блокировался на 50% (IC50).

По результатам исследования неожиданно выяснилось, что фторклозапин и дезметилфторклозапин существенно слабее блокируют рецептор Н1, и таким образом, предположительно вызывают меньшую седацию.
Результаты экспериментов in vitro подтверждаются исследованиями седации. Фторклозапин, дезметилфторклозапин, клозапин и дезметилклозапин перорально вводились мышам CF-1 перорально в дозах 1, 5 и 10 мг/кг (8 животных в каждой группе). Общее расстояние, пройденное животными, значительно уменьшалось при введении клозапина (рис. 1), что свидетельствует о седативном эффекте препарата. Седация при введении фторклозапина была существенно меньше. Дезметилфторклозапин в дозе 10 мг/кг вызывал несущественное уменьшение двигательной активности.
Таким образом, фторклозапин и дезметилфторклозапин обладают существенно меньшим седативным эффектом по сравнению с клозапином и дезметилклозапином.
Пример 3
Уменьшение сиалореи
Побочным эффектом агонистов мускаринового рецептора М4 является интенсивное слюноотделение (сиалорея). Сиалорея возникает у 30% пациентов, принимающих клозапин (Ben-Aryeh, Н. et. al., Biol Psychiatry, 1996, 39, 946-9), и является одной из основных причин отказа от приема препарата.
Известно, что дезметилклозапин и его аналоги связывается с рецепторами М1, М2, М3 (заявка PCT/US 2007/018201, Acadia Pharmaceuticals, Inc., опубл. 21.02.2008). Однако связывание дезметилклозапина с рецептором М4 охарактеризовано не было.
В функциональных экспериментах было изучено связывание фторклозапина (FClo), дезметилфторклозапина (dFClo), клозапина (Clo) и дезметилклозапина (dClo) с мускариновым рецептором М4. Для рецептора были построены кривые зависимости отклика от концентрации соединения, критерием отклика являлся уровень вторичного мессенджера - цАМФ, определяемого по флуоресценции после лизиса клетки, экспрессирующей рецептор.

Исследования показали, что в отличие от своих аналогов, фторированные клозапин и дезметилклозапин неожиданно слабо связывались с М4-рецепторами. Активирующая концентрация фторклозапина (16 мкМ) выходила за пределы терапевтически достижимых концентраций, активирующая концентрация дезметилфторклозапина (3,2 мкМ) в 30 раз превышала активирующую концентрацию норклозапина.
Таким образом, неожиданно слабое взаимодействие фторпроизводных с мускариновым рецептором М4 предположительно уменьшает интенсивность сиалореи.
Пример 4
Снижение риска возникновения экстрапирамидальных расстройств
Побочными эффектами антипсихотических препаратов являются во многих случаях необратимые нейролептические экстрапирамидальные расстройства (ЭПР). Риск возникновения ЭПР коррелирует со степенью блокады допаминовых рецепторов D2 (КпаЫе, М. В. et. al., Psychiatry Res, 1997, 75, 91-101). Наиболее вероятно возникновение ЭПР у пациентов, принимающих классические нейролептики (галоперидол, хлорпромазин) и некоторые атипичные антипсихотики (зипрасидон, рисперидон) (Leucht, S. et. al., Lancet, 2013, 382, 951-62). Поскольку прямое действие антипсихотических препаратов направлено на близкие по структуре рецепторы D4, соотношение связывания D4/D2 определяет ширину терапевтического окна препарата и максимальную клинически переносимую дозу.
Расширение терапевтического окна препаратов за счет изменения соотношения связывания с рецепторами D4 и D2 служило мотивацией для разработки антипсихотических препаратов. В патенте США №5538965 раскрыты лиганды допаминовых рецепторов, в которых селективность к рецептору D4 увеличена за счет введения объемного заместителя в пиперазиновый цикл.
Размеры терапевтического окна для клозапина и его фторпроизводных оценивалось по соотношению констант связывания (Kb) с допаминовыми рецепторами D2 и D4, которые были определены по значениям IC50 для соответствующих рецепторов в постановке антагонизма. Отклик на клетках, экспрессирующих рецепторы D2, определялся по изменению проводимости клетки, вызванному перераспределением внутриклеточного кальция. Для рецептора D4 критерием отклика являлся уровень вторичного мессенджера - цАМФ. Константы связывания кветиапина, оланзапина, рисперидона и галоперидола с рецепторами D2 и D4 взяты из базы данных ChemBL (https://www.ebi.ac.uk/chembl/, доступ 15.01.2014 г), использованы геометрические средние соответствующих значений.

Из приведенной таблицы видно, что фторклозапин и дезметилфторклозапин обладают высокой D4-блокирующей активностью при низкой D2-блокирующей активности.
Более того, сравнение полученных нами данных с аналогичными данными для применяемых в клинике антипсихотических препаратов (см. таблицу) показывает, что по ширине терапевтического окна фторпроизводные клозапина неожиданно существенно превосходят другие антипсихотические препараты.
Эти данные позволяют предположить, что применение фторклозапина и дезметилфторклозапина приведет к снижению вероятности возникновения ЭПР при сохранении антипсихотической активности.
Пример 5
Устранение когнитивных нарушений при шизофрении
Известно, что активация мускаринового рецептора М1 обладает прокогнитивным эффектом. Так, агонисты мускаринового рецептора М1 исследуются в клинических испытаниях для устранения когнитивных нарушений и модификации течения заболеваний в болезни Альцгеймера (Fisher, A., Neurotherapeutics, 2008, 5, 433-42) и шизофрении (Shekhar, A. et. al., Am J Psychiatry, 2008, 165, 1033-9).
Нами были проведены функциональные исследования способности фторклозапина и дезметилфторклозапина активировать рецепторы М1. Активность определялась по флуоресценции добавленного в клетки индикатора Fluo-4 NW, вызванной изменением концентрации ионов Са2+ в цитозоле.
Полученные нами кривые зависимости отклика от концентрации для рецептора М1 показывают, что дезметилфторклозапин является агонистом, и вызывает существенный отклик в терапевтическом интервале концентраций (рис. 2). В том же эксперименте фторклозапин практически не оказывает действия на рецепторы М1.
Был изучен метаболизм и распределение фторклозапина в тканях. Концентрация фторклозапина и дезметилфторклозапина была определена в тканях и органах (плазма, мозг, сердце, мышцы, печень, почки, кожа) крыс Sprague Dawley (n=6) после перорального однократного приема фторклозапина в дозе 10 мг/кг (рис. 3). Исследования метаболизма показали, что в организме крыс фторклозапин метаболизируется до дезметилфторклозапина, причем в мозге концентрации фторклозапина и его метаболита дезметилфторклозапина сопоставимы.
Таким образом, из проведенных экспериментов следует, что после приема фторклозапина его основной метаболит присутствует в мозге в концентрации, способной вызвать активацию мускариновых рецепторов, и фторпроизводные клозапина могут быть использованы для терапии когнитивных нарушений при шизофрении.
Пример 6
Антипсихотическое действие фторклозапина и дезметилфторклозапина в экспериментах in vivo
Антипсихотическое действие фторклозапина и дезметилфторклозапина было исследовано в экспериментах по предстимульному торможению акустической стартл-реакции. Предстимульное торможение (prepulse inhibition, PPI) - снижение моторной реакции организма на сильный резкий стимул, обычно звуковой, при наличии слабого предварительного стимула. Предстимульное торможение является индикатором сенсоромоторной фильтрации, отражающим способность ЦНС фильтровать сенсорную информацию. Снижение предстимульного торможения наблюдается при шизофрении и может быть смоделировано приемом агонистов дофаминовых рецепторов (апоморфина) или приемом антагонистов NDMA (кетамина). Изучение предстимульного торможения акустической стартл-реакции является общепринятым тестом для установления антипсихотической активности.
Активность дезметилфторклозапина в экспериментах по предстимульному торможению раскрыта в патенте RU 2441867 С2, опубл. 10.02.2012 (пример 2). Были проведены дополнительные исследования антипсихотических свойств фторклозапина в экспериментах по предстимульному торможению на мышах. В день тестирования животным вводили исследуемое вещество (клозапин или фторклозапин в дозах 5 и 10 мг/кг) и через 25 минут - кетамин интраперитонально в дозе 50 мг/кг. Через 5 минут после введения кетамина животных помещали в камеры для определения акустической стартл-реакции. После 5 мин акклиматизации с белым фоновым шумом 65 дБ, животных подвергали воздействию блока из шести 40-мс 120 дБ звуковых импульсов, со средним промежутком между импульсами 15 секунд (интервал 7-23 секунды) для того, чтобы оценить интенсивность начального стартл-рефлекса.
В следующем блоке испытаний мышей случайно подвергали одному из трех воздействий:
а. предварительный импульс продолжительностью 20 мс и интенсивностью 4, 8, 12 и 15 дБ, превышающий фоновый шум (т.е. 69 дБ, 71 дБ, 77дБ, 81дБ), затем, через 100 мс, - шумовой импульс интенсивностью 120 дБ;
b. шумовой импульс интенсивностью 120 дБ без предварительного импульса;
с. фоновый шум без дополнительных стимулов.
Мышей подвергали каждому из воздействий 10 раз. В финальном блоке испытаний животных подвергали воздействию блока из шести 40-мс 120 дБ звуковых импульсов.
Разница между откликом на серию из 6 первых и последних звуковых импульсов показывает привыкание к воздействию. Такая адаптация является формой неассоциативного обучения, в котором после продолжительного воздействия наблюдается снижение отклика. Интенсивность препульсного ингибирования рассчитывается по формуле:

где
АСРа - суммарная амплитуда акустического стартл-рефлекса (АСР) после воздействия а (предварительный импульс и основной шумовой импульс),
ACPb - амплитуда акустического стартл-рефлекса после воздействия b (шумовой импульс без предварительного импульса).
Результаты экспериментов РР1 представлены на рис. 4. По результатам экспериментов клозапин и фторклозапин продемонстрировали статистически достоверное дозозависимое восстановление вызванного кетамином нарушения РР1. Клозапин в дозе 10 мг/кг полностью восстанавливал PPI. Активность FClo в дозе 10 мг/кг была сопоставима с активностью клозапина в дозе 5 мг/кг.
Таким образом, из проведенных экспериментов следует, что фторклозапин и дезметилфторклозапин сопоставимы с клозапином по своему антипсихотическому действию.
Пример 7
Антигаллюцинаторное действие фторпроизводных клозапина
Известно, что предшественник серотонина (5-окситриптофан, 5-ОТ) вызывает у мышей характерный гиперкинез в виде резких встряхиваний головой (twitches) средней продолжительностью 30-60 минут, что объясняется активацией серотонинергической системы ЦНС. Было исследовано влияние фторпроизводных клозапина на выраженность 5-окситриптофанового гиперкинеза у мышей. Каждая экспериментальная группа включала 10 особей мышей самцов с массой тела 20-22 г. Исследуемые вещества вводили внутрижелудочно в дозах 1.0, 2.5, 5.0 и 10.0 мг/кг за 30 минут до введения 5-окситриптофана в дозе 300 мг/кг внутрибрюшинно. Подсчитывали число встряхиваний головой за 1 минуту с интервалами 10 минут в течение 60 минут.
Наиболее выраженное угнетение встряхиваний, вызванных приемом 5-ОТ, наблюдалось для клозапина и фторклозапина (рис. 5). Для субстанции фторклозапина этот эффект прослеживался при введении в диапазоне доз от 1,0 мг/кг до 10,0 мг/кг. Дозозависимый эффект имел место в диапазоне доз от 1,0 мг/кг до 5,0 мг/кг, после чего выходил на «плато».
Таким образом, полученные данные свидетельствуют о наличии у изучаемых соединений центрального серотонинблокирующего действия, что подтверждает их антигаллюцинаторное действие.
В ходе проведенного дополнительного исследования активности фторклозапина и дезметилфторклозапина на панели терапевтически релевантных рецепторов, сопряженных с G-белками, была обнаружена относительно слабая активность по отношению к семейству адренергических рецепторов. В совокупности с результатами предварительных токсикологических исследований, полученные данные свидетельствуют об уменьшении риска появления вегетативных дисфункций, таких как тахисистолия, ортостатизм, нарушение аккомодации, нарушение функции ЖКТ, мочеиспускания, набор веса, нарушение координации движений.
Синтез фторклозапина и дезметилфторклозапина
11-(4-метилпиперазин-1-ил)-7-фторо-8-хлоро-5Н-дибензо[b,е][1,4]диазепин (фторклозапин) может быть синтезирован из 11-амино-7-фторо-8-хлоро-5Н-дибензо[b,е][1,4]диазепина по следующей схеме:

В 2-хлитровой плоскодонной колбе, снабженной магнитной мешалкой и обратным холодильником, прибавляют 64,9 г соединения 1 в 450 мл диэтилового эфира. К полученной суспензии прибавляют 124 мл 3 М HCl в диоксане. Реакционную массу перемешивают 30 мин. Образовавшиеся кристаллы отфильтровывают, отжимают и промывают на фильтре двумя порциями по 150 мл диэтилового эфира. Выход 2 73 г, 98% от теоретического.
В 2-хлитровой плоскодонной колбе, снабженной магнитной мешалкой и обратным холодильником, растворяют 98 г соединения 2 в смеси толуол:дмсо = 490:490 мл, прибавляют 291,7 мл метилпиперазина. Прибор продувают аргоном, убирают подачу инертного газа с баллона, (оставляя шар заполненный аргоном) и кипятят 36 ч. ТСХ-контроль (дихлорметан:метанол = 20:1).
Выливают реакционную массу в воду и трижды экстрагируют этилацетатом порциями по 150 мл. Объединенный органический слой промывают тремя порциями воды по 150 мл. Сушат над сульфатом натрия и отгоняют растворитель на РПИ. В кубовый остаток прибавляют 500 мл метанола, перемешивают на МПУ 10 мин. Выпавшие кристаллы отфильтровывают, отжимают на фильтре и промывают 100 мл метанола на фильтре.
Продукт 3 очищают перекристаллизацией из метанола с активированным углем, рассчитывая объем растворителя на 1 г продукта-15 мл метанола и 10% массы соединения 3 активированного угля. Выход 3 59 г 61%.1H NMR (DMSO-d6, 400 MHz) δ, м.д. 2.198 (s, 3Н, N-СН3), 2.371 (br. s, 4H, 2 СН2 piperazine), 3.286 (br. s, 4H, 2 СН2 piperazine), 6.886 (d, 1H, J=10,4 Hz), 6.954 (d, 1H, J=8,0 Hz), 7.00-7.04 (m (d+t), 2H), 7.188 (d, 1H, J=8,0 Hz), 7.3-7.37 (m (s+t), 2H).
11-(пиперазин-1-ил)-7-фторо-8-хлоро-5Н-дибензо[b,е][1,4]диазепин (дезметилфторклозапин) может быть синтезирован из 11-амино-7-фторо-8-хлоро-5Н-дибензо[b,е][1,4]диазепина по следующей схеме:

В 2-хлитровой плоскодонной колбе, снабженной магнитной мешалкой и обратным холодильником, растворяют 63 г соединения 2 в смеси толуол:дмсо = 315:315 мл, прибавляют 145,6 г пиперазина. Прибор продувают аргоном, убирают подачу инертного газа с баллона, (оставляя шар заполненный аргоном) и кипятят реакционную массу 36 ч. ТСХ-контроль (дихлорметан:метанол = 20:1). Затем смесь охлаждают до комнатной температуры, и выливают в 2 л воды. Экстрагируют тремя порциями по 200 мл этилацетата. Объединенные органические слои промывают тремя порциями воды по 100 мл. Затем органический слой сушат над сульфатом натрия.
Органическую фазу отфильтровывают через слой силикагеля 10 мм и промывают на фильтре 2 литрами этилацетата. Маточный раствор экстрагируют 4 М раствором соляной кислоты в воде. После этого водную фазу промывают тремя порциями этилацетата по 150 мл.
Затем, при охлаждении, подщелачивают водную фазу предварительно охлажденным 4 М раствором NaOH до рН 10. Выпавшие кристаллы отфильтровывают, отжимают и промывают на фильтре тремя порциями по 150 мл воды. Полученный продукт 4 перекристаллизовывают из толуола (этанола, метилэтилкетона), рассчитывая объем растворителя на 1 г продукта 3 мл растворителя. Выход 4 45 г, 50% от теоретического.1H NMR (DMSO-d6, 400 MHz) δ, м.д. 2.748 (br. s, 4H, 2 СН2 piperazine), 3.225 (br. s, 4H, 2 CH2 piperazine), 6.884 (d, 1H, J=10,4 Hz), 6.941 (d, 1H, J=8,0 Hz), 7.00-7.04 (m (d+t), 2H), 7.197 (d, 1H, J=8,0 Hz), 7.3-7.37 (m (s+t), 2H).
Примеры фармацевтических композиций, содержащих фторклозапин и дезметилфторклозапин
Соединения фторклозапин и дезметилфторклозапин могут быть использованы в виде субстанции либо в виде фармацевтической композиции. Для приготовления фармацевтической композиции эффективное количество конкретного соединения в виде фармацевтически приемлемой соли, сольвата или гидрата, либо в виде свободных соединений тщательно смешивают с фармацевтически приемлемым носителем.
Неограничивающими примерами фармацевтически приемлемых, нетоксичных солей могут служить соли аминогруппы, образованные неорганическими кислотами, такими как соляная, бромоводородная, фосфорная, серная и хлорная кислоты, или органическими кислотами, такими как уксусная, щавелевая, малеиновая, винная, янтарная или малоновая кислоты, или полученные другими методами, используемыми в данной области, например, с помощью ионного обмена. К другим фармацевтически приемлемым солям относятся адипинат, альгинат, аскорбат, аспартат, бензолсульфонат, бензоат, бисульфат, борат, бутират, камфорат, камфорсульфонат, цитрат, циклопентанпропионат, диглюконат, додецилсульфат, этансульфонат, формиат, фумарат, глюкогептонат, глицерофосфат, глюконат, гемисульфат, гептанат, гексанат, гидройодид, 2-гидрокси-этансульфонат, лактобионат, лактат, лаурат, лаурил сульфат, малат, малеат, малонат, метансульфонат, 2-нафталинсульфонат, никотинат, нитрат, олеат, оксалат, пальмитат, памоат, пектинат, персульфат, 3-фенилпропионат, фосфат, пикрат, пивалат, пропионат, стеарат, сукцинат, сульфат, тартрат, тиоцианат, п-толуолсульфонат, ундеканат, валериат и подобные.
Фармацевтически приемлемый носитель может находиться в разнообразных формах в зависимости от вида введения. Фармацевтические композиции желательно изготавливать в виде единичной дозированной формы, пригодной, предпочтительно, для перорального или парентерального введения. Для получении композиций может быть использован любой из известных в фармацевтике носителей, таких как вода, гликоли, масла, спирты и подобные им вещества, крахмалы, сахара, каолин, повидон, диоксид кремния, стеарат магния, тальк, смазывающие вещества, связующие, вещества, способствующие распаду лекарственной формы, и подобные им вещества. В случае композиций для парентерального введения носитель обычно включает стерильную воду, по меньшей мере, большей частью, хотя могут быть включены и другие ингредиенты, например, для того, чтобы достичь растворимости. Например, могут быть приготовлены растворы для инъекций, в которых носитель включает физиологический раствор, раствор глюкозы или нейтральные масла.
Обычно соединение вводится пациенту, нуждающемуся в лечении, в дневной дозировке ориентировочно от 25 мг до 7000 мг на пациента, предпочтительно от 100 до 300 мг на пациента. Количество соединения, которое будет эффективным в лечении или профилактике конкретного расстройства или состояния, зависит, в частности, от хорошо известных факторов, влияющих на эффективную дозировку препаратов. Подбор дозы может осуществляться индивидуально, начиная с назначения небольших доз (25 мг) и постепенно повышая их до получения терапевтического эффекта.
Разработанные в данном изобретении фармацевтические композиции можно вводить один раз или множество раз через промежутки времени, например, от 1 до 4 раз в день. Следует понимать, что точная дозировка, режим и продолжительность лечения могут изменяться с возрастом, весом и состоянием пациента, подвергаемого лечению, и могут быть определены эмпирически с использованием известных протоколов тестирования или экстраполяцией данных тестов in vivo или in vitro или диагностических данных. Дополнительно следует понимать, что для любого конкретного индивидуума определенные режимы дозировки следует корректировать с течением времени в соответствии с необходимостью индивидуума и профессиональным суждением специалиста, вводящего или следящего за введением препаратов.
Следует также понимать, что конкретный уровень дозировки и частота введения дозы для любого конкретного пациента могут меняться и будут зависеть от факторов, включая активность конкретного используемого соединения, возраст, массу тела, общее состояние здоровья, пол, режим питания, способ введения, лекарственную комбинацию, тяжесть конкретного состояния.
Нижеприведенные составы демонстрируют возможные, но неограничивающие примеры лекарственных препаратов, содержащих в своем составе фторклозапин и дезметилфторкпозапин:
Таблетка 1
Таблетка 2
Раствор для инъекций
Капсула 1
Таким образом, в результате проведенных нами экспериментов неожиданно было обнаружено, что соединения фторклозапин и Дезметилфторклозапин, в отличие от других известных из уровня техники соединений, обладающих антипсихотической активностью, не только не уступают (а в некоторых случаях и превосходят), по эффективности клозапину - единственному нейролептику, официально рекомендованныму к применению при резистентности к другим антипсихотическим средствам, - но и демонстрируют значительно более низкую вероятность возникновения побочных эффектов, присущих клозапину (и даже многим другим антипсихотическим препаратам), в том числе, таких как седация, тахикардия, ортостатизм, агранулоцитоз и сиалорея.
Это позволяет сделать вывод о том, что указанные соединения могут быть использованы для создания эффективного лекарственного средства, применение которого при лечении терапевтически резистентных форм шизофрении позволит устранить как позитивные симптомы шизофрении (в том числе бред, слуховые галлюцинации, расстройства мышления), так ее и негативные симптомы (включая уплощенный аффект, бедность речи), а также когнитивные нарушения, и применение которого не вызовет серьезных побочных эффектов у пациентов, ограничивающих его применение, в том числе, таких как таких как седация, тахикардия, ортостатизм, агранулоцитоз и сиалорея.
Реферат
Группа изобретений относится к медицине, а именно к фармакологии, психиатрии, и может быть использовано для изготовления лекарственных средств для лечения терапевтически резистентных форм шизофрении. Для этого предложено использовать соединения 11-(4-метилпиперазин-1-ил)-7-фторо-8-хлоро-5Н-дибензо[b,е][1,4]-диазепин, 11-(пиперазин-1-ил)-7-фторо-8-хлоро-5Н-дибензо[b,е][1,4]-диазепин, их фармацевтически приемлемые соли, сольваты или гидраты. Также предложена фармацевтическая композиция. Группа изобретений позволяет создать эффективное лекарственное средство, применение которого при лечении терапевтически резистентных форм шизофрении позволяет устранить как позитивные, так и негативные симптомы шизофрении, а также когнитивные нарушения, и применение которого не вызывает серьезных побочных эффектов у пациентов, ограничивающих его применение, в том числе, таких как седация, тахикардия, ортостатизм, агранулоцитоз и сиалорея. 2 н. и 8 з.п. ф-лы, 5 ил., 1 табл., 7 пр.
Формула
Документы, цитированные в отчёте о поиске
Лекарственное средство для лечения шизофрении и способ его получения

Комментарии