Метод уничтожения нежелательных клеток-мишеней - RU2182493C2
Код документа: RU2182493C2
Чертежи










Описание
Изобретение относится к избирательной очистке клеточной популяции от клеток-мишеней путем обработки клеточной популяции двумя иммунотоксинами.
Так называемые аутологические трансплантаты стволовых клеток включают клетки, изолированные из крови или костного мозга больных раком, содержащие, после предварительной терапии больных, достаточное количество незрелых предшественников клеток крови и иммунных клеток для восстановления функции нефункционирующего костного мозга на короткое время, или на более длительный период после повторного введения клеток в кровь больных, из которой эти клетки были выделены.
В уровне техники известна очистка аутологических гемопоэтических трансплантатов с использованием антител в том случае, когда трансплантаты представляют собой неотобранные специально образцы костного мозга. Такой метод очистки опубликован, например, Myklebust, А. Т., Godal, A., Juell, S. и Fodstad О. "Comparison of two antibody-based methods for elimination of breast cancer cells from human bone marrow". Cancer Res. (USA) 1994, 54/1 (201-214) и Myklebust, А.Т., Godal, A., Pharo, A., Juell, S. и Fodstad 0. "Eradication of small cell lung cancer cells from human bone marrow with immunotoxins". Cancer Res. (USA) 1993, 53 (16), 3784-3788. В обеих публикациях применяются иммунотоксины, в которых антитела конъюгированы с токсином. Принцип заключается в уничтожении злокачественных клеток из собранных клеток костного мозга перед повторной инъекцией клеточной суспензии больному.
В последние годы разрабатываются методы, в которых используется фактически противоположный принцип. Применяя так называемую трансплантацию стволовых клеток, пытаются провести позитивный отбор из крови или костного мозга субпопуляции нормальных клеток, которые в состоянии восстановить нормальную функцию костного мозга после того, как эти клетки повторно вводятся пациенту. Эти "стволовые клетки" состоят из смеси наиболее незрелых предшественников клеток крови и иммунных клеток, а также из более дифференцированных клеток. Выделение таких клеток может быть выполнено либо с помощью так называемого афареза периферической крови, процедуры, занимающей один или более дней, либо путем иммуноабсорбции/отбора CD34+-клеток (незрелых клеток-предшественников) из крови или костного мозга с применением различных известных в уровне техники технических приемов.
Stray K. M. et al., "Purging tumor cells from bone marrow or peripheral blood using avidin, biotin, iromunoadsorbtion" In: P.G.Adrian, G. Samuel and A. W-W. Diana (Eds), Advances in bone marrow purging and processing, pp.97-103, Orlando: Willelis Inc., 1994, описывает выделение клеток костного мозга или продукта афареза из периферической крови. Эта процедура очистки проводится у больных лимфомой и у больных раком молочной железы. Метод включает стадию обогащения CD34+ -клетками перед очисткой В-клеток или клеток рака молочной железы с помощью так называемой колонки с авидином. В этом случае очистка проводится непрямым методом, таким образом, что клеточная суспензия первоначально инкубируется с первичными антителами, которые взаимодействуют с клетками рака молочной железы, клеточная суспензия отмывается и еще раз инкубируется с антителом, которое взаимодействует с первичными антителами. Это крысиное антитело биотинилировано, то есть соединено с молекулой, которая прочно связывается с авидином. Когда данная клеточная суспензия окончательно наносится на колонку с гранулами, конъюгированными с авидином, опухолевые клетки улавливаются за счет взаимодействия между клетками и комплексом первичные антитела - биотинилированные вторичные антитела - авидин. Результатом очистки с использованием такой системы является самое большее 3.2 log снижение злокачественных клеток. Применение этого принципа занимает много времени и является громоздким, так как перед нанесением на колонку с клеточной суспензией приходится работать на нескольких этапах, включая инкубацию с антителом и две отмывки. Таким образом, трудно избежать повреждения стволовых клеток или неспецифического захвата стволовых клеток колонкой, в результате чего происходит нежелательная потеря клеток, принципиально важных для восстановления нормальной функции костного мозга.
Tyer. C.L. et al., "Breast cancer cells are effectively purged from peripheral blood progenitor cells using an inimunomagnetic technique". Abstract to the first meeting of International Society for Hematotherapy and Graft Engineering, Orlando FL, 1993, описывает иммуномагнитный метод, сходный с применяемым в публикации Miklebust et al., смотри выше. Этот метод, однако, используется на клетках периферической крови. Этот принцип также совершенно отличается от применения иммунотоксинов и эффективность очистки варьирует от 3.3 до 4.8 log снижения злокачественных клеток в модельных экспериментах. В реферате не упоминается ни о каком дополнительном использовании непрямой системы, включающей инкубацию с первичными антителами с последующей отмывкой и новой инкубацией с гранулами, связанными с антителами, которые взаимодействуют с первичным антителом, но такое предположение является правомерным. Эта процедура включает также дополнительную и, возможно, травматическую обработку нормальных клеток, кроме того, данная процедура требует много времени. Ее эффективность ограничена, и в реферате ничего не упоминается о выделении популяций CD34+ -клеток, которое является основной проблемой в этом методе, так как отбор CD34+-клеток per se занимает много времени и является трудоемким. Таким образом, в большинстве случаев для отбора CD34+-клеток применяется иммуномагнитный принцип, за которым в этом примере следует один или два иммуномагнитных этапа с целью очистки. Следовательно, существует значительный риск разрушения клеток и их потери при применении метода, требующего длительно продолжающейся процедуры и являющегося дорогостоящим.
Lemoli, R.M.et al. (1994) Bone Marrow Transplant 13: 465-471, описывают очистку CD34+ гемопоэтических клеток человека с использованием техники иммуно абсорбции с авидин-биотином. Они увеличили очистку неопластических клеток путем использования нескольких иммунотоксинов, содержащих белок, инактивирующий рибосомы, - сапорин, и направленных против лимфоидассоциированных антигенов CD30 и CD2. Тессе, R., et al. (1991) Int. J. Cancer, 49: 310-316, описывают выделение аутологического костного мозга перед трансплантацией пациентам, страдающим моноцитарной лейкемией, с помощью 2-х иммунотоксинов, специфичных к моноцитарной клеточной линии и соединенных с сапорином, и с помощью 2-х MoAbs (моноклональных антител) с высокой специфичностью в отношении циркулирующих моноцитов и М5b, направленных к клеткам острой нелимфоидной лейкемии (ANLL). В W091/09058 описываются иммунотоксины, включающие миеломоноцитспецифичные МоАb 195, применяемые для очистки ANLL из клеток костного мозга. Tonevitsky, A.G., et al., (1986) Int. J. Cancer, 37: 263-273, описывают выделение мышиных эритролейкемических стволовых клеток из костного мозга с применением иммунотоксина, включающего конъюгат А-цепи рицина и МоАb МАЕ 15, который взаимодействует с поверхностью нормальных и неопластических мышиных эритроидных клеток: модель для исследований терапии с помощью трансплантации костного мозга.
В случае выделения стволовых клеток для трансплантации одна из главных целей состояла в том, что клетки, которые предполагается заново ввести больным, выделяются избирательно с таким условием, что трансплантаты не должны содержать каких-либо злокачественных клеток. В предшествующих исследованиях недавно показано, что такие препараты стволовых клеток неожиданно включают злокачественные клетки в большом количестве тестируемых случаев. До настоящего времени было сделано очень ограниченное число попыток удалить или избирательно уничтожить злокачественные клетки в таких трансплантатах. Частично это связано с тем, что опытные исследователи в этой области науки не видели в этом нужды, а также потому, что предполагалось, что имеющиеся известные методы не являлись специфическими и, таким образом, также должны были уничтожать или удалять уязвимые стволовые клетки. Более того, получение костного мозга или мобилизированной периферической крови от пациента является не простым и не неограниченным, и такой метод для выделения трансплантатов стволовых клеток должен выполняться в течение короткого периода времени и должен не иметь осложнений для того, чтобы можно было избежать потери или повреждения нормальных клеток. Таким образом, ссылаясь на изложенное выше, доводом в пользу использования трансплантатов стволовых клеток частично является то, что трансплантант должен быть полностью свободен от раковых клеток, частично то, что восстановление функции костного мозга происходит быстрее, чем после трансплантации костного мозга без предварительного отбора. Из этого следует, что абсолютно необходимо создать метод, который оставляет интактными хрупкие нормальные стволовые клетки, и который практичен для выполнения в сочетании с процедурами выделения стволовых клеток.
Целью настоящего изобретения является, следовательно, создание метода выделения трансплантатов стволовых клеток, который не включал бы отмеченных выше неудобств.
Данные цели, достигнутые в настоящем изобретении, характеризуются в прилагаемой формуле изобретения.
Настоящее изобретение относится к очистке собранных популяций стволовых клеток в случае солидных опухолей с использованием метода, в котором клеточная популяция экспонируется с композицией из двух или более антител, связанных с бактериальными токсинами. Применяемые антитела направлены к антигенам, ассоциированным с клетками-мишенями.
В последующем изложении изобретение описывается более детально с помощью использования примера очистки трансплантатов стволовых клеток, выделенных из периферической крови, для удаления клеток рака молочной железы.
Известные варианты техники выделения клеток включают иммуноадсорбцию, отбор стволовых клеток периферической крови (PBSC) или CD-34+-клеток из крови или костного мозга. Однако не существует известной безвредной и достаточно эффективной техники для очистки этих клеточных популяций от опухолевых клеток. Кажется очевидным, что даже среди этих незрелых клеток существуют опухолевые клетки, которые, в соответствии с ранее известными данными, не должны содержать CD34-рецепторы. Существенно, что в изобретении, описанном ниже, неожиданно отделяются также раковые клетки, не обладающие токсичностью по отношению к нормальным предшественникам.
Перед сбором трансплантата стволовых клеток из периферической крови необходимо мобилизовать стволовые клетки из костного мозга путем использования химиотерапии или лечения ростовыми факторами с помощью методов, известных в уровне техники. Сбор стволовых клеток может выполняться в соответствии с одним или несколькими методами в зависимости от того, какой тип клеток желателен. В одном методе собираются стволовые клетки периферической крови. Это может быть осуществлено с помощью ведения пациентов по схеме, включающей проведение лейкафереза на 10 и 11 день после введения G-CSF (гранулоцит-колониестимулирующего фактора) (10 мкг/кг/день) после получения высоких доз химиотерапии и тотального облучения тела. Скорость тока крови может быть фиксирована, например, на уровне 70 мл/мин с помощью использования сепаратора клеток крови CS-300 Plus (Baxter Healthcare Corporation, Fenwal Division, Deerfield, IL, USA). Средний объем крови, обработанный в течение такой процедуры, может составлять около 10 литров в течение 2,5 часа при отборе через двухпроходный катетер, вставленный в центральные вены. Может быть собрано пятьдесят мл PBSC с помощью забуференного физраствора (PBS), 1% сывороточного альбумина человека (HSA), в процессоре СоЬе 2991 для удаления тромбоцитов. Для применения в настоящем изобретении концентрация клеток (2-4•l010/aфapeз) может регулироваться до 1•108/мл для негативного отбора (очистки) с помощью иммунотоксинов.
Если желательно получение CD-34+-клеток, они могут быть выделены путем позитивного отбора с помощью ISOLEX 50® или ISOLEX 300® (Baxter). В этом методе продукт, полученный при афарезе или из костного мозга, который может составлять от около 4•1010 до 6•1010 клеток, может быть совместно смешен и проинкубирован, например, с анти-СВ34+ моноклональным антителом 9С5 в концентрации 0.5 мкг/1•106 клеток при 4oС в течение 30 минут при легком перемешивании на мешалке. Обработанные клетки отмываются PBS с 1% HSA на процессоре Соbе для удаления несвязавшихся антител. DYNAL® гранулы М-450 добавляются к CD34+ фракции в количестве 0.5 гранулы на 1 имеющую ядро клетку при 4oС на 30 минут. Магнитное отделение розеток от клеток, не являющихся мишенями, может быть выполнено с помощью 2-х или 3-х кратного смыва несвязавшихся клеток PBS, 1% HSA. CD34+-клетки могут затем отделяться от Dynal® гранул путем добавления, например, ChymoCell-R (химопапаин) до конечной концентрации 200 pKat/мл в течение 15 минут при комнатной температуре. Таким образом, CD34+ клетки могут собираться путем отмыва с помощью PBS в 5% цитрате натрия. Известны также другие процедуры для отбора стволовых клеток/ранних клеток-предшественников.
Связывающий профиль нескольких антител к клеточным линиям рака молочной железы и опухолевому материалу
изучался другими исследователями и частично подтвержден нами. Антитела, которые связываются с большим процентом клеток рака молочной железы и не связываются с важными нормальными незрелыми клетками в
крови и костном мозге, конъюгируются с экзотоксином A Pseudomonas (РЕ), и способность к уничтожению клеток рака молочной железы в культуре проверяется, главным образом, с помощью определения продукции
колоний. Основываясь на связывающем профиле антител изобретатели настоящего изобретения создали все пять различных иммунотоксинов:
1. МОС31-РЕ. Этот конъюгат связывается с очень высоким
процентом всех клеток рака молочной железы и был очень эффективным в модельных экспериментах и в действующих концентрациях обладал крайне низкой токсичностью в отношении нормальных гемопоэтических
клеток-предшественников.
2. NrLu10-PE. Этот конъюгат связывается с тем же антигеном, что и описанный выше, но с другим его эпитопом. Он слегка менее активен, чем МОС31-РЕ.
3. ВМ7-РЕ. Этот конъюгат связывается с белковой частью антигена муцина, который найден главным образом на клетках рака молочной железы. Антиген присутствует на большом проценте клеток рака молочной железы, но не на всех клетках. Иммунотоксин показал высокую специфическую активность в отношении раковых клеток, но не был так эффективен, как два предшествующих иммунотоксина.
4. ВМ2-РЕ. Этот конъюгат связывается с сахарсодержащим эпитопом того же антигена, что и ВМ7-РЕ. Иммунотоксин показал приблизительно ту же самую эффективность, что и ВМ7-РЕ, в сочетании с очень низкой токсичностью в отношении нормальных клеток.
5. MLuCl-PE. Этот конъюгат связывается с совершенно другим антигеном, а именно LewisY антигеном. Иммунотоксин был слегка менее активным, чем предшествующий, и также демонстрировал умеренную токсичность в отношении нормальных клеток.
Иммунотоксины в соответствии с пунктами 1,2,5 испытывали индивидуально и в комбинации в модельных экспериментах для очистки обычных образцов костного мозга от раковых клеток (Myklebust et al., Cancer Research, 1994). Как уже отмечалось, огромным преимуществом использования трансплантантов стволовых клеток является сокращение интервала повторного достижения нормальной функции костного мозга (то есть надежность процедуры). Однако несмотря на то, что ожидалось, такие трансплантаты загрязнены опухолевыми клетками и было необходимо применить токсины, способные уничтожить все раковые клетки в трансплантате в отсутствие значительного влияния на нормальные клетки.
Был начат поиск иммунотоксинов, более специфичных для рака молочной железы, чем MLuCl-PE, и более подходящих для очистки при раке молочной железы.
В течение этого поиска неожиданно было открыто, что комбинация МОС31-РЕ и ВМ7-РЕ была более эффективной, чем сумма каждого из предыдущих токсинов, применяемых по отдельности. Это демонстрируется ниже в Таблице 1. Дальнейшие исследования связывания между антителом и клеточными линиями показали, что комбинация иммунотоксинов ведет к более прочному взаимодействию, чем взаимодействие антител по одиночке.
МОС31 связывается с большинством клеток рака молочной железы, включая те из них, которые менее дифференцированы. ВМ7 узнает антиген муцин, который экспрессируется на значительной фракции клеток рака молочной железы, а также на клетках, которые более дифференцированы. NrLu10 и ВМ2 связываются с антигеном, узнаваемым МОС31 и ВМ7, соответственно, и, учитывая это, не особенно вероятно, чтобы они добавляли бы что-нибудь в комбинацию иммунотоксинов МОС31 и ВМ7. MLuCl-PE теоретически был интересен тем, что он связывается с антигеном другим, чем иммуно токсины, упомянутые выше. MLuCl-PE был, однако, токсичным для нормальных клеток, и модельные эксперименты не показали каких-либо явных преимуществ включения его в комбинацию.
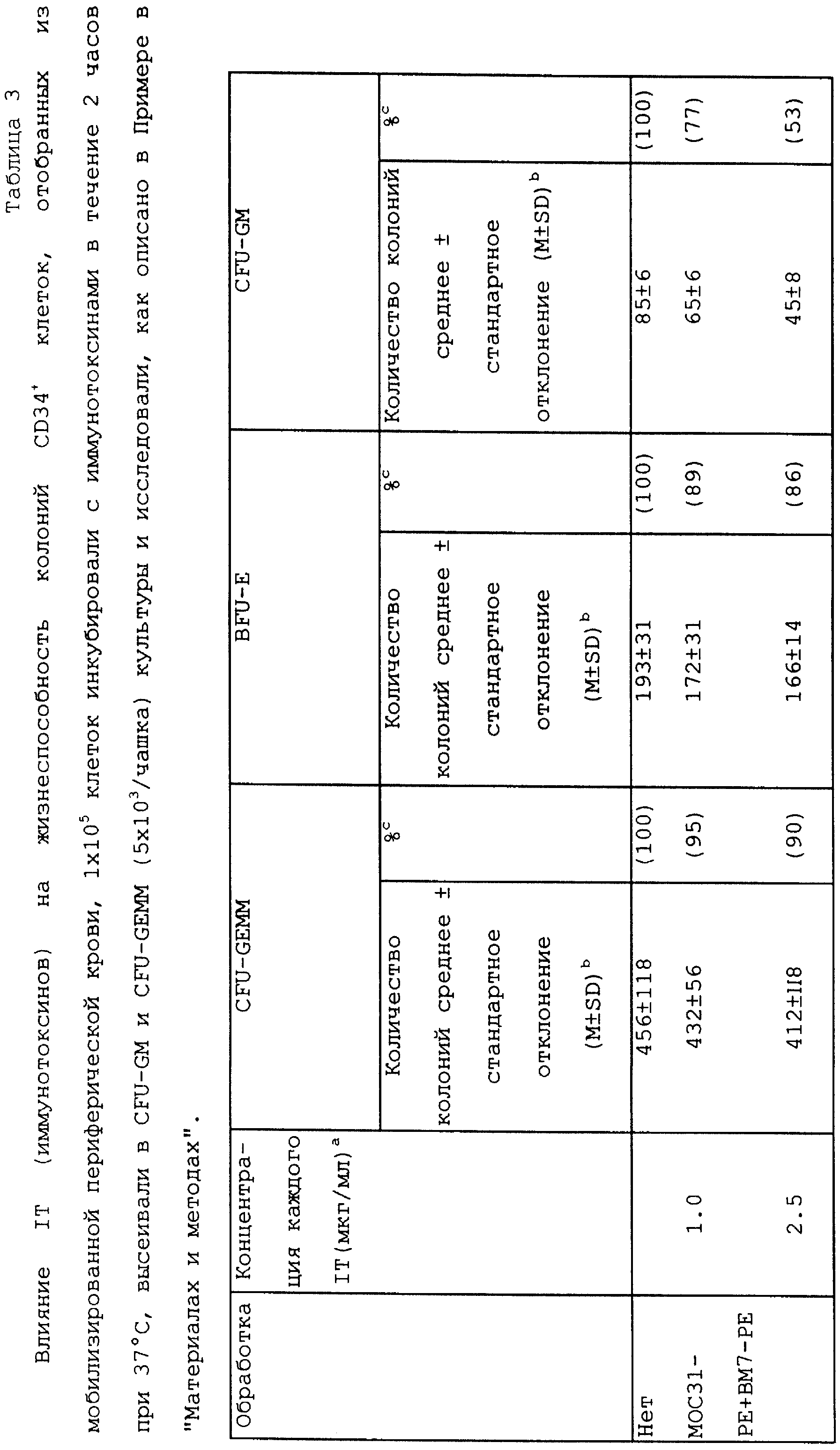
В примере, представленном ниже, описывается очистка трансплантатов, периферических стволовых клеток (продукты афареза). Кроме того, изобретатели выполнили несколько экспериментов с применением комбинации МОС31-РЕ и ВМ7-РЕ в опытах, когда опухолевые клетки добавлялись к собранным периферическим стволовым клеткам или костному мозгу перед иммуномагнитным позитивным отбором СР-34+-клеток. Результаты одного из таких экспериментов показаны в Таблице 2. С помощью двух различных клеточных линий показано, что позитивный отбор CD-34+-клеток самих по себе (без какой-либо формы очистки) удаляет до 3.8 log опухолевых клеток из первоначально собранной клеточной популяции. В других экспериментах эффект "очистки" при отборе CD-34 клеток варьировал от 2-3 log, что также характерно ссылаясь на литературу. Когда обработка иммунотоксином применялась на позитивно отобранной популяции CD-34 клеток, суммарный эффект очистки составлял более 4.7 log (Таблица 2) для обеих клеточных линий. Более чем 4.7 log означает в этом случае, что все определяемые опухолевые клетки удалялись. В других экспериментах мы имеем в отдельных определениях растущие опухолевые клетки и нормальные клетки-предшественники, взятые из популяции CD-34+ клеток после одночасовой обработки иммунотоксином. В этих экспериментах мы наблюдали, что опухолевые клетки уничтожаются или умирают за короткое время после обработки, в то время как опухолевые клетки в неочищенных контрольных популяциях росли и образовывали колонии и/или пролиферировали, образуя адгезивный тип клеточных культур. Обработка не влияла на нормальные стволовые клетки, так что при тестировании трех различных систем жизнеспособности нормальных клеток-предшественников оказалось, что они только незначительно снижены. В Таблице 3 представлен сходный эксперимент, в котором CD34+-клетки инкубировали с иммунотоксинами в течение 2 часов при 37oС, и было показано, что стволовые клетки по существу выживали при обработке иммунотоксинами.
Большой неожиданностью было то, что применение двух антител, направленных к антигенам, экспрессируемым эпителиальными клетками в соответствии с настоящим изобретением, каждый из которых был соединен с бактериальным токсином - экзотоксином A Pseudomonas, уничтожало злокачественные клетки без какого-либо повреждающего воздействия на нормальные стволовые клетки в собранном материале из периферической крови и костного мозга. Из уровня техники известно, что клетки могут быть уничтожены бактериальными экзотоксинами и что степень уничтожения увеличивается при связывании токсина с антителами, направленными к эпитопам, экспрессируемым клетками-мишенями. Однако известно также, что если незрелые клетки подвергаются действию одного или нескольких иммунотоксинов, существует большая вероятность того, что эта обработка уничтожит в клеточной популяции нормальные стволовые клетки. Более того, эти нормальные стволовые клетки чувствительны к обработке ех vivo, сопровождающейся механическими травмами и изменениями температуры. В настоящем изобретении клеточная популяция, например трансплантат стволовых клеток, собранный из периферической крови, подвергается действию композиции из двух антител, каждое из которых конъюгировано с РЕ. Так как один из иммунотоксинов был чрезвычайно активен, неожиданно было продемонстрировано, что с помощью применения комбинации двух антител, связанных с бактериальным токсином, эффект очистки оказывается большим, чем сумма эффектов, в том случае, когда иммунотоксины используются по отдельности. Этот синэргический эффект демонстрируется в Таблице 4 настоящего открытия с использованием антител ВМ7 и МОС31, связанных с экзотоксином A Pseudomonas, в отношении уничтожения РМ1 клеток рака молочной железы человека. Оба иммунотоксина являются моноклональными антителами, направленными против антигенов, ассоциированных с опухолью, и связанными с бактериальным токсином - экзотоксином A Pseudomonas. Одно из антител узнает эпителиальный антиген, кодируемый GA 733-2 геном, который экспрессируется большинством клеток карциномы и, следовательно, может применяться во всех случаях вовлечения карцином (например, рака молочной железы, колоректального рака, рака простаты, рака яичников, рака легких и рака поджелудочной железы). Другое антитело направлено к муцину, мукозному белку, который слегка отличается от одного типа карциномы к другому. В общем виде антиген может быть описан как комплекс белков, кодирующихся генами MUC-1, MUC-2 и MUC-3. Примерами упомянутых выше антител являются МОС31 и ВМ7.
Конъюгация антитела и токсина может быть выполнена различными способами. Выбор одного или более антител в композиции для привязывания к бактериальным экзотоксинам выполнялся таким способом, чтобы связывающий участок антитела был направлен к эпитопам, экспрессирующимся на большинстве клеток-мишеней и неэкспрессирующимся на нормальных клетках. Ранее проблема в этой области состояла в том, что как злокачественные клетки, так и нормальные клетки крови экспрессируют на клеточной поверхности общие антигены. В примере, включенном в настоящее открытие, используются два моноклональных антитела МОС31 и ВМ7. Первое из этих антител направлено к эпителиальным клеткам, которые, если появляются в периферической крови, то являются злокачественными. Антиген (весь белок) кодируется геном GA 733-2. Этот антиген имеет, однако, несколько эпитопов, и важно выбрать мишенью те эпитопы, которые наиболее широко экспрессируются.
Антитело ВМ7 представляет собой одно из антител, направленных к эпитопу антигена, экспрессируемого MUCI геном. Несколько генов кодируют сходные антигены, например, (MUC2, MUC3).
Бактериальный токсин Pseudomonas экзотоксин А имеет относительно умеренное токсическое влияние на нормальные стволовые клетки и злокачественные клетки. Однако, когда он связывается с антителами, направленными к антигенам, экспрессирующимся на клетках-мишенях, токсическое влияние на них существенно возрастает. В Таблице 5 демонстрируется, что смесь иммунотоксинов в соответствии с настоящим, изобретением, даже после такого короткого времени инкубации как 60 минут, уничтожает T-47D клетки, MCF7 клетки и РМ1 клетки с намного более высокой степенью эффективности, чем с помощью других методов, известных ранее. Комбинация этих двух иммунотоксинов дает, таким образом, неожиданные результаты по отношению к тому, что должно было бы ожидаться, благодаря свой избирательной эффективности, простоте и только незначительной токсичности в отношении нормальных клеток-предшественников.
Можно утверждать, что известно применение нескольких иммунотоксинов, состоящих их экзотоксина A Pseudomonas, конъюгированного с тремя различными антителами, см. Myklebust et al., 1993 и 1994. Одно из антител (МОС31) применяли сходным образом в настоящем изобретении для того, чтобы очистить неотобранные клетки костного мозга. Однако использование других антител не кажется оптимальным, среди прочего, потому, что одно из них направлено к тому же самому антигену, что и МОС31, и потому, что другое (MLuCl) имеет перекрестные реакции с нормальными клетками и в связи с этим иммунотоксин, связанный с этим антителом, легко может проявлять токсический эффект по отношению к большинству незрелых стволовых клеток. В настоящем изобретении на препаратах очищенных стволовых клеток мы получили другое моноклональное антитело, которое дополняет эффект МОС31 и нашли, что комбинация этих двух антител, применяемых как иммунотоксины, дает совершенно неожиданные результаты.
Благодаря высокой специфической активности открытых иммунотоксинов кажется возможным вводить их смесь при лечении in vivo больных, страдающих различными типами карциномы. Если раковое заболевание ограничено, то будет возможно делать инъекцию или инфузию каждого из них или их смеси внутривенно, например, когда выявлено распространение болезни до костного мозга. Другая возможность состоит в том, чтобы вводить иммунотоксины по одному или в комбинации больным с дальнейшим распространением болезни, захватывающей абдоминальную жидкость (асциты) или плевральную жидкость. Третий вариант состоит в том, чтобы лечить больных с распространением ракового заболевания в центральной нервной системе. В этом случае иммунотоксины могут вводиться непосредственно в опухолевую ткань, в спинномозговую жидкость или в артерию, снабжающую мозг кровью.
Не известно использование этих иммунотоксинов in vivo, за исключением МОС31-РЕ, который был применен при лептоменингеальной опухоли как модели для мелкоклеточного рака легких. ВМ7-РЕ не описывается в литературе вообще.
Важной проблемой при использовании иммунотоксинов in vivo является то, что их полупериод жизни является часто очень коротким, то есть имунотоксины разрушаются и удаляются из крови прежде, чем их концентрация станет в опухоли достаточно высокой. В US PS 5322678 Morgan et al. запатентовали модификацию антительной части иммунотоксина, позволяющую уменьшить проблему, касающуюся короткого полупериода жизни in vivo. В настоящем изобретении предлагается сходная модификация токсинной части, процедура, которая ранее не выполнялась и не была известна.
Пример 1
Эффективное освобождение от клеток рака
молочной железы собранных стволовых клеток периферической крови с помощью иммунотоксинов.
Введение
Высокая доза химиорадиотерапии с поддерживающим введением аутологических
гемопоэтических стволовых клеток используется с нарастающей частотой для лечения больных с различными формами рака (1, 2). В тех случаях, когда этот подход остается безуспешным, наиболее общей
причиной является рецидив болезни, а не интоксикация, инфекции и отсутствие приживления трансплантанта (3). Важно, что есть твердые доказательства того, что у больных, получающих лечение в высоких
дозах, реинфузия аутотрансплантатов, содержащих клоны опухолевых клеток, может внести вклад в возникновение рецидива и влиять на его исход (4). Исследования клеток аутотрансплантатов с помощью
генов-маркеров показали, что опухолевые клетки, остающиеся в реинфузируемом костном мозге (ВМ), вносят вклад в возобновление заболевания (5). Это заключение дополнительно подтверждается результатами,
полученными на больных с фолликулярными лимфомами, которые показывают, что эффективная очистка ВМ улучшает безрецидивный период жизни (6).
Применение чувствительной иммуноцитохимической техники позволяет обнаружить загрязнение опухолевыми клетками в гистологически нормальных аутотрансплантатах костного мозга у больных раком молочной железы, подвергавшихся лечению высокими дозами, в количестве 37-62% (7). Аутотрансплантаты стволовых клеток периферческой крови (PBSC), собранные путем афареза после предварительного лечения гемопоэтическими ростовыми факторами и химиотерапии, применяются в возрастающей степени в надежде на то, что эти продукты будут иметь низкую вероятность содержания опухолевых клеток. Однако недавно было показано, что, хотя содержание опухолевых клеток в PBSC аутотрансплантатах является менее обширным по сравнению со сборами ВМ, опухолевые клетки все еще часто находят в мобилизированных PBSC сборах от пациентов с раком молочной железы (4, 7). Кроме того, недавние данные показывают, что химиотерапия и/или ростовые факторы могут вызывать выход опухолевых клеток в периферический кровоток у больных, как с исходно обнаруженными раковыми клетками в костном мозге, так и без их обнаружения (7, 8), результатом чего является дополнительное увеличение риска загрязнения PBSC трансплантатов опухолевыми клетками.
Для избежания реинфузии злокачественных клеток PBSC аутотрансплантаты при карциноме молочной железы могут нуждаться в очистке in vitro. Здесь мы описываем практичный и быстрый метод очистки, показывающий, что процедура инкубации в течение 60 мин с It (иммунотоксинами), непосредственно добавленными к продукту афареза, избирательно уничтожает более чем 5 log опухолевых клеток.
МАТЕРИАЛЫ И МЕТОДЫ
Клеточная линия. РМ1 линия клеток рака молочной железы была создана в нашей лаборатории из асцитной жидкости, отобранной у больной с продвинутой стадией
заболевания. MCF7 и T-47D линии клеток получены от American Type Culture Collection (Rockwille, MD) (ATCC HTB 22 и АТСС НТВ 133 соответственно). Клетки культивировали при 37o С в атмосфере
5% СO2 в среде RPMI 1640 (RPMI) с добавлением 10% прогретой инактивированной сыворотки плодов телят (FCS) и антибиотиков (100 Е/мл пенициллина, 100 мкг/мл стрептомицина). Среда и добавки
были получены от GIBCO (Paisley, UK).
Костный мозг человека и клетки-предшественники периферической крови. Клетки ВМ получены от здоровых доноров-добровольцев. Фракция мононуклеарных клеток (MNC) BM была получена от Lymphoprep® (Nycomed, Pharma Oslo, Norway): и дважды отмывалась забуференным физраствором (PBS) перед использованием в экспериментах. PBSC готовили, отбирая у больных не-ходжкинской лимфомой. Для мобилизации PBSC больные предварительно получали химиотерапию в сочетании с гемопоэтическими ростовыми факторами (G-CSF, Neupogen, Amgen/Hoffman-La Roche, Basel, Switzerland). Через одиннадцать-двенадцать дней после химиотерапии, когда количество CD34+-клеток в периферической крови высоко, стволовые клетки собирались с помощью CS-3000 plus сепаратора клеток крови (Baxter Healthcare Corp., Fenwal Division, Deerfield, IL).
Токсин, антитела и создание иммунотоксинов. Анти-MUCI (9) антитело ВМ7 (IgG1 было подарено S. Kaul (Frauenklinik, University of Heidellberg, Germany), а анти-ЕGР2 (10) антитело МОС-31 (IgG2a) было любезно предоставлено L. de Leij (University of Groningen, The Netherlands) и МСА Development (Groningen). РЕ получен от Swiss Serum и Vaccine Institute (Bern, Switzerland). Каждое антитело было конъюгировано с РЕ через тиоэфирный мостик, образованный с помощью сульфосукцинимидил-4-(Н-малеимидометил)циклогексан-1-карбоксилата (Pierce, Rockford, IL), как описано ранее (11).
Обработка иммунотоксином. Действие обработки IT на жизнеспособность образующих клоны клеток рака молочной железы тестировали с помощью инкубации 2•106 экспонентно растущих опухолевых клеток в RPMI с FCS с указанными концентрациями IT при 37oС при легком перемешивании (100 об/мин на орбитальном инкубаторе (Gallenkamp, Leicestershire, UK) ) в течение различных периодов времени, как указано для каждого эксперимента. Клетки дважды отмывали в PBS с 1% FCS перед высеванием для определения образования клонов, в некоторых экспериментах 10% опухолевых клеток примешивали к мононуклеарным клеткам ВМ или PBSC, инкубировали с IT, отмывали и определяли жизнеспособность опухолевых клеток или образующих клоны гемопоэтических клеток-предшественников.
Определение образования колоний опухолевыми клетками и гемопоэтическими клетками-предшественниками. Применяемое определение способности опухолевых клеток образовывать клоны на мягком агаре описано ранее (12). Три параллельные пробы культуры инкубировали в течение 14 дней при 37oС в 5% СО2, 5% O2 и 90% N2 и подсчитывали колонии, имеющие более 50 клеток, на цейсовском стереомикроскопе.
Способность образовывать клоны обработанных и необработанных нормальных клеток-предшественников оценивали с помощью CFU-GEMM способа (13), в котором 5•104 PBSC на мл культивировали индивидуально в стандартных метилцеллюлозных культурах (НСС-4433 Methocult, Terry Fox Labs, Vancouver, ВС) в IMDM среде (GIBCO). Через 19 дней инкубации BFU-Е и CFU-GM колонии подсчитывали в инвертированном фазовоконтрастном микроскопе. Каждое определение выполняли с тремя параллельными культурами в 1 мл 35 мм чашек при 37oС в 5% СO2, в атмосфере 100% влажности.
РЕЗУЛЬТАТЫ
Рост клеток рака молочной железы человека на мягком агаре. В нескольких экспериментах наблюдались линейные взаимоотношения между числом высеянных опухолевых клеток и
числом образованных колоний. С линией РМ1 клеток эффективность образования клонов была в интервале от 20 до 30% (не показано). В экспериментах с T-47D и MCF7 клеточными линиями были подтверждены
наблюдаемые ранее (14) линейные взаимоотношения с РЕ порядка 27% и 22%, соответственно. Эти данные были использованы для расчета эффективности снижения количества клеток рака молочной железы в
результате обработки.
Эффективность индивидуальных иммунотоксинов и их смеси в плане уничтожения клеток рака молочной железы. В модельных экспериментах были использованы три различные концентрации каждого IT. Как показано в Таблице 4, только крайне слабые эффекты были получены с ВМ7 конъюгатами при двух более низких концентрациях, в то время как 2.5 log уничтожения клеток был достигнут при концентрации 1.0 мкг/мл. С МОС-31 при концентрации 0,1 мг/мл наблюдалось близкое к 3 log уничтожениt клеток, при самой высокой концентрации (1 мкг/мл) эффективность была по крайней мере 5 log, максимальный эффект, который возможно определить при этом способе анализа (14). При использовании смеси обоих IT, каждый при указанных концентрациях, все опухолевые клетки уничтожались уже при концентрации 0.1 мкг/мл (Таблица 4). Результаты показывают, что смесь двух IT может уничтожать клетки рака молочной железы очень эффективно, и данные также предполагают, что аддитивность может быть получена путем комбинации двух конъюгатов. Сходные результаты были получены, когда эффективность IT была протестирована при их негативном действии на две другие клеточные линии рака молочной железы (не показано). Исходя из ожидаемой гетерогенности экспрессии антигенов на клетках-мишенях, кажется логичным использование комбинации IT при дальнейшем развитии метода, пригодного для клинического применения.
PM1 клетки инкубировали с иммунотоксинами в течение 2 ч при 37oС, высевали на мягкий агар и определяли образовавшиеся колонии, как описано в "Материалах и Методах".
Влияние времени инкубации. В описанных выше экспериментах была использована инкубация с IT в течение 120 мин. При клиническом применении по практическим причинам должно быть выгодно применять даже более короткое время инкубации. Для изучения того, может ли быть снижено время экспозиции с IT без ущерба для уничтожения опухолевых клеток, смесь двух конъюгатов, применяемых в концентрации 1 мкг/мл каждый, тестировали в отношении действия против трех линий клеток рака молочной железы, используя различное время инкубации. Во всех случаях 120 минутная экспозиция с IT-приводила к уничтожению всех опухолевых клеток. Существенно, что обработка была такой же эффективной, когда время инкубации было снижено до 90 мин и даже до 60 мин (Таблица 5), и данные показывают, что при применяемых концентрациях IT самое короткое время инкубации достаточно для уничтожения всех образующих клоны опухолевых клеток, присутствующих в культурах опухолевых клеток.
Опухолевые клетки, одни (2х106/мл) или добавленные (отношение 1:10) к клеткам-предшественникам периферической крови (суммарное количество 1х107/мл), инкубировали с IT при 37oС в течение указанных периодов времени, высевали на мягкий агао и определяли как в табл. 4.
Для проверки, может ли токсическое действие на клетки рака молочной железы изменяться в присутствии большого числа нормальных гемопоэтических клеток, выполнялись эксперименты, в которых опухолевые клетки примешивали в отношении 1:10 к PBSC, собранным путем афареза. Как показано в Таблице 5, IT в присутствии нормальных клеток также уничтожают более чем 5 log PM1 опухолевых клеток уже при времени инкубации только в течение 60 мин. Так как результаты были одинаковыми для всех трех клеточных линий, данные показывают, что процедура с использованием IT может быть эффективно применена в клинических условиях.
Влияние условий инкубации и концентрации клеток. Для проверки эффективности процедуры с использованием IT в условиях, сходных с теми, которые должны применяться на клинических образцах, РМ1 опухолевые клетки примешивали в отношении 1:10 к PBSC в экспериментах, когда неотмытые клетки, взятые непосредственно из мешочка афареза, перед инкубацией с IT ресуспендировали в нормальном солевом растворе с ACD (маточный раствор мешочка, R 2220, Baxter Healthcare Corp., Fenwal Division). Результаты были сравнимы с получаемыми в первоначальных экспериментах с клетками, которые отмывали и ресуспендировали в RPMI с 10% FCS. Было обнаружено (Таблица 6), что в обоих случаях обработка IT в течение 60 мин уничтожает все РМ1 клетки, что указывает на то, что при клиническом применении IT могут быть введены непосредственно в мешочек афареза и что низкий рН в таких условиях не влияет на цитотоксичность IT.
Клетки из афарезного мешочка переносили в три пробирки, содержащие 1х108 клеток каждая. В двух пробирках клетки (в объемах 500-700 мкл) разводили в PBS с 20% ACD и 1% альбумином человека до конечного объема 1 мл. Одну из пробирок использовали как контроль и для инкубации с IT (Группа А). Клетки в третьей пробирке отмывали и ресуспендировали, доводя объем до 1 мл в RPMI с 10% FCS (Группа B). В группах, подвергающихся обработке, клетки инкубировали при 37oС в течение 1 часа с 1 мкг/мл каждого IT, отмывали и высевали на мягкий агар. Определение и расчеты как в таблице 1. Эффективность посева в необработанных контрольных культурах была в интервале 20 - 30%.
В афарезных мешочках суммарное количество клеток будет достаточно высоким, и представлялось, что при таких высоких концентрациях клеток эффективность процедуры может быть снижена по сравнению с условиями, используемыми в модельных экспериментах. Однако в тех экспериментах, когда тестировалась эта возможность, никаких различий в эффективности действия не было обнаружено при суммарной концентрации клеток, увеличивающейся от исходно 1•107 до 5•107 и затем до 1•108 на мл (Таблица 6).
Токсичность IT в отношении нормальных гемопоэтических клеток-предшественников. Действие IT на жизнеспособность CFU-GM и BFU-E изучали в условиях инкубации, описанных выше. Было обнаружено (Таблица 1), что инкубация имеющих ядра PBSC со смесью IT даже в течение 120 мин не снижала жизнеспособности клеток-предшественников ни когда они тестировались после отмыва и ресуспендирования клеток в RPMI с 10% FCS, ни когда использовались неотмытые клетки, ресуспендированные в нормальном солевом растворе с ACD.
Так как для клинического применения обработанные клетки будут замораживаться с последующим размораживанием перед процедурой возвращения их больному, изучался также эффект таких процедур на клетки-предшественники. Было обнаружено, что замораживание и оттаивание только слегка снижают количество CFU-GM и BFU-E (Таблица 7). Следует отметить, что обработка IT сама по себе не снижала значительно жизнеспособности клеток-предшественников, хотя наблюдалось небольшое снижение среднего числа клеточных колоний в группе, где клетки обрабатывали в условиях низкого рН. Данные показывают, что концентрация IT, которая эффективно уничтожает опухолевые клетки после инкубации в течение 60 мин, оказывает только незначительный эффект на выживание нормальных образующих клоны клеток, обработанных в течение в два раза более длительного времени.
ОБСУЖДЕНИЕ
Аутологическая трансплантация циркулирующих
гемопоэтических клеток в последнее время привлекает большое внимание благодаря своим преимуществам по сравнению с трансплантацией ВМ (15, 16). В дополнение к быстрому восстановлению функций костного
мозга предполагается, что применение PBSC должно позволить избежать риска реинфузии опухолевых клеток, загрязняющих трансплантант. Однако было показано, что проблема загрязненности опухолевыми
клетками снижается, но не исчезает (4). Также, должно быть отмечено, что высокая доза химиотерапии, включающая применение колониестимулирующих факторов, может вызывать выход опухолевых клеток в
периферическую кровь (7, 8). Следовательно, создание быстрой и практичной процедуры очистки продуктов афареза высокообосновано.
Описано несколько методов для удаления клеток рака молочной железы из ВМ, включая хемоиммуноразделение, иммуномагнитные процедуры и применение иммунотоксинов (14, 17, 18, 19). В отличие от этого, описывается очень мало работ по очистке препаратов PBSC (20, 21), хотя IT, соединенные с рибосомо-инактивирующим белком, использовали для уничтожения лимфоидных опухолевых клеток, добавленных к CD34-позитивным клеточньм коллекциям, полученным из ВМ (24). В более позднем исследовании была получена эффективность очистки в 2 log в дополнение к непрямой очистке в 3 log, достигнутой с помощью процедуры селекции CD34-клеток. Целью настоящей работы была разработка надежной процедуры выделения клеток рака молочной железы из PBSC. Результаты, полученные в модельных экспериментах, показывают, что 60-минутная инкубация с 1 мкг/мл каждого из двух конъюгатов, включающих антикарциномные антитела и РЕ, эффективно уничтожает все опухолевые клетки, примешанные к PBSC, не оказывая токсического эффекта на нормальные клетки-предшественники. Существенно, что метод позволяет добавлять IT непосредственно в продукт афареза, и после инкубации клетки отмываются, центрифугируются и становятся готовыми для замораживания. В особенности благодаря своей простоте и эффективности метод должен быть привлекательным для применения при ведении отобранных групп больных раком молочной железы в комплексе с высокой дозой химиотерапии в сочетании с трансплантацией PBSC. Высокоизбирательная эффективность нашей процедуры должна быть приписана следующим факторам.
Во-первых, известно, что антиген, узнаваемый МОС31 антителом, экспрессируется на большинстве клеток почти при всех исследованных видах рака молочной железы (10). ВМ7 антитело, которое узнает кор-белок (апопротеин), экспрессирующийся MUC-1 "геном" (9), также связывается с большой фракцией клеток рака молочной железы (25). Совместно эти два моноклональных антитела, по-видимому, в значительной степени перекрывают гетерогенность экспрессии антигенов, выявляемую при раке молочной железы. Во-вторых, ранее мы показали, что при конструировании IT важно применять токсин, который сочетается с используемыми антителами (11). Мы нашли, что РЕ конъюгаты при использовании ряда моноклональных антител, включая те из них, которые применялись здесь, очень эффективны (14). Более того, IT с РЕ всегда являются более токсичными, чем эквимолярные концентрации свободных РЕ (11, 18), проявляя специфичность таких IT.
Требуется, чтобы процедуры очистки были эффективными и надежными, необходимо также, чтобы метод был практичным и мог применяться в клиническом масштабе. В дополнение к тому преимуществу, что IT могут добавляться непосредственно в афарезный мешочек, наш метод включает только 60-минутную инкубацию для уничтожения всех образующих клоны опухолевых клеток. Более того, эта обработка не является токсичной для нормальных гемопоэтических клеток-предшественников, и в экспериментах по очистке ВМ даже намного более высокие концентрации IT хорошо ими переносились (14). Мы также показали, что замораживание и оттаивание PBSC, обработанных IT, не ведет к возникновению дополнительной токсичности, заслуживает внимания также то, что процедура с использованием IT не ведет к неспецифической потере клеток, что по опыту может быть при применении методов, включающих удаление опухолевых клеток с помощью иммуногранул или иммуноабсорбции.
Ранее мы рассчитали, что количество конъюгата, остающееся в обработанном IT BM после отмывки, составляет около 0.75% от суммарного добавленного количества (26). В клинической установке обработка PBSC, содержащих приблизительно 2•1010 мононуклеарных клеток, рекомендуемой концентрацией в 2 мкг 1Т/мл (1•108 клеток) должна затем вести, как ожидается, к содержанию в конечном продукте максимально 3 мкг IT. Это составляет содержание свободного токсина, в 100-150 раз меньшее, чем теоретически рассчитанная максимальная доза толерантности (26). Таким образом, реинфузия очищенных PBSC не должна, как ожидается, проявлять какой-либо системной токсичности.
Безуспешность терапии высокими дозами в сочетании с трансплантацией аутологичных гемопоэтических клеток-предшественников может даже больше определяться эффективностью системного лечения, чем эффективностью очистки трансплантатов (1). Несмотря на это логично удалить злокачественные клетки, которые должны присутствовать в аутотрансплантате, и недавно полученные доказательства при исследованиях других типов опухолей показывают важность такой очистки (16). При раке молочной железы мы предполагаем применить простую, надежную и эффективную процедуру, такую же, что и описанная здесь.
Пример 2
Так как клетки рака молочной
железы могут характеризоваться различной чувствительностью к иммунотоксинам так, что эффективность очистки с помощью ВМ7 и МОС31 может быть различной при использовании клеток рака молочной железы от
различных больных, тот же самый эксперимент, что и выполненный ранее на РМ1 клетках рака молочной железы (Пример 1), был повторен с другой клеточной линией, МА11. Было обнаружено, что эффект обработки
иммунотоксинами был также хорош или даже лучше при их действии на МА11 клетки по сравнению с влиянием на РМ1 клетки (Таблица 4). Результаты подтверждают высокую специфическую активность обработки
иммунотоксинами для очистки.
В отдельных экспериментах изучалась кинетика активности иммунотоксина в отношении уничтожения клеток в опыте, когда РМ1 клетки рака молочной железы добавляли к клеткам-предшественникам периферической крови (отношение 1:100). После инкубации в течение 2 часов смешанную суспензию клеток замораживали и затем оттаивали перед тем, как клетки высевали, и жизнеспособность раковых клеток и нормальных клеток-предшественников определяли в параллельных экспериментах. Было найдено, что интоксикация клеток рака молочной железы наступает быстро, и в течение приблизительно 72 часов все опухолевые клетки погибают. По сравнению с этим не было найдено никаких отличий в жизнеспособности нормальных клеток-предшественников в культурах с обработанными иммунотоксинами и необработанными клетками в тех же временных рамках.
Примеры 3-4
Карциномные клетки, которые распространились до кости или костного мозга, плевральной или
абдоминальной полостей, ткани мозга и спинного мозга, а также урогенитального тракта, могут быть избирательно уничтожены иммунотоксинами, введенными в опухоль, в жидкости указанных полостей тела или
системно, например, в метастазирующие опухолевые клетки-мишени таких тканей, как кровь, кости и костный мозг.
Пример 3
МА-11 клетки рака молочной железы человека вводили в
левый желудочек сердца иммунодефицитных крыс. У необработанных контрольных животных развивались симптомы сдавления спинного мозга и их необходимо было забить через 34-37 дней после введения клеток. У
животных, обработанных с помощью внутривенного введения однократной дозы МОС31-РЕ (20 мкг/крыса), выявлялся продолжительный бессимптомной период жизни, и некоторые животные жили более 50 дней.
Другой эксперимент с использованием той же модели подтвердил эти результаты, и в этом случае некоторые животные выживали в течение периода наблюдения сроком в 110 дней. В этих экспериментах одну группу крыс обрабатывали иммунотоксином, включающим 425.3 антитело, направленное против EGF рецептора, конъюгированное с РЕ. Все животные в этой группе выжили.
В третьем эксперименте с этой моделью у контрольных крыс проявлялись симптомы сдавления спинного мозга и их необходимо было забить между 40-м и 60-м днями после введения клеток. Этот эксперимент включал три опытные группы, одну обрабатывали 20 мкг 425.3-РЕ и одна получала 10 мг каждого из двух иммунотоксинов. Значительное увеличение продолжительности бессимптомного периода жизни получено с обоими иммунотоксинами, применяемыми индивидуально, давая 60% и 80% длительности выживаемости с МОС31-РЕ и 425.3-РЕ, соответственно. В экспериментах с их комбинацией все животные выживали без симптомов болезни.
В четвертом эксперименте с этой моделью действие МОС31-РЕ сравнивали с таковым цис-платина и доксорубицина. В этом эксперименте все животные, обработанные МОС31-РЕ, выживали в течение более 70 дней, в то время как доксорубицин проявлял только слабый эффект, а крысы, обработанные цис-платином, жили не дольше, чем контрольные животные, обработанные солевым раствором. Эти данные убедительно демонстрируют, что применяемые иммунотоксины находятся далеко впереди в отношении уничтожения метастазов рака молочной железы по сравнению с доксорубицином и цис-платином, двумя лекарствами, наиболее часто применяемыми в клинике.
Пример 4
МТ-1 клеточная линия рака молочной железы человека применялась в двух различных экспериментах. В первом из них
клетки вводили в левый желудочек сердца и контрольных животных необходимо было забить в среднем через 19 дней из-за симптомов сдавления спинного мозга. Все животные, обработанные путем внутривенного
введения 425.3-РЕ через один день после инъекции клеток, выжили. В других экспериментах МТ-1 опухолевые клетки вводили непосредственно в полость большой берцовой (тибиальной) кости крыс, содержащую
костный мозг. Всех необработанных животных необходимо было забить 20-ю днями позже из-за роста тибиальных опухолей, в то время как все крысы, обработанные путем внутривенного введения 20 мкг 425.3-РЕ
через один день после инъекции клеток, прожили более 100 дней.
Кроме того, в такой модели, когда МТ-1 опухолевые клетки вводили непосредственно в костный мозг тибиальной кости крыс, эффект ВМ7-РЕ, введенного либо на первый день, либо на седьмой день, был сравним с эффектами 425.3-РЕ в группах животных, обработанных им в те же дни, что и ВМ7-РЕ. Более того, исследовался также эффект доксорубицина (Адриамицина), введенного внутривенно на 7-й и 14-й дни. Было обнаружено, что оба иммунотоксина вылечивали 80% крыс, вводились ли они на первый или на седьмой день. Когда применялась комбинация двух иммунотоксинов с половинной концентрацией каждого, все животные выживали. По сравнению с этим доксорубицин был явно менее эффективным, оставляя в живых только 35% животных через 90 дней. Контрольных животных необходимо было забить, как и в предшествующих экспериментах, через 20 дней после введения клеток. Данные подтверждают выявленный ранее эффект 425.3-РЕ. Существенно, что обнаружение, что ВМ7-РЕ является таким же эффективным, что и 425.3-РЕ. Оба агента по эффективности действия ушли далеко вперед по сравнению с доксорубицином, одним из лекарств, наиболее часто применяемым при лечении рака молочной железы. Более того, комбинация двух иммунотоксинов вылечивала от этой болезни всех животных.
Пример 5
В двух вариантах экспериментов
тестировали эффект полученного рекомбинантным способом иммунотоксина, направленного против продукта егbВ2-гена, с выполненным рекомбинантным способом вариантом РЕ. В модели, описанной в Примере 4,
самая высокая концентрация рекомбинантного иммунотоксина значительно увеличивала продолжительность жизни животных, и 35% крыс выживали. В модели, когда МТ-1 клетки рака молочной железы вводили
интратекально (подоболочечно) иммунодефицитным крысам, обработка рекомбинантным иммунотоксином также была интратекальной (на 1-й, 2-й и 3-й дни), что вело к значительному увеличению продолжительности
жизни животных. Этот эффект был дозозависимым, и две различные дозы увеличивали продолжительность жизни животных с 10.6 дней (обработанные солью контроли) до 23.4 дней и 32.8 дней при применении двух
различных доз иммунотоксина. При самой высокой дозе 20% крыс выживало. Так как токсичности не наблюдалось даже при применении самой высокой дозы, ожидается, что эффект при оптимальных дозах может быть
даже еще лучшим.
Реферат
Изобретение относится к медицине и касается способа уничтожения клеток рака молочной железы или других карциномных клеток, препарата для уничтожения клеток, а также набора для выполнения способа. Сущность изобретения заключается в уничтожении нежелательных клеток-мишеней в клеточной популяции, включающей содержащие ядро клетки, собранные из периферической крови, или СD34+-клетки, или сходные с ними ранние клетки-предшественники, при этом клеточную популяцию in vitro или in vivo экспонируют с двумя или более иммунотоксинами, которые избирательно уничтожают клетки мишени. Преимущество изобретения заключается в избирательности действия на злокачественные клетки. 3 с. и 9 з.п. ф-лы, 7 табл.

Комментарии