Композиции из культивируемого мяса - RU2778255C2
Код документа: RU2778255C2
Чертежи






















Описание
ПЕРЕКРЕСТНАЯ ССЫЛКА
[001] Данная заявка испрашивает приоритет согласно предварительной заявке на патент США № 62/532998, поданной 15 июля 2017 г., содержание которой полностью включено в настоящий документ посредством ссылки.
ОБЛАСТЬ ТЕХНИКИ
[002] Настоящее изобретение относится помимо прочего к композициям из культивируемого мяса и способам их получения.
УРОВЕНЬ ТЕХНИКИ
[003] Культивируемое мясо, также известное как искусственное (синтетическое) или чистое мясо, получают из клеточной культуры с использованием методов тканевой инженерии, оно является значимой альтернативой традиционному производству мяса с использованием живых животных. В последнее десятилетие этому открытию уделялось повышенное внимание в общественном мнении, популярных СМИ, инвесторами и научным сообществом, особенно после получения первого культивированного в лаборатории говяжьего бургера. Пища, полученная с использованием животных, считается нерациональной, поскольку животные потребляют большое количество пищи в течение всей своей жизни, причем 80-90% калорий расходуется на метаболизм животного и получение непригодных к пище тканей. При сравнении различных отраслей промышленности говядина оказывает наибольшее воздействие на окружающую среду, однако в общем все продукты животного происхождения оказывают

[004] Интенсивное промышленное ведение сельского хозяйства и плохие условия содержания животных являются причиной заболеваний пищевого происхождения, таких как свиной и птичий грипп, а также распространения кишечной палочки, сальмонеллы и кампилобактер, которые можно обнаружить в мясе. Получение мяса в стерильной контролируемой среде может улучшить безопасность пищи. Кроме того, 70% всех антибиотиков, используемых в Соединенных Штатах, передаются сельскохозяйственным животным в качестве пищевой добавки, которая способствует отбору устойчивых к противомикробным препаратам штаммов и увеличивает вероятность возникновения бактерий, резистентных ко многим лекарственным препаратам. Злоупотребление антибиотиками является ключевой причиной появления бактерий, резистентных к антибиотикам, на которые только в США возлагают ответственность за экономические потери в размере 55 миллиардов долларов, 2 миллиона инфекций, 250000 госпитализаций и по меньшей мере 23000 смертей в год. Бактерии с резистентностью к колистину, последнему средству из антибиотиков, недавно появились на китайских свинофермах.
[005] Современная технология культивирования мяса фокусируется на культуре сателлитных клеток. Клетки выращивают в двумерных (2D) баллонах или на микроносителях в суспензии, изолируют, дифференцируют и собирают. Однако ткани состоят не исключительно из клеток; большую часть ткани представляет внеклеточный матрикс (ВКМ), который состоит из макромолекул, таких как гликопротеины и олигосахариды, и придает ткани ее биохимические и биомеханические свойства. ВКМ регулирует поведение клеток и влияет на их композицию. Таким образом, ВКМ-продуцирующие клетки существенны для культивируемого мяса, и таких процессов, как сбор клеток, следует избегать. Кроме того, трехмерная (3D) клеточная культура имитирует естественную клеточную среду и имеет решающее значение для правильного поведения клеток, которое влияет на биохимическое содержание клеток.
КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
[006] В некоторых вариантах реализации настоящее изобретение относится к пригодным к употреблению в пищу композиций, содержащим мышечные трубочки, и к способу получения пригодных к употреблению в пищу композиций.
[007] Изобретение частично основано на выводах о том, что культура клеток, содержащая множество типов клеток (например, сателлитные клетки, ВКМ-секретирующие клетки и эндотелиальные клетки), показала лучшую выживаемость, пролиферацию и образование мышечных трубочек по сравнению с контрольной группой, например, при выращивании на трехмерных пористых матрицах.
[008] Изобретение дополнительно частично основано на неожиданных выводах о том, что сателлитные клетки, такие как сателлитные клетки, отличные от клеток человека, обладали лучшей дифференциальной активностью при совместном культивировании с низкой концентрацией эндотелиальных клеток (ЭК) вместо высокой концентрации ЭК.
[009] В соответствии с одним аспектом обеспечен способ получения пригодной к употреблению в пищу композиции, включающий стадии: (а) инкубирования трехмерной пористой матрицы и множества типов клеток, содержащих: (i) миобласты или их клетки-предшественники; и по меньшей мере одно из: (ii) по меньшей мере один тип клеток, секретирующих внеклеточный матрикс (ВКМ); или (iii) эндотелиальных клеток или их клеток-предшественников, причем миобласты или их клетки-предшественники и их эндотелиальные клетки или их клетки-предшественники инкубируют при соотношении в диапазоне между 10:1 и 1:10; и (b) индуцирования дифференцировки миобластов или их клеток-предшественников в мышечные трубочки, в результате чего получают пригодную к употреблению в пищу съедобную композицию.
[010] В некоторых вариантах реализации множество типов клеток содержит миобласты или их клетки-предшественники, по меньшей мере, один тип клеток, секретирующих внеклеточный матрикс (ВКМ), и эндотелиальные клетки или их клетки-предшественники.
[011] В некоторых вариантах реализации ВКМ-секретирующая клетка выбрана из группы, состоящей из: стромальных клеток, фибробластов, перицитов, гладкомышечных клеток и их клеток-предшественников.
[012] В некоторых вариантах реализации множество типов клеток содержит миобласты, ВКМ-секретирующие клетки и эндотелиальные клетки.
[013] В некоторых вариантах реализации клетка-предшественник миобласта представляет собой сателлитную клетку.
[014] В некоторых вариантах реализации эндотелиальные клетки выбраны из скелетных микроваскулярных эндотелиальных клеток, гладкомышечных клеток аорты или их комбинации.
[015] В некоторых вариантах реализации множество типов клеток содержит сателлитные клетки, ВКМ-секретирующие клетки и эндотелиальные клетки.
[016] В некоторых вариантах реализации миобласты или их клетки-предшественники и ВКМ-секретирующие клетки инкубируют при соотношении в диапазоне между 10:1 и 1:1.
[017] В некоторых вариантах реализации ВКМ-секретирующие клетки и эндотелиальные клетки инкубируют при соотношении в диапазоне между 1:10 и 1:1.
[018] В некоторых вариантах реализации сателлитные клетки, ВКМ-секретирующие клетки и эндотелиальные клетки инкубируют при соотношении в диапазоне между 10:1:1 и 2:1:10.
[019] В некоторых вариантах реализации ВКМ-секретирующая клетка представляет собой фибробласт, его клетку-предшественник или их комбинацию.
[020] В некоторых вариантах реализации трехмерная пористая матрица выбрана из группы, состоящей из структурированного белка, неструктурированного белка и полисахарида. В некоторых вариантах реализации структурированный белок представляет собой структурированный соевый белок. В некоторых вариантах реализации трехмерная пористая матрица содержит поры со средним диаметром в диапазоне от 20 до 1000 микрометров.
[021] В некоторых вариантах реализации множество типов клеток представляют собой клетки, отличные от клеток человека. В некоторых вариантах реализации множество клеток происходит от млекопитающего домашнего скота.
[022] В некоторых вариантах реализации миобласты или их клетки-предшественники и трехмерную пористую матрицу инкубируют при соотношении в диапазоне от 103 до 107миобластов или их клеток-предшественников к 10 мг трехмерной пористой матрицы. В некоторых вариантах реализации трехмерная пористая матрица дополнительно содержит внеклеточный матрикс.
[023] В соответствии с другим аспектом обеспечена композиция, содержащая: (а) трехмерную пористую матрицу; (b) мышечные трубочки, содержащие 100000-250000 ядер мышечной трубочки на мм3трехмерной пористой матрицы; и (c) множество типов клеток, выбранных из группы, состоящей из: (i) миобластов или их клеток-предшественников; и, по меньшей мере, одного из: (ii), по меньшей мере, одного типа ВКМ-секретирующих клеток; или (iii) эндотелиальных клеток или их клеток-предшественников, причем эндотелиальные клетки или их клетки-предшественники составляют менее 15% от множества клеток.
[024] В некоторых вариантах реализации композиция является пригодной к употреблению в пищу.
[025] Если не указано иное, все технические и/или научные термины, используемые в настоящем документе, имеют то же значение, которое обычно понимают специалисты в области техники, к которой относится изобретение. Хотя способы и материалы, подобные или эквивалентные тем, что описаны в настоящем документе, могут использоваться при практическом применении или испытании вариантов реализации изобретения, ниже описаны примеры способов и/или материалов. В случае конфликта будет осуществлен контроль описания патента, включая определения. В дополнение материалы, способы и примеры являются только иллюстративными и не предназначены для обязательного ограничения.
[026] Дополнительные варианты реализации и полный объем применимости настоящего изобретения станут очевидными из подробного описания, приведенного ниже. Однако следует понимать, что подробное описание и определенные примеры, хотя и указывают предпочтительные варианты реализации изобретения, даны только в качестве иллюстрации, поскольку для специалистов в данной области техники будут очевидны различные изменения и модификации в пределах сущности и объема изобретения из этого подробного описания.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
[027] На Фиг. 1A-1C представлены фотографии, показывающие коммерческие ТСБ (структурированный соевый белок). (A) показывает крупные, средние и маленькие куски продуктов ТСБ. (B) и (C) показывают 2 других коммерческих хлопьевидных продукта ТСБ, подписанного как TVP (слева) и Arcon (справа).
[028] На Фиг. 2A-2B представлены фотографии, показывающие подготовку матрицы ТСБ (A) и клетку, содержащую матрицы из ТСБ (B).
[029] На Фиг. 3A-3B представлены изображения СЭМ с 100-кратным увеличением крупного ТСБ (A) и среднего ТСБ (B).
[030] На Фиг. 4А-4В представлены изображения СЭМ с 2×105 увеличением крупного ТСБ (A) и среднего ТСБ (B).
[031] На Фиг. 5A-5C представлены изображения конфокальной микроскопии матриц из ТСБ, заселенных фибробластами (красный) и эндотелиальными (зеленый) клетками на 8 (A), 18 (B) и 21 (C) дни после засева фибробластов.
[032] На Фиг. 6 представлены изображения конфокальной микроскопии, сделанные через 14 дней после засева 200 000 фибробластов (красный) на три различных образца матриц (образцы 1-3), полученные из различных источников, обозначенных как Крупные, Средние, Малые и Средние от 90°, при этом матрицы, обозначенные как Средние от 90°, были вырезаны с пористой стороны ТСБ при процедуре получения матриц из ТСБ. Масштабная линейка = 1 мм.
[033] На Фиг. 7 представлено изображение конфокальной микроскопии миобластов, культивируемых на матрице из ТСБ в течение 14 дней (Голубой - ДАФИ (4,6-Диамидино-2-фенилиндол дигидрохлорид), Зеленый - десмин).
[034] На Фиг. 8 представлены изображения конфокальной микроскопии скелетных мышечных клеток быка, культивируемых на матрице из ТСБ в течение 14 дней (Голубой - ДАФИ, Зеленый-фаллоидин).
[035] На Фиг. 9А-9Е представлены микроснимки гладкомышечных клеток аорты быка (ГМКАБ) (пассаж 8), засеянные в разные среды. (А) Базальная среда; (B) Коммерческая среда; (C) обогащение фетальной бычьей сывороткой (15%); (D) обогащение заменимыми аминокислотами; и (E) обогащение пируватом. Масштабная линейка = 100 мкм.
[036] На Фиг. Фиг. 10А-10В представлены вертикальные гистограммы сравнения различных сред при пролиферации гладкомышечных клеток аорты быка в пассаже 9 (А) и пассаже 10 (В) после 3 дней культивирования.
[037] На Фиг. 11А-11В представлен график, демонстрирующий кинетику роста дермальных фибробластов быка (ДФБ) (A) и гладкомышечных клеток аорты быка (ГМКАБ; B).
[038] На Фиг. 12A-12L представлены изображения флуоресцентно-меченных эндотелиальных клеток аорты быка (ЭКАБ), засеянных в сокультуре с поддерживающими клетками на 2 (A, D, G и J), 6 (B, E, H и K) и 8 (C, F, I и L) дни. Клетки ЭКАБ (зеленый) засевали либо с гладкомышечными клетками аорты быка (ГМК; A-F), либо дермальными фибробластами быка (ДФБ; G-L), оба красного цвета. A-C и G-I представляют собой сканирование фрагментов 3×3 с увеличением в ×5. D-F и J-L представляют собой увеличение ×20. Масштабная линейка = 100 мкм.
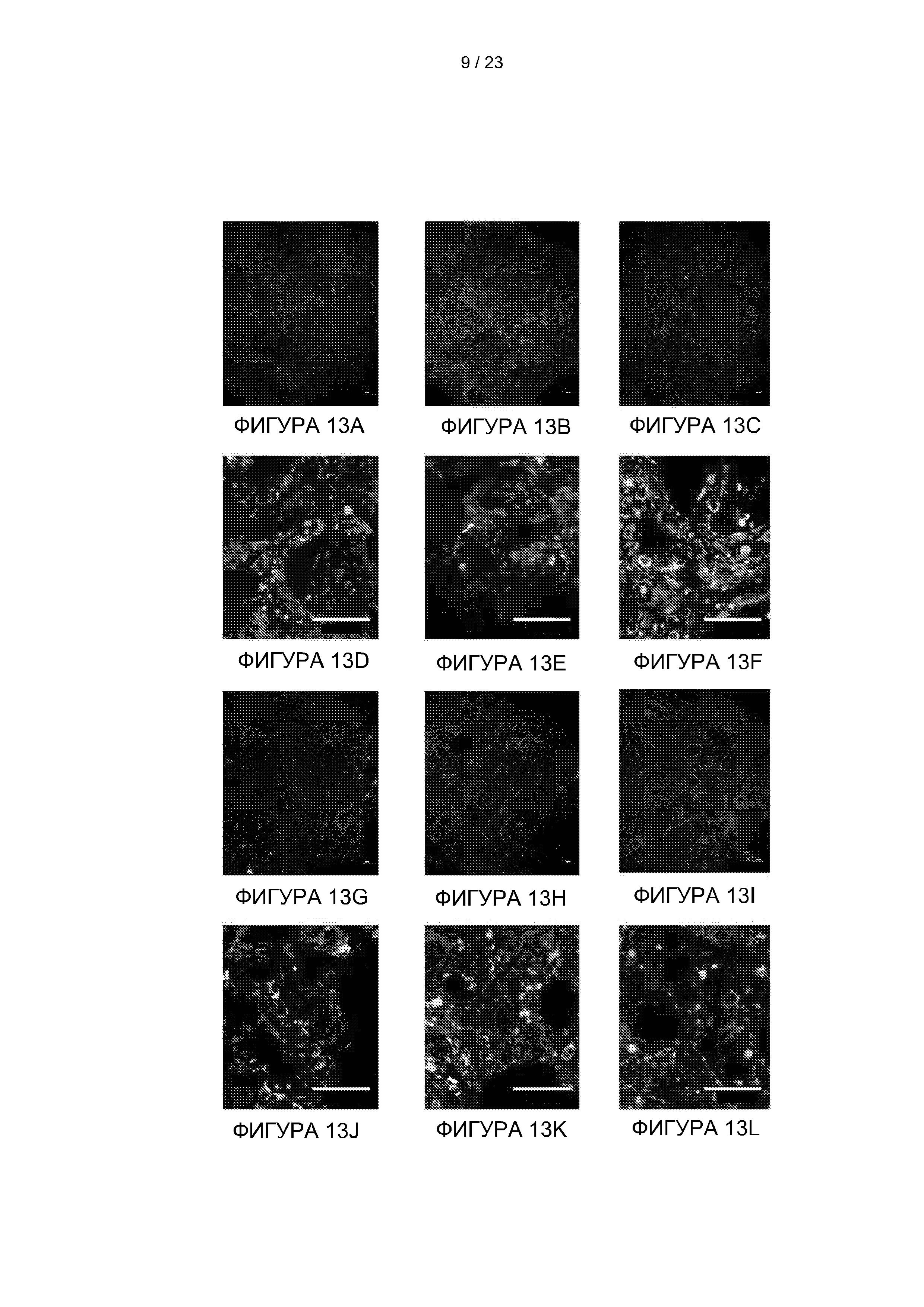
[039] На Фиг. 13А-13L представлены изображения флуоресцентно-меченных микроваскулярных эндотелиальных клеток скелетной мышцы быка (МЭКСкМБ), засеянных в сокультуре с поддерживающими клетками на 2 (A, D, G и J), 6 (B, E, H и K), и 8 (C, F, I и L) дни. Клетки МЭКСкМБ (зеленый) засевали либо гладкомышечными клетками аорты быка (ГМК; A-F), либо дермальными фибробластами быка (ДФБ; G-L), оба красного цвета. A-C и G-I представляют собой сканирование фрагментов 3×3 с увеличением в ×5. D-F и J-L представляет собой увеличение ×20. Масштабная линейка = 100 мкм.
[040] На Фиг. 14A-14F представлены изображения флуоресцентно-меченных сокультур клеток, содержащих ЭКАБ и ГМК в различных соотношениях. (A и D) 5:1 ЭКАБ к ГМК; (B и E) 1:1 ЭКАБ к ГМК. (С и F) представляют увеличение B и Е, соответственно. А-С представляют изображения, снятые на 2 день, и D-F - на 6 день. Масштабная линейка = 100 мкм
[041] На Фиг. 15A-15E представлены изображения флуоресцентно-меченных сокультур клеток, содержащих ЭКАБ и ДФБ в различных соотношениях. (A и C) 5:1 ЭКАБ к ГМК; (B и D) 1:1 ЭКАБ к ГМК. (E) более высокое разрешение D. A и B представляют изображение, снятое на 2 день, а C и D - на 6 день. ЭКАБ - красный; Масштабная линейка = 100 мкм.
[042] На Фиг. 16A-16L представлены изображения флуоресцентно-меченных клеточных сокультур, содержащих ЭКАБ и ГМК в различных соотношениях. (A-D) 1:3 ЭКАБ к ГМК; (E-H) 1:1 ЭКАБ к ГМК; и (I-L и F) 5:1 ЭКАБ к ГМК. (B, D, F, H, J и L) представляют увеличение (A, C, E, G, I и K), соответственно. (A, B, E, F, I и J) представляют изображение, снятое на 2 день, и (C, D, G, H, K и L) - на 6 день. ЭКАБ - красный; Масштабная линейка = 100 мкм.
[043] Фиг. 17A-17G демонстрируют дифференцировку сателлитных клеток быка (СКБ) и образование мышечных трубочек. (A-C) представляют изображения клеток СКБ до дифференцировки; (D-F) - изображения клеток СКБ после дифференцировки. (G) - вертикальная гистограмма, показывающая индекс слияния (ИС) образцов. (A и D) световая микроскопия; (B и E) Хехст; и (С и F) Миогенин. Разница в автоматическом ИС до и после дифференцировки оказалась статистически значимой (P-значение=0,00003), тогда как разница между автоматическим и ручным ИС - нет.
[044] На Фиг. 18A-18G представлены светлопольные микроснимки СКБ в 0 день дифференцировки. (А) Контрольная группа; (B) фактор роста фибробластов быка (бФРФ); (C) эпидермальный фактор роста (ЭФР); (D) ИФР-1 (инсулиноподобный фактор роста 1); (E) Про-ЛИФ (среда для пролиферации без фактора роста ЛИФ (лейкоз-ингибирующий фактор)); (F) отъем; и (G) DiI. Масштабная линейка = 300 мкм.
[045] На Фиг. 19A-19G представлены светлопольные микроснимки СКБ на 4 день дифференцировки. (А) Контрольная группа; (B) фактор роста фибробластов быка (бФРФ); (C) эпидермальный фактор роста (ЭФР); (D) ИФР-1 (инсулиноподобный фактор роста 1); (E) Про-ЛИФ; (F) отъем; и (G) DiI. Масштабная линейка = 300 мкм.
[046] Фиг. 20А-20Н демонстрируют образование мышечной трубочки СКБ через 7 дней дифференцировки. (A-G) - светлопольные микроснимки (A) Контрольная группа; (B) фактор роста фибробластов быка (бФРФ); (C) эпидермальный фактор роста (ЭФР); (D) ИФР-1 (инсулиноподобный фактор роста 1); (E) Про-ЛИФ; (F) отъем; и (G) DiI. Масштабная линейка = 300 мкм. (H) - вертикальная гистограмма в % площади мышечных трубочек, количественно определенная для каждого из различных условий расселения.
[047] На Фиг. 21 представлена вертикальная гистограмма, демонстрирующая количественные значения покрытия клетками пористых матриц на 7 день со питательной средой или средой Про-ЛИФ.
[048] На Фиг. 22A-22L представлены изображения конфокальной микроскопии флуоресцентно-меченого СКБ, дифференцированного на пористой матрице. Фаза размножения включала: (A-D) клетки, культивируемые на питательной среде; (E-H) клетки, культивируемые на среде Про-ЛИФ; (I-L) Клетки, культивируемые на среде Про-ЛИФ-бФРФ. Фаза дифференцировки включала: (A, E и I) к среде для дифференцировки не добавляли факторы роста (ФР); (B, F и J) в среду для дифференцировки добавляли ИФР-1; (C, G и K) в среду для дифференцировки добавляли ЭФР; и (D, H и L) в среду для дифференцировки добавляли ИФР-1 и ЭФР. DiI (красный); десмин (зеленый); Масштабная линейка = 100 мкм.
[049] На Фиг. 23A-23O представлены иммунофлуоресцентные микроснимки три-культур, выращенных на матрицах L-ПЛА/ПЛГ, взятых через 14 дней после засева. СКБ, ГМК и ЭКАБ засевали на матрицы L-ПЛА/ПЛГ с различной плотностью клеточной популяции (A-E) 2:1:1 и (F-J) 2:1:5. (K-O) более высокое разрешение (A-E). Матрицы окрашивали (A, F и K) на ДАФИ (4,6-Диамидино-2-фенилиндол дигидрохлорид); (В, G и L) Миогенин; (С, Н и М) DiI; (D, I и N) CD31. (E, J и O) представляют собой объединенное изображение. Масштабная линейка = 100 мкм (A-J); 10 мкм (К-О).
[050] На Фиг. 24A-24F представлены иммунофлуоресцентные микроснимки матриц L-ПЛА/ПЛГ через 14 дней после засева. СКБ, ГМК и ЭКБ засевали на матрицы L-ПЛА/ПЛГ с различной плотностью клеточной популяции (A-C) 2:1:1 и (D-F) 2:1:5. (A и D) СКБ и ГМК (2:1); (B и E) СКБ и ЭКБ (2:1); и (C и F) монокультура только СКБ. Матрицы окрашивали на ДАФИ (синий); миогенин (серый); DiI (красный); и CD31 (зеленый). Масштабная линейка = 100 мкм.
[051] На Фиг. 25A-25H представлены иммунофлуоресцентные микроснимки СКБ, культивированного совместно с ГМК на матрицах из структурированных соевых белков, через 14 дней после засева. Испытывали различные клеточные плотности (A-D) 2: 1: 1 и (E-H) 2: 1: 5. Матрицы окрашивали на (A и E) ДАФИ; (В и F) миогенин; (С и G) DiI; (D) и (H) представляют собой объединенные изображения (A-C) и (E-G), соответственно. Масштабная линейка = 100 мкм.
[052] На Фиг. 26A-26E представлены иммунофлуоресцентные микроснимки СКБ, ГМК и ЭКБ, культивируемых совместно на матрицах из структурированных соевых белков через 14 дней после засева. Матрицы окрашивали на (A) ДАФИ; (B) миогенин; (C) DiI; и (D) CD31. (E) представляет собой объединенное изображение (A-D).
[053] На Фиг. 27А-27В представлены микроснимки трихромного окрашивания трех культур СКБ, ГМК и ЭКБ, засеянных на матрице L-ПЛА/ПЛГ в соотношении 2:1:1, через 14 дней после засева. (A) Сканирование с увеличением ×5 и (B) увеличением ×10. Матрицы окрашены в три цвета. Положительные пятна внеклеточного матрикса (ВКМ) объединены в кружки. Масштабная линейка = 100 мкм.
[054] На Фиг. 28A-28C представлены вертикальные гистограммы, показывающие влияние поддерживающих клеток на миогенную дифференцировку и важность соотношения различных клеток в культуре. Миогенная дифференцировка показана для три-культур (СКБ: ГМК: ЭКБ) и контрольных групп (сокультура или монокультура) при плотностях клеточных популяций (A) 2:1:1 и (B) 2:1:5 на матрице L-ПЛА/ПЛГ , (С) 2:1:1 на структурированном соевом белке со статистическим анализом.
[055] Фиг. 29A-29N описывают дифференцировку три-культур на матрицах из структурированного белка. (A-L) представляют собой флуоресцентные изображения иммуноокрашенных матриц из структурированного соевого белка через 14 дней после засева. Клетки засевали на матрицы из структурированного соевого белка (A, E и I) СКБ, (B, F и J) СКБ + ЭКБ; (C, G и K) СКБ + ГМК; и (D, H и L) три-культура СКБ + ГМК + ЭКБ. (A-D) ×20-кратное увеличение, (E-H) сканирование фрагментов ×20 и (I-L) окрашивание миогенин, × 63-кратное увеличение. Матрицы окрашивали ДАФИ (синий), миогенин (серый), DiI (красный) и CD31 (зеленый). Масштабная линейка = 100 мкм. (M) представляет собой вертикальную гистограмму количественного определения экспрессии миогенина на матрицах из ТСБ в монокультуре (только СКБ), сокультурах (СКБ + ЭКБ; или СКБ + ГМК) и три-культуре (СКБ + ГМК + ЭКБ). (N) - вертикальная гистограмма количественного определения покрытия СКБ на матрицах из ТСБ в монокультуре и сокультуре с ГМК.
[056] На Фиг. 30 представлены флуоресцентные изображения иммуноокрашенного СКБ, засеянного без геля на матрицах Gelfoam, через 14 дней после засева. Матрицы окрашивали ДАФИ (синий), миогенин (серый), DiI (красный); и CD31 (зеленый). Масштабная линейка = 50 мкм.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
[057] Настоящее изобретение относится к композициям, наборам и способам получения культивируемого мяса для потребления в пищу. Настоящее изобретение в некоторых вариантах реализации относится к пригодной к употреблению в пищу композиции, содержащей пористый структурированный белок и трехмерную мультиклеточную ткань, содержащую миобласты и один или более типов клеток, прикрепленных к нему. Изобретение, кроме того, относится к способам получения композиции путем культивирования миобластов in vitro и клеток одного или более типов с трехмерной пористой матрицей (например, пористым структурированным белком) в определенных условиях.
[058] В некоторых вариантах реализации композиция согласно изобретению может быть предназначена для потребления людьми, животными, не являющимися людьми, или теми, и другими. В некоторых вариантах реализации продукты из культивируемого мяса представляют собой пищевые продукты для потребления человеком. В других вариантах реализации продукты из культивируемого мяса используют в качестве корма для животных, такого как корм для скота, корм для аквакультуры или корм для домашних животных.
[059] В некоторых вариантах реализации изобретение относится к способу получения пригодной к употреблению в пищу композиции, включающему стадии:
а. инкубирования трехмерной пористой матрицы и множества типов клеток, содержащих миобласты и, по меньшей мере, один тип клеток, секретирующих ВКМ, выбранных из группы, состоящей из: адипоцитов, фибробластов и их клеток-предшественников; и эндотелиальную клетку или ее клетку-предшественник
b. обеспечения возможности размножения множества типов клеток на трехмерной пористой матрице; и
с. индуцирования дифференцировки миобластов в мышечные трубочки;
тем самым обеспечивая возможность образования клетками пригодной к употреблению в пищу композиции, содержащей трехмерную мультиклеточную ткань, содержащую мышечные клетки и пористый структурированный белок.
[060] Используемый в настоящем документе термин «мышечная трубочка» относится к многоядерному волокну, которое образуется в результате слияния множества миобластов и/или миоцитов. Используемый в настоящем документе термин «мышечная клетка» относится к любой клетке, которая относится к мышечной ткани и может охватывать: миобласты, сателлитные клетки (СК), мышечные трубочки, миофибриллы и ткани миофибрилл.
[061] В некоторых вариантах реализации способ включает культивирование миобластов in vitro или ex vivo и обеспечивает возможность дифференцировки этих клеток в определенные типы мышечных клеток, таких как клетки скелетных мышц или гладкомышечные клетки.
[062] В некоторых вариантах реализации изобретение относится к пригодной к употреблению в пищу композиции, содержащей: пористый структурированный белок; и трехмерную мультиклеточную ткань, содержащую мышечные клетки, при этом трехмерная многоклеточная ткань прикреплена к пористому структурированному белку, и при этом трехмерная мультиклеточная ткань происходит от культивирования in vitro множества типов клеток, содержащих: миобласты и один или более типов клеток, выбранных из: адипоцитов, фибробластов, гладкомышечных клеток, эндотелиальных клеток и их клеток-предшественников с пористым структурированным белком.
[063] Как проиллюстрировано ниже, композиция может содержать фибробласты, которые секретируют внеклеточные молекулы так, чтобы образовать внеклеточный матрикс (ВКМ), обеспечивая дополнительную структурную и механическую подложку клеткам.
[064] Как дополнительно проиллюстрировано ниже, композиция может содержать эндотелиальные клетки (ЭК) или эндотелиальные клетки-предшественники (ЭКП) для обеспечения подложки для ткани, обеспечения передачи сигналов и/или образования капиллярного эндотелия.
[065] В некоторых вариантах реализации трехмерная мультиклеточная ткань содержит мышечные клетки, включая клетки скелетных мышц, гладкомышечные клетки и сателлитные клетки. В некоторых вариантах реализации трехмерная мультиклеточная ткань содержит жировые клетки (например, адипоциты). В некоторых вариантах реализации трехмерная мультиклеточная ткань содержит внеклеточный матрикс, секретируемый специализированными клетками (например, фибробластами). В некоторых вариантах реализации трехмерная мультиклеточная ткань содержит эндотелиальные клетки или капиллярный эндотелий, образованный эндотелиальными клетками, включая, но не ограничиваясь этим, аортальные эндотелиальные клетки и скелетные микроваскулярные эндотелиальные клетки. В некоторых вариантах реализации трехмерная мультиклеточная ткань дополнительно содержит внеклеточный матрикс. В некоторых вариантах реализации трехмерная мультиклеточная ткань дополнительно содержит адипоциты. В некоторых вариантах реализации трехмерная мультиклеточная ткань дополнительно содержит капилляры.
[066] В некоторых вариантах реализации изобретение относится к композиции, подходящей для выращивания клеток, содержащей пористый структурированный белок и среду для культивирования клеток. В другом варианте реализации композиция, подходящая для выращивания клеток, дополнительно содержит фактор роста, цитокины, биоактивные агенты, питательные вещества, аминокислоты, соединения антибиотиков, противовоспалительные соединения или любую их комбинацию. Подходящая среда и соединения, подходящие для жизнеспособности и выращивания клеток, известны специалисту в данной области техники.
[067] В некоторых вариантах реализации изобретение относится к композиции, содержащей: множество типов клеток, включающих миобласты и один или более типов клеток, выбранных из: адипоцитов, эндотелиальных клеток фибробластов, гладкомышечных клеток и их клеток-предшественников, прикрепленных к пористому структурированному белку.
[068] В некоторых вариантах реализации изобретение обеспечивает набор, содержащий: трехмерную пористую матрицу (например, пористый структурированный белок); и множество типов клеток, содержащих: миобласты и один или более типов клеток, выбранных из: адипоцитов, фибробластов, гладкомышечных клеток, эндотелиальных клеток и их клеток-предшественников. В некоторых вариантах реализации набор предназначен для получения пригодной к употреблению в пищу композиции. В некоторых вариантах реализации набор дополнительно содержит по меньшей мере один компонент, выбранный из: среды для культивирования клеток, фактора роста, среды для дифференцировки, стимуляторов дифференцировки. В некоторых вариантах реализации набор дополнительно содержит среду для культивирования клеток. В другом варианте реализации среда для культивирования клеток выбрана из сухой порошковой среды, гранулированного препарата, водной жидкости или концентрата среды. В некоторых вариантах реализации множество типов клеток заморожены. В некоторых вариантах реализации набор дополнительно содержит инструкции по применению.
Множество типов клеток
[069] Как будет понятно специалисту в данной области техники, многочисленные типы клеток или популяцию клеток можно культивировать с трехмерной пористой матрицей для образования трехмерной мультиклеточной тканевой архитектуры. В некоторых вариантах реализации один или более тип клеток выбран из: миобластов, ВКМ-секретирующих клеток, эндотелиальных клеток.
[070] В некоторых вариантах реализации один или более тип клеток представляет собой клетки-предшественники миобластов. В некоторых вариантах реализации один или более тип клеток представляет собой клетки-предшественники ВКМ-секретирующей клетки. В некоторых вариантах реализации один или более тип клеток представляет собой клетки-предшественники эндотелиальной клетки.
[071] В контексте настоящего документа клетка-предшественник содержит мезенхимальную стволовую клетку (МСк), эмбриональную стволовую клетку (ЭСк), взрослую стволовую клетку, дифференцированную ЭСк, дифференцированную взрослую стволовую клетку и индуцированную плюрипотентную стволовую клетку (иПСк). В контексте настоящего документа термин «клетка-предшественник» относится к клетке, способной служить источником дифференцированных клеток в множественных линиях дифференцировки, таких как миобласты, фибробласты, адипоциты, стромальные клетки, фибробласты, перициты, гладкомышечные клетки и эндотелиальные клетки. «Клетки-предшественники» отличаются от стволовых клеток тем, что они обычно не обладают обширной способностью к самообновлению.
[072] В некоторых вариантах реализации клетка из множества типов клеток согласно настоящему изобретению представляет собой клетку-предшественник. В некоторых вариантах реализации клетка-предшественник культивируется в монокультуру. В некоторых вариантах реализации клетка-предшественник дифференцируется в монокультуру. В некоторых вариантах реализации клетка-предшественник дифференцируется в монокультуру и затем инкубируется на трехмерной пористой матрице с множеством клеток в соответствии со способом согласно настоящему изобретению. Неограничивающий пример включает, но не ограничивается ими, культивирование и дифференцировку мезенхимальной стволовой клетки в клетку миобласта, а затем засев и последующее инкубирование дифференцированного миобласта на трехмерной пористой матрице. Способы культивирования и индуцирования дифференцировки клеток-предшественников в зрелые клетки будут очевидны для специалиста в данной области техники.
[073] В некоторых вариантах реализации множество типов клеток содержит миобласты и фибробласты. В некоторых вариантах реализации множество типов клеток содержит миобласты, фибробласты и/или клетки-предшественники фибробластов. В некоторых вариантах реализации множество типов клеток содержит миобласты, фибробласты и адипоциты. В некоторых вариантах реализации множество типов клеток содержит миобласты, фибробласты, адипоциты и/или клетки-предшественники фибробластов и/или клетки-предшественники адипоцитов. В некоторых вариантах реализации множество типов клеток содержит миобласты, фибробласты и эндотелиальные клетки. В некоторых вариантах реализации множество типов клеток содержит миобласты, фибробласты и эндотелиальные клетки, и/или клетки-предшественники фибробластов, и/или клетки-предшественники эндотелия. В некоторых вариантах реализации множество типов клеток содержит миобласты и гладкомышечные клетки. В некоторых вариантах реализации множество типов клеток содержит миобласты, гладкомышечные клетки и эндотелиальные клетки. В некоторых вариантах реализации множество типов клеток содержит миобласты, гладкомышечные клетки, эндотелиальные клетки и адипоциты. В некоторых вариантах реализации множество типов клеток содержит миобласты, фибробласты, эндотелиальные клетки и адипоциты. В некоторых вариантах реализации множество типов клеток содержит миобласты, фибробласты, эндотелиальные клетки, адипоциты и/или клетки-предшественники фибробластов, и/или клетки-предшественники адипоцитов, и/или эндотелиальные клетки-предшественники.
[074] В некоторых вариантах реализации множество типов клеток получают от живых животных и культивируют в первичной клеточной линии. В качестве неограничивающего примера клетки можно получить при биопсии и культивировать ex vivo. В качестве другого неограничивающего примера клетки можно получить из коммерческих источников.
[075] В некоторых вариантах реализации множество типов клеток происходят от стволовых клеток, таких как плюрипотентные эмбриональные стволовые клетки. В другом варианте реализации используют мезенхимальные стволовые клетки (МСК). Как известно специалисту в данной области техники, МСК могут служить источником мышечных клеток, жировых клеток, костных клеток и хрящевых клеток. В другом варианте реализации клетки представляют собой индуцированные плюрипотентные стволовые клетки (иПСК). В другом варианте реализации клетки происходят от тотипотентных эмбриональных стволовых клеток, таких как клетки от стадии бластоцисты, оплодотворенной яйцеклетки, плаценты, и пупочного канатика от этих животных.
[076] В некоторых вариантах реализации множество типов клеток происходит от клеток, отличных от клеток человека. В некоторых вариантах реализации множество типов клеток происходит от клеток, отличных от клеток человека, выбранных из группы, состоящей из: млекопитающих, птиц, рыб, беспозвоночных, рептилий, амфибий и их комбинации. В некоторых вариантах реализации множество типов клеток происходит от млекопитающих. В некоторых вариантах реализации множество типов клеток происходит от млекопитающих, отличных от человека. В некоторых вариантах реализации множество типов клеток происходит от млекопитающего домашнего скота. В контексте настоящего документа термин «домашний скот» содержит любое домашнее млекопитающее, полудомашнее млекопитающее или дикое млекопитающее в неволе. Неограничивающие примеры млекопитающих, отличных от человека, включают: антилопу, медведя, бобра, бизона, кабана, верблюда, карибу, крупный рогатый скот, оленя, слона, лося, лису, жирафа, козу, зайца, лошадь, козерога, кенгуру, льва, ламу, американского лося, пекари, свинью, кролика, тюленя, овцу, белку, тигра, кита, яка и зебру или их комбинации. В некоторых вариантах реализации множество типов клеток происходит от клеток птиц. Неограничивающие примеры птиц включают: курицу, утку, эму, гуся, рябчика, страуса, фазана, голубя, перепела и индейку или их комбинации. В некоторых вариантах реализации множество типов клеток происходит от рыб. Неограничивающие примеры рыб включают в себя: окуня, сома, карпа, треску, угря, камбалы, фугу, групер, пикшу, палтуса, сельдь, скумбрию, махи, марлин, хоплостетуса, таутоголябруса, щуку, минтай, лосось, сардину, акулу, пагруса, морской язык, рыбу-меч, тилапию, форель, тунец и судака или их комбинации. В некоторых вариантах реализации множество типов клеток происходит от беспозвоночных. Неограничивающие примеры беспозвоночных включают омара, краба, креветки, моллюски, устрицы, мидии и морского ежа. В некоторых вариантах реализации множество типов клеток происходит от рептилий. Неограничивающие примеры рептилий включают: змею, аллигатора и черепаху. В некоторых вариантах реализации множество типов клеток происходит от амфибий. Неограничивающий пример амфибий включает лягушек.
Засев и культивирование клеток
[077] Как станет понятно специалисту в данной области техники, каждый тип клеток, используемых в композиции и способе, описанных в настоящем документе, могут иметь предпочтительный или оптимальный диапазон плотности клеток и предпочтительную среду или факторы роста, подходящие для жизнеспособности клеток. В некоторых вариантах реализации каждый тип клеток засевают с определенной плотностью клеток. В некоторых вариантах реализации клетки засевают одновременно или последовательно.
[078] В некоторых вариантах реализации миобласты засевают с плотностью клеток от 103 до 107 клеток на 10 мг пористого структурированного белка. В некоторых вариантах реализации разные типы клеток засевают в определенном соотношении. В некоторых вариантах реализации соотношение засеянных миобластов к засеянным фибробластам находится в диапазоне между 1:1000 и 1000:1. В некоторых вариантах реализации соотношение засеянных миобластов и засеянных фибробластов к засеянным эндотелиальным клеткам находится в диапазоне между 1:20 и 20:1. В некоторых вариантах реализации соотношение засеянных миобластов и засеянных фибробластов к засеянным адипоцитам находится в диапазоне между 1:5000 и 5000:1. В некоторых вариантах реализации соотношение засеянных сателлитных клеток к засеянным гладкомышечным клеткам находится в диапазоне между 5:1 и 1:5. В некоторых вариантах реализации соотношение засеянных сателлитных клеток к засеянным скелетным микроваскулярным эндотелиальным клеткам находится в диапазоне между 10:1 и 1:10. В некоторых вариантах реализации соотношение засеянных гладкомышечных клеток к засеянным скелетным микроваскулярным эндотелиальным клеткам находится в диапазоне между 10:1 и 1:10. В некоторых вариантах реализации соотношение засеянных сателлитных клеток к засеянным гладкомышечным клеткам к засеянным скелетным микроваскулярным эндотелиальным клеткам находится в диапазоне между 10:1: 1 и 2:1:10. В одном варианте реализации соотношение засеянных сателлитных клеток к засеянным гладкомышечным клетками к засеянным скелетным микроваскулярным эндотелиальным клеткам находится в диапазоне между 2:1:1 и 2:1:5 или в любом соотношении между ними. В одном варианте реализации соотношение засеянных сателлитных клеток к засеянным гладкомышечным клеткам к засеянным скелетным микроваскулярным эндотелиальным клеткам находится в диапазоне между 2:1:1 и 2:1:2, или в любом соотношении между ними. В одном варианте реализации соотношение засеянных сателлитных клеток к засеянным гладкомышечным клетками к засеянным скелетным микроваскулярным эндотелиальным клеткам находится в диапазоне между 2:1:1 и 2:1:3, или в любом соотношении между ними. В одном варианте реализации соотношение засеянных сателлитных клеток к засеянным гладкомышечным клетками к засеянным скелетным микроваскулярным эндотелиальным клеткам находится в диапазоне между 2:1:1 и 2:1:4, или в любом соотношении между ними. Каждая возможность представляет отдельный вариант реализации настоящего изобретения.
[079] В некоторых вариантах реализации плотность засеянных клеток и плотность инкубированных клеток сравнительно одинаковы.
[080] В одном варианте реализации «% покрытия» относится к площади или объему пористой матрицы, который находится в контакте с клетками или мышечными трубочками. В другом варианте реализации % покрытия относится к площади или объему пористой матрицы, которые заняты клетками или мышечными трубочками. В контексте настоящего документа клетки, находящиеся в контакте с матрицей, находятся на или внутри нее, или в комбинации этого.
[081] В некоторых вариантах реализации покрытие % множества клеток составляет по меньшей мере 10%, по меньшей мере 20%, по меньшей мере, 30%, по меньшей мере 40%, по меньшей мере 50%, по меньшей мере 60%, по меньшей мере 70%, по меньшей мере 80%, по меньшей мере 90 или, по меньшей мере, 99%. В некоторых вариантах реализации покрытие % множества клеток составляет 5-20%, 15-30%, 25-40%, 35-50%, 45-60%, 55-70%, 65-80%, 75-90%, 85-100% или любой диапазон между ними. Каждая возможность представляет отдельный вариант реализации настоящего изобретения.
[082] В некоторых вариантах реализации покрытие % сателлитных клеток составляет по меньшей мере 35%, по меньшей мере 50%, по меньшей мере 60%, по меньшей мере 70%, по меньшей мере 80%, по меньшей мере 90 или по меньшей мере 99%. В некоторых вариантах реализации покрытие % сателлитных клеток составляет 25-40%, 35-50%, 45-60%, 55-70%, 65-80%, 75-90%, 85-100% или любой диапазон между ними. Каждая возможность представляет отдельный вариант реализации настоящего изобретения.
[083] В некоторых вариантах реализации покрытие % эндотелиальных клеток составляет не более 2%, не более 5%, не более 10%, не более 15%, не более 20%, не более 25%, не более 30 %, не более 35%, не более 40%, не более 45% или не более 50%. В некоторых вариантах реализации покрытие % эндотелиальных клеток составляет 5-15%, 10-25%, 20-35%, 30-50% или любой диапазон между ними. Каждая возможность представляет отдельный вариант реализации настоящего изобретения.
[084] В некоторых вариантах реализации эндотелиальные клетки используются для увеличения пролиферации миобластов или их клеток-предшественников. В некоторых вариантах реализации эндотелиальные клетки ингибируют дифференцировку миобластов или их клеток-предшественников в мышечные трубочки. В некоторых вариантах реализации эндотелиальные клетки поддерживают выращивание и пролиферацию миобластов или их клеток-предшественников. В некоторых вариантах реализации для дифференцировки миобластов или их клеток-предшественников эндотелиальные клетки не требуются. В некоторых вариантах реализации в соответствии со способом согласно настоящему изобретению активность эндотелиальных клеток (например, секреция миогенных агентов, стабилизация выращивания миобластов, выживание или то, и другое) сохраняется в течение определенного периода. В некоторых вариантах реализации определенный период для эндотелиальной активности представляет собой период, необходимый для того, чтобы миобласты или их клетки-предшественники достигли покрытия по меньшей мере 30%, по меньшей мере 40%, по меньшей мере 50%, по меньшей мере 60%, по меньшей мере 70%, по меньшей мере 80%, по меньшей мере 90% или по меньшей мере 99% трехмерной пористой матрицы. В некоторых вариантах реализации определенный период эндотелиальной активности представляет собой период, необходимый для достижения миобластами или их клетками-предшественниками покрытия по меньшей мере 30%.
[085] В некоторых вариантах реализации покрытие % мышечных трубочек составляет по меньшей мере 5%, по меньшей мере 20%, по меньшей мере 35%, по меньшей мере 50%, по меньшей мере 70%, по меньшей мере 85%, по меньшей мере 90%, по меньшей мере 90% или по меньшей мере 99%. В некоторых вариантах реализации покрытие % мышечных трубочек составляет 1-10%, 5-20%, 15-35%, 30-50%, 40-65%, 60-85%, 80-90%, 90-100%, или любой диапазон между ними. Каждая возможность представляет отдельный вариант реализации настоящего изобретения.
[086] В некоторых вариантах реализации мышечные трубочки в композиции согласно настоящему изобретению содержат 10000-100000 ядер на мм3 трехмерной пористой матрицы, 10000-100000 ядер на мм3 трехмерной пористой матрицы, 15000-200000 ядер на мм3 трехмерной пористой матрицы, 50000-500000 ядер на мм3 трехмерной пористой матрицы, 5000-1000000 ядер на мм3 трехмерной пористой матрицы, 10000-250000 ядер на мм3 трехмерной пористой матрицы, 10000-1500000 ядер на мм3 трехмерной пористой матрицы или любой диапазон между ними. Каждая возможность представляет отдельный вариант реализации настоящего изобретения.
[087] Как будет очевидно специалистам в данной области техники, ВКМ влияет на дифференцировку миобластов в мышечные трубочки. В некоторых вариантах реализации ВКМ-секретирующие клетки, используемые в соответствии со способами согласно настоящему изобретению, улучшают дифференцировку миобластов. В некоторых вариантах реализации ВКМ-секретирующие клетки улучшали дифференцировку миобластов путем моделирования физических свойств ткани.
[088] Как определено в настоящем документе, термины «улучшенный» и «увеличенный» являются взаимозаменяемыми.
[089] В некоторых вариантах реализации улучшение составляет по меньшей мере на 5%, по меньшей мере на 20%, по меньшей мере на 35%, по меньшей мере на 50%, по меньшей мере на 75%, по меньшей мере на 90%, по меньшей мере на 100% по меньшей мере на 250%, по меньшей мере на 500%, по меньшей мере на 750%, по меньшей мере на 1000%, по меньшей мере на 2500% или по меньшей мере на 5000%. В некоторых вариантах реализации улучшение составляет 5-15%, 10-35%, 25-45%, 40-70%, 65-90%, 85-150%, 100-500% или 250-1000%. Каждая возможность представляет отдельный вариант реализации настоящего изобретения.
[090] Неограничивающие примеры физических свойств ткани включают, но не ограничиваются ими, прочность, пористость, гибкость, жесткость и т.д.). Физические свойства ткани можно определить в соответствии с ее модулем Юнга, модулем вязкости или другими параметрами, которые будут очевидны для специалиста в данной области техники.
[091] В некоторых вариантах реализации способ согласно настоящему изобретению дополнительно включает этап стерилизации пористого структурированного белка. В некоторых вариантах реализации пористый структурированный белок стерилизуют перед засевом или инкубированием множества типов клеток. В некоторых вариантах реализации стерилизация осуществляется гамма-излучением. В другом варианте реализации стерилизация осуществляется с использованием этанола. Процедуры стерилизации очевидны для специалиста в данной области техники.
[092] Специалист в данной области техники поймет, что засев и/или культивирование клеток проводят в присутствии среды для культивирования клеток. В другом варианте реализации среда для культивирования клеток содержит фактор роста, цитокины, биоактивные агенты, питательные вещества, аминокислоты, соединения антибиотиков, противовоспалительные соединения или любую их комбинацию. Подходящая среда и соединения, подходящие для жизнеспособности и роста клеток, известны специалисту в данной области техники.
[093] Факторы роста, которые можно использовать в способах и композициях согласно изобретению, включают, но не ограничиваются ими, тромбоцитарный фактор роста (ТЦФР), инсулиноподобный фактор роста (ИФР-1). Известно, что ТЦФР и ИФР-1 индуцируют митогенные, хемотаксические и пролиферативные (дифференцирующие) клеточные ответы. Фактором роста может быть, но не ограничиваясь этим, одно или более из следующего: ТЦФР, например, тромбоцитарный фактор роста AA, тромбоцитарный фактор роста BB; ИФР, например, ИФР-I, ИФР-II; факторы роста фибробластов (ФРФ), например, кислотный ФРФ, основной ФРФ, фактор роста β-эндотелиальных клеток, ФРФ 4, ФРФ 5, ФРФ 6, ФРФ 7, ФРФ 8 и ФРФ 9; трансформирующие факторы роста (ТФР), например, ТФР-P1, ТФР β1,2, ТФР-β2, ТФР-β3, ТФР-β5; костные морфогенетические белки (КМБ), например, КМБ 1, КМБ 2, КМБ 3, КМБ 4; факторы роста эндотелия сосудов (ФРЭС), например ФРЭС, фактор роста плаценты; эпидермальные факторы роста (ЭФР), например, ЭФР, амфирегулин, бетацеллюлин, гепарин-связывающий ЭФР; интерлейкины, например, ИЛ-1, ИЛ-2, ИЛ-3, ИЛ-4, ИЛ-5, ИЛ-6, ИЛ-7, ИЛ-8, ИЛ-9, ИЛ-10, ИЛ-11, ИЛ- 12, ИЛ-13, ИЛ-14; колониестимулирующие факторы (КСФ), например, Г-КСФ, ГМ-КСФ, М-КСФ; фактор роста нервов (ФРН); фактор стволовых клеток; фактор роста гепатоцитов,
[094] Как проиллюстрировано ниже, в случае клеток, полученных от быка, оптимальная среда для размножения сателлитных клеток (СК) (то есть среда Про-ЛИФ) содержит среду роста Bovine СК (СКБ) (99%), амфотерицин B (AB/AM; 1% 1 ×), ZnCl2 (50 мкМ), ЭФР (62 нг/мл), ИФР-1 (100 нг/мл) и бФРФ (10 нг/мл).
[095] Как проиллюстрировано ниже, в случае клеток, полученных от быка, оптимальная питательная среда СК содержит DMEM/HEPES (модифицированная по способу Дульбекко минимальная питательная среда Игла/ 4-(2-гидроксиэтил)-1-пиперазин этансульфоновая кислота) (43,5%), питательную смесь Хэма F-10 (43,5%), фетальную бычью сыворотку (10%), MEM NEAA (минимальная питательная среда, заменимые аминокислоты) (1% 1 ×), GlutaMAX (1%) и AB/AM (1% 1 ×).
[096] Как проиллюстрировано ниже, в случае клеток, полученных от быка, оптимальная среда для дифференцировки СК содержит DMEM/HEPES (97%), донорскую конскую сыворотку (2%), AB/AM (1% 1 ×), ИФР-1 (100 нг/мл) и ЭФР (62 нг/мл).
Пористая матрица
[002] В некоторых вариантах реализации множество клеток согласно изобретению инкубируют с пористой матрицей. В контексте настоящего документа термин «матрица» относится к структуре, содержащей материал, который обеспечивает поверхность, подходящую для адгезии/прикрепления, созревания, дифференцировки и пролиферации клеток. Матрица может дополнительно обеспечивать механическую устойчивость и подложку. Матрица может иметь особую геометрию или форму для того, чтобы влиять на трехмерную геометрию или ограничивать ее, или форму, предполагаемую популяцией пролиферирующих клеток. В некоторых вариантах реализации пористая матрица согласно изобретению является трехмерной.
[097] В некоторых вариантах реализации средний диаметр пор пористой матрицы находится в диапазоне от 20 микрометров (мкм) до 1000 мкм, от 20 мкм до 900 мкм, от 20 мкм до 800 мкм, от 20 мкм до 700 мкм, от 20 мкм до 600 мкм, От 20 мкм до 500 мкм, от 20 мкм до 400 мкм, от 20 мкм до 300 мкм, от 20 мкм до 200 мкм, от 20 мкм до 100 мкм, от 50 мкм до 1000 мкм, от 50 мкм до 900 мкм, от 50 мкм до 800 мкм, 50 мкм. до 700 мкм, от 50 мкм до 600 мкм, от 50 мкм до 500 мкм, от 50 мкм до 400 мкм, от 50 мкм до 300 мкм, от 50 мкм до 200 мкм, от 50 мкм до 100 мкм, от 100 мкм до 1000 мкм, от 100 мкм до 900 от 100 до 800 мкм, от 100 до 700 мкм, от 100 до 600 мкм, от 100 до 500 мкм, от 100 до 400 мкм, от 100 до 300 мкм, от 100 до 200 мкм, от 500 до 1000 мкм, От 500 до 900 мкм, от 500 до 800 мкм, от 500 до 700 мкм или от 500 до 600 мкм. Каждая возможность представляет отдельный вариант реализации настоящего изобретения. В некоторых вариантах реализации средний диаметр пор пористой матрицы находится в диапазоне от 20 до 1000 мкм.
[098] В некоторых вариантах реализации пористая матрица является пригодной к употреблению в пищу. В некоторых вариантах реализации пористая матрица содержит структурированный белок. В некоторых вариантах реализации пористая матрица содержит полисахарид. В некоторых вариантах реализации структурированный белок представляет собой структурированный растительный белок. В некоторых вариантах реализации структурированный белок представляет собой структурированный соевый белок (например, ТСБ).
[099] Термин «структура» используется в настоящем документе для обозначения жесткой массы или гибкой массы, отдельных клеток, которые могут легко образовать различные размеры, геометрии и конфигурации, и которые не диспергируются в воде.
[0100] Подходящие структурированные белковые материалы в виде частиц для использования в настоящем документе могут состоять из от 30% до 100% белка в пересчете на сухую массу и от 0% до 70% материалов, связанных с исходным белковым материалом или добавленными вспомогательными материалами. Примеры вспомогательных материалов представляют собой углеводы, витамины, ароматизаторы, красители или другие. В некоторых вариантах реализации белковые частицы состоят из 50%-100% белка, или 50%-80% белка в пересчете на массу сухого вещества.
[0101] Подходящие неструктурированные белки, которые можно структурировать для образования структурированных белковых материалов в виде частиц, доступны из различных источников. В качестве неограничивающего примера источником таких белков является растительный белок и белки некоторых грибов; однако можно применять животный белок. Примерами подходящих животных белков являются казеин, коллаген и яичный белок. Примерами подходящих источников растительного белка являются соевые бобы, семена сафлора, кукуруза, арахис, пшеница, пшеничный глютен, горох, семена подсолнечника, нут, хлопковое семя, кокос, рапс, семена кунжута, белки листьев, глютен, одноклеточные белки, такие как дрожжи, и тому подобное.
[0102] Другим примером подходящего источника белка являются грибы. В некоторых вариантах реализации источник грибного белка содержит количество белка 15-20% (по массе), 20-30% (по массе), 28-45% (по массе) или 10-40% (по массе) в расчете на массу сухого вещества.
[0103] В общем случае, если источником белка является растительный белок, перед использованием белок помещают в относительно чистую форму. Так, например, если источником белка являются соевые бобы, соевые бобы можно экстрагировать растворителем, например, гексаном, для удаления из них масла. Полученный в результате обезжиренный соевый жмых содержит около 50% белка.
[0104] Соевый жмых можно обработать известным способом для удаления углеводов и получения продуктов с более высоким содержанием белка, например, концентратов соевого белка, содержащих около 70% белка, или изолятов соевого белка, содержащих около 90% или более белка. В свою очередь, можно применять разнообразные подходящие способы предшествующего уровня техники для превращения соевой муки, концентрата, изолята и других пригодных к употреблению в пищу белок-содержащих материалов в подходящие структурированные белковые материалы в виде частиц.
[0105] Подходящие способы для превращения неструктурированных животных и растительных белок-содержащих материалов в структурированные белки в виде частиц раскрыты, например, в следующем патенте США № 2682466, выданном 29 июня 1954 г. Бойеру; №3142571, выданному 28 июля 1964 г. Китчелу; №3488770, выданном 6 января 1970 г. Аткинсону; №3498794, выданном 3 марта 1970 г. Калверт и др.; №3759715, выданном 18 сентября 1973 г. Лоепикте и др.; №3778222, выданном 11 декабря 1973 г. Строммеру; №3794731, выданном 26 февраля 1974 г. Даннерт и др..; №3814823, выданном 4 июня 1974 г. Янг и др..; и поданная заявка на патент США №248581, поданной 28 апреля 1972 г., в настоящее время пат. №3840679, выданном 8 октября 1974 г. Лиепе и др.; которые включены в настоящий документ посредством ссылки.
[0106] В альтернативных вариантах реализации пористый структурированный белок может быть заменен другими пористыми композициями, глотаемыми и пригодными к употреблению в пищу, а также жевательными. В контексте настоящего документа термины «глотаемый» и «пригодный к употреблению в пищу» относятся к композициям, которые можно безопасно вводить в организм. Эти композиции включают абсорбируемые, и не абсорбируемые, а усваиваемые и не усваиваемые. В контексте настоящего документа термин «жевательный» относится к композиции, которую можно разламывать/измельчать на более мелкие части путем жевания перед проглатыванием. Специалист в данной области техники поймет, что подходящую съедобную композицию можно выбирать в соответствии с физическими свойствами (например, модулем Юнга, модулем вязкости, жесткостью и т.д.) для желаемого использования (например, потребления взрослым человеком).
[0107] В соответствии со способом согласно настоящему изобретению множество типов клеток засевают на трехмерной пористой матрице как таковой. В некоторых вариантах реализации множество типов клеток, засеянных на трехмерной пористой матрице, не требует отвердителей. В некоторых вариантах реализации множество типов клеток, засеянных на трехмерной пористой матрице, требуют отвердителей. В некоторых вариантах реализации отвердители увеличивают прилипание или прикрепление множества типов клеток к трехмерной пористой матрице. Неограничивающие примеры отвердителей включают, но не ограничиваются ими, тромбин или фибрин.
[0108] В контексте настоящего документа термины «гелеобразующий агент» и «отвердитель» являются взаимозаменяемыми.
[0109] В обсуждении, если не указано иное, прилагательные, такие как «по существу» и «около», модифицирующие характеристику условия или отношения признака или признаков варианта реализации изобретения, понимаются как означающие, что условие или характеристика определены в пределах допусков, приемлемых для осуществления варианта реализации в применении, для которого они предназначены. Если не указано иное, слово «или» в описании и формуле изобретения рассматривают включающим «или», а не исключающим или, и указывает по меньшей мере на одну из или любую комбинацию элементов, к которым оно присоединяется.
[0110] Следует понимать, что термины в единственном числе, используемые выше и в других местах в настоящем документе, относятся к «одному или более» из перечисленных компонентов. Специалисту в данной области техники будет понятно, что использование единственного числа включает множественное число, если специально не указано иное. Следовательно, термины в единственном числе и «по меньшей мере, один» используются в данной заявке взаимозаменяемо.
[0111] В целях лучшего понимания настоящих идей и никоим образом не для ограничения объема этих идей, если не указано иное, следует понимать все числа, выражающие количества, проценты или пропорции и другие числовые значения, используемые в описании и формуле изобретения, означают модифицируемые термином «около». Соответственно, если не указано иное, числовые параметры, изложенные в следующем описании и прилагаемой формуле изобретения, являются приблизительными значениями, которые могут варьироваться в зависимости от желаемых свойств, которые должны быть получены. Как минимум, каждый числовой параметр должен быть, по меньшей мере, истолкован с учетом числа заявленных значащих цифр и с применением обычных методов округления.
[0112] В описании и формуле изобретения настоящей заявки каждый из глаголов «содержать», «включать» и «иметь» и их спряжения используется для указания того, что объект или объекты после глагола не обязательно являются законченным списком компонентов, элементов или частей подлежащего или подлежащих глагола.
[0113] Другие термины в контексте настоящего документа определены их общеизвестными значениями в данной области техники.
[0114] Дополнительные задачи, преимущества и новые признаки настоящего изобретения станут очевидными для специалиста в данной области техники при рассмотрении следующих примеров, которые не предназначены для ограничения. Кроме того, каждый из различных вариантов реализации и аспектов настоящего изобретения, описанных выше и заявленных в разделе формулы изобретения ниже, находит экспериментальную поддержку в следующих примерах.
[0115] Понятно, что некоторые признаки изобретения, которые для ясности описаны в контексте отдельных вариантов реализации, также могут быть предоставлены в комбинации в одном варианте реализации. И наоборот, различные признаки изобретения, которые для краткости описаны в контексте одного варианта реализации, также могут быть предусмотрены отдельно или в любой подходящей комбинации, или как подходящие в любом другом описанном варианте реализации изобретения. Некоторые признаки, описанные в контексте различных вариантов реализации, не должны рассматриваться как существенные признаки этих вариантов реализации, если только вариант реализации не осуществим без этих элементов.
ПРИМЕРЫ
[0116] В общем случае, номенклатура, используемая в настоящем документе, и лабораторные процедуры, применяемые в настоящем изобретении, включают молекулярные, биохимические, микробиологические методы и метод рекомбинантных ДНК. Такие методы подробно описаны в литературе. См., например, "Molecular Cloning: A laboratory Manual" Sambrook et al., (1989); "Current Protocols in Molecular Biology" Volumes I-III Ausubel, R. M., ed. (1994); Ausubel et al., "Current Protocols in Molecular Biology", John Wiley and Sons, Baltimore, Maryland (1989); Perbal, "A Practical Guide to Molecular Cloning", John Wiley & Sons, New York (1988); Watson et al., "Recombinant DNA", Scientific American Books, New York; Birren et al. (eds) "Genome Analysis: A Laboratory Manual Series", Vols. 1-4, Cold Spring Harbor Laboratory Press, New York (1998); методология изложена в патенте США №4,666,828; №4,683,202; №4,801,531; №5,192,659 и №5,272,057; "Cell Biology: A Laboratory Handbook", Volumes I-III Cellis, J. E., ed. (1994); "Culture of Animal Cells - A Manual of Basic Technique" by Freshney, Wiley-Liss, N. Y. (1994), Third Edition; "Current Protocols in Immunology" Volumes I-III Coligan J. E., ed. (1994); Stites et al. (eds), "Basic and Clinical Immunology" (8th Edition), Appleton & Lange, Norwalk, CT (1994); Mishell and Shiigi (eds), "Strategies for Protein Purification and Characterization - A Laboratory Course Manual" CSHL Press (1996); "Bacteriophage Methods and Protocols", Volume 1: Isolation, Characterization, and Interactions, которые включены в настоящий документ посредством ссылки. Другие общие ссылки приведены в настоящем документе.
Материалы и способы
Структурированный соевый белок
[0117] Структурированный соевый белок (ТСБ) коммерчески доступен в виде нескольких различных продуктов. Матрицы ТСБ были получены из 5 различных источников коммерческих ТСБ - 3 куска ТСБ (Фиг. 1A), купленные в местном магазине по продаже диетических продуктов, и 2 образца хлопьев ТСБ (Фиг. 1B-1C), купленных у ADM. ТСБ стерилизовали в гамма-излучении 25-40 кГр в течение 3,5 часов и хранили в стерильной среде или с использованием 70% (об./об.) этанола в течение 15 минут. Затем следовали 3 промывки с ФСБ (фосфатно-солевой буфер).
Подготовка матрицы ТСБ
[0118] Хлопья ТСБ (от Arcon или TVP) выбирали с использованием пинцета Грефе для получения одинаковой толщины около 200-400 мкм (на 1 слой). Хлопья инкубировали в 5-10 мл стерильной ОДВ (Обедненная дейтерием вода) (при 37°С в течение ночи (во флаконе на 50 мл). На следующий день хлопья нарезали на матрицы по 6 мм с использованием иглы для биопсии 6 мм внутри колпака на 10 см планшете, необработанном культурой клеток. С помощью пипетки Пастера матрицу удаляли из иглы для биопсии и переносили во флакон с 5 мл питательной среды. Куски ТСБ инкубировали в ОДВ при 37°С в течение ночи. Затем хлопья нарезали на цилиндры (вкладка на Фиг. 2А) с использованием шприца для биопсии и нарезали на диски толщиной 1 мм с использованием ножа (Фиг. 2А). Затем матрицы помещали в 5 мл питательной среды.
Засев матрицы
[0119] Для одной матрицу 2×106 СКБ переносили в эппендорф и центрифугировали в течение 4 минут при 1500 ОЦУ (относительное центробежное ускорение). Между тем каждую матрицу помещали в лунку 6-луночного планшета, необработанного культурой клеток, с 50 мкл питательной среды. После центрифугирования из пробирки Эппендорфа отсасывали среду аспиратором, оставляя поддон с клетками. Затем с каждым эппендорфом выполняли следующие стадии: (1) среду тщательно отсасывали аспиратором из матрицы с использованием пинцета, чтобы осторожно сдавить матрицу, и остатки среды вакуумировали; (2) добавляли 7 мкл тромбина (20 МГЕ/мл сигмы в ФСБ) и 7 мкл фибриногена (15 мг/мл сигмы в ФСБ); (3) затем клетки засевали на матрицу; (4) матрицы инкубировали при 37°С в течение 30 мин до сушки и затем добавляли в лунку 2 мл среды для размножения; (5) на следующий день после того, как матрицу переносили в новый контейнер (например, в 24 лунки, необработанные культурой клеток, с дном из покровного стекла) с использованием стерильного пинцета Грефе и в него добавляли 2 мл среды для размножения; (6) матрицу инкубировали при 37°С и 5% СО2; (7) матрицу хранили в среде для размножения в течение 7 дней; (8) среду заменяли каждые 2 дня (2 мл); (9) через 7 дней среду для размножения заменяли средой для дифференцировки СКБ; и (10) среду для дифференцировки заменяли каждые 2 дня в течение 5 дней.
Культура клеток
[0120] Сателлитные клетки быка (СКБ) культивировали в среде для пролиферации СКБ 43,5% DMEM/HEPES (Gibco), 43,5% Nut Mix F-10 (Gibco), 10% ФБС (HyClone), 1% заменимые аминокислоты (Gibco), 1 % GlutaMAX (Gibco) и 1% пенициллин-стрептомицин-амфотерицин раствор B (Biological Industries (Ab/Am, BI) с добавлением 50 мкМ ZnCl2 (Millipore), 62 нг/мл ЭФР (R&D Systems), 100 нг/мл ИФР-1 (R&D Systems), 10 нг/мл ЛИФ (R&D Systems) и 10 нг/мл бФРФ (R&D Systems). Среда для дифференцировки СКБ состояла из DMEM/HEPES с добавлением 2% ФБС и 1% Ab/Am. Красный флуоресцентный белок (КФБ), экспрессирующий дермальные фибробласты (Lonza, США), культивировали в минимальной питательной среде Дульбекко (DMEM; Gibco ЛИФe Technologies) с добавлением 10% ФБС (HyClone; Thermo Fisher Scientific), 1% заменимых аминокислот (Biological Industries), 0,2% β-меркаптоэтанола (Biological Industries) и 100 единиц/мл пенициллина и 0,1 мг/мл стрептомицина (Pen-Strep Solution, Biological Industries, Израиль). Миобласты (American Type Culture Collection) культивировали в среде DMEM с добавлением 10% ФБС, 2,5% буфера HEPES (Biological Industries) и 1% раствора пенициллин/стрептомицин. Среда для дифференцировки миобластов состоит из DMEM с добавлением 2% ФБС, 2,5% буфера HEPES и 1% раствора пенициллин/стрептомицин. Инкубирования проводили в 5% (об./об.) увлажненной атмосфере CO2 при 37°C. Гладкомышечные клетки быка (ГМК; CellAplications) культивировали, как описано в таблице 3. Эндотелиальные клетки аорты быка (ЭКАБ; CellApplications) культивировали в коммерческих средах (CellApplications). Микроваскулярные ЭК скелетной мышцы быка (МЭКСкМБ; AngioProteomie) культивировали в коммерческой среде ВКМ (ScienCell) с 10% общего количества ФБС. Дермальные фибробласты быка (ДФБ; ScienCell) культивировали либо в коммерческой среде (FM-2; ScienCell), либо в среде DMEM с высоким содержанием глюкозы, обогащенной 15%ФБС.
Иммуногистохимия
[0121] Матрицы промывали дважды в ФСБ, затем фиксируют в 4% параформальдегиде (ПФА) в течение 20 минут на шейкере. Матрицы трижды промывали ФСБ в течение 5 минут на шейкере, а затем пермеабилизовали 0,3% Тритоном X-100 (Bio Lab Ltd) в течение 10 минут. Затем матрицы трижды промывали ФСБ в течение 5 минут и затем погружали в 5% бычий сывороточный альбумин (БСА; Millipore) в ФСБ на ночь при 4°C. Матрицы инкубировали с 250 мкл первичного антитела (в 5% БСА в ФСБ) в течение 3 часов при комнатной температуре. После инкубирования матрицы промывали 4 раза c ФСБ в течение 5 минут. Затем клетки инкубировали при комнатной температуре в течение 3 часов со вторичным антителом (в ФСБ) и 4',6-диамидино-2-фенилиндолом (ДАФИ, 1:1000 в ФСБ; Vector Laboratories) в планшете, покрытом оловянной фольгой на шейкере. Матрицы промывали с ФСБ в течение 5 минут на шейкере и получали изображение с помощью конфокального микроскопа (LSM 700, Zeiss).
Гладкомышечные клетки аорты быка (ГКАБ)
[0122] Влияние на пролиферацию клеток четырех различных составов среды сравнивали с коммерческой средой (BSM) (Таблица 3). В начале эксперимента клетки находились в пассаже 8, и засевали при 4000 клеток/см2в 6-луночный планшет. На 3 день клетки трипсинизировали, подсчитывали с помощью гемоцитометра и повторно засевали при 4000 клеток/см2. Эксперимент проводили дважды, используя одни и те же клетки для каждого условия. Односторонний дисперсионный анализ использовали для проверки статистической значимости.
Кинетика роста клеток
[0123] Приблизительно 4×103 клеток/см2 засевали и подсчитывали каждый день с помощью гемоцитометра в течение шести дней. Подсчитанные значения наносили на график.
Окрашивание клеток
[0124] Поддерживающие клетки (ДФБ или ГМКАБ) окрашивали 3 мл свежей среды с 15 мкл липофильных меченых веществ DiD (1 мг/мл, растворенных в абсолютированном этаноле; #D7757, Molecular Probes®, США). Эндотелиальные клетки быка (ЭКБ; ЭКАБ или МЭКСкМБ) окрашивали 3 мл свежей среды с 5 мкл липофильных меченых веществ DiI (3 мг/мл, растворенных в абсолютированном этаноле; #D, Molecular Probes®, США) и инкубировали в течение 30 мин в 37°С. После одной промывки средой и затем еще двух промывок ФСБ клетки трипсинизировали, и они были готовы к засеву, как описано ниже.
Засев клеток на пористой матрице
[0125] ЭК быка (1,25×105) и поддерживающие клетки (0,25×105) ресуспендировали в 5 мкл 1:1 смеси 1 5 мг/мл фибриногена (Sigma Aldrich) и 20 NIH ед./мл тромбина (Sigma Aldrich). Раствор фибриногена готовили разбавлением лиофилизованного фибриногена человека (Sigma Chemical) в 40 мМ глицин-трис-буфере. Раствор тромбина готовили разбавлением тромбина (Sigma Aldrich) в 40 мМ хлорида кальция. Затем суспензию сокультуры засевали на круглые пористые матрицы L-ПЛА-ПЛГ диаметром 4 мм и обеспечивали возможность отверждения в 12-луночных планшетах, необработанных культурой клеток, в течение 30 минут в инкубаторе (37°C, 5% CO2). После отверждения в каждую лунку добавляли 2 мл эндотелиальной культурной среды (ВКМ, ScienCell) с добавлением дополнительных 5% ФБС и 2 нМ ФРЭС. Среду заменяли через день.
[0126] Для дополнительной настройки соотношения клеток, засеянных на пористых матрицах клетки засевали, как описано выше, со следующими модификациями: клетки сначала засевали в среде 1:1 (bEBM эпителиальная базальная среда, AngioProteomie: коммерческая среда поддерживающих клеток) и клетки ресуспендировали в 5 мкл смеси 1:1 15 мг/мл фибриногена (Johnson and Johnson) и 2 ед/мл тромбина (Johnson and Johnson).
Дифференцировка сателлитных клеток быка (СКБ) в 2D
[0127] 5×104 СКБ (пассаж 4) засевали на 24-луночный планшет, обработанный культурой клеток, с дном из покровного стекла в трех экземплярах. Клетки выращивали в соответствии с протоколом образования мышечных трубочек следующим образом: 4 дня в питательной среде и 7 дней в среде для дифференцировки (t = 0 относится к точке, когда начали использование среды для дифференцировки). Затем клетки окрашивали красителем Хехст и Миогенин в дни -1 и 7.
Оптимизация дифференцировки СКБ в 2D
[0128] СКБ (пассаж 4) выращивали в течение 4 дней среде для размножения с различными ФР(как описано ниже) и выращивали в течение 7 дней в среде для дифференцировки (DMEM-HEPES + 2% HS). День 0 определяли как день, когда среду помещали в среду для дифференцировки.
Составы сред для размножения включали: (1) Контрольная группа - Питательная среда (без добавления ФР); (2) фактор роста фибробластов быка (бФРФ; 10 нг/мл); (3) эпидермальный фактор роста (ЭФР; 62 нг/мл); (3) инсулиноподобный фактор роста 1 (ИФР-1; 100 нг/мл); (4) Про-ЛИФ; бФРФ 10 нг/мл, ЭФР 62 нг/мл, ИФР-1 100 нг/мл и ZnCl2 50 мкМ); (6) ФР отъема: среда про-ЛИФ в течение 3 дней, затем 3 промывки питательной средой (каждые 5 минут), затем 1 день питательной среды; (7) клетки окрашивали красителем DiI, выращенным в питательной среде, чтобы проверить, влияет ли DiI, флюоресцентный краситель, добавляемый для отслеживания клеток, на дифференцировку клеток.
[0129] Авторы изобретения дополнительно проверили действие ФР: ИФР-1, ЭФР и их комбинации во время фазы дифференцировки. СКБ (пассаж 4) выращивали в течение 4 дней в питательной среде, а затем выращивали в течение 7 дней в среде для дифференцировки с различными ФР (как показано ниже). Составы сред для дифференцировки включали: (1) Контрольная группа - исходные среды для дифференцировки (DMEM-HEPES + 2% HS); (2) ИФР-1 (100 нг/мл); (3) ЭФР (62 нг/мл); и (4) ИФР-1 (100 нг/мл) + ЭФР (62 нг/мл). Клетки визуализировали с использованием системы светлопольной микроскопии для всех случаев, описанных выше.
Оптимизация размножения СКБ на 3D-матрицах
[0130] Для этой цели установили двойной двухфакторный эксперимент (засевной объем и состав среды для размножения) в двух экземплярах, как указано ниже: (1) засевной объем и количество клеток: (а) засевной объем 10 мкл и 1×106 СКБ; (b) 10 мкл засевного объема и 2 × 106 СКБ; и (c) 20 мкл засевного объема и 2 × 106СКБ. (2) Среда для размножения: (а) Питательная среда; и (b) среда про-ЛИФ (питательная среда + бФРФ + ЭФР + ИФР-1 + ZnCl2). СКБ (пассаж 4) окрашивали с использованием DiI и затем засевали на пористые матрицы (Arcon) в соответствии с протоколом засева Arcon.
Оптимизация дифференцировки СКБ на 3D-матрицах
[0131] Для этой цели установили двухфакторный эксперимент (среда для размножения на первой неделе и среда для дифференцировки на второй неделе): (1) среда для размножения: (а) Контрольная группа (Питательная среда); (b) Про-ЛИФ; и (c) Про-ЛИФ - бФРФ. (2) Среда для дифференцировки либо отдельно, либо с обогащенная следующим образом: (а) Контрольная группа (среда для дифференцировки с 2% лошадиной сывороткой); (b) + ИФР-1; (в) + ЭФР; и (d) + ИФР-1 + ЭФР. СКБ (пассаж 4) окрашивали с использованием DiI. Четыре (4) мм пористых матриц засевали 0,5 × 106 СКБ (пассаж 4) в 5 мкл фибрина. Получали изображение клеток на 2, 7 и 14 дни после засева. Матрицы окрашивали десмином. Окрашивание проводили в соответствии с протоколом окрашивания способом тотального препарата с использованием первичного поликлонального антитела 1:00 козы против десмина (Santa Cruz Cat. № SK-7559) и вторичного антитела Alexa 1: 200 488 осла против IgG козы (Invitrogen Cat. No. A11055 ).
Окрашивание сателлитных клеток быка (СКБ) перед засевом
[0132] СКБ окрашивали 1 мл свежей среды с 5 мкл липофильных меченных веществ DiI (3 мг/мл, разведенных в абсолютированном этаноле, Molecular Probes®, США) и инкубировали в течение 30 минут при 37°C. После 1 промывки средой и затем 2 промывок ФСБ клетки трипсинизировали, и они были готовы к засеву, как описано выше.
Засев клеток на L-ПЛА-ПЛГ
[0133] Сателлитные клетки быка (СКБ) с или без ЭК быка (ЭКБ), и с или без поддерживающих клеток ресуспендировали в 6 мкл смеси 1:1 15 мг/мл фибриногена (Sigma Aldrich) и 20 NIH ед./мл тромбина (Sigma Aldrich). Раствор фибриногена готовили разбавлением лиофилизованного фибриногена человека (Sigma Chemical) в 40 мМ глицин-трис-буфере. Раствор тромбина готовили разбавлением тромбина (Sigma Aldrich) в 40 мМ хлорида кальция. Затем суспензию клеток засевали на круглые матрицы L-ПЛА-ПЛГ диаметром 4 мм и обеспечивали возможность отверждения в 12-луночных планшетах, необработанных культурой клеток, в течение 30 минут внутри инкубатора (37°C, 5% CO2). После отверждения в каждую лунку добавляли 1 мл смеси эндотелиальной культурной среды 1:1 со питательной средой СКБ (Про-ЛИФ). Среду заменяли через день. Через неделю среду заменяли средой для дифференцировки СКБ (обогащенной ИФР-1 и ЭФР) на дополнительную неделю.
Засев клеток на матрицах из структурированного соевого белка
[0134] Сателлитные клетки быка (СКБ) с или без ЭК быка и с или без поддерживающих клеток ресуспендировали в 15 мкл смеси 1:1 15 мг/мл фибриногена (Sigma Aldrich) и 20 NIHU/мл тромбина (Sigma Aldrich). Раствор фибриногена готовили разбавлением лиофилизованного фибриногена человека (Sigma Chemical) в 40 мМ глицин-трис-буфере. Раствор тромбина готовили разбавлением тромбина (Sigma Aldrich) в 40 мМ хлорида кальция. Затем суспензию клеток засевали с обеих сторон круглых матриц из структурированного соевого белка диаметром 6 мм и обеспечивали возможность для отверждения в 12-луночных планшетах, необработанных культурой клеток, в течение 45 минут внутри инкубатора (37°C, 5% CO2). После отверждения в каждую лунку добавляли 1 мл смеси эндотелиальной культурной среды 1:1 с питательной средой СКБ (Про-ЛИФ). Среду заменяли через день. Через неделю среду заменяли средой для дифференцировки СКБ (обогащеннойИФР-1 и ЭФР) на дополнительную неделю.
[0135] Два соотношения засева и 2 типа эндотелиальных клеток (и их подходящую среду) испытывали, как описано в таблицах ниже:
Таблица 1 - Засев на матрицы L-ПЛА\ПЛГ
Таблица 2 - Засев на матрицах из структурированного соевого белка
Засев клеток на Gelfoam (желатиновая гемостатическая губка)
[0136] Клетки быка (СКБ) ресуспендировали в 15 мкл питательной среды СКБ. Затем суспензию клеток засевали с обеих сторон матриц Gelfoam © диаметром 6 мм и оставляли для отверждения в 12-луночных планшетах, необработанных культурой клеток, в течение 30 мин внутри инкубатора (37°C, 5% CO2). После отверждения в каждую лунку добавляли 1 мл питательной среды СКБ (Про-ЛИФ). Среду заменяли через день. Через неделю среду заменяли средой для ифференцировки СКБ (дополненной ИФР-1 и ЭФР) на дополнительную неделю.
Выращивание клеток на матрицах
[0137] Через одну и две недели после засева получали изображения меченного красителем DiI СКБ, засеянного на матрицах L-ПЛА/ПЛГ и Arcon, с использованием конфокальной микроскопии для оценки выращивания клеток.
Иммунофлуоресцентное окрашивание способом тотального препарата
[0138] Через две недели после засева матрицы фиксировали 4% параформальдегидом (ПФА; Electron Microscopy Sciences) в течение 20 минут, c последующими тремя промывками ФСБ (Gibco® Life Technologies). Пермеабилизацию достигали инкубированием матриц в течение 15 минут при комнатной температуре (КТ) в 0,3% растворе Тритона X-100 (Bio Lab Ltd). После трех промывок с ФСБ матрицы инкубировали в течение ночи в блокирующем буфере (10% ФБС, 1% (мас./об.) глицина и 0,01% тритона в ФСБ) при 4°C. Затем матрицы инкубировали в течение ночи при 4°С с первичными антителами: 1:50 козьим антителом против-CD31 (Санта-Круз), с 1:50 мышиным антителом против-MYH (Санта-Круз) или без него, разбавленными блокирующим буфером. После нескольких промывок ФСБ образцы инкубировали с 1:400 ослиным антителом против-козьего Alexa Fluor®488 (Jackson ImmunoResearch), 1:50 Alexa Flour 647-конъюгированным мышиным антителом против-миогенина (Santa Cruz) и 1:1000 ДАФИ (4',6-диамидино-2-фенилиндол, Sigma-Aldrich) с или без 1:300 против-мыши Alexa Flour 647, в течение 3 ч при КТ. После нескольких промывок с ФСБ, немедленно получали изображения матриц на конфокальном микроскопе Zeiss LSM700 (Carl Zeiss) с использованием программного обеспечения Zen. Обработку изображений и дополнительный анализ проводили с использованием программного обеспечения FIJI. Матрицы L-ПЛА/ПЛГ также окрашивали иммунофлуоресценцией способом тотального препарата через одну неделю после засева.
Криоразделение и трихромное окрашивание
[0139] В конце каждого эксперимента матрицы инкубировали в течение ночи в 30% (мас./об.) растворе сахарозы при 4°С. Затем матрицы заключали в соединение с оптимальной температурой резания (ОТР) (Tissue-Tec, США) и замораживали для последующего криоразделения. Заключенные в OTР матрицы подвергали криоразделению на секции толщиной 5 и 10 мкм. Затем срезы толщиной 5 мкм окрашивали в соответствии со стандартным протоколом трихромного окрашивания.
Пример 1
Трехмерный структурный анализ пористой матрицы из ТСБ
[0140] Матрицы из ТСБ исследовали с использованием сканирующей электронной микроскопии (СЭМ) для анализа их трехмерной (3D) структуры как в микронном, так и в наноразмерном масштабе. Изображения 100 × показали, что ТСБ обладал пористостью с размером пор 100-1000 мкм, что может быть использовано для культивирования клеток. Было показано, что стенки у крупного ТСБ были толще, чем у среднего ТСБ (Фиг. 3A и 3B). СЭМ изображения (увеличение 2×105) крупного ТСБ показали, что ТСБ содержал 30 нм шариковые кластеры белка. Анализ среднего ТСБ показал более аморфный клееподобный материал между этими кластерами (Фиг. 4А и 4В).
Пример 2
Выращивание и пролиферация фибробластов, культивируемых на пористой матрице
[0141] Исследовали прикрепление и пролиферацию фибробластов на матрице из ТСБ. Сначала 50000 дермальных фибробластов, которые были помечены КФБ, засевали на матрица из ТСБ и культивировали. После 14 дней инкубирования матрицу из ТСБ, заселенную дермальными фибробластами, дополнительно засевали 200000 эндотелиальных клеток и инкубировали в течение дополнительных 7 дней. Проводили иммуно-окрашивание образцов ТСБ, заселенных клетками, получали изображения с использованием конфокальной микроскопии через 8, 18 и 21 день после засева фибробластов. Результаты продемонстрировали, что фибробласты пролиферировали и покрывали матрицу из ТСБ, даже когда были засеяны при низком количестве 50000 клеток (Фиг. 5A). После засева эндотелиальных клеток (Фиг. 5B), эндотелиальные клетки собирались в кластеры (Фиг. 5C). Затем были исследованы матрицы из каждого источника матриц, вырезанные под углом 90° к направлению поверхности ТСБ. Каждую из матриц засеивали 200000 клеток фибробластов и инкубировали в течение 14 дней. Результаты продемонстрировали, что клетки фибробластов росли и пролиферировали на крупной и средней матрице из ТСБ (Фиг.6). Эти результаты указывали на то, что клетки могут заполнить матрицу после 14 дней культивирования.
Пример 3
Выращивание миобластов, культивируемых на пористой матрице
[0142] Для оценки применимости генерирования мышечной ткани были выполнены эксперименты для исследования выращивания мышечных клеток на матрице из ТСБ.
[0143] Для этой цели 0,5×106 миобластов засевали на матрицы из ТСБ и культивировали в присутствии среды для дифференцировки, в которой было мало сыворотки и, следовательно, она лучше подходила для получения культивируемого мяса. Изображения миобластов на 14 день (Фиг. 7) показали, что миобласты пролиферировали на матрице из ТСБ, следовательно, клетки могут заполнять матрицу после 14 дней культивирования.
Пример 4
Пролиферация клеток скелетных мышц быка, культивируемых на ТСБ
[0144] Чтобы оценить применимость для потребления человеком, клетки скелетных мышц быка (бКСкМ) засевали на матрицу из ТСБ. В частности, 0,5×106клеток бКСкМ засевали на каждую матрицу и культивировали в присутствии среды для дифференцировки. На 14 день получали изображения клеток с помощью конфокальной микроскопии. Изображения (Фиг. 8) показали, что бКСкМ пролиферировал на матрице из ТСБ, указывая на то, что ТСБ применим для получения культивируемого мяса.
Пример 5
Пролиферация гладкомышечных клеток аорты быка (ГМК)
[0145] Авторы изобретения исследовали влияние четырех различных составов сред по сравнению с коммерческой средой (BSM; таблица 3) на пролиферацию ГМК, засеянной (Фиг. 9A-9E) в средах, описанных ниже.
Таблица 3. Составы различных сред, испытанных на ГМК
[0146] На 3 день не было обнаружено существенной разницы в количестве клеток в пяти различных средах (Фиг. 10A). На 3 день следующего эксперимента (Фиг. 10B), наблюдалась значительная разница между четырьмя различными обработками (P <0,01), и в ходе ретроспективного анализа было выявлено, что количество клеток, подвергшихся воздействию среды, обогащенной пируватом, было значительно выше по сравнению с средой, обогащенной заменимыми аминокислотами, и средой с добавлением 15% ФБС (со значениями P<0,05 и <0,01, соответственно). Разница между коммерческой средой и средой, обогащенной пируватом натрия, была незначительной (P=0,052). Поэтому авторы изобретения использовали среду, обогащенную пируватом натрия (1 мМ), для культивирования ГМКАБ.
Пример 6
Характеристика выращивания ДФБ и ГМК в определенных условиях
[0147] После определения потребительских составов сред авторы изобретения исследовали кинетику их роста в этих условиях (Пример 5). Было установлено, что скорости роста ДФБ (Фиг. 11A) и ГМКАБ очень схожи (Фиг. 11B).
Пример 7
Влияние ЭК и поддерживающих клеток на васкуляризацию
[0148] Для того чтобы проверить, усиливают ли васкуляризацию и покрытие матрицы эндотелиальные клетки быка (EC; ЭКАБ - эндотелиальные клетки аорты быка, или МЭКСкМБ - микроваскулярные эндотелиальные клетки скелетных мышц быка) , засеянные в сокультуре с поддерживающими клетками, ЭКАБ засевали совместно с ДФБ или ГМКАБ. Действительно, совместное культивирование фибробластов вместе с миобластами и эндотелиальными клетками, как было показано, увеличивало васкуляризацию искусственных мышечных конструкций и способствовало стабилизации структуры сосуда с течением времени. Было обнаружено, что клетки покрывают всю матрицу (Фиг. 12). Кроме того, когда ЭКАБ засевали в сокультуре с ГМКАБ (Фиг. 12A), авторы изобретения заметили, что окрашивание ЭК со временем уменьшалось. Также в этой комбинации сосудоподобная структура была видна на 2 день. Когда ЭКАБ засевали в сокультуре с ДФБ (Фиг. 12B), авторы изобретения не заметили сосудистых структур. Когда МЭКСкМБ засевали в сокультуре с ГМКАБ (Фиг. 13A), авторы изобретения заметили гораздо больше ГМКАБ, чем МЭКСкМБ. Кроме того, сосудоподобные структуры были видны с ГМКАБ (Фиг. 13A) и с ДФБ (Фиг. 13B), в течение всего периода эксперимента.
Пример 8
Определенное соотношение клеток улучшает образование сетки кровеносных сосудов
[0149] Для дополнительного улучшения сетки сосудов авторы изобретения засевали бычий ЭКАБ с поддерживающими клетками (ДФБ или ГМКАБ) в различных соотношениях. Авторы изобретения исследовали 3 различных соотношения ЭК: 1:3, 1:1 и 5:1 к поддерживающим клеткам. Авторы изобретения ясно наблюдали самосборку клеток ЭКАБ (Фиг. 14-16), которые создавали сосуды, уже на 2 день в присутствии ГМКАБ (Фиг. 14 и 16). Авторы изобретения также заметили, что к 6 дню было меньше ЭК, чем к 2 дню, и что ЭКАБ создал область сетки судов в соотношении 1:1 ЭКАБ к ГМКАБ. ЭКАБ в присутствии ДФБ, как оказалось, не создавал сосудов (Фиг. 15).
Пример 9
Дифференцировка сателлитных клеток быка (СКБ) в культуру клеток
[0150] Затем авторы изобретения исследовали экспрессию миогенина до и после образования мышечной трубочки из СКБ и дополнительно оценили способность использовать ДАФИ-миогенин для измерения индекса слияния (ИС). Авторы изобретения обнаружили мало доказательств экспрессии миогенина в недифференцированном СКБ (Фиг. 17). Экспрессия миогенина происходила главным образом в ядрах мышечных трубочек и в некоторых ядрах вокруг мышечных трубочек. Было показано, что индекс слияния (ИС) можно рассчитать автоматически по отношению числа ядер миогенин/Хехст, которое оказалось сравнимым с ручным расчетом ИС. Этот протокол дополнительно использовали для количественного определения образования мышечных трубочек.
Пример 10
Оптимизация дифференцировки СКБ в культуру клеток
[0151] Затем авторы изобретения хотели оптимизировать дифференцировку СКБ в 2D. Авторы изобретения проверили, какие факторы роста (ФР) можно добавить во время (1) фазы размножения, которая не будет препятствовать образованию мышечной трубочки на стадии дифференцировки, и (2) в конце фазы дифференцировки, которая увеличит размер мышечной трубочки и ИС.
[0152] После фазы размножения и перед фазой дифференцировки в образцах, которые не содержали бФРФ (Фиг. 18), появились спонтанные мышечные трубочки, что свидетельствовало о том, что бФРФ ингибирует образование мышечных трубочек. ЭФР, ИФР-1 и DiI, по-видимому, не влияют на образование мышечной трубочки. Увеличение плотности клеточной популяции произошло в ИФР-1, Про-ЛИФ и отъеме. На 4 день дифференцировки авторы изобретения наблюдали увеличение общего количества мышечных трубочек в условиях культивирования бФРФ и Про-ЛИФ. бФРФ сохранял стволовость СКБ, и после удаления клетки внезапно начинали дифференцировку (Фиг. 19). На 7 день дифференцировки авторы изобретения наблюдали большую площадь мышечной трубочки в контрольной группе, отъеме и DiI по сравнению с другими испытуемыми условиями (Фиг. 20). Авторы изобретения пришли к выводу, что между образованием мышечной трубочки и гибелью клеток существует тонкая грань. Соответственно, клетки следует выращивать в среде для размножения, содержащей бФРФ (отдельно или с Про-ЛИФ) до достижения заселенности, а затем переносить в среду для дифференцировки в течение короткого периода времени 2-5 дней. В дополнение показана избыточная распространенность мышечных трубочек при добавлении ИФР-1 или ИФР-1 и ЭФР в среду для культивирования клеток.
Пример 11
Оптимизация размножения СКБ на пористой матрице
[0153] Затем авторы изобретения попытались увеличить покрытие СКБ на матрице из ТСБ выше 60%, так как предыдущие эксперименты показали низкое покрытие клеток на пористой матрице. Таким образом, ФР добавляли к фазе размножения, и начальное количество клеток при засеве увеличивалось. Количественная оценка площади покрытия клеток показала, что клетки, культивируемые с питательной средой, обогащенной ФР (то есть Про-ЛИФ), покрывали 72±15% матрицы, в то время как клетки, культивированные исключительно на питательной среде, покрывали приблизительно 18% матрицы (Фиг. 21). Разница, которая оказалась статистически значимой между двумя обработками (значение P = 0,0009).
Пример 12
Оптимизация дифференцировки СКБ на пористой матрице
[0154] Чтобы найти оптимальные условия для образования мышечной трубочки на 3D матрицах, авторы изобретения сканировали множество комбинаций сред для размножения и последовательно сред для дифференцировки. Мышечные трубочки, образованные без ФР в средах для дифференцировки (Фиг. 22A, E и I), были небольшими и округлыми. Добавление ИФР-1 в среду для дифференцировки в результате приводило к появлению мышечных трубочек, которые редко наблюдались в питательных средах (Фиг. 22B), обычно в Про-ЛИФ-бФРФ (Фиг. 22J), и в изобилии в Про-ЛИФ средах (Фиг. 22F). Добавление ЭФР к средам для дифференцировки приводило к появлению мышечных трубочек во всех средах для размножения (Фиг. 22C, G и K). Добавление ИФР-1 + ЭФР приводило к появлению мышечных трубочек в питательной среде (Фиг. 22D) и Про-ЛИФ-бФРФ (Фиг. 22L), а также изобилию мышечных трубочек в Про-ЛИФ (Фиг. 22H).
Пример 13
Три-культура увеличивает пролиферацию, удлинение и покрытие СКБ на пористой матрице
[0155] Затем авторы изобретения хотели исследовать влияние три-культурного СКБ с постоянным количеством гладкомышечных клеток (ГМК) и различным количеством скелетного микроваскулярного эндотелия (СкМВЭК) (2:1:1 и 2:1:5, соответственно) на выживаемость СКБ, пролиферацию и дифференцировку мышечных трубочек (положительно для маркера дифференцировки - миогенин). Авторы изобретения наблюдали, что при низкой концентрации СкМВЭК (2:1:1) СКБ, по-видимому, более удлинен по сравнению с их внешним видом при инкубировании с более высокой концентрацией СкМВЭК (2:1:5; Фиг. 28). Авторы изобретения также наблюдали увеличение покрытия СКБ на пористой матрице и, по-видимому, увеличение дифференцировки по сравнению с монокультурой или сокультурами, содержащими СКБ (контрольные группы). Авторы изобретения пришли к выводу, что три-культуры лучше поддерживают пролиферацию и дифференцировку СКБ по сравнению с другими испытанными группами в обоих соотношениях инкубирования, и вывели потенциал дифференцировки СКБ следующим образом: только СКБ <СКБ+ЭК<СКБ+ГМК<СКБ+ЭК+ГМК (Фиг. 23-26 и 28). Авторы изобретения также наблюдали секрецию внеклеточного матрикса (ВКМ) в три-культурах СКБ+ГМК+СкМВЭК (2:1:1) (Фиг. 27A-27B).
Пример 14
Три-культура увеличивает дифференцировку СКБ на матрице из структурированного соевого белка
[0156] Затем авторы изобретения хотели исследовать влияние культивирования трех культур СКБ с постоянным количеством гладкомышечных клеток (ГМК) и скелетного микроваскулярного эндотелия (СкМВЭК) (2:1:1, соответственно) на выживание СКБ, пролиферацию и дифференцировку мышечных трубочек (положительный по маркеру дифференцировки - миогенин). Авторы изобретения наблюдали не только увеличение покрытия СКБ по матрице из ТСБ при засеве либо в сокультуре с ГМК, либо в три-культуре с ГМК и ЭКБ, но также увеличение дифференцировки СКБ по сравнению с монокультурой (только СКБ) или сокультурой (СКБ с ЭКБ; Фиг. 29).
Пример 15
Засев СКБ без добавления геля-отвердителя
[0157] Затем авторы изобретения хотели исследование влияние засева СКБ на разрешенную к применению в США матрицу на основе коллагена (Gelfoam ©) без добавления отвердителей (например, фибрина. Авторы изобретения наблюдали успешную дифференцировку СКБ, что было продемонстрировано образованием мышечной трубочки (фиг. 30).
[0158] Хотя некоторые признаки изобретения были проиллюстрированы и описаны в настоящем документе, для специалистов в данной области техники теперь будут очевидны многие модификации, замены, изменения и эквиваленты. Следовательно, следует понимать, что прилагаемая формула изобретения предназначена для охвата всех таких модификаций и изменений, которые соответствуют действительной сущности изобретения.
Реферат
Настоящее изобретение относится к области клеточной биологии и пищевой промышленности, в частности к способу получения пригодной к употреблению в пищу композиции и композиции, полученной таким способом. Для осуществления способа сначала инкубируют множество типов клеток животного, не являющегося человеком, и пригодную к употреблению в пищу трехмерную пористую матрицу. После чего индуцируют дифференцировку миобластов или их клеток-предшественников в мышечные трубочки. Причём указанное множество типов клеток содержит миобласты или их клетки-предшественники, включая сателлитные клетки, и секретирующие внеклеточный матрикс (ВКМ) клетки, включая фибробласты, а также, необязательно, небольшое количество эндотелиальных клеток или их клеток-предшественников, не более 15% от указанного множества. Настоящее изобретение позволяет улучшить выживаемость, пролиферацию и образование мышечных трубочек при получении пригодной для употребления в пищу композиции, продукта из культивируемого мяса. 2 н. и 22 з.п. ф-лы, 167 ил., 3 табл., 15 пр.

Комментарии