Цельноклеточная система для биокатализа монооксигеназ цитохрома p450 - RU2684714C2
Код документа: RU2684714C2
Чертежи











Описание
Объектом настоящего изобретения является способ цельноклеточного катализа для преобразования субстратов монооксигеназ цитохрома P450 эукариотического происхождения в ценные биотехнологические продукты. Объектом настоящего изобретения также являются генетически конструируемые микроорганизмы для проведения таких биотрансформаций с высокими скоростями и способы получения штаммов этих микроорганизмов.
УРОВЕНЬ ТЕХНИКИ, ПРЕДШЕСТВУЮЩИЙ ИЗОБРЕТЕНИЮ
Монооксигеназы цитохрома P450 (P450) играют важную роль в метаболизме ряда гидрофобных соединений. Они участвуют в синтезе стероидов, жирных кислот, витаминов и других биологических процессах, таких как детоксикация ксенобиотиков (Maurer et al., 2003; Urlacher et Girhard, 2012). P450 катализирует широкий спектр реакций, включая реакции гидроксилирования, N-окисления, N-, O- и S-деалкилирования, сульфоокисления, дезаминирования, десульфуризации, дегалогенирования, перекисного окисления, восстановления N-оксида, реакций перегруппировки, связывания фенольных C-C и C-O, расщепления связей C-C и другие (Bernhardt et al., 1996; Bernhardt et al., 2006).
Способность P450 катализировать регео-, хемо- и стереоспецифическое окисление большого числа субстратов отражает их биологические роли и делает их важными кандидатами для биотехнологических применений.
В частности, стероидные гормоны широко используют в качестве противовоспалительных, противозачаточных и антипролиферативных лекарственных средств. У млекопитающих синтез этих стероидов начинается с реакции отщепления боковой цепи холестерина до прегненолона. Прегненолон служит в качестве основания для продукции последующих стероидных гормонов, таких как гидрокортизон (Szczebara et al., 2003), и большой интерес связан с его крупномасштабным промышленным преобразованием из недорогих субстратов, таких как холестерин и его аналогов растительного происхождения.
Однако реакция отщепления боковой цепи холестерина до прегненолона является лимитирующим этапом в общем процессе синтеза стероидов. У млекопитающих эту реакцию катализирует мембраносвязанный фермент CYP11A1 с использованием адренодоксина и адренодоксинредуктазы в качестве переносчиков электронов.
Значительные усилия были направлены на воссоздание ферментативной системы отщепления боковой цепи стерина в рекомбинантных микроорганизмах, таких как Escherichia coli (Sakamoto et al., EP2386634), но все еще вызывает затруднение получение удовлетворительного уровня ферментативной активности в основном вследствие того, что CYP11A1 млекопитающих представляет собой нерастворимый мембраносвязанный фермент, и что CYP11A1, по-видимому, не сворачивается правильно в прокариотических хозяевах.
Было доказано, что не содержащее плазмиду производное B. megaterium DSM319 является ценным хозяином для коэкспрессия прокариотического цитохрома P450 CYP106A2 из B. megaterium ATCC 13368 с адренодоксинредуктазой (AdR) и адренодоксином (Adx) крупного рогатого скота; его применяли для цельноклеточного преобразования гидрофобных кислот с терпеновой структурой, такой как противовоспалительная пентациклическая тритерпен-11-кето-β-босвеллиевая кислота (KBA). В этой работе исследовали рекомбинантную систему B. megaterium в равнении с экспрессирующим естественным образом CYP106A2 штаммом B. megaterium ATCC 13368 и цельноклеточной системой на основе E. coli. Прокариотический цитохром P450 CYP106A2 из B. megaterium ATCC 13368 представляет собой одну из немногих клонированных бактериальных стероидгидроксилаз. Недавно идентифицировали в качестве в качестве первой описанной бактериальной P450 дитерпенгидроксилазы, которая способна осуществлять одноэтапное региоселективное аллильное гидроксилирование абиетиновой кислоты (Bleif et al., 2012).
Тем не менее, по-прежнему необходимым является микроорганизм, который обеспечивает в качестве цельноклеточного катализатора экспрессию и катализ с высокими скоростями биоконверсии субстратов из монооксигеназ цитохрома P450 эукариотического происхождения, такое как реакция отщепления боковой цепи холестерина до прегненолона посредством нерастворимого CYP11A1.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Неожиданно авторы изобретения открыли, что возможной являлась экспрессия и катализ биоконверсии субстратов из монооксигеназ цитохрома P450 эукариотического происхождения при высоких скоростях путем использования микроорганизма в качестве цельноклеточного катализатора и путем увеличения его накопительной способности, зависящей от полигидроксиалканоатных гранул.
В частности, авторы изобретения получали преобразование с высокой скоростью холестерина, аналогов и производных холестерина в прегненолон, гидроксилированные аналоги холестерина и секостероиды посредством коэкспрессия в B. megaterium MS941 нерастворимого CYP11A1 крупного рогатого скота, адренодоксинредуктазы (AdR) крупного рогатого скота и адренодоксина (Adx) крупного рогатого скота.
Таким образом, первый аспект настоящего изобретения представляет собой генетически конструируемый микроорганизм, способный преобразовывать холестерин, его аналоги и производные холестерина в предшественники или производные стероидных гормонов, где указанный микроорганизм содержит по меньшей мере одну последовательность ДНК, кодирующую цитохром P450 эукариотического происхождения, экзогенную последовательность ДНК, кодирующую Adx, и экзогенную последовательность ДНК, кодирующую AdR.
Второй аспект настоящего изобретения представляет собой способ получения предшественников стероидных гормонов, включающий этапы:
- предоставления микроорганизма, как описано выше,
- культивирования указанного микроорганизма в условиях, обеспечивающих экспрессию экзогенных последовательностей ДНК,
- приведения культуры указанного микроорганизма в контакт с субстратом, выбранным из группы, состоящей из холестерина, аналогов и производных холестерина, и
- выделение предшественников или производных стероидных гормонов.
Третий аспект настоящего изобретения представляет собой способ получения рекомбинантных штаммов, которые являются улучшенными в отношении преобразования холестерина, аналогов и производных холестерина в предшественники или производные стероидных гормонов, включающий этапы:
- предоставление микроорганизма,
- введение способами генетической инженерии в указанный микроорганизм по меньшей мере одной последовательности ДНК, кодирующей цитохром P450 эукариотического происхождения, экзогенной последовательности ДНК, кодирующей Adx и экзогенной последовательности ДНК, кодирующей AdR.
Четвертый аспект настоящего изобретения представляет собой способ увеличения накопительной способности микроорганизма в отношении гидрофобных или гидрофильных соединений, включающий этапы:
- предоставления микроорганизма, содержащего функциональную систему эндогенной полимеразы, способную образовывать полигидроксиалканоатные тельца (PHA-тельца); и
- модуляции способами генетической инженерии в указанном микроорганизме экспрессии по меньшей мере одного гена, участвующего в образовании PHA-телец,
таким образом, получая микроорганизм с повышенной накопительной способностью в отношении гидрофобных или гидрофильных соединений.
Эти и другие признаки и преимущества описываемых микроорганизмов и способов будут более понятны из следующего ниже подробного описания в совокупности с прилагаемой формулой изобретения.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
1. Генетически конструируемые микроорганизмы по изобретению
Неожиданно авторы изобретения обнаружили, что возможной являлась экспрессия и катализ биоконверсии субстратов из монооксигеназ цитохрома P450 эукариотического происхождения с высокими скоростями путем использования микроорганизма в качестве цельноклеточного катализатора.
В частности, авторы изобретения получали преобразование с высокими скоростями холестерина, аналогов и производных холестерина в прегненолон посредством коэкспрессии в B. megaterium MS941 нерастворимого CYP11A1 крупного рогатого скота, адренодоксинредуктазы (AdR) и адренодоксина (Adx) крупного рогатого скота, как описано в примере 2 и на фигурах 2-12.
Таким образом, настоящее изобретение относится к генетически конструируемому микроорганизму, способному преобразовывать холестерин, холестерина аналоги и его производные в предшественники стероидных гормонов, где указанный микроорганизм содержит по меньшей мере одну последовательность ДНК, кодирующую цитохром P450 эукариотического происхождения, экзогенную последовательность ДНК, кодирующую Adx и экзогенную последовательность ДНК, кодирующую AdR.
Под "генетически конструируемый" микроорганизм подразумевают любой микроорганизм по настоящему изобретению, который модифицировали способами генетической инженерии, известных в данной области специалисту в данной области.
Такие способы представляют собой общепринятые способы, если не указано иное, в областях биоинформатики, клеточной биологии, культивирования клеток, молекулярной биологии, трансгенной биологии, микробиологии, рекомбинантной ДНК и иммунологии, которые известны специалистам в данной области. Такие способы полностью описаны в литературе. См., например, Current Protocols in Molecular Biology (Frederick M. AUSUBEL, 2000, Wiley and son Inc, Library of Congress, USA); Molecular Cloning: A Laboratory Manual, Third Edition, (Sambrook et al., 2001, Cold Spring Harbor, New York: Cold Spring Harbor Laboratory Press); Oligonucleotide Synthesis (M.J. Gait ed., 1984); Mullis et al., патент США № 4683195; Nucleic Acid Hybridization (B.D. Harries & S.J. Higgins eds. 1984); Transcription And Translation (B.D. Hames & S.J. Higgins eds. 1984); Culture Of Animal Cells (R.I. Freshney, Alan R. Liss, Inc., 1987); Immobilized Cells And Enzymes (IRL Press, 1986); B. Perbal, A Practical Guide To Molecular Cloning (1984); the series, Methods In ENZYMOLOGY (J. Abelson and M. Simon, eds.-in-chief, Academic Press, Inc., New York), в частности, т.154 и 155 (Wu et al., eds.) и т. 185, "Gene Expression Technology" (D. Goeddel, ed.); Gene Transfer Vectors For Mammalian Cells (J.H. Miller and M.P. Calos eds., 1987, Cold Spring Harbor Laboratory); Immunochemical Methods In Cell And Molecular Biology (Mayer and Walker, eds., Academic Press, London, 1987); Handbook Of Experimental Immunology, Volumes I-IV (D.M. Weir and C.C. Blackwell, eds., 1986) и Manipulating the Mouse Embryo, (Cold Spring Harbor Laboratory Press, Cold Spring Harbor, N.Y., 1986).
Эти способы в соответствии с настоящим изобретением относится к способам, обеспечивающим модуляцию экспрессии гена, известным в данной области специалисту в данной области. "Модуляция экспрессии гена" или "модуляция одного гена способами генетической инженерии", или "генетически конструируемый микроорганизм, где один ген модулируют" включают способы, обеспечивающие сверхэкспрессию одного представляющего интерес гена или иным образом снижающие или подавляющие экспрессию одного представляющего интерес гена. Под "сверхэкспрессией" или "подавлением" одного представляющего интерес гена подразумевают получение уровня экспрессии указанного гена выше или ниже его нормального уровня экспрессии, соответственно. В качестве неограничивающего примера сверхэкспрессию представляющего интерес гена можно получать введением в клетку или микроорганизм экзогенной последовательности ДНК, кодирующей такой представляющий интерес ген. Подавление представляющего интерес гена можно получать способами сайленсинга гена, известными специалисту в данной области, такими как способы антисмысловой РНК и РНК-интерференции, известные как способы нокдауна гена. В качестве неограничивающего примера подавление гена можно получать экспериментом замены представляющего интерес гена-мишени путем замены такого гена нефункциональной копией указанного гена (как описано в примере 4 для делеции гена phaC) или путем эксперимента нокаута с делецией одной части или всех генов с использованием в качестве неограничивающих примеров специфических эндонуклеаз.
Под "введением в клетку или микроорганизм одной последовательности ДНК способами генетической инженерии" подразумевают действие трансформирования указанной клетки или микроорганизма представляющей интерес последовательностью ДНК любыми способами трансформации, известными специалисту в данной области в качестве неограничивающего примера, такими как способ опосредованной PEG трансформации протопластов, используемый в примере 1 (Barg H. et al., (2005).
Под "экзогенной последовательностью(ми) ДНК" подразумевают последовательность(и) нуклеиновой кислоты, которая исходно и/или естественным образом не экспрессируется в рассматриваемом микроорганизме или в том виде, в котором она содержится в природном штамме микроорганизма (например, в контексте уровня экспрессии), и которую использовали для трансформации указанного микроорганизма для получения генетически конструируемого микроорганизма, как указано выше. В конкретном варианте осуществления экзогенная последовательность ДНК происходит от другого вида по сравнению с рассматриваемым микроорганизмом (например, другого вида микроорганизма или организма). В другом конкретном варианте осуществления экзогенная последовательность происходит от одного и того микроорганизма.
Термин "нуклеиновая кислота", как правило, относится по меньшей мере к одной молекуле или цепи ДНК, РНК или их производному или имитатору, содержащему по меньшей мере одно нуклеиновое основание, такое как, например, природное пуриновое или пиримидиновое основание, встречающееся в ДНК (например, аденин "A", гуанин "G", тимин "T" и цитозин "C") или РНК (например, A, G, урацил "U" и C). Нуклеиновую кислоту можно получать любым способом, известным специалисту в данной области (см. выше и, например, Sambrook et al., 2000).
В другом конкретном варианте осуществления указанные экзогенные последовательности ДНК вводили в указанный микроорганизм способами генетической инженерии. Для введения таких последовательностей можно использовать любые способы, известные специалисту в данной области в качестве неограничивающего примера, такие как способ опосредованной PEG трансформации протопластов в примере 1 (Barg H. et al., (2005)).
Указанная экзогенная последовательность(и) ДНК может кодировать представляющие интерес белки, такие как цитохром P450 и окислительно-восстановительные партнеры AdR и Adx, и экспрессия "экзогенной ДНК" может обозначать каждую индивидуальную последовательность или включать целую последовательность, содержащую каждые индивидуальные последовательности. В качестве неограничивающего примера указанный микроорганизм трансформировали одной плазмидой, содержащей указанные экзогенные последовательности ДНК, как описано в примере 1. В качестве другого неограничивающего примера указанные экзогенные последовательности ДНК интегрировали в геном указанного микроорганизма известными в данной области способами, такими как, например, гомологичная рекомбинация.
Под "микроорганизмом" подразумевают микроорганизм, используемый для конструкции указанного генетически конструируемого микроорганизма по настоящему изобретению. В контексте настоящего изобретения микроорганизм можно выбирать, например, из списка, состоящего из Escherichia coli, Bacillus licheniformis, Bacillus megaterium, Bacillus subtilis, Kluyveromyces lactis, Saccharomyces cerevisiae и Schizosaccharomyces pombe.
В конкретном варианте осуществления изобретения микроорганизм представляет собой Bacillus megaterium. В другом конкретном варианте осуществления изобретения микроорганизм представляет собой штамм Bacillus megaterium, выбранный из группы, состоящей из штаммов, депонированных в Deutsche Stammsammlung von Mikroorganismen und Zellkulturen, далее в настоящем описании, сокращенно обозначаемом как "DSM", штамм с номерами доступа DSM 1517, DSM 1668, DSM 1669, DSM 1670, DSM 1671, DSM 1804, DSM 2894, DSM 30587, DSM 30601, DSM 30782, DSM 30787, DSM 30897, DSM 319, DSM 32, DSM 321, DSM 322, DSM 3228, DSM 333, DSM 337, DSM 339, DSM 344, DSM 3641, DSM 509, DSM 510, DSM 786 и DSM 90.
В конкретном варианте осуществления изобретения микроорганизм представляет собой штамм DSM 319 Bacillus megaterium. В конкретном варианте осуществления изобретения микроорганизм представляет собой штамм Bacillus megaterium, который не может экспрессировать ген основной внеклеточной протеазы nprM (например, штамм, ген nprM основной внеклеточной протеаза которой удаляют или подавляют). В конкретном варианте осуществления изобретения микроорганизм представляет собой Bacillus megaterium, обозначаемый как MS941 Bacillus megaterium. Под штаммом MS941Bacillus megaterium подразумевают штамм, как указано у Wittchen K.D. and Meinhardt F., (1995) и у Jingwen Z. and al., (2012), и который получают из штамма DSM319 дикого типа нокаутом гена nprM основной внеклеточной протеазы.
Один из аспектов настоящего изобретения относится к генетически конструируемому микроорганизму, способному преобразовывать холестерин, аналоги холестерина и его производные в предшественники или производные стероидных гормонов, где указанный микроорганизм содержит по меньшей мере одну последовательность ДНК, кодирующую цитохром P450 эукариотического происхождения, экзогенную последовательность ДНК, кодирующую Adx, и экзогенную последовательность ДНК, кодирующую AdR.
Под "цитохромом P450" подразумевают монооксигеназы, которые способны катализировать участников реакций (как приведено в обзоре Van Bogaert I.N. et al., (2011) или Urlacher V.B. and Girhard M. (2011), или http://dmelson.uthsc.edu/CytochromeP450.html). Цитохром P450 по настоящему изобретению является мембраносвязанным (нерастворимым) или цитоплазматическим (растворимым) у своих соответствующих исходных хозяев.
В конкретном варианте осуществления указанный цитохром P450 по настоящему изобретению выбран из группы, состоящей из CYP11A1 (EC: 1.14.15.6 в соответствии с нумерацией комиссии по ферментам), CYP17A1 (EC: 1.14.99.9 или 4.1.2.30), CYP21A1, CYP11B1 (EC: 1.14.15.4), CYP11B2, CYP3A4, CYP46A1, CYP27A1 и CYP21A2 (EC: 1.14.99.10).
В контексте настоящего изобретения цитохром P450, вводимый в микроорганизм, является эукариотического происхождения, т.е. может представлять собой экзогенную AdR и Adx. Под выражением "эукариотического происхождения" подразумевают белок, исходно экспрессируемый (т.е. происходящий из) в эукариотическом организме в качестве неограничивающих примеров рода Homo, Rattus, Mus, Sus, Bos, Gallus, Taeniopygia, Ovis, Macacamulatta, Capra, Odontesthes, Trichoplax, Alligator, Eublepharis, Macaca, Papio, Callithrix, Oryctolagus, Mesocricetus, Canis, Rana, Glandirana, Oncorhynchus, Epinephelus, Acanthopagrus, Tautogolabrus, Pimephales, Carassius, Gobiocypris, Anguilla, Dasyatis, Felis и Equus, или в линиях клеток, получаемых из этих организмов для культур in vitro, или первичных клетках, получаемых из живых тканей и устанавливаемых для культивирования in vitro. В конкретном варианте осуществления указанный цитохром P450 по настоящему изобретению представляет собой белок, исходно экспрессируемый в эукариотическом организме вида, выбранного из группы, состоящей из Homo sapiens, Mus musculus, Rattus norvegicus, Sus scrofa, Bos taurus, Gallus gallus, Taeniopygia guttata, Ovis aries, Taeniopygia guttata, Macaca mulatta, Capra hircus, Equus caballus, Odontesthes bonariensis, Trichoplax adhaerens, Alligator mississippiensis, Eublepharis macularius, Macaca fascicularis, Papio ursinus, Callithrix jacchus, Oryctolagus cuniculus, Mesocricetus auratus, Canis lupus familiaris, Rana catesbeiana, Glandirana rugosa, Oncorhynchus mykiss, Epinephelus coioides, Acanthopagrus schlegelii, Tautogolabrus adspersus, Pimephales promelas, Carassius auratus, Gobiocypris rarus, Anguilla japonica и Dasyatis Americana.
В конкретном варианте осуществления цитохром P450, вводимый в микроорганизм, представляет собой цитохром P450 из Bos Taurus. В другом конкретном варианте осуществления в качестве неограничивающего примера указанный цитохром P450 представляет собой CYP11A1 из Bos Taurus (обозначаемый как P00189 в UniProtKB/Swiss-Prot) и катализирует реакция отщепления боковой цепи холестерина, аналогов холестерина и его производных до прегненолона или других предшественников и производных стероидных гормонов. В другом конкретном варианте осуществления указанный цитохром P450 катализирует гидроксилирование витамина D2 до 20-гидроксивитамина D2, 17,20-дигидроксивитамина D2 и 17,20,24-тригидроксивитамина D2 (Nguyen M.N. et al., 2009), гидроксилирование витамина D3 до 20-гидроксивитамина D3, 20,23-дигидроксивитамина D3 и 17,20,23-тригидроксивитамина D3 (Tuckey R.C. et al., 2008). В другом конкретном варианте осуществления в качестве других неограничивающих примеров указанный цитохром P450 катализирует окисление эргостерина до 17,24-дигидроксиэргостерина, 20-гидрокси-22,23-эпокси-22,23-дигидроэргостерина и 22-кето-23-гидрокси-22,23-дигидроэргостерина (Tuckey R.C. et al., 2012). В другом конкретном варианте осуществления белковая последовательность указанного цитохрома P450 представляет собой SEQ ID NO: 2. В другом конкретном варианте осуществления белковая последовательность указанного цитохрома P450 представляет собой вариант SEQ ID NO: 2 при условии, что он сохраняем свою биологическую активность.
Указанный микроорганизм по изобретению содержит по меньшей мере одну последовательность ДНК, кодирующую цитохром P450 эукариотического происхождения или вариант указанного цитохрома P450. Кодируемый цитохром P450 эукариотического происхождения или его вариант по изобретению не является слитым белком.
Под "AdR" подразумевают адренодоксинредуктазу (EC: 1.18.1.6) или адренодоксин-NADP+редуктазу, фермент, который является известным как первый компонент в митохондриальной системе переноса электронов цитохрома P450 и который участвует в биосинтезе всех стероидных гормонов.
В конкретном варианте осуществления указанный фермент AdR выбран из группы, состоящей из AR (NADPH:адренодоксиноксидоредуктазы (EC=1,.18.1.6), кодируемой геном arh1) из Schizosaccharomyces pombe или из Saccharomyces cerevisiae и FNR (ферредоксин-NADP-редуктазы (EC=1.18.1.2), кодируемую геном fpr) из Escherichia coli.
В конкретном варианте осуществления фермент AdR, который вводят в микроорганизм, представляет собой AdR из Bos Taurus (обозначаемый как P08165 в UniProtKB/Swiss-Prot). В другом конкретном варианте осуществления белковая последовательность указанной AdR представляет собой SEQ ID NO: 3. В другом конкретном варианте осуществления белковая последовательность указанной AdR представляет собой вариант SEQ ID NO: 3 при условии, что он сохраняет свою биологическую активность.
Под "Adx" подразумевают адренодоксин или ферредоксин 1, белок, который является известным своей активностью переноса электронов из адренодоксинредуктазы на CYPA11.
В конкретном варианте осуществления указанный фермент Adx выбран из группы, состоящей из Fdx млекопитающих, Etp1fd из Schizosaccharomyces pombe, Yah1 из Saccharomyces cerevisiae.
В конкретном варианте осуществления в качестве неограничивающего примера фермент Adx, который вводят в микроорганизм, представляет собой Adx из Bos Taurus (обозначаемый как P00257 в UniProtKB/Swiss-Prot). В другом конкретном варианте осуществления белковая последовательность указанного Adx представляет собой SEQ ID NO: 4. В другом конкретном варианте осуществления белковая последовательность указанного Adx представляет собой вариант SEQ ID NO: 4 при условии, что он сохраняет свою биологическую активность.
Указанный генетически конструируемый микроорганизм по настоящему изобретению дополнительно содержит функциональную систему эндогенной полимеразы, способную образовывать полигидроксиалканоатные тельца.
Под "функциональной системой эндогенной полимеразы, способной образовывать полигидроксиалканоатные тельца" подразумевают систему регулона синтеза PHA или эквивалентную систему по отношению к виду микроорганизма, которая позволяет указанному микроорганизму продуцировать в качестве неограничивающих примеров полигидроксиалканоатные тельца (PHA-тельца) или полигидроксиалканоатные гранулы, или эквивалентные по отношению к рассматриваема виду микроорганизма, такие как полигидроксибутиратные тельца (PHB-тельца) или полигидроксибутиратные гранулы. В конкретном варианте осуществления генетически конструируемый микроорганизм по настоящему изобретению способен продуцировать полигидроксиалканоатные тельца (PHA-тельца) или полигидроксиалканоатные гранулы. В другом конкретном варианте осуществления указанный генетически конструируемый микроорганизм по настоящему изобретению способен продуцировать полигидроксибутиратные тельца (PHB-тельца) или полигидроксибутиратные гранулы.
Под системой регулона синтеза PHA подразумевают набор генов, кодирующих ключевые ферменты биосинтеза полигидроксиалканоатов, которые обеспечивают ковалентную связь активированных предшественников, таких как сложны тиоэфир (R)-3-гидроксиацил-кофермента A с длиной цепи 3-14 атомов C, которые являются субстратами pha-синтазы. Было выделено более 59 генов pha-синтазы с высокой гомологией более чем из 45 видов бактерий, обладающих широкой специфичностью (как, описано в http://mibi1.unimuenster.de/Biologie.IMMB.Steinbuechel/Forschung/PHA.html и у
Активность указанной системы полимераз, способной образовывать полигидроксиалканоатные тельца по настоящему изобретению, можно измерять посредством окрашивания нильским красным или нильским синим и флуоресцентной микроскопии (как представлено у Ostle A.G. and Holt J.G., 1982; Spierkemann P. et al., 1999; Der-Shyan S. et al., 2000), или как указано в примере 4.
Экспрессия "функциональной системы эндогенной полимеразы, способной образовывать полигидроксиалканоатные тельца" включает случай, когда способность образовывать полигидроксиалканоатные тельца является недетектируемой соответствующим измерением активности, как указано выше, но когда гены такой системы эндогенных полимераз являются детектируемыми геномными способами и допускающими образование детектируемых полигидроксиалканоатных тельц в конкретных условиях, в качестве неограничивающего примера таких как, когда другой ген pha-синтазы является сверхэкспрессированным.
В другом варианте осуществления указанный генетически конструируемый микроорганизм по настоящему изобретению дополнительно содержит по меньшей мере один ген, участвующий в образовании PHA-телец, где указанную экспрессию гена "модулируют", как описано выше. В конкретном варианте осуществления указанный ген является сверхэкспрессированным. В другом конкретном варианте осуществления указанный ген подавляют. В другом конкретном варианте осуществления проводят нокаут указанного гена. В другом конкретном варианте осуществления указанный ген представляет собой один из генов pha-синтазы, как указано в ссылках выше. В другом конкретном варианте осуществления указанный ген выбран из группы, состоящей из PhaR (pha-синтазы), PhaP (фазина), PhaC (pha-синтазы), PhaE (Pha-синтазы), PhaQ (поли-бета-гидроксибутиратчувствительного репрессора), PhaB (ацетоацетил-CoA-редуктазы) и PhaA (3-кетотиолазе). В другом конкретном варианте осуществления указанный генетически конструируемый микроорганизм по настоящему изобретению содержит сверхэкспрессированную PhaC (pha-синтазу). В другом конкретном варианте осуществления указанный генетически конструируемый микроорганизм по настоящему изобретению содержит сверхэкспрессированный PhaP (фазин). В другом конкретном варианте осуществления указанный генетически конструируемый микроорганизм по настоящему изобретению содержит сверхэкспрессированную PhaA (3-кетотиолазу). В другом конкретном варианте осуществления указанный генетически конструируемый микроорганизм по настоящему изобретению является нокаутным по генам Pha-деполимеразы (PhaZ, поли(3-гидроксиалкановая кислота) деполимеразы, PhaZ1, PhaZ2 и PhaZ3).
В другом варианте осуществления указанный генетически конструируемый микроорганизм по настоящему изобретению содержит более одного гена, участвующего в образовании PHA-телец, где экспрессию указанных генов "модулируют", таких как в двух, трех, четырех, пяти, шести, семи, восьми, девяти, десяти или более десяти генов.
В другом варианте осуществления указанный генетически конструируемый микроорганизм по настоящему изобретению модифицируют путем сверхэкспрессии по меньшей мере одного гена, выбранного из группы, состоящей из PhaR, PhaP, PhaC, PhaE, PhaB и PhaA, и/или подавления или инактивации по меньшей мере одного гена, выбранного из группы, состоящей из PhaZ и PhaQ.
В другом конкретном варианте осуществления указанный генетически конструируемый микроорганизм по настоящему изобретению содержит все совместно сверхэкспрессируемые PhaA (3-кетотиолазу), PhaB (ацетоацетил-CoA-редуктазу), PhaC (pha-синтазу) и PhaR (pha-синтазу).
В другом конкретном варианте осуществления указанный генетически конструируемый микроорганизм по настоящему изобретению содержит сверхэкспрессированную PhaC (pha-синтазу) и PhaR (pha-синтазу) в качестве субъединиц pha-полимеразы того же класса IV.
В другом конкретном варианте осуществления указанный генетически конструируемый микроорганизм по настоящему изобретению содержит сверхэкспрессированную PhaC (pha-синтазу) и PhaE (pha-синтазу) в качестве субъединиц pha-полимеразы того же класса III.
В другом варианте осуществления указанные сверхэкспрессированные гены в генетически конструируемом микроорганизме по настоящему изобретению представляют собой гены, происходящие из того же вида микроорганизма. В другом варианте осуществления указанные сверхэкспрессированные гены в генетически конструируемом микроорганизме по настоящему изобретению представляют собой гены из других видов микроорганизма. В качестве неограничивающих примеров эти гены принадлежат к системе генов pha из Ralstonia eutropha, Pseudomonas aeruginosa и Allochromatium vinosum.
В другом конкретном варианте осуществления указанный микроорганизм по настоящему изобретению представляет собой Bacillus megaterium. В другом конкретном варианте осуществления указанный микроорганизм по настоящему изобретению представляет собой Bacillus megaterium штамма MS941.
Субстраты, которые генетически конструируемый микроорганизм по настоящему изобретению способен преобразовывать, включают фитостерин, получаемый из циклоартенола и ланостерина. Среди эти субстратов под "холестерином, аналогами холестерина и его производными" подразумевают перечень субстратов, выбранных из группы, состоящей из холестерина, брассикастерина, кампестерина, эргостадиенола, такого как эргост-5,22-диенол, эргоста-5,24(28)-диенол, эргоста-5,24(25)-диенол, эргостатриенола, такого как эргоста-5,22,24(25)-триенол, эргоста-5,22,24(28)-триенол, эргоста-5,7,22-триенола, эргостатетренола, такого как эргоста-5,7,22,24(25) или эргоста-5,7,22,24(28), десмостерина, бета-ситостерина, генерола, смеси оксистеролов, стигмастерина, витамина D, 7-дегидрохолестерина и эргостерина, как проиллюстрировано в примерах 3-5 и на фигурах 2-12.
Используемые в настоящее время в промышленных способах смеси стероидов также входят в это определение субстратов, такие как генерол 100 и ADM90 (содержащие брассикастерин + кампестерин + стигмастерин + β-ситостерин в различных отношениях).
Под "вариантом(ами)" подразумевают варианты белка и нуклеиновой кислоты. Варианты белков могут представлять собой природные варианты, такие как варианты сплайсинга, аллели и изоформы. Изменения в аминокислотной последовательности можно вводить посредством замены, делеции или вставки одного или более кодонов в последовательность нуклеиновой кислоты, кодирующей белок, которые приводят к изменению в аминокислотной последовательности белка. Варианты белков могут представлять собой белок, содержащий консервативную или неконсервативную замену. Например, вариант SEQ ID NO: 2, SEQ ID NO: 3 или SEQ ID NO: 4 может представлять собой полипептид, содержащий по меньшей мере одну замену в конкретном аминокислотном остатке. Варианты белков могут включать могут включать белки, которые обладают по меньшей мере приблизительно 80% идентичностью аминокислотных последовательностей с полипептидной последовательностью, описываемой в настоящем описании. Предпочтительно вариант белка обладает по меньшей мере приблизительно 80%, 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% идентичностью аминокислотных последовательностей с полноразмерной полипептидной последовательностью или фрагментом полипептидной последовательности, как описано в настоящем описании. Идентичность аминокислотных последовательностей определяют как процент аминокислотных остатков в последовательности варианта, которые являются идентичными аминокислотным остаткам в эталонной последовательности после выравнивания последовательностей и введения пропусков при необходимости для получения максимального процента идентичности последовательности и без учета каких-либо консервативных замен как часть идентичности последовательности. Идентичность последовательности можно определять для всей длины последовательности варианта, все длины эталонной последовательности или для обеих. Процент идентичности для белковых последовательностей можно рассчитывать путем проведения попарного общего выравнивания на основании алгоритма выравнивания Нидлмана-Вунша для поиска оптимального выравнивания (включая пропуски) двух последовательностей по всей длине, например, с использованием программы Needle и с использованием матрицы BLOSUM62 со штрафом за открытие пропуска 10 и штрафом за продление пропуска 0,5.
Последовательности нуклеиновой кислоты вариантов могут включать последовательности нуклеиновой кислоты, которые обладают по меньшей мере приблизительно 80% идентичностью последовательности нуклеиновой кислоты с последовательностью нуклеиновой кислоты, описываемой в настоящем описании. Предпочтительно последовательности нуклеиновой кислоты вариантов обладают по меньшей мере приблизительно 80%, 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% идентичностью последовательности нуклеиновой кислоты с полноразмерной последовательностью нуклеиновой кислоты или фрагментом последовательности нуклеиновой кислоты, как описано в настоящем описании. Идентичность последовательности нуклеиновой кислоты можно рассчитывать способами, хорошо известными специалисту в данной области. Процент идентичности можно рассчитывать путем проведения попарного общего выравнивания на основании алгоритма выравнивания Нидлмана-Вунша для поиска оптимального выравнивания (включая пропуски) двух последовательностей по всей их длине, например, с использованием программы Needle и с использованием матрицы DNAFULL со штрафом за открытие пропуска 10 и штрафом за продление пропуска 0,5. Примеры вариантов нуклеиновой кислоты могут представлять собой варианты нуклеиновой кислоты, кодирующие белки SEQ ID NO: 2, SEQ ID NO: 3 и SEQ ID NO: 4, и варианты нуклеиновой кислоты, кодирующие гены системы pha.
Как используют в настоящем описании, "аминокислота" относится к 20 стандартным альфа-аминокислотам, а также природным и синтетическим производным. Полипептид может содержать L- или D-аминокислоты или их сочетание.
2. Способы получения стероидных гормонов по изобретению
Авторы изобретения получали преобразование с высокой скоростью холестерина, аналогов и производных холестерина в прегненолон, аналоги гидроксилированного холестерина и секостероиды посредством коэкспрессии в MS941 B. megaterium растворимого CYP11A1 крупного рогатого скота, адренодоксинредуктаза (AdR) крупного рогатого скота и адренодоксина (Adx), как продемонстрировано в примерах 3-5 и фигурах 2-12.
Таким образом, второй аспект настоящего изобретения относится к способу получения предшественников и производных стероидных гормонов, включающему этапы:
- предоставления микроорганизма, как описано в указанном выше разделе, озаглавленном "Генетически конструируемые микроорганизмы по изобретению",
- культивирования указанного микроорганизма в условиях, обеспечивающих экспрессию указанных экзогенных последовательностей ДНК,
- приведения культуры указанного микроорганизма в контакт с субстратом, и
- выделения предшественников и производных стероидных гормонов.
В конкретном варианте осуществления указанные "предшественники и производные стероидных гормонов " выбраны из группы, состоящей из прегненолона, 7-дегидропрегненолона, гидроксиэргостерина и гидроксистигмастерина. В другом конкретном варианте осуществления указанные предшественники и производные стероидных гормонов выбраны из группы из гидроксилированных аналогов холестерина и секостероидов (таких как витамины D2 и D3 в качестве производных аналогов холестерина 7-дегидрохолестерина и эргостерина).
Под "культивированием указанного микроорганизма в условиях, обеспечивающих экспрессию указанных экзогенных последовательностей ДНК", подразумевают любое хорошо известное культивирование, и включая способы в области биотехнологии. В качестве иллюстративного примера условия культивирования микроорганизма по настоящему изобретению приведены в примерах 1 и 2.
"Субстраты", которые генетически конструируемый микроорганизм по настоящему изобретению способен преобразовывать, включают фитостерол, получаемый из циклоартенола и ланостерола.
В конкретном варианте осуществления настоящее изобретение относится к способу получения предшественников и производных стероидных гормонов, включающему этапы:
- предоставления микроорганизма как описано в указанном выше разделе, озаглавленном "Генетически конструируемые микроорганизмы по изобретению",
- культивирования указанного микроорганизма в условиях, обеспечивающих экспрессию указанных экзогенных последовательностей ДНК,
- приведения культуры указанного микроорганизма в контакт с субстратом, выбранным из группы, состоящей из холестерина, аналогов и производных холестерина, и
- выделения предшественников и производных стероидных гормонов.
Под "холестерином, аналогами холестерина и его производными" подразумевают перечень соединений, выбранных из группы, состоящей из холестерина, брассикастерина, кампестерина, эргостадиенола, такого как эргоста-5,22-диенол, эргоста-5,24(28)-диенол, эргоста-5,24(25)-диенол, эргостатриенола, такого как эргоста-5,22,24(25)-триенол, эргоста-5,22,24(28)-триенол, эргоста-5,7,22-триенол, эргостатетренола, такого как эргоста-5,7,22,24(25) или эргоста-5,7,22,24(28), десмостерина, бета-ситостерина, генерола, генерола 100, стерола ADM90, смеси оксистеролов, стигмастерина, витамина D, 7-дегидрохолестерина и эргостерина, как проиллюстрировано в примерах 3-5 и на фигурах 2-12.
В конкретном варианте осуществления настоящее изобретение относится к способу получения предшественников и производных стероидных гормонов, включающему этапы:
- предоставления микроорганизма, как описано в указанном выше разделе, озаглавленном "Генетически конструируемые микроорганизмы по изобретению",
- культивирования указанного микроорганизма в условиях, обеспечивающих экспрессию указанных экзогенных последовательностей ДНК,
- приведения культуры указанного микроорганизма в контакт с субстратом, используемом в настоящее время в промышленных способах, и
- выделения предшественников и производных стероидных гормонов.
"Смеси стеринов, используемые в настоящее время в промышленных способах," означают субстраты, такие как генерол 100 и ADM90 (содержащий брассикастерин + кампестерин + стигмастерин + β-ситостерин в различных отношениях), как проиллюстрировано в примерах 3-5 и на фигуре 12.
Под "приведением в контакт" культуры указанного микроорганизма с субстратом подразумевают обеспечение физического взаимодействия указанного микроорганизма по настоящему изобретению с субстратом по настоящему изобретению. Такое взаимодействие можно получать в среде для культивирования или вне ее. В конкретном варианте осуществления указанная среда для культивирования содержит средства для пермеабилизации микроорганизма по настоящему изобретению и/или солюбилизации субстрата по настоящему изобретению. Растворение субстрата в этих средствах можно проводить перед добавлением к культуре микроорганизма.
Эти средства можно выбирать из группы, состоящей из этанола, Tween-80, тергитола, поливинилпирролидона (PVP), сапонинов (таких как сапонин Quillaja, который содержится в неочищенных экстрактах, например, мыльного дерева Quillaja saponaria), циклодекстрины и их производные (например, 2-гидроксипропил-β-циклодекстрин). В другом конкретном варианте осуществления можно использовать смеси таких средств, такие как в качестве неограничивающих примеров смесь этанола и Tween-80, смесь тергитола и этанола, смесь сапонинов (например, сапонина Quillaja) и циклодекстринов. Можно использовать производные циклодекстринов, такие как в качестве неограничивающего примера 2-гидроксипропил-β-циклодекстрин. В другом конкретном варианте осуществления субстраты подвергают кристаллизации совместно с поливинилпирролидоном (PVP).
В другом конкретном варианте осуществления перед добавлением к культуре микроорганизмов субстрат сначала растворяют в 2-гидроксипропил-β-циклодекстрине, где указанная культура содержит сапонин Quillaja. В другом конкретном варианте осуществления субстраты растворяют в растворе, содержащем 2-гидроксипропил-β-циклодекстрин в диапазоне процентов от 10 до 60%, предпочтительно от 20 до 50%, более предпочтительно от 40 до 50% и сапонин Quillaja в диапазоне процентов от 1 до 10%, предпочтительно от 2 до 8%, более предпочтительно от 3 до 6%. В другом конкретном варианте осуществления субстраты растворяют в растворе, содержащем 45% 2-гидроксипропил-β-циклодекстрина и 4% сапонина Quillaja, как указано в примере 2.
В другом варианте осуществления конечная концентрация 2-гидроксипропил-β-циклодекстрина в культуре микроорганизмов составляет от 1 до 4%, предпочтительно от 2 до 3%, более предпочтительно 2,25%, как проиллюстрировано в примере 2. В другом варианте осуществления конечная концентрация сапонина Quillaja в культуре микроорганизмов составляет от 0,05 до 0,25%, предпочтительно от 0,075 до 0,225%, более предпочтительно от 0,1 до 0,2%, как проиллюстрировано в примере 2.
В конкретном варианте осуществления настоящее изобретение относится к способу получения предшественников и производных стероидных гормонов, включающему этапы:
- предоставления микроорганизма, как описано в указанном выше разделе, озаглавленном "Генетически конструируемые микроорганизмы по изобретению",
- культивирования указанного микроорганизма в условиях, обеспечивающих экспрессию указанных экзогенных последовательностей ДНК,
- приведения культуры указанного микроорганизма в контакт с субстратом, где указанный субстрат предварительно растворяли в растворе, содержащем 2-гидроксипропил-β-циклодекстрин и сапонин Quillaja, и
- выделения предшественников и производных стероидных гормонов.
В другом конкретном варианте осуществления настоящее изобретение относится к способу получения предшественников и производных стероидных гормонов, включающему этапы:
- предоставления микроорганизма как описано в указанном выше разделе, озаглавленном "Генетически конструируемые микроорганизмы по изобретению",
- культивирования указанного микроорганизма в условиях, обеспечивающих экспрессию указанных экзогенных последовательностей ДНК,
- приведения культуры указанного микроорганизма в контакт с субстратом,
i. где указанный субстрат предварительно растворяли в растворе, содержащем 2-гидроксипропил-β-циклодекстрин и сапонин Quillaja,
ii. где конечные концентрации этих компоненты в среде для культивирования составляют соответственно 2,25% и 0,2%, и
- выделения предшественников и производных стероидных гормонов.
3. Способы получения рекомбинантных штаммов по изобретению
Третий аспект настоящего изобретения представляет собой способ получения рекомбинантных штаммов, которые являются улучшенными в отношении преобразованию субстратов, таких как холестерин и получаемые аналоги в предшественники стероидных гормонов, как описано выше, включающий этапы:
- предоставления микроорганизма по настоящему изобретению,
- введения способами генетической инженерии в указанный микроорганизм по меньшей мере одной последовательности ДНК, кодирующей цитохром P450 эукариотического происхождения по настоящему изобретению, экзогенной последовательности ДНК, кодирующей Adx, и экзогенной последовательности ДНК, кодирующей AdR.
В конкретном варианте осуществления указанный способ включает цитохром P450 эукариотического происхождения, выбранный из группы, состоящей из CYP11A1, CYP17A1, CYP11B1, CYP21A1, CYP11B2, CYP3A4, CYP46A1, CYP27A1 и CYP21A2 (EC: 1.14.99.10).
В другом конкретном варианте осуществления указанный способ включает микроорганизм, содержащий функциональную систему эндогенных полимераз, способную образовывать полигидроксиалканоатные тельца, как описано в указанном выше разделе, озаглавленном "Генетически конструируемые микроорганизмы по изобретению".
В другом конкретном варианте осуществления указанный микроорганизм настоящего способа представляет собой Bacillus megaterium. В другом конкретном варианте осуществления указанный микроорганизм настоящего способа представляет собой штамм MS941 Bacillus megaterium.
В другом варианте осуществления способ по настоящему изобретению дополнительно содержит этап модулирования способами генетической инженерии в указанном микроорганизме экспрессии по меньшей мере одного гена, участвующего в образовании PHA-телец, как описано в указанном выше разделе, озаглавленном "Генетически конструируемые микроорганизмы по изобретению".
4. Способы повышения накопительной способности микроорганизма по изобретению
Неожиданно авторы изобретения обнаружили, что возможными является экспрессия и катализ биоконверсии субстратов из монооксигеназ цитохрома P450 эукариотического происхождения при высоких скоростях путем использования микроорганизма в качестве цельноклеточного катализатора и путем повышения накопительной способности в зависимости от полигидроксиалканоатных гранул.
Таким образом, дополнительный аспект изобретения относится к способу повышения накопительной способности микроорганизма в отношении гидрофобных или гидрофильных соединений, включающему этапы:
a. предоставления микроорганизма, содержащего функциональную систему эндогенных полимера, способных образовывать полигидроксиалканоатные тельца, как описано в указанных выше абзацах; и
b. модулирования способами генетической инженерии в указанном микроорганизме экспрессии по меньшей мере одного гена, участвующего в образовании PHA-телец, как описано в указанных выше абзацах,
таким образом, получая микроорганизм с повышенной накопительной способностью в отношении гидрофобных или гидрофильных соединений.
В конкретном варианте осуществления указанные гидрофобные соединения представляют собой:
- (i)холестерин, аналоги холестерина и его производные, и/или
- (ii) предшественники стероидных гормонов и их производные.
Таким образом, этот аспект изобретения также относится к способу увеличения накопительной способности микроорганизма в отношении (i) холестерина, аналога холестерина и его производных, и/или (ii) предшественников стероидных гормонов и их производных, включающему этапы:
a. предоставления микроорганизма, содержащего функциональную систему эндогенных полимераз, способную образовывать полигидроксиалканоатные тельца, как описано в указанных выше абзацах; и
b. модулирования способами генетической инженерии в указанном микроорганизме экспрессии по меньшей мере одного гена, участвующего в образовании PHA-телец, как описано в указанных выше абзацах,
таким образом, получая микроорганизм с повышенной накопительной способностью в отношении (i) холестерина, аналогов холестерина и его производных, и/или (ii) предшественников стероидных гормонов и их производных.
Активность указанной системы полимераз, способной образовывать полигидроксиалканоатные тельца по настоящему изобретению, можно измерять посредством окрашивания нильским красным или нильским синим и флуоресцентной микроскопии (Ostle A.G. and Holt J.G., 1982; Spierkemann P. et al., 1999; Der-Shyan S. et al., 2000), и как указано в примере 4.
В конкретном варианте осуществления указанная накопительная способность является пропорционально увеличенной относительно экспрессии гена полимеразы PhaC. Другими словами, введение экзогенной последовательности ДНК, кодирующей ген PhaC обеспечивает увеличение способности микроорганизма по настоящему изобретению запасать полигидроксиалканоаты в гранулах и увеличение способности указанного микроорганизма преобразовывать указанный субстрат в продукты. В качестве неограничивающего примера сверхэкспрессии экзогенного гена phaC в MS941Bacillus megaterium со сверхэкспрессией CYPA11 и его окислительно-восстановительных партнеров авторы изобретения повышали способность указанного генетически конструируемого микроорганизма преобразовывать холестерин, аналоги и производные холестерина в предшественники стероидных гормонов, гидроксилированные аналоги холестерина и секостероиды, как описано в примерах 3-5.
В другом конкретном варианте осуществления указанная накопительная способность является пропорционально повышенной относительно экспрессии гена PhaP. Другими словами, сверхэкспрессия экзогенной последовательности ДНК, кодирующей ген PhaP, обеспечивает увеличение способности микроорганизма по настоящему изобретению запасать полигидроксиалканоаты в гранулах и повышать способность указанного микроорганизма преобразовывать указанный субстрат в продукты.
В другом конкретном варианте осуществления указанная накопительная способность является пропорционально повышенной относительно экспрессии гена PhaA. Другими словами, сверхэкспрессия экзогенной последовательности ДНК, кодирующей ген PhaA, обеспечивает увеличение способности микроорганизма по настоящему изобретению запасать полигидроксиалканоаты в гранулах и увеличение способности указанного микроорганизма преобразовывать указанный субстрат в продукты.
В другом конкретном варианте осуществления указанная накопительная способность является пропорционально повышенной относительно подавления генов деполимеразы Pha (PhaZ, поли(3-гидроксиалкановая кислота)деполимеразы, PhaZ1, PhaZ2 и PhaZ3). Другими словами, нокаут генов деполимеразы Pha (PhaZ, поли(3-гидроксиалкановая кислота)деполимеразы, PhaZ1, PhaZ2 и PhaZ3) и подавление или снижение экспрессии белка(ов), кодируемых указанным геном(ами), обеспечивает увеличение способности микроорганизма по настоящему изобретению запасать полигидроксиалканоаты в гранулах и увеличение способности указанного микроорганизма преобразовывать указанный субстрат в продукты.
В другом конкретном варианте осуществления указанная накопительная способность является пропорционально повышенной относительно сопутствующей сверхэкспрессии PhaA (3-кетотиолазы), PhaB (ацетоацетил-CoA-редуктазы), PhaC (pha-синтазы) и PhaR (pha-синтазы). Другими словами, сверхэкспрессия экзогенных последовательностей ДНК, кодирующий гены PhaA, PhaB, PhaC и PhaR, обеспечивает увеличение способности микроорганизма по настоящему изобретению запасать полигидроксиалканоаты в гранулах и увеличение способности указанного микроорганизма преобразовывать указанный субстрат в продукты.
В другом конкретном варианте осуществления указанная накопительная способность является пропорционально повышенной относительно сопутствующей сверхэкспрессии PhaC (pha-синтазы) и PhaR (pha-синтазы) в качестве субъединиц того же класса IV pha-полимеразы. Другими словами, сверхэкспрессия экзогенных последовательностей ДНК, кодирующих гены PhaC и PhaR, обеспечивает увеличение способности микроорганизма по настоящему изобретению запасать полигидроксиалканоаты в гранулах и увеличение способности указанного микроорганизма преобразовывать указанный субстрат в продукты.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
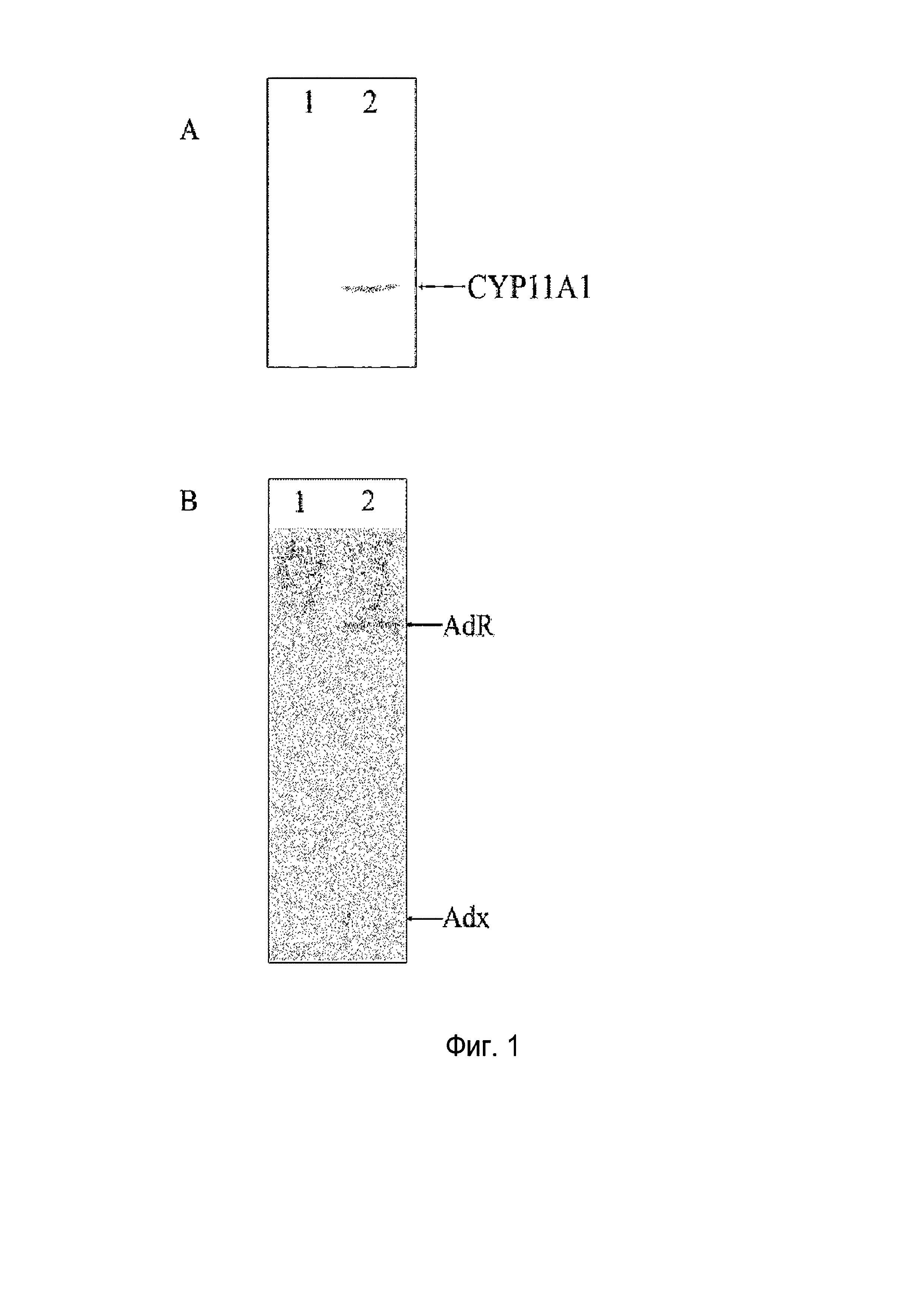
Фигура 1: Иммуноокрашивания CYP11A1 (A) и AdR/Adx (B); дорожка 1: штамм дикого типа B. megaterium MS941; дорожка 2: штамм B. megaterium MS941, трансформированный pSMF2.1_SCCAA.
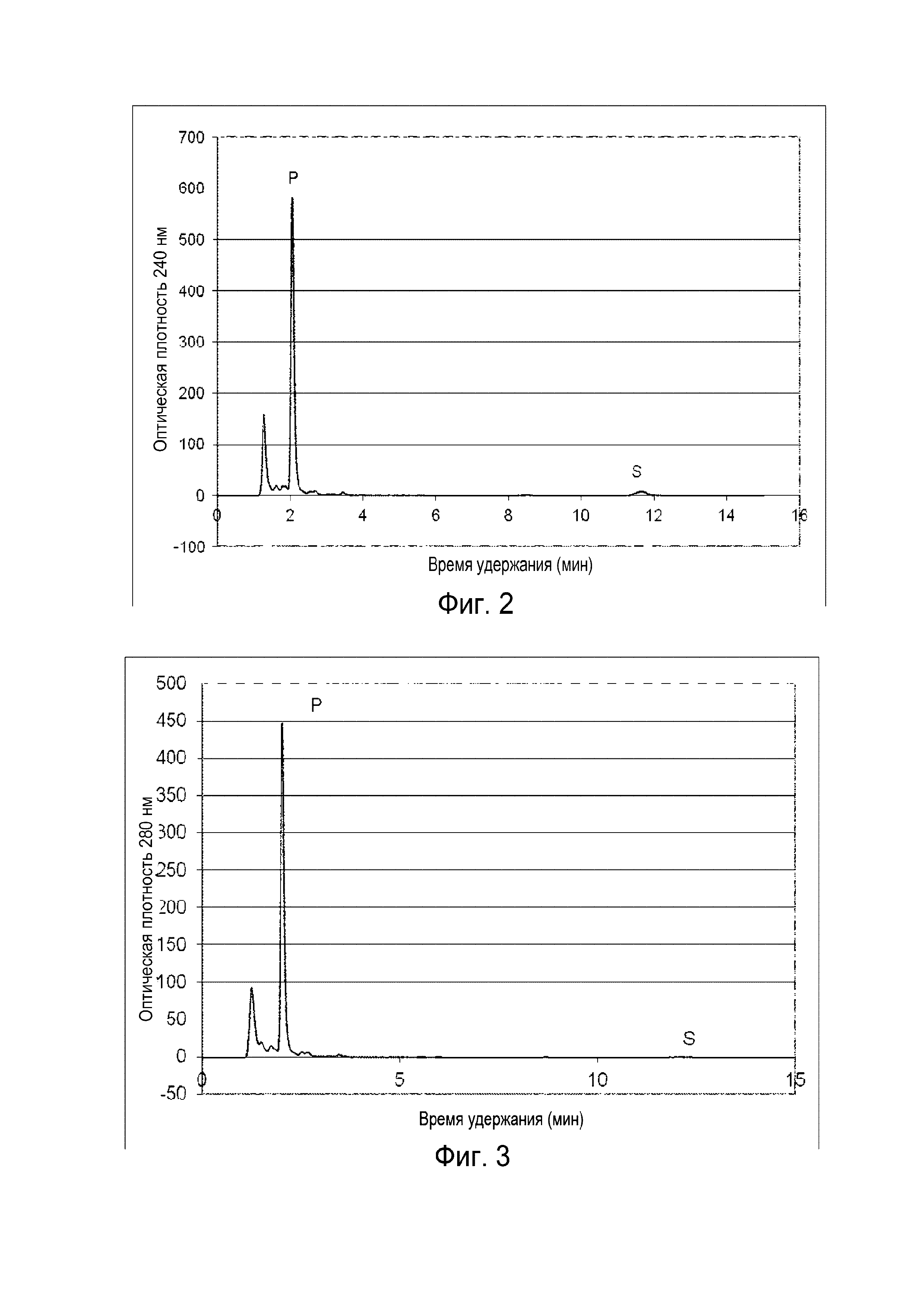
Фигура 2: Хроматограмма ВЭЖХ, демонстрирующая преобразование холестерина ("S" для субстрата) в прегненолон ("P" для продукта) штаммом B. megaterium MS941, трансформированным pSMF2.1_SCCAA.
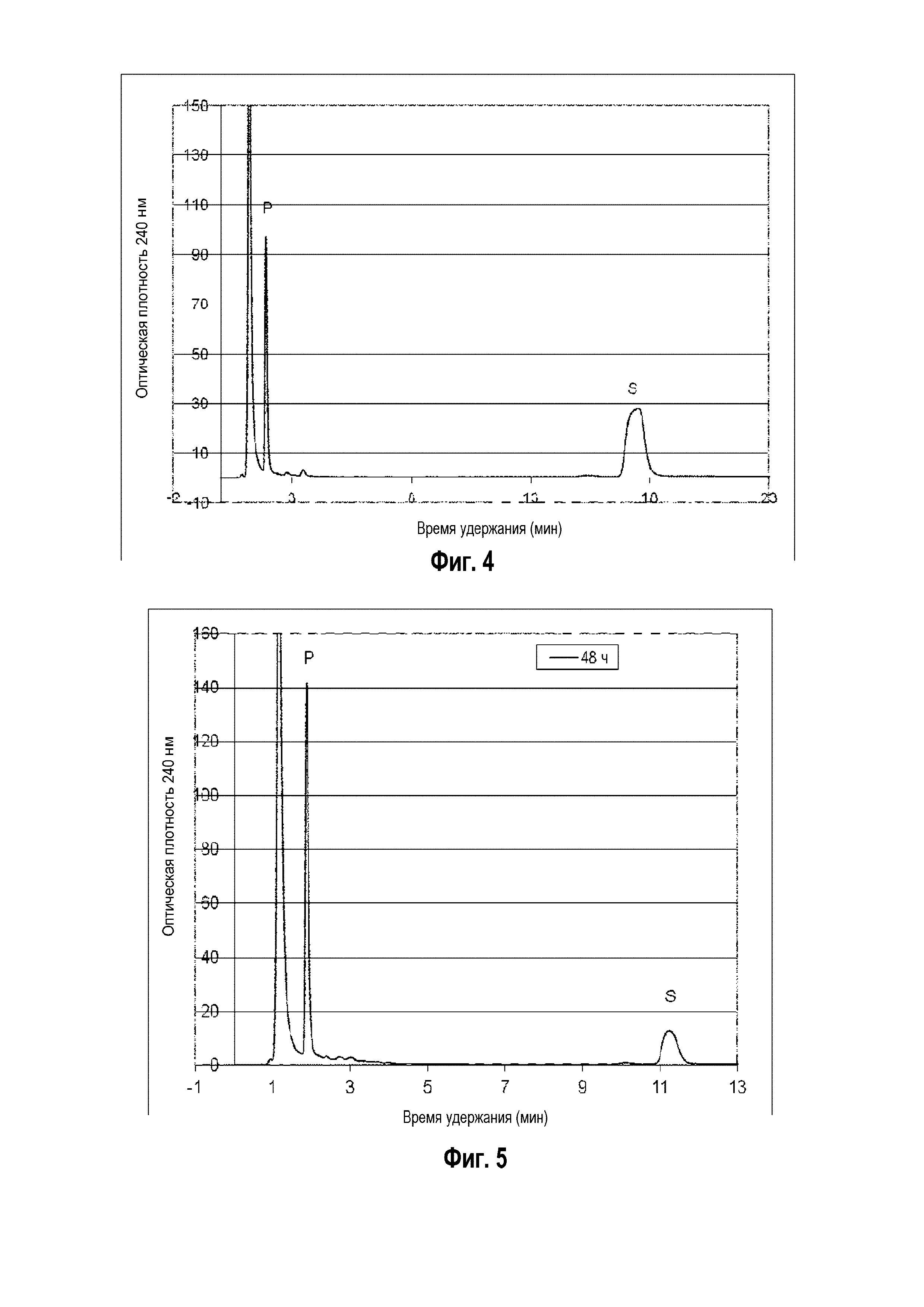
Фигура 3: Хроматограмма ВЭЖХ, демонстрирующая преобразование 7-дегидрохолестерина ("S" для субстрата) в 7-дегидропрегненолон ("P" для продукта) штаммом B. megaterium MS941, трансформированным pSMF2.1_SCCAA.
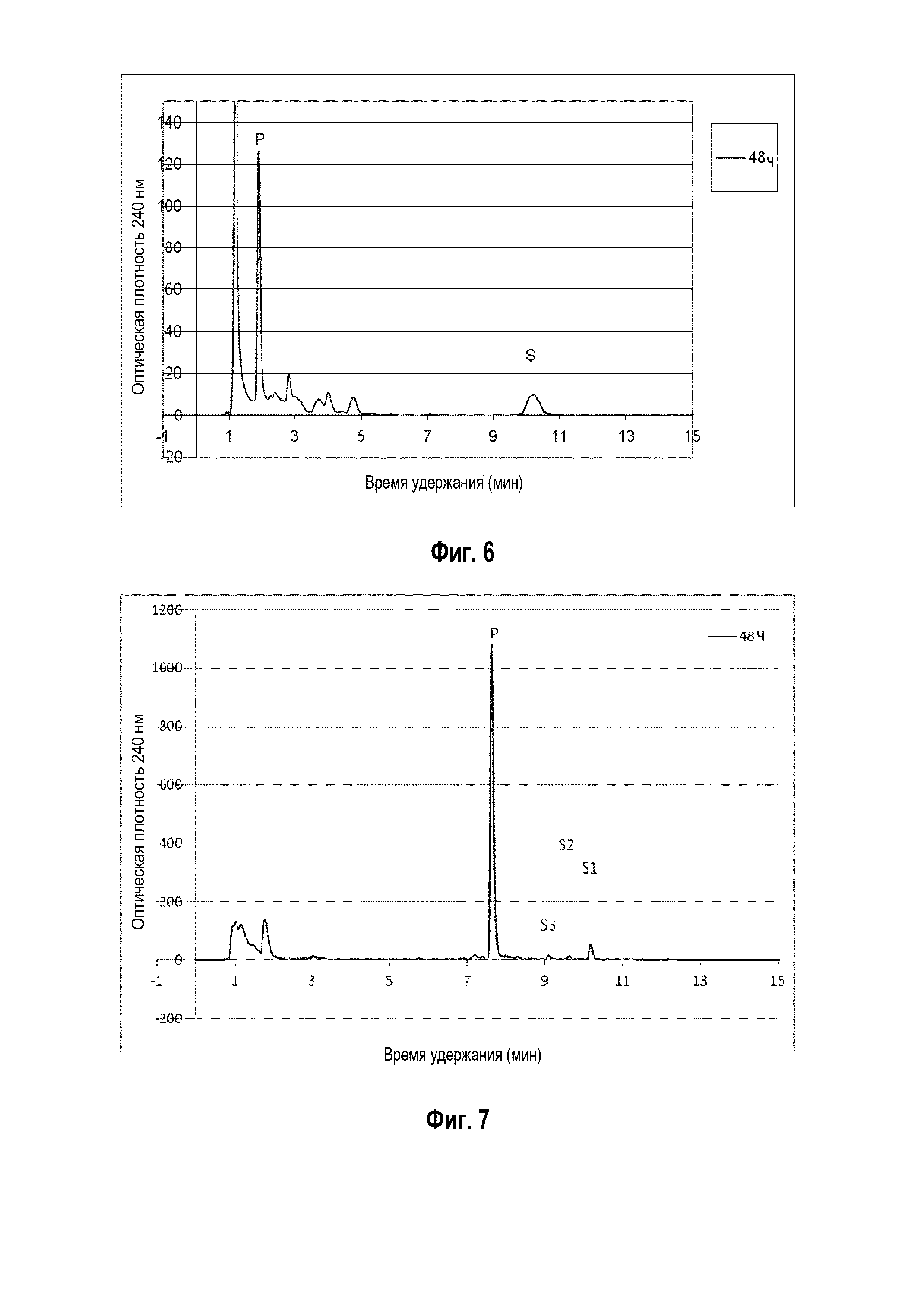
Фигура 4: Хроматограмма ВЭЖХ, демонстрирующая преобразование кампестерина ("S" для субстрата) в прегненолон ("P" для продукта) штаммом B. megaterium MS941, трансформированным pSMF2.1_SCCAA.
Фигура 5: Хроматограмма ВЭЖХ, демонстрирующая преобразование эргостадиенола ("S" для субстрата) в прегненолон ("P" для продукта) штаммом B. megaterium MS941, трансформированным pSMF2.1_SCCAA.
Фигура 6: Хроматограмма ВЭЖХ, демонстрирующая преобразование десмостерина ("S" для субстрата) в прегненолон ("P" для продукта) штаммом B. megaterium MS941, трансформированным pSMF2.1_SCCAA.
Фигура 7: Хроматограмма ВЭЖХ, демонстрирующая преобразование смеси оксистеролов ("S1", "S2" и "S3" для субстратов различных оскистеролов) в прегненолон ("P" для продукта) штаммом B. megaterium MS941, трансформированным pSMF2.1_SCCAA.
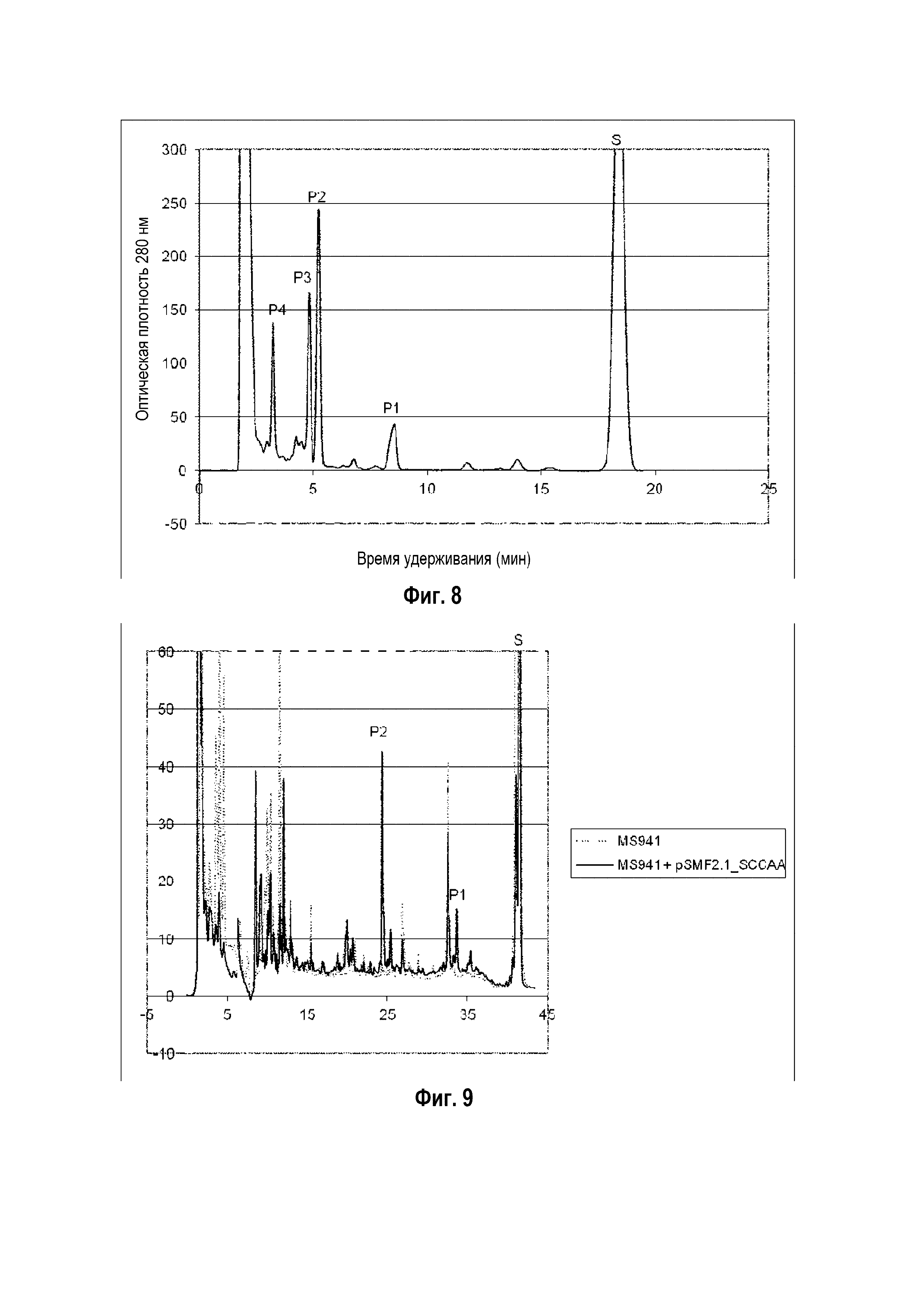
Фигура 8: Хроматограмма ВЭЖХ, демонстрирующая преобразование эргостерина ("S" для субстрата) в гидроксиэргостерин ("P1", "P2", "P3" и "P4" для различных гидроксилированных форм продуктов) штаммом B. megaterium MS941, трансформированным pSMF2.1_SCCAA.
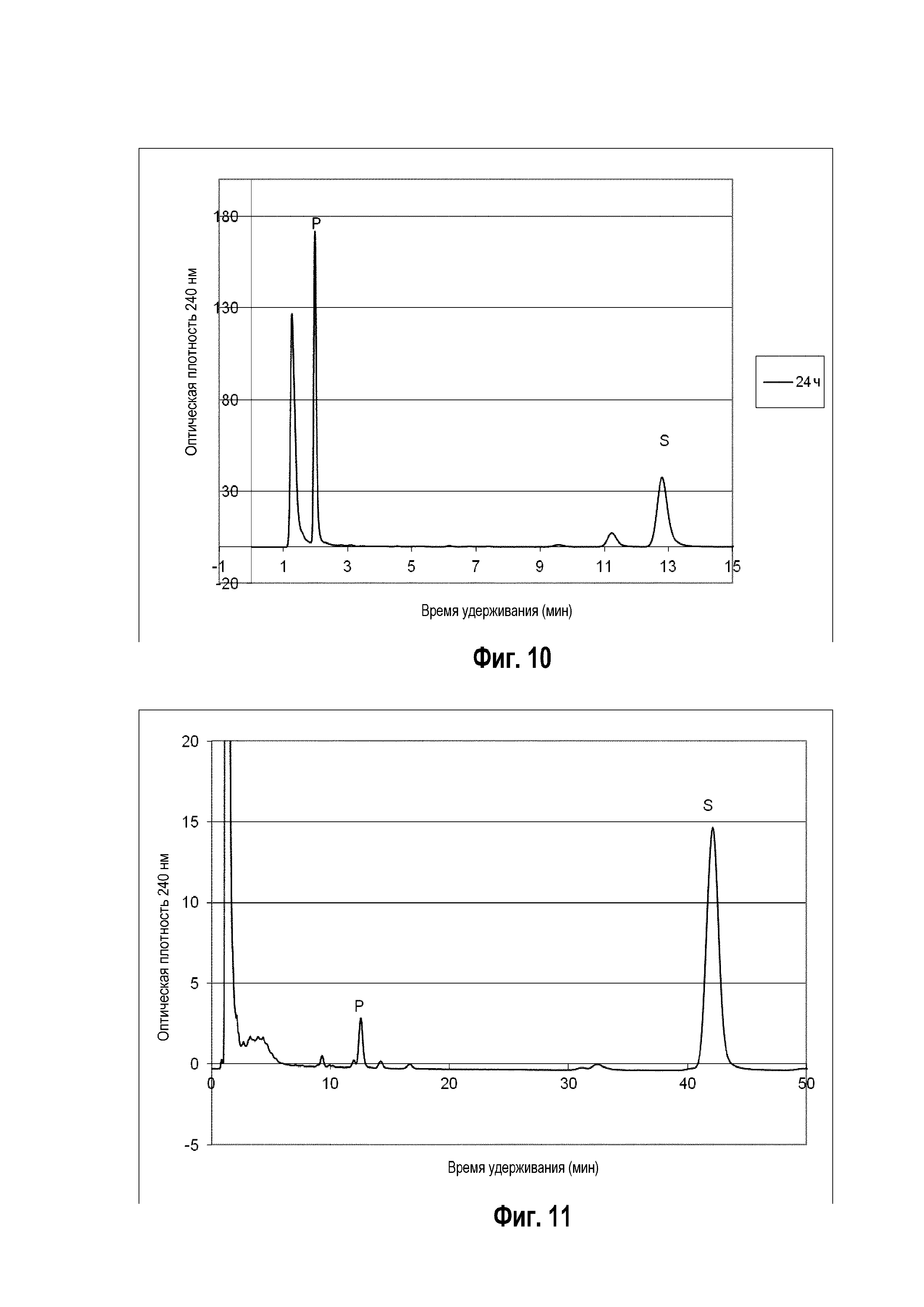
Фигура 9: Хроматограмма ВЭЖХ, демонстрирующая преобразование витамина D ("S" для субстрата) в гидроксивитамин D ("P1" и "P2" для различных форм гидроксивитамина Ds) штаммом B. megaterium MS941, трансформированным pSMF2.1_SCCAA (сплошная линия) в сравнении с B. megaterium MS941 (точечная линия).
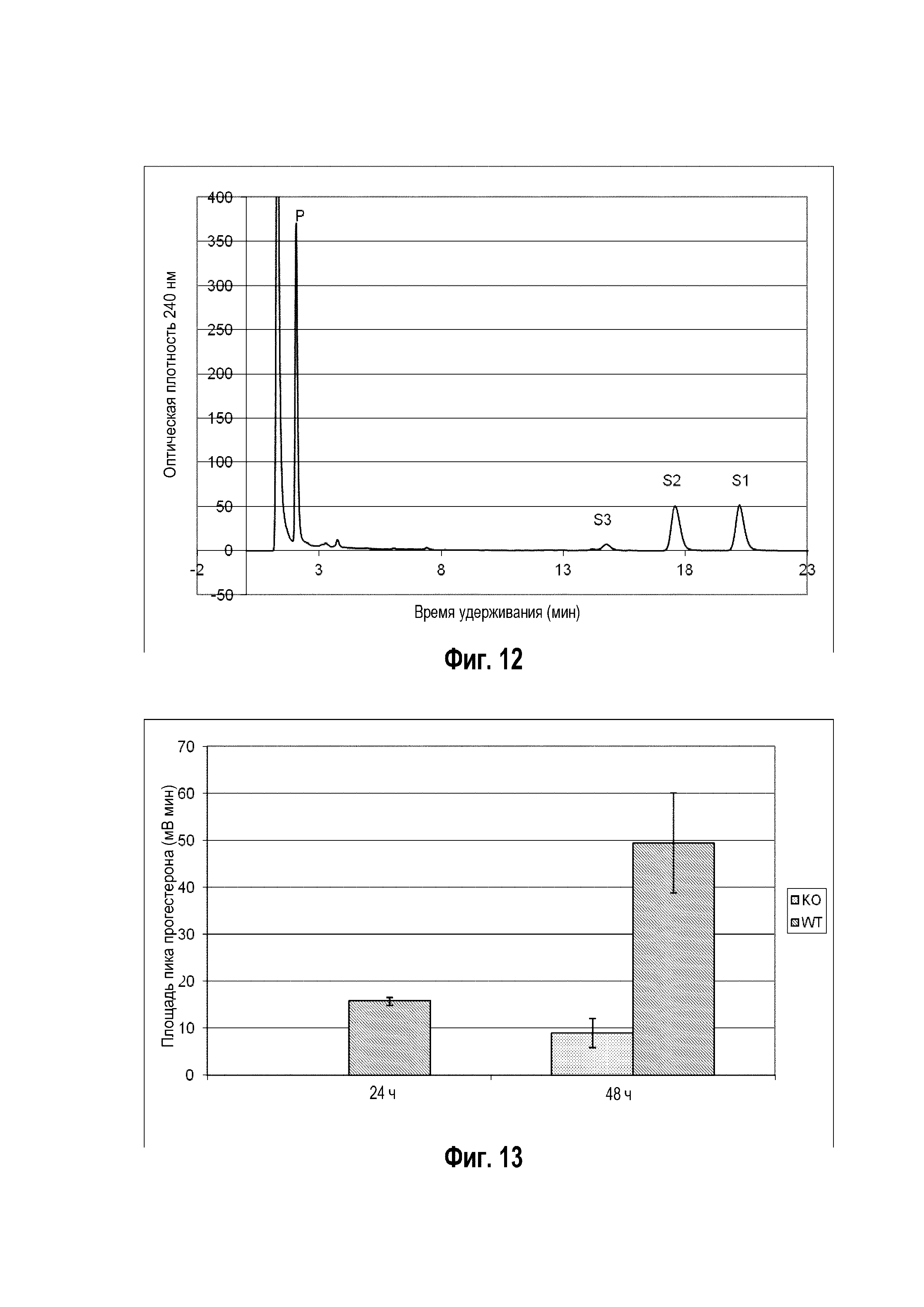
Фигура 10: Хроматограмма ВЭЖХ, демонстрирующая преобразование бета-ситостерина ("S" для субстрата) в прегненолон ("P" для продукта) штаммом B. megaterium MS941, трансформированным pSMF2.1_SCCAA.
Фигура 11: Хроматограмма ВЭЖХ, демонстрирующая преобразование стигмастерина ("S" для субстрата) в гидроксистигмастерин ("P" для продукта) штаммом B. megaterium MS941, трансформированным pSMF2.1_SCCAA.
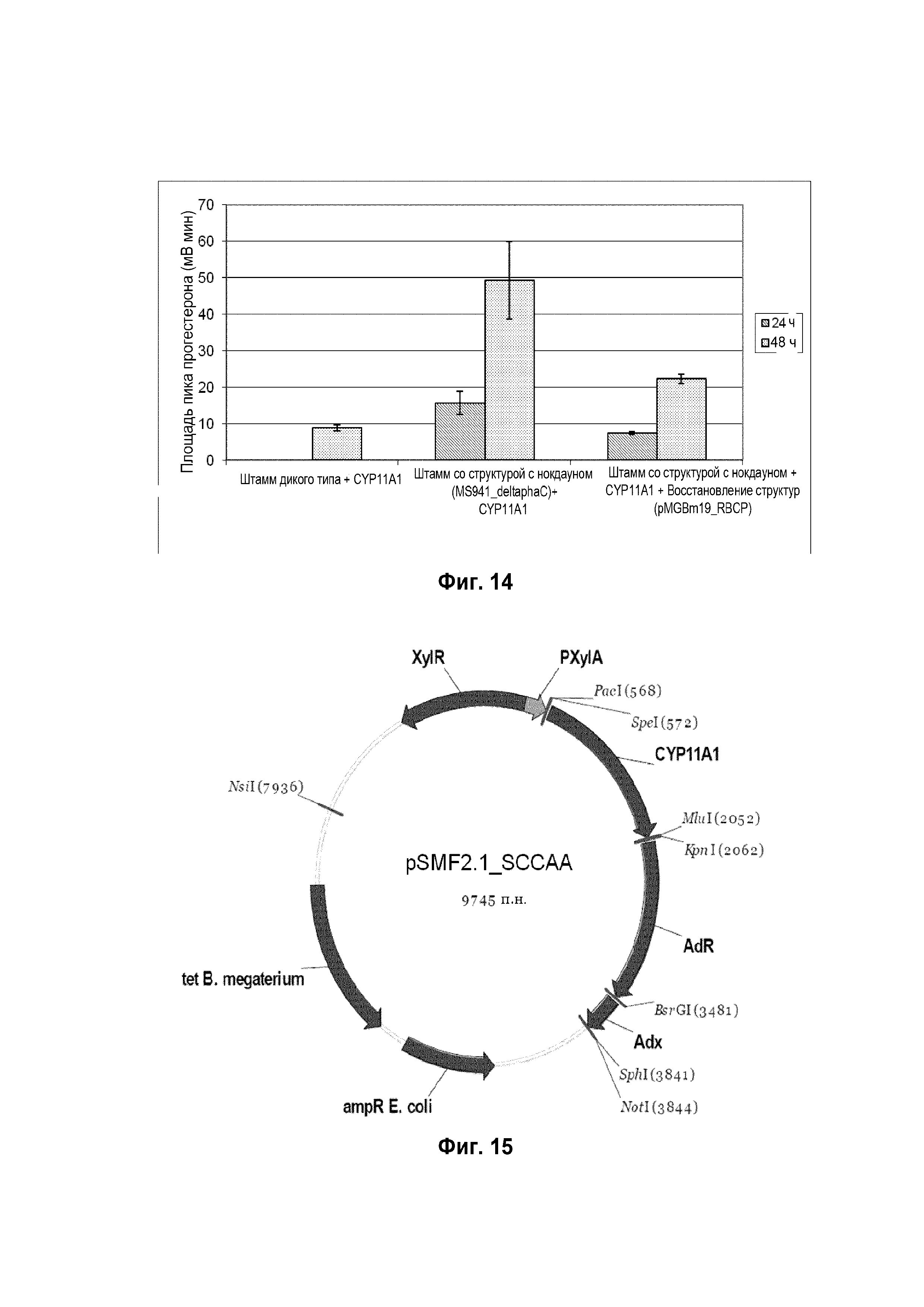
Фигура 12: Хроматограмма ВЭЖХ, демонстрирующая преобразование генерола 100 ("S1", "S2" и "S3" для трех различных стеролов, содержащихся в основном в 100) в прегненолон ("P" для продукта) штаммом B. megaterium MS941, трансформированным pSMF2.1_SCCAA.
Фигура 13: Сравнение активности in vivo CYP11A1 в отсутствие и в присутствии полигидроксибутиратных телец (KO: штамм B. megaterium MS941 с нокаутом по PhaC; WT: штамм B. megaterium MS941 дикого типа) через 24 и 48 часов реакции.
Фигура 14: Восстановление активности преобразования субстрата в штамме с недостаточностью PHB (MS941_deltaphaC), сверхэкспрессирующим CYP11A1 и его окислительно-восстановительные партнеры; сравнение активности in vivo CYP11A1 в отсутствие (структуры штамм с нокаутом (MS941_deltaphaC) + CYP11A1) и в присутствии полигидроксибутиратных телец (штамм дикого типа + CYP11A1) и в штамме, где тельца PHB восстанавливали трансформацией штамма плазмидой, кодирующей структурный оперон (структуру штамм с нокаутом (MS941_deltaphaC) +CYP11A1 + восстановление структур (pMGBm19_RBCP).
Фигура 15: Карта экспрессирующего вектора pSMF2.1_SCCAA.
Фигура 16: Сравнение выходов прегненолона, продуцируемого в различных микроорганизмах, экспрессирующих различный цитохром P450.
КРАТКОЕ ОПИСАНИЕ ПОСЛЕДОВАТЕЛЬНОСТЕЙ
SEQ ID NO: 1: Последовательность плазмиды pSMF2.1_SCCAA.
SEQ ID NO: 2: Аминокислотная последовательность CYP11A1.
SEQ ID NO: 3: Аминокислотная последовательность AdR.
SEQ ID NO: 4: Аминокислотная последовательность Adx.
ПРИМЕРЫ
ПРИМЕР 1: Конструкция экспрессирующей плазмиды B. megaterium pSMF2.1_SCCAA
Для клонирования соответствующих генов использовали следующие ниже ферменты рестрикции:
- CYP11A1: SpeI/MluI
- AdR: KpnI/SacI
- Adx: BsRGI/SphI
Плазмиду pSMF2.1_SCCAA получают из челночного вектора pKMBm4 Bacillus megaterium (полученного от группы профессора Dr. Dieter Jahn, TU Braunschweig, Stammen S. et al., (2010)). pKMBm4 модифицировали, как описано ниже:
A) участок рестрикции PacI удаляли посредством мутагенеза,
B) вводили новый участок множественного клонирования (Bleif et al., 2012)
C) вводили фрагменты, кодирующие адренодоксин, адренодоксинредуктаза и CYP11A1.
Все три гена находятся под контролем сильного индуцибельного промотора PXylA. Каждый ген содержит свой собственный участок связывания рибосомы.
В E. coli экспрессируют бета-лактамазу, обеспечивающую устойчивость к ампициллину.
В B. megaterium экспрессируют белок устойчивости к тетрациклину, обеспечивающий устойчивость к тетрациклину.
Карта плазмиды и последовательность pSMF2.1_SCCAA соответственно приведены на фигуре 15 и SEQ ID NO: 1.
Штамм MS941 Bacillus megaterium получали от группы D. Jahn/Technische
Клетки B. megaterium трансформировали опосредованной PEG трансформацией протопластов по Barg H. et al., (2005).
ПРИМЕР 2: Условия культивирования рекомбинантного B. megaterium и обработка образцов
Для культивирования B. megaterium использовали среды LB (25 г/л), TB (24 г/л дрожжевого экстракта, 12 г/л триптона, 0,4% глицерина, 10 мМ буфера фосфата калия) или таблетированную среду EnPresso™. Все реагенты приведены в таблице 1 ниже.
Предварительная культура
Проводили инокуляцию 50 мл среды, содержащей 10 мкг/мл тетрациклина, клетками из планшета или исходного раствора в глицерине.
Основная культура
Проводили инокуляцию 50 мл среды, содержащей 10 мкг/мл тетрациклина, 500 мкл образца предварительной культуры.
Индукция экспрессии белка
Основную культуру выращивали до тех пор, пока она не достигала оптической плотности ~0,4. Экспрессию белка индуцировали после добавления o 0,25 г ксилозы, растворенной в 1 мл дистиллированной воды.
Солюбилизация субстрата
Стероиды растворяли в 45% растворе 2-гидроксипропил-β-циклодекстрина/4% растворе сапонина Quillaja. Добавляли 2,5 мл раствора к культуре непосредственно после индукции белка, с получением конечной концентрации сапонина Quillaja 0,2% и конечной концентрации 2-гидроксипропил-β-циклодекстрина 2,25%.
Обработка образца для анализа ВЭЖХ
Стероиды без собственного поглощения преобразовывали в их Δ4-3-кето-производные для обеспечения фотометрической детекции при 240 нм.
1 мл образцов культуры кипятили в воде в течение 1 минуты. Добавляли 20 мкл раствора холестериноксидазы (5 мг холестериноксидаза и 5 мг холата Na, растворенного в 5 мл 50 мМ буфера HEPES pH 7, содержащего 0,05% Tween-20) и инкубировали образец при 37°C при встряхивании 1000 об/мин. в течение 1 часа. Для анализа ВЭЖХ образец экстрагировали два раза 1 мл этилацетата и растворяли экстракт в соответствующем растворителе.
ПРИМЕР 3: Преобразование холестерина, аналогов и производных холестерина в прегненолон генетически конструированным B. megaterium MS941, экспрессирующим CYP11A1 крупного рогатого скота и его окислительно-восстановительные партнеры Adx и AdR.
Штамм MS941 Bacillus megaterium генетически модифицировали для экспрессии стероидогенного фермента CYP11A1 и его окислительно-восстановительных партнеров Adx и AdR. B. megaterium трансформировали экспрессирующим вектором pSMF2.1_SCCAA (фигура 1), содержащим гены CYP11A1, AdR и Adx под контролем сильного индуцибельного промотора PXylA, как описано в примере 1, и кодирующего соответственно белки SEQ ID NO: 2, SEQ ID NO: 3 и SEQ ID NO: 4. До настоящего времени митохондриальный цитохром P450 CYP11A1 не экспрессировали в Bacillus megaterium.
Экспрессию всех трех белков подтверждали иммуноокрашиванием (фигура 1).
Следующие ниже субстраты солюбилизировали 2-гидроксипропил-β-циклодекстрином и сапонином Quillaja и преобразовывали in vivo указанным выше рекомбинантным штаммом: холестерин, 7-дегидрохолестерин, кампестерин, эргоста-5,24-диенол, десмостерин, смесь оксистеролов, эргостерин, витамин D, бета-ситостерин, стигмастерина, генерол. (фигуры 2-12).
В заключение эта система обеспечивает цельноклеточный биокатализ гидрофобных стероидов холестерина, его аналогов растительного происхождения и витамина D и обладает способностью поглощать высокие концентрации соединений с очень низкой растворимостью в воде и преобразовывать их с высокими скоростями. Выход продукта этой системы является лучше по сравнению с другими системами, продуцирующими прегненолон (фигура 16).
ПРИМЕР 4: Роль полигидроксибутиратных телец (PHB-телец) в преобразовании холестерина, аналогов и производных холестерина в прегненолон генетически конструируемым B. megaterium MS941, экспрессирующим CYP11A1 крупного рогатого скота и его окислительно-восстановительные партнеры Adx и AdR.
Было показано, что флуоресцентный аналог холестерина холестерин 25-NBD локализуется в запас углерода, служащий PHB-тельцами в живых клетках B. megaterium (данные не показаны). Для локализации CYP11A1 в клетках B. megaterium слитый белок экспрессировали в живых клетках B. megaterium, содержащих флуоресцентный белок eGFP и CYP11A1. Аналогично холестерину 25-NBD CYP11A1eGFP локализовался в PHB-тельцах, идентичность которых подтверждали окрашиванием нильским красным (данные не показаны).
Из генома B. megaterium удаляли продуцирующую PHB-тельца полимеразу PhaC гомологичной рекомбинацией. В кратком изложении, конструировали кассету для делеции, состоящую из фланкирующих областей гена PhaC. Эту конструкцию клонировали в плазмиду, содержащую термочувствительный участок начала репликации. После двух событий гомологичной рекомбинации получали элиминацию плазмида инкубацией при непермиссивной температуре репликации. Делецию гена подтверждали ПЦР. Для подтверждения роли PHB-телец в агрегации CYP11A1 и запасе субстрата мониторинг получаемого отсутствия PHB-телец в клетках B. megaterium проводили путем окрашивания нильским красным (данные не показаны). Это морфологическое изменение приводило к существенному снижению активности цельноклеточного преобразования штамма с нокаутом по PhaC, трансформированного pSMF2.1_SCCAA (фигура 13).
ПРИМЕР 5: Модуляция полигидроксибутиратных телец (PHB-телец) в генетически конструируемом штамме B. megaterium MS941, экспрессирующем CYP11A1 крупного рогатого скота и его окислительно-восстановительные партнеры Adx и AdR
a - Преобразование холестерина, аналогов и производных холестерина в прегненолон
Активность преобразования субстрата штамма, экспрессирующего структуру с недостаточностью CYP11A1, восстанавливали трансформацией плазмидой, кодирующей структурный оперон генов PhaR, PhaB, PhaC и PhaP под контролем исходного промотора генов PhaR, PhaB и PhaC (плазмида pMGBm19_RBCP, фигура 14).Для дополненного штамма демонстрировали увеличение выхода продукта более чем на 100% через 48 часов по сравнению со штаммом с удаленной структурой. Активность преобразования все еще являлась значительно ниже по сравнению со штаммом дикого типа, т.к. рекомбинантная экспрессия структурного оперона, по-видимому, приводила к сниженной экспрессии CYP11A1 и его окислительно-восстановительных партнеров (вследствие совместной экспрессии дополнительных белков).
Эти данные убедительно иллюстрируют важную роль структур гранул для цельноклеточной системы.
b - Накопительная способность Bacillus megaterium MS941 модуляцией генов системы Pha
Применяли следующие ниже стратегии:
1) Получают сверхэкспрессию гена фазина (в случае phaP Bacillus megaterium) для модификации размера гранул. Ген фазина встраивают в вектор под контролем индуцибельного промотора ксилозы. Трансформируют Bacillus megaterium получаемой плазмидой. Эффективность преобразования субстрата в продукт в штамме, свехэкспрессирующем phaP, измеряют, как описано в примере 2 и на фигурах 2-12.
2) Получают нокаут гена деполимеразы Pha для затруднения деполимеризации гранул. Локусы генома деполимеразы Pha амплифицируют посредством ПЦР введением делеций локусов, что приводит к нефункциональному гену. Этот нефункциональный фрагмент ДНК вводят в вектор-"нокаут" для замены исходного геномного функционального гена нефункциональным геном в эксперименте замены гена. Эффективность преобразования субстрата в продукт в штамме с нокаутом по гену деполимеразы измеряют, как описано в примере 2 и на фигурах 2-12.
3) Метаболизм Bacillus megaterium конструируют для продукции ацетил-CoA, основного предшественника метаболизма для продукции гранул, введением гена 3-кетотиолазы (phaA) в вектор под контролем индуцибельного промотора ксилозы. Трансформируют Bacillus megaterium получаемой плазмидой. Эффективность преобразования субстрата в продукт в штамме со сверхэкспрессией phaA, измеряют, как описано в примере 2 и на фигурах 2-12.
4) Гены, участвующие в синтезе гранул (3-кетотиолазы (phaA), ацетоацетил-CoA-редуктазы (phaB), фазина (phaP) и pha-синтазы (phaC/phaR), являются сверхэкспрессированными. Указанные выше гены вводят в вектор под контролем индуцибельного промотора ксилозы. Трансформируют Bacillus megaterium получаемой плазмидой. Эффективность преобразования субстрата в продукт в the штамме со сверхэкспрессией phaA, phaB, phaP, phaC и phaR, измеряют, как описано в примере 2 и на фигурах 2-12.
5) Более активные синтазы pha из других организмов вводят в штамм MS941 Bacillus megaterium для продукции большего количества полимера. Используют гены Pha из Ralstonia eutropha, Pseudomonas aeruginosa и Allochromatium vinosum. Экзогенные гены pha-синтазы вводят ввектор под контролем индуцибельного промотора ксилозы. Трансформируют Bacillus megaterium с получением плазмиды. Эффективность преобразования субстрата в продукт в штамме со сверхэкспрессией pha-синтазы(з) из других микроорганизмов измеряют, как описано в примере 2 и на фигурах 2-12.
ССЫЛКИ
Barg H, Malten M, Jahn M and Jahn D. 2005. Protein and vitamin production in Bacillus megaterium. In: J. L. Barredo (Eds). Microbial Processes and Products. Humana Press Inc., Totowa, 165-184.
Bernhardt R. 1996. Cytochrome P450: structure, function, and generation of reactive oxygen species. Rev Physiol Biochem Pharmacol. 127:137-221.
Bernhardt R. 2006. Cytochromes P450 as versatile biocatalysts. J Biotechnol. Jun 25;124(1):128-45.
Bleif S, Hannemann F, Zapp J, Hartmann D, Jauch J, Bernhardt R. 2012. A new Bacillus megaterium whole-cell catalyst for the hydroxylation of the pentacyclic triterpene 11-keto-beta-boswellic acid (KBA) based on a recombinant cytochrome P450 system. Appl Microbiol Biotechnol. 93: 1135-1146.
Der-Shvan S1, Yun-Ting W1, Chia-Yin L1. 2000. Rapid detection of polyhydroxyalkanoate-accumulating bacteria isolated from the environment by colony PCR. Microbiology, Aug. 2000, vol. 146, No. 8: 2109-2025.
Ewen K.M., Schiffler B., Uhlmann-Schiffler H., Bernhardt R., Hannemann F. (2008) The endogenous adrenodoxin reductase-like flavoprotein arh1 supports heterologous cytochrome P450-dependent substrate conversions in Schizosaccharomyces pombe. FEMS Yeast Res. 8: 432-41.
Jingwen Z. Hua L., Guocheng D., Jianghua L. and Jian C. (2012) Production of alpha-Cyclodextrin Glycosyltransferase in Bacillus megaterium MS941 by Systematic Codon Usage Optimization. Journal of Agricultural and Food Chemistry 60, 10285-10292.
Liebergesell, M.; Sonomoto, K.; Madkour, M.; Mayer, F.; Steinbuchel, A. 1994. Eur. J. Biochem. 226, 71-80.
Maurer SC, Schulze H, Schmid RD, Urlacher V. 2003. Immobilisation of P450 BM-3 and an NADP+ Cofactor Recycling System: Towards a Technical Application of Heme-Containing Monooxygenases in Fine Chemical Synthesis. Advanced synthesis and catalysis, vol. 345: 802-810.
Nguyen MN, Slominski A, Li W, Ng YR, Tuckey RC. 2009. Metabolism of vitamin d2 to 17,20,24-trihydroxyvitamin d2 by cytochrome p450scc (CYP11A1). Drug Metab Dispos. 2009 Apr; 37(4):761-7.
Ostle AG and Holt JG. 1982. Appl. Environ. Microbiol. July, vol. 44 no. 1: 238-241.
Slominski A, Semak I, Zjawiony J, Wortsman J, Gandy MN, Li J, Zbytek B, Li W, Tuckey RC. 2005. Enzymatic metabolism of ergosterol by cytochrome p450scc to biologically active 17alpha,24-dihydroxyergosterol. 12: 931-939.
Sakamoto, T. 2011. STEROL SIDE CHAIN-CLEAVING ENZYME PROTEIN AND USE THEREOF. European Patent. EP EP 2 386 634 A1.
Spiekermann P, Rehm BH, Kalscheuer R, Baumeister D,
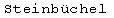
Stammen S, Muller BK, Korneli C, Biedendieck R, Gamer M, Franco-Lara E, Jahn D. 2010. High-yield intra- and extracellular protein production using Bacillus megaterium. Appl Environ Microbiol. 76: 4037-4046.
Stubbe J, Tian J. 2003. Polyhydroxyalkanoate (PHA) homeostasis: The role of PHA synthase. Nat Prod Rep. 20:445-457.
Sudesh K, Abe H, Doi Y. 2000. Synthesis, structure, and properties of polyhydroxyalkanoates: Biological polyesters. Prog Polym Sci. 25:1503-1555.
Szczebara FM, Chandelier C, Villeret C, Masurel A, Bourot S, Duport C, Blanchard S, Groisillier A, Testet E, Costaglioli P, Cauet G, Degryse E, Balbuena D, Winter J, Achstetter T, Spagnoli R, Pompon D, Dumas B. 2003. Nat Biotechnol. 21: 143 - 149.
Tuckey RC, Cameron KJ. 1993. Side-chain specificities of human and bovine cytochromes P-450scc. Eur J Biochem. Oct 1;217(1):209-15.
Tuckey RC, Nguyen MN, Slominski A. 2008. Kinetics of vitamin D3 metabolism by cytochrome P450scc (CYP11A1) in phospholipid vesicles and cyclodextrin. Int J Biochem Cell Biol. 40(11) 2008 May 20.
Tuckey RC, Li W, Shehabi HZ, Janjetovic Z, Nguyen MN, Kim TK, Chen J, Howell DE, Benson HA, Sweatman T, Baldisseri DM, Slominski A. 2011. Production of 22-hydroxy metabolites of vitamin d3 by cytochrome p450scc (CYP11A1) and analysis of their biological activities on skin cells. Drug Metab Dispos. 39:1577-1588.
Tuckey RC, Nguyen MN, Chen J, Slominski AT, Baldisseri DM, Tieu EW, Zjawiony JK, Li W. 2012. Human cytochrome P450scc (CYP11A1) catalyzes epoxide formation with ergosterol. Drug Metab Dispos. Mar; 40(3):436-44.
Urlacher V.B. and Girhard M. 2011. Cytochrome P450 monooxygenases: an update on perspectives for synthetic application. Trends in Biotechnology. Jan, 2012; vol 30, N°1: 26-36.
Van Bogaert, I.N. Groeneboer S, Saerens K, Soetaert W. 2011. The role of cytochrome monooxygenases in microbial fatty acid metabolism. FEBS J., 278 (2), 206-221.
Wang F, Lee SY. 1997. Production of poly(3-hydroxybutyrate) by fed-batch culture of filamentation-suppressed recombinant Escherichia coli. Appl Environ Microbiol. 63: 4765-4769.
Wittchen KD, Meinhardt F. 1995. Inactivation of the major extracellular protease from Bacillus megaterium DSM319 by gene replacement. Appl Microbiol Biotechnol. 42: 871-877.
Реферат
Группа изобретений относится к области биотехнологии. Предложен генетически конструируемый микроорганизм, способный преобразовывать холестерин, аналоги и производные холестерина в предшественники стероидных гормонов, где указанный микроорганизм содержит по меньшей мере одну последовательность ДНК, кодирующую цитохром P450 эукариотического происхождения, экзогенную последовательность ДНК, кодирующую Adx, и экзогенную последовательность ДНК, кодирующую AdR, и где указанный микроорганизм представляет собой. Предложен способ получения предшественников стероидных гормонов с использованием указанного микроорганизма. Предложен способ получения рекомбинантных штаммов микроорганизма, которые являются улучшенными в отношении преобразования холестерина, аналогов и производных холестерина в предшественники стероидных гормонов. Группа изобретений позволяет увеличить выход предшественников стероидных гормонов по сравнению с другими системами, продуцирующими указанный продукт. 3 н. и 11 з.п. ф-лы, 16 ил., 1 табл., 5 пр.

Комментарии