Ингибирующий раствор и способ подавления боли, воспаления или спазма - RU2180852C2
Код документа: RU2180852C2
Чертежи



























Описание
Изобретение относится к растворам для хирургического орошения и способам их применения и конкретно к противовоспалительным, противоболевым и противосудорожным растворам для хирургического орошения.
Артроскопия представляет хирургическую процедуру, в которой камеру, присоединенную к дистанционному источнику света и видеомонитору, вводят в анатомический сустав (например, коленный, плечевой и т.д.) через небольшой портальный разрез в вышележащей кожной или суставной капсуле. Через аналогичные портальные разрезы хирургические инструменты могут быть помещены в сустав, где их использование направляется за счет артроскопической визуализации. Так как артроскопическое мастерство включает улучшенное, увеличенное количество оперативных процедур, однажды выполненных "открытой" хирургической техникой, может теперь сопровождаться артроскопически. Такие процедуры включают, например, менискэктомию и реконструкции связки в колене, плечевых акромиопластий и очищений раны манжета повора плеча и локтевой синовэктомии. В результате, расширенные хирургические показания и развитие артроскопов небольшого диаметра, артроскопов кисти и колена также стали рутинными.
В процессе каждой артроскопии физиологическая орошающая жидкость (например, нормальный солевой раствор или лактированный раствор Рингера) непрерывно промывается через сустав, раздувая суставную капсулу и удаляя оперативный шлам, обеспечивая тем самым более четкую внутрисуставную визуализацию. Патент США 4505493 Marshall раскрывает изомолярный раствор глицерина в воде для непроводящего и оптически чистого орошающего раствора для артроскопии.
Орошение также используется в других процедурах, таких как внутрисосудистая диагностика, и терапевтических процедурах, урологических процедурах и обработке ожогов и любых оперативных ран. В каждом случае используется физиологическая жидкость для орошения раны или полости в органе или проходе. Обычные физиологические орошающие жидкости не обеспечивают болеутоляющего или противовоспалительного действия.
Облегчение боли и страдания у послеоперационных пациентов является сферой специального внимания в клинической медицине, особенно в свете растущего количества операций амбулаторных больных, проводимых каждый год. Наиболее широко используемые агенты, ингибиторы циклооксигеназы (например, ибупрофен) и синтетические наркотические препараты (например, морфин, фентанил) оказывают значительные побочные эффекты, включающие гастроинтестинальное раздражение/кровотечение и респираторную депрессию. Сильное распространение тошноты и рвоты, связанной с наркотическими препаратами является особенно проблематичным в послеоперационный период. Терапевтические агенты, предназначенные для лечения послеоперационной боли, избегающие в то же время вредных побочных эффектов, не являются легко разрабатываемыми, потому что молекулярные мишени для этих агентов широко распределяются по всему телу и опосредуют разнообразные физиологические действия. Несмотря на значительную клиническую необходимость в подавлении боли и воспаления, а также вазоспазм и спазма гладкой мышцы, способы для освобождения от боли, воспаления и подавления спазма при эффективных дозах, в то же время с минимальными вредными систематическими побочными эффектами не разработаны. В качестве примера, обычные (т. е. внутривенные, оральные или внутримышечные) способы введения опиатных агонистов в терапевтических дозах часто связываются со значительными вредными побочными эффектами, включающими тяжелую респираторную депрессию, изменения по отношению к усталости и психическому расстройству и сильную тошноту и рвоту.
Прежние исследования продемонстрировали способность эндогенных агентов, таких как серотонин (5-гидрокситриптамин, на который иногда ссылаются как на "5-НТ"), брадикинин и гистамин продуцировать боль и воспаление. Sicutery, F. , et al. , Serotonin-Bradykinin Potentiation in the Pain Receptors in Man, Life Sci., 4, pp. 309-316 (1965), Rosenthal, S.R., Histamine as the Chemical Mediator for Cutaneous Pain, J. Invest. Dermat. 69, pp. 98-105 (1977), Richardson, В. Р. , et al., Identification of serotonin M-Receptor Subtypes and their Specific Blockade by a New Class of Drugs, Nature 316, pp. 126-131 (1985), Whalley, E.T., et al., The effect of Kinin Agonists and Antagonists, Naunyn-Schmiedeb Arch. Pharmacjl. 36, pp. 652-57 (1987), Lang, E. et al., Chemo-Sensitivity of Fine Afferents from Rat Skin in Vitro, J. Neurophysiol. 63, pp. 887-901 (1990).
Например, было продемонстрировано, что 5-НТ, примененный в случае обработки основания волдыря человека (оголенной кожи) вызывал боль, которую можно было подавить 5-НТ3 антагонистами рецептора, Richardson et al., 1985. Подобным же образом, периферийно-примененный брадикинин продуцировал боль, которую можно было блокировать брадикиновыми антагонистами рецептора. Sicutery, et al., 1965, Whalley, et al., 1987, Dray A. et al., Bradykinin and Inflammatory Pain, Trends Neurosci. 16, pp. 99-104 (1993). Периферийно-примененный гистамин продуцировал вазодилатацию, зуд и боль, которые могли быть подавлены антагонистами рецептора гистамина. Rosenthal, 1997, Douglas, W. W., "Histamine and 5-Hydroxytryptamin (Serotonin) and their Antagonists", in Goodman, L.S., et al., ed. The Pharmacol, ogical Basis of Theraupeutics, Mac Millan Publishing Company, New York, pp. 6050638 (1985), Rumore, M.M. et al. , Analgesic Effects of Antihistaminics, Life Sci., 36, pp. 403-416 (1985). Было продемонстрировано, что комбинации этих трех агонистов (5-НТ, брадикинина и гистамина) примененных вместе обнаруживают эффект, вызванный синергетической болью, продуцирующий продолжительный и интенсивный болевой сигнал. Sicutery, et al., 1965, Richardson et al., 1985, Kessler, W. et al., Excitation of cutaneous Afferent Nerve Endings in Vitro by a Combination of Inflammatory Mediators and Conditioning Effect of Substance P., Exp. Brain Res. 91, pp. 467-476 (1992).
В организме 5-НТ располагается в тромбоцитах и центральных нейронах, гистидин находится в клетках молочной железы, а брадикинин продуцируется из молекулы предшественника большего размера в процессе травмы ткани, изменений рН, изменений температуры и т. д. Так как 5-НТ может быть высвобожден в больших количествах из тробмоцитов в участках поврежденной ткани, имеет место продуцирование уровней плазмы, в 20 раз превышающих уровни в спокойном состоянии (Ashton, J. H., et al., Serotonin as Mediator of Cyclic Flow Variations in Stenosed Canine Coronary Arteries, Circulation 73, pp. 572-578 (1986), возможно, что эндогенный 5-НТ играет роль в продуцировании послеоперационной боли, гиперальгезии и воспалении. Фактически, было показано, что активированные тромбоциты возбуждают периферийные ноцицепторы in vitro. Ringkamp, M. et al., Activated Human Platelets in Plasma Excite Nociceptors in Rat Skin, in Vitro, Neurosci. Lett. 170, pp. 103-106 (1994). Таким же образом, гистамин и брадикинин также высвобождаются в ткань в процессе травмы. Kimura, E. et al., Changes in Bradykinin Level in Coronary Sinus Blood After the Experimental Occlusion of a Coronary Artery, Am Heart J. 85, pp. 635-647 (1973), Douglas, 1985, Dray et al. (1993).
Кроме того, известно, что простагландины также вызывают боль и воспаление. Ингибиторы циклооксигеназы, например ибупрофен, обычно используются для блокирования продуцирования простагландинов, тем самым снижая простагландин-опосредованную боль и воспаление. Flower, R.J., et al., Analgesic-Antiperetics and Anti-Inflammatory Agents, Drugs Employed in the Treatment of Gout, in Goodman, L.S. et al., ed. The Pharmacological Basis of Theraupeutics, Mac Millan Publishing Company, New York, pp. 674-715 (1985). Ингибиторы циклооксигеназы ассоциируются с некоторыми вредными систематическими побочными эффектами, когда обычно применяются. Например, индометацин или кетеролак хорошо распознавались по гастроинтестинальному и ренальному вредным побочным эффектам.
Как обсуждалось, 5-НТ, гистамин, брадикинин и простагландины вызывают боль и воспаление. Различные рецепторы, через которые эти агенты опосредуют их влияние на периферийные ткани были известны и/или обсуждались в течение последних двух декад. Большинство исследований, было проведено на крысах или других моделях животных. Однако существует различие в фармакологии и рецепторной последовательностях человека и животных. Не было проведено исследований, окончательно продемонстрировавших важность 5-НТ, гистамина или брадикинина в продуцировании послеоперационной боли у человека.
Кроме того, антагонисты этих медиаторов в настоящее время не используются для лечения послеоперационной боли. Класс лекарств, названный 5-НТ и норпинефрин, поглощал антагонисты, которые включают амитриптилен, использовался орально с умеренным успехом для состояний хронической боли. Однако механизмы хроники в зависимости от состояния острой боли значительно различаются. Фактически, два исследования по установлению острой боли с использованием амитриптилена в ходе хирургической операции показали отсутствие эффекта амитриптилена в облегчении боли. Levine, J.D./, et al., Desipramine Enhances Opiate Posoperative Analgesia, Pain 27, pp. 45-49 (1986), Kerrick, J. M. , et al., Low-Dose Amitriptylene as an Ajunct to Opioids for Posoperative Pain: a Placebo-Controlled Trial Period, Pain 52, pp. 325-30 (1993). В обоих исследованиях лекарство давали орально. Второе исследование отмечает, что орально введенный амитриптилен действительно продуцирует в меньшей степени общее хорошее самочувствие у послеоперационных пациентов, которое могло быть обусловлено сродством лекарства к множеству аминовых рецепторов в мозге.
Амитриптилен, кроме блокирования поглощения 5-НТ и норпинефрина, является мощным антагонистом 5-НТ рецептора. Поэтому отсутствие эффективности в снижении послеоперационной боли в ранее упомянутом исследовании, будет очевидно находиться в противоречии с предложенной ролью для эндогенного 5-НТ при острой боли. Существует ряд причин для отсутствия облегчения острой боли, найденных с амитриптиленом в этих двух исследованиях. (1) В первом исследовании использовали амитриптилен в предоперационный период в течение одной недели вплоть до ночи перед операцией, тогда как во втором исследовании амитриптилен использовали только в послеоперационный период. Поэтому амитриптилен не присутствовал в оперируемом участке ткани в течение фазы острого повреждения ткани, время, в течение которого подразумевается, что 5-НТ является высвобожденным. (2) Известно, что амитриптилен интенсивно метаболизируется печенкой. При оральном введении, концентрация амитриптилена в оперируемом участке ткани, может быть недостаточно высокой в течение достаточно продолжительного периода времени, для подавления активности послеоперационного высвобождения 5-НТ во втором исследовании. (3) Так как существует множество медиаторов воспаления, а исследования продемонстрировали синергизм между медиаторами воспаления, блокирование только одним агентом (5-НТ) не может быть достаточным для подавления воспалительного ответа в поврежденной ткани.
Было проведено несколько исследований, демонстрирующих способность чрезвычайно высоких концентраций (1-3% растворы, т.е. 10-30 мг на миллитр) антагонистов рецептора гистамина1 (Н1) выступать в качестве локального анестезирующего агента для хирургических процедур. Полагают, что этот анестизирующий эффект не обусловлен опосредованием через H1 рецепторы, а скорее обусловлен неспецифическим взаимодействием с нейрональной мембраной натриевых каналов (аналогично действию лидокаина). Данные побочные эффекты (например, седативный эффект) связаны с указанными высокими "анестезирующими" концентрациями антагонистов гистаминового рецептора в общепринятом локальном введении антагонистов гистаминового рецептора, не использующихся в период хирургической операции.
Настоящее изобретение представляет собой раствор с низкой дозой (т.е. разбавленный), состоящий из смеси множества агентов, направленных на подавление локально опосредованной боли и воспаления, в жидкости, выступающей в качестве носителя физиологического электролита. Изобретение также представляет собой способ высвобождения орошающего раствора в процессе операции, содержащего эти агенты, непосредственно к хирургическому участку, где раствор работает локально на нейрорецепторном уровне с предварительно ослабевающим пределом боли и воспаления на участке. Противоболевые/противовоспалительные агенты в растворе включают агенты, выбранные из следующих классов антагонистов рецепторов, агонистов рецепторов и ингибиторов ферментов, каждый класс, действующий по различным молекулярным механизмам действия на боль и подавление воспаления: (1) антагонистов серотонинового рецептора, (2) агонистов серотонинового рецептора, (3) антагонистов гистаминового рецептора, (4) антагонистов брадикининового рецептора, (5) каликреиновых ингибиторов, (6) антагонистов тахикининового рецептора, включающих подтипы антагонистов нейрокинин1 и нейрокинин2 рецепторов, (7) антагонистов кальцитонин-ген опосредованного пептидного (CGRP) рецептора, (8) антагонистов интерлейкинового рецептора, (9) ингибиторов липооксигеназы, (10) простаноидных антагонистов рецептора, включающих подтипы антагонистов эйкозаноидных ЕР-1 и ЕР-2 рецепторов и подтипы антагонистов тромбоксанового рецептора, (11) антагонистов лейкотриенового рецептора, включающих подтипы антагонистов лейкотриен В4 рецептора и подтипы антагонистов лейкотриен D4 рецептора, (12) синтетических наркотических антагонистов рецептора, включающих подтипы антагонистов мю-опиатного, дельта-опиатного и каппа-опиатного рецепторов, (13) пуриноцепторных агонистов и антагонистов, включающих антагонисты Р2х рецептора и антагонисты Р2у рецептора, (14) аденазинтрифосфат (АТР)-чувствительных открывателей калиевых каналов, и (15) антагонистов кальциевых каналов. Каждый из вышеприведенных агентов выступает как в качестве противовоспалительного агента, так и противоноцицептивного, т.е. противоболевого или анальгезирующего агента. Выбор агентов из этих классов соединений приспосабливается для конкретного применения.
Некоторые предпочтительные варианты раствора настоящего изобретения также включают противосудорожные агенты для конкретных применений. Например, противоспазматические агенты могут быть включены в растворы, используемые для сосудистых процедур для ограничения вазоспазма и для уринарных процедур для ограничения спазма в уринарном тракте и стенке мочевого пузыря. Для таких применений противоспазматический агент используют в растворе. Например, может быть включен противоболевой/противовоспалительный агент, который служит также в качестве противоспазматического агента. Пригодные противоболевые/противовоспалительные агенты, которые также выступают в качестве противоспазматического агента, включают антагонисты серотонинового рецептора, антагонисты тахикининового рецептора, АТР-чувствительные открыватели калиевых каналов и антагонисты кальциевых каналов. Другие агенты, которые могут быть использованы в растворе специально для придания им противоспазматических свойств, включают антагонисты эндотел и нового рецептора и нитроксидные доноры (активаторы фермента).
Настоящее изобретение представляет собой также способ производства медикаментозных соединений в виде орошающего раствора для использования в непрерывно орошаемом оперативном участке или в ране в течение операционной процедуры. Способ включает растворение в жидкости, выступающей в качестве носителя физиологического электролита, множества противоболевых/противовоспалительных агентов и для некоторых применений противоспазматических агентов, каждый агент включается с концентрацией предпочтительно не более чем 100000 наномолей и более предпочтительно не более чем 10000 наномолей.
Способ настоящего изобретения обеспечивает высвобождение разбавленной комбинации множества антагонистов к медиаторам боли, воспаления и спазма и подавления агониста рецептора непосредственно в ране, такой как суставная ткань в процессе артроскопических процедур. Так как активные ингредиенты в растворе применяются непосредственно к оперативным тканям непрерывным образом, лекарства могут быть использованы при чрезвычайно низких дозах относительно тех доз, которые требуются для терапевтического эффекта, когда то же самое лекарство высвобождается орально, внутримышечно или внутрисосудисто. Преимущество агентов с низкими дозами является трехцелевым. Наиболее важным является отсутствие систематических побочных эффектов, которые часто ограничивают полезность этих агентов. Низкие терапевтические дозы, использованные в растворе настоящего изобретения, сводят к минимуму внутрисосудистое поглощение включенных агентов, тем самым сводя к минимуму систематические эффекты. Кроме того, агенты выбранные для конкретных применений в растворах настоящего изобретения являются высокоспецифическими по отношению к медиаторам, на которых они работают. Эта специфичность поддерживается использованием низких доз. Наконец, стоимость этих активных агентов на литр является чрезвычайно низкой.
Локальное введение агентов посредством орошения гарантирует также известную концентрацию в периферийном участке, являющемся мишенью, независимо от вариабельности между пациентами в метаболизме, кровотоке и т.д. Из-за прямой формы высвобождения раствора терапевтическая концентрация получается непрерывно. Таким образом, представляет собой улучшенный дозированный контроль. Локальное введение активных агентов прямо в рану или оперативный участок, кроме того, снижает, по существу, разложение агентов на протяжении внеклеточных процессов, т.е. первого и второго прохода метаболизма, который тем не менее имел место, когда агенты вводили орально, внутривенно или внутримышечно. Это является особенно верным для тех активных агентов, которые представляют пептиды, которые быстро метаболизуются. Например, некоторые агенты в следующих классах являются пептическими: антагонисты брадикининового рецептора, антагонисты тахикининового рецептора, антагонисты синтетического наркотического рецептора, антагонисты CGRP рецептора, и антагонисты интерлейкинового рецептора. Локальное непрерывное высвобождение в рану или оперативный участок сводит к минимум деструкцию, и в то же время представляет собой также непрерывную замену той части агента, которая может разрушиться, с гарантией, что локальная терапевтическая концентрация, достаточная для поддержания нахождения рецептора, поддерживается в ходе продолжения оперативной процедуры.
Локальное введение раствора во время хирургической процедуры в соответствии с настоящим изобретением продуцирует "упреждающий анальгезивный" эффект. Оккупированием рецепторов мишеней или инактивированием пораженных ферментов, до инициирования обширной оперативной травмы локально, агенты настоящего раствора модулируют сигнальную трансмиссию для упреждающего подавления намеченного патологического процесса. Когда медиаторы воспаления и способы ингибируются до того, как они могут оказать влияние на повреждение ткани, польза, которая извлекается при этом является более существенной, чем если они даются после повреждения.
Полагают, что подавление больше чем одного медиатора воспаления за счет применения многокомпонентного раствора настоящего изобретения существенно снижает степень воспаления и боль. Орошающие растворы настоящего изобретения включают комбинации лекарств, каждое эффективное против множества анатомических рецепторов или ферментов. Лекарственные агенты являются, таким образом, одновременно эффективными против комбинации патологических процессов, включающих боль и воспаление, вазоспазм и спазм гладкой мышцы. Считается, что действие этих медиаторов является синергетическим в том, что множество антагонистов рецептора и ингибирующих агонистов настоящего изобретения представляет собой повышенную эффективность в комбинации относительно эффективности индивидуальных агентов. Синергетическое действие некоторых агентов настоящего изобретения обсуждается посредством примера, приведенного ниже при детальном описании этих агентов.
Дополнительно к артроскопии раствор настоящего изобретения может быть также локально применен для любой полости тела человека или протоки, оперативной раны, травматической раны (например, ожогов) или в любой оперативной процедуре/или процедуре вмешательства, в которой может быть проведено орошение. Эти процедуры включают, но не ограничиваются ими, урологические процедуры, кардиоваскулярные диагностические процедуры вмешательства и/или терапевтические процедуры, и оральные, зубные и периодонтальные процедуры. Термин "рана", как он использован здесь повсюду, если не оговорено особо, предполагает включение хирургических ран, оперативных участков/участков вмешательства, травматических ран и ожогов.
Использованный внутриоперативно, раствор должен давать в клинике значительное снижение боли и воспаления в операционном участке по сравнению с используемыми в настоящее время орошающими жидкостями, тем самым снижая послеоперационные анальгетические (т.е. опиатные) потребности пациента и соответственно позволяя проводить более раннюю мобилизацию операционного участка пациента. Для использования настоящего раствора не требуется особых усилий в части операции и персонала операционного помещения по сравнению с обычными орошающими жидкостями.
Настоящее изобретение будет теперь описано более
детально с помощью примера и со ссылкой на сопровождающие чертежи, на которых:
фиг. 1, 2А и 2В представляют диаграммы процентного содержания вазоконстрикции в зависимости от времени в
контрольных артериях, в проксимальном сегменте рассматриваемых артерий и в дистальном сегменте рассматриваемых артерий соответственно, для исследований, проведенных на животных, описанных в Примере
VII, где демонстрируется влияние на вазоконстрикцию инфузии гистаминовых и серотониновых антагонистов, использованных в растворах настоящего изобретения, в процессе баллон ангиопластики, и
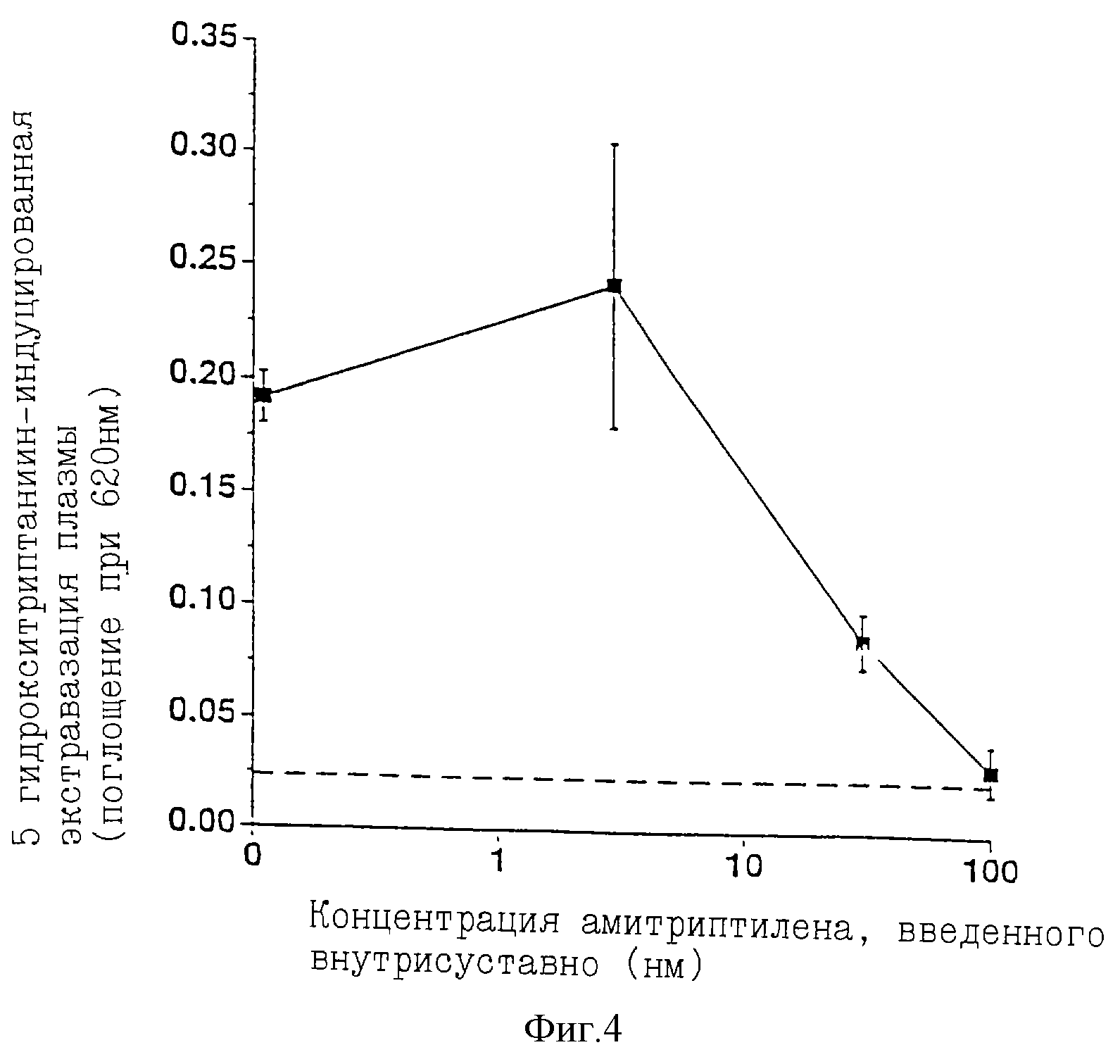
фиг. 3 и 4 представляют диаграммы экстравазации плазмы в зависимости от дозы амитриптилена, использованной в растворах настоящего изобретения, высвобожденного внутривенно и внутрисуставно
соответственно, в коленный сустав, в котором экстравазацию индуцировали путем введения 5-гидрокситриптамина животным, в исследовании, описанном в Примере VIII.
Орошающий раствор настоящего изобретения представляет разбавленный раствор, содержащий множество агентов подавляющих боль/воспаление и противоспазматические агенты в физиологическом носителе. Носитель представляет жидкость, содержащую физиологические электролиты, такие как нормальный солевой раствор или лактированный раствор Рингера. Носитель представляет предпочтительно жидкость, но для некоторых применений, например ожогов, может быть приготовлен в виде пасты или мази.
Противовоспалительные/противоболевые агенты выбирают из группы, состоящей из (1) антагонистов серотонинового рецептора, (2) агонистов серотонинового рецептора, (3) антагонистов гистаминового рецептора, (4) антагонистов брадикининового рецептора, (5) каликреиновых ингибиторов, (6) антагонистов тахикининового рецептора, включающих подтипы антагонистов нейрокининового1 и нейрокининового2 рецептора, (7) антагонистов кальцитонин-ген опосредованного пептидного (CGRP) рецептора, (8) антагонистов интерлейкинового рецептора, (9) ингибиторов ферментов, активных в синтезе метаболитов арахидоновой кислоты, включающих (а) фосфолипазные ингибиторы, которые включают PLA2 изоформы ингибиторов и PLCγ изоформы ингибиторов (b) циклооксигеназные ингибиторы, и (с) липооксигеназные ингибиторы, (10) антагонистов простаноидных рецепторов, включающих подтипы антагонистов эйкозаноидного ЕР-1 и ЕР-2 рецептора и подтипы антагонистов тромбоксанового рецептора, (11) антагонистов лейкотриенового рецептора, включающих подтипы антагонистов лейкотриенового B4 рецептора и подтипы антагонистов лейкотриенового D4 рецептора, (12) антагонистов синтетического наркотического рецептора, включающих подтипы агонистов мю-опиатного, дельта-опиатного и каппа-опиатного рецептора, (13) агонистов и антагонистов, пуриноцепторных рецепторов, включающих антагонисты Р2х рецептора и агонисты Р2у рецептора, (14) аденазинтрифосфат (АТР)-чувствительных открывателей калиевых каналов, и (15) антагонистов кальциевых каналов. Соответствующие противовоспалительные/противоболевые агенты, которые также действуют как противоспазматические агенты, включают антагонисты серотонинового рецептора, антагонисты тахикининового рецептора, АТР-чуствительные открыватели калиевых каналов и антагонисты кальциевых каналов. Другие агенты, которые могут быть использованы в растворе для придания ему противоспазматических свойств, включают антагонисты эндотелинового рецептора и нитроксидные доноры (активаторы фермента).
В каждом хирургическом растворе настоящего изобретения агенты включаются с низкими концентрациями и высвобождаются локально с низкими дозами относительно концентраций и доз, требуемых с обычными способами введения лекарства для достижения желаемого терапевтического эффекта. Невозможно получить эквивалентный терапевтический эффект путем высвобождения аналогично дозированных агентов через другие пути (т. е. внутривенно, внутримышечно или орально) введения лекарства, так как лекарства, даваемые систематически, подвергаются первому и второму проходу метаболизма. Каждый агент предпочтительно включается с низкой концентрацией от 0,1 до 10000 наномолей, за исключением циклооксигеназных ингибиторов, которые могут требоваться при больших концентрациях в зависимости от конкретно выбранного ингибитора. Конкретные агенты, выбранные для использования в растворе, и концентрации агентов меняются в соответствии с конкретным применением, как описано ниже.
Раствор в соответствии с настоящим изобретением может включать именно один агент или множество ингибирующих агентов боли/воспаления, один агент или множество противоспазматических агентов, или комбинацию обоих ингибирующих противоспазматических и ингибирующих агентов боли/воспаления из пронумерованных классов, при низкой концентрации. Однако вследствие вышеупомянутого синергетического эффекта множества агентов и желания широко блокировать боль и воспаление предпочтительно, чтобы использовалось множество агентов.
Хирургические растворы представляют новый терапевтический подход к высвобождению множества фармакологических агентов, действующих на точный рецептор и молекулярные мишени ферментов. На сегодняшний день, фармакологическая стратегия сосредоточена на создании высокоспецифических лекарств, которые являются селективными для индивидуальных подтипов рецепторов и изоформ ферментов, которые опосредуют ответ к индивидуальным нейротрансмиттерам и гормонам. В качестве примера, эндотелиновые пептиды представляют некоторые наиболее известные сильнодействующие вазоконстрикторы. Селективные антагонисты, которые являются специфическими для подтипов эндотелиновых (ЕТ) рецепторов, разыскиваются некоторыми фармацевтическими компаниями для использования при лечении широкого круга нарушений, включающих повышенные уровни эндотелина у человека. Для распознавания потенциальной роли рецепторного подтипа ЕТА при гипертензии эти лекарственные компании специально нацеливаются на развитие селективных антагонистов к подтипу ЕТА рецептора для предупреждающего лечения коронарного вазоспазма. Это типичная фармакологическая стратегия, хотя и общепризнанная, является неоптимальной, так как многие другие вазоконстрикторные агенты (например, серотонин, простагландин, эйкозаноид и т.д.) одновременно могут быть ответственными за инициирование и поддержание вазоспастического эпизода. Кроме того, несмотря на инактивацию единичного рецепторного подтипа или фермента, активация других рецепторных подтипов или ферментов и конечной сигнальной трансмиссии часто могут привести к каскадному эффекту. Это объясняет значительную трудность в применении единичного рецептор-специфического лекарства для блокирования патофизиологического процесса, в котором множество трансмиттеров играют роль. Поэтому нацеливание только на специфический индивидуальный рецепторный подтип, такой как ЕТА, является, вероятно, неэффективным.
В противоположность стандартному подходу к фармакологической терапии терапевтический подход хирургического раствора настоящего изобретения основан на рациональности того, что комбинация лекарств, действующих одновременно на точные молекулярные мишени, требуется для подавления полного спектра событий, которые лежат в основе развития патологического состояния. Кроме того, вместо нацеливания одного специфического рецепторного подтипа, хирургические растворы состоят из лекарств, которые работают с мишенью путем обычного молекулярного механизма в различных клеточных физиологических процессах, включающих развитие боли, воспаления, вазоспазм и спазма гладкой мышцы. Таким образом, каскадное действие дополнительных рецепторов и ферментов в ноцицептивных, воспалительных и спастических путях, сводится к минимуму хирургических растворов. В этих патофизиологических путях хирургические растворы ингибируют каскадный эффект "верхнего потока" и "нижнего потока".
Пример ингибирования "верхнего потока" представляет циклоокисгеназные антагонисты в регулировании боли и воспаления. Циклоокисгеназные ферменты (COX1 и СОХ2) катализируют превращение арахидоновой кислоты в простагландин Н, который является интермедиатом в биосинтезе воспалительных и ноцицептивных медиаторов, включающих простагландины, лейкотриены и тромбоксаны. Циклооксигеназные ингибиторы блокируют образование "верхнего потока" этих воспалительных и ноцицептивных медиаторов. Эта стратегия предотвращает блокирование взаимодействий семи описанных подтипов простаноидных рецепторов с их естественными лигандами. Аналогичный ингибитор "верхнего потока", включенный в хирургические растворы, представляет апротинин, калликреиновый ингибитор. Ферментный калликреин, сериновая протеаза, разрывает высокомолекулярные кининогены в плазме с образованием брадикининов, важных медиаторов боли и воспаления. Путем ингибирования действия калликреина апротинин эффективно ингибирует синтез брадикининов, обеспечивая тем самым эффективное ингибирование "верхнего потока" этих медиаторов воспаления.
Хирургические растворы являются также полезными в использовании ингибиторов "нижнего потока" для контроля патофизиологических путей метаболизма. В препаратах сосудистой гладкой мышцы, которые были подвергнуты предварительному сокращению различными нейротрансмиттерами (например, серотонином, гистамином, эндотелином и тромбоксаном), вовлеченные в каронарный вазоспазм АТР-чувствительные открыватели калиевых каналов (KCOs) продуцируют релаксацию гладкой мышцы, которая является концентрационно зависимой (Quast et al., 1994, Kashiwabada et al., 1994). Поэтому KCOs обеспечивают значительное преимущество в хирургических растворах в регулировании вазоспазма и спазма гладкой мышцы за счет обеспечения антиспастических эффектов "нижнего потока", которые являются независимыми от физиологических комбинаций агонистов, инициирующих спастическое явление. Аналогично, NO доноры и антагонисты кальциевых каналов, зависимые от электрического напряжения, могут ограничивать вазоспазм и спазм гладкой мышцы, инициированный множеством медиаторов, известных ранее в действии спастического пути метаболизма. Эти антагонисты тех же самых кальциевых каналов могут также обеспечивать блокаду воспаления "нижнего потока". Moncada, S., Flower, R. and Vane, J. in Goodman's and Gilman's Pharacological Basis of Therapeutics (7th ed.), MacMillan Publ. Inc., pp. 660-5 (1995).
Нижеследующее представляет описание соответствующих лекарств, попадающих в вышеупомянутый класс противовоспалительных/противоболевых агентов, а также соответствующих концентраций для использования в растворах настоящего изобретения. В то же время не желая ограничиваться теорией, также излагается обоснование выбора различных классов агентов, которые, как полагается, делают агенты способными участвовать в операции.
А. Антагонисты серотонинового рецептора.
Предполагают, что серотонин продуцирует боль за счет стимулирования серотонинового2 (5-НТ2) и/или серотонинового3 (5-НТ3) рецепторов на ноцицептивных нейронах на периферии. Большинство исследователей соглашается с тем, что 5-НТ3 рецепторы на периферийных ноцицепторах служат связью немедленного ощущения боли, продуцированной 5-НТ (Richardson et al., 1985). Дополнительно к ингибированию 5-НТ индуцированной боли антагонисты 5-НТ3 рецептора за счет ингибирования ноцицепторной активации также могут ингибировать нейрогенное воспаление. Barnes P.J., et al., Modulation of Neurogenic Inflamation: Novel Approaches to Iflamatory Disease, Trends in Pharmacological Sciences 11, pp. 185-189 (1990). Изучение коленных суставов крыс, однако, требовало 5-НТ2 рецептора, являющегося ответственным за ноцицепторную активацию за счет 5-НТ. Grubb, B.D. et al., A Study of 5-YN-Receptors Associated with Afferent Nerves Located in Normal and Inflamed Rat Anrle Joints, Agents Actions 25, pp. 216-18 (1988). Поэтому активация 5-НТ2 рецепторов также может играть роль в периферической боли и нейрогенном воспалении.
Одно назначение раствора настоящего изобретения заключается в блокировании боли и множества воспалительных процессов. Таким образом, антагонисты 5-НТ2 и 5-НТ3 рецептора оба являются пригодными для использования либо индивидуально, либо вместе в растворе настоящего изобретения, как будет описано впоследствии. Амитриптилен (ElavilTM) является подходящим антагонистом 5-НТ2 рецептора для использования в настоящем изобретении. Амитриптилен использовался клинически в течение многих лет в качестве антидепрессанта, и найдено, что он обладал полезными эффектами для некоторых пациентов с хронической болью. Метаклопрамид (ReglanTM) используется клинически в качестве противорвотного лекарства, но обнаруживает умеренное сродство к 5-НТ3 рецептору и может ингибировать действия 5-НТ в этом рецепторе, возможно ингибирование боли обусловлено высвобождением 5-НТ из тромбоцитов. Таким образом, он также является пригодным для использования в настоящем изобретении.
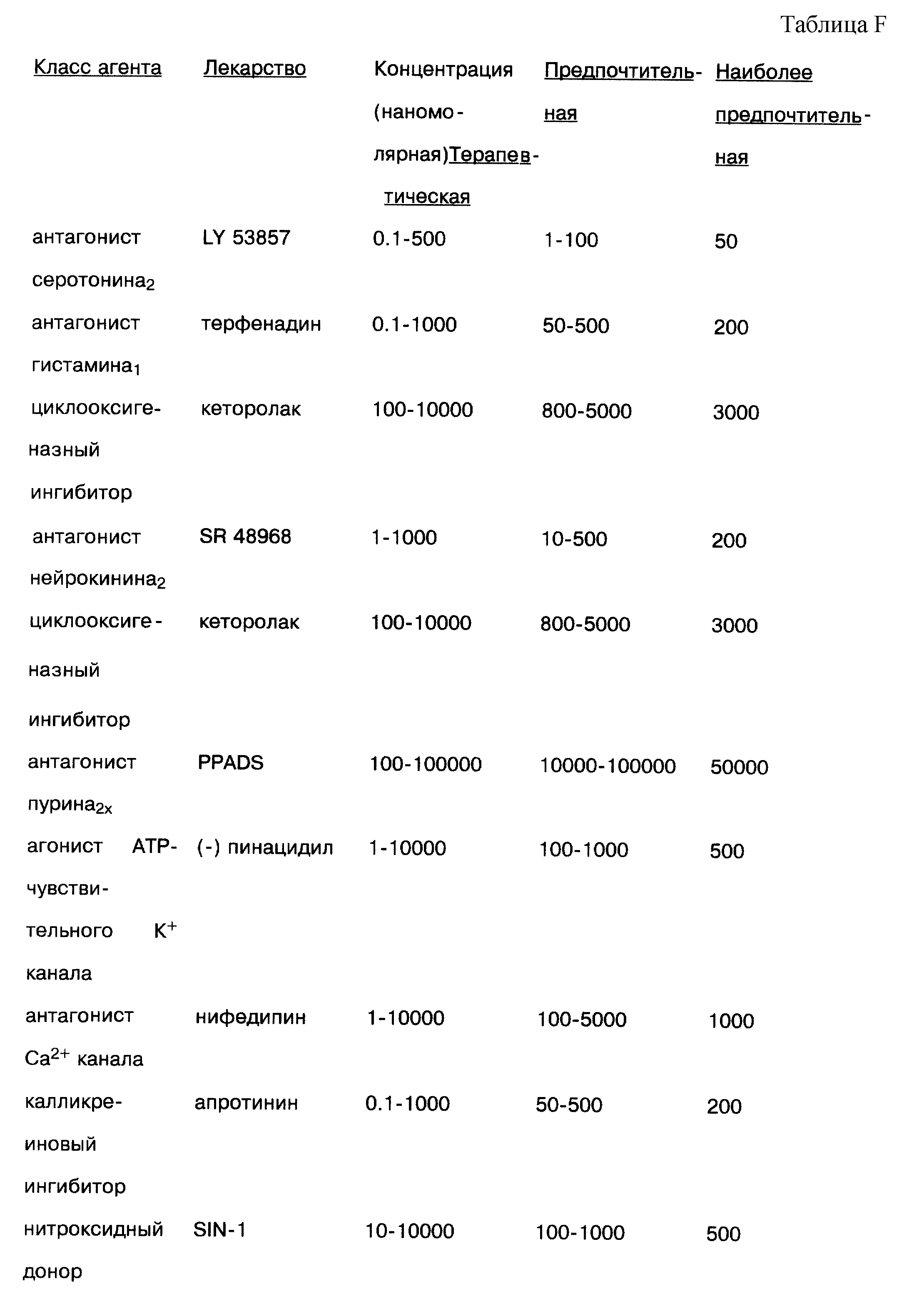
Другие пригодные антагонисты 5-НТ2 рецептора включают имипрамин, тразадон, десипрамин и кетансерин. Кетансерин был использован клинически благодаря его анти-гипертензивному действию. Hender, T., et al., Effects of New Serotonin Anatagonist, Ketaserin, in Experimental and Clinical Hypertension, Am. J. Hypertension, pp. 317s-23s (Jul. 1988). Другие пригодные антагонисты 5-НТ3 рецептора включают кисаприд и ондансетрон. Пригодные антагонисты серотонинового1В рецептора включают юхимбин, N-[-метокси-3-(4-метил-1-пиперанзинил)фенил] -2'-метил-4'-(5-метил-1,2,4-оксадиазол-3-ил)[1,1-бифенил] -4-карбоксамид ("GR127935") и метиотепин.
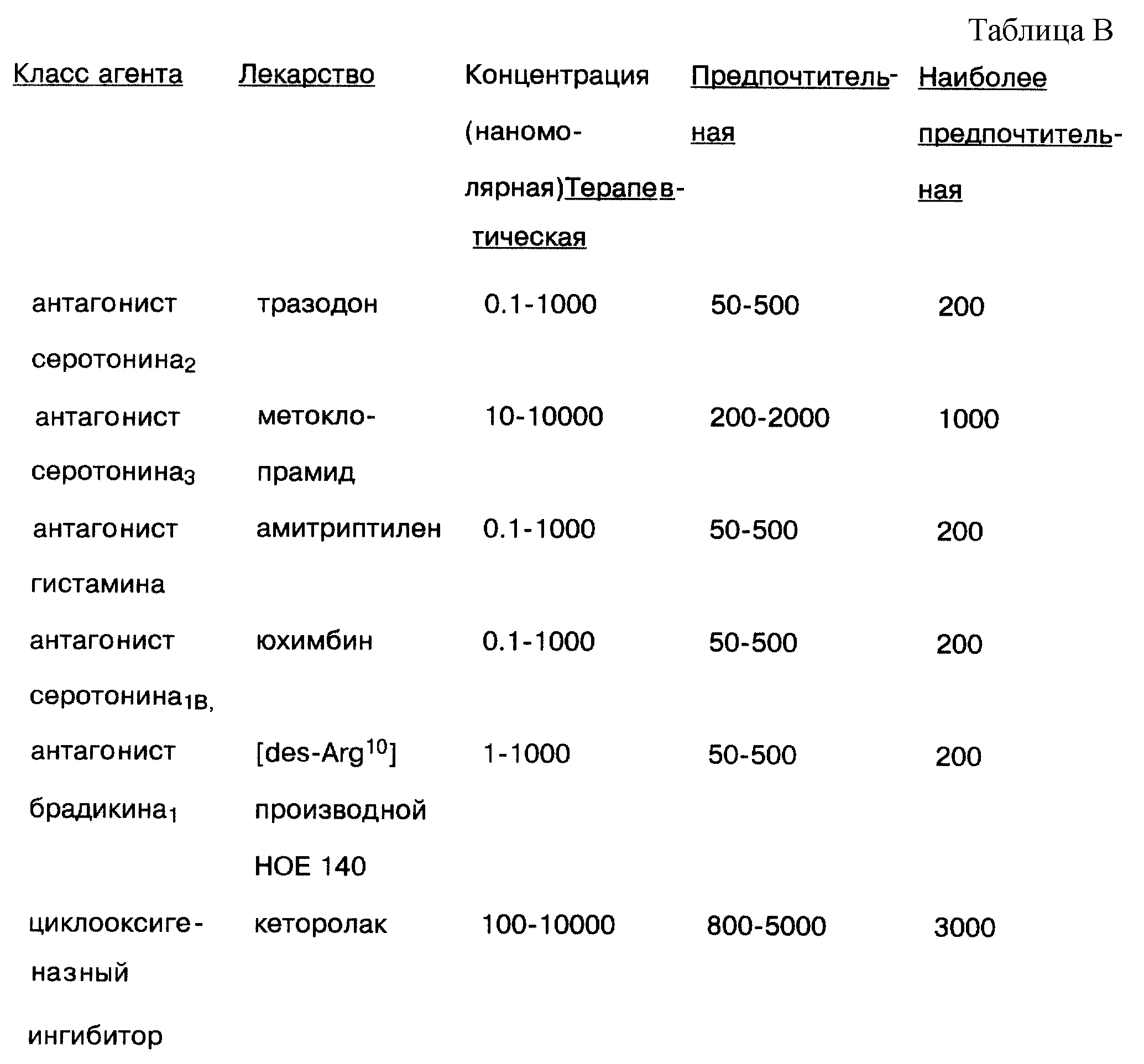
Терапевтические и предпочтительные концентрации для использования этих лекарств в растворе настоящего изобретения представлены в табл. 1.
В. Агонисты серотонинового рецептора.
5-HT1A, 5-HT1B и 5-НТ1D рецепторы являются известными в ингибировании аденилат циклазной активности. Таким образом, включение этих антагонистов серотонинового1А, серотонинового1В и серотонинового1D рецептора с низкой дозой в раствор должно ингибировать опосредованную нейронами боль и воспаление. Такого действия ожидают от агонистов серотонина1Е и cepотонина1F рецептора, потому что эти рецепторы также ингибируют аденилат циклазу.
Буспирон является агонистом соответствующего 1А рецептора для использования в настоящем изобретении. Суматриптан является агонистом соответствующего 1А 1В, 1D и 1F рецептора. Агонистом соответствующего 1А и 1D рецептора является дигидроэрготамин. Агонистом соответствующего 1Е рецептора является эргоновин. Терапевтические и предпочтительные концентрации для этих агонистов рецепторов приводятся в табл. 2.
С. Агонисты гистаминового рецептора.
Гистаминовые рецепторы обычно делятся на гистамин1 (H1) и гистамин2 (Н2) подтипы. Классическая воспалительная реакция при периферическом введении гистамина опосредуется через H1 рецептор, Douglas, 1985. Поэтому раствор настоящего изобретения предпочтительно включал антагонист гистаминового H1 рецептора. Прометазин (PhenerganTM) является обычно используемым противорвотным лекарством, которое в сильной степени блокирует H1 рецепторы и является пригодным для использования в настоящем изобретении. Интересно, было показано, что это лекарство обладает также локальными анестезирующими эффектами, но концентрации, необходимые для этого эффекта, на несколько порядков выше, чем те, которые необходимы для блокирования H1 рецепторов, таким образом, полагают что эффекты оказываются за счет различных механизмов. Концентрация антагониста гистаминового рецептора в растворе является достаточной для подавления H1 рецепторов, включенных в ноцицепторную активацию, но не достигает "локального анестезирующего" эффекта, исключая тем самым участие рассматриваемых систематических побочных эффектов.
Гистаминовые рецепторы являются известными также для опосредования вазомоторного тонуса в коронарных артериях. Исследования in vitro на сердце человека продемонстрировали, что подтип гистаминового1 рецептора опосредует контракцию коронарной гладкой мышцы. Ginsburg, R., et al., Histamin Provacation of Clinical Coronary Artery Spasm: Implications Concerning Pathogenesis of Variant Angina Pectoris, American Heart J., Vol. 102, pp. 819-822 (1980). Некоторые исследования подтверждают, что гистамин-индуцированная гиперсокращаемость в коронарной системе человека является наиболее заметной в проксимальных артериях в регулировании атеросклерозов и ассоциированной денудации артериального эндотелия. Keitoku, M. et al., Different Histamin Action in Proximal and Distal Human Coronary Arteries in Vitro, Cardiovascular Reserch 24, pp. 614-622 (1990). Поэтому антагонисты гистаминового рецептора могут быть включены в кардиоваскулярный орошающий раствор.
Другие пригодные антагонисты H1 рецептора включают терфенадин, дифенилгидрамин и амитриптилен. Так как амитриптилен также является эффективным в качестве антагониста серотонинового2 рецептора, он обладает двойной функцией когда используется в настоящем изобретении. Соответствующие терапевтические и предпочтительные концентрации для каждого из этих антагонистов H1 рецептора приводятся в табл. 3.
D. Антагонисты брадикининового рецептора.
Брадикининовые рецепторы обычно делятся на брадикинин1 (B1) и брадикинин2 (В2) подтипы. Исследования показали, что острая периферическая боль и воспаление, продуцированные брадикинином, опосредуются за счет B2 подтипа, где брадикинин-индуцированная боль в регулировании хронического воспаления опосредуется через подтип B1. Perkins, M.N., et al., Antinociceptive Activity of The Bradykinin B1 and B2 Receptor Antagonists, des-Arg9, [Leu8]-BK and HOE 140, in Two Models of Persistent Hyperalgia in The Rat, Pain 53, pp. 191-97 (1993), Dray, A., et al., Bradykinin and Inflammatory Pain, Trends Neurosci 16, pp. 99-104 (1993), каждый из указанных источников приводится здесь в виде ссылки.
В настоящее время антагонисты брадикининового рецептора клинически не используются. Эти лекарства представляют пептиды (малые протеины), и таким образом они могут приниматься орально, потому что они не будут усваиваться. Антагонисты к В2 рецептору блокируют брадикинин-индуцированную острую боль и воспаление. Dray et al. , 1993. Антагонисты В2 рецептора подавляют боль в хронических состояниях воспаления. Perkins et al., 1993, Dray et al., 1993. Поэтому в зависимости от применения раствор настоящего изобретения предпочтительно включает либо один, либо оба антагониста B1 и В2 рецептора. Например, артроскопия проводится для обоих состояний острого и хронического, и, таким образом, орошающий раствор для артроскопии может включать оба антагониста B1 и B2 рецептора.
Соответствующие антагонисты брадикининового рецептора для использования в настоящем изобретении включают следующие антагонисты брадикининового1 рецептора: [des-Arg10] производное D-Arg-(Hyp3-Thi5-D-Tic7-Oic8)-BK ("the [des-Arg10] производное НОЕ 140", доступное из Hoechst Pharmaceuticals), и [Leu8] des-Arg9-BK. Соответствующие антагонисты брадикининового2 рецептора включают: [D-Phe7] -BK, D-Arg(Hyp3-Thi5,8-D-Phe7)-BK ("NPC 349"), D-Arg-(Hyp3-D-Tic7-Oic8)-BK ("HOE 140"). Эти соединения более полно описываются в ранее приведенных ссылках Perkins et al., 1993, and Dray et al., 1993. Соответствующие терапевтические и предпочтительные концентрации приводятся в табл. 4.
Е. Калликреиновые ингибиторы.
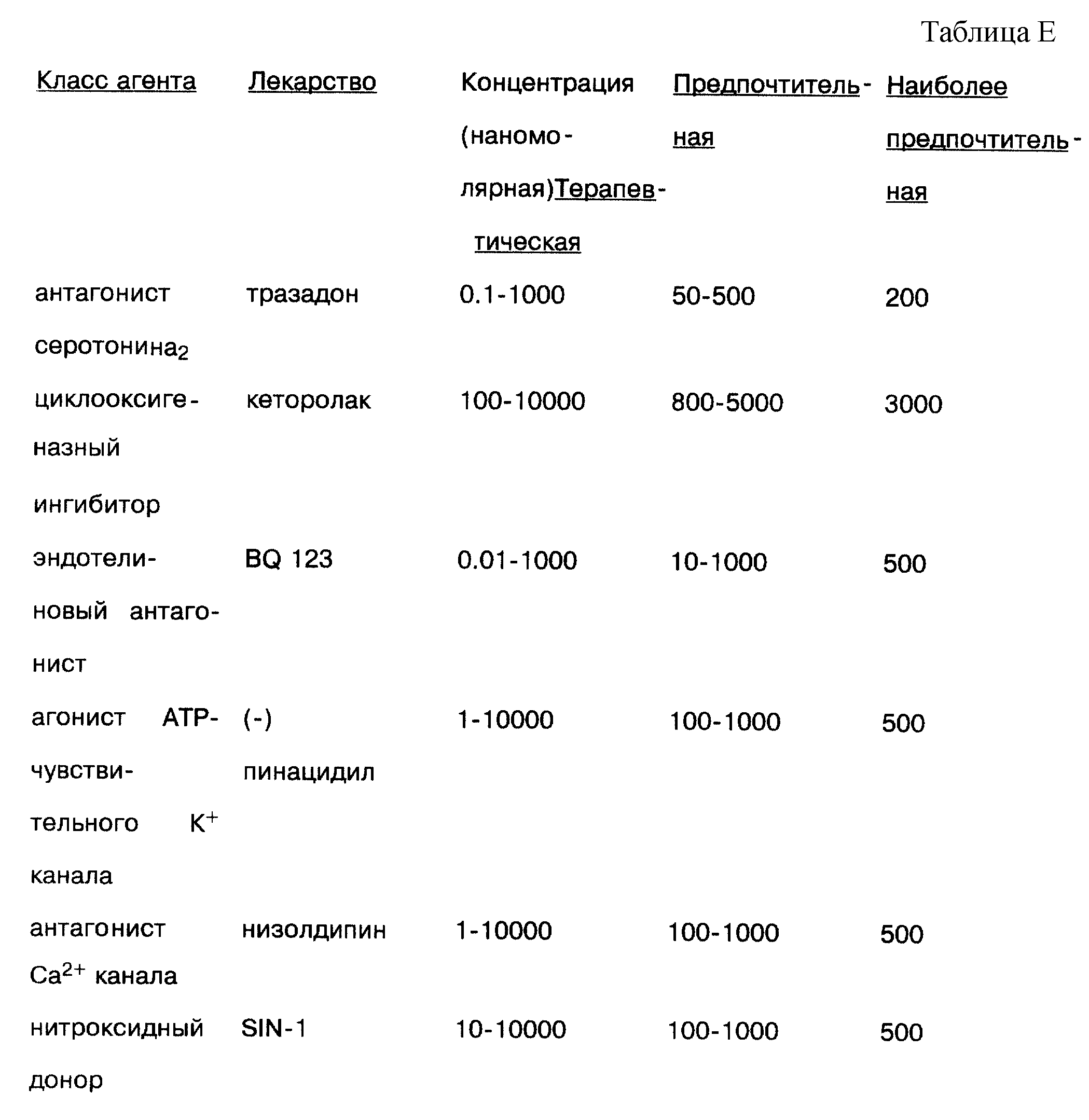
Пептидный брадикинин является наиболее важным медиатором боли и воспаления, как отмечалось ранее. Брадикинин продуцируется в виде продукта расщепления за счет действия калликреина на высокомолекулярные кининогены в плазме. Поэтому полагают, что калликреиновые ингибиторы являются терапевтическими в подавлении продуцирования брадикинина и в конечном счете боли и воспаления. Соответствующий брадикининовый ингибитор для использования в настоящем изобретении представляет апротинен. Соответствующие концентрации для использования в растворах настоящего изобретения приводятся в табл. 5.
F. Антагонисты тахикининового рецептора.
Тахикинины (Tks) представляют семейство структурно родственных пептидов, которые включают вещество Р, нейрокинин A (NKA) и нейрокинин В (NKB). Нейроны представляют главный источник Tks в периферии. Важный общий эффект Tks является нейрональной стимуляцией, но другие эффекты включают эндотелий-зависимую вазодилатацию, протеиновую экстравазацию плазмы, дегрануляцию клеток молочной железы и рекруитмент и стимуляцию клеток воспаления. Maggi, C. A., Gen Pharmacol., vol. 22, pp. 1-24 (1991). Вследствие вышеприведенного физиологического действия, опосредованного активацией ТК рецепторов, ТК рецепторы нацеливают для ускорения анальгезии и лечения нейрогенного воспаления.
1. Подтипы антагонистов нейрокининового1 рецептора.
Вещество Р активирует подтип нейрокининового рецептора, на который ссылаются как на NK-1. Известно, что вещество Р обладает множеством действий, которые продуцируют воспаление и боль в периферии после активации С-волокна, включая вазодилатацию, экстравазацию плазмы и дегрануляцию клеток молочной железы. Levine, J.D., et al., Peptides and Primary Afferent Nociceptor, J. Neurosci. , 13, p. 2273 (1993). Соответствующий антагонист вещества Р представляет ([D-Рrо9[спиро-гамма-лактам] Lеu0, Тrр11физалаемин-(1-11)) ("GR82334"). Другие антагонисты пригодные для использования в настоящем изобретении, которые действуют на NK-1 рецептор, представляют: 1-амино-2-(2-метокси-фенил)-этид)-7, 7-дифенил-4-пергидроксиизоиндолон(3аR7аR) ("RP 67580") и 2s, 3s-цис-3-(2-метоксибензиламино)-2-бензгидрилхинукледин ("СР 96345"). Соответствующие концентрации этих агентов приводятся в табл. 6.
2. Подтипы антагонистов нейрокининового2 рецептора.
Нейрокинин А представляет пептид, который локализуется в сенсорных нейронах с веществом Р и который также ускоряет воспаление и боль. Нейрокинин А активирует специфический нейрокининовый рецептор, на который ссылаются как на NK2. Admonds-Alt, S. et al., A Potent and Selective Non-Peptide Antagonist of the Neurokinin А (NК2) Receptor, Life Sci., 50:PL 101 (1992). В уринарном тракте, Nks оказывают мощное спастическое влияние только через NК2 рецептор в мочевом пузыре человека, а также в мочеиспускательном канале и мочеточнике человека. Maggi, C. A. , Gen. Pharmacol., vol. 22, pp. 1-24 (1991). Таким образом, желательные лекарства для включения в хирургический раствор для использования в урологических процедурах будут содержать антагонист NK-2 рецептора для уменьшения спазма. Примеры пригодных NK-2 антагонистов включают: ((S-)-N-метил-N-[4-(4-ацетиламино-4-фенилпиперидино)-2-(3,4-дихлорфенил)бутил] бензамид ("(+/-)-SR 48968"), Met-Asp-Trp-Phe-Dap-Leu ("MEN 10627"), и cyc(Gln-Trp-Phe-Gly-Leu-Met) ("L 659877"). Соответствующие концентрации этих агентов приводятся в табл. 7.
G. Антагонисты CGRP рецептора.
Кальцитонин ген-опосредованный пептид (CGRP) представляет пептид, который также солокализуется в сенсорных нейронах с веществом Р и который выступает в качестве вазодилаторного агента и усиливает действие вещества Р. Brain, S. D. , et al., Inflamatory Oedema Induced by Synergism Between Calcitonin Gene-Related Peptide () and Mediators of Increased Vascular Permeability, Br. J. Pharmacolo. 99, p. 202 (1985). Пример соответствующего антагониста CGRP рецептора представляет альфа-CGRP-(8-37), усеченная версия CGRP. Этот пептид подавляет активацию CGRP рецепторов. Соответствующие концентрации этого агента приводятся в табл. 8.
Н. Антагонист интерлейкинового рецептора.
Интерлейкины представляют семейство пептидов, классифицированных как цитокинины, продуцируемые лейкоцитами и другими клетками в ответ на медиаторов воспаления. Интерлейкины (IL) могут быть сильнодействующими периферически гипералгезивными агентами. Ferriera, S.H., et al., Interleukin-Ibeta as a Potent Hyperalgesic Agent Antagonized by a Tripeptide Analogue, Nature 334, p. 698 (1988). Пример соответствующего антагониста IL-1 бета рецептора представляет Lys-D-Pro-Thr, который представляет усеченную версию IL-1 бета. Этот трипептид ингибирует активацию IL-1 бета рецепторов. Соответствующие концентрации этого агента приводятся в табл. 9.
I. Ингибиторы активности ферментов в синтетических путях метаболизма для метаболитов арахидоновой кислоты.
1. Фосфолипазные ингибиторы.
Продуцирование арахидоновой кислоты фосфолипазой A2 (PLA2) приводит к каскаду реакций, которые продуцируют многочисленные медиаторы воспаления, известные как эйкозаноиды. Существует целый ряд стадий, через которые этот путь метаболизма может ингибироваться, тем самым уменьшая продуцирование этих медиаторов воспаления. Примеры ингибирования этих различных стадий приводятся ниже.
Ингибирование изоформы фермента PLA2 ингибирует высвобождение арахидоновой кислоты из клеточных мембран и поэтому ингибирует продуцирование простагландинов и лейкотриенов, приводя в результате к противовоспалительным и аналгезированным свойствам этих соединений. Gkaser, K.B., Regulation of Phospholipase A2 Enzymes: Selective Inhibitors and Their Pharamacological Potential, Adv. Pharmacol. 32, p. 3 (1995). Пример соответствующего агониста изоформы PLA2 представляет маноалид. Соответствующие концентрации для этого агента приводятся в табл. 10. Ингибирование PLAγ изоформы также будет приводить в результате к снижению продуцирования простаноидов и лейкотриенов и поэтому будет приводить в результате к уменьшению боли и воспаления. Пример ингибитора PLAγ изоформы представляет 1-[6-(17β -3-метоксиэстра-1,3,5(10)-триен-17-ил)амино)гексил]-1Н-пиррол-2,5-дион.
2. Циклооксигеназные ингибиторы.
Нестероидные противовоспалительные лекарства (NSAIDs) широко используются в качестве противовоспалительных, противопиретических, противотромботических и аналгезирующих агентов. Lewis, R.A., Prostaglandins and Leukotrienes, In. : Textbook of Rheumatology, 3d ed. (Kelley W.N., et al., eds), p. 258 (1989). Молекулярные мишени для этих лекарств представляют циклооксигеназы типа I и типа II (СОХ-1 и СОХ-2). Эти ферменты являются хорошо известными в качестве Простагландин Н синтазы 1 (конститутивной) и 2 (индуктивной) (PGHS) и катализируют превращение арахидоновой кислоты в Простагландин Н, который является интермедиатом в биосинтезе простагландинов и тромбоксанов. СОХ-2 фермент был идентифицирован в эндотелиальных клетках, микрофагах и фибробластах. Этот фермент индуцируется IL-1 и эндотоксином, а его экспрессия является нерегулируемой в сайтах воспаления. Конститутивная активность СОХ-1 и индуцированная активность СОХ-2 обе приводят к синтезу простагландинов, которые вносят вклад в боль и воспаление.
NSAIDs, имеющиеся в настоящее время на рынке (диклофенак, напроксен и индометацин, ибупрофен и т.д.), являются обычно неселективными ингибиторами обеих изоформ СОХ, но могут показывать большую селективность для СОХ-1 по сравнению с селективностью для COX-2, хотя это отношение меняется для различных соединений. Использование ингибиторов СОХ-1 и 2 для блокирования образования простагландинов представляет лучший терапевтический подход, чем попытки блокирования взаимодействий натуральных лигандов с семью описанными подтипами простаноидных рецепторов. Сообщения об антагонистах эйкозаноидных рецепторов (ЕР1, ЕР2, ЕР3) являются очень редкими, и сообщалось только о специфических, с высоким сродством антагонистах Тромбоксан А2 рецепторов. Wallace, J. and Cirino, G., Trends in Pharm. Sci., Vol., 15, pp. 405-406 (1994).
Использование циклооксигеназных ингибиторов является противопоказанием пациентам с язвенной болезнью, гастритами или ренальным ухудшением. В Соединенных Штатах только доступная инъецируемая форма этого класса лекарств представляет кетеролак (ToradolTM), доступный из Syntex Pharmaceuticals, который обычно используется внутримышечно или внутривенно для послеоперационных пациентов, но вновь противопоказан для вышеупомянутых категорий пациентов. Использование кетеролака или любого другого циклооксигеназного ингибитора(ров) в растворе в существенно более низких концентрациях, чем используются в настоящее время в ходе операции, могут позволить использовать это лекарство для других категорий пациентов с противопоказаниями. Добавление циклооксигеназного ингибитора к раствору настоящего изобретения придает точный механизм ингибирования продуцирования боли и воспаления в процессе артроскопии или другой операционной процедуры/процедуры вмешательства.
Предпочтительными циклооксигеназными ингибиторами для использования в настоящем изобретении являются кетеролак и индометацин. Из этих двух агентов индометацин является наименее предпочтительным, потому что требует относительно высоких доз. Терапевтические и предпочтительные концентрации для использования в растворе приводятся в табл. 11.
3. Липооксигеназные ингибиторы.
Ингибирование фермента липооксигеназы подавляет продуцирование лейкотриенов, таких как лейкотриен B4, который как известно является важным медиатором воспаления и боли. Lewis, R.A., Prostaglandins and Leukotrienes, In: Textbook of Rheumatology, 3d ed. (Kelley W.N., et al., eds), p. 258 (1989). Пример 5-липооксигеназного антагониста представляет 2,3,5-триметил-6-(12-гидрокси-5,10-додекадиинил)-1,4-бензохинон ("АА 861"), соответствующая концентрация которого приведена в табл. 12.
J. Антагонисты простаноидного рецептора.
Специфические простаноиды, продуцированные в виде метаболитов арахидоновой кислоты, опосредуют их воспалительные эффекты через активацию простаноидных рецепторов. Примерами классов специфических простаноидных антагонистов являются подтипы антагонистов эйкозаноидного ЕР-1 и ЕР-4 рецептора и подтипы антагонистов тромбоксанового рецептора. Соответствующим антагонистом простагландинового E2 рецептора является 2-ацетилгидразид 8-хлордибенз[b,f][1,4] оксазепин-10(11Н)карбоновой кислоты ("SC 19220"). Подтип антагониста соответствующего тромбоксанового рецептора представляет [15-(1α,2β(5Z),3β,4α]-7-[3-[2-(фениламино)-карбонил] гидразино] метил]-7-оксобицикло[2,2,1] -гепт-2-ил] -5-гептановая кислота ("SQ 29548"). Соответствующие концентрации для этих агентов приводятся в табл. 13.
К. Антагонисты лейкотриенового рецептора.
Лейкотриены (LTB4, LTC4 и LTD4) представляют продукты 5-липооксигеназного пути метаболизма арахидоновой кислоты, которая генерируется ферментативно и обладает важными биологическими свойствами. Лейкотриены являются причастными к ряду патологических состояний, включая воспаление. Специфические антагонисты рассматриваются в настоящее время многими фармацевтическими компаниями для потенциального терапевтического вмешательства в эти патологии. Halushka, P. V. , et al., Annu. Rev. Pharmacol. Toxicol. 29:213-239 (1989), Ford-Hutchison, A. Crit. Rev. Immunol. 10:1-12 (1990). LTB4 находится в определенных иммунных клетках, включающих эозинофилы и нейтрофилы. LTB4 присоединяется к этим рецепторам в результате хемотаксиса и лизосомального ферментативного высвобождения, внося тем самым вклад в процесс воспаления. Процесс сигнальной трансдукции, ассоциированный с активацией LTB4 рецептора, включает G-протеин-опосредованную стимуляцию фосфотидного (Р1) метаболизма и повышает содержание внутриклеточного кальция.
Пример соответствующего антагониста лейкотриенового В4 рецептора представляет SС(+)-(S)-7(3-(2-циклопропилметил)-3-метокси-4-[(метиламино)-карбонил] фенокси)пропокси)-3,4-дигидро-8-пропил-2Н-1-бензопиран-2-пропановая кислота ("SC 53228"). Концентрации этого агента, которые применимы для практики настоящего изобретения, приводятся в табл. 14. Другие пригодные антагонисты лейкотриенового B4 рецептора включают [3-[2(7-[7-хлор-2-хинолинил)этил)фенил] [[3-(диметиламино-3-оксопропил)тио] метил] тио пропановую кислоту ("МК 0571") и лекарства LY 66071, a ICI 203219. МК 0571 также действует как подтип антагониста LTB4 рецептора.
L. Агонисты синтетического наркотического рецептора.
Синтетические наркотические рецепторы являются антиноцицептивными и поэтому агонисты к этим рецепторам являются желательными. Синтетические наркотические рецепторы включают подтипы мю-, дельта- и каппа-опиатного рецептора. Мю-рецепторы располагаются на терминальных сенсорных нейронах в периферии и активация этих рецепторов ингибирует сенсорную активность нейрона. Basbaum, A. I. et al., Opiate analgesia: How Central is a Peripheral Target? , N. Engl. J. Med., 325:1168 (1991). Дельта- и каппа-рецепторы располагаются на симпатических терминальных эферентах и ингибируют высвобождение простагландинов, подавляя тем самым боль и воспаление. Taiwo, Y.O. et al., Kappa- and Delta-Opoids Block Sympathetically Dependent Hyperalgesia, J.Neurosci, Vol. 11, page 928 (1991). Примерами агонистов мю-опиатного рецептора являются фентанил и Try-D-Ala-Gly-[N-MePhe] -NH(CH2)2 ("DAMGO"). Примером агониста соответствующего дельта-опиатного рецептора является [D-Pen2,D-Реn5] энкефалин ("DPDPE"). Примером агониста соответствующего каппа-опиатного рецептора является (транс)-3,4-дихлор-N-метил-N-[2-(1-пирролидинил)циклогексил] -бензол ацетамид ("U50488"). Соответствующие концентрации каждого из этих агентов приводятся в табл. 15.
М. Пуриноцепторные антагонисты и агонисты.
Внеклеточный АТР действует в качестве сигнальной молекулы через взаимодействие с Р2 пуриноцепторами. Одним из большого класса пуриноцепторов являются пуриноцепторы Р2х, которые являются лигандно-связанными ионными каналами, обладающими характерной проницаемостью ионных каналов к ионам Na+, К+ и Са+. P2х рецепторы, описанные в сенсорных нейронах, являются важными для первичной афферентной нейротрансмиссии и ноцицептирования. АТР является известным в деполяризации сенсорных нейронов и играет роль в ноцицепторной активации, так как АТР, высвобожденный из поврежденных клеток, стимулирует P2x рецепторы, приводя к деполяризации ноцицептивных терминальных нервных волокон. Р2х рецептор имеет сильно ограниченное распределение (Chen, C.C., et al., Nature, vol. 377, pp. 428-431 (1995), так как он является селективно экспрессированным в нервы сенсорных С-волокон, которыми управляет спинной мозг, и известно, что многие их этих С-волокон несут рецепторы для болевого стимула. Таким образом, сильно рестриктированная локализация экспрессии для субединиц P2x рецептора делает эти подтипы превосходными мишенями для аналгезивного воздействия.
Соответствующие антагонисты P2x/АТР пуриноцепторов для использования в настоящем изобретении включают, в качестве примера, сурамин и пиридоксилфосфат-6-азофенил-2,4-дисульфоновую кислоту ("PPADS"). Соответствующие концентрации для этих агентов приводятся в табл. 16.
Известно, что агонисты P2у рецептора, G-протеин-спаренного рецептора, оказывают влияние на релаксацию гладкой мышцы через поднятие IP3 уровней с последующим увеличением внутриклеточного кальция. Примером агониста P2у рецептора является 2-me-S-ATP.
N. Аденозин трифосфат (АТР)-чувствительные открыватели калиевых каналов.
АТР-чувствительные калиевые каналы были обнаружены в большом числе тканей, включая мозг, и исследования по связыванию с использованием радиоактивных меченых лигандов подтвердили их существование. Открывание этих каналов заставляет вытекать калий (К+) и гиперполяризовать клеточную мембрану. Эта гиперполяризация индуцирует снижение внутриклеточного свободного кальция посредством подавления зависимых от электрического напряжения кальциевых (Са2+) каналов и Са2+ каналов, оперированных рецептором. Эти объединенные действия оказывают воздействие на клетку в релаксированном состоянии, т.е. состоянии, которое является более сопротивляемым активации. Было показано, что открыватели калиевых каналов (KCOs) предотвращают стимул спаренной секреции и рассматриваются для влияния на предварительно соединенные нейрональные рецепторы и, таким образом, будут подавлять эффекты, обусловленные нервной стимуляцией, и высвобождать медиаторы воспаления. Quast. U., et al., Cellular Pharmacology of Potassiun Channel Openers in Vascular Smooth Muscle Cardiovasc. Res., Vol. 28, pp. 805-810 (1994).
АТР-чувствительные калиевые каналы были обнаружены в сосудистой и несосудистой гладкой мышце, и исследования по связыванию с радиоактивными мечеными лигандами подтвердили их существование. Открывание этих каналов гиперполяризует клеточную мембрану и таким образом приводит к тому, что действует на клетку гладкой мышцы в релаксированном состоянии или состоянии, которое является более сопротивляемым активации, достигая отсюда вазорелаксации. Открыватели К+ каналов (КСО) были охарактеризованы, как обладающие сильнодействующей антигипертензивной активностью in vivo и вазорелаксационной активностью in vitro. В медицинской литературе нет прецедента, демонстрирующего терапевтическое использование этих агентов в качестве противовоспалительных, антиноцицептивных и противоспазматических агентов мочевого пузыря.
Ожидаются синергетические взаимодействия между антагонистами эндотелиума (ЕТA) и открывателями АТР-чувствительных калиевых каналов (KCOs) в достижении вазорелаксации или релаксации гладкой мышцы. Целесообразность двойного использования этих лекарств основывается на факте, что эти лекарства обладают различными молекулярными механизмами действия в ускорении релаксации гладкой мышцы и предупреждении вазоспазма. Первоначальное внутриклеточное поднятие кальция в клетках гладкой мышцы, индуцированное ЕТA рецептором, последовательно передает активацию зависимых от электрического напряжения каналов и ввод внеклеточного кальция, который требуется для сокращения. Антагонисты ЕТA рецептора будут специфически блокировать этот опосредованный эффект рецептора, но не будут блокировать повышения в кальции, высвобождаемом за счет активации других G-протеин спаренных рецепторов в мышечную клетку.
Лекарства, выступающие в роли открывателей калиевых каналов, такие как пинацидил, будут открывать эти каналы, вызывая вытекание К и гиперполяризацию клеточной мембраны. Эта гиперполяризация будет приводить к уменьшению сокращения, опосредованного другими рецепторами, за счет следующих механизмов: (1) индуцирования снижения внутриклеточного свободного кальция посредством ингибирования зависимых от электрического напряжения Са каналов путем уменьшения вероятности открывания обоих типов L-типа и Т-типа кальциевых каналов, (2) ограничения индуцированного агонистом (каналов, управляемых рецептором) высвобождения Са из внутриклеточных источников посредством ингибирования образования IP3 и (3) снижения эффективности кальция как активатора сокращаемых протеинов. Следовательно, объединенные действия этих двух классов лекарств будут связывать клетки мишени в релаксированном состоянии или состоянии, которое является более сопротивляемым активации.
Соответствующие отрыватели АТР-чувствительных K+ каналов для практики настоящего изобретения включают: (-)пинацидил, хромакалин, никорандил, миноксидил, N-циaнo-N'-[1,1-диметил-[2,2,3,3-3 H]пропил]-N''-(3-пиридинил)гуанидин ("Р 1075"), и N-циано-N'-(2-нитроксиэтил)-3-пиридинкарбоксимидамид монометансульфонат ("KRN 2391"). Концентрации для этих агентов приводятся в табл. 17.
О. Антагонисты кальциевого канала.
Антагонисты кальциевого канала представляют четкую группу лекарств, которые мешают трансмембранному потоку ионов кальция, требуемому для активации клеточных реакций, опосредующих нейровоспаление. Кальций, вошедший в тромбоциты и клетки белой крови, является ключевым моментом опосредования активации ответа в этих клетках. Кроме того, роль брадикининовых рецепторов и нейрокининовых рецепторов (NK1 и NK2) в опосредовании нейровоспаления, сигнального пути трансдукции увеличивает содержание внутриклеточного кальция, приводя, таким образом, к активации антагонистов кальциевых каналов в мембране плазмы. Во многих тканях антагонисты кальциевых каналов, такие как нифедипин, могут снижать высвобождение арахидоновой кислоты, простагландинов и лейкотриенов, которые пробуждаются различными стимулами. Moncada, S., Flower, R. and Vane, J., in Goodman's and Gilman's Pharmacological Basis of Theurapeutics (7th ed.), MacMillan Publ. Inc., pp. 660-5 (1995).
Антагонисты кальциевых каналов мешают также трансмембранному течению ионов кальция, требуемому сосудистой гладкой мышце для сокращений. Это влияние представляет собой целесообразность использования кальциевых антагонистов в предполагаемом применении в процедурах в ходе операции, целью которых является смягчение вазоспазма и релаксации гладкой мышцы. Дигидропиридины, включающие низолдипин, действуют в качестве специфических ингибиторов (антагонистов) зависимого от электрического напряжения вхождения подтипа L-типа кальциевых каналов. Систематическое введение антагониста кальциевого канала нифедипина в процессе сердечной хирургии было ранее использовано для предотвращения или уменьшения вазоспазма коронарной артерии. Seitelberg, R. et al. , Circulation, vol. 83, pp. 460-468 (1991). Вновь, в медицинской литературе нет прецедента, демонстрирующего терапевтическое использование этих агентов в качестве противовоспалительных, анти-ноцицептивных и антиспазматических агентов мочевого пузыря.
Антагонисты кальциевых каналов, которые находятся среди противоболевых/противовоспалительных/противоспазматических агентов, полезных в настоящем изобретении, проявляют синергетический эффект, когда объединяются с другими агентами настоящего изобретения. Антагонисты кальциевых каналов (Са2+ и нитроксидные (NO) доноры взаимодействуют в достижении вазорелаксации или релаксации гладкой мышцы, т.е. в ингибировании спазматической активности. Целесообразие двойного использования, основанное на факте, что эти лекарства обладают различными молекулярными механизмами действия, не может быть полностью эффективным в достижении одной релаксации, и могут иметь место различные периоды эффективности. Фактически существует большое число исследований, показывающих, что одни антагонисты кальциевых каналов не могут достигнуть полной релаксации сосудистой мышцы, которая была сокращена предварительно агонистом рецептора.
Влияние низолдипина, использованного без добавок и в комбинации с нитроглицерином, на спазм внутренней артерии молочной железы (IMA) показывает, что комбинация этих двух лекарств продуцирует значительный положительный синергетический эффект в предупреждении сокращения (Liu et al., 1994). Эти исследования обеспечивают научную основу для комбинации антагониста кальциевого канала и нитроксидного (NO) донора для более эффективного предупреждения вазоспазма и релаксации гладкой мышцы. Сообщались примеры систематического введения нитроглицерина и нифедипина в процессе сердечной хирургии для предупреждения и лечения миокардальной ишемии или вазоспазма коронарной артерии (Cohen et al., 1983, Seitelberger et al., 1991).
Антагонисты кальциевых каналов проявляют также синергетический эффект с подтипом А (ЕТA)антагонистов, эндотел и нового рецептора. Yanagisawa и соавторы наблюдали, что дигидропиридиновые антагонисты и антагонисты кальциевого канала блокировали эффекты ET-11 эндогенного агониста в ЕТA рецепторе в гладкой мышце коронарной артерии и, следовательно, высказали предположение о том, что ЕТ-1 является эндогенным агонистом кальциевых каналов, чувствительных к электрическому напряжению. Было найдено, что непрерывная фаза повышения внутриклеточного кальция в клетках гладкой мышцы, индуцированная ЕТA рецептором активации, требует внеклеточного кальция и по крайней мере частично блокируется никардипином. Таким образом, перенос антагониста кальциевого канала, как ожидается, будет синергетически усиливать действие антагониста ЕТA, когда объединяется в хирургическом растворе.
Антагонисты кальциевых каналов и открыватели АТР-чувствительного калиевых каналов аналогично проявляют синергетическое действие. Калиевые каналы, которые являются АТР-чувствительными (КATP), спаривают мембранный потенциал клетки с клеткой в метаболическом состоянии за счет чувствительности к адонизин нуклеотидам. КATP каналы подавляются внутриклеточным АТР, но стимулируются внутриклеточными нуклеотидными дифосфатами. Активность этих каналов контролируется электрохимической движущей силой в калии и внутриклеточными сигналами (например, АТР или G-протеина), но не пропускается мембранным потенциалом per se. КATP каналы гиперполяризуют мембрану и таким образом позволяют ей контролировать остаточный потенциал клетки. АТР-чувствительные калиевые потоки были обнаружены в скелетной мышце, мозге и в сосудистой и несосудистой гладкой мышце, и исследования по связыванию с радиоактивным меченым лигандом подтвердили существование этих каналов, которые являются рецепторами-мишенями для лекарств открывателей калиевого канала, таких как пинацидил. Открывание этих каналов вызывает выход калия и гиперполяризацию клеточной мембраны. Эта гиперполяризация (1) индуцирует уменьшение внутриклеточного свободного кальция посредством ингибирования зависимых от электрического напряжения Са2+ каналов за счет снижения вероятности открывания кальциевых каналов обоих типов L-типа и Т-типа, (2) ограничение количества агониста, индуцированного высвобождением Са2+ (каналов, управляемых рецептором) из внутриклеточного источника, через подавление образования инозитол трифосфата (IР3), и (3) снижение эффективности кальция в качестве активатора сокращаемых протеинов. Эти объединенные действия этих двух классов лекарств будут связывать клетки мишени в релаксированном состоянии или состоянии, которое является более сопротивляемым активации.
Наконец, антагонисты кальциевых каналов и тахикининовые и брадикининовые антагонисты проявляют синергетические эффекты в опосредованном нейровоспалении. Была установлена роль нейрокининовых рецепторов в опосредовании нейровоспаления. Путь метаболизма сигнальной трансдукции нейролейкин1 (NK1) и нейролейкин2 (NK2) рецептора (членов суперсемейства спаренных G-протеинов) включает увеличение внутриклеточного кальция, приводя таким образом, к активации кальциевых каналов в плазменной мембране. Аналогично, соединяется активация брадикининовых (ВК2) рецепторов с увеличением внутриклеточного кальция. Таким образом, антагонисты кальциевых каналов мешают обычному механизму включения повышенного содержания внутриклеточного кальция, часть из которого входит через каналы L-типа. Это является основой для синергетического взаимодействия между антагонистами кальциевого канала и антагонистами этих рецепторов.
Соответствующие антагонисты кальциевого канала для практики настоящего изобретения включают низолдипин, нифедипин, нимодипин, лацидипин и израдипин. Соответствующие концентрации для этих агентов приводятся в табл. 18.
Р. Противоспазматические агенты.
1. Многофункциональные агенты
Некоторые
противоболевые/противовоспалительные агенты, описанные выше, служат также для ингибирования вазокстрикции или спазма гладкой мышцы. Как таковые эти агенты также выполняют функцию
противоспазматического агента и, таким образом, используются с пользой в сосудистых и уринарных применениях. Противоболевые/противовоспалительные агенты, которые также служат в качестве
противоспазматических агентов, включают: антагонисты серотонинового рецептора, конкретно антагонисты серотонина2, антагонисты тахикининового рецептора, АТР-чувствительные открыватели
калиевых каналов и антагонисты кальциевых каналов.
Нитроксидные доноры.
Нитроксидные доноры могут быть включены в растворы настоящего изобретения особенно из-за их противосудорожной активности. Нитроксид (NО) играет критическую роль в качестве молекулы медиатора многих физиологических процессов, включающих вазодилатацию и регулирование нормального сосудистого тонуса. Внутри эндотелиальных клеток фермент, известный как NO синтаза (NOS), катализирует превращение L-аргинина в NO, который действует как мессенджер и опосредует ответ в примыкающих клетках гладкой мышцы. NO непрерывно образуется и высвобождается с помощью сосудистого эндотелия при базальных условиях, которые ингибируют сокращения и контроль базального коронарного тонуса и продуцируются в эндотелии в ответ на различные антагонисты (такие как ацетилхолин) и других эндотелий зависимых вазодилаторов. Таким образом, регулирование NO синтазной активности и конечных уровней NO являются ключевыми молекулярными задачами, контролирующими сосудистый тонус. Muramatsu, K., et al., Coron. Artery Dis., vol. 5, pp. 815-820 (1994).
Ожидают синергетического взаимодействия между NO донорами и открывателями АТР-чувствительных калиевых каналов (KCOs) в достижении вазорелаксации или релаксации гладкой мышцы. Целесообразность двойного использования основана на факте, что эти лекарства имеют различные молекулярные механизмы действия в ускорении релаксации гладкой мышцы и предупреждении вазоспазма. Из выращенных коронарных артериальных клеток гладкой мышцы, очевидно, что вазоконстрикторы: вазопрессин, анготензин II и эндотелин, все ингибируют КATP, протекающий через ингибирование протеин киназы А. Кроме того, сообщалось, что КATP, существующий в гладкой мышце мочевого пузыря, ингибируется мукариновыми агонистами. Действия NO в опосредованной релаксации гладкой мышцы протекает через независимые молекулярные пути метаболизма (описанные выше), включающие протеин киназу G. Это подтверждает, что комбинация двух лекарств будет более эффективной в релаксации гладкой мышцы, чем применение одного лекарства.
Соответствующие нитроксидные доноры для практики настоящего изобретения включают нитроглицерин, нитропруссид натрия, лекарство FK 409, 3-морфолиносиднонимин или линсидомин хлоргидрат ("SIN-1"), и S-нитрозо-N-ацетилпениламин ("SNAP"). Концентрации для этих агентов приводятся в табл. 19.
3. Антагонисты эндотел и нового рецептора.
Эндотелин является 21 аминокислотным пептидом, который является одним из наиболее известных сильнодействующих вазоконстрикторов. Были описаны три различных человеческих эндотелиальных пептида, обозначенных как ЕТ1, ЕТ2 и ЕТ3, которые опосредовали их физиологические эффекты через по крайней мере два подтипа рецепторов, на которые ссылаются как на ЕТA и ЕТB рецепторы. Сердечные и сосудистые гладкие мышцы содержат преимущественно ЕТA рецепторы, и этот подтип является ответственным за контракцию в этих тканях. Кроме того, было найдено, что ЕТA рецепторы часто опосредовали контрактильную реакцию в выделенных препаратах гладкой мышцы. Было найдено, что антагонисты ЕТA рецептора являются сильнодействующими антагонистами контракции человеческой коронарной артерии. Таким образом, антагонисты на ЕТA рецептор должны быть терапевтически полезными в ингибировании в ходе операции коронарного вазоспазма и могут быть дополнительно использованы в ингибировании контракции гладкой мышцы в урологических применениях. Miller, R.C. et al., Trends in Pharmacol. Sci., vol. 14, pp. 54-60 (1993).
Соответствующие антагонисты эндотелинового рецептора включают: цикло(D-Asp-D-Val-Leu-D-Trp) ("BQ 123"), (N,N-гексаметилен)-карбомоил-Lеu-D-Trp-(CHO)-D-Trp-OH ("BQ 610"), (R)2-[R-[(s)-2-([1-гексагидро-1Н-азепинил]карбонил]амино-4-метил-пентаноил)амино-3-(3-[1-метил-1Н-индодил)]пропиониламино-3-(2-пиридил)пропионовую кислоту ("FR 139317"), цикло(D-Asp-Pro-D-Ile-Leu-D-Trp) ("JKC 301"), цикло(D-Ser-Pro-D-Val-Leu-D-Trp) ("JK 302"), и 5(диметиламино)-N-(3,4-диметил-5-изоксазолил)-1-нафталинсульфонамид ("BMS 182874"). Концентрации для двух агентов, выступающих представителями соответствующих соединений, приводятся в табл. 20.
VI. Способы применения.
Раствор настоящего изобретения применяли для различных операционных процедур/процедур вмешательства, включающих хирургическую, и диагностическую, и терапевтическую технику. Применения включали использование в качестве орошающего раствора в ходе операции в процессе артроскопической хирургии анатомических суставов, урологических процедур и внутрисосудистой диагностики и терапевтических процедур. Термин "в ходе операции", как он использован здесь повсюду, обозначает применение раствора в ходе проведения операции или медицинской процедуры вмешательства, и для многих процедур будет предпочтительно также проводить применение раствора до инициирования процедуры. Такие процедуры обычно используют физиологические орошающие жидкости, такие как нормальный солевой раствор или лактированный раствор Рингера, применяемый для хирургического участка с помощью техники, хорошо известной специалистам в этой области. Способ настоящего изобретения представляет противоболевой/противовоспалительный/ противосудорожный орошающий раствор настоящего изобретения вместо обычно применяемых орошающих жидкостей. Орошающий раствор применяется к ранам или хирургическому участку до начала процедуры, предпочтительно до травмы ткани, и продолжается непрерывно в течение всей процедуры, с упреждающим блокированием боли и воспаления и/или спазма. Термин "орошение", как он использован здесь повсюду, обозначает промывание раны или анатомической структуры потоком жидкости. Термин "непрерывно", как он использован здесь повсюду, обозначает также включение ситуаций, в которых имеет место повторение и частое орошение ран с частотой, достаточной для поддержания предварительно определенной терапевтической локальной концентрации применяемых агентов, и применений, в которых могут быть перемежающиеся прекращения орошаемого потока жидкости, вызванные необходимостью оперативной техники.
Артроскопическая техника, для которой может быть применен настоящий раствор, включает, как пример, но не ограничиваясь примером, частичную менискэктомию и реконструкции связок в колене, акромиопластию плеча, санацию манжета поворота плеча, синовэктомию сустава и артроскопию кисти и колена. Орошающий раствор непрерывно подается в ходе операции к суставу со скоростью потока, достаточной для раздувания суставной капсулы, для удаления операционного дебриса и для того, чтобы дать возможность беспрепятственной внутрисуставной визуализации.
Соответствующий орошающий раствор для контроля болевого ощущения и отека в процессе такой артроскопической процедуры представлен в Примере I, приведенном ниже. Для артроскопии предпочтительно, чтобы раствор включал комбинацию, и предпочтительно все или любой из следующих агентов: антагонист серотонинового2 рецептора, антагонист серотонинового3 рецептора, антагонист гистаминового1 рецептора, агонист серотонинового рецептора, действующий на 1А, 1В, 1D, 1F и/или 1Е рецепторы, антагонист брадикининового1 рецептора, антагонист брадикининового2 рецептора и циклооксигеназный ингибитор, и предпочтительно все из вышеуказанных агентов.
Этот раствор использует чрезвычайно низкие дозы этих ингибиторов боли и воспаления вследствие локального применения агентов непосредственно к операционному участку в ходе процедуры. Например, меньше чем 0,05 мг амитриптилена (антагонист соответствующего серотонинового2 и гнетаминового1 "двойного" рецептора) требуется на литр орошающего раствора для обеспечения значительной локальной концентрации в ткани, которая будет ингибировать 5-НТ2 и H1 рецепторы. Эта доза является чрезвычайно низкой относительно дозы 10-25 мг орального амитриптилена, которая является обычной исходной дозой для этого лекарства.
В каждом из хирургических растворов настоящего изобретения агенты включены с низкими концентрациями и высвобождаются локально с низкими дозами относительно концентраций и доз, требуемых в обычных способах введения лекарства для достижения желаемого терапевтического эффекта. Невозможно получение эквивалентного терапевтического эффекта за счет высвобождения подобно дозированных агентов через другие (т.е. внутривенный, внутримышечный или оральный) пути введения лекарства, так как лекарства, даваемые систематически, подвергаются первому и второму проходу метаболизма.
Например, используя крысиную модель артроскопии, заявители исследовали способность амитриптилена, антагониста 5-HT2, ингибировать 5-НТ-индуцированную экстравазацию плазмы в колене крысы в соответствии с настоящим изобретением. Это исследование, описанное более полно в Примере VIII, сравнивает терапевтическое дозирование амитриптилена, высвобожденного локально (т.е. внутрисуставно) в колено и внутрисосудисто. Результаты демонстрируют, что внутрисуставное введение амитриптилена требует полного уровня дозирования приблизительно в 200 раз ниже, чем требуется через внутривенный путь, для достижения того же терапевтического эффекта. Данные говорят о том, что только малая доля лекарства, высвобожденного внутрисуставно, поглощается локальной синовиальной тканью, а различие уровней лекарства в плазме между двумя путями введения гораздо больше, чем различие в полных уровнях дозирования амитриптилена.
Практика настоящего изобретения должна отличаться от обычных внутрисуставных инъекций опиатов и/или анальгетиков по окончании процедуры артроскопии или "открытия" сустава (например, колена, плеча и т.д.). Раствор настоящего изобретения используется для непрерывной инфузии в течение всей хирургической процедуры для обеспечения преимущественного ингибирования боли и воспаления. По сравнению с высокими концентрациями, необходимыми для достижения терапевтической эффективности, постоянная инфузия локальных анальгетиков, таких как лидокаин (0,5-2% растворы), будет приводить к глубокой систематической токсичности.
При заканчивании процедуры настоящего изобретения может быть желательной инъекция или в других отношениях применение более высокой концентрации тех же ингибиторов боли и воспаления в нерегулярном растворе в операционный участок, в качестве альтернативы или дополнения к опиатам.
Раствор настоящего изобретения находит также применение во внутримышечной диагностике и терапевтических процедурах с потенциально пониженным спазмом стенки сосуда, агрегации тромбоцитов и ноцицептивной активации, продуцированной сосудистой манипуляцией. Соответствующий раствор для такой процедуры раскрывают в Примере II, приведенном ниже. Внутрисосудистый раствор предпочтительно включает любую комбинацию и предпочтительно все из следующих агентов: антагонист 5-НТ2 рецептора (Saxena, P.R. et al., Cardiovascular Effacts of Serotonin Inhibitory Agonists and Antagonists, J. Cardiovasc. Pharmacol. 15, (Suppl. 7), pp. S17-S34 (1990), Douglas, 1985), антагонист 5-НТ3 рецептор для блокирования активации этих рецепторов на симпатических нейронах и С-волокнах ноцицептивных нейронов в стенках сосуда, которые, как было показано, продуцируют бради- и тахикардию (Saxena, P.R. et al., 1990), антагонист брадикининового1 рецептора и циклооксигеназный ингибитор для предотвращения продуцирования простагландинов в участках поврежденной ткани, которые уменьшают боль и воспаление. Кроме того, внутрисосудистый раствор будет также предпочтительно содержать антагонист серотонина1В (известный также как серотонин1dβ), потому что было известно, что серотонин продуцирует значительный сосудистый спазм посредством активации серотониновых1B рецепторов у людей. Kaumann, A.J., et al., Variable Participation of 5-YN1-Like Receptors and 5-YN2 Receptors in Serotonin-Induced Contraction of Human Isolated Coronary Arteries, Circulation 90, pp. 1141-53 (1994). Это возбуждающее действие серотониновых 1В рецепторов на сосудистые стенки, приводит к вазоконстрикции, что находится в противоречии с ранее обсуждавшимся ингибирующим действием серотониновых1B рецепторов в нейронах. С целью приготовления внутрисосудистого раствора термин "ингибирующие агенты боли/воспаления" имеет в виду также включение ингибирующих агентов спазма сосудистых стенок и ингибирующих агентов агрегации тромбоцитов.
Раствор настоящего изобретения находит также применение для уменьшения боли и воспаления, связанных с урологическими процедурами, такими как резекция транс-уретральной простаты и аналогичных урологических процедур, использующих лазер. Исследования продемонстрировали, что серотонин, гистамин и брадикинин продуцируют воспаление в тканях нижнего уринального тракта. Schwarz, M. M. et al. , Vascular Leakage in the Kidney and Lower Urinary Tract: Effect of Histamine, Serotonin and Bradykinin, Proc. Soc. Exp. Biol. Med. 140, pp. 535-539 (1972). Соответствующий орошающий раствор для урологических процедур раскрывают в Примере III, приведенном ниже. Раствор предпочтительно включает комбинацию и предпочтительно все из следующих агентов: антагонист гистаминового1 рецептора для ингибирования гистамин-индуцированной боли и воспаления, антагонист 5-НТ3 рецептора для блокирования активации этих рецепторов на периферальных С-волокнах ноцицептивных нейронов, антагонист брадикина1 и брадикина2 и циклоокисгеназный ингибитор для уменьшения боли/воспаления, продуцированной простагландинами в участках поврежденной ткани. Предпочтительно включается также антиспазматический агент для предупреждения спазма в уретральном канале и спазма стенки мочевого пузыря.
Раствор настоящего изобретения может быть также применен в ходе операции для ингибирования боли и воспаления в хирургических ранах, а также для уменьшения боли и воспаления, связанных с ожогами. Результаты исследования ожогов свидетельствуют о том, что высвобождается значительное количество биогенных аминов, которые не только продуцируют боль и воспаление, но также приводят к глубокой экстравазации плазмы (потери жидкости), часто высвобождая компонент тяжелых ожогов угрожающий жизни. Holliman, C.J., et al., The Effect of Ketanserin, a Specific Serotonin Antagonist, on Burn Shock Hemodynamic Parameters in a Porcine Burn Model, J. Trauma 23, pp. 867-871 (1983). Раствор, раскрытый в Примере I для артроскопии, может быть также применен к ранам или ожогам для контроля боли и воспаления. Агенты раствора Примера I могут быть альтернативно внесены при тех же концентрациях в пасты или основы мази для применения к ожогу или ране.
VII. Примеры
Следующий ниже
пример представляет несколько составов в соответствии с настоящим изобретением, пригодных для определенных операционных процедур с последующим суммированием двух клинических исследований, использующих
агенты настоящего изобретения.
А. Пример I
Орошающий раствор для артроскопии.
Следующий состав является пригодным для использования в орошении анатомического сустава в процессе артроскопических процедур. Каждое лекарство солюбилизировали в жидкость, выступающую в качестве носителя, содержащую физиологические электролиты, такие как нормальный солевой раствор или лактированный раствор Рингера, в то время как остальные растворы описаны в последующих примерах (см. табл. А).
В. Пример II
Орошающий раствор для внутрисосудистых
терапевтических процедур.
Следующие лекарства и области концентраций в растворе в жидкости, выступающей в качестве физиологического носителя, являются пригодными для использования в орошении операционных участков в процессе внутрисосудистых процедур (см. табл. B).
С. Пример III
Орошающий раствор для урологических процедур.
Следующие лекарства и области концентраций в растворе в жидкости, выступающей в качестве физиологического носителя, являются пригодными для использования в орошении операционных участков в ходе урологических процедур (см. табл. C).
D. Пример IV
Орошающий раствор для артроскопии, ожогов, общих хирургических ран и оральных/дентальных применений.
Следующая композиция является предпочтительной для использования в анатомическом орошении в процессе артроскопии и оральных/дентальных процедурах и в умении обращаться с ожогами и общими хирургическими ранами. В то время как раствор, приведенный в Примере I, является пригодным для использования настоящим изобретением, следующий раствор является даже более предпочтительным, потому что ожидается более высокая эффективность (см. табл. D).
Е. Пример V
Орошающий раствор для внутрисосудистых терапевтических процедур.
Следующие лекарства и области концентраций в растворе в жидкости, выступающей в качестве физиологического носителя, являются предпочтительными для использования в орошении операционных участков в ходе внутрисосудистых процедур. Вновь этот раствор является предпочтительным относительно раствора, приведенного в Примере II, из-за более высокой эффективности (см. табл. E).
F. Пример VI
Орошающий раствор для
урологических процедур.
Следующие лекарства и области концентраций в растворе в жидкости, выступающей в качестве физиологического носителя, являются предпочтительными для использования в орошении операционных участков в ходе урологических процедур. Полагают, что раствор обладает даже большей эффективностью, чем раствор, приведенный в предыдущем Примере III (см. табл. F).
G. Пример VII
Баллон дилатация нормальных подвздошных артерий у Новозеландского белого кролика и влияние блокады гистамин/серотонинового рецептора на реакцию.
Цель этого исследования была направлена на два аспекта. Сначала была применена новая in vivo модель для исследования артериального тонуса. Период времени, в течение которого происходило изменение артериального размера до и после баллон ангиопластии, описывается ниже. Во-вторых, была исследована роль гистамина и серотонина, использованных вместе, в контроле артериального тонуса в этой обстановке и затем проведено исследование за счет селективной инфузии блокирующих агентов гистаминового и серотонинового рецепторов до и после ангиопластичного повреждения.
1. Конструкционные рассмотрения.
Это исследование было предназначено для описания периода времени, в течение которого происходило изменение просвета артериальных размеров в одной группе артерий, и для оценки влияния блокады серотонин/гистминового рецептора на эти изменения во второй группе аналогичных артерий. Для облегчения сравнения двух различных групп обе группы были обработаны идентичным образом за исключением содержимого инфузии, выполненной в процессе эксперимента. У контрольных животных (артерий) инфузия была проведена с нормальным солевым раствором (растворитель для испытываемого раствора). Гистамин/серотонин рецепторная блокада обработанных артерий, получавших солевой раствор, содержащий блокирующие агенты с одной и той же скоростью и в одну и ту же часть протокола в качестве контрольных животных. Конкретно, испытываемый раствор включал: (а) антагонист серотонина3, метаклопрамид при концентрации 16,0 мкМ, (b) антагонист серотонина2 , тразадон при концентрации 1,6 мкМ, и (с) антагонист гистамина, прометазин при концентрации 1,0 мкМ, все в нормальном солевом растворе. Это исследование было выполнено в разведывательных целях, статистически и вслепую. Отнесение к специфическим группам было статистическим и исследователи работали вслепую с содержимым инфузионного раствора (одного солевого раствора или солевого раствора, содержащего антагонисты гистамин/серотонинового рецептора) до окончания ангиографического анализа.
2. Протокол животного.
Этот протокол был утвержден Медицинским центром Seattle Veteran Affiars по использованию животных и исследовательская лаборатория являлась полностью аккредитованной Американской Ассоциацией Accreditation of Laboratory Animak Care. Были изучены подвздошные артерии 3-4 кг самцов Новозеландского белого кролика, выкормленных регулярной кроличьей едой. Животные были успокоены с использованием внутривенного введения ксилазина (5 мг/кг веса) и Кетамина (35 мг/кг веса) и был проведен разрез в вентральной средней части шеи для выделения каротидной артерии. Артерия была лигирована дистально, выполнена артериотомия и оболочка 5 French была введена в опущенную аорту. Были зарегистрированы нулевая линия давления крови и частота сердечного сокращения и затем ангиограмма дистальной аорты и билатеральных подвздошных артерий была зарегистрирована на 35 мм кинопленке (скорость рамки 15 в секунду) с использованием инъекции вручную иопамидола 76% (Squibb Diagnostics, Princeton, NJ) в опущенную аорту. Для каждой ангиограммы каллиброванный образец был помещен в радиографическое поле обзора для корректировки значений, когда проводили измерение диаметра. 2,5 французский инфузионный катетер (Advanced Cardiavascular Systems, Santa Clara, CA) был введен через каротидную оболочку и установлен на 1-2 см выше разветвления аорты. Инфузия испытываемого раствора, либо одного солевого раствора, либо солевого раствора, содержащего антагонисты гистаминового/серотонинового рецептора, была начата со скоростью 5 см3 в минуту и продолжалась в течение 15 минут. Через 5 минут инфузии была проведена вторая ангиограмма с использованием предварительно описанной процедуры, затем 2,5 мм баллон ангиопластичный катетер (the Ligthning, Cordis Corp., Miami, FGL) был быстро продвинут через флуороскопическое направляющее приспособление в левую и затем в правую подвздошную артерии. В каждой подвздошной артерии баллон-катетер был осторожно установлен между проксимальным и дистальным бедренными разветвлениями, использующими костистые ориентиры (bony landmarks), и баллон был надут в течение 30 секунд до давления 12 атм. Баллонный катетер был наполнен, используя разбавленный раствор радиографического контрастного агента таким образом, что диаметр наполненного баллона мог быть зафиксирован на кинопленку. Ангиопластичный катетер был быстро удален и другая ангиограмма была зарегистрирована на кинопленку через 8 минут после того, как была начата инфузия. Инфузия была продолжена до точки, соответствующей 15 минутам, и была зарегистрирована другая ангиограмма (четвертая). Затем инфузия была прекращена (было введено общее количество раствора 75 см3) и инфузионный катетер был удален. В точке, соответствующей 30 минутам (через 15 минут после прекращения инфузии), была зарегистрирована конечная ангиограмма как прежде. Давление крови и частота сердечных сокращений были зарегистрированы в точках, соответствующих 15 минутам и 30 минутам, немедленно до начала ангиограмм. После конечной ангиограммы животное было безболезненно умерщвлено передозировкой анестезирующих агентов, введенных внутривенно, и подвздошные артерии были восстановлены и зафиксированы погружением в формацию для гистологического анализа.
3. Ангиографический анализ.
Ангиограммы были зарегистрированы на 35 мм кинопленке при скорости рамки 15 проходов в секунду. Для анализа ангиограммы проектировали из проектора Vanguard на расстояние около 15 см (5,5 фута). Диаметры подвздошной артерии в предварительно определенных местоположениях относительно баллон ангиопластичного участка регистрировали в основном вручную, удерживая инструмент измерения после поправки на величину, которую определяли измерением калиброванного объекта. Измерения были проведены на нулевой линии (до того как была начата инфузия испытываемого раствора), на 5 минуте инфузии, немедленно после баллон ангиопластии (через 8 минут после начала введения испытываемого раствора), на 15 минуте (как раз до того, как была прекращена инфузия) и на 30 минуте (через 15 минут после прекращения инфузии). Измерения диаметра были проведены в трех участках в каждой подвздошной артерии: ближе к участку баллон дилатации, в участке баллон дилатации и в дистальном участке баллон дилатации.
Измерения диаметра были затем переведены в измерения площади с помощью
формулы:
Площадь=(Рi)(Диаметр2)/4.
Для расчета вазоконстрикции была использована величина нулевой линии для представления максимальной площади артерии и процент
вазоконстрикции был рассчитан в виде:
% Вазоконстрикции = {Зона нулевой линии - Зона в точке в последний момент времени / Зона нулевой линии] • 100.
4. Статистические способы.
Все величины выражаются как значение +/-1 стандартной ошибки значения. Время протекания вазомоторного ответа в контрольных артериях было определено с использованием одного пути анализа изменения с поправкой на повторные измерения Post hoc сравнения данных между конкретными временными точками было проведено с использованием теста Scheffe. Как только были определены временные точки, в которых имела место значительная вазоконстрикция в контрольных артериях, контрольные артерии и артерии, обработанные антагонистом серотонин/гистаминового рецептора были сравнены в тех временных точках, где имела место значительная вазоконстрикция в контрольных артериях, с использованием множественного анализа вариаций, с обработанной группой, идентифицированной как независимая переменная величина. Для компенсации отсутствия единой ранее установленной гипотезы р - величина, равная меньше 0,01, считалась значительной. Статистические расчеты были проведены с использованием статистической программы для Wibdows, версия 4.5 (Statsoft, Tulsa, OK).
5. Результаты.
Время протекания изменения размера артерии до и после баллон ангиопластии в нормальных артериях, получавших инфузию солевого раствора, было оценено в 16 артериях от 8 животных (табл. 21). Были изучены три сегмента каждой артерии: проксимальный сегмент непосредственно верхнего потока из баллон дилатированного сегмента, баллон дилатированный сегмент и дистальный сегмент непосредственно нижнего потока из баллон дилатированного сегмента. Проксимальный и дистальный сегменты продемонстрировали аналогичные параметры изменения в артериальных размерах: в каждом из них было значительное изменение в артериальном диаметре, когда были сравнены все временные точки (проксимальный сегмент, р= 0,0002 и дистальный сегмент, р меньше 0,001, ANOVA). Post hoc испытания показали, что диаметры в точке непосредственно после ангиопластии были значительно меньше, чем диаметры в нулевой линии или в точке на 30 минуте в каждом из этих сегментов. С другой стороны, артериальные диаметры в каждом сегменте в точках на 5 минуте, 15 минуте и 30 минуте были аналогичными с диаметрами в нулевой линии. Баллон дилатированные сегменты показали меньшие изменения в артериальном размере, чем проксимальный и дистальный сегменты. Диаметр нулевой линии этого сегмента составлял 1,81+/-0,05 мм, нормальный растянутый диаметр баллона составлял 2,20+/-0,03 мм (р меньше 0,0001 против диаметра нулевой линии баллон обработанного сегмента). Таким образом, раздутый баллон заставлял периферически растягиваться баллон дилатированный сегмент, но наблюдали только небольшое увеличение в диаметре просвета от нулевой линии к точке на 30 минуте (1,82+/-0,05 мм к 1,94+/-0,07 мм, p=NS за счет post hoc испытаний).
Артериальные диаметры просвета были использованы для расчета площади просвета, затем измерения площади были использованы для расчета процентного содержания вазоконстрикции путем сравнения 5-минутных данных, тотчас после ангиопластии, 15 и 30 минутных данных с измерениями нулевой линии. Данные проксимального и дистального сегмента, выраженные в виде процентного содержания вазоконстрикции, показаны на фиг. 1, изменения в количестве вазоконстрикции в течение времени являются значительными (в проксимальном сегменте р=0,0008, в дистальном сегменте р=0,0001 ANOVA). Post hoc испытания идентифицировали вазоконстрикцию тотчас после ангиопластии, как значительно отличающуюся от той, которая имеет место в точке, соответствующей 30 минуте (р меньше 0,001 в обоих сегментах). В дистальном сегменте, тотчас после ангиопластии, вазоконстрикция была значительно меньше, чем это имело место в точке, соответствующей 5 минутам (р меньше 0,01), другие различия внутри этого промежутка были незначительными по данным post hoc испытаний.
Изменение просвета в контрольных артериях может быть суммировано следующим образом: 1) Вазоконстрикция с потерей приблизительно 30% зоны просвета нулевой линии имеет место в сегментах проксимальной и дистальной артерии к баллон дилатированному сегменту сразу после баллон дилатации. Имеют место тенденции к меньшему содержанию вазоконстрикции в проксимальном и дистальном сегментах до дилатации, но также и в точке, соответствующей 15 минуте (приблизительно через 7 минут после дилатации), точке, соответствующей 30 минуте (приблизительно через 22 минуты после дилатации), тенденция относительно вазодилатации заменялась предыдущей вазоконстрикцией, 2) В баллон дилатированном сегменте наблюдаются только небольшие изменения в размерах просвета, и, несмотря на использование баллона со значительно большим растянутым диаметром, чем присутствовал в этом сегменте в нулевой линии, значительного увеличения в диаметре просвета дилатированного сегмента не наблюдалось. Эти находки приводят к заключению о том, что любое влияние предполагаемой гистамин/серотониновой обработки будет обнаруживаемым только в проксимальном и дистальном сегментах в точках, соответствующих времени, когда происходила вазоконстрикция.
Блокирующий раствор гистамин/серотонинового рецептора был введен в 16 артерий (8 животным), данные ангиографии были оценены во всех временных точках в 12 артериях. Измерения частоты сердечных сокращений и систольного давления крови были оценены в подгруппе (subset) животных (табл. 22). Различий в частоте сердечных сокращений или систольного давления крови не наблюдали, когда сравнивали две группы животных в пределах конкретных временных точек. Гистамин/серотониновая обработка животных показала тенденцию к относительному снижению в систольном давлении крови от нулевой линии к 30-минутному (-14+/-5 мм Нg, р=0,04) и уменьшению частоты сердечных сокращений (-26+/-10, р=0,05). Внутри группы контрольных животных не происходило изменения частоты сердечных сокращений или систольного давления крови в процессе проведения эксперимента.
Было проведено сравнение проксимальных и дистальных сегментов гистамин/серотонинобработанных артерий с контрольными артериями, используя процентное содержание измерения вазоконстрикции. Фиг. 2А показывает влияние введения гистамин/серотонина в проксимальный сегмент вазоконстрикции, относительно вазоконстрикции, присутствующей в контрольных артериях. Когда было проведено сравнение результатов в двух обработанных группах в нулевой линии тотчас после ангиопластии и в точке, соответствующей 15 минуте, гистамин/серотониновое введение приводило к меньшей вазоконстрикции по сравнению с контрольным введением солевого раствора (р=0,003, 2 пути ANOVA). Сравнение в дистальном сегменте двух обработанных групп иллюстрируется на фиг. 2В. Несмотря на наблюдающееся различие в значениях измерений диаметра в дистальном сегменте, сосуды, обработанные раствором, показывали меньшую вазоконстрикцию, чем сосуды, обработанные солевым раствором в нулевой линии тотчас после ангиопластии и в точках, соответствующих 15 минуте, этот образец не достигал статистического значения (р= 0,32, 2 пути ANOVA). Отсутствие статистического значения может быть приписано меньшей, чем ожидалось, вазоконстрикции в контрольных сосудах.
Н. Пример VIII
Ингибирование амитриптиленом 5-гидрокситриптаниин-индуцированной экстравазации плазмы коленного сустава - сравнение
внутрисуставного и внутривенного путей введения.
Следующее исследование было проведено для того, чтобы сравнить два пути введения антагониста 5-НТ2 рецептора, амитриптилена: 1) непрерывное внутрисуставное введение, по сравнению с 2) внутривенной инъекцией в синовиальную модель воспаления крысиного колена. Была определена способность амитриптилена ингибировать 5-НТ-индуцированную экстравазацию плазмы сустава путем сравнения эффективности и полной дозы лекарства амитриптилена, доставленного через каждый путь.
1. Животные.
Было получено утверждение Institutional Animal Care Committee at University of California, San Francisco для этих исследований. Самцы крыс Sprague-Dawley (Bantin and Kingman, Fremont, CA), весящих 300-450 г были использованы в этих исследованиях. Крысы были размещены при контролированных условиях освещения (свет включали с 6 утра до 6 часов вечера), с пищей и водой доступными ab libitum.
2. Экстравазация плазмы.
Крысы были подвергнуты анестезированию барбиталом натрия (65 мг/кг), и затем им проводили инъекцию в хвостовую вену, голубого красителя Evans (50 мг/кг в объеме 2,5 мл/кг), который выступал в качестве маркера для экстравазации плазмы. Капсула коленного сустава была подвергнута воздействию за счет иссечения вышележащей кожи, и 30-каллиброванную иглу вводили в сустав и использовали для введения жидкости. Скорость введения (250 мкл/мин) контролировали с помощью сифона Sage Instrument Syringe pump (Model 341 D, Orion Research Inc. , Boston, MA). В суставное пространство вводили 25-каллиброванную иглу и проводили извлечение перфузатной жидкости при 250 мкл/мин, контролируя процесс за счет Sage Instrument Syringe pump (Model 351).
Крысы были статистически распределены на три группы: 1) те, которые получали только внутрисуставно (IA) 5-НТ (1 мкМ), 2) те, которые получали амитриптилен внутривенно (IV) (с дозами в области от 0,01 до 1,0 мг/кг) с последующим IA 5-НТ (1 мМ), и 3) те, которые получали амитриптилен внутрисуставно (IA) (концентрации в области от 1 до 100 нМ) с последующим IA 5-НТ (1 мМ) плюс IA амитриптилен. Во всех группах уровни экстравазации плазмы нулевой линии были получены сначала каждого эксперимента путем перфузии 0,9% солевого раствора внутрисуставно и сбора трех образцов перфузата в течение 15-минутного периода (один раз каждые 5 минут). Первой группе был затем введен 5-НТ IA в течение полных 25 минут. Образцы перфузата собрали каждые 5 минут в течение полных 25 минут. Затем образцы анализировали на содержание голубого красителя Evans путем спектрофотометрического измерения поглощения при 620 нм, которое линейно связано с его концентрацией (Carr and Wilhtlm, 1964). IV амитриптиленовой группе лекарство было введено через хвостовую вену инъекцией голубого красителя Evans. Коленные суставы были затем подвергнуты перфузии в течение 15 минут солевым раствором (нулевая линия) с последующей 25-минутной перфузией 5-НТ (1 мкМ). Образцы перфузата собирали каждые 5 минут и анализировали, как приведено выше.
Колени некоторых крыс были исключены из исследования вследствие физического повреждения коленного сустава или ошибки во время вливания или экстракции (обнаруживаемой по присутствию крови в перфузате и высоким уровням экстравазации плазмы нулевой линии или распухания коленного сустава, обусловленного неправильным введением иглы).
а. 5-НТ-индуцированная экстравазация плазмы.
Нулевая линия экстравазации плазмы была измерена во всех трех испытанных коленных суставах (полное число n=22). Уровни нулевой линии экстравазации плазмы были ниже усредненных 0,022+/-0,003 единиц поглощения при 620 нм (среднее +/- стандартная ошибка значения). Этот уровень нулевой линии экстравазации показан на фиг. 1 и 2 в виде прерывистой линии.
5-НТ (1 мкМ) перфузированный в коленный сустав продуцировал зависимое от времени увеличение экстравазации в плазме выше уровней нулевой линии. В течение 25-минутной перфузии 5-НТ внутрисуставно, максимальные уровни экстравазации плазмы были достигнуты в течение 15 минут и продолжались до тех пор, пока перфузия не была прекращена через 25 минут (данные не показаны). Поэтому уровни 5-НТ-индуцированной экстравазации плазмы являются средними от точек, соответствующих 15, 20 и 25 минутам в процессе каждого эксперимента. Усредненная 5-НТ-индуцированная экстравазация плазмы 0,192+/-0,011 приводила приблизительно к 8-кратной стимуляции выше нулевой линии. Это значение представляется графически на фиг. 3 и 4, соответствующих "0" дозе IV амитриптилена и "0" концентрации IA амитриптилена соответственно.
b. Влияние амитриптилена, введенного внутривенно, на 5-НТ-индуцированную экстравазацию плазмы.
Амитриптилен, введенный посредством инъекции в хвостовую вену, продуцировал зависимое от дозы уменьшение в 5-НТ-индуцированной экстравазации плазмы, как показано на фиг. 3. Величина IC50 для IV амитриптиленового ингибирования 5-НТ-индуцированной экстравазации плазмы полностью ингибируется дозой IV амитриптилена 1 мг/кг, усредненная экстравазация плазмы равна 0,034+/-0,010.
с. Влияние внутрисуставного введения амитриптилена на 5-НТ-индуцированную экстравазацию плазмы.
Амитриптилен, введенный один в повышающейся концентрации внутрисуставно, не оказывал влияния на уровни экстравазации плазмы относительно нулевой линии, с усредненной экстравазацией плазмы 0,018+/-0,002 (данные не показаны). Амитриптилен, соперфузированный в повышающихся концентрациях с 5-НТ, продуцировал зависимое от концентрации снижении в 5-НТ-индуцированной экстравазации плазмы, как показано на фиг. 4. 5-НТ-индуцированная экстравазация в присутствии 3 нМ IA амитриптилена не значительно отличалась от той, которая была продуцирована одним 5-НТ, однако 30 нМ амитриптилена, соперфузированных с 5-НТ, продуцировали бoльше чем 50% ингибирование, в то время как 100 нМ амитриптилена продуцировали полное ингибирование 5-НТ-индуцированной экстравазации плазмы. Величина IC50 для IA амитриптиленового ингибирования 5-НТ-индуцированной экстравазации плазмы составляла приблизительно 20 нМ.
Большая часть найденного настоящим исследованием состоит в том, что 5-НТ (1 мкМ), перфузированный внутрисуставно в коленный сустав, продуцировал стимулирование экстравазации плазмы, которое составляло приблизительно величину в 8 раз выше уровней нулевой линии и что либо внутривенное, либо внутрисуставное введение антагониста 5-HT2 рецептора, амитриптилена, может ингибировать индуцированную 5-НТ экстравазацию плазмы. Полная доза введенного амитриптилена, однако, существенно отличается между двумя способами высвобождения лекарства. Величина IC50 для ингибирования IV амитриптиленом 5-НТ-индуцированной экстравазации плазмы составляла 0,025 мг/кг, или 7,5•10-3 мг для 300 г взрослой крысы. Величина IC50 для IА ингибирования амитриптиленом 5-НТ-индуцированной экстравазации плазмы составляла приблизительно 20 нМ. Так как 1 мл этого раствора высвобождали каждые 5 минут в течение полных 35 минут в процессе эксперимента, полная доза перфузированного в колено раствора была 7 мл, с полной дозой 4,4•10-5 мг, перфузированной в колено. Эта IA амитриптиленовая доза составляла приблизительно величину в 200 раз меньше, чем доза IV амитриптилена. Кроме того, вероятно, что только небольшая доля IA перфузированного лекарства систематически поглощалась, приводя в результате даже к большему различию в полной дозе высвобожденного лекарства.
Так как 5-НТ может играть важную роль в возникновении хирургической боли и воспаления, как обсуждалось раньше, 5-НТ антагонисты такие, как амитриптилен, могут быть полезными, если используются в ходе операции. В недавних исследованиях были предприняты попытки определения влияния орального введения амитриптилена на постоперативную ортопедическую боль (Kerrick et al., 1993). Оральная доза, такая низкая, как 50 мг, продуцировала нежелательные CNS побочные эффекты, такие как "ухудшенное ощущение самочувствия". Их исследование, кроме того, также показало, что орально введенный амитриптилен продуцировал более высокие показатели болевой шкалы, чем плацебо (РO.05) у послеоперационных пациентов. Было ли это обусловлено общим неприятным ощущением, продуцированного оральным введением амитриптилена, является неизвестным. Напротив, внутрисуставный путь введения позволяет вводить чрезвычайно низкие концентрации лекарства, которое высвобождается локально к участку воспаления, приводя, возможно, к максимальной пользе с минимальными побочными эффектами.
В то время как предпочтительный вариант изобретения был проиллюстрирован и описан, должно быть понятно, что различные изменения в обсуждавшихся растворах и способах могут быть проведены без отклонения от сути и объема изобретения. Например, могут быть рассмотрены альтернативные ингибиторы боли и воспаления и противоспазматические агенты, которые могут усиливать или заменять раскрытые агенты в соответствии с описанием содержащимся в них. Поэтому это описание предназначается для того, чтобы был защищен патент, который ограничивается только определениями приложенной формулы изобретения.
Реферат
Изобретение относится к растворам для хирургического орошения и способам их применения, в частности к противовоспалительным, противоболевым и противосудорожным растворам. Раствор для непрерывного орошения раны в процессе медицинской процедуры включает по меньшей мере два ингибирующих агента боли/воспаления или спазма в физиологической жидкости. Физиологическая жидкость выступает в качестве носителя. Каждый агент в растворе находится в концентрации не больше чем 100000 нмолей. Указанные ингибирующие агенты действуют посредством различных молекулярных механизмов в клетках-мишенях. Орошающий раствор настоящего изобретения представляет собой разбавленный раствор и обеспечивает подавление боли, воспаления или спазма при низких дозах ингибирующих агентов. 4 с. и 26 з.п. ф-лы, 28 табл., 5 ил.


Комментарии