Бактериолитический комплекс, способ его полученияи штамм для осуществления способа - RU2193063C2
Код документа: RU2193063C2
Чертежи


Описание
Изобретения относятся к области биотехнологии и могут быть использованы при получении лечебного препарата для медицинских и ветеринарных целей.
Известно использование бактериолитических препаратов в качестве лекарственных средств для лечения ряда заболеваний, вызванных патогенной микрофлорой, в том числе устойчивой к антибиотикам.
Известен препарат, обладающий бактериолитическим действием - лизоцим (Егоров Н. С. Основы учения об антибиотиках, 1979, "Высшая школа", стр. 347-349). Лизоцим яичного белка активен в отношении узкого спектра микроорганизмов, который ограничен, в основном, микрококками. По специфичности действия на пептидогликан клеточной стенки микроорганизмов лизоцим является мурамидазой, то есть разрушает связь между мурамовой кислотой и глюкозамином с образованием фрагментов с мурамовой кислотой на редуцирующем конце.
Именно поэтому лизоцим лизирует узкий спектр грамположительных микроорганизмов. В частности, он не лизирует клеточные стенки стафилококков - грамположительных патогенных бактерий, отличительной чертой которых является наличие пентаглицинового межпептидного мостика, придающего дополнительную жесткость их клеточной стенке. Кроме того, как большинство ферментных препаратов лизоцим недостаточно стабилен. Все вышесказанное касается и лизоцимов из других источников, например, растительных или бактериальных.
Известен также ферментный препарат на основе бактериолитических ферментов - лизостафин (Schindler С.A., Schuchardt V.Т. Lysostaphin: a new bacteriolytic agent for the Staphylococcus. 1964, Proc. of the Nation. Acad. Sci. USA, v. 51, 3, pp. 415-421).
Однако он не стабилен и используется только в лабораторной практике.
Известен комплекс бактериолитических ферментов, лизирующий грамположительные микроорганизмы, в частности патогенные множественно устойчивые к антибиотикам стафилококки и другие микроорганизмы, полученный из культуральной жидкости бактерии Xanthomonas campestris ВКПМ В-4102 (патент RU 1549227, кл. C 12 N 9/00, 1984).
Комплекс бактериолитических ферментов из культуральной жидкости бактерии Xanthomonas campestris является основой для 2 препаратов: препарат, используемый в медицине, получил название лизоамидаза, а используемый в ветеринарии - лизомаст.
В его состав входят три бактериолитических фермента: мурамидаза, мурамоилаланинамидаза, эндопептидаза, высокополимерный полисахарид, протеаза и балластные компоненты (О.А. Степная, Л.А. Ледова, И.С. Кулаев. "Бактериолитические ферменты". - "Успехи биологической химии", т.XXXIX, ОНТИ ПНЦ РАН, Пущино, 1999, стр. 341-346).
Соотношение компонентов в комплексе, установленное авторами,
составляет, мас.%:
бактериолитические
ферменты (мурамидаза, мурамоилаланинамидаза эндопептидаза) - 1,0-2,0
протеаза - 0,5-1,0
балластные компоненты - 4,0-8,0
полисахарид - остальное
Три
бактериолитических фермента обладают разной субстратной специфичностью по отношению к: пептадогликанам клеточных стенок микроорганизмов: а) мурамидаза - аналог
лизоцима по специфичности; 6)
мурамоилаланинамидаза, отщепляющая пептидную часть пептидогликана от полисахаридной; в) эндопептидаза, разрушающая связи внутри межпептидных мостиков клеточной стенки.
За счет этого препарат активно
разрушает клетки широкого спектра грамположительных микроорганизмов, в том числе патогенных стрептококков и стафилококков.
Благодаря наличию в лизоамидазе протеазы и двух из бактериолитических ферментов лизоамидазы - эндопептидазы и мурамоилаланинамидазы, - обладающих одновременно и протеолитической активностью, препарат хорошо очищает раны от некротических масс.
Полисахарид в составе комплекса обеспечивает стабильность бактериолитических ферментов (О.А. Степная, Л.A. Ледова, И.С. Кулаев. Биохимия, т.58, вып. 10, 1993, стр. 1523-1528). Структура полисахарида образована повторяющейся единицей, состоящей из N-ацетилглюкозамина, N-ацетилманнуроновой и 14-ацетилгалактуроновой кислот (L.M. Lilkhosherstov, S.N. Senchenkova, Y.A. Knirel еt at. FEBS Litters, N 368, 1995, p. 113-116).
Недостатком этого комплекса является то, что из-за наличия практически половины бактериолитических ферментов в денатурированной форме и балластных компонентов недостаточно высока его бактериолитическая активность. Кроме того, балластные компоненты не обладают медицинским действием, но возможно возникновение на них аллергических реакций.
Известен способ получения комплекса литических ферментов (патент RU 1774658, кл. C 12 N 9/36, 1990), включающий культивирование штамма - продуцента Xanthomonas campestris ВКПМ В-1402 на жидкой питательной среде, содержащей глюкозу, бактопептон, белково-витаминный концентрат (БВК) в количестве 2,5-6,0 г/л и минеральные соли, в условиях аэрации и перемешивания с последующим выделением целевого продукта, при этом часть БВК вносят в исходную среду. Содержание бактериолитических ферментов в культуральной жидкости в единицах бактериолитической активности составляет 40-60 ед/мд.
Выделение проводят по способу выделения комплекса литических ферментов, описанному в патенте RU 1755581, кл. C 12 N 9/36, 1990, включающему охлаждение фильтрата культуральной жидкости, осаждение целевого продукта органическим растворителем, охлаждение и отделение осадка, диализа и лиофильную сушку, причем перед осаждением фильтрат охлаждают, подкисляют до рН 3,5-5,0, добавляют 2,5-3, 5 объема охлажденного этанола, выдерживают без перемешивания на холоду.
Содержание бактериолитических ферментов в препарате в единицах бактериолитической активности не превышает 50 ед/мг препарата.
Выход готового препарата от содержания литического комплекса в культуральной жидкости 40-60%.
И содержание бактериолитических ферментов в культуральной жидкости и выход готового препарата при осуществлении этого способа недостаточно велики.
Наиболее близким к предлагаемому
способу по совокупности существенных признаков и достигаемому
эффекту является способ получения комплекса литических ферментов (патент RU 1549227, кл. С 12 N 9/00, 1984), который предусматривает
культивирование бактерии Хanthomonas campestris ВКПМ В-4102 на
питательной среде, содержащей следующие компоненты, г/л:
глюкоза - 2,0-12,0
бактопептон - 2,0-6,0
белково-витаминный концентрат - 2,5-6,0
Nа2НРO4x12Н2О - 0,5-4,0
КН2РO4 - 0,1-1,0
NaCl - 0,35-1,0
MgSO4x7Н2О - 0,2-3,0
FeSO4x7Н2
О - 0,01-0,1
вода - до 1 л
Процесс прекращают после достижения стабильной литической активности
культуральной жидкости. Затем биомассу отделяют центрифугированием, комплекс
литических ферментов, содержащихся в растворе, выделяют дробным осаждением ацетоном с последующим фракционным осаждением
сульфатом аммония, осадок растворяют, раствор диализуют, лиофильно сушат.
Содержание бактериолитических ферментов в культуральной жидкости в единицах бактериолитической активности не превышает 63 ед/мл.
Выход готового препарата недостаточно высок - он составляет от содержания литического комплекса в культуральной жидкости около 20%.
Недостатком указанного способа является то, что белково-витаминный концентрат в настоящее время не выпускается отечественной промышленностью ввиду того, что его производство является неэкологичным, использование в составе среды дорогостоящего импортного бактопептона фирмы Difco (США) нерационально, так как значительно увеличивает стоимость конечного продукта.
Кроме того, использование для осаждения ферментов из культуральной жидкости продуцента этанола (RU 1755581), как и ацетона (RU 1549227) приводит к необратимой денатурации примерно половины бактериолитических, определяющих терапевтическое действие препарата ферментов, содержащихся в культуральной жидкости (по результатам определения бактериолитической активности и электрофоретическому анализу), а следовательно, к значительному уменьшению выхода продукта (см. чертеж).
В готовых препаратах лизоамидазы, полученных по известным способам, присутствует значительное количество минорных компонентов балластных белков (см. чертеж), которые, не имея медицинского эффекта, могут вызывать аллергическую реакцию.
Известен штамм - продуцент комплекса - бактерии Xanthomonas campestris ВКПМВ-102.
Недостатком этого штамма-продуцента является то, что из-за наличия в продуцируемом комплексе минорных компонентов недостаточно высока бактериолитическая активность.
Задача, на решение которой направлены заявляемые изобретения, - получение комплекса бактериолитических ферментов.
Технический результат, который может быть получен при осуществлении изобретения, заключается в увеличении количества и содержания бактериолитических ферментов в культуральной жидкости бактерии-продуцента, увеличении выхода продукта, оптимизации состава конечного продукта (уменьшение содержания в конечном продукте балластных белков), ускорении процесса получения готового продукта.
При этом также происходят удешевление продукта и ускорение процесса его получения.
Сущность предлагаемого бактериолитического комплекса заключается в том, что он продуцируется штаммом бактерии Xanthomonas campestris XL1 (Lysobacter sp. XL1) и кроме бактериолитических ферментов - мурамидазы, мурамоилаланинамидазы, эндопептидазы, полисахарида и протеазы, он дополнительно содержит бактериолитический фермент, имеющий молекулярную массу около 22 кДа.
Эти компоненты содержатся
в комплексе при следующем соотношении, мас.%:
бактериолитические ферменты (мурамидаза, мурамоилаланинамидаза, эндопептидаза),
бактериолитический фермент, имеющий молекулярную массу около 22
кДа - 2-5
протеаза - 1-2
балластные компоненты - 2-4
полисахарид - остальное
Предлагаемый препарат
- комплекс бактериолитических ферментов разрушает клетки
грамположительных микроорганизмов, в том числе патогенных множественно устойчивых к антибиотикам (см. таблицу).
Наличие дополнительного бактериолитического фермента в препарате увеличивает бактериолитическую активность последнего. Предлагаемый комплекс содержит примерно в два раза меньше балластных компонентов, что очевидно из результатов электрофоретического анализа, представленных на чертеже. Бактериолитическая активность комплекса составляет 60-90 ЛЕ/мг.
Сущность предлагаемого способа
получения бактериолитического комплекса заключается в том, что
штамм-продуцент Xanthomonas campestris XL1 (Lysobacter sp. XL1) культивируют на питательной среде, содержащей глюкозу, пептон, дрожжевой
экстракт или дрожжевой автолизат фосфорнокислые соли натрия и
калия, сернокислый магний, хлористый калий, сернокислое железо и воду при следующем содержании компонентов, г/л:
глюкоза - 2,0-6,
0
пептон - 1,5-6,0
дрожжевой экстракт - 1,
0-6,0
или дрожжевой автолизат с аминным азотом 440-490 мг/л - 40-300 мл
Nа2НРO4x12Н2О
- 4,0-5,0
КH2PО41,0-2,0
MgSO4x7H2O - 4,0-6,0
КСl - 0,4-1,60
FеSO4x7Н2О - 0,05-0,20
вода
- до 1 л
Процесс прекращают по достижении стабильной
литической активности культуральной жидкости. Биомассу отделяют центрифугированием, из культуральной жидкости ферментный комплекс
осаждают сульфатом аммония (70-85% насыщения), осадок растворяют,
раствор диализуют, лиофильно сушат.
Технический эффект при использовании предлагаемого способа достигается тем, что в
известном способе культивирование штамма бактерии Xanthomonas
campestris XL1 проводят на питательной среде, содержащей глюкозу, пептон, дрожжевой экстракт или дрожжевой автолизат, фосфорнокислые соли
натрия и калия, сернокислый магний, хлористый калий,
сернокислое железо и воду при следующем содержании компонентов, г/л:
глюкоза - 2,0-6,0
пептон - 1,5-6,0
дрожжевой
экстракт - 1,0-6,0
или дрожжевой автолизат с
аминным азотом 440-490 мг/л - 40-300 мл
Nа2НРO4x12Н2О - 4,0-5,0
КН2РO4
- 1,0-2,0
MgSO4x7H2O - 4,
0-6,0
КCl - 0,4-1,60
FeSO4x7H2O - 0,05-0,20
вода - до 1 л
а осаждение комплекса
сульфатом аммония проводят непосредственно из культуральной
жидкости.
Предлагаемые компоненты питательной среды и их соотношения позволяют сделать среду дешевле и повысить содержание бактериолитических ферментов в культуральной жидкости продуцента с 30-60 ЛЕ/мл (в известных способах) до 70-90 ЛЕ/мл снизить содержание в ней балластных белков (см. чертеж).
Бактериолитическую активность в процессе культивирования и в
ходе выделения ферментного комплекса определяют следующим образом: к 2 мл суспензии лиофилизированных клеток Staphylococcus aureus 209-Р в
0,01 М трис-НСl буфере, рН 8,4-8,5 с концентрацией 0,5-0,6
единиц оптической плотности, прогретой в течение 10 минут при 37оС, добавляют 0,1 мл пробы, смесь инкубируют 5 минут при 37оС. Активность рассчитывают по формуле
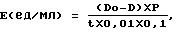
где D - оптическая плотность пробы после инкубации;
Do - оптическая плотность контроля;
t - время инкубации, минуты;
Р - разведение пробы;
0,01 - оптическая плотность, соответствующая 1 единице активности;
0,1 - объем пробы, мл (патент RU 1549227).
Увеличение в питательной среде содержания сульфата магния стимулирует продукцию бактериолитических ферментов.
Изменение схемы выделения - исключение из схемы очистки дробного осаждения ацетоном (патент RU 1549227) или спиртом (патент RU 1755581) - сокращает длительность процесса получения конечного продукта и увеличивает выход целевого продукта с 20-50% (в известных способах) до 80-100% от содержания в культуральной жидкости.
Для осуществления предлагаемого способа предлагается штамм бактерии Xanthomonas camрestris XL1 (Lysobacter sp. XL1) - продуцент бактериолитического комплекса.
Штамм бактерии Xanthomonas campestris XL1 (Lysobacter sp. XL1) депонирован во Всероссийской коллекции микроорганизмов при Институте биохимии и физиологии микроорганизмов им. Г. К. Скрябина РАН (г. Пущино Московской области, проспект Науки, 5) под номером ВКМ В-2249 Д.
Штамм получен путем селекции на селективных средах из штамма бактерий Xanthomonas campestris BKПM В 4102.
Культурально-морфологические признаки штамма
Неподвижные
(отсутствие жгутиков) прямые палочки размером 0,6-0,7x2,
0 мкм, расположенные одиночно и попарно.
На стандартных питательных средах (МПА, BBL, Becton Dickinson) образует круглые колонии 2 мм и более в диаметре, выпуклые, гладкие, блестящие, слизистые, края ровные, желтые, непрозрачные. Выделяет в питательную среду черно-коричневый пигмент, время появления которого и интенсивность зависят от состава среды. Имеет мукоидный рост на агаризованной среде с 5% глюкозы. Окраска по Граму методом Грегерсена (Gregersen, 1978) - грамотрицительная.
Биохимические признаки
Анаэроб. Хемоорганотроф. Нуждается в
факторах роста.
Оксидазо- и каталазоположительный.
Оптимальная температура роста: +25-30оС, растет при +4оС и слабо при +37oС.
Не обладает способностью к денитрификации. Образует кислоту в аэробных условиях из глюкозы.
Гидролизует желатин, эскулин, казеин.
Образует H2S из пептона.
Растет на средах, содержащих до 4% NaCl.
Идентификация проведена на основании: Bergey's manual of systematic bacteriology. Eds. Noel R. Krieg, John G. Holt. Baltimore; London Williams & Wilkins. 1984, v.1.
Штамм Xanthomonas campestris XL1 не патогенен для человека и животных. Штамм продуцирует бактериолитический комплекс, включающий бактериолитические ферменты (мурамидазу, мурамоилаланинамидазу, эндопептидазу, бактериолитический фермент, имеющий молекулярную массу около 22 кДа), протеазу, кислый высокомолекулярный полисахарид, и балластные компоненты.
На чертеже представлены белковые спектры бактериолитических комплексов (электрофорез в полиакриламидном теле), полученных по известным и предлагаемому способам.
Возможность осуществления способа подтверждается следующими примерами, но не ограничивается ими.
Пример 1.
В колбу емкостью 750 мл вносят 150
мл питательной среды состава, г/л:
глюкоза - 5,0
пептон - 2,0
дрожжевой
экстракт - 2,5
Nа2НРO4х12Н2О - 4,0
КН2
РO4 - 1,0
КСl - 0,5
MgSO4х7Н2О - 3,0
FeSO4х7Н2О - 0,1
вода - до 1 л
доводят рН среды до 7,0 10%-ным
раствором NaOH. Колбу со средой стерилизуют. В стерильную колбу со средой вносят 10% инокулята
бактерий Xanthomonas campestris XL1 и культивируют в течение 24 часов при 29оС на качалке (200
оборотов в минуту). Бактериальные клетки отделяют центрифугированием.
К 24 часам культивирования бактериолитическая активность культуральной жидкости составляет 72 ЛЕ/мл.
Пример 2.
Культивируют штамм Xanthomonas campestris XLl, как указано в
примере 1, на среде следующего состава, г/л:
глюкоза - 5,0
пептон - 2,0
дрожжевой автолизат - 100 мл
Na2HPО4х12H2О - 4,2
КН2РО4 - 1,0
КCl - 0,6
MgSО4х7Н2О - 5,
0
FeSO4х7Н2О - 0,1
вода - до 1 л
К 24 часам
культивирования бактериолитическая активность культуральной жидкости составляет 70 ЛЕ/мл.
Пример 3.
Культивируют штамм-продуцент, как указано в примере 1, на среде
следующего состава, г/л:
глюкоза - 5,0
пептон - 2,0
дрожжевой экстракт - 2,0
Na2HPО4х12H2O - 4,2
КН2РO4 - 1,0
КСl - 0,6
MgSO4х7Н2О - 5,0
FeSO4
х7Н2О - 0,1
вода - до 1 л
К 24 часам культивирования активность
культуральной жидкости 90 ЛЕ/мл.
Пример 4.
В ферментер Анкум вносят 6 л
питательной среды следующего состава, г/л:
глюкоза - 5,0
пептон - 2,0
дрожжевой экстракт - 2,0
Nа2НРO4x12Н2O - 4,2
КH2PО4 - 1,0
КСl - 0,6
МgSO4х7Н2О - 5,
0
FeSO4х7H2O - 0,1
вода - до 1 л
стерилизуют при 0,5
кгс/см2 30 минут.
В ферментер вносят стерильно 300 мл посевного материала, выращенного на среде вышеуказанного состава. Культивирование ведут при 29оС, подаче воздуха 0,3 объема на 1 объем среды в минуту. чтобы парциальное давление кислорода в среде не опускалось ниже 30% от насыщения.
Поддерживают рН среды в интервале 6,2-7,5, подавая в среду соответственно 10%-ный раствор NaOH при его понижении или 10%-ный раствор НСl при повышении рН. К 24 часам культивирования активность культуральной жидкости составляет 70 ЛЕ/мл.
К охлажденной культуральной жидкости (5,6 л) добавляют сульфат аммония до 80% насыщения, выдерживают 12 часов, отделяют осадок центрифугированием. Осадок растворяют в воде, диализуют, после диализа получают 500 мл раствора, содержащего бактериолитический комплекс.
Раствор лиофильно сушат, получают около 5 г препарата с активностью 72 ЛE/мг препарата.
Суммарная бактериолитическая активность культуральной жидкости составляет 355320 ЛЕ, суммарная активность конечного продукта 360000 ЛЕ. Выход готового продукта 100% от содержания в культуральной жидкости.
Результаты электрофоретического анализа препаратов лизоамидазы, полученных по известным способам и по предлагаемому способу, представлены на чертеже.
Пример 5.
Культуру-продуцент Xanthomonas campestris XL1 выращивают в ферментере Анкум, как в примере 4, на среде, описанной в примере 2. К 24 часам активность культуральной жидкости составляет 65 ЛЕ/мл. При получении конечного продукта по схеме, приведенной в примере 4, бактериолитическая активность препарата - 60 ЛЕ/мг. Выход конечного продукта составляет 100%.
Электрофоретический анализ конечных продуктов показал, что при использовании известных способов получения комплекса конечный продукт имеет большое количество балластных белков, причем многие из них находятся в препарате в таком же количестве, что и бактериолитические ферменты.
Конечный продукт, полученный предлагаемым способом, содержит значительно меньшее количество балластных белков и обогащен бактериолитическими ферментами.
Данные таблицы показывают, что предлагаемый препарат по сравнению с известным лизирует дополнительно 10 штаммов бактерий семи видов и, кроме того, лизирует дополнительно клетки 18 клинических штаммов золотистого стафилококка, выделенных непосредственно от больных.
Таким образом, предлагаемый способ позволяет повысить содержание бактериолитических ферментов в культуральной жидкости продуцента Xanthomonas campestris XL1, увеличить выход конечного продукта, уменьшить содержание в конечном продукте балластных белков (см. чертеж).
Кроме того, способ сокращает время процесса получения конечного продукта, уменьшает стоимость конечного продукта.
Реферат
Изобретения относятся к области биотехнологии и могут быть использованы при получении лечебного препарата для медицинских и ветеринарных целей. Бактериолитический комплекс, продуцируемый бактерией Xanthomonas campestris XL1 (штамм депонирован под номером ВКМ В-2249 Д) содержит бактериолитические ферменты (мурамидаза, мурамоилаланинамидаза, эндопептидаза, бактериолитический фермент с молекулярной массой около 22 кДа, протеазу), полисахарид и балластные компоненты. Способ получения бактериолитического комплекса включает культивирование штамма-продуцента на питательной среде, содержащей глюкозу, пептон, дрожжевой экстракт или дрожжевой автолизат, фосфорнокислые соли натрия и калия, сернокислый магний, хлористый калий, сернокислое железо и воду. Изобретение обеспечивает увеличение содержания и выхода целевого продукта, ускорение и удешевление продукта и процесса его получения. 3 с.п. ф-лы, 1 табл., 1 ил.
Формула
Глюкоза - 2,0-6,0
Пептон - 1,5-6,0
Дрожжевой экстракт или дрожжевой автолизат с аминным азотом - 1,0-6,0
440-490 мг/л - 40-300 мл
Na2HPО4•12H2О - 4,0-5,0
КН2РО4 - 1,0-2,0
MgSО4•7H2О - 4,0-6,0
КСl - 0,4-1, 60
FeSO4•7H2O - 0,05-0,20
Вода - До 1 л
осаждение комплекса сульфатом аммония проводят непосредственно из культуральной жидкости.

Комментарии