Микроорганизмы, продуцирующие путресцин, и способ получения путресцина с использованием этих микроорганизмов - RU2665825C2
Код документа: RU2665825C2
Чертежи





















Описание
ПРЕДШЕСТВУЮЩИЙ УРОВЕНЬ ТЕХНИКИ
1. Область изобретения
Настоящее изобретение относится к рекомбинантному микроорганизму, имеющему повышенную путресциновую продуктивность, и к способу получения путресцина с высоким выходом с использованием этого микроорганизма.
2. Описание предшествующего уровня техники
Полиамины, такие как спермидин, спермин или тому подобное, присутствуют в большинстве живых клеток, и путресцин (или 1,4-бутандиамин) используется в качестве предшественника в метаболизме спермидина и спермина. Путресцин обнаружен у грамотрицательных бактерий и грибов и присутствует в высоких концентрациях у различных видов, указывая на то, что он играет важную роль в метаболических путях микроорганизмов.
В целом, путресцин является важным сырьем в синтезе полиамина нейлона-4, 6, получаемого взаимодействием с адипиновой кислотой. Путресцин получают главным образом химическим синтезом через акрилонитрил и сукцинонитрил из пропилена. Этот химический синтез представляет собой трехстадийный процесс, включающий реакцию каталитического окисления, реакцию с использованием цианидного соединения и реакцию гидрогенизации с использованием водорода под высоким давлением. Существуют проблемы, заключающиеся в том, что этот химический синтез вреден для окружающей среды и, кроме того, потребляет большое количество энергии, приводя к истощению запасов нефти. Таким образом, существует потребность в разработке более безопасного для окружающей среды и энергоэффективного способа получения путресцина, включающего использование биомассы.
У микроорганизмов путь биосинтеза путресцина идентичен пути синтеза аргинина от глутамата до синтеза орнитина. Возможны два пути биосинтеза путресцина у микроорганизмов. В одном пути происходит декарбоксилирование орнитина как промежуточного продукта с образованием путресцина. В другом пути происходит образование агматина посредством декарбоксилирования аргинина, синтезированного из орнитина, с последующим синтезом путресцина из агматина (Morris et al., J Biol. Chem. 241: 13, 3129-3135, 1996). Эти два пути приводят к выработке энергии, необходимой для метаболизма или позволяющей клетке быть устойчивой к окислительному стрессу.
В качестве способа получения путресцина с использованием микроорганизма был заявлен способ получения путресцина в высокой концентрации трансформацией Е. coli и Corynebacterium (международная патентная публикация № WO 06/005603; международная патентная публикация № WO 09/125924; Qian ZD et al., Biotechnol. Bioeng. 104: 4, 651-662, 2009; Schneider et al., Appl. Microbiol. Biotechnol. 88: 4, 859-868, 2010; Schneider et al., Appl. Microbiol. Biotechnol. 91: 17-30, 2011). Например, в WO 09/125924 раскрыт способ получения путресцина с высоким выходом путем улучшения биосинтетического пути орнитина, вместо инактивации путей, вовлеченных в деградацию и утилизацию путресцина, присутствующих у Е. coli, и инактивации превращения орнитина, как предшественника путресцина, в аргинин. Кроме того, в Schneider (2010) раскрыт способ получения путресцина в высокой концентрации путем введения и улучшения белка, способного превращать орнитин в путресцин, в штамм Corynebacterium sp., не продуцирующий путресцин.
Кроме того, в последнее время активно проводятся исследования транспортеров путресцина в клетках Е. coli, дрожжей, растений и животных (К Igarashi, Plant Physiol. Biochem. 48: 506-512, 2010). Транспорт путресцина в Ε. coli происходит 4 путями; potABCD или potFGHI, зависимыми от гидролиза АТФ, и potE как Н+-котранспортером, и puuP из пути puu. Относительно значений Km этих комплексов, вовлеченных в транспорт путресцина, для PotFGHI, potABCD, potE и puuP они составляют 0,5 мМ, 1,5 мМ, 1,8 мМ и 3,7 мМ, соответственно. Из этих четырех путей транспорта путресцина комплекс potFGHI считают наиболее подходящим. Кроме того, транспортер potE имеет функции транспорта путресцина как внутрь клетки, так и из нее. При нейтральном рН путресцин проникает в клетки вместе с протонами. Тем не менее, поскольку экспрессия путресцинсинтазы (speF) происходит в условиях кислого рН, проникновение в клетки внеклеточного орнитина и внеклеточное выведение путресцина, синтезированного в клетках, происходят одновременно (Kurihara et. al., J. Bacteriology 191: 8, 2776-2782, 2009).
Известными экспортерами путресцина у дрожжей являются TPO1 и TPO4. Эти аминокислотные последовательности очень похожи на аминокислотные последовательности бациллярного мультилекарственного транспортера (bacillus multidrug transporter) Bit.
Характеристики этих двух экспортеров сходны с potE у Е. coli, и они имеют функции импорта путресцина, спермидина и спермина в щелочных условиях и их экспорта в кислых условиях. Кроме того, дрожжи со сверхэкспрессией гена TPO5 резистентны к 120 мМ путресцина, в то время как мутанты с инактивированным геном TPO5 чувствительны к 90 мМ путресцина (Tachihara et. al., J. Biological Chemistry, 280(13): 12637-12642, 2005).
Регуляция синтеза и разрушения, а также проникновения и выведения путресцина в клетках животных происходит различными путями. Несмотря на отсутствие исследований выведения полиаминов в клетках животных, а также у Е. coli или дрожжей, есть сообщение о том, что SLC3A2 (аргинин/диаминовый экспортер) функционирует, обеспечивая импорт аргинина в клетки и экспорт путресцина, ацетилспермидина и ацетилспермина в клетках эпителия толстой кишки. Тем не менее, сообщений о проникновении путресцина в клетки растений и его экспорте из них не было (Igarashi et al., Plant Physiol. & Biochem. 48: 506-512, 2010).
С другой стороны, поскольку микроорганизм Corynebacterium sp. не имеет пути биосинтеза путресцина, исследований относительно экспорта путресцина проведено не было. Согласно недавнему сообщению, сверхэкспрессия мембранного белка cg2983 у штамма, продуцирующего кадаверин, приводит к восстановлению клеточного роста и повышению кадавериновой продуктивности (Kind et. al., Metabolic Engineering 13: 617-627, 2011).
Тем не менее, сообщений о связи экспортера путресцина с продуцированием путресцина или ростом микроорганизмов, продуцирующих путресцин, не было. В указанной выше литературе нет упоминаний о связи мембранного белка cg2983 со способностью к экспорту путресцина.
С учетом этих данных, авторы настоящего изобретения приложили многочисленные усилия для разработки штамма, способного продуцировать путресцин с более высоким выходом. В результате, было установлено, что NCgl2522 функционирует как экспортер путресцина у штамма, продуцирующего путресцин, микроорганизма Corynebacterium sp., и что путресцин можно получать с высоким выходом путем усиления активности NCgl2522, по сравнению с его эндогенной активностью. Кроме того, количество путресцина в культуральной среде может быть увеличено экспрессией NCgl2522 у Е. coli, имеющей путь синтеза путресцина, и, таким образом, авторы настоящего изобретения предположили, что NCgl2522 также функционирует как экспортер путресцина у Е. coli, завершив посредством этого настоящее изобретение.
КРАТКОЕ ИЗЛОЖЕНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
Задачей настоящего изобретения является обеспечение рекомбинантного микроорганизма, модифицированного для усиления активности NCgl2522, продуцирующего посредством этого путресцин с высоким выходом.
Другой задачей настоящего изобретения является обеспечение способа получения путресцина с высоким выходом с использованием этого микроорганизма.
КРАТКОЕ ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
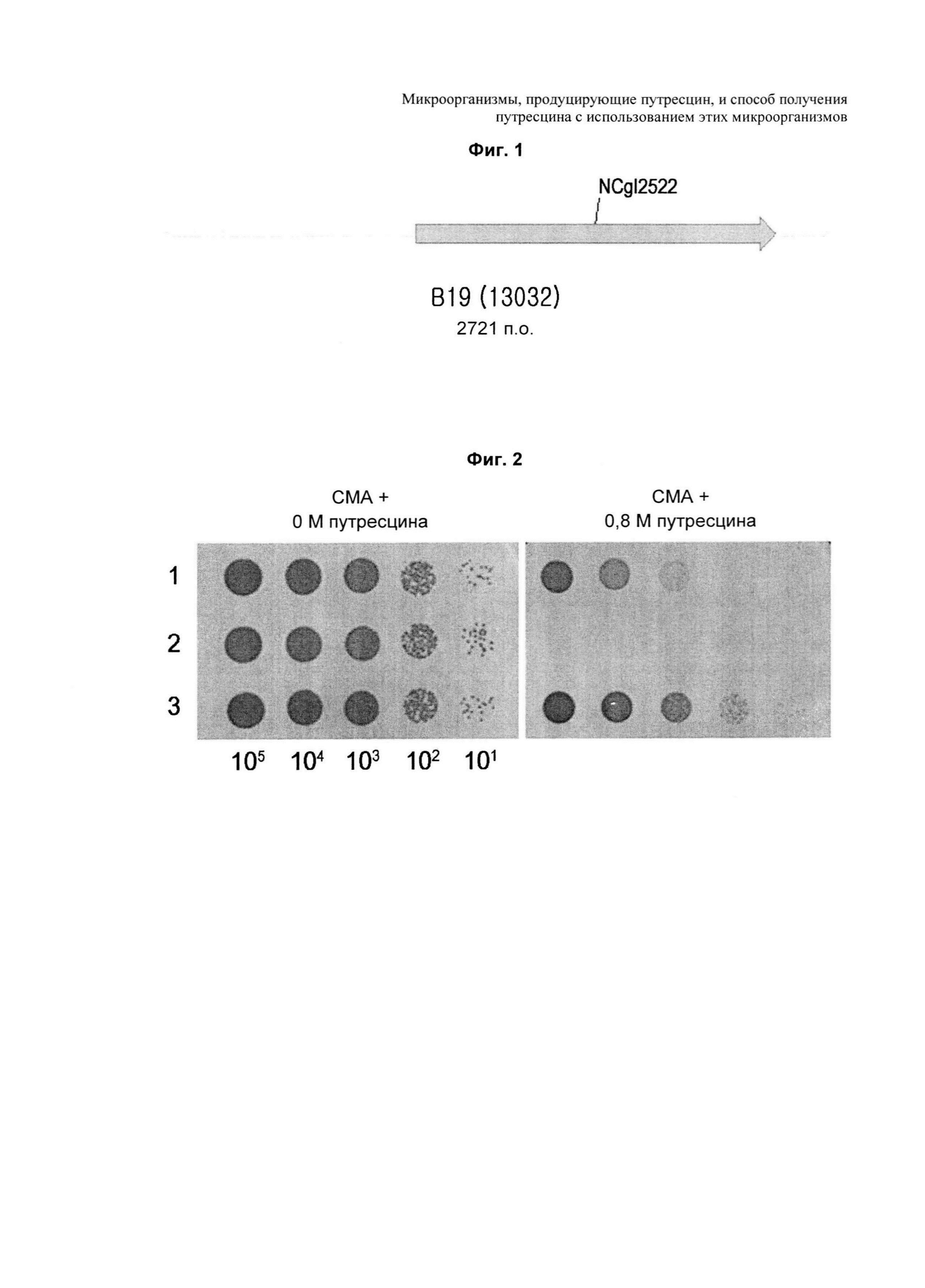
На ФИГ. 1 представлена диаграмма, на которой показано, что NCgl2522 включен в клон (В19), окончательно селектированный из трансформированных колоний, в которые была введена хромосомная библиотека Corynebacterium по настоящему изобретению.
На ФИГ. 2 представлен результат оценки резистентности к путресцину у рекомбинантного штамма с делецией или усилением NCgl2522 по настоящему изобретению.
1: КССМ11240Р
2: КССМ11240Р ΔNCgl2522
3: КССМ11240Р P(CJ7)-NCgl2522
ПОДРОБНОЕ ОПИСАНИЕ ПРЕДОЧТИТЕЛЬНЫХ ВОПЛОЩЕНИЙ
В одном аспекте для выполнения указанной задачи согласно настоящему изобретению предложен микроорганизм, продуцирующий путресцин, где указанный микроорганизм модифицирован для усиления активности белка, имеющего аминокислотную последовательность, представленную в SEQ ID NO: 21 или 23.
В одном конкретном воплощении согласно настоящему изобретению предложен микроорганизм, продуцирующий путресцин, где указанный микроорганизм дополнительно модифицирован для ослабления активности орнитинкарбамоилтрансферазы (ArgF) и белка (NCgl1221), вовлеченного в экспорт глутамата, по сравнению с их эндогенной активностью, и в который введена активность орнитиндекарбоксилазы (ODC).
В другом конкретном воплощении согласно настоящему изобретению предложен микроорганизм, продуцирующий путресцин, где орнитинкарбамоилтрансфераза (ArgF) имеет аминокислотную последовательность, представленную в SEQ ID NO: 29, белок (NCgl1221) вовлеченный в экспорт глутамата, имеет аминокислотную последовательность, представленную в SEQ ID NO: 30, и орнитиндекарбоксилаза (ODC) имеет аминокислотную последовательность, представленную в SEQ ID NO: 33.
В еще одном конкретном воплощении согласно настоящему изобретению предложен микроорганизм, продуцирующий путресцин, где указанный микроорганизм дополнительно модифицирован для усиления активности ацетил-гамма-глутамилфосфатредуктазы (ArgC), ацетилглутаматсинтазы или орнитинацетилтрансферазы (ArgJ), ацетилглутаматкиназы (ArgB) и ацетилорнитинаминотрансферазы (ArgD), по сравнению с их эндогенной активностью.
В еще одном конкретном воплощении согласно настоящему изобретению предложен микроорганизм, продуцирующий путресцин, где ацетил-гамма-глутамилфосфатредуктаза (ArgC), ацетилглутаматсинтаза или орнитинацетилтрансфераза (ArgJ), ацетилглутаматкиназа (ArgB) и ацетилорнитинаминотрансфераза (ArgD) имеют аминокислотные последовательности, представленные в SEQ ID NO: 25, 26, 27 и 28, соответственно.
В еще одном конкретном воплощении согласно настоящему изобретению предложен микроорганизм, продуцирующий путресцин, активность ацетилтрансферазы (NCgl1469) которого дополнительно ослаблена.
В еще одном конкретном воплощении согласно настоящему изобретению предложен микроорганизм, продуцирующий путресцин, где ацетилтрансфераза имеет аминокислотную последовательность, представленную в SEQ ID NO: 31 или 32.
В еще одном конкретном воплощении согласно настоящему изобретению предложен микроорганизм, продуцирующий путресцин, представляющий собой Escherichia sp. или Corynebacterium sp.
В еще одном конкретном воплощении согласно настоящему изобретению предложен микроорганизм, продуцирующий путресцин, представляющий собой Е. coli или Corynebacterium glutamicum.
В другом аспекте согласно настоящему изобретению предложен способ получения путресцина, включающий стадии культивирования микроорганизма, продуцирующего путресцин, с получением клеточной культуры и выделения путресцина из культивированного микроорганизма или клеточной культуры.
Далее настоящее изобретение будет описано подробно.
Согласно настоящему изобретению предложен рекомбинантный микроорганизм Corynebacterium sp., где микроорганизм Corynebacterium sp., продуцирующий путресцин, модифицирован для усиления активности NCgl2522, по сравнению с его эндогенной активностью, и, таким образом, он имеет повышенную путресциновую продуктивность.
При использовании здесь термин «NCgl2522» относится к пермеазе, принадлежащей к MFS (суперсемейство мембранных транспортеров), представляющей собой мембранный белок, выделенный из Corynebacterium glutamicum АТСС13032. Известно, что NCgl2522 экспортирует диаминопентан из Corynebacterium glutamicum. В настоящем изобретении было подтверждено, что NCgl2522 функционирует как транспортер, обеспечивающий внеклеточный экспорт путресцина, продуцируемого внутри клеток. На основании этого факта, согласно настоящему изобретению предложен рекомбинантный микроорганизм, демонстрирующий продукцию путресцина с высоким выходом, где NCgl2522 модифицирован для усиления активности, по сравнению с его эндогенной активностью, и, таким образом, экспорт продуцируемого внутриклеточно путресцина повышен.
При использовании здесь термин «эндогенная активность» относится к активности фермента, которой микроорганизм обладает в его нативном состоянии, то есть в состоянии без модификации, и значение «модифицирован для усиления активности, по сравнению с эндогенной активностью», состоит в том, что активность фермента введена впервые или дополнительно улучшена, по сравнению с активностью соответствующего фермента до модификации.
В настоящем изобретении «усиление ферментативной активности» включает улучшение ферментативной активности путем улучшения активности эндогенного гена, амплификации эндогенного гена внутренними или внешними факторами, удаления регуляторного фактора, подавляющего экспрессию гена, увеличения числа копий гена, повышения активности путем введения чужеродного гена или модификацией регуляторной последовательности экспрессии, в частности, заменой или модификацией промотора и мутацией внутри гена, а также введение или улучшение активности самого фермента с достижением эффектов, выходящих за пределы эндогенных функций.
В настоящем изобретении «модифицирован для усиления активности, по сравнению с эндогенной активностью» означает, что активность микроорганизма повышена после манипуляции, такой как введение гена, проявляющего активность, или увеличение числа копий гена, удаление регуляторного фактора, подавляющего экспрессию гена, или модификация регуляторной последовательности экспрессии, например, использование улучшенного промотора, по сравнению с активностью микроорганизма до манипуляции.
NCgl2522, активность которого повышена по настоящему изобретению, может представлять собой, без ограничения, белок, имеющий аминокислотную последовательность SEQ ID NO: 21 или 23, или аминокислотную последовательность, на 70% или более гомологичную ей, предпочтительно на 80% или более гомологичную ей, более предпочтительно на 90% или более гомологичную ей, намного более предпочтительно на 95% или более гомологичную ей, намного более предпочтительно на 98% или более гомологичную ей и наиболее предпочтительно на 99% или более гомологичную ей. Кроме того, поскольку аминокислотная последовательность белка, проявляющего активность, может различаться в зависимости от вида или штамма микроорганизма, белок не ограничен ими. То есть, белок может представляет собой мутантный белок или искусственный вариант, имеющий аминокислотную последовательность, содержащую замену, делецию, вставку или добавление одной или нескольких аминокислот в одном или более чем одном положении аминокислотной последовательности SEQ ID NO: 21 или 23, при условии, что белок способствует повышению путресциновой продуктивности благодаря усилению его активности. При использовании здесь термин «несколько» аминокислот означает конкретно от 2 до 20, предпочтительно от 2 до 10 и более предпочтительно от 2 до 5 аминокислот, хотя он может различаться в зависимости от положения или типа аминокислотного остатка в трехмерной структуре белка. Кроме того, замена, делеция, вставка, добавление или инверсия аминокислот могут включать мутации, встречающиеся в природе, обусловленные индивидуальными или видовыми различиями микроорганизмов, имеющих активность полипептида, или искусственные изменения.
У микроорганизма Corynebacterium sp. нет путей биосинтеза путресцина. Тем не менее, при введении внешней орнитиндекарбоксилазы (ODC) происходит синтез путресцина и его выведение за пределы клеток, что указывает на присутствие транспортера, то есть экспортера, функционирующего как переносчик путресцина, среди множества мембранных белков микроорганизма Corynebacterium sp.Соответственно, для выделения экспортера путресцина из микроорганизма Corynebacterium sp., авторы настоящего изобретения получили хромосомную библиотеку дикого типа Corynebacterium glutamicum АТСС13032, трансформировали этой библиотекой путресцин-продуцирующий штамм Corynebacterium glutamicum КССМ11138Р и селектировали штаммы, растущие в минимальной среде, содержащей путресцин. Селекцией третичных колоний был окончательно селектирован клон (В19), имеющий резистентность к путресцину, и было проведено секвенирование для подтверждения того, что клон содержит NCgl2522 (см. ФИГ. 1). В качестве экспортера путресцина, NCgl2522, имеющий происхождение от Corynebacterium glutamicum АТСС13032, имеет аминокислотную последовательность, представленную SEQ ID NO: 21, и NCgl2522, имеющий происхождение от Corynebacterium glutamicum АТСС13869, на 98% гомологичный указанной выше аминокислотной последовательности, имеет аминокислотную последовательность, представленную в SEQ ID NO: 23.
Полинуклеотид, кодирующий NCgl2522 по настоящему изобретению, может включать полинуклеотид, кодирующий белок, имеющий аминокислотную последовательность SEQ ID NO: 21 или 23, или аминокислотную последовательность, на 70% или более гомологичную ей, предпочтительно на 80% или более гомологичную ей, более предпочтительно на 90% или более гомологичную ей, намного более предпочтительно на 95% или более гомологичную ей, намного более предпочтительно на 98% или более гомологичную ей и наиболее предпочтительно на 99% или более гомологичную ей, при условии, что белок имеет активность, сходную с активностью белка NCgl2522, и может включать нуклеотидную последовательность 20 или 22.
При использовании здесь термин "гомология" относится к сходству между двумя аминокислотными последовательностями, и она может быть определена хорошо известными способами с использованием BLAST 2.0, рассчитывающего такие параметры, как показатель, идентичность и сходство.
Кроме того, полинуклеотид, кодирующий NCgl2522 по настоящему изобретению, может представлять собой вариант, гибридизующийся в строгих условиях с нуклеотидной последовательностью SEQ ID NO: 20 или 22, или зонд, имеющий происхождение от указанной выше нуклеотидной последовательности, при условии, что он кодирует функциональный NCgl2522. При использовании здесь термин «строгие условия» означает условия, позволяющие проводить специфичную гибридизацию полинуклеотидов. Например, такие строгие условия подробно описаны в литературе (J. Sambrook et al., Molecular Cloning, A Laboratory Manual, 2nd Edition, Cold Spring Harbor Laboratory press, Cold Spring Harbor, New York, 1989; F.M Ausubel et al., Current Protocols in Molecular Biology, John Wiley & Sons, Inc., New York).
В настоящем изобретении «модификация для усиления активности NCgl2522, по сравнению с эндогенной активностью», может быть проведена способом, выбранным из способов увеличения числа копий полинуклеотида, кодирующего белок, модификации последовательности регуляции экспрессии для повышения экспрессии полинуклеотида, модификации полинуклеотидной последовательности на хромосоме для усиления активности фермента, удаления регуляторного фактора, подавляющего экспрессию гена, и их комбинаций.
Число копий полинуклеотида может быть, без ограничения, увеличено функциональным связыванием полинуклеотида с вектором или его интеграцией в геном клетки-хозяина. Конкретно, число копий полинуклеотида в геноме клетки-хозяина может быть увеличено путем введения в клетку-хозяина вектора, функционально связанного с полинуклеотидом, кодирующим белок по настоящему изобретению, проходящего репликацию и функционирующего независимо от клетки-хозяина, или путем введения в клетку-хозяина вектора, функционально связанного с полинуклеотидом, способного интегрировать полинуклеотид в геном клетки-хозяина.
При использовании здесь термин «вектор» относится к ДНК-конструкции, содержащей нуклеотидную последовательность, кодирующую желаемый белок, функционально связанную с подходящей последовательностью регуляции экспрессии для экспрессии желаемого белка в подходящей клетке-хозяине. Регуляторная последовательность включает промотор, способный инициировать транскрипцию, возможно, последовательность оператора для регуляции транскрипции, последовательность, кодирующую подходящий сайт связывания рибосомы на мРНК, и последовательность, регулирующую терминацию транскрипции и трансляции. После трансформации вектором подходящей клетки-хозяина он может проходить репликацию или функционировать независимо от генома хозяина и может быть интегрирован в сам геном.
Вектор, используемый в настоящем изобретении, не ограничен особым образом, при условии, что он способен к репликации в клетке-хозяине, и может быть использован любой вектор, известный в данной области. Примеры традиционных векторов могут включать естественную или рекомбинантную плазмиду, космиду, вирус и бактериофаг. Например, в качестве фагового вектора или космидного вектора могут быть использованы pWE15, М13, MBL3, MBL4, IXII, ASHII, АРМ, t10, t11, Charon4A и Charon21A. В качестве плазмидного вектора могут быть использованы тип pBR, тип pUC, тип pBluescriptll, тип pGEM, тип pTZ, тип pCL и тип рЕТ. Вектор, применимый в настоящем изобретении, не ограничен особым образом, и может быть использован любой известный вектор экспрессии. Предпочтительно, может быть использован вектор pDZ, pACYC177, pACYC184, pCL, pECCG117, pUC19, pBR322, pMW118 или pCCIBAC, и, более предпочтительно, может быть использован вектор pDZ.
Далее, полинуклеотид, кодирующий желаемый белок в хромосоме, может быть заменен мутантным полинуклеотидом с использованием вектора для хромосомной вставки. Введение полинуклеотида в хромосому может быть осуществлено любым способом, известным в данной области, например, гомологичной рекомбинацией. Поскольку вектор по настоящему изобретению может быть введен в хромосому гомологичной рекомбинацией, он может дополнительно содержать селекционный маркер для подтверждения хромосомной вставки. Селекционный маркер предназначен для селекции клеток, трансформированных вектором, то есть для подтверждения вставки желаемого полинуклеотида, и селекционный маркер может включать маркеры, обеспечивающие селектируемые фенотипы, такие как резистентность к лекарственным средствам, ауксотрофность, резистентность к цитотоксическим агентам или экспрессия поверхностных белков. Только клетки, экспрессирующие селекционный маркер, способны выживать или демонстрировать различные фенотипы в среде, обработанной селективным агентом, и, таким образом, можно селектировать трансформированные клетки.
При использовании здесь термин «трансформация» означает введение вектора, содержащего полинуклеотид, кодирующий целевой белок, в клетку-хозяина, таким образом, что в клетке-хозяине происходит экспрессия белка, кодируемого полинуклеотидом. При условии, что трансформированный полинуклеотид может быть экспрессирован в клетке-хозяине, он может быть интегрирован или помещен в хромосому клетки-хозяина или существовать вне хромосомы. Кроме того, полинуклеотид включает ДНК и РНК, кодирующую целевой белок. Полинуклеотид может быть введен в любой форме, при условии, что он может быть введен в клетку-хозяина и экспрессирован в ней. Например, полинуклеотид может быть введен в клетку-хозяина в форме экспрессионной кассеты, представляющей собой генную конструкцию, содержащую все элементы, необходимые для ее автономной экспрессии. Обычно экспрессионная кассета содержит промотор, функционально связанный с полинуклеотидом, сигналы терминации транскрипции, сайты связывания рибосом или сигналы терминации трансляции. Экспрессионная кассета может быть представлена в форме самореплицируемого вектора экспрессии. Полинуклеотид может также быть сам по себе введен в клетку-хозяина и функционально связан с последовательностями, необходимыми для экспрессии в клетке-хозяине.
Более того, при использовании здесь термин «функционально связанный» обозначает функциональную связь между полинуклеотидной последовательностью, кодирующей желаемый белок, и последовательностью промотора, инициирующего и опосредующего транскрипцию полинуклеотидной последовательности.
Кроме того, модификация регуляторной последовательности экспрессии для повышения экспрессии полинуклеотида может быть, без ограничения, проведена путем индукции модификации в регуляторной последовательности экспрессии посредством делеции, вставки, неконсервативной или консервативной замены нуклеотидной последовательности или их комбинации с целью дополнительного усиления активности регуляторной последовательности экспрессии или заменой регуляторной последовательности экспрессии нуклеотидной последовательностью, имеющей более сильную активность. Регуляторная последовательность экспрессии включает, без ограничения, промотор, последовательность оператора, последовательность, кодирующую сайт связывания рибосомы, и последовательность, регулирующую терминацию транскрипции и трансляции.
Сильный гетерологичный промотор вместо исходного промотора может быть связан выше экспрессионной единицы полинуклеотида, и примеры сильного промотора могут включать промотор CJ7, промотор lysCPI, промотор EF-Tu, промотор groEL, промотор асеА или асеВ и, более предпочтительно, промотор lysCP1 или промотор CJ7 как промотор, имеющий происхождение от Corynebacterium, и полинуклеотид, кодирующий фермент, функционально связан с ним, таким образом, что интенсивность его экспрессии может быть повышена. Здесь промотор lysCP1 представляет собой промотор, улучшенный заменой нуклеотидной последовательности промоторной области полинуклеотида, кодирующего аспартаткиназу и аспартатполуальдегиддегидрогеназу, и является сильным промотором, повышающим экспрессию гена аспартаткиназы, приводя к 5-кратному повышению активности соответствующего фермента по сравнению с диким типом (WO 2009/096689). Кроме того, промотор CJ7 представляет собой промотор, обнаруженный при исследовании последовательности сильного промотора у Corynebacterium ammoniagenes, и его экспрессия и сильная промоторная активность подтверждены у Corynebacterium ammoniagenes и Escherichia. Промотор CJ7 представляет собой промотор, который также демонстрирует высокую экспрессионную активность у Corynebacterium glutamicum (патент Кореи №0620092 и WO 2006/065095).
Далее, модификация последовательности полинуклеотида в хромосоме может быть, без ограничения, проведена путем индукции мутации регуляторной последовательности экспрессии посредством делеции, вставки, неконсервативной или консервативной замены последовательности полинуклеотида или их комбинации с целью дополнительного усиления активности последовательности полинуклеотида или заменой последовательности последовательностью полинуклеотида, модифицированной для усиления активности.
В одном предпочтительном воплощении настоящего изобретения для обеспечения микроорганизма Corynebacterium sp. с повышенной путресциновой продуктивностью, число копий гена может быть увеличено путем введения в хромосому полинуклеотида, имеющего нуклеотидную последовательность SEQ ID NO: 20 или 22, кодирующего NCgl2522, вовлеченный в выведение путресцина, или собственный промотор NCgl2522 может быть заменен промотором, имеющим улучшенную активность, предпочтительно промотором CJ7, имеющим нуклеотидную последовательность SEQ ID NO: 24.
При использовании здесь термин "микроорганизм, имеющий путресциновую продуктивность" или "микроорганизм, продуцирующий путресцин" относится к микроорганизму, полученному приданием путресциновой продуктивности исходному штамму, не имеющему путресциновой продуктивности. Микроорганизм, которому придана путресциновая продуктивность или который продуцирует путресцин, может, без ограничения, представляет собой микроорганизм, имеющий повышенную продуктивность орнитина для использования в качестве исходного вещества для биосинтеза путресцина, модифицированный для повышения активности ацетилглутаматсинтазы, превращающей глутамат в ацетилглутамат (N-ацетилглутамат), или орнитинацетилтрансферазы (ArgJ), превращающей ацетилорнитин в орнитин, ацетилглутаматкиназы (ArgB), превращающей ацетилглутамат в ацетилглутамилфосфат (N-ацетилглутамилфосфат), ацетил-гамма-глутамилфосфатредуктазы (ArgC), превращающей ацетилглутамилфосфат в ацетилглутаматполуальдегид (N-ацетилглутаматполуальдегид), или ацетилорнитинаминотрансферазы (ArgD), превращающей ацетилглутаматполуальдегид в ацетилорнитин (N-ацетилорнитин), по сравнению с эндогенной активностью, для усиления пути биосинтеза от глутамата до орнитина. Кроме того, микроорганизм представляет собой микроорганизм, модифицированный для ослабления активности орнитинкарбамоилтрансферазы (ArgF), вовлеченной в синтез аргинина из орнитина, белка (NCgl1221), вовлеченного в выведение глутамата, и/или белка (NCgl469), ацетилирующего путресцин, по сравнению с эндогенной активностью, и/или модифицированный для придания активности орнитиндекарбоксилазы (ODC).
В этой связи, ацетил-гамма-глутамилфосфатредуктаза (ArgC), ацетилглутаматсинтаза или орнитинацетилтрансфераза (ArgJ), ацетилглутаматкиназа (ArgB), ацетилорнитинаминотрансфераза (ArgD), орнитинкарбамоилтрансфераза (ArgF), белок (NCgl1221), вовлеченный в экспорт глутамата, и орнитиндекарбоксилаза (ODC) могут предпочтительно иметь, без ограничения, аминокислотные последовательности, представленные в SEQ ID NO: 25, 26, 27, 28, 29, 30 и 33, соответственно, или аминокислотные последовательности, на 70% или более гомологичные им, более предпочтительно на 80% или более гомологичные им или намного более предпочтительно на 90% или более гомологичные им, соответственно. Кроме того, белок (NCgl469), ацетилирующий путресцин, может предпочтительно иметь, без ограничения, аминокислотную последовательность, представленную в SEQ ID NO: 31 или 32, или аминокислотную последовательность, на 70% или более гомологичную им, более предпочтительно на 80% или более гомологичную им или намного более предпочтительно на 90% или более гомологичную им.
Из этих белков, повышение активности ацетил-гамма-глутамилфосфатредуктазы (ArgC), ацетилглутаматсинтазы или орнитинацетилтрансферазы (ArgJ), ацетилглутаматкиназы (ArgB), ацетилорнитинаминотрансферазы (ArgD) и орнитиндекарбоксилазы (ODC) может быть достигнуто описанным выше способом повышения активности NCgl2522, например, способом, выбранным из способов увеличения числа копий полинуклеотида, кодирующего белок, модификации последовательности регуляции экспрессии для повышения экспрессии полинуклеотида, модификации последовательности полинуклеотида в хромосоме для усиления активности фермента, удаления регуляторного фактора, подавляющего экспрессию полинуклеотида фермента, и их комбинаций.
Кроме того, активность орнитинкарбамоилтрансферазы (ArgF), белка (NCgl1221), вовлеченного в экспорт глутамата, и белка (NCgl469), ацетилирующего путресцин, может быть уменьшена способом выбранным из группы, состоящей из частичной или полной делеции полинуклеотида, кодирующего белок, модификации последовательности регуляции экспрессии для подавления экспрессии полинуклеотида, модификации последовательности полинуклеотида в хромосоме для уменьшения активности белка и их комбинаций.
Подробнее, частичная или полная делеция полинуклеотида, кодирующего белок, может быть проведена введением вектора для хромосомной вставки в микроорганизм с заменой посредством этого полинуклеотида, кодирующего эндогенный целевой белок, в хромосоме на частично удаленный полинуклеотид или маркерный ген. «Частичный» может варьировать в зависимости от типа полинуклеотида, но конкретно относится к 1-300, предпочтительно 1-100 и более предпочтительно 1-50 нуклеотидам.
Кроме того, модификация регуляторной последовательности экспрессии может быть проведена путем индукции модификации регуляторной последовательности экспрессии посредством делеции, вставки, неконсервативной или консервативной замены нуклеотидной последовательности или их комбинации с целью уменьшения активности регуляторной последовательности экспрессии или заменой регуляторной последовательности экспрессии нуклеотидной последовательностью, имеющей более слабую активность. Регуляторная последовательность экспрессии включает промотор, последовательность оператора, последовательность, кодирующую сайт связывания рибосомы, и последовательность, регулирующую терминацию транскрипции и трансляции.
Кроме того, модификация последовательности полинуклеотида в хромосоме может быть проведена индукцией мутации последовательности посредством делеции, вставки, неконсервативной или консервативной замены последовательности полинуклеотида или их комбинации с целью уменьшения ферментативной активности или заменой последовательности последовательностью полинуклеотида, модифицированной для ослабления активности.
Более того, регуляторный фактор, подавляющий экспрессию полинуклеотида фермента, может быть удален путем замены полинуклеотида фактора, подавляющего экспрессию, на частично удаленный полинуклеотид или маркерный ген. «Частичный» может варьировать в зависимости от типа полинуклеотида, но конкретно относится к 1-300, предпочтительно 1-100 и более предпочтительно 1-50 нуклеотидам.
В то же время, микроорганизм по настоящему изобретению представляет собой микроорганизм, продуцирующий путресцин, и включает прокариотический микроорганизм, экспрессирующий белок, имеющий аминокислотную последовательность, представленную в SEQ ID NO: 21 или 23, и его примеры могут включать микроорганизмы, принадлежащие к Escherichia sp., Shigella sp., Citrobacter sp., Salmonella sp., Enterobactersp., Yersinia sp., Klebsiella sp., Erwiniasp., Corynebacterium sp., Brevibacterium sp., Lactobacillus sp., Selenomanas sp., Vibrio sp., Pseudomonas sp., Streptomyces sp., Arcanobacterium sp., Alcaligenes sp. или тому подобным. Микроорганизм по настоящему изобретению предпочтительно представляет собой микроорганизм, принадлежащий к Escherichia sp., или микроорганизм, принадлежащий к Corynebacterium sp., и более предпочтительно Е. coli или Corynebacterium glutamicum.
В определенном воплощении настоящего изобретения микроорганизм Corynebacterium sp. с регистрационным номером КССМ11138Р (публикация патента Кореи №2012-0064046) и микроорганизм Corynebacterium sp. с регистрационным номером КССМ11240Р (заявка на патент Кореи №2012-0003634) использовали в качестве штаммов, имеющих усиленный синтетический путь от глутамата до путресцина, получая посредством этого путресцин в высокой концентрации.
В еще одном воплощении настоящего изобретения были использованы путресцин-продуцирующие штаммы КССМ11138Р и КССМ11240Р, основанные на Corynebacterium glutamicum АТСС13032, и путресцин-продуцирующие штаммы DAB12-a и DAB12-D, основанные на Corynebacterium glutamicum АТСС13869, имеющие одинаковый генотип. Штамм АТСС13869 может быть получен из Американской коллекции типовых культур (АТСС). То есть, каждому штамму в каталоге АТСС присвоен уникальный регистрационный номер, и штамм можно заказать по регистрационному номеру. Конкретно, путресцин-продуцирующий штамм DAB12 характеризуется делецией гена, кодирующего орнитинкарбамоилтрансферазу (ArgF), и гена, кодирующего экспортер глутамата NCgl1221, введением гена, кодирующего орнитиндекарбоксилазу (OCD), и заменой промотора оперона гена биосинтеза орнитина (argCJBD) улучшенным промотором у Corynebacterium glutamicum АТСС13869. Кроме того, штамм DAB12-D характеризуется тем, что он получен модификацией штамма DAB12-a для ослабления активности белка (NCgl1469), ацетилирующего путресцин, по сравнению с эндогенной активностью.
Согласно одному предпочтительному Примеру, в качестве путресцин-продуцирующих штаммов были получены Corynebacterium glutamicum КССМ11138Р, полученный делецией гена, кодирующего орнитинкарбамоилтрансферазу (ArgF), и гена, кодирующего экспортер глутамата NCgl1221, заменой собственного промотора генного кластера ArgCJBD, кодирующего фермент, вовлеченный в биосинтез орнитина из глутамата, на улучшенный промотор, и введением гена, кодирующего орнитиндекарбоксилазу (OCD), в хромосому Corynebacterium glutamicum АТСС13032 дикого типа, и Corynebacterium glutamicum КССМ11240Р, полученный дополнительным ослаблением гена, кодирующего ацетилтрансферазу NCgl1469 у данного микроорганизма.
В то же время, для получения штамма с делецией NCgl2522, имеющего происхождение от Corynebacterium glutamicum АТСС 13032, получали плазмиду pDZ-1'NCgl2522(K/O), основанную на нуклеотидной последовательности NCgl2522, имеющей происхождение от Corynebacterium glutamicum АТСС13032.
Плазмидой pDZ-1'NCgl2522(K/0) трансформировали полученные путресцин-продуцирующие штаммы КССМ11138Р и КССМ11240Р, селектировали штаммы с делецией NCgl2522 и обозначали их КССМ11138Р ΔNCgl2522 и КССМ11240Р ΔNCgl2522, соответственно. Таким же образом получали штаммы с делецией NCgl2522, имеющие происхождение от Corynebacterium glutamicum АТСС13869, и обозначали их DAB12-a ΔNCgl2522 и DAB12-D ΔNCgl2522.
Путресциновую продуктивность 4 типов штаммов с делецией NCgl2522, полученных таким образом, сравнивали с путресциновой продуктивностью исходного штамма, и, в результате, у всех КССМ11138Р ΔNCgl2522, КССМ11240Р ΔNCgl2522, DAB12-a ΔNCgl2522 и DAB12-b ΔNCgl2522 с делецией NCgl2522 путресциновая продуктивность была снижена, по сравнению с исходным штаммом (см. Таблицу 3). На основании этого результата, авторы настоящего изобретения подтвердили, что активность NCgl2522 у путресцин-продуцирующего штамма тесно связана с путресциновой продуктивностью, и получили штаммы с усилением NCgl2522 для повышения путресциновой продуктивности посредством усиления этой активности.
Для этого в одном предпочтительном Примере настоящего изобретения NCgl2522 дополнительно вводили в транспозон штамма Corynebacterium glutamicum, или собственный промотор NCgl2522 в хромосоме заменяли промотором CJ7 (КССМ10617, патент Кореи №10-0620092), который был впервые разработан авторами настоящего изобретения.
Путресциновую продуктивность 6 типов штаммов с усилением NCgl2522, полученных таким образом, сравнивали с путресциновой продуктивностью исходного штамма, и в результате у всех штаммов, полученных дополнительным введением NCgl2522 в транспозон, путресциновая продуктивность была повышена, по сравнению с исходным штаммом (см. Таблицу 6). У штаммов с усилением NCgl2522, демонстрировавших улучшение путресциновой продуктивности, измеряли внутриклеточные концентрации путресцина, и в результате они продемонстрировали снижение внутриклеточных концентраций путресцина, по сравнению с исходным штаммом (см. Таблицу 9). На основании этих результатов, авторы настоящего изобретения подтвердили, что усиление активности NCgl2522 у путресцин-продуцирующих штаммов приводит к повышению внеклеточного экспорта путресцина, продуцируемого внутри клеток, повышая посредством этого путресциновую продуктивность.
Соответственно, микроорганизм Corynebacterium sp., имеющий усиленную путресциновую продуктивность, где путресцин-продуцирующий штамм Corynebacterium glutamicum КССМ11138Р был модифицирован для усиления активности NCgl2522, по сравнению с эндогенной активностью, и, таким образом, демонстрирует усиленную способность к экспорту путресцина, был обозначен Corynebacterium glutamicum СС01-0510 и депонирован в соответствии с Будапештским договором в Корейском центре культур микроорганизмов (Korean Culture Center of Microorganisms, KCCM) 8 марта 2013 г. под регистрационным номером КССМ11401Р.
В соответствии с другим аспектом настоящего изобретения согласно настоящему изобретению предложен способ получения путресцина, включающий стадии:
(1) культивирования микроорганизма, продуцирующего путресцин, с получением клеточной культуры; и
(2) выделения путресцина из культивированного микроорганизма или клеточной культуры.
В данном способе стадия культивирования микроорганизма может, без ограничения, быть предпочтительно проведена посредством периодической культуры, постоянной культуры и подпитываемой культуры, известных в данной области. В этом отношении, условия культивирования не ограничены, но можно поддерживать оптимальный рН (например, рН от 5 до 9, предпочтительно рН от 6 до 8 и наиболее предпочтительно рН 6,8), используя основание (например, гидроксид натрия, гидроксид калия или аммиак) или кислоту (например, фосфорную кислоту или серную кислоту). Кроме того, можно поддерживать аэробные условия, добавляя в клеточную культуру кислород или кислородсодержащую смесь газов. При культивировании можно поддерживать температуру от 20 до 45°С и предпочтительно от 20 до 40°С. Кроме того, культивирование предпочтительно проводят в течение приблизительно 10-160 часов. Путресцин, продуцируемый при описанном выше культивировании, может выводиться в культуральную среду или оставаться внутри клеток.
Кроме того, используемая культуральная среда может содержать сахар и углевод (например, глюкозу, сахарозу, лактозу, фруктозу, мальтозу, мелассу, крахмал и целлюлозу), масло и жир (например, соевое масло, подсолнечное масло, арахисовое масло и коксовое масло), жирную кислоту (например, пальмитиновую кислоту, стеариновую кислоту и линолевую кислоту), спирт (например, глицерин и этанол) и органическую кислоту (например, уксусную кислоту), по отдельности или в комбинации, в качестве источника углерода; азот-содержащее органическое соединение (например, пептон, дрожжевой экстракт, мясной бульон, солодовый экстракт, кукурузный экстракт, соевую муку и мочевину) или неорганическое соединение (например, сульфат аммония, хлорид аммония, фосфат аммония, карбонат аммония и нитрат аммония), по отдельности или в комбинации, в качестве источника азота; дигидрофосфат калия, гидрофосфат калия или соответствующую натрий-содержащую соль, по отдельности или в комбинации, в качестве источника фосфора; другие необходимые вещества, стимулирующие рост, включая соли металлов (например, сульфат магния или сульфат железа), аминокислоты и витамины.
Способ выделения путресцина, продуцируемого на стадии культивирования по настоящему изобретению, может быть проведен, например, с применением подходящего способа, известного в данной области для периодической культуры, постоянной культуры или подпитываемой культуры, с получением посредством этого желаемых аминокислот из культуры.
Далее настоящее изобретение будет описано более подробно со ссылкой на Примеры. Тем не менее, эти Примеры приведены лишь в иллюстративных целях, и изобретение не следует ограничивать этими Примерами.
Сравнительный пример 1: Получение микроорганизма Corvnebacterium sp., продуцирующего путресцин
Для получения микроорганизма Corynebacterium sp., продуцирующего путресцин, путь биосинтеза аргинина из орнитина был заблокирован, путь биосинтеза орнитина из глутамата был усилен и была введена чужеродная орнитиндекарбоксилаза (OCD) с получением микроорганизма с обеспеченной путресциновой продуктивностью, как описано в патенте Кореи №10-2012-0064046.
Конкретно, исходя из Corynebacterium glutamicum АТСС13032, ген, кодирующий орнитинкарбамоилтрансферазу (ArgF), и ген, кодирующий NCgl1221, представляющий собой белок, вовлеченный в экспорт глутамата, удаляли из хромосомы штамма гомологичной рекомбинацией для повышения внутриклеточного содержания глутамата, являющегося предшественником орнитина. Затем в хромосому штамма вводили ген, кодирующий орнитиндекарбоксилазу (OCD), имеющий происхождение от Е. coli W3110, вовлеченный в синтез путресцина из орнитина. Кроме того, собственный промотор генного кластера argCJBD, кодирующего фермент, вовлеченный в синтез орнитина из глутамата, заменяли на улучшенный промотор CJ7 с получением штамма Corynebacterium glutamicum, имеющего путресциновую продуктивность. В данном случае argCJBD кодирует ацетил-гамма-глутамилфосфатредуктазу (ArgC), ацетилглутаматсинтазу или орнитинацетилтрансферазу (ArgJ), ацетилглутаматкиназу (ArgB) и ацетилорнитинаминотрансферазу (ArgD), вовлеченные в путь биосинтеза орнитина из глутамата. Штамм Corynebacterium glutamicum, имеющий путресциновую продуктивность, полученный таким образом, был депонирован в соответствии с Будапештским договором в Корейском центре культур микроорганизмов (КССМ) 24 ноября 2010 г. под регистрационным номером КССМ11138Р. Подробное описание получения микроорганизма Corynebacterium sp., имеющего путресциновую продуктивность, приведено в публикации патента Кореи №10-2012-0064046, содержание которого полностью включено посредством ссылки.
Сравнительный пример 2: Получение микроорганизма Corynebacterium sp., продуцирующего путресцин
Ген, кодирующий ацетилтрансферазу NCgl1469 у Corynebacterium glutamicum КССМ11138Р, полученного в Сравнительном примере 1, ослабляли во избежание образования N-ацетилпутресцина, посредством чего был получен штамм Corynebacterium glutamicum, имеющий повышенную путресциновую продуктивность, в качестве еще одного микроорганизма Corynebacterium sp., продуцирующего путресцин.
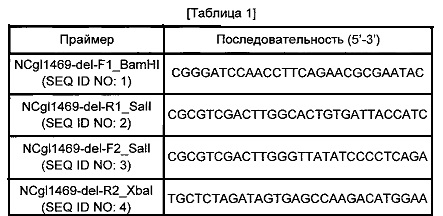
Конкретно, на основании нуклеотидной последовательности гена NCgl1469 Corynebacterium glutamicum АТСС13032, конструировали пару праймеров SEQ ID NO: 1 и 2 для получения фрагмента гомологичной рекомбинации N-концевой области NCgl1469 и пару праймеров SEQ ID NO: 3 и 4 для получения фрагмента гомологичной рекомбинации С-концевой области NCgl1469, как указано в Таблице 1 ниже.
Проводили PCR с использованием геномной ДНК Corynebacterium glutamicum АТСС 13032 в качестве матрицы и двух пар праймеров, получая PCR-фрагменты N-концевой и С-концевой областей, соответственно. Проводили электрофорез этих PCR-фрагментов для получения желаемых фрагментов. В данном случае PCR-реакцию проводили в течение 30 циклов денатурации в течение 30 секунд при 95°С, отжига в течение 30 секунд при 55°С и удлинения в течение 30 секунд при 72°С. Фрагмент N-концевой области, полученный таким образом, обрабатывали рестриктазами BamHI и SalI и фрагмент С-концевой области, полученный таким образом, обрабатывали рестриктазами SalI и XbaI. Обработанные таким образом фрагменты клонировали в вектор pDZ, обработанный рестриктазами BamHI и XbaI, конструируя плазмиду pDZ-NCgl1469(K/O).
Плазмидой pDZ-NCgl1469(K/O) трансформировали Corynebacterium glutamicum КССМ11138Р путем электропорации с получением трансформанта. Затем трансформант высевали и культивировали на чашке с BHIS (37 г/л сердечно-мозгового экстракта, 91 г/л сорбита, 2%-й агар), содержащей канамицин (25 мкг/мл) и X-gal (5-бром-4-хлор-3-индолин-D-галактозид), для образования колоний. Из колоний, образованных на чашке, отбирали колонии синего цвета как штамм, в который была введена плазмида pDZ-NCgl1469(K/O).
Отобранным штаммом засевали среду СМ (10 г/л глюкозы, 10 г/л полипептона, 5 г/л дрожжевого экстракта, 5 г/л мясного экстракта, 2,5 г/л NaCl, 2 г/л мочевины, рН 6,8) и культивировали на качалке при 30°С в течение 8 часов. Затем проводили серийное разведение каждой клеточной культуры от 10-4 до 10-10. Затем разведенные образцы высевали и культивировали на твердой среде, содержащей X-gal, для образования колоний.
Из образованных колоний отбирали сравнительно редкие белые колонии для получения штамма Corynebacterium glutamicum с повышенной путресциновой продуктивностью, делецией гена, кодирующего NCgl1469. Штамм Corynebacterium glutamicum, имеющий улучшенную путресциновую продуктивность, полученный таким образом, был обозначен КССМ11138Р ANCgl1469 и депонирован в соответствии с Будапештским договором в Корейском центре культур микроорганизмов (КССМ) 26 декабря 2011 г. под регистрационным номером КССМ11240Р. Подробное описание получения микроорганизма Corynebacterium sp., продуцирующего путресцин, приведено в заявке на патент Кореи №10-2012-0003634, содержание которой полностью включено посредством ссылки.
Пример 1: Исследование экспортера путресцина и селекция библиотечных клонов с резистентностью к путресцину
Corynebacterium glutamicum не имеет путей биосинтеза путресцина. Тем не менее, при введении внешней орнитиндекарбоксилазы в Corynebacterium glutamicum для придания способности продуцировать путресцин, он продуцирует путресцин и выводит за пределы клеток. Это указывает на присутствие транспортера, то есть белка, функционирующего как переносчик путресцина, среди множества мембранных белков микроорганизма Corynebacterium sp.
Для разделения и выделения экспортера путресцина из микроорганизма Corynebacterium sp.получали хромосомную библиотеку Corynebacterium glutamicum АТСС13032 дикого типа. Конкретно, хромосому Corynebacterium glutamicum АТСС13032 обрабатывали рестриктазой Sau3AI для неполного расщепления. Фрагмент гена размером 3~5 т.п.о. выделяли и клонировали в вектор pECCG122, обработанный BamHI (челночный вектор Ε. coli и Corynebacteríum; публикация патента Кореи №10-1992-0000933).
Хромосомной библиотекой Corynebacterium, полученной таким образом, трансформировали путресцин-продуцирующий штамм Corynebacterium glutamicum КССМ11138Р по Сравнительному примеру 1 и затем отбирали штаммы, растущие в минимальной среде, содержащей 0,35 M путресцина (содержащей 10 г глюкозы, 0,4 г MgSO4⋅7H2O, 4 г NH4Cl, 1 г KH2PO4, 1 г K2HPO4, 2 г мочевины, 10 мг FeSO4⋅7H2O, 1 мг MnSO4⋅5H2O, 5 мг никотинамида, 5 мг тиамина гидрохлорида, 0,1 мг биотина, 1 мМ аргинина, 25 мг канамицина, 0,35 M путресцина, на основе 1 л дистиллированной воды, рН 7,0). Из приблизительно 5,5×105 трансформантов, введенных с хромосомной библиотекой Corynebacterium, были отобраны 13 колоний, и затем каждый библиотечный клон, резистентность которого к путресцину также подтверждали вторым исследованием, повторно вводили в путресцин-продуцирующий штамм. В конечном счете, был отобран один клон (В19), резистентность которого к путресцину была подтверждена третьим исследованием. Этот клон секвенировали. В результате, было обнаружено, что данный клон В19 имеет NCgl2522 (ФИГ. 1).
NCgl2522, выделенный как экспортер путресцина из Corynebacterium glutamicum АТСС13032, имеет аминокислотную последовательность, представленную SEQ ID NO: 21, кодируемую полинуклеотидом, имеющим нуклеотидную последовательность, представленную SEQ ID NO: 20.
Пример 2: Получение штамма с делецией NCgl2522 и оценка его путресциновой продуктивности
<2-1> Получение штамма с делецией NCgl2522 из путресцин-продуцирующего штамма на основе АТСС13032
Для оценки того, вовлечен ли NCgl2522, имеющий происхождение от Corynebacterium glutamicum АТСС13032, в транспорт путресцина, конструировали вектор для делеции гена, кодирующего NCgl2522.
Конкретно, на основании нуклеотидной последовательности гена, кодирующего NCgl1469, представленной SEQ ID NO: 20, конструировали пару праймеров SEQ ID NO: 5 и 6 для получения фрагмента гомологичной рекомбинации N-концевой области NCgl1469 и пару праймеров SEQ ID NO: 7 и 8 для получения фрагмента гомологичной рекомбинации С-концевой области NCgl1469, как указано в Таблице 2 ниже.

Проводили PCR с использованием геномной ДНК Corynebacterium glutamicum АТСС13032 в качестве матрицы и двух пар праймеров, амплифицируя PCR-фрагменты N-концевой и С-концевой областей гена NCgl2522. Проводили электрофорез этих PCR-фрагментов для получения желаемых фрагментов. В данном случае PCR-реакцию проводили в течение 30 циклов денатурации в течение 30 секунд при 95°С, отжига в течение 30 секунд при 55°С и удлинения в течение 30 секунд при 72°С. Фрагмент N-концевой области, полученный таким образом, обрабатывали рестриктазами BamHI и SalI и фрагмент С-концевой области, полученный таким образом, обрабатывали рестриктазами SalI и XbaI. Обработанные таким образом фрагменты клонировали в вектор pDZ, обработанный рестриктазами BamHI и XbaI, конструируя плазмиду pDZ-1'NCgl2522(K/O).
Плазмидой pDZ-1'NCgl2522(K/O) трансформировали Corynebacterium glutamicum КССМ11138Р и КССМ11240Р по Сравнительным примерам 1 и 2 электропорацией, соответственно, с получением трансформантов. Затем трансформанты высевали и культивировали на чашке с BHIS (37 г/л сердечно-мозгового экстракта, 91 г/л сорбита, 2%-й агар), содержащей канамицин (25 мкг/мл) и X-gal (5-бром-4-хлор-3-индолин-D-галактозид), для образования колоний. Из колоний, образованных на чашке, отбирали колонии синего цвета как штамм, в который была введена плазмида pDZ-1'NCgl2522(K/O).
Отобранные штаммы культивировали на качалке в среде СМ (10 г/л глюкозы, 10 г/л полипептона, 5 г/л дрожжевого экстракта, 5 г/л мясного экстракта, 2,5 г/л NaCl, 2 г/л мочевины, рН 6,8) при 30°С в течение 8 часов. Затем проводили серийное разведение каждой клеточной культуры от 10-4 до 10-10. Затем разведенные образцы высевали и культивировали на твердой среде, содержащей X-gal, для образования колоний. Из образованных колоний отбирали сравнительно редкие белые колонии, получая в конечном счете штаммы с делецией гена, кодирующего NCgl2522, в результате вторичного кроссинговера. Штаммы, прошедшие окончательный отбор, подвергали PCR с использованием пары праймеров SEQ ID NO: 5 и 8 для подтверждения делеции гена, кодирующего NCgl2522. Мутантные штаммы Corynebacterium glutamicum были обозначены КССМ11138Р ANCgl2522 и КССМ11240Р ANCgl2522, соответственно.
<2-2> Получение штамма с делецией NCgl2522 из путресцин-продуцирующего штамма на основе АТСС13869
Штамм с делецией NCgl2522 получали из путресцин-продуцирующих штаммов на основе Corynebacterium glutamicum АТСС13869, DAB12-a (делеция argF, делеция NCgl1221, введение speC Ε. coli, замена промотора оперона arg; см. Сравнительный пример 1) и DAB12-D (делеция argF, делеция NCgl1221, введение speC Ε. coli, замена промотора оперона arg, делеция NCgl1469; см. Сравнительный пример 2), имеющих тот же генотип, что КССМ11138Р и КССМ11240Р, представляющие собой путресцин-продуцирующие штаммы на основе Corynebacterium glutamicum АТСС13032.
Конкретно, для анализа последовательностей гена, кодирующего NCgl2522, имеющий происхождение от Corynebacterium glutamicum АТСС13869, и экспрессируемого с него белка проводили PCR с использованием геномной ДНК Corynebacterium glutamicum АТСС13869 в качестве матрицы и пары праймеров SEQ ID NO: 5 и 8. В данном случае PCR-реакцию проводили в течение 30 циклов денатурации в течение 30 секунд при 95°С, отжига в течение 30 секунд при 55°С и удлинения в течение 2 минут при 72°С. Полученный таким образом PCR-продукт разделяли электрофорезом и подвергали секвенированию. В результате, было обнаружено, что нуклеотидная последовательность гена, кодирующего NCgl2522, имеющий происхождение от Corynebacterium glutamicum АТСС13869, представлена SEQ ID NO: 22, и аминокислотная последовательность кодируемого им белка представлена SEQ ID NO: 23. При сравнении аминокислотной последовательности NCgl2522, имеющего происхождение от Corynebacterium glutamicum АТСС13032, с аминокислотной последовательностью NCgl2522, имеющего происхождение от Corynebacterium glutamicum АТСС13869, было обнаружено, что эти последовательности гомологичны на 98%.
Для делеции гена, кодирующего NCgl2522, имеющий происхождение от Corynebacterium glutamicum АТСС13869, так же как в Примере <2-1>, проводили PCR с использованием геномной ДНК Corynebacterium glutamicum АТСС13869 в качестве матрицы и двух пар праймеров, указанных в Таблице 2, амплифицируя PCR-фрагменты N-концевой и С-концевой областей гена NCgl2522, соответственно. Проводили электрофорез этих PCR-фрагментов для получения желаемых фрагментов. В данном случае PCR-реакцию проводили в течение 30 циклов денатурации в течение 30 секунд при 95°С, отжига в течение 30 секунд при 55°С и удлинения в течение 30 секунд при 72°С. Фрагмент N-концевой области, полученный таким образом, обрабатывали рестриктазами BamHI и SalI, и фрагмент С-концевой области, полученный таким образом, обрабатывали рестриктазами SalI и XbaI. Обработанные таким образом фрагменты клонировали в вектор pDZ, обработанный рестриктазами BamHI и XbaI, конструируя плазмиду pDZ-2'NCgl2522(K/O).
Так же как в Примере <2-1>, плазмидой pDZ-2'NCgl2522(K/O) трансформировали Corynebacterium glutamicum DAB12-a и DAB12-b, соответственно. Отбирали штаммы с делецией гена, кодирующего NCgl2522. Отобранные таким образом мутантные штаммы Corynebacterium glutamicum были обозначены DAB12-a ANCgl2522 и DAB12-b ANCgl2522, соответственно.
<2-3> Оценка путресциновой продуктивности штамма с делецией NCgl2522
Для подтверждения эффекта делеции NCgl2522 на путресциновую продуктивность путресцин-продуцирующего штамма сравнивали путресциновую продуктивность мутантных штаммов Corynebacterium glutamicum, полученных в Примерах<2-1>и<2-2>.
Конкретно, 4 типа мутантов Corynebacterium glutamicum (КССМ11138Р ANCgl2522, КССМ11240Р ANCgl2522, DAB12-a ANCgl2522 и DAB12-b ANCgl2522) и 4 типа исходных штаммов (КССМ11138Р, КССМ11240Р, DAB12-a и DAB12-b) высевали на чашки со средой СМ (1% глюкозы, 1% полипептона, 0,5% дрожжевого экстракта, 0,5% мясного экстракта, 0,25% NaCl, 0,2% мочевины, 100 мкл 50%-го NaOH, 2% агара, рН 6,8, на основе 1 л), содержащей 1 мМ аргинина, и культивировали при 30°С в течение 24 часов, соответственно. 1 платиновую петлю каждого штамма, культивированного таким образом, засевали в 25 мл титрационной среды (8% глюкозы, 0,25% соевого белка, 0,50% кукурузного экстракта, 4% (NH4)2SO4, 0,1% KH2PO4, 0,05% MgSO4⋅7H2O, 0,15% мочевины, 100 г биотина, 3 мг тиамина гидрохлорида, 3 мг пантотената кальция, 3 мг никотинамида, 5% СаСО3, на основе 1 л), и затем культивировали при 30°С и 200 об/мин в течение 98 часов. Для культивирования всех штаммов в среды добавляли 1 мМ аргинина. В каждой культуре измеряли концентрацию путресцина, и результаты показаны в Таблице 3 ниже.
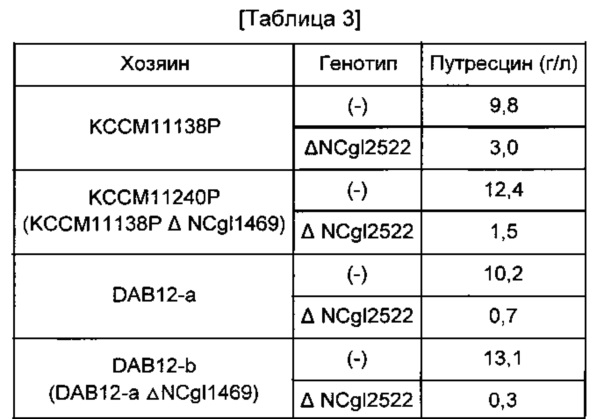
Как показано в Таблице 3, у 4 типов мутантных штаммов Corynebacterium glutamicum с делецией NCgl2522 наблюдали существенное снижение продукции путресцина.
Пример 3: Получение штамма с усилением NCgl2522 и оценка его путресциновой продуктивности
<3-1> Введение NCgl2522 в ген транспозона в хромосоме АТСС13032
Для подтверждения повышения продукции путресцина дополнительной хромосомной вставкой гена NCgl2522 (содержащего собственную промоторную область) у микроорганизма Corynebacterium sp.КССМ11138Р, продуцирующего путресцин, NCgl2522 вводили в ген транспозона. Был использован вектор для трансформации pDZTn (публикация патента Кореи №10-2008-0033054), позволяющий вводить ген в ген транспозона на хромосоме микроорганизма Corynebacterium sp.
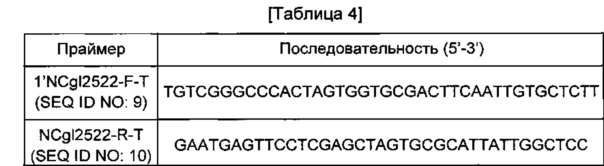
Ген NCgl2522, содержащий собственную промоторную область, амплифицировали с использованием хромосомы штамма АТСС13032 в качестве матрицы и пары праймеров SEQ ID NO: 9 и 10 (см. Таблицу 4). В данном случае PCR-реакцию проводили в течение 30 циклов денатурации в течение 30 секунд при 95°С, отжига в течение 30 секунд при 55°С и удлинения в течение 30 секунд или 2 минут при 72°С. В результате PCR был получен фрагмент гена размером 1,88 т.п.о. Этот PCR-продукт подвергали электрофорезу в 0,8%-м агарозном геле для элюирования и очистки полосы желаемого размера. Вектор pDZTn обрабатывали XhoI и проводили клонирование PCR-продукта NCgl2522 штамма АТСС13032 путем слияния. Для клонирования слиянием использовали набор In-FusionHD Cloning Kit (Clontech). Полученная плазмида была обозначена pDZTn-1'NCgl2522.
Corynebacterium glutamicum КССМ11138Р, описанный в Сравнительном примере 1, трансформировали плазмидой pDZTn-1'NCgl2522 путем электропорации с получением трансформантов. Из трансформантов проводили отбор штамма, в транспозон которого был введен NCgl2522, так же как в Примере 2.
Проводили PCR с использованием геномной ДНК выбранного штамма и пары праймеров SEQ ID NO: 9 и 10 для подтверждения введения NCgl2522 в транспозон при введении плазмиды pDZTn-1'NCgl2522. В данном случае PCR-реакцию проводили в течение 30 циклов денатурации в течение 30 секунд при 94°С, отжига в течение 30 секунд при 55°С и удлинения в течение 2 минут при 72°С.
Отобранный таким образом мутантный штамм Corynebacterium glutamicum был обозначен КССМ11138Р Tn:1'NCgl2522.
<3-2> Получение штамма с заменой промотора NCgl2522 из путресцин-продуцирующего штамма на основе АТСС13032
Для усиления активности NCgl2522 у путресцин-продуцирующего штамма проводили введение промотора CJ7 (WO 2006/65095) перед старт-кодоном NCgl2522 на хромосоме.
Сначала получали фрагмент гомологичной рекомбинации, содержащий промотор CJ7, имеющий нуклеотидную последовательность, представленную SEQ ID NO: 24, имеющий оригинальную последовательность NCgl2522 на обоих концах промотора. Конкретно, проводили PCR с использованием геномной ДНК Corynebacterium glutamicum АТСС13032 в качестве матрицы и пары праймеров SEQ ID NO: 11 и 12 с получением 5'-концевой области промотора CJ7. В данном случае PCR-реакцию проводили в течение 30 циклов денатурации в течение 30 секунд при 94°С, отжига в течение 30 секунд при 55°С и удлинения в течение 30 секунд при 72°С.Далее проводили PCR с использованием пары праймеров SEQ ID NO: 13 и 14 в тех же условиях с получением промоторной области CJ7. Кроме того, проводили PCR с использованием геномной ДНК Corynebacterium glutamicum АТСС13032 в качестве матрицы и пары праймеров SEQ ID NO: 15 и 16 в тех же условиях с получением 3'-концевой области промотора CJ7. Праймеры, использованные при замене промотора, идентичны представленным в Таблице 5 ниже.
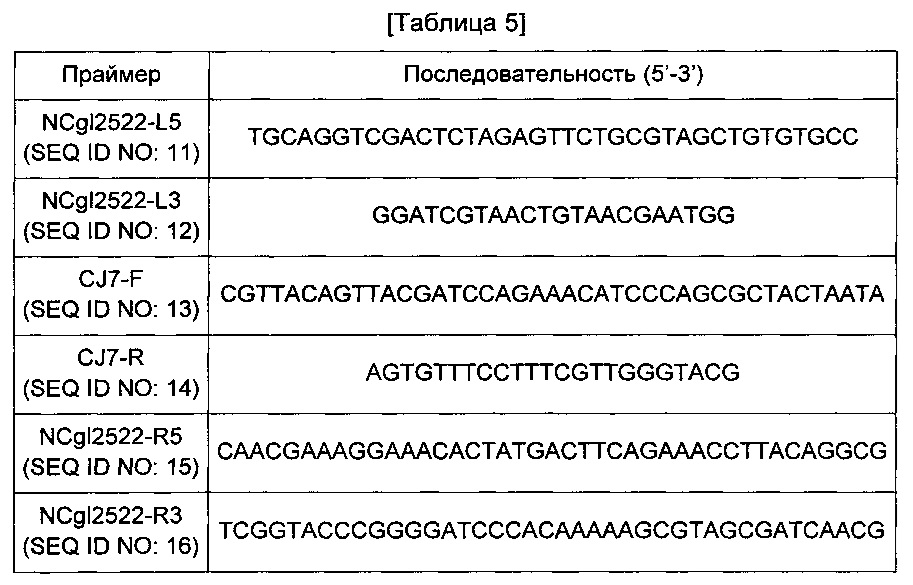
Каждый PCR-продукт, полученный таким образом, клонировали слиянием в вектор pDZ, обработанный BamHI и XbaI. Для клонирования слиянием использовали набор In-FusionHD Cloning Kit (Clontech). Полученная плазмида была обозначена pDZ-P(CJ7)-1'NCgl2522.
Плазмидой pDZ-P(CJ7)-1'NCgl2522, полученной таким образом, трансформировали Corynebacterium glutamicum КССМ11138Р и КССМ11240Р по Сравнительным примерам 1 и 2 путем электропорации с получением трансформантов. Трансформантов, полученных таким образом, засевали в среду СМ и культивировали на качалке при 30°С в течение 8 часов. Каждую полученную из них культуру разводили от 10-4 до 10-10, высевали и культивировали на чашках с BHIS, содержащей 25 кг/мл канамицина и X-gal, для образования колоний.
Белые колонии встречались относительно редко, по сравнению с большинством колоний синего цвета, и их отбирали, чтобы в итоге получить штамм, в котором промотор NCgl2522 был заменен на промотор CJ7 вторичным кроссинговером. Проводили PCR с использованием геномной ДНК выбранного штамма в качестве матрицы и пары праймеров SEQ ID NO: 13 и 16 для подтверждения того, что введение плазмиды pDZ-1'CJ7(NCgl2522) привело к введению промотора CJ7 перед старт-кодоном NCgl2522 на хромосоме. В данном случае PCR-реакцию проводили в течение 30 циклов денатурации в течение 30 секунд при 94°С, отжига в течение 30 секунд при 55°С и удлинения в течение 1 минуты при 72°С.
Мутантные штаммы Corynebacterium glutamicum, отобранные таким образом, были обозначены КССМ11138Р P(CJ7)-NCgl2522 и КССМ11240Р P(CJ7)-NCgl2522, соответственно.
<3-3> Введение гена NCgl2522 в ген транспозона на хромосоме АТСС13869
Для подтверждения повышения продукции путресцина дополнительной хромосомной вставкой гена NCgl2522 у путресцинового штамма, имеющего происхождение от Corynebacterium glutamicum АТСС 13869, проводили введение NCgl2522 (содержащего промоторную область) в ген транспозона. Ген NCgl2522 амплифицировали с использованием хромосомы штамма АТСС13869 в качестве матрицы и пары праймеров SEQ ID NO: 17 и 10 (см. Таблицу 6). В данном случае PCR-реакцию проводили в течение 30 циклов денатурации в течение 30 секунд при 94°С, отжига в течение 30 секунд при 55°С и удлинения в течение 30 секунд или 2 минут при 72°С. В результате PCR был получен фрагмент гена размером 1,97 т.п.о. PCR-фрагмент NCgl2522, полученный таким образом, клонировали слиянием в вектор pDZ, обработанный Xhol. Для клонирования слиянием использовали набор In-FusionHD Cloning Kit (Clontech). Полученная плазмида была обозначена pDZTn-2'NCgl2522.
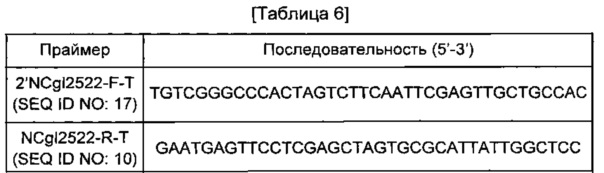
Плазмидой pDZTn-2'NCgl2522 трансформировали Corynebacterium glutamicum DAB12-a, так же как в Примере <3-1>, для подтверждения введения NCgl2522 в транспозон.
Отобранный таким образом мутантный штамм Corynebacterium glutamicum был обозначен DAB12-a Tn:2'NCgl2522.
<3-4> Получение штамма с заменой промотора NCgl2522 из путресцин-продуцирующего штамма на основе АТСС13869
Для введения промотора CJ7 перед старт-кодоном NCgl2522 Corynebacterium glutamicum АТСС 13869, проводили PCR с использованием геномной ДНК Corynebacterium glutamicum АТСС13869 в качестве матрицы и трех пар праймеров, приведенных в Таблице 7 ниже, так же как в Примере <3-2>, соответственно. После этого амплифицировали PCR-фрагменты промоторной области CJ7, ее N-концевой области и С-концевой области и затем проводили электрофорез с получением желаемых фрагментов. В данном случае PCR-реакцию проводили в течение 30 циклов денатурации в течение 30 секунд при 94°С, отжига в течение 30 секунд при 55°С и удлинения в течение 30 секунд при 72°С. PCR-фрагменты промоторной области CJ7, ее N-концевой области и С-концевой области, полученные таким образом, клонировали слиянием в вектор pDZ, обработанный BamHI и XbaI. Для клонирования слиянием использовали набор In-FusionHD Cloning Kit (Clontech). Полученная плазмида была обозначена pDZ-P(CJ7)-2'NCgl2522.

Плазмидой pDZ-'P(CJ7)-2'NCgl2522 трансформировали каждый из Corynebacterium glutamicum DAB12-a и DAB12-b, так же как в Примере <3-2>, отбирая штаммы, в которых перед старт-кодоном NCgl2522 был введен промотор CJ7. Мутантные штаммы Corynebacterium glutamicum, отобранные таким образом, были обозначены DAB12-a P(CJ7)-NCgl2522 и DAB12-b P(CJ7)-NCgl2522.
<3-5> Оценка путресциновой продуктивности штамма с усилением NCgl2522
Для подтверждения эффекта усиления активности NCgl2522 заменой промотора на путресциновую продуктивность путресцин-продуцирующего штамма, сравнивали путресциновую продуктивность 6 типов мутантных штаммов Corynebacterium glutamicum (КССМ11138Р Tn:1'NCgl2522, КССМ11138Р P(CJ7)-NCgl2522, KCCM11240P P(CJ7)-NCgl2522, DAB12-a Tn:2'NCgl2522, DAB12-a P(CJ7)-NCgl2522 и DAB12-b P(CJ7)-NCgl2522), полученных в Примерах <3-1> - <3-4>, и 4 типов исходных штаммов (КССМ11138Р, КССМ11240Р, DAB12-a и DAB12-b). Каждый штамм культивировали так же, как в Примере 2-3, в каждой культуре измеряли концентрацию путресцина, и результаты показаны в Таблице 8 ниже.

Как показано в Таблице 8, у всех 6 типов мутантных штаммов Corynebacterium glutamicum, у которых активность NCgl2522 была усилена дополнительным введением NCgl2522 в транспозон или заменой промотора, наблюдали повышение продукции путресцина.
Пример 4: Измерение внутриклеточной концентрации путресцина у штамма с усилением NCgl2522
Для подтверждения снижения внутриклеточной концентрации путресцина при усилении способности экспортировать путресцин у мутантного штамма Corynebacterium glutamicum с усиленной активностью NCgl2522 измеряли внутриклеточные концентрации путресцина у мутантного штамма Corynebacterium glutamicum КССМ11138Р Tn:1'NCgl2522 и у исходного штамма КССМ11138Р посредством экстракции с использованием органического растворителя. Анализ внутриклеточных метаболитов проводили в соответствии со способом, описанным в литературе (Nakamura J et al., Appl. Environ. Microbiol. 73(14): 4491-4498, 2007).
Сначала мутантный штамм Corynebacterium glutamicum KCCM11138P Tn:1'NCgl2522 и исходный штамм KCCM11138P засевали в 25 мл среды СМ (1% глюкозы, 1% полипептона, 0,5% дрожжевого экстракта, 0,5% мясного экстракта, 0,25% NaCl, 0,2% мочевины, 100 мкл 50%-го NaOH, рН 6,8, на основе 1 л), содержащей 1 мМ аргинина, и культивировали на качалке при 30°С и 200 об/мин. Когда при культивировании клеточный рост достигал экспоненциальной фазы, клетки выделяли из культуральной среды быстрой вакуумной фильтрацией (Durapore HV, 0.45 m; Millipore, Billerica, MA). Фильтр с адсорбированными клетками дважды отмывали 10 мл охлажденной воды и затем погружали в метанол, содержащий 5 М морфолинэтансульфоновой кислоты и 5 М метионинсульфона на 10 минут.
Полученный из них экстракт смешивали с равным объемом хлороформа и 0,4-кратным объемом воды, и только водную фазу наносили на центрифужную колонку для удаления белковых примесей. Профильтрованный экстракт анализировали масс-спектрометрией с капиллярным электрофорезом, и результаты показаны в Таблице 9 ниже.
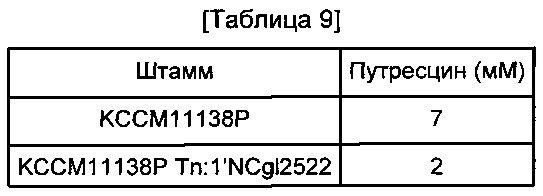
Как показано в Таблице 9, у мутантного штамма Corynebacterium glutamicum КССМ11138Р Tn:1'NCgl2522 с усиленной активностью NCgl2522 наблюдали снижение внутриклеточной концентрации путресцина по сравнению с исходным штаммом КССМ11138Р. Это указывает на то, что улучшенная способность экспортировать путресцин в результате усиления активности NCgl2522 у мутантного штамма Corynebacterium glutamicum КССМ11138Р Tn:1'NCgl2522 приводит к эффективному внеклеточному экспорту внутриклеточного путресцина.
Пример 5: Оценка резистентности штамма с делецией или усилением NCgl2522 к путресцину
Для анализа эффекта NCgl2522 на резистентность к путресцину оценивали резистентность штаммов КССМ11240Р, КССМ11240Р ANCgl2522 и КССМ11240Р P(CJ7)-NCgl2522 к путресцину.
Каждый штамм засевали в 2 мл жидкой среды СМ, содержащей 1 мМ аргинина, и культивировали при 30°С в течение приблизительно 10 часов с последующим разведением в указанном порядке: 105, 104, 103, 102 и 101. Каждое разведение, полученное таким образом, наносили на чашку с СМА (1% глюкозы, 1% полипептона, 0,5% дрожжевого экстракта, 0,5% мясного экстракта, 0,25% NaCl, 0,2% мочевины, 1,8% агара, 1 мМ аргинина, рН 6,8, на основе 1 л), содержащей 0 M или 0,8 M путресцина, и затем культивировали при 30°С в течение 48 часов для сравнения различий в росте штаммов.
В результате, штаммы продемонстрировали два разных типа роста. Как показано на ФИГ. 2, штамм с делецией гена NCgl2522 не рос в условиях высокой концентрации путресцина, в то время как штамм с усилением гена NCgl2522 рос в тех же условиях. Этот результат демонстрирует, что повышенный рост клеток КССМ11240Р P(CJ7)-NCgl2522 в условиях высокой концентрации путресцина, по сравнению с исходным штаммом, обусловлен повышенной способностью к экспорту путресцина, благодаря усилению гена NCgl2522. В результате, введение и усиление NCgl2522 необходимы для ферментации высоких концентраций путресцина.
Пример 6: Ферментация путресцина посредством введения NCgl2522 в Е. coli
Для подтверждения повышения продукции путресцина при экспрессии NCgl2522 Corynebacterium glutamicum АТСС13032 в штамме Ε. coli W3110 дикого типа, имеющем путь биосинтеза путресцина, в W3110 вводили вектор, экспрессирующий speC, представляющий собой фермент синтеза путресцина, или вектор, экспрессирующий NCgl2522.
Для получения speC-экспрессирующего вектора использовали хромосому W3110 в качестве матрицы и пару праймеров SEQ ID NO: 34 и 35 для амплификации фрагмента гена speC размером приблизительно 2,1 т.п.о. (см. Таблицу 10). Этот PCR-продукт подвергали электрофорезу в 0,8%-м агарозном геле, после чего проводили элюирование и очистку полосы желаемого размера. Вектор pSE280 (Invitrogen), содержащий промотор Trc, обрабатывали Ncol и EcoRI и затем PCR-продукт speC клонировали слиянием в данный вектор. При клонировании слиянием использовали набор In-Fusion® HD Cloning Kit (Clontech). Полученная плазмида была обозначена pSE280-speC.
Для получения NCgl2522-экспрессирующего вектора использовали pSE280 в качестве матрицы и пару праймеров SEQ ID NO: 36 и 37 для получения фрагмента промотора Trc и хромосому Corynebacterium glutamicum АТСС13032 в качестве матрицы и пару праймеров SEQ ID NO: 38 и 39 для получения фрагмента NCgl2522. Эти PCR-продукты подвергали электрофорезу в 0,8%-м агарозном геле, после чего проводили элюирование и очистку полос желаемого размера. Фрагмент промотора trc и фрагмент NCgl2522 клонировали слиянием в pcdBAC, обработанный HindIII. Полученная плазмида была обозначена pcd BAC-P(trc)-NCgl2522.
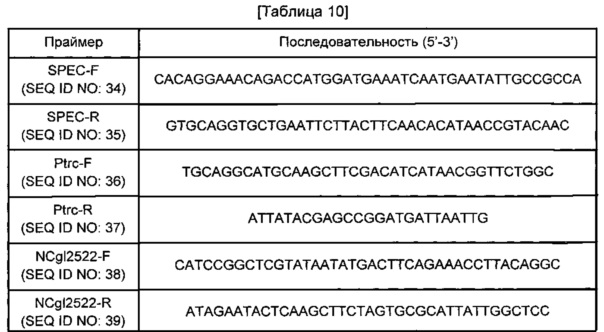
Плазм идами pSE280-speC или pcc1BAC-P(trc)-NCgl2522 трансформировали W3110. Трансформацию Е. coli проводили с использованием 2-кратного раствора TSS (Epicentre). Е. coli с введенной pSE280-speC высевали и культивировали на чашках с LB (10 г триптона, 5 г дрожжевого экстракта, 10 г NaCl, 2% агара, на основе 1 л), содержащей ампициллин (100 мкг/мл), для образования колоний. Е. coli с введенной pcd BAC-P(trc)-NCgl2522 высевали и культивировали на чашках с LB, содержащей хлорамфеникол (35 мкг/мл), для образования колоний. У полученных таким образом штаммов анализировали путресциновую продуктивность.
Конкретно, W3110, W3110 pSE280-speC и W3110 pcd BAC-P(trc)-NCgl2522 высевали на чашки с LB, LA и LC, соответственно, культивировали при 37°С в течение 24 часов и затем засевали в 25 мл титрационной среды (2 г (NH4)2PO4, 6,75 г KH2PO4) 0,85 г лимонной кислоты, 0,7 г MgSO4⋅7H2O, 0,5% (об./об.) следовых элементов, 10 г глюкозы, 3 г AMS, 30 г CaCO3, на основе 1 л) и культивировали при 37°С в течение 24 часов. Раствор следовых металлов содержит 5 М HCl, 10 г FeSO4⋅7H2O, 2,25 г ZnSO4⋅7H2O, 1 г CuSO4⋅5H2O, 0,5 г MnSO4⋅5H2O, 0,23 г Na2B4O7⋅10H2O, 2 г CaCl2⋅2H2O и 0,1 г (NH4)6Mo7O2⋅4H2O в 1 л.
В каждой культуре измеряли концентрацию путресцина, и результаты показаны в Таблице 11 ниже.

Как показано в Таблице 11, у штамма W3110 pcd BAC-P(trc)-NCgl2522 с введением NCgl2522 наблюдали высокую продукцию путресцина, по сравнению с штаммом W3110pcc1BAC-pSE280-speC с введением фермента биосинтеза путресцина speC.
Этот результат демонстрирует, что белок NCgl2522 также обладает способностью к экспорту путресцина у Е. coli.
Авторы настоящего изобретения обнаружили, что дополнительное введение NCgl2522 в транспозон микроорганизма Corynebacterium sp.КССМ11138Р усиливает активность NCgl2522 у штамма Corynebacterium glutamicum и, таким образом, путресцин можно получать с высоким выходом, благодаря повышенной способности к экспорту путресцина, и они обозначили данный штамм Corynebacterium glutamicum СС01-0510 и депонировали его в соответствии с Будапештским договором в Корейском центре культур микроорганизмов (КССМ) 8 марта 2013 г. под регистрационным номером КССМ11401Р.
На основании приведенного выше описания, специалистам в данной области должно быть понятно, что при практическом применении изобретения могут быть использованы другие конкретные воплощения, без выхода за рамки технической идеи или основных признаков изобретения. В этой связи, описанные выше приведены лишь в иллюстративных целях, и изобретение не следует ограничивать этими примерами. Следует понимать, что объем настоящего изобретения включает все модификации или модифицированные формы, имеющие происхождение от значения и объема соответствующих пунктов формулы изобретения или их эквивалентов, но не от приведенного выше подробного описания. Эффект изобретения
Микроорганизм Corynebacterium sp., имеющий улучшенную путресциновую продуктивность, по настоящему изобретению был модифицирован для усиления активности NCgl2522 по экспорту внутриклеточного путресцина, по сравнению с его эндогенной активностью, что привело к повышенному внеклеточному экспорту путресцина и повышенной резистентности к путресцину.
Кроме того, было обнаружено, что при экспрессии NCgl2522 у Е. coli, имеющей путь синтеза путресцина, по настоящему изобретению количество внеклеточного путресцина увеличивалось. Соответственно, NCgl2522, имеющий происхождение от Corynebacterium glutamicum, можно использовать у микроорганизма, продуцирующего путресцин, что может найти широкое применение при эффективном получении путресцина.
Реферат
Группа изобретений относится к микроорганизму, продуцирующему путресцин, и способу получения путресцина с использованием указанного микроорганизма. В предложенном микроорганизме усилена активность белка, имеющего аминокислотную последовательность, представленную в SEQ ID NO: 21 или 23, по сравнению с активностью указанного белка у микроорганизма дикого типа. Способ получения путресцина включает культивирование указанного микроорганизма с получением клеточной культуры и выделение путресцина из культивированного микроорганизма или клеточной культуры. Группа изобретений обеспечивает получение путресцина с высоким выходом. 2 н. и 8 з.п. ф-лы, 11 табл., 6 пр., 2 ил.

Комментарии