Способ получения ксантозин-5'-монофосфата, штамм corynebacterium ammoniagenes - продуцент ксантозин-5'-монофосфата (варианты) - RU2209249C2
Код документа: RU2209249C2
Чертежи




Описание
Изобретение относится к ферментативным способам получения ксантозин-5'-монофосфата и к микроорганизмам, используемым в этих способах.
Ксантозин-5'-монофосфат (ХМР) является промежуточным продуктом в биосинтезе пуриновых нуклеотидов и используется в качестве исходного материала для продукции гуанозин-5'-монофосфата (GMP), известного как вкусовая добавка (Kuninaka, 1960, J. Agr. Chem. Soc. Japan, 34,489), и в качестве исходного материала для получения лекарственных препаратов (патент США 5736530).
Описание уровня техники
В число способов получения ксантозин-5'-монофосфата в процессе прямой ферментации входят способы, использующие различные штаммы коринеформных бактерий. Было
установлено, что штаммы Corynebacterium glutamicum (Micrococcus glutamicum) и Brevibacterium ammoniagenes (переименован в настоящее время в Corynebacterium ammoniagenes), нуждающиеся в гуанине, или
гуанин и аденине, способны накапливать большое количество ХМР в подходящих условиях для ферментации (Misawa et al, 1964, Agr. Biol. Chem., 28, 690-693; Misawa et al, 1964, Agr. Biol. Chem., 28,
694-699; Demain et al, 1965, Appl. Microbiol., 13, 757-765; Misawa et al, 1969, Agr. Biol. Chem., 33, 370-376). Накопление ХМР этими штаммами происходит, по-видимому, вследствие прямой экскреции из
клетки синтезированных de novo нуклеотидов, потому что активность ХМР пирофосфорилазы (ксантин фосфорибозилтрансферазы) была очень низкой или совсем отсутствовала, а экзогенный ксантин не превращался
растущими клетками в ХМР (Misawa et al, 1964, Agr. Biol. Chem., 28, 694-699).
Кроме того, сообщалось о накоплении ХМР вместе с IMP мутантами В. subtilis, нуждающимися в гуанине, или гуанине и аденине, и с низкой активностью 5'-нуклеотидазы (Akiya et al, 1972, Agr. Biol. Chem., 36, 27-234).
Позже был описан процесс с использованием аденин-зависимых типа "lеакy"(неполный блок синтеза аденина), нуждающихся также в гуанине мутантов Corynebacterium ammoniagenes с низкой активностью нуклеотидазы и намного большей продуктивностью ХМР (Fujio et al, 1984, J. Ferment. Technol., 62, 131).
Также были сделаны попытки увеличить продуктивность штаммов Corynebacterium ammoniagenes - продуцентов ксантозин-5' -монофосфата путем придания им дополнительных свойств. Было установлено, что продуктивность штаммов Corynebacterium ammoniagenes - продуцентов ксантозин-5'-монофосфата может быть значительно увеличена путем придания аденин-гуанин-зависимым мутантам чувствительности к лизоциму (патентные заявки Кореи 86-248 и 89-540) или устойчивость к антибиотикам, ингибиторам синтеза клеточной стенки (выложенная заявка Японии 60-156399 А2).
Как чувствительность к лизоциму, так и устойчивость к антибиотикам очевидным образом связаны с проницаемостью клеточной мембраны для ксантозин-5'-монофосфата.
Хорошо известно, что разнообразные воздействия, которые вызывают стресс у микробных клеткок (температура, облучение, голод, ингибиторы и антибиотики), могут приводить к разрывам РНК и ДНК с последующей экскрецией производных нуклеиновых кислот (Domain A. (1968). Production of purine nucleotides by fermentation. In: Progress in Inductrial Microbiology, vol.18. Ed. D. J. D. Hockenhell. J.& A.Churchill Ltd., London). В настоящее время общепризнано, что проникновение метаболитов через цитоплазматическую мембрану обычно происходит с участием более или менее специфических транспортных белков, осуществляющих их выброс (Рао et al, 1998, Microbiol. Mol. Biol. Rev., 62, 1-34; Paulsen et al, 1998, J. Mol. Biol., 277, 573-592; Saier et al, 1999, J. Mol. Microbiol. Biotechnol., 1, 257-279). В свою очередь, логично предположить, что эти транспортеры могут индуцироваться или активироваться в условия стресса. Много лет назад было показано (Billen, D., 1957, Arch. Biochem. Biophys., 67, 333-340), что облученные УФ- и рентгеновскими лучами клетки Escherichia coli экскретируют свободные основания, рибозиды, мононуклеотиды и АТФ. Такое высвобождение не было результатом лизиса клеток, поскольку никакие производные ДНК или (поли)пептиды при этом не обнаруживались. Необходимость присутствия глюкозы и неорганического фосфата для максимального высвобождения, а также ингибирование его арсенатом или низкой температурой указывает на участие ферментативного процесса, вероятно включающего в себя синтез транспортных белков.
В дополнение, дефицит ионов марганца (Мn2+) в культуре аденин-leaky ауксотрофов Corynebacterium ammoniagenes вызывает "изменение степени проницаемости мембраны" для инозин-5'-монофосфата, что приводит к заметному накоплению указанного нуклеотида (Furuya et al, 1970, Agr. Biol. Chem. 34, 210-217). Позднее было установлено, что дефицит ионов марганца влияет на функционирование марганец-зависимой рибонуклеотидредуктазы, имеющейся у коринеформных бактерий, и индуцирует стресс несбалансированного роста (Auling et al, 1980. Arch. Microbiol., 127, 105-114; Willing et al, 1988, Eur. J. Biochem., 170, 603-611). В этих условиях клетки обнаруживают рост в виде филаментов, экскретируют белки и некоторые метаболиты в культуральную среду.
Повышенная продукция инозин-5'-монофосфата в присутствии ионов марганца некоторыми мутантами Brevibacterium ammoniagenes, как предполагалось, также обусловлена "улучшенной проницаемостью" мембраны для IMP. Эти мутанты проявляли повышенную чувствительность к различным антибиотикам, детергентам, красителям и лизоциму (Teshiba, S. and Furuya A., 1983, Agr. Biol. Chem., 47, 1035-1041), очевидным образом связанную с изменениями в бактериальной мембране.
С другой стороны, продукция гуанозина у Bacillus subtilis была заметно улучшена путем введения мутаций, придающих устойчивость к ингибирующим концентрациям метионина и аналога метионина, DL-метионинсульфоксида (Matsui et al, 1977, Appl. Environ. Microbioi., 34, 337-341; Matsui et al, 1979, Agr. Biol. Chem., 43, 1317-1323). Устойчивость к метионинсульфоксиду обусловлена, главным образом, понижением специфической активности 5'-нуклеотидазы и частичной утратой IMP-дегидрогеназой способности к ингибированию и репрессии под действием GMP (Matsui et al, 1977, Appl. Environ. Microbiol., 34, 337-341). Более того, способность PRPP амидотрансферазы к репрессии и ингибированию под действием GMP также была утрачена (Matsui et al, 1979, Agr. Biol. Chem., 43, 1317-1323). IMP-дегидрогеназа, превращающая IMP в ХМР, является первым ферментом в пути, характерным для синтеза GMP, и регулируется, главным образом, GMP (Nishikawa et al, 1967, J. Biochem., 62, 92). PRPP амидотрансфераза является первым ферментом в пути биосинтеза пуриновых нуклеотидов и регулируется АМР и GMP (Nishikawa et al, 1967, J. Biochem., 62, 92; Sato and Shiio, 1970, J. Biochem., 68, 763). Однако устойчивость к аналогам метионина никогда ранее не использовалась для улучшения штаммов коринеформных бактерий - продуцентов ХМР.
Описание изобретения
В настоящем изобретении вышеупомянутые точки зрения были приняты во внимание, и объектом настоящего изобретения является более эффективный способ получения ксантозин-5'-монофосфата с высоким
выходом для промышленного назначения и микроорганизм, который может быть использован в указанном способе.
С этой целью авторы настоящего изобретения после большого числа экспериментов с бактериями - продуцентами ксантозин-5'-монофосфата установили, что микроорганизмы, принадлежащие к Corynebacterium ammoniagenes и содержащие обнаруженные впервые мутации, придающие устойчивость к ингибиторам биосинтеза и/или функционирования клеточной мембраны, ингибиторам фосфорилирования, разобщающим агентам, ингибиторам РНК-полимеразы и аналогам метионина, продуцируют и накапливают значительно большее количество ксантозин-5'-монофосфата в культуральной жидкости. Изучение ряда мутаций показало прямую взаимосвязь между устойчивостью к таким соединениям и накоплением ксантозин-5'-монофосфата.
Прежде не было известно, что продуктивность ксантозин-5'-монофосфата может быть улучшена путем придания таких свойств микроорганизмам - продуцентам ксантозин-5' -монофосфата.
Поэтому была продолжена работа на основе данного наблюдения, что привело к созданию настоящего изобретения.
Таким образом, предметом
настоящего изобретения является:
(1). Коринеформная бактерия, которая обладает устойчивостью к подавлению роста под действием ингибиторов, выбранных из группы, состоящей из ингибиторов
биосинтеза и/или функционирования клеточной мембраны, ингибиторов фосфорилирования, разобщающих агентов, ингибиторов РНК-полимеразы и аналогов метионина, и обладает способностью к продукции
ксантозин-5'-монофосфата.
(2). Коринеформная бактерия, которая обладает способностью к продукции ксантозин-5'-монофосфата и устойчивостью к глицину.
(3). Коринеформная бактерия, которая обладает способностью к продукции ксантозин-5'-монофосфата и устойчивостью к полимиксину.
(4). Коринеформная бактерия, которая обладает способностью к продукции ксантозин-5'-монофосфата и устойчивостью к олигомицину.
(5). Коринеформная бактерия, которая обладает способностью к продукции ксантозин-5'-монофосфата и устойчивостью к карбонилцианид m-хлорфенилгидразону (СССР).
(6). Коринеформная бактерия, которая обладает способностью к продукции ксантозин-5'-монофосфата и устойчивостью к рифампицину.
(7). Коринеформная бактерия, которая обладает способностью к продукции ксантозин-5'-монофосфата и устойчивостью к аналогу метионина, где аналог метионина выбран из группы, включающей D,L-метионинсульфоксид, L-метионинсульфоксид, D,L-метионинсульфон и L-метионинсульфон.
(8). Коринеформная бактерия по любому из пп.1-7, отличающаяся тем, что указанная бактерия принадлежит к роду Corynebacterium ammoniagenes.
(9). Коринеформная бактерия по п.2, отличающаяся тем, что указанной бактерией является Corynebacterium ammoniagenes AGRI 10-52 (ВКПМ В-8006).
(10). Коринеформная бактерия по п.3, отличающаяся тем, что указанной бактерией является Corynebacterium ammoniagenes AGRI 101-51 (ВКПМ В-8010).
(11). Коринеформная бактерия по п.4, отличающаяся тем, что указанной бактерией является Corynebacterium ammoniagenes AGRI 67-52 (ВКПМ В-8004).
(12). Коринеформная бактерия по п.5, отличающаяся тем, что указанной бактерией является Corynebacterium ammoniagenes AGRI 97-52 (ВКПМ В-8008).
(13). Коринеформная бактерия по п.6, отличающаяся тем, что указанной бактерией является Corynebacterium ammoniagenes AGRI 93-38 (ВКПМ В-8003).
(14). Коринеформная бактерия по п.7, отличающаяся тем, что указанной бактерией является Corynebacterium ammoniagenes AGRI 11-51 (ВКПМ В-8005).
(15). Коринеформная бактерия по п.7, отличающаяся тем, что указанной бактерией является Corynebacterium ammoniagenes AGRI 47-51 (ВКПМ В-8007).
(16). Способ получения ксантозин-5'-монофосфата методом ферментации, включающий стадии выращивания бактерии, описанной в любом из пп.1-15, в питательной среде с целью продукции и накопления ксантозин-5'-монофосфата в питательной среде, и выделения ксантозин-5'-монофосфата из культуральной жидкости.
Настоящее изобретение будет более детально разъяснено ниже.
Основываясь на вышеуказанных наблюдениях, авторы пришли к выводу, что разумно предположить, что некоторые мутации, оказывающие влияние на функционирование клеточной мембраны, репликацию ДНК, механизмы транскрипции и трансляции, могут имитировать условия стресса и индуцировать повышение активности некоторых специфических транспортеров, увеличивая таким образом накопление производных нуклеиновых кислот, в особенности ксантозин-5'-монофосфата. Более того, в свете того факта, что опосредованная транспортерами экскреция может зависеть от энергетического статуса бактериальной клетки, мутации, усиливающие АТФ-регенерирующию активность, также могут быть полезньми для улучшения штаммов - продуцентов ксантозин-5'-монофосфата.
Микроорганизм согласно настоящему изобретению может быть получен, исходя из микроорганизма, уже обладающего способностью к продукции ксантозин-5'-монофосфата, путем придания ему заданной устойчивости. С другой стороны, микроорганизм согласно настоящему изобретению также может быть получен путем придания способности к продукции ксантозин-5'-монофосфата микроорганизму, обладающему заданной устойчивостью.
Термин "бактерия, обладающая устойчивостью к ингибиторам биосинтеза и/или функционирования клеточной мембраны" означает микроорганизм, полученный из штамма бактерии, принадлежащей к коринеформным бактериям, в качестве исходного штамма, и генетически модифицированный таким образом, что он может расти в питательной среде, содержащей ингибиторы биосинтеза и/или функционирования клеточной мембраны. Термин "ингибитор биосинтеза и/или функционирования клеточной мембраны" означает вещество (например, глицин, полимиксин, грамицидин), которое подавляет биосинтез цитоплазматической мембраны или влияет на ее нормальное функционирование. Таким образом, использованный здесь термин "устойчивость к подавлению роста ингибиторами биосинтеза и/или функционирования клеточной мембраны" означает, что указанный мутант способен расти в питательной среде, содержащей такое вещество, как ингибитор, в количестве, которое будет подавлять рост исходных штаммов.
Например, микроорганизм, который может образовывать колонии в течение 3-5 дней в ходе выращивания при 32oС на чашках с агаром, содержит 40 г/л или более, предпочтительно 50 г/л или более глицина, 40 мг/л или более, предпочтительно 50 мг/л или более полимиксина, 5 мг/л или более, предпочтительно 10 мг/л или более грамицидина, является устойчивым к указанным веществам.
Термин "бактерия, обладающая устойчивостью к ингибитору фосфорилирования" означает микроорганизм, полученный из штамма бактерии, принадлежащей к коринеформным бактериям, в качестве исходного штамма, и генетически модифицированный таким образом, что он может расти в питательной среде, содержащей ингибитор фосфорилирования. Термин "ингибитор фосфорилирования" означает вещество (например, олигомицин), которое ингабирует синтез АФТ из АДФ и Рi, F0/F1 АТФазой (АТФ синтазой). Таким образом, использованный здесь термин "устойчивость к подавлению роста ингибиторами фосфорилирования" означает, что указанный мутант способен расти в питательной среде, содержащей такое вещество, как ингибитор, в количестве, которое будет подавлять рост исходных штаммов.
Например, микроорганизм, который может образовывать колонии в течение 3 дней в ходе выращивания при 32oС на чашках с агаром, содержит 50 мг/л или более, предпочтительно 100 мг/л или более олигомицина, является устойчивым к олигомицину.
Термин "бактерия, обладающая устойчивостью к разобщающим агентам" означает микроорганизм, полученный из штамма бактерии, принадлежащей к коринеформным бактериям, в качестве исходного штамма, и генетически модифицированный таким образом, что он может расти в питательной среде, содержащей разобщающий агент. Термин "разобщающий агент" означает вещество (например, динитрофенол, карбонилцианид m-хлорфенилгидразон (СССР), р-трифторметоксикарбонилцианидфенилгидразон (FCCP)), которое нарушает необходимую связь между дыхательной цепью и системой фосфорилирования. Таким образом, использованный здесь термин "устойчивость к разобщающему агенту" означает, что указанный мутант способен расти в питательной среде, содержащей такое вещество, как ингибитор, в количестве, которое будет подавлять рост исходных штаммов.
Например, микроорганизм, который может образовывать колонии в течение 3 дней в ходе выращивания при 32oС на чашках с агаром, содержит 2 мг/л или более, предпочтительно 4 мг/л или более СССР или FCCP, является устойчивым к СССР или FCCP.
Термин "бактерия, обладающая устойчивостью к ингибитору РНК-полимеразы" означает микроорганизм, полученный из штамма бактерии, принадлежащей к коринеформным бактериям, в качестве исходного штамма, и генетически модифицированный таким образом, что он может расти в питательной среде, содержащей ингибитор РНК-полимеразы. Термин "ингибитор РНК-полимеразы" означает вещество (например, рифампицин (также называемый как рифампин)), которое ингибирует активность ДНК-зависимой РНК-полимеразы. Таким образом, использованный здесь термин "устойчивость к ингибитору РНК-полимеразы" означает, что указанный мутант способен расти в питательной среде, содержащей такое вещество, как ингибитор, в количестве, которое будет подавлять рост исходных штаммов.
Например, микроорганизм, который может образовывать колонии в течение 3 дней в ходе выращивания при 32oС на чашках с агаром, содержит 5 мг/л или более, предпочтительно 15 мг/л или более рифампицина, является устойчивым к рифампицину.
Термин "бактерия, обладающая устойчивостью к аналогу метионина" означает микроорганизм, полученный из штамма бактерии, принадлежащей к коринеформным бактериям, в качестве исходного штамма, и генетически модифицированный таким образом, что он может расти в питательной среде, содержащей аналог метионина. Термин "аналог метионина" означает вещество, похожее на метионин по структуре (например, D, L-метионинсульфоксид, L-метионинсульфоксид, D,L-метионинсульфон и L-метионинсульфон). Таким образом, использованный здесь термин "устойчивость к аналогу метионина" означает, что указанный мутант способен расти в питательной среде, содержащей такое вещество в качестве ингибитора, в количестве, которое будет подавлять рост исходных штаммов.
Например, микроорганизм, который может образовывать колонии в течение 5 дней в ходе выращивания при 32oС на чашках с агаром, содержит 5 г/л или более, предпочтительно 10 г/л или более D,L-метионинсульфоксида или L-метионинсульфоксида или 5 г/л или более, предпочтительно 10 г/л или более D,L-метионинсульфона или L-метионинсульфона, является устойчивым к этим веществам.
В число "коринеформных бактерий", упомянутых выше в настоящем изобретении, входят бактерии, до сих пор классифицировавшиеся как род Brevibacterium, но в настоящее время объединенные в род Corynebacterium (Int. J. Syst. Bacteril., 41, 255 (1981)), и бактерии, принадлежащие к роду Brevibacterium, близкородственные роду Corynebacterium. Примеры таких коринеформных бактерий следующие.
Corynebacterium
ammoniagenes (Brevibacterium ammoniagenes)
Corynebacterium acetoacidophilum
Corynebacterium acetoglutamicum
Corynebacterium alkanolyticum
Corynebacterium
callunae
Corynebacterium glutamicum
Corynebacterium lilium (Corynebacterium glutamicum)
Corynebacterium melassecola
Corynebacterium thermoaminogenes
Corynebacterium herculis
Brevibacterium divaricatum (Corynebacterium glutacicum)
Brevibacterium flavum (Corynebacterium glutamicum)
Brevibacterium immariophilum
Brevibacterium lactofermentum (Corynebacterium glutamicum)
Brevibacterium roseum
Brevibacterium saccharolyticum
Brevibacterium thiogenitalis
Brevibacterium album
Brevibacterium cerinum
Microbacterium ammoniaphilum
В частности, следующие штаммы этих бактерий приведены в качестве примеров:
Corynebacterium ammoniagenes
(Brevibacterium ammoniagenes) ATCC 6871, ATCC 6872, ВКПМ В-6307
Corynebacterium acetoacidophilum ATCC 13870
Corynebacterium acetoglutamicum ATCC 15806
Corynebacterium
alkanolyticum ATCC 21511
Corynebacterium callunae ATCC 15991
Corynebacterium glutamicum ATCC 13020, ATCC 13032, ATCC 13060
Corynebacterium lilium (Corynebacterium
glutamicum) ATCC 15990
Corynebacterium melassecola ATCC 17965
Corynebacterium thermoaminogenes AJ 12340 (FERM BP-1539)
Corynebacterium herculis ATCC13868
Brevibacterium divaricatum (Corynebacterium glutacicum) ATCC 14020
Brevibacterium flavum (Corynebacterium glutamicum) ATCC 13826, ATCC 14067
Brevibacterium immariophilum ATCC
14068
Brevibacterium lactofermentum (Corynebacterium glutamicum) ATCC 13665, ATCC 13869
Brevibacterium roseum ATCC 13825
Brevibacterium saccharolyticum ATCC 14066
Brevibacterium thiogenitalis ATCC 19240
Brevibacterium album ATCC 15111
Brevibacterium cerinum ATCC 15112
Microbacterium ammoniaphilum ATCCATCC 15354
В дополнение к
ранее упомянутым свойствам эти бактерии могут обладать другими специфическими свойствами, такими как потребность в различных пищевых добавках, устойчивость к антибиотикам, чувствительность к
антибиотикам и зависимость от них, не выходя при этом за рамки настоящего изобретения. Более того, микроорганизмы согласно настоящему изобретению могут быть модифицированы методами генетической
рекомбинации с целью повышения активности ферментов, вовлеченных в биосинтез ксантозин-5'-монофосфата.
Мутантные микроорганизмы, пригодные для осуществления настоящего изобретения, могут быть получены с помощью мутаций, используя традиционные методы мутагенеза, такие как облучение УФ-светом, рентгеновское облучение, радиационное облучение и обработка химическими мутагенами с последующим отбором с использованием метода реплики. Упомянутым мутагеном является N-метил-N'-нитро-N-нитрозогуанидин (здесь и далее упоминаемый как NTG).
Таким образом, любой известный штамм, принадлежащий к коринеформным бактериям, таким как Corynebacterium ammoniagenes, уже обладающим способностью к продукции ксантозин-5'-монофосфата, можно подвергнуть процедуре мутагенеза для получения мутантного штамма, а затем проверить указанный мутантный штамм, чтобы определить, удовлетворяет ли он указанным выше требованиям согласно настоящему изобретению, относящимся к устойчивости к подавлению роста ингибиторами биосинтеза и/или функционирования клеточной мембраны, ингибиторами фосфорилирования, разобщающими агентами, ингибиторами РНК-полимеразы или аналогами метионина, и вследствие этого является пригодным для использования в указанном изобретении. Штаммы, мутировавшие, как указано выше, выявляются путем выращивания в питательной среде и отбора штаммов, обладающих способностью к продукции ксантозин-5'-монофосфата с более высоким выходом, чем исходный штамм, а полученные штаммы используются в настоящем изобретении.
Штаммы, удовлетворяющие требованиям согласно настоящему изобретению, также могут быть получены методами генетической рекомбинации, хорошо известными лицу, имеющему опыт в указанной области.
Вышеуказанные свойства устойчивости могут быть совмещены в одном штамме последовательной селекцией или с помощью методов генетической рекомбинации.
Характерными примерами штаммов, которые могут быть использованы в практических целях согласно настоящему изобретению, являются AGRI 101-51 (ВКПМ B-8010), AGRI 10-52 (ВКПМ B-8006), AGRI 67-52 (ВКПМ В-8004), AGRI 97-52 (ВКПМ В-8008), AGRI 11-51 (ВКПМ В-8005), AGRI 47-51 (ВКПМ В-8007) и AGRI 93-38 (ВКПМ В-8003). Коринеформные бактерии, которые могут быть использованы для получения ксантозин-5'-монофосфата в соответствии с настоящим изобретением, обладают такими же бактериологичесими (культурально-биохимическими) свойствами, как и исходный штамм, за исключением устойчивости к подавлению роста ингибиторами биосинтеза и/или функционирования клеточной мембраны, ингибиторами фосфорилирования, разобщающими агентами, ингибиторами РНК-полимеразы или аналогами метионина, и способности к продукции ксантозин-5'-монофосфата с более высокими выходами. Коллекционные номера (ВКПМ В- номера) соответствуют номерам микроорганизмов, депонированных во Всероссийской коллекции промышленных микроорганизмов (ВКПМ), РФ, Москва, 1-й Дорожный проезд, 1.
Указанные штаммы были выведены (получены) из исходного штамма Corynebacterium ammoniagenes AGRI 45-11 (ВКПМ В-8009), являвшегося устойчивым к стрептомицину производньм штамма Corynebacterium ammoniagenes АJ 13606 - продуцента ксантозин-5'-монофосфата. Штамм Corynebacterium ammoniagenes АJ 13606, в свою очередь, был получен из штамма Corynebacterium ammoniagenes AG98-79 - продуцента инозин-5'-монофосфата, производного известного штамма (ВКПМ В-1073) (Авторское свидетельство СССР 515783), путем введения в геном штамма AG98-79 ряда мутаций: потребность в гуанине для роста (мутация типа "leaky"), чувствительность к высокой температуре и устойчивость к сульфагуанидину.
Микроорганизмы - продуценты ксантозин-5'-монофосфата, полученные описанным выше методом, могут выращиваться тем же способом, что и обычные культивируемые микроорганизмы. Так, в качестве питательной среды может быть использована жидкая среда для выращивания, содержащая источник(и) углерода, источник(и) азота, ионы металлов и, если необходимо, другие пищевые добавки, такие как аминокислоты, нуклеиновые кислоты и витамины. В качестве источника углерода, например, могут быть использованы глюкоза, фруктоза, рибоза, мальтоза, манноза, сахароза, крахмал, гидролизат крахмала, меласса и так далее. В качестве источника азота могут быть использованы источники органического азота, такие как пептон, экстракт кукурузы, соевая мука, дрожжевой экстракт и мочевина, а кроме того, источники неорганического азота, такие как аммонийные соли серной, азотной, соляной, угольной и других кислот, газообразный и водный аммиак, как поодиночке, так и в комбинации. В качестве других пищевых добавок выбираются неорганические соли, аминокислоты, витамины и т.д., необходимые для роста бактерий, и используются как поодиночке, так и в комбинации.
Выращивание обычно проводится в аэробных условиях. рН питательной среды находится в интервале от 5 до 9. Температура выращивания обычно выбирается в интервале от 25oС до 40oС таким образом, чтобы она была подходящей для роста используемых микроорганизмов и для накопления ксантозин-5'-монофосфата. Выращивание предпочтительно проводится до тех пор, пока накопление ксантозин-5'-монофосфата не станет максимальным. Обычно выращивание в течение от 1 до 6 дней приводит к этому результату.
Для сепарации (отделения) и выделения ксантозин-5'-монофосфата из конечной культуральной жидкости могут быть использованы известные методики очистки.
Указанный способ получения ксантозин-5'-монофосфата в соответствии с настоящим изобретением обладает преимуществами с промышленной точки зрения потому, что он позволяет накапливать ксантозин-5'-монофосфат в больших количествах с небольшой побочной продукцией инозин-5'-монофосфата, ксантозина или ксантина.
Наилучший способ осуществления настоящего изобретения
Следующие примеры призваны проиллюстрировать настоящее изобретение более детально.
Пример 1
Отбор мутантов, устойчивых к глицину
Глицин в концентрации от 1 до
6% оказывает влияние на синтез клеточной стенки путем ингибирования D-аланил:D-аланиллигазы и аланинрацемазы. Мутанты Escherichia coli с повышенной устойчивостью к глицину также проявляют повышенную
чувствительность к пенициллину G (Wijsman and Pafort, 1974, Mol. Gen. Genet. , 128, 349-357). Таким образом, путем отбора мутантов, устойчивых к глицину, можно получить штаммы с нарушенной функцией
клеточной оболочки. Этот дефект может имитировать условия стресса и индуцировать транспортер, участвующий в экскреции ХМР. По этой причине были отобраны мутанты, устойчивые к подавлению их роста
глицином.
Штамм Corynebacterium ammoniagenes AGRI 45-11 (ВКПМ В-8009) был обработан 50 мкг/мл NTG в течение 20 минут. Затем клетки были помещены на среду PYM следующего состава, г/л: пептон - 10.0, дрожжевой экстракт - 10.0, мясной экстракт - 5.0, NaCl - 2.5, агар - 20.0, и содержащей 40 г/л, 50 г/л или 60 г/л глицина. Засеянные чашки инкубировались при 30oС в течение 5 дней. Среди появившихся колоний был выбран наиболее продуктивный штамм Corynebacterium ammoniagenes AGRI 10-52 (ВКПМ В-8006).
Этот штамм и исходный штамм Corynebacterium ammoniagenes AGRI 45-11 (ВКПМ В-8009) выращивались при 32oС в течение 20 часов с аэрацией в посевной среде следующего состава, г/л: глюкоза - 20.0, пептон - 10.0, дрожжевой экстракт -10.0, NaCl - 2.5, рН 7.2, помещенной в пробирки 20•200 мм. Затем 0.3 мл полученной культуры высевались в 3 мл среды для ферментации следующего состава (смотри ниже) в пробирках 20•200 мм и выращивались при 32oС в течение 72 часов на качалке.
После выращивания накопленное в культуральной жидкости количество ХМР определялось известными методами.
Результаты приведены в таблице 1. Как указано в таблице 1, штамм AGRI 10-52, устойчивый к глицину, накапливал больше ХМР, чем исходный штамм.
Состав минимальной среды, г/л:
Глюкоза
- 90.0
Мочевина - 7,2
Глутамат, мононатриевая соль - 20,0
Mamenou (T-N) - 1,4
КН2РO4 - 15,0
К2НРO4 - 15,0
MgSO4•7H2O - 10,0
СаСl2•2Н2О - 0,1
MnCl2•4H2O - 0,01
ZnSO4•
7H2O - 0,001
FeSO4•7H2O - 0,01
Биотин - 0,00003
Са пантотенат - 0,01
Тиамин - HCl - 0,005
Аденин - 0,025
Гуанин - 0,025
рН (доведенный КОН) - 7,2
Пример 2
Отбор мутантов, устойчивых к полимиксину В
Полимиксин В является полипептидным антибиотиком, эффективным против
грамотрицательных бактерий. Считается, что мишенью для антибиотика является клеточная мембрана бактерии. Авторы настоящего изобретения установили, что полимиксин В при высоких концентрациях (40-50
мкг/мл) подавлял рост грамположительных бактерий Corynebacterium ammoniagenes. Мутации, придающие устойчивость к полимиксину В, могут оказывать влияние на цитоплазматическую мембрану и имитировать
условия стресса, индуцируя транспортер экскреции ХМР. По этой причине были отобраны мутанты, устойчивые к подавлению роста указанным антибиотиком.
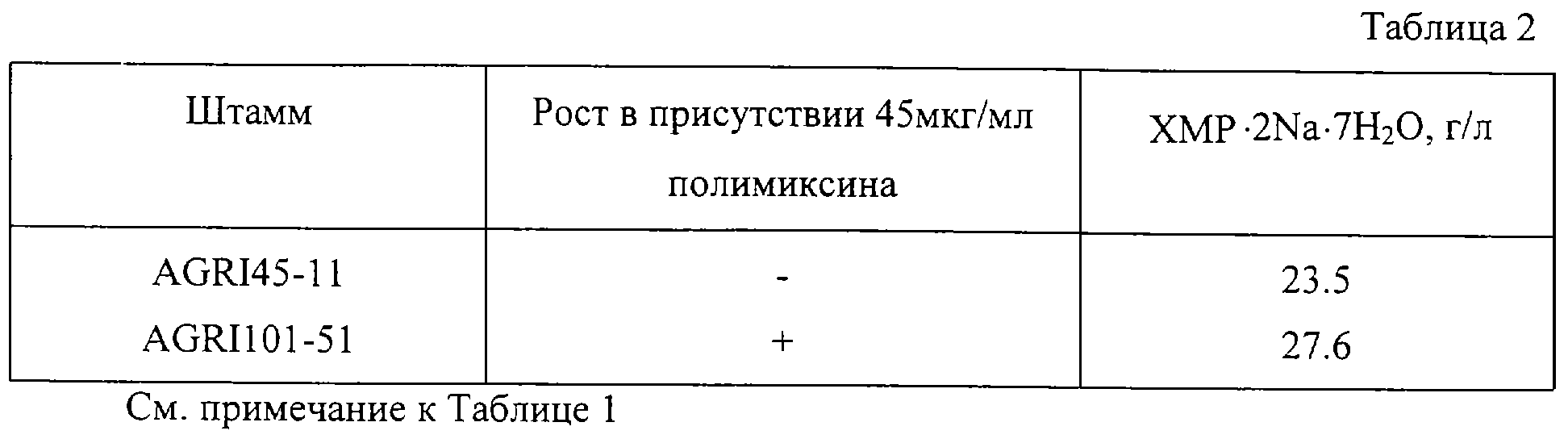
Штамм Corynebacterium ammoniagenes AGRI 45-11 (ВКПМ В-8009) был обработан NTG, клетки были помещены на среду PYM такого же состава, как и в Примере 1, содержащей 45 мкг/мл, 50 мкг/мл, 55 мкг/мл или 60 мкг/мл полимиксина. Засеянные чашки инкубировались при 30oС в течение 5 дней. Среди появившихся колоний был выбран наиболее продуктивный штамм Corynebacterium ammoniagenes AGRI 101-51 (ВКПМ В-8010).
Этот штамм и исходный штамм Corynebacterium ammoniagenes AGRI 45-11 (ВКПМ В-8009) выращивались при 32oС в течение 20 часов с аэрацией в посевной среде также, как и в Примере 1. Затем 0.3 мл полученной культуры высевались в 3 мл среды для ферментации такого же состава, как и в Примере 1, в пробирках 20х200 мм и выращивались при 32oС в течение 72 часов на качалке. После выращивания накопленное в культуральной жидкости количество ХМР определялось известными методами.
Результаты приведены в таблице 2. Как указано в таблице 2. штамм AGRI 101-51, устойчивый к полимиксину, накапливал больше ХМР, чем исходный штамм.
Пример 3 Отбор мутантов, устойчивых к рифампицину
Рифампицин и его производные являются антибиотиками,
ингибирующими активность ДНК-зависимой РНК-полимеразы путем связывания с β--субъединицей фермента и предотвращения инициации транскрипции (Hartman et al, 1967, Biochim. Biophys. Acta, 145,
843-844; Linn et al, 1975, J. Bacteriol., 122, 1387-1390). Мутации устойчивости к рифампицину, как сообщалось, обладают плейотропньми эффектами на комплекс метаболитических процессов различных
бактерий (Каnе et al. , 1979, J. Bacteriol., 137, 1028-1030; Jin and Gross, 1989, J. Bacteriol., 171, 5229-5231; Лившиц и Суходолец, 1973, Генетика, 9, 102-111), сходных с реакцией на условия стресса.
По этой причине были отобраны мутанты, устойчивые к подавлению роста рифампицином, и проверена их способность к продукции ХМР.
Штамм Corynebacterium ammoniagenes AGRI 45-11 (ВКПМ В-8009) был помещен на среду PYM такого же состава, как и в Примере 1, содержащей 5 мкг/мл, 15 мкг/мл, 30 мкг/мл или 50 мкг/мл рифампицина и засеянные чашки инкубировались при 30oС в течение 3 дней. Мутанты, устойчивые к рифампицину, были выбраны среди спонтанно появившихся колоний. Среди этих мутантов был выбран наиболее продуктивный штамм Corynebacterium ammoniagenes AGRI 93-38 (ВКПМ В-8003).
Этот штамм и исходный штамм Corynebacterium ammoniagenes AGRI 45-11 (ВКПМ В-8009) выращивались при 32oС в течение 20 часов с аэрацией в посевной среде также, как и в Примере 1. Затем 0.3 мл полученной культуры высевались в 3 мл среды для ферментации такого же состава, как и в Примере 1, в пробирках 20•200 мм и выращивались при 32oС в течение 72 часов на качалке. После выращивания накопленное в культуральной жидкости количество ХМР определялось известными методами.
Результаты приведены в таблице 3. Как указано в таблице 3, штамм AGRI 93-38, устойчивый к рифампицину, накапливал примерно на 10% больше ХМР, чем исходный штамм.
Пример 4
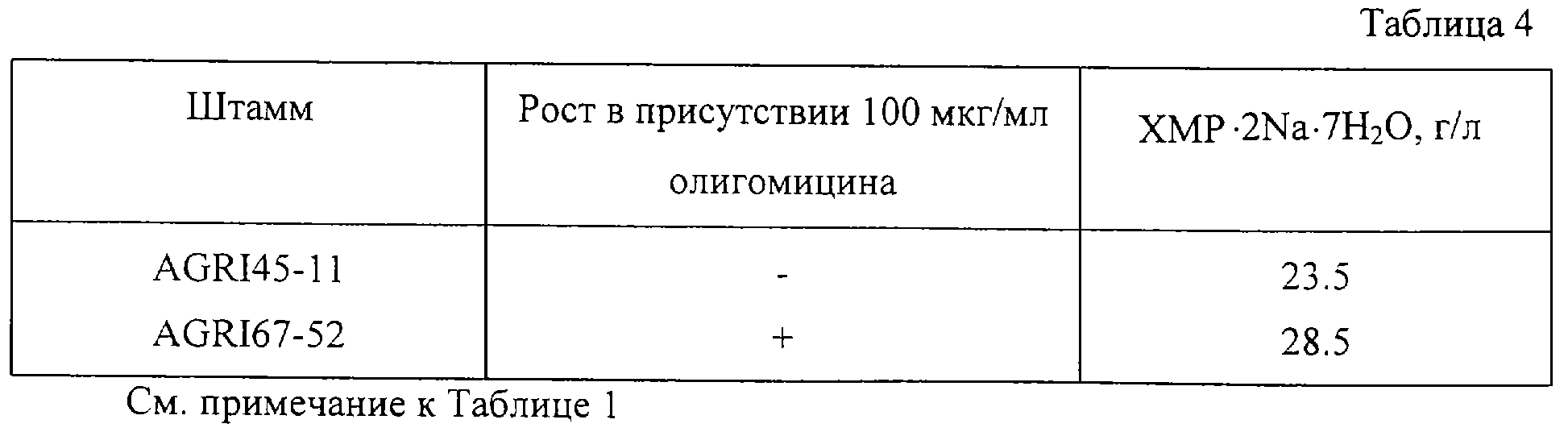
Отбор мутантов, устойчивых к олигомицину
Олигомицин является хорошо известньм ингибитором фосфорилирования, который блокирует синтез АТФ F0/F1 АТФазой. Мутации, преодолевающие эффект антибиотика, могут обладать
повышенной АТФ-генерирующей активностью. В свою очередь, активация продукции АТФ может иметь положительный эффект на экскрецию пуриновых нуклеотидов, осуществляемую транспортером.
Ряд мутантов, устойчивых к 50 или 100 мкг/мл олигомицина, был отобран, исходя из штамма Corynebacterium ammoniagenes AGRI 45-11 (ВКПМ В-8009) с использованием процедуры, описанной в примере 1, но вместо глицина был использован олигомицин. Показано, что некоторые из них были более продуктивны, чем исходный штамм. Наилучший мутант, Corynebacterium ammoniagenes AGRI 67-52 (ВКПМ В-8004) при проверке в паре, как описано в примере 1, накапливал примерно на 22% больше ХМР, чем исходный штамм Corynebacterium ammoniagenes AGRI 45-11 (ВКПМ В-8009) (таблица 4).
Пример 5
Отбор
мутантов, устойчивых к карбонилцианид-m-хлорфенилгидразону
Карбонилцианид-m-хлорфенилгидразон (СССР) является хорошо известным разобщающим агентом, которой нарушает необходимую связь между
дыхательной цепью и системой фосфорилирования. Мутации, преодолевающие влияние указанного антибиотика, могут усиливать энергетический метаболизм клетки и увеличивать АТФ-генерирующую активность. В
свою очередь, активация продукции АТФ может иметь положительный эффект на экскрецию пуриновых нуклеотидов, осуществляемую транспортером.
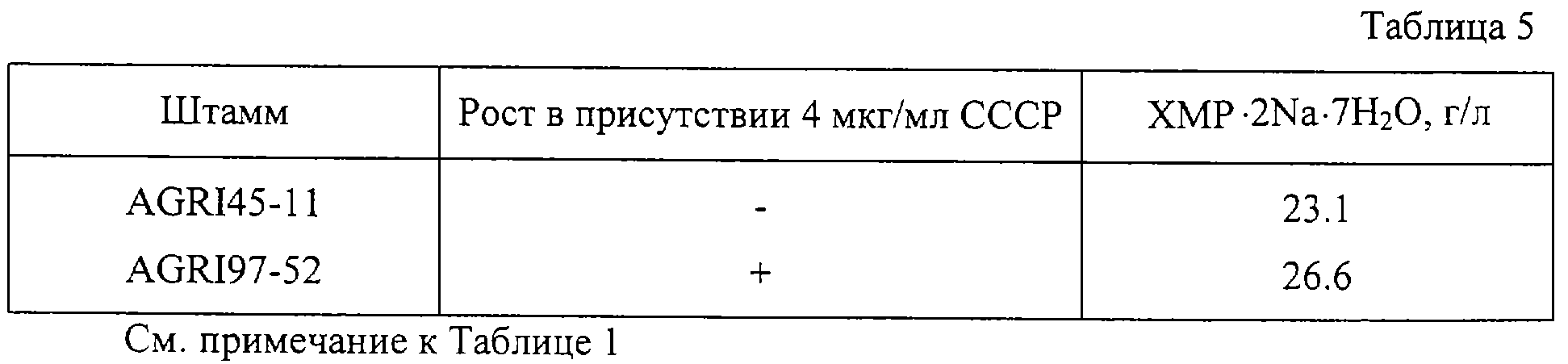
Штамм Corynebacterium ammoniagenes AGRI 45-11 (ВКПМ В-8009) был обработан NTG, клетки были помещены на среду PYM такого же состава, как и в Примере 1, содержащей 2 мкг/мл, 4 мкг/мл или 6 мкг/мл СССР вместо глицина. Засеянные чашки инкубировались при 30oС в течение 5 дней. Среди появившихся колоний был выбран наиболее продуктивный штамм Corynebacterium ammoniagenes AGRI 97-52 (ВКПМ В-8008). Этот штамм и исходный штамм Corynebacterium ammoniagenes AGRI 45-11 (ВКПМ В-8009) выращивались при 32oС в течение 20 часов с аэрацией в посевной среде также, как и в Примере 1. Затем 0.3 мл полученной культуры высевались в 3 мл среды для ферментации такого же состава, как и в Примере 1, в пробирках 20•200 мм и выращивались при 32oС в течение 72 часов на качалке. После выращивания накопленное в культуральной жидкости количество ХМР определялось известными методами.
Результаты приведены в таблице 5. Как указано в таблице 5, штамм AGRI 97-52 накапливал примерно на 15% больше ХМР, чем исходный штамм.
Пример 6
Отбор мутантов, устойчивых к метионинсульфоксиду
DL-метионин и его аналог, антагонист глутамина, DL-метионинсульфоксид в
высокой концентрации подавляет рост штамма Corynebacterium ammoniagenes AGRI 45-11 (ВКПМ В-8009) - продуцента ХМР. Известно, что устойчивые к метионинсульфоксиду мутанты Bacillus subtilis могут
обладать способностью к повышенной продукции гуанозина (Matsui et al, Appl. Environ. Microbiol., 34, 337-341, 1977; Matsui et al, Agric. Biol. Chem., 43 (6), 1317-1323, 1979; Matsui et al, Agric.
Biol. Chem., 46 (9), 2347-2352, 1982). По этой причине были получены мутанты, устойчивые к указанному аналогу.
Штамм Corynebacterium ammoniagenes AGRI 45-11 (ВКПМ В-8009) был обработан
NTG, аликвоты были помещены в пробирки 20•200 мм и выращивались при 32oС в течение 20 часов в минимальной среде следующего состава (смотри ниже) на качалке. Затем клетки были собраны
и высеяны на агаризованную минимальную среду, содержащую несколько комбинаций ингибиторов:
1. DL-метионинсульфоксид (5 мг/мл)+DL-метионин (7.5 мг/мл);
2. DL-метионинсульфоксид (10
мг/мл)+DL-метионин (7.5 мг/мл);
3. DL-метионинсульфоксид (5 мг/мл)+DL-метионин (20 мг/мл);
4. DL-метионинсульфоксид (10 мг/мл)+DL-метионин (20 мг/мл);
Состав минимальной
среды, г/л:
Глюкоза - 20,0
Мочевина - 2,0
КН2РO4 - 1,0
К2НРO4 - 3,0
MgSO4•7H2O - 0,
3
CaCl2•2H2O - 0,1
MnCl2•4H2O - 0,0036
ZnSO4•7H2O - 0,001
FeSO4
•7H2O - 0,01
Биотин - 0,00003
Са пантотенат - 0,01
Тиамин - НСl - 0,005
Аденин - 0,025
Гуанин - 0,025
рН (доведенный КОН) - 7,
2
Агар (в твердой среде) - 20,0
Мутанты, появившиеся после выращивания в течение от 4 до 8 дней, были отобраны, и была проверена их продуктивность в отношении ХМР. Среди них выделен
штамм Corynebacterium ammoniagenes AGRI 11-51 (ВКПМ В-8005). Этот штамм и исходный штамм Corynebacterium ammoniagenes AGRI 45-11 (ВКПМ В-8009) выращивались при 32oС в течение 20 часов с
аэрацией в посевной среде также, как и в Примере 1. Затем 0.3 мл полученной культуры высевались в 3 мл среды для ферментации такого же состава, как и в Примере 1, в пробирках 20•200 мм и
выращивались при 32oС в течение 72 часов на качалке. После выращивания накопленное в культуральной жидкости количество ХМР определялось известньми методами. Результаты приведены в таблице
6. Как указано в таблице 6, штамм AGRI 11-51 накапливал примерно на 31% больше ХМР, чем исходный штамм.
Пример 7
Отбор мутантов, устойчивых к метионинсульфону
Другой
аналог метионина, D, L-метионинсульфон, в высокой концентрации также подавляет рост штамма Corynebacterium ammoniagenes AGRI 11-51 (ВКПМ В-8005) - продуцента ХМР. Мутанты, устойчивые к указанному
аналогу, были получены с использованием процедуры, описанной в Примере 6, за исключением того, что была использована единственная комбинация ингибиторов: D,L-метионинсульфон - 10 мг/мл + D,L-метионин
- 20 мг/мл.
Среди мутантов, появившихся после выращивания в течение от 4 до 8 дней, был выбран штамм Corynebacterium ammoniagenes AGRI 47-51 (ВКПМ В-8007). Этот штамм и исходный штамм Corynebacterium ammoniagenes AGRI 45-11 (ВКПМ В-8009) выращивались при 32oС в течение 20 часов с аэрацией в посевной среде также, как и в Примере 1. Затем 0.3 мл полученной культуры высевались в 3 мл среды для ферментации такого же состава, как и в Примере 1, в пробирках 20•200 мм и выращивались при 32oС в течение 72 часов на качалке. Результаты приведены в таблице 7.
Как указано в таблице 7, штамм AGRI47-51 накапливал примерно на 36% больше ХМР, чем исходный штамм.
Реферат
Изобретение относится к биотехнологии. Ксантозин-5 -монофосфат получают методом ферментации, который включает в себя выращивание коринеформной бактерии - продуцента ксантозин-5 -монофосфата в питательной среде и выделение его из культуральной жидкости. В качестве продуцента используют штаммы бактерии Corynebacterium ammoniagenes (варианты), обладающие устойчивостью к подавлению роста под действием ингибитора. 9 с. и 1 з.п. ф-лы, 7 табл.

Комментарии