Способ идентификации бактерий acinetobacter nosocomialis - RU2712895C1
Код документа: RU2712895C1
Описание
Изобретение относится к области биотехнологии. Может быть использовано при бактериологических исследованиях по идентификации бактерий комплекса Acinetobacter calcoaceticus - Acinetobacter baumannii, включающего вид A. nosocomialis, а также в производстве питательных сред для этих исследований.
Известен способ идентификации видов рода Acinetobacter фенотипическими тестами (Gerner-Smidt P., Tjernberg I., Ursing J. Reliability of phenotypic tests for identification of Acinetobacter species. J. Clin. Microbiol. 1991, vol. 29, no.2; pp. 277-282. https://jim.asm.Org/content/jcm/29/2/277.full.pdf). Чистые культуры бактерий изучали тестами на рост при 30°С, 37°С, 41°С, 44°С в сердечно-мозговом бульоне (Дифко). Оксидацию глюкозы выявляли в пробирках со средой Хью-Лейфсона. Гидролиз желатина определяли в пробирках по классической методике. Гемолиз изучали на кровяном агаре с 5% крови овец и человека. Ассимиляционные тесты проводили в жидкой среде, содержащей минеральную основу и источник углерода в концентрации 0,1%. Использовали 18 источников углерода: DL-лактат, DL-4-аминобутират, транс-аконитат, цитрат, глутарат, аспартат, аделат, бета-аланин, L-гистидин, D-малат, малонат, гистамин, фенилацетат, L-фенилаланин, левулинат, цитраконат, 4-гидроксибензоат, L-тартрат. Все реакции учитывали визуально через 1-2 дня, тесты ассимиляции и гидролиз желатины до 6 суток. Далее штаммы идентифицировали по специальной компьютерной программе на соответствие определенному геновиду. Было установлено, что только у 78% штаммов (из 181 штаммов) правильно определен вид. Фенотипически правильно идентифицированы 10% штаммов геновида 1, 65% штаммов геновида 3; геновид 13 (ныне A.nosocomialis) ошибочно определен как другой геновид у 8 штаммов и не идентифицирован у остальных 7 штаммов. Геновиды 1, 2, 3, 13 имеют близкое фенотипическое сходство и их невозможно дифференцировать до вида. В связи с этим было предложено объединить геновиды 1, 2, 3, 13 в комплекс A. calcoaceticus - A. baumannii (комплекс АСВ) и завершать идентификацию ацинетобактеров в диагностических лабораториях выявлением этого комплекса.
Известен также способ фенотипической идентификации видов комплекса A. calcoaceticus - A. baumannii, в том числе A. nosocomialis (Nemec A., Krizova L., Maixnerova M., van der Reijden T.J.K., Deschaght P., Passet V., Vaneechoutte M., Brisse S., Dijkshoorn L. Genotypic and phenotypic characterization of the Acinetobacter calcoaceticus - Acinetobacter baumannii complex with the proposal of Acinetobacter pittii sp.nov. (formerly Acinetobacter genomic species 3) and Acinetobacter nosocomialis sp.nov. (formerly Acinetobacter genomic species 13 TU). Research in Microbiology. 2011, vol. 162, no.2; pp. 393-404. https://doi.org/l0.1016/j.resmic.2011.02.006). Чистые культуры бактерий комплекса АСВ изучали тестами на рост при 37°С, 41°С, 44°С в сердечно-мозговом бульоне (Оксоид). Окисление и кислотообразование на глюкозе исследовали на среде Хью-Лейфсона. Тесты утилизации выполняли в жидкой минеральной среде с добавлением 0,1% источника углерода при 30°С. Использовали 35 источников углерода: этанол, D-глюкозу, адипат, бета-аланин, L-арабинозу, L-аргинин, L-аспартат, азелат, бензоат, цитраконат, цитрат, гентизат, глутарат, D-глюконат, L-глутамат, гистамин, L-гистидин, DL-лактат, L-лейцин, левулинат, малонат, D-малат, L-орнитин, L-фенилаланин, фенилацетат, путресцин, трикарбаллилик кислота, D-рибоза, L-тартрат. Фенотипический анализ проводили также с помощью тест-системы API 20 NF (bio Merieux, Франция). Исследования проводили при 30°С с учетом результатов через 2 суток. Исследования показали, что виды бактерий комплекса АСВ четко отделены от других видов ацинетобактеров. Однако, виды комплекса АСВ имеют близкое фенотипическое сходство. Только по некоторым признакам выявлено неравномерное распределение: рост при 44°С наиболее характерен для видов A. baumannii и геновида 13TU; частота положительных результатов среди геноваров 3, 13TU, A. baumannii, A. calcoaceticus по утилизации левулината-5%, 5%, 24%, 91% соответственно; утилизации цитраконата - 0, 0, 40%, 0 соответственно. Нет ни одного признака, который отличается у 100% штаммов вида от других видов. Учитывая медицинскую значимость бактерий были предложены названия новых видов Acinetobacter pitii (ранее (геновид 3) и Acinetobacter nosocomialis ранее геновид 13TU).
Известно, что наиболее точным методом идентификации видов Acinetobacter, в том числе вида A. nosocomialis, является молекулярный метод частичного секвенирования гена rpoB (Park G.N., Kang H.S., Kim H.R., Jung В. К., Kim D.H., Chang K.S. A comparison of genospecies of clinical isolates in the Acinetobacter spp.complex obtained from hospitalized patiens in Busan, Korea. Biomed Sci Letters; 2019, vol. 25. no. 1; pp. 40-53. https://doi.org/l0.15616/BSL.2019.25.1.40 https://www.e-sciencecentral.org/articles/SC000034422). Исследуемый клинический изолят инкубируют в сердечно-мозговом бульоне при 37°С в течение 18 ч. Геномную ДНК бактерий изолята экстрагируют с использованием набора для выделения ДНК Accuprep (Bioneer, Daejeon, Korea) в соответствии инструкцией производителя. Извлеченную ДНК хранят при -20°С до дальнейшего анализа. ПЦР амплификацию участка гена для секвенирования проводят с использованием олигонуклеотидных специфических праймеров для необходимого участка гена rpoВ. ПНР проводят в заданном оптимальном режиме. Продукты ПЦР анализируют электрофорезом в 1,5% агарозном геле с бромидом этидия и визуализируют в УФ свете. Амплифицированную геномную ДНК в геле очищают с использованием комплекта для очистки геля Accuprep (Bioneer, Daejeon, Korea). Очищенные продукты ПЦР секвенируют с помощью службы секвенирования, которая использует профессиональную установку молекулярного анализа (Cosmo GENTECH Inc., Seul, Korea). После секвенирования ДНК последовательности сравнивают с эталонными данными в базе данных Genbank с использованием Basic Local Aligument Search Tool (BLAST) для идентификации вида. Достоинством способа является его точность: в данном исследовании все 123 изученных штаммов A.baumannii, A. nosocomialis, A. pittii, A. calcoaceticus были идентифицированы до вида правильно. Однако, способ сложный, трудоемкий и требует специального оснащения.
Известен также способ идентификации видов бактерий, в том числе A. nosocomialis, с использованием фенотипического метода матрично-активированной лазерной десорбции/ионизации с время пролетной масс-спектрометрией (MALDI - TOF MS). Объектом исследования являются чистые культуры микроорганизмов (часть колонии бактерий), а также клинический материал (кровь, моча), которые исследуют согласно инструкции по применению масс-спектрометром Microflex с базой данных MALDI Biotyper (Bruker Daltonics Inc., Германия). Уровень идентификации бактерий трактуется по критериям, указанным в инструкции: score 2300-3000 высокая вероятность идентификации вида; 2000-2299 надежная идентификация рода, вероятная идентификация вида; 1700-1999 вероятная идентификация рода, 0000-1699 ненадежная идентификация. При наличии в базе данных представителей A. baumannii, A. nosocomialis, A. pittii, A. calcoaceticus обеспечивается быстрая и точная идентификация этих видов (Espinal P., Seifert Н., Dijks-hoorn L., Vila J., Roka I. Rapid and accurate identification of genomic species from the Acinetobacter baumannii (Ab) group by MALDI-TOF MS. Clin. Microbiol. Infect. 2012, vol. 18. no. 11: pp. 1097-1103. https://doi:10.1111/j.1469-0691.2011.03696.x). Однако, в некоторых случаях отмечали ошибки в идентификации A. nosocomialis, что потребовало корректировки состава матрицы в протоколе ведения исследования масс-спектрометром Microflex с базой данных MALDI Biotyper (Sedo О., Nemec A., Krizova L., Kacalova M., Zdrahal Z. Improvement of MALDI-TOF MS profiling for the differentiation of species with in the Acinetobacter calcoaceticus - A. baumannii complex. Syst. Appl. Microbiol. 2013, vol. 36, no. 8; pp. 572-578. https://doi:10.1016/j.syapm.2013.08.001).
Прототипом заявляемого способа нами избран способ фенотипической идентификации видов комплекса A. calcoaceticus- A.baumannii, в том числе A. nosocomialis, по статье Nemec A, et al. (Nemec A., Krizova L., Maixnerova M., van der Reijden T.J.K., Deschaght P., Passet V., Vaneechoutte ML, Brisse S., Dijkshoorn L. Genotypic and phenotypic characterization of the Acinetobacter calcoaceticus - Acinetobacter baumannii complex with the proposal of Acinetobacter pittii sp.nov. (formerly Acinetobacter genomic species 3) and Acinetobacter nosocomialis sp. nov. (formerly Acinetobacter genomic species 13TU). Research in Microbiology. 2011, vol. 162, no. 2; pp. 393-404. https://doi.org/10.1016/j.resmic.2011.02.006), так как он содержит наиболее полную характеристику фенотипических признаков A. nosocomialis и других видов комплекса АСВ и наиболее близок заявляемому способу по совокупности существенных признаков.
Недостатком прототипного способа является сложность исследования, вследствие применения многочисленных фенотипических тестов, и невозможность точной идентификации вида A. nosocomialis.
Эти же недостатки имеет аналог по статье Gerner-Smidt P. et al.
Недостатком аналога, основанного на секвенировании участков гена rpoВ, является сложность исследования, ввиду его многоэтапности и использования специальных приборов.
Недостатком аналога, основанного на применении метода MALDI - TOF масс-спектрометрии, является необходимость сложного прибора и недостаточная точность, в некоторых случаях, идентификации A. nosocomialis.
Целью изобретения является упрощение и повышение точности исследования по идентификации бактерий вида A. nosocomialis.
В соответствии с изобретением решение указанной технической задачи достигается тем, что после предварительного отбора материала, подлежащего исследованию, - чистой культуры грамотрицательных коккобактерий, растущих при 37°С и 44°С, аэробов, неподвижных, оксидазо-отрицательных, каталазо-положительных; не ферментирующих, но окисляющих D-глюкозу с образованием кислоты; не имеющих нитратредуктазы; утилизирующих в качестве единственного источника углерода этанол, L-аргинин, L-гистидин, L-арабинозу, путресцин, трикарбаллиловую кислоту; не утилизирующих D-глюкозу; засевают исследуемую суточную агаровую культуру бактерий по полной петле (диаметром 2 мм) в лунку планшета с 0,1 мл питательной среды, содержащей мочевину (СAS по 57-13-6), Na2HPO4, KH2РO4, NaCl, индикатор феноловый красный, воду дистиллированную при следующем содержании ингредиентов: мочевина 10,0 - !5,0 г, Na2HPO4 1,1 г, KH2РО4 1,1 г, NaCl 5,0 г; 0,4% водно-щелочной раствор фенолового красного 5,0 мл, вода дистиллированная 1 л, при этом мочевину вносят после стерилизации всех остальных ингредиентов при 121°С в течение 20 мин, рН 7,0±0,1; инкубируют посевы в аэробных условиях при 37°С; определяют принадлежность бактерий к виду A. nosocomialis по времени изменения исходного желтого цвета среды в красный или малиновый при окончательном учете выявления уреазы быстрой активности по изменению окраски среды через 3 ч инкубации посевов бактерий. Примечание: 1. Приготовление 0,4% водно-щелочного раствора фенолового красного - вносят в фарфоровую ступку 0,1 г порошка фенолового красного; 5,7 мл 0,2% раствора NaOH, воду дистиллированную до 25 мл, растирают до гомогенного раствора темно-красной окраски, который сразу используют (не хранят). 2. Бактериологический контроль качества питательной среды заявляемого способа проводят при изготовлении и применении среды; суточные агаровые культуры контрольных штаммов A. nosocomialis или Morganella morganii (положительный контроль) и A. baumannii или Escherichia coli (отрицательный контроль) засевают по одной петле (диаметром 2 мм) в 0,1 мл питательной среды в лунках планшета, инкубируют аэробно при 37°С в течение 3 ч, учитывают результат: питательная среда пригодна к использованию, если в лунке с A. nosocomialis (или М. morganii) она пробрела малиновую окраску, при этом в лунках с A.baumannii (или Е. coli) и в лунке без посева бактерий сохраняется исходный цвет среды.
Отличительный существенный признак способа - окончательный учет выявления уреазы быстрой активности по изменению окраски питательной среды проводят через 3 ч инкубации посева бактерий. Этот признак выявляет особый вариант уреазы бактерий - уреазу быстрой активности. Этот признак не применялся в прототипе и аналогах. Более того, уреазный тест не использовался в прототипе и аналогах при фенотипической характеристике всех видов ацинетобактеров комплекса АСВ. Его пригодность для идентификации A. nosocomialis не очевидна и требовала изучения всех видов ацинетобактеров комплекса АСВ. Нами были изучены 85 штаммов A. baumannii, 21 штамм A. nosocomialis, 10 штаммов A. pittii, 2 штамма A. calcoaceticus комплекса АСВ, видовая принадлежность которых была установлена методом MALDI - TOF MS. Было установлено, что все штаммы A. nosocomialis (100%) имели уреазу быстрой активности, которая выявлялась через 3 ч аэробной инкубации посевов при 37°С (таблица 1). У A. baumannii выявлен только 1 штамм (1,17%) с уреазой быстрой активности; у A. pittii, A. calcoaceticus она не выявлена (таблица 2). Часть штаммов A. baumannii (17,6%) и 1 штамм A. calcoaceticus имели уреазу низкой активности, которая выявлялась через 8-24 ч инкубации посевов (таблица 2). Эта уреаза низкой активности не имеет таксономического значения и не пригодна для идентификации ацинетобактеров. Отличительный существенный признак непосредственно определяет решение поставленной технической задачи - упрощения и повышения точности исследования по идентификации бактерий A. nosocomialis, так как простое визуальное выявление уреазы быстрой активности позволяет с высокой точностью отличать 100% штаммов A. nosocomialis от всех остальных изученных видов комплекса АСВ (A. baumannii, A. pittii, A. calcoaceticus), что ранее было невозможно фенотипическими тестами без применения сложных приборов метода MALDI-TOF MS. Это доказательство механизма достижения технического результата представлено впервые в материалах данной заявки.
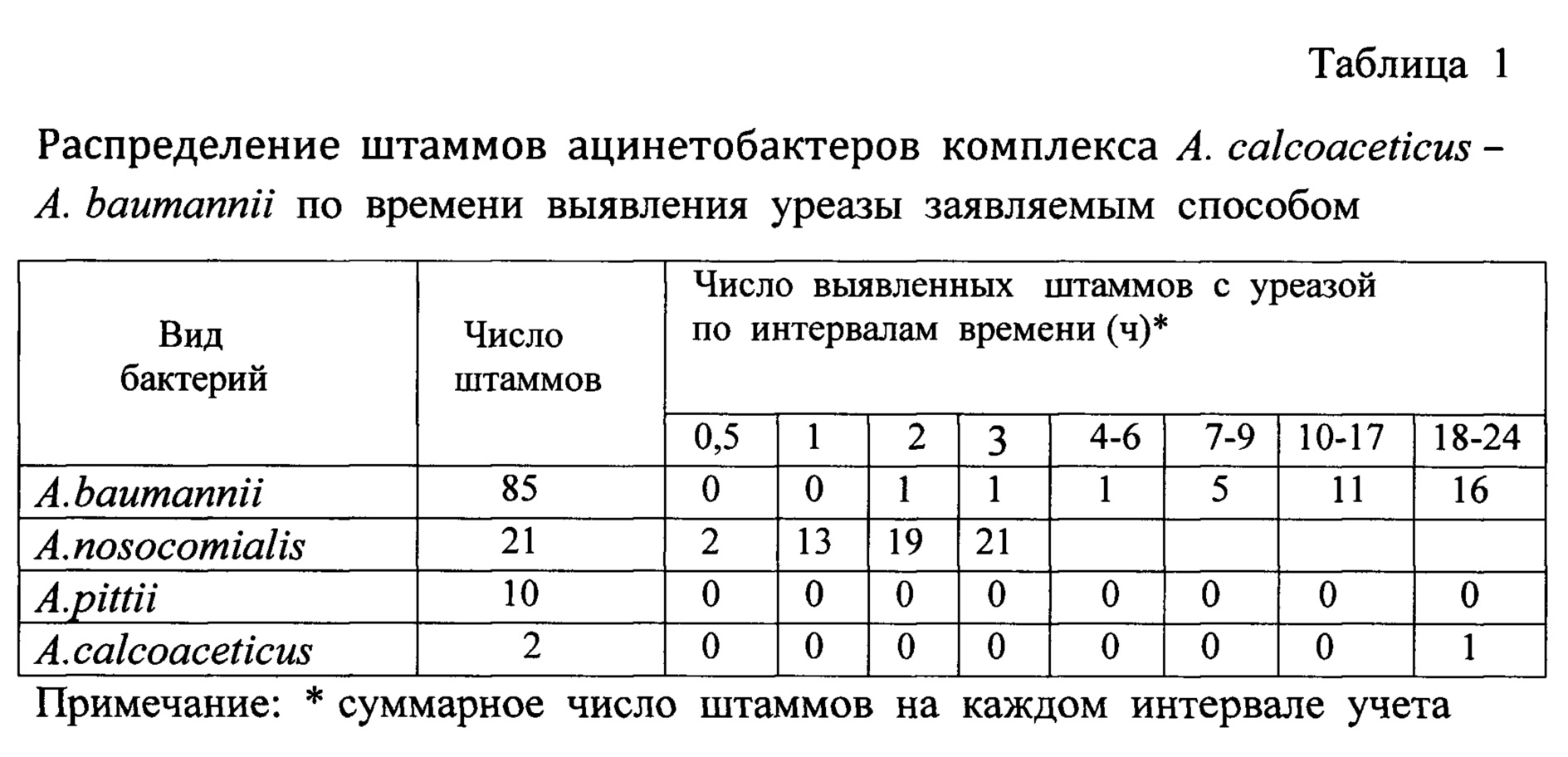
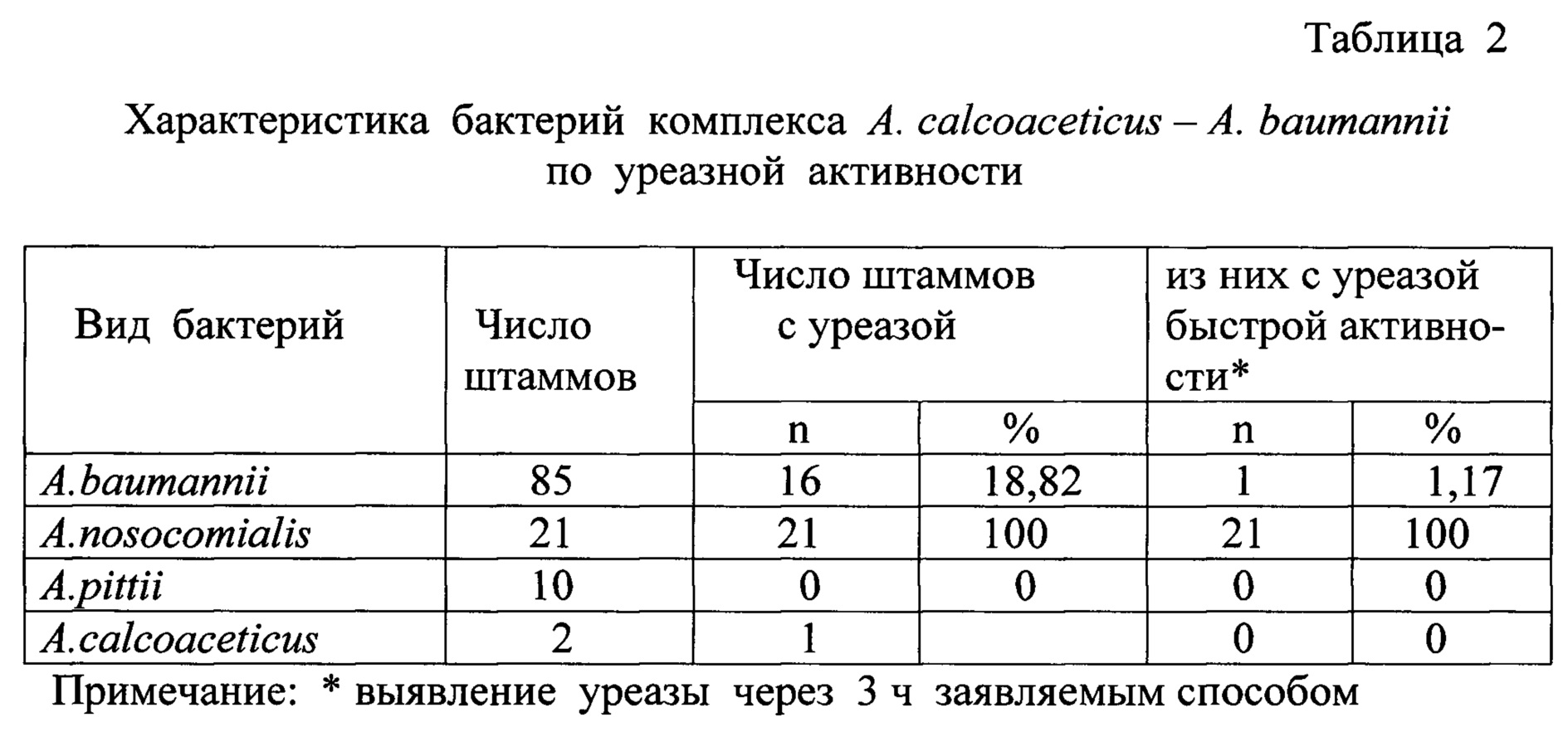
Существенным признаком способа является предварительный отбор материала, подлежащего исследованию, - чистой культуры грамотрицательных коккобактерий, растущих при 37°С и 44°С, аэробов, неподвижных, оксидазо-отрицательных, каталазо-положительных; не ферментирующих, но окисляющих глюкозу с образованием кислоты; не имеющих нитратредуктазы; утилизирующих в качестве единственного источника углерода этанол, L-аргинин, L-гистидин, L-арабинозу, путресцин, трикарбаллиловую кислоту; не утилизирующие D-глюкозу, что устанавливает принадлежность ее к ацинетобактерам комплекса АСВ.
Существенными признаками способа являются также использование питательной среды определенного состава для выявления уреазы, аэробные условия культивирования бактерий, температурный режим, визуальное выявление уреазы по изменению окраски рН-индикатора щелочными продуктами гидролиза мочевины. Содержание ингредиентов питательной среды установлено нами экспериментально: оптимальное количество мочевины 10,0-15,0 г/л, она самостерилизована, вносить ее следует после стерилизации всех остальных ингредиентов среды при 121°С в течение 20 мин, соотношение солей Na2HPO4 1,1 г/л и KH2РO4 1,1 г/л определяет оптимальную для уреазы рН 7,0±0,1. Аэробные условия культивирования определяются принадлежностью ацинетобактеров к аэробным бактериям (не следует выращивать посевы ацинетобактеров на среде с мочевиной под слоем вазелинового масла). Оптимальная температура культивирования ацинетобактеров комплекса АСВ на среде с мочевиной 37°С. Для визуального учета гидролиза мочевины уреазой целесообразно использовать рН-индикатор 0,4% водно-щелочной раствор фенолового красного 5 мл/л.
Примеры, подтверждающие возможность осуществления способа
Пример 1. Исследуемый материал - чистая культура клинического изолята бактерий, выделенная из мочи больного, у которой предварительно выявлена совокупность признаков: грамотрицательные коккобактерий, растут при 37°С и 44°С, аэробы, неподвижные, оксидазо-отрицательные, каталазо-положительные; не ферментируют, но окисляют D-глюкозу с образованием кислоты; не имеют нитратредуктазы; утилизируют в качестве единственного источника углерода этанол, L-аргинин, L-гистидин, L-арабинозу, путресцин, трикарбаллиловую кислоту; не утилизируют D-глюкозу. Суточную агаровую исследуемого штамма вносят полной петлей (диаметром 2 мм) в 0,1 мл питательной среды с мочевиной заявляемого способа в лунке планшета. Таким же образом засевают в отдельные лунки суточные культуры контрольных штаммов A. nosocomialis или М. morganii (положительный контроль) и A.baumannii или Е. coli (отрицательный контроль), одну лунку со средой не засевают (один контроль используют для всех штаммов, исследуемых в данный день). Посевы выращивают аэробно при 37°С в течение 3 ч, после чего учитывают результат: изменение исходной желтой окраски среды в красную в лунке с посевом исследуемого штамма бактерий указывает на выявление уреазы быстрой активности и принадлежность бактерий к виду A. nosocomialis, при этом такой же результат отмечается в лунке положительного контроля, а в лунках отрицательного контроля и без посева бактерий среда сохраняет исходную окраску. Контрольная видовая идентификация исследуемого штамма бактерий методом MALDI - TOF масс-спектрометрии с использованием базы данных MALDI Biotyper (Bruker Daltonics Inc., Германия) подтвердила принадлежность бактерий к виду A. nosocomialis.
Примечание к примеру 1. Методика приготовления питательной среды с мочевиной заявляемого способа. В 1 л дистиллированной воды вносят, г/л: Na2HPO4 1,1; KH2РО4 1,1; NaCl 5,0; 0,4% водно-щелочной раствор фенолового красного 5 мл, стерилизуют при 121°С 20 мин, затем добавляют 10,0 г самостерилизованной мочевины (CAS по 57-13-6), разливают во флаконы. Среда прозрачная, желтой окраски, пригодна к использованию в течение 30 суток при хранении от 4°С до 8°С. Контроль питательной среды: контрольные штаммы бактерий - клинический штамм A. nosocomialis, имеющий уреазу быстрой активности, или штамм М. morganii (положительный контроль); клинический штамм A. baumannii, не имеющий уреазы быстрой активности, или штамм Е. coli (отрицательный контроль). Суточные агаровые культуры контрольных штаммов засевают по полной петле (диаметром 2 мм) в лунки планшета с 0,1 мл исследуемой среды заявляемого способа, одну лунку со средой не засевают. Посевы инкубируют аэробно при 37°С в течение 3 ч, затем учитывают результат. Питательная среда пригодна к использованию, если в лунке с посевом A. nosocomialis или М. morganii исходная желтая окраска среды изменилась в малиновую, а в лунках с A. baumannii или Е. coli и без посева бактерий сохранилась исходная окраска среды.
Пример 2. Исследуемый материал - чистая культура бактерий, выделенных из реки Невы, у которых предварительно была выявлена совокупность признаков: грамотрицательные коккобактерий, растут при 37°С и 44°С, аэробы, неподвижные, оксидазо-отрицательные, каталазо-положительные, не ферментируют, но окисляют D-глюкозу с образованием кислоты; не имеют нитратредуктазы; утилизируют в качестве единственного источника углерода этанол, L-аргинин, L-гистидин, L-арабинозу, путресцин, трикарбаллиловую кислоту; не утилизируют D-глюкозу. Суточную агаровую культуру исследуемого штамма вносят полной петлей (диаметром 2 мм) в лунку планшета с 0,1 мл питательной среды заявляемого способа, содержащую мочевину 15,0 г/л и остальные ингредиенты по примечанию к примеру 1. Таким же образом засевают в отдельные лунки контрольные штаммы A. nosocomialis или М. morganii (положительный контроль) и A. baumannii или Е. coli (отрицательный контроль), одну лунку со средой не засевают. Посевы инкубируют при 37°С в течение 3 ч, после чего учитывают результат: изменение исходной желтой окраски среды в малиновую в лунке с посевом исследуемого штамма бактерий указывает на выявление уреазы быстрой активности и принадлежность бактерий к виду A. nosocomialis, при этом такой же результат отмечается в лунке положительного контроля, а в лунках отрицательного контроля и без посева бактерий среда сохраняет исходную окраску. Контрольная видовая идентификация исследуемого штамма бактерий методом MALDI - TOF масс-спектрометрии подтвердила его вид - A. nosocomialis.
Таким образом, при всех предельных концентрациях основного ингредиента питательной среды заявляемого способа (мочевина 10,0-15,0 г/л) получены четкие, точные результаты идентификации вида A. nosocomialis у бактерий, выделенных из клинического материала и внешней среды.
Реферат
Изобретение относится к биотехнологии. Способ идентификации бактерий Acinetobacter nosocomialis предусматривает предварительный отбор культуры бактерий для исследования с совокупностью фенотипических признаков комплекса Acinetobacter calcoaceticus - Acinetobacter baumannii, посев ее в 0,1 мл среды, содержащей мочевину, NaHPО, КНРО, NaCl, 0,4% водно-щелочной раствор фенолового красного и дистиллированную воду в заданных соотношениях. Проводят аэробную инкубацию при 37°С в течение 3 ч с последующей идентификацией Acinetobacter nosocomialis по выявлению уреазы быстрой активности. Изобретение позволяет упростить способ и повысить точность идентификации бактерий A. nosocomialis. 2 табл., 1 пр.
Формула
Документы, цитированные в отчёте о поиске
Способ выделения и идентификации бактерий комплекса acinetobacter calcoaceticus - acinetobacter baumannii

Комментарии