Штамм стрептомицетов для продуцирования антипаразитарных соединений и способы продуцирования этих соединений - RU2125609C1
Код документа: RU2125609C1
Чертежи


Описание
Известно, что авермектины, которые представляют собой комплекс родственных соединений, обладающих противопаразитарной активностью, могут быть продуцированы путем аэробной ферментации штаммов АТСС 31267, 31271 и 31272 Streptomyce avermitilis (см., например, патенты США 4 310 519 и 4 429 042). Два последних штамма представляют собой замороженную культуру в ампуле и лиофилизованную культуру в пробирке, соответственно полученные путем УФ-облучения АТСС 31267 S. avermitilis.
Штаммы S. avermitilis, описанные в вышеупомянутых патентах США, продуцируют класс соединений, который в общих чертах описан как C-076 (автомектины, см. ниже формулу I). Этот класс соединений включает в себя восемь различных, но близкородственных авермектинов, описанных в литературе как A1a, A1b, A2a, A2b, B1a, B1b, B2a и B2b, Соединения серии "a" относятся к натуральным авермектинам, в которых заместителем в 25-положении является (S)-втор-бутил, а соединения серии "b" относятся к натуральным авермектинам, в которых заместителем в 25-положении является изопропил. Обозначения "A" и "B" относятся к авермектинам, в которых заместителем в 5-положении является метокси или гидрокси соответственно. И наконец, цифра "1" в вышеуказанных обозначениях означает, что данные авермектины имеют двойную связь в 22 - 23-положении, а цифра "2" означает, что данные авермектины имеют водород в 22-положении, и гидрокси в 23-положении.
Так, например, авермектины представляют собой соединения формулы I:

где пунктирная линия обозначает простую или двойную связь;
R1 представляет собой H или гидрокси; причем R1 представляет собой гидрокси лишь в том случае, если пунктирная линия является простой связью;
R2 представляет собой изопропил или втор-бутил; и
R3 представляет собой метокси или гидрокси.
Известно, что другие штаммы S. avermitilis продуцируют один или несколько "натуральных" авермектинов, где заместителем в 25-положении является либо изопропил, либо (S)-втор-бутил(1-метилпропил), либо "ненатуральных" авермектинов, где заместителем в 25-положении является либо изопропил, либо (S)-втор-бутил. Например, штамм АТСС 31780 S. avermitilis раскрывается в патенте США N 4 378 353; штаммы АТСС 53567 и АТСС 53568 раскрываются в заявке на Европатент (EP) 276 131; штамм АТСС 53692 раскрывается в EP 276 103; а описание NCIB 12121 можно найти в EP 214731. Однако, каждый из этих штаммов S. avermitilis является прямым или непрямым потомством штамма АТСС 31267 S. avermitilis. Таким образом, вышеуказанные штаммы S. avermitilis, которые обладают способностью продуцировать одно или несколько соединений авермектина, представляют собой родительский штамм и его потомство.
В литературе (пат. США N 5 015 662) был описан еще один штамм S. avermitilis, АТСС 53814. Этот штамм отличается своей способностью к биоконверсии серий соединений типа милбемицина, и неспособностью продуцировать значительные количества авермектинов.
Настоящее изобретение относится к новому авермектин-продуцирующему штамму S. avermitilis, а именно подвиду niger NRRL 21005. Кроме того, настоящее изобретение относится к новым способам продуцирования авермектинов с использованием подвидов niger NRRL 21005 Streptomyces avermitilis.
Настоящее изобретение относится к биологически чистой культуре микроорганизма Streptomyces avermitilis подвида niger NRRL 21005, либо к его авермектин-продуцирующему мутанту или варианту.
Настоящее изобретение также относится к способу продуцирования одного или нескольких авермектинов, заключающемуся в том, что подвид niger NRRL 21005 S. avermitilis или его авермектин-продуцирующий мутант или вариант культивируют в водной культуральной среде, содержащей усвояемые источники углерода, азота и неорганических солей, в аэробных глубинных условиях до тех пор, пока не будет продуцирован один или несколько авермектинов, а затем указанный авермектин или авермектины выделяют.
На фиг. 1 представлена дендограмма подвидов niger NRRL 21005 (A58267.2) Streptomyces avermitilis и других видов Streptomyces avermitilis.
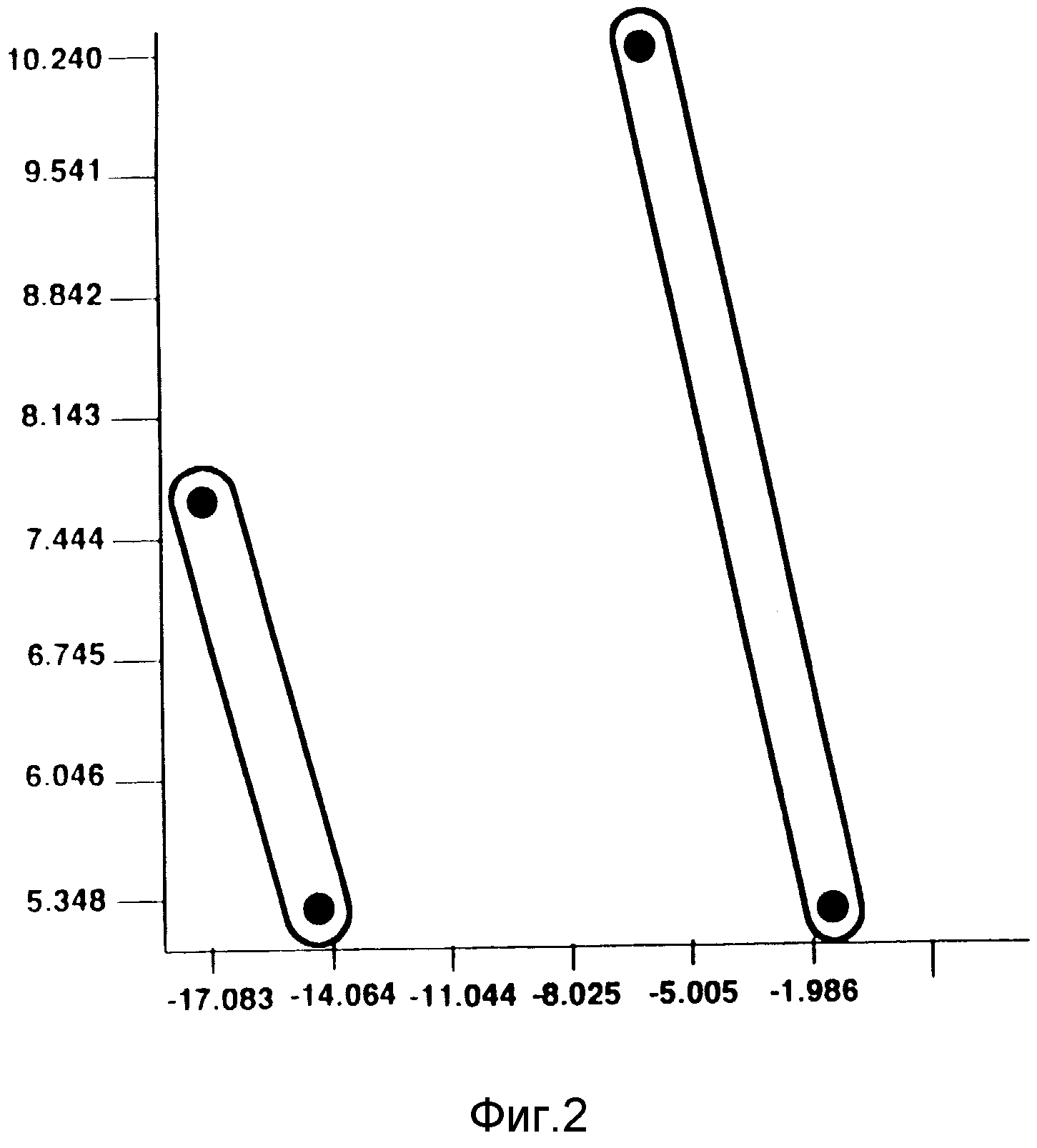
На фиг. 2 показана диаграмма главных компонент, построенная на основании анализа жирных кислот, и иллюстрирующая родство между A58267.2 и другими видами S. avermitilis.
В одном из своих вариантов настоящее изобретение относится к биологически чистой культуре микроорганизма Streptomyces avermitilis подвида niger NRRL 21005 (штамм NRRL 21005), или его авермектин-продуцирующего мутанта или варианта.
Для удобства этот новый микроорганизм настоящего изобретения, продуцирующий авермектины, был также назван культурой A58267.2. Культура A58267.2 представляет собой улучшенный штамм культуры A58267.21, являющейся натуральным вариантом культуры A58267. Культура A58267 была выделена из образца почвы, собранной в Италии.
Культура A52867.2 была депонирована согласно Будапештскому договору, и часть указанной чистой культуры депонирована в Северном региональном исследовательском центре, Службе сельскохозяйственных исследований, Северном центральном регионе (Министерство сельского хозяйства США, 1815 North University Street, Peoria, Illinois 61604), под номером NRRL 21005. Постоянное место депонирования этой культуры в Северном региональном исследовательском центре (Пеория, Иллинойс) и ее доступность обеспечивается на протяжении всего эффективного срока действия любого патента, выданного на данную заявку. Допуск к указанным культурам является свободным в течение всего времени рассмотрения заявки в соответствии со ст. 37 1.14 C.F.R. (Свода федеральных правил) и Раздела 35 U.S.C. 112 (Кодекса законов США). Все ограничения на публичную выдачу указанных культур будут окончательно сняты после выдачи патента.
Таксономические исследования A58267.2 (NRRL 21005) были проведены Frederick P. (Mertz Lilly Research Laboratories). На основе этих исследований, новый микроорганизм был классифицирован как новый подвид (штамм) рода и вида Streptomyces avermitilis, которому было дано наименование "подвид niger" Streptomyces avermitilis. Указанная классификация была проведена на основе лабораторной классификации и анализа опубликованных исследований аналогичных видов.
Используемые методы
Таксономические исследования были проведены с использованием методов, рекомендованных Международным проектом по характеризации видов
Streptomyces (ISP) [Shirlino, E. B. u
Jottlieb D. "Methods for characterisation of Streptomyces species", Jnt. J. Syst. Bacteriol. 16: 313-340 (1966)], и методов, рекомендованных для характеризации
видов Nocardia [Jordon R.E., Barnett
D.A., Handerhan J.E., и Pano C.H., "Nocardia cveliaca, Nocardia the Nocardin Strain", Jut. J. Syst. Bacteriol, (24): 54-63 (1974)].
Для определения цвета были использованы цветовые диаграммы (ISCC-NBSCentroid Color Charts), стандартный образец N 2106 (Национальное бюро стандартов, 1958, Министерство торговли США, Вашингтон, D.C.).
Морфологию исследовали с помощью оптического микроскопа и сканирующего электронного микроскопа (SEM).
Наличие изомера диаминапимелиновой кислоты (DAP), и углеводов в гидролизатах целых клеток было установлено с помощью хроматографических методов Becker и др. , "Rapid Differentiation between Nocardia and Streptomyces by Paper Chromatography of whole - cell Hydrolysates", Appl. Microbiol., 12: 421-423 (1964) и Lechevalier, и др., A University Laboratory Approach, Dietz и Fhayer (eds), Society for Industrial Microbiology, Special Publication N6 Arlington, Virginia, стр. 227 - 233.
Резистентность к антибиотикам измеряли путем нанесения чувствительных к антибиотикам дисков на поверхность чашек с агаром с засеянной ISP N 2. Резистентность оценивали как (+), если не наблюдалось зоны ингибирования, и как (-), если зона ингибирования наблюдалось.
Состав менахинонов определяли способами, описанными Kroppen - stedt R.M. в "Chemical Methods in Bacterial Systematics", M. Goodfellow and D.E. Minnikin (изд.), стр. 173-196 (1985); и Collins M.D., там же, стр. 267-285.
Анализ жирных кислот проводили с использованием микробной системы идентификации HP 5898A Miller и др., "Bacterial Identification fy Gas Chromatography of Whole - cell Fatty Acids", Hewlett - Packard Application Note 228-41, (1985).
Метиловые сложные эфиры жирных кислот получали из лиофилизованных целых клеток, культивированных в идентичных условиях.
NaCl - толерантность определяли путем добавления NaCl к ISP-агару N 2 до получения нужной концентрации.
Дендрограмму, показанную на фиг. 1, генерировали с помощью компьютера на основе эквлидова кодового расстояния.
Анализ по методу главных компонент, показанный на фиг.2, представляет собой двумерный анализ, который также был проведен с помощью компьютерной обработки.
Культуральные свойства.
Культура A58267.2 недостаточно хорошо растет на большинстве сред, и не продуцирует воздушные гифы ни на комплексных средах, ни на каких-либо питательных средах определенного состава. Обратная сторона окрашивается в желто-коричневый цвет, за исключением тех случаев, когда культивирование проводится на агаре Беннетта, где продуцируется характерный черный пигмент. Слабый, слегка коричневатый растворимый пигмент продуцируется в ISP-среде 2, а красновато-коричневый растворимый пигмент продуцируется в агаре Беннетта. Указанные культуральные характеристики представлены в таблице 1.
Морфологические характеристики
Воздушные гифы не продуцируются культурой A58267.2. Поэтому морфологические исследования и
исследования поверхности спор не могли быть проведены. Спорангиев,
подвижных клеток или склероциев не наблюдалось. Культура A58267.2 не дает фрагмента во время культивирования на твердых или жидких
средах.
Физиологические характеристики
Культура A58267.2 утилизировала следующие углеводы при использовании ISP-среды 9 в качестве базальной среды: D- и L-арабинозу,
целобиозу, D-фруктозу, D-галактозу, D-глюкозу, глицерин, гликоген,
изо-инозит, инулин, D-мальтозу, D-маннит, маннозу, мелибиозу, D-раффинозу, L-рамнозу, D-рибозу, трегалозу, ксилит и D-ксилозу.
Культура A58267.2 не обнаруживала способности к утилизации некоторых
углеводов, использованных со ISP-средой 9 в качестве базальной среды, а именно адонита, целлюлозы, декстрина, дульцита, этанола,
изо-эритритола, D-лактозы, мелецитозы, a-метил-D-глюкозида, салицина,
сорбита, L-сорбозы и сахарозы.
Культура A58267.2 способна разлагать аденин, малат кальция, казеин, крахмал и мочевину.
A58267.2 продуцировала каталазу, H2S и разжиженный желатин и обладала способностью к выживанию в условиях температуры 50oC в течение 8 часов. A58267.2 обнаруживала толерантность к NaCl при концентрациях до (включая) 6%.
A58267.2 оказывалась неспособной к гидролизу аллантоина, эластина, эскулина, гуанина, гиппурата, гипоксантина, тестостерона, L-тирозина или ксантина. Эта культура не продуцировала меланоидных пигментов, не восстанавливала нитраты, и не продуцировала фосфотазу, а также она не обнаруживала резистентность к лизоциму при концентрации 50 мг/мл.
Культура A58267.2 обнаруживала резистентность в 2 мкг /микрограмм/ линкомицина, 30 мкг налидиксовой кислоты, 10 ед. пенициллина G, 300 ед. полимиксина B, и 5 мкг триметоприма. A58267.2 показала чувствительность к 10 ед. бацитрацина, 30 мкг цефалотина, 30 мкг хлоромицетина, 15 мкг эритромицина, 10 мкг олеандомицина, 5 мкг рифампина, 10 мкг стрептомицина, 30 мкг тетрациклина, 10 мкг тобрамицина и 30 мкг ванкомицина.
Культуру A58267.2 культивировали при температуре в пределах от 15 до 37oC. Оптимальная температура составляет около 30oC.
Анализ
клеточной стенки
Анализ клеточных стенок родительского штамма A58267.21 показал, что гидролизованные целевые клетки
содержали L L-диаминопимелиновую кислоту (DAP). Сахара, присутствующие в
экстрактах целых клеток, являются глюкозой и рибозой. Типом жирной кислоты является 2C, а мажорным менахиноном является
MK-9(H6) Измерения выявили характерный для рода Streptomyces тип
клеточной стенки, и, как и ожидалось, штамм A58267.2 имеет аналогичный тип клеточной стенки.
Идентичность
штамма A58267.2
Как было выявлено, культура A58267.2 имеет тип 1
клеточной стенки, полный состав сахаров типа NC, а состав менахинонов соответствует, главным образом, МК-9(H6).
Указанные хемотаксономические свойства, а также культуральные и
морфологические характеристики A58267.2 подтверждают причисление данного изолята к роду Streptomyces [см., Lechevalier и др., "Chemical
Composition as a Criterion in the Classification of Aerobic
Actinomyceses, Int. J.Syst. Bacteriol. 20; 435-443 (1970)].
Хотя в АТСС "Catalogue of Bacterial and Bacteriophages" 18-ое изд. (1992) раскрывается 11 штаммов Streptomyces avermifilis, однако, в литературе S. Avermitilis, однако в литературе S. avermitilis АТСС 31267 идентифицирован как непрямой или прямой родитель 10 из 11 штаммов. Если АТСС 31267 (A54508) не является прямым родительским штаммом, то часто прямым родительским штаммом является поколение первой генерации, АТСС 31272 (A54508.3). Описания потомства либо АТСС 31267, либо 31272 в литературе свидетельствует о том, что это потомство имеет общие с родительским штаммом характеристики, однако при этом они обладают некоторыми отличительными особенностями (см., например, таксономическое описание АТСС 53567 и 53568 в EP 276131). Поэтому в качестве штаммов для сравнения со штаммом АТСС 21005 (A58267.2) из всех прямых или непрямых родительских штаммов были выбраны один известный штамм S. avermitilis, АТСС 31267/A54508, и один штамм, являющийся его потомством первой генерации (АТСС 31272/A54508.3).
В одном в высокой степени детерминативном сравнении анализ жирных кислот осуществляли на A58267.2, A54508 и A54508.3. В таблице 2 показано сравнение процентных содержаний специфических жирных кислот, обнаруженные в каждом штамме.
Дендрограмма, генерированная с помощью компьютера, и построенная исходя из профилей жирных кислот, представлена на фиг. 1. Эта дендрограмма иллюстрирует родственное соотношение A58267.2 с другими штаммами Streptomyces avermitilis как показано с помощью эквлидова кодового расстояния. Культуры, показавшие степень родства ниже уровня 10,00, интерпретировались как синонимичные, т. е. принадлежащие к одному и тому же виду. Степень родства A58267.2 по отношению к S. avermitilis находится на уровне, превышающем 10,00.
Анализ методом главных компонент относится к области многомерного статистического анализа, который имеет дело с внутренними соотношениями совокупности переменных. В данном анализе наибольшая величина дисперсии внутри исходных данных или данных результатов испытаний выражена в виде главных компонент [Alderson G., "The Application and Relevance of Nonhierarchic Methods in Bacterial Taxonomy", b "Computer-assisted Bacterial Systematics", Goodfellow, M., и др. (изд.), Academic Press, Нью-Йорк (1985)]. Таким образом, может быть построена диаграмма, иллюстрирующая разброс и изменчивость. Затем, путем оценки этой дисперсии, могут быть оценены взаимные соответствия, и может быть охарактеризована микробная популяция. В соответствии с этим, исходя из данных о составе жирных кислот, была построена двумерная диаграмма главных компонент, иллюстрирующая взаимосвязь культуры A58267 и ее родительского штамма A58267.21 с другими видами S.avermitilis. Полученные данные показаны на фиг.2.
Как в дендрограмме, так и в диаграмме главных компонент образовалось два различных кластера. A58267.2 и A58267.21 образуют один кластер, а A54580 и A54580.3 образуют другой кластер. Эти два кластера обладают достаточным сходством, которое указывает на то, что штаммы в этих кластерах являются родственными, но они также обладают достаточным различием, которое свидетельствует о том, что ни кластеры, ни отдельные штаммы в этих кластерах не являются идентичными.
Различия между A58267.2 и A54840.3 систематизированы в таблице 3.
Как было установлено ранее, различия между штаммами S. аvermitelis A58267.2 и A54508/A54508.3 являются недостаточными, чтобы можно было квалифицировать A58267.2 как отдельный вид. Однако эти различия являются вполне достаточными, чтобы выделить A58267.2 в отдельный подвид (штамм), отличающийся от известных штаммов Streptomyces аvermitilis. Таким образом, A58267.2 была квалифицирована как подвид S. avermitilis, а в частности как подвид niger NRRL 21005 Streptomyces avermitilis. Название "niger" этот штамм получил благодаря своей окраске, продуцируемой на агаре Беннетта.
В другом своем варианте настоящее изобретение относится к способу продуцирования одного или нескольких авермектинов, который заключается в том, что подвид niger NRRL 21005 S. avermitilis, или его авермектин-продуцирующий мутант или вариант культивируют в водной культуральной среде, содержащей усвояемые источники углерода, азота, и неорганических солей в глубинных аэробных условиях до тех пор, пока не будет продуцироваться один или несколько авермектинов, после чего указанные авермектины выделяют. Полученные авермектины могут быть выделены с помощью различных процедур выделения и очистки, хорошо известных специалистам.
Как и в случае других микроорганизмов, характеристики авермектин-продуцирующей культуры настоящего изобретения, подвида niger NRRL 21005 Streptomyces avermitilis, могут быть модифицированы. Мутанты данного штамма могут быть получены известными методами, например, путем обработки штамма различными физическими и химическими мутагенами, такими как ультрафиолетовое излучение, рентгеновское излучение, гамма-излучение, и химические соединения, такие как н-метил-N'-нитро-N-нитрозогуанидин. Натуральные варианты указанного штамма также могут быть получены стандартными методами, например путем скрининга культур родительского штамма. В объем настоящего изобретения входят такие натуральные варианты и индуцированные мутанты подвида niger NRRL 21005 S. avermitilis, которые сохраняют способность к продуцированию авермектина.
Для культивирования культуры S.avermitilis настоящего изобретения может быть использована любая из имеющихся подходящих сред. Так, например, предпочтительными углеводными источниками при крупномасштабной ферментации являются глюкоза, манноза, и особенно, картофельный декстрин. Однако могут быть также использованы и другие источники углеводов, такие как рибоза, ксилоза, фруктоза, галактоза, маннит и т.п.
Предпочтительными источниками азота является соевая мука, хотя могут быть также использованы фермент, или кислотно-гидролизованный казеин, дрожжи, печеночная мука, мясные пептоны, рыбная мука и т.п.
В культуральную среду могут быть введены питательные неорганические соли, например обычно используемые растворимые соли, такие как хлорид, карбонат, сульфат, нитрат цинка, натрия, магния, кальция, аммония и т.п.
Культуральная среда должна также содержать основные микроэлементы, необходимые для роста и развития организма. Такие микроэлементы обычно присутствуют в других компонентах среды в качестве примесей в количествах, достаточных для удовлетворения потребностей микроорганизма в росте. Если необходимо, то в среды для крупномасштабной ферментации могут быть добавлены небольшие количества (например, 0,2 г/л) пеногасителя, такого как полипропиленгликоль, имеющий молекулярную массу около 2000.
Примеры предпочтительных концентраций компонентов культуральной среды приводятся ниже, в примере 1.
Для продуцирования значительных количеств авермектинов предпочтительным являются глубинное аэробное культивирование, проводимое в ферментерах. Небольшие количества культуры A58267.2 могут быть получены путем культивирования во встряхиваемой колбе. Поскольку лаг-период при продуцировании авермектина обычно связан с инокуляцией больших ферментерах спорообразующим микроорганизмом, то предпочтительно использовать активно растущий посевной материал. Такой вегетативный посевной материал приготавливают путем инокуляции небольшого объема культуральной среды спорообразующими или мицеллярными фрагментами микроорганизма, и получают в результате свежие активно растущие культуры микроорганизма. Затем вегетативный посевной материал переносят в более объемный сосуд и начинают стадию продуцирования авермектинов. Среда для вегетативного посевного материала может быть такой же, что и при осуществлении более крупномасштабных ферментаций, однако можно использовать и другие подходящие среды.
В способе настоящего изобретения авермектины продуцируют с использованием организма A58267.2, культивируемого при температурах от около 15oC до около 37o C. Оптимальная температура продуцирования авермектина составляет от около 29oC до около 31oC.
Как обычно практикуется в условиях глубинного аэробного культивирования, стерильный воздух подают в сосуд снизу, а среду размешивают с помощью стандартной турбинной мешалки, максимальное поглощение кислорода при ферментации в используемых условиях, таким образом, не превышает около 0,16 мМ/л/мин. В полностью перегороженном 115-литровом ферментере, скорость аэрации и размешивания должна быть достаточной для поддержания уровня растворения кислорода, по крайней мере 45% насыщенности воздуха кислородом при внутреннем давлении в сосуде 5,0 атм.
Продуцирование авермектинов может контролироваться в процессе ферментации путем тестирования образцов питательной среды посредством сравнения с имеющимися стандартными с использованием различных методов, таких как ВЭЖХ.
После продуцирования в условиях глубинной аэробной ферментации, авермектины могут быть выделены из ферментационной среды известными способами, обычно применяемыми в этих целях. Обычно авермектины, продуцированные в процессе ферментации культуры A58267.2 или ее аверметкин-продуцирующего мутанта или варианта, присутствуют в обоих отфильтрованных бульонах, и особенно в мицеллярной массе. Поэтому, если авермектины предназначены для непосредственного введения животным, то весь культуральный бульон может быть осушен и смешан с пищей для этих животных.
Более предпочтительно, если авермектины выделяют из всего культурального бульона, и выделение отдельных соединений авермектина осуществляют путем экстракции растворителем и хроматографического фракционирования с использованием различных систем растворителей и хроматографической техники. Техника сепарации и выделения авермектинов описана в патенте США N 4 429 042: и Miller T.W. и др., Antimicrob. Agents Chemother. 15(3); 368-371 (1979).
Предпочтительные способы сепарации и выделения описаны в приведенных ниже примерах.
После получения и выделения авермектинов их используют, в частности, для лечения животных, страдающих паразитарными инфекциями, а также в качестве антигельминтных средств, инсектицидов и акарицидов. Использование этих соединений в качестве антигельмитных средств хорошо известно в ветеринарии и широко описано в литературе (см., например, пат. США NN 4 429 042 и 4 310 519).
Кроме того, может быть получен (не необязательно) ивермектин, который представляет собой хорошо известное производное комбинации восстановленного авермектина B1a и B1b способами, описанными Charbula и др., в патенте США N 4 199 569, который вводится в настоящее описание посредством ссылки.
Для более полной иллюстрации способов настоящего изобретения ниже приводятся примеры. Однако эти примеры не должны рассматриваться как некое ограничение объема настоящего изобретения во всех отношениях.
В представленных ниже примерах: спектральные данные13C-ядерного магнитного резонанса для авермектиновых соединений A1a, A1b, A2a, A2b, B2a, B1b, B2a и B2b, в растворе дейтерированного хлороформа, были получены с помощью спектрометра General Electric Model QE 300 (Femont, CA). Объем раствора каждого образца составляет около 0,7 мл. Химические сдвиги для каждого соединения авермектина относительно дейтерохлороформа даны в миллионных долях (77 мл. д). Данные FABMS (масс-спектроскопия путем бомбардировки быстрыми атомами) были получены с использованием спектрометра ZABII-SE (VG Analytical, Манчестер, Англия).
Пример 1
Ферментация
A58267.2
A. Качалочная колба
Культуру штамма niger
NRRL 21005 Streptomyces avermitilis, хранившуюся в жидком азоте, использовали для инокуляции 0,5 мл вегетационной среды первой
стадии, имеющей следующий состав:
Вегетационная среда
Ингредиент - Количество (г/л)
Триптиказ - 30,0
Дрожжевой экстракт - 3,0
MgSO4 •
7H2O - 2,0
Глюкоза - 5,0
Мальтоза - 4,0
Деионизированная вода, дост.кол. - до 50 мл
Нескорректированный pH 7,0; после стерилизации pH не корректировали;
pH после стерилизации - 6,9.
Инокулированную вегетационную среду инкубировали в широкогорлой 250 мл колбе Эрленмейера при 30oC в течение 46 часов на шейкере, вращающемся по круговой орбите в 2 дюйма (5,08 см) при 250 об/мин. Колба была защищена двумя биозащитными фильтрами, а угол наклона стола шейкера составлял 0oC.
B. Биореактор для
ферментации A58267.2
Для получения большого объема
посевного материала 10 мл инкубированной среды первой стадии, приготовленной, как описано выше в Части A, использовали для инокуляции 400 мл
вегетационной среды для второй стадии, имеющей тот же
состав, что и среда для первой стадии. Эту среду второй стадии инкубировали в широкогорлой 2-литровой колбе Эрленмейера при 30oC в
течение 48 часов на шейкере, вращающемся по круговой
орбите в 2 дюйма (5,08 см) при 250 об/мин. Эта колба также была защищена двумя биозащитными фильтрами, и угол наклона вибрационного стола составлял
0oC.
Эту вегетационную
среду второй стадии (400 мл) использовали для инокуляции 107 л стерильной питательной производственной среды, имеющей следующий состав:
Питательная производственная среда
Ингредиент
- Количество (г /л)
Соевая мука - 5,0
Картофельный декстрин - 80,0
Овсяная мука для детского питания - 5,0
Сырая меласса - 5,0
CaCO3 - 2,0
Глицерин - 1,0 мл
Минеральная маточная смесь Чапека - 2,0 мл
Деионизированная вода, дост. кол-во - до 107 л
Некорректированный pH 6,5; коррекцию pH до 7,3
осуществляли с использованием около 30 мл 5 н. NaOH; после стерилизации pH 7,0. Добавляли пеногаситель SAG 471 при 0,2 г/л (Union Carbide Sistersille,
Зап.Вирджиния).
Инокулированную производительную среду оставляли в 115-литровом ферментере со смесителем на 10-11 дней при температуре 30oC для ферментации. Растворенный кислород поддерживали на уровне около 45% насыщенности воздуха, поскольку размешивание проводилось при низкой скорости (от около 137 до около 255 об/мин).
Пример 2
Общее
выделение авермектинов
Весь
ферментационный бульон из 115 л, полученных в соответствии с описанием в примере 1, доводили до pH 6,5 с использованием 5 н. HCl. Затем к раствору добавляли равный
объем MeOH и полученный раствор
фильтровали через керамический фильтр Mebralox (U.S.Filter /SCT, Bazet, Франция). После этого фильтрат пропускали через колонку, содержащую 10 л HP-20SS (Dialon)
(Mitsubishi Chemical Industries Ltd,
Токио, Япония). Затем колонку элюировали линейным градиентом 50-100% MeOH в воде. Собранные фракции анализировали с помощью ВЭЖХ на колонке [4,6 мм (внутр.диам.) х
30 см], содержащей Dynamax C18 (Rainin Company, Woburn, MA). Колонку элюировали с использованием изократного градиента MeOH: CH3CN:(0,2% HOAc, pH, доведенный до 5,0 при помощи
NaOH) = 44:44:12, со скоростью
потока 1,5 мл/мин. На основе указанного ВЭЖХ-анализа, фракции объединяли в два пула. Эти пулы концентрировали при пониженном давлении до получения около 500 мл водного
раствора. Затем пулы
экстрагировали CHCl3, а экстракты выпаривали, в результате чего получали 18,25 г маслообразного продукта (Пул A) и 6,48 г маслообразного продукта (Пул B).
Пример 3
Обработка Пула A
Пул A (18,25 г) из примера 2 растворяли в 45 мл MeOH и хроматографировали на клонке (5 см (внутр. диам.) х 1,1 м), содержащей Сефадекс LH-20
(Pharmacia, Piscataway, New
Jersey). Колонку элюировали MeOH, и фракции анализировали с помощью ВЭЖХ. Фракции, содержащие авермектины, объединяли в два пула и выпаривали, в результате чего получали
Пул C (10,96 г) и Пул I (1,45
г).
Пример 4.
Обработка Пула C
Материал из Пула C (2 г из материала, полученного в примере 3) растворяли в 4,5 мл MeOH и
хроматографировали на колонке (41,4
мм (внутр.диам.) х 25 см), содержащей Dynamax - 60A C18 (Rainin, Woburn, Massachusetts). Колонку элюировали с использованием линейного градиента CH3CN:MeOH:H2O =
40:40:20 - 46: 46: 8 в течение 100 минут со скоростью потока 15 мл/мин. На основании ВЭЖХ-анализа было получено 4 пула: Пул E (489 мг), Пул F (624 мг), Пул G (656 мг),
и Пул H (177 мг).
Пример 5
Выделение авермектина AIa
Пул B из примера 2 растворяли в 30 мл MeOH и хроматографировали как описано в примере 3. Колонку элюировали MeOH,
а фракции
анализировали с помощью ВЭЖХ. Фракции, содержащие авермектины, объединяли и выпаривали, в результате чего получали остаток (658 мг). Часть (200 мг) остатка хроматографировали на колонке (2,
5 см
(внутр.диам.) х 30 см), содержащей Chomegabond MC18 (ES Industries, Berlin, New Jersey), с использованием градиента CH3CN: MeOH:H2O = 40:40:20 - 42:42:16 в течение 90 минут
при
скорости потока 5 мл/мин. В результате описанной процедуры получали 63 мг аверметина Ala; FAB-Ms m/z = 909 [Авер.A1a + Na]+; ЯМР (75 МГц, CDCl3) δ: 11,96;
12,
88; 15,03; 16,30; 17,62; 18,32; 19,82; 20,18; 27,44; 30:50; 34,18; 34,43; 35,13; 36,52; 39,66; 40,41; 45,61; 56,32; 56,41; 57,69; 67,18; 68,07; 68,15; 68,32; 74,83; 76,01; 76,89; 77,41; 78,15; 80,
43;
80,50; 81,92; 118,25; 118,31; 119,58; 124,79; 135,10; 135,98; 136,08; 137,58; 139,85; 173,81; 94,88; 98,44; 68,33; 127,74.
Пример 6
Выделение авермектинов A2a и BIb
Материал из Пула F (из примера 4) растворяли в 2,5 MeOH и хроматографировали на колонке, как описано в примере 4. Колонку элюировали изократически с использованием MeOH:H2O= 85:15,
при
скорости потока 15 мл/мин, в результате чего получали чистый авермектин A2a (202 мг); FAB-MS: m/z = 927 [Авер.A2a + Na]+;13C-ЯМР (75 МГц, CDCl3)
δ
: 173,4; 139,83; 137,48; 135,79; 135,60; 124,80; 119,65; 118,43; 117,47; 99,56; 98,41; 94,78; 81,67; 80,50; 80,36; 79,27; 78,15; 77,50; 76,80; 75,90; 70,67; 68,79; 68,25; 68,12; 68,06; 67,55;
67,18;
57,60; 56,38; 45,54; 41,06; 40,70; 39,62; 36,27; 35,61; 35,04; 34,41; 34,26; 34,07; 27,18; 20,20; 19,86; 18,31; 17,65; 15,06; 13,72; 12,37; 11,75; и авермектин B1b (79 мг): FAB-MSm/z = 881
[Авер.BIb + Na]+;13C-ЯМР (75 МГц, CDCl3) δ : 173,56; 139,54; 137,95; 137,80; 135,97; 135,07; 127,72; 124,70: 120,31; 118,28; 118,00; 98,43; 95,63;
94,88; 81,
83; 80,38; 80,32; 79,32; 79,22; 78,22; 77,26; 75,96; 68,32; 68,28; 68,24; 68,10; 67,67; 67,21; 56,46; 56,36; 45,66; 40,45; 39,72; 36,63; 34,52; 34,22; 30,88; 28,31; 21,03; 20,18; 19,88; 18,
37; 17,68;
16,51; 15,08; 14,86;
Пример 7
Выделение авермектинов A1b и B1a
Материал из Пула G (из Примера 4) растворяли в 3 мл CH3CN и хроматографировали на
колонке (2,5 см
(внутр.диам.) х 30 см), содержащей Chromegabond MC18 (ES Industries, Берлин, Нью-Джерси) в течение 100 минут с использованием линейного градиента CH3CN : H2O = 73
: 27 - 80 : 20
при скорости потока 5 мл/мин в трех отдельных сериях, в результате чего получали чистый авермектин A1b (145 мг); FAB-MS m/z = 875 [Aвер.A1b + Na]+;13
C-ЯМР (75 МГц,
CDCl3) δ : 173,39; 139,61; 137,35; 135,50; 134,87; 127,58; 119,45; 118,29; 118,07; 98,22; 94,41; 94,69; 81,68; 80,29; 80,22; 79,10; 77,99; 77,28; 77,00; 76,65; 75,73;
68,08; 68,05;
67,91; 66,98; 57,43; 57,21; 56,18; 45,39; 40,24; 39,45; 36,36; 34,30; 34,05; 30,65; 28,09; 20,82; 20,03; 19,66; 18,15; 17,48; 16,31; 14,87; 14,64; 124,63; и авермектин B1a (245 мг);
FAB-M m/z = 895
[Авер.B1a + Na]+;13C-ЯМР (75 МГц, CDCl3) δ: 173,40; 139,53; 137,84; 137,70; 136,08; 135,08; 127,74; 124,69; 120,23; 118,23; 117,94;
98,42; 95,69;
94,87; 94,87; 81,69; 80,23; 80,15; 79,13; 78,05; 75,69; 74,61; 68,12; 68,03; 67,93; 67,46; 67,01; 56,26; 56,17; 45,43; 40,28; 39,51; 36,33; 34,93; 34,23; 34,05; 30,32; 27,25; 19,99; 19,
66; 18,24; 17,
50; 16,15; 14,85; 12,74; 11,81.
Пример 8
Выделение авермектинов A2b, B2a, и B2b
Материал из Пула E (из примера 4) растворяли в 1,9 мл CH3CN и
хроматографировали на колонке, описанной в примере 7. Колонку элюировали в течение 100 минут, линейным градиентом CH3CN : H2O = 65:35 - 75:25, при скорости потока 5 мл/мин, в
двух отдельных сериях, в результате чего получали чистый авермектин A2b (80 мг); FAB-MS m/z = 913 [Авер.A2b + Na]+;13C-ЯМР (75 МГц, CDCL3) δ : 173,
60; 139,83; 137,47; 135,92; 135,54; 124,75; 119,52; 118,21; 117,44; 99,53; 98,37; 94,69; 81,53; 80,43; 80,30; 79,21; 78,10; 77,34; 76,81; 75,92; 72,24; 69,75; 68,24; 68,10; 68,05; 67,46; 67,14; 57,65;
56,38; 56,31; 45,52; 40,99; 40,63; 39,60; 36,37; 35,95; 34,47; 34,14; 27,86; 20,68; 20,16; 19,80; 18,29; 17,59; 15,05; 13,85; 13,55; авермектин B2a (125 мг); FAB-MS m/z = 913 [Авер.B2a +
N]+;13C-ЯМР (75 МГц, CDCl3) δ: 173,63; 139,68; 138,01; 135,62; ≈ 135; 124,72; 120,34; 117,92; 117,54; 99,63; 98,47; 94,77; 81,55; 80,35; 79,31; 79,08;
78,17; 76,07; 72,35; 69,86; 68,43; 68,32; 68,10; 67,68; 67,51; 67,25; 56,3; 56,3; 45,67; 41,11; 40,72; 39,75; 36,55; 36,07; 34,57; 34,24; 34,17; 27,96; 20,80; 20,21; 19,97; 18,41; 17,68; 15,17; 13,95;
13,67; и авермектин B2b (145 мг); FAB-MSm/z = 899 [Авер.B2b+ Na]+;13C-ЯМР (75 МГц, CDCl3) δ : 173,09; 139,44; 137,65; 137,57; 135,44; 124,50; 120,
90;
117,76; 117,34; 99,41; 98,26; 94,63; 81,47; 80,19; 79,20; 79,10; 78,04; 75,72; 70,57; 69,66; 68,10; 68,03; 67,97; 67,45; 67,36; 67,05; 56,28; 56,24; 45,45; 40,57; 39,52; 36,17; 35,46; 34,90; 34,
26;
34,09; 33,91; 27,04; 20,00; 19,69; 18,16; 17,51; 14,91; 13,56; 12,33; 11,59;
Реферат
Изобретение относится к биотехнологии. Получен штамм Streptomyces avermitilis подвида niger NRRL 21005, продуцирующий авермектины Ala, Alb, A2a, A2b, Bia, Bib, B2a и B2b. Выращивание этого штамма в среде, содержащей источники углерода, азота и неорганических солей в условиях аэробного глубинного культивирования проводят до продуцирования одного или более авермектинов. В способе продуцирования ивермектина после продуцирования штаммов авермектинов Bia и Bib проводят их восстановление. В результате использования штамма Streptomyces avermitilis подвида niger NRRL 21005 получают соединения, обладающие антипаразитарными свойствами. 3 с.п. ф-лы, 2 ил., 3 табл.


Комментарии