Способ изменения функционального состояния мрнк, обеспечивающий ее избирательное и специфическое распознавание - RU2724485C2
Код документа: RU2724485C2
Чертежи
Описание
Область изобретения
Изобретение относится к изменению функционального состояния любой нуклеиновой кислоты, что позволяет ее специфическое и избирательное распознавание и последующую селективную манипуляцию. Настоящее решение является полностью универсальным и доступным в таких областях, как биотехнология, молекулярная биология, вирусология, медицина и т.д. Изобретение имеет непосредственную применимость и широкий терапевтический потенциал, наиболее предпочтительно в области онкологии, но не ограничивается этой конкретной областью.
Предпосылки создания изобретения
С точки зрения современного уровня техники, в отличие от других, химически сходных конструкций, решение, описанное в настоящем изобретении, создано с диаметрально отличной целью.
Двухвалентная система, описанная в документе WO 2011/117353 (Moeller, Udesen, 2011), представляет собой многофункциональную конструкцию для одновременного взаимодействия связанных олигонуклеотидов с двумя отдельными нуклеиновыми кислотами-мишенями, чтобы насытить их сайты связывания и таким образом модулировать их биологическую функцию. Поскольку каждый олигонуклеотид распознает молекулу нуклеиновой кислоты различной мишени, сама конструкция в основном функционирует так же, как и стандартный антисмысловой олигонуклеотид (по отношению к молекулам нуклеиновой кислоты каждой отдельной мишени) и ни в коем случае не увеличивает селективность их распознавания.
Аналогично, коньюгат антисмысловых олигонуклеотидов, описанный в документе WO 2011/031520 (Agrawal et al., 2011), предназначен для распознавания двух молекул нуклеиновой кислоты (одинаковых или разных), в то время как аналогично документу WO 2011/117353 (Moeller, Udesen, 2011), распознает молекулы нуклеиновой кислоты-мишени индивидуально (т.е. через один антисмысловой олигонуклеотид). Следовательно, в документе не рассматривается вопрос об их избирательном распознавании.
Другие химически подобные конструкции, описанные в документах WO 2009/023819 (Kandimalla et al., 2009), WO 2005/111238 (Epstein et al., 2005), WO 2005/078096 (Zamore et al., 2005), WO 2004/064782 (Agrawal et al., 2004) были разработаны для иммунорегуляции, для повышения их клеточного поглощения, рекрутинга miRNA и иммуностимулирующих целей соответственно. Однако ни одна из них не решает проблему селективного распознавания молекул нуклеиновой кислоты-мишени.
Во всех этих случаях описанные конструкции представляют собой лишь своего рода «улучшенную», многовалентную форму взаимодействующей молекулы, более того, которая предназначена для решения диаметральных отличных проблем, не связанных с настоящим решением. Таким образом, фундаментальные различия заключаются в том, что существующие конструкции, в отличие от настоящего изобретения, не решают проблему разнородности антисмысловых олигонуклеотидов.
Современные научные знания в" этой области направлены на лечение онкологических заболеваний, в то же время важно отметить, что гены слияния, характерные исключительно для опухолевых клеток, являются причинами многих опухолевых заболеваний (лейкемии, лимфомы, саркомы и т.д.) и могут быть, безусловно, рассмотрены как перспективная цель противораковой терапии. Уникальная последовательность нуклеиновой кислоты слияния позволяет специфически и избирательно таргетировать опухолевые клетки без терапевтического вмешательства в здоровые клетки. Противораковые терапии, основанные на интерференции терапевтических агентов с нуклеиновыми кислотами, таким образом, могут быть направлены против обычных слитых нуклеиновых кислот и, таким образом, для достижения терапевтического эффекта исключительно в опухолевых клетках. В контексте антисмысловых стратегий это означает целевое молчание генов слияния посредством вмешательства в слитую мРНК, тем самым предотвращая синтез обычных слитых белков.
Проблема недостаточной специфичности этих антисмысловых стратегий (в терминах связывающей специфичности терапевтических агентов к целевой последовательности мРНК, их аффинности связывания с целевой мРНК и энергии связи с целевой мРНК) была решена в основном химическими модификациями терапевтических агентов, например, путем химической модификации рибозы и/или фосфодиэфирной цепи (Pirollo, Rait et al., 2003; Stahel, Zangmeister-Wittke, 2003; Jansen, Zangemeister-Wittke, 2002). Несмотря на это, окончательное решение еще не определено, поскольку модифицированные терапевтические агенты не являются достаточно специфическими и селективными, и они вызывают молчание терапевтически нецелевых генов (Burnett, Rossi, 2012). Это, следовательно, влияет на экспрессию нецелевых белков, что приводит к серьезным клиническим побочным эффектам с отрицательным воздействием на качество жизни пациентов.
Что касается принципа распознавания мРНК-мишени, применение одного терапевтического, последовательность - специфического олигонуклеотида, который связывается с определенным участком целевой мРНК, представляет собой общепринятый стандарт антисмысловых стратегий. В случае слияния мРНК этот специфический участок чаще всего является сайтом прямого слияния двух индивидуальных партнеров по слиянию (Diakos et al., 2007; Rangatia, Bonnet, 2006; Rapozzi et al., 2006; Scherr et al., 2005, Scherr et al., 2003; Tanaka et al., 1997). Однако опубликованные данные ясно указывают на то, что, несмотря на значительное улучшение физико-химических свойств антисмысловых терапевтических агентов, применение одного интерферирующего олигонуклеотида до сих пор не привело к ожидаемому прогрессу в вопросе о неспецифическом связывании антисмысловых олигонуклеотидов к непреднамеренным молекулам мРНК (Summerton et al., 2007).
Таким образом, современный уровень техники по-прежнему сталкивается с фундаментальной проблемой, состоящей в специфичности и избирательности терапевтического эффекта исключительно для первичной цели. Таким образом, реальный прогресс в противораковых стратегиях заключается не в разработке новых терапевтических агентов как таковых, а в развитии систем, позволяющих избирательное терапевтическое действие.
Ограничение с точки зрения недостаточной специфичности и селективности противораковых стратегий решается настоящим изобретением, которое представляет собой универсальное решение для любой терапевтической стратегии, основанной на вмешательстве в нуклеиновые кислоты. Принцип специфического и селективного распознавания нуклеиновой кислоты-мишени вместе с принципом селективного действия описывается и объясняется посредством целенаправленной интерференции в обычные слитые гены, что позволяет применять настоящее изобретение в противораковых антисмысловых стратегиях.
Во всех упомянутых патентах и публикациях термин «специфичность» строго относится к комплементарному спариванию оснований олигонуклеотида и последовательности-мишени нуклеиновой кислоты, то есть специфичность = комплементарность; тогда как в настоящем изобретении термин «специфичность» относится к комплементарному распознаванию и связыванию только с одной определенной нуклеиновой кислотой-мишенью, то есть специфичность = селективное распознавание нуклеиновой кислоты-мишени.
Следовательно, настоящее изобретение, несомненно, отличается от существующих антисмысловых систем, предназначенных для контролируемого вмешательства нуклеиновых кислот. Другими словами, настоящее изобретение представляет принципиально инновационное решение.
Краткое описание изобретения
Недостаточная специфичность, обусловленная гомологией последовательностей к нуклеиновой кислоте-мишени, например, мишень-мРНК, эффективно устраняется путем изменения функционального состояния мРНК-мишени, обеспечивающей ее избирательное и специфическое распознавание и последующее избирательное вмешательство, манипулирование, обнаружение, количественную оценку, маркировку, предварительное таргетирование и сортировку, где мРНК таргетируется конструкцией, включающей по меньшей мере два последовательность - специфических олигонуклеотида, которые взаимно связаны между собой посредством размер - специфического полимерного фрагмента, длина которого определяет их взаимное расстояние, причем каждый из последовательность - специфических олигонуклеотидов нацелен на заранее определенную последовательность - мишень мРНК, что приводит к стабильному гетеродуплексу, и благодаря этому изменению эта мРНК избирательно и специфически распознается. Специфическое и избирательное распознавание нуклеиновой кислоты впоследствии может быть использовано для селективного терапевтического вмешательства, когда передача генетической информации, кодируемой нуклеиновой кислотой, прерывается, или для диагностических и исследовательских целей.
Этим чередованием определенные последовательности нуклеиновых кислот специфически распознаются, причем эти последовательности должны находиться на точно определенном расстоянии друг от друга. В случае одновременного распознавания определенных последовательностей на определенном расстоянии друг от друга интерферирующая система, предназначенная для конкретного пространственного распределения последовательностей-мишеней, образует термодинамически предпочтительную и энергетически стабильную связь с нуклеиновой кислотой-мишенью. Этот принцип распознавания минимизирует вероятность неспецифического взаимодействия и стабильного связывания с произвольными нуклеиновыми кислотами, и, следовательно, нежелательная интерференция с нуклеиновыми кислотами вне основной цели резко снижается.
Описанный принцип распознавания нуклеиновой кислоты резко повышает специфичность и селективность интерференции с отдельной особо выбранной специфической нуклеиновой кислотой. Описанный принцип полностью универсален и не ограничивается только взаимосвязью двух последовательность - специфических олигонуклеотидов, то есть он обеспечивает целенаправленное соединение любого количества олигонуклеотидов (n≥2) через соответствующее количество неинтерферирующих полимерных связывающих фрагментов (n≥1), все в отношении заявленного изобретения.
В предпочтительном варианте осуществления изобретения, когда мРНК-мишень представляет собой слитую мРНК, каждая из указанных последовательностей расположена на соответствующем партнере по слиянию, а интерферирующая система нацелена исключительно на нуклеиновую кислоту слияния, которая непосредственно обеспечивает селективное терапевтическое воздействие исключительно в опухоли клетки. Более того, поскольку антисмысловые системы способны оказывать воздействие во всех клетках, содержащих мРНК-мишень, настоящее изобретение обеспечивает перспективность лечебной терапии, поскольку его применение позволяет избирательно проводить терапевтический таргетинг на опухолевые стволовые клетки. Другими словами, описанное нововведение приносит надежду на полное и постоянное излечение онкологического расстройства.
В контексте противораковых антисмысловых стратегий, направленных на вмешательство генов слияния, этот принцип обеспечивает устойчивую интерференцию со слитой мРНК-мишенью исключительно в том случае, когда обе комплементарные последовательности отдельных партнеров по слиянию, которые, кроме того, находятся на точно определенном расстоянии друг от друга, распознаются. Таким образом, специфичность и избирательность интерференции значительно возрастают, тогда как вероятность неспецифического стабильного взаимодействия с особо гомологичными последовательностями исключается. В отсутствие одновременного распознавания обеих комплементарных последовательностей, т.е. в случае нежелательного взаимодействия с непреднамеренной мРНК, частичное взаимодействие такой системы с нецелевой мРНК является энергетически неустойчивой и приводит к спонтанному разъединению (Dias, Stein, 2002).
Применение настоящего изобретения в медицине продемонстрировано с помощью антисмысловых систем, предназначенных для противораковой терапии, с основной целью селективной интерференции обычных слитых генов. В контексте онкологических заболеваний, характеризующихся наличием генов слияния, это означает выборочное нацеливание исключительно на поврежденные клетки, которое революционно максимизирует терапевтическое вмешательство в первичную мишень. В области онкологии настоящее изобретение представляет собой революционный инструмент для вмешательства исключительно в опухолевые клетки (т.е. без вмешательства в здоровые клетки).
Подробное описание изобретения
Настоящее решение является способом изменения функционального состояния любой мРНК, обеспечивающим ее избирательное и специфическое распознавание и последующее избирательное вмешательство, манипулирование, обнаружение, количественное определение, маркирование, предварительное таргетирование и сортировку этой мРНК, позволяющим увеличить специфичность и селективность нацеливания на конкретную нуклеиновую кислоту в целом и с заданной областью применения (например, контролируемое ингибирование обычных слитых генов, обнаружение наличия и количественная оценка нуклеиновых кислот, маркировка нуклеиновой кислоты, предварительное нацеливание и сортировка нуклеиновых кислот). Таким образом, предметом изобретения является специфическое и избирательное нацеливание любой конкретной нуклеиновой кислоты путем одновременного распознавания двух (или более) последовательностей-мишеней, которые, кроме того, должны находиться на заранее определенном расстоянии друг от друга.
С точки зрения инновативности настоящее изобретение обеспечивает революционный инструмент, повышающий селективность и специфичность распознавания нуклеиновой кислоты-мишени, позволяющий ее избирательное вмешательство, манипулирование, обнаружение, количественную оценку, маркировку, предварительное таргетирование и сортировку.
Селективное распознавание определенной нуклеиновой кислоты (предпочтительно мРНК) описанным способом может быть впоследствии использовано для селективного терапевтического вмешательства его естественной биологической функции, когда изменение ее функционального состояния предотвращает передачу кодированной генетической информации. Таким образом прерывается механизм передачи генетической информации от нуклеиновой кислоты к белку, что в случае слияния мРНК позволяет прямое подавление экспрессии обычных слитых онкопротеинов.
Аналогично, селективное распознавание определенной нуклеиновой кислоты (предпочтительно мРНК) описанным способом, приводящее к изменению его функционального состояния, может впоследствии использоваться для различных диагностических или исследовательских целей:
- для прямого обнаружения, визуализации, локализации и количественной оценки распознанной нуклеиновой кислоты (предпочтительно мРНК) посредством целенаправленного включения детектируемых фрагментов, например. FITC, RITC, изотопа Р32 в первичную структуру последовательность-специфических олигонуклеотидов. Использование маркированных последовательность-специфических олигонуклеотидов позволяет количественно распознать определяемую мРНК в анализируемом образце in situ, in vitro, in vivo и ex-vivo,
- для очистки и сортировки распознанной мРНК из других нуклеиновых кислот, присутствующих в обработанном образце,
- для функционального анализа конкретных генов путем целенаправленного включения фотолабильных функциональных групп в первичную структуру последовательность-специфических олигонуклеотидов, обеспечивающих обратимое изменение функционального состояния распознанной мРНК.
Понятия и определения
Антисмысловая система. В отличие от используемых в настоящее время антисмысловых систем для контролируемого подавления мишеней мРНК (Guo et al., 2013; Burnett, Rossi, 2012; Vaishnaw et al., 2010; Missalidis, 2008; Wang et al., 2003; Clark, 2000), настоящее изобретение устраняет их наиболее значительное ограничение, которое состоит в недостаточной специфичности и селективности распознавания основной мишени (т.е промискуитет антисмысловых олигонуклеотидов). Промискуитет стандартных антисмысловых систем, тесно связанный с длиной антисмыслового олигонуклеотида, эффективно решается одновременной интерференцией двух (или более) антисмысловых олигонуклеотидов, которые дополнительно распознают последовательности-мишени, локализованные на точно определенном расстоянии друг от друга. В области противоопухолевой терапии и, в частности, для контролируемого подавления обычных слитых генов, настоящее изобретение посредством его конструкции и механизма распознавания мРНК-мишени представляет собой пилотную (до сих пор не применяемую) антисмысловую систему.
Конструкция. Описанная конструкция содержит два (или более) последовательность-специфических олигонуклеотида, которые взаимно связаны между собой посредством размер-специфического полимерного связывающего фрагмента.
Последовательность-специфический олигонуклеотид. Олигонуклеотиды представляют собой последовательности, которые комплементарны нуклеиновой кислоте-мишени (предпочтительно мРНК) или производным нуклеиновой кислоты. Целевые нуклеиновые кислоты предпочтительно имеют человеческое происхождение.
Олигонуклеотиды могут быть образованы любыми нуклеотидами, необязательно с помощью химических производных/аналогов, таких как ДНК, РНК, 2'-O-(2-метоксиэтил) -РНК, 2'-O-метил-РНК, 2'-O-фтор-РНК, LNA, PNA, морфолино, INA, FAN A, ANA, UNA, HNA и т.д., и в настоящем изобретении они могут быть взаимно объединены либо в виде блоков олигонуклеотидов со специфической химической модификацией, либо как отдельные олигонуклеотиды, содержащие различные модифицированные нуклеотиды. Как нуклеотидные основания, так и сахарофосфатная цепь могут быть химически модифицированы.

Примеры производных РНК
А: модификации сахарного фрагмента; В: модификации фосфатной связи; С: модификации сахарно-фосфатной цепи.
В настоящем изобретении первый олигонуклеотид, второй олигонуклеотид, необязательно другой олигонуклеотид содержит последовательную последовательность по меньшей мере 3 нуклеотидов, которая способна спаривать основание до комплементарной последовательности-мишени нуклеиновой кислоты (предпочтительно мРНК), где
- нуклеотиды могут быть A, I, U, Т, С, G или их производными
- олигонуклеотиды могут содержать любую взаимную комбинацию нуклеотидов или их производных.
Другими предпочтительными последовательностями олигонуклеотидов являются по меньшей мере 4 нуклеотида, по меньшей мере 5, по меньшей мере 6, по меньшей мере 7, по меньшей мере 8, по меньшей мере 9, по меньшей мере 10, по меньшей мере 11, по меньшей мере 12, по меньшей мере 13, по меньшей мере 14, по меньшей мере, 15, по меньшей мере, 16, по меньшей мере 17, по меньшей мере 18, по меньшей мере 19, по меньшей мере 20, по меньшей мере 21, по меньшей мере 22, по меньшей мере 23, по меньшей мере 24, по меньшей мере 25, по меньшей мере 26, при не менее 27, не менее 28, не менее 29, не менее 30, не более 30, не более 29, не более 28, не более 27, не более 26, не более 25, не более 24, не более 23, не более 22, не более 21, не более 20, не более 19, не более 18, не более 17, не более 16, не более 15, не более 14, не более 13, не более 12, не более 11, не более 10, не более 9, не более 8, не более 7, не более 6, не более 5, не более 4, не более 3 нуклеотидов.
Предпочтительная длина олигонуклеотидов (индивидуально) составляет от 10 до 25 нуклеотидов.
Каждый из олигонуклеотидов внутри одной конструкции распознает различные комплементарные последовательности любой, но единственной определенной нуклеиновой кислоты - мишени (предпочтительно мРНК).
Длина олигонуклеотидов в одной настоящей конструкции может изменяться в зависимости от конкретного применения. Более сильное взаимодействие с нуклеиновой кислотой - мишенью может быть достигнуто путем увеличения длины олигонуклеотида. С другой стороны, удлинение олигонуклеотидов может ухудшить их биодоступность и клеточную интернализацию. Однако, поскольку настоящее изобретение включает два (или более) олигонуклеотида в комбинации (совместное одновременное связывание с нуклеиновой кислотой - мишенью), можно использовать более короткие олигонуклеотиды, предпочтительно состоящие из менее 17 нуклеотидов.
Размер-специфический полимерный связывающий фрагмент. Последовательность-специфические олигонуклеотиды взаимосвязаны посредством размер-специфического полимерного связывающего фрагмента через ковалентную связь, поддерживающего 5' до 3' ориентацию всех последовательно связанных олигонуклеотидов. Полимерный связывающий фрагмент присоединен к 5'-концу первого олигонуклеотида и 3'-концу второго олигонуклеотида, где олигонуклеотиды связаны указанным полимерным связывающим фрагментом.
Полимерный связывающий фрагмент может состоять из любой последовательности и количества нуклеотидов (или нуклеотидных производных/аналогов), предпочтительно от 3 до 50 нуклеотидов (в любой их комбинации). Полимерный связывающий фрагмент может также состоять из абазических единиц, и в этом случае связывающий фрагмент представляет собой просто полимерный сахар-фосфат или химически модифицированную основную цепь.
Полимерный связывающий фрагмент может быть ковалентно присоединен к нуклеотидному основанию или к сахарофосфатной цепи олигонуклеотидов.
Полимерный связывающий фрагмент может, например, быть полипептидом, полисахаридом, насыщенным или ненасыщенным углеводородом (С2-С40), предпочтительно водорастворимым природным или синтетическим полимером.
В предпочтительном варианте осуществления полимерный связывающий фрагмент содержит ненуклеотидный полимер, такой как поли(мет)акрилат или модифицированный поли(мет)акрилат (предпочтительно поли(этиленокси) и 2(N,N-диметиламино)этил(мет)акрилат), поли(виниловый спирт), поли(винилпирролидон), поли(этиленгликоль), поли(акриламид), поли(оксазолин), поли(этиленимин), поли(алкиленоксид), полимер на основе лактона, поли(акриловая кислота) поли(лактидная кислота), поли(гликолевая кислота), поли(пропилен), поли(стирол), поли(олефин), поли(амид), поли(цианоакрилат), поли(имид), поли(этилентерефталат), поли(тетраметиленгликоль), поли(уретан), а также их взаимное сочетание или комбинацию из других природных или синтетических полимеров (Kadajji, Betageri, 2011).
Длина полимерной связывающей части может быть скорректирована в соответствии с конкретным применением конструкции. Длина полимерного связывающего фрагмента предпочтительно доводится до взаимного расстояния между последовательностями-мишенями нуклеиновой кислоты-мишени, предпочтительно мРНК. В случае, когда комплементарные последовательности составляют до 20 нуклеотидов, отдаленных друг от друга, конечная длина размер-специфического полимерного связующего фрагмента может составлять от 10 до 100 ангстрем на основе расстояния между нуклеотидами в линейной, полностью удлиненной нуклеиновой кислоте. Длина полимерного связывающего фрагмента не ограничена и может свободно регулироваться в соответствии с конечным применением. Обычно предпочтительно, чтобы полимерный связывающий фрагмент имел длину не более 1000 ангстрем, не более 900, 800, 700, 600, 500, 400, 300, 200 или. 100 ангстрем. Также предпочтительно, чтобы полимерный связывающий фрагмент имел длину по меньшей мере 5 ангстрем, например, 10, 15, 20, 25, 30, 35, 40 или 45 ангстрем.
Предпочтительные диапазоны размер-специфического полимерного связующего фрагмента составляют от 5 до 1000 ангстрем, от 10 до 800 ангстрем, от 20 до 500 ангстрем, от 20 до 200 ангстрем, от 10 до 1000 ангстрем и от 20 до 80 ангстрем.
Синтез
Последовательность-специфические олигонуклеотиды. Химический синтез последовательность-специфических олигонуклеотидов проводят на твердой подложке с использованием метода фосфороамидирования, то есть путем последовательной олигомеризации отдельных мономеров, полученных из защищенных 2'-дезоксинуклеозидов (dA, dC, dG, dT), рибонуклеозидов (А, С, G, U) или других химически модифицированных нуклеозидов, тогда как их конкретный выбор и порядок последовательности зависят от конечного применения. Синтетический цикл включает поэтапное коньюгирование отдельных нуклеозидов с растущим олигомером в последовательности, соответствующей последовательности, комплементарной нуклеиновой кислоте-мишени (предпочтительно мРНК). По завершении последовательность-специфический олигонуклеотид высвобождается из твердой подложки в раствор, полученный для конъюгации с полимерным связывающим фрагментом.
Синтез РНК, ДНК олигонуклеотидов.
Цикл синтеза. Синтез размер-специфических олигонуклеотидов протекает поэтапно в направлении от 3' к 5', когда один нуклеотид добавляют к растущему олигомеру в течение цикла синтеза до тех пор, пока не будет получена желаемая последовательность (Greco, Tor, 2007).

Стадия 1: Детритиляция (удаление защитной группы)
Защитную группу диметокситритила (DMT) удаляют раствором кислоты, например, 2% трихлоруксусной кислоты или 3% дихлоруксусной кислоты в инертном растворителе (дихлорметане или толуоле).
Стадия 2 и 3: Активация и связывание (конъюгация олигонуклеозидов)
0,02-0,2 М раствор нуклеозидного фосфорамидита в ацетонитриле активируется 0,2-0,7 М раствором кислотного азольного катализатора, то есть 1Н-тетразол, 2-этилтиотетразол, 2-бензилтиотетразол, 4,5-дицианимидазол или другим аналогичным соединением (Wei, 2013). Активированный фосфорамидит в 1,5-2,0-кратном избытке над олигонуклеотидами, присоединенными к твердой подложке, затем подвергают взаимодействию с исходным твердым носителем (первое сопряжение) или прекурсором олигонуклеотида, связанным с носителем (после сопряжений). 5'-гидроксигруппа реагирует с активированной фосфорамидитной частью входящего нуклеозидного фосфорамидита с образованием фосфит-триэфирной связи. По завершении реакций сопряжения любые несвязанные реагенты и побочные продукты удаляются путем промывки.
Стадия 4: Окисление
Недавно образовавшиеся три-координированные соединения фосфитного триэфира затем окисляются йодом и водой в присутствии слабых оснований (пиридин, лютидин или коллидин) в тетракоординированный фосфатный триэфир. Окисление можно проводить в безводных условиях с использованием трет-бутилгидропероксида (Alul et al., 1991) или, в конечном счете, с использованием (18)-(+)-(10-камфорсульфонил)-оксазиридина (Manoharan et al., 2000).
Стадия 5: Кэширование.
Твердый материал, связанный с носителем, обрабатывают смесью уксусного ангидрида и 1-метилимидазола.
После прекращения реакции связывания и окисления небольшая часть сухих веществ носителя 5'-ОН-групп (от 0,1 до 1%) остается непрореагировавшей, и ее необходимо окончательно блокировать, например путем ацетилирования, чтобы предотвратить образование олигонуклеотидов с удалением внутренней основы, обычно называемых (n-1) шормерами.
Стадия 6: Расщепление
Расщепление олигонуклеотида из твердого носителя и дезактивацию проводят с использованием концентрированного гидроксида аммония.
Синтез РНК ДНК олигонуклеотидов с фосфоротиоатной иепъю Модифицированные олигонуклеотиды, в которых один из атомов кислорода в фосфодиэфирной цепи заменен атомом серы, синтезируются аналогично общим РНК и ДНК олигонуклеотидам (подробности см. в разделе цикла синтеза). Разница заключается в замене стадии окисления сульфированием.
Синтез ЛНК олигонуклеотидов
Модифицированные олигонуклеотиды, в которых рибоза модифицирована ковалентным мостиком между атомами 2'-O и 4'-С, синтезируют согласно Obika et al. (1997) и Кошкин и др. (1998).
Синтез ПНК олигонуклеотидов
Модифицированные олигонуклеотиды, в которых сахар-фосфатная цепь образована путем повторения N-(2-аминоэтил)-глициновых единиц, взаимно связанных через пептидоподобную связь, синтезируют согласно Nielsen et al. (1991).
Синтез морфолиновых олигонуклеотидов
Модифицированные олигонуклеотиды, в которых нуклеотидная связь связана с морфолиновым кольцом и взаимосвязана с ним через фосфородиамидатную связь, синтезируются в соответствии с Summerton and Weller (1991, 1993b, 1997).
Синтез ГНК олигонуклеотидов
Модифицированные олигонуклеотиды, в которых сахар-фосфатную цепь образуют повторяющиеся гликолевые фрагменты, связанные между собой фосфодиэфирной связью, синтезируют согласно Ueda et al. (1971) и Cook et al. (1995, 1999).
Синтез ТНК олигонуклеотидов
Модифицированные олигонуклеотиды, в которых сахар-фосфатная цепь образована треозой вместо рибозы, синтезируются согласно Chaput and Szostak (2003).
Размер-специфический полимерный связывающий фрагмент. Химический синтез размер-специфического полимерного связывающего фрагмента осуществляют с использованием общих методов органической и полимерной химии, которые позволяют контролировать конечную молекулярную массу и, следовательно, конечную длину полимерной цепи, например, радикальной полимеризации переноса атомов (Matyjaszewski, Xia, 2001). Размер-специфический полимерный связывающий фрагмент может быть бифункциональным фрагментом (т.е. функционально модифицированным на обоих его концах), чтобы обеспечить последующее присоединение к обоим последовательность-специфическим олигонуклеотидам с образованием конечной 5' к 3'-ориентированной конструкции.
Бифункциональный размер-специфический полимерный связывающий фрагмент предпочтительно получают ненуклеотидными полимерами, такими как полиэтиленгликоль (ПЭГ), однако полученная конструкция не ограничивается этим конкретным типом полимерного фрагмента (подробное описание возможных структурных вариантов см. в подробном описании изобретения). ПЭГилирование нуклеотидов и способы получения ПЭГилированных нуклеотидов были описаны ранее Jaschke et al. (1994) и Fischer et al. (2008).
Альтернативно, если размер-специфический полимерный связывающий фрагмент не подвергается прямому синтезу, можно использовать коммерчески доступные полимерные фрагменты, такие как 17-O-ОМТ-гексаэтиленоксид-1-O-фосфорамидит, 8-DMT-O-триэтиленоксид-1 -О-фосфорамидит, 6-ЭМТ-гександиол-1-O-DMT-фосфорамидит или 1,3-пропандиол, фосфорамидит и другие.
Конструкция. Синтез конечной конструкции осуществляют путем последовательной конъюгации размер-специфического полимерного связывающего фрагмента с первым последовательность-специфическим олигонуклеотидом и последующим присоединением полученного прекурсора ко второму последовательность-специфическому олигонуклеотиду, например, с помощью «click» химии (Presolski et al., 2011; Besanceney-webler et al., 2011; Bowman, Hoyle, 2010).
Краткое описание фигур
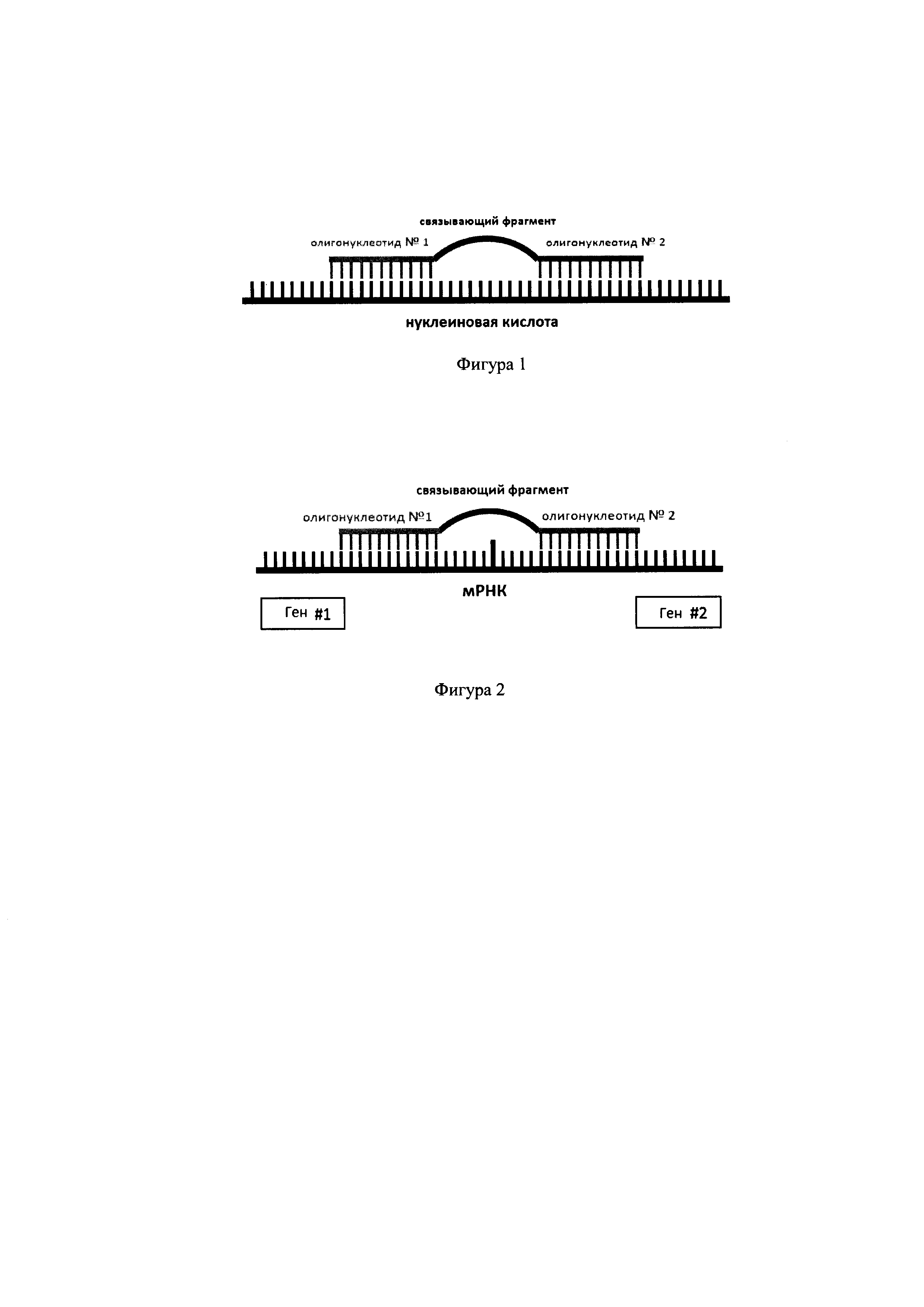
На фигуре 1 показан общий принцип высокоспецифического взаимодействия интерферирующей системы с последовательностью-мишенью нуклеиновой кислоты через два последовательность-специфических олигонуклеотида, взаимно связанных между собой посредством размер-специфического связывающего фрагмента. Предлагаемый принцип универсален и настраивается таким образом, чтобы он обеспечивал целенаправленное соединение любого количества последовательность-специфических олигонуклеотидов (n≥2) посредством соответствующего количества неинтерферирующих размер-специфических полимерных связывающих фрагментов (n≥1).
На фигуре 2 показано высокоспецифическое взаимодействие интерферирующей системы с последовательностями-мишенями слитой мРНК через два последовательность-специфических олигонуклеотида, взаимно связанных между собой посредством размер-специфического полимерного связывающего фрагмента. Каждый из последовательность-специфических олигонуклеотидов связывается с соответствующей последовательностью партнеров по слиянию.
Примеры
Раствор, описанный в настоящем изобретении, можно считать универсально применимым для селективного и специфического распознавания любой нуклеиновой кислоты-мишени, предпочтительно слитой мРНК. В контексте антисмысловых систем, когда нуклеиновая кислота-мишень является слитой мРНК (ее присутствие однозначно характеризует и отличает опухолевые клетки от здоровых), настоящее изобретение обеспечивает селективное распознавание и нацеливание исключительно на опухолевые клетки. Инновация в виде повышенной селективности и специфичности распознавания исключительно нуклеиновой кислоты-мишени, предпочтительно слитой мРНК, позволяет контролировать вмешательство мишеней слитых генов.
Пример 1. Селективное и специфическое распознавание BCR-ABL слитой мРНК при хронической миелогенной лейкемии или Ph+ остром лимфобластном лейкозе или другой неоплазии, где присутствует BCR-ABL слитая РНК, с использованием настоящего изобретения.
Предлагаемая конструкция избирательно и специфически распознает BCR-ABL мРНК таким образом, что первый последовательность-специфический олигонуклеотид нацелен на последовательность BCR, а второй олигонуклеотид нацелен на последовательность ABL, в то время как оба олигонуклеотида взаимно связаны размер-специфическим полимерным связывающим фрагментом. Также возможно применять более двух последовательность-специфических олигонуклеотидов, когда каждый из них нацелен либо на BCR, либо на ABL, где каждый из партнеров по слиянию таргетируется, по меньшей мере, одним олигонуклеотидом. Последовательность-специфические олигонуклеотиды взаимосвязаны через соответствующее количество полимерных связывающих фрагментов. Стабильное, термодинамически и энергетически предпочтительное дополнительное взаимодействие между конструкцией и BCR-ABL мРНК-мишени образуется только в том случае, когда каждая из последовательностей-мишеней полностью распознается и, кроме того, отдалена от другой на определенное расстояние, размер-специфическим полимерным связывающим фрагментом. Таким образом, вероятность стабильного связывания конструкции с частично гомологичными мРНК сводится к минимуму, что предотвращает стабильное вмешательство с непреднамеренными молекулами мРНК. Что касается того факта, что слитая BCR-ABL мРНК присутствует исключительно в опухолевых клетках, описанный принцип распознавания мРНК BCR-ABL приводит к преимущественному и стабильному вмешательству исключительно в опухолевых клетках, таким образом, к селективному распознаванию и таргетированию опухолевых клеток.
Последовательности отдельных последовательность-специфических олигонуклеотидов в конструкции комплементарны последовательностям-мишеням индивидуальных партнеров слияния BCR, ABL. Последовательности-мишени BCR, ABL могут быть необязательно относящимися к первичной последовательности слитой BCR-ABL мРНК, однако в предпочтительном варианте осуществления расстояние последовательностей-мишеней от Точки разрыва сайта слияния составляет не более 100 нуклеотидов, независимо от конкретного варианта BCR-ABL слитой мРНК.

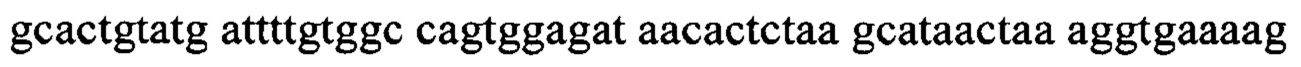
Частичная первичная последовательность слитой BCR-ABL мРНК (GenBank: AJ311467.1); BCR - черный, ABL - серый; последовательности-мишени подчеркнуты.

Пример конструкции, предназначенной для селективного и специфического распознавания BCR-ABL мРНК. Дополнительный олигонуклеотид к BCR (17 нт) и ABL1 (17 нт) показан в черном и сером соответственно.
Аналогично Примеру 1 ниже приведены Примеры 2-7 в сокращенной форме, а также список других слитых мРНК.
Пример 2. Селективное и специфическое распознавание слитой мРНК AML1-ETO при острой миелоидной лейкемии М2 или другой неоплазии, где присутствует слитая мРНК AML1-ETO, с использованием настоящего изобретения.

Частичная первичная последовательность слитой AML1-ETO мРНК (GenBank: S78158.\);AML1- черный, ЕГО - серый; последовательности-мишени подчеркнуты.
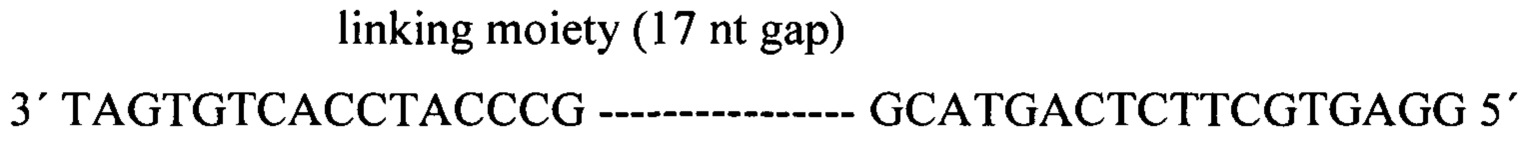
Пример конструкции, предназначенной для селективного и специфического распознавания AML1-ETO мРНК. Дополнительный олигонуклеотид к AML1 (16 нт) и ЕТО (18 нт) показан в черном и сером соответственно.
Пример 3. Селективное и специфическое распознавание CBFB-MYH11 слитой мРНК при острой миелоидной лейкемии М4 или другой неоплазии, где присутствует CBFB-MYH11 слитая мРНК, с использованием настоящего изобретения.
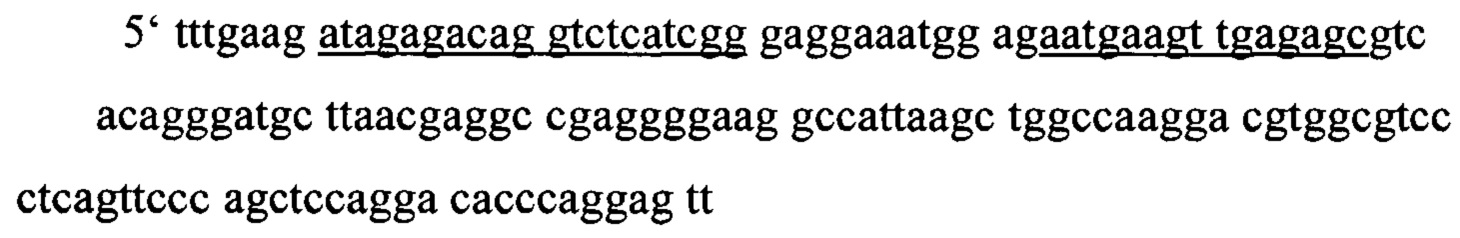
Частичная первичная последовательность слитой CBFB-MYH11 мРНК (GenBank: AF249897.1); CBFB - черный, MYH11 - серый; последовательности-мишени подчеркнуты.
linking moiety (12 nt gap)

Пример конструкции, предназначенной для селективного и специфического распознавания CBFB-MYH11 мРНК. Дополнительный олигонуклеотид к CBFB (20 нт) и MYH11 (15 нт) показан в черном и сером соответственно.
Пример 4. Селективное и специфическое распознавание RBM15-MKL1 слитой мРНК при остром миелоидном лейкозе или другой неоплазии, где присутствует RBM15-MKL1 слита мРНК, с использованием настоящего изобретения.

Частичная первичная последовательность слитой RBM15-MKL1 мРНК (GenBank: AF364035.1); RBM15 - черный, MKL1 - серый; последовательности-мишени подчеркнуты.

Пример конструкции, предназначенной для селективного и специфического распознавания RBM15-MKL1 мРНК. Дополнительный олигонуклеотид к RBM15 (14 нт, 17 нт) и MKL1 (17 нт) показаны в черном и сером соответственно.
Пример 5. Селективное и специфическое распознавание MOZ-CBP слитой мРНК при остром миелоидном лейкозе или другой неоплазии, где присутствует MOZ-CBP слитая мРНК с использованием настоящего изобретения.

Частичная первичная последовательность MOZ-CBP слитой мРНК (GenBank: AJ251844.1); MOZ- черный, СВР - серый; последовательности-мишени подчеркнуты.

Пример конструкции, предназначенной для селективного и специфического распознавания MOZ-CBP мРНК. Дополнительный олигонуклеотид к MOZ (18 нт, 19 нт) и СВР (15 нт) показаны в черном и сером, соответственно.
Пример 6. Селективное и специфическое распознавание TAF2N-TEC слитой мРНК при миксоидной хондросаркоме или другой неоплазии, где присутствует TAF2N-TEC слитая мРНК, с использованием настоящего изобретения.

Частичная первичная последовательность слитой TAF2N-TEC мРНК (GenBank: AJ245932.1); TAF2N - черный, ТЕС - серый; последовательности-мишени подчеркнуты.

Пример конструкции, предназначенной для селективного и специфического распознавания TAF2N-TEC мРНК. Дополнительные олигонуклеотиды к TAF2N (16 нт) и ТЕС (17 нт, 16 нт) показаны соответственно черным и серым.
Пример 7. Селективное и специфическое распознавание BRD4-NUT слитой мРНК при медиастинальной карциноме или другой неоплазии, где присутствует BRD4-NUT слитая мРНК, с использованием настоящего изобретения.

Частичная первичная последовательность слитой BRD4-NUT мРНК (GenBank: AY166680.1); BRD4 - черный, NUT - серый; последовательности-мишени подчеркнуты.

Пример конструкции, предназначенной для селективного и специфического распознавания BRD4-NUT мРНК. Дополнительные олигонуклеотиды к BRD4 (18 нт, 18 нт) и NUT (IS нт, 18 нт) показаны в черном и сером соответственно.
По аналогии, можно селективно и специфически распознавать следующие слитые мРНК:


Другие применения настоящего изобретения демонстрируются в Примерах 8-11.
Пример 8. Селективное и специфическое терапевтическое вмешательство в естественную биологическую функцию любой мРНК, когда после применения настоящего изобретения и изменения функционального состояния распознанной мРНК предотвращается передача генетической информации, кодируемой этой мРНК. Таким образом, прерывается механизм трансляции генетической информации из мРНК в белок, который в случае слитой мРНК, такой как в Примерах 1-7, приводит к прямому подавлению экспрессии обычных слитых онкобелков.
Пример 9. Селективное и специфическое обнаружение любых мРНК и последующая их количественная оценка, когда последовательность-специфические олигонуклеотиды содержат встроенную детектируемую метку, такую как изотоп FITC, RITC, Р32, который после применения настоящего изобретения и изменения функционального состояния распознанной мРНК излучает детектируемый сигнал, соответствующий стабильному гетеродуплексу.
Пример 10. Очистка и сортировка селективно и специфически распознанной мРНК из других нуклеиновых кислот, присутствующих в анализируемом образце, когда применение настоящего изобретения приводит к изменению функционального состояния распознанной мРНК, то есть сформирован стабильный гетеродуплекс с отличной электрофоретической подвижностью. Следовательно, можно выделить распознанные мРНК из других нуклеиновых кислот путем применения внешнего электрического поля. Аналогичным образом посредством целенаправленной модификации последовательность-специфических олигонуклеотидов с первичными антителами можно сортировать распознанную мРНК после применения настоящего изобретения на основе ее взаимодействия со вторичными антителами.
Пример 11. Функциональный анализ отдельных генов, когда первичная структура последовательность-специфических олигонуклеотидов содержит встроенные фотолабильные функциональные группы, обеспечивающие обратимое изменение функционального состояния распознанной мРНК. После применения настоящего изобретения и изменения функционального состояния распознанной мРНК этот эффект можно нивелировать путем применения излучения требуемой длины волны. Таким образом, можно селективно и специфически изучать эффекты подавления экспрессии генов в условиях in situ и in vivo.
Реферат
Предложенная группа изобретений относится к области медицины. Предложена конструкция для связывания последовательностей-мишеней нуклеиновой кислоты, содержащая две комплементарные последовательности олигонуклеотидов длиной до 20 нуклеотидов, отдаленных друг от друга посредством полимерного связующего фрагмента, конечная длина которого составляет от 10 до 100 ангстрем на основе расстояния между нуклеотидами в линейной, полностью удлиненной нуклеиновой кислоте. Предложен раствор для нацеливания на опухолевые клетки, содержащий указанную конструкцию. Предложен способ связывания конструкции с последовательностью-мишенью нуклеиновой кислоты, обеспечивающий избирательное распознавание нуклеиновой кислоты-мишени, включающий контактирование нуклеиновой кислоты-мишени с конструкцией для формирования гетеродуплекса. Предложен способ лечения пациента, страдающего от рака и способ диагностики рака. Предложенная группа изобретений обеспечивает образование стабильного гетеродуплекса и избирательное распознавание нуклеиновой кислоты. 5 н. и 25 з.п. ф-лы, 2 ил., 11 пр.

Комментарии