Путресцин-продуцирующий микроорганизм и способ получения путресцина с использованием указанного микроорганизма - RU2727666C2
Код документа: RU2727666C2
Чертежи

Описание
Область изобретения
Настоящее изобретение относится к путресцин-продуцирующему микроорганизму и способу получения путресцина с использованием указанного микроорганизма.
Предшествующий уровень техники
Известно, что путресцин представляет собой сырье для получения полиамида. До сих пор путресцин получали химическими методами с использованием нефтепродуктов в качестве сырья, и технологии получения путресцина путем ферментирования с использованием технологии генной инженерии и технологии ферментирования в настоящее время находятся на стадии изучения.
Например, известен микроорганизм, способный продуцировать путресцин, в котором были произведены действия с метаболическим путем микроорганизма рода Corynebacterium (KR Публикация заявки на патент No. 2014-0115244, Международная публикация No. WO 2014-148743).
Между тем, формиатдегидрогеназа представляет собой фермент, который восстанавливает NAD+ (то есть, второй субстрат), катализируя окисление муравьиной кислоты, и в результате он продуцирует NADH и СО2. Известно, что NADH представляет собой важное вещество в общем метаболизме микроорганизмов. Это связано с тем, что увеличение количества NADH может приводить к увеличению восстановительной способности у микроорганизмов, что может служить преимуществом для получения целевого вещества.
Способ получения янтарной кислоты и биоспирта в анаэробных условиях путем усиления NADH с использованием формиатдегидрогеназы уже известен. Янтарную кислоту можно получить путем восстановительного ТСА (цикл трикарбоновых кислот) (обратный ТСА) в условиях анаэробной ферментации. Количество NADH в пути восстановительного ТСА напрямую связано с продукцией янтарной кислоты, и два моля NADH расходуется в этом пути от оксалоацетата до янтарной кислоты. В действительности, сообщалось о том, что при получении янтарной кислоты из глюкозы в анаэробных условиях усиление FDH может приводить к увеличению выхода янтарной кислоты на 20% (Appl Environ Microbiol., 2012, 78(9): 3325-3337). Однако в отличие от янтарной кислоты NADH не используется в качестве непосредственного субстрата в пути биосинтеза путресцина, и не сообщалось ни о какой связи между формиатдегидрогеназой и продукцией путресцина.
ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Техническая задача
Авторы настоящего изобретения приложили усилия для повышения продукции путресцина у путресцин-продуцирующего микроорганизма, и, в результате, они подтвердили, что сверхэкспрессия формиатдегидрогеназы может повышать уровни NADH и АТР у путресцин-продуцирующего микроорганизма, и таким образом, продукцию путресцина можно увеличить, завершив посредством этого настоящее изобретение.
Техническое решение
Задача настоящего изобретения заключается в том, чтобы обеспечить путресцин-продуцирующий микроорганизм рода Corynebacterium, у которого активность формиатдегидрогеназы (Fdh) увеличена по сравнению с таковой до модификации.
Задача настоящего изобретения также заключается в том, чтобы обеспечить способ получения путресцина с использованием этого микроорганизма.
Полезные эффекты изобретения
Микроорганизм рода Corynebacterium с увеличенной продуктивностью по путресцину по настоящему изобретению модифицирован таким образом, что активность формиатдегидрогеназы (FDH) может быть увеличена, что приводит к увеличению продукции NADH и АТР. В результате микроорганизм может увеличивать продукцию путресцина, и его можно эффективно использовать для крупномасштабного производства путресцина.
Краткое описание графических материалов
На Фиг. 1 показано изображение геля SDS-PAGE (электрофорез в полиакриламидном геле в присутствии додецилсульфата натрия), иллюстрирующее результаты сверхэкспрессии CbFdh с использованием хозяина Escherichia coli, где на дорожке 1 представлен результат экспрессии белка в клеточном лизате, который экспрессировался в Е. coli BL21 DE3 при 18°С в течение 24 часов; на дорожке 2 представлен результат по растворимому белку, экспрессированному в Е. coli BL21 DE3 при 18°С в течение 24 часов; на дорожке 3 представлен результат экспрессии белка в клеточном лизате, который экспрессировался в Е. coli BL21 DE3 при 30°С в течение 8 часов; на дорожке 4 представлен результат по растворимому белку, экспрессированному в Е. coli BL21 DE3 при 30°С в течение 8 часов; на дорожке 5 представлен результат экспрессии белка в клеточном лизате, который экспрессировался в Е. coli Rosetta DE3 при 18°С в течение 24 часов; на дорожке 6 представлен результат по растворимому белку, экспрессированному в Е. coli Rosetta DE3 при 18°С в течение 24 часов; на дорожке 7 представлен результат экспрессии белка в клеточном лизате, который экспрессировался в Е. coli Rosetta DE3 при 30°С в течение 8 часов, и на дорожке 8 представлен результат по растворимому белку, экспрессированному в Е. coli Rosetta DE3 при 30°С в течение 8 часов.
На Фиг. 2 представлен график, иллюстрирующий количество продуцированного NADH в зависимости от времени. Используемый буфер представлял собой 100 мМ фосфатный буфер (рН 7,2), и используемая контрольная группа представляла собой реакционный образец без растворимого белка. CbFdh представляет собой реакционный образец, содержащий 10% растворимого белка, который представляет собой формиатдегидрогеназу, сверхэкспрессированную при 30°С с использованием Е. coli BL21 DE3. В случае CbFdh было подтверждено, что количество NADH (то есть, продукт реакции CbFdh) продолжало увеличиваться с течением времени. ОП - оптическая плотность.
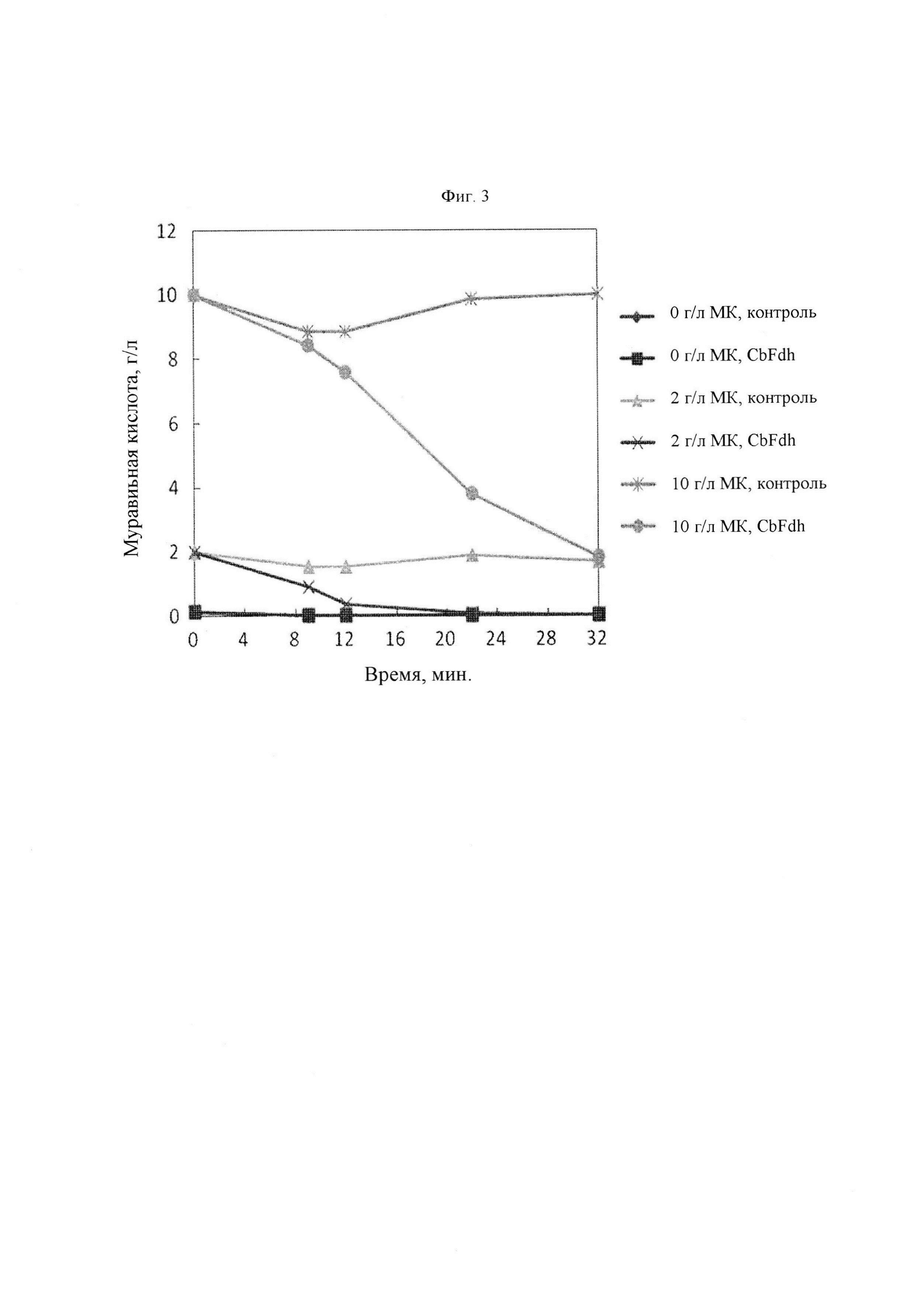
На Фиг. 3 представлен график, иллюстрирующий концентрацию муравьиной кислоты (МК) в зависимости от времени. Контрольная группа представляет собой штамм, представляющий собой микроорганизм Corynebacterium glutamicum, в который был вставлен вектор pSCEC_CJ7. CbFdh представляет собой микроорганизм, в который вставлена плазмида pSCEC_CJ7_CbFdh, способная экспрессировать ген формиатдегидрогеназы, имеющий происхождение из С. boidinii. Муравьиную кислоту в каждой из концентраций 0 г/л, 2 г/л и 10 г/л добавляли в культуральную среду и наблюдали изменения в концентрации муравьиной кислоты между контрольной группой и CbFdh.
Наилучшее воплощение изобретения
Для решения вышеизложенных задач в одном аспекте настоящего изобретения предложен путресцин-продуцирующий микроорганизм рода Corynebacterium, у которого увеличена активность формиатдегидрогеназы.
При использовании здесь термин "формиатдегидрогеназа" (здесь и далее "Fdh") в общем смысле относится к ферменту, который катализирует реакцию окисления с использованием муравьиной кислоты в качестве субстрата и тем самым восстанавливает NAD+ и продуцирует NADH и СО2.
Поскольку аминокислотная последовательность определенного белка, демонстрирующего активность, может варьировать в зависимости от вида или штамма микроорганизма, происхождение последовательностей Fdh не ограничено ими.
В частности, Fdh может быть получен из Ceriporiopsis subvermispora, Methylobacterium extorquens, Methylosinus trichosporium, Cupriavidus oxalaticus, Candida methylica, Methylotrophic bacterium, Ancylobacter aquaticus, Komagataella pastoris, Mycobacterium vaccae, Arabidopsis thaliana и так далее и может быть получен из Corynebacterium glutamicum (Microbiology (2012), 158, 2428-2439), который был недавно раскрыт. В частности, Fdh может быть получен из Candida boidinii, но происхождение Fdh не ограничено этим.
Дополнительно в настоящем изобретении Fdh может включать без ограничения любой белок, который имеет аминокислотную последовательность SEQ ID NO: 10, или любой белок, который будучи белком по существу обладающим активностью Fdh, имеет аминокислотную последовательность, имеющую гомологию с аминокислотной последовательностью SEQ ID NO: 10 по меньшей мере 70%, в частности по меньшей мере 80%, более конкретно по меньшей мере 90%, даже еще более конкретно по меньшей мере 95% и наиболее точно по меньшей мере 99%.
Очевидно, что любая аминокислотная последовательность, которая является такой же как SEQ ID NO: 10 и имеет биологическую активность по существу такую же как белок с SEQ ID NO: 10 или эквивалентную такой активности, может входить в объем настоящего изобретения, даже если аминокислотная последовательность имеет частичную делецию, модификацию, замену или вставку.
Полинуклеотид, кодирующий Fdh по настоящему изобретению, может включать полинуклеотид, имеющий гомологию последовательности с аминокислотной последовательностью SEQ ID NO: 10 по меньшей мере 70%, в частности по меньшей мере 80%, более конкретно по меньшей мере 90%, еще более конкретно по меньшей мере 95% и наиболее конкретно по меньшей мере 99%, при условии что полинуклеотид обладает активностью, подобной таковой Fdh. Например, полинуклеотид может включать нуклеотидную последовательность SEQ ID NO: 9.
Дополнительно полинуклеотид, кодирующий Fdh по настоящему изобретению, может быть гибридизован с нуклеотидной последовательностью SEQ ID NO: 9 или зондом, полученным из нуклеотидной последовательности SEQ ID NO: 9 в жестких условиях, и он может представлять собой модифицированную форму, кодирующую Fdh, которая нормально функционирует.
При использовании здесь термин "гомология" относится к степени идентичности с данной аминокислотной последовательностью или нуклеотидной последовательностью и может быть выражена в процентах. В настоящем изобретении последовательность, гомологичная данной аминокислотной последовательности или нуклеотидной последовательности, обладающая такой же или сходной активностью как данная аминокислотная последовательность или нуклеотидная последовательность, может быть обозначена как "% гомологии". Например, гомология может быть подтверждена с помощью стандартного программного обеспечения для расчета таких параметров как вес выравнивания, идентичность и сходство, в частности BLAST 2.0, или путем сравнения последовательностей в гибридизационных экспериментах по Саузерну в определенных строгих условиях, и определенные строгие условия гибридизации входят в объем технологии и могут быть определены способом, известным специалисту средней квалификации в данной области техники (например J. Sambrook et al., Molecular Cloning, A Laboratory Manual, 2nd Edition, Cold Spring Harbor Laboratory press, Cold Spring Harbor, New York, 1989; F.M. Ausubel et al., Current Protocols in Molecular Biology, John Wiley & Sons, Inc., New York). При использовании здесь термин "строгие условия" относится к условиям, которые разработаны так, чтобы предоставлять возможность специфической гибридизации между полинуклеотидами. Например, эти условия более точно описаны в литературе (например, J. Sambrook et al., supra).
При использовании здесь термин "увеличение активности" обозначает, что активность увеличена по сравнению с эндогенной активностью, которой обладает микроорганизм, или его активностью до модификации. Увеличение активности может включать как введение экзогенного Fdh, так и повышение активности эндогенного Fdh. В частности, увеличение активности может означать, что активность Fdh увеличена, и тем самым путресцин-продуцирующая способность увеличена.
В частности, увеличение активности по настоящему изобретению может быть выполнено следующими способами:
(1) увеличение числа копий полинуклеотида, кодирующего фермент;
(2) модификация последовательности регуляции экспрессии для увеличения экспрессии полинуклеотида;
(3) модификация полинуклеотидной последовательности на хромосоме для повышения активности фермента; и
(4) модификация полинуклеотидной последовательности для повышения ферментативной активности путем комбинации Способов (1)-(3) и так далее, но способы не ограничены этим.
Увеличение числа копий полинуклеотида в Способе (1) может быть выполнено в форме, где полинуклеотид функционально связан с вектором или путем вставки полинуклеотида в хромосому клетки-хозяина, но способ специально не ограничен этим. В частности, увеличение числа копий полинуклеотида может быть выполнено путем введения в клетку-хозяина вектора, с которым полинуклеотид, кодирующий фермент по настоящему изобретению, функционально связан, который может реплицироваться и функционировать независимо от хозяина. Альтернативно, увеличение числа копий полинуклеотида может быть выполнено путем введения в клетку-хозяина вектора, с которым полинуклеотид функционально связан, что позволяет вставить полинуклеотид в хромосому клетки-хозяина, тем самым увеличивая число копий полинуклеотида в хромосоме клетки-хозяина.
Дополнительно в одном аспекте увеличение числа копий может быть выполнено путем введения экзогенного полинуклеотида или полинуклеотида в кодон-оптимизированной модифицированной форме. Введение экзогенной полинуклеотидной последовательности может быть выполнено путем введения в клетку-хозяина экзогенного полинуклеотида, кодирующего фермент, который проявляет такую же активность как фермент или подобную активность. Экзогенный полинуклеотид можно использовать без ограничения независимо от его происхождения или последовательности при условии, что он проявляет такую же активность как вышеописанный фермент или подобную активность. Дополнительно для оптимизированной транскрипции и трансляции экзогенного полинуклеотида в клетке-хозяине его кодон может быть оптимизирован и введен в клетку-хозяина. Введение может быть выполнено специалистом средней квалификации в данной области техники путем выбора подходящего способа трансформации, известного в данной области техники, и экспрессия введенного полинуклеотида в клетке-хозяине может приводить к продуцированию фермента, тем самым увеличивая его активность.
Затем модификация последовательности регуляции экспрессии для увеличения экспрессии полинуклеотида согласно Способу (2) может быть выполнена с помощью индуцирования модификации последовательности регуляции экспрессии путем делеции, вставки, неконсервативной или консервативной замены или их комбинации для дополнительного повышения активности последовательности регуляции экспрессии или путем замены на последовательность нуклеиновой кислоты, имеющей намного более сильную активность, хотя способ специально не ограничен указанными вариантами. Последовательность регуляции экспрессии может включать промотор; последовательность оператора; последовательность, кодирующую участок связывания с рибосомой; последовательности, регулирующие терминацию транскрипции и трансляции, и так далее, но последовательность регуляции экспрессии не ограничена ими.
В частности, вместо исходного промотора сильный гетерологичный промотор может быть присоединен выше по ходу транскрипции от единицы экспрессии полинуклеотида, и примеры сильного промотора могут включать промотор CJ7, промотор lysCP1, промотор EF-Tu, промотор groEL, промотор асеА, промотор асеВ и так далее. Более конкретно, промотор, имеющий происхождение из Corynebacterium (например промотор lysCP1: WO 2009/096689), или промотор CJ7 (Патент Кореи No. 10-0620092 и Международная публикация No. WO 2006/065095) может быть функционально связан с единицей экспрессии полинуклеотида, с тем чтобы повысить уровень экспрессии полинуклеотида, кодирующего фермент, но промотор не ограничен ими.
Более того, модификация полинуклеотидной последовательности на хромосоме согласно Способу (3) может быть выполнена путем индуцирования мутации в последовательности регуляции экспрессии путем делеции, вставки, неконсервативной или консервативной замены в полинуклеотидной последовательности или их комбинации или путем замены последовательности на полинуклеотидную последовательность, модифицированную, с тем чтобы иметь дополнительно повышенную активность, но способ не ограничен указанными вариантами.
Наконец, Способ (4), который относится к модификации для повышения ферментативной активности путем комбинации Способов (1)-(3), может быть выполнен путем применения комбинации по меньшей мере из одного способа из следующих способов: увеличение числа копий полинуклеотида, кодирующего фермент, модификация последовательности регуляции экспрессии для увеличения экспрессии полинуклеотида, модификация полинуклеотидной последовательности на хромосоме и модификация экзогенного полинуклеотида, проявляющего активность фермента, или его модифицированного кодон-оптимизированного полинуклеотида.
При использовании здесь термин "вектор" относится к ДНК-конструкции, содержащую нуклеотидную последовательность полинуклеотида, кодирующего целевой белок, в которой целевой белок функционально связан с подходящей регуляторной последовательностью, так что он может быть экспрессирован у подходящего хозяина. Регуляторная последовательность включает промотор, способный инициировать транскрипцию, любую операторную последовательность для регуляции транскрипции, последовательность, кодирующую подходящий домен для связывания рибосом на мРНК, и последовательность для регуляции терминации транскрипции и трансляции. После трансформации в подходящую клетку-хозяина вектор может быть реплицирован или функционировать независимо от генома хозяина, или сам может быть интегрирован в геном хозяина.
Вектор, используемый в настоящем изобретении, можно специально не ограничивать при условии, что этот вектор способен реплицироваться в клетке-хозяине, и можно использовать любой вектор, известный в данной области техники. Примеры вектора могут включать естественные или рекомбинантные плазмиды, космиды, вирусы и бактериофаги. Например в качестве фагового вектора или космидного вектора могут быть использованы pWE15, М13, MBL3, MBL4, IXII, ASHII, APII, t10, t11, Charon4A, Charon21A и так далее, и в качестве плазмидного вектора могут быть использованы векторы на основе pBR, pUC, pBluescriptII, pGEM, pTZ, pCL, pET и так далее, и в частности могут быть использованы pDZ, pACYC177, pACYC184, pCL, pECCG117, pUC19, pBR322, pMW118, pCC1BAC и так далее.
В одном воплощении полинуклеотид, кодирующий целевой белок в хромосоме, может быть заменен на модифицированный полинуклеотид с помощью вектора для вставки в хромосому. Вставка полинуклеотида в хромосому может быть выполнена любым способом, известным в данной области техники (например, гомологичной рекомбинацией), но способ не ограничен этим.
При использовании здесь термин "трансформация" относится к процессу введения в клетку-хозяина вектора, содержащего полинуклеотид, кодирующий целевой белок, что обеспечивает экспрессию белка, кодируемого полинуклеотидом в клетке-хозяине. Для трансформированного полинуклеотида не имеет значения, введен ли трансформированный полинуклеотид в хромосому клетки-хозяина и локализован в ней, или он локализован вне хромосомы при условии, что он может быть экспрессирован в клетке-хозяине, и оба случая включены. Дополнительно полинуклеотид включает ДНК и РНК, которые кодируют целевой белок. Полинуклеотид может быть введен в любой форме при условии, что он может быть введен в клетку-хозяина и экспрессироваться в ней. Например, полинуклеотид может быть введен в клетку-хозяина в форме экспрессионной кассеты, которая представляет собой генную конструкцию, включающую все необходимые элементы, требуемые для самостоятельной экспрессии. Экспрессионная кассета традиционно может содержать промотор, функционально связанный с полинуклеотидом, сигнал терминации транскрипции, домен связывания с рибосомой и сигнал терминации трансляции. Экспрессионная кассета может быть в форме экспрессионного вектора, способного к саморепликации. Дополнительно, полинуклеотид может, без ограничения, быть введен в клетку-хозяина как есть и функционально связан с последовательностью, необходимой для его экспрессии в клетке-хозяине.
Дополнительно при использовании здесь термин "функционально связан" относится к функциональной связи между промоторной последовательностью, которая инициирует и опосредует транскрипцию полинуклеотида, кодирующего целевой белок по настоящему изобретению, и вышеописанной генной последовательностью.
При использовании здесь термин "путресцин-продуцирующий микроорганизм" или "микроорганизм, обладающий продуктивностью по путресцину" относится к микроорганизму, от природы обладающему путресцин-продуцирующий способностью, или микроорганизму, у которого путресцин-продуцирующая способность предоставлена его родительскому штамму, не обладающему путресцин-продуцирующей способностью.
Путресцин-продуцирующий микроорганизм может представлять собой микроорганизм, обладающий увеличенной продуктивностью по орнитину (то есть, исходному веществу для биосинтеза путресцина), где микроорганизм модифицирован с тем, чтобы иметь более высокие активности ацетилглутаматсинтазы, превращающей глутамат в N-ацетилглутамат, или орнитинацетилтрансферазы (ArgJ), превращающей ацетилорнитин в орнитин, ацетилглутаматкиназы (ArgB), превращающей ацетилглутамат в N-ацетилглутамилфосфат, ацетил-гамма-глутамилфосфатредуктазы (ArgC), превращающей ацетилглутамилфосфат в полуальдегид N-ацетилглутамат, или ацетилорнитинаминотрансферазы (ArgD), превращающей полуальдегид ацетилглутамат в N-ацетилорнитин, по сравнению с их эндогенными активностями с целью усилить путь биосинтеза от глутамата до орнитинглутамата, но специально не ограничиваясь указанными вариантами.
Дополнительно микроорганизм может представлять собой микроорганизм, который модифицирован для инактивации эндогенной активности орнитинкарбамоилтрансферазы (ArgF), вовлеченной в синтез аргинина из орнитина, белка, проявляющего активность экспортера глутамата, и/или ацетилтрансферазы, которая ацетилирует путресцин, и/или модифицирован для введения активности орнитиндекарбоксилазы (ODC).
В частности, орнитинкарбамоилтрансфераза (ArgF), белок, проявляющий активность экспортера глутамата, орнитиндекарбоксилаза (ODC), орнитинацетилтрансфераза (ArgJ), ацетилглутаматкиназа (ArgB), ацетил-гамма-глутамилфосфатредуктаза (ArgC) и ацетилорнитинаминотрансфераза (ArgD) могут в частности включать аминокислотную последовательность, представленную каждой из SEQ ID NO: 11, 12, 13, 14, 15, 16 и 17, или аминокислотную последовательность, обладающую гомологией с вышеуказанными последовательностями, составляющей по меньшей мере 70%, в частности по меньшей мере 80%, более конкретно по меньшей мере 90%, еще более конкретно по меньшей мере 95% и наиболее точно по меньшей мере 99%, но аминокислотные последовательности не ограничены указанными вариантами.
Дополнительно ацетилтрансфераза, которая ацетилирует путресцин, может в частности включать аминокислотную последовательность, представленную SEQ ID NO: 18 или 19, или аминокислотную последовательность, обладающую гомологией с вышеупомянутыми последовательностями, составляющей по меньшей мере 70%, в частности по меньшей мере 80%, более конкретно по меньшей мере 90%, еще более конкретно по меньшей мере 95% и наиболее конкретно по меньшей мере 99%, но аминокислотные последовательности не ограничены этими указанными вариантами.
Дополнительно микроорганизм может представлять собой такой микроорганизм, у которого активность белка, осуществляющего экспорт путресцина, увеличена по сравнению с его эндогенной активностью, но микроорганизм не ограничен этим. Белок, проявляющий активность по экспортированию путресцина, может включать аминокислотную последовательность, представленную в SEQ ID NO: 20 или 21, и аминокислотную последовательность, обладающую гомологией с вышеуказанными последовательностями, составляющую по меньшей мере 70%, в частности по меньшей мере 80%, более конкретно по меньшей мере 90%, еще более конкретно по меньшей мере 95% и наиболее конкретно по меньшей мере 99%, но аминокислотные последовательности не ограничены указанными вариантами.
Между тем, микроорганизм по настоящему изобретению может представлять собой микроорганизм, обладающий продуктивностью по путресцину, и он может включать прокариотические микроорганизмы, экспрессирующие белок Fdh (например, микроорганизмы рода Escherichia, Shigella, Citrobacter, Salmonella, Enterobacter, Yersinia, Klebsiella, Erwinia, Corynebacterium, Brevibacterium, Lactobacillus, Selenomanas, Vibrio, Pseudomonas, Streptomyces, Arcanobacterium, Alcaligenes и так далее.). В частности микроорганизм по настоящему изобретению может представлять собой микроорганизм рода Corynebacterium или рода Escherichia и более конкретно Corynebacterium glutamicum, но указанный микроорганизм не ограничен перечисленными вариантами.
В другом аспекте настоящего изобретения предложено применение микроорганизма Corynebacterium для получения путресцина. Микроорганизм Corynebacterium может представлять собой микроорганизм, у которого активность формиатдегидрогеназы (Fdh) увеличена по сравнению с активностью до его модификации, и применение может заключаться в получении путресцина.
Еще в одном аспекте настоящего изобретения предложен способ получения путресцина, включающий (а) культивирование путресцин-продуцирующего микроорганизма рода Corynebacterium, у которого активность формиатдегидрогеназы (Fdh) увеличена в среде, и (б) выделение путресцина из микроорганизма или из культуральной среды, полученных на стадии (а).
Пояснения по поводу формиатдегидрогеназы и микроорганизма с повышенной продуктивностью по путресцину являются такими как описано выше.
В вышеуказанном способе культивирование микроорганизма рода Corynebacterium может быть выполнено путем известного периодического культивирования, непрерывного культивирования, периодического культивирования с подпиткой и так далее, но способ не ограничен указанными вариантами. В частности для условий культивирования подходящий рН (например, рН от 5 до 9, конкретно рН от 6 до 8 и наиболее конкретно рН 6,8) может быть подведен с использованием основного соединения (например, гидроксида натрия, гидроксида калия или аммиака) или кислотного соединения (например, фосфорной кислоты или серной кислоты), но подведение рН специально не ограничено указанными вариантами. Дополнительно, кислород или кислород-содержащая смесь газов может быть введена в культуру для поддержания аэробных условий. Температуру в культуре можно поддерживать от 20°С до 45°С, конкретно от 25°С до 40°С, и можно культивировать в течение 10-160 часов, но условия культивирования не ограничены указанными вариантами. Продуцированный путресцин может секретироваться в среду или может оставаться в клетках.
Дополнительно в качестве источника углерода для применяемой культуральной среды можно использовать сахара и углеводы (например, глюкозу, сахарозу, лактозу, фруктозу, мальтозу, мелассу, крахмал и целлюлозу), масла и жиры (например, соевое масло, подсолнечное масло, арахисовое масло и кокосовое масло), жирные кислоты (например, пальмитиновую кислоту, стеариновую кислоту и линолевую кислоту), спирты (например, глицерин и этанол), органические кислоты (например, уксусную кислоту) и так далее по отдельности или в комбинации, но источник углерода не ограничен указанными вариантами. В качестве источника азота можно использовать азот-содержащие органические соединения (например, пептон, дрожжевой экстракт, мясной бульон, солодовый экстракт, жидкий кукурузный экстракт, соевую муку и мочевину), неорганические соединения (например, сульфат аммония, хлорид аммония, фосфат аммония, карбонат аммония и нитрат аммония) и так далее по отдельности или в комбинации, но источники азота не ограничены указанными вариантами. В качестве источника фосфора можно использовать дигидрофосфат калия, гидроортофосфат калия, соответствующие им натрий-содержащие соли и так далее по отдельности или в комбинации, но источники фосфора не ограничены указанными вариантами. Дополнительно незаменимые стимулирующие рост вещества, такие как соли металлов (например, сульфат магния и сульфат железа), аминокислоты и витамины могут содержаться в культуральной среде.
В отношении выделения путресцина, продуцируемого во время культивирования по настоящему изобретению, желаемые аминокислоты можно собирать из культуральной жидкости подходящим способом, известным в данной области техники (например центрифугированием, фильтрованием, анионообменной хроматографией, кристаллизацией, ВЭЖХ (Высокоэффективная жидкостная хроматография) и так далее), и путресцин можно выделять из культуральной среды или микроорганизма с помощью подходящего способа, известного в данной области техники.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Здесь и далее настоящее изобретение будет описано более подробно со ссылкой на следующие Примеры. Однако эти Примеры предназначены исключительно для иллюстративных целей, и объем изобретения не ограничен этими Примерами.
Пример 1: Экспрессия CbFdh в Е. coli и оценка реакционной способности
1) Экспрессия гена CbFdh в Е. coli
Для сверхэкспрессии формиатдегидрогеназы Candida boidinii (CbFdh) в Е. coli культивировали штамм Candida boidinii КСТС17776 и получали его геномную ДНК. Ген формиатдегидрогеназы (CbFdh) (SEQ ID NO: 9) вставляли в вектор рЕТ28а с использованием праймеров SEQ ID NO: 1 и 2.
Более точно, ПЦР проводили в следующих условиях: 30 циклов, каждый из которых состоял из денатурации при 95°С в течение 30 секунд, отжига при 55°С в течение 30 секунд и удлинения цепи при 72°С в течение 1 минуты. Продукт ПЦР подвергали электрофорезу в 1,0% агарозном геле и полосу 1,1 т.н. элюировали и очищали. Образец, содержащий раствор очищенного продукта ПЦР и вектора рЕТ28а, обрабатывали ферментами рестрикции, NcoI и XhoI при 37°С в течение 4 часов, подвергали электрофорезу в 1,5% агарозном геле и каждый из фрагментов нуклеиновой кислоты, по размеру соответствующий CbFdh и вектору, вырезали и получали очищенные фрагменты нуклеиновой кислоты с использованием набора Gel prep (GeneAll, Korea). Фрагмент-CbFdh и фрагмент-вектор, каждый в количестве 1 мг, лигировали с использованием лигазы Т4 и с помощью электропорации вводили в штамм DH5α Е. coli при 2500 В. Штамм, полученный после электропорации, высевали на чашку со средой LB, содержащей спектиномицин (50 мкг/л), культивировали в течение ночи при 37°С в течение одних суток, и затем отбирали устойчивые штаммы. Полученный штамм высевали на чашку со средой LB, содержащей канамицин (50 мкг/л), культивировали в течение ночи при 37°С в течение одних суток и отбирали устойчивые штаммы. Выбранные штаммы подвергали ПЦР в таких же условиях как описано выше с использованием промотора Т7 и праймеров SEQ ID NO: 3 и 4 для терминаторной последовательности, подвергали электрофорезу в 1,0% агарозном геле и вставку CbFdh подтверждали путем наблюдения полосы 1,3 т.н.
Штамм, у которого вставка CbFdh была подтверждена, культивировали в среде LB (3 мл) при 37°С в течение 12 часов после добавления в нее ампициллина (50 мг/мл). Культивированный штамм добавляли в среду LB (50 мл), содержащую антибиотик, и культивировали при 37°С. Когда поглощение при 600 нм достигало 0,8, в культуральную среду добавляли 0,2 мМ IPTG (изопропилтиогалактозид) и индуцировали экспрессию в условиях различных температур/времени. Культивированный штамм промывали и клетки лизировали с помощью ультразвукового гомогенизатора. После лизиса клеток, сверхэкспрессия CbFdh (41 кДа, SEQ ID NO: 10) была подтверждена по результатам электрофореза в геле SDS-PAGE (Фиг. 1).
2) Оценка активности экспрессированного гена CbFdh
Для оценки активности CbFdh в качестве реакционного буфера использовали 100 мМ фосфатный буфер (рН 7,2). Раствор, который был приготовлен путем добавления 10 мМ NAD+ и 0,1% формиата натрия к буферу, использовали в качестве контрольной группы. Между тем, лизат клеток, в которых сверхэкспрессия CbFdh была подтверждена в Примере 1-1, добавляли к контрольной группе до концентрации 10% и оценивали активность CbFdh. Изменения показателей реакционного раствора подтверждали при длине волны 339 нм с использованием считывателя 96-луночных планшетов. Известно, что NADH селективно поглощает свет с длиной волны 340 нм.
В результате было подтверждено, что NADH непрерывно продуцировался в течение нескольких минут (Фиг. 2). С помощью этого Примера было оценено, что CbFdh может сверхэкспрессироваться в Е. coli, и что экспрессированный белок обладает своей уникальной активностью.
Пример 2: Получение микроорганизма Corynebacterium, экспрессирующего CbFdh
Затем авторы изобретения поставили задачу подтвердить, можно ли увеличить путресцин-продуцирующую способность путем усиления функции CbFdh у путресцин-продуцирующего микроорганизма рода Corynebacterium. Для того, чтобы экспрессировать CbFdh в микроорганизме рода Corynebacterium и подтвердить его активность, в область выше от инициирующего кодона гена CbFdh ввели промотор CJ7 (КССМ10617, Патент Кореи No. 10-0620092).
Сначала проводили ПЦР с использованием геномной ДНК Corynebacterium glutamicum АТСС13032 в качестве матрицы вместе с парой праймеров SEQ ID NO: 5 и 6 так чтобы получить ген, включающий последовательность промотора CJ7. ПЦР проводили в следующих условиях: 30 циклов, каждый из которых состоял из денатурации при 95°С в течение 30 секунд, отжига при 55°С в течение 30 секунд и удлинения цепи при 72°С в течение 30 секунд. Электрофорез проводили в 1,5% агарозном геле, и было подтверждено присутствие нуклеиновой кислоты как продукта ПЦР размером 400 пар нуклеотидов (п.н.). Очищенный фрагмент нуклеиновой кислоты промотора CJ7 отделяли от полученного продукта ПЦР с использованием набора PCR prep (GeneAll, Korea). Образец, содержащий раствор очищенного фрагмента нуклеиновой кислоты промотора CJ7 и вектора pSCEC, обрабатывали ферментами рестрикции, BamHI и XbaI при 37°С в течение 4 часов, подвергали электрофорезу в 1,5% агарозном геле и фрагменты нуклеиновой кислоты размером 400 п. н. вырезали и фрагмент промотора CJ7 и фрагменты нуклеиновой кислоты вектора pSCEC получали с использованием набора Gel prep (GeneAll, Korea). Фрагмент промотора CJ7 и вектора pSCEC, каждый в количестве 1 мг, лигировали с использованием лигазы Т4 и с помощью электропорации вводили в штамм DH5a Е. coli при 2500 В. Штамм, полученный после электропорации, высевали на чашку со средой LB, содержащей спектиномицин (50 мкг/л), культивировали в течение ночи при 37°С в течение одних суток, и из них были выбраны 18 различных типов устойчивых штаммов. Выбранные 18 различных типов штаммов подвергали ПЦР для отбора колоний с использованием праймеров SEQ ID NO: 5 и 6, и было подтверждено присутствие продукта ПЦР размером 400 п. н. По результатам ПЦР для отбора колоний было подтверждено получение pSCEC_CJ7, имеющего промотор CJ7.
В таких же условиях для получения продукта ПЦР CbFdh как в Примере 1 был получен продукт ПЦР CbFdh, который может быть вставлен в pSCEC_CJ7 с использованием праймеров SEQ ID NO: 7 и 8. pSCEC_CJ7, который был обработан ферментами рестрикции (XbaI и SalI), и продукт ПЦР CbFdh лигировали и затем вставляли в DH5a Е. coli. pSCEC_CJ7_CbFdh получали из выбранных штаммов и вводили электропорацией в путресцин-продуцирующие микроорганизмы рода Corynebacterium (то есть, КССМ11240Р (Публикация заявки на патент KR No. 2013-0082478) и КССМ11401Р (Публикация заявки на патент KR No. 2014-0017243)) при 2500 В.
Штаммы, полученные электропорацией, культивировали путем посева на чашки со средой BHIS (сердечно-мозговая вытяжка 37 г/л, сорбит 91 г/л и агар 2%), содержащей спектиномицин (50 мкг/л) и таким образом получали колонии. Выбранные штаммы культивировали в инкубаторе-встяхивателе в среде СМ (глюкоза 10 г/л, полипептон 10 г/л, дрожжевой экстракт 5 г/л, мясной экстракт 5 г/л, NaCl 2,5 г/л и мочевина 2 г/л (рН 6,8)), содержащей спектиномицин (50 мкг/л), и таким образом проводили их окончательный отбор. Штамм КССМ11240Р, в который вставлен pSCEC_CJ7_CbFdh, получил название KCCM11240P/pSCEC_CJ7_CbFdh (СС04-0081), и КССМ11240Р, в который вставлен pSCEC_CJ7, получил название KCCM11240P/pSCEC_CJ7. Подобным образом, штамм КССМ11401Р, в который вставлен pSCEC_CJ7_CbFdh, получил название KCCM11401P/pSCEC_CJ7_CbFdh, и штамм КССМ11401Р, в который вставлен pSCEC_CJ7, получил название KCCM11401P/pSCEC_CJ7.
Из них штамм СС04-0081 был депонирован в Корейском Центре Культур Микроорганизмов (КССМ), который представляет собой международный орган депонирования в соответствии с Будапештским договором, 8 января 2016 года (No. доступа КССМ 11798Р).
Пример 3: Оценка активности CbFdh у микроорганизма Corynebacterium
Для подтверждения активности формиат-декарбоксилазы у микроорганизма рода Corynebacterium, в который вставлен CbFdh, анализировали изменения концентрации муравьиной кислоты в среде, куда была добавлена муравьиная кислота (Фиг. 3). Муравьиную кислоту в каждой из концентраций 0 г/л, 2 г/л и 10 г/л добавляли в культуральный бульон штамма Corynebacterium с повышенной активностью CbFdh и культуральный бульон штамма Corynebacterium, которому был вставлен пустой вектор. В качестве штамма с повышенной активностью CbFdh и штамма с пустым вектором использовали KCCM11240P/pSCEC_CJ7_CbFdh и KCCM11240P/pSCEC_CJ7, соответственно.
В результате культивирования было подтверждено, что в случае штамма с пустым вектором муравьиная кислота оставалась в культуральном бульоне, когда муравьиную кислоту добавляли в культуральный бульон в каждой из концентраций, 2 г/л и 10 г/л. Напротив, в случае штамма с повышенной активностью CbFdh муравьиная кислота, добавленная в концентрации 2 г/л, полностью расщеплялась в течение 24 часов, и дополнительно, муравьиная кислота, добавленная в концентрации 10 г/л не полностью расщеплялась в течение 32 часов, но уровень муравьиной кислоты продолжал снижаться. По сравнению со штаммом контрольной группы в момент времени 32 часа было подтверждено, что примерно 80% муравьиной кислоты было преобразовано.
При анализе изменений количества муравьиной кислоты было подтверждено, что штамм с повышенной активностью CbFdh расщепляет муравьиную кислоту. В результате было подтверждено, что CbFdh, введенный в микроорганизм рода Corynebacterium, нормально экспрессировался и его функция поддерживалась.
Пример 4: Оценка продуктивности путресцин-продуцирующего микроорганизма Corynebacterium с повышенной активностью CbFdh
Каждый из четырех типов модифицированных штаммов Corynebacterium glutamicum (то есть, KCCM11240P/pSCEC_CJ7_CbFdh, KCCM11240P/pSCEC_CJ7, KCCM11401P/pSCEC_CJ7_CbFdh и KCCM11401P/pSCEC_CJ7), полученных для оценки продуктивности путресцин-продуцирующего микроорганизма Corynebacterium с повышенной активностью CbFdh, распределяли по чашке со средой СМ (глюкоза (1%), полипептон (1%), дрожжевой экстракт (0,5%), мясной экстракт (0,5%), NaCl (0,25%), мочевина (0,2%), 50% NaOH (100 мкл), спектиномицин (50 мкг), агар (2%), рН 6,8 в расчете на 1 л), содержащей аргинин (1 мМ), и культивировали при 30°С в течение 24 часов. Платиновую петлю каждого из культивированных штаммов инокулировали в 25 мл среды для титрования (глюкоза (8%), соевый белок (0,25%), твердая фракция кукурузного экстракта (0,50%), (NH4)2SO4 (4%), KH2PO4 (0,1%), MgSO4⋅7H2O (0,05%), мочевина (0,15%), биотин (100 мкг), тиамин⋅HCl (3мг), кальций-пантотеновая кислота (3 мг), никотинамид (3 мг), СаСО3 5%, спектиномицин (50 мкг) в расчете на 1 л) и затем культивировали в инкубаторе-встряхивателе при 30°С при 200 об./мин. в течение 98 часов в случае штаммов KCCM11240P/pSCEC_CJ7_CbFdh и KCCM11240P/pSCEC_CJ7 и 104 часов в случае штаммов KCCM11401P/pSCEC_CJ7_CbFdh и KCCM11401P/pSCEC_CJ7.
Концентрации путресцина, продуцированного каждым продуктом культивирования, измеряли, и результаты показаны в Таблице 1 ниже.

Концентрацию путресцина в культуре анализировали путем ВЭЖХ. Как показано в Таблице 1 выше в случае штамма KCCM11240P/pSCEC_CJ7 не наблюдали существенного изменения в величине продукции путресцина в зависимости от присутствия/отсутствия муравьиной кислоты (5 г/л). Напротив, штамм, в который был введен KCCM11240P/pSCEC_CJ7_CbFdh, демонстрировал увеличение величины продукции путресцина более чем на 7% по сравнению с величиной продукции штаммом KCCM11240P/pSCEC_CJ7 независимо от присутствия/отсутствия муравьиной кислоты (5 г/л). Было подтверждено, что величина продукции путресцина штамма, у которого активность Fdh была повышена, была увеличена независимо от присутствия/отсутствия муравьиной кислоты.
Дополнительно, в случае штамма KCCM11401P/pSCEC_CJ7, который оценивали в той же среде без добавления муравьиной кислоты, количество продуцированного путресцина составило 11,4 г/л, и у штамма KCCM11401P/pSCEC_CJ7, культивированного в среде, куда была добавлена муравьиная кислота (5 г/л), выход был меньше примерно на 6% (10,7 г/л). Напротив, в случае штамма KCCM1140lP/pSCEC_CJ7_CbFdh, у которого активность CbFdh была повышена, было произведено такое же количество путресцина (12,0 г/л) независимо от присутствия/отсутствия муравьиной кислоты.
В результате анализа продукции путресцина штаммом KCCM11401P/pSCEC_CJ7_CbFdh и штаммом KCCM11401P/pSCEC_CJ7 было подтверждено, что штамм, у которого активность CbFdh была повышена, демонстрировал увеличение продукции путресцина по меньшей мере на 5% по сравнению со штаммом KCCM11401P/pSCEC_CJ7. Было подтверждено, что штамм, где активность CbFdh была повышена, демонстрировал увеличение продуктивности по путресцину независимо от присутствия/отсутствия муравьиной кислоты.
Суммируя вышеизложенные результаты, можно заключить, что было подтверждено, что штамм, представляющий собой путресцин-продуцирующий микроорганизм, в который была введена формиатдегидрогеназа (CbFdh), демонстрировал дополнительное увеличение величины продукции путресцина, и этот эффект проявляется независимо от добавления муравьиной кислоты. Дополнительно, ожидается, что настоящее изобретение предоставит возможность эффективной продукции путресцина в крупном масштабе.
На основании вышеизложенного специалист в области техники, к которой принадлежит данное изобретение, понимает, что настоящее изобретение может быть воплощено в других конкретных формах без изменения технических идей или существенных признаков настоящего изобретения. В этом отношении примеры воплощений, раскрытые здесь, служат исключительно для иллюстративных целей и не предназначены ограничивать объем настоящего изобретения. Наоборот, настоящее изобретение предназначено охватывать не только воплощения, представленные в примерах, но также могут быть включены различные альтернативные, модифицированные, эквивалентные и другие воплощения, сохраняющие идею и входящие в объем настоящего изобретения, как определено в прилагаемой формуле.
Реферат
Группа изобретений относится к путресцин-продуцирующему микроорганизму и способу получения путресцина с использованием указанного микроорганизма. Предложен путресцин-продуцирующий микроорганизм рода Corynebacterium, у которого активность формиатдегидрогеназы (Fdh) увеличена по сравнению с активностью до модификации. Также предложен способ получения путресцина, включающий культивирование вышеуказанного микроорганизма в среде и выделение путресцина из микроорганизма или из культуральной среды. Группа изобретений обеспечивает увеличение продукции путресцина. 2 н. и 8 з.п. ф-лы, 3 ил., 1 табл., 4 пр.
Формула
Документы, цитированные в отчёте о поиске
Микроорганизмы для получения путресцина и способ получения путресцина с их использованием

Комментарии