Микроорганизм рода escherichia, обладающий продуктивностью по l-триптофану, и способ получения l-триптофана с его использованием - RU2711981C2
Код документа: RU2711981C2
Описание
Область изобретения
Настоящее изобретение относится к микроорганизму рода Escherichia, продуцирующему L-триптофан, у которого активность фосфатазы модифицирована с инактивацией, и способу получения L-триптофана с использованием этого микроорганизма.
Предшествующий уровень техники
L-триптофан, который представляет собой незаменимую аминокислоту, широко применяется в качестве исходного материала для фармацевтических продуктов, таких как пищевые добавки, растворы для инфузий и так далее, и широко используется в качестве компонента здорового питания и так далее. L-триптофан может быть получен способом химического синтеза, способом ферментативной реакции, способом ферментации и так далее, но в настоящее время используется главным образом способ прямой ферментации с использованием микроорганизма.
Микроорганизм имеет путь биосинтеза ароматических соединений, в котором фосфоенолпируват (PEP), который представляет собой промежуточное соединение в гликолизе, и эритрозо-4-фосфат (Е4Р), который представляет собой продукт пентозофосфатного пути, инициируют полимеризацию 3-дезокси-D-арабиногептулозонат-7-фосфат (DAHP) синтазой (ЕС 2.5.1.54). В вышеуказанном пути каждый из PEP и Е4Р конъюгирован с фосфатом, и они представляют собой вещества, обладающие высокой энергией. Более того, в последующем пути биосинтеза ароматических соединений PEP вовлечен в реакцию, которая происходит под действием 5-енолпирувилшикимат-3-фосфат (EPSP) синтазы (ЕС 2.5.1.19), и PRPP используется в реакции антранилатфосфорибозилтрансферазы. Соответственно, известно, что для биосинтеза триптофана требуется большое количество высокоэнергетических веществ. В более ранних исследованиях путем внутриклеточного количественного анализа было показано, что из 20 аминокислот самый высокий уровень энергии требуется для биосинтеза триптофана (Proc. Natl. Acad. Sci. USA, (2002) V99, pp 3695-3700). Следовательно, можно сделать вывод о том, что PEP и Е4Р играют важную роль у штаммов, продуцирующих триптофан в высокой концентрации в зависимости от непрерывного поступления предшественников и эффективного использования энергии.
Соответственно, для стабильного поступления Е4Р чаще всего использовали способ увеличения биосинтеза путем усиления экспрессии генов tktA (ID гена в NCBI: 12931960), которые кодируют транскетолазу (ЕС 2.2.1.1) (Current Opinion in Biotechnology, (2009) V20, pp 651-658). Кроме того, многочисленные исследования по уменьшению использования АТР (аденозинтрифосфат), который представляет собой высокоэнергетическое вещество, проводятся с целью поддержания внутриклеточного уровня энергии (FEMS Microbiol Lett, (2009) V297, рр 217-224). Однако, все еще сохраняется потребность в разработке способа получения L-триптофана с высокой эффективностью.
Раскрытие изобретения
Техническая задача
Авторы настоящего изобретения провели интенсивную исследовательскую работу для разработки способа эффективного получения L-триптофана. В результате авторы настоящего изобретения разработали способ сохранения энергии, которая затрачивается без необходимости, при одновременном поддержании концентрации Е4Р в клетках путем предупреждения расщепления Е4Р, синтезированного в триптофан-продуцирующих штаммах, и подтвердили, что продуктивность по L-триптофану улучшилась, тем самым осуществляя настоящее изобретение.
Техническое решение
Задача настоящего изобретения заключается в том, чтобы предложить микроорганизм рода Escherichia, продуцирующий L-триптофан.
Другая задача настоящего изобретения заключается в том, чтобы предложить способ получения L-триптофана с использованием микроорганизма, продуцирующего L-триптофан.
Полезные эффекты изобретения
В настоящем изобретении предложен микроорганизм рода Escherichia, продуцирующий L-триптофан, у которого активность фосфатазы, содержащей аминокислотную последовательность SEQ ID NO: 1, модифицирована с инактивацией, и в связи с этим показан эффект, состоящий в том, что L-триптофан может быть получен с высоким выходом, эффективно и экономично с использованием вышеописанного микроорганизма. Полученный с его помощью L-триптофан можно применять не только в кормах для животных или кормовых добавках, но также в различных продуктах, таких как пищевые продукты или пищевые добавки для человека, лекарственные средства и так далее.
Наилучшее воплощение изобретения
Задача настоящего изобретения заключается в том, чтобы предложить микроорганизм рода Escherichia, продуцирующий L-триптофан.
Другая задача настоящего изобретения заключается в том, чтобы предложить способ получения L-триптофана с использованием микроорганизма, продуцирующего L-триптофан.
Решение задачи
Для решения вышеизложенной задачи в одном аспекте настоящего изобретения предложен микроорганизм рода Escherichia, продуцирующий L-триптофан, у которого активность фосфатазы, содержащей аминокислотную последовательность SEQ ID NO: 1, модифицирована с инактивацией. Например, микроорганизм рода Escherichia, продуцирующий L-триптофан, может представлять собой микроорганизм, у которого продуктивность по L-триптофану увеличена по сравнению с микроорганизмом рода Escherichia, продуцирующим L-триптофан, у которого эндогенная активность фосфатазы не модифицирована с инактивацией.
Как его используют здесь, термин "L-триптофан" относится к ароматической L-аминокислоте, которая представляет собой α-аминокислоту и является незаменимой аминокислотой, не синтезируемой in vivo, имеющей химическую формулу C11H12N2O2. Для увеличения продуктивности микроорганизма по L-триптофану традиционно использовали: способ непрерывного восполнения предшественника, то есть эритрозо-4-фосфата (Е4Р), у триптофан-продуцирующих штаммов; усиление экспрессии генов tktA для эффективного использования энергии; усиление биосинтеза путем блокирования боковых ветвей пути биосинтеза; или использование меньшего количества АТР, и другие.
Как его используют здесь, термин "фосфатаза" может относиться к белку, который катализирует реакцию удаления фосфатной группы из субстрата. Фосфатаза по настоящему изобретению, которая имеет аминокислотную последовательность SEQ ID NO: 1, представляет собой белок, кодируемый геном yidA. Дополнительно, эта фосфатаза обозначена как фосфатаза фосфосахара (phosphosugar phosphatase) (ID гена в NCBI: 12933583) в базе данных NCBI (http://www.ncbi.nlm.nih.gov), и также она обозначена как сахарная фосфатаза (sugar-phosphatase) в базе данных ЕсоСус (http://www.ecocyc.org). Этот белок катализирует расщепление субстратов-фосфосахаров до cахаров и фосфорных кислот. Однако, взаимосвязь между описываемым таким образом ферментом и усилением продукции триптофана не была выяснена.
Фермент, описанный выше, может без ограничений включать помимо аминокислотной последовательности, представленной в SEQ ID NO: 1, любую аминокислотную последовательность, которая имеет гомологию 70% или больше, в частности 80% или больше, более конкретно 90% или больше, еще более конкретно 95% или больше, даже еще более конкретно 98% или больше, и даже еще более конкретно 99% или больше, с вышеупомянутой аминокислотной последовательностью, при условии, что фермент проявляет по существу такое же или соответствующее действие, как у вышеупомянутого фермента. Кроме того, очевидно, что вариант фермента, имеющий аминокислотную последовательность с частичной делецией, модификацией, заменой или вставкой, также входит в объем настоящего изобретения при условии, что аминокислотная последовательность имеет гомологию, описанную выше, и проявляет действие, соответствующее каждому ферменту.
Гены, кодирующие фосфатазу, имеющую аминокислотную последовательность SEQ ID NO: 1, могут быть включены без ограничения при условии, что они имеют последовательность, способную кодировать вышеупомянутый фермент, и могут быть представлены как гены yidA. В частности, гены, кодирующие фермент, также могут включать без ограничения, в дополнение к нуклеотидной последовательности, представленной в SEQ ID NO: 2, любую последовательность гена, кодирующую фермент, которая имеет гомологию 80% или больше, в частности 90% или больше, более конкретно 95% или больше, еще более конкретно 98% или больше, и даже еще более конкретно 99% или больше, с вышеупомянутой нуклеотидной последовательностью, при условии, что эта последовательность гена кодирует фермент, который проявляет по существу такое же или соответствующее действие, как и вышеупомянутый фермент. Кроме того, очевидно, что любая нуклеотидная последовательность, которая имеет гомологию, описанную выше, может входить в объем настоящего изобретения, несмотря на то, что нуклеотидная последовательность может иметь частичную делецию, модификацию, замену или вставку.
Как его используют здесь, термин "гомология" относится к проценту идентичности между двумя полинуклеотидными или полипептидными группировками. Соответствие последовательности одной группировки последовательности другой можно определить методом, известным в данной области техники. Например, гомологию можно определить путем прямого выравнивания последовательностей (например по таким параметрам как сумма баллов (score), идентичность и сходство) двух полинуклеотидных молекул или двух полипептидных молекул с помощью компьютерной программы (например, BLAST 2.0), которая является легкодоступной и способна выравнивать информацию о последовательностях. Дополнительно гомологию между полинуклеотидами можно определить путем гибридизации полинуклеотидов в условиях образования стабильной двойной цепи в гомологичных участках и последующего расщепления гибридизованной цепи нуклеазой, специфичной к одноцепочечной нуклеиновой кислоте для определения размера расщепленных фрагментов.
Как его используют здесь, термин "эндогенная активность" относится к активному состоянию фермента в микроорганизме в природном состоянии или до модификации.
Как его используют здесь, термин "модифицированный с инактивацией" относится к случаю, когда ген, кодирующий фермент, совсем не экспрессируется, и/или к случаю, когда ген экспрессируется, но не проявляет активность, или его активность снижена по сравнению с таковой нативного штамма или штамма до модификации.
Инактивация активности фермента по сравнению с его эндогенной активностью относится к случаю, когда у микроорганизма активность фермента отсутствует или его активность снижена по сравнению с таковой, которой он обладал исходно в своем природном состоянии или до модификации.
Снижение активности относится к концепции, включающей случай, когда активность самого фермента ниже, чем активность фермента, который изначально присутствовал у микроорганизма, вследствие модификации гена, кодирующего фермент; случай, когда уровень общей ферментативной активности в клетке ниже, чем таковой у природного штамма или таковой у штамма до модификации вследствие ингибирования экспрессии или ингибирования трансляции гена, кодирующего этот фермент, или комбинацию обоих случаев.
Способ модификации такой ферментативной активности с инактивацией может быть достигнут различными хорошо известными в данной области техники способами. Примеры таких способов могут включать способ замены гена, кодирующего фермент, на хромосоме на ген, мутированный таким образом, что ферментативная активность может быть снижена, включая случай, когда ферментативная активность устранена; способ частичной или полной делеции гена, кодирующего фермент; способ замены последовательности контроля экспрессии гена, кодирующего фермент, на последовательность, имеющую слабую активность или не имеющую активности; способ введения модификации в последовательность контроля экспрессии гена, кодирующего фермент, на хромосоме; способ частичной или полной делеции гена, кодирующего фермент, на хромосоме; способ введения антисмыслового олигонуклеотида (например антисмысловой РНК), который ингибирует трансляцию с мРНК в фермент путем комплементарного связывания с транскриптом гена на хромосоме; способ исключения возможности присоединения к рибосоме путем образования вторичной структуры вследствие искусственного добавления последовательности Шайна-Дальгарно (SD) и комплементарной ей последовательности на переднем конце SD-последовательности гена, кодирующего фермент; способ с использованием технологии обратной транскрипции (RTE), с помощью которого добавляют промотор для обратной транскрипции на 3'-конец открытой рамки считывания (ORF) соответствующей последовательности, и так далее, и также может включать их комбинацию, но специально не ограничиваясь этим.
В частности, способ частичной или полной делеции гена, кодирующего фермент, может быть выполнен путем замены полинуклеотида, кодирующего эндогенный белок-мишень в хромосоме, на полинуклеотид или маркерный ген, имеющий частичную делецию в последовательности нуклеиновой кислоты, с использованием вектора для вставки в хромосому бактерии. В примере воплощения способа частичной или полной делеции гена можно использовать способ делеции гена путем гомологичной рекомбинации.
Как его используют здесь, термин "часть", несмотря на то что она может варьировать в зависимости от типов полинуклеотидов, может конкретно относиться к последовательности от 1 нуклеотида до 300 нуклеотидов, более конкретно от 1 нуклеотида до 100 нуклеотидов и еще более конкретно от 1 нуклеотида до 50 нуклеотидов, но специально не ограничиваясь этим.
Как его используют здесь, термин "гомологичная рекомбинация" относится к генетической рекомбинации, которая происходит путем кроссинговера по локусам генетической цепи (genetic chain loci), имеющим взаимную гомологию.
В частности, способ модификации последовательности контроля экспрессии можно выполнять путем индукции модификации последовательности контроля экспрессии путем делеции, вставки, неконсервативной или консервативной замены или их комбинации в последовательности нуклеиновой кислоты последовательности контроля экспрессии; или путем замены на более слабый промотор и так далее. Последовательность контроля экспрессии может включать последовательность промотора, оператора, последовательность, кодирующую участок связывания с рибосомой, и последовательности, контролирующие терминацию транскрипции и трансляции.
Кроме того, способ модификации последовательности гена на хромосоме можно выполнять путем индукции модификации в последовательности путем делеции, вставки, неконсервативной или консервативной замены или их комбинации в последовательности гена для дополнительного ослабления ферментативной активности; или путем замены на последовательность гена, которая была улучшена с целью ослабления активности, или последовательность гена, которая была улучшена с целью устранения активности.
В соответствии с примером воплощения настоящего изобретения для инактивации эндогенной активности фосфатазы, имеющей аминокислотную последовательность SEQ ID NO: 1, было обнаружено, что продуктивность по L-триптофану у различных Escherichia coli, продуцирующих L-триптофан, у которых ген yidA, кодирующий фосфатазу, делетирован, увеличивалась по сравнению с родительскими штаммами, у которых yidA не делетирован. Следовательно, было подтверждено, что микроорганизм рода Escherichia, продуцирующий L-триптофан, у которого эндогенная активность фосфатазы модифицирована с инактивацией, обладала способностью эффективно продуцировать L-триптофан.
В настоящем изобретении микроорганизм, продуцирующий L-триптофан, относится к микроорганизму, способному продуцировать L-триптофан из источника углерода из вышеупомянутой среды. Дополнительно, микроорганизм, продуцирующий L-триптофан, может представлять собой рекомбинантный микроорганизм. В частности, типы микроорганизмов конкретно не ограничены при условии, что микроорганизм может продуцировать L-триптофан. Однако микроорганизм может представлять собой микроорганизм, принадлежащий родам Enterobacter, Escherichia, Erwinia, Serratia, Providencia, Corynebacterium и Brevibacterium, и в частности, микроорганизм, принадлежащий роду Escherichia.
Более конкретно, микроорганизм рода Escherichia может в частности представлять собой Escherichia coli. Однако любые микроорганизмы, принадлежащие роду Escherichia, которые могут увеличивать продуктивность по L-триптофану путем инактивации активности фосфатазы, могут быть включены без ограничения.
В частности, родительский штамм микроорганизма рода Escherichia, продуцирующего L-триптофан при инактивации активности фосфатазы, может быть конкретно не ограничен, при условии, что микроорганизм обладает продуктивностью по триптофану. Например, микроорганизм, продуцирующий триптофан, может представлять собой микроорганизм у которого, для усиления пути биосинтеза триптофана, активности гена в конкурентном пути, регулятора в направляющем пути триптофанового оперона и ген для введения и расщепления триптофана были ослаблены или инактивированы, и/или активность триптофанового оперона была сверхэкспрессирована. Способ ослабления или инактивации активности является таким же, как объяснено выше, и способы, известные в данной области техники, могут быть включены без ограничения. Дополнительно, способы для сверхэкспрессии активности триптофанового оперона, известные в данной области техники, включены без ограничения. Например, способы могут включать способ дополнительной вставки полинуклеотида, который включает, частично или полностью, нуклеотидную последовательность гена оперона или участка контроля экспрессии, введенную извне в хромосому; способ увеличения числа копий путем введения в векторную систему; способ усиления активности оперона путем замены последовательности контроля экспрессии, которая контролирует экспрессию гена, на другую последовательность контроля экспрессии, модификации, имеющей индуцированную мутацию в части или во всей нуклеотидной последовательности участка контроля экспрессии, и введение модификации в сам ген, и так далее, но не ограничиваясь этим. В частности, микроорганизм может представлять собой Escherichia coli, у которой ген pheA, ген trpR, ген mtr и/или ген tnaAB частично или полностью делетированы и/или триптофан сверхэкспрессируется.
В настоящем изобретении в дополнение к гену pheA, гену trpR, гену mtr, гену tnaAB и триптофановому оперону и белковым последовательностям, кодируемым ими, последовательности ДНК и белка, используемые в настоящем изобретении, могут быть взяты из известной базы данных, например GenBank от NCBI, но не ограничиваясь этим. Дополнительно, специфические подробности в отношении гена pheA, гена trpR, гена mtr, гена tnaAB и так далее можно найти в описаниях патента Кореи No. 10-0792095 и публикации патента Кореи No. 10-2013-0082121, и описания таковых могут быть включены во всей полноте посредством ссылки в настоящее описание.
В примере воплощения настоящего изобретения подтверждено, что в результате инактивации активности фосфатазы у различных родительских штаммов любой микроорганизм рода Escherichia, продуцирующий L-триптофан, независимо от его родительского штамма, имел значительно улучшенную продуктивность по L-триптофану, когда активность фосфатазы была инактивирована.
В другом аспекте настоящего изобретения предложен способ получения L-триптофана, включающий культивирование микроорганизма рода Escherichia по настоящему изобретению, продуцирующего L-триптофан, у которого активность фосфатазы, содержащей аминокислотную последовательность SEQ ID NO: 1, модифицирована с инактивацией, в среде, и выделение L-триптофана из культуральной среды или культивированного микроорганизма.
Среда и другие условия культивирования, используемые для культивирования микроорганизма по настоящему изобретению, конкретно не ограничены, но можно использовать любую среду, применяемую для традиционного культивирования микроорганизма рода Escherichia. В частности, микроорганизм по настоящему изобретению можно культивировать в традиционной среде, содержащей подходящие источники углерода, источники азота, источники фосфора, неорганические соединения, аминокислоты и/или витамины и так далее, в аэробных условиях, подводя температуру, рН и так далее.
Примеры источников углерода для использования в настоящем изобретении могут включать углеводы, такие как глюкоза, фруктоза, сахароза, мальтоза, маннит, сорбит и так далее; спирты, такие как сахарные спирты, глицерин, пируват, лактат, цитрат и так далее, и аминокислоты, такие как органическая кислота, глутаминовая кислота, метионин, лизин и так далее. Дополнительно, природные органические питательные вещества, такие как гидролизат крахмала, меласса, сырая меласса, рисовые отруби, маниоковый крахмал, тростниково-сахарная меласса, жидкий кукурузный экстракт и так далее, и в частности, углеводы, такие как глюкоза и стерильная предварительно обработанная меласса (то есть меласса, преобразованная в редуцирующий сахар) и так далее. Дополнительно можно использовать различные другие источники углерода в подходящем количестве без ограничения. Источники углерода можно использовать по отдельности или в комбинации из двух или более, но не ограничиваясь этим.
Примеры источников азота для использования в настоящем изобретении могут включать неорганические соединения, такие как аммиак, сульфат аммония, хлорид аммония, ацетат аммония, фосфат аммония, карбонат аммония, нитрат аммония и так далее; аминокислоты, такие как глутаминовая кислота, метионин, глутамин и так далее, и органические источники азота, такие как пептон, NZ-амин, мясной экстракт, дрожжевой экстракт, солодовый экстракт, жидкий кукурузный экстракт, гидролизат казеина, рыба или продукты ее переработки, обезжиренный соевый жмых или продукты его переработки и так далее. Эти источники азота можно использовать по отдельности или в комбинации из двух или более, но не ограничиваясь этим.
Примеры источников фосфора для использования в настоящем изобретении могут включать однозамещенный фосфат калия, гидроортофосфат калия, соответствующие натрийсодержащие соли и так далее, но не ограничиваясь этим. Примеры неорганических соединений могут включать хлорид натрия, хлорид кальция, хлорид железа, сульфат магния, сульфат марганца, карбонат кальция и так далее, и дополнительно могут быть включены аминокислоты, витамины и/или подходящие предшественники для культуральной среды. Эти среды или предшественники могут быть добавлены в культуру при периодическом культивировании или непрерывном культивировании.
В настоящем изобретении рН в культуре можно подводить во время культивирования путем добавления в культуру подходящим образом такого соединения как гидроксид аммония, гидроксид калия, аммиак, фосфорная кислота и серная кислота. Дополнительно во время культивирования можно использовать пеногаситель, такой как полигликолевый сложный эфир жирной кислоты, для подавления образования пены. Дополнительно кислород или газ, содержащий кислород, можно вводить в культуру для поддержания аэробного состояния культуры; или азот, водород или углекислый газ можно вводить без введения газа с целью поддержания анаэробного или микроаэробного состояния культуры.
Температура культуры обычно может находиться в диапазоне от 27°C до 40°С, и более конкретно от 30°С до 37°С, но не ограничиваясь этим. Культивирование можно продолжать до тех пор, пока не будет получено желаемое количество полезных веществ, и в частности от 10 часов до 100 часов, но время культивирования не ограничено этим.
L-Триптофан можно выделять подходящим способом, известным в данной области техники, например при периодическом культивировании, непрерывном культивировании или периодическом культивировании с подпиткой и так далее, в соответствии со способом культивирования по настоящему изобретению.
Также выделение может включать стадию очистки. Стадия очистки дает возможность очистить выделенный L-триптофан с использованием подходящего способа, известного в данной области техники.
Примеры осуществления изобретения
Здесь и далее настоящее изобретение будет описано более подробно со ссылкой на соответствующие примеры воплощений. Однако раскрытые здесь примеры воплощений предназначены исключительно для иллюстративных целей и не предназначены никаким образом ограничивать объем настоящего изобретения.
Пример 1: Получение дефицитного по yidA штамма дикого типа
Этот пример описывает получение штамма с инактивированной фосфатазой из штамма, продуцирующего L-триптофан.
Для усиления продуктивности по триптофану у штамма W3110, штамм Escherichia coli дикого типа, то есть репрезентативного микроорганизма рода Escherichia, ген yidA, кодирующий фосфатазу, был делетирован путем гомологичной рекомбинации из штамма W3110 trpΔ2 (Публикация патента Кореи No. 10-2013-0082121), у которого продуктивность по триптофану была усилена, и у которого ген tnaAB в форме оперона гена pheA (NCBI ID гена: 12934467), кодирующего хоризматмутазу/префенатдегидрогеназу (CM-PDT), ген tnaA (NCBI ID гена: 12933600), кодирующий триптофаназу и ген tnaB (NCBI ID гена: 12933602), кодирующий импортер триптофана, были делетированы.
В частности, для делетирования гена yidA, имеющего нуклеотидную последовательность SEQ ID NO: 2, использовали способ одностадийной инактивации с использованием рекомбиназы lambda Red, разработанной Datsenko КА с соавторами (Proc Natl Acad Sci USA, (2000) 97: 6640-6645). В качестве маркера для подтверждения вставки гена промотор rmf был лигирован с pUC19 (New England Biolabs (USA)), и использовали хлорамфениколовый ген pUCprmfmloxP, полученный путем лигирования мутанта, кассеты IoxP-CmR-loxP, которая была получена из pACYC184 (New England Biolab) (Публикация патента Кореи No. 10-2009-0075549).
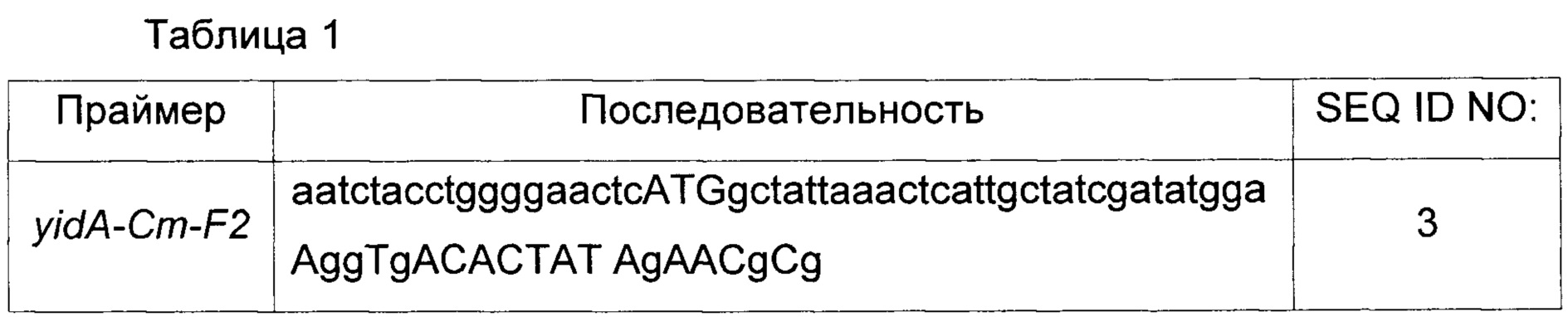
Во-первых, первичную полимеразную цепную реакцию (здесь и далее называемую ПЦР) проводили с использованием pUCprmfmloxP в качестве матрицы и комбинации праймеров с SEQ ID NO: 3 и 4, включающих часть гена yidA и частично нуклеотидную последовательность гена устойчивости к хлорамфениколу гена pUCprmfmloxP, в условиях: 30 циклов денатурации при 94°С в течение 30 секунд, отжиг при 55°С в течение 30 секунд и элонгация при 72°С в течение 1 минуты, тем самым получая ПЦР-продукт ΔyidA1st (примерно 1,2 т.п.н.). Здесь и далее, ПЦР-продукт ΔyidA1st (1,2 т.п.н.), полученный путем ПЦР, подвергали электрофорезу в 0,8% агарозном геле, элюировали и затем использовали в качестве матрицы для вторичной ПЦР. Вторичную ПЦР проводили с использованием элюированного продукта первичной ПЦР в качестве матрицы и комбинации праймеров SEQ ID NO: 5 и 6, содержащих нуклеотидные последовательности по 20 п.н. с 5'- и 3'-участков продукта ПЦР, полученного в первичной ПЦР, в условиях: 30 циклов денатурации при 94°C в течение 30 секунд, отжиг при 55°C в течение 30 секунд и элонгация при 72°C в течение 1 минуты, тем самым получая ПЦР-продукт ΔyidA (примерно 1,3 т.п.н.). Полученный таким образом ПЦР-продукт подвергали электрофорезу в 0,8% агарозном геле, элюировали и затем использовали в рекомбинации.
Е. coli W3110 trpΔ2, который был трансформирован вектором pKD46 в соответствии с одностадийным способом инактивации, разработанным Datsenko KА с коллегами (Proc Natl Acad Sci USA., (2000) 97:6640-6645), был получен как компетентный штамм, и трансформацию выполняли путем введения фрагмента гена, ΔyidA (1,3 т.п.н.), полученного путем первичной и вторичной ПЦР. Штаммы культивировали в среде LB, содержащей хлорамфеникол, и затем отбирали первичные трансформанты, обладающие устойчивостью к хлорамфениколу.
После удаления pKD46 из полученных таким образом первичных рекомбинантных штаммов, обладающих устойчивостью к хлорамфениколу, в них вводили вектор pJW168 (Gene, (2000) 247, 255-264) с тем, чтобы удалить маркерный ген устойчивости к хлорамфениколу из штаммов (Gene, (2000) 247, 255-264). ПЦР проводили с использованием праймеров SEQ ID NO: 7 и 8 для получения ПЦР-продукта (примерно 0,5 т.п.н.), что указывает на то, что эти полученные в итоге штаммы имели делецию гена yidA. Эти штаммы, имеющие делецию этого гена, обозначали как W3110 trpΔ2 yidA.
Последовательности праймеров, использованных в этом Примере, приведены в Таблице 1 ниже.

Пример 2: Получение триптофан-продуцирующего штамма с инактивированной фосфатазой
В этом примере KCCM11166P (Патент Кореи No. 10-1261147), который представляет собой другую репрезентативную Escherichia coli, продуцирующую триптофан, использовали в качестве родительского штамма, и ген yidA, кодирующий фосфатазу, делетировали путем гомологичной рекомбинации таким же образом, как описано в Примере 1.
Путем анализа ПЦР-продукта (примерно 0,5 т.п.н.), который был получен с помощью ПЦР с использованием праймеров SEQ ID NO: 7 и 8, было подтверждено, что полученные в итоге штаммы имели делецию гена yidA, и затем эти штаммы были обозначены как СА04-2805.
Пример 3: Оценка продуктивности по триптофану дефицитного по yidA штамма дикого типа
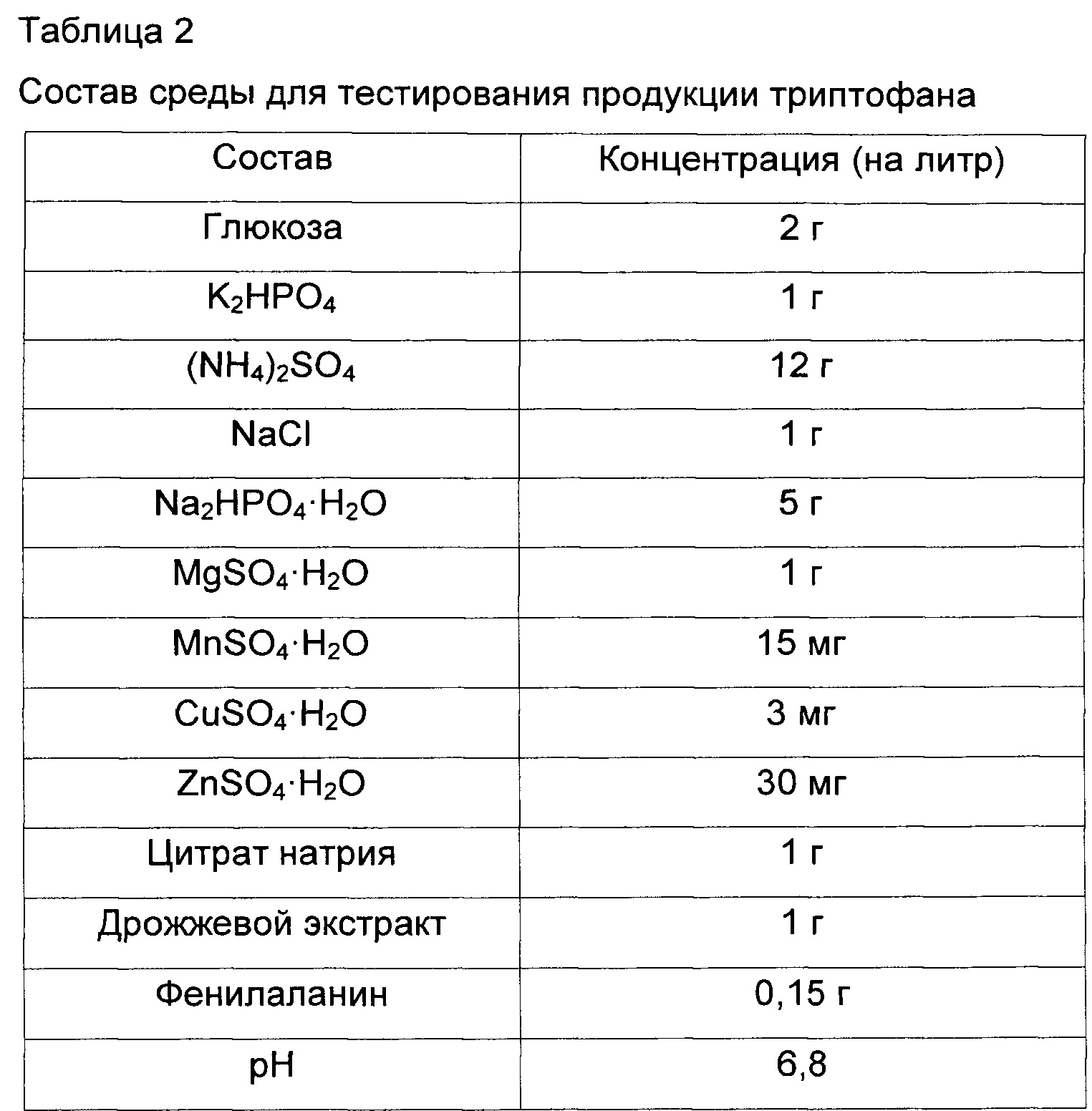
Для сравнения продуктивности по триптофану W3110 trpΔ2 yidA, полученного в Примере 1, и W3110 trpΔ2, который представляет собой родительский штамм, pCL-Dtrp_att-trpEDCBA и pBAC-Dtrp_att-trpDCBA были введены в каждый штамм методом трансформации. Введенные векторы представляли собой векторы, у которых экспрессия триптофанового оперона усилена таким образом, что триптофан может продуцироваться в избытке вследствие освобождения от механизма контроля в контрольном участке триптофанового оперона (Публикация патента Кореи No. 10-2013-0082121). Штаммы с введенным вектором культивировали на среде для тестирования продукции триптофана, изготовленной согласно составу, представленному в Таблице 2 ниже, и сравнивали их продуктивности по L-триптофану.
Одну платиновую петлю каждого из штаммов после культивирования в течение ночи на твердой среде LB в инкубаторе при 37°C инокулировали в среду для тестирования (25 мкл), представленную в Таблице 2. После этого полученные в результате культуры культивировали в инкубаторе при 37°C и 200 об/мин в течение 48 часов для сравнения концентрации триптофана (Таблица 3).
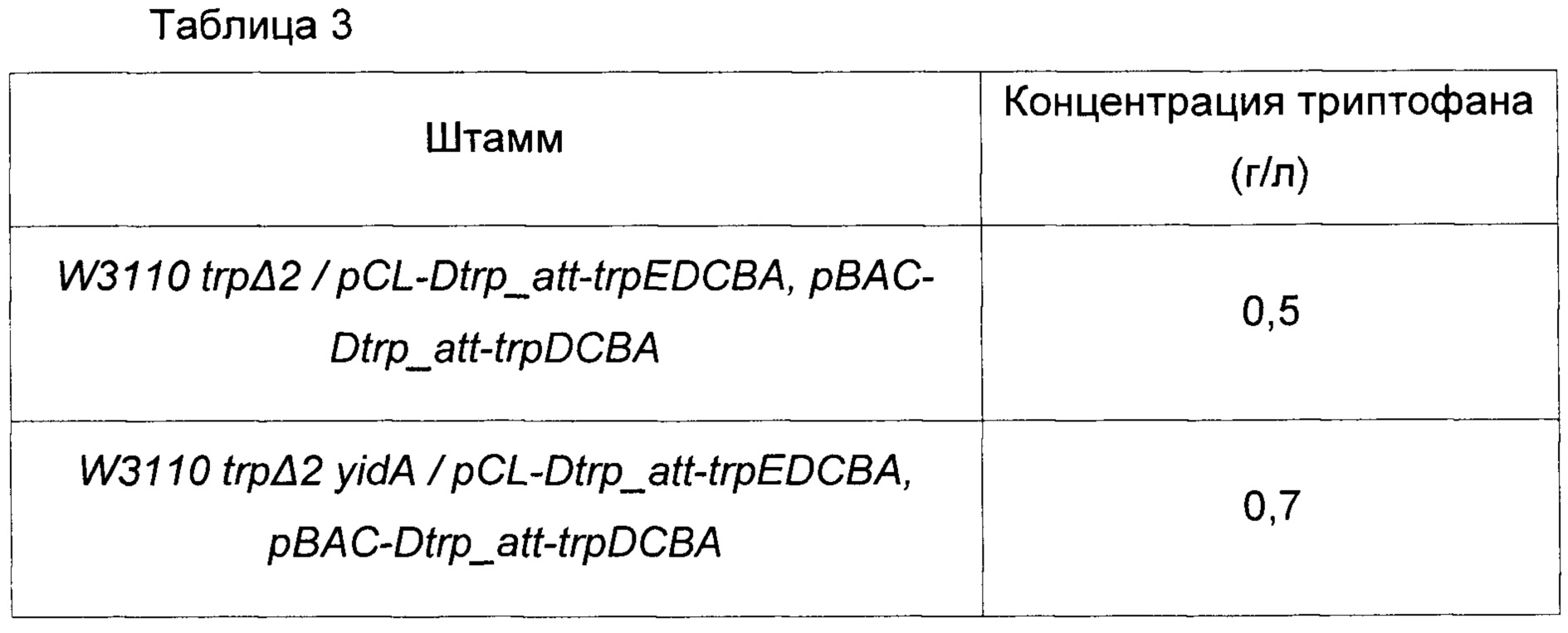
Представленные выше результаты показывают, что продуктивность по триптофану штамма, у которого фосфатаза, кодируемая геном yidA, была инактивирована, повышалась на 40% по сравнению со штаммом, у которого фосфатаза не была инактивирована. Следовательно, было подтверждено, что продуктивность по триптофану можно улучшать путем инактивации фосфатазы, кодируемой yidA. Из этих результатов можно заключить, что разрушение Е4Р, важного предшественника биосинтеза триптофана, было ингибировано, и посредством этого поддерживалась концентрация Е4Р в клетках. В результате энергия, которая затрачивалась без необходимости, сохранялась и использовалась для биосинтеза.
Пример 4: Оценка продуктивности по триптофану у дефицитного по yidA штамма
Для измерения титра триптофана у дефицитного по yidA штамма (СА04-2805), полученного в Примере 2, и родительского штамма (KCCM11166P), штаммы культивировали в среде для титрования триптофана, изготовленной согласно составу, представленному в Таблице 4, и затем было подтверждено улучшение эффективности продукции L-триптофана.
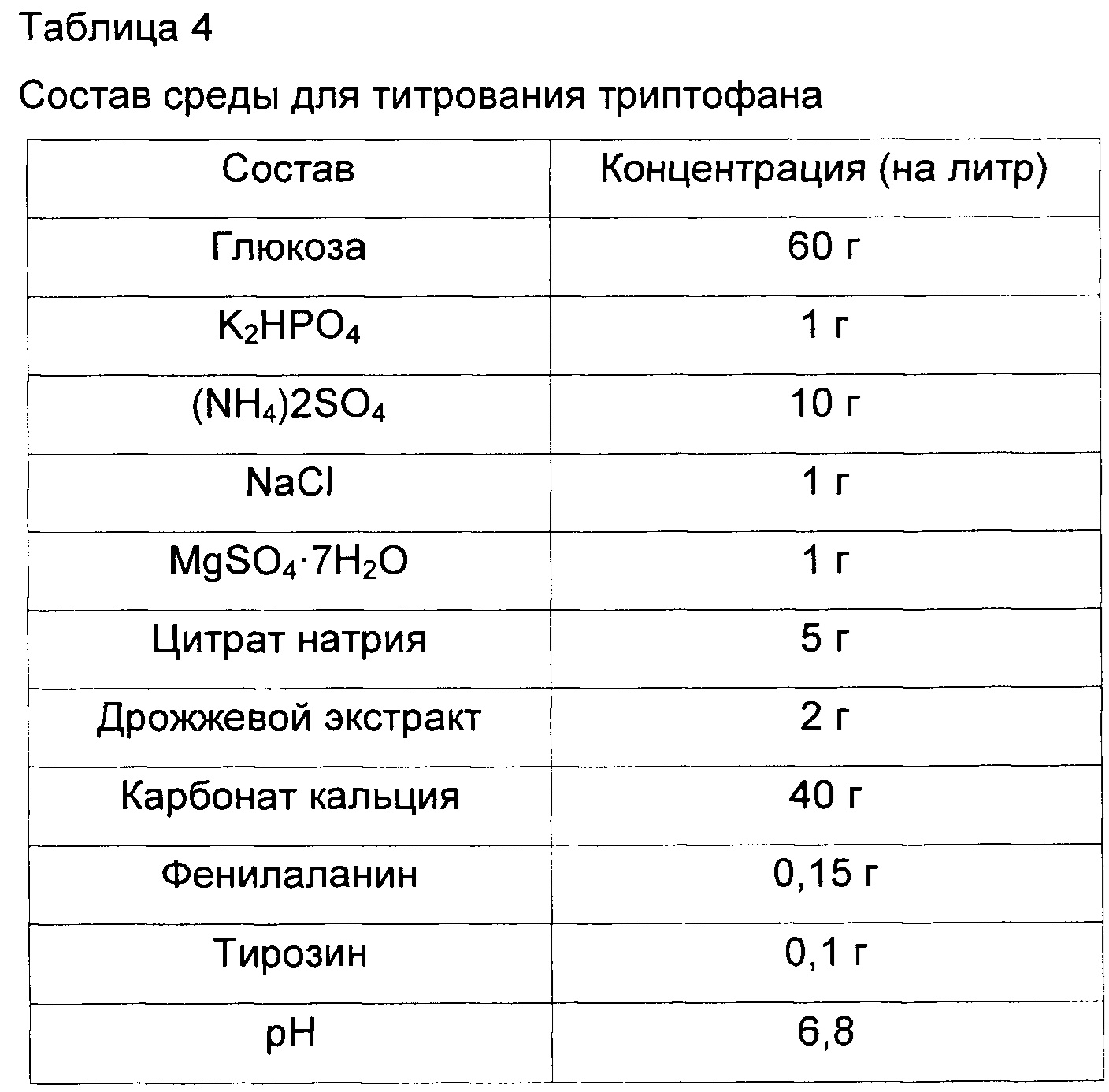
Одну платиновую петлю каждого из Е. coli KCCM11166P и Е. coli СА04-2805 после культивирования в течение ночи на твердой среде LB в инкубаторе при 37°C инокулировали в среду для титрования (25 мл), представленную в Таблице 4. После этого полученные в результате культуры культивировали в инкубаторе при 37°C и 200 об/мин в течение 48 часов для сравнения скорости потребления глюкозы и концентрации триптофана.
В результате, как показано в Таблице 5 ниже, было подтверждено, что концентрация триптофана в случае СА04-2805, штамма, у которого фосфатаза, кодируемая геном yidA, была инактивирована, увеличивалась примерно на 10% по сравнению с таковой в случае KCCM11166P, родительского штамма, который брали в качестве контроля.

Авторы настоящего изобретения подтвердили, что штамм на основе KCCM11166P, который представляет собой дефицитный по yidA штамм, у которого активность фосфатазы была инактивирована, проявляет улучшенную способность продуцировать триптофан, и он получил название "СА04-2805" или "СА04-2805 (KCCM11166P_AyidA)" и депонирован в KCCM 5 декабря 2014 года, где ему был присвоен депозитарный номер KCCM11636P.
Представленные выше результаты подтверждают, что микроорганизм рода Escherichia по настоящему изобретению, продуцирующий триптофан, штамм, у которого активность фосфатазы инактивирована, может обладать улучшенной способностью продуцировать L-триптофан по сравнению с немодифицированным штаммом, который был взят для инактивации.
Несмотря на то, что настоящее изобретение описано со ссылкой на конкретные иллюстративные воплощения, специалист в области техники, к которой принадлежит данное изобретение, понимает, что настоящее изобретение может быть воплощено в других конкретных формах без отступления от технической идеи или существенных признаков настоящего изобретения. Следовательно, примеры воплощений, описанные здесь, служат исключительно для иллюстративных целей и не предназначены ограничивать объем настоящего изобретения. Кроме того, объем настоящего изобретения определяется главным образом прилагаемой формулой изобретения, а не подробным описанием, и следует понимать, что все модификации или вариации, возникающие на основе идеи и объема настоящего изобретения и эквивалентные им, включены в объем прилагаемой формулы.
Реферат
Изобретение относится к биотехнологии. Описан микроорганизм рода, обладающий улучшенной способностью продуцировать L-триптофан по сравнению с немодифицированным микроорганизмом, где активность фосфатазы, содержащей аминокислотную последовательность SEQ ID NO: 1, модифицирована с инактивацией для того, чтобы поддерживать внутриклеточную концентрацию E4P (эритрозо-4-фосфата). Изобретение также относится к способу получения L-триптофана с помощью указанного микроорганизма. Кроме того, изобретение также относится к способу ингибирования разрушения внутриклеточного E4P микроорганизма рода, включающему инактивирование активности фосфатазы, содержащей аминокислотную последовательность SEQ ID NO: 1, в микроорганизме родаИзобретение расширяет арсенал средств для получения L-триптофана. 3 н. и 1 з.п. ф-лы, 5 табл., 4 пр.

Комментарии