Способ идентификации микроводорослей - RU2619640C1
Код документа: RU2619640C1
Чертежи


Описание
Изобретение относится к области биологии и гидробиологии и предназначено для определения вида одноклеточных микроводорослей, присутствующих в воде.
Известен способ определения вида микроводоросли путем рассмотрения пробы воды под микроскопом (И.Г. Радченко, В.И. Капков, В.Д. Федоров. Практическое руководство по сбору и анализу проб морского фитопланктона: Учебно-методическое пособие для студентов биологических специальностей университетов. - М.: Мордвинцев, 2010. - 60 с.), в котором обнаруженные экземпляры сравниваются с эталонными изображениями в каталоге-определителе. При этом требуется специальная обработка пробы воды с целью окраски и обездвиживания клеток микроводорослей, кроме того, требуются специальные кюветы для уменьшения толщины слоя жидкости, в которой находятся исследуемые клетки микроводорослей. Персонал, выполняющий подготовку проб и распознавание вида микроводоросли, должен пройти соответствующее обучение. Применение специальных приспособлений и химических реагентов существенно снижает практичность и оперативность выполнения анализа. Известный способ практически не поддается автоматизации.
Наиболее близким по технической сущности к заявляемому изобретению является выбранный в качестве прототипа способ лазерной индуцированной флуоресценции (ЛИФ) (В.В. Фадеев, Д.К. Бунин, П.С. Венедиктов. Методы лазерного мониторинга фотосинтезирующих организмов. Квантовая электроника, 23, №11, 1996. С. 963-973), при котором возбуждение флуоресценции одноклеточных микроводорослей осуществляется с помощью лазерного облучения с последующим измерением спектра флуоресцентного излучения пигментов, содержащихся в клетках. Метод ЛИФ позволяет обнаруживать в водной среде присутствие пигментов, характерных для разных групп микроводорослей.
Так, например, Н.А. Гаевский в своей докторской диссертации (Гаевский Н.А. Критериии методология оценки структурно-функционального состояния альгоценоза на основе флуоресцентного анализа: Дис. д-ра биол. наук. - Красноярск: Кр ГУ, 2003. - 286 с. 2003) выделяет шесть таких групп: зеленые, эвгленовые, харовые, содержащие хлорофилл a и хлорофилл b; ксантофитовые и рафидофитовые (хлорофилл a и хлорофилл с); диатомовые, динофитовые, золотистые, бурые (хлорофилл a, хлорофилл с, фукоксантин); криптофитовые (хлорофилл а, хлорофилл с, фикобилины); красные (хлорофилл а, хлорофилл d, фикобилины); сине-зеленые (хлорофилл а, фикобилины). Три группы выделяет Д.Г. Дундфорф с соавторами (Dumforf D.G., Deane J.A., TanS. etal. Phylogenetic assessment of the eucariotic light-harvesting antenna proteins with implications for plastide evolution // J. Mol. Evol. - 1999. - 48, N 1. - P. 59-68.): зеленые, эвгленовые (хлорофилл а, хлорофилл b); диатомовые, динофитовые, золотистые, бурые (хлорофилл а, хлорофилл с, фукоксантин); криптофитовые, сине-зеленые, красные (фикобилинпротеины). Статистически достоверные различия спектров возбуждения флуоресценции хлорофилл а и фикобилинов у водорослей разных отделов позволяют количественно оценивать их вклад в сигнал флуоресценции.
Недостаток известного способа (прототипа) в том, что он не позволяет отличить, например, зеленые водоросли от эвгленовых и харовых, диатомовые от динофитовых и золотистых и т.п. Кроме того, таким методом нельзя различить разные виды микроводорослей в пределах одного отдела.
Задачей заявляемого изобретения является устранение недостатков прототипа, а именно создание способа, позволяющего по измеренным спектрам ЛИФ определять вид микроводоросли.
Технический результат предлагаемого способа заключается в возможности идентификации присутствующих в воде микроводорослей разных отделов и разного вида, с улучшенными техническими характеристиками, высоким быстродействием и с возможностью автоматизации процесса измерения.
Сущность заявляемого технического решения заключается в том, что в отличие от прототипа, где измерение флуоресценции осуществляется при одной температуре, значение которой не контролируется и не учитывается в дальнейшем анализе, в предлагаемом способе измерение флуоресценции в пробе водной среды с находящимися в ней клетками микроводоросли осуществляется в термокамере, температура в которой изменяется в диапазоне от 5°С до 80°С. Измеренные температурные зависимости интенсивности флуоресценции пигментов клеток микроводоросли в указанном диапазоне температур сравниваются с соответствующими значениями для известных микроводорослей. В результате сравнения определяется вид водоросли, присутствующий в исследуемой пробе воды.
В работе (С.С. Вознесенский, А.Ю. Попик, Е.Л. Гамаюнов, Т.Ю. Орлова, Ж.В. Маркина. Влияние температуры среды на спектры лазерно-индуцированной флуоресценции микроводорослей. Вестник Дальневосточного отделения Российской академии наук, 3 (181), 2015. С. 30-35.) приведены результаты исследования температурной зависимости спектров ЛИФ хлорофилла а для культур микроводорослей, принадлежащих разным отделам, в которой авторами показано, что функция температурной зависимости интенсивности ЛИФ хлорофилла а может быть представлена выражением (1):

где

а - температурный коэффициент флуоресценции;
Т - температура среды.
Значения температурного коэффициента флуоресценции а для разных микроводорослей в разных температурных диапазонах (С.С. Вознесенский, А.Ю. Попик, Е.Л. Гамаюнов, Т.Ю. Орлова, Ж.В. Маркина. Влияние температуры среды на спектры лазерно-индуцированной флуоресценции микроводорослей. Вестник Дальневосточного отделения Российской академии наук, 3 (181), 2015. С. 30-35.) авторы статьи определили путем аппроксимации функцией (1) экспериментальных температурных зависимостей интенсивности ЛИФ. Вычисленные значения температурного коэффициента флуоресценции а для исследованных водорослей приведены в таблице 1.
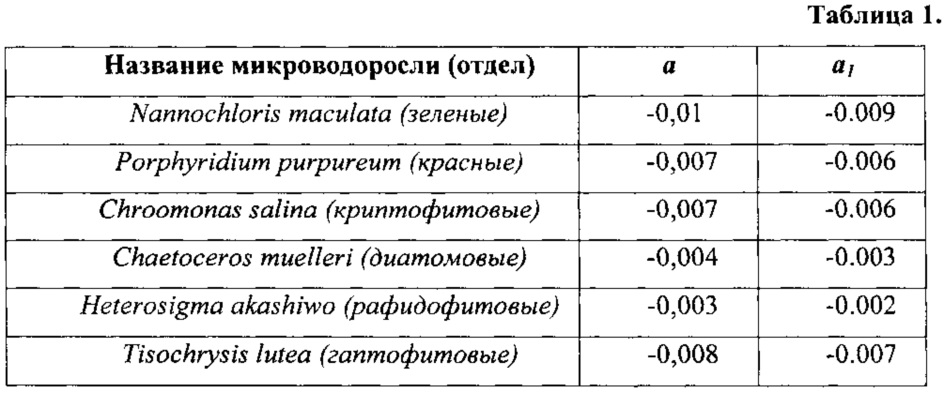
Очевидно, что численные значения коэффициента а различаются для разных микроводорослей из разных отделов и, следовательно, могут служить характерными признаками для распознавания.
Заявителями замечено, что в диапазоне температур 5-30°С аппроксимирующая кривая мало отличается от прямой линии, и, следовательно, можно использовать аппроксимацию более простой - линейной функцией, уравнение которой имеет вид:

где a1 - параметр, определяющий наклон прямой, и b - параметр сдвига.
Параметр a1 является тангенсом угла наклона прямой и в рассматриваемой задаче характеризует быстроту (скорость) изменения интенсивности ЛИФ с ростом температуры. Для разных микроводорослей параметр a1 имеет разные значения, поэтому в дальнейшем используется как информативный признак для идентификации.
Параметр b зависит от конструкции измерительной установки и условий нормировки при построении графиков, поэтому в настоящей методике для идентификации не используется.
Значения коэффициента а1, вычисленные для исследованных в работе (С.С. Вознесенский, А.Ю. Попик, Е.Л. Гамаюнов, Т.Ю. Орлова, Ж.В. Маркина. Влияние температуры среды на спектры лазерно-индуцированной флуоресценции микроводорослей. Вестник Дальневосточного отделения Российской академии наук, 3 (181), 2015. С. 30-35.) микроводорослей, также приведены в таблице 1.
Можно заметить, что у красных и криптофитовых микроводорослей коэффициент а1 имеет одинаковое значение, что не позволяет однозначно идентифицировать присутствие в среде одной из них. В таком случае предлагается увеличить температуру нагрева пробы с микроводорослью вплоть до 80°С.
Было обнаружено, что при дальнейшем нагревании образцов с микроводорослями температурная зависимость интенсивности ЛИФ хлорофилла а перестает быть монотонной. На температурной кривой видны характерные интервалы, ограниченные точками локальных максимумов и минимумов, в которых существенно изменяется скорость спада или роста интенсивности ЛИФ.
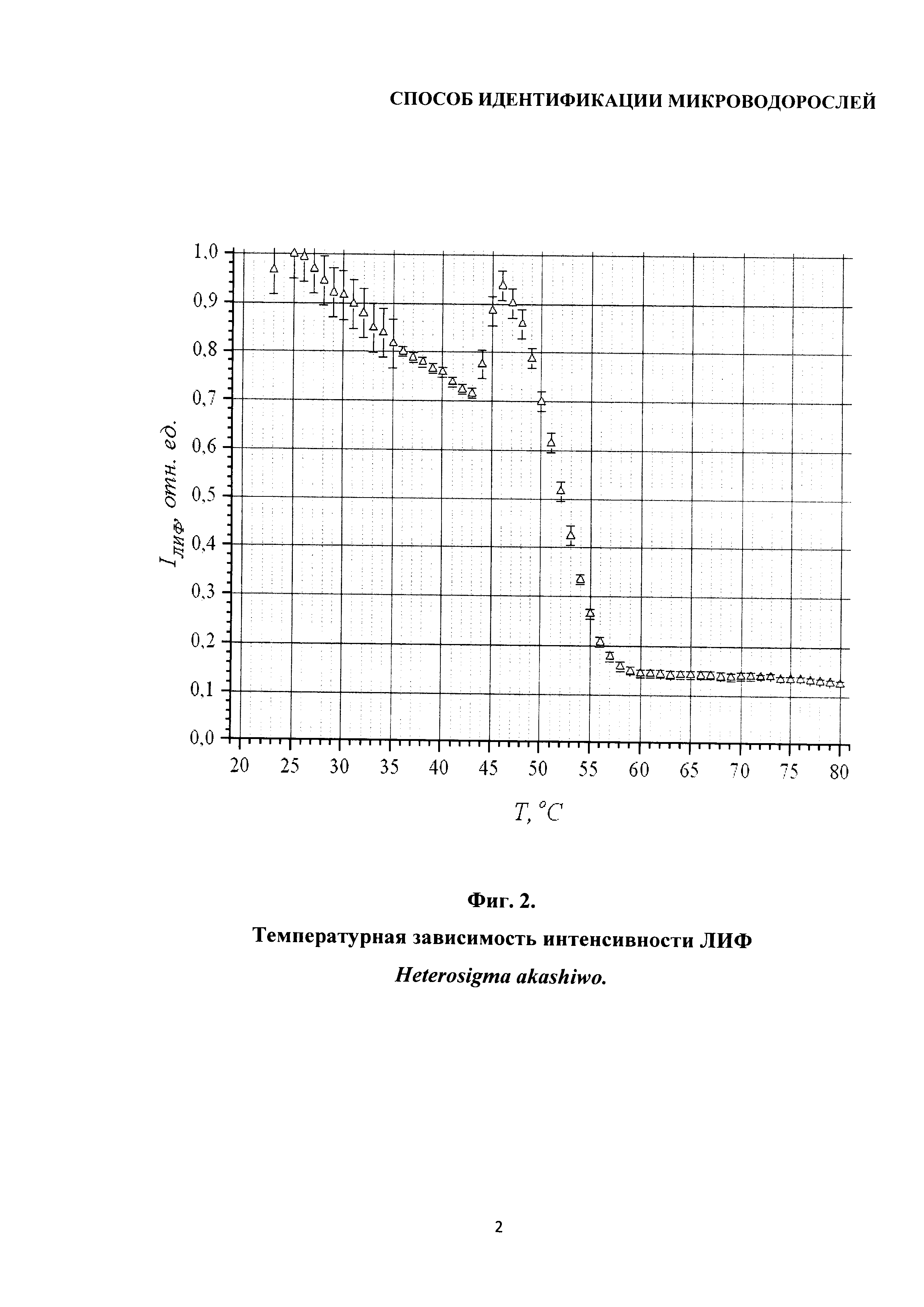
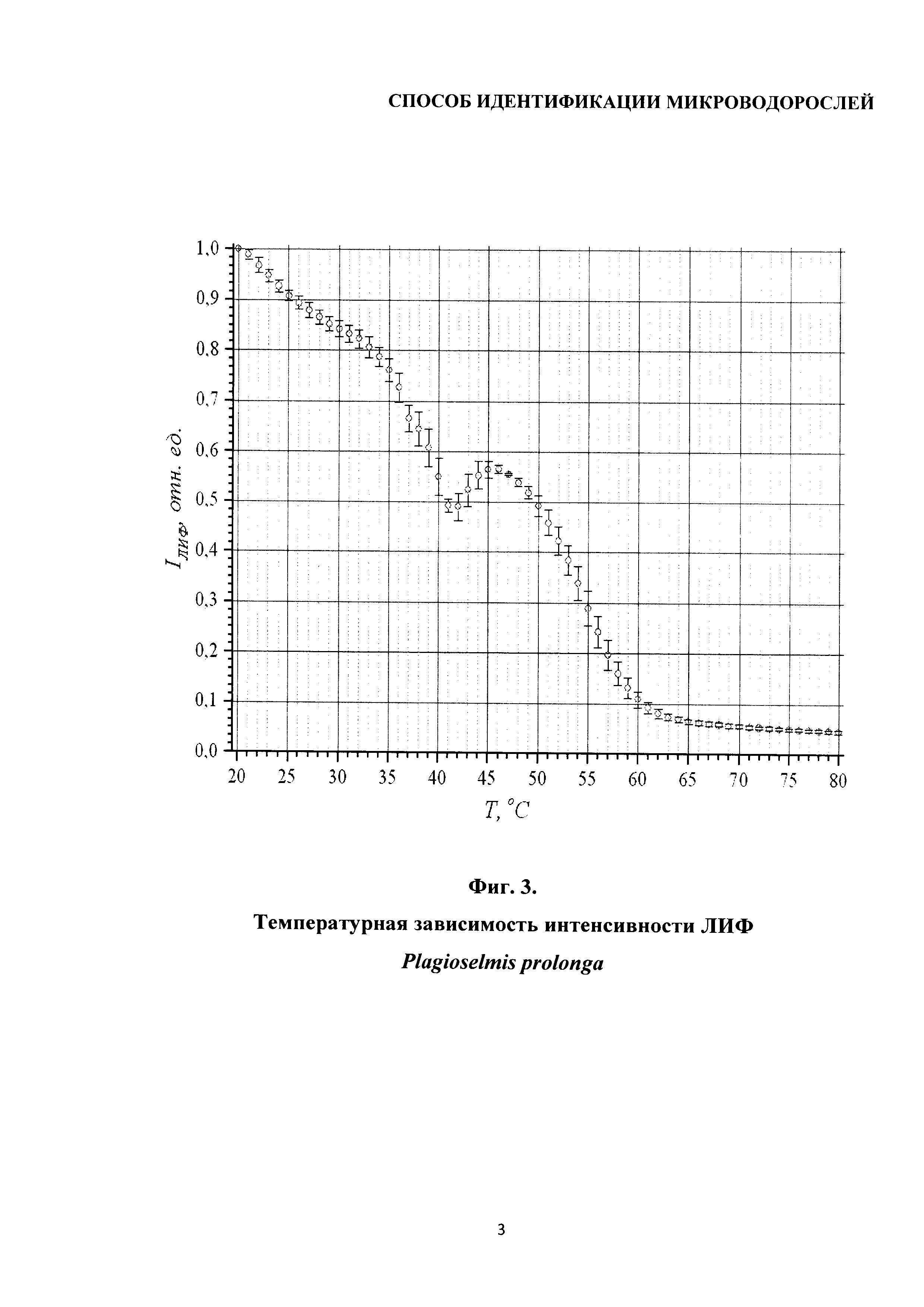
Сущность изобретения поясняется чертежами, где на фиг. 1 изображена температурная зависимость интенсивности ЛИФ хлорофилла а микроводоросли Chroomonas salina; на фиг. 2 - температурная зависимость интенсивности ЛИФ Heterosigma akashiwo; на фиг. 3 показана температурная зависимость интенсивности ЛИФ Plagioselmis prolonga; на фиг. 4 изображена температурная зависимость интенсивности ЛИФ Tisochrysis lutea.
В качестве примеров рассмотрим экспериментальные графики температурной зависимости интенсивности ЛИФ для некоторых микроводорослей, полученных заявителями.
Пример 1
На фиг. 1 приведены результаты измерений интенсивности ЛИФ хлорофилла а микроводоросли Chroomonas salina, в диапазоне температур 20-80°С, где видны характерные участки изменения интенсивности ЛИФ от температуры:
1) В диапазоне 20-35°С наблюдается монотонное уменьшение интенсивности флуоресценции, аналогичное рассмотренному выше в диапазоне 5-30°С.
2) Диапазон 35-39°С характеризуется увеличением скорости снижения интенсивности флуоресценции хлорофилла а.
3) В диапазоне 39-49°С наблюдается увеличение интенсивности флуоресценции с достижением выраженного максимального значения.
4) В диапазоне 49-70°С происходит быстрый спад интенсивности флуоресценции;
5) В диапазоне 70-80°С происходит медленный спад интенсивности флуоресценции с монотонным асимптотическим приближением к минимальному уровню.
Уменьшение интенсивности флуоресценции наблюдаемое в диапазоне 20-35°С с ростом температуры, так называемое температурное тушение флуоресценции, так же как и в ранее рассмотренном диапазоне 5-30°С, объясняется повышением колебательной энергии молекул вещества, которое приводит к дезактивации возбужденных уровней в результате безызлучательной колебательной релаксации молекул.
В рассматриваемом случае уменьшение интенсивности флуоресценции вызвано воздействием температуры на молекулы хлорофилла а, входящего в состав клеток микроводорослей. Уменьшение интенсивности ЛИФ хорошо аппроксимируется экспоненциальной функцией (1) с соответствующим температурным коэффициентом а=-0,007, или линейной функцией с температурным коэффициентом а1=-0,006 (таблица 1).
Достижение выраженного минимума интенсивности флуоресценции в диапазоне температур 35-39°С связано с началом денатурации белковых структур в клетках микроводорослей и нарушением работы цепи транспорта электронов. В результате происходит уменьшение передачи на хлорофилл а энергии, поглощенной другими пигментами.
Уменьшение интенсивности ЛИФ в диапазоне температур 35-39°С может быть аппроксимировано линейной функцией (2) с температурным коэффициентом а2=-0,04.
Дальнейшее повышение температуры до 49°С приводит к гибели клеток, сопровождающейся интенсивным разрушением их оболочек и внутренних компонентов. В результате высвобождаются молекулы свободного хлорофилла а интенсивность флуоресценции которого выше флуоресценции хлорофилла а, связанного в хлоропластах клеток. Поэтому в данном диапазоне температур наблюдается интенсивный рост флуоресценции до выраженного максимального значения. Увеличение интенсивности ЛИФ в диапазоне температур 39-49°С хорошо аппроксимируется линейной функцией (2) с температурным коэффициентом а3=0,06.
Дальнейшее увеличение температуры приводит к спаду флуоресценции вследствие увеличения безызлучательной релаксации и разрушения молекул хлорофилла а. Уменьшение интенсивности ЛИФ в диапазоне температур 49-70°С хорошо аппроксимируется линейной функцией (2) с температурным коэффициентом a4=- 0,04.
При дальнейшем росте температуры продолжается распад структур, в состав которых входят молекулы хлорофилла, наблюдается постепенное снижения интенсивности флуоресценции. В диапазоне температур 70-80°С наблюдаемая зависимость хорошо аппроксимируется линейной функцией (2) с температурным коэффициентом а5=-0,008. Совокупность значений характерных температур и температурных коэффициентов для микроводоросли Chroomonas salina сведены в таблицу 2.
Пример 2
На фиг. 2 приведены результаты измерений интенсивности ЛИФ микроводоросли Heterosigma akashiwo в диапазоне температур 20-80°С.
График температурной зависимости интенсивность ЛИФ для этой микроводоросли похож на рассмотренный в примере 1. При этом отличаются значения температурных диапазонов и температурных коэффициентов флуоресценции, численные значения которых приведены в таблице 2.
Пример 3
На фиг. 3 приведены результаты измерений интенсивности ЛИФ микроводоросли Plagioselmisprolonga в диапазоне температур 20-80°С.
Температурная зависимость интенсивность ЛИФ для этой микроводоросли мало отличается от рассмотренной в примерах 1 и 2. При этом отличаются значения температурных диапазонов и температурных коэффициентов флуоресценции, численные значения которых приведены в таблице 2.
Пример 4
На фиг. 4 приведены результаты измерений интенсивности ЛИФ микроводоросли Tisochrysis lutea в диапазоне температур 20-80°С.
Аналогично рассмотренным в примерах 1-3 на температурной кривой видны неярко выраженные максимумы интенсивности флуоресценции при температурах 34°С и 43°С.
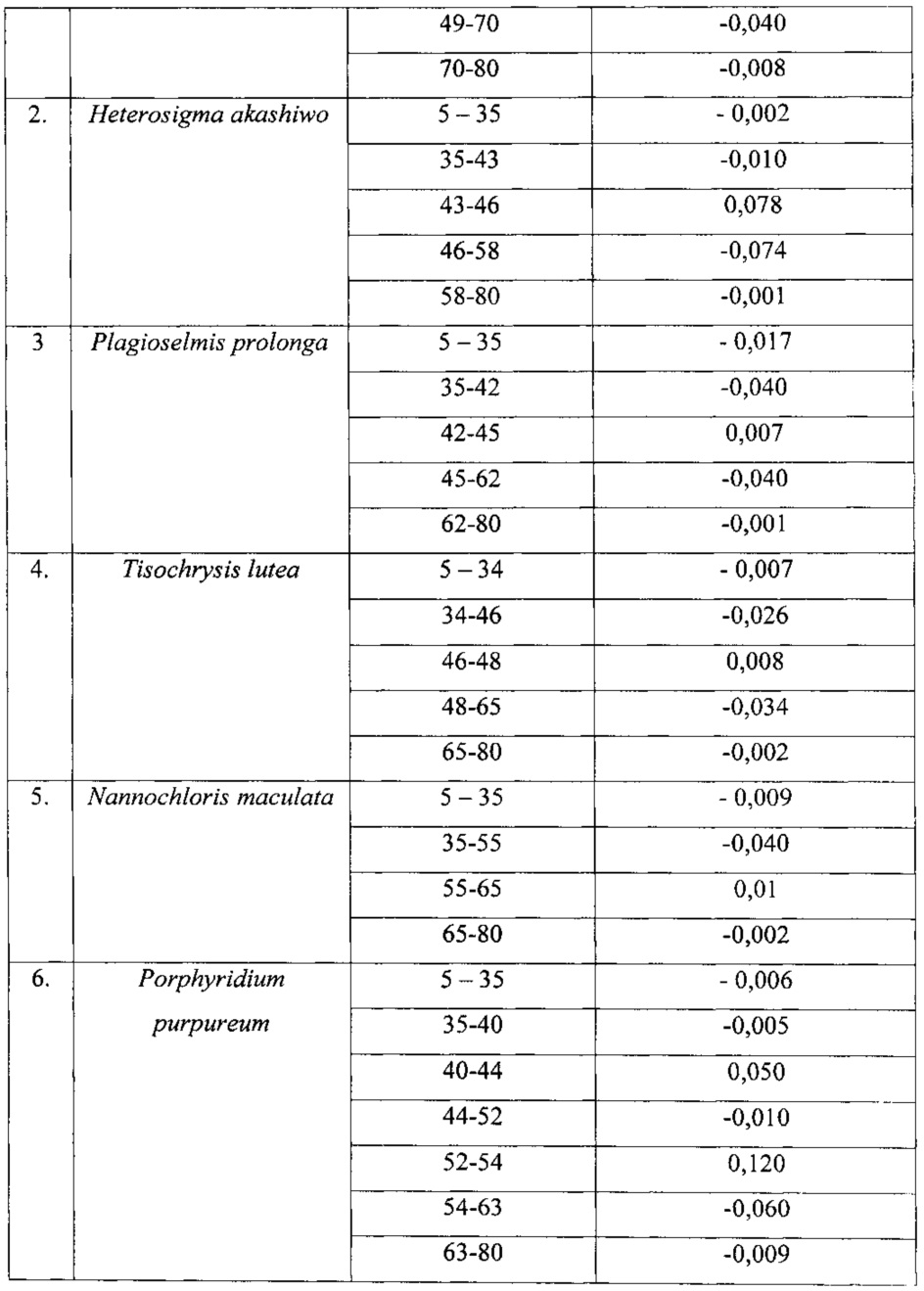
Численные значения температурных диапазонов и коэффициентов флуоресценции микроводоросли Tisochrysis lutea приведены в таблице 2, а также приведены характерные диапазоны температур и соответствующие им значения температурных коэффициентов для микроводорослей Nannochloris maculata и Porphyridium purpureum.

Из приведенных примеров видно, что характер зависимости интенсивности флуоресценции от температуры и значения температуры, при которых наблюдаются минимальные и максимальные уровни интенсивности флуоресценции, отличаются для разных культур микроводорослей. Это позволяет использовать выявленные экспериментально температурные диапазоны и значения температурных коэффициентов флуоресценции как отличительные признаки для идентификации отдельных видов микроводорослей.
Заявляемый способ идентификации микроводорослей реализован следующим образом.
Исходная проба воды с идентифицируемой культурой микроводоросли помещается в термостатирующую камеру, в которой обеспечивается возбуждение флуоресценции пигментов клеток микроводоросли одним из известных методов, например методом лазерной индуцированной флуоресценции (ЛИФ). Измерение интенсивности флуоресценции одного или нескольких пигментов, например хлорофилла а, выполняется при изменении температуры в диапазоне 5-80°С.
Измеренные температурные зависимости интенсивности флуоресценции пигментов клеток микроводоросли в указанном диапазоне температур сравниваются с образцовыми зависимостями для известных видов микроводорослей. Для упрощения процедуры сравнения и автоматизации процесса идентификации в измеренных температурных зависимостях интенсивности флуоресценции пигментов клеток микроводоросли выявляются характерные температурные диапазоны, границы которых определяются по максимальным и минимальным значениям интенсивности флуоресценции пигментов. В каждом характерном температурном диапазоне вычисляются температурные коэффициенты флуоресценции. Вычисленные значения температурных коэффициентов и характерные температурные диапазоны сравниваются с соответствующими значениями для известных микроводорослей. В результате сравнения определяется вид водоросли, присутствующий в исследуемой пробе воды.
Заявляемый способ позволяет идентифицировать присутствующие в воде одноклеточные микроводоросли без необходимости предварительной химической обработки пробы воды, сократить время и автоматизировать процесс идентификации микроводорослей.
Реферат
Изобретение относится к биотехнологии. Предложен способ идентификации микроводорослей. Способ включает воздействие методом лазерной индуцированной флуоресценции на образец пробы анализируемой среды в термокамере с последующим измерением спектра флуоресцентного излучения при изменении температуры в диапазоне 5-80°С. Измеренные температурные зависимости спектров флуоресценции пигментов клеток микроводоросли в указанном диапазоне температур сравнивают с соответствующими зависимостями для известных микроводорослей и определяют вид водоросли. Способ обеспечивает идентификацию микроводорослей с возможностью автоматизации процесса измерения. 4 ил., 2 табл., 4 пр.

Комментарии