Новые ротавирусные вакцинные композиции и способ получения вышеуказанных композиций - RU2643929C2
Код документа: RU2643929C2
Чертежи
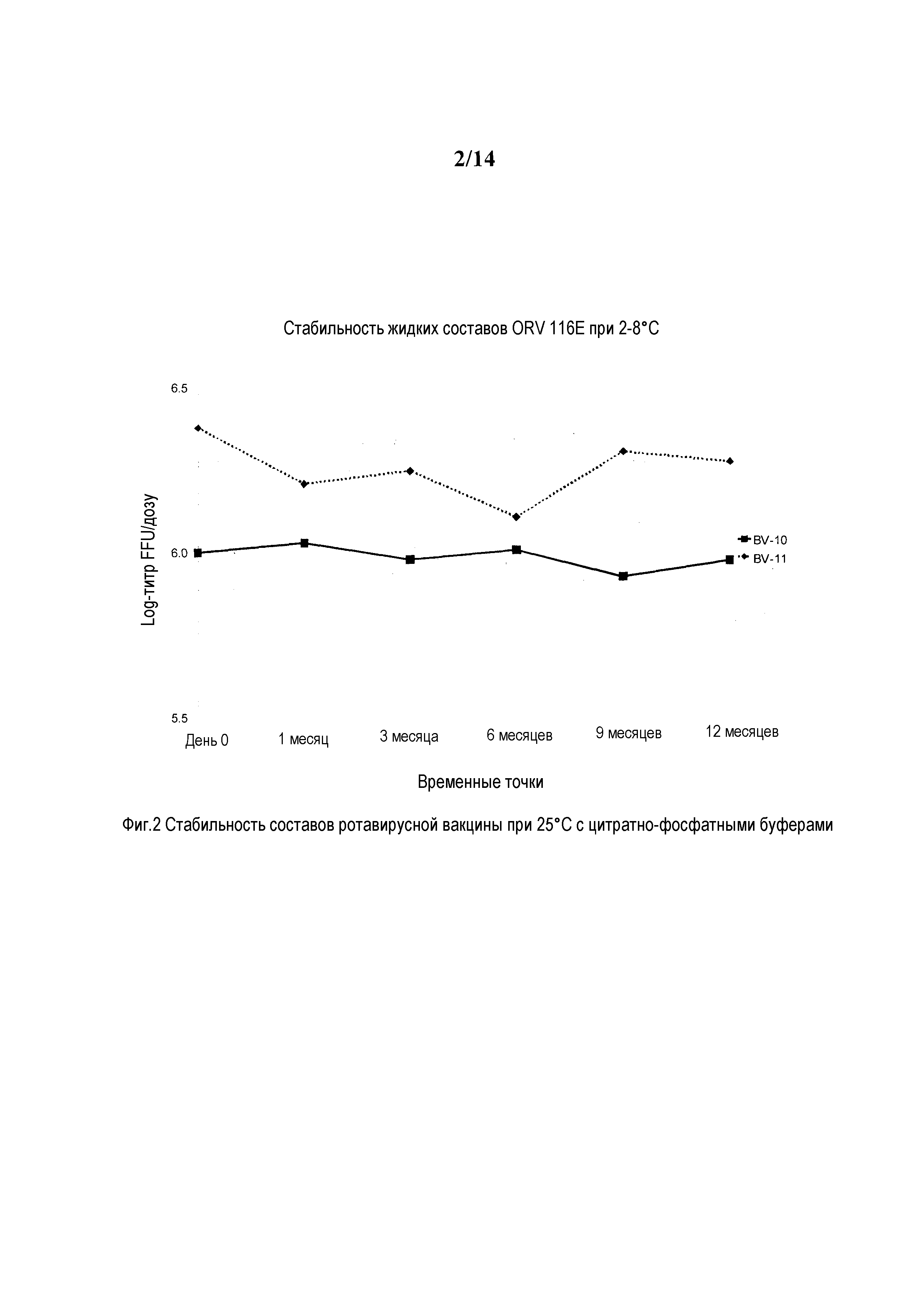










Описание
ОБЛАСТЬ ИЗОБРЕТЕНИЯ
Изобретение относится к новым ротавирусным вакцинным композициям и способу получения вышеуказанных композиций. Более конкретно, изобретение относится к новым ротавирусным вакцинным композициям, содержащим ротавирусные антигены, стабилизаторы и новые буферы. Буферы предварительно смешивают с ротавирусными вакцинными композициями по изобретению. Вакцинные композиции по изобретению представляют собой стабильные жидкие составы ротавирусных вакцин для перорального введения.
ПРЕДШЕСТВУЮЩИЙ ИЗОБРЕТЕНИЮ УРОВЕНЬ ТЕХНИКИ
Ротавирус является наиболее частой причиной тяжелой обезвоживающей диареи по всему миру. Каждый год более полумиллиона детей в возрасте менее пяти лет умирают от ротавирусной диареи. Более 80% из этих смертей, связанных с ротавирусом, происходят в развивающихся странах Африки к югу от Сахары и Южной Азии. Кроме того, ротавирус отвечает за 25-50% всех госпитализаций, связанных с диареей, как в развивающихся, так и в развитых странах, и за 23 миллиона случаев амбулаторной медицинской помощи ежегодно у детей раннего возраста. Почти каждый ребенок к пятилетнему возрасту будет инфицирован ротавирусом. Вследствие огромного мирового бремени ротавирусного заболевания разработка вакцин против этого патогена является приоритетной в последние тридцать лет. Две живые пероральные ротавирусные вакцины, которые доступны на рынке, представляют собой RotaTeq® (Merck and Co., Inc., PA, USA and Sanofi Pasteur MSD SNC, Lyon, France) и Rotarix® (GSK Biologicals, Rixensart, Belgium). В апреле и октябре 2009 г. Стратегическая консультативная группа экспертов ВОЗ (SAGE) рассмотрела дополнительные данные по эффективности из различных популяций в Африке и Азии, и послерегистрационные исследования в Америке, и продлила рекомендацию о вакцинации во всех регионах мира.
Капсид ротавируса состоит из трех концентрических белковых слоев. Внешний слой, состоящий из VP7 и VP4, теряется во время проникновения вируса в клетку-хозяина. Полевые изоляты ротавируса можно адаптировать для роста с высоким титром в тканевой культуре за счет обработки трипсином и добавления в среду для культивирования трипсина, который расщепляет VP4 на два фрагмента, VP8* и VP5*. Известно, что ингибиторы протеаз снижают репликацию ротавируса in vitro и in vivo. Когда трипсин ассоциирован с трехслойными частицами (TLP), он неактивен и недоступен для ингибиторов протеаз, таких как апротинин. Когда внешний слой растворяется под действием кальций-хелатирующих средств, высвобождаются VP5*, VP8* и VP7 и активируется ассоциированный трипсин, позволяя расщеплять белки вирусного капсида, а также другие экзогенные белки. Показано, что добавление ингибиторов трипсина значительно снижает синтез вирусной мРНК и вирусных белков в клетках и обладает ключевым ингибирующим действием, если происходит, когда вирус проникает в клетку. Это указывает на то, что внедрение трипсина в ротавирусные частицы может повышать их инфекционность.
Инфекционность усиливается за счет обработки трипсином. Трипсин превращает неинфекционную фракцию вируса в инфекционный вирус, позволяя этой фракции терять оболочку в инфицированной клетке. Было обнаружено, что трипсин расщепляет структурный полипептид бычьего ротавируса массой 88,000 дальтон с продуктами расщепления массой 67,000 и 20,000 дальтон. Активация ротавируса трипсином (полученным от свиней) является общеизвестной, и было также произведено добавление трипсина в среду после инфицирования для получения оптимального выхода продукта. Однако источником трипсина является свинья, т.е. он получен от свиней. Показано, что трипсин свиного происхождения может содержать другие загрязняющие вирусы, такие как свиной цирковирус 1 и 2, который является нежелательным. Также, когда свиной трипсин использовали для выращивания ротавирусов, были обнаружены следы других рискованных загрязняющих веществ, таких как полихлорированные бифенилы (ПХБ). Таким образом, очень важно то, что следует избегать использования трипсина животного происхождения в биопроцессе культивирования ротавируса в максимально возможной степени. Дополнительно, поскольку продукты, связанные со свиньями, также являются препятствием для определенных религиозных конфессий, особенно в исламских регионах мира, таким образом, вакцины полностью свободные от продуктов свиного происхождения являются более выгодными и полезными. Были начаты исследования по разработке технологического процесса для введения в использование рекомбинатного трипсина, который является новым этапом в биопроцессе, для того чтобы преодолеть риск ПХБ и других животных источников в составах вакцин. Рекомбинантный трипсин свободен от животных компонентов (ACF), высокоспецифичен по действию, свободен от загрязнения химотрипсином, свободен от посторонних примесей животного происхождения и безопасен для использования человеком.
Компания Wyeth первой получила приоритет для запуска коммерческой ротавирусной вакцины на рынке в 1998-99. Композиция Rotashield (Wyeth) включала живой реассортантный тетравалентный ротавирусный антиген человека и обезьяны, в среде с амфотерицином B, выращенный в диплоидных клеточных линиях зародыша макаки резус, сахарозу, мононатриевый глутаминат, монофосфат калия, дифосфат калия, фетальную бычью сыворотку, неомицина сульфат. Однако из-за проблем, связанных с инвагинацией кишечника, и неблагоприятными воздействиями после введения вакцины Wyeth отозвала свои коммерческие составы ротавирусных вакцин с рынка. Современные вакцины, которые включают в себя вакцину с моновалентным человеческим серотипом - P1A[8]G1 (Rotarix), и другую вакцину, содержащую пять реассортантов человеческого и бычьего ротавируса - G1, G2, G3, G4 и P1A [8] (RotaTeq), продемонстрировали общую эффективность и безопасность в клинических испытаниях. Хотя был достигнут значительный прогресс относительно связи инвагинации кишечника с ротавирусными вакцинами, основные не отвеченные вопросы все еще остаются нерешенными. Уже существуют наблюдения и доказательства, что имеющиеся ротавирусные вакцины, в основном, показали плохую эффективность при тестировании в развивающихся странах, что привело к основаниям для беспокойства относительно потенциальной эффективности любой будущей пероральной живой ротавирусной вакцины в этих условиях (Bresee JS, Glass RI, Ivanoff B, Gentsch J. Current status и future priorities for rotavirus vaccine development, evaluation and implementation in developing countries. Vaccine 1999; 17: 2207-22). В странах с высоким уровнем доходов от ротавируса умирают несколько детей, в то время как, в мировом масштабе, большинство детей, которые умирают каждый год от ротавирусной инфекции, из стран с низким уровнем доходов. Несмотря на программы вакцинации, исследования ротавирусных вакцин в странах с низким уровнем доходов продемонстрировали умеренную эффективность, в отличие от стран с высоким уровнем доходов. С такими умеренными результатами ротавирусных вакцин в развивающихся странах может быть связана комбинация факторов, которая включает ограниченный доступ к медицинской помощи (гидратационной терапии), слабую инфраструктуру, высокие затраты на перевозку вакцин, особенности способа введения вакцин, специфичность серотипического спектра действия, наряду с большей распространенностью нарушения питания. Современные исследования в этой области требуют дальнейшего изучения ротавирусных вакцин в странах с низким уровнем доходов и выявления новых путей для улучшения характеристик вакцины. Самое главное, необходима стабильность составов ротавирусной вакцины, для того чтобы успешно преодолеть дорогую и длительную транспортировку и складское хранение в этих представляющих интерес странах с низким уровнем доходов. Хотя, предыдущие патенты, доступные в области ротавирусных вакцин против ротавирусных инфекций, предоставляют экспериментальные данные по стабильности составов ротавирусных вакцин, практические выводы на современном уровне техники отражают значительные трудности со стабильностью после первого года со дня производства вакцины. Таким образом, необходимо продемонстрировать исследования эффективной стабильности для составов ротавирусной вакцины в течение, по меньшей мере, 24 месяцев хранения, для обеспечения мировых программ вакцинации, по меньшей мере, в развитых странах или в других странах с низким уровнем доходов, где борьба с ротавирусом, можно считать, находится все еще в начальной стадии.
Ротавирус представляет собой кислото-неустойчивый вирус со временем полужизни менее чем 12 мин при pH 2,0. Он быстро инактивируется при таком кислом pH. Ротавирусные вакцины предназначены для введения новорожденным пероральным путем, при этом антиген в ротавирусной вакцине, скорее всего, будет инактивирован кислотой желудочного сока. Таким образом, для предотвращения инактивации вируса кислотой желудочного сока, необходимо вводить антациды или буферы заранее или в комбинации с пероральным ротавирусным вакцинированием.
Благодаря патенту США № 6616931 Merck первыми вступили на территорию ротавирусных вакцин. US 6616931 описывал ротавирусную вакцинную композицию, содержащую состав Жидкой Ротавирусной Вакцины, который включал в себя штамм ротавируса:(от 1×105 до 1000×105 БОЕ/мл), сахар, выбранный из группы, состоящей из сахарозы, лактозы (от 1% до 70% масс./об.), маннит, сорбит, декстрозу, фукозу, трегалозу, полиаспарагиновую кислоту, или N-ацетилнейраминовую кислоту, инозитолгексафосфат (фитиновую кислоту), и сиаловую кислоту, фосфат [от 0,01 M до 2 M] , выбранный из группы, состоящей из монофосфата, полифосфата, фосфорилированных сахаров, и карбоксилат (от 0,05 M до 2 M), выбранный из группы, состоящей из сукцината (0,05 M), цитрата (0,07 M), фумарата, тартрата, малеата, лактата, рекомбинантный сывороточный альбумин человека (от 0,5 до 1,25%), и полисорбат (от 0,1 до 2%) для жидких и лиофилизированных составов. В случае лиофилизированного состава описано неионное поверхностно-активное вещество, выбранное из группы, состоящей из полисорбатов, полисорбата 80 (от 0,00 до 0,1%). В качестве буферных средств в ротавирусном составе были использованы цитрат и фосфаты в диапазонах от 0,05 M до 2 M и от 0,01 M до 2 M, чтобы противостоять кислой среде желудочного сока. Коммерческая вакцина "Rotateq" от Merck включает 5 живых штаммов ротавируса (G1, G2, G3, G4, и P1), сахарозу, цитрат натрия, натрия фосфата одноосновный моногидрат, гидроксид натрия, полисорбат 80 и эмбриональную телячью сыворотку. Эта коммерчески доступная ротавирусная вакцина отражает композицию в выданном им патенте США 6616931. Вакцина Rotateq предоставлялась в виде 2 мл жидкого раствора для перорального введения 5 живых реассортантных ротавирусов на основе человеческих и бычьих штаммов, содержащих минимум из 2,0-2,8×106 инфекционных единиц (IU) на дозу реассортанта, в зависимости от серотипа, и не более чем 116×106 IU на суммарную дозу.
Однако, US 6616931 (WO 2002/011540) также цитирует, что лиофилизация ротавирусных вакцин может приводить к потере титра вируса во время лиофильной сушки. Это может приводить к низкому выходу, и к низкой мощности лиофилизированного состава вакцины, а также в случае снижения ниже необходимых уровней приводить в результате к неэффективной иммунизации. Патент также признает, что перед растворением лиофилизированный состав теряет активность при комнатных температурах. Буферные средства для жидких составов, описанные в этом патенте включают цитрат, фосфат, сукцинат, бикарбонаты, и в комбинации с другими. Кроме того, сообщается, что концентрация фосфата должна сохраняться ниже чем 0,35 M во избежание осаждения состава вирусной вакцины. Использование бикарбонатов для стабилизации состава вирусной вакцины также категорически не рекомендуется, поскольку сообщают, что они вредны для стабильности состава. Дополнительно, в описании отсутствуют демонстрационные примеры различных компонентов буферов, за исключением компонентов цитратов, сукцинатов и фосфатов. Таким образом, очевидно, что существует потребность в новых компонентах буферов для улучшения стабильности ротавирусной вакцины и жидких составов буферов.
Вслед за Merck, Glaxo Smithkline также зарегистрировала и затем получила патент США № 7285280 по составу ротавирусной вакцины. US 7285280 описывает вакцинную композицию с живым ослабленным ротавирусом, объединенную с органическим антацидом цитратом натрия, или неорганическим антацидом гидроксидом алюминия или карбонатом кальция, и ксантановой камедью для перорального введения. Состав вакцины лиофилизируется с карбонатом кальция, присутствующим в качестве антацида, и растворяется при помощи водного раствора перед введением. Альтернативно, этот патент также описывает состав вакцины в виде быстрорастворимой таблетки в лиофилизированной форме для непосредственного помещения на язык новорожденного/ребенка, где ротавирусный антиген, антацид и ксантановая камедь уже присутствуют в таблетке. Таким образом, соответствующее описание продукта по патенту US 7285280 коммерчески доступного "Rotarix" от GSK представляет собой лиофилизированную вакцину, которую необходимо растворять перед введением с добавлением разбавителя, который предоставляется с вакциной отдельно. "Rotarix порошок и растворитель для пероральной суспензии" содержит в лиофилизированном порошке живой ослабленный штамм ротавируса человека RIX4414, который производится на клетках Vero не менее чем 106.0CCID50, 9 мг сахарозы и 13,5 мг сорбита, декстран, модифицированную Дульбекко среду Игла (DMEM), аминокислоты, в то время как растворитель включает ксантановую камедь, карбонат кальция и стерильную воду. Доза вакцины после растворения составляет 1 мл, и необходимы две отдельные дозы для введения с временным интервалом, по меньшей мере, 4 недели между первой и второй дозой. Хотя был сделана доступная лекарственная форма в 1 мл, она не производилась доступной в виде полностью стабильного единого жидкого состава в практическом плане. Состав вакцины Rotarix является лиофилизированным, и входит в комплект с отдельным пероральным аппликатором, содержащим растворитель, и стеклянным флаконом, содержащим лиофилизированный антиген вакцины в форме порошка вместе с отдельным адаптером для переноса. Необходимо выполнить подробные отдельные десять шагов, следующих друг за другом в хронологически правильном порядке, для того, чтобы обеспечить надлежащее растворение. Это растворение вакцины путем смешивания вакцины и растворителя имеет свои недостатки. Введение этой вакцины проходит через утомительный процесс начального соединения адаптера для переноса со стеклянным флаконом, содержащим антиген вакцины в форме порошка, с последующим соединением адаптера для переноса с пероральным аппликатором, смешиванием антигена вакцины и растворителя надлежащим образом, для обеспечения мутности восстановленного раствора, удаления адаптера для переноса, а затем введения вакцины. Все эти шаги по отдельности требуют эффективных профессиональных навыков сотрудника/медицинского работника, который вводит вакцину новорожденному/ребенку/пациенту. Таким образом, по-прежнему желательно иметь единый жидкий состав с подходящими объемами доз составов ротавирусных вакцин.
Затем патент США 8192747, принадлежащий GSK, описывает жидкий пероральный ротавирусный состав, содержащий живой ослабленный ротавирусный антиген, сахар (от 35% до 70% масс./масс.), выбранный из сахарозы, маннита, мальтозы, декстрозы, лактозы и трегалозы (40-70%), карбоксилат, который представляет собой адипат натрия (от 50 мМ до 2 M, ограничен от 100 мМ до 1 M, дополнительно ограничен от 400 до 700 мМ), и карбоновую кислоту, адипиновую кислоту вместе с ионами кальция, где композиция имеет антацидную емкость, по меньшей мере, 12 мин. Карбоксилаты с подтвержденной буферной емкостью в этом патенте включают среди прочих цитраты, ацетаты, малонаты, малаты, глутаминаты, фумараты, лактобионаты, малеаты, глюкуронаты, галактуронаты, галактараты и тартраты наряду с соответствующей солью кислоты и гидроксида натрия. Дополнительно, составы, раскрытые в этом патенте также могут включать конкретные коммерчески доступные компоненты антацидов, такие как, предпочтительно гидроксид алюминия и гидроксид магния, другие упомянутые нерастворимые в воде антациды включают карбонат магния, карбонат алюминия, фосфат алюминия, смесь гидроксида алюминия и карбоната магния, алюминий магний карбонат, гидроксид алюминия-карбонат магния-сорбит-маннит, гидроксиалюминий-карбонат натрия, дигидроксиалюминий карбонат калия. Хотя в этом патенте приведен список антацидов, должна быть установлена стабильность состава вакцины с конкретным антацидом. Кроме этого, под вопросом находится действие антацида на живой вирус, когда он присутствует в виде ингредиента в составе вакцины с другим антигеном вакцины и другими стабилизаторами/консервантами или эксципиентами. Коммерчески доступные антациды, смешанные с составами вакцины могут стать причиной коагуляции антигена вакцины и образования плотных масс в жидком составе. Кроме того, в жидких составах вакцины, антацид остается по большей части в виде суспензии и, таким образом, его не рекомендуют включать в состав вакцины. Описание продукта коммерчески доступной вакцины Rotarix следующего поколения (GSK) предлагает жидкий состав вакцины, "Пероральная суспензия Rotarix в предварительно заполненном пероральном аппликаторе", содержащий живой ослабленный штамм RIX4414 ротавируса человека с не менее чем 106.0CCID50, который производится на клетках Vero, 1073 мг сахарозы, динатрия адипат, модифицированную Дульбекко среду Игла (DMEM) и стерильную воду в 1,5 мл лекарственной формы для перорального введения.
Bharat Biotech International Limited владеет патентом 242868, выданным в Индии (публикация PCT WO 2007/132480), который также раскрывает уникальный состав ротавирусной вакцины, стабильный при 2°-8°C при использовании цитратно-фосфатных буферов в диапазонах концентраций от 100 мМ до 150 мМ и от 310 мМ до 400 мМ, соответственно, наряду с другими определенными компонентами состава. Этот патент включает в себя отдельное введение индивидууму цитратно-бикарбонатного буфера перед введением вакцины. Согласно этому патенту, цитрат-бикарбонаты сами по себе не входят в состав. Настоящее изобретение преодолевает этот недостаток, при этом подтверждено, что цитратно-бикарбонатная буферная система, присутствующая в составе вакцины вместе с ротавирусным антигеном, сохраняет буферную емкость без нарушения стабильности вакцины в составе. Публикация PCT WO 2011/07363 Bharat Biotech затем описывает и раскрывает новый биопроцесс для предварительной подготовки с сывороточным альбумином человека во время культивирования зараженной вирусом клетки-хозяина, благодаря которому обеспечиваются лучшие характеристики стабильности вакцины.
Как уже упоминалось выше, в составах ротавирусной вакцины необходим конкретный буферный компонент для борьбы с кислой средой желудка. Хотя изначальные коммерческие составы ротавирусной вакцины от GSK включали антациды, однако самая последняя коммерческая версия ротавирусной вакцины от GS переключилась с антацидов на буферы. В упрощенной форме, можно констатировать, что, как известно антацид нейтрализует pH кислой среды желудка, в то время как буфер сохраняет pH самого состава вакцины в чрезвычайно кислой среде желудка. Всегда выгодно смешивать с составом буферы, которые могут защитить антиген вакцины от кислоты желудочного сока в желудке, а также поддерживают стабильность вакцины.
Список буферных компонентов или антацидов для противодействия кислой среде желудка был процитирован в предшествующем изобретению уровню техники, наиболее предпочтительными являются цитратно-фосфатные буфера. Нынешний существующий уровень техники признает некоторые неустранимые проблемы использования цитратно-фосфатных буферов в составах вакцины. Они являются наиболее физиологическими из распространенных буферов и имитируют определенные компоненты внеклеточных жидкостей, но также они имеют ряд потенциальных недостатков. Например, фосфаты ингибируют многие ферментативные реакции, включая расщепление ДНК ферментами рестрикции, лигирование ДНК и бактериальную трансформацию. Фосфаты, скорее всего, будут легко загрязняться микроорганизмами и склонны выпадать в осадок во время фиксации. Семейство патентов-аналогов US'931 от Merck рекомендует не использовать фосфаты в качестве буфера выше определенного предела 0,35 М во избежание осаждения фосфатных солей в составах вакцины. Патент US'797 от GSK прямо упоминает, что составы ротавирусной вакцины являются предпочтительно свободными от фосфатов. Цитрат натрия был использован GSK в их патенте US'280 в качестве неорганического антацида. Однако, в следующем патенте US'797 GSK, по-видимому, полностью отказалась от использования цитратов в качестве буфера. US'797 описывает карбоксилаты, для которых специально подразумевается получение из дикарбоновой кислоты. Цитратные буферы получают из лимонной кислоты. Лимонная кислота имеет три карбоксильные функциональные группы. Цитратные буферы получают путем смешивания лимонной кислоты и предпочтительно цитрата натрия до получения желаемого pH. Таким образом, цитратные буферы являются буферами, приготовленными из трикарбоновых кислот.
Из описания уровня техники также очевидно, что ротавирусные вакцины требуют или антацидов или буферов для противостояния чрезвычайно кислой среде желудка. Буферы важны, поскольку суспендированный ротавирусный антиген в растворе не должен испытывать потерю активности и должен взаимодействовать благоприятным образом с остальными эксципиентами, чтобы оптимизировать эффективность вакцины. Они имеют решающее значение для эффективности и стабильности вакцин, поскольку значительное повышение или понижение pH раствора может вызвать денатурацию белка/ротавирусного живого антигена в вакцине. Буфер для использования с составом вакцины должен удовлетворять критериям дешевизны и легкости приготовления, а также устойчивости к окислению, чтобы быть стабильным. Также важно выбрать буфер, который не токсичен для приготовления. Подходящая буферная система не должна снижать титр антигена вакцины, а также должна функционировать в качестве потенциального ингредиента для борьбы с высоко кислотной средой внутри пациента, которому должна вводиться вакцина. Буферы, являющиеся неотъемлемой частью ротавирусных вакцин, поскольку они необходимы для сохранения pH состава вакцины при высоко кислом pH желудка, должны также обеспечивать, чтобы титр вакцины не ослабляется ниже его иммуногенных уровней. Буферы, которые являются другим ингредиентом составов ротавирусной вакцины, предназначенные для противодействия кислой среде желудка, должны поддерживать стабильность состава вакцины для длительного применения. Возможности использования других карбоксилатов в качестве буферов могут быть описаны в известном уровне техники, однако должны быть установлены полные и конкретные комбинации этих буферов с антигеном и другими стабилизирующими эксципиентами в составах ротавирусных вакцин. Конкретная комбинация подходящих буферов с антигеном в одном отдельном флаконе не должна демонстрировать никакого образования преципитатов, и должна показывать долгосрочную стабильность. Несмотря на то, что исчерпывающий список из множества возможных буферных компонентов упоминается в известном уровне техники у Merck и GS, биологическая композиция не может быть одобрена на основе простых предположений и возможностей, когда существующий уровень техники не подкреплен никакими экспериментальными данными. Было экспериментально показано в известном уровне техники, что только цитраты, фосфаты, и, в некоторой степени, сукцинаты, являются наиболее широко приемлемыми буферами в вакцинах.
Буферы, как известно, действуют в комбинированных системах. Каждая из комбинированных буферных систем специфична по своим уникальным физико-химическим свойствам и буферной емкости. Выбор конкретной комбинированной буферной системы, в частности, раствора, зависит от типа композиции. Настоящее изобретение имеет дело с ротавирусными вакцинными композициями, которые включают живой ослабленный вирус и широкий спектр других компонентов состава, таких как один или несколько сахаров, и частично гидролизованных белков наряду с присутствием других возможных стабилизирующих компонентов. Компоненты взаимодействуют друг с другом множеством разнообразных способов, и, таким образом, следует подтверждать выбор конкретной комбинированной буферной системы, которая подходит к типу конкретного состава, таким образом, сохраняя его функциональную активность. В отличие от возможных буферов, которые всего лишь упоминаются в известном уровне техники, ключевой особенностью новых комбинированных буферных систем, которые не упоминаются в известном уровне техники и чья роль в стабилизации составов ротавирусной вакцины подробно представлена в настоящем изобретении, является стабильность в течение минимум двух лет.
Таким образом, изобретены новые вакцинные композиции с новыми комбинированными буферными системами для составов ротавирусной вакцины, которые являются дополнительно безопасными и эффективными, а также обеспечивают максимальную эффективность ротавирусной вакцины, которая в то же самое время остается также стабильной в течение сравнительно большого количества времени, для осуществления более лучшей транспортировки ротавирусных вакцин по всему миру. Настоящее изобретение предлагает использование новых комбинированных буферных систем, которые все отсутствуют на известном уровне техники, для препаратов ротавирусной вакцины, которые человек может легко проглотить и усвоить в организме без ущерба для титра вируса, и в то же время остающихся высокостабильными. Преодоление существующих ограничений, связанных с составами ротавирусной вакцины, при помощи такой идеальной вакцины и состава/составов буфера, описанного в настоящем изобретении, будет иметь значительную пользу для общемировой вакцинации против ротавирусных инфекций.
Лиофилизированные составы вакцин имеют более длительную стабильность, но приносят более высокие затраты на производство. Логистика, связанная со случаем лиофилизированных вакцин, также снижает шансы сделать ротавирусные вакцины доступными в отдаленных районах мира. Сложная транспортная инфраструктура для флаконов с лиофилизированной вакциной прибавляется к проблеме логистики и повышенным расходам на вакцины. Таким образом, авторы настоящего изобретения экспериментально продемонстрировали жидкие составы ротавирусной вакцины с новыми альтернативными буферами в диапазонах объема дозы, включающих минимум от 1 мл составов до 2,5 мл объема дозы составов, для продолжительного срока в пределах, по меньшей мере, двух лет. Это является значительным усовершенствованием по сравнению с нынешним существующим уровнем техники, доступным для составов ротавирусной вакцины. Составы ротавирусной вакцины, которые стабильны вплоть до двух лет при низких температурах, будут способствовать легкой транспортировке вакцин с одновременным снижением затрат, также можно будет легко производить поддержание вирусного титра в составе для индуцирования требуемой иммуногенности.
ЦЕЛИ ИЗОБРЕТЕНИЯ
Первичной целью по изобретению является разработка состава вакцины для профилактики и лечения ротавирусных инфекций у людей.
Другой целью по изобретению является создание ротавирусной вакцинной композиции с подходящими другими новыми буферами для обеспечения стабильности ротавирусного антигена в вакцинной композиции. Еще одной целью по изобретению является создание ротавирусной вакцинной композиции с подходящими другими новыми буферами, которые бы сохраняли pH ротавирусной вакцинной композиции при высококислом pH желудка во время введения вакцины.
Другой целью по изобретению является создание стабильной ротавирусной вакцинной композиции со стабилизаторами и буферами для перорального введения, не требующей предварительного введения антацида.
Дополнительной целью по изобретению является создание стабильной ротавирусной вакцинной композиции, которая была бы способна обеспечить долгосрочную стабильность ротавирусного антигена без потери активности вакцины на срок в пределах по меньшей мере 2 года.
Еще одной целью по изобретению является создание способа адаптации ротавируса в присутствии рекомбинантного трипсина для получения новой ротавирусной вакцинной композиции, которая лишена каких-либо загрязнений из животных источников, а также полностью свободна от других компонентов животного происхождения.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
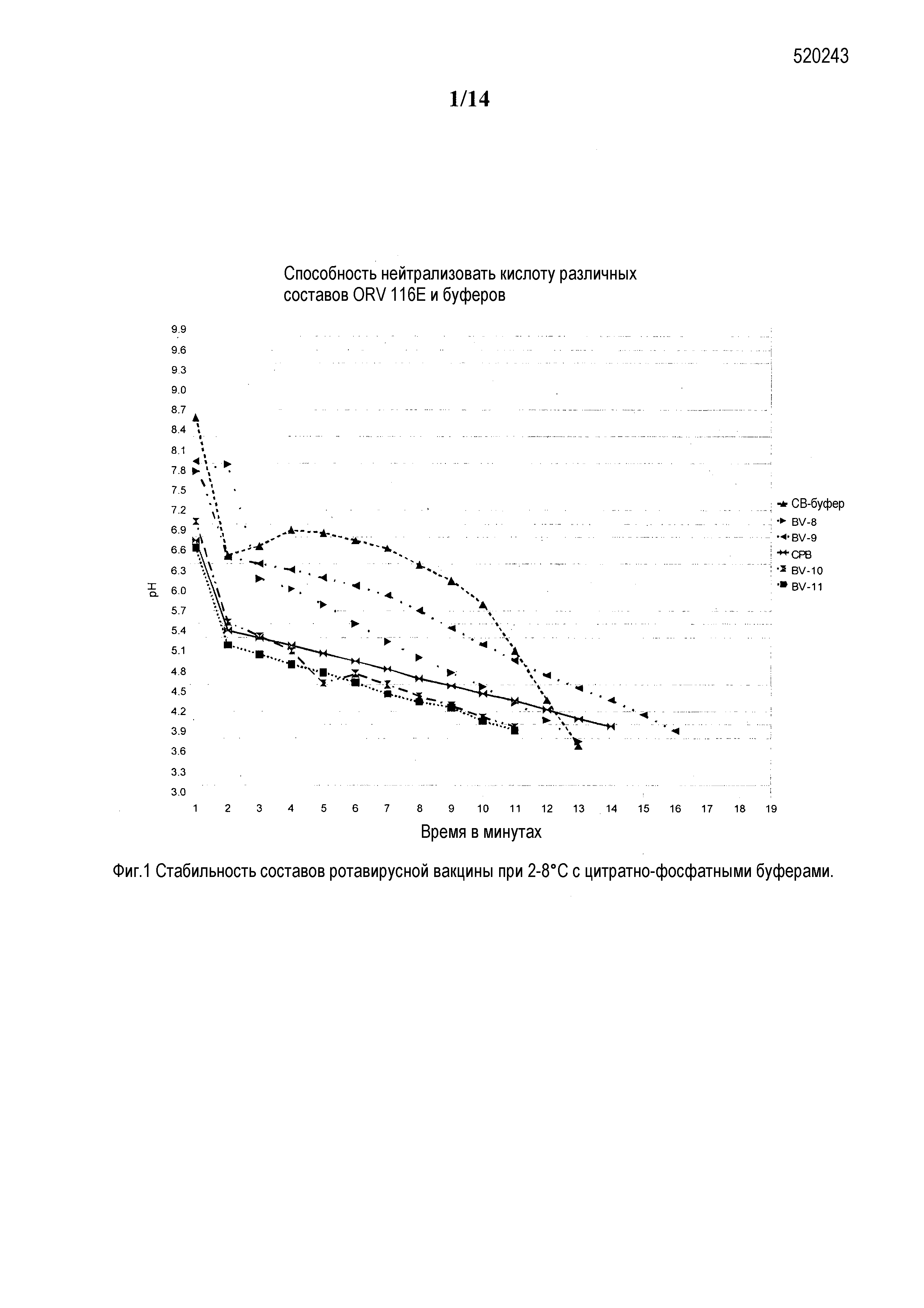
Фиг. 1: Результаты анализа различных составов по способу Россет-Райса для грудных детей для изучения буферной емкости составов.
Фиг. 2: Стабильность составов ротавирусной вакцины при 2-8°C с цитратно-фосфатными буферами.
Фиг. 3: Стабильность составов ротавирусной вакцины при 25°C с цитратно-фосфатными буферами.
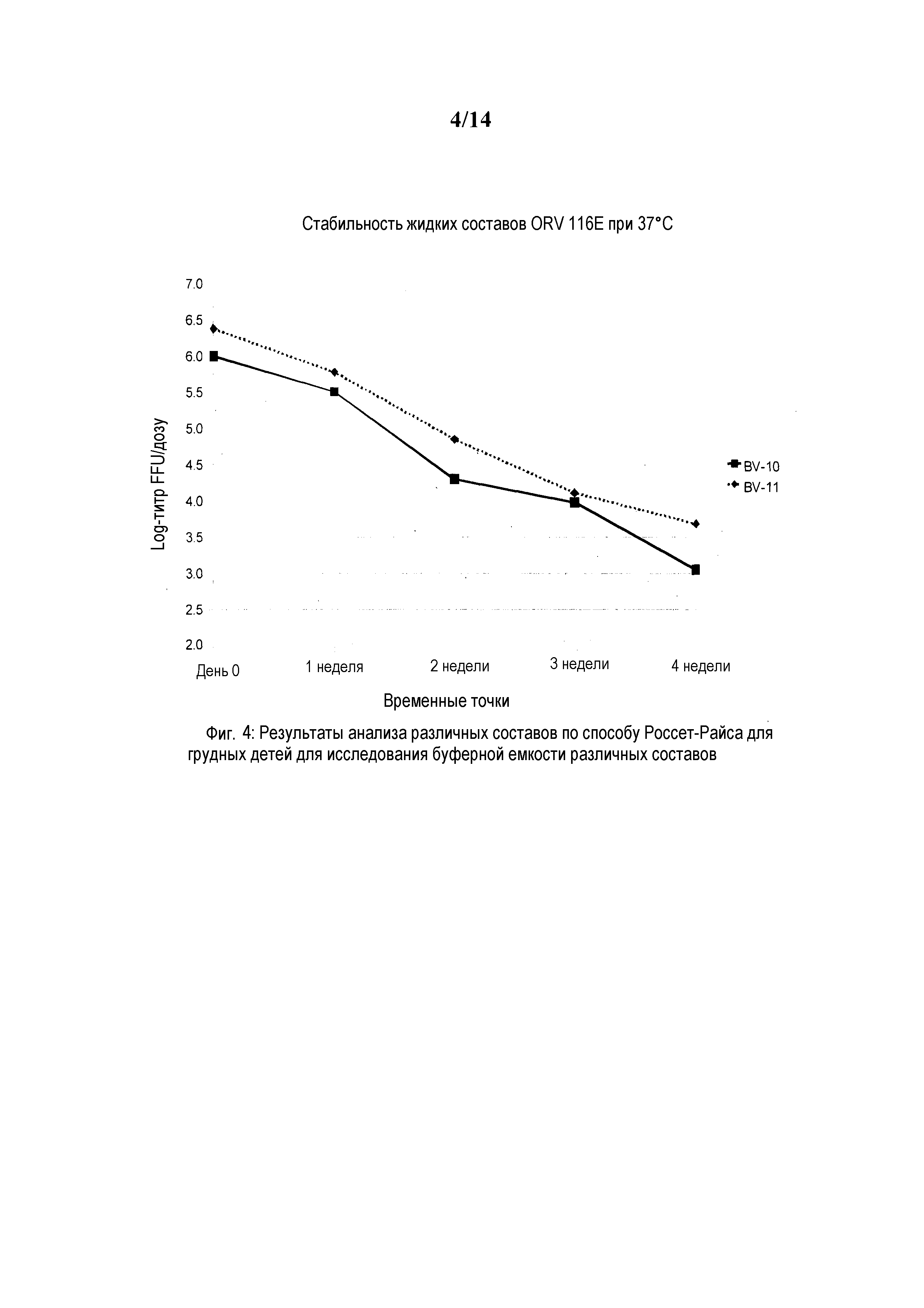
Фиг. 4: Стабильность составов ротавирусной вакцины при 37°C с цитратно-фосфатными буферами.
Фиг. 5: Исследования стабильности составов ротавирусной вакцины с использованием цитратно-бикарбонатных буферов при 2°-8°C.
Фиг. 6: Исследования стабильности составов ротавирусной вакцины с использованием цитратно-бикарбонатных буферов при 25°C.
Фиг. 7: Исследования стабильности составов ротавирусной вакцины с использованием карбонатно-бикарбонатных буферов при 2-8°C.
Фиг. 8: Исследования стабильности составов ротавирусной вакцины с использованием карбонатно-бикарбонатных буферов при 25°C.
Фиг. 9: Исследования стабильности составов ротавирусной вакцины с использованием буферов с гидроксикарбонатом магния при 2-8°C и 25°C.
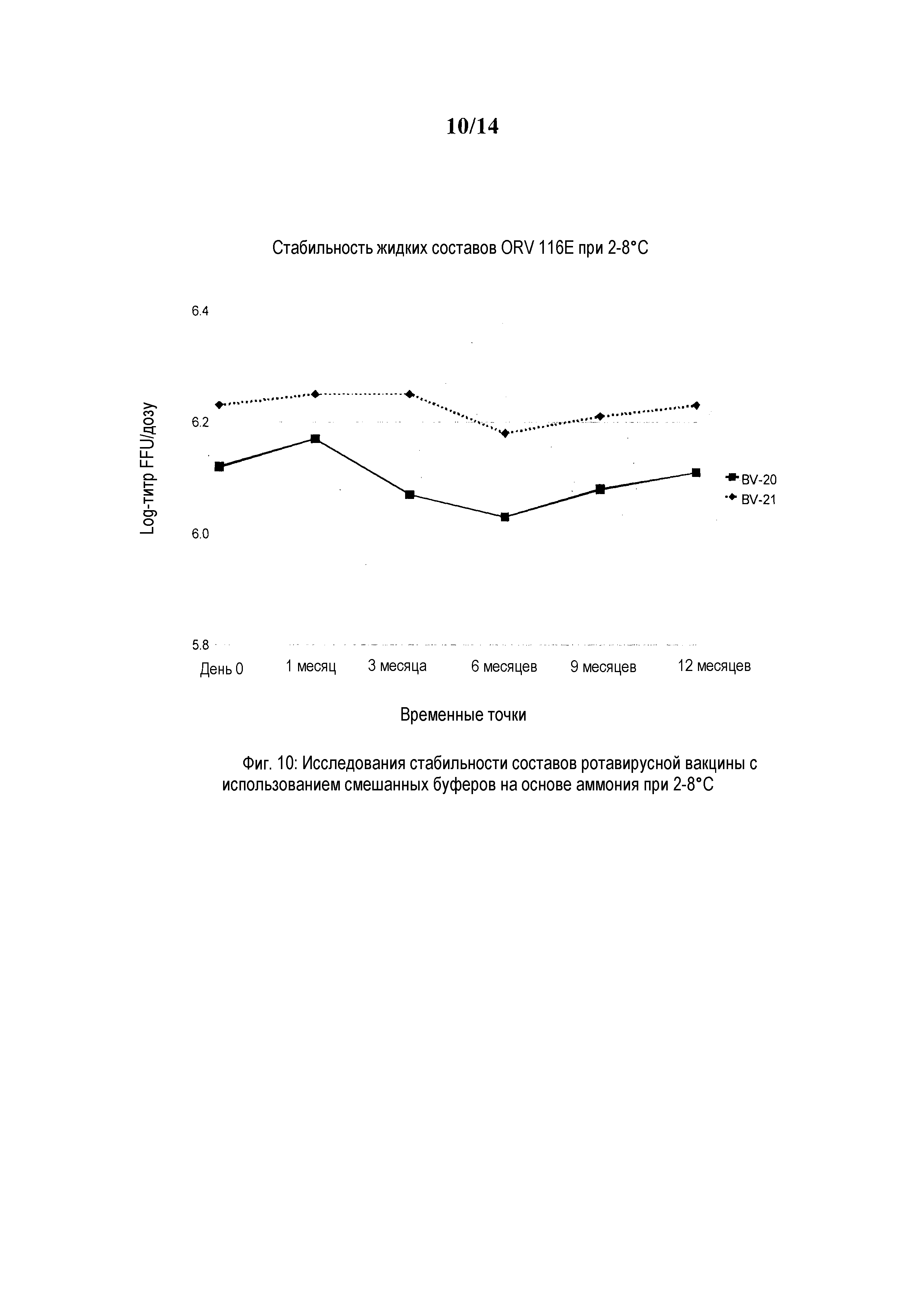
Фиг. 10: Исследования стабильности составов ротавирусной вакцины с использованием смешанных буферов при 2-8°C.
Фиг. 11: Стабильность составов ротавирусной вакцины при 25°C со смешанными буферами на основе аммония.
Фиг. 12: Стабильность составов ротавирусной вакцины при 37°C со смешанными буферами на основе аммония.
Фиг. 13: Воздействие различных буферов на составы ORV на log титр в зависимости от времени.
Фиг. 14: Воздействие различных буферов на составы ORV на потерю log титра в зависимости от времени.
ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Определения:
FFU/мл (единицы флуоресцентного фокусирования на мл): Измерение концентрации живого вируса в данном количестве жидкости/собранных клеток. Ее измеряют путем нанесения известного количества вирусной жидкости на слой культивируемых клеток, которые заражаются вирусом, и последующего подсчета участков в культуре, которые выглядят инфицированными.
Целевой титр: Каждая единичная доза ротавирусной вакцины для человека должна содержать не менее чем 105.5 ffu/дозу, которая называется целевой титр, для индуцирования иммуногенности вакцины, до конца срока годности вакцины.
Требуемую вирусную массу добавляют на основании титра массы и целевого титра для состава на основании объема. Типичные титры массы ротавируса составляют приблизительно 107.5 на дозу, в то время как титры состава около 106.0 или 105.5 на дозу, за исключением нескольких партий, которые были составлены с титром примерно 104.0 для того чтобы проверить влияние титра вакцины на стабильность данной композиции. Все компоненты в результате выражены в процентах по массе/объему.
Типичный целевой титр составлял примерно 106.0 во время получения вакцины; стояла задача получить состав вакцины с титром минимум 105.0 после допустимой потери титра 0,5 log (с запасом на ошибку оценки титра примерно +/-0,30), после двух лет хранения при 2°-8°C. Любая композиция, которая показывала потерю титра больше чем 0,3, по сравнению с титром дня 0 при 2°-8°C, рассматривалась как демонстрирующая признаки нестабильности. Конечно, потери титра достаточно высоки при 25°C и 37°C в зависимости от времени хранения, но эти результаты используют только с целью скрининга.
Общий объем дозы, приведенный в качестве примера в различных составах в диапазонах от 0,5 мл до 2,0 мл, имеет составы с учетом того факта, что вакцина способна легко абсорбироваться новорожденным. Эксципиенты (сахара) растворяют в желаемом новом буферном растворе/растворах, поскольку это является обычной практикой для биологических препаратов, в то время как стабилизаторы [(Сывороточный альбумин человека (САЧ)/Гидролизат лактальбумина (LAH)] готовят в виде водных растворов (в воде для инъекций), и стерильно фильтруют все растворы. Оба этих раствора получают на основании массы/объема. Хотя на основании исследований по нейтрализации кислоты известно, что общий объем вакцины с буфером составляет 2,5 мл, были также протестированы меньшие объемы буфера. Это было также подтверждено информацией по коммерческим ротавирусным вакцинам, находящейся в общем доступе.
В соответствии с требованиями, подробные варианты осуществления настоящего изобретения описаны в настоящем документе с помощью примеров; однако, следует понимать, что раскрытые варианты осуществления являются лишь примерами изобретения, которые могут быть воплощены в различных формах. Таким образом, конкретные структурные и функциональные подробности, описываемые в настоящем документе, не должны рассматриваться, как ограничивающие, а лишь в качестве основы для формулы изобретения и в виде типичной основы для обучения специалиста в данной области для того чтобы по-разному использовать настоящее изобретение практически в любой соответствующей подробной структуре. Кроме того, термины и фразы, которые использованы в настоящем документе, предназначены не для ограничения, а скорее для того чтобы обеспечить понятное описание изобретения.
Пример 1: Способ адаптации ротавируса в присутствии рекомбинантного трипсина
Маломасштабные исследования проводили с использованием T-колб и CF1 (клеточная фабрика 1), далее увеличивая масштаб до CF40 для исследования сравнительной инфекционности и выходов ротавируса в клетках Vero. После заражения, урожай вирусной жидкости (VH) на мл в отношении выхода по урожаю наблюдали через каждые 48 часов. Проводили три серии экспериментов с использованием Т-колб и наборов клеток и рассматривали среднее по трем экспериментам, результаты представлены в таблице ниже.
Таким образом, из экспериментов очевидно, что рекомбинантный трипсин дает лучшие выходы продукта по сравнению со свиным трипсином, поскольку свиной трипсин содержит в качестве примеси химотрипсин, а также свободен от любых потенциальных опасностей, связанных со свиным цирковирусом (PCV 1 и 2), а также с ПХБ.
ПРИМЕР 2: Буферная емкость различных новых буферов и вакцина с составами буферов
Оптимальный буфер можно выбирать, измеряя буферную емкость конкретного буфера. Буферную емкость измеряют как количество буфера, которое будет поддерживать pH в нейтральных условиях данного состава в высококислых средах. Как правило, чем ближе забуференный pH к pKa, тем больше буферная емкость. Буферную емкость различных буферов тестировали с использованием 34 мг-экв. соляной кислоты. Результаты измерений буферной емкости служили основанием для включения буферов в составы вакцины. Определение буферной емкости буферов и составов вакцины проводили с использованием 34 мг-экв. соляной кислоты и хорошо известного анализа Россет-Райса для грудных детей, принятый на известном уровне техники.
Пример 2.1: Буферные емкости различных буферов
Была проверена буферная емкость следующих новых буферов, которые могут быть включены в составы ротавирусной вакцины:
Выводы: Буфер с гидроксикарбонатом магния, карбонатно-бикарбонатная и цитратно-бикарбонатная комбинированные буферные системы представляют собой сильные буферы, и даже после добавления 20 мл концентрированной соляной кислоты (HCl), pH опускался приблизительно от 6,5 до 7,0 от начального pH. Лактатно-бикарбонатный буфер и 0,05 M цитратный и 0,1 M бикарбонатный буферы являются буферами умеренной силы, при этом pH достигает от 5,5 до 6,0 после добавления 20 мл HCl. Все вышеуказанные буферы способны нейтрализовать 5 мл HCl, когда pH находится в диапазоне от 9,0 до приблизительно 7,0. Поскольку объем желудочного сока составляет приблизительно от 3,0 мл до 5,0 мл, все эти буферы можно использовать в качестве буферов для сохранения pH вакцины в желудке. Когда эти буферы используют в составе, из-за присутствия наряду с буферами других эксципиентов 1 мл вакцины способен нейтрализовать 5 мл кислоты, но pH будет находиться около 6,0 вместо 7,0. pH 6,0 не дестабилизирует вирусный антиген, и, таким образом, эти буферы можно добавлять к пероральным составам вакцины.
Кроме вышеупомянутых новых буферов проверяли буферную емкость смешанных буферов на основе ацетата аммония. Смешанные комбинированные буферные системы на основе ацетата аммония не упоминаются ни в какой литературе в известном уровне техники относительно составов ротавирусной вакцины. Оценивали буферную емкость таких смешанных буферов на основе аммония. Был проверен смешанный буфер с аммонийными солями (ацетат аммония + бикарбонат аммония + ортофосфат диаммония в 0,5 M буфере) для подтверждения его буферной емкости. Добавляли от 0,5 до 2 мл смешанного буфера к 0,5 мл концентрированной соляной кислоты и измеряли pH.
Из вышеприведенной таблицы понятно, что даже после добавления концентрированной соляной кислоты к 0,5 мл буфера, буфер способен сохранять pH 7,25, который указывает на то, что эти аммониевые буферы представляют собой сильные буферы, которые могут противостоять изменениям pH после добавления концентрированной кислоты, и также, когда буфер добавляют постепенно от 0,5 мл до 2,0 мл, pH увеличивается в диапазоне от 7,7 до 8,0.
Пример 2.2: Буферная емкость различных составов вакцины и новых буферов
В попытках создать новые стабильные композиции вакцины и буферы мы приготовили большое количество составов с различными буферами в широком диапазоне концентраций. При создании таких композиций основой являлись несколько ведущих факторов:
• Способность нейтрализовать кислоту или буферная емкость выбранного буфера.
• Объем буфера должен быть меньше чем 2,0 мл для заданной кислотной системы.
• Стабильность комбинации буфер + вирусная вакцина.
Для таких исследований в качестве базовых композиций служили чистые жидкие вакцинные композиции без буферов, которые оказались стабильными при 2°-8°C. Еще раз, обобщая сказанное, композиции, которые показали потерю титра менее чем 0,5 log, или те, у которых конечный титр составлял более чем 105.50, считаются стабильными композициями.
2.2.1. Буферная емкость различных составов вакцины с цитратно-бикарбонатным, карбонатно-бикарбонатным и цитратно-фосфатным буфером была также протестирована с использованием 34 мг-экв. HCl и представлена в нижеприведенной таблице.
2.2.2. Анализ Россет-Райса для грудных детей (BRR): Поскольку ротавирусную вакцину вводят перорально, она будет подвергаться воздействию кислотности желудка, где pH составляет приблизительно от 1,8 до 2,0, из-за чего ротавирусный антиген будет инактивирован. Для предупреждения инактивации эффективности вируса, буферы, применяемые в составах, сохраняют состав с нейтральными уровнями pH. Инактивация ротавируса происходит при pH 2,0 или 3,0, но отсутствует или является минимальной при pH 4,0. Буферную емкость данного состава определяют как время поддержания pH состава выше 4,0 и оценивают посредством анализа Россет-Райса для грудных детей, который является валидированным способом и описан в известном уровне техники.
Процедура анализа BRR: Воду для инъекций добавляли к составу в лабораторном стакане на 50 мл до конечного объема 10 мл. Стакан помещали на водяную баню и поддерживали температуру 37°C. Измеряли и записывали начальный pH раствора. После этого 4,0 мл 0,1 N соляной кислоты добавляли в стакан, содержащий 10 мл конечного объема состава. Одновременно включали насос для добавления 0,5 мл/мин 0,1 N HCl с использованием перистальтического насоса. Записывали значения pH по времени каждую минуту до тех пор, пока сохранялся pH 4,0 или выше. Останавливали часы и насос. (Ссылка: Geigy scientific Tables, Volume 1, 1981 addition, Page 126). Была проверена буферная емкость некоторых составов ротавирусной вакцины с новыми комбинированными буферными системами (соответствующие компоненты составов были упомянуты при наличии подходящей возможности). Результаты буферной емкости представлены в таблице ниже.
Цитратно-бикарбонатный буфер представляет собой буфер с 0,03 M тринатрия цитрата и 0,3 M бикарбоната натрия.
Пример состава BV-8 содержит сахарозу 40,0% масс./об., трегалозу 0,5% масс./об., лактозу 5,0% масс./об., гидролизат лактальбумина 0,5% масс./об., рекомбинантный сывороточный альбумин человека (рСАЧ) 0,08% масс./об., 0,5 M смешанный буфер с диаммония водород ортофосфатом, ацетатом аммония и бикарбонатом аммония наряду с ротавирусным антигеном 116E с объемом дозы 1 мл.
Пример состава BV-9 содержит сахарозу 30,0% масс./об., трегалозу 2% масс./об., лактозу 5,0% масс./об., гидролизат лактальбумина 1% масс./об., рСАЧ 0,08% масс./об., 0,5 M смешанный буфер с диаммония водород ортофосфатом, ацетатом аммония и бикарбонатом аммония наряду с ротавирусным антигеном 116E с объемом дозы 1,5 мл.
CPB представляет собой буфер с 0,35 M тринатрия цитрата и 0,05 M фосфата калия.
Пример состава BV-10 содержит сахарозу 40,0% масс./об., трегалозу 0,5% масс./об., гидролизат лактальбумина 0,5% масс./об., рСАЧ 0,35% масс./об., буфер с 0,05 M фосфата калия и 0,35 M тринатрия цитрата наряду с ротавирусным антигеном 116E с объемом дозы 2,0 мл.
Пример состава BV-11 содержит сахарозу 40,0% масс./об., трегалозу 0,5% масс./об., гидролизат лактальбумина 0,5% масс./об., рСАЧ 0,35% масс./об., 1,1 M фосфатно-калийный буфер с объемом дозы 2,0 мл.
Выводы
Также измеряли отдельно 2,5 мл цитратно-бикарбонатного буфера, который вводили новорожденным отдельно перед введением вакцины по ранее заведенному порядку, и который сохранял pH 4 и выше в течение приблизительно 12 мин. Примеры составов BV-8 и BV-9 представляют собой партии со смешанными буферами на основе аммония и способны нейтрализовать, и сохраняли pH выше 4,0 в течение приблизительно 15 мин.
Конкретный пример состава BV-10, который включает приготовленную комбинированную буферную систему, где концентрация цитрата повышена до 0,35 М и фосфат снижен до 0,05 M, проверяли на буферную емкость с использованием 2,0 мл в качестве объема дозы. Наблюдали буферную емкость, которая составила 12 мин. Этот состав также способен нейтрализовать достаточное количество кислоты и демонстрирует хорошую буферную емкость. Таким образом, в этом буфере был рассмотрен 0,35 M цитрат.
Пример 3: Стабильность составов ротавирусной вакцины с новыми буферами
Среди новых буферов некоторые из наиболее благоприятных буферов, демонстрирующие лучшую стабильность по сравнению с другими, включают карбонатно-бикарбонатную буферную систему, буфер с гидроксикарбонатом магния, цитратно-бикарбонатную буферную систему, и смешанный буфер с солями аммония. Были проведены исследования окончательной стабильности вакцин с этими новыми буферами вместе с финальными составами ротавирусной вакцины и способами их производства.
Эксперименты включали введение ионов цинка для дополнительной стабильности конечных составов ротавирусной вакцины. Согласно наблюдениям ионы цинка повышают стабильность вакцины за счет взаимодействия с композицией способом, известным в данной области. Inge Erk et.al Journal of Virology, Vol. 77, No. 6 Mar. 2003, p. 3595-3601 демонстрирует, что основные белки капсида тримеров VP6 ротавируса играют значительную роль обеспечивая гибкость вируса в присутствии ионов цинка при данном pH и температуре. Новые составы ротавирусной вакцины, таким образом, содержат ионы цинка также для придания лучшей стабильности ротавирусному антигену в конечных составах.
Штамм ротавируса человека 116E является природно ослабленным (реассортант человеческого и бычьего ротавирусов). Исследования стабильности конечных составов с ротавирусным антигеном проводили в различных диапазонах температур. Различные составы вакцины подвергали температурам от 2 до 8°C, и 25°C. Наблюдения титра вакцины проводили в значениях FFU/доза (фокусообразующие единицы), которые отмечали через равные промежутки времени в зависимости от протоколов. Рассматривали максимальное падение потери титра вакцины в диапазоне 0,3 log для сохранения в качестве стабильного состава ротавирусной вакцины с новыми буферными системами при 2-8°C. Как объяснялось ранее, вирусный титр вакцины измеряют как функцию от времени хранения для оценки стабильности состава. Для каждого из случаев, описанных в нижеизложенных примерах, наблюдали, что после 24 месяцев хранения при 2-8°C состав вакцины остался стабильным (без потери титра или с минимальной потерей с учетом величины ошибки). Однако при комнатной температуре наблюдали максимум 1,5 log потери титра вакцины в течение периода в шесть месяцев. Такая потеря титра вакцины приводит к выводу о стабильности вакцины при 25°C в течение шести месяцев.
Пример 3.1: Стабильность ротавирусных составов с комбинациями цитратно-фосфатного буфера
Пример состава BV-10 содержит сахарозу 40,0% масс./об., трегалозу 0,5% масс./об., гидролизат лактальбумина 0,5% масс./об., рСАЧ 0,35% масс./об., буфер с 0,05M фосфата калия и 0,35M тринатрия цитрата наряду с ротавирусным антигеном 116E с объемом дозы 2,0 мл.
Пример состава BV-11 содержит сахарозу 40,0% масс./об., трегалозу 0,5% масс./об., гидролизат лактальбумина 0,5% масс./об., рСАЧ 0,35% масс./об., 1,1M фосфатно-калийный буфер с объемом дозы 2,0 мл.
Данные по стабильности BV-10 и BV-11 представлены ниже:
Пример 3.2: Составы вакцины с буфером с 0,03 M цитрата и 0,3 M бикарбоната (CB-буфером)
Безводный тринатрия цитрат (молекулярная масса 294,1 г) в количестве 9,6 г и безводный бикарбонат натрия (молекулярная масса 84,01 г) в количестве 25,6 г последовательно добавили к 500 мл в стерильную стеклянную бутыль, таким образом, чтобы получить 0,032 M цитрата и 0,3 M бикарбоната. Компоненты полностью растворяли и доводили объем до 1 литра водой для инъекций. Проверяли pH и поддерживали его на уровне от 8,2 до 8,4. Сосуд с буфером затем переносили в 2 л сосуд для работы под давлением из нержавеющей стали и соединяли с фильтром. Раствор фильтровали через 0,2 мкм фильтр в боксе микробиологической безопасности с использованием сжатого воздуха. Буфер собирали в другую стерильную бутыль, бутыль помечали и хранили при 2-8°C для дальнейшего использования.
Составы были приготовлены с использованием этой (0,032 M)цитратно-(0,3M)бикарбонатной комбинированной буферной системы, включая ротавирусный антиген 116E с 106 ffu/дозу и другие стабилизаторы и компоненты, упомянутые ниже в объемах дозы, указанных в последующей таблице соответственно для каждого состава (который идентифицируется по уникальному номеру состава, как соответствующим образом обозначено Bharat Biotech International Limited в таблицах); была протестирована стабильность состава вакцины от 2° до 8°C, и при 25°C в различные интервалы времени, вплоть до 2 лет, и представлена в соответствующих столбцах (фиг. 5 и 6).
Пример 3.3: Составы вакцины с карбонатным и бикарбонатным буфером/буферами (0,2 M и 0,1 M) (CAB-буфер)
Одной из других буферных систем, хорошо подходящих для использования для препаратов вакцин, которые будут приниматься внутрь и усваиваться организмом человека, является карбонатно-бикарбонатная буферная система. Это потому, что эта буферная система отвечает приблизительно за 80% внеклеточного забуферивания и присутствует в плазме крови в форме комбинации угольной кислоты (H2CO3) и бикарбоната (HCO3-) для поддержания pH в пределах 7,35-7,45. Эта система чрезвычайно благоприятна для использования в органической среде, поскольку она отвечает требованиям не-ингибирования действия ферментов, имеет подходящий диапазон щелочного pH, обладает простотой и разумной хорошей стабильностью. Эта комбинированная буферная система не описана в известном уровне техники, в частности, относительно молярности бикарбоната менее чем 0,15 M.
Пример 5.1: 0,2 M карбонатно-бикарбонатный буфер
Карбонат натрия безводный (молекулярная масса 105,99 г) в количестве 1,69 г и бикарбонат натрия безводный (молекулярная масса 84,01 г) в количестве 15,4 г последовательно добавили к 500 мл в стерильную стеклянную бутыль, таким образом, чтобы получить 0,2 M карбоната и 0,2 M бикарбоната. Компоненты полностью растворяли и доводили объем до 1 литра водой для инъекций. Проверяли pH и поддерживали его на уровне от 9,2 до 9,5. Сосуд с буфером затем переносили в 2 л сосуд для работы под давлением из нержавеющей стали и соединяли с фильтром. Раствор фильтровали через 0,2 мкм фильтр в боксе микробиологической безопасности с использованием сжатого воздуха. Буфер собирали в другую стерильную бутыль, бутыль помечали и хранили при 2-8°C для дальнейшего использования.
Пример 5.2: 0,1 M карбонатно-бикарбонатный буфер
Карбонат натрия безводный (мол. масса 105,99) в количестве 0,53 г и бикарбонат натрия безводный (мол. масса 84,01) в количестве 7,98 г последовательно добавили к 500 мл в стерильную стеклянную бутыль, таким образом, чтобы получить 0,1 M карбонат и 0,1 М бикарбонат. Компоненты полностью растворяли и доводили объем до 1 литра водой для инъекций. Проверяли pH и поддерживали его на уровне от 9,2 до 9,5. Сосуд с буфером затем переносили в 2 л сосуд для работы под давлением из нержавеющей стали и соединяли с фильтром. Раствор фильтровали через 0,2 мкм фильтр в боксе микробиологической безопасности с использованием сжатого воздуха. Буфер собирали в другую стерильную бутыль, бутыль помечали и хранили при 2-8°C для дальнейшего использования.
Составы были приготовлены с использованием этой приготовленной 0,2 M карбонатно-бикарбонатной комбинированной буферной системы и 0,1 M карбонатно-бикарбонатной комбинированной буферной системы, включая ротавирусный антиген 116E с 106 ffu/дозу и другие стабилизаторы и компоненты, упомянутые ниже в объемах дозы, указанных в последующей таблице соответственно для каждого состава (который определяется по уникальному номеру состава, как указано в таблице 3(g)); была протестирована стабильность состава вакцины от 2° до 8°C, и 25°C в различные интервалы времени, вплоть до 2 лет, которая представлена в соответствующих столбцах (фиг. 7 и 8).
Стабильность при 25°C
Пример 3.4: Составы вакцины с 0,1 M буфером с гидроксикарбонатом магния (MHC-буфер)
Обезвоженный гидроксикарбонат магния (молекулярная масса 314,98 г) последовательно добавили к 500 мл воды для инъекций в стерильной стеклянной бутыли, для того чтобы получить 0,1 M гидрокарбонат. Компоненты хорошо встряхивали для однородности, поскольку эта соль нерастворима в воде. Суспензию доводили до объема 1 литр водой для инъекций, полностью растворяли и доводили объем до 1 литра водой для инъекций. Проверяли pH и поддерживали его на уровне от 10 до 10,5. Раствор стерилизовали автоклавированием при 121°C в течение 30 мин. Буфер собирали в другую стерильную бутыль, бутыль помечали и хранили при 2-8°C для дальнейшего использования.
Получали составы с использованием этой 0,1 M комбинированной буферной системы с гидроксикарбонатом магния, включая ротавирусный антиген 116E с 106 ffu/дозу и другие стабилизаторы и компоненты, упомянутые ниже в объемах дозы, указанных в последующей таблице соответственно для каждого состава (который определяется по уникальному номеру состава, как указано в таблице 3(j)); была протестирована стабильность состава вакцины от 2° до 8°C, и 25°C в различные интервалы времени, вплоть до 2 лет и представлена в соответствующих столбцах (фиг. 9).
Стабильность при 2-8°C и 25°C
Пример 3.5: Составы вакцины с 0,5 M смешанным буфером с солями аммония (Смешанный Буфер)
Диаммония водород ортофосфат (мол. масса 132,06 г) в количестве 66,03 г, ацетат аммония (мол. масса 77,08 г) в количестве 38,54 г и бикарбонат аммония (мол. масса 79,02 г) в количестве 39,51 г последовательно добавили к 500 мл в стерильную стеклянную бутыль, таким образом, чтобы получить 0,5 M смешанный буфер с солями аммония. Компоненты полностью растворяли и доводили объем до 1 литра водой для инъекций. Проверяли pH и поддерживали его на уровне от 7,6 до 7,8. Сосуд с буфером затем переносили в 2 л сосуд для работы под давлением из нержавеющей стали и соединяли с фильтром. Раствор фильтровали через 0,2 мкм фильтр в боксе микробиологической безопасности с использованием сжатого воздуха. Буфер собирали в другую стерильную бутыль, бутыль помечали и хранили при 2-8°C для дальнейшего использования.
Получали составы с использованием этой 0,5 M смешанной комбинированной буферной системы, включая ротавирусный антиген 116E с 106 ffu/дозу и другие стабилизаторы и компоненты, упомянутые ниже в объемах дозы, указанных в последующей таблице соответственно для каждого состава (который определяется по уникальному номеру состава, как указано в таблице 3(l)); была протестирована стабильность состава вакцины от 2° до 8°C в различное время в течение периода в 1 год и представлена в соответствующих столбцах (фиг. от 10 до 13).
Стабильность при 2-8°C
Стабильность BV-9 и BV-10 при 2-8°C
Пример 4: Значения pH буферов и составов вакцины до и после периода стабильности
Также важно проверить pH буферов, используемых в различных составах, и соответствующие значения pH, поскольку буферы присутствуют в конечных составах вакцины. Это делают для того чтобы проверить заданные диапазоны pH конечного состава вакцины во время и после срока хранения вакцины. Такие данные представлены ниже. Системы на основе бикарбоната имеют pH выше 8, что превышает физиологический буферный pH. Однако вакцина остается стабильной даже через два года при 2-8°C после периода стабильности.
Кроме того, эксперименты проводили с постоянными компонентами состава, в тоже время меняя различные буферы, и исследовали стабильность составов вакцины в течение длительных периодов времени. Соответствующие фиг. 13 и 14 показывают сравнительную стабильность вакцины с различными новыми буферами и постоянными компонентами состава, которые включают сахарозу 40% масс./об., трегалозу 0,5% масс./об., LAH 1% масс./об., рСАЧ 0,35% масс./об. и ротавирусный антиген 116E.
Ссылки
1. Wainwright, WH. The Development of Live, Attenuated Rotavirus Vaccines: A Manufacturer's Resource Guide. Seattle: PATH; 2006.
2. Bharat Biotech's International PCT publication WO 2007/132480 (granted Indian Patent 242868 and granted in UK 0821386.0) and WO 2011/07363.
3. US patent 6403098 (Merck) and US patent 6616931 (Merck).
4. Inge Erk et.al Journal of Virology, Vol. 77, No. 6 Mar. 2003, p. 3595-3601.
5. http://www.ou.edu/research/electron/bmz5364/buffers.html visited Feb 10, 2012.
6. http://nature.berkeley.edu/soilmicro/methods/phosphate%20buffer.pdf visited Feb 10, 2012.
7. Guidelines to assure the quality, safety and efficacy of live attenuated rotavirus vaccines (oral) WHO Technical Report Series No 941, 2007.
8. Harry B. Greenberg, Mary K. Estes, Rotaviruses: From Pathogenesis to Vaccination, doi:10.1053/j.gastro.2009.02.076. (Gastroenterology 2009).
9. Penelope H. Dennehy, Rotavirus Vaccines: an Overview, Clinical Microbiology Reviews, Jan. 2008, Vol. 21, No. l, p. 198-208.
10. Bresee JS, Glass RI, Ivanoff B, Gentsch J. Current status and future priorities for rotavirus vaccine development, evaluation and implementation in developing countries. Vaccine 1999; 17: 2207-22.
11. (Ref:Geigy scientific Tables, Volume 1,1981 addition, Page 126).
Реферат
Изобретение относится к медицине, а именно к лечению инфекционных болезней, и может быть использовано для получения вакцинной композиции, содержащей ротавирусные антигены. Вакцина включает ротавирусный антиген 116Е, комбинированную буферную систему, выбранную из: буфера с 0,35 М тринатрия цитратом - 0,05 М фосфатом калия, буфер с 0,03 М цитратом натрия - 0,3 М бикарбонатом натрия, буфер с 0,1 М-0,2 М карбонатом натрия и бикарбонатом натрия, буфер с гидроксикарбонатом магния и буфер с ацетатом аммония, бикарбонатом аммония и диаммония ортофосфатом; комбинацию сахаров, состоящую из 20%-75% масс./об. сахарозы, до 10% масс./об. лактозы и до 1% масс./об. трегалозы; 0,4% масс./об. рекомбинантного сывороточного альбумина человека. Использование изобретения позволяет получить стабильную вакцинную композицию для перорального введения. 8 з.п. ф-лы, 14 ил., 3 табл., 4 пр.

Комментарии