Способ культивирования вида haematococcus для производства астаксантина - RU2730670C2
Код документа: RU2730670C2
Чертежи

Описание
Настоящее изобретение относится к усовершенствованному способу культивирования вида Haematococcus для производства астаксантина.
Микроскопическая водоросль Haematococcus pluvialis известна своим вторичным метаболическим соединением, а именно астаксантином, который обладает высокой пигментационной и антиоксидантной способностью. Его окрашивающее свойство в основном используется для аквакультуры, чтобы увеличить розовый цвет лосося и креветочного мяса (Lorenz & Cysewski 2000). В качестве антиоксидантного агента астаксантин продается как вспомогательный продукт для здоровья человека (см. AstaReal, Algatechnologies Ltd, Cyanotech Ltd, Nutrex Hawaii Ltd, Fuji Health Science Inc.). Основным источником астаксантина в наши дни является химический синтез (см. CARDAX и BASF, предназначен только для кормов для животных).
Тем не менее, астаксантин из природных источников приобретает повышенный интерес и обладает высокой важностью из-за нескольких исследований, которые показывают лучшую биодоступность и антиоксидантную способность и общее предпочтение потребителями натуральных или «био» продуктов (Nguyen 2013).
Тем не менее, производство астаксантина H. pluvialis по-прежнему является дорогостоящей и сложной технологией. В какой-то степени это основано на том факте, что производство астаксантина H. pluvialis происходит обычно, когда деление клеток прекращается. Производство астаксантина индуцируется определенными факторами стресса, такими как высокая интенсивность света (более 200 мкмоль фотонов м-2с-1), солевой стресс и дефицит питательных веществ (Aflalo et al. 2007).
Поэтому современные методы культивирования состоят из двух фаз: (i) «зеленой фазы», при которой параметры культивирования являются оптимальными для получения высокой плотности клеток для обеспечения достаточной биомассы (интенсивность света: 50-200 мкмоль фотоны м-2 с-1, температура: 20-25 °С, рН 6,5-8); и (ii) «красной» фазы, при которой стресс применяется для увеличения выработки и накопления астаксантина, сопровождающихся значительным снижением или прекращением деления клеток. Следовательно, с точки зрения астаксантина в качестве продукта, общепринятые технологии страдают от непроизводительной зеленой фазы, что составляет около 50% от общего периода производства (Suh et al. 2006; Aflalo et al. 2007). Кроме того, двухстадийная процедура требует более высоких технических усилий, требуя две отдельные биореакторные системы: для обеспечения низкой интенсивности света зеленая фаза в основном располагается внутри помещения, освещенная искусственными источниками света, что позволяет избежать фотохимического стресса, тогда как красная фаза извлекает преимущество при высокой интенсивности солнечного излучения, обеспечиваемого в наружных фотобиореакторах.
Помимо очевидных недостатков прерывистого двухфазного метода, современные системы культивирования основаны на увеличении суспензии в трубчатых реакторах и открытых прудах (Lorenz и Cysewski 2000). Однако эти системы, как известно, имеют высокие затраты, например, на строительство, эксплуатацию и техническое обслуживание (Ozkan et al. 2012). Недавние достижения в области проектирования биореакторов продемонстрировали, что биореакторы на биопленках дают возможность преодолеть некоторые из этих недостатков биореакторов суспензионного типа (например, Berner et al. 2014). В частности, H. pluvialis успешно выращивали в биопленках с использованием биореакторов с пористым субстратом при низкой интенсивности света (Wan et al. 2014; Yin et al. 2015; Zhang et al. 2014). Образование астаксантина также описано в золь-гель-иммобилизованных живых микроводорослях (Fiedler et al., 2007).
Задача настоящего изобретения состоит в том, чтобы обеспечить улучшенную выработку астаксантина с использованием биопленочного (иммобилизованного) культивирования Haematococcus в одностадийной процедуре с использованием высокой интенсивности света для увеличения производительности биомассы и для стимулирования и увеличения выработки астаксантина. Другая цель изобретения заключается в том, чтобы избежать недостатков двухстадийной обработки уровня техники.
Сущность изобретения
Задача, лежащая в основе изобретения, решается способом культивирования вида Haematococcus для выработки астаксантина, который включает стадии:
- обеспечения субстрата,
- размещения вида Haematococcus на поверхности субстрата,
- экспонирования вида Haematococcus, расположенного на субстрате, высокой интенсивности света с начала процесса культивирования и
- ухода от двухстадийного процесса культивирования вида Haematococcus с первой стадией, которая является первоначальным культивированием, происходящим при воздействии на вид Haematococcus низкой световой энергии, за которой следует вторая стадия последующего культивирования вида Haematococcus при воздействии на вид Haematococcus более высокой, чем на первой стадии, световой энергии для индукции синтеза астаксантина;
- необязательно, сбора культивируемого вида Haematococcus ; и/или
- выделения астаксантина.
Изобретение основано на неожиданном обнаружении того, что не обязательно получать достаточное количество клеточной массы вида Haematococcus на первой стадии (зеленая фаза) при воздействии низкой освещенности и после образования достаточного количества клеточной массы индуцировать образования астаксантина при высокой интенсивности света.
В отличие от культивирования вида Haematococcus, в частности H. pluvialis, в соответствии с текущим уровнем техники, которое является двухстадийным культивированием, способ изготовления по настоящему изобретению предусматривает одностадийное культивирование как биомассы, так и астаксантина при высокой интенсивности освещения в сочетании с низкими затратами на техническое обслуживание и сбор, что, в частности, обеспечивается применением фотобиореактора на биопленках.
Согласно изобретению термин «высокая интенсивность света» понимается специалистом не как относительный термин, а как конкретный, например, эквивалентный, по меньшей мере, около 150, 200, 250 или 500 мкмоль фотонов м-2с-1 или более.
Факторы стресса - это факторы окружающей среды, которые индуцируют выработку астаксантина у вида Haematococcus, в частности H. pluvialis, такие как интенсивность света выше 150 мкмоль фотонов м-2с-1, соленость (0,8% NaCl), температуры выше 30oC и голодание по питательным веществам в частности по азоту и фосфору, но также дефициты по другим веществам также могут играть определенную роль. В частности, содержание астаксантина в клетках вида Haematococcus, в частности H. pluvialis, выращенных в биопленках, как описано в данном документе, все еще может быть увеличено на около 50% при воздействии на клетки среды, не содержащей азота или фосфора, в дополнение к высокой интенсивности света. В той же самой обстановке общая продуктивность астаксантина на поверхность роста все еще может быть увеличена вплоть до около 15% за счет применения истощения азота и/или фосфора.
Свет, который используется для культивирования H. pluvialis, обычно находится в ультрафиолетовом и видимом диапазоне от 300 до 780 нм.
Имеются некоторые данные о выработке биомассы H. pluvialis при высокой интенсивности света (около 1000 мкмоль фотонов м-2с-1), однако накопление астаксантина низкое и происходит только при высоком освещении в сочетании с ограничением питательных веществ (Del Río et al. 2005; Garcia-Malea López et al. 2006). Согласно изобретению весь процесс культивирования может быть выполнен в одностадийном режиме с высокой интенсивностью (естественной) освещенности и в зависимости от способа сбора, он может быть оптимизирован для непрерывного процесса производства с высокой продуктивностью биомассы, высоким содержанием астаксантина и высокой производительностью астаксантина. За 10 дней при интенсивности света 785 мкмоль фотонов м-2с-1 производительность биомассы может достигать 16 г сухого вещества м-2д-1 при содержании астаксантина в 2-2,5% сухого вещества. Таким образом, производительность астаксантина может достигать 0,39 мг м-2д-1. В обычных двухстадийных подходах, эти значения имеют тенденцию быть ниже, даже только в случае второй стадии, а именно, в красной фазе. Более точный расчет, учитывающий весь период для обеих стадий, будет еще ниже, как отмечает Wang et al. (2013).
В одном из воплощений настоящего изобретения вид Haematococcus является Haematococcus pluvialis. Изобретение далее будет описано со ссылкой на H. pluvialis. Специалист в данной области понимает, что раскрытие, относящееся к H. pluvialis, также применимо к другим видам Haematococcus, которые способны продуцировать астаксантин.
В другом воплощении изобретения низкая энергия света на первой стадии (зеленая фаза) составляет от около 50 мкмоль фотонов м-2с-1 до менее чем около 200 мкмоль фотонов м-2с-1.
В еще одном воплощении более высокая энергия света на второй стадии (красная фаза) составляет, по меньшей мере, около 200 мкмоль фотонов м-2с-1, в частности, по меньшей мере, около 500 мкмоль фотонов м-2с-1.
В другом воплощении изобретения Haematococcus культивируется на поверхности материала (субстрата).
В еще одном воплощении изобретения материал представляет собой листовой материал.
В другом воплощении изобретения листовой материал является пористым.
В следующем воплощении изобретения листовой материал выбирают из группы, состоящей из бумаги, сложного эфира целлюлозы, в частности, ацетата целлюлозы, сложного эфира целлюлозы, целлюлозы, нитрата целлюлозы, полиамидов, сложных полиэфиров и/или полиолефинов.
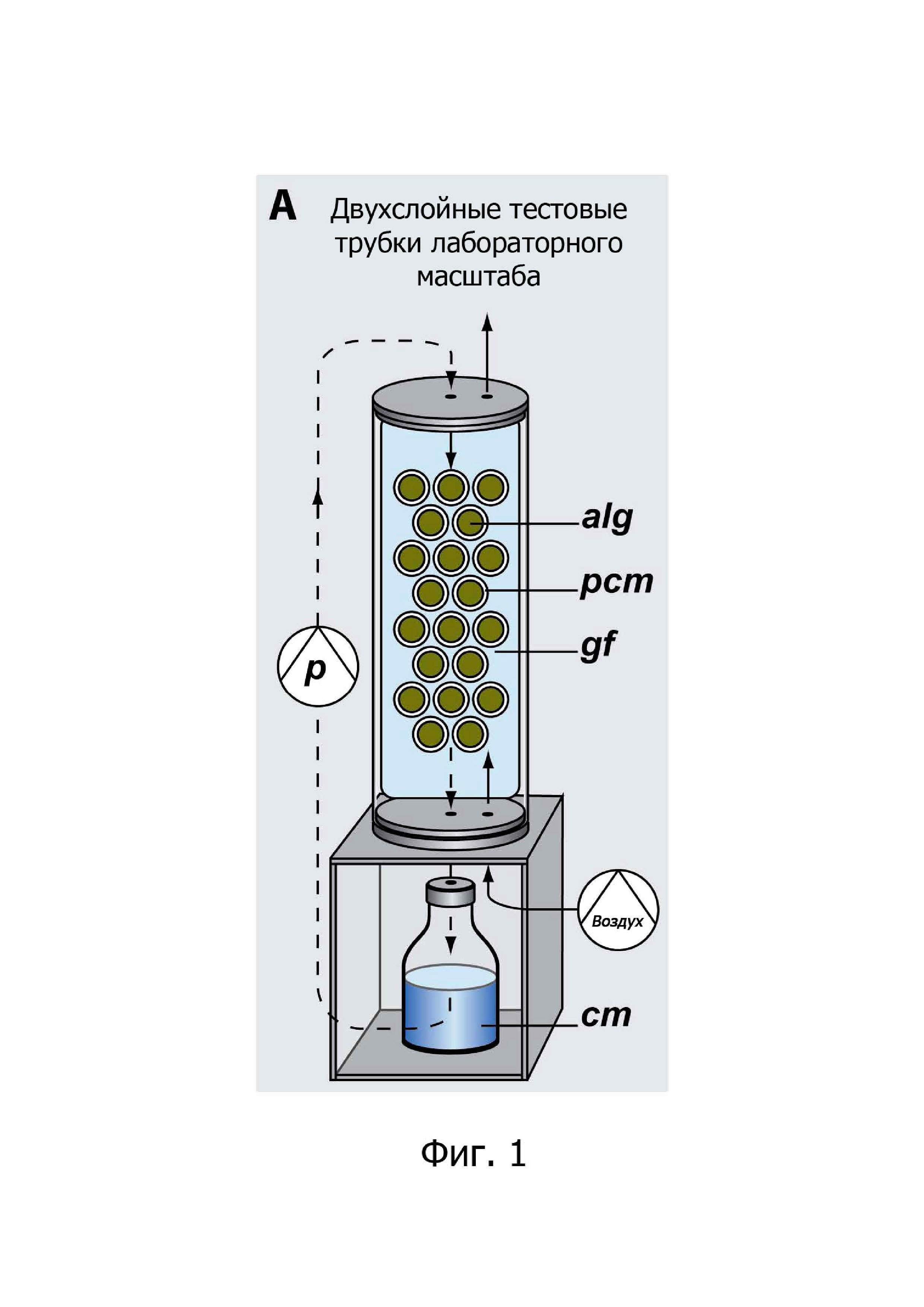
На фиг. 1 показана двухслойная тестовая трубка лабораторного масштаба.
На фиг. 2 показана выработка биомассы и астаксантина H. pluvialis, культивируемых при различных интенсивностях света.
На фиг. 3 сравнивается производительность биомассы (г м-2) и астаксантина (г м-2) H. pluvialis 10-дневного одностадийного процесса, представленного в данном документе, в сравнении с гипотетическим двухстадийным процессом PSBR, объединяющим «зеленую фазу» и «красную фазу», по 5 дней каждая.
Подробное описание изобретения
В WO 2005/010140 A1 описан особенно полезный способ культивирования микроводорослей в биопленке, их рост и сбор астаксантина, в частности пористый субстрат для применения в настоящем изобретении. Этот источник включен ссылкой. На фиг. 1 изображена двухслойная тестовая трубка лабораторного масштаба. Alg - иммобилизованные микроводоросли, pcm - поликарбонатная мембрана в качестве носителя для микроводорослей, gf - стекловолоконный мат, воздушный мембранный насос для подачи воздуха, cm - культуральная среда, представленная Schultze et al. (2015) для культивирования микроводорослей в биопленках при различных условиях освещения и СО2. Другие лабораторные модификации биореакторов с пористым субстратом, реализующие принцип, описанный в WO 2005/010140 A1, были описаны Liu et al. (2013); Murphy et al. (2012); Nowack et al. (2005), включенных ссылкой.
Масштабируемые разработки этой технологии, предлагающей поверхность субстрата с площадью в несколько квадратных метров для культивирования на биопленке, были описаны Naumann et al. (2013) и Zhang et al. (2015), которые включены ссылкой.
H. pluvialis выращивали с использованием биореакторов с пористым субстратом при низкой интенсивности света с использованием устройств, представленных Zhang et al. (2014), Wan et al. (2014) и Yin et al. (2015), все включены ссылкой.
Вместо культивирования H. pluvialis в этих вариациях биореакторов с пористым субстратом H. pluvialis можно выращивать, иммобилизовать в биопленке на другом субстрате, который не демонстрирует две основные поверхности. Это могут быть пластиковые или бетонные структуры и т.п., которые поставляются с культуральной средой, нанесенной на поверхность биопленки.
Используя эти процедуры культивирования, H. pluvialis можно культивировать и подвергать воздействию высокой интенсивности света.
На фиг. 2 показано культивирование H. pluvialis при разных уровнях освещенности с 5% дополнительного СО2 в эксперименте, как описано в примере 1 ниже. При низких интенсивностях света 45 мкмоль м-2с-1 (сравнимо с зеленой фазой культивирования суспензии) астаксантин не продуцируется и достигается только умеренная производительность биомассы. Высокая интенсивность света около 530 и 785 мкмоль м-2с-1 привела к увеличению производительности биомассы и астаксантина параллельно, показывая, что (i) индукция астаксантина светом высокой интенсивности не ухудшает рост, наблюдаемый в биореакторах суспензионного типа, и (ii) выработка астаксантина может проводиться в непрерывном одностадийном процессе, который не страдает от непроизводительных (зеленых) фаз роста. Наивысшая продуктивность астаксантина достигалась при 785 мкмоль м-2с-1. Свет высокой интенсивности индуцировал общую выработку астаксантина около 0,39 г астаксантина м-2д-1, которая была линейной в течение экспериментального периода и достигла 3,3 г м-2 после 10 дней роста. При более длительных периодах культивирования астаксантин может быть выше 4 г/м2, а при более высоких интенсивностях света 1,013 мкмоль м-2с-1 производительность астаксантина все еще достигает 0,32 г м-2д-1 (данные не показаны). Был создан гипотетический двухстадийный сценарий для сравнения производительности с одностадийной системой в соответствии с изобретением.
На фиг. 3 сравнивается биомасса (г м-2 ± SD, n = 3, фиг. 3A) и суммарный астаксантин (г м-2 ± SD, n = 3; фиг. 3B) продуктивность H. pluvialis 16-дневного одностадийного процесса, представленного в данном документе, в сравнении с двухстадийным процессом PSBR, объединяющим «зеленую фазу» и «красную фазу» по 8 дней для сравнения эффективности одно- и двухфазных подходов, когда свет является единственным применяемым фактором стресса. Однофазный подход состоял из экспозиции 1000 мкмоль фотонов м-2с-1в течение 16 дней (черные квадраты), тогда как двухфазный подход состоял из 8 дней при 90 мкмоль фотонов м-2с-1 и 8 дней при 1000 мкмоль фотонов м-2 (серые квадраты). Вертикальная пунктирная линия указывает, когда происходит переключение интенсивности света для двухфазного подхода. Цикл света/темноты составлял 14/10 часов, а аэрация была дополнена 5% CO2 в течение всего периода культивирования. Биомасса увеличивалась линейно на каждой фазе культивирования, но с очень разными темпами (фигура 3А). Наблюдались скорость роста 5,4 г м-2д-1 при слабом освещении и она увеличилась до 17,2 г м-2д-1 при переключении на свет высокой интенсивности. Это значение было аналогично тому, которое было получено в течение первых 8 дней культивирования непосредственно при 1000 мкмоль фотонов м-2с-1 в однофазном подходе. Кроме того, на 8-й день общее количество биомассы было в три раза выше в однофазном подходе со значением 146 г м-2 по сравнению с 48,2 г м-2 в двухфазном. Аналогичные тенденции наблюдались при анализе общих значений астаксантина: накопление в двухфазной группе происходило только при высоком освещении, по сравнению с теми, которые наблюдались в течение первых восьми дней однофазной: 0,34 и 0,35 г м-2д-1, соответственно (фигура 8B). На 8-й день выход астаксантина составлял 2,5 г/м2 при 1000 мкмоль фотонов м-2с-1 и 0,08 г/м2 при 90 мкмоль фотонов м-2с-1, что приводит к 32-кратному увеличению. Эта разница была отменена после облучения светом высокой интенсивности, а выработка астаксантина достигла 2,8 г м-2 в обеих группах на 16-й день. Однако в двухфазной системе требуется в два раза длительное, чем при однофазном подходе. Поэтому эффект высокой освещенности, следовательно, не зависит от начала воздействия. То есть применение фазы с светло-зеленым светом низкой интенсивности препятствовало высокой продуктивности, требующей более длительного периода культивирования для достижения аналогичных выходов, что увеличивает затраты и риски контаминации.
Согласно изобретению, после культивирования H. pluvialis могут отделяться от подложки, в частности перфорированной подложки, под действием механических сил, таких как очистка или отрыв воздушным лезвием или другими подходящими инструментами для выдувания материалов, или, путем химической обработки, такой как обработка поверхностно-активными веществами и/или органическими растворителями.
В другом воплощении H. pluvialis можно собирать вместе с перфорированной подложкой. Это может быть практичным, если H. pluvialis разлагаются оставаясь на подложке, чтобы, например, получить ингредиенты путем экстракции. Выделенные H. pluvialis или клеточный дебрис можно механически отделить от экстракта вместе с подложкой.
В еще одном воплощении (низкие) объемы жидкости (например, воды, культуральной среды) могут быть использованы для смывания иммобилизованных H. pluvialis с перфорированной подложки, получения плотной суспензии H. pluvialis для дальнейшей обработки (концентрирования, сушки, и/или экстракции астаксантина) или H. pluvialis могут быть получены путем сбора разрыхленной биомассы в текущей культуральной среде.
В частности, H. pluvialis можно отделить от подложки после высыхания и затем можно собрать.
В другом воплощении H. pluvialis можно взрыхлить на подложке и использовать после сушки или без сушки или без экстракции астаксантина.
В еще одном воплощении экстракция астаксантина может быть осуществлена обработкой химическими веществами, такими как растворители, в частности, органическими растворителями, когда H. pluvialis остается на субстрате, а астаксантин удаляется из H. pluvialis с помощью химических веществ.
В частности, экстракцию астаксантина из высушенных или концентрированных клеток H. pluvialis можно проводить способами, использующими органические растворители (Dong et al., 2014), такими как предварительная обработка соляной кислотой с последующей экстракцией ацетоном, экстракцией растворителем смеси гексан/изопропанол, экстракцией метанолом экстракцией ацетоном или другими природными маслами, такими как соевое масло или пальмовое масло. Астаксантин, кроме того, может быть получен путем сверхкритической экстракции с использованием двуокиси углерода (например, Nobre et al ., 2006) после дробления клеток H. pluvialis.
Изобретение описывается следующими неограничивающими примерами.
Пример 1
Экспериментальная установка
Стендовые фотобиореакторы с биопленками
Стендовый двухслойный фотобиореактор (PBR), описанный Schultze et al (2015), включен ссылкой. Вкратце, система состоит из стекловолокна (50 x 10 см), размещенного вертикально внутри прозрачной трубки PMMA (длиной 50 см, диаметром 12 см) на поливинилхлоридной (PVC) подложке. Культурная среда постоянно циркулирует с помощью перистальтического насоса. Она применяется в верхней части стекловолокна, распространяясь вниз с гравитацией и возвращаясь к среднему резервуару, помещенному внутри подложки из PVC. Система снабжена 1 л культуральной среды, которая заменяется каждые 2-3 дня для того, чтобы избежать ограничения питательных веществ для роста водорослей. Аэрация подается внутри из PVC-трубки.
Для инокуляции биореактора суспензионные культуры H. pluvialis концентрировали, а затем фильтровали на поликарбонатных мембранах (PC40, размер пор 0,4 мкм, диаметр 25 мм, Whatman, Dassel, Германия), как описано Naumann et al (2013), чтобы получить начальную плотность биомассы 5 г м-2. Затем фильтры помещали на стеклянные маты из влажного стекловолокна на PBR.
Для одностадийного подхода в течение экспериментального периода использовалась питательная среда, богатая питательными веществами, и оценивались различные интенсивности света. Для сравнения был проведен двухстадийный эксперимент при слабом освещении. Полная культуральная среда первоначально использовалась для роста. Через 6 дней стресс был вызван изменением среды, а именно отсутствием источника азота и/или дополнительной солью (0,8%).
Отбор проб и определение массы сухого вещества
В каждой точке отбора проб из каждого PBR собирали, по меньшей мере, три фильтра. Биомассу, которая заросла область инокуляции, удаляли и фильтр сушили сублимационной сушкой до постоянной массы. Сухую массу определяли гравиметрически, а биомассу хранили при -20 °С до анализа астаксантина.
Определение астаксантина
Астаксантин определяли спектрофотометрически, как описано Li et al (2012). Лиофилизированные образцы биомассы экстрагировали диметилсульфоксидом (DMSO, Мерк, Дармштадт, Германия), инкубировали при 70 °С в течение 5 минут, затем центрифугировали при 4000 g в течение 5 минут. Экстракцию повторяли до получения бесцветного осадка. Надосадочные жидкости собирали и измеряли OD при 530 нм (планшетный ридер Infinite M200, Tecan, Männedorf, Швейцария). Когда это необходимо для полной экстракции, клетки разрушали дроблением песком. Концентрация астаксантина определялась на основе калибровочной кривой, построенной по стандарту астаксантина (чистота 98,6%, д-р Эренсторфер, Аусбург, Германия), растворенного и разведенного в DMSO.
Кроме того, для культивирования H. pluvialis могут использоваться другие искусственные или природные культуральные среды, которые пригодны для стимуляции роста микроводорослей.
Дополнительный CO2, выгодно стимулирующий рост биомассы, особенно в условиях высокой освещенности, однако это не является существенным.
Источником света, как правило, может быть искусственное освещение и применение естественного солнечного света, при этом применение солнечного света может быть предпочтительным по экономическим причинам (в частности, если требуется высокая интенсивность).
Список литературы
Aflalo C, Meshulam Y, Zarka A, Boussiba S (2007) On the Relative Efficiency of Two- vs. One-stage Production of Astaxanthin by the Green Alga Haematococcus pluvialis. Biotechnol Bioeng 98:300-305. doi: 10.1002/bit.21391
Berner F, Heimann K, Sheehan M (2014) Microalgal biofilms for biomass production. J Appl Phycol. doi: 10.1007/s10811-014-0489-x
Del Río E, Acién FG, García-Malea MC, et al (2005) Efficient one-step production of astaxanthin by the microalga Haematococcus pluvialis in continuous culture. Biotechnol Bioeng 91:808-815. doi: 10.1002/bit.20547
Dong, S., Huang, Y., Zhang, R., Wang, S., & Liu, Y. (2014). Four Different Methods Comparison for Extraction of Astaxanthin from Green Alga Haematococcus pluvialis, 2014
Fiedler, D., Hager, U., Franke, H., Soltmann, U., Böttcher, H., (2007) Algae biocers: astaxanthin formation in sol-gel immobilised living microalgae. J. Mater. Chem. 2007, 17, 261-266
García-Malea LópezMC, Sánchez EDR, Casas López JL, et al (2006) Comparative analysis of the outdoor culture of Haematococcus pluvialis in tubular and bubble column photobioreactors. J Biotechnol 123:329-342. doi: 10.1016/j.jbiotec.2005.11.010
Li Y, Miao F, Geng Y, et al (2012) Accurate quantification of astaxanthin from Haematococcus crude extract spectrophotometrically. Chinese J Oceanol Limnol 30:627-637. doi: 10.1007/s00343-012-1217-5
Liu T, Wang J, Hu Q, et al (2013) Attached cultivation technology of microalgae for efficient biomass feedstock production. Bioresour Technol 127:216-222. doi: 10.1016/j.biortech.2012.09.100
Lorenz RT, Cysewski GR (2000) Commercial potential for Haematococcus microalgae as a natural source of astaxanthin. Trends Biotechnol 18:160-167.
Murphy T, Fleming E, Bebout L, et al (2012) A Novel Microbial Cell Cultivation Platform for Space Applications. In: 1st Annual International Space Station Research and Develop- ment Conference. Denver, CO: American Astronomical Society (AAS). pp 335-339
Naumann T, Çebi Z, Podola B, Melkonian M (2013) Growing microalgae as aquaculture feeds on twin-layers: a novel solid-state photobioreactor. J Appl Phycol 25:1413-1420. doi: 10.1007/s10811-012-9962-6
Nguyen K (2013) Astaxanthin: a comparative case of synthetic vs. natural production. Chem Biomol Eng Publ Other Work 1:1-11.
Nobre, B., Marcelo, F., Passos, R., Beirao, L., Palavra, A., Gouveia, L., & Mendes, R. (2006). Supercritical carbon dioxide extraction of astaxanthin and other carotenoids from the microalga Haematococcus pluvialis. European Food Research and Technology, 223, 787-790. Retrieved from http://dx.doi.org/10.1007/s00217-006-0270-8
Nowack ECM, Podola B, Melkonian M (2005) The 96-well Twin-Layer system: A novel approach in the cultivation of microalgae. Protist 156:239-251. doi: 10.1016/j.protis.2005.04.003
Olivieri G, Salatino P, Marzocchella A (2014) Advances in photobioreactors for intensive microalgal production: configurations, operating strategies and applications. J Chem Technol Biotechnol 89:178-195. doi: 10.1002/jctb.4218
Ozkan A, Kinney K, Katz L, Berberoglu H (2012) Reduction of water and energy requirement of algae cultivation using an algae biofilm photobioreactor. Bioresour Technol 114:542-8. doi: 10.1016/j.biortech.2012.03.055
Schultze LKP, Simon M-V, Li T, et al (2015) High light and carbon dioxide optimize surface productivity in a Twin-Layer biofilm photobioreactor. Algal Res 8C:37-44. doi: 10.1016/j.algal.2015.01.007
Suh IS, Joo H-N, Lee C-G (2006) A novel double-layered photobioreactor for simultaneous Haematococcus pluvialis cell growth and astaxanthin accumulation. J Biotechnol 125:540-6. doi: 10.1016/j.jbiotec.2006.03.027
Wan M, Hou D, Li Y, et al (2014) The effective photoinduction of Haematococcus pluvialis for accumulating astaxanthin with attached cultivation. Bioresour Technol 163C:26-32. doi: 10.1016/j.biortech.2014.04.017
Wang J, Sommerfeld MR, Lu C, Hu Q (2013) Combined effect of initial biomass density and nitrogen concentration on growth and astaxanthin production of. Algae 28:193-202.
Yin S, Wang J, Chen L, Liu T (2015) The water footprint of biofilm cultivation of Haematococcus pluvialis is greatly decreased by using sealed narrow chambers combined with slow aeration rate. Biotechnol Lett. doi: 10.1007/s10529-015-1864-7
Zhang L, Chen L, Wang J, et al (2015) Attached cultivation for improving the biomass productivity of Spirulina platensis. Bioresour Technol 181:136-142. doi: 10.1016/j.biortech.2015.01.025
Zhang W, Wang JJ, Wang JJ, Liu T (2014) Attached cultivation of Haematococcus pluvialis for astaxanthin production. Bioresour Technol 158C:329-335. doi: 10.1016/j.biortech.2014.02.044
Реферат
Изобретение относится к области биотехнологии, в частности к способу культивирования вида рода Haematococcus, а именно Haematococcus pluvialis, для производства астаксантина. Способ культивирования Haematococcus pluvialis для выработки астаксантина включает стадии обеспечения субстрата, расположения Haematococcus pluvialis на поверхности субстрата, экспонирования Haematococcus pluvialis, расположенного на субстрате, высокой интенсивности света по меньшей мере около 150 мкмоль фотонов мсс начала процесса культивирования, сбора культивируемых Haematococcus pluvialis и выделения астаксантина. Высокая интенсивность света составляет по меньшей мере около 200 мкмоль фотонов мс, в частности по меньшей мере около 500 мкмоль фотонов мс. В качестве субстрата(подложки) может быть применен листовой материал, например пористый лист, из бумаги, сложного эфира целлюлозы, в частности ацетата целлюлозы, смешанного сложного эфира целлюлозы, целлюлозы, нитрата целлюлозы, полиамидов, сложных полиэфиров и/или полиолефинов. Способ обеспечивает высокий выход астаксантина, позволяет упростить процесс и сократить затраты на получение астаксантина. 3 з.п. ф-лы, 3 ил., 1 пр.

Комментарии