Производство активной высокофосфорилированной n-ацетилгалактозамин-6-сульфатазы человека и ее применение - RU2607376C2
Код документа: RU2607376C2
Чертежи


























Описание
ПЕРЕКРЕСТНАЯ ССЫЛКА НА РОДСТВЕННЫЕ ЗАЯВКИ
[0001] Данная заявка претендует на приоритет предварительной заявки на патент США № 61/366714, поданной 22 июля 2010 г. и включенной во всей своей полноте в данный документ посредством ссылки.
ОБЛАСТЬ ТЕХНИКИ
[0002] Данное изобретение описывает технические области клеточной и молекулярной биологии и медицины, в частности, производство активных высокофосфорилированных лизосомальных ферментов сульфатазы человека и их применение в ведении лизосомальных болезней накопления, связанных с дефицитом лизосомального фермента сульфатазы. В частности, данное изобретение описывает производство активной высокофосфорилированной рекомбинантной человеческой N-ацетилгалактозамин-6-сульфатазы (GALNS) и ее применение в ведении мукополисахаридоза IVa типа (МПС IVa или синдром Моркио типа А) и других болезней лизосомального накопления, связанных с дефицитом GALNS.
ИЗВЕСТНЫЙ УРОВЕНЬ ТЕХНИКИ
[0003] Лизосомальные болезни накопления (ЛБН) возникают в результате дефицита специфических лизосомальных ферментов в клетке, играющих важную роль в расщеплении клеточных отходов в лизосоме. Дефицит таких лизосомальных ферментов приводит к накоплению в лизосоме неразложившегося «хранившегося материала», что приводит к опуханию и неправильной функции лизосом и, в конце концов, к повреждению клетки и ткани. Большое число лизосомальных ферментов было выявлено и скоррелировано с соответствующими заболеваниями. Как только будет определен недостающий фермент, лечение может быть сведено к единственной проблеме эффективной доставки требуемого фермента в пораженные ткани пациентов.
[0004] Одним из путей лечения лизосомальных болезней накопления является внутривенная фермент-заместительная терапия (ФЗТ) (Kakkis, Expert Opin. Investig. Drugs 11(5): 675-685, 2002). ФЗТ пользуется преимуществом сосудистой системы для доставки фермента из одного места введения в большинство тканей. Как только фермент распространится по организму, он должен быть захвачен клетками. Основание для захвата клетками состоит в уникальной природе лизосомальных ферментов. Лизосомальные ферменты составляют отдельный класс гликопротеинов, определенных по фосфату в положении 6 терминальных остатков маннозы. Маннозо-6-фосфат связывается с высокой аффинностью и специфичностью рецептором на поверхности большинства клеток (Munier-Lehmann et al., Biochem. Soc. Trans. 24(1): 133-136, 1996; Marnell et al., J. Cell. Biol. 99(6): 1907-1916, 1984). Рецептор маннозо-6-фосфата (MPR), имеющий два сайта связывания маннозо-6-фосфата в полипептидной цепи (Tong et al., J. Biol. Chem. 264:7962-7969, 1989), напрямую захватывает фермент из крови и поставляет в ткани, опосредуя затем внутриклеточную передачу в лизосому.
[0005] Широкомасштабное производство лизосомальных ферментов включает экспрессию в линиях клеток млекопитающих. Цель состоит в предоминирующей секреции рекомбинантного фермента в окружающую среду роста для сбора и дальнейшего процессинга. В идеальной системе для широкомасштабного производства лизосомальных ферментов, фермент будет эффективно фосфорилирован и затем направлен преимущественно к поверхности клетки (т.е. для секреции), а не преимущественно в лизосому. Как описано выше, такой способ выделения фосфорилированных лизосомальных ферментов является прямо противоположным ситуации, происходящей в обычных клетках. Производство линий клеток, используемых для производства лизосомальных ферментов, направлено на максимизацию уровня маннозо-6-фосфата на моль фермента, но для него характерна низкая специфическая продуктивность. In vitro попытки получения лизосомальных ферментов, содержащих высокие уровни молекул маннозо-6-фосфата, привели к переменному успеху (Canfield et al., патент США № 6537785). Фермент in vitro обладает высокими уровнями маннозо-6-фосфата, а также высокими уровнями немодифицированной терминальной маннозы. Конкуренция между маннозо-6-фосфатом и рецепторами маннозы за лизосомальный фермент приводит к необходимости получения высоких доз фермента для эффективности и может привести к большей иммуногенности в ущерб подвергнутому лечению субъекту.
[0006] Сульфатазы составляют уникальный подкласс лизосомальных ферментов. Сульфатазы расщепляют сульфатные эфиры из целого ряда субстратов, включая, например, стероиды, углеводы, протеогликаны и гликолипиды. Все известные эукариотические сульфатазы содержат остаток цистеина в своем каталитическом сайте. Активность сульфатазы требует пост-трансляционной модификации такого остатка цистеина в Cα-формилглицин (FGly). Цистеин для активации FGly пост-трансляционного фермента находится в эндоплазматическом ретикулуме на нескрученных сульфатазах непосредственно после трансляции, перед связыванием сульфатаз с лизосомой (Dierks et al., Proc. Natl. Acad. Sci. USA 94:11963-11968, 1997). Формилглицин-генерирующий фермент, катализирующий такую реакцию, представлен фактором модификации сульфатазы 1 (SUMF1). Важным в такой уникальной пост-трансляционной модификации является и тот факт, что мутации в SUMF1, приводящие к нарушенному образованию FGly в лизосомальных ферментах сульфатазы, вызывают у человека множественную сульфатазную недостаточность (МСН) (Diez-Ruiz et al., Annu. Rev. Genomics Hum. Genet. 6:355-379, 2005).
[0007] В соответствии с этим, терапевтическая эффективность композиции лизосомального фермента сульфатазы зависит от уровня маннозо-6-фосфата и присутствия активного фермента в композиции.
[0008] Таким образом, в данной области техники существует необходимость в эффективной и продуктивной системе для широкомасштабного производства терапевтически эффективных, активных, высокофосфорилированных лизосомальных ферментов сульфатазы для ведения лизосомальных болезней накопления, вызванных или связанных с дефицитом таких лизосомальных ферментов сульфатазы.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
[0009] Данное изобретение описывает открытие о том, что когда производная линия клеток CHO-K1 (обозначенная как G71), которая является дефективной в эндосомальной ацидификации, разработана для экспрессии рекомбинантного фактора модификации сульфатазы человека 1 (SUMF1), модифицированные клетки G71 вырабатывают высокие уровни активных высокофосфорилированных рекомбинантных лизосомальных ферментов сульфатазы частично путем предотвращения потери материала в лизосомальном компартменте при производстве линии клеток. В одном варианте воплощения изобретение описывает комплементную линию группы клеток END3, которая со-экспрессирует рекомбинантный SUMF1 человека и рекомбинантную N-ацетилгалактозамин-6-сульфатазу (GALNS) человека, что приводит к высокому выходу активного высокофосфорилированного фермента. Типичные линии клеток представлены G71, G71S и их производными, с сохранением требуемого свойства G71, т.е. способности обеспечивать высокий выход активированных высокофосфорилированных рекомбинантных лизосомальных ферментов сульфатазы. Такое применение группы комплементации END3 модифицированной линии клеток CHO-K1, со-экспрессирующих рекомбинантный SUMF1 человека и рекомбинантный лизосомальный фермент сульфатазы, будет особенно полезным для производства активных высокофосфорилированных лизосомальных ферментов сульфатазы для использования в ведении лизосомальных болезней накопления фермент-заместительной терапией (ФЗТ).
[0010] В первом аспекте изобретение описывает новейший способ получения активных высокофосфорилированных рекомбинантных лизосомальных ферментов сульфатазы человека или их биологически активных фрагментов, мутантов, вариантов или производных в клетки CHO группы комплементации END3 или ее производном в количествах, обеспечивающих их терапевтическое применение. В обширном варианте воплощения изобретения способ включает следующие этапы: (а) культивация клетки CHO-производной группы комплементации END3 или ее производной; (б) получение первого вектора экспрессии млекопитающих, способного экспрессировать активный высокофосфорилированный рекомбинантный лизосомальный фермент сульфатазы человека или его биологически активный фрагмент, мутант, вариант или производное в клетке CHO-производной комплементарной группе END3 или ее производном; (в) получение второго вектора экспрессии млекопитающих, способного экспрессировать рекомбинантный фактор модификации сульфатазы человека 1 (SUMF1) или его биологически активный фрагмент, мутант, вариант или производное в клетке CHO-производной комплементарной группы END3 или ее производном; (г) трансфекция клетки CHO-производной комплементарной группы END3 или ее производного первыми и вторыми векторами экспрессии; (д) выбор и клонирование трансфектанта клетки CHO-производной комплементарной группы END3 или ее производного, который экспрессирует активный высокофосфорилированный рекомбинантный лизосомальный фермент сульфатазы человека или ее биологически активный фрагмент, мутант, вариант или производное; и (е) оптимизация способа обработки клеточной культуры для производства высокофосфорилированного рекомбинантного лизосомального фермента сульфатазы человека или ее биологически активного фрагмента, мутанта, варианта или производного. Рекомбинантный лизосомальный фермент сульфатазы человека выбирают из группы, состоящей из арилсульфатазы A (ARSA), арилсульфатазы B (ARSB), идуронат-2-сульфатазы (IDS), сульфамидазы/гепарин-N-сульфатазы (SGSH), N-ацетилглюкозамин-сульфатазы (G6S) и N-ацетилгалактозамин-6-сульфатазы (GALNS).
[0011] Способ включает этапы трансфекции кДНК, кодирующей весь или часть лизосомального фермента сульфатазы, и кДНК, кодирующей весь или часть SUMF1 человека в клетку CHO-производной комплементарной группы END3 или ее производную. В некоторых вариантах воплощения изобретения первый и второй векторы экспрессии, способные экспрессировать кодируемые активные высокофосфорилированные рекомбинантные человеческие лизосомальные ферменты сульфатазы и SUMF1 человека, соответственно, трансфицируются одновременно в клетку CHO-производной комплементарной группы END3 или ее производную. В некоторых вариантах воплощения изобретения первый и второй векторы экспрессии трансфицируются в клетку CHO-производной комплементарной группы END3 или ее производную последовательным образом. В некоторых вариантах воплощения изобретения используют кДНК, кодирующую человеческий лизосомальный фермент сульфатазы полной длины, в то время как в других вариантах воплощения изобретения используют кДНК, кодирующую его биологически активный фрагмент, мутант, вариант или производное. В некоторых вариантах воплощения изобретения используют кДНК, кодирующую SUMF1 человека полной длины, в то время как в других вариантах воплощения изобретения используют кДНК, кодирующую его биологически активный фрагмент, мутант, вариант или производное. В некоторых вариантах воплощения изобретения многочисленные векторы экспрессии используют для трансфера кДНК человеческого лизосомального фермента сульфатазы и SUMF1 человека одновременно или последовательно в клетку CHO-производной комплементарной группы END3 или ее производную. В некоторых вариантах воплощения изобретения используют один вектор экспрессии для трансфера кДНК человеческого лизосомального фермента сульфатазы и SUMF1 человека одновременно в клетку CHO-производной комплементарной группы END3 или ее производную. В предпочтительном варианте воплощения изобретения клетка CHO-производной комплементарной группы клеток END3 или ее производная представлены линией клеток G71, линией клеток G71S, или производным G71 или G71S.
[0012] В предпочтительном варианте воплощения изобретения способ включает получение активного высокофосфорилированного рекомбинантного человеческого лизосомального фермента сульфатазы, например арилсульфатазы A (ARSA), арилсульфатазы B (ARSB), идуронат-2-сульфатазы (IDS), сульфамидазы/гепарин-N-сульфатазы (SGSH), N-ацетилглюкозамин-сульфатазы (G6S) или N-ацетилгалактозамин-6-сульфатазы (GALNS), из линии клеток CHO комплементарной группы END3 или ее производного. В особенно предпочтительном варианте воплощения изобретения способ включает получение активной высокофосфорилированной рекомбинантной N-ацетилгалактозамин-6-сульфатазы (GALNS) человека из линии клеток CHO комплементарной группы END3 или ее производного. Линия клеток комплементарной группы END3 представлена любой модифицированной линией клеток СНО, которая сохраняет свойства линии клеток комплементарной группы END3, например, дефективная эндосомальная ацидификация. В предпочтительном варианте воплощения изобретения клетка CHO-производной комплементарной группы END3 или ее производная представлены линией клеток G71, линией клеток G71S, или производным G71 или G71S.
[0013] Во втором аспекте данное изобретение описывает линию клеток млекопитающих с дефективной эндосомальной ацидификацией, характеризующуюся своей способностью вырабатывать активные высокофосфорилированные рекомбинантные лизосомальные ферменты сульфатазы человека в количествах, достаточных для терапевтического использования такого лизосомального фермента сульфатазы. В предпочтительных вариантах воплощения изобретение описывает CHO-K1-производные линии клеток комплементарной группы END3, обозначенные G71, G71S, или их производные, которые способны вырабатывать большие количества активных высокофосфорилированных рекомбинантных лизосомальных ферментов сульфатазы человека, что позволяет проводить широкомасштабное производство таких терапевтических лизосомальных ферментов сульфатазы. В более предпочтительных вариантах воплощения изобретения линия клеток экспрессирует и секретирует рекомбинантный лизосомальный фермент сульфатазы человеку в количествах по меньшей мере примерно 0,5, предпочтительно по меньшей мере примерно 0,75, более предпочтительно по меньшей мере примерно 1,0, и еще более предпочтительно по меньшей мере примерно 1,25 пг/клетка/сутки.
[0014] Линия клеток группы комплементации END3 представлена любой модифицированной линией клеток СНО, которая сохраняет свойства линии клеток группы комплементации END3, например, дефективную эндосомальную ацидификацию. В одном варианте воплощения изобретения линию клеток СНО группы комплементации END3 получают из G71 или ее производного, и она включает (а) вектор экспрессии для рекомбинантного фактора модификации сульфатазы человека 1 (SUMF1) и (б) вектор экспрессии для рекомбинантного лизосомального фермента сульфатазы человека, при этом рекомбинантный лизосомальный фермент сульфатазы человека выбирают из группы, состоящей из арилсульфатазы A (ARSA), арилсульфатазы B (ARSB), идуронат-2-сульфатазы (IDS), сульфамидазы/гепарин-N-сульфатазы (SGSH), N-ацетилглюкозамин-сульфатазы (G6S) и N-ацетилгалактозамин-6-сульфатазы (GALNS). В предпочтительном варианте воплощения изобретения линия клеток СНО группы комплементации END3 включает вектор экспрессии для рекомбинантной N-ацетилгалактозамин-6-сульфатазы (GALNS) человека. В более предпочтительном варианте воплощения изобретения линия клеток СНО группы комплементации END3 экспрессирует и секретирует рекомбинантный GALNS человека. В другом предпочтительном варианте воплощения изобретения линию клеток СНО группы комплементации END3 выбирают из группы, состоящей из клона 4, клона 5, клона C6, клона C2, клона C5, клона C7, клона C10, клона C11 и клона C30. В более предпочтительном варианте воплощения изобретения линия клеток СНО группы комплементации END3 представлена клоном С2. В другом предпочтительном варианте воплощения изобретения линия клеток СНО группы комплементации END3 адаптирована к росту в суспензии.
[0015] В третьем аспекте изобретение описывает рекомбинантные лизосомальные ферменты сульфатазы человека, получаемые в соответствии со способами по данному изобретению, и, следовательно, они присутствуют в количествах, позволяющих использовать лизосомальные ферменты сульфатазы терапевтическим образом. Лизосомальные ферменты сульфатазы могут быть представлены белками полной длины, или их фрагментами, мутантами, вариантами или производными. В некоторых вариантах воплощения изобретения лизосомальный фермент сульфатазы или его фрагмент, мутант, вариант или производное по данному изобретению могут быть модифицированы, как это необходимо, для повышения его стабильности или фармакокинетических свойств (например, ПЭГилирование, мутагенез, слияние, конъюгация). В предпочтительных вариантах воплощения изобретения фермент представлен лизосомальным ферментом сульфатазы человека, фрагментом лизосомального фермента сульфатазы человека с биологической активностью нативного фермента сульфатазы, или полипептидом, имеющим аминокислотную последовательность, которая по существу гомологична таковой лизосомального фермента сульфатазы человека. В некоторых вариантах воплощения изобретения лизосомальный фермент сульфатазы представлен белком с последовательностью, полученной у человека или млекопитающего, или ее производным. В других вариантах воплощения изобретения дефицит лизосомального фермента сульфатазы приводит к заболеванию человека, такому как метахроматическая лейкодистрофия или МЛД (т.е. дефицит арилсульфатазы A (ARSA)), синдром Марото-Лами или МПС VI типа (т.е. дефицит арилсульфатазы B (ARSB)), синдром Хантера или МПС II типа (т.е. дефицит идуронат-2-сульфатазы (IDS)), синдром Санфилиппо А или МПС IIIa типа (т.е. дефицит сульфамидазы/гепарин-N-сульфатазы (SGSH)), синдром Санфилиппо D или МПС IIId типа (т.е. дефицит N-ацетилглюкозамин-сульфатазы (G6S)) и синдром Моркио A или МПС IVa типа (т.е. дефицит N-ацетилгалактозамин-6-сульфатазы (GALNS)). В особенно предпочтительном варианте воплощения изобретения дефицит лизосомального фермента сульфатазы приводит к возникновению синдрома Моркио А или МПС IVa типа (т.е. дефицит N-ацетилгалактозамин-6-сульфатазы (GALNS)). В другом особенно предпочтительном варианте воплощения изобретения дефицит лизосомального фермента сульфатазы связан с заболеванием человека, таким как множественная сульфатазная недостаточность или МСН (т.е. дефицит N-ацетилгалактозамин-6-сульфатазы (GALNS)).
[0016] Лизосомальный фермент сульфатазы также может иметь последовательность, полученную у человека или млекопитающего, или ее производное. В других вариантах воплощения изобретения в каждом из его аспектов лизосомальный фермент сульфатазы идентичен в своей аминокислотной последовательности соответствующему участку аминокислотной последовательности лизосомального фермента сульфатазы человека или млекопитающего. В других вариантах воплощения изобретения молекула полипептида представлена нативным лизосомальным ферментом сульфатазы из человека или млекопитающего. В других вариантах воплощения изобретения полипептид лизосомального фермента сульфатазы по существу гомологичен (т.е. идентичен по меньшей мере примерно на 80%, 85%, 90%, 95%, 96%, 97%, 98% или 99% аминокислотной последовательности) по длине по меньшей мере примерно 25, 50, 100, 150 или 200 аминокислот, или всей длине полипептида, нативной аминокислотной последовательности лизосомального фермента сульфатазы фермента человека или млекопитающего. В некоторых вариантах воплощения изобретения лизосомальный фермент сульфатазы представлен N-ацетилгалактозамин-6-сульфатазой (GALNS) человека. Аминокислотная последовательность GALNS человека представлена SEQ ID NO:4, из которых аминокислоты 27-522 соответствуют секретируемому белку-предшественнику. В некоторых вариантах воплощения изобретения этот фермент GALNS включает или состоит из аминокислотной последовательности, которая идентична по меньшей мере примерно на 50%, 55%, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 95%, 96%, 97%, 98% или 99% аминокислотам 27-522 последовательности SEQ ID NO: 4, или последовательности, идентичной аминокислотам 27-522 последовательности SEQ ID NO: 4. Фермент GALNS преимущественно сохраняет аминокислоты каталитического сайта, соответствующие Цис в положении 53 секретируемого белка-предшественника (аминокислота 79 последовательности SEQ ID NO: 4), способного конвертироваться в Cα-формилглицин. Фермент GALNS также может сохранять другие аминокислоты в области активного сайта, включая по меньшей мере 1, 2, 3, 4, 5, 6, 7, 8 или все заряженные аминокислоты: Асп288, Асн289, Асп39, Асп54, Гис236, Лиз140, Гис142, Лиз310 и α-спираль: Арг83. Источник Sukegawa, Human Molecular Genetics, 2000, Vol. 9, No. 9 1283-1290, включенный сюда во всей своей полноте посредством ссылки, описывает дополнительные мутации, которые снижают активность GALNS у пациентов и коррелирует со степенью тяжести различных мутаций относительно их соответствующего 3-мерного расположения в ферменте. В других вариантах воплощения изобретения субъект, которому вводят лизосомальный фермент сульфатазы, представлен человеком.
[0017] В предпочтительных вариантах воплощения изобретения лизосомальный фермент сульфатазы является высокофосфорилированным рекомбинантным лизосомальным ферментом сульфатазы человека, выработанным линией клеток с дефицитом эндосомальной ацидификации, например, линией клеток, полученной из СНО-производной группы комплементации END3. Линия клеток группы комплементации END3 представлена любой модифицированной линией клеток СНО, которая сохраняет свойства линии клеток группы комплементации END3, например, дефективную эндосомальную ацидификацию. В предпочтительном варианте воплощения изобретения клетка CHO-производной комплементарной группы клеток END3 или ее производное представлены линией клеток G71, линией клеток G71S, или производным G71 или G71S. С другой стороны, лизосомальный фермент сульфатазы может быть получен в любой клетке-хозяине, например любой линии клеток СНО или линии клеток, полученной из СНО, культивированной в условиях, обеспечивающих экспрессию и секрецию высокофосфорилированного рекомбинантного лизосомального фермента сульфатазы при относительно высоком выходе, например, в количествах, составляющих по меньшей мере примерно 0,5, по меньшей мере примерно 0,75, по меньшей мере примерно 1,0, или по меньшей мере примерно 1,25 пг/клетка/сутки.
[0018] В более предпочтительных вариантах воплощения изобретения рекомбинантный лизосомальный фермент сульфатазы человека обладает высоким уровнем фосфорилированных олигосахаридов (т.е. выше чем примерно 0,25, предпочтительно выше 0,5, и более предпочтительно выше примерно 0,75 бис-фосфорилированных олигоманнозных цепей на цепь белка).
[0019] В некоторых вариантах воплощения изобретение описывает рекомбинантный лизосомальный фермент сульфатазы человека, например GALNS, с указанным высоким уровнем фосфорилированных олигосахаридов. Например, лизосомальный фермент сульфатазы имеет от 0,5 до 1,0 бис-фосфорилированных олигоманнозных цепей на мономерную белковую цепь, или от 0,5 до 0,9 бис-фосфорилированных олигоманнозных цепей на мономерную белковую цепь, или от 0,5 до 0,8 бис-фосфорилированных олигоманнозных цепей на мономерную белковую цепь, или от 0,5 до 0,75 бис-фосфорилированных олигоманнозных цепей на мономерную белковую цепь, или от 0,54 до 0,75 бис-фосфорилированных олигоманнозных цепей на мономерную белковую цепь. Предусмотрены и другие подобные диапазоны, например, по меньшей мере 0,4, 0,45, 0,5, 0,55, 0,6 или 0,65 бис-фосфорилированных олигоманнозных цепей на мономерную белковую цепь до 0,7; 0,75; 0,8; 0,85; 0,9; 0,95; 0,98 или 1,0 бис-фосфорилированных олигоманнозных цепей на мономерную белковую цепь, или любая комбинация этих чисел. В предпочтительных вариантах воплощения изобретения фермент представлен рекомбинантной N-ацетилгалактозамин-6-сульфатазой (GALNS) человека, например, с последовательностью SEQ ID NO: 4.
[0020] В некоторых вариантах воплощения изобретения рекомбинантный лизосомальный фермент сульфатазы человека имеет высокий процент (т.е. по меньшей мере примерно 50%, 55%, 60% или 65%, предпочтительно по меньшей мере примерно 70%, 75%, 80%, 85%, 90% или 95%) конверсии остатка цистеина в активном сайте в Cα-формилглицин (FGly). В предпочтительных вариантах воплощения изобретения фермент представлен активной рекомбинантной N-ацетилгалактозамин-6-сульфатазой (GALNS) человека, и остаток цистеина в активном сайте представлен Цис в положении 53 (положение 79 последовательности SEQ ID NO: 4).
[0021] В отдельных вариантах воплощения изобретения рекомбинантный лизосомальный фермент сульфатазы человека имеет высокий уровень фосфорилированных олигосахаридов, например, любой диапазон или уровень бис-фосфорилированных олигоманнозных цепей на мономерную белковую цепь, описанные в тексте данной заявки, вместе с высоким процентом конверсии остатка цистеина активного сайта в Cα-формилглицин (FGly), например, любой описанный здесь процентный показатель. В предпочтительных вариантах воплощения изобретения фермент представлен активной высокофосфорилированной рекомбинантной N-ацетилгалактозамин-6-сульфатазой (GALNS) человека, например, с последовательностью SEQ ID NO: 4.
[0022] В любом из предшествующих вариантов воплощения изобретения по меньшей мере 99,5%, по меньшей мере 99%, по меньшей мере 98,5%, по меньшей мере 98%, по меньшей мере 97%, по меньшей мере 95%, по меньшей мере 90%, по меньшей мере 85%, по меньшей мере 80%, по меньшей мере 75%, по меньшей мере 70%, или по меньшей мере 65% рекомбинантного лизосомального фермента сульфатазы человека, например, GALNS (SEQ ID NO: 4), находится в форме предшественника, как это определено окрашиванием Кумасси синим при проведении SDS-PAGE в восстанавливающих условиях или SDS-электрофореза в капиллярном геле (SDS-CGE).
[0023] Кроме того, лизосомальный фермент сульфатазы, например GALNS (SEQ ID NO: 4), необязательно обладает специфической активностью, составляющей по меньшей мере примерно 30% (например, 35%, 40%, 45%, 50%, 55%, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 95%, в 2 раза, в 2,5 раза, в 3 раза, в 4 раза, в 5 раз, в 10 раз, в 15 раз, в 20 раз, в 30 раз, в 40 раз или в 50 раз) больше, чем специфическая активность контрольного лизосомального фермента сульфатазы с одинаковой аминокислотной последовательностью, который был получен в клетках-хозяевах (например, клетках СНО или клетках, полученных из СНО), которые не экспрессируют рекомбинантный SUMF1 человека.
[0024] В любом из предшествующих вариантов воплощения изобретения описанный лизосомальный фермент сульфатазы, например, GALNS (SEQ ID NO: 4), характеризуется специфическим захватом (захватом К) фибробластами, и такой показатель составляет от примерно 0,1 до 10 нМ, или от примерно 0,1 до 7 нМ, или от примерно 0,5 до 5 нМ, или от примерно 1 до 5 нМ, или от примерно 1 до 3,5 нМ, примерно 1 нМ, примерно 1,5 нМ, примерно 2 нМ, примерно 2,5 нМ, примерно 3 нМ или примерно 3,5 нМ, или любую комбинацию этих чисел.
[0025] В любом из предшествующих вариантов воплощения изобретения по меньшей мере примерно 50%, по меньшей мере примерно 55%, по меньшей мере примерно 60%, по меньшей мере примерно 65%, по меньшей мере примерно 70%, по меньшей мере примерно 75%, или по меньшей мере примерно 80% рекомбинантного лизосомального фермента сульфатазы человека, например GALNS (SEQ ID NO: 4), связывается в колонке с рецептором маннозо-6-фосфата.
[0026] Согласно данному аспекту, описаны очищенные композиции любого из таких вариантов воплощения изобретения с лизосомальным ферментом сульфатазы, в которых компонент лизосомального фермента сульфатазы, например GALNS (SEQ ID NO: 4), имеет чистоту по меньшей мере примерно 90%, 95%, 97%, 98% или 99%, как это определено окрашиванием Кумасси синим при проведении SDS-PAGE в невосстанавливающих условиях или другим способом определения чистоты (например, SDS-PAGE в восстанавливающих или невосстанавливающих условиях с последующим окрашиванием Кумасси синим или серебром, или хроматографическим разделением путем ВЭЖХ, включая С4 обращенные фазы (ОФ) или С3 ОФ), или эксклюзионной хроматографией (ЭХ)) В некоторых вариантах воплощения изобретения значительное количество компонента лизосомального фермента сульфатазы очищенной композиции представлено в секретируемой форме предшественника (например, по меньшей мере 65%, 70%, 75%, 80%, 85%, 90%, 95%, 97%, 98%, 98,5%, 99% или 99,5% предшественника), как это определено окрашиванием Кумасси синим при проведении SDS-PAGE в восстанавливающих условиях или другим способом определения предшественника (например, SDS-PAGE в восстанавливающих условиях с последующим окрашиванием Кумасси синим или серебром, или хроматографическим разделением путем ВЭЖХ (например, С4 обращенные фазы (ОФ), С3 ОФ), или эксклюзионной хроматографией (ЭХ), или комбинацией электрофоретического разделения и хроматографического разделения, например, SDS-PAGE с последующим капиллярным гель-электрофорезом (SDS-CGE)).
[0027] В отдельных вариантах воплощения изобретения компонент лизосомального фермента сульфатазы очищенной композиции имеет высокий уровень фосфорилированных олигосахаридов, например, любой диапазон или уровень бис-фосфорилированных олигоманнозных цепей на мономерную белковую цепь, описанные в тексте данной заявки, вместе с высоким процентом конверсии остатка цистеина активного сайта в Cα-формилглицин (FGly), например, любой описанный здесь процентный показатель. В отдельных вариантах воплощения изобретения очищенная композиция характеризуется захватом К, как это описано в тексте данной заявки.
[0028] В родственных аспектах изобретение описывает стерильные композиции, содержащие любой описанный здесь лизосомальный фермент сульфатазы или его очищенную композицию, вместе со стерильным фармацевтически приемлемым разбавителем, носителем и/или вспомогательным веществом. Такие стерильные композиции могут иметь форму растворов или лиофилизированного порошка, необязательно в пробирках, который может быть восстановлен путем добавления стерильного разбавителя.
[0029] В четвертом аспекте изобретение описывает способ очистки рекомбинантных лизосомальных ферментов сульфатазы человека, полученных способами по данному изобретению. В предпочтительном варианте воплощения изобретения лизосомальные ферменты сульфатазы очищают с использованием двухколоночного процесса (краситель-лигандная хроматография, например Кумасси-сефароза, и катионообменная хроматография, например SE Hi-Cap), включая по меньшей мере пять этапов очистки: (1) фильтрация сбора, т.е. питательной среды из линии клеток CHO группы комплементации END3 или ее производного, экспрессирующей фактор модификации сульфатазы человека 1 (SUMF1) и рекомбинантный лизосомальный фермент сульфатазы человека; (2) корректировка pH профильтрованного сбора до pH 4,5 (для индуцирования преципитации контаминантных белков); (3) загрузка pH-скорректированной профильтрованной смеси в колонку с красителем-лигандом, например колонку с Кумасси-сефарозой, промывание колонки и элюирование лизосомального фермента сульфатазы из колонки; (4) загрузка элюата из колонки краситель-лиганд в катионообменную колонку, например колонку SE Hi-Cap, промывание колонки и элюирование лизосомального фермента сульфатазы из колонки; и (5) ультрафильтрация и диафильтрация элюата из катионообменной колонки. Необязательно, профильтрованная смесь из этапа (1) концентрируется в 10-20 раз путем ультрафильтрации перед корректировкой рН. Необязательно, лизосомальный фермент сульфатазы после ультрафильтрации и диафильтрации на этапе (5) соединяется с буфером композиции. В особенно предпочтительном варианте воплощения изобретения лизосомальный фермент представлен рекомбинантной N-ацетилгалактозамин-6-сульфатазой (GALNS) человека.
[0030] В другом предпочтительном варианте воплощения изобретения лизосомальные ферменты сульфатазы очищаются с использованием трехколоночного процесса (улавливающая хроматография, например, катионообменная SE Hi-Cap; промежуточная хроматография, например, краситель-лиганд Capto Blue, Цинк-хелатная сефароза FF или Capto Adhere; и полирующая хроматография, например, ToyoPearl Butyl 650M, Phenyl Sepharose Hi-Sub или Phenyl Sepharose Low-Sub), включая по меньшей мере пять этапов очистки: (1) ультрафильтрация сбора, т.е. питательной среды из линии клеток CHO группы комплементации END3 или ее производного, экспрессирующей фактор модификации сульфатазы человека 1 (SUMF1) и рекомбинантный лизосомальный фермент сульфатазы человека, путем, например, Sartocon Cassettes, (30 кДа, Hydrosart); (2) корректировка pH профильтрованного сбора до pH 4,5 (для индуцирования преципитации контаминантных белков); (3) загрузка pH-скорректированной профильтрованной смеси в улавливающую колонку, например, Fractogel EMD SE Hi-CAP (M) катионообменную колонку, промывание колонки и элюирование лизосомального фермента сульфатазы из колонки; (4) загрузка элюата из улавливающей колонки в промежуточную колонку, например, колонку с красителем-лигандом Capto Blue, цинк-хелатной сефарозой FF или Capto Adhere, промывание колонки и элюирование лизосомального фермента сульфатазы из колонки; и (5) загрузка элюата в полирующую колонку, например, ToyoPearl Butyl 650M, Phenyl Sepharose Hi-Sub или Phenyl Sepharose Low-Sub, промывание колонки и элюирование лизосомального фермента сульфатазы из колонки. Элюированный лизосомальный фермент сульфатазы из этапа (5) соединяется с буфером композиции. Необязательно, элюированный лизосомальный фермент сульфатазы из этапа (5) подвергается ультрафильтрации, и затем соединяется с буфером композиции. Необязательно, рН лизосомального фермента сульфатазы из колонки на этапе (4) устанавливается на уровне 3,5 для вирусной инактивации при низком рН перед загрузкой в полирующую колонку на этапе (5). В особо предпочтительном варианте воплощения изобретения лизосомальный фермент сульфатазы представлен рекомбинантной N-ацетилгалактозамин-6-сульфатазой (GALNS) человека.
[0031] В другом предпочтительном варианте воплощения изобретения лизосомальные ферменты сульфатазы очищаются с использованием другого трехколоночного процесса (улавливающая или иммобилизационная металл-аффинная хроматография (ИМАХ), например, краситель-лиганд Capto Blue, цинк-хелатная сефароза FF или Capto Adhere; промежуточная хроматография, например, Fractogel EMD SE Hi-Cap катионообменная; и полирующая хроматография, например, ToyoPearl Butyl 650M, Phenyl Sepharose Hi-Sub или Phenyl Sepharose Low-Sub), разработанного для снижения протеолитического расщепления (т.е. усечения) лизосомального фермента сульфатазы, включая по меньшей мере шесть этапов очистки: (1) фильтрация сбора, т.е. питательной среды из линии клеток млекопитающих, например линии клеток CHO группы комплементации END3 или ее производного, экспрессирующей фактор модификации сульфатазы человека 1 (SUMF1) и рекомбинантный лизосомальный фермент сульфатазы человека, ультрафильтрация/диафильтрация профильтрованной среды, например, путем использования кассет Sartocon Cassettes (30 кДа, Hydrosart), с получением концентрированной профильтрованной среды, например, сконцентрированной в 20 раз, и фильтрация активированным углем концентрированной профильтрованной среды; (2) загрузка профильтрованной активированным углем и сконцентрированной среды в улавливающую колонку или колонку ИМАХ, например, краситель-лиганд Capto Blue, цинк-хелатная сефароза FF или Capto Adhere, промывание улавливающей колонки в условиях, при которых лизосомальный фермент сульфатазы остается в улавливающей колонке, и элюирование лизосомального фермента сульфатазы из улавливающей колонки; (3) необязательно, фильтрация элюата из улавливающей колонки через фильтр, например, фильтр Mustang Q, для удаления вирусов; (4) корректировка pH элюата или профильтрованного элюата из улавливающей колонки к кислому pH, например, pH 4,5±0,1, затем фильтрация элюата с кислым подкорректированным pH или профильтрованного элюата из улавливающей колонки; (5) загрузка профильтрованного элюата с корректированным кислым pH или профильтрованного элюата из улавливающей колонки в промежуточную колонку, например, Fractogel EMD SE Hi-CAP катионообменную колонку, промывание промежуточной колонки в условиях, при которых лизосомальный фермент сульфатазы остается в промежуточной колонке, и элюирование лизосомального фермента сульфатазы из промежуточной колонки; (6) корректировка pH элюата из промежуточной колонки до низкого pH, например, pH 3,5±0,1, для инактивации вирусов; и (7) загрузка прошедшего инактивацию вирусов элюата с низким pH из промежуточной катионообменной колонки в полирующую колонку, например, колонку для хроматографии с гидрофобным взаимодействием (ХГВ), например, ToyoPearl Butyl 650M, Phenyl Sepharose Hi-Sub или Phenyl Sepharose Low-Sub, промывание полирующей колонки в условиях, при которых лизосомальный фермент сульфатазы остается в полирующей колонке, и элюирование лизосомального фермента сульфатазы из полирующей колонки. В предпочтительном варианте воплощения изобретения этап (3) включен в процесс очистки. В другом предпочтительном варианте воплощения изобретения этап (3) исключен из процесса очистки. Необязательно, (8) элюированный лизосомальный фермент сульфатазы из этапа (7) подвергается буфер-обмену с композицией, например, включая, но не ограничиваясь, композиции, описанные в тексте данной заявки, такие как 20 мМ NaOAc/HOAc, 50 мМ NaH2PO4, 30 мМ аргинин HCl, 2% (в/о) сорбитол, pH 5,4, и концентрация элюированного лизосомального фермента сульфатазы в композиции корректируется до соответствующей концентрации, например, 3 мг/мл; (9) любой остаточный вирус и ДНК, присутствующая в композиции очищенного лизосомального фермента сульфатазы, удаляется путем фильтрации через вирусный фильтр и фильтр ДНК; и (10) в композицию очищенного лизосомального фермента сульфатазы добавляется неионный сурфактант, например, полисорбат 20 (PS20 или Твин-20). Финальная композиция очищенного лизосомального фермента сульфатазы (нерасфасованное лекарственное вещество) хранится при 2-8°C или в замороженном виде. В особенно предпочтительном варианте воплощения изобретения этапы (8)-(10) включены в процесс очистки. В особенно предпочтительном варианте воплощения изобретения лизосомальный фермент сульфатазы представлен рекомбинантной N-ацетилгалактозамин-6-сульфатазой (GALNS) человека.
[0032] В некоторых вариантах воплощения изобретения среду собирают на этапе (1) при рН примерно 6,5. В некоторых вариантах воплощения изобретения фильтр из активированного угля на этапе (1) представлен фильтром с активированным углем Zeta Plus R55. В некоторых вариантах воплощения изобретения улавливающая колонка из этапа (2) представлена колонкой Zn-IMAC. В некоторых вариантах воплощения изобретения колонка Zn-IMAC представлена Zn-хелатной колонкой с сефарозой FF. В некоторых вариантах воплощения изобретения фильтр на этапе (3) представлен фильтром Mustang Q. В некоторых вариантах воплощения изобретения кислое значение рН элюата или профильтрованного элюата из этапа (2) или (3) скорректировано на этапе (4) до примерно 4,5±0,1. В некоторых вариантах воплощения изобретения промежуточная колонка из этапа (5) представлена катионообменной колонкой. В некоторых вариантах воплощения изобретения катионообменная колонка представлена колонкой Fractogel EMD SE Hi-Cap. В некоторых вариантах воплощения изобретения низкое значение рН элюата из промежуточной колонки из этапа (6) скорректировано на этапе (6) до примерно 3,5±0,1. В некоторых вариантах воплощения изобретения полирующая колонка из этапа (7) представлена колонкой для хроматографии с гидрофобным взаимодействием (ХГВ). В некоторых вариантах воплощения изобретения колонка ХГВ представлена колонкой ToyoPearl Butyl 650M.
[0033] В некоторых вариантах воплощения изобретения композиция включает 20 мМ NaOAc/HOAc, 50 мМ NaH2PO4, 30 мМ аргинина HCl, 2% (о/в) сорбитол, pH 5,4. В некоторых вариантах воплощения изобретения неионный сурфактант представлен полисорбатом 20 (ПС20). В некоторых вариантах воплощения изобретения концентрация лизосомального фермента сульфатазы в композиции корректируется до примерно 3 мг/мл. В некоторых вариантах воплощения изобретения вирусный фильтр представлен фильтром DV20, и фильтр ДНК представлен фильтром Mustang Q. В некоторых вариантах воплощения изобретения неионный сурфактант, добавляемый в композицию, представлен полисорбатом 20 (ПС20), до финальной концентрации 0,01% (в/о).
[0034] В пятом аспекте изобретение описывает очищенную композицию активной высокофосфорилированной рекомбинантной N-ацетилгалактозамин-6-сульфатазы (GALNS) человека или ее биологически активный мутант, вариант или производное, используемые для лечения субъекта, страдающего лизосомальной болезнью накопления, вызванной (например, мукополисахаридоз типа IVa (МПС IVa) или синдром Моркио типа А) или связанной с (например, множественная сульфатазная недостаточность (МСД)) дефицитом фермента GALNS. В предпочтительном варианте воплощения изобретения очищенная композиция активной высокофосфорилированной рекомбинантной GALNS человека включает компонент фермента GALNS, имеющий: (а) чистоту по меньшей мере примерно 90%, 95%, 97%, 98% или 99%, как это определено окрашиванием Кумасси синим или серебром при проведении SDS-PAGE в невосстанавливающих условиях; (б) по меньшей мере примерно 80%, 85%, 90% или 95% конверсию остатка цистеина в положении 53 в Cα-формилглицин (FGly) (положение 79 последовательности SEQ ID NO: 4); (в) N-присоединенное гликозилирование в остатках аспарагина в положениях 178 и 397, при этом некоторые олигоманнозные цепи, присоединенные к остатку аспарагина в положении 178, являются бис-фосфорилированными; (г) от 0,5 до 1,0, или от 0,5 до 0,9, или от 0,5 до 0,8, или от 0,5 до 0,75, или от 0,54 до 0,75 бис-фосфорилированных олигоманнозных цепей на мономерную белковую цепь (например, по меньшей мере 0,4; 0,45; 0,5; 0,55; 0,6 или 0,65 и до 0,7; 0,75; 0,8; 0,85; 0,9; 0,95; 0,98 или 1,0 бис-фосфорилированных олигоманнозных цепей на мономерную белковую цепь, или любая комбинация любого из данных чисел); и (д) по меньшей мере 65%, или по меньшей мере 70% (например, по меньшей мере 75%, 80%, 85%, 90%, 95%, 97%, 98%, 98,5%, 99% или 99,5%) фермента GALNS представлено в форме предшественника, как это определено окрашиванием Кумасси синим при проведении SDS-PAGE в восстанавливающих условиях или SDS-капиллярным гель-электрофорезом (SDS-CGE). Кроме того, фермент GALNS также, необязательно, может обладать (е) специфической активностью, которая по меньшей мере примерно на 30% (например, 35%, 40%, 45%, 50%, 55%, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 95%, в 2 раза, в 2,5 раза, в 3 раза, в 4 раза, в 5 раз, в 10 раз, в 15 раз, в 20 раз, в 30 раз, в 40 раз или в 50 раз) больше, чем специфическая активность контрольного фермента GALNS с такой же самой аминокислотной последовательностью, который был получен в клетках-хозяевах (например, клетках СНО или клетках, полученных из СНО), которые не экспрессируют рекомбинантный SUMF1 человека. Необязательно, фермент GALNS характеризуется специфическим захватом (захватом К) фибробластами, который составляет от примерно 0,1 до 10 нМ, или от примерно 0,1 до 7 нМ, или от примерно 0,5 до 5 нМ, или от примерно 1 до 5 нМ, или от примерно 1 до 3,5 нМ, примерно 1 нМ, примерно 1,5 нМ, примерно 2 нМ, примерно 2,5 нМ, примерно 3 нМ или примерно 3,5 нМ, или любую комбинацию этих чисел.
[0035] Очищенная, активная высокофосфорилированная рекомбинантная GALNS человека стоит из основной полосы примерно 55-60 кДа (т.е. предшественника GALNS человека, составляющего по меньшей мере примерно 75%, или по меньшей мере 80%, предпочтительно по меньшей мере примерно 85%, более предпочтительно по меньшей мере примерно 90%, и еще более предпочтительно по меньшей мере примерно 95%, по меньшей мере 97%, по меньшей мере 98%, по меньшей мере 98,5%, по меньшей мере 99%, или по меньшей мере 99,5% видимых белков) и меньших полос ~39 кДа и ~19 кДа (т.е. зрелая или подвергнутая обработке GALNS человека, составляющая менее чем примерно 25%, менее чем примерно 20%, предпочтительно менее чем примерно 15%, более предпочтительно менее чем примерно 10%, и еще более предпочтительно менее чем примерно 5%, менее чем примерно 3%, менее чем примерно 2%, менее чем примерно 1,5%, менее чем примерно 1% или менее чем примерно 0,5% видимых белков) при проведении SDS-PAGE в восстанавливающих условиях, или как это определено SDS-CGE. В особенно предпочтительном варианте воплощения изобретения очищенная, активная высокофосфорилированная рекомбинантная GALNS человека состоит по существу из одной полосы примерно 55-60 кДа (т.е. предшественника GALNS человека) при проведении SDS-PAGE в восстанавливающих условиях, или как это определено SDS-CGE. В одном варианте воплощения изобретения очищенная, активная высокофосфорилированная рекомбинантная GALNS человека используется для лечения МПС IVa или синдрома Моркио типа А. В одном варианте воплощения изобретения очищенная, активная высокофосфорилированная рекомбинантная GALNS человека используется для лечения МСН.
[0036] В шестом аспекте изобретение описывает способ лечения заболеваний, вызванных в целом или частично дефицитом, или связанных с дефицитом лизосомального фермента сульфатазы. Способ включает введение терапевтического рекомбинантного лизосомального фермента сульфатазы человека, полученного способами по данному изобретению, при этом лизосомальный фермент сульфатазы связывается с рецептором MPR и транспортируется через мембрану клеток, входит в клетку и доставляется в лизосомы в клетке.
[0037] В одном варианте воплощения изобретения способ включает лечение субъекта, страдающего от дефицита лизосомального фермента сульфатазы, включающий введение нуждающемуся в этом субъекту терапевтически эффективного количества указанного лизосомального фермента сульфатазы, при этом указанный лизосомальный фермент сульфатазы представлен рекомбинантным лизосомальным ферментом сульфатазы человека или его биологически активным фрагментом, мутантом, вариантом или производным, выработанным клеткой CHO-производной комплементарной группы END3 или ее производным. В некоторых вариантах воплощения изобретения способ включает введение терапевтического рекомбинантного лизосомального фермента сульфатазы человека или его биологически активного фрагмента, мутанта, варианта или производного в виде монотерапии или в комбинации с фармацевтически приемлемым носителем, разбавителем или вспомогательным веществом. Предпочтительные варианты воплощения изобретения включают оптимизацию дозы к потребностям подвергнутых лечению субъектов, преимущественно млекопитающих, и более преимущественно, человека, для наиболее эффективного снижения дефицита лизосомального фермента сульфатазы.
[0038] Такие терапевтические лизосомальные ферменты сульфатазы особенно полезны, например, в лечении пациентов, страдающих от лизосомальных болезней накопления, вызванных дефицитом лизосомального фермента сульфатазы, таких как пациенты, страдающие от метахроматической лейкодистрофии или МЛД, мукополисахаридоза VI типа (МПС VI) или синдрома Марото-Лами, мукополисахаридоза II типа (МПС II) или синдрома Хантера, мукополисахаридоза IIIa типа (МПС IIIa) или синдрома Санфилиппо типа А, мукополисахаридоза IIId типа (МПС IIId) или синдрома Санфилиппо типа D и мукополисахаридоза IVa типа (МПС IVa) или синдрома Моркио типа А. В особенно предпочтительном варианте воплощения изобретения лизосомальная болезнь накопления представлена МПС IVa типа или синдромом Моркио А типа, и лизосомальный фермент сульфатазы представлен рекомбинантной N-ацетилгалактозамин-6-сульфатазой (GALNS) человека. В других вариантах воплощения изобретение также описывает фармацевтические композиции, включающие недостающий лизосомальный фермент сульфатазы, вызывающий лизосомальную болезнь накопления, и фармацевтически приемлемый носитель, разбавитель или вспомогательное вещество.
[0039] В другом варианте воплощения изобретения способ включает лечение субъекта, страдающего от лизосомальной болезни накопления, связанной с дефицитом одного или более лизосомальных ферментов сульфатазы, и такой способ включает введение нуждающемуся в этом субъекту терапевтически эффективного количества указанного лизосомального фермента сульфатазы, при этом указанный лизосомальный фермент сульфатазы представлен рекомбинантной N-ацетилгалактозамин-6-сульфатазой (GALNS) человека или ее биологически активным фрагментом, мутантом, вариантом или производным, выработанным клеткой CHO-производной комплементарной группы END3 или ее производной. В некоторых вариантах воплощения изобретения способ включает введение терапевтического рекомбинантного фермента GALNS человека или его биологически активного фрагмента, мутанта, варианта или производного в виде монотерапии или в комбинации с фармацевтически приемлемым носителем, разбавителем или вспомогательным веществом. В особенно предпочтительном варианте воплощения изобретения лизосомальная болезнь накопления представлена множественной сульфатазной недостаточностью (МСН).
[0040] В особенно предпочтительных вариантах воплощения изобретения клетка CHO-производной комплементарной группы END3 или ее производное представлены линией клеток G71, линией клеток G71S, или производным G71 или G71S.
[0041] В еще одном варианте воплощения изобретения данное изобретение описывает способ заместительной терапии ферментами путем введения терапевтически эффективного количества лизосомального фермента сульфатазы субъекту, нуждающемуся в заместительной терапии ферментами, при этом клетки пациента содержат лизосомы с количеством лизосомального фермента сульфатазы, недостаточным для предотвращения или снижения повреждения клеток, при этом достаточные количества лизосомального фермента сульфатазы попадают в лизосомы для предотвращения или снижения повреждения клеток. Клетки могут находиться внутри или за пределами ЦНС, или не должны быть отделены от крови стенками капилляров, эндотелиальные клетки которых способствуют диффузии активного действующего вещества при плотном контакте друг с другом.
[0042] В отдельном варианте воплощения изобретение описывает композиции и фармацевтические композиции, включающие активный рекомбинантный лизосомальный фермент сульфатазы человека, обладающие биологической активностью, которая снижена, недостающая или отсутствует в лизосоме-мишени, и вводимые субъекту. Предпочтительные активные лизосомальные ферменты сульфатазы человека включают, но не ограничиваются, арилсульфатазу A, арилсульфатазу B, идуронат-2-сульфатазу, сульфамидазу/гепарин-N-сульфатазу, N-ацетилглюкозамин-6-сульфатазу и N-ацетилгалактозамин-6-сульфатазу. В предпочтительном варианте воплощения изобретения N-ацетилгалактозамин-6-сульфатаза представлена активным рекомбинантным лизосомальным ферментом сульфатазы человека.
[0043] В предпочтительном варианте воплощения изобретение описывает способ лечения субъекта, страдающего от МПС IVa типа или синдрома Моркио типа А, или МСН, путем введения субъекту терапевтически эффективного количества любой рекомбинантной N-ацетилгалактозамин-6-сульфатазы (GALNS) человека, очищенных композиций и/или описанных здесь стерильных композиций.
[0044] В более предпочтительном варианте воплощения изобретение описывает способ лечения субъекта, страдающего от МПС IVa типа или синдрома Моркио типа А, или МСН, путем введения субъекту терапевтически эффективного количества рекомбинантной N-ацетилгалактозамин-6-сульфатазы (GALNS) человека, выработанной клетками группы комплементации END3, при этом рекомбинантная GALNS человека обладает высоким уровнем конверсии остатка цистеина активного сайта в Cα-формилглицин (FGly) (т.е. по меньшей мере примерно 50%, предпочтительно по меньшей мере примерно 70%, более предпочтительно по меньшей мере примерно 90%, еще более предпочтительно по меньшей мере примерно 95% конверсии), и высокими уровнями фосфорилирования (т.е. более чем примерно 0,25, предпочтительно более чем 0,5, и более предпочтительно, более чем примерно 0,75 бис-фосфорилированных олигоманнозных цепей на белковую цепь).
[0045] В особенно предпочтительном варианте воплощения изобретение описывает способ лечения субъекта, страдающего МПС IVa типа или синдромом Моркио типа А, или МСН, путем введения субъекту терапевтически эффективного количества композиции с очищенной, активной и высокофосфорилированной рекомбинантной GALNS человека, включающей компонент фермента GALNS, имеющий: (а) чистоту по меньшей мере примерно 90%, 95%, 97%, 98% или 99%, как это определено окрашиванием Кумасси синим или серебром при проведении SDS-PAGE в невосстанавливающих условиях; (б) по меньшей мере примерно 80%, 85%, 90% или 95% конверсию остатка цистеина в положении 53 в Cα-формилглицин (FGly) (положение 79 последовательности SEQ ID NO: 4); (в) от 0,5 до 1,0, или от 0,5 до 0,9, или от 0,5 до 0,8, или от 0,5 до 0,75, или от 0,54 до 0,75 бис-фосфорилированных олигоманнозных цепей на мономерную белковую цепь (например, по меньшей мере 0,4; 0,45; 0,5; 0,55; 0,6 или 0,65 и до 0,7; 0,75; 0,8; 0,85; 0,9; 0,95; 0,98 или 1,0 бис-фосфорилированных олигоманнозных цепей на мономерную белковую цепь, или любая комбинация любого из данных чисел); и (г) по меньшей мере 65%, или по меньшей мере 70% (например, по меньшей мере 75%, 80%, 85%, 90%, 95%, 97%, 98%, 98,5%, 99% или 99,5%) фермента GALNS представлено в форме предшественника, как это определено окрашиванием Кумасси синим при проведении SDS-PAGE в восстанавливающих условиях или SDS-капиллярным гель-электрофорезом (SDS-CGE). Кроме того, фермент GALNS также, необязательно, может обладать (д) специфической активностью, которая по меньшей мере примерно в 30% (например, 35%, 40%, 45%, 50%, 55%, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 95%, в 2 раза, в 2,5 раза, в 3 раза, в 4 раза, в 5 раз, в 10 раз, в 15 раз, в 20 раз, в 30 раз, в 40 раз или в 50 раз) больше, чем специфическая активность контрольного фермента GALNS с той же самой аминокислотной последовательностью, который был получен в клетках-хозяевах (например, клетках СНО или клетках, полученных из СНО), которые не экспрессируют рекомбинантный SUMF1 человека. Необязательно, фермент GALNS характеризуется специфическим захватом (захватом К) фибробластами, который составляет от примерно 0,1 до 10 нМ, или от примерно 0,1 до 7 нМ, или от примерно 0,5 до 5 нМ, или от примерно 1 до 5 нМ, или от примерно 1 до 3,5 нМ, примерно 1 нМ, примерно 1,5 нМ, примерно 2 нМ, примерно 2,5 нМ, примерно 3 нМ или примерно 3,5 нМ, или любую комбинацию этих чисел.
[0046] Очищенная, активная высокофосфорилированная рекомбинантная GALNS человека состоит из основной полосы примерно 55-60 кДа (т.е. предшественника GALNS человека, составляющего по меньшей мере примерно 75%, или по меньшей мере примерно 80%, предпочтительно по меньшей мере примерно 85%, более предпочтительно по меньшей мере примерно 90%, и еще более предпочтительно по меньшей мере примерно 95%, по меньшей мере примерно 97%, по меньшей мере примерно 98%, по меньшей мере примерно 98,5%, по меньшей мере примерно 99%, или по меньшей мере примерно 99,5% видимых белков) и меньших полос ~39 кДа и ~19 кДа (т.е. зрелая или подвергнутая обработке GALNS человека, составляющая менее чем примерно 25%, менее чем примерно 20%, предпочтительно менее чем примерно 15%, более предпочтительно менее чем примерно 10%, и даже более предпочтительно менее чем примерно 5%, менее чем примерно 3%, менее чем примерно 2%, менее чем примерно 1,5%, менее чем примерно 1% или менее чем примерно 0,5% видимых белков) при проведении SDS-PAGE в восстанавливающих условиях, или как это определено SDS-CGE. В особенно предпочтительном варианте воплощения изобретения очищенная, активная высокофосфорилированная рекомбинантная GALNS человека состоит по существу из одной полосы примерно 55-60 кДа (т.е. предшественника GALNS человека) при проведении SDS-PAGE в восстанавливающих условиях, или как это определено SDS-CGE.
[0047] В некоторых вариантах воплощения изобретения субъект страдает от МПС IVa типа или синдромом Моркио типа А. В некоторых вариантах воплощения изобретения субъект страдает от МСН.
[0048] Также предусмотрено соответствующее использование активных высокофосфорилированных лизосомальных ферментов сульфатаз по изобретению, которые преимущественно получают способами по изобретению, в получении препарата для лечения лизосомальных болезней накопления, описанных выше.
[0049] В седьмом аспекте данное изобретение описывает фармацевтические композиции, включающие активный высокофосфорилированный рекомбинантный лизосомальный фермент сульфатазы человека, как это описано выше, используемый для лечения заболеваний, вызванных полностью или частично, или связанных с дефицитом такого лизосомального фермента сульфатазы, и один или более фармацевтически приемлемых носителей, разбавителей или вспомогательных веществ. В предпочтительном варианте воплощения изобретения фармацевтическая композиция включает активную высокофосфорилированную рекомбинантную N-ацетилгалактозамин-6-сульфатазу (GALNS) человека или ее биологически активный фрагмент, мутант, вариант или производное, полученные способами по данному изобретению, и один или более фармацевтически приемлемых носителей, разбавителей или вспомогательных веществ. Такие фармацевтические композиции могут подходить для введения несколькими путями, такими как интратекальный, парентеральный, местный, интраназальный, ингаляция или пероральный путь введения. В предпочтительном варианте воплощения изобретения фармацевтические композиции подходят для парентерального введения. В объем данного аспекта включены варианты воплощения изобретения, описывающие последовательности нуклеиновых кислот, кодирующих лизосомальные ферменты сульфатазы полной длины или их фрагменты, мутанты, варианты или производные, которые могут быть введены in vivo в клетки с дефицитом лизосомального фермента.
[0050] В более предпочтительном варианте воплощения изобретения фармацевтическая композиция включает активную высокофосфорилированную рекомбинантную N-ацетилгалактозамин-6-сульфатазу (GALNS) человека или ее биологически активный фрагмент, мутант, вариант или производное, полученные способами по данному изобретению, и один или более фармацевтически приемлемых носителей, разбавителей или вспомогательных веществ в композиции, включающей один или более буферных агентов и один или более стабилизаторов. В определенных вариантах воплощения изобретения композиция включает количество фосфатного буфера, эффективное для снижения дефосфорилирования указанного фермента GALNS; и стабилизирующее количество одного или более стабилизаторов, выбираемых из группы, состоящей из солей аминокислот, буферов аминокислот, сурфактантов и полиолов; при этом указанная композиция имеет значение рН примерно 5,0-5,8.
[0051] В некоторых вариантах воплощения изобретения фермент GALNS включает аминокислотную последовательность, которая по меньшей мере на 95% идентична аминокислотам 27-522 последовательности SEQ ID NO:4 и имеет: (i) чистоту по меньшей мере примерно 95%, как это определено окрашиванием Кумасси синим при проведении SDS-PAGE в невосстанавливающих условиях, (ii) по меньшей мере примерно 80% конверсию остатка цистеина в положении 53 в Cα-формилглицин (FGly), и (iii) необязательно, от 0,5 до 0,8 бис-фосфорилированных олигоманнозных цепей на мономерную белковую цепь, при этом по меньшей мере 70% указанного фермента GALNS присутствует в форме предшественника, как это определено окрашиванием Кумасси синим при проведении SDS-PAGE в восстанавливающих условиях. В некоторых вариантах воплощения изобретения фермент GALNS имеет чистоту по меньшей мере 95%, как это определено ОФ-ВЭЖХ. В некоторых вариантах воплощения изобретения по меньшей мере 80%, по меньшей мере 85%, по меньшей мере 90%, по меньшей мере 95%, по меньшей мере 97%, по меньшей мере 98%, по меньшей мере 98,5%, по меньшей мере 99% или по меньшей мере 99,5% фермента GALNS представлено в форме предшественника, как это определено окрашиванием Кумасси синим при проведении SDS-PAGE в восстанавливающих условиях. В некоторых вариантах воплощения изобретения, по меньшей мере 80%, по меньшей мере 85%, по меньшей мере 90%, по меньшей мере 95%, по меньшей мере 97%, по меньшей мере 98%, по меньшей мере 98,5%, по меньшей мере 99% или по меньшей мере 99,5% фермента GALNS представлено в форме предшественника, как это определено SDS-капиллярным гель-электрофорезом. В некоторых вариантах воплощения изобретения фермент GALNS обладает по меньшей мере 90% конверсией остатка цистеина в положении 53 относительно Cα-формилглицина (FGly). В некоторых вариантах воплощения изобретения 50-80% фермента GALNS связывается колонкой с рецептором маннозо-6-фосфатом. В некоторых вариантах воплощения изобретения фермент GALNS специфически захватывается (K-захват) фибробластами в количестве примерно 1-5 нМ. В некоторых вариантах воплощения изобретения фермент GALNS специфически захватывается (K-захват) фибробластами в количестве примерно 1-3,5 нМ.
[0052] Концентрация GALNS или его биологически активного фрагмента, мутанта, варианта или производного в композиции составляет от примерно 0,1 до 10 мг/мл, предпочтительно от примерно 0,5 до 5 мг/мл, и более предпочтительно от примерно 0,5 до 1,5 мг/мл.
[0053] В определенных вариантах воплощения изобретения композиция включает количество фосфатного буфера, эффективного для снижения дефосфорилирования указанного фермента GALNS. В родственных вариантах воплощения изобретения фосфатный буфер представлен NaH2PO4 или его эквивалентом. В дополнительном варианте воплощения изобретения композиция дополнительно включает второй буфер. В одном варианте воплощения изобретения второй буфер представлен ацетатным буфером. В другом варианте воплощения изобретения ацетатный буфер представлен NaOAc/HOAc или его эквивалентом. Типичные буферы описаны более подробно в разделе подробного описания.
[0054] Предусмотрено, что концентрация NaOAc/HOAc или его эквивалента в композиции составляет от примерно 5 до 100 мМ, предпочтительно от примерно 5 до 50 мМ, и более предпочтительно от примерно 10 до 30 мМ. В родственном варианте воплощения изобретения концентрация NaH2PO4 или его эквивалента в композиции составляет от примерно 5 до 100 мМ, предпочтительно от примерно 25 до 100 мМ, и более предпочтительно от примерно 25 до 75 мМ. В определенных вариантах воплощения изобретения рН композиции составляет примерно рН 4,5-6,5, предпочтительно примерно рН 5,0-6,0, и более предпочтительно примерно рН 5,0-5,8.
[0055] В другом варианте воплощения изобретения композиция включает стабилизирующее количество одного или более стабилизаторов, выбираемых из группы, состоящей из солей аминокислот, буферов аминокислот, сурфактантов и полиолов. В одном варианте воплощения изобретения стабилизатор представлен солью аргинина или гистидина или буфером, необязательно, аргинина гидрохлоридом. В родственном варианте воплощения изобретения стабилизатор представлен полисорбатом, необязательно, полисорбатом 20. В дополнительном варианте воплощения изобретения стабилизатор представлен трехатомным или высшим сахароспиртом, необязательно сорбитолом. Типичные стабилизаторы описаны более подробно в разделе подробного описания.
[0056] В определенных вариантах воплощения изобретения стабилизаторы выбирают из аргинин HCl или его эквивалента, Твин-20 (полисорбата 20) или его эквивалента, и сорбитола или его эквивалента. В некоторых вариантах воплощения изобретения концентрация аргинин HCl или его эквивалента в композиции составляет от примерно 5 до 200 мМ, предпочтительно от примерно 10 до 100 мМ, и более предпочтительно от примерно 10 до 50 мМ. В другом варианте воплощения изобретения концентрация Твин-20 или его эквивалента в композиции составляет от примерно 0,001 до 1,0% (в/о), предпочтительно от примерно 0,005 до 0,2% (в/о), и более предпочтительно от примерно 0,005 до 0,015% (в/о). В родственном варианте воплощения изобретения концентрация сорбитола или его эквивалента в композиции составляет от примерно 0,1 до 10% (в/о), предпочтительно от примерно 0,5 до 5 % (в/о), и более предпочтительно от примерно 1,0 до 3,0% (в/о). В одном варианте воплощения изобретения композиция включает соль аргинина или буфер, полисорбат и полиол.
[0057] Изобретение дополнительно описывает способ предотвращения дефосфорилирования рекомбинантного фермента GALNS человека, включающий смешивание фермента GALNS и фосфатного буфера до финальной концентрации фосфатного буфера между примерно 25 мМ и 75 мМ. В типичных вариантах воплощения изобретения показатель дефосфорилирования снижен в сравнении с композицией этого же самого фермента в 1 мМ фосфатном буфере, например, при тестировании спустя 1 неделю, 2 недели, 3 недели, 1 месяц, 2 месяца, 3 месяца, 4 месяца, 5 месяцев или 6 месяцев хранения при комнатной температуре (например, 25°C).
[0058] В особенно предпочтительном варианте воплощения изобретения фармацевтическая композиция включает активную высокофосфорилированную рекомбинантную N-ацетилгалактозамин-6-сульфатазу (GALNS) человека или ее биологически активный фрагмент, мутант, вариант или производное, полученные способами по данному изобретению, и один или более фармацевтически приемлемых носителей, разбавителей или вспомогательных веществ в композиции, включающей NaOAc/HOAc и NaH2PO4 в качестве буферных агентов, а также аргинин HCl, Твин-20 (полисорбат 20) и сорбитол в качестве стабилизаторов. Концентрация GALNS в композиции составляет примерно 1,0±0,5 мг/мл. Концентрация NaOAc/HOAc в композиции составляет примерно 20±10 мМ, и концентрация NaH2PO4 в композиции составляет примерно 50±25 мМ. Значение рН композиции составляет рН 5,4±0,4. Концентрация аргинин HCl в композиции составляет примерно 30±20 мМ. Концентрация Твин-20 в композиции составляет примерно 0,01±0,005% (в/о). Концентрация сорбитола в композиции составляет примерно 2,0±1,0% (в/о).
[0059] В другом аспекте изобретение описывает способ определения активности лизосомального фермента сульфатазы, включающий: (а) культивацию клеток хондроцитов, взятых у пациента, страдающего дефицитом лизосомального фермента сульфатазы, например, пациента, страдающего синдромом Моркио, в условиях, способствующих поддержанию дифференциации хондроцитов; (б) контакт хондроцитов с лизосомальным ферментом сульфатазы, что приводит к разрушению кератансульфата; и (в) определение уровней кератансульфата в клетках, при этом пониженный уровень кератансульфата в клетках, контактировавших с лизосомальным ферментом сульфатазы, в сравнении с клетками, не контактировавшими с лизосомальным ферментом сульфатазы, является показателем активности лизосомального фермента сульфатазы. В некоторых вариантах воплощения изобретения лизосомальный фермент сульфатазы представлен N-ацетилгалактозамин-6-сульфатазой (GALNS). В некоторых вариантах воплощения изобретения культивацию проводят в среде, включающей фактор роста инсулина 1 (ФРИ1), трансформирующий фактор роста бета (ТФР-β), трансферрин, инсулин и аскорбиновую кислоту. В некоторых вариантах воплощения изобретения кератансульфат определяют конфокальной микроскопией или путем связывания с антителом к кератансульфату. Способ может проводиться с использованием любого лизосомального фермента сульфатазы, включая встречающийся в природе или рекомбинантный фермент человека, или его фрагменты или варианты, включая варианты, включающие аминокислотную последовательность, которая идентична по меньшей мере на 80%, 85%, 90%, 95% или 100% ферменту-предшественнику человека, без сигнальной последовательности, или его зрелой форме.
[0060] В еще одном аспекте изобретение описывает анализ на основе клеток для измерения активности рекомбинантного лизосомального фермента человека для разрушения естественных субстратов. Способ включает (а) культивацию изолированной клетки человека с дефицитом лизосомального фермента в условиях, при которых естественные субстраты для лизосомального фермента накапливаются; (б) контакт клетки с лизосомальным ферментом; (в) лизис клетки; (г) добавление к лизату клетки фермента, который (i) специфичен для естественных субстратов, и (ii) расщепляет небольшие олигосахариды из естественных субстратов; (д) мечение небольших олигосахаридов определяемой молекулой; (е) необязательно, разделение небольших меченых олигосахаридов; (ж) определение небольших меченых олигосахаридов; и (з) определение активности лизосомального фермента разрушать естественные субстраты путем сравнения (i) количества небольших меченых олигосахаридов из клеток, контактировавших с лизосомальным ферментом, и (ii) количества небольших меченых олигосахаридов из клеток, не контактировавших с лизосомальным ферментом, при этом снижение показателя (з)(i) в сравнении с (з)(ii) указывает на активность лизосомального фермента разрушать естественные субстраты. В одном варианте воплощения изобретения небольшой олигосахарид представлен моно-, ди- или трисахаридом. В родственном варианте воплощения изобретения небольшой олигосахарид представлен дисахаридом. В некоторых вариантах воплощения изобретения лизосомальный фермент выбирают из группы, состоящей из арилсульфатазы В (ARSB), идуронат-2-сульфатазы (IDS), сульфамидазы/гепарин-N-сульфатазы (SGSH), N-ацетилглюкозамин-сульфатазы (G6S) и N-ацетилгалактозамин-6-сульфатазы (GALNS). В некоторых вариантах воплощения изобретения лизосомальный фермент представлен α-L-идуронидазой (IDU). В некоторых вариантах воплощения изобретения лизосомальный фермент представлен α-глюкозидазой (GAA). В некоторых вариантах воплощения изобретения лизосомальный фермент представлен β-глюкоронидазой (GUSB). В некоторых вариантах воплощения изобретения лизосомальный фермент представлен β-галактозидазой (GLB1).
[0061] Подходящие клетки человека, которые могут использоваться в основанном на клетках анализе, включают любую клетку человека с дефицитом лизосомального фермента, подвергаемого тестированию, которая может накапливать естественные субстраты для лизосомального фермента. Например, могут использоваться клетки, которые естественным образом обладают полным (100%) или частичным дефицитом активности, например, снижением активности на 30%, 50%, 70%, 80%, 90%, 95% или более. Могут использоваться клетки, экспрессирующие мутантный фермент с пониженной активностью, или клетки, полученные у пациентов, страдающих лизосомальной болезнью накопления, например мукополисахаридозом. Могут использоваться клетки, которые были изменены рекомбинантным способом для нокаута или снижения активности лизосомального фермента, например, посредством введения мутации в кодирующий ген или его промотор, или другой регуляторный участок. Могут использоваться клетки, обработанные для снижения активности лизосомального фермента, например, обработанные антисмысловой или РНК-интерференцией для снижения экспрессии фермента.
[0062] Подходящие ферменты, расщепляющие (разрушающие) небольшие олигосахариды из углеводов и «специфичные» относительно (т.е. расщепляют преимущественным образом) естественных субстратов лизосомального фермента, могут быть выбраны специалистом в данной области. Например, для определения активности GALNS или GLB1 (ферментов, которые разрушают кератансульфат) фермент из этапа (г) может быть представлен кератаназой II или любым другим ферментом, который воздействует преимущественно на кератансульфат. В качестве другого примера для определения IDU, ARSB, IDS или GUSB (ферментов, разрушающих дерматансульфат) фермент из этапа (г) может быть представлен хондроитиназой АВС или любым ферментом, воздействующим преимущественно на дерматансульфат. В качестве другого примера для определения IDU, IDS, SGHS, G6S или GUSB (ферментов, разрушающих гепарансульфат) фермент из этапа (г) может быть представлен гепараназой I или гепараназой II, или обоими из них. В качестве еще одного примера для определения GAA (фермента, разрушающего гликоген) фермент из этапа (г) может быть представлен α-амилазой или любым ферментом, действующим преимущественно на гликоген.
[0063] Этот основанный на клетках способ обладает большой чувствительностью в определении активности лизосомального фермента. В некоторых вариантах воплощения изобретения активность лизосомального фермента определяют, когда концентрация лизосомального фермента составляет всего примерно 10 нМ, или примерно 5 нМ, или примерно 1 нМ, или примерно 0,75 нМ, или примерно 0,5 нМ, или примерно 0,25 нМ, или примерно 0,1 нМ, или примерно 0,05 нМ, или примерно 0,01 нМ, или примерно 0,005 нМ, или примерно 1 пМ, или примерно 0,5 пМ.
[0064] Другие характеристики и преимущества изобретения будут очевидны при рассмотрении нижепредставленного детального описания. Однако следует понимать, что детальное описание и специфические примеры, при указании предпочтительных вариантов воплощения изобретения, приводятся только в иллюстративных целях, поскольку для специалиста в данной области, исходя из этого детального описания, станут очевидны различные изменения и модификации, включенные в объем и идею данного изобретения.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
[0065] Фигура 1 описывает нуклеотидную последовательность фактора модификации сульфатазы человека 1 (SUMF1) (SEQ ID NO:1).
[0066] Фигура 2 описывает аминокислотную последовательность фактора модификации сульфатазы человека 1 (SUMF1) (SEQ ID NO:2).
[0067] Фигура 3 описывает нуклеотидную последовательность N-ацетилгалактозамин-6-сульфатазы (GALNS) человека (SEQ ID NO:3).
[0068] Фигура 4 описывает аминокислотную последовательность N-ацетилгалактозамин-6-сульфатазы (GALNS) человека (SEQ ID NO:4). Сигнальный пептид из 26 аминокислот на N-конце отсутствует в синтезированном GALNS.
[0069] Фигура 5 отображает структуру и характеристики синтезированной N-ацетилгалактозамин-6-сульфатазы (GALNS) человека (SEQ ID NO:5).
[0070] Фигура 6 отображает экспрессию N-ацетилгалактозамин-6-сульфатазы (GALNS) человека из клеток G71S, со-трансфицированных фактором модификации сульфатазы человека 1 (SUMF1) и векторами экспрессии GALNS человека. (A) Скрининг клона G71S на предмет активного GALNS в 96 лунках. (B) Продуктивность клона G71S вырабатывать GALNS в пикограммах на клетку в сутки.
[0071] Фигура 7 иллюстрирует схему контроллера биореактора WAVE, используемого для широкомасштабного производства клеток G71S, экспрессирующих N-ацетилгалактозамин-6-сульфатазу (GALNS) человека и ее варианты.
[0072] Фигура 8 отображает стабильность активности очищенного фермента N-ацетилгалактозамин-6-сульфатазы (GALNS) человека при хранении при 4°C (ромбы) или при -70°C (треугольники).
[0073] Фигура 9 отображает очистку N-ацетилгалактозамин-6-сульфатазы (GALNS) человека (A) быстропоточной хроматографией с голубой сефарозой 6 с последующей (B) Fractogel SE Hi-CAP хроматографией. Чистоту определяют по окрашиванию Кумасси синим при проведении SDS-PAGE (слева) и вестерн-блоттинга с использованием антитела к GALNS (IVA) (справа).
[0074] Фигура 10 отображает очистку N-ацетилгалактозамин-6-сульфатазы (GALNS) человека путем ультрафильтрации/диафильтрации (УФ/ДФ), хроматографии Fractogel SE Hi-Cap, Zn-хелатной хроматографии с сефарозой и хроматографией ToyoPearl Butyl 650M. Чистоту определяют по окрашиванию Кумасси синим при проведении SDS-PAGE (вверху слева) и вестерн-блоттингу с использованием антитела к GALNS (вверху справа), антитела к катепсину L (внизу слева) и антитела к СНОР (белкам клеток яичника китайского хомячка) (внизу справа).
[0075] Фигура 11 отображает схемы процесса восстановления N-ацетилгалактозамин-6-сульфатазы (GALNS) человека и процесс очистки, используемый для процесса Фазы I/II (слева) и процесса Фазы III (справа).
[0076] Фигура 12 отображает сравнение N-ацетилгалактозамин-6-сульфатазы (GALNS) человека, очищенной в соответствии с процессом Фазы I/II (полоса 3) или процессом Фазы III (полоса 5) Пять микрограмм (5 мкг) очищенного GALNS было разделено анализом SDS-PAGE в восстанавливающих условиях, а гель был окрашен Кумасси синим. Полоса 1 соответствует 15 мкл маркера SeeBlue Plus2. Молекулярная масса в кДа указана слева от окрашенного геля.
[0077] Фигура 13 отображает дозозависимое снижение количества субстрата дерматансульфата, которое отмечалось в клетках GM01391, обработанных IDU.
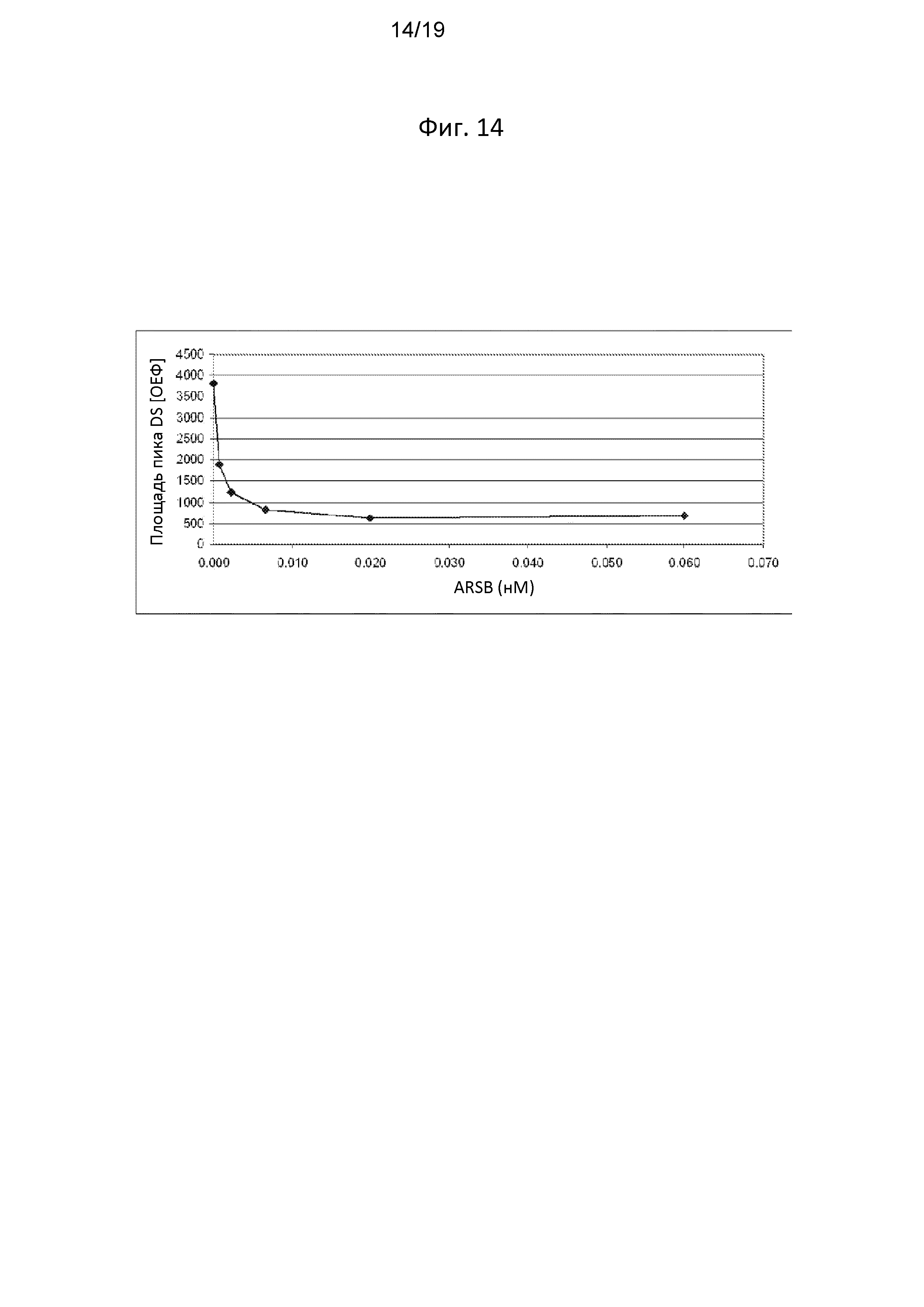
[0078] Фигура 14 отображает дозозависимое снижение количества субстрата дерматансульфата, которое отмечалось в клетках GM00519, обработанных ARSB.
[0079] Фигура 15 отображает захват N-ацетилгалактозамин-6-сульфатазы (GALNS) человека, меченой (обозначено кружками) или конъюгированной с A488 (квадраты) или А555 (треугольники), культивированными синовиоцитами.
[0080] Фигура 16 отображает стабильность очищенного фермента N-ацетилгалактозамин-6-сульфатазы (GALNS) человека при хранении в течение 1 или 2 месяцев при 5°C, при 25°C или при 40°C, как указано в композиции, включающей 15 мМ аргинин HCl, 30 мМ аргинин HCl, 15 мМ NaCl или 30 мМ NaCl (панели обозначены 51, 52, 54 или 55, соответственно) при pH 5,0, pH 5,4 или pH 5,8 (панели обозначены A, B или C, соответственно). Стабильность была измерена по проценту (%) площади пика агрегатов GALNS в композиции после хранения, как это определено эксклюзионной высокоэффективной жидкостной хроматографией (ЭХ-ВЭЖХ).
[0081] Фигура 17 отображает стабильность активности очищенного фермента N-ацетилгалактозамин-6-сульфатазы (GALNS) человека при хранении в течение 2 месяцев при 5°C, при 25°C или при 40°C, как указано в композиции, включающей 15 мМ аргинин HCl, 30 мМ аргинин HCl, 15 мМ NaCl или 30 мМ NaCl (панели обозначены 51, 52, 54 или 55, соответственно) при pH 5,0, pH 5,4 или pH 5,8 (панели обозначены A, B или C, соответственно).
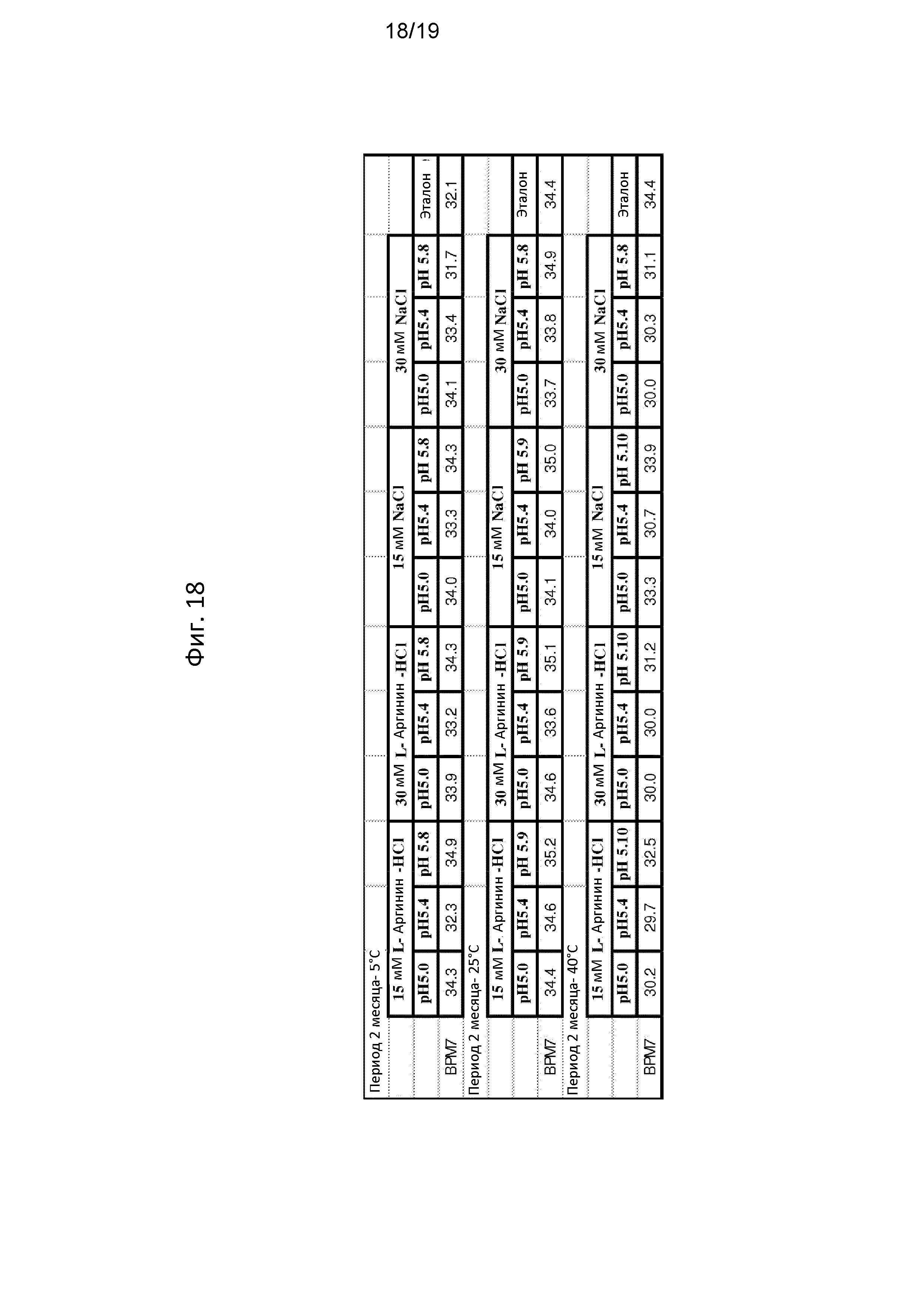
[0082] Фигура 18 отображает профиль гликозилирования очищенного фермента N-ацетилгалактозамин-6-сульфатазы (GALNS) человека при хранении в течение 2 месяцев при 5°C, при 25°C или при 40°C, как указано в композиции, включающей 15 мМ аргинин HCl, 30 мМ аргинин HCl, 15 мМ NaCl или 30 мМ NaCl при pH 5,0, pH 5,4 или pH 5,8, как указано. Процент бис-фосфорилированной маннозы 7 (БФМ7) был измерен капиллярным электрофорезом (КЭ) после расщепления фермента GALNS ПНГазой F для расщепления аспарагина N-присоединенных олигосахаридов. Указан процент БФМ7 для эталонной партии GALNS, хранившейся в течение 2 месяцев при 5°C, при 25°C или при 40°C, как это указано для композиции, включающей 100 мМ фосфатного буфера.
[0083] Фигура 19 отображает стабильность очищенного фермента N-ацетилгалактозамин-6-сульфатазы (GALNS) человека при хранении в течение 2 месяцев при 5°C, при 25°C или при 40°C, как указано в композиции, включающей 15 мМ аргинин HCl, 30 мМ аргинин HCl, 15 мМ NaCl или 30 мМ NaCl (панели обозначены 51, 52, 54 или 55, соответственно) при pH 5,0, pH 5,4 или pH 5,8 (панели обозначены A, B или C, соответственно). Стабильность фермента GALNS была измерена по проценту (%) площади пика фермента GALNS в композиции после хранения, как это определено высокоэффективной жидкостной хроматографией с обращенными фазами (ОФ-ВЭЖХ).
ДЕТАЛЬНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
[0084] Данное изобретение описывает открытие способа, согласовывающего потребность в широкомасштабном производстве рекомбинантных лизосомальных ферментов сульфатазы с необходимостью наличия продукта активного высокофосфорилированного лизосомального фермента сульфатазы, достаточного для включения в лизосомы и, следовательно, являющегося терапевтически эффективным.
[0085] Терапевтическая эффективность препарата лизосомального фермента зависит от уровня маннозо-6-фосфата в данном препарате. Фосфат добавляют к указанному гликопротеину путем пост-трансляционной модификации в эндоплазматическом ретикулуме и раннем комплексе Гольджи. Скрученные лизосомальные ферменты имеют уникальную третичную детерминанту, которая распознается модифицирующим олигосахарид ферментом. Детерминанта состоит из набора специфически расположенных лизинов и присутствует на большинстве лизосомальных ферментов, несмотря на отсутствие гомологии первичной последовательности. Модифицирующий фермент, UDP-GlcNAc фосфотрансфераза, связывается с белковой детерминантной и добавляет GlcNAc-1-фосфат в 6 положение терминальных остатков маннозы на олигосахаридах поблизости от сайта связывания; второй фермент, фосфодиэфир α-GlcNAcase, затем расщепляет связь GlcNAc-фосфат для обеспечения терминального олигосахарида маннозо-6-фосфата (Canfield et al., патент США No. 6537785). Цель модификации маннозо-6-фосфата заключается в отклонении лизосомальных ферментов от пути секреции в путь секреции лизосом внутри клетки. Фермент, несущий маннозо-6-фосфат, связан с MPR в транс-Гольджи и направлен к лизосоме вместо клеточной поверхности.
[0086] Кроме присутствия маркера маннозо-6-фосфата на олигосахаридах лизосомального фермента, лизосомальная направленность ферментов зависит от ацидификации эндосом-переносчиков, образующихся на конце комплекса транс-Гольджи. Химическое тушение кислой среды такими эндосомами с диффундирующими основными молекулами приводит к извлечению содержания везикул, включая лизосомальные ферменты, во внеклеточную среду (Braulke et al., Eur. J. Cell Biol. 43(3): 316-321, 1987). Ацидификация требует наличия специфической вакуолярной АТФазы, находящейся в мембране эндосомы (Nishi et al., Nat. Rev. Mol. Cell Biol. 3(2): 94-103, 2002). Нехватка такой АТФазы, как ожидается, повышает секрецию лизосомальных ферментов за счет направления в лизосомы. Ожидается, что получение линий клеток, несущих дефекты в вакуолярной АТФазе, предотвратит непродуктивную диверсию фосфорилированного рекомбинантного фермента во внутриклеточный компартмент лизосомы.
[0087] В 1984 г. были получены и охарактеризованы мутанты клеток яичника китайского хомяка (СНО), имеющие особый дефект в эндосомальной ацидификации (Park et al., Somat. Cell Mol. Genet. 17(2): 137-150, 1991). Клетки CHO-K1 были мутагенизированы химическим образом и селектированы на предмет выживаемости при повышенных температурах в присутствии токсинов. Эти токсины требовали эндосомальной ацидификации для полной экспрессии собственной летальности (Marnell et al., J. Cell. Biol. 99(6): 1907-1916, 1984). В предыдущем исследовании для избежания селекции токсин-специфической резистентности был выбран коктейль из двух токсинов с различными механизмами действия. Принцип его заключается в том, что при существовании незначительной вероятности того, что непрогнозируемые мутации могут приводить к резистентности к одному отдельному токсину, вероятности двух одновременных непрогнозируемых мутаций, специфических для двух полностью различных токсинов, не существует. Селекция проводилась при повышенной температуре для обеспечения проведения чувствительных к температуре мутаций. Такой генетический скрининг привел к появлению двух мутантов, один из которых был обозначен G.7.1 (G71), и такие мутанты были резистентны к токсинам при повышенных температурах. Поражение в G71 было вызвано не благодаря захвату или механизму действия двух токсинов, но произошло в результате неспособности клона ацидифицировать эндосомы при повышенных температурах. Такая неспособность также была очевидна при пермиссивной температуре (34°C), но в меньшей степени. Клетки G71 также были ауксотрофными относительно железа при повышенных температурах, несмотря на нормальный захват трансферрина из среды (Timchak et al., J. Biol. Chem. 261(30): 14154-14159, 1986). Поскольку железо высвобождается из трансферрина только при низком рН, ауксотрофия железа, несмотря на нормальный захват трансферрина, указывала на недостаточную эндосомальную ацидификацию. Другое исследование показало, что дефект ацидификации был выражен преимущественно в эндосомах, а не в лизосомах (Stone et al., J. Biol. Chem. 262(20): 9883-9886, 1987). Данные по G71 соответствовали выводу о том, что мутация приводила к дестабилизации вакуолярной АТФазы, ответственной за эндосомальную ацидификацию. Дестабилизация была наиболее очевидной при повышенных температурах (39,5°C), однако частично проходила и при пониженных температурах (34°C). Исследование переноса двух эндогенных лизосомальных ферментов, катепсина D и альфа-глюкозидазы, в клетках G71 (Park et al., Somat. Cell Mol. Genet. 17(2):137-150, 1991) показало, что оба фермента были количественно секретированы при повышенных температурах, и гликозилирование ферментов не было подвергнуто воздействию. Секреция фосфорилированной кислой альфа-глюкозидазы была по существу повышена при непермиссивных температурах.
[0088] Терапевтическая эффективность композиции лизосомального фермента сульфатазы не только зависит от уровня маннозо-6-фосфата, но также зависит и от присутствия активного фермента в этой композиции. Все известные сульфатазы содержат остаток цистеина в своем каталитическом сайте; такой остаток цистеина подвергается пост-трансляционной модификации в Cα-формилглицин (FGly) для активации фермента. Такая пост-трансляционная активация цистеина фермента в FGly, что катализируется фактором модификации сульфатазы 1 (SUMF1), происходит в эндоплазматическом ретикулуме на нескрученных сульфатазах непосредственно после трансляции, перед связыванием сульфатаз с лизосомамой (Dierks et al., Proc. Natl. Acad. Sci. USA 94:11963-11968, 1997). Важность такой уникальной пост-трансляционной модификации подчеркивается тем фактом, что мутации в SUMF1, приводящие к нарушенному образованию FGly в лизосомальных сульфатазных ферментах, вызывают у человека множественную сульфатазную недостаточность (МСН) (Diez-Ruiz et al., Annu. Rev. Genomics Hum. Genet. 6:355-379, 2005).
[0089] Таким образом, способность клеток G71, мутантных клеток СНО с дефективной эндосомальной ацидификацией со-экспрессировать рекомбинантный фактор модификации сульфатазы человека 1 (SUMF1) и лизосомальные ферменты сульфатазы человека обеспечивает механизм для широкомасштабного производства активных высокофосфорилированных рекомбинантных лизосомальных ферментов сульфатаз человека, используемых для ведения лизосомальных болезней накопления, вызванных или связанных с дефицитом таких лизосомальных ферментов сульфатаз.
I. ОПРЕДЕЛЕНИЯ
[0090] Если иное не определено, все используемые здесь технические и научные термины имеют такое же самое значение, что используемое обычно значение специалистом в области науки, к которой принадлежит изобретение. Следующие ссылки предоставляют специалисту в данной области общее определение многих терминов, используемых в данном изобретении: Singleton et al., DICTIONARY OF MICROBIOLOGY AND MOLECULAR BIOLOGY (2d ed. 1994); THE CAMBRIDGE DICTIONARY OF SCIENCE AND TECHNOLOGY (Walker ed., 1988); THE GLOSSARY OF GENETICS, 5TH ED., R. Rieger et al. (eds.), Springer Verlag (1991); и Hale & Marham, THE HARPER COLLINS DICTIONARY OF BIOLOGY (1991).
[0091] Каждая публикация, заявка на патент, патент и другая процитированная здесь ссылка включены посредством ссылки во всей своей полноте при условии, что они совместимы с данным изобретением.
[0092] Следует отметить, что, как это используется в данной заявке и прилагаемой формуле изобретения, формы единственного числа включают и формы множественного числа, если контекст четко не указывает иное.
[0093] В контексте данного изобретения нижеприведенные термины обладают закрепленным за ним значением, если не указано иное.
[0094] «Аллельный вариант» обозначает любые из двух или более полиморфных форм гена, занимающих один и тот же локус в гене. Аллельные вариации возникают естественным путем в ходе мутаций и могут привести к фенотипическому полиморфизму в популяциях. Генные мутации могут быть молчащими (т.е. не вводить изменения в кодируемый полипептид) или могут кодировать полипептиды с измененными аминокислотными последовательностями. «Аллельные варианты» также обозначают кДНК, полученные из транскриптов мРНК генетических аллельных вариантов, а также кодируемые ими белки.
[0095] «Амплификация» обозначает любой способ, с помощью которого копируется последовательность полинуклеотидов и, таким образом, распространяется в большее число полинуклеотидных молекул, например, путем обратной транскрипции, полимеразной цепной реакции и лигазной цепной реакции.
[0096] Первая последовательность является «антисмысловой последовательностью» относительно второй последовательности, если полинуклеотид, последовательность которого является первой последовательностью, специфически гибридизирует с полинуклеотидом, последовательность которого является второй последовательностью.
[0097] «кДНК» обозначает ДНК, комплементарную или идентичную мРНК в одноцепочечной или двухцепочечной форме.
[0098] В тексте данной заявки используются условные обозначения для описания полинуклеотидных последовательностей: левый конец одноцепочечной полинуклеотидной последовательности является 5’-концом; левостороннее направление двухцепочечной полинуклеотидной последовательности обозначается как 5’-направление. Направление добавления нуклеотидов от 5’- до 3’-конца образующихся транскриптов РНК обозначается как направление транскрипции. Спираль ДНК, имеющая такую же самую последовательность, что и мРНК, обозначается как «кодирующая нить»; последовательности в цепи ДНК, имеющие такую же самую последовательность, что и мРНК, транскрибированная из такой ДНК, и расположенные 5’ относительно 5’-конца транскрипта РНК, обозначаются как «восходящие последовательности»; последовательности на цепи ДНК, имеющие такую же последовательность, что и РНК, расположенные 3’ относительно 3’-конца кодирующего транскрипта РНК, обозначаются как «нисходящие последовательности».
[0099] Термин «комплементарный» обозначает топологическую совместимость или соответствие взаимодействующих поверхностей двух полинуклеотидов. Таким образом, две молекулы могут быть описаны как комплементарные и, более того, характеристики контактных поверхностей комплементарны друг другу. Первый полинуклеотид комлементарен второму полинуклеотиду, если нуклеотидная последовательность первого полинуклеотида идентична нуклеотидной последовательности полинуклеотидного связующего партнера второго полинуклеотида. Таким образом, полинуклеотид с последовательностью 5’-TATAC-3’ комплементарен полинуклеотиду с последовательностью 5’-GTATA-3’. Нуклеотидная последовательность «по существу комплементарна» эталонной нуклеотидной последовательности, если последовательность, комплементарная рассматриваемой нуклеотидной последовательности, по существу идентична эталонной нуклеотидной последовательности.
[00100] «Консервативная замена» обозначает замену в полипептиде аминокислоты функционально подобной аминокислотой. Каждая из нижепредставленных шести групп включает аминокислоты, являющиеся консервативными заменами друг другу:
1) Аланин (A), серин (S), треонин (T);
2) Аспарагиновая кислота (D), глутаминовая кислота (E);
3) Аспарагин (N), глутамин (Q);
4) Аргинин (R), лизин (K);
5) Изолейцин (I), лейцин (L), метионин (M), валин (V); и
6) Фенилаланин (F), тирозин (Y), триптофан (W).
[00101] Термин «фрагмент» при использовании относительно полипептидов обозначает полипептиды, которые короче полипептида полной длины вследствие разветвления на N-конце или C-конце белка или обоих концов, и/или делеции внутреннего участка или фрагмента белка. Фрагменты полипептида могут быть получены известными в науке способами.
[00102] Термин «мутант» при использовании относительно полипептидов обозначает полипептиды, в которых одна или более аминокислот белка были замещены другой аминокислотой. Аминокислотная замена может быть консервативной заменой, как это указано выше, или может быть неконсервативной заменой. Мутантные полипептиды могут быть получены известными в науке способами.
[00103] Термин «производное», при использовании относительно полипептидов обозначает полипептиды, химически модифицированные такими способами, как например, но не ограничиваясь, убихитинилирование, мечение (например, радионуклидами или различными ферментами), ковалентное присоединение полимера, такое как пегилирование (т.е. дериватизация с полиэтиленгликолем) и вставка или замещение путем химического синтеза аминокислот, таких как орнитин, которые в естественном виде не встречаются в белках человека. Производные полипептиды могут быть получены известными в науке способами.
[00104] Термин «производное» при использовании относительно линий клеток обозначает линии клеток, которые являются потомками материнской линии клеток; например, этот термин включает клетки, которые были пересеяны или субклонированы из материнских клеток и сохраняют требуемое свойство, потомство материнской линии клеток, которое было мутировано и селектировано на предмет сохранения требуемого свойства, и потомство материнской линии клеток, которое были изменено для содержания различных векторов экспрессии или различных нуклеиновых кислот, добавленных экзогенным способом.
[00105] «Определение» обозначает определение присутствия, отсутствия или количества аналита в образце и может включать количественное определение количества аналита в образце или на клетку в образце.
[00106] «Определяемая молекула» или «метка» относится к композиции, определяемой спектроскопическими, фотохимическими, биохимическими, иммунохимическими или химическими способами. Например, используемые метки включают32P,35S, флуоресцирующие красители, электронно-плотные реагенты, ферменты (например, обычно используемые в ИФА), биотин-стрептавидин, диоксигенин, гаптены и белки, для которых имеются антисыворотка или моноклональные антитела, или молекулы нуклеиновых кислот с последовательностью, комплементарной мишени. Определяемая молекула часто генерирует измеримый сигнал, такой как радиоактивный, хромогенный или флуоресцентный сигнал, который может использоваться для количественного определения количества связанной определяемой молекулы в образце. Определяемая молекула может быть введена или присоединена к праймеру или зонду ковалентным образом, или посредством ионных, ван-дер-ваальсовых или водородных связей, например, введением радиоактивных нуклеотидов или биотинилированных нуклеотидов, которые распознаются стрептавидином. Определяемая молекула может определяться прямым или косвенным образом. Косвенное определение может включать связывание второй молекулы, определяемой прямым или косвенным образом, к определяемой молекуле. Например, определяемая молекула может быть лигандом связующего партнера, такого как биотин, являющийся связующим партнером для стрептавидина, или нуклеотидная последовательность, которая является связующим партнером для комплементарной последовательности, с которой она может специфически гибридизировать. Связующий партнер может определяться прямым образом, например, антитело может быть мечено флуоресцентной молекулой. Связующий партнер также может определяться косвенным образом, например, нуклеиновая кислота с комплементарной нуклеотидной последовательностью может быть частью разветвленной молекулы ДНК, которая, в свою очередь, определяется по гибридизации с другими мечеными молекулами нуклеиновых кислот (См., например, Fahrlander et al., Bio/Technology 6:1165, 1988). Количественное определение сигнала производят, например, способом сцинтилляции, денситометрии или проточной цитометрии.
[00107] «Диагностический» обозначает идентификацию присутствия или природы патологического состояния. Диагностические способы отличаются по своей специфичности и избирательности. В то время как отдельный диагностический способ может не обеспечить точную диагностику состояния, достаточно, если этот способ обеспечивает положительный признак, помогающий в диагностике.
[00108] Термин «эффективное количество» обозначает дозу, достаточную для получения требуемого результата в состоянии здоровья, патологии и заболевании субъекта или в диагностических целях. Требуемый результат может включать субъективное или объективное улучшение у реципиента дозы. «Терапевтически эффективное количество» обозначает количество агента, эффективное для достижения запланированного благотворного эффекта на здоровье.
[00109] Термин «кодирующий» обозначает свойство, присущее специфическим последовательностям нуклеотидов в полинуклеотиде, такое как ген, кДНК или мРНК, служить в качестве матриц для синтеза других полимеров и макромолекул в биологических процессах, включая определенную последовательность нуклеотидов (т.е. рРНК, тРНК и мРНК) или определенную последовательность аминокислот и возникающие вследствие этого биологические свойства. Таким образом, ген кодирует белок, если транскрипция и трансляция мРНК, полученная из такого гена, приводит к образованию белка в клетке или другой биологической системе. Кодирующая цепь, нуклеотидная последовательность которой идентична последовательности мРНК и обычно представлена в списке последовательностей, и некодирующая цепь, используемая в качестве матрицы для транскрипции гена или кДНК, могут быть обозначены как кодирующие белок или другой продукт этого гена или кДНК. Если иное не указано, «нуклеотидная последовательность, кодирующая аминокислотную последовательность» включает все нуклеотидные последовательности, являющиеся вырожденными версиями друг друга и кодирующие одинаковую аминокислотную последовательность. Нуклеотидные последовательности, кодирующие белки и РНК, могут включать интроны.
[00110] «Эквивалентная доза» обозначает дозу, которая содержит одинаковое количество активного действующего вещества.
[00111] «Контрольная последовательность экспрессии» обозначает нуклеотидную последовательность в полинуклеотиде, которая регулирует экспрессию (транскрипцию и/или трансляцию) функционально связанной с ней нуклеотидной последовательности. «Функционально связанный» обозначает функциональную взаимосвязь между двумя частями, в которой активность одной части (например, способность регулировать транскрипцию) приводит к воздействию на другую часть (например, транскрипцию последовательности). Контрольные последовательности экспрессии могут включать, например, не ограничиваясь, последовательности промоторов (например, индуцируемые или конститутивные), энхансеров, терминаторов транскрипции, старт-кодона (т.е. ATG), сплайсинг-сигналов для интронов и стоп-кодонов.
[00112] «Вектор экспрессии» обозначает вектор, включающий рекомбинантный полинуклеотид, включающий контрольные последовательности экспрессии, функционально связанные с нуклеотидной последовательностью, которую требуется экспрессировать. Вектор экспрессии включает достаточное количество цис-активных элементов для экспрессии; другие элементы для экспрессии могут быть предоставлены клеткой-хозяином или системой экспрессии in vitro. Векторы экспрессии включают все известные в науке векторы, такие как космиды, плазмиды (например, отдельные или содержащиеся в липосомах) и вирусы, которые включают рекомбинантный полинуклеотид.
[00113] «Высокофосфорилированный», «высокий уровень фосфорилирования» и «высокий уровень фосфорилированных олигосахаридов» обозначает композиции лизосомальных ферментов сульфатаз, в которых по меньшей мере 50% лизосомального фермента сульфатазы связывается с катион-независимым рецептором маннозо-6-фосфата посредством фосфорилированных олигосахаридов. Связывание дополнительно характеризуется чувствительностью к конкуренции с маннозо-6-фосфатом. Высокофосфорилированный лизосомальный фермент сульфатазы также может относиться к лизосомальному ферменту сульфатазы с по меньшей мере 0,25, предпочтительно по меньшей мере 0,5, и более предпочтительно по меньшей мере 0,75 бис-фосфорилированных олигоманнозных цепей на белковую цепь. С другой стороны, высокофосфорилированный лизосомальный фермент сульфатазы (GALNS) может относиться к ферменту, для которого специфический захват, т.е. захват К (концентрация фермента/лиганда, которая дает половину максимального значения захвата) фибробластами составляет от примерно 0,1 до 10 нМ, или от примерно 0,1 до 7 нМ, или от примерно 0,5 до 5 нМ, или от примерно 1 до 5 нМ, или от примерно 1 до 3,5 нМ, или примерно 1 нМ, примерно 1,5 нМ, примерно 2 нМ, примерно 2,5 нМ, примерно 3 нМ или примерно 3,5 нМ, или любую комбинацию этих чисел.
[00114] Термин «бис-фосфорилированные олигоманнозные цепи» в контексте данного изобретения обозначает цепи олигосахаридов, содержащие маннозу, которые N-присоединены к остаткам аспарагина в лизосомальных ферментах сульфатазы и включают два остатка маннозо-6-фосфата. Как правило, бис-фосфорилированные олигоманнозные цепи имеют 7 остатков маннозы, т.е. бис-фосфат маннозы 7 (БФМ7), которые присоединены к двум остаткам GlcNAc, которые, в свою очередь, присоединены к остатку аспарагина в лизосомальном ферменте сульфатазы.
[00115] Термины «активный», «активированный» и «высокая степень активации» относятся к композициям лизосомальных ферментов сульфатаз, в которых по меньшей мере 50%, 55%, 60%, 65%, предпочтительно по меньшей мере 70%, 75%, 80%, 85%, 90% или 95% остатка цистеина активного сайта протеина было пост-трансляционно модифицировано в Cα-формилглицин (FGly). С другой стороны, термины «активный», «активированный» и «высокая степень активации» относятся к композициям лизосомальных ферментов сульфатаз, которые обладают специфической активностью, составляющей по меньшей мере примерно на 30% (например, 35%, 40%, 45%, 50%, 55%, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 95%, в 2 раза, в 2,5 раза, в 3 раза, в 4 раза, в 5 раз, в 10 раз, в 15 раз, в 20 раз, в 30 раз, в 40 раз или в 50 раз) больше, чем специфическая активность контрольного лизосомального фермента сульфатазы с той же самой аминокислотной последовательностью, который был получен в клетках-хозяевах (например, клетках СНО или клетках, полученных из СНО), которые не экспрессируют рекомбинантный SUMF1 человека. Подходящая контрольная композиция лизосомального фермента сульфатазы предпочтительно имеет такую же самую аминокислотную последовательность, что и высокоактивная композиция, и экспрессируется одним и тем же геном с использованием одного и того же промотора или регуляторной последовательности(ей) в одной и той же клетке-хозяине, за исключением случая, если клетка-хозяин не экспрессирует рекомбинантный SUMF1 человека и ее получают при одних и тех же или подобных условиях культивации, включая один и тот же период культивации, и, необязательно, очищают до одной и той же или подобной степени, что и высокоактивную композицию.
[00116] Термин «активный высокофосфорилированный» относится к композициям лизосомальных ферментов сульфатаз, в которых по меньшей мере 50%, предпочтительно по меньшей мере 70%, более предпочтительно по меньшей мере 90%, и даже более предпочтительно по меньшей мере 95% остатков цистеина в активном сайте протеина было пост-трансляционно модифицировано в Cα-формилглицин (FGly) и с по меньшей мере 0,25, предпочтительно по меньшей мере 0,5, и более предпочтительно по меньшей мере 0,75 бис-фосфорилированными олигоманнозными цепями на белковую цепь.
[00117] Термин «биологически активный» обозначает фрагменты полипептида (т.е. фермента), его мутанты, варианты или производные, которые сохраняют по меньшей мере значительное количество (например, по меньшей мере примерно 50%, предпочтительно по меньшей мере примерно 70%, и более предпочтительно по меньшей мере примерно 90%) одного или более свойств биологической активности полипептида полной цепи. При использовании относительно лизосомального фермента сульфатазы, его биологически активный фрагмент, мутант, вариант или производное сохраняет по меньшей мере значительное количество сульфатазной активности (т.е. расщепление сульфатных эфиров от отдельных веществ). При использовании относительно фактора модификации сульфатазы 1 (SUMF1), его биологически активный фрагмент, мутант, вариант или производное сохраняет по меньшей мере значительное количество активности образования формилглицина (т.е. модификации остатка цистеина активного сайта лизосомального фермента сульфатазы в Cα-формилглицин (FGly)).
[00118] Термин «чистота» или «чистый» при использовании относительно полипептидов обозначает количество полипептида, подвергнутого анализу в сравнении с любыми загрязняющими веществами, которые могут быть определены с использованием отдельного способа. Для рекомбинантных лизосомальных ферментов сульфатаз по изобретению «чистота» может быть определена путем подвергания композиции фермента сульфатазы электрофоретическому разделению в ходе SDS-PAGE в восстанавливающих или невосстанавливающих условиях с последующим окрашиванием Кумасси синим или серебром, или хроматографическим разделением в ходе ВЭЖХ (например, с С4 обращенными фазами (ОФ), С3 ОФ), или любым другим хроматографическим разделением, например, эксклюзионной хроматографией (ЭХ) и т.п. С использованием любого из таких способов очищенные рекомбинантные лизосомальные ферменты сульфатазы по изобретению имеют чистоту по меньшей мере примерно 80%, или по меньшей мере примерно 85%, предпочтительно по меньшей мере примерно 90%, более предпочтительно по меньшей мере примерно 95%, и даже более предпочтительно по меньшей мере примерно 97%, 98% или 99%.
[00119] Термин «предшественник» или «форма предшественника» относится к форме рекомбинантного лизосомального фермента сульфатазы, которая секретируется в клетке млекопитающего, т.е. с отсутствующей сигнальной последовательностью, и с отсутствием определенных модификаций, например внутреннего расщепления протеинов, которое обычно происходит в лизосоме. Термин «зрелый», «зрелая форма», «обработанный» или «обработанная форма» обозначает форму рекомбинантного лизосомального фермента сульфатазы, которая обычно присутствует в лизосоме. Для рекомбинантных лизосомальных ферментов сульфатаз по изобретению относительное обилие «предшественника» или «формы предшественника» и «зрелого», «зрелой формы», «процессированного» или «процессированной формы» может быть определено путем подвергания композиции сульфатазного фермента электрофоретическому разделению в ходе SDS-PAGE в восстанавливающих условиях с последующим окрашиванием Кумасси синим или серебром, или путем хроматографического разделения ВЭЖХ (например, с С4 обращенными фазами (ОФ), С3 ОФ), или любым другим хроматографическим разделением, например, эксклюзионной хроматографией (ЭХ) и т.п., или комбинацией электрофоретического разделения и хроматографического разделения, например, SDS-PAGE с последующим капиллярным гель-электрофорезом (SDS-CGE). С использованием таких способов очищенные рекомбинантные лизосомальные ферменты сульфатазы по изобретению состоят по меньшей мере примерно из 65%, 70% или 75%, предпочтительно по меньшей мере примерно из 80% или 85%, более предпочтительно по меньшей мере примерно из 90%, и даже более предпочтительно по меньшей мере примерно из 95%, 97%, 98%, 98,5%, 99% или 99,5% «предшественника» или «формы предшественника». С другой стороны, с использованием этих способов очищенные рекомбинантные лизосомальные ферменты сульфатазы по изобретению состоят из менее чем примерно 35%, 30% или 25%, предпочтительно из менее чем примерно 20% или 15%, более предпочтительно менее чем примерно из 10%, и даже более предпочтительно менее чем примерно из 5%, 3%, 2%, 1,5%, 1% или 0,5% «зрелых», «зрелой формы», «процессированных» или «процессированной формы». В некоторых вариантах воплощения изобретения определяют только «предшественника» или «форму предшественника» (т.е. композиция фермента сульфатазы состоит по существу из единственной определяемой полосы при проведении SDS-PAGE в восстанавливающих условиях, или как это определено SDS-CGE, или по единственному пику при проведении ВЭЖХ).
[00120] Термины «идентичный» или процент «идентичности» в контексте двух или более полинуклеотидов или полипептидных последовательностей обозначают две или более последовательностей или субпоследовательностей, которые являются одинаковыми или имеют определенный процент нуклеотидов или аминокислотных остатков, являющихся одинаковыми, при сравнении и выравнивании для максимального соответствия, как это измерено с использованием одного из следующих алгоритмов сравнения последовательностей или визуального наблюдения.
[00121] «Линкер» обозначает молекулу, которая соединяет две другие молекулы, ковалентным образом или ионной связью, ван-дер-ваальсовой или водородной связью, например, молекулу нуклеиновой кислоты, которая гибридизирует в одну комплементарную последовательность на 5’-конце, и в другую комплементарную последовательность на 3’-конце, соединяя, таким образом, две некомплементарные последовательности.
[00122] «Низкий уровень фосфорилирования» или «низкое фосфорилирование» обозначает композицию лизосомальных ферментов сульфатазы, в которой захват в клетках фибробластах имеет половину от максимальной концентрации более 10 нМ, или фракция лизосомальных ферментов сульфатаз, которая связывает рецептор маннозо-6-фосфата в колонке, составляет менее чем примерно 25%.
[00123] Термин «встречающийся в природе» применительно к объекту обозначает факт того, что объект может присутствовать в природе. Например, полипептидная или полинуклеотидная последовательность, присутствующая в организме (включая вирусы) и которая может быть выделена из природного источника и непреднамеренно не модифицирована человеком в лаборатории, является встречающейся в природе.
[00124] «Фармацевтическая композиция» обозначает композицию, подходящую для фармацевтического использования у субъекта животного, включая человека и млекопитающих. Фармацевтическая композиция включает фармакологически эффективное количество терапевтического лизосомального фермента сульфатазы и также включает один или более фармацевтически приемлемых носителей, разбавителей или вспомогательных веществ. Фармацевтическая композиция охватывает композицию, включающую активное действующее вещество(а) и инертный ингредиент(ы), которые включают носитель, разбавитель или вспомогательное вещество, а также любой продукт, который образуется, прямым или косвенным образом, из комбинации, комплексообразования или агрегации любого двух или более ингредиентов, или в результате диссоциации одного или более ингредиентов, или в результате реакций или взаимодействий другого типа одного или более ингредиентов. В соответствии с этим, фармацевтические композиции по данному изобретению включают любую композицию, полученную путем смешивания лизосомального фермента сульфатазы по данному изобретению с одним или более фармацевтически приемлемых носителей, разбавителей или вспомогательных веществ.
[00125] «Фармацевтически приемлемый носитель, разбавитель или вспомогательное вещество» обозначает любые стандартные фармацевтические носители, разбавители, буферы и вспомогательные вещества, такие как, например, и без ограничения, забуференный фосфатом физиологический раствор, 5% водный раствор декстрозы и эмульсии, такие как эмульсия масло в воде или вода в масле, и различные типы смачивающих агентов и/или адъювантов. Подходящие фармацевтические носители, разбавители или вспомогательные вещества и композиции описаны в Remington’s Pharmaceutical Sciences, 19th Ed. (Mack Publishing Co., Easton, 1995). Предпочтительные фармацевтические носители, разбавители или вспомогательные вещества зависят от предполагаемого пути введения активного действующего вещества. Типичные пути введения включают, например, но не ограничиваясь, энтеральные (например, пероральный) или парентеральные (например, подкожные, внутримышечные, внутривенные или интраперитонеальные) инъекции; или местное, чрескожное или чресслизистое введение.
[00126] «Фармацевтически приемлемая соль» представлена солью, которая может быть включена в лизосомальный фермент сульфатазы для фармацевтического применения, включая, например, соли металлов (натрия, калия, магния, кальция и т.д.) и соли аммония или органических аминов.
[00127] «Полинуклеотид» обозначает полимер, состоящий из нуклеотидных единиц. Полинуклеотиды включают встречающиеся в природе нуклеиновые кислоты, такие как дезоксирибонуклеиновая кислота («ДНК») и рибонуклеиновая кислота («РНК»), а также аналоги нуклеиновых кислот. Аналоги нуклеиновых кислот включают таковые, которые включают не встречающиеся в природе основания, нуклеотиды, задействованные в образовании связей с другими нуклеотидами, кроме встречающейся в природе фосфодиэфирной связи, или таковые, которые включают основания, присоединенные посредством связей, отличных от фосфодиэфирных связей. Таким образом, аналоги нуклеотидов включают, например, но не ограничиваясь, фосфоротиоаты, фосфородитиоаты, фосфоротриэфиры, фосфорамидаты, боранофосфаты, метилфосфонаты, хиральные метилфосфонаты, 2-О-метилрибонуклеотиды, пептид-нуклеиновые кислоты (ПНК) и т.п. Такие полинуклеотиды могут быть синтезированы, например, с использованием автоматического ДНК-синтезатора. Термин «нуклеиновая кислота» обычно обозначает большие полинуклеотиды. Термин «олигонуклеотид» обычно обозначает короткие полинуклеотиды, обычно не более чем примерно 50 нуклеотидов. Следует понимать, что если нуклеотидная последовательность представлена последовательностью ДНК (т.е. A, T, G, C), она также включает последовательность РНК (т.е. A, U, G, C), в которой «U» заменяет «Т».
[00128] «Полипептид» обозначает полимер, состоящий из остатков аминокислот, их родственных встречающихся в природе структурных вариантов, в также их синтезированных не встречающихся в природе аналогов, присоединенных посредством пептидных связей, их родственных встречающихся в природе структурных вариантов и их синтезированных не встречающихся в природе аналогов. Синтезированные полипептиды могут быть синтезированы, например, с использованием автоматического полипептидного синтезатора. Термин «протеин» обычно обозначает большие полипептиды. Термин «пептид» обычно обозначает короткие полипептиды. Для описания полипептидных последовательностей в тексте данной заявки используют условные обозначения: левый конец полипептидной последовательности является аминотерминальным; правый конец полипептидной последовательности является карбокситерминальным.
[00129] «Праймер» обозначает полинуклеотид, который способен специфически гибридизировать в установленную полинуклеотидную матрицу и обеспечивать точку инициации синтеза комплементарного полинуклеотида. Такой синтез происходит, когда полинуклеотидный праймер находится в условиях, при которых синтез индуцируется, т.е. в присутствии нуклеотидов, комплементарной полинуклеотидной матрицы и агента для полимеризации, такого как ДНК-полимераза. Праймер обычно одноцепочечный, но может быть и двухцепочечным. Праймеры обычно представлены дезоксирибонуклеиновыми кислотами, но для различного применения может использоваться целый ряд синтезированных и представленных в природе праймеров. Праймер комплементарен матрице, с которой он должен гибридизировать для образования сайта инициации синтеза, но не обязательно должен отображать точную последовательность матрицы. В таком случае специфическая гибридизация праймера в матрице зависит от строгости условий гибридизации. Праймеры могут быть мечены, например, хромогенными, радиоактивными или флуоресцентными молекулами, и использоваться в качестве определяемых молекул.
[00130] «Зонд» при использовании относительно полинуклеотида обозначает полинуклеотид, который способен специфически гибридизировать в установленную последовательность другого полинуклеотида. Зонд специфически гибридизирует в отдельный комплементарный полинуклеотид, но не обязательно должен отображать точную комплементарную последовательность матрицы. В таком случае специфическая гибридизация зонда в установленную последовательность зависит от строгости условий гибридизации. Зонды могут быть мечены, например, хромогенными, радиоактивными или флуоресцентными молекулами, и использоваться в качестве определяемых молекул.
[00131] «Профилактическое» лечение представлено лечением, вводимым субъекту, у которого отсутствуют признаки заболевания или присутствуют только ранние признаки, в целях снижения риска развития патологии. Соединения по изобретению могут вводиться в качестве профилактического лечения для снижения вероятности развития патологии или для сведения к минимуму степени тяжести патологии в случае ее развития.
[00132] «Рекомбинантный полинуклеотид» обозначает полинуклеотид с последовательностями, которые естественным образом не соединены друг с другом. Амплифицированный или собранный рекомбинантный полинуклеотид может быть включен в подходящий вектор, и вектор может использоваться для трансформации подходящей клетки-хозяина. Клетка-хозяин, которая включает рекомбинантный полинуклеотид, обозначается как «рекомбинантная клетка-хозяин». Затем ген экспрессируется в рекомбинантную клетку-хозяина для продуцирования, например, «рекомбинантного полипептида». Рекомбинантный полинуклеотид также может выполнять некодирующую функцию (например, промотора, точки начала репликации, сайта связывания рибосом и т.д.).
[00133] «Гибридизация специфическим образом в», «специфическая гибридизация» или «избирательно гибридизировать в» обозначает связывание, дупликацию или гибридизацию молекулы нуклеиновой кислоты преимущественно в отдельную нуклеотидную последовательность при строгих условиях при присутствии такой последовательности в комплексной смеси (например, общей клеточной смеси) ДНК или РНК.
[00134] Термин «строгие условия» обозначают условия, при которых зонд будет гибридизировать преимущественно в указанную субпоследовательность, и, в меньшей степени, или ни в малейшей степени, в другие последовательности. «Строгая гибридизация» и «строгие условия гибридизации и промывания» в контексте экспериментов с гибридизацией нуклеиновой кислоты, таких как саузерн- и нозерн-гибридизации, зависят от последовательностей и отличаются при разных параметрах окружающей среды. Обширное руководство по гибридизации нуклеиновых кислот представлено в Tijssen (1993) Laboratory Techniques in Biochemistry and Molecular Biology--Hybridization with Nucleic Acid Probes part I chapter 2 “Overview of principles of hybridization and the strategy of nucleic acid probe assays”, Elsevier, New York. В целом, очень строгие условия гибридизации и промывания составляют примерно на 5°C ниже, чем термальная точка плавления (Tm) для специфической последовательности при определенной концентрации ионов и рН. Tm является температурой (при определенной концентрации ионов и рН), при которой 50% указанной последовательности гибридизирует в превосходно соответствующий зонд. Очень строгие условия гибридизации выбирают таким образом, чтобы они были равны Tm для отдельного зонда.
[00135] Примером строгих условий гибридизации для гибридизации комплементарных нуклеиновых кислот, имеющих более чем 100 комплементарных остатков на фильтре в ходе саузерн или нозерн-блоттинга, является 50% формалин с 1 мг гепарина при 42°C, при этом гибридизация должна проводиться в течение ночи. Примером очень строгих условий промывания является 0,15 М NaCl при 72°C в течение примерно 15 минут. Примером строгих условий промывания является промывание 0,2X SSC при 65°C в течение 15 минут (описание буфера SSC см. в Sambrook et al.). Часто промыванию при очень строгих условиях предшествует промывание в условиях низкой строгости для удаления фонового сигнала зонда. Примером среды для промывания со средней строгостью условий для дуплекса, например, более чем 100 нуклеотидов, является 1x SSC при 45°C в течение 15 минут. Примером среды для промывания с низкой строгостью условий для дуплекса, например, более чем 100 нуклеотидов, является 4-6x SSC при 40°C в течение 15 минут. В целом, соотношение сигнал/шум 2x (или выше) от отмечаемого значения для неродственного зонда в отдельном анализе гибридизации указывает на определение специфической гибридизации.
[00136] «Субъект» диагностики или лечения представлен человеком или животным, включая млекопитающего или примата.
[00137] Фраза «по существу гомологичный» или «по существу идентичный» в контексте двух нуклеиновых кислот или полипептидов обычно обозначает две или более последовательности или субпоследовательности, которые имеют идентичность нуклеотидов или аминокислотных остатков, составляющую по меньшей мере 40%, 60%, 80%, 90%, 95%, 96%, 97%, 98% или 99% при сравнении и сопоставлении для максимального соответствия, как это измерено с использованием одного из нижеприведенных алгоритмов сравнения последовательностей или визуальным наблюдением. Предпочтительно, идентичность по существу существует в участке последовательностей, имеющих в длину по меньшей мере примерно 50 остатков, более предпочтительно, для участка по меньшей мере примерно со 100 остатками, и наиболее предпочтительно, для последовательностей, которые по существу идентичны, по меньшей мере примерно с 150 остатками. В наиболее предпочтительном варианте воплощения изобретения последовательности по существу идентичны во всей длине одного или обоих биополимеров, подвергаемых сравнению.
[00138] Для сравнения последовательностей обычно одна последовательность служит в качестве эталонной последовательности, с которой сравнивают исследуемые последовательности. При использовании алгоритма сравнения последовательности, исследуемая и эталонная последовательности вводятся в компьютер, указываются координаты субпоследовательностей, при необходимости, и устанавливаются параметры программы алгоритма последовательности. Алгоритм сравнения последовательностей затем вычисляет процент идентичности последовательности для исследуемой последовательности(ей) относительно эталонной последовательности на основе установленных параметров программы.
[00139] Оптимальное выравнивание последовательностей для сравнения может быть проведено, например, с использованием локального алгоритма гомологичности Smith & Waterman, Adv. Appl. Math. 2:482, 1981, алгоритма гомологичного выравнивания Needleman & Wunsch, J. Mol. Biol. 48:443, 1970, поиском способа подобия Pearson & Lipman, Proc. Natl. Acad. Sci. USA 85:2444, 1988, компьютерным внедрением таких алгоритмов (GAP, BESTFIT, FASTA, and TFASTA in the Wisconsin Genetics Software Package, Genetics Computer Group, 575 Science Dr., Madison, WI) или визуальным наблюдением.
[00140] Одним из примеров используемого алгоритма является PILEUP. PILEUP создает выравнивание множественных последовательностей из группы родственных последовательностей с использованием прогрессивных, парных выравниваний для демонстрации взаимосвязи и процентной идентичности последовательности. Он также позволяет построить дерево или древовидную диаграмму, отображающую взаимоотношения кластеров, используемые для создания выравнивания. PILEUP предусматривает упрощение способа прогрессивного выравнивания Feng & Doolittle, J. Mol. Evol. 35:351-360, 1987. Этот способ подобен способу, описанному Higgins & Sharp, CABIOS 5:151-153, 1989. Программа может выровнять до 300 последовательностей, каждую с максимальной длиной 5000 нуклеотидов или аминокислот. Процедура множественного выравнивания начинается с попарного выравнивания двух наиболее подобных последовательностей с получением кластера двух сопоставленных последовательностей. Такой кластер затем сопоставляется со следующей наиболее похожей последовательностью или кластером выровненных последовательностей. Два кластера последовательностей выравнивают простым расширением парного выравнивания двух отдельных последовательностей. Финальное выравнивание получают с использованием серий прогрессивных попарных выравниваний. Программа выполняется путем установления специфических последовательностей и их аминокислотных или нуклеотидных координатов для участков сравнения последовательностей и путем указания параметров программы. Например, эталонная последовательность может быть сопоставлена с другими исследуемыми последовательностями для определения процентного соотношения идентичности последовательности с использованием следующих параметров: штраф за открытие гэпа по умолчанию (3,00), штраф за продолжение гэпа по умолчанию (0,10) и взвешенные конечные гэпы. Другой алгоритм, используемый для получения множественных выравниваний последовательностей, представлен Clustal W (Thompson et al., Nucleic Acids Research 22: 4673-4680, 1994).
[00141] Другим примером алгоритма, подходящего для определения процентного показателя идентичности последовательности и подобия последовательности, является алгоритм BLAST, описанный в Altschul et al., J. Mol. Biol. 215:403-410, 1990. Программное обеспечение для проведения анализов BLAST представлено для публичного доступа Национальным центром биотехнологической информации. Этот алгоритм включает вначале идентификацию пар последовательностей с высоким показателем (HSP) путем идентификации коротких групп в длине W в исследуемой последовательности, которая совпадает или соответствует определенному положительному пороговому значению Т при сопоставлении с группой такой же длины в последовательности базы данных. Т обозначает пороговый показатель ближайшей группы (Altschul et al., J. Mol. Biol. 215:403-410, 1990). Такие начальные совпадения соседних групп выступают в качестве ключевых моментов для инициации поиска для обнаружения больших HSP, содержащих такие группы. Затем совпадающие группы расширяют в обоих направлениях в каждой последовательности для максимально возможного повышения показателя кумулятивного выравнивания. Кумулятивные показатели для нуклеотидных последовательностей рассчитывают с использованием параметров М (выигрышный показатель для пары совпадающих остатков; всегда >0) и N (показатель штрафа за несовпадающие остатки; всегда <0). Для аминокислотных последовательностей для расчета кумулятивного показателя используют матрицу замен. Расширение совпадающих групп в каждом направлении обрывается в следующих случаях: кумулятивный показатель выравнивания падает на величину Х от своего максимального достигнутого значения; кумулятивный показатель приближается к нулю или ниже его по причине аккумуляции одного или более выравниваний остатков с отрицательным показателем; или достигнут конец любой последовательности. Параметры W, T и X алгоритма BLAST определяют чувствительность и скорость выравнивания. Программа BLASTN (для нуклеотидных последовательностей) использует по умолчанию длину группы (W), равную 11, ожидание (Е), равное 10, M=5, N=-4, и сравнение обеих цепей. Для аминокислотных последовательностей программа BLASTP использует по умолчанию длину группы (W), равную 3, ожидание (E), равное 10, и матрицу замен BLOSUM62 (см. Henikoff & Henikoff, Proc. Natl. Acad. Sci. USA 89:10915, 1989).
[00142] Кроме расчета процентной идентичности последовательности, алгоритм BLAST также выполняет статистический анализ подобия между двумя последовательностями (см., например, Karlin & Altschul, Proc. Natl. Acad. Sci. USA 90:5873-5787, 1993). Одним из показателей подобия, представляемых алгоритмом BLAST, является наименьшая суммарная вероятность (P(N)), которая дает представление о вероятности, с которой случайным образом будут совпадать две нуклеотидные или аминокислотные последовательности. Например, нуклеиновая кислота считается подобной эталонной последовательности, если наименьшая суммарная вероятность при сравнении исследуемой нуклеиновой кислоты с эталонной нуклеиновой последовательностью менее чем примерно 0,1, более предпочтительно, менее чем примерно 0,01, и наиболее предпочтительно, менее чем примерно 0,001.
[00143] Дополнительным свидетельством того, что две последовательности нуклеиновых кислот или полипептидов по существу идентичны, является тот факт, что полипептид, кодируемый первой нуклеиновой кислотой, обладает иммунологической перекрестной реакционной способностью относительно полипептида, кодируемого второй нуклеиновой кислотой, как это описано ниже. Таким образом, полипептид обычно по существу идентичен второму полипептиду, например, если два полипептида отличаются только консервативными заменами. Другим показателем того, что две последовательности нуклеиновых кислот по существу идентичны, является тот факт, что две молекулы гибридизируют друг в друга при строгих условиях, как это описано в тексте данной заявки.
[00144] «По существу чистый» или «выделенный» обозначает, что рассматриваемые виды являются присутствующими доминирующими видами (т.е. на молярной основе, преобладают в сравнении с любым другим отдельным макромолекулярным видом в композиции), и по существу очищенная фракция представлена композицией, в которой рассматриваемый вид включает по меньшей мере примерно 50% (на молярной основе) всех присутствующих видов макромолекул. В целом, по существу чистая композиция обозначает, что примерно 80-90% или более видов макромолекул, присутствующих в композиции, являются интересующими очищенными видами. Рассматриваемые виды очищены до значительной гомогенности (загрязняющие виды не могут быть определены в композиции стандартными способами определения), если композиция состоит по существу из одного макромолекулярного вида. Согласно данному определению, виды растворителей, небольшие молекулы (<500 дальтон), стабилизаторы (например, БСА) и ионы металлов не считаются макромолекулами. В некоторых вариантах воплощения изобретения лизосомальные ферменты сульфатазы по изобретению по существу чистые или выделенные. В некоторых вариантах воплощения изобретения лизосомальные ферменты сульфатазы по изобретению по существу чистые или выделенные относительно исходных макромолекулярных материалов, используемых в их синтезе. В некоторых вариантах воплощения изобретения фармацевтическая композиция по изобретению включает по существу очищенный или выделенный терапевтический лизосомальный фермент сульфатазы, смешанный с одним или более фармацевтически приемлемых носителей, разбавителей или вспомогательных веществ.
[00145] «Терапевтическое» лечение является лечением, вводимым субъекту с признаками или симптомами патологии в целях снижения или элиминации данных признаков или симптомов. Признаки или симптомы могут быть биохимическими, клеточными, гистологическими, функциональными, субъективными или объективными. Лизосомальные ферменты сульфатазы по изобретению могут вводиться в качестве терапевтического лечения или для диагностики.
[00146] «Терапевтический индекс» обозначает диапазон дозы (количество и/или время введения) выше минимального терапевтического количества и ниже неприемлемого токсического количества.
[00147] «Лечение» обозначает профилактическое лечение или терапевтическое лечение или диагностическое лечение.
[00148] Термин «единица лекарственной формы» в контексте данного изобретения обозначает физические дискретные единицы, подходящие в качестве однократной дозы для субъектов человека и животных, при этом каждая единица содержит предварительно определенное количество лизосомального фермента сульфатазы по данному изобретению, рассчитанное в количестве, достаточном для выработки требуемого эффекта, в комбинации с одним или более фармацевтически приемлемых носителей, разбавителей или вспомогательных веществ. Спецификации новейших лекарственных форм по данному изобретению зависят от конкретного используемого лизосомального фермента сульфатазы и эффекта, которого необходимо достичь, а также фармакодинамики, связанной с каждым лизосомальным ферментом сульфатазы, у хозяина.
II. ПОЛУЧЕНИЕ ЛИЗОСОМАЛЬНЫХ ФЕРМЕНТОВ СУЛЬФАТАЗЫ
[00149] В одном аспекте данное изобретение описывает новейший способ получения активных высокофосфорилированных лизосомальных ферментов сульфатазы в количествах, обеспечивающих терапевтическое использование таких ферментов. В целом, способ описывает трансформацию подходящей линии клеток с использованием кДНК, кодирующей фактор модификации сульфатазы человека 1 (SUMF1) или его биологически активный фрагмент, мутант, вариант или производное, и кДНК, кодирующей лизосомальный фермент сульфатазы полной длины или его биологически активный фрагмент, мутант, вариант или производное. Специалист в данной области может приготовить векторы экспрессии, кроме описанных здесь векторов, для оптимального получения таких лизосомальных ферментов сульфатазы в подходящих линиях трансфицированных клеток. Кроме того, специалист в данной области может легко получить фрагменты кДНК, кодирующей биологически активные фрагменты, варианты, мутанты или производные встречающегося в природе SUMF1 или лизосомальных ферментов сульфатазы, обладающих такой же или подобной биологической активностью относительно встречающихся в природе ферментов полной длины.
Клетки-хозяева
[00150] Клетки-хозяева, используемые для получения рекомбинантных лизосомальных ферментов сульфатаз, представлены линиями клеток с недостаточной эндосомальной ацидификацией, характеризующимися своей способностью вырабатывать такие лизосомальные ферменты сульфатазы в количествах, позволяющих использовать фермент терапевтическим способом. Изобретение описывает полученную из CHO-K1 комплементарную линию группы клеток END3, обозначаемую G71. Изобретение также описывает линию клеток G71, которая была адаптирована к росту в суспензионной культуре, не содержащей сыворотку, обозначенной G71S. Изобретение также описывает производные линии клеток G71 и G71S, которые были субклонированы дополнительно или которые содержат разные плазмиды экспрессии.
[00151] Клетки, содержащие и экспрессирующие ДНК или РНК, кодирующие рекомбинантный белок, обозначаются в тексте данной заявки как генетически модифицированные клетки. Клетки млекопитающих, содержащие и экспрессирующие ДНК или РНК, кодирующие рекомбинантный белок, обозначаются в тексте данной заявки как генетически модифицированные клетки млекопитающих. Введение ДНК или РНК в клетки осуществляется известным способом трансфекции, таким как, например и не ограничиваясь, электропорация, микроинъекция, баллистическая трансфекция, осаждение кальция фосфатом, осаждение модифицированным кальция фосфатом, обработка катионоактивным липидом, фотопорация, способы слияния, опосредованный рецептором трансфер или осаждение полибреном. С другой стороны, ДНК или РНК могут быть введены путем инфекции вирусным вектором. Способы получения клеток, включая клетки млекопитающих, экспрессирующих ДНК или РНК, кодирующую рекомбинантный белок, описаны в со-заявках на патенты США, находящиеся на рассмотрении сер. № 08/334797 под названием “In Vivo Protein Production and Delivery System for Gene Therapy”, by Richard F Selden, Douglas A. Treco and Michael W. Heartlein (от 4 ноября 1994 г.); патент США сер. № 08/334455 под названием “In Vivo Production and Delivery of Erythropoietin or Insulinotropin for Gene Therapy”, by Richard F Selden, Douglas A. Treco and Michael W. Heartlein (от 4 ноября 1994 г.) и патент США сер. № 08/231439 под названием “Targeted Introduction of DNA Into Primary or Secondary Cells and Their Use for Gene Therapy”, by Douglas A. Treco, Michael W. Heartlein and Richard F Selden (от 20 апреля 1994 г.). Данные каждой из таких заявок приводятся здесь во всей своей полноте посредством ссылки.
[00152] В предпочтительных вариантах воплощения изобретения клетка-хозяин, используемая для получения рекомбинантных лизосомальных ферментов сульфатазы, представлена линией клеток с недостаточной эндосомальной ацидификацией, характеризующейся своей способностью вырабатывать такие лизосомальные ферменты сульфатазы в количествах, позволяющих использовать фермент терапевтическим способом. В предпочтительных вариантах воплощения изобретение описывает полученную из CHO-K1 комплементарную линию группы клеток END3, обозначаемую G71, и линию клеток G71, которая была адаптирована для роста в суспензионной культуре с отсутствием сыворотки, обозначенную G71S, которые со-экспрессируют фактор модификации сульфатазы человека 1 (SUMF1) и рекомбинантный лизосомальный фермент сульфатазы, и, таким образом, способны вырабатывать большие количества активных высокофосфорилированных лизосомальных ферментов сульфатазы, как это определено в главе «ОПРЕДЕЛЕНИЯ», что обеспечивает широкомасштабное производство терапевтических лизосомальных ферментов сульфатазы. В более предпочтительных вариантах воплощения изобретения линия клеток G71 или G71S, или их производное, экспрессирует и секретирует рекомбинантный лизосомальный фермент сульфатазы в количестве по меньшей мере примерно 0,5, предпочтительно по меньшей мере примерно 0,75, более предпочтительно по меньшей мере примерно 1,0, и еще более предпочтительно по меньшей мере примерно 1,25 пг/клетка/сутки.
Векторы и конструкции нуклеиновых кислот
[00153] Конструкция нуклеиновой кислоты, используемая для экспрессии рекомбинантного белка, фактора модификации сульфатазы человека 1 (SUMF1) или лизосомальный фермент сульфатазы, или оба соединения, может быть представлен вектором, который экспрессируется экстрахромосомально (эписомально) в трансфицированной клетке млекопитающего, или вектором, который интегрируется случайным образом или в предварительно выбранном сайте посредством гомологичной рекомбинации, в геном клетки реципиента. Конструкция, которая экспрессируется экстрахромосомально, включает, кроме последовательностей, кодирующих рекомбинантный белок, последовательности, достаточные для экспрессии белка в клетках и, необязательно, для репликации конструкции. Он обычно включает промотор, ДНК, кодирующую рекомбинантный белок, и сайт полиаденилирования. ДНК, кодирующая рекомбинантный белок, располагается в конструкции таким образом, что ее экспрессия находится под контролем промотора. Необязательно, конструкция может включать дополнительные компоненты, например, один или более из следующих: сайт сплайсинга, последовательность энхансера, ген селектируемого маркера под контролем соответствующего промотора, ген маркера амплификации под контролем соответствующего промотора, и участок прикрепления к матриксу (MAR) или другой элемент, известный в науке, который повышает экспрессию участка, в который он вставлен.
[00154] В вариантах воплощения изобретения, в которых вектор ДНК встраивается в геном клетки, включены только последовательности нуклеиновых кислот, кодирующие рекомбинантный белок. Необязательно, он может включать последовательность промотора и энхансера, сайт или сайты полиаденилирования, сайт или сайты сплайсинга, последовательности нуклеиновых кислот, кодирующие избирательный маркер или маркеры, последовательности нуклеиновых кислот, кодирующие амплифицируемый маркер, участок прикрепления к матриксу (MAR) или другой элемент, известный в науке, который повышает экспрессию участка, в который он вставлен, и/или ДНК, гомологичную геномной ДНК в клетке реципиента, для целенаправленной интеграции ДНК к выбранному сайту в геноме (к выбранным ДНК или последовательностям ДНК).
Способы культивации клеток
[00155] Клетки млекопитающих, содержащие ДНК или РНК, кодирующую рекомбинантный белок, культивируют в условиях, подходящих для роста клеток и экспрессии ДНК или РНК. Клетки, экспрессирующие рекомбинантный белок, могут быть идентифицированы с использованием известных способов и описанных здесь способов, и рекомбинантный белок может быть выделен и очищен с использованием известных способов и описанных здесь способов с или без амплификации выработки рекомбинантного белка. Идентификация может проводиться, например, путем скрининга генетически модифицированных клеток млекопитающих, имеющих фенотип, являющийся признаком присутствия ДНК или РНК, кодирующей рекомбинантный белок, таким как ПЦР скрининг, скрининг с использованием саузерн-блоттинга, или скрининг на предмет экспрессии рекомбинантного белка. Селекция клеток, содержащих включенную кодирующую рекомбинантный белок ДНК, может сопровождаться включением избирательного маркера в конструкцию ДНК с последующей культивацией трансфицированных или инфицированных клеток, содержащих ген избирательного маркера, в условиях, подходящих для выживания только тех клеток, которые экспрессируют ген избирательного маркера. Дополнительная амплификация введенной конструкции ДНК может проводиться при культивации генетически модифицированных клеток млекопитающих при соответствующих условиях (например, культивации генетически модифицированных клеток млекопитающих, содержащих амплифицированный ген маркера в присутствии концентрации препарата, при которой могут выжить только клетки, содержащие множественные копии амплифицированного гена маркера).
[00156] Генетически модифицированные клетки млекопитающих, экспрессирующие рекомбинантный белок, могут быть идентифицированы, как это описано в тексте данной заявки, путем определения продукта экспрессии. Например, клетки млекопитающих, экспрессирующие активные высокофосфорилированные лизосомальные ферменты сульфатазы, могут быть идентифицированы иммуноферментным сендвич-анализом. К фрагменту активного действующего вещества могут быть направлены антитела.
Варианты лизосомальных ферментов сульфатазы
[00157] В определенных вариантах воплощения изобретения мутанты или варианты активных высокофосфорилированных лизосомальных ферментов сульфатазы могут быть получены и использоваться в целом ряде применений, в которых могут применяться активные высокофосфорилированные лизосомальные ферменты сульфатазы. Мутанты аминокислотных последовательностей или варианты полипептида могут быть представлены мутантами или вариантами с заменой, вставкой или делецией. Мутанты или варианты с делецией не содержат один или более остатков нативного белка, которые не являются важными для функционирования или иммуногенной активности. Общий тип мутанта или варианта с делецией представлен таковым с отсутствием секреторных сигнальных последовательностей или сигнальных последовательностей, направляющих белок на связывание с определенной частью клетки. Мутанты или варианты со вставками обычно включают дополнение материала на неконечном участке полипептида. Это может включать вставку иммунореактивной антигенной детерминанты или просто отдельного остатка. Терминальные вставки, также называемые белками слияния, описаны ниже.
[00158] Варианты могут быть по существу гомологичными или по существу идентичными немодифицированному лизосомальному ферменту сульфатазы, как это указано выше. Предпочтительные варианты представлены вариантами активного высокофосфорилированного лизосомального фермента-полипептида сульфатазы, который сохраняет по меньшей мере некоторую биологическую активность, например сульфатазную активность, лизосомального фермента сульфатазы. Другие предпочтительные варианты включают варианты полипептида N-ацетилгалактозамин-6-сульфатазы человека, которые сохраняют по меньшей мере некоторую сульфатазную активность N-ацетилгалактозамин-6-сульфатазы человека.
[00159] Мутанты или варианты с заменой обычно включают замену одной аминокислоты из полипептида дикого типа другой аминокислотой в одном или более сайтов в белке, и могут быть разработаны для модуляции одного или более свойств полипептида, таких как, например и без ограничения, стабильность относительно протеолитического расщепления, без потери других функций или свойств. Замены такого типа являются преимущественно консервативными, т.е. одна аминокислота замещается другой аминокислотой подобной формы и заряда. Консервативные замены хорошо известны в науке и включают, например, следующие замены: аланина на серин; аргинина на лизин; аспарагина на глутамин или гистидин; аспартата на глутамат; цистеина на серин; глутамина на аспарагин; глутамата на аспартат; глицина на пролин; гистидина на аспарагин или глутамин; изолейцина на лейцин или валин; лейцина на валин или изолейцин; лизина на аргинин; метионина на лейцин или изолейцин; фенилаланина на тирозин, лейцин или метионин; серина на треонин; треонина на серин; триптофана на тирозин; тирозина на триптофан или фенилаланин; и валина на изолейцин или лейцин.
[00160] Один аспект данного изобретения предусматривает получение мутантов или вариантов с сайтами гликозилирования, в которых был мутирован O- или N-присоединенный сайт гликозилирования лизосомального фермента сульфатазы. Такие мутанты или варианты будут содержать важную информацию относительно биологической активности, физической структуры и потенциала связывания с субстратом активного высокофосфорилированного лизосомального фермента сульфатазы. В отдельных аспектах предусмотрено получение других вариантов или мутантов полипептида активного фосфорилированного лизосомального фермента сульфатазы, сохраняющих биологическую активность, но с повышенной или пониженной активностью связывания субстратов. Как таковые, мутации активного сайта или каталитического участка особенно предусмотрены для получения мутантов или вариантов белков с измененной активностью связывания субстратов. В таких вариантах воплощения изобретения последовательность активного высокофосфорилированного лизосомального фермента сульфатазы сравнивают с последовательностями других родственных ферментов, и выбранные остатки подвергают специфической мутации.
[00161] При нумерации аминокислот зрелого белка от предполагаемого аминоконца в качестве аминокислоты 1, типичные мутации, которые могут оказаться полезными, включают, например, замену всех или некоторых потенциально гликозилированных остатков аспарагина, включая положения 178 и 397 рекомбинантной N-ацетилгалактозамин-6-сульфатазы (GALNS) человека (см. Фигуру 5).
[00162] Связывание с субстратом может быть модифицировано мутациями в/возле активного сайта лизосомального фермента сульфатазы. Принимая во внимание, что такие мутации являются типичными, специалисту в данной области будет очевидно, что могут быть введены и другие мутации в последовательности фермента для обеспечения дополнительной структурной и функциональной информации о данном белке и его активности.
[00163] Для построения мутантов или вариантов, таких как описаны выше, специалист в данной области может использовать хорошо известные стандартные способы. Особенно предусмотрены N-терминальные делеции, С-терминальные делеции, внутренние делеции, а также случайный и точечный мутагенез.
[00164] N-терминальные делеции и С-терминальные делеции являются формами мутагенеза в виде делеций, которые используют преимущество, например, присутствия подходящего одного сайта рестрикции возле конца C- или N-терминального участка. ДНК расщепляется в сайте, и концы расщепляются нуклеазами, такими как BAL31, экзонуклеаза III, ДНКаза I и нуклеаза S1. Повторное соединение двух концов приводит к образованию серии ДНК с делециями различного размера вокруг сайта рестрикции. Белки, экспрессируемые из такого мутанта, могут быть проанализированы на предмет соответствующей биологической функции, например, ферментативной активности, с использованием стандартных для науки способов и описанных в тексте данной заявки. Подобные способы могут использоваться относительно мутантов с внутренней делецией с использованием двух надлежащих образом расположенных сайтов рестрикции, что позволяет провести точно определенную делецию с повторным лигированием концов, как это описано выше.
[00165] Также предусмотрены мутанты с частичным расщеплением. В таких случаях специалисту в данной области следует использовать «частый резак», который режет ДНК в многочисленных местах в зависимости от продолжительности времени реакции. Таким образом, при варьировании условий реакции возможно генерировать серии мутантов различного размера, которые затем могут быть подвергнуты скринингу на предмет активности.
[00166] Случайная мутация в виде вставки также может быть проведена путем обрезания последовательности ДНК ДНКазой I, например, и вставки участка нуклеотидов, которые кодируют 3, 6, 9, 12 и т.д. аминокислот, с последующим повторным лигированием конца. Как только будет выполнена такая мутация, мутанты могут быть подвергнуты скринингу на предмет различной активности белка дикого типа.
[00167] Точечный мутагенез также может использоваться для идентификации, какие именно аминокислотные остатки важны в отдельных видах активности, связанной с биологической активностью лизосомального фермента сульфатазы. Таким образом, специалист в данной области будет способен получить изменения в отдельных основаниях цепи ДНК, что приведет к изменению кодона и миссенс-мутации.
[00168] Аминокислоты отдельного белка могут быть изменены для создания эквивалентной, или даже улучшенной молекулы второго поколения. Такие изменения предусматривают замену отдельной аминокислоты в белке без заметной потери способности к интерактивному связыванию с такими структурами, как, например, антигенсвязующие участки антител или сайты связывания на молекулах субстрата или рецепторах. Поскольку именно интерактивная способность и природа белка определяют биологическую функциональную активность белка, в белковой последовательности могут быть проведены определенные замены аминокислот, а также в кодирующей последовательности ДНК, с получением белка с подобными свойствами. Таким образом, в последовательности ДНК генов могут быть внесены различные изменения без заметной потери их биологических свойств или активности, как это указано ниже.
[00169] При проведении таких изменений может учитываться индекс гидрофобности аминокислот. Принято, что относительный показатель гидрофобности аминокислот вносит свой вклад во вторичную структуру получаемого белка, что, в свою очередь, определяет взаимодействие белка с другими молекулами, например ферментами, субстратами, рецепторами, ДНК, антителами, антигенами и т.п. Каждой аминокислоте был назначен свой индекс гидрофобности на основе их свойства гидрофобности и показателя заряда (Kyte & Doolittle, J. Mol. Biol., 157(1):105-132, 1982, включено сюда посредством ссылки). В целом, аминокислоты могут быть замещены другими аминокислотами с подобным индексом гидрофобности или показателем, и при этом обеспечивать получение белка с подобной биологической активностью, т.е. обеспечивать получение белка с эквивалентной биологической функциональностью.
[00170] Кроме того, замена подобных аминокислот может эффективно проводиться на основе гидрофильности. Патент США № 4554101, включенный сюда посредством ссылки, указывает, что наибольший средний показатель местной гидрофильности белка, который регулируется гидрофильностью прилегающих к нему аминокислот, коррелирует с биологическим свойством белка. Таким образом, аминокислота может быть замещена другой аминокислотой, имеющей подобное значение гидрофильности, с получением биологически эквивалентного или иммунологически эквивалентного белка.
[00171] Типичные замены аминокислот, которые могут использоваться в таком контексте по изобретению, включают, но не ограничиваются, обмен аргинина на лизин; глутамата на аспартат; серина на треонин; глутамина на аспарагин; и валина на лейцин и изолейцин. Другие такие замены, которые учитывают необходимость в ретенции некоторой или полной биологической активности при изменении вторичной структуры белка, будут известны специалисту в данной области.
[00172] Использование пептидных миметиков является другим типом варианта, который предусмотрен для получения полипептидов по изобретению. Миметики являются пептидосодержащими молекулами, которые имитируют элементы вторичной структуры белка. См., например, Johnson et al., “Peptide Turn Mimetics” in BIOTECHNOLOGY AND PHARMACY, Pezzuto et al., Eds., Chapman and Hall, New York (1993). Базовое обоснование использования пептидных миметиков заключается в том, что пептидный остов белков существует главным образом для ориентации боковых цепей аминокислот для облегчения молекулярных взаимодействий, таких как взаимодействия между антителом и антигеном. Считается, что пептидный миметик обуславливает молекулярные взаимодействия, подобно встречающейся в природе молекуле. Такие принципы могут использоваться в комбинации с описанными выше принципами для получения молекул второго поколения с множеством естественных свойств лизосомальных ферментов сульфатазы, но с измененными и даже улучшенными характеристиками.
Модифицированное гликозилирование лизосомальных ферментов сульфатазы
[00173] Также могут быть получены варианты активного высокофосфорилированного лизосомального фермента сульфатазы с модифицированной схемой гликозилирования относительно исходного полипептида, например, путем удаления одной или более молекул углеводов и/или добавлением одного или более участков гликозилирования, которые отсутствуют в нативном полипептиде.
[00174] Гликозилирование обычно представлено N-гликозилированием или O-гликозилированием. N-гликозилирование относится к присоединению молекулы углевода к боковой цепи по остатку аспарагина. Трипептидные последовательности аспарагин-Х-серин и аспарагин-Х-треонин, де Х представлен любой аминокислотой, за исключением пролина, являются последовательностями распознавания для ферментативного присоединения молекулы углевода к боковой цепи аспарагина. Присутствие любой из этих трипептидных последовательностей в полипептиде создает потенциальный участок гликозилирования. Таким образом, N-присоединенные участки гликозирования могут быть добавлены к полипептиду путем изменения аминокислотной последовательности, таким образом, полипептид будет содержать одну или более таких трипептидных последовательностей. O-гликозилирование относится к присоединению одного из сахаров N-ацетилгалактозамина, галактозы или ксилозы к гидроксиаминокислоте, наиболее часто представленной серином или треонином, однако также могут использоваться 5-гидроксипролин или 5-гидроксилизин. O-присоединенные участки гликозилирования могут быть добавлены путем вставки или замещения одного или более остатков серина или треонина в последовательности исходного полипептида.
Переключение домена
[00175] Различные участки белков лизосомального фермента сульфатазы обладают большой степенью гомологичности последовательности. Могут быть идентифицированы те мутации в полипептидах лизосомального фермента сульфатазы, которые изменяют его функцию. Данные исследования потенциально важны, по меньшей мере, по двум причинам. Во-первых, они обеспечивают разумное ожидание того, что другие гомологи, аллельные варианты и мутанты такого гена могут существовать в родственных видах, таких как крыса, кролик, обезьяна, гиббон, шимпанзе, макака, бабуин, корова, свинья, лошадь, овца и кошка. При выделении таких гомологов, вариантов и мутантов, и в сочетании с другими анализами, могут быть идентифицированы определенные активные или функциональные домены. Во-вторых, это обеспечит начальную точку для дальнейшего мутационного анализа молекулы, как это описано выше. Одним из способов, в котором может использоваться такая информация, является «переключение домена».
[00176] Переключение домена подразумевает получение рекомбинантных молекул с использованием разных, но родственных полипептидов. Например, при сравнении последовательности лизосомального фермента сульфатазы, например, N-ацетилгалактозамин-6-сульфатазы, с последовательностью подобного лизосомального фермента сульфатазы из другого источника и с мутантами и аллельными вариантами таких полипептидов, можно спрогнозировать функционально значимые участки таких молекул. Затем возможно переключать родственные домены таких молекул в целях определения критической значимости таких участков для функции фермента и эффекта в нарушении лизосомального накопления. Такие молекулы могут иметь дополнительную ценность в том, что такие «химеры» могут отличаться от естественных молекул при возможном сохранении той же самой или даже улучшенной функции.
[00177] Основываясь на известных сейчас многочисленных лизосомальных ферментах сульфатазы, дальнейший анализ мутаций и их прогнозируемый эффект на вторичную структуру добавит больше информации. Предусматривается, что мутанты, переключающие домены между лизосомальными ферментами сульфатазы предоставят полезную информацию о взаимоотношении структура/функция таких молекул и полипептидов, с которыми они взаимодействуют.
Белки слияния
[00178] Кроме описанных выше мутаций, данное изобретение дополнительно предусматривает получение специального вида вставочного варианта, известного как белок слияния. Такая молекула обычно имеет полный или существенный участок нативной молекулы, присоединенной на N- или C-конце ко всему или участку второго полипептида. Например, слияние обычно включает лидерные последовательности из других видов для обеспечения рекомбинантной экспрессии белка в гетерологичном хозяине. Другое полезное слияние включает добавление иммунологически активного домена, такого как антигенная детерминанта антитела, для облегчения очистки белка слияния. Включение сайта расщепления в месте или возле места слияния облегчит удаление постороннего полипептида после очистки. Другое полезное слияние включает присоединение функциональных доменов, таких как активные сайты ферментов, домены гликозилирования, клеточные сигналы мишеней или трансмембранные участки.
[00179] На рынке представлены различные системы экспрессии с белками слияния, которые могут использоваться в данном изобретении. Особенно полезные системы включают, но не ограничиваются, систему глутатион S-трансферазы (GST) (Pharmacia, Piscataway, NJ), систему белкового связывания мальтозы (NEB, Beverley, MA), систему FLAG (IBI, New Haven, CT), систему 6xHi (Qiagen, Chatsworth, CA). Такие системы способны продуцировать рекомбинантные полипептиды, несущие только небольшое количество дополнительных аминокислот, которые маловероятно влияют на антигенную способность рекомбинантного полипептида. Например, система FLAG и система 6xHis добавляют только короткие последовательности, обе из которых, как известно, являются малоантигенными и не влияют отрицательным образом на скручивание полипептида в его нативную конформацию. Другое N-терминальное слияние, которое считается полезным, представлено слиянием дипептида Мет-Лиз на N-терминальном участке белка или пептидов. Такое слияние может приводить к полезному повышению экспрессии или активности белка.
[00180] Особенно полезная конструкция слияния может быть представлен конструкцией, в которой полипептид или фрагмент полипептида активного высокофосфорилированного лизосомального фермента сульфатазы слит с гаптеном для повышения иммуногенности слитой молекулы лизосомального фермента сульфатазы. Это может оказаться полезным в получении антител к активному высокофосфорилированному лизосомальному ферменту сульфатазы для обеспечения определения белка. В других вариантах воплощения изобретения может быть получена конструкция слияния, которая улучшит связывание композиций, родственных с лизосомальным ферментом сульфатазы, со специфическим сайтом или клеткой.
[00181] Другие конструкции слияния включают гетерологичный пептид с требуемыми свойствами, например, наличием мотива для связывания лизосомального фермента сульфатазы с отдельным органом, тканью или типом клеток. В предпочтительном варианте воплощения изобретения конструкция слияния, включая связывающийся с костью пептид, например, из 6 остатков аспарагиновой кислоты (6xAsp или 6D), слитый с лизосомальным ферментом сульфатазы, может связывать ферментом с отдельными частями кости.
[00182] Другие предусмотренные изобретением конструкции слияния включают гетерологичный полипептид с требуемыми свойствами, например, наличием константного участка Ig для увеличения периода полужизни в сыворотке или антителе или его фрагменте для связывания. Другие системы слияния продуцируют полипептидные гибриды, если необходимо исключить партнер слияния из требуемого полипептида. В одном варианте воплощения изобретения партнер слияния присоединен к полипептиду рекомбинантного активного высокофосфорилированного лизосомального фермента сульфатазы пептидной последовательностью, содержащей специфическую последовательность распознавания протеазой. Примеры подходящих последовательностей распознаются протеазой вируса гравировки табака (Life Technologies, Gaithersburg, MD) или фактором Xa (New England Biolabs, Beverley, MA).
Производные
[00183] Как это указано выше, производное соединение относится к полипептидам, модифицированным химически такими способами, как, например и без ограничения, убихитинилирование, мечение (например, радионуклидами или различными ферментами), ковалентное присоединение полимера, такое как пэгилирование (дериватизация с полиэтиленгликолем) и вставка или замена путем химического синтеза аминокислот, таких как орнитин. Производные лизосомального фермента сульфатазы также используются в качестве терапевтических агентов и могут быть получены способами по изобретению.
[00184] Полиэтиленгликоль (ПЭГ) может быть присоединен к лизосомальному ферменту сульфатазы, полученному способами по изобретению, для обеспечения более длительного периода полужизни in vivo. Группа ПЭГ может иметь любой подходящий молекулярный вес и может быть линейной или разветвленной. Средняя молекулярная масса ПЭГ будет предпочтительно варьировать от примерно 2 килодальтон («кДа») до примерно 100 кДа, более предпочтительно от примерно 5 кДа до примерно 50 кДа, наиболее предпочтительно от примерно 5 кДа до примерно 10 кДа. Группы ПЭГ будут обычно присоединены к лизосомальным ферментам сульфатазы по изобретению посредством ацилирования или восстановительного алкилирования с использованием реакционной группы на молекуле ПЭГ (например, альдегидной, амино-, тиоловой или эфирной группы) с реакционной группой на молекуле белка (например, альдегидная, амино- или эфирная группа). Добавление молекул ПЭГ к интересующим полипептидам может проводиться с использованием хорошо известных в науке способов. См., например, международную публикацию № WO 96/11953 и патент США № 4179337.
[00185] Лигирование полипептида лизосомального фермента сульфатазы с ПЭГ обычно проводят в водной фазе, и оно может быть легко подвергнуто мониторингу с использованием аналитической ВЭЖХ с обращенными фазами. ПЭГилированные пептиды могут быть легко очищены путем препаративной ВЭЖХ и их характеризуют с использованием аналилитической ВЭЖХ, анализа аминокислот и путем масс-спектрометрии с лазерной десорбцией.
Метки
[00186] В некоторых вариантах воплощения изобретения терапевтический лизосомальный фермент сульфатазы помечен для облегчения его определения. «Метка» или «определяемая молекула» относится к композиции, определяемой спектроскопическими, фотохимическими, биохимическими, иммунохимическими, химическими или иными физическими способами. Например, метки, подходящие для использования в данном изобретении, включают, но не ограничиваются следующим: радиоактивные метки (например,32P), флуорофоры (например, флуоросцеин), электронно-плотные реагенты, ферменты (например, обычно используемые в ИФА), биотин, дигоксигенин, или гаптены и белки, которые могут быть сделаны определяемыми, например, посредством включения радиометки в гаптен или пептид, или использоваться для определения антител, специфически реагирующих с гаптеном или пептидом.
[00187] Примеры меток, подходящих для использования в данном изобретении, включают, но не ограничиваются следующим: флуоресцентные красители (например, флуоресцеин изотиоцианат, техасский красный, родамин и т.п.), радиометки (например,3H,125I,35S,14C или32P), ферменты (например, пероксидаза хрена, щелочная фосфатаза и другие ферменты, обычно используемые в ИФА), и колориметрические метки, такие как коллоидное золото, окрашенные стеклянные или пластиковые гранулы (например, полистирен, полипропилен, латекс и т.д.).
[00188] Метка может быть присоединена прямым или косвенным образом к требуемому компоненту лизосомального фермента сульфатазы в соответствии с известными в науке способами. Предпочтительно, метка в одном варианте воплощения изобретения ковалентно присоединена к лизосомальному ферменту сульфатазы с использованием реагента изоцианата для конъюгации активного действующего вещества по изобретению. В одном аспекте изобретения для конъюгации метки с лизосомальным ферментом сульфатазы для образования конъюгата метки и лизосомального фермента сульфатазы без присоединенного к нему активного действующего вещества могут использоваться бифункциональные реагенты изоцианата. Конъюгат метки и лизосомального фермента сульфатазы может использоваться в качестве промежуточного вещества для синтеза меченого конъюгата по изобретению или может использоваться для определения конъюгата лизосомального фермента сульфатазы. Как указано выше, может использоваться целый ряд меток, и их выбор должен зависеть от требуемой чувствительности, легкости конъюгации с требуемым компонентом лизосомального фермента сульфатазы, требований стабильности, имеющегося инструмента и условий распределения. Нерадиоактивные метки часто присоединяют косвенным образом. Как правило, с лизосомальным ферментом сульфатазы ковалентно связана молекула лиганда (например, биотин). Затем лиганд связывается с другой молекулой (например, стрептавидином), которая по сути определяется или ковалентно связана с сигнальной системой, такой как определяемый фермент, флуоресцентным соединением или хемилюминесцентным соединением.
[00189] Лизосомальные ферменты сульфатазы по изобретению также могут быть конъюгированы непосредственно с сигнал-генерирующими соединениями, например, путем конъюгации с ферментом или флуорофором. Ферменты, подходящие для использования в качестве меток, включают, но не ограничиваются следующим: гидролазы, в частности, фосфатазы, эстеразы и гликозидазы, или оксидотазы, в частности, пероксидазы. Флуоресцентные соединения, т.е. флуорофоры, подходящие для использования в качестве меток, включают, но не ограничиваются следующим: флуоресцеин и его производные, родамин и его производные, дансил, умбеллиферон и т.д. Дополнительные примеры подходящих флуорофоров включают, но не ограничиваются следующими: эозин, TRITC-амин, хинин, флуоросцеин W, акридин желтый, лиссамин родамин, В-сульфонил хлорид эритросцеин, рутений (трис, бипиридиний), техасский красный, никотинамидадениндинуклеотид, флавинадениндинуклеотид и т.д. Хемилюминесцентные соединения, подходящие для использования в качестве меток, включают, но не ограничиваются, люциферин и 2,3-дигидрофталазиондионы, например, люминол. Обзор различных систем мечения или систем воспроизведения сигнала, которые могут использоваться в способах по данному изобретению, см. в патенте США № 4391904.
[00190] Способы определения меток хорошо известны специалисту в данной области. Таким образом, например, если метка радиоактивная, способы для определения включают сцинтилляционный счетчик или пленку для фотографии, как в ауторадиографии. Если метка представлена флуоресцентной меткой, она может быть определена по испусканию флуорохрома с соответствующей длиной световой волны и определению полученной флуоресценции. Флуоресценция может быть определена визуально, путем использования электронных детекторов, таких как устройства с зарядовой связью (CCD) или фотомультипликаторы и т.п. Подобным образом, ферментативные метки могут быть определены при обеспечении соответствующих субстратов для фермента и определения полученного продукта реакции. Колориметрические или хемилюминесцентные метки могут быть определены просто наблюдением за цветом, связанным с меткой. Специалисту в данной области станут очевидны и другие системы мечения и определения, подходящие для использования в способах по данному изобретению. Такие меченые модуляторы и лиганды могут использоваться в диагностике заболевания или состояния здоровья.
[00191] В предпочтительном варианте воплощения изобретения способ включает этап получения активных высокофосфорилированных лизосомальных ферментов сульфатазы из линий клеток с дефектами в эндосомальном транспорте. В особенно предпочтительном варианте воплощения изобретения способ включает этап получения активной высокофосфорилированной рекомбинантной N-ацетилгалактозамин-6-сульфатазы (GALNS) человека из CHO-производной группы клеток G71 или ее производного. Получение лизосомальных ферментов сульфатаз, таких как, например и без ограничения, GALNS, включает следующие этапы: (a) получение линии клеток G71 или производных линии клеток G71, которые со-экспрессируют рекомбинантный лизосомальный фермент сульфатазы человека, например, N-ацетилгалактозамин-6-сульфатазу (GALNS), и рекомбинантный фактор модификации сульфатазы человека 1 (SUMF1); (б) культивация лизосомального фермента сульфатазы человека и со-экспрессирующих SUMF1 линий клеток; и (в) повышение масштабов получения лизосомального фермента сульфатазы человека и со-экспрессирующих SUMF1 линий клеток в биореакторе для получения лизосомальных ферментов сульфатазы. В предпочтительных вариантах воплощения изобретения лизосомальный фермент сульфатазы человека, например, N-ацетилгалактозамин-6-сульфатаза (GALNS), и кДНК SUMF1 челоека субклонируют в векторы экспрессии млекопитающих, как это описано в тексте данной заявки ниже.
[00192] Для разработки линии клеток G71 или G71S, клон G71, адаптированный к росту в суспензионной культуре без сыворотки, был со-трансфицирован вектором экспрессии млекопитающих GALNS человека, вектором экспрессии млекопитающих SUMF1 человека и геном избирательного маркера, после чего были выбраны стабильные трансформанты. После первого этапа субклонирования стабильных трансфектантов, линии клеток были отобраны с использованием флуоресцентного субстрата и специфическим образом обозначены. Линии клеток G71 или G71S были проанализированы на предмет специфической для клеток продуктивности (пг продукта/клетки) во вращателе с микроносителями или в суспензионной культуре, соответственно. Были идентифицированы наилучшие производители GALNS человека и помещены в повышенном количестве в биореактор для получения доклинического материала.
[00193] В другом варианте воплощения изобретение описывает анализ на основе клеток для измерения активности рекомбинантного лизосомального фермента человека для разрушения естественных субстратов. Способ включает (а) культивацию изолированной клетки человека с дефицитом лизосомального фермента в условиях, при которых естественные субстраты для лизосомального фермента накапливаются; (б) контакт клетки с лизосомальным ферментом; (в) лизис клетки; (г) добавление к лизату клетки фермента, который (i) специфичен для естественных субстратов, и (ii) расщепляет небольшие олигосахариды из естественных субстратов; (д) мечение небольших олигосахаридов определяемой молекулой; (е) необязательно, разделение небольших меченых олигосахаридов; (ж) определение небольших меченых олигосахаридов; и (з) определение активности лизосомального фермента разрушать естественные субстраты путем сравнения (i) количества небольших меченых олигосахаридов из клеток, контактировавших с лизосомальным ферментом, и (ii) количества небольших меченых олигосахаридов из клеток, не контактировавших с лизосомальным ферментом, при этом снижение показателя (з)(i) в сравнении с (з)(ii) указывает на активность лизосомального фермента разрушать естественные субстраты. В одном варианте воплощения изобретения небольшой олигосахарид представлен моно-, ди- или трисахаридом. В родственном варианте воплощения изобретения небольшой олигосахарид представлен дисахаридом.
[00194] В некоторых вариантах воплощения изобретения лизосомальный фермент выбирают из группы, состоящей из арилсульфатазы B (ARSB), идуронат-2-сульфатазы (IDS), сульфамидазы/гепарин-N-сульфатазы (SGSH), N-ацетилглюкозамин-сульфатазы (G6S) и N-ацетилгалактозамин-6-сульфатазы (GALNS). В некоторых вариантах воплощения изобретения лизосомальный фермент представлен α-L-идуронидазой (IDU). В некоторых вариантах воплощения изобретения лизосомальный фермент представлен α-глюкозидазой (GAA). В некоторых вариантах воплощения изобретения лизосомальный фермент представлен β-глюкоронидазой (GUSB). В некоторых вариантах воплощения изобретения лизосомальный фермент представлен β-галактозидазой (GLB1).
[00195] Подходящие клетки человека, которые могут использоваться в основанном на клетках анализе, включают любую клетку человека с дефицитом лизосомального фермента, подвергаемого тестированию, которая может накапливать естественные субстраты для лизосомального фермента. Например, могут использоваться клетки, которые естественным образом обладают полным (100%) или частичным дефицитом активности, например, снижением активности на 30%, 50%, 70%, 80%, 90%, 95% или более. Могут использоваться клетки, экспрессирующие мутантный фермент с пониженной активностью, или клетки, полученные у пациентов, страдающих лизосомальной болезнью накопления, например, мукополисахаридозом. Могут использоваться клетки, которые были изменены рекомбинантным способом для нокаута или снижения активности лизосомального фермента, например, посредством введения мутации в кодирующий ген или его промотор, или другой регуляторный участок. Могут использоваться клетки, обработанные для снижения активности лизосомального фермента, например обработанные антисмысловой или РНК-интерференцией для снижения экспрессии фермента.
[00196] Подходящие ферменты, расщепляющие (разрушающие) небольшие олигосахариды из углеводов и «специфичные» относительно (т.е. расщепляют преимущественным образом) естественных субстратов лизосомального фермента, могут быть выбраны специалистом в данной области. Например, для определения активности GALNS или GLB1 (ферментов, которые разрушают кератансульфат) фермент из этапа (г) может быть представлен кератаназой II или любым ферментом, который воздействует преимущественно на кератансульфат. В качестве другого примера для определения IDU, ARSB, IDS или GUSB (ферментов, разрушающих дерматансульфат) фермент из этапа (г) может быть представлен хондроитиназой АВС или любым другим ферментом, воздействующим преимущественно на дерматансульфат. В качестве другого примера для определения IDU, IDS, SGHS, G6S или GUSB (ферментов, разрушающих гепарансульфат) фермент из этапа (г) может быть представлен гепараназой I или гепараназой II, или обоими ферментами. В качестве еще одного примера для определения GAA (фермента, разрушающего гликоген) фермент из этапа (г) может быть представлен α-амилазой или любым ферментом, действующим преимущественно на гликоген.
[00197] Этот основанный на клетках способ обладает большой чувствительностью в определении активности лизосомального фермента. В некоторых вариантах воплощения изобретения активность лизосомального фермента определяют, когда концентрация лизосомального фермента составляет всего примерно 10 нМ, или примерно 5 нМ, или примерно 1 нМ, или примерно 0,75 нМ, или примерно 0,5 нМ, или примерно 0,25 нМ, или примерно 0,1 нМ, или примерно 0,05 нМ, или примерно 0,01 нМ, или примерно 0,005 нМ, или примерно 1 пМ, или примерно 0,5 пМ.
III. ОЧИСТКА ЛИЗОСОМАЛЬНЫХ ФЕРМЕНТОВ СУЛЬФАТАЗЫ
[00198] Материал биореактора, содержащий рекомбинантный GALNS человека, был подвергнут стерильной фильтрации 0,2 мкм и содержался при 4°C. Материал биореактора был загружен в улавливающую колонку непосредственно или сконцентрирован в 10-20 раз ультрафильтрацией перед загрузкой в улавливающую колонку. Значение рН материала биореактора или сконцентрированного материала биореактора было скорректировано до рН 4,5, и такой материал был загружен в колонку с голубой сефарозой, промыт последовательно 20 мМ ацетата/фосфата, 50 мМ NaCl, pH 4,5 и 20 мМ ацетата/фосфата, 50 мМ NaCl, pH 6,0 и элюирован 20 мМ ацетата/фосфата, 100 мМ NaCl, pH 7,0. Элюат из колонки с голубой сефарозой затем был нагружен в Fractogel SE Hi-Cap, промыт последовательно 20 мМ ацетата/фосфата, 50 мМ NaCl, pH 5,0 и 20 мМ ацетата/фосфата, 50 мМ NaCl, pH 5,5, и элюирован 20 мМ ацетата/фосфата, 50-350 мМ NaCl градиент, pH 5,5. Элюат из Fractogel SE Hi-Cap был соединен с 10 мМ NaOAc, 1 мМ NaH2PO4, 0,005% Твин-80, pH 5,5.
[00199] С другой стороны, материал биореактора, содержащий рекомбинантный GALNS человека, был сконцентрирован в 20 раз ультрафильтрацией перед загрузкой в улавливающую колонку. Значение рН сконцентрированного материала биореактора было скорректировано до рН 4,5, материал был профильтрован и затем загружен в колонку Fractogel SE Hi-Cap, с последующей промывкой 10 мМ ацетата/фосфата, 50 мМ NaCl, pH 4,5 и 10 мМ ацетата/фосфата, 50 мМ NaCl, pH 5,0 и элюированием 10 мМ ацетата/фосфата, 140 мМ NaCl, pH 5,0. Элюат из колонки Fractogel SE Hi-Cap был скорректирован до 500 мМ NaCl, pH 7,0 и загружен в Zn-хелатную колонку с сефарозой (Zn-IMAC), промыт 10 мМ ацетата/фосфата, 125 мМ NaCl, 10 мМ имидазола, pH 7,0, и элюирован 10 мМ ацетата/фосфата, 125 мМ NaCl, 90 мМ имидазола, pH 7,0. Элюат из Zn-хелатной колонки с сефарозой (Zn-IMAC) был скорректирован до рН 3,5 для вирусной инактивации при низком рН, скорректирован до 10 мМ ацетата/фосфата, 2M NaCl, pH 5,0, и затем загружен в колонку ToyoPearl Butyl 650M, промыт 10 мМ ацетата/фосфата, 2M NaCl, pH 5,0, и элюирован 10 мМ ацетата/фосфата, 0,7 M NaCl, pH 5,0. Элюат из колонки ToyoPearl Butyl 650M был подвергнут ультрафильтрации и диафильтрации в 20 мМ ацетата, 1 мМ фосфата, 150 мМ NaCl, pH 5,5, и затем добавлен в 20 мМ ацетата, 1 мМ фосфата, 150 мМ NaCl, 0,01% Твина-20, pH 5,5.
[00200] С другой стороны, материал биореактора, содержащий рекомбинантный GALNS человека, был профильтрован, сконцентрирован в 20 раз ультрафильтрацией/диафильтрацией, и затем профильтрован через активированный уголь перед загрузкой в улавливающую колонку. Сконцентрированный материал биореактора был загружен в Zn-хелатную колонку с сефарозой FF (Zn-IMAC) при проводимости ~55±5 мСм/см, промыт последовательно 10 мМ ацетата/фосфата, 500 мМ NaCl, pH 7,0 и 10 мМ ацетата/фосфата, 125 мМ NaCl, pH 7,0 (буфер A), и затем элюирован смесью 70% буфера A и 30% 10 мМ ацетата/фосфата, 125 мМ NaCl, 300 мМ имидазола, pH 7,0 (буфер B). Элюат из Zn-хелатной колонки с сефарозой FF (Zn-IMAC) был скорректирован до проводимости ~6,0±0,5 мСм/см и pH 7,0 и загружен в фильтр Mustang Q для удаления потенциальных вирусов. Фильтрат из Mustang Q был скорректирован до pH 4,5±0,1, профильтрован через фильтр CUNO 60ZA, затем подключенным фильтром 0,2 мкм, и затем загружен в колонку Fractogel EMD SE Hi-Cap (M), промыт последовательно 10 мМ ацетата/фосфата, 50 мМ NaCl, pH 4,5 и смесью 80% буфера A (10 мМ ацетата/фосфата, pH 5,0) и 20% буфера B (10 мМ ацетата/фосфата, 250 мМ NaCl, pH 5,0), и элюирован с линейным градиентом 20%-75% буфера B (в 80%-25% буфера A). Элюат из колонки Fractogel EMD SE Hi-Cap затем был скорректирован до pH 3,5±0,1 добавлением 0,2 М цитратного буфера, рН 3,4 для инактивации вирусов при низком рН. Элюат из колонки Fractogel EMD SE Hi-Cap с низким рН для вирусной инактивации был скорректирован до 2M NaCl и до pH 5,0 добавлением 0,2 M цитратного буфера, pH 6,0, и затем загружен в колонку ToyoPearl Butyl 650M, промыт 10 мМ ацетата/фосфата, 2M NaCl, pH 5,0 (буфер A), и затем элюирован смесью 35% буфера A и 65% буфера B (10 мМ ацетата/фосфата, pH 5,0). Элюат из колонки ToyoPearl Butyl 650M был подвергнут буфер-обмену с 20 мМ NaOAc/HOAc, 50 мМ NaH2PO4, 30 мМ аргинина HCl, 2% (в/о) сорбитола, pH 5,4, и, необязательно, скорректирован до финальной концентрации 3 мг/мл GALNS. GALNS, подвергнутый буфер-обмену, со скорректированной концентрацией, был профильтрован через вирусный фильтр (DV20) и фильтр ДНК (Mustang Q) для удаления любого остаточного вируса и ДНК. Твин-20 (также известный как полисорбат 20 или PS20) был добавлен к финальной концентрации 0,01% (в/о), что позволило получить нерасфасованное лекарственное вещество (НЛВ). НЛВ хранили при 2-8°C или в замороженном виде.
[00201] С другой стороны, материал биореактора, содержащий рекомбинантный GALNS человека, был профильтрован, сконцентрирован в 20 раз ультрафильтрацией/диафильтрацией, и затем профильтрован через активированный уголь перед загрузкой в улавливающую колонку. Сконцентрированный материал биореактора был загружен в Zn-хелатную колонку с сефарозой FF (Zn-IMAC) при проводимости ~50±5 мСм/см, промыт последовательно 10 мМ ацетата/фосфата, 500 мМ NaCl, pH 7,0 и 10 мМ ацетата/фосфата, 125 мМ NaCl, pH 7,0 (буфер A), и затем элюирован смесью 70% буфера A и 30% 10 мМ ацетата/фосфата, 125 мМ NaCl, 300 мМ имидазола, pH 7,0 (буфер B). Элюат из Zn-хелатной колонки с сефарозой FF(Zn-IMAC) был скорректирован до pH 4,5±0,1 1,75 M ацетатом, pH 4,0, профильтрован через фильтр Millipore COHC, смешан с 10 мМ ацетата/фосфата, pH 4,5 в соотношении 30:70 (в/в), и затем загружен в колонку Fractogel EMD SE Hi-Cap (M) при проводимости <7 мСм/см, промыт последовательно 10 мМ ацетата/фосфата, 50 мМ NaCl, pH 4,5 и смесью 80% буфера A (10 мМ ацетата/фосфата, pH 5,0) и 20% буфера B (10 мМ ацетата/фосфата, 250 мМ NaCl, pH 5,0), и элюирован с линейным градиентом 20%-75% буфера B (в 80%-25% буфера A). Элюат из колонки Fractogel EMD SE Hi-Cap затем был скорректирован до pH 3,5±0,1 добавлением 0,4 М цитратного буфера, рН 3,4 для инактивации вирусов при низком рН. Элюат из колонки Fractogel EMD SE Hi-Cap с низким рН для вирусной инактивации был скорректирован до 2M NaCl и pH 5,0 5±0,1 добавлением 0,4 M цитратного буфера, pH 6,0, смешан с 10 мМ ацетата/фосфата, pH 5, содержащим 5 M NaCl для достижения концентрации 2 M NaCl, и затем загружен в колонку ToyoPearl Butyl 650M, промыт последовательно 10 мМ ацетата/фосфата, 2M NaCl, pH 4,4±0,1 и 10 мМ ацетата/фосфата, 2,5M NaCl, pH 5,0 (буфер A), и затем элюирован с линейным градиентом от 100% до 32% буфера A и от 0% до 68% буфера B (10 мМ ацетата/фосфата, pH 5,0), а затем смесью 32% буфера A и 68% буфера B. Элюат из колонки ToyoPearl Butyl 650M был подвергнут буфер-обмену с 20 мМ NaOAc/HOAc, 50 мМ NaH2PO4, 30 мМ аргинина HCl, 2% (в/о) сорбитола, pH 5,4, и, необязательно, скорректирован до финальной концентрации 3 мг/мл GALNS. GALNS, подвергнутый буфер-обмену, со скорректированной концентрацией, был профильтрован через вирусный фильтр (DV20) и фильтр ДНК (Mustang Q) для удаления любого остаточного вируса и ДНК. Твин-20 (также известный как полисорбат 20 или ПС20) был добавлен к финальной концентрации 0,01% (в/о), что позволило получить нерасфасованное лекарственное вещество (НЛВ). НЛВ хранили при 2-8°C или в замороженном виде.
[00202] Очистка рекомбинантного GALNS человека описана подробно ниже, и очистка рекомбинантного GALNS человека с использованием способов, модифицированных в сравнении с описанными выше протоколами, описаны подробно ниже.
[00203] Рекомбинантный фермент GALNS человека был экспрессирован в клетках G71S, как это описано в Примере III, и очищен, как это описано в Примере V или Примере VI. Очищенный рекомбинантный GALNS человека по изобретению может быть сопоставлен с другими зарегистрированными препаратами GALNS. Masue et al., J. Biochem. 110:965-970, 1991 описали очистку и характеристики GALNS из плаценты человека. Было выявлено, что очищенный фермент имеет молекулярную массу 120 кДа, состоит из полипептидов 40 кДа и 15 кДа, последний из которых оказался гликопротеином. Таким образом, фермент GALNS, описанный Masue et al., соответствует подвергнутой обработке форме, отображенной на Фигуре 5. Bielicki et al., Biochem. J. 279:515-520, 1991 описали очистку и характеристики GALNS из печени человека. При проведении анализа SDS-PAGE было выявлено, что фермент имеет молекулярную массу 70 кДа при невосстанавливающих условиях и молекулярные массы 57 кДа, 39 кДа и 19 кДа при восстанавливающих условиях. Bielicki et al., Biochem J. 311: 333-339, 1995 описали очистку и характеристики рекомбинантного GALNS человека из клеток яичника китайского хомяка. При проведении анализа SDS-PAGE было выявлено, что очищенный фермент имеет молекулярную массу 58-60 кДа при невосстанавливающих условиях и молекулярные массы 55-57 кДа, 39 кДа и 38 кДа при восстанавливающих условиях. Таким образом, ферменты GALNS, описанные Bielicki et al., соответствуют смеси предварительно обработанной формы (формы предшественника) фермента, и подвергнутая обработке форма представлена на Фигуре 5. В отличие от этого рекомбинантный фермент GALNS человека по изобретению состоит практически полностью из формы предшественника фермента (см. Фигуру 9 и Фигуру 12), или преимущественно (т.е., по меньшей мере примерно на 85%) из формы предшественника фермента (см. Фигуру 10).
IV. ЛИЗОСОМАЛЬНЫЕ ФЕРМЕНТЫ СУЛЬФАТАЗЫ И ЛИЗОСОМАЛЬНЫЕ БОЛЕЗНИ НАКОПЛЕНИЯ
[00204] Лизосомальный фермент сульфатазы представлен ферментом полной длины или любым его фрагментом, мутантом, вариантом или производным, сохраняющим по меньшей мере значительное количество (например, по меньшей мере примерно 50%, предпочтительно по меньшей мере примерно 75%, и более предпочтительно по меньшей мере примерно 90%), по существу всю или всю терапевтическую или биологическую активность (например, сульфатазную активность) фермента.
[00205] В некоторых вариантах воплощения изобретения лизосомальный фермент сульфатазы представлен таковым, который, при отсутствии экспрессии или выработки, или при по существу пониженной экспрессии или выработке, приведет к возникновению заболевания, включая, но не ограничиваясь, лизосомальные болезни накопления. В некоторых вариантах воплощения изобретения лизосомальный фермент сульфатазы представлен таковым, который, при отсутствии экспрессии или выработки, или при по существу пониженной экспрессии или выработке, может и не привести к возникновению заболевания, но его отсутствие или пониженная экспрессия или выработка связана с возникновением заболевания, включая, но не ограничиваясь, лизосомальные болезни накопления. Преимущественно, лизосомальный фермент сульфатазы получают из человека или он имеет человеческое происхождение.
[00206] Преимущественно, в лечении лизосомальных болезней накопления лизосомальный фермент сульфатазы представлен ферментом, который присутствует в клетке, и отсутствие его экспрессии или выработки или по существу снижение его экспрессии или выработки приводит к возникновению лизосомальной болезни накопления. С другой стороны, в лечении лизосомальных болезней накопления лизосомальный фермент сульфатазы представлен ферментом, отсутствие которого или по существу сниженная экспрессия или выработка связана с заболеванием, однако его отсутствие или по существу сниженная экспрессия или выработка сами по себе могут и не привести к заболеванию. Преимущественно, лизосомальный фермент сульфатазы получают из человека или он имеет человеческое происхождение.
[00207] Преимущественно, фермент представлен лизосомальным ферментом сульфатазы, таким как арилсульфатаза A (ARSA) (Genbank Accession No. NP_000478 (изоформа a), Genbank Accession No. NP_001078897 (изоформа b) и другие варианты), арилсульфатазой B/N-ацетилглюкозамин 4-сульфатазой (ARSB) (Genbank Accession No. P15848), идуронат-2-сульфатазой (IDS) (Genbank Accession No. NP_000193 (изоформа a), Genbank Accession No. NP_006114 (изоформа b)), сульфамидазой/гепарин-N-сульфатазой (SGSH) (Genbank Accession No. NP_000190), N-ацетилглюкозамин-сульфатазой (G6S) (Genbank Accession No. NP_002067) и галактоза 6-сульфатазой/N-ацетилгалактозамин-6-сульфатазой (GALNS) (Genbank Accession No. NP_000503). Таблица лизосомальных болезней накопления и недостающих лизосомальных ферментов сульфатазы, которые используются в качестве терапевтических агентов, представлена ниже:
[00208] В предпочтительных вариантах воплощения изобретения лизосомальный фермент сульфатазы является рекомбинантным лизосомальным ферментом сульфатазы человека, вырабатываемым линией клеток с дефективной эндосомальной ацидификацией. В более предпочтительных вариантах воплощения изобретения рекомбинантный лизосомальный фермент сульфатазы человека является активным и имеет высокий уровень фосфорилированных олигосахаридов, как указано в главе «ОПРЕДЕЛЕНИЯ». В наиболее предпочтительных вариантах воплощения изобретения лизосомальный фермент сульфатазы представлен активной высокофосфорилированной рекомбинантной N-ацетилгалактозамин-6-сульфатазой (GALNS) человека.
[00209] Таким образом, лизосомальные болезни накопления, которые могут быть подвергнуты лечению или предотвращены с использованием способов по данному изобретению, включают, но не ограничиваются, метахроматическую лейкодистрофию или МЛД, синдром Марото-Лами или МПС VI типа, синдром Хантера или МПС II типа, синдром Санфилиппо А или МПС IIIa типа, синдром Санфилиппо D или МПС IIId типа и синдром Моркио А или МПС IVa типа. В особенно предпочтительном варианте воплощения изобретения дефицит лизосомального фермента сульфатазы приводит к возникновению синдрома Моркио А или МПС IVa типа. В другом особенно предпочтительном варианте воплощения изобретения лизосомальный фермент сульфатазы представлен таковым, что его дефицит связан с лизосомальной болезнью накопления человека, такой как множественная сульфатазная недостаточность или МСН.
[00210] Таким образом, в соответствии с указанной выше таблицей, для каждого заболевания лизосомальный фермент сульфатазы должен предпочтительно включать специфический активный лизосомальный фермент сульфатазы, которого не хватает при заболевании. Например, для способов, относящихся к МПС II типа, преимущественным ферментом является идунорат-2-сульфатаза. Для способов, относящихся к МПС IIIA типа, преимущественным ферментом является сульфамидаза/гепарин-N-сульфатаза. Для способов, относящихся к МПС IIID типа, преимущественным ферментом является N-ацетилглюкозамин-6-сульфатаза. Для способов, относящихся к МПС IVA типа, преимущественным ферментом является галактоза 6-сульфатаза/N-ацетилгалактозамин-6-сульфатаза. Для способов, относящихся к МПС VI типа, преимущественным ферментом является N-ацетилгалактозамин-4-сульфатаза. Для способов, относящихся к метахроматической лейкодистрофии (МЛД), преимущественным ферментом является арилсульфатаза А. Для способов, относящихся к множественной сульфатазной недостаточности (МСН), фермент может быть представлен арилсульфатазой A, арилсульфатазой B/N-ацетилглюкозамин 4-сульфатазой, идуронат-2-сульфатазой, сульфамидазой/гепарин-N-сульфатазой, N-ацетилглюкозамин-сульфатазой или галактоза 6-сульфатазой/N-ацетилгалактозамин-6-сульфатазой, и предпочтительный фермент представлен галактоза 6-сульфатазой/N-ацетилгалактозамин-6-сульфатазой.
V. МУКОПОЛИСАХАРИДОЗ IVA ТИПА (СИНДРОМ МОРКИО, МПС IVA ТИПА)
[00211] Мукополисахаридоз IVA типа (синдром Моркио, МПС IVA типа) является наследуемым, аутосомно-рецессивным заболеванием, принадлежащем к группе мукополисахаридных болезней накопления. Синдром Моркио вызывается недостатком лизосомального фермента, необходимого для распада двух гликозамингликанов (ГАГ), кератансульфата (КС) и хондроитин-6-сульфата (Х6С). В частности, МПС IVa типа характеризуется отсутствием фермента N-ацетилгалактозамин-6-сульфатазы (GALNS) и экскрецией КС в моче. Недостаток GALNS приводит к накоплению аномально больших количеств мукополисахаридов в гиалиновом хряще, основном компоненте скелетных тканей. У всех пациентов отмечается системная скелетная дисплазия. Другие симптомы варьируют по степени тяжести от пациента к пациенту и могут включать потерю слуха, катаракту, нестабильность позвоночника, клапанную болезнь сердца и проблемы с дыханием, помимо прочего.
[00212] GALNS гидролизирует эфирные связи сульфата в галактоза-6-сульфате из КС и N-ацетилгалактозамин-6-сульфате из Х6С. GALNS человека экспрессируется в виде белка-предшественника 55-60 кДа только с 2 потенциальными сайтами гликозилирования, присоединенными через аспарагин. Маннозо-6-фосфат (М6Ф) является частью олигосахаридов, присутствующих на молекуле GALNS. М6Ф распознается рецептором на лизосомальной поверхности клеток и, вследствие этого, является важным для эффективного захвата GALNS.
[00213] Подобно всем сульфатазам GALNS должен быть процессирован со стороны формилглицин-активирующего фермента (FGE), кодируемого геном фактора модификации сульфатазы 1 (SUMF1) для придания активности. Принимая во внимание такой этап активации, включающий пост-трансляционную модификацию остатка цистеина активного сайта в Cα-формилглицин (FGly), гиперэкспрессия рекомбинантных сульфатаз может привести к выработке сульфатазных ферментов с низкой специфической активностью (т.е. смесь активированных и неактивированных сульфатазных ферментов) и низким титром выработки (т.е. распад и/или отсутствие секреции неактивированных сульфатаз).
[00214] Целью данного изобретения является обеспечение активного высокофосфорилированного фермента человека N-ацетилгалактозамин-6-сульфатазы, полезного для лечения синдрома Моркио и других заболеваний, например, множественной сульфатазной недостаточности (МСН), которые вызваны или связаны с дефицитом фермента N-ацетилгалактозамин-6-сульфатазы. Такой активный высокофосфорилированный фермент человека N-ацетилгалактозамин-6-сульфатаза обладает способностью локализироваться в тканях, в которых накапливается КС и Х6С, обладает адекватными уровнями М6Ф для эффективного захвата, по существу высоким процентным показателем FGly для активности фермента и относительно высокими уровнями выработки.
[00215] Следует понимать, что описанные здесь способы по изобретению применяют в производстве других лизосомальных ферментов сульфатаз, например, арилсульфатазы A (ARSA), арилсульфатазы B/N-ацетилглюкозамин 4-сульфатазы (ARSB), идуронат-2-сульфатазы (IDS), сульфамидазы/гепарин-N-сульфатазы (SGSH) и N-ацетилглюкозамин-сульфатазы (G6S), используемых для лечения лизосомальных болезней накопления, которые вызваны или характеризуются недостатком таких ферментов.
VI. ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ И ВВЕДЕНИЕ
[00216] Лизосомальные сульфатазные ферменты по изобретению могут быть введены с использованием целого ряда путей. Для пероральных композиций лизосомальные ферменты сульфатазы могут использоваться как поодиночке, так и в комбинации с соответствующими дополнительными веществами для получения таблеток, порошков, гранул или капсул, например, со стандартными добавками, такими как лактоза, маннитол, кукурузный крахмал или картофельный крахмал; со связующими веществами, такими как кристаллинцеллюлоза, производные целлюлозы, акациевая камедь, кукурузный крахмал или желатин; с дезинтеграторами, такими как кукурузный крахмал, картофельный крахмал или натрия карбоксиметилцеллюлоза; с лубрикантами, такими как тальк или магния стеарат; и, при необходимости, с разбавителями, буферными агентами, увлажнителями, консервантами и ароматизаторами.
[00217] Лизосомальные ферменты сульфатазы по изобретению могут быть представлены в виде композиций для введения путем их растворения, суспендирования или эмульгирования в водном или неводном растворителе, таком как растительное или другие подобные масла, глицериды синтетических алифатических кислот, эфиры высших алифатических кислот или пропиленгликоль; и, при необходимости, со стандартными добавками, такими как солюбилизаторы, агенты изотоничности, суспендирующие агенты, эмульгаторы, стабилизаторы и консерванты.
[00218] Лизосомальные ферменты сульфатазы по изобретению могут использоваться в аэрозольных композициях для введения путем ингаляции. Лизосомальные ферменты сульфатазы по изобретению могут включать в свою композицию находящиеся под давлением приемлемые пропелленты, такие как дихлордифторметан, пропан, азот и т.п.
[00219] Кроме того, лизосомальные ферменты сульфатазы по изобретению могут быть представлены в виде свечей путем смешивания с целым рядом оснований, таких как эмульгированные основания или водорастворимые основания. Лизосомальные ферменты сульфатазы по изобретению могут быть введены ректально в виде свечей. Свеча может включать носители, такие как масло какао, карбоваксы и полиэтиленгликоли, которые размягчаются при температуре тела, но остаются твердыми при комнатной температуре.
[00220] Единичные лекарственные формы лизосомальных ферментов сульфатазы по изобретению для перорального или ректального введения могут быть представлены такими единицами, как сиропы, эликсиры и суспензии, при этом каждая единица лекарственной формы, например, чайная ложка, столовая ложка, таблетка или свеча, содержит предопределенное количество активного действующего вещества, содержащего лизосомальный фермент сульфатазы. Подобным образом, единичные лекарственные формы для инъекции или внутривенного введения могут включать лизосомальный фермент сульфатазы в виде раствора в стерильной воде, физиологическом растворе или другом фармацевтически приемлемом носителе.
[00221] В практическом использовании лизосомальные ферменты сульфатазы по изобретению могут быть скомбинированы в виде активного действующего вещества в однородной смеси с одним или более фармацевтически приемлемых носителей, разбавителей или вспомогательных веществ в соответствии со стандартными фармацевтическими способами смешивания соединений. Носитель, разбавитель или вспомогательное вещество может принимать целый ряд форм, в зависимости от предпочтительной формы препарата для введения, например, перорального или парентерального (включая внутривенное). При приготовлении композиций лизосомальных ферментов сульфатаз для пероральных лекарственных форм, может использоваться любая из обычных фармацевтических сред, таких как, например, вода, гликоли, масла, спирты, ароматизаторы, консерванты, красители и т.п. в случае пероральных жидких композиций, например, суспензий, эликсиров и растворов; или носители, такие как крахмалы, сахара, микрокристаллическая целлюлоза, разбавители, грануляторы, лубриканты, связующие агенты, дезинтеграторы и т.п. в случае пероральных твердых композиций, например, порошков, твердых и мягких капсул и таблеток, при этом твердые пероральные композиции являются преимущественными относительно жидких композиций.
[00222] Изобретение описывает композиции любого описанного здесь фермента GALNS, необязательно, в концентрации от примерно 0,1 до 5 мг/мл (или от 0,5 до 1,5 мг/мл) белка, и, необязательно, при рН примерно 5-5,8, включающие (i) количество фосфатного буфера, эффективного для снижения дефосфорилирования указанного фермента GALNS; и (ii) стабилизирующее количество одного или более стабилизаторов, выбираемых из группы, состоящей из солей аминокислот, буферов аминокислот, сурфактантов и полиолов. В некоторых вариантах воплощения изобретения композиция может включать второй буферный агент. В определенных вариантах воплощения изобретения композиции включают любые композиции очищенных рекомбинантных ферментов GALNS человека, описанные в тексте данной заявки, фосфатный буфер в концентрации от примерно 25 мМ до примерно 75 мМ и ацетатный буфер в концентрации от примерно 10 мМ до примерно 30 мМ, а также стабилизатор, снижающий агрегацию белка. В некоторых вариантах воплощения изобретения композиция включает соль аргинина или гистидина или буфер и, необязательно, неионный сурфактант, и, необязательно, трехатомный или высший полиол (сахароспирт). В специфических вариантах воплощения изобретения композиция включает соль аргинина или буфер, полисорбат, необязательно, полисорбат 20, и сорбитол. В любом из таких вариантов воплощения изобретения фосфатный буфер может быть представлен NaH2PO4. В любом из таких вариантов воплощения изобретения ацетатный буфер может быть представлен NaOAc/HOAc.
[00223] Второй буферный агент может быть представлен любым агентом, подходящим для поддержания рН в требуемом диапазоне. Подходящие буферы включают Трис, цитратный, сукцинатный, ацетатный, глюконатный или другие буферы органических кислот. В некоторых вариантах воплощения изобретения стабилизатор представлен солью аминокислоты или буфером, необязательно, солью или буфером аргинина, лизина, глицина, глутамина, аспарагина, гистидина, аланина, орнитина, лейцина, 2-фенилаланина или глутаминовой кислоты. В некоторых вариантах воплощения изобретения стабилизатор представлен сурфактантом, необязательно, неионным сурфактантом. Подходящие сурфактанты включают полисорбаты, например полисорбат 20 или полисорбат 80, полоксамеры, например, полоксамер 188 или 184, производные полиоксиэтилена, производные полиоксипропилена, натрия монолаурат и натрия додецилсульфат. Неограничивающие примеры известных неионных сурфактантов включают алифатические, первичные или вторичные спирты с линейной или разветвленной цепью или фенолы с оксидами алкилена, обычно этиленоксидом и обычно с 6-30 группами этиленоксида. Другие известные неионные сурфактанты включают моно- или диалкильные алканоламиды, алкилполигликозиды и амиды полигидроксижирных кислот. Неограничивающие примеры известных анионных сурфактантов включают натриевые, аммонийные и моно-, ди- и три-этаноламиновые соли алкилсульфатов, сульфаты алкиловых эфиров, алкарилсульфонаты, алкилсукцинаты, алкилсульфосукцинаты, N-алкоил саркозинаты, алкилфосфаты, фосфаты алкиловых эфиров, карбоксилаты алкиловых эфиров и α-олефин сульфонаты. Обычно алкильные группы содержат от 8 до 18 атомов углерода и могут быть ненасыщенными. Сульфаты алкилэфиров, фосфаты алкилэфиров и карбоксилаты алкилэфиров могут содержать от 1 до 10 единиц этиленоксида или пропиленоксида на молекулу, и, предпочтительно, содержат от 2 до 3 единиц этиленоксида на молекулу. Известные анионные сурфактанты включают натрия или аммония лаурилсульфат и сульфат натрия или аммония лаурилэфира. Неограничивающие примеры известных амфотерных сурфактантов включают оксиды алкиламина, алкилбетаины, алкиламидопропил бетаины, алкилсульфобетаины, алкилглицинаты, алкилкарбоксиглицинаты, алкиламфопропионаты, алкиламидопропилгидроксисултаины, ацилтаураты и ацилглутаматы, при этом алкильные и ацильные группы имеют от 8 до 18 атомов углерода.
[00224] В некоторых вариантах воплощения изобретения стабилизатор представлен полиолом или сахаром, преимущественно, трехатомным или высшим сахароспиртом. Подходящие полиолы включают эритритол, арабитол, мальтитол, целлобиитол, лактитол, маннитол, треитол, сорбитол, ксилитол, рибитол, миоинозитол, галактитол, глицерол и глицерин. Известные полиолы также включают спирты, полученные из лактозы, трегалозы и стахиозы. Известные невосстанавливающие сахара включают сахарозу, трегалозу, сорбозу, мелезитозу и раффинозу. Известные сахара также включают ксилозу, маннозу, фруктозу, глюкозу; дисахариды, такие как лактоза, мальтоза, сахароза, трисахариды, такие как раффиноза, и полисахариды, такие как декстран.
[00225] Изобретение также описывает способ предотвращения дефосфорилирования очищенного рекомбинантного фермента GALNS человека, включающий смешивание указанного фермента GALNS и количества фосфатного буфера, эффективного для снижения дефосфорилирования, необязательно, до финальной концентрации от примерно 25 мМ до примерно 75 мМ фосфатного буфера. В некоторых вариантах воплощения изобретения очищенный рекомбинантный фермент GALNS человека также смешивают со вторым буферным агентом, включающим любые описанные выше агенты. В некоторых вариантах воплощения изобретения фермент также смешивают со стабилизирующим количеством одного или более стабилизаторов, выбираемых из группы, состоящей из солей аминокислот, буферов аминокислот, сурфактантов и полиолов. В типичных вариантах воплощения изобретения показатель дефосфорилирования снижен по сравнению с композицией этого же самого фермента в 1 мМ фосфатном буфере, например, при тестировании спустя 1 неделю, 2 недели, 3 недели, 1 месяц, 2 месяца, 3 месяца, 4 месяца, 5 месяцев или 6 месяцев хранения при комнатной температуре (например, 25°C). В специфических вариантах воплощения изобретения после хранения в течение таких периодов при 40°C проводятся ускоренные тесты на стабильность.
[00226] В определенных вариантах воплощения изобретения снижение дефосфорилирования в композиции GALNS (в сравнении с 1 мМ фосфатным буфером) может составлять, по меньшей мере, примерно 2%, примерно 3%, примерно 4%, примерно 5%, примерно 10%, примерно 15%, примерно 20%, примерно 30%, примерно 40% или примерно 50% или более. В другом варианте воплощения изобретения уровень бис-фосфорилированной маннозы 7 (БФМ7) на GALNS в композиции составляет от примерно 25% до примерно 40% или от примерно 30% до 35%.
[00227] В вариантах воплощения любого описанного выше способа или композиции, фермент GALNS может быть представлен рекомбинантным ферментом N-ацетилгалактозамин-6-сульфатазы (GALNS) человека, включающим аминокислотную последовательность, которая по меньшей мере на 95% идентична аминокислотам 27-522 последовательности SEQ ID NO:4, и (i) имеет чистоту по меньшей мере примерно 95%, как это определено окрашиванием Кумасси синим при проведении SDS-PAGE в невосстанавливающих условиях, (ii) имеет конверсию по меньшей мере примерно 80% остатка цистеина в положении 53 в Cα-формилглицин (FGly), и (iii) имеет от 0,5 до 0,8 бис-фосфорилированных олигоманнозных цепей на мономерную белковую цепь, при этом по меньшей мере 70%, по меньшей мере 80%, по меньшей мере 85%, по меньшей мере 90%, по меньшей мере 95%, по меньшей мере 97%, по меньшей мере 98%, по меньшей мере 98,5%, по меньшей мере 99% или по меньшей мере 99,5% указанного фермента GALNS представлено в форме предшественника, как это определено окрашиванием Кумасси синим при проведении SDS-PAGE в восстанавливающих условиях или SDS-капиллярного гель-электрофореза (SDS-CGE).
[00228] Относительно чрескожных путей введения способы для чрескожного введения препаратов описаны в Remington’s Pharmaceutical Sciences, 17th Edition, (Gennaro et al., Eds. Mack Publishing Co., 1985). Дермальные или кожные повязки являются преимущественными способами для чрескожной доставки лизосомальных сульфатазных ферментов по изобретению. Повязки преимущественно содержат усилитель абсорбции, такой как ДМСО, для увеличения абсорбции лизосомальных ферментов сульфатазы. Другие способы чрескожной доставки препаратов описаны в патентах США № 5962012, 6261595 и 6261595, каждый из которых включен сюда во всей своей полноте посредством ссылки.
[00229] Фармацевтически приемлемые вспомогательные вещества, такие как носители, адъюванты, переносчики или разбавители, являются коммерчески доступными. Кроме того, фармацевтически приемлемые вспомогательные вещества, такие как агенты для корректировки рН и буферные агенты, агенты для регуляции тоничности, стабилизаторы, смачивающие агенты и т.п., также представлены на рынке.
[00230] В каждом из этих аспектов композиции лизосомальных ферментов сульфатазы включают, но не ограничиваются, композиции, подходящие для перорального, ректального, местного, парентерального (включая подкожное, внутримышечное и внутривенное), легочного (назальная или буккальная ингаляция) или назального введения, однако большинство подходящих способов в любом отдельном случае будет зависеть, частично, от природы и степени тяжести подвергнутых лечению состояний, и от природы активного действующего вещества. Типичные пути введения представлены пероральным и внутривенным путями. Композиции лизосомальных ферментов сульфатазы могут быть представлены удобным образом в виде единичных лекарственных форм и получены любым способом, известным в фармации.
[00231] Принимая во внимание легкость введения, таблетки и капсулы представляют наиболее удобную единичную лекарственную форму с использованием, безусловно, твердых фармацевтических носителей. При необходимости, таблетки могут быть покрыты с использованием стандартных водных или неводных способов. Процент активного лизосомального фермента сульфатазы в таких композициях может, конечно же, варьировать и может составлять от примерно 2% до примерно 60% по весу лекарственной формы.
[00232] Композиции лизосомальных ферментов сульфатазы по изобретению могут быть введены в капсулах или присоединены к вирусным оболочкам или везикулам, или включены в клетки. Везикулы являются мицеллярными частицами, обычно сферической формы, и часто имеют липидную природу. Липосомы являются везикулами, образованными из бислойной мембраны. Подходящие везикулы включают, но не ограничиваются, однослойные везикулы и многослойные липидные везикулы или липосомы. Такие везикулы и липосомы могут быть получены из целого ряда липидных или фосфолипидных соединений, таких как фосфатидилхолин, фосфатидиловая кислота, фосфатидилсерин, фосфатидилэтаноламин, сфингомиелин, гликолипиды, ганглиозиды, и т.д., с использованием стандартных способов, таких как описанные, например, в патенте США № 4394448. Такие везикулы или липосомы могут использоваться для введения лизосомального фермента сульфатазы внутриклеточно и для доставки лизосомальных ферментов сульфатазы в органы-мишени. Контролируемое высвобождение интересующего лизосомального фермента сульфатазы также может быть достигнуто при использовании инкапсуляции (см., например, патент США № 5186941).
[00233] Может использоваться любой способ введения, доставляющий композицию лизосомального фермента сульфатазы в кровоток, или предпочтительно, по меньшей мере, за пределы гематоэнцефалического барьера. Предпочтительно, композицию лизосомального фермента сульфатазы вводят периферическим путем, более предпочтительно, внутривенно или с использованием сердечного катетера. Также используют введение в яремную и сонную артерии. Композиции лизосомального фермента сульфатазы могут быть введены местно или регионально, например, интраперитонеально, подкожно или внутримышечно. В одном аспекте изобретения композиции лизосомального фермента сульфатазы вводят с одним или более фармацевтически приемлемых носителей, разбавителей или вспомогательных веществ.
[00234] Специалисту в данной области очевидно, что уровни дозы могут варьировать как функция специфического лизосомального фермента сульфатазы, степени тяжести симптомов и восприимчивости субъекта к побочным эффектам. Предпочтительные дозы отдельного лизосомального фермента сульфатазы могут быть легко определены специалистом в данной области с использованием целого ряда способов, включая, но не ограничиваясь, анализ ответа на дозу и фармакокинетики, проводимых у пациентов, на подопытных животных и in vitro.
[00235] Вводимые дозы могут также зависеть от индивидуальных потребностей, требуемого эффекта, определенного используемого лизосомального фермента сульфатазы и выбранного пути введения. Дозы лизосомального фермента сульфатазы варьируют от примерно 0,2 пмоль/кг до примерно 20 нмоль/кг, предпочтительные дозы варьируют от 2 пмоль/кг до 2 нмоль/кг, и особенно предпочтительные дозы варьируют от 2 пмоль/кг до 200 пмоль/кг. С другой стороны, дозы лизосомального фермента сульфатазы могут находиться в диапазоне от 0,01 до 1000 мг/кг, предпочтительные дозы могут находиться в диапазоне от 0,1 до 100 мг/кг, и особенно предпочтительные дозы находятся в диапазоне от 0,1 до 10 мг/кг. На такие дозы может влиять, например и без ограничения, конкретный лизосомальный фермент сульфатазы, форма фармацевтической композиции, путь введения и место действия конкретного лизосомального фермента сульфатазы.
[00236] Лизосомальные ферменты сульфатазы по изобретению используют для терапевтического, профилактического и диагностического вмешательства у животных, и, в частности, у человека. Лизосомальные ферменты сульфатазы могут характеризоваться преимущественным накоплением в отдельных тканях. Преимущественные медицинские показания для диагностического применения включают, например, любое состояние, связанное с интересующим органом-мишенью (например, легкими, печенью, почками, селезенкой).
[00237] Рассматриваемые способы находят применение в лечении целого ряда различных болезненных состояний. В определенных вариантах воплощения изобретения особый интерес представляет использование рассматриваемых способов при болезненных состояниях, при которых лизосомальный фермент сульфатазы с требуемой активностью был идентифицирован ранее, однако такой лизосомальный фермент сульфатазы не доставляется в место действия, область или компартмент несоответствующим образом для выработки полностью удовлетворительного терапевтического результата. С использованием таких лизосомальных ферментов сульфатазы рассматриваемые способы получения активных высокофосфорилированых лизосомальных ферментов сульфатазы могут использоваться для увеличения терапевтической эффективности и терапевтического индекса лизосомального фермента сульфатазы.
[00238] Лечение подразумевает получение какого-либо полезного результата у субъекта, связанного с введением лизосомального фермента сульфатазы, включая пониженную вероятность приобретения заболевания, профилактики заболевания, замедление, остановку или обратное развитие, прогрессирование заболевания или снижение степени тяжести симптомов, связанных с болезненным состоянием, поразившим хозяина, при этом снижение степени тяжести или польза используются в своем широком смысле и обозначают, по меньшей мере, снижение амплитуды параметра, например, симптома, связанного с патологическим состоянием, подвергнутым лечению, таким как воспаление и связанная с ним боль. Как таковое, лечение также включает ситуации, когда патологическое состояние или, по меньшей мере, связанные с ним симптомы, полностью ингибируются, например предотвращается их возникновение, или они прекращаются, например останавливаются, таким образом, хозяин более не страдает от патологического состояния, или, по меньшей мере, более не страдает от симптомов, характеризующих патологическое состояние.
[00239] В соответствии со способами по изобретению лечению подвергается целый ряд хозяев. Как правило, такие хозяева представлены «млекопитающими» или «относятся к млекопитающим», и такие термины используются здесь в широком смысле, обозначая организмы, включенные в класс млекопитающих, включая отряды хищников (например, собаки и кошки), грызунов (например, мыши, морские свинки и крысы) и приматов (например, человека, шимпанзе и обезьян). Во многих вариантах воплощения изобретения хозяева представлены человеком.
[00240] Теперь, после общего описания изобретения, его принципы могут быть более понятны при изучении следующей ссылки на представленные ниже примеры, которые содержат типичные протоколы для получения и очистки активных высокофосфорилированных лизосомальных ферментов сульфатазы и их применения для лечения лизосомальных болезней накопления. Представленные примеры приводятся только в иллюстративных целях и не предназначены для ограничения области применения данного изобретения никоим образом. Были сделаны попытки повышения точности используемых значений (например, количества, температуры и т.д.), однако следует учитывать некоторые погрешности и отклонения экспериментов.
ПРИМЕРЫ
ПРИМЕР I
ВЕКТОРЫ ЭКСПРЕССИИ МЛЕКОПИТАЮЩИХ ДЛЯ ФАКТОРА МОДИФИКАЦИИ СУЛЬФАТАЗЫ 1 (SUMF1) ЧЕЛОВЕКА И N-АЦЕТИЛГАЛАКТОЗАМИН-6-СУЛЬФАТАЗЫ (GALNS) ЧЕЛОВЕКА
[00241] Целью было построение векторов экспрессии млекопитающих, подходящих для выработки в стабильно трансфицированных клетках соответствующих количеств активных лизосомальных ферментов сульфатазы с улучшенными уровнями фосфорилирования.
[00242] кДНК полной длины фактора модификации сульфатазы 1 человека (SUMF1) (см. заявки на патент США № US 20005/0123949, дата публикации 9 июня 2005 г. и US 2004/0229250, дата публикации 8 ноября 2004 г., обе из которых включены сюда во всей своей полноте посредством ссылки), кодирующая полипептид из 374 аминокислот, была клонирована в кДНК4 вектора экспрессии млекопитающих (Invitrogen, Carlsbad, CA), который содержит энхансер-промотор CMV человека и сайт множественного клонирования. Эффективная терминация транскрипта была обеспечена присутствием полиаденилирующей последовательности гормона роста рогатого скота. Маркер селекции был представлен геном резистентности к зеоцину под контролем промотора ЕМ-7 и последовательности раннего полиаденилирования SV40. Полученная плазмида была обозначена как pcDNA4 SUMF1. Последовательности полинуклеотида SUMF1 человека (SEQ ID NO:1) и полипептида (SEQ ID NO:2) представлены на Фигуре 1 и Фигуре 2, соответственно.
[00243] кДНК полной длины N-ацетилгалактозамин-6-сульфатазы (GALNS) человека (см. Tomatsu et al., Biochem. Biophys. Res. Commun. 181(2):677-683, 1991), кодирующая полипептид из 522 аминокислот, включая сигнальный пептид из 26 аминокислот, была клонирована в вектор экспрессии млекопитающих pCIN (BioMarin), содержащий энхансер-промотор CMV человека, присоединенный к интрону β-глобина IVS2 кролика и сайту множественного клонирования. Эффективная терминация транскрипта была обеспечена присутствием полиаденилирующей последовательности гормона роста рогатого скота. Маркер селекции был представлен геном неомицин фосфотрансферазы, который несет точечную мутацию для снижения эффективности фермента. Подавленный маркер был дополнительно дефектирован слабым промотором HSV-tk. Полученная плазмида была обозначена pCIN 4A. Последовательности полинуклеотида GALNS человека (SEQ ID NO:3) и полипептида (SEQ ID NO:4) представлены на Фигуре 3 и Фигуре 4, соответственно.
[00244] Для повышения уровней экспрессии SUMF1 и GALNS, элементы присоединения участка скаффолда/матрицы (MAR) (см. Mermod et al., патент США № 7129062) были клонированы в плазмиды экспрессии SUMF1 и GALNS.
[00245] BMAR SUMF1 был получен путем расщепления P<1_68 X_X NcoI в MAR (Selexis) с использованием BamHI и HincII, и последующей вставки высвобожденного фрагмента MAR в pcDNA4 SUMF1, расщепленную BglII и NruI.
[00246] PMAR SUMF1 была получена путем расщепления P<1_68 NcoI в (MAR) SV40 EGFP (Selexis) с использованием HindIII и XbaI для удаления гена EGFP, и последующей вставки гена SUMF1, высвобожденного из pcDNA4 SUMF1 путем расщепления с использованием HindIII и XbaI.
[00247] BMAR 4A была получена путем расщепления BMAR SUMF1 с использованием PmeI и SpeI для удаления гена SUMF1, и последующей вставки гена GALNS, высвобожденного из pCIN 4A путем расщепления с использованием PmeI и SpeI.
[00248] PMAR 4А была получена путем расщепления P<1_68 NcoI в (MAR) SV40 EGFP (Selexis) с использованием HindIII и XbaI для удаления гена EGFP, и последующей вставки гена GALNS, высвобожденного из pCIN 4A путем расщепления с использованием HindIII и XbaI.
[00249] кДНК полной длины GALNS человека также была клонирована в вектор экспрессии млекопитающих pcDNA4 (Invitrogen, Carlsbad, CA). pCDNA4 SUMF1 была расщеплена HindIII и XbaI для удаления кДНК SUMF1, и pCIN 4A был расщеплен HindIII и XbaI для выделения кДНК GALNS. Фрагмент кДНК GALNS HindIII/XbaI был лигирован во фрагмент вектора pcDNA4 HindIII/XbaI. Полученная плазмида была обозначена как pcDNA4-4A.
[00250] Целостность гена GALNS в векторах экспрессии pCIN 4A, BMAR и pCDNA4-4A была подтверждена путем рестрикционного картирования с использованием ферментов, предоставленных New England Biolabs. Вектор экспрессии PMAR 4A не был картирован.
[00251] Структура полностью процессированной формы N-ацетилгалактозамин-6-сульфатазы (GALNS) человека представлена на Фигуре 5. GALNS экспрессируется в виде полипептида из 522 аминокислот с последовательностью сигнального пептида из 26 аминокислот. Полипептид GALNS из 496 аминокислот секретируется в виде пред-процессинговой формы (предшественника) фермента с молекулярным весом примерно 55-60 кДа. В активном GALNS остаток цистеина в положении 53 предшественника или полностью процессированного полипептида GALNS (соответствующего положению 79 полипептида GALNS полной длины) был конвертирован в Cα-формилглицин (FGly) фактором модификации сульфатазы 1 (SUMF1). В лизосоме GALNS расщепляется после положения 325 полностью процессированного полипептида GALNS, приводя к образованию пептидных фрагментов GALNS примерно 40 кДа и 19 кДа. Такие пептиды GALNS соединены дисульфидным мостиком между остатками цистеина (С) в положениях 282 и 393 полностью процессированного полипептида GALNS. Существует два канонических N-присоединенных сайтов гликозилирования в положениях 178 и 397 полностью процессированного полипептида GALNS. Бис-фосфорилированная манноза 7 (БФМ7), включающая 2 маннозо-6-фосфатных остатков, находилась на N178, но не на N397.
ПРИМЕР II
ЛИНИИ КЛЕТОК G71S, СО-ЭКСПРЕССИРУЮЩИЕ ФАКТОР МОДИФИКАЦИИ СУЛЬФАТАЗЫ 1 (SUMF1) ЧЕЛОВЕКА И N-АЦЕТИЛГАЛАКТОЗАМИН-6-СУЛЬФАТАЗУ (GALNS) ЧЕЛОВЕКА
[00252] Целью была разработка линий клеток, способных продуцировать активные лизосомальные ферменты сульфатазы с улучшенными уровнями фосфорилирования.
[00253] Клетки G71 (Rockford K. Draper) были получены непосредственно из CHO-K1 (ATCC CCL-61). Линия клеток G71 является чувствительным к температуре мутантом CHO-K1 относительно ацидификации эндосом, что, как это было отмечено, способствует разнице в общей секреции белка и фосфорилировании остатков маннозы для нескольких ферментов при повышенной температуре (Park et al., Somat. Cell Mol. Genet. 17(2): 137-150, 1991; Marnell et al., J. Cell. Biol. 99(6): 1907-1916, 1984).
[00254] Клетки G71 содержались при 34°C в среде BioWhittaker UltraCHO, дополненной 2,5% фетальной бычьей сыворотки, 2 мМ глутамина, гентамицина и амфотерицина.
[00255] Для облегченного использования линий клеток для выработки белка, соответствующие клетки G71 были предварительно адаптированы к среде роста без содержания сыворотки с использованием протокола для адаптации субстратзависимых, сывороточнозависимых клеток млекопитающих к высокоплотной и не содержащей сыворотку суспензионной культуре (Sinacore et al., Mol. Biotechnol. 15(3):249-257, 2000), что позволило получить линию клеток G71S, адаптированную к не содержащей сыворотку суспензионной культуре. С другой стороны, соответствующие клетки G71, после стабильного трансфицирования, как это описано ниже, могут быть адаптированы к среде роста без содержания сыворотки, как это указано в Sinacore et al.
[00256] Сопоставленные комбинации векторов экспрессии SUMF1 человека и GALNS человека (Пример I), pcDNA4 SUMF1 плюс pCIN4 4A, BMAR SUMF1 плюс BMAR 4A, или PMAR SUMF1 плюс PMAR 4A, были трансфицированы в соответствии с протоколом MARtech II, как это описано Selexis, в клетки G71S, выращенные в питательной среде, дополненной раствором с антибиотиками и антимикотическими препаратами (100 МЕ пенициллина, 10 мг стрептомицина, 25 мкг амфотерицина B, Cellgro). Пулы трансфектантов были выращены на среде UltraCHO (Cambrex), дополненной 5% γ-облученной фетальной бычьей сывороткой (ФБС, JRH), 200 мкг/мл G418 (AG Scientific) и 200 мкг/мл зеоцина (Invitrogen), и клонированы с ограниченным разведением на 96-лучочных планшетах в этой же питательной среде. Рост клона был подвергнут мониторингу с использованием визуализации Cell Screen (Innovatis). Все клоны были подвергнуты скринингу с использованием ИФА с захватом активного фермента GALNS (см. Пример IV). Продуктивность клеток была рассчитана путем деления значения фермент-улавливающей активности, определенного ИФА для определения активности GALNS, на рост клеток (Vi-Cell, Beckman Coulter) в сутки в течение периода 4 дня.
[00257] Клоны 202 G71S были получены и подвергнуты скринингу на предмет активного GALNS: 86 клонов со-трансфицированы pcDNA4 SUMF1 плюс pCIN 4A, 65 клонов со-трансфицированы BMAR SUMF1 плюс BMAR 4A, и 51 клон со-трансфицирован PMAR SUMF1 плюс PMAR 4A. Клоны были изначально выбраны на основе высоких уровней активного GALNS из 96-луночных планшетов с тканевой культурой (Фигура 6А). Активность GALNS была измерена с использованием фермент-улавливающего ИФА и представлена в единицах нг/мл (ось y). Ось x отображает три условия со-трансфицирования, используемые для экспрессии SUMF1 и GALNS: промотор hCMV без MAR, промотор hCMV с MAR и промотор SV40 с MAR. Каждый ус представляет отдельный клон из соответствующей популяции. Плотность клеток не учитывалась для данного скрининга клона из 96 лунок, и на данной фигуре отображены не все со-трансфицированные клоны G71S.
[00258] Клоны G71S с наивысшей выработкой активного GALNS были выбраны для анализа продуктивности (Фигура 6В). Суточная продуктивность клеток была измерена в пг/клетка/сутки и получена путем деления активности GALNS на плотность клеток в данные сутки. Данная фигура отображает четвертый день (96 часов) после высеивания 5×105 клеток/колба. Клоны были проанализированы на предмет GALNS с использованием фермент-улавливающего ИФА, и результаты были представлены в пг/клетка/сутки (ось y). Положительный контроль состоял из клонов ВНК и СНО, экспрессирующих GALNS (BioMarin). Каждый вертикальный ус представляет отдельный клон. Активный GALNS вырабатывался клонами pCIN 4A, но только незначительно выше фонового анализа.
[00259] Анализ клонов путем скрининга 96 лунок и анализ 4-дневной продуктивности показали, что ко-трансфекция векторов экспрессии элементами MAR повышала продуктивность клонов G71S в сравнении с ко-трансфекцией векторов экспрессии без элементов MAR. Ко-трансфицированные клоны BMAR 4A+BMAR SUMF1 характеризовались быстрым образованием пулов, быстрым ростом клона и способностью вырабатывать более чем в 2 раза более активный GALNS, чем клоны PMAR 4A с максимальной выработкой, и до 10-кратного увеличения в сравнении с клонами CHO 4A и BHK 4A с отсутствующими элементами MAR.
[00260] Клоны G71S, экспрессирующие GALNS, были адаптированы к среде роста без содержания сыворотки с использованием протокола, представленного в Sinacore et al., Mol. Biotechnol. 15(3):249-257, 2000. Полная адаптация была проведена в присутствии обоих агентов селекции (зеоцина в концентрации 200 мкг/мл и неомицина в концентрации 200 мкг/мл). Клоны G71, экспрессирующие GALNS и культивированные в T-колбах, были разделены следующим образом: (1) в 125 мл шейкер со средой Cambrex UltraCHO и 5% ФБС (партия № 8L2242); (2) в 125 мл шейкер со средой JRH 302M (производственная среда) и 5% ФБС; и (3) в T-колбы в качестве резерва (UltraCHO, 5% ФБС). Как только были получены суспензионные культуры, находящиеся в них клетки были отобраны, и была начата очистка от ФБС. Когда скорость роста возвратилась к показателю >0,5 (л/сутки) для 3 пассажей, и показатель жизнеспособности составил >95%, концентрация ФБС была снижена до 50%. Клетки были оставлены в любой заданной концентрации ФБС в течение минимум 3 пассажей. После адаптации к росту в 2,5% ФБС, клетки были помещены непосредственно в среду, не содержащую сыворотку. Клетки были объединены в свежей среде с 10% (о/о) ДМСО. Было проведено тестирование пробной оттаянной партии клеток для обеспечения того, что клетки выжили после замораживания. Двум клонам G71S, экспрессирующим GALNS, из трансфекции BMAR 4A + BMAR SUMF1, клонам 4 и 5, потребовалось примерно 15 пассажей для адаптации к суспензионной культуре, не содержащей сыворотку. Клон С6, экспрессирующий GALNS, из трансфекции pcDNA4 SUMF1 плюс pCIN 4A, также был выделен и адаптирован к культуре без содержания сыворотки.
[00261] Спаренные комбинации векторов экспрессии SUMF1 человека и GALNS человека (Пример I), pcDNA4 SUMF1 плюс pCDNA4-4A, были трансфицированы в клетки G71S, в основном как это описано выше, за исключением того, что 200 мкг/мл зеоцина (Invitrogen) использовали для селекции. Шесть клонов, экспрессирующих GALNS, а именно C2, C5, C7, C10, C11 и C30, были выделены и адаптированы к суспензионной культуре, не содержащей сыворотку, в основном как это описано выше.
ПРИМЕР III
ШИРОКОМАСШТАБНОЕ КУЛЬТИВИРОВАНИЕ ЛИНИЙ КЛЕТОК G71S, ЭКСПРЕССИРУЮЩИХ N-АЦЕТИЛГАЛАКТОЗАМИН-6-СУЛЬФАТАЗУ (GALNS) ЧЕЛОВЕКА
[00262] Целью было измерение выработки фермента из клонов G71S, экспрессирующих N-ацетилгалактозамин-6-сульфатазу (GALNS) человека. Линии клеток G71S, адаптированные к суспензионной культуре без содержания сыворотки и со-экспрессирующие SUMF1 человека и GALNS человека, были культивированы в больших масштабах и проанализированы на предмет выработки активного фермента GALNS.
[00263] Поскольку адаптация к суспензионной культуре без содержания сыворотки была относительно быстрой для линии клеток-хозяев G71S, было решено, что выработка может быть проведена в биореакторе WAVE, работающем в режиме перфузии. Биореактор WAVE обеспечивает большую гибкость относительно используемых объемов инокулята, потому что увеличение масштабов может быть проведено непосредственно в резервуаре, снижая риск контаминации и ускоряя выработку материала. Фигура 7 отображает схематическую настройку биореактора WAVE. Диаграмма работы в режиме перфузии отображает, что датчик нагрузки отслеживает объем среды в резервуаре путем определения веса резервуара и корректируя скорость добавления и роста для поддержания требуемого объема. В 10 л резервуаре значение рН также контролируется на определенной установленной точке зондом, вставленным в резервуар.
[00264] Материал клонов 4 и 5 G71S, экспрессирующих GALNS, был получен при масштабе 1 л. При таком процессе рН культуры не контролировали. Функциональное ограничение резервуара WAVE представлено пропускной способностью 3 объема резервуара в сутки (ОР/сутки). Для предотвращения любой инактивации материала, клеточно-специфическая скорость перфузии (КССП) составила 0,3 нл/клетка/сутки, и среднее время выдерживания ферментов GALNS составило восемь часов. Таким образом, плотность клеток в резервуаре поддерживалась на уровне приблизительно 10-12×106 клеток/мл. Скорость роста для клонов 4 и 5 G71S, экспрессирующих GALNS, составила 0,16 и 0,20, соответственно. Сливание клеток для поддержания требуемой плотности клеток проводили непосредственно из резервуара.
[00265] Значение рН отобранной жидкости было скорректировано до рН от 5,5 до 6,5 для поддержания ферментативной активности, т.к. ранее было показано, что GALNS стабилен при рН 6. Это сопровождалось рассчитанным по времени болюсным добавлением 5% по объему буфера натрия цитрата рН 4,0, смешанного в ходе процесса со сбором из реактора. Скорректированная собранная жидкость хранилась при 4°C перед дальнейшей переработкой. Средний титр для двух клонов 4 и 5 G71S, экспрессирующих GALNS, составил примерно 4,2 мг/л со связанной специфической продуктивностью примерно 1,25 пг/клетка/сутки.
[00266] Клоны C2, C5, C6, C7, C10, C11 и C30 G71S, экспрессирующие GALNS, были культивированы подобным образом в больших масштабах и проанализированы на предмет выработки активного фермента GALNS.
ПРИМЕР IV
ИЗМЕРЕНИЕ КОНЦЕНТРАЦИИ И АКТИВНОСТИ N-АЦЕТИЛГАЛАКТОЗАМИН-6-СУЛЬФАТАЗЫ (GALNS) ЧЕЛОВЕКА
[00267] Твердофазный иммуноферментный анализ (ИФА) был разработан для измерения концентрации и активности фермента GALNS, полученного из клонов G71S, со-экспрессирующих SUMF1 человека и N-ацетилгалактозамин-6-сульфатазу (GALNS) человека.
ИФА с улавливанием активного фермента
[00268] ИФА с улавливанием активного фермента измеряет активность фермента GALNS в твердой фазе с последующим захватом антителом, специфическим к GALNS, связанным с планшетом для ИФА.
[00269] Буферы. Буфер A (карбонатный буфер): растворить 3,09 г Na2CO3 и 5,88 г NaHCO3 в 900 мл деионизированной (DI) H2O, затем добавить DI H2O до финального объема 1000 мл. Проконтролировать, чтобы значение рН составляло от 9,4 до 9,6, затем провести фильтрующую стерилизацию. Для полного покрытия одного 96-луночного микропланшета 100 мкл в лунку, развести 19 мкл антитела к GALNS в одной пробирке (12 мл). Буфер B (ИФА блокирующий буфер и буфер для серийного разведения): 1x подкисленный ФСБ, 0,05% Твина-20 и 2% БСА, скорректировать до pH 6,5 уксусной кислотой. Буфер BW(буфер для промывания): 100 мМ NaOAc и 0,05% Твин-20, скорректировать до pH 6,5 уксусной кислотой. Буфер C (субстратный буфер): 25 мМ натрия ацетата, 1 мМ NaCl, 0,5 мг/мл опресненного БСА и 0,01% натрия азида, скорректировать до pH 4,0 ледяной уксусной кислотой. Буфер D (буфер α-галактозидазы): 300 мМ натрия фосфата двухосновного, 0,1 мг/мл БСА, 0,01% натрия азида и 0,01% Твина-20, скорректировать до pH 7,2 фосфорной кислотой. Буфер E (останавливающий буфер): 350 мМ глицина и 440 мМ карбонатного буфера, скорректировать до pH 10,7 с использованием 6 M NaOH.
[00270] Реагенты. Антитело IgG к GALNS: поликлональные кроличьи антитела представлены белком G, очищенным от сыворотки. В D-ФСБ общий белок = 3,17 мг/мл (BCA). Аликвоты (19 мкл) хранили при -20oC и каждую использовали только один раз. Субстрат 4MU-Gal-6-S (твердый; 440 MW): 100 мМ маточного раствора, приготовленного в воде DI, хранили при 4oC. α-галактозидаза (Sigma G-4155): развести до 12 мкг/мл в буфере D перед использованием.
[00271] Протокол: Связывание антитела к GALNS с планшетом: планшет Nunc MaxiSorp для ИФА (Nalge/Nunc International, Fisher # 12-565-135) покрывают антителом к GALNS при финальной концентрации белка 5 мкг/мл в буфере A. Для приготовления такого раствора оттаивают одну аликвоту 19 мкл, быстро центрифугируют (10 секунд) в микроцентрифуге для сбора жидкости. Переносят все 19 мкл в 12 мл буфера А. Тщательно перемешивают путем переворачивания, затем сливают в резервуар с последующей загрузкой планшета (100 мкл на лунку) с использованием многоканальной пипетки. Накрывают планшет и инкубируют при 4°C в течение ночи. Удаляют несвязанное антитело к GALNS: промывают планшет наполнением буфером BW трижды. Блокирование: блокируют планшет буфером В (320 мкл на лунку), затем накрывают планшет и инкубируют при 37°C в течение 1 часа. Готовят серию разведений очищенных стандартных и исследуемых (неизвестных) образцов GALNS в ходе этапа блокирования: стандарт разводят в буфере В до максимального значения линейного диапазона анализа (128 нг/мл в ряду А), затем серийно разводят (2-кратно) в рядах B-G 96-луночного планшета. Полоса Н содержит холостой буфер (т.е. фермент GALNS отсутствует). Вначале готовят концентрацию 500 мкл при 128 нг/мл в буфере В. Затем проводят серийное 2-кратное разведение в буфере В (250 мкл в 250 мкл) до достижения концентрации 2 нг/мл. Удаление блокирующего буфера: после этапа блокирования буфер В сливают. Связывание стандартных и исследуемых образцов фермента GALNS с антителом к GALNS: нагружают планшет 100 мкл/лунка серийно разведенными стандартными и исследуемыми образцами (в двух повторностях). Накрывают планшет и инкубируют при 37°C в течение 1 часа. Удаление ингибиторов GALNS: промывают планшет наполнением буфером BW трижды. Добавление субстрата GALNS (первая реакция): готовят достаточное количество финального раствора субстрата для нагрузки 100 мкл в лунку (приготовление не более чем за 1 час перед использованием). Разводят маточный раствор 4MU-Gal-6-S (100 мМ) в 1 мМ буфера С. Вносят в лунку по 100 мкл. Накрывают планшет и инкубируют при 37°C в течение 30 минут. Добавление α-галактозидазы (вторая реакция): добавляют 50 мкл 12 мкг/мл α-галактозидазы в буфере D в каждую лунку. Накрывают планшет и инкубируют при 37°C в течение 15 минут. Стоп-реакция: вносят 100 мкл буфера Е (стоп-буфер) в каждую лунку для ионизации высвобождаемого 4MU. Перенос на планшет Fluoroplate: переносят (8 лунок за один раз) 200 мкл из каждой лунки с 250 мкл планшета ИФА на черный плоскодонный и не подвергнутый обработке планшет для микротитрации (Fluoroplate, Costar #3915). Считывание показателя флуоресценции: считывают планшет с использованием планшет-ридера Gemini (Molecular Devices Corporation) и программы SOFTmax PRO (возбуждение при 366 нм, эмиссия при 446 нм, отсечение при 435 нм).
ИФА GALNS
[00272] ИФА GALNS измеряет концентрацию фермента GALNS в клеточной культуре, находящейся в кондиционированной среде, или других исследуемых образцах с использованием иммуноферментного сэндвич-анализа.
[00273] Буферы. Буфер A (карбонатный буфер): растворить 3,09 г Na2CO3 и 5,88 г NaHCO3 в 900 мл деионизированной (DI) H2O, затем добавить DI H2O до финального объема 1000 мл. Проконтролировать, чтобы значение рН составляло от 9,4 до 9,6, затем провести фильтрующую стерилизацию. Для полного покрытия одного 96-луночного микропланшета 100 мкл в лунку, развести 19 мкл антитела к GALNS в одной пробирке (12 мл). Буфер B (ИФА блокирующий буфер и буфер для серийного разведения): 1x подкисленный ФСБ, 0,05% Твина-20 и 2% БСА, скорректировать до pH 6,5 уксусной кислотой. Буфер BW(буфер для промывания): 100 мМ NaOAc и 0,05% Твин-20, скорректировать до pH 6,5 уксусной кислотой. Буфер F (стоп-буфер): 2N H2SO4: в 600 мл общем объеме, добавить 100 мл 12N H2SO4 и 500 мл воды MilliQ.
[00274] Реагенты. Антитело IgG к GALNS: поликлональные кроличьи антитела представлены белком G, очищенным от сыворотки. В D-ФСБ общий белок = 3,17 мг/мл (BCA). Аликвоты (19 мкл) хранили при -20oC и каждую использовали только один раз. Антитело для определения, конъюгированное с HRP (RIVAH): финальное конъюгированное антитело разбавляют в соотношении 1:100 в D-ФСБ/1% БСА и хранят в виде аликвот 120 мкл при -20°C для однократного применения. Набор субстрата TMB EIA (BioRad #172-1067).
[00275] Протокол. Связывание антитела к GALNS с планшетом: планшет Nunc MaxiSorp для ИФА (Nalge/Nunc International, Fisher # 12-565-135) покрывают антителом к GALNS при финальной концентрации белка 5 мкг/мл в буфере A. Для приготовления такого раствора оттаивают одну аликвоту 19 мкл, быстро центрифугируют (10 секунд) в микроцентрифуге для сбора жидкости. Переносят все 19 мкл в 12 мл буфера А. Тщательно перемешивают путем переворачивания, затем сливают в резервуар с последующей загрузкой планшета (100 мкл на лунку) с использованием многоканальной пипетки. Накрывают планшет и инкубируют при 37oC (конвекционный инкубатор) в течение 2 часов. Не использовать горячий блок. Удаляют несвязанное антитело к GALNS: промывают планшет наполнением буфером BW трижды. Блокирование: блокируют планшет буфером В (320 мкл на лунку), затем накрывают планшет и инкубируют при 37°C в течение 1 часа. Готовят серию разведений очищенных стандартных и исследуемых (неизвестных) образцов GALNS в ходе этапа блокирования: стандарт разводят в буфере В до максимального значения линейного диапазона анализа (40 нг/мл в ряду А), затем серийно разводят (2-кратно) в рядах B-G 96-луночного планшета. Полоса Н содержит холостой буфер (т.е. фермент GALNS отсутствует). Вначале готовят концентрацию 500 мкл при 40 нг/мл в буфере В. Затем проводят серийное 2-кратное разведение в буфере В (250 мкл в 250 мкл) до достижения концентрации 0,625 нг/мл. Удаление блокирующего буфера: после этапа блокирования буфер В сливают. Связывание стандартных и исследуемых образцов фермента GALNS с антителом к GALNS: нагружают планшет 100 мкл/лунка серийно разведенных стандартных и исследуемых образцов (в двух повторностях). Накрывают планшет и инкубируют при 37°C в течение 1 часа. Промывание: промывают планшет наполнением буфером BW трижды. Связывание конъюгированного определяющего антитела: оттаивают одну аликвоту (120 мкл) антитела RIVAH, быстро центрифугируют (10 секунд) в микроцентрифуге для сбора жидкости. Разводят все 120 мкл в 11,9 мл буфера В и резко переворачивают пробирку для перемешивания. Сливают в резервуар и добавляют 100 мкл на лунку с использованием многоканальной пипетки. Накрывают планшет и инкубируют при 37°C в течение 30 минут. Промывание: промывают планшет наполнением буфером BW трижды. Субстрат ТМВ: готовят финальный раствор субстрата путем смешивания 1,2 мл раствора В с 10,8 мл раствора А. Сливают в резервуар и добавляют 100 мкл на лунку с использованием многоканальной пипетки. Накрывают планшет и инкубируют при 37°C в течение 15 минут. Стоп-раствор: вносят пипеткой 12 мл 2N H2SO4 стоп-раствора в резервуар и добавляют по 100 мкл в лунку с использованием многоканальной пипетки. Осторожно нажимают для перемешивания. Считывание показаний A450: показания планшета считываются в планшет-ридере.
Анализ специфической активности GALNS
[00276] Анализ специфической активности GALNS измеряет ферментативную активность GALNS в растворе с использованием GALNS-специфического субстрата.
[00277] Буферы. MilliQ H2O используют для всех буферов. Буфер для разведения (DB): для 1 л DB растворить 1,74 мл уксусной кислоты, 0,75 г натрия ацетата, 233,6 мг NaCl, 2 мл 50% Твина-20 и 10 мл 1% натрия азида в MilliQ H2O, и скорректировать pH до 4,0±0,5 с использованием 0,1 M NaOH, если pH менее 3,95, и 0,1 M уксусной кислоты, если pH более чем 4,05. Финальные концентрации следующие: 19,5 мМ уксусной кислоты, 5,5 мМ натрия ацетата, 1 мМ NaCl, 0,1% Твина-20 и 0,01% натрия азида. Фосфатный буфер (PB): для 1 л PB растворить 13,9 г NaH2PO4-H2O и 55 г NaHPO4-7H2O в MilliQ H2O, и скорректировать pH до 7,2. Финальная концентрация составляет 300 мМ NaPi. Стоп-буфер (SB): для 1 л SB растворить 26,2 г глицина и 46,6 г натрия карбоната в MilliQ H2O, и скорректировать pH до 10,6 с помощью NaOH. Буфер для анализа (AB): развести маточный раствор 4MU-Gal-6S в соотношении 1:50 в DB (2 мМ финальный раствор). Буфер β-галактозидазы (βGB): 25 мкг/мл β-галактозидазы в 300 мМ NaPi, pH 7,2.
[00278] Реагенты. 4MU-Gal-6S: 100 мМ в H2O (Toronto Research Chemicals, № по каталогу M334480). β-галактозидаза: Sigma G-4155. 4-метилумбеллиферон (4MU стандарт): Sigma M-1381 (10 мМ маточный раствор в ДМСО).
[00279] Протокол. Выполнить серийные разведения фермента GALNS. Для очищенных композиций GALNS (~1,5 мг/мл), развести образцы в соотношении 1:10000 в пробирках для микроцентрифугирования с низкой белковой адгезией (USA Scientific, № по каталогу 1415-2600), содержащих DB, перед серийным разведением 1:1. Поместить 100 мкл DB в 96-луночный планшет с низким связыванием белка. В первый ряд внести пипеткой 100 мкл образца GALNS. Затем серийно развести (1:1) вниз по планшету (A-G на 96-луночных планшетах). В лунку Н образец не вносить (холостой). Линейный диапазон данного анализа составляет 1-75 нг/мл. Использовать данную процедуру для приготовления стандартной кривой 4MU. Развести маточный раствор 10 мМ 4MU в ДМСО в соотношении 1:100 в DB. Начать строить стандартную кривую 4MU путем добавления 50 мкл 50 мкМ 4MU в первую лунку, затем разводить серийно. Добавить 50 мкл субстрата, разведенного в AB (2 мМ 4MU-галактоза-6S в DB) в 96-луночный планшет для анализа флуоресценции. Предварительно инкубировать субстрат в течение 10 минут при 37°C. Добавить 50 мкл из 100 мкл серийных разведений GALNS и стандартов 4MU к 50 мкл субстрата АВ. Инкубировать при 37°C в течение 30 минут (эта первая реакция удаляет сульфат из субстрата), потушить первую реакцию и начать вторую реакцию путем добавления 50 мкл β-галактозидазы (развести маточный раствор β-галактозидазы до 25 мкг/мл в βGB. Фосфат ингибирует GALNS, а повышение рН также прекращает реакцию GALNS. Полученный рН находится в оптимальном диапазоне значений рН для β-галактозидазы. Инкубировать эту вторую реакцию в течение 15 минут при 37°C. Ионизировать высвобожденный 4MU путем добавления 100 мкл SB. Снять показатели Ex355 Em460 на 96-луночном флуоресцентном планшет-ридере. Расчет активности фермента (при 37°C в pH 4,0 буфере): 1 единица = мкмоль 4MU высвобожденного/мин; активность = мкмоль 4MU/мин/мл; специфическая активность = мкмоль 4MU/мин/мг. Расчет концентрации белка: использовать коэффициент экстинкции GALNS (1 мг/мл = 1,708 единиц поглощения при 280 нм).
ПРИМЕР V
ОЧИСТКА N-АЦЕТИЛГАЛАКТОЗАМИН-6-СУЛЬФАТАЗЫ (GALNS) ЧЕЛОВЕКА
[00280] Целью было получение большого количества рекомбинантной N-ацетилгалктозамин-6-сульфатазы (GALNS) человека. Стабильно трансфицированные клетки G71, со-экспрессирующие SUMF1 человека и GALNS человека, были выращены в условиях культуры биореактора, и активный фермент GALNS был очищен от клеточной среды.
[00281] Аппарат жидкостной хроматографии. Система Amersham Pharmacia Biotech AKTA explorer 900, использующая контрольное программное обеспечение Unicorn.
[00282] Способы анализа белка. Стандартные процедуры были соблюдены для проведения SDS-PAGE, окрашивания Кумасси синим (B101-02-COOM), вестерн-блоттинга и анализа белков по Бредфорду. Этапы очистки были проанализированы по полученной активности, и чистота продукта GALNS была оценена визуально анализом SDS-PAGE. Присутствие обработанных примесей было определено вестерн-блоттингом с использованием антитела к GALNS. Концентрация белка была измерена с использованием анализа белков по Бредфорду. Концентрация финального очищенного белка GALNS была оценена по измерению A280 с использованием коэффициента экстинкции 1,708.
[00283] Хроматографические смолы. Голубая сефароза 6 FF (GE Healthcare, партия № 306346) и Fractogel SE Hi-Cap (Merck KgaA, FC040894449).
[00284] Определение активности ферментов GALNS. Специфическую активность GALNS определяли с использованием небольшого флуоресцентного субстрата 4-метилумбеллиферил-6-S-GAL (4-MU-6-S-GAL). Анализ специфической активности GALNS предполагает двухэтапную реакцию, при этом добавление β-галактозидазы необходимо после инкубации GALNS с субстратом в течение определенного времени для высвобождения флуоресцентной метки. Измерения проводят с использованием флуоресцентного планшет-ридера.
[00285] В обессоливающей колонке 10DG (Bio-RAD) было установлено равновесие буфером калибровки (EQB, 50 мМ NaOAc, 10 мМ NaCl, pH 5,8). MilliQ H2O используют для всех буферов. Три (3) мл очищенного GALNS (0,5-2 мг/мл) было загружено в обессоливающую колонку, элюировано и собрано по аликвотам 4 мл в отдельные пробирки для испытаний с использованием EQB. Концентрация белка была рассчитана с использованием коэффициента экстинкции GALNS (1 мг/мл = 1,708 единиц поглощения при 280 нм).
[00286] Обессоленные образцы GALNS были серийно разведены (1:1) в буфере разведения (DB, 50 мМ NaOAc, 1 мМ NaCl, pH 4,0+0,5 мг/мл БСА). Маточный раствор БСА был обессолен перед использованием путем загрузки маточного раствора 50 мг/мл БСА (не более 5% CV) в колонку G25, в которой перед этим было установлено равновесие с использованием milliQ H2O. 100 мкл образца обессоленного GALNS было внесено пипеткой в первый ряд 96-луночного планшета с низким связыванием белка, и вниз по рядам планшета были внесены серийные разведения образцов GALNS (ряды A-G на 96-луночных планшетах). 100 мкл DB было внесено пипеткой в последнюю лунку (Н). Верхний предел линейного диапазона в этом анализе составляет 200 нг/мл, и линейный диапазон составляет 3-200 нг/мл. Эта же процедура была проведена для приготовления стандартной кривой 4-метилумбеллиферона (4MU) (Sigma M-1381, 10 мМ маточный раствор в ДМСО). 50 мкл серийного разведения 100 мкл GALNS и 4MU было перенесено в новый 96-луночный планшет для флуоресценции (планшет с черным дном). 50 мкл 2 мМ 4MU-галактозы-6S (in milliQ H2O) было добавлено к анализируемым образцам и инкубировано при 37°C в течение 30 минут. Эта первая реакция была потушена и начата вторая реакция путем добавления 50 мкл β-галактозидазы (Sigma G-4155, маточный раствор, разведенный до 12 мкг/мл в 300 мМ NaPi, pH 7,2), и инкубирована при 37°C в течение 15 минут. Высвобожденный 4MU был ионизирован добавлением 100 мкл стоп-буфера (глицин/карбонат, рН 10,6). Планшеты были интерпретированы в планшет-ридере для 96-луночных флуоресцентных планшетов (возбуждение 355 нм, эмиссия 460 нм). 1 единица определена как 1 мкмоль 4MU высвобожденного/мин, активность фермента представлена в мкмоль 4MU/мин/мл, и специфическая активность представлена в мкмоль 4MU/мин/мг, все при 37°C в буфере с рН 4,0.
[00287] Первый процесс очистки. Первый процесс очистки включал этап ультрафильтрации (УФ) с последующим 2-колоночным процессом очистки.
[00288] 1. Фильтрация сбора (ФС): материал биореактора был подвергнут 0,2 мкм стерильной фильтрации.
[00289] 2. Ультрафильтрация (УФ): материал из биореактора был сконцентрирован 10-20Х ультрафильтрацией через мембрану 30 кДа Sartocon.
[00290] 3. Корректировка рН 4,5: концентрированный материал биореактора (УФ (20Х)) был скорректирован до рН 4,5 буфером для корректировки рН (1,75 M NaOAc, pH 4,0) при комнатной температуре и подвергнут стерильной фильтрации перед загрузкой в колонку с голубой сефарозой.
[00291] 4. Колонка с голубой сефарозой 6 Fast Flow (FF): материал с скорректированным pH 4,5, подвергнутый УФ (20X), был загружен в колонку с голубой сефарозой, и белок GALNS был элюирован, как это указано в Таблице 1 и на Фигуре 9A.
[00292] 5. Колонка Fractogel SE Hi-Cap: элюат из колонки с голубой сефарозой был скорректирован до рН 4,3 и загружен в колонку Fractogel SE Hi-Cap, и белок GALNS был элюирован, как это указано в Таблице 2 и на Фигуре 9B.
[00293] Белок GALNS из элюата был собран путем фракционирования, исключая «плечо» перед элюированием и «хвост» после элюирования.
[00294] 6. Финальная УФ/ФС: элюат из колонки Fractogel SE Hi-CAP был сконцентрирован ультрафильтрацией и стерильно профильтрован, как это описано выше.
[00295] Композиция. Очищенный белок GALNS был соединен с 10 мМ NaOAc, 1 мМ NaH2PO4, 0,005% Твин-80, pH 5,5.
[00296] Исследования стабильности. Стабильность финального очищенного GALNS в композиции была подвергнута мониторингу при 4°C и -70°C как функция от времени путем хранения небольших аликвот образцов GALNS при соответствующих температурах. При определенных временных точках аликвоты замороженных образцов были быстро оттаяны на водяной бане 37°C перед измерением активности. Фигура 8 указывает, что очищенный GALNS был стабильным при 4°C и -70°C в течение периода до, по меньшей мере, 79 дней в буфере композиции.
[00297] Результаты первого процесса очистки. Таблица 3 показывает результаты очистки для трех композиций белка GALNS, выработанного клоном 4 G71S в биореакторе с суспензионной культурой. Чистота была оценена визуально в ходе SDS-PAGE как примерно 95% во всех случаях.
[00298] Фигура 9 отображает SDS-PAGE белка GALNS, разделенного (A) быстропоточной хроматографией с голубой сефарозой 6 с последующей (B) Fractogel SE Hi-CAP хроматографией. Гели были окрашены Кумасси синим (слева) или антителом к GALNS (справа). Для проведения вестерн-блоттинга кроличье антитело к GALNS было разведено в соотношении 1:5000, и вторичное антитело было представлено кроличьим антителом к щелочной фосфатазе. Белок GALNS имеет очевидный молекулярный вес ~55-60 кДа на SDS-PAGE, что соответствует ожидаемому размеру секретируемой пред-процессированной формы (предшественника) фермента с отсутствием остатка 26 аминокислоты сигнального пептида, а также с отсутствием расщепления после положения 325.
[00299] Характеристика N-конца. N-конец очищенного белка GALNS был определен с помощью LC/MS. N-терминальная последовательность была установлена как APQPPN, что соответствует спрогнозированному N-концу секретированной формы GALNS с отсутствием 26 аминокислотного остатка сигнального пептида (в сравнении с полипептидными последовательностями GALNS человека, представленными на Фигуре 4 и Фигуре 5).
[00300] Второй процесс очистки. Второй процесс очистки включал этап ультрафильтрации/диафильтрации (УФ/ДФ) с последующим 3-колоночным процессом очистки.
[00301] 1. Ультрафильтрация (УФ/ДФ): материал из биореактора был сконцентрирован 20Х ультрафильтрацией/диафильтрацией через мембрану 30 кДа Sartocon при рН 5,5.
[00302] 2. Корректировка рН 4,5: концентрированный материал биореактора (УФ/ДФ (20Х)) был скорректирован до рН 4,5 буфером для корректировки рН (1,75 M NaOAc, pH 4,0) при комнатной температуре и подвергнут стерильной фильтрации перед загрузкой в колонку Fractogel EMD SE Hi-Cap.
[00303] 3. Колонка Fractogel EMD SE Hi-Cap: материал со скорректированным pH 4,5 и подвергнутый УФ/ДФ (20X), был загружен в колонку Fractogel EMD SE Hi-Cap, промыт последовательно 10 мМ ацетата/фосфата, 50 мМ NaCl, pH 4,5 и 10 мМ ацетата/фосфата, 50 мМ NaCl, pH 5,0, и белок GALNS был элюирован 10 мМ ацетата/фосфата, 140 мМ NaCl, pH 5,0.
[00304] 5. Zn-хелатная колонка с сефарозой FF: элюат из колонки Fractogel SE Hi-Cap был скорректирован до 500 мМ NaCl, pH 7,0 и загружен в Zn-хелатную колонку с сефарозой FF (Zn-IMAC), промыт 10 мМ ацетата/фосфата, 125 мМ NaCl, 10 мМ имидазола, pH 7,0, и белок GALNS был элюирован 10 мМ ацетата/фосфата, 125 мМ NaCl, 90 мМ имидазола, pH 7,0.
[00305] 6. Корректировка pH 3.5: элюат из Zn-хелатной колонки с сефарозой FF, содержащий белок GALNS, был скорректирован до pH 3,5 для вирусной инактивации при низком pH, и затем скорректирован до 10 мМ ацетата/фосфата, 2 M NaCl, pH 5,0.
[00306] 7. Колонка ToyoPearl Butyl 650M: элюат из Zn-хелатной колонки с сефарозой FF с низким рН был загружен в колонку ToyoPearl Butyl 650M, промыт 10 мМ ацетата/фосфата, 2 M NaCl, pH 5,0, и белок GALNS был элюирован 10 мМ ацетата/фосфата, 0,7 M NaCl, pH 5,0.
[00307] 8. Финальная УФ/ФС: элюат из колонки ToyoPearl Butyl 650M был подвергнут ультрафильтрации и диафильтрации в 20 мМ ацетата, 1 мМ фосфата, 150 мМ NaCl, pH 5,5.
[00308] Композиция. Очищенный белок GALNS был соединен с 10 мМ NaOAc/HOAc, 1 мМ NaH2PO4, 150 мМ NaCl, 0,01% Твин-20, pH 5,5.
[00309] Результаты второго процесса очистки. Таблица 4 отображает восстановление белка GALNS, полученного из клона С2 G71S в биореакторе с суспензионной культурой с использованием второго процесса очистки. Чистота фермента GALNS в композиции (т.е. формы предшественника и зрелой или подвергнутой обработке формы вместе) составила примерно 98%, как это определено С3 ОФ-ВЭЖХ. Процент формы предшественника фермента GALNS составил примерно 85%, как это определено SDS-капиллярным гель-электрофорезом.
[00310] Фигура 10 отображает SDS-PAGE фермента GALNS, разделенного ультрафильтрацией/диафильтрацией (УФ/ДФ), путем хроматографии Fractogel SE Hi-Cap, Zn-хелатной хроматографии с сефарозой FF и хроматографией ToyoPearl Butyl 650M. Гели были окрашены Кумасси синим (вверху слева), антителом к GALNS (вверху справа), антителом к катепсину L (внизу слева) и антителом к СНО (СНОР, внизу справа). Для проведения вестерн-блоттинга кроличье поликлональное антитело к GALNS было разведено в соотношении 1:5000, и вторичное антитело было представлено конъюгатом с кроличьим антителом AP; поликлональное антитело козы к катепсину L было разведено в соотношении 1:1000, и вторичное антитело было представлено конъюгатом антитела козы к HRP; и кроличье поликлональное антитело к CHOP было разведено в соотношении 1:1000, и вторичное антитело было представлено конъюгатом антитела к HRP кролика. Предшественник фермента GALNS имеет очевидный молекулярный вес ~55-60 кДа при SDS-PAGE, и зрелые или процессированные формы фермента GALNS имеют очевидный молекулярный вес ~39 кДа и ~19 кДа при SDS-PAGE.
[00311] Обзор первого процесса очистки. Фермент GALNS был очищен с использованием схемы очистки, которая была модифицирована в сравнении со стандартной схемой (см. Таблицу 5). Собранный из биореактора материал был подвергнут 0,2 мкм стерильной фильтрации и хранился при 4°C перед загрузкой в улавливающую колонку с голубой сефарозой. Профильтрованный материал из биореактора был загружен непосредственно или сконцентрирован до 15Х путем ультрафильтрации. Модификация схемы очистки была необходима, поскольку дальнейшие этапы очистки, хроматография с сефарозой SP с последующей хроматографией с фенил-сефарозой не позволяли получить по существу чистый GALNS. Использование хроматографии SE Hi-Cap в качестве замещения двух колонок для дальнейшей очистки привело к 2-колоночному процессу очистки, при этом чистота финального материала была существенно улучшена, и общее восстановление GALNS было существенно повышено от ~22% до ~80%. Чистота фермента GALNS (состоящего по существу из формы предшественника, см. Фигуру 9), как это определено хроматографией C4-ОФ, была приблизительно установлена как >95%, и очищенный фермент GALNS оставался стабильным в буфере композиции в течение более чем 79 дней при 4ºC и -70ºC.
[00312] Обзор второго процесса очистки. Фермент GALNS также был очищен с использованием второй схемы очистки (см. Таблицу 6). Общее восстановление GALNS составило примерно 70%, и чистота фермента GALNS (включая формы предшественника и зрелые или процессированные формы, см. Фигуру 10), как это определено C4-ОФ хроматографией, была приблизительно установлена как примерно 97%.
[00313] Данные анализы показывают, что описанные выше протоколы для получения рекомбинантных лизосомальных ферментов сульфатазы обеспечивают эффективный способ для получения больших количеств высокоочищенного фермента, в частности, секретированной пред-процессированной формы (предшественника) N-ацетилгалактозамин-6-сульфатазы (GALNS) человека.
ПРИМЕР VI
ОЧИСТКА N-АЦЕТИЛГАЛАКТОЗАМИН-6-СУЛЬФАТАЗЫ (GALNS) ЧЕЛОВЕКА С МИНИМАЛЬНЫМ УСЕЧЕНИЕМ
[00314] Контроль протеолитического расщепления рекомбинантных ферментов является проблемой в производстве и получении композиций основанных на белках лекарственных препаратов. Целью было получение большого количества рекомбинантной N-ацетилгалктозамин-6-сульфатазы (GALNS) человека в секретированной пред-процессированной форме (предшественника). Был разработан процесс производства, позволяющий проводить широкомасштабное производство GALNS человека с минимальным усечением протеазами, в частности, катепсином L.
[00315] В контексте данного изобретения термин «минимальное усечение» обозначает, что GALNS является по меньшей мере на 98%, по меньшей мере на 98,5%, по меньшей мере на 99% или по меньшей мере на 99,5% интактным в финальных очищенных композициях, как это определено при проведении SDS-PAGE при восстанавливающих условиях с последующим окрашиванием Кумасси синим или SDS-капиллярным гель-электрофорезом (SDS-CGE).
[00316] Во время разработки процесса производства для широкомасштабного производства GALNS было обнаружено, что ~55 кДа секретируемой формы предшественника фермента было восприимчиво к протеолитической деградации под действием протеаз, в частности, катепсина L, которые активны при кислых значениях рН. Деградация GALNS под действием протеаз приводит к образованию зрелой, усеченной формы GALNS, которая может быть определена как две полосы ~40 кДа и ~19 кДа при проведении SDS-PAGE в восстанавливающих условиях. Такое протеолитическое усечение было усилено при низком рН (т.е. 4,5-5,0), необходимом для этапа улавливания в катионообменной колонке. Данный диапазон рН обеспечивал условия, которые были благоприятны для активности кислых протеаз, таких как катепсины, присутствующих в клетке в собранной клеточной культуре.
[00317] Были внесены изменения в процесс восстановления и очистки GALNS для сведения к минимуму присутствия и/или активности протеаз, которые могут усекать GALNS, секретированный в питательную среду с клетками.
[00318] Диаграммы процесса, отображающие типичные процессы восстановления и очистки для широкомасштабного производства GALNS, представлены на Фигуре 11. Процесс с левой стороны отображает процесс восстановления и очистки, используемый в фазе I/II процесса, подобно схеме очистки, описанной выше в Примере V, что приводит к образованию различного количества усечения, варьирующего от ~6-30% пептидной цепи благодаря активации катепсина L, как это определено при проведении SDS-PAGE в восстанавливающих условиях с последующим окрашиванием Кумасси синим (см. Фигуру 12, полоса 3), или варьирующего от 65,3% до 93,7% интактной формы предшественника GALNS, как это определено при проведении SDS-CGE (см. Таблицу 8). Способ SDS-PAGE обеспечивает визуальную, но более качественную информацию о распаде белка, в то время как способ SDS-CGE предоставляет более количественную информацию относительно % интактного белка, присутствующего в финальных очищенных композициях.
[00319] Процесс с правой стороны на Фигуре 11 отображает процесс восстановления и очистки, используемый в ходе процесса фазы III, что приводит к минимальному усечению, варьирующему от 98% до 99,6% интактной формы предшественника GALNS, как это определено при проведении SDS-PAGE в восстанавливающих условиях с последующим окрашиванием Кумасси синим (см. Фигуру 12, полоса 5), или при проведении SDS-CGE (см. Таблицу 8).
[00320] Обзор внесенных в процесс изменений. Для снижения степени и вариабельности усечения GALNS, во внимание принимали два фактора: (i) протеазы значительно менее активны при нейтральном рН; и (ii) этапы катионообменной хроматографии и аффинной хроматографии с иммобилизированным металлом (IMAC) разделяют протеазы и GALNS. Процесс фазы III (см. Фигуру 11, справа) использует эти факторы и помогает снизить усечение GALNS во время процедуры очистки. Это было достигнуто путем переключения порядка первых двух этапов колонки, с захватом на колонке Zn-IMAC при pH 6,5-7,0. Такое переключение первых двух колонок также сделало более удобным сбор и хранение клеточной культуры при более высоком рН (т.е. рН 6,5) в сравнении с более кислым значением рН (т.е. рН 5,5), который использовался в процессе фазы I/II (см. Фигуру 11, слева). Хранение не содержащего клеток сбора при рН 6,5 снижает возможность активации протеаз, например, катепсинов, присутствующих в жидкости клеточной культуры, что предотвращает или снижает усечение GALNS.
[00321] Процесс III фазы. Каждый из этапов в типичном процессе фазы III восстановления и очистки GALNS обобщен ниже.
[00322] 1. Бесклеточный сбор (1Х). Стабильно трансфицированные клетки G71, со-экспрессирующие SUMF1 человека и GALNS человека, были выращены в условиях культуры биореактора, как это описано в Примере III. Материал биореактора (т.е. жидкость клеточной культуры), содержащий GALNS, был собран при pH 6,5 и профильтрован с использованием схемы титрации CUNO 30SP02A, с последующим использованием CUNO 90ZA08A и фильтра 0,2 мкм CUNO BioAssure.
[00323] 2. УФ/ДФ (20Х). Жидкость клеточной культуры была подвергнута ультрафильтрации/диафильтрации (УФ/ДФ) в 10 мМ фосфата/ацетата, 50 мМ NaCl, pH 6,5 при проводимости ≤7 мСм/см. Этап УФ/ДФ был проведен с использованием кассет Sartocon 30 кДа Hydrosart. Жидкость клеточной культуры была сконцентрирована до 20Х. Для сравнения, процесс УФ/ДФ фазы I/II проводился при рН 5,5. Более высокое значение рН в процессе фазы III снижает возможность усечения GALNS протеазами, присутствующими в бесклеточном сборе.
[00324] 3. Угольный фильтр. Материал после проведения УФ/ДФ (20Х) был профильтрован через активированный уголь Zeta Plus R55 (Z1274), а затем подвергнут стерильной фильтрации с использованием 0,2 мкм фильтра перед хранением при 2-8°C. Угольный фильтр существенно снизил давление при загрузке в дальнейшем колонки Zn-IMAC.
[00325] 4. Аффинная хроматография с иммобилизированным металлом (IMAC). Колонка для аффинной хроматографии с Zn-иммобилизированным металлом (Zn-IMAC) была уравновешена в 10 мМ фосфата/ацетата, 500 мМ NaCl, pH 7,0, и загружена при проводимости ~55±5 мСм/см прошедшим угольную фильтрацию УФ/ДФ (20X) материалом при pH 7,0±0,1 путем добавления 50 мМ фосфатного буфера, pH 9,2 содержащего 2,5 M NaCl. Загруженная колонка была промыта 10 мМ фосфата/ацетата, 500 мМ NaCl, pH 7,0, с последующим промыванием 10 мМ фосфата/ацетата,125 мМ NaCl, pH 7,0 (буфер A). GALNS был элюирован из колонки смесью 70% буфера А и 30% буфера В (10 мМ фосфата/ацетата, 125 мМ NaCl, 300 мМ имидазола, pH 7,0).
[00326] 5. Фильтр Mustang Q. Элюат из колонки Zn-IMAC был скорректирован до проводимости ~6,0±0,5 мСм/см при pH 7,0, и загружен на фильтр Mustang Q для удаления вирусов.
[00327] 6. Корректировка рН и фильтрация. Фильтрат из фильтра Mustang Q был скорректирован до pH 4,5±0,1, профильтрован с использованием фильтра CUNO 60ZA с последующей фильтрацией 0,2 мкм встроенным фильтром, и затем загружен в катионообменную колонку.
[00328] 7. Катионообменная хроматография. Катионообменная колонка Fractogel SE HiCap была уравновешена в 10 мМ фосфата/ацетата, 50 мМ NaCl, pH 4,5, и загружена профильтрованным через фильтр Mustang Q фильтратом, скорректированным до pH 4,5±0,1 при проводимости <7 мСм/см. Загруженная колонка была промыта 10 мМ фосфата/ацетата, 50 мМ NaCl, pH 4,5, затем смесью 80%:20% 10 мМ фосфата/ацетата, pH 5,0 (буфер A) и 10 мМ фосфата/ацетата, 250 мМ NaCl, pH 5,0 (буфер B). GALNS был элюирован из колонки с линейным градиентом от 20 до 75% буфера В в от 80% до 25% буфера A (т.е., от 50 до 190 мМ NaCl).
[00329] 8. Низкое значение рН поддерживалось для вирусной инактивации. Элюат из колонки Fractogel SE HiCap был подкислен до pH 3,5±0,1 для инактивации вирусов путем добавления 0,2 M цитратного буфера, pH 3,4, сохранялось низкое значение pH в течение ~1 часа, затем элюат был скорректирован до pH 5,0±0,1 добавлением 0,2 M цитратного буфера, pH 6,0, и затем загружен в полирующую хроматографическую колонку с гидрофобным взаимодействием (ХГВ).
[00330] 9. Хроматография с гидрофобным взаимодействием (ХГВ). Колонка ХГВ ToyoPearl Butyl 650M была уравновешена с использованием 10 мМ фосфата/ацетата, 2 M NaCl, pH 5,0, и загружена элюатом из колонки Fractogel SE HiCap с низким рН и прошедшим инактивацию вирусов, скорректированным до 2 M NaCl, pH 5,0. Загруженная колонка была промыта 10 мМ фосфата/ацетата, 2 M NaCl, pH 5,0 (буфер A). GALNS был элюирован из колонки смесью 35% буфера А и 65% буфера В (10 мМ фосфата/ацетата, pH 5,0).
[00331] 10. Буфер-обмен и корректировка рчGALNS до 3 мг/мл. Элюат из колонки ХГВ ToyoPearl Butyl 650M был подвергнут буфер-обмену с 20 мМ ацетата, 50 мМ фосфата, 30 мМ аргинина, 2% (о/о) сорбитола, pH 5,4, и затем скорректирован до финальной концентрации 3 мг/мл GALNS в этом же буфере.
[00332] 11. Удаление вирусов и ДНК путем фильтрации. Элюат из колонки ХГВ ToyoPearl Butyl 650M, подвергнутый буфер-обмену, был профильтрован для удаления каких-либо остаточных вирусов и ДНК с использованием вирусного фильтра (DV20) и фильтра ДНК (Mustang Q).
[00333] 12. Добавление ПС20 к 0,01%. Элюат из колонки ХГВ ToyoPearl Butyl 650M, подвергнутый буфер-обмену, фильтрованию на предмет вирусов и ДНК, был скорректирован до 0,01% (о/о) полисорбата 20 (ПС20 или Твин-20).
[00334] 13. Хранение НЛВ при 2-8°C или в замороженном виде. Финальная композиция очищенного GALNS, т.е. нерасфасованное лекарственное вещество (НЛВ), хранилась при 2-8°C или в замороженном виде.
[00335] Результаты. Как это видно из результатов SDS-PAGE (см. Фигуру 12, полоса 5), очевидная молекулярная масса основной полосы составляет ~55 кДа, что соответствует ожидаемому значению для мономера GALNS. Полосы мигрируют в очевидных молекулярных массах ~40 кДа и ~19 кДа в партии № AP400802, которая была получена с использованием процесса фазы I/II (полоса 3), и являются продуктами распада GALNS, полученными в результате протеолитического расщепления между Q348 и G349. Такое усечение по существу снижено в партии № BMN110-0110-001, которая была получена с использованием процесса фазы III (полоса 5). Существует небольшая полоса в обеих композициях, которые мигрируют незначительно медленнее, чем продукт расщепления ~40 кДа.
[00336] Обзор дополнительных внесенных в процесс изменений. Модифицированный процесс фазы III был разработан для решения определенных проблем: (i) образование осадка в концентрированном сборе; (ii) потеря GALNS на этапе улавливания в Zn-IMAC; (iii) потеря GALNS во фракции промывания на этапе колонки ToyoPearl Butyl; и (iv) присутствие высоких уровней примесей CHOP в элюате из этапа ToyoPearl Butyl.
[00337] Модифицированный процесс III фазы. Каждый из этапов в типичном процессе фазы III восстановления и очистки GALNS обобщен ниже.
[00338] 1. Бесклеточный сбор (1Х). Стабильно трансфицированные клетки G71, со-экспрессирующие SUMF1 человека и GALNS человека, были выращены в условиях культуры биореактора, как это описано в Примере III. Материал биореактора (т.е. жидкость клеточной культуры), содержащий GALNS, был собран при pH 6,5 и профильтрован с использованием схемы титрации Millipore DOHC, с последующим использованием Millipore XOHC и фильтра 0,2 мкм Millipore SHC.
[00339] 2. УФ/ДФ (20Х). Жидкость клеточной культуры была подвергнута ультрафильтрации/диафильтрации (УФ/ДФ) в 10 мМ фосфата/ацетата, 50 мМ NaCl, pH 6,5 при проводимости ≤7 мСм/см. Этап УФ/ДФ был проведен с использованием кассет Sartocon 30 кДа Hydrosart. Жидкость клеточной культуры была сконцентрирована 20Х.
[00340] 3. Угольный фильтр. Материал после проведения УФ/ДФ (20Х) был профильтрован через активированный уголь Zeta Plus R55 (Z1274), а затем подвергнут стерильной фильтрации с использованием 0,2 мкм фильтра перед хранением при 2-8°C.
[00341] 4. Аффинная хроматография с иммобилизированным металлом (IMAC). Колонка для аффинной хроматографии с иммобилизированным цинком Zn (Zn-IMAC) была промыта 50 мМ ацетатным буфером, pH 5,0, заполнена 50 мМ ZnSO4, промыта 50 мМ ацетатным буфером, pH 5,0, и затем уравновешена в 10 мМ фосфата/ацетата, 500 мМ NaCl, pH 7,0, содержащим 5 мМ имидазола. Уравновешенная колонка Zn-IMAC была загружена при проводимости ~50±5 мСм/см прошедшим угольную фильтрацию, УФ/ДФ (20X) материалом при pH 7,0±0,1 при добавлении в процессе 50 мМ фосфатного буфера, pH 9,2±0,1, содержащего 2,5 M NaCl в соотношении 75:25 (о/о) во время загрузки колонки Zn-IMAC. Загруженная колонка была промыта 10 мМ фосфата/ацетата, 500 мМ NaCl, pH 7,0, с последующим промыванием 10 мМ фосфата/ацетата,125 мМ NaCl, pH 7,0 (буфер A). GALNS был элюирован из колонки смесью 70% буфера А и 30% буфера В (10 мМ фосфата/ацетата, 125 мМ NaCl, 300 мМ имидазола, pH 7,0).
[00342] 5. Корректировка рН и фильтрация. Элюат из колонки Zn-IMAC был скорректирован до pH 4,5±0,1 с помощью 1,75 M ацетата, pH 4,0, и затем профильтрован с использованием фильтра Millipore COHC. Профильтрованный материал был смешан в процессе с 10 мМ фосфата/ацетата, рН 4,5 в соотношении 30:70 (о/о) во время загрузки катионообменной колонки.
[00343] 6. Катионообменная хроматография. Катионообменная колонка Fractogel SE HiCap была уравновешена в 10 мМ фосфата/ацетата, 50 мМ NaCl, pH 4,5, и загружена профильтрованным и скорректированным до pH 4,5 элюатом из колонки Zn-IMAC при проводимости <7 мСм/см. Загруженная колонка была промыта 10 мМ фосфата/ацетата, 50 мМ NaCl, pH 4,5, затем смесью 80%:20% 10 мМ фосфата/ацетата, pH 5,0 (буфер A) и 10 мМ фосфата/ацетата, 250 мМ NaCl, pH 5,0 (буфер B). GALNS был элюирован из колонки с линейным градиентом от 20% до 75% буфера В в от 80% до 25% буфера A (т.е., от 50 до 190 мМ NaCl).
[00344] 7. Низкое значение рН поддерживалось для вирусной инактивации. Элюат из колонки Fractogel SE HiCap был подкислен до pH 3,5±0,1 для инактивации вирусов путем добавления 0,4 M цитратного буфера, pH 3,4, содержался при низком pH в течение ~1 часа (при температуре 12-23°C), был скорректирован до pH 5,0±0,1 добавлением 0,4 M цитратного буфера, pH 6,0, смешан с 10 мМ фосфатного/ацетатного буфера, pH 5, содержащего 5 M NaCl, для достижения финальной концентрации 2 M NaCl, и затем профильтрован через фильтр 0,2 мкм перед загрузкой в полирующую колонку для хроматографии с гидрофобным взаимодействием (ХГВ).
[00345] 8. Хроматография с гидрофобным взаимодействием (ХГВ). Колонка ХГВ ToyoPearl Butyl 650M была уравновешена в 10 мМ фосфата/ацетата, 2 M NaCl, pH 4,4, и загружена профильтрованным элюатом из колонки Fractogel SE HiCap с низким рН и прошедшем инактивацию вирусов, скорректированным до 2 M NaCl, pH 4,3-4,4. Загруженная колонка была промыта 10 мМ фосфата/ацетата, 2 М NaCl, pH 4,4, с последующим промыванием 10 мМ фосфата/ацетата, 2,5 М NaCl, pH 5,0 (буфер A). GALNS был элюирован из колонки с линейным градиентом от 100% до 32% буфера A в от 0 до 68% буфера B (10 мМ фосфата/ацетата, pH 5,0) (т.е. от 2,5 до 0,8 M NaCl) с последующим промыванием смесью 32% буфера A и 68% буфера B (т.е. 0,8 M NaCl).
[00346] 9. Буфер-обмен, удаление ДНК и вирусов путем фильтрации, и корректировка рчGALNS до 3 мг/мл. Элюат из колонки ХГВ ToyoPearl Butyl 650M был подвергнут буфер-обмену в 20 мМ натрия ацетата, 50 мМ натрия фосфата, 30 мМ аргинина-HCl, 2% (в/о) сорбитола, pH 5,4. Элюат из колонки ХГВ ToyoPearl Butyl 650M, подвергнутый буфер-обмену, был профильтрован для удаления любых остаточных вирусов и ДНК с использованием вирусного фильтра (DV20) и фильтра ДНК (Mustang Q). Профильтрованный и подвергнутый буфер-обмену элюат из колонки ХГВ ToyoPearl Butyl 650M затем был скорректирован до финальной концентрации GALNS 3 мг/мл в том же буфере, что указан выше.
[00347] 10. Добавление ПС20 к 0,01%. Элюат из колонки ХГВ ToyoPearl Butyl 650M, подвергнутый буфер-обмену, фильтрованию на предмет вирусов и ДНК, был скорректирован до 0,01% (о/о) полисорбата 20 (ПС20 или Твин-20).
[00348] 11. Хранение НЛВ при 2-8°C или в замороженном виде. Финальная композиция очищенного GALNS, т.е. нерасфасованное лекарственное вещество (НЛВ), была пропущена через 0,2 мкм Millipak 200 фильтр в контейнер для финального хранения, и хранилась в пакетах при температуре 2-8°C или в замороженном виде.
[00349] Результаты. При соблюдении данного модифицированного процесса III фазы, связывание GALNS в колонках Zn-IMAC и ToyoPearl Butyl улучшено, и примеси СНОР в элюате из ToyoPearl Butyl снижены. Очищенный в ходе данного процесса III фазы GALNS сопоставим по всем исследуемым свойствам (например, представленным в Таблице 7 ниже) с ферментом, очищенным в ходе процесса III фазы, описанного выше.
[00350] Характеристика рчGALNS, полученного в ходе процесса восстановления и очистки III фазы. GALNS, очищенный с использованием процесса фазы III, был сопоставлен с ферментом, очищенным в ходе процесса фазы I/II. Результаты характеристик приведены в таблице (Таблица 7). Несмотря на то, что обе композиции GALNS кажутся сопоставимыми по всем исследуемым свойствам, фермент, очищенный в ходе процесса фазы III, имел существенно меньшее усечение в сравнении с ферментом, очищенным в ходе процесса фазы I/II.
[00351] Таблица 8 сравнивает процент интактного GALNS с использованием способа SDS-CGE в финальной очищенной композиции в партиях, которые были получены с использованием процесса фазы I/II (65,3-93,7%) или процесса фазы III (98-99,6%). Полученные здесь значения выступают в поддержку результатов, полученных способом SDS-PAGE, и указывают, что степень усечения существенно снижена в результате модификаций, внесенных в процесс очистки.
[00352] Данные анализы показывают, что описанные выше протоколы для получения рекомбинантных лизосомальных ферментов сульфатазы с минимальным усечением обеспечивают эффективный способ для получения больших количеств высокоочищенного фермента, в частности, секретированной пред-процессированной формы (предшественника) N-ацетилгалактозамин-6-сульфатазы (GALNS) человека.
ПРИМЕР VII
ХАРАКТЕРИСТИКА ОЧИЩЕННОЙ N-АЦЕТИЛГАЛАКТОЗАМИН-6-СУЛЬФАТАЗЫ (GALNS) ЧЕЛОВЕКА
[00353] Линии клеток G71 вырабатывают белки (например, лизосомальные ферменты) с повышенными уровнями высокоманнозного фосфорилирования, по сравнению с тем, что отмечено в средней линии клеток млекопитающих, и, соответственно, пониженный уровень нефосфорилированных высших маннозных олигосахаридов. Лизосомальный фермент сульфатазы (например, рекомбинантной N-ацетилгалактозамин-6-сульфатазы человека (GALNS)), включающий высокий уровень бис-фосфорилированных высокоманнозных олигосахаридов, как это указано в тексте данной заявки, сопоставим с молекулами, полученными в Canfield et al., патент США № 6537785, которые не включают комплекс олигосахаридов, и включают только высокоманнозные олигосахариды.
[00354] Для определения уровней нефосфорилированной высшей маннозы в лизосомальном ферменте сульфатазы специалист в данной области может использовать экзогликозидазное секвенирование высвобожденных олигосахаридов («секвенирование FACE») для точного определения процента нефосфорилированных высших маннозных цепей олигосахаридов. На нормальном профилирующем геле FACE с уменьшением объемов партии нефосфорилированная высшая манноза со-мигрирует с отдельным комплексом олигосахаридов (например, олигоманнозой 6 и полностью сиалированным биантеннарным комплексом). Нефосфорилированная высшая манноза затем дифференцирует от других олигосахаридов по ферментативному секвенированию.
[00355] Для определения повышенного фосфорилирования очищенного лизосомального фермента сульфатазы (например, рекомбинантной N-ацетилгалактозамин-6-сульфатазы человека (GALNS)), экспрессируемого в клетках G71S, был определен уровень маннозо-6-фосфата (М6Ф) на лизосомальном ферменте сульфатазы, а также способность фермента связываться с рецептором М6Ф (MPR).
[00356] Рекомбинантный фермент GALNS человека, экспрессированный в клетках G71S и очищенный, был проанализирован способом флуоресцентного углеводного электрофореза (FACE) и хроматографии на смоле MPR-сефароза. Система FACE использует электрофорез в полиакриламидном геле для разделения, количественной оценки и определения последовательности олигосахаридов, высвобожденных из гликопротеинов. Относительная интенсивность полосы олигоманнозы 7 бис-фосфата (О7Ф) на FACE (Hague et al., Electrophoresis 19(15): 2612-20, 1998) и процентный показатель активности, сохраненной на колонке MPR (Cacia et al., Biochemistry 37(43): 15154-61, 1998), предоставили надежные показания уровня фосфорилирования на моль белка.
[00357] Специфическая активность. Специфическая активность рекомбинантной N-ацетилгалактозамин-6-сульфатазы (GALNS) человека была определена с использованием небольшого флуоресцирующего субстрата 4-метилумбеллиферил-6-S-GAL (4MU-Gal-6S) при 37°C. С использованием этого анализа специфическая активность очищенного GALNS составила 165 мкмоль/мин/мг (0,165 Ед/мг).
[00358] Стабильность в сыворотке человека. Была определена стабильность GALNS в сыворотке ex vivo. Сыворотка человека (Sigma H-4522) была подвергнута стерилизационной фильтрации через 0,2 мкм PES фильтр, и 4 мл подвергнутой стерилизационной фильтрации сыворотки человека было предварительно инкубировано в колбе T-25 с клеточной культурой в течение 1 часа при 37°C в атмосфере 10% CO2 (pH в данной точке было 7,4±0,1). 0,4 мл обессоленного и очищенного GALNS (2 мг/мл очищенного GALNS было обессолено в ФСБ с использованием колонок Bio-RAD 10DG) было добавлено в предварительно инкубированную сыворотку человека, или контроль ФСБ, содержащий 0,5 мг/л БСА. 100 мкл образцы были отобраны в установленных временных точках (например, 0; 1; 3,5; 7,5 и 26 часов) и добавлены к 900 мл буфера для тушения (QB, 50 мМ NaOAc, pH 5,6+150 мМ NaCl+0,5 мг/мл БСА+0,001% Твина-80). Образцы хранили при 4°C до готовности для измерения активности фермента GALNS.
[00359] Активность фермента GALNS была измерена с использованием ИФА с захватом активного фермента. При экстраполяции на экспоненциальной кривой спада % активности остатка фермента GALNS, было оценено, что период полужизни очищенного GALNS ex vivo в сыворотку составил 217 часов.
[00360] Захват синовиоцитами (хондроцитами). Была определена способность GALNS быть захваченным синовиоцитами (хондроцитами).
[00361] Хондроциты (номер ATCC CRL-1832) культивируют в питательной среде (Ham’s F12+10% ФБС) при 37°C в 5% CO2 в 12-луночных чашках. Анализ захвата трех образцов требует использования 4×12 луночных чашек. Очищенные образцы GALNS и эталонный образец GALNS были разведены до 1 мкМ в подкФСБ/БСА (кислый ФСБ+200 мкг/мл БСА). Из маточных растворов 1 мкМ были получены кривые захвата разведения для образцов GALNS и эталонного образца: 50,5 мкл (1 мкМ рчASB) в 5 мл разбавителе для анализа захвата (UAD, DMEM+2 мМ L-глутамин +0,5 мг/мл БСА), что привело к получению 10 нМ образцов GALNS и эталонного образца, которые были далее серийно разведены до 5; 2,5; 1,25; 0,62,; 0,31 и 0,16 нМ путем серийных двукратных разведений в UAD. Питательная среда из 12-луночных чашек конфлюэнтных хондроцитов была аспирирована, 1 мл UAD (холостой раствор) или серийных разведений образцов GALNS или эталонных образцов было добавлено в лунки и инкубировано в течение 4 часов при 37°C в инкубаторе с 10% CO2. Среда захвата была аспирирована, каждая чашка была перевернута для полного опорожнения, и каждая лунка была промыта один раз 1 мл ФСБ. ФСБ был аспирирован, и хондроциты были рассоединены путем добавления 0,5 мл трипсина/ЭДТА (0,25% трипсина/0,1% ЭДТА (Mediatech 25-053-CI, партия 25053025)) на лунку. После отсоединения от чашки, были отобраны аликвоты хондроцитов в предварительно охлажденные на льду пробирки Эппендорфа (в целом 30 пробирок). Трипсинизированные хондроциты были охлаждены и затем пеллетированы при низкой скорости в микроцентрифуге (4000 об/мин в течение 3 минут). Трипсин был полностью аспирирован, пеллет клеток был промыт 1 мл ФСБ, затем единожды было повторено микроцентрифугирование и этап аспирации. 200 мкл буфера для лизиса клеток (CLB, 50 мМ натрия ацетат, pH 5,6+0,1% Тритон X-100) было добавлено в каждую пробирку. Пеллеты клеток были ресуспендированы в ходе пульсирующего встряхивания трижды. После ресуспендирования смеси лизированных клеток хранили в течение ночи при -80°C или они были сразу же проанализированы.
[00362] Лизаты клеток были оттаяны при комнатной температуре и перенесены на лед, когда оттаяли. Лизаты клеток были перемешаны для ресуспендирования любого видимого твердого материала, и затем подвергнуты микроцентрифугированию при 14 Коб/мин в течение 10 минут при 4°C для пеллетирования нерастворимого материала. Супернатанты были перенесены в новый набор пробирок, и пеллет был слит. Затем был проведен анализ активности GALNS на супернатантах. Обычно строят семиточечную кривую разведения (серийные двукратные разведения, начиная от 10 нМ и заканчивая 0,16 нМ), которая заключает в скобки ожидаемое значение Кзахвата довольно равномерно с обеих сторон. Молярность исходных образцов рассчитывается с использованием молекулярного веса только белка.
[00363] Очищенный GALNS имеет значение Kd для захвата синовиоцитами, на основе связывания лиганда с одной стороны, равное 4,9 нМ.
[00364] Анализ связывания рецептором маннозо-6-фосфата (М6Ф) на планшете. Способность GALNS связываться с рецептором маннозо-6-фосфата (М6Ф) была определена в ходе планшет-связуюшего анализа. Планшеты FluoroNunc с активным связыванием были покрыты 4 мкг/мл рецептора М6Ф. Покрытые планшеты были дважды промыты 250 мкл/лунка буфером для промывания (WB, TBS+0,05% Твин 20), и неспецифическое связывание было блокировано 200 мкл/лунка буфером для блокирования и разведения (BDB, буфер Pierce SuperBlock, партия №CA46485). Планшеты были инкубированы в течение 1 часа при комнатной температуре (КТ). В течение этого этапа блокирования очищенные образцы GALNS (0,5-2 мг/мл, которые хранили при 4°C в течение 2 недель) были разведены до 10 нМ в BDB, и затем серийно разведены в буфере для разведения (DB, 50 мМ NaOAc, 1 мМ NaCl, pH 4,0+0,5 мг/мл БСА) (250 мкл +250 мкл) до 5; 2,5; 1,25; 0,62; 0,31 и 0.16 нМ. Блокированные планшеты были промыты WB, как указано выше, и разведенные образцы GALNS были распределены по лункам в двух повторностях при 100 мкл/лунка и инкубированы в течение 1 часа при КТ. В течение данного этапа инкубации было получено 2 мМ активного субстрата путем разведения 0,1 мл 100 мМ маточного раствора 6S-галактоза-4MU (хранившегося в H2O, -20°C) в 5 мл DB, и предварительно нагрето на водяной бане при 37°C. После инкубации планшеты были дважды промыты WB, как это описано выше, было добавлено 100 мкл разбавленного субстрата и определена специфическая активность GALNS.
[00365] С использованием данного анализа было установлено, что очищенный GALNS имеет значение Kd для связывания с рецептором М6Ф на основе связывания одним сайтом, равное 2,4 нМ.
[00366] Связывание рецептора маннозо-6-фосфата (М6Ф) в колонке. Способность GALNS связываться с рецептором маннозо-6-фосфата (М6Ф) была определена в ходе анализа связывания в колонке. Колонка с рецептором М6Ф была подготовлена в соответствии с инструкциями производителя. Рецептор М6Ф был получен из лаборатории Peter Lobel, смола для колонки была представлена активированной смолой NHS (Bio-RAD Affi-Gel 15), и размер колонки составил 0,7 мл. Колонка с рецептором М6Ф была уравновешена 10 колоночными объемами (ОК) равновесного буфера (EQ, подкисленный ФСБ, pH 6,0, содержащий 5 мМ β-глицерофосфата, 0,05% Твина 20, 5 мМ глюкозо-1-фосфата и 0,02% NaN3) при скорости потока 0,25 мл/мин. 6 мкг очищенного GALNS (на 200 мкл) было загружено в колонку с рецептором М6Ф при скорости потока 0,1 мл/мин. Несвязанный GALNS был вымыт из колонки 10 ОК EQ при скорости потока 0,25 мл/мин. Связанный GALNS был элюирован из колонки с использованием 0-100% буфера элюирования (EL, подкисленный ФСБ, pH 6,0, содержащий 5 мМ β-глицерофосфата, 0,05% Твина 20, 5 мМ маннозо-6-фосфата и 0,02% NaN3) с градиентом (10 ОК), с последующим промыванием 2 ОК 100% EL. Колонка была уравновешена повторно с использованием 3 ОК EQ.
[00367] С использованием ИФА GALNS было определено, что процент очищенного GALNS, связывающегося с рецептором М6Ф, составляет 56%.
[00368] Анализ общего содержания олигосахаридов капиллярным электрофорезом (КЭ). Для определения уровня маннозо-6-фосфорилирования GALNS, был определен профиль N-присоединенных углеводов по общему содержанию олигосахаридов в GALNS капиллярным электрофорезом (КЭ), как это описано в Ma et al., Anal. Chem. 71(22):5185-5192, 1999. Способ использует ПНГазу F для расщепления олигосахаридов, N-присоединенных к аспарагину. Расщепленные олигосахариды были изолированы и дериватизированы флуоресцентным красителем, и помещены в центрифужную колонку G10 для удаления избыточного красителя. Очищенные и помеченные флуоресцентно олигосахариды были разделены электрофорезом, и пики были затем подвергнуты количественному анализу с использованием программного обеспечения MDQ-CE (32 Karat версия 7.0).
[00369] С использованием этого анализа было определено, что количества бис-фосфорилированной маннозы 7 (БФМ7), моно-фосфорилированной маннозы 6 (МФМ6) и олигосахаридов, содержащих сиалиновую кислоту, в очищенном GALNS составили 0,58 моль/моль фермента, 0,08 моль/моль фермента, и неопределяемое, соответственно. Процент белков GALNS, содержащих ВФМ7, был оценен как 29%.
[00370] Характеристика бис7 олигосахарида. Было определено расположение олигосахаридов бис-фосфорилированной маннозы 7 (БФМ7) в GALNS. Остаток аспарагина (Асн) в положении 178 был гликозилирован в N-положении к БФМ7. Остаток Асн в положении 397 не был гликозилирован в N-положении с БФМ7, но было выявлено его доминирующее присутствие в виде сахаров олигоманнозного типа.
[00371] Гидроксиаппатитовая аффинность. Была разработана костная модель in vitro для определения способности GALNS связываться с костью. Суспензия гидроксиаппатита 4 мг/мл степени HTP-DNA (Bio-RAD) была приготовлена и уравновешена в DBS+50 мкг/мл БСА, pH 7,4. Очищенный GALNS, после добавления 50 мкг/мл БСА, был обессолен в DBS, pH 7,4. Обессоленный GALNS в финальной концентрации приблизительно 2 мг/мл был серийно разведен в DBS+50 мкг/мл БСА, pH 7,4 на 96-луночном планшете. 50 мкл серийно разведенного GALNS было перенесено на 96-луночный планшет для фильтрации (Millipore #MSGVN2210, гидрофильный ПВДФ, низкое связывание белка, размер пор 22 мкм). 50 мкл суспензии гидроксиаппатита было добавлено в лунки планшета для фильтрации, содержащего серийно разведенный GALNS, и инкубировано в течение 1 часа при 37°C при незначительном встряхивании. Планшет был подвергнут вакуумной фильтрации.
[00372] Супернатанты вакуумного фильтра были проанализированы ВЭЖХ или на предмет активности фермента GALNS, как это описано выше. Очищенный GALNS имел значение Kd для гидроксиаппатита 3-4,0 мкМ.
[00373] Линия клеток G71S, экспрессирующих фактор модификации сульфатазы человека 1 (SUMF1), вырабатывает лизосомальные ферменты сульфатазы с повышенными показателями активации (т.е. конверсией остатка цистеина активного сайта в Cα-формилглицин (FGly)).
[00374] Для определения повышенной активации очищенного рекомбинантного лизосомального фермента сульфатазы (например, N-ацетилгалактозамин-6-сульфатазы (GALNS) человека), со-экспрессированного с SUMF1 в клетках G71S, был определен показатель конверсии остатка цистеина активного сайта в FGly на очищенном лизосомальном ферменте сульфатазы.
[00375] Активация GALNS. Процент активации, т.е. процент конверсии остатка цистеина активного сайта цистеина (Cys) в Cα-формилглицин (FGly) GALNS был определен с помощью LC/MS (TFA). Показатель TIC/1000 для Cys, FGly и Gly составил 39, 1840 и 183, соответственно, указывая на то, что примерно 90% очищенного GALNS находится в активной (т.е. FGly) форме.
[00376] Обобщение. Таблица 9 обобщает характеристики рекомбинантного GALNS, экспрессированного в клетках клона 4G71S. Таблица 10 обобщает характеристики рекомбинантного GALNS, экспрессированного в клетках клона С2 G71S.
[00377] Данные результаты показывают, что очищенный рекомбинантный GALNS человека имеет высокий уровень активации и высокие уровни фосфорилирования маннозо-6-фосфата. Таким образом, клетки G71S, со-экспрессирующие SUMF1 и лизосомальный фермент сульфатазы (т.е. GALNS), эффективно вырабатывают активный высокофосфорилированный лизосомальный фермент сульфатазы. Повышенный уровень высших маннозных остатков на таких лизосомальных ферментах сульфатазы ведет к повышенному захвату MPR на клетках.
ПРИМЕР VIII
ЗАХВАТ И АКТИВНОСТЬ РЕКОМБИНАНТНОЙ N-АЦЕТИЛГАЛАКТОЗАМИН-6-СУЛЬФАТАЗЫ (GALNS) ЧЕЛОВЕКА В ХОНДРОЦИТАХ IN VITRO ПРИ СИНДРОМЕ МОРКИО
[00378] Были оценены захват рекомбинантной N-ацетилгалактозамин-6-сульфатазы (GALNS) человека лизосомами из хондроцитов при синдроме Моркио и способность GALNS разрушать кератансульфат (КС) in vitro.
[00379] Хондроциты пациентов с мукополисахаридозом IVa типа (МПС IVa типа, синдром Моркио) имеют пониженную активность GALNS и характеризуются накоплением в лизосомах КС. Модель МПС IVa типа in vitro была установлена с использованием хондроцитов, выделенных из образцов биопсии гребня подвздошной кости у пациента с МПС IVa типа. Однако первичные хондроциты де-дифференцируют и теряют свои свойства хондроцитов в культуре. Таким образом, в культуре были установлены условия для индуцирования дифференциации хондроцитов in vitro.
[00380] Хондроциты, выделенные у пациента с МПС IVa типа, обозначенные MQCH, были культивированы в альгинатных гранулах в присутствии ИФР-1, ТФР-β, трансферрина, инсулина и аскорбиновой кислоты (среда роста для хондроцитов, Lonza #CC-3225). Питательную среду заменяли два раза в неделю на протяжении экспериментов, от 6 до 15 недель. Такие условия культуры индуцировали экспрессию фенотипа хондроцитов и их дифференциацию. Эти клетки MQCH экспрессировали маркеры хондроцитов, включая определяющий пол участок Y-box 9 (Sox 9), коллаген II, коллаген X, олигомерный матриксный белок хряща и агрегант мРНК, как это измерено количественным анализом ОТ-ПЦР с использованием РНК, выделенной из культур клеток MQCH. Такие культивированные клетки MQCH также вырабатывают внеклеточный матрикс.
[00381] Была проведена конфокальная микроскопия для подтверждения того, что клетки MQCH накапливают КС. Клетки MQCH в 8-недельной культуре были трипсинизированы, перенесены на предметные стекла цитоспиновым способом, зафиксированы в ацетоне и заморожены до момента использования. После оттаивания клетки были регидратированы и окрашены с использованием, в качестве первичных и вторичных антител, моноклональным антителом к КС (Chemicon) и конъюгированным антителом козы к кроличьему антителу Alexa-488 (зеленый), соответственно. Клетки MQ-CH характеризовались пятнистым внутриклеточным окрашиванием, что соответствовало накоплению КС в лизосомах.
[00382] Для определения возможности захвата очищенного рекомбинантного GALNS человека клетками MQCH в лизосомах и разрушения КС, 6-недельная клеточная культура MQCH была инкубирована с 10 нМ рекомбинантного GALNS человека дважды в неделю в течение 9 недель. Захват GALNS и клиренс КС были измерены конфокальной микроскопией. Используемые первичные антитела были следующими: (a) кроличье поликлональное антитело к GALNS и моноклональное антитело к лизосомальному ассоциированному с мембраной белку 1 (LAMP-1), или (б) моноклональное антитело к КС и поликлональное антитело к LAMP-1. Используемые вторичные антитела были следующими: конъюгированные антитела Alexa-488 (зеленые) для определения антител к GALNS или антител к КС, или конъюгированные антитела Alexa-555 или -594 (красные) для определения антител к LAMP-1. Препараты клеток MQCH были помещены в гистологическую среду, содержащую DAPI, который окрашивает ядра.
[00383] В клетках MQCH, обработанных GALNS, отмечалась значительная со-локализация фермента GALNS и КС с лизосомальным маркером LAMP-1. При воздействии на MQCH рекомбинантным GALNS человека количество внутриклеточного КС было снижено.
[00384] Захват GALNS также был измерен с использованием ИФА с захватом фермента GALNS и ИФА, определяющим специфическую активность GALNS, как это описано в Примере IV выше. Здоровые хондроциты человека (NHKC), экспрессирующие GALNS, использовали в качестве положительного контроля. Как это показано в Таблицах 11 и 12, не подвергнутые обработке клетки MQCH не имеют определяемого фермента или активности GALNS, а клетки MCQH, обработанные в течение 9 недель 10 нМ GALNS, обладают существенной активностью и ферментом GALNS.
[00385] Эти результаты показывают, что очищенный рекомбинантный GALNS человека захватывается хондроцитами при синдроме Моркио в лизосомы и может разрушать лизосомальный КС in vitro. Такие хондроциты при синдроме Моркио могут использоваться в модели эффективности in vitro для исследования лизосомальных ферментов сульфатазы, таких как GALNS, разрушающих КС.
ПРИМЕР IX
АКТИВНОСТЬ РЕКОМБИНАНТНЫХ ЛИЗОСОМАЛЬНЫХ ФЕРМЕНТОВ ЧЕЛОВЕКА В РАЗУРШЕНИИ ЕСТЕСТВЕННЫХ СУБСТРАТОВ В КЛЕТОЧНОМ АНАЛИЗЕ IN VITRO
[00386] Клеточные анализы in vitro были разработаны для измерения активности рекомбинантных лизосомальных ферментов человека, например лизосомальных ферментов сульфатазы, в разрушении естественных субстратов.
[00387] Ферментативную активность рекомбинантных лизосомальных ферментов человека, например лизосомальных ферментов сульфатазы, обычно измеряют в ходе бесклеточного анализа in vitro с использованием искусственного флуорогенного субстрата (см. Пример 4, описывающий GALNS). Однако измеренная активность фермента зависит от размера искусственного субстрата, т.е. количества единиц моносахаридов. Кроме того, активность фермента измеряют в среде, не отражающей ситуацию in vivo. Таким образом, бесклеточный анализ in vitro не принимает во внимание ни способность лизосомального фермента расщеплять естественные субстраты, ни его способность захватываться клетками-мишенями и локализироваться в лизосомах.
[00388] Клеточный in vitro анализ был разработан для измерения активности двух рекомбинантных лизосомальных ферментов человека, альфа-L-идуронидазы (IDU) и арилсульфатазы B (ARSB), в разрушении их естественных субстратов, т.е. внутриклеточных субстратов, содержащих дерматансульфат (ДС). ДС содержит различные сульфатированные дисахаридные единицы идуроновой кислоты β (1-3)-N-ацетилгалактозамина β (1-4).
[00389] Фибробластные клетки человека GM00519 с дефицитом ARSB или фибробластные клетки человека GM01391 с дефицитом IDU были культивированы до состояния конфлюэнтности в 12-луночных планшетах, и культуры содержали после достижения конфлюэнтности в течение 3-6 недель для накопления внутриклеточного ДС.
[00390] Затем пост-конфлюэнтные клетки GM00519 или GM01391 были подвергнуты воздействию насыщающих доз рекомбинантного ARSB человека (10 нМ) или рекомбинантного IDU человека (25 нМ), соответственно, в течение 4-5 дней. Неподвергнутые воздействию клетки и клетки, подвергнутые воздействию лизосомального фермента сульфатазы, были собраны, лизированы и центрифугированы.
[00391] Активность лизосомального фермента в лизатах клеток была измерена путем определения остаточного содержания ДС в клетках следующими способами: (1) лизис клеток; (2) специфическое расщепление субстратов, содержащих ДС, на дисахариды с использованием хондроитин ABC-лиазы (EC 4.2.2.4) в лизате клеток; (3) мечение дисахаридов ДС флуоресцентным красителем (например, 2-аминоакридоном, AMAC); (4) разделение дисахаридов ДС (например, капиллярно-зональным электрофорезом, КЗЭ); и (5) определение меченых дисахаридов ДС (например, лазер-индуцированной флуоресценцией, ЛИФ). Такие способы описаны, например, в Zinellu et al., Electrophoresis 2:2439-2447, 2007, and Lamari et al., J. Chromatogr. B 730:129-133, 1999 (обзор сделан в Volpi et al., Electrophoresis 29:3095-3106, 2008).
[00392] Таблица 13 отображает процент разрушения ДС с использованием клеток GM00519, обработанных ARSB, как это определено путем измерения количества содержащего дисахарид N-ацетилгалактозамин-4-сульфата (4S дисахарида), являющегося доминирующим дисахаридом ДС. Подобные результаты были получены с использованием клеток GM01391, обработанных IDU.
[00393] Представленный выше анализ указывает, что клетки-мишени захватывают рекомбинантный ARSB и IDU человека, которые затем локализируются в лизосомах, где они разрушают свой естественный субстрат, внутриклеточный ДС.
[00394] Был проведен эксперимент поиска дозы для определения концентрации, при которой ограничивается скорость IDU в ходе такого клеточного анализа. Клетки GM01391 были культивированы в 12-луночных планшетах. Спустя 4 недели после конфлюэнтности клетки были подвергнуты воздействию различных концентраций IDU, варьирующих от 0,8 нМ до 25 нМ, в течение 6 или 26 часов. Лизаты клеток были получены и подвергнуты обработке, как это описано выше. IDU была определена как не ограничивающая скорости ниже 1 нМ.
[00395] В ходе второго эксперимента поиска дозы, клетки GM01391 в возрасте 3 недель после конфлюэнтности были подвергнуты воздействию различных концентраций IDU, от 0,01 до 0,2 нМ, в течение 2 дней. Лизаты клеток были получены и подвергнуты обработке, как это описано выше. В этом эксперименте известное количество внутреннего стандартного моносахарида, GlcNAc-6S, было внесено в лизаты клеток для контроля восстановления во время обработки. Как это показано на Фигуре 13, дозозависимое снижение количества субстрата ДС наблюдалось в клетках GM01391, обработанных IDU.
[00396] В ходе подобного эксперимента поиска дозы, клетки GM00519 в возрасте 3 недель после конфлюэнтности были подвергнуты воздействию различных концентраций ARSB, от 0,001 до 0,06 нМ, в течение 5 дней. Лизаты клеток были получены и подвергнуты обработке, как это описано выше. В этом эксперименте известное количество внутреннего стандартного моносахарида, GlcNAc-6S, было внесено в лизаты клеток для контроля восстановления во время обработки. Как это показано на Фигуре 14, дозозависимое снижение количества субстрата ДС наблюдалось в клетках GM00519, обработанных ARSB.
[00397] Клеточный анализ in vitro был разработан для измерения активности рекомбинантного лизосомального фермента сульфатазы человека, GALNS, в плане разрушения своего естественного субстрата, т.е. внутриклеточных субстратов, содержащих кератансульфат (КС).
[00398] Клетки MQCH с дефицитом GALNS были культивированы, как это описано в Примере 8 выше, и подвергнуты воздействию рекомбинантного GALNS человека в количестве 1 или 10 нМ. После обработки, лизаты клеток MQCH были приготовлены и расщеплены кератаназой II (EC 3.2.1), которая расщепляет большие олигосахариды КС в дисахариды КС. Дисахариды КС были мечены AMAC, разделены КЗЭ и определены ЛИФ, как это описано выше для дисахаридов ДС. GlcNAc-6S, моносахарид КС, был внесен в лизаты клеток как внутренний стандарт для контроля восстановления во время обработки. Количества двух характерных дисахаридов КС, Gal6S-GlcNAc6S и Gal-GlcNAc6S, были измерены, и полученные данные были скорректированы количеством восстановленного GlcNAc6S. Таблица 14 отображает процент распада КС с использованием клеток MQCH, обработанных GALNS, как это определено измерением количества двух характерных дисахаридов КС.
[00399] Представленный выше анализ указывает, что клетки-мишени захватывают рекомбинантный GALNS человека, который затем локализируется в лизосомах, где GALNS разрушает свой естественный субстрат, внутриклеточный КС.
[00400] В целом такие результаты показывают, что активность рекомбинантных лизосомальных ферментов человека, ARSB, IDU и GALNS, в плане разрушения своих естественных субстратов может быть измерена и количественно определена в ходе клеточных анализов in vitro. Следует иметь в виду, что такой клеточный анализ in vitro может быть легко модифицирован для измерения и количественного определения активности других лизосомальных ферментов сульфатазы, а также целого ряда рекомбинантных лизосомальных ферментов.
ПРИМЕР X
ДОСТАВКА РЕКОМБИНАНТНОЙ N-АЦЕТИЛГАЛАКТОЗАМИН-6-СУЛЬФАТАЗЫ (GALNS) ЧЕЛОВЕКА В СПЕЦИФИЧЕСКИЕ ТКАНИ
[00401] Была оценена способность рекомбинантной N-ацетилгалактозамин-6-сульфатазы (GALNS) человека, экспрессируемой в клетках G71 и очищенной, быть доставленной в специфические ткани, пораженные или связанные с дефицитом GALNS, после введения мышам.
[00402] Высокоспецифическое распределение кератансульфата придает мукополисахаридозу IVa типа (МПС IVa типа) или синдрому Моркио очень характерный фенотип. Кератансульфат преимущественно находится в хряще (зона роста кости суставов, клапан сердца, гортань и носовая перегородка) и роговице, и именно в этих тканях накапливается кератансульфат у пациентов с МПС IVA типа. Таким образом, N-ацетилгалактозамин-6-сульфатаза (GALNS), находящаяся в дефиците при МПС IVA типа или синдроме Моркио, важна для доставки фермента GALNS к ростовым пластинкам длинных трубчатых костей, клапану сердца, роговице, гортани и носу. Для наблюдения за такими специфическими тканями, являющимися плохо васкулязированными мишенями, у мышей была исследована доставка флуоресцентного GALNS.
[00403] У мышей было исследовано два иммуногистохимических способа окрашивания: (1) GALNS человека, конъюгированный с Alexa 488, и (2) неконъюгированный GALNS человека. Конъюгация GALNS человека с Alexa 488 проводилась с использованием набора для мечения Molecular Probes Alexa Fluor 488 C5 maleimide (A-10254). Химический процесс конъюгации малеимида привел к мечению 1:1 относительно соотношения с белком.
[00404] Для подтверждения того, что флуоресцентная метка не мешает захвату GALNS, иммуноцитохимический эксперимент был проведен с использованием культивированных синовиоцитов (ATCC # CRL-1832). Для сравнения неконъюгированного GALNS с конъюгированным GALNS (GALNS-A488 или GALNS-A555) использовали стандартный анализ захвата. Клетки были инкубированы с ферментом GALNS в течение 4 часов с последующим вытеснением α-L-идуронидазой (IDU) в течение 2 часов. Результаты показали, конъюгация с Alexa 488 не влияла на захват клетками. Фигура 15 отображает ожидаемое значение Kd для GALNS, GALNS-A488 и GALNS-A555. Захват измеряли ИФА антигена лизата клеток, а не ферментной активности, поскольку мечение инактивировало фермент. Kd неконъюгированных и конъюгированных ферментов GALNS было определено как примерно равное.
[00405] Для определения стабильности флуоресцентной метки, как только фермент GALNS был введен в клетку, было проведено иммуноокрашивание конъюгированного и неконъюгированного GALNS. Первичное антитело, используемое для окрашивания, было представлено G-очищенным кроличьим антителом к GALNS в концентрации 1 мкг/мл. Все изображения были получены с использованием эпи-флюоресцентного микроскопа с широким полем Leica IRE2 и программного обеспечения MetaMorph. Для измерения со-локализации на таких изображениях по причине присутствия внеплоскостного света потребовалось проведение деконволюции стека изображений. Деконволюция была проведена с использованием программного обеспечения для визуализации AutoQuant/AutoDeblur и теоретической функции рассеяния точки (слепой алгоритм).
[00406] Иммуноокрашивание показало достаточно хорошее перекрывание с сигналом, который был амплифицирован относительно материала GALNS-A488. Наблюдаемое повышение чувствительности было вызвано первичным и вторичным антителом, являющимися поликлональными.
[00407] Для определения связывания фермента GALNS в лизосоме, было проведено иммуноокрашивание культивированных синовиоцитов с Molecular Probes Lysotracker или другим ферментом, локализирующимся в лизосоме. Lysotracker показал незначительное перекрывание с ферментом GALNS-488; однако окрашивание было неоднородным. 2-часовое вытеснение лизосомального фермента с использованием рекомбинантной N-ацетилгалактозамино-4-сульфатазы (рчASB) человека показало определенную со-локализацию с GALNS.
[00408] Описанные выше эксперименты показали, что фермент GALNS-A488 захватывается клетками и локализируется в лизосоме и может использоваться для определения биораспределения in vivo.
[00409] Было проведено два исследования in vivo. Первое пилотное исследование включало болюсную инъекцию однократной дозы (10 мг/кг) в хвостовую вену здоровых мышей Balb/c, после чего было проведено второе исследование с множественными (5) инъекциями через день 10 мг/кг в хвостовую вену здоровых мышей Balb/c. Таблица 15 и Таблица 16 описывают планы экспериментов для первого и второго исследований, соответственно.
[00410] В первом пилотном исследовании материал сердца, печени и коленного сустава был собран во временных точках 2 ч и 24 ч. Во втором исследовании материал сердца, почки, печени и кости с четырехглавой и камбаловидной мышцей был собран во временных точках 2 ч, 4 ч и 8 ч. Для обоих исследований материал сердца, почки и печени был погружен и зафиксирован в 4% параформальдегиде (ПФА) в течение 4 дней, покрыт парафином, затем послойно нарезан с толщиной 7 мкм. Кость, включая мышцу во втором исследовании, была зафиксирована погружением в 4% ПФА в течение 8 дней, декальцифицирована, покрыта парафином и нарезана послойно с толщиной 7 мкм.
[00411] Изображения мышей, которым было введено GALNS-A488, были получены с использованием конфокальной микроскопии с лазерным сканированием Zeiss. Для проведения анализа в первом пилотном исследовании для клапана сердца и печени был получен один конфокальный стек на образец, которые использовали для волюметрического анализа. Для зоны роста было получено два конфокальных стека/образец и использовано для волюметрического анализа. Во втором исследовании было получено по одному конфокальному стеку на образец клапана сердца, почки и печени, и такие стеки использовали для волюметрического анализа; для зоны роста и зоны оставшегося хряща (zrc) было получено два конфокальных стека/образец, которые использовали для волюметрического анализа.
[00412] Заключения конфокальной микроскопической визуализации были следующими: (1) было возможно определить флуоресцентный GALNS in vivo; (2) сигнал был специфическим (отсутствие фона) и локализация была лизосомальной; (3) присутствие GALNS было продемонстрировано в синусоидальной клетке в печени; (5) в сердце фермент GALNS присутствовал в перегородке и предсердии, но более важно, что он был четко видим на уровне клапана сердца, где он был шире распространен после множественных инъекций; (6) в месте соединения бедренной и большеберцовой кости фермент GALNS присутствовал в минерализированной части кости (эпифиз), а также в костном мозге. GALNS присутствовал в зоне роста. В частности, GALNS в обильном количестве присутствовал в хондроцитах покоящейся зоны (или зоны запасного хряща), присутствовал в начале зоны пролиферации, и повторно появился в большом количестве в зоне остеогенеза в конце зоны роста. Несмотря на трудность в количественном определении кумулятивного эффекта множественных инъекций, второе исследование отобразило более широкое распределение. Таблица 17 отображает обобщение исследований визуализации конфокальной микроскопией.
[00413] Для вторичного окрашивания начальным этапом была оптимизация первичного антитела к GALNS. Различные ткани были окрашены разведениями 1:100 до 1:400 кроличьим антителом к GALNS, очищенным белком G. Результаты первого пилотного исследования показали, что разведение 1:100 было оптимальным для высокого соотношения сигнал/шум. Данный результат был подтвержден во втором исследовании. Оставшиеся слайды были обработаны при разведении первичного антитела 1:100 и разведении вторичного антитела 1:1000.
[00414] Сигнал для мышей Balb/c, которым была введена доза GALNS, имел сигнал выше контроля (т.е. у мышей, которым вводили ФСБ-Цис) при окрашивании антителом к GALNS, окрашенным белком G. Для подтверждения того, что фермент GALNS был локализирован в лизосоме, срезы были окрашены антителом к LAMP1. LAMP1 является маркером для лизосом. Изображения показывают на перекрывание между антителами к LAMP1 и GALNS, указывая на то, что фермент GALNS был локализирован в лизосоме.
[00415] В целом, два исследования in vivo указывают, что биораспределение GALNS связано с васкуляризацией, т.е. более васкуляризированные ткани имеют более флуоресцирующий сигнал. Более важным является то, что исследования доказали присутствие GALNS в местах накопления кератансульфата при синдроме Моркио, даже если такие места являются плохо васкуляризированными.
ПРИМЕР XI
Композиции N-ацетилгалактозамин-6-сульфатазы (GALNS) человека
[00416] Целью было исследование эффекта различных вспомогательных веществ, например, буферов, агентов изотоничности и стабилизаторов, на активность и структуру рекомбинантной N-ацетилгалактозамин-6-сульфатазы (GALNS) человека в композициях по изобретению.
[00417] Фермент GALNS был получен, как это описано в ПРИМЕРЕ V.
[00418] Фермент GALNS был охарактеризован, как это описано в ПРИМЕРЕ VII.
[00419] В ПРИМЕРЕ V очищенный рекомбинантный фермент GALNS человека был соединен с 10 мМ NaOAc/HOAc, 1 мМ NaH2PO4, 150 мМ NaCl и 0,005% или 0,01% Твина-20 при pH 5,5. Было отмечено, что при хранении в фосфатном буфере с низкой концентрацией происходило дефосфорилирование фермента GALNS. В соответствии с этим концентрация фосфатного буфера была повышена до 100 нМ NaH2PO4. При хранении в фосфатном буфере с высокой концентрацией какого-либо значительного дефосфорилирования фермента GALNS не отмечалось. Однако образование растворимых агрегатов GALNS отмечалось при хранении при 5°C, 25°C или 40°C, и образование нерастворимых агрегатов GALNS отмечалось при хранении при 40°C.
[00420] В первом исследовании оценивали влияние концентрации стабилизатора и рН на стабильность рекомбинантного GALNS. Очищенный рекомбинантный фермент GALNS был соединен с 20 мМ NaOAc/HOAc, 50 мМ NaH2PO4, 0,01% Твина-20 и 4% сахарозой или 2% сорбитолом. Исследуемые стабилизаторы: 15 мМ или 30 мМ аргинина гидрохлорида (аргинин HCl); и 15 мМ или 30 мМ NaCl. Исследуемые значения рН: 5,0, 5,4 и 5,8. Значение рН композиций с рН 5,8 было определено как варьирующее от рН 5,8 до 6,0. После хранения композиций фермента в течение периода времени до 2 месяцев при 5°C, 25°C или 40°C, фермент GALNS был проанализирован с использованием различных анализов, описанных в ПРИМЕРЕ VI.
[00421] Образование растворимых агрегатов в различных композициях было определено путем исследования фермента GALNS эксклюзионной высокоэффективной жидкостной хроматографией (ЭХ-ВЭЖХ). Присутствие 15 мМ и 30 мМ аргинина HCl супрессировало рост растворимых агрегатов, как это определено ЭХ-ВЭЖХ (Фигура 16).
[00422] Стабильность активности фермента GALNS в композициях измеряли с использованием анализа активности фермента in vitro. При 5°C активность фермента GALNS была стабильной в присутствии аргинин HCl или NaCl; при 25°C активность фермента GALNS была незначительно снижена в присутствии аргинина HCl или NaCl; и при 40°C активность фермента GALNS в композициях, содержащих NaCl, была, по меньшей мере, устойчива (Фигура 17).
[00423] Дефосфорилирование фермента GALNS в композициях было исследовано измерением процента бис-фосфорилированной маннозы 7 (БФМ7) капиллярным электрофорезом (КЭ) после расщепления фермента ПНГазой F для расщепления олигосахаридов, присоединенных к аспарагину в N-положении. Спустя 2 месяца при хранении при 5°C, 25°C или 40°C, фермент GALNS во всех ферментных композициях имел профиль гликозилирования относительно % БФМ7, который был сопоставим с профилем гликозилирования эталонной партии GALNS, которую использовали в фазе I клинической композиции (Фигура 18).
[00424] Чистота фермента GALNS в композициях определялась анализом фермента высокоэффективной жидкостной хроматографией с обращенными фазами (ОФ-ВЭЖХ). Спустя 2 месяца хранения при 5°C или 25°C ни в одной из композиций не отмечалось изменений площади пика; при 40°C композиции, содержащие аргинин HCl, при pH 5,0 и pH 5,4, также не характеризовались изменением площади пика, но в композициях, содержащих NaCl, при pH 5,0 и pH 5,4, и во всех композициях при pH 5,8 отмечалось снижение площади пика (Фигура 19). На хроматограммах ОФ-ВЭЖХ композиций отмечалось послепиковое плечо. Композиция GALNS, содержащая 30 мМ аргинина HCl, характеризовалась наименее выдающимся послепиковым плечом.
ПРИМЕР XII
Типичные композиции N-ацетилгалактозамин-6-сульфатазы (GALNS) человека
[00425] Данный пример описывает руководство по параметрам для использования в составлении композиций, включающих рекомбинантную N-ацетилгалактозамин-6-сульфатазу (GALNS) человека или ее биологически активные фрагменты, мутанты, варианты или аналоги, которые могут использоваться в лечении синдрома Моркио или МПС IVa типа. Параметры, используемые для получения композиций GALNS по изобретению, включают, но не ограничиваются, буферные агенты для поддержания рН, агенты для корректировки изотоничности, отсутствие или присутствие стабилизаторов, и отсутствие или присутствие других вспомогательных веществ, носителей, разбавителей и т.п.
[00426] В ПРИМЕРЕ XI рекомбинантный GALNS был получен в концентрации примерно 1 мг/мл. Предпочтительный GALNS получают в концентрации, варьирующей от примерно 0,1 до 10 мг/мл, предпочтительно от примерно 0,5 до 5 мг/мл, и более предпочтительно от примерно 0,5 до 1,5 мг/мл. В одном варианте воплощения изобретения композиция GALNS по изобретению включает фермент GALNS в концентрации примерно 1±0,5 мг/мл.
[00427] В ПРИМЕРЕ XI рекомбинантный фермент GALNS был соединен в композицию с 20 мМ NaOAc/HOAc, 50 мМ NaH2PO4, при pH 5,0; 5,4 и 5,8. Предпочтительный буферный агент представлен NaOAc/HOAc или его эквивалентом, и NaH2PO4, или его эквивалентом, при этом концентрация NaOAc/HOAc варьирует от примерно 5 до 100 мМ, предпочтительно от примерно 5 до 50 мМ, и более предпочтительно от примерно 10 до 30 мМ, и концентрация NaH2PO4 варьирует от примерно 5 до 100 мМ, предпочтительно от примерно 25 до 100 мМ, и более предпочтительно от примерно 25 до 75 мМ. В типичном варианте воплощения изобретения композиция GALNS по изобретению включает буфер NaOAc/HOAc в концентрации примерно 20±10 мМ и буфер NaH2PO4 в концентрации примерно 50±25 мМ.
[00428] Предпочтительное значение рН композиции составляет примерно рН 4,5-6,5, предпочтительно примерно рН 5,0-6,0, и более предпочтительно примерно рН 5,0-5,8. В одном варианте воплощения изобретения композиция GALNS по изобретению имеет значение рН примерно рН 5,4±0,4.
[00429] В ПРИМЕРЕ XI рекомбинантный фермент GALNS соединяют в композиции с 15 мМ или 30 мМ аргинина HCl или NaCl. Предпочтительный стабилизирующий агент представлен аргинином HCl или его эквивалентом с концентрацией, варьирующей от примерно 5 до 200 мМ, предпочтительно от примерно 10 до 100 мМ, и более предпочтительно от примерно 10 до 50 мМ. В типичном варианте воплощения изобретения композиция GALNS по изобретению включает аргинин HCl в концентрации примерно 30±20 мМ.
[00430] В ПРИМЕРЕ XI рекомбинантный фермент GALNS соединен в композиции с 0,01% Твина-20. Предпочтительный стабилизирующий агент представлен Твином-20 (также известным как полисорбат-20) или его эквивалентом в концентрации, варьирующей от примерно 0,001 до 1,0% (в/о), предпочтительно от примерно 0,005 до 0,2% (в/о), и более предпочтительно от примерно 0,005 до 0,015% (в/о). В одном варианте воплощения изобретения композиция GALNS по изобретению включает Твин-20 в концентрации примерно 0,01%±0,005% (в/о).
[00431] В ПРИМЕРЕ XI рекомбинантный фермент GALNS соединен в композиции с 4% сахарозой или 2% сорбитолом. Предпочтительный стабилизирующий агент/криопротектор/агент, регулирующий тоничность, представлен сорбитолом или его эквивалентом в концентрации, варьирующей от примерно 0,1 до 10% (в/о), предпочтительно от примерно 0,5 до 5 % (в/о), и более предпочтительно от примерно 1,0 до 3,0% (в/о). Типичная композиция GALNS по изобретению включает сорбитол в концентрации примерно 2,0%±1,0% (в/о).
[00432] В соответствии с этим, типичные композиции фермента GALNS по изобретению представлены в Таблице 18.
ПРИМЕР XIII
ВЛИЯНИЕ РЕКОМБИНАНТНОЙ N-АЦЕТИЛГАЛАКТОЗАМИН-6-СУЛЬФАТАЗЫ (GALNS) ЧЕЛОВЕКА И ДРУГИХ ЛИЗОСОМАЛЬНЫХ ФЕРМЕНТОВ СУЛЬФАТАЗЫ НА МЫШЕЙ С ДЕФИЦИТОМ АКТИВНОСТИ ЛИЗОСОМАЛЬНОГО ФЕРМЕНТА СУЛЬФАТАЗЫ
[00433] Оценивают влияние активных высокофосфорилированных лизосомальных ферментов сульфатазы человека по изобретению, например, рекомбинантной N-ацетилгалактозамин-6-сульфатазы (GALNS) человека, на мышей с дефицитом активности лизосомального фермента сульфатазы.
[00434] Рекомбинантный белок GALNS человека экспрессируется в клетках G71S и очищается. В соответствии с описанными здесь способами или с использованием известных в науке процедур могут быть экспрессированы и очищены и другие рекомбинантные лизосомальные ферменты сульфатазы человека.
[00435] Было описано несколько мышиных моделей дефицита лизосомального фермента сульфатазы человека, включая: метахроматическую лейкодистрофию (МЛД) (дефицит арилсульфатазы A), (Hess et al., Proc. Natl. Acad. Sci. USA 93:14821-14826, 1996), мукополисахаридоз типа VI (МПС VI) или синдром Марото-Лами (дефицит арилсульфатазы B) (Evers et al., Proc. Natl. Acad. Sci. USA 93:8214-8219, 1996), мукополисахаридоз типа II (МПС II) или синдром Хантера (дефицит идуронат-2-сульфатазы) (Muenzer et al., Acta Paediatr. Suppl. 91(439):98-99, 2002; Cardone et al., Hum. Mol. Genet. 15:1225-1236, 2006), мукополисахаридоз типа IIIa (МПС IIIa) или синдром Санфилиппо A (дефицит сульфамидазы/гепаран-N-сульфатазы) (Bhaumik et al., Glycobiology 9(12):1389-1396, 1999), мукополисахаридоз типа IVa (МПС IVa) или синдром Моркио A типа (дефицит N-ацетилгалктозамин-6-сульфатазы) (Tomatsu et al., Hum. Mol. Genet. 12:3349-3358, 2003), и множественная сульфатазная недостаточность (МСН) (дефицит фактора модификации сульфатазы 1) (Settembre et al., Proc. Natl. Acad. Sci. USA 104:4506-4511, 2007). Мышиная модель мукополисахаридоза типа IIId (МПС IIId) или синдром Санфилиппо D (дефицит N-ацетилглюкозамин-6-сульфатазы) до сих пор еще не описана.
[00436] Мышиные модели с дефицитом лизосомального фермента сульфатазы человека могут использоваться для оценки осуществимости фермент-заместительной терапии (ФЗТ) как способа лечения лизосомальных болезней накопления. Например, у нокаутных мышей МПС IVa (мыши GALNS-/-; Tomatsu et al., Hum. Mol. Genet. 12:3349-3358, 2003) ферментативная активность GALNS не определяется, и у таких мышей отмечается повышенный уровень гликозамингликанов (ГАГ) в моче, т.е. кератинсульфата и хондроитин-6-сульфата, и накопление ГАГ в множественных тканях и органах, например печени, почках, селезенке, сердце, мозге, костном мозге и хрящах. Однако у мышей GALNS-/- не отмечается аномалий скелета, связанных с данным заболеванием у людей. Была разработана другая мышиная модель МПС IVa, позволяющая экспрессировать неактивный GALNS человека и мутированный, инактивный эндогенный GALNS мыши (мыши GALNStm(hC79S.mC76S)slu; Tomatsu et al., Hum. Mol. Genet. 14:3321-3335, 2005). У мышей GALNStm(hC79S.mC76S)slu, у которых не определялась активность фермента GALNS, отмечалась повышенная экскреция ГАГ в моче, накопление ГАГ в множественных тканях, включая внутренние органы, мозг, роговицу, кости, связки и костный мозг, и лизосомальное накопление отмечено в множественных тканях с очевидным отложением в костях. Патологические изменения у мышей GALNStm(hC79S.mC76S)sluотличаются от таковых, отмечаемых для мышей GALNS-/-. Однако подобно мышам GALNS-/-, у мышей GALNStm(hC79S.mC76S)sluне отмечается аномалий скелета, связанных с данным заболеванием у людей. Таким образом, мыши GALNS-/- или GALNStm(hC79S.mC76S)sluмогут использоваться для исследования эффекта введения рекомбинантного GALNS человека при повышенном уровне ГАГ в моче и накоплении ГАГ в тканях.
[00437] Мышам GALNS-/-, GALNStm(hC79S.mC76S)sluили мышам дикого типа в возрасте 4 недель еженедельно внутривенно вводят инъекции (n = по меньшей мере 6 или 8 на группу) различных доз рекомбинантного GALNS человека (например, 0,1; 0,3; 1; 3;10 мг/кг) или контрольный носитель до возраста 16-20 недель, и затем мышей умерщвляют для гистологического исследования. Мочу у мышей собирают, после чего определяют экскрецию ГАГ в моче, как это описано (Tomatsu et al., Hum. Mol. Genet. 12:3349-3358, 2003). Патологическое исследование различных тканей проводят в соответствии с описанием (Tomatsu et al., Hum. Mol. Genet. 12:3349-3358, 2003).
[00438] Использование мышей GALNS-/- или GALNStm(hC79S.mC76S)sluпоказывает ожидаемую способность рекомбинантного GALNS человека по изобретению снижать: (1) уровень экскреции ГАГ в моче; (2) накопление ГАГ в множественных тканях, например, внутренних органах, роговице, мозге, костях, связках и костном мозге; (3) лизосомальное накопление в множественных тканях; и (4) накопление в кости.
[00439] Эффект рекомбинантного GALNS человека изучают на мышиной модели множественной сульфатазной недостаточности (МНС) (мыши SUMF1-/-; Settembre et al., Proc. Natl. Acad. Sci. USA 104:4506-4511, 2007). Принимая во внимание, что у мышей SUMF1-/- отмечается частая смертность в раннем периоде жизни, инъекции таким мышам рекомбинантного GALNS человека начаты ранее, чем это описано выше для мышей GALNS-/-.
[00440] С соблюдением известных в науке процедур, исследуют влияние других рекомбинантных лизосомальных ферментов сульфатазы человека, т.е. арилсульфатазы А, арилсульфатазы В, идуронат-2-сульфатазы, сульфамидазы/гепаран-N-сульфатазы и N-ацетилглюкозамин-6-сульфатазы, на мышиных моделях МСН (мыши ASA-/-; Hess et al., Proc. Natl. Acad. Sci. USA 93:14821-14826, 1996), МПС VI (мыши As1-s-/-; Evers et al., Proc. Natl. Acad. Sci. USA 93:8214-8219, 1996), МПС II (мыши idsy/-; Cardone et al., Hum. Mol. Genet. 15:1225-1236, 2006), МПС IIIa (Bhaumik et al., Glycobiology 9(12):1389-1396, 1999) и МПС (мыши SUMF1-/-; Settembre et al., Proc. Natl. Acad. Sci. USA 104:4506-4511, 2007).
ПРИМЕР XIV
ЛЕЧЕНИЕ ПАЦИЕНТОВ-ЛЮДЕЙ С МУКОПОЛИСАХАРИДОЗОМ IVA ТИПА (ИЛИ СИНДРОМОМ МОРКИО) ИЛИ ДЕФИЦИТОМ ДРУГОГО ЛИЗОСОМАЛЬНОГО ФЕРМЕНТА СУЛЬФАТАЗЫ С ИСПОЛЬЗОВАНИЕМ РЕКОМБИНАНТНОЙ N-АЦЕТИЛГАЛАКТОЗАМИН-6-СУЛЬФАТАЗЫ (GALNS) ЧЕЛОВЕКА И ДРУГИХ ЛИЗОСОМАЛЬНЫХ ФЕРМЕНТОВ СУЛЬФАТАЗЫ
[00441] Пациенты-люди с проявлением клинического фенотипа дефицита лизосомального фермента сульфатазы, такие как пациенты с диагнозом мукополисахаридоза IVA типа (МПС IVa или синдром Моркио), являются кандидатами для проведения фермент-заместительной терапии с использованием рекомбинантного фермента, т.е. N-ацетилгалактозамин-6-сульфатазы (GALNS) человека. У всех пациентов, страдающих от дефицита лизосомального фермента сульфатазы, проявляются некоторые клинические признаки избыточного или опасного накопления во внутренних органах и мягких тканях материала накопления в лизосомах, что проявляется различной степенью функционального нарушения или ухудшения состояния здоровья, связанного с отдельной лизосомальной болезнью накопления. У всех пациентов с МПС IVa появляются определенные клинические признаки деформации кости, низкорослость и аномальная походка, и/или накопление гликозамингликанов (ГАГ) в крови или моче, с различной степенью функционального нарушения.
[00442] Предпочтительно, уровни фермента у пациента, страдающего дефицитом лизосомального фермента сульфатазы, контролируются для подтверждения отсутствия или пониженной активности лизосомального фермента сульфатазы в его тканях. Пациенты с менее чем 10%, предпочтительно менее чем 5%, более предпочтительно менее чем 2% и еще более предпочтительно менее чем 1% активности лизосомального фермента у относительно здорового субъекта являются подходящими кандидатами на лечение соответствующим лизосомальным ферментом сульфатазы. Могут быть собраны данные для определения активности лизосомального фермента сульфатазы у пациента перед, в течение и после лечения.
[00443] Эффективность определяют измерением процентного снижения экскреции субстрата в моче, т.е. гликозамингликана (ГАГ) лизосомального фермента сульфатазы с течением времени. Уровни ГАГ в моче пациентов, страдающих от дефицита лизосомального фермента сульфатазы, сравнивают с нормальными уровнями экскреции и/или уровнями не подвергнутых лечению пациентов, страдающих от дефицита этого же лизосомального фермента сульфатазы, и/или уровнями у этого же пациента до лечения лизосомальным ферментом сульфатазы. Снижение экскреции нераспавшихся ГАГ после лечения лизосомальным ферментом сульфатазы более чем на 25%, предпочтительно более чем на 50% является валидным способом измерения ответа индивидуума на лечение.
[00444] Эффективность также может быть определена по сниженным признакам и симптомам патологии, ассоциированной с лизосомальной болезнью накопления. Эффективность может быть определена проведением биопсии тканей и исследованием клеток и/или лизосом для определения степени снижения ГАГ в лизосомах, клетках или тканях. Эффективность может быть определена по функциональной оценке, которая может быть объективной или субъективной (например, пониженная боль или затруднение функционирования, повышенная мышечная сила или выносливость, повышенный сердечный выброс, выносливость при выполнении физических упражнений, изменения массы тела, роста или внешнего вида и т.п.).
[00445] Фармацевтическая композиция, включающая рекомбинантный GALNS человека, экспрессированный в клетках G71S и очищенный, получена в соответствии с известными в науке процедурами. Предпочтительно вводить фармацевтические композиции по изобретению внутривенно.
[00446] Основная схема первичного клинического исследования для изучения эффекта введения рекомбинантного GALNS человека пациентам с МПС IVa типа включает открытое исследование безопасности/эффективности с повышением дозы, в ходе которого пациентам внутривенно вводят различные дозы фермента с фиксированным интервалом, например, и без ограничения, проводят еженедельные инъекции фермента.
[00447] У пациентов с МПС IVa эффективность определяют измерением, например, пониженного уровня ГАГ в крови или моче, что вероятно наблюдается в течение нескольких недель ФЗТ, повышенной выносливости при проведении тестов сердечной, легочной и/или двигательной функции, что вероятно отмечается в течение нескольких месяцев ФЗТ, и/или изменений в скелете и/или росте тела, что вероятно отмечается в течение нескольких лет ФЗТ.
[00448] Измерения ГАГ в моче используют для установления соответствующего режима введения доз, а также для определения эффективности путем измерения процентного снижения экскреции ГАГ в моче с течением времени.
[00449] Может использоваться целый ряд тестов на выносливость, включая, например, и не ограничиваясь, тесты ходьбой (расстояние, пройденное за 6 или 12 минут), поднятие по лестнице (ступенька в минуту), и функцию легких/дыхания, включая сердечную функцию (ЭКГ, эхокардиограмма), функцию легких (ЖЕЛ, ОФВ1, максимальная скорость выдоха).
[00450] У более юных пациентов, подвергнутых лечению в течение продолжительных периодов, может быть измерен рост (высота).
[00451] Лизосомальные болезни накопления, связанные с дефицитом активности лизосомального фермента сульфатазы, и которые могут быть подвергнуты лечению или предотвращены с использованием способов по данному изобретению, представлены следующими: метахроматическая лейкодистрофия (МЛД), мукополисахаридоз типа VI (МПС VI) или синдром Марото-Лами, мукополисахаридоз типа II (МПС II) или синдром Хантера, мукополисахаридоз типа IIIa (МПС IIIa) или синдром Санфилиппо A, мукополисахаридоз типа IIId (МПС IIId) или Синдром Санфилиппо D, мукополисахаридоз типа IVa (МПС IVa) или синдром Моркио А, или множественная сульфатазная недостаточность (МСН). Для каждой лизосомальной болезни накопления рекомбинантный лизосомальный фермент сульфатазы должен включать специфический лизосомальный фермент сульфатазы.
[00452] Для способов, относящихся к МЛД, предпочтительный лизосомальный фермент сульфатазы представлен арилсульфатазой А. Для способов, относящихся к МПС VI, предпочтительный лизосомальный фермент сульфатазы представлен арилсульфатазой В. Для способов, относящихся к МПС II, предпочтительный лизосомальный фермент сульфатазы представлен идуронат-2-сульфатазой. Для способов, относящихся к МПС IIIA типа, предпочтительным лизосомальным ферментом сульфатазы является сульфамидаза/гепаран-N-сульфатаза. Для способов, относящихся к МПС IIID типа, предпочтительным лизосомальным ферментом сульфатазы является N-ацетилглюкозами-6-сульфатаза. Для способов, относящихся к МПС IVA типа, предпочтительным лизосомальным ферментом сульфатазы является N-ацетилгалактозамин-6-сульфатаза. Для способов, относящихся к МСН, предпочтительным лизосомальным ферментом сульфатазы является N-ацетилгалактозамин-6-сульфатаза.
[00453] Ожидается, что многочисленные модификации и изменения по изобретению, изложенные в иллюстративных примерах выше, станут очевидными для специалиста в данной области. Вследствие этого в изобретение будут включены только ограничения, представленные в прилагаемой формуле изобретения.
Реферат
Группа изобретений относится к области биотехнологии. Предложен способ получения композиции, содержащей очищенный рекомбинантный фермент N-ацетилгалактозамин-6-сульфатазу (GALNS) человека, где фермент GALNS включает аминокислотную последовательность, идентичную по меньшей мере на 95% аминокислотам 27-522 последовательности SEQ ID NO:4. Предложены композиции, включающие эффективное количество рекомбинантного фермента N-ацетилгалактозамин-6-сульфатазы (GALNS) человека. Группа изобретений позволяет получать большое количество фермента GALNS человека, 98% которого представлено в форме предшественника, и может быть использована в производстве лекарственного средства для лечения мукополисахаридоза IVa типа (МПС IVa) или синдрома Моркио типа А. 5 н. и 4 з.п. ф-лы, 19 ил., 19 табл., 14 пр.

Комментарии