Лентивирусные векторы, псевдотипированные мутантными baev гликопротеинами - RU2618864C2
Код документа: RU2618864C2
Чертежи






























Описание
Настоящее изобретение относится к псевдотипированным лентивирусным векторам, обеспечивающим эффективный перенос генов в гемопоэтических клетках.
Генная терапия подает большие надежды в лечении многих наследственных и приобретенных заболеваний, о чем свидетельствует успех лечения Х-сцепленного тяжелого комбинированного иммунодефицита (ТКИД-Х1), дефицита аденозиндезаминазы (АДА) и хронической гранулематозной болезни. Недавно сообщалось об успешном лечении пациентов, страдающих Х-сцепленной адренолейкодистрофией (АЛД), с применением лентивирусных векторов. В этом испытании генная терапия на основе гемопоэтических стволовых клеток (ГСК) позволяла остановить прогрессирование заболевания у двух пациентов, страдающих этим смертельным демиелинизирующим заболеванием центральной нервной системы. Важно, что для коррекции всех этих дефектов гемопоэтической системы терапевтический ген нужно доставить в клетки, способные как к самообновлению, так и к дифференцировке во все гемопоэтические линии. Поскольку ГСК соответствуют этим критериям, они являются привлекательными кандидатами для генной терапии.
Однако основным препятствием трансдукции лентивирусным вектором ГСК является то, что 75% ГСК находятся в Go фазе клеточного цикла, и не позволяют проводить классическую трансдукцию лентивирусным вектором. Это ограничение препятствует применению обычных лентивирусных векторов для генной терапии ГСК, поскольку не позволяет осуществлять эффективный перенос гена в субпопуляцию покоящихся (Go) ГКС (Sutton et al. (1999) J. Virol. 73:3649-3660). Для преодоления этого ограничения во многих исследованиях с применением лентивирусных векторов для трансдукции hCD34+клеток применяли введение высоких доз вектора и присутствие очень мощных цитокиновых коктейлей (ТПО, ФСК, Flk-3, IL-6, IL-3) для индукции входа ГСК в клеточный цикл. Очень часто используют ретронектин, фрагмент фибронектина, для солокализации векторных частиц и клеток-мишеней, или множественные применения векторов для достижения высокого уровня переноса генов в ГСК. Однако нежелательным эффектом длительной стимуляции цитокинами является снижение полипотенциальности и длительное приживление человеческих ГСК. Кроме того, слишком высокая доза вектора повышает риск многокопийной интеграции, и в частности, инсерционного мутагенеза.
Таким образом, имеется потребность в вирусных векторах, обеспечивающих трансдукцию покоящихся ГСК с уменьшенным риском многокопийной интеграции.
Эффективный перенос гена в покоящиеся Т и В лимфоциты с целью генной терапии или иммунотерапии позволяет обеспечить лечение некоторых генетических дисфункций гемопоэтической системы, таких как иммунодефицита, и разработку новых терапевтических стратегий для рака и приобретенных заболеваний. Лентивирусные векторы (LV) не способны к трансдукции некоторых покоящихся типов клеток, таких как покоящиеся Т- и В-клетки (Bovia et al. (2003) Blood 101: 1727-1733; Verhoeyen et al. (2003) Blood 101: 2167-2174). В Т-клетках завершение обратной транскрипции, импорта в ядро и последующей интеграции в геном лентивирусных векторов, псевдотипированных гликопротеином оболочки из вируса везикулярного стоматита (VSV-G), не осуществляется эффективно, пока они не активируются через Т-клеточный рецептор или при воздействии цитокинов, определяющих выживаемость, индуцирующих их переход в Gib фазу клеточного цикла. Лентивирусная трансдукция В-клеток является другой проблемой, поскольку даже индуцированная стимуляцией В-клеточного рецептора (BCR) пролиферация не является достаточной для обеспечения эффективной трансдукции VSV-G псевдотипированными лентивирусными векторами (VSV-G-LV).
Таким образом, имеется потребность в вирусных векторах, обеспечивающих трансдукцию покоящихся Т- и В-клеток.
Для доставки генов с помощью лентивирусного вектора в гемопоэтические клетки нужно, чтобы на их поверхности был представлен оболочечный белок «входа», обеспечивающий эффективное слияние вектора и клетки. Процесс встраивания гетерологичного оболочечного гликопротеина в оболочку лентивирусного вектора называется «псевдотипированием». В течение долгого времени использовали VSV-G, ассоциированный с вирусными оболочками, полученными из ВИЧ-1. Тем не менее, имеются недостатки при использовании VSV-G-LV. С долговременной экспрессией VSV-G связана токсичность, что затрудняет генерацию стабильных клеточных линий. В дополнение, VSV-G-LV являются чувствительными к человеческому комплементу, что делает их непригодными для использования in vivo. Только высокие дозы VSV-G-LV (множественность заражения = MOI 50-100) обеспечивают эффективную трансдукцию hCD34+клеток, повышая риск многокопийной интеграции, и таким образом, генотоксичности (Di Nunzio et al. (2007) Hum. Gene Ther. 18: 811-820). У людей может также развиваться сильный иммунный ответ против VSV-G, что может снижать эффективность второго применения VSV-G-LV. Все эти свидетельства ограничивают применение VSV-G-LV ех vivo и in vivo. Химерный оболочечный гликопротеин, содержащий внеклеточные и трансмембранные домены оболочечного гликопротеина вируса лейкемии кошек RD114, гибридизованный с цитоплазматическим хвостом (обозначенным TR) оболочечного гликопротеина вируса лейкемии мышей A (MLV-A), далее обозначенный в настоящей заявке как RD114/TR и описанный в международной заявке WO 03/091442, как кажется, является достаточно хорошей альтернативной оболочкой. Действительно, этот псевдотип не является чувствительным к человеческой системе комплемента, что делает его привлекательным для применения in vivo. RD114/TR-LV обеспечивает эффективную трансдукцию CD34+клеток человека и макаки. Однако уровни трансдукции остаются ниже уровней для VSV-G-LV, и титры RD114 гораздо ниже, чем для VSV-G-LV. Кроме того, RD114/TR гликопротеин не может эффективно проникать в мышиные клетки. Таким образом, эта рецепторная специфичность ограничивает возможности работы с этим LV, поскольку большая часть моделей доклинических испытаний, пригодных для генной терапии, является мышиными моделями.
Настоящее изобретение основано на неожиданном открытии авторов изобретения, что лентивирусные векторы, псевдотипированные с химерным оболочечным гликопротеином, который включает или состоит из гибрида трансмембранного и внеклеточного домена оболочечного гликопротеина эндогенного ретровируса бабуинов (BaEV) и оболочечного гликопротеина цитоплазматического хвостового домена вируса лейкемии мышей (MLV); или модифицированным оболочечным гликопротеином BaEV, где цитоплазматический хвостовой домен лишен ингибирующего слияние R пептида;
проявляют свойства трансдукции, особо пригодные для переноса гена в гемопоэтические клетки, включая ГСК и покоящиеся Т- и В-клетки. Действительно, эти новые LV могут трансдуцировать очень эффективно и стабильно hCD34+ клетки вплоть до 70% при низких дозах вектора и при умеренной стимуляции цитокинами. BaEV-LV явно превосходит VSV-G и RD114/TR-LV для трансдукции CD34+клеток макаки и человека. Кроме того, авторы изобретения показали, что BaEV-LV трансдуцирует очень ранние hCD34+клетки-предшественники, включая ГСК, когда эти клетки способны к восстановлению на модели иммунодефицита мышей, и высокий уровень трансдуцированных клеток крови был найден в некоторых гемопоэтических тканях, и в этих тканях в других линиях клеток крови. Важно, что BaEV-LV способны к трансдукции предварительно стимулированных IL-7 клеток памяти и интактных Т-клеток в высоких уровнях. Далее, в отличие от VSV-G-LV и RD114/TR-LV, эти BaEV-LV также обеспечивают высокий уровень трансдукции покоящихся и BCR-стимулированных В-клеток без индукции смены фенотипа.
Таким образом, настоящее изобретение относится к псевдотипированной вирусной векторной частице для переноса биологического материала в клетки, где указанная векторная частица содержит по меньшей мере:
- химерный оболочечный протеин, содержащий или состоящий из гибрида трансмембранного и внеклеточного домена оболочечного гликопротеина эндогенного ретровируса бабуина (BaEV) и цитоплазматического хвостового домена оболочечного гликопротеина вируса лейкемии мышей (MLV); или
- модифицированный оболочечный гликопротеин BaEV, где цитоплазматический хвостовой домен лишен ингибирующего слияние R пептида.
Настоящее изобретение также относится к псевдотипированной вирусной векторной частице в соответствии с настоящим изобретением для применения в лечении гемопоэтических нарушений.
Другим объектом настоящего изобретения является медикамент, содержащий псевдотипированную вирусную векторную частицу в соответствии с настоящим изобретением в качестве активного ингредиента.
Настоящее изобретение также относится к применению псевдотипированной вирусной векторной частицы в соответствии с настоящим изобретением для переноса биологического материала в гемопоэтические клетки ex vivo.
Другим объектом настоящего изобретения является способ трансдукции гемопоэтической клетки, включающий обеспечение контакта гемопоэтической клетки с псевдотипированной вирусной векторной частицей в соответствии с настоящим изобретением в условиях, обеспечивающих трансдукцию гемопоэтической клетки псевдотипированной вирусной векторной частицей.
Настоящее изобретение также относится к пакующей стабильный вирус клеточной линии, продуцирующей псевдотипированную вирусную векторную частицу, как описано выше.
Подробное описание изобретения
Псевдотипированная вирусная векторная частица
Настоящее изобретение относится к псевдотипированной вирусной векторной частице для переноса биологического материала в клетки, где указанная векторная частица содержит по меньшей мере:
- химерный оболочечный гликопротеин, содержащий или состоящий из гибрида трансмембранного и внеклеточного домена оболочечного гликопротеина эндогенного ретровируса бабуина (BaEV) и цитоплазматического хвостового домена оболочечного гликопротеина вируса лейкемии мышей (MLV); или
- модифицированный оболочечный гликопротеин BaEV, где цитоплазматический хвостовой домен лишен ингибирующего слияние R пептида.
Как подразумевается в настоящей заявке, термин «векторная частица» означает любую частицу, ответственную за презентирование химерного оболочечного гликопротеина или модифицированного BaEV оболочечного гликопротеина на своей поверхности, и за обратимое связывание с биологическим материалом. Такая векторная частица предпочтительно является вирусной векторной частицей, в частности ретровирусной векторной частицей. Предпочтительно, указанная ретровирусная векторная частица выбрана из группы, состоящей из онковирусной вирусной частицы, включая вирусные частицы вируса лейкемии мышей (MLV), вируса лейкоза птиц (ALV), респираторного синцитиального вируса (RSV) или вируса обезьян Мейзена-Пфейзера (MPMV); лентивирусной векторной частицы, такой как векторные частицы вируса иммунодефицита человека (ВИЧ), например, ВИЧ-1 или ВИЧ-2, вируса иммунодефицита обезьян (SIV), вируса иммунодефицита кошек (FIV), вируса инфекционной анемии лошадей (EIAV) и вируса артроэнцефалита коз (CAEV), и спумавирусной векторной частицы, такой как вирусная частица пенящего вируса человека (HFV).
Лентивирусные векторные частицы хорошо известны специалистам в данной области техники и подробно описаны в Naldini et al. (2000) Adv. Virus. Res. 55:599-609 и Negre et al. (2002) Biochimie 84:1161-1171. Обычно лентивирусные векторные частицы в соответствии с настоящим изобретением содержат по меньшей мере следующие компоненты: (i) оболочечный компонент, состоящий из фосфолипидного двойного слоя, связанного с оболочечными белками, где оболочечные белки содержат по меньшей мере вышеуказанные химерные или модифицированные гликопротеины, указанная оболочка окружает (ii) коровый компонент, состоящий из ассоциации gag белка, где указанный капсид сам окружает (iii) геномные компоненты, обычно состоящие из рибонуклеиновых кислот (РНК), и (iv) ферментативного компонента (pol). Биологический материал может присутствовать в оболочке, в капсиде и/или в геномных компонентах.
Лентивирусные векторные частицы могут быть легко приготовлены специалистом в данной области техники, например, в соответствии с указаниями Sandrin et al. (2002) Blood 100:823-832. Вкратце, лентивирусные векторные частицы можно создать путем совместной экспрессии упаковочных элементов (т.е. коровый и ферментативного компонентов), геномного компонента и оболочечного компонента в так называемых клетках-продуцентах, например, клетках эмбриональной почки человека 293Т. Как правило, можно применять от трех до четырех плазмид, но их число может быть выше, в зависимости от степени, до которой лентивирусные компоненты разрушаются на отдельные единицы.
Как применяется в настоящей заявке, термин «псевдотипированный вирусный
вектор» относится к вирусному вектору, содержащему чужеродные вирусные оболочечные гликопротеины. Как правило, вирусные векторы в соответствии с настоящим изобретением являются псевдотипированными с вышеуказанными химерными или модифицированными гликопротеинами.
Эндогенный ретровирус бабуинов или BaEV является ретровирусом С типа, присутствующим во множественных провирусных копиях в ДНК бабуинов. Оболочечный гликопротеин BaEV подробно описан в Benveniste et al. (1974) Nature 248: 17-20 и Todaro et al. (1974) Cell 2: 55-61.
В контексте настоящего изобретения термин «оболочечный гликопротеин BaEV» относится к форме оболочечного гликопротеина BaEV дикого типа или к мутанту указанного оболочечного гликопротеина BaEV дикого типа, который по меньшей мере на 80%, предпочтительно по меньшей мере на 85%, еще более предпочтительно по меньшей мере на 90%, более предпочтительно по меньшей мере на 95%, еще более предпочтительно по меньшей мере на 99% идентичен указанному оболочечному гликопротеину BaEV дикого типа, где указанный мутантный гликопротеин сохраняет способность гликопротеина дикого типа к связыванию и слиянию с мембраной гемопоэтической клетки.
Как правило, оболочечный гликопротеин BaEV дикого типа кодирован нуклеиновокислотной последовательностью SEQ ID №:1. Предпочтительно, она состоит из последовательности SEQ ID №:2. Как известно специалисту в данной области техники, оболочечный гликопротеин BaEV построен из цитоплазматического хвостового домена, трансмембранного домена и внеклеточного домена. Области, соответствующие цитоплазматическому хвостовому домену, трансмембранному домену и внеклеточному домену в последовательности оболочечного гликопротеина, могут быть легко определены специалистом в данной области техники. Как правило, цитоплазматический хвостовой домен расположен между аминокислотами 530-564 оболочечного гликопротеина BaEV дикого типа. Предпочтительно, цитоплазматический хвостовой домен дикого типа из оболочечного гликопротеина BaEV содержит или состоит из аминокислотной последовательности SEQ ID №:3. Как правило, трансмембранный домен расположен между аминокислотами 507 и 529 оболочечного гликопротеина дикого типа. Предпочтительно, трансмембранный домен дикого типа из оболочечного гликопротеина BaEV содержит или состоит из аминокислотной последовательности SEQ ID №4. Как правило, внеклеточный домен расположен между аминокислотами 1-506 оболочечного гликопротеина BaEV дикого типа. Предпочтительно, внеклеточный домен дикого типа из оболочечного гликопротеина BaEV содержит или состоит из аминокислотной последовательности SEQ ID №: 5.
В частном варианте осуществления настоящего изобретения цитоплазматический хвостовой домен оболочечного гликопротеина BaEV лишен ингибирующего слияние R пептида.
В контексте настоящего изобретения выражение «ингибирующий слияние R пептид» означает С-концевую часть цитоплазматического хвостового домена оболочечного гликопротеина, которая несет тирозиновый сигнал эндоцитоза YXXL, и которая отщепляется вирусной протеазой во время созревания вириона, таким образом, усиливая слияние с мембраной оболочечного гликопротеина. Ингибирующий слияние R пептид оболочечного гликопротеина BaEV, как правило, расположен между аминокислотами 547 и 564 оболочечного гликопротеина BaEV дикого типа. Предпочтительно, ингибирующий слияние R пептид оболочечного гликопротеина BaEV содержит или состоит из аминокислотной последовательности SEQ ID №: 6.
Таким образом, в особо предпочтительном варианте осуществления модифицированный оболочечный гликопротеин BaEV, в котором цитоплазматический хвостовой домен не содержит ингибирующего слияние R пептида, содержит или состоит из аминокислотной последовательности SEQ ID №: 7. Такой модифицированный оболочечный гликопротеин BaEV далее обозначается как «BaEVRLess».
В другом частном варианте осуществления цитоплазматический хвостовой домен оболочечного гликопротеина BaEV заменен цитоплазматическим хвостовым доменом оболочечного гликопротеина вируса лейкемии мышей (MLV).
Оболочечный гликопротеин вируса лейкемии мышей подробно описан в Ott et al. (1990) J. Virol. 64:151-166. Оболочечный гликопротеин вируса лейкемии мышей предпочтительно относится к штамму 4070А.
В контексте настоящего изобретения термин «оболочечный гликопротеин MLV» относится к форме оболочечного гликопротеина MLV дикого типа или к мутанту указанного оболочечного гликопротеина MLV дикого типа, который по меньшей мере на 80%, предпочтительно по меньшей мере на 85%, еще более предпочтительно по меньшей мере на 90%, более предпочтительно по меньшей мере на 95%, еще более предпочтительно по меньшей мере на 99% идентичен указанному оболочечному гликопротеину MLV дикого типа, где указанный мутантный гликопротеин сохраняет способность гликопротеина дикого типа к взаимодействию с вирусными коровыми белками, в частности, с лентивирусными коровыми белками.
Область, соответствующая цитоплазматическому хвостовому домену в последовательности оболочечного гликопротеина, может быть легко определена специалистами в данной области техники. Как правило, цитоплазматический хвостовой домен оболочечного гликопротеина MLV расположен между аминокислотами 622 и 654 оболочечного гликопротеина MLV дикого типа. Предпочтительно, цитоплазматический хвостовой домен дикого типа из оболочечного гликопротеина MLV содержит или состоит из аминокислотной последовательности SEQ ID №:8.
Таким образом, в особо предпочтительном варианте осуществления химерный оболочечный гликопротеин, который содержит или состоит из гибрида трансмембранного или внеклеточного домена оболочечного гликопротеина BaEV и цитоплазматического хвостового домена оболочечного гликопротеина MLV, содержит или состоит из аминокислотной последовательности SEQ ID №:9. Такой химерный оболочечный гликопротеин далее обозначается как «BaEV/TR».
Авторы настоящего изобретения продемонстрировали, что BaEV/TR и BaEVRLess гликопротеины были встроены с более высоким уровнем на поверхность лентивируса, чем гликопротеин BaEV дикого типа.
Кроме того, авторы настоящего изобретения продемонстрировали, что совместная презентация специфических цитокинов на вирусных векторных частицах обеспечивает усиление направленной трансдукции интересующих клеток.
Таким образом, в частном варианте осуществления вирусная векторная частица в соответствии с настоящим изобретением может дополнительно презентировать, предпочтительно на своей поверхности, по меньшей мере один цитокин, выбранный из группы, состоящей из фактора стволовых клеток (ФСК), тромбопоэтина (ТПО), IL-2, IL-15 и IL-7.
Предпочтительно, указанный по меньшей мере один цитокин выбран из группы, состоящей из человеческого ФСК, человеческого ТПО, человеческого IL-2, человеческого IL-15 и человеческого IL-7.
В контексте настоящего изобретения цитокин может быть цитокином дикого типа или любым мутантом указанного цитокина дикого типа, который по меньшей мере на 80%, предпочтительно по меньшей мере на 85%, еще более предпочтительно по меньшей мере на 90%, более предпочтительно по меньшей мере на 95%, еще более предпочтительно по меньшей мере на 99% идентичен указанному цитокину дикого типа, с тем условием, что указанный мутантный цитокин обладает по существу теми же самыми свойствами, что и цитокин дикого типа, из которого он получен.
Цитокин ФСК дикого типа предпочтительно содержит или состоит из последовательности SEQ ID №:10. ТПО дикого типа предпочтительно содержит или состоит из последовательности SEQ ID №:11. IL-2 дикого типа предпочтительно содержит или состоит из последовательности SEQ ID №: 12. IL-7 дикого типа предпочтительно содержит или состоит из последовательности SEQ ID №: 13. IL-15 дикого типа предпочтительно содержит или состоит из последовательности SEQ ID №: 14.
Процентную идентичность можно рассчитать путем выполнения парного глобального выравнивания на основе алгоритма выравнивания Нидлмана-Вунша для поиска оптимального выравнивания (включая разрывы) двух последовательностей по всей длине, например, с применением Needle, или с помощью BLOSUM62 матрицы со штрафом на внесение разрыва в выравнивание 10 и штрафом на продолжение разрыва 0,5.
В особо предпочтительном варианте осуществления псевдотипированную вирусную векторную частицу в соответствии с настоящим изобретением можно получить или получают посредством способа получения, описанного в разделе «Способ получения псевдотипированной вирусной векторной частицы» ниже.
Биологический материал
Псевдотипированные вирусные векторные частицы из настоящего изобретения представляют особый интерес для переноса биологических материалов в клетки, в частности, в гемопоэтические клетки.
Соответственно, в предпочтительном варианте осуществления псевдотипированные вирусные векторные частицы, как определено выше, дополнительно содержат биологический материал.
Как подразумевается в настоящей заявке, выражение «биологический материал» относится к одному или нескольким соединениям, способным изменять структуру и/или функцию клетки. В контексте настоящего изобретения биологический материал предпочтительно является одной или несколькими нуклеиновыми кислотами, которые в случае лентивирусных векторных частиц могут быть включены в геном векторной частицы. Геном, как правило, содержит одну или несколько нуклеиновых кислот, предпочтительно, связанных с генетическими элементами, необходимыми для их экспрессии в клетке-мишени, такими как промоторы и терминаторы, с расположенными по бокам цис-действующими элементами, необходимыми для включения генома в коровый элемент, его обратной транскрипции в дезоксирибонуклеиновую кислоту (ДНК), импорта ретротранскрибированного генома в ядро клетки-мишени, и интеграции ретротранскрибированного генома в геном клетки-мишени.
Примеры интересующих нуклеиновых кислот включают глобиновые гены, гемопоэтические факторы роста, которые включают эритропоэтин (ЭПО), интерлейкины (особенно интерлейкин-1, интерлейкин-2, интерлейкин-3, интерлейкин-6, интерлейкин-12, и т.д.), и колониестимулирующие факторы (такие, как гранулоцитарный колониестимулирующий фактор, гранулоцитарно/макрофагальный колониестимулирующий фактор, или колониестимулирующий фактор стволовых клеток), тромбоцит-специфический интегрин aIIbβ, гены множественной лекарственной устойчивости; гены gp91 или gp47, дефектные у пациентов с хронической гранулематозной болезнью (ХГБ); антивирусные гены, придающие клетке устойчивость к инфекции патогенами, такими как вирус иммунодефицита человека; гены, кодирующие факторы гемокоагуляции VIII или IX, которые являются мутантными при гемофилии; лиганды, вовлеченные в Т-клеточно-опосредованный иммунный ответ, такие как Т-клеточные рецепторы антигена, В-клеточные рецепторы антигена (иммуноглобулины), общая γ-цепь рецептора интерлейкина, комбинация Т- и В-клеточных рецепторов антигена по отдельности и/или в комбинации с одноцепочечными антителами (ScFv), IL-2, IL-12, ФНО, интерфероном-гамма, CTLA4, В7 и тому подобными; гены, экспрессируемые в опухолевых клетках, таких как MelanA; гены MAGE (такие, как MAGE-1, MAGE-3), P198, Р1А, gp100, и т.д.
Как подразумевается в настоящей заявке, термин «перенос» относится к исходной способности векторной частицы к доставке биологического материала в мембрану или цитоплазму клетки-мишени при связывании с клеткой-мишенью. После доставки биологический материал может быть перемещен в другую часть клетки.
Как применяется в настоящей заявке, клетки-реципиенты, в которые нужно перенести биологический материал, или клетки-мишени, означают любую клетку, которая может связаться с вышеуказанной векторной частицей. Если векторная частица является лентивирусной векторной частицей, клетка-мишень означает любую клетку, способную к трансдукции с помощью векторной частицы. Эти клетки предпочтительно являются гемопоэтическими клетками человека.
Гемопоэтические клетки
Как применяется в настоящей заявке, термин «гемопоэтическая клетка» означает, как правило, клетки крови, как из миелоидной, так и из лимфоидной линии. В частности, термин «гемопоэтическая клетка» включает как недифференцированные и слабо дифференцированные клетки, такие как гемопоэтические стволовые клетки и клетки-предшественники, так и дифференцированные клетки, такие как Т-лимфоциты, В-лимфоциты или дендритные клетки. Предпочтительно, гемопоэтические клетки выбраны из группы, состоящей из гемопоэтических стволовых клеток, CD34+клеток-предшественников, в частности, клеток периферической крови CD34+, очень ранних клеток-предшественников CD34+, В-клеток-предшественников CD19+, миелоидных клеток-предшественников CD13+ Т-лимфоцитов, В-лимфоцитов, моноцитов, дендритных клеток; опухолевых В-клеток, в частности, клеток В-клеточной хронической лимфоцитарной лейкемии (BCLL) и В-клеточной лимфомы из клеток маргинальной зоны (MZL), и тимоцитов.
Как известно специалистам в данной области техники, каждая гемопоэтическая клетка происходит из гемопоэтической стволовой клетки костного мозга.
Как применяется в настоящей заявке, термин «гемопоэтическая стволовая клетка» или «ГСК» относится к клетке, способной восполнять все типы клеток крови и самообновляться. Гемопоэтические стволовые клетки могут быть, в частности, определены как клетки, поддерживающие уровни миелоидных, Т- и В-клеток на четко выявляемых уровнях (обычно более 1% от периферических клеток крови) в течение 16 недель при введении в циркуляцию мыши-реципиента с истощенной гемопоэтической системой (Schroeder (2010) Cell Stem Cell 6: 203-207).
Как применяется в настоящей заявке, термин «CD34+клетка-предшественник» относится к гетерогенной популяции, включающей субпопуляцию ГСК, плюрипотентных стволовых клеток и клеток на ранних стадиях детерминации дифференцировки. Клетки-предшественники CD34+ постоянно мигрируют в/из костного мозга здоровых взрослых животных. Они могут дифференцироваться до получения всех линий гемопоэтических клеток, находящихся в циркуляции. Выражение «CD34+клетки периферической крови» в частности, относится к CD34+ клеткам, присутствующим в крови.
Авторы настоящего изобретения предварительно стимулировали CD34+ранние человеческие клетки-предшественники сильным цитокиновым коктейлем (ФСК, ТПО и Flt3-L), и трансдуцировали их псевдотипированными лентивирусными векторными частицами BaEV/TR и BaEVRLess. Они показали, что псевдотипированные лентивирусные векторные частицы могут эффективно трансдуцировать человеческие CD34+ ранние клетки-предшественники, в частности, более чем на 70% в присутствии ретронектина.
Далее, авторы настоящего изобретения показали, что высокая трансдукция человеческих CD34+ клеток, полученная с псевдотипированными лентивирусными векторными частицами BaEV/TR и BaEVRLess, была обусловлена стабильной трансдукцией транзиторных предшественников. Действительно, не отмечено существенного различия между пропорцией трансдуцированных BaEV/TR и BaEVRLess лентивирусными векторными частицами CD34+клеток после предварительной стимуляции ФСК/ТПО и клоногенных предшественников, полученных из них. Напротив, для лентивирусных векторных частиц, псевдотипированных VSV-G, пропорция трансдуцированных клоногенных предшественников была существенно ниже, чем уровень трансдуцированных CD34+ клеток, из которых они были получены.
Как применяется в настоящей заявке, термин «очень ранняя CD34+ клетка-предшественник» означает подгруппу CD34+клеток-предшественников, обогащенных в ГСК.
Как применяется в настоящей заявке, термин «CD19+ В-клетка-предшественник» означает популяцию В-клеток, экспрессирующих на поверхности CD10, CD34 и CD19.
Как применяется в настоящей заявке, термин «миелоидная CD13+ клетка-предшественник» означает популяцию миелоидных клеток, экспрессирующих на поверхности CD34 и CD13, и факультативно CD33.
Авторы изобретения показали, что BaEV/TR и BaEVRLess псевдотипированные лентивирусные векторные частицы способны к трансдукции с высокой эффективностью гемопоэтических предшественников, способных к репопуляции иммунодефицитной мыши. Они оценили способность к долговременному восстановлению трансдуцированных этими псевдотипированными лентивирусными векторными частицами человеческих CD34+клеток на модели иммунодефицитных мышей Rag2-/- γ-/- Balbc и мышиной модели NOD/SCID/γc-/- (NSG). Они показали, что очень ранние CD34+клетки-предшественники, а также CD19+ В-клетки-предшественники и миелоидные CD13+ клетки были трансдупированы до той же самой степени посредством псевдотипированных лентивирусных векторных частиц BaEV/TR и BaEVRLess из настоящего изобретения при низких инфицирующих дозах векторной частицы. Далее, BaEV/TR-LV и BaEVRLess-LV трансдуцировали hCD34+ клетки, приводя к высоким уровням восстановления в костном мозге и к наивысшим уровням трансдукции ТКИД репопулирующих клеток (до 90% CD45+GFP+клеток) в костном мозге. Они также показали, что эти высокие уровни трансдукции поддерживались у мыши - первичного реципиента во всех гемопоэтических тканях (костном мозге, тимусе и селезенке). Эквивалентный высокий уровень трансдукции был выявлен для незрелых предшественников (hCD34+ клеток), лимфоидных клеток (CD19+) и миелоидных клеток (CD13+ и CD14+) в костном мозге. Напротив, лентивирусные векторные частицы, псевдотипированные VSV-G, трансдуцируют ранние CD34+предшественники, CD13+ миелоидные предшественники и моноциты до гораздо более низких уровней. Для лентивирусных векторных частиц, псевдотипированных RD114/TR, также был выявлена низкая трансдукция всех различных костномозговых клеточных линий. Аналогичная картина наблюдалась для Т- и В-клеток и моноцитов в селезенке. RD114/TR-LV продемонстрировали вариабельные уровни трансдукции ТКИД репопулирующих клеток (в диапазоне от 3,2-76% от GFP+CD45+ клеток).
Авторы изобретения также показали, что в селезенке и костном мозге процент GFP+hCD45+ клеток поддерживался или повышался после вторичной трансплантации hCD34+ клеток, выделенных из первичных реципиентов у иммунодефицитной мыши. Далее, и для BaEV/TR-, и для BaEVRLess-LV были обнаружены высокие уровни GFP+hCD34+ ранних предшественников, лимфоидных (CD19+) и миелоидных (CD13+) клеток в костном мозге этих мышей - вторичных реципиентов, и эквивалентный процент GFP+ клеток был выявлен в этих разных линиях. Таким образом, авторы настоящего изобретения показали, что вторичные восстановленные ТКИД репопулирующие клетки способны к смешанной дифференцировке, и что действительное человеческие ГСК были генетически модифицированы до высоких уровней BaEV/TR- и BaEVRLess-LV.
Авторы настоящего изобретения показали, что BaEV/TR и BaEVRLess псевдотипированные лентивирусные векторные частицы обеспечивают эффективную трансдукцию человеческих Т-клеток, в частности предварительно стимулированных IL-7 человеческих Т-клеток. Эти псевдотипированные лентивирусные векторные частицы превосходили лентивирусные векторные частицы, псевдотипированные VSV-G в тех же самых дозах вектора в присутствии ретронектина. Важно, что BaEV/TR и BaEVRLess псевдотипированные лентивирусные векторные частицы обеспечивают эффективную трансдукцию как интактных, так и предварительно стимулированных IL-7 Т-клеток памяти. Действительно, они обеспечивают трансдукцию IL-стимулированных Т-клеток без нарушения их интактного фенотипа. Особо интересно, что они также обеспечивают близкий к 100% перенос гена Т-клеток при стимуляции Т-клеточного рецептора (TCR) при MOI 10.
Таким образом, в частном варианте осуществления гемопоэтической клеткой-предшественником является Т-клетка, предпочтительно интактная или Т-клетка памяти.
BaEV/TR и BaEVRLess псевдотипированные лентивирусные векторные частицы также обеспечивают высоко эффективную трансдукцию 20-30% покоящихся В-клеток, и таким образом, явно превосходят лентивирусные векторные частицы, псевдотипированные с VSV-G или RD114/TR, не обеспечивающие трансдукцию или обеспечивающие очень низкую трансдукцию покоящихся В-клеток человека. Далее, при стимуляции В-клеточного рецептора (BCR), BaEV/TR и BaEVRLess псевдотипированные лентивирусные векторные частицы трансдуцируют до 70% В-клеток, в то время как трансдукция лентивирусными векторными частицами, псевдотипированными с VSV-G, действительно не превышает 5%. Важно, что как клетки памяти, так и интактные В-клетки были эффективно трансдуцированы BaEV/TR и BaEVRLess псевдотипированными лентивирусными векторными частицами.
Таким образом, в частном варианте осуществления целевые гемопоэтические клетки являются В-клетками, в частности, покоящимися В-клетками, предпочтительно, интактными клетками или В-клетками памяти. Они могут быть также опухолевой В-клеткой, в частности, В-клеткой хронической лимфоцитарной лейкемии (BCLL) или В-клеточной лимфомы из клеток маргинальной зоны (MZL).
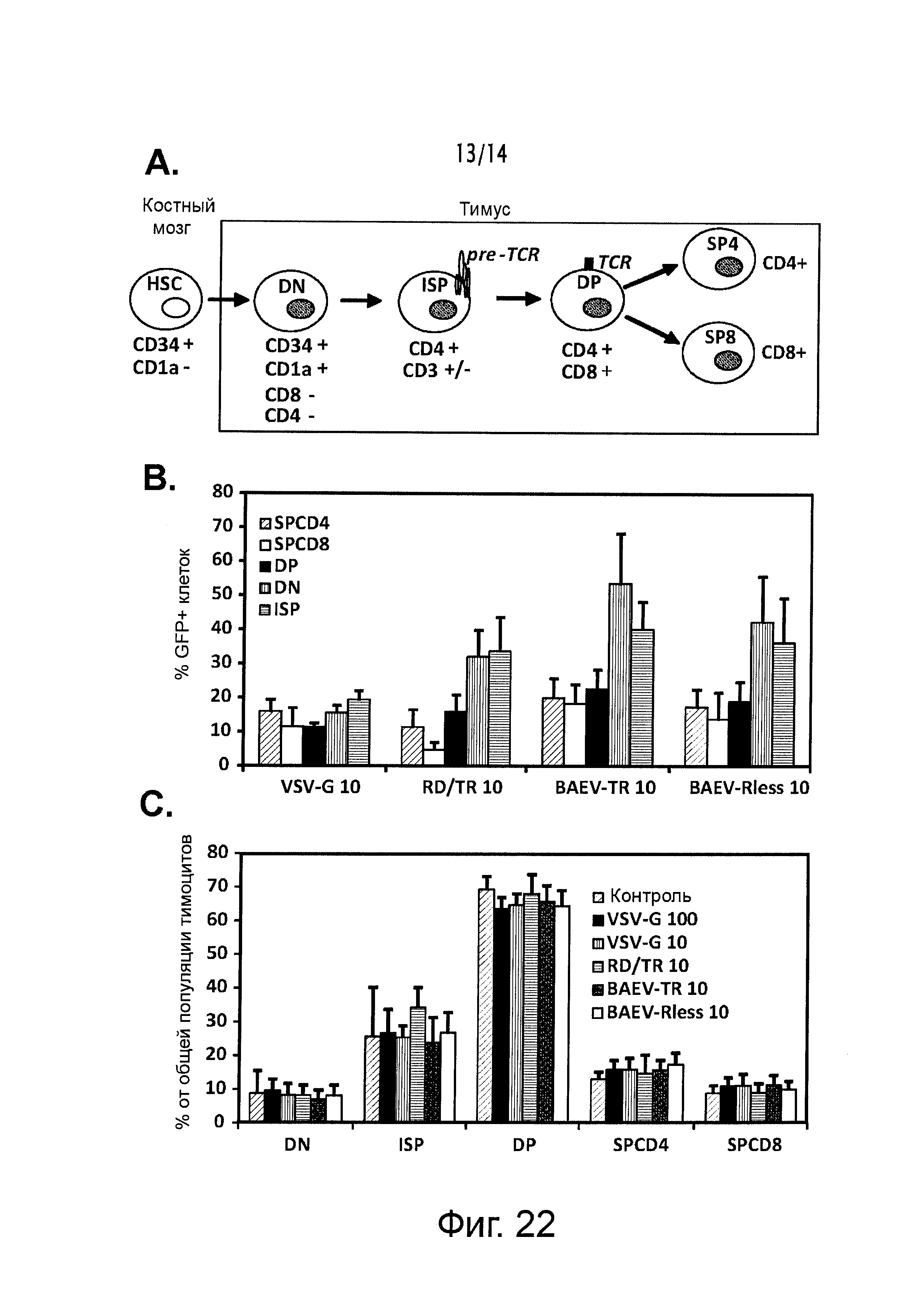
Благодаря потенциальному значению переноса тимоцитарных генов для иммуномодуляции, авторы настоящего изобретения оценили активность BaEVgp-LV по сравнению с другими LV псевдотипами для трансдукции различных субпопуляций тимоцитов. При выделении тимоцитов из тимуса человека, их трансдуцировали в присутствии определяющего выживание цитокина IL-7 с VSV-G-, RD114/TR-, BaEV/TR-, и BaEVRLess-LV, кодирующими GFP репортер при MOI 10. Авторы настоящего изобретения показали, что RD114/TR-LV, BaEV/TR-LV и BaEVRLess-LV обеспечивают предпочтительную трансдукцию тимоцитов на ранних стадиях развития (двойных негативных и незрелых CD4 одинарных позитивных клеток), в то время как они обеспечивают трансдукцию более зрелых до более низких уровней. Как уже было установлено для зрелых человеческих Т-клеток, BaEVgp LV трансдуцируют все различные субпопуляции тимоцитов более эффективно, чем RD114/TR-LV. Далее, трансдукция различными псевдотипами лентивирусных векторов не оказывает влияние на распределение различных субпопуляций тимоцитов. Таким образом, авторы настоящего изобретения продемонстрировали, что BaEVgp-LV являются отличным инструментом для трансдукции тимоцитов, и что они особенно превосходят VSV-G- и RD114/TR-LV для трансдукции субпопуляций незрелых двойных негативных (DN) и незрелых CD4 одинарных позитивных (ISP) тимоцитов.
Таким образом, в частном варианте осуществления гемопоэтическая клетка-мишень является тимоцитом.
Наконец, авторы настоящего изобретения предварительно стимулировали свежевыделенные общие Т-клетки пуповинной крови с цитокином выживания Т-клеток IL-7 для сохранения интактного фенотипа Т-клеток, а затем трансдуцировали их различными векторами: VSV-G-, RD114/TR-, BaEV/TR-, и BaEVRLess-LV, кодирующими GFP репортер, при MOI 10 или 20, или при MOI 50 для VSV-G-LV. Они показали, что BaEV/TR- и BaEVRLess-LV обеспечивают эффективность трансдукции, значительно более высокую (40-50% трансдукции) при MOI=10, по сравнению с VSV-G или RD114/TR-LV. Важно, что BaEV/TR- и BaEVRLess-LV легко достигали 65% трансдукции, когда доза вектора повышалась в два раза (MOI=20). Во всех случаях интактные недавние тимоцитарные эмигранты (CD69L+CD45RA+CD31+) были трансдуцированы до той же степени, что и более зрелые интактные ПК Т-клетки (CD69L+CD45RA+CD31-), Далее, трансдукция не оказывала влияния на распределение этих двух интактных ПК Т-клеточных популяций.
Таким образом, в частном варианте осуществления гемопоэтические клетки-мишени являются интактными клетками. Как применяется в настоящей заявке, термин «интактные клетки» относится к клеткам, которые не подвергаются клеточной активации в ответ на стимул. В частности, «интактная клетка» может быть клеткой, которую не подвергали воздействию антигена.
Поскольку сильная стимуляция цитокиновым коктейлем индуцирует дифференцировку ГСК и потерю их способности к самообновлению, очень важно как можно меньше предварительно стимулировать клетки, чтобы как можно больше предотвратить их дифференцировку, и для большего сохранения их «признаков стволовых клеток».
Авторы настоящего изобретения применяли псевдотипированные вирусные векторы в соответствии с настоящим изобретением при фиксированной MOI (число инфекционных частиц на клетку) 10 и различных протоколах предварительной стимуляции цитокинами человеческих CD34+ ранних клеток-предшественников: (1) без стимуляции; (2) при стимуляции ФСК или ТПО; (3) при стимуляции ФСК и ТПО; (4) при стимуляции ФСК, ТПО и Flt3-L. Важно, что наиболее сильный использованный цитокиновый коктейль для предварительной стимуляции был слабее коктейлей для предварительной стимуляции, используемых в настоящее время в клинике для ограничения клеточной дифференцировки. Авторы настоящего изобретения показали, что BaEV/TR и BaEVRLess лентивирусные векторные частицы были способны к трансдукции 10-20% не стимулированных человеческих CD34+ранних клеток-предшественников, в то время как лентивирусные векторы, псевдотипированные VSV-G или RD114/TR (как описано в международной заявке WO 2009/013324), были неспособными к эффективной трансдукции нестимулированных покоящихся человеческих CD34+ ранних клеток-предшественников при таких же дозах вектора. Далее, стимуляция одним ТПО была достаточной для трансдукции человеческих CD34+ ранних клеток-предшественников до 60% для BaEV/TR и BaEVRLess псевдотипированных лентивирусных векторов, в то время как лентивирусные векторы, псевдотипированные с VSV-G или RD114/TR, трансдуцировали только 8-20% человеческих CD34+ранних клеток-предшественников в этих условиях. Предварительная стимуляция одним ФСК обеспечивала трансдукцию 30-50% человеческих CD34+ ранних клеток-предшественников с BaEV/TR и BaEVRLess псевдотипированными лентивирусными векторами, в то время как лентивирусные векторы, псевдотипированные с VSV-G или RD114/TR, достигают уровней трансдукции только 10%. Наконец, предварительная стимуляция комбинацией ТПО и ФСК или ТПО, СФК и Flt3-L с инкубацией с одним BaEV/TR или BaEVRLess псевдотипированным лентивирусным вектором обеспечивает до 75% трансдукции человеческих CD34+ ранних клеток-предшественников, в то время как лентивирусные векторы, псевдотипированные только с RD114/TR, достигают 40% трансдукции.
Соответственно, в предпочтительном варианте осуществления гемопоэтическая клетка-мишень не является предварительно стимулированной по меньшей мере одним цитокином. В частности, она не являются предварительно стимулированной ФСК, ТПО и/или Flt3-L.
В другом предпочтительном варианте осуществления гемопоэтическая клетка-мишень предварительно стимулирована только ФСК или ТПО. В другом предварительном варианте осуществления гемопоэтическая клетка-мишень предварительно стимулирована только ФСК и ТПО.
Как применяется в настоящей заявке, термин «предварительная стимуляция» или «предварительно симулированный» означает, что гемопоэтическая клетка контактирует по меньшей мере с одним цитокином в концентрации или в течение периода времени, подходящих для индукции специфической активации гемопоэтической клетки.
Как применяется в настоящей заявке, термин «fms-подобный лиганд рецепторной тирозинкиназы-3», «Flt3 лиганд» или «Flt3-L» означает цитокин, повышающий число иммунных клеток путем активации гемопоэтических предшественников. Flt3-L предпочтительно является человеческим Flt3-L, и более предпочтительно, содержит или состоит из последовательности SEQ ID №: 15.
Способ получения псевдотипированной вирусной векторной частицы
Настоящее изобретение также относится к способу получения псевдотипированной вирусной векторной частицы, включающему:
а) трансфекцию клетки с:
(i) по меньшей мере одной первой нуклеиновокислотной последовательностью, содержащей способный к упаковке геном ретровирусного происхождения;
(ii) по меньшей мере одной второй нуклеиновокислотной последовательностью, содержащей кДНК, кодирующую коровые белки из указанных ретровирусов, и
(iii) по меньшей мере одной третьей нуклеиновокислотной последовательностью, содержащей кДНК, кодирующую:
- химерный оболочечный гликопротеин, содержащий или состоящий из гибрида трансмембранного и внеклеточного домена оболочечного гликопротеина эндогенного ретровируса бабуинов (BaEV) и цитоплазматического хвостового домена оболочечного гликопротеина вируса лейкемии мышей (MLV), как определено выше; или
- модифицированный оболочечный гликопротеин BaEV, в котором цитоплазматический хвостовой домен лишен ингибирующего слияние R пептида, как определено выше;
до получения клетки-продуцента;
b) сохранение клетки-продуцента в культуре в течение времени, достаточного для экспрессии кДНК для продукции кодированных белков; и
c) обеспечение формирования из кодированных белков вирусных векторных частиц в соответствии с настоящим изобретением.
«Ретровирус» означает вирус, геном которого состоит из молекулы РНК, и который включает обратную транскриптазу, т.е. член семейства Retroviridae. Ретровирусы делятся на онковирусы, лентивирусы и спумавирусы. Предпочтительно, указанный ретровирус является онковирусом, например, MLV, ALV, RSV или MPMV; лентивирусом, например, ВИЧ-1, ВИЧ-2, SIV, EIAV или CAEV; или спумавирусом, таким как HFV. Геномы этих ретровирусов доступны в базах данных. Более предпочтительно, указанный ретровирус является лентивирусом, в частности, ВИЧ-1, ВИЧ-2 или SIV.
В контексте настоящего изобретения «нуклеиновокислотная последовательность, содержащая способный к упаковке геном ретровирусного происхождения» означает последовательность, содержащую ретровирусные нуклеиновокислотные последовательности, известные как «цис-действующие последовательности». Они включают длинные концевые повторы (LTR) для контроля транскрипции и интеграции, psi-последовательность, необходимую для капсидирования, и последовательности участка связывания праймера (PBS) и полипуринового тракта (РРТ), необходимые для обратной транскрипции ретровирусного генома. Предпочтительно, указанная нуклеиновокислотная последовательность, содержащая способный к упаковке геном ретровирусного происхождения, дополнительно содержит трансген.
Указанный ретровирусный геном может быть с дефективной репликацией или быть компетентным к репликации, при отсутствии какой-либо транс-комплементарной функции. Компетентный к репликации геном дополнительно содержит ретровирусные гены gag, pol и env. В геноме с дефективной репликацией вирусные гены gag, pol и env удалены. Однако сборка вирусных векторных частиц из настоящего изобретения может быть достигнута путем обеспечения в транс-последовательности другой плазмиды, кодирующей gag, pol и/или env гликопротеин, но дефективной для «цис» последовательностей. Их экспрессия обеспечивает капсидирование трансгена, исключая гены, необходимые для умножения вирусного генома и для образования полных вирусных частиц.
«Капсидный белок из ретровируса» означает белки, кодируемые генами gag и pol. Ген gag кодирует полипротеин, который далее обрабатывается ретровирусной протеазой в структурные белки, содержащие капсид. Ген pol кодирует ретровирусную протеазу, обратную транскриптазу, и интегразу.
С целью трансфекции указанные первая, вторая и третья нуклеиновокислотные последовательности могут переноситься на одном и том же векторе, или на двух или трех отдельных векторах. Как правило, одна плазмида кодирует капсидный ретровирусный компонент вирусной векторной частицы. Происхождение генов gag и pol обеспечивает наименование вирусной векторной частицы. Например, выражение «вирусная частица, полученная из HIV-1» обычно означает, что гены gag и pol векторной частицы получены из HIV-1.
Термин «трансфекция» означает введение чужеродной нуклеиновой кислоты (ДНК, кДНК или РНК) в клетку так, чтобы клетка-носитель экспрессировала введенный ген или последовательность для получения необходимого вещества, как правило, белка, кодированного введенным геном или последовательностью. Введенный ген может включать регуляторные или контрольные последовательности, такие как стартовая, терминирующая, промоторная, сигнальная, секреторная или другие последовательности, используемые в генетическом механизме клетки. Клетка-носитель, получающая и экспрессирующая введенные ДНК или РНК, является «трансфицированной».
Для получения вирусных частиц можно применять любую клетку, совместимую с экспрессией лентивирусных генов Gag и Pol, или любую клетку, которую можно приспособить для такой экспрессии. Например, можно применять такие клетки-продуценты, как 293 Т клетки и клетки насекомых (в частности, для векторов, полученных из HIV), ТЕ 671 и НТ1080 клетки (в частности, для векторов, полученных из MLV).
Терапевтическое применение
Настоящее изобретение также относится к медикаменту, содержащему псевдотипированную вирусную векторную частицу, как определено выше, в качестве активного ингредиента, в частности псевдотипированную вирусную векторную частицу, как определено выше, дополнительно содержащую биологический материал, который предпочтительно является одной или несколькими нуклеиновыми кислотами.
Оно также относится к фармацевтической композиции, содержащей псевдотипированную вирусную векторную частицу, как определено выше, в частности, псевдотипированную вирусную векторную частицу, как определено выше, дополнительно содержащую биологический материал, который предпочтительно является одной или несколькими нуклеиновыми кислотами, и фармацевтически пригодным носителем.
Настоящее изобретение также относится к способу лечения субъекта, нуждающегося в нем, дополнительно включающему применение терапевтически эффективного количества псевдотипированной вирусной векторной частицы, как определено выше, в частности, псевдотипированной вирусной векторной частицы, как определено выше, дополнительно содержащей биологический материал, который предпочтительно является одной или несколькими нуклеиновыми кислотами, у субъекта, нуждающегося в лечении.
В контексте настоящего изобретения «субъект» означает человека или млекопитающее, не являющееся человеком, такое, как грызун (крыса, мышь, кролик), примат (шимпанзе), представитель семейства кошачьих (кошка), представитель семейства псовых (собака). Предпочтительно, субъект является человеком.
Как применяется в настоящей заявке, «фармацевтически пригодный носитель» означает носитель, который можно применять у пациента вместе с вирусным вектором из настоящего изобретения, и который не нарушает его фармакологической активности и не является токсичным при применении в дозах, достаточных для доставки фармацевтически эффективного количества вирусного вектора.
Фармацевтически пригодные носители и растворители, которые можно использовать в фармацевтических условиях настоящего изобретения, включают ионообменники, окись алюминия, стеарат алюминия, лецитин; самоэмульгирующиеся системы лекарственной доставки (SEDDS), такие как d-α-токоферол-полиэтиленгликоль-1000-сукцинат; сурфактанты, используемые в фармацевтических лекарственных формах, такие как Твин или другие подобные полимерные матрицы доставки; сывороточные белки, такие как сывороточный альбумин человека; буферные вещества, такие как фосфаты; глицин, сорбиновую кислоту, сорбат калия, частичные глицеридные смеси насыщенных растительных жирных кислот, воду, соли или электролиты, такие как протамин-сульфат, динатрия гидросульфат, калия гидросульфат, натрия хлорид, соли цинка, коллоидный диоксид кремния, магния трисиликат, поливинилпирролидон, вещества на основе целлюлозы, полиэтиленгликоль, натрия карбоксиметилцеллюлозу, полиакрилаты, воски, полиэтилен-полиоксипропилен блок-сополимеры, полиэтиленгликоль и ланолин, но не ограничиваются ими. Предпочтительно, можно также применять циклодекстрины, такие как α-, β-, и γ-цикло декстрин, или химически модифицированные производные, такие как гидроксиалкилциклодекстрины, включая 2- и 3-гидроксипропил-β-циклодекстрины, или другие солюбилизированные производные, для усиления доставки композиций в соответствии с настоящим изобретением.
Можно применять любой подходящий способ применения, известный специалистам в данной области техники. В частности, псевдотипированную вирусную векторную частицу в соответствии с настоящим изобретением можно применять, например, пероральным путем или парентеральным путем (в частности, путем внутривенной инъекции и интрафеморальной инъекции (в костномозговую полость)). Когда выбран парентеральный способ введения, псевдотипированные вирусные векторные частицы могут быть в форме растворов и суспензий для инъекций, находящихся в ампулах или флаконах. Формы для парентерального введения обычно получают путем смешивания псевдотипированных вирусных векторных частиц в соответствии с настоящим изобретением с буферными веществами, стабилизаторами, консервантами, солюбилизирующими агентами, изотоническими агентами и суспендирующими агентами. В соответствии с известными методиками, эти смеси можно затем стерилизовать и кондиционировать в форме для внутривенных инъекций. Специалист в данной области техники может применять в качестве буферных агентов буферные агенты на основе органических фосфатных солей. Примеры суспендирующих агентов включают метилцеллюлозу, камедь акации и натрия карбоксиметилцеллюлозу. Примеры стабилизаторов включают сульфит натрия и метасульфит натрия, а примеры консервантов включают натрия п-гидроксибензоат, сорбиновую кислоту, крезол и хлоркрезол.
«Терапевтически эффективное количество» означает количество вирусного вектора, обеспечивающее терапевтический эффект у субъекта, подвергающегося лечению. Терапевтический эффект может быть объективным (т.е. измеряемый каким-либо анализом или маркером) или субъективным (т.е. субъект отмечает или ощущает эффект). Как известно специалисту в данной области техники, эффективные дозы варьируют в зависимости от пути применения, размера и/или массы тела субъекта, а также возможности совместного использования с другими агентами.
Когда псевдотипированную вирусную векторную частицу применяют в качестве медикамента у субъекта в способе лечения, предпочтительным является внутривенное ведение или медуллярное введение, в частности, введение в костный мозг в бедре или плече. Для внутривенного введения можно применять дозу примерно от 5×108 до 109псевдотипированных вирусных векторных частиц, как определено выше, в то время как при медуллярном применении можно применять дозу примерно от 108 до 5×108псевдотипированных вирусных векторных частиц.
В частном варианте осуществления псевдотипированная вирусная векторная частица предназначена для лечения гемопоэтических нарушений или аутоиммунного заболевания.
Настоящее изобретение также относится к применению псевдотипированной вирусной векторной частицы, как определено выше, для производства медикамента, предназначенного для лечения гемопоэтических нарушений или аутоиммунного заболевания. Оно также относится к способу лечения гемопоэтических нарушений или аутоиммунного заболевания у субъекта, включающему введение терапевтически эффективного количества псевдотипированной вирусной векторной частицы из настоящего изобретения субъекту, который нуждается в лечении.
Как применяется в настоящей заявке, выражение «нарушение гемопоэза» относится к заболеванию крови, в частности, к заболеванию с вовлечением гемопоэтических клеток. Предпочтительно, указанное нарушение гемопоэза является моногенным нарушением гемопоэза.
Как применяется в настоящей заявке, выражение «моногенное нарушение гемопоэза» относится к генетическому нарушению гемопоэза, обусловленному мутацией единичного гена.
Примеры нарушений гемопоэза включают миелодисплазию, апластическую анемию, анемию Фанкони, пароксизмальную ночную гемоглобинурию, серповидно-клеточную анемию, синдром Даймонда-Блэкфана, синдром Швахмана-Даймонда, синдром Костмана, хроническую гранулематозную болезнь, адренолейкодистрофию, дефицит адгезии лейкоцитов, гемофилию, талассемию, бета-талассемию; лейкемию, такую как острый лимфобластный лейкоз (ОЛЛ), острый миелобластный (миелоидный лейкоз) (ОМЛ), зрелый лимфобластный лейкоз, хронический лимфоцитарный лейкоз (ХЛЛ), В-клеточный хронический лимфоцитарный лейкоз (В-ХЛЛ), хронический миелоидный лейкоз (ХМЛ), ювенильный хронический миелолейкоз (ЮХМЛ) и ювенильный миеломоноцитарный лейкоз (ЮММЛ), тяжелый комбинированный иммунодефицит (ТКИД), Х-сцепленный тяжелый комбинированный иммунодефицит, синдром Вискотт-Олдрича (СВА), дефицит аденозиндезаминазы (ДАД), синдром Чедиака-Хигаси, лимфому Ходжкина, неходжкинскую лимфому (НХЛ) и СПИД.
Предпочтительно, нарушение гемопоэза выбрано из группы, состоящей из синдрома Фанкони, гемофилии, бета-талассемии, синдрома Вискотт-Олдрича, Х-сцепленного тяжелого комбинированного иммунодефицита, дефицита аденозиндезаминазы, хронической гранулематозной болезни и адренолейкодистрофии.
Как применяется в настоящей заявке, выражение «аутоиммунное заболевание» относится к заболеванию, обусловленному сверхактивным иммунным ответом организма на вещества и ткани, присутствующие в организме в норме. Соответственно, при специфически нацеленных иммунных (гемопоэтических) клетках, вовлеченных в этот сверхактивный иммунный ответ, векторные частицы из настоящего изобретения могут быть полезными инструментами в лечении аутоиммунных заболеваний.
Аутоиммунные заболевания включают, в частности, острый демиелинизирующий энцефаломиелит, острый геморрагический лейкоэнцефалит, болезнь Аддисона, агаммаглобулинемию, гнездную алопецию, латеральный амиотрофический склероз, анкилозирующий спондилит, антифосфолипидный синдром, антисинтетазный синдром, атопическую аллергию, аутоиммунную апластическую анемию, аутоиммунную кардиомиопатию, аутоиммунную энтеропатию, аутоиммунную гемолитическую анемию, аутоиммунный гепатит, аутоиммунное заболевание внутреннего уха, аутоиммунный лимфопролиферативный синдром, аутоиммунную периферическую нейропатию, аутоиммунный панкреатит, аутоиммунный полиэндокринный синдром, аутоиммунный прогестероновый дерматит, аутоиммунную тромбоцитопеническую пурпуру, аутоиммунную уртикарную сьшь, аутоиммунный увеит, болезнь Бало, концентрический склероз Бало, синдром Бехчета, болезнь Бергера, энцефалит Бикерстаффа, синдром Блау, буллезный пемфигоид, рак, болезнь Кастлмана, целиакию, хроническую воспалительную демиелинизирующую полинейропатию, хронический рецидивирующий мультифокальный остеомиелит, синдром Черджа-Стросс, рубцовый пемфигоид, синдром Когана, синдром холодовой агглютинации, дефицит компонента комплемента 2, краниальный артериит, CREST синдром, болезнь Крона, синдром Кушнга, кожный лейкоцитокластический ангиит, болезнь Дего, болезнь Деркума, герпетиформный дерматит, дерматомиозит, сахарный диабет 1 типа, диффузный кожный системный склероз, синдром Дресслера, дискоидную красную волчанку, экзему, связанный с энтезитом артрит, эозинофильный фасциит, эозинофильный гастроэнтерит, приобретенный буллезный эпидермолиз, узловую эритему, эссенциальную смешанную криоглобулинемию, синдром Эвана, оссифицирующую прогрессирующую фибродисплазию, фиброзирующий альвеолит, гастрит, желудочно-кишечный пемфигоид, гигантоклеточный артериит, синдром Гудпасчера, базедову болезнь, синдром Гийена-Барре (СГБ), энцефалит Хашимото, тиреоидит Хашимото, гемолитическую анемию, пурпуру Шенлейна-Геноха, гестационный герпес, гипогаммаглобулинемию, идиопатическое воспалительное демиелинизирующее заболевание, идиопатический легочный фиброз, идиопатическую тромбоцитопеническую пурпуру, IgA нефропатию, миозит с включенными тельцами, воспалительную демиелинизирущую полинейропатию, интерстициальный цистит, ювенильный идиопатический артрит, ювенильный ревматоидный артрит, болезнь Кавасаки, миастенический синдром Ламберта-Итона, лейкоцитокластический васкулит, красный плоский лишай, склероатрофический лишай, IgA-зависимый линейный дерматоз (ЛАД), болезнь Лу Герига, волчаночный гепатит, системную красную волчанку, синдром Majeed, болезнь Меньера, микроскопический полиангиит, синдром Миллера-Фишера, смешанное заболевание соединительной ткани, кольцевидную склеродермию, болезнь Мухи-Габерманна, рассеянный склероз, миастению гравис, миозит, нейромиелит зрительного нерва, нейромиотонию, глазной рубцевой пемфигоид, опсоклонус-миоклонус-синдром, атрофическую форму аутоиммунного тиреоидита, палиндромный ревматизм, паранеопластическую мозжечковую дегенерацию, пароксизмальную ночную гемоглобинурию (ПНГ), синдром Парри-Ромберга, синдром Персонейджа-Тернера, парспланит, вульгарную пузырчатку, пернициозную анемию, перивенозный энцефаломиелит, POEMS-синдром, узелковый полиартериит, ревматическую полимиалгию, полимиозит, первичный билиарный цирроз, первичный склерозирующий холангит, прогрессирующую воспалительную нейропатию, псориаз, псориатический артрит, гангренозную пиодермию, истинную эритроцитарную аплазию, энцефалит Расмуссена, синдром Рейно, рецидивирующий полихондрит, синдром Рейтера, синдром усталых ног, ретроперитонеальный фиброз, ревматоидный артрит, ревматическую лихорадку, саркоидоз, синдром Шмидта, синдром Шницлера, склерит, склеродермию, синдром Шегрена, спондилоартропатию, болезнь Стилла, синдром мышечной скованности, подострый бактериальный эндокардит, синдром Сусака, синдром Свита, хорею Сиденгама, симпатическую офтальмию, синдром Такаясу, височный артериит, синдром Толоса-Ханта, поперечный миелит, язвенный колит, недифференцированное заболевание соединительной ткани, недифференцированную спондилоартропатию, васкулит, витилиго и гранулематоз Вегенера.
Предпочтительно, аутоиммунное заболевание выбрано из онкологического заболевания, диабета, гемофилии, увеита и энцефаломиелита.
Как применяется в настоящей заявке, термин «онкологическое заболевание» охватывает все типы онкопатологии, включая лейкемию, в частности В-ХЛЛ, ХМЛ или Т-клеточную лейкемию, такую как ОЛТ, а также меланому.
Способы трансдукции
Настоящее изобретение также относится к применению псевдотипированной вирусной векторной частицы, как определено выше, для переноса биологического материала, как определено выше в разделе «Биологический материал», в гемопоэтическую клетку, как определено выше в разделе «Гемопоэтическая клетка», ex vivo.
Другой объект настоящего изобретения относится к способу трансдукции гемопоэтической клетки, как определено выше в разделе «Гемопоэтическая клетка», включающему обеспечение контакта гемопоэтической клетки с псевдотипированной векторной частицей, как определено выше, в условиях, обеспечивающих осуществление трансдукции гемопоэтической клетки псевдотипированной вирусной векторной частицей.
Как применяется в настоящей заявке, «перенос» или «трансдукция» относится к способности вирусной векторной частицы к исходной доставке биологического материала к мембране или цитоплазме клетки-мишени, при связывании с клеткой-мишенью. После доставки биологический материал может быть перемещен в другую часть клетки.
Условия выполнения трансдукции клеток-мишеней хорошо известны специалистам в данной области техники, и включают, как правило, инкубацию клеток, подлежащих трансдукции, предпочтительно, культивируемых во флаконах, планшетах или чашках, покрытых ретронектином, и факультативно, предварительно стимулированных цитокиновым коктейлем, с псевдотипированными вирусными векторными частицами из настоящего изобретения, предпочтительно, при MOI 1, 5, 10 или 100, предпочтительно, в среде, не содержащей сыворотки.
Пакующая клеточная линия
Настоящее изобретение также относится к стабильной пакующей вирус клеточной линии, продуцирующей псевдотипированную вирусную векторную частицу, как определено выше, предпочтительно, продуцирующей псевдотипированную вирусную векторную частицу, содержащую по меньшей мере химерный оболочечный гликопротеин, содержащий или состоящий из гибрида трансмембранного и внеклеточного домена оболочечного гликопротеина BaEV и цитоплазматического хвостового домена оболочечного гликопротеина MLV.
Действительно, авторы настоящего изобретения показали, что BaEV/TR не был цитотоксичным для клеток-продуцентов 293Т.
В контексте настоящего изобретения стабильная пакующая вирус клеточная линия означает клеточную линию, стабильно экспрессирующую различные компоненты псевдотипированной вирусной векторной частицы из настоящего изобретения. Как правило нуклеиновые кислоты, кодирующие различные компоненты псевдотипированной вирусной векторной частицы интегрированы в геном клеточной линии.
В частности, такая стабильная пакующая вирус клеточная линия может быть любой клеткой, способной экспрессировать лентивирусные гены Gag и Pol, или любой клеткой, которую можно сконструировать для поддержки такой экспрессии. Например, они могут быть 293Т клетками, и клетками насекомых (в частности, для векторов, полученных из ВИЧ), ТЕ 671 и НТ1080 клетками (в частности, для векторов, полученных из MLV).
Краткое описание фигур
На фигуре 1 приведено схематическое изображение BaEV гликопротеина дикого типа, RD114/TR и BaEV/TR химерных гликопротеинов и BaEVRLess гликопротеина. Цитоплазматический домен RD114 и BaEV гликопротеина дикого типа заменяли на один из MLV-A гликопротеинов, с получением химерных RD114/TR и BaEV/TR гликопротеинов, соответственно. R пептид цитоплазматического хвоста BaEV гликопротеина дикого типа удаляли с получением BaEVRLess мутантного гликопротеина.
На фигуре 2 приведены гистораммы где представлены титры различных псевдотипированных лентивирусных векторных частиц (псевдотипированных VSV-G (1), RD114/TR (2), BaEVwt (3), BaEV/TR (4) и BaEVRLess (5)), кодирующих GFP маркерный ген, полученный путем инфекции НЕК293Т клеток серийными разведениями концентрированных векторных препаратов. Процент GFP+клеток определяли путем цитометрии спустя 3 дня после инфекции. Инфекционные титры подсчитывали в виде GFP инфекционных единиц (ИЕ)/мл. Показаны средние значения (n=7) за исключением BaEVwt (n=3).
На фигуре 3 приведены гистограммы, где представлен относительный процент трансдукции НЕК293Т клеток посредством VSV-G (1), RD114/TR (2), BaEV/TR (3) или BaEVRLess (4) псевдотипированных лентивирусных векторных частиц при инкубации при 37°С в течение 1 часа в термоинактивированной человеческой сыворотке (белые столбцы; сыворотку инактивировали нагреванием при 56°С перед инкубацией с векторами для инактивации комплемента, где свежая сыворотка содержит активный комплемент) или свежей человеческой сыворотке (черные столбцы), относительно трансдукции тех же самых вирионов, инкубированных в ЭТС. Показаны значения для инкубации вектора с сывороткой для 3 различных доноров (А, В и С).
На фигуре 4 приведены гистограммы, где представлен процент трансдукции не стимулированных (белые столбцы), предварительно стимулированных ФСК (заштрихованные столбцы), предварительно стимулированных ТПО (столбцы с вертикальными полосками), предварительно стимулированных ФСК+ТПО (столбцы с горизонтальными полосками), или предварительно стимулированных ФСК+ТПО+Flt3-L (черные столбцы) человеческих CD34+ клеток посредством VSV-G (1), RD114/TR (2), BaEV/TR (3) или BaEVRLess (4) псевдотипированных лентивирусных векторных частиц при MOI 10. Анализ GFP экспрессирующих клеток проводили спустя 6 суток после трансдукции.
На фигуре 5 приведены графики, где представлен процент трансдукции предварительно стимулированных ФСК/ТПО CD34+ клеток посредством VSV-G (х), RD114/TR (•), BaEV/TR (▲) или BaEVRLess (■) псевдотипированных лентивирусных векторных частиц при MOI 1, 5, 10, 20 (и 100 для VSV-G псевдотипированных лентивирусных векторных частиц). Анализ GFP экспрессирующих клеток проводили спустя 6 дней после трансдукции путем FACS.
На фигуре 6 приведены графики, где представлен процент трансдукции предварительно стимулированных посредством ФСК+ТПО+FltS-L CD34+клеток с помощью VSV-G (х), RD114/TR (•), BaEV/TR (▲) или BaEVRLess (■) псевдотипированных лентивирусных векторных частиц при MOI 1, 5, 10, 20 (и 100 для VSV-G псевдотипированных лентивирусных векторных частиц) Анализ GFP экспрессирующих клеток проводили спустя 6 дней после трансдукции путем FACS.
На фигуре 7 приведены гистограммы, где представлен процент эритроцитарных, гранулоцитарных и дендритных колониеобразующих клеток (КОК), экспрессирующих GFP после трансдукции предварительно стимулированных ФСК+ТПО (белые столбцы) или ФСК+ТПО+Flt3-L (черные столбцы), полученных из пуповинной крови CD34+клеток посредством VSV-G (1), RD114/TR (2), BaEV/TR (3) или BaEVRLess (4) псевдотипированных лентивирусных векторных частиц при MOI 100 для VSV-G и 10 для других псевдотипов. Спустя 3 дня после трансдукции клетки высевали в среду с добавлением цитокинов для индукции миелоидной дифференцировки. На 14 день культивирования эритроцитарные, гранулоцитарные и дендритные колониеобразующие клетки (КОК) метили для определения экспрессии GFP посредством флуоресцентной микроскопии после посева.
На фигуре 8 приведены гистограммы, где представлен процент эритроцитарных, гранулоцитарных и дендритных колониеобразующих клеток (КОК), экспрессирующих GFP (черные столбцы), и CD34+клеток, экспрессирующих GFP (белые столбцы), после трансдукции предварительно стимулированных ФСК+ТПО полученных из пуповинной крови CD34+клеток посредством VSV-G (1), RD114/TR (2), BaEV/TR (3) или BaEVRLess (4) псевдотипированных лентивирусных векторных частиц при MOI 100 для VSV-G и 10 для других псевдотипов. Спустя 3 дня после трансдукции клетки высевали в среду с добавлением цитокинов для индукции миелоидной дифференцировки. Процент GFP+ CD34+клеток определяли посредством FACS анализа спустя 6 суток после трансдукции. Процент GFP КОК определяли посредством FACS анализа спустя 17 суток после трансдукции. Звездочка указывает, что доля GFP+ CD34+клеток достоверно отличается от доли GFP+ колоний трансдуцированных клеток (Т-критерий Стьюдента:*: р<0,05, NS: не достоверно).
На фигуре 9 приведены гистограммы, где представлен процент CD45+ человеческих клеток (белые столбцы), CD34+CD19- незрелых клеток-предшественников (черные столбцы), CD34+CD19+B-предшественников (заштрихованные столбцы), CD20+В-клеток (столбцы с вертикальными полосками), CD13+ миелоидных предшественников (столбцы с горизонтальными полосками) и CD14+ гранулоцитов и моноцитов (столбцы с диагональными полосками) в костном мозге, экспрессирующих GFP после трансдукции предварительно стимулированных ФСК+ТПО CD34+ клеток в течение 48 часов с VSV-G (1), RD114/TR (2), BaEV/TR (3) и BaEVRLess (4) псевдотипированными лентивирусными векторными частицами при MOI, указанных в скобках. При облучении новорожденных мышей Rag2-/-; γc-/- Balbc им интраперитонеально вводили 2,105 трансдуцированных человеческих CD34+клеток. Спустя 12 недель восстановления, у мышей анализировали приживление человеческих клеток (CD45) в костном мозге, и процент трансдукции (GFP+клеток) различных гемопоэтических клеток анализировали посредством FACS, как указано выше.
На фигуре 10 приведены гистограммы, где представлен процент CD45+ человеческих клеток (белые столбцы), CD34+ CD10- CD19- очень незрелых клеток-предшественников (черные столбцы), CD34+CD10+CD19- пре/про В-клеток (заштрихованные столбцы), CD19+ CD20- пре-В-клеток (столбцы с вертикальными полосками), CD34+CD10+CD19+ незрелых В-клеток (столбцы с горизонтальными полосками), CD20+ зрелых В-клеток (столбцы с диагональными полосками) и CD3+Т-клеток (столбцы с перекрещенными полосками) в селезенке, экспрессирующих GFP после трансдукции предварительно стимулированных ФСК/ТПО CD34+ клеток в течение 48 часов с VSV-G, RD114/TR, BaEV/TR и BaEVRLess псевдотипированными лентивирусными векторными частицами при MOI, указанных в скобках. При облучении новорожденных мышей Rag2-/-; γc-/- Balbc им интраперитонеально вводили 2,105трансдуцированных человеческих CD34+клеток. Спустя 12 недель восстановления, у мышей анализировали приживление человеческих клеток (CD45) в селезенке, и процент трансдукции (GFP+ клеток) различных гемопоэтических клеток анализировали посредством FACS, как указано выше.
На фигуре 11 приведены гистограммы, где представлен процент трансдукции клеток костного мозга макаки CD34+посредством VSV-G (1), RD114/TR (2), BaEV/TR (3) или BaEVRLess (4), псевдотипированных SIV векторными частицами, которые инкубировали при 37°С в течение 1 часа в термоинактивированной сыворотке макаки (белые столбцы; сыворотку инактивировали нагреванием при 56°С перед инкубацией с векторами для инактивации комплемента, где свежая сыворотка содержит активный комплемент) или в свежей сыворотке макаки (черные столбцы), относительно трансдукции тех же самых вирионов, инкубированных в ФСК. Показаны значения для инкубации векторов с сывороткой от 2 различных макак (А и В).
На Фигуре 12 приведены гистограммы, где представлен процент предварительно стимулированных ФСК+Flt3-L-IL3+IL6 клеток костного мозга яванских макак CD34+, экспрессирующих GFP после трансдукции, в присутствии ретронектина, посредством VSV-G (1), BaEV/TR (2) или BaEVRLess (3) псевдотипированных SIV векторных частиц при MOI, указанных в скобках.
На фигуре 13 приведены гистограммы, где представлен процент предварительно стимулированных ФСК+Flt3-L+IL3+IL6 клеток костного мозга макак-резус CD34+, экспрессирующих GFP после трансдукции, в присутствии ретронектина, посредством VSV-G (1), BaEV/TR (2) или BaEVRLess (3) псевдотипированных SIV векторными частицами при MOI, указанных в скобках.
На фигуре 14 приведены гистограммы, где представлен процент предварительно стимулированных IL7 Т-клеток, экспрессирующих GFP после трансдукции, в присутствии ретронектина (черные столбцы) или без него (белые столбцы), посредством VSV-G (1), RD114/TR (2), BaEV/TR (3) или BaEVRLess (4) псевдотипированных лентивирусных векторных частиц при MOI 10.
На фигуре 15 приведены гистограммы, где представлен процент предварительно стимулированных IL7 Т-клеток памяти (белые столбцы) и интактных Т-клеток (черные столбцы), экспрессирующих GFP после трансдукции посредством VSV-G (1), RD114/TR (2), BaEV/TR (3) или BaEVRLess (4) псевдотипированных лентивирусных векторных частиц при MOI, указанных в скобках.
На фигуре 16 приведены гистограммы, где представлен процент предварительно TCR-стимулированных Т-клеток, экспрессирующих GFP после трансдукции, в присутствии ретронектина (черные столбцы) или без него (белые столбцы), посредством VSV-G (1), RD114/TR (2), BaEV/TR (3) или BaEVRLess (4) псевдотипированных лентивирусных векторных частиц при MOI 10.
На фигуре 17 приведены гистограммы, где представлен процент покоящихся В-клеток, экспрессирующих GFP после трансдукции, в присутствии ретронектина (черные столбцы) или без него (белые столбцы), посредством VSV-G (1), RD114/TR (2), BaEV/TR (3) или BaEVRLess (4) псевдотипированных лентивирусных векторных частиц при MOI, указанных в скобках.
На фигуре 18 приведены гистограммы, где представлен процент покоящихся В-клеток памяти (белые столбцы) и интактных покоящихся В-клеток (черные столбцы), экспрессирующих GFP после трансдукции посредством VSV-G (1), RD114/TR (2), BaEV/TR (3) или BaEVRLess (4) псевдотипированных лентивирусных векторных частиц при MOI, указанных в скобках.
На фигуре 19 приведены гистограммы, где представлен процент предварительно BCR-стимулированных покоящихся В-клеток памяти (белые столбцы) и интактных покоящихся В-клеток (черные столбцы), экспрессирующих GFP после трансдукции посредством VSV-G (1), RD114/TR (2), BaEV/TR (3) или BaEVRLess (4) псевдотипированных лентивирусных векторных частиц при MOI, указанных в скобках.
На фигуре 20 приведены гистограммы, где представлен процент MZL В-клеток, экспрессирующих GFP после трансдукции, в присутствии ретронектина (черные столбцы) или без него (белые столбцы), посредством VSV-G (1), RD114/TR (2), BaEV/TR (3) или BaEVRLess (4) псевдотипированных лентивирусных векторных частиц при MOI, указанных в скобках.
На фигуре 21А приведены графики, где представлен процент GFP+ hCD45+ клеток, выявленных посредством FACS после 1-й и 2-й трансплантации у мышей. Клетки пуповинной крови hCD34+ предварительно стимулировали цитокиновьм коктейлем (TnO+OCK+Flk-3L) в течение 16 часов, и трансдуцировали с BaEV/TR-LV и BaEVRLess-LV при MOI=10 в течение 36 часов. Затем клетки (2×105) вводили в печень облученных новорожденных NOD/SCID γс -/- мышей (NSG мышей). После восстановления в течение 8-9 недель различные гемопоэтические ткани (костный мозг, селезенку и тимус) от этих первичных трансплантации у мышей (1-й) анализировали для определения приживления человеческих клеток посредством анти-hCD45 окрашивания. Процент GFP+ hCD45+ клеток, выявленных посредством FACS, указан для каждого типа вектора и каждой гемопоэтической ткани. Затем выделяли hCD34+ клетки из костного мозга каждой из этих мышей при первичной трансплантации, и 1-2×105 выделенных hCD34+ клеток вводили одной или двум мышам после той же самой процедуры, как при первичной трансплантации. Спустя 8-9 недель после трансплантации, этих мышей с вторичной трансплантацией анализировали для определения приживления трансдуцированных человеческих клеток (hCD45+ GFP+) в костном мозге, селезенке и тимусе. Первичные и соответствующие вторичные трансплантации указаны одним и тем же символом.
На фигуре 21В приведены графики, где представлен выявление GFP+ человеческих В-клеток (CD19+), человеческих незрелых клеток-предшественников (CD34+) и миелоидных клеток-предшественников (CD13+) посредством FACS в образце костного мозга типичной NSG мыши - вторичного реципиента для определения трансдукции BaEV/TR-LV.
На фигуре 22А приведено схематическое изображение дифференцировки тимоцитов. HSC - гемопоэтическая стволовая клетка; DN - двойной негативный; ISP - незрелые CD4 одинарные позитивные клетки; DP - двойной позитивный; SP4 - одинарные позитивные CD4+; СРВ - одинарные позитивные CD8+; TCR - Т-клеточный рецептор.
На фигуре 22 В приведены гистограммы, где представлен процент свежевыделенных тимоцитов, экспрессирующих GFP после трансдукции в присутствии IL7 (20 нг/мл) с VSV-G-, RD114/TR-, BaEV/TR-, и BaEVRLess-LV, кодирующих GFP-репортер при MOI 10. При множественном окрашивании CD3, CD4 и CD8 трансдукцию в различных субпопуляциях тимоцитов определяли посредством FACS.
На фигуре 22С приведены гистограммы, где представлено распределение различных субпопуляций тимоцитов при инкубации всех тимоцитов с различными векторами, по сравнению с нетрансдуцированными тимоцитами.
На фигуре 23А приведены гистограммы, где представлен процент свежевыделенных общих ПК Т-клеток, экспрессирующих GFP после предварительной стимуляции с IL7 в течение 48 часов и последующей трансдукции с различными векторами: VSV-G-, RD114/TR-, BaEV/TR- и BaEVRLess-LV, кодирующих GFP-репортер при MOI 10 или 20, или VSV-G-LV при MOI 50. Спустя 3 дня после трансдукции клетки окрашивали для человеческого поверхностного маркера CD45RA, CD62L, CD31, и определяли эффективность трансдукции в недавних тимоцитарных эмигрантах (RA+/62L+/31+) и более зрелых интактных ПК Т-клетках (RA+/62L+/31 -) посредством FACS анализа.
На фигуре 23 приведены гистограммы, где представлен распределение различных субпопуляций интактных ПК Т-клеток при инкубации ПК Т-клеток с различными векторами, по сравнению с нетрансдуцированными Т-клетками.
Пример
Следующий пример демонстрирует выгодные свойства BaEV/TR- и BaEVRLess псевдотипированных лентивирусных векторных частиц для применения в качестве частицы, переносящей гены, по сравнению с предшествующими псевдотипированными лентивирусными частицами.
Материалы и методы
Получение лентивирусных векторов и титрование
Самоинактивирующиеся векторы, полученные из ВИЧ-1, получали путем временной трансфекции ПЕК 293Т клеток из клеточной линии эмбриональной почки человека (American Type Culture Collection, Роквилл, Мэриленд, CRL-1573). 2,6×106 ПЕК 293Т клеток высевали на 10 см2 чашки для культивирования тканей за 24 до трансфекции. 293Т клетки выращивали на минимальной эссенциальной среде Игла, модифицированной по способу Дульбекко (DMEM, Invitrogen), с добавлением 10% эмбриональной телячьей сыворотки (ЭТС). Клетки трансфицировали путем осаждения фосфатом кальция с 8,6 мкг Gag-Pol упаковочной конструкции 8.91, полученным из ВИЧ-1 SIN переносящим вектором pHIV-SFFV-GFP-SIN, кодирующим GFP, и либо 2,5 мкг pMD.G, который кодирует VSV-G гликопротеин (GP), либо 7 мкг phCMV-RDl 14/TR, phCMV-BaEVWT, phCMV-BaEV/TR или phCMV-BaEVRLess. Спустя 16 часов после трансфекции, среду DMEM заменяли на среду, не содержащую сыворотки (Opti-MEM, Invitrogen), и спустя 36 часов после трансфекции собирали векторы, фильтровали через мембрану с размером пор 0,45 мкм, и концентрировали с применением системы для ультрафильтрационного концентрирования (Vivaspin, Satorius; 2 ч при 3000 g (4°С)) или с помощью низкоскоростного концентрирования, путем центрифугирования вирусной надосадочной жидкости при 3000 g при 4°С в течение ночи, или посредством ультрацентрифугирования (4°С, 25000 об./мин, 2 часа). Затем векторы хранили при -80°С. Для определения эффективности трансдукции и инфекционных титров ВИЧ-векторов серийные разведения векторных препаратов добавляли к 293Т клеткам, и определяли процент GFP+ клеток посредством проточной цитометрии спустя 3 дня после трансдукции. Инфекционные титры выражали в виде инфекционных векторных частиц на миллилитр (инфекционных частиц ИЕ/мл). Множественность инфицирования (MOI) определяли на пролиферирующих 293Т клетках и указывали во всех экспериментах по трансдукции.
Стабильность псевдотипированных векторов в сыворотке человека или макаки
Инфекционные псевдотипированные ВИЧ- или SIV-векторные частицы (150000 GFP инфекционных единиц в 50 мкл суспендирующего буфера) смешивали с 50 мкл термоинактивированной или свежей человеческой сыворотки. В качестве контроля вирионы инкубировали при 37°С в течение 1 часа, а затем применяли для трансдукции HEK293T клеток-мишеней. Рассчитывали относительный процент трансдукции инкубированных в человеческой сыворотке вирионов по сравнению с трансдукцией тех же самых вирионов, инкубированных в ЭТС.
Сбор образцов и выделение человеческих CD34+ клеток
Образцы пуповинной крови (ПК) от доношенных беременностей собирали в стерильные пробирки, содержащие антикоагулянт (SIGMA) после получения информированного согласия в соответствии с Хельсинкской декларацией. МКПК низкой плотности отделяли центрифугированием на градиенте Lymphoprep (Axis shield). CD34+ стволовые клетки/клетки-предшественники очищали из фракции мононуклеарных клеток с набором для магнитного выделения CD34 (Miltenyi MACS, Miltenyi Biotec), в соответствии с инструкциями производителя. Чистота выбранной CD34+ фракции была оценена посредством FACS анализа с конъюгированным с аллофикоцианином анти-CD34 антителом (BD Pharmingen), и превышала 95% во всех экспериментах. Затем CD34+клетки замораживали в ЭТС (Эмбриональная телячья сыворотка, Lonza), 10% ДМСО и хранили при -80°С.
Выделение Т-клеток и В-клеток и лентивирусная трансдукция
Образцы периферической крови взрослых, полученные от здоровых взрослых доноров после информированного согласия, собирали в пробирки, содержащие кислый цитрат декстрозы (КЦД). Т-клетки и CD19+ В-клетки очищали путем негативной селекции с применением комплексной тетрамерной системы Rosette(StemSep Technologies, Ванкувер, Канада). Чистоту выделенных В- и Т-клеток контролировали с применением анти-hCD19APC и анти-hCD3APC антител, соответственно, и анализировали посредством клеточной сортировки с активацией флуоресценции (FACScalibur; BD). Т- и В-лимфоциты культивировали в среде RPMI 1640 (GibcoBRL Invitrogen, Окленд, Новая Зеландия) с добавлением 10% ЭТС и пенициллина/стрептомицина. Т-клетки предварительно стимулировали анти-CD3 + анти-CD28 антителами (1 мкг/мл) в присутствии 4IL2 (1 нг/мл) или предварительно стимулировали в течение 3 суток с pIL7, как описано в Verhoeyen et al. (2003) Blood 101: 2167-2174 (10 нг/мл; BDBiosciences, Le Pont de Claix, Франция). В-клетки немедленно высевали для трансдукции или предварительно стимулировали с Staphylococcus Aureus Cowan (SAC; 0,001%; Calbiochem, Сан-Диего, Калифорния) + IL2 (1 нг/мл; SIGMA), как описано в Levy et al. (2010) Blood 116:498-500. Вкратце, 1Е5 клетки высевали в 48-луночные планшеты, и добавляли концентрированный вектор в указанных дозах. Процент GFP+ клеток определяли посредством FACS спустя 72 часа после трансдукции. Трансдуцированные Т-клеточные культуры продолжали культивировать в RPMI с добавлением pIL7, восполняя каждые 3 суток, и собирали для FACS анализов, qPCR и Alu-PCR. В-клетки переносили в MS5 клеточный монослой в RPMI с добавлением 10% АВ сыворотки, 5% ЭТС, 50 нг/мл рФСК, 10 нг/мл pIL15 и 5 нг/мл pIL2, и среду обновляли каждые 4 суток.
Выделение CD34+-клеток из костного мозга макак
Взрослых самцов яванских макак (Масаса fascicularis) массой тела 3-4,5 кг получали из Маврикия, и помещали в отдельные клетки в виварии с 2 уровнем безопасности (СЕА, Fontenay-aux Roses), в соответствии с национальными правилами. Все экспериментальные процедуры проводили в соответствии с Европейскими указаниями по уходу за животными. Исследования проводили в соответствии с протоколами, утвержденными региональным комитетом по экспериментам на животных. Все процедуры и отбор образцов крови проводили после выполнения анестезии животных с кетамином 10 мг/кг массы тела (Imalgene 1000).
Костномозговые мононуклеарные клетки получали из плечевых костей и подвздошного гребня путем аспирации, и выделяли путем центрифугирования в стандартном градиенте плотности фиколла. Клетки отмывали дважды в фосфатном буферном растворе (ФБР) и ресуспендировали в ФБР/1% ЭТС. Затем фракцию обогащали CD34+клетками путем позитивной иммуномагнитной селекции (клон 561; Dynabeads M-450 CD34; Dynal), в соответствии с инструкциями производителя. После иммуноселекции очищенную фракцию CD34+клеток окрашивали с применением анти-CD34 моноклональных антител (клон 563, BD-Pharmingen). Чистота отобранных CD34+клеток находилась в диапазоне 85-95%
Трансдукция ГСК человека и макаки
CD34+клетки человека и макаки инкубировали в течение ночи в 24-луночных планшетах в бессывороточной среде (CellGro, CellGenix) с добавлением антибиотиков (PENSTREP, Invitrogen) и с человеческими рекомбинантными цитокинами (как указано); фактором стволовых клеток (рФСК, 100 нг/мл), тромбопоэтином (ТПО, 20 нг/мл), и Flt3 лигандом (Flt3-L, 100 нг/мл) (Preprotech) для человеческих ПК CD34+ клеток. Для костномозговых CD34+ клеток яванских макак добавляли человеческий рекомбинантный интерлейкин-6 (IL6) (20 нг/мл) и интерлейкин-3 (IL3) (20 нг/мл) (Preprotech) в предыдущий коктейль. 5,104 предварительно стимулированных CD34+клеток трансдуцировали в 48-луночных планшетах с концентрированной надосадочной жидкостью лентивирусного вектора при MOI 1, 5, 10, 20 или 100 (как указано) в бессывороточной среде (CellGro, CellGenix). Где указано, трансдукцию проводили на планшетах, покрытых ретронектином (фрагментом рекомбинантного человеческого ретронектина СП-296) (Takara). На 3 сутки после трансдукции к клеткам добавляли свежую среду с цитокинами. Спустя 3 и 6 суток после трансдукции определяли процент GFP+ клеток посредством проточной цитометрии.
Клоногенный анализ CD34+клеток
CD34+ клетки трансдуцировали, как описано выше, отмывали ФБР (Invitrogen), и высевали на планшеты с плотностью 1000 клеток/мл в полной метилцеллюлозной среде (1% метилцеллюлоза, 15% ФБР, 1% БСА, инсулин из бычьей поджелудочной железы (1 мкг/мл), насыщенный железом трансферрин (200 мг/мл), 10-4 М 2-меркаптоэтанол, 2 мМ L-глутамин, ФСК (50 нг/мл), IL3 (10 нг/мл), IL6 (10 нг/мл), эритропоэтин (3 Ед./мл) (Stem Cell technologies). GFP+колонии отмечали при световой и флуоресцентной микроскопии спустя 14 суток после посева. Вестерн-блот анализ BaEVwt, BaEV/TR и BaEVRLess лентивирусные векторы очищали в градиенте сахарозы путем ультрацентрифугирования (2 часа, 25000 об./мин, 4°С) и замораживали после ресуспендирования в ФБР. Верхнюю часть мембраны окрашивали антителами против поверхностного домена BaEV гликопротеина, нижнюю часть мембраны окрашивали антителами против р24 капсида ВИЧ-1 для оценки эквивалентной нагрузки очищенных векторов. Указаны положения BaEV мутантных гликопротеинов и ВИЧ капсида.
Животные
BALB/c Rag2-/-, γс-/- иммунодефицитные мыши были получены от Dr Mamoro Ito, и Taconic (CIEA, Кавасаки, Япония). Всех используемых мышей помещали в виварий в Ecole Normale Superieure de Lyon, Франция (PBES). Животных держали в течение всего эксперимента в стерильных условиях, и все эксперименты проводили в соответствии с указаниями по уходу за лабораторными животными по протоколам, утвержденным местным этическим комитетом.
Кондиционирование и восстановление мышей BALB/c Rag2-/-, γс-/-
Новорожденных мышей BALB/c Rag2-/-, γс-/- в возрасте 2-4 суток подвергали сублетальному облучению 2×1,5 Грей. Для оценки способности к восстановлению/дифференцировки hCB-CD34+клеток, клетки трансдуцировали при MOI 10 с BaEV/TR-, BaEVRLess-, RD114/TR-, VSV-G-LV, и спустя 48 часов после трансдукции 2,105 клеток вводили внутрипеченочно новорожденным мышам. На 10-12 недели после трансплантации человеческих клеток отбирали периферическую кровь из лицевой вены для проверки способности к восстановлению путем анализа процента приживления человеческих клеток (hCD45+ клеток) посредством FACS.
FACS анализ
Мышей умерщвляли не 10-12 неделе после трансплантации человеческих клеток в соответствии с биоэтическими процедурами, и собирали все гемопоэтические ткани. Затем выделяли клетки из костного мозга, селезенки, тимуса и периферической крови. Для детекции LV трансдукции приживленных клеток проводили анализ посредством проточной цитометрии с применением АФЦ-меченных анти-hCD45 антител для детекции общего приживления человеческих клеток в костном мозге. АФЦ-меченные антитела (BD Pharmingen) использовали для детекции hCD19 (В-клеток), hCD34 (ранних клеток-предшественников) и hCD13 (миелоидных предшественников).
Результаты
Мутантный BaEV/TR гликопротеин и BaEVRLess гликопротеин могут эффективно псевдотипировать ВИЧ-1 вектор
BaEV/TR химерный гликопротеин был сконструирован авторами настоящего изобретения путем замены его цитоплазматического домена на один из MLV-A гликопротеина (Фигура 1). Второй мутант конструировали путем удаления ингибирующего слияние R пептида из карбокси-концевого цитоплазматического домена с получением BaEVRLess гликопротеина (Фигура 1). Авторы настоящего изобретения сравнили эти разные мутантные BaEV гликопротеины по их способности к псевдотипированию лентивирусных векторов, полученных из ВИЧ-1, с VSV-G и RD114/TR гликопротеинами
RD114/TR, BaEV/TR, BaEVRLess и VSV-G ВИЧ векторы получали путем временной трансфекции в HEK293T клетки вместе с gagpol упаковкой и ВИЧ вектором, кодирующим GFP. Надосадочные жидкости векторов концентрировали посредством низкоскоростного или ультрацентрифугирования (в 100 раз). Анализ инфекции HEK293T клеток показал, что титры выше 1,107 ИЕ/мл были получены для BaEV/TR и BaEVRLess псевдотипированных LV с получением 40-кратного повышения, по сравнению с BaEVwt-LV. RD114/TR и VSV-G псевдотипированные векторы обеспечили титры 6,107 ИЕ/мл и 1,109 ИЕ/мл (Фигура 2). Иммуноблоттинг подтвердил низкое включение BaEVwt гликопротеина на поверхность лентивирусного вектора, по сравнению с BaEV/TR и BaEVRLess гликопротеинами в равном количестве из ВИЧ-1 капсида. Эти данные согласовались с повышением титров, полученных для BaEV/TR и BaEVRLess псевдотипированных LV, по сравнению с BaEVwt-LV.
Инфекционные титры LV, псевдотипированных BaEV мутантными гликопротеинами (BaEV/TR и BaEVRLess) были схожими с титрами RD114/TR-LV и таким образом, далее учитывались для трансдукции человеческих CD34+ранних клеток-предшественников и Т- и В-клеток.
Стабильность BaEV мутантных псевдотипированных векторов и резистентность к инактивации человеческой сывороткой
С учетом клинического применения in vivo, LV, псевдотипированные мутантным BaEV, должны быть устойчивыми к действию человеческой системы комплемента. Эту устойчивость определяли путем сравнения инфекционных титров LV, инкубированных в человеческой сыворотке в течение 1 часа при 56°С. Отмечалось, что нагревание разрушает комплемент человека, так что термоинактивированную человеческую сыворотку использовали в качестве контроля. Полученные остаточные инфекционные титры отмечали для инфицирующей способности LV, инкубированных с эмбриональной телячьей сывороткой (100%) (Фигура 3). Как ожидалось, LV, псевдотипированные VSV-G, инактивировались 3-мя разными человеческими сыворотками. LV, псевдотипированные BaEV/TR и BaEVRLess, оставались стабильными в присутствии сывороток, содержащих комплемент, поскольку не отмечалось снижения эффективности трансдукции при инкубации в присутствии человеческого комплемента от трех различных доноров. Таким образом, авторы настоящего изобретения пришли к заключению, что BaEV/TR и BaEVRLess LV были устойчивыми к человеческой системе комплемента в той же самой степени, как RD114/TR-LV. Стабильность LV, псевдотипированных BaEV мутантом, в человеческой сыворотке, делает их лучшими кандидатами, чем VSV-G LV псевдотипы для применения in vivo.
Псевдотипированные BaEV LV значительно превосходят VSV-G- и RD114/TR-LV для трансдукции человеческих CD34+клеток
Как BaEV/TR, так и BaEVRLess псевдотипированные LV связывались с hASCTI и hASCT2 на клеточной мембране hCD34+клеток, в то время как RD114/TR LV связывались только с hASCT2. Ранее было описано, что RD114/TR-LV могут эффективно трансдуцировать hCD34+ клетки только в присутствии ретронектина. Действительно, ретронектин является фрагментом фибронектина, который, как отмечалось, обеспечивает связывание с клетками и векторами, и таким образом, повышает трансдукцию hCD34+клеток. Для оценки роли ретронектина в трансдукции LV псевдотипированными BaEV, авторы настоящего изобретения вначале предварительно стимулировали hCD34+клетки сильным цитокиновым коктейлем (pOCK+pTnO+rFlt3-L), и трансдуцировали их VSV-G, RD114/TR, BaEV/TR, BaEVRLess псевдотипированными LV при MOI 10 в ячейках, покрытых или не покрытых ретронектином. Авторы настоящего изобретения отмечали, что в присутствии ретронектина оба BaEV-LV трансдуцировали hCD34+клетки более чем на 70%.
Как упоминалось выше, сильная стимуляция цитокиновым коктейлем индуцирует ГСК к дифференцировке и потере способности к самообновлению. Действительно, чем меньше клетки предварительно стимулированы, тем меньше они дифференцируются и тем больше сохраняют свою природу «стволовой клетки». Далее, чем сильнее стимуляция цитокинами, тем выше риск множественной интеграции вектора на клетку при высоких дозах вектора. Это может повысить риск генотоксичности при генной терапии. Таким образом, авторы настоящего изобретения проверили, могут ли BaEV-псевдотипированные LV эффективно трансдуцировать hCD34+ клетки после слабой предварительной стимуляции цитокинами при низких дозах векторов.
Во-первых, они применяли векторы при фиксированной MOI (число инфекционных частиц на клетку) 10, и при различных протоколах предварительной стимуляции цитокинами для hCD34+клеток (Фигура 4): (1) без стимуляции; (2) стимуляция одним цитокином, рФСК или рТПО; (3) рФСК и рТПО; (4) рФСК+рТПО+rFlt3-L. Важно, что самая сильная использованная предварительная стимуляция цитокинами была ниже, чем коктейли для стимуляции, используемые в настоящее время в клинической практике для ограничения клеточной дифференцировки. Авторы изобретения отмечали, что стимуляция одним ТПО была достаточной для трансдукции hCD34+клеток до 60% для BaEV-псевдотипированных LV, в то время как VSV-G-LV и RD114/TR-LV трансдуцировали только 8-20% hCD34+ клеток при стимуляции ТПО. Стимуляция одним ФСК обеспечивает 30-50% трансдукцию hCD34+клеток, в то время как VSV-G-LV и RD114/TR-LV достигали уровня трансдукции только 10%. Предварительная стимуляция комбинацией ТПО+ФСК или ТПО+ФСК+FLK-3 с единственной инкубацией BaEV-LV приводила к трансдукции до 75% hCD34+клеток, в то время как RD114/TR-LV обеспечивали не более 40% трансдукции. В заключение, для всех различных протоколов предварительной стимуляции цитокинами псевдотипирование с BaEV LV превосходило VSV-G- и RD114/TR-LV в трансдукции hCD34+клеток. Далее, результаты, полученные для нестимулированных клеток, показали, что BaEV/TR LV и BaEVRLess LV были способны к трансдукции 10-20% нестимулированных hCD34+клеток в присутствии ретронектина. Напротив, VSV-G- и RD114/TR LV были неспособными к эффективной трансдукции нестимулированных покоящихся hCD34+клеток при тех же самых дозах вектора (MOI=10).
Во-вторых, должен быть устранен риск инсерционного мутагенеза для ограничения побочных эффектов генной терапии. Таким образом, авторы настоящего изобретения снизили дозу вектора для ограничения многокопийных интеграции. Тестировали разные MOI при стимуляции рФСК+рТПО и pOCK+pTnO+pFlt3-L (Фигуры 5 и 6). BaEV/TR-псевдотипированные LV трансдуцировали значительно лучше hCD34+ клетки при низких дозах векторов, достигая 60% (рФСК+рТПО) и 70% (рФСК+рТПО+pFlt3-L) при MOI 5. BaEVRLess-LV существенно превосходили RD114/TR-LV при MOI 5. VSV-G LV при низких дозах вектора (MOI 5-10) были гораздо менее эффективными. Только при MOI 100 эти VSV-G-LV обеспечивали эффективную трансдукцию hCD34+клеток, при дозе вектора, используемой в настоящее время для клинических испытаний генной терапии. Но уровень трансдукции VSV-G-LV оставался значительно ниже, чем BaEV-LV (VSV-G-LV (MOI 100)=50-60% и BaEV-LV (MOI 20)=75-90%; Фигуры 5 и 6). Авторы отметили, что в условиях более сильной стимуляции BaEV/TR-, BaEVRLess-LV and RD114/TR-LV достигают плато при MOI 10 для BaEV/TR-LV и RD114/TR LV (75% и 50% трансдукции, соответственно). Следовательно, инкубация с низкими дозами векторов BaEV LV, ниже или равными 10, была достаточной для высокоэффективной трансдукции hCD34+клеток и в гораздо большей степени, чем RD114/TR-LV и VSV-G LV. В заключение, BaEV-псевдотипированные LV, и в частности, BaEV/TR-LV являются более эффективными для трансдукции hCD34+клеток, чем имеющиеся в настоящее время VSV-G-LV и RD114/TR-LV векторы. Ясно, что эффективность VSV-G-LV трансдукции hCD34+клеток зависит от цитокинового коктейля для стимуляции, в то время как это не наблюдается для BaEV-псевдотипированных LV.
Низкие дозы BaEV-LV векторов обеспечивают трансдукцию с высоким уровнем транзиторных предшественников
Авторы настоящего изобретения желали подтвердить, что высокая трансдукция hCD34+клеток, полученная с BaEV псевдотипами, была обусловлена стабильной трансдукцией трназиторных предшественников. Таким образом, они определяли эффективность трансдукции BaEV-псевдотипированных LV на гемопоэтических предшественниках посредством клоногенного анализа, проведенного в полутвердой метилцеллюлозной среде. Клетки, предварительно стимулированные рФСК+рТПО и pOCK+pTnO+pFlt3-L, трансдуцировали с RD114/TR, BaEV/TR, BaEVRLess псевдотипированньши векторами при MOI 10 и VSV-G при MOI 100. Авторы настоящего изобретения выбрали более высокое значение MOI для VSV-G, поскольку при клинических испытаниях в настоящее время применяют MOI 100 для данного псевдотипа с целью трансдукции hCD34+клеток. Таким образом, казалось более уместным применение этой высокой дозы вектора для сравнения. Спустя 3 дня после трансдукции, клетки культивировали в метилцеллюлозной среде (с добавлением цитокинов), что обеспечивало их дифференцировку в миелоидные колонии. Авторы настоящего изобретения наблюдали спустя 14 суток эритробластные, гранулоцитарные и смешанные колонии, экспрессирующие или не экспрессирующие GFP+. Во-первых они сравнили число GFP-экспрессирующих колоний для различных предварительных стимуляторов (Фигура 7). Для всех исследованных векторов обе стимуляции дали схожие результаты. Доля клоногенных предшественников, трансдуцированных с векторами, псевдотипированньши обоими BaEV мутантами при MOI 10, была выше, чем только при VSV-G cMOI 100 (BaEV/TR-LV=50-70%, BaEVRLess-LV=45-70%, VSV-G-LV=25-50%). При той же самой дозе вектора, использованной для BaEV/TR- и BaEVRLess-псевдотипированных LV, только 10-35% клоногенных предшественников было трансдуцировано с RD114/TR LV псевдотипами. Не было существенной разницы между долей RD114/TR-, BaEV/TR-, BaEVRLess LV трансдуцированных CD34+клеток после предварительной стимуляции рФСК+рТПО и клоногенными предшественникми, полученными из них, что указывало, что трансдукция hCD34+клеток была стабильной (Фигура 8). Напротив, для VSV-G LV доля трансдуцированных клоногенных предшественников была существенно ниже, чем уровень трансдуцированных CD34 клеток, из которых они были получены (Фигура 8), позволяя предположить, что VSV-G псевдотипированные векторы трансдуцировали более дифференцированные CD34+ клетки, или более токсичными, чем другие тестируемые векторы. Эти результаты показали, что BaEV/TR- и BaEVRLess-LV псевдотипы стабильно трансдуцировали с высоким уровнем репопулирующие клетки-предшественники.
BaEV-псевдотипированные LV трансдуцируют с высокой эффективностью репопулирующие гемопоэтические предшественники у иммунодефицитных мышей
Для определения эффективности трансдукции векторов, псевдотипированных обоими BaEV, для репопулирующих гемопоэтических предшественников, CD34+клетки пуповинной крови предварительно стимулировали 16 часов с рФСК, рТПО и FLk-3L, a затем трансдуцировали с RD114/TR, BaEV/TR, BaEVRLess псевдотипированными векторами при MOI 10, или VSV-G-псевдотипированными LV при МО 100, и трансплантировали сублетально облученными иммунодефицитным Balbc, Rag2-/-, γс-/- новорожденным мышам или NOD/SCID/γc-/- (NSG) мышам (Таблица 1). На обеих мышиных моделях наблюдался приживление полной человеческой системы крови, поскольку они не содержали Т-, В-, и NK-клеток.
Спустя 8-10 недель животных умерщвляли и определяли процент общих содержащих ядро клеток человеческой крови (CD45+) в костном мозге посредством FACS анализ (Таблица 1).


Сопоставимый высокий уровень приживления с человеческими клетками наблюдали для всех условий трансдукции (до 89%, Таблица 1). Однако, общие VSV-G-LV обеспечивали гораздо более низкую трансдукцию ТКИД репопулирующих клеток, по сравнению с другими векторами. Для VSV-G-LV авторы настоящего изобретения выявили 32% трансдуцированных hCD45+клеток во всем костном мозге мышей (1) (Таблица 1). В костном мозге, для VSV-G псевдотипированных LV при MOI 100, они наблюдали смещение трансдукции, поскольку большинство пре-В и про-В-клеток (CD19+ CD34+клеток) показали 33% трансдукции, но ранние предшественники (CD34+CD19-) и миелоидные предшественники (CD13+) и моноциты (CD14+) показали самое большее только 5-8% трансдукции (Фигура 9).
Напротив, для BaEV/TR- и BaEVRLess-LV подробного фенотипирования было показано, что очень ранние клетки-предшественники (CD34+CD19-), а также В-клеточные CD19+ предшественники и миелоидные предшественники CD13+-клетки были трансдуцированы в той же самой степени, поскольку было выявлено более 30% трансдукции для всех этих разных клеточных линий (Фигура 9). В таблице 1 показано, что BaEV/TR-LV и BaEVRLess-LV трансдуцированные hCD34+ клетки обеспечивали высокие уровни восстановления в костном мозге при наивысших уровнях трансдукции ТКИД репопулирующих клеток (до 90% CD45+GFP+ клеток) в костном мозге. Далее, эти высокие уровни трансдукции поддерживались у мышей-первичных реципиентов во всех гемопоэтических тканях (костном мозге, тимусе и селезенке, Таблица 1). Эквивалентный высокий уровень трансдукции был выявлен для незрелых предшественников (hCD34+ клетки), лимфоидных клеток (CD19+) и миелоидных клеток (CD13+ и CD14+) в костном мозге (Таблица 1).
Для RD114/TR-LV менее 5% во всех разных костномозговых клеточных линиях было выявлено у NR1 мышей. Идентичная картина была найдена для предшественников, Т- и В-клеток, и моноцитов в селезенке (Фигура 10). RD114/TR-LV продемонстрировали вариабельные уровни трансдукции ТКИД репопулируюих клеток (в диапазоне 3,2-76% от GFP+CD45+ клеток. Таблица 1).
В целом, эти данные свидетельствуют, что BaEV/TR- и BaEVRLess-LV обеспечивают трансдукцию очень ранних предшественников репопулирующих клеток, так называемых чГСК, способных к дифференцировке в различные линии у иммунодефицитных мышей. Напротив, VSV-G LV псевдотипы не приводили к эквивалентной трансдукции различных гемопоэтических линий, указывая, что VSV-G LV трансдуцируют более дифференцированные предшественники, и в меньшей степени истинные ГСК, по сравнению с BaEV/TR- и BaEVRLess-LV.
Чтобы подтвердить, что истинные ГСК были генетически модифицированы, были проведены вторичные восстановления NSG мышей с костномозговыми hCD34 клетками от первичных NSG мышей, предварительно восстановленных с BaEV/TR- и BaEVRLess-LV трансдуцированными hCD34+клетками в течение по меньшей мере 2 месяцев.
Для улучшения приживления у вторичных реципиентов первичные NSG костномозговые клетки, полученные из hCD34+ клеток, культивировали с ФСК и ТПО для повышения хоминг-индекса этих клеток. После предварительной стимуляции в течение 16-18 часов 1-2×105 hCD34+ клетки вводили в печень новорожденных NSG мышей, подвергнутых суб-летальному облучению. Спустя 8-9 недель после трансплантации анализировали костный мозг, селезенку и тимус мышей-вторичных реципиентов для определения процента человеческих CD45+ GFP+ клеток (Фигура 21А). В селезенке и костном мозге процент GFP+ hCD45+ клеток поддерживался или повышался у мышей-вторичных реципиентов (Фигура 21А). Далее, для BaEV/TR- и BaEVRLess-LV были определены высокие уровни продукции GFP+ hCD34+ ранних предшественников, лимфоидных (CD19+) и миелоидных (CD13+) клеток в костном мозге этих мышей-вторичных реципиентов, и эквивалентный процент GFP+ клеток был выявлен в этих разных клеточных линиях (Фигура 21 В). Это свидетельствовало, что вторичные восстанавливающие ТКИД репопулирующие клетки были способны к многолинейной дифференцировке, и таким образом, что истинные человеческие ГСК были генетически модифицированы до высоких уровней посредством BaEV/TR- и BaEVRLess-LV.
BaEV/TR и BaEVRLess- псевдотипированные SIV векторы эффективно трансдуцируют CD34+ костномозговые клетки макак-резус и яванских макак
Лентивирусные векторы на основе ВИЧ очень эффективно трансдуцировали hCD34+-клетки, в то время как они очень плохо трансдуцировали соответствующие клетки от макак Старого Света (бабуинов, макак-резус и яванских макак). Это связано с факторами рестрикции (TRIM5a), мешающими на некоторых этапах после входа ВИЧ в клетки обезьян. Таким образом, поскольку яванские макаки являются важной животной моделью, авторы настоящего изобретения переключились на LV системы на основе SIV (вируса иммунодефицита обезьян), ранее разработанные авторами настоящего изобретения (Negre et al. (2000) Gene Ther, 7: 1613-1623), которые не были связаны с этими ограничениями после входа, и обеспечивали эффективную трансдукцию Т-клеток и CD34+клеток макак. Для всех псевдотипов были получены схожие инфекционные титры для псевдотипов, полученных из SIV, по сравнению с ВИЧ-векторами.
Стабильность псевдотипированных векторов оценивали в сыворотке яванских макак. Те же самые количества псевдотипированных инфекционных частиц смешивали со свежей сывороткой макак, и с сывороткой макак, инкубированной в течение 1 часа при 56°С, что позволяло инактивировать систему комплемента. В отличие от VSV-G LV, которые быстро инактивировались в свежей сыворотке, RD114/TR-, BaEV/TR- и BaEVRLess-LV псевдотипы оставались стабильными при инкубации с сывороткой макак (Фигура 11). Это было подтверждено с двумя независимыми донорами-макаками.
Для оценки трансдукции CD34+ клеток макаки авторы настоящего изобретения предварительно стимулировали CD34+ клетки яванских макак, полученные из костного мозга, сильным цитокиновым коктейлем (pOCK+pTnO+pFlt3-L+pIL3+pIL6) в течение 16 часов. Они трансдуцировали клетки с VSV-G, RD114/TR, BaEV/TR, BaEVRLess псевдотипированными SP/-LV при MOI 10 или 20 в культуральных ячейках, покрытых ретронектином (Фигура 12). Как сообщалось для VSV-G-LV псевдотипов, они обеспечивали низкий уровень трансдукции CD34+ клеток макаки, независимо от наличия ретронектина. Важно, что для RD114/TR, BaEV/TR и BaEVRLess LV псевдотипов был необходим ретронектин для трансдукции CD34+клеток макаки. BaEV/TR псевдотипированные SIV-LV при MOI 20 трансдуцировали до 60% CD34+клеток макаки, в то время как BaEVRLess LV продемонстрировали до 45% трансдукции (Фигура 12). Трансдукция CD34+ клеток слегка отличалась, поскольку BaEV/TR-LV обеспечивали наивысшие уровни трансдукции (50%), и VSV-G- и BaEVRLess-LV по эффективности (Фигура 13).
Эти первые результаты показали, что BaEV/TR- и BaEVRLess-LV псевдотипы эффективно трансдуцировали CD34+клетки яванских макак и макак-резус, что означало, что можно оценить эти векторы при доклиническом анализе векторов для генной терапии на этих моделях приматов, которые биологически очень близки к людям.
BaEV/TR- и BaEVRLess-LV обеспечивают эффективную трансдукцию человеческих Т-клеток, стимулированных pIL7 и с Т-клеточным рецептором
Другой важной мишенью для генной терапии являются Т-клетки. Интактные Т-клетки являются мишенями для генной терапии, поскольку они являются долгоживущими клетками, которые при коррекции могут существовать в течение нескольких лет.BaEV/TR- и BaEVRLess-LV обеспечивали эффективную трансдукцию pIL7 пре-стимулированных человеческих Т-клеток и превосходили VSV-G-LV в тех же самых дозах векторов (MOI=10) в присутствии ретронектина (% трансдукции, BaEV/TR-LV=25-43%, BaEVRLess=25-45%, VSV-G-LV=5-15%; Фигура 14). К удивлению, RD114/TR-LV обеспечивали гораздо меньшую эффективность трансдукции предварительно стимулированных pIL7 Т-клеток, по сравнению с BaEV-LV (RD114/TR-LV=5-15%). Далее, BaEV/TR- и BaEVRLess-LV обеспечивали эффективный высокий уровень трансдукции и интактных, и предварительно стимулированных IL7 Т-клеток памяти (Фигура 15). Поскольку pIL7 является цитокином выживания Т-клеток, регулирующим гомеостаз Т-клеток, не индуцируется переключение от интактного фенотипа до фенотипа клеток памяти, по сравнению со стимуляцией Т-клеточного рецептора (TCR), индуцирующей переключение от интактного фенотипа до фенотипа Т-клеток памяти. Действительно, BaEV/TR- и BaEVRLess-LV обеспечивали трансдукцию Т-клеток, стимулированных IL7, без нарушения их интактного фенотипа. Это очень выгодно для многих приложений генной терапии.
До настоящего времени большинство клинических испытаний применяют TCR-стимулированные Т-клетки. Важно, что BaEV/TR- и BaEVRLess-LV обеспечивают до 90% Т-клеточного переноса генов в TCR-стимулированных клетках при низких дозах вектора (MOI=10), и таким образом, превосходят VSV-G- и RD114/TR-LV в трансдукции TCR-престимулированных Т-клеток (Фигура 16).
В целом, новые BaEV/TR- и BaEVRLess-LV являются многообещающими инструментами переноса генов для генной терапии Т-клеток.
BaEV/TR- и BaEVRLess-LV обеспечивают эффективную трансдукцию нестимулированных и BCR-стимулированных В-клеток человека
В-лимфоциты являются привлекательной мишенью для генной терапии генетических заболеваний, связанных с дисфункцией В-клеток. Кроме того, долговременная экспрессия трансгена в В-клетках представляет особый интерес для иммунотерапии благодаря возможности индукции специфической иммунной активации или толерантности. Далее, эффективная доставка генов или миРНК для нокдауна экспрессии генов в первичных В-лимфоцитах человека позволяет изучить функцию генов в этих клетках. Далее, первичные В-клетки очень плохо трансдуцируются с VSVG-псевдотипированными LV даже при стимуляции пролиферации путем поперечной сшивки CD40 в присутствии различных цитокинов.
Поскольку LV, псевдотипированные BaEV гликопротеином, были способны к трансдукции Т-клеток, авторы настоящего изобретения оценили их для переноса генов в первичные В-клетки человека.
VSV-G-LV были не способны к эффективной трансдукции нестимулированных покоящихся В-клеток даже при высоких дозах вектора (MOI=100, VSV-G-LV<5% трансдукции). Интересно, что RD114/TR-LV обеспечивали очень низкие уровни трансдукции до 8% от первичных покоящихся В-клеток (Фигура 17). BaEV/TR-LV и BaEVRLess-LV обеспечивали высоко эффективную трансдукцию 20-30% покоящихся В-клеток, и такими образом, явно превосходили VSV-G-LV и RD114/TR-LV (Фигура 17, Ретронектин). При стимуляции В-клеточного рецептора (BCR) BaEV/TR- и BaEVRLess-LV трансдуцировали до 70% В-клеток, в то время как эффективность трансдукции VSV-G-LV не превышала 5%. RD114/TR-LV обеспечивали трансдукцию 25% BCR-стимулированных первичных В-клеток. Важно, что BaEV/TR- и BaEVRLess-LV эффективно трансдуцировали как клетки памяти, так и интактные В-клетки в присутствии ретронектина (Фигуры 18 и 19). Важно, что первичные В-клетки из маргинальной зоны лимфомы (MZL) были эффективно трансдуцированы BaEV/TR- и BaEVRLess-LV (до 75%) в присутствии ретронектина (Фигура 20).
Таким образом, BaEV/TR-LV и BaEVRLess-LV превосходили VSV-G-LV и RD114/TR-LV в трансдукции человеческих здоровых и опухолевой В-клеток, и могут быть многообещающим инструментом для генной терапии и иммунотерапии на основе В-клеток.
BaEVgp LV обеспечивают высокий уровень трансдукции тимоцитов на ранних стадиях дифференцировки
Тимус является первичной областью развития Т-клеток, и играет ключевую роль в индукции аутотолерантности. Таким образом, нацеливание на тимус интересующего антигена может приводить к индукции толерантности. Действительно, это было достигнуто путем прямой инъекции растворимого антигена, вирусного вектора, несущего интересующий антиген, или даже целых клеток (Khoury et al. (1993) J Exp Med. 178: 559-66, Marodon et al. (2006) Blood 108: 2972-8, Posselt et al. (1992) Science 256: 1321-4). Во-вторых, была продемонстрирована коррекция генетического иммунодефицита in situ, ZAP-70, путем интратимусной инъекции лентивирусного вектора, экспрессирующего корректирующий ген (Adjali et al. (2005) J Clin Invest. 115: 2287-95).
Тимоцитарная дифференцировка является строго регулируемым процессом, осуществляющимся благодаря взаимодействию с клетками стромы тимуса и стимуляции цитокинами (Фигура 22А). Гемопоэтические стволовые клетки (CD34+ CD1a-) мигрируют из костного мозга в тимус, где они вначале начинают экспрессию CD1a, прекращают экспрессию CD8 и CD4 маркеров (стадия CD8-CD4- двойных негативных (DN) клеток; 2-5% от всех тимоцитов). Эти DN клетки затем развиваются в незрелые CD4 одинарные позитивные клетки (ISP) и начинают экспрессию пре-Т-клеточного рецептора (пре-TCR; Фигура 22А). Появление CD8 поверхностного маркера вместе с CD4 и созреванием TCR называется двойной позитивной (DP) стадией развития тимоцитов (80-90% от всех тимоцитов). При селекции в тимусе DP тимоциты развиваются в CD8+ CD4- (SP8) и CD8-CD4+ (SP4) тимоциты (Фигура 22А).
Из-за потенциального значения тимоцитарного генного переноса для иммуномодуляции важно разработать векторы для эффективной трансдукции тимоцитов. Таким образом, авторы настоящего изобретения оценили эффективность BaEVgp-LV по сравнению с другими псевдотипами LV для трансдукции всех этих разных субпопуляций тимоцитов. При выделении тимоцитов из тимуса человека их трансдуцировали в присутствии цитокина выживания IL7 с VSV-G-, RD114/TR-, BaEV/TR-, и BaEVRLess-LV, кодирующими GFP репортер, при MOI 10. Во всех экспериментах по трансдукции использовали планшеты, покрытые ретронектином. Спустя три дня определяли уровни трансдукции посредством FACS в различных субпопуляциях тимоцитов с применением стройного окрашивания CD4/CD8/CD3.
VSV-G-LV не обеспечивали эффективную трансдукцию всех этих разных субпопуляций, достигая от 10 до 20% трансдуцированных клеток (Фигура 22 В). Хотя RD114/TR-LV, BaEV/TR-LV и BaEVRLess-LV обеспечивают предпочтительную трансдукцию тимоцитов на ранних стадиях развития (DN и ISP), они трансдуцируют более зрелые клетки с низким уровнем (Фигура 22 В). Как уже было выявлено для зрелых человеческих Т-клеток, BaEVgp LV трансдуцируют все различные субпопуляции тимоцитов более эффективно, чем RD114/TR-LV. Далее, трансдукция с различными псевдотипами лентивирусных векторов не оказывала влияния на распределение различных субпопуляций тимоцитов (Фигура 22С). Это указывало, что BaEVgp-LV являются отличным инструментом для трансдукции тимоцитов, и что они, в частности, превосходят VSV-G- и RD114/TR-LV в трансдукции незрелых DN и ISP субпопуляций тимоцитов.
BaEVgp-LV обеспечивают высокий уровень трансдукции недавних тимоцитарных эмигрантов из пуповинной крови
Особый интерес для Т-клеточной генной терапии или иммунотерапии могут представлять генетически модифицированные истинные интактные Т-клетки, которые считаются клетками, существующими в течение всей жизни индивидуума. Таким образом, авторы настоящего изобретения сосредоточились на Т-клетках пуповинной крови (ПК), поскольку они важны в контексте аллогенных ПК трансплантаций. Большинство ПК Т-клеток являются интактными и обеспечивают преимущество, снижая риск реакции трансплантат-против-хозяина (РТПХ), обычного побочного эффекта, наблюдаемого при аллогенной трансплантации костного мозга, включая аллогенные зрелые Т-клетки. Однако, в отличие от зрелых Т-клеток, ПК Т-клетки обеспечивают меньший эффект трансплантат-против-лейкемии.
Большинство ПК Т-клеток (70-80%) идентифицируют посредством CD31, CD62L и CD45RA-позитивного окрашивания, при этом клетки являются популяцией высоко незрелых интактных Т-клеток, и называются недавними тимоцитарными эмигрантами (RTE). Генетическая модификация этих клеток в контексте аллогенной трансплантации для повышения их эффекта трансплантат-против-лейкемии без повышения РТПХ может быть благоприятной (Micklethwaite et al. (2010) Blood 115: 2695-703). Таким образом, авторы настоящего изобретения протестировали некоторые псевдотипы лентивирусных векторов на их эффективность трансдукции ПК RTE.
Для сохранения интактного фенотипа Т-клеток предварительно стимулировали свежевыделенные общие ПК Т-клетки с цитокином выживания Т-клеток IL7, а затем трансдуцировали различными векторами: VSV-G-, RD114/TR-, BaEV/TR- и BaEVRLess-LV, кодирующими GFP репортер при MOI 10 или 20, за исключением VSV-G-LV, для которых применяли более высокую дозу вектора (MOI 50). На Фигуре 23 показано, что BaEV/TR- и BaEVRLess-LV демонстрируют значительно большую эффективность трансдукции (40-50%) при MOI=10, по сравнению с VSV-G или RD114/TR-LV (Фигура 23А). Важно, что BaEV/TR- и BaEVRLess-LV легко достигали 65% трансдукции при 2-кратном повышении дозы вектора (MOI=20; Фигура 23А). Во всех случаях интактные недавние тимоцитарные эмигранты (CD69L+ CD45RA+ CD31+) были трансдуцированы до той же самой степени, что и более зрелые интактные ПК Т-клетки (CD69L+ CD45RA+ CD31-; Фигура 23А). Далее, трансдукция не оказывала влияния на распределение этих двух интактных ПК Т-клеточных популяций (Фигура 23В).
Обсуждение
В данном примере авторы настоящего изобретения описали эффективное псевдотипирование лентивирусных векторов с применением нового оболочечного гликопротеина BaEV, полученного из эндогенного вируса бабуинов. Два мутанта этого гликопротеина: BaEV/TR химерный гликопротеин и BaEVRLess гликопротеин обеспечивают лучшее включение на поверхность LV, по сравнению с BaEVwt гликопротеином. LV, псевдотипированные этими оболочками, можно получить с высокими титрами (1,107 ИЕ/мл). Как и RD114/TR-LV псевдотипы, они были стабильными в сыворотки человека и макаки, что обеспечивает возможные клинические перспективы для доставки трансгенов т vivo.
Что касается трансдукции hCD34+клеток, BaEV мутантные LV псевдотипы превосходили VSV-G и RD114/TR. Во-первых, они способны к трансдукции hCD34+клеток при протоколах очень низкой предварительной стимуляции. Действительно, в настоящее время применяют цитокиновые коктейли, содержащие рФСК, рТПО, pFlt3-L и IL3, но отмечалось, что чем более стимулированы hCD34+клетки, тем более они дифференцируются и теряют их способность к долговременному гемопоэтическому восстановлению. Далее, считается, что IL3 существенно повышает CD34+дифференцировку. Действительно, авторы настоящего изобретения показали, что BaEV/TR- и BaEVRLess-LV достигают высоких уровней трансдукции hCD34+клеток, если они предварительно стимулированы рФСК, рТПО или одновременно стимулированы рФСК и рТПО в течение короткого периода времени 16 часов. Эти протоколы умеренной стимуляции цитокинами существенно снижают риск дифференцировки ГСК, присутствующих в популяции hCD34+клеток. Очень важно, что эти результаты свидетельствую о том, что BaEV/TR-LV псевдотипы могут трансдуцировать 10-20% нестимулированных hCD34+клеток, в то время как VSV-G-LV и RD114/TR-LV остаются неэффективными. Таким образом, поскольку не требуется стимуляции цитокинами для достижения эффективной трансдукции hCD34+ клеток с BaEV/TR- или BaEVRLess-LV, можно обеспечить лучшее сохранение стволовой природы hCD34+клеток.
Другим важным наблюдением было то, что при низких значениях MOI (5 и 10) лентивирусные векторы, псевдотипированные BaEV/TR и BaEVRLess, соответственно, равным образом трансдуцируют человеческие CD34+ клетки, лучше, чем VSV-G LV псевдотипы при MOI 100. Применение лентивирусного вектора при очень низком значении MOI позволяет ограничить инсерционный мутагенез, который происходит, когда провирусную ДНК вставляют в онкоген клеток-акцепторов. Если в геном клетки-акцептора интегрировано слишком много векторов, это может приводить к генотоксичности из-за нарушения регуляции генов клетки-акцептора. Таким образом, в случае BaEV-LV можно существенно снизить дозы вектора до безопасных уровней без существенной потери уровни трансдукции. Напротив, при для VSV-G-LV очень высокие дозы векторов были необходимы для обеспечения эффективной трансдукции hCD34+ клеток.
Способность BaEV/TR- и BaEVRLess-LV псевдотипов к высокой трансдукции транзиторных репопулирующих клеток и восстановлению костного мозга и селезенки иммунодефицитных мышей с клетками с генетическими маркерами во всех различных человеческих клеточных линиях являются аргументами, позволяющими предположить, что они действительно трансдуцируют ГСК.
Далее, новые BaEV/TR- и BaEVRLess-LV являются перспективными инструментами переноса генов для Т-клеточной генной терапии, поскольку они обеспечивают высокую трансдукцию предварительно стимулированных IL7 Т-клеток без индукции смены фенотипа. Кроме того, если учитывать необходимость коррекции времени жизни, необходимо трансдуцировать долгоживущие интактные Т-клетки, которые, как было показано, были высоко восприимчивыми к BaEV/TR- и BaEVRLess-LV опосредованному переносу генов, и могут найти множество видов применения in vivo.
Наконец, эти BaEV/TR- и BaEVRLess-LV представляют новый инструмент, обеспечивающий высоко устойчивый перенос генов для первичных покоящихся В-клеток, что позволяет легко изучить функцию генов и терапевтический перенос генов в этих клетках. Эти новые векторы позволяют обеспечить экспрессию состимулирующих молекул, таких как CD40L или В7 молекулы в неделящихся опухолевых В-клетках, таких как В-ХЛЛ, для установления иммунного ответа против генетически модифицированных и немодифицированных клеток. Они также обеспечивают введение ДНК, кодирующей легкие и тяжелые цепи специфических антител (например, антител, специально направленных против ВИЧ и ВГС) или эпитопов, в аутологичные В-клетки памяти, для обеспечения иммунотерапии и индукции толерантности при реинфузии созданных клеток.
Доставка генов in vivo из лентивирусных векторов, несущих BaEV/TR- или BaEVRLess-LV в ГСК, В-клетки или Т-клетки существенно облегчает генную терапию. Доставка генов in vivo имеет множество преимуществ. Перенос генов in vivo может быть нацелен на все ГСК в их нише стволовых клеток, что создает микросреду, регулирующие выживание и поддержку ГСК. Далее, для большинства заболеваний существует требование минимального числа генетически скорректированных клеток, подлежащих трансфузии. Это требование может быть ограничивающим фактором при лечении детей, поскольку выделение CD34+ приводит к существенной потере этой целевой популяции или к синдромам костномозговой недостаточности, таким как анемия Фанкони, при котором пациенты уже страдают от снижения числа hCD34 клеток. Все эти проблемы можно преодолеть путем направленной доставки гена в ГКС in vivo. Аналогичные заключения относятся к Т- и особенно к В-клеткам, поскольку последние клетки легко поддаются апоптозу при культивировании ех vivo.
В целом авторы настоящего изобретения разработали новый и явно эффективный псевдотип для лентивирусных векторов. BaEV/TR и BaEVRLess псевдотипированные LV, вероятно, станут пригодными для многих фундаментальных и клинических приложений, поскольку они обладают рядом преимуществ, таких как очень высокая трансдукция первичных ГСК, Т-клеток и В-клеток.
Справочная таблица идентификаторов последовательности
Реферат
Настоящая группа изобретений относится к биотехнологии. Предложены псевдотипированная вирусная векторная частица для переноса биологического материала в гемопоэтические клетки, способ ее получения и ее применение, медикамент для лечения гемопоэтических нарушений или аутоиммунных заболеваний, содержащий указанную частицу, способ трансдукции гемопоэтический клетки и стабильная пакующая вирус клеточная линия. Предложенная псевдотипированная вирусная векторная частица является лентивирусной и содержит химерный оболочечный гликопротеин или модифицированный оболочечный гликопротеин эндогенного ретровируса бабуинов (BaEV). При этом химерный оболочечный гликопротеин содержит трансмембранный и внеклеточный домен оболочечного гликопротеина BaEV и цитоплазматический хвостовой домен оболочечного гликопротеина вируса лейкемии мышей (MLV). Модифицированный оболочечный гликопротеин BaEV лишен ингибирующего слияние R пептида в цитоплазматическом хвостовом домене. Предложенная векторная частица эффективно трансдуцирует гемопоэтические клетки и может быть использована в генной терапии. 6 н. и 7 з.п. ф-лы, 27 ил., 2 табл., 1 пр.
Формула
Документы, цитированные в отчёте о поиске
Опосредованный вирусом усиленный перенос днк

Комментарии