Фармацевтические композиции - RU2690377C2
Код документа: RU2690377C2
Чертежи

Описание
РОДСТВЕННАЯ ЗАЯВКА
[0001] Данная заявка испрашивает приоритет на основании предварительной заявки США №61/792440, поданной 15 марта 2013 года. Содержание вышеуказанной заявки полностью включено в настоящее описание в качестве ссылки.
УРОВЕНЬ ТЕХНИКИ ИЗОБРЕТЕНИЯ
[0002] Зачастую требуется улучшение фармакокинетических характеристик активного средства (например, увеличение продолжительности действия лекарственного средства или минимизация нежелательных эффектов). Лекарственные средства, в частности, пептидные лекарственные средства, как правило, хорошо растворяются в жидкостях организма и могут быстро абсорбироваться, приводя к стремительному увеличению уровня доступного лекарственного средства, в отличие от постепенного высвобождения. Композиции, обеспечивающие постепенное или более длительное высвобождение лекарственного средства, могут способствовать уменьшению колебаний концентрации лекарственного средства после введения, увеличению нагрузки лекарственного средства при введении, повышению стабильности и эффективности как in vivo, так и in vitro, снижению токсичности и улучшению соблюдения режима пациентом вследствие уменьшения частоты введения. Таким образом, существует потребность в фармацевтических композиций, содержащих активное средство, которые обеспечивают длительное высвобождение активного средства.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
[0003] Настоящее изобретение относится к ионному комплексу, содержащему катионный полипептид и анионный наполнитель, выбранный из: PEG-карбоновой кислоты; жирной кислоты, содержащей 10 или более атомов углерода; анионных фосфолипидов; и их сочетаний в разных молярных соотношениях. Изобретение также относится к фармацевтической композиции, содержащей ионный комплекс настоящего изобретения и фармацевтически приемлемый носитель. Катионный полипептид, входящий в состав ионного комплекса, обладает фармакологической активностью, а комплекс может обеспечивать более желательный фармакокинетический профиль после введения, например, замедленное высвобождение в случае применения комплекса катионного полипептида по сравнению с применением катионного полипептида самого по себе.
[0004] Изобретение также относится к применению ионного комплекса и фармацевтической композиции, содержащей такой комплекс, для лечения индивидуума, страдающего от заболевания или расстройства, чувствительного к фармакологической активности катионного полипептида, входящего в состав ионного комплекса. В одном варианте осуществления расстройство, подлежащее лечению, чувствительно к модуляции рецептора меланокортина-4 (MC4R) у индивидуума, нуждающегося в лечении. Способ включает введение индивидууму эффективного количества ионного комплекса, содержащего в качестве катионного полипептида модулятор MC4R, например, модулятор формулы I, приведенной в настоящем описании. В конкретном варианте осуществления расстройство, чувствительное к модуляции MC4R, включает диабет 1 типа, диабет 2 типа, ожирение, резистентность к инсулину, метаболический синдром, мужскую эректильную дисфункцию, женское половое расстройство, неалкогольную жировую дистрофию печени, неалкогольный стеатогепатит, расстройства, связанные с токсикоманией, в том числе связанные с алкоголизмом расстройства приема пищи, кахексия, воспаление и тревожность.
[0005] В некоторых вариантах осуществления соединения и композиции настоящего изобретения в отношении MC4R и рецептора меланокортина-3 (MC3R) обладают более высокой селективностью и активностью, чем в отношении рецептора меланокортина-1 (MC1R). Соединения и композиции настоящего изобретения могут уменьшить или устранить такие нежелательные побочные эффекты, как повышение артериального давления, увеличение частоты сердечных сокращений, нежелательное влияние на половое возбуждение и увеличение пигментации кожи.
[0006] Ионный комплекс и фармацевтические композиции настоящего изобретения, содержащие указанный комплекс, могут улучшить фармакокинетические характеристики катионного полипептида, входящего в состав комплекса. Например, они могут увеличить продолжительность фармакологического действия катионного полипептида и при этом значительно сократить отношение максимального уровня лекарственного средства к минимальному в его фармакокинетическом профиле. Следовательно, терапевтическую дозу катионного пептида можно поддерживать в организме в пределах, соответствующих полезному воздействию, уменьшая тем самым возможность нежелательных побочных эффектов, которые могут быть связаны с высоким уровнем катионного полипептидного лекарственного средства, используемого отдельно. Композиции, которые могут обеспечить постепенное или более длительное высвобождение активного средства, могут способствовать уменьшению колебаний концентрации лекарственного средства после введения, увеличению нагрузки лекарственного средства при введении, повышению стабильности и эффективности как in vivo, так и in vitro, снижению токсичности и улучшению соблюдения режима пациентом вследствие уменьшения частоты введения. Композиции ионного комплекса настоящего изобретения можно использовать для эффективного терапевтического введения в разных режимах дозирования, включающих введение, по меньшей мере, один раз в день, один раз в неделю, один раз в 2 недели, один раз каждые четыре недели, один раз каждые 2 месяца, один раз каждые 3 месяца, один раз каждые 4 месяца, один раз каждые 5 месяцев или один раз каждые 6 месяцев.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
[0007] На фиг. 1 представлен график, демонстрирующий фармакокинетический профиль каждой из идентифицированных фармацевтических композиций после введения яванским макакам.
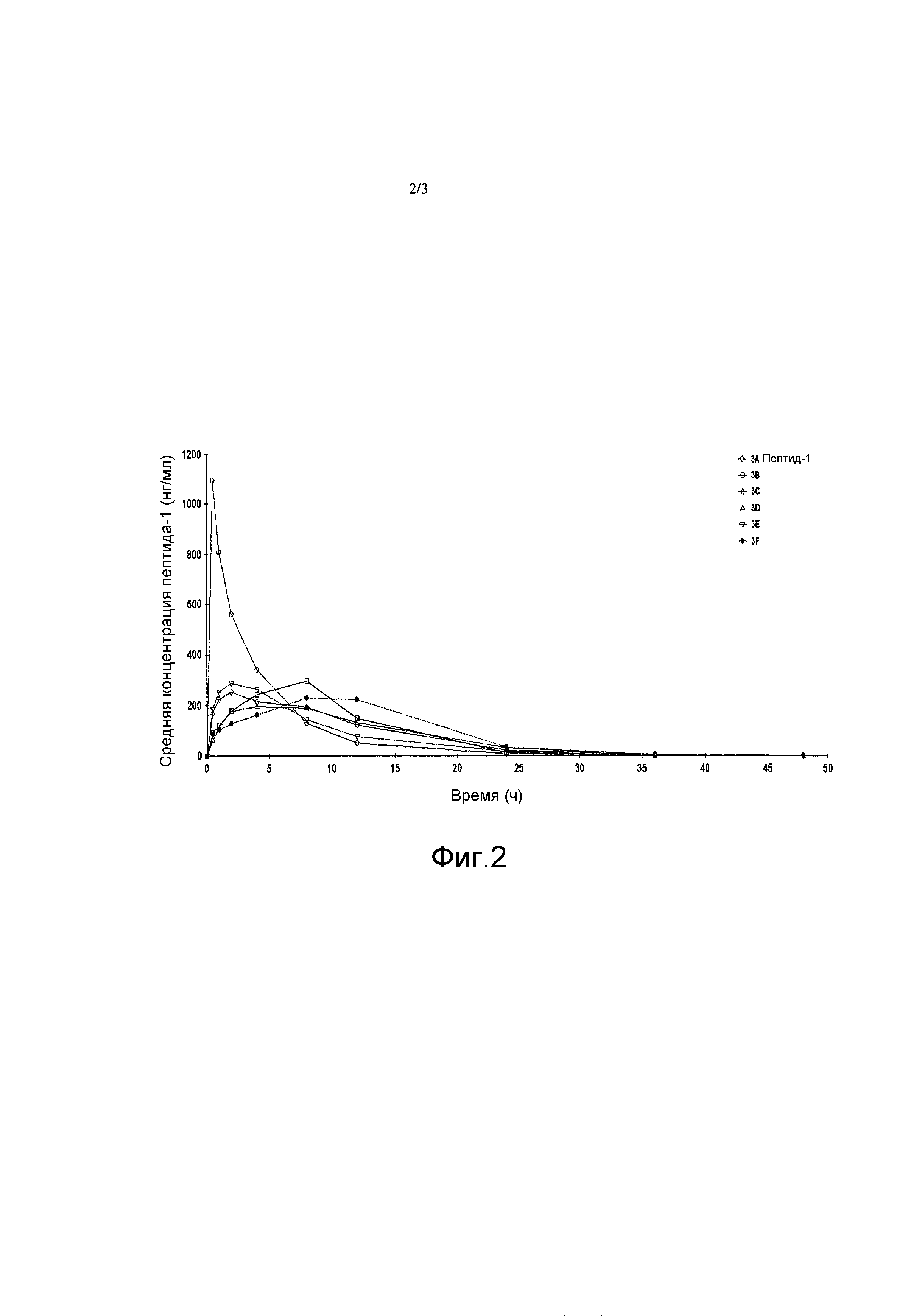
[0008] На фиг. 2 представлен график, демонстрирующий фармакокинетический профиль каждой из идентифицированных фармацевтических композиций после введения яванским макакам.
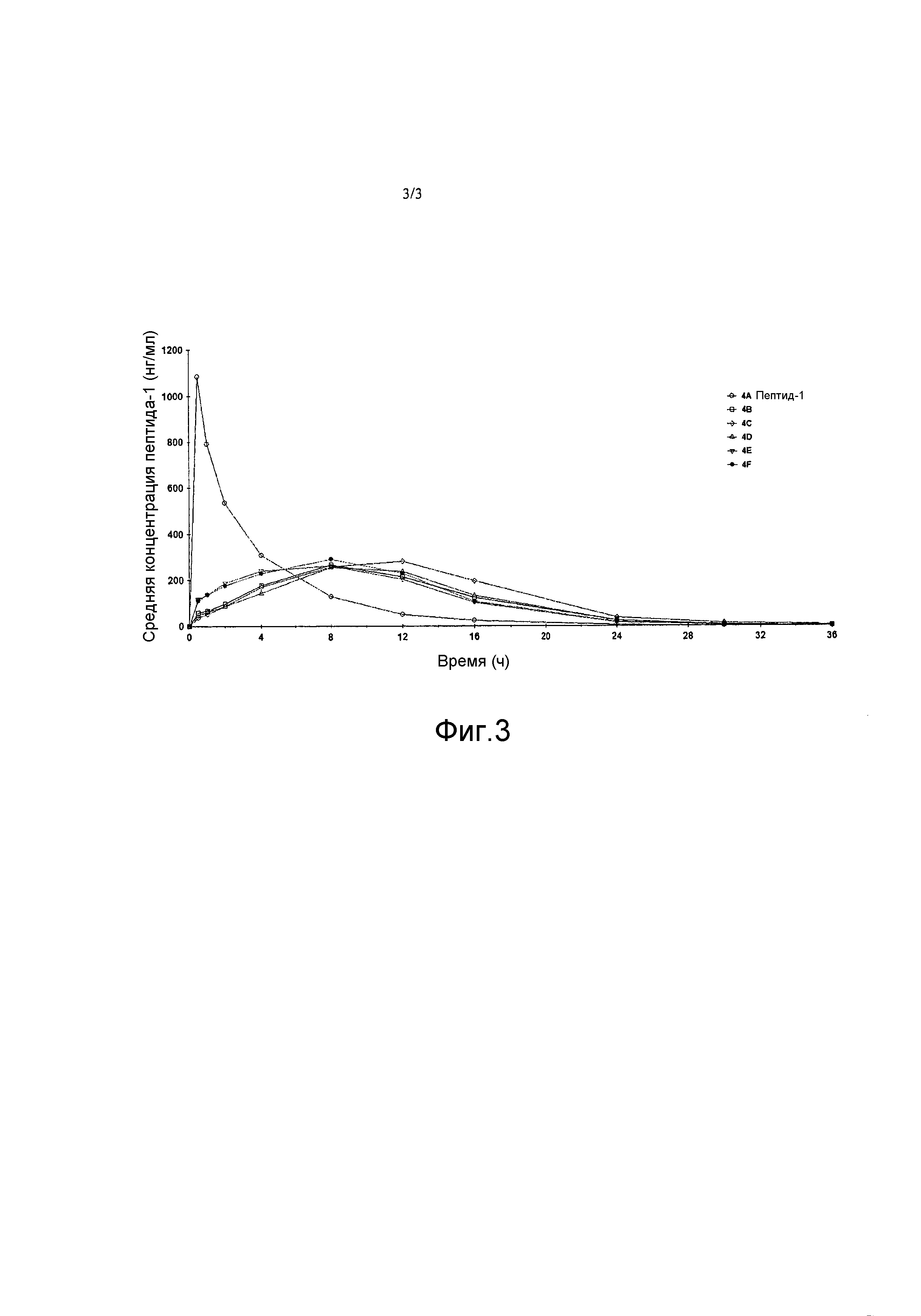
[0009] На фиг. 3 представлен график, демонстрирующий фармакокинетический профиль каждой из идентифицированных фармацевтических композиций после введения яванским макакам.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
[0010] Далее приведено описание иллюстративных вариантов осуществления настоящего изобретения.
ГЛОССАРИЙ
[0011] Для определения пептидов используют традиционную номенклатуру, в соответствии с которой N-концевую аминогруппу изображают слева, а C-концевую карбоксильную группу изображают справа.
[0012] В соответствии с данным описанием, термин "аминокислота" включает как природные, так и неприродные аминокислоты. Если не указано иначе, все аминокислоты и их остатки, входящие в состав описанных здесь соединений, могут находиться в D- или L-конфигурации.
[0013] Если не указано иначе, все используемые здесь технические и научные термины имеют традиционные значения, известные рядовым специалистам в области, к которой принадлежит настоящее изобретение. Все упомянутые здесь публикации, патентные заявки, патенты и другие ссылки включены в настоящее описание в качестве ссылки во всей их полноте.
[0014] Если не указано иначе, все сокращенные наименования (например, Ala) аминокислот в данном описании относятся к аминокислотным остаткам, то есть, к структуре -NH-C(R)(R')-CO-, где каждый из R и R', независимо от других, обозначает водород или боковую цепь аминокислоты (например, в случае Ala R=CH3, а R'=Н, или R и R' могут быть соединены с образованием циклической системы).
[0015] Обозначение "Ас" или "NH2" на конце полипептида означает, что соответствующий конец является ацилированным или амидированным, соответственно.
[0016] Термин "ковалентная связь между боковыми цепями аминокислот" означает, что каждая из боковых цепей двух рассматриваемых аминокислотных остатков содержит функциональную группу, способную образовывать ковалентную связь с другой функциональной группой. Примеры таких связей включают дисульфидные мостики, образованные боковыми цепями Cys, hCys или Pen, а также амидные связи, образованные аминогруппой боковой цепи одной аминокислоты и карбоксильной группой боковой цепи другой аминокислоты, такой как, например, Asp, Glu, Lys, Orn, Dbu или Dpr. При образовании ковалентной связи между боковыми цепями аминокислот может происходить циклизация полипептида. Такой циклический полипептид может быть указан либо структурной формулой, либо с помощью сокращенного обозначения "c()" или "цикло()". Например, "-c(Cys-Cys)-" или "-цикло(Cys-Cys)-" обозначает структуру:

тогда как "-c(Asp-Lys)-" или "-цикло(Asp-Lys)-" обозначает структуру:

Ионный комплекс:
[0017] Изобретение относится к ионному комплексу, содержащему катионный полипептид и анионный наполнитель, выбранный из: PEG-карбоновой кислоты; жирной кислоты, содержащей 10 или более атомов углерода; фосфолипида; и их сочетаний. Молярное отношение катионного полипептида к анионному наполнителю в ионном комплексе составляет, например, примерно от 1:1 до 1:10, где молярное отношение приведено с учетом отношения заряда катионного полипептида к заряду анионного наполнителя. Обычно используют молярное отношение, выбранное из группы, включающей примерно 1:1, примерно 1:2, примерно 1:3, примерно 1:4, примерно 1:5, примерно 1:6, примерно 1:7, примерно 1:8, примерно 1:9 или примерно 1:10.
Анионные наполнители
Анионный фосфолипид:
[0018] В соответствии с настоящим описанием, "анионный фосфолипид" представляет собой фосфолипид, в котором один или несколько атомов кислорода фосфатной группы (фосфатных групп) депротонированы с образованем фосфорорганического оксоаниона и отрицательно заряженного липида. Природные анионные фосфолипиды обычно содержат жирнокислотную цепь длиной C16 или больше. Анионный фосфолипид может нести один или несколько (например, 1, 2, 3, 4, 5, 6 или больше) отрицательных зарядов. В некоторых вариантах осуществления анионный фосфолипид выбирают из: фосфатидной кислоты (PA), фосфатидилглицерина (PG), фосфатидилинозитола (PI) или фосфатидилсерина (PS). Подходящие анионные липиды включают такие соединения, как: L-α-фосфатидная кислота, 1-олеоил лизофосфатидная кислота, L-α-фосфатидилглицерин, 1,2-ди-О-тетрадецил-sn-глицеро-3-фосфо-(1'-rac-глицерин), 1,2-димиристоил-sn-глицеро-3-фосфо-(1'-rac-глицерин) (DMPG), 1,2-димиристоил-sn-глицеро-3-фосфо-L-серин (DMPS), 1,2-дипальмитоил-sn-глицеро-3-фосфатидная кислота (DPPA), 1,2-дистеароил-sn-глицеро-3-фосфатидная кислота (DSPA), 1,2-дистеароил-sn-глицеро-3-фосфоэтаноламин (DSPE), mPEG-2000-DSPE, mPEG-5000 DSPE, 1,2-дипальмитоил-sn-глицеро-3-фосфоэтаноламин (DPPE), mPEG-2000-DPPE, mPEG-5000-DPPE, 1-(1,2-дигексадеканоилфосфатидил)инозитол-4,5-бисфосфат, тринатриевая соль, и 1-(1,2-дигексадеканоилфосфатидил)инозитол-3,4,5-трифосфат, тетранатриевая соль, 1-пальмитоил-2-олеоилфосфатидилглицерин (POPG), L-пальмитоил-2-арахидоноил-sn-глицеро-3-фосфоглицерин (PAPG), DSPG (дистеароил фосфатидилглицерин), DPPG (дипальмитоил фосфатидилглицерин), DEPG (Dielaidoyl Фосфатидилглицерин), DOPG (диолеоил Фосфатидилглицерин), DEPA (диэлаидоил фосфатидная кислота), DOPA (диолеоил фосфатидная кислота), DSP (дистеароил фосфатидилсерин), DPPS (дипальмитоил фосфатидилсерин), DEPS (диэлаидоил фосфатидилсерин) и DOPS (диолеоил фосфатидилсерин), L-α-лизофосфатидилсерин, L-α-лизофосфатидилинозитол, тетрадецилфосфоновая кислота, L-α-фосфатидилинозит-4-фосфат, L-α-фосфатидилинозитол-4,5-бисфосфат, 1,2-дифитаноил-sn-глицеро-3-фосфат, 1,2-ди-O-тетрадецил-sn-глицеро-3-фосфо-(1'-rac-глицерин) и их смеси.
[0019] Конкретные анионные фосфолипиды, подходящие для применения в настоящем изобретении, включают 1,2-дистеароил-sn-глицеро-3-фосфоэтаноламин (DSPE)-конъюгированный полиэтиленгликоль, который имеет следующую структуру:

где значение "n" варьирует в зависимости от молекулярной массы. Такие анионные фосфолипиды обозначают здесь mPEG-(мол. масса)DSPE. Подходящие примеры включают mPEG-2000-DSPE и mPEG-5000-DSPE, где DSPE представляет собой 1,2-дистеароил-sn-глицеро-3-фосфоэтаноламин. Другие примеры включают mPEG-2000-DPPE и mPEG-5000-DPPE, где DPPE представляет собой 1,2-дипальмитоил-sn-глицеро-3-фосфоэтаноламин.
[0020] Кроме того, можно получить и использовать синтетические анионные фосфолипиды с длиной цепи менее C16. Также можно получить синтетические липиды, содержащие жирные кислоты, несущие дополнительные анионные группы в жирнокислотных цепях. Примером таких соединений является 1-пальмитоил-2-глутарил-sn-глицеро-3-фосфохолин, который содержит жирную кислоту с более короткой цепью, которая заканчивается карбоксильной группой.
[0021] Указанные природные и синтетические анионные липиды можно получить из нескольких коммерческих источников, таких как полярные липиды Avanti (Alabaster, AL), или Lipoid LLC (Newark, NJ), или Cordon Pharma (Boulder, CO), или NOF Corp America (White Plains, NY).
Жирная кислота:
[0022] В соответствии с данным описанием "жирная кислота" представляет собой карбоновую кислоту с длинным алифатическим хвостом (длинной алифатической цепью), которая может быть насыщенной или ненасыщенной и содержит углеродную цепь из 10 или более атомов. Цепь из атомов углерода может быть линейной, разветвленной, насыщенной, моно- или поли-ненасыщенной.
[0023] Подходящие насыщенные жирные кислоты включают, без ограничения: каприновую кислоту, лауриновую кислоту, миристиновую кислоту, пальмитиновую кислоту, стеариновую кислоту, арахидоновую кислоту, докозановую кислоту, тетракозановую кислоту и гексакозановую кислоту.
[0024] Подходящие ненасыщенные жирные кислоты включают, без ограничения: цис-2-деценовую кислоту, миристолеиновую кислоту, пальмитолеиновую кислоту, сапиеновую кислоту, олеиновую кислоту, элаидиновую кислоту, вакценовую кислоту, линолевую кислоту, линоэлаидиновую кислоту, α-линоленовую кислоту, арахидоновую кислоту, цис-паринаровую кислоту, эйкозапентаеновую кислоту и фитановую кислоту.
PEG-карбоновые кислоты:
[0025] Используемый здесь термин "PEG-карбоновая кислота" относится к полиэтиленгликолевому (PEG) полимеру, функционализированному карбоновой кислотой. PEG можно функционализировать с получением монофункционального (монокарбоксилат) или гомобифункционального (дикарбоксилат) производного. Функционализированный PEG может быть линейным или разветвленным. Средний диапазон молекулярной массы PEG-карбоновой кислоты, подходящей для применения в настоящем изобретении, может составлять примерно от 1000 до 100000.
[0026] Гомобифункциональные PEG, подходящие для применения в настоящем изобретении, можно описать в целом как СООН-PEG-COOH, или химической формулой:
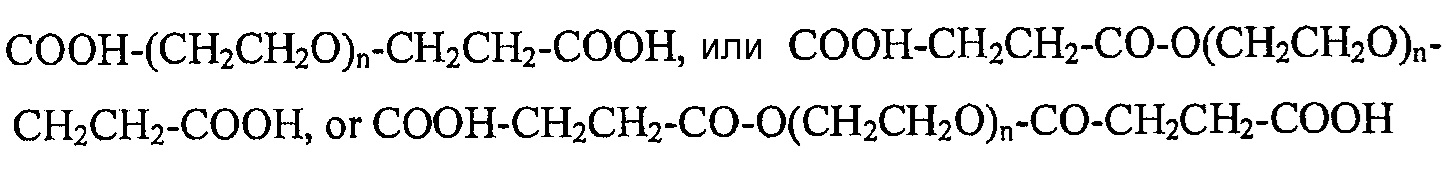
где значение "n" варьирует в зависимости от молекулярной массы. Например, PEG-карбоновая кислота, указанная в примерах как PEG-10000-дикарбоксилат, представляет собой гомобифункциональный PEG, имеющий молекулярную массу 10000. Для применения в настоящем изобретении подходит средний диапазон молекулярных масс примерно от 1000 до 100000. Как правило, молекулярная масса варьирует от 1000 до 40000.
[0027] Один тип монофункциональных PEG-карбоновых кислот, подходящих для применения в настоящем изобретении, можно описать в целом как mPEG-COOH, или химической формулой:
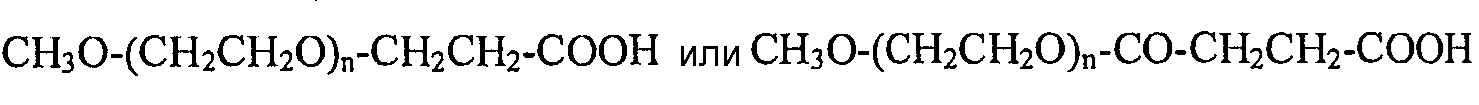
где значение "n" также варьирует в зависимости от молекулярной массы. Например, используемый в примерах mPEG-10000 представляет собой монофункциональный PEG, содержащий метоксигруппу, как показано в формуле. Для применения в настоящем изобретении подходит средний диапазон молекулярных масс примерно от 1000 до 100000. Как правило, молекулярная масса варьирует от 1000 до 40000.
[0028] Другой тип монофункциональных PEG-карбоновых кислот, подходящих для применения в настоящем изобретении, можно описать в целом как PEG-COOH или химической формулой: НО-(CH2CH2O)n-CH2CH2-COOH, где значение "n" варьирует в зависимости от молекулярной массы. Например, PEG-карбоновая кислота, указанная в примерах как PEG-10000-монокарбоксилат, представляет собой монофункциональный PEG, имеющий молекулярную массу 10000. Для применения в настоящем изобретении подходит средний диапазон молекулярных масс примерно от 1000 до 100000. Как правило, молекулярная масса варьирует от 1000 до 40000.
[0029] Подходящие PEG-карбоновые кислоты включают, без ограничения, PEG-10000-монокарбоксилат, PEG-20000-монокарбоксилат, mPEG-1000-монокарбоксилат, mPEG-2000-монокарбоксилат, mPEG-5000-монокарбоксилат, mPEG-10000-монокарбоксилат, mPEG-20000-монокарбоксилат, mPEG-30000-монокарбоксилат, mPEG-40000-монокарбоксилат, PEG-1000-дикарбоксилат, PEG-2000-дикарбоксилат, PEG-3500-дикарбоксилат, PEG-5000 дикарбоксилата, PEG-7500-дикарбоксилат, PEG-10000-дикарбоксилат и Y-образный PEG-40000-монокарбоксилат. Указанные выше Y-образные PEG-карбоновые кислоты можно изобразить следующим образом:

где значение "n" определяет молекулярную массу.
[0030] В конкретных вариантах осуществления PEG-карбоновая кислота выбрана из группы, включающей PEG-5000-монокарбоксилат, PEG-10000-монокарбоксилат, PEG-20000-монокарбоксилат, mPEG-5000-монокарбоксилат, mPEG-10000-монокарбоксилат, mPEG-20000-монокарбоксилат, PEG-5000-дикарбоксилат и PEG-10000-дикарбоксилат.
[0031] Подходящие PEG-карбоновые кислоты можно получить на коммерческиой основе от Nanocs, Inc. (New York, NY), JenKem Technology (Allen, TX) или NOF Corp America (White Plains, NY).
[0032] В некоторых вариантах осуществления в состав композиции могут входить два или более из описанных выше анионных наполнителей (таких как PEG-карбоновая кислота, анионный фосфолипид и жирная кислота). Например, фармацевтическая композиция настоящего изобретения может содержать PEG-карбоновую кислоту и анионный фосфолипид, PEG-карбоновую кислоту и жирную кислоту, или жирную кислоту и анионный фосфолипид. В следующем варианте осуществления в состав композиции могут входить три или более анионных наполнителей, выбранных из жирной кислоты, анионного фосфолипида и PEG-карбоновой кислоты. В конкретных вариантах осуществления сочетание анионных наполнителей выбрано из стеариновой кислоты и mPEG-2000-DspE; DPPA и PEG-10000-дикарбоксилата; DPPA и PEG-3350; DPPA; DPPA и mPEG-3350; и mPEG-2000-DSPE. В следующем варианте осуществления любой из описанных здесь анионных фосфолипидов можно дополнительно объединить с карбоксиметилцеллюлозой (CMC) с получением, например, сочетания mPEG-2000-DspE и CMC.
Катионные пептиды:
[0033] В данном описании термин "катионный полипептид" относится к любому полипептиду, который несет положительный заряд при рН примерно 5,0. Катионный полипептид может содержать природные аминокислотные остатки, неприродные аминокислотные остатки, или их смесь. Положительный заряд катионных полипептидов обусловлен наличием катионной функциональной группы, либо присутствующей в боковой цепи аминокислоты полипептидной последовательности, либо являющейся частью альфа-аминогруппы аминокислоты полипептидной последовательности, либо той и другой. Положительный заряд катионного полипептида также может быть обусловлен наличием катионной функциональной группы, лигированной с полипептидом по любому из концов пептидной последовательности, или по боковой цепи аминокислоты, входящей в состав последовательности. Катионный полипептид может содержать несколько катионных функциональных групп. Например, катионный полипептид может содержать 1, 2, 3, 4, 5, 6 или более катионных функциональных групп, каждая из которых может нести положительный заряд. Такие функциональные группы включают, например, аминогруппы (первичные, вторичные или третичные), четвертичные аммониевые группы, гуанидиногруппы, амидиногруппы, пиридин, имидазольные группы, фосфониевые группы и сульфониевые группы. В конкретном варианте осуществления катионная группа представляет собой аминогруппу, гуанидиногруппу или имидазольную группу.
[0034] Катионные полипептиды настоящего изобретения могут содержать один или несколько хиральных центров и, следовательно, могут существовать в виде разных стереоизомерных форм. Все стереоизомеры и их смеси входят в объем настоящего изобретения. Рацемические соединения можно разделить на индивидуальные энантиомеры методом препаративной высокоэффективной жидкостной хроматографии на колонке с хиральной стационарной фазой, с использованием методов, известных специалистам в данной области. Кроме того, можно разделить промежуточные хиральные соединения и использовать их для получения хиральных соединений настоящего изобретения.
[0035] Описанные здесь катионные полипептиды могут существовать в виде одной или нескольких таутомерных форм. Все таутомеры и их смеси входят в объем настоящего изобретения.
[0036] Катионные полипептиды, подходящие для применения в настоящем изобретении, включают, без ограничения, перечисленные ниже категории полипептидов и конкретные полипептидов, а также полипептиды, представленные формулой I. Катионные полипептиды являются фармакологически активными.
Агонисты LHRH (GnRH):
Лейпролид: Pyr-His-Trp-Ser-Tyr-D-Leu-Leu-Arg-Pro-NHEt (SEQ ID NO: 46)
Бусерелин: Pyr-His-Trp-Ser-Tyr-D-Ser(tBU)-Leu-Arg-Pro-NHEt (SEQ ID NO: 47)
Гистрелин: Pyr-His-Trp-Ser-Tyr-D-His(Bzl)-Leu-Arg-Pro-NHEt (SEQ ID NO: 48)
Госерелин: Pyr-His-Trp-Ser-Tyr-D-Ser(tBU)-Leu-Arg-Pro-Azagly-NH2 (SEQ ID NO: 49)
Деслорелин: Pyr-His-Trp-Ser-Tyr-D-Trp-Leu-Arg-Pro-NHEt (SEQ ID NO: 50)
Нафарелин: Pyr-His-Trp-Ser-Tyr-D-Nal(2)-Leu-Arg-Pro-Gly-NH2 (SEQ ID NO: 51)
Трипторелин: Pyr-His-Trp-Ser-Tyr-D-Trp-Leu-Arg-Pro-Gly-NH2 (SEQ ID NO: 52)
Аворелин: Pyr-His-Trp-Ser-Tyr-D-Trp(2-Me)-Leu-Arg-Pro-NHEt (SEQ ID NO: 53)
Антагонисты GnRH:
Абареликс: Ac-D-Nal(2)-D-Phe(4Cl)-D-Pal(3)-Ser-(Me)Tyr-D-Asn-Leu-Lys(iPr)-Pro-D-Ala-NH2 (SEQ ID NO: 54)
Цетрореликс: Ac-D-Nal(2)-D-Phe(4Cl)-D-Pal(3)-Ser-Tyr-D-Cit-Leu-Arg-Pro-D-Ala-NH2 (SEQ ID NO: 55)
Дегареликс: Ac-D-Nal(2)-D-Phe(4Cl)-D-Pal(3)-Ser-Phe(4-(4S)-гексагидро-2,6-диоксо-4-пиримидинил(карбонил)амино)-D-Phe(4-гуанидино)-Leu-Lys(iPr)-Pro-D-Ala-NH2 (SEQ ID NO: 56)
Ганиреликс: Ac-D-Nal(2)-D-Cpa(4)-D-Pal(3)-Ser-Tyr-D-Harg(Et)2-Leu-Harg(Et)2-Pro-D-Ala-NH2 (SEQ ID NO: 57)
Аналоги соматостатина:
Октреотид: D-Phe-[Cys-Phe-D-Trp-Lys-Thr-Cys]-Thr-ол (SEQ ID NO: 58)
Ланреотид: D-Nal(2)-[Cys-Tyr-D-Trp-Lys-Val-Cys]-Thr-NH2 (SEQ ID NO: 59)
Вапреотид: D-Phe-[Cys-Tyr-D-Trp-Lys-Val-Cys]-Trp-NH2 (SEQ ID NO: 60)
Пасиреотид (сигнифор): цикло[(4R)-4-(2-аминоэтилкарбамоилокси)-L-пролил-L-фенилглицил-D-триптофил-L-лизил-4-О-бензил-L-тирозил-L-фенилаланил] (SEQ ID NO: 60)
Другие пептиды:
Глюкагон
Амилин
Прамлинтид
Инсулин
Глюкагон-подобный пептид 1 (GLP-1)
Агонист GLP-1
Эксенатид
Паратгормон (РТН)
Адренокортикотропный гормон (АКТГ)
Ботулинический токсин
Амилоидный пептид
Холецистикинин
Кальцитонин
Конотоксин
Приалт
Желудочный ингибиторный пептид
Инсулиноподобный фактор роста, в том числе полученный в промышленном масштабе рекомбинантный IGF-1, такой как
Инкрелекс
Рилизинг-фактор гормона роста
Противомикробный фактор
Глатирамер (Копаксон)
Гематид (пегинесатид)
Насиритид
Пептид ANF
Пептид ангиотензин
АКТГ
Человеческий гормон роста (hGH), в том числе полученный в промышленном масштабе рекомбинантный hGH
Меланокортин
Опиоидный пептид
Динорфин
Окситоцин
Аналог окситоцина, включающий антагонисты
Вазопрессин и его аналоги и
Соматостатин и его аналоги
Катионные полипептиды формулы I:
[0037] Катионные полипептиды, подходящие для применения в настоящем изобретении, включают соединения формулы (I):

или их фармацевтически приемлемые соли,
где:
R1 обозначает Н или С1-С6 ацил;
R2 обозначает -NR3R4, или -OR5, где каждый из R3, R4 и R5 независимо обозначает Н или C1-С6 алкил;
А1 обозначает аминокислотный остаток, выбранный из Arg, Lys, Orn, His, Nle, Phe, Val, Leu, Trp, Tyr, Ala, Ser, Thr, Gln, Asn, Asp, Glu или TzAla; или
А1 обозначает фрагмент, выбранный из необязательно замещенного С1-С12 алкила, необязательно замещенного С6-С18 арила, необязательно замещенного C5-С18 гетероарила, аралкила, в котором арильная часть представляет собой необязательно замещенный С6-С18 арил, а алкильная часть представляет собой необязательно замещенный С1-С12 алкил, или гетероаралкила, где гетероарильная часть представляет собой необязательно замещенный С5-С18 гетероарил, а алкильна часть представляет собой необязательно замещенный С1-С12 алкил;
каждый из А2 и А8 независимо обозначает остаток аминокислоты, выбранный из Cys, hCys, Pen, Asp, Glu, Lys, Orn, Dbu или Dpr, где пары А2 и А8 выбирают таким образом, чтобы обеспечить возможность образования ковалентной связи между соответствующими боковыми цепями;
А3 отсутствует или обозначает аминокислотный остаток, выбранный из Ala, Tle, Val, Leu, Ile, Cha, Pro, Ser, Thr, Lys, Arg, His, Phe, Gln, Sar, Gly, Asn или Aib;
А4 отсутствует или обозначает аминокислотный остаток, выбранный из Atc, Ala, QAla, Aib, Sar, Ser, Thr, Pro, Hyp, Asn, Gln, необязательно замещенного His, Trp, Tyr, Lys, Arg, sChp, или остаток Х, где Х обозначает аминокислоту, представленную следующей структурной формулой

А5 обозначает необязательно замещенный Phe, необязательно замещенный 1-Nal, или необязательно замещенный 2-Nal;
А6 обозначает Arg; и
А7 обозначает Trp,
где любой аминокислотный остаток может находиться в L- или в D-конфигурации.
[0038] В иллюстративных вариантах осуществления А3 и А4 не отсутствуют одновременно. Остальные переменные имеют значения и предпочтительные значения, определенные выше и ниже в применении к формуле (I).
[0039] В иллюстративных вариантах осуществления, если А4 обозначает аминокислоту, А3 отличается от Aib или Gly. Остальные переменные имеют значения и предпочтительные значения, определенные выше в применении к формуле (I).
[0040] В иллюстративных вариантах осуществления, если А4 обозначает His, а А5 обозначает D-Phe или 2-Nal, А3 отличается от D-аминокислоты или L-Ala. Остальные переменные имеют значения и предпочтительные значения, определенные выше в применении к формуле (I).
[0041] В иллюстративных вариантах осуществления, если каждый из А2 и А8 выбран из Cys, hCys или Pen, то: (a) если А4 отсутствует, А3 отличается от L-His; (b) если А3 отсутствует, А4 отличается от L-His; и (c) если А4 обозначает His, А3 отличается от Glu, Leu или Lys. Остальные переменные имеют значения и предпочтительные значения, определенные выше в применении к формуле (I).
[0042] В иллюстративных вариантах осуществления: 1) А3 и А4 не отсутствуют одновременно; 2) если А4 обозначает аминокислоту, А3 отличается от Aib или Gly; и 3) если А4 обозначает His, а А5 обозначает D-Phe или 2-Nal, А3 отличается от D-аминокислоты или L-Ala; 4) если каждый из А2 и А8 выбран из Cys, hCys или Pen, то: (a) если А4 отсутствует, А3 отличается от L-His; (b) если А3 отсутствует, А4 отличается от L-His; и (c) если А4 обозначает His, А3 отличается от Glu, Leu или Lys. Остальные переменные имеют значения и предпочтительные значения, определенные выше в применении к формуле (I).
[0043] В другом варианте осуществления полипептидов формулы (I), А4 обозначает L-аминокислоту. В других вариантах осуществления А4 отсутствует. Остальные переменные имеют значения и предпочтительные значения, определенные выше в применении к формуле (I).
[0044] В иллюстративных вариантах осуществления А5 может представлять собой необязательно замещенный 1-Nal или необязательно замещенный 2-Nal, например, необязательно замещенный D-2-Nal. А5 может быть замещен по любому из пяти ароматических атомов углерода заместителем, выбранным из F, Cl, Br, I, -СН3, -ОН, -CN, амин, -NO2 или -OCH3.
[0045] В следующем варианте осуществления полипептидов формулы (I), A5 представляет собой необязательно замещенный D-Phe. А5 может быть замещен по любому из пяти ароматических атомов углерода заместителем, выбранным из F, Cl, Br, I, -СН3, -ОН, -CN, амин, -NO2 или -OCH3. Подходящие примеры А5 включают, без ограничения, остаток D-аминокислоты, выбранный из:

Остальные переменные имеют значения и предпочтительные значения, определенные выше в применении к формуле (I).
[0046] В другом варианте осуществления полипептидов формулы (I) A5 обозначает необязательно замещенный D-2-Nal. А5 может быть замещен по любому из пяти ароматических атомов углерода заместителем, выбранным из F, Cl, Br, I, -СН3, -ОН, -CN, амин, -NO2 или -OCH3.
[0047] В следующем варианте осуществления полипептидов формулы (I) А4 обозначает His, необязательно замещенный по любому замещаемому положению заместителем, выбранным из F, Cl, Br, I, -СН3, -ОН, -CN, амин, -NO2, бензил или -OCH3. Остальные переменные имеют значения и предпочтительные значения, определенные выше в применении к формуле (I).
[0048] В конкретном варианте осуществления соединения настоящего изобретения представляют собой полипептиды формулы (I), которые характеризуются EC50 в отношении MC4R, составляющим примерно от 0,01 нМ до 10 нМ, например 0,01-3 нМ, при этом соотношение EC50(MCLR)/EC50(MC4R) составляет, по меньшей мере, 10. В другом варианте осуществления полипептиды настоящего изобретения включают полипептид, представленный одной из нижеследующих структурных формул:

или его фармацевтически приемлемую соль.
[0049] В следующем варианте осуществления полипептиды настоящего изобретения включают полипептид, представленный одной из нижеследующих структурных формул:

или его фармацевтически приемлемую соль.
[0050] В другом варианте осуществления полипептиды настоящего изобретения включают полипептид, представленный одной из нижеследующих структурных формул:

или его фармацевтически приемлемую соль.
[0051] В следующем варианте осуществления полипептиды настоящего изобретения включают полипептид, представленный формулой (I), где А4 обозначает аминокислотный остаток, выбранный из Atc, Ala, QAla, Aib, Sar, Ser, Thr, Pro, Hyp, Asn, Gln, необязательно замещенного His, Trp, Tyr, Lys, Arg, sChp, или остаток Х. Примеры таких пептидов включают пептид, представленный одной из нижеследующих структурных формул:

или его фармацевтически приемлемую соль.
[0052] В иллюстративных вариантах осуществления полипептиды настоящего изобретения включают пептид, представленный одной из нижеследующих структурных формул:

или его фармацевтически приемлемую соль.
[0053] В другом варианте осуществления полипептиды настоящего изобретения включают полипептиды, представленные формулой (I), где А3 обозначает аминокислотный остаток, выбранный из Tle, Val, Leu, Ile, Cha, Pro, Ser, Thr, Lys, Arg, His, Phe, Gln, Sar, Gly, Asn или Aib; а А4 обозначает аминокислотный остаток, выбранный из Atc, Ala, QAla, Aib, Sar, Ser, Thr, Pro, Hyp, Asn, Gln, замещенного His, Trp, Tyr, Lys, Arg, sChp, или остаток Х. Примером таких полипептидов является полипептид, представленный одной из нижеследующих структурных формул:

или его фармацевтически приемлемая соль.
[0054] В следующем варианте осуществления полипептиды настоящего изобретения включают полипептид, представленный одной из нижеследующих структурных формул:

или его фармацевтически приемлемую соль.
[0055] В следующем варианте осуществления полипептиды настоящего изобретения включают полипептид, представленный одной из нижеследующих структурных формул:

или его фармацевтически приемлемую соль.
[0056] В следующем варианте осуществления полипептиды настоящего изобретения включают полипептид, представленный одной из нижеследующих структурных формул:

или его фармацевтически приемлемую соль.
[0057] В следующем варианте осуществления полипептиды настоящего изобретения включают полипептид, представленный одной из нижеследующих структурных формул:

или его фармацевтически приемлемую соль. В другом варианте осуществления полипептиды настоящего изобретения включают полипептид, представленный одной из нижеследующих структурных формул:

или его фармацевтически приемлемую соль.
В альтернативном варианте осуществления катионные пептиды, подходящие для применения в настоящем изобретении, включают пептиды формулы (II) или их фармацевтически приемлемые соли:
Выделенный полипептид нижеследующей структурной формулы (II):

или его фармацевтически приемлемая соль,
в которой:
где:
R1 обозначает Н или С1-С6 ацил;
R2 обозначает -NR3R4, или -OR5, где каждый из R3, R4 и R5 независимо обозначает Н или C1-С6 алкил;
А1 отсутствует; или
А1 обозначает аминокислотный остаток, выбранный из Arg, Lys, Orn, His, Nle, Phe, Val, Leu, Trp, Tyr, Ala, Ser, Thr, Gln, Asn, Asp, Glu или TzAla; или
А1 обозначает фрагмент, выбранный из необязательно замещенного С1-С12 алкила, необязательно замещенного С6-С18 арила, необязательно замещенного C5-С18 гетероарила, аралкила, в котором арильная часть представляет собой необязательно замещенный С6-С18 арил, а алкильная часть представляет собой необязательно замещенный С1-С12 алкил, или гетероаралкила, где гетероарильная часть представляет собой необязательно замещенный С5-С18 гетероарил, а алкильная часть представляет собой необязательно замещенный С1-С12 алкил;
каждый из А2 и А8 независимо обозначает остаток аминокислоты, выбранный из Cys, hCys, Pen, Asp, Glu, Lys, Orn, Dbu или Dpr, где пары А2 и А8 выбирают таким образом, чтобы обеспечить возможность образования ковалентной связи между соответствующими боковыми цепями;
А3 отсутствует или обозначает аминокислотный остаток, выбранный из Ala, Tle, Val, Leu, Ile, Cha, Pro, Ser, Thr, Lys, Arg, His, Phe, Gln, Sar, Gly, Asn, Aib или остаток Y, где Y представляет собой аминокислоту, выбранную из аминокислот, представленных нижеследующими структурными формулами
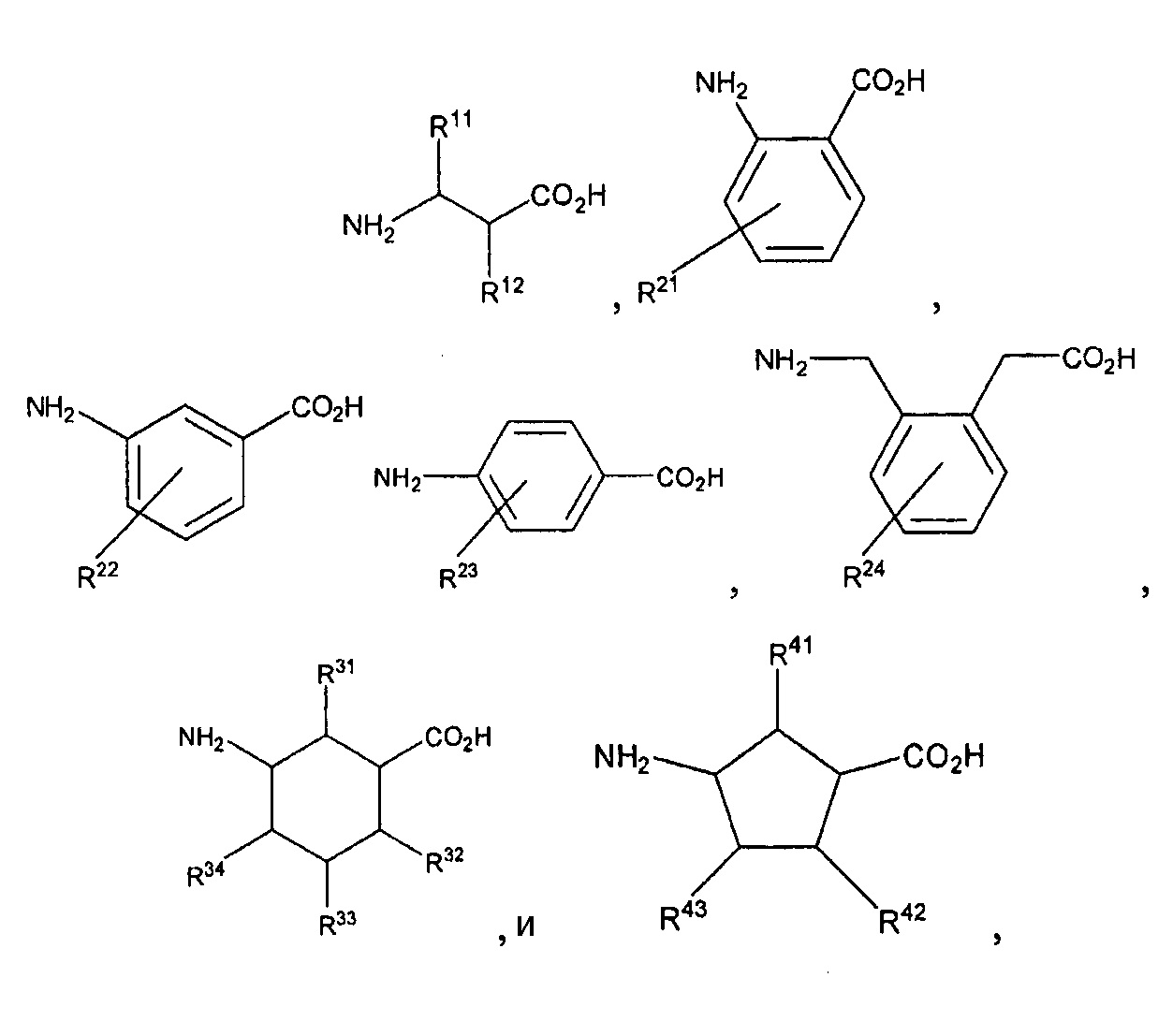
где:
каждый из R11 и R12 независимо обозначает Н, -СН3, фенил или бензил;
каждый из R21, R22, R23 и R24 независимо обозначает Н, -СН3, -CF3, фенил, бензил, F, Cl, Br, I, -OCH3 или -ОН;
каждый из R31, R32, R33, R34, R41, R42 и R43 независимо обозначает Н, -СН3, -CF3, фенил, бензил, F, Cl, Br, I, -OCH3 или -ОН;
А4 отсутствует или обозначает аминокислотный остаток, выбранный из Atc, Ala, QAla, Aib, Sar, Ser, Thr, Pro, Hyp, Asn, Gln, необязательно замещенного His, Trp, Tyr, Lys, Arg, sChp, или остаток Х, где Х обозначает аминокислоту, представленную нижеследующей структурной формулой


где:
каждый из R51 и R52 независимо обозначает Н, -СН3, фенил или бензил;
каждый из R61, R62, R63 и R64 независимо обозначает Н, -СН3, -CF3, фенил, бензил, F, Cl, Br, I, -ОСН3 или -ОН;
каждый из R71, R72, R73, R74, R81, R82 и R83 независимо обозначает Н, -СН3, -CF3, фенил, бензил, F, Cl, Br, I, -ОСН3 или -ОН;
А5 обозначает необязательно замещенный Phe, необязательно замещенный 1-Nal, или необязательно замещенный 2-Nal;
А6 обозначает Arg; и
А7 обозначает Trp,
где любой аминокислотный остаток может находиться в L- или в D-конфигурации.
В иллюстративных вариантах осуществления каждый из А3 и А4 независимо обозначает остаток аминокислоты, выбранной из аминокислот, представленных нижеследующими структурными формулами:
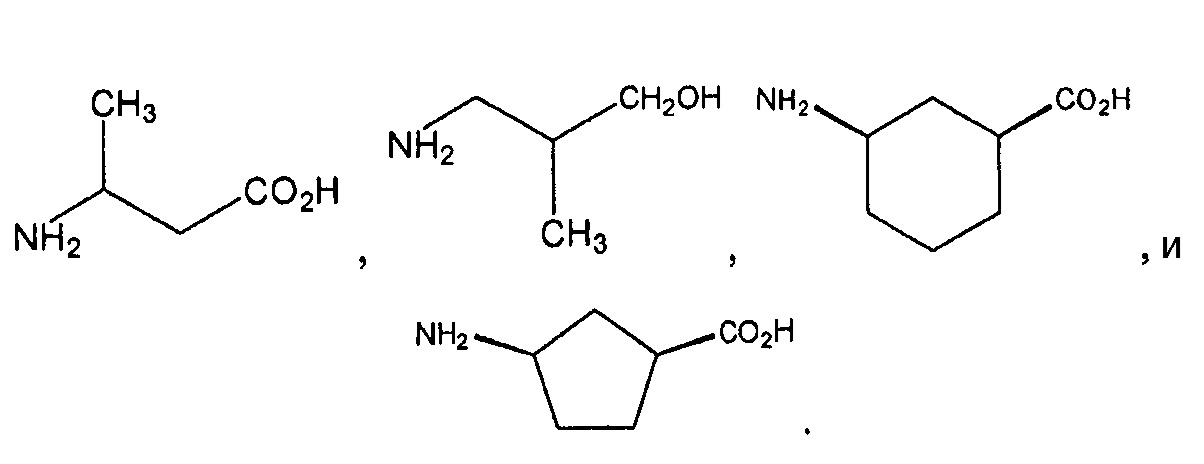
Остальные переменные имеют значения и предпочтительные значения, определенные выше в применении к формуле (I).
[0058] Термин "алкил", используемый отдельно или как часть более крупного фрагмента, такого как "гидроксиалкил", "алкоксиалкил", "алкиламин" обозначает линейную или разветвленную, насыщенную алифатическую группу, содержащую указанное число атомов углерода, обычно от 1 до 12 атомов углерода. Более конкретно, алифатическая группа может содержать от 1 до 8, от 1 до 6 или от 1 до 4 атомов углерода. Данный термин иллюстрируется такими группами, как метил, этил, н-пропил, изопропил, н-бутил, изобутил, трет-бутил, н-гексил и т.п.
[0059] "Галогеналкил" представляет собой алкильную группу, замещенную одним или несколькими атомами галогена.
[0060] Термин "галоген" включает фтор, хлор, бром или иод.
[0061] "Циано" представляет собой группу -CN.
[0062] "Ph" обозначает фенильную группу.
[0063] Термин "карбонил" относится к двухвалентной группе -C(O)-.
[0064] Термин "арил", используемый отдельно или как часть более крупного фрагмента, такого как "аралкил", относится к ароматической карбоциклической группе размером от 6 до 18 атомов углерода, содержащей один цикл, или несколько конденсированных циклов. Термин "арил" также включает ароматический карбоцикл (карбоциклы), сопряженный с циклоалкильными или гетероциклоалкильными группами. Примеры арильных групп включают фенил, бензо[d][1,3]диоксол, нафтил, фенантренил и т.п.
[0065] Термин "арилокси" относится к группе -OAr, где О обозначает атом кислорода, а Ar обозначает арильную группу, описанную выше.
[0066] "Аралкил" представляет собой алкил, в котором, по меньшей мере, один алкильный атом водорода замещен арильным фрагментом, таким как бензил, -(CH2)2фенил, -(CH2)3фенил, -СН(фенил)2 и т.п.
[0067] Термин "гетероарил", используемый отдельно или как часть более крупного фрагмента, такого как "гетероаралкил", включает 5-18-членную моноциклическую, бициклическую или трициклическую гетероароматическую систему, содержащую от одного до четырех циклических гетероатомов, независимо выбранных из азота, кислорода и серы. Термин "гетероарил" также включает гетероароматический цикл (циклы), сопряженный с циклоалкильными или гетероциклоалкильными группами. Конкретные примеры гетероарильных групп включают пиридил, необязательно замещенный пирролил, пиримидинил, фурил, тиенил, имидазолил, оксазолил, изоксазолил, тиазолил, изотиазолил, пиразолил, 1,2,3-триазолил, 1,2,4-триазолил, 1,2,3-оксадиазолил, 1,2,4-оксадиазолил, 1,2,5-оксадиазолил, 1,3,4-оксадиазолил, 1,3,4-триазинил, 1,2,3-триазинил, бензофурил, [2,3-дигидро]бензофурил, изобензофурил, бензотиенил, бензотриазолил, изобензотиенил, индолил, изоиндолил, 3Н-индолил, бензимидазолил, имидазо[2-а]пиридил, бензотиазолил, бензоксазолил, хинолизинил, хиназолинил, фталазинил, хиноксалинил, циннолинил, нафтиридинил, пиридо[3,4-b]пиридил, пиридо[3,2-b]пиридил, пиридо[4,3-b]пиридил, хинолил, изохинолил, тетразолил, 1,2,3,4-тетрагидрохинолил, 1,2,3,4-тетрагидроизохинолил, пуринил, птеридинил, карбазолил, ксантенил, бензохинолил и т.п.
[0068] Термин "гетероаралкил" относится к алкилу, в котором, по меньшей мере, один алкильный атом водорода замещен гетероарильным фрагментом, таким как -СН2-пиридинил, -СН2-пиримидинил и т.п.
[0069] Термин "алкокси" относится к группе -O-R, где R обозначает "алкил", "циклоалкил", "алкенил" или "алкинил". Примеры алкоксигрупп включают, например, метокси, этокси, этенокси и т.п.
[0070] "Гидроксиалкил" и "алкоксиалкил" представляют собой алкильные группы, замещенные гидроксилом и алкоксильной группой, соответственно.
[0071] Термин "амино" относится к -NH2; "алкиламин" и "диалкиламин" представляют собой группы -NHR и -NR2, соответственно, где R обозначает алкильную группу. Термины "циклоалкиламин" и "дициклоалкиламин" относятся к -NHR и -NR2, соответственно, где R обозначает циклоалкильную группу. "Циклоалкилалкиламин" представляет собой -NHR, где R обозначает циклоалкилалкильную группу. "[Циклоалкилалкил][алкил]амин" представляет собой -N(R)2, где один R обозначает циклоалкилалкил, а другой R обозначает алкил.
[0072] Термин "ацил" относится к Rʺ-C(O)-, где Rʺ обозначает Н, алкил, замещенный алкил, гетероалкил, замещенный гетероалкил, алкенил, замещенный алкенил, арил, алкиларил или замещенный алкиларил, и обозначается в общей формуле конкретного варианта осуществления как "Ас".
[0073] Подходящие заместители "алкила", "арила", "гетероарила" и т.п. включают фрагменты, введение которых приводит к образованию стабильного соединения настоящего изобретения. Примеры подходящих заместителей могут быть выбраны из группы, включающей галоген, -CN, -ОН, -NH2, (C1-С4)алкил, (C1-С4)галогеналкил, арил, гетероарил, (С3-С7)циклоалкил, (5-7-членный)гетероциклоалкил, -NH(C1-C6)алкил, -N((C1-C6)алкил)2, (C1-C6)алкокси, (C1-C6)алкоксикарбонил,

Более конкретно, заместители могут быть выбраны из галогена, -CN, -ОН, -NH2, (C1-С4)алкила, (С1-С4)галогеналкила, (С1-С4)алкокси, фенила и (С3-С7)циклоалкила. В контексте данного изобретения термин "замещение" также включает случаи замещения атома водорода атомом дейтерия. р обозначает целое число, равное 1 или 2.
[0074] Замещенный Phe может содержать от одного до пяти заместителей на любых ароматических атомах углерода, причем заместители могут быть выбраны из F, Cl, Br, I, -СН3, -ОН, -CN, амина, -NO2 или -OCH3. Примеры подходящих заместителей включают

[0075] Замещенный His включает от одного до трех заместителей на любых замещаемых циклических атомах, причем подходящие заместители могут быть выбраны из F, Cl, Br, I, -СН3, -ОН, -CN, амина, -NO2, бензила или -OCH3. Примеры включают 1-метилгистидин и 3-метилгистидин.
[0076] Обозначение "(аминокислота)n" указывает на то, что аминокислота повторяется n раз. Например, обозначение "(Pro)2" или "(Arg)3" указывает на то, что остатки пролина или аргинина повторяются, соответственно, два или три раза.
[0077] Фармацевтически приемлемые соли раскрытых здесь соединений включены в настоящее изобретение. Например, соль кислоты и соединения, содержащего аминогруппу или другую основную группу, можно получить путем взаимодействия соединения с подходящей органической или неорганической кислотой, с получением фармацевтически приемлемых анионогенных солевых форм. Примеры анионогенных солей включают ацетаты, бензолсульфонаты, бензоаты, бикарбонаты, битартраты, бромиды, кальций эдетаты, камсилаты, карбонаты, хлориды, цитраты, дигидрохлориды, эдетаты, эдисилаты, эстолаты, эзилаты, фумараты, глицептаты, глюконаты, глутаматы, гликоллиларсанилаты, гексилрезорцинаты, гидробромиды, гидрохлориды, гидроксинафтоаты, иодиды, изотионаты, лактаты, лактобионаты, малаты, малеаты, манделаты, мезилаты, метилсульфаты, мукаты, напсилаты, нитраты, памоаты, пантотенаты, фосфаты/дифосфаты, полигалактуронаты, салицилаты, стеараты, субацетаты, сукцинаты, сульфаты, таннаты, тартраты, теоклаты, тозилаты, триэтиодиды и трифторацетаты.
[0078] Соли соединений, содержащих кислотную функциональную группу, можно получить путем взаимодействия с подходящим основанием. Соответствующие фармацевтически приемлемые соли, которые можно получить путем взаимодействия с основаниями, дающими фармацевтически приемлемые катионы, включают соли щелочных металлов (особенно натрия и калия), соли щелочноземельных металлов (особенно кальция и магния), соли алюминия и соли аммония, а также соли, образованные физиологически приемлемыми органическими основаниями, такими как триметиламин, триэтиламин, морфолин, пиридин, пиперидин, пиколин, дициклогексиламин, Ν,Ν'-дибензилэтилендиамин, 2-гидроксиэтиламин, бис-(2-гидроксиэтил)амин, три-(2-гидроксиэтил)амин, прокаин, дибензилпиперидин, дегидроабиетиламин, Ν,Ν'- бисдегидроабиетиламин, глюкамин, N-метилглюкамин, коллидин, хинин, хинолин и основные аминокислоты, такие как лизин и аргинин.
Фармацевтические композиции
[0079] Изобретение также относится к фармацевтической композиции, содержащей ионный комплекс, включающий: катионный полипептид; анионный наполнитель, выбранный из: PEG-карбоновой кислоты; жирной кислоты, содержащей 10 или более атомов углерода; анионных фосфолипидов; и их сочетаний; и фармацевтически приемлемый носитель. В одном варианте осуществления фармацевтическая композиция также содержит дополнительный наполнитель, как описано ниже (например, карбоксиметилцеллюлозу (CMC)). Например, любой из описанных здесь анионных фосфолипидов можно дополнительно объединить с карбоксиметилцеллюлозой (CMC), например в виде сочетаний mPEG-2000-DspE и CMC.
[0080] Отношение концентраций катионного пептида и анионного наполнителя определяется в виде молярного соотношения заряда катионного полипептида к заряду анионного наполнителя. Например, в пересчете на один положительный заряд полипептида количество анионного наполнителя может варьировать от 1:1 до 1:10. В случае присутствия дополнительных положительных зарядов в полипептиде отношение анионного наполнителя можно скорректировать соответствующим образом. Варьируя количество анионного наполнителя в данном соотношении, можно модулировать характеристики высвобождения полипептида in vivo. Более высокое соотношение, как правило, приводит к получению композиции, которая обеспечивает более медленное высвобождение полипептида в участке введения, чем композиция, полученная при использовании более низкого соотношения.
[0081] Термин "фармацевтически приемлемый носитель" в применении к фармацевтической композиции настоящего изобретения относится к биосовместимой полярной жидкости. Полярная природа жидкости помогает поддерживать комплекс в ионной форме. Биосовместимые полярные жидкости включают, без ограничения, PEG (полиэтиленгликоль, например, полиэтиленгликоль, имеющий среднюю молекулярную массу от 100 до 5000), полиол (например, пропиленгликоль (ПГ), трипропиленгликоль, глицерин), этанол, бензиловый спирт, ДМСО, NMP, ДМФА, воду, буферные растворы и их смеси. Следует понимать, что в состав фармацевтической композиции могут входить другие разбавители и другие наполнители, как описано ниже.
[0082] В некоторых вариантах осуществления фармацевтическая композиция настоящего изобретения при введении индивидууму образует депо лекарственного средства. В некоторых вариантах осуществления после введения индивидууму депо лекарственного средства медленно высвобождает активное соединение. В одном аспекте, после введения индивидууму, по меньшей мере, часть фармацевтической композиции осаждается с образованием депо лекарственного средства и высвобождает фармакологически активное соединение с течением времени. В некоторых вариантах осуществления композиции настоящего изобретения обеспечивают высокие концентрации полипептида структурной формулы (I), подходящие для создания депо лекарственного средства, обеспечивающего длительное устойчивое высвобождение терапевтически эффективных уровней полипептида in vivo. Концентрация полипептида структурной формулы (I) в композиции может варьировать, например, в диапазоне, составляющем примерно от 0,0001 мг/мл до 100 мг/мл.
[0083] Фармацевтическая композиция настоящего изобретения может содержать вспомогательные наполнители (также называемые здесь со-наполнители). Подходящие примеры вспомогательных наполнителей включают рН-стабилизирующие буферы, консерванты, поверхностно-активные вещества, антиоксиданты, средства, придающие тоничность, а также ионные и неионные полимеры, описанные в данном документе.
[0084] Такой со-наполнитель может способствовать образованию однородных суспензий и дисперсий ионного комплекса, или даже гидрофобного анионного наполнителя, такого как липид или жирная кислота. Класс со-наполнителей включает диспергирующие и эмульгирующие средства, такие как лецитин, соевое масло, касторовое масло, миглиол, полиэтиленгликоль (с молекулярной массой в диапазоне от 200 до 5000), метилцеллюлозу и карбоксиметилцеллюлозу.
[0085] В данном описании термин "поверхностно-активное вещество" относится к поверхностно-активному средству, или веществу, способному снижать поверхностное натяжение жидкости, в которой оно растворено. Подходящие поверхностно-активные вещества включают полисорбаты, полоксамеры, тритон, додецилсульфат натрия, лаурилсульфат натрия и бетаины. Например, поверхностно-активные вещества включают полиоксиэтилен(20)сорбитана монолаурат (Tween® 20, например, от Sigma-Aldrich), полиоксиэтилен(20)сорбитана монопальмитат (Tween® 40), полиоксиэтилен(20)сорбитана моноолеат (Tween® 80), полоксамер 188, полиоксиэтилен-полиоксипропиленовый блок-сополимер (Pluronic® F-68, например, от Sigma-Aldrich), полиэтиленгликоль 660-12-гидроксистеарат (Soluto1® HS 15 BASF), кокамидопропилбетаин, линолеилбетаин, миристилбетаин, цетилбетаин, полиэтоксилированное касторовое масло (Cremophor®, теперь Kolliphor BASF) и лецитин.
[0086] В данном описании термин "средства, регулирующие тоничность" относится к веществам, используемым для модуляции тоничности композиции. Тоничность, как правило, связана с осмотическим давлением раствора, и обычно определяется по отношению к сыворотке крови человека. Композиция может быть гипотонической, изотонической или гипертонической. Как правило, композиция предпочтительно является изотонической. Изотоническая композиция представляет собой жидкость, или жидкость, полученную путем разведения твердой формы, например, лиофилизированной формы, и представляет собой раствор, имеющий такую же тоничность, как и некий другой раствор, с которым его сравнивают, такой как физиологический раствор и сыворотка крови. Вещества, регулирующие тоничность, могут способствовать уменьшению боли и раздражения у индивидуума после введения. Подходящие средства, регулирующие тоничность, включают декстрозу, глицерин, гидроксиэтилкрахмал, лактозу, маннит (например, D-маннит), раффинозу, сорбит, сахарозу, трегалозу, хлорид натрия, хлорид кальция, хлорид магния и хлорид калия.
[0087] Термин "буфер", в соответствии с данным описанием, обозначает наполнитель, который стабилизирует рН фармацевтической композиции. Подходящие буферы хорошо известны в данной области и описаны в литературе. Примеры подходящих буферов включают гистидиновые буферы, цитратные буферы, сукцинатные буферы, ацетатные буферы и фосфатные буферы, или их смеси. Наиболее предпочтительные буферы содержат цитрат, L-гистидин, или смеси L-гистидина и гидрохлорида L-гистидина. Другим предпочтительным буфером является ацетатный буфер. Независимо от используемого буфера, рН можно регулировать с помощью кислоты или основания, известных в данной области, таких как соляная кислота, уксусная кислота, фосфорная кислота, серная кислота и лимонная кислота, гидроксид натрия и гидроксид калия.
[0088] Ионные полимеры, подходящие для применения в качестве вспомогательного наполнителя, включают ионную карбоксиметилцеллюлозу (CMC), гиалуроновую кислоту, поли(глутаминовую кислоту), поли(аспарагиновую кислоту), сополимер глутаминовой кислоты и глицина, сополимер аспарагиновой кислоты и глицина, сополимер глутаминовой кислоты и аланина, сополимер аспарагиновой кислоты и аланина, гликолят крахмала, полигалактуроновую кислоту, поли(акриловую кислоту), каррагинан и альгиновую кислоту.
[0089] В некоторых вариантах осуществления средний диапазон молекулярной массы CMC составляет примерно от 5000 до 700000. В некоторых вариантах осуществления метилцеллюлоза и карбоксиметилцеллюлоза могут способствовать модуляции вязкости ионного комплекса, обеспечивая образование депо лекарственного средства с замедленным высвобождением и высвобождение активного соединения с течением времени после введения индивидууму.
[0090] Неионные полимеры, подходящие для применения в качестве вспомогательного наполнителя, включают полиэтиленгликоль с молекулярной массой в диапазоне примерно от 100 до 100000, например, примерно от 100 до 60000, например, примерно от 100 до 10000, например, примерно от 100 до 5000. Другие диапазоны массы включают примерно от 200 до 60000. Подходящие примеры нейтральных полимеров включают PEG-3350 и PEG-3400. Полиэтиленгликолевые полимеры включают как PEG, так и mPEG, который может представлять собой монометоксильное или диметоксильное производное. Структуру PEG можно изобразить следующим образом:
НО-(CH2CH2O)n-СН2СН2-ОН
где значение "n" варьирует в зависимости от молекулярной массы. Например, кислота PEG-3500 имеет молекулярную массу 3500.
[0091] mPEG может иметь одну из двух нижеследующих структур:
Монометокси mPEG: CH3O-(CH2CH2O)n-СН2СН2-OH. Один конец кэпирован метоксигруппой, а на другом конце присутствует гидроксильная (ОН) группа.
Диметокси mPEG: CH3O-(CH2CH2O)n-СН2СН2-ОСН3. Оба конца кэпированы метоксильными группами.
[0092] Разбавители добавляют к фармацевтическим композициям настоящего изобретения, чтобы растворить или суспендировать ионный комплекс настоящего изобретения. Разбавители включают биосовместимые вещества, такие как неводных инъекционные жидкости с низкой вязкостью. Неводные инъекционные жидкости с низкой вязкостью включают касторовое масло, растительное масло, минеральное масло, сквален, моноглицериды, диглицериды, триглицериды, или смеси глицеридов. В некоторых вариантах осуществления разбавитель представляет собой Miglyol® 812 (от Sasol GmbH, Germany), Labrafac® WL1349 (триглицерид каприловой кислоты от Gattefosse company, France), Lipoid MCT (от Lipoid company, Germany) и т.п.
[0093] Используемый здесь термин "депо лекарственного средства" относится к осадку, который может образовыватся после введения фармацевтической композиции настоящего изобретения. Композиции могут образовывать депо лекарственного средства медленного высвобождения и высвобождать активное соединение с течением времени после введения индивидууму. В одном аспекте, по меньшей мере, часть композиции выпадает в осадок и высвобождает фармакологически активное соединение с течением времени после введения индивидууму.
[0094] "Консервант" представляет собой соединение, которое можно добавить к композиции для уменьшения бактериальной активности или нежелательных химических изменений в композициях. Примеры консервантов включают бензиловый спирт, этанол, метанол, изопропанол, бутилпарабен, этилпарабен, метилпарабен, пропилпарабен, катехол, 2-хлорфенол, м-крезол, фенол, резорцин, ксилит, 2,6-диметилциклогексанол, 2-метил-2,4-пентадиол, поливинилпирролидон, бензетония хлорид, мертиолят (тимерсозал), бензойную кислоту, хлорид бензалкония, хлорбутанол, бензоат натрия, пропионат натрия и хлорид цетилпиридиния.
способы ЛЕЧЕНИЯ
[0095] Настоящее изобретение относится к применению ионного комплекса и содержащей его фармацевтической композиции для лечения пациента, страдающего от заболевания или расстройства, чувствительного к фармакологической активности катионного полипептида, входящего в состав ионного комплекса. В одном варианте осуществления подлежащее лечению расстройство является чувствительным к модуляции MC4R у индивидуума, нуждающегося в лечении. Способ включает введение индивидууму эффективного количества ионного комплекса, содержащего в качестве катионного полипептида модулятор MC4R, например, описанный в формуле I настоящего документа. В конкретном варианте осуществления расстройство, чувствительное к модуляции MC4R, включает диабет 1 типа, диабет 2 типа, ожирение, резистентность к инсулину, метаболический синдром, мужскую эректильную дисфункцию, женское половое расстройство, неалкогольную жировую дистрофию печени, неалкогольный стеатогепатит, расстройства, связанные с токсикоманией, в том числе связанные с алкоголизмом расстройства приема пищи, кахексия, воспаление и тревожность.
[0096] В некоторых вариантах осуществления ионный комплекс и фармацевтическая композиция, содержащие катионный полипептид формулы I, могут обладать более высокой селективностью и активностью в отношении MC4R и рецептора меланокортина-3 (MC3R), чем в отношении рецептора меланокортина-1 (MC1R). Ионный комплекс и фармацевтическая композиция настоящего изобретения могу способствовать уменьшению или устранению таких нежелательных побочных эффектов, как повышение артериального давления, увеличение частоты сердечных сокращений, нежелательное влияние на половое возбуждение и увеличение пигментации кожи.
[0097] В данном описании фраза "расстройство, чувствительное к модуляции рецептора меланокортина-4" относится к любому расстройству, которое можно лечить путем активации (агонистической) или ингибирования MC4R. Примеры таких расстройств подробно описаны ниже.
[0098] В данном описании термин "модулятор" относится к соединениям, способным взаимодействовать с рецептором-мишенью и оказывать влияние на его биологическую функцию. Примеры модуляторов включают полные агонисты, частичные агонисты, нейтральные антагонисты и обратные агонисты.
[0099] В данном описании термин "агонист" относится к любому химическому соединению, природному или синтетическому, которое при взаимодействии (например, при связывании) с мишенью, здесь с MC4R, повышает сигнальную активность MC4R до уровня выше фонового. Агонист может представлять собой суперагонист (т.е. соединение, способное продуцировать более высокий максимальный ответ, чем эндогенный агонист рецептора-мишени, и, следовательно, имеющее эффективность более 100%), полный агонист (т.е. соединение, которое вызывает максимальный ответ после связывания с рецептором и его активации) или частичный агонист (т.е. соединение, способное активировать рецептор, но не способное вызвать максимальный ответ рецепторной системы). Примеры агонистов MC4R подробно описаны ниже.
[00100] В настоящем описании термин "антагонист" относится к любому химическому соединению, которое при взаимодействии (например, при связывании) с мишенью, здесь с MC4R, блокирует в дозозависимой манере сигнальную активность соединения-агониста MC4R.
[00101] В настоящем описании термин "обратный агонист" относится к любому химическому соединению, которое при взаимодействии (например, при связывании) с мишенью, здесь с MC4R, уменьшает в дозозависимой манере фоновый уровень сигнальной активности MC4R.
[00102] В настоящем описании термин "эффективное количество" относится к количеству фармакологически активного средства, присутствующего в виде либо ионного комплекса, либо фармацевтической композиции, содержащей ионный комплекс, которое является терапевтически или профилактически достаточным для лечения целевого расстройства. Примеры эффективного количества обычно находятся в диапазоне примерно от 0,0001 мг/кг массы тела до 500 мг/кг массы тела. Иллюстративный диапазон включает дозы примерно от 0,001 мг/кг массы тела до 500 мг/кг. Например, эффективное количество может варьировать примерно от 0,005 мг/кг до 500 мг/кг. В других примерах, диапазон может составлять примерно от 0,0001 мг/кг до 5 мг/кг. В следующих примерах эффективное количество может варьировать примерно от 0,01 мг/кг массы тела до 50 мг/кг массы тела, или от 0,01 мг/кг массы тела до 20 мг/кг массы тела.
[00103] В настоящем описании термин "другое средство" включает любой активный фармацевтический ингредиент (API), который в сочетании с описанным здесь пептидом повышает терапевтический эффект описанного здесь пептида отдельно или в синергизме с описанным здесь пептидом (т.е. их совместное действие превышает аддитивный эффект). В настоящем описании термин "повышенный терапевтический эффект" включает улучшенный терапевтический профиль, отличный от синергизма. Примеры повышенных терапевтических эффектов включают уменьшение эффективной дозы описанного здесь пептида, увеличение терапевтического окна описанного здесь пептида и т.д. Можно вводить одно или несколько других средств. Примеры других средств подробно описаны ниже.
[00104] Другое средство можно вводить до введения описанного здесь пептида, одновременно с введением такого пептида, или после введения такого пептида. Соответственно, описанный здесь пептид и другое средство можно вводить вместе в составе одной композиции, или их можно вводить в составе разных композиций, например, одновременно или последовательно. Например, если описанный здесь пептид и другое средство вводят последовательно в составе разных композиций, описанный здесь пептид можно вводить до или после другого терапевтического средства. Кроме того, описанный здесь пептид и другое средство можно вводить с использованием одинаковых или разных схем ведения. Например, описанный здесь пептид и другое терапевтическое средство могут иметь разные периоды полужизни и/или могут действовать в разных временных масштабах, так что описанный здесь пептид можно вводить чаще, чем другое терапевтическое средство, или наоборот. И наконец, описанный здесь пептид можно вводить раньше другого средства, что приводит к дополнительному повышению терапевтической эффективности в результате последовательного применения обоих терапевтических средств. И описанный здесь пептид, и другое средство можно вводить однократно или длительно.
[00105] Эффективного количества в способах или композициях настоящего изобретения можно достичь путем совместного введения первого количества соединения, обладающего модуляторной активностью в отношении MC4R, или его фармацевтически приемлемой соли, и второго количества, по меньшей мере, одного другого средства. В одном варианте осуществления каждый из описанного здесь пептида и второго средства вводят в соответствующем эффективном количестве (т.е. каждый вводят в количестве, которое является терапевтически эффективным в случае раздельного введения). В другом варианте осуществления каждый из описанного здесь пептида и второго средства вводят в количестве, которое само по себе не обеспечивает терапевтический эффект (субтерапевтическая доза). В следующем варианте осуществления описанный здесь пептид вводят в эффективном количестве, а другое средство вводят в субтерапевтической дозе. В следующем варианте осуществления описанный здесь пептид можно ввести в субтерапевтической дозе, тогда как второе средство вводят в эффективном количестве. В иллюстративном варианте осуществления сочетание описанного здесь пептида и другого средства оказывает повышенный терапевтический эффект, или синергический эффект по сравнению с описанным здесь пептидом или другим средством, используемыми по отдельности.
[00106] Наличие синергического эффекта можно определить с помощью соответствующих методов анализа взаимодействия лекарственных средств. Подходящие способы включают, например, уравнение Sigmoid-Emax (Holford, N.H.G. and Scheiner, L.B., Clin. Pharmacokinet. 6: 429-453 (1981)), уравнение аддитивности Loewe (S., Muischnek, H., Arch. Exp. Pathol. Pharmacol. 114: 313-326 (1926)), а также уравнение для определения медианного эффекта (Chou, T.C. and Talalay, P., Adv. Enzyme Regul. 22: 27-55 (1984)). Каждое из указанных выше уравнений можно использовать с применением экспериментальных данных для получения соответствующего графика, помогающего проанализировать эффекты сочетания лекарственных средств. Соответствующие графики, построенные с помощью указанных выше уравнений, включают кривые зависимости концентрация-эффект, изоболограммы и кривые показателя аддитивности, соответственно.
[00107] В настоящем описании термин "индивидуум" относится к млекопитающему, предпочтительно к человеку, но может также относиться к животному, нуждающемуся в ветеринарном лечении и включающему домашних животных (таких как собаки, кошки и т.п.), сельскохозяйственных животных (таких как коровы, овцы, свиньи, лошади и т.п.) и лабораторных животных (таких как крысы, мыши, морские свинки и т.п.).
[00108] В настоящем описании термин "лечение" включает достижение, частичное или существенное, задержки, подавления или предотвращения развития клинических симптомов, связанных с целевым расстройством. Например, термин "лечение" включает достижение, частичное или существенное, одного или нескольких из следующих результатов: частичное или полное снижение массы тела (которое можно измерить, например, с помощью индекса массы тела, BMI); облегчение или улучшение клинических симптомов или показателей, связанных с ожирением, таких как диабет типа 2, преддиабетическое состояние, уровень гемоглобина A1C (Hb1Ac) в крови выше 6%, гиперинсулинемия, гиперлипидемия, нечувствительность к инсулину, непереносимость глюкозы и т.д.; задержка, подавление или предотвращение развития ожирения и связанных с ожирением показателей; или задержка, подавление или предотвращение, частично или полностью, возникновения или развития ожирения или связанных с ожирением показателей. Задержка, подавление или предотвращение развития ожирения включает, например, задержку, подавление или предотвращение у индивидуума, имеющего нормальный вес, развития ожирения. Термин "лечение" также включает частичное или полное снижение риска ишемической болезни сердца, инсульта и диабета (например, типа 2), связанного с метаболическим синдромом, а также облегчение или улучшение клинических симптомов или признаков метаболического синдрома, таких как один или несколько из пяти перечисленных выше показателей. Например, термин "лечение" включает задержку, ингибирование или предотвращение развития параметров, связанных с метаболическим синдромом, таких как резистентность к инсулину, клиренс глюкозы и параметры сердечно-сосудистых заболеваний, включающие частоту сердечных сокращений и уровень артериального давления, болезнь суставов, воспаление, апноэ во сне, переедание и другие расстройства пищевого поведения, включающие булимию, поддерживающую терапию при хирургической операции по поводу уменьшения массы тела и поддерживающую терапию для уменьшения массы тела перед ортопедической хирургией. Термин "профилактическое лечение" относится к лечению, предпринимаемому до появления клинических симптомов целевого расстройства с целью предотвращения, подавления или уменьшения частоты его проявления.
Чувствительные расстройства
[00109] Примеры расстройств, чувствительных к модуляции MC4R, и, в более общем значении, расстройств, чувствительных к фармакологическому действию перечисленных выше категорий полипептидов и конкретных полипептидов, включают острые и хронические воспалительные заболевания, такие как общее воспаление, воспалительные заболевания кишечника, воспаление мозга, сепсис и септический шок; заболевания с аутоиммунным компонентом, такие как ревматоидный артрит, подагрический артрит и рассеянный склероз; метаболические заболевания и медицинские состояния, сопровождающиеся увеличением массы, такие как ожирение, расстройства приема пищи и синдром Прадера-Вилли; метаболические заболевания и медицинские состояния, сопровождающиеся потерей массы, такие как анорексия, булимия, истощение, обусловленное СПИДом, кахексия, кахексия, обусловленная раком, и истощение у немощных пожилых людей; диабет и связанные с ним состояния и осложнения, такие как ретинопатия; неопластическая пролиферация, включающая рак кожи и рак предстательной железы; медицинские состояния репродуктивных или половых органов, такие как эндометриоз и маточное кровотечение у женщин, половая дисфункция, эректильная дисфункции и снижение полового ответа у женщин; заболевания или состояния, возникающие в результате лечения или инсульта в организме, такие как отторжение трансплантата, ишемия и реперфузионное повреждение, лечение травм спинного мозга и ускорение заживления ран, а также потеря массы, вызванная химиотерапией, лучевой терапией, временной или постоянной иммобилизацией или диализом; сердечно-сосудистые заболевания или состояния, такие как геморрагический шок, кардиогенный шок, гиповолемический шок, сердечно-сосудистые расстройства и сердечная кахексия; легочные заболевания или состояния, такие как острый респираторный дистресс-синдром, хроническая обструктивная болезнь легких, астма и легочный фиброз; меры по повышению иммунной толерантности и предотвращению угрозы для иммунной системы, например, связанные с определенными видами аллергии или отторжением органного трансплантата; лечение дерматологических заболеваний и состояний, таких как псориаз, истощение пигментации кожи, акне, образование келоидов и рак кожи; поведенческие состояния и расстройства, состояния и расстройства центральной нервной системы или неврологические состояния и расстройства, такие как тревожность, депрессия, ухудшение памяти и дисфункция памяти, модуляция ощущения боли и лечение невропатической боли; состояния и заболевания, связанные с потреблением алкоголя, злоупотреблением алкоголем и/или алкоголизмом; а также почечные состояния или заболевания, такие как почечная кахексия или натрийурез. Другие примеры включают нормализующую или гомеостатическую активность у индивидуума, включающую высвобождение тироксина, синтез и высвобождение альдостерона, регуляцию температуры тела, артериального давления, частоты сердечных сокращений, тонуса сосудов, мозгового кровотока, уровня глюкозы в крови, костного метаболизма, формирования или развития костной ткани, массы яичников, развития плаценты, секреции пролактина и ФСГ, внутриматочного развития плода, родов, сперматогенеза, секреции кожного сала и феромонов, нейропротекции и роста нервов, а также модуляцию мотивации, способности к обучению и других поведенческих параметров. Другие примеры включают переедание, булимию или другие расстройства пищевого поведения.
[00110] В иллюстративных вариантах осуществления расстройства, чувствительные к модуляции рецептора MC4R, включают сахарный диабет 1 типа, диабет 2 типа, ожирение, инсулинорезистентность, метаболический синдром, сердечно-сосудистые заболевания или дисбаланс липопротеидов низкой плотности/липопротеидов высокой плотности/триглицеридов, неалкогольную жировую дистрофию печени и расстройства, связанные с токсикоманией.
[00111] В иллюстративных вариантах осуществления расстройства, чувствительные к модуляции рецептора MC4R, включают диабет 1 типа, диабет 2 типа, ожирение, резистентность к инсулину или метаболический синдром.
Ожирение
[00112] В настоящем описании термин "ожирение" относится к индивидууму, индекс массы тела (BMI) которого составляет примерно 30 кг/м2 или выше, например, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37 кг/м2, или больше. В конкретных вариантах осуществления индивидуум, страдающий от ожирения, имеет BMI в пределах, определенных как "ожирение" Центром контроля заболеваний. См. URL http://www.cdc.gov/obesity/defining.html, последнее обращение 28 октября 2011 года. Например, в некоторых вариантах осуществления считается, что взрослый человек страдает от ожирения, если его BMI ≥30,0 кг/м2.
Диабет и связанные с ним расстройства
[00113] В иллюстративных вариантах осуществления индивидуумы, котрых можно лечить с помощью способов настоящего изобретения, страдают от расстройств, связанных с диабетом, или имеют повышенный риск развития таких расстройств. Термин "расстройства, связанные с диабетом" относится к диабету (в том числе типа 1 (OMIM 222100) и типа 2 (OMIM 125853)), резистентности к инсулину и метаболическому синдрому.
[00114] В иллюстративных вариантах осуществления индивидуум, подлежащий лечению, страдает от диабета (типа 1 или типа 2), резистентности к инсулину или метаболического синдрома. В иллюстративных вариантах осуществления расстройство включает диабет, например, диабет 2 типа. В иллюстративных вариантах осуществления индивидуум страдает от диабета 2 типа, или имеет повышенный риск развития диабета 2 типа, в соответствии с определением Всемирной организации здравоохранения и Международной диабетической федерации в разделе "Определение и диагностика сахарного диабета и промежуточной гипергликемии", опубликованном в 2006 году, который включен в настоящее описание в качестве ссылки во всей своей полноте. В иллюстративных вариантах осуществления у индивидуума, страдающего от диабета, уровень глюкозы в плазме натощак ≥126 мг/дл, или 2-часовой уровень глюкозы в плазме крови (через 2 часа после перорального введения 75 г глюкозы) ≥200 мг/дл. В иллюстративных вариантах осуществления у диабетического или преддиабетического индивидуума наблюдаются повышенные уровни гликированного гемоглобина, например, они могут превышать 4,5, 4,6, 4,7, 4,8, 4,9, 5,0, 5,1, 5,2, 5,3, 5,4, 5,5, 5,6, 5,8, 6,0, 6,2, 6,4, 6,6, 6,8, 7,0, 7,2, 7,4, 7,6% или более от общего гемоглобина. В иллюстративных вариантах осуществления диабетического или преддиабетического индивидуума можно идентифицировать или дополнительно охарактеризовать путем анализа генетических полиморфизмов (в том числе, например, полиморфизмов, обуславливающих изменение уровня экспрессии, например, повышение или понижение уровня экспрессии, и/или изменение кодирующих последовательностей), в одном или нескольких генах из приведенных ниже в таблице 1, или вблизи указанных генов:
[00115]

[00116] В иллюстративных вариантах осуществления, другие гены, которые можно использовать для идентификации или дополнительной характеристики индивидуумов, подлежащих лечению с помощью способов настоящего изобретения, включают FTO (OMIM 610966), JAZF 1 (OMIM 606246) и HHEX (OMIM 604420).
[00117] В иллюстративных вариантах осуществления индивидуум, подлежащий лечению с помощью способов настоящего изобретения, страдает от диабета 1 типа. В иллюстративных вариантах осуществления индивидуума с диабетом 1 типа характеризуют путем анализа С-пептида, например, у такого индивидуума уровень С-пептида натощак составляет менее чем примерно 1,0 нмоль/л, например, менее чем 1,2, 1,1, 1,0, 0,9, 0,8, 0,7, 0,6, 0,5, 0,4 нмоль/л, или меньше, например, менее чем 0,33, 0,25, 0,2 или 0,1 нмоль/л. В иллюстративных вариантах осуществления уровень С-пептида измеряют после перорального введения глюкозы (через 2 часа после перорального введения 75 г глюкозы) и детектируют увеличение менее чем на 0,54 нмоль/л, например, менее чем на 0,50, 0,45, 0,40, 0,35, 0,30, 0,25, 0,20, 0,15 или 0,10 нмоль/л. Отклоняющийся от нормы уровень глюкозы натощак (110-125 мг/дл) или ухудшенную толерантность к глюкозе (через 2 часа после перорального введения 75 г глюкозы: 140-199 мг/дл) можно использовать для идентификации или дальнейшей характеристики снижения функции бета-клеток у индивидуумов с диабетом 1 типа. В иллюстративных вариантах осуществления диабет типа 1 идентифицируют или дополнительно характеризуют по наличию аутоантител к антигенам островковых клеток и/или инсулину, например, аутоантител, направленных против GAD 65 кДа (OMIM 138275) и/или фосфатаза-родственной молекулы IA-2.
Резистентность к инсулину
[00118] В иллюстративных вариантах осуществления расстройство представляет собой "резистентность к инсулину", которую можно идентифицировать с помощью любых средств, известных в данной области, и охарактеризовать пониженной способностью инсулина уменьшать уровень глюкозы в крови. В иллюстративных вариантах осуществления, резистентность к инсулину определяют или дополнительно характеризуют по наличию одного или нескольких полиморфизмов (включающих, например, полиморфизмы, приводящие к изменению уровней экспрессии, например, к повышению или понижению уровней экспрессии, а также к образованию вариантов генных продуктов кодирующих последовательностей, таких как белки) в одном или нескольких из следующих генов: RETN, PTPN1, TCF1 (OMIM 142410; см, например, полиморфизм 0011), PPP1R3A (OMIM 600917; см, например, полиморфизмы 0001, 0003), PTPN1 (OMIM 176885; см, например, полиморфизм 0001), ENPP1 (OMIM 173335; см, например, полиморфизм 0006), IRS1 (OMIM 147545; см, например, полиморфизм 0002), EPHX2 (OMIM 13281 1; см, например, полиморфизм 0001), ген лептин (OMIM 164160, см., например, полиморфизмы 0001 и 0002), ген рецептора лептина (OMIM 601007 см., например, полиморфизмы 0001, 0002, 0004, и 0005), или ген рецептора инсулина (INSR, OMIM 147670 см., например, полиморфизмы 0001-0037).
Метаболический синдром
[00119] В иллюстративных вариантах осуществления расстройство представляет собой метаболический синдром. В соответствии с данным описанием термин "метаболический синдром" относится к группе симптомов, которые возникают вместе и увеличивают риск ишемической болезни сердца, инсульта и диабета 2 типа. Согласно Американской ассоциации кардиологов и Национального института сердца, легких и крови, считается, что метаболический синдром (также называемый синдром X) присутствует, если у индивидуум наблюдается три или более из следующих симптомов:
1) Артериальное давление равно или выше 130/85 мм рт.ст.;
2) Уровень сахара (глюкозы) в крови натощак равен или превышает 100 мг/дл;
3) Большая окружность талии (длина вокруг талии):
- у мужчин - 40 дюймов или более;
- у женщин - 35 дюймов или более;
4) Низкий холестерин HDL:
- у мужчин - ниже 40 мг/дл;
- у женщин - ниже 50 мг/дл;
5) Уровень триглицеридов равен или превышает 150 мг/дл.
Метаболический синдром можно диагностировать путем определения у индивидуума кровяного давления, уровня глюкозы в крови, уровня холестерина HDL, уровня холестерина LDL, уровня общего холестерина и уровня триглицеридов.
[00120] В иллюстративных вариантах осуществления индивидуум имеет центральное ожирение (окружность талии ≥80 см у женщин; ≥90 см у мужчин Азии, а также Южной и Центральной Америки, и ≥94 см у всех других мужчин), BMI 30 кг/м2, повышенный уровень триглицеридов (≥150 мг/дл, или специальное лечение этой липидной аномалии), пониженный уровень холестерина HDL (<40 мг/дл у мужчин, <50 мг/дл у женщин, или специальное лечение этой липидной аномалии), повышенное кровяное давление (sBP=130 мм рт.ст. или dBP=85 мм рт.ст., или лечение ранее диагностированной гипертонии), или повышенный уровень глюкозы в плазме натощак (FPG=100 мг/дл или существующий диагноз диабета 2 типа), в том числе их сочетания. В иллюстративных вариантах осуществления индивидуум, подлежащий лечению с помощью способов настоящего изобретения, страдает от метаболического синдрома, или имеет повышенный риск метаболического синдрома, определеноного Международной Диабетической Федерацией в "The IDF consensus worldwide definition of the metabolic syndrome", опубликованном в 2006 году, который включен в данный документ в качестве ссылки в полном объеме, т.е. индивидуум имеет центральное ожирение (как описано выше, и/или BMI >30 кг/м2), и любые два симптома из повышенного уровня триглицеридов, пониженного уровня холестерина HDL, повышенного кровяного давления, или повышенного уровня глюкозы в плазме натощак. В иллюстративных вариантах осуществления метаболический синдром характеризуется, или дополнительно характеризуется, наличием у индивидуума мутации в локусе, выбранном из 3q27 (см., например, OMIM 605552) и/или 17pl2 (см., например, OMIM 605572).
Расстройства, вызванные мутациями MC4R
[00121] Настоящее изобретение относится к способу лечения расстройства у индивидуума, страдающего от ослабленного ответа MC4R на α-меланокортин-стимулирующий гормон (α-MSH). Способ включает введение эффективного количества агониста рецептора меланокортина-4 (MC4R). В иллюстративном варианте осуществления индивидуум является гетерозиготным носителем мутации MC4R, приводящей к ослабленному ответу MC4R на α-меланокортин-стимулирующий гормон (α-MSH). Поскольку гетерозиготные носители сохраняют способность отвечать на природный лиганд MC4R, лечение MC4R-ассоциированных заболеваний у гетерозиготных носителей путем введения агониста MC4R не требует знания типа мутации MC4R.
[00122] В одном иллюстративном варианте осуществления заболевание представляет собой ожирение, например, MC4R-ассоциированное ожирение. В другом иллюстративном варианте осуществления расстройство представляет собой метаболический синдром.
[00123] Продукт человеческого гена MC4R (hMC4R) представляет собой хорошо охарактеризованный белок, кодируемый геномной последовательностью с номером доступа в GenBank CH471077. Мутации в рецепторе MC4R являются причиной тяжелого ожирения в детском возрасте. В популяции несовершеннолетних с выявленным ожирением встречаемость носителей мутаций MC4R составляет примерно 2,5%, причем наивысшая встречаемость, составляющая 6%, наблюдается среди детей, страдающих тяжелым ожирением. Люди с мутациями MC4R имеют более или менее одинаковый фенотип, как описано для мышей с мутацией в гене рецептора МС4. Такие люди имеют четкую гиперфагию, гиперинсулинемию, повышенную жировую массу, сопровождающуюся безжировой компонентой массы тела, повышенную минеральную плотность кости и повышенную линейную скорость роста, без каких-либо изменений в уровнях кортизола, гонадотропина, гормонов щитовидной железы и половых стероидных гормонов. В отличие от удаления рецептора МС4, гиперфагия и гиперинсулинемия, как правило, имеют тенденцию к уменьшению с возрастом человека. Подобно мышам с нокаутом MC4R, гетерозиготные носители имеют промежуточный фенотип по сравнению с гомозиготными носителями. Проявившаяся гиперфагия, наблюдающаяся при испытательном приеме пищи, является менее тяжелой, чем у людей с дефицитом лептина. Степень дисфункции рецептора МС4, определяемая с помощью анализов in vitro, может предсказать количество пищи, проглоченной во время испытательного приема пищи индивидуумом, несущим указанную конкретную мутацию, и коррелирует с появлением и тяжестью фенотипа ожирения. По меньшей мере, 90 разных мутаций рецептора МС4 связаны с ожирением и могут быть обнаружены другие мутации рецептора МС4, приводящие к появлению подобного фенотипа ожирения.
[00124] Примеры мутаций MC4R, которые вызывают ожирение у человека, описаны в Farooqi et al., The Journal of Clinical Investigation, July 2000, vol. 106 (2), pp. 271-279 и Vaisse et al., The Journal of Clinical Investigation, July 2000, vol. 106(2), pp. 253-262, соответствующие части которых включены в настоящее описание посредством ссылки.
[00125] Другие мутации, способные вызвать ожирение у человека, включают R18H, R18L, S36Y, P48S, V50M, F51L, E61K, I69T, D90N, S94R, G98R, I121T, A154D, Y157S, W174C, G181D, F202L, A219V, I226T, G231S, G238D, N240S, C271R, S295P, P299L, E308K, I317V, L325F и 750DelGA, как описано в Xiang et al, "Pharmacological characterization of 30 human melanocortin-4 receptor polymorphisms with the endogenous proopiomelanocortin-derived agonists, synthetic agonists, and the endogenous agouti-related protein antagonist", Biochemistry, 2010 Jun 8; 49(22):4583-600, соответствующие части которых включены в настоящее описание посредством ссылки.
[00126] Другие примеры мутаций, которые могут вызывать ожирение у человека, включают мутации, перечисленные в онлайн-каталоге менделеевской наследственности человека (OMIM), представляющим собой базу данных генов и генетических нарушений человека, под регистрационным номером 155541 (MC4R) (точнее, под регистрационными номерами 155541.0001-155541.0023) в URL http://omim.org/entry/155541. Типичные примеры мутаций включают 4-BP DEL, NT631; 4-BP INS, NT732; TYR35TER; ASP37VAL; SER58CYS; ILE102SER; ASN274SER; 1-BP INS, 112A; 4-BP DEL, 211CTCT; ILE125LYS; ALA175THR; ILE316SER; TYR287TER; ASN97ASP; 15-BP DEL (кодоны delta88-92); и SER127LEU. Соответствующие части базы данных OMIM включены в данный документ в качестве ссылки.
[00127] В иллюстративных вариантах осуществления мутация MC4R приводит к сохранению сигнальной активности MC4R.
[00128] Мутации в геномной последовательности, кодирующей MC4R, можно обнаружить с помощью методов, хорошо известных рядовому специалисту в данной области техники. Например, геномную последовательность можно клонировать с использованием нуклеотидных праймеров, таких как, например, праймеры, описанные в Farooqi et al, The Journal of Clinical Investigation, July 2000, vol. 106 (2), pp. 271-279 и Vaisse et al, The Journal of Clinical Investigation, July 2000, vol. 106(2), pp. 253-262, после чего клонированную последовательность можно анализировать с использованием коммерчески доступных секвенаторов и программного обеспечения.
[00129] Активность MC4R можно измерить с помощью способов, хорошо известных рядовому специалисту в данной области техники. Например, клетки временно трансфицируют клонированной ДНК MC4R, трансфицированные клетки приводят в контакт с агонистом MC4R (например α-MSH) и измеряют уровень внутриклеточного цАМФ, вторичного мессенджера MC4R, методом электрохемилюминесценции, описанным, например, в Roubert et al, Journal of Endocrinology (2010) 207, pp. 177-183. Уменьшение сигнала MC4R можно установить путем сравнения уровня внутриклеточного цАМФ, продуцируемого в ответ на конкретный агонист MC4R дикого типа и мутантным MC4R.
[00130] Модуляторы MC4R (например, агонисты) также можно использовать для лечения пациентов, страдающих от других расстройств, таких как пониженный тон природных агонистов MC4R. Примеры таких пациентов включают индивидуумов, гетерозиготных или гомозиготных по мутациям в генах, играющих важную роль в лептин-зависимом пути (Nature Clinical Practice Endocrinology and Metabolism, 2006; 2; 6; 318 and NEng J Med: 2007; 356; 3; 237), проопиомеланокортиновом процессинге (Nature Genetics, 1998, 155; Cell Metabolism, 2006; 3; 135; Annals Acad Med, 2009, 38; 1; 34), или по мутациям в генах, кодирующих конвертазы прогормонов.
Режимы введения
[00131] Введение ионного комплекса или описанной здесь фармацевтической композиции, используемой для осуществления описанных в данном документе методов, можно осуществлять непрерывно, ежечасно, четыре раза в день, три раза в день, два раза в день, один раз в день, один раз в два дня, два раза в неделю, один раз в неделю, раз в две недели, раз в месяц, или раз в два месяца, раз в 3 месяца, раз в 4 месяца, раз в 5 месяцев или один раз в 6 месяцев или больше, или с использованием некоторых других периодических режимов введения. Композиции ионных комплексов настоящего изобретения можно использовать для эффективного терапевтического введения, например, один раз в день, один раз в неделю, один раз в 2 недели, один раз каждые четыре недели, один раз каждые 2 месяца, один раз в 3 месяца, один раз в 4 месяца, один раз в 5 месяцев или один раз в 6 месяцев.
[00132] Подходящие способы введения включают, без ограничения, периферическое введение. Примеры периферического введения включают пероральное, подкожное, внутрибрюшинное, внутримышечное, внутривенное, ректальное, трансдермальное, трансбуккальное, сублингвальное, ингаляционное, легочное или трансназальное введение. В предпочтительных вариантах осуществления используют подкожное введение.
Сочетанная терапия
[00133] Любой описанный здесь пептид, входящий в состав ионного комплекса, или не входящий в состав комплекса (например, пептид 1 до комплексообразования) можно использовать для лечения любого из заболеваний, чувствительных к модуляции MC4R, путем введения в сочетании с одним или несколькими другими фармацевтически активными соединениями ("другое средство"). Такое сочетанное введение можно осуществлять с использованием стандартной лекарственной формы, которая содержит один или несколько пептидов, описанных в данном документе, и одно или несколько других средств, такие стандартные лекарственные формы включают таблетки, капсулы, спрей, ингаляционный порошок, жидкости для инъекций и т.п. Альтернативно сочетанное введение можно осуществлять путем введения двух разных лекарственных форм, одна из которых содержит один или несколько описанных здесь пептидов, а другая лекарственная форма содержит одно или несколько других средств. В данном случае лекарственные формы могут быть одинаковыми или разными. Ниже приведены неограничивающие примеры сочетанных способов лечения.
[00134] Описанный здесь пептид (например, входящий в состав ионного комплекса, или не входящий в состав комплекса) можно использовать в сочетании с одним или несколькими другими средствами, подходящими для лечения разных расстройств, связанных с изменением массы тела и режима питания, таких как ожирение и/или избыточный вес. В частности, другое средство может представлять собой лекарство от ожирения, которое влияет на расход энергии, гликолиз, глюконеогенез, глюкогенолиз, липолиз, липогенез, абсорбцию жиров, отложение жиров, выделение жиров, механизмы голодания, и/или насыщения, и/или жажды, аппетит/мотивацию, прием пищи или моторику желудочно-кишечного тракта. Лекарственные средства, которые снижают потребление энергии, включают, в частности, разные фармакологические средства, называемые анорексигенными средствами, которые используются в качестве вспомогательных средств для поведенческой терапии в программах снижения веса.
[00135] Как правило, общая доза средств или лекарств, подавляющих ожирение, при применении в сочетании с одним или несколькими из описанных здесь пептидов, может находиться в диапазоне от 0,1 до 3000 мг/день, предпочтительно примерно от 1 до 1000 мг/день, более предпочтительно примерно от 1 до 200 мг/день, причем указанную дозу можно вводить в один прием, или ее можно разделить на 2-4 приема. Однако точная доза определяется лечащим врачом и зависит от таких факторов, как активность вводимого соединения, возраст, масса, состояние пациента и его способность отвечать на лечение.
[00136] Один или несколько из описанных здесь пептидов (например, входящих в состав ионного комплекса, или не входящих в состав комплекса) можно использовать в сочетании с одним или несколькими другими средствами, используемыми для лечения диабета.
[00137] В дополнение или альтернативно один или несколько из описанных здесь пептидов можно дополнительно объединить с одним или несколькими другими средствами, используемыми для лечения болезней, расстройств и состояний, связанных с ожирением и/или избыточным весом, таких как резистентность к инсулину; нарушенная толерантность к глюкозе; диабет типа 2; метаболический синдром; дислипидемия (в том числе гиперлипидемия); гипертония; сердечные расстройства (например, ишемическая болезнь сердца, инфаркт миокарда); сердечно-сосудистые заболевания; неалкогольная жировая дистрофия печени (в том числе неалкогольный стеатогепатит); болезни суставов (в том числе вторичный остеоартрит); гастроэзофагеальный рефлюкс; апноэ во сне; атеросклероз; инсульт; макро и микро сосудистые заболевания; стеатоз (например, печени); желчные камни; и расстройства желчного пузыря.
Другое средство
[00138] Одно или несколько других средств могут быть выбраны, например, из группы, включающей
инсулин и аналоги инсулина;
средства, усиливающие секрецию инсулина, в том числе сульфонилмочевины (например, глипизид), и прандиальные регуляторы уровня глюкозы (иногда называемые "стимуляторы секреции кратковременного действия"), такие как, например, меглитиниды (репаглинид и натеглинид);
средства, улучшающие действие инкретина: инкретин, инкретиномиметик, средства, улучшающие функцию инкретина, например, GLP-1, GIP; агонисты GLP-1 (например, экзенатид и лираглутид (VICTOZA)), ингибиторы DPP-4 (например, вилдаглиптин, саксаглиптин и ситаглиптин)
средства, повышающие чувствительность к инсулину, включающие агонисты гамма-рецептора, активируемого пролифератором пероксисом (PPARγ), такие как тиазолидиндионы (например, пиоглитазон и розиглитазон), а также средства с любым сочетанием активности в отношении PPAR альфа, гамма и дельта;
средства, модулирующие баланс глюкозы в печени, такие как бигуаниды (например метформин), ингибиторы фруктоза-1,6-бифосфатазы, ингибиторы гликогенфосфорилазы, ингибиторы киназы гликогенсинтазы и активаторы глюкокиназы;
средства, направленные на снижение/замедление абсорбции глюкозы из кишечника, такие как ингибиторы альфа-глюкозидазы (например, миглитол и акарбоза);
средства, которые являются антагонистами действия глюкагона, или уменьшают его секрецию, такие как аналоги амилина (например, прамлинтид);
средства, предотвращающие реабсорбцию глюкозы в почках, такие как ингибиторы натрий-зависимого транспортера глюкозы 2 (SGLT-2) (например, дапаглифлозин);
средства, предназначенные для лечения осложнений длительной гипергликемии, такие как ингибиторы альдозоредуктазы (например, эпалрестат и ранирестат);
средства, используемые для лечения осложнений, связанных с микроангиопатиями;
средства против дислипидемии, такие как ингибиторы HMG-КоА-редуктазы (статины, например, розувастатин), а также другие средства, снижающие уровень холестерина;
агонисты PPARA (фибраты, например гемфиброзил и фенофибрат);
средства, способствующие выведению желчных кислот (например, холестирамин);
ингибиторы абсорбции холестерина (например, растительные стерины (такие как фитостерины), синтетические ингибиторы);
ингибиторы транспортного белка холестериновых эфиров (СЕТР); ингибиторы илеальной транспортной системы желчных кислот (ингибиторы IB AT);
смолы, связывающие желчные кислоты;
никотиновая кислота (ниацин) и ее аналоги;
антиоксиданты, такие как пробукол;
омега-3 жирные кислоты;
антигипертензивные средства, включающие антагонисты адренергических рецепторов, такие как бета-блокаторы (например, атенолол), альфа-блокаторы (например, доксазозин) и смешанные альфа/бета-блокаторы (например, лабеталол);
агонисты адренергического рецептора, в том числе агонисты альфа-2 (например, клонидин);
ингибиторы ангиотензин-конвертирующего фермента (ACE) (например, лизиноприл), блокаторы кальциевых каналов, такие как дигидропиридины (например, нифедипин), фенилалкиламины (например, верапамил) и бензотиазепины (например, дилтиазем);
антагонисты рецептора ангиотензина II (например, кандесартан); антагонисты рецептора альдостерона (например, эплеренон);
адренергические средства центрального действия, такие как центральные агонисты альфа (например, клонидин); и диуретические средства (например, фуросемид);
модуляторы гемостаза, в том числе антитромботические средства, такие как активаторы фибринолиза;
антагонисты тромбина;
ингибиторы фактора VIIa; антикоагулянты, такие как антагонистs витамина K (например варфарин), гепарин и его низкомолекулярные аналоги, ингибиторы фактора Ха и непосредственные ингибиторы тромбина (например, аргатробан); антитромбоцитарные средства, такие как ингибиторы циклооксигеназы (например, аспирин), ингибиторы рецептора аденозиндифосфата (АДФ) (например, клопидогрель), ингибиторы фосфодиэстеразы (например, силостазол), ингибиторы гликопротеина IIB/IIA (например, тирофибан) и ингибиторы обратного захвата аденозина (например, дипиридамол);
средства против ожирения, такие как средства, подавляющие аппетит (например, эфедрин), в том числе норадренергические средства (например, фентермин) и серотонинергические средства (например, сибутрамин), ингибиторы липазы поджелудочной железы (например, орлистат), модуляторы микросомального транспортного белка (МТР), ингибиторы диацилглицеринацилтрансферазы (DGAT) и антагонисты рецепторов каннабиноидов (CB 1) (например, римонабант);
средства, модифицирующие пищевое поведение, такие как модуляторы рецептора орексина и модуляторы меланиноконцентрирующего гормона (MCH);
модуляторы нейропептида Y (NPY)/рецептора NPY;
модуляторы киназы пируватдегидрогеназы (PDK);
модуляторы серотониновых рецепторов;
модуляторы лептина/рецептора лептина;
модуляторы грелина/рецептора грелина;
средства, усиливающие функцию бета-клеток;
средства, стимулирующие расход энергии (например, стимуляторы бета-адренергических рецепторов, агонисты UCP-1, модуляторы и стимуляторы бурого жира);
средства, вызывающие лизис адипоцитов (например, антитела);
никотин или средства от никотиновой зависимости;
эстроген, природный или синтетический модулятор рецептора эстрогенов;
модулятор μ-опиоидного рецептора; и
средства, модулирующие транспорт моноаминов, такие как селективные ингибиторы обратного захвата серотонина (SSR1) (например флуоксетин), ингибиторы обратного захвата норадреналина (NARI), ингибиторы обратного захвата норадреналина-серотонина (SNRI), блокаторы тройного обратного захвата моноаминов (например, тесофенсин) и ингибиторы моноаминоксидазы (MAOI) (например, толоксатон и амифламин), или их фармацевтически приемлемые соли.
[00139] В иллюстративном варианте осуществления агонист MC4R (например, агонист MC4R, который входит в состав ионного комплекса, или не входит в состав комплекса) и другое средство вводят одновременно, последовательно или раздельно с приемом диеты с очень низким содержанием калорий (VLCD), или низкокалорийной диеты (LCD).
Способ получения ионного комплекса
[00140] Кроме того, изобретение относится к способу получения ионного комплекса и фармацевтической композиции настоящего изобретения. Способ включает получение катионного полипептида и анионного наполнителя, выбранного из PEG-карбоновой кислоты, жирной кислоты, содержащей 10 или более атомов углерода, фосфолипида или их сочетания. Объединение катионного полипептида и анионного наполнителя в условиях, способствующих образованию ионного комплекса, и получение фармацевтической композиции, содержащей ионный комплекс.
[00141] Например, смесь анионного наполнителя, выбранного из PEG-карбоновой кислоты, жирной кислоты, содержащей 10 или более атомов углерода, фосфолипида, или их сочетания, и любого другого наполнителя в водной среде (например, в воде) можно равномерно распределить с достижением хорошо диспергированного состояния путем автоклавирования смеси при подходящих условиях. Подходящие условия могут включать, например, диапазон времени примерно от 3 минут до 25 минут и температуру от 121°С до 134°С. Пример подходящих условий включает период времени, составляющий примерно 15 минут, и температуру, равную примерно 121°С. Кроме того, автоклавирование позволяет получить стерильную смесь. Затем к смеси можно добавить стерильный водный раствор катионного пептида с получением стерильного гомогенного ионного комплекса настоящего изобретения. В зависимости от природы анионного наполнителя можно получить либо прозрачный раствор, либо однородную суспензию ионного комплекса. Например, PEG-карбоновая кислота и mPEG2000-DSPE. используемые в описанных здесь примерах, как правило, дают прозрачный раствор, содержащий ионный комплекс, тогда как применение липида DPP обычно приводит к получению гомогенной суспензии, содержащей ионный комплекс.
[00142] В качестве альтернативы, смесь ионного комплекса можно получить путем растворения наполнителей в воде, содержащей катионный полипептид, с последующей стерилизацией полученной смеси фильтрованием через фильтр 0,2 мкм.
[00143] Способ получения ионного комплекса, содержащего катионный полипептид и анионный наполнитель, выбранный из: PEG-карбоновой кислоты; жирной кислоты, содержащей 10 или более атомов углерода; фосфолипида; и их сочетания, который включает:
a) получение смеси анионного наполнителя и водного наполнителя-разбавителя;
b) автоклавирование смеси в условиях, достаточных для стерилизации наполнителя;
c) добавление к смеси наполнителей стерильного раствора, содержащего катионный полипептид и водный разбавитель для пептида.
В одном варианте осуществления смесь наполнителей представляет собой суспензию. В другом варианте осуществления смесь наполнителей представляет собой раствор.
[00144] В альтернативном варианте осуществления настоящее изобретение предлагает способ получения ионного комплекса, содержащего катионный полипептид и анионный наполнитель, выбранный из: PEG-карбоновой кислоты; жирной кислоты, содержащей 10 или более атомов углерода; фосфолипида; и их сочетания, который включает:
a) приготовление раствора анионного наполнителя и водного наполнителя-разбавителя;
b) фильтрация раствора, полученного на стадии а, через фильтр 0,2 микрон;
c) добавление к раствору наполнителей, полученному на стадии b, стерильного раствора, содержащего катионный полипептид и водный разбавитель для пептида.
[00145] В следующем варианте осуществления изобретение предлагает способ получения ионного комплекса, содержащего катионный полипептид и анионный наполнитель, выбранный из: PEG-карбоновой кислоты; жирной кислоты, содержащей 10 или более атомов углерода; фосфолипида; и их сочетания, который включает:
a) получение раствора, содержащего анионный наполнитель, представляющий собой водный наполнитель-разбавитель, и катионный полипептид;
b) стерилизация полученного раствора путем фильтрации через фильтр 0,2 микрон.
Подходящие примеры наполнителя и наполнителя для катионного полипептида включают полиол (такой как пропиленгликоль, трипропиленгликоль, глицерин), этанол, бензиловый спирт, ДМСО, NMP, ДМФА, воду, рН-стабилизирующие буферные растворы и их смеси.
ПРИМЕРЫ
Синтез пептидов
[00146] Катионные полипептиды, подходящие для применения в настоящем изобретении, получают путем традиционного твердофазного пептидного синтеза. Например, пептид 1 и другие описанные здесь аналоги MC4R, можно получить по способам, описанным в патенте США 8349797, содержание которого включено в настоящее описание в качестве ссылки. Пептидную цепь удлиняют постадийно, начиная с производного С-концевой аминокислоты, присоединенного к соответствующему твердому носителю-смоле, подходящему для пептидного синтеза. Для синтеза пептида, содержащего С-концевую амидную функциональную группу, в качестве твердого носителя используют амидную смолу Ринка MBHA. Для синтеза пептида, содержащего свободную С-концевую карбоксильную функциональную группу, можно использовать такие смолы, как 2-хлортритилхлоридная смола, смола Ванга, или смола Меррифилда, способные к образованию эфирной связи с Fmoc-аминокислотой. Большинство указанных, содержащих сложноэфирную связь, конъюгатов Fmoc-аминокислота-смола являются коммерчески доступными от разных источников и широко используются, когда это целесообразно.
Синтез дисульфид-циклизованных пептидов
[00147] Линейное амидное производное дисульфид-содержащего циклического пептида собирают, используя Fmoc-химию, на твердофазном пептидном синтезаторе. Fmoc-Амидную смолу Ринка помещают в реакционный сосуд и оставляют набухать в NMP. Затем ее обрабатывают 20% пиперидином в NMP в течение 15 минут и трижды промывают NMP. Смолу тестируют на положительную оценку в тесте Кайзера (Kaiser, E., Colescot, R.L., Bossinge, C.D. & Cook, P.I. Anal. Biochem., 1990, 34: 595-598). Смолу ресуспендируют в NMP и смешивают с Fmoc-производным первой С-концевой аминокислоты и HOBt. Реакцию сочетания инициируют путем добавления реагента HBTU и DIPEA. После перемешивания в течение 2-3 часов завершение реакции сочетания подтверждают путем получения отрицательного результата в тесте Кайзера, с использованием небольшой аликвоты смолы, взятой из реакционной смеси. Затем смолу промывают три раза NMP. После этого группу Fmoc удаляют, как описано ранее, и весь цикл повторяют с Fmoc-производным второй С-концевой аминокислоты, как описано. Такой же цикл реакций повторяют последовательно для каждой следующей аминокислоты. Хлораниловый тест на окрашивание (Vojkovsky, T. Pept. Res, 1995, 8: 236-237) используют вместо теста Кайзера для анализа удаления защитной группы Fmoc с остатка пролина в пептидной последовательности, а также для тестирования завершения реакции сочетания аминокислоты с пролином (отрицательный результат в хлораниловом тесте). В случае пептидов, содержащих N-концевую ацетильную группу, после удаления защитных групп Fmoc пептидную смолу обрабатывают в течение 10 минут уксусным ангидридом и пиридином. После получения отрицательного результата в тесте Кайзера смолу промывают NMP, дихлорметаном и сушат в вакууме. Для синтеза указанных пептидов используют Fmoc-производные аминокислот. В случае аминокислот, содержащих три функциональные группы, используют следующие производные: Fmoc-Cys(Trt)-OH, Fmoc-Trp(Boc)-OH, Fmoc-Arg(Pbf)-OH, Fmoc-His(Trt)-OH, Fmoc-Asn(Trt)-OH, Fmoc-Gln(Trt)-OH, Fmoc-hCys(Trt)-OH, Fmoc-Pen(Trt)-OH, Fmoc-Tyr(But)-ОН, Fmoc-His(L-Me)-ОН, Fmoc-His(3-Me)-OH и Fmoc-Glu(O-But)-ОН.
[00148] Чтобы отщепить пептид от смолы, а также для удаления защиты с функциональных групп боковой цепи, конъюгат пептид-смола помещают в смесь: 2% TIS/5% воды/5% (масс/объем) DTT/88% ТФУ. Раствор оставляют перемешиваться в течение 3,5 часов и затем фильтруют. Фильтрат смешивают с холодным безводным этиловым эфиром. Осадок собирают центрифугированием. Растворитель декантируют и осадок пептида ресуспендируют в свежем эфире. Обработку эфиром повторяют еще два раза. Пептид сушат в вакууме. Неочищенный линейный пептидный продукт разводят до концентрации 2 мг/мл 5% уксусной кислотой и по каплям при интенсивном перемешивании добавляют 0,5 М иод/метанол до достижения стойкого бледно-желтого окрашивания раствора. Раствор перемешивают еще 10 минут. Затем избыток иода гасят путем добавления при перемешивании 1 М тиосульфата натрия до бесцвечивания смеси. Раствор циклического пептида лиофилизируют и неочищенный порошок очищают методом препаративной ВЭЖХ, используя колонку с обращенной фазой С-18. Фракции, содержащие очищенный продукт, объединяют и лиофилизируют. Пептиды анализируют методом масс-спектрометрии, используя технику ионизации электрораспылением, и идентифицируют по корректной массе.
Синтез лактам-циклизованных пептидов
[00149] Циклические лактам-содержащие пептиды также синтезируют с помощью стандартных методов твердофазного пептидного синтеза. В случае пептидов, содержащих С-концевой Dpr, смолу Fmoc-Dpr(Mtt)-BHA переносят в реактор твердофазного пептидного синтезатора. Группу Fmoc удаляют, как описано выше, и следующую Fmoc-защищенную аминокислоту, например, такую как Fmoc-Trp(Boc)-OH, присоединяют к смоле посредством стандартных реакций сочетания. Защитную группу Fmoc удаляют и остальные аминокислоты добавлены по отдельности в правильной последовательности, повторяя реакции сочетания и удаления защитных групп до завершения синтеза аминокислотной последовательности. Для присоединения глутаминовой кислоты используют Fmoc-Glu(OPip). Полностью собранный пептид ацетилируют по N-концу, как в способе, описанном ранее для дисульфид-содержащих пептидов. Затем удаляют ортогональные защитные группы с боковых цепей. Например, ортогональные защитные группы с конъгата пептид-смола, содержащего Glu, боковая цепь которого защищена 2-фенилизопропиловым (OPip) сложным эфиром, или Dpr, боковая цепь которого защищена 4-метилтритилом (Mtt), отщепляют путем обработки 1% ТФУ в дихлорметане. После удаления защитных групп конъюгат пептид-смола суспендируют в NMP и обрабатывают HBTU DIPEA. После циклизации (отрицательный результат в тесте Кайзера) пептид-смолу промывают дихлорметаном и сушат. Отщепление циклического пептида от смолы, а также любых оставшихся защитных групп проводят с использованием трифторуксусной кислоты (ТФУ) в присутствии воды и 1,2-этандитиола (EDT). Продукт осаждают путем добавления холодного безводного эфира и собирают центрифугированием. Конечную очистку проводят методом ВЭЖХ на колонке с обращенной фазой С-18. Очищенный пептид лиофилизируют и определяют его массу методом масс-спектрометрии с использованием технологии электронного распыления.


[00150] Некоторые катионные полипептиды, приведенные в таблице 1, тестируют, чтобы определить их активность, с помощью описанных ниже анализов. Результаты таких анализов представлены в таблице 2.
Тестирование пептидов:
Радиолигандные анализы связывания:
[00151] Анализы связывания рецептора с целью определения константы связывания (Kd) или ингибирующей концентрации (IC50) путем вытеснения радио-меченого лиганда из комплекса с рецептором циклическим пептидом настоящего изобретения можно проводить с помощью любого способа, известного в данной области.
[00152] В качестве примера, препараты клеточных мембран для анализа связывания получают из клеток СНО-K1, трансфицированных с целью стабильной экспрессии рецепторов hMC подтипов 1, 3, 4 или 5. Конкурентное ингибирование связывания [125I](Tyr2)-(Nle4-D-Phe7)-alpha-MSH([125I]-NDP-α-MSH проводят в полипропиленовых 96-луночных планшетах. Коротко говоря, клеточные мембраны (1-10 мкг белка/лунку), полученные по описанному выше способу, инкубируют в 50 мМ Трис-HCl, рН 7,4, содержащем 0,2% BSA, 5 мМ MgCl2, 1 мМ CaCl2 и 0,1 мг/мл бацитрацина, с использованием возрастающих концентраций тестируемого соединения и 0,1-0,3 нМ [125I]-NDP-α-MSH в течение примерно 120 минут при 37°С. Связанный лиганд [125I]-NDP-α-MSH отделяют от свободного [125I]-NDP-α-MSH фильтрацией через планшеты с фильтром из стекловолокна GF/C (Unifilter®, Meriden, CT, USA), предварительно замоченные в 0,1% (масс/объем) полиэтиленимине (PEI). Фильтры промывают три раза 50 мМ Трис-HCl, рН 7,4, при температуре примерно 0-4°С, и затем анализировали на радиоактивность. Результаты анализа связывания обрабатывают с помощью компьютерного нелинейного регрессионного анализа.
Анализ стимуляции циклического АМФ:
[00153] Агонистический или антагонистический статус циклического пептида настоящего изобретения определяют с помощью функциональных анализов, которые можно проводить любым способом, известным в данной области.
[00154] Электрохемилюминесцентный (ECL) анализ
[00155] Уровни внутриклеточного циклического АМФ (цАМФ), стимулированного пептидами, определяют в дозо-зависимой манере с помощью электрохемилюминесцентного (ECL) анализа (Meso Scale Discovery, Gaithersburg, MD, USA; далее называемый "MSD"). Коротко говоря, клетки СНО-К1, стабильно экспрессирующие подтипы рецептора hMC, суспендируют в буфере RMPI 1640® для анализа (буфер RMPI 1640, содержащий 0,5 мМ IBMX и 0,2% белковой смеси (блокатор А MSD)). Трансгенные клетки СНО-К1, стабильно экспрессирующие рецептор hMC подтипов 1, 3, 4 или 5, распределяют в количестве примерно 7000 клеток/лунку в 384-луночные планшеты Multi-Array (MSD), содержащие встроенные углеродные электроды и покрытые антителами против цАМФ. После добавления возрастающих концентраций тестируемых соединений клетки инкубируют в течение примерно 40 минут при 37°С. Добавляют буфер для лизиса клеток (HEPES-забуференный физиологический раствор, содержащий MgCl2 и Triton X-100®, рН 7,3), содержащий 0,2% белковой смеси и 2,5 нМ TAG™ рутений-меченого цАМФ (MSD), после чего клетки инкубируют в течение примерно 90 минут при комнатной температуре. В конце второго периода инкубации добавляют буфер для считывания (трис-забуференный раствор, содержащий сореагент ECL и Triton X-100, рН 7,8) и сразу определяют уровни цАМФ в клеточных лизатах путем детекции ECL с помощью ридера Sector Imager 6000 reader® (MSD). Результаты обрабатывают с помощью компьютерного анализа нелинейной регрессии (XL fit; IDBS) и выражают в виде значений ЕС50. ЕС50 представляет собой концентрацию агонистического соединения, необходимую для получения ответа, составляющего 50% от максимального, например, 50% от максимального уровня цАМФ, определенного с помощью описанного выше анализа.
Анализ путем измерения уровня цАМФ:
[00156] Клетки, трансфицированные человеческим МС4-R, выращивают до слияния в 96-луночных планшетах (помещая примерно 250000 клеток на лунку). Клетки обрабатывают с тройными повторами 0,2 мМ изобутилметилксантином (IBMX) и сортируют в зависимости от концентрации пептида или, альтернативно, пептида в присутствии 20 нМ NDP-MSH. Клетки обрабатывают одинаковым образом и образцы, содержащие только 20 нМ NDP-MSH, используют в качестве положительных контролей в объеме 200 мкл. В качестве отрицательного контроля используют пустые образцы, содержащие только буфер. После инкубации в течение одного часа при 37°С клетки лизируют путем добавления 50 мкл буфера для лизиса клеток. Общее количество цАМФ, накопленное в 250 мкл указанной инкубационной среды, количественно определяют с использованием коммерчески доступного набора для анализа цАМФ при низких значениях рН (Amersham Biosciences) в соответствии с методом, предлагаемым поставщиком набора. Пептид, вызывающий накопление цАМФ в таком же диапазоне или выше, как и альфа-MSH, используемый в качестве положительного контроля, считают агонистом. Строят график с использованием результатов, полученных для агониста, кривую подгоняют и определяют значения ЕС50. Пептид, вызывающий накопление в том же диапазоне, что и отрицательный контроль (пустой буфер в отсутствии альфа-MSH), считается неэффективным в тестируемой концентрации. Пептид, вызывающий пониженное накопление, считается антагонистом, если наблюдается ингибирование уровня цАМФ по сравнению с уровнем, индуцируемым альфа-MSH, также используемым в анализе. Подобный анализ можно проводить с использованием клеток, экспрессирующих hMC-1R, hMC-3R и hMC-5R.
Измерение накопления цАМФ с помощью β-галактозидазной (β-Gal) репортерной системы:
[00157] Используют систему считывания хемилюминесценции с комплементацией фрагментов ферментов (EFC) и с применением β-галактозидазы (β-Gal) в качестве системы функционального репортера. Данная аналитическая система, использующая разные системы рецепторов меланокортина, является коммерчески доступной (система для анализа цАМФ Hunter GPCR, Discoverx Corp, Fremont, CA). В указанном анализе используют фермент β-Gal, который расщепляется на два комплементарных фрагмента; ЕА - ферментный акцептор и ED - ферментный донор. В данном анализе фрагмент ED, гибридизованный с цАМФ, конкурирует с цАМФ, продуцируемым клетками, за связывание с цАМФ-специфичными антителами. Затем добавляют ЕА, образующий активный β-Gal с несвязанным ED-цАМФ. Затем образовавшийся активный фермент конвертирует хемилюминесцентный субстрат, генерируя сигнал, который регистрируют на стандартном ридере для микропланшетов.
[00158] Коротко говоря, в планшет высевают 10000 клеток на лунку, инкубируют в течение ночи и затем каждую лунку (клетки инкубируют с 10 мкл буфера для анализа) инкубируют с 4-кратными серийными концентрациями тестируемого соединения в буфере для клеточного анализа (5 мкл) и цАМФ-специфичным антителом (5 мкл) в течение 30 мин при 37°С. Затем добавляют буфер для лизиса клеток (20 мкл), содержащий конъюгат фрагмента фермента ED-цАМФ и репортерный субстрат (Emerald II-Galacton Star, 5:1), после чего инкубируют в течение 60 мин при комнатной температуре. Затем добавляют 20 мкл реагента, содержащего фрагмент ЕА β-Gal. После инкубации в течение 120 мин при комнатной температуре измеряют хемилюминесценцию с помощью планшет-ридера (Envision) и результаты используют для вычисления значений ЕС50 тестируемых пептидов.
[00159] Результаты представлены в таблице 2.
Получение ионного комплекса и фармацевтической композиции настоящего изобретения
Пример 1: Получение композиции 2А (пептид 1 и mPEG-10000-монокарбоксилат)
[00160] Смесь mPEG-10000-монокарбоксилата (5,4 г) и 8,4 г воды помещают во флакон. Флакон закрывают пробкой, герметизируют и автоклавируют в течение 15 мин при 121°С, получая однородный прозрачный вязкий раствор. После охлаждения флакон переносят в асептический вытяжной шкаф. Флакон открывают и добавляют стерильный водный раствор пептида 1 (100 мг в 1 мл), предварительно отфильтрованный через фильтр 0,2 мкм. Композицию пептида получают в виде однородного прозрачного вязкого раствора. Концентрация пептида 1 по данным ВЭЖХ составляет 9,9 мг/мл.
Пример 2: Получение композиции 2B (пептид 1 и PEG-10000-дикарбоксилат)
[00161] Смесь PEG-10000-дикарбоксилата (2,7 г) и 2,0 г воды помещают во флакон. Флакон закрывают пробкой, герметизируют и автоклавируют в течение 15 мин при 121°С, получая однородный прозрачный вязкий раствор. После охлаждения флакон переносят в асептический вытяжной шкаф. Флакон открывают и добавляют стерильный водный раствор пептида 1 (50 мг в 0,5 мл), предварительно отфильтрованный через фильтр 0,2 мкм. Композицию пептида получают в виде однородного прозрачного вязкого раствора. Концентрация пептида 1 по данным ВЭЖХ составляет 10,8 мг/мл.
Пример 3: Получение композиции 2C (пептид 1 и mPEG-20000-монокарбоксилат)
[00162] Смесь mPEG-20000-карбоксилата (1,8 г) и 3,5 г смеси пропиленгликоль-этанол-вода (в соотношении 40:15:45 об/об) помещают во флакон. Флакон закрывают пробкой, герметизируют и автоклавируют в течение 15 мин при 121°С, получая однородный прозрачный вязкий раствор. После охлаждения флакон переносят в асептический вытяжной шкаф. Флакон открывают и добавляют стерильный водный раствор пептида 1 (30 мг в 0,5 мл), предварительно отфильтрованный через фильтр 0,2 мкм. Композицию пептида получают в виде однородного прозрачного вязкого раствора. Концентрация пептида 1 по данным ВЭЖХ составляет 6 мг/мл.
Пример 4: Получение композиции 2D (пептид 1 и DPPА натрия)
[00163] Смесь DPPA натрия (302 мг) и 8,6 г смеси пропиленгликоль-вода 1:1 помещают во флакон. Флакон закрывают пробкой, герметизируют и автоклавируют в течение 15 мин при 121°С, получая однородную дисперсию липидов. После охлаждения флакон переносят в асептический вытяжной шкаф. Флакон открывают и добавляют стерильный водный раствор пептида 1 (100 мг в 1 мл), предварительно отфильтрованный через фильтр 0,2 мкм. Композицию пептида получают в виде однородной невязкой дисперсии. Концентрация пептида 1 по данным ВЭЖХ составляет 9,6 мг/мл.
Пример 5: Получение композиции 2Е (пептид 1 и стеарат натрия)
[00164] Смесь маннита (300 мг) и стеарата натрия (165 мг) в 8,3 г воды помещают во флакон. Флакон закрывают пробкой и нагревают при 75°С в течение 0,5 ч с получением прозрачного раствора. После охлаждения добавляют примерно 400 мкл 1,0N уксусной кислоты, чтобы довести рН до значения в диапазоне 6-7. Флакон закрывают пробкой, герметизируют и автоклавируют в течение 15 мин при 121°С. После охлаждения флакон переносят в асептический вытяжной шкаф. Флакон открывают и добавляют стерильный водный раствор пептида 1 (100 мг в 1,0 г водного раствора), предварительно отфильтрованный через фильтр 0,2 мкм. Композицию пептида получают в виде однородной светлой молочно-белой непрозрачной невязкой суспензии. Концентрация пептида 1 по данным ВЭЖХ составляет 9,7 мг/мл.
Пример 6: Получение композиции #3B (пептид 1, стеарат натрия и mPEG-2000-DSPE)
[00165] Смесь mPEG-2000-DspE (1,85 г) и стеарата натрия (100,1 мг) в 10,8 мл воды помещают во флакон. Флакон закрывают пробкой и нагревают при 75°С в течение 1 часа. После охлаждения добавляют примерно 240 мкл уксусной кислоты, чтобы довести рН до значения в диапазоне 6-7. Флакон закрывают пробкой, герметизируют и автоклавируют в течение 15 мин при 121°С. После охлаждения флакон переносят в асептический вытяжной шкаф. Флакон открывают и добавляют стерильный водный раствор пептида 1 (120 мг в 1,2 г), предварительно отфильтрованный через фильтр 0,2 мкм. Композицию пептида получают в виде однородной светлой молочно-белой непрозрачной невязкой суспензии. Концентрация пептида 1 по данным ВЭЖХ составляет 10,1 мг/мл.
Пример 7: Получение композиции #3C (пептид 1, DPPA натрия и PEG-10000-дикарбоксилат)
[00166] Смесь PEG-10000-дикарбоксилата (1,68 г) и DPPA натрия (362,4 мг) в 9,1 мл воды помещают во флакон. Флакон закрывают пробкой, герметизируют и автоклавируют в течение 15 мин при 121°С, получая однородную молочно-белую непрозрачную суспензию. После охлаждения флакон переносят в асептический вытяжной шкаф. Флакон открывают и добавляют стерильный водный раствор пептида 1 (120 мг в 1,2 г), предварительно отфильтрованный через фильтр 0,2 мкм. Композицию пептида получают в виде однородной молочно-белой непрозрачной суспензии. Концентрация пептида 1 по данным ВЭЖХ составляет 10,6 мг/мл.
Пример 8: Получение композиции #3D (пептид 1, DPPA натрия и PEG-3350)
[00167] Смесь PEG-3350 (1,8 г в 10,8 мл водного раствора) и DPPA (363 натрия мг) помещают во флакон. Флакон закрывают пробкой, герметизируют и автоклавируют в течение 15 мин при 121°С, получая однородную молочно-белую непрозрачную суспензию. После охлаждения флакон переносят в асептический вытяжной шкаф. Флакон открывают и добавляют стерильный водный раствор пептида 1 (120 мг в 1,2 г), предварительно отфильтрованный через фильтр 0,2 мкм. Композицию пептида получают в виде однородной молочно-белой непрозрачной суспензии. Концентрация пептида 1 по данным ВЭЖХ составляет 10,1 мг/мл.
Пример 9: Получение композиции #3Е (пептид 1, DPPA натрия, PEG-3350 и CMC натрия)
[00168] Водный раствор CMC натрия (средний МВ 90000) (72 мг в 9,0 мл) смешивают с PEG-3350 (1,8 г). К полученному прозрачному раствору добавляют DPPA натрия (216 мг). Флакон закрывают пробкой, герметизируют и автоклавируют в течение 15 мин при 121°С, получая однородную молочно-белую непрозрачную суспензию. После охлаждения флакон переносят в асептический вытяжной шкаф. Флакон открывают и добавляют стерильный водный раствор пептида 1 (120 мг в 1,2 г), предварительно отфильтрованный через фильтр 0,2 мкм. Композицию пептида получают в виде однородной молочно-белой непрозрачной суспензии. Концентрация пептида 1 по данным ВЭЖХ составляет 10,9 мг/мл.
Пример 10: Получение композиции #3F (пептид 1, mPEG-2000-DSPE и CMC натрия)
[00169] Водный раствор CMC натрия (средний МВ 90000), (72 мг в 10,8 мл, или 6,7 мг/мл) смешивают с mPEG-2000-DSPE (1,85 г). Флакон закрывают пробкой, герметизируют и автоклавируют в течение 15 мин при 121°С, получая однородный прозрачный раствор. Альтернативно содержимое флакона, включающее смесь CMC натрия и mPEG-2000-DSPE, перемешивают в течение ночи, получая прозрачный раствор, который стерилизуют фильтрованием через фильтр 0,2 мкм. Флакон открывают внутри асептического вытяжного шкафа и добавляют стерильный водный раствор пептида 1 (120 мг в 1,2 г), предварительно отфильтрованный через фильтр 0,2 мкм. Композицию пептида получают в виде однородного прозрачного раствора. Концентрация пептида 1 по данным ВЭЖХ составляет 10,5 мг/мл.
Пример 11: Получение композиции #4B (пептид 1 и mPEG-2000-DSPE)
[00170] Смесь mPEG-2000 (1,855 DspE г) и маннита (181 мг) в 8,8 мл воды для инъекций (продутой азотом в течение 10 мин) помещают во флакон. Флакон закрывают пробкой и осторожно переворачивают, чтобы полностью смочить все твердые ингредиенты водой. Затем его автоклавируют в течение 15 мин при 121°С. Содержимое флакона на данной стадии представляет собой прозрачный раствор. После охлаждения флакон переносят в асептический вытяжной шкаф. Флакон открывают и добавляют в течение 1 ч стерильный водный раствор пептида 1 (120 мг в 1,2 г), предварительно отфильтрованный через фильтр 0,2 мкм. Композицию пептида получают в виде однородного прозрачного раствора. Концентрация пептида 1 по данным ВЭЖХ составляет 8,7 мг/мл.
Пример 12: Получение композиции #4C (пептид 1, mPEG-2000-DSPE и CMC)
[00171] Водный раствор CMC натрия (средний МВ 90000) с концентрацией 8,9 мг/мл получают в продутой азотом воде для инъекций. 9,8 мл указанного раствора помещают во флакон и добавляют mPEG-2000-DSPE (1,853 г) и маннит (182 мг). Флакон закрывают пробкой и осторожно переворачивают, чтобы полностью смочить все твердые ингредиенты растворителем. Затем его автоклавируют в течение 15 мин при 121°С. Содержимое флакона на данной стадии представляет собой прозрачный раствор. После охлаждения флакон переносят в асептический вытяжной шкаф. Флакон открывают и добавляют в течение 1 ч стерильный водный раствор пептида 1 (120 мг в 1,2 г), предварительно отфильтрованный через фильтр 0,2 мкм. Композицию пептида получают в виде однородного прозрачного раствора. Концентрация пептида 1 по данным ВЭЖХ составляет 8,0 мг/мл.
Пример 13: Получение композиции #4D (пептид 1, mPEG-2000-DSPE и DPPA)
[00172] Смесь mPEG-2000-DSPE (1,86 г), DPPA натрия (363 мг) и маннита (60,2 мг) в 9 мл воды для инъекций (продутой азотом в течение 10 мин) помещают во флакон. Флакон закрывают пробкой и осторожно переворачивают, чтобы полностью смочить все твердые ингредиенты водой. Затем его автоклавируют в течение 15 мин при 121°С. Содержимое флакона на данной стадии представляет собой светлую молочно-белую гомогенную суспензию. После охлаждения флакон переносят в асептический вытяжной шкаф. Флакон открывают и добавляют в течение 1 ч стерильный водный раствор пептида 1 (120 мг в 1,2 г), предварительно отфильтрованный через фильтр 0,2 мкм, с получением однородной светлой молочно-белой непрозрачной невязкой суспензии. Концентрация пептида 1 по данным ВЭЖХ составляет 9,2 мг/мл.
Пример 14: Получение композиции #4E (пептид 1, mPEG-2000-DSPE и CMC)
[00173] Водный раствор CMC натрия в концентрации 7,2 мг/мл получают в продуваемой азотом воде для инъекций. К 10 мл указанного раствора, помещенного во флакон, добавляют mPEG-2000-DSPE (0,94 г) и маннит (181,7 мг). Флакон закрывают пробкой и осторожно переворачивают, чтобы полностью смочить все твердые ингредиенты растворителем. Затем его автоклавируют в течение 15 мин при 121°С. Содержимое флакона на данной стадии представляет собой прозрачный бесцветный раствор. После охлаждения флакон переносят в асептический вытяжной шкаф. Флакон открывают и добавляют в течение 1 ч стерильный водный раствор пептида 1 (120 мг в 1,2 г), предварительно отфильтрованный через фильтр 0,2 мкм. Композицию пептида получают в виде однородного прозрачного раствора. Концентрация пептида 1 по данным ВЭЖХ составляет 9,6 мг/мл.
Пример 15: Получение композиции #4F (пептид 1, mPEG-2000-DSPE и DPPА)
[00174] Смесь mPEG-2000-DSPE (0,954 г), DPPA натрия (183,7 мг) и маннита (61,7 мг) в 9,6 мл воды для инъекций (продутой азотом в течение 10 мин) помещают во флакон. Флакон закрывают пробкой и осторожно переворачивают, чтобы полностью смочить все твердые ингредиенты водой. Затем его автоклавируют в течение 15 мин при 121°С. Содержимое флакона на данной стадии представляет собой светлую молочно-белую гомогенную суспензию. После охлаждения флакон переносят в асептический вытяжной шкаф. Флакон открывают и добавляют в течение 1 ч стерильный водный раствор пептида 1 (120 мг в 1,2 г), предварительно отфильтрованный через фильтр 0,2 мкм, с получением однородной светлой молочно-белой непрозрачной невязкой суспензии. Концентрация пептида 1 по данным ВЭЖХ составляет 9,9 мг/мл.
Пример 16: Получение композиции, содержащей пептид 1, mPEG-2000-DSPE, CMA и D-маннит

Масштаб описанного ниже способа, рассчитанный на объем композиции 10 мл, можно легко уменьшить до конечного объема 1 мл, как показано в приведенной выше таблице.
Водный раствор CMC натрия (средний МВ 90000) (80 мг) и D-маннита (220 мг) в 7 мл воды для инъекций помещают в предварительно взвешенный флакон с мешалкой и пробкой. К указанному раствору добавляют твердый mPEG-2000-DSPE натрия (1 г). Флакон закрывают пробкой и герметизируют. Затем флакон помещают на водяную баню при 60°С и перемешивают его содержимое. Альтернативно флакон можно поместить в печь, поддерживаемую при температуре 60°С. Вначале содержимое флакона может быть мутным, но в течение 1-2 часов оно превращается в прозрачный однородный раствор. Затем флакон оставляют остывать до комнатной температуры. После чего флакон открывают и добавляют водный раствор пептида 1 (100 мг в 1 мл, в пересчете на содержание чистого пептида). Содержимое может на мгновение стать мутным, но при перемешивании превращается в прозрачный гомогенный раствор. Флакон взвешивают и массу общего содержимого доводят до 10,1 г путем добавления необходимого количества воды для инъекций. Затем полученную композицию перемешивают и фильтруют через фильтр 0,2 мкм внутри асептического вытяжного шкафа. Композицию пептида получают в виде прозрачного однородного раствора и анализируют методом ВЭЖХ, подтверждая концентрацию пептида 1 10 мг/мл.
Пример 17: Получение композиции, содержащей пептид 1, DPPА натрия и PEG-3350

Масштаб описанного ниже способа, рассчитанный на объем композиции 10 мл, можно легко уменьшить до конечного объема 1 мл, как показано в приведенной выше таблице.
В предварительно взвешенный флакон с пробкой добавляют 1,2 г PEG-3350 и 8 мл воды для инъекций. Содержимое растворяют путем перемешивания и добавляют 302 мг DPPA натрия. Флакон закрывают пробкой, герметизируют и автоклавируют в течение 15 мин при 121°С, получая однородную непрозрачную молочно-белую суспензию. После охлаждения флакон переносят в асептический вытяжной шкаф. Флакон открывают и добавляют стерильный водный раствор пептида 1 (100 мг в 1 мл воды, в пересчете на содержание чистого пептида), предварительно отфильтрованный через фильтр 0,2 мкм. Массу общего содержимого флакона доводят до 10,1 г путем добавления необходимого количества воды для инъекций. После перемешивания получают композицию пептида в виде однородной молочно-белой непрозрачной суспензии. Полученный пептид анализируют методом ВЭЖХ, подтверждая концентрацию пептида 1 10 мг/мл.
Пример 18: Введение композиций яванским макакам для анализа фармакокинетики
[00175] Яванских макак (со средним диапазоном массы тела от 3 до 7 кг) распределяют в группы по 6 животных для каждой описанной выше композиции, а также для композиции 3А. Всем обезьянам в группах вводят подкожно в область лопатки однократную болюсную дозу лекарственного средства из расчета 0,5 мг/кг массы тела. Образцы крови берут в разные моменты времени, начиная через 30 минут после введения дозы и вплоть до 36 или 48 часов. Получают плазму и анализируют концентрацию пептидного лекарственного средства методом ЖХ-МС/МС. Результаты фармакокинетического анализа представлены ниже в таблице 3, а графическое изображение фармакокинетического профиля приведено на фиг. 1, фиг. 2 и фиг. 3.
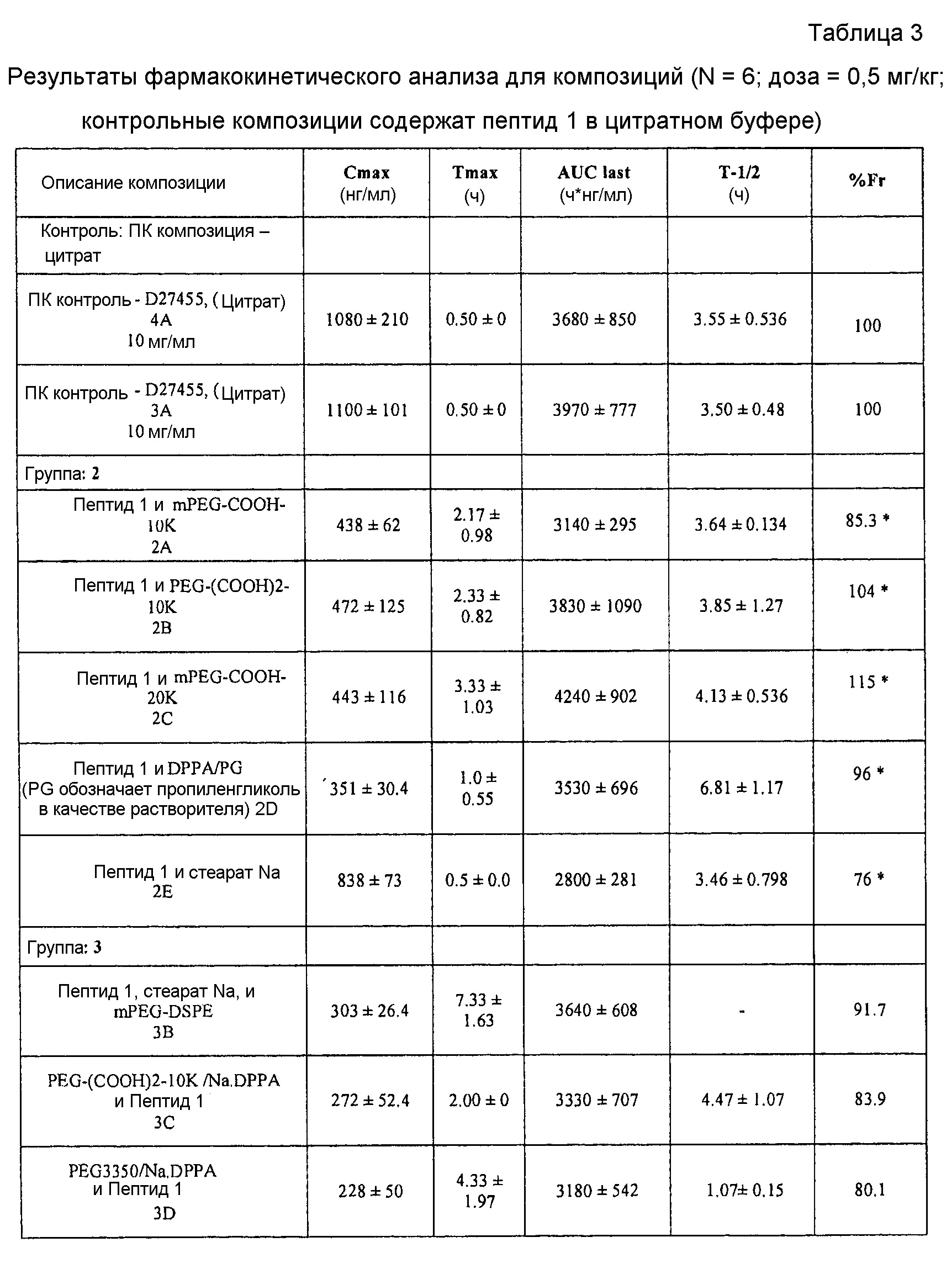

Как видно из результатов сравнительного фармакокинетического анализа примеров ионных комплексов пептида 1, наблюдается значительное уменьшение Cmax (Cmax пептида 1 составляет 1100 нг/мл, а Cmax комплекса 3D составляет 228 нг/мл). Многие другие ионные комплексы настоящего изобретения характеризуются подобным диапазоном пониженных значений Cmax по сравнению пептидом 1. Кроме того, некоторые из указанных ионных комплексов имеют гораздо более высокие значения Tmax (Tmax пептида 1 составляет 0,5 ч, тогда как у многих ионных комплексов Tmax достигает нескольких часов).
Описания всех патентов, опубликованных заявок и цитирующихся здесь ссылок включены в данный документ во всей их полноте.
Хотя настоящее изобретение конкретно демонстрируется и описывается со ссылкой на иллюстративные варианты его осуществления, специалисты в данной области могут осуществить разные изменения формы и деталей изобретения, не отступая от его объема, определенного в прилагаемой формуле изобретения.
Реферат
Настоящее изобретение относится к ионному комплексу, имеющему активность модулятора рецептора меланокортина-4, содержащему катионный полипептид SEQ ID NO: 1 или его фармацевтически приемлемую соль; метокси(полиэтиленгликоль 2000)-1,2-дистеароил-sn-глицеро-3-фосфоэтаноламин (mPEG-2000-DSPE) и карбоксиметилцеллюлозу (CMC). Комплекс может обеспечивать более желательный фармакокинетический профиль после введения, по сравнению с применением катионного полипептида самого по себе. Также изобретение относится к применению ионного комплекса и фармацевтической композиции, содержащей такой комплекс, для лечения индивидуума, страдающего от заболевания или расстройства, чувствительного к фармакологической активности катионного полипептида, входящему в состав ионного комплекса. 6 н. и 15 з.п. ф-лы, 4 табл., 3 ил., 18 пр.SEQ ID NO: 1
Формула
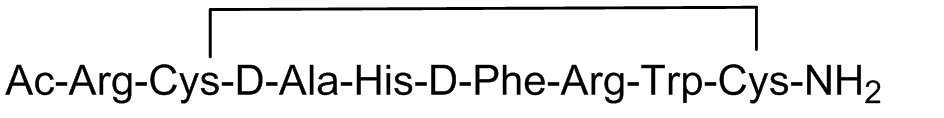
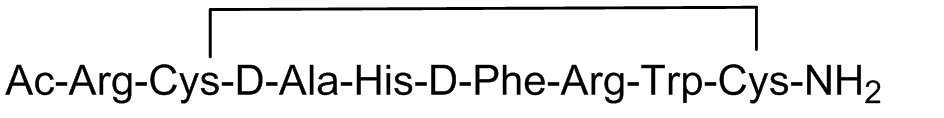
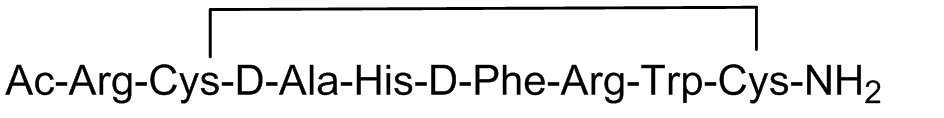
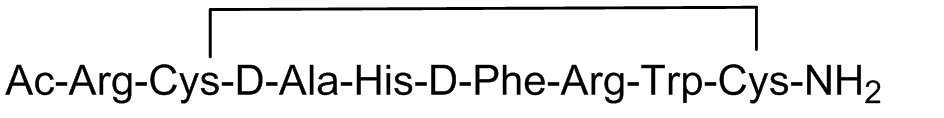
Документы, цитированные в отчёте о поиске
Имплантат октреотида, содержащий высвобождающее вещество


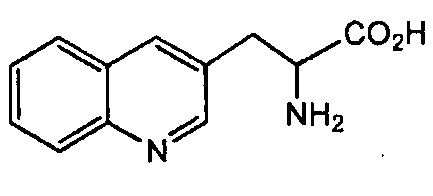

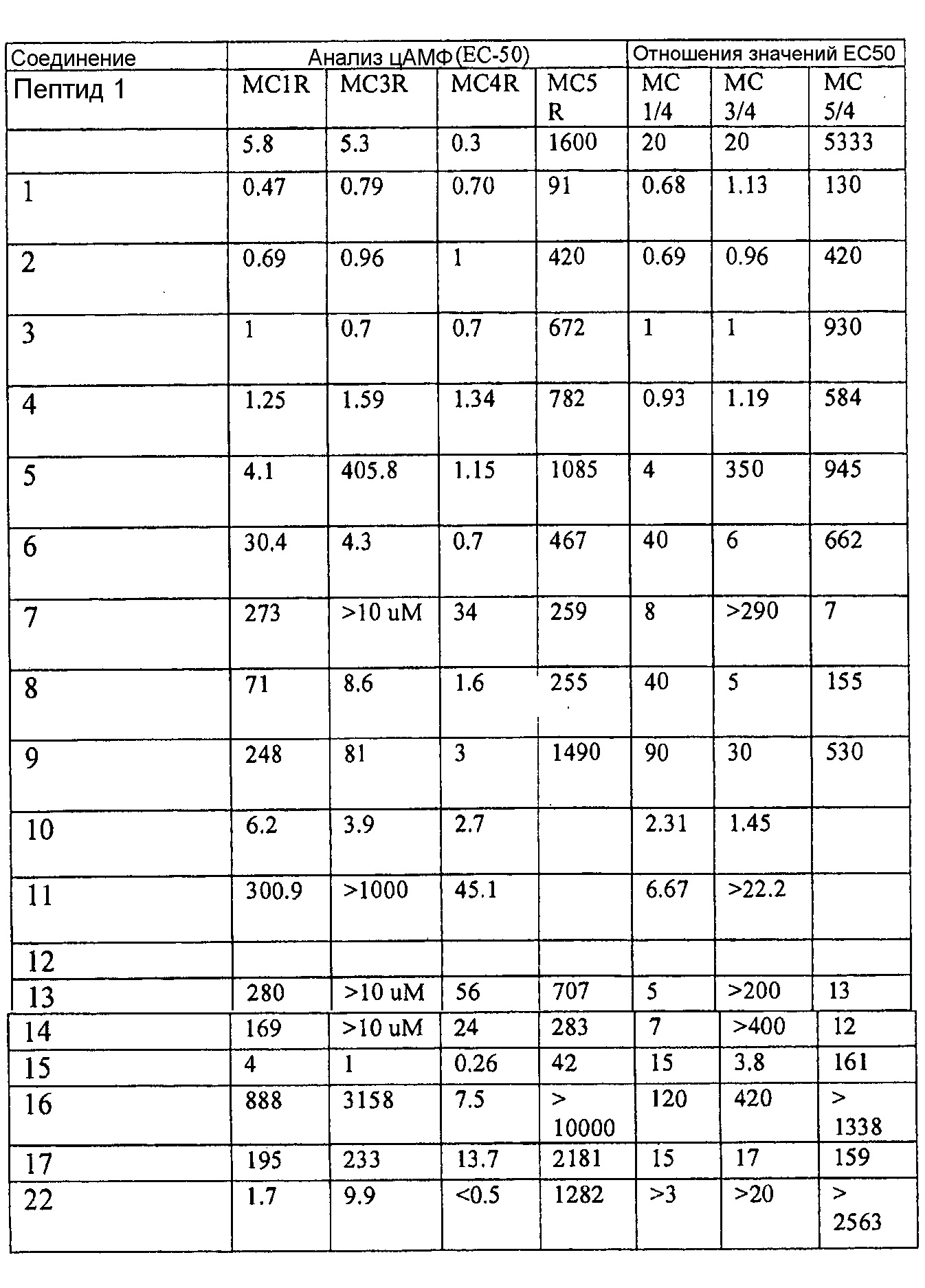

Комментарии