Терапевтическое применение агониста tlr и комбинированная терапия - RU2603467C2
Код документа: RU2603467C2
Чертежи






Описание
ПЕРЕКРЕСТНЫЕ ССЫЛКИ НА РОДСТВЕННЫЕ ЗАЯВКИ
Настоящая заявка претендует на приоритет и привилегии предварительной заявки на патент США № 61/388953, поданной 1 октября 2010, предварительной заявки на патент США № 61/388967, поданной 1 октября 2010 и предварительной заявки на патент США № 61/390447, поданной 6 октября 2010, содержание которых включено в настоящую заявку в полном объеме с помощью ссылки.
ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Настоящее изобретение направлено на составы агониста TLR, предпочтительно агониста TLR8, и комбинированную терапию, включающую введение агониста TLR8 и противоракового агента, для применения в лечении рака.
ПРЕДПОСЫЛКИ ИЗОБРЕТЕНИЯ
Стимулирование иммунной системы, которое включает стимулирование врожденного иммунитета, адаптивного иммунитета, или обоих этих видов иммунитета, является сложным процессом, который может привести либо к защитному, либо к неблагоприятному физиологическому результату для организма хозяина. В последнее время появился повышенный интерес к механизмам, лежащим в основе врожденного иммунитета, которые, как полагают, инициируют или поддерживают адаптивный иммунитет. Этот интерес частично подогревался недавним открытием семейства рецепторных белков, распознающих высоко консервативные структуры патогенов, известных как toll-подобные рецепторы (TLRs), которые, как полагают, принимают участие во врожденном иммунитете, в качестве рецепторов молекулярных структур, связанных с патогенами (PAMPs). Таким образом, композиции и способы, применимые для модулирования врожденного иммунитета, вызывают огромный интерес, поскольку они могут влиять на терапевтические подходы к лечению болезненных состояний, в т.ч. рака, инфекционных заболеваний, аутоиммунных заболеваний, воспаления, аллергии, астмы, отторжения трансплантата, реакции трансплантата против хозяина (GvHD) и иммунодефицита.
Toll-подобные рецепторы (TLRs) представляют собой семейство трансмембранных белков I типа, активация которых in vivo инициирует врожденный иммунный ответ, в который вовлечены определенные цитокины, хемокины и факторы роста. Хотя все TLRs могут активировать некоторые внутриклеточные сигнальные молекулы, например, ядерный фактор каппа бета (NF-kB) и митоген-активируемые протеин киназы (MAP киназы), конкретный набор выделяющихся цитокинов и хемокинов, по-видимому, является уникальным для каждого вида TLR. TLR7, 8 и 9 входят в подсемейство TLRs, которые локализованы в эндосомальных или лизосомальных компартментах иммунных клеток, например, дендритных клеток и моноцитов. В противоположность TLR7 и 9, которые активно экспрессируются на плазмацитоидных дендритных клетках (pDC), TLR8 экспрессируются главным образом на миелоидных DC (mDC) и моноцитах. Это подсемейство опосредует распознавание микробных нуклеиновых кислот, например, одноцепочечных РНК. Агонисты TLR8 стимулируют выработку различных воспалительных цитокинов, в том числе интерлейкина-6, интерлейкина-12, фактора некроза опухолей-альфа и интерферона-гамма. Кроме того, эти агонисты способствуют повышенной экспрессии ко-стимулирующих молекул, например, CD40, CD80, CD83 и CD86, молекул главного комплекса гистосовместимости и хемокиновых рецепторов. Интерфероны типа I, т.е. IFNα и IFNβ также продуцируются клетками при активации агонистов TLR8.
Низкомолекулярные синтетические имидазолхинолины (с молекулярной массой менее 400 Дальтон), которые сходны с пуриновыми нуклеотидами аденозином и гуанозином, были первыми выявленными агонистами TLR7 и TLR8. Некоторые из этих соединений продемонстрировали противовирусные и противораковые свойства. Например, агонист TLR7 имиквимод (ALDARATM), был одобрен Управлением США по пищевым продуктам и лекарственным препаратам в качестве местного средства для лечения поражений кожи, вызванных определенными штаммами папиломавируса человека. Имиквимод может также применяться для лечения первичных раковых заболеваний кожи и кожных опухолей, например, базально-клеточных карцином, кератоакантом, актинического кератоза и болезни Бовена. Агонист TLR7/8 резиквимод (R-848) проходит апробацию в качестве местного средства для лечения генитального герпеса человека.
Доксорубицин является лекарственным средством, применяемым в химиотерапии для лечения рака. Он представляет собой антрациклиновый антибиотик, близко родственный природному продукту дауномицину, и подобно всем антрациклинам он действует за счет внедрения в структуру ДНК. Доксорубицин обычно применяется в лечении широкого круга раковых заболеваний, включая гематологические злокачественные заболевания, многие типы раковых заболеваний и саркомы мягких тканей.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение, главным образом, направлено на комбинированную терапию, включающую введение бензо[b]азепинового агониста TLR8 и одного или нескольких дополнительных средств лечения, например, противоракового агента (например, доксорубицина), предназначенную для применения в лечении, облегчении или профилактике рака, предпочтительно, солидных опухолей (например, сарком, карцином и лимфом) и для других применений, включая лечение лейкемий, лечение некоторых кожных заболеваний или состояний, например, атопического дерматита, лечения инфекционных заболеваний, предпочтительно, вирусных заболеваний, и для применения в качестве адъювантов в вакцинах, предназначенных для применения в терапии рака и в лечении инфекционных заболеваний. Конкретно, настоящее изобретение направлено на способы и композиции, включающие бензо[b]азепиновый агонист TLR8, а именно VTX-2337, и доксорубицин. В предпочтительных вариантах осуществления, VTX-2337 и доксорубицин применяются для лечения ракового заболевания, и это раковое заболевание выбрано из группы, состоящей из рака яичников, рака груди, рака головы и шейного отдела, рака почек, рака мочевого пузыря, гепатоклеточного рака, колоректального рака, меланомы и лимфомы или любой их комбинации.
Предпочтительно, VTX-2337 включают в состав в концентрации от примерно 0,001 мг/мл до примерно 50 мг/мл, от примерно 0,01 мг/мл до примерно 50 мг/мл, от примерно 0,5 мг/мл до примерно 50 мг/мл, от примерно 1 мг/мл до примерно 40 мг/мл или от примерно 2 мг/мл до примерно 15 мг/мл. В некоторых вариантах осуществления, VTX-2337 включают в состав в концентрации от примерно 0,5 мг/мл до примерно 10 мг/мл, от примерно 0,5 мг/мл до примерно 8 мг/мл, от примерно 0,5 мг/мл до примерно 6 мг/мл, от примерно 0,5 мг/мл до примерно 4 мг/мл, от примерно 0,5 мг/мл до примерно 2 мг/мл. В некоторых вариантах осуществления, VTX-2337 включают в состав в концентрации примерно 0,5 мг/мл, примерно 1 мг/мл, примерно 2 мг/мл, примерно 4 мг/мл, примерно 6 мг/мл, примерно 8 мг/мл, примерно 10 мг/мл, примерно 15 мг/мл, примерно 20 мг/мл, примерно 25 мг/мл, примерно 30 мг/мл, примерно 40 мг/мл или примерно 50 мг/мл. Предпочтительно, состав включает примерно 1-30%, 5-15% или 5-10% масса/объем циклодекстрина, предпочтительно, β-циклодекстрина и, наиболее предпочтительно, сульфобутилового эфира β-циклодекстрина. В некоторых вариантах осуществления, состав включает 1%, 5%, 10%, 15%, 20%, 25% или 30% масса/объем циклодекстрина, предпочтительно, β-циклодекстрина и, наиболее предпочтительно, сульфобутилового эфира β-циклодекстрина. В конкретном варианте осуществления, состав представляет собой водный раствор, включающий VTX-2337 в концентрации не менее 2 мг/мл. В другом варианте осуществления, состав включает 15% масса/объем циклодекстрина, предпочтительно, β-циклодекстрина и, наиболее предпочтительно, сульфобутилового эфира β-циклодекстрина. В предпочтительных вариантах осуществления, состав подходит для инъекции млекопитающему, предпочтительно, человеку. В конкретных вариантах осуществления, инъекцию осуществляют подкожным путем, внутримышечным путем или трансдермальным путем. В некоторых вариантах осуществления, состав подходит для внутривенного введения.
Предпочтительно, восстановленный состав по настоящему изобретению подходит для инъекции млекопитающему, предпочтительно, человеку. В конкретных вариантах осуществления, инъекцию осуществляют подкожным путем, внутримышечным путем или трансдермальным путем. В некоторых вариантах осуществления, состав подходит для внутривенного введения.
Далее, настоящее изобретение относится к способам лечения раковых заболеваний путем введения субъекту, предпочтительно, человеку, доксорубицина и агониста TLR8 VTX-2337, который содержит циклодекстрин. В предпочтительном варианте осуществления, VTX-2337 вводят в комбинации с одним или несколькими дополнительными средствами лечения, где указанные средства выбраны из химиотерапевтических агентов, цитокинов, антител, гормональной терапии или лучевой терапии. В одном из вариантов осуществления, VTX-2337 вводят в качестве компонента схемы лечения солидной опухоли. В другом варианте осуществления, солидная опухоль является одной из форм ракового заболевания, выбранного из рака яичника, рака груди, рака головы и шейного отдела, рака почек, рака мочевого пузыря, гепатоклеточного рака, колоректального рака или лимфомы, или любой комбинации перечисленных заболеваний. В одном из вариантов осуществления, VTX-2337 вводят в качестве компонента схемы лечения лимфомы. В одном из вариантов осуществления эта лимфома является ходжкинской лимфомой. В другом варианте осуществления, эта лимфома является неходжкинской лимфомой. В другом варианте осуществления, VTX-2337 применяется в качестве адъюванта вакцины для лечения рака. В некоторых вариантах осуществления способов лечения рака, VTX-2337 вводят инъекцией или внутривенно. В конкретных вариантах осуществления, инъекцию осуществляют подкожным путем, внутримышечным путем или трансдермальным путем. В конкретном варианте осуществления, состав вводят подкожной инъекцией.
В некоторых вариантах осуществления способов лечения рака, VTX-2337 вводят субъекту в дозировке от примерно 0,02 до 10 мг/кг (например, приблизительно 0,05-0,075 мг/кг или приблизительно от 0,04 до 5 мг/кг) массы тела субъекта. В некоторых вариантах осуществления, VTX-2337 вводят в дозировке примерно 0,02 мг/кг, примерно 0,05 мг/кг, примерно 1 мг/кг, примерно 2 мг/кг или примерно 5 мг/кг. Например, считая, что масса тела субъекта составляет приблизительно 70 кг, VTX-2337 вводят в количестве примерно 1,4-700 мг (например, 3,5-5,25 мг, или приблизительно 2,8-350 мг). В некоторых других вариантах осуществления, VTX-2337 вводят субъекту раз в неделю или раз в две недели.
Настоящее изобретение относится также к фармацевтической упаковке или набору, включающему один или несколько контейнеров, заполненных жидким или лиофилизированным VTX-2337 и противораковым агентом (например, доксорубицином) по настоящему изобретению, для лечения рака или одного или нескольких симптомов рака. Жидкий или лиофилизированный VTX-2337 и противораковый агент (например, доксорубицин) могут быть упакованы в один и тот же или различные контейнеры набора. Предпочтительно, состав VTX-2337 включает примерно 1-30%, 5-15% или 5-10% масса/объем циклодекстрина, предпочтительно, β-циклодекстрина и, наиболее предпочтительно, сульфобутилэфир β-циклодекстрина. В некоторых вариантах осуществления, состав VTX-2337 включает 2%, 5%, 10%, 15%, 20%, 25% или 30% масса/объем циклодекстрина, предпочтительно, β-циклодекстрина и, наиболее предпочтительно, сульфобутилового эфира β-циклодекстрина. В конкретном варианте осуществления, состав представляет собой водный состав VTX-2337. Предпочтительно, VTX-2337 включен в состав в концентрации не менее 2 мг/мл и состав, независимо от того, является ли он водным или восстановленным лиофилизированным составом, подходит для подкожной инъекции млекопитающим, предпочтительно, человеку.
В одном из вариантов осуществления, VTX-2337 входит в состав в концентрации не менее 2 мг/мл. Кроме того, этот состав подходит для введения субъекту, где субъект предпочтительно является человеком, с помощью инъекции, которая является подкожной, внутримышечной или трансдермальной инъекцией. В некоторых вариантах осуществления, VTX-2337 вводят субъекту в дозировке примерно от 0,02 до 10 мг/кг, примерно от 0,04 до 5 мг/кг или примерно 0,05-0,075 мг/кг. В некоторых других вариантах осуществления, VTX-2337 вводят субъекту раз в неделю или раз в две недели.
В предпочтительном варианте осуществления, VTX-2337 вводят в комбинации с одним или несколькими дополнительными средствами лечения, где эти средства выбраны из химиотерапевтических агентов, цитокинов, антител, гормональной терапии или лучевой терапии. Настоящее изобретение относится также к способам лечения инфекционных заболеваний, вызванных вирусом, где этот вирус является вирусом гепатита.
В предпочтительном варианте осуществления, доксорубицин включают в состав для инъекций, наиболее предпочтительно, для внутривенного введения. В некоторых вариантах осуществления, VTX-2337 согласно настоящему изобретению включают в состав для введения интрадермальным, трансдермальным, подкожным или внутримышечным путем.
В некоторых вариантах осуществления способов лечения рака, доксорубицин вводят субъекту в дозировке примерно от 0,02 до 10 мг/кг массы тела или примерно от 0,04 до 5 мг/кг массы тела субъекта.
Настоящее изобретение относится также к способу лечения рака с помощью составов бензо[b]азепинового агониста TLR8 в низких дозировках. Этот способ включает введение субъекту, у которого имеется такая необходимость, бензо[b]азепинового агониста TLR8 в дозировке менее 0,007 мг/кг/неделю, например, от 0,002 мг/кг/неделю до 0,006 мг/кг/неделю. В одном из вариантов осуществления, бензо[b]азепиновый агонист TLR8 представляет собой 2-амино-N,N-дипропил-8-(4-(пирролидин-1-карбонил)фенил)-3H-бензо[b]азепин-4-карбоксамид. Этот способ может включать введение бензо[b]азепинового агониста TLR8 в качестве единственного действующего ингредиента или дополнительно включает введение второго терапевтического агента, например, противоракового лекарственного средства в комбинации с составом бензо[b]азепинового агониста TLR8 в низкой дозировке. Упомянутый второй терапевтический агент может представлять собой другой бензо[b]азепиновый агонист TLR8 или молекулу лекарственного средства, раскрытого в настоящем изобретении (например, доксорубицин, гемцитабин или циклофосфамид). Этот способ можно также осуществлять в комбинации с одним или несколькими дополнительными средствами лечения (например, лучевой терапией) в схемах лечения раковых заболеваний.
В другом аспекте, настоящее изобретение относится также к дозированной форме для подкожного введения, включающей бензо[b]азепиновый агонист TLR8 для лечения рака у субъекта, где эта дозированная форма для подкожного введения, при введении человеку в дозировке 2-4 мг/м2 агониста, обеспечивает AUC0-inf агониста от примерно 55 до примерно 90 ч*нг/мл, например, от примерно 60 до примерно 80 ч*нг/мл.
В еще одном аспекте, настоящее изобретение относится также к дозированной форме для подкожного введения, включающей бензо[b]азепиновый агонист TLR8 для лечения рака у субъекта, где эта дозированная форма для подкожного введения, при введении человеку в дозировке 2-4 мг/м2 агониста, обеспечивает Cmax агониста от примерно 10 до примерно 30 нг/мл, например, от примерно 15 до примерно 25 нг/мл.
Изобретение относится также к фармацевтической композиции, включающей жидкий или лиофилизированный состав бензо[b]азепинового агониста TLR8 (например, VTX-2337) и противораковый агент (например, доксорубицин). Состав этого агониста и противораковый агент могут входить в одну и ту же фармацевтическую композицию или в различные композиции, и в последнем случае состав агониста и противораковый агент можно вводить одновременно или последовательно.
В приведенном выше описании в общих чертах изложены наиболее важные отличительные признаки настоящего изобретения, для того, чтобы можно было понять приведенное ниже подробное описание и для того, чтобы можно было лучше понять вклад настоящего изобретения в технику. Другие цели и отличительные признаки настоящего изобретения станут ясны из приведенного ниже подробного описания в сочетании с примерами.
ОПИСАНИЕ ИЛЛЮСТРАТИВНОГО МАТЕРИАЛА
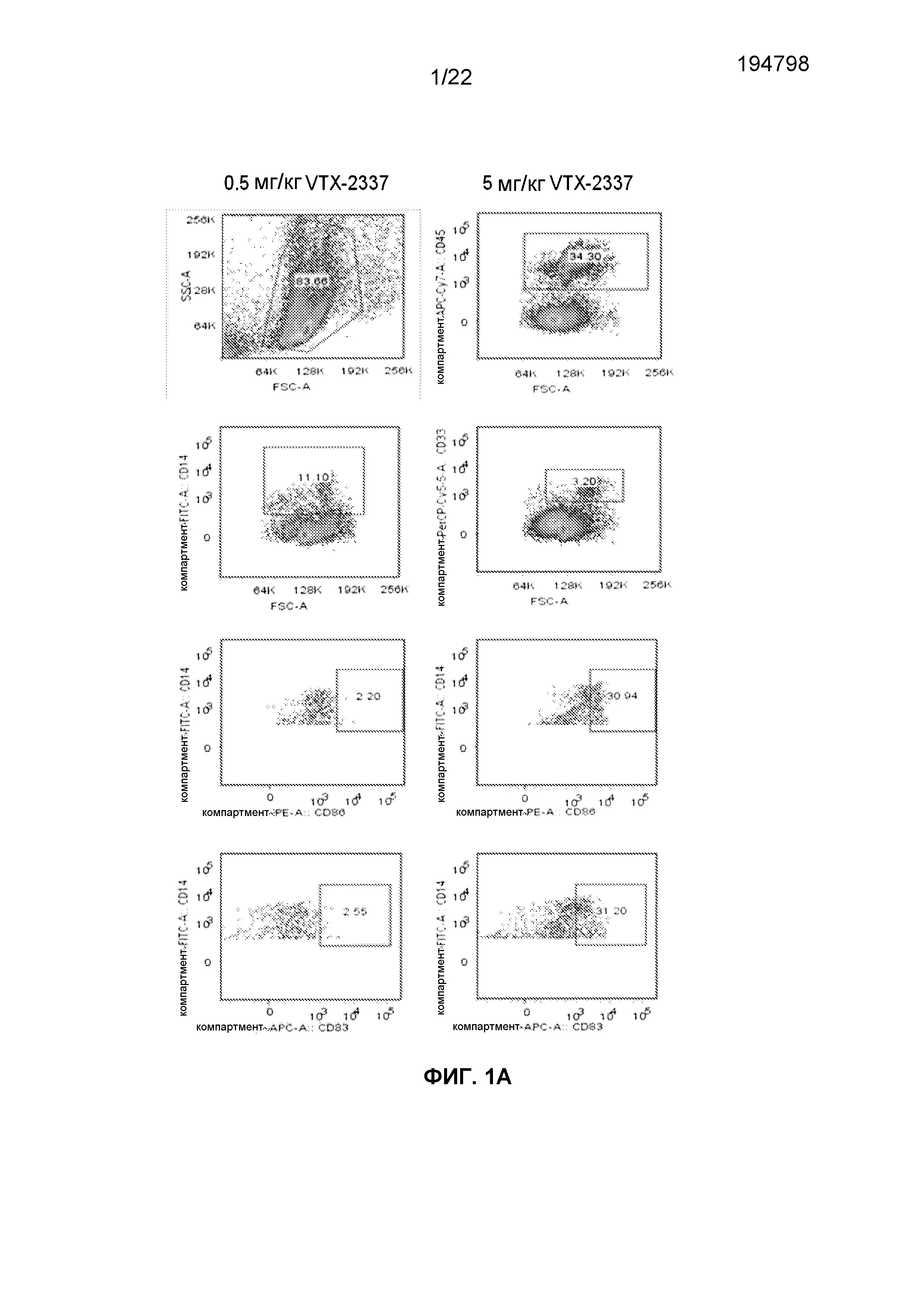
Фиг.1A представляет собой подборку FACS изображений, полученных для гематолимфоидных клеток мышей NSG-HIS. Мышам NSG вводили гематопоэтические стволовые клетки CD34+ человека, полученные из пуповинной крови. Показаны уровни энграфтмента (приживаемости) человеческих клеток (CD45+, CD45+CD14+, CD45+CD33). Мышам вводили 0,5 или 5 мг/кг VTX-2337. Показано созревание клеток CD14+ (CD83, CD86).
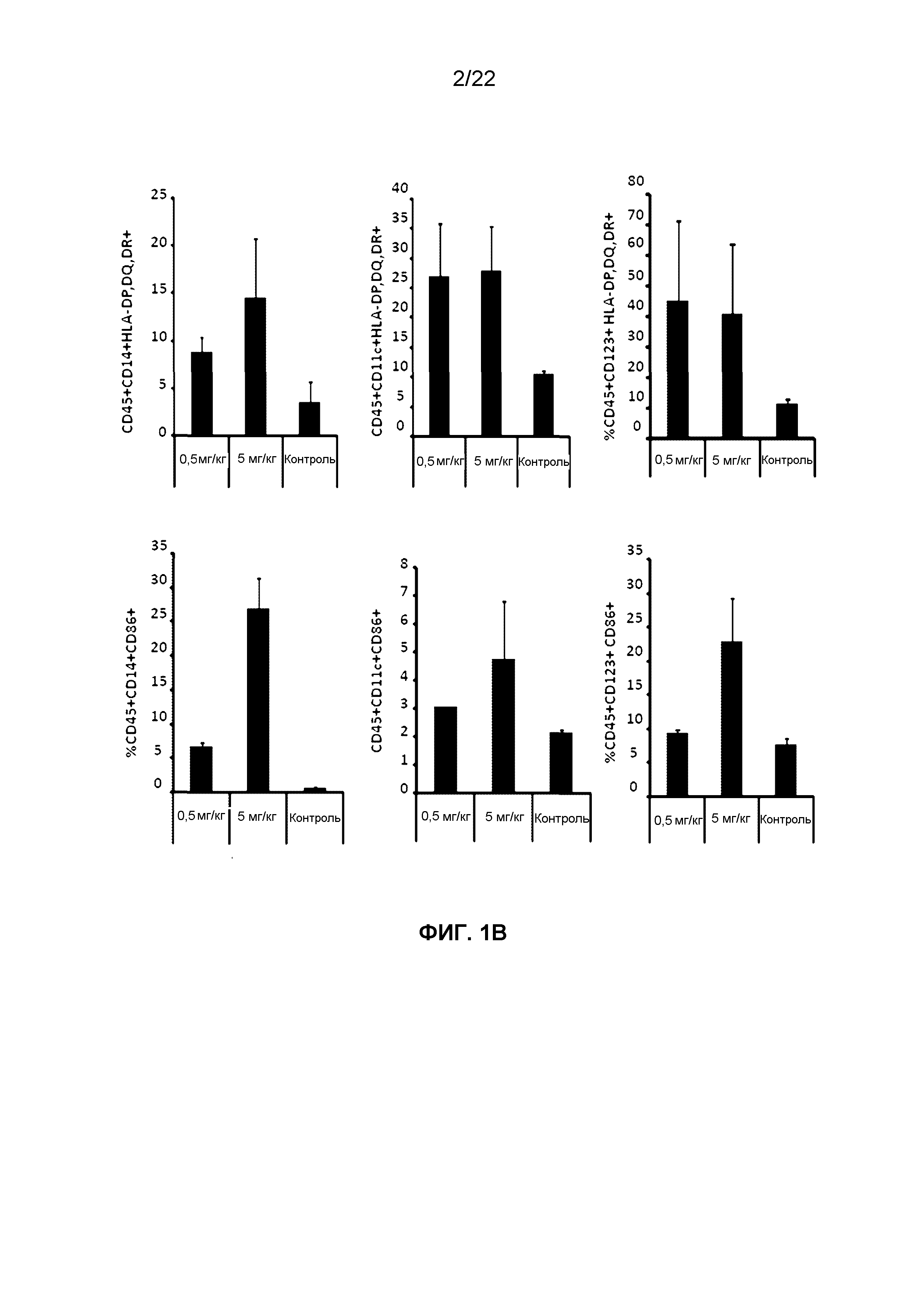
Фиг.1B представляет собой группу гистограмм, демонстрирующих изменение содержания маркеров активации (CD86+, MHC класса II) на моноцитах (CD45+ CD14+), mDC (CD45+ CD11c+) и pDC (CD45+ CD123+) через 6 часов после SC введения VTX-2337 мышам NSG-HIS.
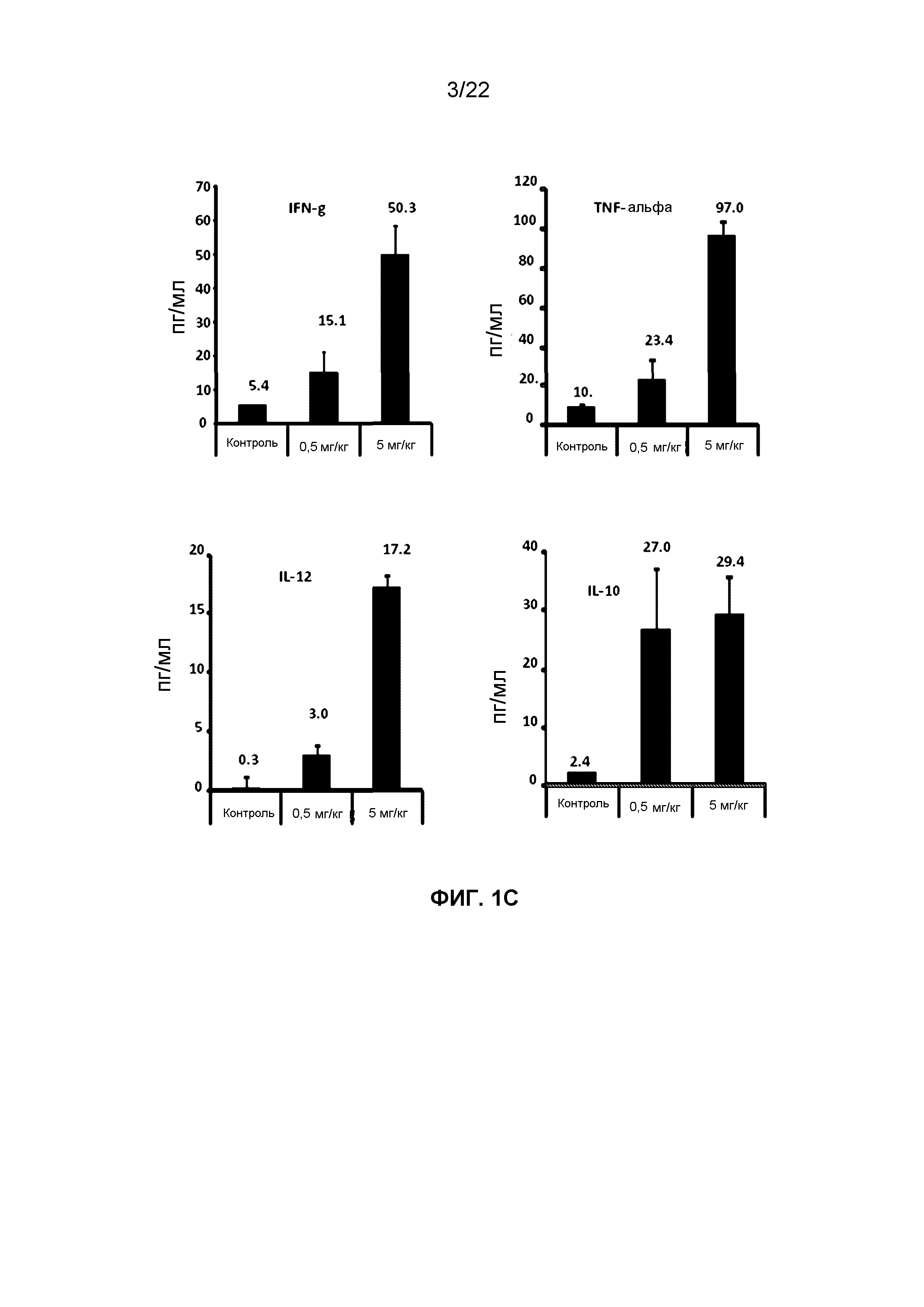
Фиг.1C представляет собой группу гистограмм, демонстрирующих изменение уровней цитокинов в плазме (INF-g, TNF-альфа, IL-12 и IL-10) через 6 часов после SC введения VTX-2337 мышам NSG-HIS.
Фиг.2 представляет собой группу гистограмм, демонстрирующих изменение уровней цитокинов в плазме (INF-g, IL-10, TNF-альфа) у мышей, которым не вводили препараты (CTRL), вводили доксил в максимальной переносимой дозе (MTD, 50 мг/м2) или 5 мг/кг VTX-2337 через 5 дней после введения доксила.
Фиг.3A представляет собой схематическое изображение протокола введения доксила мышам NSG-HIS, VTX-2337 или их комбинации в модели гуманизированного мышиного (NSG-HIS) рака яичников, в которой для генерации опухоли использовались клетки рака яичника человека линии OVCAR5.
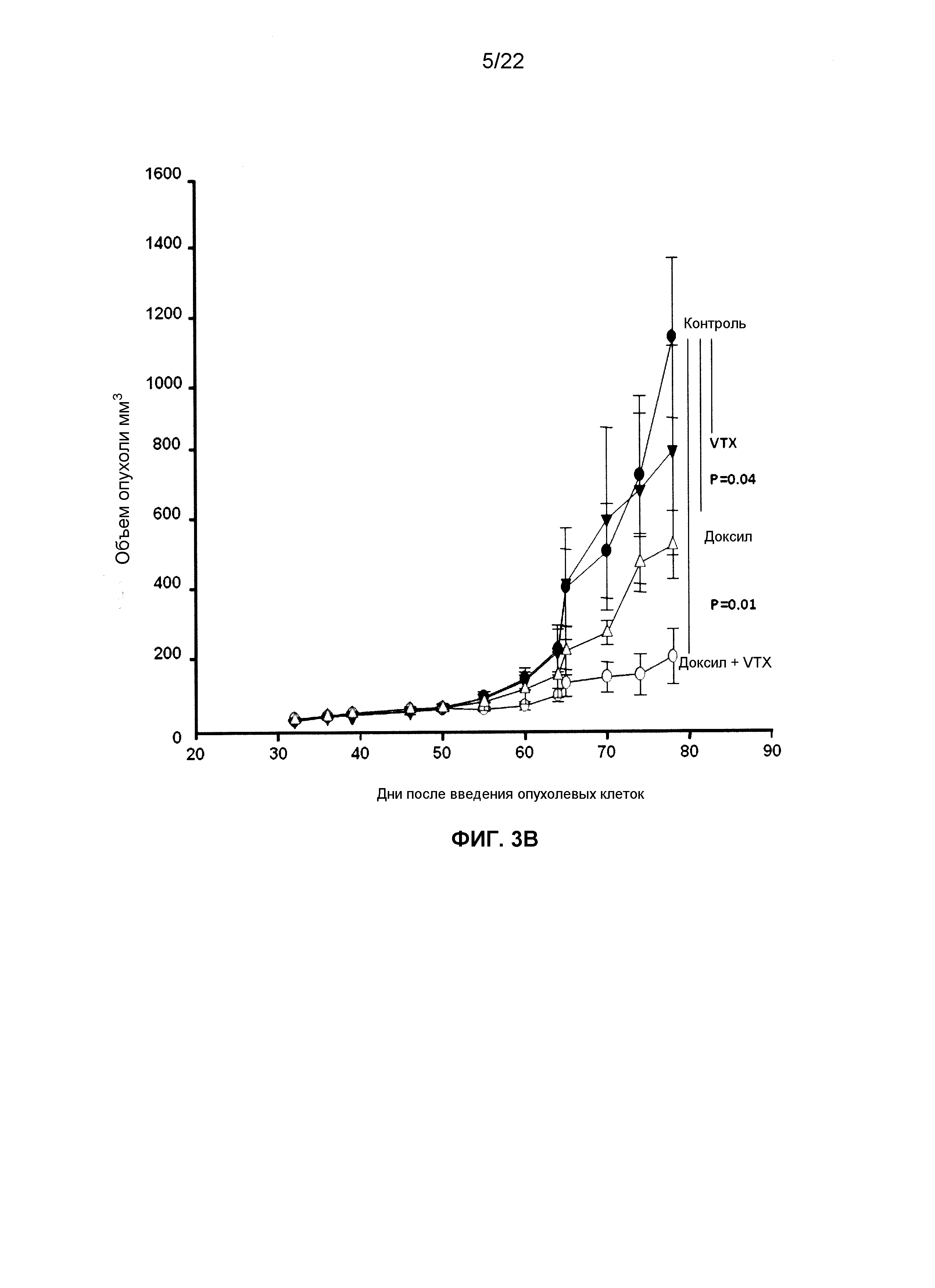
Фиг.3B представляет собой линейный график, демонстрирующий изменение размеров опухолей NSG-HIS у мышей, которым вводили доксил в дозировке 50 мг/м2, VTX-2337 в дозировке 0,5 мг/кг или их комбинацию с течением времени после прививки клеток OVCAR5.
Фиг.3C представляет подборку IHC изображений, демонстрирующих опухоли, в которые проникли клетки CD45+, из мышей, которым вводили Доксил в дозировке 50 мг/м2, VTX-2337 в дозировке 0,5 мг/кг или их комбинацию в модели гуманизированного рака яичников.
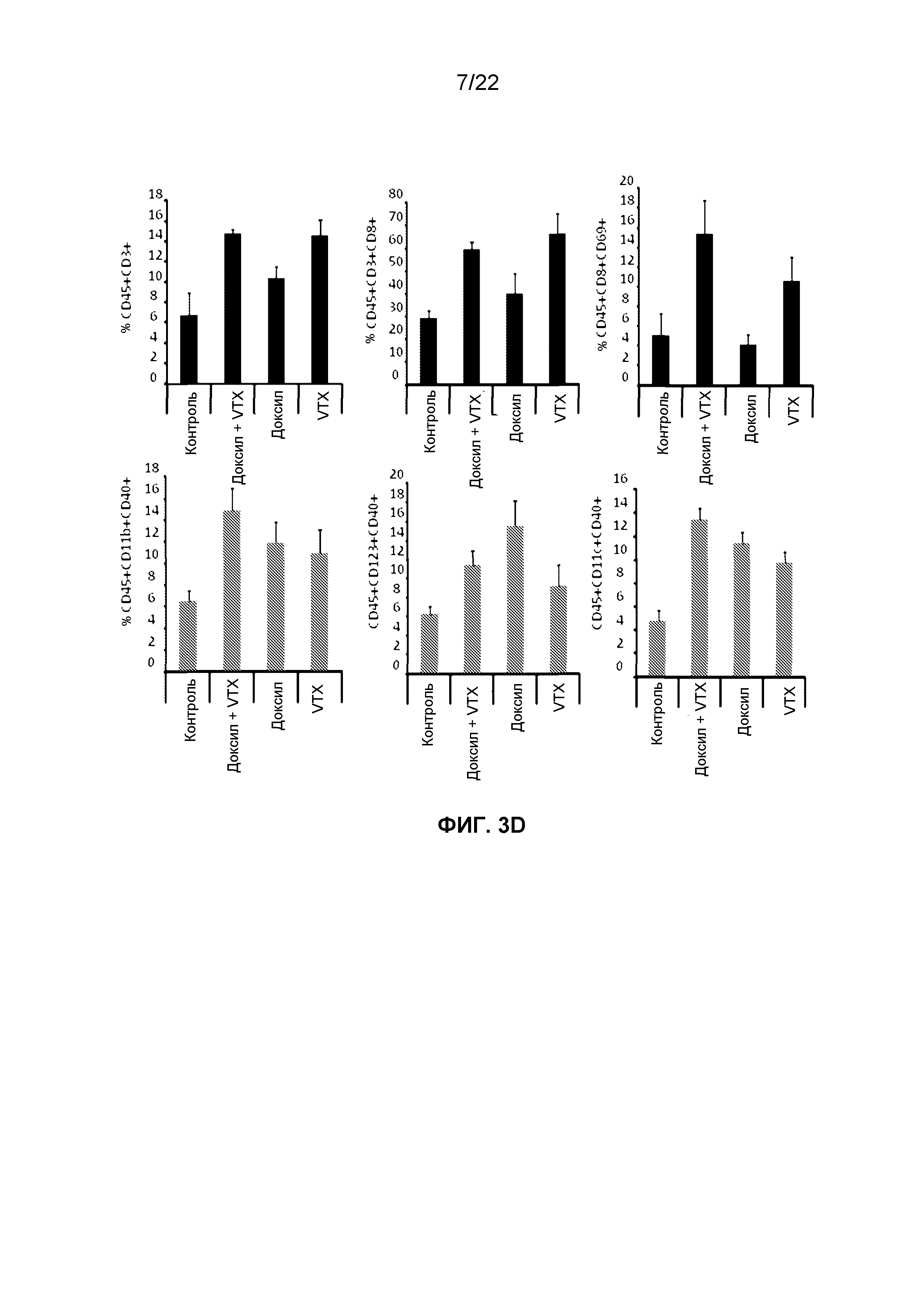
Фиг.3D представляет собой группу гистограмм, демонстрирующих изменение уровней проникающих в опухоль CD3+, CD8+, CD69+ активированных CD3+ CD8+ T клеток и CD40+ активированных макрофагов (CD45+ CD11b+), pDC (CD45+ CD123+) и mDC (CD45+ CD11c+) у мышей, которым вводили Доксил в дозировке 50 мг/м2, VTX-2337 в дозировке 0,5 мг/кг или их комбинаций в модели гуманизированного рака яичников.
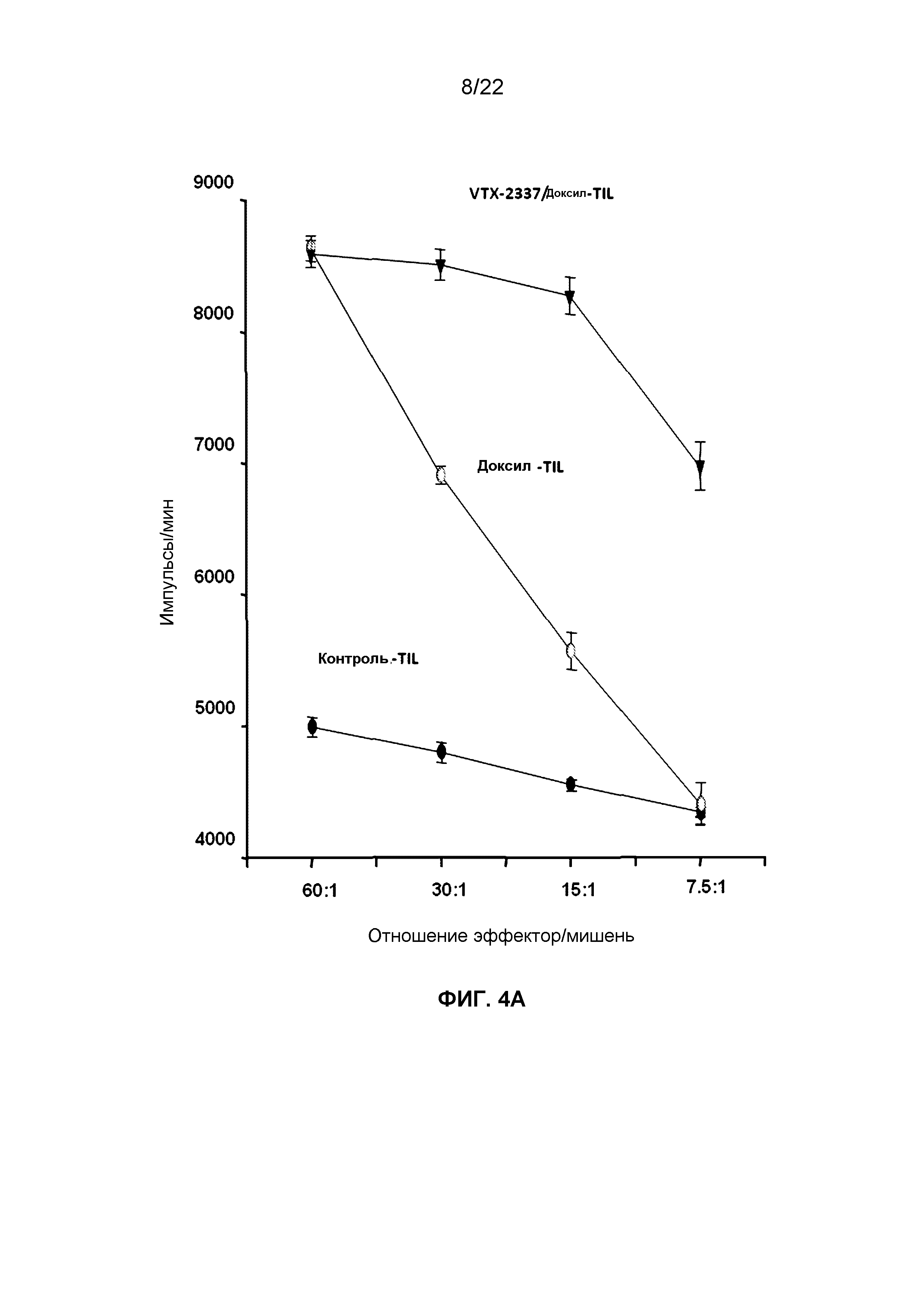
Фиг.4A представляет собой линейный график, демонстрирующий изменения в числе импульсов в минуту (cpm) литических клеток OVCAR5, меченных51Cr, подвергнутых лизису при действии TIL, извлеченных из мышей, которым вводили доксил или комбинацию VTX-2337 и доксила, в ответ на изменение отношения эффектора TIL к мишеням - клеткам OVCAR5.
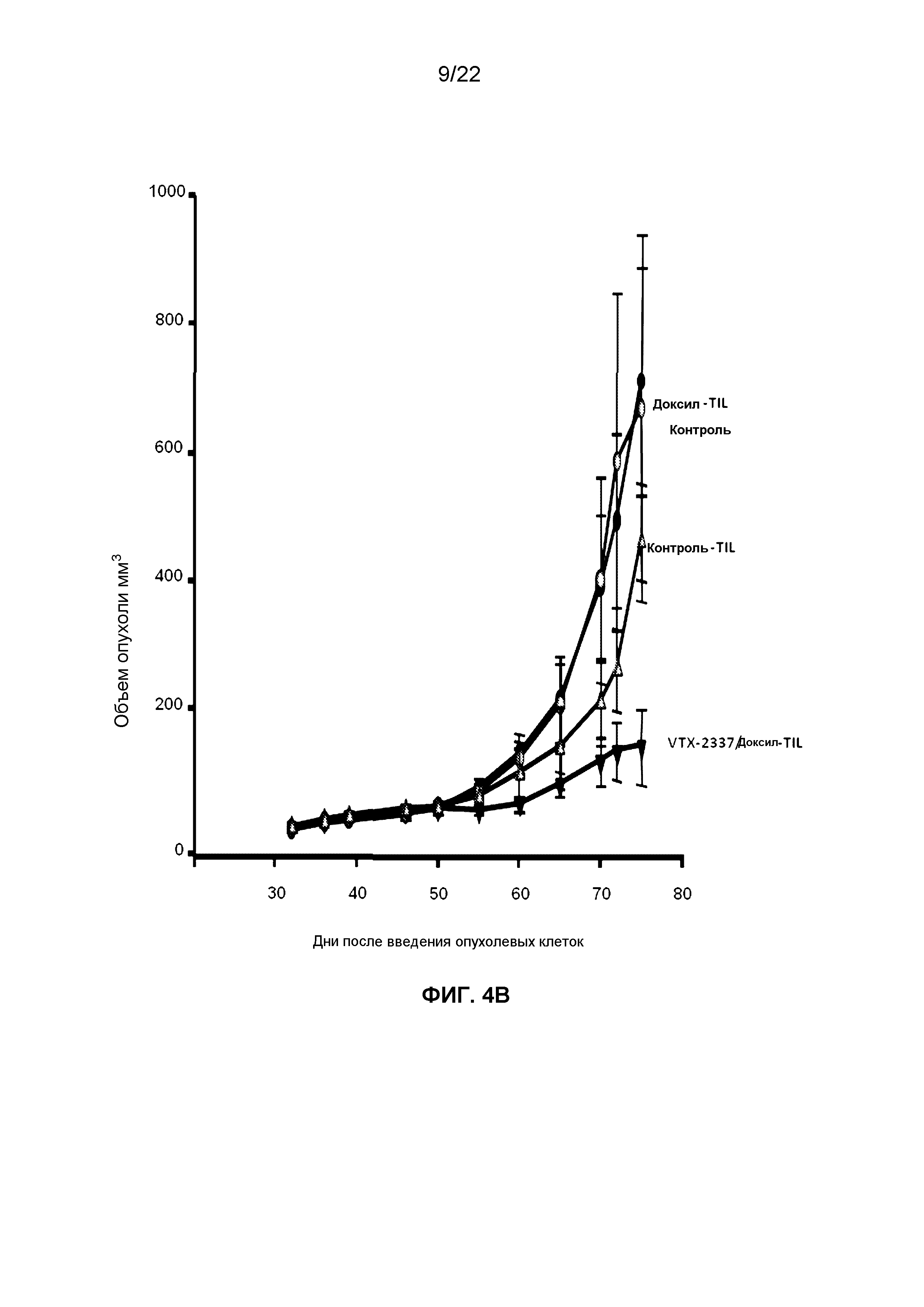
Фиг.4B представляет собой линейный график, демонстрирующий изменения размера опухоли с течением времени у мышей NSG-HIS, которым прививали клетки OVCAR 5 и вводили адоптивно перенесенные TILS из мышей в эксперименте, описанном на фиг.3.
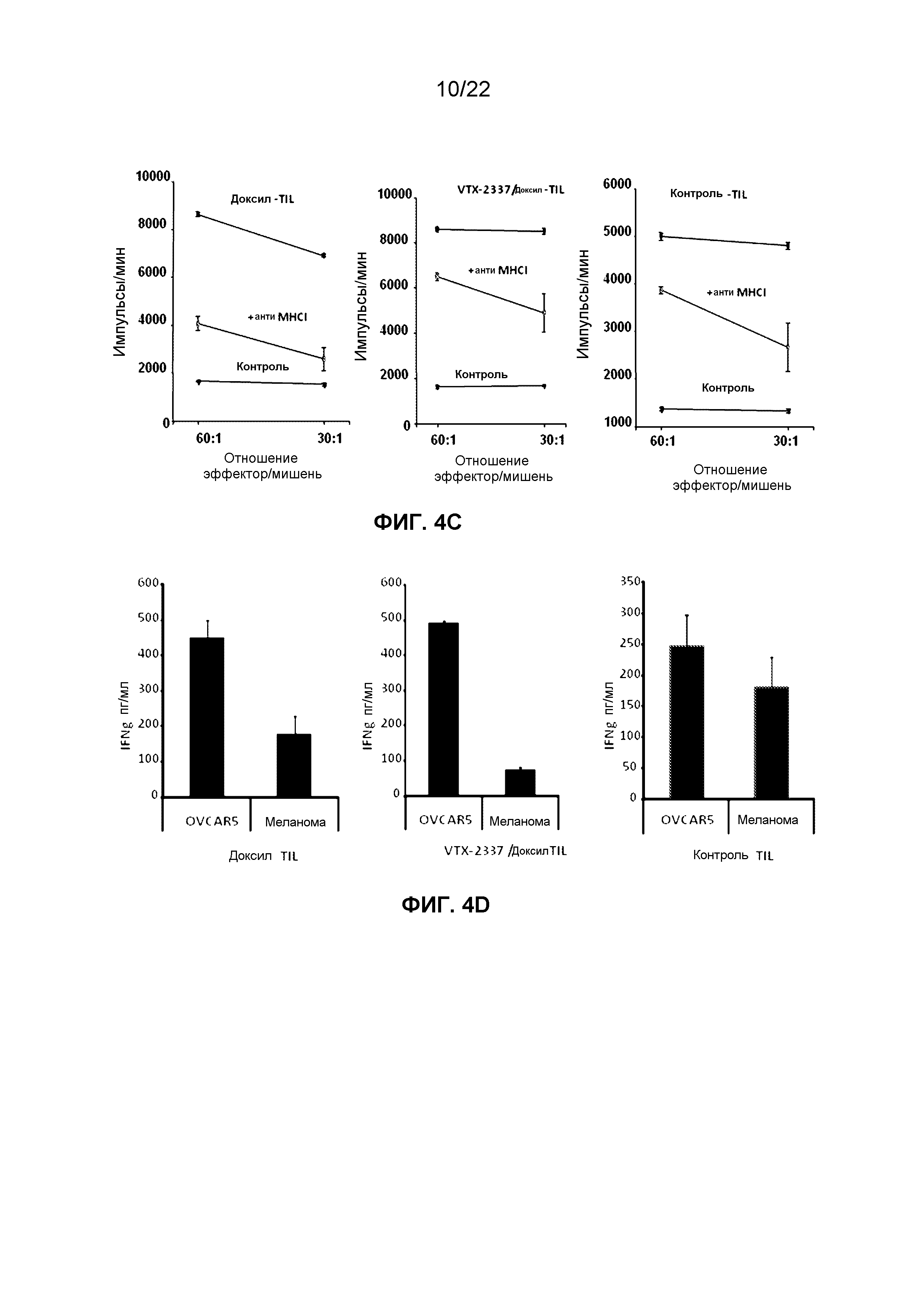
Фиг.4C представляет собой группу графиков, демонстрирующих изменения в числе импульсов литических клеток OVCAR5, меченных51Cr, подвергнутых лизису при действии TIL, извлеченных из мышей, которым вводили доксил или комбинацию VTX-2337 и доксила, в отсутствие или присутствии антиМНС класса I (MHCI) нейтрализующего антитела.
Фиг.4D представляет собой группу гистограмм, демонстрирующих изменение уровней IFNg, высвободившегося под действием TIL, инкубированных с клетками OVCAR5 или клетками меланомы.
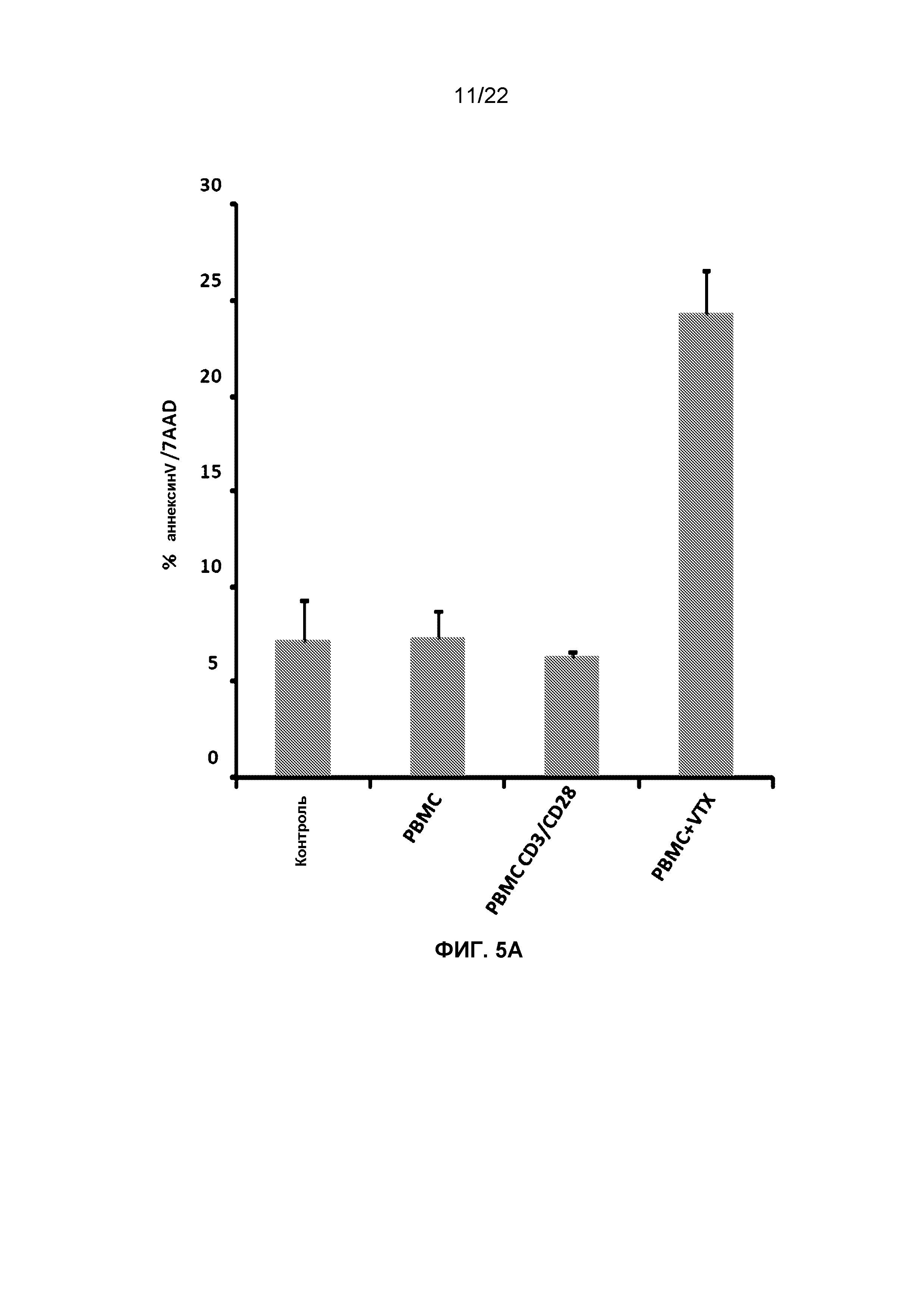
Фиг.5A представляет собой гистограмму, демонстрирующую изменение процентного содержания апоптотических клеток, окрашенных аннексином-V и 7AAD из числа клеток OVCAR5, обработанных кондиционированной средой из человеческих PBMCs, которые инкубировали с чистым буфером, гранулами CD3/CD28 или 1 мкг/мл VTX-2337.
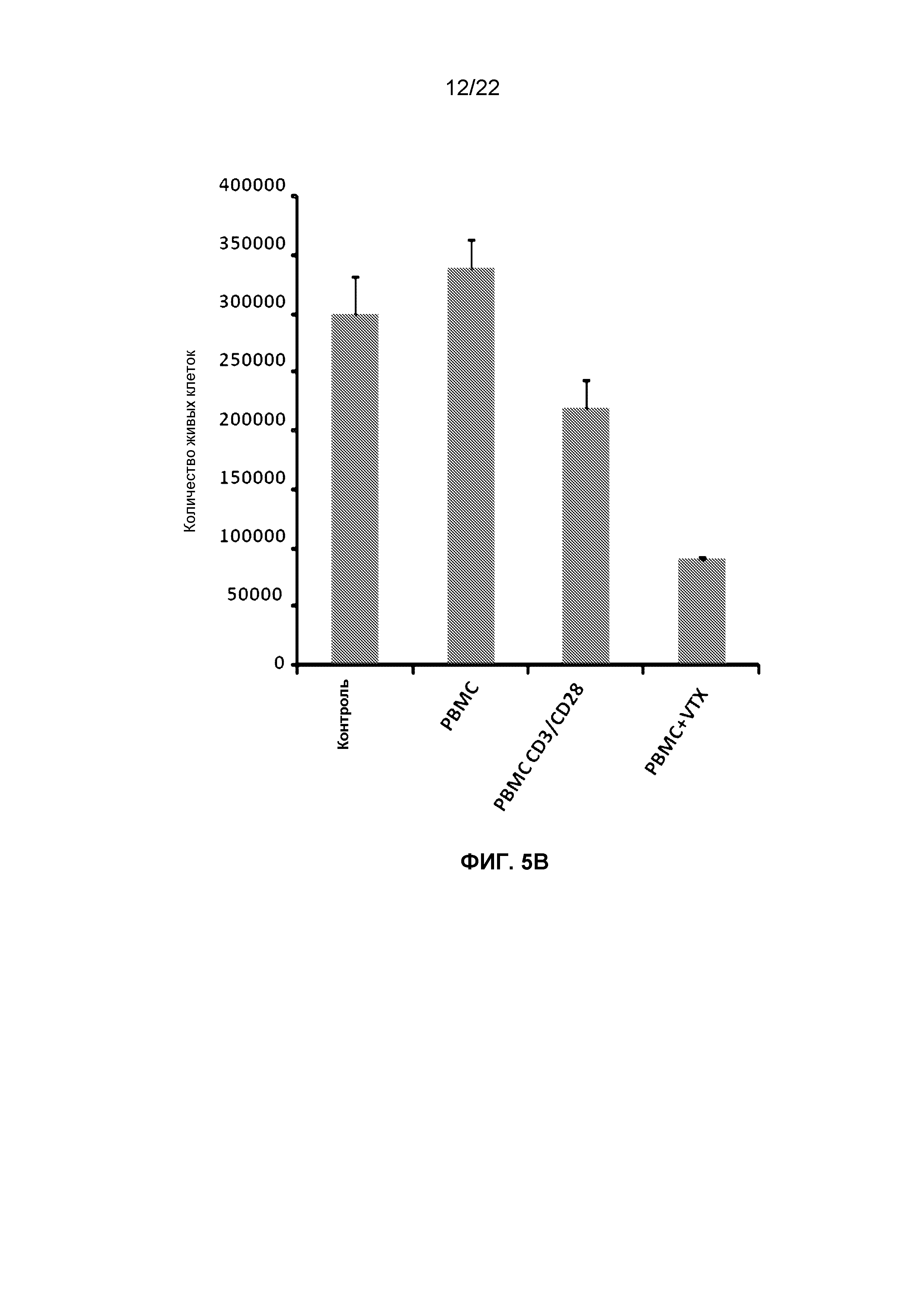
Фиг.5B представляет собой гистограмму, демонстрирующую изменение количества живых клеток среди клеток OVCAR5, обработанных кондиционированной средой из человеческих PBMCs, которые инкубировали с чистым буфером, гранулами CD3/CD28 или 1 мкг/мл VTX-2337.
Фиг.5С представляет собой изображение, демонстрирующее пленку вестерн-блоттинга, показывающую экспрессию рецептора TNF-альфа 1 на клетках OVCAR5.
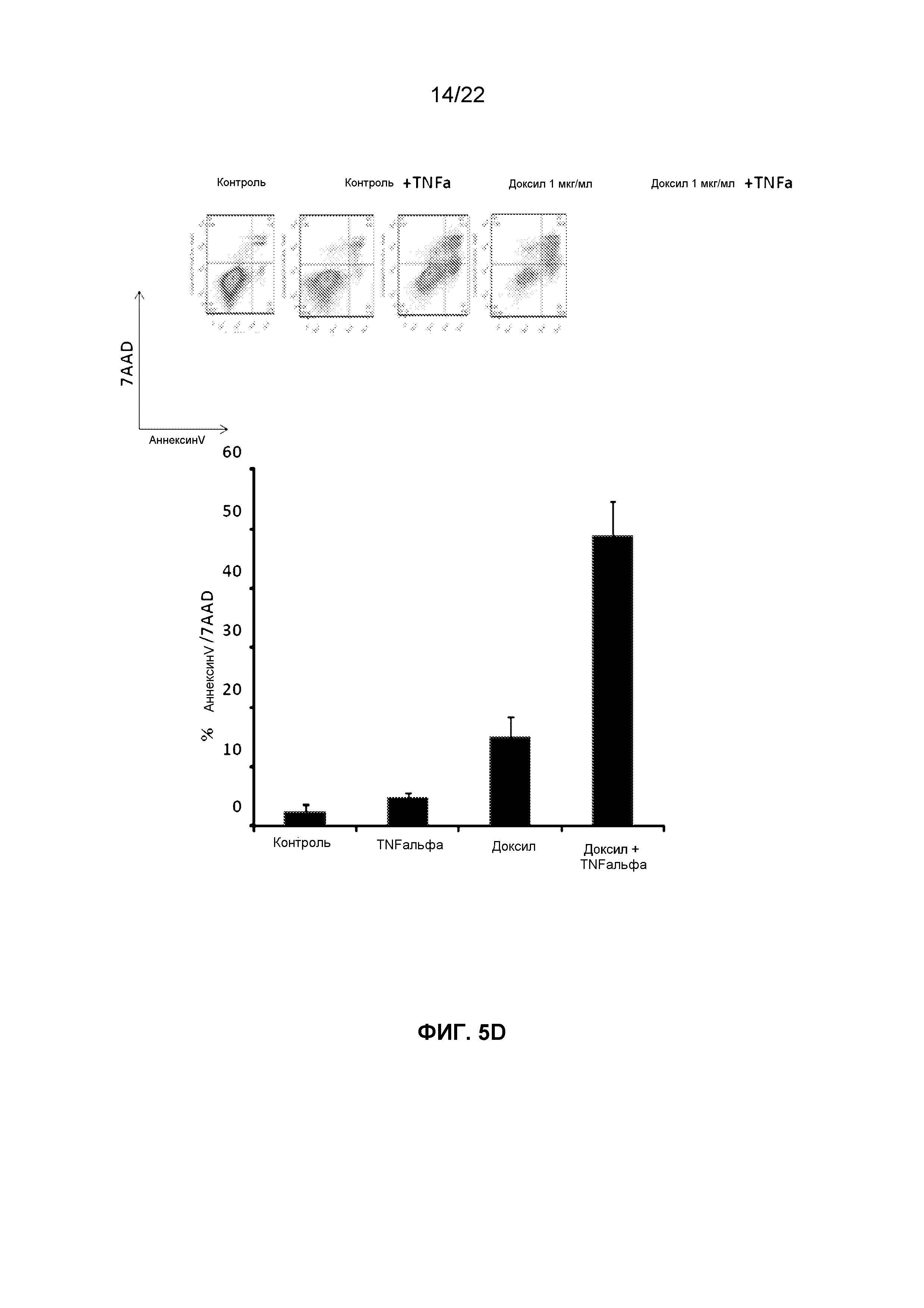
Фиг.5D представляет собой группу графиков, демонстрирующих FACS изображения клеток OVCAR5, обработанных TNFальфа (10 нг/мл) или Доксилом (1 мкг/мл) или их комбинацией, и итоговые изменения в процентном содержании апоптотических клеток, окрашенных аннексином-V и 7AAD.
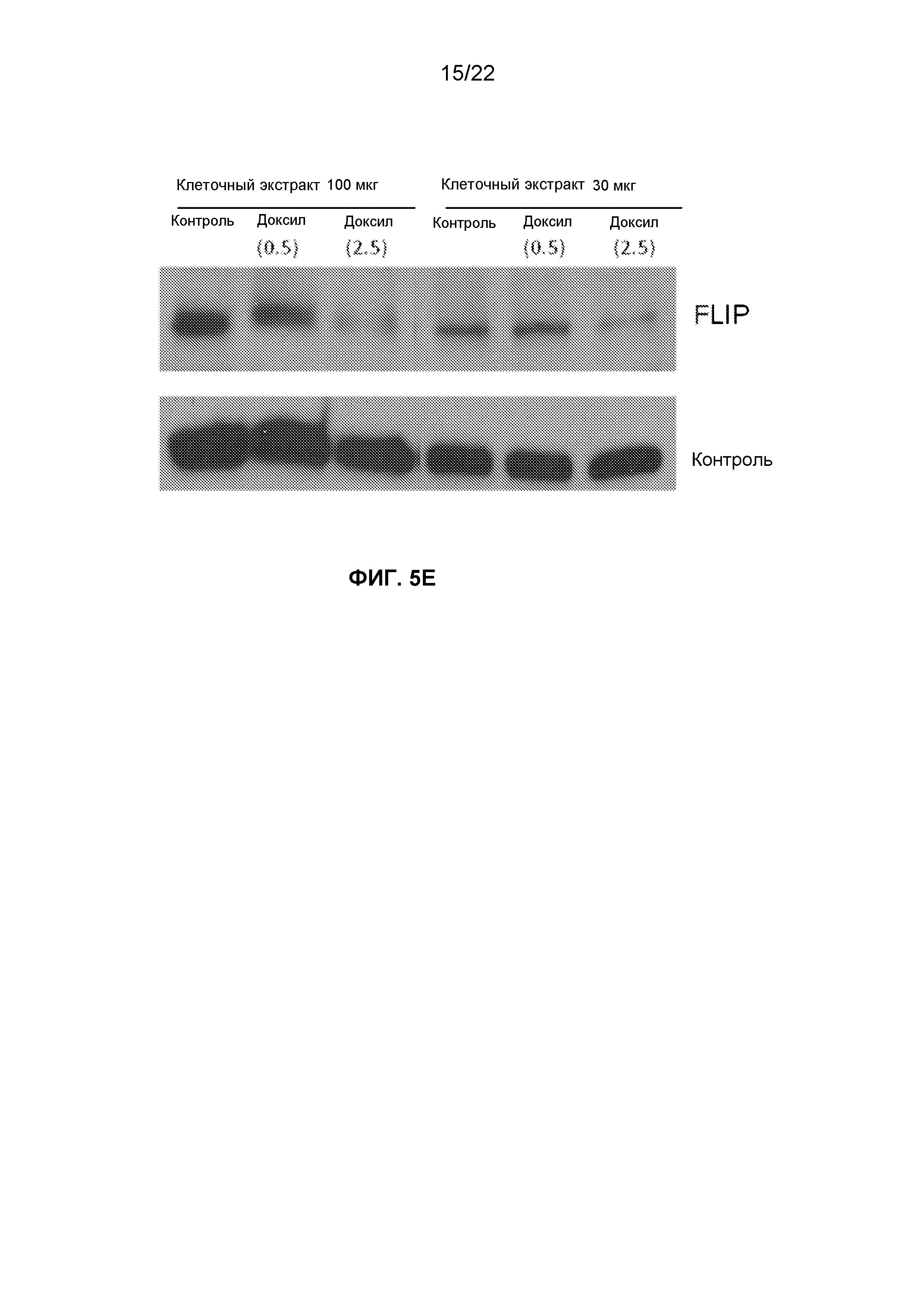
Фиг.5E представляет собой изображение пленки вестерн-блоттинга экспрессии FLIPL на клетках OVCAR5, обработанных 0,5 или 2,5 мкг/мл Доксила.
Фиг.5F представляет собой группу графиков, демонстрирующих FACS изображения клеток OVCAR5, которые предварительно культивировали с 10 мкг/мл циклогексимида (cyclx) в течение 24 ч и затем обрабатывали 10 или 50 нг/мл TNFальфа, и итоговые изменения в процентном содержании апоптотических клеток, окрашенных аннексином-V и 7AAD.
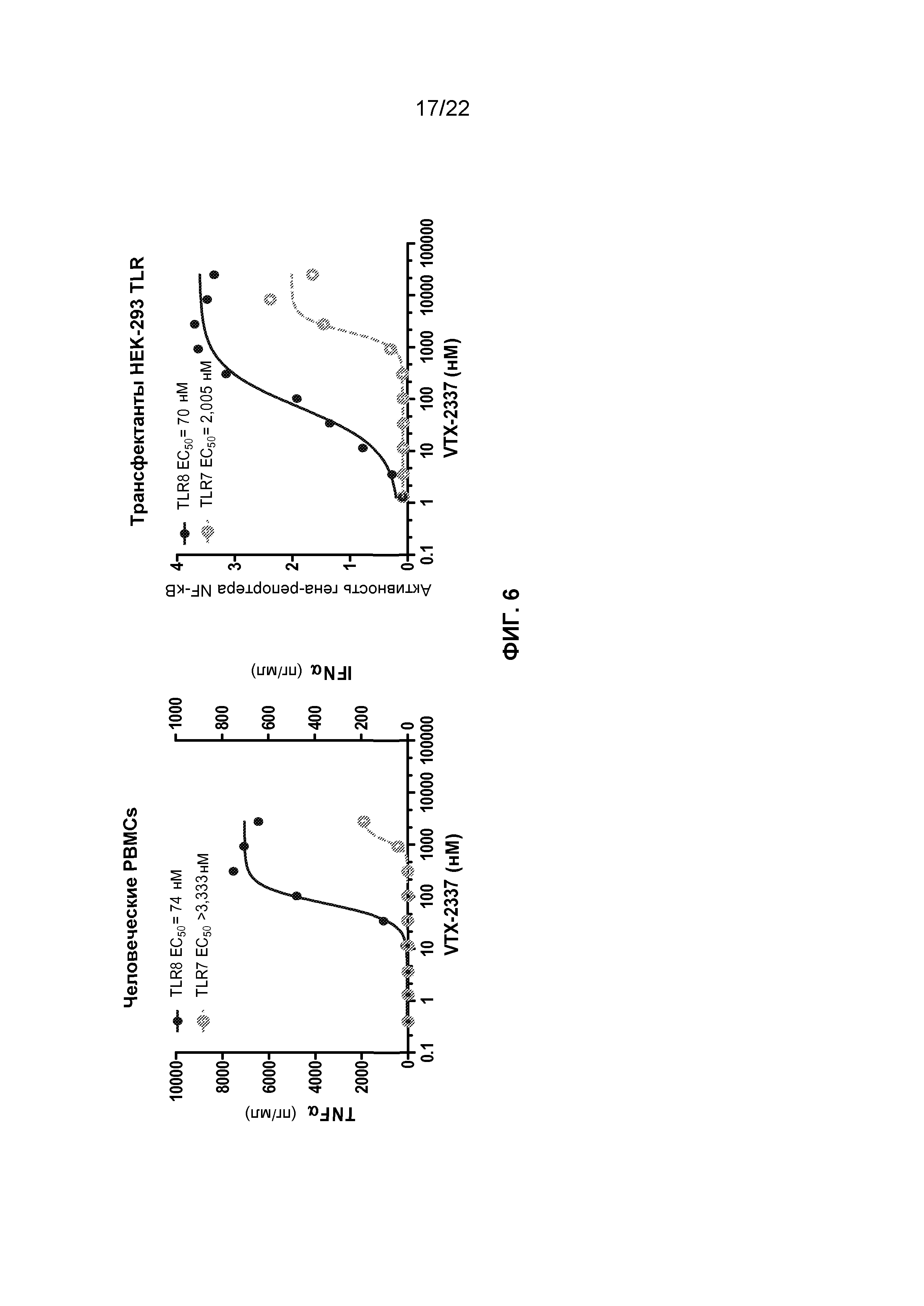
Фиг.6 представляет собой группу графиков, демонстрирующих эффективность и селективность VTX-2337 в мононуклеарных клетках периферической крови (PBMCs) 15 здоровых доноров и также в клетках HEK293, трансфецированных TLR8 или TLR7 и NF-κB регулируемым геном-репортером.
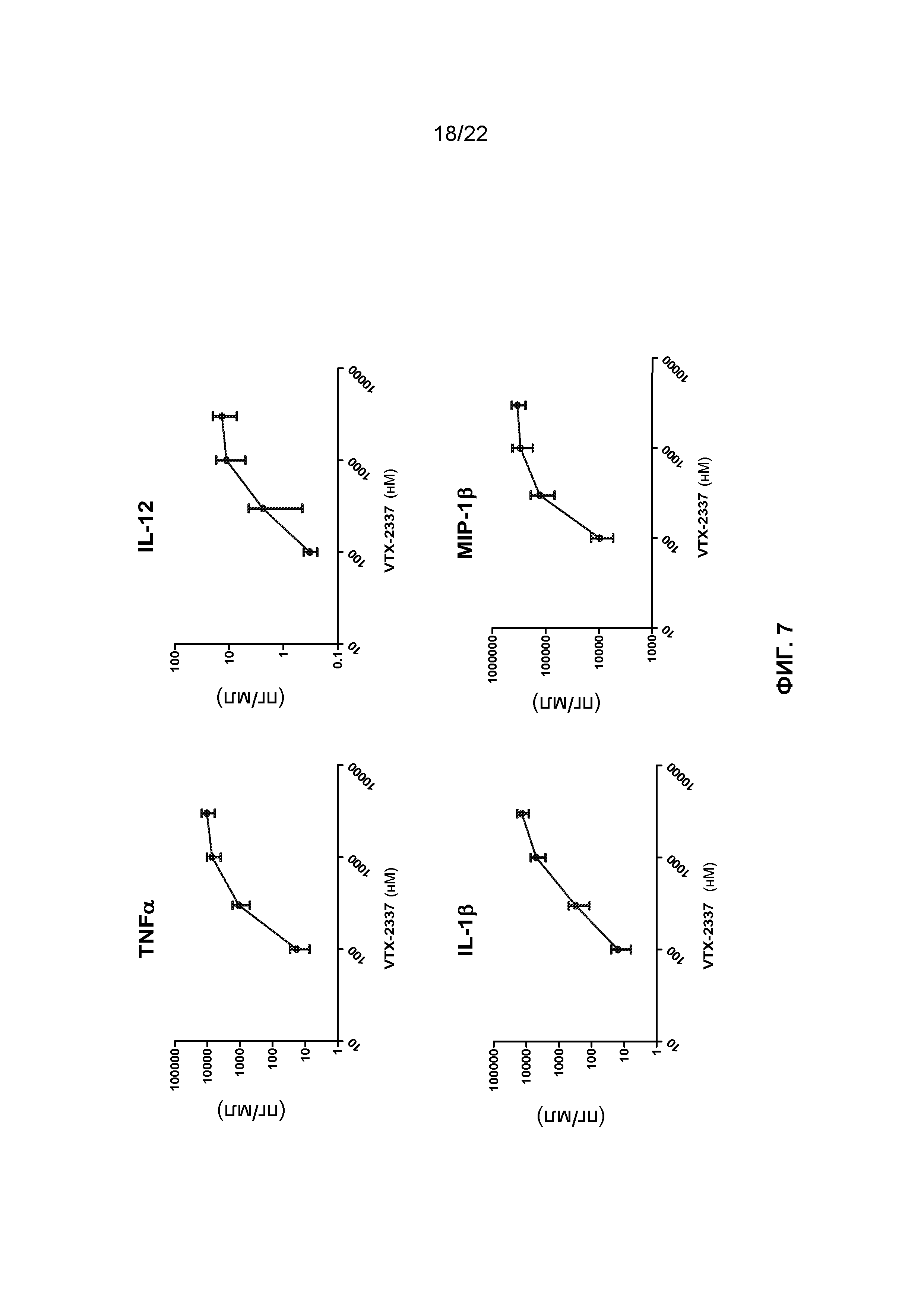
Фиг.7 представляет собой группу графиков, демонстрирующих, что VTX-2337 стимулирует определенный набор цитокинов и хемокинов в цельной крови человека.
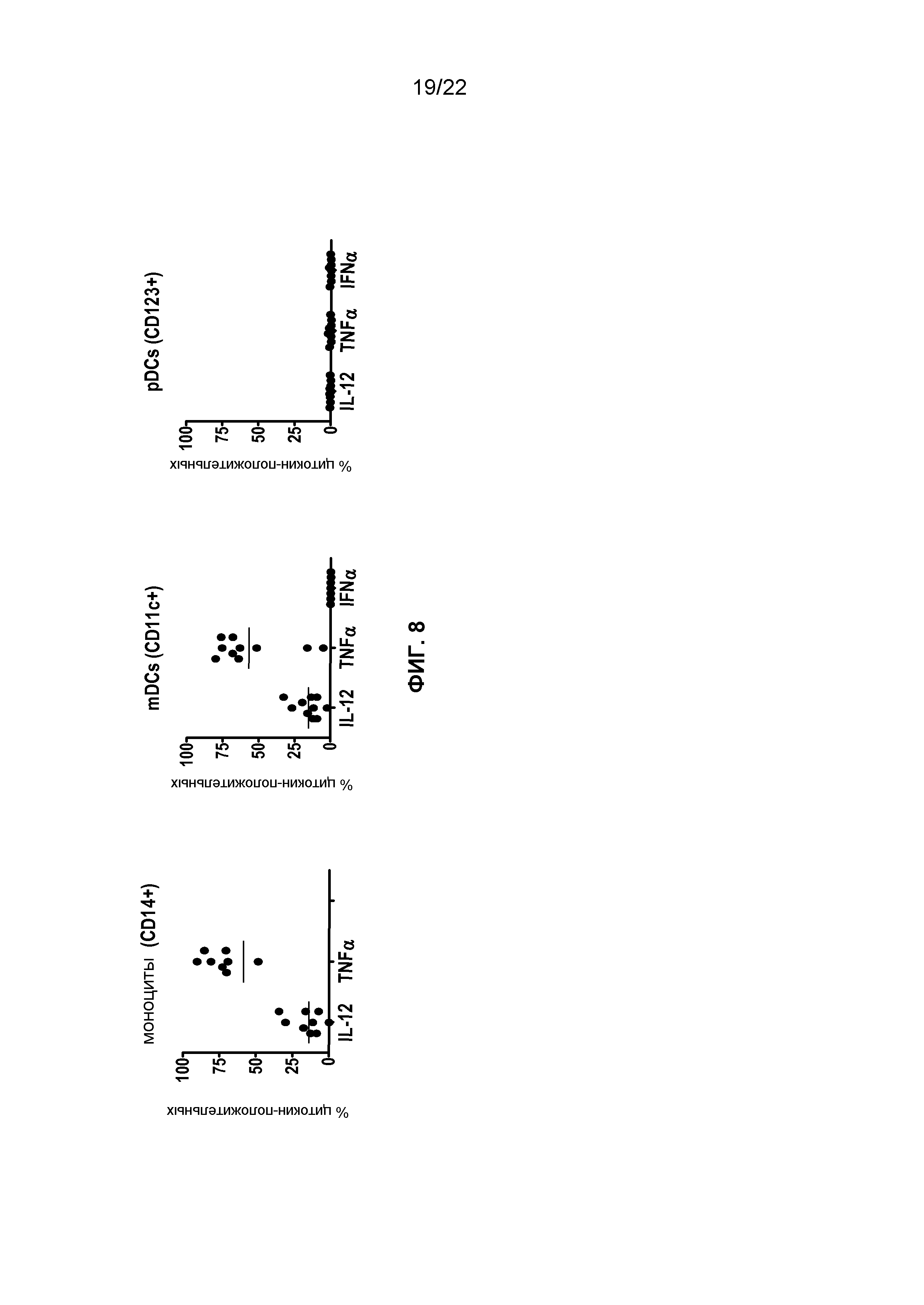
Фиг.8 представляет собой группу графиков, демонстрирующих, что VTX-2337 активирует моноциты и миелоидные дендритные клетки (mDCs), но не плазмацитоидные дендритные клетки (pDCs).
Фиг.9 представляет собой график, демонстрирующий фармакокинетику VTX-2337 после подкожного введения. Цифровые метки “1-8” на графике относятся к группам 1-8 соответственно.
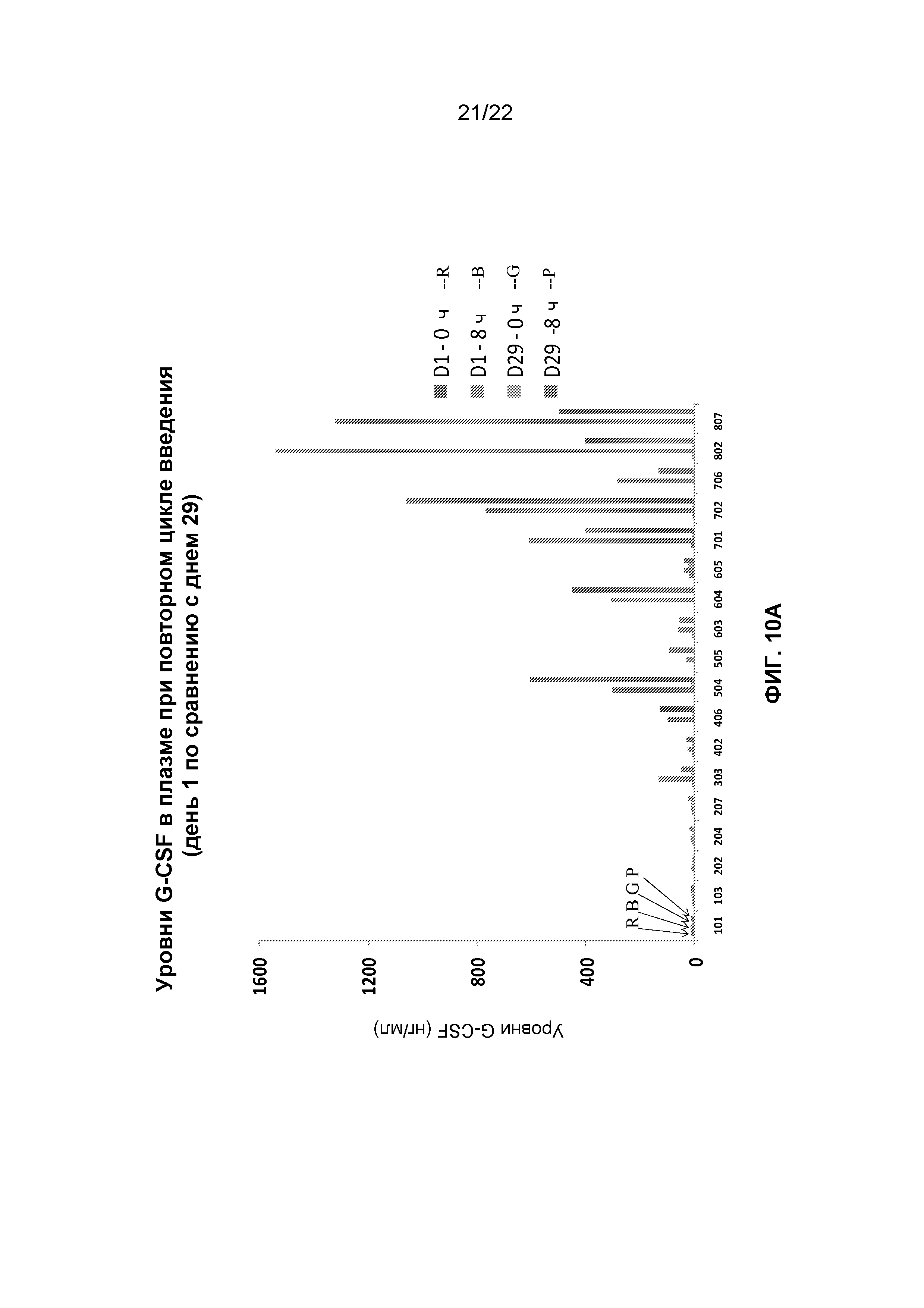
Фиг.10A и 10B представляют собой графики, демонстрирующие устойчивую фармакодинамическую реакцию в течение неоднократных циклов введения.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
В приведенном ниже по тексту сопроводительном описании подробно изложены некоторые варианты осуществления настоящего изобретения. Хотя при практическом воплощении или тестировании настоящего изобретения могут применяться любые способы и материалы, аналогичные или эквивалентные описанным, в настоящей заявке приведены предпочтительные методики и материалы. Другие отличительные признаки, цели и преимущества настоящего изобретения будут ясны из приведенного описания. В данной заявке формы единственного числа включают также формы множественного числа, если контекст явно не указывает на противоположное. Если отсутствуют иные определения, все технические и научные термины, использованные в тексте, имеют те же значения, которые понимает под ними рядовой специалист в той области техники, к которой относится изобретение. В случае конфликта определений, приоритет имеет настоящее описание.
Настоящее изобретение относится к композициям и способам, в которых бензо[b]азепиновый агонист TLR8 (например, VTX-2337) и другое средство лечения (такое, как противораковый агент, например, доксорубицин) применяются для лечения, облегчения или профилактики раковых заболеваний или других расстройств, раскрытых в настоящей заявке. VTX-2337 представляет собой новый, мощный и селективный низкомолекулярный агонист TLR8. Составы VTX-2337 описаны в международной публикации PCT WO 10/014913. Составы по настоящему изобретению подходят для применения в способах лечения рака у людей, которые описаны в настоящей заявке.
Если не указано иное, следует понимать, что терминология, использованная в настоящей заявке, предназначена только для описания конкретных вариантов осуществления и не носит ограничивающего характера. Что касается данного описания и следующей за ним формулы изобретения, необходимо упомянуть ряд терминов, которые имеют приведенные ниже определения.
«Субъект» в контексте настоящего изобретения предпочтительно является млекопитающим. Млекопитающее может быть человеком, приматом, кроме человека, мышью, крысой, собакой, лошадью или коровой, но не ограничивается этими примерами. Субъект может быть мужского или женского пола. Субъект может быть субъектом, у которого ранее диагностировали или выявили наличие ракового заболевания и который необязательно уже подвергался или подвергается в настоящее время терапевтическому вмешательству с целью лечения рака, например, которому вводили Доксил или осуществляли лучевую терапию. В качестве альтернативы, субъект может являться таким субъектом, у которого ранее не диагностировали наличие ракового заболевания, но у которого имеется опасность развития такого заболевания. Например, субъект может являться таким субъектом, у которого проявляются один или несколько симптомов, характерных для рака.
Термины «заболевание», «расстройство» и «состояние» в настоящей заявке являются взаимозаменяемыми и относятся к любому нарушению нормальной деятельности организма или к появлению любого типа патологии. Этиологический агент, вызывающий это нарушение нормальной физиологии, может быть или не быть известен. Кроме того, хотя у двух пациентов может быть диагностировано одно и то же расстройство, конкретные симптомы, проявляющиеся у этих индивидуумов, могут быть или не быть идентичными.
Термин «лечение» в настоящем описании относится к уменьшению тяжести и/или частоты повторения симптомов, устранению симптомов и/или лежащей в их основе причины, предупреждению появления симптомов и/или лежащей в их основе причины, ослаблению или устранению угрозы. Например, лечение пациента путем введения противоракового агента по настоящему изобретению охватывает проведение химической профилактики у пациента, восприимчивого к развитию рака (например, имеющего повышенный риск развития рака в результате химической предрасположенности, факторов окружающей среды и т.п.), и/или людей, выживших после лечения рака, у которых имеется опасность рецидива, а также лечение ракового пациента, как за счет подавления, так и за счет обращения развития расстройства или заболевания.
Термины «облегчение» или «ослабление» в настоящем описании относятся к облегчению, как минимум, одного симптома заболевания, расстройства или состояния.
Термины «предупреждение» и «профилактика» в настоящем описании включают либо предотвращение, либо замедление наступления клинически очевидного развития заболевания, а также предотвращение или замедление наступления доклинически очевидной стадии заболевания у индивидуума, находящегося в зоне риска. Эти термины включают профилактическое лечение индивидуумов, у которых существует опасность развития заболевания.
При упоминании соединения по настоящему изобретению, заявители имеют в виду, что термин «соединение» охватывает не только указанную молекулу, но также ее фармацевтически приемлемые фармакологически активные аналоги, включая, но не ограничиваясь этим, соли, сложные эфиры, амиды, пролекарства, конъюгаты, активные метаболиты и другие подобные производные, аналоги и родственные соединения.
Под терминами «эффективное количество» и «терапевтически эффективное количество» соединения по настоящему изобретению подразумевается нетоксичное, но достаточное для обеспечения желаемого эффекта количество лекарственного средства или агента.
Под «фармацевтически приемлемым» подразумевается материал, который не является нежелательным ни с биологической, ни с какой-либо другой точки зрения, т.е. этот материал можно включить в фармацевтическую композицию, вводимую пациенту, не вызывая при этом какого-либо нежелательного биологического эффекта, или неблагоприятного взаимодействия с каким-либо другим компонентом композиции в которой содержится этот фармацевтически приемлемый материал. Если термин «фармацевтически приемлемый» используется в отношении фармацевтического носителя или эксципиента, подразумевается, что этот носитель или эксципиент соответствует требуемым стандартам токсикологических и производственных испытаний, или что он включен в Inactive Ingredient Guide (Руководство по неактивным ингредиентам), подготовленное Управлением по пищевым продуктам и лекарственным средствам США. Термин «фармакологически активный» (или просто «активный» или «действующий»), например, «фармакологически активное» производное или аналог, относится к производному или аналогу, имеющему тот же самый тип фармакологической активности, что и исходное соединение и в приблизительно эквивалентной степени.
Под фразой «при необходимости», например, «при необходимости введения» или «если имеется такая необходимость» подразумевается, что состав вводят пациенту, когда у него наблюдаются симптомы или если ожидается, что они появятся, или в любое время, когда пациент и/или лечащий врач думает, что следует лечить (терапевтически или профилактически) нежелательные симптомы (например, симптомы, возникающие при раке).
Агонисты TLR по настоящему изобретению
1.1 Состав
Составы VTX-2337 включают действующее соединение приведенной ниже структуры. Составы по настоящему изобретению подходят для подкожного введения субъекту, предпочтительно, субъекту из числа людей, но они могут применяться и для введения другими путями.
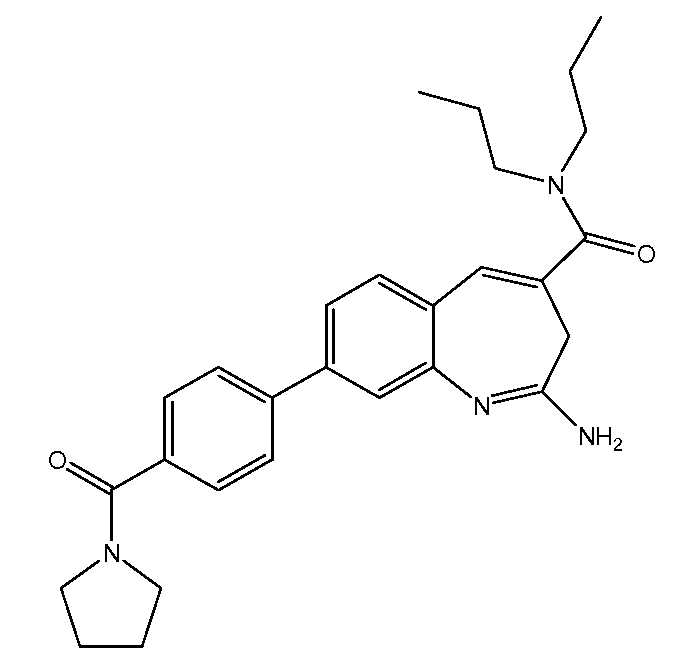
Составы VTX-2337 по настоящему изобретению включают один или несколько фармацевтически приемлемых эксципиентов. Термин «эксципиент» в настоящем описании, если говорить в общем, относится к биологически неактивному соединению, применяемому в комбинации с действующими ингредиентами состава. Эксципиент может применяться, например, в качестве солюбилизирующего агента, стабилизирующего агента, разбавителя, инертного носителя, консерванта, связующего вещества, дезинтегрирующего средства, покрытия, вкусоароматического агента или красителя. Предпочтительно, как минимум, один эксципиент выбран таким образом, чтобы придать составу одно или несколько полезных физических свойств, например, повышенную стабильность и/или растворимость действующего агента (агентов). В составах по настоящему изобретению, как указано в описании, основным действующим агентом является VTX-2337. Однако, VTX-2337 может быть включен в один состав с другими действующими агентами, например, другими агонистами TLR, противораковыми агентами или антивирусными агентами, как описано в настоящей заявке.
«Фармацевтически приемлемый» эксципиент представляет собой такой эксципиент, который был одобрен регулирующим органом штата или федерального государства для применения у млекопитающих и, предпочтительно, для применения людьми, или упомянут в фармакопее США, Европейской Фармакопее или другой общепризнанной фармакопее для применения у животных и, предпочтительно, для применения людьми.
Примеры эксципиентов включают некоторые инертные белки, например, альбумины; гидрофильные полимеры, например, поливинилпирролидон; аминокислоты, например, аспарагиновую кислоту (которая в качестве альтернативы может именоваться аспартатом), глутаминовую кислоту (которая в качестве альтернативы может именоваться глутаматом), лизин, аргинин, глицин и гистидин; жирные кислоты и фосфолипиды, например, алкилсульфонаты и каприлаты; ПАВ, например, натрий додецилсульфат и полисорбат; неионные ПАВ, например, TWEEN®, PLURONICS® или полиэтиленгликоль (ПЭГ); углеводы, например, глюкозу, сахарозу, маннозу, мальтозу, трегалозу, и декстрины, включая циклодекстрины; полиолы, например, маннит и сорбит; хелатообразующие агенты, например, ЭДТА; и противоионы, образующие соли, например, натрий.
Составы VTX-2337 могут содержать циклодекстрин, который увеличивает растворимость в воде агониста TLR. Циклодекстрины представляют собой кристаллические, негигроскопичные циклические олигомеры α-D-глюкопиранозы. В результате затрудненного вращения вокруг связей, соединяющих глюкопиранозные звенья, циклодекстрины имеют не цилиндрическую, а тороидальную форму. Из-за ограниченного вращения они имеют жесткую структуру с центральной полостью, размер которой меняется в соответствии с числом глюкопиранозных звеньев в молекуле. Тремя наиболее распространенными циклодекстринами являются α-циклодекстрин, β-циклодекстрин и γ-циклодекстрин, которые содержат шесть, семь или восемь глюкопиранозных звеньев, соответственно. Благодаря соответствующему расположению гидроксильных групп в молекуле циклодекстрина и форме молекулы, внутренняя поверхность полости является гидрофобной, тогда как внешняя поверхность является гидрофильной. Первичные гидроксильные группы расположены на более узкой (внутренней) стороне тороидальной молекулы, в то время как вторичные гидроксильные группы расположены на более широком (внешнем) краю. Это расположение позволяет размещать во внутренней полости циклодекстринов широкий круг небольших гидрофобных молекул за счет образования комплексов включения.
Циклодекстрины, которые подходят для применения в составах по настоящему изобретению, известны в технике. Например, TRAPPSOLTM и другие циклодекстрины производятся CTD, Inc. (High Springs, FL) и CAPTISOL® (сульфобутиловый эфир β-циклодекстрина) присутствует в имеющихся в продаже препаратах для инъекции, таких как ABILIFY IMTM, GEODON и VFEND IV. Предпочтительно, в составах по настоящему изобретению применяется CAPTISOL®.
Могут применяться другие водорастворимые агенты. Примеры подобных агентов включают полоксамер, повидон K17, повидон K12, твин 80, этанол, кремофор/этанол, полиэтиленгликоль 300, полиэтиленгликоль 400 и пропиленгликоль. В предпочтительных вариантах осуществления, составы по настоящему изобретению содержат менее 10% объем/объем таких агентов. В некоторых вариантах осуществления, применяется солюбилизирующие агенты на масляной основе, такие как липиодол или арахисовое масло.
В некоторых вариантах осуществления, составы VTX-2337 можно получать в жидкой или твердой форме, такой как порошок, таблетки, пилюли или капсулы. Жидкие составы могут иметь такие формы, как суспензии, растворы или эмульсии в масляных или водных носителях, и они могут содержать агенты, способствующие образованию состава данного типа, например, суспендирующие, стабилизирующие и/или диспергирующие агенты. В одном из вариантов осуществления, состав представляет собой водный раствор. В другом варианте осуществления, конечный состав является лиофилизированным. В следующих вариантах осуществления, состав включает коллоидные системы доставки лекарственных средств. Такие системы доставки лекарственных средств включают, например, липосомы, альбуминовые микросферы, микроэмульсии, наночастицы и нанокапсулы.
В одном из вариантов осуществления, VTX-2337 представляет собой жидкий или лиофилизированный состав, подходящий для инъекции млекопитающему, предпочтительно, человеку. В одном из вариантов осуществления, этот состав является стерильным. В другом варианте осуществления, состав является стерильным лиофилизированным составом, который подходит для инъекции после восстановления с помощью определенного количества водного носителя. В одном из вариантов осуществления, жидкий или лиофилизированный состав готовят в виде дозированной лекарственной формы, которая описана ниже. Составы могут содержать или не содержать консервант.
В некоторых вариантах осуществления, состав VTX-2337 дополнительно включает один или несколько адъювантов. Примеры подходящих адъювантов включают иммуностимуляторы, например, полученные из микробов (например, бактериальные продукты, токсины, например, холерный токсин и термолабильный токсин из E.coli, липиды, липопротеины, нуклеиновые кислоты, пептидогликаны, углеводы, пептиды), клетки, цитокины (например, дендритные клетки, IL-12 и GM-CSF), гормоны и малые молекулы. Применяемые в настоящем изобретении адъюванты включают, не ограничиваясь этим, адъюванты на масляной основе (например, адъювант Фрейнда), CpG олигонуклеотиды, адъюванты на основе солей алюминия, адъюванты на основе солей кальция, эмульсии и составы на основе ПАВ (например, MF59, ASO2, монтанид, ISA-51, ISA-720 и QA21).
Согласно некоторым вариантам осуществления, VTX-2337 включают в состав в концентрациях от примерно 0,5 до примерно 50 мг/мл. В некоторых вариантах осуществления, бензо[b]азепиновый агонист TLR включают в состав в концентрациях от примерно 1 мг/мл до примерно 5 мг/мл, от примерно 1 мг/мл до примерно 10 мг/мл, от примерно 1 мг/мл до примерно 20 мг/мл или от примерно 1 мг/мл до примерно 30 мг/мл. В других вариантах осуществления, VTX-2337 включают в состав в концентрациях от примерно 0,5 мг/мл до примерно 1 мг/мл, от примерно 0,5 мг/мл до примерно 2 мг/мл или от примерно 0,5 мг/мл до примерно 5 мг/мл. В некоторых вариантах осуществления, VTX-2337 включают в состав в концентрациях от 0,5 до 10 мг/мл, от 0,5 до 5 мг/мл или от 1 до 5 мг/мл. В других вариантах осуществления, VTX-2337 включают в состав в концентрациях в диапазоне 10-20 мг/мл, 20-30 мг/мл или 30-50 мг/мл. В некоторых вариантах осуществления, VTX-2337 включают в состав в концентрациях примерно 1 мг/мл, примерно 2 мг/мл, примерно 4 мг/мл, примерно 5 мг/мл, примерно 6 мг/мл, примерно 8 мг/мл, примерно 10 мг/мл, примерно 15 мг/мл, примерно 20 мг/мл, примерно 25 мг/мл, примерно 30 мг/мл или примерно 40 мг/мл.
Составы VTX-2337 необязательно можно получать в виде дозированных форм. Термин «дозированная форма» относится к физически дискретным единицам, подходящим для намеченного применения, т.е. для разового введения субъекту, подвергаемому лечению. Каждая единица содержит заранее установленное количество действующего агента (агентов), в комбинации с подходящим фармацевтически приемлемым эксципиентом (эксципиентами). Например, дозированная форма может содержать в одном флаконе определенный объем препарата, например, 1 мл, 2 мл, 3 мл, 4 мл, 5 мл, 6 мл, 7 мл, 8 мл, 9 мл, 10 мл, 15 мл или 20 мл, имеющего определенную концентрацию действующего агента. Дозированная форма может включать единственный действующий агент, т.е. VTX-2337, как описано в настоящем изобретении, его производные и аналоги, или их смеси с другими действующими агентами (например, противораковыми агентами, такими как доксорубицин) для применения в комбинированной терапии. В предпочтительных вариантах осуществления, дозированная лекарственная форма включает от 15 мг/мл до примерно 40 мг/мл VTX-2337. Составы необязательно содержатся в контейнерах для единичной дозы или нескольких доз, например, в запаянных ампулах или плотно закрытых флаконах, и могут находиться в лиофилизированном состоянии. Растворы и суспензии для инъекций, предназначенные для употребления сразу после разведения, могут приготавливаться из стерильных порошков, гранул и таблеток, согласно способам, известным в технике. Примеры дозированных форм включают, не ограничиваясь этим, таблетки; каплеты; капсулы, например, мягкие эластичные желатиновые капсулы; крахмальные капсулы; пастилки; леденцы; дисперсии; суппозитории; мази; припарки (горячие компрессы); пасты; порошки; повязки; кремы; пластыри; растворы; наклейки; аэрозоли (например, назальные спреи или ингаляторы); гели; жидкие дозированные формы, подходящие для перорального или мукозального введения пациенту, включая суспензии (например, водные или неводные жидкие суспензии, эмульсии масло в воде или жидкие эмульсии вода в масле), растворы и эликсиры; жидкие дозированные формы, подходящие для подкожного введения субъекту; и стерильные твердые препараты (например, кристаллические или аморфные твердые препараты), которые могут быть восстановлены с получением жидких дозированных форм, подходящих для подкожного введения субъекту.
Дополнительную информацию относительно способов получения композиций и составов, а также ингредиентов, входящих в эти композиции и составы согласно настоящему изобретению, можно найти в стандартных справочниках по данной области, как, например, в “Remington's Pharmaceutical Sciences”, Mack Publishing Co., Easton, PA.
1.2 Способы применения
Комбинация VTX-2337 и одного или нескольких дополнительных средств лечения (например, противораковых агентов, таких как доксорубицин) применима в способах лечения рака. Предпочтительно, составы VTX-2337 применяются в комбинациях с одним или несколькими дополнительными средствами лечения в схемах лечения рака. В некоторых вариантах осуществления, рак представляет собой солидную опухоль. В одном из вариантов осуществления, раковое заболевание выбрано из группы, состоящей из рака яичников, рака груди, рака головы и шейного отдела, рака почек, рака мочевого пузыря, гепатоклеточного рака, колоректального рака, меланомы и лимфомы или любой их комбинации. В конкретном варианте осуществления, раковое заболевание представляет собой лимфому. В одном из вариантов осуществления, эта лимфома является неходжкинской лимфомой.
Способы тестирования эффективности агониста TLR8 для лечения рака, или комбинации противоракового агента и агониста TLR8 для лечения рака, включают, не ограничиваясь этим, исследования in vitro, например, анализы, в которых используются человеческие PBMC, клетки HEK, или IHC (иммуногистохимия) и FACS (сортировка флуоресцентно-активированных клеток) для проникающих в опухоль клеток, а также лизис опухолевых клеток, и исследования in vivo, например, такие, в которых используются мыши NSG-HIS или гуманизированные мыши (NSG-HIS), которым введены линии клеток яичников, или пациенты из числа людей.
1.2.1 Комбинированная терапия
Комбинированная терапия, помимо введения VTX-2337, дополнительно охватывает применение одного или нескольких средств, которые содействуют профилактике или лечению рака. Такие средства включают, не ограничиваясь этим, химиотерапевтические агенты, иммунотерапевтические средства, анти-ангиогенные агенты, цитокины, гормоны, антитела, полинуклеотиды, радиационные и фотодинамические способы лечения. В конкретных вариантах осуществления, комбинированная терапия может применяться для профилактики рецидива рака, подавления образования метастазов или подавления роста и/или распространения раковой опухоли или метастаза. В настоящем описании фраза «в комбинации с» означает, что состав VTX-2337 по настоящему изобретению вводят в качестве составной части схемы лечения, которая включает одно или несколько дополнительных средств лечения, как более подробно описано в следующих разделах.
В некоторых вариантах осуществления, VTX-2337 вводят до, одновременно или после применения одного или нескольких других средств лечения. В некоторых вариантах осуществления, VTX-2337 вводят до или после (например, через 5 дней) введения противоракового агента (например, доксорубицина). В одном из вариантов осуществления, VTX-2337 входит в один состав с одним или несколькими другими средствами лечения. В другом варианте осуществления, одно или несколько других средств лечения вводят в составе отдельной фармацевтической композиции. Согласно этому варианту осуществления, одно или несколько других средств лечения можно вводить субъекту тем же путем, которым вводят VTX-2337, или другим путем.
1.2.1.1 Комбинация с доксорубицином
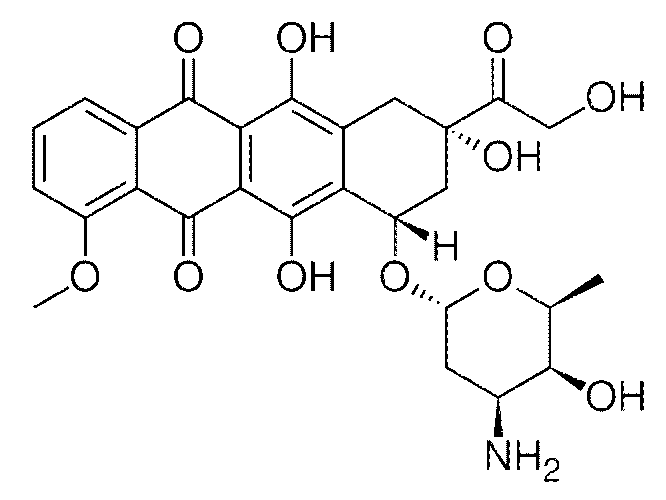
В некоторых вариантах осуществления, состав, включающий VTX-2337, вводят в комбинации с доксорубицином. Предпочтительно, доксорубицин находится в ПЭГилированной липосомальной форме. Ниже показана химическая структура доксорубицина:
1.2.1.2 Комбинация с другими противораковыми агентами
В некоторых вариантах осуществления, состав, включающий VTX-2337 по настоящему изобретению, вводят в комбинации с одним или несколькими противораковыми агентами, предпочтительно, химиотерапевтическими агентами. Эти химиотерапевтические агенты включают, не ограничиваясь перечисленными, следующие группы соединений: цитотоксичные антибиотики, антиметаболиты, антимитотические агенты, алкилирующие агенты, соединения платины, соединения мышьяка, ингибиторы ДНК топоизомеразы, таксаны, аналоги нуклеозидов, растительные алкалоиды и токсины; а также их синтетические производные. Ниже по тексту приведены не ограничивающие примеры конкретных представителей этих групп. Алкилирующие агенты включают азотистые иприты, например, циклофосфамид, ифосфамид, трофосфамид и хлорамбуцил; нитрозомочевины, такие как кармустин (BCNU) и ломустин (CCNU); алкилсульфонаты, например, бусульфан и треосульфан; и триазины, например, дакарбазин. Соединения, содержащие платину, включают цисплатин, карбоплатин, ароплатин и оксалиплатин. Растительные алкалоиды включают алкалоиды барвинка, такие как винкристин, винбластин, виндезин и винорелбин; и таксоиды, такие как паклитаксел и доцетаксол. Ингибиторы ДНК топоизомеразы включают эпиподофиллины, такие как этопозид, тенипозид, топотекан, 9-аминокамптотекин, камптотекин и криснатол; и митомицины, такие как митомицин C. Анти-фолаты включают ингибиторы DHFR, такие как метотрексат и триметрексат; ингибиторы IMP дегидрогеназы, например микофеноловую кислоту, тиазофурин, рибавирин, гидроксимочевину и EICAR; и ингибиторы рибонуклеотид редуктазы, такие как дефероксамин. Аналоги пиримидина, включают аналоги урацила, такие как 5-фторурацил, флоксуридин, доксифлуридин и ратитрексед; и аналоги цитозина, такие как цитарабин (ara C), цитозина арабинозид и флударабин. Аналоги пурина включают меркаптопурин и тиогуанин. Антиметаболиты ДНК включают 3-HP, 2'-дезокси-5-фторуридин, 5-HP, альфа-TGDR, афидиколина глицинат, ara-C, 5-аза-2'-дезоксицитидин, бета-TGDR, циклоцитидин, гуаназол, инозина гликодиальдегид, мацебецин II и пиразолоимидазол. Антимитотические агенты включают аллоколхицин, галихондрин B, колхицин, производное колхицина, долстатин 10, майтанзин, ризоксин, тиоколхицин и тритилцистеин.
Другие примеры химиотерапевтических агентов для применения вместе с составами агонистов бензо[b]азепина TLR по настоящему изобретению включают ингибиторы изопренилирования; дофаминергические нейротоксины, например, ион 1-метил-4-фенилпиридиния; ингибиторы клеточного цикла, например, стауроспорин; актиномицины, например, актиномицин D и дактиномицин; блеомицины, например, блеомицин A2, блеомицин B2 и пепломицин; антрациклины, такие как даунорубицин, доксорубицин (адриамицин), идарубицин, эпирубицин, пирарубицин, зорубицин и митоксантрон; ингибиторы MDR, такие как верапамил; и ингибиторы Ca2+ АТФазы, такие как тапсигаргин.
Композиции, включающие один или несколько химиотерапевтических агентов (например, FLAG, CHOP), также рассматриваются для применения в комбинации с VTX-2337 по настоящему изобретению. FLAG включает флударабин, цитозина арабинозид (Ara-C) и G-SCF. CHOP включает циклофосфамид, винкристин, доксорубицин и преднизон. Каждый из приведенных выше списков является иллюстративным и не предназначен для ограничения объема изобретения.
В одном из вариантов осуществления, VTX-2337 вводят в комбинации с одним или несколькими из перечисленных ниже средств: IFNα, IL-2, Дакарбазином (Bayer), темозоломидом (Schering), тамоксифеном (AZ), кармустином (BMS), мелфаланом (GSK), прокарбазином (Sigma-Tau), винбластином, карбоплатином, цисплатином, таксолом, циклофосфамидом, доксорубицином, ритуксаном (Genentech/Roche), герцептином (Genentech/Roche), гливеком (Gleevec), ирессой (AZ), авастином (Genentech/Roche) или тарцевой (Genentech/Roche).
В другом варианте осуществления, VTX-2337 по настоящему изобретению вводят в комбинации с одним или несколькими из следующих средств: энедиином, например, калихеамицином и эсперамицином; дуокармицином, метотрексатом, доксорубицином, мелфаланом, хлорамбуцилом, Ara-C, виндезином, митомицином C, цис-платином, этопозидом, блеомицином и 5-фторурацилом.
Подходящие токсины и химиотерапевтические агенты, которые могут применяться в комбинации с составами бензо[b]азепиновых агонистов TLR по настоящему изобретению описаны в Remington's Pharmaceutical Sciences, 19th Ed. (Mack Publishing Co., 1995), и в Goodman and Gilman's The Pharmacological Basis of Therapeutics, 7th Ed. (MacMillan Publishing Co. 1985). Другие подходящие токсины и/или химиотерапевтические агенты известны специалисту в данной области техники.
Другие примеры противораковых агентов, которые могут применяться в комбинации с VTX-2337 согласно настоящему изобретению включают, не ограничиваясь этим, следующие средства: ацивицин; акларубицин; акодазола гидрохлорид; акронин; адозелезин; алдеслейкин; алтретамин; амбомицин; аметантрона ацетат; аминоглутетимид; амсакрин; анастрозол; антрамицин; аспарагиназу; асперлин; азацитидин; азетепу; азотомицин; батимастат; бензодепу; бикалутамид; бисантрена гидрохлорид; биснафтида димезилат; бизелесин; блеомицина сульфат; бреквинар натрия; бропиримин; бусульфан; кактиномицин; калустерон; карацемид; карбетимер; карбоплатин; кармустин; карубицина гидрохлорид; карзелезин; цедефингол; хлорамбуцил; циролемицин; цисплатин; кладрибин; криснатола мезилат; циклофосфамид; цитарабин; дакарбазин; дактиномицин; даунорубицина гидрохлорид; децитабин; дексормаплатин; дезагуанин; дезагуанина мезилат; диазиквон; доцетаксел; доксорубицин; доксорубицина гидрохлорид; дролоксифен; дролоксифена цитрат; дромостанолона пропионат; дуазомицин; эдатрексат; эфлорнитина гидрохлорид; эламтируцин; энлоплатин; энпромат; эпипропидин; эпирубицина гидрохлорид; эрбулозол; эзорубицина гидрохлорид; эстрамустин; эстрамустин фосфат натрия; этанидазол; этопозид; этопозида фосфат; этоприн; фадрозола гидрохлорид; фаразабин; фенретинид; флоксуридин; флударабина фосфат; фторурацил; флуроцитабин; фосхидон; фостриецин натрия; гемцитабин; гемцитабина гидрохлорид; гидроксимочевину; идарубицина гидрохлорид; ифосфамид; илмофозин; интерлейкин II (включая рекомбинантный интерлейкин II или rIL2); интерферон альфа-2а; интерферон альфа-2b; интерферон альфа-n1; интерферон альфа-n3; интерферон бета-Ia; интерферон гамма-Ib; ипроплатин; иринотекана гидрохлорид; ланреотида ацетат; летрозол; леупролида ацетат; лиарозола гидрохлорид; лометрексол натрия; ломустин; лозоксантрона гидрохлорид; мазопрокол; майтанзин; меклоретамина гидрохлорид; мегестрола ацетат; меленгестрола ацетат; мелфалан; меногарил; меркаптопурин; метотрексат; метротрексат натрия; метоприн; метуредепу; митиндомид; митокарцин; митокромин; митогиллин; митомальцин; митомицин; митоспер; митотан; митоксантрона гидрохлорид; микофеноловую кислоту; нокодазол; ногаламицин; ормаплатин; оксисуран; паклитаксел; пегаспаргазу; пелиомицин; пентамустин; пепломицина сульфат; перфосфамид; пироброман; пипосульфан; пироксантрона гидрохлорид; пликамицин; пломестан; порфимер натрия; порфиромицин; преднимустин; прокарбазина гидрохлорид; пуромицин; пуромицина гидрохлорид; пиразофурин; рибоприн; роглетимид; сафингол; сафингола гидрохлорид; семустин; симтразен; спарфосат натрия; спарсомицин; спирогермания гидрохлорид; спиромустин; спироплатин; стрептонигрин; стрептозоцин; сулофенур; талисомицин; текогалан натрия; тегафур; телоксантрона гидрохлорид; темопорфин; тенипозид; тероксирон; тестолактон; тиамиприн; тиогуанин; тиотепу; тиазофурин; тирапазамин; торемифена цитрат; трестолона ацетат; трицирибина фосфат; триметрексат; триметрексата глукуронат; трипторелин; тубулозола гидрохлорид; урацил иприт; уредепу; вапреотид; вертепорфин; винбластина сульфат; винкристина сульфат; виндезин; виндезина сульфат; винепидина сульфат; винглицината сульфат; винлеурозина сульфат; винорелбина тартрат; винрозидина сульфат; винзолидина сульфат; ворозол; зениплатин; зиностатин; зорубицина гидрохлорид.
Другие противораковые лекарственные средства, которые могут найти применение в комбинациях по настоящему изобретению, включают, не ограничиваясь этим: 5-этинилурацил; абиратерон; акларубицин; ацилфульвен; адеципенол; адозелезин; альдеслейкин; антагонисты ALL-TK; альтретамин; амбамустин; амидокс; амифостин; аминолевулиновую кислоту; амрубицин; амсакрин; анагрелид; анастрозол; андрографолид; ингибиторы ангиогенеза; антагонист D; антагонист G; антареликс; анти-дорзализирующий морфогенетический белок-1; антиандроген, карцинома простаты; антиэстроген; антинеопластон; антисмысловые олигонуклеотиды; афидиколина глицинат; модуляторы гена апоптоза; регуляторы апоптоза; апуриновую кислоту; ara-CDP-DL-PTBA; аргинин деаминазу; асулакрин; атаместан; атримустин; аксинастатин 1; аксинастатин 2; аксинастатин 3; азасетрон; азатоксин; азатирозин; производные баккатина III; баланол; батимастат; антагонисты BCR/ABL; бензохлорины; бензоилстауроспорин; производные бета-лактама; бета-алетин; бетакламицин В; бетулиновую кислоту; ингибитор bFGF; бикалутамид; бисантрен; бисазиридинилспермин; биснафид; бистратен А; бизелезин; брефлат; бропиримин; будотитан; бутионина сульфоксимин; кальципотриол; калфостин С; производные камптотецина; канарипокс IL-2; капецитабин; карбоксамид-амино-триазол; карбоксиамидотриазол; CaRest M3; CARN 700; ингибитор, полученный из хряща; карзелезин; ингибиторы казеинкиназы (ICOS); кастаноспермин; цекропин В; цетрореликс; хлорины; хлорхиноксалина сульфонамид; цикапрост; цис-порфирин; кладрибин; аналоги кломифена; клотримазол; коллимицин А; коллимицин В; комбретастатин А4; аналог комбретастатина; конагенин; крамбесцидин 816; криснатол; криптофицин 8; производные криптофицина А; курацин А; циклопентантрахиноны; циклоплатам; ципемицин; цитарабина окфосфат; цитолитический фактор; цитостатин; дакликсимаб; децитабин; дегидродидемнин В; деслорелин; дексаметазон; дексифосфамид; дексразоксан; дексверапамил; диазиквион; дидемнин В; дидокс; диэтилнорспермин; дигидро-5-азацитидин; дигидротаксол, 9-; диоксамицин; дифенилспиромустин; доцетаксел; докозанол; долазетрон; доксифлуридин; дролоксифен; дронабинол; дуокармицин SA; эбселен; экомустин; эделфозин; эдреколомаб; эфлорнитин; элемен; эмитефур; эпирубицин; эпристерид; аналог эстрамустина; агонисты эстрогена; антагонисты эстрогена; этанидазол; этопозида фосфат; эксеместан; фадрозол; фазарабин; фенретинид; филграстим; финастерид; флавопиридол; флезеластин; флуастерон; флударабин; фтордауноруницина гидрохлорид; форфенимекс; форместан; фостриецин; фотемустин; гадолиния тексафирин; галлия нитрат; галоцитабин; ганиреликс; ингибиторы желатиназы; гемцитабин; ингибиторы глутитиона; гепсульфам; герегулин; гексаметилена бисацетамид; гиперицин; ибандроновую кислоту; идарубицин; идоксифен; идрамантон; илмофозин; иломастат; имидозоакридоны; имиквимод; иммуностимулирующие пептиды; ингибитор рецептора инсулин-подобного фактора роста-1; агонисты интерферона; интерфероны; интерлейкины; иобенгуан; иододоксорубицин; ипомеанол 4-; ироплакт; ирсогладин; изобенгазол; изогомогаликондрин В; итасетрон; джасплакинолид; кахалалид F; ламелларина-N триацетат; ланреотид; леинамицин; ленограстим; лентинана сульфат; лептостатин; летрозол; фактор, ингибирующий лейкоз; лейкоцитарный альфа-интерферон; леупролид + эстроген + прогестерон; леупрорелин; левамизол; лиарозол; линейный аналог полиамина; липофильный дисахаридный пептид; липофильные соединения платины; лиссоклинамид 7; лобаплатин; ломбрицин; лометрексол; лонидамин; лозоксантрон; ловастатин; локсорибин; луртотекан; лютеция тексафирин; лизофиллин; литические пептиды; майтазин; манностатин А; маримастат; мазопрокол; маспин; ингибиторы матрилизинов; ингибиторы матриксных металлопротеиназ; меногарил; мербарон; метерелин; метиониназу; метоклопрамид; ингибитор MIF; мифепристон; милтефозин; миримостим; несовпадающую двухнитевую РНК; митогуазон; митолактол; аналоги митомицина; митонафид; митотоксин сапорин-фактор роста фибробластов; митоксантрон; мофаротен; молграмостин; моноклональные антитела; хорионический гонадотропин человека; монофосфорил липид А + клеточная стенка миобактерий sk; мопидамол; ингибитор гена мультилекарственной резистентности; политерапию на основе мультиопухолевого супрессора-1; противораковое вещество из числа ипритов; микапероксид В; экстракт клеточной стенки микобактерий; мириапорон; N-ацетилдиналин; N-замещенные бензамиды; нафарелин; нагрестип; налоксон + пентазоцин; напавин; нафтерпин; нартограстим; недаплатин; неморубицин; неридроновую кислоту; нейтральную эндопептидазу; нилутамид; низамицин; модуляторы оксида азота; нитроксидный антиоксидант; нитруллин; О6-бензилгуанин; октреотид; окиценон; олигонуклеотиды; онапристон; ондансетрон; ондансетрон; орацин; пероральные стимуляторы цитокинов; ормаплатин; озатерон; оксалиплатин; оксауномицин; паклитаксел; аналоги паклитаксела; производные паклитаксела; палауамин; пальмитоилризоксин; памидроновую кислоту; панакситриол; паномифен; парабактин; пазеллиптин; пегаспарагазу; пелдезин; пентосан полисульфат натрия; пентостатин; пентрозол; перфлуброн; перфосфамид; периллиловый спирт; феназиномицин; фенилацетат; ингибиторы фосфатазы; пицибанил; пилокарпина гидрохлорид; пирарубицин; пиритрексим; плацетин А; плацетин В; ингибитор активатора плазминогена; комплекс платины; соединения платины; комплекс платина-триамин; порфимер натрия; порфиромицин; преднизон; пропил бис-акридон; простагландин J2; ингибиторы протеасомы; иммунный модулятор на основе белка А; ингибитор протеинкиназы С; ингибиторы протеинкиназы С; микроалгал; белковые ингибиторы тирозинфосфатазы; ингибиторы пурин нуклеозид фосфорилазы; пурпурины; пиразолоакридин; пиридоксилированный конъюгат гемоглобин-полиоксиэтилен; антагонисты raf; ралтитрексед; рамосетрон; ингибиторы ras фарнезил протеин трансферазы; ингибиторы ras; ингибитор ras-GAP; деметилированный ретеллиптин; рений Re 186 этидронат; ризоксин; ризозимы; ретинамид RII; роглетимид; рохитукин; ромуртид; роквинимекс; рубигинон В1; рубоксил; сафингол; саинтопин; SarCNU; саркофитол А; сарграмостим; миметики Sdi 1; семустин; ингибитор 1 старения; смысловые олигонуклеотиды; ингибиторы сигнальной трансдукции; модуляторы сигнальной трансдукции; одноцепочечный антигенсвязывающий белок; сизофиран; собузоксан; боркаптат натрия; фенилацетат натрия; солверол; соматомедин-связывающий белок; сонермин; спарфозивую кислоту; спикамицин D; спиромустин; спленопентин; спонгистатин 1; скваламин; ингибитор стволовых клеток; ингибиторы деления стволовых клеток; стипиамид; ингибиторы стромелизина; сульфинозин; сверхактивный антагонист вазоактивного интестинального пептида; сурадисту; сурамин; сваинсонин; синтетические гликозаминогликаны; таллимустин; тамоксифена метиодид; тауромустин; тазаротен; текогалан натрий; тегафур; теллурапирилий; ингибиторы теломеразы; темопорфин; темозоломид; тенипозид; тетрахлордекаоксид; тетразомин; талибластин; тиокоралин; тромбопоэтин; миметик тромбопоэтина; тималфазин; агонист рецептора тимопоэтина; тимотринан; тироид-стимулирующий гормон; олово этил этиопурпурин; тирапазамин; титаносена бихлорид; топсентин; торемифен; тотипотентный фактор стволовых клеток; ингибиторы трансляции; третиноин; триацетилуридин; трицирибин; триметрексат; трипторелин; трописетрон; туростерид; ингибиторы тирозин киназы; тирфостины; ингибиторы UBC; убенимекс; ингибирующий фактор роста, полученный из урогенитального синуса; антагонисты рецептора урокиназы; вапреотид; вариолин В; векторную систему, эритроцитную генную терапию; веларезол; верамин; вердины; вертепорфин; винорелбин; винксалтин; витаксин; ворозол; занотерен; зениплатин; зиласкорб; и зиностатин стималамер.
1.2.1.3 Комбинация с лучевой терапией
В другом варианте осуществления, с целью лечения рака, VTX-2337 по настоящему изобретению вводят в сочетании с проведением лучевой терапии. Такие способы охватывают схемы, включающие дистанционную лучевую терапию, интерстициальную имплантацию радиоизотопов (I-125, палладия, иридия), применение таких радиоактивных изотопов, как стронций-89, троакальную лучевую терапию, интраперитонеальную лучевую терапию P-32, и/или общую лучевую терапию брюшной полости и тазовой области. В схемах лучевой терапии может применяться любой подходящий цитотоксичный радионуклид или терапевтический изотоп. В некоторых вариантах осуществления, этот радиоизотоп представляет собой изотоп, испускающий альфа-излучение, например,225Ac,224Ac,211At,212Bi,213Bi,212Pb,224Ra или223Ra. В других вариантах осуществления, цитотоксичный радионуклид представляет собой изотоп, испускающий бета-излучение, например,186Re,188Re,90Y,131I,67Cu,177Lu,153Sm,166Ho или64Cu. В некоторых вариантах осуществления, цитотоксичный радионуклид представляет собой изотоп, который испускает электроны Оже и электроны с низкой энергией, например,125I,123I или77Br. В других вариантах осуществления, изотоп представляет собой198Au,32P и т.п.
В некоторых вариантах осуществления, количество введенного субъекту радионуклида составляет от примерно 0,001 мКюри/кг до примерно 10 мКюри/кг. В некоторых вариантах осуществления, количество введенного субъекту радионуклида составляет от примерно 0,1 мКюри/кг до примерно 1,0 мКюри/кг. В других вариантах осуществления, количество введенного субъекту радионуклида составляет от примерно 0,005 мКюри/кг до примерно 0,1 мКюри/кг.
1.2.1.4 Комбинация с терапевтическими антителами
В другом варианте осуществления, VTX-2337 по настоящему изобретению вводят в комбинации с одним или несколькими иммунотерапевтическими агентами, например, антителом или вакциной. В некоторых вариантах осуществления, антитела применяются in vivo против рака в терапевтических и/или профилактических целях.
Не ограничивающие примеры терапевтических и профилактических антител, которые могут применяться в комбинации с составом бензо[b]азепинового агониста TLR по настоящему изобретению, включают MDX-010 (Medarex, NJ), который является гуманизированным антителом против CTLA-4, применяемым в настоящее время в клинической практике для лечения рака простаты, SYNAGIS® (MedImmune, MD), который является гуманизированным моноклональным антителом против респираторного синцитиального вируса (RSV) для лечения RSV инфекции; и HERCEPTIN® (трастузумаб) (Genentech, CA), который является гуманизированным моноклональным антителом против HER-2, для лечения метастатического рака груди. Другими примерами являются гуманизированное анти-CD 18 F(ab')2 (Genentech); CDP860, который является гуманизированным анти-CD18 F(ab')2 (Celltech, UK); PRO542, который является анти-ВИЧ gp120 антителом, слитым с CD4 (Progenics/Genzyme Transgenics); оставир, который является человеческим антителом против гепатита B (Protein Design Lab/Novartis); PROTOVIRTM, который является гуманизированным анти-CMV IgG1 антителом (Protein Design Lab/Novartis); MAK-195 (SEGARD), который является мышиным анти-TNF-α F(ab')2 (Knoll Pharma/BASF); IC14, который является анти-CD14 антителом (ICOS Pharm); гуманизированное анти-VEGF IgG1 антитело (Genentech); OVAREXTM, который является мышиным анти-CA 125 антителом (Altarex); PANOREXTM, который является мышиным антителом против антигена IgG2a поверхности клеток 17-IA (Glaxo Wellcome/Centocor); BEC2, который является мышиным IgG антителом против идиотипа IgG (GD3 эпитоп) (ImClone System); IMC-C225, который является химерным анти-EGFR IgG антителом (ImClone System); VITAXINTM, который является гуманизированным антителом против αVβ3 интегрина (Applied Molecular Evolution/MedImmune); кэмпас 1H/LDP-03, который является гуманизированным анти-CD52 антителом (Leukosite); смарт M195, который является гуманизированным анти-CD33 IgG антителом (Protein Design Lab/Kanebo); RITUXANTM, который является химерным анти-CD20 IgG1 антителом (IDEC Pharm/Genentech, Roche/Zettyaku); LYMPHOCIDETM, который является гуманизированным анти-CD22 IgG антителом (Immunomedics); Smart ID10, который является гуманизированным анти-HLA антителом (Protein Design Lab); DIAGNOSTIC REAGENT ONCOLYMTM (Lym-1), который является радиоактивно меченным мышиным анти-HLA антителом (Techniclone); ABX-IL8, который является человеческим анти-IL8 антителом (Abgenix); анти-CD11a, который является гуманизированным IgG1 антителом (Genentech/Xoma); ICM3, который является гуманизированным анти-ICAM3 антителом (ICOS Pharm); IDEC-114, который является приматизированным анти-CD80 антителом (IDEC Pharm/Mitsubishi); ZEVALINTM, который является радиоактивно меченным мышиным анти-CD20 антителом (IDEC/Schering AG); IDEC-131, который является гуманизированным анти-CD40L антителом (IDEC/Eisai); IDEC-151, который является приматизированным анти-CD4 антителом (IDEC); IDEC-152, который является приматизированным анти-CD23 антителом (IDEC/Seikagaku); SMART анти-CD3, который является гуманизированным анти-CD3 IgG (Protein Design Lab); 5G1.1, который является гуманизированным антителом против фактора 5 комплемента (C5) (Alexion Pharm); D2E7 является гуманизированным анти-TNFα антителом (CAT/BASF); CDP870 является гуманизированным анти-TNFα фрагментом Fab (Celltech); IDEC-151, который является приматизированным анти-CD4 IgG1 антителом (IDEC Pharm/SmithKline Beecham); MDX-CD4, который является человеческим анти-CD4 IgG антителом (Medarex/Eisai/Genmab); CDP571, который является гуманизированным анти-TNFα IgG4 антителом (Celltech); LDP-02, который является гуманизированным анти-α4β7 антителом (LeukoSite/Genentech); ОртоКлон OKT4A, который является гуманизированным анти-CD4 IgG антителом (Ortho Biotech); ANTOVATM, который является гуманизированным анти-CD40L IgG антителом (Biogen); ANTEGRENTM, который является гуманизированным анти-VLA-4 IgG антителом (Elan); MDX-33, который является человеческим анти-CD64 (FcγR) антителом (Medarex/Centeon); SCH55700 является гуманизированным анти-IL-5 IgG4 антителом (Celltech/Schering); SB-240563 и SB-240683, которые являются гуманизированными анти-IL5 и IL-4 антителами, соответственно (SmithKline Beecham); rhuMab-E25, который является гуманизированным анти-IgE IgG1 антителом (Genentech/Novartis/Tanox Biosystems); ABX-CBL, который является мышиным анти CD-147 IgM антителом (Abgenix); BTI-322, который является крысиным анти-CD2 IgG антителом (Medimmune/Bio Transplant); Ортоклон/OKT3, который является мышиным анти-CD3 Ig2a антителом (Ortho Biotech); SIMULECTTM, который представляет собой химерное анти-CD25 IgG1 антитело (Novartis Pharm); LDP-01, который представляет собой гуманизированное IgG антитело против β2-интегрина (LeukoSite); Анти-LFA-1, который представляет собой мышиное анти CD18 F(ab')2 (Pasteur-Merieux/Immunotech); CAT-152, который является человеческим анти-TGF-β2 антителом (Cambridge Ab Tech); и Косервин M, который является химерным антителом против фактора-VII (Centocor). Перечисленные выше иммунореактивные реагенты, а также любые другие иммунореактивные реагенты могут вводиться по любой схеме, известной специалисту в данной области техники, включая схемы, рекомендованные поставщиками иммунореактивных реагентов.
1.2.1.5 Комбинации с другими терапевтическими агентами
В дополнение к противораковым агентам и терапевтическим антителам, VTX-2337 по настоящему изобретению можно вводить в комбинации с другими терапевтическими агентами, такими как анти-ангиогенные агенты (например, в способах лечения солидных опухолей, а также для лечения и профилактики метастазов) и антигормональные агенты (в частности в способах лечения гормонозависимых раковых заболеваний, например, рака груди и рака простаты).
В одном из вариантов осуществления, VTX-2337 по настоящему изобретению вводят в комбинации с одним или несколькими анти-ангиогенными агентами. Такие агенты включают, не ограничиваясь перечисленными, ангиостатин, талидомид, крингл 5, эндостатин, серпин (ингибитор сериновой протеазы) анти-тромбин, 29 кДа N-концевой и 40 кДа C-концевой протеолитические фрагменты фибронектина, 16 кДА протеолитический фрагмент пролактина, 7,8 кДа протеолитический фрагмент тромбоцитарного фактора-4, пептид, содержащий 13 аминокислотных остатков, соответствующий фрагменту тромбоцитарного фактора-4 (Maione et al., 1990, Cancer Res.51:2077-2083), пептид, содержащий 14 аминокислотных остатков, соответствующий фрагменту коллагена I (Tolma et al., 1993, J.Cell Biol. 122:497-511), пептид, содержащий 19 аминокислотных остатков, соответствующий фрагменту тромбоспорина I (Tolma et al., 1993, J.Cell Biol. 122:497-511), пептид, содержащий 20 аминокислотных остатков, соответствующий фрагменту SPARC (Sage et al., 1995, J.Cell.Biochem.57:1329-1334) или любые фрагменты, члены семейств или их варианты, включая их фармацевтически приемлемые соли.
Кроме того, были описаны другие пептиды, которые ингибируют ангиогенез и соответствуют фрагментам ламинина, фибронектина, проколлагена и EGF (смотрите, например, Cao, 1998, Prog Mol Subcell Biol. 20:161-176). Было продемонстрировано, что моноклональные антитела и циклические пентапептиды, которые блокируют определенные интегрины, связывающие белки RGD (т.е. включают пептидный фрагмент Arg-Gly-Asp), обладают анти-васкуляризационной активностью (Brooks et al., 1994, Science 264:569-571; Hammes et al., 1996, Nature Medicine 2:529-533). Кроме того, ингибирование рецептора урокиназного активатора плазминогена антагонистами рецептора ингибирует ангиогенез, рост опухолей и образование метастазов (Min et al., 1996, Cancer Res.56: 2428-33; Crowley et al., 1993, Proc Natl Acad Sci. 90:5021-25).
В другом варианте осуществления, VTX-2337 по настоящему изобретению применяется в комбинации со средством для гормонального лечения. Такие средства лечения включают введение гормональных антагонистов (например, флутамида, бикалютамида, тамоксифена, ралоксифена, леупролида ацетата (LUPRON), антагонистов LH-RH), ингибиторы биосинтеза и процессинга гормонов и стероиды (например, дексаметазон, ретиноиды, дельтоиды, бетаметазон, кортизол, кортизон, преднизон, дегидротестостерон, глюкокортикоиды, минералкортикоиды, эстроген, тестостерон, прогестины), производные витамина A (например, полностью транс-ретиноевая кислота (ATRA)); аналоги витамина D3; антигестагены (например, мифепристон, онапристон) и антиандрогены (например, ципротерона ацетат).
В другом варианте осуществления, VTX-2337 по настоящему изобретению применяется в сочетании со средствами лечения, в которых применяются полинуклеотидные соединения, например, антисмысловые полинуклеотиды, рибозимы, молекулы, обеспечивающие РНК-интерференцию, полинуклеотиды с тройной спиралью и т.п.
1.2.1.6 Комбинация с иммунорегулирующими агентами
В некоторых вариантах осуществления, VTX-2337 по настоящему изобретению вводят в комбинации с иммунорегулирующим агентом. В некоторых вариантах осуществления, бензо[b]азепиновый агонист TLR включают в один состав с иммунорегулирующим агентом. «Иммунорегулирующий агент» представляет собой вещество, которые подавляет, маскирует или улучшает работу иммунной системы субъекта, которому вводится этот агент. Типовыми примерами таких агентов являются препараты, которые подавляют выработку цитокинов, понижают или подавляют экспрессию аутоантигенов или маскируют MHC антигены. Примеры таких агентов включают 2-амино-6-арил-5-замещенные пиримидины (смотрите, патент США № 4665077), азатиоприн (или циклофосфамид, если имеют место нежелательные реакции на азатиоприн); бромкриптин; глутаровый альдегид (который маскирует MHC антигены, как описано в патенте США № 4120649); анти-идиотипические антитела для антигенов MHC и фрагментов MHC; циклоспорин A; стероиды, например, глюкокортикостероиды, например, преднизон, метилпреднизолон и дексаметазон; цитокин или антагонисты рецептора цитокина, включая антитела против интерферона-γ, -β или -α; антитела против фактора-α некроза опухолей; антитела против фактора-β некроза опухолей; антитела против интерлейкина-2 и антитела против рецептора IL-2; анти-L3T4 антитела; гетерологичный анти-лимфоцитарный глобулин; pan-T антитела, предпочтительно анти-CD4 или анти-CD4/CD4a антитела; растворимые пептиды, содержащие LFA-3 связывающий домен; стрептокиназу; TGF-β; стрептодорназу; FK506; RS-61443; дезоксиспергуалин; и рапамицин. Примеры цитокинов включают, не ограничиваясь этим, лимфокины, монокины и традиционные полипептидные гормоны. В число цитокинов входят гормоны роста, например, гормон роста человека, N-метионил гормон роста человека и гормон роста крупного рогатого скота; паратиреоидный гормон; тироксин; инсулин; проинсулин; релаксин; прорелаксин; гликопротеиновые гормоны, например, фолликулостимулирующий гормон (FSH), тиреоидстимулирующий гормон (TSH) и лютеинизирующий гормон (LH); печеночный фактор роста; фактор роста фибробластов; пролактин; плацентарный лактоген; фактор некроза опухолей-α; ингибирующее вещество Мюллера; мышиный гонадотропин-ассоциированный пептид; ингибин; активин; сосудистый эндотелиальный фактор роста; интегрин; тромбопоэтин (TPO); факторы роста нервной ткани, например, NGF-α; фактор роста тромбоцитов; трансформирующие факторы роста (TGFs), например, TGF-α и TGF-α; инсулин-подобные факторы роста I и II; эритропоэтин (EPO); остеоиндуктивные факторы; интерфероны; колониестимулирующие факторы (CSFs), такие как макрофаг-CSF (M-CSF); гранулоцит-макрофаг-CgP (GM-CSP); и гранулоцит-CSF(G-CSF); интерлейкины (ILs), такие как IL-1, IL-Ia, IL-2, IL-3, IL-4, IL-5, IL-6, IL-7, IL-8, IL-9, IL-11, IL-12, IL-15; факторы некроза опухолей, например, TNF-α или TNF-β; и другие полипептидные факторы включая LIF и kit лиганд (KL). В настоящей заявке термин «цитокин» включает белки из природных источников и из рекомбинантных клеточных культур, а также биологически активные эквиваленты цитокинов с нативной последовательностью.
В некоторых вариантах осуществления, способы по настоящему изобретению дополнительно включают введение субъекту одного или нескольких иммуномодулирующих агентов, предпочтительно цитокинов. Предпочтительные цитокины выбраны из группы, состоящей из интерлейкина-1 (IL-1), IL-2, IL-3, IL-12, IL-15, IL-18 G-CSF, GM-CSF, тромбопоэтина и γ-интерферона.
1.2.1.7 Комбинации с соединениями, которые улучшают функцию моноцитов или макрофагов
В некоторых вариантах осуществления, в сочетании с составами бензо[b]азепинового агониста TLR по настоящему изобретению можно применять соединение, которое улучшает функцию моноцитов или макрофагов (например, как минимум, приблизительно на 25%, 50%, 75%, 85%, 90%, 99% или более). Такие соединения известны в технике и включают, не ограничиваясь этим, цитокины, такие как интерлейкины (например, IK-12) и интерфероны (например, альфа или гамма интерферон).
В некоторых вариантах осуществления, соединение, которое улучшает функцию моноцитов или макрофагов, входит в один состав с VTX-2337 и, таким образом, вводится одновременно с VTX-2337.
В других вариантах осуществления, соединение, которое улучшает функцию моноцитов или макрофагов, вводят отдельно от VTX-2337 и его можно вводить одновременно (в течение периода в несколько часов друг за другом), во время одного и того же курса терапии, или последовательно с VTX-2337. В таких вариантах осуществления, соединение, которое улучшает функцию моноцитов или макрофагов, предпочтительно вводят пациенту из числа людей. В одном из вариантов осуществления содержание лейкоцитов, моноцитов, нейтрофилов, лимфоцитов и/или базофилов в крови пациента находится в нормальных для людей пределах. Нормальный диапазон содержания лейкоцитов (общее содержание) в крови человека составляет примерно 3,5-10,5 (109/л). Нормальный диапазон содержания нейтрофилов в крови человека составляет примерно 1,7-7,0 (109/л), моноцитов примерно 0,3-0,9 (109/л), лимфоцитов примерно 0,9-2,9 (109/л), базофилов примерно 0-0,3 (109/л) и эозинофилов примерно 0,05-0,5 (109/л). В других вариантах осуществления субъект из числа людей имеет меньшее содержание лейкоцитов в крови по сравнению с нормальным для людей диапазоном, например, как минимум, приблизительно 0,01, 0,05, 0,1, 0,2, 0,3, 0,4, 0,5, 0,6, 0,7 или 0,8 (109/л) лейкоцитов.
1.2.2 Целевые раковые заболевания
Типы раковых заболеваний, которые подвергаются лечению способами по настоящему заболеванию, включают солидные раковые опухоли, например, рак яичников, рак груди, рак головы и шейного отдела, рак почек, рак мочевого пузыря, гепатоклеточный рак, колоректальный рак, или лимфому, или любые комбинации перечисленных заболеваний. Другие типы раковых заболеваний, которые можно лечить способами по настоящему изобретению, включают, не ограничиваясь этим, саркомы и карциномы человека, например, фибросаркому, миксосаркому, липосаркому, хондросаркому, остеогенную саркому, хордому, ангиосаркому, эндотелиосаркому, лимфангиосаркому, лимфангиоэндотелиосаркому, синовиому, мезотелиому, опухоль Эвинга, лейомиосаркому, рабдомиосаркому, саркому толстой кишки, рак поджелудочной железы, рак простаты, плоскоклеточный рак, базально-клеточную карциному, аденокарциному, карциному потовых желез, карциному сальных желез, папиллярную карциному, папиллярную аденокарциному, цистаденокарциному, медуллярный рак, бронхогенный рак, гепатому, рак желчного протока, хориокарциному, семиному, эмбриональную карциному, опухоль Вильмса, рак шейки матки, опухоль яичка, рак легких, мелкоклеточный рак легких, эпителиальную карциному, глиому, астроцитому, медуллобластому, краниофарингиому, эпендимому, пинеалому, гемангиобластому, нейрому слухового нерва, олигодендроглиому, менингиому, меланому, нейробластому, ретинобластому; лейкозы, например, острый лимфоцитарный лейкоз и острый миелоцитарный лейкоз (миелобластный, промиелоцитарный, миеломоноцитарный, моноцитарный и эритролейкоз); хронический лейкоз (хронический миелоцитарный (гранулоцитарный) лейкоз и хронический лимфоцитарный лейкоз); а также истинную полицитемию, лимфому (болезнь Ходжкина и неходжкинскую лимфому), множественную миелому, макроглобулинемию Вальденстрема и заболевания, связанные с тяжелыми цепями.
1.3. Введение и дозировки
VTX-2337 согласно настоящему изобретению предпочтительно включается в составы для инъекций, наиболее предпочтительно, для подкожного введения. В некоторых вариантах осуществления, VTX-2337 согласно настоящему изобретению включают в составы для введения интрадерамальным, трансдермальным, внутривенным или внутримышечным путями.
Составы по настоящему изобретению содержат такое количество VTX-2337, которое эффективно для намеченной цели. Конкретные дозировки выбирают также на основе ряда других факторов, включая возраст, пол, биологический вид и состояние пациента. Эффективные количества можно также определить на основании кривых доза-реакция, полученных для in vitro тестовых систем или для животных моделей.
В некоторых вариантах осуществления, дозировку VTX-2337 измеряют в единицах мг/кг массы тела. В других вариантах осуществления, дозировку измеряют в единицах мг/кг сухой массы тела (т.е. массы тела за вычетом количества жира). В других вариантах осуществления, дозировку измеряют в единицах мг/м2 площади поверхности тела. В других вариантах осуществления, дозировку измеряют в единицах мг на дозу, введенную пациенту. В отношении композиций и способов по настоящему изобретению может применяться любое измерение дозировки, и перевод единиц дозировки можно осуществлять с помощью стандартных в технике способов.
Примеры схем введения, которые могут применяться в способах по настоящему изобретению, включают, не ограничиваясь этим, ежедневное введение, три раза в неделю (дробное введение), каждую неделю или каждые 14 дней. В некоторых вариантах осуществления, схемы введения включают, не ограничиваясь этим, ежемесячное введение или введение каждые 6-8 недель. В предпочтительном варианте осуществления, состав бензо[b]азепинового агониста TLR по настоящему изобретению вводят путем подкожной инъекции раз в неделю или раз в две недели в комбинации с подходящим средством лечения для лечения рака у субъекта, предпочтительно, субъекта из числа людей.
Типовые дозировки VTX-2337 включают дозировки, выраженные в количестве миллиграммов на килограмм массы субъекта. В одном из вариантов осуществления, дозировка составляет от примерно 0,02 до 10 мг/кг массы тела или от примерно 0,04 до 5 мг/кг массы тела. В конкретном варианте осуществления, дозировка составляет примерно 0,05 мг/кг, примерно 0,1 мг/кг, примерно 0,5 мг/кг, примерно 1 мг/кг, примерно 5 мг/кг или примерно 10 мг/кг массы тела субъекта.
В некоторых вариантах осуществления способов лечения рака, VTX-2337 вводят субъекту индивидуально или в составе комбинированной терапии для лечения рака в дозировке от примерно 0,02 до 10 мг/кг массы тела или от примерно 0,04 до 5 мг/кг массы тела субъекта. В конкретных вариантах осуществления, бензо[b]азепиновый агонист TLR вводят в дозировке примерно 0,05 мг/кг, примерно 0,1 мг/кг, примерно 0,5 мг/кг, примерно 1 мг/кг, примерно 5 мг/кг или примерно 10 мг/кг массы тела субъекта. В некоторых других вариантах осуществления, VTX-2337 вводят субъекту в режиме один раз в неделю или один раз в две недели. В конкретных вариантах осуществления, дневная доза составляет, как минимум, 0,05 мг, 0,50 мг, 1,0 мг, 5,0 мг, 10 мг, 15 мг, 20 мг, 30 мг или, как минимум 50 мг.
В некоторых вариантах осуществления, дозировка бензо[b]азепинового агониста TLR8 (например, VTX-2337), вводимого индивидуально или в составе комбинированной терапии для лечения рака составляет примерно 0,1-10 мг/м2 (например, 0,1-0,3 мг/м2, 0,1-3,9 мг/м2, 0,1-1 мг/м2, 0,1-2 мг/м2, 0,1-4 мг/м2,2-4 мг/м2, 2,5-3,5 мг/м2, 2-6 мг/м2, 2-8 мг/м2). Этот диапазон включает дозировки 0,1 мг/м2, 1 мг/м2, 2 мг/м2, 3 мг/м2, 4 мг/м2, 5 мг/м2, 6 мг/м2, 7 мг/м2, 8 мг/м2 и дозировки находящиеся в промежутках между ними. Следует отметить, что диапазон 2,5-3,5 мг/м2 соответствует ~0,05-0,075 мг/кг, если предположить, что площадь поверхности тела 1,5 м2 соответствует массе тела 70 кг. Частота введения предпочтительно составляет один раз каждые 7-21 день (например, один раз каждые 7, 10, 14, 18, 21 день). В некоторых вариантах осуществления, частота введения предпочтительно составляет 1, 2 или 3 раза каждые 7-21 дней (например, один раз каждые 7, 10, 14, 18, 21 день). Бензо[b]азепиновый агонист TLR8 можно давать до тех пор, пока болезнь не начнет прогрессировать или не проявится неприемлемая токсичность. В некоторых вариантах осуществления, пациенту дают 2-20 доз (например, 2, 4, 6, 8, 10, 12, 14, 16, 18, 20 доз). Предпочтительным путем введения является подкожное введение.
В некоторых вариантах осуществления способов лечения рака, доксорубицин вводят субъекту индивидуально или в составе комбинированной терапии по настоящему изобретению в дозировке от примерно 0,02 до 10 мг/кг массы тела или примерно от 0,04 до 5 мг/кг массы тела субъекта или не более 50 мг/м2 площади поверхности тела субъекта.
Рекомендованные дозировки для интрадермального, внутримышечного, интраперитонеального, подкожного, эпидурального или внутривенного введения находятся в диапазоне примерно от 0,02 до 10 мг/кг массы тела в день. Подходящие дозировки для местного введения находятся в диапазоне от примерно 0,001 миллиграмма до примерно 50 миллиграммов, в зависимости от площади нанесения. Специалист в данной области должен принять во внимание, что дозировки, как правило, выше и/или частота введения выше для начального периода лечения по сравнению с поддерживающей схемой введения.
Доксорубицин предпочтительно включают в состав для инъекций, наиболее предпочтительно, для внутривенного введения. В некоторых вариантах осуществления, доксорубицин включают в состав для введения интрадермальным, трансдермальным, подкожным или внутримышечным путем.
В некоторых вариантах осуществления, дозировку доксорубицина измеряют в единицах мг/кг массы тела. В других вариантах осуществления, Дозировку измеряют в единицах мг/кг сухой массы тела (т.е. массы тела за минусом содержания жира). В других вариантах осуществления, дозировку измеряют в единицах мг/м2 площади поверхности тела. В других вариантах осуществления, дозировку измеряют в единицах мг на дозу, введенную пациенту. В отношении композиций и способов по настоящему изобретению может применяться любое измерение дозировки, и перевод единиц дозировки можно осуществлять с помощью стандартных в технике способов.
В некоторых вариантах осуществления, доксорубицин вводят до, одновременно с или после введения VTX-2337.
В некоторых вариантах осуществления способов лечения рака, доксорубицин вводят субъекту в дозировке от примерно 0,02 до 10 мг/кг массы тела, или от примерно 0,04 до 5 мг/кг массы тела субъекта.
1.3.1 Типовые схемы лечения рака
В конкретных вариантах осуществления, составы VTX-2337 по настоящему изобретению применяются в комбинации с существующими схемами лечения рака у субъекта, предпочтительно, субъекта из числа людей. В соответствии с этим вариантом осуществления, состав бензо[b]азепинового агониста TLR можно вводить до, после или одновременно с подходящим противораковым агентом (агентами) с целью лечения рака. Предпочтительно, введение VTX-2337 координируют с дозировками и временем введения противоракового агента (агентов) в зависимости от типа ракового заболевания, истории болезни и состояния субъекта, а также конкретного выбранного противоракового агента (агентов).
В одном из вариантов осуществления, схема включает 5-фторурацил, цисплатин, доцетаксел, HERCEPTIN®, гемцитабин, IL-2, паклитаксел и/или VP-16 (этопозид) для лечения рака груди. В другом варианте осуществления, схема включает паклитаксел, доцетаксел, митоксантрон и/или антагонист рецептора андрогена (например, флутамид) для лечения рака простаты. В следующем варианте осуществления схема включает флударабин, цитозина арабинозид, гемтузумаб (MYLOTARG), даунорубицин, метотрексат, винкристин, 6-меркаптопурин, идарубицин, митоксантрон, этопозид, аспарагиназу, преднизон и/или циклофосфамид для лечения лейкемии. В одном из вариантов осуществления, схема включает дексаметазон для лечения миеломы. В одном из вариантов осуществления, схема включает дакарбазин для лечения меланомы. В одном из вариантов осуществления, схема включает иринотекан для лечения колоректального рака. В одном из вариантов осуществления, схема включает паклитаксел, доцетаксел, этопозид и/или цисплатин для лечения рака легких. В одном из вариантов осуществления, схема включает циклофосфамид, CHOP, этопозид, блеомицин, митоксантрон и/или цисплатин для лечения неходжкинской лимфомы. В одном из вариантов осуществления, схема включает цисплатин для лечения рака желудка. В одном из вариантов осуществления, схема включает гемцитабин для лечения рака поджелудочной железы.
Продолжительность лечения противораковым агентом может меняться в соответствии с конкретным применяемым терапевтическим агентом. В некоторых вариантах осуществления, введение является дискретным, т.е. дневную дозу делят на несколько отдельных введений. Согласно некоторым вариантам осуществления, способ лечения включает, как минимум, один цикл, предпочтительно, более, чем один цикл, в течение которого вводят одно терапевтическое средство или последовательность терапевтических средств. Подходящий период времени для проведения одного цикла, а также общее число циклов и промежуток между циклами могут быть определены специалистом в данной области при помощи стандартных способов.
В конкретном варианте осуществления, схема включает гемцитабин в дозировке от 100 до 1000 мг/м2/цикл. В другом варианте осуществления, схема включает дакарбазин в дозировке от 200 до 4000 мг/м2/цикл. В предпочтительном варианте осуществления, дозировка дакарбазина находится в пределах от 700 до 1000 мг/м2/цикл. В следующем варианте осуществления, схема включает флударабин в дозировке от 25 до 50 мг/м2/цикл. В следующем варианте осуществления, схема включает цитозина арабинозид (Ara-C) в дозировке от 200 до 2000 мг/м2/цикл. В другом варианте осуществления, схема включает доцетаксел в дозировке от 1,5 до 7,5 мг/кг/цикл. В следующем варианте осуществления, схема включает паклитаксел в дозировке от 5 до 15 мг/кг/цикл. В другом варианте осуществления, схема включает цисплатин в дозировке от 5 до 20 мг/кг/цикл. В следующем варианте осуществления, схема включает 5-фторурацил в дозировке от 5 до 20 мг/кг/цикл. В следующем варианте осуществления схема включает доксорубицин в дозировке от 2 до 8 мг/кг/цикл. В следующем варианте осуществления, схема включает эпиподофиллотоксин в дозировке от 40 до 160 мг/кг/цикл. В следующем варианте осуществления, схема включает циклофосфамид в дозировке от 50 до 200 мг/кг/цикл. В следующем варианте осуществления, схема включает иринотекан в дозировке от 50 до 75, от 75 до 100, от 100 до 125 или от 125 до 150 мг/м2/цикл. В другом варианте осуществления, схема включает винбластин в дозировке от 3,7 до 5,4, от 5,5 до 7,4, от 7,5 до 11 или от 11 до 18,5 мг/м2/цикл. В другом варианте осуществления, схема включает винкристин в дозировке от 0,7 до 1,4 или от 1,5 до 2 мг/м2/цикл. В еще одном варианте осуществления, схема включает метотрексат в дозировке от 3,3 до 5, от 5 до 10, от 10 до 100, или от 100 до 1000 мг/м2/цикл.
В одном из вариантов осуществления, схема лечения охватывает применение низкой дозировки химиотерапевтического агента. Согласно этому варианту осуществления, первоначальное лечение субъекта VTX-2337 по настоящему изобретению увеличивает чувствительность опухоли к последующему введению противоракового агента. Таким образом, этот противораковый агент можно вводить субъекту в дозировке, которая находится около или ниже нижнего предела диапазона приемлемых дозировок этого агента, вводимого индивидуально. В одном из вариантов осуществления, схема включает последующее введение доцетаксела в дозировке от 6 до 60 мг/м2/день или менее. В другом варианте осуществления, схема включает последующее введение паклитаксела в дозировке от 10 до 135 мг/м2/день или менее. В другом варианте осуществления, схема включает последующее введение флударабина в дозировке от 2,5 до 25 мг/м2/день или менее. В следующем варианте осуществления, схема включает последующее введение цитозина арабинозида (Ara-C) в дозировке от 0,5 до 1,5 мг/м2/день или менее. В следующем варианте осуществления, схема включает последующее введение гемцитабина в дозировке от 10 до 100 мг/м2/цикл. В следующем варианте осуществления, схема включает последующее введение цисплатина, например, PLATINOL или PLATINOL-AQ (Bristol Myers) в дозировке от 5 до 10, от 10 до 20, от 20 до 40, или от 40 до 75 мг/м2/цикл. В другом варианте осуществления, схема включает последующее введение цисплатина в диапазоне от 7,5 до 75 мг/м2/цикл. В следующем варианте осуществления, схема включает последующее введение карбоплатина, например, PARAPLATIN (Bristol Myers) в дозировке от 2 до 4, от 4 до 8, от 8 до 16, от 16 от 35 или от 35 до 75 мг/м2/цикл. В другом варианте осуществления, схема включает последующее введение доцетаксела, например, TAXOTERE (Rhone Poulenc Rorer) в дозировке от 6 до 10, от 10 до 30 или от 30 до 60 мг/м2/цикл. В следующем варианте осуществления, схема включает последующее введение паклитаксела, например, TAXOL (Bristol Myers Squibb) в дозировке от 10 до 20, от 20 до 40, от 40 до 70, или от 70 до 135 мг/кг/цикл. В следующем варианте осуществления, схема включает последующее введение 5-фторурацила в дозировке от 0,5 до 5 мг/кг/цикл. В еще одном варианте осуществления, схема включает последующее введение доксорубицина, например, ADRIAMYCIN (Pharmacia & Upjohn), DOXIL (Alza), RUBEX (Bristol Myers Squibb) в дозировке от 2 до 4, от 4 до 8, от 8 до 15, от 15 до 30 или от 30 до 60 мг/кг/цикл.
Описанные выше схемы введения приведены лишь с иллюстративными целями и их не следует рассматривать, как ограничение объема изобретения.
1.4 Наборы
Настоящее изобретение относится к фармацевтический упаковке или набору, включающим один или несколько контейнеров, наполненных жидким или лиофилизированным VTX-2337 и/или доксорубицином. В предпочтительных вариантах осуществления, этот жидкий или лиофилизированный состав является стерильным. В одном из вариантов осуществления, набор включает жидкий или лиофилизированный состав по настоящему изобретению в одном или нескольких контейнерах, и один или несколько других профилактических или терапевтических агентов, применимых для лечения рака или инфекционного заболевания. Упомянутые один или несколько других профилактических или терапевтических агентов могут находиться в том же самом контейнере, что и VTX-2337 или в одном или нескольких других контейнерах. Предпочтительно, VTX-2337 включают в состав в концентрациях от примерно 0,5 мг/мл до примерно 50 мг/мл, от примерно 1 мг/мл до примерно 40 мг/мл, или от примерно 2 мг/мл до примерно 15 мг/мл, и состав подходит для инъекции, предпочтительно, подкожной инъекции. Предпочтительно, набор содержит VTX-2337 в дозированной форме. Более предпочтительно, эта дозированная форма является такой формой, которая способна обеспечить введение разовой дозы от примерно 0,02 до 10 мг/кг, или от примерно 0,04 до 5 мг/кг массы тела субъекта, подвергаемого лечению.
В некоторых вариантах осуществления, набор дополнительно включает инструкции по применению в лечении рака (например, применению жидких составов по настоящему изобретению индивидуально или в комбинации с другим профилактическим или терапевтическим агентом), а также описание побочных эффектов и информация о дозировках для одного или нескольких путей введения. Указанный контейнер (контейнеры) необязательно сопровождается уведомлением, в форме, предписанной правительственным учреждением, регулирующим производство, применение или продажу фармацевтических средств или биологических продуктов, в котором отражено, что указанное учреждение одобрило производство, применение или продажу набора для введения людям.
Все публикации и патентные документы, упомянутые в настоящей заявке, включены в заявку с помощью ссылок, как если бы про каждую из этих публикаций и документов было индивидуально указано, что она включена в заявку посредством ссылки. Упоминание публикаций и патентных документов не предполагает признания того, что любой из этих источников относится к известному уровню техники, а также не является признанием этого в отношении содержания или данных указанных источников.
Ниже по тексту изобретение более подробно описано с привлечением следующих примеров, которые не предполагают ограничения объема настоящего изобретения. Специалисту в данной области должно быть очевидно, что при практической реализации изобретения в материалы и методики можно внести многочисленные изменения, не отступая от целей и преимуществ настоящего изобретения.
1.5 Примеры
Пример 1: Химиотерапия с применением агониста TLR8 и доксила эффективно активирует противоопухолевый иммунный ответ у человека в мышиной модели иммунной системы человека
Из-за различий иммунных систем мыши и человека многие эффекты иммуномодулирующих лекарственных средств нельзя в полной мере исследовать в сингенных мышиных моделях. Были разработаны новые модели на основе мышей с человеческой иммунной системой (HIS), имеющих опухоль, для исследования взаимодействий между химиотерапией и иммуномодулирующей терапией. Было протестировано индивидуальное действие и взаимодействие между доксорубицином, т.е. лекарственным средством, которое вызывает иммуногенную смерть опухолевых клеток и активирует антиген-презентирующие клетки, и VTX-2337, т.е. агонистом TLR-8, который вызывает мощную активацию и поляризацию типа 1 миелоидных DSc (дендритных клеток) человека, и показано уменьшение активности на мышиных лейкоцитах. Nod/SCID/ILRγC нокаутированным (NSG) мышам вводили человеческие клетки пуповинной крови CD34+ от HLA-A2+ человеческих доноров; осуществляли s.c. (подкожную) трансплантацию человеческой HLA-A2+ раковой опухоли яичников OVCAR5; и вводили ПЭГилированный липосомальный доксорубицин (доксил или PLD); VTX-2337; или два этих агента в комбинации. У мышей NSG-HIS обнаруживалась полностью человеческая кроветворная система, включая субпопуляции человеческих моноцитов, макрофагов и плазмацитоидных и миелоидных DCs, а также T-клеток. У мышей NSG-HIS VTX-2337 вызывал дозозависимую активацию человеческих клеток CD14+ и CD11c+ in vivo в течение 6 часов. В плазме мышей, которым вводили VTX-2337, наблюдалась временная дозозависимая повышающая регуляция человеческих цитокинов Th1, но также наблюдалось появление IL-10, достигая максимальных значений в течение 6 часов и затем понижаясь в течение 24 часов. Доксил при индивидуальном введении также вызывал умеренную активацию CD11c+ DCs in vivo и умеренную повышающую регуляцию цитокинов Th1. Комбинация двух указанных средств вызывала мощную активацию CD11c+ DCs и моноцитов и заметно увеличивала содержание цитокинов Th1, но не IL-10. Опухоли OVCAR5 успешно приживались, причем наблюдалось проникновение в опухоль человеческих лейкоцитов. Введение VTX-2337 и доксила независимо вызывало проникновение человеческих лейкоцитов в опухоль и дозозависимым образом ограничивало рост ксенотрансплантатов опухолей яичников человека, тогда как комбинация этих двух лекарственных средств приводила к наибольшей частоте проникновения человеческих лейкоцитов в опухоль и значительно ограничивало рост опухолей яичников. Комбинированная активация врожденного и адаптивного иммунитета при действии VTX-2337 и доксила, а также повышение чувствительности опухолевых клеток под действием доксила к эффекторным механизмам адаптивного и врожденного иммунитета, служило основой наблюдаемого взаимодействия, подавляющего рост опухоли. Модель NSG-HIS обеспечила удобное средство для установления взаимодействия при химиотерапии с применением агониста TLR8 и доксила, и полученные результаты явились основой для клинического исследования.
Материалы и методики
Реагенты:
Состав VTX-2337: 40 мг/мл 2-амино-N,N-дипропил-8-(4-(пирролидин-1-карбонил)фенил)-3H-бензо[b]азепин-4-карбоксамид, который превращали в комплекс включения с 15% масс./объем Capsitol® (сульфобутиловым эфиром β-циклодекстрина) в 10 мМ цитратном буфере (pH=6,5). Этот состав перед применением разбавляли 0,9% стерильным хлоридом натрия до подходящих концентраций.
PLD (т.е. доксил, изготовленный Ben Venue Laboratories Inc Bedford OH 4414146) приобретали в аптеке больницы университета Пенсильвании.
Получение мышей NSG-HIS:
Все исследования на мышах in vivo были одобрены ведомственным комитетом Университета Пенсильвании по уходу и использованию животных в соответствии с директивами национального института здоровья (NIH). Мышей NOD-scid IL2Rγnull (NSG), полученных в службе поддержки ксенотрансплантации университета Пенсильвании, подвергали предварительному облучению (250 рад), и на следующий день осуществляли внутривенную (i.v.) инъекцию человеческой пуповинной крови, лишенной T-клеток, содержащей 1-2×105 CD34+ (LONZA, 2C-101). Приблизительно через 3 месяца проверяли степень приживления и воспроизведения кроветворной системы человека, осуществляя отбор крови и окрашивание hCD45 (BD Pharmingen, clone 2DI cat# 557833 APC-CY7).
Измерение уровней цитокинов:
В некоторых экспериментах мышам NSG-HIS подкожно (s.c.) вводили 0,5 или 5 мг/кг VTX-2337, индивидуально или в сочетании с интраперитонеальным (i.p.) введением PLD в максимальной переносимой дозе (MTD, 50 мг/м2). В других экспериментах PBMC (мононуклеарные клетки периферической крови) человека стимулировали in vitro VTX-2337. Во всех эеспериментах, плазму и супернатанты среды собирали через 6 часов после введения VTX-2337. Уровни цитокинов, образовавшиеся в результате введения VTX-2337 или VTX-2337 плюс PLD, измеряли как in vitro, так и in vivo в лаборатории Rules Based Medicine (Ausin, TX), с использованием методики, основанной на технологии фирмы Luminex, в которой определяются уровни 96 человеческих анализируемых веществ либо в супернатантах культур, либо в образцах плазмы, отобранных у животных, которым вводили препараты.
Введение препаратов мышам NSG-HIS с опухолями OVCAR5:
Клетки OVCAR5 вводили подкожно (5×106 клеток) мышам NSG-HIS, которым были привиты HLA-A2+ CD34+. У контрольных мышей, которым не вводились препараты, опухоли прогрессивно развивались, что приводило к смерти животных в течение 90 дней после введения опухолевых клеток. Два раза в неделю измеряли размеры опухолей и рассчитывали объем по формуле: (длина × длина)×(ширина)/2. Мышей с опухолями случайным образом распределяли по четырем экспериментальным группам (n=8-10/группа), когда средние объемы опухолей достигали примерно 50 мм3, или через ~30 дней после имплантации опухолевых клеток. Экспериментальные группы включали контрольную группу, получавшую носитель, группу, получавшую PLD (50 мг/м2, i.p. каждые две недели), группу, получавшую VTX-2337 (0,5 мг/кг, вводили подкожно через день по три раза в каждом цикле) или группу, получавшую комбинацию PLD и VTX-2337, где введение VTX-2337 начинали через 5 дней после PLD. Продолжительность циклов введения препаратов составляла 14 дней и в каждой группе осуществляли 3 цикла введения. Во время каждого цикла введения, группы, которым давали PLD, получали химиотерапевтическое средство в день 1, тогда как группы, получавшие VTX-2337 индивидуально или в комбинации с PLD, получали VTX-2337 на 5, 7 и 9 дни цикла.
Цитометрия в потоке:
Для проведения анализа лейкоцитов способом поточной цитометрии, опухоли, костный мозг или селезенку помещали в 6 см чашки Петри, измельчали и переносили в 15 мл пробирки и инкубировали в течение 2 ч в растворе, содержащем 2 мг/мл коллагена (Sigma #C9407) и ДНКазу (Sigma #D5025-15KO) в RPMI (Cellgro #1640CV) при непрерывном вращении. Суспензию пропускали через 70-мкм клеточный фильтр, используя поршень шприца, промывали, центрифугировали и ресуспендировали осадок в PBS, 2%FBS (GIBCO #10437). После суспендирования, 3-5×106 клеток окрашивали 0,5 мкг/мл Ab в течение 30 мин при 4ºC, промывали и анализировали поточной цитометрией FACS-Canto (BD Pharmingen). Клетки окрашивали, используя человеческие hCD45 (BD Pharmingen clone 2D1 catalog#557833 APC-CY7), hCD3 (Biolegend clone UCHT1 #300429 PerCP/Cy5.5), hCD4 (BD Pharmingen clone RPA-T4 #555349 APC), hCD8 (eBioscience clone RPA-T8 #11-0088 FITC), hCD11b (BD Pharmingen clone ICRF44 #555388 PE), hCD11c (Biolegend, clone 3.9 #301608 Pe-Cy7), hCD123 (BD Pharmingen clone 7G3 #558714 PerCP-Cy5.5), hCD14 (eBioscience clone 61D3 #25-0149 PE-Cy7), hCD40 (eBioscience clone 5C3 #11-0409 FITC), hCD80 (Biolegend clone 2D10 #305216 AF647) и hCD86 [BD Pharmingen clone 2331(FUN-1) #555658 PE].
Размножение T клеток in vitro, селекция реактивности и исследование адоптивного переноса:
Лейкоциты, проникающие в опухолевую ткань (TILs), вначале извлекали из фрагментов опухолей различных экспериментальных групп, помещенных в культуру с высокой концентрацией рекомбинантного человеческого интерлейкина 2 (rhIL-2, 600 IU/мл), как указано в других источниках (смотрите, например, Dudley, M.E., et al., 2003. J.Immunother 26:332-342 и Riddell, S.R., and Greenberg, P.D. 1990. J Immunol Methods 128:189-201). Вкратце, фрагменты опухолей (~2×2 мм) из животных различных экспериментальных групп помещали в среду AIMV (GIBCO #12055) с добавкой 5% сыворотки человека (Valley Biomedical Inc #1017) и 600 I.U./мл hIL-2 (PeproTech #AF-200-02). Половину среды заменяли каждые 3 дня до достижения экспоненциального роста; затем культуры при необходимости делили на части, чтобы сохранить концентрацию клеток в диапазоне ~5×105-1×106 клеток/мл. Когда получали достаточное количество клеток, оценивали реактивность всех культур в отношении OVCAR5 in vitro. Затем выращивали OVCAR5-специфичные реакционноспособные TILs, используя ранее описанные методики (смотрите, например, Dudley, M.E., et al. 2003 J.Immunother 26:332-342). Вкратце, 2×108 аллогенных облученных питающих клеток (HLA-A2+ человеческих PBMC) смешивали с 30 мкг/мл антител OKT3 (eBioscience clone OKT3 #16-0037-85), 600 IU/мл rhIL-2 (PeproTech #AF-200-02), и 1×106 TIL, перемешивали и помещали аликвоты полученной смеси в 175 см3 колбы для культур тканей. Затем колбы инкубировали в вертикальном положении при 37ºC в 5% CO2. На 5 день половину среды заменяли 1:1 смесью AIM V, содержащей 600 IU/мл rhIL-2. Добавляли среду в эти колбы по необходимости, чтобы поддерживать концентрацию клеток примерно 0,5-1×106 клеток/мл. Считали, что каждая из исходных лунок представляет собой независимую культуру TIL и содержали ее отдельно от других. В исследовании адоптивного переноса мышам NSG, которым были имплантированы не человеческие CD34+, осуществляли подкожное введение 5×106 клеток OVCAR5 через 30-40 дней после внутривенной (i.v.) инъекции 1×107 размноженных T-клеток.
Выделение цитокинов и исследования цитотоксичности:
Активность и специфичность TILs определяли путем анализа секреции цитокинов и прямым измерением CTL (CTL - цитотоксический T-лимфоцит). Для проведения анализа выделения интерферона-γ (IFNγ), TIL и контрольные линии T-клеток перед проведением исследования совместной культуры дважды промывали для удаления rhIL-2. В каждую из лунок 96-луночного плоскодонного планшета помещали 1×105 TILs и 1×105 стимулирующих клеток. Культуры TILs, как правило, стимулировали клетками OVCAR5 и опухолевыми клетками двух контрольных линий HLA-A2+ меланомы (526mel и 624mel). В некоторых лунках для обеспечения MHC-зависимой (MHC - главный комплекс гистосовместимости) активности, клетки-мишени предварительно обрабатывали нейтрализующими анти-HLA A, B и C антителами (eBioscience clone w6/32 #16-9983-85). После совместного культивирования в течение ночи, собирали супернатанты и количественно определяли секрецию IFNγ с помощью анализа ELISA (Biolegend #430102). В анализе CTL клетки OVCAR5 подвергали импульсному облучению изотопом хром-55, помещали смеси TIL с клетками-мишенями в различных соотношениях в 96-луночные планшеты и инкубировали в течение 4 ч. В некоторых лунках OVCAR5 предварительно инкубировали с нейтрализующими анти-HLA A, B и C антителами. После инкубирования 30 мл среды из совместной культуры капали на микропланшет LumaPlate и оставляли для высыхания на ночь. Радиоактивность регистрировали на приборе для определения сцинтилляции жидкостей Wallac 1450 Microbeta Plus.
Определение выживаемости клеток при действии аннексина V/7AAD:
Для обнаружения апоптоза, опухолевые клетки обрабатывали аннексином V/7AAD (BD Pharmingen #559763). Апоптозные клетки определяли с помощью цитометрии в потоке, согласно протоколу изготовителя. Вкратце, клетки OVCAR5, выращенные и обработанные изучаемыми препаратами, собирали и осаждали центрифугированием при 1200 об/мин, затем дважды промывали ледяным PBS и вновь суспендировали в связывающем буфере (Pharmingen #51-66121 E) в концентрации 1×106 клеток/мл; 100 мкл этого раствора (1×105 клеток) переносили в каждую из двух 5-мл культуральных пробирок. Пять мкл аннексина V-PE (Pharmingen #51-65875Y) добавляли в каждую 100-мкл порцию раствора, осторожно перемешивали, инкубировали в темноте при комнатной температуре в течение 15 мин, промывали PBS, инкубировали с 5 мкл 7AAD (BD Pharmingen #51-68981E) в течение 10 минут и анализировали с помощью FACS в течение 1 ч.
Экстракция белка и вестерн-блоттинг:
Весь содержавшийся в клетках белок экстрагировали на льду в течение 30 мин в буфере для лизиса [M-PER реагент для экстракции белка млекопитающих #78501 ThermoScientific]. Затем подвергали денатурации 50 мкг белка из каждого образца в 2Х загрузочном буфере при 100ºC в течение 5 мин, разделяли электрофорезом на полиакриламидном геле в присутствии додецилсульфата натрия (SDS-PAGE) и переносили на мембрану из нитроцеллюлозы. Затем эти мембраны инкубировали в 5% обезжиренном молоке в течение 2 ч при комнатной температуре и после этого инкубировали с первым антителом (Cell Signaling #3210 rabbit) в течение ночи при 4ºC. После этого мембраны три раза промывали в фосфатном буферном солевом растворе (PBS), содержавшем 0,5% Tween 20 (Sigma) и инкубировали со вторым антителом (BioRad 172-1019) в течение 2 ч при комнатной температуре. Полосы белков визуализировали с использованием ECL (Amersham #RPN2132), применяя пленку X-films (Bioexpress # F-9023).
Активация противоопухолевых эффекторных механизмов в человеческих PBMC in vitro под действием агониста TLR8
VX-2337 является селективным и мощным агонистом TLR8, который эффективно активирует человеческие mDC и моноциты. Его активность главным образом ограничена указанными популяциями клеток, и популяции других человеческих лейкоцитов не активируются непосредственно, хотя косвенная активация может обеспечивать активацию моноцитов и DC. Для изучения общего влияния активации TLR8 на человеческих лейкоцитах, мононуклеарные клетки периферической крови (PBMC) здоровых добровольцев (n=6) инкубировали с VTX-2337 в широком диапазоне концентраций в течение 24 часов. В ответ на активацию TLR8 при действии VTX-2337 наблюдалось дозозависимое образование высоких уровней TNFα, IFNγ и IL-12p70. Таким образом, уникальная особенность активации TLR8 PBMC заключается в генерации эффекторных медиаторов, которые, как известно, играют решающую роль в клеточно-опосредованном иммунном ответе на образование раковой опухоли. В результате агонисты TLR8 применимы для иммунотерапии у людей.
Агонист TLR8 эффективно активирует человеческие APCs и стимулирует иммунную активацию Th1 (T-хэлперов 1) in vivo у мышей NSG-HIS
Активность VTX-2337 оценивали в новой мышиной модели, в которой иммунную систему мышей NSG воспроизводили человеческими клетками пуповинной крови CD34+. Если гематопоэтические стволовые клетки человека восстанавливают костный мозг и начинают кроветворение, животные в течение трех-четырех месяцев демонстрируют полное воспроизведение иммунной системы человека, включая B клетки, CD3, CD4, CD8, NK, mDC, pDC и моноциты. Поскольку при стимулировании действием VTX-2337 в человеческих PBMCs наблюдаются иммуностимулирующие эффекты, ожидалось, что мыши NSG-HIS будут обладать высокой чувствительностью к VTX-2337. Действительно, введение VTX-2337 этим мышам воспроизводило иммуностимулирующие эффекты, ранее продемонстрированные для человеческих PBMC, с дозозависимым увеличением поверхностной экспрессии целого ряда ко-стимулирующих молекул, включая CD83, CD86 и MHC класса II на имплантированных человеческих CD14+ моноцитах CD11c, mDCs и CD123 pCDs. Кроме того, было продемонстрировано увеличение уровней человеческих цитокинов в крови, которое, как известно, играет важную роль в иммунном ответе на опухоли, и ранее связанного с активацией TLR8. Эти цитокины включают IFNγ, TNFα и IL-12p40.
Структура белка TLR8 различается у разных биологических видов, и хотя VTX-2337 обладает активностью у мышей, его молекула была оптимизирована для наиболее эффективного и селективного действия на человеческий TLR8.
Вследствие селективности VTX-2337 в отношении человеческого TLR8, мыши NSG-HIS были выбраны в качестве модели мышиного организма с воспроизведенной кроветворной системой человека, для изучения влияния VTX-2337 на человеческие лейкоциты in vivo. Высокий уровень приживаемости гематолимфоидных клеток человека наблюдался у мышей NSG-HIS через 14-22 недели после переноса клеток человеческой пуповинной крови CD34+, введенных внутривенно мышам NSG в возрасте 6 недель, что оценивали путем количественного определения человеческих (h) CD45 в различных компартментах (фиг.1A); клетки hCD45+ составляют 35-75% общего количества клеток крови, 40-68% общего количества клеток в селезенке и 40-70% общего количества клеток в костном мозге.
Для демонстрации активности VTX-2337 in vivo, VTX-2337 вводили в дозировках 0,5 или 5 мг/кг s.c. мышам NSG-HIS с полностью воспроизведенной кроветворной системой через несколько недель после трансплантации. Через шесть часов собирали клетки селезенки для определения уровней маркеров активации. Мыши, которым вводили либо 0,5, либо 5 мг/кг VTX-2337 демонстрировали заметное увеличение экспрессии CD83, CD86, а также MHC класса II на моноцитах (CD45+CD14+), миелоидных DC (mDC, CD45+CD11c+) и плазмацитоидных DC (pDC, CD45+CD123+) по сравнению с мышами, не получавшими препарата (фиг.1B).
Профиль человеческих цитокинов исследовали в мышиной плазме после одного подкожного введения VTX-2337 (0,5 или 5 мг/кг), используя анализ, основанный на технологии фирмы Luminex (фиг.1c). Дозозависимое повышение концентрации Th1 поляризующих цитокинов, в т.ч. IFNγ, TNFα и IL-12p40 наблюдалось в течение шести часов. Значительное увеличение уровней IL-10 в плазме также было обнаружено у животных, получавших VTX-2337, по сравнению с контрольными. Таким образом, VTX-2337 индуцирует непосредственную активацию компартмента человеческих моноцитов/DC и последующую эффективную активацию человеческой иммунной системы in vivo, хотя наблюдалось также и увеличение выработки IL-10.
Активация TLR8 после введения PLD, приводящая к выработке цитокинов клетками Th1
Тестировали «фазированную» схему введения, в которой на первом этапе вводили PLD в максимальной переносимой дозе (MTD, 50 мг/м2, i.p.) NSG мышам в возрасте 20-28 недель, которым были имплантированы hCD34+, для разрушения опухолевых клеток и высвобождения иммуногенного антигена; через 5 дней вводили VTX-2337 (0,5 мг/кг) для активации APCs (антиген-презентирующих клеток). Через 6 часов после инъекции VTX-2337 измеряли уровни различных цитокинов в плазме. Мыши NSG-HIS, не получавшие препаратов, не продемонстрировали обнаружимого содержания интерферона гамма (IFNγ) в плазме. Аналогично, введение только PLD не вызвало какого-либо повышения IFNγ; однако, комбинация VTX-2337 и PLD (фиг.2) приводила к появлению значительных уровней IFNγ, которые были близки к уровням, генерированным при индивидуальном введении VTX-2337 (фиг.1C). Кроме того, комбинированное введение VTX-2337 и PLD вызывало повышающую регуляцию TNFα по сравнению с контрольными животными, не получавшими препаратов, которая была аналогична повышающей регуляции, наблюдавшейся при индивидуальном введении PLD или VTX-2337. Таким образом, введение после PLD позволяло VTX-2337 вызывать ответ Th1. Важно отметить, что хотя и PLD, и VTX-2337 вызывали повышающую регуляцию IL-10 при индивидуальном введении фиг.2), этот эффект ослабляется при введении комбинации этих двух препаратов (фиг.2). Описанные данные в целом показывают, что 5-дневнй промежуток между введением PLD и VTX-2337 позволял сохранять профиль Th1 цитокинов, индуцированный действием VTX-2337, и, кроме того, давал возможность понижать уровни IL-10. Таким образом, описанная комбинация вызывала оптимальную ответную выработку цитокинов. Одновременное введение PLD и VTX-2337 приводило к отрицательному взаимодействию, поскольку такая схема подавляла ответное выделение IFNγ.
Повышение уровней TNFα и IL-10 в плазме продемонстрировало, что введение PLD мышам NSG-HIS вызывало иммунную активацию. Эта иммунная активация согласуется с тем, что доксорубицин вызывает «гибель антигенных клеток», как у нормальных, так и у опухолевых клеток, и подтверждает, что активация TLR8 под действием VTX-2337 усиливает противоопухолевый ответ. Введение VTX-2337 и PLD® приводит как к уменьшению уровней противовоспалительного медиатора IL-10 в плазме, так и к повышению уровней IFNγ и TNFα.
Активация TLR8 улучшает противоопухолевую активность PLD in vivo
Указанную комбинацию MTD PLD и VTX-2337 в количестве 0,5 мг/кг, т.е. в дозировке, которая для мышей сравнима с применявшейся в исследованиях по клинической онкологии, впоследствии использовали для введения мышам NSG-HIS с опухолями. Схему введения планировали таким образом, чтобы получить преимущества фармакодинамической активности PLD и VTX-2337, используя несколько 14-дневных циклов введения. Мышам NSG-HIS, у которых имелись опухоли, вначале вводили PLD для стимулирования смерти опухолевых клеток. Через 5 дней после этого осуществляли многократное введение VTX-2337 для активации иммунных клеток-мусорщиков, в т.ч. mDC, моноцитов и макрофагов, которые удаляли умирающие опухолевые клетки. Как ожидалось, PLD в MTD (максимальной переносимой дозе) приводил к значительному уменьшению скорости роста опухоли по сравнению с контрольной группой, получавшей носитель, в то время, как при индивидуальном введении VTX-2337 наблюдалось незначительное влияние на рост опухоли. Комбинация двух указанных агентов обеспечивала заметное ослабление роста опухоли по сравнению с индивидуальным введением PLD на протяжении трех 14-дневных циклов введения.
В ходе исследования совместного действия PLD и VTX-2337 на рак яичников человека, мышам NSG-HIS-A2 с имплантированными hCD34 вводили соответствующие HLA-A2+ клетки рака яичников человека OVCAR5 (5×106). После того, как опухоли хорошо приживались, группам мышей (n=8-9/группа) вводили носитель, только Доксил, только VTX-2337 или комбинацию VTX-2337 и доксила. Интересно отметить, что несмотря на иммуномодулирующее действие VTX-2337, мыши, которые получали только агонист TLR8 продемонстрировали такой же рост опухоли, как и контрольные мыши, не получавшие препаратов. Как и ожидалось, мыши, которым вводили PLD в MTD (50 мг/м2 i.p.), продемонстрировали ослабление роста опухоли по сравнению с контрольными мышами, не получавшими препарата. Важно отметить, что наблюдалось сильное положительно взаимодействие между двумя применявшимися препаратами; эффект от PLD значительно усиливался при применении совместно с VTX-2337 (P=0,04) (фиг.3B), где комбинация этих препаратов почти полностью подавляла рост опухоли.
На стадии дальнейшего исследования взаимодействия двух указанных препаратов, в конце исследования отбирали образцы опухолей из каждой экспериментальной группы, и оценивали проникновение лейкоцитов с помощью иммуногистохимии и цитометрии в потоке. В тканях опухолей контрольной группы присутствовало относительно небольшое количество человеческих клеток CD45+ (фиг.3C), тогда как все группы, получавшие препараты, продемонстрировали увеличение инфильтрации CD45+. Опухоли мышей, получавших комбинацию PLD и VTX-2337, продемонстрировали наибольшее увеличение проникновения человеческих клеток CD45+, по отношению к группами, получавшим либо только PLD, либо только VTX-2337 (фиг.3С). Для получения дополнительных характеристик композиций и состояния созревания популяции человеческих лейкоцитов, проникающих в опухоли, в различных группах, использовали цитометрию в потоке. PLD сам по себе не вызвал значимых изменений лимфоцитов, проникающих в опухоль, по сравнению с контрольной группой. Интересно отметить, что агонист TLR8 вызывал значительное увеличение общего количества CD3+ T клеток в процентах по отношению к CD8+ T клеткам, а также процентной доли CD69+(активированных)CD3+CD8+ T клеток. Комбинация PLD и агониста TLR8 вызывала аналогичные изменения. Кроме того, было обнаружено увеличение количества проникающих в опухоль CD40+(активированных)макрофагов(CD45+CD11b+), pDC(CD45+CD123+) и mDC(CD45+CD11c+) у мышей, которым вводили VTX-2337, только PLD или их комбинацию (фиг.3D). Интересно отметить, что наблюдалось относительное увеличение отношения проникающих в опухоль макрофагов по сравнению с pDC, и mDC к pDC у мышей, которые получали комбинацию препаратов, по сравнению с каждым из препаратов по отдельности.
Активация TLR8 способствует формированию опухоль-специфичных CTLs (цитолитических T-лимфоцитов) после введения PLD
Описанные выше результаты указывают на сильное положительное взаимодействие между PLD и VTX-2337 при борьбе с опухолями. Опосредованное T-клетками CD8+ отторжение является решающим компонентом противоопухолевого иммунного ответа и это отторжение могло бы являться одним из механизмов, опосредующих упомянутое взаимодействие. Важно, что комбинация VTX-2337 плюс PLD вызывает эффективное подавление опухоли.
Во время исследования этого взаимодействия, анализировали качество T-клеточного инфильтрата, появляющегося в ответ на введение PLD, VTX-2337 или их комбинации. TILs из опухолей, извлеченных у мышей NSG-HIS-A2, которым вводили любой из препаратов индивидуально, комбинацию PLD и VTX-2337 или носитель (контрольная группа), изолировали и размножали, используя rhIL-2 (600 IU/мл). В качестве контроля изолировали T-клетки из селезенок мышей NSG-HIS-A2, не имевших опухолей.
Размноженные Ex vivo TILs адоптивно переносили (на 30 и 40 дни после введения опухолевых клеток) мышам NSG, имевшим опухоли OVCAR5. TILs, изолированные либо из контрольных животных, получавших носитель, либо из доноров, получавших PLD, а также T-клетки из селезенок мышей, не имевших опухолей, адоптивно перенесенные реципиентам с опухолями, не смогли бороться с ростом опухолей у мышей-реципиентов (фиг.4B). Однако TILs мышей, получавших комбинацию PLD и VTX-2337 (“PLD/VTX-2337” или “VTX-2337/Доксил”), проявили способность эффективно регулировать рост опухолей OVCAR5 у мышей-реципиентов (фиг.4B). Эти результаты подтвердили, что in vivo PLD и агонист TLR8 в комбинации вызывают эффективный T-клеточный противоопухолевый иммунный ответ.
TILs тестировали на присутствие опухоль-специфичных CTL in vitro. TIL мышей-доноров, которым вводили комбинацию PLD и VTX-2337 эффективно вызывали лизис51Cr меченых целевых клеток OVCAR5 (фиг.4A), тогда как TILs мышей-доноров, получавших только PLD, обладали меньшей литической активностью. Их способность осуществлять лизис целевых клеток была значительно выше, чем у TILs из животных контрольной группы, получавших носитель. Во всех экспериментальных группах, лизис клеток-мишеней под действием TIL был отнесен на счет реакции CTL на антигены, ограниченные MHC-I, поскольку добавление нейтрализующих антител анти-MHC класса I ослабляло уничтожение клеток под действием CTL (фиг.4C). TIL культивировали совместно либо с клетками OVCAR5, либо с клеточными линиями меланомы. TILs доноров, получавших как PLD, так и PLD/VTX-2337, выделяли значительно больше IFNγ в качестве реакции на клетки OVCAR5 по сравнению с клетками меланомы (фиг.4D). TIL из контрольных животных, не получавших препаратов, вырабатывали минимальное количество специфичных IFNγ в ответ на стимуляцию OVCAR5. Лимфоциты, размноженные из селезенок мышей, не имевших опухолей, не проявляли цитолитической активности или не вырабатывали IFNγ в ответ на клетки OVCAR5.
CTLs (цитотоксичные T-клетки или цитотоксичные лимфоциты) из мышей, получавших PLG/VTX-2337, имели значительно более высокий уровень цитотоксической активности по сравнению с аналогичными клетками из мышей, получавших только PLD, подтверждая, что активация TLR8 APCs усиливает выработку специфичных противоопухолевых T-клеток. Активность CTL была с одной стороны ограничена MHC класса I и с другой стороны была специфична в отношении клеток OVCAR5, что было продемонстрировано добавлением mAb против MHC класса I и слабой активностью против клеточных мишеней, не соответствующих HLA-A2+. С помощью экспериментов по адоптивному переносу было продемонстрировано, что увеличение активности опухоль-специфичных CTL в результате введения PLD/VTX-2337 стимулировало противоопухолевую активность in vivo. У мышей NSG, имеющих опухоль, с не воспроизведенной кроветворной системой, которым осуществляли адоптивный перенос 1×107 T-клеток на 30-й и 40-й день после введения OVCAR5, размноженные TILs из мышей, которым вводили VTX-2337/PLD® проявляли способность эффективно подавлять рост опухоли. Примечательно, что клетки, полученные из опухолей мышей, которым вводили только PLD®, оказались не более эффективны, чем клетки мышей из контрольной группы.
Кроме того, полученные результаты демонстрируют, что активация APC под действием VTX-2337 улучшает развитие адаптивного иммунного ответа, вызванного антрациклинами. Хотя формирование опухоль-специфичных CTL является важным компонентом терапевтического действия VTX-2337, при введении в комбинации с PLD, этот эффект может дополняться выделением медиаторов с противоопухолевой активностью. Выделение IFNγ в высоких концентрациях может активировать клетки NK, увеличивая лизис опухолевых клеток. Выработка IL-12 под действием VTX-2337 также играет важную роль в развитии успешной иммунной реакции на опухоли. Сообщается, что этот медиатор активирует NK клетки, усиливает анти-ангиогенные сигнальные пути, дополняет реакцию Th1 и CTL и, кроме того, проявляет непосредственную противоопухолевую активность, которая усиливается под действием THFα. Поэтому производили оценку непосредственной активности медиаторов, выработка которых индуцируется при селективной активации TLR8 под действием VTX-2337, против опухолевых клеток OVCAR5.
TNFα частично опосредует взаимодействие между активацией TLR8 и PLD.
Проводили эксперименты для демонстрации того, что TNFα обуславливают увеличение противоопухолевой активности, наблюдаемое для комбинации Доксил/VTX-2337. Свежие отмученные человеческие PBMCs активировали либо VTX-2337 (1 мкг/мл), либо гранулами анти CD3/28, и через 6 часов собирали образцы среды. Клетки OVCAR5 подвергали действию культуральной среды, через 24 часа проводили оценку апоптоза и через 48 часов оценивали выживаемость клеток.
Помимо выработки опухоль-специфичных CTLs, активация TLR8 может также инициировать врожденные противоопухолевые реакции, включая выделение растворимых медиаторов, например, членов семейства TNF, которые могут воздействовать непосредственно на опухолевые клетки, вызывая апоптоз. Поскольку активация TLR8 связана с выработкой значительных количеств TNFα, как показано на фиг.1, TNFα является возможным медиатором действия VTX-2337. Экспрессию рецептора 1 TNFα (TNFR1) в клетках OVCAR5 исследовали и регистрировали с помощью Вестерн-блоттинга (фиг.5C). Во время исследования чувствительности клеток OVCAR5 к TNFα, клетки инкубировали в течение 24 часов с 20 нг/мл TNFα, т.е. дозой, которая проявляет непосредственное цитотоксическое действие. Несмотря на экспрессию TNFR1, клетки OVCAR5 оказались устойчивы к TNFα-опосредованному апоптозу, что было показано при окрашивании аннексином-V и 7AAD (фиг.5D).
Опухолевые клетки способны противостоять TNFα-опосредованному апоптозу за счет избыточной экспрессии ингибиторного белка, сходного с FAAD-подобным IL-1h-превращающим ферментом (FLICE), или FLIP. Белок FLIP, который может существовать как в длинной (FLIPL, 55 КДа), так и в короткой (FLIPS, 28 КДа) формах способен блокировать апоптоз, вызванный членами семейства TNF, включая TNFα и TRAIL, в различных типах клеток. Клетки OVCAR5 экспрессировали FLIPL, т.е. форму FLIP массой 55 КДа (фиг.5E, полоса CTRL: контрольные необработанные клетки).
Поскольку доксорубицин провоцирует смерть клеток и его активность in vivo усиливается под действием VTX-2337, было произведено исследование, способен ли доксорубицин делать клетки OVCAR5 более восприимчивыми к TNFα-индуцированному апоптозу. Клетки OVCAR5 в течение 24 ч преинкубировали либо с контрольной средой, либо со средой, содержавшей PLD в концентрации 1 мкг/мл, после чего инкубировали либо с контрольной средой, либо со средой, содержавшей TNFα (20 нг/мл) в течение 12 ч. TNFα и Доксил в случае индивидуального применения вызывали минимальный апоптоз, в то время, как для клеток, которые были обработаны комбинацией этих двух агентов, наблюдалось значимое увеличение апоптоза (фиг.5D). С помощью вестерн-блоттинга было обнаружено, что обработка клеток OVCAR5 PLD ингибирует экспрессию FLIP (фиг.5E).
Как показано на фиг.1C и фиг.2, под действием VTX-2337 или комбинации препаратов имела место значительная повышающая регуляция TNFα. Активация семейства TNFα рецепторов на опухолевых клетках может вести к активации каспазы 8, что приводит к апоптозу. Было обнаружено, что клетки OVCAR5 экспрессируют рецептор 1 TNFα, но они практически полностью невосприимчивы к TNFα самому по себе. Однако в том случае, когда клетки OVCAR5 обрабатывали комбинацией агентов, наблюдалось усиление апоптоза по сравнению с индивидуальными агентами. Доксорубицин убивает клетки, встраиваясь между основаниями молекулы ДНК, что нарушает репликацию ДНК и ингибирует трансляцию, приводя к нарушению биосинтеза макромолекул и повреждению ДНК за счет выработки ROS (активных форм кислорода). Кроме того, было продемонстрировано ингибирование экспрессии FLIP клетками OVCAR5, которые были предварительно обработаны PLD, и это дает основание предположить, что нарушение синтеза нового белка делает эти опухолевые клетки более чувствительными к апоптозу, опосредованному членами семейства TNF.
Подводя итог вышесказанному, гибель опухолевых клеток, опосредованная доксорубицином, не является независимой от иммунологических процессов, но опосредуется активацией иммунной системы и развитием адаптивного иммунного ответа, который принимает участие в борьбе с опухолевыми клетками. Однако активность доксорубицина может также ослаблять развитие защитного иммунного ответа вследствие токсического действия иммунной системы. Неожиданно было обнаружено, что добавление агониста TLR8 VTX-2337 в схему лечения улучшает противоопухолевое действие PLD в новой мышиной модели рака яичников, в которой используются мыши NSG-HIS, имеющие опухоли. Было установлено, что введение VTX-2337 усиливает миграцию иммунных клеток в опухолевую ткань и улучшает выработку опухоль-специфичных CTLs, которые способны осуществлять лизис клеток OVCAR5 in vitro и бороться с ростом опухоли in vivo. Активация TLR8 приводит также к выделению большого количества медиаторов, в т.ч. TNFα, IL-12 и IFNγ, которые обладают противоопухолевой активностью и способны дополнительно усиливать противоопухолевую реакцию. TNFα, которые в больших количествах образуются при активации TLR8, способны непосредственно действовать на клетки OVCAR5, вызывая апоптоз, причем клетки становятся более чувствительными к этому сигнальному пути апоптоза, благодаря влиянию доксорубицина на синтез белка. Все эти результаты в сочетании друг с другом демонстрируют, что иммунотерапия может повышать эффективность современных способов лечения рака яичников. Проводится исследование VTX-2337 в комбинации с PLD® в качестве лечения второй линии для пациентов с рецидивирующим раком яичников на поздних стадиях.
Пример 2: Эффективность и селективность VTX-2337
Оценивали полумаксимальную эффективную концентрацию (EC50) VTX-2337 при активации TLR8 и TLR7 на мононуклеарных клетках периферической крови (PBMCs), взятых у 15 здоровых доноров, а также на клетках HEK293, трансфецированных TLR8 или TLR7 и NF-κB регулируемым геном-репортером. Как показано на фиг.6, в клетках PBMCs, VTX-2337-стимулированная выработка TNFα, т.е. маркера активации TLR8, характеризуется значением EC50, равным 74 нМ, и выработка IFNα, т.е. маркера активации TLR7, характеризуется значением EC50>3,333 нМ, показывая, что VTX-2337 в 45 с лишним раз более селективен к TLR8, по сравнению с TLR7. Данные, относящиеся к TLR8 и TLR7 для трансфецированных клеток HEK293, хорошо коррелируют с данными для PBMC, где значение EC50 для TLR8 составляет 70нМ и для TLR7 равно 2,005 нМ. Кроме того, было установлено, что VTX-2337 не обладает активностью в отношении TLR2, TLR3, TLR4, TLR5, TLR6 или TLR9 в концентрациях до 25 мкМ.
Пример 3: VTX-2337 стимулирует ряд цитокинов и хемокинов в цельной крови человека
Иммуностимулирующие свойства VTX-2337 характеризовали с помощью человеческой мультианалитической панели (MAP), версии 1.8 (Rules Based Medicine) для количественного определения 98 анализируемых компонентов, связанных с воспалительными процессами, в т.ч. цитокинов, хемокинов и других белков, продуцируемых лейкоцитами в ответ на активацию TLR7/8. Отбирали образцы цельной крови у 6 нормальных добровольцев и активировали in vitro VTX-2337 в концентрациях 0,1, 0,3, 1,0 и 3,0 мкМ, используя систему Instant Leukocyte Culture System (систему быстрого культивирования лейкоцитов). Совместное культивирование с VTX-2337 привело к дозозависимому увеличению количества иммунных медиаторов, в т.ч. TNFα, IL-1240, IL-1β и MIP-1β, как показано на фиг.7.
Пример 4: VTX-2337 активирует моноциты и миелоидные дендритные клетки (mDCs), но не плазмацитоидные дендритные клетки (pDCs)
Для определения клеточной специфичности VTX-2337, человеческие PBMCs от здоровых доноров стимулировали 0,8 мкМ VTX-2337 и оценивали выработку внутриклеточных цитокинов в определенных субпопуляциях клеток, присутствующих в PBMCs, с помощью цитометрии в потоке. Как показано на фиг.8, данные выражены в процентных долях клеток, позитивных в отношении IL-12, TNFα и IFNα для моноцитов (CD14+), pDC (CD123+) и mDC (CD11c+). Каждая точка данных отображает реакцию для индивидуального донора (n=10). Горизонтальные бары отображают средние значения для группы. Внутриклеточные уровни IL-12 и TNFα повышались в обработанных VTX-2337 моноцитах и mDC, но не в pDCs, что согласуется с моделью клеточной экспрессии TLR8.
Пример 5: Клиническое исследование VTX-2337 фазы I
Проводили клиническое исследование с повышением дозы для оценки безопасности, переносимости и фармакологии VTX-2337 при введении взрослым субъектам с солидными опухолями или лимфомой на поздних стадиях. Основные цели исследования заключались в оценке безопасности и фармакокинетики VTX-2337 и в выявлении токсичности, ограничивающей дозировку. Дополнительные цели исследования заключались в оценке фармакодинамической реакции на VTX-2337 и в определении максимальной переносимой дозы (MTD) для одного цикла введения VTX-2337.
Методика исследования:
VTX-2337 вводили еженедельно с помощью подкожной инъекции, в дни 1, 8 и 15 28-дневного цикла введения, в течение двух циклов. Используя модифицированную схему увеличения дозировок Фибоначчи, группы, в которых осуществлялось последовательное введение, получали дозы VTS-2337 в пределах от 0,1 мг/м2 до 3,9 мг/м2. Образцы плазмы для фармакокинетического анализа отбирали после первого введения в первом цикле и для фармакодинамического анализа после первого введения в первом и втором цикле.
Клинические реакции оценивали с помощью RECIST (критерии оценки реакции при солидных опухолях), и субъектам с CR (т.е. полной реакцией), PR (т.е. частичной реакцией) или SD (т.е. стабильным заболеванием) разрешали провести дополнительные циклы введения.
Демографические данные пациентов:
В исследовании было задействовано тридцать три субъекта с различными солидными злокачественными опухолями на поздних стадиях в 8 последовательных группах. У участников экспериментов имелось следующее распределение раковых заболеваний: колоректальный рак (n=9 или 27% об общего числа участников), рак поджелудочной железы (n=6/18%), меланома (n=5/15%), холангиокарцинома (n=2/6%), почечно-клеточный рак (n=2/6%) и по одному субъекту (3%) с гепатоклеточным раком, раком груди, раком эндометрия, раком простаты, раком яичников, аденокистозной карциномой языка, метастатической базально-клеточной карциномой, нейроэндокринной карциномой двенадцатиперстной кишки и печени, опухолью неизвестного происхождения.
Образцы плазмы отбирали через 0,5, 1, 1,5, 2, 4, 8 и 24 часа после подкожного введения первой дозы VTX-2337 и количественно определяли уровни VTX-2337 в плазме с помощью ЖХ-МС/МС. VTX-2337 быстро поступал в системный кровоток при среднем значении Tmax от 0,5 до 0,8 часов после введения. VTX-2337 также быстро выводился из кровотока со средним периодом полужизни (t1/2) от 1,7 до 6,7 часа. Как максимальные уровни в плазме (Cmax), так и общее время системного воздействия возрастали с повышением дозировки. Рассчитывали нормализованные по дозе значения (DN) Cmax и AUC(0-∞). Чаще всего, в исследованном диапазоне дозировок, фармакокинетика VTX-2337, по-видимому, является линейной. Результаты исследований фармакокинетики показаны на фиг.9 и в приведенной ниже таблице 1.
Для оценки фармакодинамической (PD) реакции на VTX-2337, отбирали образы крови через 0, 4, 8 и 24 часа после подкожного введения первой дозы VTX-2337 первого цикла. Уровни иммунных медиаторов в плазме определяли количественно, используя человеческую мультианалитическую панель (MAP), версии 1.8 (Rules Based Medicine). Между 4 и 8 часами после введения препарата наблюдалось дозозависимое увеличение числа биомаркеров, в т.ч. G0CSF, MCP-1, MIP-1β и TNFα, причем эти уровни, как правило, возвращались к исходным значениям в течение 24 часов. Для сравнения с группой онкологических больных показаны уровни медиаторов в плазме, отобранной у 9 здоровых добровольцев. Фармакодинамические реакции после подкожного введения VTX-2337 продемонстрированы ниже в таблице 2.
Фармакодинамические реакции на VTX-2337 измеряли после введения первых доз первого и второго циклов введения VTX-2337 (день 1 и день 29) для выяснения того, вызывает ли повторное введение сравнимые эффекты. Бары на фиг.10A и 10B отражают уровни G-CSF и MIP-1β у индивидуальных пациентов в каждой группе, которым осуществляли более одного цикла введения VTX-2337. Не наблюдалось ни увеличения ни существенного ослабления иммунного ответа после одного цикла введения VTX-2337. Другими словами, фармакодинамическая реакция остается постоянной на протяжении нескольких циклов введения.
Профиль нежелательных явлений:
VTX-2337 в основном является безопасным и хорошо переносимым. Наиболее обычными нежелательными явлениями, связанными с этим препаратом, являлись реакции в месте инъекции, умеренные лихорадочные явления и гриппоподобные симптомы. Такие симптомы после введения иммуномодулирующего агента не являются неожиданными. Не наблюдалось нежелательных гематологических явлений или реакций желудочно-кишечного тракта, связанных с препаратом.
В итоге, удалось установить, что еженедельное подкожное введение нового агониста TLR8 VTX-2337 в целом является безопасным и хорошо переносится; уровни VTX-2337 в плазме и PD реакция на VTX-2337 увеличивались дозозависимым образом; и что подкожное введение VTX-2337 стимулировало выработку многих медиаторов воспаления, в т.ч. цитокинов и хемокинов, указывая на активацию врожденного иммунного ответа.
Включение посредством ссылок
Полное содержание каждого из патентных документов и научных статей, упомянутых в настоящей заявке, включено в заявку посредством ссылок для любых целей.
Эквиваленты
Настоящее изобретение можно воплотить в других конкретных формах, не отступая от его сути или существенных характеристик. Поэтому описанные выше варианты осуществления следует считать во всех отношениях иллюстративными, а не ограничивающими объем описанного изобретения. Таким образом, объем изобретения обозначен в приложенной формуле изобретения, а не в предшествующем описании, и считается, что все изменения формулы изобретения, которые соответствуют смыслу и рамкам эквивалентности, охвачены изобретением.
Реферат
Группа изобретений касается химиотерапии. Предложены: способ лечения рака, включающий введение пациенту состава, содержащего бензо[b]азепиновый агонист TLR8 2-амино-N,N-дипропил-8-(4-(пирролидин-1-карбонил)фенил)-3Н-бензо[b]азепин-4-карбоксамид (VTX) или его фармацевтически приемлемую соль и фармацевтически приемлемый носитель, в комбинации с доксорубицином, и набор для лечения рака, включающий контейнеры с указанными соединениями. Технический результат состоит в синергизме подавления объёма опухоли заявленным сочетанием VTX+ доксорубицин. 2 н. и 31 з.п. ф-лы, 2 табл., 24 ил.

Комментарии