Способ введения dsрнк или днк, способной к продуцированию dsрнк в c.elegans (варианты), способ негативной регуляции экспрессии интересующего гена в c.elegans (варианты) - RU2240349C2
Код документа: RU2240349C2
Чертежи



Описание
Настоящее изобретение касается характеристики или идентификации функции гена с использованием ингибирования двунитевой РНК (dsPHKi) и способов идентификации ДНК, ответственной за индукцию конкретного фенотипа в клетке, а также способа определения функции последовательностей известных генов.
Недавно в Nature Vol. 391, pp. 806-811, February 98, было описано, что введение двунитевой РНК в клетку приводит к сильной и специфичной интерференции с экспрессией эндогенных генов в этой клетке, причем эта интерференция является по существу более эффективной, чем обеспечиваемая одной из двух нитей РНК индивидуально, как предполагается в антисмысловой (antisense) технологии. Было также обнаружено, что у червя нематоды Caenorhabditis elegans (C.elegans) это специфичное ослабление активности гена происходит, когда РНК вводят в геном или в полость тела этого червя.
Авторы настоящего изобретения использовали эту методику, а затем применили ее для разработки новых и имеющих изобретательский уровень способов определения функций генов или фрагментов ДНК, которые секвенированы в различных проектах, таких как, например, проект генома человека, и которые еще нужно согласовывать с конкретной функцией, а также для использования при идентификации ДНК, ответственной за придание конкретного фенотипа.
Таким образом, согласно первому аспекту настоящего изобретения предложен способ идентификации ДНК, ответственной за придание фенотипа клетке, при котором а) конструируют кДНК или геномную библиотеку ДНК указанной клетки в ориентации относительно промотора (промоторов), способного поддерживать транскрипцию указанной кДНК или ДНК на двунитевую (ds) РНК при связывании соответствующего фактора транскрипции с указанным промотором (промоторами), б) вводят указанную библиотеку в одну или более чем одну из указанных клеток, содержащих указанный фактор транскрипции, и в) идентифицируют и выделяют желаемый фенотип указанной клетки, содержащей указанную библиотеку, и идентифицируют фрагмент ДНК или кДНК из указанной библиотеки, ответственный за придание указанного фенотипа.
В предпочтительном воплощении изобретения перед стадией б) эта библиотека может быть организована в иерархические пулы, как описано более детально в предложенных примерах, так, чтобы она включала в себя, например, семейства генов.
Согласно следующему аспекту изобретения предложен также способ определения функции известной последовательности ДНК, при котором а) идентифицируют гомолог (гомологи) указанной ДНК в клетке, б) выделяют гомолог (гомологи) соответствующей ДНК или его фрагмент из указанной клетки, в) клонируют указанный гомолог или его фрагмент в соответствующий вектор в ориентации относительно промотора (промоторов), способного поддерживать транскрипцию dsPHK при связывании соответствующего фактора транскрипции с указанными промоторами, г) вводят указанный вектор в указанную клетку со стадии а), содержащую указанный фактор транскрипции, и д) идентифицируют фенотип указанной клетки по сравнению с диким типом.
В каждом аспекте изобретения нуклеотидная или ДНК последовательность может быть представлена либо в смысловой, либо в антисмысловой ориентации относительно одиночного промотора, который обладает свойствами, определенными выше, или альтернативно она может быть представлена между двумя идентичными промоторами. В обоих воплощениях dsPHK обеспечивается транскрипцией, инициируемой с этого промотора после его связывания с соответствующим фактором транскрипции.
Клетка согласно изобретению либо может быть выделена из организма, либо может содержаться в организме. Когда клетка содержится в организме, этот организм может быть адаптирован к экспрессии соответствующего фактора транскрипции. Этот организм может представлять собой любой из следующих: растение, животное, гриб или дрожжи, но предпочтительно может представлять собой червя нематоду C.elegans, который может представлять собой любое из следующего: дикий тип, мутант nuc-1 или pha-ts C.elegans или комбинацию указанных мутаций. В альтернативном воплощении ДНК или кДНК библиотеку, либо гомолог ДНК или его фрагмент можно предпочтительно трансфецировать или трансформировать в микроорганизм, такой как бактериальная или дрожжевая клетка, который можно скармливать организму, который предпочтительно представляет собой червя нематоду C.etegans. В данном воплощении изобретения микроорганизм может быть адаптирован к экспрессии соответствующего фактора транскрипции. Предпочтительно этот микроорганизм представляет собой E.coli.
В каждом аспекте изобретения ДНК библиотеку, гомолог ДНК или фрагмент ДНК можно конструировать в подходящем ДНК векторе, который содержит последовательность нуклеотидов, которая кодирует указанный фактор транскрипции. Альтернативно указанный фактор транскрипции кодируется дополнительным вектором. Даже в следующем альтернативном воплощении клетка или организм могут либо экспрессировать, либо быть адаптированными к экспрессии указанного фактора транскрипции. Предпочтительно, любой из векторов, используемых в способе согласно изобретению, содержит селективный маркер, который может представлять собой, например, нуклеотидную последовательность, кодирующую sup-35 или его фрагмент. Эту нуклеотидную последовательность можно ориентировать относительно промотора так, что связывание фактора транскрипции с этим промотором инициирует транскрипцию ДНК на двунитевую РНК. На фиг.10 проиллюстрированы векторы и ориентация последовательности ДНК, которая обеспечивает продуцирование двунитевой РНК в C.etegans. Таким образом, в одном воплощении ДНК локализована между двумя промоторами на векторе, способном экспрессировать dsPHK при связывании соответствующего фактора транскрипции с указанными промоторами. Альтернативно этот вектор содержит две копии последовательности ДНК, организованные в смысловой и в антисмысловой ориентации относительно промотора, и причем этот маркер является селективным, когда содержится в мутанте pha-1 C.elegans. Предпочтительно эти промоторы представляют собой любые из Т7, Т3 или SP6 промоторов, и фактор транскрипции включает в себя соответствующую полимеразу.
Предпочтительно селективный маркер включает в себя нуклеотидную последовательность, способную ингибировать или предотвращать экспрессию гена в указанной клетке, причем этот ген является ответственным за придание известного фенотипа. Эта нуклеотидная последовательность может представлять собой участок указанного гена, либо быть идентичной указанному гену, который придает указанный фенотип, причем эта нуклеотидная последовательность сама по себе ориентирована относительно подходящего промотора (промоторов), способного инициировать транскрипцию двунитевой РНК при связывании соответствующего фактора транскрипции с указанным промотором (промоторами). Альтернативно эта нуклеотидная последовательность может представлять собой участок указанной последовательности гена или быть идентичной указанной последовательности гена, который придает указанный фенотип, причем эта нуклеотидная последовательность является такой, что дает возможность интеграции указанного подходящего или дополнительного вектора посредством гомологичной рекомбинации в геном указанной клетки, и после указанной интеграции указанная нуклеотидная последовательность способна ингибировать экспрессию указанной последовательности гена, придающего указанный фенотип. В данном воплощении указанная нуклеотидная последовательность содержит стоп-кодоны, достаточные для предотвращения трансляции указанной нуклеотидной последовательности после ее интеграции в указанный геном.
Предпочтительно при указанном способе к указанной клетке или организму можно добавлять соединения в целях скрининга на желаемые фенотипы, такие как, например, устойчивость или чувствительность к этому соединению по сравнению с диким типом. Промоторы предпочтительно являются индуцируемыми. Фактор транскрипции в некоторых воплощениях может иметь фаговое происхождение, как, например, Т7 полимераза, управляемая фаговым промотором. Однако когда используют C.elegans, можно применять специфичный для червей или тканеспецифичный промотор, такой как, например, let858, SERCA, UL6, myo-2 или myo-3. Предпочтительно штамм E.coli представляет собой штамм, отрицательный по РНКазе III, и даже более предпочтительно представляет собой РНКазо-отрицательный штамм.
В следующем аспекте настоящего изобретения предложен способ создания трансгенного организма, не являющегося человеком, содержащего экзогенный фактор транскрипции и трансген, содержащий промотор, операбельно сцепленный с фрагментом ДНК, который экспрессируется при связывании с ним указанного фактора транскрипции, при котором: а) получают первый трансгенный организм, содержащий первую конструкцию, включающую в себя ДНК, кодирующую экзогенный фактор транскрипции, и второй трансгенный организм, содержащий вторую конструкцию, включающую в себя по меньшей мере один промотор, операбельно сцепленный с желаемой последовательностью ДНК, которая экспрессируется при связывании с ним фактора транскрипции указанного первого трансгенного организма, б) скрещивают указанные первый и второй трансгенные организмы и отбирают потомство, экспрессирующее указанную желаемую последовательность ДНК. В одном воплощении указанные первый и второй трансгенные организмы создают посредством трансформации указанных первой и второй конструкций в соответствующие микроорганизмы для последующего скармливания соответствующему организму. Предпочтительно указанная вторая конструкция содержит указанную желаемую последовательность ДНК в такой ориентации относительно указанного промотора, чтобы он был способен инициировать транскрипцию указанной ДНК в dsPHK при связывании с ним указанного фактора транскрипции. В данном воплощении указанная вторая конструкция содержит два промотора, фланкирующие указанную желаемую последовательность ДНК, причем эти промоторы могут инициировать транскрипцию указанной последовательности ДНК в dsPHK при связывании указанного фактора транскрипции с указанными промоторами. Альтернативно указанная последовательность ДНК представлена в смысловой и в антисмысловой ориентации относительно указанного промотора так, чтобы продуцировать dsPHK при связывании этого фактора транскрипции с этими промоторами. В каждом из этих воплощений первую и/или вторую конструкции можно предпочтительно обеспечивать репортерным геном, операбельно сцепленным с промотором, который способен инициировать транскрипцию указанного репортерного гена при связывании с ним указанного фактора транскрипции. Предпочтительно этот репортерный ген кодирует любое из следующего: люцифераза, зеленый флуоресцентный белок, β-галактозидаза или β-лактамаза.
В настоящее изобретение также включен способ оценивания клонов, идентифицированных в экспериментах с дрожжевыми двухгибридными векторами, причем эти эксперименты хорошо известны специалистам в данной области и были впервые предложены Chien et al. (1991) для обнаружения белок-белковых взаимодействий. При этом способе согласно изобретению обеспечивают конструкцию, включающую в себя ДНК, кодирующую белок, идентифицированный в эксперименте с двухгибридным вектором, причем эта конструкция является такой, что указанная ДНК представлена в ориентации относительно одного или более чем одного промотора, способного поддерживать транскрипцию указанной ДНК в двунитевую РНК при связывании соответствующего фактора транскрипции с указанными промоторами; трансформируют клетку, такую как бактериальная клетка, или альтернативно трансформируют организм, содержащий указанный фактор транскрипции, указанными конструкциями, и идентифицируют фенотипическое изменение в указанной клетке или в указанном организме, который может представлять собой C.elegans или тому подобный, по сравнению с диким типом. Предпочтительно этот фактор транскрипции является индуцируемым в этой клетке или в этом организме. Еще раз, эта последовательность ДНК может быть локализована либо между двумя промоторами, либо в обеих ориентациях, как смысловой, так и антисмысловой, относительно одиночного промотора, как описано выше. Предпочтительно этот промотор представляет собой промотор фаговой полимеразы, а указанный фактор транскрипции представляет собой РНК-полимеразу, и предпочтительно Т7 полимеразу. В объем настоящего изобретения также включены векторы, используемые для трансформации указанных клеток или указанных организмов, а также сами эти клетки или организмы.
В следующем аспекте настоящего изобретения предложен способ облегчения инвазии растений вредителями, при котором а) идентифицируют последовательность ДНК от указанного вредителя, которая является критической для его выживания, роста, пролиферации или воспроизводства, б) клонируют указанную последовательность со стадии а) или ее фрагмент в подходящий вектор относительно одного или более чем одного промотора, способного транскрибировать указанную последовательность в РНК или dsPHK при связывании соответствующего фактора транскрипции с указанными промоторами, и в) вводят указанный вектор в растение.
Таким образом, предпочтительно, способ согласно изобретению обеспечивает особенно селективный механизм облегчения инвазии вредителями и в некоторых случаях паразитарной инвазии растений так, что когда вредитель питается на растении, он будет ферментативно расщеплять экспрессируемую dsPHK в этом растении, таким образом ингибируя экспрессию ДНК внутри этого вредителя, которая является критической для его роста, выживания, пролиферации или воспроизводства. В предпочтительном воплощении вредитель может представлять собой любой из следующих: Tylenchulus ssp., Radopholus ssp., Rhadinaphelenchus ssp., Heterodera ssp., Rotylenchulus ssp., Pratylenchus ssp., Belonolaimus ssp., Canjanus ssp., Meloidogyne ssp., Globodera ssp., Nacobbus ssp., Ditylenchus ssp., Aphelenchoides ssp., Hirschmenniella ssp., Anguina ssp., Hoplolaimus ssp., Heliotylenchus ssp., Criconemella ssp., Xiphinema ssp., Longidorus ssp., Trichodorus ssp., Paratrichodorus ssp., Aphelenchs ssp. Последовательность ДНК или ее фрагмент согласно данному аспекту изобретения можно клонировать между двумя тканеспецифичными промоторами, как, например, между двумя корнеспецифичными промоторами.
Следующий аспект изобретения касается вектора, используемого в каждом из способов по изобретению для конструирования указанной библиотеки, причем этот вектор содержит два идентичных промотора, ориентированных так, что они способны инициировать транскрипцию последовательности ДНК, локализованной между указанными промоторами, в dsPHK при связывании соответствующего фактора транскрипции с указанными промоторами. Эта последовательность ДНК может, например, включать в себя множественный сайт клонирования. Предпочтительно этот вектор экспрессии содержит нуклеотидную последовательность, кодирующую селективный маркер. В одном воплощении эта нуклеотидная последовательность, кодирующая указанный селективный маркер, локализована между двумя идентичными промоторами, ориентированными так, что они способны инициировать транскрипцию ДНК, локализованной между указанными промоторами, на двунитевую РНК при связывании соответствующего фактора транскрипции с указанными промоторами. Предпочтительно этот селективный маркер включает в себя нуклеотидную последовательность, кодирующую sup-35, для введения в C.elegans, имеющий мутацию pha-1.
Предпочтительно фактор транскрипции включает в себя фаговую полимеразу, которая связывается либо с соответствующим фаговым промотором, либо со специфичным для C.elegans промотором, и даже более предпочтительно Т7 полимеразу. Предпочтительно вектор включает в себя множественный сайт клонирования между указанными идентичными промоторами.
В следующем аспекте изобретения предложен вектор экспрессии для экспрессии соответствующего фактора транскрипции для использования в способе согласно изобретению, причем этот вектор содержит последовательность нуклеотидов, кодирующую указанный фактор транскрипции, операбельно сцепленную с подходящими последовательностями регуляции экспрессии. Предпочтительно эти последовательности регуляции экспрессии включают в себя промоторы, которые представляют собой индуцируемые, конститутивные, общие или тканеспецифичные промоторы, либо их комбинации. Предпочтительно фактор транскрипции включает в себя фаговую полимеразу, и предпочтительно Т7, Т3 или SP6 РНК-полимеразу.
В следующем аспекте изобретения предложена селективная система для идентификации трансформации клетки или организма вектором согласно изобретению, причем эта система включает в себя вектор согласно изобретению, где указанный селективный маркер включает в себя нуклеотидную последовательность, способную ингибировать или предотвращать экспрессию гена в указанной клетке или в указанном организме, причем этот ген является ответственным за придание известного фенотипа. Предпочтительно указанная нуклеотидная последовательность соответствует участку указанного гена или является идентичной указанному гену, который придает указанный известный фенотип, и причем сама эта нуклеотидная последовательность локализована между двумя идентичными промоторами, способными инициировать транскрипцию двунитевой РНК при связывании с ними соответствующего фактора транскрипции. Альтернативно эта нуклеотидная последовательность включает в себя нуклеотидную последовательность, которая представляет собой участок указанной последовательности гена или является идентичной указанной последовательности гена, который придает известный фенотип указанной клетке или указанному организму, и которая является такой, что после интеграции указанного вектора посредством гомологичной рекомбинации в хромосому указанной клетки или указанного организма указанная последовательность ингибирует экспрессию указанной последовательности гена, придающего указанный известный фенотип. Предпочтительно согласно этому воплощению эта нуклеотидная последовательность содержит стоп-кодоны, достаточные для предотвращения трансляции этой нуклеотидной последовательности после интеграции в указанную хромосому. Предпочтительно последовательность известного гена включает в себя ген sup-35 или его фрагмент, который является селективным при идентификации потомства, растущего при температуре выше 25°С, после введения в мутант pha-1 et123ts червя C.elegans.
В следующем аспекте изобретения предложена указанная последовательность известного гена, включающая в себя ген sup-35 или его фрагмент, который является селективным при идентификации потомства, растущего при температуре выше 25°С, после введения указанного вектора в мутант pha-1 et123ts червя C.elegans. В еще одном аспекте предложен способ определения функции последовательности ДНК многоклеточного организма, при котором а) обеспечивают i) конструкцию, содержащую фрагмент указанной ДНК, клонированный между двумя промоторами, способными поддерживать транскрипцию в указанном многоклеточном организме, в многоклеточном организме, способном инициировать транскрипцию с указанного промотора; б) идентифицируют фенотип указанного многоклеточного организма по сравнению с диким типом.
Настоящее изобретение можно понять более ясно с помощью следующих примеров, которые приведены исключительно для примера, со ссылкой на сопровождающие чертежи, где:
Фиг.1 представляет собой нуклеотидную последовательность плазмиды PGN1 в соответствии с настоящим изобретением.
Фиг.2 представляет собой нуклеотидную последовательность плазмиды PGN100 в соответствии с настоящим изобретением.
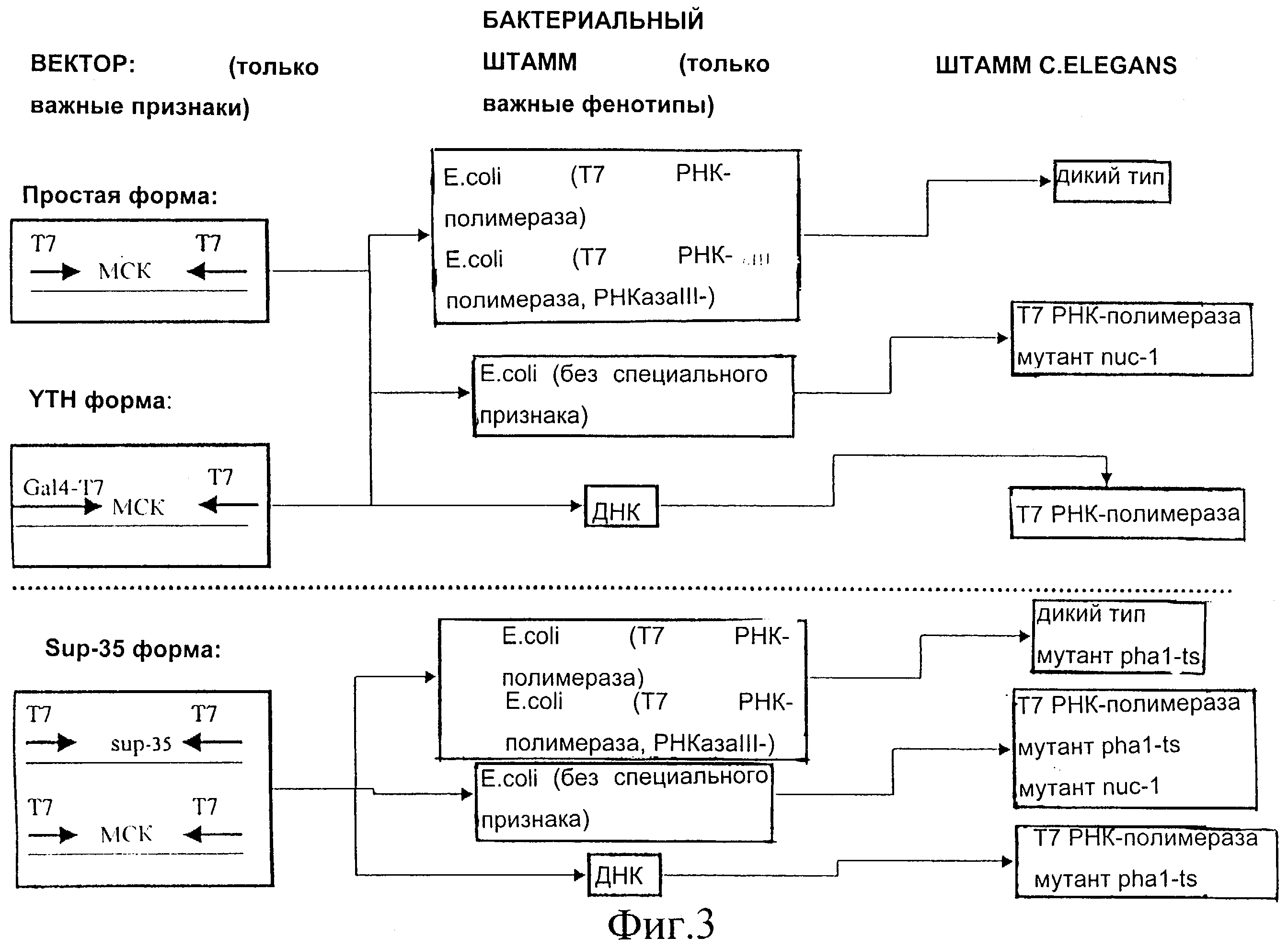
Фиг.3 представляет собой схематическое изображение используемых векторов и режим трансформации, используемый в способах согласно настоящему изобретению.
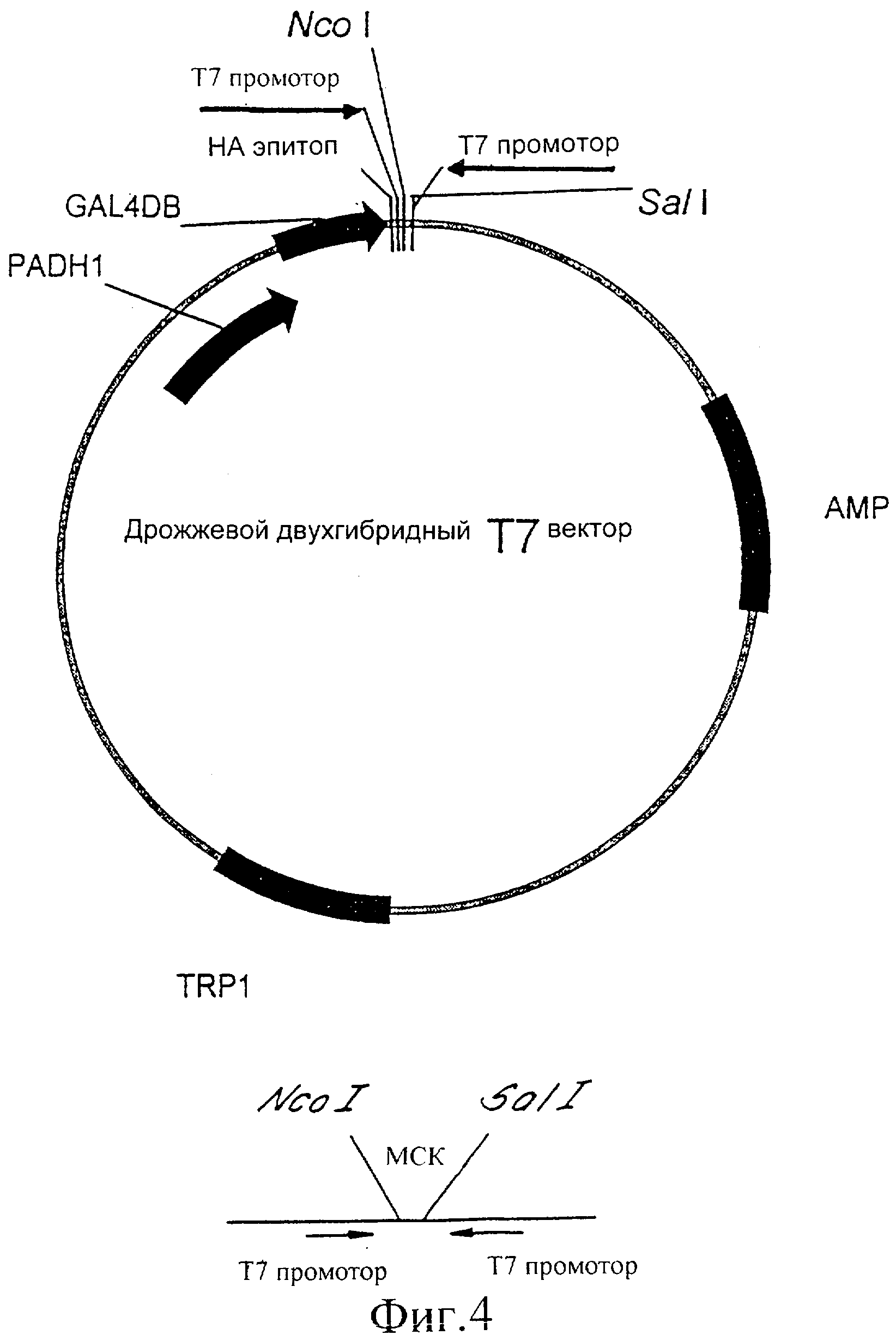
Фиг.4 представляет собой иллюстрацию вектора экспрессии, используемого в соответствии с изобретением.
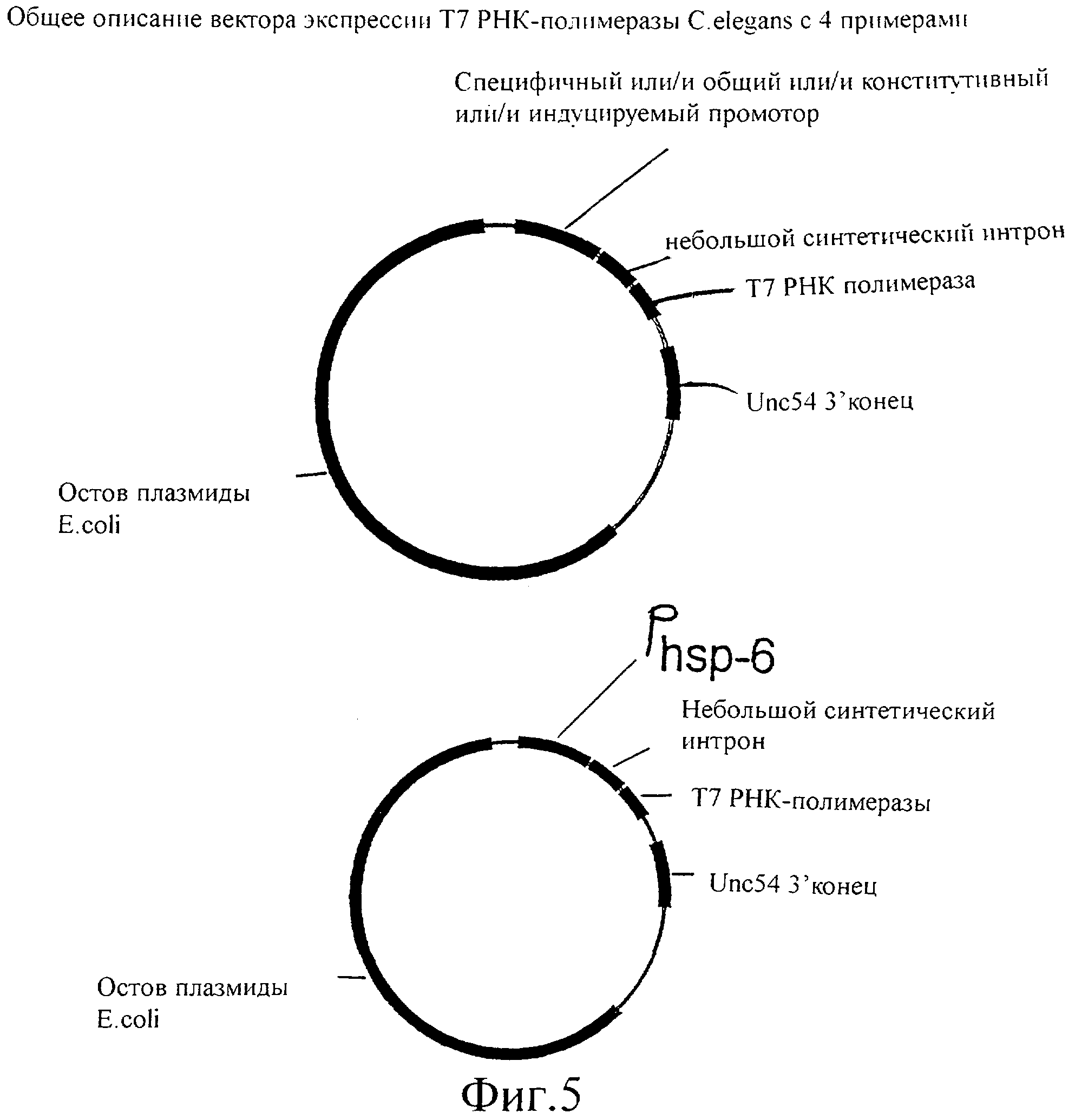
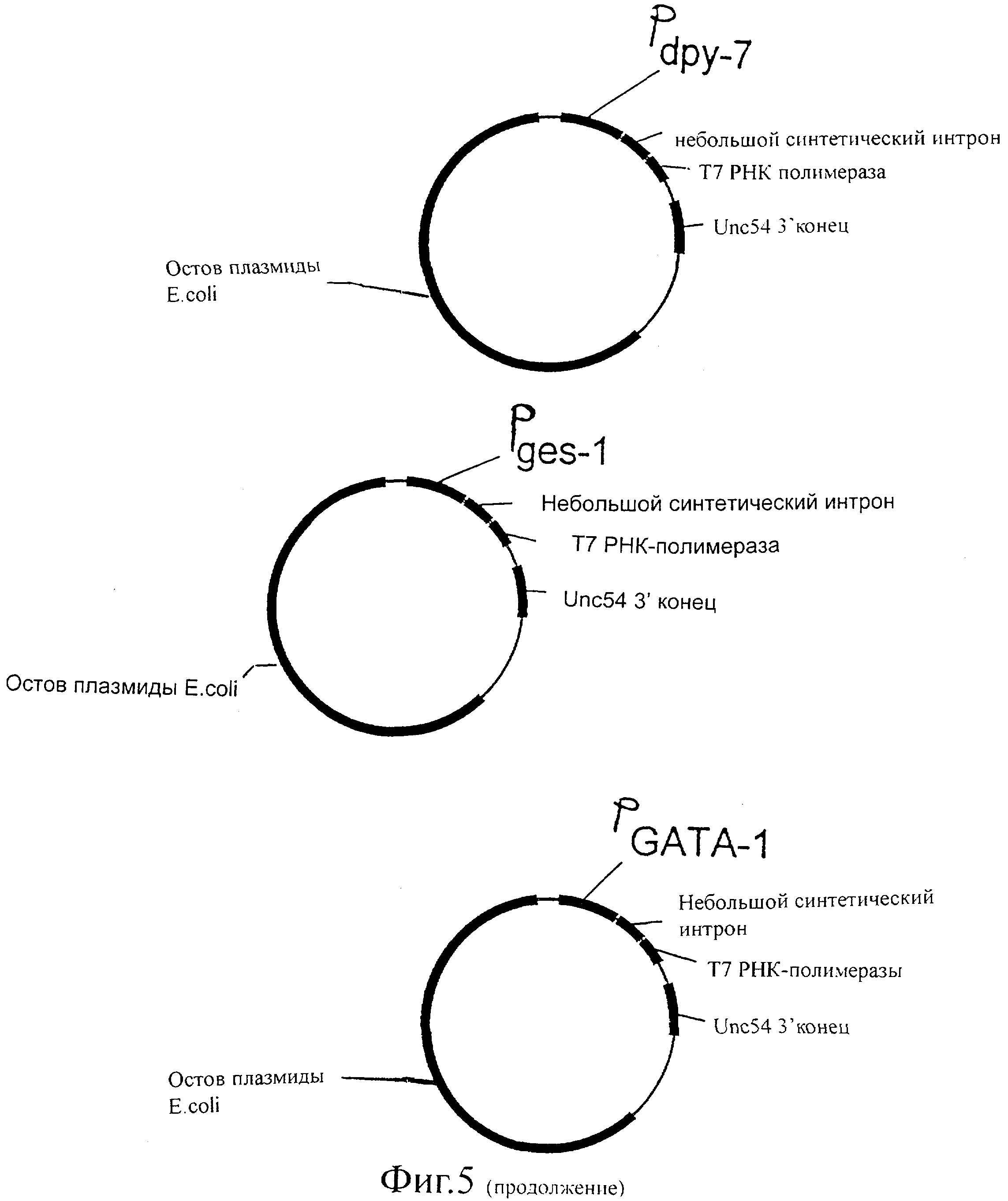
Фиг.5 представляет собой схематическую иллюстрацию векторов экспрессии Т7 РНК-полимеразы, используемых для трансформации C.elegans.
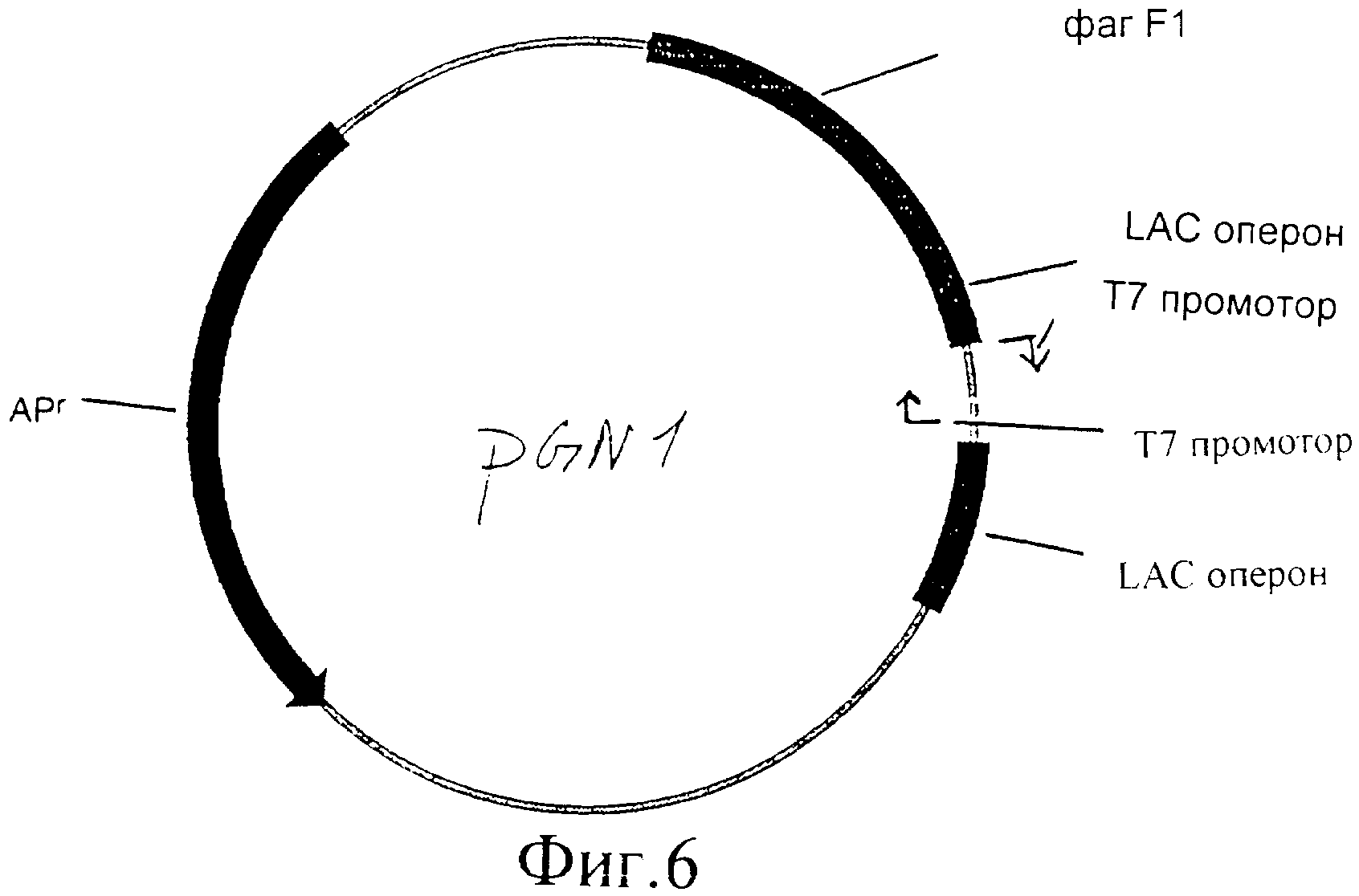
Фиг.6 представляет собой иллюстрацию плазмиды PGN1.
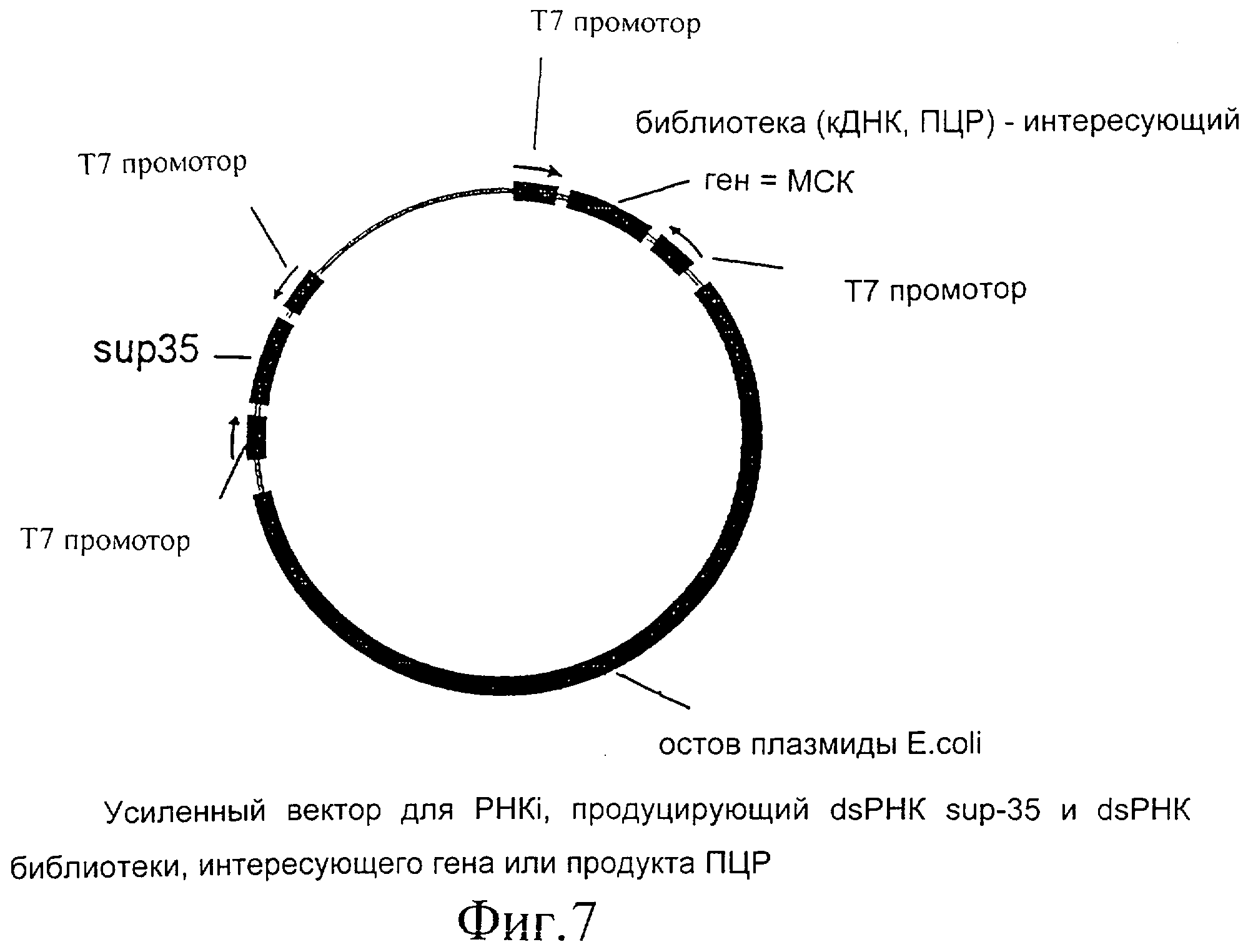
Фиг.7 представляет собой диаграммное изображение усиленного вектора для dsPHK ингибирования, кодирующего sup-35 dsPHK.
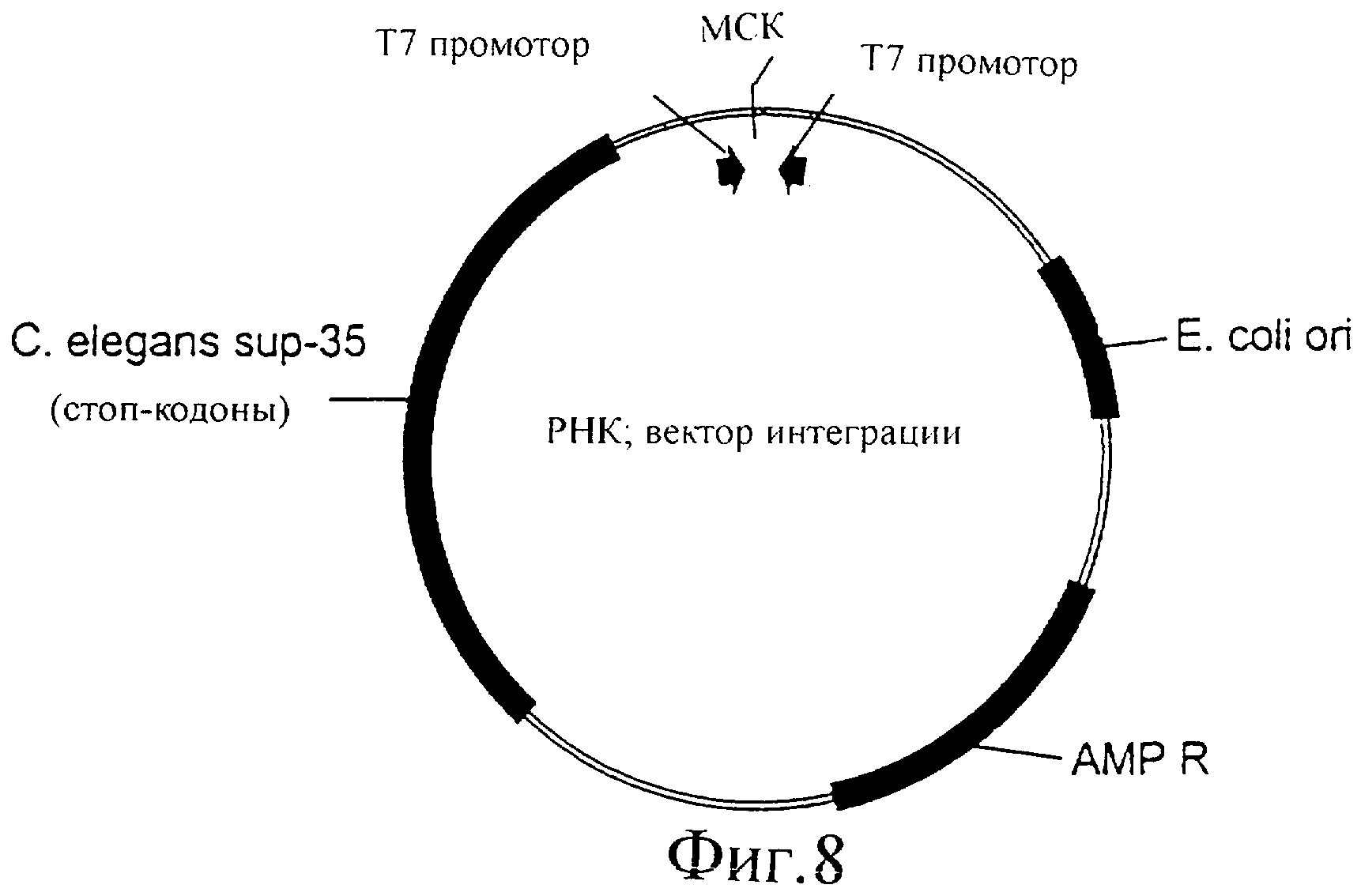
Фиг.8 представляет собой иллюстрацию вектора для интеграции в геном C.elegans.
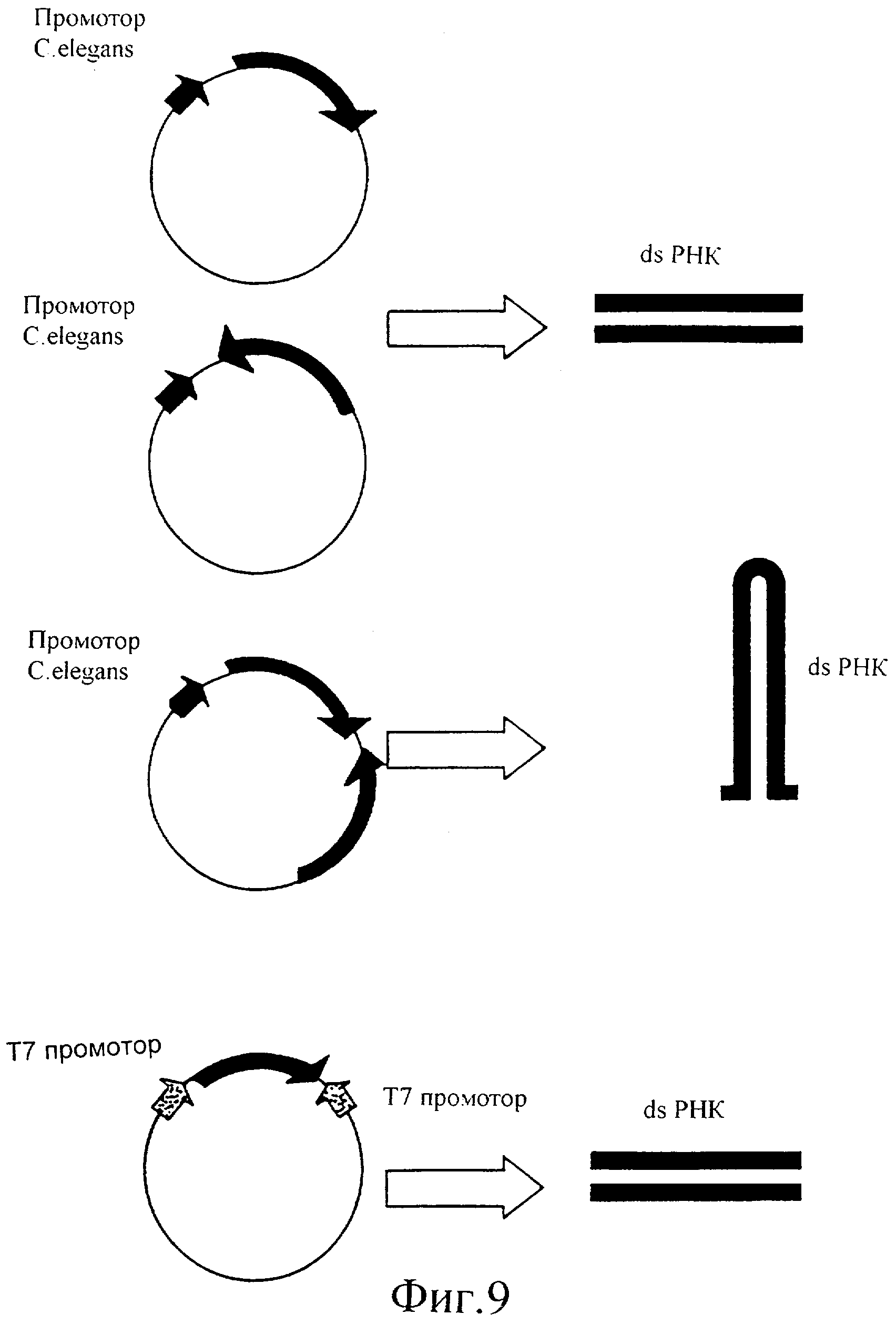
Фиг.9 представляет собой иллюстрацию положения последовательности (последовательностей) ДНК относительно подходящего промотора для инициации экспрессии dsPHK с этой последовательности (последовательностей) ДНК.
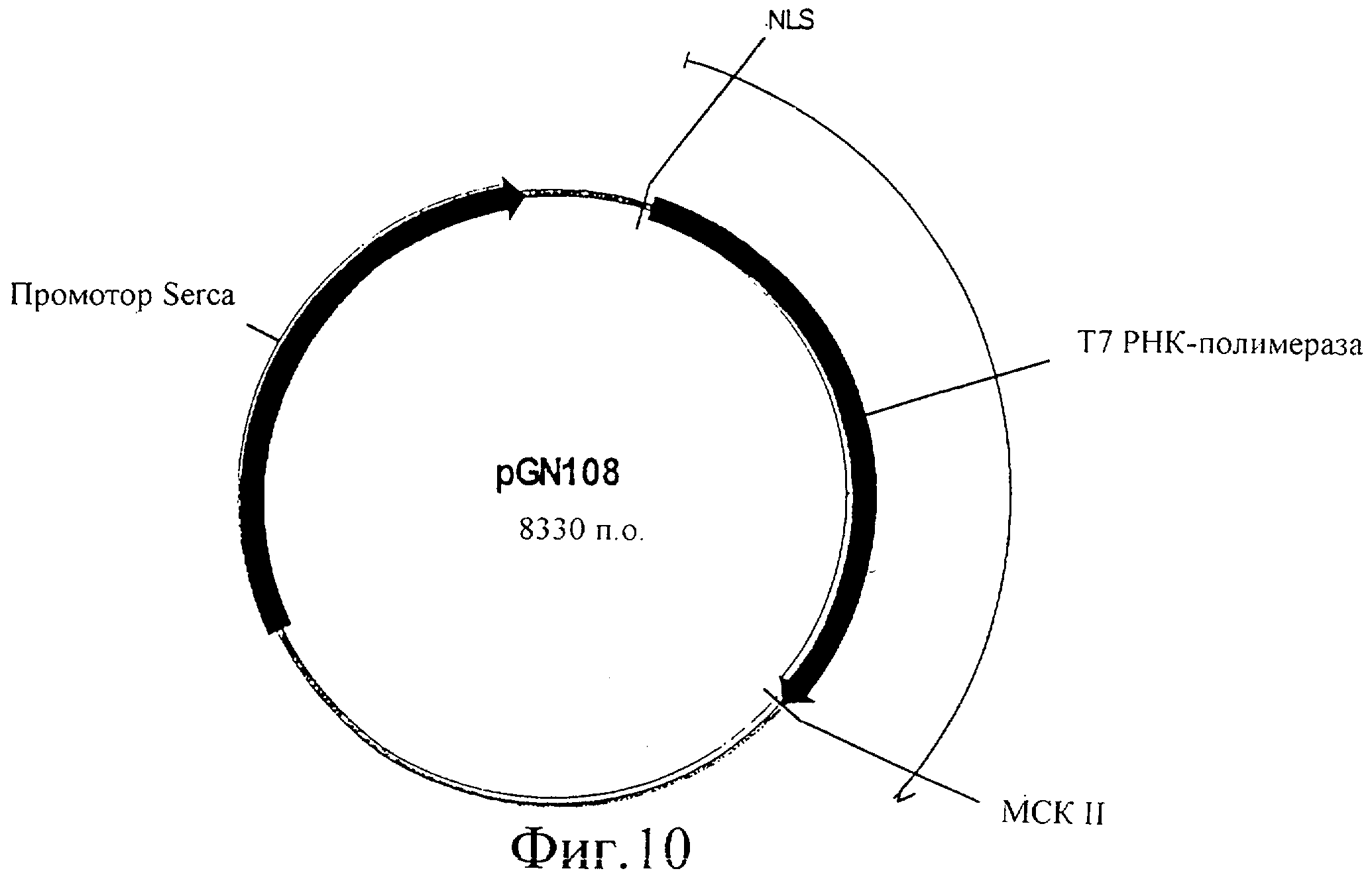
Фиг.10 представляет собой изображение плазмиды pGN108.
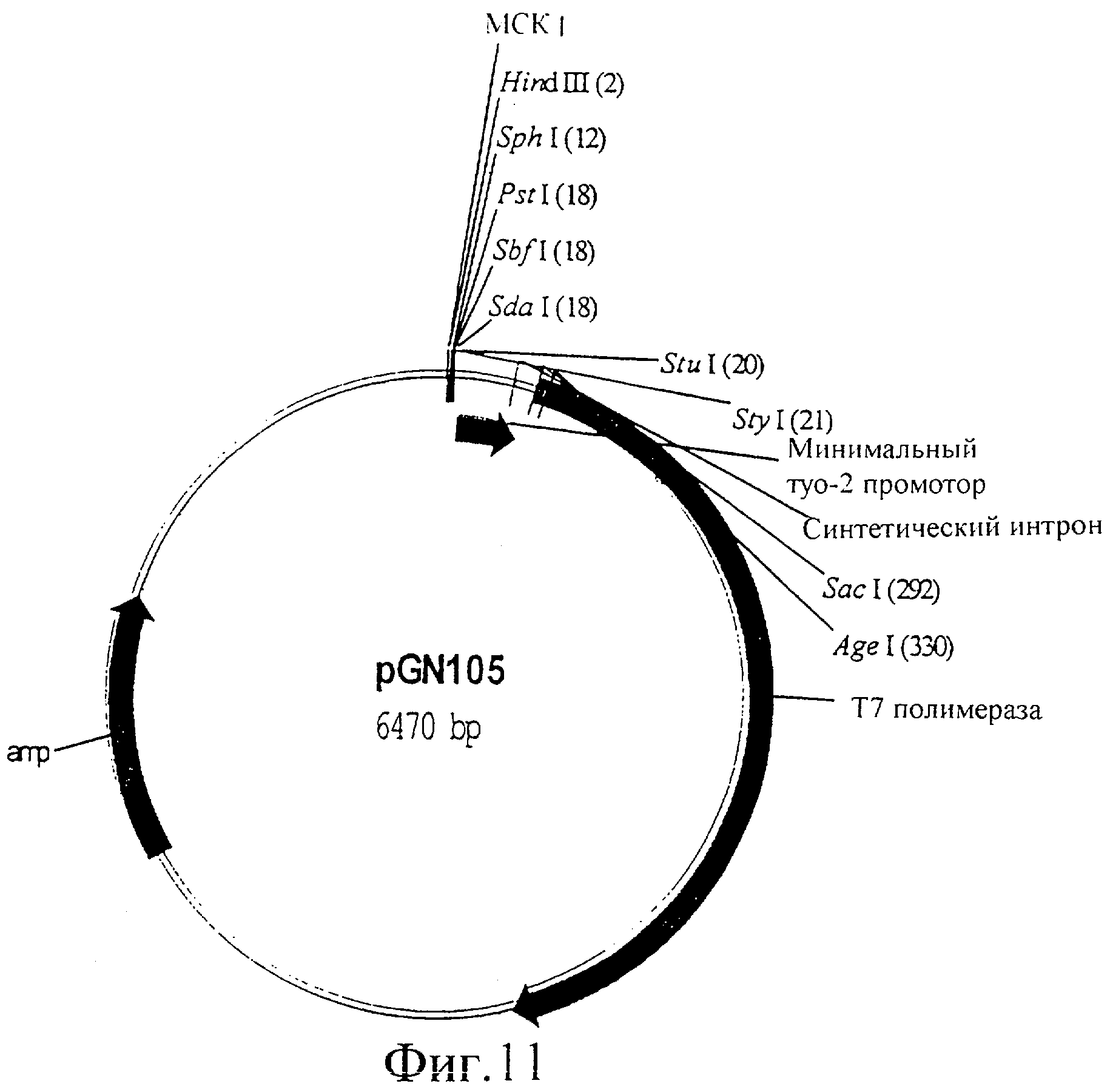
Фиг.11 представляет собой изображение плазмиды pGN105.
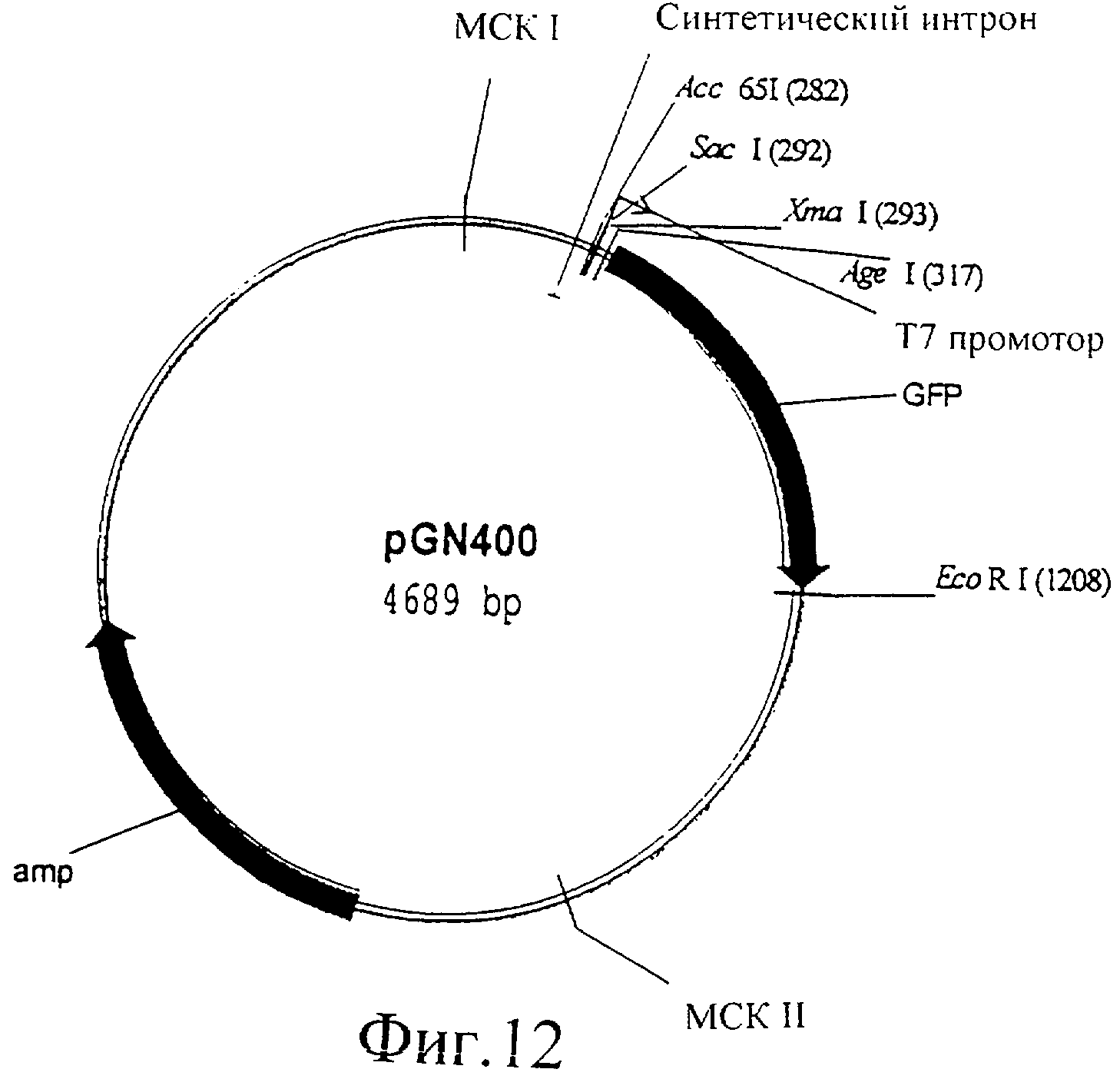
Фиг.12 представляет собой изображение плазмиды pGN400.
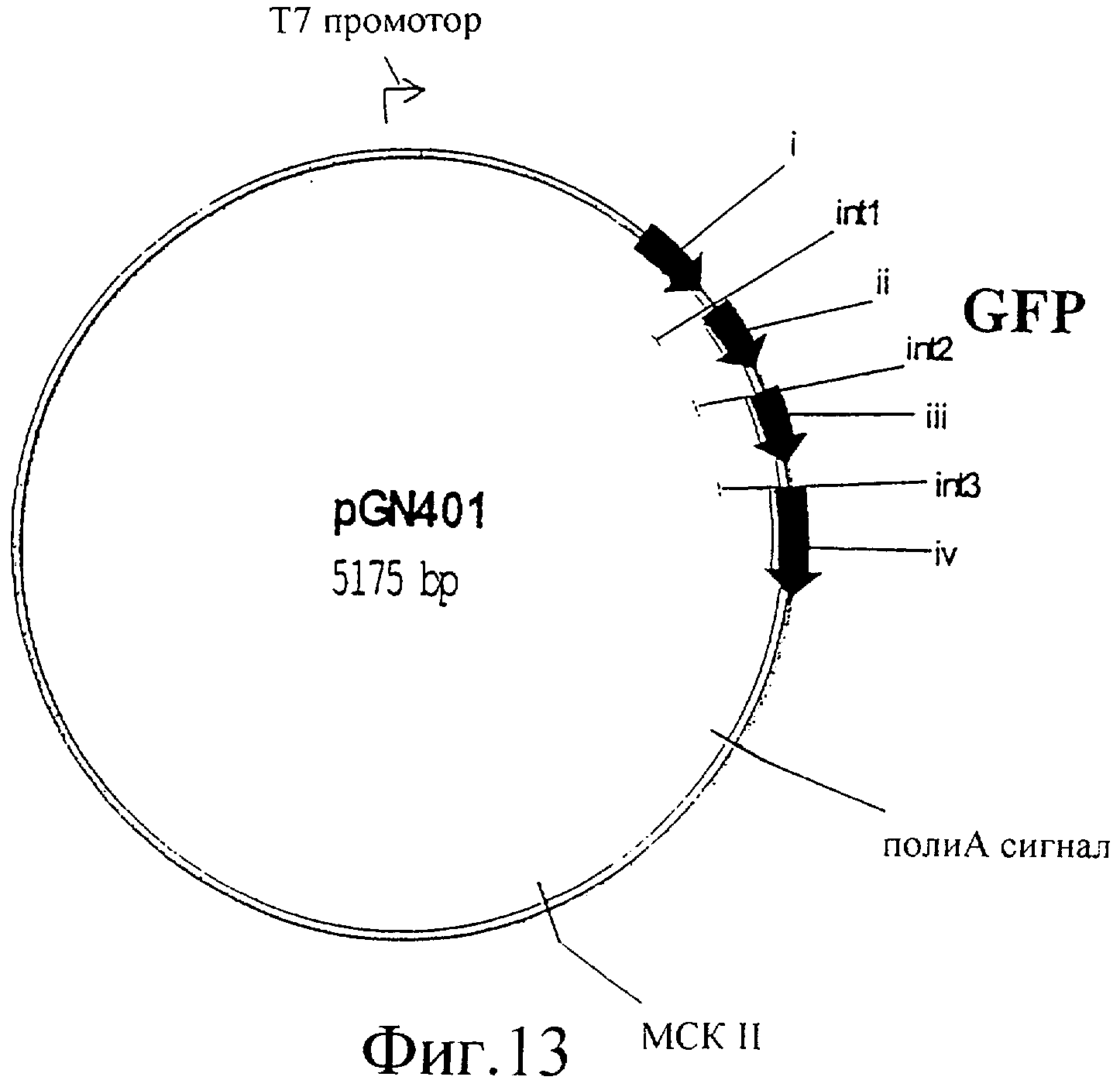
Фиг.13 представляет собой изображение плазмиды pGN401.
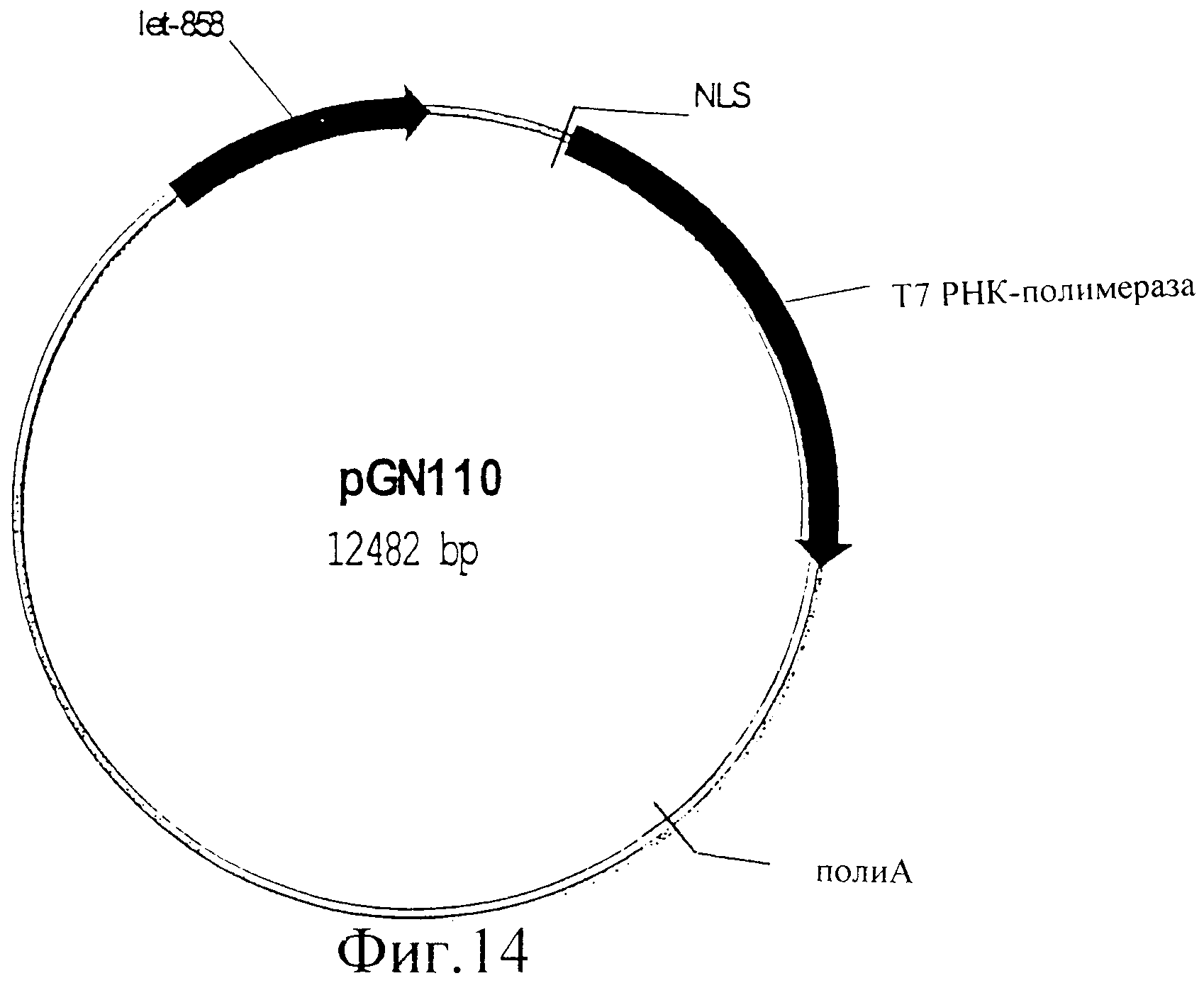
Фиг.14 представляет собой изображение плазмиды pGN110.
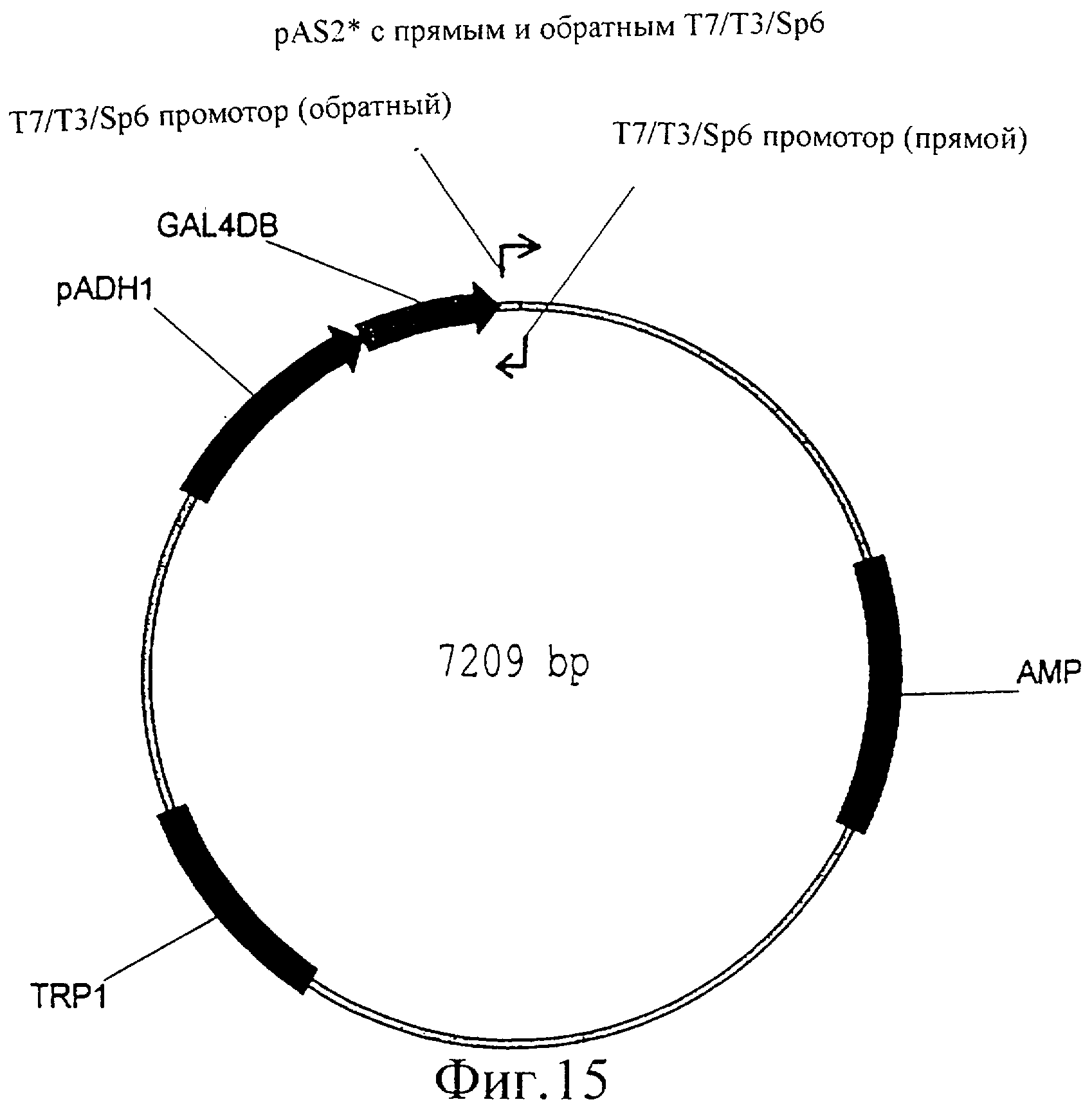
Фиг.15 представляет собой изображение плазмиды pAS2 с прямым и обратным T7/T3/SP6 промоторами.
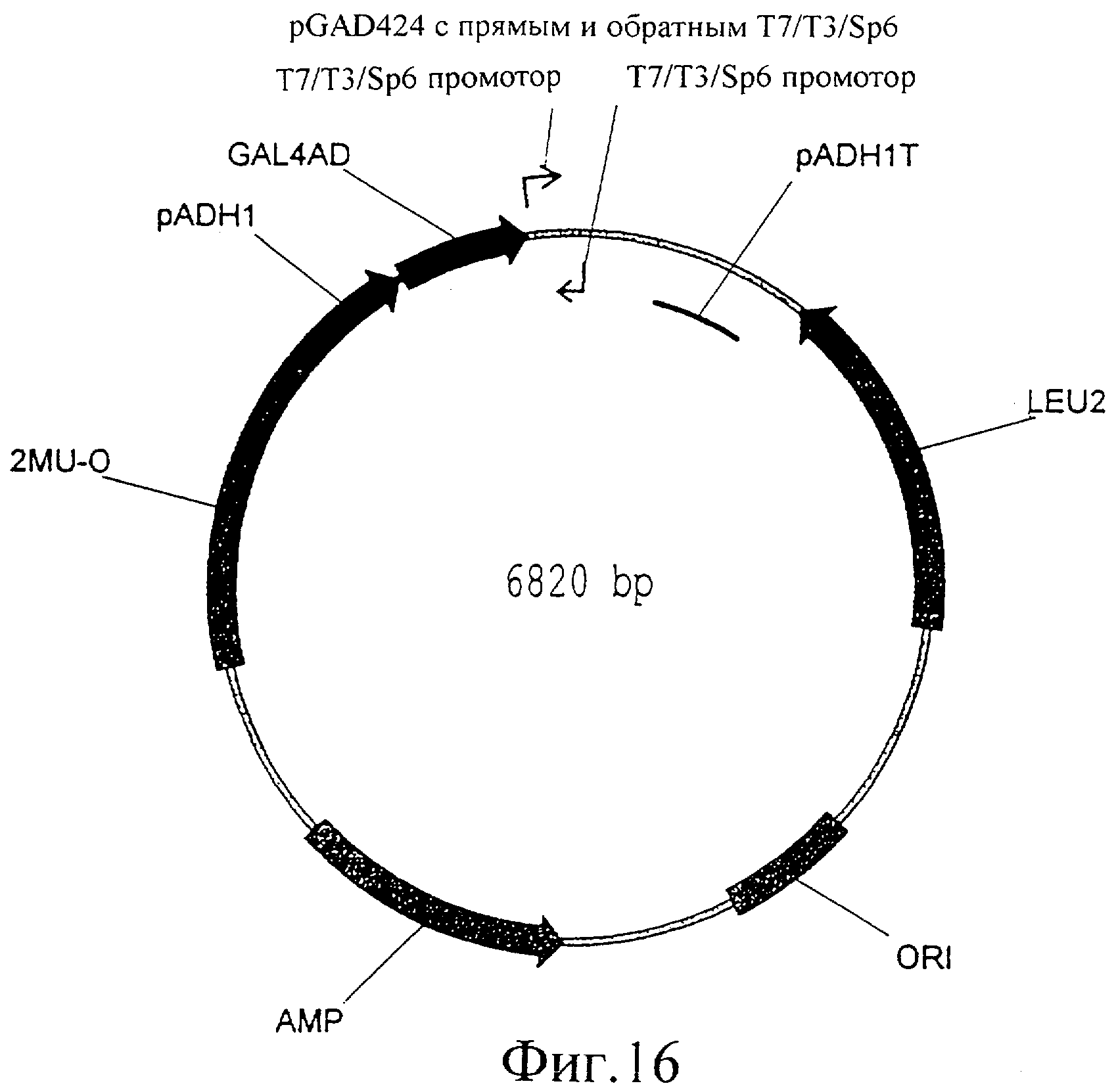
Фиг.16 представляет собой изображение плазмиды pGAD424 с прямым и обратным T7/T3/SP6 промоторами.
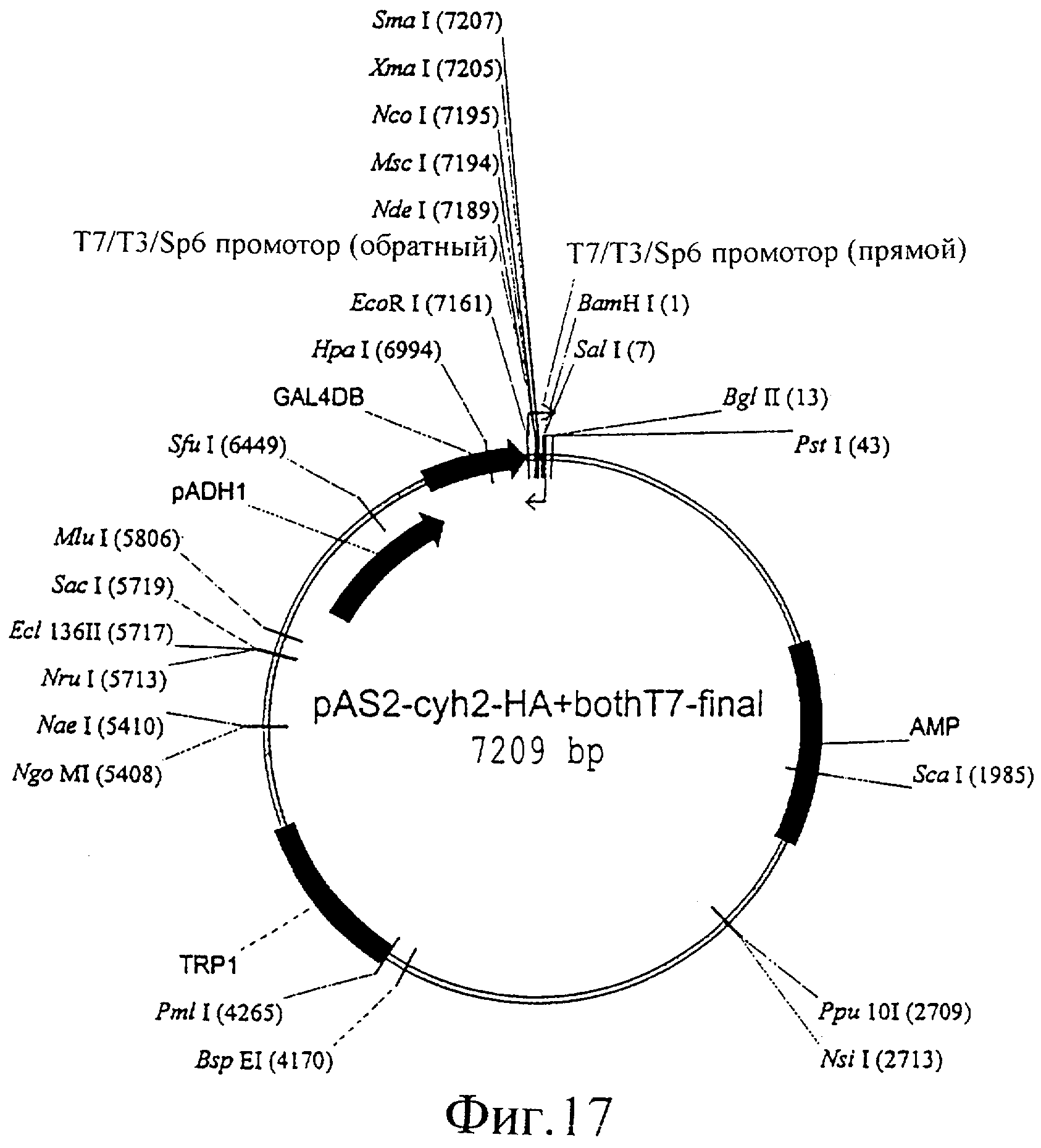
Фиг.17 представляет собой изображение плазмиды pAS2-cyh2-HA+, both-T7-final.
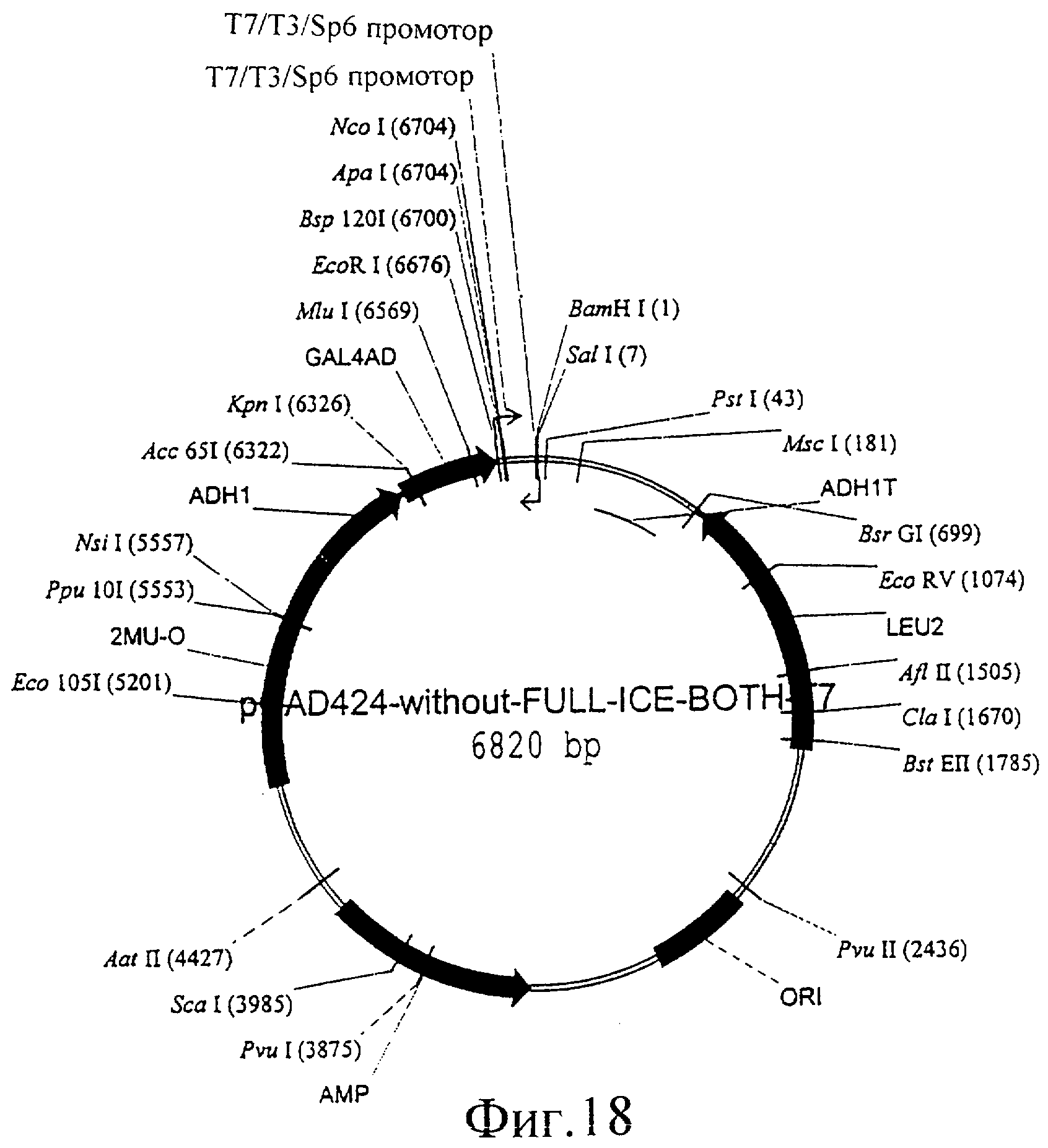
Фиг.18 представляет собой изображение плазмиды pGAD424-without-FULL-ICE-BOTH-T7.
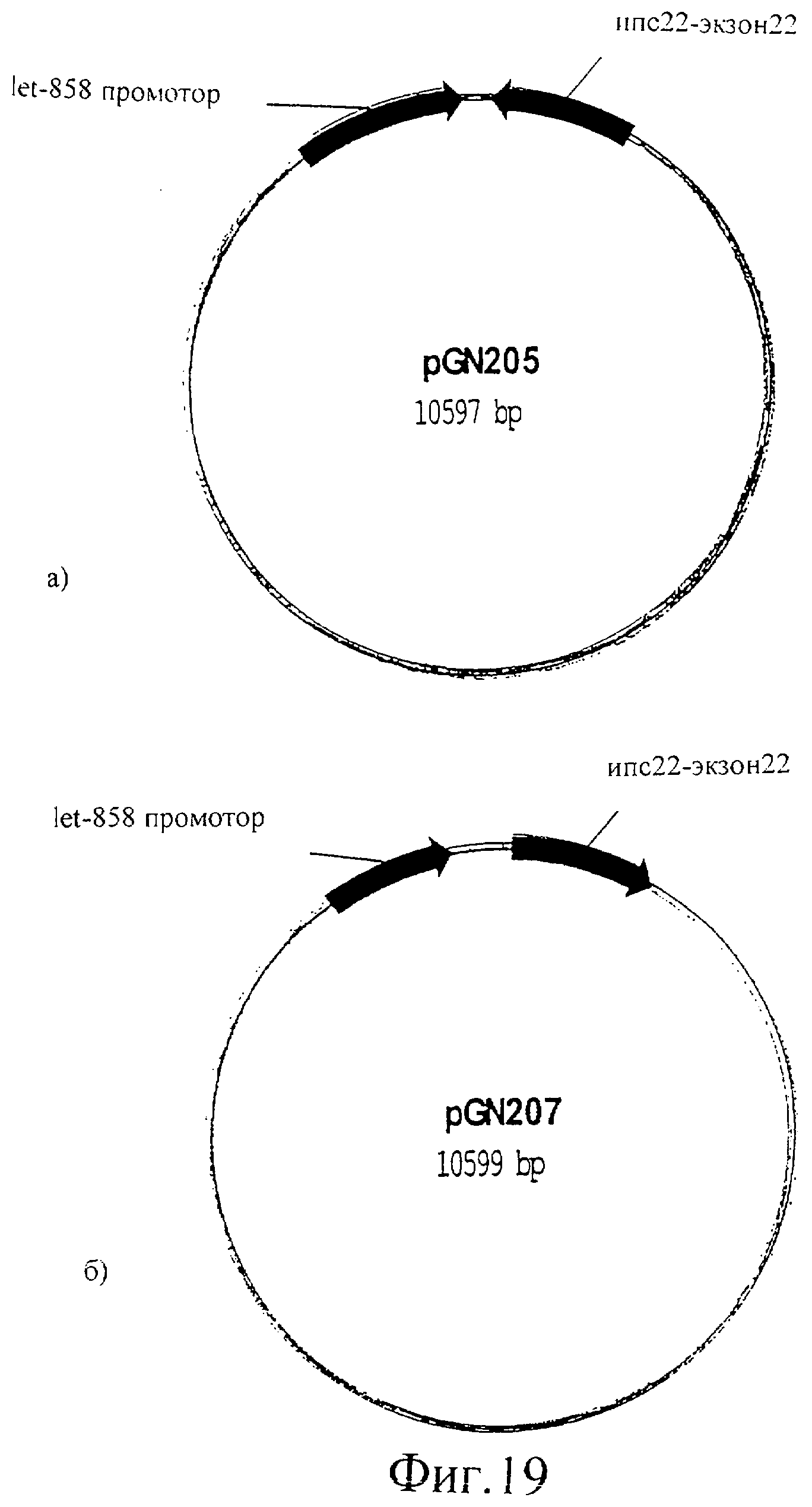
Фиг.19 (а) представляет собой изображение плазмиды pGN205 и (б) представляет собой изображение плазмиды pGN207.
Пример А: Конструирование упорядоченной и иерархически сгруппированной кДНК библиотеки и ее применения.
Случайно упорядоченная и сгруппированная библиотека:
Вектор представляет собой вектор E.coli, содержащий два Т7 промотора, с множественным сайтом клонирования (МСК) между ними. Эти два промотора ориентированы по направлению друг к другу и по направлению к МСК. В присутствии Т7 РНК-полимеразы, экспрессируемой в E.coli, C.elegans или в любом другом организме, РНК будет продуцироваться, начиная с этих двух Т7 промоторов. Поскольку они ориентированы в противоположном направлении, обе нити РНК будут продуцироваться с ДНК, встроенной (клонированной) в МСК между этими двумя промоторами, что приводит в результате к образованию двунитевой РНК (dsPHK) при связывании с ними Т7 РНК-полимеразы.
Библиотеку кДНК C.elegans конструируют в МСК, используя стандартные молекулярно-биологические методики. Эту библиотеку трансформируют в E.coli, и полученные E.coli выращивают в культуре и хранят в 96-многолуночных планшетах. На этой стадии плазмидную ДНК можно выделить и хранить в 96-многолуночных планшетах, соответствующих планшетам с колониями E.соli. Оценивают примерно 100000 колоний. Таким образом, эта библиотека будет содержать примерно в 5 раз больше вариантов суммарной экспрессируемой кДНК C.elegans, что дает возможность присутствия в этой библиотеке последовательностей с низкой экспрессией. Это будет давать в результате примерно 1041 96-луночный планшет. Эти планшеты, если необходимо, иерархически группируют. Для настоящего группирования клоны располагают в ряд от 10 до 100. Если иерархическое группирование осуществляют по 8 или 12 (числа более удобны, так как 96-луночные планшеты имеют решетку 8 на 12), это будет давать в результате примерно 87 многолуночных планшетов и примерно 8352 лунки. Если иерархическое группирование осуществляют по 96 лунок, которые составляют полный планшет, это дает в результате примерно 11 планшетов и примерно 1041 лунку. На любой стадии иерархического группирования плазмидную ДНК можно выделить, что будет менее трудоемким, когда используют меньше планшетов, но приведет к потере сложности, хотя этого не должно быть в случае группирования по 12. Группирование ДНК можно также осуществлять с исходной ДНК.
В приведенных ниже экспериментах описано, как следует осуществлять иерархическое группирование, как для библиотеки ДНК, так и для библиотеки E.coli.
Упорядоченная библиотека для PHKi технологии, содержащая каждый ген генома C.elegans, с ее применениями.
Как только проект секвенирования генома подходит к концу, эту информацию можно использовать при применении технологии Т7 РНК ингибирования. Каждый ген генома C.elegans можно клонировать, используя ПЦР технологию. Предпочтительно будут клонированы экзоны с минимальной длиной 500 п.о. (пар оснований). Если экзоны слишком малы, фрагменты меньшего размера будут выделены с помощью ПЦР, либо даже участки интронов и прилежащие экзоны будут выделять с помощью ПЦР технологии таким образом, чтобы клонировать по меньшей мере существенную часть транслируемого района гена. Для этого необходимо провести по меньшей мере 17000 реакций ПЦР. Эту коллекцию продуктов ПЦР будут клонировать в Т7 вектор, как описано (два Т7 промотора, ориентированных по направлению друг к другу, с множественным сайтом клонирования между ними). Каждый продукт ПЦР либо клонируют независимо, либо его можно использовать для создания случайной библиотеки, аналогичной описанной библиотеке кДНК. Если каждый продукт ПЦР клонируют индивидуально, полученные в результате бактерии и плазмидную ДНК можно группировать различными способами. Во-первых, эту коллекцию индивидуально клонированных продуктов ПЦР в Т7 PHKi векторе можно группировать случайным образом, как описано для случайной библиотеки. Это группирование можно также осуществлять более рациональным путем. Например, гены генома C.elegans можно анализировать, используя биоинформационные средства (в силикобиологии (silico biology)). Различные гены генома будут принадлежать к семейству генов или будут иметь гомологи в геноме. Эти члены семейства генов будут группировать, либо будут группировать члены, являющиеся гомологами. Таким образом, суммарное число примерно из 17000 клонов сокращают до более удобного количества. Эту библиотеку можно использовать для скрининга на фенотипы в способах согласно изобретению. Полученный в результате фенотип дает функциональное описание гена или семейства генов, либо гомологов генов генома C.elegans. Поскольку эта библиотека состоит из участка каждого гена в геноме, этот способ обеспечивает описание полного генома в функционально-фенотипическом отношении. Для этого двунитевую РНК (dsPHK) необходимо ввести червю. Этого введения одиночных клонов, либо сгруппированных клонов, которые группировали случайным образом или рациональным путем, можно достичь несколькими способами, как описано.
Пример вектора для экспрессии двунитевой PHKi
Можно использовать любой вектор, содержащий Т7 промотор, который содержит также множественный сайт клонирования (существует много коммерчески доступных векторов). Сконструированы праймеры, содержащие Т7 промотор, и праймер с обратной комплементарной нитью, оба с соответствующими концами. Эти праймеры можно гибридизовать и, если желательно, клонировать в выбранный вектор. Минимальной последовательностью для Т7 промотора является TAATACGACTCACTATAGGGCGA. Хотя любой вектор можно использовать для конструирования вектора экспрессии Т7, далее следует пример, как достичь этого с вектором pGEM-Szf(-).
- Вектор pGEM-3zf(+) (PROMEGA) подвергали ферментативному гидролизу HindIII и SaII.
- Праймеры oGN1 и oGN2 смешивали вместе в конечной концентрации 1 мкг/30 мкл, кипятили и медленно охлаждали до комнатной температуры.
- Праймер лигировали в вектор, используя стандартные методики лигирования. Полученный в результате вектор представляет собой pGN1 (показан на фиг.1) и содержит два Т7 промотора, ориентированных по направлению друг к другу, а также содержит множественный сайт клонирования между ними.
Последовательностями oGN1 и oGN2 являются:
- oGN1: AGC TGT ААТ ACG ACT CAC TAT AGG GCG AGA AGC ТТ
- oGN2: TCG ААА GCT TCT CGC АТА АТА GTG AGT CGT АТТ АС
Пример конструирования библиотеки
Можно выделить РНК из каждого организма, который чувствителен к PHKi. Как правило, выделенную РНК затем копируют на двунитевую кДНК, а затем конструируют в подходящие вектора для клонирования. Существует несколько методик, и можно заказать молекулярно-биологические наборы от различных фирм, включая Promega, Clontech, Boehringer Mannheim, BRL и т. д., которые обеспечивают:
- выделение РНК,
- в конечном счете, можно выделить полиА РНК (в распоряжении имеются несколько методик и наборов),
- синтез первой нити с обратной транскриптазой AMV (вирус миелобластоза птиц), случайными гексамерными праймерами и/или олиго(dТ) праймером,
- синтез второй нити с РНКазой Н, ДНК полимеразой I,
- заполнение концов с ДНК полимеразой Т4,
- добавление адаптера с Т4 ДНК лигазой,
- в конечном счете, обработка Т4 полинуклеотидкиназой,
- клонирование кДНК в вектор.
Полученную в результате лигазную смесь можно считать кДНК библиотекой. Эта лигазная смесь содержит все кДНК по этой методике, лигированные в интересующий вектор. Чтобы упорядочить эту библиотеку, эту лигазную смесь нужно трансформировать в штаммы E.coli.
Применение этой библиотеки E.coli или ДНК
Штамм, продуцирующий Т7 РНК:
- стандартным штаммом является BL21 (DE3): F-ompT[lon]hsds(r-m-; и штамм В E.coli)λ(DE3). В конечном счете, можно использовать варианты BL21 (DE3), хотя используют BL21 (DE3) pLysS;
- любой другой штамм E.coli, который продуцирует Т7 РНК-полимеразу, который можно иметь в распоряжении, необходимо конструировать. Его можно легко получить, используя фаг, который является коммерчески доступным, в этом случае используют вектор λСЕ6 (поставляемый Promega). Почти каждый штамм E.coli можно трансфецировать этим фагом, и он будет продуцировать Т7 РНК-полимеразу;
- мутант E.coli no РНКазе III:
В принципе, в распоряжении имеются различные штаммы; авторы изобретения для использования в первом эксперименте выбрали штамм АВ301-105: rna-19, suc-11, bio-3, gdhA2, his95, rnc-105, relА1, spoT1, metB1 (Kinder et al., 1973, Mol. Gen. Genet., 126:53), однако, другие штаммы могут подходить лучше. Данный штамм инфицируют λСЕ6, и, таким образом, будет сконструирован вариант, продуцирующий Т7.
Червей С.elegans дикого типа можно выращивать на пулах бактерий. Эти бактерии экспрессируют Т7 РНК-полимеразу. Это приводит к образованию в кишке С.elegans больших количеств dsPHK, которая будет диффундировать в организме и приводить к ингибированию экспрессии. Теперь эту библиотеку можно использовать для скрининга нескольких фенотипов. Эта методика имеет преимущество в том, что она является значительно более быстрой для обнаружения генов, имеющих отношение к определенным путям метаболизма, чем известная технология С.elegans. Кроме того, если обнаруживают интересующий фенотип, ответственный за него ген можно легко клонировать.
При использовании иерархического группирования можно легко обнаружить во втором скрининге соответствующий клон из пула. Затем встроенную ДНК этого клона можно секвенировать. В результате этого эксперимента создают базу генетических и биохимических данных в одну стадию.
Штаммы C.elegans дикого типа можно комбинировать с соединениями для скрининга на фенотип, лекарственную устойчивость или лекарственную чувствительность. Штамм C.elegans может представлять собой мутантный штамм, подвергаемый скринингу на усиленный фенотип, ослабленный фенотип или новый фенотип. Штамм C.elegans может представлять собой мутантный штамм, и скрининг библиотеки можно комбинировать с соединениями. Так можно проводить скрининг на лекарственную устойчивость, лекарственную чувствительность, усиленный фенотип, ослабленный фенотип или новый фенотип. Штамм E.coli может представлять собой любой штамм, экспрессирующий Т7 РНК-полимеразу, подобный, например, BL21 (DE3), но образование двунитевой РНК можно усилить с помощью использования специального штамма E.coli, который является отрицательным по РНКазе III.
РНКаза III распознает специфичные петли в dsPHK. В конечном счете, можно использовать штамм E.coli, который является делетированным по иным РНКазам, чем РНКаза III, либо можно использовать штамм E.coli, который является делетированным по одной или более чем одной РНКазе. Экспрессия Т7 РНК-полимеразы в наиболее известных штаммах E.coli и конструкции, которые имеются в распоряжении для создания штаммов E.coli, продуцирующих Т7 РНК-полимеразу, как правило, включают в себя индуцируемый промотор. Таким образом, продуцирование Т7 РНК-полимеразы и, следовательно, продуцирование dsPHK является регулируемым. Преимущественно этот признак можно использовать для “импульсного” кормления червей C.elegans на определенных стадиях роста. Этих червей выращивают на не индуцированных штаммах E.coli. Когда червь достигает интересующей стадии, индуцируют продуцирование Т7 РНК-полимеразы в бактериях. Это дает возможность изучения функции любого гена в любой момент жизненного цикла животного.
Скрининг библиотеки на гомологи предполагаемых представляющих интерес генов человека и определение функции этих генов
Сотни генов выделены в различных проектах, представляющих собой геномные проекты, направления дифференциальной экспрессии, гибридизационные исследования и т. д. Описанная библиотека кДНК может обеспечить путь оценивания и/или определения функции этих генов быстрым и эффективным способом. Прежде всего, гомолог или гомологи, либо гены червя необходимо идентифицировать с помощью биоинформационных средств (в силикобиологии). Конструируют праймеры ПЦР, и фрагмент кДНК выделяют, используя ПЦР технологию. ПЦР можно проводить на иерархических пулах. Положительный пул или индивидуальные лунки, содержащие бактерии, которые имеют соответствующую кДНК, скармливают C.elegans и оценивают фенотип.
ПЦР можно проводить на кДНК, выделенной из C.elegans. Полученную в результате ДНК можно клонировать в Т7 вектор и трансформировать в продуцирующую dsPHK E.coli, на которой затем кормят червей C.elegans.
Нужно делать выбор в зависимости от того, какой путь является более быстрым и более надежным.
Если ген принадлежит к семейству генов, может быть необходимо кормить червя на смеси бактерий. Каждая из них содержит участок члена этого семейства генов. Штаммы E.coli, условия роста, комбинации с соединениями можно подбирать, как описано выше.
Если используют рациональную библиотеку, в которой все гены C.elegans клонированы организованным и структурированным путем, гомолог C.elegans, а также, в конечном счете, другие гомологи, ортологи и члены семейства генов легко прослеживать в библиотеке, используя силикобиологию. ПЦР не вовлечена в эту стадию, и можно выделить бактерии и/или ДНК, на которых будут выращивать червя.
Примеры
Идея этой серии экспериментов состояла в тестировании как PHKi вектора, так и различных штаммов E.coli, которые были сконструированы.
1) Конструирование тест-плазмиды
Можно использовать любую кДНК, которая дает явный фенотип у червя при ее выключении или использовании в PHKi эксперименте. Известно, что хорошим кандидатом является unс-22, но возможны и другие гены. Авторы изобретения выбрали чувствительную систему, которую можно использовать на более поздней стадии. Эту систему тестировали с sup-35 на генетическом фоне pha-1. Экзон 5 sup-35 выделяли с помощью ПЦР и клонировали в вектор с Т7 промотором pGN1. Полученный в результате вектор обозначили pGN2. Мутантные черви pha-1 (е2123) не могут производить потомство при температурах выше 25°С. Это происходит вследствие проблемы развития в эмбриогенезе. Когда sup-35 выключен или ингибирован в этом штамме, потомство может расти при этой температуре. Комбинация мутантных червей pha-1 и PHKi sup-35 является хорошей системой для оценки различных возможных вариантов.
2) Тестирование PHKi с использованием штамма E.coli, который продуцирует dsPHK.
- pGN2 вводили в штамм E.coli BL21 (DE3) и индуцировали Т7 РНК-полимеразу с помощью ИПТГ (изопропилтиогалактозид). Червей C.elegans (pha-1 (e2123)) высевали на эти бактерии и выращивали при ограничивающей температуре 25°С. Поскольку этот мутант при данной температуре является эмбриональным мутантом, никакого потомства не будет наблюдаться. Если ген sup-35 эффективно ингибируется dsPHK, присутствующей в E.coli, потомство будет наблюдаться.
- pGN2 вводили в штамм E.coli АВ301-105 (DE3) и индуцировали Т7 РНК-полимеразу с помощью ИПТГ. Червей C.elegans (pha-1 (e2123)) высевали на эти бактерии и выращивали при ограничивающей температуре 25°С. Поскольку этот мутант при данной температуре является эмбриональным мутантом, никакого потомства не будет наблюдаться. Если ген sup-35 эффективно ингибируется dsPHK, присутствующей в E.coli, потомство будет наблюдаться.
3) Усовершенствование штамма червя для лучшего поглощения dsPHK.
Перед высевом pha-1 C.elegans на штамм E.coli, который продуцирует двунитевую РНК sup-35, этого червя подвергали мутагенезу с помощью ЭМС (этилметансульфонат). Затем потомство этого мутагенизированного червя высевали на бактерии. Червь, который питается на этих бактериях, дает больше потомства, которое имеет мутацию, что приводит в результате к улучшению поглощения dsPHK, и его можно использовать для дальнейших экспериментов.
Стабильная интеграция вектора, продуцирующего dsPHK, в геном червя, продуцирующего Т7 РНК-полимеразу
Можно сконструировать вектор E.coli, обладающий следующими признаками: два Т7 промотора, направленных по направлению друг к другу, с сайтом рестрикции или множественным сайтом клонирования между ними. Кроме того, этот вектор может содержать геномную ДНК sup35 C.elegans, сконструированную таким образом, что она содержит несколько стоп-кодонов с различными интервалами, таким образом, что полноразмерный белок не может экспрессироваться с фрагмента геномной ДНК sup35, как проиллюстрировано на фиг.8. Любую кДНК или фрагмент кДНК можно клонировать в множественный сайт клонирования между двумя Т7 промоторами. Когда этот вектор вводят в штамм C.elegans, который экспрессирует Т7 РНК-полимеразу, кДНК или фрагмент ДНК, клонированный между двумя Т7 промоторами, будет транскрибироваться, генерируя dsPHK с клонированного фрагмента.
Этот вектор конструируют для использования в мутантных червях pha-1 (е2123), экспрессирующих Т7 РНК-полимеразу. Экспрессия Т7 РНК-полимеразы может быть конститутивной или регулируемой, общей или тканеспецифичной. Эти черви pha-1 (е2123) не могут производить потомство при температурах выше 25°С, что является следствием проблемы развития в эмбриогенезе. Когда в этом штамме sup-35 ингибирован или выключен, потомство может расти при этой температуре.
Когда вектор вводят в червя, этот вектор может интегрировать посредством гомологичной рекомбинации (интеграция по Кэмпбеллу). Показано, что гомологичная рекомбинация происходит в C.elegans, хотя и с низкими частотами (Plasterk and Groenen, EMBO J. 11:287-290, 1992). Гомологичная рекомбинация по гену sup35 будет приводить к выключению этого гена, поскольку два полученных в результате гена sup-35 будут содержать стоп-кодоны. Полученный в результате червь и его потомство, если эта рекомбинация происходит в яйцах, будут иметь копию вектора, интегрированную в геном. Это потомство можно отобрать, поскольку только черви, у которых sup-35 выключен, будут иметь потомство при температурах выше 25°С. Кроме того, полученный в результате червь будет стабильно продуцировать двунитевую РНК с фрагмента ДНК, клонированного между двумя Т7 промоторами. Теперь этого червя можно считать стабильным трансгенным штаммом червя с ослаблением функции гена, фрагмент которого клонирован между двумя Т7 промоторами.
ДНК можно доставлять червю с помощью нескольких методик, включая инъекцию, баллистическую трансформацию, вымачивание в растворе ДНК, кормление бактериями. Можно принять во внимание новые, а также другие способы, которые повышают эффективности трансформации.
Штамм-мишень C.elegans может, кроме того, иметь другие мутации кроме мутации pha-1 (е2123), а также может экспрессировать другие гены кроме Т7 РНК-полимеразы.
ПРИМЕР Б: ДРОЖЖЕВОЙ ДВУХГИБРИДНЫЙ РНKi ВЕКТОР
Можно сконструировать дрожжевой двухгибридный вектор, содержащий два Т7 промотора. Эти вектора можно сконструировать таким образом, чтобы они реплицировались как в дрожжах, так и в E.coli. Как правило, библиотеки кДНКдля этой дрожжевой двухгибридной системы создают в векторах Gal4 или LexA. Эту библиотеку конструируют в векторах, имеющих активаторный домен одного из этих генов. Можно сконструировать вектор, с помощью которого можно также осуществлять двухгибридный скрининг в дрожжах, но который также содержит два Т7 промотора, ориентированных по направлению друг к другу, с сайтом клонирования между ними. Порядок последовательностей в этой плазмиде будет, таким образом, таким: “остов плазмиды (GAL4-T7), МСК, Т7, остов”. Библиотеку кДНК C.elegans, сконструированную в этом векторе, можно использовать в качестве стандартной дрожжевой двухгибридной библиотеки в эксперименте по выделению белков, взаимодействующих с данным белком. Как только клон выделен, эту плазмиду можно ввести в штамм E.coli, экспрессирующий Т7 РНК-полимеразу, и, следовательно, он будет продуцировать dsPHK этого клонированного фрагмента. Бактерии, продуцирующие эту dsPHK, можно скармливать червю, и можно оценивать фенотипы. Как в предыдущем примере, эта методика оценивания для вновь выделенного дрожжевого двухгибридного клона значительно короче, чем стандартная методика, которая требует стадий ПЦР и/или клонирования, экспериментов с РНК и/или экспериментов по выключению генов. В большинстве случаев выделенные клоны сначала секвенируют, и на основании этого сиквенса принимают решение, продолжать ли дальнейшие эксперименты. В настоящем изобретении каждый выделенный клон можно легко ввести в соответствующую E.coli и скармливать червю. Затем оценивание проводят с помощью фенотипического анализа.
Чтобы применять данную методику, дрожжевые двойные гибриды получали, используя известный ген в качестве приманки, а вновь сконструированную библиотеку в качестве мишени. Белки, кодируемые клонами в этой мишени, которые взаимодействуют с белком-приманкой, будут давать в результате положительные дрожжевые клоны, экспрессирующие репортерную молекулу, такую как можно наблюдать с помощью окрашивания X-gal на LacZ. Плазмиду, кодирующую этот белок-мишень, выделяют непосредственно из дрожжевого штамма и вводят в E.coli. Эта E.coli представляет собой E.coli, экспрессирующую Т7 РНК-полимеразу. В этом случае двунитевая РНК продуцируется с ДНК, клонированной в множественный сайт клонирования этого вектора. Когда эту dsPHK скармливают червю, используя способы, описанные ранее, ген у червя ингибирован, что приводит в результате к конкретному фенотипу.
- Этот дрожжевой двухгибридный вектор можно предпочтительно использовать для конструирования упорядоченной и иерархически сгруппированной библиотеки, как описано в предыдущем примере.
- Можно также сконструировать дрожжевой штамм, который условно продуцирует Т7 РНК-полимеразу. После дрожжевых двухгибридных экспериментов можно индуцировать экспрессию Т7 РНК-полимеразы, что приводит к продуцированию dsPHK в дрожжевой клетке. После этого дрожжи можно скармливать червю. В распоряжении имеются данные, показывающие, что черви C.elegans могут питаться на дрожжах.
Конструирование штамма, продуцирующего Т7 РНК-полимеразу, и его применения
Можно сконструировать штамм C.elegans, который экспрессирует Т7 РНК-полимеразу. Эта экспрессия может быть общей и конститутивной, но также может регулироваться тканеспецифичным промотором, индуцируемым промотором, временным промотором или промотором, который имеет одну из этих характеристик или сочетание характеристик. В этот штамм C.elegans можно вводить ДНК. Это осуществляют либо с помощью инъекции, обстрела частицами, электропорации, либо, как упомянуто выше, с помощью кормления. Если ДНК представляет собой плазмиду, как описано в предыдущих примерах, то есть плазмиду, содержащую клонированный фрагмент кДНК или ПЦР фрагмент между двумя фланкирующими Т7 промоторами, то dsPHK этого кДНК или ПЦР фрагмента образуется в клетке или в целом организме, что приводит к негативной регуляции соответствующего гена. Эта введенная ДНК может обладать эффективной временной негативной регуляцией. Эта введенная ДНК может образовать экстрахромосомную структуру, причем эта структура может привести в результате к большему каталитическому выключению или ослаблению функционального фенотипа. Эта плазмида может также интегрировать в геном этого организма, что приводит в результате к тому же каталитическому выключению или ослаблению функционального фенотипа, но эта плазмида стабильно передается.
- Плазмидную ДНК, содержащую кДНК, либо участок кДНК, либо EST или ПЦР фрагмент С. elegans, клонированный между двумя Т7 промоторами, как описано в примерах А) и Б), можно ввести в червя с Т7 РНК-полимеразой с помощью стандартных методик. Можно анализировать фенотипы.
- ДНК из упорядоченной и сгруппированной библиотеки, как в примере А), можно ввести в червя с Т7 РНК-полимеразой с помощью стандартных методик (инъекция, обстрел). Можно анализировать фенотипы. При иерархическом пуле исходный клон можно легко обнаружить.
- Такую же методику можно осуществлять с мутантным червем, экспрессирующим Т7 РНК-полимеразу. Скрининг на усиленные, ослабленные или новые фенотипы.
- Эту методику можно использовать, чтобы обеспечить скрининг соединений, скрининг либо со штаммом дикого типа, либо с мутантным штаммом на усиленные или новые фенотипы.
- ДНК можно ввести в червя с помощью новых способов. Одним из них является доставка ДНК посредством E.coli. В этом случае иерархически сгруппированную библиотеку скармливают животному. Чтобы предотвратить ферментативный гидролиз ДНК E.coli в кишке нематоды, предпочтительно будут использовать С.elegans, недостаточный по ДНКазе, такой как nuc-1 (е1392). Эта методика будет одной из наиболее интересных, поскольку она будет независимой от эффективностей трансформации других методик, а также в целом более быстрой и менее трудоемкой.
2) Предполагаемые усовершенствования этого способа
- Вектор конструируют таким образом, что он содержит кДНК sup-35 или участок этой кДНК, клонированный между двумя Т7 промоторами. Остальная часть вектора является такой, как описана в примерах А) и Б). Этот вектор можно ввести в мутант C.elegans pha-1ts. В этом случае существует система температурной селекции, и только те черви, которые поглотили ДНК и экспрессируют двунитевую РНК sup-35, будут выживать при ограничивающих температурах. Иерархически сгруппированную библиотеку можно доставлять любым способом, описанным выше.
- Этот вектор можно использовать для конструирования библиотеки, которую вводят в E.coli, экспрессирующую Т7 РНК-полимеразу. В этом случае авторы изобретения имеют аналогичный скрининг, как в части А), с дополнительным скринингом на червей, где dsPHK sup-35 является активной.
- ДНК или dsPHK sup-35 можно доставлять на различных плазмидах. Для кормления, как кормления ДНК (пример В), так и кормления dsPHK (примеры А и Б) это означает, что эти две плазмиды могут присутствовать в одной бактерии, или что червя кормят на смеси бактерий, одна из которых содержит конструкцию sup-35.
Пример конструирования C.elegans, продуцирующего Т7 РНК-полимеразу
Для продуцирования Т7 РНК-полимеразы у червя существует несколько возможностей. Т7 РНК-полимераза может экспрессироваться под различными промоторами, которые представляют собой индуцируемые промоторы, конститутивные промоторы, общие промоторы и ткане-(клетка)специфичные промоторы, либо их комбинации. Примерами этих промоторов является промотор белка теплового шока hsp-16, кишечный промотор ges-1, промотор cet858, а также промотор dpy-7 и промоторный элемент GATA1. В данном примере Т7 РНК-полимераза экспрессируется под контролем промотора hsp-16, который имеется в распоряжении в векторе pPD49.78. T7 РНК-полимеразу выделяют в виде продукта ПЦР, используя праймеры GN3 и GN4.
Полученный в результате продукт ПЦР подвергают ферментативному гидролизу с помощью Nhel и Ncol, поскольку вектор, в который авторы изобретения собираются клонировать, представляет собой Fire вектор pPD49.78. Полученный в результате вектор представляет собой pGN100, проиллюстрированный на фиг.2 oGN3: CAT GGC AGG ATG AAC ACG ATT AAC ATC GC oGN4: ATG GCC CCA TGG TTA CGG GAA CGC GAA GTC CG pGN100 включена.
Этот вектор вводят в червя, используя стандартные методики, такие как, например, микроинъекция.
Таким образом, сконструировали следующие штаммы:
- Дикий тип (pGN100)
- nuc-1 (e1392) (pGN100)
- pha-1 (е2123) (pGN100)
- рha-1; nuc-1 (pGN100)
Все эти штаммы способны продуцировать Т7 РНК-полимеразу при индукции температурой или, альтернативно, металлами, как, например, применением тяжелого кадмия или ртути. Методика температурной индукции состоит в том, что животное подвергают температурному сдвигу до температуры 30-33°С по меньшей мере в течение одного часа, затем животное подвергают обратному сдвигу до стандартных температур (15-25°С).
Штамм дикого типа, продуцирующий Т7 РНК-полимеразу, можно использовать для продуцирования любой РНК в этом черве. Более конкретно в этих червей можно вводить плазмиды из описанных библиотек, и можно оценивать фенотипы.
Мутантного червя nuc-1 будут использовать для введения ДНК через бактерии, на которых питается этот червь. Поскольку червь nuc-1 не осуществляет ферментативный гидролиз ДНК, плазмидная ДНК может проходить через кишечную стенку. Если она поглощается клетками, которые продуцируют Т7 РНК-полимеразу, будет продуцироваться dsPHK, ингибируя, таким образом, ген, с которого транскрибируется эта РНК.
Мутантный штамм pha-1, который продуцирует Т7 РНК-полимеразу, можно использовать для усовершенствования этих методик, как описано выше. ДНК можно вводить с помощью обстрела, микроинъекции или кормления. Более конкретно этот штамм можно использовать для векторов, которые продуцируют dsPHK с sup-35 и с интересующего гена, причем последний может представлять собой продукт ПЦР, кДНК или библиотеку, как описано.
Мутант pha-1; nuc-1, продуцирующий Т7 РНК-полимеразу, можно использовать для бактериальной доставки ДНК. ДНК предпочтительно будет представлять собой плазмиду, которая продуцирует dsPHK как с sup-35, так и с интересующего гена. Штамм червя будет предпочтительно продуцировать Т7 РНК-полимеразу в кишке. Доставка предпочтительно будет происходить посредством кормления червя на бактериях, содержащих эту плазмиду.
Применение PHKi технологии у растений
Нематоды ответственны за большую часть вреда, наносимого растениям, и, более конкретно, растениям, используемым в сельскохозяйственном производстве. PHKi методики согласно изобретению можно применять к растениям, чтобы предотвратить дальнейшее питание этих паразитических нематод. На первой стадии из паразитической растительной нематоды выделяют фрагмент ДНК, который является критическим для выживания или роста этих животных, либо их питания или пролиферации. Любой ген, экспрессия с которого является существенной, подходит для этой цели.
Участок этого гена, экзон или кДНК, клонируют. Этот фрагмент ДНК можно клонировать под контролем тканеспецифичного промотора, предпочтительно корнеспецифичного промотора, даже более предпочтительно между двумя корнеспецифичными промоторами. ДНК этого клонированного гена под контролем корнеспецифичного промотора можно ввести в интересующее растение, используя растительную трансгенную технологию. Для каждой паразитической нематоды может требоваться различный участок ДНК, и подобным образом для каждой расы растений может быть необходим различный промотор.
Когда используют корнеспецифичный промотор, в корне будет продуцироваться РНК или dsPHK с этого введенного участка ДНК. Поскольку нематода питается на растении, эта РНК и/или dsPHK будет поедаться или проглатываться нематодой. Эта РНК и/или dsPHK может входить в клетки нематоды и осуществлять свое ингибиторное действие на ДНК-мишень. В зависимости от природы клонированного участка ДНК червя нематода будет неспособна выживать, питаться, размножаться и т.д., что в любом случае предотвращает дальнейшее питание животного на растении и, таким образом, защищает растение.
Конструирование C.elegans, продуцирующего Т7 РНК-полимеразу
Чтобы продуцировать Т7 РНК-полимеразу или другие РНК-полимеразы у животных, и более конкретно у нематод, и наиболее конкретно у C.elegans, можно рассмотреть несколько возможностей. Т7 РНК-полимераза может экспрессироваться под различными промоторами. Эти промоторы могут представлять собой индуцируемые промоторы, конститутивные промоторы, общие промоторы, тканеспецифичные промоторы или их комбинации.
Пример 1:
Конструирование базового вектора для экспрессии Т7 полимеразы у C.elegans
Кодирующую последовательность Т7 полимеразы амплифицировали ПЦР с λСЕ6 (Novagen, Madison, USA), используя праймеры oGN26 (ATGGAATTCTTACGCGAACGCGAAGTCCG) и oGN46 (CTCACCGGTAATGAACACGATTAACATCGC), используя стандартные методики (PCR, A practical approach, 1993, Ed. J. McPherson, et al., IRL Press). Полученный в результате фрагмент ДНК, кодирующий Т7 РНК-полимеразу, подвергали ферментативному гидролизу с помощью Agel и EcoRI и встраивали в Fire вектор pPD97.82, подвергнутый ферментативному гидролизу с помощью Agel и EcoRI. Полученная в результате конструкция кодирует открытую рамку считывания Т7 РНК-полимеразы в слиянии с сигналом ядерной локализации большого Т антигена SV40 (NLS) с аминокислотной последовательностью MTAPKKKRKVPV. Эта последовательность сигнала ядерной локализации требуется для перемещения Т7 РНК-полимеразы из цитоплазмы в ядро, где она способна связываться с ее специфичными промоторами, обозначенными как Т7 промоторы. Вверх по течению (в 3′-5′ направлении) от кодирующей последовательности для слитого белка Т7 полимеразы находится минимальный промотор (myo-2), которому предшествует множественный сайт клонирования (МСК), в который можно встраивать несколько промоторов C.elegans. Эта плазмида (pGN105, показанная на фиг.11) представляет собой базовую Т7 РНК-полимеразную плазмиду, которая обеспечивает экспрессию Т7 полимеразы в C.elegans. Производные этой плазмиды, где промоторы клонированы в множественный сайт клонирования, дают возможность индуцируемой, конститутивной, общей и тканеспецифичной экспрессии Т7 РНК-полимеразы в C.elegans, поскольку эта экспрессия будет регулироваться промотором, клонированным в множественный сайт клонирования.
Не ограничиваясь данными примерами, для следующих промоторов известно, что они индуцируют экспрессию в следующих тканях:
let-858 (повсеместная экспрессия), myo-2 (глоточная экспрессия), myo-3 (мышца стенки тела), egl-15 (мышцы женских половых органов), unc-119 (постганглионарный нейрон).
Пример 2
Конструирование вектора для экспрессии Т7 РНК-полимеразы в мышечной ткани C.elegans
Кодирующую последовательность Т7 полимеразы амплифицировали ПЦР с λСЕ6, используя праймеры OGN43 (GCCACCGGTGCGAGCTCATGAACACGATTAACATCGC) и oGN44 (CACTAGTGGGCCCTTACGCGAACGCGAAGTCCG), подвергали ферментативному гидролизу с помощью Agel/Spel и встраивали в вектор pGK13, подвергнутый ферментативному гидролизу с помощью Agel/Spel. (Этот вектор содержит сильный промотор SERCA, который управляет экспрессией в глотке, мышцах женских половых органов, мышцах хвоста и стенки тела). Сигнал ядерной локализации (NLS) большого Т антигена SV40 встраивали перед кодирующей последовательностью Т7 полимеразы с помощью встраивания двух перекрывающихся олигонуклеотидов oGN45 (CCGGATGACTGCTCCAAAGAAGAAGCGTAAGCT) и oGN46 (CTCACCGGTAATGAACACGATTAACATCGC) в сайты рестрикции SacI/AgeI. Полученную в результате конструкцию обозначили pGN108, как показано на фиг.10. Введение этой плазмиды в C.elegans приводит к экспрессии Т7 РНК-полимеразы в глотке, мышцах женских половых органов, мышцах хвоста и стенки тела.
Чтобы протестировать экспрессию и функциональность Т7 РНК-полимеразы в C.elegans под регуляцией промотора SERCA, pGN108, который кодирует Т7 РНК-полимеразу под контролем промотора SERCA, инъецировали в C.elegans. Тест-вектор инъецировали совместно. Этот тест-вектор кодирует GFP (green fluorescent protein (зеленый флуоресцентный белок)) под контролем Т7 промотора (pGN401 на фиг.13). Эту плазмиду pGN401 конструировали с помощью встраивания двух перекрывающихся олигонуклеотидов оGN41 (CCCGGGATTAATACGACTCACTATA) и оGN42 (CCGGTATAGTGAGTCGTATTAATCCCGGGAGCT) в открытый по SacI/AgeI Fire вектор pPD97.82 с образованием Т7 промотора. Кроме того, совместно инъецировали селективный маркер, чтобы отбирать трансформанты (rol6, pRF4). Последний селективный вектор pRF4 хорошо известен специалистам в данной области. Трансгенные F1 можно легко выделить, поскольку они проявляют rol6 фенотип. Эти трансгенные C.elegans все экспрессировали GFP в глотке, мышцах женских половых органов, мышцах хвоста и стенки тела. Эти данные ясно показывают, что Т7 РНК-полимераза функционально экспрессируется под регуляцией промотора SERCA, и что экспрессируемая Т7 РНК-полимераза связывается с Т7 промотором, присутствующим в pGN401, и инициирует транскрипцию гена GFP, который затем функционально экспрессируется, что приводит к флуоресценции в мышечных тканях, где SERCA индуцирует экспрессию Т7 РНК-полимеразы.
Пример 3
Конструирование вектора для повсеместной экспрессии Т7 полимеразы у C.elegans
Слитый ген NLS-T7 РНК-полимераза выделяли из pGN108 с помощью XmaI/Bsp1201 и клонировали в Fire вектор pPD103.05, подвергнутый ферментативному гидролизу с помощью XmaI/Bsp1201. Это дает в результате вектор, где Т7 РНК-полимераза клонирована под регуляцией промотора let858. Этот специфичный промотор обеспечивает экспрессию Т7 РНК-полимеразы во всех тканях. Полученную в результате плазмиду обозначили pGN110 (фиг.14).
Пример 4:
Конструирование вектора для опосредованной Т7 РНК-полимеразой экспрессии фрагментов ДНК, генов и кДНК под контролем Т7 промотора
Fire вектор pPD97.82 подвергали ферментативному гидролизу с помощью SacI/AgeI, и последовательность Т7 промотора образовывали с помощью встраивания двух перекрывающихся олигонуклеотидов oGN41 (CCCGGGATTAATACGACTCACTATA) и OGN42 (CCGGTATAGTGAGTCGTATTAATCCCGGGAGCT) в сайты рестрикционных эндонуклеаз SacI/AgeI. Эта конструкция (pGN400, фиг.12) содержит открытую рамку считывания GFP, клонированную между сайтами рестрикционных эндонуклеаз SacI и EcoRI под регуляцией Т7 промотора. Любой ген, кДНК или фрагмент ДНК можно клонировать в этот вектор с помощью делетирования гена GFP в виде фрагмента AgeI/SacI и клонирования интересующего фрагмента ДНК в этот вектор. Предпочтительно этот интересующий фрагмент ДНК можно получить с помощью ПЦР амплификации, вводя SacI/AfeI сайты в праймеры. Полученный в результате ПЦР амплификации фрагмент ДНК подвергают ферментативному гидролизу, и ген GFP в pGN400 замещают этим амплифицированным фрагментом ДНК.
Каждый вектор, который содержит Т7 промотор, можно использовать с целью индуцированной Т7 РНК-полимеразой экспрессии в C.elegans, как например коммерчески доступные pGEM векторы и pBluescript векторы. Это ясно показали с помощью вектора pGN401, который экспрессирует GFP под регуляцией Т7 промотора в трансгенных C.elegans, которые экспрессируют Т7 РНК-полимеразу.
Использование pGN400 имеет преимущество в том, что в этот вектор включен 3′UTR фрагмент из unc-54, который усиливает транскрипцию или стабильность РНК.
Создание постоянных тканеспецифичных “псевдо-выключенных” PHKi линий C.elegans
В настоящее время выключенные гены у C.elegans получают в результате случайного, широкомасштабного мутагенеза и клонового отбора на основе ПЦР. Этот способ является громоздким, требующим очень много времени и утомительным. Описано, что введение двунитевой РНК в клетку приводит к сильной и специфичной интерференции экспрессии эндогенных генов. У C.elegans генную экспрессию можно негативно регулировать с помощью инъекции РНК в полость тела червя, вымачивания червя в растворе, содержащем dsPHK, или скармливания E.coli, которая экспрессирует dsPHK, соответствующую интересующему гену. Клетки С. elegans обладают способностью захватывать dsPHK из их внеклеточной окружающей среды. Сообщали, что мРНК является мишенью этой опосредованной dsPHK генетической интерференции (Montgomery and Fire 1998). Предполагают также, что РНК-мишень деградирует в ядре прежде, чем может произойти трансляция. Хотя опосредованное PHKi ослабление экспрессии гена может передаваться следующим поколениям, наследование является слабым, и этот эффект быстро теряется в процессе передачи следующему потомству. Это происходит, вероятно, вследствие постоянного снижения пула dsPHK. Здесь авторы изобретения предлагают способ конструирования линий C.elegans с постоянным наследуемым PHKi фенотипом. Этот способ включает в себя создание трансгенных линий C.elegans путем введения плазмид, содержащих фрагменты кДНК гена-мишени в смысловой и антисмысловой ориентации под контролем промотора червя, либо путем транскрипции инвертированного повтора кДНК с единственной конструкции. Альтернативно, dsPHK можно транскрибировать с вектора, содержащего кДНК, фланкированную двумя Т7 промоторами, в штамме C.elegans, который экспрессирует Т7 полимеразу. Результатом является трансгенный червь с наследуемым стабильным “псевдо-выключенным” фенотипом. Экспрессия кДНК или Т7 полимеразы может быть общей и конститутивной, но может быть также регулируемой под тканеспецифичным промотором. В противоположность PHKi, индуцированному внешней dsPHKi (инъецированной, вымоченной или скормленной), этот способ позволит получить условное тканеспецифичное ингибирование экспрессии гена.
Ингибирование экспрессии unc-22 РНК интерференцией приводит к “колеблющемуся” фенотипу
Unc-22 кДНК (экзон 22) клонировали в смысловой и в антисмысловой ориентации в pPD103.05 (A.Fire nr L2865), содержащий промотор let858, который способен экспрессировать РНК последовательности во всех тканях. Полученные в результате плазмиды обозначили pGN205 (фиг.19а) и pGN207 (фиг.19б). Эти конструкции вводили в C.elegans вместе с селективным маркером (rol-6; GFP). Трансгенные индивидуумы F1 (экспрессирующие rol-6 или GFP) проявляли “колеблющийся” фенотип, указывая на то, что PHKi может быть опосредованным эндогенной транскрипцией РНК с трансгенной ДНК. PHKi фенотип сегрегировал совместно с селективным маркером в следующем потомстве. Это привело в результате к созданию линий C.elegans с постоянным PHKi фенотипом.
Создание стабильных линий с Т7 РНК-полимеразой и создание двойных трансгенных червей
Экспрессионная система в C.elegans, основанная на экзогенной РНК-полимеразе, требует двух плазмид. Одна кодирует РНК-полимеразу под контролем специфичного промотора, тогда как другая плазмида кодирует фрагмент ДНК, который нужно экспрессировать, под регуляцией Т7 промотора. В случае полустабильных PHKi, также обозначаемых как псевдостабильные выключения, интересующую ДНК клонируют между двумя Т7 промоторами так, чтобы могла продуцироваться dsPHK.
Поскольку известно, что Т7 РНК-полимеразная экспрессионная система является системой высокой экспрессии, это приведет к проблемам создания двойных трансгенных животных. Если ген, который нужно экспрессировать в нематоде C.elegans, токсичен, это будет приводить к летальным эффектам и, следовательно, к конструированию C.elegans без высоко регулируемой стабильной экспрессии интересующего гена. Если интересующий ген является существенным для выживания организма, PHKi с фрагментом ДНК из этого гена будет также приводить к летальным эффектам, так что псевдостабильные выключения невозможны.
Чтобы преодолеть эту проблему, авторы настоящего изобретения разработали систему, состоящую из двух трансгенных животных. Первое животное является трансгенным по Т7 РНК-полимеразе, причем эта Т7 РНК-полимераза может экспрессироваться во всех клетках, либо в специфических клетках или тканях, как показано в предыдущих примерах. Второе трансгенное животное является трансгенным по интересующему фрагменту ДНК. Это может быть ген или кДНК, сцепленная с Т7 промотором, либо, если исследователь хочет осуществить PHKi, фрагмент ДНК такого гена, клонированный между двумя Т7 промоторами.
Оба трансгенных животных являются жизнеспособными и не проявляют каких-либо аберрантных фенотипов. Это является следствием того, что Т7 РНК-полимераза, экспрессируемая в первом трансгенном организме, не является токсичной для этого организма, даже если экспрессируется на относительно высоких уровнях. Во втором трансгенном организме интересующий ген не экспрессируется, либо dsPHK не продуцируется, поскольку эти трансгенные животные не содержат Т7 РНК-полимеразу.
Экспрессию интересующего гена или кДНК, либо PHKi с фрагментом ДНК теперь можно получить путем скрещивания этих двух трансгенных животных. Их потомство является двойным трансгенным и экспрессирует интересующий ген, либо экспрессирует dsPHK интересующего фрагмента ДНК. Чтобы получить достаточно мужских особей в таком скрещивании, одна из мужских особей этих трансгенных животных может представлять собой мутант C.elegans с фенотипом, способствующим генерации мужских особей. Примером такого мутанта является him-5. Предпочтительно такой мутант будут использовать для получения C.elegans, трансгенного по Т7 РНК-полимеразе, тогда как гермафродит содержит фрагмент ДНК под регуляцией Т7 промотора.
Чтобы эффективно отбирать двойное трансгенное потомство, во второе трансгенное животное можно ввести второй трансген. Этот трансген содержит репортерный ген под регуляцией Т7 промотора. Этот репортерный ген может представлять собой GFP, люциферазу, бета-галактозидазу или бета-лактамазу. Примером такого трансгена являются векторы pGN400 и pGN401.
Чтобы получить индуцируемую тканеспецифичную экспрессию трансгена в C.elegans, авторы изобретения могут создать линию мужских особей (то есть him-5), несущих Т7 полимеразную конструкцию под контролем различных промоторов C.elegans, которые таким образом обеспечивают тканеспецифичную экспрессию. Этих мужских особей можно скрещивать с гермафродитами, несущими интересующий ген под контролем Т7 промотора.
Кроме того, эти трансгены можно интегрировать в геном животного. Описаны способы создания стабильной интеграции плазмиды в геном животного (Methods in cell biology, Vol. 48, 1995, ed. by Epstein and Shakes, Academic Press), которые включают в себя облучение животного. Это можно осуществить для обоих животных, но предпочтительно такой обработке подвергают животных, экспрессирующих Т7 РНК-полимеразу. Это дает в результате коллекцию нематод C.elegans, которые стабильно экспрессируют Т7 РНК-полимеразу под контролем различных промоторов. Примерами таких промоторов являются myo-2 (глоточная экспрессия), myo-3 (мышцы стенки тела), egl-15 (мышцы женских половых орагнов), unc-119 (постганглионарный нейрон), SERCA (мышцы), let858 (все клетки), ges-1 (кишка).
Конструирование дрожжевых двухгибридных векторов PHKi - Т7 промотор
pGAD424 с прямой и обратной ориентацией Т7/Т3 и/или SP6
В большинстве двухгибридных экспериментов библиотеку кДНК клонируют в плазмиду pGAD424 (фиг.16), которая сконструирована с дополнительными сайтами рестрикции в полилинкере, такими как Ncol сайт (Clontech). Эта библиотека дает возможность скрининга связывающихся белков в дрожжевом двухгибридном эксперименте. Авторы изобретения сконструировали новый дрожжевой двухгибридный вектор с такими же возможностями для проведения дрожжевого двухгибридного эксперимента, но который содержит два дополнительных Т7 промотора, так что этот вектор можно использовать для индуцированных Т7 РНК-полимеразой псевдостабильных выключений. Для этого авторы изобретения встроили прямой Т7 с помощью использования Т7 линкера (состоящего из следующих праймеров: aattcttaatacgactcactatagggcc и catgggccctatagtgagtcgtattaag) в EcoRI-NcoI сайт pGAD424. Полученный в результате вектор обозначили pGAD424-without-FULL-ICE-both-T7. Внимание уделяли элиминации стоп-кодонов и использованию аминокислот, максимально совместимых с полилинкером. Такую же стратегию авторы изобретения применили для обратного Т7 (состоящего из обоих праймеров: gatccgtcgacagatctccctatagtgagtcgtattactgca и gtaatacgactcactatagggagatctgtcgacg) с BamHI и PstI. Чтобы избежать потери SaII, авторы изобретения включили этот сайт в праймер.
SaII сайт является важным, поскольку большинство библиотек клонируют в этот сайт, адаптеры имеются в распоряжении. Это делает вновь сконструированный вектор совместимым с существующими векторами.
pAS2 с прямой и обратной ориентацией Т7/Т3 и/или SP6
Аналогичный дрожжевой двухгибридный вектор сконструировали на основе pAS2 (Clontech). С помощью частичного ферментативного гидролиза EcoRV авторы изобретения смогли удалить значительную часть гена суh2. Правильную конструкцию можно выделить и проверить с помощью рестрикционного ферментативного гидролиза с помощью BgIII. Этот сайт рестрикции присутствует в EcoRV фрагменте pAS2, который нужно элиминировать. Это элиминирует cyh2 ген, который является слегка токсичным геном и вовлечен в задержку роста. Этот ген является несущественным для проведения РНКi и дрожжевых двухгибридных экспериментов. После элиминации EcoRV фрагмента сайт рестрикции EcoRI, который локализован между последовательностями ДНК, кодирующими GAL4DB и НА (эпитоп), становится уникальным для этой плазмиды, и его можно использовать для замещения НА линкером, содержащим Т7 промотор. Это гарантирует постоянство всех сайтов рестрикции, давая возможность как клонирования в рамке считывания, так и совместимости с предшествующими векторами и pGAD424. Авторы изобретения использовали следующий линкер (праймеры: aattcttaatacgactcactatagggca и tatgccctatagtgagtcgtattaag), используя сайты клонирования EcoRI и NdeI. Такую же стратегию авторы изобретения применили для обратного Т7 (праймеры: gatccgtcgacagatctccctatagtgagtcgtattactgcacatgggccctatagtgagtcgtattaag и gtaatacgactcactatagggagatctgtcgacg) с BamHI и PstI. Чтобы избежать потери SaII, авторы изобретения включили его в праймер. Полученный в результате вектор обозначили pAS2-cyh2-HA+both T7-final.
Наличие Т7 промотора (или альтернативно Т3 или SP6 промотора) в pGAD424 дает возможность быстрого перехода от взаимодействующего белка к PHKi и определению функции выделенного фрагмента ДНК. Дополнительным преимуществом является способность создания с помощью транскрипции in vitro вместе с трансляцией in vitro (имеется ATG в рамке считывания либо с GAL4DB, либо с GAL4AD) меченого белка, который можно использовать для контролей in vitro (например, анализов задержки (pull-down анализы)) фактического белок-белкового взаимодействия.
Последовательности полученных плазмид и также SP6 и Т3 полимеразы идентифицированы в перечне последовательностей, представленном ниже.







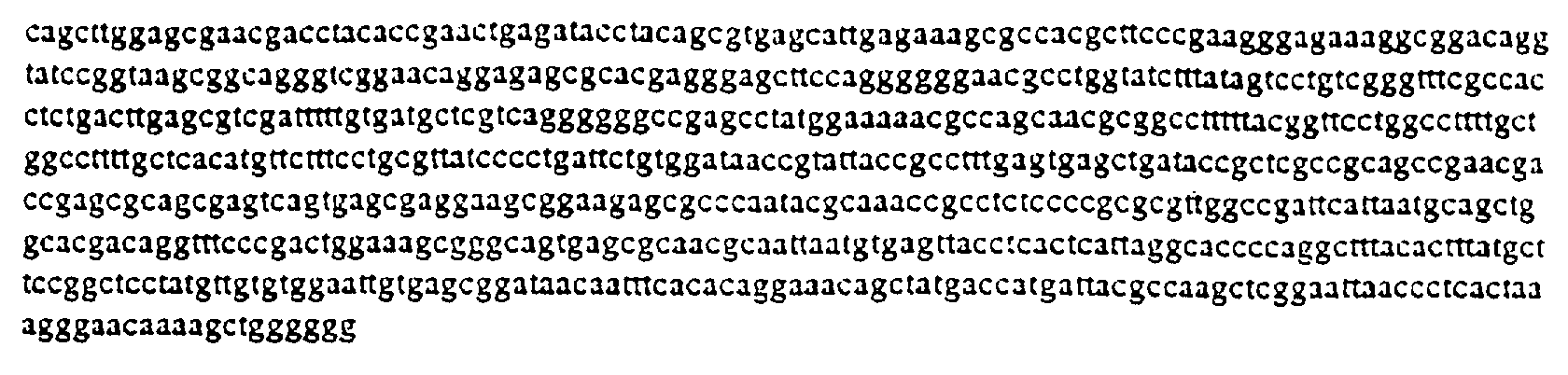






Реферат
Изобретение касается характеристики или идентификации функции гена с использованием ингибирования двунитевой РНК (dsРНК). Предложены способ введения dsРНК или ДНК, способной к продуцированию dsРНК, в C.elegans (варианты) и способ негативной регуляции экспрессии интересующего гена в C.elegans (варианты). Предложенные способы предусматривают введение в C.elegans dsРНК или ДНК, способную к продуцированию dsРНК, в результате экспрессии которой происходит ингибирование экспрессии мишеневого гена. Изобретение позволяет проводить исследования, касающиеся установления функции мишеневых генов, и может быть использовано в генной инженерии. 8 c. и 90 з.п. ф-лы, 19 ил.

Комментарии