Нерепликативные трансдукторные частицы и основанные на трансдукторных частицах репортерные системы - RU2661101C2
Код документа: RU2661101C2
Чертежи












































Описание
Ссылка на родственные заявки
По настоящей заявке испрашивается приоритет в соответствии с предварительной заявкой на патент США №61/779177, поданной 13 марта 2013 г., предварительной заявкой на патент США №61/897040, поданной 29 октября 2013 г., и предварительной заявкой на патент США №61/939126, поданной 12 февраля 2014 г., каждая из которых полностью включена в настоящий документ посредством ссылки.
Перечень последовательностей
Настоящая заявка содержит перечень последовательностей, который был представлен в электронном виде в формате ASCII и полностью включен в настоящий документ. Указанная копия ASCII, созданная 10 апреля 2014 г., названа 25938PCT_CRF_SequenceListing.txt, и ее размер составляет 65305 байт.
Область техники
Настоящее изобретение относится к способам и композициям для упаковки и доставки нерепликативных трансдукторных репортерных молекул в клетки для обнаружения генов-мишеней в клетках.
Уровень техники
Трансдукторная частица относится к вирусу, способному доставлять невирусную нуклеиновую кислоту в клетку. Основанные на вирусах репортерные системы были использованы для обнаружения наличия клеток и основаны на лизогенной фазе вируса, делающей возможной экспрессию репортерной молекулы из клетки. Эти основанные на вирусах репортерные системы используют компетентные по репликации трансдукторные частицы, которые экспрессируют репортерные молекулы и заставляют клетку-мишень излучать обнаруживаемый сигнал.
Однако было показано, что литический цикл вируса вреден для основанных на вирусах репортерных анализов. Carriere, С. et al., Conditionally replicating luciferase reporter phages: Improved sensitivity for rapid detection and assessment of drug susceptibility of Mycobacterium tuberculosis. Journal of Clinical Microbiology, 1997. 35(12): p. 3232-3239.


Существуют недостатки, однако, связанные с супрессированием, но не исключением функции репликации бактериофага в основанных на бактериофагах репортерных анализах. Во-первых, контрольные функции репликации бактериофага накладывают ограничивающие анализ условия. Например, литический цикл репортерного фага phAE40, используемый

Кроме того, функции репликации вируса трудно контролировать. Репликация вируса должна быть супрессирована при использовании трансдукторных частиц в качестве репортерной системы. Например, литическую активность репортерного фага phAE40, о котором сообщал


Можно ожидать, что репортерные анализы, основываясь на естественном лизогенном цикле фагов, будут проявлять литическую активность спорадически. Кроме того, анализы, которые основаны на лизогенном цикле фага, могут быть склонны к суперинфекционному иммунитету от клеток-мишеней, уже лизогенизированных аналогичным фагом, а также природные системы рестрикции хозяина, которые направленно воздействуют на проникающую вирусную нуклеиновую кислоту, тем самым ограничивая круг хозяев этих репортерных фагов.
В других примерах системы производства трансдукторных частиц разрабатывают для упаковки экзогенных молекул нуклеиновых кислот, но трансдукторная частица часто содержит комбинацию экзогенных молекул нуклеиновых кислот и нативных потомственных вирусных молекул нуклеиновых кислот. Нативный вирус может проявлять литическую активность, что представляет собой препятствие для проведения анализа, и литическая активность вируса должна быть устранена для того, чтобы очистить трансдукторные частицы. Тем не менее, это очищение, как правило, невозможно. В патенте США №2009/0155768 А, озаглавленном Reporter Plasmid Packaging System for Detection of Bacteria, Scholl с соавт. описывает развитие такой системы трансдукторных частиц. Продукт системы представляет собой сочетание репортерной трансдукторной частицы и нативного бактериофага (фиг. 8 в качестве ссылки). Хотя авторы указывают на то, что трансдукторная частица и нативный бактериофаг могут быть разделены с помощью ультрацентрифугирования, такое разделение возможно только в системе, где трансдукторная частица и нативный вирус характеризуются различными плотностями, которые позволили бы разделение с помощью ультрацентрифугирования. В то время как эта характеристика проявляется в основанной на бактериофаге Т7 системе упаковки, описанной в ссылке, для нее не характерно то, что, как правило, применимо для других вирусных систем. Общее для вирусного упаковочного устройства представляет собой проявление упаковки "полной головки", которая приведет к тому, что нативный вирус и трансдукторная частица проявят неотличимые плотности и не смогут быть разделены с помощью ультрацентрифугирования. Вирусные упаковочные системы также основаны на минимальном количестве упаковки как требовании для правильной структурной сборки вируса, что приводит к нативному вирусу и трансдукторной частице с неразличимыми плотностями.
Таким образом, существует потребность в нерепликативных трансдукторных частицах, которые не страдают от вредного воздействия литических функций вируса и с возможностью быть ограниченными иммунитетом суперинфекции и механизмами ограничения хозяев, которые нацелено воздействуют на вирусные молекулы нуклеиновых кислот и вирусные функции, все из которых могут ограничить производительность репортерного анализа путем увеличения пределов обнаружения и приводя в результате к ложноотрицательным результатам.
Даже там, где трансдукторные частицы были сконструированы, способы использования трансдукторных частиц для обнаружения и сообщения о наличии молекул-мишеней нуклеиновых кислот в клетках характеризуются ограничениями. Некоторые способы требуют разрушения клетки и трудоемких техник для выделения и обнаружения транскриптов в лизате. Способы обнаружения включают в себя использование меченых зондов, таких как антитела, аптамеры, или зондов-нуклеиновых кислот. Меченые зонды, направленные на ген-мишень, могут приводить к неспецифическому связыванию с непредусмотренными мишенями или производить сигналы, которые характеризуются высоким соотношением сигнал-шум. Таким образом, существует потребность в специфических, эффективных и точных способах обнаружения и сообщения об эндогенных молекулах нуклеиновых кислот в клетках.
Соответственно, необходимы способы и системы для производства нерепликативных трансдукторных частиц, которые делают возможной упаковку и экспрессию репортерных молекул в клетках, при этом устраняя компетентный по репликации потомственный вирус. Также необходимы эффективные и точные способы обнаружения молекул в клетках с использованием экспрессированных репортерных молекул.
Сущность изобретения
В настоящем документе раскрыта упаковочная система бактериальной клетки для упаковки репортерной молекулы нуклеиновой кислоты в нерепликативную трансдукторную частицу, где указанная бактериальная клетка содержит лизогенизированный геном бактериофага, не содержащий ген бактериофага, кодирующий последовательность сайта инициации упаковки, причем удаление указанного гена бактериофага препятствует упаковке молекулы нуклеиновой кислоты бактериофага в указанную нерепликативную трансдукторную частицу; и репортерная молекула нуклеиновой кислоты содержит второй ген бактериофага, причем указанный второй ген бактериофага кодирует последовательность сайта инициации упаковки и облегчает упаковку копии указанной репортерной молекулы нуклеиновой кислоты в указанную нерепликативную трансдукторную частицу, причем указанный второй ген бактериофага способен экспрессировать белок, который кодируется указанным геном, причем указанная копия указанной репортерной молекулы нуклеиновой кислоты образует репликон, поддающийся упаковке в указанную нерепликативную трансдукторную частицу.
Согласно некоторым вариантам осуществления репортерная молекула нуклеиновой кислоты функционально связана с промотором. Согласно другому варианту осуществления промотор выбирают для содействия реактивности репортерной молекулы, экспрессированной из указанной репортерной молекулы нуклеиновой кислоты в указанную бактериальную клетку. Согласно одному варианту осуществления репортерная молекула нуклеиновой кислоты содержит точку начала репликации. Согласно еще одному варианту осуществления репликон содержит конкатемер, поддающийся упаковке в указанную нерепликативную трансдукторную частицу.
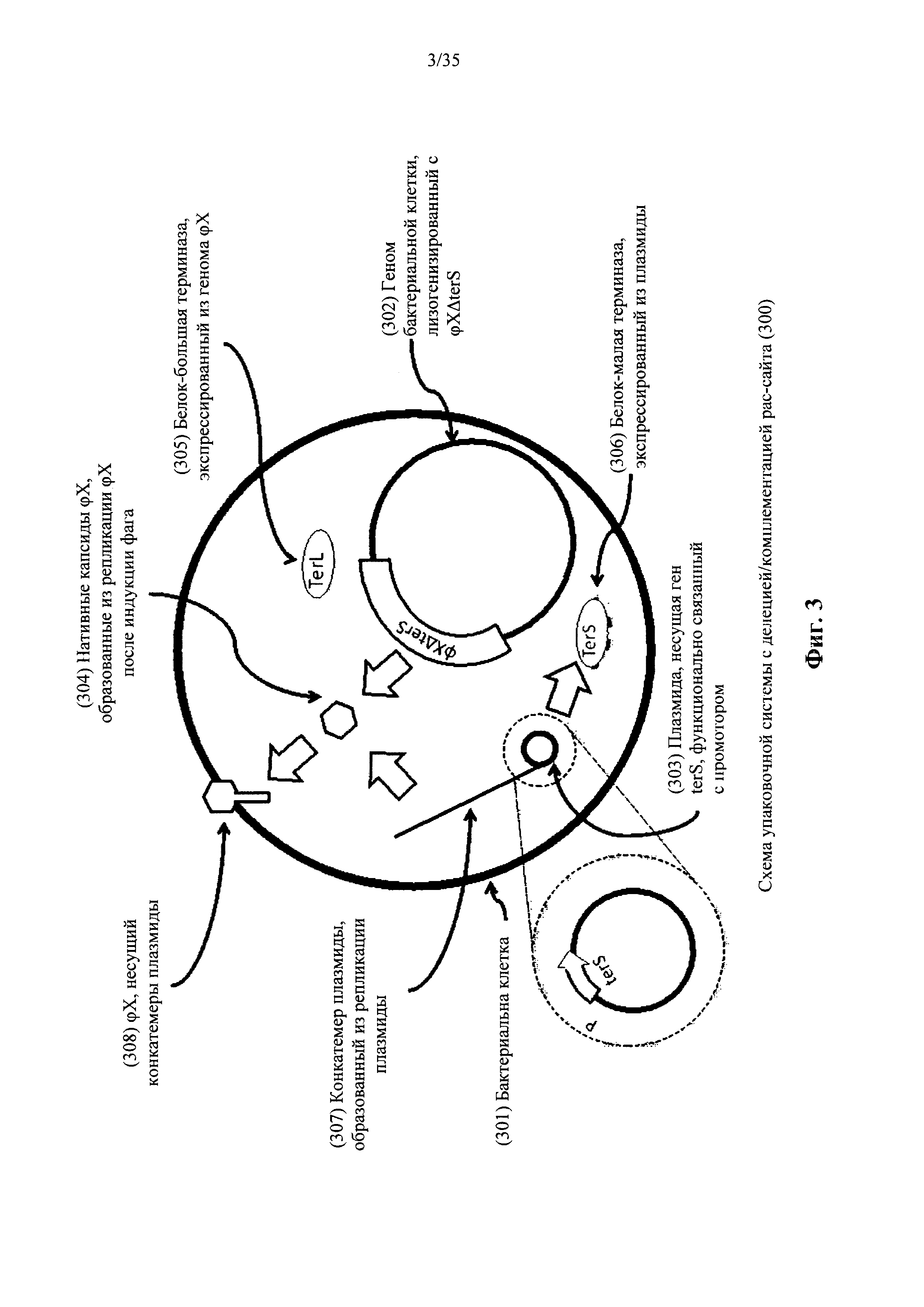
Согласно одному варианту осуществления первый и второй указанные гены бактериофага каждый содержат ген расА бактериофага P1 Enterobacteriaceae и содержат указанную последовательность сайта инициации упаковки. Согласно одному варианту осуществления второй ген бактериофага содержит последовательность SEQ ID NO: 9. Согласно другому варианту осуществления репликон представляет собой литический репликон бактериофага P1 Enterobacteriaceae. Согласно некоторым вариантам осуществления репликон содержит контролируемый репрессором С1 промотор Р53, антисмысловой промотор Р53, ген repL и делецию внутри рамки считывания гена kilA. Согласно одному варианту осуществления репликон содержит последовательность SEQ ID NO: 3.
Согласно еще одному варианту осуществления первый и второй гены бактериофага каждый содержит ген малой терминазы (terS), содержащий указанную последовательность сайта инициации упаковки. Согласно одному варианту осуществления ген terS представляет собой ген terS бактериофага ϕ11 или ϕ80α S. aureus.
Согласно другому варианту осуществления репликон происходит от точки начала репликации плазмиды рТ181 S. aureus. Согласно еще одному варианту осуществления репликон содержит последовательность SEQ ID NO: 5. Согласно некоторым вариантам осуществления последовательность сайта инициации упаковки указанного второго гена бактериофага содержит рас-сайт. Согласно другим вариантам осуществления рас-сайт указанного второго гена бактериофага содержит последовательность SEQ ID NO: 7. Согласно одному аспекту последовательность сайта инициации упаковки указанного второго гена бактериофага содержит cos-сайт. Согласно другому аспекту последовательность сайта инициации упаковки указанного второго гена бактериофага содержит конкатемерное сцепление.
Согласно другому аспекту плазмида содержит указанную репортерную молекулу нуклеиновой кислоты. Согласно одному аспекту второй ген бактериофага функционально связан с промотором. Согласно другому варианту осуществления промотор представляет собой индуцируемый промотор или конститутивный промотор. Согласно одному варианту осуществления бактериофаг включает бактериофаг Р1 Enterobacteriaceae. Согласно еще одному варианту осуществления бактериофаг включает бактериофаг ϕ80α или бактериофаг ϕ11 S. aureus. Согласно одному аспекту бактериальная клетка включает клетку Е. coli. Согласно другому аспекту бактериальная клетка включает клетку S. aureus. Согласно еще одному варианту осуществления бактериальная клетка включает грамотрицательную клетку. Согласно другим вариантам осуществления бактериальная клетка включает грамположительную клетку.
Согласно другому аспекту репортерная молекула нуклеиновой кислоты содержит репортерный ген. Согласно одному аспекту репортерный ген кодирует обнаруживаемый и/или селектируемый маркер. Согласно некоторым аспектам репортерный ген выбирают из группы, состоящей из ферментов, опосредующих люминесцентные реакции (luxA, luxB, luxAB, luc, ruc, nluc), ферментов, опосредующих колориметрические реакции (LacZ, HRP), флуоресцентных белков (GFP, eGFP, YFP, RPP, CFP, BFP, mCherry, флуоресцентные белки ближней инфракрасной области), аффинных пептидов (His-Tag, 3X-FLAG) и селективных маркеров (ampC, tet(M), CAT, erm). Согласно другому аспекту репортерная молекула нуклеиновой кислоты содержит аптамер. Согласно еще одному аспекту репортерная молекула нуклеиновой кислоты содержит последовательность транскрипта нуклеиновой кислоты, которая комплементарна второй последовательности в указанной репортерной молекуле нуклеиновой кислоты.
Согласно одному варианту осуществления последовательность транскрипта нуклеиновой кислоты комплементарна клеточному транскрипту. Согласно другому варианту осуществления последовательность транскрипта нуклеиновой кислоты содержит цис-репрессорную последовательность. Согласно еще одному варианту осуществления копия указанной репортерной молекулы нуклеиновой кислоты содержит последовательность транскрипта нуклеиновой кислоты, которая комплементарна второй последовательности в указанной копии указанной репортерной молекулы нуклеиновой кислоты, причем последовательность транскрипта нуклеиновой кислоты комплементарна клеточному транскрипту и причем указанная последовательность транскрипта нуклеиновой кислоты содержит цис-репрессорную последовательность.
Согласно некоторым вариантам осуществления способ упаковки репортерной молекулы нуклеиновой кислоты в нерепликативную трансдукторную частицу включает обеспечение условий указанной описанной в настоящем документе бактериальной клетке, которые индуцируют литическую фазу указанного бактериофага для получения нерепликативных трансдукторных частиц, упакованных с указанной репортерной молекулой нуклеиновой кислоты; и выделение указанной нерепликативной трансдукторной частицы, содержащей указанную репортерную молекулу нуклеиновой кислоты. Согласно одному варианту осуществления нерепликативная трансдукторная частица не содержит реплицируемый геном бактериофага. Согласно другому варианту осуществления индукция указанной литической фазы запускает удаление указанной молекулы нуклеиновой кислоты геномного острова из указанного генома указанной бактериальной клетки.
Согласно другому варианту осуществления композиция содержит указанную нерепликативную трансдукторную частицу, содержащую копию указанной репортерной молекулы нуклеиновой кислоты, полученной с помощью описанного в настоящем документе способа.
Настоящее изобретение включает упаковочную систему бактериальной клетки для упаковки репортерной молекулы нуклеиновой кислоты в нерепликативную трансдукторную частицу, где указанная бактериальная клетка содержит лизогенизированный геном бактериофага, содержащий первую последовательность сайта инициации упаковки бактериофага, причем указанная первая последовательность сайта инициации упаковки бактериофага содержит мутацию, которая предотвращает упаковку молекулы нуклеиновой кислоты бактериофага в указанную нерепликативную трансдукторную частицу; и репортерная молекула нуклеиновой кислоты содержит вторую последовательность сайта инициации упаковки бактериофага, причем указанная вторая последовательность сайта инициации упаковки бактериофага не содержит указанную мутацию и облегчает упаковку копии указанной репортерной молекулы нуклеиновой кислоты в указанную нерепликативную трансдукторную частицу, причем указанная копия указанной репортерной молекулы нуклеиновой кислоты образует репликон для упаковки в указанную нерепликативную трансдукторную частицу.
Согласно одному варианту осуществления репортерная молекула нуклеиновой кислоты функционально связана с промотором. Согласно другому варианту осуществления промотор выбирают для содействия реактивности репортерной молекулы, экспрессированной из указанной репортерной молекулы нуклеиновой кислоты в указанной бактериальной клетке. Согласно еще одному варианту осуществления репортерная молекула нуклеиновой кислоты содержит точку начала репликации. Согласно одному варианту осуществления репликон содержит конкатемер, поддающийся упаковке в указанную нерепликативную трансдукторную частицу. Согласно другому аспекту первая и вторая последовательности сайта инициации упаковки бактериофага каждая содержит последовательность сайта инициации упаковки из гена малой терминазы. Согласно одному аспекту первая и указанная вторая последовательности сайта инициации упаковки бактериофага каждая содержит последовательность рас-сайта из гена расА бактериофага Р1 Enterobacteriaceae. Согласно другому аспекту первая последовательность сайта инициации упаковки бактериофага содержит SEQ ID NO: 2. Согласно еще одному аспекту вторая последовательность сайта инициации упаковки бактериофага содержит SEQ ID NO: 1. Согласно одному варианту осуществления репликон включает литический репликон бактериофага P1 Enterobacteriaceae. Согласно другому варианту осуществления репликон содержит контролируемый репрессором С1 промотор Р53, антисмысловой промотор Р53, ген repL и делецию внутри рамки считывания гена kilA. Согласно одному варианту осуществления репликон содержит последовательность SEQ ID NO: 3. Согласно некоторым аспектам первая и вторая последовательности сайта инициации упаковки бактериофага каждая содержит последовательность рас-сайта из гена малой терминазы (terS) бактериофага ϕ11 или ϕ80α S. aureus. Согласно одному аспекту репликон происходит от точки начала репликации плазмиды рТ181 S. aureus. Согласно еще одному аспекту репликон содержит последовательность SEQ ID NO: 5. Согласно одному аспекту первая последовательность сайта инициации упаковки бактериофага содержит последовательность SEQ ID NO: 2. Согласно некоторым вариантам осуществления вторая последовательность сайта инициации упаковки бактериофага содержит последовательность SEQ ID NO: 1. Согласно другим вариантам осуществления последовательность сайта инициации упаковки содержит рас-сайт. Согласно другому варианту осуществления последовательность сайта инициации упаковки содержит cos-сайт. Согласно еще другому варианту осуществления последовательность сайта инициации упаковки содержит конкатемерное сцепление. Согласно некоторым вариантам осуществления мутация в указанной первой последовательности сайта инициации упаковки бактериофага содержит молчащую мутацию. Согласно другому варианту осуществления мутация в указанной первой последовательности сайта инициации упаковки бактериофага предотвращает расщепление указанной последовательности инициации упаковки. Согласно другому варианту осуществления плазмида содержит указанные репортерные молекулы нуклеиновой кислоты. Согласно одному варианту осуществления бактериофаг включает бактериофаг P1 Enterobacteriaceae.
Согласно другому варианту осуществления бактериофаг включает бактериофаг ϕ11 или бактериофаг ϕ80α S. aureus. Согласно одному аспекту бактериальная клетка включает клетку Е. coli. Согласно другому аспекту бактериальная клетка включает клетку S. aureus. Согласно некоторым вариантам осуществления бактериальная клетка включает грамотрицательную клетку. Согласно другому аспекту бактериальная клетка включает грамположительную клетку. Согласно другому аспекту репортерная молекула нуклеиновой кислоты содержит репортерный ген. Согласно еще одному аспекту репортерный ген кодирует обнаруживаемый маркер и/или селектируемый маркер.
Согласно другим аспектам репортерный ген выбирают из группы, состоящей из: генов, кодирующих ферменты, опосредующие люминесцентные реакции (luxA, luxB, luxAB, luc, ruc, nluc), генов, кодирующих ферменты, опосредующие колориметрические реакции (LacZ, HRP), генов, кодирующих флуоресцентные белки (GFP, eGFP, YFP, RFP, CFP, BFP, mCherry, флуоресцентные белки ближней инфракрасной области), молекул нуклеиновых кислот, кодирующих аффинные пептиды (His-Tag, 3X-FLAG), и генов, кодирующих селективные маркеры (ampC, tet(M), CAT, erm). Согласно другому аспекту репортерная молекула нуклеиновой кислоты содержит аптамер. Согласно другим аспектам репликон упаковывается в указанную нерепликативную трасдукторную частицу с помощью упаковочного устройства бактериофагов. Согласно некоторым вариантам осуществления репортерная молекула нуклеиновой кислоты содержит последовательность транскрипта нуклеиновой кислоты, которая комплементарна второй последовательности в указанной репортерной молекуле нуклеиновой кислоты. Согласно другому варианту осуществления последовательность транскрипта нуклеиновой кислоты комплементарна клеточному транскрипту.
Согласно одному аспекту последовательность транскрипта нуклеиновой кислоты содержит цис-репрессорную последовательность. Согласно другому аспекту копия указанной репортерной молекулы нуклеиновой кислоты содержит последовательность транскрипта нуклеиновой кислоты, которая комплементарна второй последовательности в указанной копии указанной репортерной молекулы нуклеиновой кислоты, причем последовательность транскрипта нуклеиновой кислоты комплементарна клеточному транскрипту и причем указанная последовательность транскрипта нуклеиновой кислоты содержит цис-репрессорную последовательность.
Согласно определенным аспектам способ упаковки репортерной молекулы нуклеиновой кислоты в нерепликативную трансдукторную частицу включает: обеспечение условий указанной описанной в настоящем документе бактериальной клетке, которые индуцируют литическую фазу указанного бактериофага для получения нерепликативных трансдукторных частиц, упакованных с указанной репортерной молекулой нуклеиновой кислоты; и выделение указанной нерепликативной трансдукторной частицы, содержащей указанную репортерную молекулу нуклеиновой кислоты.
Согласно другим аспектам нерепликативная трансдукторная частица не содержит реплицируемый геном бактериофага. Согласно одному аспекту индукция указанной литической фазы запускает удаление указанной молекулы нуклеиновой кислоты геномного острова из указанного генома указанной бактериальной клетки.
Согласно другому аспекту в настоящем изобретении предусмотрена композиция, содержащая указанную нерепликативную трансдукторную частицу, содержащую копию указанной репортерной молекулы нуклеиновой кислоты, полученной с помощью описанного в настоящем документе способа.
Согласно одному аспекту в настоящем изобретении предусмотрена упаковочная система бактериальной клетки для упаковки репортерной молекулы нуклеиновой кислоты в нерепликативную трансдукторную частицу, где указанная бактериальная клетка содержит: лизогенизированный геном бактериофага, содержащий первый ген бактериофага, содержащий делецию последовательности сайта инициации упаковки указанного первого гена бактериофага, которая предотвращает упаковку молекулы нуклеиновой кислоты бактериофага в указанную нерепликативную трансдукторную частицу; и репортерная молекула нуклеиновой кислоты содержит второй ген бактериофага, содержащий вторую последовательность сайта инициации упаковки, облегчающую упаковку копии указанной репортерной молекулы нуклеиновой кислоты в указанную нерепликативную трансдукторную частицу, причем указанный второй ген бактериофага кодирует белок, причем указанная копия указанной репортерной молекулы нуклеиновой кислоты образует репликон для упаковки в указанную нерепликативную трансдукторную частицу.
Согласно другому аспекту репортерная молекула нуклеиновой кислоты функционально связана с промотором. Согласно одному аспекту промотор выбирают для содействия реактивности репортерной молекулы, экспрессированной из указанной репортерной молекулы нуклеиновой кислоты в указанной бактериальной клетке. Согласно определенным аспектам репортерная нуклеиновая кислота содержит точку начала репликации. Согласно другому аспекту репликон содержит конкатемер, поддающийся упаковке в указанную нерепликативную трансдукторную частицу. Согласно одному аспекту первый и указанный второй гены бактериофага каждый содержит ген расА бактериофага P1 Enterobacteriaceae и содержит указанную последовательность сайта инициации упаковки. Согласно другому аспекту первый ген бактериофага содержит SEQ ID NO: 6. Согласно определенным аспектам второй ген бактериофага содержит SEQ ID NO: 7. Согласно одному аспекту репликон включает литический репликон бактериофага P1 Enterobacteriaceae. Согласно еще другому аспекту репликон содержит контролируемый репрессором С1 промотор Р53, антисмысловой промотор Р53, ген repL и делецию внутри рамки считывания гена kilA. Согласно другому аспекту репликон содержит последовательность SEQ ID NO: 3. Согласно другим аспектам первый и указанный второй гены бактериофага каждый содержит ген малой терминазы (terS), содержащий указанную последовательность сайта инициации упаковки. Согласно одному аспекту ген terS представляет собой тон terS бактериофага ϕ11 или бактериофага ϕ80α S. aureus. Согласно другому аспекту первый ген бактериофага содержит последовательность SEQ ID NO: 8. Согласно еще одному аспекту второй ген бактериофага содержит последовательность SEQ ID NO: 9. Согласно одному аспекту репликон происходит от точки начала репликации плазмиды рТ181 S. aureus. Согласно одному варианту осуществления репликон содержит последовательность SEQ ID NO: 5. Согласно другому варианту осуществления последовательность сайта инициации упаковки указанного второго гена бактериофага содержит рас-сайт. Согласно еще одному варианту осуществления последовательность сайта инициации упаковки указанного второго гена бактериофага содержит cos-сайт.
Согласно определенным вариантам осуществления последовательность сайта инициации упаковки указанного второго гена бактериофага содержит конкатемерное сцепление. Согласно одному варианту осуществления плазмида содержит указанную репортерную молекулу нуклеиновой кислоты. Согласно другому варианту осуществления второй ген бактериофага функционально связан с промотором. Согласно еще другому варианту осуществления промотор представляет, собой индуцируемый промотор или конститутивный промотор. Согласно определенным вариантам осуществления бактериофаг включает бактериофаг P1 Enterobacteriaceae. Согласно одному варианту осуществления бактериофаг включает бактериофаг ϕ80α или бактериофаг ϕ11 S. aureus. Согласно другим вариантам осуществления бактериальная клетка включает клетку Е. coli. Согласно другому варианту осуществления бактериальная клетка включает клетку S. aureus. Согласно одному варианту осуществления бактериальная клетка включает грамотрицательную клетку. Согласно другому варианту осуществления бактериальная клетка включает грамположительную клетку.
Согласно другому аспекту репортерная молекула нуклеиновой кислоты содержит репортерный ген. Согласно одному аспекту репортерный ген кодирует обнаруживаемый и/или селектируемый маркер. Согласно другому аспекту репортерный ген выбирают из группы, состоящей из генов, кодирующих ферменты, опосредующие люминесцентные реакции (luxA, luxB, luxAB, luc, ruc, nluc), генов, кодирующих ферменты, опосредующие колориметрические реакции (LacZ, HRP), генов, кодирующих флуоресцентные белки (GFP, eGFP, YFP, RPP, CFP, BFP, mCherry, флуоресцентные белки ближней инфракрасной области), молекул нуклеиновых кислот, кодирующих аффинные пептиды (His-Tag, 3X-FLAG), и генов, кодирующих селективные маркеры (ampC, tet(M), CAT, erm). Согласно одному варианту осуществления репортерная молекула нуклеиновой кислоты содержит аптамер. Согласно другому варианту осуществления репликон упаковывается в указанную нерепликативную трасдукторную частицу с помощью упаковочного устройства бактериофагов. Согласно еще другому варианту осуществления репортерная молекула нуклеиновой кислоты содержит последовательность транскрипта нуклеиновой кислоты, которая комплементарна второй последовательности в указанной репортерной молекуле нуклеиновой кислоты. Согласно одному варианту осуществления последовательность транскрипта нуклеиновой кислоты комплементарна клеточному транскрипту. Согласно другому варианту осуществления последовательность транскрипта нуклеиновой кислоты содержит цис-репрессорную последовательность. Согласно определенным вариантам осуществления копия указанной репортерной молекулы нуклеиновой кислоты содержит последовательность транскрипта нуклеиновой кислоты, которая комплементарна второй последовательности в указанной копии указанной репортерной молекулы нуклеиновой кислоты, причем последовательность транскрипта нуклеиновой кислоты комплементарна клеточному транскрипту и причем указанная последовательность транскрипта нуклеиновой кислоты содержит цис-репрессорную последовательность.
В настоящем изобретении предусмотрен способ упаковки репортерной молекулы нуклеиновой кислоты в нерепликативную трансдукторную частицу, включающий: обеспечение условий указанной бактериальной клетке по любому из пп. 86-125, которые индуцируют литическую фазу указанного бактериофага для получения нерепликативных трансдукторных частиц, упакованных с указанной репортерной молекулой нуклеиновой кислоты; и выделение указанной нерепликативной трансдукторной частицы, содержащей указанную репортерную молекулу нуклеиновой кислоты. Согласно одному варианту осуществления нерепликативная трансдукторная частица не содержит реплицируемый геном бактериофага. Согласно другому варианту осуществления индукция указанной литической фазы вызывает удаление указанной молекулы нуклеиновой кислоты геномного острова из указанного генома указанной бактериальной клетки.
Согласно некоторым аспектам в настоящем изобретении предусмотрена композиция, содержащая указанную нерепликативную трансдукторную частицу, содержащую копию указанной репортерной молекулы нуклеиновой кислоты, полученной с помощью описанного в настоящем документе способа.
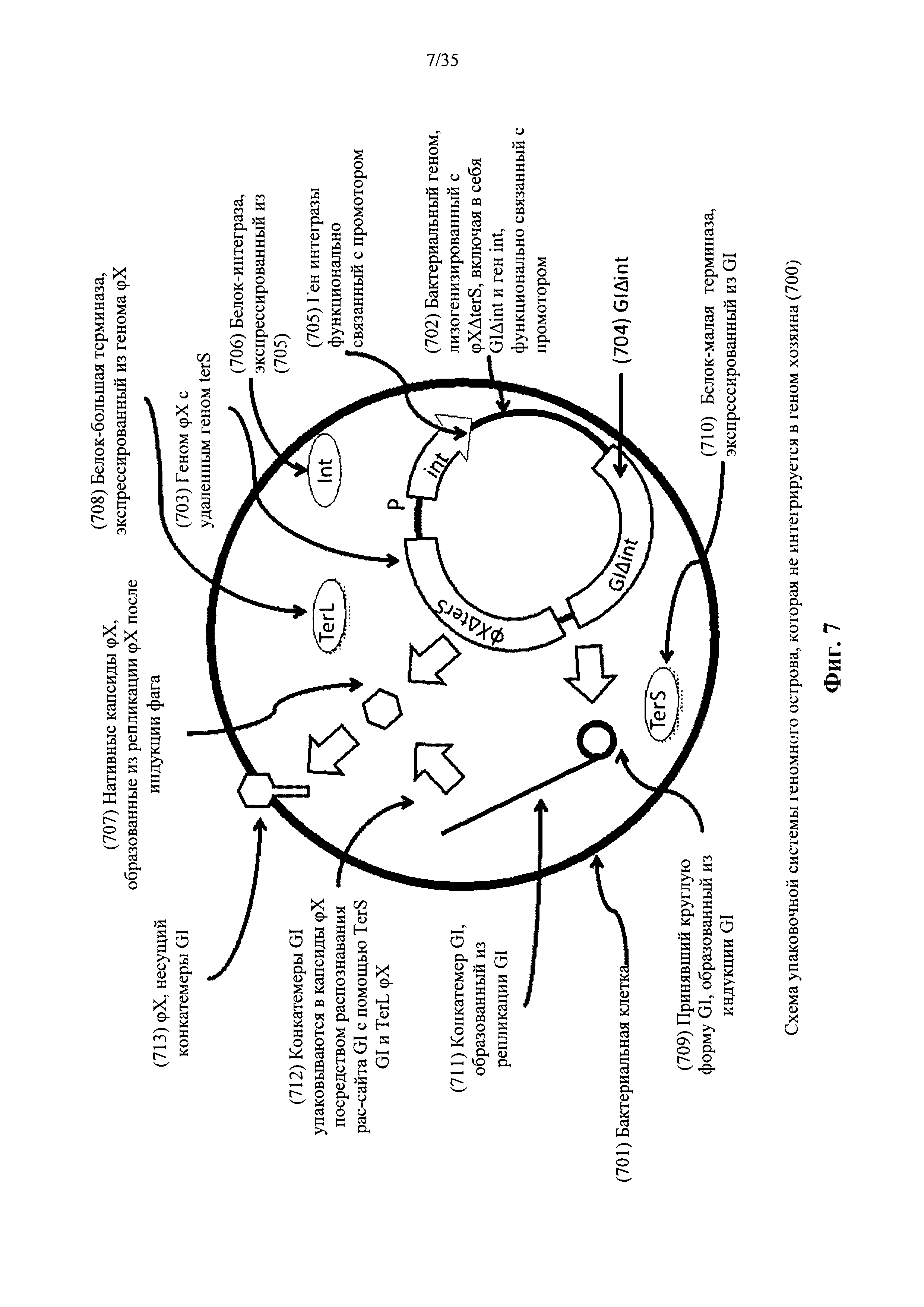
Согласно другому аспекту в настоящем изобретении предусмотрена упаковочная система бактериальной клетки для упаковки репортерной молекулы нуклеиновой кислоты в нерепликативную трансдукторную частицу, где указанная бактериальная клетка содержит: лизогенизированный геном бактериофага, не содержащий упаковочный ген и содержащий гены, которые кодируют белки, которые образуют указанную нерепликативную трансдукторную частицу; и молекулу нуклеиновой кислоты геномного острова, содержащую репортерную молекулу нуклеиновой кислоты и упаковочный ген. Согласно одному аспекту, упаковочный ген содержит ген малой терминазы (terS). Ген terS включает ген terS бактериофага ϕ80α или ген terS бактериофага ϕ11 S. aureus.
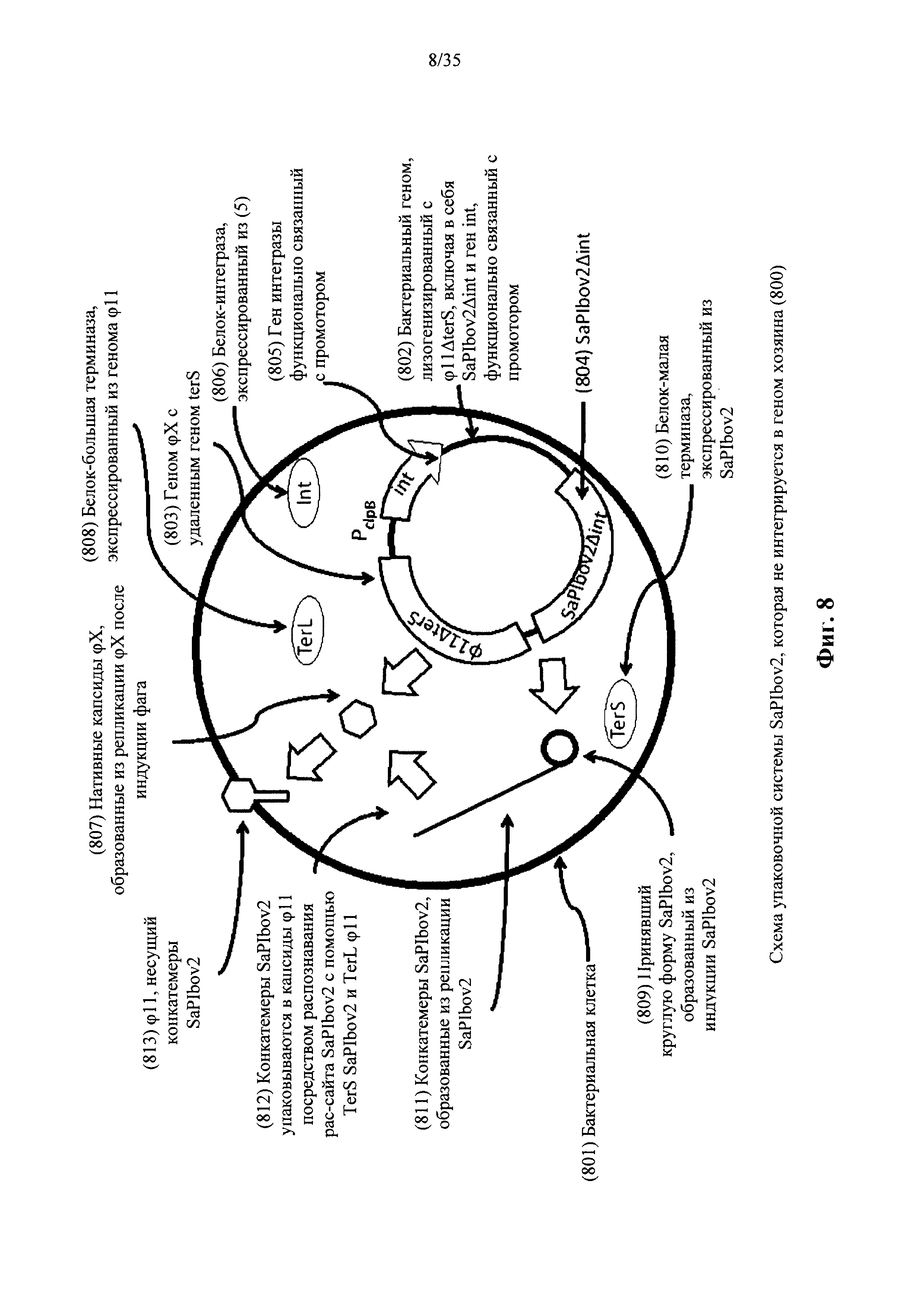
Согласно одному аспекту ген terS содержит последовательность SEQ ID NO: 9. Согласно другому аспекту молекула нуклеиновой кислоты геномного острова включает молекулу нуклеиновой кислоты SaPIbov2 геномного острова. Согласно еще одному аспекту молекулу нуклеиновой кислоты геномного острова выбирают из группы, состоящей из молекул нуклеиновой кислоты геномного острова SAPI, SaPI1, SaPI2, SaPIbov1 и SaPibov2. Согласно другому варианту осуществления репортерная молекула нуклеиновой кислоты функционально связана с промотором. Согласно еще одному варианту осуществления репортерная молекула нуклеиновой кислоты содержит точку начала репликации. Согласно некоторым вариантам осуществления бактериофаг включает бактериофаг ϕ80α или бактериофаг ϕ11 S. aureus. Согласно другим вариантам осуществления бактериальная клетка включает клетку S. aureus. Согласно одному варианту осуществления молекула нуклеиновой кислоты геномного острова содержит ген интегразы и причем указанный ген интегразы кодирует белок-интегразу для вырезания и интегрирования молекулы нуклеиновой кислоты геномного острова из и в бактериальный геном указанной бактериальной клетки. Согласно другому варианту осуществления ген интегразы содержит последовательность SEQ ID NO: 10. Согласно еще одному варианту осуществления молекулу нуклеиновой кислоты геномного острова интегрируют в бактериальный геном указанной бактериальной клетки.
Согласно некоторым аспектам молекула нуклеиновой кислоты геномного острова может быть реплицирована и образовывать молекулярный репликон, который поддается упаковке с помощью упаковочного устройства бактериофагов в указанной бактериальной клетке. Согласно другому аспекту молекула нуклеиновой кислоты образует конкатемер. Согласно еще одному аспекту реплицированная молекула нуклеиновой кислоты геномного острова способна быть упакована в указанную нерепликативную трансдукторную частицу. Согласно некоторым аспектам упаковочный ген содержит последовательность сайта рас. Согласно другому аспекту упаковочный ген содержит последовательность сайта cos. Согласно еще одному варианту осуществления упаковочный ген содержит конкатемерное сцепление.
Согласно другим вариантам осуществления репортерная молекула нуклеиновой кислоты содержит репортерный ген. Согласно некоторым вариантам осуществления репортерный ген кодирует обнаруживаемый и/или селектируемый маркер. Согласно другому варианту осуществления репортерный ген выбирают из группы, состоящей из ферментов, опосредующих люминесцентные реакции (luxA, luxB, luxAB, luc, ruc, nluc), ферментов, опосредующих колориметрические реакции (LacZ, HRP), флуоресцентных белков (GFP, eGFP, YFP, RFP, CFP, BFP, mCherry, флуоресцентные белки ближней инфракрасной области), аффинных пептидов (His-Tag, 3X-FLAG) и селективных маркеров (ampC, tet(M), CAT, erm). Согласно некоторым вариантам осуществления репортерная молекула нуклеиновой кислоты содержит аптамер. Согласно другим вариантам осуществления молекула нуклеиновой кислоты геномного острова не содержит ген интегразы. Согласно другому варианту осуществления в настоящем изобретении включает в себя бактериальный ген, содержащий ген интегразы, функционально связанный с промотором, и причем указанный ген интегразы кодирует белок-интегразу для вырезания и интеграции указанной молекулы нуклеиновой кислоты геномного острова из и в бактериальный геном указанной бактериальной клетки. Согласно одному варианту осуществления репортерная молекула нуклеиновой кислоты содержит последовательность транскрипта нуклеиновой кислоты, комплементарную второй последовательности в указанной репортерной молекуле нуклеиновой кислоты. Согласно другим вариантам осуществления последовательность транскрипта нуклеиновой кислоты комплементарна клеточному транскрипту. Согласно еще другим вариантам осуществления последовательность транскрипта нуклеиновой кислоты содержит цис-репрессорную последовательность. Согласно другому варианту осуществления копия указанной репортерной молекулы нуклеиновой кислоты содержит последовательность транскрипта нуклеиновой кислоты, комплементарную второй последовательности в указанной копии указанной репортерной молекулы нуклеиновой кислоты. Согласно другим вариантам осуществления последовательность транскрипта нуклеиновой кислоты комплементарна клеточному транскрипту. Согласно другим вариантам осуществления последовательность транскрипта нуклеиновой кислоты содержит цис-репрессорную последовательность.
В настоящем изобретении предусмотрен способ упаковки репортерной молекулы нуклеиновой кислоты в нерепликативную трансдукторную частицу, включающий: обеспечение условий указанной бактериальной клетке по любому из пп. 130-160, которые индуцируют литическую фазу указанного бактериофага для получения нерепликативных трансдукторных частиц, упакованных с указанной репортерной молекулой нуклеиновой кислоты; и выделение указанной нерепликативной трансдукторной частицы, содержащей указанную репортерную молекулу нуклеиновой кислоты. Согласно некоторым вариантам осуществления нерепликативная трансдукторная частица не содержит реплицируемый геном бактериофага. Согласно одному варианту осуществления индукция указанной литической фазы вызывает удаление указанной молекулы нуклеиновой кислоты геномного острова из указанного генома указанной бактериальной клетки.
Согласно другому варианту осуществления в настоящем изобретении предусмотрена композиция, содержащая указанную нерепликативную трансдукторную частицу, содержащую копию указанной репортерной молекулы нуклеиновой кислоты, полученной с помощью описанного в настоящем документе способа.
В настоящем изобретении также предусмотрен способ обнаружения наличия или отсутствия бактериальной клетки в образце, включающий: введение в образец нерепликативной трансдукторной частицы, содержащей репортерный ген, кодирующий репортерную молекулу, и не содержащей геном бактериофага при таких условиях, что нерепликативная трансдукторная частица может преобразовывать указанную бактериальную клетку и причем указанный репортерный ген может быть экспрессирован в указанной бактериальной клетке; обеспечение условий для активации указанной репортерной молекулы и обнаружение наличия или отсутствия репортерного сигнала, передаваемого от указанной экспрессированной репортерной молекулы, причем наличие указанного репортерного сигнала правильно указывает на наличие указанной бактериальной клетки.
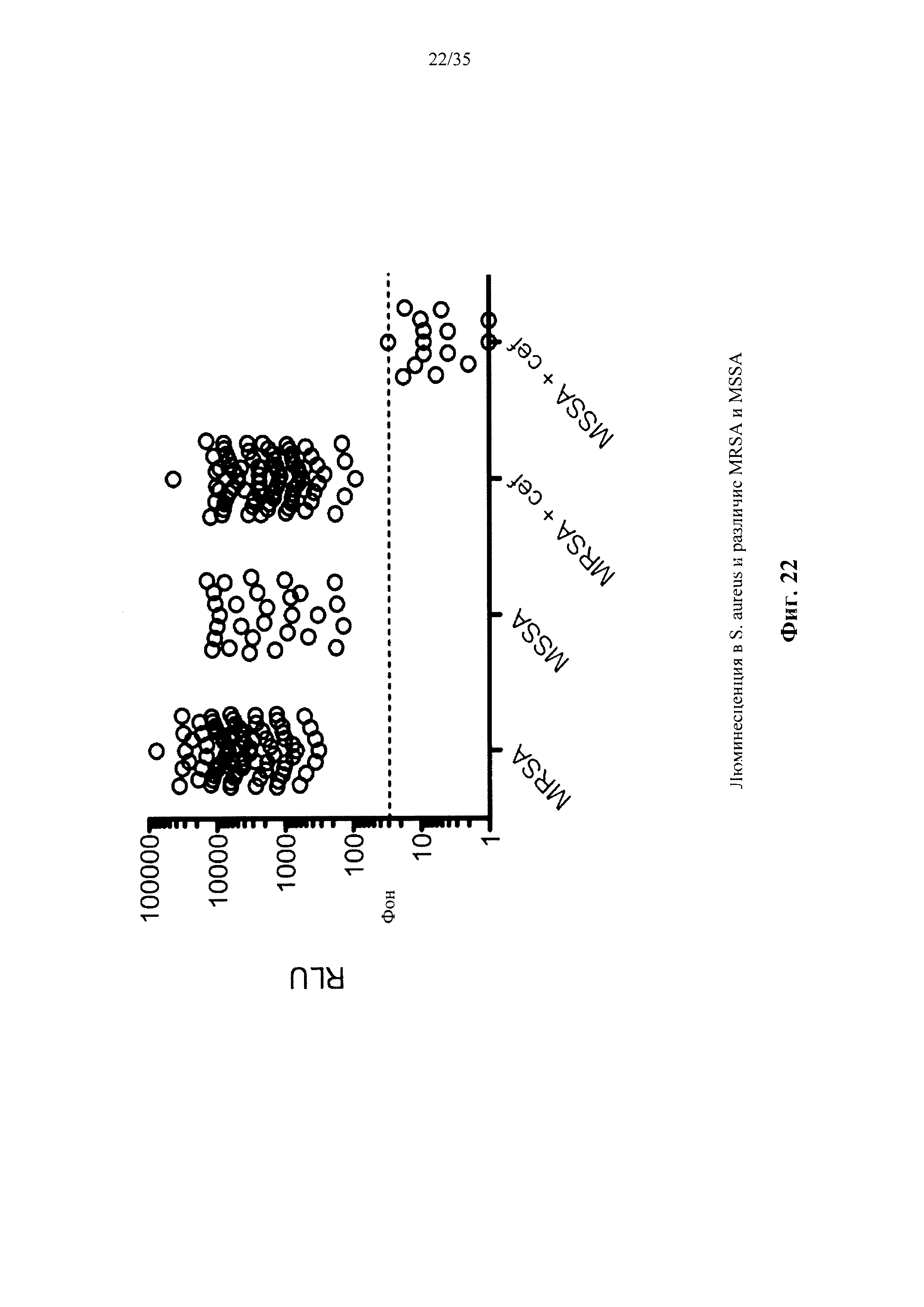
Согласно одному варианту осуществления способ обеспечивает по меньшей мере 80% специфичность обнаружения по отношению к стандарту, по меньшей мере 90% специфичность обнаружения по отношению к стандарту или по меньшей мере 95% специфичность обнаружения по отношению к стандарту. Согласно другому варианту осуществления способ обеспечивает по меньшей мере 80% чувствительность обнаружения по отношению к стандарту, по меньшей мере 85% чувствительность обнаружения по отношению к стандарту или по меньшей мере 90% чувствительность обнаружения по отношению к стандарту, или по меньшей мере 95% чувствительность обнаружения по отношению к стандарту. Согласно еще одному варианту осуществления способ обеспечивает по меньшей мере 95% специфичность обнаружения и по меньшей мере 90% чувствительность обнаружения по отношению к стандарту. Согласно другому варианту осуществления стандарт представляет собой общепринятый стандарт. Согласно еще одному варианту осуществления бактериальная клетка включает резистентную к метициллину клетку Staphylococcus aureus (MRSA). Согласно другим вариантам осуществления бактериальная клетка содержит чувствительную к метициллину клетку Staphylococcus aureus (MSSA).
Согласно другому варианту осуществления репортерный ген кодирует обнаруживаемый и/или селектируемый маркер. Согласно одному варианту осуществления репортерный ген выбирают из группы, состоящей из генов, кодирующих ферменты, опосредующие люминесцентные реакции (luxA, luxB, luxAB, luc, ruc, nluc), генов, кодирующих ферменты, опосредующие колориметрические реакции (LacZ, HRP), генов, кодирующих флуоресцентные белки (GFP, eGFP, YFP, RFP, CFP, BFP, mCherry, флуоресцентные белки ближней инфракрасной области), молекул нуклеиновых кислот, кодирующих аффинные пептиды (His-Tag, 3X-FLAG), и генов, кодирующих селективные маркеры (ampC, tet(M), CAT, erm). Согласно одному варианту осуществления репортерный ген функционально связан с конститутивным промотором.
Согласно другому аспекту репортерный сигнал может быть обнаружен от образца при пределе обнаружения (LoD), составляющем менее 1000 колониеобразующих единиц (КОЕ). Согласно другим аспектам репортерный сигнал может быть обнаружен от образца при пределе обнаружения (LoD), составляющем менее 100 колониеобразующих единиц (КОЕ). Согласно одному аспекту репортерный сигнал может быть обнаружен от образца при пределе обнаружения (LoD), составляющем менее 10 колониеобразующих единиц (КОЕ). Согласно другим аспектам репортерный сигнал может быть обнаружен от образца при LoD, составляющем менее пяти КОЕ. Согласно другому аспекту репортерный сигнал может быть обнаружен от образца при LoD, составляющем три или менее КОЕ.
Согласно одному варианту осуществления способ включает обеспечение антибиотиком указанного образца в заранее определенной концентрации и обнаружение наличия или отсутствия указанного репортерного сигнала для определения того, устойчива или чувствительна ли указанная бактериальная клетка к указанному антибиотику. Согласно другому варианту осуществления способ включает обеспечение различными предварительно определенными концентрациями антибиотика указанного образца и определение количества указанного репортерного сигнала для определения минимальной ингибирующей концентрации указанной бактериальной клетки для указанного антибиотика.
Согласно одному аспекту в настоящем изобретении предусмотрена композиция, содержащая конструкт нуклеиновой кислоты, который кодирует репортерный транскрипт нуклеиновой кислоты, способный образовывать по меньшей мере две конформации, включающие первую конформацию, которая предотвращает экспрессию репортера, содержащего внутримолекулярную двухцепочечную область, содержащую первую подпоследовательность и вторую подпоследовательность, и вторую конформацию, которая не содержит указанную внутримолекулярную двухцепочечную область и обеспечивает экспрессию репортерного гена, причем преобразование между указанными первой и второй конформациями опосредуется конкурентным связыванием клеточного транскрипта с указанной первой и/или указанной второй подпоследовательностью.
Согласно другому аспекту в настоящем изобретении предусмотрена нерепликативная трансдукторная частица, содержащая указанный конструкт нуклеиновой кислоты. Согласно еще одному аспекту конкурентное связывание указанного клеточного транскрипта с указанной первой и/или указанной второй подпоследовательностью приводит к указанной второй конформации указанного репортерного конструкта нуклеиновой кислоты. Согласно одному аспекту первая подпоследовательность или вторая подпоследовательность содержит цис-репрессорную последовательность. Согласно другому аспекту цис-репрессорная последовательность содержит последовательность, которая комплементарна или по существу комплементарна части указанного клеточного транскрипта. Согласно другим аспектам первая подпоследовательность или указанная вторая подпоследовательность содержит последовательность репортерного гена. Согласно еще одному аспекту последовательность репортерного гена содержит сайт связывания рибосом. Согласно другим аспектам последовательность репортерного гена кодирует обнаруживаемую молекулу. Согласно другому аспекту обнаруживаемый маркер содержит флуоресцентную молекулу или фермент, способный опосредовать люминесцентную или колориметрическую реакцию. Согласно одному варианту осуществления последовательность репортерного гена кодирует селектируемый маркер. Согласно другому варианту осуществления селектируемый маркер содержит ген устойчивости к антибиотику.
Согласно другим вариантам осуществления первая подпоследовательность и указанная вторая подпоследовательность находятся в цис-положении друг к другу на указанном конструкте нуклеиновой кислоты с образованием указанной внутримолекулярной двухцепочечной области. Согласно некоторым вариантам осуществления первая подпоследовательность и указанная вторая подпоследовательность комплементарны или по существу комплементарны друг другу и образуют указанную внутримолекулярную двухцепочечную область. Согласно одному варианту осуществления первая подпоследовательность или указанная вторая подпоследовательность указанной первой конформации содержит транскрипционную энхансерную последовательность, и причем указанная транскрипционная энхансерная последовательность находится выше против хода транскрипции от кодирующей области указанной последовательности репортерного гена. Согласно другому варианту осуществления первая конформация указанного репортерного luxB транскрипта нуклеиновой кислоты способна связываться с расщепляющим ферментом. Согласно другим вариантам осуществления первая конформация указанного репортерного транскрипта нуклеиновой кислоты представляет собой мишень для деградации с помощью клеточного фермента. Согласно другим аспектам первая конформация содержит несвязывающую внутримолекулярную область. Согласно другому аспекту несвязывающая внутримолекулярная область расположена со стороны 3' указанной первой подпоследовательности и со стороны 5' указанной второй подпоследовательности. Согласно другим аспектам несвязывающая внутримолекулярная область содержит последовательность YUNR, в которой Y представляет собой пиримидин, U представляет собой урацил, N представляет собой любой нуклеотид и R представляет собой пурин.
Согласно одному варианту осуществления первая подпоследовательность или вторая подпоследовательность содержит модифицированную последовательность указанного клеточного транскрипта. Согласно другому варианту осуществления модифицированная последовательность содержит нуклеотидную замену. Согласно еще одному варианту осуществления модифицированная последовательность содержит вставку, делецию или инверсию последовательности указанного клеточного транскрипта.
Способ включает композицию, содержащую конструкт нуклеиновой кислоты, который кодирует репортерный транскрипт нуклеиновой кислоты, содержащий последовательность репортерного гена, и способен образовывать по меньшей мере две конформации указанного репортерного транскрипта нуклеиновой кислоты, первую нестабильную конформацию, которая предотвращает трансляцию указанной последовательности репортерного гена в указанном репортерном транскрипте нуклеиновой кислоты, и вторую устойчивую конформацию в результате связывания указанной первой нестабильной конформации с клеточным транскриптом, указанная вторая стабильная вторичная конформация делает возможной трансляцию указанной последовательности репортерного гена указанного репортерного транскрипта нуклеиновой кислоты.
Согласно одному варианту осуществления композиция содержит нерепликативную трансдукторную частицу, содержащую указанный конструкт нуклеиновой кислоты. Согласно другому варианту осуществления клеточный транскрипт связывается на последовательности 3'UTR указанного репортерного транскрипта нуклеиновой кислоты. Согласно одному варианту осуществления вторая стабильная вторичная конформация образуется путем расщепления части последовательности указанной первой нестабильной вторичной конформации. Согласно другому варианту осуществления последовательность репортерного гена кодирует обнаруживаемую молекулу. Согласно некоторым вариантам осуществления обнаруживаемый маркер содержит флуоресцентную молекулу или фермент, способный опосредовать люминесцентную или колориметрическую реакцию. Согласно другим вариантам осуществления последовательность репортерного гена кодирует селективный маркер. Согласно другому варианту осуществления селективный маркер содержит ген устойчивости к антибиотику.
В настоящем изобретении также предусмотрена композиция, содержащая конструкт нуклеиновой кислоты, который кодирует репортерный транскрипт нуклеиновой кислоты, содержащий последовательность репортерного гена и способен образовывать по меньшей мере две конформации указанного репортерного транскрипта нуклеиновой кислоты, содержащего первую конформацию, которая предотвращает дальнейшую транскрипцию указанного конструкта нуклеиновой кислоты, и вторую конформацию, образованную путем связывания указанной первой конформации с клеточным транскриптом, причем указанная вторая конформация обеспечивает транскрипцию указанного конструкта нуклеиновой кислоты. Согласно некоторым вариантам осуществления композиция содержит нерепликативную трансдукторную частицу, содержащую указанный конструкт нуклеиновой кислоты. Согласно другому варианту осуществления репортерный транскрипт нуклеиновой кислоты содержит цис-репрессорную последовательность.
Согласно одному варианту осуществления репортерный транскрипт нуклеиновой кислоты содержит последовательность репортерного гена. Согласил другому варианту осуществления первая конформация образуется из связывания указанной цис-репрессорной последовательности с указанной последовательностью репортерного гена. Согласно некоторым вариантам осуществления первая конформация представляет собой субстрат для расщепления фермента. Согласно одному варианту осуществления первая конформация указанного репортерного транскрипта нуклеиновой кислоты содержит последовательность, которая образует структуру терминации транскрипции. Согласно другим вариантам осуществления связывание указанного клеточного транскрипта с указанной последовательностью, которая образует структуру терминации транскрипции, приводит к прекращению расщепления части указанного репортерного транскрипта нуклеиновой кислоты и образованию указанной второй конформации.
В настоящем изобретении предусмотрен вектор, содержащий регуляторную последовательность, функционально связанную с последовательностью нуклеиновой кислоты, которая кодирует указанный описанный в настоящем документе репортерный транскрипт нуклеиновой кислоты.
В настоящем изобретении предусмотрен способ обнаружения транскрипта-мишени в клетке, включающий: введение в указанную клетку указанного описанного в настоящем документе репортерного конструкта нуклеиновой кислоты; и обнаружение наличия или отсутствия выходного сигнала от указанной клетки, причем указанное наличие указанного выходного сигнала указывает на наличие транскрипта-мишени в указанной клетке. Способ включает обнаружение наличия бактериальной клетки на основании обнаружения указанного наличия указанного транскрипта-мишени.
Согласно одному варианту осуществления предусмотрен способ обнаружения наличия бактериальной клетки в образце, включающий введение в указанный образец указанного описанного в настоящем документе репортерного конструкта нуклеиновой кислоты; и обнаружение наличия или отсутствия выходного сигнала от указанного образца, причем указанное наличие указанного выходного сигнала указывает на наличие бактериальной клетки в указанном образце.
В настоящем изобретении предусмотрен набор, содержащий компартмент для удерживания образца, содержащего клетку и указанный описанный в настоящем документе репортерный конструкт нуклеиновой кислоты, и инструкции для обнаружения наличия или отсутствия выходного сигнала от указанного образца, причем наличие выходного сигнала указывает на наличие транскрипта-мишени в указанной клетке
В настоящем изобретении предусмотрена композиция, содержащая нерепликативную трансдукторную частицу, содержащую репортерный конструкт нуклеиновой кислоты, содержащий первый промотор, функционально связанный с репортерным геном, причем указанный первый промотор способен к индукции с помощью эндогенного белка-индуктора в бактериальной клетке.
В настоящем изобретении предусмотрен способ обнаружения наличия бактериальной клетки в образце, включающий контактирование указанного образца с нерепликативной трансдукторной частицей, содержащей репортерный конструкт нуклеиновой кислоты, содержащий первый промотор, функционально связанный с репортерным геном, причем указанный первый промотор способен к индукции с помощью эндогенного белка-индуктора в бактериальной клетке; и обнаружение наличия или отсутствия выходного сигнала от указанного репортерного гена, причем указанное наличие указанного выходного сигнала свидетельствует о наличии указанной бактериальной клетки в указанном образце.
Согласно одному варианту осуществления первый промотор представляет собой такой же, как индуцируемый промотор, функционально связанный с молекулой-мишенью нуклеиновой кислоты в указанной бактериальной клетке.
В настоящем изобретении предусмотрена композиция, содержащая нерепликативную трансдукторную частицу, содержащую репортерный конструкт нуклеиновой кислоты, содержащий репортерный ген, который кодирует репортерную молекулу, нерепликативную трансдукторную частицу, способную проникать в бактериальную клетку, и огражденный субстрат, который представляет собой экзогенный по отношению к указанной бактериальной клетке, который после удаления ограждения способен реагировать с указанной репортерной молекулой в указанной клетке.
В настоящем изобретении предусмотрен способ обнаружения наличия бактериальной клетки в образце, включающий контактирование указанного образца с ограниченным субстратом и нерепликативной трансдукторной частицей, содержащей репортерный конструкт нуклеиновой кислоты, содержащий репортерный ген, который кодирует репортерную молекулу, огражденный субстрат, экзогенный по отношению к указанной бактериальной клетке, который без ограждения способен реагировать с указанной репортерной молекулой в указанной клетке; и обнаружение наличия или отсутствия выходного сигнала от указанной репортерной молекулы, причем указанное наличие указанного выходного сигнала свидетельствует о наличии указанной бактериальной клетки в указанном образце.
Согласно одному варианту осуществления фермент-мишень в указанной клетке связывается с указанным огражденным субстратом для получения не огражденного субстрата. Согласно некоторым вариантам осуществления не огражденный субстрат взаимодействует с указанной репортерной молекулой для получения выходного сигнала.
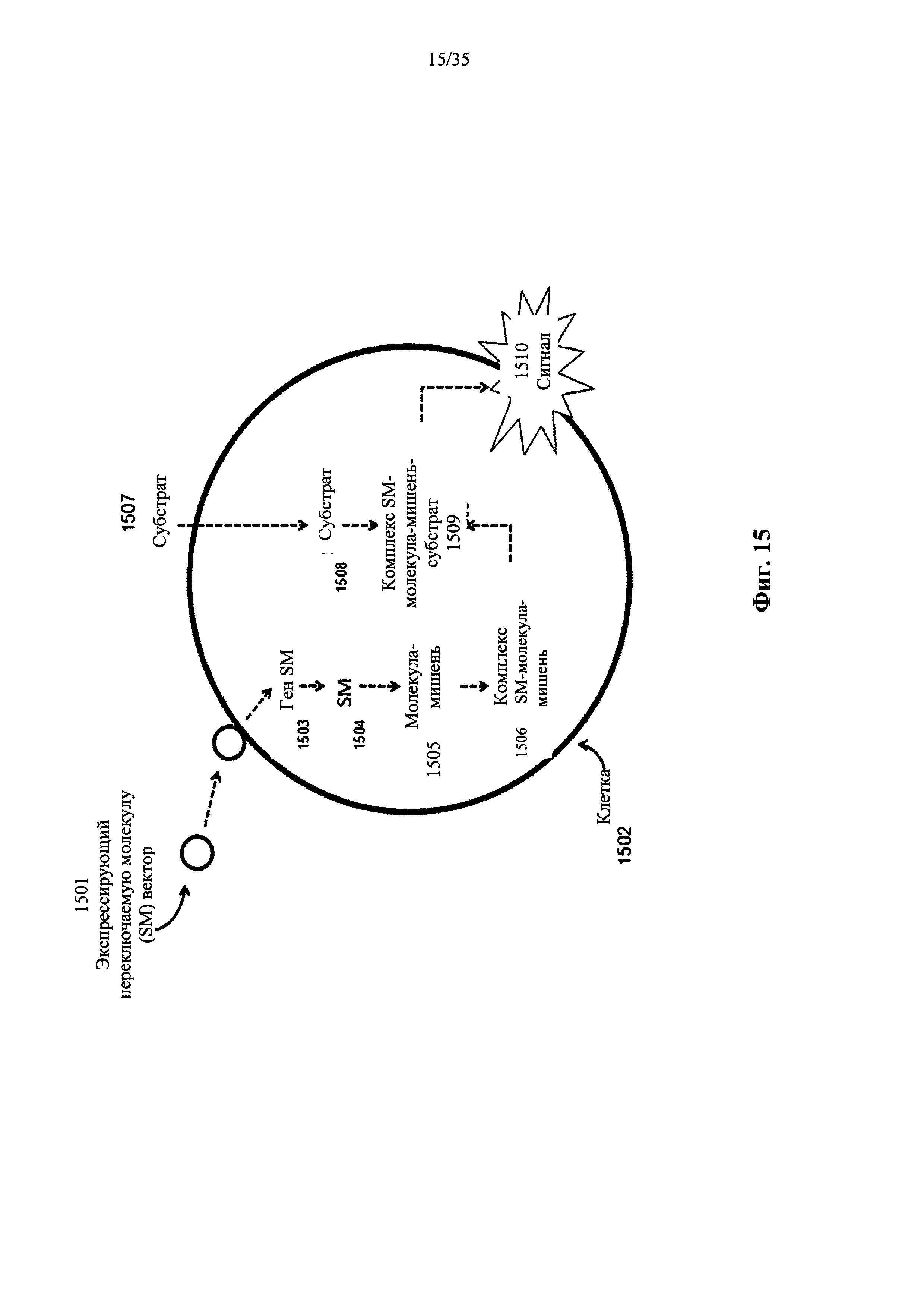
В настоящем изобретении также предусмотрена композиция, содержащая нерепликативную трансдукторную частицу, содержащую репортерный конструкт нуклеиновой кислоты, кодирующий переключаемую молекулу, способную связываться с молекулой-мишенью в бактериальной клетке для образования комплекса; и субстрат, способный проникать в указанную клетку и связываться с указанным комплексом для получения обнаруживаемого сигнала от указанной клетки.
В настоящем изобретении предусмотрен способ обнаружения наличия бактериальной клетки в образце, включающий контактирование указанного образца с субстратом и нерепликативной трансдукторной частицей, содержащей репортерный конструкт нуклеиновой кислоты, кодирующий переключаемую молекулу, способную связываться с молекулой-мишенью в указанной клетке для образования комплекса, субстрат, способный связываться с указанным комплексом для образования связанного с субстратом комплекса и обнаружение наличия или отсутствия выходного сигнала от указанного связанного с субстратом комплекса, причем указанное наличие указанного выходного сигнала свидетельствует о наличии указанной бактериальной клетки в указанном образце. Согласно одному варианту осуществления связывание указанной переключаемой молекулы с указанной молекулой-мишенью производит конформационное изменение в указанной переключаемой молекуле. Согласно другому варианту осуществления конформационное изменение в указанной переключаемой молекуле позволяет указанному субстрату связываться с указанным комплексом.
Краткое описание чертежей
Эти и другие особенности, аспекты и преимущества настоящего изобретения станут более понятными с учетом последующего описания и прилагаемых графических материалов, где:
На фиг. 1 показан пример конструкции и функции основанной на молчащей мутации/комплементации упаковочной системы плазмиды Р1 в соответствии с вариантом осуществления настоящего изобретения.
На фиг. 2 показана схема вектора pGWP10001 в соответствии с вариантом осуществления настоящего изобретения.
На фиг. 3 показан пример конструкции и функции упаковочной системы плазмиды с делецией рас-сайта/комплементацией в соответствии с вариантом осуществления настоящего изобретения.
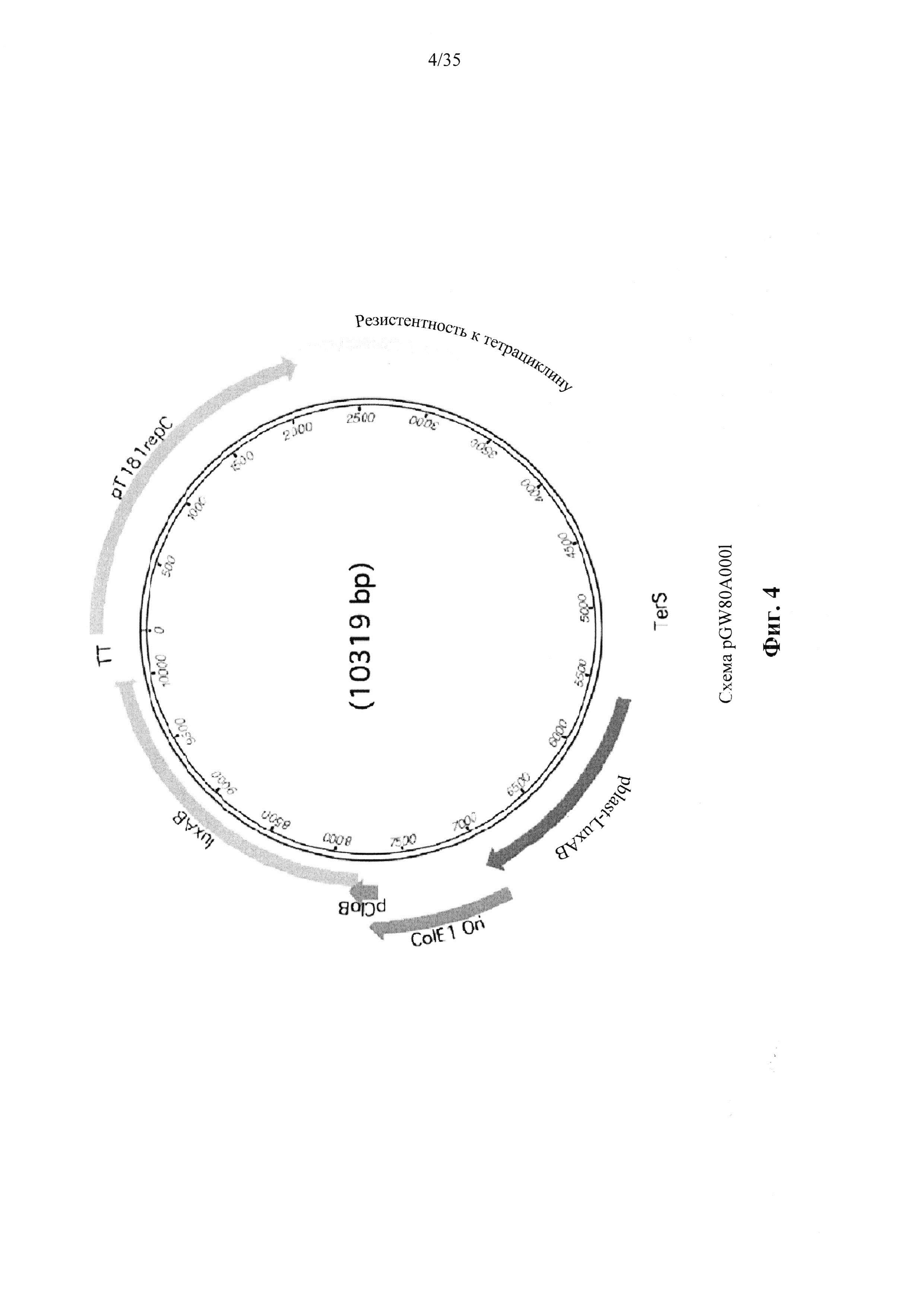
На фиг. 4 показана схема вектора pGW80A0001 в соответствии с вариантом осуществления настоящего изобретения.
На фиг. 5 показан процесс упаковки геномного острова (GI) бактериофагом в соответствии с вариантом осуществления настоящего изобретения.
На фиг. 6 показан пример конструкции и функции основанной на GI упаковочной системы в соответствии с вариантом осуществления настоящего изобретения.
На фиг. 7 показана конструкция и функция основанной на GI упаковочной системы, в которой отсутствует ген интегразы, в соответствии с вариантом осуществления настоящего изобретения.
На фиг. 8 показана конструкция и функции основанной на SaPIbov2 упаковочной системы, в которой отсутствует ген интегразы, в соответствии с вариантом осуществления настоящего изобретения.
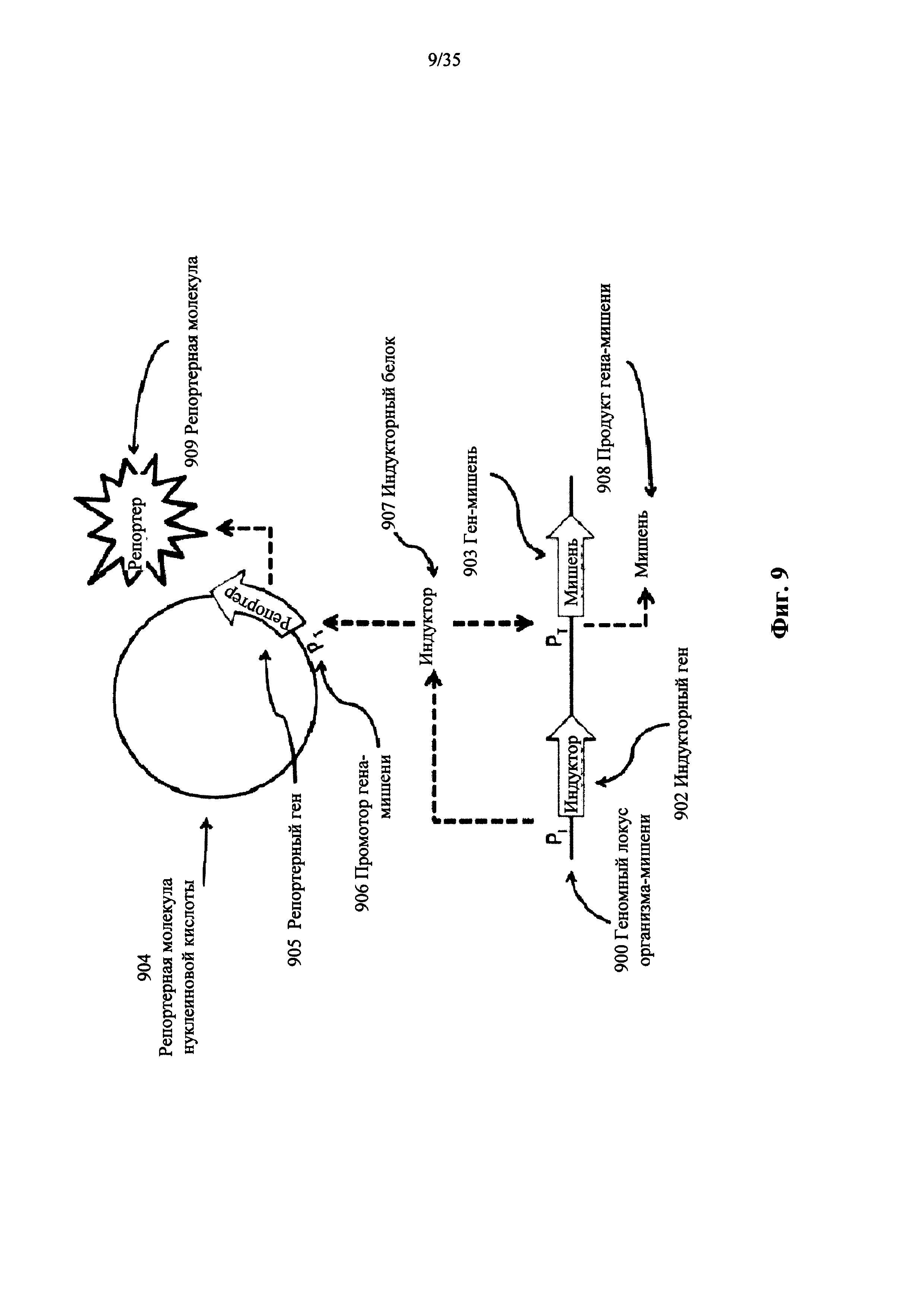
На фиг. 9 показана система для использования NRTP для обнаружения индукторов к промоторам гена-мишени в пределах жизнеспособных клеток в соответствии с вариантом осуществления настоящего изобретения.
На фиг. 10 показана репортерная система, которая включает в себя репортерную молекулу нуклеиновой кислоты (например, плазмиду), которую конструируют для обнаружения VanR, индуктора промотора гена устойчивости к ванкомицину (vanA) в Enterococcus faecium (или Е. faecalis) в соответствии с вариантом осуществления настоящего изобретения. Репортерная плазмида несет репортерный ген, который функционально связан с промотором гена vanA.
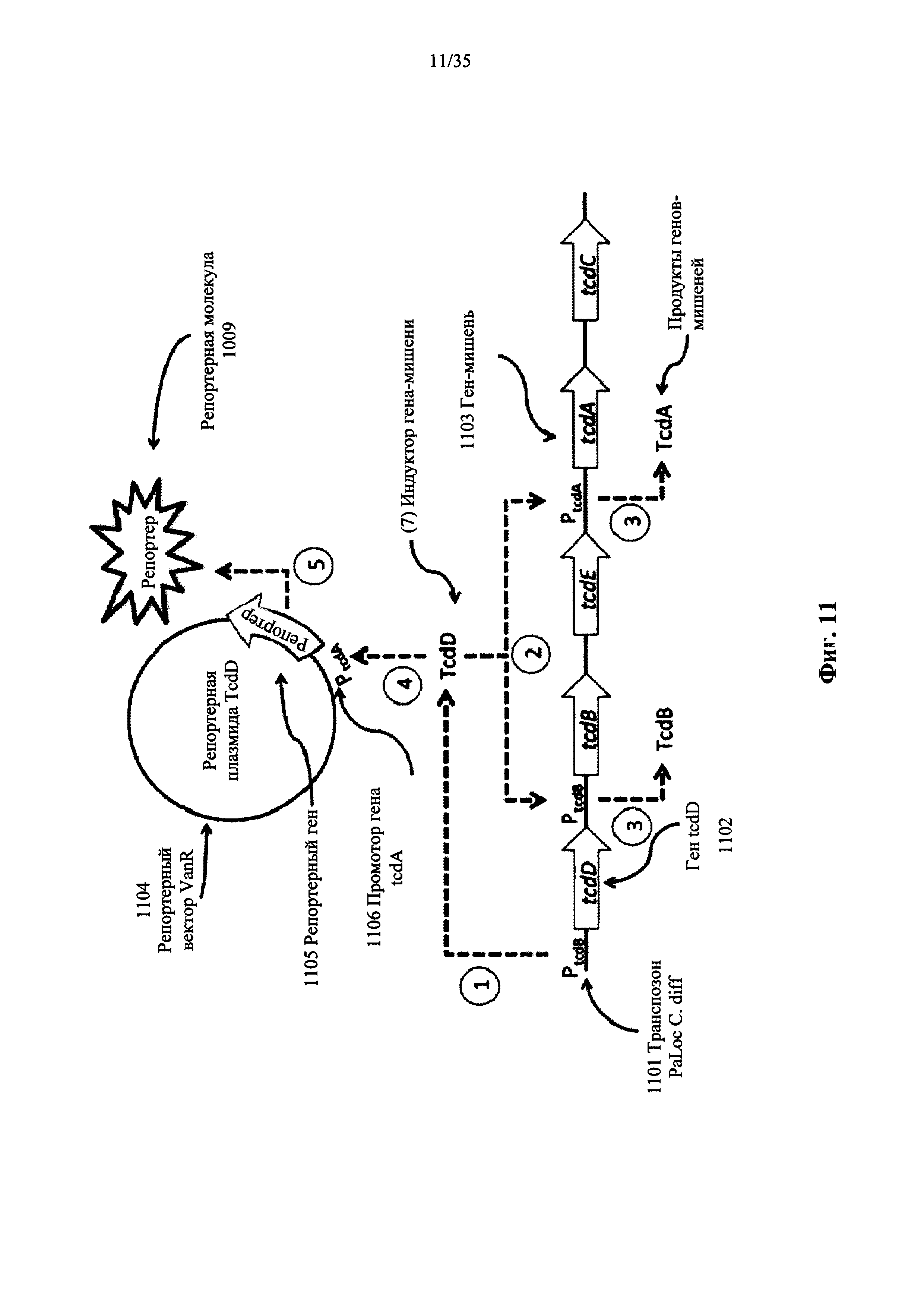
На фиг. 11 показана репортерная система, которая включает в себя репортерную молекулу нуклеиновой кислоты, сконструированную для обнаружения TcdD, индуктора промоторов генов токсинов А и В (tcdA и tcdB, соответственно) С. difficile, в соответствии с вариантом осуществления настоящего изобретения. Репортерная молекула нуклеиновой кислоты включает в себя репортерный ген, который функционально связан с промотором гена tcdA.
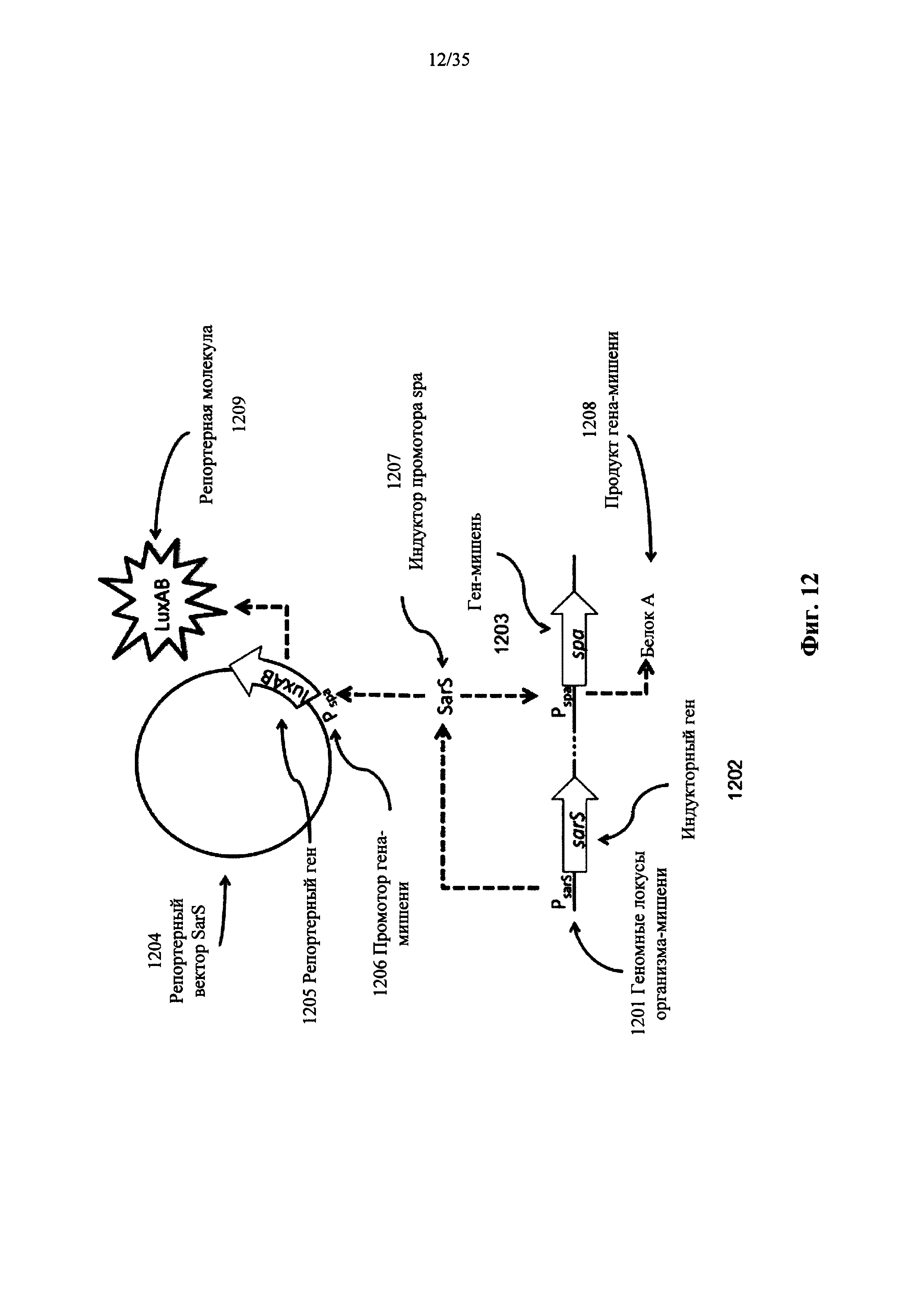
На фиг. 12 показана репортерная система, которая включает в себя репортерную молекулу нуклеиновой кислоты, сконструированную для обнаружения SarS, индуктора промотора гена белка (spa) в S. aureus, в соответствии с вариантом осуществления настоящего изобретения. Репортерная молекула нуклеиновой кислоты включает в себя бактериальные гены люциферазы luxA и luxB, функционально связанные с промотором гена spa (Pspa).
На фиг. 13 показана репортерная система, которая содержит систему для обнаружения внутриклеточных ферментов в живых клетках, которая использует молекулы огражденного субстрата, которые могут лишаться ограждения с помощью внутриклеточного фермента-мишени, в соответствии с вариантом осуществления настоящего изобретения.
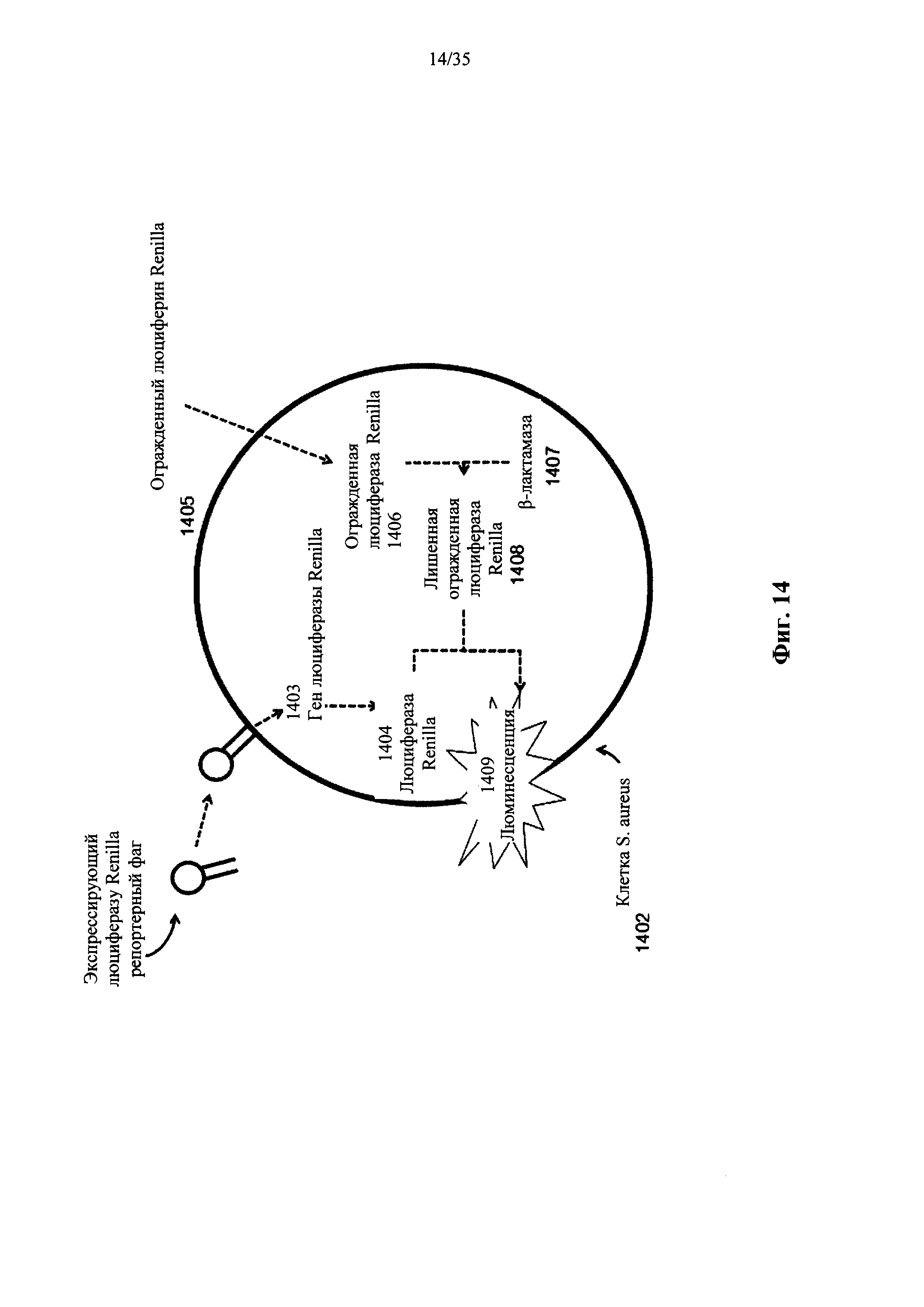
На фиг. 14 показана конструкция и функция системы обнаружения с ферментом β-лактамазой в соответствии с вариантом осуществления настоящего изобретения.
На фиг. 15 показана репортерная систем обнаружения внутриклеточных молекул в жизнеспособных клетках, которая использует переключаемые молекулы, способные производить обнаруживаемый сигнал при их связывании с молекулой-мишенью, в соответствии с вариантом осуществления настоящего изобретения.
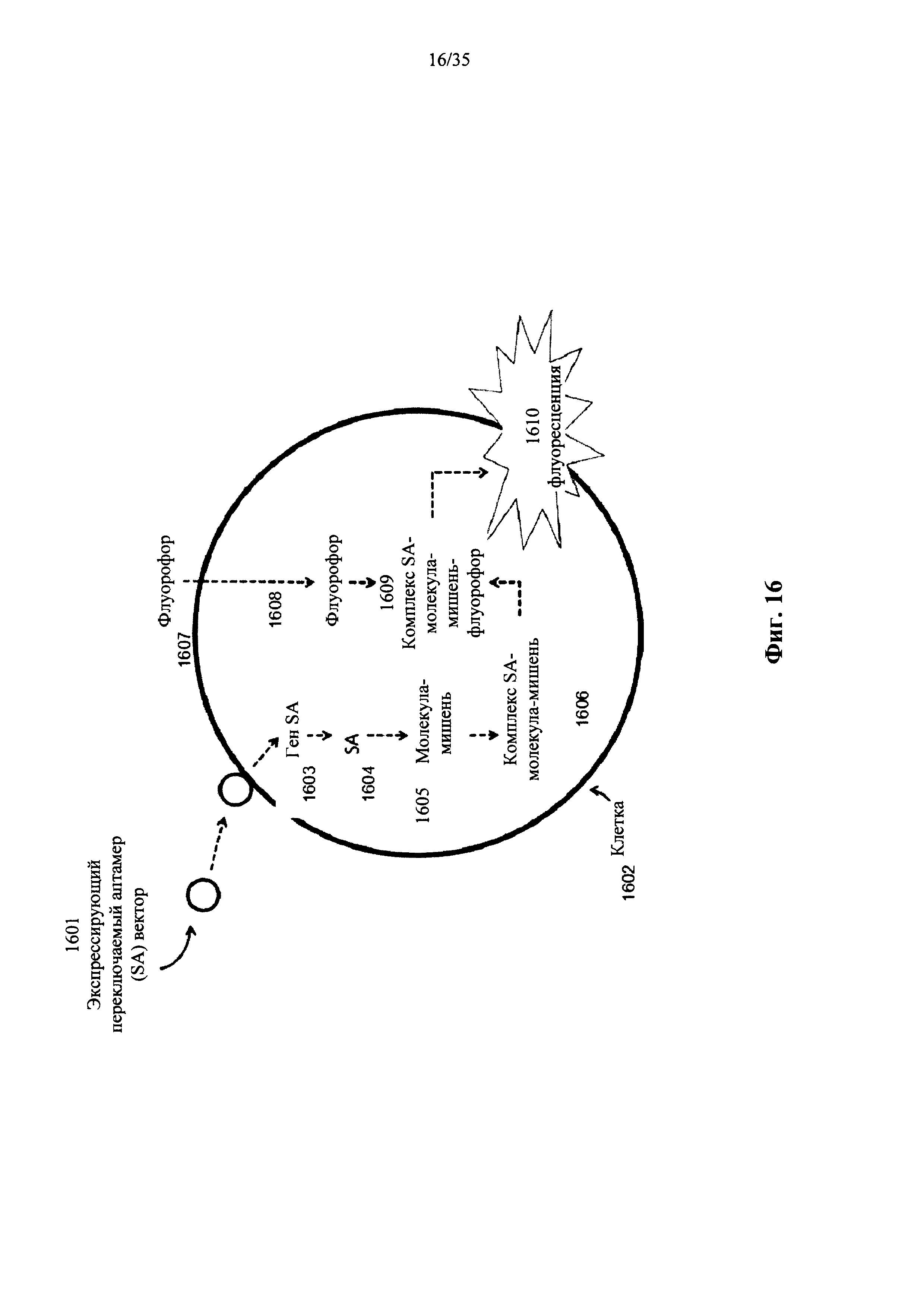
На фиг. 16 показана конструкция и функция основанной на бактериофаге/переключаемом аптамере (SA) внутриклеточной системы репортерной молекулы в соответствии с вариантом осуществления настоящего изобретения.
На фиг. 17 показан пример системы, которая использует цис-репрессорный механизм, который может направленно воздействовать на 5' UTR (нетранслируемую область) репортерной последовательности на репортерном транскрипте в соответствии с вариантом осуществления настоящего изобретения.
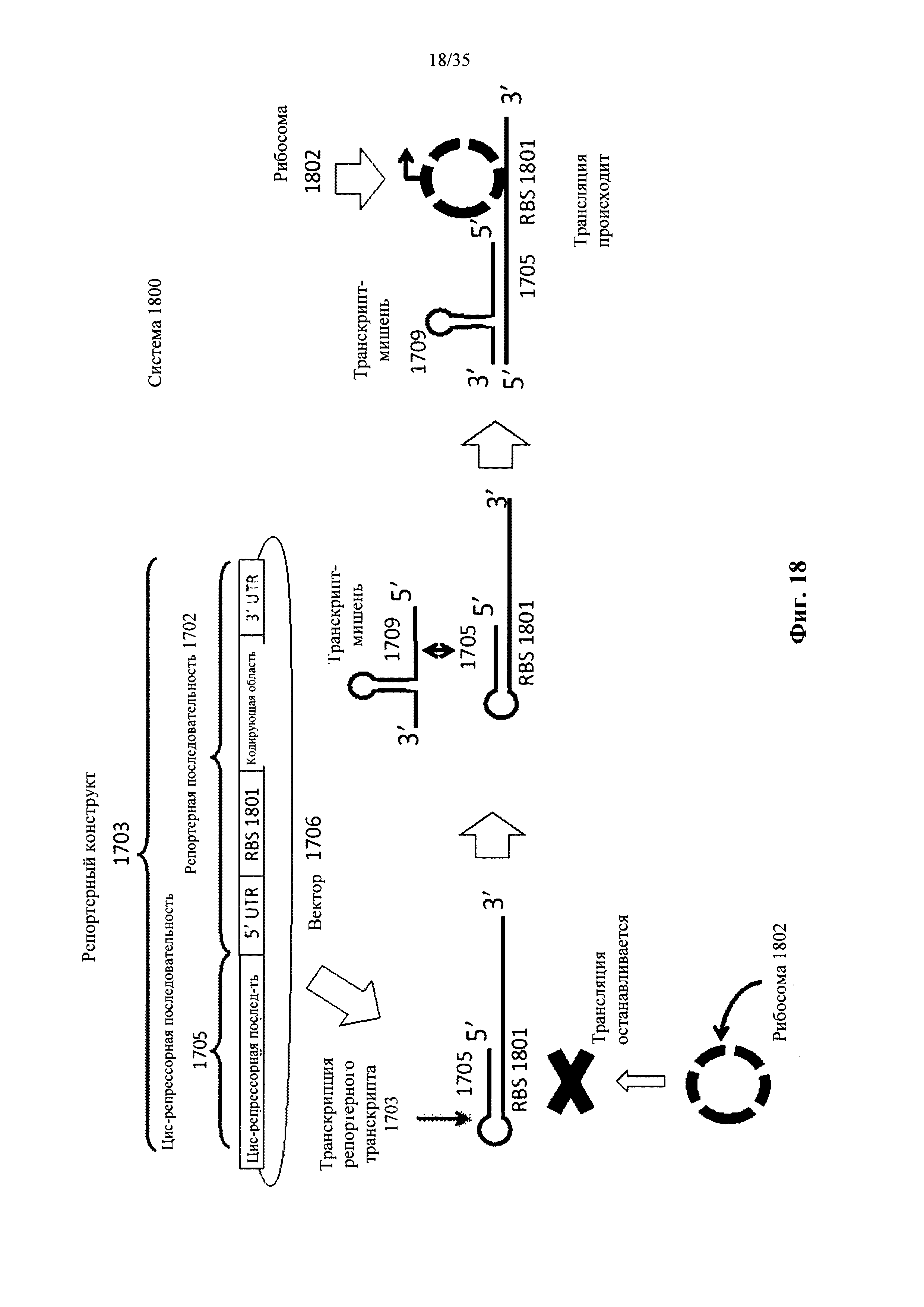
На фиг. 18 показан пример системы для обнаружения наличия транскрипта-мишени в клетке, которая основана на цис-репрессорном механизме, направлено воздействующем на сайт связывания рибосом (RBS) репортерной последовательности в репортерном транскрипте в соответствии с вариантом осуществления настоящего изобретения.
На фиг. 19 показана иллюстративная система для обнаружения наличия транскрипта-мишени в клетке, которая основана на цис-репрессорном механизме, направлено воздействующем на кодирующую область ("AUG") репортерной последовательности в репортерном транскрипте, в соответствии с вариантом осуществления настоящего изобретения.
На фиг. 20 показана иллюстративная система для обнаружения наличия транскрипта-мишени в клетке, которая основана на репрессорном механизме с использованием нестабильного репортерного транскрипта в соответствии с вариантом осуществления настоящего изобретения.
На фиг. 21 показаны результаты анализа трансдукции, в котором 36 чувствительных к тетрациклину MRSA подвергали воздействию трансдукторных частиц, несущих pGW80A0001, и затем наносили на планшеты со средами, содержащими 5 мкг/мл тетрациклина, в соответствии с вариантом осуществления настоящего изобретения.
На фиг. 22 показана люминесценция, измеренная от 80 клинических штаммов MRSA и 28 клинических штаммов чувствительных к метициллину S. aureus (MSSA), трансдуцированных с трансдукторной частицей, в соответствии с вариантом осуществления настоящего изобретения.
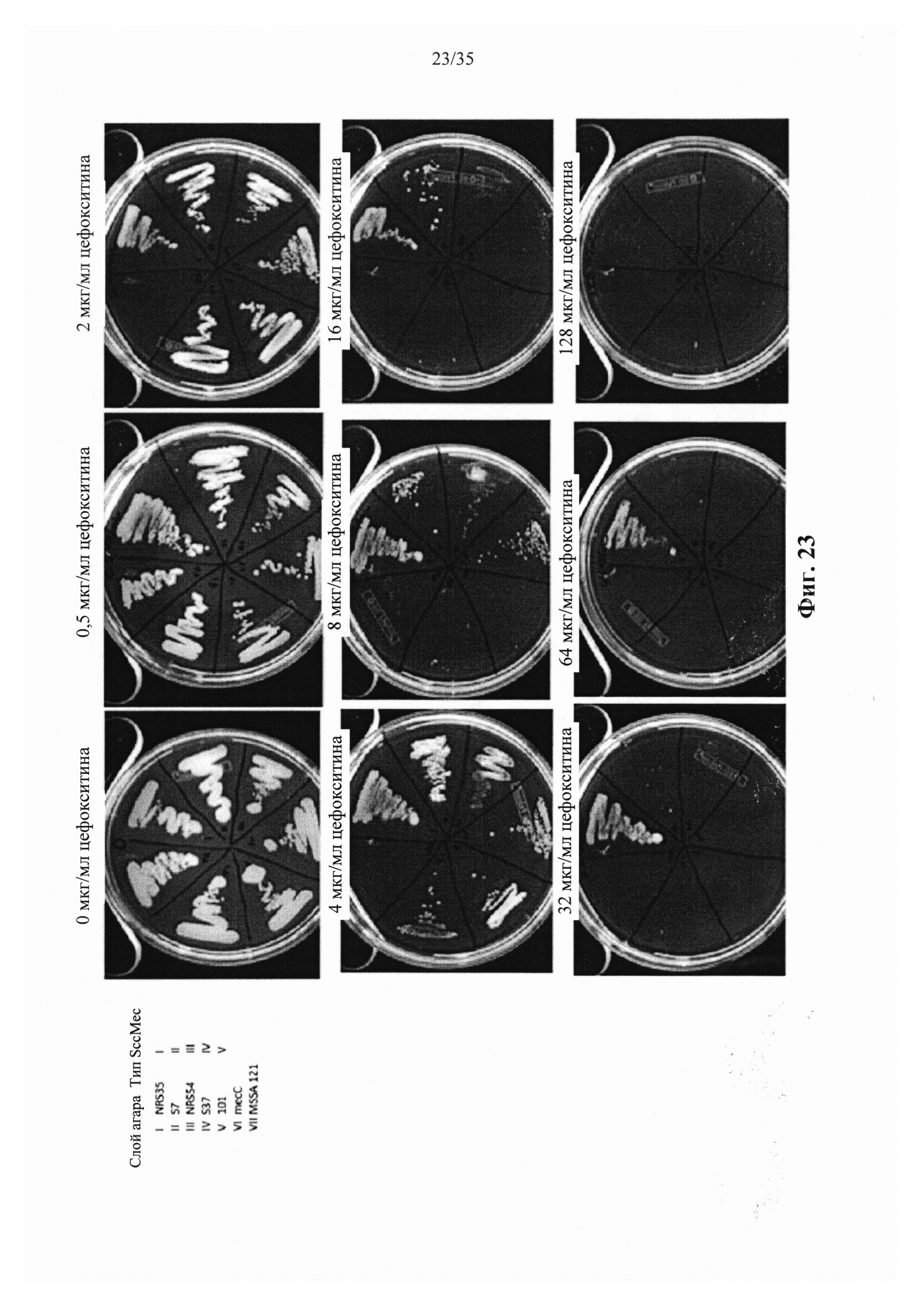
На фиг. 23 показаны результаты роста S. aureus при 4, 8, 16, 32, 64 и 128 мкг/мл цефокситина.
На фиг. 24 показаны значения RLU, полученные с помощью анализа NRTP в присутствии 4, 8, 16, 32, 64 и 128 мкг/мл цефокситина. Ось х на фиг. 24 установлена на граничном значении RLU MSSA.
На фиг. 25 показана вторичная структура транскрипта mecA (SEQ ID NO: 16), созданного на основе самой низкоэнергетической конформации, рассчитанной с помощью MFold и визуализированой с помощью VARNA.
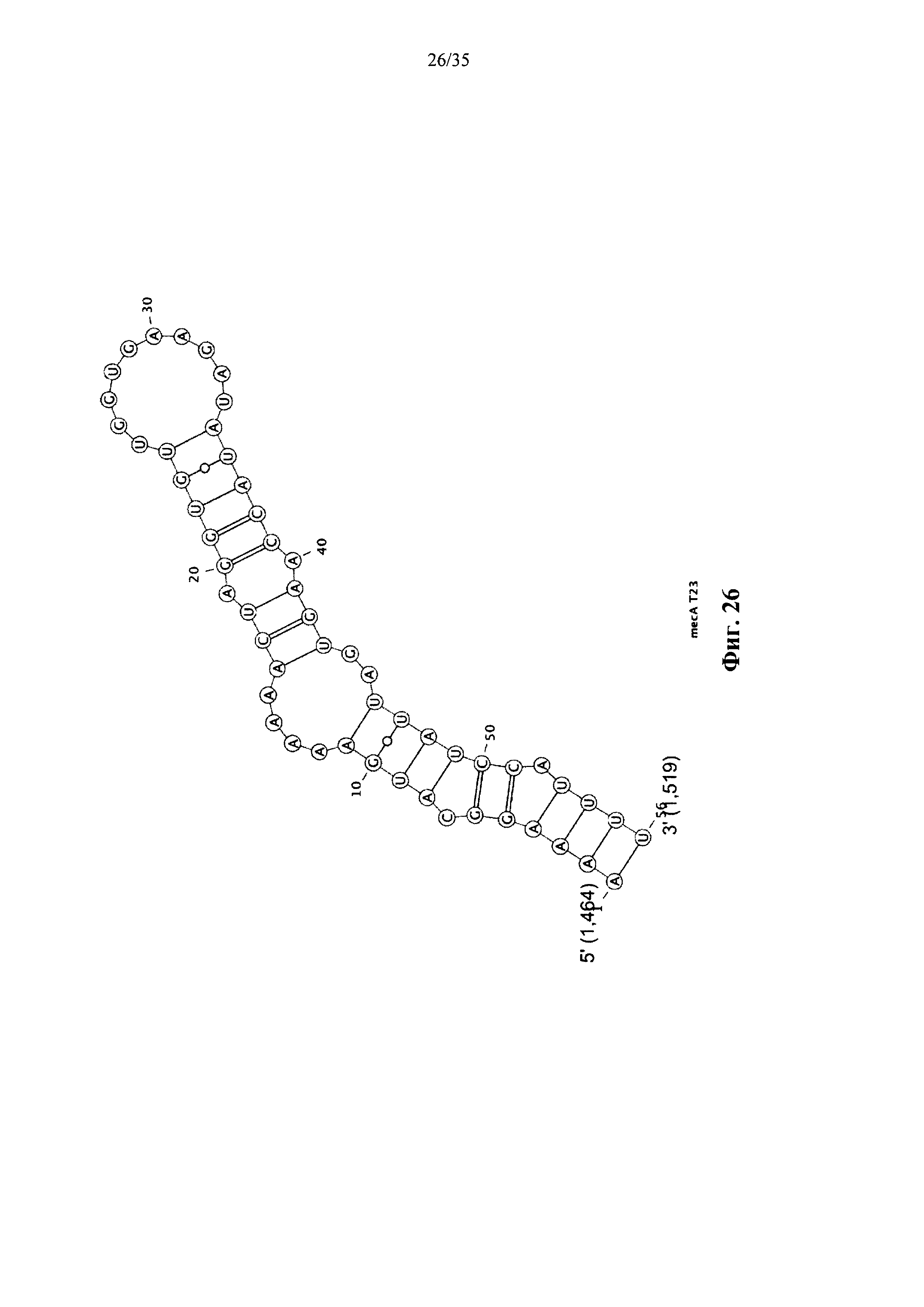
На фиг. 26 показана терминальная петля 23 (Т23) транскрипта mecA (нуклеотиды 1464-1519 в SEQ ID NO: 16), которая содержит консенсусную последовательность YUNR.
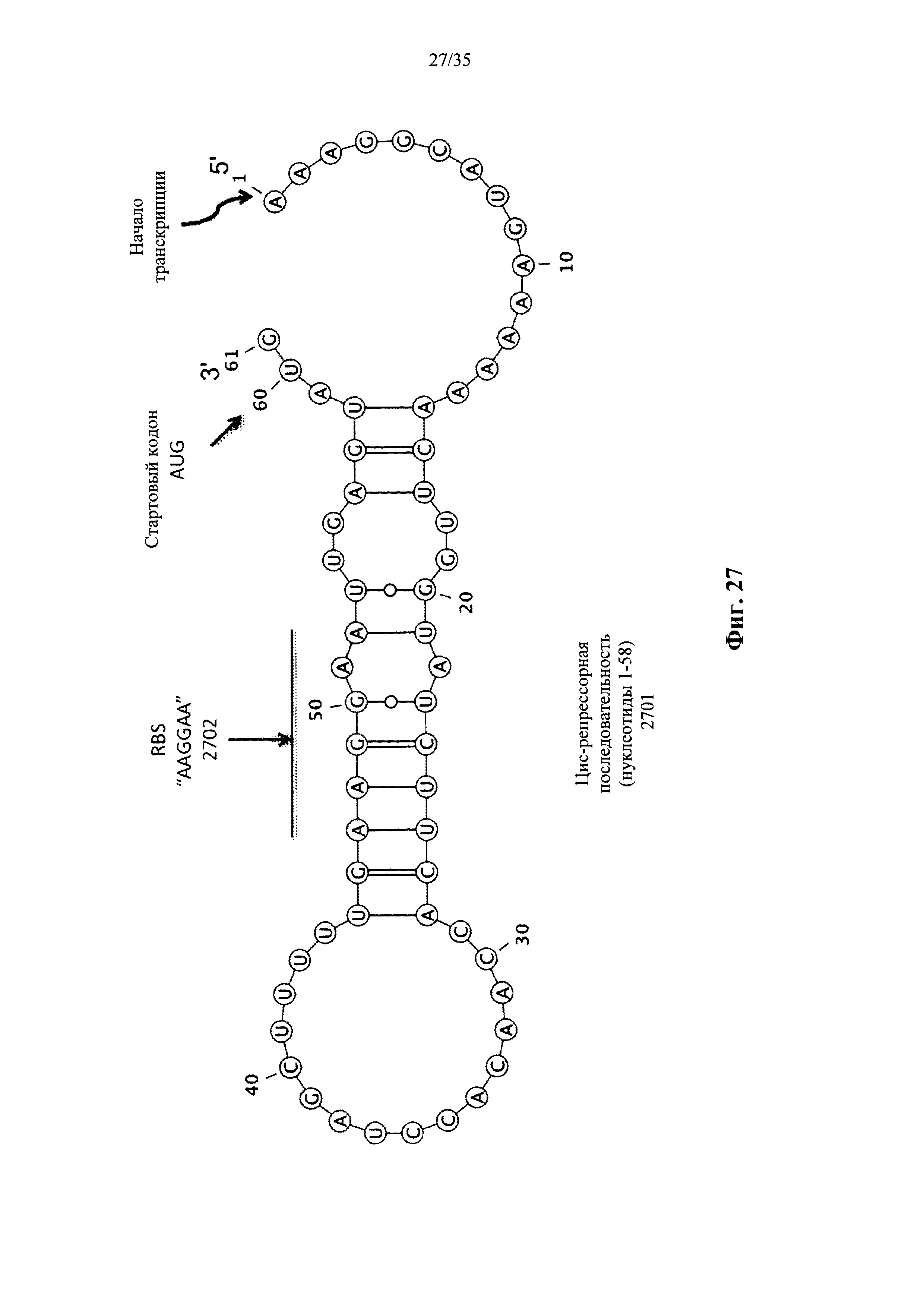
На фиг. 27 показана цис-репрессорная последовательность, добавленная к 5'-концу генов luxAB и разработанная для образования структуры "петля-на-стебле", которая блокирует последовательность RBS ("AAGGAA") гена luxAB (нуклеотиды 1-61 в SEQ ID NO: 19).
На фиг. 28 показана схема образования пар оснований между транскриптом-мишенью (нуклеотиды 1464-1519 в SEQ ID NO: 16) и цис-репрессорной последовательностью репортерного транскрипта (нуклеотиды 1-61 в SEQ ID NO: 19).
На фиг. 29 показан пример последовательности гена-мишени mecA (SEQ ID NO: 15) в соответствии с вариантом осуществления настоящего изобретения.
На фиг. 30 показана иллюстративная последовательность транскрипта mecA, которая может быть использована для разработки репортерного транскрипта (SEQ ID NO: 16), в соответствии с вариантом осуществления настоящего изобретения.
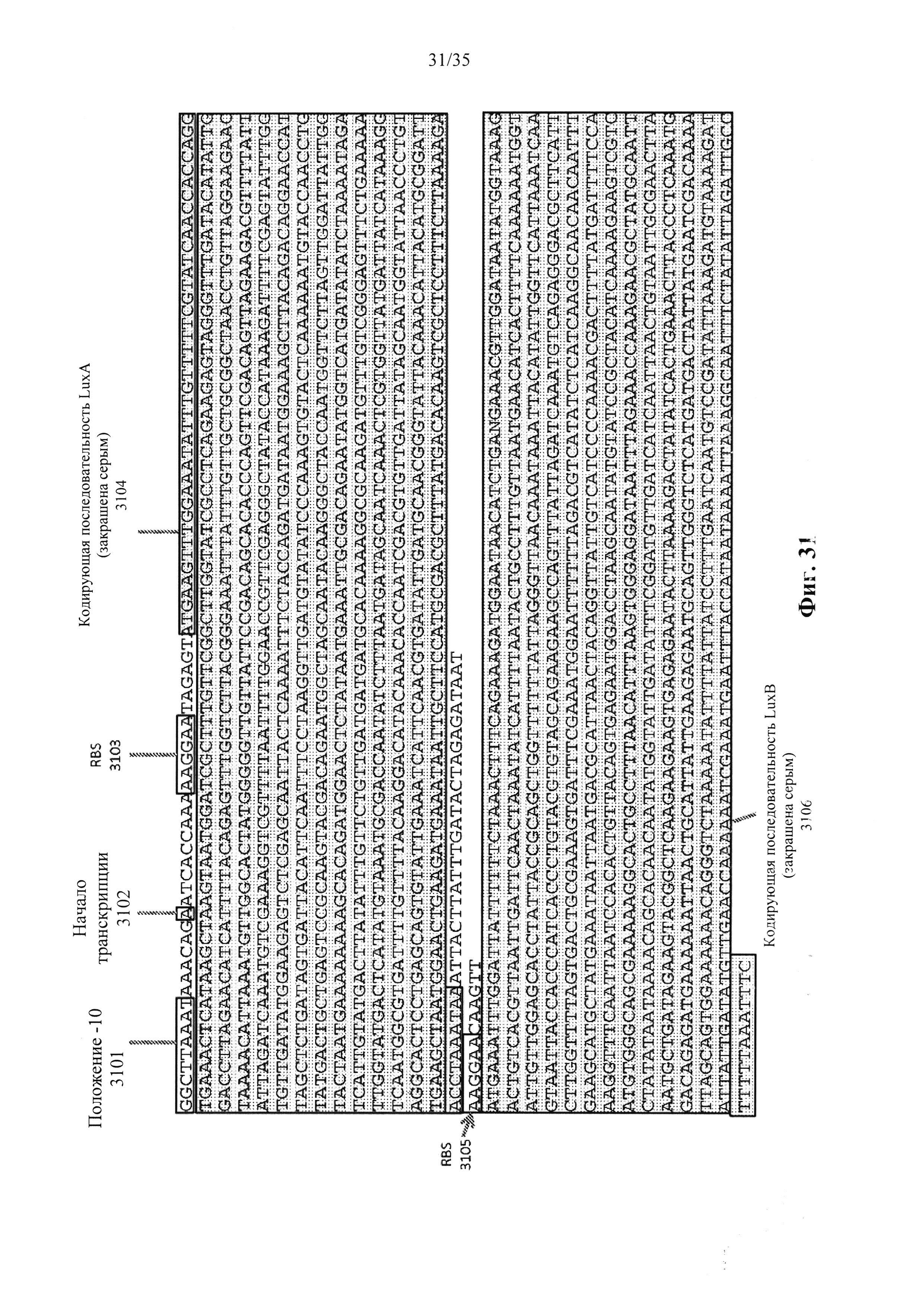
Фиг. 31 представляет собой пример последовательности ДНК локусов гена luxAB (SEQ ID NO: 17), которая может быть использована для разработки репортерного транскрипта, в соответствии с вариантом осуществления настоящего изобретения.
Фиг. 32 представляет собой пример последовательности транскрипта luxAB, которая может быть использована для разработки репортерного транскрипта (SEQ ID NO: 18), в соответствии с вариантом осуществления настоящего изобретения.
Фиг. 33 представляет собой пример цис-репрессорной последовательности транскрипта luxAB, которая может быть использована в репортерном транскрипте (SEQ ID NO: 19), в соответствии с вариантом осуществления настоящего изобретения.
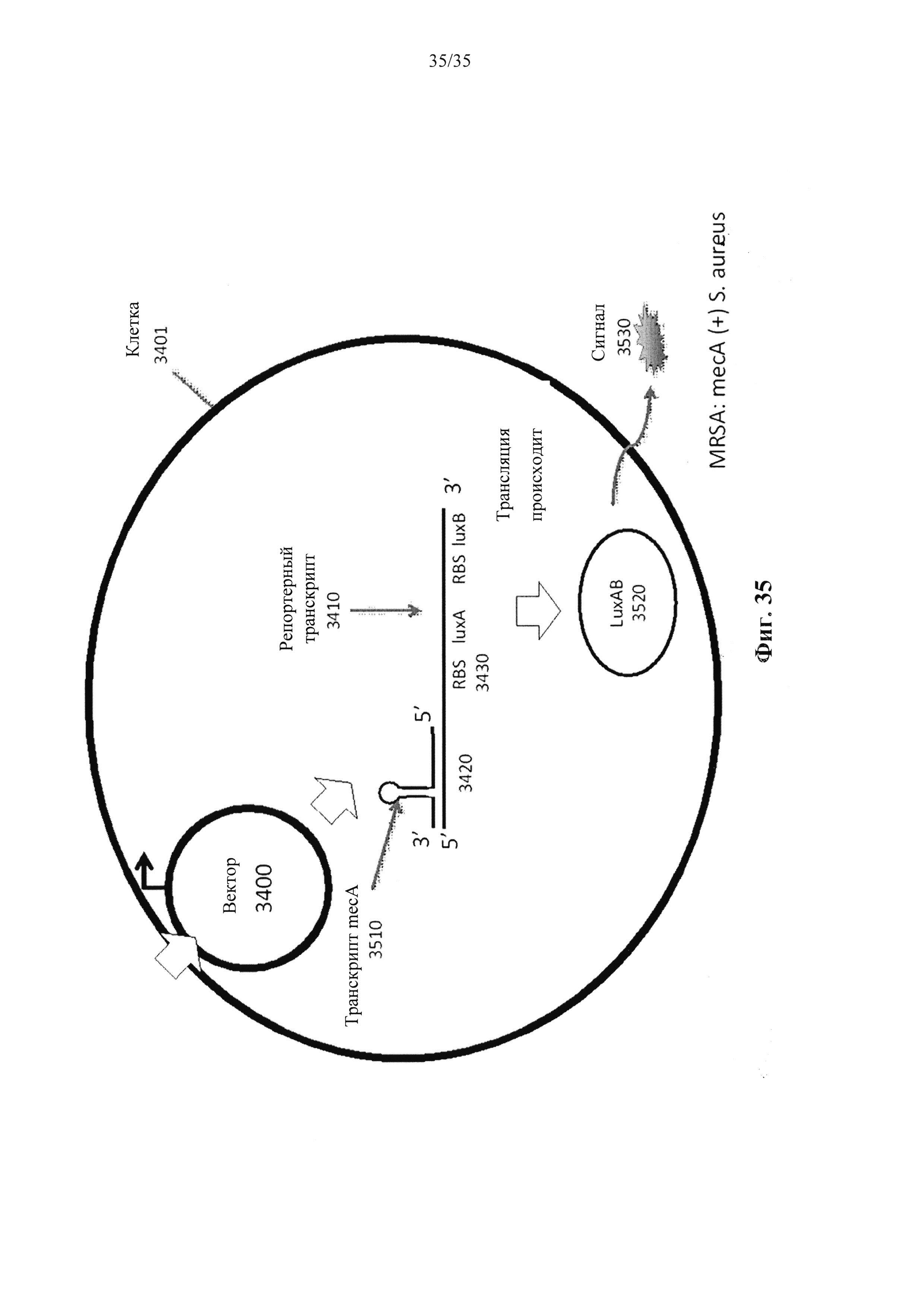
На фиг. 34 показан пример клетки, содержащей вектор, который кодирует репортерный транскрипт, где нет эндогенного транскрипта mecA в клетке, в соответствии с вариантом осуществления настоящего изобретения.
На фиг. 35 показан вектор, введенный в клетку, где вектор кодирует репортерный транскрипт, который включает в себя цис-репрессорную последовательность и репортерную последовательность (гены luxA и luxB). Когда транскрипт mecA, присутствующий в клетке, связывается с цис-репрессорной последовательностью, ингибирующая петля шпильки открывается и подвергается воздействию RBS для гена luxA. Может происходить трансляция репортерных последовательностей (luxA и luxB), в результате чего происходит образование фермента luxAB. Фермент LuxAB производит обнаруживаемый люминесцентный сигнал. Таким образом, репортерный вектор транскрипта сообщает о наличии эндогенных транскриптов mecA внутри клетки.
Подробное описание изобретения
I. Определения
Используемые в формуле изобретения и в описании термины определяются, как указано ниже, если не указано иное.
Используемая в настоящем документе "репортерная молекула нуклеиновой кислоты" относится к нуклеотидной последовательности, содержащей молекулу ДНК или РНК. Репортерная молекула нуклеиновой кислоты может быть природного происхождения или представлять собой искусственную или синтетическую молекулу. Согласно некоторым вариантам осуществления репортерная молекула нуклеиновой кислоты представляет собой экзогенную по отношению к клетке-хозяину и может быть введена в клетку-хозяина, как часть экзогенной молекулы нуклеиновой кислоты, такой как плазмида или вектор. Согласно некоторым вариантам осуществления репортерная молекула нуклеиновой кислоты может быть комплементарна гену-мишени в клетке. Согласно другим вариантам осуществления репортерная молекула нуклеиновой кислоты содержит репортерный ген, кодирующий репортерную молекулу (например, репортерный фермент, белок). Согласно некоторым вариантам осуществления репортерную молекулу нуклеиновой кислоты называют "репортерным конструктом" или "репортерным конструктом нуклеиновой кислоты".
"Репортерная молекула" или "репортер" относится к молекуле (например, нуклеиновой кислоте или белку), которая придает организму обнаруживаемый или селектируемый фенотип. Обнаруживаемый фенотип может быть колориметрическим, флуоресцентным или люминесцентным, например. Репортерные молекулы могут быть экспрессированы с репортерными генами, кодирующими ферменты, опосредующие люминесцентные реакции (luxA, luxB, luxAB, luc, ruc, nluc), генами, кодирующими ферменты, опосредующие колориметрические реакции (LacZ, HRP), генами, кодирующими флуоресцентные белки (GFP, eGFP, YFP, RFP, CFP, BFP, mCherry, флуоресцентные белки ближней инфракрасной области), молекулами нуклеиновых кислот, кодирующими аффинные пептиды (His-Tag, 3X-FLAG), и генами, кодирующими селективные маркеры (ampC, tet(M), CAT, erm). Репортерная молекула может быть использована в качестве маркера для успешного захвата молекулы нуклеиновой кислоты или экзогенной последовательности (плазмиды) в клетку. Репортерная молекула может также использоваться для указания на наличие описанных в настоящем документе гена-мишени, молекулы-мишени нуклеиновой кислоты, внутриклеточной молекулы-мишени или клетки. Кроме того, репортерная молекула может представлять собой нуклеиновую кислоту, такую как аптамер или рибозим.
Согласно некоторым аспектам настоящего изобретения репортерная молекула нуклеиновой кислоты функционально связана с промотором. Согласно другим аспектам настоящего изобретения промотор может быть выбран или разработан для содействия реактивности и перекрестной реактивности репортерной системы, основанной на активности промотора в конкретных клетках (например, конкретного вида), а не в других. Согласно некоторым аспектам репортерная молекула нуклеиновой кислоты содержит точку начала репликации. Согласно другим аспектам выбор точки начала репликации может аналогично способствовать реактивности и перекрестной реактивности репортерной системы, когда репликация репортерной молекулы нуклеиновой кислоты в клетке-мишени способствует или требуется для производства репортерного сигнала на основании активности точки начала репликации в конкретных клетках (например, конкретного вида), а не в других. Согласно некоторым вариантам осуществления репортерная молекула нуклеиновой кислоты образует репликон, способный к упаковке в виде конкатемерной ДНК в потомственный вирус во время репликации вируса.
Используемый в настоящем документе "транскрипт-мишень" относится к части нуклеотидной последовательности ДНК или молекулы мРНК, которая в природе образуется клеткой-мишенью, включая в себя образованные при транскрипции ген-мишень и мРНК, которая представляет собой продукт процессинга РНК первичного продукта транскрипции. Транскрипт-мишень может также упоминаться как клеточный транскрипт или встречающийся в природе транскрипт.
Используемый в настоящем документе термин "транскрипт" относится к длине нуклеотидной последовательности (ДНК или РНК), транскрибируемой из последовательности-матрицы или гена ДНК или РНК. Транскрипт может представлять собой последовательность кДНК, транскрибируемую с РНК-матрицы, или последовательность мРНК, транскрибируемую с ДНК-матрицы. Транскрипт может представлять собой кодирующий или некодирующий белок. Транскрипт может также быть транскрибирован со сконструированного конструкта нуклеиновой кислоты.
Транскрипт, полученный из репортерной молекулы нуклеиновой кислоты, может упоминаться как "репортерный транскрипт". Репортерный транскрипт может включать в себя репортерную последовательность и цис-репрессорную последовательность. Репортерный транскрипт может содержать последовательности, которые образуют области комплементарности, таким образом, что транскрипт включает в себя две области, которые образуют дуплекс (например, межмолекулярную дуплексную область). Одна область может упоминаться как "цис-репрессорная последовательность" и характеризоваться комплементарностью к части или всему транскрипту-мишени и/или репортерной последовательности. Вторая область транскрипта называется "репортерная последовательность" и может характеризоваться комплементарностью к цис-репрессорной последовательности. Комплементарность может представлять собой полную комплементарность или существенную комплементарность. Присутствие и/или связывание цис-репрессорной последовательности с репортерной последовательностью может образовывать конформацию в репортерном транскрипте, которая может блокировать дополнительную экспрессию репортерной молекулы. Репортерный транскрипт может образовывать вторичные структуры, такие как шпилечная структура, так что области в репортерном транскрипте, которые комплементарны друг другу, могут гибридизоваться друг с другом.
"Введение в клетку", когда речь идет о молекуле нуклеиновой кислоты или экзогенной последовательности (например, плазмиде, векторе, конструкте), означает облегчение захвата и поглощения в клетку, как понятно специалистам в настоящей области техники. Поглощение или захват конструктов или транскриптов нуклеиновых кислот может происходить посредством пассивной диффузии или с помощью активных клеточных процессов, или с помощью вспомогательных средств или устройств, включая в себя посредством использования бактериофага, вируса и трансдукторных частиц. Значение этого термина не ограничивается клетками in vitro; молекула нуклеиновой кислоты может быть также "введена в клетку", где клетка представляет собой часть живого организма. В таком случае, введение в клетку будет включать в себя доставку в организм. Например, для доставки in vivo молекулы нуклеиновых кислот, конструкты или векторы согласно настоящему изобретению могут быть инъецированы в участок ткани или введены системно. Введение in vitro в клетку включает в себя известные в настоящей области техники способы, такие как электропорация и липофекция. Дополнительные подходы описаны в настоящем документе или известны в настоящей области техники.
"Трансдукторная частица" относится к вирусу, способному обеспечить доставку невирусной молекулы нуклеиновой кислоты в клетку. Вирус может представлять собой бактериофаг, аденовирус и т.д.
"Нерепликативная трансдукторная частица" относится к вирусу, способному обеспечить доставку невирусной молекулы нуклеиновой кислоты в клетку, но не упаковывает свой собственный реплицированный вирусный геном в трансдукторную частицу. Вирус может представлять собой бактериофаг, аденовирус и т.д.
"Плазмида" представляет собой небольшую молекулу ДНК, которая физически отделена от и может реплицироваться независимо от хромосомной ДНК внутри клетки. Наиболее часто встречается в виде небольших круглых, двухцепочечных молекул ДНК в бактериях, плазмиды иногда присутствуют в археях и эукариотических организмах. Плазмиды рассматриваются как репликоны, способные к автономной репликации в подходящем хозяине.
"Вектор" представляет собой молекулу нуклеиновой кислоты, используемую в качестве проводника для искусственного переноса чужеродного генетического материала в другую клетку, где он может быть реплицирован и/или экспрессирован.
"Вирус" представляет собой небольшой инфекционный патоген, который реплицирует только внутри живых клеток других организмов. Вирусные частицы (известные как вирионы) включают в себя две или три части: I) генетический материал, созданный из молекул либо ДНК, либо РНК, которые несут генетическую информацию; II) белковую оболочку, которая защищает эти гены; и в некоторых случаях, III) конверт липидов, который окружает белковую оболочку.
"MRSA" относится к резистентному к метициллину Staphylococcus aureus.
"MSSA" относится к чувствительному к метициллину Staphylococcus aureus.
Термин "улучшающий" относится к любому терапевтически полезному результату в лечении патологического состояния, например, патологического состояния, включая в себя профилактику, уменьшение тяжести или прогрессирования, ремиссию или излечение.
Термин "in situ" относится к процессам, которые происходят в живой клетке, растущей отдельно от живого организма, например, растущей в тканевой культуре.
Термин "in vivo" относится к процессам, которые происходят в живом организме.
Используемый в настоящем документе термин "млекопитающее" включает в себя как людей, так и отличных от людей млекопитающих, и включает в себя без ограничения людей, нечеловекообразных приматов, собак, кошачьих, мышевидных, крупный рогатый скот, лошадей и свиней.
"G", "С", "А" и "U" каждый, как правило, означает нуклеотид, который содержит гуанин, цитозин, аденин и урацил в качестве основания, соответственно. "Т" и "dT" используются в настоящем документе взаимозаменяемо и относятся к дезоксирибонуклеотиду, в котором нуклеотидное основание представляет собой тимин, например, дезоксириботимин. Тем не менее, следует понимать, что термин "рибонуклеотид" или "нуклеотид", или "дезоксирибонуклеотид" может также относиться к модифицированному нуклеотиду, как подробно изложено ниже, или суррогатно замещенному фрагменту. Специалисту в настоящей области техники хорошо известно, что гуанин, цитозин, аденин и урацил могут быть заменены другими фрагментами без существенного изменения свойств спаривания оснований олигонуклеотида, содержащего нуклеотид, несущий такой замещенный фрагмент. Например, без ограничения, нуклеотид, содержащий инозин в качестве своего основания, может образовывать комплементарную пару оснований с нуклеотидами, содержащими аденин, цитозин или урацил. Следовательно, нуклеотиды, содержащие урацил, гуанин или аденин могут быть заменены в нуклеотидных последовательностях согласно изобретению нуклеотидом, содержащим, например, инозин. Последовательности, содержащие такие замещенные фрагменты, представляют собой варианты осуществления настоящего изобретения.
Используемый в настоящем документе термин "комплементарный", когда используется для описания первой нуклеотидной последовательности по отношению ко второй нуклеотидной последовательности, относится к способности олигонуклеотида или полинуклеотида, содержащего первую нуклеотидную последовательность, гибридизировать и образовывать дуплексную структуру при определенных условиях с олигонуклеотидом или полинуклеотидом, содержащим вторую нуклеотидную последовательность, как будет понятно специалисту в настоящей области техники. Комплементарные последовательности также описаны как связывающиеся друг с другом и характеризующиеся аффинностями связывания.
Например, первая нуклеотидная последовательность может быть описана как комплементарная ко второй нуклеотидной последовательности, когда две последовательности гибридизуют (например, путем отжига) в жестких условиях гибридизации. Условия гибридизации включают в себя температуру, ионную силу, рН и концентрацию органического растворителя для стадий отжига и/или промывки. Термин жесткие условия гибридизации относится к условиям, при которых первая нуклеотидная последовательность будет гибридизоваться предпочтительно с ее последовательностью-мишенью, например, со второй нуклеотидной последовательностью, и в меньшей степени или вообще не будет с другими последовательностями. Жесткие условия гибридизации зависят от последовательности и отличаются при различных параметрах окружающей среды. Как правило, жесткие условия гибридизации выбирают так, чтобы они были приблизительно на 5°С ниже точки плавления (Tm) для нуклеотидной последовательности при определенной ионной силе и значении рН. Tm представляет собой температуру (при определенной ионной силе и рН), при которой 50% первых нуклеотидных последовательностей гибридизуются с точно соответствующей последовательностью-мишенью. Обширное пособие по гибридизации нуклеиновых кислот находится, например, в Tijssen (1993) Laboratory Techniques in Biochemistry and Molecular Biology-Hybridization with Nucleic Acid Probes part I, chap. 2, "Overview of principles of hybridization and the strategy of nucleic acid probe assays," Elsevier, N.Y. ("Tijssen"). Могут применяться другие условия, такие как соответствующие физиологическим условия как те, с которыми можно столкнуться внутри организма. Специалист в настоящей области техники будет способен определить набор условий наиболее подходящих для исследования комплементарности двух последовательностей в соответствии с конечным применением гибридизированных нуклеотидов.
Это включает в себя спаривание оснований олигонуклеотида или полинуклеотида, содержащего первую нуклеотидную последовательность, с олигонуклеотидом или полинуклеотидом, содержащим вторую нуклеотидную последовательность, по всей длине первой и второй нуклеотидной последовательности. Такие последовательности могут быть отнесены к "полностью комплементарным" по отношению друг к другу в настоящем документе. Однако там, где первая последовательность упоминается как "по существу комплементарная" по отношению ко второй последовательности в настоящем документе, две последовательности могут быть полностью комплементарными или они могут образовывать одно или несколько, но, как правило, не более 4, 3 или 2 ошибочно спаренных оснований при гибридизации, сохраняя способность к гибридизации в условиях, наиболее актуальных для их окончательного применения. Однако там, где два олигонуклеотида предназначены для образования при гибридизации одного или нескольких одноцепочечных липких концов, такие липкие концы не должны рассматриваться как несоответствия в отношении определения комплементарности. Например, дцРНК, содержащая один олигонуклеотид из 21 нуклеотида в длину, а другой олигонуклеотид из 23 нуклеотидов в длину, причем более длинный олигонуклеотид содержит последовательность из 21 нуклеотида, которая полностью комплементарна более короткому олигонуклеотиду, может быть отнесена к "полностью комплементарной" для описанных в настоящем документе целей.
Используемые в настоящем документе "комплементарные" последовательности могут также включать в себя или быть образованы полностью из не-уотсон-криковских пар оснований и/или пар оснований, образованных из неприродных и модифицированных нуклеотидов, в мере вышеуказанных требований в отношении их способности к выполнению гибридизации. Такие не-уотсон-криковские пары оснований включают в себя без ограничений G:U колебание или хугстиновское спаривание оснований.
Термины "комплементарный", "полностью комплементарный" и "по существу комплементарный" в настоящем документе могут быть использованы по отношению к соответствию оснований между двумя цепями в дцРНК или между антисмысловой цепью дцРНК и последовательностью-мишенью, между комплементарными цепями одноцепочечной последовательности РНК или одноцепочечной последовательности ДНК, как будет понятно из контекста их использования.
Используемая в настоящем документе "дуплексная структура" содержит две антипараллельные и по существу комплементарные последовательности нуклеиновых кислот. Комплементарные последовательности в конструкте нуклеиновой кислоты, между двумя транскриптами, между двумя областями внутри транскрипта или между транскриптом и последовательностью-мишенью могут образовывать "дуплексную структуру". Как правило, большинство нуклеотидов каждой нити представляют собой рибонуклеотиды, но как описано подробно в настоящем документе, каждая или обе нити могут также включать в себя по меньшей мере один нерибонуклеотид, например, дезоксирибонуклеотид и/или модифицированный нуклеотид. Две нити, образующие дуплексную структуру, могут представлять собой различные части одной большой молекулы РНК или они могут представлять собой отдельные молекулы РНК. Там, где две нити представляют собой часть одной крупной молекулы и, следовательно, соединены непрерывной цепью нуклеотидов между 3'-концом одной нити и 5'-концом соответствующей другой нити, образующей дуплексную структуру, соединительная цепь РНК упоминается как "петля шпильки". Там, где две нити ковалентно связаны другими способами, отличными от непрерывной цепи нуклеотидов между 3'-концом одной нити и 5'-концом соответствующей другой нити, образующей дуплексную структуру, соединительная конструкция называется "линкер". Нити РНК могут содержать такое же или разное количество нуклеотидов. Максимальное число пар оснований представляет собой число нуклеотидов в самой короткой цепи дуплекса минус любые выступы, которые присутствуют в дуплексе. Как правило, дуплексная структура составляет от 15 до 30 или от 25 до 30, или от 18 до 25, или от 19 до 24, или от 19 до 21, или 19, 20 или 21 пару оснований в длину. Согласно одному варианту осуществления дуплекс составляет 19 пар оснований в длину. Согласно другому варианту осуществления дуплекс составляет 21 пару оснований в длину. Когда две разные миРНК используются в комбинации, длины дуплекса могут быть одинаковыми или могут отличаться.
Используемый в настоящем документе термин "область комплементарности" относится к области на антисмысловой нити, которая по существу комплементарна последовательности, например, последовательности-мишени, как определено в настоящем документе. Где область комплементарности не полностью комплементарна последовательности-мишени, ошибочные спаривания наиболее допустимы в терминальных областях и, если присутствуют, как правило, находятся в терминальной области или областях, например, в пределах 6, 5, 4, 3 или 2 нуклеотидов 5' и/или 3' конца.
Термин процент "идентичности" в контексте двух или более последовательностей нуклеиновых кислот или полипептидов, относятся к двум или более последовательностям или подпоследовательностям, которые содержат точно установленный процент нуклеотидов или аминокислотных остатков, которые представляют собой одинаковые при сравнении и выровнены на максимальное соответствие, что измерено с использованием одного из алгоритмов сравнения последовательностей, описанных ниже (например, BLASTP и BLASTN или других алгоритмов, доступных специалистам в настоящей области техники) или путем визуального осмотра. В зависимости от применения, процент "идентичности" может существовать в пределах сравниваемой области последовательности, например, в пределах функционального домена или, альтернативно, существует по всей длине этих двух сравниваемых последовательностей.
При сравнении последовательностей, как правило, одна последовательность выступает в качестве эталонной последовательности, с которой сравниваются исследуемые последовательности. При использовании алгоритма сравнения последовательностей, исследуемую и эталонную последовательности вводят в компьютер, указывают координаты подпоследовательностей, если необходимо, и указывают параметры программы алгоритма последовательности. Алгоритм сравнения последовательностей затем вычисляет процент идентичности последовательностей для исследуемой последовательности(ей) по отношению к эталонной последовательности на основании указанных параметров программы.
Оптимальное выравнивание последовательностей для сравнения может быть проведено, например, с помощью алгоритма локальной гомологии Smith & Waterman, Adv. Appl. Math. 2:482 (1981), с помощью алгоритма выравнивания гомологии Needleman & Wunsch, J. Mol. Biol. 48: 443 (1970), с помощью поиска способа сходства Pearson & Lipman, Proc. Nat'l. Acad. Sci. USA 85:2444 (1988), с помощью компьютерных реализаций этих алгоритмов (GAP, BESTFIT, FASTA и TFASTA in the Wisconsin Genetics Software Package, Genetics Computer Group, 575 Science Dr., Madison, Wis.) или путем визуального осмотра (смотрите в основном Ausubel et al., ниже).
Один из примеров алгоритма, который пригоден для определения процента идентичности последовательности и сходства последовательностей, представляет собой алгоритм BLAST, который описан в Altschul et al., J. Mol. Biol. 215: 403-410 (1990). Программное обеспечение для осуществления анализов BLAST публично доступно через Национальный центр биотехнологической информации (www.ncbi.nlm.nih.gov/).
Термин "достаточное количество" означает количество, достаточное для получения желаемого эффекта, например, количество, достаточное для получения обнаруживаемого сигнала от клетки.
Термин "терапевтически эффективное количество" означает такое количество, которое эффективно для улучшения симптомов заболевания. Терапевтически эффективное количество может представлять собой "профилактически эффективное количество", поскольку профилактику можно считать лечением.
Следует отметить, что используемые в описании и прилагаемой формуле изобретения формы единственного числа включают в себя ссылки на множественное число, если из контекста явно не следует иное.
II. Лизогенный и литический цикл вирусов
Вирусы подвергаются лизогенным и литическим циклам в клетке-хозяине. Ее ни лизогенный цикл принят, фаговая хромосома может быть интегрирована в бактериальную хромосому или она может установить себя в качестве стабильной плазмиды в хозяине, где она может оставаться в состоянии покоя в течение длительных периодов времени. Если индуцируется лизоген, фаговый геном вырезается из бактериальной хромосомы и инициирует литический цикл, который завершается лизисом клетки и высвобождением фаговых частиц. Литический цикл приводит к производству новых фаговых частиц, которые высвобождаются с помощью лизиса хозяина.
Определенный умеренный фаг может проявлять литическую активность и склонность к этому может варьировать с разными бактериями-хозяевами. Чтобы проиллюстрировать этот феномен, литическую активность двух умеренных фагов S. aureus на десяти MRSA клинических штаммах изучали с помощью анализа бляшкообразования (таблица 1). Фаг ϕ11 проявлял литическую активность в 10 из 10 клинических MRSA штаммов и фаг ϕ80α проявлял литическую активность в шести из 10 клинических MRSA штаммов. Таким образом, можно ожидать, что репортерные анализы, основывающиеся на естественном лизогенном цикле фагов, будут проявлять литическую активность спорадически.
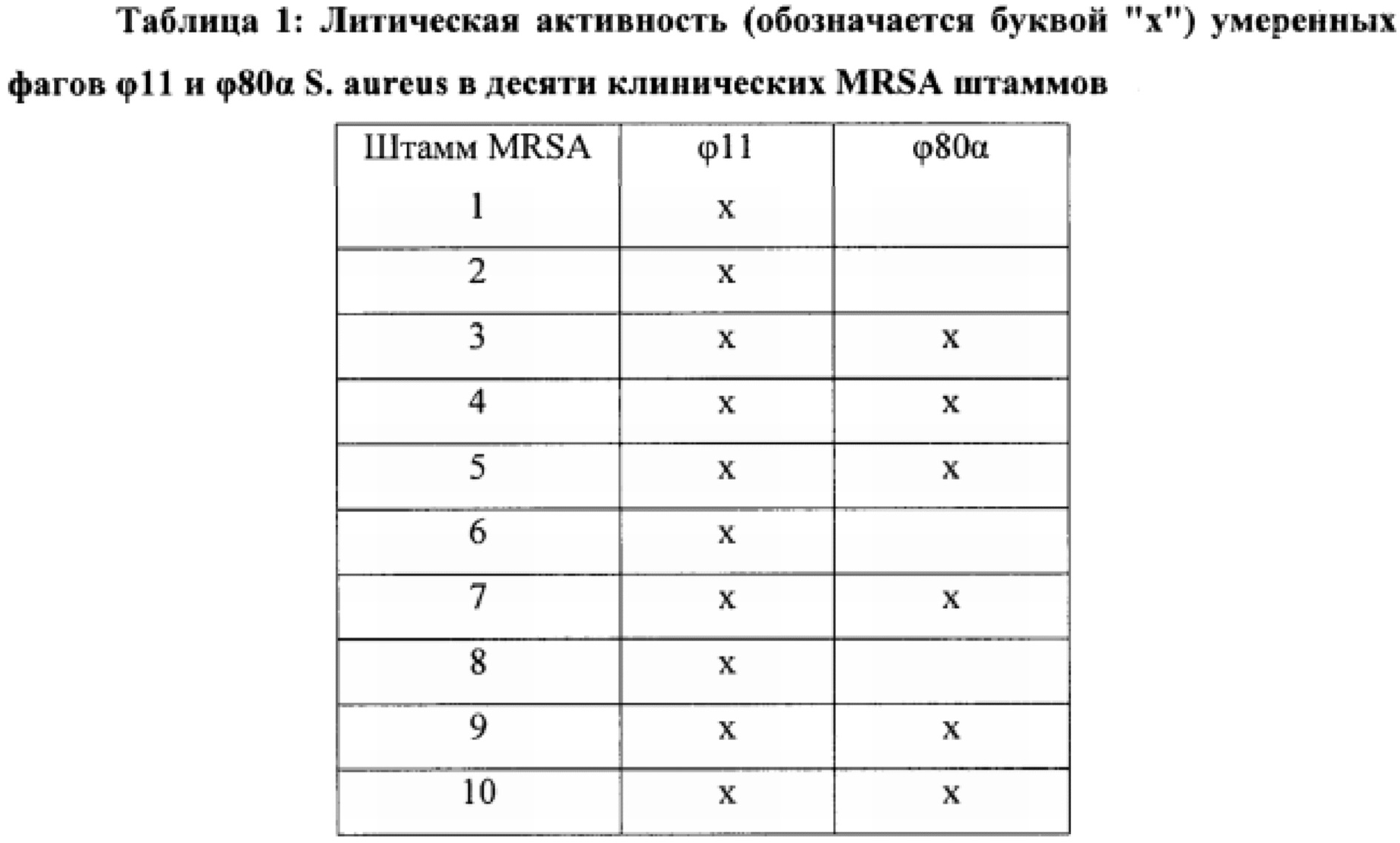
Кроме того, основанные на вирусах репортерные анализы, такие как основанные на фагах репортеры, могут нести последствия от ограниченной реактивности (т.е. аналитической инклюзивности) из-за ограничений в диапазоне хозяев фага, вызванных основанными на хозяине и полученными от профага механизмами резистентности фагов. Эти механизмы резистентности направленно воздействуют на нуклеиновую кислоту нативного фага, что может приводить к деградации или иному ингибированию ДНК фага и функций. Такие механизмы резистентности включают в себя системы рестрикции, которые расщепляют ДНК фага, и системы CRISPR, которые ингибируют полученные из фагов транскрипты.
Как литическая активность, так и фаговая резистентность может быть ингибирована для анализов, основанных на репортерных фагах. Литическая активность может ингибировать сигнал путем уничтожения или иным образом ингибируя клетку в его способности производить обнаруживаемый сигнал и, таким образом, влияя на ограничения обнаружения путем уменьшения количества обнаруживаемого сигнала или предотвращения образования обнаруживаемого сигнала. Механизмы фаговой резистентности могут ограничивать круг хозяев фага и ограничивать инклюзивность основанного на фаге репортера, сходным образом влияя на ограничения обнаружения путем уменьшения количества обнаруживаемого сигнала или предотвращения образования обнаруживаемого сигнала. Как литическая активность, так и фаговая резистентность, вызванная введением ДНК фага в репортерном фаге, может приводить к ложноотрицательным результатам в анализах, которые включают эти фаговые репортеры.
III. Способы получения нерепликативных трансдукторных частиц (NRTP)
А. Основанные на разрушении/комплементации способы получения нерепликативных трансдукторных частиц
1) Основанная на молчащей мутации/комплементации упаковочная система
Настоящее изобретение включает способы получения NRTP с использованием основанных на молчащей мутации/комплементации способов.
Эта упаковочная система нерепликативных трансдукторных частиц основана на введении молчащей мутации в компонент генома вируса, который узнается устройством упаковки вирусов как элемент, из которого начинается геномная упаковка во время вирусного производства. Примеры такого элемента включают в себя последовательность рас-сайта бактериофагов рас-типа и последовательность cos-сайта бактериофагов cos-типа.
Поскольку эти сайты инициации упаковки часто обнаруживаются в областях кодирования генов, которые необходимы для производства вируса, молчащую мутацию вводят таким образом, что рас-сайт больше не распознается в качестве сайта инициации упаковки устройством вирусной упаковки. В то же время, мутация не нарушает ген, в котором закодирован сайт. Путем нарушения последовательности сайта упаковки мутантный вирус способен подвергаться литическому циклу, но не способен упаковывать свою геномную ДНК в свою упаковочную единицу.
Экзогенная репортерная молекула нуклеиновой кислоты, такая как плазмидная ДНК, может быть введена в клетку-хозяина, которая была лизогенизирована с вирусным геномом с мутантной последовательностью сайта инициации упаковки. Экзогенная репортерная молекула нуклеиновой кислоты может включать в себя нативную последовательность сайта инициации упаковки. Экзогенная репортерная молекула нуклеиновой кислоты может быть введена в клетку и реплицироваться в клетке. Когда мутированный вирус подвергается литическому циклу, экспрессированное устройство вирусной упаковки упаковывает экзогенную репортерную молекулу нуклеиновой кислоты с нативной последовательностью сайта инициации упаковки в вирусную упаковочную единицу. Вирусный геном не упаковывается в упаковочную единицу, так как его последовательность сайта инициации упаковки мутирована. Согласно некоторым вариантам осуществления мутация в последовательности сайта инициации упаковки содержит молчащую мутацию, которая предотвращает расщепление последовательности инициации упаковки, но не нарушает экспрессию генного продукта, который охватывает последовательность сайта инициации упаковки. Это производит нерепликативные трансдукторные частицы, например, вирусные структурные компоненты, несущие реплицированную экзогенную молекулу нуклеиновой кислоты.
Пример такой системы основан на бактериофаге Р1, фаге рас-типа. Согласно одному варианту осуществления плазмида, включающая в себя нативный рас-сайт Р1, трансформируется в клетку. Клетка лизогенизирует с геномом профага Р1. Геном профага Р1 включает в себя молчащую мутацию в последовательности рас-сайта, кодируемой геном расА Р1. Когда литический цикл профага индуцируется, система приводит к производству основанных на Р1 трансдукторных частиц, несущих плазмидную ДНК. Пример молчащей мутации, которая подходит для этой системы, описан в опубликованном патенте США №2005/0118719, поданном 7 ноября 2002 г., который полностью включен посредством ссылки. Пример также обеспечивается SEQ ID NO: 2, представленной ниже (рас-сайт Р1с молчащими мутациями, строчные буквы обозначают мутированные основания).
На фиг. 1 показан пример конструкции и функции основанной на молчащей мутации/комплементации упаковочной системы 100 плазмиды Р1 в соответствии с вариантом осуществления настоящего изобретения. В этой системе, клетка Е. coli 101 лизогенизирует с профагом Р1 102, который включает в себя молчащую мутацию в своей последовательности сайта инициации упаковки (например, рас-сайт). Клетку трансформируют плазмидой, содержащей нативный рас-сайт 103, и плазмида реплицируется в клетке для образования конкатемеров плазмиды 104. Плазмида может также включать в себя репортерный ген, который кодирует репортерную молекулу. Когда индуцируется литический цикл профага Р1, профаг Р1 вырезается из бактериального генома и экспрессирует структурные компоненты Р1, такие как белки капсида 105. Структурные компоненты Р1 только упаковывают ДНК, которая содержит нативный рас-сайт (например, ДНК плазмиды), таким образом производя нерепликативные трансдукторные частицы, несущие ДНК плазмиды 106 (например, репортерный ген).
Пример вектора для использования в основанной на молчащей мутации/комплементации упаковочной системе плазмиды Р1 показан на фиг. 2. Подробнее о том, как сконструировать штаммы и векторы основанной на молчащей мутации/комплементации упаковочной системы плазмиды Р1 описаны подробно в примере 1 ниже.
2) Основанная на делеции/комплементации упаковочная система
В настоящем изобретении предусмотрены способы получения NRTP с использованием основанного на делеции/комплементации способа.
Эта упаковочная система нерепликативных трансдукторных частиц основана на удалении компонента генома вируса, который распознается вирусным упаковочным устройством, как элемент, от которого начинается геномная упаковка во время вирусного производства. Примеры такого элемента включают в себя последовательность рас-сайта бактериофагов рас-типа и последовательность cos-сайта бактериофагов cos-типа. Эти сайты инициации упаковки часто находятся в областях кодирования генов, которые необходимы для производства вируса. Согласно некоторым вариантам осуществления удаляется только сайт инициации упаковки, что позволяет мутированному вирусу подвергаться литическому циклу, но не позволяет вирусу упаковать его геномную ДНК. Например, SEQ ID NO: 6 представляет собой пример гена расА Р1 с удаленной последовательностью рас-сайта (строчные символы указывают на удаленную последовательность рас-сайта). Согласно другим вариантам осуществления удаляется весь ген, содержащий сайт инициации упаковки. Например, в SEQ ID NO: 8 показано удаление гена terS (строчные символы показывают удаленную последовательность).
В одном примере геном клетки лизогенизирует с вирусным геномом, где был удален сайт инициации упаковки. Комплементарную плазмиду вводят в клетку, и плазмидная ДНК включает в себя ген с последовательностью сайта инициации упаковки, который дополняет удаленную последовательность сайта инициации упаковки в вирусном геноме. Когда мутированный вирус подвергается литическому циклу, вирусные упаковывающие белки упаковывают репликон плазмидной ДНК в упаковочную единицу из-за его сайта инициации упаковки, и производятся нерепликативные трансдукторные частицы, переносящие реплицированную плазмидную ДНК.
Согласно некоторым вариантам осуществления предпочтительно, чтобы делеция/комплементация разрабатывались таким образом, чтобы не было гомологии между мутантной вирусной ДНК и комплементарной экзогенной ДНК. Потому что отсутствие гомологии между мутантной вирусной ДНК и комплементарной экзогенной ДНК исключает возможность гомологичной рекомбинации между двумя молекулами ДНК, которая может приводить к повторному введению последовательности упаковки в геном вируса. Для достижения отсутствия гомологии, одна стратегия состоит в удалении полного гена, содержащего последовательность сайта инициации упаковки из генома вируса, а затем дополнении этого гена экзогенной молекулой ДНК, которая содержит не более, чем точную последовательность ДНК, которая была удалена из вируса. В этой стратегии комплементарная молекула ДНК предназначена для экспрессии гена, который был удален из вируса.
Предусмотрен другой пример такой системы с использованием бактериофага ϕ80α, фага рас-типа. Геном фага лизогенизируют в бактериальную клетку-хозяина, и геном фага включает в себя ген малой терминазы, где рас-сайт профага рас-типа ϕ80α был удален. Плазмиду, включающую в себя комплементарный ген малой терминазы с нативным рас-сайтом, трансформируют в клетку. Когда индуцируется литический цикл лизогенизированного профага, упаковочная система бактериофага упаковывает плазмидную ДНК в структурные компоненты потомства бактериофага скорее, чем нативную ДНК бактериофага. Таким образом, упаковочная система производит нерепликативные трансдукторные частицы, несущие ДНК плазмиды.
На фиг. 3 показан пример конструкции и функции упаковочной системы 300 плазмиды с делецией/комплементацией рас-сайта, в соответствии с вариантом осуществления настоящего изобретения. Бактериальную клетку 301 лизогенизируют с фагом рас-типа 302, у которого удален ген малой терминазы (terS). Клетку трансформируют с плазмидой репликации по типу катящегося кольца 303, которая включает в себя ген малой терминазы, который дополняет делецию гена terS в фаге. Ген малой терминазы содержит последовательность сайта инициации упаковки, например, рас-сайта. Плазмида 303 может также включать в себя репортерный ген, который кодирует репортерную молекулу.
Белковый комплекс, содержащий белки малой терминазы и большой терминазы, способен распознавать и расщеплять двухцепочечную молекулу ДНК в или вблизи рас-сайта, и это позволяет плазмидной молекуле ДНК быть упакованной в фаговый капсид. Когда профаг в клетке индуцируется, литический цикл фага производит фаговые структурные белки 304 и фаговый белок большой терминазы 305. Комплементарная плазмида реплицируется, и экспрессируется белок малой терминазы 306. Реплицированная плазмидная ДНК 307, содержащая ген terS (и репортерный ген), упаковывается в фаговые капсиды, приводя в результате к нерепликативным трансдукторным частицам, несущим только плазмидную ДНК 308. На фиг. 4 показан пример полученного в результате вектора, используемого в упаковочной системе плазмиды с делецией/комплементацией рас-сайта. Более подробная информация о компонентах и конструкции упаковочной системы плазмиды с делецией/комплементацией рас-сайта представлена в примере 2 ниже.
В. Основанная на острове патогенности упаковочная система
Острова патогенности (PTI) представляют собой подмножество горизонтально перенесенных генетических элементов, известных как геномные острова. Существует определенное семейство высокомобильных PTI в Staphylococcus aureus, которые индуцируются для вырезания и копирования определенных резидентных профагов. Эти PTI упаковываются в мелкоголовчатые фагоподобные частицы и переносятся с частотой, соизмеримой с бляшкообразующим титром фага. Этот процесс относится к циклу вырезания репликации-упаковки (ERP) SaPI, и перенос с высокой частотой SaPI относится к SaPI-специфическому переносу (SPST), чтобы отличить его от классической обобщенной трансдукции (CGT). SaPI характеризуются высоко консервативной генетический организацией, которая аналогична таковой бактериофагов и четко отличает их от всех других горизонтально приобретенных геномных островов. Кодированные SaPI1 и кодированные SaPIbov2 интегразы требуются как для удаления, так и для интеграции соответствующих элементов, и предполагается, что то же самое верно и для других SaPI. Фаг 80α может индуцировать несколько различных SaPI, включающих в себя SaPI1, SaPI2 и SaPIbov1, в то время как ϕ11 может индуцировать SaPIbov1, но ни один из двух других SaPI.
На фиг. 5 изображен естественный процесс упаковки геномного острова (GI) 500 с помощью бактериофага. В природе бактериальная клетка 501, лизогенизированная с подходящим профагом 503 и переносящая GI 504, может производить фаговые частицы, несущие конкатемеры GI 512. В этом процессе, когда фаг индуцируется в его литический цикл, геном фага вырезается (не показан) из бактериального генома 502, который затем экспрессирует белки бактериофага, включающие в себя составляющие капсида 505 и белок большой терминазы (TerL) 506. Индукция профага запускает вырезание GI через экспрессию белка-интегразы GI (int) 507. Аналогичным вырезанному геному фага образом (не показано), GI приобретает круглую форму 508, экспрессирует собственный белок малой терминазы (TerS) 509 и начинает реплицировать, образуя конкатемеры GI 510. Ген TerL фага и ген TerS GI может затем объединять, связывать и расщеплять конкатемер GI через последовательность рас-сайта в геноме GI, и конкатемер GI затем может быть упакован в фаговые капсиды 511, приводя в результате к фаговым частицам, несущим конкатемеры GI 512.
В природных системах, как показано на фиг. 5, полученный в результате лизат, полученный из производства фага, включает в себя как нативные фаговые частицы, а также GI-содержащие фаговые частицы. Нативные фаговые частицы представляют собой результат упаковки нативного генома фага в связи с распознаванием рас-сайта в конкатемерах фагового генома.
1) Конструкция и функция упаковочной системы геномного острова (GI)
Способы согласно настоящему изобретению для получения NRTP включают основанную на GI упаковочную систему.
По сравнению с плазмидной упаковочной системой, природная упаковочная система GI получает преимущества от факта того, что ДНК, которая упаковывается, получают из геномной области в бактериальном геноме и, таким образом, не требуется поддержание плазмиды бактериальным хозяином.
Согласно некоторым вариантам осуществления настоящее изобретение включает в себя упаковочную систему бактериальной клетки для упаковки репортерной молекулы нуклеиновой кислоты в нерепликативную трансдукторную частицу, причем бактериальная клетка содержит лизогенизированный геном бактериофага без упаковочного гена и геномный остров, криптический фаг или другую молекулу нуклеиновой кислоты, требующую бактериофаг (например, хелперный фаг) для мобилизации молекулы нуклеиновой кислоты и содержащую репортерную молекулу нуклеиновой кислоты и упаковочный ген. Основанные на геномных островах системы могут быть основаны на островах патогенности S. aureus (SaPI), криптическом фаге Р4 и хелперном фаге Р2 Е. coli, и криптическом фаге Р7 и хелперном фаге Р1 Enterococci, например.
GI-упаковочные системы могут быть использованы таким образом, что экзогенные последовательности нуклеиновых кислот упаковываются бактериофагом. Это может быть достигнуто путем включения таких экзогенных последовательное гей нуклеиновых кислот в GI.
В целях устранения нативного фага из этого процесса, ген малой терминазы профага может быть удален. Последовательность гена малой терминазы содержит последовательность рас-сайта нативного фага, и это удаление характеризуется эффектом предотвращения упаковки нативной фаговой ДНК. Согласно другим вариантам осуществления может быть удален только рас-сайт гена малой терминазы. GI, который будет упакован, включает в себя собственный рас-сайт и ген малой терминазы, который экспрессирует подходящий белок малой терминазы, и только ДНК GI будет поддаваться упаковке в этой системе.
На фиг. 6 показан пример конструкции и функции основанной на GI упаковочной системы 600, в соответствии с вариантом осуществления настоящего изобретения. В этой системе бактериальная клетка 601 характеризуется лизогенизированным геномом с подходящим профагом 603, который характеризуется делецией своего гена малой терминазы, и клеточный геном 602 несет GI 604. Когда фаг вовлекается в свой литический цикл, геном фага вырезается (не показано) из бактериального генома 602. Фаговый геном экспрессирует белки бактериофага, включающие в себя составляющие капсида 605 и белок большой терминазы (TerL) 606. Индукция профага также запускает вырезание GI через экспрессию белка-интегразы GI (int) 607. Аналогичным вырезанному фаговому геному образом (не показано), GI принимает округлую форму 608 и экспрессирует свой белок малой терминазы (TerS) 609 и реплицируется, образуя конкатемер GI 610. Ген TerL фага и ген TerS GI могут затем объединяться, связываться и расщеплять конкатемер GI через последовательность рас-сайта в ДНК GI. Конкатемер GI может быть упакован в фаговые капсиды 611, приводя в результате к фаговым частицам, несущим конкатамеры GI 612. В этой системе фаговая ДНК не будет упакована в фаговые частицы, поскольку в ней отсутствует ген terS, который содержит последовательность рас-сайта фага, и таким образом, не может быть распознана экспрессированными белками TerS GI и TerL фага.
Когда фаговые частицы, содержащие упакованную ДНК GI, вводят в клетку-реципиент, фаг будет связываться с поверхностью клетки-реципиента, а затем вводить упакованный конкатемер ДНК GI в клетку. После проникновения внутрь клетки GI может снова экспрессировать свой белок-интегразу, и GI может интегрироваться в его конкретный сайт в геноме клетки-реципиента. Если экзогенные последовательности ДНК включены в GI перед упаковкой, упаковочная система позволяет, таким образом, доставку экзогенных последовательностей ДНК в клетку-реципиент и интеграцию этих экзогенных последовательностей ДНК в геном клетки-реципиента.
2) Основанная на GI упаковочная система без интегразы
Согласно другому варианту осуществления описанную выше упаковочную систему конструируют таким образом, что упакованная ДНК GI не может интегрировать в геном клетки-реципиента. Это может быть достигнуто с помощью делеции гена интегразы в GI и дополнения делеции путем способствования экспрессии гена интегразы в транс-пложении от GI. Таким образом, белок-интеграза доступен для вырезания GI в упаковывающейся клетке-хозяине, и ДНК GI, которая была упакована в бактериофаг, не содержит ген интегразы и не может экспрессировать белок-интегразу, таким образом предотвращая интеграцию доставленного GI.
На фиг. 7 изображена конструкция и функция основанной на GI системы упаковки, которая не содержит ген int 700, в соответствии с вариантом осуществления настоящего изобретения. В этой системе, бактериальная клетка 701 лизогенизирует с подходящим профагом, у которого удален его ген малой терминазы 703. Геном клетки 702 несет GI, который характеризуется удаленным геном интегразы (int) 704, а также несет удаленный ген int, функционально связанный с подходящим промотором 705. Ген int, таким образом, может экспрессировать интегразный белок (Int) в трансположении от GI 706. Когда фаг вовлекается в его литический цикл, генома фага вырезается (не показано) из бактериального генома 702, который затем экспрессирует белки бактериофага, включающие в себя составляющие капсида 707 и белок большой терминазы (TerL) 708. Индукция профага также запускает вырезание GI через экспрессию белка-интегразы 707. Схожим вырезанному геному фага образом (не показано), вырезанный GI принимает округлую форму 709, экспрессирует свой собственный белок малой терминазы (TerS) 710 и начинает реплицировать, образуя конкатемер GI 711. Ген TerL фага и ген TerS GI могут затем объединяться, связаться и расщеплять конкатемер GI через последовательности рас-сайта в ДНК GI и конкатемер GI затем может быть упакован в фаговые капсиды 712, приводя в результате к фаговым частицам, несущим конкатемеры GI 713. В этой системе ДНК фага не будет упаковываться, так как она не содержит ген terS, который содержит фаговую последовательность рас-сайта, и таким образом, не может быть распознана экспрессированными белками TerS GI и TerL фага.
Когда фаговые частицы, содержащие упакованную ДНК GI, не содержащую ген int вводят клетку-реципиент, фаг будет связываться с поверхностью клетки-реципиента, а затем вводить упакованный конкатемер ДНК GI в клетку. После попадания внутрь клетки GI не может экспрессировать свой белок-интегразу из-за отсутствия гена интегразы и GI не может интегрировать в конкретный сайт в геноме клетки-реципиента. Если экзогенные последовательности ДНК включены в GI перед упаковкой, упаковочная система позволяет, таким образом, доставку экзогенных последовательностей ДНК в клетку-реципиент и доставленные последовательности ДНК не интегрируют в геном клетки-реципиента в конкретном сайте интеграции GI.
3) Конструкция и функции основанной на SaPIbov2 упаковочной системы без интегразы
Согласно некоторым вариантам осуществления способ получения NRTP включает использование SaPIbov2 GI и бактериофага ϕ11 в основанной на GI упаковочной системе. Согласно альтернативным вариантам осуществления могут использоваться другие SAPI GI и другие подходящие бактериофаги, включающие в себя SaPI1, SaPI2, SaPIbov1 и SaPIbov2 SAPI вместе с бактериофагом 80α, и SaPIbov1 и SaPIbov2 SAPI вместе с бактериофагом ϕ11. На основании приведенного ниже описания, специалисту в настоящей области техники известно, как разработать основанную на GI упаковочную систему без гена int, как описано в разделе II А.
На фиг. 8 изображена конструкция и функция основанной на SaPIbov2 упаковочной системы 800, которая не содержит ген int, в соответствии с вариантом осуществления настоящего изобретения. В этой системе клетка S. aureus 801 лизогенизирует с ϕ11, который характеризуется удаленным геном малой терминазы 803. Геном клетки 802 несет SaPIbov2, который характеризуется удаленным геном интегразы (int) 804 и также несет удаленный ген int, функционально связанный с конститутивно экспрессированным промотором гена PclpB 805. Ген int может экспрессировать белок-интегразу (Int) в транс-положении от SaPIbov2 806. Когда фаг вовлекается в свой литический цикл, геном фага вырезается (не показано) из бактериального генома 802, который затем экспрессирует белки бактериофага, включающие в себя составляющие капсида 807 и белок большой терминазы (TerL) 808. Индукция профага также запускает вырезание SaPIbov2 с помощью экспрессии белка-интегразы 806. Схожим вырезанному геному фага образом (не показано), вырезанный SaPIbov2 принимает округлую форму 809, экспрессирует свой собственный белок малой терминазы (TerS) 810 и начинает реплицировать, образуя конкатемер SaPIbov2 811. Ген TerL фага и ген TerS GI могут затем объединяться, связываться и расщеплять конкатемер SaPIbov2 через последовательность рас-сайта в ДНК SaPIbov2, и конкатемер SaPIbov2 может быть упакован в фаговые капсиды 812, образуя в результате фаговые частицы, несущие конкатемеры SaPIbov2 813. В этой системе ДНК фага не будет упаковываться, так как она не содержит ген terS, который содержит фаговую последовательность рас-сайта и таким образом, не может быть распознана экспрессированными белками TerS SaPIbov2 и TerL фага.
IV. Репортеры
Согласно некоторым вариантам осуществления NRTP и конструкты согласно настоящему изобретению содержат репортерную молекулу нуклеиновой кислоты, включающую в себя репортерный ген. Репортерный ген может кодировать репортерную молекулу и репортерная молекула может представлять собой обнаруживаемый или селективный маркер. Согласно некоторым вариантам осуществления репортерный ген кодирует репортерную молекулу, которая производит обнаруживаемый сигнал при экспрессии в клетке.
Согласно некоторым вариантам осуществления репортерная молекула может представлять собой флуоресцентную репортерную молекулу, такую как, без ограничения, зеленый флуоресцентный белок (GFP) усиленный GFP, желтый флуоресцентный белок (YFP), голубой флуоресцентный белок (CFP), синий флуоресцентный белок (BFP), красный флуоресцентный белок (RFP) или mCherry, а также флуоресцентные белки ближней инфракрасной области.
Согласно другим вариантам осуществления репортерная молекула может представлять собой фермент, опосредующий люминесцентные реакции (luxA, luxB, luxAB, luc, ruc, nluc и т.д.). Репортерные молекулы могут включать в себя бактериальную люциферазу, эукариотическую люциферазу, фермент, подходящий для колориметрического обнаружения (LacZ, HRP), белок, подходящий для иммунологического обнаружения, например, аффинные пептиды (His-метка, 3Х-FLAG), нуклеиновую кислоту, которая функционирует в качестве аптамера или которая проявляет ферментативную активность (рибозим), или селективный маркер, например, гена резистентности к антибиотику (ampC, tet(M), CAT, erm). Другие известные в настоящей области техники репортерные молекулы могут быть использованы для получения сигналов для обнаружения нуклеиновой кислоты-мишени или клетки-мишени.
Согласно другим аспектам репортерная молекула содержит молекулу нуклеиновой кислоты. Согласно некоторым аспектам репортерная молекула представляет собой аптамер со специфической активностью связывания или проявляет ферментативную активность (например, аптазим, ДНКзим, рибозим).
Репортеры и репортерные анализы описаны далее в разделе V в настоящем документе.
V. NRTP и репортерные анализы
А. Индукторный репортерный анализ
Настоящее изобретение включает способы использования NRTP в качестве репортерных молекул для использования с эндогенными или природными индукторами этих промоторов гена-мишени в пределах жизнеспособных клеток. NRTP согласно настоящему изобретению могут быть сконструированы с использованием способов, описанных в разделе III и ниже в примерах 1-6.
Согласно некоторым вариантам осуществления способ включает применение NRTP в качестве репортера, причем NRTP содержит репортерный ген, который функционально связан с индуцируемым промотором, который контролирует экспрессию гена-мишени в пределах клетки-мишени. Когда NRTP, которая включает в себя репортерный ген, вводят в клетку-мишень, экспрессия репортерного гена возможна посредством индукции промотора гена-мишени в репортерной молекуле нуклеиновой кислоты.
На фиг. 9 изображен геномный локус клетки-мишени 900 с двумя генами, геном, кодирующим индуктор 902, и геном-мишенью 903. Также изображена репортерная молекула нуклеиновой кислоты 904, которая включает в себя репортерный ген. 905, который функционально связан с промотором 906 гена-мишени клетки-мишени. Репортерная молекула нуклеиновой кислоты 904 может быть введена в клетку посредством NRTP. В нативной клетке, когда ген-индуктор 902 экспрессируется и производит индукторный белок 907, индукторный белок 907 способен индуцировать промотор гена-мишени 906, который функционально связан с геном-мишенью, что приводит к экспрессии гена-мишени и производству продукта гена-мишени 908.
Когда репортерная молекула нуклеиновой кислоты 904 присутствует в организме-мишени, индуктор 907 может также индуцировать промотор гена-мишени 906, присутствующий в репортерной молекуле нуклеиновой кислоты 904, тем самым вызывая экспрессию репортерного гена 905, приводя в результате к производству репортерной молекулы 909, способной производить обнаруживаемый сигнал.
Таким образом, производство обнаруживаемого сигнала от репортерной молекулы 909 указывает на наличие клетки, основываясь на наличии индукторного белка 907 в клетке-мишени.
1) Репортерная система VanR
Согласно одному варианту осуществления репортерная система включает в себя NRTP, содержащую репортерную молекулу нуклеиновой кислоты (например, плазмиду). Репортерная молекула нуклеиновой кислоты может быть сконструирована для обнаружения VanR, индуктора промотора гена резистентности к ванкомицину (vanA) в Enterococcus faecium (или E. faecalis). Репортерная плазмида несет репортерный ген, который функционально связан с промотором гена vanA.
На фиг. 10 показана конструкция и функция репортерной системы VanR. На фиг. 10 изображена область транспозона Tn1546 1001, который может присутствовать в Е. faecium. Транспозон Tn1546 может включать в себя ген-индуктор vanR 1002 и ген-мишень vanA 1003. Также на фигуре изображена репортерная молекула нуклеиновой кислоты 1004, которая может быть упакована в NRTP и введена в клетку. Репортерная молекула нуклеиновой кислоты 1004 включает в себя репортерный ген 1005, который функционально связан с промотором PH 1006, который контролирует экспрессию оперона vanHAX, который включает в себя ген vanA. В нативной клетке, когда ген vanR 1002 экспрессируется и производит белок VanR 1007, VanR способен индуцировать РН 1006 в транспозоне Tn1546, тем самым вызывая экспрессию гена vanA и, таким образом, производя белок vanA 1008. Когда репортерная молекула нуклеиновой кислоты 1003 (вектор) присутствует в организме-мишени, VanR также способен индуцировать PH 1006 в репортерной молекуле нуклеиновой кислоты 1003, тем самым вызывая экспрессию репортерной молекулы 1009. Таким образом, производство репортерной молекулы представляет собой показатель наличия VanR в клетке-мишени.
Примеры промоторов, подходящих для разработки анализа VRE, включают в себя: промотор гена vanA и промотор гена vanB. Arthur, М., et al., The VanS sensor negatively controls VanR-mediated transcriptional activation of glycopeptide resistance genes of Tn1546 and related elements in the absence of induction. J. Bacteriol., 1997. 179(1): p. 97-106.
2) Репортерная система TcdD
Согласно другому варианту осуществления этой системы, репортерную молекулу нуклеиновой кислоты вводят в клетку с использованием NRTP. Репортерная молекула нуклеиновой кислоты может быть сконструирована для обнаружения TcdD, индуктора промоторов генов токсинов А и В (tcdA и tcdB, соответственно) С. difficile. Репортерная молекула нуклеиновой кислоты включает в себя репортерный ген, который функционально связан с промотором гена tcdA.
На фиг. 11 представлена конструкция и функция репортерной системы TcdD, в соответствии с вариантом осуществления настоящего изобретения. На фиг. 11 изображена область транспозона PaLoc 1101, которая может присутствовать в С. difficile. Транспозон PaLoc может содержать ген tcdD 1102 и ген-мишень tcdA 1103. Также на фигуре изображена репортерная молекула нуклеиновой кислоты 1104 (например, вектор), которую вводят в клетку с использованием NRTP. Репортерная молекула нуклеиновой кислоты 1104 включает в себя репортерный ген 1105, который функционально связан с промотором гена tcdA (PtcdA) 1106.
В нативной клетке, когда ген tcdA экспрессируется и продуцирует белок TcdD 1107, TcdD способен индуцировать PtcdA 1106 в транспозоне PaLoc 1101, тем самым вызывая экспрессию гена tcdA 1103 и, таким образом, производя белок токсина А 1108.
Когда репортерная молекула нуклеиновой кислоты 1104 присутствует в организме-мишени, TcdD также способен индуцировать PtcdA 1106 в репортерном векторе, тем самым вызывая экспрессию репортерной молекулы 1109. Таким образом, производство репортерной молекулы 1109 свидетельствует о наличии TcdD в клетке-мишени.
Примеры промоторов, подходящих для разработки анализа С. difficile, включают в себя: промотор гена tcdA и промотор гена tcdB. Karlsson, S., et al., Expression of Clostridium difficile Toxins A and В and Their Sigma Factor TcdD Is Controlled by Temperature. Infect. Immun., 2003. 71(4): p. 1784-1793.
Клетки-мишени и индукторы: Клетки-мишени могут включать в себя эукариотические и прокариотические клетки-мишени и связанные индукторы.
Системы доставки вектора: Доставка вектора, содержащего рекомбинантную ДНК, может быть выполнена с помощью небиологических или биологических систем. Включая в себя без ограничения липосомы, вирусоподобные частицы, полученные из фага или вирусов трансдукторные частицы и конъюгацию.
3) Основанная на бактериофаге репортерная система SarS
Согласно другому варианту осуществления настоящего изобретения репортерную молекулу нуклеиновой кислоты конструируют для обнаружения SarS, индуктора промотора гена белка A (spa) в S. aureus. Репортерная молекула нуклеиновой кислоты может быть введена в клетку в NRTP и включает в себя бактериальные люциферазные гены luxA и luxB, функционально связанные с промотором гена spa (Pspa). Репортерная молекула нуклеиновой кислоты доставляется к S. aureus посредством NRTP, например. Если SarS присутствует в клетке, он будет индуцировать экспрессию генов luxAB, таким образом, производя фермент-люциферазу, который способен производить люминесцентный сигнал.
На фиг. 12 представлена конструкция и функция репортерной системы SarS, в соответствии с одним вариантом осуществления настоящего изобретения. На фиг. 12 изображена область генома S. aureus 1201, которая содержит ген sarS 1202 и ген spa 1203. Также на фигуре показана репортерная молекула нуклеиновой кислоты (например, вектор) 1204, поставляемая с NRTP в клетку, и которая включает в себя репортерные гены luxAB 1205, функционально связанные с промотором Pspa 1206, который контролирует экспрессию гена spa 1203.
В нативной клетке, когда экспрессируется ген sarS 1202, производя белок SarS 1207, белок способен индуцировать Pspa 1206 в транспозоне генома S. aureus, тем самым вызывая экспрессию гена spa 1203 и производя белок А 1208.
Когда репортерная молекула нуклеиновой кислоты 1204 присутствует в организме-мишени, SarS 1207 также способен индуцировать Pspa 1206 в репортерной молекуле нуклеиновой кислоты 1204, тем самым вызывая экспрессию luxAB, приводя в результате к производству фермента-люциферазы 1209, который может производить люминесцентный сигнал. Таким образом, производство люциферазы свидетельствует о присутствии SarS в клетке-мишени.
В. Ферментный репортерный анализ
В настоящем изобретении предусмотрена система обнаружения внутриклеточных ферментов в живых клетках, которая использует огражденные молекулы субстрата, которые могут лишаться ограждения с помощью внутриклеточного фермента-мишени, в соответствии с вариантом осуществления настоящего изобретения.
На фиг. 13 изображена конструкция и функции системы обнаружения внутриклеточных ферментов. Экспрессирующий репортерную молекулу вектор 1301 доставляется в клетку-мишень 1302 с NRTP (не показано). Экспрессирующий репортерную молекулу вектор 1301 способен проникать в клетку-мишень 1302 через NRTP и доставлять ген репортерной молекулы 1303 в клетку-мишень 1302, и репортерная молекула 1304 затем может быть экспрессирована из гена репортерной молекулы 1303. Огражденный субстрат 1305 также добавляется в клетку-мишень 1302, и он способен проникать в клетку-мишень 1302. Если внутриклеточный фермент-мишень 1307 присутствует в клетке-мишени 1306, фермент 1307 способен удалять ограждающий компонент из иммобилизованного субстрата 1305, таким образом, производя лишенный ограждения субстрат 1308. Лишенный ограждения субстрат 1308 может реагировать с репортерной молекулой 1304 внутри клетки 1302, и продукт этой реакции приводит к обнаруживаемому сигналу 1309.
Клетки-мишени и ферменты-мишени: Клетки-мишени могут включать в себя эукариотические и прокариотические клетки-мишени и связанные с ними ферменты, включающие в себя, например, β-лактамазу в S. aureus.
Системы доставки вектора: Доставка вектора, содержащего рекомбинантную ДНК, может быть выполнена с помощью небиологических или биологических систем. Включая в себя без ограничения липосомы, вирусоподобные частицы, полученные из фагов или вирусов трансдукторные частицы и конъюгацию.
Репортерные молекулы и огражденные субстраты: Могут быть использованы различные репортерные молекулы и огражденные субстраты, описанные в Daniel Sobek, J.R., Enzyme detection system with caged substrates, 2007, Zymera, Inc.
1) Основанный на бактериофаге β-лактамазный репортер
Согласно одному варианту осуществления экспрессирующий репортерную молекулу вектор может быть внесен с помощью NRTP, таким образом, что вектор может быть доставлен в бактериальную клетку. Репортерная молекула для экспрессии может представлять собой люциферазу Renilla, а огражденный субстрата может представлять собой люциферин Renilla, который огражден таким образом, что фермент β-лактамаза, который представляет собой эндогенный по отношению к клетке-мишени, может расщеплять ограждающее соединение из огражденного люциферина и выпускать лишенный ограждения люциферин.
На фиг. 14 изображена конструкция и функция системы обнаружения фермента β-лактамазы, в соответствии с вариантом осуществления настоящего изобретения. Экспрессирующий люциферазу Renilla вектор, внесенный с помощью основанной на бактериофаге NRTP 1401, добавляется к клетке-мишени S. aureus 1402. Экспрессирующий люциферазу Renilla вектор способен проникать в клетку-мишень 1402 с помощью NRTP, содержащей вектор. NRTP доставляет ген люциферазы Renilla 1403 в клетку-мишень 1402, и люцифераза Renilla 1404 может быть экспрессирована из ее гена. Огражденный люциферин Renilla 1405 также добавляется в клетку-мишень 1402 и он способен проникать в клетку-мишень 1402. Если внутриклеточная β-лактамаза 1407 присутствует в клетке-мишени 1402, фермент способен удалять ограждающий компонент огражденного люциферина 1406, таким образом, производя лишенный ограждения люциферин 1408. Лишенный ограждения люциферин 1408 может затем реагировать с люциферазой Renilla 1404 внутри клетки 1402, и продукт этой реакции приводит в результате к люминесценции 1409.
Таким образом, когда клетка-мишень, которая содержит β-лактамазу, подвергается воздействию NRTP и огражденного люциферина, клетка будет проявлять люминесцентный сигнал, который свидетельствует о наличии β-лактамазы, присутствующей в клетке.
С. Внутриклеточный молекулярный репортер
В настоящем изобретении предусмотрена система для обнаружения внутриклеточных молекул в жизнеспособных клетках, которая использует переключаемые молекулы, способные производить обнаруживаемый сигнал после их связывания с молекулой-мишенью.
На фиг. 15 изображена конструкция и функция основанной на переключаемой молекуле (SM) внутриклеточного системы обнаружения молекулы. Экспрессирующий SM вектор 1501 доставляется в клетку-мишень 1502 в NRTP. Экспрессирующий SM вектор 1501 способен проникать в клетку-мишень 1502 и доставлять ген SM 1503 в клетку-мишень 1502. Белок SM 1504 затем может быть экспрессирован из гена SM 1503. Белок SM 1504 затем может связываться с молекулой-мишенью 1505 внутри клетки и, таким образом, образовывать комплекс SM-молекула-мишень 1506. Связывание SM 1504 с молекулой-мишенью 1505 в результате приводит к конформационному изменению в SM 1504, что делает связанную SM поддающейся к связыванию субстрата. Субстрат 1508 добавляется в клетку 1507, и он способен проникать в клетку 1502. Связанная SM внутри клетки 1502 способна также связываться с субстратом, образуя комплекс SM-молекула-мишень-субстрат 1509. Наконец, связывание субстрата 1508 связанной с молекулой-мишенью SM характеризуется эффектом производства обнаруживаемого сигнала 1510. Таким образом, производимый системой обнаруживаемый сигнал свидетельствует о наличии молекулы-мишени внутри клетки.
Клетки-мишени и молекулы-мишени: Могут быть использованы различные эукариотические и прокариотические клетки-мишени, и основанные на переключаемом аптамере SM могут быть разработаны для направленного воздействия на различные основанные на нуклеиновых кислотах и аминокислотах внутриклеточные молекулярные мишени, как описано в Samie Jaffrey, J.P., Coupled recognition/detection system for in vivo and in vitro use, 2010, Cornell University.
Системы доставки вектора: Доставка вектора, содержащего рекомбинантную ДНК, может быть выполнена с помощью небиологических или биологических систем. Включая в себя без ограничения липосомы, вирусоподобные частицы, полученные из фагов или вирусов трансдукторные частицы и конъюгацию.
1) Основанная на нерепликативной трансдукторной частице/переключаемом аптамере внутриклеточная молекулярная репортерная система
В одном примере этого способа экспрессирующий переключаемую молекулу вектор может переноситься с помощью такой основанной на бактериофаге трансдукторной частицы, что вектор может быть доставлен в бактериальную клетку. Переключаемая молекула для экспрессии может представлять собой переключаемый аптамер, который предназначен для того, чтобы подвергаться конформационному изменению при его связывании с внутриклеточной молекулой-мишенью. Конформационное изменение позволяет аптамеру затем связываться с флуорофором, который проявляет повышенную флуоресценцию при связывании с аптамером.
На фиг. 16 изображена конструкция и функция основанной на бактериофаге/переключаемом аптамере (SA) внутриклеточной молекулярной репортерной системы. Экспрессирующий SA вектор, переносимый с помощью NRTP 1601, добавляется к клетке-мишени 1602. NRTP 1601 способен доставлять экспрессирующий SA вектор и экспрессирующий SA ген 1603 в клетку-мишень 1602. Белок SA 1604 затем может экспрессироваться из гена SA 1603. Белок SA 1604 может затем связываться с молекулой-мишенью 1605 внутри клетки и, таким образом, образовывать комплекс SA-молекула-мишень 1606. Связывание SA 1604 с молекулой-мишенью 1605 в результате приводит к конформационному изменению в SA, что делает связанный SA поддающимся к связыванию флуорофора 1608. Флуорофор 1607 добавляется к клетке и может проникнуть в клетку 1608. Связанный SA внутри клетки может также связываться с флуорофором, образуя комплекс SA-молекула-мишень-флуорофор 1609. Наконец, связывание флуорофора связанным с молекулой-мишенью SA характеризуется эффектом повышения флуоресценции флуорофора 1610. Таким образом, создаваемый системой обнаруживаемый флуоресцентный сигнал свидетельствует о присутствии молекулы-мишени внутри клетки.
D. Репортерный анализ транскриптов
В настоящем изобретении предусмотрен репортерный анализ, включающий основанный на антисмысловой РНК способ обнаружения транскриптов-мишеней в пределах жизнеспособных клеток, вызывая экспрессию репортерной молекулы, если транскрипт-мишень присутствует в клетке.
Некоторые внутриклеточные способы в настоящей области техники ингибирования экспрессии генов используют малую интерферирующую РНК, такую как двухцепочечная РНК (дцРНК), для направленного воздействия на транскрибированные гены в клетках. ДцРНК содержит антисмысловые и смысловые нити, которые доставляются в или экспрессируются в клетках, и нити дцРНК действуют посредством транс-действующего механизма ингибирования, где одна нить (как правило, антисмысловая нить) связывается с последовательностью гена-мишени (РНК-транскриптом) и предотвращает экспрессию последовательности гена-мишени. Было показано, что двухцепочечные молекулы РНК блокируют (нокаутируют) экспрессию гена в высоко консервативном регулирующем механизме, известном как РНК-интерференция (RNAi). В публикации WO 99/32619 (Fireet al.) раскрыто использование дцРНК, составляющей по меньшей мере 25 нуклеотидов в длину, для ингибирования экспрессии генов в С. elegans. Также было показано, что дцРНК деградирует РНК-мишень в других организмах, включающих в себя растения (смотрите, например, WO 99/53050, Waterhouseet al.; and WO 99/61631, Heifetzet al.), дрозофил (смотрите, например, Yang, D., et al, Curr. Biol. (2000) 10:1191-1200) и млекопитающих (смотрите WO 00/44895, Limmer; and DE 10100586.5, Kreutzer et al.). Тем не менее, связывание нити дцРНК с геном-мишенью может быть неспецифическим. Если бы подобный механизм был бы применен к системе обнаружения, это неспецифическое связывание могло привести к высокому количеству ложных срабатываниям, которые делают его непригодным для развития клинически применимых систем обнаружения.
Было показано, что предыдущие транс-действующие механизмы ингибирования не пригодны для развития клинически применимых систем обнаружения. Например, некоторые способы приводят к высоким уровням неспецифических сигналов и до 90% ложных срабатываний, при достижении 90% чувствительности анализа. Смотрите патент США №8329889. Были разработаны некоторые способы посттранскрипционной регуляции экспрессии генов, которые используют цис-репрессорный маркерный транскрипт, такой как зеленый флуоресцентный белковый маркер, где сайт связывания рибосомы маркера заблокирован цис-репрессорной последовательностью, наряду с транс-активирующим РНК-транскриптом. Когда транс-активирующий РНК-транскрипт связывается с цис-репрессорным маркерным транскриптом, структура шпильки цис-репрессорного маркерного транскрипта изменяется, и выше против хода транскрипции сайт связывания рибосомы маркерного гена подвергается воздействию, делая возможной транскрипцию и экспрессию маркерного гена. Однако эти способы не были ранее использованы для обнаружения эндогенных транскриптов, и не были успешными за пределами основного механизма переключения для управления экспрессией генов в клетках.
1) Взаимодействие и механизмы молекул нуклеиновых кислот
Способы согласно настоящему изобретению пользуются преимуществом механизмов регулирования уровня транскрипта, включая в себя механизм антисмысловой РНК (асРНК) в клетках, чтобы доставить молекулы нуклеиновых кислот в клетки. Антисмысловой механизм включает в себя все формы специфического к последовательности распознавания мРНК, приводя к уменьшенной, устраненной, увеличенной, активированной или иным образом измененной экспрессии транскрипта-мишени. Смотрите Good, L., Translation Repression By Antisense Sequences. Cellular and Molecular Life Sciences, 2003. 60(5): p. 854-861 и Lioliou, E., RNA-mediated regulation in bacteria: from natural to artificial systems, New Biotechnology. 2010. 27(3): p. 222-235. Природные асРНК найдены во всех трех царствах жизни, и они влияют на разрушение, угнетение и активацию матричной РНК (мРНК), а также процессинг и транскрипцию РНК. Смотрите регулирование Sabine, В., Antisense-RNA regulation and RNA Interference. Biochimica et Biophysica Acta (BBA) - Gene Structure and Expression, 2001. 1575(1-3): p. 15-25. Этот механизм используется в ингибировании синтеза белков в терапевтических целях.
Антисмысловая РНК представляет собой одноцепочечную РНК, которая комплементарна нити матричной РНК (мРНК), транскрибированной внутри клетки. асРНК может быть введена в клетку для ингибирования трансляции комплементарной мРНК по спариванию оснований с ним и для физического препятствования механизму трансляции. Отжиг антисмысловой РНК с комплементарной последовательностью-мишенью мРНК и трансляция последовательности-мишени мРНК нарушается вследствие стерических затруднений либо доступа рибосомы, либо считывания рибосомы.
Механизм антисмысловой РНК отличается от РНК-интерференции (RNAi), связанного процесса, в котором фрагменты двухцепочечной РНК (дцРНК, также называемые малые интерферирующие РНК (миРНК)) запускают каталитически опосредованное молчание генов, наиболее часто путем направленного воздействия на индуцированный РНК комплекс сайленсинга (RISC) для связывания и разрушения мРНК. Отжиг нити молекулы дцРНК с мРНК или ДНК может приводить к быстрой деградации дуплексной РНК, гибридному дуплексу РНК/ДНК или дуплексной РНК, напоминающей предшественник тРНК с помощью рибонуклеазы в клетке, или путем расщепления РНК-мишени самим антисмысловым соединением.
Путь РНК-интерференции встречается у многих эукариот и инициируется ферментом Dicer, который расщепляет длинные молекулы двухцепочечных РНК (дцРНК) на короткие двухцепочечные фрагменты ~ 20 нуклеотидов, называемые миРНК. Каждая миРНК разматывается на две одноцепочечные РНК (оцРНК), называемые пассажирская нить и нить-гид. Пассажирская нить деградирует, и нить-гид включается в индуцированный РНК комплекс сайленсинга (RISC). В посттранскрипционном сайленсинге генов, основания нити-гида образуют пары с комплементарной последовательностью в молекуле матричной РНК, и расщепление индуцируется белком, называемым Argonaute, каталитическим компонентом комплекса RISC.
В отношении взаимодействий нуклеиновых кислот механизмов согласно настоящему изобретению, взаимодействия между репортерным транскриптом и транскриптом-мишенью может относиться к образованию пар оснований между петлями, присутствующими в обоих транскриптах (например, "целующиеся комплексы") или между петлей и одноцепочечной (оц) областью. В некоторых случаях, образование целующихся комплексов достаточно для опосредования желаемого эффекта взаимодействия, а в других случаях распространение первичных контактов будет приводить к взаимодействию, приводящему в результате к желаемому эффекту.
2) Механизмы для цис-репрессии и транс-активации трансляции репортерного конструкта посредством регулирования на уровне транскриптов
В последующем описании показаны транскрипторные репортерные системы, основанные на различных механизмах репрессии/активации, которые могут использоваться в соответствии с вариантами осуществления настоящего изобретения. На каждой из фигур 17-20 вектор включает в себя конструкт, содержащий репортерную последовательность, и области на репортерном конструкте показаны на каждой из фигур, включая в себя области, на которые могут направлено воздействовать для репрессии цис-репрессированной последовательностью. Приведенное ниже описание содержит неограничивающие примеры различных механизмов ингибирования транскрипции, включающие в себя ослабление транскрипции, ослабление трансляции и дестабилизацию транскрипта, а также различные механизмы активации, включающие в себя конформационные изменения и расщепление.
На фиг. 17 показан пример системы 1700, которая использует цис-репрессрный механизм, который может направленно воздействовать на 5' UTR (нетранслируемую область) 1701 репортерной последовательности 1702 на репортерном транскрипте 1703. Также показаны области внутри репортерной последовательности 1702 (5'UTR (1701), RBS, кодирующая область 3'UTR). Цис-репрессорная последовательность 1705 находится выше против хода транскрипции от репортерной последовательности и до 5' UTR 1701 репортерной последовательности. РНК-полимераза 1704 транскрибирует последовательность репортерного конструкта 1703 из вектора 1706.
В некоторый момент во время транскрипции процесс транскрипции останавливается путем образования структуры стебель-петля терминации транскрипции (ТТ) 1707 в репортерном транскрипте 1703, из-за взаимодействия в транскрибированной цис-репрессорной последовательности 1705. Структура терминации транскрипции 1707 останавливает 1708 РНК-полимеразу 1704 от траскрибирования вектора 1706 Согласно некоторым вариантам осуществления белок терминации транскрипции (например, NusA в E. coli) связывается с РНК-полимеразой и/или структурой терминации транскрипции 1707 для прекращения транскрипции репортерного конструкта.
Когда транскрипт-мишень 1709 присутствует в клетке, транскрипт-мишень 1709 связывается с репортерным транскриптом 1703. Согласно некоторым вариантам осуществления связывание между транскриптом-мишенью и репортерным транскриптом происходит путем спаривания оснований нуклеотидов в каждой последовательности. Взаимодействие между транскриптом-мишенью 1709 и репортерным транскриптом 103 вызывает расщепление 1710 структуры стебель-петля терминации транскрипции (ТТ) 1707. Расщепление репортерного транскрипта 1703 может происходить с помощью клеточного фермента, такого как РНКаза III, например. В этом случае вторичную структуру транскрипта-мишени анализируют на наличие консенсусной последовательности РНКазы III среди областей оцРНК вторичной структуры, например 5'-nnWAWGNNNUUN-3' (SEQ ID NO: 20) или 5'-NAGNNNNCWUWnn-3' (SEQ ID NO: 21), где "N" и "n" представляют собой любой нуклеотид и "W" представляет собой А или U, и "N" указывает на относительно строгие требования к уотсон-криковскому спариванию оснований, а "n" указывает на минимальный требование к спариванию оснований. Когда такая консенсусная последовательность находится на транскрипте-мишени, петля структуры терминации транскрипции 1707 может быть предназначена для того, чтобы быть комплементарной указанной консенсусной последовательности РНКазы III, так что когда оцРНК в каждой молекулы РНК гибридизуется, образуется сайт расщепления РНКазы III, делая возможным расщепление структуры терминации транскрипции 1707. В транскрипте mecA, петля Т23, начиная с нуклеотида 1404, содержит последовательность CAGAUAACAUUUU (SEQ ID NO: 22), которая подходит для такого подхода.
Согласно некоторым вариантам осуществления конструируют сайт расщепления в репортерном конструкте таким образом, что репортерный транскрипт расщепляется после транскрипции. Расщепление в приведенном примере может происходить в непосредственной близости к месту петли в структуре терминации транскрипции. Транскрипция повторно инициируется 1711 РНК-полимеразой 104. Расщепление структуры стебель-петля терминации транскрипции (ТТ) 1707 позволяет остатку репортерной последовательности 1702 транскрибироваться и затем транслироваться. Это приводит к получению обнаруживаемого или селективного маркера из транслированной репортерной молекулы.
В прокариотах структура терминации транскрипции 1707 включает в себя Rho-независимый механизм со структурой стебель-петля, которая составляет 7-20 пар оснований в длину, богатую парами оснований цитозин-гуанин и за ней следует цепь остатков урацила. NusA связывается со структурой стебель-петля терминации транскрипции 1707, заставляющей РНК-полимеразу останавливаться во время транскрипции поли-урациловой последовательности. Слабые аденин-урациловые связи снижают энергию дестабилизации дуплекса РНК-ДНК, что позволяет разматываться и диссоциировать от РНК-полимеразы. У эукариот структура терминации транскрипции 1707 распознается белковыми факторами и включает в себя расщепление нового транскрипта с последующим полиаденилированием.
На фиг. 18 показан пример системы 1800 для обнаружения наличия транскрипта-мишени в клетке, которая основана на цис-репрессорном механизме, нацеленно воздействующем на сайт связывания рибосом (RBS) 1801 репортерной последовательности 1702 в репортерном транскрипте 1703. RBS 1801 представляет собой последовательность мРНК, которая связана с рибосомой 1802 при инициировании трансляции белка. Цис-репрессорная последовательность 1705 предназначена для связывания с RBS 1801 (например, цис-репрессорная последовательность 1705 комплементарна последовательности RBS 1801). RBS 1801 связывается с цис-репрессорной последовательностью 1705 и становится поглощенной (недоступной для рибосом 1802), предотвращая репортерную трансляцию 1703. Когда транскрипт-мишень 109 из клетки связывается с репортерным транскриптом 1703, транскрипт-мишень 1709 характеризуется более высокой аффинностью связывания для последовательности RBS 1801, и конформационное изменение происходит в репортерном транскрипте 1703 таким образом, что высвобождает связывание между цис-репрессорной последовательностью 1705 и последовательностью RBS 1801. Это позволяет рибосоме 1802 связываться с RBS 1801, тем самым делая возможной трансляцию репортерного транскрипта 1703.
На фиг. 19 показана иллюстративная система 1900 для обнаружения наличия транскрипта-мишени в клетке, которая основана на цис-репрессорном механизме, нацеленно воздействующем на кодирующую область ("AUG") 1901 репортерной последовательности 1702 в репортерном транскрипте 1703. Цис-репрессорную последовательность 1705 конструировали таким образом, чтобы она связывалась с (например, была комплементарна) кодирующей областью 1901 репортерной последовательности 1702. Стартовый кодон "AUG" показан, как часть кодирующей области 1901. Связывание цис-репрессорной последовательности 1705 и кодирующей области 1901 приводит к конформации, которая приводит к расщеплению 1902 репортерного конструкта 1703. Расщепление репортерного транскрипта 1703 предотвращает трансляцию.
Когда транскрипт-мишень 1709 присутствует в клетке, транскрипт-мишень 1709 связывается с цис-репрессорной последовательностью 1705 таким образом, что вызывает конформационное изменение в репортерном транскрипте 1703. Это конформационное изменение препятствует или удаляет взаимодействие между цис-репрессорной последовательностью 1705 и кодирующей областью 1901 репортерной последовательности 1702, таким образом, позволяя трансляцию репортерной последовательности 1702.
На фиг. 20 показана иллюстративная система 2000 для обнаружения наличия транскрипта-мишени в клетке, которая основана на механизме репрессии с использованием нестабильного репортерного транскрипта 2001. Репортерный транскрипт 2001 разработан быть нестабильным таким образом, чтобы он образовывал нестабильную конформацию, которая предотвращает трансляцию репортерного транскрипта 2001. Репортерный транскрипт 2001 определяется как неустойчивый, если он склонен к быстрой деградации под воздействием различных факторов, таких как активность экзосомных комплексов или деградосом. Транскрипт-мишень 1709 в клетке связывается с участком неустойчивого репортерного транскрипта 2001. В этом примере участок, отвечающий за дестабилизацию транскрипта, находится в 3' UTR 2005 репортерной последовательности, и 3' UTR 2005 действует как цис-репрессорная последовательность репортерного конструкта 1703. Связывание транскрипта-мишени 1709 с UTR 3' 2005 репортерной последовательности приводит к событию расщепления 2003, которое стабилизирует репортерный транскрипт 2001 и позволяет трансляцию 2004 репортерного транскрипта 2001. Расщепление происходит при связывании транскрипта-мишени 1709 и служит для удаления части последовательности, которая отвечает за дестабилизацию транскрипта. В этом примере, транскрипт-мишень 1709 связывается с 3' UTR 405 репортерной последовательности, но система 400 также может быть разработана таким образом, что связывание и расщепление происходит в 5' UTR, выше против хода транскрипции от 5' UTR или ниже по ходу транскрипции 3' UTR. Связывание и расщепление может происходить в любом месте за пределами областей, необходимых для трансляции репортерной последовательности 1702.
Согласно некоторым вариантам осуществления цис-репрессорная последовательность содержит две последовательности, которые могут связываться друг с другом (например, быть комплементарными друг другу), и конформация репортерного транскрипта, которая представляет собой результат связывания двух последовательностей цис-репрессорной последовательности, предотвращает трансляцию репортерной последовательности в репортерный транскрипт.
3) Природные и синтетические системы для механизмов репрессии/активации
Описаны несколько природных и синтетически произведенных механизмов на транскриптном уровне, которые демонстрируют отдельные механизмы (т.е. конформационное изменение и расщепление), используемые в каждом из примеров, представленных на фигурах 17-20.
Терминация транскрипции наблюдалась в опосредованном антисмысловой РНК (асРНК) ослаблении транскрипции. В одном примере, за двумя взаимодействиями петля-петля между RNAIII/repR мРНК впоследствии следует образование стабильного дуплекса. Этот комплекс стабилизирует Rho-независимую структуру терминатора для остановки удлинения РНК-полимеразой (RNAP).
Механизм секвестрации RBS был описан с помощью разработки синтетической системы рибосвитч. В этой системе последовательность, комплементарная к RBS, находится выше против хода транскрипции RBS, позволяя наличие линкерной последовательности двух областей. После транскрипции мРНК, две комплементарные области гибридизуются, создавая шпильку, которая предотвращает стыковку рибосомы. Для активации трансляции синтетическая РНК транс-активации, несущая последовательность RBS, связывается с гибридизованной РНК, позволяя RBS подвергаться воздействию и быть доступной для трансляции.
Предотвращение трансляции из-за раскалывания РНК было также описано в природной системе, где асРНК MicC направленно воздействует на последовательность внутри кодирующей области ompD мРНК. Взаимодействие, которое обеспечивается Hfq, вызывает расщепление мРНК по РНКазы Е.
Еще один природный механизм демонстрирует событие расщепления для активации скорее трансляции, а не ее ингибирования. асРНК GadY Е. coli нацеленно воздействует на межгенную область между двумя генами оперона gadXW. После образования стабильной спирали между GadY и 3' UTR из gadX, происходит расщепление РНКазы в транскрипте, и стабилизация транскрипта gadX делает возможным его трансляцию.
4) Механизм конформационного изменения путем цис-репрессии репортерной последовательности и путем связывания транскрипта-мишени
Общие механизмы, используемые в настоящем изобретении, представляют собой межмолекулярные взаимодействия между нуклеиновыми кислотами, которые могут приводить к двум последующим механизмам: (1) конформационному изменению во вторичной структуре молекул нуклеиновых кислот и (2) событию расщепления. В настоящем документе описаны способы разработки репортерных транскриптов, которые могут подвергаться конформационному изменению между цис-репрессорной конформацией и дерепрессорной конформацией, так что конформационное изменение индуцируется связыванием транскрипта-мишени с репортерным транскриптом.
Как описано выше, репортерный транскрипт может содержать репортерную последовательность и быть разработан таким образом, чтобы трансляция репортерной генной последовательности блокировалась цис-репрессией связывающего сайта рибосомы (RBS) репортерного гена.
Согласно некоторым вариантам осуществления следующие инструменты могут быть использованы для разработки репортерных транскриптов согласно настоящему изобретению.
1) вторичная структура РНК рассчитывается с использованием программы вторичной структуры, такой как Mfold, доступной на сервере, поддерживаемом Институтом РНК колледжа гуманитарных и естественных наук, Университетом в Олбани, Государственным университетом Нью-Йорка (веб-сервер Mfold для упаковки нуклеиновой кислоты и прогнозирования гибридизации. Nucleic Acids Res. 31 (13), 3406-15, (2003)) (http://mfold.rna.albany.edu/?q=mfold/RNA-Folding-Form)).
2) Межмолекулярные взаимодействия РНК рассчитываются с использованием программного обеспечения, такого как предсказания взаимодействия РНК-РНК с использованием Integer Programming (RactIP), доступного на сервере, поддерживаемом Высшей школой информатики, Институтом Нара науки и технологий (NAIST), Департаментом биологических наук и информатики, Университет Кейо Япония (http://rna.naist.jp/ractip/).
3) вторичную структуру РНК визуализируют с использованием приложения для визуализации для РНК (VARNA) (http://varna.lri.fr/), которое представляет собой легкий апплет Java, посвященный разработке вторичной структуры РНК.
Вторичная структура транскрипта-мишени может быть создана на основе конформации с самой низкой энергией, рассчитанной с помощью MFold и визуализированой с VARNA.
Области оцРНК или области-мишени могут быть идентифицированы к транскрипте-мишени, который может идеально подходить для связывания с репортерным транскриптом. В некоторых случаях вторичная структура транскрипта-мишени включает в себя консенсусную последовательность или последовательность петли, которая может связываться с частью репортерной последовательности. Например, в транскрипте mecA метициллин-устойчивого S. aureus существует терминальная петля, которая включает в себя консенсусную последовательность YUNR ("UUGG"), которая может быть использована для связывания с цис-репрессорной последовательностью репортерного транскрипта. Анализ вторичной структуры транскрипта-мишени может выявить только эти или более областей оцРНК, которые могут быть пригодны для связывания с цис-репрессорной последовательностью. Цис-репрессорная последовательность репортерного транскрипта может быть разработана для связывания только с этими или более областями оцРНК.
Согласно некоторым вариантам осуществления цис-репрессорная последовательность может быть разработана для связывания с RBS репортерной последовательности в репортерном транскрипте и образовывать структуру стебель-петля в репортерном транскрипте, так что цис-репрессорная последовательность блокирует связывание РНК-полимеразы с RBS репортерной последовательности. После связывания цис-репрессорной последовательности с областью оцРНК транскрипта-мишени, RBS репортерной последовательности может подвергаться воздействию и может быть инициирована трансляция репортерной последовательности.
Согласно некоторым вариантам осуществления цис-репрессорная последовательность репортерного транскрипта может быть разработана для того, чтобы располагаться на 5'-конце репортерной последовательности, и быть разработана для создания структуры стебель-петля в репортерной последовательности, такой, что последовательность RBS репортерной последовательности блокируется. Цис-репрессорная структура стебель-петля может быть разработана, чтобы блокировать последовательность RBS на основании конформации с наименьшей энергией репортерного транскрипта, рассчитанного с помощью MFold и визуализированного с VARNA. Предсказанные межмолекулярные взаимодействия между транскриптом-мишенью и цис-репрессорной последовательностью репортерного транскрипта можно рассчитать с помощью RactIP и визуализировать с помощью VARNA. Может быть изображена схема для визуализации спаривания оснований между транскриптом-мишенью и цис-репрессорной последовательностью репортерного транскрипта, как показано на фиг. 28 ниже.
Взаимодействие может включать в себя спаривание оснований между 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49 или 50 или более нуклеотидами в последовательности-мишени и цис-репрессорной последовательности. Комплементарное связывание между двумя последовательностями может быть полностью комплементарным, по существу комплементарным или частично комплементарным. Спаривание оснований может происходить вдоль смежных нуклеотидных последовательностей или областей внутри мишени и цис-репрессорной последовательности, например, как показано на фиг. 28.
5) Механизмы расщепления для цис-репрессорных транскриптов или репортерных транскриптов
Общие механизмы, используемые в настоящем изобретении, представляют собой межмолекулярные взаимодействия между молекулами нуклеиновых кислот, которые могут приводить к двум последующим механизмам: (1) конформационному изменению во вторичной структуре молекул нуклеиновых кислот и (2) событию расщепления. В настоящем документе описаны способы и системы для разработки репортерных транскриптов, которые используются для события расщепления.
Согласно некоторым вариантам осуществления механизм для расщепления может быть использован в системе и способах согласно настоящему изобретению для цис-репрессии или для транс-активации. Например, как описано выше на фигурах 17, 19 и 20, система может быть разработана, чтобы получить преимущество механизма раскалывания, подвергая последовательность нуклеиновой кислоты репортерного транскрипта воздействию расщепляющего фермента (РНКазы) или секвестрации одноцепочечной последовательности, которая распознается специфической к последовательности РНКазой.
В одном примере сайт рибонуклеазы Е (РНКазы Е) может быть разработан в репортерном транскрипте ("*" указывает на расщепляющийся сайт): (G,A)N(C,A)N(G)(G,U,A)*(A,U)(C,U)N(C,A)(C,A). Смотрите Kaberdin et al., Probing the substrate specificity of E. coli RNase E using a novel oligonucleotide-based assay. Nucleic Acids Research, 2003, Vol. 31, No. 16 (doi: 10.1093/nar/gkg690).
В цис-репрессорной системе цис-репрессорная последовательность может быть включена в конструкцию репортерного транскрипта, например, такую, что при транскрипции конформация репортерного транскрипта подвергает одноцепочечную область, содержащую мотив распознавания последовательности РНКазы Е, воздействию в желаемом месте для расщепления. Согласно некоторым вариантам осуществления сайт расщепления может быть вовлечен в репрессию транскрипции репортерного транскрипта, например, если сайт расщепления находится в кодирующей области репортерного гена.
Для системы транс-дерепрессии, цис-репрессорный транскрипт может быть сконструирован для связывания с транскриптом-мишенью, например, таким, что взаимодействие приводит к конформационному изменению в репортерном транскрипте, которое изолирует одноцепочечную область, содержащую сайт РНКазы Е.
Система может быть разработана так, чтобы цис-репрессорный механизм был связан с конкретной вторичной структурой, создаваемой конформацией цис-репрессорной последовательности, такая как описанная выше структура терминации транскрипции. В этом примере событие раскалывания служит для де-репрессии репортерной последовательности. Это может быть достигнуто путем разработки цис-репрессорной последовательности для взаимодействия с (связывания с) встречающейся в природе плазмидой или другим клеточным транскриптом, так что взаимодействие приводит к созданию одноцепочечной области, содержащей сайт РНКазы Е, который может расщепляться и, таким образом, удаляет цис-репрессорную последовательность из репортерного транскрипта.
Согласно некоторым вариантам осуществления, когда событие расщепления используется для экспрессии репортера, сайт РНКазы Е разрабатывается для того, чтобы быть вне кодирующей области репортерной последовательности с достаточной длиной последовательности в 5' и 3' UTR для обеспечения жизнеспособного репортерного транскрипта. В этом случае сайт РНКазы Е разрабатывается, чтобы составлять по меньшей мере 0, 1, 2, 3, 4, 5, 10, 20, 30, 40, 50, 60, 70, 80, 90, 100, 200, 300, 400, 500 или более пар оснований выше против хода транскрипции от стартового кодона в прокариотических системах и по меньшей мере 18, 20, 30, 40, 50, 60, 70, 80, 90, 100, 200, 300, 400, 500 или более пар оснований выше против хода транскрипции от стартового кодона в эукариотических системах, или по меньшей мере 10, 20, 30, 40, 50, 60, 70, 80, 90, 100, 200, 300, 400, 500 или более пар оснований ниже по ходу транскрипции от стоп-кодона. Согласно другим вариантам осуществления, когда событие расщепления используется для репрессии репортера, сайт РНКазы Е предназначен для того, чтобы быть в пределах кодирующей области репортерной последовательности или размещаться иным образом, чтобы ингибировать экспрессию репортера.
6) Транскрипты
Как описано выше, транскрипт представляет собой длину нуклеотидной последовательности (ДНК или РНК), транскрибированной с матричной последовательности ДНК или РНК или гена. Транскрипт может представлять собой последовательность кДНК, транскрибированную с РНК-матрицы, или последовательности мРНК, транскрибированную с ДНК-матрицы. Транскрипт может быть транскрибирован со сконструированного конструкта нуклеиновой кислоты. Транскрипт может содержать области комплементарности таким образом, что транскрипт включает в себя две области, которые могут образовывать внутримолекулярный дуплекс. Одна область может быть отнесена к "цис-репрессорной последовательности", которая связывается с и блокирует трансляцию репортерной последовательности. Вторая область транскрипта называется "репортерная последовательность", которая кодирует репортерную молекулу, например, обнаруживаемый или селективный маркер.
Транскрипты согласно настоящему изобретению могут представлять собой последовательность транскрипта, которая может составлять 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24 или 25 нуклеотидов в длину. Согласно другим вариантам осуществления транскрипт может составлять по меньшей мере 25, 30, 40, 50, 60, 70, 80, 90, 100, 500, 1000, 1500, 2000, 3000, 4000, 5000 или более нуклеотидов в длину. Цис-репрессорная последовательность и репортерная последовательность могут быть одинаковой длины или разной длины.
Согласно некоторым вариантам осуществления цис-репрессорная последовательность отделена от репортерной последовательности 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 35, 40, 45, 50, 55, 60 или более разделительными нуклеотидами.
7) Векторы
Согласно другому аспекту транскрипты (включающие в себя антисмысловые и смысловые последовательности) согласно настоящему изобретению экспрессируются с единиц транскрипции, вставленных в ДНК или РНК векторы (смотрите, например, Couture, A, et al., TIG. (1996), 12:5-10; Skillern, A., et al., международную публикацию согласно PCT № WO 00/22113, Conrad, международную публикацию согласно РСТ № WO 00/22114 и Conrad, патент США №6054299). Эти последовательности могут быть введены в виде линейного конструкта, круговой плазмиды или вирусного вектора, включая в себя основанные на бактериофагах векторы, которые могут быть включены и унаследованы в качестве трансгена, интегрированного в геном хозяина. Транскрипт также может быть построен для обеспечения того, чтобы быть унаследованным как внехромосомная плазмида (Gassmann, et al., Proc. Natl. Acad. Sci. USA (1995) 92:1292).
Последовательности транскриптов могут быть транскрибированы с помощью промотора, расположенного на плазмиде экспрессии. Согласно одному варианту осуществления цис-репрессорная и репортерная последовательности экспрессируются в виде инвертированного повтора, соединенного линкерной полинуклеотидной последовательностью, так что транскрипт содержит структуру стебля и петли.
Рекомбинантные экспрессирующие векторы могут быть использованы для экспрессии транскриптов согласно настоящему изобретению. Рекомбинантные экспрессирующие векторы, как правило, представляют собой ДНК-плазмиды или вирусные векторы. Вирусные векторы, экспрессирующие транскрипты, могут быть построены на основании, но без ограничения, аденоассоциированного вируса (для обзора смотрите Muzyczka, et al., Curr. Topics Micro. Immunol. (1992) 158:97-129)); аденовируса (смотрите, например, Berkner, et al., BioTechniques (1998) 6:616), Rosenfeld et al. (1991, Science 252:431-434) и Rosenfeld et al. (1992), Cell 68:143-155)) или альфавируса, а также других известных в настоящей области техники. Ретровирусы были использованы для введения различных генов в различные типы клеток, включающие в себя эпителиальные клетки, in vitro и/или in vivo (смотрите, например, Eglitis, et al, Science (1985) 230:1395-1398; Danos and Mulligan, Proc. Natl. Acad. Sci. USA (1998) 85:6460-6464; Wilson et al., 1988, Proc. Natl. Acad. Sci. USA 85:3014-3018; Armentano et al., 1990, Proc. Natl. Acad. Sci. USA 87:61416145; Huber et al., 1991, Proc. Natl. Acad. Sci. USA 88:8039-8043; Ferry et al., 1991, Proc. Natl. Acad. Sci. USA 88:8377-8381; Chowdhury et al., 1991, Science 254:1802-1805; van Beusechem. et al., 1992, Proc. Natl. Acad. Sci. USA 89:7640-19; Kay et al., 1992, Human Gene Therapy 3:641-647; Dai et al., 1992, Proc. Natl. Acad. Sci. USA 89:10892-10895; Hwu et al., 1993, J. Immunol. 150:4104-4115; патент США №4868116; патент США №4980286; заявку согласно РСТ WO 89/07136; заявку согласно РСТ WO 89/02468; заявку согласно РСТ WO 89/05345 к заявку согласно РСТ WO 92/07573). Рекомбинантные ретровирусные векторы, способные к трансдукции и экспрессии генов, вставленных в геном клетки, могут быть получены путем трансфекции рекомбинантного ретровирусного генома в соответствующим образом упакованные клеточные линии, такие как РА317 и Psi-CRIP (Comette et al., 1991, Human Gene Therapy 2:5-10; Cone et al., 1984, Proc. Natl. Acad. Sci. USA 81:6349). Рекомбинантные аденовирусные векторы могут быть использованы для инфицирования широкого спектра клеток и тканей у восприимчивых хозяев (например, крыса, хомяк, собака и шимпанзе) (Hsu et al., 1992, J. Infectious Disease, 166:769), а также они характеризуются тем преимуществом, что не требуют митотически активных клеток для инфекции.
Может быть использован любой вирусный вектор, способный принимать кодирующие последовательности для транскрипта(ов), которые будут экспрессироваться, например, векторы, полученные из аденовируса (AV); аденоассоциированного вируса (AAV); ретровирусов (например, лентивирусов (LV), рабдовирусов, вируса мышиного лейкоза); вируса герпеса и т.п. Тропизм вирусных векторов может быть модифицирован с помощью псевдотипирования векторов с белками оболочки или другими поверхностными антигенами от других вирусов, или путем замены различных белков капсида вируса, в случае необходимости.
Например, представленные в настоящем изобретении лентивирусные векторы могут быть псевдотипированы с поверхностными белками из вируса везикулярного стоматита (VSV), бешенства, лихорадки Эбола, Мокола и т.п. Представленные в настоящем изобретении AAV векторы могут быть сделаны для нацеленного воздействия на различные клетки путем конструирования векторов для экспрессии различных серотипов капсидных белков. Способы конструирования AAV векторов, которые экспрессируют различные серотипы капсидных белков, известны специалистам в настоящей области техники; смотрите, например, Rabinowitz J Е et al. (2002), J Virol 76:791-801, полное описание которой включено в настоящий документ посредством ссылки.
Выбор рекомбинантных вирусных векторов, пригодных для использования в настоящем изобретении, способы вставки последовательностей нуклеиновых кислот для экспрессии транскриптов в вектор и способы доставки вирусного вектора в представляющие интерес клетки известны специалистам в настоящей области техники. Смотрите, например, Dornburg R (1995), Gene Therap. 2: 301-310; Eglitis M A (1988), Biotechniques 6: 608-614; Miller A D (1990), Hum Gene Therap. 1: 5-14; Anderson W F (1998), Nature 392: 25-30 и Rubinson D A et al., Nat. Genet. 33: 401-406, полное описание которых приведено в настоящем документе посредством ссылки.
Вирусные векторы могут быть получены из AV и AAV. Подходящий AV вектор для экспрессии транскриптов, приведенный в настоящем изобретении, способ построения рекомбинантного вектора AV, а также способ доставки вектора в клетки-мишени, описан в Xia Н et al. (2002), Nat. Biotech. 20: 1006-1010. Подходящие векторы AAV для экспрессии транскриптов, показанных в настоящем изобретении, способы построения рекомбинантного вектора AV и способы доставки векторов в клетки-мишени описаны в Samulski R et al. (1987), J. Virol. 61: 3096-3101; Fisher K J et al. (1996), J. Virol, 70: 520-532; Samulski R et al. (1989), J. Virol. 63: 3822-3826; патенте США №5252479; патенте США №5139941; международной патентной заявке № WO 94/13788 и международной патентной заявке № WO 93/24641, полное содержание которых включено в настоящий документ посредством ссылки.
Промотор, запускающий экспрессию транскриптов либо в ДНК плазмиды, либо в вирусном векторе, представленный в настоящем изобретении, может представлять собой эукариотическую РНК-полимеразу I (например, рибосомальный РНК промотор), РНК-полимеразу II (например, ранний промотор ЦМВ или промотор актина или промотор мяРНК U1) или вообще промотор РНК-полимеразу III (например, промотор мяРНК U6 или 7SK РНК) или прокариотической промотор, например, промотор Т7, включающий, что экспрессия плазмиды также кодирует РНК-полимеразу Т7, необходимую для транскрипции с промотора Т7. Промотор может также направлять экспрессию трансгена в поджелудочную железу (смотрите, например, регуляторную последовательность инсулина для поджелудочной железы (Bucchini et al, 1986. Proc. Natl. Acad. Sci. USA 83:2511-2515)).
Кроме того, экспрессия транскрипта может точно регулироваться, например, с использованием индуцируемой регуляторной последовательности и систем экспрессии, таких как регуляторная последовательность, которая чувствительна к определенным физиологическим регуляторам, например, уровням циркулирующей глюкозы или гормонам (Docherty et al., 1994, FASEB J. 8:20-24). Такие индуцируемые системы экспрессии, пригодные для контроля экспрессии трансгена в клетках или в млекопитающих, включают в себя регулирование с помощью экдизона, с помощью эстрогена, прогестерона, тетрациклина, химических индукторов димеризации и изопропил-бета-D-1-тиогалактопиранозида (IPTG). Специалист в настоящей области техники сможет выбрать соответствующую регуляторную/промоторную последовательность на основании предполагаемого использования трансгена дцРНК.
Как правило, рекомбинантные векторы, способные экспрессировать молекулы транскриптов, доставляются, как описано ниже, и сохраняются в клетках-мишенях. Кроме того, могут быть использованы вирусные векторы, которые обеспечивают временную экспрессию молекул транскрипта. Такие векторы могут быть введены повторно по мере необходимости. После экспрессии транскрипт связывается с РНК-мишенью и модулирует свою функцию или экспрессию. Доставка экспрессирующих транскрипт векторов может быть системной, например, путем внутривенного или внутримышечного введения, путем введения в клетки-мишени эксплантировано от пациента с последующей реинтродукцией в пациента, или любыми другими средствами, которые позволяют введение в желаемую клетку-мишень.
Экспрессирующие транскрипты ДНК плазмиды, как правило, трансфицируют в клетки-мишени в виде комплекса с катионными липидными носителями (например, Oligofectamine) или не катионными основанными на липидах носителями (например, Transit-TKO™). Множественные липидные трансфекции для опосредованных дцРНК нокдаунов, нацелено воздействующие на различные области единственного гена PROC или нескольких генов PROC в течение недели или более, также рассматриваются в соответствии с настоящим изобретением. Успешное внедрение векторов в клетки-хозяева можно контролировать с использованием различных известных способов. Например, временная трансфекция может быть сигнальной с репортером, таким как флуоресцентный маркер, такой как зеленый флуоресцентный белок (GFP). Стабильная трансфекция клеток ex vivo может быть обеспечена с использованием маркеров, которые обеспечивают трансфицированную клетку с резистентностью к конкретным факторам окружающей среды (например, антибиотикам и лекарствам), например, резистентностью к гигромицину В.
Доставка вектора, содержащего рекомбинантную ДНК, может быть выполнена с помощью небиологических или биологических систем. Включая в себя без ограничения липосомы, вирусоподобные частицы, полученные из фагов или вирусов трансдукторные частицы и конъюгацию.
8) Репортеры для анализа транскриптов
Согласно некоторым вариантам осуществления конструкт нуклеиновой кислоты содержит репортерную последовательность (например, последовательность репортерного гена). Репортерный ген кодирует репортерную молекулу, которая вырабатывает сигнал при экспрессии в клетке. Согласно некоторым вариантам осуществления репортерная молекула может представлять собой обнаруживаемый или селективный маркер. Согласно некоторым вариантам осуществления репортерная молекула может представлять собой флуоресцентную репортерную молекулу, такую как зеленый флуоресцентный белок (GFP), желтый флуоресцентный белок (YFP), голубой флуоресцентный белок (CFP), синий флуоресцентный белок (BFP) или красный флуоресцентный белок (RPP). Согласно другим вариантам осуществления репортерная молекула может представлять собой хемилюминесцентный белок.
Репортерные молекулы могут представлять собой бактериальную люциферазу, эукариотическую люциферазу, флуоресцентный белок, фермент, подходящий для колориметрического обнаружения, белок, подходящий для иммунологического обнаружения, пептид, подходящий для иммунологического обнаружения, или нуклеиновую кислоту, которая функционируют в качестве аптамера или которая проявляет ферментативную активность.
Селективные маркеры также могут быть использованы в качестве репортера. Селективный маркер может представлять собой ген устойчивости к антибиотику, например.
9) Клетки и гены-мишени для анализа репортерных транскриптов
Примеры клеток, которые могут быть использованы для обнаружения, включают в себя грамположительные и грамотрицательные бактерии, такие как S. aureus, Е. coli, K. pneumoniae и т.д., грибы, такие как Streptomyces coelicolor, и другие эукариотические клетки, включающие в себя клетки от человека, других млекопитающих, насекомых, беспозвоночных или растений.
Транскрипты-мишени могут включать в себя любой эндогенный транскрипт, как кодирующий, так и некодирующий. Транскрипты-мишени могут быть получены из эукариотических и прокариотических клеток, включающих в себя, например, транскрипт mecA в клетках S. aureus (указывающий на MRSA), транскрипт tcdB в С. difficile (указывающий на токсигенный С. diff) и транскрипты HPV Е6/Е7 в эпителиальных клетка шейки матки (указывающие на злокачественную опухоль шейки матки). Гены, связанные с инфекционными патогенами, такими как вирусы, могут также представлять собой мишени, включая в себя ВИЧ, HPV и т.д. Другие примеры генов-мишеней включают в себя некодирующую РНК, такую как транспортная РНК (тРНК) и рибосомальная РНК (рРНК), а также такие РНК, как мноРНК, микроРНК, миРНК, мяРНК, экзосомальные РНК и piPHK и некодируемые РНК.
ПРИМЕРЫ
Ниже приведены примеры определенных вариантов осуществления для выполнения настоящего изобретения. Примеры предлагаются только в целях иллюстрации и никоим образом не предназначены для ограничения объема настоящего изобретения. Были приложены усилия для того, чтобы гарантировать точность в отношении используемых чисел (например, количества, температуры и т.д.), но некоторая экспериментальная ошибка и отклонение, конечно же, должна приниматься во внимание.
В практическом осуществлении настоящего изобретения применяют, если не указано иначе, общепринятые среди специалистов в данной области способы белковой химии, биохимии, способы рекомбинантной ДНК и фармакологии. Такие методики полностью описаны в литературе. Смотри, например, Т.Е. Creighton, Proteins: Structures and Molecular Properties (W.H. Freeman and Company, 1993); A.L. Lehninger, Biochemistry (Worth Publishers, Inc., current addition); Sambrook, et al., Molecular Cloning: A Laboratory Manual (2nd Edition, 1989); Methods In Enzymology (S. Colowick and N. Kaplan eds., Academic Press, Inc.); Remington's Pharmaceutical Sciences, 18th Edition (Easton, Pennsylvania: Mack Publishing Company, 1990); Carey and Sundberg Advanced Organic Chemistry 3rd Ed. (Plenum Press) Vols A and В (1992)
Пример 1: система упаковки с молчащей мутацией/комплементацией
Ниже представлен пример разработки и конструирования системы упаковки на основе молчащей мутации/комплементации для получения нерепликативных частиц для трансдукции.
Материалы, используемые для разработки системы упаковки, перечислены ниже:
Бактериальные штаммы:
N1706, лизоген Е. coli K-12 P1 c1-100 Tn9
Векторы:
Y14439 (основная цепь pBHR1)
Следующие ниже инвентарные номера Genbank (N.B., последовательности, обозначенные инвентарным номером, представляют собой последовательности, приведенные в базе данных на момент приоритетной даты данной заявки) или SEQ ID №№ можно использовать для основной цепи вектора и кассетных последовательностей:
- Х06758 (гены бактериальной люциферазы luxAB)
- SEQ ID №1 (нативный рас-сайт P1)
- SEQ ID №3 (литический репликон P1, содержащий контролируемый репрессором С1 промотор Р53, антисмысловую последовательность к промотору Р53, гены repL и делецию гена kilA внутри рамки считывания)
- SEQ ID №4 (промотор Pblast, запускающий экспрессию luxAB)
Конструирование мутированного штамма N1706(pac): расА: иллюстративная последовательность мутированной последовательности расА показана в SEQ ID №2, приведенной в неформальном списке последовательностей ниже. Мутацию можно провести, конструируя мутированную последовательность посредством синтеза гена и затем заменяя нативную последовательность в N1706 на мутированную последовательность посредством подхода аллельной замены.
Конструирование репортерного вектора GWP10001: вектор GWP10001 содержит участок начала репликации pBHR1, проявляющего широкую грамотрицательную активность, два селективных маркера для канамицина и хлорамфеникола, нативную последовательность рас-сайта бактериофага Р1, гены luxA и luxB, которые происходят из Vibrio harveyi, функционально связанные с конститутивным промотором бластициллина (Pblast), и литический репликон Р1, содержащий контролируемый репрессором С1 промотор Р53, антисмысловую последовательность к промотору Р53, гены repL и делецию гена kilA внутри рамки считывания.
На фигуре 2 показан полученный вектор (GWP10001, SEQ ID №11), который можно сконструировать множеством способов, которые известны специалисту в данной области, включая получение кассет при помощи ПЦР из их нативных источников или при помощи синтеза гена и сборки вектора при помощи традиционного клонирования на основе рестриктазы или альтернативных методик, таких как сборка по Гибсону.
Система упаковки с молчащей мутацией/комплементацией: Система упаковки включает в себя мутантный по расА штамм N1706(pac), дополненный вектором pGWP10001. Как известно специалисту в данной области, способ конструирования данной системы можно осуществить трансформацией N1706(pac) вектором pGWP10001. Вектор pGWP10001 может поддерживаться в культурах трансформированного N1706(pac) посредством выращивания трансформанта в присутствие 50 мкг/мл канамицина.
Получение частиц для трансдукции, несущих плазмидную ДНК: Нерепликативные частицы трансдукции, несущие вектор pGWP10001, можно получить из трансформантов N1706(pac) посредством термической индукции при 42°С. Инкубация при 42°С приводит к индукции литического цикла Р1, при котором профаг исключается из генома N1706, приводит к получению структурных элементов фага и упаковке конкатемерной ДНК pGWP10001, образуемых литическим репликоном в фаговых частицах потомства, как изображено на фигуре 1. Полученный клеточный лизат затем собирают, и он содержит нерепликативные частицы для трансдукции, каждая из которых состоит из частиц бактериофага Р1, несущих линейный конкатемер ДНК pGWP10001.
Пример 2: система упаковки с делецией/комплементацией
Ниже представлен пример разработки и конструирования системы упаковки на основе делеции/комплементации для получения нерепликативных частиц для трансдукции.
Материалы, используемые для разработки системы упаковки, перечислены ниже:
Бактериальные штаммы:
RN4220 представляет собой штамм S. aureus с нарушенной рестрикцией, который является нелизогенным производным NCTC 8325 и является эффективным реципиентом для ДНК Е. coli. Он был впервые описан у Kreiswirth, B.N. et al., The toxic shock syndrome exotoxin structural gene is not detectably transmitted by a prophage. Nature, 1983. 305(5936): p. 709-712.
RN10616 получают при лизогенизации RN4220 бактериофагом ϕ80α. Ubeda, С. et al., Specificity of staphylococcal phage and SaPI DNA packaging as revealed by integrase and terminase mutations. Molecular Microbiology, 2009. 72(1): p. 98-108.
ST24 получают при делеции гена малой субъединицы терминазы terS из лизогенизированного бактериофага ϕ80α в RN10616. Ubeda, С. et al., Specificity of staphylococcal phage and SaPI DNA packaging as revealed by integrase and terminase mutations. Molecular Microbiology, 2009. 72(1): p. 98-108.
Векторы:
Примеры плазмид, которые можно использовать в качестве исходных плазмид для кассет в некоторых вариантах осуществления по изобретению, описаны в публикации Charpentier, Е., et al., Novel Cassette-Based Shuttle Vector System for Gram-Positive Bacteria. Appl. Environ. Microbiol., 2004. 70(10): p. 6076-6085.
Следующие ниже инвентарные номера в Genbank можно использовать для кассетных последовательностей:
- SEQ ID №5 (первоисточник плазмиды рТ181 S. aureus или вариант по числу копий репликации рТ181 сор-623 repC)
- M21136 (tetA(M))
- SEQ ID №12 (последовательность промотора PclpB)
- SEQ ID №9 (последовательность гена малой субъединицы терминазы (terS) ϕ11)
- L09137 (amp ColE1 ori)
- Х06758 (luxAB)
- М62650 (терминация транскрипции)
Делеция terS: Конструирование штамма с выключением гена terS ST24 можно выполнить при помощи основанной на аллельной замене стратегии, приводящей к получению делеции в рамке считывания, удаляющей большую часть кодирующей последовательности гена малой субъединицы терминазы ϕ80α. Детали данной стратегии описаны в публикации Ubeda, С. et al., Specificity of staphylococcal phage and SaPI DNA packaging as revealed by integrase and terminase mutations. Molecular Microbiology, 2009. 72(1): p. 98-108.
Иллюстративная последовательность штамма с выключением гена terS показана в SEQ ID №13, (показана в списке последовательностей ниже). SEQ ID №13 представляет собой локусы геномной последовательности RN10616, демонстрирующие делецию terS и комплементацию ϕ80α.
Конструирование вектора: Вектор GW80A0001 представляет собой челночный вектор Е. coli/S. aureus. Вектор содержит участки начала репликации S. aureus (рТ181сор-623 repC) и Е. coli (ColE1ori), селективные маркеры по устойчивости к ампициллину (amp) и тетрациклину (tet(M)) для селекции Е. coli и S. aureus, соответственно, последовательность гена малой субъединицы терминазы (terS) ϕ11, которая включает в себя свой собственный промотор, гены luxA и luxB, которые происходят из Vibrio harveyi, функционально связанные с конститутивным промотором PclpB S. aureus, и последовательность терминации транскрипции (ТТ).
На 4 фигуре показан полученный в результате вектор (pGW80A0001, SEQ ID №14), который можно конструировать множеством способов, которые известны специалисту в данной области. В одном примере кассету tet(M) и гены luxAB можно получать при амплификации ПЦР из общедоступных векторов pCN36 и pCN58 (Charpentier, Е., et al.). PclpB можно получать при амплификации ПЦР из RN4220S. aureus и terS можно получать при амплификации ПЦР из RN10616. Основную цепь вектора можно получать, удаляя ген ermC общедоступного вектора pCN48 (Charpentier, Е., et al.), и различные компоненты готового вектора pGW80A0001 можно собирать в данную основную цепь вектора посредством соответствующим образом разработанного клонирования на основе рестриктазы.
Система упаковки с делецией/комплементацией: Система упаковки может включать в себя штамм с выключением гена terS ST24, дополненный вектором pGW80A0001, чтобы получить штамм GW24. Как известно специалисту в данной области, способ конструирования данной системы можно осуществить посредством трансформации ST24 вектором pGW80A0001. Вектор pGW80A0001 может сохраняться в культурах трансформированного ST24 посредством выращивания трансформанта в присутствие 5 мкг/мл тетрациклина.
Получение частиц для трансдукции, несущих плазмидную ДНК: Нерепликативные частицы для трандукции, несущие вектор pGW80A0001, можно получить из GW24 посредством способа индукции митомицином С, который был впервые продемонстрирован в Е. coli и в настоящее время является стандартной методикой для получения профагов из лизогенизированных бактерий. Otsuji, N. et al., Induction of Phage Formation in the Lysogenic Escherichia coli K-12 by Mitomycin C. Nature, 1959. 184(4692): p. 1079-1080. Данный способ индукции профага приводит к индукции литического цикла ϕ80α, в котором профаг исключается из генома GW24, , получению структурных элементов фага и упаковки конкатемерной ДНК pGW80A0001 в фаговых частицах потомства, как изображено на фигуре 2. Полученный клеточный лизат затем собирают, и он содержит нерепликативные частицы для трандукции, каждая из которых содержит частицы бактериофага ϕ80α, несущие линейный конкатемер ДНК pGW80A0001.
Пример 3: система упаковки на основе SaPIbov2, лишенной интегразы
Ниже представлен пример разработки и конструирования системы упаковки на основе SaPIbov2 для получения нерепликативных частиц для трансдукции.
Материалы, используемые для разработки системы упаковки, перечислены ниже:
Следующие ниже материалы можно использовать для разработки системы упаковки на основе SaPIbov2, лишенной интегразы.
Бактериальные штаммы:
RN451 представляет собой штамм S. aureus, лизогенизированный бактериофагом ϕ11.
JP2131 представляет собой RN451, который был лизогенизирован SaPIbov2. Смотри Maiques, Е. et al., Role of Staphylococcal Phage and SaPI Integrase in Intra- and Interspecies SaPI Transfer. J. Bacteriol., 2007. 189(15): p. 5608-5616.
JP2488 представляет собой штамм JP2131, в котором ген int был удален из SapIbov2 (SaPIbov2Δint). Maiques, Е. et al., Role of Staphylococcal Phage and SaPI Integrase in Intra- and Interspecies SaPI Transfer. J. Bacteriol., 2007. 189(15): p. 5608-5616.
Бактериофаг:
Бактериофаг ϕ11 можно получить из штамма RN0451 S. aureus посредством способа индукции митомицином С, который был впервые описан в Е. coli и в настоящее время является стандартной методикой для получения профагов из лизогенизированных бактерий. Otsuji, N. et al., Induction of Phage Formation in the Lysogenic Escherichia coli K-12 by Mitomycin C. Nature, 1959. 184(4692): p. 1079-1080.
Промоторы:
PclpB можно использовать в качестве промотора в данном примере. Промотор гена clpB представляет собой конститутивный промотор, используемый для контроля экспрессии гена int. Последовательность промотора гена clpB (PclpB) S. aureus была впервые описана в 2004. Frees, D., et al., Clp ATPases are required for stress tolerance, intracellular replication and biofilm formation in Staphylococcus aureus. Molecular Microbiology, 2004. 54(5): p. 1445-1462. Ее также впервые применили для контроля экспрессии гена в плазмиде в 2004. rnaud, М., A. Chastanet, and М. Debarbouille, New Vector for Efficient Allelic Replacement in Naturally Nontransformable, Low-GC-Content, Gram-Positive Bacteria. Appl. Environ. Microbiol., 2004. 70(11): p. 6887-6891. Промотор можно получать из RN4220 S. Aureus, применяя праймеры, описанные в 2004. Id.
Получение совместного лизогена ϕ11/SaPIbov2Δint (RN451(ϕ11 SaPIbov2Δint)): Штамм JP2488(ϕ11 SaPIbov2Δint) можно получать при лизогенизации JP2488 бактериофагом ϕ11.
Деления terS ϕ11 (RN451(ϕ11ΔterS SaPIbov2Δint)): Штамм RN451(ϕ11ΔterS SaPIbov2Δint) можно получить делецией гена terS ϕ11 из RN451(ϕ11SaPIbov2Δint), как описано в публикации Tormo, М.А. et al., Staphylococcus aureus Pathogenicity Island DNA Is Packaged in Particles Composed of Phage Proteins. J. Bacteriol., 2008. 190(7): p. 2434-2440.
Встраивание PclpB-int в геном S. aureus (RN451(ϕ11ΔterS SaPIbov2Δint PclpB-int)): RN451(ϕ11ΔterS SaPIbov2Δint PclpB-int) можно получить при помощи первоначального слияния PclpB и int посредством стандартных методик молекулярной биологии, затем вводя продукт слияния PclpB-int в геном RN451(ϕ11ΔterS SaPIbov2Δint) и затем, отбирая клоны, которые обладают PclpB-int, встроенным за пределами участков ϕ11 и SaPIbov2.
Получение частиц ϕ11, несущих только конкатемеры SaPIbov2Δint PclpB-int: частицы ϕ11, несущие только конкатемеры SaPIbov2Δint PclpB-int, можно получить при помощи индукции митомицином С RN451(ϕ11ΔterS SaPIbov2Δint PclpB-int), как описано у Otsuji, N. et al., Induction of Phage Formation in the Lysogenic Escherichia coliK-12 by Mitomycin C. Nature, 1959. 184(4692): p. 1079-1080. Клеточный лизат содержит нерепликативные частицы для трандукции, каждая из которых содержит структурные белки бактериофага ϕ11, несущие линейный конкатемер происходящей из GI ДНК.
Специалист в данной области поймет, как конструировать NRTP по изобретению, используя указанные выше материалы и хорошо известные методики молекулярной биологии и генетические методики в данной области.
Пример 4: частицы для трансдукции репортера в отношении SarS на основе terS делеции/комплементации
Ниже представлен пример репортерной системы по SarS на основе репортера-индуктора, которая использует нерепликативную частицу для трансдукции на основе terS делеции/комплементации.
Репортерный ген: Бактериальная люцифераза (luxAB). Гены luxA и luxB происходят из Vibrio harveyi. У них отсутствует транскрипционный промотор и каждый из них содержит свой собственный участок связывания рибосомы.
Промотор гена Spa (Pspa): Промотор гена spa будет использоваться для контроля экспрессии генов luxAB.
Конструирование слитого Pspa-luxAB: Гены luxAB можно подвергать слиянию с последовательностью промотора Pspa, таким образом, что гены luxAB функционально связаны с промотором Pspa.
Конструирование репортерного вектора, экспрессирующего luxAB
Экспрессирующий luxAB репортерный вектор можно конструировать при помощи стандартных молекулярно-биологических методик, встраивая продукт слияния Pspa-luxAB в MCS челночного вектора, изображенного ниже.

Челночный вектор Е. coli/S. Aureu, который несет участки начала репликации S. aureus (рТ181сор-623 repC) и Е. coli (ColE1ori), гены устойчивости к ампициллину (amp) и тетрациклину (tet(M)), ген малой субъединицы терминазы (terS) ϕ11 под контролем конститутивного промотора (PclpB), участок множественного клонирования (MCS) и последовательность терминации транскрипции (ТТ).
Инвентарные номера Genbank для кассетных последовательностей:
J01764 (репликоны рТ181)
M21136 (tetA(M))
Инвентарный номер пока не доступен (PclpB)
AF424781 УЧАСТОК: 16526…16966 (terS)
L09137(amp ColE1 ori)
М62650 (ТТ)
Репродукцию вектора для проведения манипуляций in vitro и для верификации манипуляций можно осуществить при помощи Е. coli Тор 10 и готовый модифицированный вектор можно затем вводить в RN0451ΔterS S. aureus. Частицы для трансдукции, несущие челночный вектор, можно получить из трансформантов RN0451ΔterS посредством способа индукции митомицином С, который был впервые описан в Е. coli в 1959 г. и в настоящее время представляет собой стандартную методику для получения профагов из лизогенизированных бактерий. Otsuji, N., et al., Induction of Phage Formation in the Lysogenic Escherichia coliK-12 by Mitomycin C. Nature, 1959. 184(4692): p. 1079-1080. Затем собирают клеточный лизат, и он содержит нерепликативные частицы для трандукции, каждая из которых содержит структурные белки бактериофага ϕ11, несущие линейный конкатемер плазмидной ДНК, способной выступать в качестве репортерной молекулы в присутствии SarS в целевых клетках S. aureus.
Пример 5: частицы для трансдукции репортера β-лактамазы на основе terS делеции/комплементации
Ниже следует пример репортерной системы по β-лактамазе на основе репортера внутриклеточного фермента, которая использует нерепликативную частицу для трансдукции на основе terS делеции/комплементации.
Репортерный ген: люцифераза Renilla (ruc)
Промотор: Промотор может представлять собой PblaZ. Конститутивный промотор бета-лактамазы можно использовать для запуска экспрессии гена ruc.
Внутриклеточный субстрат: внутриклеточный коэлентеразин-фосфат как описано в Daniel Sobek, J.R., Enzyme detection system with caged substrates, 2007, Zymera, Inc.
Конструирование слитого продукта PblaZ-ruc: Гены ruc можно подвергнуть слиянию с последовательностью промотора PblaZ, так, чтобы гены ruc были функционально связаны с промотором PblaZ.
Конструирование экспрессирующего ruc репортерного вектора: экспрессирующий ruc репортерный вектор можно конструировать при помощи стандартных молекулярно-биологических методик, встраивая продукт слияния PblaZ-ruc в MCS челночного вектора, изображенного выше в разделе V, А, 3), i).
Репродукцию вектора для проведения манипуляций in vitro и для верификации манипуляций можно осуществить при помощи Е. coli Тор 10 и готовый модифицированный вектор можно затем вводить в RN0451ΔterS S. aureus. Частицы для трансдукции, несущие челночный вектор, можно получить из трансформантов RN0451ΔterS посредством способа индукции митомицином С, который был впервые описан в Е. coli в 1959 г. и в настоящее время представляет собой стандартную методику для получения профагов из лизогенизированных бактерий. Otsuji, N., et al., Induction of Phage Formation in the Lysogenic Escherichia coliK-12 by Mitomycin C. Nature, 1959. 184(4692): p. 1079-1080. Затем собирают клеточный лизат, и он содержит NRTP, каждая из которых содержит структурные белки бактериофага ϕ11, несущие линейный конкатемер плазмидной ДНК, способной экспрессировать люциферазу Renilla в жизнеспособных клетках S. aureus в пределах круга хозяев ϕ11.
Пример 6: частицы для трандукции репортера внутриклеточной молекулы на основе terS делеции/комплементации
Ниже следует пример репортерной системы на основе репортера внутриклеточной молекулы, которая использует нерепликативную частицу для трансдукции на основе terS делеции/комплементации.
Промотор: Промотор может представлять собой PblaZ. Конститутивный промотор бета-лактамазы можно использовать для запуска экспрессии гена ruc.
Переключаемый аптамер: Переключаемые аптамеры можно разрабатывать и конструировать, как описано в Samie Jaffrey, J.P., Coupled recognition/detection system for in vivo and in vitro use, 2010, Cornell University.
Флуорофорный субстрат: Соответствующие флуорофорные субстраты в сочетании с указанными выше переключаемыми аптамерами можно разрабатывать и конструировать, как описано в Samie Jaffrey, J.P., Coupled recognition/detection system for in vivo and in vitro use, 2010, Cornell University.
Конструирование слитого продукта PblaZ-SA: Ген SA можно подвергнуть слиянию с последовательностью промотора PblaZ, таким образом, чтобы ген SA был функционально связан с промотором PblaZ.
Конструирование экспрессирующего SA репортерного вектора: Экспрессирующий SA репортерный вектор можно конструировать при помощи стандартных молекулярно-биологических методик, встраивая продукт слияния PblaZ-SA в MCS челночного вектора, указанного выше в примере 4. Репродукцию вектора для проведения манипуляций in vitro и для верификации манипуляций можно осуществить при помощи Е. coli Тор 10 и готовый модифицированный вектор можно затем вводить в RN0451ΔterS S. aureus. Частицы для трансдукции, несущие челночный вектор, можно получить из трансформантов RN0451ΔterS посредством способа индукции митомицином С, который был впервые описан в Е. coli в 1959 г. и в настоящее время представляет собой стандартную методику для получения профагов из лизогенизированных бактерий. Otsuji, N., et al., Induction of Phage Formation in the Lysogenic Escherichia coliK-12 by Mitomycin C. Nature, 1959. 184(4692): p. 1079-1080. Клеточный лизат затем собирают, и он содержит нерепликативные частицы для трандукции, каждая из которых содержит структурные белки бактериофага ϕ11, несущие линейный конкатемер плазмидной ДНК, способной экспрессировать SA в жизнеспособных клетках S. aureus в пределах круга хозяев ϕ11.
Пример 7: репортерная система на основе нерепликативной частицы для трансдукции
Нерепликативные частицы для трансдукции, описываемые выше, можно использовать в репортерной системе для определения наличия жизнеспособных бактерий посредством экспрессии репортерной молекулы (например, luxAB). Когда данная частица для трансдукции вводит репортерный вектор (например, pGW80A0001) в клетку в пределах круга хозяев частицы для трансдукции, клетки, в которых промотор (например, PclpB) распознается транскрипционным аппаратом клеток, способны запускать экспрессию репортерной молекулы в клетке.
Для проверки функционального состояния нерепликативных частиц для трандукции в качестве репортеров для определения наличия клеток S. aureus, разработаны различные анализы репортерного гена MSSA/MRSA. В варианте осуществления нерепликативную частицу для трансдукции создавали из специфичного для S. aureus бактериофага, и встраивали гены бактериальной люциферазы luxAB под контролем конститутивного промотора. Когда нерепликативная частица для трансдукции доставляла репортерную нуклеиновую кислоту в S. aureus, конститутивный промотор запускал экспрессию luxAB, подходящих для репортирования о наличии жизнеспособных S. aureus.
Кроме того, антибиотик цефокситин добавляли до, одновременно или после добавления частиц для трансдукции в образец, содержащий клетки S. aureus. Если клетки не были фенотипически резистентны к цефокситину (то есть, не являлись MRSA), люминесценция снижалась или исчезала, указывая на то, что клетки являлись MSSA. Тем не менее, если клетки фенотипически были резистентны к цефокситину (то есть, являлись MRSA), наблюдали увеличение люминесценции или детектируемый уровень люминесценции, указывающие на то, что клетки являлись MRSA.
Анализ фукционирования гена-репортера жизнеспособных клеток на основе нерепликативной частицы для трансдукции
Анализировали функционирование нерепликативной частицы для трансдукции в качестве репортера. Круг хозяев для трансдукции нерепликативной частицы для трансдукции на основе бактериофага ϕ80α проверяли в 101 клиническом изоляте MRSA. Анализ трансдукции проводили, подвергая культуры каждого бактериального изолята, выращенного в модифицированном TSB, действию клеточного лизата GW24, содержащего нерепликативные частицы для трандукции, и культивируя смесь на твердых средах, содержащих тетрациклин.
В данном примере нерепликативная частица для трансдукции несла селектируемый маркер по тетрациклину. Клетки, трансдуцированные нерепликативными частицами для трандукции, как ожидали, были устойчивы к тетрациклину. Кроме того, трансдукцию проверяли при помощи люминесцентного анализа, подвергая каждый бактериальный изолят в жидкой культуре действию клеточного лизата, содержащего нерепликативные частицы для трандукции и оценивая смеси в отношении люминесцентной активности бактериальной люциферазы после инкубационного периода.
Анализ трансдукции показал, что нерепликативная частица для трансдукции на основе ϕ80α была способна трансдуцировать все из 101 клинического изолята MRSA и ни одного из стафилококков, не являющихся S. aureus.
На фигуре 21 показаны результаты анализа трансдукции, в котором 36 тетрациклин-чувствительных MRSA подвергали действию частиц для трансдукции, несущих pGW80A0001, и затем наносили на планшеты со средой, содержащей 5 мкг/мл тетрациклина. Результаты показали, что все 36 штаммов MRSA росли на среде, содержащей тетрациклин вследствие трансдукции pGW80A0001. Контрольные эксперименты, в которых изоляты MRSA наносили на содержащие тетрациклин среды, не подвергая действию частиц для трансдукции, не показали никакого роста (не показано). Кроме того, выделение плазмиды из трансдуцированных штаммов MRSA демонстрировало восстановление плазмиды pGW80A0001, как подтверждалось при секвенировании выделенной плазмиды. Результаты трансдукции, таким образом, демонстрировали, что участок начала репликации репортерной плазмиды проявлял активность во всех проверяемых изолятах MRSA.
На фигуре 22 иллюстрируется люминесценция, измеренная в 80 клинических изолятах MRSA и 28 клинических изолятах метициллин-чувствительного S. aureus (MSSA), трансдуцированных частицей для трансдукции. В эксперименте культуры MRSA и MSSA растили до оптической плотности 0,1 при 600 нм, и затем 100 мкл культур, выращенных в модифицированном TSB, смешивали с 10 мкл клеточного лизата GW24, содержащего частицы для трансдукции, и дополнительно инкубировали при 37°С на протяжении 4 часов до проведения анализа люминесценции. Измерения люминесценции проводили, добавляя 10 мкл 1 мМ раствора деканаля, альдегида, который запускает люминесцентную реакцию в клетках, экспрессирующих бактериальную люциферазу. Как ожидалось, люминесценцию наблюдали как в MRSA, так и в MSSA, трансдуцированных специфичной для S. aureus нерепликативной частицей для трансдукции. Кроме того, когда цефокситин добавляли в клеточные культуры в то же самое время, когда добавляли частицы для трансдукции, люминесценцию наблюдали в MRSA, но не в MSSA, таким образом, демонстрируя способность частиц для трансдукции быть репортерами как на присутствие MSSA, так и MRSA. Результаты люминесценции, таким образом, демонстрируют, что промотор, запускающий экспрессию luxAB, проявляет активность во всех проверяемых изолятах S. aureus.
Оптимизация анализа MRSA по репортеру жизнеспособности клеток на основе нерепликативной частицы для трансдукции - препарат реагента частицы для трансдукции
Получение и создание препарата реагента нерепликативной частицы для трансдукции оптимизировали для готового препарата. Вкратце, ферментацию в объеме 15 л проводили, используя среды TSB, включая индукцию GW24 пероксидом. Партию для ферментера объемом 15 л инокулировали из 200 мл ночной высеваемой культуры (соотношение инокулята 1,3% (об./об.)). Культуру индуцировали пероксидом водорода при O.D. равной 0,8 и охлаждали до 25°С после индукции без контроля величины рН или DO. Надосадочную жидкость культуры собирали посредством тангенциальной поточной фильтрации (TFF) следующим утром с целью отстаивания фаговых частиц для трансдукции из клеточного дебриса. Вещество затем дополнительно концентрировали и диафильтровали в буфере SM без желатина и хранили при 2-8°С до окончательного стерилизующего фильтрования и хранения.
Подробные сводные данные способа приведены ниже:
Рост в бутыли для высевного материала
(1) Инокулировать 200 мл TSB, содержащего 5 мкг/мл тетрациклина с использованием GW24
(2) Инкубировать при 37°С, 200 об/мин в течение 10-18 часов.
Высевание для ферментации (15 л TSB с 5 мкг/мл тетрациклина)
(1) Подготовить модуль ферментера при следующих ниже условиях ферментации: 37°С, перемешивание при 250 об/мин, обдув воздухом при 15 л/мин и обратное давление при 3 фунт/кв. дюйм (избыточное).
(2) Инокулировать ферментер, используя 200 мл ночной высеваемой культуры.
Индукция культуры
(1) Как только OD при 600 нм достигает 0,8 (0,6-0,9), индуцировать культуру с использованием 0,5 мМ H2O2
(2) Увеличить заданное значение температуры ферментера до 42°С
Условия после индукции и контроль
(1) Как только окончиться 30 минут индукции, установите целевую температуру для ферментера на 25°С
(2) Через один час после охлаждения выключите подачу воздуха к ферментеру и установите перемешивание на ноль
(3) Проверяйте культуру при ферментации с часовым интервалом или чаще по мере необходимости, пока OD при 600 нм не снизится до 0,40 или ниже.
Сбор/очистка
(1) После того, как культура при ферментации достигнет минимума OD600 менее чем или равного 0,40, возьмите 20 мл асептического образца и добавьте 30 мкл бензоназы в ферментер.
(2) Снова установите перемешивание на 250 об/мин предоставьте возможность перемешиваться в течение 60 минут для инкубации с бензоназой.
(3) Очистите образец EOF с использованием центрифугирования в течение 15 минут при 3000 g.
(4) Пропустите очищенное вещество через мембранный фильтр с размером пор 0,45 мкМ
Концентрация и замена буфера
(1) Концентрируйте очищенную культуру посредством TFF, 10-кратно используя мембрану с плоским слоем 500 кДа.
(2) Проведите диафильтрование концентрированной культуры при постоянном объеме в обмен на буфер SM Buffer без желатина, применяя мембрану 500 кДа для TFF, используемую для концентрации
Окончательная фильтрация
(1) Проведите фильтрование концентрированного материала с замененным буфером через фильтр с размером пор 0,2 мкм.
(2) Храните готовый отфильтрованный фаговый материал при 2-8°С.
Можно использовать различные другие реагенты и препараты, как известно специалистам в данной области, чтобы получить препарат.
Оптимизация анализа MRSA по репортеру жизнеспособности клеток на основе нерепликативной частицы для трансдукции - препарат сред для выращивания
Препарат среды для выращивания оптимизировали для анализа по репортеру выживаемости клеток MRSA на основе NRTP. Для того чтобы получить люминесценцию в анализе MRSA на основе NRTP, необходимо сбалансировать среду для роста Staphylococcus aureus и она должна содержать достаточную концентрацию катионов и вспомогательных веществ, чтобы способствовать трансдукции NRTP. Среда TSBmod, используемая в анализах до данного исследования по разработке препарата, как известно, имела проблемы осаждения, которые повлияли на стабильность среды. Для препаратов сред для выращивания требуется стабильность в готовом препарате с заданным показателем 1 год при комнатной температуре.
Способы/процедуры: приготовление клеток для анализа MRSA
(1) Десять уникальных штаммов MRSA для анализа выборки и один уникальный штамм из MSSA тестировали в анализе MRSA.
(2) Ночные культуры выращивали в глубоком 96-луночном планшете при разведении 1:50 в TSB из замороженного маточного раствора для однократного использования и инкубировали при 37°С на круговой качалке в течение >15 часов. MRSA/MSSA (8 мкл) в TSB (392 мкл)
(3) На следующий день выращивали дневную культуру при разведении ночной культуры в соотношении 1:50 в 96-луночном планшете с глубокими лунками (392 мкл TSB+8 мкл клеток) и инкубировали при 37°С на круговой качалке в течение 4 часов.
(4) Клетки центрифугировали в центрифуге в течение 5 минут при мощности 1800 g и 10°С, отработанные среды отбирали аспирацией, не разрушая осадка.
(5) Центрифугированные клетки промывали в 50 мМ Tris-HCl рН 7,2, центрифугировали, отбирали аспирацией буфер, не разрушая осадка и ресуспендировали в 400 мкл RPMI. RPMI использовали для того, чтобы уменьшить вариабельность метаболического состояния клеток и имитировать низкий уровень метаболизма, как обнаружено в клинических образцах.
(6) Планшеты закрывали пленкой с микропорами и инкубировали на платформе в течение 48 ч.
(7) OD считывали, перенося 200 мкл культуры в RPMI в мелколуночный планшет для определения OD и контрольную лунку только со средой RPMI использовали для вычитания OD контроля.
(8) Клетки нормализовали до OD равной 0,1 в 100 мкл
(9) Другое разведение 1:10 было сделано в RPMI для того, чтобы получить OD равную 0,005
Основные среды для анализа готовили для проведения тестирования, как показано в таблице 2, и репрезентативный ряд модификаций сред в препарате для анализа MRSA показан в таблице 3.

В каждый препарат сред добавляли NRTP и цефокситин согласно приведенной ниже таблице 4, чтобы приготовить реагент сред с NRTP:

Анализ MRSA проводили с использованием следующих ниже стадий:
(1) Подготовить к работе аналитический планшет: добавить 198 мкл реагента сред с фагом и 2,0 мкл каждого разведения бактерий при OD равной 0,05 и OD равной 0,005 в RPMI (приблизительно соответствующей 20000 и 2000 КОЕ/мл, соответственно) или 2,0 мкл RPMI в качестве контроля.
(2) Инкубировать аналитический планшет: инкубировать аналитический планшет на круговой качалке при ~100 об/мин в течение 4 часов при 37°С.
(3) Подготовить люминометр (Molecular Devices SpectraMax L): промыть реагентную линию 70% этанолом, после чего DI водой, затем заполнить субстратным реагентом. Настроить программное обеспечение как Fast Kinetic с вводом 50 мкл субстратного реагента при 250 мкл/сек после 10 точек исходной линии и считывать 40 точек каждые 0,25 секунд.
(4) Провести анализ: тестировать планшет с каждым бактериальным разведением после доведения до комнатной температуры в течение 5 минут.
Анализ
(1) Определить пороговое значение, усредняя RLU контроля среди всех повторов и временных точек и добавляя три стандартных отклонения.
(2) Определить максимальную RLU для каждого образца, используя SoftMaxPro.
(3) Определить, не является ли максимальная RLU большей, чем пороговое значение RLU, и если так, то данные по образцу использовали для сравнения эффективности сред.
(4) Нормализовать все максимальные величины RLU к максимальной RLU в TSB M1 (среде, применяемой до начала разработки препарата) для анализируемого штамма при определенном разведении.
(5) Усреднить нормализованные величины RLU по всем штаммам MRSA для определенных сред и их модификаций
(6) Усреднить средние величины для планшетов с двумя разведениями, в конечном счете, получая одно численное значение, отражающее кратность увеличения эффективности, основанного на RLU, определенных сред среди 10 различных штаммов MRSA в 2 тестируемых клеточных разведениях.
Результаты анализа MRSA по репортеру жизнеспособности клеток на основе NRTP
Определение порогового значения RLU: Среднее значение и стандартное отклонение RLU вычисляли для всех временных точек (25) для каждого контрольного повтора (4). Пороговое значение вычисляли для каждого планшета как среднее значение RLU контроля плюс три стандартных отклонения.
Определение относительного улучшения характеристик: максимальные RLU экспортировали из SoftMaxPro для каждого образца (контроли, MSSA и MRSA при всех разведениях) и сравнивали в порогом отсечения RLU. Если для образца имелись 2 точки данных больших, чем пороговое значение для концентрации фага, то для анализа использовали максимальную величину RLU.
Величины нормализовали делением максимальной RLU на максимальную RLU его контрольного состояния (такого как штамм в исходной среде TSB M1, при анализируемом разведении). Полученные соотношения усредняли для 10 MRSA для каждого условия сред и каждого разведения, как показано в таблице 5. Средние значения для двух разведений также показаны в таблице.
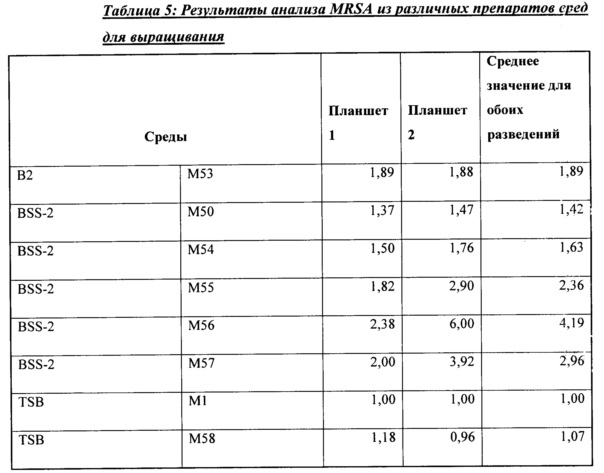
Заключение
BSS2-M56 показала наилучшую эффективность по среднему значению среди различных исследуемых сред. Среды на основе буфера HEPES работали лучше, чем буферные среды с Tris-HCl. HEPES, как известно, является биологически благоприятной буферной системой в отличие от Tris-HCl. Основанная на В2 основа/бульон обладал лучшей эффективностью, чем бульон на основе TSB.
Различные другие реагенты и препараты можно использовать, как известно специалистам в данной области, чтобы получить препарат. Другие подходящие препараты были разработаны посредством схожих экспериментов, как описано выше. Примеры других подходящих препаратов включены ниже в таблицах 6, 7 и 8.
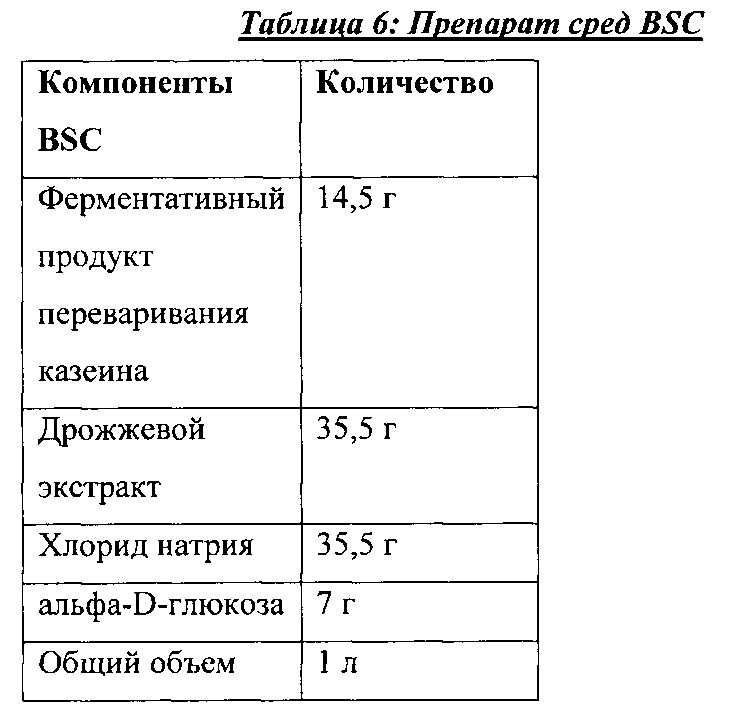


Оптимизация анализа MRSA по репортеру жизнеспособности клеток на основе нерепликативной частицы для трансдукции - препарат субстратного реагента
Для того чтобы получить люминесценцию в анализе MRSA, субстратный реагент должен включать в себя альдегид в качестве субстрата для люциферазы. Первоначально разработанный препарат алифатического альдегида (4,2 мМ тридеканаль в TSB) не был стабилен, и в нем образовывалась гетерогенная эмульсия, а не раствор. Данный пример в общих чертах обрисовывает разработку препарата субстратного реагента, который решает данные проблемы с заданным показателем стабильности в течение 6 месяцев при комнатной температуре или 2-8°С.
Данный пример описывает стадии, которые предпринимали для разработки реагента субстрата для готового препарата.
Способы/процедуры
Все эксперименты скрининга и эксперименты в отношении стабильности проводили, используя «модельную систему», которая состояла из штамма RN4220S. aureus, содержащего экспрессирующую LuxAB плазмиду. Типичные подготовка и способ тестирования представлены ниже.
(1) Ночная культура: 2 мл TSB+1 мкл тетрациклина в концентрации 10 мг/мл+1 колония бактерий модельной системы из планшета с TSA, перемешиваемая при 225 об/мин в течение ночи при 37°С
(2) Дневная культура: разведенная ночная культура в соотношении 1:50 или 1:100 в TSB + 5 мкг/мл тетрациклина, перемешиваемая при 225 об/мин в течение 1,5-2 часов при 37°С.
(3) Нормализовать дневную культуру: измеряли 1 мл дневной культуры на Nanodrop с использованием кюветы при 600 нм, с контролем в виде TSB+5 мкг/мл тетрациклина. Разбавляли до OD равной 0,1 с использованием TSB+5 мкг/мл тетрациклина.
(4) Разбавить культуру для исследования: Разбавляли культуру с OD равной 0,1 с использованием TSB+5 мкг/мл тетрациклина до разведений 1:200, 1:2000 и 1:20000, которые приблизительно соответствуют 100000, 10000 и 1000 КОЕ/мл.
(5) Высевать бактерии: добавляли 200 мкл каждого разведения и контроль (TSB+5 мкг/мл тетрациклина без бактерий) в трех повторах в белый аналитический планшет Greiner Bio-one для каждого субстрата, который было необходимо исследовать.
(6) Подготовить люминометр (SpectraMax L): промыть реагентную линию 70% этанолом, после чего DI водой, затем заполнить субстратом. Настроить программное обеспечение как Fast Kinetic с вводом 50 мкл субстрата при 250 мкл/сек после 10 точек исходной линии и считывать 40 точек каждые 0,25 секунд.
(7) Провести анализ: тестировать каждый препарат субстратных реагентов с использованием промывки и наполнения SpectraMax L после каждого субстрата. Довести все субстратные реагенты до комнатной температуры перед исследованием.
Все подтверждающие эксперименты проверяли, используя анализ MRSA для того, чтобы обеспечить схожие результаты в действительном анализе, поскольку модельная система использовалась при скрининге новых препаратов.
(1) Приготовить культуру: десять низкоэффективных штаммов MRSA и один штамм MSSA выращивали до логарифмической фазы роста в TSB в блоке с глубокими лунками объемом 2 мл. Клетки центрифугировали, промывали 1x PBS, затем ресуспендировали в средах RPMI.
(2) Нормализовать бактерии: провести измерения 200 мкл культуры в RPMI и контроля RPMI в прозрачном планшете Greiner Bio-one на приборе VersaMax при 600 нм. Вычесть OD контроля из результатов для каждого штамма. Нормализовать каждый штамм до OD равной 0,05 в средах RPMI.
(3) Развести бактерии: развести культуру с OD 0,05 в соотношении 1:10 в средах RPMI до OD 0,005.
(4) Приготовить реагент сред с фагами: добавить фаг, цефокситин и пируват натрия к BSS-M56, включая:
a. Цефокситин (5 мкг/мл)
b. Маточный раствор лизата GW24 (0,03Х)
c. Пируват натрия (0,025 М)
(5) Подготовить к работе аналитический планшет = добавить 198 мкл реагента сред с фагом и 2,0 мкл каждого разведения бактерий (OD равная 0,05 и OD равная 0,005 в RPMI, приблизительно соответствующая 20000 и 2000 КОЕ/мл) или 2,0 мкл RPMI в качестве контроля в двух повторах.
(6) Инкубировать аналитический планшет = инкубировать аналитический планшет на круговой качалке при ~100 об/мин (3 скорость) в течение 4 часов при 37°С.
(7) Подготовить люминометр (SpectraMax L) = промыть реагентную линию 70% этанолом, после чего DI водой, затем заполнить субстратом. Настроить программное обеспечение как Fast Kinetic с вводом 50 мкл субстрата при 250 мкл/сек после 10 точек исходной линии и считывать 40 точек каждые 0,25 секунд.
(8) Провести анализ = тестировать каждый препарат субстратных реагентов с использованием промывки и наполнения SpectraMax L после каждого субстрата.
Эксперименты по усовершенствованию препарата субстратного реагента разрабатывали, чтобы улучшить следующие ниже параметры:
(1) Улучшить растворимость, добавляя поверхностно-активные вещества (Tween 20, Triton Х-100, NP-40, Brij-35, SNS и т.д.), добавляя растворителя (этанол, метанол, DMSO и т.д.), добавляя нелетучие масла (касторовое масло)
(2) Улучшить стабильность, добавляя стабилизаторы (триэтаноламин, циклодекстрин и т.д.), добавляя антиоксиданты (витамин Е, ацетат витамина Е, PEG 1000 витамина Е, оксиразу и т.д.), корректировать способ добавления тридеканаля (с поверхностно-активным веществом, с растворителем, в готовый раствор, с антиоксидантом и т.д.), хранение тридеканаля и субстратного реагента в азоте для снижения окисления альдегида, и снижение возможности микробного загрязнения, добавляя консерванты, такие как ProClin, и стерилизующим фильтрованием субстратного реагента.
(3) Улучшить эффективность анализа, корректируя величину рН препарата и величину рН буферной системы
(4) Улучшить общую эффективность посредством определения альдегида с самым высоким результатом RLU (исследовали альдегиды из 6-14 атомов углерода во множественных препаратах, чтобы определить наблюдается ли улучшение растворимости, стабильности и эффективности анализа).
(5) Улучшить общую эффективность, добавляя противовспенивающее средство для того, чтобы снизить пенообразование во время приготовления реагента и добавления реагента к образцу при анализе.
Анализ и результаты
Данные кинетической реакции наносили на график для каждого образца и линию соотносили со средним значением в каждой точке считывания из трех повторов. Типично, результаты показаны при разведении 1:2000 модельной системы бактерий с OD равной 0,1, приблизительно соответствующей 10000 КОЕ/мл или 2000 КОЕ/анализ.
Нормализованную максимальную RLU к максимальной RLU субстратного реагента сравнения анализировали для экспериментов в отношении стабильности. В каждой временной точке для стабильности максимальную RLU для каждого образца нормализовали к максимальной RLU субстрата сравнения. Нормализованную максимальную RLU наносили на график в зависимости от временной точки и линейную регрессию с CI 95% наносили на график. Заключение
Основные параметры, скорректированные исходя из препарата сравнения для получения препарата субстратного реагента, кратко изложены в таблице 9.


Два препарата субстратных реагентов получили для двух разных температур хранения, один - для хранения при 2-8°С и один - при 18-24°С.
Готовые препараты субстратных реагентов, хранящиеся при 2-8°С. Препарат: 0,5% Triton Х-100 + 4,2 мМ тридеканаля + 0,5% ацетат витамина Е + 100 м.д. противовспенивающего средства Y30 + 0,5% триэтаноламин + 82% 0,1 М лимонной кислоты + 18% 0,1 М цитрата натрия @рН3 + 0,05% ProClin 300. Препарат не выпадал в осадок через 1 месяц при 2-8°С и был способен определять штаммы MRSA так же, как и в день 0.
Готовые препараты субстратных реагентов, хранящиеся при 18-24°С. Препарат: 05,% Triton Х-100 + 6,3 мМ тридеканаля + 100 м.д. противовспенивающего средства Y30 + 0,5% триэтаноламин + 82% 0,1 М лимонной кислоты + 18% 0,1 М цитрата натрия @рН3 + 2% а-токоферол-PEG 1000-сукцинат + 0,05% ProClin 300. Препарат не выпадал в осадок через 1 месяц при 18-24°С и был способен определять штаммы MRSA так же, как и в день 0.
Различные другие реагенты и препараты можно использовать, как известно специалистам в данной области, чтобы получить препарат.
Аналитическая эффективность анализа MRSA по репортеру жизнеспособности клеток на основе нерепликативной частицы для трансдукции
Аналитическую эффективность оптимизированного анализа MRSA с NRTP проверяли, включая анализ предела детектирования в исследовании и анализ перекрестной реактивности и нежелательного микробного взаимодействия в анализе, при критической оценке с использованием нецелевых организмов.
А) анализ предела детектирования
Предел детектирования анализа с NRTP оценивали посредством определения наименьшего количества клеток MRSA, представляющих различные штаммы, которые могут произвести сигнал в относительной световой единице (RLU) выше, чем порог, определяемый для контрольных образцов. Штаммы MRSA включали в себя SCCmec I, II, и IV типа, а также штамм MRSA, несущий вариант гена mecA - mecC, - штамм MRSA, который общепринятые разрешенные FDA анализы MRSA при помощи ПЦР не были способны определить.
Следующие ниже основные материалы использовали в исследовании клинической эффективности:
Реагент сред для выращивания: BSS-M56S
Субстратный реагент: готовые препараты субстратных реагентов, которые необходимо хранить при 18-24°С, как описано выше.
Реагент с частицей для трансдукции: основа BSS-M56 с 10 мкг/мл (то есть, 2Х концентрацией) цефокситина и реагент с частицей для трансдукции, как описано выше, в 2Х концентрации.
Протокол исследования LoD:
Ночная культура: Для каждого штамма MRSA и штамма MSSA в качестве отрицательного контроля 2 мл TSB инокулировали колонией штамма, предварительно выращенного в планшетах с TSA. Ночные культуры MRSA содержали 5 мкг/мл цефокситина. Все образцы инкубировали в течение ночи при 37°С во встряхивателе-инкубаторе.
Дневная культура: 20 мкл каждой из ночных культур переносили в новую культуральную пробирку, содержащую 2 мл реагента сред для выращивания.
Инокуляты затем инкубировали при 37°С при встряхивании в течение приблизительно 1 ч 45 мин, пока OD (при 600 нм) не достигала 0,1.
Серийные разведения:
a) 1000 мкл каждого образца распределяли в ряд А 96-луночного планшета с глубокими лунками объемом 2 мл.
b) Оставшиеся ряды (В-Н) затем заполняли 900 мкл реагента сред для выращивания.
c) 10-кратные серийные разведения затем готовили, забирая 100 мкл из ряда А и смешивая их в ряду В и так далее таким образом, чтобы ряд Н содержал образцы из материала ряда А в разведении 10-7.
Пересчет бактериальной загрузки: 5 мкл из каждой лунки ряда Е помещали в планшет с TSA, который затем наклоняли, позволяя капле жидкости распределиться по планшету (для того, чтобы позднее облегчить подсчет колоний). (Ряд Е представляет собой разведение 10-4 из ряда А). Планшеты затем инкубировали в течение ночи при 37°С.
Подготовка к анализу:
a) Лунки белого 96-луночного аналитического планшета заполняли 100 мкл 2х реагента частицы для трансдукции.
b) Затем ряды F и G (то есть, 10-5 и 10-6-кратные разведения ряда А, соответственно) использовали для заполнения лунок 96-луночного аналитического планшета, содержащего реагент с частицей для трансдукции таким образом, чтобы каждый образец был добавлен в четырех повторах.
c) Затем планшет герметично закрывали воздухопроницаемой крышкой и инкубировали в течение 4 часов при 37°С при умеренном встряхивании, 50 об/мин.
В конце 4 часов планшет убирали из инкубатора и сразу же измеряли люминесценцию на приборе SpectraMax L, в который вводили 50 мкл субстратного реагента, и определяли люминесценцию в течение периода времени 1 минута.
Анализ:
Данные по люминесценции от каждого образца наносили на график в виде RLU в зависимости от времени. Контрольные образцы использовали для того, чтобы определить пороговое значение, рассчитанный для всех временных точек контрольных образцов, применяя следующую ниже формулу: (среднее значение RLU контроля + 3* SD RLU контроля).
Среднее значение пика RLU для ввода после субстрата затем получали для каждого образца, для того, чтобы определить образец в наибольшем разведении, для которого получали величину RLU, которая превышала пороговое значение контрольных образцов. Число колониеобразующих единиц (КОЕ) при наибольшем разведении, для которого получали величину RLU, которая превышала пороговое значение контрольных образцов, определяли из исследования по подсчету загрузки, и данное число КОЕ отражалось как LoD в данном исследовании.
Результаты:
LoD для всех исследуемых образцов MRSA, как определили, был ниже 10 КОЕ. В таблице кратко изложены результаты наименьших LoD, полученные в исследовании:

Все исследуемые штаммы MRSA показали в результате менее чем 10 КОЕ, определяемых в анализе с NRTP выше порогового значения, вычисленного по контрольным образцам. Для MSSA не получили величин RLU выше порогового значения контрольных образцов.
Величины RLU показаны при наибольшем разведении, для которого получали величину RLU, которая превышала пороговое значение контрольных образцов, их наносили на график в виде средней величины RLU и стандартного отклонения для исследуемых четырех повторов для каждого образца. Горизонтальная ось представляет собой набор пороговых значений контрольных образцов и число КОЕ для образца, которое получали для каждой точки данных RLU, совмещены с данными. Для всех образцов MRSA получали величины RLU выше порогового значения, в то время как для MSSA - не получали.
Исследование перекрестной реактивности и нежелательного микробного взаимодействия
Проводили исследование перекрестной реактивности и нежелательного микробного взаимодействия. Цель исследования заключалась в том, чтобы проверить ряд бактериальных штаммов, с которыми обычно сталкиваются в клинических образцах и которые, как известно, потенциально находятся в кругу хозяев бактериофага ϕ80α, в анализе MRSA, чтобы увидеть имела ли место перекрестная реактивность или нежелательное микробное взаимодействие данных штаммов с фагом или субстратом, используемым в исследовании.
Проведенные ранее эксперименты с клиническими образцами привели к получению ложноположительных результатов в присутствии Enterococci faecalis и Staphylococcus epidermidis, как показано исходя из наличия синих и белых колоний при нанесении на планшеты с BBL™ CHROMagar™ Staph aureus. Кроме того, Listeria monocytogenes и Listeria innocua могут находиться в инфекционном кругу хозяев или быть проникающими для фага ϕ80α, которые также могут вносить вклад в перекрестную реактивность при анализе MRSA. В исследовании проверяли Enterococci faecalis, Staphylococcus epidermidis, Listeria monocytogenes и Listeria innocua перекрестной реактивности / нежелательного взаимодействия в анализе жизнеспособности MRSA. Каждый штамм проверяли при большом количестве клеток порядка 106, 107 или 108 клеток в анализируемом объеме. Тестирования проводили без добавления лизата GW24, чтобы разрешить проблему, связанную с аутолюминесценцией штаммов.
В эксперименте 1 исследовали различные штаммы (MSSA-S121, NRS# 9- Staphylococcus haemolyticus, NRS # 6- Staphylococcus epidermidis, ATCC 12228-Staphylococcus epidermidis, ATCC 15305- Staphylococcus saprophyticus, ATCC 29212-Enterococcus. faecalis, ATCC 60193-Candida albicans, ATCC 12453-Proteus mirabilis) в отношении люминесценции при большом количестве клеток в нормальных условиях анализа.
Эксперимент 2: подвыборку штаммов, которые являлись люминесцентными в эксперименте 1, повторно анализировали в присутствие различных антибиотиков в различных концентрациях, чтобы погасить фоновую люминесценцию.
Эксперимент 3: Е. faecalis и S32 (MRSA) исследовали с использованием различных препаратов субстратов, разработанных, как описано выше, без лизата GW24 и без инкубации.
Эксперимент 4: АТСС 33090-Listeria innocua и АТСС 19111-Listeria monocytogenes исследовали в отношении фонового сигнала и неспецифической люминесценции и повторно исследовали с использованием различных препаратов субстратов, разработанных, как описано выше, наряду с Е. faecalis и S. epidermidis.
Эксперимент 5: Е. faecalis повторно исследовали с использованием готового препарата субстрата, разработанного, как описано выше.
Препараты субстратных реагентов, тестируемых в данном исследовании, кратко описаны в таблице 10.
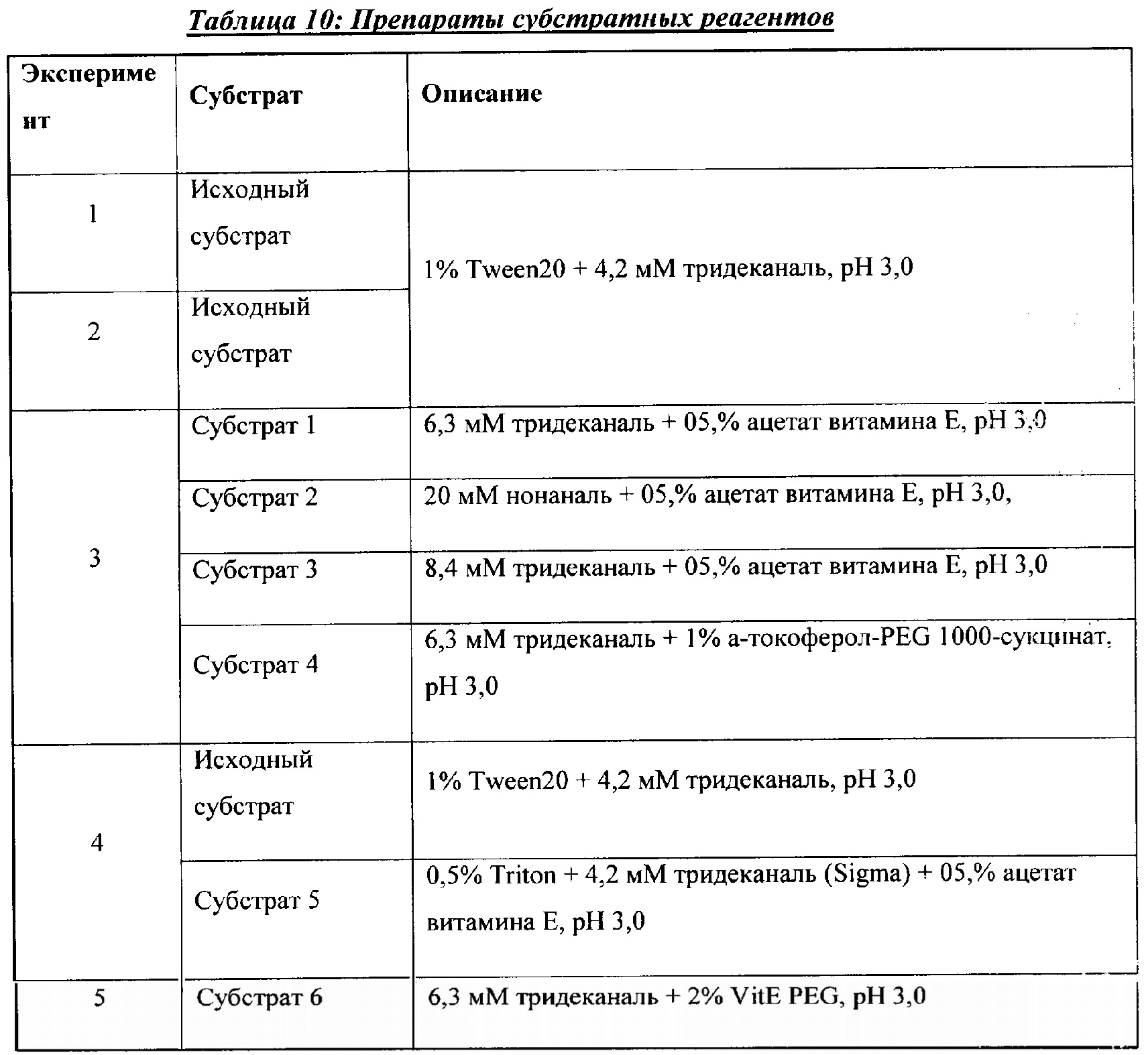
Способы/процедуры:
Ниже следуют стадии, выполненные для анализа MRSA.
A) Выращивание штаммов для экспериментов 1-5
За день до анализа ночную культуру высевали в глубокий 96-луночный планшет при разведении 1:50 в TSB из замороженного маточного раствора для однократного использования и инкубировали при 37°С на круговой качалке в течение >15 часов. Бактерии (8 мкл) в TSB (392 мкл).
Поглощение культуры измеряли на приборе Versamax. TSB был установлен как контроль в шаблоне SoftmaxPro. Оптическую плотность (OD) измеряли при 600 нм.
В день анализа клетки ресуспендировали до OD 0,5 для подготовки к анализам. Получали BSS-M56 для экспериментов 1-5.
B) реагент сред с частицей для трансдукции получали для всех экспериментов 1, 2, 4 и 5 (реагент без частицы для трансдукции использовали в эксперименте 3): 15 мкг/мл цефокситина + маточный раствор лизата GW24, как описано выше, при 30Х.
C) Приготовление образца: различные разведения делали из ночных культур штаммов. Все штаммы разводили BSS М56.
D) Анализ MRSA был проведен для экспериментов 1-5
Среды загружали в присутствии или без фага и цефокситина при концентрации 5 мкг/мл в аналитический планшет. Добавляли 2,5 мкл клеток. Аналитический планшет инкубировали с крышкой для планшета при 37°С на круговой качалке со скоростью, установленной приблизительно при 100 об/мин в течение 4 часов.
Далее, проводили измерения на аналитических планшетах в приборе SpectraMax L со следующими ниже параметрами анализа:
Люминесценция в режиме Fast Kinetic
Считывание 20 временных точек с интервалами в 0,5 секунд. Субстраты вводили при помощи инжектора М в количестве 50 мкл/лунку при 250 мкл/сек, включая 5 считываний исходной линии. Никакой температуры инкубации не устанавливали, и считывание происходило при комнатной температуре.
До начала анализа SpectraMax L наполняли субстратным реагентом.
Результаты анализировали с помощью следующего ниже:
A) Определяли пороговое значение, усредняя RLU контроля по всем повторам и временным точкам и добавляя три стандартных отклонения.
B) Определяли максимальную RLU для каждого образца, используя SoftMaxPro.
C) Определяли, была ли максимальная RLU больше чем пороговое значение RLU, и если так, то данные образца использовали для анализа.
Краткое описание результатов
Эксперимент 1: различные штаммы тестировали в отношении перекрестной реактивности и нежелательного взаимодействия, используя препарат исходного субстрата, из этих проверенных, NRS# 9- S. haemolyticus, NRS # 6- S. epidermidis и E. faecalis ложноположительно тестировали в анализе MRSA.
Эксперимент_2: из трех исследуемых штаммов NRS #9 и Е. faecalis положительно тестировали MRSA с использованием всех исследуемых условий цефокситина. Все три штамма (NRS #9, Е. faecalis, NRS #6) положительно тестировали, когда в анализе не использовали никакого реагента с частицей для трансдукции, указывая на то, что неспецифическая люминесценция не являлась зависимой от реагента с частицей для трансдукции, а скорее зависимой от штамма и субстратного реагента. Carb (карбенициллин) во всех исследуемых концентрациях был эффективен для удаления ложноположительного сигнала.
Эксперимент 3: Е. faecalis давал положительный сигнал без реагента с частицей для трансдукции. Штамм S32 MRSA давал положительный сигнал без реагента с частицей для трансдукции. Данный результат был показателен для субстратного реагента, вызывающего фоновую люминесценцию. Субстрат 4 был эффективен при удалении фонового сигнала в анализе.
Эксперимент 4: Штаммы АТСС 33090 -Listeria innocua, АТСС 19111-Listeria monocytogenes, тестировали в отношении люминесценции с реагентом с частицей для трансдукции и субстратным реагентом, поскольку Listeria sp. Может находиться в кругу хозяев бактериофага, используемого в анализе MRSA. Люминесценцию наблюдали в L. innocua с реагентом и без реагента с частицей для трансдукции, используя препарат исходного субстрата, указывающей на то, что люминесценция была следствием неспецифической реакции, возможно, с субстратом. Субстрат 5 был эффективен при удалении люминесценции в Listeria, но не Е. faecalis.
Эксперимент 5: повторно тестировали Е. faecalis с субстратом 6. В двух независимых прогонах в два разных дня с высокой загрузкой клеток при OD 0,5, анализ привел к получению отрицательных результатов.
Заключение
Исследование перекрестной реактивности демонстрируют фоновую люминесценцию в нескольких бактериальных видах при высокой загрузке. Для выходного излучения не требовалось реагента с частицей для трансдукции и определенные субстратные препараты, использующие фосфатные ионы вносили вклад в неспецифический сигнал. Поскольку не наблюдали никакого выходного излучения в видах с перекрестной реактивностью при использовании реагента с частицей для трансдукции, в случае, когда ϕ80α проникает в виды с перекрестной реактивностью, выходное излучение предотвращается из-за отсутствия активности промотора PclpB S. Aureus, который функционально связан с генами бактериальной люциферазы и/или отсутствия активности участка начала репликации рТ181 S. aureus в данных видах.
Замена буфера с двухосновного фосфата натрия на цитрат натрия и лимонную кислоту убирала фоновую люминесценцию из всех исследуемых видов с перекрестной реактивностью, за исключением Е. faecalis. Субстрат 6 с добавленным ингредиентом α токоферол-PEG 1000-сукцинат устранял оставшийся неспецифический сигнал в Е. faecalis.
Клиническая эффективность анализа MRSA по репортеру клеточной выживаемости на основе нерепликативной частицы для трансдукции - результаты в сравнении с прямым высеванием на CHROMAgar MRSA II
Скрининговое исследование MRSA было разработано, используя экспрессирующие luxAB нерепликативные частицы для трандукции (NRTP) на основе ϕ80α. Анализ состоял из добавления NRTP в клинический образец с подозрением на содержание MRSA, инкубации образца в течение периода из 4 часов при 37°С и затем исследования инкубированных образцов посредством введения альдегида в образец то время как проводилось измерение люминесценции с фотоэлектронным умножителем. Результаты анализа сравнивали с результатами коммерчески доступных хромогенных сред, разработанных для определения MRSA, в качестве эталона сравнения для того, чтобы определить чувствительность и специфичность анализа. Анализ на основе NRTP, как ожидали, хорошо коррелировал с эталоном сравнения на основе культур, поскольку для обоих необходимо присутствие жизнеспособных клеток MRSA и обе зависят от экспрессии фенотипа MRSA. Результаты показали превосходную корреляцию с эталоном сравнения.
Цель исследования заключалась в том, чтобы определить эффективность анализа MRSA на основе NRTP относительно CHROMAgar MRSA II из остатков образцов мазков из носа, собранных с целью скрининга MRSA.
Объем исследования:
Деидентифицированные образцы мазков из носа, собранные у пациентов в целях наблюдения за MRSA клиническим учреждением, тестировали в отношении присутствия MRSA, используя анализ MRSA на основе NRTP, CHROMAgar MRSA II, CHROMAgar SA и Blood Agar TSA посредством прямого высевания и посредством обогащения культуры после высевания. Результаты анализа MRSA на основе NRTP сравнивали с результатами анализа с CHROMAgar MRSA II для того, чтобы вычислить чувствительность и специфичность анализа MRSA на основе NRTP относительно CHROMAgar MRSA II.
Следующие ниже основные материалы использовали в исследовании клинической эффективности:
Реагент сред для выращивания: BSS-M56
Субстратный реагент: готовые препараты субстратных реагентов, которые необходимо хранить при 18-24°С, как описано выше.
Реагент с частицей для трансдукции: основа BSS-M56 с 10 мкг/мл (то есть, 2Х концентрацией) цефокситина и реагент с частицей для трансдукции, как описано выше, в 2Х концентрации.
Способы/процедуры
Описание клинического образца: пробирки для транспортировки образца, содержащие жидкий Amies (220093 - BD BBL™ CultureSwab™ Liquid Amies) предоставляли в клиническое учреждение для сбора деидентифицированных остатков мазков из носа, собираемых клиническим учреждением. До размещения мазков из носа в предоставленные пробирки для транспортировки клиническое учреждение использовало мазок для проведения своего собственного прямого скрининга MRSA в культуре, делая посев мазка штрихом на культуральный планшет. Более конкретно, образцы из ноздрей собирали по внутренней стандартной процедуре клинического учреждения и используя стандарты сбора мазков клинического учреждения. Клиническое учреждение затем проводило скрининг непосредственно в культуре с использованием мазка. Оставшийся тампон на стержне для сбора мазка затем добавляли в пробирку для переноса образца, в которой кончик тампон на стержне с мазком погружали в буфер Amies в пробирке для переноса образца. Затем образцы хранили при комнатной температуре в течение периода 2-24 часов до дальнейшей обработки.
Манипуляции с образцом: После получения образцы хранились в течение ночи при комнатной температуре в боксе микробиологической безопасности вертикально, чтобы гарантировать погружение тампона на стержне с мазком в буфер Amies в пробирке для переноса образца. После хранения в течение ночи образцы далее обрабатывали следующим ниже образом.
Приготовление клинического образца
Используя пипетку объемом 1 мл, 300 мкл реагента сред для выращивания добавляли в пробирки фирмы Falcon объемом 15 мл.
Тампон на стержне из оставшихся мазков из носа удаляли из первоначальной пробирки для транспортировки и помещали в реагент сред для выращивания в соответствующую в пробирку фирмы Falcon. Содержимое тампона на стержне затем смывали в реагенте сред для выращивания в пробирке фирмы Falcon, перекатывая его назад и вперед в реагенте среды для выращивания 4-6 раз. Тампон на стержне затем помещали обратно в первоначальную пробирку для транспортировки и хранили при 2-3°С до конца исследования, в то время как смытые клинические образцы в пробирке фирмы Falcon переносили в пробирки объемом 1,5 мл и хранили при комнатной температуре до дальнейшей обработки.
Проведение анализа MRSA с NRTP: следующие ниже образцы загружали непосредственно в белый 96-луночный аналитический планшет.
Клинические образцы: 100 мкл смытого материала из каждого клинического образца в одном повторе.
Положительный контроль MRSA: 2 мкл тщательно перемешенной культуры известного изолята MRSA при OD 0,1 в 98 мкл реагента сред для выращивания в трех повторах.
Отрицательный контроль MSSA: 2 мкл тщательно перемешенной культуры известного изолята MSSA при OD 0,1 в 98 мкл реагента сред для выращивания в трех повторах.
Контроли: 100 мкл реагента сред для выращивания в трех повторах.
К каждому образцу добавляли 100 мкл реагента с частицей для трансдукции. Затем аналитический планшет помещали в инкубатор, установленный на 37°С, встряхивая на круговой качалке в течение 4 часов. В конце 4 часов, планшет удаляли из инкубатора и сразу же измеряли люминесценцию на SpectraMax L, в который вводили 50 мкл субстратного реагента и определяли люминесценцию в течение периода времени 1 минута.
Высевание бактерий для подсчета КОЕ в клинических образцах: каждый смытый клинический образец высевали для того, чтобы определить число бактериальных колоний на CHROMAgar MRSA II, CHROMAgar SA и Blood Agar (TSA II) посредством прямого и обогащенного культивирования, как указано ниже. Число КОЕ организмов определяли при прямом высевании. Число КОЕ MRSA определяли, высевая на CHROMAgar MRSA II. Число КОЕ S. aureus КОЕ определяли, высевая на планшет с CHROMAgar SA. Число КОЕ любого организма, чей рост поддерживается КОЕ Blood Agar TSA, определяли, высевая на Blood Agar TSA. В случае, когда прямое высевание не приводило к появлению колоний из-за того, что загрузка организмов была ниже предела детектирования используемого планшета, также проводили обогащение образца, инкубируя часть смытого клинического образца в TSB в течение ночи при 37°С при встряхивании и затем снова высевая обогащенную культуру на CHROMAgar MRSA II. Все планшеты инкубировали в течение 20-24 часов при 37°С. После инкубации регистрировали число КОЕ любых колоний, появившихся на каждом планшете.
Анализ: присутствие и загрузку КОЕ MRSA, S. aureus и всех микроорганизмов в пересчете на смытый клинический образец вычисляли на основе числа КОЕ, полученного на CHROMAgar MRSA II, CHROMAgar SA и Blood Agar TSA, соответственно.
Анализ исследования с NRTP: данные каждого образца наносили на график в виде RLU в зависимости от времени.
Определение порогового значения: пороговое значение для анализа рассчитывали по всем временным точкам для контрольных образцов, используя следующую ниже формулу: (среднее значение RLU контроля + 3* SD RLU контроля).
Определение MRSA-положительного образца: RLU каждой временной точки после введения субстрата, как определяли, было выше или ниже порогового значения в анализе. Ели две или более точек данных после введения были выше порогового значения в анализе, то образец рассматривали как «MRSA-положительный».
Результаты: MRSA-положительные результаты анализа с NRTP сравнивали с MRSA-положительными результатами прямого высевания и высевания обогащенной культуры на CHROMAgar MRSA II. Следующие ниже вычисления проводили для того, чтобы определить чувствительность и специфичность анализа с NTRP по сравнению с CHROMAgar MRSA II.
• Истинно положительный (TP)

• Истинно отрицательный (TN)

• Ложно положительный (FP)

• Ложно отрицательный (FN)

• Чувствительность=TP/(TP+FN)
• Специфичность=TN/(TN+FP)
Результаты в сравнении с прямым высеванием на CHROMAgar MRSA II
В таблице 11 показаны следующие ниже результаты, которые были получены при сравнении анализа с NRTP относительно прямого высевания на CHROMAgar MRSA II.

На основании указанных выше данных чувствительность и специфичность анализа в сравнении с прямым высеванием на CHROMAgar MRSA II, как вычислили, составляла:
Чувствительность = 100%
Специфичность = 92%
Клиническая эффективность анализа MRSA по репортеру клеточной выживаемости на основе нерепликативной частицы для трансдукции - результаты в сравнении с обогащающим культивированием с последующим высеванием на CHROMAgar MRSA II
На основании результатов в сравнении с прямым высеванием на CHROMAgar MRSA II, все клинические образцы повторно тестировали в сравнении с обогащенной культурой с последующим высеванием на CHROMAgar MRSA II. Мотивация для последующего тестирования была основана на возможности того, что ложноположительные результаты, при сравнении с прямым высеванием на самом деле могут быть истинно положительными, что было определено при анализе с NRTP, но, возможно, было пропущены при прямом высевании. Часть оставшихся образцов мазка повторно тестировали посредством анализа с NRTP, как описано выше. Другую часть оставшихся смытых образцов мазка также тестировали посредством обогащающего культивирования с последующим высеванием на CHROMAgar MRSA II. Тестирование обогащающего культивирования состояло из добавления 100 мкл оставшегося смытого материала мазка в 2 мл TSB и инкубирования при 37°С при встряхивании в течение периода 18-24 часов. Полученные культуры затем высевали штрихом на CHROMAgar MRSA II для того, чтобы определить присутствие MRSA в культуре. В таблице 12 просуммированы данные из обоих анализов с прямым высеванием и обогащением с последующим высеванием - показаны только те образцы, для которых получили MRSA-положительный результат либо в анализе с NRTP, либо на CHROMAgar MRSA II.
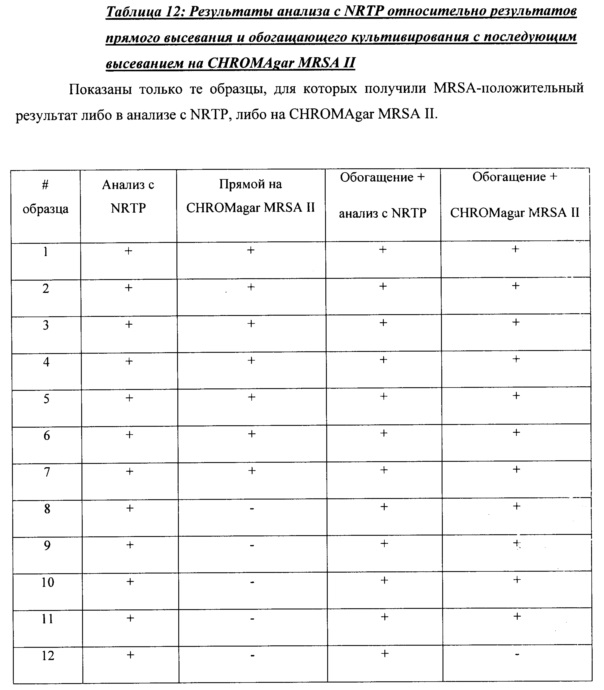
В таблице 13 показаны следующие ниже результаты, которые были получены при сравнении анализа с NRTP относительно обогащенной культуры клинических образцов с последующим высеванием на CHROMAgar MRSA II.
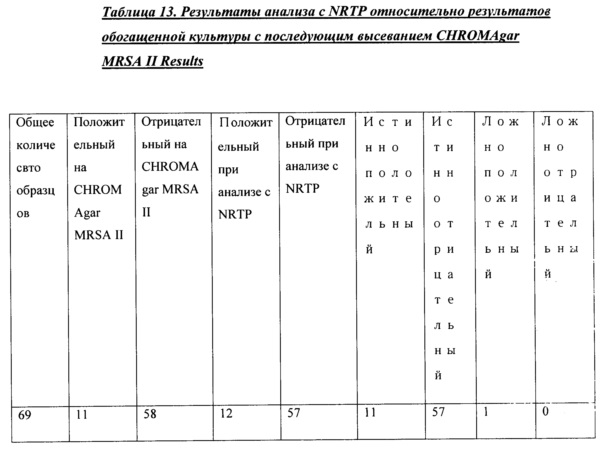
На основании указанных выше данных чувствительность и специфичность анализа в сравнении обогащающим культивированием с последующим высеванием на CHROMAgar MRSA II, как вычислили, составляла:
- Чувствительность = 100%
- Специфичность = 983,%
Пример 8: анализ на основе NRTP для тестирования антимикробной чувствительности - корреляция минимальной ингибирующей концентрации с выходной люминесценцией
В другом примере анализ чувствительности S. aureus к цефокситину был разработан для определения минимальной ингибирующей концентрации цефокситина, необходимой для ингибирования роста устойчивого к цефокситину S. aureus. В отличие от анализа устойчивости MRSA к цефокситину, как описано выше, который позволяет различить чувствительные к цефокситину от устойчивого к цефокситину S. aureus, анализ чувствительности MRSA к цефокситину в данном примере описывает разработку анализа для определения минимального количества цефокситина, необходимого для ингибирования роста S. aureus в присутствие цефокситина.
Следующие ниже основные материалы использовали в исследовании клинической эффективности:
Реагент сред для выращивания: BSS-M56S
Субстратный реагент: готовые препараты субстратных реагентов, которые необходимо хранить при 18-24°С, как описано в примере 7.
Реагент с частицей для трансдукции: основа BSS-M56 с 10 мкг/мл (то есть, 2Х концентрацией) цефокситина и реагент с частицей для трансдукции, как описано в примере 7, в 2Х концентрации. Протокол исследования MIC.
Ночная культура: для каждого штамма MRSA (NRS35 и S7) и штамма отрицательного контроля MSSA (MSSA121) 2 мл TSB инокулировали колонией штамма, предварительно выращенного на планшетах с TSA. Ночные культуры MRSA включали в себя 5 мкг/мл цефокситина. Все образцы инкубировали в течение ночи при 37°С во встряхивателе-инкубаторе.
Дневная культура: 20 мкл каждой из ночных культур переносили в новую культуральную пробирку, содержащую 2 мл реагента сред для выращивания. Затем инокуляты инкубировали при 37°С при встряхивании в течение приблизительно 1 ч 45 мин, пока OD (600 нм) не достигнет 0,1.
Определение MIC посредством высевания:
a) Каждую из дневных культур высевали штрихом в планшеты с TSA, содержащих цефокситин в концентрации 4, 8, 16, 32, 64, и 128 мкг/мл.
b) Планшеты инкубировали в течение 18 часов при 37°С, чтобы определить рост.
Подготовка к анализу с NRTP:
а) Лунки белого 96-луночного аналитического планшета заполняли 100 мкл 2х реагента с частицей для трансдукции.
b) Для каждой из дневных культур пять лунок затем заполняли 100 мкл дневной культуры.
c) Для каждой из дневных культур добавляли цефокситин в одну лунку так чтобы концентрация цефокситина в лунке составляла 4, 8, 16, 32, 64 и 128 мкг/мл.
d) Затем планшет герметично закрывали воздухопроницаемой крышкой и инкубировали в течение 4 часов при 37°С при умеренном встряхивании, 50 об/мин.
В конце 4 часов планшет убирали из инкубатора и сразу же измеряли люминесценцию на приборе SpectraMax L, в который вводили 50 мкл субстратного реагента, и определяли люминесценцию в течение периода времени 1 минута.
Анализ:
Максимальную величину люминесценции после добавления субстратного реагента для каждого образца наносили на график. Величины RLU образца MSSA использовали для того, чтобы определить пороговое значение, рассчитанное, используя следующую ниже формулу: (среднее значение RLU MSSA + 3* SD RLU MSSA).
Результаты:
На фигуре 23 показаны результаты роста S. aureus при концентрации цефокситина 4, 8, 16, 32, 64 и 128 мкг/мл. На фигуре 24 показаны величины RLU, полученные в анализе с NRTP в присутствие 4, 8, 16, 32, 64 и 128 мкг/мл цефокситина. Х-ось на фигуре 24 представляет собой ряд величин порогового значения RLU MSSA.
Как можно увидеть на фигуре 23, MRSA NRS25 демонстрирует MIC 128 мкг/мл цефокситина, в то время как MRSA S7 демонстрирует MIC 64 мкг/мл цефокситина. Соответственно, MRSA NRS25 демонстрирует люминесценцию заметно выше порогового значения RLU MSSA для концентрации цефокситина вплоть до 64 мкг/мл цефокситина, в то время как MRSA S7 демонстрирует люминесценцию выше порогового значения RLU MSSA для концентрации цефокситина вплоть до 32 мкг/мл.
Основываясь на указанных выше данных в анализе с NRTP демонстрируют, что величины RLU, получаемые при анализе, коррелируют с результатами MIC и, таким образом, анализ с NRTP можно использовать для разработки анализов чувствительности к антибиотикам.
Пример 9: анализ по репортерному транскрипту: механизм конформационного изменения посредством блокирующей RBS цис-репрессии трансляции Luxab, активированной транскриптом гена mecA Mrsa
Как описано выше, репортерный транскрипт можно сконструировать таким, образом, чтобы трансляция последовательности репортерного гена блокировалась цис-репрессией участка связывания рибосомы (RBS) репортерного гена.
Следующие ниже средства использовали для конструирования репортерных транскриптов по изобретению.
1) Вторичную структуру РНК рассчитывали, используя программу для вторичной структуры, такую как Mfold (http://mfold.rna.albany.edu/?q=mfold/RNA-Folding-Form).
2) Межмолекулярные взаимодействия РНК рассчитывали, используя программное обеспечение, такое как InterACTion для предсказания взаимодействия РНК-РНК, используя интегральное программирование (RactIP) (http://rna.naist.ip/ractip/).
3) Вторичную структуру РНК визуализировали, используя приложение для визуализации РНК (VARNA) (http://varna.lri.fr/).
На фигуре 25 показана вторичная структура транскрипта mecA, полученная на основе конформации с наименьшей энергией, рассчитанной при помощи MFold и визуализированной при помощи VARNA. Терминальная петля 23 (Т23) содержит последовательность YUNR UUGG, состоящую из оснований 1487-1490 последовательности транскрипта mecA. Анализ вторичной структуры транскрипта гена mecA выявил несколько участков оцРНК, которые подходят для конструирования цис-репрессированного репортера luxAB, который можно дерепрессировать посредством взаимодействий репортера и участка оцРНК.
Как подробно показано на фигуре 26, терминальная петля 23 (Т23) транскрипта mecA содержит консенсусную последовательность YUNR. Консенсусная последовательность YUNR (пиримидин-урацил-нуклеотид-пурин), как было показано, является особо важной мишенью для межмолекулярных комплексов РНК в природных системах. Цис-репрессирующая последовательность конструировали так, чтобы образовалась структура типа «стебель - петля» с RBS репортерной последовательности, такой что цис-репрессирующая последовательность блокирует связывание РНК-полимеразы с RBS репортерной последовательности. Репортерную последовательность подвергали действию связывания петли цис-репрессирующей структуры типа «стебель - петля» с Т23 транскрипта mecA.
Как показано на фигуре 27, цис-репрессирующую последовательность 2701 добавляли к 5'-концу генов luxAB и конструировали так, чтобы образовалась структура типа «стебель - петля», которая блокирует последовательность RBS («AAGGAA») 2702 гена luxA. Цис-репрессирующая структура типа «стебель - петля» блокирует последовательность RBS luxA («AAGGAA»), как предсказывали на основе конформации с наименьшей энергией транскрипта luxAB, включающего в себя цис-репрессирующую последовательность на 5'-конце транскрипта luxAB, как рассчитано при помощи MFold и визуализировано при помощи VARNA.
Первые 61 нуклеотидов цис-репрессированных генов luxAB показаны на ФИГ. 7, вплоть до инициирующего кодона AUG гена luxA. Последовательность RBS «AAGGAA» включает в себя основания 47-52. Данную терминальную петлю репортерного транскрипта конструировали так, чтобы происходило взаимодействие (связывание) с терминальной петлей 23 (Т23) транскрипта mecA, которая содержит последовательность YUNR.
Терминальную петлю цис-репрессирующей последовательности конструировали так, чтобы происходило взаимодействие с Т23 транскрипта mecA, так, чтобы гибридизация цис-репрессированного транскрипта luxAB и транскрипта mecA при взаимодействии петли из цис-репрессирующей структуры типа «стебель - петля» и Т23 транскрипта mecA приводило к воздействию на RBS гена luxA. На фигуре 28 показаны предсказанные межмолекулярные взаимодействия между последовательностью Т23 mecA и цис-репрессирующей последовательностью транскрипта luxAB, рассчитанные при помощи RactIP и визуализированные при помощи VARNA. Линии обозначают спаривание оснований между транскриптом mecA и цис-репрессированным транскриптом luxAB. Взаимодействие между двумя последовательностями приводит к воздействию на последовательность RBS luxA AAGGAA и, таким образом, дерепрессированию репортера luxAB.
Пример 10: анализ по репортерному транскрипту: Способы определения целевых транскриптов или генов, используя репортерную систему mecA-luxAB
В другом примере предлагается способ определения целевого гена mecA, используя репортерную систему mecA-luxAB. Здесь, mecA представляет собой целевой транскрипт, и luxAB представляет собой репортерную молекулу.
1. Создание репортенрной конструкции
Вектор, содержащий репортерную конструкцию, кодирующую luxAB, можно конструировать при помощи стандартных молекулярно-биологических методик, встраивая репортерную конструкцию в челночный вектор, способный размножаться и в Е. Coli, и в S. aureus. Вектор может содержать участок начала репликации, который является функциональным в Е. coli, и селективный маркер, который экспрессируется в Е. coli и подходит для осуществления роста клеток Е. coli, трансформированных вектором и растущих при селектирующих условиях. Вектор также может содержать участок начала репликации, который является функциональным в S. aureus и селективный маркер, который экспрессируется в S. aureus и подходит для осуществления роста клеток Е. coli, трансформированных вектором и растущих при селектирующих условиях. Репродукцию вектора для проведения манипуляций in vitro и для верификации манипуляций можно осуществить при помощи подходящего лабораторного клонированного штамма Е. coli и готовый модифицированный вектор можно затем вводить в штаммы S. aureus.
Репортерную конструкцию можно сначала вводить в клетку S. aureus для транскрибирования конструкции и получения репортерного транскрипта.
2. Конструирование иис-репрессированного репортерного транскрипта
Предлагаются способы конструирования цис-репрессированного репортерного транскрипта, который может связываться с целевым транскриптом mecA. Репортерный транскрипт можно конструировать при помощи стандартных молекулярно-биологических методик. Гены luxA и luxB служат в качестве репортерных генов и могут происходить из Vibrio harveyi. В генах отсутствует транскрипционный промотор, и каждый ген содержит свой собственный участок связывания рибосомы (RBS). Когда оба гена luxA и luxB транслируются в клетке, комплекс белков luxA и luxB может образовывать активный фермент люциферазу (LuxAB). Смотри Farinha, М.А. and A.M. Kropinski, Construction of broad-host-range plasmid vectors for easy visible selection and analysis of promoters. J. Bacteriol., 1990. 172(6): p. 3496-3499.
Цис-репрессирующую последовательность можно располагать против хода транскрипции генов luxAB и по ходу транскрипции промотора, и она включает в себя последовательность, которая комплементарна RBS luxA. Последовательность линкера может отделять комплементарные участки цис-репрессирующей последовательности и последовательности luxA. После транскрипции вектора комплементарные участки цис-репрессирующей последовательности и последовательность RBS luxA образуют комплекс, создавая структуру типа «стебель - петля», которая предотвращает присоединение рибосомы и, таким образом, трансляцию.
Структура типа «стебель - петля» репортерного транскрипта конструируют для дестабилизации и образования открытого комплекса, когда он взаимодействует с встречающейся в природе последовательностью транскрипта mecA (эндогенной для клетки). Для того чтобы активировать трансляцию последовательности гена luxA, природный транскрипт mecA служит в качестве транс-активирующей РНК, которая связывается с цис-репрессированным репортерным транскриптом и открывает ингибирующую структуру типа «стебель - петля», которая блокирует RBS гена luxA. Как только RBS не блокируется цис-репрессирующей последовательностью, может происходить трансляция luxA. Транскрипцию репортерной конструкции проводят посредством функционального связывания репортерной последовательности с конститутивным промотором против хода транскрипции цис-репрессирующей последовательности.
Пример последовательности гена-мишени mecA показан на фигуре 29. Последовательность представляет собой последовательность ДНК локусов гена mecA (из Staphylococcus aureus subsp. aureus SA40, полный геном в GenBank: СР0036041,; SEQ ID №15) и ее можно использовать для получения репортерной конструкции, содержащей репортерную последовательность и цис-репрессирующую последовательность. Показаны -10 позиция 2901, позиция инициации транскрипции 2902, RBS 2903, кодирующий участок (в сером 904) и последовательность терминации транскрипции 2905.
На фигуре 30 показана иллюстративная последовательность транскрипта mecA, которую можно использовать для конструирования репортерного транскрипта (SEQ ID №16) согласно варианту осуществления по изобретению. Для mecA показаны RBS 3001 и кодирующая последовательность 3002.
Фигура 31 представляет собой пример последовательности ДНК локусов гена luxAB, которую можно использовать для конструирования репортерного транскрипта согласно варианту осуществления по изобретению. Последовательность ДНК локусов гена luxAB получали из генов Vibrio fischeri luxA и luxB для альфа- и бета-субъединиц люциферазы (GenBank: Х06758.1) (SEQ ID №17). Показаны -10 позиция 3101, позиция инициации транскрипции 3102, RBS для luxA 3103, кодирующая последовательность luxA 3104 (ретуширование серым тоном), RBS для luxB 3105 и кодирующая последовательность luxB (ретуширование серым тоном) 3106.
Фигура 32 представляет собой пример последовательности транскриита luxAB, которую можно использовать для конструирования репортерного транскрипта (SEQ ID №18). Показаны RBS для luxA 3201, кодирующая последовательность luxA 3202 (ретуширование серым тоном), RBS для luxB 3203 и кодирующая последовательность luxB (ретуширование серым тоном) 3204.
Фигура 33 представляет собой пример последовательности цис-репрессированного транскрипта luxAB, которую можно использовать в репортерном транскрипте (SEQ ID №19). Показаны цис-репрессирующая последовательность (прямоугольник с пунктирной линией) 3301, RBS для luxA 3302, кодирующая последовательность luxA 3303 (ретуширование серым тоном), RBS для luxB 3304 и кодирующая последовательность luxB (ретуширование серым тоном) 3305.
3. Способы определения наличия или отсутсвия целевого транскрипта mecA, используя репортерный транскрипт
Предлагаются примеры определения присутствия или отсутствия целевого транскрипта mecA в клетке с использованием репортерных транскриптов по изобретению. На фигуре 34 показан пример клетки, содержащей вектор 3400, который кодирует репортерный транскрипт 1410, где не существует эндогенного транскрипта mecA в клетке 3401 (например, геном клетки не содержит ген mecA). В данном случае цис-репрессирующая последовательность 3420 связывается с RBS 3430 генов luxAB. В некоторых вариантах осуществления цис-репрессирующая последовательность 3420 может связываться с частью или всем RBS гена luxA, RBS гена luxB, или и тем, и другим. Данное событие связывания блокирует и предотвращает трансляцию генов luxAB, и репортерная молекула (например, люцифераза) не продуцируется 6 клетке. Таким образом, не определяется никакого сигнала, указывая на отсутствие гена mecA в клетке.
В другом примере клетки содержат эндогенный транскрипт mecA (например, геном клетки содержит ген mecA). На фигуре 35 показан вектор 3400, встраиваемый в клетку 3401. Вектор 3400 кодирует репортерный транскрипт 3410, который включает в себя цис-репрессирующую последовательность 3420 и репортерную последовательность (гены luxA и luxB). Когда транскрипт mecA 3510, присутствующий в клетке, связывается с цис-репрессирующей последовательностью 1420, ингибирующая петля шпильки открывается и RBS 3430 для гена luxA становится доступной для воздействия. Трансляция репортерной последовательности (luxA и luxB) может произойти, приводя к образованию фермента luxAB 3520. Фермент luxAB 3520 позволяет получить детектируемый люминесцентный сигнал 3530. Таким образом, вектор с репортерным транскриптом 3400 отражает присутствие эндогенных транскриптов mecA 3510 в клетке 3401.
В то время как изобретение особенным образом показано и описано со ссылкой на предпочтительный вариант осуществления и различные альтернативные варианты осуществления, специалисту в соответствующей области будет понятно, что различные изменения в форме и деталях можно сделать в настоящем документе, не отступая от сущности и объема изобретения.
Все ссылки, выданные патенты и патентные заявки, цитируемые в текста настоящей заявки, включены, таким образом, в качестве ссылки в полном объеме, во всех смыслах.
СПИСОК ИСПОЛЬЗОВАННОЙ ЛИТЕРАТУРЫ
1. Michael G. Schmidt, D.A.S., Caroline Westwater, Joseph W. Dolan, Brian D. Hoel, Philip A. Werner, James S. Norris, Laura M. Kasman, Nucleic Acid Delivery and Expression, 2005.
2. Kreiswirth, B.N. et al., The toxic shock syndrome exotoxin structural gene is not detectably transmitted by a prophage. Nature, 1983. 305(5936): p. 709-712.
3. Ubeda, C. et al., Specificity of staphylococcal phage and SaPI DNA packaging as revealed by integrase and terminase mutations. Molecular Microbiology, 2009. 72(1): p. 98-108.
4. Otsuji, N. et al., Induction of Phage Formation in the Lysogenic Escherichia coliK-12 by Mitomycin C. Nature, 1959. 184(4692): p. 1079-1080.
5. Brantl, S. (2007) Regulatory mechanisms employed by cis-encoded antisense RNAs. Curr. Opin. Microbiol. 10, 102-109.
6. Isaacs, F.J. et al. (2004) Engineered riboregulators enable post-transcriptional control of gene expression. Nat. Biotechnol. 22, 841-847.
7. Pfeiffer, V. et al. (2009) Coding sequence targeting by MicC RNA reveals bacterial mRNA silencing downstream of translational initiation. Nat. Struct. Mol. Biol. 16, 840-846.
8. Opdyke, J.A. et al. (2004) GadY, a small-RNA regulator of acid response genes in Escherichia coli. J. Bacteriol. 186, 6698-6705.
9. Carriere, C, et al., Conditionally replicating luciferase reporter phages: Improved sensitivity for rapid detection and assessment of drug susceptibility of Mycobacterium tuberculosis. Journal of Clinical Microbiology, 1997. 35(12): p. 3232-3239.
10. Merten, O.-W. and M. Al-Rubeai, Viral Vectors for Gene Therapy: Methods and Protocols. Methods in Molecular Biology. Vol. 737. 2011.
11. Lofdahl, S., J.E. Sjostrom, and L. Philipson, CLONING OF RESTRICTION FRAGMENTS OF DNA FROM STAPHYLOCOCCAL BACTERIOPHAGE-PHI-11. Journal of Virology, 1981. 37(2): p. 795-801.
12. Charpentier, E., et al., Novel Cassette-Based Shuttle Vector System for Gram-Positive Bacteria. Appl. Environ. Microbiol., 2004. 70(10): p. 6076-6085.
13. Novick, R.P., I. Edelman, and S. Lofdahl, Small staphylococcus-auerusplasmids are transduced as linear multimers that are formed and resolved by replicative processes. Journal of Molecular Biology, 1986. 192(2): p. 209-220.
14. Westwater, С., et al., Development of a P1 phagemid system for the delivery of DNA into Gram-negative bacteria. Microbiology, 2002. 148(4): p. 943-950.
15. Norris, J.U., et al., Tissue-Specific and Pathogen-Specific Toxic Agents and Ribozymes. 1999.
16. Maiques, E., et al., Role of Staphylococcal Phage and SaPI Integrase in Intra- and Interspecies SaPI Transfer. J. Bacteriol., 2007. 189(15): p. 5608-5616.
17. Frees, D., et al., Clp ATPases are required for stress tolerance, intracellular replication and biofilm formation in Staphylococcus aureus. Molecular Microbiology, 2004. 54(5): p. 1445-1462.
18. Arnaud, M., A. Chastanet, and M. Debarbouille, New Vector for Efficient Allelic Replacement in Naturally Nontransformable, Low-GC-Content, Gram-Positive Bacteria. Appl. Environ. Microbiol., 2004. 70(11): p. 6887-6891.
19. Tormo, M.A., et al., Staphylococcus aureus Pathogenicity Island DNA Is Packaged in Particles Composed of Phage Proteins. J. Bacteriol., 2008. 190(7): p. 2434-2440.
20. Arthur, M., et al., The VanS sensor negatively controls VanR-mediated transcriptional activation of glycopeptide resistance genes of Tn1546 and related elements in the absence of induction. J. Bacteriol., 1997. 179(1): p. 97-106.
21. Karlsson, S., et al., Expression of Clostridium difficile Toxins A and В and Their Sigma Factor TcdD Is Controlled by Temperature. Infect. Immun., 2003. 71(4): p. 1784-1793.
22. Daniel Sobek, J.R., Enzyme detection system with caged substrates, 2007, Zymera, Inc.
23. Sarnie Jaffrey, J.P., Coupled recognition/detection system for in vivo and in vitro use, 2010, Cornell University.
24. Good, L., Translation repression by antisense sequences. Cellular and Molecular Life Sciences, 2003. 60(5): p. 854-861.
25. Samine, В., Antisense-RNA regulation and RNA interference. Biochimica et Biophysica Acta (BBA) - Gene Structure and Expression, 2002. 1575(1-3): p. 15-25.
Реферат
Изобретение относится к биохимии и вирусологии и касается способов и системы для упаковки репортерных молекул нуклеиновых кислот в нерепликативные трансдукторные частицы для использования в качестве репортерных молекул. Упаковочная система бактериальной клетки для упаковки репортерной молекулы нуклеиновой кислоты в нерепликативную содержит лизогенизированный геном бактериофага, не содержащий первый ген бактериофага, кодирующий первую последовательность сайта инициации упаковки, причем удаление указанного первого гена бактериофага предотвращает упаковку молекулы нуклеиновой кислоты бактериофага в указанную нерепликативную трансдукторную частицу; иплазмиду с репортерной молекулой нуклеиновой кислоты, содержащей репортерный ген, содержащую второй ген бактериофага, причем указанный второй ген бактериофага кодирует вторую последовательность сайта инициации упаковки и облегчает упаковку копии указанной плазмиды с репортерной молекулой нуклеиновой кислоты в указанную нерепликативную трансдукторную частицу, причем указанный второй ген бактериофага способен экспрессировать белок, который кодируется указанным вторым геном, причем указанная копия указанной плазмиды с репортерной молекулой нуклеиновой кислоты образует репликон, поддающийся упаковке в указанную нерепликативную трансдукторную частицу, причем указанный бактериофаг выбран из бактериофага P1 Enterobacteriaceae, бактериофага ϕ80α или бактериофага ϕ11 S. aureus. Изобретение позволяет получить нерепликативные трансдукторные частицы, которые не страдают от вредного воздействия литических функций вируса. 8 н. и 128 з.п. ф-лы, 35 ил., 13 табл., 10 пр.
Формула
Документы, цитированные в отчёте о поиске
Опосредованная рецепторами доставка генов с использованием векторов на основе бактериофагов

Комментарии