Радиоактивный агент для диагностической визуализации - RU2445120C2
Код документа: RU2445120C2
Чертежи

Описание
Область техники
Настоящее изобретение относится к композиции радиоактивного меченного фтором аминокислотного соединения. В частности, оно относится к композиции радиоактивного меченного фтором аминокислотного соединения, применяемого для обнаружения опухолей посредством позитронно-эмиссионной томографии (ПЭТ(PET)).
Предшествующий уровень техники
Радиоактивный агент для диагностической визуализации представляет собой лекарственное средство, непосредственно вводимое в человеческий организм, и является фармацевтической композицией, содержащей в качестве эффективного компонента соединение, меченное специфическим радиоизотопом. Радиоактивный агент для диагностической визуализации позволяет проводить диагностику путем введения агента пациенту и обнаружения излучения, испускаемого соединением, с последующим построением изображения на основании информации, полученной от излучения. Проводимую таким образом диагностику называют радиодиагностическим обследованием, которое эффективно при диагностике множества заболеваний, включая болезни сердца и рак. Также радиодиагностическое обследование отличается тем, что оно имеет не только высокую специфичность и чувствительность к заболеваниям, но также обладает преимуществом по сравнению с другими методиками обследования, обеспечивая информацию о функциональности повреждений.
Соединения, которые исследуют и разрабатывают в качестве таких радиоактивных агентов для диагностической визуализации, включают 1-амино-3-[18F]фторциклобутанкарбоновую кислоту (далее в настоящем описании называемую как [18F]-FACBC). Известно, что [18F]-FACBC потребляется клетками с помощью переносчика аминокислот. Следовательно, ожидают, что [18F]-FACBC будет разработана как вещество для диагностики опухолей, так как оно в значительной степени поглощается опухолевыми клетками, которые являются высоко пролиферирующими и активно синтезируют белок.
В области радиоактивных агентов для диагностической визуализации часто возникает проблема, когда во время введения средства соединения разлагаются в результате собственного излучения, что вызывает снижение радиохимической чистоты из-за так называемого радиолиза. В частности, в ПЭТ веществах для определения позитронных нуклидов, таких как18F, радиолиз часто становится более проблематичным, так как период полураспада нуклидов, используемых в нем, короче, чем таковой нуклидов, используемых в SPECT-веществах для обнаружения нуклидов, излучающих гамма-излучение, таких как99mTc, и, следовательно, их радиоактивность во время транспортировки должна быть выше, чем SPECT агентов, вследствие чего повышается их окончательная энергия излучения.
Для обычных фармацевтических препаратов в руководстве ICH рекомендовано, что если количество примесей в средстве превосходит 1,0%, должно проводиться определение структуры примесей, когда максимальная суточная доза эффективного компонента составляет до не более чем 1 мг (непатентный документ 1). В большинстве случаев, физическое количество примесей, возникающих в результате радиолиза, которое может расцениваться одним аспектом разложения вещества, составляет до около 10-12 моль, даже если оно превосходит 1,0%. Так как количество образующихся примесей, таких как радиоактивные разложившиеся субстанции, составляет ничтожное количество, структурное определение примесей посредством ЯМР исследования затруднено, хотя определение только молекулярной массы и предположения об их фрагментах может быть осуществлено масс-спектрометрией, которая имеет великолепную чувствительность определения. Также очень трудно провести проверку наличия или отсутствия влияния примеси на эффективность, такую как накопление вещества в опухоли.
Следовательно, содержание примесей в радиоактивном агенте для диагностической визуализации должно поддерживаться настолько низким, насколько возможно, и предпочтительно, чтобы радиолиз, который может вызывать образование примесей, также подавлялся насколько возможно.
Для ингибирования радиолиза изучали различные методы, нацеленные на применение [18F]-фтордеоксиглюкозы (далее в настоящем описании называемой как [18F]-FDG).
В брошюре международной публикации № WO 03/090789 описан метод уменьшения радиолиза [18F]-FDG путем добавления к раствору [18F]-FDG буфера на основе слабой кислоты и введения, полученного способом (патентный документ 1). Также в брошюре международной публикации № WO 04/043497 описано добавление этанола к раствору [18F]-FDG для получения композиции жидкости, в которой может быть снижен радиолиз [18F]-FDG для улучшения стабильности (патентный документ 2).
В выложенном японском патенте (Kokai) №10-147542 описана методика, использующая органические соединения высокой физиологической переносимости, такие как моносахариды, дисахариды, органические кислоты и их соли или сложные эфиры, в качестве средств, защищающих от излучения (патентный документ 3). В этой публикации органические соединения с высокой физиологической переносимостью и особенно эффективные в качестве средств, защищающих от излучения, определяют как имеющие скорость реакции, одинаковую с ОН радикалами, Н радикалами или гидратированными электронами в диапазоне 1×108-5×1010 моль-1с-1.
В брошюре международной публикации № WO04/056725 описан метод твердофазного синтеза для18F-меченых радиоизотопов, включая [18F]-FACBC (патентный документ 4). В этом документе предполагают, что радиолиз18F-меченых радиоизотопов снижается путем добавления к композиции жидкости аскорбиновой кислоты.
Непатентный документ 1: ICH HARMONISED TRIPARTTITE GUIDELINE, IMPURITIES IN NEW DRUG PRODUCTS Q3B(R2) (стр.7) (URL: http://www.pmda.go.jp/ich/q/q3br2_06_7_3e.pdf).
Патентный документ 1: Брошюра международной публикации № WO 03/090789.
Патентный документ 2: Брошюра международной публикации № WO 04/043497.
Патентный документ 3: Выложенный японский патент (Kokai) № Н10-147542.
Патентный документ 4: Брошюра международной публикации № WO 04/056725.
Описание изобретения
Проблемы, которые будут решены с помощью изобретения
Как описано выше, в брошюре международной публикации № WO 03/090789 и брошюре международной публикации № WO 04/043497 описаны условия предотвращения радиолиза [18F]-FDG в растворе. Однако в этих документах описана только методика снижения радиолиза только [18F]-FDG, и не описана какая-либо методика снижения радиолиза ряда радиоактивных меченных фтором аминокислотных соединений, таких как [18F]-FACBC.
Кроме того, технической характеристикой изобретения, описанного в брошюре международной публикации № WO 03/090789, является добавление буфера, таким образом увеличивая радиохимическую стабильность [18F]-FDG при рН, обладающей буферным действием, и в сравнительных примерах указано, что радиохимическая стабильность [18F]-FDG не увеличивается с NaCl, который не обладает буферным действием.
В выложенном японском патенте (Kokai) № Н10-147542 описана методика использования органического соединения высокой физиологической переносимости в качестве средства для радиоактивных фармацевтических препаратов, защищающего от излучения. Однако, не очевидно, какое соединение выбирают в качестве органического соединения высокой физиологической переносимости или какое количество соединения добавляют с целью предотвращения радиолиза ряда радиоактивных меченных фтором аминокислотных соединений, таких как [18F]-FACBC.
В брошюре международной публикации № WO 04/056725 предлагают, что добавление аскорбиновой кислоты в композицию жидкости для инъекций снижает радиолиз18F-меченных радиоизотопных индикаторов. Однако она не содержит какого-либо конкретного описания использования аскорбиновой кислоты в качестве добавки для [18F]-FACBC. Также нет описания при каких условиях ее необходимо использовать.
Настоящее изобретение было разработано в свете вышеуказанных обстоятельств и имеет целью обеспечить композицию, включающую радиоактивное меченное фтором аминокислотное соединение, радиолиз которого может быть снижен.
Средства для решения проблемы
В результате кропотливых исследований авторы изобретения обнаружили, что радиолиз [18F]-FACBC уменьшается в зависимости от рН. В частности, было обнаружено, что когда значение рН не превышает 5,9, его стабильность сохраняется даже при отсутствии фармацевтических добавок или буферов, которые предотвращают радиолиз.
Следовательно, было обнаружено, что снижение радиохимической чистоты радиоактивного агента для диагностической визуализации может быть уменьшено путем поддержания рН конечного агента в диапазоне 2,0-5,9 и, таким образом, настоящее изобретение было завершено.
В соответствии с одним аспектом настоящего изобретения обеспечивают радиоактивный агент для диагностической визуализации, который включает раствор, содержащий в качестве эффективного компонента радиоактивное соединение, представленное следующей формулой (1):

где раствор имеет значение рН 2,0-5,9. В предпочтительном варианте осуществления радиоактивного агента для диагностической визуализации в соответствии с настоящим изобретением вышеуказанный раствор может иметь значение рН 2,0-4,9.
Радиоактивным агентом для диагностической визуализации в соответствии с настоящим изобретением может быть агент, к которому дополнительно добавлена фармацевтическая добавка. В качестве фармацевтических добавок могут быть использованы различные соединения, которые являются общепринятыми в качестве добавочных соединений, включая регуляторы рН и средства для улучшения растворения, а также сахар, сахарный спирт, сахарный лактон и подобные. Предпочтительно может быть использован сахарный спирт.
В качестве сахарного спирта может быть использовано одно или более соединений, выбираемых из группы, состоящей из эритритола, ксилита, сорбита и маннита. Их добавляемое количество не ограничено, пока оно может дополнительно снижать радиолиз, но предпочтительно составляет не меньше чем 0,5 мкмоль/мл, более предпочтительно не менее чем 1,0 мкмоль/мл, еще более предпочтительно не менее чем 5,0 мкмоль/мл и особенно предпочтительно не менее чем 10,0 мкмоль/мл. Верхняя граница добавляемого количества должна представлять собой количество, которое применимо для фармацевтических добавок; например, верхней границей является общая суточная доза 200 мг для ксилита, 1,5 г для сорбита и 1,2 г для маннита.
В радиоактивном агенте для диагностической визуализации в соответствии с настоящим изобретением радиоактивная концентрация особо не ограничена, пока при использовании может быть обеспечено достаточное количество радиоактивности. В частности, радиоактивной концентрацией при применении предпочтительно является 25-125 МБк/мл и более предпочтительно 25-100 МБк/мл.
В настоящей спецификации соединения, применимые в качестве фармацевтических добавок, обозначают соединения, которые одобрены в качестве фармацевтических добавок в Фармакопее Японии, Фармакопее Соединенных Штатов, Европейской Фармакопее и так далее. Кроме того, сахарный спирт обозначает восстановленную форму сахара, сахарный лактон обозначает циклическое сложноэфирное соединение, которое получают интрамолекулярной дегидратационной конденсацией сахара.
Эффект изобретения
В соответствии с настоящим изобретением значение рН раствора, содержащего радиоактивное меченное фтором аминокислотное соединение, устанавливают в пределах 2,0-5,9 и таким образом обеспечивают композицию радиоактивного меченного фтором аминокислотного соединения, в которой снижен радиолиз.
Наилучший способ осуществления изобретения
Далее в настоящем описании будут описаны наиболее предпочтительные варианты осуществления композиции радиоактивного меченного фтором аминокислотного соединения по настоящему изобретению.
Радиоактивный агент для диагностической визуализации в соответствии с настоящим изобретением получают в 4 стадии; стадия прикрепления радиоактивного фтора к предшественнику (стадия 1); стадия проведения депротектирования соединения, к которому прикреплен радиоактивный фтор (стадия 2); стадия проведения очистки раствора, содержащего анти-[18F]-FACBC после депротектирования (стадия 3); и стадия преобразования очищенного раствора анти-[18F]-FACBC в препарат (стадия 4).
Радиоактивный фтор может быть получен известным способом, например, способом, в котором Н218О обогащенная вода используется в качестве мишени и подвергается воздействию облучения протонами. В таких обстоятельствах радиоактивный фтор существует в Н218О обогащенной воде, используемой в качестве мишени. Н218О обогащенной воде, содержащей радиоактивный фтор, позволяют проходить через, например, колонку из анионообменной смолы так, что радиоактивный фтор абсорбируется и собирается на колонке, таким образом отделяясь от Н218О обогащенной воды. После этого через колонку позволяют проходить раствору карбоната калия для элюирования радиоактивного фтора, и элюат дополняют катализатором переноса фаз и выпаривают досуха, таким образом активируя радиоактивный фтор.
На стадии 1 высушенный радиоактивный фтор растворяют в ацетонитриле и к раствору ацетонитрила в качестве предшественника добавляют этил цис-1-(N-трет-бутоксикарбонил)амино-3-[(трифторметил)сульфонилокси]циклобутанкарбоксилат для возможности их реакции при нагревании. В результате радиоактивный фтор добавляют к предшественнику, посредством чего синтезируют этил транс-1-(N-трет-бутоксикарбонил)амино-3-[18F]фторциклобутанкарбоксилат.
На стадии 2 этил транс-1-(N-трет-бутоксикарбонил)амино-3-[18F]фторциклобутанкарбоксилат, полученный на стадии 1, депротектируют для получения раствора, содержащего анти-[18F]-FACBC в качестве продукта-мишени. На этой стадии условия депротектирования предпочтительно являются кислыми. Например, к раствору, содержащему этил транс-1-(N-трет-бутоксикарбонил)амино-3-[18F]фторциклобутанкарбоксилат, для проведения депротектирования может быть добавлена соляная кислота. Количество кислоты, которое необходимо добавить, не должно ограничиваться, пока количество обеспечивает кислые условия, достаточные для депротектирования.
На стадии 3 проводят очистку раствора, содержащего анти-[18F]-FACBC, который получают на стадии 2. Используемый процесс очистки включает различные процессы, такие как процесс жидкость-жидкостной экстракции и процесс колоночного разделения. Например, может быть использован процесс, при котором реакционный раствор вводят в ВЭЖХ для получения фракции, содержащей анти-[18F]-FACBC. Раствор анти-[18F]-FACBC может быть получен на этой стадии.
Радиоактивный агент для диагностической визуализации по настоящему изобретению может быть получен путем обработки раствора анти-[18F]-FACBC, полученного на стадии 3, различными операциями, требуемыми для получения препарата, включая операцию выпаривания органических растворителей, операцию добавления фармацевтических добавок, операцию регулирования рН, операцию регулирования радиоактивной концентрации и операцию стерилизации посредством автоклавирования, фильтрации или подобного. На этой стадии предпочтительно, чтобы значение рН контролировалось в диапазоне от 2,0 до 5,9. С этой целью предпочтительно, чтобы значение рН ранее на стадии 3 контролировалось в диапазоне 2,0-5,9. Также возможно, чтобы рН контролировалось в диапазоне от 2,0 до 5,9 непосредственно после получения раствора анти-[18F]-FACBC. Посредством такой стадии 4 может быть получен радиоактивный агент для диагностической визуализации, который содержит в качестве эффективного ингредиента анти-[18F]-FACBC и доведен до рН раствора в диапазоне от 2,0 до 5,9.
При этом радиоактивный агент для диагностической визуализации в соответствии с настоящим изобретением должен иметь радиоактивность, допускающую получение при его использовании ПЭТ изображения и, следовательно, радиоактивную концентрацию в момент получения устанавливают для соответствия такой радиоактивности. Например, если непосредственно после получения он имеет радиоактивность 1,4 ГБк в около 2 мл, при использовании он будет иметь радиоактивность 50-225 МБк, таким образом, позволяя получать достаточное изображение ПЭТ для взрослых.
Пример
Далее в описании настоящее изобретение описано более подробно с помощью примеров. Однако эти примеры никак не ограничивают рамки настоящего изобретения.
Примеры 1-16, сравнительные примеры 1-5: взаимоотношение между рН и снижением радиохимической чистоты
Н218О, содержащей ион фтора [18F], позволяли проходить через колонку из анионообменной смолы для абсорбции и сбора ионов фтора [18F] на колонке. Затем колонку промывали водой и получали смесь, содержащую ион фтора [18F], раствор карбоната калия и катализатор перехода фаз в соответствии с обычным способом (например, способом, описанным в ссылках (Radioisotopes, 50, (2001), p.205-227; Radioisotopes, 50, (2001), p.228-256; “Production and quality control of radioactive agents for PET - Handbook of synthesis and clinical use-(2nd edition)”, edited by PET Chemistry Workshop).
Полученную смесь нагревали в реакционном сосуде для выпаривания воды досуха и подвергали азеотропной дистилляции с добавлением ацетонитрила и к ней добавляли раствор этил цис-1(N-трет-бутоксикарбонил)амино-3-[(трифторметил)сульфонилокси]циклобутанкарбоксилата в ацетонитриле. Полученный раствор нагревали при перемешивании, так чтобы не выпарить ацетонитрил, таким образом позволяя протекать реакции нуклеофильного замещения для получения меченного фтором [18F]соединения.
После охлаждения реакционного сосуда до около 40°С к реакционному раствору для разведения добавляли воду для инъекций и смесь пропускали через силикагелевую колонку для обращенно-фазовой хроматографии для сбора меченного фтором [18F]соединения. Эту колонку промывали и заполняли током газообразного гелия и затем в колонку заполняли 4 моль/л раствора гидроксида натрия с последующим закрытием выхода из колонки. Через 3 минуты выход колонки открывали и щелочной раствор элюировали из колонки и собирали во флакон. Такую операцию повторяли дважды и промывали водой и затем промывные воды объединяли со щелочным раствором, полученным выше.
Затем к раствору, полученному как указано выше, добавляли соляную кислоту и нагревали до около 60°С для осуществления реакции депротектирования. Затем смесь пропускали через колонку из ион-задерживающей смолы, колонку из окиси алюминия и колонку из смолы для обращенно-фазовой хроматографии в таком порядке для проведения очистки и получения основного раствора анти-[18F]-FACBC. Значение рН основного раствора анти-[18F]-FACBC устанавливали около 3,5 путем предшествующего помещения раствора соляной кислоты в сосуд, в который вводили основной раствор анти-[18F]-FACBC.
Измеряли радиоактивность полученного основного раствора анти-[18F]-FACBC и затем основной раствор разводили физиологическим солевым раствором так, чтобы в момент начала эксперимента (0 часов в таблице 2) он имел радиоактивную концентрацию около 510 МБк/мл. 2,23 мл этого раствора отмеряли в сосуд объемом 5 мл и добавляли к нему заранее определенное количество заранее определенного раствора, указанного в таблице 1, для получения испытуемого раствора. Радиоактивная концентрация испытуемых растворов непосредственно после получения составила 653-686 МБк/мл.
Образец раствора хранили в электрической термостатической камере, установленной на 25°С, ТЖХ анализ проводили в следующих условиях в момент начала эксперимента (0 часов) и через 8,5 часов после начала эксперимента, и значение радиохимической чистоты рассчитывали в соответствии со следующим уравнением (1). Измерение радиохимической чистоты повторяли три раза для каждого испытуемого раствора.
Условия ТЖХ анализа:
Подвижная фаза: ацетонитрил/вода/100% уксусная кислота = 4/1/1
ТЖХ планшет: Silica Gel 60F254 (торговое наименование, толщина мембраны: 0,25 мм, производимый Merck & Co., Inc.)
Подвижная длина: 10 см
ТЖХ сканер: Rita Star (производимый Raytest)
Количество анализов: три раза

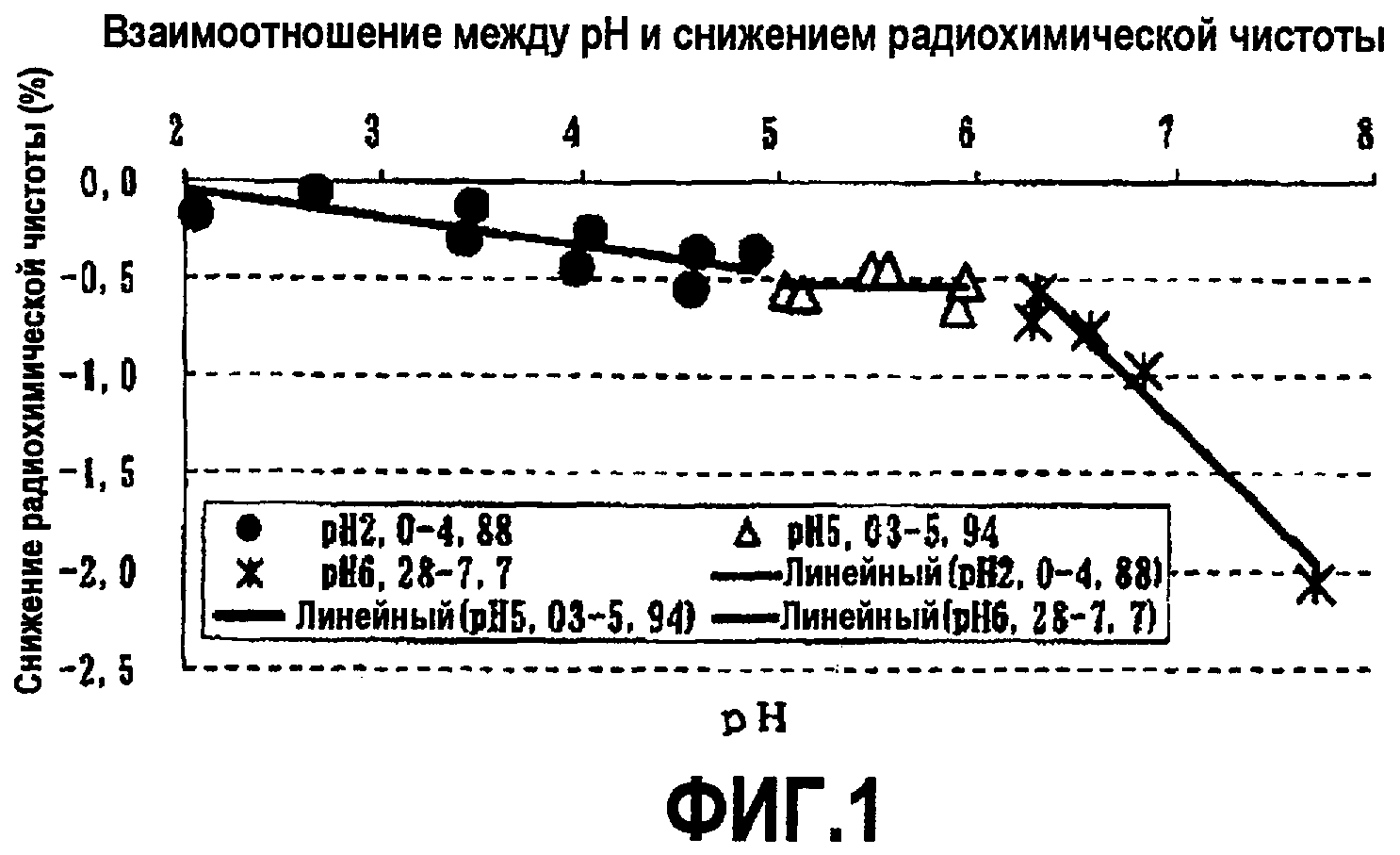
Результаты показаны в таблице 2 и фиг.1.
В отношении связи между рН и снижением радиохимической чистоты, при увеличении рН с 2,00 до 5,94 наблюдали относительно легкое снижение радиохимической чистоты. Рассчитывали уклон, основанный на линейном приближении, и в результате уклон составил -0,145 в диапазоне рН 2,00-4,88 и -0,10 в диапазоне рН 5,03-5,94.
С другой стороны, когда значение рН было не менее 6,28, при увеличении рН возникало резкое снижение радиохимической чистоты. Рассчитывали уклон на основании линейного приближения и в результате он составил -1,000. Это значение было около 6,7-кратного значения в диапазоне рН 2,00-4,88 и около 100-кратного значения в диапазоне рН 5,03-5,94. Из этого было показано, что когда значение рН составляет не менее чем 6,28, развивается резкое снижение радиохимической чистоты по сравнению с диапазоном рН 2,00-5,94.
Примеры 17-28: взаимоотношение между концентрацией маннита и радиохимической чистотой при значениях рН 3,44 и 4,78
Основной раствор анти-[18F]-FACBC получали таким же образом, как в примере 1 с использованием Н218О, содержащей ион фторида [18F]. Затем к полученному основному раствору анти-[18F]-FACBC добавляли соляную кислоту и физиологический солевой раствор так, чтобы получить в момент начала эксперимента (0 часов в таблице 4) радиоактивную концентрацию около 500 МБк/мл и значение рН около 4,8. 2,23 мл полученного раствора разливали по аликвотам во флаконы объемом 5 мл и добавляли раствор маннита или соляной кислоты в концентрации, показанной в таблице 3, в количестве, показанном в таблице 3, для получения испытуемого раствора. Радиоактивная концентрация испытуемых растворов непосредственно после получения составила 553-565 МБк/мл.
Испытуемый раствор хранили в электрической термостатической камере, установленной на 25°С, и значение радиохимической чистоты рассчитывали так же, как в примере 1 в момент начала эксперимента (0 часов) и через 8,5 часов после начала эксперимента. Измерение радиохимической чистоты повторяли три раза для каждого испытуемого раствора.
Результаты показаны в таблице 4 и на фиг.2. Во всех примерах при значении рН 3,44 и 4,78 снижение радиохимической чистоты резко уменьшалось с увеличением концентрации маннита и эффект уменьшения становился заметным при концентрации маннита не менее чем 5,0 мкмоль/мл.
Также снижение радиохимической чистоты еще больше ингибировалось при обеих концентрациях маннита при значении рН 3,44, по сравнению с 4,78.
Из вышеуказанных результатов было подтверждено, что значение рН раствора вносит вклад в радиохимическую стабильность. Также было показано, что радиолиз может быть дополнительно подавлен добавлением маннита.
Примеры 29-31, сравнительные примеры 6-8: Взаимоотношение между снижением радиохимической чистоты и радиоактивной концентрацией
Основной раствор анти-[18F]-FACBC получали таким же образом, как в примере 1, с использованием Н218О, содержащей ион фторида [18F]. Радиоактивность полученного основного раствора анти-[18F]-FACBC измеряли и его разводили и регулировали так, чтобы он имел радиоактивную концентрацию 507 МБк/мл и концентрацию маннита 10 мкмоль/мл (в настоящем описании его далее называют стандартным раствором для получения образцов в этих примерах и сравнительных примерах). 2,23 мл полученного стандартного раствора для получения образца разливали по аликвотам во флаконы объемом по 5 мл и к ним добавляли соляную кислоту таким образом, чтобы установить значение рН 3,94. Из этого флакона раствор фракционировали в количестве, показанном в таблице 5, и соответственно добавляли физиологический раствор для получения испытуемого раствора объемом 1 мл.
Отдельно 2,23 мл полученного выше стандартного раствора разливали по аликвотам во флакон объемом 5 мл и добавляли раствор гидроксида натрия до значения рН 7,91. Из этого флакона раствор фракционировали в количестве, показанном в таблице 6, и соответственно добавляли физиологический солевой раствор для получения испытуемого раствора объемом 1 мл для использования в сравнительных примерах 6-8.
Образец раствора хранили в электрической термостатической камере, установленной на 25°С, и значение радиохимической чистоты рассчитывали таким же образом, как в примере 1, в момент времени начала эксперимента (0 часов) и через 8,5 часов после начала эксперимента. Измерение радиоактивной чистоты повторяли три раза для каждого испытуемого раствора.
Результаты показаны в таблицах 7 и 8. В примерах 29-31 вне зависимости от того, какой была радиоактивная концентрация, обычно наблюдали снижение радиохимической чистоты (таблица 7). С другой стороны, в обоих сравнительных примерах 6-8 со временем наблюдали снижение радиохимической чистоты, и было показано, что радиохимическая чистота имела тенденцию к снижению при увеличении радиоактивной концентрации (таблица 8).
Из вышеуказанных результатов при значении рН 3,94 было подтверждено, что снижение радиохимической чистоты существенно уменьшалось при радиоактивной концентрации до 600 МБк/мл.
Также снижение радиохимической чистоты усиливалось при увеличении радиоактивной концентрации при значении рН 7,91 и, таким образом, было показано, что зависимое от времени снижение радиохимической чистоты анти-[18F]-FACBC не было вызвано разложением анти-[18F]-FACBC из-за отсутствия химической стабильности в отношении рН, а было вызвано разложением анти-[18F]-FACBC из-за радиолиза путем излучения.
Примеры 32-33: взаимоотношение между добавлением маннита и снижением радиохимической чистоты
Основной раствор анти-[18F]-FACBC получали таким же образом, как в примере 1. Полученный основной раствор анти-[18F]-FACBC разводили соляной кислотой и физиологическим солевым раствором так, чтобы он имел радиоактивную концентрацию 568,1 МБк/мл в заранее определенное время, когда начинали эксперимент (0 часов в таблице 9) (рН 3,98). Этот раствор разливали по аликвотам в количестве 2,23 мл в качестве испытуемых растворов (пример 32). Отдельно раствор, доведенный до 507 МБк/мл, разливали по аликвотам в количестве 2,23 мл и к нему добавляли раствор маннита для получения раствора, имеющего концентрацию маннита 10 мкмоль/мл, для использования в эксперименте (пример 33.)
Испытуемый раствор хранили в электрической термостатической камере, установленной на 25°С, ТЖХ анализ проводили в момент начала эксперимента (0 часов), через 2,5 часа, через 4,5 часа, через 6,5 часа и через 8,5 часов таким же образом, как в примере 1, и значение радиохимической чистоты рассчитывали в соответствии со следующим уравнением (2). Измерение радиохимических загрязнений повторяли три раза для каждого испытуемого раствора.
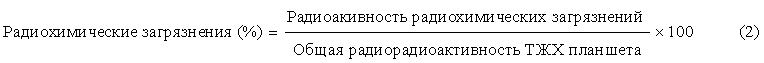
Результаты показаны в таблице 9. В испытуемом растворе, который не был смешан с маннитом (пример 32), радиохимические загрязнения снижались до 1% или меньше во все временные точки, посредством эффекта регулирования рН. Однако во временные точки до 6,5 часов после начала эксперимента была показана тенденция увеличения в зависимости от времени.
С другой стороны, в испытуемом растворе, который был смешан с маннитом (пример 33), не наблюдали увеличения радиохимической чистоты, зависимой от времени.
Из вышеуказанных результатов было показано, что смешивание с маннитом позволяет увеличить дополнительное ингибирование образования радиохимических примесей в результате радиолиза. Из этого было подтверждено, что эффект стабилизации радиохимической чистоты еще больше усиливался добавлением маннита.
Промышленная применимость
Настоящее изобретение может уменьшить радиолиз радиоактивных меченных фтором аминокислотных соединений, применимых в качестве агентов для ПЭТ, и является применимым в области радиоактивных медицинских препаратов.
Краткое описание чертежей
Фиг.1 представляет собой график, на котором показано взаимоотношение между рН и снижением радиохимической чистоты.
Фиг.2 представляет собой график, на котором показано взаимоотношение между концентрацией маннита и снижением радиохимической чистоты.
Реферат
Изобретение относится к области медицины. Композиция включает раствор в физиологическом солевом растворе радиоактивного меченного фтором аминокислотного соединения, представленного следующей формулой (1): ! ! и, по меньшей мере, одну фармацевтическую добавку, выбранную из группы, состоящей из регулятора рН, средства для улучшения растворения, сахарного спирта, сахара и сахарного лактона, где раствор не содержит буферов и имеет значение рН 2,0-5,9. Композиция радиоактивного меченного фтором аминокислотного соединения не подвержена радиолизу и пригодна для обнаружения опухолей. 6 з.п.ф-лы, 1 пр., 8 табл., 2 ил.
Формула

и, по меньшей мере, одну фармацевтическую добавку, выбранную из группы, состоящей из регулятора рН, средства для улучшения растворения, сахарного спирта, сахара и сахарного лактона, где раствор не содержит буферов и имеет значение рН 2,0-5,9.

Комментарии