Способы и средства повышения продуктивности рнк - RU2738753C2
Код документа: RU2738753C2
Чертежи























Описание
Настоящее изобретение наряду с прочим относится к способу синтеза молекулы РНК заданной последовательности, а также к реакторам для осуществления указанного способа.
Молекулы рибонуклеиновой кислоты (РНК) медицинского назначения представляют класс лекарственных средств, внимание к которым в настоящее время возрастает. Основанные на РНК лекарственные средства включают молекулы мРНК, кодирующие антигены, для применения в качестве вакцин (Fotin-Mleczek с соавт., 2012). Также рассматривают применение молекул РНК для замещающей терапии, например, обеспечивая пациентам недостающие белки, такие как ростовые факторы или ферменты (

Успешная экспрессия белка с трансфецированной РНК зависит от эффективности трансфекции, стабильности РНК и эффективности трансляции. 5'-кэп-структура и 3'-поли(А) хвост важны для эффективной трансляцией мРНК и синтеза белка в эукариотических клетках. Вновь синтезированные мРНК модифицируют по кэп-структуре, если транскрипт достигает длины 20-30 нуклеотидов. Сначала 5'-концевой нуклеотид pppN конвертируют в 5' GpppN бифункцинальным кэпирующим ферментом, обладающим активностями и РНК-5'-трифосфатазы, и гуанилилтрансферазы. Затем часть GpppN метилируют вторым ферментом с активностью (гуанин-7)-метилтрансферазы для формирования монометилированной m7GpppN тип 0 кэповой структуры. Кэп типа 0 затем конвертируют в структуру m7GpppN типа 1 в ядре путем 2'-O-метилирования (Tcherepanova с соавт., 2008).
Короткие молекулы РНК могут быть синтезированы химическими методами, а длинные РНК обычно получают в ходе реакций транскрипции in vitro, содержащих соответствующую матрицу ДНК с промотором от бактериофага, РНК-полимеразу, например, РНК-полимеразу бактериофага SP6, Т3 или Т7, и рибонуклеозидтрифосфаты (НТФ). В основном 5'-кэповые структуры могут быть интродуцированы по двум протоколам в РНК, транскрибированные in vitro.
По первому протоколу кэпирование проводят одновременно с инициацией транскрипции (ко-транскрипционное кэпирование). При таком подходе аналог кэпа из двух нуклеотидов, например, m7G(5')ppp(5')G (m7G), вносят в реакционную смесь. Матрицу ДНК обычно конструируют таким образом, что первым транскрибируемым нуклеотидом является гуанозин. Аналог кэпа непосредственно конкурирует с ГТФ за включение в качестве начального нуклеотида (стартового нуклеотида) и включают так же легко, как и какой-либо другой нуклеотид (WO 2006/004648). Чтобы способствовать включению аналога кэпа обычно применяют мольный избыток аналога кэпа относительно ГТФ (например, в соотношении 4:1) и концентрацию ГТФ уменьшают по сравнению с другими рибонуклеозидтрифосфатами АТФ, ЦТФ и УТФ. В таких условиях ГТФ обычно становится лимитирующим фактором для синтеза молекул РНК. Соответственно значительная часть других НТФ (обычно 40-70%) не используется для синтеза РНК, и остается невостребованной. При таком подходе выход РНК обычно ограничен и составляет примерно 1 мг/мл (WO 2006/004648).
По второму протоколу кэпирование происходит в отдельной ферментативной реакции после транскрипции in vitro (пост-транскрипционное или ферментативное кэпирование). Фермент кэпирования вируса осповакцины (Vaccinia Virus Capping Enzyme - VCE) обладает всеми тремя ферментативными активностями, требуемыми для синтеза m7G кэп-структуры (активностями РНК-5'-трифосфатазы, гуанилилтрансферазы и гуанин-7-метилтрансферазы). При использовании в качестве субстрата ГТФ в ходе реакции VCE получают кэпы РНК в надлежащей ориентации. Кроме того, кэп типа 1 может быть создан путем добавления второго фермента Vaccinia 2'-O-метилтрансферазы для реакции кэпирования (Tcherepanova с соавт., 2008).
Сообщают, что транскрибированная in vitro фаговыми полимеразами РНК может содержать множественные контаминанты, включая молекулы двухцепочечных РНК, выработанных путем самокомплементарной 3'-протяженности, и короткие молекулы РНК, выработанные в результате инициации абортивной транскрипции.
Молекулы РНК, синтезированные РНК-полимеразой фага Т7 в ходе транскрипции матриц линеаризованных ДНК могут быть длиннее, чем кодирующая РНК (Triana-Alonso с соавт., 1995). РНК-полимераза после отделения от матрицы ДНК может связывать транскрипт с участком матрицы и 3'-конец транскрипта с сайтом продукта и удлинять его, если 3'-конец не является частью стабильной вторичной структуры (самокомплементарная 3'-протяженность). Предполагают, что такой эффект особенно чувствителен к концентрации УТФ, и исключительно снижение концентрации УТФ приводит к правильной транскрипции. Однако снижение концентрации УТФ также может влиять на выход РНК. Особенно если РНК содержит хвост поли (А), что часто бывает в таких РНК, например, мРНК, избыток не включенного в реакцию транскрипции УТФ может привести к зависимому от РНК-матрицы включению уридиновых нуклеотидов против поли-А-последовательности, что приводит к формированию двухцепочечных молекул РНК, в результате может быть активирован врожденный иммунный ответ и снижен синтез белка (Kariko с соавт., 2011).
Помимо требуемой полной длины молекулы РНК реакции транскрипции in vitro также могут вырабатывать более короткие олигорибонуклеотиды, которые являются результатом событий по инициации абортивной транскрипции (Milligan с соавт., 1987). Такие абортивные (недозрелые) транскрипты являются короткими молекулами РНК, преждевременно высвободившимися из тройного комплекса, состоящего из РНК-полимеразы, матрицы ДНК и возникающей цепи РНК. Обычно наиболее абортивные транскрипты содержат от 2 до 8 нуклеотидов в длину и формируются в результате абортивного циклирования в ходе инициации. Интересно, что повышение абортивной транскрипции наблюдают при концентрациях НТФ ниже примерно 2 мМ (Kern с соавт., 1999). Абортивные транскрипты нежелательны, поскольку их синтез потребляет ценные НТФ и снижает выход продукта полной длины.
Для успешного создания лекарственных средств на основе РНК получение молекул РНК в качестве активных фармацевтических ингредиентов должно быть эффективным по таким показателям, как выход, качество, безопасность и стоимость, особенно если РНК вырабатывается в большом масштабе и если требуются молекулы РНК полной длины или кэпированные молекулы РНК полной длины. Описано несколько подходов к повышению продуктивности молекул РНК путем транскрипции in vitro. Ожидают, что применение высоких концентраций НТФ повышает выход молекул РНК. В другом варианте для эффективного синтеза кэпированных молекул РНК была предложена корректировка соотношения аналога кэпа к ГТФ.
Стандартные концентрации нуклеотидов для реакций транскрипции in vitro обычно варьируют от 1,5 до 16 мМ (Milligan с соавт., 1987; Sampson, Uhlenbeck, 1988; Cunningham, Ofengand, 1990; Weitzmann с соавт., 1990; Gurevich с соавт., 1991). Сообщают, что концентрации НТФ до 40 мМ возможны, если должным образом корректируют концентрации Mg++, что приводит к повышению выхода РНК (US 5256555).
Имеется несколько коммерческих наборов для осуществления транскрипции с высоким выходом, например, Т7 High Yield RNA synthesis kit (фирма New England Biolabs, Ипсуич, Массачусетс, США), TranscriptAidTM T7 High Yield Transcription kit (фирма Thermo Scientific, Уолтем, Массачусетс, США), MEGAscript® High Yield Transcription Kit (фирма Life Technologies, Карлсбад, Калифорния, США) или AmpliCap-MaxTM Т7 High Message Maker kit (фирма Epicentre, Мэдисон, Висконсин, США). Для всех наборов предлагают высокие общие рабочие концентрации НТФ от 30 до 40 мМ для стандартных реакций транскрипции. Для синтеза кэпированных мРНК концентрации ГТФ находятся в диапазоне 1,5-2 мМ ГТФ.
Хотя обычно высокие концентрации нуклеотидов рекомендуют для максимизации выхода РНК в реакциях транскрипции in vitro, использование высоких концентраций НТФ может также иметь недостатки. Например, при высоких начальных концентрациях НТФ и достаточно высоких концентрациях Mg++ (например, Mg(OAc)2) могут получать высокие выходы РНК. Однако при таких высоких концентрациях повышенная фракция НТФ может быть включена в короткие абортивные транскрипты (Керн с соавт., 1997).
Для получения кэпированной мРНК путем ко-транскрипции в присутствии аналога кэпа по экономических причинам нужны пониженные рабочие концентрации НТФ, поскольку аналог кэпа следует применять в избытке по отношению к ГТФ и это основная причина высокой стоимости. Повышенная доля аналога кэпа по отношению к ГТФ может привести к повышенной доле кэпированной РНК, но для выхода и по экономическим соображениям обычно предлагают соотношение 4:1 (фирма New England Biolabs, Синтез кэпированной РНК (Е2040), https://www.neb.com/protocols /1/01/01/capped-rna-synthesis-e2040).
Например, для транскрипции кэпированных РНК в инструкциях производителя для набора по синтезу РНК с высоким выходом (Т7 High Yield RNA) предлагают использовать 2 мМ ГТФ с превышением 4:1 аналога кэпа относительно ГТФ. Выход на 20 мкл реакции предполагают равным 40-50 мкг РНК, что соответствует 2-2,5 мг/мл с содержанием транскриптов кэпированной РНК примерно 80% (фирма New England Biolabs, Синтез кэпированной РНК (Е2040), https://www.neb.com/protocols/1/01/01/capped-rna-synthesis-e2040).
Чтобы компенсировать лимитированный выход, связанный с низкими концентрациями ГТФ, выходы кэпированных РНК повышают путем добавления в реакцию конкурирующего нуклеотида (ГТФ или АТФ в случае применения А-кэпа) таким образом, что поддерживают соотношение от 1:1 до 1:50 ГТФ по отношению к аналогу кэпа. При таком подходе количество выработанной в реакции кэпированной РНК может быть удвоено (WO 2006/004648).
Реакции транскрипции in vitro обычно выполняют в виде периодических реакций, в которых все компоненты объединяют и затем инкубируют, допуская синтез молекул РНК до завершения окончания реакции. Кроме того, разработаны реакции с подпиткой для повышение эффективности реакции транскрипции in vitro (Kern с соавт., 1997; Kern с соавт., 1999). В системе с подпиткой все компоненты объединяют, но затем дополнительные количества некоторых реагентов добавляют на протяжении некоторого времени (например, НТФ и магний) для поддержания постоянных условий реакции. Стратегия реакции с подпиткой достигает 100% улучшения по РНК на единицу РНК-полимеразы или матрицы ДНК для очень короткой матрицы ДНК из 38 пар оснований. Этот способ применяют только для синтеза молекул некэпированной РНК с трифосфатом с 5'-конца.
Сообщают о применении биореактора (реактора транскрипции) для синтеза молекул РНК путем транскрипции in vitro (WO 1995/08626). Биореактор сконструирован таким образом, что вступающие в реакцию компоненты поставляют через линию снабжения к центру реактора и продукты РНК удаляют путем пропуска исходящего потока через мембрану ультрафильтрации (у которой номинальная отсекающая молекулярная масса составляет, например, 100000 Дн).
Таким образом, выход молекул кэпированных РНК в реакциях транскрипции in vitro в основном зависит от двух факторов: общей концентрации НТФ, доступных для включения в молекулу РНК, и соотношения аналога кэпа : ГТФ. Для ко-транскрипционного кэпирования концентрации ГТФ обычно снижают по сравнению с концентрациями других НТФ. Это снижает возможный выход в результате транскрипции, особенно для матриц с высоким содержанием ГЦ.
Из вышеизложенного следует, что существует постоянная потребность в улучшенных и экономически обоснованных средствах и способах получения РНК, особенно для получения молекул кэпированной РНК полной длины, которые можно транслировать в белки.
Краткое описание изобретения
Настоящее изобретение наряду с прочим относится к способу синтеза молекулы РНК заданной последовательности, включающему следующие стадии:
а) определения доли (1) каждого из четырех нуклеотидов Г, А, Ц и У в указанной молекуле РНК и
б) синтеза указанной молекулы РНК путем транскрипции in vitro в оптимизированной для последовательности реакционной смеси, причем указанная оптимизированная для последовательности реакционная смесь включает четыре рибонуклеотида ГТФ, АТФ, ЦТФ и УТФ, причем доля (2) каждого из четырех рибонуклеотидов в оптимизированной для последовательности реакционной смеси соответствует доле (1) соответствующего нуклеотида в указанной молекуле РНК, буфер, матрицу ДНК и РНК-полимеразу.
Настоящее изобретение также относится к биореактору для синтеза молекул РНК заданной последовательности, имеющему реакционный модуль для проведения реакций транскрипции РНК in vitro в оптимизированной для последовательности реакционной смеси, модуль захвата для временного захвата молекул транскрибированной РНК и модуль управления для контроля подпитки компонентами оптимизированной для последовательности реакционной смеси в реакционный модуль, причем реакционный модуль включает фильтрующую мембрану для отделения нуклеотидов от оптимизированной для последовательности реакционной смеси, и управление подпиткой компонентами оптимизированной для последовательности реакционной смеси, основанное на измеренной концентрации отделенных нуклеотидов.
Определения
Для достижения ясности и четкости изложения ниже приводятся определения. Какие-либо технические свойства приводимых определений едины для всех и каждого из вариантов осуществления настоящего изобретения. Дополнительные определения и объяснения могут быть специально предусмотрены в контексте таких вариантов осуществления настоящего изобретения, согласно приводимым ниже пояснениям.
5'-кэп-структура: 5'-кэп представляет типично модифицированный нуклеотид, особенно гуаниновый нуклеотид, добавленный к 5'-концу молекулы РНК. Предпочтительно 5'-кэп добавляют, используя 5'-5'-трифосфатное соединение. 5'-кэп может быть метилированным, например, m7GpppN, где N означает концевой 5'-нуклеотид нуклеиновой кислоты, несущий 5'-кэп, обычно 5'-конец РНК. Природным 5'-кэпом является m7GpppN.
К другим примерам 5'-кэп-структур относятся глицерил, инвертированный дезокси абазический остаток (часть молекулы), 4',5'-метиленовый нуклеотид, 1-(бета-D-эритрофуранозил)нуклеотид, 4'-тионуклеотид, карбоциклический нуклеотид, 1,5-ангидрогекситоловый нуклеотид, L-нуклеотиды, альфа-нуклеотид, модифицированный основной нуклеотид, трео-пентофуранозильный нуклеотид, ациклический 3',4'-секо-нуклеотид, ациклический 3,4-дигидроксибутиловый нуклеотид, ациклический 3,5-гидроксипентиловый нуклеотид, 3'-3'-инвертированная нуклеотидная часть, 3'-3'-инвертированная абазическая часть, 3'-2'-инвертированная нуклеотидная часть, 3'-2'-инвертированная абазическая часть, 1,4-бутандиолфосфат, 3'-фосфорамидат, гексилфосфат, аминогексилфосфат, 3'-фосфат, 3'-фосфоротоиат, фосфородитиоат и метилфосфонатная часть молекулы, связанная или не связанная через мост.
Особенно предпочтительными 5'-кэп-структурами являются САР1 (метилирование рибозы соседнего нуклеотида m7G), САР2 (метилирование рибозы второго нуклеотида вниз по цепи m7G), САР3 (метилирование рибозы третьего нуклеотида вниз по цепи m7G), САР4 (метилирование рибозы четвертого нуклеотида вниз по цепи m7G), 5'-кэп-структура, которая может быть сформирована аналогом кэпа.
Аналог кэпа: Аналог кэпа относится к нерастяжимым динуклеотидам, обладающим функциональностью кэпа, а это означает, что он способствует трансляции или локализации, и/или предупреждает разрушение молекулы РНК при включении с 5'-конца молекулы РНК. Нерастяжимость означает, что аналог кэпа может быть присоединен только с 5'-конца, поскольку он не имеет 5'-трифосфата и, следовательно, не может распространяться в 3'-направлении матрицезависимой РНК-полимеразой.
К аналогам кэпа относятся, но ими перечень не ограничивается, химические структуры, выбранные из группы, включающей m7GpppG, m7GpppA, m7GpppC, неметилированные аналоги кэпа (например, GpppG); диметилированные аналоги кэпа (например, m2,7GpppG), триметилированные аналоги кэпа (например, m2,2,7GpppG), диметилированные симметричные аналоги кэпа (например, m7Gpppm7G), или антиреверсные аналоги кэпа (например, ARCA; m7,2'OmeGpppG, m7,2'dGpppG, m7,3'OmeGpppG, m7,3'dGpppG и их тетрафосфатные производные) (Stepinski с соавт., 2001). Примеры аналогов кэпа представлены в табл. 1.


Другие аналоги кэпа описаны ранее (US 7074596, WO 2008/016473, WO 2008/157688, WO 2009|149253, WO 2011|015347 и WO 2013|059475). Ранее был описан синтез N7-(4-хлорфеноксиэтил)-замещенных динуклеотидных аналогов кэпа (Kore с соавт., 2013).
Особенно предпочтительными аналогами кэпа являются G[5']ppp[5']G, m7G[5']ppp[5']G, m32,2,7G[5']ppp[5']G, m27,3'-OG[5']ppp[5']G(3'-ARCA), m27,2'OGpppG (2'-ARCA), m27,2'-OGppspG D1 (β-S-ARCA D1) и m27,2'-OGppspG D2 (β-S-ARCA D2).
Нуклеиновая кислота: Понятие «нуклеиновая кислота» означает какую-либо ДНК- или РНК-молекулу и является синонимом понятия «полинуклеотид». Кроме того, модификации или производные нуклеиновой кислоты в контексте настоящего изобретения однозначно относятся к общему понятию «нуклеиновая кислота». Например, пептидная нуклеиновая кислота (ПНК) также относится к понятию «нуклеиновая кислота».
Моноцистронная РНК: Моноцистронная РНК обычно является РНК, предпочтительно мРНК, которая включает только одну открытую рамку считывания (ОРС). Открытая рамка считывания в контексте настоящего изобретения является последовательностью из нескольких триплетов нуклеотидов (кодонов), которая может быть транслирована в пептид или белок.
Би-/мультицистронная РНК: РНК, предпочтительно мРНК, которая обычно содержит две (бицистронная) или несколько (мультицистронная) открытых рамок считывания (open reading frames - ORF). Открытая рамка считывания в контексте настоящего изобретения является последовательностью из нескольких триплетов нуклеотидов (кодонов), которая может быть транслирована в пептид или белок.
Иммуностимулирующая РНК: Иммуностимулирующей РНК (исРНК) в контексте настоящего изобретения обычно может быть РНК, способная индуцировать врожденный иммунный ответ. Обычно исРНК не содержит открытой рамки считывания и поэтому не обеспечивает пептида-антигена, но вызывает врожденный иммунный ответ, например, путем связывания с рецепторами патоген-ассоциированных молекулярных паттернов (ПАМП; например, с Toll-подобным рецептором - Toll-like-receptor (TLR)) или с другими внутриклеточными РНК сенсорами (например, RIG-I, MDA-5 или PKR).
Аналоги нуклеотидов: Аналоги нуклеотидов - это нуклеотиды, структурно близкие (аналоги) природным нуклеотидам, включающие модификации фосфатного каркаса, модификации сахаров или модификации нуклеиновых оснований.
Синтез нуклеиновых кислот: Молекулы нуклеиновых кислот, применяемые в настоящем изобретении и описанные в нем, могут быть получены, используя какой-либо метод, известный в данной области, включая методы синтеза, например, твердофазного синтеза, размножения in vivo (например, размножения вирусов in vivo), а также методы in vitro, например реакции транскрипции in vitro.
В настоящем изобретении молекулу РНК получают путем транскрипции in vitro соответствующей молекулы ДНК. Такая матрица ДНК предпочтительно включает необходимый промотор, например, промотор Т7 или SP6, для транскрипции in vitro, за которым следует требуемая нуклеотидная последовательность, кодирующая молекулу РНК, которую хотят получить, и сигнал терминации транскрипции in vitro. Молекула ДНК, формирующая матрицу по меньшей мере для одной целевой РНК, может быть получена путем ферментативного размножения и последующего выделения в виде части плазмиды, которая может быть реплицирована в бактериях. К плазмидам, которые можно рассматривать в качестве применимых в настоящем изобретении, относятся, например, плазмиды pUC18, pUC19, pBR322, pT7Ts (GenBank номер U26404; Lai с соавт., 1995), серия pGEM®, например, pGEM®-1 (GenBank номер X65300; фирма Promega) и pSP64 (GenBank номер X65327); см. также Mezei, Storts, 2001.
РНК: Аббревиатуру «РНК» обычно применяют для обозначения рибонуклеиновой кислоты. Это молекула нуклеиновой кислоты, т.е. полимер, состоящий из нуклеотидов. Нуклеотидами обычно являются мономеры аденозинмонофосфат, уридинмонофосфат, гуанозинмонофосфат и цитидинмонофосфат, которые соединены друг с другом вдоль так называемого каркаса молекулы. Каркас молекулы сформирован фосфодиэфирными связями между сахаром, т.е. рибозой, первого мономера и фосфатом второго соседнего мономера. Специфическая последовательность мономеров называется последовательностью РНК.
Матричная РНК (мРНК): В эукариотических клетках транскрипция обычно происходит внутри ядра или митохондрий. In vivo транскрипция ДНК обычно приводит к формированию так называемой преждевременной РНК, которая должна быть переработана в так называемую матричную РНК, обычно сокращенно обозначаемую «мРНК». Переработка преждевременной РНК, например, в эукариотических организмах, включает множество различных посттранскрипционных модификаций, таких как сплайсинг, 5'-кэпирование, полиаденилирование, экспорт из ядра или митохондрий и тому подобное. Сумму этих процессов также называют созреванием мРНК. Зрелая мРНК обычно представляет нуклеотидную последовательность, которая может быть транслирована в аминокислотную последовательность определенного пептида или белка. Обычно зрелая мРНК включает 5'-кэп, 5'-нетранслируемую область (5'НТО), открытую рамку считывания, 3'(НТО) и последовательность поли(А). В контексте настоящего изобретения мРНК также может быть искусственной молекулой, т.е. молекулой, не существующей в природе. Это означает, что мРНК в контексте настоящего изобретения может, например, включать комбинацию 5'НТО, открытую рамку считывания, 3'НТО и последовательность поли(А), которые в такой комбинации в природе не существуют.
Самореплицирующаяся РНК (репликоны): Самореплицирующиеся РНК являются векторами доставки, основанными на альфа-вирусах, разработанных из вируса леса Семлики (Semliki Forest virus - SFV), вируса Синдбис (Sindbis -SIN) и вируса венесуэльского энцефалита лошадей (Venezuelan equine encephalitis - VEE). Альфа-вирусы представляют вирусы одноцепочечной РНК, в которой структурные гены альфа-вируса могут быть замещены на целевые гетерологичные гены. Помещая структурные гены in trans, репликон РНК упаковывают в частицы репликона (replicon particles - RP), которые можно применять для генной терапии или для генетической вакцинации (см., например, Vander Veen с соавт., 2012). После попадания в клетку-хозяина геномная вирусная РНК сначала служит в качестве мРНК для трансляции вирусных неструктурных белков (nonstructural proteins - nsPs), необходимых для инициации амплификации вирусной РНК. Репликация РНК происходит через синтез минус-цепи полной длины, используемой в качестве матрицы для синтеза дополнительных РНК размером с геном и для транскрипции плюс-цепи субгеномной РНК от внутреннего промотора. Такие РНК затем можно рассматривать в качестве самореплицирующихся РНК, поскольку неструктурные белки, ответственные за репликацию (и транскрипцию гетерологичных генов) остаются в таком репликоне. Описанные альфа-вирусные векторы называют «репликонами».
Последовательность молекулы нуклеиновой кислоты: Последовательность молекулы нуклеиновой кислоты обычно рассматривают в качестве специфической индивидуальной структуры, обусловленной порядком расположения нуклеотидов.
Открытая рамка считывания: Открытая рамка считывания (ОРС) в контексте настоящего изобретения, как правило, может представлять собой последовательность из нескольких нуклеотидных триплетов, которые могут быть транслированы в пептид или белок. Открытая рамка считывания предпочтительно содержит стартовый кодон, т.е. комбинацию трех последовательно расположенных нуклеотидов, кодирующих обычно аминокислоту метионин (АТГ или АУГ) на 5'-конце и последующей области, длина которой обычно кратна 3 нуклеотидам. ОРС предпочтительно заканчивается спот-кодоном (например, ТАА, ТАГ, ТГА). Обычно открытая рамка считывания имеет единственный стоп-кодон. Таким образом, открытая рамка считывания в контексте настоящего изобретения предпочтительно представляет нуклеотидную последовательность, состоящую из ряда нуклеотидов, которые могут быть поделены по три, которая начинается со стартового кодона (например, АТГ или АУГ) и предпочтительно заканчивается стоп-кодоном (например, ТАА, ТГА, или ТАГ или УАА, УАГ, УГА, соответственно). Открытая рамка считывания может быть изолированной или может быть включена в более длинную последовательность нуклеиновой кислоты, например, в вектор или мРНК. Открытая рамка считывания также может быть названа «областью кодирования белка» или «кодирующей областью».
Оптимизированная для последовательности реакционная смесь: Реакционная смесь для применения в реакции транскрипции in vitro молекулы РНК заданной последовательности, включающая четыре нуклеотидтрифосфата (НТФ) ГТФ, АТФ, ЦТФ и УТФ, где доля (2) каждого из четырех нуклеозидтрифосфатов (НТФ) в оптимизированной для последовательности реакционной смеси соответствует доле (1) соответствующего нуклеотида в указанной молекуле РНК, также включает буфер, матрицу ДНК и РНК-полимеразу. Если рибонуклеотид отсутствует в указанной молекуле РНК, то он отсутствует и в оптимизированной для последовательности реакционной смеси.
Оптимизированная для последовательности смесь нуклеозидтрифосфатов (НТФ): смесь нуклеозидтрифосфатов (НТФ) для применения в реакции транскрипции in vitro молекулы РНК заданной последовательности, включающая четыре нуклеозидтрифосфата (НТФ) ГТФ, АТФ, ЦТФ и УТФ, где доля (2) каждого из четырех нуклеозидтрифосфатов (НТФ) в оптимизированной для последовательности смеси нуклеозидтрифосфатов (НТФ) соответствует доле (1) соответствующего нуклеотида в указанной молекуле РНК. Если рибонуклеотид отсутствует в определенной молекуле РНК, то он отсутствует и в оптимизированной для этой последовательности смеси трифосфатов (НТФ).
Модифицированный нуклеозидтрифосфат: Понятие «модифицированный нуклеозидтрифосфат» в контексте настоящего изобретения относится к химическим модификациям, в том числе модификациям каркаса молекулы, а также модификациям сахаров и модификациям оснований. Такие модифицированные нуклеозидтрифосфаты в контексте настоящего изобретения также называют (нуклеотидными) аналогами.
В этом контексте модифицированные нуклеозидтрифосфаты, согласно описанному в настоящем изобретении, являются аналогами/модификациями нуклеотидов, например, модификации молекулы, модификации сахаров или модификации оснований. Модификация каркаса по настоящему изобретению является модификацией, в которой фосфаты каркаса нуклеотидов химически модифицированы. Модификация сахаров по настоящему изобретению является химической модификацией сахара в нуклеотидах. Кроме того, модификация оснований по настоящему изобретению представляет химическую модификацию основания, как части молекулы нуклеотида. В этом контексте нуклеотидные аналоги или модификации предпочтительно выбирают из аналогов нуклеотидов, которые применимы для транскрипции и/или трансляции.
Модификации сахаров
Модифицированные нуклеозиды или нуклеотиды, которые можно применять в контексте настоящего изобретения, могут быть модифицированы в части молекулы, представленной сахаром. Например, 2'-гидроксильная группа (ОН) может быть модифицирована по числу разных «окси» или «дезокси» заместителей. К примерам модификаций «окси»-2'-гидроксильной группы относятся, но ими перечень не исчерпывается, алкокси или арилокси (-OR, например, R=Н, алкил, циклоалкил, арил, аралкил, гетероарил или сахар); полиэтиленгликоли (polyethyleneglycol - PEG), -O(CH2CH2O)nCH2CH2OR; «закрытая» нуклеиновая кислота («locked» nucleic acid - LNA), в которой 2'-гидроксил соединен, например, метиленовым мостом с 4'-углеродом некоторых сахаров рибозы; и аминогруппы (-О-амино, где аминогруппой, например, NRR, может быть алкиламино, диалкиламино, гетероциклил, ариламино, диариламино, гетероариламино или дигетероариламино, этилендиамин, полиамино) или аминоалкокси.
«Дезокси»-модификации включают водород, амино (например, алкиламино, диалкиламино, гетероциклил, ариламино, диариламино, гетероариламино, дигетероариламино или аминокислота); или аминогруппа может быть присоединена к сахару через линкер, который включает один или несколько атомов C, N и О.
Группа сахара также может содержать один или несколько атомов углерода, которые обладают противоположной стереохимической конфигурацией относительно соответствующего углерода в рибозе. Например, модифицированный нуклеотид может включать, например, сахар арабинозу.
Модификации каркаса
Фосфатный каркас также может быть дополнительно модифицирован в модифицированных нуклеозидах и нуклеотидах. Фосфатные группы каркаса могут быть модифицированы путем замещения одного или нескольких атомов кислорода разными заместителями. Кроме того, модифицированные нуклеозиды и нуклеотиды могут включать полную замену немодифицированного фосфата модифицированным фосфатом согласно описанию настоящего изобретения. К примерам модифицированных фосфатных групп относятся, но ими перечень не ограничивается, фосфоротиоат, фосфороселенаты, боранофосфаты, сложные эфиры боранофосфатов, фосфонаты водорода, фосфороамидаты, алкил или арилфосфонаты и фосфотриэфиры. Фосфородитиоаты содержат два несшивающих атома кислорода, замещенные серой. Фосфатный линкер также может быть модифицирован путем замещения связующего кислорода на азот (соединенные мостом фосфороамидаты), серу (соединенные мостом фосфоротиоаты) и углерод (соединенные мостом метиленфосфонаты).
Модификации оснований
Модифицированные нуклеозиды и нуклеотиды, которые могут быть использованы в настоящем изобретении, могут иметь дополнительную модификацию, затрагивающую основание как часть молекулы. К примерам нуклеиновых оснований, обнаруженных в РНК, относятся, но ими перечень не ограничивается, аденин, гуанин, цитозин и урацил. Например, нуклеозиды и нуклеотиды, описанные в настоящем изобретении, могут быть химически модифицированы по большой бороздке. В некоторых вариантах осуществления настоящего изобретения химические модификации большой бороздки могут включать аминогруппу, тиоловую группу, алкильную группу или галогеновую группу.
В особенно предпочтительных вариантах осуществления настоящего изобретения аналоги/модификации нуклеотидов выбирают из модификаций оснований, которые предпочтительно выбраны из группы, включающей: 2-амино-6-хлорпуринрибозид-5'-трифосфат, 2-аминопуринрибозид-5'-трифосфат; 2-аминоаденозин-5'-трифосфат, 2'-амино-2'-дезоксицитидинтрифосфат, 2-тиоцитидин-5'-трифосфат, 2-тиоуридин-5'-трифосфат, 2'-фтортимидин-5'-трифосфат, 2'-O-метилинозин-5'-трифосфат, 4-тиоуридин-5'-трифосфат, 5-аминоаллилцитидин-5'-трифосфат, 5-аминоаллилуридин-5'-трифосфат, 5-бромцитидин-5'-трифосфат, 5-бромуридин-5'-трифосфат, 5-бром-2'-дезоксицитидин-5'-трифосфат, 5-бром-2'-дезоксиуридин-5'-трифосфат, 5-иодоцитидин-5'-трифосфат, 5-иодо-2'-дезоксицитидин-5'-трифосфат, 5-иодоуридин-5'-трифосфат, 5-иодо-2'-дезоксиуридин-5'-трифосфат, 5-метилцитидин-5'-трифосфат, 5-метилуридин-5'-трифосфат, 5-пропинил-2'-дезоксицитидин-5'-трифосфат, 5-пропинил-2'-дезоксиуридин-5'-трифосфат, 6-азацитидин-5'-трифосфат, 6-азауридин-5'-трифосфат, 6-хлорпуринрибозид-5'-трифосфат, 7-деазааденозин-5'-трифосфат, 7-деазагуанозин-5'-трифосфат, 8-азааденозин-5'-трифосфат, 8-азидоаденозин-5'-трифосфат, бензимидазолрибозид-5'-трифосфат, N1-метиладенозин-5'-трифосфат, N1-метилгуанозин-5'-трифосфат, N6-метиладенозин-5'-трифосфат, O6-метилгуанозин-5'-трифосфат, псевдоуридин-5'-трифосфат, или пуромицин-5'-трифосфат, ксантозин-5'-трифосфат. Особое предпочтение отдают нуклеотидам с модификациями оснований из группы, включающей: 5-метилцитидин-5'-трифосфат, 7-деазагуанозин-5'-трифосфат, 5-бромцитидин-5'-трифосфат и псевдоуридин-5'-трифосфат.
В некоторых вариантах осуществления настоящего изобретения к модифицированным нуклеозидам относят пиридин-4-он-рибонуклеозид, 5-азауридин, 2-тио-5-азауридин, 2-тиоуридин, 4-тиопсевдоуридин, 2-тиопсевдоуридин, 5-гидроксиуридин, 3-метилуридин, 5-карбоксиметилуридин, 1-карбоксиметилпсевдоуридин, 5-пропинилуридин, 1-пропинилпсевдоуридин, 5-тауринометилуридин, 1-тауринометилпсевдоуридин, 5-тауринометил-2-тиоуридин, 1-тауринометил-4-тиоуридин, 5-метилуридин, 1-метилпсевдоуридин, 4-тио-1-метилпсевдоуридин, 2-тио-1-метилпсевдоуридин, 1-метил-1-деазапсевдоуридин, 2-тио-1-метил-1-деазапсевдоуридин, дигидроуридин, дигидропсевдоуридин, 2-тиодигидроуридин, 2-тиодигидропсевдоуридин, 2-метоксиуридин, 2-метокси-4-тиоуридин, 4-метоксипсевдоуридин и 4-метокси-2-тиопсевдоуридин.
В некоторых вариантах осуществления настоящего изобретения к модифицированным нуклеозидам относят 5-азацитидин, псевдоизоцитидин, 3-метилцитидин, N4-ацетилцитидин, 5-формилцитидин, N4-метилцитидин, 5-оксиметилцитидин, 1-метилпсевдоизоцитидин, пирролцитидин, пирролпсевдоизоцитидин, 2-тиоцитидин, 2-тио-5-метил-цитидин, 4-тиопсевдоизоцитидин, 4-тио-1-метил-псевдоизоцитидин, 4-тио-1-метил-1 -деазапсевдоизоцитидин, 1-метил-1-деазапсевдоизоцитидин, зебуларин, 5-азазебуларин, 5-метилзебуларин, 5-аза-2-тио-зебуларин, 2-тиозебуларин, 2-метоксицитидин, 2-метокси-5-метилцитидин, 4-метоксипсевдоизоцитидин и 4-метокси-1-метил-псевдоизоцитидин.
В других вариантах осуществления настоящего изобретения к модифицированным нуклеозидам относят 2-аминопурин, 2,6-диаминопурин, 7-деазааденин, 7-деаза-8-азааденин, 7-деаза-2-аминопурин, 7-деаза-8-аза-2-аминопурин, 7-деаза-2,6-диаминопурин, 7-деаза-8-аза-2,6-диаминопурин, 1-метиладенозин, N6-метиладенозин, N6-изопентиладенозин, N6-(цис-гидроксиизопентинил)аденозин, 2-метилтио-N6-(цис-гидроксиизопентинил) аденозин, N6-глицинилкарбамоиладенозин, N6-треонилкарбамоиладенозин, 2-метилтио-N6-треонил карбамоиладенозин, N6,N6-диметиладенозин, 7-метиладенин, 2-метилтиоаденин и 2-метоксиаденин.
В некоторых вариантах осуществления настоящего изобретения к модифицированным нуклеозидам относят инозин, 1-метилинозин, виозин, вибутозин, 7-деазагуанозин, 7-деаза-8-азагуанозин, 6-тиогуанозин, 6-тио-7-деазагуанозин, 6-тио-7-деаза-8-азагуанозин, 7-метилгуанозин, 6-тио-7-метилгуанозин, 7-метилинозин, 6-метоксигуанозин, 1-метилгуанозин, N2-метилгуанозин, N2,N2-диметилгуанозин, 8-оксогуанозин, 7-метил-8-оксогуанозин, 1-метил-6-тиогуанозин, N2-мeтил-6-тиoгyaнoзин и N2,N2-диметил-6-тиогуанозин.
В других вариантах осуществления настоящего изобретения нуклеотид может быть модифицирован по большой бороздке и может включать замещаемый водород по положению С-5 урацила на метильную группу или галогенную группу.
В некоторых вариантах осуществления настоящего изобретения модифицированным нуклеозидом является 5'-O-(1-тиофосфат)аденозин, 5'-O-(1-тиофосфат)цитидин, 5'-O-(1-тиофосфат)гуанозин, 5'-O-(1-тиофосфат)уридин или 5'-O-(1-тиофосфат)-псевдоуридин.
В другом варианте осуществления настоящего изобретения к модифицированным нуклеозидам относят модификации нуклеозидов из группы, включающей 6-азацитидин, 2-тиоцитидин, α-тиоцитидин, псевдоизоцитидин, 5-аминоаллилуридин, 5-иодоуридин, N1-метилпсевдоуридин, 5,6-дигидроуридин, α-тиоуридин, 4-тиоуридин, 6-азауридин, 5-оксиуридин, дезокситимидин, 5-метилуридин, пирролцитидин, инозин, α-тиогуанозин, 6-метилгуанозин, 5-метилцитидин, 8-оксогуанозин, 7-деазагуанозин, N1-метиладенозин, 2-амино-6-хлорпурин, N6-метил-2-аминопурин, псевдоизоцитидин, 6-хлорпурин, N6-метиладенозин, α-тиоаденозин, 8-азидоаденозин, 7-деазааденозин.
Ранее были описаны другие модифицированные нуклеотиды (WO 2013052523).
Выход: Выход, также называемый выходом продукта реакции, означает количество продукта, полученного в химической или энзиматической реакции. Абсолютный выход может быть выражен в виде массы в граммах или в молях (молярный выход). Относительный выход, дробный выход или процентный выход, которые выражают эффективность процесса синтеза, рассчитывают путем деления количества полученного продукта на теоретически возможный выход (единицы измерений должны быть едиными).
Относительный выход = (реальный выход)/(теоретически возможный выход)
Реальный выход: Реальный выход означает количество продукта, полученного в результате химической реакции.
Теоретически возможный выход: Теоретически возможный выход означает максимальное количество продукта, которое может быть получено в идеально эффективной химической или ферментативной реакции. На практике большинство реакций не обладает великолепной эффективностью - реальный выход обычно меньше теоретически возможного выхода. Теоретически возможный выход рассчитывают, основываясь на мольном количестве лимитирующего реагента, учитывая стехиометрию реакции. Для расчета обычно допускают, что происходит только одна реакция.
Выход РНК: Выход РНК означает количество продукта, полученного в реакции транскрипции in vitro. Выход РНК может быть выражен в виде концентрации РНК (г/мл или моль/л). Умножение концентрации РНК на объем реакции показывает абсолютное количество РНК (в граммах или молях).
Реальный выход РНК: Реальный выход РНК означает экспериментально определенное количество продукта (РНК) в реакции транскрипции in vitro в определенный момент времени, например выход после окончания реакции. Например, концентрацию РНК можно определить по измерению оптической плотности при 260 нм по использованию спектрофотометра (Kolitz с соавт., 2013). Одна единица поглощения при 260 нм соответствует 40 нг/мкл РНК (1 А260=40 нг/мкл РНК).
Теоретически возможный выход РНК: Теоретически возможный выход РНК означает максимально возможный выход РНК, основанный на доступных НТФ в реакции транскрипции in vitro. Обычно в стандартной реакции транскрипции с равными концентрациями четырех НТФ (АТФ, ГТФ, ЦТФ, УТФ) нуклеотид, который соответствует наиболее часто встречаемому нуклеотиду в последовательности РНК, становится лимитирующим фактором. В оптимизированной для последовательности реакции транскрипции, при использовании оптимизированной для целевой последовательности смеси НТФ ни один из нуклеотидов не становится лимитирующим фактором.
Для расчета теоретически возможного выхода РНК в реакции транскрипции количество каждого НТФ (в молях) на момент начала реакции транскрипции делят на число соответствующих нуклеотидов, присутствующих в последовательности молекулы РНК, и получают возможное число молекул РНК, которые могут быть синтезированы (в молях). Умножая на молекулярную массу РНК, получают теоретически возможный выход РНК в единицах массы (граммы). В стандартной реакции транскрипции при использовании равных концентраций каждого НТФ тот НТФ, который соответствует наиболее часто встречающемуся нуклеотиду в последовательности РНК, становится лимитирующим фактором для синтеза молекул РНК. Напротив, в оптимизированной для последовательности реакции транскрипции ни один из НТФ не становится лимитирующим фактором, поскольку все типы НТФ содержатся в том же соотношении, что и соответствующие нуклеотиды в последовательности молекулы РНК.
Относительный выход РНК: Относительный выход РНК, долевой выход РНК или процентный выход РНК, которые выражают эффективность процесса синтеза, рассчитывают путем деления количества полученного продукта РНК (реальный выход РНК) на теоретически возможный выход РНК (единицы измерений должны быть едиными):
Относительный выход РНК = (реальный выход РНК)/(теоретически возможный выход РНК)
Для выражения эффективности реакции транскрипции in vitro может быть рассчитан процентный выход РНК:
Процентный выход РНК = (реальный выход РНК)/(теоретически возможный выход РНК)×100
Подробное описание изобретения
Настоящее изобретение относится к способу синтеза молекулы РНК заданной последовательности, включающему следующие стадии:
а) определения доли (1) каждого из четырех нуклеотидов Г, А, Ц и У в указанной молекуле РНК и
б) синтеза указанной молекулы РНК путем транскрипции in vitro в оптимизированной для последовательности реакционной смеси, причем указанная оптимизированная для последовательности реакционная смесь включает четыре рибонуклеотида ГТФ, АТФ, ЦТФ и УТФ, причем доля (2) каждого из четырех рибонуклеотидов в оптимизированной для последовательности реакционной смеси соответствует доле (1) соответствующего нуклеотида в указанной молекуле РНК, буфер, матрицу ДНК и РНК-полимеразу.
В контексте настоящего изобретения, как это показано в примере 1 и на фиг. 5 и 6, установлено, что применение оптимизированной для последовательности реакционной смеси, содержащей четыре рибонуклеозидтрифосфата (НТФ) ГТФ, АТФ, ЦТФ и УТФ, для получения молекулы РНК с заданной последовательностью методом транскрипции in vitro приводит к повышенному выходу продукта РНК и небольшому количеству не включенных и соответственно использованных впустую НТФ по сравнению с неоптимизированной реакционной смесью с эквимолярными начальными концентрациями всех четырех НТФ. Этот аспект особенно важен, если применяют модифицированные нуклеотиды, которые трудно синтезировать и потому они дороги. В оптимизированной для последовательности НТФ смеси ГТФ, АТФ, ЦТФ и УТФ содержатся в пропорциях, которые соответствуют пропорциям указанных нуклеотидов Г, А, Ц и У, содержащихся в указанной последовательности РНК. Предполагают, что в оптимизированных для последовательности реакциях транскрипции in vitro четыре НТФ потребляются в равной степени и транскрипция продолжается до тех пор, пока НТФ не будут использованы, тем самым впустую тратят меньше материала.
Кроме того, ожидают, что вышеуказанной вероятности синтеза молекул РНК, которые длиннее кодирующей РНК, например, из-за самокомплементарной 3'-протяженности (Triana-Alonso с соавт., 1995), можно избежать при использовании оптимизированных для последовательности смесей НТФ, поскольку к концу реакции не остается избытка УТФ. Особенно, если РНК содержит поли (А) хвост, что обычно для таких РНК, а именно мРНК, избыток не включенного в реакцию транскрипции УТФ может привести к зависимому от матрицы РНК включению уридиновых нуклеотидов напротив поли-А-последовательности, в результате чего возникают двухцепочечные молекулы РНК, которые могут активировать врожденный иммунный ответ и понизить синтез белка (Kariko с соавт., 2011).
Ниже будут детально рассмотрены способы получения молекул РНК с помощью транскрипции in vitro, известные в данной области. Также известно применение аналогов нуклеотидов для улучшения, например, стабильность молекулы РНК. В настоящем изобретении рассматривают концентрацию рибонуклеозидтрифосфатов (НТФ) в реакционной смеси реакции транскрипции in vitro.
Таким образом, на первой стадии способа по настоящему изобретению определяют долю (1) каждого из четырех нуклеотидов Г, А, Ц и У в указанной молекуле РНК. Это можно выполнить каким-либо из известных в данной области способов, например, путем простого подсчета числа нуклеотидов или с помощью компьютерных методов.
Доля (1) каждого из нуклеотидов затем может быть охарактеризована в каких-либо соответствующих терминах, в том числе в числах, процентах, единицах мольной доли или мольных процентах. Мольную или молярную долю (xi) представляют в виде количества компонента (выраженного в молях), ni, поделенного на общее количество компонентов в смеси, ntot. Сумма всех мольных долей равна 1. Та же концепция, выраженная со знаменателем 100, означает мольный процент или молярное процентное соотношение (моль %).
Основываясь на доле каждого из нуклеотидов в указанной молекуле РНК, на следующей стадии способа по настоящему изобретению указанную молекулу РНК синтезируют методом транскрипции in vitro в оптимизированной для последовательности реакционной смеси, включающей четыре рибонуклеозидтрифосфата (НТФ) ГТФ, АТФ, ЦТФ и УТФ или их аналоги, и где доля (2) каждого из четырех рибонуклеозидтрифосфатов (НТФ) в оптимизированной для последовательности реакционной смеси соответствует доле (1) соответствующего нуклеотида в указанной молекуле РНК.
В предпочтительном варианте осуществления настоящего изобретения стадия б) способа по настоящему изобретению включает подстадии:
б1) получения оптимизированной для последовательности смеси рибонуклеозидтрифосфатов (НТФ), включающей четыре рибонуклеозидтрифосфата (НТФ) ГТФ, АТФ, ЦТФ и УТФ, где доля (2) каждого из четырех рибонуклеозидтрифосфатов (НТФ) в оптимизированной для последовательности смеси рибонуклеозидтрифосфатов (НТФ) соответствует доле (1) соответствующего нуклеотида в указанной молекуле РНК, и
б2) синтеза указанной молекулы РНК методом транскрипции in vitro в оптимизированной для последовательности реакционной смеси, включающей оптимизированную для последовательности реакционную смесь рибонуклеозидтрифосфатов (НТФ) подстадии (б1), буфер, матрицу ДНК и РНК-полимеразу.
Таким образом, в таком предпочтительном варианте осуществления настоящего изобретения оптимизированную для последовательности смесь рибонуклеозидтрифосфатов (НТФ) получают, исходя из определения доли (1), и затем эту смесь добавляют в реакционную смесь. Все приведенные выше определения, касающиеся оптимизированной для последовательности реакционной смеси, и особенно те, которые относятся к заключению «доля (1) соответствует доле (2)», также применяют к оптимизированной для последовательности смеси рибонуклеозидтрифосфатов (НТФ).
В связи с изложенным выше специалистам в данной области, очевидно, что если указанная молекула РНК не содержит всех нуклеотидов Г, А, Ц и У, соответственно, то же самое будет относиться к оптимизированной для последовательности смеси рибонуклеозидтрифосфатов (НТФ) и к оптимизированной для последовательности реакционной смеси.
Согласно настоящему изобретению понятие «доля (1) соответствует доле (2)» означает, что доля рибонуклеозидтрифосфатов (НТФ) в оптимизированной для последовательности смеси НТФ или в оптимизированной для последовательности реакционной смеси адаптирована к доле нуклеотидов в молекуле РНК. Специалисту очевидно, что нет необходимости в том, чтобы доля (2) в точности отражала долю (1), но что требуется, чтобы отдельные доли (2) каждого рибонуклеозидтрифосфата в оптимизированной для последовательности смеси НТФ или в оптимизированной для последовательности реакционной смеси отражали долю (1) соответствующего нуклеотида в указанной молекуле РНК.
Для более подробного описания соотношения между долей (1) и долей (2) ниже подробнее рассматривают формулировку «доля (1) соответствует доле (2)»:
а) Применительно к доле рибонуклеозидтрифосфата в оптимизированной для последовательности смеси НТФ или в оптимизированной для последовательности реакционной смеси, которая соответствует первому нуклеотиду синтезируемой молекулы РНК, в соответствии с одним из вариантов осуществления настоящего изобретения, допустимо, что доля (2) предпочтительно находится в диапазоне доли (1), например, доля (1) и доля (2) отличаются не более чем на 25%, 20%, 15%, 10%, 7%, 5% или на величину от 0,1% до 5%.
б) Применительно к другим рибонуклеозидтрифосфатам в оптимизированной для последовательности смеси НТФ или в оптимизированной для последовательности реакционной смеси, которая не соответствует первому нуклеотиду указанной молекулы РНК, доля (2) предпочтительно находится в диапазоне доли (1), например, доля (1) и доля (2) различаются не более чем на 25%, 20%, 15%, 10%, 7%, 5% или на величину от 0,1% до 5%.
В предпочтительном варианте осуществления настоящего изобретения стартовый нуклеотид вносят в оптимизированную для последовательности смесь НТФ или в оптимизированную для последовательности реакционную смесь до начала транскрипции in vitro. Стартовым нуклеотидом является нуклеотид, который соответствует первому нуклеотиду указанной молекулы РНК (позиция +1). Стартовый нуклеотид могут специально добавлять для повышения скорости инициации РНК-полимеразы. Указанные стартовые нуклеотиды также известны в данной области и включают нуклеозидмонофосфат, нуклеозиддифосфат, нуклеотидтрифосфат. Стартовый нуклеотид может быть мононуклеотидом, динуклеотидом или тринуклеотидом. Первым нуклеотидом может быть мононуклеотид, динуклеотид или тринуклеотид. Если первым нуклеотидом указанной молекулы РНК является Г, стартовый нуклеотид предпочтительно ГТФ или ГМФ.
В предпочтительном варианте осуществления настоящего изобретения указанным стартовым нуклеотидом является динуклеотид. В еще более предпочтительном варианте осуществления настоящего изобретения стартовым нуклеотидом является аналог кэпа.
В предпочтительном варианте осуществления настоящего изобретения аналог кэпа выбран из группы, состоящей из G[5']ppp[5']G, m7G[5']ppp[5']G, m32,2,7G[5']ppp[5']G, m27,3'-OG[5']ppp[5']G (3'-ARCA), m27,2'-OGpppG (2'-ARCA), m27,2'-OGppspG D1 (β-S-ARCA D1) и m27,2'-OGppspG D2 (β-S-ARCA D2).
Однако в другом предпочтительном варианте осуществления настоящего изобретения в оптимизированной для последовательности смеси НТФ или в оптимизированной для последовательности реакционной смеси стартовый нуклеотид, соответствующий первому нуклеотиду указанной молекулы РНК, вносят в избытке по сравнению с долей этого нуклеотида в указанной молекуле РНК, который обнаружен в первом положении указанной молекулы РНК.
Предпочтительно стартовый нуклеотид вносят в начальной концентрации в диапазоне примерно 1-20 мМ, 1-17,5 мМ, 1-15 мМ, 1-12,5 мМ, 1-10 мМ, 1-7,5 мМ, 1-5 мМ или 1-2,5 мМ. Еще более предпочтительно стартовый нуклеотид вносят в начальной концентрации примерно 5-20 мМ или 7,5-17,5 мМ.
В предпочтительном приведенном выше варианте осуществления настоящего изобретения первый нуклеотид молекулы РНК представлен Г, стартовый нуклеотид является аналогом Г и соответствующий рибонуклеозидтрифосфат является ГТФ. В таком варианте осуществления настоящего изобретения аналог кэпа присутствует в реакционной смеси в избытке по сравнению с ГТФ. Предпочтительно аналог кэпа вносят в начальной концентрации в диапазоне примерно 1-20 мМ, 1-17,5 мМ, 1-15 мМ, 1-12,5 мМ, 1-10 мМ, 1-7,5 мМ, 1-5 мМ или 1-2,5 мМ. Еще более предпочтительно аналог кэпа вносят в начальной концентрации примерно 5-20 мМ, 7,5-20 мМ, 10-20 мМ или 12,5-20 мМ.
Методы транскрипции in vitro известны в данной области (Geall с соавт., 2013; Brunelle с соавт., 2013). К реагентам, используемым в данных методах, обычно относят:
1) линеаризованную матрицу ДНК с последовательностью промотора, обладающую высоким связывающим сродством для соответствующей РНК-полимеразы, например, из числа РНК-полимераз бактериофагов,
2) рибонуклеозидтрифосфаты (НТФ) для четырех оснований (аденина, цитозина, гуанина и урацила);
3) аналог кэпа согласно описанному выше (например, m7G(5')ppp(5')G (m7G));
4) ДНК-зависимую РНК-полимеразу (например, РНК-полимеразу Т7, Т3 или SP6);
5) ингибитор рибонуклеазы (РНазы) для инактивирования какой-либо комтаминантной РНазы;
6) пирофосфотазу для разрушения пирофосфата, который может ингибировать транскрипцию;
7) MgCl2, который поставляет Mg2+ в качестве ко-фактора полимеразы;
8) буфер для поддержания требуемой величины pH, который также может содержать антиоксиданты и полиамины, например спермидин, в оптимальных концентрациях.
В предпочтительном варианте осуществления настоящего изобретения в оптимизированную для последовательности реакционную смесь, которую применяют для патентоспособного способа синтеза молекулы РНК заданной последовательности, вносят буфер, выбранный из группы, включающей 4-(2-оксиэтил)-1-пиперазинэтансульфоновую кислоту (4-(2-hydroxyethyl)-1-piperazineethanesulfonic acid - HEPES) и трис(оксиметил)аминометан (tris(hydroxymethyl)aminomethane - Tris). Предпочтительно буфер применяют в концентрации 10-100 мМ, 10-75 мМ, 10-50 мМ, 10-40 мМ, 10-30 мМ или 10-20 мМ. Величину pH буфера могут корректировать, например, NaOH, KOH или HCl. Предпочтительно буфер имеет pH 6-8,5, 6,5-8,0, 7,0-7,5, еще более предпочтительно 7,5. Наиболее предпочтителен буфер, выбранный из группы, включающей 80 мМ HEPES/KOH, pH 7,5 и 40 мМ Tris/HCl, pH 7,5.
В предпочтительном варианте осуществления настоящего изобретения РНК-полимеразу, включенную в оптимизированную для последовательности реакционную смесь, выбирают из группы, состоящей из РНК-полимераз Т3, Т7 и SP6. Предпочтительно концентрация РНК-полимеразы составляет примерно 1-100 нМ, 1-90 нМ, 1-80 нМ, 1-70 нМ, 1-60 нМ, 1-50 нМ, 1-40 нМ, 1-30 нМ, 1-20 нМ или примерно 1-10 нМ. В еще более предпочтительном варианте концентрация РНК-полимеразы составляет примерно 10-50 нМ, 20-50 нМ или 30-50 нМ. Наиболее предпочтительна концентрация РНК-полимеразы примерно 40 нМ. В связи с этим концентрация 500-10000 ЕД/мл РНК-полимеразы предпочтительна. Более предпочтительна концентрация 1000-7500 ЕД/мл и наиболее предпочтительна концентрация РНК-полимеразы 2500-5000 ЕД/мл. Специалисту в данной области очевидно, что выбор концентрации РНК-полимеразы обусловлен концентрацией матрицы ДНК.
В предпочтительном варианте осуществления настоящего изобретения концентрация матрицы ДНК, включенной в оптимизированную для последовательности реакционную смесь, находится в диапазоне примерно 1-50 нМ, 1-40 нМ, 1-30 нМ, 1-20 нМ или примерно 1-10 нМ. Еще более предпочтительна концентрация матрицы ДНК примерно 10-30 нМ. Наиболее предпочтительна концентрация матрицы ДНК примерно 20 нМ. В этом контексте особенно предпочтительна концентрация матрицы ДНК примерно 1-200 мкг/мл, более предпочтительна примерно 10-100 мкг/мл и наиболее предпочтительна концентрация примерно 20-50 мкг/мл (например, 25 или 50 мкг/мл).
В предпочтительном варианте осуществления настоящего изобретения оптимизированная для последовательности реакционная смесь включает пирофосфатазу. Предпочтительно концентрация пирофосфатазы составляет примерно 1-20 ЕД/мл, 1-15 ЕД/мл, 1-10 ЕД/мл, 1-5 ЕД/мл или 1-2,5 ЕД/мл. Еще более предпочтительна концентрация пирофосфатазы примерно 1 ЕД/мл или примерно 5 ЕД/мл.
В предпочтительном варианте осуществления настоящего изобретения оптимизированная для последовательности реакционная смесь включает ионы Mg++. Предпочтительно ионы Mg++ представляют в форме MgCl2 или Mg(OAc)2. Предпочтительно начальная концентрация свободного Mg++ составляет примерно 1-100 мМ, 1-75 мМ, 1-50 мМ, 1-25 мМ или 1-10 мМ. Еще более предпочтительная начальная концентрация свободного Mg++ составляет примерно 10-30 мМ или примерно 15-25 мМ. Наиболее предпочтительная начальная концентрация свободного Mg++ составляет примерно 24 мМ. Специалисту в данной области очевидно, что на выбор концентрации Mg++ влияет общая суммарная начальная концентрация НТФ.
В предпочтительном варианте осуществления настоящего изобретения оптимизированная для последовательности реакционная смесь включает восстанавливающее средство для сохранения РНК-полимеразы в активном состоянии. Предпочтительно восстанавливающее средство выбирают из группы, включающей дитиотреитол (ДТТ), дитиоэритритол (ДТЭ), трис(2-сарбоксиэтил)фосфин (ТКЭФ) и β-меркаптоэтанол. Предпочтительно концентрация восстанавливающего средства составляет примерно 1-50 мМ, 1-40 мМ, 1-30 мМ, или 1-20 мМ, или 1-10 мМ. Еще более предпочтительная концентрация восстанавливающего средства составляет примерно 10-50 мМ или 20-40 мМ. Наиболее предпочтительной является оптимизированная для последовательности реакционная смесь, включающая 40 мМ ДТТ.
В предпочтительном варианте осуществления настоящего изобретения оптимизированная для последовательности реакционная смесь включает полиамин. Предпочтительно полиамин выбирают из группы, включающей спермин и спермидин. Предпочтительно концентрация полиамина составляет примерно 1-25 мМ, 1-20 мМ, 1-15 мМ, или 1-10 мМ, или 1-5 мМ или примерно 2,5 мМ. Еще более предпочтительная концентрация полиамина составляет примерно 2 мМ или 20-40 мМ. Наиболее предпочтительной является оптимизированная для последовательности реакционная смесь, включающая 2 мМ спермидина.
В предпочтительном варианте осуществления настоящего изобретения оптимизированная для последовательности реакционная смесь включает ингибитор рибонуклеазы. Предпочтительно концентрация ингибитора рибонуклеазы составляет примерно 1-500 ЕД/мл, 1-400 ЕД/мл, 1-300 ЕД/мл, 1-200 ЕД/мл или 1-100 ЕД/мл. Еще более предпочтительная концентрация ингибитора рибонуклеазы составляет примерно 200 ЕД/мл.
В предпочтительном варианте осуществления настоящего изобретения начальная суммарная концентрация НТФ в оптимизированной для последовательности смеси НТФ или в оптимизированной для последовательности реакционной смеси составляет менее 20 мМ, менее 15 мМ, менее 10 мМ, менее 7,5 мМ, менее 5,0 мМ или менее 2,5 мМ.
В предпочтительном варианте осуществления настоящего изобретения понятие «начальная суммарная концентрация» означает общую концентрацию НФТ, например, сумму концентраций АТФ, ГТФ, ЦТФ и/или УТФ, которые изначально находятся в оптимизированной для последовательности смеси НТФ или в оптимизированной для последовательности реакционной смеси, когда различные компоненты оптимизированной для последовательности реакционной смеси объединяют в итоговом объеме для проведения реакции транскрипции in vitro. Естественно, что по мере протекания реакции нуклеотиды инкорпорируют в молекулу РНК, и в результате суммарная концентрация нуклеотидов постепенно уменьшалась относительно исходной величины.
Главная задача, решаемая в настоящем изобретении, заключается в том, что применение оптимизированной для последовательности смеси НТФ или оптимизированной для последовательности реакционной смеси приводит к повышенной эффективности синтеза РНК даже при низких начальных суммарных концентрациях нуклеотидов (например, 2 мМ). Напротив, ранее предполагали, что для повышенного выхода РНК необходимы высокие концентрации суммарных нуклеотидов порядка 12 мМ-40 мМ (US 6586218).
Кроме того, ожидают, что синтез коротких абортивных молекул РНК уменьшается при низких начальных суммарных концентрациях нуклеотидов (например, 2,5 мМ) в оптимизированной для последовательности смеси НТФ или оптимизированной для последовательности реакционной смеси. Напротив, повышение абортивной транскрипции наблюдают, когда концентрациях НТФ стандартной эквимолярной смеси НТФ снижается ниже примерно 2 мМ (Kern с соавт., 1999).
Другой предпочтительный вариант осуществления настоящего изобретения относится к форме, в которой НТФ добавляют к оптимизированной для последовательности смеси НТФ или оптимизированной для последовательности реакционной смеси. Рибонуклеозидтрифосфаты (НТФ) ГТФ, АТФ, ЦТФ и УТФ или их аналоги могут применять вместе с одновалентными или двухвалентными катионами в качестве противоиона. Предпочтительно одновалентный катион выбирают из группы, состоящей из Li+, Na+, K+, NH4+ или трис(оксиметил)аминометана (триса). Предпочтительно двухвалентный катион выбирают из группы, состоящей из Mg++, Ва++ и Mn++.
В наиболее предпочтительном варианте осуществления настоящего изобретения противоионом НТФ является трис(оксиметил)аминометан (трис).
Известно, что РНК-полимеразы бактериофагов чувствительны к ингибированию солями. Описано отрицательное воздействие высоких концентраций NaCl на выход РНК (например, Kern, Davis, 1997; US 6586218 В2). Высокие концентрации Na-НТФ, особенно когда придерживаются метода подпитки НТФ, могут приводить к снижению выхода РНК. Это осложнение может быть преодолено за счет применения трис-нуклеотидов, поскольку активность РНК-полимеразы меньше подвергается действию высоких концентраций триса по сравнению с высокими концентрациями Na. В примере 5 и на фиг. 12 показывают, что выход РНК чувствительнее к добавлению Na по сравнению с добавлением триса.
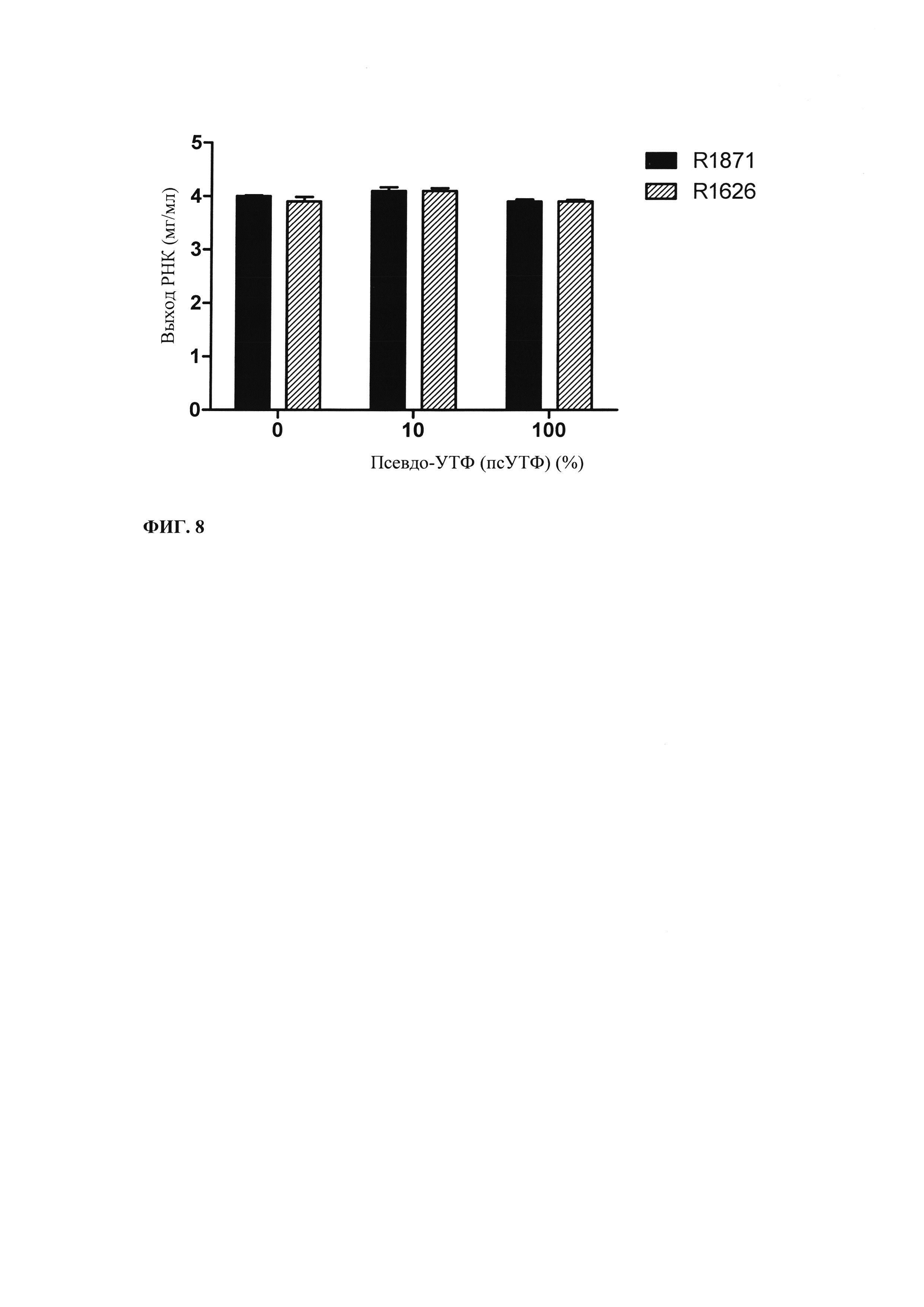
В данной области известно, что вместо рибонуклеозидтрифосфатов ГТФ, ФТФ, ЦТФ и УТФ, соответственно, могут применять модифицированные нуклеотидтрифосфаты (аналоги) в реакциях транскрипции in vitro, например, чтобы повысить стабильность РНК. В примере 3 и на фиг. 8 показывают, что часть или все УТФ в оптимизированной для последовательности смеси НТФ или оптимизированной для последовательности реакционной смеси могут быть заменены на псевдо-УТФ.
Таким образом, в предпочтительном варианте осуществления настоящего изобретения по меньшей мере один рибонуклеозид частично или полностью может быть заменен на модифицированный нуклеозидтрифосфат в оптимизированной для последовательности смеси НТФ или оптимизированной для последовательности реакционной смеси.
В предпочтительном варианте осуществления настоящего изобретения указанный модифицированный нуклеозидтрифосфат выбран из группы, включающей псевдоуридин-5'-трифосфат, 1-метилпсевдоуридин-5'-трифосфат, 2-тиоуридин-5'-трифосфат, 4-тиоуридин-5'-трифосфат и 5-метилцитидин-5'-трифосфат.
Специалистам в данной области очевидно, что можно только до начала транскрипции in vitro точно установить концентрации отдельных компонентов оптимизированной для последовательности смеси НТФ или оптимизированной для последовательности реакционной смеси. Следовательно, в предпочтительном варианте осуществления настоящего изобретения числа и доли, описанные выше, отражают начальные условия, имеющиеся в оптимизированной для последовательности смеси рибонуклеозидтрифосфатов (НТФ) и в оптимизированной для последовательности реакционной смеси до начала транскрипции.
В другом предпочтительном варианте осуществления настоящего изобретения при осуществлении транскрипции in vitro в оптимизированную для последовательности реакционную смесь вносят оптимизированную для последовательности смесь рибонуклеозидтрифосфатов (НТФ) согласно описанию настоящего изобретения.
В контексте настоящего изобретения установлено, что выход РНК может быть дополнительно повышен путем внесения в реакцию транскрипции in vitro подпитки дополнительными количествами оптимизированной для последовательности смеси НТФ (подпитка НТФ). В примере 1 и на фиг. 6 показано, что дополнительное внесение оптимизированной для последовательности смеси НТФ существенно повышает выход РНК.
Свежую оптимизированную для последовательности смесь НТФ добавляют таким образом, что сохраняют требуемое соотношение аналога кэпа к соответствующему нуклеотиду, например, ГТФ (например, 4:1). Предпочтительно свежую оптимизированную для последовательности смесь НТФ добавляют в конце реакции транскрипции in vitro, когда все нуклеотиды в оптимизированной для последовательности реакционной смеси израсходованы. Соотношение остающегося аналога кэпа к свежедобавленному соответствующему нуклеотиду, например ГТФ (например, 4:1), примерно может поддерживаться, поскольку аналог кэпа сохраняется в количестве, близком к 100% в конце реакции транскрипции, что объясняется тем, что только одна молекула аналога кэпа может включаться в одну молекулу РНК. Такая стратегия не меняет эффективности кэпирования, повышает выход продукта (более чем в 4,5 раза в зависимости от последовательности РНК) и резко сокращает его стоимость. Кроме того, повышенное содержание НТФ предотвращает осаждение молекул РНК в процессе транскрипции, что обычно наблюдают при стандартных концентрациях НТФ (как для стандартных, так и для оптимизированных для последовательности реакций).
Зависящее от последовательности включение НТФ также позволяет осуществлять мониторинг хода реакции in vitro. В примере 6 и на фиг. 13 показано, что мониторинг реакции in vitro можно осуществлять путем разделения невстроенных в последовательность нуклеотидов в ходе реакции транскрипции in vitro и измерением оптической плотности при 260 нм. Причина заключается в том, что снижение общей концентрации всех четырех НТФ непосредственно коррелирует с количеством синтезированной РНК. Такой прямой подход был бы невозможен, если бы использовали стандартную смесь НТФ с равным соотношением нуклеозидтрифосфатов. Снижение поглощения при 260 нм можно непосредственно учитывать и переводить в получаемые молекулы РНК, отделенные от РНК и ДНК для предотвращения интерференции, например, фильтрацией через мембрану с низкой величиной номинального отсечения по молекулярной массе (molecular weight cut-off - MWCO).
Методы количественного подсчета содержания нуклеиновых кислот и нуклеотидов известны в данной области. К спектрофотометрическим методам количественного определения нуклеиновых кислот относят традиционные измерения оптической плотности (Kolitz с соавт., 2013) и более чувствительные методы флуоресценции с использованием флуоресцентных красителей, например, этидиумбромида, и флуориметра с требуемой длиной волны возбуждения (например, 302 или 546 нм) (Gallagher, 2011). Таким образом, в предпочтительном варианте осуществления настоящего изобретения после синтеза указанной молекулы РНК методом транскрипции in vitro отделяют и подсчитывают количество невстроенных в последовательность НТФ.
В предпочтительном варианте осуществления настоящего изобретения указанную молекулу выбирают из группы, состоящей из некодирующих и кодирующих молекул РНК.
Некодирующей молекулой РНК (нкРНК; ncRNA) является функциональная молекула РНК, которая не транслируется в пептид или белок. К некодирующим молекулам РНК относятся широко распространенные и функционально важные РНК, например, транспортная РНК (тРНК; tRNA) и рибосомальная РНК (рРНК; rRNA), например, малая нуклеолярная РНК (мноРНК; snoRNA), микроРНК (microRNA), малая интерферирующая РНК (миРНК; siRNA), малая ядерная РНК (мяРНК; snRNA), внеклеточная РНК (вкРНК; exRNA), малая некодирующая РНК (пнРНК; piRNA) и длинная нкРНК, например, Xist и HOTAIR (Esteller, 2011). Кроме того, к молекулам некодирующей РНК относят иммуностимулирующую РНК (исРНК; isRNA).
Предпочтительно иммуностимулирующая РНК может быть линейной одноцепочечной РНК. Более предпочтительно, если иммуностимулирующая РНК может быть длинной линейной одноцепочечной некодирующей РНК. В этом контексте особенно предпочтительно, если исРНК несет трифосфат с 5'-конца.
Иммуностимулирующая РНК (исРНК) может включать какую-либо последовательность РНК, о которой известно присущее ей иммуностимулирующее действие, например, включая, но ими перечень не ограничивается, последовательности РНК, представляющие и/или кодирующие лиганды Toll-подобных рецепторов (Toll-like-receptor - TLR), предпочтительно выбранные из семейства представителей TLR1-TLR10 человека или семейства представителей TLR1-TLR13 грызунов, более предпочтительно выбранные из семейства представителей TLR1-TLR10 человека, еще более предпочтительно из TLR7 и TLR8, лиганды к внутриклеточным рецепторам РНК (например, RIG-I, MDA-5 или PKR) (Meylan, Tschopp, 2006), или какую-либо иную иммуностимулирующую последовательность РНК. Кроме того, молекулы иммуностимулирующей РНК могут включать какую-либо иную РНК, способную вызывать врожденный иммунный ответ. Такая иммуностимулирующая РНК может включать, но ими не ограничиваться, рибосомальную РНК (рРНК), транспортную РНК (тРНК), матричную РНК (мРНК) и вирусную РНК (вРНК). Предпочтительно иммуностимулирующая РНК не является кодирующей РНК. Такая иммуностимулирующая РНК может содержать 1000-5000, 500-5000, 5-5000 или 5-1000, 5-500, 5-250, 5-100, 5-50 или 5-30 нуклеотидов.
В другом предпочтительном варианте осуществления настоящего изобретения такие молекулы иммуностимулирующей РНК состоят из РНК формулы (1) или включают ее:

где:
G обозначает гуанозин (гуанин), уридин (урацил) или аналог гуанозина (гуанина) или уридина (урацила), предпочтительно гуанозин (гуанин) или его аналог;
X обозначает гуанозин (гуанин), уридин (урацил), аденозин (аденин), тимидин (тимин), цитидин (цитозин) или аналог этих нуклеотидов (нуклеозидов), предпочтительно уридин (урацил) или его аналог;
N обозначает последовательность нуклеиновой кислоты, длиной примерно 4-50, предпочтительно примерно 4-40, более предпочтительно примерно 4-30 или 4-20 нуклеотидов, каждый нуклеотид N независимо выбирают из гуанозина (гуанина), уридина (урацила), аденозина (аденина), тимидина (тимина), цитидина (цитозина) или аналогов этих нуклеотидов (нуклеозидов);
а означает целое число от 1 до 20, предпочтительно от 1 до 15, наиболее предпочтительно от 1 до 10;
l означает целое число от 1 до 40,
где если l=1, G обозначает гуанозин (гуанин) или его аналог,
где l>1 по меньшей мере 50% указанных нуклеотидов (нуклеозидов) являются гуанозином (гуанином) или его аналогом;
m означает целое число по меньшей мере 3;
причем если m=3, X обозначает уридин (урацил) или его аналог, и
если m>3, присутствует по меньшей мере 3 последовательно расположенных уридина (урацила) или аналогов уридина (урацила);
n означает целое число от 1 до 40,
причем если n=1, G обозначает гуанозин (гуанин) или его аналог,
если n>1 по меньшей мере 50% указанных нуклеотидов (нуклеозидов) являются гуанозином (гуанином) или его аналогом;
u, v могут независимо друг от друга обозначать целое число от 0 до 50,
предпочтительно если u=0, v≥1 или
если v=0, u≥1;
где молекула нуклеиновой кислоты формулы (I) содержит в длину по меньшей мере 50 нуклеотидов, предпочтительно по меньшей мере 100 нуклеотидов, более предпочтительно по меньшей мере 150 нуклеотидов, еще более предпочтительно по меньшей мере 200 нуклеотидов и наиболее предпочтительно по меньшей мере 250 нуклеотидов.
В наиболее предпочтительном варианте осуществления настоящего изобретения молекулой РНК формулы (1) может быть выбрана, например, молекула следующей последовательности:

Кодирующая РНК является функциональной молекулой РНК, которая может быть транслирована в пептид или белок. Предпочтительно молекула кодирующей РНК включает по меньшей мере одну открытую рамку считывания, кодирующую по меньшей мере один пептид или белок.
В этом контексте молекула кодирующей РНК может включать одну (моноцистронная), две (бицистронная) или более (полицистронная) открытых рамок считывания (ОРС). Молекула кодирующей РНК может быть молекулой матричной РНК (мРНК), молекулой вирусной РНК (вРНК) или самореплицирующейся молекулой РНК (репликон). Предпочтительно молекулой РНК является мРНК.
В предпочтительном варианте осуществления настоящего изобретения указанная молекула РНК длинее 100 нуклеотидов. В равной степени предпочтительно, если длина РНК 100-15000 нуклеотидов, 100-12500, 100-10000 нуклеотидов, 100-7500 нуклеотидов, 100-5000 нуклеотидов, 100-2500 нуклеотидов, 100-1500 нуклеотидов или 100-1000 нуклеотидов.
В предпочтительном варианте осуществления настоящего изобретения указанный синтез молекулы РНК заданной последовательности проводят крупномасштабным синтезом.
В контексте настоящего изобретения понятие «крупный масштаб» относится к выходу указанной молекулы РНК в результате реакции в количестве, исчисляемом миллиграммами, предпочтительно по меньшей мере в количестве одного грамма.
В предпочтительном варианте осуществления настоящего изобретения реакцию транскрипции in vitro проводят в биореакторе, также называемом реактором транскрипции или РНК-реакторе для крупномасштабного синтеза РНК. Таким образом, биореактор может быть адаптирован для осуществления описанного выше способа настоящего изобретения.
В контексте настоящего изобретения таким биореактором для синтеза молекул РНК заданной последовательности, предпочтительно в крупном масштабе, является система реактора для транскрипции in vitro модульной конструкции, включающая реакционный модуль для проведения реакций транскрипции РНК in vitro в оптимизированной для последовательности реакционной смеси, модуль-ловушку для временного захвата молекул транскрибированной РНК, и контрольный модуль для контроля подачи компонентов оптимизированной для последовательности реакционной смеси в реакционный модуль. Реакционный модуль включает фильтрующую мембрану для отделения нуклеотидов от реакционной смеси и контролирует подачу компонентов оптимизированной для последовательности реакционной смеси с помощью контрольного модуля, основанного на измеренной концентрации отделенных нуклеотидов.
Понятие «биореактор» или «реактор для транскрипции» в контексте настоящего изобретения означает камеру, или пробирку, или колонку, в которых реакцию транскрипции in vitro проводят в определенных условиях. Температуру в биореакторе можно регулировать для поддержания точной определенной температуры, обычно от 4°C до 40°C. Биореактор может быть оснащен притоком или линией подпитки и выходным портом. Биореактор может иметь мешалку для обеспечения переменных скоростей перемешивания.
В настоящем изобретении биореактор содержит фильтрующую мембрану для отделения нуклеотидов из реакционной смеси, в частности, для отделения нуклеотидов и других низкомолекулярных компонентов из оптимизированной для последовательности реакционной смеси. Введение фильтрующей мембраны в такую жидкостную систему, например, мембраны для ультрафильтрации, применяют для отделения высокомолекулярных компонентов, например, белков и/или полинуклеотидов, от низкомолекулярных компонентов, таких как нуклеотиды. Фильтрующая мембрана служит для избирательного сохранения иммобилизованной матрицы ДНК, РНК-полимеразы и синтезированных молекул РНК в активной зоне реакционного модуля, при этом молекулы меньшего размера, например, нуклеотиды (НТФ), могут проникать сквозь фильтрующую мембрану в отдельный меньшего размера отсек реакционного модуля, т.е. фильтрационный отсек. Концентрация нуклеотидов затем может быть измерена, например, с помощью спектроскопического анализа в отделенной жидкости, содержащей низкомолекулярные компоненты. В качестве альтернативы, концентрация нуклеотидов может быть измерена с помощью системы ВЭЖХ онлайн. Применение оптимизированной для последовательности смеси НТФ в такой системе реактора позволяет измерять в реальном времени концентрации нуклеотидов в ходе реакции транскрипции in vitro, чтобы проводить мониторинг хода реакции транскрипции in vitro.
Подходящие фильтрующие мембраны могут состоять из различных материалов, известных специалисту в данной области (van de Merbel, 1999). Например, мембраны могут состоять из регенерированной или модифицированной целлюлозы или из синтетических материалов. К последним относятся полисульфон (ПСУ), полиакрилонитрил (ПАН), полиметилметакрилат (ПММА), смеси полиарилэфирсульфонов, поливинилпирролидона и полиамида (продукт Polyamix.RTM.). Например, к полисульфонам относят полиэфирсульфон поли(окси-1,4-фенилсульфонил-1,4-фенил) [ПЭС]. В некоторых вариантах осуществления настоящего изобретения полиэфирсульфон можно использовать в качестве полупроницаемой мембраны при осуществлении настоящего изобретения. В некоторых случаях мембраны ПЭС обладают повышенной гидрофильностью (и/или улучшенной смачиваемостью мембраны водой) по сравнению с мембранами ПСУ. В некоторых вариантах осуществления настоящего изобретения смачиваемость мембран ПЭС, например, может быть дополнительно увеличена за счет включения водорастворимого полимера поливинилпирролидона.
Важным параметром, который влияет на прохождение молекул через фильтрующую мембрану, является размер пор или распределение пор по размерам. Фильтрующую мембрану обычно характеризуют величиной номинального отсечения по молекулярной массе (molecular weight cut-off-MWCO), т.е. определенным ограничительным размером, который соответствует молекулярной массе наименьшего соединения, которое сохраняется более чем на 90%. Для каждого применения необходимо выбрать должную величину MWCO таким образом, чтобы высокомолекулярные соединения в основном задерживались, но в то же время чтобы обеспечивался быстрый перенос анализируемого вещества. Величина MWCO фильтрующей мембраны биореактора по настоящему изобретению может быть в диапазоне 10-100 кДа, 10-75 кДа, 10-50 кДа, 10-25 кДа или 10-15 кДа. Еще более предпочтительно величина MWCO фильтрующей мембраны находится в диапазоне примерно 10-50 кДа. Предпочтительно фильтрующая мембрана выбрана из группы, в которую входит регенерированная целлюлоза, модифицированная целлюлоза, полисульфон (ПСУ), полиакрилонитрил (ПАН), полиметилметакрилат (ПММА), поливиниловый спирт (ПВС) и полиарилэфирсульфон (ПАЭС).
В предпочтительном варианте осуществления настоящего изобретения биореактор включает иммобилизованную на твердом носителе матрицу ДНК в качестве основы для реакции транскрипции РНК. Иммобилизованная матрица ДНК позволяет повторно использовать матрицу и снижать контаминацию продукта РНК за счет остаточной ДНК. Кроме того, иммобилизация делает применение ДНКазы несущественным для удаления матрицы ДНК из конечного продукта РНК. Матрица ДНК, которая предпочтительно иммобилизована на твердом носителе в активной зоне реакционного модуля, может быть химически синтезированной молекулой ДНК, выделенным фрагментом рестрикции ДНК, плазмидой или амплифицированной молекулой ДНК, например, путем амплификации, например, в ходе полимеразной цепной реакции (ПЦР). Матрица ДНК может быть двухцепочечным дуплексом или единицей, состоящей из двухцепочечной области промотора выше по цепи от одноцепочечной РНК-кодирующей области. Матрица ДНК может быть модифицирована лигандом для иммобилизации на твердом носителе с 5'-конца, 3'-конца или по внутреннему нуклеотиду цепи ДНК.
В контексте настоящего изобретения понятие «твердый носитель» относится к каждой нерастворимой основе, на поверхности которой можно иммобилизовать молекулу ДНК. Твердый носитель может быть выбран из группы, состоящей из агарозы, модифицированной агароза, сефароза, полистирола, латекса, целлюлозы и ферро- или ферромагнитных частиц. Методы и стратегии выбора требуемых твердых подложек и соединения молекул ДНК с такой твердой подложкой известны в данной области (смотри, например, Arndt-Jovin с соавт., 1975; Kerrigan с соавт., 2001; WO 1995/08626). Иммобилизация матрицы ДНК на твердом носителе может быть осуществлена через ковалентную или нековалентную связь. Предпочтительно иммобилизация матрицы ДНК осуществляется через нековалентную связь. Например, иммобилизация матрицы ДНК к твердому носителю осуществляется через нековалентное взаимодействие биотина-стрептавидина. Некодирующая цепь матрицы ДНК может быть модифицирована за счет 5'-концевой группы биотина, функция которой заключается в иммобилизации цепи ДНК на твердой подложке матрикса, включающего белок стрептавидин. Комплементарная РНК-кодирующая цепь матрицы ДНК может оставаться неиммобилизованной. Также возможна иммобилизация матриц ДНК на твердых основах за счет других типов нековалентных связей, например, поли(А)-поли(Т) и поли(Г)-поли(Ц) взаимодействий. Не менее предпочтительна иммобилизация матрицы ДНК посредством ковалентной связи, например, сложноэфирной связи или ее производной. Обычно перед соединением твердая основа может содержать активные группы, например, NHS, карбодиимид и др., способные вступать в реакцию соединения с молекулой ДНК. Молекула ДНК может быть соединена с твердой подложкой посредством прямой связи (например, используя функциональные группы амино-, сульфгидрильную-, карбоксильную-, гидроксильную-, альдегидные и кетонные группы). Связь с материалом твердой основы может включать в себя спейсеры для оптимизации пространственного разделения матрицы ДНК и основы. Спейсер может быть обеспечен путем инсерции дополнительных нуклеотидов на 5'-конце матрицы ДНК.
В соответствии с предпочтительным вариантом осуществления настоящего изобретения модуль захвата биореактора включает смолу/твердую фазу для захвата транскрибированных молекул РНК и для отделения транскрибированных молекул РНК от других растворимых компонентов оптимизированной для последовательности смеси для реакции транскрипции. Предпочтительно модуль захвата включает средства очистки захваченных транскрибированных молекул РНК, например, с помощью процесса промывки или др. Также предпочтительно, если модуль захвата включает средство для элюирования захваченных транскрибированных молекул РНК, предпочтительно с помощью элюирующего буфера.
В другом предпочтительном варианте осуществления настоящего изобретения биореактор дополнительно включает модуль оттока для возвращения оставшейся отфильтрованной оптимизированной для последовательности реакционной смеси, т.е. других растворимых компонентов оптимизированной для последовательности реакционной смеси за исключением транскрибированных молекул РНК, предпочтительно когда средством возвращения оставшейся отфильтрованной оптимизированной для последовательности реакционной смеси является насос. Таким образом, установленный модуль оттока предпочтительно включает иммобилизованные ферменты, например, пирофосфатазу, или смолу для захвата разрушающих компонентов, например, фосфата.
В предпочтительном варианте осуществления настоящего изобретения биореактор включает по меньшей мере один ионоизбирательный электрод. В контексте настоящего изобретения понятие «ионоизбирательный электрод» относится к датчику (например, к сенсору), который конвертирует активность специфического иона, растворенного в растворе, в электрический потенциал, причем электрический потенциал можно измерить, например, с помощью вольтметра или pH-метра. В частности понятие «ионоизбирательный электрод» в контексте настоящего изобретения подразумевает систему, включающую или состоящую из мембраны, обладающей избирательной проницаемостью, и обычно разделяет два электролита. В настоящем изобретении ионоизбирательный электрод обычно включает сенсорную часть, которая предпочтительно содержит мембрану, обладающую избирательно проницаемостью, и электрод сравнения. Мембрана обычно ионоизбирательна и отличается разной проницаемостью для разных типов ионов. Предпочтительно по меньшей мере один ионоизбирательный электрод биореактора включает мембрану, выбранную из группы, в которую входят стеклянная мембрана, твердотельная мембрана, мембрана на жидкой основе и составная мембрана.
В предпочтительных вариантах осуществления настоящего изобретения биореактор, описанный в настоящем изобретении, содержит по меньшей мере один ионоизбирательный электрод, причем по меньшей мере один ионоизбирательный электрод содержит или состоит из системы, содержащей мембрану, предпочтительно мембрану, описанную в настоящем изобретении, более предпочтительно электрохимическую мембрану с разной проницаемостью для различных типов ионов, причем мембрана, предпочтительно описанная в настоящем изобретении, более предпочтительно электрохимическая мембрана, разделяющая два электролита. В одном из вариантов осуществления настоящего изобретения мембрана содержит или состоит из слоя твердого электролита или раствора электролита в растворителе, несмешивающемся с водой. Предпочтительно мембрана находится в контакте с раствором электролита с одной или с обеих сторон. В предпочтительном варианте осуществления настоящего изобретения ионоизбирательный электрод содержит внутренний электрод сравнения. В некоторых вариантах осуществления настоящего изобретения такой внутренний эталонный электрод сравнения может быть замещен, например, металлическим контактом, диэлектриком или полупроводниковым слоем.
Благодаря ионоизбирательному электроду достигают высокой чувствительности, быстрого, точного и неразрушительного измерения активности или концентраций иона в разных средах. Помимо непосредственных измерений активностей ионов или концентраций ионов они могут, в частности, с помощью калибровочной кривой, осуществлять прямой мониторинг изменений концентраций, в качестве элементов контроля дозы агентов или в качестве очень точных индикаторных электродов в потенциометрических титрованиях.
В предпочтительных вариантах осуществления настоящего изобретения биореактор содержит по меньшей мере один ионоизбирательный электрод, предпочтительно описанный в настоящем изобретении, для измерения концентрации одного или нескольких типов ионов по меньшей мере в одном отсеке биореактора. Например по меньшей мере один ионоизбирательный электрод можно применять для измерения концентрации одного или нескольких типов ионов в реакционном модуле, контрольном модуле или модуле оттока биореактора. Предпочтительно по меньшей мере один ионоизбирательный электрод применяют для измерения концентрации одного или нескольких типов ионов в реакционном модуле, более предпочтительно в активной зоне реакционного модуля или в отсеке фильтрации. Кроме того, по меньшей мере один ионоизбирательный электрод может быть включен в сенсорный блок биореактора, предпочтительно согласно описанию настоящего изобретения. Ионоизбирательный электрод может быть расположен в самом биореакторе, на биореакторе или вне биореактора (например, может быть присоединен к биореактору обходным путем). В контексте настоящего изобретения фраза «биореактор содержит по меньшей мере один ионоизбирательный электрод» таким образом, может относиться к ситуации, когда по меньшей мере один ионоизбирательный электрод является частью биореактора, или к ситуации, когда по меньшей мере один ионоизбирательный электрод является отдельным физическим предметом относительно биореактора, но который используют вместе с биореактором.
В некоторых вариантах осуществления настоящего изобретения биореактор содержит по меньшей мере один ионоизбирательный электрод, предпочтительно описанный в настоящем изобретении, для измерения концентрации одного или нескольких типов ионов в жидкости, находящейся по меньшей мере в одном отсеке биореактора, причем ион предпочтительно выбран из группы, включающей Н+, Na+, K+, Mg2+, Са2+, Сl- и РО43-.
В некоторых вариантах осуществления настоящего изобретения биореактор включает по меньшей мере один ионоизбирательный электрод, предпочтительно описанный в настоящем изобретении, который соединен с потенциометром, предпочтительно многоканальным потенциометром (например, 6-канальным потенциометром высокого разрешения CITSens Ion Potentiometer, фирма C-CIT Sensors AG, Швейцария).
В предпочтительном варианте осуществления настоящего изобретения биореактор включает по меньшей мере один ионоизбирательный электрод, причем по меньшей мере один ионоизбирательный электрод предпочтительно является трубчатым электродом, более предпочтительно выбранным из группы, включающей Mg2+-избирательный трубчатый электрод, Na++-избирательный трубчатый электрод, Cl-+-избирательный трубчатый электрод, РО43-+-избирательный трубчатый электрод, pH-избирательный трубчатый электрод и Са2++-избирательный трубчатый электрод, которые предпочтительно применяют в соединении с потенциометром. Еще более предпочтительно биореактор включает по меньшей мере один ионоизбирательный электрод, причем по меньшей мере один ионоизбирательный электрод предпочтительно выбранный из группы, включающей CITSens Ion Mg2+-избирательный мини-трубчатый электрод, CITSens Ion Na+-избирательный мини-трубчатый электрод, CITSens Ion Cl--избирательный мини-трубчатый электрод, CITSens Ion РО43+-избирательный мини-трубчатый электрод, CITSens Ion рН-избирательный мини-трубчатый электрод и CITSens Ion Са2+-избирательный мини-трубчатый электрод (все электроды фирмы C-CIT Sensors AG, Швейцария), предпочтительно в соединении с потенциометром, более предпочтительно с многоканальным потенциометром, например, 6-канальным потенциометром высокого разрешения CITSens Ion Potentiometer, (фирма C-CIT Sensors AG, Швейцария).
Ионоизбирательные электроды имеют многочисленные преимущества для практического использования. Например, они не влияют на исследуемый раствор и поэтому проводить неразрушающие измерения. Кроме того, ионоизбирательные электроды мобильны, применимы для непосредственных измерений, а также в качестве датчиков титрований и экономически эффективны. Основное преимущество использования ионоизбирательного электрода в биореакторе (например, биореакторе для транскрипции) заключается в возможности измерения in situ без отбора проб и без причинения разрушений.
В предпочтительном варианте осуществления настоящего изобретения биореактор, или точнее контрольный модуль биореактора, включает сенсорный блок для анализа параметров важных процессов, например, величины pH, электропроводности и концентрации нуклеотидов в оптимизированной для последовательности реакционной смеси. Предпочтительно сенсорный блок биореактора включает датчик, например, УФ проточную кювета для длины волны в области УФ 260/280 нм для измерения в реальном времени концентрации нуклеотидов по ходу реакции транскрипции in vitro. Предпочтительно датчик сенсорного блока измеряет концентрацию нуклеотидов в качестве параметра процесса с помощью фотометрического анализа.
В соответствии с предпочтительным вариантом осуществления настоящего изобретения биореактор включает контрольный модуль. Сбор данных и анализ с помощью контрольного модуля позволяет контролировать встроенную насосную систему (привод) для повторных подпиток компонентами оптимизированной для последовательности смеси НТФ или компонентами оптимизированной для последовательности реакционной смеси, например, буферными компонентами, РНК-полимеразой или нуклеотидами. Плотное контролирование и регулирование позволяет проводить реакцию транскрипции in vitro при оптимальном устойчивом состоянии, что приводит к высоким выходом продукта. Предпочтительно контрольный модуль управляет добавлением оптимизированной для последовательности смеси рибонуклеозидтрифосфатов (НТФ) к оптимизированной для последовательности реакционной смеси, предпочтительно когда указанный биореактор содержит привод для добавления оптимизированной для последовательности смеси рибонуклеозидтрифосфатов (НТФ) к оптимизированной для последовательности реакционной смеси. Кроме того, через привод также можно добавить другие компоненты реакции оптимизированной для последовательности реакционной смеси, например, компоненты буфера, или Mg++, к смеси для реакции транскрипции in vitro. В соответствии с другим предпочтительным вариантом осуществления настоящего изобретения, биореактор работает в полунепрерывном или непрерывном режиме. Понятие «полунепрерывный режим» в контексте настоящего изобретения относится к операции в реакции транскрипции in vitro в качестве повторяющихся серий реакций транскрипции. Например, реакции дают возможность протекать в течение конечного времени, и затем продукт удаляют, новые реагенты добавляют и повторяют полный цикл реакции. Понятие «непрерывный режим» в контексте настоящего изобретения относится к реакции, которую проводят непрерывно в активной зоне реакционного модуля биореактора с дополнительными реагентами, постоянно добавляемыми через входящую питающую линию, и продуктами реакции, которые постоянно удаляют через выходной порт. Реактор непрерывного режима контролирует доставку реагентов и удаление продуктов реакции через контролирующее скорость устройство, что является преимуществом для реакций с ограничениями подачи реагентов и ингибирующих продуктов.
В другом объекте настоящее изобретение относится к молекуле РНК, получаемой описанным способом по настоящему изобретению. Предпочтительно РНК, полученная с помощью способа по настоящему изобретению, отличается пониженной иммуностимулирующей активностью по сравнению с РНК, полученной с помощью способов предшествующего уровня техники, в частности, по сравнению с РНК, полученной с помощью способа транскрипции in vitro, в котором смесь НТФ не оптимизирована в отношении транскрибируемой последовательности, например, с помощью способа с использованием стандартной эквимолярной смеси НТФ.
Другой объект настоящего изобретения относится к применению оптимизированной для последовательности смеси НТФ, оптимизированной для молекулы РНК заданной последовательности для синтеза указанной молекулы РНК. Все определения и конкретные варианты осуществления настоящего изобретения, относящиеся к оптимизированной для последовательности смеси рибонуклеозидтрифосфатов (НТФ), сделанной выше по отношению к способу по настоящему изобретению, также применимы к указанному применению по настоящему изобретению.
Главным образом, в соответствии с предпочтительным вариантом осуществления настоящего изобретения оптимизированную для последовательности смесь НТФ оптимизируют способом, включающим следующие стадии:
а) определения доли (1) каждого из четырех нуклеотидов Г, А, Ц и У в указанной молекуле РНК и
б) получения оптимизированной для последовательности смеси рибонуклеозидтрифосфатов (НТФ), включающей четыре рибонуклеозидтрифосфата (НТФ) ГТФ, АТФ, ЦТФ и УТФ, причем доля (2) каждого из четырех рибонуклеозидтрифосфатов в оптимизированной для последовательности смеси рибонуклеозидтрифосфатов (НТФ) соответствуют доле (1) соответствующего нуклеотида в указанной молекуле РНК.
Другой объект настоящего изобретения также относится к оптимизированной для последовательности смеси рибонуклеотидтрифосфатов (НТФ) для синтеза молекулы РНК заданной последовательности, включающей четыре рибонуклеозидтрифосфата ГТФ, АТФ, ЦТФ и УТФ, причем доля (2) каждого из четырех рибонуклеозидтрифосфатов в оптимизированной для последовательности смеси рибонуклеозидтрифосфатов (НТФ) соответствуют доле (1) соответствующего нуклеотида в указанной молекуле РНК.
Другой объект настоящего изобретения также относится к набору, содержащему оптимизированную для последовательности смесь рибонуклеотидтрифосфатов (НТФ), оптимизированную для молекулы РНК заданной последовательности согласно описанному выше. Оптимизированная для последовательности смесь НТФ может быть получена в одной пробирке, содержащей все четыре типа НТФ (ГТФ, АТФ, ЦТФ и УТФ) или каждый НТФ находится в отдельной пробирке. Все определения или конкретные варианты осуществления настоящего изобретения, сделанные выше и касающиеся способа по настоящему изобретению также применимы к указанному набору по настоящему изобретению.
Краткое описание фигур
Приводимые ниже фигуры предназначены только для дополнительного пояснения и иллюстрации настоящего изобретения. Эти фигуры не ограничивают области охвата настоящего изобретения.
Фиг. 1. Г/Ц оптимизированная последовательность мРНК R1871, кодирующей антиген стволовых клеток простаты Homo sapiens (HsPSCA), которая соответствует SEQ ID NO: 1.
Фиг. 2. Г/Ц оптимизированная последовательность мРНК R2988, кодирующей люциферазу Photinus pyralis (PpLuc), которая соответствует SEQ ID NO: 2.
Фиг. 3. Г/Ц оптимизированная последовательность мРНК R1626, кодирующей Homo sapiens сигнальный пептид муцин-1/рецептор эпидермального фактора роста/ муцин-1 гибридный белок (EGFR/муцин-1), которая соответствует SEQ ID NO: 3.
Фиг. 4. Последовательность некодирующей иммуностимулирующей РНК R2025, которая соответствует SEQ ID NO: 4.
Фиг. 5. Выходы РНК в зависимости от времен, а именно мРНК, кодирующей HsPSCA (R1871) и EGFR/муцин-1 (R1626). Молекулы мРНК синтезируют методом транскрипции in vitro, согласно описанному в примере 1.
(А) Выход РНК в стандартных реакциях транскрипции, достигающих плато примерно через 30 мин примерно при 1,4 мг/мл РНК, а именно РНК длиной 5337 нуклеотидов, кодирующая EGFR/муцин-1 (R1626), и примерно при 1,8 мг/мл РНК, а именно РНК длиной 589 нуклеотидов, кодирующая HsPSCA (R1871).
(Б) Выход РНК в оптимизированных для последовательности реакциях транскрипции существенно выше по сравнению со стандартными реакциями транскрипции. Через 60 мин (R1626) и 120 мин (R1871) обе РНК достигают сходных плато примерно при 3,9 мг/мл РНК. Показаны среднее значение и стандартное отклонение по трем повторам.
Фиг. 6. Сравнение выходов РНК, полученных при использовании стандартных и оптимизированных для последовательности (кэпНТФ) смесей для мРНК, кодирующих HsPSCA (R1871), люциферазу (PpLuc, R2988) и EGFR/муцин-1 (R1626). Эксперименты проводят согласно описанному в примере 1 (время реакции 5 ч). Выходы РНК трех разных молекул РНК, отличающихся длиной молекул, примерно равные для каждого типа реакции транскрипции. Однако получают разные выходы, зависящие от применяемых смесей нуклеотидов для транскрипции in vitro.
Величины выхода реакций стандартной транскрипции (равная концентрация НТФ для каждого НТФ) составляют примерно 1,5 мг/мл РНК, транскрипции с двухкратной концентрацией смеси кэп-НТФ (2х кэпНТФ) составляют примерно 3,0 мг/мл РНК, транскрипции с оптимизацией для последовательности составляют примерно 3,9 мг/мл РНК и транскрипции с оптимизацией для последовательности с подпиткой НТФ составляют примерно 6,75 мг/мл РНК. Показаны среднее значение и стандартное отклонение по трем повторам.
Фиг. 7. Анализ эффективности кэпирования, которую достигают с помощью стандартной и оптимизированной для последовательности транскрипции мРНК люциферазы Photinus pyralis (PpLuc).
РНК расщепляют рибозимом хаммерхэд HHNUH2d по описанию в примере 2 и возникающие фрагменты РНК отделяют денатурирующим гель-электрофорезом (denaturing polyacrylamide gel electrophoresis - dPAGE). Некэпированная (без кэпа) и ферментативно кэпированная (Ф-кэп) РНК служат контролями.
Сопоставимых величин эффективности кэпирования достигают при использовании стандартной и оптимизированной для последовательности смесей НТФ для синтеза мРНК, кодирующих люцифетазу Photinus pyralis (PpLuc).
Фиг. 8. Сравнение выходов РНК, используя УТФ и псевдо-УТФ в оптимизированных для последовательности кэпНТФ смесях для мРНК (R1626) сигнального пептида муцин-1/рецептора эпидермального фактора роста/муцин-1 гибридный белок (EGFR/Муцин-1) и мРНК (R1871) антигена стволовых клеток простаты (HsPSCA). Эксперименты проводят согласно описанному в примере 3. В смесях УТФ замещают 0%, 10% или 100% псевдо-УТФ (псУ) согласно указанному. Показаны среднее значение и стандартное отклонение по трем повторам.
Фиг. 9. Сравнение теоретического и реального выходов РНК для некодирующей иммуностимулирующей РНК R2025, используя стандартную (при равных пропорциях нуклеотидов) и оптимизированную для последовательности смеси НТФ в присутствии дополнительных нуклеотидов (концентрация 13,45 мМ суммы НТФ; 13,45 мМ кэпа или ГТФ для равных смесей (4-кратный избыток относительно ГТФ); 11,2 мМ кэпа или ГТФ для оптимизированных для последовательности смесей НТФ (4-кратный избыток относительно ГТФ)). Белые столбцы: реальные выходы. Черные столбцы: теоретические выходы. Эксперименты проводят согласно описанному в примере 4. Показаны среднее значение и стандартное отклонение по трем повторам.
Фиг. 10. Сравнение теоретического и реального выходов РНК, а именно мРНК, кодирующей антиген стволовых клеток простаты Homo sapiens (HsPSCA) (R1871), используя стандартное (равное) и оптимизированное для последовательности соотношение НТФ в присутствии дополнительных нуклеотидов (13,45 мМ общей концентрации НТФ; 13,45 мМ кэпа или ГТФ для смесей в равных пропорциях (4-кратный избыток относительно ГТФ); 13,7 мМ кэпа или ГТФ для оптимизированных для последовательности смесей НТФ (4-кратный избыток относительно ГТФ)). Белые столбцы: реальные выходы. Черные столбцы: теоретические выходы. Эксперименты проводят согласно описанному в примере 4.
Фиг. 11. Эффективность транскрипции при использовании оптимизированных для последовательности НТФ-смесей Na-НТФ или трис-НТФ в присутствии соответствующих добавленных солей (NaCl; Трис/HCl, pH 7,5). Эксперименты проводят согласно описанному в примере 5.
Фиг. 12. Мониторинг развития оптимизированной для последовательности реакции транскрипции путем изменения количества получаемой РНК и расходования смеси нуклеотидов. Эксперименты проводят согласно описанному в примере 6.
Фиг. 13. Выходы РНК, а именно мРНК, кодирующей люциферазу (PpLuc) (R2988)
Photinus pyralis, в зависимости от концентрации кэпа. Молекулы мРНК синтезируют методом транскрипции in vitro, используя общие концентрации НТФ 4 мМ и 13,45 мМ оптимизированной для последовательности PpLuc смеси НТФ в присутствии различных концентраций аналога кэпа. Эксперименты проводят согласно описанному в примере 7. (А) Реальная РНК (мг/мл). (Б) Относительный выход РНК (%).
Фиг. 14. Выходы РНК, а именно мРНК, кодирующей антиген стволовых клеток простаты Homo sapiens (HsPSCA) (R1871), зависящие от концентрации кэпа. Молекулы мРНК синтезируют методом транскрипции in vitro, используя общие концентрации НТФ 2 мМ, 4 мМ и 13,45 мМ оптимизированной для последовательности HsPSCA смеси НТФ в присутствии различных концентраций аналога кэпа. Эксперименты проводят согласно описанному в примере 7. (А) Реальный выход РНК (мг/мл). (Б) Относительный выход РНК (%).
Фиг. 15. Выходы РНК, а именно мРНК, кодирующей антиген стволовых клеток простаты Homo sapiens (HsPSCA) (R1871), зависящие от концентрации стартового нуклеотида ГТФ. Молекулы мРНК синтезируют методом транскрипции in vitro, используя общие концентрации НТФ 13,45 мМ оптимизированной для последовательности HsPSCA смеси НТФ, к которой добавляют стартовый нуклеотид ГТФ до концентрации 20 мМ. Эксперименты проводят согласно описанному в примере 8. (А) Реальный выход РНК (мг/мл). (Б) Относительный выход РНК (%).
Фиг. 16. Выходы РНК, а именно мРНК, кодирующей люциферазу Photinus pyralis (PpLuc) (R2988), зависящие от концентрации стартового нуклеотида ГТФ. мРНК синтезируют транскрипцией in vitro, используя общие концентрации НТФ 13,45 мМ оптимизированной для последовательности PpLuc смеси НТФ, к которой добавляют стартовый нуклеотид ГТФ до концентрации 20 мМ. Эксперименты проводят согласно описанному в примере 8. (А) Реальный выход РНК (мг/мл). (Б) Относительный выход РНК (%).
Фиг. 17. Выходы РНК, а именно мРНК, кодирующей EGFR/Муцин-1 (R1626), зависящие от концентрации стартового нуклеотида ГТФ. Молекулы мРНК синтезируют транскрипцией in vitro, используя общие концентрации НТФ 13,45 мМ оптимизированной для последовательности EGFR/муцин-1 смеси НТФ, к которой добавляют стартовый нуклеотид ГТФ до концентрации 20 мМ. Эксперименты проводят согласно описанному в примере 8. (А) Реальный выход РНК (мг/мл). (Б) Относительный выход РНК (%).
Фиг. 18. Схематическое изображение реактора, включающего модули для непрерывного и полунепрерывного режима, с иммобилизованной на смоле линейной ДНК в качестве матрицы для реакции транскрипции.
Фиг. 19. Пониженная иммуностимуляция за счет РНК, синтезированной с применением оптимизированной для последовательности смеси НТФ по сравнению с применением стандартной эквимолярной смеси НТФ. Уровни цитокинов и хемокинов в клеточных надосадках измеряют согласно описанному в примере 10.
Фиг. 20. Г/Ц оптимизированная последовательность, кодирующая НА вируса гриппа A H1N1 (Нидерланды, 2009), которая представлена SEQ ID NO: 6 (пример 11).
Фиг. 21. Выходы РНК по времени для РНК, кодирующей НА (пример 11). Выход РНК в разное время показано для РНК, синтезированной транскрипцией in vitro в биореакторе, используя стандартную смесь НТФ (TS(1)), транскрипцией при оптимизации для последовательности в биореакторе без подпитки (TS(2)), транскрипцией при оптимизации для последовательности в биореакторе с подпиткой (TS(3)) или транскрипцией при оптимизации для последовательности в биореакторе с пониженной концентрацией РНК-полимеразы Т7 и пониженной концентрацией матрицы (TS(4)), соответственно.
Фиг. 22. Поверхностная экспрессия белка НА, определенная методом жидкостной цитометрии (пример 11). Среднее геометрическое интенсивности флуоресценции (СГИФ) определяют для клеток, трансфецированных РНК, полученной транскрипцией in vitro в биореакторе, используя стандартную смесь НТФ (TS(1)), транскрипцией при оптимизации для последовательности в биореакторе без подпитки (TS(2)), транскрипцией при оптимизации для последовательности в биореакторе с подпиткой (TS(3)) или транскрипцией при оптимизации для последовательности в биореакторе с пониженной концентрацией РНК-полимеразы Т7 и пониженной концентрацией матрицы (TS(4)), соответственно.
Фиг. 23. Иммуностимуляция за счет РНК, синтезированной транскрипцией in vitro в биореакторе, используя стандартную смесь НТФ (TS(1)), транскрипцией при оптимизации для последовательности в биореакторе без подпитки (TS(2)), транскрипцией при оптимизации для последовательности в биореакторе с подпиткой (TS(3)) или транскрипцией при оптимизации для последовательности в биореакторе с пониженной концентрацией РНК-полимеразы Т7 и пониженной концентрацией матрицы (TS(4)), соответственно. Уровни цитокинов и хемокинов в клетках надосадков измеряют согласно описанному в примере 11.
Примеры
Приводимые ниже примеры предназначены только для дополнительного пояснения и иллюстрации настоящего изобретения. Эти примеры не ограничивают области охвата настоящего изобретения.
Пример 1. Получение мРНК
1. Получение конструкций ДНК и мРНК
Для настоящего примера получают и применяют для последующих реакций транскрипции in vitro последовательности ДНК, кодирующие мРНК (R1871) антигена стволовых клеток простаты Homo sapiens (HsPSCA), мРНК R2988 люциферазы Photinus pyralis (PpLuc) и сигнальный пептид муцин-1 Homo sapiens/рецептор эпидермального фактора роста/муцин-1 гибридный белок (EGFR/Муцин-1) (R1626).
Для первого препарата конструируют вектор для транскрипции in vitro, содержащий промотор Т7, за которым следует последовательность, кодирующая указанные выше белки. Конструкции получают путем модификации кодирующей последовательности дикого типа путем интродукции оптимизированной по ГЦ последовательности для стабилизации, затем стабилизирующей последовательности, производной от альфа-глобина-3'-UTR (мутантная последовательность альфа-глобина-3'-UTR-mutated alpha-globin-3'-UTR (muag)), отрезок из 64 аденозинов (поли-А последовательность) и отрезок из 30 цитозинов (поли-Ц последовательность), а также гистонная петля-на-стебле.
Кроме того, создают вектор для транскрипции in vitro, содержащий промотор Т7, расположенную за ним последовательность, кодирующую иммуностимулирующую РНК (R2025), которая не кодирует белок.
Конструкции РНК и их нуклеотидные композиции перечислены в табл. 1 и табл. 2, соответственно.


2. Транскрипция in vitro
Соответствующие плазмиды ДНК, полученные в разделе 1, транскрибируют in vitro, используя полимеразу Т7. Затем мРНК очищают, используя метод PureMessenger® (фирма CureVac, Тюбинген, Германия; WO 2008/077592 A1). Стандартный объем реакции транскрипции составляет 20 мкл. Для последующей очистки мРНК методом ВЭЖХ, например, для кэп-анализа, берут по 1 мл реакционных объемов.
Матрицы линеаризованной плазмидной ДНК (50 мкг/мл) транскрибируют при 37°C в течение 3 ч (или согласно указанному) в 80 мМ HEPES/KOH, pH 7,5, 24 мМ MgCl2, 2 мМ спермидине, 40 мМ DTT, 5 ЕД/мл пирофосфатазы (фирма Thermo Fisher Scientific), 200 ЕД/мл ингибитора рибонуклеаз Ribolock (фирма Thermo Fisher Scientific), 5000 ЕД/мл РНК-полимеразы Т7 (фирма Thermo Fisher Scientific). Рибонуклеозидтрифосфаты (НТФ) добавляют согласно разделам 3-7, представленным ниже. После транскрипции матрицу ДНК удаляют путем расщепления ДНКазой I (фирма Roche) (100 ЕД/мл, 1 мМ CaCl2, 30 мин при 37°C).
РНК осаждают 2,86 М LiCl в 3,45-кратном объеме реакционной смеси в течение 16 ч при -20°C и затем центрифугируют (30 мин, 16000 g, 4°C). Осадки промывают 75% этанолом в пятикратном объеме реакции транскрипции (центрифужные пробирки, 5 мин центрифугирования в режиме 16000 g, 4°C), высушивают и заново растворяют в объеме воды, равном 2,5 объемам реакции транскрипции.
Выходы РНК определяют по поглощению при 260 нм с помощью спектрофотометра NanoDrop®. Одна единица поглощения при 260 нм соответствует 40 нг/мкл РНК (1 А260=40 нг/мкл РНК).
Для определения числа инкорпорированных нуклеотидов общее количество выработанной РНК пересчитывают в число молекул путем деления на молекулярную массу. Путем умножения числа соответствующего нуклеотида, содержащегося в последовательности, получают инкорпорированные нуклеотиды. Для определения оставшихся нуклеотидов (%) в конце реакции траснкрипции, это число делят на число доступных нуклеотидов в соответствии с уравнением:
Уравнение (1):

Выход РНК показывает число молекул, получаемых в результате реакции (нМ). Стартовую концентрацию НТФ [НТФ (стартовый)] указывают в нМ, объем реакции в мкл.
Для расчета остающейся концентрации соответствующих нуклеотидов, НТФ, доступные в начале реакции, умножают на процент остающихся НТФ в конце реакции транскрипции по формуле:
Уравнение (2):
НТФ (остающийся) (мМ) = НТФ (стартовый) × НТФ (остающийся) (%)
3. Стандартная транскрипция in vitro в присутствии аналога кэпа
Для получения 5'-кэпированных РНК, с использованием аналога кэпа, осуществляют стандартную транскрипцию с аналогом кэпа 5,8 мМ m7G(5')ppp(5')G, 4 мМ АТФ, 4 мМ ЦТФ, 4 мМ УТФ и 1,45 мМ ГТФ (все реактивы от фирмы Thermo Fisher Scientific) (см. табл. 3). Аналог кэпа и ГТФ применяют в пропорции 4:1.



Типичный выход транскриптов РНК в реакции составляет примерно 1,5 мг/мл.
4. Транскрипция in vitro в присутствии аналога кэпа, используя двойные концентрации аналога кэпа и НТФ (2×КэпНТФ)
Концентрации аналога кэпа и НТФ удваивают по сравнению с концентрациями при стандартных условиях транскрипции таким образом, что реакции проводят при концентрациях 11,6 мМ аналога кэпа m7G(5')ppp(5')G, 8 мМ АТФ, 8 мМ ЦТФ, 8 мМ УТФ и 2,9 мМ ГТФ (все реактивы от фирмы Thermo Fisher Scientific) (см. табл. 3). Аналог кэпа и ГТФ применяют в пропорции 4:1.


Типичный выход транскрипции при использовании двойных концентраций аналога кэпа НТФ составляет примерно 3 мг/мл реакционной смеси.
5. Транскрипция in vitro при оптимизации для последовательности в присутствии аналога кэпа.
Для реакций транскрипции in vitro при оптимизации для последовательности концентрации рибонуклеозидтрифосфатов (НТФ) рассчитывают для каждой конкретной последовательности исходя из состава этой последовательности (табл. 2) таким образом, что общая концентрация всех НТФ составляет 13,45 мМ как в стандартных реакциях транскрипции. Концентрация аналога кэпа в четыре раза выше по сравнению с рассчитанной концентрацией ГТФ таким образом, что получают соотношение кэп/ГТФ 4:1.



Типичный выход РНК в результате транскрипции при использовании оптимизированных для последовательности аналога кэпа и НТФ составляет примерно 3,9 мг/мл реакционной смеси.
6. Оптимизированная для последовательности транскрипция in vitro при наличии аналога кэпа с подпиткой НТФ.
Для оптимизированных для последовательности реакций транскрипции in vitro рассчитывают концентрации рибонуклеозидтрифосфатов (НТФ) для каждой отдельной последовательности в соответствии с нуклеотидным составом последовательности (табл. 2) таким образом, что общая концентрация всех НТФ составляет 13,45 мМ, как и в стандартных реакциях транскрипции. Концентрация аналога кэпа в 4 раза выше расчетной концентрации ГТФ таким образом, что получают соотношение кэп/ГТФ 4:1 (см. табл. 7).
Для подпитки НТФ добавляют 13,45 мМ НТФ без аналога кэпа (в объем 2,69 мкл) к реакционной смеси через 2,5 ч. Поскольку в этот момент времени >99% аналога кэпа сохраняется в реакции транскрипции, соотношение 4:1 кэп/ГТФ может быть сохранено.

Типичный выход РНК в реакции транскрипции при использовании оптимизированного для последовательности аналога кэпа и НТФ с последующей подпиткой НТФ составляет примерно 3 мг/мл реакционной смеси.
7. Стандартная транскрипция in vitro некэпированной РНК
Для получения некэпированной 5'-трифосфат-РНК транскрипцию осуществляют в присутствии 4 мМ каждого из АТФ, ГТФ, ЦТФ и УТФ (все реактивы фирмы Thermo Fisher Scientific). Некэпированную РНК применяют в качестве контроля в анализе кэпирования (фиг. 7).
8. Ферментативное кэпирование мРНК
Ферментативное кэпирование осуществляют, используя систему кэпирования ScriptCap™ m7G (фирма Cellscript, Мэдисон, Висконсин, США) по инструкциям производителя. Вкратце, в одной реакции 60 мкг некэпированной РНК денатурируют нагреванием (10 мин, 65°C) в объеме 68,5 мкл и немедленно охлаждают на льду (5 мин). После внесения компонентов реакции (1 × буфер для кэпирования ScriptCap, 1 мМ ГТФ, 0,1 мМ SAM, 1000 ЕД/мл ингибитора РНКазы ScripGuard, 400 ЕД/мл фермента кэпирования ScriptCap) до конечного объема реакции 100 мкл, инкубируют в течение 1 ч при 37°C. РНК осаждают в 2,86 М LiCl в 3,45-кратном объеме реакции в течение 16 ч при -20°C, затем центрифугируют (30 мин, режим 16000 g, 4°C). Осадки промывают 75% этанолом в 0,5-кратном объеме реакции (инверторное центрифугирование 5 мин, 16000 g, 4°C), высуживают и заново растворяют в H2O. Ферментативно кэпированную РНК применяют в качестве контроля в анализе кэпирования (фиг. 7).
9. Результаты
Выход РНК в стандартных реакциях транскрипции in vitro и при оптимизации для последовательности определяют в определенные временные точки в течение 2 ч согласно описанному выше (п. 2).
На фиг. 5А показано, что примерно через 30 мин выход РНК в стандартных реакциях транскрипции достигает плато примерно при 1,4 мг/мл для РНК длиной 5337 нуклеотидов, кодирующих EGFR/муцин-1 (R1626), и примерно при 1,8 мг/мл для РНК длиной 589 нуклеотидов, кодирующих HsPSCA (R1871).
Из фиг. 5Б следует, что выход РНК в реакциях транскрипции при оптимизации для последовательности существенно выше по сравнению со стандартными реакциями транскрипции. Через 60 мин (R1626) и 120 мин (R1626), соответственно, обе РНК достигают сходных плато примерно при 3,9 мг/мл.
На фиг. 6 можно видеть, что выходы РНК для трех разных молекул РНК разной длины практически одинаковы для каждого типа реакции транскрипции через 5 ч.
Выход в стандартных условиях транскрипции (равные концентрации НТФ) составляет примерно 1,5 мг/мл РНК, при транскрипции с двухкратной концентрацией смеси кэп-НТФ (2×кэпНТФ) составляет примерно 3,0 мг/мл РНК, при транскрипции с оптимизацией для последовательности составляет примерно 3,9 мг/мл РНК и при транскрипции с оптимизацией для последовательности с подпиткой НТФ составляет примерно 6,75 мг/мл РНК.
Таким образом, в реакции транскрипции с оптимизацией для последовательности происходит примерно трехкратное повышение выхода РНК по сравнению со стандартными реакциями транскрипции. Такой выход может быть дополнительно повышен примерно в два раза путем обогащения реакции НТФ (подпитка НТФ).
Пример 2. Исследование САР
1. Принцип исследования
Рибозим типа хаммерхэд HHNUH2d (5'-GCAUGGCUGAUGAGGCCUCGACCGAUAGGUCGAGGCCGAAAAGCUUUCUCСС-3') (SEQ ID NO: 5) инкубируют с транскрибированной in vitro РНК из примера 1 и продукты расщепления отделяют денатурирующим полиакриламидным гель-электрофорезом (denaturing polyacrylamide-gel-electrophoresis-dPAGE).
2. Реакция расщепления рибозимом
В одной реакции 10 пМ HHNUH2d и 10 пМ соответствующей генерации 4 РНК отжигают в 0,625 мМ EDTA в общем объеме 6 мкл (2 мин при 95°C, 0,1°C/сек до 25°C, 10 мин при 25°C). После добавления 4 мкл 100 мМ MgCl2, 125 мМ Трис/HCl, pH 7,5 (итоговая концентрация 40 мМ MgCl2, 50 мМ Трис/HCl) реакционную смесь инкубируют при 25°C в течение 1 ч. Для анализа методом денатурирующего полиакриламидного гель-электрофореза (denaturing polyacrylamide-gel-electrophoresis - dPAGE), 1×реакцию останавливают 30 мкл 95% формамида, 20 мМ EDTA.
3. Разделение в геле, подсчет продуктов расщепления и расчет степени кэпирования
После остановки реакционную смесь денатурируют теплом (нагревание до 80°C в течение 2 мин, затем сразу помещают на лед на 5 мин) и разделяют в 10 см×8 см×1,0 мМ 20% денатурирующем полиакриламидном геле (8 М мочевина (фирма AppliChem), 20% акриламид : бисакриламид 19:1 (фирма AppliChem), 1×ТВЕ (Трис-борат-EDTA буфер), 1% раствора аммония персульфата (Ammonium persulfate solution - APS (фирма AppliChem), 0,1% TEMED (фирма AppliChem); 180 V, 2 ч, Mini-PROTEAN® Tetra Cell (фирма BioRad)). Гели окрашивают в течение 10 мин в красителе 1:10000 SYBR Gold (фирма Invitrogen) в Трис-боратном буфере и регистрируют в системе гель-документации Е-ВОХ VX2 с 312 нм-УФ Transilluminator (фирма Peqlab) (максимум возбуждения для SYBR Gold: ~300 нМ, эмиссия: ~537 нМ).
Для определения доли кэпирования в препаратах мРНК полоски 13-мерных (производных от нкэпированной фракции) или 14-мерных (производных от кэпированной фракции) продуктов расщепления подсчитывают, используя программное обеспечение Quantity One 1-D Analysis Software (фирма BioRad).
Степени кэпированной и некэпированной РНК, соответственно, рассчитывают по формуле:
Уравнение (4):

Уравнение (5):

4. Результаты
Из фиг. 7 следует, что достигают сравнимых эффективностей кэпирования для стандартной и оптимизированной для последовательностей смесей мРНК люциферазы Photinus pyralis (PpLuc).
Пример 3. Сравнение выходов РНК, используя УТФ и псевдо-УТФ в оптимизированных для последовательности смесях.
Реакции транскрипции in vitro могут быть осуществлены путем замены одного или нескольких из четырех нуклеотидов АТФ, ГТФ, ЦТФ и УТФ на аналоги нуклеотидов. Примерами таких модифицированных НТФ являются псевдоуридин (псУ или ψ) трифосфат и 5-метилцитидин (5 mC) трифосфат. Процент модифицированного нуклеотида в смеси может варьировать от 0% до 100% замещаемого природного нуклеотида.
Чтобы проверить, можно ли применить модифицированные нуклеотиды, например, псевдоуридин (псУ) трифосфат, в оптимизированных для последовательности нуклеотидных смесях, УТФ заменяют на 10% и на 100% псевдоуридинтрифосфатом. В контрольной реакции применяют 100% УТФ.
Транскрипция in vitro при оптимизации для последовательности в присутствии аналога кэпа
Для реакций транскрипции in vitro с оптимизацией для последовательностей концентрацию рибонуклеозидтрифосфатов (НТФ) рассчитывают для каждой конкретной последовательности в соответствии с нуклеотидным составом последовательности (табл. 2) таким образом, что общая концентрация всех НТФ составляет 13,45 мМ как и в стандартных реакциях транскрипции. Концентрация аналога кэпа в 4 раза превышает рассчитанную концентрацию ГТФ таким образом, что получают соотношение кэп/ГТФ 4:1.
Результаты
На фиг. 8 показано, что при использовании УТФ и псевдо-УТФ в оптимизированных для последовательностей смесях нуклеотидов с аналогом кэпа (смеси кэпНТФ) получают при сопоставимых выходах РНК независимо от процента псевдо-УТФ в оптимизированной для последовательности смеси.
Это установлено для двух разных мРНК, кодирующих муцин-1 сигнальный пептид/рецептор эпидермального фактора роста/муцин-1 гибридный белок (EGFR7 муцин-1) (R1626) и антиген стволовых клеток простаты (HsPSCA) мРНК (R1871), соответственно.
Пример 4. Сравнение теоретического и реального выходов РНК, используя стандартные и оптимизированные для последовательностей смеси.
Компоненты для реакций транскрипции собирают согласно описанному в примере 1, пункте 2. НТФ либо равнопропорциональны (эквимолярны), либо их доля соответствует выработанной РНК, согласно описанному в примере 1, пункт 5. Для некоторых реакций дополнительный нуклеотид (ГТФ или аналог кэпа) добавляют в пропорции 4: относительно ГТФ.
Результаты
На фиг. 9 показано, что реальные выходы РНК для R2025 могут быть повышены для оптимизированных для последовательностей смесей НТФ по сравнению со стандартными смесями НТФ (равное содержание НТФ).
Из фиг. 10 следует, что реальный выход РНК, а именно мРНК, кодирующей антиген стволовых клеток простаты Homo sapiens (HsPSCA) (prostate stem cell antigen - HsPSCA; R1871), может быть повышен для оптимизированных для последовательностей смесей НТФ по сравнению со стандартными смесями НТФ (равное содержание НТФ).
Пример 5. Воздействие противоионов НТФ на выходы РНК
Воздействие противоионов НТФ на выходы РНК исследуют с помощью мРНК, кодирующей, например, Homo sapiens муцин-1 сигнальный пептид/рецептор эпидермального фактора роста/муцин-1 гибридный белок (EGFR/муцин-1) (R1626). Компоненты для реакций транскрипции собирают согласно описанному в примере 1, пункте 2, используя оптимизированные для последовательностей соотношения НТФ и суммарную концентрацию 13,45 мМ. НТФ содержат Na+ или трис+ (оба реактива от фирмы Thermo Scientific) в качестве противоионов. Кроме того, реакции Na-НТФ обогащены разными концентрациями NaCl, реакции трис-НТФ обогащены разными концентрациями трис/HCl. Через 2,5 ч от начала проведения реакции РНК очищают и ее концентрацию определяют согласно описанию в примере 1, разделе 2.
Результаты
На фиг. 11 показано, что выход РНК для Homo sapiens муцин-1 сигнальный пептид/рецептор эпидермального фактора роста/муцин-1 гибридный белок (EGFR7 муцин-1) (R1626), используя оптимизированную для последовательности смесь НТФ, имеющую примерно ту же концентрацию 150 мМ трис-HCl. Напротив, выход РНК начинает снижаться при концентрации NaCl выше 75 мМ.
Описано отрицательное воздействие высоких концентраций NaCl на выходы РНК (например, Kern с соавт., 1997; US 6586218 В2). Следовательно, высокие концентрации Na-НТФ, особенно при применении стратегии подпитки НТФ, могут привести к пониженным уровням РНК. Этого ограничения можно было бы избежать с помощью трис-НТФ, поскольку полимеразная активность не зависит от высоких концентраций Трис/HCl.
Пример 6. Мониторинг по ходу реакции транскрипции
Крупномасштабные реакции транскрипции (350 мкл) антигена стволовых клеток простаты Homo sapiens (HsPSCA; R1871) осуществляют согласно описанному в примере 1, п.2, используя оптимизированные для последовательностей пропорции НТФ и суммарную концентрацию НТФ 13,45 мМ Трис-НТФ. Аналог кэпа содержится с избытком относительно ГТФ в пропорции 4:1. В определенных временных точках (15/30/60/90/120 мин после начала реакции) отбирают по 20 мкл образца, очищают РНК и определяют поглощение при 260 нм, согласно описанному в примере 1, п. 2. Второй образец объемом 40 мкл берут в то же время и фильтруют через устройство Microcon YM10 (фирма Merck Millipore, Дармштадт, Германия) (режим 16000 g, 5 мин, 17°C). Поглощение потока при 260 нм, соответствующее инкорпорированному аналогу кэпа и НТФ, определяют, используя спектрофотометр NanoDrop® по инструкциям производителя (T009-Technical Bulletin NanoDrop 1000 & 8000; фирма Thermo Fisher Scientific, Уилмингтон, Делавер, США).
Результаты
На фиг. 12 показано, что применение оптимизированной для последовательности смеси рибонуклеотидов позволяет измерять развитие реакции транскрипции in vitro путем определения оставшейся общей концентрации нуклеотидов в определенные временные точки. Снижение концентрации суммарной НТФ прямо коррелирует с количеством синтезированной РНК.
Таким образом, ход реакции транскрипции может быть точно определен в качестве функции измеренной концентрации НТФ в данный момент времени и расчета потребленного в ходе реакции количества НТФ в молях. Основываясь на этой информации можно рассчитать количество синтезированной РНК.
Эта процедура особенно полезна для непрерывного мониторинга хода реакции, например, в реакторе для транскрипции. Это было бы невозможно, если бы применяли стандартную смесь НТФ, поскольку расходование в реакции НТФ не может отражать количество синтезированной РНК.
Пример 7. Выходы РНК при использовании оптимизированных для последовательности смесей как функция концентрации кэпа
Компоненты для реакций транскрипции собирают согласно описанному в примере 1, п. 2, используя суммарные концентрации НТФ 2 мМ, 4 мМ и 13,45 мМ НТФ, представленные на фиг. 14 и 15. НТФ классифицируют в соответствии с последовательностью образуемой РНК согласно описанию в примере 1, п.5 (оптимизированная для последовательности смесь рибонуклеотидов для PpLuc и HsPSCA). Реакции осуществляют при разных концентрациях (0, 0,25, 2,0, 10, 16 и 20 мМ) аналога кэпа (m7G(5')ppp(5')G), указанных на фиг. 14 и 15.
Результаты
Из фиг. 13А следует, что реальный выход РНК, а именно мРНК PpLuc, повышается при повышенных концентрациях аналога кэпа. Реальный выход РНК выше при суммарной концентрации НТФ 13,45 мМ по сравнению с 4 мМ. Фиг. 13Б показывает, что относительный выход РНК, а именно мРНК PpLuc, возрастает до концентрации аналога кэпа примерно 16 мМ. Повышение относительного выхода РНК больше для низких концентраций НТФ (4 мМ) по сравнению с высокой концентрацией НТФ (13,45 мМ).
На фиг. 14А показано, что реальный выход РНК, а именно мРНК HsPSCA, повышается при повышенных концентрациях аналога кэпа. Реальный выход РНК выше при суммарной концентрации НТФ 13,45 мМ по сравнению с 4 мМ и 2 мМ. Фиг. 14Б показывает, что относительный выход РНК, а именно мРНК HsPSCA, возрастает до концентрации аналога кэпа примерно 16 мМ. Повышение относительного выхода РНК наблюдают для самых низких концентраций НТФ (2 мМ).
Эти результаты показывают, что применение оптимизированных для последовательностей смесей приводит к повышенной эффективности синтеза кэпированной РНК даже при низкой начальной суммарной концентрации нуклеотидов (например, 2 мМ). Напротив, ранее было сделано заключение, что для повышенного выхода РНК необходимы высокие концентрации суммарных нуклеотидов порядка 12-40 мМ (US 6586218).
Сравнение мРНК PpLuc (1870 нуклеотидов) и мРНК HsPSCA (589 нуклеотидов) показывает, что относительные выходы не зависят от длины РНК для определенной суммарной концентрации НТФ.
Пример 8. Выходы РНК при использовании оптимизированных для последовательностей смесей как функция концентрации стартового нуклеотида ГТФ
Компоненты для реакций транскрипции собирают, согласно описанному в примере 1, п. 2, и осуществляют реакции при общей концентрации оптимизированной для последовательности смеси 13,45 мМ для Р625, Р1040 и Р532. НТФ классифицируют в соответствии с последовательностью образуемой РНК согласно описанию в примере 1, п.5 (оптимизированная для последовательности смесь рибонуклеотидов для PpLuc, HsPSCA и EGFR/муцин-1). Реакции осуществляют добавлением определенных концентраций (0, 0,25, 2,0, 10, 16 и 20 мМ) стартового нуклеотида ГТФ к оптимизированной для последовательности смеси НТФ, что указано на фиг. 16-18.
Результаты
На фиг. 15А и 15Б показано, что реальный и относительный выход РНК, а именно мРНК HsPSCA, повышается до концентрации стартового нуклеотида ГТФ примерно 10 мМ и снижается при более высоких концентрациях ГТФ.
На фиг. 16А и 16Б показано, что реальный и относительный выход РНК, а именно мРНК PpLuc, незначительно повышается до концентрации стартового нуклеотида примерно 10 мМ и снижается при более высоких концентрациях ГТФ.
Из фиг. 17А и 17Б следует, что реальный и относительный выход РНК, а именно мРНК EGFR/муцин-1, повышается до концентрации стартового нуклеотида ГТФ примерно 10 мМ и снижается при более высоких концентрациях ГТФ.
Эти результаты показывают, что применение оптимизированной для последовательности смеси рибонуклеотидов (НТФ) и дополнительного количества стартового нуклеотида ГТФ приводит к повышенной эффективности синтеза РНК до концентрации стартового нуклеотида ГТФ примерно 10 мМ.
Пример 9. Биореактор
На фиг. 18 показан предпочтительный вариант биореактора 1 в соответствии с настоящим изобретением в схематическом виде. На фиг. 18 показана модульная структура биореактора. Из фиг. 18 следует, что биореактор 1 содержит модули 2, 3, 4, 5. Модуль реакции 1 представляет сосуд, применяемый для непрерывного и полунепрерывного процесса синтеза молекул РНК заданной последовательности. Модуль реакции 2 содержит смолу с иммобилизованной ДНК, применяемой в качестве матрицы для реакции транскрипции РНК. В данной конструкции иммобилизация ДНК позволяет повторно применять матрицы и снизить контаминацию требуемого продукта РНК каким-либо видом остаточной ДНК. Кроме того, иммобилизация матрицы ДНК замещает применение фермента ДНКазы для расщепления остаточной ДНК. После транскрипции образовавшиеся молекулы РНК могут быть выпущены партия за партией или непрерывно в модуль захвата 3. Модуль захвата 3 содержит смолу/твердую фазу для захвата молекул РНК и для отделения РНК от других растворимых компонентов реакции транскрипции. Затем молекулы РНК могут быть удалены из биореактора 1 с помощью линии выпуска или иным образом (не показано) в приемник или иным образом, при этом могут проводить дополнительную элюцию РНК или очистку. Промывная жидкость и/или буфер для элюции могут быть поставлены в модуль захвата 3 с помощью соответствующей промывки и танк для буфера 31 присоединен к области передачи между модулем реакции 2 и модулем захвата 3.
Для осуществления мониторинга и контроля процесса транскрипции в модуле реакции 2 предусматривают мембрану для ультрафильтрации 21 для отделения высокомолекулярных компонентов, например, белков и полинуклеотидов, от низкомолекулярных компонентов, например, нуклеотидов. Мембрана отделяет центр реакции 22, в котором проводят реакцию транскрипции, от отсека фильтрации 23, в который поступает отфильтрованная реакционная смесь. Исходя из концентрации нуклеотидов в отфильтрованной реакционной смеси в фильтрующем отсеке 23 модуля реакции 2, используемой в качестве определяющего параметра процесса, подача нуклеотидов, компонентов буфера и/или ферментов в модуль реакции 2 из емкости подпитки 24 может контролироваться и регулироваться с помощью насоса подачи 43, что позволяет осуществлять реакцию транскрипции РНК в оптимальных стабильных условиях, получая в результате высокий уровень транскрипции. В качестве измерительного средства предусматривают сенсорный блок 41 для измерения параметров реакции в реакционной смеси. Сенсорный блок 41 по меньшей мере включает датчик фотометрического анализа, например, УФ проточную кювету для УФ 260/280 нм, для отфильтрованной жидкости, содержащей низкомолекулярные компоненты, отфильтрованную жидкость экстрагируют из отсека фильтрации 23, перекачивают насосом 25 и возвращают в отсек фильтрации 23. В линии промывки предусматривают сенсор сенсорного блока 41 для возможности проводить мониторинг в реальном времени отфильтрованной жидкости внутри отсека фильтрации 23. Применение оптимизированной для последовательности смеси рибонуклеотидов в биореакторе 1 позволяет измерять в реальном времени концентрацию нуклеотидов в отсеке фильтрации 23 во время реакции транскрипции в активной зоне 22 реакционного модуля 2. Сенсорный блок 41 является частью контрольного модуля 4, который дополнительно включает контроллер 42 и привод в форме насоса для подпитки 43. Сенсорный блок 41 и насос для подпитки 43 соединены с контроллером 42, чтобы обеспечить сигналы измерения и приема командных сигналов от контроллера 42. Кроме того, другие критические параметры процесса, например, величина pH отфильтрованной жидкости или электропроводность отфильтрованной жидкости можно анализировать с помощью дополнительных датчиков сенсорного блока 41. Анализ и сбор данных контроллером 42, обычно в форме системы на основе компьютера или иной, позволяют контролировать насос подпитки 43 в качестве привода для повторной подпитки нуклеотидами, компонентами буфера и/или ферментами, поступающими в модуль реакции 2, а также в качестве контроля дополнительных насосов в биореакторе 1 для нормализации ключевых параметров процесса в условиях оптимальной устойчивой реакции.
Для того чтобы предупредить потерю компонентов реакции, биореактор 1 в предпочтительном варианте осуществления настоящего изобретения дополнительно включает модуль оттока 5, соединенный с модулем захвата 3, причем указанный модуль оттока 5 собирает неиспользованные исходные материалы, например, нуклеотиды и ферменты, и возвращает их назад в реакционный модуль 2 с помощью насоса оттока 51. Модуль оттока 5 содержит иммобилизованные ферменты, например, пирофосфатазу, или смолу для захвата разрушающих компонентов, например, фосфата или других.
Описанные выше варианты осуществления настоящего изобретения и соответствующие фигуры предназначены только для иллюстрации и никоим образом не ограничивают настоящего изобретения, поскольку модификации описываемого изобретения могут быть произведены в рамках охвата формулы настоящего изобретения.
Пример 10. Иммуностимулирующая активность молекул РНК
В этом примере сравнивают иммуностимулирующие свойства молекул РНК, синтезированных с оптимизированной для последовательности смесью НТФ и стандартной эквимолярной смесью НТФ. Иммуностимуляцию определяют путем измерения уровней цитокинов и хемокинов в надосадках клеток, трансфецированных мРНК.
Стандартные и оптимизированные для последовательности реакции транскрипции in vitro мРНК люциферазы (pPluc) проводят согласно описанию в примере 1.
Затем мРНК очищают осаждением LiCl.
Анализ иммуностимуляции
Клетки HeLa высевают в количестве 4×105 на лунку в 6-луночный планшет в 2 мл среды для культуры клеток HeLa, содержащей среду Gibco® RPMI 1640, обогащенную 25 мМ HEPES, 2 мМ L-глутамина и 100 ЕД/мл
пенициллина/стрептомицина (все реактивы от фирмы Lonza, Базель, Швейцария) и 10% фетальной сыворотки теленка (фирма Perbio Science, Бонн, Германия). На следующий день клетки трансфецируют 2 мкг РНК или воды для инъекций в качестве отрицательного контроля, используя реагент Lipofectamine® 2000 (фирма Life Technologies, Дармштадт, Германия, номер в каталоге 11668-027). Вкратце, компоненты реагента липофектамин и РНК, каждый из которых разведен в среде Opti-MEM® (фирма Life Technologies), объединяют в пропорции РНК : липофектамин 1:1,5 и инкубируют в течение 20 мин при комнатной температуре. Отрицательный контроль, содержащий воду для инъекций вместо РНК, смешивают с Lipofectamine2000. Между тем клетки однократно промывают 2 мл среды Gibco® RPMI 1640, обогащенной 25 мМ HEPES и 2 мМ L-глутамина (среда без сыворотки и пенициллина/стрептомицина) и 2 мл среды без сыворотки и пенициллина/стрептомицина добавляют к клеткам, после чего добавляют 0,5 мл смеси для трансфекции РНК: липофектамин. После инкубировании в течение 4 ч при 37°C и 5% CO2 среду, содержащую смесь для трансфекции, замещают 2 мл среды для культуры клеток HeLa.
Через 24 ч собирают надосадки без клеток и измеряют концентрации IL-6, CXCL10 и CCL5 с помощью моноклональных антител, иммобилизованных на микрогранулах (cytometric bead array - СВА), по инструкциям производителя (фирма BD Biosciences), используя следующие наборы: Human Soluble Protein Master Buffer Kit (номер в каталоге 558264), Растворитель для анализа (номер в каталоге 560104), Human IL-6 Flex Set (номер в каталоге 558276), Human CXCL10 Flex Set (номер в каталоге 558280) и Human CCL5 Flex Set (номер в каталоге 558324) (все наборы от фирмы BD Biosciences). Данные анализируют, используя программное обеспечение FCAP Array v3.0 (фирма BD Biosciences).
Результаты
На фиг. 19 показано, что уровни секретированных IL-6, CXCL10 и CCL5 ниже для РНК, синтезированной при использовании оптимизированной для последовательности смеси НТФ, по сравнению с той же РНК, синтезированной при использовании стандартной эквимолярной смеси НТФ, что указывает на пониженную иммуностимулирующую активность РНК, при использовании оптимизированной для последовательности смеси НТФ.
Пример 11. Транскрипция in vitro в биореакторе
Получение ДНК, применяемой для транскрипции in vitro (P1140):
Вектор ДНК для транскрипции in vitro (P1140) получают инсерцией следующих элементов в вектор ДНК (pCV32(KanR)):
5'-UTR: 32L4 (Top-UTR)
ORF: НА из H1N1 (Нидерланды2009) (высокое содержание ГЦ)
3'-UTR: Альбумин 7
В результате транскрипции in vitro полученного вектора ДНК получают молекулу РНК длиной 2083 н.о. Соответствующая последовательности РНК (SEQ ID NO: 6) показана на фиг. 20.
Конструкция РНК отличается следующим составом нуклеотидов:
Г=540 (25,92%)
Ц=676 (32,45%)
А=541 (25,97%)
У=326 (15,65%)
Г/Ц=58.37%
Линеаризация вектора ДНК:
Плазмиду Р1140 линеаризируют, используя следующие условия:
0,5 мкг плазмидной ДНК
1,5 мкл 10×буфера для реакции
1 мкл EcoRI
Добавляют воду для инъекций до 15 мкл
Реакцию инкубирования проводят в течение 3 ч при 37°C. Затем осуществляют экстракцию фенолом/хлороформом и осаждают изопропанолом.
Транскрипция in vitro:
Стандартная смесь кэп/НТФ


(Итоговая концентрация НТФ без кэпа составляет 13,45 мМ)
Расчет НТФ и кэпа
Такую же общую концентрацию НТФ 13,45 мМ, которую применяют в стандартной реакции транскрипции, применяют для реакции транскрипции при оптимизации для последовательности. Четырехкратное количество ГТФ применяют для аналога кэпа.

Получение оптимизированной для последовательности смеси кэпа/НТФ для Р1140:

5× буфер для транскрипции:
400 мМ HEPES
120 мМ MgCl2
10 мМ спермидин
200 мМ DTT
25 ЕД/мл неорганической пирофосфатазы
В биореакторе исследуют 4 разные реакции транскрипции:
Применяют биореактор DasBox Bioreaktor фирмы Dasgip. Реакцию проводят при перемешивании 50 об./мин. В определенные моменты времени отбирают по 20 мкл образцов. Концентрацию РНК измеряют по поглощению света при длине волны 260 нМ после осаждения LiCl.
Применяют четыре разных условия осуществления транскрипции in vitro:
1. Транскрипция с применением стандартной смеси НТФ

Реакцию транскрипции инкубируют 3 ч при 37°C.
Затем добавляют 6 мкл ДНКазы 1(1 мг/мл) и 0,2 мкл раствора CaCl2 (0,1 М)/мкг матрицы ДНК в реакцию транскрипции и инкубируют в течение 2 ч при 37°C.
2. Транскрипция с оптимизацией для последовательности (1,5 ч без подпитки)

Реакцию транскрипции инкубируют в течение 1,5 ч при 37°C.
Затем добавляют 6 мкл ДНКазы I (1 мг/мл) и 0,2 мкл раствора CaCl2 (0,1 М)/мкг матрицы ДНК в реакцию транскрипции и инкубируют в течение 2 ч при 37°C.
3. Реакция транскрипции с оптимизацией для последовательности с подпиткой.


Реакцию транскрипции инкубируют в течение 1,5 ч при 37°C.
12934,6 мкл оптимизированной для последовательности смеси кэп/НТФ и 5× буфер для транскрипции вносят через 1,5 ч. Реакцию транскрипции инкубируют в течение дополнительных 1,5 ч при 37°C.
Затем добавляют 6 мкл ДНКазы I (1 мг/мл) и 0,2 мкл раствора CaCl2 (0,1 М)/мкг матрицы ДНК в реакцию транскрипции и инкубируют в течение 2 ч при 37°C.
4. Транскрипция с оптимизацией для последовательности с пониженной концентрацией РНК-полимеразы Т7 и пониженной концентрацией матрицы.

Результаты
Транскрипция в оптимизированной для последовательности смеси реакции транскрипции приводит к повышенным концентрациям транскрибированной РНК по сравнению с транскрипцией в стандартных условиях (фиг. 21, TS(1)). Дополнительная подпитка нуклеотидами и буфером для транскрипции дополнительно повышает количество транскрибированной РНК (фиг. 21, TS(3)).
Выход

Экспрессия и иммуностимуляция:
Клетки HeLa высевают в количестве 4×105 на лунку в 6-луночный планшет в 2 мл среды для культуры клеток HeLa, содержащей среду Gibco® RPMI 1640, обогащенную 25 мМ HEPES, 2 мМ L-глутамином и 100 IЕД/мл пенициллина/стрептомицина (все реактивы от фирмы Lonza, Базель, Швейцария) и 10% фетальной сыворотки теленка (фирма Perbio Science, Бонн, Германия). На следующий день клетки переносят с разными концентрациями 2 мкг РНК или воды для инъекций в качестве отрицательного контроля, используя продукт Lipofectamine® 2000 (фирма Life Technologies, Дармштадт, Германия, номер в каталоге 11668-027). Вкратце, компоненты реагент липофектамин и РНК, каждый из которых разведен в среде Opti-MEM® (фирма Life Technologies), объединяют в пропорции РНК : липофектамин 1:1,5 и инкубируют в течение 20 мин при комнатной температуре. Отрицательный контроль, содержащий воду для инъекций вместо РНК, смешивают с Lipofectamine2000. Между тем клетки однократно промывают 2 мл среды Gibco® RPMI 1640, обогащенной 25 мМ HEPES и 2 мМ L-глутамина (среда без сыворотки и пенициллина/стрептомицина), 2 мл среды без сыворотки и пенициллина/стрептомицина и затем к клеткам добавляют 0,5 мл смеси для трансфекции РНК: липофектамин. При инкубировании в течение 4 ч при 37°C и 5% CO2 среду, содержащую смесь для трансфекции, удаляют и вносят 2 мл среды для культуры клеток HeLa.
Через 24 ч отбирают надосадки и клетки.
Экспрессия белка
Поверхностную экспрессию белка НА определяют методом жидкостной цитометрии. Прикрепленные клетки HeLa отмывают однократно 1 мл ФСБ и собирают, используя буфер для открепления без трипсина (40 мМ трис HCl pH 7,5; 150 мМ NaCl, 1 мМ EDTA). Клетки инкубируют с мышиным моноклональным антителом анти-НА (H1N1) (фирма IмMune Technology, Нью-Йорк, США), затем со вторым анти-мышиным FITC-конъюгированным антителом (фирма Sigma-Aldrich, Тауфкирхен, Германия). Клетки измеряют с помощью клинического программного обеспечения BD FACS Canto и исследуют, используя программное обеспечение FlowJo, версия 10.6. Статистический анализ осуществляют, используя программное обеспечение Graph Pad Prism Software, версия 5.01.
Результаты
РНК, транскрибированная в оптимизированной для последовательности реакционной смеси (фиг. 22, TS(2), TS(3), TS(4)), приводит к повышенной экспрессии кодированного белка НА по сравнению с РНК, транскрибированной в стандартных условиях (фиг. 22, TS(1)).
Иммуностимуляция
Концентрации IL-6, CXCL10 и CCL5 измеряют в свободных от клеток надосадках методом цитометрического определения биологических аналитов с помощью моноклональных антител, иммобилизованных на микрогранулах (cytometric bead array - СВА), по инструкциям производителя (фирма BD Biosciences), используя следующие наборы:

Полученные данные исследуют, используя программное обеспечение FCAP Array v3.0 (фирма BD Biosciences). Статистическую обработку проводят с помощью программного обеспечения Graph Pad Prism, версия 5.01.
Результаты
Транскрибированная в стандартных условиях РНК (фиг. 23, TS1) индуцирует повышенные уровни цитокинов IL-6, CXCL10 и CCL5 в клетках Hela по сравнению с РНК, транскрибированной в оптимизированной для последовательности реакционной смеси (фиг. 23, TS2, TS3, TS4).
--->
ПЕРЕЧЕНЬ ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> КУРЕВАК АГ
<120> СПОСОБЫ И СРЕДСТВА ПОВЫШЕНИЯ ПРОДУКТИВНОСТИ РНК
<130> CU01P165WO2
<160> 6
<170> PatentIn version 3.5
<210> 1
<211> 589
<212> РНК
<213> Искусственная
<220>
<223> G/C оптимизированная последовательность мРНК R1871, кодирующая антиген стволовых клеток простаты Homo sapiens (HsPSCA)
<400> 1
gggagaaagc uuaccaugaa ggccgugcug cucgcgcugc ugauggccgg ccuggcccug 60
cagccgggga ccgcccugcu gugcuacagc ugcaaggccc aggucucgaa cgaggacugc 120
cugcaggugg agaacugcac gcagcugggc gagcagugcu ggaccgcccg gauccgcgcc 180
gugggccugc ucaccgugau cagcaagggc ugcagccuga acugcgugga cgacagccag 240
gacuacuacg ugggcaagaa gaacaucacc ugcugcgaca ccgaccugug caacgccagc 300
ggcgcccacg cccugcagcc cgcggccgcc auccuggccc ugcugcccgc ccugggccug 360
cugcucuggg gccccggcca gcugugacca cuaguuauaa gacugacuag cccgaugggc 420
cucccaacgg gcccuccucc ccuccuugca ccgagauuaa uaaaaaaaaa aaaaaaaaaa 480
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaugcau cccccccccc 540
cccccccccc cccccccccc caaaggcucu uuucagagcc accagaauu 589
<210> 2
<211> 1870
<212> РНК
<213> Искусственная
<220>
<223> G/C оптимизированная последовательность мРНК R2988, кодирующая люциферазу Photinus pyralis (PpLuc)
<400> 2
gggagaaagc uuaccaugga ggacgccaag aacaucaaga agggcccggc gcccuucuac 60
ccgcuggagg acgggaccgc cggcgagcag cuccacaagg ccaugaagcg guacgcccug 120
gugccgggca cgaucgccuu caccgacgcc cacaucgagg ucgacaucac cuacgcggag 180
uacuucgaga ugagcgugcg ccuggccgag gccaugaagc gguacggccu gaacaccaac 240
caccggaucg uggugugcuc ggagaacagc cugcaguucu ucaugccggu gcugggcgcc 300
cucuucaucg gcguggccgu cgccccggcg aacgacaucu acaacgagcg ggagcugcug 360
aacagcaugg ggaucagcca gccgaccgug guguucguga gcaagaaggg ccugcagaag 420
auccugaacg ugcagaagaa gcugcccauc auccagaaga ucaucaucau ggacagcaag 480
accgacuacc agggcuucca gucgauguac acguucguga ccagccaccu cccgccgggc 540
uucaacgagu acgacuucgu cccggagagc uucgaccggg acaagaccau cgcccugauc 600
augaacagca gcggcagcac cggccugccg aagggggugg cccugccgca ccggaccgcc 660
ugcgugcgcu ucucgcacgc ccgggacccc aucuucggca accagaucau cccggacacc 720
gccauccuga gcguggugcc guuccaccac ggcuucggca uguucacgac ccugggcuac 780
cucaucugcg gcuuccgggu gguccugaug uaccgguucg aggaggagcu guuccugcgg 840
agccugcagg acuacaagau ccagagcgcg cugcucgugc cgacccuguu cagcuucuuc 900
gccaagagca cccugaucga caaguacgac cugucgaacc ugcacgagau cgccagcggg 960
ggcgccccgc ugagcaagga ggugggcgag gccguggcca agcgguucca ccucccgggc 1020
auccgccagg gcuacggccu gaccgagacc acgagcgcga uccugaucac ccccgagggg 1080
gacgacaagc cgggcgccgu gggcaaggug gucccguucu ucgaggccaa ggugguggac 1140
cuggacaccg gcaagacccu gggcgugaac cagcggggcg agcugugcgu gcgggggccg 1200
augaucauga gcggcuacgu gaacaacccg gaggccacca acgcccucau cgacaaggac 1260
ggcuggcugc acagcggcga caucgccuac ugggacgagg acgagcacuu cuucaucguc 1320
gaccggcuga agucgcugau caaguacaag ggcuaccagg uggcgccggc cgagcuggag 1380
agcauccugc uccagcaccc caacaucuuc gacgccggcg uggccgggcu gccggacgac 1440
gacgccggcg agcugccggc cgcgguggug gugcuggagc acggcaagac caugacggag 1500
aaggagaucg ucgacuacgu ggccagccag gugaccaccg ccaagaagcu gcggggcggc 1560
gugguguucg uggacgaggu cccgaagggc cugaccggga agcucgacgc ccggaagauc 1620
cgcgagaucc ugaucaaggc caagaagggc ggcaagaucg ccgugugagg acuaguuaua 1680
agacugacua gcccgauggg ccucccaacg ggcccuccuc cccuccuugc accgagauua 1740
auaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 1800
aaaaaaugca uccccccccc cccccccccc cccccccccc ccaaaggcuc uuuucagagc 1860
caccagaauu 1870
<210> 3
<211> 5337
<212> РНК
<213> Искусственная
<220>
<223> G/C оптимизированная последовательность мРНК R1626, кодирующая Homo sapiens сигнальный пептид муцин-1/рецептор эпидермального фактора роста/ муцин-1 гибридный белок (EGFR/муцин-1)
<400> 3
gggagaaagc uuaccaugac ccccggcacc cagagcccgu ucuuccugcu ccugcugcuc 60
acggugcuga ccgucgugac cgggaugcgg ccgagcggca ccgccggggc ggcccugcuc 120
gcccugcugg ccgcccugug ccccgccucg cgcgcgcugg aggagaagaa ggugugccag 180
ggcacgagca acaagcugac ccagcucggc accuucgagg accacuuccu gagccugcag 240
cggauguuca acaacugcga ggucgugcug ggcaaccugg agaucaccua cgugcagcgg 300
aacuacgacc ugagcuuccu caagaccauc caggaggugg ccggcuacgu gcugaucgcc 360
cugaacaccg uggagcggau cccgcuggag aaccugcaga ucauccgggg caacauguac 420
uacgagaaca gcuacgcccu ggccguccuc agcaacuacg acgccaacaa gacggggcug 480
aaggagcugc cgaugcggaa ccugcaggag auccugcacg gcgcggugcg cuucucgaac 540
aacccggccc ugugcaacgu ggagagcauc caguggcggg acaucgugag cagcgacuuc 600
cucagcaaca ugagcaugga cuuccagaac caccugggcu cgugccagaa gugcgacccg 660
agcugcccga acggcagcug cuggggcgcc ggcgaggaga acugccagaa gcugaccaag 720
aucaucugcg cccagcagug cagcgggcgg ugccggggca agagccccag cgacugcugc 780
cacaaccagu gcgccgccgg cugcaccggc ccgcgggagu cggacugccu ggugugccgg 840
aaguuccgcg acgaggcgac cugcaaggac accugcccgc cgcugaugcu guacaacccg 900
accacguacc agauggacgu gaacccggag ggcaaguaca gcuucggcgc caccugcguc 960
aagaagugcc cccggaacua cguggugacc gaccacggga gcugcgugcg ggccugcggc 1020
gccgacagcu acgagaugga ggaggacggc gugcggaagu gcaagaagug cgagggcccg 1080
ugccggaagg ugugcaacgg caucggcauc ggggaguuca aggacagccu cagcaucaac 1140
gccaccaaca ucaagcacuu caagaacugc accucgauca gcggcgaccu gcacauccug 1200
ccggucgccu uccggggcga cagcuucacc cacacgccgc cgcuggaccc gcaggagcug 1260
gacauccuga agaccgugaa ggagaucacc ggcuuccucc ugauccaggc guggcccgag 1320
aaccgcaccg accugcacgc cuucgagaac cuggagauca uccggggccg gaccaagcag 1380
cacggccagu ucagccuggc cguggugagc cugaacauca ccagccucgg gcugcggucg 1440
cugaaggaga ucagcgacgg cgacgugauc aucagcggca acaagaaccu gugcuacgcc 1500
aacacgauca acuggaagaa gcuguucggc accagcggcc agaagaccaa gaucaucagc 1560
aaccggggcg agaacagcug caaggccacc gggcaggugu gccacgcccu gugcucgccg 1620
gagggcugcu ggggcccgga gccgcgggac ugcgucagcu gccgcaacgu gagccggggc 1680
cgggagugcg uggacaagug caaccuccug gagggcgagc cgcgggaguu cguggagaac 1740
agcgagugca uccagugcca cccggagugc cugccccagg cgaugaacau caccugcacc 1800
ggccgggggc cggacaacug cauccagugc gcccacuaca ucgacggccc gcacugcgug 1860
aagacgugcc cggccggcgu gaugggcgag aacaacaccc uggucuggaa guacgccgac 1920
gccggccacg ugugccaccu gugccacccg aacugcaccu acggcugcac cgggccgggc 1980
cuggagggcu gccccaccaa cggcccgaag aucccgagca ucgccaccgg cauggugggc 2040
gcgcuccugc ugcugcuggu gguggcccug gggaucggcc ucuucaugcg gcgccggcac 2100
aucgugcgga agcggacgcu gcggcggcug cugcaggagc gcgagcuggu cgagccgcug 2160
accccgagcg gcgaggcccc gaaccaggcc cuccugcgga uccugaagga gaccgaguuc 2220
aagaagauca aggugcuggg cucgggcgcc uucggcaccg uguacaaggg gcuguggauc 2280
cccgagggcg agaaggugaa gaucccggug gccaucaagg agcugcggga ggcgaccagc 2340
ccgaaggcca acaaggagau ccucgacgag gccuacguga uggccagcgu cgacaacccg 2400
cacgugugcc ggcugcuggg caucugccug accagcacgg ugcagcugau cacccagcug 2460
augccguucg gcugccuccu ggacuacgug cgggagcaca aggacaacau cggcagccag 2520
uaccugcuga acuggugcgu gcagaucgcc aagggcauga acuaccugga ggaccggcgc 2580
cuggugcacc gggaccucgc cgcgcggaac guccugguga agaccccgca gcacgugaag 2640
aucaccgacu ucgggcuggc caagcugcug ggcgccgagg agaaggagua ccacgccgag 2700
ggcggcaagg ugcccaucaa guggauggcc cuggagagca uccuccaccg gaucuacacc 2760
caccagucgg acguguggag cuacggcgug accgucuggg agcugaugac guucggcagc 2820
aagccguacg acgggauccc ggccagcgag aucagcagca uccuggagaa gggcgagcgg 2880
cugccgcagc cgccgaucug caccaucgac guguacauga ucauggugaa gugcuggaug 2940
aucgacgcgg acucgcggcc caaguuccgc gagcugauca ucgaguucag caagauggcc 3000
cgggacccgc agcgguaccu ggugauccag ggcgacgagc ggaugcaccu cccgagcccg 3060
accgacagca acuucuaccg ggcccugaug gacgaggagg acauggacga cgugguggac 3120
gccgacgagu accugauccc gcagcagggc uucuucagca gcccgucgac cagccggacc 3180
ccgcugcuga gcagccugag cgccaccagc aacaacucga cggucgccug caucgaccgc 3240
aacggccucc agagcugccc caucaaggag gacagcuucc ugcagcggua cagcagcgac 3300
ccgaccggcg cgcugaccga ggacagcauc gacgacaccu uccugccggu gccggaguac 3360
aucaaccagu cggugccgaa gcggcccgcc gggagcgugc agaacccggu guaccacaac 3420
cagccgcuga acccggcccc gagccgggac ccgcacuacc aggaccccca cagcaccgcc 3480
gugggcaacc cggaguaccu gaacaccguc cagccgacgu gcgugaacag caccuucgac 3540
agcccggccc acugggccca gaagggcucg caccagauca gccucgacaa cccggacuac 3600
cagcaggacu ucuucccgaa ggaggcgaag cccaacggca ucuucaaggg cagcaccgcc 3660
gagaacgccg aguaccugcg gguggccccg cagagcagcg aguucaucgg cgccuccggc 3720
cacgccagcu ccacccccgg gggcgagaag gagacgagcg ccacccagcg guccagcgug 3780
cccuccagca ccgagaagaa cgcggucucc augaccagcu ccgugcugag cucccacagc 3840
cccggguccg gcagcuccac gacccagggc caggacguga cccucgcccc ggccaccgag 3900
cccgccagcg gguccgccgc gacguggggc caggacguca ccagcgugcc cgugacccgc 3960
cccgcccugg ggagcaccac gccgcccgcc cacgacguca ccuccgcccc cgacaacaag 4020
cccgcgccgg gcagcaccgc cccccccgcc cacgggguga ccuccgcccc cgacacgcgg 4080
ccggcccccg gcagcaccgc gccccccgcc cacggcguga ccuccgcccc ggacacccgc 4140
ccggcccccg gcagcaccgc cccccccgcc cacgggguga ccuccgcccc ggacacgcgg 4200
cccgcccccg gcagcaccgc cccgcccgcc cacggcguca cguccgcgcc cgacaaccgc 4260
cccgcccugg ggagcaccgc cccgcccgug cacaacguga ccuccgccag cggcuccgcg 4320
agcggguccg ccagcacccu cguccacaac ggcacguccg cccgggccac caccaccccc 4380
gccagcaagu ccacgcccuu cagcaucccg ucccaccaca gcgacacccc caccacccug 4440
gcgucccaca gcacgaagac cgacgccucc agcacccacc acuccagcgu gcccccgcug 4500
accagcucca accacagcac guccccgcag cucagcaccg ggguguccuu cuucuuccug 4560
agcuuccaca ucuccaaccu gcaguucaac agcucccucg aggaccccag caccgacuac 4620
uaccaggagc ugcagcggga caucuccgag auguuccugc agaucuacaa gcagggcggc 4680
uuccucgggc ugagcaacau caaguuccgc cccggcuccg ucguggugca gcugacccuc 4740
gccuuccggg aggggacgau caacguccac gacguggaga cccaguucaa ccaguacaag 4800
accgaggccg ccagccgcua caaccugacc aucuccgacg ugagcgucuc cgacgugccc 4860
uucccguuca gcgcgcaguc cggcgccggc gugcccgggg ccgugugcca gugccggcgc 4920
aagaacuacg ggcagcucga caucuucccc gcccgggaca cguaccaccc gaugagcgag 4980
uacccgaccu accacaccca cggccgcuac guccccccca gcuccaccga ccggagcccc 5040
uacgagaagg uguccgccgg gaacggcggc agcucccuga gcuacaccaa cccggcggug 5100
gccgccgccu ccgccaaccu ggaggaccag guggaccccc ggcugaucga cggcaaguga 5160
ggacuaguua uaagacugac uagcccgaug ggccucccaa cgggcccucc uccccuccuu 5220
gcaccgagau uaauaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 5280
aaaaaaaaaa aaaaaaaaua uucccccccc cccccccccc cccccccccc ccucuag 5337
<210> 4
<211> 547
<212> РНК
<213> Искусственная
<220>
<223> Последовательность некодирующей иммуностимулирующей РНК R2025
<400> 4
gggagaaagc ucaagcuuau ccaaguaggc uggucaccug uacaacguag ccgguauuuu 60
uuuuuuuuuu uuuuuuuuga ccgucucaag guccaaguua gucugccuau aaaggugcgg 120
auccacagcu gaugaaagac uugugcggua cgguuaaucu ccccuuuuuu uuuuuuuuuu 180
uuuuuaguaa augcgucuac ugaauccagc gaugaugcug gcccagaucu ucgaccacaa 240
gugcauauag uagucaucga gggucgccuu uuuuuuuuuu uuuuuuuuuu uggcccaguu 300
cugagacuuc gcuagagacu acaguuacag cugcaguagu aaccacugcg gcuauugcag 360
gaaaucccgu ucagguuuuu uuuuuuuuuu uuuuuuccgc ucacuaugau uaagaaccag 420
guggaguguc acugcucucg aggucucacg agagcgcucg auacaguccu uggaagaauc 480
uuuuuuuuuu uuuuuuuuuu uugugcgacg aucacagaga acuucuauuc augcaggucu 540
gcucuag 547
<210> 5
<211> 52
<212> РНК
<213> Искусственная
<220>
<223> Рибозим хаммерхэд HHNUH2d
<400> 5
gcauggcuga ugaggccucg accgauaggu cgaggccgaa aagcuuucuc cc 52
<210> 6
<211> 2083
<212> РНК
<213> Искусственная
<220>
<223> G/C оптимизированная последовательность мРНК, кодирующая HA вируса гриппа A H1N1 (Нидерланды 2009)
<400> 6
ggggcgcugc cuacggaggu ggcagccauc uccuucucgg caucaagcuu accaugaagg 60
ccauccuggu gguccuccug uacaccuucg ccaccgcgaa cgccgacacg cugugcaucg 120
gcuaccacgc caacaacagc accgacaccg uggacaccgu gcucgagaag aacgucacgg 180
ugacccacuc cgugaaccug cuggaggaca agcacaacgg gaagcucugc aagcugcggg 240
gcgucgcccc gcugcaccuc gggaagugca acaucgccgg cuggauccug gggaacccgg 300
agugcgagag ccuguccacc gcgagcuccu ggagcuacau cguggagacc uccagcuccg 360
acaacggcac gugcuacccc ggcgacuuca ucgacuacga ggagcuccgc gagcagcuga 420
gcuccgugag cuccuucgag cgguucgaga ucuuccccaa gaccagcucc uggcccaacc 480
acgacagcaa caaggggguc accgccgccu gcccgcacgc cggcgcgaag uccuucuaca 540
agaaccugau cuggcucgug aagaagggga acagcuaccc caagcugucc aagagcuaca 600
ucaacgacaa gggcaaggag gugcuggucc ucugggggau ccaccacccc agcaccuccg 660
ccgaccagca gagccuguac cagaacgccg acgccuacgu guucgugggc uccagccgcu 720
acuccaagaa guucaagccc gagaucgcca uccggccgaa gguccgcgac caggagggcc 780
ggaugaacua cuacuggacg cugguggagc ccggggacaa gaucaccuuc gaggcgaccg 840
gcaaccucgu ggucccccgc uacgccuucg ccauggagcg gaacgccggg agcggcauca 900
ucaucuccga cacccccgug cacgacugca acacgaccug ccagaccccg aagggcgcca 960
ucaacaccag ccugcccuuc cagaacaucc accccaucac gaucgggaag ugccccaagu 1020
acgugaaguc caccaagcug cgccucgcga ccggccugcg gaacgucccg agcauccagu 1080
cccgcgggcu guucggcgcc aucgccgggu ucaucgaggg cggcuggacc gggauggugg 1140
acggcuggua cggguaccac caccagaacg agcagggcag cggguacgcc gccgaccuca 1200
aguccacgca gaacgcgauc gacgagauca ccaacaaggu gaacagcguc aucgagaaga 1260
ugaacaccca guucaccgcc gugggcaagg aguucaacca ccuggagaag cggaucgaga 1320
accugaacaa gaaggucgac gacggcuucc ucgacaucug gacguacaac gccgagcugc 1380
uggugcuccu ggagaacgag cgcacccugg acuaccacga cuccaacgug aagaaccucu 1440
acgagaaggu ccggagccag cugaagaaca acgccaagga gaucgggaac ggcugcuucg 1500
aguucuacca caagugcgac aacaccugca uggaguccgu gaagaacggg accuacgacu 1560
accccaagua cagcgaggag gccaagcuga accgcgagga gaucgacggc gugaagcucg 1620
aguccacgcg gaucuaccag auccuggcga ucuacagcac cgucgccagc ucccuggugc 1680
ucguggucag ccugggggcc aucuccuucu ggaugugcag caacggcucc cugcagugcc 1740
gcaucugcau cugaccacua gugcaucaca uuuaaaagca ucucagccua ccaugagaau 1800
aagagaaaga aaaugaagau caauagcuua uucaucucuu uuucuuuuuc guugguguaa 1860
agccaacacc cugucuaaaa aacauaaauu ucuuuaauca uuuugccucu uuucucugug 1920
cuucaauuaa uaaaaaaugg aaagaaccua gaucuaaaaa aaaaaaaaaa aaaaaaaaaa 1980
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaau gcaucccccc cccccccccc 2040
cccccccccc cccccaaagg cucuuuucag agccaccaga auu 2083
<---
Реферат
Настоящая группа изобретений относится к биотехнологии. Предложен способ синтеза молекулы РНК заданной последовательности, предусматривающий синтез и использование молекул РНК реакционной смеси, где реакционная смесь оптимизирована для заданной последовательности таким образом, что включает четыре рибонуклеозидтрифосфата (НТФ) ГТФ, АТФ, ЦТФ и УТФ так, что доля каждого из них соответствует доле соответствующего нуклеотида в молекуле РНК. Описана оптимизированная смесь, ее применение для синтеза молекулы РНК заданной последовательности и набор, содержащий оптимизированную смесь, буфер, матрицу ДНК и РНК-полимеразу. Данная группа изобретения обеспечивает более эффективную транскрипцию РНК in vitro. 4 н. и 31 з.п. ф-лы, 11 табл., 11 пр., 23 ил.

Комментарии