Способ и биореактор для культивирования и стимуляции трехмерных, жизнеспособных и устойчивых к механическим нагрузкам клеточных трансплантатов - RU2370534C2
Код документа: RU2370534C2
Чертежи
Описание
Изобретение касается способа и порядка соответствующего GMP (Good Manufactoring Practice = хорошей производственной практике) получения трехмерных, жизнеспособных и стойких к механическим нагрузкам клеточных культур, преимущественно опорной структуры клеточных конструкций, которые при этом могут культивироваться и стимулироваться новым способом в замкнутом биологическом миниреакторе одновременно, последовательно или с временным управлением. Эти выращенные таким образом трансплантаты могут использоваться в качестве тканезаменителей для лечения, например, дефектов соединительных и опорных тканей, прямой травмы суставов, ревматизма и дегенеративных заболеваний суставов и служить, например, при артрозе коленного сустава альтернативой обычным (оперативным) методам лечения как, например, микрофрактурирование или надсверливание.
Tissue Engineering, занимающаяся прежде всего размножением «in-vitro» гомологичного, так называемого аутологичного клеточного материала пытается вырастить функциональные замещающие клеточные и тканевые структуры, которые могут быть использованы для трансплантации в поврежденные ткани.
Для этого в лаборатории происходит обычное размножение клеточных культур (например, суставно-опорной клеточной структуры). Собственно размножение этих клеток (например, хондроцитов) происходит в однослойной культуре на дне сосуда или чаши согласно стандартным протоколам, предусматривающим также применение специфических для тканей факторов роста, медиаторов и индукторов.
Целью этих аддитивных факторов является, например, активация особой способности хрящевых клеток синтезировать достаточное количество внеклеточных матричных компонентов (EZM), чтобы при размножении «in-vitro» получить массовое соотношение 1% хондроцитов к 99% внеклеточных матричных компонентов, присущее функциональным суставным хрящам (Stockwell RA: The cell density of human articular and costal cartilage. J Anat. 1967; 101(4):753-763; Hamerman D, Schubert M: Diarthrodial joints, an essay. Amer J Med. 1962; 33:555-590).
Так как этого невозможно добиться простой добавкой дополнительной среды, предпринимается попытка различным способом возбудить/стимулировать эти хондроциты для выращивания в лабораторных условиях подходящего аутологичного (гиалинового) заменителя опорной структуры с высокой степенью дифференцировки.
Описанное размножение клеточных культур и выращивание тканезамещающих структур связано с целым рядом недостатков.
Это пассивное культивирование культур хрящевых клеток в двухмерной поверхностной структуре в простой чаше, покрытой питательной средой, не демонстрирует признаков активной стимуляции способных к дифференцировке хондроцитов.
Из работы Минута В.В, Клота С., Айгнера И. и Штайнера П. (Minuth, W.W., Kloth S., Aigner J., Steiner P.: MINUSHEET-Perfusionskultur: Stimulierung eines gewebetypischen Milieus. Bioscope 1995; 4:20-25) известна концепция, пытающаяся обойти этот недостаток путем внесения клеточного материала пациента в искусственную структуру-носитель, по своим биофизическим свойствам похожую на хондроциты и допускающую сетеподобное соединение между многослойно расположенными клетками, с последующим перфузионным выращиванием в соответствующем биологическом реакторе. В ходе многочисленных экспериментов была продемонстрирована повышенная дифференцирующая способность клеток благодаря синтезу внеклеточных матричных компонентов, объясняемая трехмерным культивированием хондроцитов в различных биосовместимых и биологически ресорбируемых матрицах, как, например, гидрогели, альгинаты, агарозы (Benya and Shaffer: Dedifferentiated chondrocytes reexpress the differentiated collagen phenotype when cultured in agarose gels. Cell. 1982; 30:215-224).
Полученное таким образом пространство имитирует оригинальные условия существования хондроцитов в живой ткани, например в коленном и бедренном суставах, и является, тем самым, выгодной адаптацией условий выращивания к условиям «in-vivo».
При контактном поверхностном выращивании клеток достаточное снабжение питательной средой обеспечивается относительно просто, так как питательные вещества находятся непосредственно над или рядом с клетками и допускают прямой диффузионный обмен веществ. И напротив, при использовании трехмерных матриц с клетками при статичной схеме культивирования возникают спады или градиенты концентрации, которые могут ограничить транспортировку материала в медиальные регионы конструкции и препятствуют, тем самым, оптимальному наличию питательных веществ для клеточных связей.
Этому эффекту, оказывающему негативное влияние на выращивание клеточного материала в пространственных несущих матрицах, противодействуют путем перфузии/трансфузии среды сквозь конструкт.
Этот активный процесс в несущей структуре обеспечивает гомогенное снабжение клеток питательными веществами и постоянное удаление метаболитов от хондроцитов. Кроме того, динамическая схема культивирования создает более высокое поступление газа и стимулирует клеточные связи в зависимости от выбранного перфузионного потока среды механически в мкПа благодаря возникающему при этом срезающему усилию (Raimondi, M.T., F. Boschetti, et al.: Mechanobiology of engineered cartilage cultured under a quantified fluid-dynamic environment. Biomechan Model Mechanobiol. 2002; 1:69-82).
Еще одним недостатком процесса размножения клеток и создания трансплантата является отсутствие абсолютной стерильности системы "сосуд с клеточной культурой". Даже рутинные процедуры, например замена среды, высев клеток или их сбор, связаны с повышенной инфекционной опасностью для находящихся в сосуде клеточных структур, так как сосуд приходится открывать, а работа в режиме «Laminar Flow-Workbench» (ламинарная проточная система) не гарантирует 100-процентной стерильности окружающей среды в смысле „Основных правил Всемирной организации здравоохранения для изготовления лекарственных средств и обеспечения их качества“ (Good Manufacturing Practice - директива Всемирной организации здравоохранения (WHO)).
Далее, в этой пассивной системе не обеспечивается максимальный газообмен через открытую для диффузии крышку, а также через питательную среду к находящемуся на дне слою клеток.
Для того чтобы избежать этих присущих сосудам с культурой недостатков, в последние годы форсированными темпами велись работы по разработке автоматизированных закрытых биореакторных систем для создания тканезамещающих структур. Эти системы (Freed und Vunjak-Novakovic: Microgravity tissue engineering. In Vitro Cell Dev Biol Anim. 1997; 33:381-385) могут предложить преимущество стерильного контролируемого культивирования и стимуляции трехмерных трансплантатов. Путем комбинации Tissue Engineerings с возможностями биотехнологии создается возможность для контроля и управления отдельными параметрами выращивания, например обработкой CO2 и O2, температурой, заменой культуральной среды, отбором проб и т.п. в биореакторных системах. (Obradovic, Carrier, Vunjak-Novakovic and Freed: Gas exchange is essential for bioreactor cultivation of tissue engineered cartilage. Biotechnol Bioeng. 1999; 63:197-205).
При конструировании биореакторов всегда большое значение уделяется хорошо продуманной системе, дающей возможность искусственно регулировать процессы. Когда речь идет о выращивании определенной ткани, система биореактора должна быть в состоянии как можно точнее воспроизводить физиологические условия и процессы «in vivo». Каждая биореакторная система воздействует на выращиваемый материал по меньшей мере одним видом механического воздействия.
Соединение позитивных качеств управляемого биореакторного выращивания аутологичных тканезаменителей в биогенной матрице со стимуляцией перфузии в культуральной среде является поэтому логичным действием по обеспечению автоматизированного, стерильного и отвечающего требованиям GMP выращивания трансплантата для получения, например жизнеспособных хондроцитов с повышенной способностью к синтезу внеклеточных матричных компонентов.
Из немецкого патента DE 4306661 A1 и работы Зиттингера М., Буйа Й., Минута В.В., Хаммера К. и Бурместера ГР. (Sittinger M, Bujia J, Minuth WW, Hammer C, Burmester GR: Engineering of cartilage tissue using bioresorbable polymer carriers in perfusion culture. Biomaterials. 1994; 15(6):451-456) известен перфузионный реактор, в котором клетки помещены в слой полимера и дополнительно окружены капсулой агарозы. Через этот цилиндрический стеклянный реактор со скоростью 0,016 мл/мин пропускается питательная среда. Сам реактор расположен в соответствующем инкубаторе, в котором созданы стандартные условия. Стерильные фильтры в емкости с питательной средой обеспечивают газообмен с окружающим воздухом.
В ходе дальнейших экспериментов с этими типами реакторов были применены сополимерные среды из слоев викрила и полидиоксанона, пропитанных поли-L-лизином или коллагенными волокнами типа II (Bujia J, Rotter N, Minuth W, Burmester G, Hammer C, Sittinger M: Cultivation of human cartilage tissue in a 3-dimensional perfusion culture chamber: characterization of collagen synthesis. Laryngorhinootologie. 1995; 74(9): 559-563 и Kreklau B, Sittinger M, Mensing MB, Voigt C, Berger G, Burmester GR, Rahmanzadeh R, Gross U: Tissue engineering of biphasic joint cartilage transplants. Biomaterials. 1999; 20(18):1743-1749). В эти слои были внедрены человеческие хондроциты, которые затем выращивались в течение двух недель в условиях перфузии. С применением закрепленной на карбонате кальция двухфазной модели из сополимера полигликолевой кислоты и поли-L-лактоновой кислоты (этикон) временной промежуток был увеличен до 70 дней.
Еще одна очень похожая на вышеописанный перфузионный биореактор система была сконструирована Мицуно С., Аллеманом Ф. и Гловацки Е. (Mizuno S, Allemann F, Glowacki J: Effects of medium perfusion on matrix production by bovine chondrocytes in three-dimensional collagen sponges. J Biomed Mater Res. 2001; 56(3):368-375). В противоположность уже описанному реактору, эта система имеет закрытую зону для искусственной питательной среды. Большая часть выращиваемого материала находится в стеклянной цилиндрической колонке шириной 1 см и длиной 10 см. Колонка заполнена многочисленными клеточными/полимерными ячейками размером 7Ч15 мм, не имеющими дополнительной капсулы. Искусственная питательная среда из питающей емкости со скоростью 300 мкл в минуту пропускается через колонку и всю систему. С помощью этой системы проводится испытание хондроцитов крупного рогатого скота в коллагеновых губках на их реакцию на перфузию в ходе выращивания в течение 15 дней.
Из патента США 5928945 также известно биореакторное устройство, в котором сросшиеся хондроциты подвергаются в камере определенным потокам и срезающим усилиям для определения усиленного синтеза коллагена типа II.
Параллельно разработке перфузионных реакторов исследовательские группы занимались проектированием биореакторов, оказывающих различные нагрузки на эксплантаты, клеточные пробы или клеточные/полимерные структуры. При проектировании биореакторов со стимуляцией опорной клеточной структуры их конструкция ориентирована на реализацию механических нажимных пуансонов или аналогичных устройств, оказывающих одноосевое давление на хрящевые трансплантаты для имитации важнейших форм нагрузки на человеческую хрящевую ткань. Конструкции многих таких систем давления отличаются большим сходством.
Камера давления одной из таких систем, разработанной Штайнмайером Й., Торцилли ПА., Бартеном-Вурстеном Н. и Лустом Г. (Steinmeyer J, Torzilli PA, Burton-Wurster N, Lust G: A new pressure chamber to study the biosynthetic response of articular cartilage to mechanical loading. Res Exp Med (Berl). 1993, 193(3):137-142), состоит из титанового корпуса, покрытого внутри слоем полиэтилена. Опытный экземпляр с максимальным диаметром 10 мм может размещаться в сосуде на дне камеры и покрываться слоем искусственной питательной среды объемом 7 мл. Так как модель не имеет перфузионной системы искусственной культуральной среды, возможно только периодическое воспроизводство давления в течение короткого времени выращивания. Воспроизводящая нагрузки система, оказывающая необходимое давление на опытный экземпляр, состоит из проходящего через запор камеры пористого тигеля и приводится в движение с помощью обычных грузов или пневматического цилиндра с создающим давление поршнем, расположенным над камерой.
Также и описанная Ли ДА и Бадером ДЛ (Lee DA, Bader DL: Compressive strains at physiological frequencies influence the metabolism of chondrocytes seeded in agarose. J Orthop Res. 1997; 15(2):181-188) система с приводом в состоянии оказывать давление одновременно на 24 опытных экземпляра. Привод установлен на окружающей инкубатор раме и передает усилие вниз к загрузочной панели внутри стерильного бокса. Загрузочная панель изготовлена из стали и оснащена 24 стальными болтами с насечкой из органического стекла диаметром 11 мм. Привод создает различные нагрузки в зависимости от степени деформации. Эта система применяется для двухдневного культивирования хондроцитов крупного рогатого скота/структур агарозы. Создаются статические и дополнительные циклические нагрузки (от 0,3 до 3 Гц) с максимальной амплитудой 15%.
Недостатком многих создающих давление реакторов является то обстоятельство, что конструкции клеточных культур при нагрузке не могут подвергаться перфузии питательной средой, а следовательно, нет возможности для изучения эффекта множественного раздражения клеток. Далее, подобное недостаточное снабжение питательными веществами препятствует оптимальному обмену веществ, а также максимальному синтезу, например, внеклеточных матричных частиц опорной клеточной структуры.
Системы давления и перфузии, описанные, например, в патенте США 6060306 и немецком патенте 19808055, позволяют одновременную многократную стимуляцию с такими параметрами как перфузионный поток, инициированные им срезающие усилия и одноосевое давление. Недостатком реакторов со стимуляцией давления является, прежде всего, то, что это давление осуществляется с помощью исполнительных двигателей или иных приводных медиаторов давления, в большинстве случаев ползунов, поршней и т.п. в пространстве биореакторов, в котором находится преимущественно аутологичный трансплантат, с последующим определенным давлением на клеточный конструкт. Вследствие нахождения аппликатора давления в стерильной системе очень трудно обеспечить герметичную конструкцию реакторов с аппликаторами давления, поэтому подобные системы отличаются повышенной сложностью. Как следствие, сферой применения этих (потенциально нестерильных) систем являются фундаментальные исследования, в то время как использование этих устройств и способов в медицинской сфере противоречит действующему закону о лекарственных средствах.
Поэтому все биореакторные аппараты для культивирования и стимуляции аутологичных тканезамещающих структур подчиняются директиве Всемирной организации здравоохранения "Основные правила Всемирной организации здравоохранения для изготовления лекарственных средств и обеспечения их качества"), а также немецкому закону о лекарственных средствах (AMG), "Конвенции о фармацевтических инспекциях" и директиве GMP 91/356/EWG. Поэтому риск инфекции, а также недостаточная гарантия стерильности систем препятствуют получению разрешения на изготовление продукта в смысле § 13 AMG.
Задача изобретения состоит в создании способа и биореактора для изготовления трехмерных, жизнеспособных и стойких к механическим нагрузкам клеточных культур, в котором они могут культивироваться и стимулироваться в тесной временной взаимосвязи или одновременно. Биореактор должен обеспечивать выполнение требований (GMP) по выращиванию трансплантата в гарантированно стерильных условиях.
Задача изобретения решается в соответствии с описанным в пункте 1 формулы изобретения способом и описанным в пункте 13 формулы изобретения биореактором. Преимущественные варианты осуществления способа описаны в пунктах 2-12 формулы изобретения; прочие варианты биореактора описаны в пунктах 14-57 формулы изобретения.
Способ согласно изобретению и биореактор согласно изобретению объединяют в одном реакторе процессы культивирования и стимуляции выращенных в соответствии с требованиями GMP трехмерных, жизнеспособных и стойких к механическим нагрузкам клеточных культур, преимущественно опорных конструктов хондроцитов. При этом стимуляция и культивирование могут осуществляться одновременно, последовательно или с временным управлением. Выращенные таким образом трансплантаты предназначены в качестве тканезаменителей для лечения, например, дефектов соединительных и опорных тканей, прямых травм суставов, ревматизма и дегенеративных заболеваний суставов.
Основным признаком способа и реактора согласно изобретению является то, что трансплантат находится в замкнутом пространстве реактора и может подвергаться воздействию стимулов, во многом соответствующих стимулам, действующим «in-vivo». Сюда относится перфузия пространственных конструкций клеточных культур кондиционированной питательной средой, вызывающая, с одной стороны, органотипичные срезающие усилия на клеточных мембранах, а кроме того, обеспечивающая повышенный обмен веществ. В этом закрытом биореакторе над трансплантатом находится магнитный поршнеобразный пуансон, служащий аппликатором нагрузки на клеточную культуру. Пуансон перемещается во внутреннем пространстве реактора бесконтактно и осуществляет при этом направленную одноосевую стимуляцию давлением на тканевый трансплантат. Бесконтактное управление миниактуатором происходит с помощью расположенных снаружи управляющих магнитов, направленное (электро)магнитное поле которых заставляет пуансон изменять свое положение в биореакторе и создавать при этом органотипичную динамическую или статическую стимуляцию давлением.
Способ и биореактор имеют то, уже упомянутое, преимущество, что во время культивирования может осуществляться также стимуляция клеточных культур, заключающаяся, прежде всего, в выращивании или регенерации соединительных и опорных тканевых структур и функциональных тканевых систем (хрящей, костей и т.п.).
Аппаратура позволяет осуществлять стерильное выращивание клеточных трансплантатов синхронно, с перфузией и под давлением, отличающееся повышенной производительностью по матричным компонентам (например, культур опорной клеточной структуры). Благодаря высокой степени автоматизации это устройство снижает до минимума число рабочих операций и уменьшает, таким образом, риск инфекции клеточной культуры. Далее, автоматизированное культивирование и стимуляция трансплантатов гарантирует высокую степень воспроизводства процесса. Благодаря конструкционным признакам биореактора согласно изобретению реализуется замкнутый контур биореактора и, как следствие, строго аутологичные культивирование и стимуляция тканезамещающих структур с соблюдением директив GMP.
Еще одной сферой применения биореактора является фармацевтическое исследование действующих начал для определения степени влияния пролиферационных и дифференцирующих веществ или комбинаций веществ на трансплантаты.
В дальнейшем приводится описание способа и реактора согласно изобретению на конкретных примерах осуществления. На фигурах изображены:
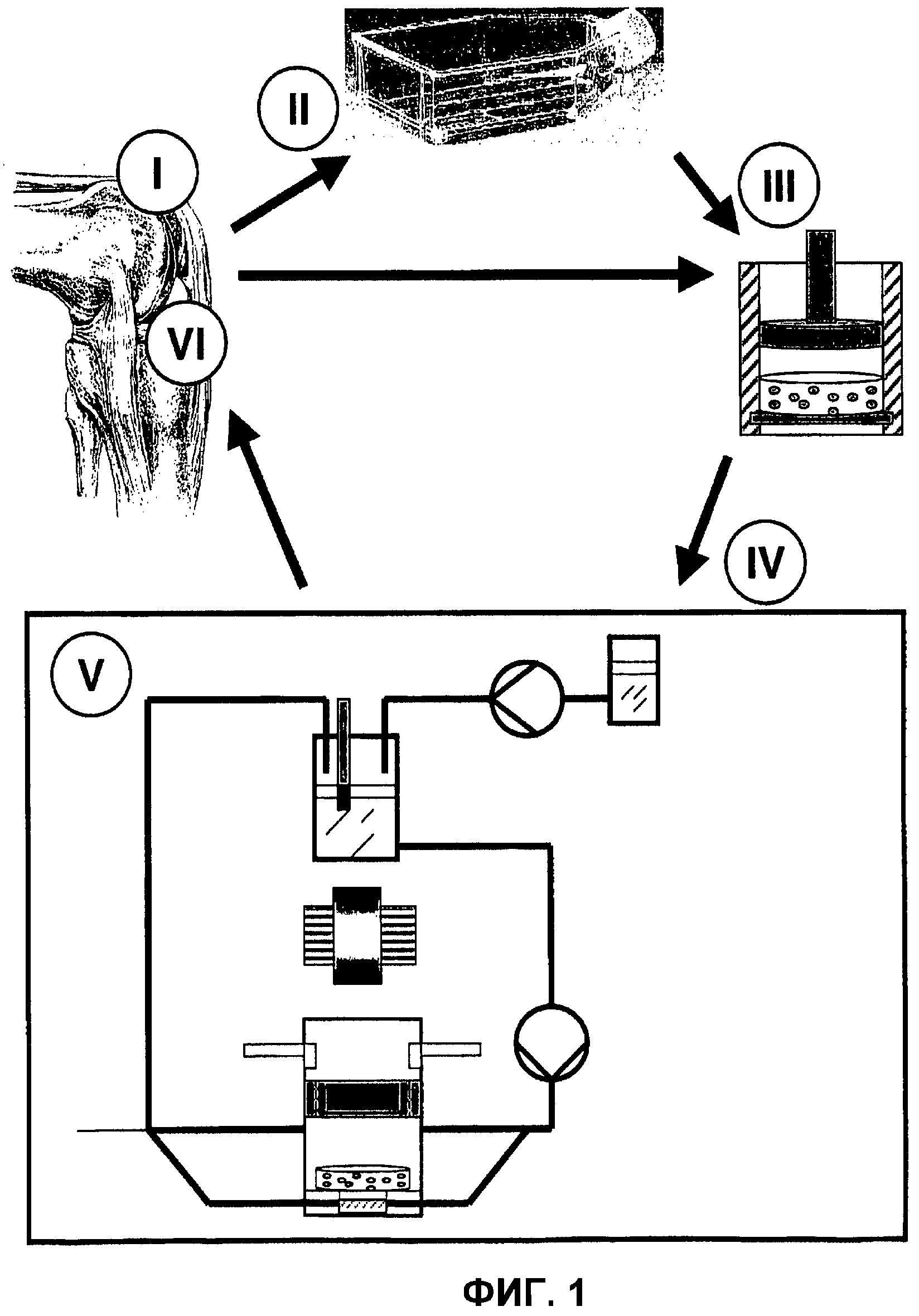
Фиг.1: Способ изготовления трансплантатов.
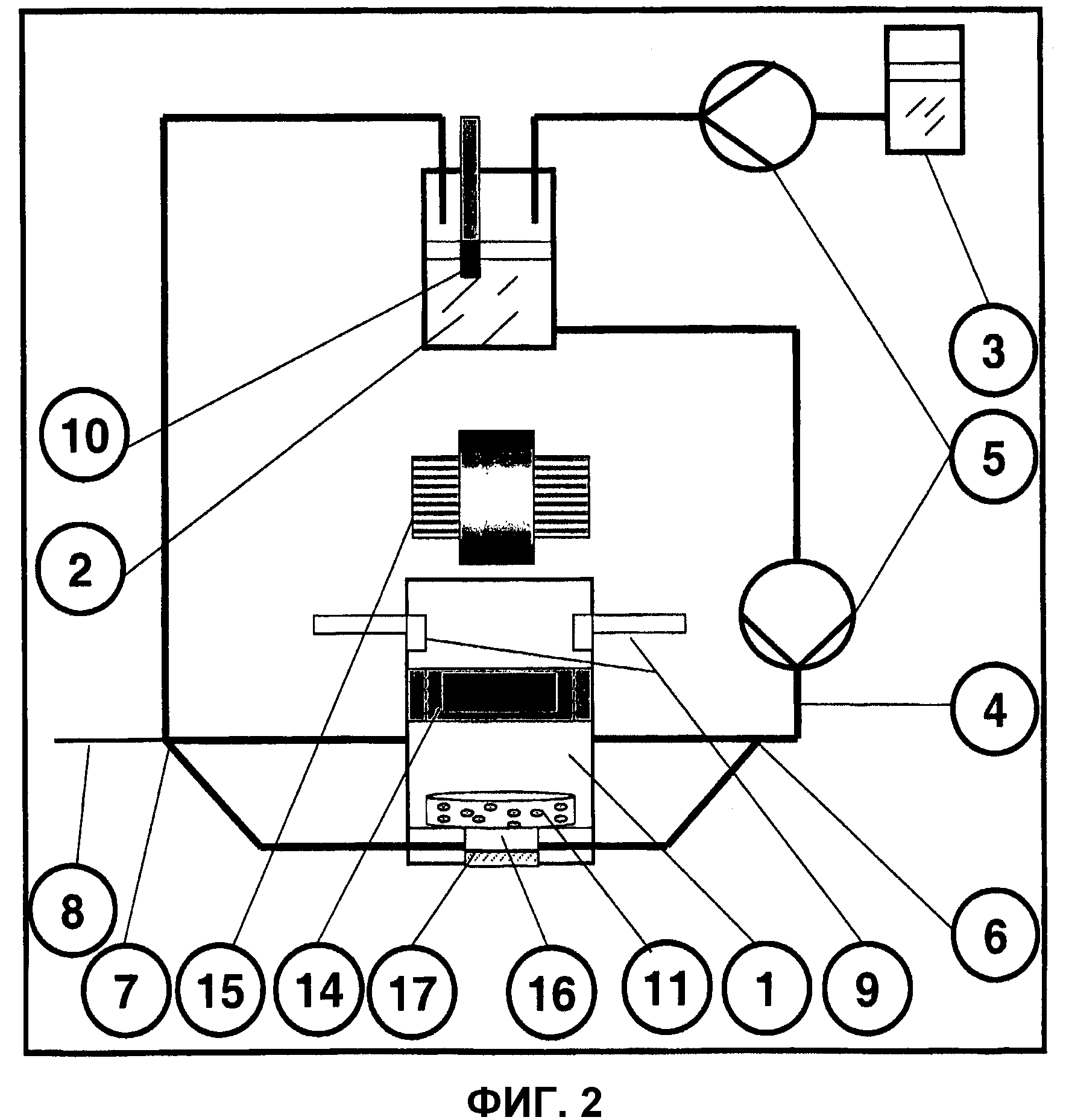
Фиг.2: Схема биореакторной системы согласно GMP.
Фиг.3: Схема однокамерного биореактора.
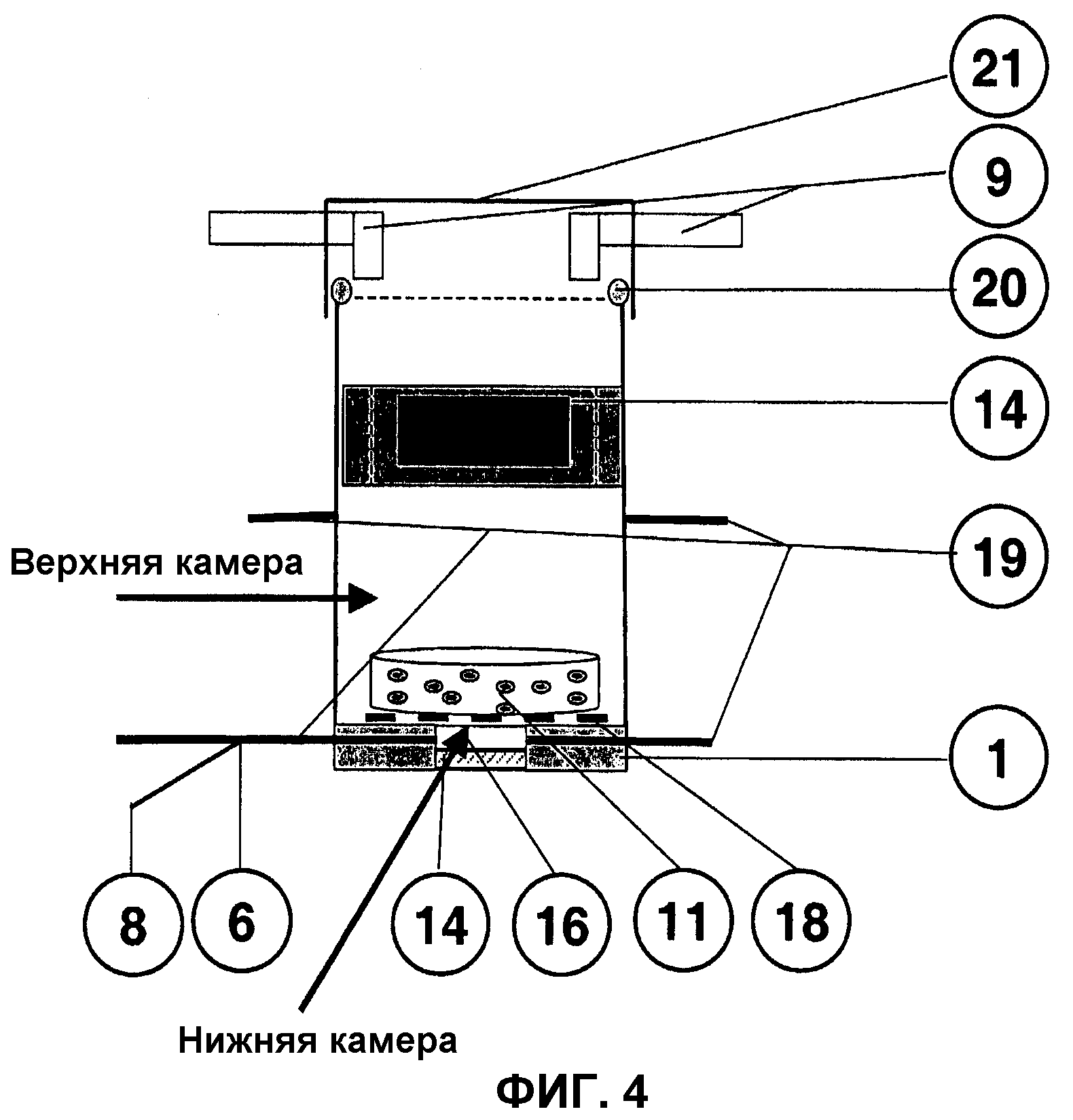
Фиг.4: Схема двухкамерного биореактора.
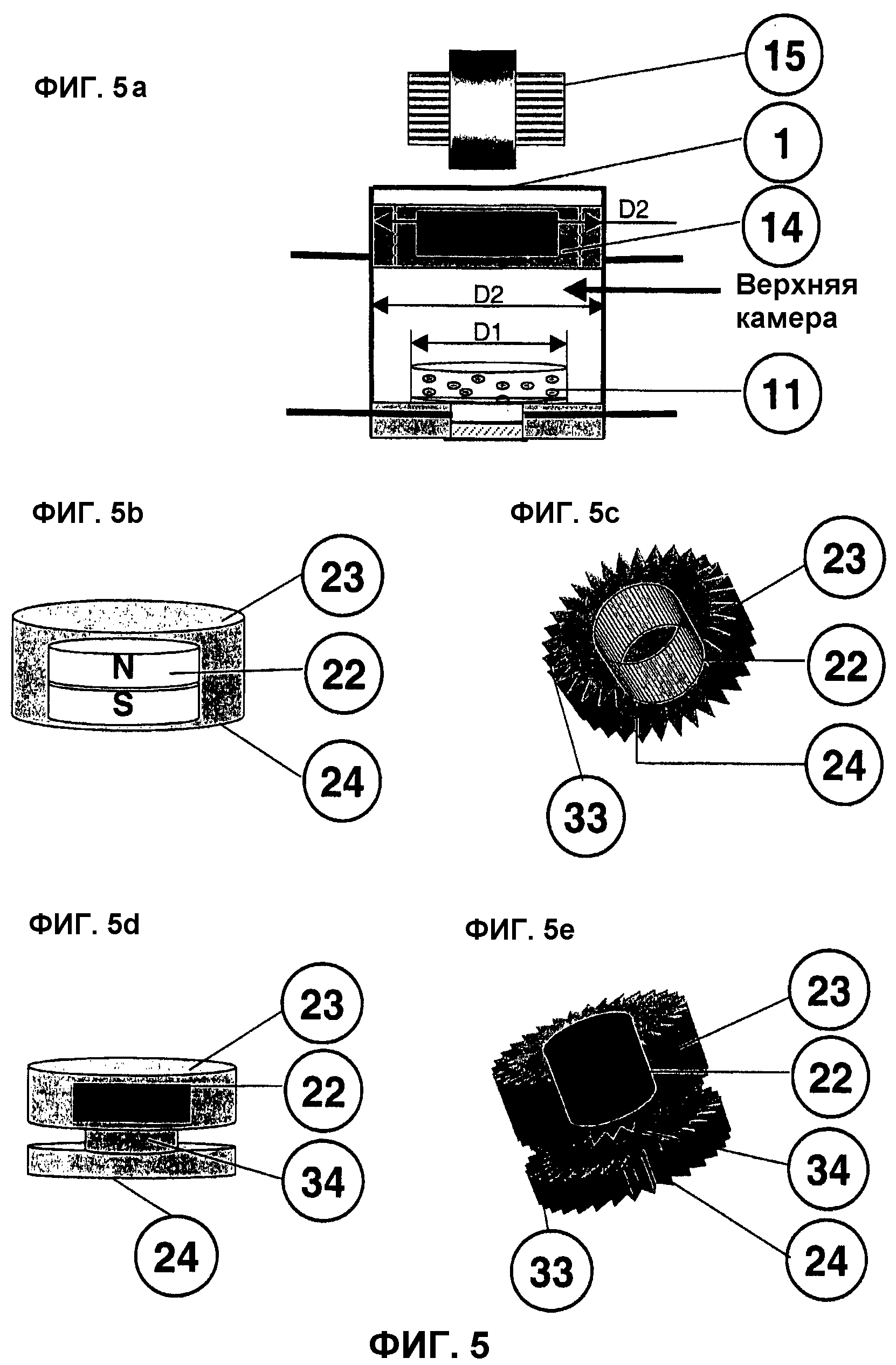
Фиг.5: Конструкция и формы выполнения миниактуатора.
Фиг.6: Схема приготовления и высева конструкции в биореакторе.
Фиг.7: Схема технического устройства для перфузии и перемешивания среды в однокамерном биореакторе.
Фиг.8: Схема технического устройства для перфузии и перемешивания среды в двухкамерном биореакторе.
Фиг.9: Схема фиксации трансплантата в биореакторе.
Фиг.10: Магнитные системы для управления миниакутатором.
Фиг.11: Схема стимуляции в двухкамерном реакторе.
Пример 1
Способ изготовления трансплантатов
На фиг.1 на примере трансплантации хрящевой ткани представлено использование биореактора для синхронного культивирования и стимуляции трехмерных клеточных трансплантатов.
Для этого у пациента, прежде всего, минимально инвазивным методом отбирается (I) здоровый клеточный материал (например, артикулярная опорная структура) и кровь. Путем ферментативного расщепления производится разделение полученного материала на отдельные клетки, после чего они пересчитываются и, в зависимости от полученного результата, высеиваются стандартными методaми Tissue Engineerings в однослойных сосудах (II) и размножаются в строго аутологичных условиях, или же сразу используются для создания конструкта (III). При этом клетки помещаются в трехмерную структуру трансплантата, состоящую из биосовместимого или ресорбируемого материала-носителя (например, гидрогелей, агарозы, коллагенов, гидроксилапатитов, полимерных комплексов и т.п.). Для этого суспендированные клетки (например, хондроциты) смешиваются с биогенной опорной структурой (например, агарозой), помещаются в колбу для высева и отверждаются, например, в цилиндрической форме для трансплантата (например, матрице хрящ-агароза). Эта адаптированная к условиям «in-vivo» трехмерная структура ведет, прежде всего, у клеток соединительных и опорных тканей (например, хондроцитов) к (ре-)дифференцировке и дополнительно к синтезу типичных тканевых субстанций и матричных компонентов (например, коллагена, протеогликана).
Эти колбы с находящимся в них пространственным клеточным трансплантатом помещаются в биореактор (IV), трансплантат выпрессовывается и помещается в биореактор. В заключение происходит отвечающее требованиям GMP одновременноe, последовательное или управляемое по времени культивирование и стимуляция этого клеточного конструкта в недавно разработанной закрытой биореакторной аппаратуре (V). На этом этапе путем многократного аналогичного условиям «in-vivo» раздражения клеточного трансплантата (стимуляции с помощью срезающего усилия, перфузии, деформации, механической нагрузки) можно добиться повышенной дифференцировки и экспрессии органотипичных маркеров.
Через короткое время в биореакторе происходит регенерация очень жизненного, богатого матрицей конструкта клеточной культуры. Этот аутологичный трансплантат извлекается (VI), в случае необходимости адаптируется к геометрии тканевого дефекта и в заключение трансплантируется в поврежденные соединительные или опорные ткани.
Пример 2
Схема биореакторной системы
На фиг.2 представлена форма выполнения биореакторной системы (с двухкамерным биореактором) для аутологичного культивирования и множественной стимуляции клеточных трансплантатов в закрытой реакторной системе способом, соответствующим GMP.
В этом примере выполнения все устройство обеспечения оптимальной температуры, влажности и состава воздуха размещено в обогреваемом и регулируемом по газу инкубаторе. Возможна также раздельная конструкция, при которой биореактор 1, среда в инкубаторе и прочие технические компоненты для контроля располагаются вне инкубатора.
Сам биореактор 1 и его компоненты являются биологически и химически инертными и могут обрабатываться в автоклаве. Кроме того, корпус и привинчиваемая крышка биореактора изготовлены из немагнитных (например, пластмассы) или слабомагнитных (например, ванадиевой стали 4) материалов.
Культуральная среда поступает из резервуара 2 через систему шлангов 4 с 3-ходовым клапаном 6 и 4-ходовым клапаном 7 с помощью циркуляционного насоса 5 в биореактор 1. Эта культуральная среда может быть обогащена полученными из крови пациента аутологичными аддитивными факторами (например, факторами роста, медиаторами и т.п.) из резервуара для вспомогательных материалов (супплементов) 3. Среда подается периодически, в режиме «Fed-Batch»» или непрерывно в биореактор 1 и, тем самым, к трансплантату 11. При замкнутом контуре среда поступает затем по шланговой системе 4 в резервуар для среды 2, оборудованный измерительными датчиками для контроля физико-химических параметров, например pH, pCO2 и pO2. Когда среда считается отработанной, она по шланговой системе 4 может направляться во внешнюю емкость для отходов. В обоих случаях существует возможность с помощью вентильного устройства 7 осуществлять стерильный отбор проб из контура реактора.
В биореакторе выращиваемый и культивируемый трансплантат 11 находится в медиальной позиции на дне реактора. Под трансплантатом 11 может находиться вторая, меньшая по размеру камера. Это проточное пространство снабжается средой через шланговую систему 4 и может быть заполнено сильнопористым, но тонким слоем агломерационного материала 16. Нижняя камера может быть отгорожена тонким прозрачным стеклом 17 и в качестве отверстия для микроскопии предназначаться для инверсного микроскопа.
Внутри верхней камеры биореактора 1 наряду с пропущенными через крышку реактора биодатчиками 9 находится миниактуатор 14. Этот выполненный как магнитный пуансон миниакутатор 14 действует как бесконтактный аппликатор давления и управляется магнитами и катушкой 15.
Пример 3
Схема однокамерного биореактора
На фиг.3 представлена возможная форма выполнения биореактора 1, состоящая из камеры для культуры, служащей для применения бесконтактно управляемого миниактуатора 14.
Выполненный однокамерным биореактор 1 состоит из корпуса крышки 21, дополнительно герметизированной зажимным кольцом 20. Через крышку пропущены биодатчики 9 для измерения в режиме «on-line», например, концентрации глюкозы, лактата и других компонентов среды. В пространстве реактора над трансплантатом 11 расположен точно пригнанный миниактуатор 14, покоящийся на специальном днище реактора с вставленным прозрачным стеклом 17.
Для подачи среды для трансплантата 11 в биореакторе 1 предусмотрены по меньшей мере одно питающее и одно отводящее соединения 19 типа Luer. На по меньшей мере одном отводящем соединении 19 с помощью трехходового клапана 6 создан пробоотборный участок 8.
Пример 4
Схема двухкамерного биореактора
На фиг.4 представлена еще одна форма выполнения биореактора 1, состоящая из двух камер, при этом в верхней расположен пуансон 14, а нижняя служит для подачи питательной среды под трансплантат 11. Эта форма выполнения по функции, характеристике и требованиям к деталям 1, 6, 8, 9, 14, 19-21 не отличается от биореактора 1, описанного в примере 3.
В аппаратуре предусмотрены по меньшей мере одно питающее и одно отводящее соединения 19 для верхней и нижней реакторных камер, которые предназначены для регулируемого с помощью клапанов снабжения соответствующей камеры и трансплантата 11.
Размеры нижней камеры выбраны такими, чтобы ее диаметр был меньше диаметра трансплантата 11. В эту камеру вставляется плоский точно подогнанный диск из пористого агломерационного материала 16, что обеспечивает возможность инверсного микроскопирования через замыкающее стекло 17 и мембрану 18 в направлении трансплантата 11. Этот диск из агломерационного материала 16 в нижней камере реактора в рамках данной аппаратуры выполняет еще одну важную функцию. При механической нагрузке трансплантата 11 через пуансон 14 он предотвращает нежелательное вдавливание желеобразного клеточного конструкта 11 в камеру. В зависимости от применяемой опорной матрицы и ее вязкости предусмотрено использование проницаемой для жидкости мембраны 18 между агломерационным материалом 16 и трансплантатом 11 для предотвращения смешивания материала-носителя с агломерационным материалом 16.
Пример 5
Конструкция и форма выполнения миниактуатора 14
На фиг.5 представлена конструкция, геометрия и различные формы миниактуатора 14, вертикально вставленного в пространство реактора (здесь на примере двухкамерной модели) и передающего осевое давление на расположенный на дне реактора трансплантат 11.
Этот магнитный аппликатор давления 14 в соответствии с изобретением (см. фиг.5a) вертикально перемещается в биореакторе 1 с бесконтактным управлением с помощью внешне расположенных управляющих магнитов 15. Абсолютно вертикальное сжатие может быть обеспечено, с одной стороны, медиальным расположением трансплантата 11 в биореакторе 1. С другой стороны, требуется точная подгонка внешнего диаметра производящего давление пуансона D2 к внутреннему диаметру биореактора D2. Это гарантирует вертикальное движение миниактуатора 14 в биореакторе 1 без перекоса пуансона. Во всех моделях биореактора этот диаметр D2 должен быть больше диаметра D1 трансплантата 11.
На фиг.5b представлена характерная конструкция этого устройства давления 14. Оно оснащено очень мощным постоянным магнитом 22, преимущественно из соединения неодима, железа и бора, перемещающимся в соответствующем направлении уже при самом незначительном магнитном или электромагнитном поле. Этот постоянный магнит 22 с лакированным или лаковым покрытием заключен в капсулу из биологически инертной пластмассы - капсулу 23. Эта преимущественно цилиндрическая капсула 23 имеет точно подогнанный внешний диаметр и скользит без трения и строго вертикально в цилиндре биореактора. На нижней стороне пластмассовой капсулы 23 наряду с плоской поверхностью могут воспроизводиться также другие органотипичные негативные формы поверхности пуансона 24, точно соответствующие позитивным формам «in-vivo» (например, выпуклости, дуги и т.п.).
Имеющаяся в данном случае новая геометрия актуатора без проточных каналов 33 в капсуле 23, позволяет, кроме того, реализовывать насосную функцию, обусловленную цикличным генерированием магнитного поля. Благодаря существующим условиям давления и клапанам в биореакторе 1 при движении вверх миниактуатора 14 происходит засасывание среды в пространство реактора. При движении вниз или компрессионном давлении на трансплантат 11 эта среда выжимается из биореактора 1.
На фиг.5c представлена еще одна примерная форма выполнения миниактуатора 14, также состоящего из сильного постоянного магнита 22 и капсулы 23 с индивидуальной поверхностью пуансона 24. Эта модель для оптимизации потока имеет по краям своей капсулы 23 так называемые проточные каналы 33. Благодаря им обеспечивается обтекание средой миниактуатора 14 во внутреннем пространстве биореактора и требуется меньшее усилие для преодоления сопротивления среды. Капсула 23 должна иметь по меньшей мере 3 направляющих выступа с точно пригнанным внешним диаметром D2 для ровного позиционирования всего миниактуатора 14 на трансплантате 11.
На фиг.5d представлен модифицированный пуансон 14 на основе фиг.5b, оборудованный удлинителем 34 для создания дистанции от постоянного магнита 22 и клеточного конструкта 11. Причиной подобного дистанцирования постоянного магнита 22 в верхней головке цилиндра относительно трансплантата 11 является стремление свести к минимуму возможное влияние поля на клеточные культуры 11.
На фиг.5e представлен миниактуатор 14 на основе фиг.5d, имеющий по меньшей мере 3 проточных канала 33 и 3 направляющих выступа с внешним диаметром D2.
Пример 6
Схема изготовления и высева конструкта в биореакторе 1
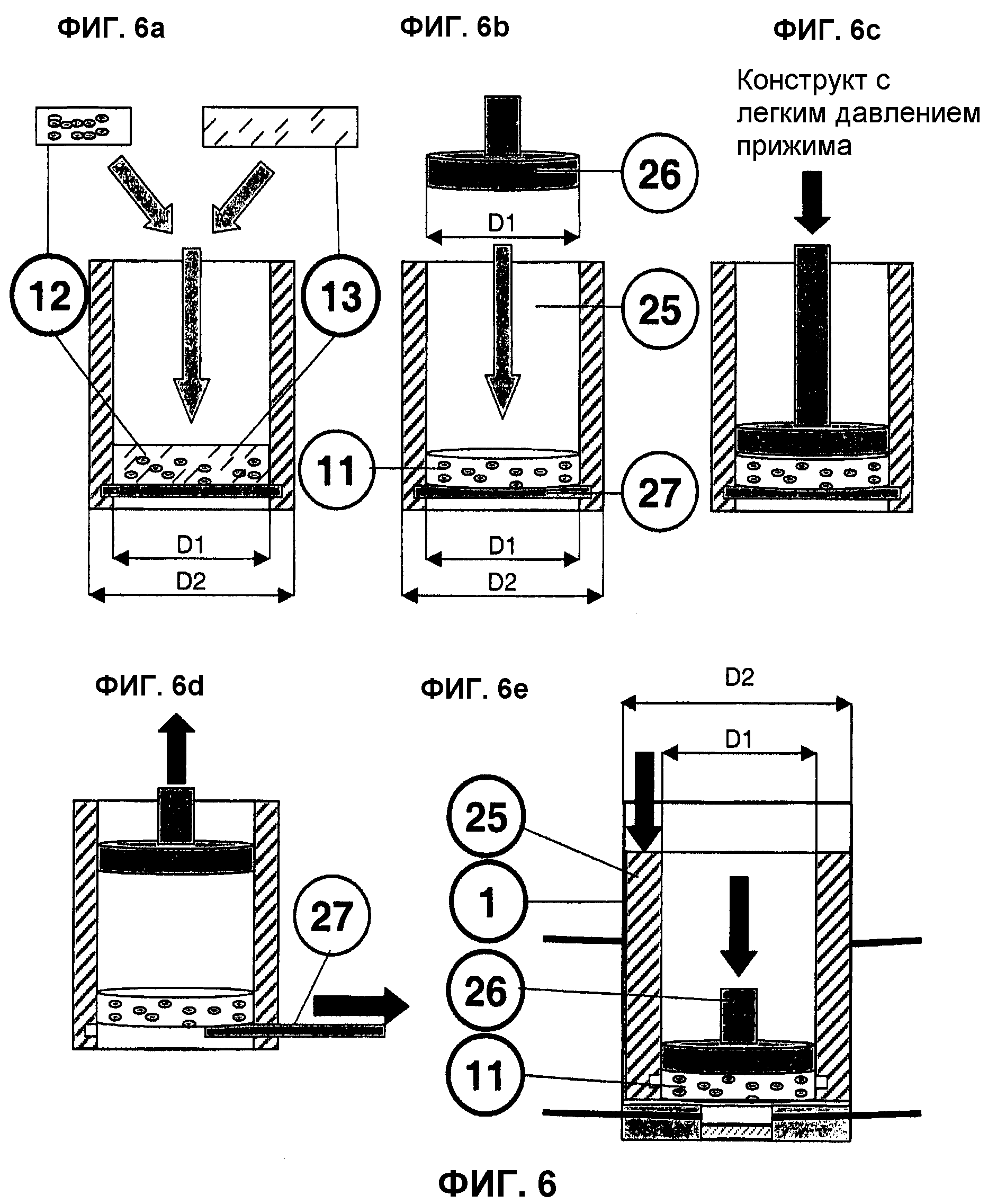
На фиг.6 представлен способ и устройство для изготовления и высева трехмерных, преимущественно цилиндрических, конструктов клеточных матриц.
На фиг.6a (высев клеточных матриц) размноженные (см. Фиг.1, II) или свежеизолированные (см. Фиг.1, III) и препарированные клетки 12 с биогенной структурой носителя 13 размножаются, суспендируются до получения гомогенности и впрыскиваются в необходимом для получения клеточной матрицы объеме в колбу для высева 25.
Точно подогнанная колба для высева 25 по своему внутреннему диаметру D1 соответствует будущему внешнему диаметру трансплантата 11, а по своему внешнему диаметру D2 - внутреннему диаметру биореактора 1.
На фиг.6b (применение пуансона) представлено применение пуансона 26 в колбе для высева 25. Во время отверждения или полимеризации соответствующей клеточной матрицы в цилиндре реактора 25 на пластине 27 в полый поршневой цилиндр вводится точно подогнанный пуансон 26 с внешним диаметром D1.
Нижняя сторона этого пуансона 26 может аналогично поверхности пуансона 24 миниактуатора 14 иметь форму органотипичных структур.
На фиг.6c (применение пуансона) представлена насадка пуансона 26 на трансплантат 11 в колбе для высева 25. Пуансон 26 садится на клеточный конструкт с легким давлением прижима для того, чтобы противодействовать образованию мениска или выпучивания верхней стороны матрицы трансплантата 11 и получить, например, цилиндрическую форму трансплантата.
Если трансплантату 11 следует придать поверхность для адаптации к поверхности «in-vivo», то это применение пуансона 26 происходит на стадии отверждения/полимеризации.
На фиг.6d (удаление пластины) насаженный пуансон 26 после придания необходимой формы трансплантату 11 поднимается и происходит удаление находящейся на дне колбы для высева 25 преимущественно гидрофобной пластины 27. Для предотвращения адгезии желатинообразного клеточного конструкта 11 к пластине 27 и колбе для высева поверхность закрывается, например, инертной пленкой или инертным полимерным материалом.
На фиг.6e (высев конструкта в биореакторе) представлен высев цилиндрического конструкта на примере двухкамерного биореактора. При этом точно подогнанная колба для высева 25 помещается в биореактор 1, после чего с помощью прижимного пуансона 26 клеточный конструкт 11 вводится медиально в препарированный реактор и высевное устройство удаляется из биореактора 1. Этот подготовленный биореактор 1 содержит пористый агломерационный материал 16 и, возможно, проницаемую для диффузии мембрану 18.
Пример 7
Схема технического устройства для перфузии конструкта и перемешивания среды в однокамерном биореакторе
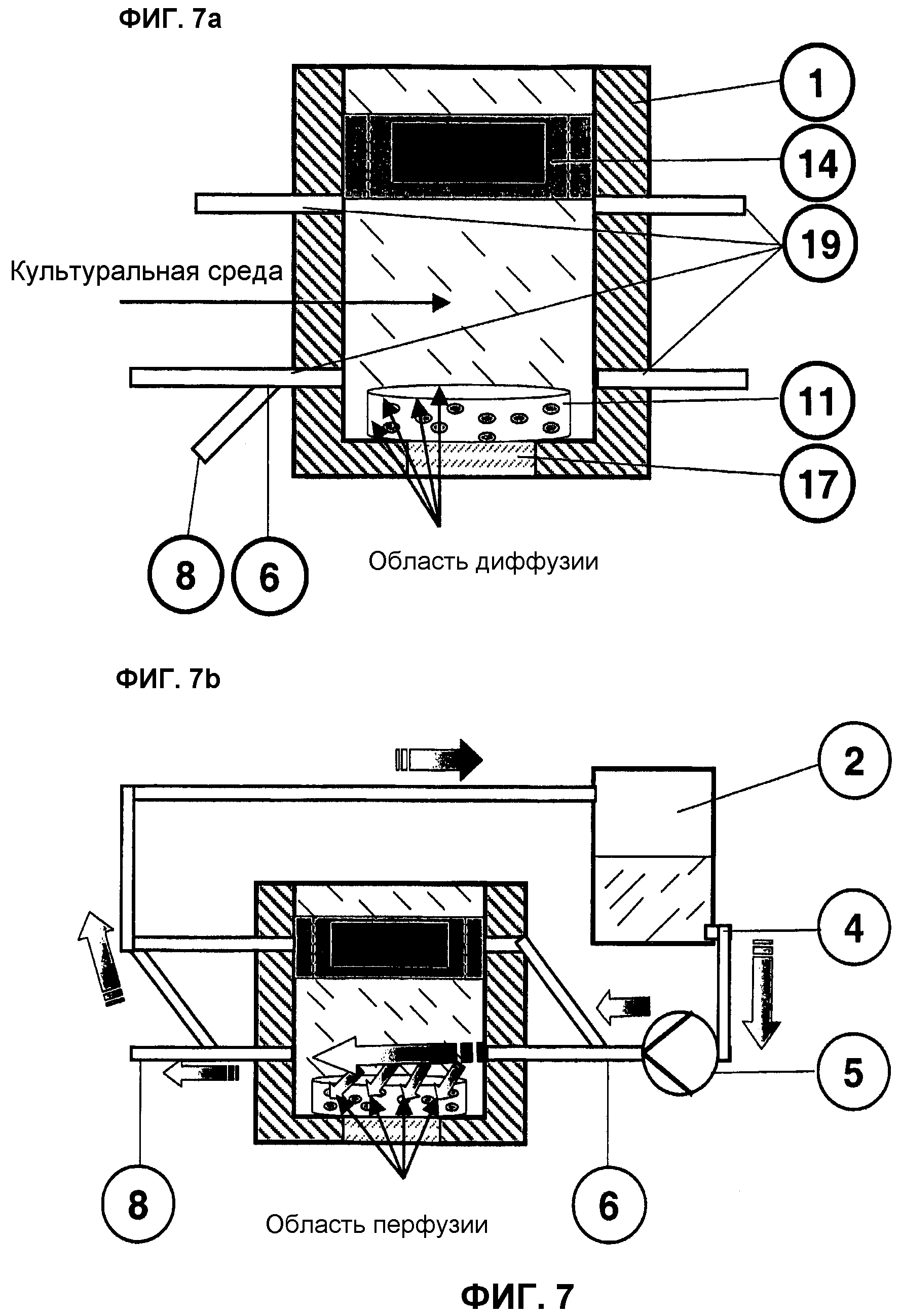
На фиг.7 представлена конструкция корпуса однокамерного реактора и ее влияние на диффузию и перфузию в трансплантате 11.
При представленной на фиг.7a форме исполнения биореактор 1 имеет четыре входящих и выходящих трубопровода с интегрированной муфтой Luer 19. Для оптимизации потока они могут различаться по размеру и расположению, в том числе, например, входить в корпус биореактора 1 по касательной. Количество подсоединенных к биореактору 1 входящих и отходящих трубопроводов 19 должно составлять не менее двух. На каждом отходящем соединении Luer 19 с помощью, например, 3-ходового клапана 6 может быть создан пробоотборный участок 8.
При статическом выращивании в биореакторе среда диффундирует, прежде всего, в верхние и краевые области, например, цилиндрического тканевого трансплантата 11 и снабжает клеточную культуру, среди прочего, нутриентами, одновременно вынося продукты обмена из матрицы.
На фиг.7b представлена непрерывная подача питательной среды из резервуара 2 с расположенным сзади факультативным резервуаром для супплементов 3 (не изображен) с помощью дозирующего циркуляционного насоса 5 по шланговой системе 4 в по меньшей мере один вход 19 биореактора 1.
Отток среды происходит через по меньшей мере один выход 19 в шланговую систему 4, в которую по меньшей мере в одном месте с помощью 3-ходового клапана 6 может быть интегрирован автономный пробоотборный участок 8. Израсходованная среда может, как здесь представлено, оставаться в контуре, поступая при этом в резервуар для среды 2, откуда она забирается затем для повторной непрерывной перфузии трансплантата 11. В ином случае она полностью выводится из контура. Культивирование трансплантата 11 происходит затем периодически или в режиме «Fed-Batch».
Целевая непрерывная подача среды культуры в пространство реактора может значительно улучшить поточную обработку трансплантата 11 по сравнению со статичной схемой на фиг.7a. Благодаря индуцированной перфузии обеспечивается промывание средой более глубоких участков конструкта. В результате оптимизируется обмен веществ, что ведет к повышению дифференцировки клеток. Далее, благодаря такому осуществлению поточной обработки конструктa стимулируется срезающее усилие на клетки.
Пример 8
Схема технического устройства для перфузии конструкта и перемешивания среды в двухкамерном биореакторе
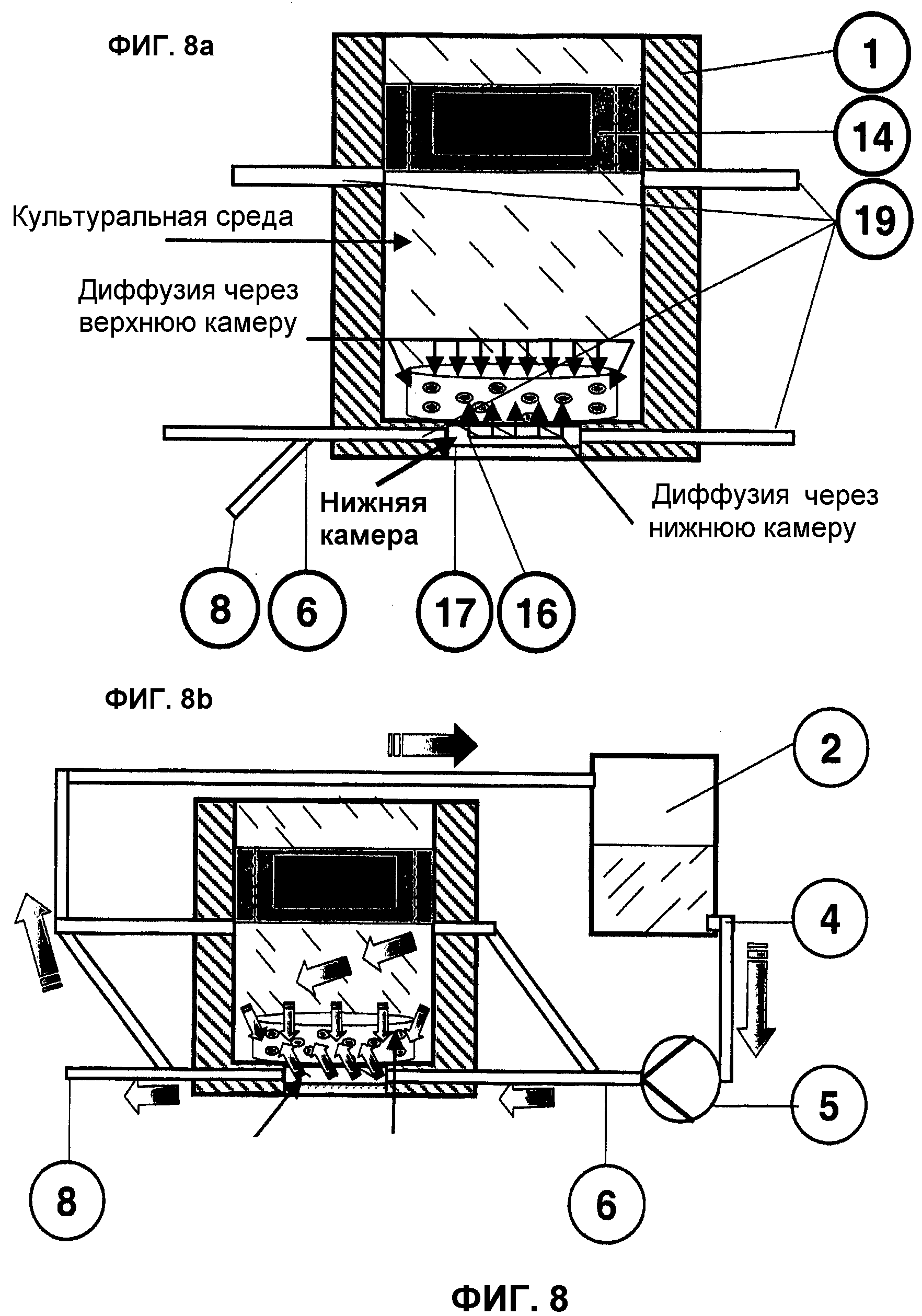
На фиг.8 представлен двухкамерный биореактор, обеспечивающий оптимизацию потока, диффузии и перфузии трансплантата и повышающий, тем самым, качество трансплантата.
На фиг.8a представлен вариант со статическим выращиванием и диффузией. Число подсоединенных к биореактору 1 подводящих и отводящих трубопроводов 19 должно составлять по меньшей мере два, при этом по меньшей мере по одному из них должны быть подсоединены к нижней и верхней камерам реактора. Изображенные на фигуре два трубопровода 19 (входящий и выходящий) на камеру в целях оптимизации потока могут иметь различное положение, позицию и диаметр.
Пробоотборный участок 8 может быть создан на любом отходящем соединении Luer 19 обеих камер, например, с помощью 3-ходового клапана 6 или т.п.
Наряду с диффузией среды в верхние и боковые области трансплантата эта новая конструкция камеры под трансплантатом 11 на статической фазе культивирования ведет к диффузии среды культуры из пористого агломерационного материала в придонные зоны структуры носителя, что улучшает обмен веществ во всем трансплантате 1.
На фиг.8b представлена непрерывная подача питательной среды из резервуара для среды 2 с расположенным сзади факультативным резервуаром для супплементов 3 (не изображен) с помощью дозирующего циркуляционного насоса 5 по шланговой системе 4 в по меньшей мере один вход нижней и верхней камеры 19 биореактора 1.
Отток среды происходит через по меньшей мере один выход 19 в шланговую систему 4, в которую по меньшей мере в одном месте с помощью 3-ходового клапана 6 может быть интегрирован автономный пробоотборный участок 8. Израсходованная среда может, как здесь представлено, оставаться в контуре, поступая при этом в резервуар для среды 2, откуда она забирается затем для повторной непрерывной перфузии трансплантата 11. В ином случае она полностью выводится из контура. Выращивание трансплантата 11 происходит затем периодически или в режиме «Fed-Batch».
Интеграция согласно изобретению второй камеры, в данном случае под трансплантатом 11, демонстрирует свои положительные качества, прежде всего, при целевой поточной обработке биологического конструкта. Если соответственно с помощью 3-ходового клапана 6 включается поток среды из резервуара 2 в нижнюю камеру, то происходит индуцированная направленная вверх перфузия трансплантата 11 при закрытом нижнем сливе, так как среда может покинуть пространство реактора только через верхний слив.
Аналогично этой схеме с помощью 3-ходового клапана 6 обеспечивается поточная обработка трансплантата 11 по направлению из верхней в нижнюю камеру. Результатом такой конструкции устройства наряду с полной перфузией является дальнейшая стимуляция клеток с помощью индуцированного срезающего усилия, влияющего на клетки и регулируемого путем изменения производительности циркуляционного насоса 5. Возможно также частичное или полное открытие 3-ходового клапана 6 для более быстрого обмена среды в биореакторе 1.
Пример 9
Схема фиксации трансплантата 11 в биореакторе 1
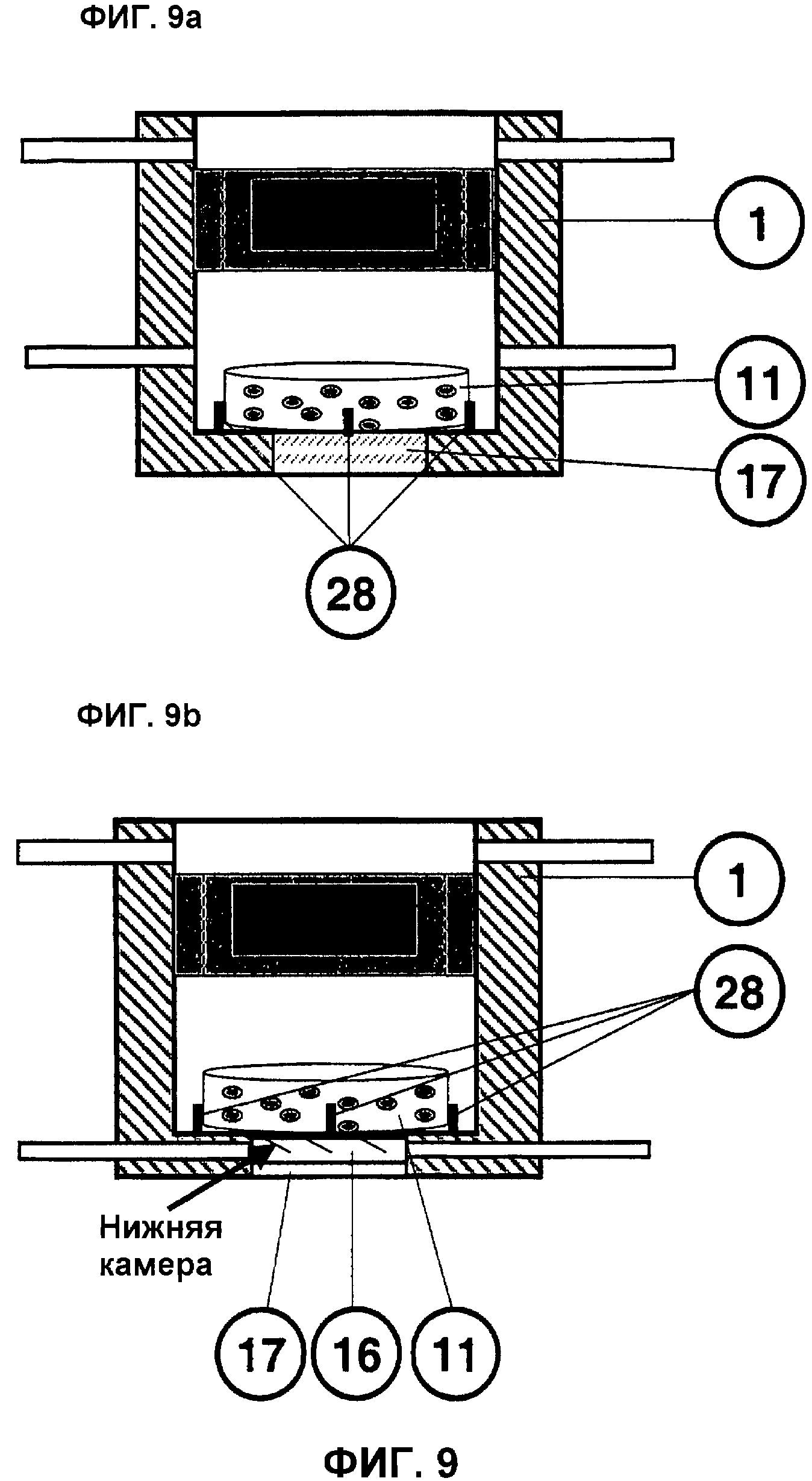
На фиг.9 представлена схема фиксации трансплантата 11 в однокамерном или двухкамерном биореакторе 1.
На фиг.9a представлен стимулируемый трансплантат 11, зафиксированный медиально поверх прозрачного стекла 17 в однокамерном биореакторе 1. С помощью по меньшей мере 3 фиксирующих стенок 28 должно предупреждаться вызываемое потоком среды горизонтальное движение трансплантата 11 по дну реактора в целях достижения оптимальной перфузии и стимуляции давлением. Эти опущенные в реактор 1 биосовместимые фиксирующие стенки 28 по своей высоте должны быть ниже амплитуды давления, прикладываемого к трансплантату 11.
На фиг.9b представлена схема использования по меньшей мере 3 фиксирующих стенок 28 в двухкамерном биореакторе для горизонтальной фиксации трансплантата 11 при различных условиях потока, идеальной вертикальной перфузии, а также механического воздействия давлением.
Пример 10
Магнитные системы для управления миниактуатором 14
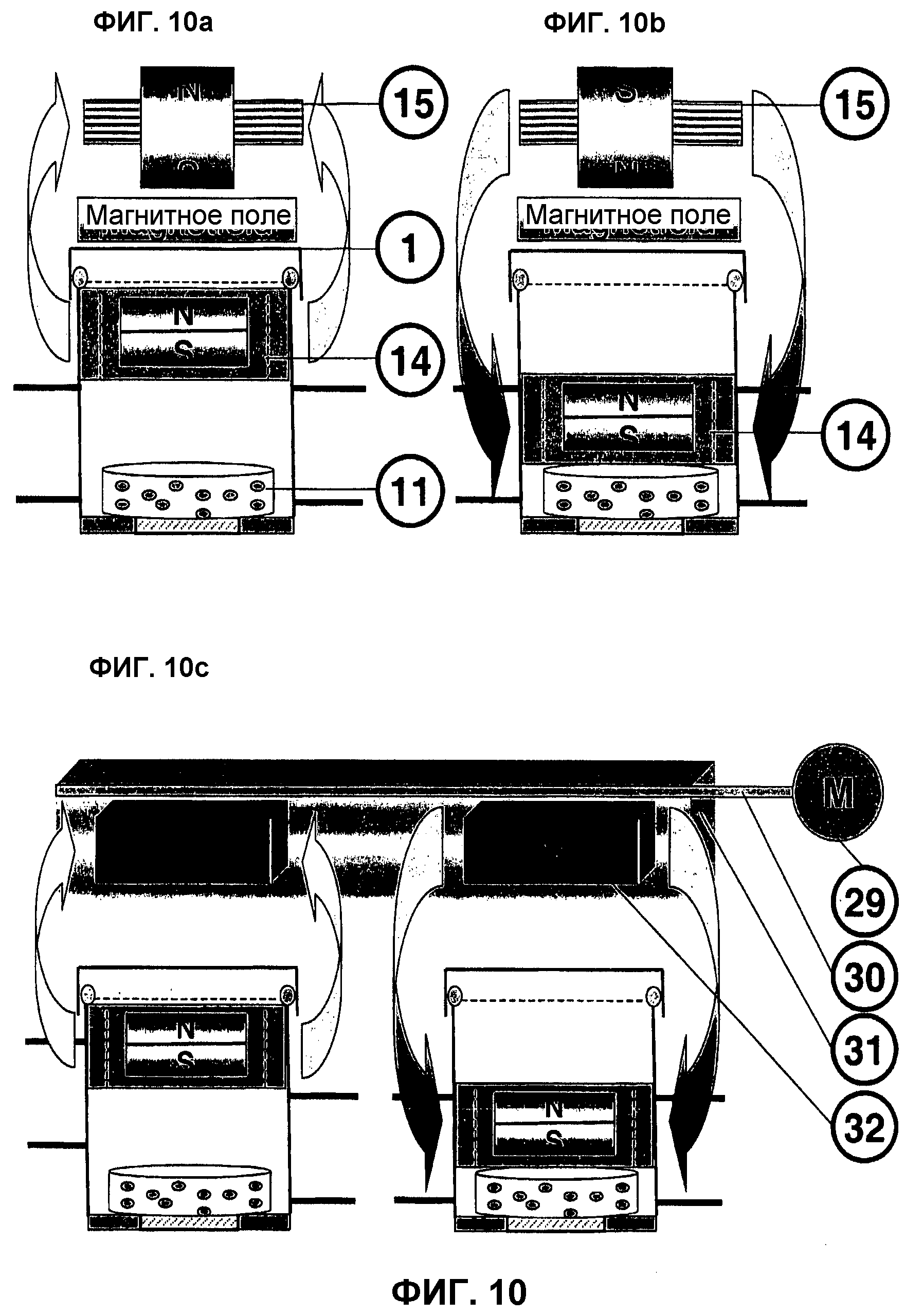
На фиг.10 представлены (на примере однокамерного биореактора) характерные устройства и расположения аппаратуры для бесконтактно управляемого способа стимуляции путем воздействия миниактуатором 14 на трансплантат 11.
На фиг.10a (магнитный эффект управления - притягивание магнита) представлены характерное устройство и принцип бесконтактного управления магнитным актуатором 14 в биореакторе 1 для деформации давлением трансплантата 11. Постоянный магнит в миниактуаторе 14 ориентирован по преобладающему направлению магнитного поля, генерируемого расположенным снаружи управляющим магнитом 15. С помощью этого магнита 15, представляющего собой, например, по меньшей мере один постоянный магнит или по меньшей мере одну катушку, генерируется определенное (электро-)магнитное поле, силовые линии которого проникают во все внутреннее пространство биореактора 1 и вызывают зависимое от направления силовых линий движение пуансона миниактуатора 14. В рамках иллюстрированного фиг.10a способа представлен принцип притягивания магнитом управления 15, в данном случае, для примера, расположенного вверху.
На фиг.10b (магнитный пример управления - отталкивание магнита) представлен пример исполнения со вторым магнитным принципом управления, реализованным магнитной системой управления 15 и миниактуатором 14, а именно магнитным отталкиванием. Путем изменения направления силового поля управляющего магнита 15 изменяется направление движения миниактуатора 14, который теперь опускается вниз на трансплантат 11. При увеличении мощности/плотности магнитного потока, исходящего от управляющего магнита 15, усиливается также и нагрузка давления на трансплантат 11 до получения целевого значения для стимуляции в условиях, близких к условиям «in-vivo».
На фиг.10c-10e представлено расположение элементов управления, позволяющее циклически и с высокой частотой управлять миниактуатором 14 в закрытом биореакторе 1.
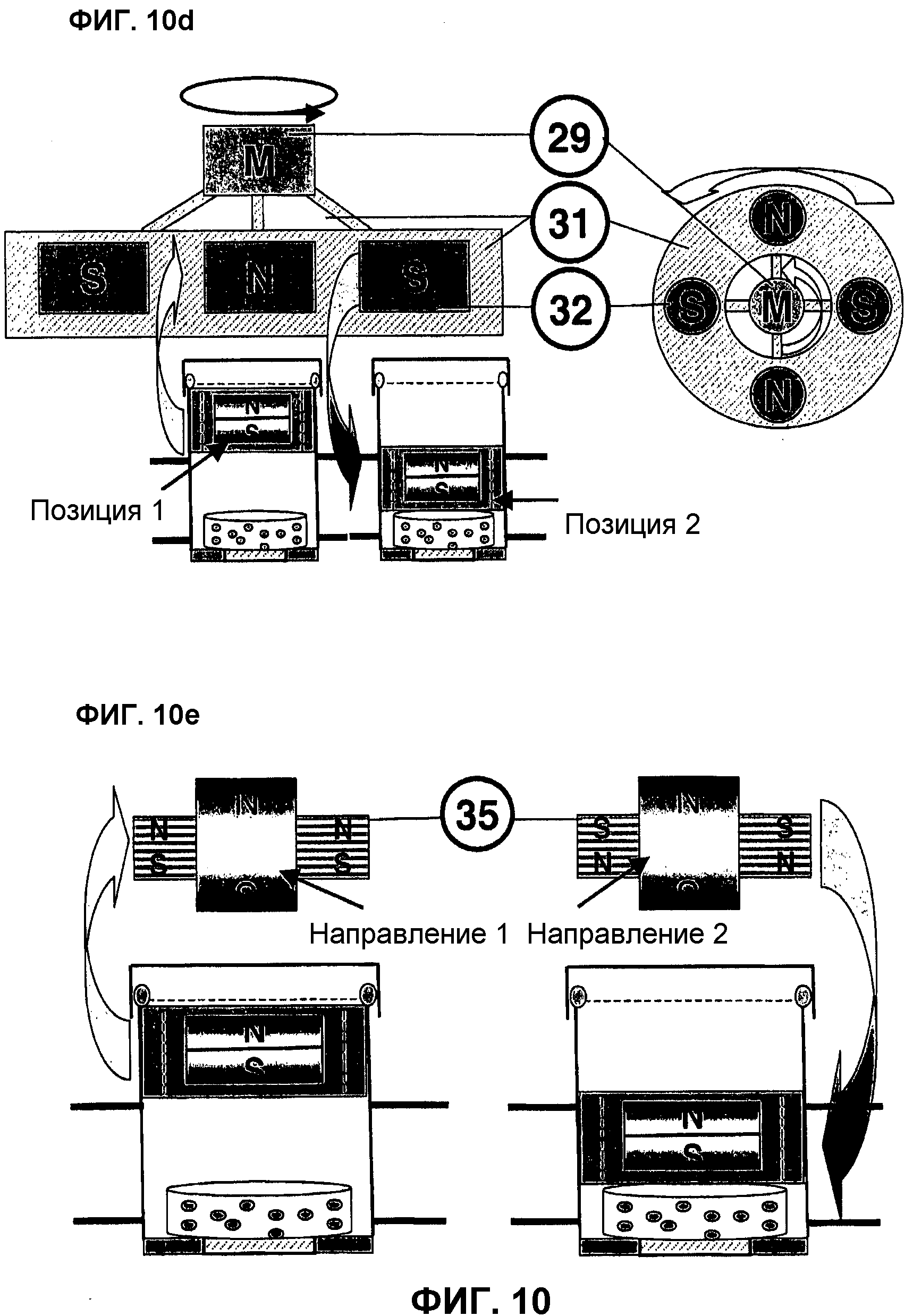
На фиг.10c (управление миниактуатором 14 с помощью направляющей пластины управляющего магнита) представлена форма выполнения системы управления на базе постоянного магнита. В данном варианте управления на расположенной, например, поверх прототипа реактора линейно управляемой направляющей пластине 31 применяются несколько постоянных магнитов 32 различных размеров, разной полярности и, тем самым, разной силы и направленности силового поля.
При этом с помощью линейного двигателя 29 осуществляется привод направляющей пластины 30 с зажатым в креплении 31 постоянным магнитом 32. Эта мобильная фаза магнитной системы делает излишним движение биореактора 1.
Система управления на фиг.10d (управление миниактуатором 14 посредством вращающегося постоянного магнита) также основана на управлении магнитным пуансоном 14 с помощью системы постоянного магнита на вращающемся диске.
При этом серводвигатель 29 вращает крепление 31 с закрепленным в нем постоянным разнополюсным магнитом 32. В это вращающееся крепление магнита могут быть установлены, например, четыре разнополюсных магнита 32, при этом при его полном вращении на трансплантат 11 дважды оказывается комплексное давление. Эти вращающиеся магниты в комбинации с частотой вращения серводвигателя 29 дают возможность изменять магнитное поле с высокой частотой и создавать, тем самым, высокодинамичную схему стимуляции трансплантата 11. Вид спереди поясняет магнитные эффекты ротационной системы на примере двух биореакторов 1. Форма выполнения этого устройства может применяться с большим числом биореакторов 1, если они расположены точно над или под центром управляющего магнита.
На фиг.10e (управление миниактуатором 14 с помощью катушки с железным сердечником 35) представлено магнитное устройство на базе магнитной катушки.
Эта система с магнитной катушкой работает с индукционной катушкой 35, в данном случае расположенной над биореактором 1, с генерированием определенного электромагнитного поля, плавно регулируемого через подводимую электрическую мощность и допускающего любую позицию миниактуатора 14 в корпусе биореактора. За счет изменения полярности направления тока происходит перемена направления силового тока и электромагнитного эффекта. Используемая катушка с железным сердечником 35 создает направленное перпендикулярно обмотке катушки электрическое поле и воздействует на статический постоянный магнит миниактуатора 14, притягивая или отталкивая его.
Автоматизированная станция этой системы состоит из мощной катушки 35 с незначительным выделением тепла и закрытого регулируемого трансформатора, мощность которого контролируется универсальным измерительным прибором. Кроме того, применяется микроконтроллер для управления реле, включающим ток в нужном направлении, что позволяет создавать эффект периодического воздействия давлением на клеточный конструкт.
Пример 11
Схема стимуляции в двухкамерном реакторе
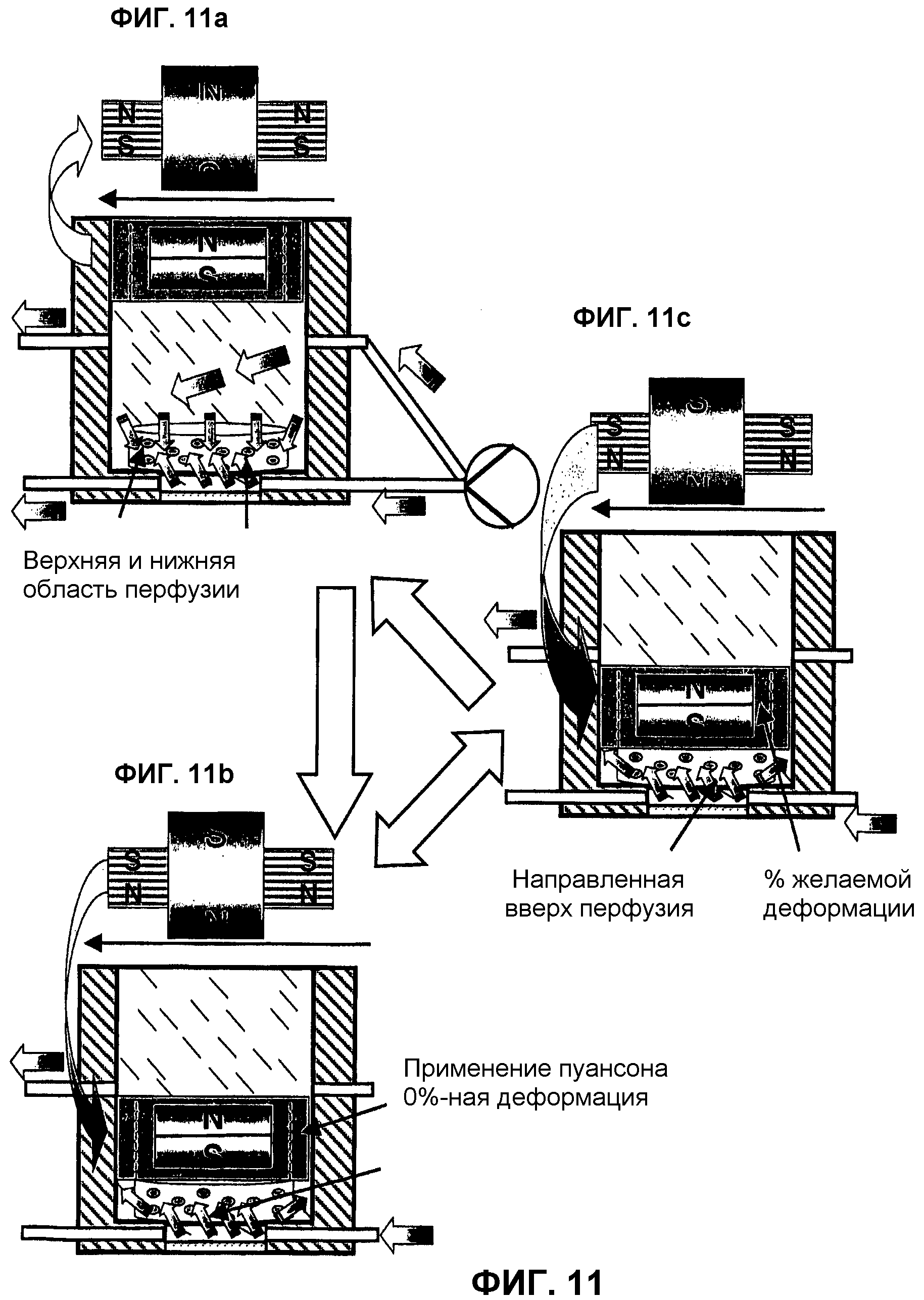
На фиг.11 представлена общая схема стимуляции нового отвечающего требованиям GMP биореактора 1. При этом механическая стимуляция давлением, перфузия и индуцированное потоком срезающее усилие в трехмерном трансплантате 11 реализуются одновременно.
На фиг.11a (стимуляция перфузии без механической нагрузки) происходит стимуляция клеточного конструкта 11 только с помощью направленного потока среды, приводящего к перфузии конструкта с воздействием срезающего усилия на клеточную мембрану в диапазоне мкПа. В представленном примере этого способа идет непрерывная подача питательной среды в два входа 19 так, чтобы обеспечивалось снабжение каждой реакторной камеры, сначала происходило выравнивание концентрации в пределах трансплантата 11, а затем, в зависимости от выбранного расхода потока, в конструкте образовывалась верхняя и нижняя перфузионные зоны. Израсходованная среда покидает реактор через два следующих выхода 19. При такой поточной стимуляции подачи на трансплантат давления не происходит, так как пуансон 14 удерживается управляющей магнитной системой 15 в крайнем верхнем положении в биореакторе 1.
На фиг.11b (стимуляция перфузии и применение пуансона) представлен второй шаг множественной стимуляции трансплантата 11 в биореакторе 1. Сначала, как в данном примере, модифицируются условия потока. С помощью 3-ходового клапана 6 поток питательной среды направляется в нижнюю реакторную камеру, откуда он, проходя с перфузией через трансплантат 11, обеспечивает обмен веществ и покидает затем верхнее пространство реактора через отводящий трубопровод. Путем изменения полярности системы управляющего магнита, в данном случае катушки с железным сердечником 35, при ограниченной силовой индукции приводится в действие магнитный миниактуатор 14, воздействующий, например, на цилиндрический трансплантат 11. Подобное применение пуансона с 0%-процентной деформацией конструкта является поворотной точкой миниактуатора 14 при динамической высокочастотной деформации клеточной матрицы 11.
На следующем этапе способа стимуляции, как это представлено на фиг.11c (стимуляция перфузии и механическая нагрузка), происходит увеличение силы магнитного поля, генерируемого катушкой 35. Результатом такого повышения плотности магнитного потока является усиление компрессии трансплантата 11 до желаемой деформации, преимущественно имитирующей процессы, аналогичные процессам «in-vivo». После этой стимуляции давлением могут в периодическом режиме попеременно осуществляться раздражение клеток и применение пуансона.
С помощью указанной аппаратуры и описанного способа может также осуществляться статическая компрессия имплантата.
В принципе, в ходе этой механической нагрузки может осуществляться направленная перфузия конструкта с помощью матрицы носителя, поставляющая клеткам нутриенты и отводящая метаболиты, прежде всего, во время фазы активного обмена веществ, например, при пролиферации и дифференцировке (внеклеточном синтезе матрицы).
После отработки протокола нагрузки давлением пуансон возвращается в свое исходное положение, продолжается перфузия клеточной культуры, например, в непрерывном режиме и извлекается, например, трансплантант 11 при достаточно синтезированной внеклеточной матрице.
Список позиций
1. Биореактор
2. Резервуар для среды
3. Резервуар для вспомогательной среды
4. Шланговая система
5. Циркуляционный насос
6. 3-ходовой клапан
7. 4-ходовой клапан
8. Пробоотборный участок
9. Биодатчики Glu/Lac
10. Измерительный щупы pH, pCO2, pO2
11. Трансплантат
12. Клетки/ткань
13. Опорная матрица
14. Миниактуатор
15. Управляющий магнит
16. Пористый агломерационный материал
17. Прозрачное стекло
18. Проницаемая мембрана
19. Шланговая муфта/соединение Luer
20. Зажимное кольцо
21. Запор реактора
22. Постоянный магнит
23. Капсула
24. Поверхность пуансона
25. Колба для высева
26. Пуансон
27. Подвижная пластина
28. Фиксирующая стенка
29. Серводвигатель
30. Направляющая
31. Крепление магнита
32. Постоянный магнит
33. Проточные каналы
34. Удлинитель
35. Катушка
Реферат
Изобретение относится к области биотехнологии, конкретно к получению биотрансплантатов, и может быть использовано в медицине. Подходящие для трансплантации клетки соединительной или опорной ткани культивируют в биореакторе (1), который состоит из основного корпуса, герметично и стерильно соединенного с крышкой (21) и образующего по меньшей мере одно реакторное пространство, в котором размещены поверхность для трансплантата (11), а также миниактуатор (14). Биореактор (1) оборудован по меньшей мере двумя муфтовыми соединениями для шлангов (19) подачи и отвода питательной среды и газа. Изобретение позволяет получить механически устойчивые к аутологичной трансплантации клетки для использования в качестве тканезаменителей при лечении дефектов соединительных и опорных тканей, прямых травм суставов, ревматизма и дегенеративных заболеваний суставов. 2 н. и 20 з.п. ф-лы, 11 ил.
Формула
a) подготовку аутологичных клеток соединительной или опорной ткани (12) известным способом для культивирования в биореакторе клеток эксплантата,
b) смешение этих клеток (12) с биосовместимой или биорезорбируемой отверждаемой несущей матрицей (13);
c) помещение полученной таким образом аутологичной клеточной матричной суспензии в колбу (25) для высева с любым соответствующим получаемому трансплантату сечением и отверждения смеси со стадии (b) с получением "in-vivo" адаптивной трехмерной структуры трансплантата (11),
d) введение колбы для высева с полученным таким образом трансплантатом (11) в пространство камеры биореактора (1), медиальное нанесение трансплантата на дно биореактора и удаление колбы для высева,
e) культивирование трансплантата под воздействием перфузионного потока и извлечение после завершения культивирования полученного материала-заменителя ткани для дальнейшего использования,
отличающийся тем, что трансплантат (11) на стадии культивирования на противолежащей дну биореактора поверхности нагружается за счет действующего в качестве мини-актуатора, схожего с колбой пуансона (14), который в биореакторе (1) размещен над трансплантатом (11) и посредством одного или нескольких расположенных снаружи контрольных/управляющих магнитов (15) перемещается по биореактору (1) продольно к поверхности трансплантата и этим обуславливает давление на трансплантат, при этом управляющий магнит (15)
(a) состоит из по меньшей мере двух постоянных магнитов (32) с различным вертикальным направлением магнитных полюсов, которые вставлены в имеющий форму прямоугольника магнитный держатель (31) и с помощью серводвигателя (29) и направляющего элемента (30) циклически перемещаются по биореактору (1) в горизонтальном направлении или которые вставлены в имеющий форму диска магнитный держатель (31) и с помощью ротационного привода серводвигателя (29) циклически перемещаются по биореактору (1), или
(b) выполнен в качестве электрического магнита с по меньшей мере одной индукционной катушкой (35), поле которой управляется с помощью меняющейся высокой частоты для обеспечения высокой динамики изменения магнитного поля и воздействия мини-актуатора (14) на трансплантат (11), причем как процесс перемешивания в пространстве биореактора под воздействием перфузионного потока, так и давление на трансплантат регулируются по времени, количеству или силе в зависимости от условий культивирования и таким образом вызывают многократное раздражение клеток, подобное раздражению "in-vivo".
(a) состоит из по меньшей мере двух постоянных магнитов (32) с различным вертикальным направлением магнитных полюсов, которые вставлены в имеющий форму прямоугольника магнитный держатель (31) и с помощью серводвигателя (29) и направляющего элемента (30) циклически перемещаются по биореактору (1) в горизонтальном направлении или которые вставлены в имеющий форму диска магнитный держатель (31) и с помощью ротационного привода серводвигателя (29) циклически перемещаются по биореактору (1), или
(b) выполнен в виде электрического магнита с по меньшей мере одной индукционной катушкой (35), поле которой управляется с помощью меняющейся высокой частоты для обеспечения высокой динамики изменения магнитного поля и воздействия мини-актуатора (14) на трансплантат (11).

Комментарии