Биорезорбируемый микроноситель для доставки клеток в область заживления и регенерации ран - RU2616866C1
Код документа: RU2616866C1
Чертежи

Описание
Область техники
Изобретение относится к биотехнологии и медицине. Более подробно изобретение относится к области создания биорезорбируемых микроносителей для доставки клеток в область заживления и регенерации ран.
Уровень техники
Кожный покров играет важную роль в жизнедеятельности организма, обеспечивая целый ряд важных функций, таких как механическая, термическая и химическая защита тканей тела, барьер для микроорганизмов, поддержание гомеостаза, обеспечение механической рецепции. Наличие долго незаживающих ран может стать причиной развития инфекций, привести к инвалидности или смерти пациента.
Кроме того, на месте обширных повреждений вследствие процессов заживления может образоваться рубцовая ткань, которая отличается по механическим и физиологическим свойствам от нормальной кожи. Это может приводить как к проявлениям дискомфорта и неудобств косметического характера, так и к ограничениям функциональности отдельных частей тела. Заживление раны - сложный процесс, включающий в себя взаимодействие между клетками эпидермиса и дермы, компонентами внеклеточного матрикса и миграцию клеток с соседних неповрежденных участков. При нарушении целостности капилляров в слое дермы происходит образование тромба, что, в свою очередь, приводит к высвобождению противовоспалительных факторов, таких как трансформирующие факторы роста α и β (TGF-α, TGF-β) и тромбоцитарный фактор роста (PDGF). В области раны начинает расти число нейтрофилов и макрофагов, начинается процесс воспаления. Выделение макрофагами цитокина TGF-β1 вызывает дифференцировку дермальных фибробластов в миофибробласты, которые синтезируют внеклеточный матрикс, преимущественно состоящий из фибронектина и гиалуроновой кислоты, стимулирующей миграцию фибробластов. Миграция кератиноцитов приводит к восстановлению барьерной функции. После этого происходит апоптоз миофибробластов с последующим их замещением фибробластами из прилегающих участков кожи, создающих коллагеновый внеклеточный матрикс.
Таким образом, в процессы заживления и регенерации вовлечено множество клеток разных типов и биологически активных веществ. Использование их в различных сочетаниях с биомедицинскими изделиями может качественно изменить подходы к восстановлению не только кожных покровов после различных повреждений.
При образовании глубоких ран кожи или обширных повреждений важной проблемой является заполнение промежутка между здоровыми тканями при невозможности сведения краев раны. Глубокие ожоги могут вызвать полное разрушение эпидермиса и дермы. Вследствие этого могут быть уничтожены эпителиальные стволовые клетки, которые находятся в базальном слое и глубоко внутри волосяного фолликула [Fuchs, Е. Skin stem cells: rising to the surface. J Cell Biol 180, 273, 2008; Fuchs, E. Finding one's niche in the skin. Cell Stem Cell 4, 499, 2009]. При этом кожа теряет возможность нормальной регенерации и заживление возможно только миграцией эпителиальных клеток с краев раны с постепенным ее сжатием. Хотя сведение раны является частью нормального процесса заживления, в случае обширных повреждений это может привести к серьезным деформациям, шрамам и контрактурам, которые часто бывают болезненными. Лечение таких состояний является весьма дорогостоящим с точки зрения здравоохранения. Сокращение поверхности раны происходит за счет работы миофибробластов, в которые дифференцируются фибробласты в ответ на механические стимулы и высвобождения трасформирующего ростового фактора TGF-beta1 [Hinz, В., Phan, S.H., Thannickal, V.J., Galli, A., Bochaton-Piallat, M.L., and Gabbiani, G. The myofibroblast: one function, multiple origins. Am J Pathol 170, 1807, 2007; Hinz, B. Formation and function of the myofibroblast during tissue repair. J Invest Dermatol 127, 526, 2007]. Существует тонкий баланс между слишком сильным и слишком слабым сокращением раны. Слишком активная работа миофибробластов также может приводить к чрезмерному стягиванию и формированию кожных деформаций.
Известно, что трансплантация кожи активно используется для закрытия и уменьшения времени эпителизации ран.
Также разрабатываются и используются клеточные суспензии для спрейного нанесения на поверхность повреждения. В обоих подходах есть свои плюсы и минусы.
Так, использование ферментов для снятия с культурального пластика листа кератиноцитов для последующей трансплантации может повреждать адгезионные белки, что приводит к механической нестабильности трансплантата [Desai, М.Н., Mlakar, J.M., McCauley, R.L., Abdullah, K.M., Rutan, R.L., Waymack, J.P., Robson, M.C., and Herndon, D.N. Lack of long-term durability of cultured keratinocyte burn-wound coverage: a case report. J Burn Care Rehabil 12, 540, 1991]. При тестировании клеточных суспензий было показано, что они слабо прикрепляются в процессе операции, в результате чего теряется значительное количество клеток [Currie, L.J., Martin, R., Sharpe, J.R., and James, S.E. A comparison of keratinocyte cell sprays with and without fibrin glue. Burns 29, 677, 2003] и уменьшается эффективность лечения.
Использование клеточных технологий в терапии повреждений кожи является перспективным направлением исследований, поскольку восстановление или замена поврежденной ткани, а также нормализация ее функций происходит за счет оптимального соотношения вводимых клеточных факторов, что ускоряет этот процесс и делает его более эффективным. При лечении обширных повреждений методы клеточной терапии могут существенно уменьшить время заживления и уменьшить вплоть до полного исчезновения образование рубцовой ткани.
В результате того, что восстановление происходит путем индукции миграции и пролиферации клеток с соседних участков, восстановленная ткань практически не отличается по своим свойствам от окружающей здоровой ткани.
Кроме того, такой подход снижает хирургическую нагрузку на пациента и является менее трудоемким для медицинского персонала. В настоящее время активно развивается направление использования клеток и биосовместимых материалов, выступающих в роли носителей. Такие материалы должны обеспечивать доставку, дифференцировку и миграцию клеток в месте повреждения, а, кроме того, впоследствии должны замещаться клетками нормальной ткани пациента, быть биологически безопасными и обладать адекватными механическими характеристиками. Для проверки свойств такой системы носитель - клетки, клетки и материал должны использоваться вместе, что дает возможность оценить биосовместимость, их взаимодействие и деградацию побочных продуктов. Простота в использовании конечного продукта будет иметь большое значение в его клиническом применении.
Одним из наиболее перспективных направлений тканевой инженерии и регенеративной медицины в настоящее время является разработка, исследование и клиническое использование комплексов, состоящих из искусственного внеклеточного матрикса и клеток, использующих матрикс как субстрат в результате их нанесения и культивирования in vitro или спонтанного заселения in vivo.
Матрикс представляет собой изделие, которое отвечает таким требованиям, как биосовместимость, определенные механические, физические свойства и предоставляет субстрат для нормального функционирования клеток. Многими научными группами продолжается поиск адекватных носителей для трансплантируемых клеток, позволяющих упростить технологию трансплантации и усовершенствовать методики лечения заболеваний, обусловленных дефектами клеточных структур и тканей. Современные исследования в этой области сосредоточены на создании жизнеспособных культивируемых трансплантатов, комбинированных с кератиноцитами или другими клеточными линиями.
При заживлении глубоких повреждений кожа склонна к образованию грубых гипертрофических рубцов, поэтому усилия многих научных групп направлены на модификацию аутотрансплантатов кожи, а также на создание недифференцированных суспензионных клеточных носителей для заполнения обширных и глубоких дефектов кожи. Такой подход способствует как большей выживаемости вводимых клеток, так и повышает скорость и полноту регенерации кожи.
В настоящее время уже используются разнообразные биорезорбируемые матриксы для ускорения заживления и регенерации кожных ран, проводятся разработки композитных трансплантатов.
Однако многочисленные методологические проблемы, связанные с самой процедурой трансплантации, а также процессами спонтанной деградации до конца не решены [Horch RE, Debus М, Wagner G, Stark GB. Cultured human keratinocytes on type I collagen membranes to reconstitute the epidermis. Tissue Eng 2000; 1: 53-67].
Использование микроносителей является альтернативной технологией заполнения и активации регенерации обширных повреждений кожи. Микроносители - это частицы от 100 до 400 мкм в диаметре, которые изготавливаются из различных материалов и могут использоваться для прикрепления клеток и последующего введения в рану. Впервые такой подход был описан van Wezel и соавт. [van Wezel, A.L. The large-scale cultivation of diploid cell strains in microcarrier culture. Improvement of microcarriers. Dev Biol Stand 37, 143, 1976]. Первые микроносители были изготовлены из DEAE Sephadex А-50. В настоящее время до клинических испытаний были доведены только микроносители из модифицированного желатина [Liu, J.Y., Hafner, J., Dragieva, G., Seifert, В., and Burg, G. Autologous cultured keratinocytes on porcine gelatin microbeads effectively heal chronic venous leg ulcers. Wound Repair Regen 12, 148, 2004] и было достоверно показано, что они способствуют реэпителизации и уменьшению размера ран. В последнее время для изготовления микроносителей используют различные материалы: полистирен, коллаген, желатин, полилактид и др. [Microcarriers and their potential in tissue regeneration. [Martin Y, Eldardiri M, Lawrence-Watt DJ, Sharpe JR. Tissue Eng Part В Rev. 2011 Feb; 17(1): 71-80].
Данные последних исследований в этой области показывают, что введение в кожные раны пористых биорезорбируемых микроносителей, загруженных культивированными кератиноцитами человека, способствовало не только оптимальной реэпителизации раны, но и стимулировало регенерацию всех поврежденных слоев кожи [Gustafson CJ, Birgisson A, Junker J, Huss F, Salemark L, Johnson H, et al. Employing human keratinocytes cultured on macroporous gelatin spheres to treat full thicknesswounds: an in vivo study on athymic rats. Burns 2007; 6: 726-35].
Таким образом, разработка биорезорбируемых материалов для создания суспензионных препаратов для эффективного лечения глубоких дефектов кожи является чрезвычайно актуальной задачей.
Наиболее близким аналогом настоящего изобретения является заменитель живой кожи, включающий биосовместимый носитель и культуру клеток кожи, отличающийся тем, что он содержит в качестве биосовместимого носителя микросферы из биорезорбируемого in vivo материала, имеющие средний диаметр 50-500 мкм, предпочтительно 80-250 мкм, и культуру клеток кожи в виде покрытия, нанесенного на поверхность этих микросфер, известный из документа RU 2104039 С1.
Существенным недостатком известного изобретения является использование в качестве материала микросфер полигидроксибутирата, сополимера полигидроксибутирата и полигидроксивалериата, полимеров лактидогликолидов, полилактонов, полиэфиров, полилактидов, полиглюколидов, полиангидридов, поскольку данные материалы являются биостабильными и их использование отрицательно сказывается на биосовместимости носителя и удорожает его.
Раскрытие изобретения
Задачей изобретения является создание биорезорбируемых микроносителей для доставки клеток в область заживления и регенерации ран, представляющих собой частицы на основе фиброина шелка Bombyx mori.
Поставленная задача решается биорезорбируемым микроносителем для доставки клеток в область повреждения для заживления и регенерации ран, представляющим собой частицы диаметром 50-300 мкм, обладающие отрицательным зарядом при физиологических значениях рН (6,0-7,5), полученным измельчением трехмерных матриксов на основе фиброина шелка Bombyx mori.
Указанный микроноситель получают измельчением трехмерных матриксов на основе фиброина шелка по следующей схеме:
a) сначала замораживают трехмерный пористый матрикс течение 12-24 часов при от -80 до -90°С,
b) затем криоизмельчают матрикс с применением диспергатора.
Причем трехмерные пористые матриксы на основе фиброина шелка получены путем замораживания-оттаивания водного раствора фиброина следующим образом:
- получают водный раствора фиброина с концентрацией 18-30 мг/мл с использованием смеси CaCl2:C2H5OH:H2O при следующем соотношении частей 1:2:8;
- замораживают смеси полученного раствора фиброина с ДМСО, при этом содержание ДМСО в растворе составляет 0,5-2%;
- размораживание и обработку этанолом заготовки трехмерного матрикса
Полученный микроноситель дополнительно может содержать специфическую среду для культивирования, подбираемую под линию клеток.
Техническим результатом, достигаемым при использовании изобретения, является способность доставлять клетки в область повреждения для заживления и регенерации ран, возможность выполнения функции каркаса для функционирующих клеток в условиях in vitro и in vivo и способность регулирования скорости биодеградации микроносителя. Использование изобретения позволяет также иммобилизировать на носителе большее количество клеток, чем в известных решениях.
Области применения: тканевая инженерия, регенеративная медицина, травматология, хирургия, косметология. Разработка и использование микроносителей из безопасных биодеградируемых материалов имеет значительный потенциал как в фундаментальном, так и прикладном значении. Микроносители могут быть использованы для решения задач клеточной биологии, например воздействия ростовых факторов на дифференцировку стволовых клеток. Создание с их помощью адекватной трехмерной среды роста для многих клеток является важнейшим фактором нормального функционирования, что позволит изучать различные внутриклеточные процессы в состоянии, максимально приближенном к естественному. На основе микроносителей созданы модельные системы для исследования клеточной миграции, ангиогенеза, остеогенеза и других процессов. Кроме того, эта технология чрезвычайно перспективна в медицинском аспекте как основа для заполнения существенных кожных дефектов и ускорения регенерации кожных покровов, так и лечения повреждений различных типов тканей в условиях затрудненного к ним доступа. К ним относятся костная и хрящевая ткани, ткани печени, центральной нервной системы и др. С помощью гепатоцитов, культивированных на микроносителях, возможно создание экстракорпорального биоискусственного устройства для пациентов с тяжелыми поражениями печени, ожидающими ее пересадки. Культивирование человеческих стволовых клеток на микроносителях позволяет сохранить их плюрипотентность и направлять их дифференцировку, что открывает широкие возможности их использования в области регенеративной медицины. Создаваемые биодеградируемые микроносители в виде суспензий могут использоваться и в качестве резервуаров для таргетной доставки лекарств при лечении широкого спектра заболеваний.
Правильный подбор материала при разработке микроносителей - основополагающий параметр при создании биорезорбируемого микроносителя для доставки клеток в область заживления и регенерации ран. Микроносители должны выполнять роль субстратов для адгезии клеток, вовлеченных в процессы заживления и регенерации ран, способствовать поддержанию пролиферативной активности и жизнеспособности клеток, а также должны обеспечивать доставку, дифференцировку и миграцию клеток в месте повреждения и замещаться клетками нормальной ткани пациента. В связи с этим, для изготовления таких изделий предпочтение отдается биосовместимым полимерам природного происхождения (биополимерам) и различным композитным материалам на их основе, таким как: альгинаты, коллаген, желатин, хитозан, гиалуроновую кислоту, полиэфиры бактериального происхождения. Биополимеры должны быть биологически безопасны: обладать высокой биосовместимостью, способностью к биодеградации, быть не токсичными, не вызывать иммунной реакции при введении в организм. Поиск материалов с необходимыми свойствами привел к возрождению интереса к полимерам, созданным на основе шелка. Источниками таких полимеров являются нити кокона шелкопряда и белки каркасной нити паутины. Они обладают впечатляющими механическими свойствами: высокой прочностью на разрыв и высокой эластичностью. Иммуногенность этих белков крайне низкая и конструкции на их основе разрушаются с образованием нетоксичных продуктов. Оба эти материала могут быть использованы для создания биосовместимых биорезорбируемых конструкций. В качестве основы для создания микроносителей для доставки клеток в область заживления и регенерации ран нами был выбран фиброин шелка Bombyx mori. По химическим свойствам фиброин шелка - амфифильный белок с перевесом в сторону гидрофобности, его изоэлектрическая точка pI=4.2. В физиологических условиях фиброин шелка приобретает отрицательный заряд. Это способствует снижению скорости адгезии клеток и увеличению скорости их миграции. Каждый природный полимер имеет свои характерные преимущества и недостатки. Поэтому перспективным направлением является создание конструкций на основе двух или более материалов. Как правило, такие конструкции обладают улучшенными характеристиками по сравнению со своими однокомпонентными аналогами. Внесение в состав микроносителей на основе фиброина шелка различных веществ может усилить адгезию клеток к поверхности изделия, для этой цели часто используются компоненты внеклеточного матрикса. Также в состав микроносителя могут быть включены биологически активные соединения, например, стимулирующие дифференцировку клеток или подавляющие их дедифференцировку. Изделия на основе фиброина характеризуются высокой прочностью и эластичностью, внесение в структуру таких изделий желатина - продукта денатурации коллагена, способствует существенному увеличению адгезии и скорости пролиферации клеток. Этот полипептид содержит специфическую последовательность RGD (аргинин-глицин-аспарагиновая кислота), которая узнается интегринами - рецепторами на поверхности клетки, участвующими в регуляции их адгезии и пролиферации. Поэтому в качестве модификатора, повышающего адгезивные свойства микроносителей, будет использоваться желатин, представляющий собой биодеградируемый полимерный продукт частичного гидролиза коллагена, сохраняющий биологические свойства, сходные со свойствами нативного коллагена. Использование желатина обусловлено его доступностью и более низкой по сравнению с коллагеном ценой. Кроме того, желатин уже долгое время используется для создания биосовместимых и биоразлагаемых материалов.
Выбор метода получения микроносителей в основном зависит от используемого материала. Среди основных подходов для создания микрочастиц выделяют следующие: самосборка кополимеров в водном растворе, получение эмульсий с последующим удалением растворителей высушиванием, метод, основанный на преципитации, и получение частиц микрогеля из гидрогеля путем механического разрушения последнего. Фиброин шелка нерастворим как в воде, так и в разбавленных растворах многих кислот и щелочей. Однако возможно получение водных растворов фиброина шелка. Наиболее часто для получения таких растворов используют 9,8 М водный раствор бромида лития или смесь CaCl2:C2H5OH:H2O в молярном соотношении 1:2:8. Длительная инкубация при высоких температурах в таких средах и последующее удаление низкомолекулярных соединений путем диализа позволяет получить водные растворы фиброина шелка с концентрацией до 150 мг/мл. Из водных растворов фиброина шелка могут быть получены трехмерные пористые матриксы методом замораживания-оттаивания. Для изготовления матриксов методом замораживания-оттаивания водный раствор фиброина, содержащий небольшое количество органического растворителя, способного смешиваться с водой (обычно используют ДМСО), помещают в форму и инкубируют при температуре ниже точки плавления. Добавление органического растворителя вызывает образование наноскопических самоорганизующихся агрегатов фиброина, который частично переходит в β-кристаллическую форму. При формировании кристаллов льда молекулы фиброина выходят из водной фазы и концентрируются вокруг агрегатов. Поры формируются на месте кристаллов льда при его оттаивании. Поры, соединенные отверстиями и каналами, формируют сложную незамкнутую внутреннюю поверхность. Их диаметр, а также пористость и механические свойства зависят от температуры замораживания, концентраций фиброина и органического растворителя. Этот метод прост и технологичен, он позволяет получать большие партии изделий с хорошей воспроизводимостью, что важно для возможности использования его в промышленных масштабах. Стенки пор таких матриксов обладают микро-/ и нанорельефом, что делает их поверхность привлекательной для эукариотических клеток. При механическом разрушении матриксов могут быть получены трехмерные поверхности сложной формы с высоким соотношением [площадь поверхности]/[объем частицы], что позволит получать клеточные композиции на микроносителях с высокой клеточной плотностью в небольшом объеме. Причем размер пор измельчаемого матрикса не оказывает влияния на свойства получаемого микроносителя. Также будут получены модифицированные трехмерные пористые матриксы из фиброина и желатина методом замораживания-оттаивания. Введение желатина в структуру матрикса не приводит к изменениям общей структуры трехмерной конструкции, а рельеф поверхности стенок пор таких матриксов становится более выраженным. Кроме того, введение желатина в состав матриксов приводит к увеличению адгезии и скорости пролиферации эукариотических клеток, в частности эмбриональных мышиных фибробластов. Таким образом, биорезорбируемые микроносители для доставки клеток в область заживления и регенерации ран будут получены путем криофрагментации трехмерных пористых матриксов на основе фиброина и модифицированных трехмерных пористых матриксов из фиброина и желатина и последующим сортингом микрочастиц. Будут отобраны микрочастицы размером 50-300 мкм, что позволит вводить их в организм посредством инъекций.
Краткое описание чертежей
На фиг. 1 представлена деструкция образцов микроносителей
Осуществление изобретения
Настоящее изобретение подкреплено следующими примерами.
Пример 1. Получение биорезорбируемых микроносителей для доставки клеток в область заживления и регенерации ран.
1. Подготовка рабочих растворов:
1.1. Подготовка раствора 1.
Готовят раствор хлорида кальция в смеси этанола и воды. Молярное соотношение компонентов CaCl2:C2H5OH:H2O в молярном соотношении 1:2:8.
1.2. Подготовка раствора 2.
Готовят навеску шелка из расчета 150 мг на 1 мл раствора 1 и переносят в емкость с раствором 1. Инкубируют в течение 5 часов на водяной бане при 70°С. Полученный раствор центрифугируют 15 минут при 13400 об/мин и супернатант диализуют против дистиллированной воды, проводя 4 смены диализа. Полученный раствор центрифугируют 15 минут при 13400 об/мин и определяют концентрацию фиброина по оптической плотности при 280 нм. Доводят раствор до концентрации фиброина 20 мг/мл, вносят 1% ДМСО и используют на стадии 2.
2. Формирование матриксов
Раствор 2 вносят в форму и замораживают в морозильной камере при -20°С в течение 7 дней. Обрабатывают 96% этанолом полученные заготовки матриксов 3 раза по 45 минут. Полученные матриксы переносят в дистиллированную воду и используют на стадии 3.
3. Получение микрочастиц из матриксов
Матриксы, полученные на стадии 2, погружают в воду и помещают на ночь в морозильную камеру при -20°С. Переносят замороженные в воде матриксы в морозильную камеру на 4 часа при -90°С. За это время охлаждают нож-диспергатор. Для этого помещают лед в полиэтиленовый пакет и прикладывают к ножу. Замороженные в воде матриксы переносят в диспергатор и размельчают в течение 45 секунд. Полученную взвесь переносят в 50 мл центрифужные пробирки и используют на стадии 4.
4. Сортинг и стерилизация микрочастиц из матриксов
Полученные микрочастицы отбирают шприцем и переносят в 2 мл эппендорфы. Центрифугируют суспензию при 13400 об/мин. Супернатант отбирают, вносят 70% этанол, ресуспендируют и хранят при +4°С.
Пример 2. Определение деструкции микроносителей в модельных системах in vitro Деструкцию образцов микроносителей в нейтральной среде определяли инкубацией в фосфатно-солевом буфере. Испытание окислительной деструкции образцов проводили в реактиве Фентона. Последний содержит 0,1 М соли Fe2+ и 1 мМ раствора 3% Н2О2. Образцы в этих средах инкубировали в течение 3 недель. Изменение массы образцов отмечали, взвешивая образцы каждые 7 дней. Результаты представлены на фиг. 1.
Анализ данных показал, что при продолжительной инкубации в нейтральной среде образцы микроносителей были стабильны, после 21 дня инкубации их масса изменялась не более чем на 15%.
Под воздействием гидроксильных радикалов реактива Фентона образцы микроносителей разрушаются к 3-й неделе менее чем на 50%.
Таким образом, образцы микроносителей устойчивы к деградации в окисляющей среде в течение 3 недель. Деградация материала предполагает также и биорезорбцию микроносителей в условиях выраженного клеточного ответа или при развитии воспалительных процессов.
Пример 3. Витализация экспериментальных образцов биорезорбируемого микроносителя для направленной доставки клеток
1. Подготовка микроносителей
Стерильную навеску микроносителя переносят в среду культивирования ДМЕМ в центрифужную пробирку из расчета 5 мг на 1 мл, ресуспендируют и центрифугируют 3 минуты при 1500 об/мин. Заменяют супернатант на 1 мл ДМЕМ с 10% эмбриональной телячьей сыворотки (ЭТС) и инкубируют при 37°С 1 час. Полученную суспензию используют на стадии 3.
2. Подготовка суспензии фибробластов мыши 3Т3
Фибробласты мыши 3Т3 снимают раствором трипсин-Версена, трипсин инактивируют ЭТС и переносят в центрифужные пробирки в ДМЕМ с 10% ЭТС, осаждают клетки, центрифугируя при 1500 об/мин в течение 7 минут. Супернатант удаляют и ресуспендируют осадок к ДМЕМ. Проводят подсчет клеток в камере Горяева и готовят суспензию, содержащую 200 тыс. клеток в 1 мл ДМЕМ с 10% ЭТС. Полученную суспензию используют на стадии 3.
3. Иммобилизация клеток на микроносителе
Суспензию микрочастиц, полученную на стадии 1, вносят в лунки 96-луночной круглодонной плашки по 50 мкл на 1 лунку и добавляют по 100 мкл суспензии клеток, полученной на стадии 2. Помещают плашку в СО2-инкубатор и инкубируют 6 часов при 37°С в атмосфере 5% СО2. Суспензию микроносителей с иммобилизованными клетками переносят в лунки 24-луночной плашки. Содержащие 1,5 мл культуральной среды ДМЕМ с 10% ЭТС. Планшет помещают в СО2-инкубатор на 37°C с 5% СО2 в атмосфере.
4. Культивирование фибробластов мыши линии 3Т3 на микроносителях
Фибробласты мыши 3Т3 культивируют на микроносителях в течение 7 дней в культуральной среде ДМЕМ с 10% ЭТС. На 3, 5 и 7 день проводят смену культуральной среды: отбирают старую среду и вносят 1,5 мл ДМЕМ с 10% ЭТС.
5. Культивирование различных концентраций фибробластов мыши линии 3Т3 на микроносителях
На основе ранее полученных данных по адгезии и пролиферации фибробластов мыши 3Т3 на трехмерных пористых матриксах из фиброина шелка были выбраны 3 концентрации инокулируемых клеток: 10000/лунку, 20000/лунку и 40000/лунку. Также была выбрана оптимальная концентрация микрочастиц на основе 3 подходов: 1 мг/мл, 5 мг/ мл и 10 мг/мл. Фибробласты мыши 3Т3 культивировали на микроносителях в течение 7 дней. На 1, 3 и 7 день образцы фиксировали 4% параформальдегидом и исследовали методом конфокальной лазерной сканирующей микроскопии. Проводили подсчет частиц, на которых выявлялись клетки, и определяли количество клеток на микрочастицах. Результаты экспериментов приведены в таблицах 1-3.


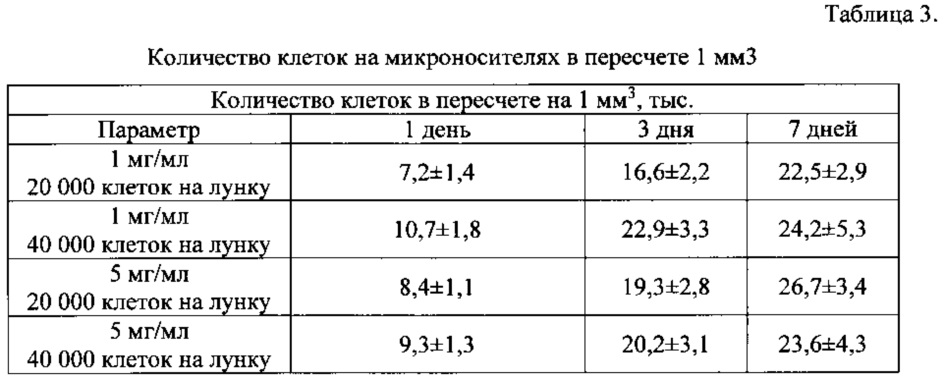
При внесении клеток в концентрации 10000/лунку вне зависимости от содержания микроносителя количество частиц с прикрепившимися клетками было значительно ниже, чем в более высоких концентрациях. При этом на 3 день культивирования количество частиц, на которых выявлялись клетки, стало ниже, чем на первый день. При высокой плотности суспензии микрочастиц (10 мг/мл) также выявляется значительно меньше микроносителей, содержащих клетки. В связи с этим, количественный подсчет клеток на микроносителях проводился для витализированных микроносителей при внесении 20000/лунку и 40000/лунку и суспензии микрочастиц с концентрацией 1 мг/мл и 5 мг/мл.
Как следует из анализа данных таблицы 3, наиболее оптимальные условия для роста фибробластов мыши 3Т3 на микроносителях создаются при использовании суспензии микрочастиц с концентрацией 5 мг/мл и внесении 20000 клеток на лунку.
Реферат
Изобретение относится к области биотехнологии и медицины. Предложен биорезорбируемый микроноситель для доставки клеток в область повреждения ткани кожи для заживления и регенерации ран. Микроноситель представляет собой частицы диаметром 50-300 мкм с отрицательным зарядом при значениях рН 6,0-7,5. При этом частицы получены измельчением трехмерных пористых матриксов на основе фиброина шелка Bombyx mori. Изобретение обеспечивает иммобилизацию на носителе большего количества клеток, возможность выполнения функции каркаса для функционирующих клеток в условиях in vitro, in vivo и регулирование скорости биодеградации микроносителя. 3 з.п. ф-лы, 1 ил., 3 табл., 3 пр.
Формула
Документы, цитированные в отчёте о поиске
Заменитель живой кожи, способ его получения и способ обработки повреждений живой кожи

Комментарии