Способы перфузионного культивирования и их применения - RU2733539C2
Код документа: RU2733539C2
Чертежи



Описание
ПЕРЕКРЕСТНАЯ ССЫЛКА НА РОДСТВЕННЫЕ ЗАЯВКИ
Настоящая заявка испрашивает приоритет предварительной заявки на выдачу патента США с регистрационным № 62/009058, поданной 6 июня 2014 г.; полное содержание которой включено в данный документ посредством ссылки.
ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Настоящее изобретение относится к способам молекулярной биологии, разработке процесса культивирования клеток и получению рекомбинантных белков.
ПРЕДПОСЫЛКИ К СОЗДАНИЮ ИЗОБРЕТЕНИЯ
Клетки млекопитающих, содержащие нуклеиновую кислоту, которая кодирует рекомбинантный белок, часто применяют для получения белков, важных с терапевтической или коммерческой точки зрения. Несмотря на то, что на протяжении многих лет в биотехнологической промышленности для способов с периодической подпиткой применяли несколько высокопроизводительных (HT) систем для культивирования клеток, никаких HT-моделей для перфузионного культивирования клеток с использованием многолуночного планшета, как известно, не существует.
КРАТКОЕ ОПИСАНИЕ
Настоящее изобретение по меньшей мере отчасти основывается на открытии того, что культивирование клетки млекопитающего в многолуночном планшете посредством конкретного способа, описанного в данном документе, приводит к значительно повышенным значениям плотности жизнеспособных клеток и выхода рекомбинантных белков, а также обеспечивает точную модель производительности культур в промышленных перфузионных производственных биореакторах. В свете этого открытия в данном документе предусматриваются способы культивирования клетки млекопитающего, способы получения рекомбинантного белка и способы тестирования производственного процесса получения рекомбинантного белка. Также предусматриваются системы в виде многолуночных планшетов для культур клеток, которые можно применять, например, для осуществления любого из описанных в данном документе способов.
В данном документе предусматриваются способы культивирования клетки млекопитающего, которые включают обеспечение многолуночного планшета, включающего в себя по меньшей мере одну лунку, содержащую клетку млекопитающего, помещенную в первую жидкую культуральную среду, причем первая жидкая культуральная среда занимает от приблизительно 5% до приблизительно 70% объема лунки; инкубирование многолуночного планшета в течение некоторого периода времени при от приблизительно 31°C до приблизительно 40°C и с перемешиванием вращением со скоростью от приблизительно 320 оборотов в минуту (об/мин) до приблизительно 500 об/мин; и, непрерывно или периодически, в течение этого периода времени, удаление первого объема первой жидкой культуральной среды и добавление к первой жидкой культуральной среде второго объема второй жидкой культуральной среды, причем первый и второй объемы являются приблизительно равными. В некоторых вариантах осуществления этих способов клетка млекопитающего представляет собой клетку яичника китайского хомячка (CHO). В некоторых вариантах осуществления этих способов клетка CHO содержит нуклеиновую кислоту, кодирующую рекомбинантный белок (например, иммуноглобулин, фермент, фактор роста, фрагмент белка или сконструированный белок).
Также предусматриваются способы получения рекомбинантного белка, которые включают обеспечение многолуночного планшета, включающего в себя по меньшей мере одну лунку, содержащую клетку млекопитающего, помещенную в первую жидкую культуральную среду, причем первая жидкая культуральная среда занимает от приблизительно 5% до приблизительно 70% объема лунки, а клетка млекопитающего содержит нуклеиновую кислоту, которая кодирует рекомбинантный белок; инкубирование многолуночного планшета в течение периода времени при от приблизительно 31°C до приблизительно 40°C и с перемешиванием вращением со скоростью от приблизительно 320 оборотов в минуту (об/мин) до приблизительно 500 об/мин; непрерывно или периодически, в течение этого периода времени, удаление первого объема первой жидкой культуральной среды и добавление к первой жидкой культуральной среде второго объема второй жидкой культуральной среды, причем первый и второй объемы являются приблизительно равными; и извлечение рекомбинантного белка из клетки млекопитающего или из первой или второй культуральной среды. В некоторых вариантах осуществления этих способов рекомбинантный белок (например, иммуноглобулин, фермент, фактор роста, фрагмент белка или сконструированный белок) извлекают из клетки млекопитающего. В некоторых вариантах осуществления этих способов рекомбинантный белок (например, секретируемый иммуноглобулин, секретируемый фермент, секретируемый фактор роста, секретируемый фрагмент белка или секретируемый сконструированный белок) извлекают из первой или второй жидкой культуральной среды.
Также предусматриваются способы тестирования производственного процесса получения рекомбинантного белка, которые включают обеспечение многолуночного планшета, включающего в себя по меньшей мере одну лунку, содержащую клетку млекопитающего, помещенную в первую жидкую культуральную среду, причем первая жидкая культуральная среда занимает от приблизительно 5% до приблизительно 70% объема лунки, а клетка млекопитающего содержит нуклеиновую кислоту, которая кодирует рекомбинантный белок; инкубирование многолуночного планшета в течение периода времени при от приблизительно 31°C до приблизительно 40°C и с перемешиванием вращением со скоростью от приблизительно 320 оборотов в минуту (об/мин) до приблизительно 500 об/мин; непрерывно или периодически, в течение этого периода времени, удаление первого объема первой жидкой культуральной среды и добавление к первой жидкой культуральной среде второго объема второй жидкой культуральной среды, причем первый и второй объемы являются приблизительно равными; выявление рекомбинантного белка в клетке млекопитающего или в первой или второй жидкой культуральной среде; и сравнение количества рекомбинантного белка, находящегося в клетке млекопитающего или в первой или второй жидкой культуральной среде, с эталонным уровнем рекомбинантного белка. В некоторых вариантах осуществления этих способов эталонный уровень рекомбинантного белка представляет собой уровень рекомбинантного белка, полученного при применении другого способа культивирования. В некоторых вариантах осуществления этих способов в другом способе культивирования используют другие первую или вторую жидкую культуральную среду, другую клетку млекопитающего, другую температуру, другой уровень перемешивания или другой многолуночный планшет. В некоторых вариантах осуществления этих способов в другом способе культивирования используют другие исходные материалы, средства, препятствующие агрегации, или жидкие культуральные среды с определенным химическим составом. В некоторых вариантах осуществления эти способы можно применять, например, для осуществления экспериментов с высокопроизводительными культурами клеток, для осуществления планирования экспериментов (DOE) или исследования в рамках концепции "качество через проектирование" (QDB). В некоторых вариантах осуществления этих способов рекомбинантный белок (например, секретируемый иммуноглобулин, секретируемый фермент, секретируемый фактор роста, секретируемый фрагмент белка или секретируемый сконструированный белок) выявляют в первой или второй жидкой культуральной среде. В некоторых вариантах осуществления этих способов рекомбинантный белок (например, иммуноглобулин, фермент, фактор роста, фрагмент белка или сконструированный белок) выявляют в клетке.
В некоторых вариантах осуществления любого из описанных в данном документе способов первый объем первой жидкой культуральной среды практически не содержит клеток млекопитающих. В некоторых вариантах осуществления любого из описанных в данном документе способов первая жидкая культуральная среда занимает от приблизительно 10% до приблизительно 60% объема лунки. В некоторых вариантах осуществления любого из описанных в данном документе способов клетка млекопитающего представляет собой клетку яичника китайского хомячка (CHO). В некоторых вариантах осуществления любого из описанных в данном документе способов скорость перемешивания вращением составляет от приблизительно 320 об/мин до приблизительно 400 об/мин. В любом из описанных в данном документе способов удаление первого объема первой жидкой культуральной среды и добавление второго объема второй жидкой культуральной среды осуществляют одновременно. В любом из описанных в данном документе способов удаление первого объема первой жидкой культуральной среды и добавление второго объема второй жидкой культуральной среды осуществляют непрерывно или периодически. В некоторых вариантах осуществления любого из описанных в данном документе способов первый объем удаляемой первой жидкой культуральной среды и второй объем добавляемой второй жидкой культуральной среды увеличивают с течением времени.
В некоторых вариантах осуществления любого из описанных в данном документе способов многолуночный планшет инкубируют в течение периода времени более 7 дней, при этом в 1-3 день инкубации, в каждый 24-часовой период, первый объем удаляемой первой жидкой культуральной среды и второй объем добавляемой второй жидкой культуральной среды составляют от приблизительно 30% до приблизительно 50% объема первой жидкой культуральной среды; в 4-6 день инкубации, в каждый 24-часовой период, первый объем удаляемой первой жидкой культуральной среды и второй объем добавляемой второй жидкой культуральной среды составляют от приблизительно 40% до приблизительно 70% объема первой жидкой культуральной среды; и в 7 день и при дальнейшей инкубации, в каждый 24-часовой период, первый объем удаляемой первой жидкой культуральной среды и второй объем добавляемой второй жидкой культуральной среды составляют от приблизительно 90% до приблизительно 150% объема первой жидкой культуральной среды. В некоторых вариантах осуществления любого из описанных в данном документе способов лунка имеет объем от приблизительно 1 мл до приблизительно 18 мл (например, от приблизительно 1 мл до приблизительно 7 мл или от приблизительно 1 мл до приблизительно 3,5 мл). В некоторых вариантах осуществления любого из описанных в данном документе способов многолуночный планшет представляет собой 6-луночный планшет, 12-луночный планшет, 24-луночный планшет, 48-луночный планшет или 96-луночный планшет. В некоторых вариантах осуществления любого из описанных в данном документе способов многолуночный планшет представляет собой планшет с глубокими лунками. В некоторых вариантах осуществления любого из описанных в данном документе способов диаметр дна лунки составляет от приблизительно 6,0 мм до приблизительно 35 мм (например, от приблизительно 12 мм до приблизительно 50 мм). В некоторых вариантах осуществления любого из описанных в данном документе способов высота лунки составляет от приблизительно 12 мм до приблизительно 50 мм. В некоторых вариантах осуществления любого из описанных в данном документе способов клетку млекопитающего суспендируют в от приблизительно 150 мкл до приблизительно 15 мл (например, от приблизительно 150 мкл до приблизительно 10 мл, от приблизительно 150 мкл до приблизительно 5 мл или от приблизительно 150 мкл до приблизительно 150 мкл) первой культуральной среды.
В некоторых вариантах осуществления любого из описанных в данном документе способов первая жидкая культуральная среда и/или вторая жидкая культуральная среда выбраны из группы, состоящей из жидкой культуральной среды с определенным химическим составом, жидкой культуральной среды, не содержащей сыворотку, жидкой культуральной среды, содержащей сыворотку, жидкой культуральной среды, не содержащей компонентов животного происхождения, и среды, не содержащей белков. В некоторых вариантах осуществления любого из описанных в данном документе способов спустя приблизительно первые 24-48 часов периода времени, каждый 24-часовой период, первый объем удаляемой первой жидкой культуральной среды и второй объем добавляемой второй жидкой культуральной среды составляют от приблизительно 30% до приблизительно 150% объема первой жидкой культуральной среды. В некоторых вариантах осуществления любого из описанных в данном документе способов перемешивание приостанавливают на период времени по меньшей мере 30 секунд перед удалением первого объема первой жидкой культуральной среды. В некоторых вариантах осуществления любого из описанных в данном документе способов многолуночный планшет закрывают плотно одноразовой газопроницаемой мембраной или газопроницаемым слоем из силикона. В некоторых вариантах осуществления любого из описанных в данном документе способов лунка имеет плоское дно или круглое дно.
Некоторые варианты осуществления любого из описанных в данном документе способов дополнительно включают периодическое добавление дополнительного объема второй жидкой культуральной среды в каждую из множества лунок с целью компенсации какого-либо уменьшения объема первой жидкой культуральной среды вследствие испарения. В некоторых вариантах осуществления любого из описанных в данном документе способов удаление первого объема первой жидкой культуральной среды и добавление к первой жидкой культуральной среде второго объема второй жидкой культуральной среды осуществляют с применением автоматизированного устройства. В некоторых вариантах осуществления любого из описанных в данном документе способов многолуночный планшет представляет собой любую из описанных в данном документе систем в виде многолуночных планшетов для культур клеток. В некоторых вариантах осуществления любого из описанных в данном документе способов в результате осуществления способа плотность жизнеспособных клеток составляет от приблизительно 15×106 клеток/мл до 60×106 клеток/мл в лунке.
Также предусматриваются способы культивирования клетки млекопитающего, которые включают культивирование в ходе процесса градиентной перфузии клетки млекопитающего, суспендированной в жидкой культуральной среде, помещенной в лунку многолуночного планшета, в условиях, обеспечивающих в среде силу сдвига текучей среды и концентрацию растворенного кислорода (O2), которые, по сути, являются такими же, как и таковые, достигаемые в среде, занимающей от приблизительно 15% до приблизительно 25% объема лунки с квадратным дном, имеющей диаметр от приблизительно 6,0 мм до приблизительно 35 мм и высоту от приблизительно 40 мм до приблизительно 50 мм, при инкубировании лунки с квадратным дном при температуре от приблизительно 31°C до приблизительно 40°C и перемешивании вращением с частотой от приблизительно 320 оборотов в минуту (об/мин) до приблизительно 360 об/мин. В некоторых вариантах осуществления этих способов клетка млекопитающего представляет собой клетку яичника китайского хомячка (CHO) (например, клетку CHO, содержащую нуклеиновую кислоту, кодирующую рекомбинантный белок (например, иммуноглобулин, фермент, фактор роста, фрагмент белка или сконструированный белок)).
Также предусматриваются способы получения рекомбинантного белка, которые включают культивирование в ходе процесса градиентной перфузии клетки млекопитающего, суспендированной в жидкой культуральной среде, помещенной в лунку многолуночного планшета, в условиях, обеспечивающих в среде силу сдвига текучей среды и концентрацию растворенного кислорода (O2), которые, по сути, являются такими же, как и таковые, достигаемые в среде, занимающей от приблизительно 15% до приблизительно 25% объема лунки с квадратным дном, имеющей диаметр от приблизительно 6,0 мм до приблизительно 35 мм и высоту от приблизительно 40 мм до приблизительно 50 мм, при инкубировании лунки с квадратным дном при температуре от приблизительно 31°C до приблизительно 40°C и перемешивании вращением с частотой от приблизительно 320 оборотов в минуту (об/мин) до приблизительно 360 об/мин; и извлечение рекомбинантного белка из клетки млекопитающего или жидкой культуральной среды. В некоторых вариантах осуществления любого из этих способов рекомбинантный белок (например, иммуноглобулин, фермент, фактор роста, фрагмент белка или сконструированный белок) извлекают из клетки млекопитающего. В некоторых вариантах осуществления любого из этих способов рекомбинантный белок (например, секретируемый иммуноглобулин, секретируемый фермент, секретируемый фактор роста, секретируемый фрагмент белка или секретируемый сконструированный белок) извлекают из жидкой культуральной среды. В некоторых вариантах осуществления этих способов клетка млекопитающего представляет собой клетку яичника китайского хомячка (CHO).
В некоторых вариантах осуществления любого из описанных в данном документе способов многолуночный планшет выбран из 6-луночного планшета, 12-луночного планшета, 24-луночного планшета, 48-луночного планшета или 96-луночного планшета. В некоторых вариантах осуществления любого из описанных в данном документе способов многолуночный планшет представляет собой планшет с глубокими лунками. В некоторых вариантах осуществления любого из описанных в данном документе способов жидкая культуральная среда выбрана из группы, состоящей из жидкой культуральной среды с определенным химическим составом, жидкой культуральной среды, не содержащей сыворотку, жидкой культуральной среды, содержащей сыворотку, жидкой культуральной среды, не содержащей компонентов животного происхождения, и среды, не содержащей белков. В некоторых вариантах осуществления любого из описанных в данном документе способов многолуночный планшет закрывают плотно одноразовой газопроницаемой мембраной или газопроницаемым слоем из силикона. В некоторых вариантах осуществления любого из описанных в данном документе способов многолуночный планшет содержит лунки, имеющие плоское дно или круглое дно. В некоторых вариантах осуществления любого из описанных в данном документе способов многолуночный планшет представляет собой одну из описанных в данном документе систем в виде многолуночных планшетов для культур клеток. В некоторых вариантах осуществления любого из описанных в данном документе способов в результате культивирования плотность жизнеспособных клеток составляет от приблизительно 15×106 клеток/мл до 60×106 клеток/мл в лунке.
Также предусматриваются системы в виде многолуночных планшетов для культур клеток, которые включают в себя сплошную опорную подставку, включающую в себя первую поверхность, включающую в себя множество отверстий; множество сосудов для культивирования, помещенных в опорную подставку и выполненных с возможностью размещения культур клеток, имеющих объем от приблизительно 200 мкл до приблизительно 18 мл, где каждое отверстие соединено с каждым сосудом для культивирования и определяет границы входа в него, и где каждый сосуд для культивирования дополнительно включает в себя по меньшей мере один канал, выполненный с возможностью регулирования потока текучей среды в сосуд для культивирования и/или из него. В некоторых вариантах осуществления любой из описанных в данном документе систем сплошная опорная подставка выполнена с возможностью включения в себя резервуара для размещения жидкости и ее подачи в канал. В некоторых вариантах осуществления любой из описанных в данном документе систем сосуд для культивирования включает в себя по меньшей мере первый и второй каналы, где первый канал выполнен с возможностью регулирования одностороннего потока текучей среды в сосуд для культивирования, а второй канал выполнен с возможностью регулирования одностороннего потока текучей среды из сосуда для культивирования. В некоторых вариантах осуществления любой из описанных в данном документе систем канал включает в себя фильтр, выполненный с возможностью избирательного предотвращения вливания клеток в сосуд для культивирования и выливания клеток из него. В некоторых вариантах осуществления любой из описанных в данном документе систем каждый из первого и второго каналов содержит фильтр, выполненный с возможностью избирательного предотвращения вливания клеток в сосуд для культивирования и выливания клеток из него. Некоторые варианты осуществления любой из описанных в данном документе систем дополнительно включают по меньшей мере одну трубку, помещенную в сплошную опорную подставку и находящуюся в жидкостном соединении с каналом, где трубка выполнена с возможностью вливания текучей среды в сосуд для культивирования и/или выливания текучей среды из него. Некоторые варианты осуществления любых из описанных в данном документе систем дополнительно включают по меньшей мере один регулятор потока текучей среды, функционально соединенный по меньшей мере с одним каналом. Некоторые варианты осуществления любой из описанных в данном документе систем дополнительно включают по меньшей мере один жидкостный расходомер, функционально соединенный по меньшей мере с одной трубкой.
Используемое в данном документе единственное число обозначает одно или несколько из определенных существительных. Например, выражение "клетка млекопитающего" обозначает "одну или несколько клеток млекопитающего".
Термин "клетка млекопитающего" означает любую клетку любого млекопитающего или любую клетку, полученную из любого млекопитающего (например, человека, хомячка, мыши, зеленой мартышки, крысы, свиньи, коровы или кролика). В некоторых вариантах осуществления клетка млекопитающего может представлять собой иммортализованную клетку. В некоторых вариантах осуществления клетка млекопитающего представляет собой дифференцированную клетку. В некоторых вариантах осуществления клетка млекопитающего представляет собой недифференцированную клетку.
Термин "0 день" означает момент времени, в который клетку млекопитающего высевают в первую жидкую культуральную среду.
Термин "1 день" означает период времени от 0 дня до приблизительно 24 часов после высевания клетки млекопитающего в первую жидкую культуральную среду.
Термин "2 день" означает период времени от приблизительно 24 часов до приблизительно 48 часов после высевания клетки млекопитающего в первую жидкую культуральную среду.
Термин "3 день" означает период времени от приблизительно 48 часов до приблизительно 72 часов после высевания клетки млекопитающего в первую жидкую культуральную среду.
Термин "4 день" означает период времени от приблизительно 72 часов до приблизительно 96 часов после высевания клетки млекопитающего в первую жидкую культуральную среду. Термин для каждого дополнительного дня ("5 день", "6 день" "7 день" и т. д.) означает период времени, который длится в течение дополнительного приблизительно 24-часового периода с момента окончания непосредственно предыдущего дня.
Термин "практически не содержит" означает композицию (например, жидкую культуральную среду), которая по меньшей мере или приблизительно на 90% очищена (например, по меньшей мере или приблизительно на 95%, 96%, 97%, 98% или по меньшей мере или приблизительно на 99% очищена или приблизительно на 100% очищена) от конкретного вещества (например, клетки млекопитающего).
Термин "0,5x объем" означает приблизительно 50% объема. Термин "0,6x объем" означает приблизительно 60% объема. Подобным образом, 0,7x, 0,8x, 0,9x и 1,0x означает приблизительно 70%, 80%, 90% или 100% объема соответственно.
Под термином "культивирование" или "культивирование клетки" подразумевают поддержание или выращивание клетки млекопитающего в условиях контролируемого комплекса физических условий.
Термин "жидкая культуральная среда" означает текучую среду, которая содержит достаточно питательных веществ для обеспечения роста клетки млекопитающего in vitro. Например, жидкая культуральная среда может содержать одно или несколько из аминокислот (например, 20 аминокислот), пурина (например, гипоксантина), пиримидина (например, тимидина), холина, инозитола, тиамина, фолиевой кислоты, биотина, кальция, ниацинамида, пиридоксина, рибофлавина, тимидина, цианокобаламина, пирувата, липоевой кислоты, магния, глюкозы, натрия, калия, сульфата железа, сульфата меди, сульфата цинка и бикарбоната натрия. В некоторых вариантах осуществления жидкая культуральная среда может содержать сыворотку от млекопитающего. В некоторых вариантах осуществления жидкая культуральная среда не содержит сыворотку или другой экстракт от млекопитающего (жидкая культуральная среда с определенным составом). В некоторых вариантах осуществления жидкая культуральная среда может содержать следовые количества металлов, гормон роста млекопитающих и/или фактор роста млекопитающих. Неограничивающие примеры жидкой культуральной среды описаны в данном документе. Дополнительные примеры жидкой культуральной среды известны из уровня техники и являются коммерчески доступными. Жидкая культуральная среда может содержать клетки млекопитающих при любой плотности. Например, как используется в данном документе, первый объем первой культуральной среды, удаляемой из лунки, может практически не содержать клеток млекопитающих.
Термин "первая жидкая культуральная среда" означает объем жидкой культуральной среды, которая является подходящей для культивирования клетки млекопитающего.
Термин "вторая жидкая культуральная среда" означает объем жидкой культуральной среды, которая является подходящей для культивирования клетки млекопитающего, отделенный от объема первой жидкой культуральной среды перед каким-либо смешиванием первой и второй жидких культуральных сред.
Термин "жидкая культуральная среда, не содержащая компонентов животного происхождения" означает жидкую культуральную среду, которая не содержит каких-либо компонентов (например, белков или сыворотки), происходящих от млекопитающих.
Термин "жидкая культуральная среда, не содержащая сыворотку" означает жидкую культуральную среду, которая не содержит сыворотку млекопитающего.
Термин "жидкая культуральная среда, содержащая сыворотку" означает жидкую культуральную среду, которая содержит сыворотку млекопитающего.
Термин "жидкая культуральная среда с определенным химическим составом" означает жидкую культуральную среду, в которой известны все химические компоненты. Например, жидкая культуральная среда с определенным химическим составом не содержит фетальную бычью сыворотку, альбумин бычьей сыворотки или альбумин человеческой сыворотки, поскольку эти препараты, как правило, содержат сложную смесь альбуминов и липидов.
Термин "жидкая культуральная среда, не содержащая белков" означает жидкую культуральную среду, которая не содержит каких-либо белков (например, каких-либо выявляемых белков).
Термин "перемешивание" означает движение многолуночного планшета, содержащего по меньшей мере одну лунку, содержащую жидкую культуральную среду, с целью увеличения концентрации растворенного O2 в жидкой культуральной среде. Перемешивание, такое как перемешивание вращением, можно осуществлять с применением любых способов, известных из уровня техники, например с помощью прибора, который двигает многолуночный планшет с помощью круговых или эллипсоидальных движений, как, например, ротационный шейкер. Иллюстративные устройства, которые можно применять для перемешивания многолуночного планшета, описаны в данном документе. Дополнительные примеры таких устройств также известны из уровня техники и являются коммерчески доступными.
Термин "иммуноглобулин" означает полипептид, содержащий аминокислотную последовательность по меньшей мере из 15 аминокислот (например, по меньшей мере из 20, 30, 40, 50, 60, 70, 80, 90 или 100 аминокислот) белка-иммуноглобулина (например, последовательность вариабельного домена, каркасная последовательность или последовательность константного домена). Иммуноглобулин может включать в себя, например, по меньшей мере 15 аминокислот из легкой цепи иммуноглобулина, например, по меньшей мере 15 аминокислот из тяжелой цепи иммуноглобулина. Иммуноглобулин может представлять собой выделенное антитело (например, IgG, IgE, IgD, IgA или IgM). Иммуноглобулин может относиться к подклассу IgG (например, IgG1, IgG2, IgG3 или IgG4). Иммуноглобулин может представлять собой фрагмент антитела, например, Fab-фрагмент, F(ab′)2-фрагмент или scFv-фрагмент. Иммуноглобулин может также представлять собой биспецифическое антитело, или триспецифическое антитело, или димерное, тримерное или мультимерное антитело, или диатело, Affibody®, или Nanobody®. Иммуноглобулин также может представлять собой сконструированный белок, содержащий по меньшей мере один домен иммуноглобулина (например, гибридный белок). Неограничивающие примеры иммуноглобулинов описаны в данном документе, а дополнительные примеры иммуноглобулинов известны из уровня техники.
Термины "фрагмент белка" или "фрагмент полипептида" означают часть полипептидной последовательности длиной по меньшей мере или приблизительно 4 аминокислоты, по меньшей мере или приблизительно 5 аминокислот, по меньшей мере или приблизительно 6 аминокислот, по меньшей мере или приблизительно 7 аминокислот, по меньшей мере или приблизительно 8 аминокислот, по меньшей мере или приблизительно 9 аминокислот, по меньшей мере или приблизительно 10 аминокислот, по меньшей мере или приблизительно 11 аминокислот, по меньшей мере или приблизительно 12 аминокислот, по меньшей мере или приблизительно 13 аминокислот, по меньшей мере или приблизительно 14 аминокислот, по меньшей мере или приблизительно 15 аминокислот, по меньшей мере или приблизительно 16 аминокислот, по меньшей мере или приблизительно 17 аминокислот, по меньшей мере или приблизительно 18 аминокислот, по меньшей мере или приблизительно 19 аминокислот или по меньшей мере или приблизительно 20 аминокислот или длиной более 20 аминокислот. Фрагмент рекомбинантного белка можно получить с применением любого из описанных в данном документе способов.
Термин "сконструированный белок" означает полипептид, который в естественных условиях не кодируется эндогенной нуклеиновой кислотой, находящейся в организме (например, млекопитающем). Примеры сконструированных белков включают ферменты (например, с одной или несколькими аминокислотными заменами, делециями, вставками или добавлениями, которые приводят к повышению стабильности и/или каталитической активности сконструированного фермента), гибридные белки, антитела (например, бивалентные антитела, тривалентные антитела или диатело) и антигенсвязывающие белки, которые содержат по меньшей мере одну рекомбинантную последовательность остова.
Термин "сила сдвига текучей среды" означает напряжение, вызываемое жидкостью, протекающей ориентировочно параллельно поверхности (например, поверхности клетки или поверхности лунки). Силу сдвига текучей среды обычно определяют как приложенную силу, деленную на площадь поперечного сечения материала, при этом площадь является параллельной вектору приложенной силы. Иллюстративные способы расчета силы сдвига текучей среды описаны в данном документе и известны из уровня техники.
Термин "концентрация растворенного O2" или "концентрация растворенного кислорода" означает количество газообразного кислорода, растворенного в жидкой культуральной среде (например, любой из жидких культуральных сред, описанных в данном документе или известных из уровня техники). Неограничивающие способы измерения концентрации растворенного O2 в жидкой культуральной среде описаны в данном документе, а остальные известны из уровня техники.
Термин "извлечение" означает частичную очистку или отделение (например, по меньшей мере с или с приблизительно 5%, например, по меньшей мере с или с приблизительно 10%, 15%, 20%, 25%, 30%, 40%, 45%, 50%, 55%, 60%, 65%, 70%, 75%, 80%, 85%, 90% или по меньшей мере с или с приблизительно 95% чистотой по весу) рекомбинантного белка от одного или нескольких других компонентов, находящихся в культуральной среде (например, клеток млекопитающих или белков в составе культуральной среды), или одного или нескольких других компонентов (например, ДНК, РНК или других белков), находящихся в лизате клеток млекопитающих. Неограничивающие способы извлечения белка из жидкой культуральной среды или из лизата клеток млекопитающих описаны в данном документе, а остальные известны из уровня техники.
Термин "секретируемый белок" или "секретируемый рекомбинантный белок" означает белок или рекомбинантный белок, который изначально содержит по меньшей мере одну сигнальную последовательность секреции при его трансляции внутри клетки млекопитающего, и посредством, по меньшей мере частично, ферментативного отщепления сигнальной последовательности секреции в клетке млекопитающего высвобождается во внеклеточное пространство (например, жидкую культуральную среду).
Выражение "градиентная перфузия" относится к постепенному изменению (например, увеличению или уменьшению) объема культуральной среды, удаляемой и добавляемой в течение дискретных периодов (например, приблизительно 24-часового периода, периода, составляющего от приблизительно 1 минуты до приблизительно 24 часов, или периода, превышающего 24 часа) в ходе периода культивирования (например, режим повторной подпитки культуральной среды, ежесуточно). Например, один вариант осуществления процесса градиентной перфузии может предусматривать следующие протоколы повторной подпитки: в 1-3 день повторная подпитка в объеме культуральной среды приблизительно 0,5x объема реактора (RV)/день, в 4-6 день повторная подпитка в объеме культуральной среды приблизительно 0,7x RV/день, а в 7 день и в последующие дни повторная подпитка в объеме культуральной среды приблизительно 1,0x RV/день. Этот конкретный пример можно изменять по отношению к количеству дней, в которые применяют определенный режим повторной подпитки, и/или по отношению к режиму повторной подпитки в течении любого конкретного 24-часового периода. Фракция среды, удаляемой и заменяемой каждый день, может изменяться в зависимости от конкретных подлежащих культивированию клеток, исходной плотности посева и плотности клеток в конкретный момент времени. "RV" или "объем реактора" означает объем культуральной среды, имеющийся в начале процесса культивирования (например, общий объем культуральной среды, имеющийся после посева).
Термин "периодическая культура с подпиткой" означает постепенное или непрерывное добавление второй жидкой культуральной среды в исходную культуру клеток без существенного или значительного удаления первой жидкой культуральной среды из культуры клеток. В некоторых вариантах осуществления периодической культуры с подпиткой вторая жидкая культуральная среда является такой же, как и первая жидкая культуральная среда. В некоторых вариантах осуществления периодической культуры с подпиткой вторая жидкая культуральная среда представляет собой концентрированную форму первой жидкой культуральной среды. В некоторых вариантах осуществления периодической культуры с подпиткой вторую жидкую культуральную среду добавляют в виде сухого порошка.
Как используется в данном документе, "удельная производительность" или "SPR" относится к массе или ферментативной активности рекомбинантного белка, вырабатываемого одной клеткой млекопитающего за день. SPR для рекомбинантного антитела обычно измеряется как масса/клетка/день. SPR для рекомбинантного белка обычно измеряется как единицы/клетка/день или (единицы/масса)/клетка/день.
Как используется в данном документе "объемная производительность" или "VPR" относится к массе или ферментативной активности рекомбинантного белка, вырабатываемого на объем культуры (например, на литр объема биореактора, сосуда или пробирки) за день. VPR для рекомбинантного антитела обычно измеряется как масса/л/день. VPR для рекомбинантного фермента обычно измеряется как единицы/л/день или масса/л/день.
Термин "микроноситель" означает частицу (например, органический полимер), имеющую размер от 20 мкм до приблизительно 1000 мкм, которая содержит поверхность, позволяющую прикрепление клетки млекопитающего (например, любой из описанных в данном документе или известных из уровня техники клеток млекопитающих) или содействующую ему. Микроноситель может содержать одну или несколько пор (например, поры со средним диаметром от приблизительно 10 мкм до приблизительно 100 мкм). Неограничивающие примеры микроносителей описаны в данном документе. Дополнительные примеры микроносителей известны из уровня техники. Микроноситель может содержать, например, полимер (например, целлюлозу, полиэтиленгликоль или сополимер молочной и гликолевой кислот).
Если не определено иное, вся техническая и научная терминология, используемая в данном документе, имеет то же значение, которое обычно понимает специалист в данной области, к которой принадлежит настоящее изобретение. Способы и материалы описаны в данном документе для применения в настоящем изобретении; при этом также можно применять и другие подходящие способы и материалы, известные из уровня техники. Материалы, способы и примеры являются только иллюстративными и не предназначены для ограничения. Все публикации, заявки на выдачи патентов, патенты, последовательности, записи в базах данных и другие ссылки, упомянутые в данном документе, включены посредством ссылки в полном объеме. В случае противоречий настоящее описание, включая определения, будет иметь преимущественную силу.
Другие признаки и преимущества настоящего изобретения будут очевидными из нижеследующих подробного описания и фигур, а также из формулы изобретения.
ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
Фигура 1 представляет собой схематическое изображение вида сверху иллюстративной системы в виде многолуночного планшета.
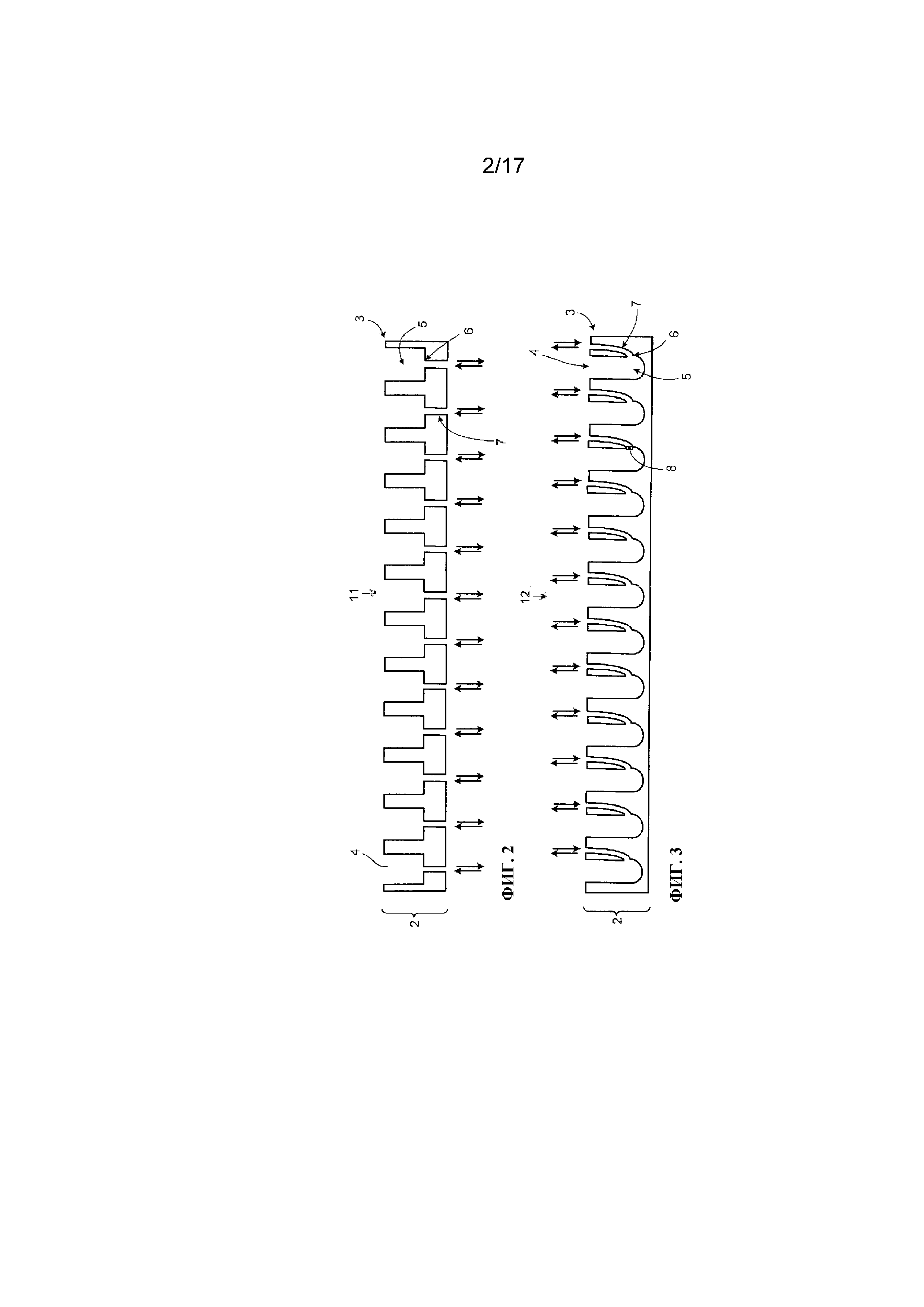
Фигура 2 представляет собой схематическое изображение вида сбоку иллюстративной системы в виде многолуночного планшета.
Фигура 3 представляет собой схематическое изображение вида сбоку альтернативной системы в виде многолуночного планшета.
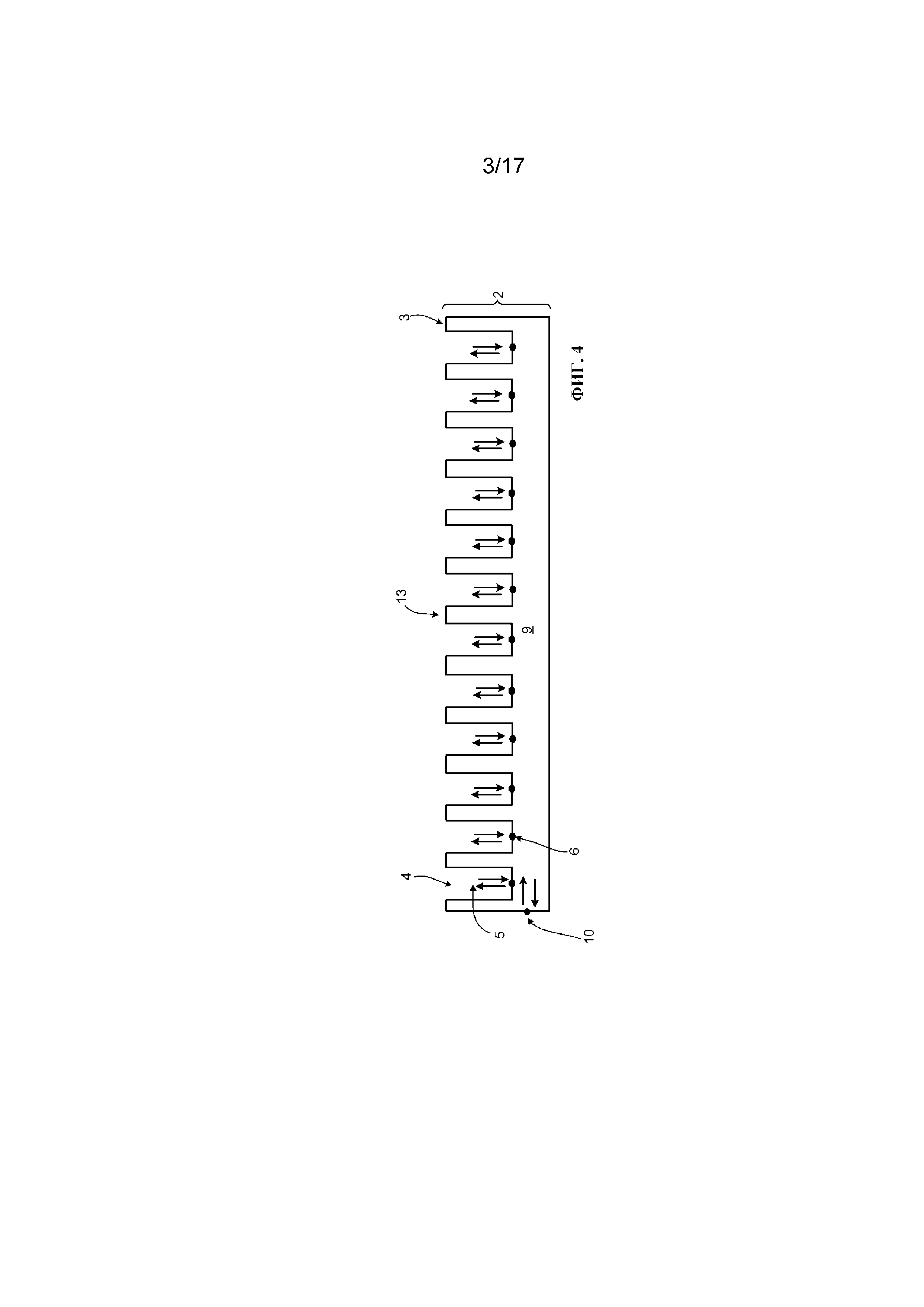
Фигура 4 представляет собой схематическое изображение вида сбоку альтернативной системы в виде многолуночного планшета.
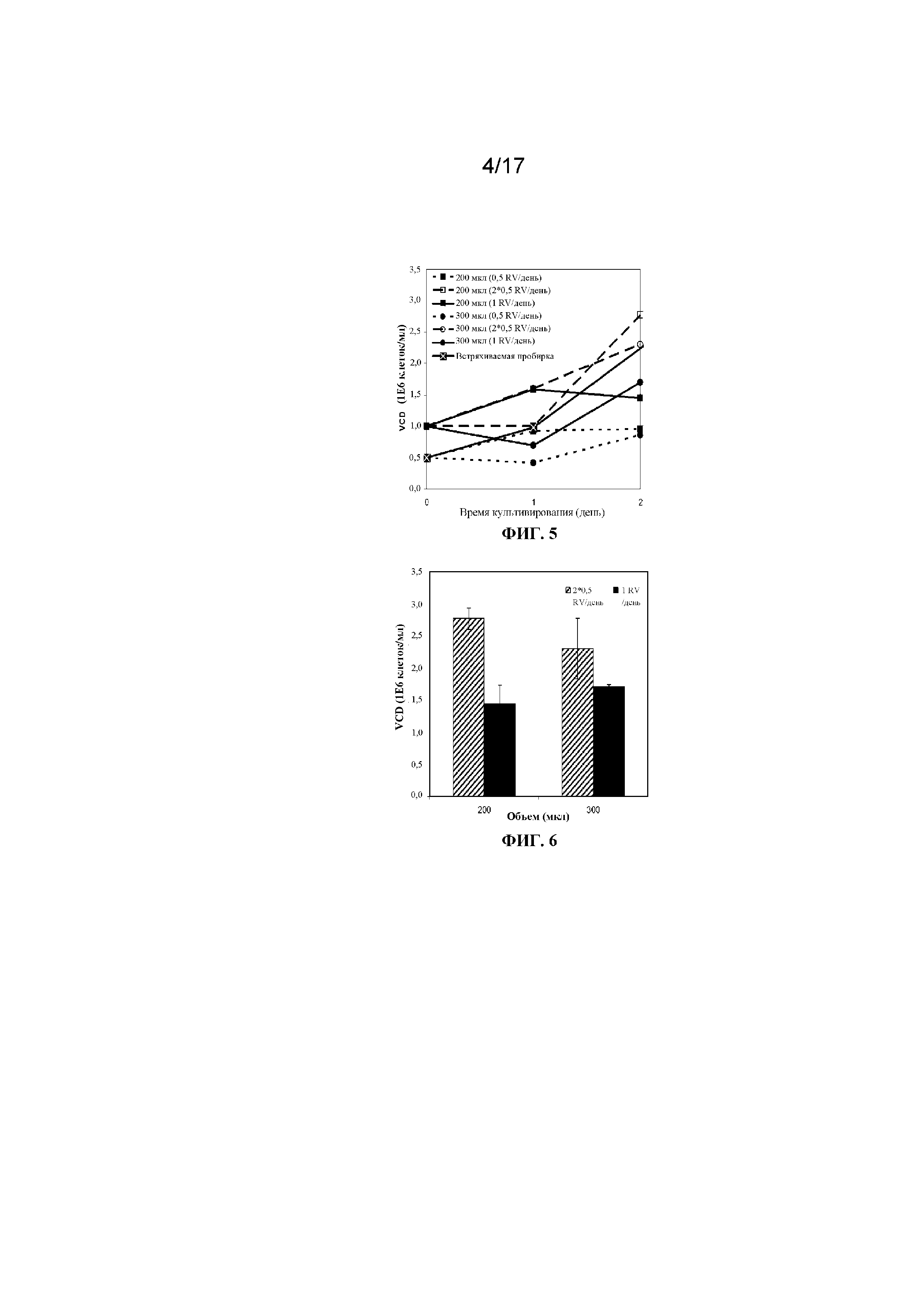
Фигура 5 представляет собой график, демонстрирующий плотность жизнеспособных клеток, наблюдаемую на протяжении двух дней перфузионного культивирования клеток во встряхиваемой пробирке на 50 мл, содержащей 10 мл культуральной среды и перемешиваемой при 160 об/мин, или в 96-луночном планшете с глубокими лунками с круглым дном, содержащем 200 мкл или 300 мкл культуральной среды и перемешиваемом при 330 об/мин, и культивирования при разных режимах периодической повторной подпитки. Планки погрешностей представляют стандартное отклонение n=2.
Фигура 6 представляет собой график, демонстрирующий конечную плотность жизнеспособных клеток в двухдневной культуре клеток в результате перфузионного культивирования в 96-луночном планшете с глубокими лунками с круглым дном, содержащем 200 мкл или 300 мкл культуральной среды и перемешиваемом при 330 об/мин, и культивирования при разных режимах периодической повторной подпитки (2×0,5 объема реактора/день или 1 объем реактора/день). Планки погрешностей представляют стандартное отклонение n=2.
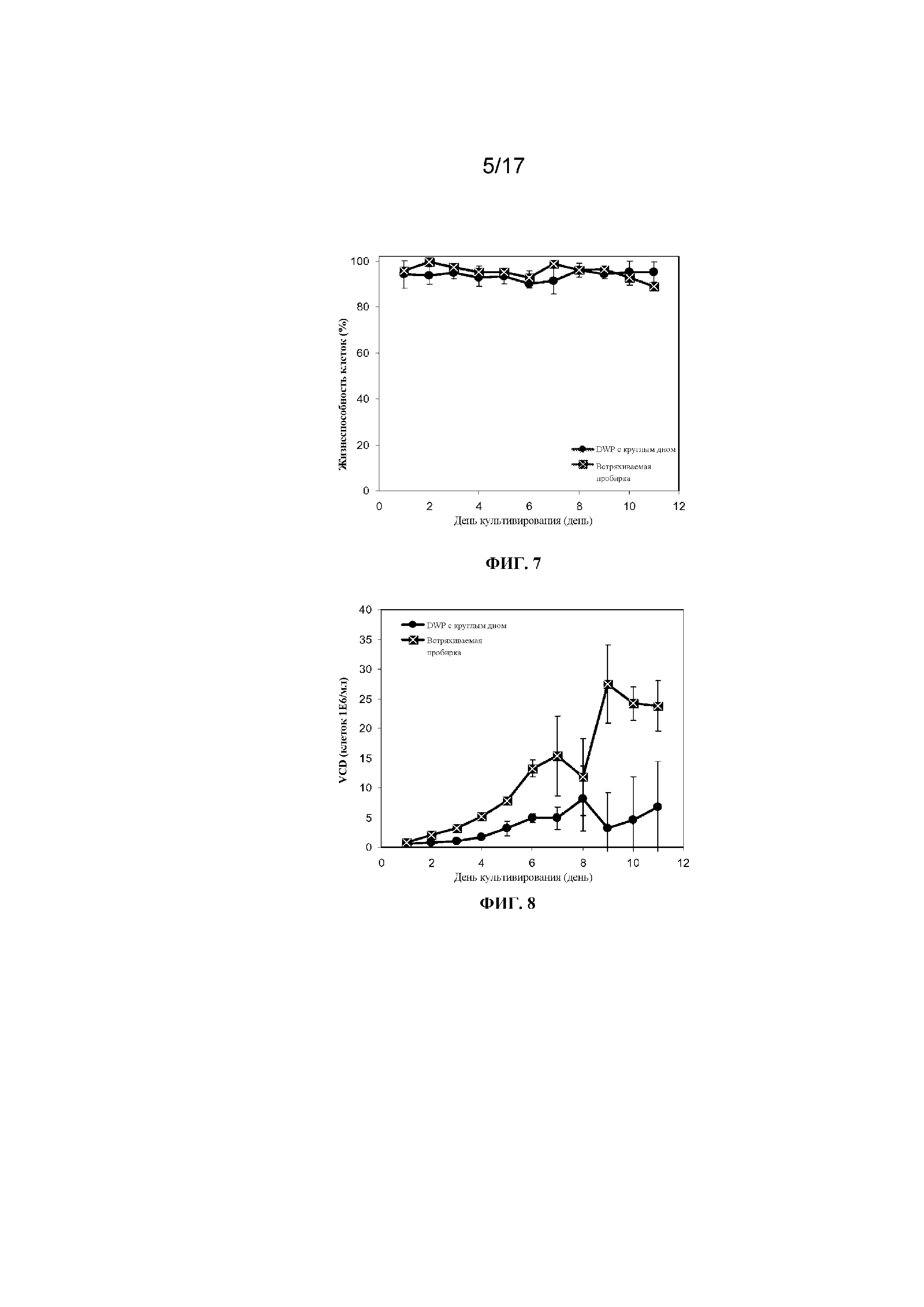
Фигура 7 представляет собой график, демонстрирующий жизнеспособность клеток в процентах в 11-дневной культуре клеток в результате перфузионного культивирования в 96-луночном планшете с глубокими лунками с круглым дном, содержащем 300 мкл культуральной среды и перемешиваемом при 360 об/мин, или во встряхиваемой пробирке, содержащей 10 мл культуральной среды и перемешиваемой при 160 об/мин Планки погрешностей представляют стандартное отклонение n=2 для культур из встряхиваемой пробирки и n=8 для культур из 96-луночного планшета с глубокими лунками с круглым дном.
На фигуре 8 представлена плотность жизнеспособных клеток культуры в 11-дневной культуре клеток в результате перфузионного культивирования в 96-луночном планшете с глубокими лунками с круглым дном, содержащем 300 мкл культуральной среды и перемешиваемом при 360 об/мин или во встряхиваемой пробирке, содержащей 10 мл культуральной среды и перемешиваемой при 160 об/мин Планки погрешностей представляют стандартное отклонение n=2 для культур из встряхиваемой пробирки и n=8 для культур из 96-луночного планшета с глубокими лунками с круглым дном.
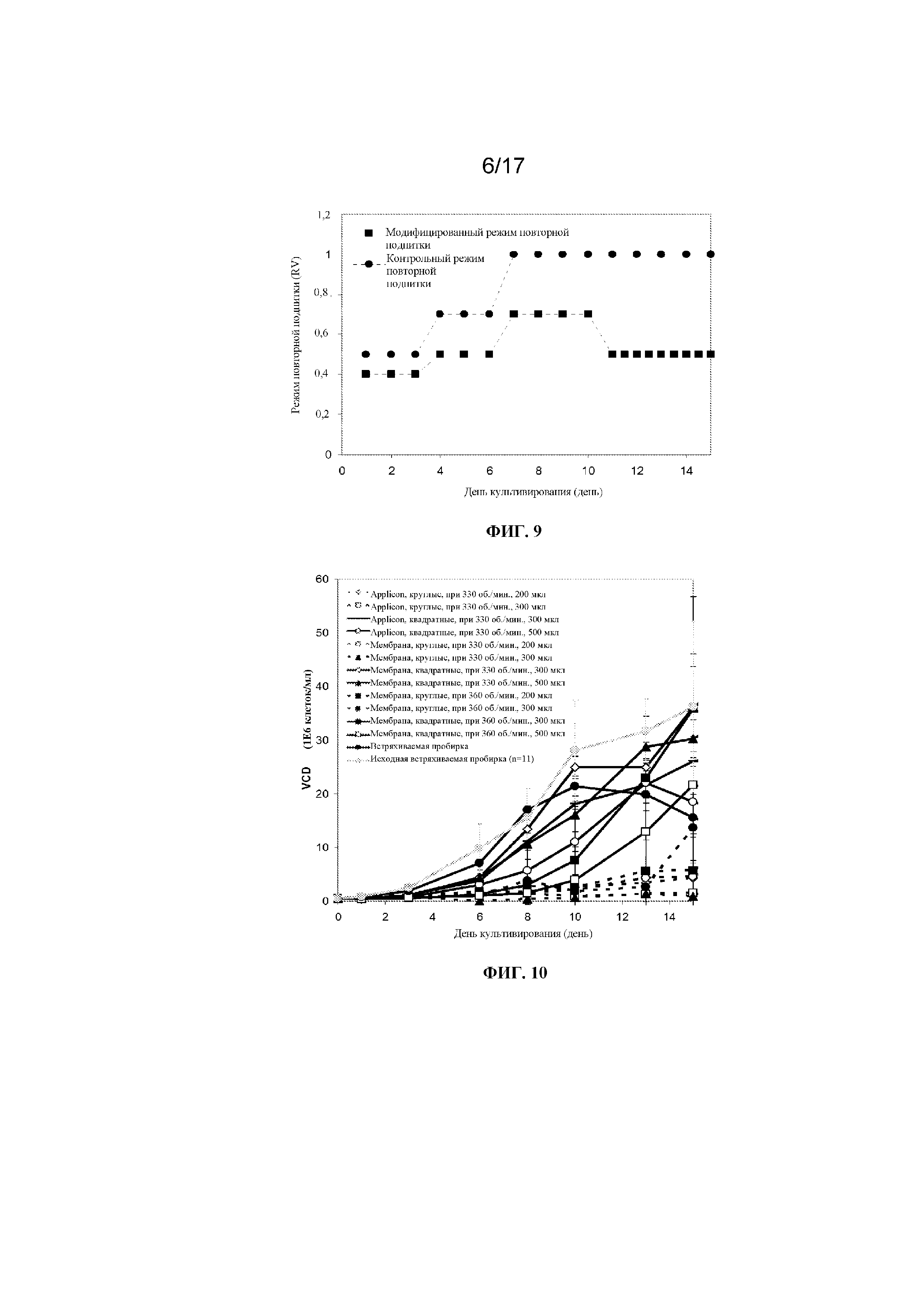
Фигура 9 представляет собой график, демонстрирующий режим повторной подпитки (выраженной в объеме(ах) реактора), применяемый на каждые день 15-дневной культуры при протоколе модифицированного режима повторной подпитки и протоколе контрольного режима повторной подпитки.
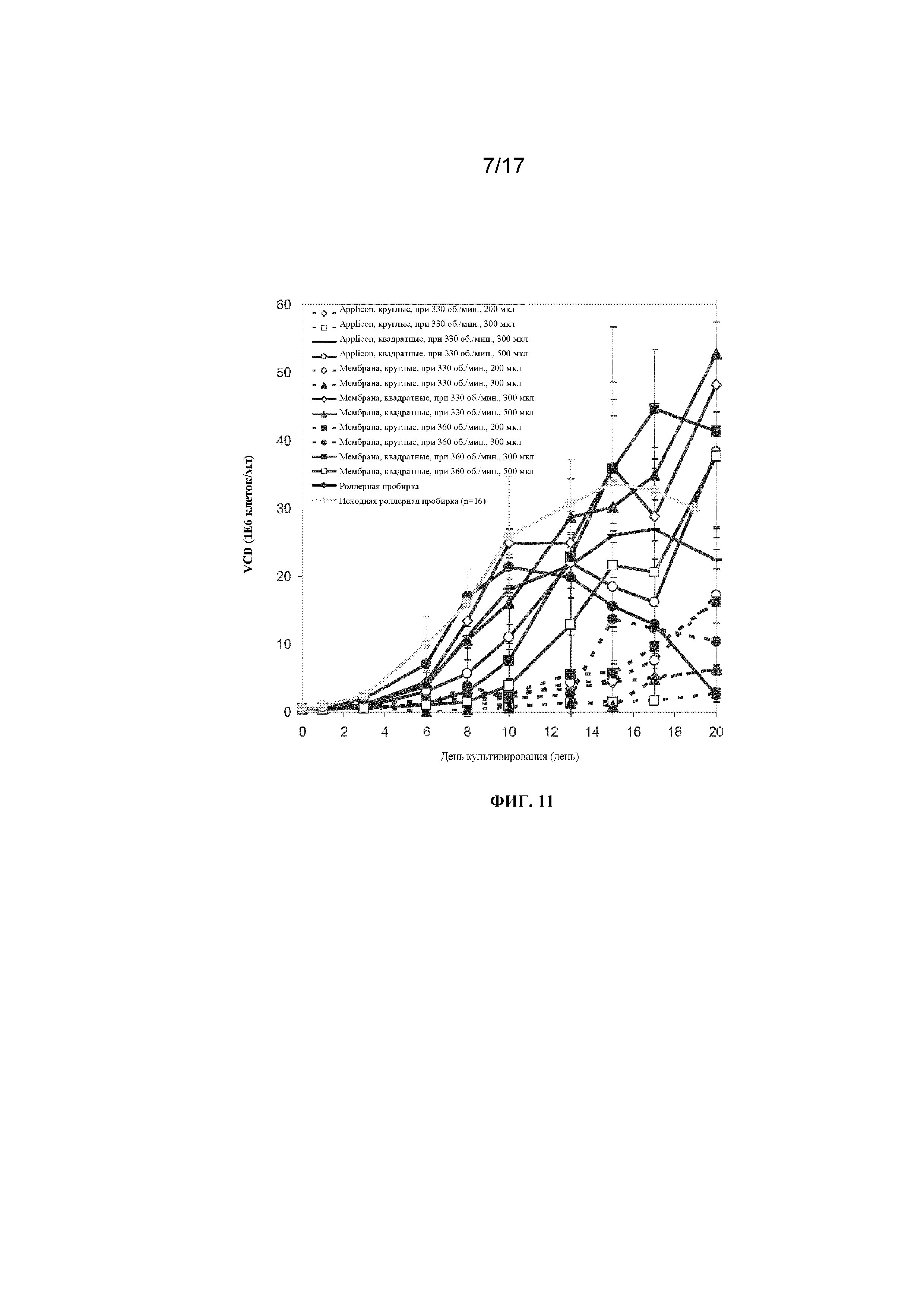
Фигура 10 представляет собой график, демонстрирующий плотность жизнеспособных клеток в зависимости от времени культивирования клеток в 96-луночных планшетах с глубокими лунками с квадратным или круглым дном, содержащих либо 200 мкл, 300 мкл либо 500 мкл культуральной среды, перемешиваемых при 330 об/мин или 360 об/мин и закрытых плотно с применением системы Applikon или одноразовой мембраны; или культивирования в контрольных встряхиваемых пробирках. Планки погрешностей представляют стандартное отклонение n=3.
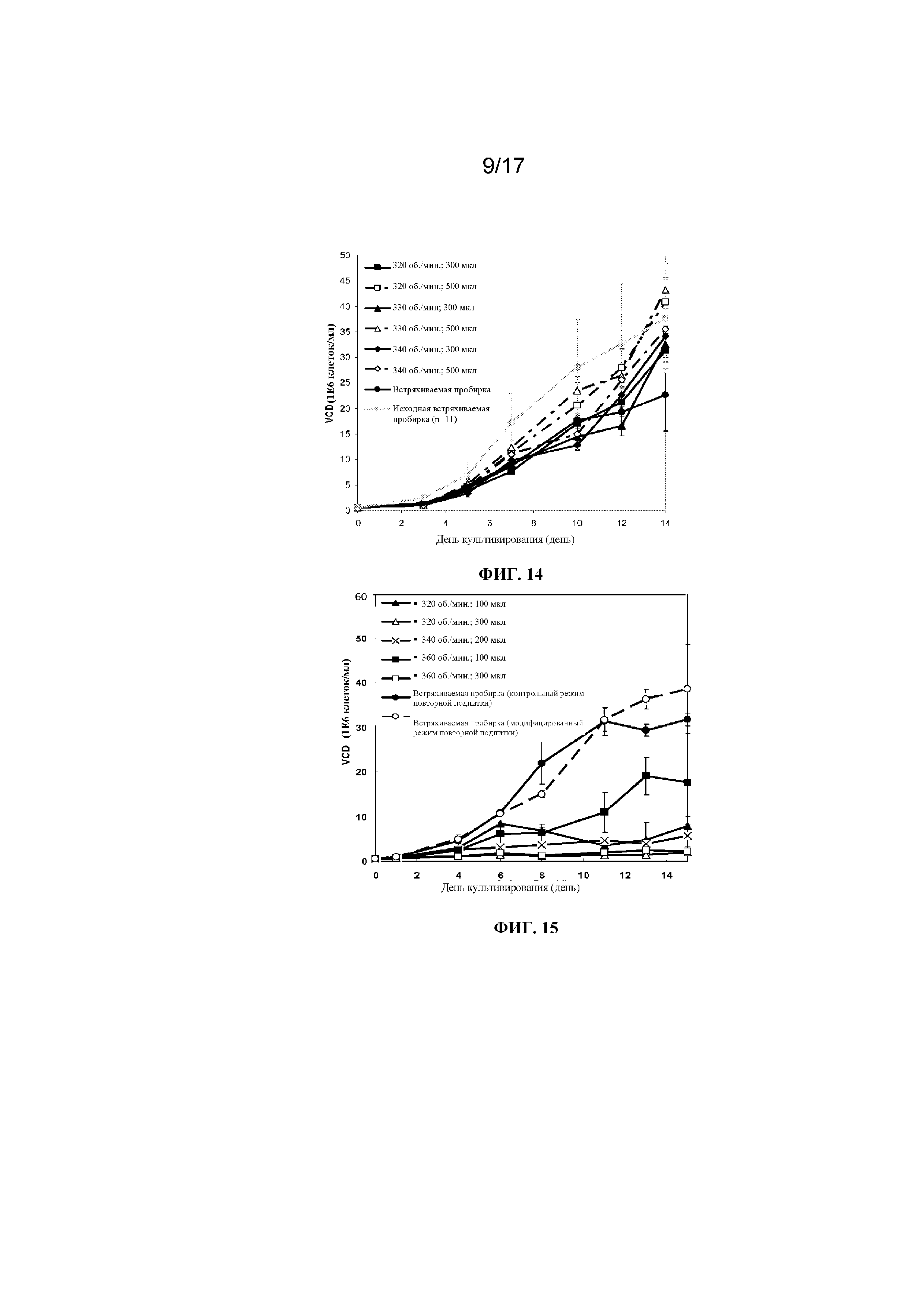
Фигура 11 представляет собой график, демонстрирующий процент жизнеспособных клеток в зависимости от времени культивирования клеток в 96-луночных планшетах с глубокими лунками с квадратным или круглым дном, содержащих либо 200 мкл, 300 мкл либо 500 мкл культуральной среды, перемешиваемых при 330 об/мин или 360 об/мин и закрытых плотно с применением системы Applikon или одноразовой мембраны; или культивирования в контрольных встряхиваемых пробирках. Планки погрешностей представляют стандартное отклонение n=3.
Фигура 12 представляет собой график, демонстрирующий плотность жизнеспособных клеток в зависимости от времени культивирования клеток в 96-луночных планшетах с глубокими лунками с квадратным или круглым дном, содержащих либо 200 мкл, 300 мкл либо 500 мкл культуральной среды, перемешиваемых при 330 об/мин или 360 об/мин и закрытых плотно с применением системы Applikon или одноразовой мембраны; или культивирования в контрольных встряхиваемых пробирках. Планки погрешностей представляют стандартное отклонение n=3.
Фигура 13 представляет собой график, демонстрирующий процент жизнеспособных клеток в зависимости от времени культивирования клеток в 96-луночных планшетах с глубокими лунками с квадратным или круглым дном, содержащих либо 200 мкл, 300 мкл либо 500 мкл культуральной среды, перемешиваемых при 330 об/мин или 360 об/мин и закрытых плотно с применением системы Applikon или одноразовой мембраны; или культивирования в контрольных встряхиваемых пробирках. Планки погрешностей представляют стандартное отклонение n=3.
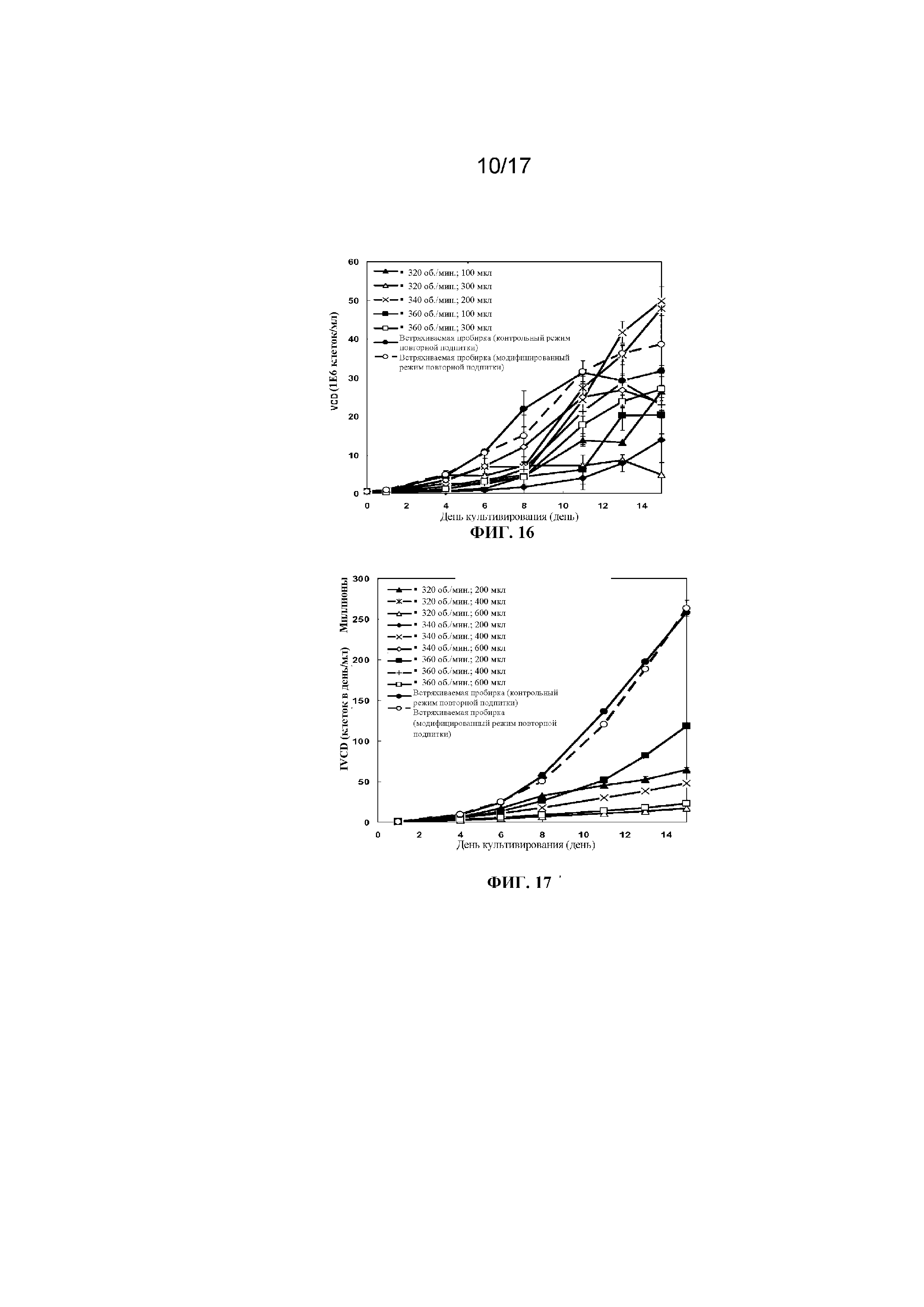
Фигура 14 представляет собой график, демонстрирующий плотность жизнеспособных клеток в зависимости от времени культивирования клеток в 96-луночных планшетах с глубокими лунками с квадратным дном, содержащих либо 300 мкл, либо 500 мкл культуральной среды и перемешиваемых при 320 об/мин, 330 об/мин или 340 об/мин; или культивирования в контрольных встряхиваемых пробирках. Планки погрешностей представляют стандартное отклонение n=3.
Фигура 15 представляет собой график, демонстрирующий плотность жизнеспособных клеток в зависимости от времени культивирования клеток в 96-луночных планшетах с глубокими лунками с круглым дном, содержащих либо 100 мкл, 200 мкл либо 300 мкл культуральной среды CD CHO и перемешиваемых при 320 об/мин, 340 об/мин или 360 об/мин, или культивирования клеток во встряхиваемой пробирке (с осуществлением перфузии сред с помощью контрольного режима повторной подпитки или модифицированного режима повторной подпитки). Планки погрешностей представляют стандартное отклонение n=2.
Фигура 16 представляет собой график, демонстрирующий плотность жизнеспособных клеток в зависимости от времени культивирования клеток в 96-луночных планшетах с глубокими лунками с квадратным дном, содержащих либо 200 мкл, 400 мкл либо 600 мкл культуральной среды CD CHO и перемешиваемых при 320 об/мин, 340 об/мин или 360 об/мин, или культивирования клеток во встряхиваемой пробирке (с осуществлением перфузии сред с помощью контрольного режима повторной подпитки или модифицированного режима повторной подпитки). Планки погрешностей представляют стандартное отклонение n=2.
Фигура 17 представляет собой график, демонстрирующий суммарную плотность жизнеспособных клеток при культивировании клеток в 96-луночных планшетах с глубокими лунками с круглым дном, содержащих либо 100 мкл, 200 мкл либо 300 мкл культуральной среды CD CHO и перемешиваемых при 320 об/мин, 340 об/мин или 360 об/мин, или при культивировании клеток во встряхиваемой пробирке (с осуществлением перфузии сред с помощью контрольного режима повторной подпитки или модифицированного режима повторной подпитки). Планки погрешностей представляют стандартное отклонение n=2.
Фигура 18 представляет собой график, демонстрирующий суммарную плотность жизнеспособных клеток при культивировании клеток в 96-луночных планшетах с глубокими лунками с квадратным дном, содержащих либо 200 мкл, 400 мкл либо 600 мкл культуральной среды CD CHO и перемешиваемых при 320 об/мин, 340 об/мин или 360 об/мин, или при культивировании клеток во встряхиваемой пробирке (с осуществлением перфузии сред с помощью контрольного режима повторной подпитки или модифицированного режима повторной подпитки). Планки погрешностей представляют стандартное отклонение n=2.
Фигура 19 представляет собой график, демонстрирующий объемную производительность при культивировании клеток в 96-луночных планшетах с глубокими лунками с круглым дном, содержащих либо 100 мкл, 200 мкл либо 300 мкл культуральной среды CD CHO и перемешиваемых при 320 об/мин, 340 об/мин или 360 об/мин, или при культивировании клеток во встряхиваемой пробирке (с осуществлением перфузии сред с помощью контрольного режима повторной подпитки или модифицированного режима повторной подпитки). Планки погрешностей представляют стандартное отклонение n=2.
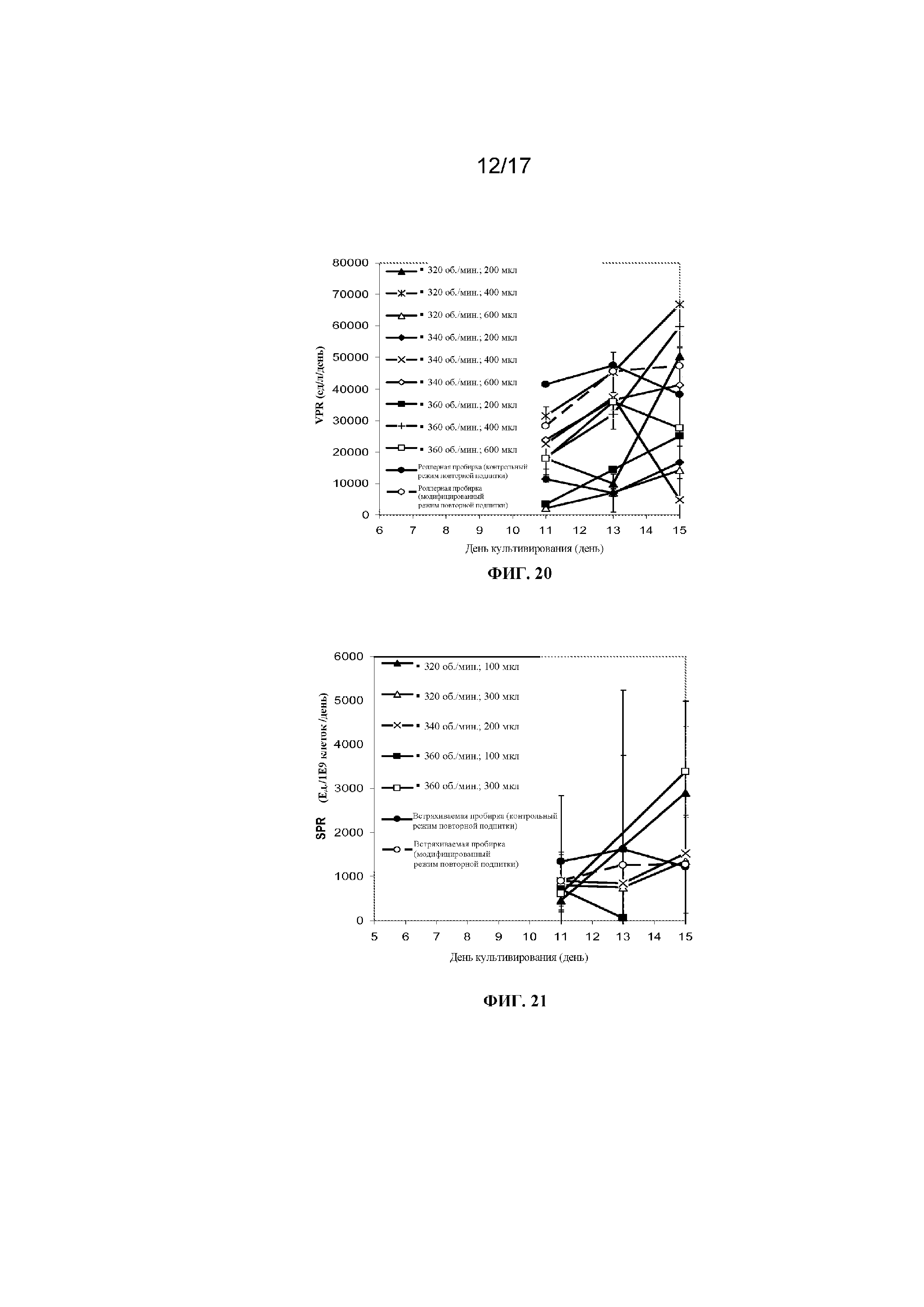
Фигура 20 представляет собой график, демонстрирующий объемную производительность при культивировании клеток в 96-луночных планшетах с глубокими лунками с квадратным дном, содержащих либо 200 мкл, 400 мкл либо 600 мкл культуральной среды CD CHO и перемешиваемых при 320 об/мин, 340 об/мин или 360 об/мин, или при культивировании клеток во встряхиваемой пробирке (с осуществлением перфузии сред с помощью контрольного режима повторной подпитки или модифицированного режима повторной подпитки). Планки погрешностей представляют стандартное отклонение n=2.
Фигура 21 представляет собой график, демонстрирующий удельную производительность при культивировании клеток в 96-луночных планшетах с глубокими лунками с круглым дном, содержащих либо 100 мкл, 200 мкл либо 300 мкл культуральной среды CD CHO и перемешиваемых при 320 об/мин, 340 об/мин или 360 об/мин, или при культивировании клеток во встряхиваемой пробирке (с осуществлением перфузии сред с помощью контрольного режима повторной подпитки или модифицированного режима повторной подпитки). Планки погрешностей представляют стандартное отклонение n=2.
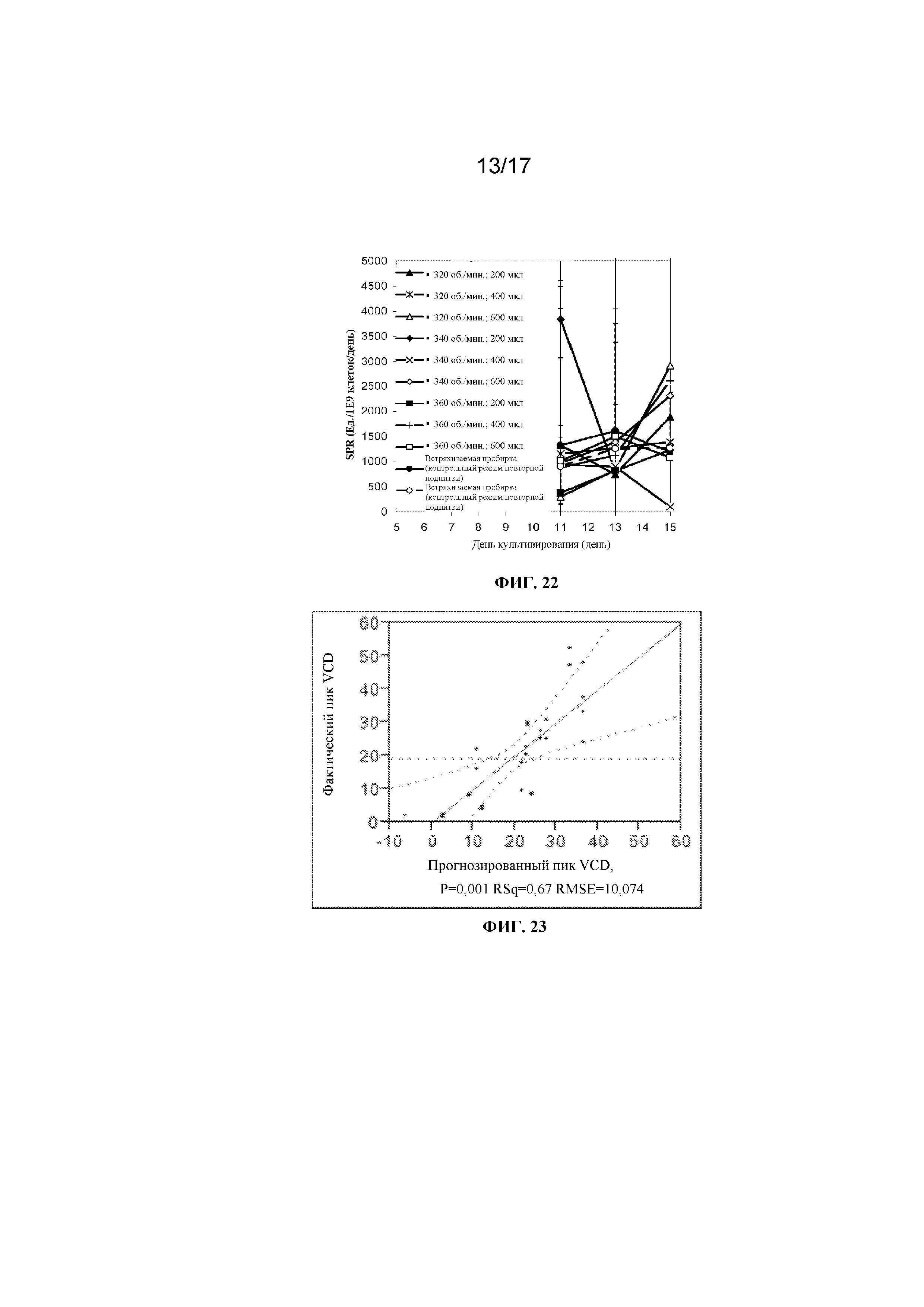
Фигура 22 представляет собой график, демонстрирующий удельную производительность при культивировании клеток в 96-луночных планшетах с глубокими лунками с квадратным дном, содержащих либо 200 мкл, 400 мкл либо 600 мкл культуральной среды CD CHO и перемешиваемых при 320 об/мин, 340 об/мин или 360 об/мин, или при культивировании клеток во встряхиваемой пробирке (с осуществлением перфузии сред с помощью контрольного режима повторной подпитки или модифицированного режима повторной подпитки). Планки погрешностей представляют стандартное отклонение n=2.
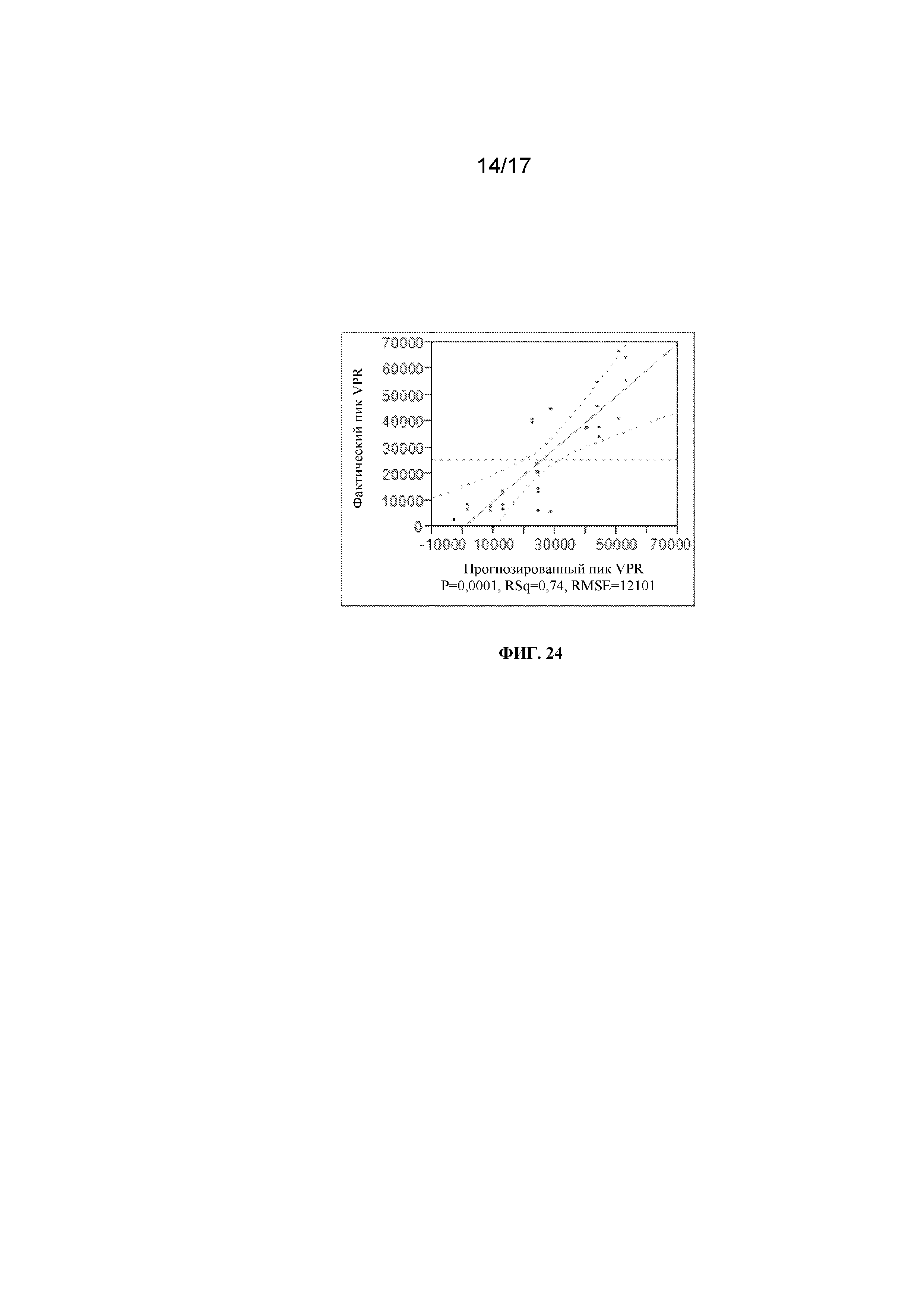
Фигура 23 представляет собой график, демонстрирующий аппроксимацию данных в реальном времени к спрогнозированным с помощью модели данным плотности жизнеспособных клеток.
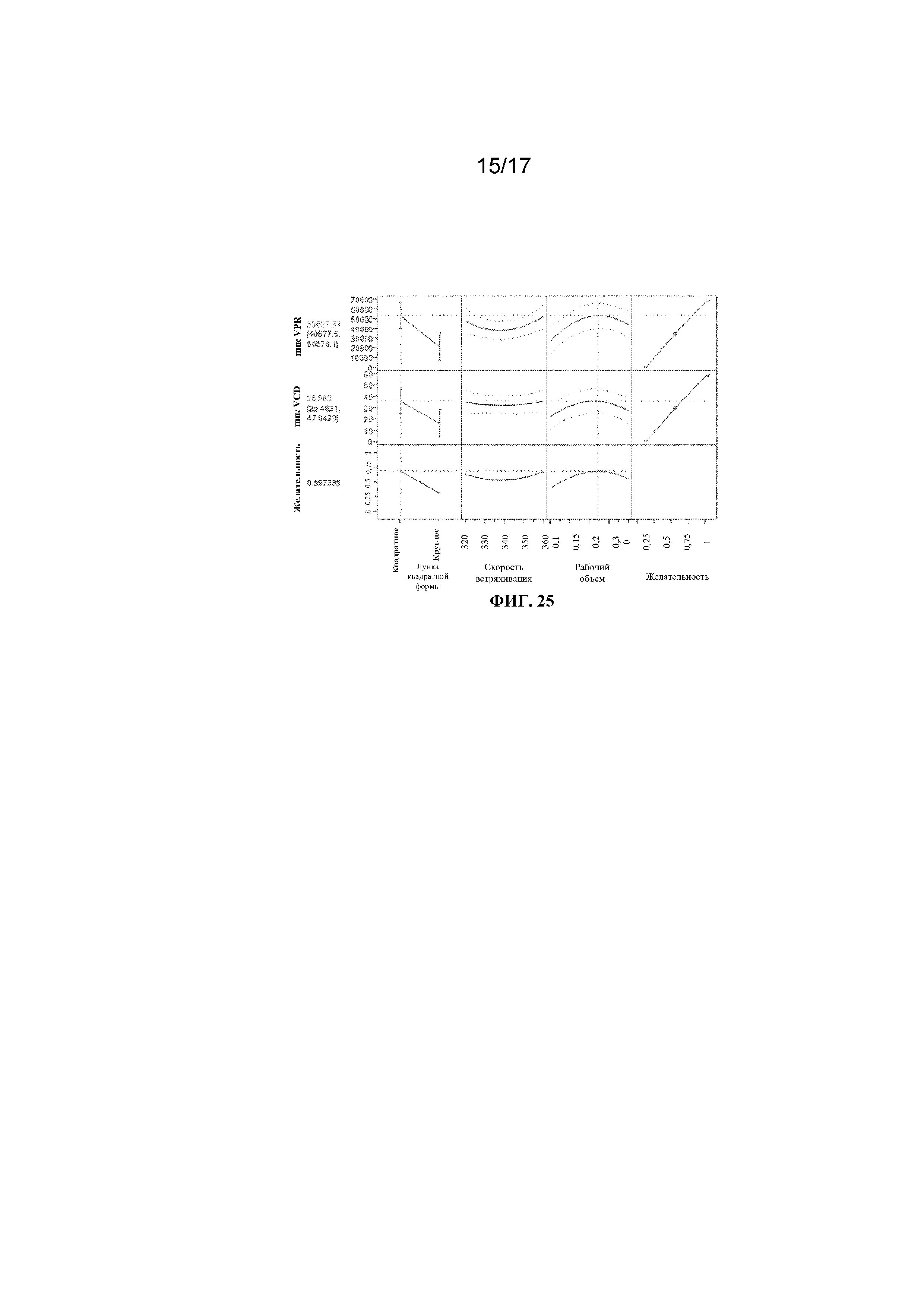
Фигура 24 представляет собой график, демонстрирующий аппроксимацию данных в реальном времени к спрогнозированным с помощью модели данным объемной производительности.
Фигура 25 представляет собой набор из двенадцати графиков, показывающих наилучшие технологические условия, исходя из подстановки экспериментальных данных в статистическую модель, с учетом стандартных отклонений.
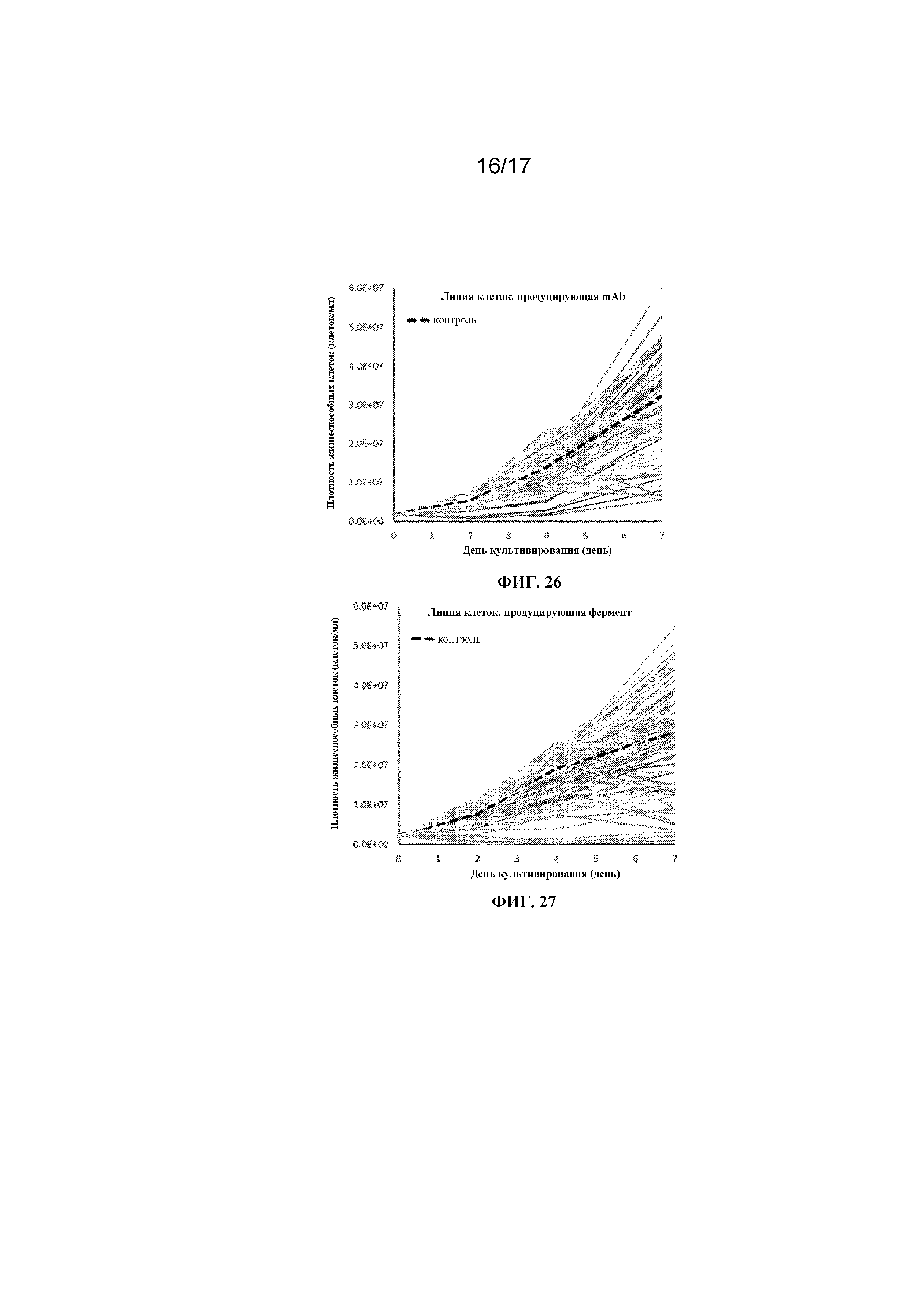
Фигура 26 представляет собой график, демонстрирующий профиль плотности жизнеспособных клеток линии клеток млекопитающих, продуцирующей рекомбинантное моноклональное антитело в 500 мкл одной или ряда других культуральных сред при помещении в 96-луночный планшет с глубокими лунками с квадратным дном и перемешивании с частотой 330 об/мин Данные контроля представляют собой среду CD CHO.
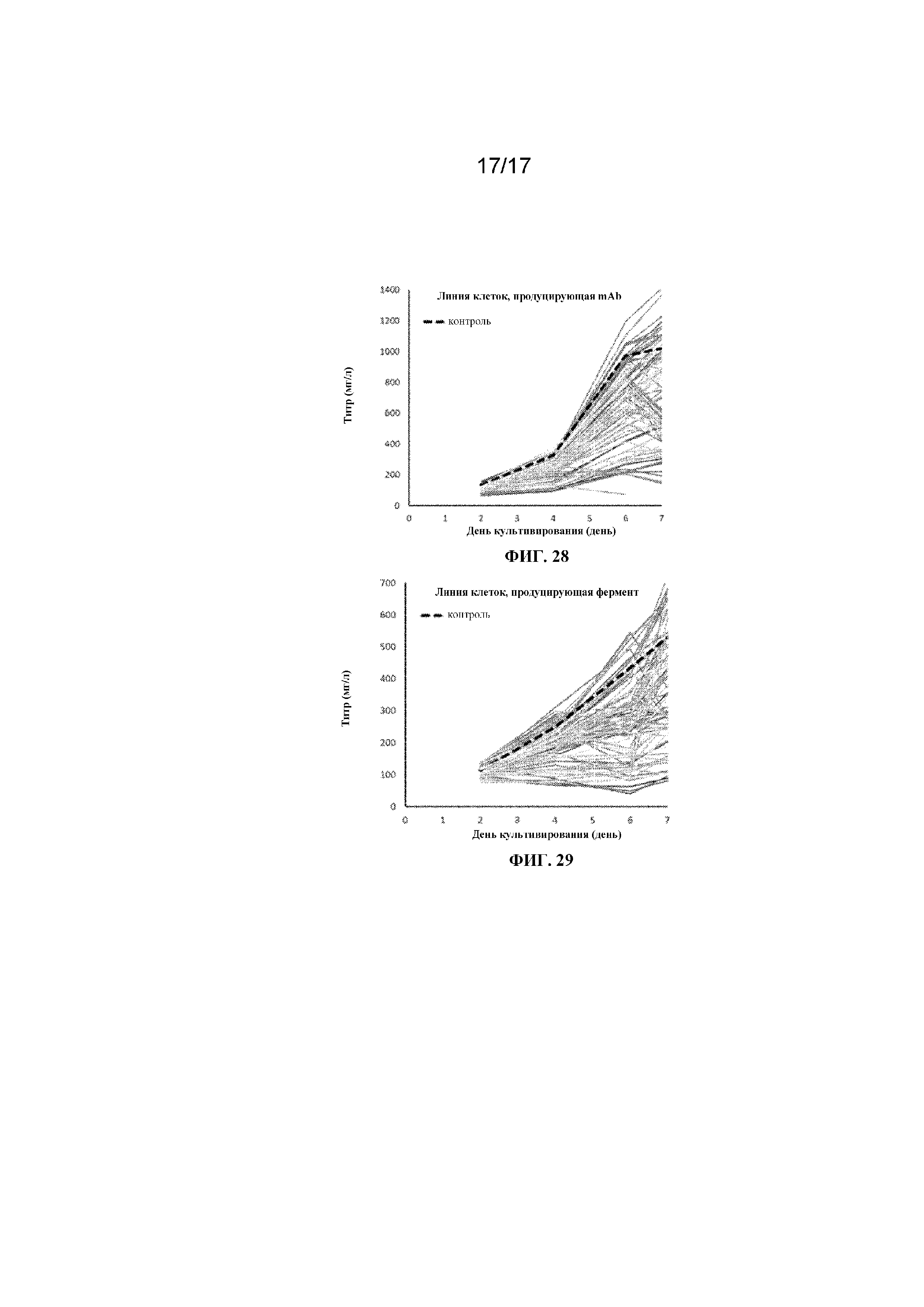
Фигура 27 представляет собой график, демонстрирующий профиль плотности жизнеспособных клеток линии клеток млекопитающих, продуцирующей рекомбинантный фермент в 96-луночном планшете с глубокими лунками с квадратным дном при перемешивании с частотой 330 об/мин. Данные контроля представляют собой среду CD CHO.
Фигура 28 представляет собой график, демонстрирующий титр (мг/мл) культуры линии клеток млекопитающих, продуцирующей рекомбинантное антитело в 500 мкл одной или ряда других культуральных сред при помещении в 96-луночный планшет с глубокими лунками с квадратным дном и перемешивании с частотой 330 об/мин Данные контроля представляют собой среду CD CHO.
Фигура 29 представляет собой график, демонстрирующий титр (мг/мл) культуры линии клеток млекопитающих, продуцирующей рекомбинантный фермент в 500 мкл одной или ряда других культуральных сред при помещении в 96-луночный планшет с глубокими лунками с квадратным дном и перемешивании с частотой 330 об/мин Данные контроля представляют собой среду CD CHO.
ПОДРОБНОЕ ОПИСАНИЕ
В данном документе предусматриваются улучшенные способы культивирования клетки млекопитающего в многолуночном планшете. С помощью способов культивирования можно достичь концентрации жизнеспособных клеток млекопитающих (например, в жидкой культуральной среде, например, первой жидкой культуральной среде, или комбинации первой и второй жидких культуральных сред), подобной концентрации, достигаемой при помощи производственного перфузионного биореактора для более крупного масштаба, например плотности жизнеспособных клеток млекопитающих более 10×106 клеток на мл, более 15×106 клеток/мл, более 20×106 клеток/мл, более 25×106 клеток/мл, более 30×106 клеток/мл, более 35×106 клеток/мл, более 40×106 клеток/мл, более 45×106 клеток/мл, более 50×106 клеток/мл, более 55×106 клеток/мл или более 60×106 клеток/мл. Например, способ культивирования может приводить в результате к концентрации жизнеспособных клеток млекопитающих, составляющей от 10×106 клеток/мл до 70×106 клеток/мл, от 10×106 клеток/мл до 65×106 клеток/мл, от 10×106 клеток/мл до 60×106 клеток/мл, от 10×106 клеток/мл до 50×106 клеток/мл, от 10×106 клеток/мл до 40×106 клеток/мл, от 10×106 клеток/мл до 30×106 клеток/мл, от 15×106 клеток/мл до 70×106 клеток/мл, от 15×106 клеток/мл до 65×106 клеток/мл, от 15×106 клеток/мл до 60×106 клеток/мл, от 15×106 клеток/мл до 55×106 клеток/мл, от 15×106 клеток/мл до 50×106 клеток/мл, от 15×106 клеток/мл до 45×106 клеток/мл, от 15×106 клеток/мл до 40×106 клеток/мл, от 15×106 клеток/мл до 35×106 клеток/мл, от 20×106 клеток/мл до 70×106 клеток/мл, от 20×106 клеток/мл до 65×106 клеток/мл, от 20×106 клеток/мл до 60×106 клеток/мл, от 20×106 клеток/мл до 55×106 клеток/мл, от 20×106 клеток/мл до 50×106 клеток/мл, от 20×106 клеток/мл до 45×106 клеток/мл, от 20×106 клеток/мл до 40×106 клеток/мл, от 25×106 клеток/мл до 70×106 клеток/мл, от 25×106 клеток/мл до 65×106 клеток/мл, от 25×106 клеток/мл до 60×106 клеток/мл,от 25×106 клеток/мл до 55×106 клеток/мл, от 25×106 клеток/мл до 50×106 клеток/мл, от 25×106 клеток/мл до 45×106 клеток/мл, от 30×106 клеток/мл до 70×106 клеток/мл, от 30×106 клеток/мл до 65×106 клеток/мл, от 30×106 клеток/мл до 60×106 клеток/мл, от 30×106 клеток/мл до 55×106 клеток/мл, от 30×106 клеток/мл до 50×106 клеток/мл, от 35×106 клеток/мл до 70×106 клеток/мл, от 35×106 клеток/мл до 65×106 клеток/мл, от 35×106 клеток/мл до 60×106 клеток/мл, от 35×106 клеток/мл до 55×106 клеток/мл, от 40×106 клеток/мл до 70×106 клеток/мл, от 40×106 клеток/мл до 65×106 клеток/мл, от 40×106 клеток/мл до 60×106 клеток/мл, от 40×106 клеток/мл до 55×106 клеток/мл, от 45×106 клеток/мл до 70×106 клеток/мл или от 45×106 клеток/мл до 65×106 клеток/мл. Ряд других способов можно применять для определения плотности клеток или плотности жизнеспособных клеток. Например, можно развести образец культуры клеток в физиологическом буфере, поместить разведенную суспензию клеток в гемоцитометр и произвести подсчет клеток с помощью световой микроскопии. В другом способе плотность жизнеспособных клеток можно определить с помощью подобного способа, но включая в физиологический буфер краситель, который селективно поглощается нежизнеспособными клетками (например, трипановый синий, как, например, способ с применением Vi-CELL от Beckman Coulter (см. веб-сайт Beckman Coulter)). В еще одном примере плотность клеток или плотность жизнеспособных клеток можно определить с помощью флуоресцентной проточной цитометрии (например, GUAVA от Merck Millipore (см. веб-сайт Millipore) и других способов подсчета клеток.
В некоторых вариантах осуществления способ культивирования приводит в результате к значительно улучшенной удельной производительности. Например, удельная производительность, достигаемая с помощью способов, предусмотренных в данном документе, является по меньшей мере в 2 раза, 3 раза, 4 раза, 5 раз, 6 раз, 7 раз, 8 раз, 9 раз, 10 раз, 15 раз, 20 раз, 30 раз, 40 раз, 50 раз, 60 раз, 70 раз, 80 раз, 90 раз или 100 раз выше, чем удельная производительность, достигаемая при практически тех же условиях культивирования, но без удаления объема первой культуральной среды и добавления второго объема второй культуральной среды. Продуктивность, достигаемая с помощью способов по настоящему изобретению, может составлять по меньшей мере 10000 единиц/л, по меньшей мере 15000 единиц/л, по меньшей мере приблизительно 20000 единиц/л, по меньшей мере приблизительно 25000 единиц/л, по меньшей мере приблизительно 30000 единиц/л, по меньшей мере приблизительно 35000 единиц/л или по меньшей мере приблизительно 40000 единиц/л (в первой и/или второй жидких культуральных средах). В некоторых вариантах осуществления продуктивность, достигаемая с помощью способов по настоящему изобретению, может составлять по меньшей мере 1 г/л, по меньшей мере 1,5 г/л, по меньшей мере 2,0 г/л, по меньшей мере 2,5 г/л, по меньшей мере 3,0 г/л, по меньшей мере 4,0 г/л, по меньшей мере 4,5 г/л или по меньшей мере 5,0 г/л.
Биологическую активность рекомбинантного белка можно оценивать с помощью ряда способов, известных из уровня техники, и они будут зависеть от активности конкретного рекомбинантного белка. Например, биологическую активность рекомбинантного белка, который представляет собой иммуноглобулин (например, антитело или фрагмента антитела), можно определить путем измерения аффинности связывания антитела со специфичным для него эпитопом (например, с применением анализа от Biocore или конкурентного твердофазного иммуноферментного анализа). Рекомбинантный белок может являться ферментом (например, рекомбинантной галактозидазой, например, рекомбинантной альфа-галактозидазой), и его биологическую активность можно определять путем измерения активности фермента (например, определения константы скорости каталитической реакции фермента путем измерения снижения концентрации выявляемого субстрата или увеличения концентрации выявляемого продукта (например, с помощью спектрофотометрии или светового излучения). Например, биологическую активность рекомбинантной галактозидазы можно выявить путем измерения снижения уровня глоботриаозилцерамида (GL-3) или галабиозилцерамида или увеличения уровня церамиддигексозида или галактозы.
Также предусматриваются системы в виде многолуночных планшетов для культур клеток, которые можно применять для осуществления, например, любого из описанных в данном документе способов.
Способы тестирования производственного процесса
В данном документе предусматриваются способы тестирования производственного процесса получения рекомбинантного белка (например, любого из описанных в данном документе или известных из уровня техники рекомбинантных белков). Эти способы включают осуществление способа получения рекомбинантного белка, описанного в данном документе, и в ходе способа и/или после его завершения выявление или измерение по меньшей мере одного (например, двух, трех, четырех, пяти, шести, семи, восьми, девяти, десяти, одиннадцати, двенадцати, тринадцати или четырнадцати) считываемого показателя культивирования (например, количества рекомбинантного белка в клетке или в первой и/или второй культуральных средах, потребления глюкозы, концентрации жизнеспособных клеток, продуцирования лактата, объемной производительности, удельной производительности, выхода лактата при превращении глюкозы, концентрации глутамина, концентрации глутамата, pH культуральной среды, парциального давления или концентрации растворенного CO2, концентрации или парциального давления растворенного O2, массообмена между метаболитами и массового баланса между метаболитами) и сравнение по меньшей мере одного считываемого показателя культивирования с эталонным уровнем по меньшей мере одного (например, двух, трех, четырех, пяти, шести, семи, восьми, девяти, десяти, одиннадцати, двенадцати или тринадцати) считываемого показателя культивирования (например, эталонным уровнем количества рекомбинантного белка, находящегося (например, выявленного) в клетке или в первой и/или второй культуральных средах, потребления глюкозы, концентрации жизнеспособных клеток, продуцирования лактата, объемной производительности, удельной производительности, выхода лактата при превращении глюкозы, концентрации глутамина, концентрации глутамата, pH культуральной среды, концентрации или парциального давления растворенного CO2, концентрации или парциального давления растворенного O2, масообмена между метаболитами и массового баланса между метаболитами).
Квалифицированным специалистам-практикам будет понятно, что какие-либо из ряда описанных в данном документе параметров культивирования (например, многолуночные планшеты, объемы, скорости или значения частоты замены объемов культуры, значения частоты перемешивания, значения температуры, среды, концентрации CO2 и уровни наклона реактора) можно применять в любой комбинации с целью осуществления этих способов. Кроме того, в способах можно применять любые клетки млекопитающих, описанные в данном документе или известные из уровня техники.
Эталонный уровень по меньшей мере одного считываемого показателя культивирования (например, количества рекомбинантного белка в клетке или в первой и/или второй культуральных средах, потребления глюкозы, концентрации жизнеспособных клеток, продуцирования лактата, объемной производительности, удельной производительности, выхода лактата при превращении глюкозы, концентрации глутамина, концентрации глутамата, pH культуральной среды, концентрации или парциального давления растворенного CO2, концентрации или парциального давления растворенного O2, масообмена между метаболитами и массового баланса между метаболитами) может представлять собой уровень, получаемый при другом способе культивирования, например, способе культивирования, в котором используют по меньшей мере один другой параметр культивирования (например, другую первую и/или вторую жидкую культуральную среду, другую клетку млекопитающего, другие значения частоты и/или тип перемешивания, другой многолуночный планшет, другой режим периодической повторной подпитки или перфузии (например, от 10% до 200% объема лунки или объема первой жидкой культуральной среды за 24-часовой период времени или другой дискретный период времени), и какой-либо из других параметров культивирования, описанных в данном документе). Эталонное количество рекомбинантного белка может представлять собой, например, уровень рекомбинантного белка, получаемого при применении комплекса параметров культивирования, которые приводят в результате к другому уровню растворенного O2 и/или другому уровню усилия сдвига жидкости.
Описанные в данном документе способы можно применять для тестирования влияния любого компонента или признака на производственный процесс. Например, описанный в данном документе способ можно применять для тестирования влияния разных исходных материалов, уровней перемешивания, многолуночных планшетов, средств, препятствующих агрегации, культуральных сред (например, культуральных сред с определенным химическим составом), или питательных элементов, или соединений по меньшей мере на один считываемый показатель культивирования (например, какой-либо из описанных в данном документе считываемых показателей культивирования, например, влияние на продуцирование рекомбинантного белка и/или рост клетки млекопитающего). Например, в данном документе предусматриваются способы тестирования эффективности первой или второй жидкой культуральной среды, исходного ингредиента или добавки, находящихся в первой или второй жидкой культуральной среде, или источника клетки млекопитающего для применения в способе получения рекомбинантного белка, которые включают обеспечение многолуночного планшета, содержащего по меньшей мере одну лунку, содержащую клетку млекопитающего, помещенную в первую жидкую культуральную среду, занимающую от приблизительно 5% до приблизительно 70% объема лунки; инкубирование многолуночного планшета в течение периода времени при от приблизительно 31°C до приблизительно 40°C с перемешиванием вращением со скоростью от приблизительно 320 об/мин до приблизительно 500 об/мин; непрерывно или периодически, в течение этого периода времени, удаление первого объема первой жидкой культуральной среды и добавление к первой жидкой культуральной среде второго объема второй жидкой культуральной среды, причем первый и второй объемы являются приблизительно равными; выявление или определение по меньшей мере одного считываемого показателя культивирования (например, какого-либо из описанных в данном документе считываемых показателей культивирования, например, количества рекомбинантного белка в клетке или в первой и/или второй культуральных средах); сравнение по меньшей мере одного считываемого показателя культивирования с эталонным уровнем по меньшей мере одного считываемого показателя культивирования (например, какого-либо из описанных в данном документе считываемых показателей культивирования, например, количества рекомбинантного белка в клетке или в первой и/или второй жидких культуральных средах), полученного посредством другого способа культивирования, в котором используют одно или несколько из другой первой или второй жидкой культуральной среды или другого источника клетки млекопитающего; и идентифицирование первой или второй жидких культуральных сред, исходного ингредиента или добавки, находящихся в первой или второй жидкой культуральной среде, или источника клетки млекопитающего, которые связаны с благоприятным изменением (например, повышением или снижением) по меньшей мере одного считываемого показателя культивирования (например, увеличенное количество рекомбинантного белка) по сравнению с эталонным уровнем, как эффективных для применения в способе получения рекомбинантного белка. Например, повышение уровня рекомбинантного белка, повышение концентрации жизнеспособных клеток, повышение объемной производительности, повышение удельной производительности и повышение потребления глюкозы по сравнению с эталонным уровнем означает, что первая или вторая жидкие культуральные среды, исходный ингредиент или добавка, находящиеся в первой или второй жидких культуральных средах, или источник клетки млекопитающего являются эффективными для применения в способе получения рекомбинантного белка.
Описанные в данном документе способы также можно применять для тестирования влияния изменения каких-либо из ряда описанных в данном документе или известных из уровня техники параметров культивирования клеток (например, объема, высоты, диаметра или формы дна лунки, частоты или типа перемешивания, силы сдвига, плотности посева культуры, pH первой или второй жидкой культуральной среды, концентрации или парциального давления растворенного O2, покрытия внутренней поверхности лунки, различного содержимого в жидких культуральных средах (например, первой и/или второй жидких культуральных средах), типа клеток млекопитающих или их линии, выделения CO2 или концентрации или парциального давления растворенного CO2, температуры, объема жидкой культуральной среды (например, объема первой и/или второй жидких культуральных сред), и/или скорости или частоты удаления первого объема первой культуральной среды и добавления второго объема второй культуральной среды к первой культуральной среде). Способы также можно применять для тестирования качества воды, используемой для получения жидкой культуральной среды (например, первой и/или второй жидких культуральных сред), и/или влияния разных металлов, находящихся в следовых количествах, в жидкой культуральной среде по меньшей мере на один считываемый показатель культивирования (например, какой-либо из описанных в данном документе считываемых показателей культивирования, например, влияние на продуцирование рекомбинантного белка и/или рост клеток млекопитающих). Способы также можно применять для тестирования влияния фактора роста или гормона роста по меньшей мере на один считываемый показатель культивирования (например, какой-либо из описанных в данном документе считываемых показателей культивирования, например, влияние на продуцирование рекомбинантного белка и/или рост клеток млекопитающих). Способ также можно применять для тестирования процессов фильтрации и фильтров, применяемых для получения первой и/или второй жидких культуральных сред. Способ также можно применять для тестирования стабильности жидкой культуральной среды и влияния жидкой культуральной среды на биологические функции (например, по меньшей мере на один из любых считываемых показателей культивирования, описанных в данном документе, например, влияние на продуцирование рекомбинантного белка и/или рост клеток млекопитающих). Способ также можно применять для скрининга различных рекомбинантных линий клеток и клеточных банков в отношении их способности к продуцированию требуемого рекомбинантного белка (например, требуемого секретируемого терапевтического белка). Как отмечено в данном документе способ также можно применять для скрининга любого параметра процесса культивирования клеток, в том числе без ограничения типа и частоты перемешивания, силы сдвига, режима и объема перфузии, плотности посева культуры и других.
Описанный в данном документе способ также можно применять для тестирования присутствия контаминанта в первой или второй жидкой культуральной среде, исходном материале, используемом для получения первой или второй жидкой культуральной среды, или источнике клетки млекопитающего. Например, в данном документе предусматриваются способы тестирования присутствия контаминанта в первой или второй жидкой культуральной среде, исходных материалах, используемых для получения первой или второй жидкой культуральной среды, или источнике клетки млекопитающего, которые включают обеспечение многолуночного планшета, содержащего по меньшей мере одну лунку, содержащую клетку млекопитающего, суспендированную в первой жидкой культуральной среде, занимающей от приблизительно 5% до приблизительно 70% объема лунки; инкубирование многолуночного планшета в течение некоторого периода времени при от приблизительно 31°C до приблизительно 40°C и с перемешиванием вращением со скоростью от приблизительно 320 об/мин (RPM) до приблизительно 500 RPM; непрерывно или периодически, в течение этого периода времени, удаление первого объема первой жидкой культуральной среды и добавление к первой жидкой культуральной среде второго объема второй жидкой культуральной среды, причем первый и второй объемы являются приблизительно равными; выявление или определение по меньшей мере одного считываемого показателя культивирования (например, какого-либо из описанных в данном документе считываемых показателей культивирования, например, количества рекомбинантного белка в клетке или в первой и/или второй культуральных средах); сравнение по меньшей мере одного считываемого показателя культивирования с эталонным уровнем по меньшей мере одного считываемого показателя культивирования (например, какого-либо из описанных в данном документе считываемых показателей культивирования, например, количества рекомбинантного белка, находящегося в клетке или в первой и/или второй культуральных средах), полученного посредством другого способа культивирования, в котором используют одно или несколько из другой первой или второй жидкой культуральной среды, других исходных материалов для получения первой или второй жидкой культуральной среды или другого источника клетки млекопитающего; и идентифицирование первой или второй жидкой культуральной среды, исходных материалов, используемых для получения первой или второй жидкой культуральной среды, или источника клетки млекопитающего, как таковых, которые содержат контаминант, если уровень по меньшей мере одного считываемого параметра культивирования изменился с неблагоприятным результатом (например, повысился или снизился) по сравнению с эталонным уровнем. Например, снижение продукции рекомбинантного белка (например, снижение уровня рекомбинантного белка в клетке или в первой и/или второй культуральных средах), объемной производительности или концентрации жизнеспособных клеток по сравнению с эталонным уровнем являются неблагоприятными изменениями, которые указывают на присутствие контаминанта в первой или второй жидкой культуральной среде, исходном материале, используемом для получения первой или второй жидкой культуральной среды, или источнике клетки млекопитающего. Некоторые способы дополнительно включают один или несколько анализов для определения принадлежности контаминанта, находящегося в первой или второй жидкой культуральной среде, исходном материале, используемом для получения первой или второй жидкой культуральной среды, или источнике клетки млекопитающего. Контаминант может являться биологическим контаминантом (например, микобактерией, грибом, бактерией, вирусом или нежелательной клеткой млекопитающего). Контаминант также может являться физически неопределенным веществом.
Способы можно применять для проведения экспериментов с высокопроизводительными культурами клеток для осуществления планирования экспериментов (DOE) или оптимизации в рамках концепции "качество через проектирование" способов культивирования клеток (QBD). Например, в данном документе предусматриваются способы оптимизации производственного процесса получения рекомбинантного белка, которые включают обеспечение многолуночного планшета, содержащего по меньшей мере одну лунку, содержащую клетку млекопитающего, суспендированную в первой жидкой культуральной среде, занимающей от приблизительно 5% до приблизительно 70% объема лунки; инкубирование многолуночного планшета в течение некоторого периода времени при от приблизительно 31°C до приблизительно 40°C и с перемешиванием вращением со скоростью от приблизительно 320 об/мин до приблизительно 500 об/мин; непрерывно или периодически, в течение этого периода времени, удаление первого объема первой жидкой культуральной среды и добавление к первой жидкой культуральной среде второго объема второй жидкой культуральной среды, причем первый и второй объемы являются приблизительно равными; выявление по меньшей мере одного считываемого показателя культивирования (например, какого-либо из описанных в данном документе считываемых показателей культивирования, например, количества рекомбинантного белка в клетке или в первой и/или второй жидких культуральных средах); сравнение по меньшей мере одного считываемого показателя культивирования с эталонным уровнем по меньшей мере одного считываемого показателя культивирования (например, какого-либо из описанных в данном документе считываемых показателей культивирования, например, количества рекомбинантного белка, находящегося в клетке или в первой и/или второй жидких культуральных средах), полученного посредством другого способа культивирования; и идентифицирование в производственном процессе и удаление из него или изменение в нем каких-либо компонентов или параметров относительно процесса культивирования, которые связаны с неблагоприятным изменением (например, повышением или снижением) по меньшей мере одного считываемого показателя культивирования (например, какого-либо из описанных в данном документе считываемых показателей культивирования, например, количества продуцируемого рекомбинантного белка) по сравнению с эталонным уровнем по меньшей мере одного считываемого показателя культивирования (например, какого-либо из описанных в данном документе считываемых показателей культивирования, например, количества продуцируемого рекомбинантного белка), или идентифицирование и добавление в производственный процесс каких-либо компонентов или параметров относительно процесса культивирования, которые связаны с благоприятным изменением (например, повышением или снижением) по меньшей мере одного считываемого показателя культивирования (например, какого-либо из описанных в данном документе считываемых показателей культивирования, например, количества продуцируемого рекомбинантного белка) по сравнению с эталонным уровнем по меньшей мере одного считываемого показателя культивирования (например, какого-либо из описанных в данном документе считываемых показателей культивирования, например, количества продуцируемого рекомбинантного белка). Например, повышение количества продуцируемого рекомбинантного белка, объемной производительности, удельной производительности или концентрации жизнеспособных клеток является благоприятным изменением считываемого показателя культивирования, а снижение количества продуцируемого рекомбинантного белка, объемной производительности, удельной производительности или концентрации жизнеспособных клеток является неблагоприятным изменением считываемого показателя культивирования. В некоторых случаях способ применяют для идентифицирования в режиме высокой производительности оптимизированных условий для культур клеток, которые можно применять для более масштабного (например, в биореакторе) получения рекомбинантного белка.
В любом из описанных в данном разделе способов эталонный уровень по меньшей мере одного считываемого показателя культивирования может быть взят из культуры, выращенной в более крупном масштабе (например, в перфузионном биореакторе, например, перфузионном биореакторе на 2000 л, перфузионном биореакторе на 40 л или перфузионном биореакторе на 12 л). В некоторых вариантах осуществления любого из описанных в данном разделе способов клетку млекопитающего культивируют в многолуночном планшете с применением любого из описанных в данном документе способов на протяжение такого же периода времени, при котором осуществляют культивирование в более крупном масштабе (при параллельном культивировании). Например, инокулят, используемый для инокуляции в многолуночный планшет в любом из описанных в данном документе способов, также используют для инокуляции в перфузионный биореактор более крупного масштаба примерно в то же время.
В одном варианте осуществления инокулят, который используют для засева лунки(лунок), получают из культуры, выращиваемой в более крупном масштабе (например, в перфузионном биореакторе более крупного масштаба). Например, в любой момент времени берут аликвоту из культуры, выращиваемой в более крупном масштабе (например, удаляют во время фазы роста, переходной фазы (например, необязательного периода, когда культуру перемещают в другой комплекс условий для роста, например, в другую жидкую культуральную среду и/или условия с другой температурой), или фазы сбора) и используют для инокуляции лунки(лунок) (например, используют для начала выращивания сателлитной культуры в многолуночном планшете). Аликвоту можно удалять из культуры, выращиваемой в более крупном масштабе, в ходе фазы роста и использовать для инокуляции или засева многолуночного планшета, содержащего по меньшей мере одну лунку, содержащую жидкую культуральную среду, а затем инкубировать лунку(лунки) в условиях, которые воспроизводят или являются подобными условиям фазы роста, которые использовали для культуры, выращиваемой в более крупном масштабе. Альтернативно, или дополнительно, аликвоту можно удалять из культуры, выращиваемой в более крупном масштабе, в ходе фазы перемещения и использовать для инокуляции или засева многолуночного планшета, содержащего по меньшей мере одну лунку, содержащую жидкую культуральную среду, а затем инкубировать лунку(лунки) в условиях, которые воспроизводят или являются подобными условиям переходной фазы, которые использовали для культуры, выращиваемой в более крупном масштабе. Альтернативно, или дополнительно, аликвоту можно удалять из культуры, выращиваемой в более крупном масштабе, в ходе фазы сбора и использовать для инокуляции или засева многолуночного планшета, содержащего по меньшей мере одну лунку, содержащую жидкую культуральную среду, а затем инкубировать лунку(лунки) в условиях, которые воспроизводят или являются подобными условиям фазы сбора, которые использовали для культуры, выращиваемой в более крупном масштабе. В любом из этих способов один или несколько параметров культивирования могут быть изменены в способах, применяемых для культивирования клетки млекопитающего в многолуночном планшете (по сравнению с параметрами или компонентами культивирования, применяемыми для культивирования клетки млекопитающего в культуре, выращиваемой в более крупном масштабе), при этом измеряют по меньшей мере один считываемый показатель культивирования и сравнивают по меньшей мере один считываемый показатель культивирования по меньшей мере с одним считываемым показателем культивирования, определенным для культуры, выращиваемой в более крупном масштабе. Как смогут понять специалисты в данной области, эти способы можно применять для тестирования влияния конкретного параметра или компонента культивирования по меньшей мере на один считываемый показатель культивирования в ходе одной или нескольких конкретных фаз процесса культивирования (например, влияние одного или нескольких параметров культивирования и/или компонента(компонентов) культивирования по меньшей мере на один считываемый показатель культивирования в ходе фазы роста, необязательной фазы перемещения и/или фазы сбора).
В определенных вариантах осуществления эти способы также можно осуществлять для определения того, находится ли контаминант в биореакторе более крупного масштаба, путем определения или выявления по меньшей мере одного считываемого показателя культивирования в многолуночном планшете (например, инокулированного аликвотой культуры из биореактора более крупного масштаба или из того же замороженного клеточного банка, используемого для инокуляции биореактора более крупного масштаба), сравнения по меньшей мере одного считываемого показателя культивирования с эталонным уровнем по меньшей мере одного считываемого показателя культивирования (например, уровнем по меньшей мере одного считываемого показателя культивирования, полученного из культуры, которая практически свободна от контаминации), и идентифицирования биореактора более крупного масштаба, как содержащего контаминант, если по меньшей мере один считываемый показатель культивирования в лунке по сравнению с эталонным уровнем по меньшей мере одного считываемого показателя культивирования указывает на то, что контаминант находится в лунке. Контаминантом может являться, например, биологический контаминант, такой как вирус, гриб, нежелательная клетка млекопитающего или бактерия, такая как микобактерия. Контаминантом может являться, например, везивирус.
Системы в виде многолуночных планшетов для культур клеток
Настоящее описание предусматривает иллюстративные системы в виде многолуночных планшетов для культур клеток, пригодные для культивирования клетки млекопитающего (например, с применением любого из описанных в данном документе способов). Эти системы сконструированы для обеспечения возможности непрерывного или периодического удаления текучей среды (например, первой жидкой культуральной среды), находящейся в сосуде(сосудах) для культивирования, и добавления в сосуд(сосуды) для культивирования текучей среды (например, второй жидкой культуральной среды) через по меньшей мере один канал, выполненный с возможностью регулирования потока текучей среды в сосуд(сосуды) для культивирования и/или из него(них).
Иллюстративные системы в виде многолуночных планшетов для культур клеток
Вид сверху неограничивающего примера системы 1 в виде многолуночного планшета для культур клеток представлен на фиг. 1. Система 1 в виде многолуночного планшета для культур клетоквключает сплошную опорную подставку 2, содержащую поверхность 3, имеющую множество отверстий 4. Отверстия могут быть организованы в любую форму, и не смотря на то, что на фиг. 1 отверстия показаны в форме линий и рядов, квалифицированным специалистам-практикам будет понятно, что можно использовать любую конфигурацию отверстий.
Вид сбоку иллюстративной системы 11 в виде многолуночного планшета для культур клеток представлен на фиг. 2. Система 11 в виде многолуночного планшета для культур клеток включает сплошную опорную подставку 2, имеющую поверхность 3, которая включает множество отверстий 4. Сплошная опорная подставка 2 может быть изготовлена из любого биологически совместимого материала (например, полистирола или любого другого биологически совместимого материала, известного из уровня техники). Сплошная опорная подставка 2 может иметь по меньшей мере 2 отверстия 4 (например, 4, 6, 9, 10, 12, 15, 18, 20, 24, 36, 48, 60, 72 или 96 отверстий 4) или может иметь по меньшей мере 3, 4, 5, 6, 12, 18, 24, 36, 48 или 96 отверстий 4. Система 11 в виде многолуночного планшета для культур клеток, показанная на фиг. 2, также имеет множество сосудов 5 для культивирования, которые образованы опорной подставкой 2 или помещены в нее и выполнены с возможностью размещения в них культур клеток (например, любых из иллюстративных клеток млекопитающих и/или сред для тканевых культур, описанных в данном документе). Сосуды 5 могут быть выполнены с возможностью размещения культур клеток любого объема, например, имеющих объем от приблизительно 0,3 мл до приблизительно 25 мл (например, от приблизительно 0,3 мл до приблизительно 24 мл, от приблизительно 0,3 мл до приблизительно 22 мл, от приблизительно 0,3 мл до приблизительно 20 мл, от приблизительно 0,3 мл до приблизительно 18 мл, от приблизительно 0,3 мл до приблизительно 16 мл, от приблизительно 0,3 мл до приблизительно 14 мл, от приблизительно 0,3 мл до приблизительно 12 мл, от приблизительно 0,3 мл до приблизительно 10 мл, от приблизительно 0,3 мл до приблизительно 8 мл, от приблизительно 0,3 мл до приблизительно 6 мл, от приблизительно 0,3 мл до приблизительно 5 мл, от приблизительно 0,3 мл до приблизительно 4 мл, от приблизительно 0,3 мл до приблизительно 3 мл, от приблизительно 0,3 мл до приблизительно 2 мл, от приблизительно 0,3 мл до приблизительно 1 мл, от приблизительно 0,5 мл до приблизительно 25 мл, от приблизительно 0,5 мл до приблизительно 24 мл, от приблизительно 0,5 мл до приблизительно 22 мл, от приблизительно 0,5 мл до приблизительно 0,5 мл до приблизительно 20 мл, от приблизительно 0,5 мл до приблизительно 18 мл, от приблизительно 0,5 мл до приблизительно 16 мл, от приблизительно 0,5 мл до приблизительно 14 мл, от приблизительно 0,5 мл до приблизительно 12 мл, от приблизительно 0,5 мл до приблизительно 10 мл, от приблизительно 0,5 мл до приблизительно 8 мл, от приблизительно 0,5 мл до приблизительно 6 мл, от приблизительно 0,5 мл до приблизительно 5 мл, от приблизительно 0,5 мл до приблизительно 4 мл, от приблизительно 0,5 мл до приблизительно 3 мл, от приблизительно 0,5 мл до приблизительно 2 мл, от приблизительно 0,5 мл до приблизительно 1 мл, от приблизительно 1 мл до приблизительно 25 мл, от приблизительно 1 мл до приблизительно 24 мл, от приблизительно 1 мл до приблизительно 22 мл, от приблизительно 1 мл до приблизительно 20 мл, от приблизительно 1 мл до приблизительно 18 мл, от приблизительно 1 мл до приблизительно 16 мл, от приблизительно 1 мл до приблизительно 14 мл, от приблизительно 1 мл до приблизительно 12 мл, от приблизительно 1 мл до приблизительно 10 мл, от приблизительно 1 мл до приблизительно 8 мл, от приблизительно 1 мл до приблизительно 7 мл, от приблизительно 1 мл до приблизительно 6 мл, от приблизительно 1 мл до приблизительно 5 мл, от приблизительно 1 мл до приблизительно 4 мл, от приблизительно 1 мл до приблизительно 3,5 мл, от приблизительно 1 мл до приблизительно 3 мл, от приблизительно 1 мл до приблизительно 2,5 мл, от приблизительно 1 мл до приблизительно 2 мл, от приблизительно 1 мл до приблизительно 1,5 мл, от приблизительно 1,5 мл до приблизительно 25 мл, от приблизительно 1,5 мл до приблизительно 24 мл, от приблизительно 1,5 мл до приблизительно 22 мл, от приблизительно 1,5 мл до приблизительно 20 мл, от приблизительно 1,5 мл до приблизительно 18 мл, от приблизительно 1,5 мл до приблизительно 16 мл, от приблизительно 1,5 мл до приблизительно 14 мл, от приблизительно 1,5 мл до приблизительно 12 мл, от приблизительно 1,5 мл до приблизительно 10 мл, от приблизительно 1,5 мл до приблизительно 8 мл, от приблизительно 1,5 мл до приблизительно 6 мл, от приблизительно 1,5 мл до приблизительно 5 мл, от приблизительно 1,5 мл до приблизительно 4 мл, от приблизительно 1,5 мл до приблизительно 3,5 мл, от приблизительно 1,5 мл до приблизительно 3 мл, от приблизительно 1,5 мл до приблизительно 2,5 мл, от приблизительно 1,5 мл до приблизительно 2,0 мл, от приблизительно 2 мл до приблизительно 25 мл, от приблизительно 2 мл до приблизительно 24 мл, от приблизительно 2 мл до приблизительно 22 мл, от приблизительно 2 мл до приблизительно 20 мл, от приблизительно 2 мл до приблизительно 18 мл, от приблизительно 2 мл до приблизительно 16 мл, от приблизительно 2 мл до приблизительно 14 мл, от приблизительно 2 мл до приблизительно 12 мл, от приблизительно 2 мл до приблизительно 10 мл, от приблизительно 2 мл до приблизительно 8 мл, от приблизительно 2 мл до приблизительно 6 мл или от приблизительно 2 мл до приблизительно 5 мл), при этом каждое отверстие 3 соединено с каждым сосудом 4 для культивирования и определяет границы входа в него.
Сосуд(сосуды) 5 для культивирования может(могут) иметь разные формы. Неограничивающие примеры форм сосуда(сосудов) для культивирования могут представлять собой практически цилиндрическую или цилиндрическую форму с противоположным отверстию 4 концевой частью, являющейся, например, плоской, полукруглой, пирамидальной или конической. Диаметр отверстия 4 может составлять, например, от приблизительно 4,0 мм до приблизительно 50 мм (например, от приблизительно 4,0 мм до приблизительно 45 мм, от приблизительно 4,0 мм до приблизительно 40 мм, от приблизительно 4,0 мм до приблизительно 35 мм, от приблизительно 4,0 мм до приблизительно 30 мм, от приблизительно 4,0 мм до приблизительно 25 мм, от приблизительно 4,0 мм до приблизительно 20 мм, от приблизительно 4,0 мм до приблизительно 15 мм, от приблизительно 4,0 мм до приблизительно 10 мм, от приблизительно 6,0 мм до приблизительно 50 мм, от приблизительно 6,0 мм до приблизительно 45 мм, от приблизительно 6,0 мм до приблизительно 40 мм, от приблизительно 6,0 мм до приблизительно 35 мм, от приблизительно 6,0 мм до приблизительно 30 мм, от приблизительно 6,0 мм до приблизительно 25 мм, от приблизительно 6,0 мм до приблизительно 25 мм, от приблизительно 6,0 мм до приблизительно 20 мм, от приблизительно 6,0 мм до приблизительно 15 мм, от приблизительно 6,0 мм до приблизительно 10 мм, от приблизительно 8 мм до приблизительно 50 мм, от приблизительно 8 мм до приблизительно 45 мм, от приблизительно 8 мм до приблизительно 40 мм, от приблизительно 8 мм до приблизительно 35 мм, от приблизительно 8 мм до приблизительно 30 мм, от приблизительно 8 мм до приблизительно 25 мм, от приблизительно 8 мм до приблизительно 20 мм, от приблизительно 8 мм до приблизительно 15 мм, от приблизительно 10 мм до приблизительно 50 мм, от приблизительно 10 мм до приблизительно 45 мм, от приблизительно 10 мм до приблизительно 40 мм, от приблизительно 10 мм до приблизительно 35 мм, от приблизительно 10 мм до приблизительно 30 мм, от приблизительно 10 мм до приблизительно 25 мм, от приблизительно 10 мм до приблизительно 20 мм, от приблизительно 15 мм до приблизительно 50 мм, от приблизительно 15 мм до приблизительно 45 мм, от приблизительно 15 мм до приблизительно 40 мм, от приблизительно 15 мм до приблизительно 35 мм, от приблизительно 15 мм до приблизительно 30 мм, от приблизительно 15 мм до приблизительно 25 мм или от приблизительно 15 мм до приблизительно 20 мм). Сосуд(сосуды) 5 для культивирования может(могут) иметь высоту от 1 см до приблизительно 12 см (например, от приблизительно 1 см до приблизительно 11 см, от приблизительно 1 см до приблизительно 10 см, от приблизительно 1 см до приблизительно 9 см, от приблизительно 1 см до приблизительно 8 см, от приблизительно 1 см до приблизительно 7 см, от приблизительно 1 см до приблизительно 6 см, от приблизительно 1 см до приблизительно 5 см, от приблизительно 1 см до приблизительно 4 см, от приблизительно 1 см до приблизительно 3 см, от приблизительно 1,2 см до приблизительно 12 см, от приблизительно 1,2 см до приблизительно 11 см, от приблизительно 1,2 см до приблизительно 10 см, от приблизительно 1,2 см до приблизительно 9 см, от приблизительно 1,2 см до приблизительно 8 см, от приблизительно 1,2 см до приблизительно 7 см, от приблизительно 1,2 см до приблизительно 6 см, от приблизительно 1,2 см до приблизительно 5 см, от приблизительно 1,2 см до приблизительно 4 см, от приблизительно 1,2 см до приблизительно 3 см, от приблизительно 1,5 см до приблизительно 11 см, от приблизительно 1,5 см до приблизительно 10 см, от приблизительно 1,5 см до приблизительно 9 см, от приблизительно 1,5 см до приблизительно 8 см, от приблизительно 1,5 см до приблизительно 7 см, от приблизительно 1,5 см до приблизительно 6 см, от приблизительно 1,5 см до приблизительно 5 см, от приблизительно 1,5 см до приблизительно 4 см, от приблизительно 1,5 см до приблизительно 3 см, от приблизительно 2 см до приблизительно 12 см, от приблизительно 2 см до приблизительно 11 см, от приблизительно 2 см до приблизительно 10 см, от приблизительно 2 см до приблизительно 9 см, от приблизительно 2 см до приблизительно 8 см, от приблизительно 2 см до приблизительно 7 см, от приблизительно 2 см до приблизительно 6 см, от приблизительно 2 см до приблизительно 5 см, от приблизительно 2 см до приблизительно 4 см, от приблизительно 2 см до приблизительно 3 см, от приблизительно 2,5 см до приблизительно 12 см, от приблизительно 2,5 см до приблизительно 11 см, от приблизительно 2,5 см до приблизительно 10 см, от приблизительно 2,5 см до приблизительно 9 см, от приблизительно 2,5 см до приблизительно 8 см, от приблизительно 2,5 см до приблизительно 7 см, от приблизительно 2,5 см до приблизительно 6 см, от приблизительно 2,5 см до приблизительно 5 см, от приблизительно 2,5 см до приблизительно 4 см, от приблизительно 3 см до приблизительно 12 см, от приблизительно 3 см до приблизительно 11 см, от приблизительно 3 см до приблизительно 10 см, от приблизительно 3 см до приблизительно 9 см, от приблизительно 3 см до приблизительно 8 см, от приблизительно 3 см до приблизительно 7 см, от приблизительно 3 см до приблизительно 6 см, от приблизительно 3 см до приблизительно 5 см, от приблизительно 4 см до приблизительно 12 см, от приблизительно 4 см до приблизительно 11 см, от приблизительно 4 см до приблизительно 10 см, от приблизительно 4 см до приблизительно 9 см, от приблизительно 4 см до приблизительно 8 см, от приблизительно 4 см до приблизительно 7 см, от приблизительно 4 см до приблизительно 6 см, от приблизительно 5 см до приблизительно 12 см, от приблизительно 5 см до приблизительно 11 см, от приблизительно 5 см до приблизительно 10 см, от приблизительно 5 см до приблизительно 9 см, от приблизительно 5 см до приблизительно 8 см или от приблизительно 5 см до приблизительно 7 см).
Система 11 в виде многолуночного планшета для культур клеток, показанная на фиг. 2, также включает канал 6, например, одно- или двусторонний клапан, выполненный с возможностью регулирования потока текучей среды в сосуд 5 для культивирования или из него. Канал 6 может быть в жидкостном соединении с сосудом 5 для культивирования в любом положении. Описанная в данном документе система в виде многолуночного планшета для культур клеток может иметь по меньшей мере один, например два, три, или по меньшей мере четыре канала 6, находящихся в жидкостном соединении с каждым сосудом 5 для культивирования. Иллюстративные положения для соединения канала 6 с сосудом 5 для культивирования показаны на фиг. 2 и фиг. 3. Канал 6 может быть выполнен с возможностью пропускания текучей среды в одном направлении (например, в сосуд 5 для культивирования или из него) или в обоих направлениях (в сосуд 5 для культивирования и из него). В некоторых вариантах осуществления первый канал 6 может быть выполнен с возможностью регулирования одностороннего потока в сосуд 5 для культивирования, а второй канал 6 выполнен с возможностью регулирования одностороннего потока из сосуда 5 для культивирования.
На фиг. 3 показана система 12 в виде многолуночного планшета для культур клеток, которая включает фильтр 8, выполненный с возможностью избирательного предотвращения вливания клеток в сосуд 5 для культивирования и выливания клеток из него. Фильтр 8 может быть любым из известных в данной области микро- или нанофильтров, используемых для фильтрования клеток млекопитающих. Система в виде многолуночного планшета для культур клеток, имеющая два или более каналов 6, может иметь фильтр 8 на каждом канале 6 или внутри него, выполненный с возможностью избирательного предотвращения вливания клеток в сосуд 5 для культивирования и выливания клеток из него.
Системы 12 и 13 в виде многолуночных планшетов для культур клеток, показанные на фиг. 2 и фиг. 3 соответственно, также включают в себя по меньшей мере одну трубку 7, расположенную в сплошной опорной подставке 2 и находящуюся в жидкостном соединении с каналом 6, при этом трубка 7 выполнена с возможностью пропускания текучей среды в сосуд 5 для культивирования и из него. В некоторых примерах система в виде многолуночного планшета для культур клеток может иметь трубку 7 в жидкостном соединении с каждым каналом 6 (например, выполненным с возможностью пропускания текучей среды в сосуд 5 для культивирования и/или из него).
Предусмотренные в данном документе системы в виде многолуночных планшетов для культур клеток могут дополнительно включать по меньшей мере один регулятор потока текучей среды, функционально связанный с каналом(каналами) 6. Предусмотренные в данном документе системы в виде многолуночных планшетов для культур клеток могут дополнительно включать в себя по меньшей мере один регулятор потока текучей среды, функционально соединенный с трубкой(трубками) 7. С помощью неограничивающих примеров регуляторов потока текучей среды можно контролировать скорость потока текучей среды и/или направление потока путем выявления изменений объема текучей среды в сосуде(сосудах) 5 для культивирования и/или давления подачи текучей среды в него(них). В некоторых примерах регуляторы потока текучей среды могут быть запрограммированы для пропускания текучей среды с конкретной скоростью за конкретный период времени с конкретным направлением потока (например, в сосуд(сосуды) 5 для культивирования и/или из него(них)).
В некоторых вариантах осуществления сплошная опорная подставка 2 выполнена с возможностью включения в себя резервуара для размещения жидкости и ее подачи в канал(каналы) 6 или трубку(трубки) 7. В некоторых примерах система в виде многолуночного планшета для культур клеток включает в себя резервуар для размещения жидкости и ее подачи в канал(каналы) 6 или трубку(трубки) 7, выполненный таким образом, что он находится снаружи по отношению к сплошной опорной подставке 2 и в жидкостном сообщении с каналом(каналами) 6 или трубкой(трубками) 7 соответственно (при этом канал(каналы) 6 или трубка(трубки) 7 выполняют функцию вливания текучей среды в сосуд(сосуды) 5 для культивирования). В некоторых вариантах осуществления сплошная опорная подставка 2 выполнена с возможностью включения в себя резервуара для размещения и хранения жидкости, удаленной из сосуда(сосудов) 5 для культивирования, при этом резервуар для размещения и хранения удаленной жидкости находится снаружи по отношению к сплошной опорной подставке 2 и в жидкостном соединении с каналом(каналами) 6 или трубкой(трубками) 7 (где канал(каналы) 6или трубка(трубки) 7 выполняют функцию выливания текучей среды из сосуда(сосудов) для культивирования 5).
Иллюстративная сплошная опорная подставка 2, выполненная с возможностью включения в себя внутреннего резервуара 9 для размещения жидкости и ее подачи в канал(каналы) 6, показана на фиг. 4. Сплошная опорная подставка 2, показанная на фиг. 4, дополнительно включает в себя обменный канал 10 для удаления или добавления жидкости во внутренний резервуар 9 или из него. Сплошная опорная подставка, которая включает в себя внутренний резервуар 9 может включать в себя одно- и/или двусторонний обменные каналы 10 (например, одно- или двусторонние клапаны). Например, сплошная опорная подставка 2, включающая в себя внутренний резервуар 9, может иметь первый обменный канал 10, который обеспечивает возможность вливания жидкости во внутренний резервуар, и второй обменный канал, который обеспечивает возможность для выливания жидкости из внутреннего резервуара. В другом примере сплошная опорная подставка 2, включающая в себя внутренний резервуар 9, может иметь один двусторонний обменный канал 10, который обеспечивает возможность вливания жидкости во внутренний резервуар 10 или ее выливания из него. Текучую среду, находящуюся во внутреннем резервуаре 10, можно вливать в сосуд(сосуды) 5 и/или выливать из них посредством применения одного или нескольких каналов 6 и/или трубок 7.
В некоторых примерах многолуночный планшет для культур клеток дополнительно содержит накрывающую крышку для закрывания планшета, выполненную с возможностью закрытия сплошной опорной подставки 2 и отверстия(отверстий) 4 (например, всех отверстий 4 сплошного опорного планшета 2), предупреждения контаминации (например, контаминации бактериями (например, микобактериями), вирусами или грибками) сосуда(сосудов) для культивирования 5, и обеспечения возможности газообмена между содержимым сосуда(сосудов) для культивирования 5 и окружающей средой. В некоторых вариантах осуществления многолуночный планшет для культур клеток дополнительно содержит газопроницаемую одноразовую мембрану или газопроницаемый силиконовый слой, расположенные между накрывающей планшет крышкой и сплошной опорной подставкой 2, для предупреждения контаминации в сосуде(сосудах) для культивирования 5, обеспечения при этом возможности газообмена между содержимым сосуда(сосудов) 5 и окружающей средой.
Текучая среда может протекать сквозь любую из описанных в данном документе систем (например, в систему и/или из нее, например, в канал 6 и/или из него, в трубку 7 и/или из нее или в обменный канал 10 и/или из него) с применением одного или нескольких из ряда способов, известных в данной области, например, давления текучей среды, давления сжатого воздуха, силы тяготения и механического давления. Например, текучую среду можно перемещать по любой из описанных в данном документе систем с применением насоса, силы тяжести, центробежной силы или механического давления. Дополнительные способы осуществления протекания текучей среды сквозь любую из описанных в данном документе систем хорошо известны из уровня техники.
Способы культивирования клетки млекопитающего
В способе, являющемся иллюстративным относительно описанных в данном документе, сначала обеспечивают многолуночный планшет. Первую жидкую культуральную среду добавляют в лунку(лунки) таким образом, чтобы среда занимала от приблизительно 5% до приблизительно 80% (например, от приблизительно 5% до приблизительно 75%, от приблизительно 5% до приблизительно 70%, от приблизительно 5% до приблизительно 65%, от приблизительно 5% до приблизительно 60%, от приблизительно 5% до приблизительно 55%, от приблизительно 5% до приблизительно 50%, от приблизительно 5% до приблизительно 45%, от приблизительно 5% до приблизительно 40%, от приблизительно 5% до приблизительно 35%, от приблизительно 5% до приблизительно 30%, от приблизительно 10% до приблизительно 80%, от приблизительно 10% до приблизительно 75%, от приблизительно 10% до приблизительно 70%, от приблизительно 10% до приблизительно 65%, от приблизительно 10% до приблизительно 60%, от приблизительно 10% до приблизительно 55%, от приблизительно 10% до приблизительно 50%, от приблизительно 10% до приблизительно 45%, от приблизительно 10% до приблизительно 40%, от приблизительно 10% до приблизительно 35%, от приблизительно 15% до приблизительно 80%, от приблизительно 15% до приблизительно 75%, от приблизительно 15% до приблизительно 70%, от приблизительно 15% до приблизительно 65%, от приблизительно 15% до приблизительно 60%, от приблизительно 15% до приблизительно 55%, от приблизительно 15% до приблизительно 50%, от приблизительно 15% до приблизительно 45%, от приблизительно 15% до приблизительно 40%, от приблизительно 20% до приблизительно 80%, от приблизительно 20% до приблизительно 75%, от приблизительно 20% до приблизительно 70%, от приблизительно 20% до приблизительно 65%, от приблизительно 20% до приблизительно 60%, от приблизительно 20% до приблизительно 55%, от приблизительно 20% до приблизительно 50%, от приблизительно 20% до приблизительно 45%, от приблизительно 25% до приблизительно 80%, от приблизительно 25% до приблизительно 75%, от приблизительно 25% до приблизительно 70%, от приблизительно 25% до приблизительно 65%, от приблизительно 25% до приблизительно 60%, от приблизительно 25% до приблизительно 55% или от приблизительно 25% до приблизительно 50%) объема лунки. По меньшей мере одну клетку млекопитающего вносят в первую жидкую культуральную среду, т.е. либо перед добавлением среды в лунку, либо после него. Многолуночный планшет инкубируют в течение некоторого периода времени при от приблизительно 31°C до приблизительно 40°C и перемешивают, например, с помощью ротационного устройства, при приблизительно 300 об/мин до приблизительно 600 об/мин (например, при любом из описанных в данном документе иллюстративных диапазонов перемешивания). Клетки можно инкубировать, например, в инкубаторе, таком как шейкер-инкубатор с диаметром (траекторией) смещения от приблизительно 3 мм до приблизительно 50 мм. В ходе инкубации в течение этого периода непрерывно или периодически удаляют первый объем первой жидкой культуральной среды (например, содержащей любую концентрацию клеток млекопитающих, например, первый объем первой жидкой культуральной среды, которая практически не содержит клеток млекопитающих или получена без клеток млекопитающих), а второй объем второй жидкой культуральной среды добавляют к первой жидкой культуральной среде. Как правило, первый и второй объемы являются приблизительно равными, но при сравнении первого и второго объемов они могут отличаться небольшим значением, например, на от приблизительно 1% до приблизительно 10% (например, от приблизительно 1% до приблизительно 8%, от приблизительно 1% до приблизительно 5% или от приблизительно 1% до приблизительно 3%). В некоторых вариантах осуществления добавляемый второй объем второй жидкой культуральной среды является меньшим (например, не более чем на приблизительно 1%, 2%, 3%, 4%, 5%, 6%, 7%, 8%, 9% или 10% меньше) чем удаляемый первый объем первой жидкой культуральной среды. Как известно из уровня техники в срок инкубирования могут быть включены короткие периоды времени (например, не более 1 минуты, не более 2 минут, не более 3 минут, не более 4 минут, не более 5 минут, не более 10 минут, не более 20 минут, не более 30 минут, не более 40 минут, не более 50 минут или не более 1 часа), в ходе которых многолуночный планшет, содержащий клетку млекопитающего и жидкую культуральную среду, достают из инкубатора для того, чтобы удалить первый объем первой жидкой культуральной среды и добавить второй объем второй жидкой культуральной среды. В некоторых примерах в срок инкубирования не включены короткие периоды времени, в ходе которых многолуночный планшет, содержащий клетку млекопитающего и жидкую культуральную среду, достают из инкубатора для того, чтобы удалить первый объем первой жидкой культуральной среды и добавить второй объем второй жидкой культуральной среды (например, посредством применения описанной в данном документе системы в виде многолуночного планшета для культур клеток).
Различные неограничивающие примеры каждого аспекта данных способов культивирования описаны ниже. Иллюстративные аспекты способов, предусмотренных в данном документе, можно без ограничения применять в любой комбинации.
Клетки млекопитающих
Способы, предусмотренные в данном документе, можно применять для культивирования ряда разных клеток млекопитающих. Клетка млекопитающего может представлять собой, например, клетку, которая растет в суспензии, или может представлять собой адгезивную клетку. Неограничивающие примеры клеток млекопитающих, которые можно культивировать с помощью любого из описанных в данном документе способов, включают клетки яичника китайского хомячка (СНО), Sp2.0, клетки миеломы (например, NS/0), В-клетки, клетки гибридомы, Т-клетки, эмбриональные клетки почки человека (НЕК) (например, НЕК 293E и НЕК 293F), клетки эпителия почки африканской зеленой мартышки (клетки Vero) и клетки эпителия почки Madin-Darby Canine (кокер-спаниель) (клетки MDCK). Дополнительные клетки млекопитающих, которые можно культивировать с помощью описанных в данном документе способов, известны из уровня техники.
Клетка млекопитающего может содержать рекомбинантную нуклеиновую кислоту (например, нуклеиновую кислоту, стабильно интегрированную в геном клетки млекопитающего), которая кодирует рекомбинантный белок. Неограничивающие примеры рекомбинантных нуклеиновых кислот, которые кодируют иллюстративные рекомбинантные белки, описаны ниже, как и рекомбинантные белки, которые можно получить с помощью описанных в данном документе способов. В некоторых случаях клетку млекопитающего, помещуаемую в многолуночный планшет для культивирования, получали из более крупной культуры. Например, клетку млекопитающего для многолуночного планшета можно получить из культуры, выращенной в биореакторе более крупного масштаба, т.е. путем применения данных способов можно получить сателлитную культуру.
Культуральные среды
Жидкие культуральные среды известны из уровня техники. Первую и/или вторую жидкие культуральные среды можно дополнить сывороткой млекопитающего (например, фетальной телячьей сывороткой и бычьей сывороткой) и/или гормоном роста или фактором роста (например, инсулином, трансферрином и эпидермальным фактором роста). В качестве альтернативы или в дополнение, первая и/или вторая жидкие культуральные среды могут представлять собой жидкую культуральную среду с определенным химическим составом, жидкую культуральную среду, не содержащую компонентов животного происхождения, жидкую культуральную среду, не содержащую сыворотку, жидкую культуральную среду, содержащую сыворотку, или жидкую культуральную среду, не содержащую белков. Неограничивающие примеры жидких культуральных сред с определенным химическим составом, жидких культуральных сред, не содержащих компонентов животного происхождения, жидких культуральных сред, не содержащих сыворотку, и жидких культуральных сред, содержащих сыворотку, являются коммерчески доступными.
Жидкая культуральная среда, как правило, содержит источник энергии (например углевод, такой как глюкоза), незаменимые аминокислоты (например, набор из двадцати основных аминокислот плюс цистеин), витамины и/или другие органические соединения, требуемые в низких концентрациях, свободные жирные кислоты и/или микроэлементы. Первую или вторую жидкие культуральные среды можно при необходимости дополнить, например, гормоном или фактором роста млекопитающих (например, инсулином, трансферрином или эпидермальным фактором роста), солями и буферами (например, солями кальция, магния и фосфатами), нуклеозидами и основаниями (например, аденозином, тимидином и гипоксантином), белком и тканевыми гидролизатами и/или любой комбинацией таких добавок.
Неограничивающие примеры жидких культуральных сред, которые особенно применимы в описанных в данном документе способах, включают, например, CD CHO, Opti CHO и Forti CHO (все доступны от Life Technologies; Гранд-Айленд, Нью Йорк), среду Hycell для CHO (Thermo Fisher Scientific, Inc.; Уолтем, Массачусетс), среду Ex-cell Fusion CD для CHO (Sigma-Aldrich Co.; Сент-Луис, Миссури) и среду Power для CHO (Lonza Group, Ltd.; Базель, Швейцария). Компоненты среды, которые также можно применять в способах по настоящему изобретению, включают без ограничения гидролизаты с определенным химическим составом (CD), например, CD-пептон, CD-полипептиды (две или более аминокислоты) и CD-факторы роста. Дополнительные примеры жидкой культуральной среды для культуры тканей и компонентов среды известны из уровня техники.
В некоторых примерах любых из описанных в данном документе способов клетку млекопитающего суспендируют в от приблизительно 100 мкл до приблизительно 25 мл (например, от приблизительно 100 мкл до приблизительно 20 мл, от приблизительно 100 мкд до приблизительно 15 мл, от приблизительно 100 мкл до приблизительно 10 мл, от приблизительно 100 мкл до приблизительно 8 мл, от приблизительно 100 мкл до приблизительно 6 мл, от приблизительно 100 мкл до приблизительно 4 мл, от приблизительно 100 мкл до приблизительно 3 мл, от приблизительно 100 мкл до приблизительно 2,5 мл, от приблизительно 100 мкл до приблизительно 2,0 мл, от приблизительно 100 мкл до приблизительно 1,5 мл, от приблизительно 100 мкл до приблизительно 1,0 мл, от приблизительно 100 мкл до приблизительно 800 мкл, от приблизительно 100 мкл до приблизительно 600 мкл, от приблизительно 100 мкл до приблизительно 500 мкл, от приблизительно 100 мкл до приблизительно 400 мкл, от приблизительно 100 мкл до приблизительно 300 мкл, от приблизительно 100 мкл до приблизительно 250 мкл, от приблизительно 100 мкл до приблизительно 200 мкл, от приблизительно 150 мкл до приблизительно 25 мл, от приблизительно 150 мкл до приблизительно 20 мл, от приблизительно 150 мкл до приблизительно 15 мл, от приблизительно 150 мкл до приблизительно 10 мл, от приблизительно 150 мкл до приблизительно 8 мл, от приблизительно 150 мкл до приблизительно 6 мл, от приблизительно 150 мкл до приблизительно 4 мл, от приблизительно 150 мкл до приблизительно 3 мл, от приблизительно 150 мкл до приблизительно 2,5 мл, от приблизительно 150 мкл до приблизительно 2,0 мл, от приблизительно 150 мкл до приблизительно 1,5 мл, от приблизительно 150 мкл до приблизительно 1,0 мл, от приблизительно 150 мкл до приблизительно 800 мкл, от приблизительно 150 мкл до приблизительно 600 мкл, от приблизительно 150 мкл до приблизительно 500 мкл, от приблизительно 150 мкл до приблизительно 400 мкл, от приблизительно 150 мкл до приблизительно 300 мкл, от приблизительно 150 мкл до приблизительно 200 мкл, от приблизительно 250 мкл до приблизительно 25 мл, от приблизительно 250 мкл до приблизительно 20 мл, от приблизительно 250 мкл до приблизительно 15 мл, от приблизительно 250 мкл до приблизительно 10 мл, от приблизительно 250 мкл до приблизительно 8 мл, от приблизительно 250 мкл до приблизительно 6 мл, от приблизительно 250 мкл до приблизительно 5 мл, от приблизительно 250 мкл до приблизительно 4 мл, от приблизительно 250 мкл до приблизительно 3 мл, от приблизительно 250 мкл до приблизительно 2,5 мл, от приблизительно 250 мкл до приблизительно 2 мл, от приблизительно 250 мкл до приблизительно 1 мл, от приблизительно 500 мкл до приблизительно 25 мл, от приблизительно 500 мкл до приблизительно 20 мл, от приблизительно 500 мкл до приблизительно 15 мл, от приблизительно 500 мкл до приблизительно 10 мл, от приблизительно 500 мкл до приблизительно 8 мл, от приблизительно 500 мкл до приблизительно 6 мл, от приблизительно 500 мкл до приблизительно 5 мл, от приблизительно 500 мкл до приблизительно 4 мл, от приблизительно 500 мкл до приблизительно 3 мл, от приблизительно 500 мкл до приблизительно 2,5 мл, от приблизительно 500 мкл до приблизительно 2 мл, от приблизительно 500 мкл до приблизительно 1 мл, от приблизительно 1 мл до приблизительно 25 мл, от приблизительно 1 мл до приблизительно 20 мл, от приблизительно 1 мл до приблизительно 15 мл, от приблизительно 1 мл до приблизительно 10 мл, от приблизительно 1 мл до приблизительно 8 мл, от приблизительно 1 мл до приблизительно 6 мл, от приблизительно 1 мл до приблизительно 5 мл, от приблизительно 1 мл до приблизительно 4 мл, от приблизительно 1 мл до приблизительно 3 мл, от приблизительно 1 мл до приблизительно 2,5 мл или от приблизительно 1 мл до приблизительно 2 мл) первой культуральной среды.
Квалифицированным специалистам будет понятно, что описанные в данном документе первая жидкая культуральная среда и вторая жидкая культуральная среда могут представлять собой один и тот же тип сред или разные среды.
Микроносители
В некоторых примерах, в которых клетка млекопитающего представляет собой адгезивную клетку, первая и/или вторая жидкие культуральные среды содержат множество микроносителей. Например, микроносители могут содержаться в лунке в конечной концентрации, например, от приблизительно 1,0 г/л до приблизительно 15,0 г/л (например, во встряхиваемой колбе в конечной концентрации от приблизительно 1,0 г/л до приблизительно 2,5 г/л, от приблизительно 1,0 г/л до приблизительно 2,0 г/л, от приблизительно 1,0 г/л до приблизительно 1,75 г/л, от приблизительно 1,0 г/л до приблизительно 1,5 г/л, от приблизительно 1,0 г/л до приблизительно 1,25 г/л, от приблизительно 2,5 г/л до 5,0 г/л, от приблизительно 5,0 г/л до приблизительно 7,5 г/л, от приблизительно 7, 5 г/л до приблизительно 10,0 г/л, от приблизительно 10,0 г/л до приблизительно 12,5 г/л, от приблизительно 12,5 г/л до приблизительно 15,0 г/л, от приблизительно 1,0 г/л до приблизительно 5,0 г/л, от приблизительно 5,0 г/л до приблизительно 10,0 г/л, от приблизительно 10,0 г/л до приблизительно 15,0 г/л, от приблизительно 2,5 г/л до приблизительно 3,5 г/л, от приблизительно 3,0 г/л до приблизительно 4,0 г/л, от приблизительно 4,0 г/л до приблизительно 5,0 г/л, от приблизительно 5,0 г/л до приблизительно 6,0 г/л, от приблизительно 6,0 г/л до приблизительно 7,0 г/л, от приблизительно 7,0 г/л до приблизительно 8,0 г/л, от приблизительно 8,0 г/л до приблизительно 9,0 г/л, от приблизительно 9,0 г/л до приблизительно 10,0 г/л, от приблизительно 10,0 г/л до приблизительно 11,0 г/л, от приблизительно 11,0 г/л до приблизительно 12,0 г/л, от приблизительно 12,0 г/л до приблизительно 13,0 г/л, от приблизительно 13,0 г/л до приблизительно 14,0 г/л или от приблизительно 14,0 г/л до приблизительно 15,0 г/л).
В некоторых вариантах осуществления множество микроносителей могут характеризоваться средним диаметром от приблизительно 20 мкм до приблизительно 1 мм (например, от приблизительно 20 мкм до приблизительно 250 мкм, от приблизительно 100 мкм до приблизительно 250 мкм, от приблизительно 150 мкм до приблизительно 250 мкм, от приблизительно 250 мкм до 500 мкм, от приблизительно 200 мкм до приблизительно 300 мкм, от приблизительно 750 мкм до 1 мм, от приблизительно 200 мкм до приблизительно 800 мкм, от приблизительно 200 мкм до приблизительно 500 мкм или от приблизительно 500 мкм до приблизительно 800 мкм), при этом микроносители имеют поверхность, позволяющую или cпособствующую прикреплению клетки млекопитающего (например, любой из описанных в данном документе или известных из уровня техники клеток млекопитающих). В некоторых примерах микроноситель может содержать одну или несколько пор (например, одну или несколько пор со средним диаметром от приблизительно 10 мкм до приблизительно 100 мкм (например, от приблизительно 10 мкм до 20 мкм, от приблизительно 20 мкм до приблизительно 30 мкм, от приблизительно 30 мкм до приблизительно 40 мкм, от приблизительно 50 мкм до приблизительно 60 мкм, от приблизительно 60 мкм до приблизительно 70 мкм, от приблизительно 70 мкм до приблизительно 80 мкм, от приблизительно 80 мкм до приблизительно 90 мкм, от приблизительно 90 мкм до приблизительно 100 мкм, от приблизительно 10 мкм до приблизительно 45 мкм, от приблизительно 45 мкм до приблизительно 80 мкм, от приблизительно 25 мкм до приблизительно 35 мкм или приблизительно 30 мкм)). В некоторых вариантах осуществления поверхность во множестве микроносителей и/или поверхность одной или нескольких пор во множестве микроносителей покрыты средством, которое способствует прикреплению клетки млекопитающего к микроносителю (например, прикреплению к внешней поверхности микроносителей и/или поверхности пор в микроносителе). Примеры таких средств, которые можно применять для содействия прикреплению клетки млекопитающего, включают без ограничения желатин, коллаген, поли-L-орнитин, полистирол и ламинин.
В некоторых примерах микроносители характеризуются средней эффективной для прикрепления клетки площадью поверхности, cоставляющей от приблизительно 0,5 м2/г микроносителей в сухом виде до 2,0 м2/г микроносителей в сухом виде (например, от приблизительно 0,75 м2/г микроносителей в сухом виде до 1,25 м2/г микроносителей в сухом виде, от приблизительно 1,0 м2/г микроносителей в сухом виде до приблизительно 1,5 м2/г микроносителей в сухом виде, от приблизительно 1,25 м2/г микроносителей в сухом виде до приблизительно 1,5 м2/г микроносителей в сухом виде, от приблизительно 1,5 м2/г микроносителей в сухом виде до приблизительно 2,0 м2/г микроносителей в сухом виде или приблизительно 1,1 м2/г микроносителей в сухом виде). В некоторых примерах микроносители характеризуются средним объемом от приблизительно 10 мл/г микроносителей в сухом виде до приблизительно 70 мл/г микроносителей в сухом виде (например, от приблизительно 10 мл/г микроносителей в сухом виде до приблизительно 20 мл/г микроносителей в сухом виде, от приблизительно 20 мл/г микроносителей в сухом виде до приблизительно 30 мл/г микроносителей в сухом виде, от приблизительно 30 мл/г микроносителей в сухом виде до приблизительно 40 мл/г микроносителей в сухом виде, от приблизительно 40 мл/г микроносителей в сухом виде до приблизительно 50 мл/г микроносителей в сухом виде, от приблизительно 50 мл/г микроносителей в сухом виде до приблизительно 60 мл/г микроносителей в сухом виде, от приблизительно 60 мл/г микроносителей в сухом виде до приблизительно 70 мл/г микроносителей в сухом виде, от приблизительно 10 мл/г микроносителей в сухом виде до приблизительно 40 мл/г микроносителей в сухом виде, от приблизительно 30 мл/г микроносителей в сухом виде до приблизительно 40 мл/г микроносителей в сухом виде, от приблизительно 40 мл/г микроносителей в сухом виде до приблизительно 70 мл/г микроносителей в сухом виде или приблизительно 40 мл/г микроносителей в сухом виде). В некоторых вариантах осуществления средняя относительная плотность микроносителей составляет от приблизительно 0,8 г/мл до приблизительно 1,2 г/мл (например, от приблизительно 0,8 г/мл до приблизительно 0,9 г/мл, от приблизительно 0,9 г/мл до приблизительно 1,0 г/мл, от приблизительно 1,0 г/мл до приблизительно 1,1 г/мл, приблизительно 1,0 г/мл, от приблизительно 1,1 г/мл до приблизительно 1,2 г/мл, от приблизительно 0,95 г/мл до приблизительно 1,05 г/мл или приблизительно 1,03 г/мл).
В некоторых вариантах осуществления микроносители имеют почти приближенную к сферической форму или эллипсоидную форму. В других примерах микроносители имеют шлифованную или шероховатую поверхность с небольшими выпуклостями, которые увеличивают общую площадь внешней поверхности микроносителя. В некоторых вариантах осуществления микроносители имеют сетчатую структуру. В некоторых примерах микроносители являются гигроскопичными. В некоторых примерах микроносители содержат целлюлозу.
В некоторых вариантах осуществления микроносители имеют внешнюю поверхность и/или поры микроносителей имеют поверхность, которые заряжены положительно (например, заряжены положительно вследствие присутствия N,N,-диэтиламиноэтиловых групп). В некоторых примерах микроносители имеют сетку или сетевидную или паутиноподобную структуру. Микроносители могут характеризоваться средней плотностью заряда от приблизительно 0,5 мэкв/г до приблизительно 2,5 мэкв/г (например, от приблизительно 0,5 мэкв/г до приблизительно 1,5 мэк/г, от приблизительно 0,75 мэк/г до приблизительно 1,25 мэк/г, приблизительно 1,1 мэкв/г, от приблизительно 1,5 мэкв/г до приблизительно 2,5 мэкв/г, от приблизительно 1,5 мэкв/г до приблизительно 2,0 мэкв/г, приблизительно 1,8 мэкв/г, от приблизительно 0,5 мэкв/г до приблизительно 1,0 мэкв/г или от приблизительно 1,0 мэкв/г до приблизительно 1,5 мэкв/г).
В некоторых случаях микроноситель может содержать природный полимер и/или синтетический полимер. Неограничивающие примеры синтетических полимеров включают полиэтиленгликоль (PEG), полиэтиленоксид, полиэтиленимин, диэтиленгиколь, триэтиленгликоль, полиалкиленгликоль, полиалкиленоксид, поливиниловый спирт, полифосфат натрия, поливинилпирролидон, простой поливинилметилэфир, полиметилоксазолин, полиэтилоксазолин, полигидроксипропилоксазолин, полигидроксипропилметакриламид, полиметакриламид, полидиметилакриламид, полигидроксипропилметакрилат, полигидроксиэтилакрилат, гидроксиметилцеллюлозу, гидроксиэтилцеллюлозу, полиглицерин, полиаспартамид, сополимер полиоксиэтилена и полиоксипропилена (полоксамер), карбоновые кислоты (например, акриловую кислоту, метакриловую кислоту, итаконовую кислоту и малеиновую кислоту), полиоксиэтилены, полиэтиленоксид, ненасыщенные моно/дикарбоновые кислоты с этиленовыми связями, полимолочную кислоту (PLA), полипропиленоксид, сополимер лактида и гликолида (PLGA), поли(эпсилонкапролактон), поли(этилэтилен), полибутадиен, полигликолид, полиметилакрилат, простой поливинилбутилэфир, полистирол, полициклопентадиенилметилнорборнен, полиэтиленпропилен, полиэтилэтилен, полиизобутилен, полисилоксан, метилакрилат, этилакрилат, пропилакрилат, н-бутилакрилат, изобутилакрилат, 2-этилакрилат, трет-бутилакрилат, метакрилаты (например, этилметакрилат, н-бутилметакрилат и изобутилметакрилат), акрилонитрилы, метакрилонитрил, винилы (например, винилацетат, винилверсатат, винилпропионат, винилформамид, винилацетамид, винилпиридины и винилимидазол), аминоалкилы (например, аминоалкилакрилаты, аминоалкилметакрилаты и аминоалкил(мет)акриламиды), стиролы, полиалкиленгликоль, полиалкиленоксид и разновидности молочной кислоты. Неограничивающие примеры природных полимеров включают целлюлозу, лецитин и гиалуроновую кислоту. Микроноситель может содержать смесь разных полимеров (например, любую комбинацию из одного или нескольких полимеров, описанных в данном документе или известных из уровня техники) в равных или разных соотношениях. Любые из описанных в данном документе микроносителей могут содержать сердцевину, содержащую один или несколько полимеров (например, любых из описанных в данном документе или известных из уровня техники полимеров), и внешний слой, который содержит один или несколько других полимеров (например, любых из описанных в данном документе или известных из уровня техники полимеров).
Неограничивающие примеры микроносителей, которые можно применять в любом из описанных в данном документе способов, включают CytoPoreTM 1 и CytoPoreTM 2 (доступные от GE Healthcare, Life Sciences, Пискатауэй, Нью-Джерси). Дополнительные примеры микроносителей, которые можно применять в любом из описанных в данном документе способов, являются общедоступными и известными из уровня техники.
Многолуночные планшеты
Из уровня техники известно множество многолуночных планшетов, которые можно применять в любых способах, описанных в данном документе. Например, многолуночный планшет может представлять собой 2-луночный планшет, 4-луночный планшет, 6-луночный планшет, 8-луночный планшет, 9-луночный планшет, 10-луночный планшет, 12-луночный планшет, 15-луночный планшет, 18-луночный планшет, 20-луночный планшет, 24-луночный планшет, 36-луночный планшет, 48-луночный планшет, 60-луночный планшет, 72-луночный планшет или 96-луночный планшет. В некоторых примерах лунка имеет объем (внутренний объем) от приблизительно 0,3 мл до приблизительно 25 мл (например, от приблизительно 0,3 мл до приблизительно 24 мл, от приблизительно 0,3 мл до приблизительно 22 мл, от приблизительно 0,3 мл до приблизительно 20 мл, от приблизительно 0,3 мл до приблизительно 18 мл, от приблизительно 0,3 мл до приблизительно 16 мл, от приблизительно 0,3 мл до приблизительно 14 мл, от приблизительно 0,3 мл до приблизительно 12 мл, от приблизительно 0,3 мл до приблизительно 10 мл, от приблизительно 0,3 мл до приблизительно 8 мл, от приблизительно 0,3 мл до приблизительно 6 мл, от приблизительно 0,3 мл до приблизительно 5 мл, от приблизительно 0,3 мл до приблизительно 4 мл, от приблизительно 0,3 мл до приблизительно 3 мл, от приблизительно 0,3 мл до приблизительно 2 мл, от приблизительно 0,3 мл до приблизительно 1 мл, от приблизительно 0,5 мл до приблизительно 25 мл, от приблизительно 0,5 мл до приблизительно 24 мл, от приблизительно 0,5 мл до приблизительно 22 мл, от приблизительно 0,5 мл до приблизительно 0,5 мл до приблизительно 20 мл, от приблизительно 0,5 мл до приблизительно 18 мл, от приблизительно 0,5 мл до приблизительно 16 мл, от приблизительно 0,5 мл до приблизительно 14 мл, от приблизительно 0,5 мл до приблизительно 12 мл, от приблизительно 0,5 мл до приблизительно 10 мл, от приблизительно 0,5 мл до приблизительно 8 мл, от приблизительно 0,5 мл до приблизительно 6 мл, от приблизительно 0,5 мл до приблизительно 5 мл, от приблизительно 0,5 мл до приблизительно 4 мл, от приблизительно 0,5 мл до приблизительно 3 мл, от приблизительно 0,5 мл до приблизительно 2 мл, от приблизительно 0,5 мл до приблизительно 1 мл, от приблизительно 1 мл до приблизительно 25 мл, от приблизительно 1 мл до приблизительно 24 мл, от приблизительно 1 мл до приблизительно 22 мл, от приблизительно 1 мл до приблизительно 20 мл, от приблизительно 1 мл до приблизительно 18 мл, от приблизительно 1 мл до приблизительно 16 мл, от приблизительно 1 мл до приблизительно 14 мл, от приблизительно 1 мл до приблизительно 12 мл, от приблизительно 1 мл до приблизительно 10 мл, от приблизительно 1 мл до приблизительно 8 мл, от приблизительно 1 мл до приблизительно 7 мл, от приблизительно 1 мл до приблизительно 6 мл, от приблизительно 1 мл до приблизительно 5 мл, от приблизительно 1 мл до приблизительно 4 мл, от приблизительно 1 мл до приблизительно 3,5 мл, от приблизительно 1 мл до приблизительно 3 мл, от приблизительно 1 мл до приблизительно 2,5 мл, от приблизительно 1 мл до приблизительно 2 мл, от приблизительно 1 мл до приблизительно 1,5 мл, от приблизительно 1,5 мл до приблизительно 25 мл, от приблизительно 1,5 мл до приблизительно 24 мл, от приблизительно 1,5 мл до приблизительно 22 мл, от приблизительно 1,5 мл до приблизительно 20 мл, от приблизительно 1,5 мл до приблизительно 18 мл, от приблизительно 1,5 мл до приблизительно 16 мл, от приблизительно 1,5 мл до приблизительно 14 мл, от приблизительно 1,5 мл до приблизительно 12 мл, от приблизительно 1,5 мл до приблизительно 10 мл, от приблизительно 1,5 мл до приблизительно 8 мл, от приблизительно 1,5 мл до приблизительно 6 мл, от приблизительно 1,5 мл до приблизительно 5 мл, от приблизительно 1,5 мл до приблизительно 4 мл, от приблизительно 1,5 мл до приблизительно 3,5 мл, от приблизительно 1,5 мл до приблизительно 3 мл, от приблизительно 1,5 мл до приблизительно 2,5 мл, от приблизительно 1,5 мл до приблизительно 2,0 мл, от приблизительно 2 мл до приблизительно 25 мл, от приблизительно 2 мл до приблизительно 24 мл, от приблизительно 2 мл до приблизительно 22 мл, от приблизительно 2 мл до приблизительно 20 мл, от приблизительно 2 мл до приблизительно 18 мл, от приблизительно 2 мл до приблизительно 16 мл, от приблизительно 2 мл до приблизительно 14 мл, от приблизительно 2 мл до приблизительно 12 мл, от приблизительно 2 мл до приблизительно 10 мл, от приблизительно 2 мл до приблизительно 8 мл, от приблизительно 2 мл до приблизительно 6 мл или от приблизительно 2 мл до приблизительно 5 мл)
В некоторых примерах многолуночный планшет представляет собой планшет с глубокими лунками. Например, внутренняя высота лунки в планшете с глубокими лунками может составлять от 1 см до приблизительно 12 см (например, от приблизительно 1 см до приблизительно 11 см, от приблизительно 1 см до приблизительно 10 см, от приблизительно 1 см до приблизительно 9 см, от приблизительно 1 см до приблизительно 8 см, от приблизительно 1 см до приблизительно 7 см, от приблизительно 1 см до приблизительно 6 см, от приблизительно 1 см до приблизительно 5 см, от приблизительно 1 см до приблизительно 4 см, от приблизительно 1 см до приблизительно 3 см, от приблизительно 1,2 см до приблизительно 12 см, от приблизительно 1,2 см до приблизительно 11 см, от приблизительно 1,2 см до приблизительно 10 см, от приблизительно 1,2 см до приблизительно 9 см, от приблизительно 1,2 см до приблизительно 8 см, от приблизительно 1,2 см до приблизительно 7 см, от приблизительно 1,2 см до приблизительно 6 см, от приблизительно 1,2 см до приблизительно 5 см, от приблизительно 1,2 см до приблизительно 4 см, от приблизительно 1,2 см до приблизительно 3 см, от приблизительно 1,5 см до приблизительно 11 см, от приблизительно 1,5 см до приблизительно 10 см, от приблизительно 1,5 см до приблизительно 9 см, от приблизительно 1,5 см до приблизительно 8 см, от приблизительно 1,5 см до приблизительно 7 см, от приблизительно 1,5 см до приблизительно 6 см, от приблизительно 1,5 см до приблизительно 5 см, от приблизительно 1,5 см до приблизительно 4 см, от приблизительно 1,5 см до приблизительно 3 см, от приблизительно 2 см до приблизительно 12 см, от приблизительно 2 см до приблизительно 11 см, от приблизительно 2 см до приблизительно 10 см, от приблизительно 2 см до приблизительно 9 см, от приблизительно 2 см до приблизительно 8 см, от приблизительно 2 см до приблизительно 7 см, от приблизительно 2 см до приблизительно 6 см, от приблизительно 2 см до приблизительно 5 см, от приблизительно 2 см до приблизительно 4 см, от приблизительно 2 см до приблизительно 3 см, от приблизительно 2,5 см до приблизительно 12 см, от приблизительно 2,5 см до приблизительно 11 см, от приблизительно 2,5 см до приблизительно 10 см, от приблизительно 2,5 см до приблизительно 9 см, от приблизительно 2,5 см до приблизительно 8 см, от приблизительно 2,5 см до приблизительно 7 см, от приблизительно 2,5 см до приблизительно 6 см, от приблизительно 2,5 см до приблизительно 5 см, от приблизительно 2,5 см до приблизительно 4 см, от приблизительно 3 см до приблизительно 12 см, от приблизительно 3 см до приблизительно 11 см, от приблизительно 3 см до приблизительно 10 см, от приблизительно 3 см до приблизительно 9 см, от приблизительно 3 см до приблизительно 8 см, от приблизительно 3 см до приблизительно 7 см, от приблизительно 3 см до приблизительно 6 см, от приблизительно 3 см до приблизительно 5 см, от приблизительно 4 см до приблизительно 12 см, от приблизительно 4 см до приблизительно 11 см, от приблизительно 4 см до приблизительно 10 см, от приблизительно 4 см до приблизительно 9 см, от приблизительно 4 см до приблизительно 8 см, от приблизительно 4 см до приблизительно 7 см, от приблизительно 4 см до приблизительно 6 см, от приблизительно 5 см до приблизительно 12 см, от приблизительно 5 см до приблизительно 11 см, от приблизительно 5 см до приблизительно 10 см, от приблизительно 5 см до приблизительно 9 см, от приблизительно 5 см до приблизительно 8 см или от приблизительно 5 см до приблизительно 7 см).
В некоторых примерах лунка (например, в многолуночном планшете с глубокими лунками) может иметь плоское дно (называемое также квадратным дном), круглое дно (называемое также полукруглым дном), коническое дно или пирамидальное дно. В некоторых вариантах осуществления диаметр любой из лунок, описанных в данном документе, может составлять от приблизительно 4,0 мм до приблизительно 50 мм (например, от приблизительно 4,0 мм до приблизительно 45 мм, от приблизительно 4,0 мм до приблизительно 40 мм, от приблизительно 4,0 мм до приблизительно 35 мм, от приблизительно 4,0 мм до приблизительно 30 мм, от приблизительно 4,0 мм до приблизительно 25 мм, от приблизительно 4,0 мм до приблизительно 20 мм, от приблизительно 4,0 мм до приблизительно 15 мм, от приблизительно 4,0 мм до приблизительно 10 мм, от приблизительно 6,0 мм до приблизительно 50 мм, от приблизительно 6,0 мм до приблизительно 45 мм, от приблизительно 6,0 мм до приблизительно 40 мм, от приблизительно 6,0 мм до приблизительно 35 мм, от приблизительно 6,0 мм до приблизительно 30 мм, от приблизительно 6,0 мм до приблизительно 25 мм, от приблизительно 6,0 мм до приблизительно 25 мм, от приблизительно 6,0 мм до приблизительно 20 мм, от приблизительно 6,0 мм до приблизительно 15 мм, от приблизительно 6,0 мм до приблизительно 10 мм, от приблизительно 8 мм до приблизительно 50 мм, от приблизительно 8 мм до приблизительно 45 мм, от приблизительно 8 мм до приблизительно 40 мм, от приблизительно 8 мм до приблизительно 35 мм, от приблизительно 8 мм до приблизительно 30 мм, от приблизительно 8 мм до приблизительно 25 мм, от приблизительно 8 мм до приблизительно 20 мм, от приблизительно 8 мм до приблизительно 15 мм, от приблизительно 10 мм до приблизительно 50 мм, от приблизительно 10 мм до приблизительно 45 мм, от приблизительно 10 мм до приблизительно 40 мм, от приблизительно 10 мм до приблизительно 35 мм, от приблизительно 10 мм до приблизительно 30 мм, от приблизительно 10 мм до приблизительно 25 мм, от приблизительно 10 мм до приблизительно 20 мм, от приблизительно 15 мм до приблизительно 50 мм, от приблизительно 15 мм до приблизительно 45 мм, от приблизительно 15 мм до приблизительно 40 мм, от приблизительно 15 мм до приблизительно 35 мм, от приблизительно 15 мм до приблизительно 30 мм, от приблизительно 15 мм до приблизительно 25 мм или от приблизительно 15 мм до приблизительно 20 мм).
В некоторых примерах многолуночный планшет закрывают плотно (например, закрывают плотно одноразовой газопроницаемой мембраной или газопроницаемым слоем силикона). Неограничивающие примеры материалов, применяемых для закрывания плотно многолуночного планшета, описаны в разделе Примеры. Дополнительные материалы, применяемые для закрывания плотно многолуночного планшета, хорошо известны их уровня техники.
Внутренняя поверхность лунки(лунок) может иметь по меньшей мере одно покрытие (например, по меньшей мере одно покрытие на основе желатина, коллагена, поли-L-орнитина, полистирола и ламинина). Дополнительные примеры многолуночных планшетов (например, с различными формами и размерами лунки(лунок)) и покрытиями внутренней поверхности лунки(лунок) известны из уровня техники и их можно применять в способах по настоящему изобретению.
Перемешивание
Для описанных в данном документе способов требуется перемешивание вращением культуры, содержащей клетку млекопитающего и первую и/или вторую жидкую культуральную среду. Перемешивание вращением можно осуществлять c частотой от приблизительно 300 об/мин до приблизительно 600 об/мин (например, от приблизительно 300 об/мин до приблизительно 580 об/мин, от приблизительно 300 об/мин до приблизительно 560 об/мин, от приблизительно 300 об/мин до приблизительно 540 об/мин, от приблизительно 300 об/мин до приблизительно 520 об/мин, от приблизительно 300 об/мин до приблизительно 500 об/мин, от приблизительно 300 об/мин до приблизительно 480 об/мин, от приблизительно 300 об/мин до приблизительно 460 об/мин, от приблизительно 300 об/мин до приблизительно 440 об/мин, от приблизительно 300 об/мин до приблизительно 420 об/мин, от приблизительно 300 об/мин до приблизительно 400 об/мин, от приблизительно 300 об/мин до приблизительно 380 об/мин, от приблизительно 300 об/мин до приблизительно 360 об/мин, от приблизительно 320 об/мин до приблизительно 600 об/мин, от приблизительно 320 об/мин до приблизительно 580 об/мин, от приблизительно 320 об/мин до приблизительно 560 об/мин, от приблизительно 320 об/мин до приблизительно 540 об/мин, от приблизительно 320 об/мин до приблизительно 520 об/мин, от приблизительно 320 об/мин до приблизительно 500 об/мин, от приблизительно 320 об/мин до приблизительно 480 об/мин, от приблизительно 320 об/мин до приблизительно 460 об/мин, от приблизительно 320 об/мин до приблизительно 440 об/мин, от приблизительно 320 об/мин до приблизительно 420 об/мин, от приблизительно 320 об/мин до приблизительно 400 об/мин, от приблизительно 320 об/мин до приблизительно 380 об/мин, от приблизительно 330 об/мин до приблизительно 600 об/мин, от приблизительно 330 об/мин до приблизительно 580 об/мин, от приблизительно 330 об/мин до приблизительно 560 об/мин, от приблизительно 330 об/мин до приблизительно 540 об/мин, от приблизительно 330 об/мин до приблизительно 520 об/мин, от приблизительно 330 об/мин до приблизительно 500 об/мин, от приблизительно 330 об/мин до приблизительно 480 об/мин, от приблизительно 330 об/мин до приблизительно 460 об/мин, от приблизительно 330 об/мин до приблизительно 440 об/мин, от приблизительно 330 об/мин до приблизительно 420 об/мин, от приблизительно 330 об/мин до приблизительно 400 об/мин, от приблизительно 330 об/мин до приблизительно 380 об/мин, от приблизительно 340 об/мин до приблизительно 600 об/мин, от приблизительно 340 об/мин до приблизительно 580 об/мин, от приблизительно 340 об/мин до приблизительно 560 об/мин, от приблизительно 340 об/мин до приблизительно 540 об/мин, от приблизительно 340 об/мин до приблизительно 520 об/мин, от приблизительно 340 об/мин до приблизительно 500 об/мин, от приблизительно 340 об/мин до приблизительно 480 об/мин, от приблизительно 340 об/мин до приблизительно 460 об/мин, от приблизительно 340 об/мин до приблизительно 440 об/мин, от приблизительно 340 об/мин до приблизительно 420 об/мин, от приблизительно 340 об/мин до приблизительно 400 об/мин, от приблизительно 360 об/мин до приблизительно 600 об/мин, от приблизительно 360 об/мин до приблизительно 580 об/мин, от приблизительно 360 об/мин до приблизительно 560 об/мин, от приблизительно 360 об/мин до приблизительно 540 об/мин, от приблизительно 360 об/мин до приблизительно 520 об/мин, от приблизительно 360 об/мин до приблизительно 500 об/мин, от приблизительно 360 об/мин до приблизительно 480 об/мин, от приблизительно 360 об/мин до приблизительно 460 об/мин, от приблизительно 360 об/мин до приблизительно 440 об/мин, от приблизительно 360 об/мин до приблизительно 420 об/мин, от приблизительно 380 об/мин до приблизительно 600 об/мин, от приблизительно 380 об/мин до приблизительно 580 об/мин, от приблизительно 380 об/мин до приблизительно 560 об/мин, от приблизительно 380 об/мин до приблизительно 540 об/мин, от приблизительно 380 об/мин до приблизительно 520 об/мин, от приблизительно 380 об/мин до приблизительно 500 об/мин, от приблизительно 380 об/мин до приблизительно 480 об/мин, от приблизительно 380 об/мин до приблизительно 460 об/мин, от приблизительно 380 об/мин до приблизительно 440 об/мин, от приблизительно 400 об/мин до приблизительно 600 об/мин, от приблизительно 400 об/мин до приблизительно 580 об/мин, от приблизительно 400 об/мин до приблизительно 560 об/мин, от приблизительно 400 об/мин до приблизительно 540 об/мин, от приблизительно 400 об/мин до приблизительно 520 об/мин, от приблизительно 400 об/мин до приблизительно 500 об/мин, от приблизительно 400 об/мин до приблизительно 480 об/мин или от приблизительно 400 об/мин до приблизительно 460 об/мин) (например, в инкубаторе, таком как шейкер-инкубатор с диаметром (траекторией) смещения от приблизительно 3 мм до приблизительно 50 мм).
Как будет понятно из уровня техники, степень перемешивания (например, скорость в об/мин) можно варьировать в зависимости от размера и формы лунки (например, одно или несколько из диаметра, формы и высоты лунки) и диаметра (траектории) смещения инкубатора, применяемого для осуществления инкубирования. Например, для достижения одинакового уровня силы сдвига текучей среды и концентрации растворенного O2 для меньшего диаметра (траектории) смещения может требоваться более высокий уровень перемешивания (например, более высокая скорость в об/мин), тогда так для большего диаметра (орбиты) смещения может требоваться более низкий уровень перемешивания (например, более низкая скорость в об/мин). В другом примере, для достижения такого же уровня силы сдвига текучей среды и концентрации растворенного O2 для лунки с большим диаметром может требоваться более низкая скорость в об/мин, тогда как для лунки с меньшим диаметром может требоваться более высокая скорость в об/мин.
В некоторых вариантах осуществления инкубирование осуществляют с применением шейкера-инкубатора для пробирок с диаметром (траекторией) смещения от приблизительно 3 мм до приблизительно 50 мм (например, от приблизительно 3 мм и приблизительно 25 мм или от приблизительно 25 мм до приблизительно 50 мм) и перемешивания со скоростью от приблизительно 320 об/мин до приблизительно 500 об/мин (например, от приблизительно 320 об/мин до приблизительно 480 об/мин, от приблизительно 320 об/мин до приблизительно 460 об/мин, от приблизительно 320 об/мин до приблизительно 400 об/мин, от приблизительно 320 об/мин до приблизительно 380 об/мин, от приблизительно 320 об/мин до приблизительно 360 об/мин, от приблизительно 320 об/мин до приблизительно 350 об/мин, от приблизительно 320 об/мин до приблизительно 340 об/мин, от приблизительно 330 об/мин до приблизительно 500 об/мин, от приблизительно 330 об/мин до приблизительно 480 об/мин, от приблизительно 330 об/мин до приблизительно 460 об/мин, от приблизительно 330 об/мин до приблизительно 440 об/мин, от приблизительно 330 об/мин до приблизительно 420 об/мин, от приблизительно 330 об/мин до приблизительно 400 об/мин, от приблизительно 330 об/мин до приблизительно 380 об/мин, от приблизительно 330 об/мин до приблизительно 370 об/мин, от приблизительно 330 об/мин до приблизительно 360 об/мин, от приблизительно 330 об/мин до приблизительно 350 об/мин, от приблизительно 340 об/мин до приблизительно 500 об/мин, от приблизительно 340 об/мин до приблизительно 480 об/мин, от приблизительно 340 об/мин до приблизительно 460 об/мин, от приблизительно 340 об/мин до приблизительно 440 об/мин, от приблизительно 340 об/мин до приблизительно 420 об/мин, от приблизительно 340 об/мин до приблизительно 400 об/мин, от приблизительно 340 об/мин до приблизительно 380 об/мин, от приблизительно 340 об/мин до приблизительно 370 об/мин, от приблизительно 340 об/мин до приблизительно 360 об/мин, от приблизительно 350 об/мин до приблизительно 500 об/мин, от приблизительно 350 об/мин до приблизительно 480 об/мин, от приблизительно 350 об/мин до приблизительно 460 об/мин, от приблизительно 350 об/мин до приблизительно 440 об/мин, от приблизительно 350 об/мин до приблизительно 420 об/мин, от приблизительно 350 об/мин до приблизительно 400 об/мин, от приблизительно 350 об/мин до приблизительно 390 об/мин, от приблизительно 350 об/мин до приблизительно 380 об/мин, от приблизительно 350 об/мин до приблизительно 370 об/мин, от приблизительно 360 об/мин до приблизительно 500 об/мин, от приблизительно 360 об/мин до приблизительно 480 об/мин, от приблизительно 360 об/мин до приблизительно 460 об/мин, от приблизительно 360 об/мин до приблизительно 440 об/мин, от приблизительно 360 об/мин до приблизительно 420 об/мин, от приблизительно 360 об/мин до приблизительно 400 об/мин, от приблизительно 360 об/мин до приблизительно 380 об/мин или от приблизительно 400 об/мин до приблизительно 500 об/мин). Перемешивание вращением можно осуществлять, например, с применением вращательного кругового встряхивания или вращательного элиптического встряхивания. Перемешивание можно осуществлять непрерывно или периодически.
Перемешивание многолуночного планшета вращением может обеспечивать практически такие же силу сдвига текучей среды и концентрацию растворенного кислорода (O2), как таковые их значения, которых достигают в лунке с квадратным дном, имеющей диаметр от приблизительно 6,0 мм до приблизительно 35 мм (например, от приблизительно 6,0 мм до приблизительно 30 мм, от приблизительно 6,0 мм до приблизительно 25 мм, от приблизительно 6,0 мм до приблизительно 20 мм, от приблизительно 6,0 мм до приблизительно 15 мм, от приблизительно 10 мм до приблизительно 35 мм, от приблизительно 10 мм до приблизительно 30 мм, от приблизительно 10 мм до приблизительно 25 мм, от приблизительно 10 мм до приблизительно 20 мм, от приблизительно 15 мм до приблизительно 35 мм, от приблизительно 15 мм до приблизительно 30 мм, от приблизительно 15 мм до приблизительно 25 мм, от приблизительно 20 мм до приблизительно 35 мм, от приблизительно 20 мм до приблизительно 30 мм или от приблизительно 25 мм до приблизительно 35 мм) и высоту от приблизительно 40 мм до приблизительно 50 мм (например, от приблизительно 40 мм до приблизительно 45 мм или от приблизительно 45 мм до приблизительно 50 мм), содержащей жидкую культуральную среду, которая занимает от приблизительно 10% до приблизительно 40% (например, от приблизительно 10% до приблизительно 35%, приблизительно 10% до приблизительно 30%, приблизительно 10% до приблизительно 25%, приблизительно 10% до приблизительно 20%, приблизительно 10% до приблизительно 15%, от приблизительно 15% до приблизительно 40%, приблизительно 15% до приблизительно 35%, приблизительно 15% до приблизительно 30%, приблизительно 15% до приблизительно 25%, приблизительно 15% до приблизительно 20%, приблизительно 20% до приблизительно 40%, приблизительно 20% до приблизительно 35%, приблизительно 20% до приблизительно 30%, приблизительно 20% до приблизительно 25%, приблизительно 25% до приблизительно 40%, приблизительно 25% до приблизительно 35%, приблизительно 25% до приблизительно 30%, приблизительно 30% до приблизительно 40%, приблизительно 30% до приблизительно 35% или от приблизительно 35% до приблизительно 40%) объема лунки, инкубируемой при температуре от приблизительно 31°C до приблизительно 40°C и перемешиваемой с частотой от приблизительно 320 об/мин до приблизительно 450 об/мин (например, от приблизительно 320 об/мин до приблизительно 440 об/мин, от приблизительно 320 об/мин до приблизительно 430 об/мин, от приблизительно 320 об/мин до приблизительно 420 об/мин, от приблизительно 320 об/мин до приблизительно 410 об/мин, от приблизительно 320 об/мин до приблизительно 400 об/мин, от приблизительно 320 об/мин до приблизительно 390 об/мин, от приблизительно 320 об/мин до приблизительно 380 об/мин, от приблизительно 320 об/мин до приблизительно 370 об/мин, от приблизительно 320 об/мин до приблизительно 360 об/мин, от приблизительно 320 об/мин до приблизительно 350 об/мин, от приблизительно 320 об/мин до приблизительно 340 об/мин, от приблизительно 320 об/мин до приблизительно 330 об/мин, от приблизительно 330 об/мин до приблизительно 450 об/мин, от приблизительно 330 об/мин до приблизительно 440 об/мин, от приблизительно 330 об/мин до приблизительно 430 об/мин, от приблизительно 330 об/мин до приблизительно 420 об/мин, от приблизительно 330 об/мин до приблизительно 410 об/мин, от приблизительно 330 об/мин до приблизительно 400 об/мин, от приблизительно 330 об/мин до приблизительно 390 об/мин, от приблизительно 330 об/мин до приблизительно 380 об/мин, от приблизительно 330 об/мин до приблизительно 370 об/мин, от приблизительно 330 об/мин до приблизительно 360 об/мин, от приблизительно 330 об/мин до приблизительно 350 об/мин, от приблизительно 330 об/мин до приблизительно 340 об/мин, от приблизительно 340 об/мин до приблизительно 450 об/мин, от приблизительно 340 об/мин до приблизительно 440 об/мин, от приблизительно 340 об/мин до приблизительно 430 об/мин, от приблизительно 340 об/мин до приблизительно 420 об/мин, от приблизительно 340 об/мин до приблизительно 410 об/мин, от приблизительно 340 об/мин до приблизительно 400 об/мин, от приблизительно 340 об/мин до приблизительно 390 об/мин, от приблизительно 340 об/мин до приблизительно 380 об/мин, от приблизительно 340 об/мин до приблизительно 370 об/мин, от приблизительно 340 об/мин до приблизительно 360 об/мин, от приблизительно 340 об/мин до приблизительно 350 об/мин, от приблизительно 350 об/мин до приблизительно 450 об/мин, от приблизительно 350 об/мин до приблизительно 440 об/мин, от приблизительно 350 об/мин до приблизительно 430 об/мин, от приблизительно 350 об/мин до приблизительно 420 об/мин, от приблизительно 350 об/мин до приблизительно 410 об/мин, от приблизительно 350 об/мин до приблизительно 400 об/мин, от приблизительно 350 об/мин до приблизительно 390 об/мин, от приблизительно 350 об/мин до приблизительно 380 об/мин, от приблизительно 350 об/мин до приблизительно 370 об/мин, от приблизительно 350 об/мин до приблизительно 360 об/мин, от приблизительно 360 об/мин до приблизительно 450 об/мин, от приблизительно 360 об/мин до приблизительно 440 об/мин, от приблизительно 360 об/мин до приблизительно 430 об/мин, от приблизительно 360 об/мин до приблизительно 420 об/мин, от приблизительно 360 об/мин до приблизительно 410 об/мин, от приблизительно 360 об/мин до приблизительно 400 об/мин, от приблизительно 360 об/мин до приблизительно 390 об/мин, от приблизительно 360 об/мин до приблизительно 380 об/мин, от приблизительно 360 об/мин до приблизительно 370 об/мин, от приблизительно 370 об/мин до приблизительно 450 об/мин, от приблизительно 370 об/мин до приблизительно 430 об/мин, от приблизительно 370 об/мин до приблизительно 410 об/мин, от приблизительно 370 об/мин до приблизительно 390 об/мин, от приблизительно 390 об/мин до приблизительно 450 об/мин, от приблизительно 390 об/мин до приблизительно 430 об/мин, от приблизительно 390 об/мин до приблизительно 410 об/мин, от приблизительно 410 об/мин до приблизительно 450 об/мин, от приблизительно 410 об/мин до приблизительно 430 об/мин или приблизительно 430 об/мин до приблизительно 450 об/мин).
Перемешивание вращением можно осуществлять с применением инкубатора с контролируемой влажной атмосферой (например, при влажности более 20%, 30%, 40%, 50%, 60%, 70%, 75%, 80%, 85%, 90% или 95%, или влажности 100%) с помощью механического устройства, которое обеспечивает перемешивание одного или нескольких многолуночных планшетов, содержащих клетку млекопитающего и жидкую культуральную среду (например, первую и/или вторую жидкую культуральную среду).
Температура
Способы культивирования, описанные в данном документе, можно осуществлять при температуре от приблизительно 31°C до приблизительно 40°C. Квалифицированным специалистам будет понятно, что в способе культивирования температуру можно изменять в определенный(определенные) момент(моменты) времени, например, почасово или ежесуточно. Например, температуру можно изменять или смещать (например, повышать или понижать) в пределах приблизительно одного дня, двух дней, трех дней, четырех дней, пяти дней, шести дней, семи дней, восьми дней, девяти дней, десяти дней, одиннадцати дней, двенадцати дней, четырнадцати дней, пятнадцати дней, шестнадцати дней, семнадцати дней, восемнадцати дней, девятнадцати дней или приблизительно двадцати дней или более после исходного посева клетки млекопитающего в лунку). Например, температуру можно смещать в сторону повышения (например, изменять на значение, не превышающее или равное приблизительно 0,1, 0,2, 0,3, 0,4, 0,5, 0,6, 0,7, 0,8, 0,9, 1,0, 1,5, 2,0, 2,5, 3,0, 3,5, 4,0, 4,5, 5,0, 5,5, 6,0, 6,5, 7,0, 7,5, 8,0, 8,5, 9,0, 9,5, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19 или на значение, не превышающее или равное приблизительно 20 градусов C). Например, температуру можно смещать в сторону понижения (например, изменять на значение, не превышающее или равное приблизительно 0,1, 0,2, 0,3, 0,4, 0,5, 0,6, 0,7, 0,8, 0,9, 1,0, 1,5, 2,0, 2,5, 3,0, 3,5, 4,0, 4,5, 5,0, 5,5, 6,0, 6,5, 7,0, 7,5, 8,0, 8,5, 9,0, 9,5, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19 или на значение, не превышающее или равное приблизительно 20°C).
Удаление и замена культуральной среды
Описанные в данном документе способы включают удаление из лунки(лунок) первого объема первой жидкой культуральной среды (например, содержащей клетки млекопитающих в любой концентрации, например, первого объема первой жидкой культуральной среды, которая практически не содержит клеток) и добавление к первой жидкой культуральной среде второго объема второй жидкой культуральной среды. Удаление и добавление можно проводить одновременно или последовательно, или путем их комбинирования. Кроме того, удаление и добавление можно осуществлять непрерывно (например, в режиме, при котором удаляется или заменяется объем, составляющий от 0,1% до 700% (например, от 1% до 600%, от 1% до 500%, от 1% до 400%, от 1% до 350%, от 1% до 300%, от 1% до 250%, от 1% до 100%, от 100% до 200%, от 5% до 150%, от 10% до 50%, от 15% до 40%, от 8% до 80% или от 4% до 30%) от объема лунки или объема первой жидкой культуральной среды за любой указанный период времени (например, в течение 24-часового периода, в течение дискретного периода времени от приблизительно 1 часа до приблизительно 24 часов, или в течение дискретного периода времени, составляющего более 24 часов)) или периодически (например, один раз каждый третий день, один раз во все последующие дни, один раз в день, два раза в день, три раза в день, четыре раза в день или пять раз в день), или в любой их комбинации. При периодическом осуществлении объем, который удаляют или заменяют (например, в течение приблизительно 24-часового периода, в течение дискретного периода времени от приблизительно 1 часа до приблизительно 24 часов, или в течение дискретного периода времени, составляющего более 24 часов) может составлять, например, от 0,1% до 700% (например, от 1% до 700%, от 1% до 600%, от 1% до 500%, от 1% до 400%, от 1% до 300%, от 1% до 200%, от 1% до 100%, от 100% до 200%, от 5% до 150%, от 10% до 50%, от 15% до 40%, от 8% до 80% или от 4% до 30%) объема лунки или объема первой жидкой культуральной среды. Удаление первого объема первой жидкой культуральной среды и добавление второго объема второй жидкой культуральной среды можно в некоторых случаях проводить примерно аналогично в течение каждого 24-часового периода (или, в качестве альтернативы, дискретного периода времени, составляющего от приблизительно 1 часа до приблизительно 24 часов, или дискретного периода времени, составляющего более 24 часов), в течение всего периода культивирования или его части. Как известно из уровня техники, скорость, с которой удаляют первый объем первой жидкой культуральной среды (объем/единица времени), и скорость, с которой добавляют второй объем второй жидкой культуральной среды (объем/единица времени), можно варьировать. Скорость удаления первого объема первой жидкой культуральной среды (объем/единица времени) и скорость добавления второго объема второй жидкой культуральной среды (объем/единица времени) могут быть приблизительно аналогичными или могут быть разными.
В качестве альтернативы, удаляемый и добавляемый объемы можно изменять (например, постепенно повышать) в течение каждого 24-часового периода (или, в качестве альтернативы, дискретного периода времени, составляющего от приблизительно 1 часа до приблизительно 24 часов, или дискретного периода времени, превышающего 24 часа) в ходе периода культивирования. Неограничивающие примеры способов, которые включают постепенное повышение объемов, описаны в данном документе. Например, объем первой удаляемой жидкой культуральной среды и объем второй добавляемой жидкой культуральной среды в течение каждого 24-часового периода (или, в качестве альтернативы, дискретного периода времени, составляющего от приблизительно 1 часа до приблизительно 24 часов, или дискретного периода времени, составляющего более 24 часов) в течение периода культивирования можно повышать (например, постепенно или путем ступенчатых приращений) в течение периода культивирования от некоторого объема, который составляет от приблизительно 0,5% до приблизительно 30% объема лунки или объема первой жидкой культуральной среды, от приблизительно 30% до приблизительно 200% объема лунки или объема первой жидкой культуральной среды.
В некоторых вариантах осуществления любого из способов, описанных в данном документе, многолуночный планшет инкубируют в течение периода времени более 7 дней, при этом в 1-3 день инкубации, в каждый 24-часовой период, первый объем удаляемой первой жидкой культуральной среды и второй объем добавляемой второй жидкой культуральной среды составляют от приблизительно 30% до приблизительно 50% объема первой жидкой культуральной среды; в 4-6 день инкубации первый объем удаляемой первой жидкой культуральной среды и второй объем добавляемой второй жидкой культуральной среды составляют от приблизительно 30% до приблизительно 50% объема первой жидкой культуральной среды; и в 7 день и при дальнейшей инкубации, в каждый 24-часовой период, первый объем удаляемой первой жидкой культуральной среды и второй объем добавляемой второй жидкой культуральной среды составляют от приблизительно 90% до приблизительно 150% объема первой жидкой культуральной среды.
В других примерах, после первых 24-48 часов периода времени, в каждый 24-часовой период, первый объем удаляемой первой жидкой культуральной среды и второй объем добавляемой второй жидкой культуральной среды составляют от приблизительно 30% до приблизительно 300% (например, от приблизительно 30% до приблизительно 280%, от приблизительно 30% до приблизительно 260%, от приблизительно 30% до приблизительно 240%, от приблизительно 30% до приблизительно 220%, от приблизительно 30% до приблизительно 200%, от приблизительно 30% до приблизительно 180%, от приблизительно 30% до приблизительно 160%, от приблизительно 30% до приблизительно 150%, от приблизительно 30% до приблизительно 140%, от приблизительно 30% до приблизительно 120%, от приблизительно 30% до приблизительно 100%, от приблизительно 30% до приблизительно 80%, от приблизительно 30% до приблизительно 60%, от приблизительно 30% до приблизительно 50%, от приблизительно 40% до приблизительно 300%, от приблизительно 40% до приблизительно 280%, от приблизительно 40% до приблизительно 260%, от приблизительно 40% до приблизительно 240%, от приблизительно 40% до приблизительно 220%, от приблизительно 40% до приблизительно 200%, от приблизительно 40% до приблизительно 180%, от приблизительно 40% до приблизительно 160%, от приблизительно 40% до приблизительно 140%, от приблизительно 40% до приблизительно 120%, от приблизительно 40% до приблизительно 100%, от приблизительно 40% до приблизительно 80%, от приблизительно 40% до приблизительно 60%, от приблизительно 50% до приблизительно 300%, от приблизительно 50% до приблизительно 280%, от приблизительно 50% до приблизительно 260%, от приблизительно 50% до приблизительно 240%, от приблизительно 50% до приблизительно 220%, от приблизительно 50% до приблизительно 200%, от приблизительно 50% до приблизительно 180%, от приблизительно 50% до приблизительно 160%, от приблизительно 50% до приблизительно 140%, от приблизительно 50% до приблизительно 120%, от приблизительно 50% до приблизительно 100% или от приблизительно 50% до приблизительно 80% объема первой жидкой культуральной среды.
Квалифицированным специалистам будет понятно, что первая жидкая культуральная среда и вторая жидкая культуральная среда могут представлять собой один и тот же тип среды. В иных случаях, первая жидкая культуральная среда и вторая жидкая культуральная среда могут отличаться.
Первый объем первой жидкой культуральной среды можно удалять, например, путем центрифугирования многолуночного планшета (например, центрифугирования на низкоскоростной центрифуге с бакет-ротором), и удаления из супернатанта первого объема первой жидкой культуральной среды, которая практически не содержит клеток. В качестве альтернативы, или в дополнение, первый объем первой жидкой культуральной среды можно удалять с помощью фильтрования или пропускания самотеком первого объема первой жидкой культуральной среды через стерильную мембрану с отсечением по молекулярной массе, которое исключает клетку млекопитающего. В качестве альтернативы, или в дополнение, первую жидкую культуральную среду можно удалять, приостанавливая перемешивание на период времени по меньшей мере 30 секунд (например, по меньшей мере одну минуту, по меньшей мере две минуты, по меньшей мере три минуты, по меньшей мере четыре минуты или по меньшей мере пять минут) до удаления первого объема первой жидкой культуральной среды. Первый объем первой жидкой культуральной среды можно удалять вручную (например, с помощью аспирации или отбора пипеткой первого объема первой жидкой культуральной среды из лунки) или в автоматическом режиме (например, с применением автоматизированного устройства или любой из систем в виде многолуночных планшетов для культур клеток, описанных в данном документе).
Второй объем второй жидкой культуральной среды можно добавлять к первой жидкой культуральной среде, например, с помощью перфузионного насоса. Вторую жидкую культуральную среду можно добавлять к первой жидкой культуральной среде вручную (например, путем добавления пипеткой второго объема второй жидкой культуральной среды непосредственно в первую жидкую культуральную среду) или в автоматическом режиме (например, с применением автоматизированного устройства или любой из систем в виде многолуночных планшетов для культур клеток, описанных в данном документе).
В некоторых примерах первый объем первой жидкой культуральной среды можно удалять, а второй объем второй жидкой культуральной среды можно добавлять к первой жидкой культуральной среде с применением любой из систем в виде многолуночных планшетов для культур клеток, предусмотренных в данном документе.
В некоторых случаях удаление первого объема первой жидкой культуральной среды (например, первого объема первой жидкой культуральной среды, которая практически не содержит клеток млекопитающих) и добавление к первой жидкой культуральной среде второго объема второй жидкой культуральной среды не осуществляют в пределах по меньшей мере 1 часа (например, в пределах 2 часов, в пределах 3 часов, в пределах 4 часов, в пределах 5 часов, в пределах 6 часов, в пределах 7 часов, в пределах 8 часов, в пределах 9 часов, в пределах 10 часов, в пределах 12 часов, в пределах 14 часов, в пределах 16 часов, в пределах 18 часов, в пределах 24 часов, в пределах 36 часов, в пределах 48 часов, в пределах 72 часов, в пределах 96 часов или 96 часов спустя) после посева клетки млекопитающего в лунку(лунки).
Некоторые варианты осуществления дополнительно включают периодическое добавление дополнительного объема второй жидкой культуральной среды в каждую из множества лунок с целью компенсации какого-либо уменьшения объема первой жидкой культуральной среды вследствие испарения. Например, такой дополнительный объем второй жидкой культуральной среды можно добавлять в каждую лунку, например, по меньшей мере один раз каждые 24 часа, по меньшей мере один раз каждые 48 часов, по меньшей мере один раз каждые 72 часа или по меньшей мере один раз каждые 96 часов. Этот дополнительный объем второй жидкой культуральной среды можно добавлять вручную или в автоматическом режиме (например, с применением автоматизированного устройства или с применением любой из систем в виде многолуночных планшетов для культур клеток, описанных в данном документе).
CO2
Способы, описанные в данном документе, могут дополнительно включать инкубирование многолуночного планшета в атмосфере, содержащей не более чем или приблизительно 15% CO2 (например, не более чем или приблизительно 14% CO2, 12% CO2, 10% CO2, 8% CO2, 6% CO2, 5% CO2, 4% CO2, 3% CO2, 2% CO2 или не более чем или приблизительно 1% CO2). Более того, любой из способов, описанных в данном документе, может включать инкубирование многолуночного планшета в увлажненной атмосфере (например, при влажности по меньшей мере или приблизительно 20%, 30%, 40%, 50%, 60%, 70%, 85%, 80%, 85%, 90% или по меньшей мере или приблизительно 95%, или приблизительно 100%).
Иллюстративные устройства
Неограничивающие примеры устройств, которые можно применять для осуществления способов культивирования, описанных в данном документе, включают: шейкер-инкубатор Multiron от INFORS (INFORS; Базель, Швейцария), поставляемый Appropriate Technical Resources (Мэриленд, США), и шейкер-инкубатор от Kuhner (Kuhner AG; Базель, Швейцария). Неограничивающие примеры устройств, которые можно применять для осуществления способов культивирования, включают ротационный шейкер-инкубатор с диаметром (орбитой) смещения от приблизительно 3 мм до приблизительно 50 мм (например, от приблизительно 1 мм до приблизительно 25 мм или от приблизительно 25 мм до приблизительно 50 мм). Дополнительные примеры шейкер-инкубаторов и инкубаторов для культивирования в роллерах известны из уровня техники.
Растворенный O2 и сила сдвига жидкости
Также предусматриваются способы культивирования, которые включают культивирование в процессе градиентной перфузии клетки млекопитающего, суспендированной в жидкой культуральной среде, помещенной в лунку многолуночного планшета в условиях, обеспечивающих в среде силу сдвига текучей среды и концентрацию растворенного кислорода (O2) таких же (или практически таких же), как значения, достигаемые в среде, занимающей от приблизительно 10% до приблизительно 40% (например, от приблизительно 10% до приблизительно 35%, от приблизительно 10% до приблизительно 30%, от приблизительно 10% до приблизительно 25%, от приблизительно 10% до приблизительно 20%, от приблизительно 10% до приблизительно 15%, от приблизительно 15% до приблизительно 40%, от приблизительно 15% до приблизительно 35%, от приблизительно 15% до приблизительно 30%, от приблизительно 15% до приблизительно 25%, от приблизительно 15% до приблизительно 20%, от приблизительно 20% до приблизительно 40%, от приблизительно 20% до приблизительно 35%, от приблизительно 20% до приблизительно 30%, от приблизительно 20% до приблизительно 25%, от приблизительно 25% до приблизительно 40%, от приблизительно 25% до приблизительно 35%, от приблизительно 25% до приблизительно 30%, от приблизительно 30% до приблизительно 40%, от приблизительно 30% до приблизительно 35% или от приблизительно 35% до приблизительно 40%) объема лунки с квадратным дном, имеющей диаметр от приблизительно 6,0 мм до приблизительно 35 мм (например, от приблизительно 6,0 мм до приблизительно 30 мм, от приблизительно 6,0 мм до приблизительно 25 мм, от приблизительно 6,0 мм до приблизительно 20 мм, от приблизительно 6,0 мм до приблизительно 15 мм, от приблизительно 10 мм до приблизительно 35 мм, от приблизительно 10 мм до приблизительно 30 мм, от приблизительно 10 мм до приблизительно 25 мм, от приблизительно 10 мм до приблизительно 20 мм, от приблизительно 15 мм до приблизительно 35 мм, от приблизительно 15 мм до приблизительно 30 мм, от приблизительно 15 мм до приблизительно 25 мм, от приблизительно 20 мм до приблизительно 35 мм, от приблизительно 20 мм до приблизительно 30 мм или от приблизительно 25 мм до приблизительно 35 мм) и высоту от приблизительно 40 мм до приблизительно 50 мм (например, от приблизительно 40 мм до приблизительно 45 мм или от приблизительно 45 мм до приблизительно 50 мм), инкубируемой при температуре от приблизительно 31°C до приблизительно 40°C, при перемешивании с частотой от приблизительно 320 об/мин до приблизительно 450 об/мин (например, от приблизительно 320 об/мин до приблизительно 440 об/мин, от приблизительно 320 об/мин до приблизительно 430 об/мин, от приблизительно 320 об/мин до приблизительно 420 об/мин, от приблизительно 320 об/мин до приблизительно 410 об/мин, от приблизительно 320 об/мин до приблизительно 400 об/мин, от приблизительно 320 об/мин до приблизительно 390 об/мин, от приблизительно 320 об/мин до приблизительно 380 об/мин, от приблизительно 320 об/мин до приблизительно 370 об/мин, от приблизительно 320 об/мин до приблизительно 360 об/мин, от приблизительно 320 об/мин до приблизительно 350 об/мин, от приблизительно 320 об/мин до приблизительно 340 об/мин, от приблизительно 320 об/мин до приблизительно 330 об/мин, от приблизительно 330 об/мин до приблизительно 450 об/мин, от приблизительно 330 об/мин до приблизительно 440 об/мин, от приблизительно 330 об/мин до приблизительно 430 об/мин, от приблизительно 330 об/мин до приблизительно 420 об/мин, от приблизительно 330 об/мин до приблизительно 410 об/мин, от приблизительно 330 об/мин до приблизительно 400 об/мин, от приблизительно 330 об/мин до приблизительно 390 об/мин, от приблизительно 330 об/мин до приблизительно 380 об/мин, от приблизительно 330 об/мин до приблизительно 370 об/мин, от приблизительно 330 об/мин до приблизительно 360 об/мин, от приблизительно 330 об/мин до приблизительно 350 об/мин, от приблизительно 330 об/мин до приблизительно 340 об/мин, от приблизительно 340 об/мин до приблизительно 450 об/мин, от приблизительно 340 об/мин до приблизительно 440 об/мин, от приблизительно 340 об/мин до приблизительно 430 об/мин, от приблизительно 340 об/мин до приблизительно 420 об/мин, от приблизительно 340 об/мин до приблизительно 410 об/мин, от приблизительно 340 об/мин до приблизительно 400 об/мин, от приблизительно 340 об/мин до приблизительно 390 об/мин, от приблизительно 340 об/мин до приблизительно 380 об/мин, от приблизительно 340 об/мин до приблизительно 370 об/мин, от приблизительно 340 об/мин до приблизительно 360 об/мин, от приблизительно 340 об/мин до приблизительно 350 об/мин, от приблизительно 350 об/мин до приблизительно 450 об/мин, от приблизительно 350 об/мин до приблизительно 440 об/мин, от приблизительно 350 об/мин до приблизительно 430 об/мин, от приблизительно 350 об/мин до приблизительно 420 об/мин, от приблизительно 350 об/мин до приблизительно 410 об/мин, от приблизительно 350 об/мин до приблизительно 400 об/мин, от приблизительно 350 об/мин до приблизительно 390 об/мин, от приблизительно 350 об/мин до приблизительно 380 об/мин, от приблизительно 350 об/мин до приблизительно 370 об/мин, от приблизительно 350 об/мин до приблизительно 360 об/мин, от приблизительно 360 об/мин до приблизительно 450 об/мин, от приблизительно 360 об/мин до приблизительно 440 об/мин, от приблизительно 360 об/мин до приблизительно 430 об/мин, от приблизительно 360 об/мин до приблизительно 420 об/мин, от приблизительно 360 об/мин до приблизительно 410 об/мин, от приблизительно 360 об/мин до приблизительно 400 об/мин, от приблизительно 360 об/мин до приблизительно 390 об/мин, от приблизительно 360 об/мин до приблизительно 380 об/мин, от приблизительно 360 об/мин до приблизительно 370 об/мин, от приблизительно 370 об/мин до приблизительно 450 об/мин, от приблизительно 370 об/мин до приблизительно 430 об/мин, от приблизительно 370 об/мин до приблизительно 410 об/мин, от приблизительно 370 об/мин до приблизительно 390 об/мин, от приблизительно 390 об/мин до приблизительно 450 об/мин, от приблизительно 390 об/мин до приблизительно 430 об/мин, от приблизительно 390 об/мин до приблизительно 410 об/мин, от приблизительно 410 об/мин до приблизительно 450 об/мин, от приблизительно 410 об/мин до приблизительно 430 об/мин или от приблизительно 430 об/мин до приблизительно 450 об/мин).
Как известно из уровня техники, для достижения определенной концентрации растворенного O2 и определенной силы сдвига текучей среды можно корректировать различные параметры культивирования клеток. Неограничивающие примеры таких параметров, которые можно корректировать, включают: объем лунки, объем жидкой культуральной среды, форму лунки (например, одно или несколько из диаметра, высоты и формы дна лунки), тип перемешивания (например, ротационное круговое перемешивание и/или ротационное эллиптическое перемешивание), частоту перемешивания, тип жидкой культуральной среды, внутреннее покрытие лунки и температуру жидкой культуральной среды. Дополнительные примеры таких параметров культивирования известны из уровня техники. Любую комбинацию описанных в данном документе или известных из уровня техники параметров культивирования можно комбинировать любым образом для достижения в культуральной среде силы сдвига текучей среды и концентрации растворенного кислорода (O2), которые являются такими же (или практически такими же), как значения, достигаемые в среде, занимающей от приблизительно 10% до приблизительно 40% (например, от приблизительно 15% до приблизительно 25%) объема лунки с квадратным дном, имеющей диаметр от приблизительно 6,0 мм до приблизительно 35 мм и высоту от приблизительно 40 мм до приблизительно 50 мм, инкубируемой при температуре от приблизительно 31°C до приблизительно 40°C при перемешивании с частотой от приблизительно 320 об/мин до приблизительно 450 об/мин (например, от приблизительно 320 об/мин до приблизительно 360 об/мин).
Уровни растворенного O2 в жидкой культуральной среде могут быть выявлены посредством применения ряда различных способов. Например, растворенный O2 можно измерять посредством применения электрода или зонда для измерения растворенного O2 (например, зондов или электродов для измерения O2, доступных от Eutech Instruments, зонда для измерения растворенного кислорода WD-35201-80, датчика содержания растворенного кислорода/озона 499 Series от Rosemount Analytical и электрода для измерения растворенного кислорода DO705 от Extech). Используя инструкции производителя, можно проводить методики калибрования и применения зондов и электродов для измерения O2.
Силу сдвига текучей среды в жидкой культуральной среде можно рассчитывать с применением способов, известных из уровня техники. Неограничивающий пример подходящего руководства, в котором описывается расчет силы сдвига текучей среды в жидкой культуральной среде, описан в Fluid Mechanics, Robert A. Granger, 1995, Dover Publications, Inc., Mineola, NY, и Fundamentals of Fluid Mechanics, Bruce R. Munson et al., John Wiley & Sons, Inc., 2009.
Способы получения рекомбинантного белка
В данном документе также предусмотрены способы получения рекомбинантного белка, которые включают культивирование клетки, способной продуцировать рекомбинантный белок, с применением описанного в данном документе способа. После осуществления способа рекомбинантный белок может быть извлечен из клетки млекопитающего и/или из первой или второй культуральной среды. В некоторых вариантах осуществления рекомбинантный белок извлекают из первой и/или второй жидкой культуральной среды в любой данный момент времени в ходе способа культивирование (например, извлекают из первой и/или второй жидкой культуральной среды в один или несколько из дней 0, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49, 50, 51, 52, 53, 54, 55, 56, 57, 58, 59, 60, 61, 62, 63, 64, 65, 66, 67, 68, 69, 70, 71, 72, 73, 74, 75, 76, 77, 78, 79, 80, 81, 82, 83, 84, 85, 86, 87, 88, 89, 90, 91, 92, 93, 94, 95, 96, 97, 98, 99 или 100 культивирования, или после более чем 100 дней культивирования). Некоторые варианты осуществления этих способов дополнительно включают добавление объема третьей культуральной среды или объема четвертой жидкой культуральной среды, но в каждом случае общий объем жидкой культуральной среды в лунке должен быть меньше объема первой жидкой культуральной среды или равняться ему.
Квалифицированным специалистам будет понятно, что какие-либо из ряда параметров культивирования (например, описанные в данном документе многолуночные планшеты, лунки, значения объема, значения скорости или частоты замены объемов культуры, значения частоты перемешивания, значения температуры, среды и значения концентрации CO2) можно применять в любой комбинации с целью осуществления данных способов. Кроме того, для получения рекомбинантного белка можно применять любые клетки млекопитающих, описанные в данном документе или известные из уровня техники.
Нуклеиновую кислоту, кодирующую рекомбинантный белок, можно вводит в клетку млекопитающего с помощью широкого спектра способов, известных в области молекулярной биологии и молекулярной генетики. Неограничивающие примеры включают трансфекцию (например, липофекцию), трансдукцию (например, инфекцию лентивирусом, аденовирусом или ретровирусом) и электропорацию. В некоторых случаях нуклеиновая кислота, которая кодирует рекомбинантный белок, не интегрирована стабильно в хромосому клетки млекопитающего (транзиентная трансфекция), в то время как в других случаях эта нуклеиновая кислота интегрирована в хромосому. В качестве альтернативы или в дополнение, нуклеиновая кислота, кодирующая рекомбинантный белок, может присутствовать в плазмиде и/или в искусственной хромосоме млекопитающего (например, искусственной хромосоме человека). В качестве альтернативы или в дополнение, нуклеиновую кислоту можно вводить в клетку путем использования вирусного вектора (например, лентивирусного, ретровирусного или аденовирусного векторов). Нуклеиновая кислота может быть функционально связанной с промоторной последовательностью (например, сильного промотора, такого как промотор β-актина и промотор CMV, или индуцируемого промотора). Вектор, содержащий нуклеиновую кислоту, может при необходимости также содержать селектируемый маркер (например ген, который придает клетке млекопитающего устойчивость к гигромицину, пуромицину или неомицину).
В некоторых случаях рекомбинантный белок является секретируемым белком и высвобождается клеткой млекопитающего во внеклеточную среду (например, первую и/или вторую жидкую культуральную среду). Например, последовательность нуклеиновой кислоты, кодирующая растворимый рекомбинантный белок, может содержать последовательность, которая кодирует сигнальный пептид для секреции на N- или С-конце рекомбинантного белка, который отщепляется ферментом, присутствующим в клетке млекопитающего, и затем высвобождается во внеклеточную среду (например, первую и/или вторую жидкую культуральную среду). Например, такой секретируемый рекомбинантный может представлять собой секретируемый иммуноглобулин, секретируемый фермент, секретируемый фактор роста, секретируемый фрагмент белка или секретируемый сконструированный белок. В иных случаях, рекомбинантный белок представляет собой растворимый белок, который не секретируется, при этом рекомбинантный белок извлекают из клетки млекопитающего. Например, рекомбинантный белок, который не секретируется, может представлять собой иммуноглобулин, фермент, фактор роста, фрагмент белка или сконструированный белок.
Неограничивающие примеры рекомбинантных белков, которые можно получить с помощью способов, предусмотренных в данном документе, включают иммуноглобулины (в том числе легкие и тяжелые цепи иммуноглобулинов, антитела или фрагменты антител (например, любой из фрагментов антител, описанных в данном документе), ферменты (например, галактозидазу (например, альфа-галактозидазу), Myozyme или Cerezyme), белки (например, фактор роста, эритропоэтин человека, фактор некроза опухоли (TNF) или интерферон альфа или бета), сконструированный белок или иммуногенные или антигенные белки, или фрагменты белков (например, белки для применения в вакцине). В некоторых вариантах осуществления рекомбинантный белок представляет собой сконструированный антиген-связывающий полипептид, который содержит каркас по меньшей мере одного многофункционального рекомбинантного белка (см., например, рекомбинантные антиген-связывающие белки, описанные в Gebauer et al., Current Opin. Chem. Biol. 13:245-255, 2009; и публикацию заявки на патент США № 2012/0164066 (включенную в данный документ посредством ссылки во всей полноте)). Неограничивающие примеры рекомбинантных белков, которые являются антителами, включают: панитумумаб, омализумаб, абаговомаб, абциксимаб, актоксумаб, адалимумаб, адекатумумаб, афелимомаб, афутузумаб, алацизумаб, алацизумаб, алемтузумаб, алирокумаб, альтумомаб, аматуксимаб, анатумомаб, аполизумаб, атинумаб, тоцилизумаб, базилизимаб, бектумомаб, белимумаб, бевацизумаб, бициромаб, канакинумаб, цетуксимаб, даклизумаб, денсумаб, экулизумаб, эдреколомаб, эфализумаб, эфунгумаб, эртумаксомаб, этарацизумаб, голимумаб, инфликсимаб, натализумаб, паливизумаб, панитумумаб, пертузумаб, ранибизумаб, ритуксимаб, тоцилизумаб и трастузумаб. Дополнительные примеры терапевтических антител, которые можно получить с помощью способов, описанных в данном документе, известны из уровня техники. Дополнительные неограничивающие примеры рекомбинантных белков, которые можно получать с помощью способов по настоящему изобретению, включают: алглюкозидазу альфа, ларонидазу, абатацепт, галсульфазу, лютропин альфа, антигемофилический фактор, агалзидазу бета, интерферон бета-1a, дарбепоэтин альфа, тенектеплазу, этанерцепт, фактор свертывания крови IX, фолликулостимулирующий гормон, интерферон бета-1a, имиглюцеразу, дорназу альфа, эпоэтин альфа и альтеплазу.
Секретируемый растворимый рекомбинантный белок можно извлекать из жидкой культуральной среды (например, из первой и/или второй жидкой культуральной среды) путем удаления или иного физического отделения жидкой культуральной среды от клеток млекопитающих. Разнообразие различных способов удаления жидкой культуральной среды от клеток млекопитающих известны из уровня техники, включая, например, центрифугирование, фильтрацию, пипетирование и/или аспирацию. Секретируемый рекомбинантный белок затем может быть извлечен из жидкой культуральной среды и дополнительно очищен с применением различных биохимических методик, включая различные типы хроматографии (например, аффинную хроматографию, хроматографию на молекулярных ситах, катионообменную хроматографию или анионообменную хроматографию) и/или фильтрации (например, фильтрацию с отсечением по молекулярной массе).
Для извлечения рекомбинантного белка клетку млекопитающего можно лизировать. Из уровня техники известен широкий спектр способов для лизирования клеток млекопитающих, включая, например, обработку ультразвуком и/или лизирование с применением детергентов, ферментов и/или химических веществ. Рекомбинантный белок может быть очищен от лизата клеток млекопитающих с применением ряда биохимических способов, известных из уровня техники, обычно начиная со стадии центрифугирования с целью удаления клеточного дебриса, а затем осуществляя одну или несколько дополнительных стадий (например, один или несколько типов хроматографии (например, аффинной хроматографии, хроматографии на молекулярных ситах, катионообменной хроматографии или анионообменной хроматографии) и/или фильтрации (например, фильтрации с отсечением по молекулярной массе)).
В некоторых вариантах осуществления извлеченный рекомбинантный белок характеризуется по меньшей мере или приблизительно 50% чистотой по весу, например, по меньшей мере или приблизительно 55% чистотой по весу, по меньшей мере 60% чистотой по весу, по меньшей мере 65% чистотой по весу, по меньшей мере 70% чистотой по весу, по меньшей мере 75% чистотой по весу, по меньшей мере 80% чистотой по весу, по меньшей мере 85% чистотой по весу, по меньшей мере 90% чистотой по весу, по меньшей мере 95% чистотой по весу, по меньшей мере 96% чистотой по весу, по меньшей мере 97% чистотой по весу, по меньшей мере 98% чистотой по весу или по меньшей мере или приблизительно 99% чистотой по весу или более 99% чистотой по весу.
ПРИМЕРЫ
Настоящее изобретение далее описывается следующими примерами, которые не ограничивают объем настоящего изобретения, описанного в формуле изобретения.
Пример 1. Значимые характеристики иллюстративного способа культивирования
Эксперименты проводили для создания маломасштабной высокопроизводительной модели перфузионных культур и для определения, смогут ли такие культуры достигать значений плотности клеток, схожих со значениями в ходе получения перфузионных культур.
Материалы и способы
Суспензионная культура клеток, продуцирующая рекомбинантную галактозидазу
Эту же клональную линию клеток, которая продуцирует рекомбинантную галактозидазу, применяли в каждом цикле процесса культивирования клеток, при этом культуральная среда, применяемая в каждом цикле процесса культивирования клеток, приведена в таблице 1.
Таблица 1. Культуральные среды, применяемые в исследованиях
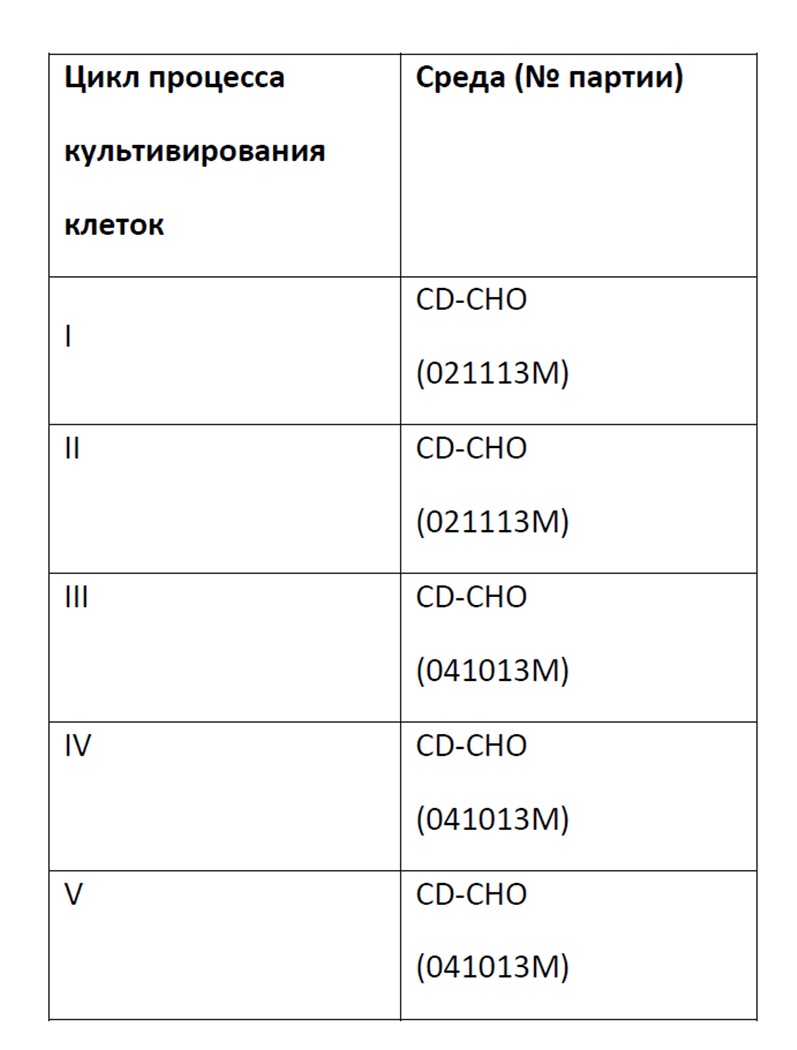
Оборудование и реагенты
В циклах процесса культивирования клеток, описанных в данном примере, применяли следующие оборудование и реагенты: шейкер-инкубатор Multitron (Appropriate Technical Resources, Inc.) (модель № AJ125), Cellometer® Auto1000 (Nexcelom Bioscience LLC), центрифуга Allegra от Beckman Coulter (модель № Allegra X-14 R), биореакторы TubeSpin® 50 (Techno Plastic Products AG, Тразадинген, Швейцария), 96-луночные микропланшеты MASTERBLOCK® с объемом лунок 2 мл (Griener Bio One, Фрикенхаузен, Германия), 96-луночные микропланшеты MASTERBLOCK® с объемом лунок 1 мл (Griener Bio One, Фрикенхаузен, Германия), настольный микроскоп с источником белого света Olympus (модель № BH-s), настольный микроскоп с источником белого света Olympus (модель № BX40), настольный микроскоп с источником белого света Olympus (модель № BX41), 0,4% раствор трипанового синего (Sigma), 0,2% раствор трипанового синего (Sigma), гемоцитометр Bright-Line® от Reichert, покровное стекло для микроскопа от Thermo Scientific, Fisher Scientific Laboratory Counter, программное обеспечение JMP (версия X), разработанное SAS®, фиксирующее устройство для микротитрационных планшетов Applikon MicroFlask (Applikon Biotechnology Inc.), микропористые одноразовые мембранные уплотнения AeraSeal (Phenix Research Products), лабораторная автоматизированная система Biomek® 3000 от Beckman Coulter, микродозатор RAININ Pipetting 360° Pipet-Lite™ XLS™ (Mettler Toledo), высокоэффективный эргономичный микродозатор (VWR®) и ванночка для реагентов (VistaLab Technologies).
Способы
Проводили исследования с тестированием диапазона различных условий для перемешивания (об/мин), формы лунок и рабочего объема. Исследования спланировали с охватом диапазонов перемешивания от 320 об/мин до 360 об/мин, лунок с круглым дном (номинальный объем 1 мл) или с квадратным дном (номинальный объем 2 мл) и рабочего объема от 100 мкл до 600 мкл. Цикл I процесса культивирования клеток осуществляли для определения исходных технологических условий для планшетов с глубокими лунками с круглым дном (номинальный объем 1 мл). Цикл II процесса культивирования клеток осуществляли для определения способности планшетов с глубокими лунками с круглым дном поддерживать высокую плотность культур клеток. Цикл III процесса культивирования клеток осуществляли для установления диапазонов параметров для оптимизации плана эксперимента, а также для сравнения фиксирующего устройства для микротитрационных планшетов Applikon MicroFlask (Applikon Biotechnology, Inc., Фостер Сити, Калифорния) со стерильными микропористыми мембранными уплотнениями (AeraSeal, Phenix Research Products, Кандлер, Северная Каролина). Цикл IV и V процесса культивирования клеток спланировали с целью оптимизации модели.
Цикл V процесса культивирования клеток спланировали с применением специально разработанного инструмента в рамках программного обеспечения JMP. Модель разработали как I-оптимальный план эксперимента с двумя непрерывными переменными (скорость встряхивания и рабочий объем) и одной категориальной величиной (форма лунок), с учетом взаимодействий третьего порядка. Значения нижнего и верхнего предела устанавливали в соответствии с таблицей 2 (с рабочими объемами, приведенными в виде фракции общего объема сосуда). План доработали для обеспечения статистической мощности 2 для учета любых нелинейных зависимостей между переменными. Наконец, исследование разработали таким образом, чтобы в общей сложности имело место 15 условий на эксперимент (шесть для лунок с круглым дном и девять для лунок с квадратным дном), проведенный в двух повторностях.
Таблица 2. Настройки непрерывных переменных, применяемых в JMP
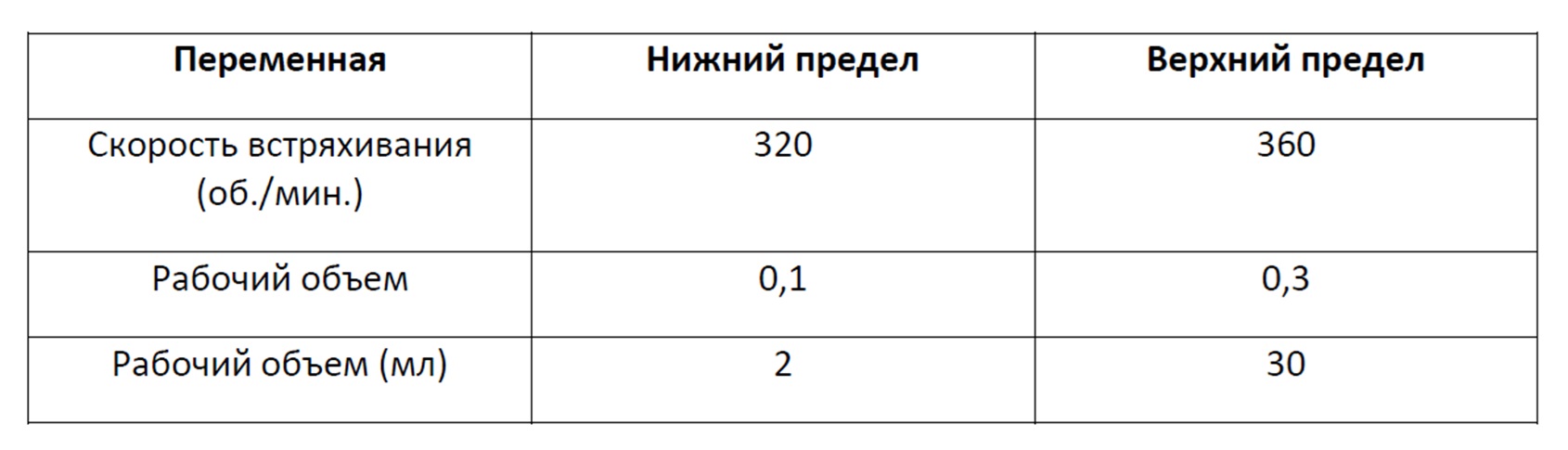
После оттаивания пробирки с банком клеток в каждый сосуд инокулировали 5×106 живых клеток/мл, с применением клеток из культуры для посева, выращенных во встряхиваемых колбах за 9, 10, 7, 0 и 7 пассажей для циклов 1-5 процесса культивирования клеток соответственно. Культуры клеток поддерживали в контролируемой среде при 5% CO2, 37°C и 80% относительной влажности в шейкере-инкубаторе. Условие с контрольной встряхиваемой пробиркой использовали в каждом эксперименте с постоянным рабочим объемом 10 мл на пробирку, с углом встряхивания 45° и перемешиванием со скоростью 160 об/мин. Для всех экспериментов (если не указано иное) испарение учитывали согласно таблице 3.
Таблица 3. Дополнение с учетом испарения
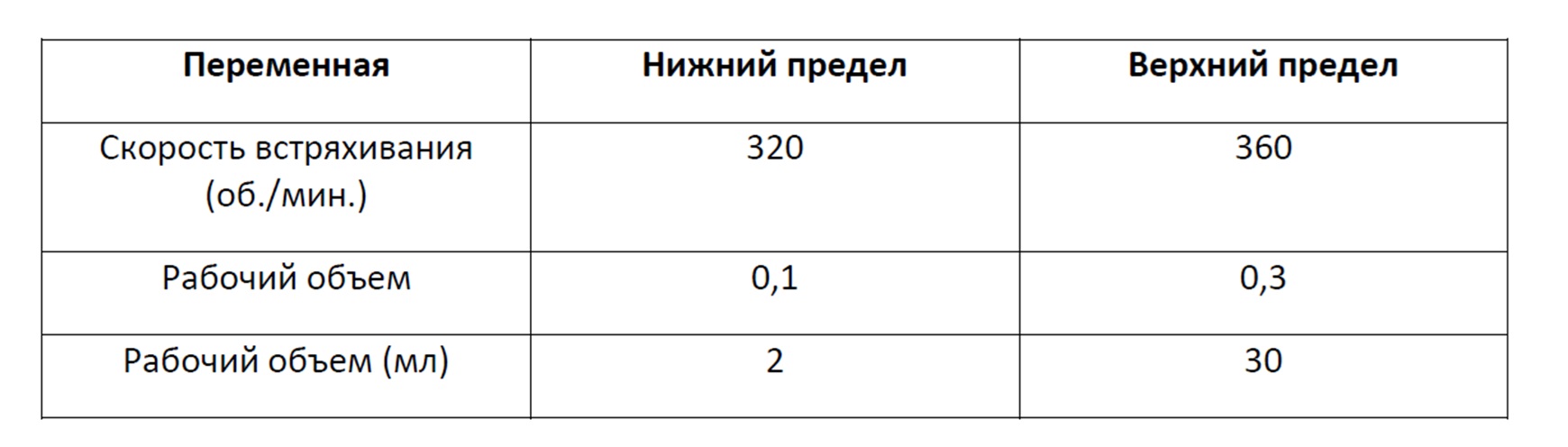
Для цикла I процесса культивирования клеток в планшет с глубокими лунками с круглым дном инокулировали 5×105живых клеток/мл и 1×106 живых клеток/мл. Начиная с 1 дня после инокулирования, ежедневно отбирали образец культуры (10 мкл) для определения плотности жизнеспособных клеток (VCD) с помощью подсчета вручную (исключение окрашивания трипановым синим) в течение 2 дней.
Для цикла II процесса культивирования клеток, начиная с первого дня после инокулирования, ежедневно отбирали образец культуры (10 мкл) для определения VCD с помощью подсчета вручную в течение 11 дней. После подсчета количества клеток планшеты центрифугировали при ~233 x g в течение 5 минут и отработанные среды удаляли. Культуральную среду заменяли при соотношениях, описанных в таблице 4.
Для циклов III и IV процесса культивирования клеток применяли планшеты с глубокими лунками (на 1 мл) с круглым дном и планшеты с глубокими лунками (на 2 мл) с квадратным дном. Начиная с первого дня после инокулирования, образцы культур отбирали каждые понедельник, среду, четверг и пятницу (схема 2-2-3) (10 мкл) для определения VCD с использованием Cellometer® Auto 1000. После подсчета количества клеток планшеты центрифугировали при ~233 x g в течение 5 минут и отработанные среды удаляли. Культуральную среду заменяли при соотношениях, описанных в таблице 4.
Для цикла V процесса культивирования клеток применяли дозатор жидкостей Biomek 3000. Начиная с первого дня после инокулирования, образцы культур отбирали каждые понедельник, среду, четверг и пятницу (0,10 x рабочий объем) для определения VCD с использованием Cellometer® Auto 1000. После подсчета количества клеток планшеты центрифугировали при ~233 x g в течение 5 минут и отобранную истощенную среду использовали сразу же или хранили при -80°C до проведения анализов активности рекомбинантной α-галактозидазы человека (rhα-Gal) для определения титра продукта. Культуральную среду заменяли при соотношениях, описанных в таблице 5, и рассчитывали объемную и удельную продуктивности в отношении rhα-Gal с использованием приведенных ниже уравнений 1 и 2. Кроме того, рассчитывали суммарный показатель плотности жизнеспособных клеток (IVCD) с использованием приведенного ниже уравнения 3.
Таблица 4. Схема периодической повторной подпитки

1 плотность посева при инокулировании 5×105 клеток/мл.
Таблица 5. Модифицированная схема периодической повторной подпитки
1 плотность посева при инокулировании 5×105 клеток/мл.
VPR=титр * PRУравнение 1
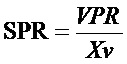
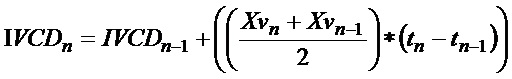
PR: скорость перфузии;
VPR: объемная продуктивность (ед./л/день);
титр: активность rhα-Gal (ед./л);
SPR: удельная продуктивность (клеток U/E9/день);
Xv: количество жизнеспособных клеток (клеток E6/мл);
IVCD: суммарная плотность жизнеспособных клеток (плотность клеток/мл);
t: время (дней).
Подсчет количества клеток вручную
Гемоцитометр и покровное стекло протирали изопропиловым спиртом (IPA). Углы покровных стекол смачивали IPA и притирали к гемоцитометру. Образцы клеток равномерно смешивали с 0,4% трипановым синим 1:1. Аликвоту 10 мкл переносили в камеру гемоцитометра. Количество клеток подсчитывали в четырех больших внешних квадратах поля: каждый большой внешний квадрат поля содержал сетку из 16 меньших квадратов. Клетки, расположенные на границах большого квадрата, подсчитывали только для двух из четырех сторон. Неокрашенные клетки подсчитывали как жизнеспособные, тогда как окрашенные синим цветом клетки считали мертвыми. Процент жизнеспособности и плотность жизнеспособных клеток рассчитывали с использованием приведенных ниже уравнений 4 и 5.
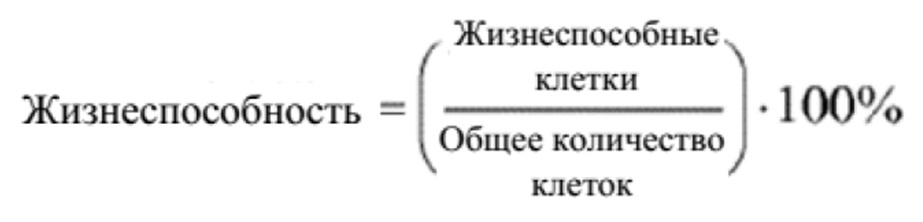
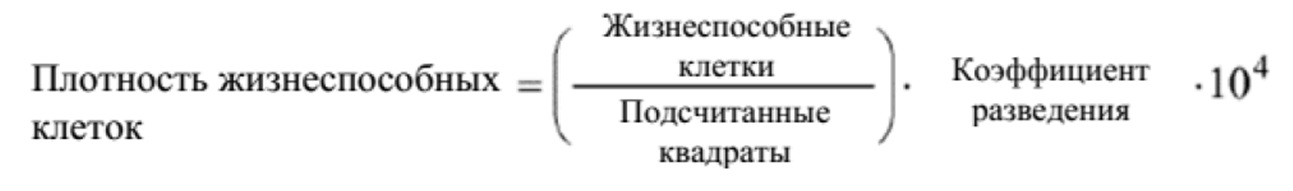
Общее количество клеток: Суммарное количество жизнеспособных клеток и мертвых клеток
Подсчет количества клеток с помощью цитометра Cellometer от Nexcelom
Образцы клеток равномерно смешивали с 0,2% трипановым синим 1:1. Аликвоту смеси 20 мкл переносили на специальные для указанного прибора предметные стекла. Количество клеток подсчитывали на четырех изображениях, полученных с помощью встроенной в прибор цифровой камеры. Неокрашенные клетки подсчитывали как жизнеспособные, тогда как окрашенные синим цветом клетки считали мертвыми.
Статистический анализ
Статистический анализ проводили с использованием программного обеспечения JMP. Используемые отклики представляли собой максимальную плотность жизнеспособных клеток (VCD или XV) и объемную продуктивность (VPR) с обеспечением максимальной желательности. Статистическую модель оценивали с помощью функции «подобранной модели» с использованием отчета скрининга эффектов. В отчете «Прогнозированные значения выбранных параметров» были представленные факторы, которые существенно влияют на переменные отклика, что было статистически определено с помощью t-критерия. Наконец, с помощью «Построения профиля прогнозирования» графически отображаются независимые эффекты параметров по отношению к переменным отклика и используется модель прогнозирования наилучших условий путем максимизации показателей функции желательности.
Результаты
Цикл I процесса культивирования клеток
В данном эксперименте на 27 день после размораживания в пробирке продуцирующую rhα-Gal линию клеток CHO (в среде CD CHO) использовали для инокулирования в сосуды при трех различных условиях (таблица 6). Профиль пролиферации культур клеток отслеживали в течение 11 дней.
Таблица 6. Испытуемые условия для процесса I культивирования клеток
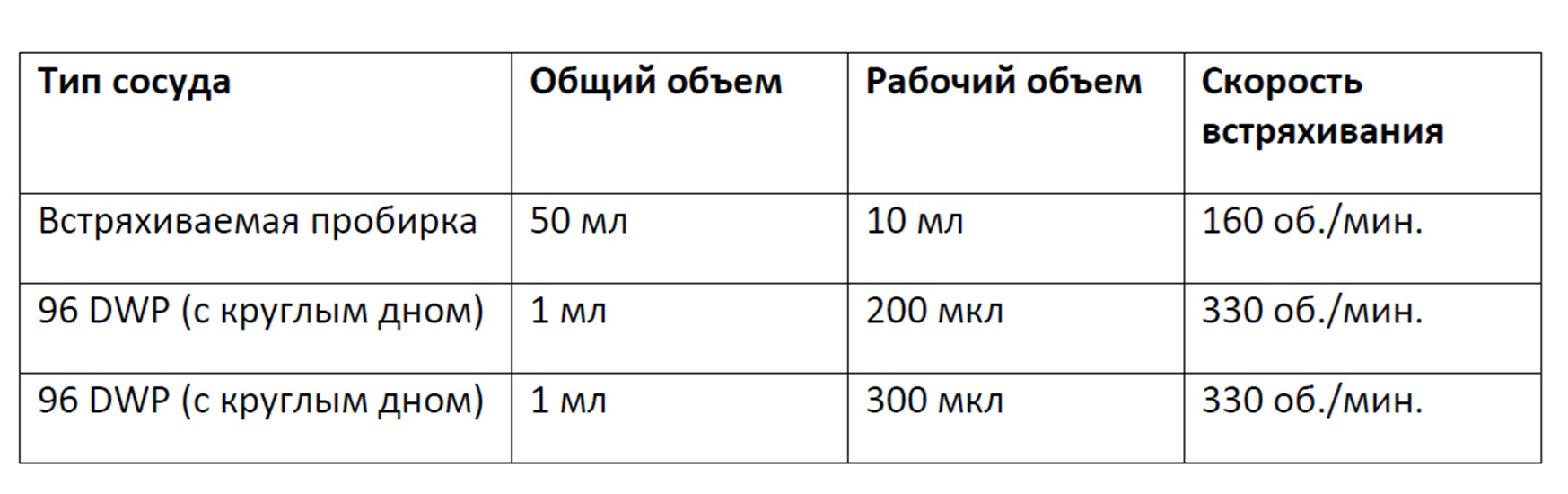
Профили плотности жизнеспособных клеток культуры, поддерживаемой в среде CD CHO в течение одиннадцати дней, показаны на фигуре 5. Процесс роста наблюдали во всех экспериментальных культурах. В случае клеток, высеянных в количестве 5×105 клеток/мл, скорость роста была минимальной в обоих рабочих объемах (200 мкл и 300 мкл), при достижении VCD, составляющей 1×106 клеток/мл. Это свидетельствует о том, что клетки могут расти в планшетах с глубокими лунками с круглым дном при низких значениях плотности посева. Для культур, высеянных в количестве 1×106 клеток/мл, также наблюдали рост ко 2 дню, при этом культуры, которые дважды в сутки повторно подпитывали при 0,5 RV, характеризовались лучшим ростом (фигура 6). Культуры, которые дважды в сутки повторно подпитывали, достигали VCD более 2×106 клеток/мл на 2 день: 2,7×106 клеток/мл в 200 мкл и 2,3 x106 клеток/мл в 300 мкл. Культуры с повторной подпиткой при примерно 1,0 RV/день характеризовались намного меньшей VCD на 2 день, что также могло быть результатом случайной потери клеток в ходе удаления истощенной среды. Эти данные указывают на то, что режим перфузии 2×0,5 RV/день обеспечивает лучший рост клеток по сравнению с режимом перфузии 1,0 RV/день. Эти данные свидетельствуют о том, что в 96-луночных планшетах с глубокими лунками (на 1 мл) с круглым дном возможно поддержание роста клеток. На протяжении всего эксперимента наблюдали, что культуры содержат небольшие осадки клеток, наблюдаемые сразу после извлечения из шейкера-инкубатора, что, вероятно, было обусловлено недостаточным перемешиванием. Такое наблюдение свидетельствует о том, что в случае планшетов с глубокими лунками (на 1 мл) с круглым дном следует использовать более высокую скорость перемешивания.
Цикл II процесса культивирования клеток
Проводили серию экспериментов для оптимизации режима перфузии, используемого для клеток, культивируемых в 96-луночных планшеты с глубокими лунками (на 1 мл) с круглым дном. В этих экспериментах продуцирующие rhα-Gal клетки (на 30 день после размораживание в пробирке) в среде CD CHO использовали для инокулирования в лунки 96-луночных планшетов с глубокими лунками с круглым дном и во встряхиваемые пробирки (как описано в таблице 7). Производительность культуры клеток оценивали в ходе 11-дневного процесса с периодической повторной подпиткой.
Таблица 7. Испытуемые условия для цикла II процесса культивирования клеток
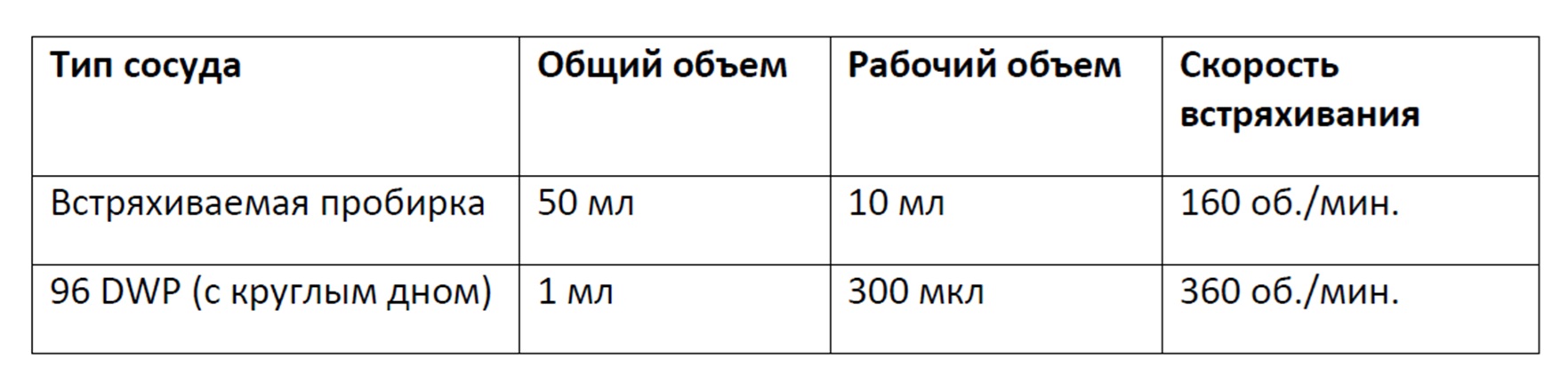
Среди всех культур поддерживался процент жизнеспособность клеток более 85% (фигура 7). Профили плотности жизнеспособных клеток для 11-дневных культур клеток, поддерживаемых в среде CD CHO, показаны на фигуре 8. Процесс роста наблюдали для всех культур до 9 дня, как только рост клеток в качестве экспериментального контроля (культура во встряхиваемой пробирке) останавливался при максимальной плотности 25×106 клеток/мл. Культура в 96-луночных планшетах с глубокими лунками с круглым дном характеризовалась более медленным темпом роста по сравнению с экспериментальным контролем, достигая максимальной VCD 8×106 клеток/мл. На 8 день в культуры в 96-луночных планшетах с глубокими лунками с круглым дном добавляли порцию (50 мкл) среды с учетом потери на испарение.
Эти данные по 96-луночному планшету с глубокими лунками с круглым дном свидетельствовали о том, что схему повторной подпитки следует откорректировать. Модифицированная схема повторной подпитки показана на фигуре 9 и в таблице 3.
Цикл III процесса культивирования клеток
Проводили серию экспериментов для оптимизации режима повторной подпитки, используемого для клеток, культивируемых в 96-луночных планшетах с глубокими лунками с круглым дном. Данные эксперименты проводили с использованием как 96-луночных планшетов с глубокими лунками на 1 мл с круглым дном, так и 96-луночных планшетов с глубокими лунками на 2 мл с квадратным дном, и модифицированный протокол режима повторной подпитки показан на фигуре 9. На 8 день после размораживания в пробирке продуцирующие rhα-Gal клетки в среде CD CHO использовали для инокулирования в планшеты с глубокими лунками обоих типов и во встряхиваемые пробирки (см. таблицу 8). Культуры в 96-луночных планшетах с глубокими лунками с квадратным дном содержали объем культуры 300 мкл или 500 мкл, тогда как культуры в 96-луночных планшетах с глубокими лунками с квадратным дном содержали объем культуры 200 мкл или 300 мкл (номинальный объем 1 мл). Лунки плотно закрывали либо с использованием системы Applikon, либо с использованием мембран AeraSeal. Все культуры в 96-луночных планшетах с глубокими лунками перемешивали либо при 330 об/мин, либо при 360 об/мин Темпы роста культуры клеток измеряли в течение 9 дней. Количество всех жизнеспособных клеток для культур в 96-луночных планшетах с глубокими лунками подсчитывали в лунках, представленных в трех повторах, и значение усредняли.
Профили плотности жизнеспособных клеток для 15-дневных культур клеток показаны на фигуре 10. Подобные профили роста наблюдали для культур в 96-луночных планшетах с глубокими лунками с квадратным дном, накрытых с использованием системы Applikon или накрытых с использованием одноразовых мембранных уплотнений (в пределах одного стандартного отклонения (1 SD) при сравнении одного с другим). Наиболее высокой плотностью жизнеспособных клеток в формате с использованием 96-луночных планшетов была плотность жизнеспособных клеток, составляющая 35×106 клеток/мл, которой достигали в 96-луночных планшетах с глубокими лунками с квадратным дном на 15 день. Наиболее высокая плотность жизнеспособных клеток, достигнутая в культурах из контрольной встряхиваемой пробирки, составляла 21×106 клеток/мл на 10 день. Культуры в 96-луночных планшетах с глубокими лунками также очень напоминали профиль роста культур в контрольной встряхиваемой пробирке до 13 дня. Тем не менее, для культур в 96-луночных планшетах с глубокими лунками с квадратным дном отмечали сходство с исходной контрольной встряхиваемой пробиркой (n=11) в ходе 15-дневного процесса. Для двух культур в 96-луночных планшетах с глубокими лунками, характеризующихся наиболее близким сходством с культурами в исходной контрольной встряхиваемой пробирке, использовали покрытия в виде мембраны, при этом их перемешивали со скоростью 330 об/мин и они содержали объем культуры 300 мкл или 500 мкл.
Культуры в 96-луночных планшетах с глубокими лунками с круглым дном в данном эксперименте не проявляли рост, сравниваемый с культурами в контрольной встряхиваемой пробирке. Наиболее высокая плотность жизнеспособных клеток, наблюдаемая среди культур в 96-луночных планшетах с глубокими лунками с круглым дном, составляла 14×106 клеток/мл на 15 день. Среди всех культур поддерживался процент жизнеспособность клеток более 85% (фигура 11), до вхождения в фазу снижения жизнеспособности. В отличие от контрольной встряхиваемой пробирки, у культур в лунках обоих типов формы продолжалась пролиферация после 14 дня, достигая значений плотности жизнеспособных клеток 50×106 клеток/мл (в лунках с квадратным дном) и 17×106 клеток/мл до 20 дня (в лунках с круглым дном) (фигуры 12 и 13). Эти данные свидетельствуют о том, что в 96-луночных планшетах с глубокими лунками с круглым дном возможно поддерживать высокие значения плотности клеток.
Таблица 8. Испытуемые условия для цикла III процесса культивирования клеток
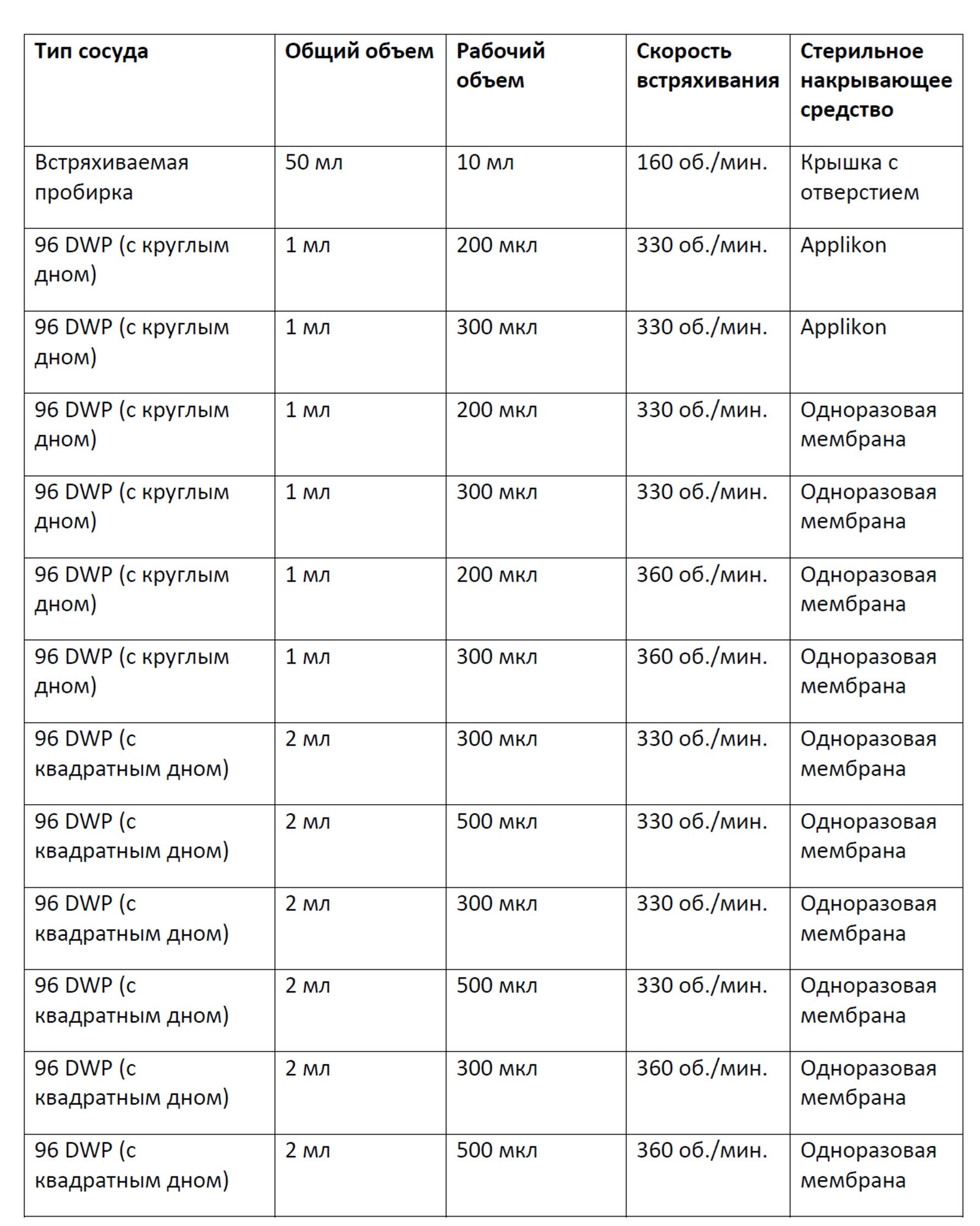
Цикл IV процесса культивирования клеток
Проводили дополнительную серию экспериментов для оптимизация роста клеток в 96-луночных планшетах с глубокими лунками с квадратным дном (номинальный объем 2 мл). В этих экспериментах в день 1 после размораживания в пробирке, клетки в среде CD CHO использовали для инокулирования в 96-луночные планшеты с глубокими лунками с квадратным дном и во встряхиваемые пробирки (n=3) (см. таблицу 9). Используемый объем культуры в этих экспериментах составлял 300 мкл или 500 мкл, при этом культуры перемешивали со скоростью 320 об/мин, 330 об/мин или 340 об/мин Рост клеток в культурах оценивали в течение 14 дней. Количество всех жизнеспособных клеток для культур подсчитывали в лунках, представленных в трех повторах, и значение усредняли.
Таблица 9. Испытуемые условия для цикла IV процесса культивирования клеток
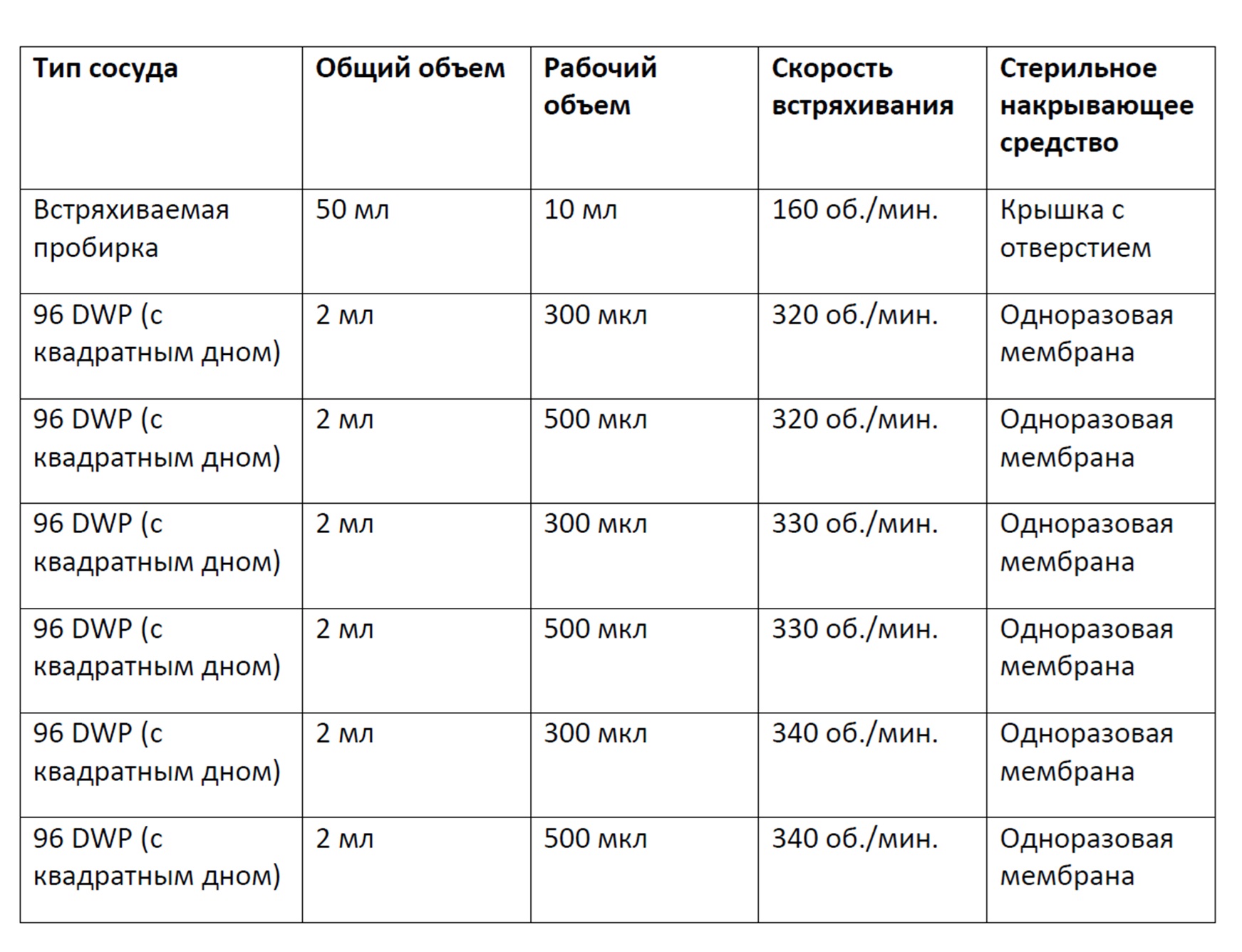
Профили плотности жизнеспособных клеток культур в 96-луночных планшетах с глубокими лунками с квадратным дном за 14 дней показаны на фигуре 14. Подобные профили роста наблюдали для всех испытуемых условий до 7 дня. После 7 дня культуры в 96-луночных планшетах с глубокими лунками с квадратным дном, содержащих объем культуры 500 мкл и перемешиваемых со скоростью 320 об/мин или 330 об/мин, характеризовались лучшим ростом клеток. Хотя при всех испытуемых условиях культивирования пролиферация продолжалась после 13 дня, с достижением плотности жизнеспособных клеток от 30×106 клеток/мл до 35×106 клеток/мл, при двух условиях культивирования с лучшими показателями роста достигали значения плотности жизнеспособных клеток более 40×106 клеток/мл. Значения плотности жизнеспособных клеток, достигаемые в культурах в 96-луночных планшетах с глубокими лунками с квадратным дном, содержащих объем культуры 500 мкл и перемешиваемых со скоростью 320 об/мин или 330 об/мин, превосходили значения плотности жизнеспособных клеток, наблюдаемые изначально в культурах этой же линии клеток во встряхиваемых пробирках (в пределах 1 стандартного отклонения) после 12 дня. До 12 дня культивирования подобную картину роста наблюдали в культурах в 96-луночных планшетах с глубокими лунками с квадратным дном, содержащих объем культуры 500 мкл и перемешиваемых со скоростью 320 об/мин или 330 об/мин, и в культурах во встряхиваемой пробирке.
Цикл V процесса культивирования клеток
Проводили серию экспериментов для оптимизации технологических условий культивирования клеток (см. описание способов планирования эксперимента). В этих экспериментах в 21 день после размораживания в пробирке клетки в среде CD CHO использовали для инокулирования в 96-луночные планшеты с глубокими лунками либо с квадратным, либо с круглым дном, или во встряхиваемые пробирки. Технологические условия для каждой испытуемой культуры показаны в таблице 10. Каждый из испытуемых 96-луночных планшетов с глубокими лунками накрывали одноразовыми мембранами AeraSeal. Культуры во встряхиваемой пробирке служили в качестве контроля (n=4): одна серия из двух культур во встряхиваемой пробирке соответствовала контрольной схеме повторной подпитки, а другая серия из двух культур во встряхиваемой пробирке соответствовала модифицированному режиму повторной подпитки, используемому в 96-луночных планшетах с глубокими лунками (изображено на фигуре 9). Испытание всех условий проводили в двух повторах. Рост клеток оценивали в ходе 9-дневного процесса с периодической повторной подпиткой.
Таблица 10. Испытуемые условия для цикла V процесса культивирования клеток
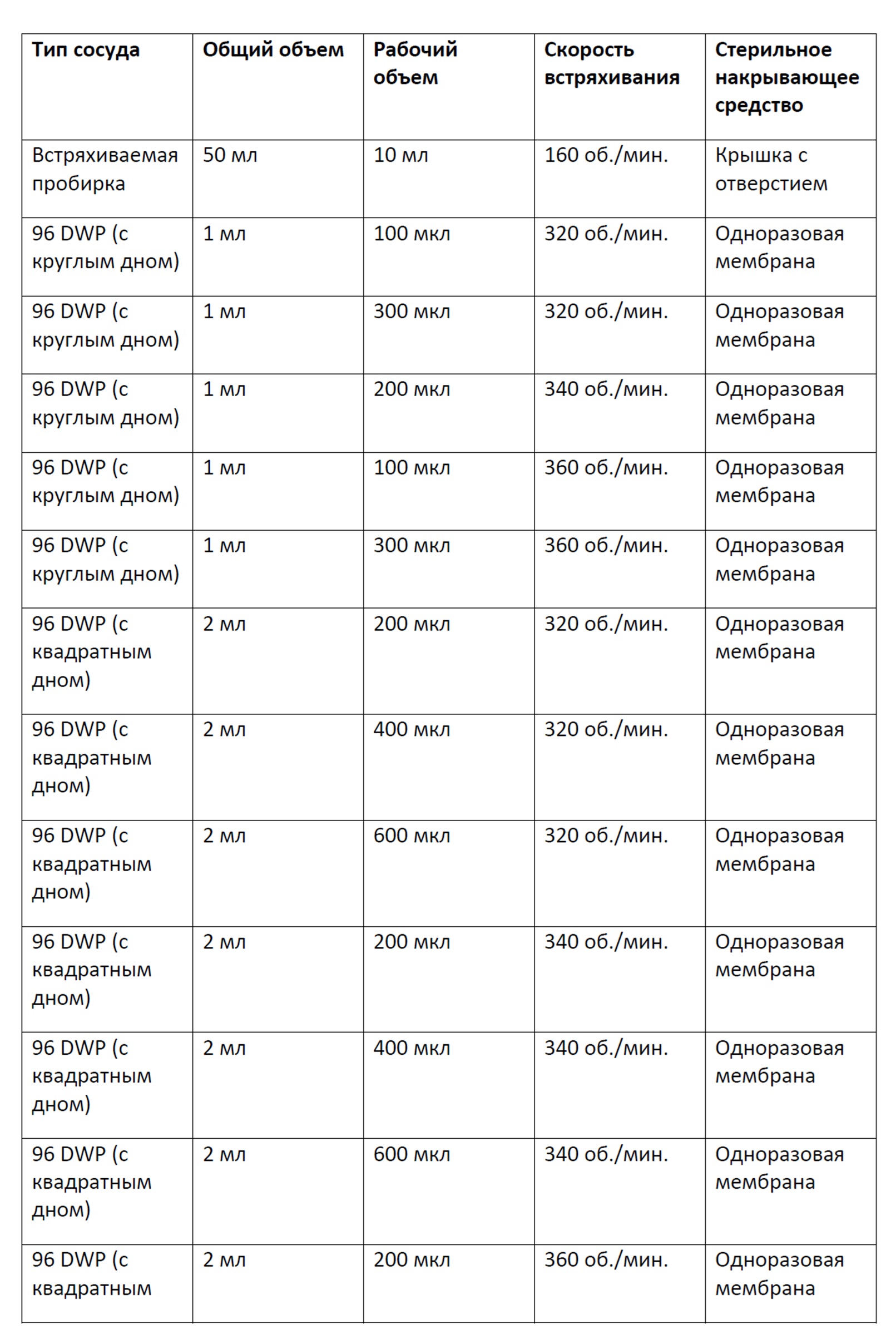
Профили плотности жизнеспособных клеток для 15-дневных культур клеток, поддерживаемых в среде CD CHO, приведенных в таблице 10, показаны на фигурах 15 и 16. Культуры в 96-луночных планшетах с глубокими лунками с круглым дном не давали таких хороших результатов, как культуры в лунках с квадратным дном в испытуемых условиях по настоящему изобретению (фигура 15 и фигура 16 соответственно). Наиболее высокая плотность жизнеспособных клеток, достигаемая в 96-луночных планшетах с глубокими лунками с круглым дном, составляла 20×106 клеток/мл в случае культуры объемом 100 мкл, перемешиваемой со скоростью 360 об/мин. Культуры в 96-луночных планшетах с глубокими лунками с квадратным дном характеризовались сравниваемыми значениями плотности жизнеспособных клеток (в пределах 1 стандартного отклонения) (в случае использования вышеописанного модифицированного режима повторной подпитки) в сравнении с культурами в контрольной встряхиваемой пробирке - с максимальной плотностью, близкой к 40×106 клеток/мл. Наилучшая производительность культур в 96-луночных планшетах с глубокими лунками с квадратным дном обеспечивалась при использовании объема культуры 400 мкл и при перемешивании со скоростью 320 об/мин или 340 об/мин, достигая максимальной плотности жизнеспособных клеток примерно 50×106 клеток/мл на 15 день. Более того, применение 96-луночных планшетов с глубокими лунками с квадратным дном, содержащих объем культуры 600 мкл и перемешиваемых со скоростью 340 об/мин, обуславливало рост клеток до 27×106 клеток/мл в день 13 и обеспечивало сравниваемые с культурами в контрольной встряхиваемой пробирке результаты (контрольный режим повторной подпитки), которые достигали максимальной плотности жизнеспособных клеток 31×106 клеток/мл. Среди всех тестируемых культур поддерживался процент жизнеспособность клеток 85%. Сравнение суммарной плотности жизнеспособных клеток для культур в контрольной встряхиваемой пробирке и культур в 96-луночных планшетах с глубокими лунками показано на фигурах 17 и 18.
Профили объемной продуктивности 15-дневных культур клеток, культивируемых в среде CD CHO, показаны на фигурах 19 и 20. Как и ожидалось, исходя из роста жизнеспособных клеток, культуры, выращенные в 96-луночных планшетах с глубокими лунками с круглым дном, характеризовались меньшей продуктивностью (фигура 19). Наилучшую объемную продуктивность 22000 единиц/л/день отмечали к 15 дню в культурах, выращенных в 96-луночных планшетах с глубокими лунками с круглым дном в 100 мкл культуральной среды и при перемешивании со скоростью 320 об/мин (фигура 19). Тем не менее культура в 96-луночном планшете с глубокими лунками с круглым дном с тем же объемом культуры и перемешиванием характеризовалась более низкой объемной продуктивностью (<5000 единиц/л/день) в течение предшествующих дней. В культурах в 96-луночных планшетах с глубокими лунками с квадратным дном (фигура 20) отмечали улучшенные показатели объемной продуктивности, которые точно соответствовали профилям роста. Сравниваемую активность (40000 единиц/л/день к 15 дню) отмечали для культур, характер роста которых очень напоминал характер роста для культур во встряхиваемой пробирке (культуры в лунках с квадратным дном, содержащих 600 мкл объема и перемешиваемых со скоростью 340 об/мин). Несколько культур с изначальным отставанием в росте, но в конечном счете с подобной максимальной плотностью жизнеспособных клеток, как и для культур во встряхиваемой пробирке (культур в 96-луночных планшетах с глубокими лунками с квадратным дном, содержащих объем 400 мкл и перемешиваемых со скоростью 340 об/мин, или объем 400 мкл или 600 мкл и перемешиваемых со скоростью 360 об/мин), характеризовались подобной объемной продуктивностью до 13 дня (достигая объемной продуктивности примерно 40000 единиц/л/день). После 13 дня объемная продуктивность снижалась, за исключением культур, выращенных в объеме 400 мкл и перемешиваемых со скоростью 360 об/мин, в случае которых достигали объемной продуктивности 60000 единиц/л/день к 15 дню. Наилучшую продуктивность отмечали в культурах в 96-луночных планшетах с глубокими лунками с квадратным дном, содержащих объем 400 мкл и перемешиваемых со скоростью 320 об/мин, в случае которых достигали объемной продуктивности 67000 единиц/л/день ко дню 15.
Большинство условий для культур в 96-луночных планшетах с глубокими лунками с круглым дном продемонстрировали сравниваемые или более низкие значения удельной продуктивности (SPR) по сравнению с культурами в контрольной встряхиваемой пробирке, за исключением культур, выращенных в объеме 100 мкл и перемешиваемых со скоростью 320 об/мин или в объеме 300 мкл и перемешиваемых со скоростью 360 об/мин (фигура 21). Данные культуры характеризовались повышенной удельной продуктивностью на 15 день. Пять культур в 96-луночных планшетах с глубокими лунками с квадратным дном со сравниваемыми или большими значениями объемной продуктивности также характеризовались сравниваемыми или большими значениями удельной продуктивности по сравнению с культурами в контрольной встряхиваемой пробирке (1600 единиц/1×109 клеток/день) (фигура 22).
Полученные данные загружали в JMP для планирования экспериментов для определения на основе статистического анализа наилучшего технологического условия. Наилучшее технологическое условие смоделировали при использовании трех характеристик: максимальная плотность жизнеспособных клеток, максимальная объемная продуктивность и максимальная удельная продуктивность. Все предельные значения откликов устанавливали с целью максимального увеличения выхода. Сперва данные приводили в соответствие с моделью, как показано на фигурах 23 и 24. Полученные данные плотности жизнеспособных клеток (фигура 23) и объемной продуктивности (фигура 24) в значительной степени согласовывались с моделью. Статистический анализ (t-критерий) выявил, что форма лунки и рабочий объем существенно влияли как на плотность жизнеспособных клеток, так и на их продуктивность, тогда как скорость встряхивания существенно влияла только на продуктивность.
Наилучшие технологические условия определили путем прогнозирования профилировщиком программы JMP (фигура 25). Исходя из анализа, наилучшая производительность клеток должна быть получена при использовании 96-луночных планшетов с глубокими лунками с квадратным дном с рабочим объемом 440 мкл и перемешивании со скоростью 360 об/мин. С учетом стандартных отклонений и сохранением аналогичной желательности, наилучший рабочий диапазон для 96-луночных планшетов с глубокими лунками с квадратным дном представлял собой рабочий объем, составляющий от приблизительно 350 мкл до приблизительно 550 мкл, а скорость встряхивания составляла от приблизительно 320 об/мин до приблизительно 360 об/мин.
Таким образом, данные показывают, что способы, предусмотренные в настоящем изобретении, можно применять в качестве модели крупномасштабных перфузионных культур клеток в биореакторе (например, путем достижения подобных значений плотности клеток за аналогичный промежуток времени). Способы, предусмотренные в настоящем изобретении, можно применять для высокопроизводительного скрининга тканевых культуральных сред (и компонентов тканевых культуральных сред).
Пример 2. Применение способов культивирования в 96-луночных планшетах с глубокими лунками для скрининга культуральной среды
Проводили серию экспериментов для испытания ряда различных тканевых культуральных сред с применением способов культивирования в 96-луночных планшетах с глубокими лунками. В этих экспериментах для инокулирования в 96-луночные планшеты с глубокими лунками с квадратным дном использовали линию рекомбинантных клеток млекопитающего, продуцирующую моноклональное антитело (клетку, продуцирующую mAb), или линию рекомбинантных клеток млекопитающего, продуцирующую фермент (клетку, продуцирующую, фермент), и клетки культивировали в течение одной недели в 500 мкл по меньшей мере одной из 102 различных тканевых культуральных сред при перемешивании со скоростью 330 об/мин Контролем в этих экспериментах была плотность жизнеспособных клеток, достигаемая при использовании того же 96-луночного планшета с глубокими лунками, той же культуральной среды, образца линии клеток и среды CD CHO. Как плотность жизнеспособных клеток, так и титр культуры измеряли в течение семи дней.
Данные на фигурах 26-29 показывают, что способы культивирования в 96-луночных планшетах с глубокими лунками, описанные в данном документе, могут служить для скрининга влияния различных тканевых культуральных сред на плотность жизнеспособных клеток и продуктивность культивируемых клеток.
ДРУГИЕ ВАРИАНТЫ ОСУЩЕСТВЛЕНИЯ
Следует понимать, что хотя настоящее изобретение описано в сочетании с его подробным описанием, вышеупомянутое описание предназначено для иллюстрации и не ограничивает объем настоящего изобретения, которое определено объемом прилагаемой формулы изобретения. Другие аспекты, преимущества и модификации находятся в пределах объема нижеследующей формулы изобретения.
Реферат
Изобретение относится к области биотехнологии. Изобретение представляет собой способ тестирования присутствия контаминанта в первой или второй жидкой культуральной среде, исходном материале, используемом для получения первой или второй жидкой культуральной среды, или источнике клетки млекопитающего, содержащей нуклеиновую кислоту, которая кодирует рекомбинантный белок, где способ включает: обеспечение многолуночного планшета, инкубацию многолуночного планшета, выявление рекомбинантного белка в клетке млекопитающего или в первой и/или второй жидкой культуральной среде; сравнение количества рекомбинантного белка, идентификацию первой или второй жидкой культуральной среды, исходного материала, используемого для получения первой или второй жидкой культуральной среды, или источника клетки млекопитающего, как содержащего контаминант, когда уровень продуцируемого рекомбинантного белка ниже эталонного уровня. Изобретение можно применять для высокопроизводительного скрининга тканевых культуральных сред и компонентов тканевых культуральных сред. 16 з.п. ф-лы, 2 пр., 10 табл., 29 ил.
Формула
Документы, цитированные в отчёте о поиске
Способы перфузионного культивирования и их применения
