Стабильные жидкие фармацевтические препараты слитого белка tnfr:fc - RU2614257C2
Код документа: RU2614257C2
Чертежи














Описание
Настоящее изобретение относится к стабильным жидким фармацевтическим препаратам слитого белка TNFR:Fc, содержащим различные буферные системы и стабилизаторы. При создании изобретения удалось, в частности, продемонстрировать, что физическая стабильность TNFR:Fc значительно улучшается при применении системы на основе цитратного буфера и лизина и/или пролина в качестве стабилизатора.
Предпосылки создания изобретения
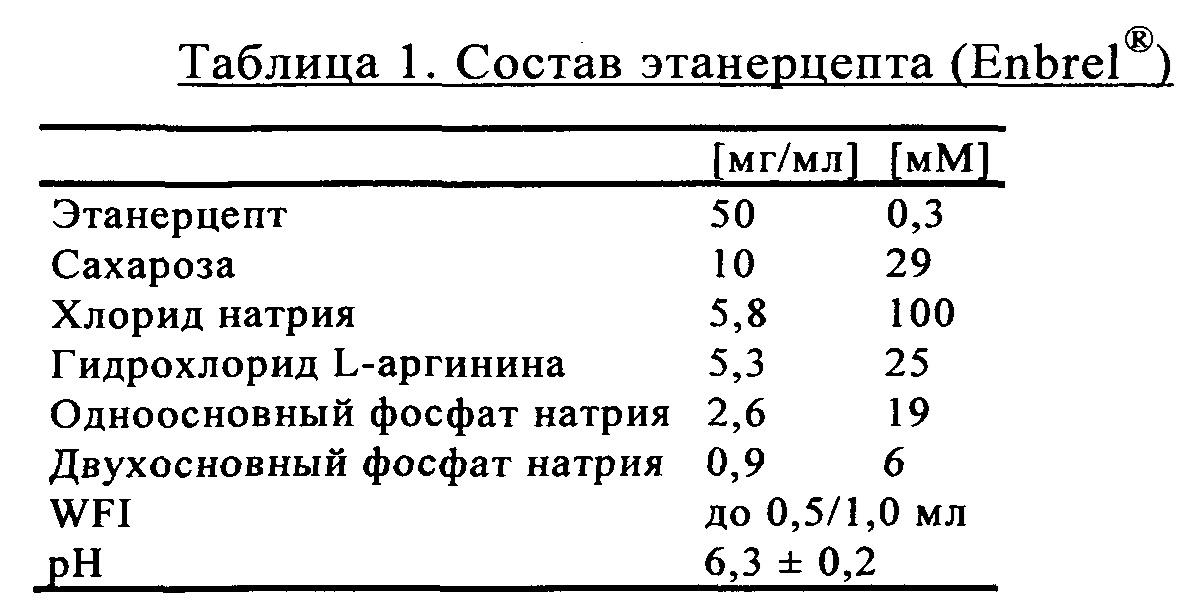
Поступающие в продажу препараты антител, как правило, приготавливают в фосфатном буфере. TNFR:Fc также, как правило, забуферивают в фосфате натрия (ЕР 1478394, WO 03/072060 А2). Например, содержащий белок TNFR:Fc этанерцепт, который в настоящее время поступает в продажу под товарным знаком Enbrel®, имеет состав, представленный в таблице 1.
Агрегацию содержащих антитело продуктов можно контролировать путем добавления небольших амфифильных молекул. Так, L-аргинин представляет собой аминокислоту, наиболее пригодную для подавления белковых взаимодействий в поступающих в продажу препаратах (Baynes и др., 44(12), 2005, cc.4919-4925; ЕР1478394). Представляя собой полярную добавку, она предотвращает агрегацию промежуточных продуктов при фолдинге белков.
Аналогично L-аргинину, L-лизин обладает способностью в значительной степени предупреждать индуцированную нагреванием и разбавлением агрегацию лизоцима (Shiraki и др., J Biochem, 132(4), 2002, cc.591-595).
L-пролин применяют в качестве стабилизатора в жидких препаратах иммуноглобулинов, таких как Sandoglobulin® или Privigen®. Являясь гидрофобной аминокислотой, он, вероятно, воздействует на гидрофобные белок-белковые взаимодействия и в результате защищает IgG от денатурации и агрегации. Кроме того, L-пролин обладает высокой безопасностью при введении пациентам с первичным иммунодефицитом, и, как установлено в опытах на животных, представляет собой малотоксичную аминокислоту (Bolli и др., Biologicals, 38(1), 2001, cc.150-157).
В современных исследованиях установлено, что цитратный буфер является ценным для препаратов моноклональных антител, поскольку он эффективно минимизирует расщепление, например, деаминирование аспарагина (Zheng и Janis, Int J Pharm, 308(1-2), 2006, cc.46-51). Другим преимуществом цитратного буфера является его способность стабилизировать значение рН в процессе замораживания, в то время как при применении общепринятой системы на основе фосфатного буфера обнаружено наибольшее изменение значения рН при снижении температуры с +25°С до -30°С (Kolhe и др., Biotechnol Prog, 26(3), 2010, cc.727-733).
Слитые белки могут образовывать различные продукты расщепления и агрегированные продукты, что в свою очередь может приводить к снижению активности и даже побочным действиям, таким как иммуногенность. Таким образом, все еще существует потребность в стабильном жидком препарате слитого белка TNFR:Fc.
Указанный препарат должен удовлетворять различным критериям. Он должен быть физиологически приемлемым и предпочтительно должен обеспечивать среду, гарантирующую стабильность биофармацевтического лекарственного средства в терапевтически эффективной концентрации. Кроме того, препарат должен обеспечивать удовлетворительный срок хранения лекарственного средства.
Таким образом, цель настоящего изобретения заключается в создании фармацевтических препаратов TNFR:Fc, которые можно применять в качестве альтернативы известным в данной области препаратам. Другая цель настоящего изобретения заключается в создании фармацевтических препаратов TNFR:Fc, которые имеют преимущество по сравнению с известными в данной области препаратами. И еще одна цель настоящего изобретения заключается в создании фармацевтических препаратов TNFR:Fc, которые обеспечивают меньшую агрегацию лекарственного средства по сравнению с известными в данной области препаратами.
При создании настоящего изобретения продемонстрировано, что путем замены, например, обычно применяемого фосфатного буфера на систему цитратного буфера и стабилизатора аргинина на лизин можно в значительной степени улучшать физическую стабильность TNFR:Fc. Предлагаемые буфер на основе лимонной кислоты и лизин в качестве стабилизатора защищают TNFR:Fc от расщепления, вызываемого механическим и температурным стрессом (при 25°С и 40°С), и установлено, что при рекомендуемой температуре хранения 2-8°С расщепление белка в предлагаемых препаратах существенно ниже, чем в обычно применяемых забуференных фосфатом препаратах. Таким образом, параметры качества, касающиеся физической стабильности продукта, можно улучшать. Повышенная физическая стабильность лекарственного продукта позволяет удлинять срок хранения по сравнению с общепринятыми содержащими продукт препаратами и гарантирует безопасность продукта.
Краткое изложение сущности изобретения
Первым объектом изобретения является фармацевтическая композиция, содержащая TNFR:Fc, цитратный буфер и аминокислоту, выбранную из группы, включающей лизин и пролин и их фармацевтически приемлемые соли.
Вторым объектом изобретения является набор, содержащий композицию, которая представляет собой первый объект изобретения, и инструкции по применению указанной композиции.
Третьим объектом изобретения является способ получения фармацевтической композиции, который представляет собой первый объект изобретения, заключающийся в том, что объединяют TNFR:Fc, цитратный буфер и аминокислоту, выбранную из группы, включающей лизин и пролин и их фармацевтически приемлемые соли.
И последним объектом изобретения является композиция, которая представляет собой первый объект изобретения, предназначенная для применения в медицине, в частности для лечения заболевания, выбранного из группы, включающей аутоиммунное заболевание, анкилозирующий спондилит, ювенильный ревматоидный артрит, псориаз, псориатический артрит, ревматоидный артрит, болезнь Вегенера (грануломатоз), болезнь Крона (или воспалительное заболевание кишечника), хроническое обструктивное заболевание легких (ХОЗЛ), гепатит С, эндометриоз, астму, кахексию, атонический дерматит, болезнь Альцгеймера и рак.
Подробное описание предпочтительных вариантов осуществления изобретения
Образование продуктов расщепления в процессе хранения TNFR:Fc, вероятно, является наиболее важным свойством молекулы. Когда TNFR:Fc входит в состав препаратов, содержащих цитрат, то он характеризуется в целом меньшей способностью к расщеплению, что может быть связано с более высоким чистым зарядом цитрата натрия по сравнению с фосфатом натрия и в результате возможным взаимодействием с заряженной молекулой TNFR:Fc.
Таким образом, первым объектом изобретения является фармацевтическая композиция, содержащая TNFR:Fc, цитратный буфер и аминокислоту, выбранную из группы, включающей лизин и пролин и их фармацевтически приемлемые соли.
Фактор некроза опухоли альфа (TNF-альфа) является представителем группы цитокинов, которые стимулируют реакцию острой фазы и, таким образом, он представляет собой цитокин, участвующий в системном воспалении. TNF-альфа обладает способностью индуцировать воспаление, индуцировать гибель клеток в результате апоптоза и ингибировать онкогенез и репликацию вирусов. С нарушением производства TNF-альфа связаны различные болезни человека, такие как аутоиммунное заболевание, анкилозирующий спондилит, ювенильный ревматоидный артрит, псориаз, псориатический артрит, ревматоидный артрит, болезнь Вегенера (грануломатоз), болезнь Крона или воспалительное заболевание кишечника, хроническое обструктивное заболевание легких (ХОЗЛ), гепатит С, эндометриоз, астма, кахексия, атопический дерматит, болезнь Альцгеймера, а также рак.
Его молекулы-рецепторы включают TNFR1 (TNF-рецептор типа 1; CD120a; р55/60; человеческий: RefSeq (мРНК): NM_001065, RefSeq (белок): NP_001056 (SEQ ID NO:1)) и TNFR2 (TNF-рецептор типа 2; CD120b; p75/80; человеческий: RefSeq (мРНК): NM_001066, RefSeq (белок): NP_001057 (SEQ ID NO:2)). TNF-R1 экспрессируется в большинстве тканей и может полностью активироваться как связанной с мембраной, так и растворимой тримерной формой TNF, в то время как TNF-R2 обнаружен только в клетках иммунной системы и реагирует на связанную с мембраной форму гомотримера TNF. При контакте с TNF-альфа TNF-рецепторы образуют тримеры и тем самым инициируют внутриклеточную передачу сигналов.
Таким образом, растворимые молекулы TNFR или их фрагменты, которые обладают способностью связываться с TNF-альфа, можно применять в качестве конкурентного ингибитора TNF-альфа. Настоящее изобретение относится к указанным растворимым молекулам TNFR, слитым с Fc-областью человеческого иммуноглобулина (TNFR:Fc).
В контексте настоящего изобретения компонент TNFR слитого белка TNFR:Fc обозначает любой полипептид TNFR, который идентичен по меньшей мере на 90%, предпочтительно по меньшей мере на 91%, например, по меньшей мере на 92% или по меньшей мере на 93%, более предпочтительно по меньшей мере на 94%, например, по меньшей мере на 95% или по меньшей мере на 96%, еще более предпочтительно по меньшей мере на 97%, например, по меньшей мере на 98% или по меньшей мере на 99% и наиболее предпочтительно на 100% аминокислотной последовательности, которая содержит по меньшей мере 150-250, предпочтительно по меньшей мере 175-245 аминокислот TNFR1 или TNFR2, предпочтительно TNFR2, более предпочтительно 200-240 и наиболее предпочтительно 225-235 аминокислот внеклеточной области TNFR2, и все еще сохраняет способность связываться с TNF-альфа по данным ELISA или любого другого общепринятого анализа. Более предпочтительно, указанный TNFR обладает способностью связываться с TNF-альфа и лимфотоксином альфа (LT-альфа) по данным ELISA или любого другого общепринятого анализа. Указанные анализы хорошо известны специалисту в данной области.
В целом считается, что полипептид «идентичен по меньшей мере на х%» аминокислотной последовательности определенной длины другого полипептида, если рассматриваемую последовательность выравнивают с наиболее соответствующей ей последовательностью аминокислотной последовательности и идентичность последовательностей этих двух выровненных последовательностей составляет по меньшей мере х%. Указанный сравнительный анализ первичной структуры последовательностей можно осуществлять с помощью, например, публично доступных компьютерных программ определения гомологии, таких как программа «BLAST», например, «blastp», которая представлена на домашней странице NCBI http://www.ncbi.nlm.nih.gov/blast/blast.cgi, с использованием задаваемых по умолчанию параметров, которые указаны в этих программах. Другие методы расчета процентов идентичности наборов полипептидов известны в данной области.
Fc-область (область кристаллизующегося фрагмента) обозначает хвостовую область антитела, и в случае IgG состоит из второго и третьего константного домена двух тяжелых цепей антитела. В определенных вариантах осуществления изобретения Fc-полипептид содержит константную область тяжелой цепи класса IgG или ее фрагмент или вариант, а в других вариантах осуществления изобретения для создания указанных слияний TNFR:Fc можно применять константную область иммуноглобулинов других изотипов. Например, можно применять полипептид TNFR:Fc, содержащий константную область тяжелой цепи IgM-класса или ее фрагмент и/или вариант. Предпочтительно Fc-фрагмент выводят из IgG, более предпочтительно из IgG1, еще более предпочтительно из человеческого IgG1. Константная область тяжелых цепей иммуноглобулина, которая в качестве конкретного примера представляет собой константный домен тяжелой цепи человеческого иммуноглобулина IgG1-класса, представленная в SEQ ID NO:3, содержит СН1-домен (аминокислоты 1-98 SEQ ID NO:3), шарнирную область (аминокислоты 99-110 SEQ ID NO:3), СН2-домен (аминокислоты 111-223 SEQ ID NO:3) и СН3-домен (аминокислоты 224-330 SEQ ID NO:3). В контексте настоящего описания Fc-домен может содержать один или все указанные компоненты: СН1 тяжелой цепи, шарнирную область, СН2- и СН3-домены, описанные выше, или их фрагменты или варианты. Конкретным вариантом осуществления изобретения является TNFR:Fc, содержащий весь или часть внеклеточного домена TNFR1 (SEQ ID NO:1) или TNFR2 (SEQ ID NO:2), который/которая слит/слита со всей или с частью SEQ ID NO:3, необязательно с помощью линкерного полипептида между TNFR-компонентом и Fc-компонентом комплекса TNFR:Fc. Например, в молекуле могут присутствовать СН1, СН2 и полная шарнирная область. В других вариантах осуществления изобретения константная область тяжелой цепи, которая содержит по меньшей мере часть СН1, представляет собой Fc-компонент TNFR:Fc. В некоторых вариантах осуществления изобретения она может включать, например, всю шарнирную область или C-концевую половину шарнирной области для обеспечения образования дисульфидного мостика между цепями. Например, СН1 может присутствовать вместе с первыми семью аминокислотами шарнирной области (аминокислоты 99-105 SEQ ID NO:3). В некоторых вариантах осуществления настоящего изобретения полипептид TNFR ковалентно связан, необязательно через полипептидный линкер, с N-концом по меньшей мере одного участка СН1-области константного домена тяжелой цепи с образованием TNFR:Fc.
Если требуется димерный слитый белок TNFR:Fc, то важно, чтобы он включал часть шарнирной области, которая участвует в образовании дисульфидного мостика между тяжелыми цепями (например, участок, состоящий из аминокислот 99-110 SEQ ID NO:3, который включает аминокислоту 109 SEQ ID NO:3). В других вариантах осуществления изобретения TNFR:Fc может содержать участки СН3-домена, которые не включают C-концевой остаток лизина (аминокислота 330 SEQ ID NO:3), поскольку, как установлено, этот остаток должен удаляться при посттрансляционном процессинге полипептидов тяжелых цепей IgG. Fc-слияния и Fc-фрагменты хорошо известны в данной области.
Предпочтительно слитый белок TNFR:Fc практически идентичен/подобен этанерцепту, более предпочтительно TNFR:Fc представляет собой этанерцепт.
Этанерцепт представляет собой димер двух молекул внеклеточной области рецептора TNF-альфа р75, каждая молекула состоит из 235 аминокислот выведенного из TNFR полипептида, который слит с состоящей из 232 аминокислот Fc-областью человеческого IgG1. Аминокислотная последовательность мономерного компонента этанерцепта представлена в SEQ ID NO:4. В димерной форме этой молекулы два из указанных слитых полипептидов (или «мономеров») удерживаются вместе с помощью трех дисульфидных мостиков, которые образованы между иммуноглобулиновыми областями двух мономеров. Таким образом, димер этанерцепта состоит из 934 аминокислот и имеет кажущуюся молекулярную массу примерно 150 кДа. В Северной Америке этанерцепт поступает в продажу от фирм Amgen и Pfizer под товарным знаком Enbrel® в виде двух различных препаратов, один в форме порошка, а другой в форме предварительно смешанной жидкости. Фирма Wyeth также поставляет на рынок Enbrel® вне пределов Северной Америки, исключая Японию, где лекарственное средство поступает в продажу от фирмы Takeda Pharmaceuticals.
Понятие «практически идентичен/подобен этанерцепту» в контексте настоящего изобретения означает, что аминокислотная последовательность TNFR:Fc идентична по меньшей мере на 95% аминокислотной последовательности, представленной в SEQ ID NO:4, более предпочтительно идентична по меньшей мере на 96%, например, идентична на 97%, и наиболее предпочтительно идентична на 98%, например, идентична на 99% аминокислотной последовательности, представленной в SEQ ID NO:4. В альтернативном или дополнительном варианте TNFR:Fc может отличаться от этанерцепта (лишь) пост-трансляционными модификациями, например, гликозилированием. Приемлемые методы изменения схемы гликозилирования, например, путем интродукции или делеции сайта гликозилирования, и анализы, предназначенные для оценки схемы гликозилирования, хорошо известны специалисту в данной области.
TNFR:Fc можно получать рекомбинантно, предпочтительно с помощью основанной на клетках млекопитающих экспрессионной системы. Предпочтительно указанная основанная на клетках млекопитающих экпрессионная система представляет собой по меньшей мере систему, выбранную из группы, включающей клеточные почки детеныша хомяка (например, BHK21); клеточные линии яичника китайского хомячка (например, СНО-K1, CHO-DG44, CHO-DXB или CHO-dhfr-); клеточные линии мышиной миеломы (например, SP2/0); клеточные линии мышиной миеломы (например, NSO); клеточные линии почки человеческого эмбриона (например, HEK-293); клеточные линии, выведенные из человеческой сетчатки (например, PER-C6), и/или линии клеток амниоцитов (например, CAP). Предпочтительно применяют экспрессионные системы на основе клеток хомяков. BHK21-клетки (клетки почки детеныша хомяка») принадлежат к квазидиплоидной созданной линии клеток сирийского хомяка, которые выведены из клона, характеризующегося необычно большой скоростью роста первичной культуры почечной ткани новорожденного хомяка. Примерами клеточных линий BHK-21 являются (но не ограничиваясь только ими) поступающие в продажу линии, и в контексте настоящего изобретения можно применять клеточные линии хомяка BHK-21 (С-13); BHK21-pcDNA3.1-HC; BHK570; Flp-In-BHK и/или BHK 21 (клон 13).
Клетки яичника китайского хомячка (СНО) представляют собой клеточную линию, выведенную из яичника китайского хомячка. Их часто используют в биологических и медицинских исследованиях, и они нашли коммерческое применение при производстве терапевтических белков. Их начали применять в 1960-х годах и исходно выращивали в виде монослойной культуры. В настоящее время СНО-клетки представляют собой наиболее широко применяемые клетки млекопитающих-хозяев для промышленного производства рекомбинатных терапевтических белков и их, как правило, выращивают в суспензионной культуре.
Примерами линий СНО-клеток, которые поступают в продажу и которые можно применять в контексте настоящего изобретения являются (но не ограничиваясь только ими) FreeStyle CHO-S-клетки; клеточная линия ER-CHO; СНО 1-15 500 CHINESE НАМ; CHO-DXB, CHO-dhfr-, CHO DP-12 клон №1934; CHO-CD36; CHO-ICAM-1; CHO-K1; Ovary; HuZP3-CHOLec3.2.8.1; xrs5; CHO-K1/ВВ2-клетки; CHO-K1/ВВ3-клетки; СНО-K1/EDG8/Galpha15-клетки; СНО-K1/М5-клетки; CHO-K1/NK1-клетки; CHO-K1/NK3-клетки; CHO-K1/NMUR1-клетки; CHO-K1/NTSR1-клетки; CHO-K1/OX1-клетки; CHO-K1/PAC1/Gα15-клетки; CHO-K1/PTAFR-клетки; CHO-K1/TRH1-клетки; CHO-K1/V1B-клетки; клеточная линия 5НТ1А Galpha-15-NFAT-BLA CHO-K1; клеточная линия AVPR2 CRE-BLA CHO-K1; CHO-S-клетки, адаптированные к SFMd; DG44-клетки; клеточная линия Flp-In-CHO; клеточная линия GeneSwitch-CHO; клеточная линия NFAT-bla CHO-K1; клеточная линия T-REx-CHO; стабильная клеточная линия GenoStat CHO K-1; набор, включающий стабильную клеточную линию GenoStat CHO K-1; клеточная линия хомячка CHO-K1, клеточная линия СНО-РЕРТ1, клеточная линия CHO SSF3 и/или СНО-НРТ1. В наиболее предпочтительном варианте осуществления изобретения экспрессионная система на основе клеток китайского хомячка представляет собой клеточную линию CHO-dhfr.
Фармацевтическая композиция может содержать TNFR:Fc в концентрации от 0,1 до 0,7 мМ, например, 0,2 или 0,6 мМ, предпочтительно в концентрации от 0,15 до 0,5 мМ, например 0,4 или 0,45 мМ, более предпочтительно в концентрации от 0,25 до 0,35 мМ, например, примерно 0,3 мМ.
Нитратный буфер может представлять собой любой приемлемый нитратный буфер. Например, цитратный буфер может содержать или состоять из цитрата натрия, цитрата калия, лимонной кислоты или их смесей. Цитратный буфер, вероятно, оказывает наибольшее влияние на стабильность препарата. В примерах продемонстрирована более высокая стабильность препарата, содержащего 50 мМ цитратный буфер, по сравнению с препаратом, содержащим 25 мМ цитратный буфер. Повышение концентрации по меньшей мере вплоть до 120 мМ может приводить к еще более существенным воздействиям. Вероятно, для стабилизации необходимо присутствие минимум 25 мМ цитратного буфера. Таким образом, фармацевтическая композиция может содержать цитратный буфер в концентрации от 25 до 120 мМ, например, от 30 до 115 мМ, предпочтительно в концентрации от 40 до 110 мМ, например, от 45 до 105 мМ, более предпочтительно в концентрации от 50 до 100 мМ, например, в концентрации 55, 60, 65, 70, 75, 80, 85, 90 или 95 мМ. В другом предпочтительном варианте осуществления изобретения фармацевтическая композиция содержит цитратный буфер в концентрации, которая указана для композиций, описанных в разделе «Примеры».
Значение рН предпочтительно составляет от 5 до 7,5, например, от 5,5 до 7, еще более предпочтительно от 6 до 6,6, например, от 6,1 до 6,5, более предпочтительно от 6,2 до 6,4, например, примерно 6,3. Установлено, что хотя предпочтительным значением рН является значение от 5 до 7,5, в альтернативном варианте можно применять также более низкие значения рН вплоть до 2,8, например, составляющие от 2,8 до 4,0.
Фармацевтическая композиция содержит аминокислоту, выбранную из группы, включающей лизин и пролин и их фармацевтически приемлемые соли, такие как гидрохлориды. Аминокислота может находиться в D-, L- или DL-конфигурации, предпочтительно в L-конфигурации.
При добавлении основной аминокислоты лизина в концентрации примерно 25 мМ имеет место выраженное аддитивное действие комбинации. По-видимому, добавление лизина, в концентрации вплоть до 100 мМ должно характеризоваться аддитивным действием. Таким образом, фармацевтическая композиция может содержать аминокислоту в концентрации от 15 до 100 мМ, предпочтительно в концентрации от 20 до 90 мМ, более предпочтительно в концентрации от 25 до 75 мМ. В другом предпочтительном варианте осуществления изобретения фармацевтическая композиция содержит аминокислоту в концентрации, которая указана для композиций, описанных в разделе «Примеры». В наиболее предпочтительном варианте осуществления изобретения аминокислота представляет собой лизин или ее фармацевтически приемлемые соли.
Кроме того, фармацевтическая композиция может содержать также по меньшей мере один модификатор тоничности, В контексте настоящего описания подразумевается, что понятие «модификатор тоничности» относится к молекуле, отличной от цитрата, лизина, или пролина, которая влияет на осмотическое давление раствора. Предпочтительно осмотическое давление фармацевтической композиции регулируют для стабилизации действующего вещества и минимизации дискомфорта пациента при введении. Как правило, предпочтительно, чтобы фармацевтическая композиция была изотоничной сыворотке, т.е. имела такое же или сходное осмотическое давление, а именно, осмотическое давление примерно от 180 до 480 мОсмоль/кг. Предпочтительно по меньшей мере один модификатор тоничности выбирают из группы, включающей хлорид натрия, цистеин, гистидин, глицин, хлорид калия, сахарозу, глюкозу и маннит, более предпочтительно модификатор тоничности представляет собой хлорид натрия и/или сахарозу. Фармацевтическая композиция может содержать по меньшей мере один модификатор тоничности в общей концентрации от 5 до 200 мМ, например, от 10 до 190 мМ, от 15 до 180 мМ, от 20 до 170 мМ, от 25 до 160 мМ, от 30 до 150 мМ, от 35 до 140 мМ, от 40 до 130 мМ или от 45 до 120 мМ, например, 110 мМ, но предпочтительно в концентрации от 50 до 100 мМ. В другом предпочтительном варианте осуществления изобретения фармацевтическая композиция содержит модификатор(ы) тоничности в концентрации, которая указана для композиций, описанных в разделе «Примеры».
Кроме того, фармацевтическая композиция может содержать по меньшей мере один эксципиент. В контексте настоящего описания понятие «эксципиент» относится к фармакологически неактивной субстанции, которую применяют в фармацевтической композиции в качестве носителя действующего вещества. В некоторых случаях введение «активной» субстанции может оказаться затруднительным и она может плохо абсорбироваться в организме человека. В таких случаях рассматриваемую субстанцию можно смешивать с эксципиентом или растворять в растворе эксципиента. Эксципиенты можно применять также для увеличения объема препаратов, которые содержат очень активные действующие вещества, для обеспечения удобства и точного дозирования. Помимо их применения в количестве, необходимом для получения однодозовой композиции, эксципиенты можно применять также в процессе производства для оптимизации обработки, связанной с активной субстанцией. В зависимости от пути введения и формы фармацевтической композиции можно применять различные эксципиенты. Так, эксципиенты могут содержать среди прочего антиадгезивы, связующие вещества, красители и консерванты, такие как антиоксиданты.
Например, по меньшей мере один эксципиент можно выбирать из группы, включающей лактозу, глицерин, ксилит, сорбит, маннит, мальтозу, инозит, трегалозу, глюкозу, бычий сывороточный альбумин (БСА), декстран, поливинилацетат (ПВА), гидроксипропилметилцелюлозу (ГПМЦ), полиэтиленимин (ПЭИ), желатин, поливинилпирролидон (ПВП), гидроксиэтилцеллюлозу (ГЭЦ), полиэтиленгликоль (ПЭГ), этиленгликоль, диметилсульфоксид (ДМСО), диметилформамид (ДМФ), L-серин, глутамат натрия, аланин, глицин, саркозин, гамма-аминомасляную кислоту (ГАМК), полиоксиэтиленсорбитанмонолаурат (Твин-20), полиоксиэтиленсорбитанмоноолеат (Твин-80), додецилсульфат натрия (ДСН), полисорбат, сополимер полиоксиэтилена, фосфат калия, ацетат натрия, сульфат аммония, сульфат магния, сульфат натрия, N-оксид триметиламина, бетаин, ионы цинка, ионы меди, ионы кальция, ионы магния, CHAPS, монолаурат сахарозы и 2-O-бета-манноглицерат. В предпочтительном варианте осуществления изобретения эксципиент можно выбирать из числа субстанций, указанных в разделе «Примеры».
Фармацевтическая композиция может содержать по меньшей мере один эксципиент в общей концентрации, составляющей по меньшей мере 0,1 мМ, например, от 0,1 до 0,7 мМ, например, в концентрации 0,6 мМ, предпочтительно в концентрации от 0,15 до 0,5 мМ, например, от 0,2 до 0,4 мМ, более предпочтительно в концентрации от 0,24 до 0,34 мМ. В другом предпочтительном варианте осуществления изобретения фармацевтическая композиция содержит эксципиент в концентрации, которая указана для композиций, описанных в разделе «Примеры».
Предпочтительно композиция является жидкой. Однако в другом варианте осуществления изобретения фармацевтическая композиция может быть лиофилизированной и ее можно восстанавливать, например, путем добавления воды с получением жидкой композиции. Таким образом, фармацевтическая композиция может содержать также фармацевтически приемлемый растворитель. В предпочтительном варианте осуществления изобретения фармацевтически приемлемый растворитель представляет собой воду. Указанные в настоящем описании концентрации компонентов относятся к жидкому препарату, а также к уже готовому лиофилизату или препарату, подлежащему лиофилизации.
Эксципиенты могут оказывать защитное действие в процессе замораживания лиофилизированных препаратов, т.е. обладать так называемыми криозащитными свойствами. Кроме того, можно добавлять металлхелатирующие агенты и поверхностно-активные вещества. Некоторые агенты могут обладать двойным действием, например, некоторые сахара или сахарные спирты могут служить, например, в качестве эксципиента, криопротектанта и/или модифицирующего тоничность агента.
Препарат, предлагаемый в настоящем изобретении, в виде водного раствора готов к применению, в то время как препарат, предлагаемы в настоящем изобретении, в лиофилизированном состоянии можно превращать в жидкие препараты, например, путем добавления воды для инъекции.
Наиболее предпочтительные композиции содержат (или состоят из) TNFR:Fc, например, этанерцепт в количестве от 0,1 до 0,7 мМ, цитратный буфер, например, цитрат натрия, в количестве от 25 до 120 мМ, лизин, например, гидрохлорид лизина, в количестве от 15 до 100 мМ, сахарозу в количестве от 10 до 100 мМ и хлорид натрия в количестве 5 до 200 мМ, значение рН составляет примерно 6,3.
В альтернативном варианте фармацевтическая композиция может содержать (или состоять из) TNFR:Fc, например, этанерцепт, в количестве 0,3 мМ, цитратный буфер, например, цитрат натрия, в количестве 50 мМ, лизин, например, гидрохлорид лизина, в количестве 25 мМ, сахарозу в количестве 29 мМ и хлорид натрия в количестве 75 мМ, значение рН составляет примерно 6,3.
В другом предпочтительном варианте осуществления изобретения фармацевтическая композиция может содержать (или состоять из) TNFR:Fc, например, этанерцепт, в количестве 0,3 мМ, цитратный буфер, например, цитрат натрия, в количестве 25 мМ, лизин, например, гидрохлорид лизина, в количестве 25 мМ, сахарозу в количестве 29 мМ и хлорид натрия в количестве 88 мМ, значение рН составляет примерно 6,3.
Однако фармацевтическая композиция может также содержать (или состоять из) этанерцепт в количестве от 0,1 до 0,7 мМ, цитратный буфер, например, цитрат натрия, в количестве от 25 до 120 мМ, пролин в количестве от 15 до 100 мМ, сахарозу в количестве от 10 до 100 мМ и хлорид натрия в количестве от 5 до 200 мМ, значение рН составляет примерно 6,3.
И, наконец, фармацевтическая композиция может содержать (или состоять из) TNFR:Fc, например, этанерцепт, в количестве 0,3 мМ, цитратный буфер, например, цитрат натрия, в количестве 25 мМ, пролин в количестве 25 мМ, сахарозу в количестве 29 мМ и хлорид натрия в количестве 75 мМ, значение рН составляет примерно 6,3.
Фармацевтическая композиция может также содержать (или состоять из) TNFR:Fc, например, этанерцепт, в количестве 0,3 мМ, цитратный буфер, например, цитрат натрия, в количестве 50 мМ, лизин, например, гидрохлорид лизина, в количестве 50 мМ, сахарозу в количестве 29 мМ и хлорид натрия в количестве 75 мМ, значение рН составляет примерно 6,3.
Фармацевтическая композиция может также содержать (или состоять из) TNFR:Fc, например, этанерцепт, в количестве 0,3 мМ, цитратный буфер, например, цитрат натрия, в количестве 120 мМ, лизин, например, гидрохлорид лизина, в количестве 25 мМ, сахарозу в количестве 29 мМ и хлорид натрия в количестве 75 мМ, значение рН составляет примерно 6,3.
Фармацевтическая композиция может также содержать (или состоять из) TNFR:Fc, например, этанерцепт, в количестве 0,3 мМ, цитратный буфер, например, цитрат натрия, в количестве 120 мМ, лизин, например, гидрохлорид лизина, в количестве 50 мМ, сахарозу в количестве 29 мМ и хлорид натрия в количестве 75 мМ, значение рН составляет примерно 6,3.
Фармацевтическая композиция может также содержать (или состоять из) TNFR:Fc, например, этанерцепт, в количестве 0,3 мМ, цитратный буфер, например, цитрат натрия, в количестве 50 мМ, лизин, например, гидрохлорид лизина, в количестве 50 мМ, сахарозу в количестве 29 мМ и хлорид натрия в количестве 75 мМ, значение рН составляет примерно 6,3.
Фармацевтическая композиция может также содержать (или состоять из) TNFR:Fc, например, этанерцепт, в количестве 0,3 мМ, цитратный буфер, например, цитрат натрия, в количестве 50 мМ, лизин, например, гидрохлорид лизина, в количестве 50 мМ, сахарозу в количестве 29 мМ и хлорид натрия в количестве 51 мМ, значение рН составляет примерно 6,3.
Фармацевтическая композиция может также содержать (или состоять из) TNFR:Fc, например, этанерцепт, в количестве 0,3 мМ, цитратный буфер, например, цитрат натрия, в количестве 120 мМ, лизин, например, гидрохлорид лизина, в количестве 25 мМ, сахарозу в количестве 29 мМ и хлорид натрия в количестве 22 мМ, значение рН составляет примерно 6,3.
Фармацевтическая композиция может также содержать (или состоять из) TNFR:Fc, например, этанерцепт, в количестве 0,3 мМ, цитратный буфер, например, цитрат натрия, в количестве 120 мМ, лизин, например, гидрохлорид лизина, в количестве 50 мМ и сахарозу в количестве 29 мМ, значение рН составляет примерно 6,3.
Фармацевтическая композиция может также содержать (или состоять из) TNFR:Fc, например, этанерцепт, в количестве 0,3 мМ, цитратный буфер, например, цитрат натрия, в количестве 50 мМ, лизин, например, гидрохлорид лизина, в количестве 50 мМ и хлорид натрия в количестве 75 мМ, значение рН составляет примерно 6,3.
Фармацевтическая композиция может также содержать (или состоять из) TNFR:Fc, например, этанерцепт, в количестве 0,3 мМ, цитратный буфер, например, цитрат натрия, в количестве 120 мМ, лизин, например, гидрохлорид лизина, в количестве 25 мМ и хлорид натрия в количестве 36 мМ, значение рН составляет примерно 6,3.
Фармацевтическая композиция может также содержать (или состоять из) TNFR:Fc, например, этанерцепт, в количестве 0,3 мМ, цитратный буфер, например, цитрат натрия, в количестве 120 мМ, лизин, например, гидрохлорид лизина, в количестве 50 мМ и хлорид натрия в количестве 17 мМ, значение рН составляет примерно 6,3.
Фармацевтическая композиция может также содержать (или состоять из) TNFR:Fc, например, этанерцепт, в количестве 0,3 мМ, цитратный буфер, например, цитрат натрия, в количестве 50 мМ, лизин, например, гидрохлорид лизина, в количестве 50 мМ, сахарозу в количестве 29 мМ и хлорид натрия в количестве 75 мМ, значение рН составляет примерно 6,3.
Фармацевтическая композиция может также содержать (или состоять из) TNFR:Fc, например, этанерцепт, в количестве 0,3 мМ, цитратный буфер, например, цитрат натрия, в количестве 75 мМ, лизин, например, гидрохлорид лизина, в количестве 25 мМ, сахарозу в количестве 29 мМ и хлорид натрия в количестве 75 мМ, значение рН составляет примерно 6,3.
Фармацевтическая композиция может также содержать (или состоять из) TNFR:Fc, например, этанерцепт, в количестве 0,3 мМ, цитратный буфер, например, цитрат натрия, в количестве 75 мМ, лизин, например, гидрохлорид лизина, в количестве 50 мМ, сахарозу в количестве 29 мМ и хлорид натрия в количестве 75 мМ, значение рН составляет примерно 6,3.
Фармацевтическая композиция может также содержать (или состоять из) TNFR:Fc, например, этанерцепт, в количестве 0,3 мМ, цитратный буфер, например, цитрат натрия, в количестве 75 мМ, лизин, например, гидрохлорид лизина, в количестве 25 мМ, сахарозу в количестве 29 мМ и хлорид натрия в количестве 56 мМ, значение рН составляет примерно 6,3.
Фармацевтическая композиция может также содержать (или состоять из) TNFR:Fc, например, этанерцепт, в количестве 0,3 мМ, цитратный буфер, например, цитрат натрия, в количестве 75 мМ, лизин, например, гидрохлорид лизина, в количестве 50 мМ, сахарозу в количестве 29 мМ и хлорид натрия в количестве 31 мМ, значение рН составляет примерно 6,3.
Фармацевтическая композиция может также содержать (или состоять из) TNFR:Fc, например, этанерцепт, в количестве 0,3 мМ, цитратный буфер, например, цитрат натрия, в количестве 75 мМ, лизин, например, гидрохлорид лизина, в количестве 25 мМ, сахарозу в количестве 19 мМ и хлорид натрия в количестве 75 мМ, значение рН составляет примерно 6,3.
Фармацевтическая композиция может также содержать (или состоять из) TNFR:Fc, например, этанерцепт, в количестве 0,3 мМ, цитратный буфер, например, цитрат натрия, в количестве 75 мМ, лизин, например, гидрохлорид лизина, в количестве 50 мМ и хлорид натрия в количестве 59 мМ, значение рН составляет примерно 6,3.
Фармацевтическая композиция может также содержать (или состоять из) TNFR:Fc, например, этанерцепт, в количестве 0,3 мМ, цитратный буфер, например, цитрат натрия, в количестве 25 мМ, лизин, например, гидрохлорид лизина, в количестве 25 мМ, сахарозу в количестве 29 мМ и хлорид натрия в количестве 75 мМ, значение рН составляет примерно 6,3.
Фармацевтическая композиция может также содержать (или состоять из) TNFR:Fc, например, этанерцепт, в количестве 0,3 мМ, цитратный буфер, например, цитрат натрия, в количестве 25 мМ, лизин, например, гидрохлорид лизина, в количестве 50 мМ, сахарозу в количестве 29 мМ и хлорид натрия в количестве 75 мМ, значение рН составляет примерно 6,3.
Фармацевтическая композиция может также содержать (или состоять из) TNFR:Fc, например, этанерцепт, в количестве 0,3 мМ, цитратный буфер, например, цитрат натрия, в количестве 50 мМ, лизин, например, гидрохлорид лизина, в количестве 25 мМ, сахарозу в количестве 29 мМ и хлорид натрия в количестве 75 мМ, значение рН составляет примерно 6,3.
Фармацевтическая композиция может также содержать (или состоять из) TNFR:Fc, например, этанерцепт, в количестве 0,3 мМ, цитратный буфер, например, цитрат натрия, в количестве 50 мМ, лизин, например, гидрохлорид лизина, в количестве 50 мМ, сахарозу в количестве 29 мМ и хлорид натрия в количестве 75 мМ, значение рН составляет примерно 6,3.
Фармацевтическая композиция может также содержать (или состоять из) TNFR:Fc, например, этанерцепт, в количестве 0,3 мМ, цитратный буфер, например, цитрат натрия, в количестве 50 мМ, лизин, например, гидрохлорид лизина, в количестве 50 мМ, сахарозу в количестве 29 мМ и хлорид натрия в количестве 48 мМ, значение рН составляет примерно 6,3.
Фармацевтическая композиция может также содержать (или состоять из) TNFR:Fc, например, этанерцепт, в количестве 0,3 мМ, цитратный буфер, например, цитрат натрия, в количестве 25 мМ, лизин, например, гидрохлорид лизина, в количестве 25 мМ, сахарозу в количестве 29 мМ и хлорид натрия в количестве 88 мМ, значение рН составляет примерно 6,3.
Фармацевтическая композиция может также содержать (или состоять из) TNFR:Fc, например, этанерцепт, в количестве 0,3 мМ, цитратный буфер, например, цитрат натрия, в количестве 25 мМ, пролин в количестве 25 мМ, сахарозу в количестве 29 мМ и хлорид натрия в количестве 88 мМ, значение рН составляет примерно 6,3.
Фармацевтическая композиция может также содержать (или состоять из) TNFR:Fc, например, этанерцепт, в количестве 0,3 мМ, цитратный буфер, например, цитрат натрия, в количестве 25 мМ, пролин в количестве 25 мМ, сахарозу в количестве 29 мМ и хлорид натрия в количестве 100 мМ, значение рН составляет примерно 6,3.
Фармацевтическая композиция может также содержать (или состоять из) TNFR:Fc, например, этанерцепт, в количестве 0,3 мМ, цитратный буфер, например, цитрат натрия, в количестве 25 мМ, лизин, например, гидрохлорид лизина, в количестве 25 мМ, сахарозу в количестве 29 мМ и хлорид натрия в количестве 88 мМ, значение рН составляет примерно 6,3.
Фармацевтическая композиция может также содержать (или состоять из) TNFR:Fc, например, этанерцепт, в количестве 0,3 мМ, цитратный буфер, например, цитрат натрия, в количестве 25 мМ, лизин, например, гидрохлорид лизина, в количестве 25 мМ, сахарозу в количестве 29 мМ и хлорид натрия в количестве 75 мМ, значение рН составляет примерно 6,3.
Фармацевтическая композиция может также содержать (или состоять из) TNFR:Fc, например, этанерцепт, в количестве 0,3 мМ, цитратный буфер, например, цитрат натрия, в количестве 50 мМ, лизин, например, гидрохлорид лизина, в количестве 50 мМ, сахарозу в количестве 29 мМ и хлорид натрия в количестве 50 мМ, значение рН составляет примерно 6,3.
Фармацевтическая композиция может также содержать (или состоять из) TNFR:Fc, например, этанерцепт, в количестве 0,3 мМ, цитратный буфер, например, цитрат натрия, в количестве 75 мМ, лизин, например, гидрохлорид лизина, в количестве 25 мМ, сахарозу в количестве 29 мМ и хлорид натрия в количестве 50 мМ, значение рН составляет примерно 6,3.
Фармацевтическая композиция может также содержать (или состоять из) TNFR:Fc, например, этанерцепт, в количестве 0,3 мМ, цитратный буфер, например, цитрат натрия, в количестве 65 мМ, лизин, например, гидрохлорид лизина, в количестве 25 мМ, сахарозу в количестве 29 мМ и хлорид натрия в количестве 55 мМ, значение рН составляет примерно 6,3.
Предпочтительно фармацевтическая композиция представляет собой стабильную жидкую композицию. Понятие «стабильная» в контексте настоящего описания означает, что TNFR:Fc отличается одной или несколькими следующими особенностями:
(I) характеризуется наличием менее 99% продуктов агрегации (АП) (SUM АП), более предпочтительно менее 98,5% SUM АП, еще более предпочтительно менее 98% SUM АП, наиболее предпочтительно менее 97,5% SUM АП по сравнению с таким же TNFR:Fc, приготовленным в виде обычно применяемого препарата на основе фосфатного буфера, который содержит этанерцепт в количестве 0,3 мМ в матриксе, включающем фосфатный буфер в количестве 25 мМ, аргинин в количестве 25 мМ и хлорид натрия в молярной концентрации, превышающей 75 мМ, или в количестве, необходимом для придания изотоничности, по данным, полученным с помощью SEC, после трех месяцев хранения при 40°С;
(II) и/или характеризуется наличием менее 99% продуктов расщепления (РП) (SUM РП), более предпочтительно менее 98% SUM РП, еще более предпочтительно менее 97% SUM РП, еще более предпочтительно менее 96% SUM РП, например, менее 95% SUM РП, наиболее предпочтительно менее 94% SUM РП, например, менее 93% SUM РП, по сравнению с таким же TNFR:Fc, приготовленным в виде обычно применяемого препарата на основе фосфатного буфера, который содержит этанерцепт в количестве 0,3 мМ в матриксе, включающем фосфатный буфер в количестве 25 мМ, аргинин в количестве 25 мМ и хлорид натрия в молярной концентрации, превышающей 75 мМ, или в количестве, необходимом для придания изотоничности, по данным, полученным с помощью SEC, после трех месяцев хранения при 40°С.
Таким образом, фармацевтический препарат, предлагаемый в изобретении, можно соответствующим образом приготавливать для длительного хранения. В контексте настоящего описания понятие «длительное хранение» относится к хранению композиции, содержащей фармацевтический препарат, в течение более 1 месяца, предпочтительно более 2, 3, 4, 5, 6, 7, 8, 9, 10, 11 или даже 12 месяцев.
Как описано ниже в примерах, стабильность препаратов, содержащих систему либо цитратного, либо фосфатного буфера в сочетании либо с лизином, либо с пролином в качестве стабилизатора, оценивали в течение трехмесячного опыта по оценке стабильности в рекомендованных (2-8°С), а также в условиях ускоренного хранения (25°С и 40°С). При этом установлено, что препараты, содержащие систему цитратного буфера, превышали препараты, содержащие систему фосфатного буфера, по таким показателям, как образование «хвостов» пиков (по данным анализа с помощью обращеннофазовой хроматографии (RPC)), образование продуктов расщепления (по данным анализа, например, с помощью SEC) и образование кислотных пиков (по данным анализа, например, с помощью СЕХ).
Указанные явления оказались частично даже более выраженными, включая повышенную стабилизацию TNFR:Fc, приготовленного в матриксе для препарата, который содержит цитрат/лизин, если препараты хранили во флаконах, имеющих большую поверхностью раздела жидкость/воздух. Данные по определению стабильности жидкой композиции дополнительно проиллюстрированы в разделе «Примеры» и, в частности, в примере 3.
Фармацевтическую композицию, которая представляет собой первый объект настоящего изобретения, можно применять в медицине. Болезни, которые можно лечить с помощью фармацевтической композиции, предлагаемой в изобретении, включают (но не ограничиваясь только ими) аутоиммунное заболевание, анкилозирующий спондилит, ювенильный ревматоидный артрит, псориаз, псориатический артрит, ревматоидный артрит, болезнь Вегенера (грануломатоз), болезнь Крона или воспалительное заболевание кишечника, хроническое обструктивное заболевание легких (ХОЗЛ), гепатит С, эндометриоз, астму, кахексию, атопический дерматит, болезнь Альцгеймера и рак. Таким образом, изобретение относится также к способу лечения, заключающемуся в том, что вводят композицию, которая представляет собой первый объект изобретения, индивидууму, нуждающемуся в этом, например, индивидууму, который страдает одной или несколькими указанными выше болезнями.
Доза TNFR:Fc должна зависеть от заболевания, серьезности состояния, истории болезни пациента и ответа на (предшествующую) терапию, и лечащий врач должен ее регулировать и осуществлять мониторинг. Фармацевтическую композицию можно вводить парентерально, например, подкожно, внутримышечно, внутривенно, внутрибрюшинно, в спинной мозг, внутрисосудисто, в синовиальную жидкость и/или внутриоболочечно либо с помощью болюсной инъекции, либо путем непрерывной инфузии.
Доза TNFR:Fc для взрослого может составлять примерно от 1 до 500 мг/м2, или примерно от 1 до 200 мг/м2 или примерно от 1 до 40 мг/м2 или примерно от 5 до 25 мг/м2. В альтернативном варианте можно вводить постоянную (базовую) дозу, количество которой может находиться в диапазоне от 2 до 500 мг/дозу, от 2 до 100 мг/дозу или примерно от 10 до 80 мг/дозу. Дозу можно вводить более одного раза в неделю, например, два или большее количество раз в неделю, используя 25-100 мг/дозу. В другом варианте осуществления изобретения приемлемая для введения путем инъекции доза содержит 80-100 мг/дозу, например, 80 мг на дозу. Дозы можно вводить еженедельно, через неделю или через несколько недель, например, с интервалом, составляющим три недели.
Подразумевается также, что улучшения состояния пациента можно достигать при использовании дозы, включающей вплоть до 100 мг фармацевтической композиции, один-три раза в неделю в течение периода времени, составляющего по меньшей мере три недели, хотя могут требоваться более длительные периоды времени для обеспечения индукции требуемой степени улучшения. Однако для неизлечимых хронических состояний схему приема можно продолжать в течение неопределенного срока. Схема приема для детей (возрастом 4-17 лет) может включать дозу от 0,4 до 5 мг/кг TNFR:Fc, которую применяют один или несколько раз в неделю.
Более конкретно, в случае ревматоидного артрита можно вводить 25 мг TNFR:Fc дважды в неделю. В другом варианте, как установлено, безопасным и эффективным является введение 50 мг один раз в неделю.
В случае псориатического артрита и анкилозирующего спондилита рекомендованная доза TNFR:Fc составляет 25 мг при введении дважды в неделю или 50 мг при введении один раз в неделю.
В случае бляшечного псориаза рекомендованная доза TNFR:Fc составляет 25 мг при введении дважды в неделю или 50 мг при введении один раз в неделю. В альтернативном варианте, можно вводить 50 мг дважды в неделю в течение вплоть до 12 недель, а затем при необходимости использовать дозу 25 мг дважды в неделю или 50 мг один раз в неделю. Лечение с использованием TNFR:Fc следует продолжать вплоть до достижения ремиссии, в течение периода времени вплоть до 24 недель. Некоторым взрослым пациентам может требоваться продолжать лечение свыше 24 недель. Лечение пациентов, у которых не обнаружен ответ после 12 недель, следует прекращать. Если показано повторное лечение с использованием TNFR:Fc, то следует соблюдать некоторые правила, касающиеся продолжительности лечения. Доза, предназначенная для применения дважды в неделю, должна составлять 25 мг, предназначенная для введения один раз в неделю - 50 мг.
В случае ювенильного идиопатического артрита (возраст пациента 4 года и выше), можно вводить 0,4 мг/кг (максимум вплоть до 25 мг на дозу) после восстановления 25 мг TNFR:Fc в 1 мл растворителя дважды в неделю в виде подкожной инъекции с интервалом между дозами 3-4 дня.
В случае детского бляшечного псориаза (возраст пациента 8 лет и выше) можно применять 0,8 мг/кг (максимум вплоть до 50 мг на дозу) один раз в неделю в течение вплоть до 24 недель. Лечение пациентов, у которых не обнаружен ответ после 12 недель, следует прекращать. Если показано повторное лечение с использованием TNFR:Fc, то необходимо следовать указанным выше руководствам, касающимся продолжительности лечения. Доза должна составлять 0,8 мг/кг (максимум вплоть до 50 мг на дозу) и ее следует применять один раз в неделю.
В случае почечной и печеночной недостаточности не требуется регулирование доз.
Вторым объектом изобретения является набор, содержащий композицию, которая представляет собой первый объект изобретения, и инструкции по применению композиции, предлагаемой в настоящем изобретении.
В предпочтительном варианте осуществления изобретения композиция находится в предварительно заполненном шприце. В другом предпочтительном варианте осуществления изобретения композиция находится в предварительно заполненном флаконе. Набор может содержать одну или несколько форм стандартных доз, включающих фармацевтическую композицию, предлагаемую в изобретении. Примерами приемлемых шприцев являются BD Hypak SCF вместимостью 1 мл, стеклянные предназначенные для предварительно заполнения шприцы, снабженные покрытыми политетрафторэтиленом (ПТФЭ) пробками (резина качества 4023/50 фирмы West). Стеклянные флаконы могут представлять собой, например, стеклянные флаконы типа 6R (гидролитический класс I), снабженные покрытыми ПТФЭ пробками (резина качества 4023/50 фирмы West). Однако можно использовать любой другой приемлемый шприц или флакон. Набор может содержать фармацевтическую композицию, предлагаемую в изобретении, в другом вторичном контейнере, таком как автоинжектор.
Предварительно заполненный шприц может содержать препарат в водной форме. Описанный шприц можно поставлять также в сочетании с автоинжектором, в котором часто находится продукт, содержащий только одну дозу, и он может иметь объем, например, от 0,1 до 1 мл. Однако шприц или автоинжектор может быть также предназначенным для многоразового использования или многодозовым. Указанный флакон может содержать препарат в лиофилизированном или водном состоянии и может служить в качестве устройства для одноразового или многоразового использования. Флакон может иметь объем, например, от 1 до 10 мл.
Третьим объектом изобретения является способ получения фармацевтической композиции, которая представляет собой первый объект изобретения, в котором объединяют TNFR:Fc, цитратный буфер и аминокислоту, выбранную из группы, включающей лизин и пролин и их фармацевтически приемлемые соли.
В одном из конкретных вариантов осуществления изобретения способ может включать дополнительную стадию добавления указанного выше фармацевтически приемлемого растворителя. Способ может дополнительно включать стадию, на которой добавляют по меньшей мере один модификатор тоничности, такой как хлорид натрия и/или сахароза, и необязательно указанный выше эксципиент. В конечном предпочтительном варианте осуществления изобретения способ может дополнительно включать стадию лиофилизации, которую можно осуществлять до или после добавления по меньшей мере одного модификатора тоничности и/или эксципиента, которые указаны выше.
Изобретение должно стать более очевидным после ознакомления с приведенными ниже примерами. Однако примеры не следует рассматривать как ограничивающие объем изобретения.
Описание чертежа
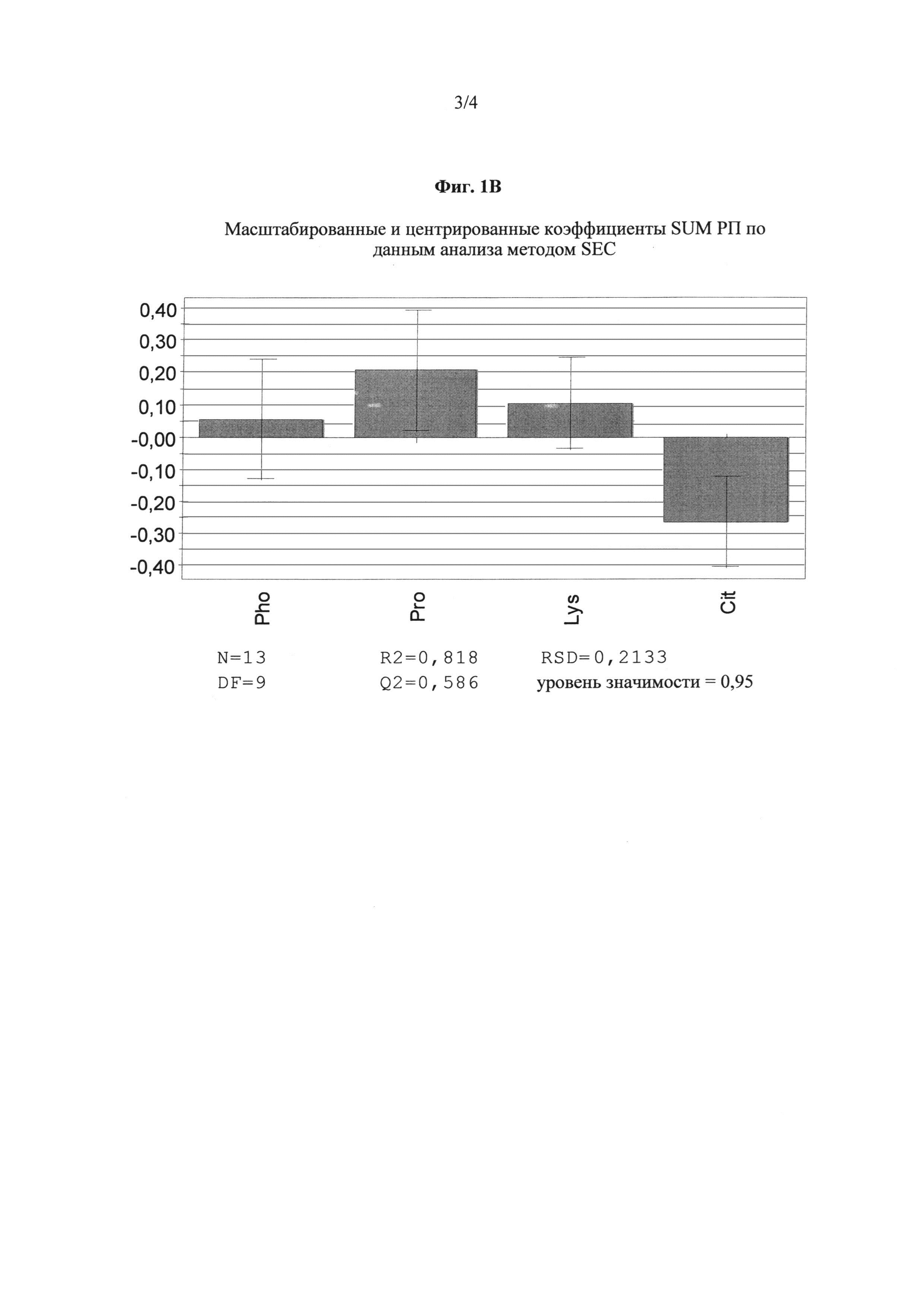
На чертеже показаны результаты SEC-анализа TNFR:Fc в процессе сфокусированного скрининга. Сокращения: Pho - система на основе фосфатного буфера; Cit - система на основе цитратного буфера; Pro - L-пролин; Lys - L-лизин. А: график коэффициентов, характеризующих продукты расщепления после хранения при 25°С. Б: график коэффициентов, характеризующих продукты расщепления после хранения при 45°С. В: график коэффициентов, характеризующих продукты расщепления после перемешивания в течение 48 ч при 600 об/мин; Г: график коэффициентов, характеризующих продукты расщепления после трех циклов замораживания и оттаивания.
Примеры
Описание материалов
TNFR:Fc, который применяли в указанных примерах, получали с использованием рекомбинантных СНО-клеток, которые культивировали с помощью периодического процесса с подпиткой в среде с определенным химическим составом. TNFR:Fc очищали из несодержащего клетки сбора стандартными методами, такими как аффинная хроматография на смолах с белком А, и с применением дополнительных стадий хроматографии и фильтрации.
Описание методов
Общие сведения
Все хроматографические методы осуществляли на ЖХВР-системах Agilent 1100 и 1200 HPLC, снабженных устройством для УФ- и флуоресцентного обнаружения.
Гель-фильтрация (SEC)
Гель-фильтрацию применяли для разделения вариантов TNFR:Fc с более низкой и более высокой молекулярной массой, а также отделения примесей и (вспомогательных) ингредиентов препаратов. Результаты представлены в виде суммарных пиков, соответствующих продуктам агрегации (АП), и суммарных пиков, соответствующих продуктам расщепления (РП). При осуществлении SEC идентичность тестируемых образцов определяли путем сравнения хроматографического времени удерживания основных пиков и времени удерживания основного пика применяемого для сравнения стандарта.
SEC осуществляли, используя две последовательно расположенные колонки Tosoh Bioscience TSK-Gel G3000SWXL (5 мкм, 250 Å, 7,8 мм I.D. (внутренний диаметр) × 300 мм (длина)) (фирма Tosoh Bioscience, Штутгарт, Германия) и подвижную фазу, содержащую 150 мМ фосфат калия, рН 6,5. Скорость потока устанавливали на уровне 0,4 мл/мин, температуру колонки на уровне 30°С. Образцы разводили подвижной фазой до концентрации 0,75 мг/мл, инъекционный объем составлял 10 мкл.
Хроматография с обращенной фазой (ОФ-ЖХВР или RPC)
Содержимое образцов определяли с помощью ОФ-ЖХВР, используя С8-колонку (5 мкм, 300 Å, 2,1 мм I.D. × 75 мм (длина)) при температуре колонки 70°С. Для разделения вариантов продуктов применяли линейный градиент от 20 до 30% подвижной фазы Б (подвижная фаза А: 10% ацетонитрила, 0,3% ПЭГ 300, 0,1% ТФК; подвижная фаза Б: 90% ацетонитрила, 0,3% ПЭГ 300, 0,1% ТФК) при скорости потока 1,0 мл/мин. Образцы подвергали десиалилированию и разводили до концентрации 2,5 мг/мл перед инъекцией. Хроматограммы после УФ-обнаружения применяли для оценки чистоты. Результаты выражали в виде содержания продукта, а также «хвостов» пика (Sum ПП).
Катионообменная хроматография (СЕХ)
Катионообменное разделение осуществляли, используя катионообменную смолу на основе кремнезема, с которой связана представляющая собой покрытие полиаспарагиновая кислота (100 мм (длина) × 4,6 мм (i.d.); частицы размером 3 мкм). Перед инъекцией образцы десиалилировали и концентрацию доводили до 2,5 мг/мл с помощью буфера для десиалилирования. Образцы элюировали с использованием линейного градиента от 30 до 50% подвижной фазы Б в течение 20 мин (А: 50 мМ ацетат натрия, рН 5,2; Б: 50 мМ ацетат натрия, 250 мМ NaCl, рН 5,2). Скорость потока и температуру устанавливали на на уровне 1,0 мл/мин и 30°С соответственно. Хроматограммы после УФ-обнаружения применяли для оценки данных. Результаты выражали в виде суммы кислотных пиков (Sum КП) и суммы основных пиков (Sum ОП).
Метод определения количества частиц (PC)
Количество частиц определяли по затемнению света, используя устройство Accusizer Nicomb SIS 780. Этот метод позволяет определять рассеяние света частицей/агрегатом в жидкой среде. На основе сигнала может быть рассчитан гидродинамический радиус частицы/агрегата. Среднее значение трех измерений рассчитывали, используя общий объем образца 2,8 мл. Использовали следующие параметры устройства: диапазон: 0,5-500 мкм (канал 512; логарифмическая шкала); скорость потока: 5 мл/мин.
Перед осуществлением анализов, описанных в примерах 1-3, оценивали влияние эксципиентов, таких как сахароза, аргинин и NaCl, на агрегацию TNFR:Fc. Полученные препараты подвергали оценке в отношении стабильности в условиях стресса, включающих перемешивание и встряхивание. Агрегаты, радиус которых составлял вплоть до 200 нм, оценивали с помощью метода SEC, а при подсчете частиц учитывали частицы размером от 500 нм до 400 мкм.
Аргинин:
Анализ методом SEC подвергнутых стрессу препаратов продемонстрировал снижение количества агрегатов в результате добавления аргинина. В то же время, образование частиц большего размера при увеличении молярной концентрации аргинина обнаружено с помощью PC-метода. Таким образом, можно заключить, что увеличение количества аргинина в препаратах TNFR:Fc способствует снижению количества более мелких частиц (радиусом (г) вплоть до 200 нм), что наиболее вероятно связано с образованием кластеров агрегатов с частицами более крупного размера, которые можно выявлять только с помощью метода определения количества частиц.
NaCl:
Добавление NaCl в более высоких молярных концентрациях приводило к таким же результатам, полученным с помощью PC-метода, что и добавление аргинина. Количество РП, выявленных с помощью SEC-метода, возрастало с повышением молярности NaCl.
Сахароза:
Добавление сахарозы в более высоких молярных концентрациях, вероятно, приводило к уменьшению радиуса частиц по данным, полученным с помощью PC-метода. С помощью SEC не было получено статистически значимых результатов.
Пример 1
Скрининг препаратов
Оценку осуществляли путем объединения DoE (метод планирования экспериментов) и однопараметрических исследований. Все препараты содержали 50 мг/мл TNFR:Fc, 100 мМ NaCl и значение рН регулировали на уровне рН 6,3. Препараты разделяли на группы, обозначенные как поверхностно-активные вещества, буфер, стабилизатор I (содержащий сахара и сахарные спирты), а также стабилизатор II (аминокислоты), при этом группы стабилизаторов создавали и оценивали с помощью статистических расчетов (таблица 3). Результаты, полученные при использовании этих групп, оценивали с позиций статистической значимости. Результаты сравнивали также с результатами, полученными при применении известного из существующего уровня техники препарата TNFR:Fc в виде Enbrel® (таблица 1).
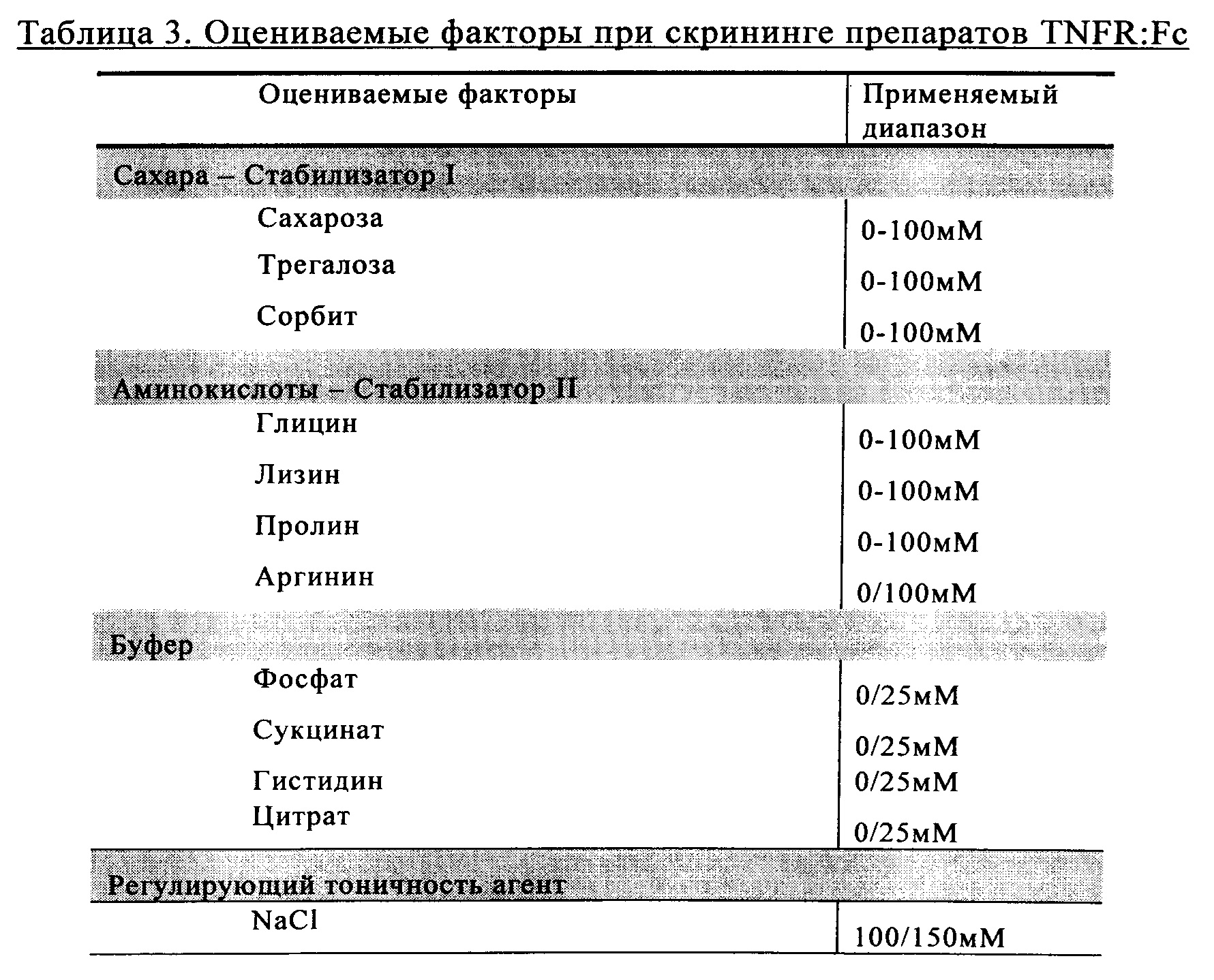
Полученные препараты (таблица 4) подвергали механическому стрессу и кратковременному стрессу в опыте по оценке стабильности (таблица 5). В качестве эталона служил препарат этанерцепта (т.е. описанный в таблице 1).


Положительное влияние на качество TNFR:Fc выходных параметров по данным RPC, СЕХ и SEC определяли следующим образом:
содержание (RPC) - отсутствие снижения,
сумма КП (СЕХ) - низкий уровень,
сумма ОП (СЕХ) - сопоставима с известным из существующего уровня техники препаратом,
сумма АП (SEC) - низкий уровень,
сумма РП (SEC) - низкий уровень.
Результаты сравнивали также с результатами, полученными для содержащего TNFR:Fc известного из существующего уровня техники препарата, соответствующего Enbrel®, и рассматривали в качестве положительных, если они были по меньшей сопоставимы с результатами, полученными для известного из существующего уровня техники препарата, соответствующего Enbrel®, или, если они превышали их касательно вышеуказанных параметров. Продемонстрировано положительное влияние на стабильность TNFR:Fc в препарате при оценке таких факторов как пролин, лизин, сахароза и цитрат (таблица 6).
Таблица 6. Результаты скрининга препаратов. Воздействие различных факторов обозначено символом минус (-) или плюс (+); - обозначает отрицательное воздействие по сравнению с известном из существующего уровня техники препаратом, соответствующим Enbrel®, и/или ожидаемое такое действие, а + обозначает положительное воздействие по сравнению с известным из существующего уровня техники препаратом, соответствующим Enbrel®, и/или ожидаемое такое действие; результат, взятый в скобки, свидетельствует о менее выраженных действиях; результаты не удовлетворяют критериям значимости; для факторов, обозначенных жирным шрифтом, продемонстрировано положительное воздействие на качество продукта; факторы, обозначенные курсивом, подлежали дополнительному исследованию (см. пример 3); для факторов, обозначенных звездочкой (*), продемонстрированы вредные воздействия, и они исключены из дополнительных исследований.

Пример 2
Сфокусированный скрининг
Выбранные при скрининге препаратов факторы, которые обладали выраженными действиями, дополнительно оценивали путем объединения их в другом DoE-подходе (препараты 1-13; факторы: пролин, лизин, фосфат, цитрат), а также в виде препаратов с одним варьируемым параметром (лизин/сукцинат (препарат 15); пролин/сукцинат (препарат 16); лизин/цитрат/полоксамер (препарат 17); трегалоза/цитрат/лизин (препарат 18)). Препарат 19 представлял собой известный из существующего уровня техники препарат, соответствующий препарату Enbrel®.

Полученные препараты подвергали кратковременному стрессу в опыте по оценке стабильности (таблица 8). Применяли аналитические методы, такие как SEC, CEX и RPC.

Результаты, полученные при изучении препаратов 1-13, представлены на фиг.1А-Г. Оценивали воздействие таких факторов, как лизин, пролин, нитратный буфер и фосфатный буфер на образование продуктов расщепления в процессе хранения содержащих TNFR:Fc препаратов при 25°С (А) и 40°С (Б), а также при применении условий стресса, связанных с перемешиванием в течение 48 ч (В) и тремя циклами замораживания и оттаивания (Г). Положительное влияние на качество TNFR:Fc выходных параметров по данным SEC определяли следующим образом:
сумма РП (SEC) - низкий уровень, отсутствие возрастания.
Выраженное положительное действие обнаружено для такого фактора, как цитратный буфер, применение которого приводило к снижению уровней продуктов расщепления в созданных на его основе препаратах TNFR:Fc при использовании условий, указанных в таблице 8. Кроме этого, только для пролина обнаружено невысокое значимое воздействие при хранении при 25°С и после перемешивания в течение 48 ч при 600 об/мин, при этом уровень продуктов расщепления повышался при применении стресса.
Оценку применяемых в качестве эксципиентов сукцинатного буфера в сочетании с лизином или пролином, а также полоксамера и трегалозы, осуществляли с помощью RPC-, SEC- и СЕХ-анализов (таблица 9).
Положительное влияние на качество TNFR:Fc выходных параметров определяли следующим образом:
содержание (RFC) - отсутствие снижения,
сумма АП (SEC) - низкий уровень,
сумма РП (SEC) - низкий уровень.
Для препаратов, содержащих сукцинат (препарат 15 (включающий лизин), препарат 16 (включающий пролин)) обнаружено образование дополнительных пиков, соответствующих продуктам расщепления, при хранении при 40°С. В результате сукцинат исключали из дополнительных исследований. Поскольку поверхностное вещество полоксамер и стабилизатор трегалоза не оказывали положительного воздействия на стабильность (при применении в таком же диапазоне, что и в известном из существующего уровня техники препарате, соответствующем Enbrel®), полоксамер и трегалозу также исключали из дополнительных исследований.

Пример 3
Оптимизация препаратов
Наиболее перспективные по данным предварительной оценки четыре препарата (препараты 1-4) подвергали оценке на стабильность при продолжительном хранении в рекомендованных (2-8°С), а также в условиях ускоренного хранения (25°С и 40°С). Опыт по определению стабильности при продолжительном хранении осуществляли с использованием препарата TNFR:Fc, которым заполняли шприцы (0,5 мл) и флаконы (1 мл). В таблице 10 представлен перечень протестированных препаратов. В качестве эталона служил известный из существующего уровня техники препарат, соответствующий Enbrel® (препарат 5). Все препараты сравнивали друг с другом, а также с указанным эталоном.

Принимали, что имеет место положительное воздействие оцениваемых факторов, таких как лизин и пролин в качестве стабилизатора, а также систем цитратного и фосфатного буферов, если стабильность, оцениваемая по выходным параметрам, таким как сумма «хвостовых» пиков (RPC), сумма пиков, соответствующих продуктам агрегации и расщепления (SEC), а также сумма кислотных пиков (СЕХ), была выше, чем у эталона. Целевые условия для выходных параметров представлены в таблице 11.

Результаты, полученные для выходных параметров, методом RPC/сумма «хвостовых» пиков (ПП), методом SEC/сумма пиков продуктов агрегации (АП) и расщепления (РП) и методом СЕХ/сумма кислотных пиков (КП), представлены в таблицах 12, 13 (хранение при 2-8°С), таблицах 14, 15 (хранение при 25°С), а также в таблицах 16, 17 (хранение при 40°С). Анализ образцов осуществляли в начале опыта по оценке стабильности, а также после хранения в течение 1, 2 и 3 месяцев при указанных температурах.
Обобщение результатов, полученных при хранении препаратов, содержащих TNFR:Fc, при 2-8, 25 и 40°С в течение трех месяцев (таблица 12)
1) RPC - Сумма «хвостов» пиков (Sum ПП)
После трех месяцев хранения при 2-8°С, 25°С и 40°С препараты TNFR:Fc, содержащие систему цитратного буфера (препараты 1-3), отличались более низкими величинами «хвостов» пиков по сравнению с препаратами, содержащими фосфатный буфер (препараты 4 и 5). Наиболее низкая абсолютная величина обнаружена для препарата, содержащего 50 мМ цитратный буфер и 25 мМ лизин (препарат 1). Указанное явление было еще более выраженным для препаратов TNFR:Fc, которые хранили во флаконах.
2) SEC - Сумма пиков, соответствующих продуктам агрегации (Sum АП)
После хранения в течение 3 месяцев при 2-8°С, 25°С и 40°С препараты TNFR:Fc 1-5 имели сопоставимое количество продуктов агрегации. Кроме того, не обнаружено различий для препаратов, находящихся во флаконах или шприцах.
3) SEC - Сумма пиков, соответствующих продуктам расщепления (Sum РП)
После хранения в течение трех месяцев при 2-8°С, 25°С и 40°С препараты TNFR:Fc, содержащие систему цитратного буфера (препараты 1-3), отличались существенно более низкими величинами пиков, соответствующих продуктам расщепления, по сравнению с препаратами, содержащими фосфатный буфер (препараты 4 и 5). Наиболее низкая абсолютная величина обнаружена для препарата, содержащего 50 мМ цитратный буфер и 25 мМ лизин (препарат 1). Указанное явление было еще более выраженным для препаратов TNFR:Fc, которые хранили во флаконах.
4) СЕХ - Сумма кислотных пиков (Sum КП)
После хранения в течение трех месяцев при 2-8°С, 25°С и 40°С препараты TNFR:Fc, содержащие систему нитратного буфера (препараты 1-3), которые находились в предварительно заполненных шприцах, отличались существенно более низкими величинами кислотных пиков по сравнению с препаратами, содержащими фосфатный буфер (препараты 4 и 5). Указанное явление было еще более выраженным для препаратов TNFR:Fc, которые хранили при 2-8°С во флаконах.
Результаты оптимизации препаратов
Стабильность препаратов 1-5 при хранении в течение трех месяцев при 2-8°С, 25°С и 40°С оценивали с помощью RPC-, SEC- и СЕХ-анализа. Установлено, что препараты, содержащие систему цитратного буфера (препараты 1-3) превосходили препараты, содержащие систему фосфатного буфера (препараты 4 и 5), в отношении образования «хвостов» пиков (RPC), образования продуктов расщепления (SEC) и образования кислотных пиков (СЕХ). Наилучшие результаты были получены с помощью RPC и SEC для препарата, содержащего систему на основе 50 мМ цитратного буфера и 25 мМ лизина в качестве стабилизатора. Одним из наиболее плохих препаратов, если не наихудшим оказался эталон, известный из существующего уровня техники; т.е. препарат, соответствующий Enbrel® (препарат 5). Расщепление TNFR:Fc, которое определяли с помощью RPC, SEC и СЕХ, в целом, было более выраженным при хранении препаратов во флаконах. Наиболее вероятно это является результатом большей поверхности раздела жидкость/воздух во флаконах по сравнению с шприцами. Таким образом, указанные воздействия являлись частично еще более выраженными, включая повышенную стабилизацию TNFR:Fc в препарате, приготовленном в содержащем цитрат/лизин матриксе препарата.

Хранение TNFR:Fc при 2-8°С - шприцы и флаконы


Хранение TNFR:Fc при 25°С - шприцы и флаконы


Хранение TNFR:Fc при 40°С - шприцы и флаконы


Перечень ссылок
WO 03/072060 А2
ЕР1478394
Baynes и др., Role of arginine in the stabilization of proteins against aggregation. Biochemistry, 44(12), 29 марта 2005 г., cc.4919-4925.
Shiraki и др., Biophysical effect of amino acids on the prevention of protein aggregation. J Biochem, 132(4), октябрь 2002 г., cc.591-595.
Bolli и др., L-Proline reduces IgG dimer content and enhances the stability of intravenous immunoglobulin (IVIG) solutions. Biologicals, 38(1), январь 2010 г., cc.150-157.
Zheng и Janis, Influence of pH, buffer species, and storage temperature on physiochemical stability of a humanized monoclonal antibody LA298. Int J Pharm, 308(1-2), 3 февраля 2006 г., cc.46-51.
Kolhe и др., Impact of freezing on pH of buffered solutions and consequences for monoclonal antibody aggregation. Biotechnol Prog, 26(3), май-июнь 2010 г., cc.727-733.
Реферат
Изобретение относится к области биотехнологии, конкретно к стабильным фармацевтическим композициям слитого белка TNFR:Fc. Получают фармацевтические композиции, а также наборы для их применения, отличающиеся физической стабильностью TNFR:Fc за счет использования системы цитратного буфера в концентрации от 25 до 120 мМ и аминокислоты, выбранной из группы, включающей лизин и пролин и их фармацевтически приемлемых солей в концентрации от 15 до 100 мМ в качестве стабилизатора. Изобретение позволяет обеспечить стабильность фармацевтических композиций этанерцепта для длительного хранения. 4 н. и 10 з.п. ф-лы, 1 ил., 17 табл., 3 пр.

Комментарии