Способ химической модификации липидов микроводорослей, способ получения мыла и мыло, включающее соли жирных кислот омыленных липидов микроводорослей - RU2542374C2
Код документа: RU2542374C2
Чертежи













































Описание
Область техники
Изобретение относится к области генной инженерии, создания аквакультур и химического модифицирования содержащей жиры микробной биомассы.
Уровень техники
Постоянно увеличивающиеся потребности мировой экономики в энергии напрямую связаны с вопросом стоимости органического топлива. Таким образом, наравне с задачей сохранения окружающей среды и уменьшения загрязнения воздуха активное внимание привлекают внутренние источники энергии и способы разработки не содержащего бензин топлива для двигателей внутреннего сгорания. Для двигателей с самовоспламенением (дизельных) было показано, что простые эфиры спиртов и жирных кислот (биодизели) являются подходящим альтернативным топливом. Биодизели имеют более высокое содержание кислорода по сравнению с дизелями на основе органического топлива, и, следовательно, уменьшают выброс твердых частиц, углеводородов и монооксида углерода в окружающую среду, а также выброс серы, по причине ее низкого содержания (Sheehan, J., et al., Life Cycle Inventory of Biodisel and Petroleum Diesel for Use in an Urban Bus, National Renewable Energy Laboratory, Report NREL/SR-580-24089, Golden, Colo. (1998); Graboski, M.S., and R.L. McCormick, Prog. Energy Combust. Sci., 24:125-164 (1998)).
Первые попытки создания, тестирования и использования биодизелей основывались на использовании рафинированных пищевых овощных масел (выделенных или восстановленных из семян при помощи экстракции растворителем) и животных жиров (например, говяжьего сала), а также пищевых отходов для синтеза топлива (см., например, Krawczyk, Т, INFORM, 7:800-815(1996); and Peterson, C.L., et al., Applied Engineering in Agriculture, 13:71-79 (1997)). Дальнейшее совершенствование указанных способов привело к попыткам получения метиловых эфиров жирных кислот (FAME, от англ. Fatty Acid Methyl Esters) из дешевых, менее рафинированных липидов пищевых отходов, таких как отработанные ресторанные масла и остатки соевых бобов после производства мыла (см., например, Mittelbach, М., and Р. Tritthart, J. Am Oil Chem. Soc., 65(7): 1185-1187 (1988); Graboski, M.S., et al., The Effect of Biodisel Composition on Engine Emissions from a DDC Series 60 Diesel Engine, Final Report to USDOE/National Renewable Energy Laboratory, Contract No. ACG-8-17106-02 (2002)).
В последние десятилетия фотоавтотрофное выращивание водорослей рассматривается как привлекательный способ создания биодизелей на основе водорослей (см. A Look Back at the U.S. Department of Energy's Aquatic Species Program; Biodiesel from Algae, NREL/TP-5 80-24190, John Sheehan, Terri Dunahay, John Benemann and Paul Roessler (1998)). Многие ученые считают, что поскольку солнечный свет является "свободным" ресурсом, фотоавтотрофное выращивание водорослей является наиболее желательным способом культивирования водорослей для их дальнейшего использования в качестве источника для получения биотоплива (см., например, Chisti, Biotechnol. Adv. 2007 May-Jun; 25(3):294-306: "гетеротрофная продукция не является такой же эффективной как использование фотосинтезирующих водорослей… поскольку обновляемые органические источники углерода, необходимые для выращивания гетеротрофных микроорганизмов, образуются главным образом в результате фотосинтеза обычно у злаковых растений"). Другие исследователи считают, что фотоавтотрофное выращивание водорослей является не просто оптимальным способом выращивания микроводорослей для получения биотоплива, а лучшим, поскольку не требуется дополнительной переэтерификации каких-либо соединений, выделенных из биомассы микроводорослей, перед их использованием в дизельном двигателе (см., Screagg et al., Enzyme and Microbial Technology, Vol.33:7, 2003, Pages 884-889).
Способы фотосинтетического выращивания являются основным объектом многих исследований в данной области в течение последних десятилетий, которые проводятся частично под влиянием Министерства энергетики США, отдела разработки топлив, который утвердил программу получения обновляемых транспортных видов топлива из водорослей, продолжавшуюся с 1978 по 1996. Основной принцип получения топлива заключался в использовании серии неглубоких освещаемых солнцем прудов, расположенных на улице, сконструированных по типу "проточных каналов", в которых водоросли, вода и питательные вещества циркулируют вокруг круглого пруда в непосредственной близости к источнику отработанного СО2 (например, из органического топлива электростанций).
Переэтерфикация экстрагированных/рафинированных растительных масел традиционно осуществляется путем взаимодействия триацилглицерола ("TAG" от англ. Triacylglycerol) с низшими алкиловыми спиртами (например, метанолом) в присутствии катализатора (например, сильной кислоты или сильного основания) с получением алкиловых сложных эфиров жирной кислоты (например, метиловые эфиры жирных кислот или "FAME") и глицерола.
Как описано выше, традиционные способы производства биодизелей основаны на использовании экстрагированных и/или рафинированных масел (выделенных или восстановленных при помощи экстракции растворителем из семян масличных растений) в качестве исходного материала для реакции переэтерификации. Широко применяются источники масел, включая сою, пальму, кокос и канолу, а экстракцию осуществляют путем высушивания растительного материала и предварительной обработки материала (например, путем раздавливания или расслаивания), чтобы усилить проникновение растворителя внутрь растений, например, такого как гексан. Экстракция указанных масел для их последующего использования в качестве исходных материалов существенно увеличивает стоимость производства биодизелей.
Аналогично способ экстракции растворителем, который используется для экстракции масел из сухого растительного материала, применяется также для экстракции масел из микробной биомассы в присутствии органического растворителя. В данном случае экстракция растворителем требует использования растворителя, который совершенно не смешивается с водой, такого как гексан, для получения фазы растворителя, в которой растворено масло, и водной фазы, в которой удерживается большая нелипидная часть биомассы. К сожалению, в промышленном масштабе производства объем летучего, потенциально канцерогенного и воспламеняющегося органического растворителя, который необходимо использовать для эффективной экстракции, настолько велик, что процесс в результате осуществляется в очень опасных условиях и не является безопасным как для окружающей среды, так и для работников производства. Кроме того, процесс экстракции растворителем сопровождается выделением большого потока отработанного растворителя, который требует правильной утилизации, а это существенно увеличивает стоимость производства.
Альтернативно существует способ экстракции "без растворителя"; в нем используется водный растворитель, содержащий не более 5% органического растворителя, для экстракции липидов из микроорганизмов, для последующей их переэтерификации и использования в качестве сырья для биодизеля. Вкратце, способ экстракции "без растворителя" включает обработку лизированной клеточной массы водным растворителем, содержащим не более 5% органического растворителя (например, гексана) с получением смеси, разделенной на фазы. Полученная смесь содержит более тяжелый водный слой и легкий слой, включающий эмульгированные жиры. Процесс экстракции с липидным слоем несколько раз повторяют до получения слоя неэмульгированных липидов. К сожалению, повторяющаяся экстракция и отмывание липидного слоя делает способ экстракции "без растворителя" очень трудоемким.
Таким образом, существует потребность в дешевых и более эффективных способах экстракции полезных биомолекул, выделенных из липидов, продуцируемых микроорганизмами. Настоящее изобретение удовлетворяет эту потребность.
Сущность изобретения
Согласно первому аспекту своего осуществления настоящее изобретение относится к решению, которое заключается в том, что химическая модификация содержащей липиды микробной биомассы может существенно увеличивать эффективность и снижать стоимость ценных материалов, получаемых из указанных липидов. Таким образом, согласно первому варианту своего осуществления настоящее изобретение относится к способу химической модификации содержащей липиды микробной биомассы, который включает этап культивирования микробной популяции, этап сбора микробной биомассы, содержащей, по крайней мере, 5% липидов на вес сухой клетки (DCW, от англ. Dry Cell Weight) и этап химической реакции полученной биомассы, в результате чего происходит ковалентная модификация, по крайней мере, 1% липидов. Согласно некоторым вариантам осуществления изобретения заявленный способ также включает этап разделения ковалентно модифицированных липидов и других компонентов биомассы,
Согласно различным вариантам осуществления изобретения соотношение ковалентно модифицированного липида к биомассе, из которой он был выделен, составляет приблизительно 10% липида и 90% биомассы или 10% липида по сухой массе. Согласно некоторым вариантам осуществления изобретения этап разделения липидов и остальных компонентов биомассы включает фазовое разделение, во время которой ковалентно модифицированные липиды формируют более легкую безводную фазу, а компоненты биомассы образуют одну или более тяжелую фазу. Согласно некоторым вариантам осуществления изобретения биомассу подвергают химической реакции без этапа предварительного обогащения, который позволяет увеличить соотношение липидов к нелипидным компонентам более чем до 50 вес.%. Согласно некоторым вариантам осуществления изобретения биомассу подвергают химической реакции после этапа предварительного обогащения, что позволяет существенно увеличить соотношение липидов к сухой массе микробов. Согласно некоторым вариантам осуществления изобретения полученную биомассу не подвергают какой-либо дополнительной обработке перед химической реакцией, помимо удаления воды и/или лизиса клеток. Согласно некоторым вариантам осуществления изобретения биомасса, которую подвергают химической реакции, содержит другие компоненты помимо воды в тех же относительных пропорциях, что и клеточная культура. Согласно некоторым вариантам осуществления изобретения содержание липидов в биомассе составляет менее 90% по отношению к весу биомассы, которую подвергают химической реакции.
Согласно одному варианту осуществления изобретения химическое модифицирование содержащей липид микробной биомассы включает реакцию переэтерификации биомассы для получения липофильной фазы, содержащей алкиловые сложные эфиры жирных кислот, и гидрофильной фазы, включающей клеточный материал и глицерол. Согласно некоторым вариантам осуществления изобретения заявленный способ также включает удаление воды из биомассы перед тем, как ее подвергают реакции переэтерификации. Согласно другим вариантам осуществления изобретения заявленный способ включает этап удаления воды из биомассы после того, как происходит ее разрушение. Согласно некоторым вариантам осуществления изобретения воду из биомассы удаляют при помощи способа, включающего лиофилизацию, сушку в барабанной сушилке или сушку биомассы в сушильном шкафу.
Согласно некоторым вариантам осуществления изобретения, в том случае, когда химическая модификация липид содержащей биомассы включает реакцию переэтерификации биомассы, заявленный способ также включает этап разрушения биомассы перед реакцией переэтерфикации. Согласно некоторым вариантам осуществления изобретения разрушение биомассы включает нагревание для получения лизата. Согласно другим вариантам осуществления изобретения биомассу разрушают путем обработки сильной кислотой или основанием в количестве, достаточном для получения лизата. Согласно другим вариантам осуществления изобретения разрушение биомассы включает ферментативную обработку одним или более ферментом, в результате чего образуется лизированная биомасса. Согласно некоторым вариантам осуществления изобретения биомассу обрабатывают, по крайней мере, одной протеазой и, по крайней мере, одним ферментом, расщепляющим полисахариды. Согласно некоторым вариантам осуществления изобретения разрушение биомассы осуществляют путем механического лизирования популяции микробов с образованием лизата. Согласно другим вариантам осуществления изобретения для разрушения биомассу подвергают осмотическому шоку, в результате чего также образуется лизат. Согласно другим вариантам осуществления изобретения биомассу разрушают путем заражения ее литическим вирусом, который формирует лизат. Согласно еще одним вариантам осуществления изобретения в биомассу для ее разрушения вводят литический ген, в результате экспрессии которого запускается автолизис микробных клеток и образуется лизат.
Согласно некоторым вариантам осуществления изобретения в результате химической модицификации микробной биомассы посредством реакции переэтерификации образуются алкиловые эфиры жирных кислот, которые представляют собой метиловые эфиры жирных кислот или этиловые эфиры жирных кислот. Согласно некоторым вариантам осуществления изобретения реакция переэтерификации включает взаимодействие биомассы со спиртом и основанием. Согласно некоторым вариантам осуществления изобретения спирт выбран из группы, включающей метанол, этанол, пропанол, изопропанол и их смеси. Согласно некоторым вариантам осуществления изобретения, основание выбрано из группы, включающей NaOH, KOH и их смеси. Согласно некоторым вариантам осуществления изобретения алкоголь представляет собой метанол, а основанием является NaOH. Согласно некоторым вариантам осуществления изобретения переэтерификация биомассы включает обеспечение контакта биомассы со спиртом и липазой. Согласно некоторым вариантам осуществления изобретения липаза экспрессируется с гена экзогенной липазы среди микробной популяции. Согласно одному из вариантов осуществления изобретения экспрессия гена экзогенной липазы индуцируется взаимодействием микробной биомассы со стимулом, который активирует индуцируемый промотор, контролирующий экспрессию гена экзогенной липазы.
Согласно различным вариантам осуществления изобретения количество магния и кальция, совместно, по весу в липофильной фазе не превышает 5 частиц на миллион. Согласно некоторым вариантам осуществления изобретения количество фосфора в липофильной фазе не превышает 0,001% по массе. Согласно некоторым вариантам осуществления изобретения количество серы в липофильной фазе не превышает 15 частиц на миллион. Согласно некоторым вариантам осуществления изобретения количество калия и натрия, совместно, по весу не превышает 5 частиц на миллион. Согласно некоторым вариантам осуществления изобретения общее содержание каротеноидов в липофильной фазе составляет не более 100 микрограмм каротеноида на грамм. Согласно некоторым вариантам осуществления изобретения общее содержание хлорофилла в липофильной фазе не превышает 0,1 мг/кг.
Согласно некоторым вариантам осуществления изобретения химическая реакция с биомассой включает обеспечение взаимодействия биомассы и фермента, который катализирует указанную химическую реакцию. Согласно некоторым вариантам осуществления изобретения таким ферментом является липаза. Согласно одному из вариантов осуществления изобретения заявленный способ также включает разделение липофильной фазы, содержащей ковалентно модифицированные липиды, и гидрофильных клеточных материалов биомассы.
Согласно различным вариантам осуществления изобретения микроорганизмы и конечная микробная масса выбраны из группы, включающей бактерии, цианобактерии, эукариотические микроводоросли, липогенные дрожжи и грибки. Согласно определенным вариантам осуществления изобретения микроорганизмы выбраны из группы, включающей эукариотические микроводоросли, представленные в Таблице 1. Согласно некоторым вариантам осуществления изобретения микроорганизмы являются представителями рода Chlorella, а согласно определенным вариантам осуществления изобретения микроорганизмы выбраны из группы, включающей следующие виды: Chlorrella fusca, Chlorella protothecoides, Chlorella pyrenoidosa, Chlorella kessleri, Chlorella vulgaris, Chlorella saccharophila, Chlorella sorokiniana и Chlorella ellipsoidea. Согласно одному варианту осуществления изобретения микроорганизмом является Chlorella prototehecoides. Согласно некоторым вариантам осуществления изобретения, микроорганизмы являются членами рода Prototheca, в частности микроорганизмы относятся к видам, выбранным из группы, включающей Prototheca wickerhamii, Prototheca stagnora, Prototheca portoricensis, Prototheca moriformis и Prototheca zopfii. Согласно некоторым вариантам осуществления изобретения микроорганизмы выбраны из группы липогенных дрожжей, представленных в Таблице 2, согласно другому варианту осуществления изобретения микроорганизмы выбраны из группы, включающей грибы, представленные в Таблице 3. Согласно некоторым вариантам осуществления изобретения микробная масса представляет собой смесь биомасс из двух различных штаммов или видов микробов, которые культивировали отдельно. Согласно одному варианту осуществления изобретения, по крайней мере, два различных штамма или вида микроорганизмов имеют различный липидный профиль. Согласно некоторым вариантам осуществления изобретения микроорганизмы имеют высокую степень таксономического сходства с членами родов Chlorella и Prototheca, в частности, по крайней мере, 95% нуклеотидной идентичности на уровне 23S рРНК, что описано в примерах.
Согласно некоторым вариантам осуществления настоящего изобретения полученная биомасса имеет содержание липидов, которое составляет, по крайней мере, 5%, по крайней мере, 10%, по крайней мере, 15%, по крайней мере, 20%, по крайней мере, 25%, по крайней мере, 30%, по крайней мере, 35%, по крайней мере, 40%, по крайней мере, 45%, по крайней мере, 50%, по крайней мере, 55%, по крайней мере, 60%, по крайней мере, 65%, по крайней мере, 70%, по крайней мере, 75%, по крайней мере, 80%, по крайней мере, 85%, или, по крайней мере, 90% по DCW. Согласно некоторым вариантам осуществления изобретения, по крайней мере, 20% липидов представлены С18. Согласно некоторым вариантам осуществления изобретения, по крайней мере, 30% липидов представлены С18. Согласно некоторым вариантам осуществления изобретения, по крайней мере, 40% липидов представлены С18. Согласно некоторым вариантам осуществления изобретения, по крайней мере, 50% липидов представлены С18. Согласно некоторым вариантам осуществления изобретения, по крайней мере, 50% липидов представляют собой С16 или молекулы с более длинной цепью. Согласно некоторым вариантам осуществления изобретения, по крайней мере, 10% липидов представлены С14 или молекулами с более короткой цепью. Согласно некоторым вариантам осуществления изобретения, по крайней мере, 20% липидов являются С14 или имеют более короткие цепи.
Согласно некоторым вариантам осуществления данного изобретения микробная популяция экспрессирует ген утилизации экзогенной сахарозы. Согласно некоторым вариантам осуществления изобретения ген представлен инвертазой сахарозы. Согласно некоторым вариантам осуществления изобретения микробная популяция экспрессирует ген фермента, участвующего в цикле обмена липидов. Согласно некоторым вариантам осуществления изобретения, таким ферментом является ацилнесущий белок (АСР)-тиоэстераза. Согласно некоторым вариантам осуществления изобретения микробная популяция также экспрессирует экзогенный "естественно совместно экспрессируемый" ацил-несущий белок, который экспрессируется совместно с ацил-АСР-тиоэстеразой. Согласно некоторым вариантам осуществления изобретения фермент, участвующий в цикле обмена липидов, имеет специфичность действия по отношению к субстрату с определенным количеством углеродных атомов в цепи.
Согласно некоторым вариантам осуществления изобретения химическая модификация содержащей липид микробной биомассы включает гидрогенизацию биомассы для насыщения, по крайней мере, части ненасыщенных связей в липидах. Согласно некоторым вариантам осуществления изобретения химическая модификация содержащей липид микробной биомассы включает интерэтерификацию биомассы для получения смеси глицеролипидов с модифицированным распределением жирных кислот в соответствии с глицеролипидами полученной биомассы. Согласно некоторым вариантам осуществления изобретения химическая модификация содержащей липид микробной биомассы включает гидроксилирование биомассы для получения гидроксилированных липидов. Согласно некоторым вариантам осуществления изобретения, по крайней мере, часть гидроксилированных липидов этерифицируют для получения эстолидов. Согласно некоторым вариантам осуществления изобретения химическая модификация содержащей липид микробной биомассы включает гидролиз биомассы для получения свободных жирных кислот из липидов. Согласно некоторым вариантам осуществления изобретения свободные жирные кислоты подвергают дополнительной химической модификации. Согласно одному варианту осуществления изобретения химическая модификация содержащей липид микробной биомассы включает деоксигенацию при повышенной температуре в присутствии водорода и катализатора, изомеризацию в присутствии водорода и катализатора, а также удаление газов и нафта-соединений.
Согласно другому варианту осуществления изобретения химическая модификация содержащей липид микробной биомассы включает сапонификацию биомассы для получения солей жирных кислот из липидов. Согласно одному варианту осуществления изобретения, биомассу получают из микроводорослей рода Prototheca. Согласно некоторым вариантам осуществления изобретения сапонификация биомассы включает взаимодействие биомассы с основанием в количестве, достаточном для превращения, по крайней мере, части глицеролипидов и/или эфиров сложных кислот в составе липидных соединений в соли жирных кислот. Согласно некоторым вариантам осуществления изобретения основанием является гидроксид щелочного металла, такой как KOH или NaOH. Согласно некоторым вариантам осуществления изобретения заявленный способ также включает взаимодействие биомассы с солью для преципитации солей жирных кислот из раствора. Согласно некоторым вариантам осуществления изобретения соль представляет собой растворимый в воде галид щелочного металла, такой как NaCl или KCl.
Согласно некоторым вариантам осуществления изобретения культивируют, по крайней мере, два различных штамма или вида микроорганизмов, полученные биомассы обеих культур смешивают для получения конечной биомассы, которую затем подвергают химическому модифицированию для модификации, по крайней мере, 1% липидов. Согласно некоторым вариантам осуществления изобретения указанные различные штаммы или виды микроорганизмов имеют различные глицеролипидные профили.
Согласно одному аспекту своего осуществления настоящее изобретение относится к способу сапонификации для получения мыла. Согласно некоторым вариантам осуществления изобретения заявленный способ включает этап культивирования микробной популяции, этап сбора полученной микробной биомассы, которая содержит, по крайней мере, 5% по DCW, включая глицеролипиды и эфиры жирных кислот, и реакцию щелочного гидролиза полученной биомассы для получения мыла в результате химического превращения, по крайней мере, части глицеролипидов или эфиров жирных кислот в соли жирных кислот. Согласно некоторым вариантам осуществления изобретения реакция щелочного гидролиза включает обработку биомассы основанием и, необязательно, нагревание биомассы. Согласно некоторым вариантам осуществления изобретения основанием является гидроксид щелочного металла, такой как KOH или NaOH. Согласно некоторым вариантам осуществления изобретения менее чем 100% глицеролипидов и эфиров жирных кислот в биомассе превращаются в соли жирных кислот. Согласно некоторым вариантам осуществления изобретения менее чем 1% глицеролипидов и эфиров жирных кислот в биомассе превращаются в соли жирных кислот.
Согласно некоторым вариантам осуществления изобретения заявленный способ сапонификации также включает полное отделение солей жирных кислот от других компонентов биомассы. Некоторые способы, заявленные в соответствии с настоящим изобретением, также включают кипячение выделенных солей жирных кислот в воде и повторную преципитацию солей жирных кислот путем введения соли в водный раствор для получения очищенного мыла. Согласно некоторым вариантам осуществления изобретения соль представляет собой растворимый в воде галид щелочного металла, такой как NaCl или KCl.
Некоторые способы сапонификации, заявленные в соответствии с настоящим изобретением, также включают объединение очищенного мыла или сапонифицированного масла с одной или более добавкой, выбранной из группы, включающей незаменимые масла, ароматические масла, душистые масла, растительные компоненты, экстракты, CO2 экстракты, глину, красители, диоксид титана, слюды, окрашивающие травы, блестки, эксфолианты, семена фруктов, растительные волокна, измельченные зернышки, муку из орехов, семян, масляные капельки, восковые капли, травы, гидрозоли, витамины, молочные порошки, консерванты, антиоксиданты, токоферолы, соли, сахара, овощные масла, воски, глицерин, морские растения, природные масла, увлажняющие масла, овощные твердые жиры, пропиленгликоль, парабены, мед, пчелиный воск, алое, полисорбат, кукурузный крахмал, какао-порошок, коралловый порошок, увлажнители, камеди, эмульгирующие агенты и уплотнители. Согласно одному варианту осуществления изобретения полученную смесь упаковывают как косметический продукт. Согласно другому варианту осуществления изобретения косметический продукт представляет собой средство для очищения лица.
Согласно одному варианту осуществления заявленного способа сапонификации соотношение солей жирных кислот к биомассе, из которой они были получены, составляет приблизительно 10% солей жирных кислот к 90% биомассы или 90% солей жирных кислот к 10% биомассы по сухому весу. Согласно некоторым вариантам осуществления изобретения биомассу подвергают реакции щелочного гидролиза без этапа предварительного обогащения, который позволяет увеличить соотношение липидной и нелипидной части биомассы до 50% во весу. Согласно некоторым вариантам осуществления изобретения полученную биомассу перед реакцией щелочного гидролиза подвергают только этапу лизиса. Согласно некоторым вариантам осуществления изобретения биомассу подвергают реакции щелочного гидролиза после этапа предварительного обогащения, что позволяет существенно увеличить соотношение липидов к нелипидным материалам биомассы. Согласно некоторым вариантам осуществления изобретения биомасса, которую подвергают щелочному гидролизу, содержит другие компоненты помимо воды в тех же относительных пропорциях, что и биомасса при ее получении. Согласно некоторым вариантам осуществления изобретения липиды составляют не более 90% от веса биомассы, которую подвергают щелочному гидролизу.
Согласно еще некоторым вариантам осуществления заявленного способа сапонификации полученная биомасса имеет содержание липидов, которое составляет, по крайней мере, 5%, по крайней мере, 10%, по крайней мере, 15%, по крайней мере, 20%, по крайней мере, 25%, по крайней мере, 30%, по крайней мере, 35%, по крайней мере, 40%, по крайней мере, 45%, по крайней мере, 50%, по крайней мере, 55%, по крайней мере, 60%, по крайней мере, 65%, по крайней мере, 70%, по крайней мере, 75%, по крайней мере, 80%, по крайней мере, 85%, или, по крайней мере, 90% по DCW. Согласно некоторым вариантам осуществления изобретения, липиды включают, по крайней мере, 50%, по крайней мере, 60%, по крайней мере, 70%, по крайней мере, 80%, по крайней мере, 90% или, по крайней мере, 95% насыщенных жирных кислот.
Согласно некоторым вариантам осуществления изобретения, способ спонификации дополнительно включает этап разрушения биомассы перед реакцией щелочного гидролиза. Согласно некоторым вариантам осуществления изобретения, разрушение биомассы осуществляют путем механического лизиса микробной популяции для получения лизата. Согласно другим вариантам осуществления изобретения, масло экстрагируют из биомассы перед реакцией сапонификации. Согласно некоторым вариантам осуществления изобретения масло вообще не содержит пигментов или не имеет цвета.
Согласно другому аспекту своего осуществления настоящее изобретение относится к композиции, включающей более легкую фазу, содержащую алкиловые эфиры жирных кислот, и, по крайней мере, одну более тяжелую фазу, содержащую компоненты микробной биомассы.
Согласно некоторым вариантам осуществления заявленной композиции, по крайней мере, 20% алкиловых эфиров жирных кислот представлены С18. Согласно некоторым вариантам осуществления изобретения, по крайней мере, 30% алкиловых эфиров жирных кислот представлены С18. Согласно некоторым вариантам осуществления изобретения, по крайней мере, 40% алкиловых эфиров жирных кислот представлены С18. Согласно некоторым вариантам осуществления изобретения, по крайней мере, 50% алкиловых эфиров жирных кислот представлены С18. Согласно некоторым вариантам осуществления изобретения, по крайней мере, 50% алкиловых эфиров жирных кислот представляют собой С16 или молекулы с более длинной цепью. Согласно некоторым вариантам осуществления изобретения, по крайней мере, 10% алкиловых эфиров жирных кислот представлены С14 или молекулами с более короткой цепью. Согласно некоторым вариантам осуществления изобретения, по крайней мере, 20% алкиловых эфиров жирных кислот являются С14 или имеют более короткие цепи.
Согласно другому аспекту своего осуществления настоящее изобретение относится к композиции, включающей легкую фазу, содержащую полностью насыщенные липиды, и, по крайней мере, одну более тяжелую фазу, содержащую микробную биомассу. Согласно еще одному аспекту настоящее изобретение относится к композиции, содержащей легкую фазу, включающую липиды, и, по крайней мере, одну более тяжелую фазу, содержащую микробную биомассу более чем из одного штамма или вида микроорганизмов. Согласно другому аспекту настоящее изобретение относится к композиции, содержащей легкую фазу, включающую гидроксилированные липиды, и, по крайней мере, одну более тяжелую фазу, включающую микробную биомассу. Согласно еще одному аспекту настоящее изобретение относится к композиции, содержащей легкую фазу, включающую свободные жирные кислоты, и, по крайней мере, одну более тяжелую фазу, включающую микробную биомассу.
Согласно дополнительному аспекту своего осуществления настоящее изобретение относится к композиции, содержащей сапонифицированное масло, полученное в результате щелочного гидролиза биомассы, созданной путем культивирования микробной популяции. Согласно некоторым вариантам осуществления изобретения заявленная композиция также содержит, по крайней мере, одно, а возможно, и более чем одно масло, выбранное из группы, включающей соевое масло, рапсовое масло, масло канолы, пальмовое масло, пальмовое косточковое масло, кокосовое масло, кукурузное масло, отработанные овощные масла, китайское масло, оливковое масло, подсолнечное масло, хлопковое масло, куриный жир, говяжий жир, свиной жир, масло из микроводорослей, масло из макроводорослей, масло из растения Cuphea, льняное масло, арахисовое масло, отборный белый жир, сало, рыжиковое масло (Camelina sativa), масло горчичных семян, масло из ореха кешью, овсяное масло, люпиновое масло, масло гибискуса, масло календулы, конопляное масло, кофейное масло, льняное, масло из фундука, масло из молочая, масло тыквенного семени, масло кориандра, ромашки, кунжутное масло, сафлоровое масло, рисовое масло, масло тунгового дерева, масло какао, кокосовое масло, масло из маковых семян, масло клещевины, масло ореха пекан, масло жожоба, масло ятрофы, масло ореха макадамия, масло бразильского ореха, масло авокадо, нефть или ее дистиллированные фракции.
Согласно различным вариантам осуществления изобретения композиция сапонифицированных масел может быть твердой (включая порошок) или жидкой. Согласно некоторым вариантам осуществления изобретения заявленная композиция дополнительно содержит каротеноиды, выделенные из биомассы, и/или несапонифицированные глицеролипиды, выделенные из биомассы, и/или полисахариды, выделенные из биомассы. Согласно некоторым вариантам осуществления изобретения сапонифицированные масла составляют, по крайней мере, 50% от общего веса композиции. Согласно другим вариантам осуществления изобретения сапонифицированные масла составляют, по крайней мере, 75% от общего веса композиции. Согласно некоторым вариантам осуществления изобретения сапонифицированные масла составляют менее 50% от общего веса композиции. Согласно некоторым вариантам осуществления изобретения сапонифицированные масла составляют менее 25% от общего веса композиции. Согласно некоторым вариантам осуществления изобретения компоненты, выделенные из биомассы, составляют, по крайней мере, 50% от общего веса композиции. Согласно некоторым вариантам осуществления изобретения компоненты, выделенные из биомассы, составляют не более 50% от общего веса композиции.
Согласно другому аспекту своего осуществления настоящее изобретение относится к набору, содержащему композицию сапонифицированных масел, как описано выше, и пищевую добавку. Согласно некоторым вариантам осуществления изобретения пищевой добавкой являются витамины или травы.
Краткое описание чертежей
На Фиг.1 представлен DCW на литр некоторых видов и штаммов Chlorella при культивировании их в присутствии различных типов глицерола как с добавлением глюкозы, так и без нее.
На Фиг.2 представлен DCW на литр некоторых видов и штаммов Chlorella при культивировании их в присутствии различных типов глицерола с добавлением глюкозы.
На Фиг.3 представлена относительная концентрация липидов в культурах некоторых штаммов и видов Chlorella при культивировании их в присутствии различных типов глицерола с добавлением глюкозы.
На Фиг.4 представлена относительная концентрация липидов в культурах некоторых штаммов и видов Chlorella при культивировании их в присутствии различных типов глицерола как с добавлением глюкозы, так и без нее.
На Фиг.5 представлена концентрация липидов, выраженная в процентах от DCW, двух видов и штаммов Chlorella при культивировании их в присутствии различных типов глицерола с добавлением глюкозы, при этом глицерол добавляют сразу после введения глюкозы.
На Фиг.6 представлена концентрация липидов, выраженная в процентах от DCW, двух видов и штаммов Chlorella при культивировании их в присутствии различных типов глицерола с добавлением глюкозы.
На Фиг.7 показана относительная концентрация липидов в культуре различных видов и штаммов Chlorella при культивировании их в присутствии 2% глюкозы и 1% глюкозы + 1% химически чистого глицерола.
На Фиг.8 представлена концентрация липидов, выраженная в процентах от DCW различных видов и штаммов Chlorella при культивировании их в присутствии глюкозы как с добавлением химически чистого глицерола, так и без него, при этом глицерол добавляют сразу после введения глюкозы либо совместно с глюкозой.
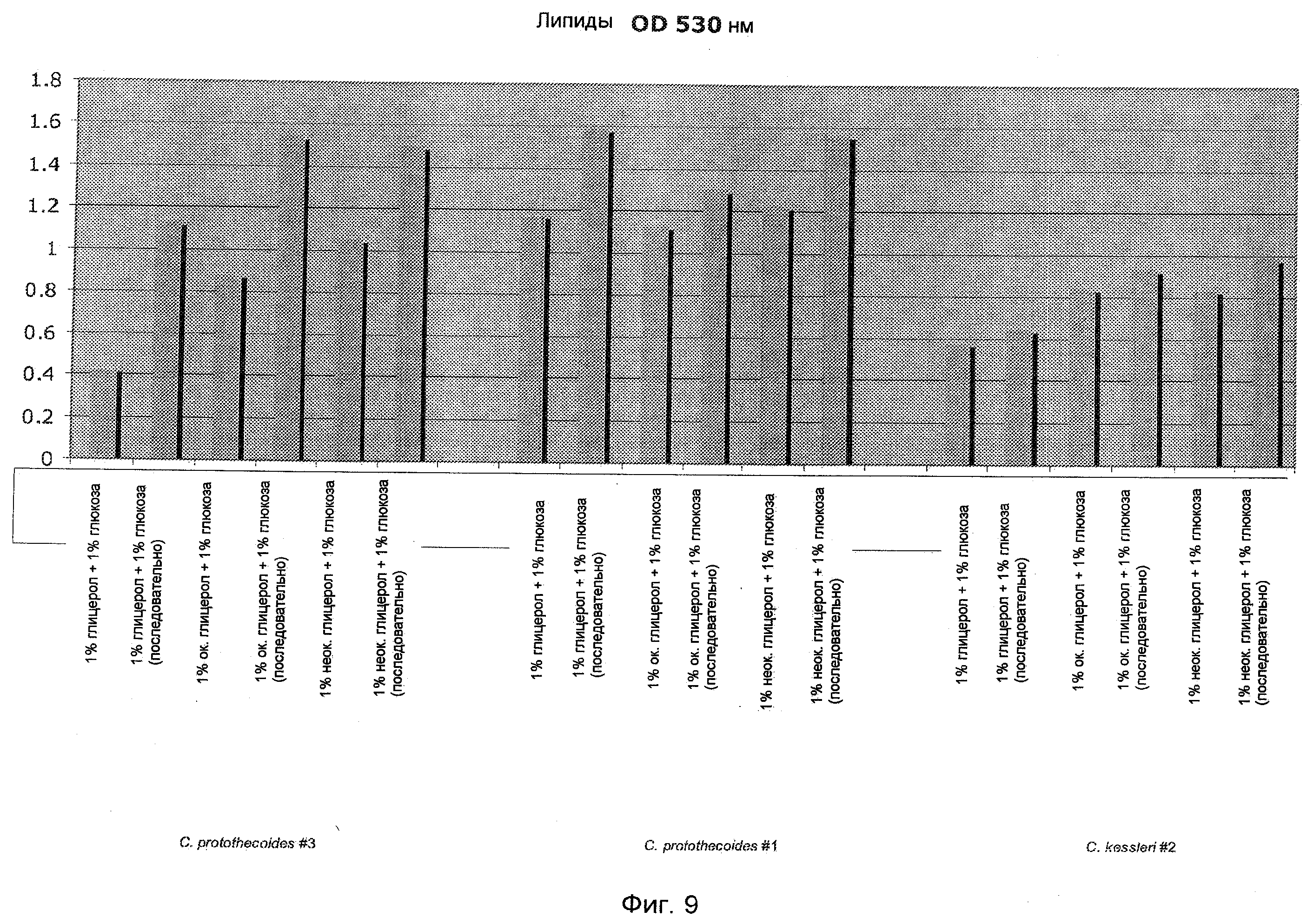
На Фиг.9 представлена относительная концентрация липидов в культуре различных штаммов и видов Chlorella при культивировании их в присутствии разных типов глицерола с добавлением глюкозы, при этом глицерол вводят совместно с глюкозой или сразу после нее.
На Фиг.10 представлен DCW на литр различных видов и штаммов Chlorella при культивировании их в присутствии различных типов глицерола с добавлением глюкозы, при этом глицерол добавляют в комбинации с глюкозой или сразу после нее.
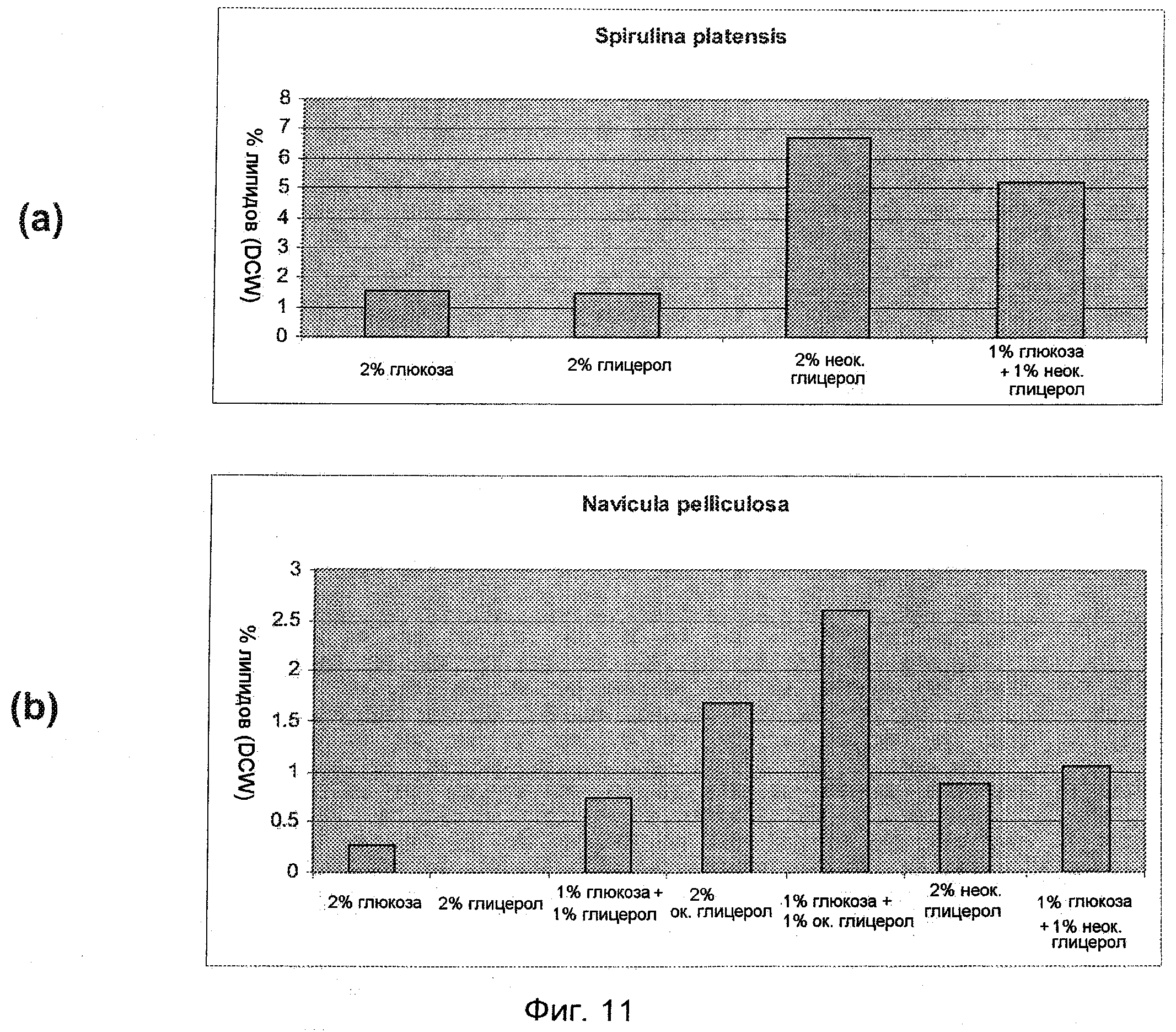
На Фиг.11(а) представлена концентрация липидов в процентах от DCW в микроорганизме Spirulina platensis, при культивировании в присутствии глюкозы, химически чистого глицерола, неокисленного глицерола как побочного продукта реакции получения биодизеля и комбинации глицерола и глюкозы.
На Фиг.11(б) представлена концентрация липидов в процентах от DCW в микроорганизме Navicula pelliculosa при культивировании в присутствии различных типов глицерола, а также комбинации глицерола и глюкозы.
На Фиг.12(а) представлена концентрация липидов в процентах от DCW в микроорганизме Scenedesmus armatus при культивировании различных типов глицерола и комбинации глицерола с глюкозой.
На Фиг.12(б) представлен DCW на литр микроорганизма Scenedesmus armatus при культивировании в присутствии различных типов глицерола и комбинации глицерола как побочного продукта реакции получения биодизеля и глюкозы.
На Фиг.13 представлен DCW на литр микроорганизма Navicula pelliculosa при культивировании в присутствии различных типов глицерола и комбинации неокисленного глицерола как побочного продукта реакции получения биодизеля и глюкозы.
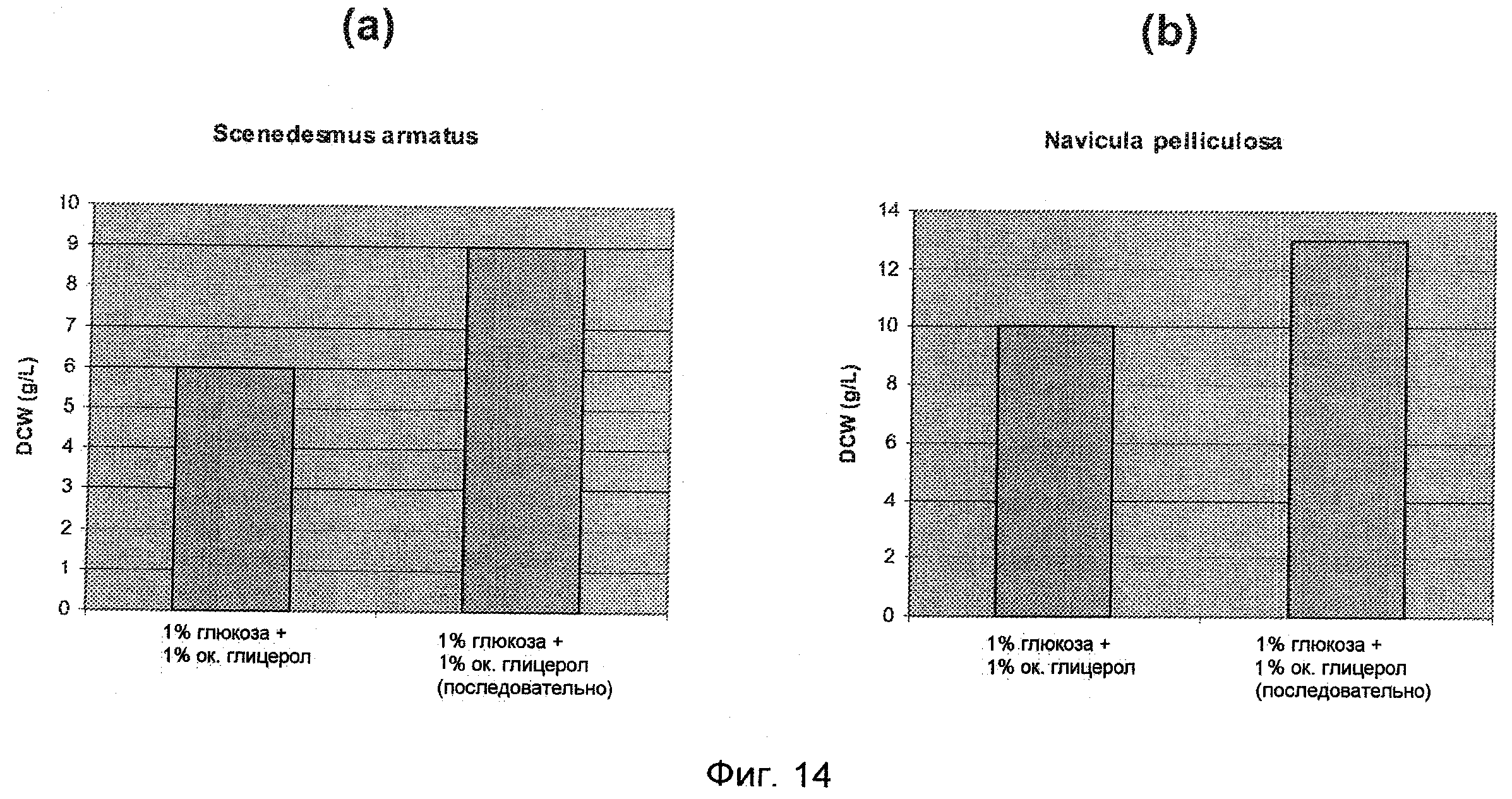
На Фиг.14(а) и 14(б) представлен DCW на литр микроорганизмов Scenedesmus armatus и Navicula pelliculosa при культивировании их в присутствии окисленного и неокисленного глицерола как побочного продукта реакции получения биодизеля с добавлением глюкозы, при этом глицерол добавляют в комбинации с глюкозой или сразу после нее.
На Фиг.15 показан синергический эффект комбинации ксилозы и глюкозы на рост микроорганизмов Chlorella, по сравнению с эффектами отдельно ксилозы и отдельно глюкозы.
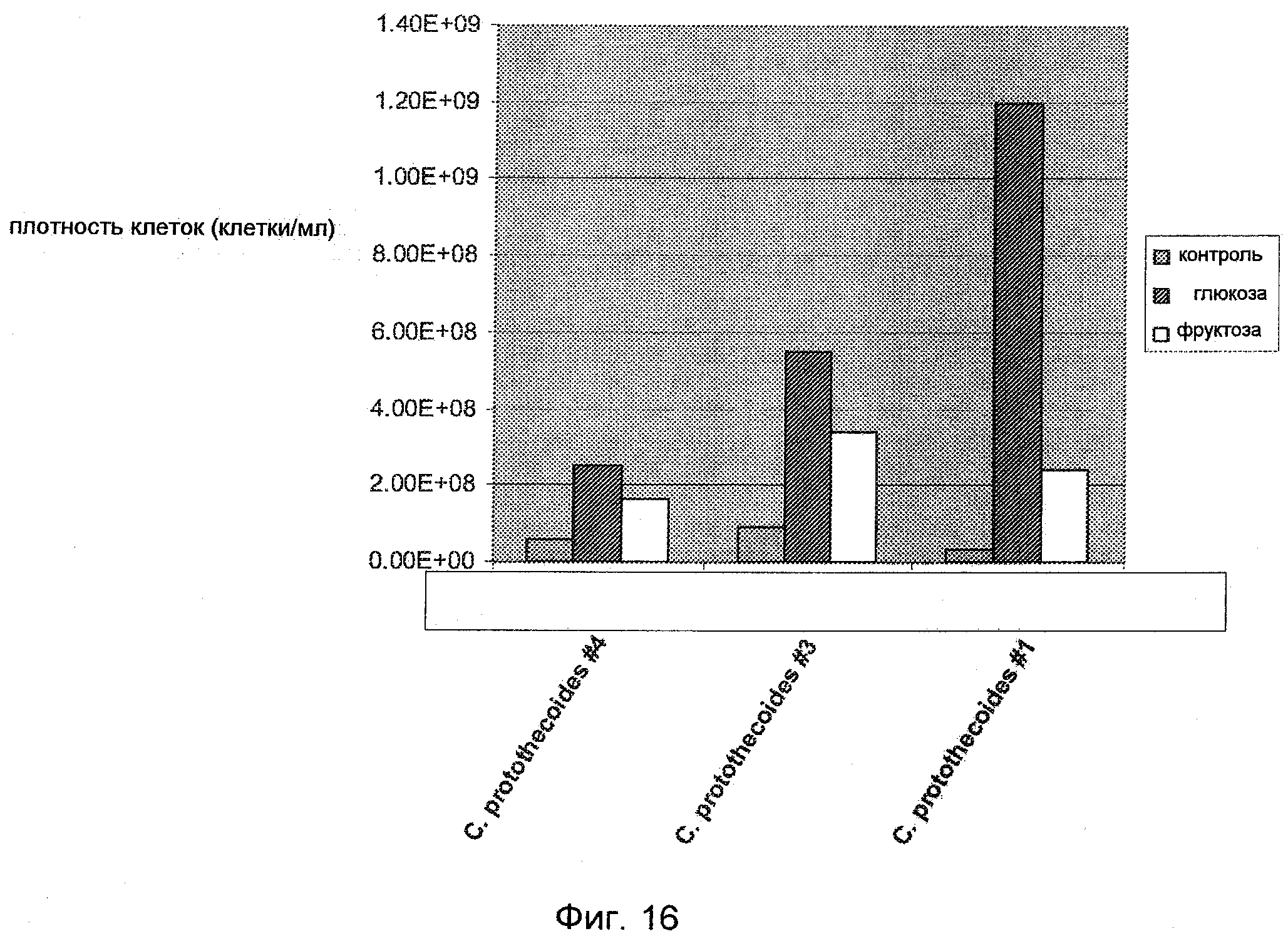
На Фиг.16 показан рост микроорганизмов Chlorella protothecoides на глюкозе и фруктозе.
На Фиг.17 представлен DCW на литр микроорганизма Chlorella protothecoides при культивировании их в присутствии глюкозы, сахарозы или одного из нескольких образцов мелассы (обозначенных как BS1, BS2 и НТМ) в присутствии сахарозоинвертазы и в ее отсутствии.
На Фиг.18 показан рост микроорганизма Chlorella protothecoides при культивировании их в присутствии глюкозы, сахарозы, или одного из нескольких образцов мелассы (обозначенных как BS1, BS2 и НТМ) в присутствии сахарозоинвертазы и в ее отсутствии; рост измеряется на основании относительной плотности клеток.
На Фиг.19 показаны результаты визуального сравнения масел, экстрагированных при помощи гексана, из штамма UTEX 1435 и из штамма UTEX 250.
На Фиг.20 показаны клетки водорослей, богатые маслами, заключенные в мыло.
На Фиг.21(а-с) представлены кладограммы, сравнивающие геномные последовательности ДНК 23s pPHK 8 различных штаммов Chlorella protothecoides.
На Фиг.22-27 представлена кривая роста различных штаммов микроводорослей, выращенных на чистом сорго как источнике углерода, в трех различных концентрациях.
На Фиг.28 показаны основные различия липидных цепей микроводорослей.
На Фиг.29 a-i представлена кладограммы, сравнивающие геномные ДНК последовательности 23S pPHK 23 различных штаммов микроводорослей.
Подробное описание изобретения
1. Определения
Определения некоторых терминов, встречающихся в описании, представлены ниже, для удобства читателей.
Термин "активная в микроводорослях", употребляемый по отношению к нуклеиновой кислоте, относится к нуклеиновой кислоте, которая функционирует в микроводорослях. Например, промотор, который используется для запуска гена устойчивости к антибиотикам для того, чтобы придать трансгенным микроводорослям устойчивость к антибиотикам, является активным именно у микроводорослей. Примерами промоторов, которые являются активными у микроводорослей, являются эндогенные промоторы, специфичные для определенных видов микроводорослей, а также промоторы, которые обнаруживаются у вирусов растений.
"Ацилнесущий белок" или "АСР" представляет собой белок, который связывается с растущей ацильной цепью во время синтеза жирных кислот тиолсложноэфирной связью на дистальном тиольном (SH) конце молекулы 4'-фосфопантетеина и является частью комплекса синтетазы жирных кислот. Фраза "естественно совместно экспрессируемый" по отношению к ацилнесущему белку в связи с ацил-АСР-тиоэстеразой означает, что АСР и тиоэстераза экспрессируются совместно естественным образом (то есть в природе) в тканях или организме, из которого они выделены, поскольку гены, кодирующие два фермента, находятся под контролем одной регуляторной последовательности, или поскольку они экспрессируются в ответ на одинаковые стимулы.
"Ацил-КоА молекула" или "ацил-КоА" представляет собой молекулу, имеющую ацильную группу, ковалентно связанную с коэнзимом А, через тиолсложноэфирную связь на дистальном тиольном конце молекулы 4'фосфопантетеина коэнзима А.
Термин "аксенический" относится к культуре организма, не содержащей других живых организмов.
Термин "биодизель" относится к эфиру жирной кислоты, полученному в результате переэтерификации липида. Эфир может представлять собой метиловый эфир, этиловый эфир или любой другой эфир в зависимости от компонентов реакции переэтерификации.
Термин "биомасса" относится к материалу, полученному в результате выращивания и/или размножения клеток. Биомасса может содержать клетки и/или межклеточное вещество, а также внеклеточные компоненты. К внеклеточным компонентам относятся, без ограничений указанными, вещества, секретируемые клетками.
Термин "биореактор" относится к закрытому или полузакрытому месту, в котором культивируют клетки, например микроорганизмы, возможно в суспензии.
Термин "катализатор" относится к агенту, такому как молекулярный или макромолекулярный комплекс, способному усиливать или стимулировать химическую реакцию реагента до конечного продукта, при этом катализатор не становится частью реагента. Таким образом, катализатор увеличивает скорость реакции, после чего катализатор может работать с другим реагентом для его преобразования в конечный продукт. В целом катализатор уменьшает общие затраты энергии активации, которая необходима для осуществления реакции, таким образом, реакция происходит быстрее или при более низкой температуре и/или быстрее достигается химическое равновесие. Примерами катализаторов являются ферменты, которые являются биологическими катализаторами, а также тепло, которое является небиологическим катализатором.
"Целлюлозный материал" относится к продуктам расщепления целлюлозы, таким как глюкоза, ксилоза, арабиноза, дисахариды, олигосахариды, лигнин, фурфурол и другие вещества.
Термин "сокультура" и его варианты, такие как "сокультивирование", означает наличие двух и более типов клеток в биореакторе. Указанные два и более типа клеток могут оба представлять собой микроорганизмы, такие как микроводоросли, либо могут представлять собой микроводоросли, культивируемые с клетками другого типа. Условия культивирования могут быть такими, которые ускоряют рост и/или размножение клеток двух и более типов, или такими, которые усиливают рост и/или размножение только одного типа клеток, или подтипа клеток указанных двух и более типов, и при этом поддерживают рост остальных клеток.
Термин "кофактор" относится к любой молекуле, отличной от субстрата, которая необходима ферменту для проявления его ферментативной активности.
"Комплементарная ДНК" ("кДНК") относится к ДНК копии иРНК, которая может быть получена, например, путем обратной транскрипции информационной РНК (иРНК) или амплификации (например, при помощи полимеразной цепной реакции ("ПЦР").
Термин "культивируемый" и его различные варианты означает целенаправленное стимулирование роста (увеличение размера клеток, содержимого клеток и/или клеточной активности) и/или размножения (увеличение количества клеток посредством митоза) одной или более клетки при помощи подходящих условий культивирования. Понятия рост и размножение могут быть объединены единым термином пролиферация. Указанная одна или более клетка может представлять собой микроорганизм, такой как микроводоросль. Под подходящими условиями культивирования понимают, например, использование определенной питательной среды (с известными характеристиками, такими как рН, ионная сила и источник углерода), специфический температурный режим, давление кислорода и уровень диоксида углерода в биореакторе. Термин не относится к росту и размножению клеток, которое происходит в природе или без какого-либо целенаправленного вмешательства человека, например к росту организмов, которые в конечном итоге фоссилизируются с получением геологического сырого масла.
Термин "экзогенный ген" относится к нуклеиновой кислоте, трансформированной (встроенной) в клетку. Трансформированная клетка может быть обозначена как рекомбинантная клетка, в которую дополнительные экзогенные гены могут быть введены. Экзогенный ген может быть геном других видов организмов (тогда он обозначается как гетерологичный ген) или принадлежать организму того же вида (тогда он обозначается как гомологичный), что и трансформируемая клетка. В случае гомологичного гена встраиваемый ген занимает различные локации в геноме клетки по отношению к эндогенным копиям гена или находится под различными регуляторными контролирующими последовательностями эндогенного гена, который он замещает. Экзогенный ген может присутствовать в клетке более чем в одной копии. Нахождение экзогенного гена в клетке может обеспечиваться путем его встраивания в геном либо за счет эписомальных молекул.
Термин "экзогенно предоставленный" относится к молекуле, которая вводится в культуральную среду, на которой выращивается культура клеток.
Термин "экстрагированный" относится к маслу или липиду, выделенному из водной биомассы как при помощи растворителя, так и без.
"Жирная ацил-АСР-тиоэстераза"представляет собой фермент, который катализирует отщепление жирной кислоты от ацилнесущего белка (АСР) во время синтеза липидов.
"Фиксированный источник углерода" относится к молекуле (молекулам), содержащей углерод, обычно органической молекуле, которая при средней температуре и давлении находится в твердой или жидкой форме.
Термин "гриб", используемый здесь, относится к гетеротрофным организмам, для которых характерно наличие клеток с хитиновой стенкой, относящимся к царству грибов.
"Гетероатом" относится к атому, отличному от атома водорода или углерода. Примерами гетероатомов являются магний, кальций, калий, натрий, сера, фосфор, железо и медь.
Термин "гомогенат" означает биомассу, которая была физически разрушена.
Термин "гидрофобная фракция" относится к части, или фракции материала, которая является более растворимой в гидрофобной фазе, чем в водной фазе. Гидрофобная фракция практически не смешивается с водой и обычно является неполярной.
Термин "увеличенный выход липидов" относится к увеличению продукции липидов микробной биомассы, которое может достигаться, например, путем увеличения сухого веса клеток на литр культуры, путем увеличения процентного содержания клеток, продуцирующих липиды, или путем увеличения общего количества липидов на объемный литр культуры в единицу времени.
"Индуцируемый промотор" представляет собой промотор, который опосредует транскрипцию функционально связанного гена в ответ на определенный стимул.
Термин "в функциональной связи" означает, что две последовательности нуклеиновой кислоты находятся в функциональной связи друг с другом, например контрольная последовательность (обычно промотор) и связанная последовательность. Промотор находится в функциональной связи с экзогенным геном, если он может опосредовать его транскрипцию.
Термин "in situ" означает "на месте" или "на месте первоначального образования". Например, культура может включать первый микроорганизм, такой как микроводоросль, секретирующий катализатор, и второй микроорганизм, секретирующий субстрат, при этом и первый, и второй микроорганизмы продуцируют компоненты, необходимые для осуществления определенной химической реакции, которая произойдет in situ, в этой же совместной культуре, и не потребует дополнительного разделения или обработки материалов.
"Липаза" представляет собой фермент, который катализирует гидролиз сложноэфирных связей в липидных субстратах. Липаза катализирует гидролиз липидов до глицеролов и жирных кислот, кроме того, она может катализировать переэтерификацию TAGs до сложных эфиров жирных кислот.
"Липиды" представляют собой липофильные молекулы, которые могут быть выделены из микроорганизмов. Основная биологическая функция липидов состоит в сохранении энергии, кроме того, они являются структурными компонентами клеточных мембран, выступают в роли сигнальных молекул, и выполняют ряд других биологических функций. Липиды растворимы в неполярных растворителях (таких как эфир и хлороформ) и относительно плохо растворимы в воде. Липиды состоят главным образом из длинных, гидрофобных, углеводородных "хвостов". Примерами липидов являются жирные кислоты (насыщенные и ненасыщенные); глицериды или глицеролипиды (такие как моноглицериды, диглицериды, триглицериды (включая TAGs) или нейтральные жиры и фосфоглицериды или глицерофосфолипиды); неглицериды (сфинголипиды, стероловые липиды, включая холестерин и стероидные гормоны, преноловые липиды, включая терпеноиды, воски и поликетиды); и комплексные липидные производные (липиды, связанные с сахарами); сложные эфиры жирных кислот; стеролы; пигменты (например, каротеноиды и оксикаротеноиды), ксантофиллы, фитостеролы, эрготионины, липоевая кислота, антиоксиданты, включая бета-каротин и токоферол. Также к липидам относятся полиненасыщенные жирные кислоты, такие как арахидоновая кислота, стеаридоновая кислота, холестерин, десместрол, астаксантин, и n-6 и n-3 высоконенасыщенные жирные кислоты, такие как эйкозапентаеновая кислота (ЕРА), докозапентаеновая кислота и докозагексаеновая кислота (DHA).
"Фермент липидного цикла" - это фермент, участвующий в метаболизме липидов, то есть в синтезе липидов, их модификации или деградации; к таким ферментам относятся, например, без ограничений указанными, липазы, жирные ацил-АСР-тиоэстеразы, а также ацилнесущие белки.
"Предельная концентрация питательного вещества" - это концентрация питательного вещества в культуре, которая ограничивает размножение культивируемого организма. А "непредельная концентрация питательного вещества" - это такая концентрация, которая может поддерживать максимальные темпы размножения в течение определенного периода культивирования. Таким образом, количество клеток, образующееся в течение определенного времени культивирования меньше в присутствии предельной концентрации питательного вещества, по сравнению количеством клеток при использовании непредельной концентрации. Говорят, что питательное вещество "в избытке" в культуре, когда питательное вещество присутствует в концентрации, превышающей ту, которая поддерживает максимальную скорость размножения.
Термин "глицеролипидный профиль" относится к процентному распределению глицеролипидов с различной длиной углеродной цепи и степенью насыщенности в определенном образце биомассы. Например, образец может содержать глицеролипиды, из которых приблизительно 60% составляют глицеролипиды С18:1, 20% - С18:0, 15% - С16:0, и 5% - С14:0. Когда углеродную цепь обозначают без учета насыщенности, как, например, "С18", это означает, что цепь может иметь любую степень насыщенности; например, микробная масса, которая содержит 20% липидов С18, может включать как С18:0 липиды, так и С18:1 или С18:2, и т.д., в одинаковых или различных количествах, но в сумме они составляют 20% микробной биомассы.
Термин "лизат" относится к раствору, содержащему содержимое лизированных клеток. "Лизирование" означает разрушение плазматической мембраны и, необязательно, клеточной стенки биологического организма, достаточное для того, чтобы высвободились, по крайней мере, некоторые внутриклеточные компоненты, осуществляемое обычно при помощи механического, осмотического воздействия или путем заражения вирусом, который нарушает целостность клеток.
"Микроводоросль" это микробный организм, который может быть как (а) эукариотическим и содержать хлоропласт или остаток хлоропласта, так и (б) цианобактерией. Микроводоросли являются облигатными фотоавтотрофами, которые не могут метаболизировать фиксированный углерод как источник энергии, как и гетеротрофы, которые могут сущестовать только без фиксированного источника углерода. К микроводорослям могут быть отнесены одноклеточные организмы, которые отделяются от сестринских клеток вскоре после клеточного деления, такие как Chlamydomonas, a также микроорганизмы, такие как, например, Volvox, которые представляют собой простые многоклеточные фотосинтезирующие микроорганизмы из двух различных типов клеток. К "микроводорослям" также относятся другие фотосинтезирующие организмы, обладающие свойством клеточной адгезии, такие как Amenellum, Anabaena и Pyrobotrys, а также организмы, содержащие структуры, подобные хлоропласту, но не обладающие тем не менее способностью к фотосинтезу, такие как микроводоросли рода Prototheca и некоторые динофлагелляты.
Термины "микроорганизм" или "микроб", которые являются взаимозаменяемыми и постоянно используются в настоящем описании, относится к микроскопическим одноклеточным организмам.
Термин "масло" относится к гидрофобному, липофильному, неполярному углеродсодержащему веществу и объединяет (без ограничений указанными) геологические сырые масла, дистиллированные фракции геологических масел, овощные масла, масла из водорослей и микробные липиды.
Термин "липогенные дрожжи", используемый здесь, относится к дрожжам, которые обладают способностью накапливать липиды в количестве более 10% от DCW. К липогенным дрожжам относятся такие дрожжи, как Yarrowia lipolytica, а также штаммы дрожжей, полученные путем генной инженерии, например Saccharomyces cerevisiae, которые накапливают более 10% липидов от DCW.
"Осмотический шок" - это разрушение бактерий, водорослей и других клеток в растворе с последующим резким понижением осмотического давления. Осмотический шок иногда применяют для высвобождения клеточных компонентов в раствор.
"Фотобиореактор" - это контейнер, по крайней мере, одна из частей которого является частично прозрачной или открытой, что позволяет свету проникать внутрь, в котором культивируют один или более вид водорослей. Фотобиореакторы могут быть закрытыми, как, например, в случае полиэтиленового контейнера или колбы Эрленмейера, или могут быть открытыми для воздействия окружающей среды, например, как пруд на открытом воздухе.
"Полисахарид-разрушающий фермент" - это фермент, способный катализировать гидролиз или деполимеризацию любого полисахарида. Например, целлюлазы являются полисахарид-разрушающими ферментами, катализирующими гидролиз целлюлозы.
"Полисахариды" (или "гликаны") - это углеводороды, состоящие из моносахаридов, связанных между собой гликозидными связями. Целлюлоза является примером полисахарида, который составляет клеточную стенку определенных видов растений. Целлюлоза может быть деполимеризована при помощи ферментов с образованием моносахаридов, таких как ксилоза и глюкоза, а также дисахаридов и олигосахаридов.
"Порт" при использовании по отношению к биореактору, означает открытый канал в биореакторе, который позволяет осуществляться притоку и оттоку различных материалов, таких как газы, жидкости и клетки. Порт обычно связан с трубами, идущими от биореактора.
Термин "рекомбинантный", который используется по отношению, например, к клеткам или нуклеиновым кислотам, белкам или векторам, означает, что клетка, нуклеиновая кислота, белок или вектор были модифицированы путем введения гетерологичной нуклеиновой кислоты или белка или за счет изменения нативной (природной) нуклеиновой кислоты или белка, либо, что клетка была получена из клетки, уже модифицированной таким образом. Таким образом, рекомбинантные клетки экспрессируют ненативные гены, а именно гены, которые нельзя обнаружить в нативной (нерекомбинантной) форме клетки, либо экспрессируют нативные гены иначе, чем нерекомбинантные клетки, то есть нативный ген либо гиперэкспрессируется, слабо экспрессируется или не экспрессируется вовсе, по отношению к экспрессии этого же гена нерекомбинантной клеткой. "Рекомбинантная нуклеиновая кислота" - это нуклеиновая кислота, обычно образуемая in vitro в результате различных манипуляций, например, при помощи использования эндонуклеаз или полимераз, полученная нуклеиновая кислота не обнаруживается в природе (и может включать очищенные препараты существующих в природе нуклеиновых кислот). Таким образом, изолированная нуклеиновая кислота, в линейной форме, или вектор экспрессии, полученные in vitro путем связывания молекул ДНК, которые в норме не соединяются (например, имеется в виду связывание двух различных нуклеиновых кислот функциональной связью), являются рекомбинантными. Когда рекомбинантную нуклеиновую кислоту вводят в клетку-хозяин или организм, она может реплицироваться нерекомбинантно, то есть с использованием in vivo аппарата клетки-хозяина; однако такие нуклеиновые кислоты, полученные рекомбинантным путем и затем реплицирующиеся нерекомбинантно, все равно считаются рекомбинантными. Аналогично "рекомбинантный белок" представляет собой белок, полученный при помощи рекомбинантных технологий, то есть путем экспрессии рекомбинантной нуклеиновой кислоты.
Термин "сапонифицированное (омыленное) масло" относится к солям карбоксильных кислот или другим родственным соединениям, которые образуются во время сапонификации сложных эфиров жирных кислот, выделенных из микробных источников. Сложные эфиры жирных кислот могут быть получены из триацилглицеролов (TAGs), продуцируемых микроорганизмами. Соединениями, родственными маслам, выделенным из микробных источников, являются каротеноиды, токоферолы, токотриенолы и другие соединения биологического происхождения.
"Разрушение ультразвуком" - способ разрушения биологических материалов, например клеток, при помощи использования энергии звуковых волн.
"Солома" это высушенные стебли и листья злаковых растений, оставшиеся после сбора зерна.
"Ген утилизации сахарозы" - это ген, при экспрессии которого усиливается способность клетки утилизировать сахарозу в качестве источника энергии. Примерами генов утилизации сахарозы являются транспортеры сахарозы, сахарозоинвертазы и гексокиназы, такие как глюкокиназы и фруктокиназы.
II. Общая часть
Определенные микроорганизмы могут использоваться для продукции липидов в больших количествах для последующего их применения в транспортном топливе и нефтехимическом производстве, а также в других сферах. Настоящее изобретение предлагает способы, которые позволяют существенно снизить стоимость и увеличить эффективность получаемых липидов и других ценных соединений на основе липидов, выделенных из микроорганизмов. Подходящими микроорганизмами, которые могут использоваться в способах, заявленных в настоящем изобретении, являются микроводоросли, липогенные дрожжи, грибы, бактерии и цианобактерии. Подходящим для использования в соответствии с настоящим изобретением является род микроводорослей Chlorella. Настоящее изобретение также относится к способам in situ переэтерификации триацилглицеридов (TAGs) до сложных алкиловых эфиров жирных кислот, которые могут использоваться в качестве биодизельного топлива и/или для других целей, кроме того, настоящее изобретение относится к другим способам химической модификации липидов, выделенных из биомассы.
Настоящее изобретение также относится к способам получения сложных алкиловых эфиров жирных кислот (например, метиловых эфиров жирных кислот (FAME)), заключающимся в культивировании популяции микроорганизмов, которые обладают способностью продуцировать липиды, такие как триглицериды, в объеме 5% от своего DCW. Согласно данному способу микробную массу собирают из культуры и, необязательно, высушивают, чтобы удалить воду. Затем осуществляют переэтерификацию путем добавления низшего алкилового спирта и катализатора (например, NaOH) для создания липофильной фазы, содержащей сложные алкиловые эфиры жирных кислот, и гидрофильной фазы, содержащей гидрофильный клеточный материал. Липофильная фаза может быть легко отделена от гидрофильной фазы.
Прямая переэтерфикация биомассы, без промежуточного этапа разделения фракций, во время которого липофильные компоненты экстрагируют из биомассы, позволяет существенно уменьшить стоимость процесса получения биодизеля по сравнению со способами, которые включают этапы традиционной экстракции и рафинирования перед переэтерификацией.
Способы, заявленные в соответствии с настоящим изобретением, имеют ряд дополнительных преимуществ, по сравнению с традиционными способами получения биодизелей за счет in situ переэтерификации глицеролипидов до алкиловых эфиров жирных кислот. В частности, микроорганизмы, которые используются в соответствии с настоящим изобретением, могут культивироваться в условиях, позволяющих регулировать содержание глицеролипидов в клетках. Неожиданно авторами изобретения было показано, что значительная доля глицеролипидов может быть конвертирована в алкиловые эфиры жирных кислот в клетках, которые имеют более высокие соотношения липиды:нелипидные компоненты, выраженные как функция DCW. Кроме того, такие увеличенные соотношения липиды:нелипидные компоненты также имеют одно удивительное преимущество: алкиловые эфиры жирных кислот, полученные из клеток, имеющих такие высокие соотношения липидов и нелипидных компонентов, имеют более низкое содержание гетероатомов, по сравнению с эфирами, полученными из клеток, имеющих низкое соотношение липидов и нелипидных компонентов. Завленные способы значительно отличаются от существующих общепринятых способов данного производства, главным образом потому, что фотоавтотрофное выращивание микроводорослей является лучшим способом культивирования микроводорослей для получения биотоплива (см., например, Rodolfi, et al., Biotechnology & Bioengineering 102(1):100-112 (2008), где представлены результаты скрининга штаммов микроводорослей на предмет продуктивности биомассы и содержания липидов при их выращивании в фотобиореакторе на открытом воздухе). Также было обнаружено, что чем выше содержание липидов в биомассе, тем лучше качество конечного продукта после прямой химической модификации. Настоящее изобретение относится к гетеротрофным способам культивирования микробов (например, микроводорослей) для получения более высокого содержания липидов для последующей прямой химической модификации и получения химических продуктов высокого качества.
Настоящее изобретение также относится к другим способам химической модификации содержащей липид микробной биомассы, включая, без ограничений, указанными гидрогенизацию, интерэтерификацию, гидроксилирование, гидролиз и сапонификацию. Эти способы могут использоваться по отношению к различным микроорганизмам и при различных условиях культивирования, указанных в настоящем описании, для получения широкого спектра химических продуктов для последующего их различного применения.
Настоящее изобретение также относится к полезным композициям, включающим: композиции, содержащие легкую фазу сложных алкиловых эфиров жирных кислот и, по крайней мере, одну более тяжелую фазу, включающую микробную биомассу; композиции, содержащие легкую фазу полностью насыщенных липидов и, по крайней мере, одну более тяжелую фазу, включающую микробную биомассу; композиции, содержащие легкую фазу липидов и, по крайней мере, одну более тяжелую фазу, включающую микробную биомассу из одного или более штамма или вида; композиции, содержащие легкую фазу гидроксилированных липидов и, по крайней мере, одну более тяжелую фазу, включающую микробную биомассу; и композиции, содержащие легкую фазу свободных жирных кислот и, по крайней мере, одну более тяжелую фазу, включающую микробную биомассу. Настоящее изобретение также относится к композициям, содержащим сапонифицированные масла, полученные при помощи щелочного гидролиза биомассы, созданной путем культивирования микроорганизмов.
III. Микроорганизмы
Микроорганизмы, подходящие для использования в соответствии с настоящим изобретением, продуцируют липиды, которые можно использовать для химической модификации с целью создания биодизелей или для получения сложных эфиров жирных кислот для других целей, например для получения промышленного химического сырья или пищевых масел, а также для синтеза других химических соединений. Подходящими липидами для создания биодизелей и химического синтеза являются TAGs, содержащие молекулы жирных кислот. Согласно некоторым вариантам осуществления изобретения подходящие жирные кислоты содержат, по крайней мере 8, по крайней мере, 10, по крайней мере, 12, по крайней мере, 14, по крайней мере 16, по крайней мере, 18, по крайней мере, 20, по крайней мере, 22, по крайней мере 24, по крайней мере, 26, по крайней мере, 28, по крайней мере, 30, по крайней мере 32, или, по крайней мере, 34 атома углерода или более. Согласно определенным вариантам осуществления изобретения указанные выше жирные кислоты являются насыщенными (без двойных и тройных углерод-углеродных связей); мононенасыщенными (одна двойная связь); полиненасыщенными (две и более двойные связи); линейными (нециклическими); и/или имеют незначительные разветвления структуры или не имеют их вовсе.
Согласно некоторым вариантам осуществления изобретения из культивируемых микроорганизмов, подходящих для последующей переэтерификации и модификации in situ, согласно настоящему изобретению можно получить биомассу, которая в сухом состоянии будет содержать, по крайней мере, 5%, по крайней мере, 10%, по крайней мере, 15%, по крайней мере, 20%, по крайней мере, 25% масел. Согласно другому варианту осуществления изобретения, высушенная биомасса имеет содержание масел, составляющее, по крайней мере, 30%, по крайней мере, 35%, по крайней мере, 40%, по крайней мере, 45%, по крайней мере, 50%, по крайней мере, 55%, по крайней мере, 60%, по крайней мере, 65%, по крайней мере, 70%, по крайней мере, 75%, по крайней мере, 80%, по крайней мере, 85% или по крайней мере, 90%. Термин "сухой" или "высушенный", используемый в контексте изобретения, означает, что материал вообще не содержит воды. Биомасса также может подвергаться химической модификации без предварительной сушки; например, такая биомасса содержит центрифугированную клеточную массу.
Согласно некоторым вариантам осуществления изобретения из культивируемых микроорганизмов, подходящих для последующей переэтерификации и модификации in situ, согласно настоящему изобретению можно получить биомассу, в которой, по крайней мере, 10% липидов представляют собой С18, по крайней мере, 15% липидов представляют собой С18, по крайней мере, 20% липидов представляют собой С18, или, по крайней мере, 25% липидов представляют собой С18. Согласно другому варианту осуществления изобретения биомасса содержит липиды, из которых, по крайней мере, 30% представляют собой С18, по крайней мере, 35% липидов являются С18, по крайней мере, 40% липидов являются С18, по крайней мере, 45% липидов являются С18, или, по крайней мере, 50% липидов представляют собой С18 липиды. Согласно еще одному варианту осуществления изобретения биомасса может содержать липиды, из которых, по крайней мере, 10%, по крайней мере, 15%, по крайней мере, 20%, по крайней мере, 25%, по крайней мере, 30%, по крайней мере, 35%, по крайней мере, 40%, по крайней мере, 45%, или по крайней мере, 50% липидов представляют собой С14 и/или С16, или имеют более длинную углеродную цепь. Альтернативно липидный компонент биомассы может, по крайней мере, на 10%, по крайней мере, на 20% быть представлен С14 или липидами с более короткой углеродной цепью.
Микроорганизмы, подходящие для использования в соответствии с настоящим изобретением, могут быть как природными, так и полученными при помощи генной инженерии, для увеличения выхода липидов, для получения TAGs, имеющих высокое содержание жирных кислот с желаемой длиной углеродной цепи (например, С18), или для создания определенного сырья (например, мелассы) как источника энергии и углерода. Такие способы генной инженерии описаны ниже в разделе "Конструирование путей обмена липидов".
Любые виды микроорганизмов, продуцирующие липиды, могут использоваться в соответствии с настоящим изобретением, хотя микроорганизмы, которые в природе продуцируют подходящие липиды в больших количествах, являются предпочтительными. Кроме того, микроорганизмы, продуцирующие нужные липиды в большом количестве в расчете по отношению к DCW при специфических условиях ферментации, также являются предпочтительными. Согласно способам, заявленным в настоящем изобретении, могут применяться микроводоросли; примеры микроводорослей (род и вид), которые могут использоваться в соответствии с настоящим изобретением, представлены в Таблице 1 (без ограничений указанными).
Примеры липогенных дрожжей, которые могут использоваться в способах, заявленных в настоящем изобретением, представлены в Таблице 2 (без ограничений указанными).
Примеры грибов, которые могут использоваться в способах, заявленных в настоящем изобретением, представлены в Таблице 3 (без ограничений указанными).
Факторы, которые учитываются при отборе микроорганизмов для использования в соответствии с настоящим изобретением, помимо способности продуцировать липиды для создания биодизелей, следующие: (1) высокое содержание липидов в процентах от веса клетки; (2) легкость культивирования; и (3) удобство обработки. Предпочтительные микроорганизмы выращивают гетеротрофно (на сахаре, в отсутствие света) или получают путем генной инженерии при помощи способов, описанных, например, в заявках на патенты США №№ 60/941,581 (от 1 июня 2007), 60/959,174 (от 10 июля 2007), 60/968,291 (от 27 августа 2007) и 61/024,069 (от 28 января 2008).
Факторы, влияющие на удобство обработки могут включать, например, доступность эффективных способов для лизирования клеток. В способах, заявленных в настоящем изобретении, могут также применяться бактерии, в частности липогенные бактерии, такие как представители рода Rhodococcus, Rhodococcus opacus и Phodococcus sp.
Определенные виды микроводорослей, используемые в способах, заявленных в настоящем изобретении, могут быть идентифицированы путем амплификации определенных регионов-мишеней генома. Например, идентификация специфических видов или штаммов микроводорослей может происходить путем амплификации и секвенирования ядерной и/или хлоропластной ДНК при помощи праймеров и методики, которая позволяет использовать любой участок генома (см., например, Wu et al., Bot. Bull. Acad. Sin. (2001) 42:115-121 "Identification of Chlorella spp. Isolates using ribosomal DNA sequences"). Общепринятые способы филогенетического анализа, такие как амплификация и секвенирование рибосомального внутреннего транскрибируемого спейсера (ITS1 и ITS2 рДНК), 23S pPHK, 18s pPHK и других консервативных участков генома, могут также использоваться для индентификации микроводорослей и других организмов, продуцирующих углеводороды и липиды, которые могут использоваться в соответствии с настоящим изобретением. Примеры способов идентификации и классификации водорослей можно посмотреть также здесь: Genetics, 2005 Aug; 170(4):1601-10 and RNA, 2005 Apr. 11(4):361-4.
Сравнение геномной ДНК также может использоваться для идентификации подходящих видов микроводорослей, используемых в соответствии с настоящим изобретением. Участки консервативной ДНК, включая, без ограничений указанными, ДНК, кодирующую 23S рРНК, могут быть выделены из определенных видов микроводорослей, амплифицированы и сопоставлены с консенсусными последовательностями микроводорослей, которые таксономически относятся к видами микроводорослей, подходящим для использования в соответствии с настоящим изобретением. Примеры таких последовательностей ДНК для видов рода Chlorella и Prototheca представлены ниже в разделе Примеры.
Согласно некоторым вариантам осуществления изобретения микроводоросли, подходящие для использования в соответствии с настоящим изобретением, имеют геномные последовательности ДНК, кодирующие 23S рРНК, которые, по крайней мере, на 99%, по крайней мере, на 98%, по крайней мере, на 97%, по крайней мере, на 96%, по крайней мере, на 95%, по крайней мере, на 94%, по крайней мере, на 93%, по крайней мере, на 92%, по крайней мере, на 91%, по крайней мере, на 90%, по крайней мере, на 89%, по крайней мере, на 88%, по крайней мере, на 87% или, по крайней мере, на 86%, идентичны, по крайней мере, одной нуклеотидной последовательности из списка SEQ ID NOs:3-6. Согласно другим вариантам осуществления изобретения микроводоросли, подходящие для использования в соответствии с настоящим изобретением, имеют геномные последовательности ДНК, кодирующие 23S рРНК, которые, по крайней мере, на 85%, по крайней мере, на 80%, по крайней мере, на 75%, по крайней мере, на 70%, по крайней мере, на 65% или, по крайней мере, на 60% идентичны, по крайней мере, одной нуклеотидной последовательности из списка SEQ ID NOs:3-29.
Chlorella - род одноклеточных зеленых водорослей, относимый к отделу Chlorophyta, который может использоваться в соответствии с настоящим изобретением. Некоторые виды Chlorella являются гетеротрофами по своей природе. Chlorella, в частности Chlorella protothecoides, является предпочтительным микроорганизмом для данного изобретения, поскольку имеет высокое содержание липидов, в особенности липидов с длинной цепью, подходящих для биодизеля и для химической модификации в другие молекулы. Кроме того, этот вид микроводоросли выращивается гетеротрофно.
Prototheca - род одноклеточных микроводорослей, которые не способны к фотосинтезу и считаются мутантами рода Chlorella, также подходят для использования в соответствии с настоящим изобретением. В то время как водоросли рода Chlorella получают энергию путем фотосинтеза, виды рода Prototheca являются облигатными гетеротрофами. Водоросли рода Prototheca имеют сферическую форму, диаметр от 2 до 15 микрометров и не имеют жгутика. Водоросли рода Prototheca, в частности вид Prototheca moriformis, является предпочтительным микроорганизмом для использования в соответствии с настоящим изобретением, благодаря своей липидной композиции, в частности наличию насыщенных липидов, пригодных для сапонификации. Кроме того, липиды, экстрагированные из указанных видов микроводорослей, имеют незначительное количество красящих примесей, что также делает их пригодными для сапонификации.
Как и растения, и животные, водоросли и другие микробы запасают избыток энергии в форме липидов, чтобы использовать их тогда, когда другие источники (например, солнечный свет) будут недоступны. Кроме того, изменение содержания липидов позволяет водорослям жить в водной среде и плавать и, таким образом, регулировать доступ солнечного света для осуществления фотосинтеза. Способность модифицировать плавучесть за счет изменения содержания липидов позволяет клеткам микроводорослей синтезировать внутриклеточные липиды в высокой концентрации по сравнению с высшими растениями. Такая особенность делает микроводоросли подходящими микроорганизмами для получения биомассы для последующей in situ химической модификации, поскольку, как показано в описании, из биомассы с высоким содержанием липидов можно получить большее количество чистых TAG производных, чем из биомассы с низким липидным профилем, в особенности из фотосинтетически-выращенной биомассы с низким содержанием липидов. Соответственно, микроорганизмы, из которых можно получить биомассу с высоким содержанием липидов, являются предпочтительными для использования в настоящем изобретении.
А. Способы выращивания
Микроорганизмы могут выращиваться как для последующих нужных генетических манипуляций, так и для получения липидов. Формирующую культуру выращивают в небольшом масштабе, по крайней мере первоначально, в условиях, при которых исходный микроорганизм может расти. Например, если исходный микроорганизм является фотоавтотрофом, первичную культуру выращивают в присутствии света. Условия культивирования могут меняться, если микроорганизм специально создают или генетически модифицируют таким образом, чтобы он мог расти независимо от наличия света. Культуры для получения липидов обычно выращивают в большом количестве.
1. Способы фотосинтетического выращивания
Фотосинтезирующие микроорганизмы, такие как микроводоросли, могут выращиваться в присутствии света в жидкой культуральной среде, которая может находиться, например, в фотобиореакторе. Количество фотонов, попадающих в культуру микроводорослей, может регулироваться, равно как и другие параметры, такие как длинноволновый спектр и соотношение часов света:тьмы в течение суток. Микроводоросли также могут выращиваться при естественном освещении, а также при постоянной или переменной комбинации естественного и искусственного освещения. Например, микроводоросли рода Chlorella могут культивироваться при естественном освещении во время светлого времени суток и при искусственном освещении в течение ночи.
Количество газа в фотобиореакторе, в котором выращивают микроорганизмы, такие как микроводоросли, можно регулировать. Какая-то часть объема фотобиореактора может быть занята другим газом, чем тот, который присутствует в жидкости. Для того, чтобы поместить газ в фотобиореактор, может использоваться подвод газа. В фотобиореактор можно закачать любой газ, например воздух, воздух/CO2, различные смеси газов, инертные газы, такие как аргон и любые другие газы. Скорость подачи газа в фотобиореактор также можно регулировать. Увеличение потока газа в фотобиореактор увеличивает мутность культуры микроводорослей. Расположение портов, через которые подается газ в фотобиореактор, также может влиять на мутность культуры микроводорослей при заданной скорости потока. Соотношение воздух/CO2 в смеси также можно регулировать для достижения оптимального количества СО2 и достижения максимального роста определенного микроба. Микроводоросли значительно быстрее растут при свете и в атмосфере 3% CO2/97% воздуха, чем в 100% воздушной атмосфере. Атмосфера 3% CO2/97% воздуха содержит приблизительно в 100 больше СО2, чем просто воздух. Например, согласно заявленным способам в биореактор или фотобиореактор можно вводить следующие смеси воздух:CO2: 99,75% воздуха:0,25% СО2, приблизительно 99,5% воздуха:0,5% CO2, приблизительно 99,0% воздуха: 1,00% CO2, приблизительно 98,0% воздуха:2,0% СО2, приблизительно 97,0% воздуха:3,0% СО2, приблизительно 96,0% воздуха:4,0% CO2, приблизительно 95,00% воздуха:5,0% CO2. Смесь 95,00% воздуха:5,0% CO2, которая используется в фотобиореакторе для культивирования клеток Botrycoccus, описана в J Agric Food Chem. 2006 Jun. 28; 54(13):4593-9; J Biosci Bioeng. 1999; 87(6):811-5; и Nat Prod. 2003 Jun; 66(6):772-8.
Культуру микроводорослей можно выращивать и поддерживать в закрытых фотобиореакторах, изготовленных из любого типа прозрачного или полупрозрачного материала. К таким материалам относятся контейнеры Plexiglas®, стеклянные укрытия, контейнеры, изготовленные из таких материалов, как полиэтилен, прозрачные или полупрозрачные трубы, и другие материалы. Культуру микроводорослей можно выращивать и поддерживать в открытых фотобиореакторах, таких как канальные пруды, отстойные пруды и другие открытые водоемы.
"Затенение водорослей" означает неспособность источника света проникать и достигать всех клеток фотосинтезирующей культуры. Клетки, расположенные близко к источнику света, будут "затенять" (за счет их физического присутствия и поглощения фотонов в хлоропластах) клетки, расположенные дальше от источника света, и, следовательно, ограничивать воздействие на них энергии, необходимой для превращения источника углерода в липиды или другие материалы, необходимые для клеточного роста и размножения. Путем перемешивания культуры можно обеспечить воздействие света на все клетки, однако "затенение" тем не менее влияет на общую продолжительность воздействия и приводит к замедлению роста и более низкому содержанию липидов в клетках по отношению к DCW. В результате, для достижения высокой плотности клеток в культуре и/или высокого содержания липидов может потребоваться более длительный период культивирования. Даже после продолжительного периода выращивания клетки, выращенные на свету, как на единственном источнике энергии, редко содержат более 15% липидов в расчете на DCW. Кроме того, фотосинтетическое выращивание микроводорослей приводит к высокому содержанию хлорофилла в биомассе и, в свою очередь, к очень высокой концентрации магния в переэтерифицированной биомассе, поскольку магний является компонентом хлорофилла, а хлорофилл представляет собой высокогидрофобное вещество, которое накапливается в липофильной фазе. Кроме того, в водорослях, выращенных фотосинтетически, накапливается большее количество каротеноидов, чем в водорослях, выращенных гетеротрофно.
2. Гетеротрофные способы выращивания микробов для продукции липидов
Помимо способов фотосинтетического выращивания микроводоросли можно культивировать в жидкой среде, помещенной в биореактор, куда нет доступа свету. Такие гетеротрофные способы выращивания основаны на использовании фиксированных источников углерода (например, глюкозы глицерола, целлюлозы и т.д.), которые поставляют энергию для роста и продукции липидов. Условия культивирования могут регулироваться, чтобы максимально увеличить продукцию липидов.
Культуральная среда для микроводорослей обычно содержит компоненты, такие как фиксированный источник азота, следовые элементы, необязательно, буфер для регуляции рН и фосфаты. К другим компонентам могут относиться фиксированный источник углерода, такой как ацетат или глюкоза; а также соли, такие как хлорид натрия, в особенности для морских микроводорослей. Примерами следовых элементов являются цинк, бор, кобальт, медь, марганец и молибден, например, в их соответствующих формах, таких как ZnCl2, Н3ВО3, CoCl2·2H2O, MnCl2·4H2O и (NH4)6Mo7O24·4H2O. Эти и другие параметры культивирования, такие как рН культуральной среды, идентичность и концентрация следовых элементов и других компонентов среды, также можно регулировать для достижения желаемого уровня продукции липидов согласно способам, заявленным в настоящем изобретении.
Для организмов, способных расти на фиксированном источнике углерода, указанный источник может быть представлен, например, глюкозой, фруктозой, сахарозой, галактозой, ксилозой, маннозой, рамнозой, глицеролом, источниками целлюлозы и/или флоридозидом. Может использоваться один или более экзогенный источник углерода в концентрации, по крайней мере, 50 мкмоль, по крайней мере, 100 мкмоль, по крайней мере, 500 мкмоль, по крайней мере, 5 ммоль, по крайней мере, 50 ммоль, и, по крайней мере, 500 ммоль. Для многих видов из рода Chlorella, например, гетеротрофное выращивание способствует высокому выходу биомассы и накоплению большого количества липидов в клетках.
Для липидной продукции клетки, включая рекомбинантные клетки, обычно культивируют или ферментируют в большом количестве. Культивирование может происходить в большом объеме жидкости, например, в составе супензионных культур. К другим примерам относится начало культивирования небольшой культуры клеток, которая развивается до большой биомассы за счет роста и размножения клеток одновременно с продукцией липидов. Для размещения большого объема культуры могут использоваться биореакторы или ферментеры из нержавеющей стали. Можно использовать ферментер, аналогичный тому, который применяется при изготовлении пива и/или вина, поскольку для продукции этанола используются очень большие ферментеры.
Ферментер обеспечивают подходящими источниками питательных веществ для культуры клеток. К таким источникам относятся сырые материалы, такие как, например: фиксированный источник углерода, например глюкоза, кукурузный крахмал, деполимеризованная целлюлоза, сахароза, сахарный тростник, сахарная свекла, лактоза, молочная сыворотка, или меласса; источник жира, например, такой как жиры или овощные масла; источник азота, например белки, соевая мука, кукурузная жидкость, аммиак (чистый или в форме соли), нитраты и их соли, или молекулярный азот; и источник фосфора, такой как соли фосфата. Кроме того, использование ферментера позволяет контролировать условия культивирования, такие как температура, рН, давление кислорода и уровень диоксида углерода. Газы, такие как кислород или нитроген, можно пропускать через жидкую культуру.
Ферментер может использоваться для того, чтобы клетки прошли различные фазы своего роста. Например, после инокуляции липид-продуцирующих клеток в культуральную среду начинается лаг-период (лаг-фаза) перед тем как клетки начнут расти. После лаг-фазы скорость роста постоянно увеличивается, пока клетки не входят в лог или экспоненциальную фазу. После экспоненциальной фазы обычно наступает замедление или полное прекращение деления клеток по причине уменьшения количества питательных веществ, в частности азота. После замедления рост останавливается, и клетки переходят в стационарную фазу, во время которой происходит преобразование фиксированного источника углерода в желаемый продукт, такой как TAG. Если поддерживать стационарную фазу в течение длительного периода времени, это приведет к более высокой концентрации желаемого продукта в процентах от DCW, такого как липиды, в случае микроорганизмов, описанных здесь. В некоторых случаях желательно поддерживать микробные клетки в станционарной фазе, в которой клетки превращают углеводород, такой как глюкоза, в липиды, и не позволять клеткам делиться в течение длительного периода времени, чтобы получить микробную биомассу, содержащую более чем 30%, более чем 40%, более чем 50%, более чем 60% липидов в расчете на сухой вес клеток. Обычно вполне достаточно ограничить количество азота, чтобы предотвратить деление клеток.
Микроорганизмы, выращенные в условиях, описанных здесь, и известные из области техники, могут содержать, по крайней мере, 20% липидов по весу, предпочтительно, по крайней мере, 40% липидов по весу, более предпочтительно, по крайней мере, 50% липидов по весу, еще более предпочтительно, по крайней мере, 60% липидов по весу, предпочтительно, по крайней мере, 70% липидов по весу и, наиболее предпочтительно, по крайней мере, 80% липидов по весу. Согласно некоторым вариантам осуществления изобретения микроорганизмы культивируют при условиях, описанных здесь, до тех пор, пока содержание липидного компонента не будет составлять, по крайней мере, 20% по весу; период культивирования обычно занимает 1 неделю. Согласно некоторым вариантам осуществления изобретения период культивирования составляет не более 14 дней, не более 13 дней, не более 12 дней, не более 11 дней, не более 10 дней, не более 9 дней, не более 8 дней, не более 6 дней, не более 5 дней, не более 4 дней, или не более 3 дней. В течение любого из указанных периодов культивирования микроорганизмы в итоге могут содержать, по крайней мере, 20%, по крайней мере, 25%, по крайней мере, 30%, по крайней мере, 35%, по крайней мере, 40%, по крайней мере, 45%, по крайней мере, 50%, по крайней мере, 55%, по крайней мере, 60%, по крайней мере, 65%, по крайней мере, 70%, по крайней мере, 75%, по крайней мере, 80%, по крайней мере, 85% или, по крайней мере, 90% липидов по DCW. Согласно некоторым вариантам осуществления изобретения микроорганизмы культивируют при описанных условиях до достижения липидной концентрации, по крайней мере, 20% по весу, в течение периода, составляющего, по крайней мере, 2 дня. Согласно некоторым вариантам осуществления изобретения период культивирования составляет, по крайней мере, 3 дня, по крайней мере, 4 дня, по крайней мере, 5 дней, по крайней мере, 6 дней, по крайней мере, 7 дней или, по крайней мере, 8 дней. В течение любого из указанных периодов культивирования микроорганизмы в итоге могут содержать, по крайней мере, 20%, по крайней мере, 25%, по крайней мере, 30%, по крайней мере, 35%, по крайней мере, 40%, по крайней мере, 45%, по крайней мере, 50%, по крайней мере, 55%, по крайней мере, 60%, по крайней мере, 65%, по крайней мере, 70%, по крайней мере, 75%, по крайней мере, 80%, по крайней мере, 85% или, по крайней мере, 90% липидов по DCW.
Условия культивирования могут регулироваться для увеличения выхода липидов, подходящих для использования в биодизеле, или других нужных молекул и/или для уменьшения стоимости производства. Например, согласно некоторым вариантам осуществления изобретения микроб (например, микроводоросли) культивируют в присутствии предельной концентрации одного или более питательного вещества, например азота. Такие условия способствуют увеличению выхода липидов по сравнению с выходом липидов в культуре, в которой азот присутствует в избытке. В частности, увеличение выхода липидов составляет приблизительно 10%, 20%, 30%, 40%, 50%, 75%, 100%, 200%, 300%, 400% или 500%. Микроб можно культивировать в присутствии предельно допустимой концентрации питательного вещества в течение не полного периода культивирования, а какой-то отрезок времени. Согласно определенным вариантам осуществления изобретения концентрацию питательного вещества изменяют с предельно допустимой концентрации на непредельную концентрацию, по крайней мере, дважды в течение всего периода культивирования. Дополнительно и как показано на чертежах, может использоваться определенный фиксированный источник углерода, такой как глицерол, для увеличения процентного выхода липидов на вес клетки, поскольку он дает больший выход, чем другие фиксированные источники углерода.
Для увеличения выхода липидов в источник сырья для липид-продуцирующих микробов (например, микроводорослей) может быть добавления уксусная кислота. Уксусная кислота непосредственно запускает ту реакцию метаболизма, которая инициирует синтез жирных кислот (то есть ацетил-КоА); таким образом, введение уксусной кислоты в культуру увеличивает продукцию жирных кислот. В целом согласно данному варианту осуществления изобретения, микроб культивируют в присутствии достаточного количества уксусной кислоты для увеличения выхода липидов и/или жирных кислот, продуцируемых микробами, поскольку общий выход липидов (например, жирных кислот) выше, чем при отсутствии уксусной кислоты в культуре.
Согласно другому варианту осуществления изобретения выход липидов увеличивают путем культивирования липид-продуцирующего микроба (например, микроводорослей) в присутствии одного или более кофактора фермента липидного цикла (например, фермента синтетазы жирных кислот). В целом согласно данному варианту осуществления изобретения концентрация кофактора(ов) достаточна для увеличения выхода микробных липидов (например, жирных кислот) по сравнению с выходом липидов, который отмечается при отсутствии кофактора(ов). Согласно определенному варианту осуществления изобретения кофактор(ы) вводят в культуру путем включения в нее микроба (например, микроводоросли), содержащей экзогенный ген, кодирующий данный кофактор(ы). Альтернативно кофактор(ы) может вводиться в культуру путем введения микроба (например, микроводоросли), содержащей экзогенный ген, кодирующий белок, который участвует в синтезе этого кофактора. Согласно определенным вариантам осуществления изобретения к подходящим кофакторам относятся любые витамины, необходимые для фермента, участвующего в липидном цикле, такие как, например, биотин или пантотенат. Гены, кодирующие кофакторы, подходящие для использования в соответствии с настоящим изобретение, или участвующие в синтезе таких кофакторов, хорошо известны и могут быть введены в микробы (например, микроводоросли) при помощи методик и технологий, хорошо известных специалистам в данной области.
Микробная биомасса с высоким процентом накопленных масел/липидов по отношению к сухому весу может быть получена при помощи различных способов культивирования, известных из области техники. Биомасса микроводорослей с высоким процентом накопленных масел/липидов является полезной в соответствии с настоящим изобретением. Li и соавт. описывает культуру Chlorella vulgaris, выращенную в автотрофных условиях (то есть в условиях для фотосинтеза) с использованием высоких концентраций железа, которая содержит вплоть до 56,6% липидов от DCW (Li et al., Bioresource Technology 99(11):4717-22 (2008)). Rodolfi и соавт. описывают культуры Nanochloropsis sp. и Chaetoceros calcitrans с содержанием липидов 60% и 39,8% от DCW соответственно, выращенные в фотобиореакторе в условиях недостатка азота (Rodolfi et al., Biotechnology & Bioengineering 102(1): 100-112 (2008)). Solovchenko и соавт. описывают культуры Parietochloris incise с накоплением приблизительно 30% липидов (DCW) при фототрофическом выращивании в условиях дефицита азота (Solovchenko et al., Journal of Applied Phcology 20:245-251 (2008)). Chlorella protothecoides может продуцировать вплоть до 55% липидов (DCW) при гетеротрофном культивировании в условиях дефицита азота (Miao and Wu, Biorecource Technology 97:841-846 (2006)). Другие виды Chlorella, включая Chlorella emersonii, Chlorella sorokiniana и Chlorella minutissima, могут накапливать вплоть до 63% липидов (DCW) при выращивании в биореакторах с механическим перемешиванием в среде с низким содержанием азота (Illman et al., Enzyme and Microbial Technology 27:631-635 (2000)). Также высокое процентное накопление липидов по отношению к DCW, а конкретно 70% липидов (DCW), было показано для культур Dumaliella tertiolecta, выращенных в условиях повышенного содержания NaCl (Takagi et al., Journal of Bioscience and Bioengineering 101(3): 223-226 (2006)), и 75% липидов (DCW) в культуре Botryococcus braunii (Banerjee et al., Critical Reviews in Biotechnology 22(3):245-279 (2002)). Указанные и аналогичные способы могут применяться для фотосинтетического и гетеротрофного выращивания микроводорослей, продуцирующих липиды.
Биомасса микроводорослей, выращенная при помощи способов культивирования, описанных здесь, и пригодная для использования в соответствии с настоящим изобретением, содержит, по крайней мере, 10% масла микроводорослей в расчете на сухой вес. Согласно некоторым вариантам осуществления изобретения биомасса микроводорослей содержит, по крайней мере, 15%, по крайней мере, 25%, по крайней мере, 35%, по крайней мере, 45%, по крайней мере, 50%, по крайней мере, 55% или, по крайней мере, 60% липидов в расчете на сухой вес клетки. Согласно некоторым вариантам осуществления изобретения биомасса микроводорослей содержит от 10 до 90% микробного масла, от 25 до 75% микробного масла, от 40 до 75% микробного масла или от 50 до 70% микробного масла по сухому весу.
Согласно различным вариантам осуществления изобретения биомасса микроводорослей содержит, по крайней мере, 25%, по крайней мере, 26%, по крайней мере, 27%, по крайней мере, 28%, по крайней мере, 29%, по крайней мере, 30%, по крайней мере, 31%, по крайней мере, 32%, по крайней мере, 33%, по крайней мере, 34%, по крайней мере, 35%, по крайней мере, 36%, по крайней мере, 37%, по крайней мере, 38%, по крайней мере, 39%, по крайней мере, 40%, по крайней мере, 41%, по крайней мере, 42%, по крайней мере, 43%, по крайней мере, 44%, по крайней мере, 45%, по крайней мере, 46%, по крайней мере, 47%, по крайней мере, 48%, по крайней мере, 49% или, по крайней мере, 50% микробного масла на сухой вес клетки. Согласно другим вариантам осуществления изобретения биомасса микроводорослей содержит, по крайней мере, 51%, по крайней мере, 52%, по крайней мере, 53%, по крайней мере, 54%, по крайней мере, 55%, по крайней мере, 56%, по крайней мере, 57%, по крайней мере, 58%, по крайней мере, 59%, по крайней мере, 60%, по крайней мере, 61%, по крайней мере, 62%, по крайней мере, 63%, по крайней мере, 64%, по крайней мере, 65%, по крайней мере, 66%, по крайней мере, 67%, по крайней мере, 68%, по крайней мере, 69%, по крайней мере, 70%, по крайней мере, 71%, по крайней мере, 72%, по крайней мере, 73%, по крайней мере, 74%, по крайней мере, 75%, по крайней мере, 76%, крайней мере, 77%, по крайней мере, 78%, по крайней мере, 79%, по крайней мере, 80%, по крайней мере, 81%, по крайней мере, 82%, по крайней мере, 83%, по крайней мере, 84%, крайней мере, 85%, по крайней мере, 86%, по крайней мере, 87%, по крайней мере, 88%, по крайней мере, 89% или, по крайней мере, 90%, микробного масла на сухой вес клетки.
а. Использование нетрадиционных источников углерода
Микроорганизм может расти на нетрадиционных источниках углерода естественным образом или быть сконструирован для роста на таких источниках, к которым относятся, например, сахароза, ксилоза, целлюлозные материалы, сироп сорго и отходы. Подходящими целлюлозными материалами являются материалы, оставшиеся после переработки травянистых растений и деревьев, а также сельскохозяйственных растений, например различные части растений, в частности стебли и листья, которые не являются первичными пищевыми продуктами или продуктами для получения волокон. К примерам относятся отходы сельского хозяйства, такие как багасса сахарного тростника, мякинные оболочки риса, кукурузные волокна (включая стебли, листья, пленки, кочерыжки кукурузного початка), пшеничная солома, рисовая солома, жом сахарной свеклы, цитрусовый жом, кожура цитрусовых; древесные отходы, такие как лесоматериалы из твердой и мягкой древесины, а также остатки лиственных и хвойных деревьев после строительства; древесные отходы, такие, как отходы лесопилок (древесные стружки и опилки) и отходы целлюлозного производства; городские отходы, такие как (фрагменты бумаги коммунально-бытовых отходов, городские древесные отходы, и городские травяные отходы, такие как трава, образующаяся при стрижке газонов; а также отходы после деревянного строительства. Дополнительными целлюлозными материалами являются специальные целлозные растения, такие как просо прутьевидное, гибридные тополя, мискантус, волокнистый тростник и волокнистое сорго. Из указанных материалов выделяют сахара с 5-ю атомами углерода, одним из которых является ксилоза.
При других гетеротрофных способах выращивания микроводоросли могут утилизировать смешанный источник углерода, например сироп сорго и чистое сорго. Сироп сорго получают из сока сладкого сорго. Его углеводный профиль состоит главным образом из глюкозы (декстрозы), фруктозы и сахарозы. Микроводоросли скринируют для определения их способности утилизировать сорго в качестве единственного источника углерода. В качестве примеров (без ограничений указанными) можно привести некоторые штаммы Chlorella protothecoides, Chlorella luteovirdis, Prototheca moriformis, Chlorella kessleri, Parachlorella kessleri и Prototheca stagnora, которые могут утилизировать сироп сорго в гетеротрофных условиях, как показано в Примерах ниже.
Некоторые микроорганизмы могут расти на фиксированном источнике углерода естественным образом или быть сконструирован для роста на таком источнике, который представляет собой гетерогенный источник соединений, например, такой как муниципальные отходы, вторично обработанные органические отходы, сточные воды и другие источники фиксированного углерода и других питательных веществ, таких как сульфаты, фосфаты и нитраты. Органические отходы являются подходящим источником питания для синтеза липидов, а культуры, выращенные на них, являются недорогим источником липидов для последующей in situ переэтерификации и получения биодизеля или других химических модификаций в соответствии со способами, заявленными в настоящем изобретении.
Для уменьшения стоимости производства биодизелей или других химически модифицированных липидов сырой, частично очищенный или очищенный глицерол, образующийся как побочный продукт переэтерификации липидов, может дальше использоваться в качестве исходного сырья для ферментации, например, липид-продуцирующими микробными культурами. Таким образом, настоящее изобретение относится к способам, включающим этап культивирования микроба (например, микроводорослей) в первой микробной культуре; этап переэтерификации микробной биомассы для получения сложных эфиров жирных кислот и глицерола, как описано ниже; и добавление полученного глицерола во вторую микробную культуру в качестве исходного сырья. Первая и вторая культура могут представлять собой культуру одного микроба, но это не является обязательным. Если необходимо, в соответствии с настоящим изобретением может использоваться циклическая система, когда полученный и выделенный из культуры глицерол возвращают в ту же культуру.
Улучшенные культуральные параметры, включая использование глицерола для ферментации множественными родами как эукаротических, так и прокариотических микробов, включая микробы рода Chlorella, Navicula, Scenedesmus и Spirulina, описаны в тексте. Как показано в примерах, микробы совершенно различных эволюционных линий, включая микробы рода Chlorella, Navicula, Scenedesmus и Spirulina, а также культуры различных видов Chlorella, очень хорошо растут не только на химически чистом глицероле, но и на окисленном или неокисленном глицероле, который является побочным продуктом переэтерификации при производстве биодизелей. Для некоторых определенных микробов, таких как штаммы Chlorella, клеточное деление происходит быстрее в присутствии глицерола, чем в присутствии глюкозы.
В способах, заявленных в соответствии с настоящим изобретением, могут использоваться микроорганизмы, например, культивируемые посредством двухэтапного процесса выращивания, когда клетки сначала "кормят" глицеролом, чтобы быстро увеличить их плотность в культуре, а затем - глюкозой, чтобы происходило накопление липидов. Этот способ имеет существенные экономические преимущества, поскольку глицерол, являющийся побочным продуктом переэтерификации, возвращается обратно в процесс производства. Кроме того, предлагаются также и другие способы выращивания микробов, например, такие, при которых в качестве источника энергии используется смесь глицерола и глюкозы, или способы, при которых глюкозу дают в течение фазы роста, а глицерол вводят во время фазы продукции липидов. Подпитка такими смесями имеет существенные экономические преимущества. Указанные альтернативные методики применялись по отношению к микробам из различных эволюционных линий, как прокариот, так и эукариот, что доказывает возможность применения указанных альтернативных условий культивирования для микробной ферментации в соответствии со способами настоящего изобретения.
Множественные виды Chlorella, равно как и множественные штаммы разных видов Chlorella, лучше растут в присутствии глицерола как побочного продукта яереэтерификации, чем в присутствии эквивалентного количества химически чистого глицерола. Глицерол, образующийся в качестве побочного продукта переэтерификации, содержит остаточный метанол и другие примеси помимо собственно глицерола. Например, на Фиг.1-6 показано, что штаммы Chlorella protothecoides и Chlorella kessleri демонстрируют лучшую продуктивность на подкисленном или неподкисленном глицероле как побочном продукте реакции переэтерификации для получения биодизеля, но сравнению с химически чистьм глицеролом. Другие микробы, такие как Scenedesmus к Navicula микроводоросли, также лучше растут в присутствии глицерола, который является побочным продуктом реакции переэтерификации, чем на эквивалентном количестве химически чистого глицерола.
На Фиг.1 показано, что сухой вес клетки на литр (DCW на л) был выше при выращивании на глицероле как побочном продукте реакции получения биодизеля, чем на чистом глицероле, и указанная тенденция сохранялась, когда клетки выращивали только на глицероле или на его комбинации с глюкозой. На Фиг.2 показана аналогичная картина для дополнительных штаммов микроводорослей рода Chlorella. На Фиг.12(б) показано, что DCW на литр для микроогранизма Scenedesmus armatus выше при выращивании на подкисленном или неподкисленном глицероле как побочном продукте реакции получения биодизеля, чем на химически чистом глицероле. На Фиг.13 показано, что DCW на литр для микроорганизма Navicula pelliculosa также выше на неподкисленном глицероле, который является побочным продуктом реакции переэтерификации, чем на химически чистом глицероле.
На Фиг.3 и 4 показано, что у многих видов из рода Chlorella и многих штаммов различных видов рода Chlorella уровень липидов (или содержание липидов) на литр выше в том случае, если клетки культивируют в присутствии глицерола как побочного продукта реакции получения биодизеля, по сравнению с тем уровнем, который отмечается при выращивании клеток в присутствии эквивалентных концентраций химически чистого глицерола.
На Фиг.5 и 6 показано, что многие виды из рода Chlorella и многие штаммы различных видов рода Chlorella накапливают большую процентную часть DCW в форме липидов (количество липидов выражено в процентах от веса клетки) при культивировании в присутствии глицерола как побочного продукта реакции получения биодизеля, чем при выращивании клеток в присутствии эквивалентных концентраций химически чистого глицерола. На Фиг.11 показано, что Scenedesmus armatus и Navicula pelliculosa также накапливают большую процентную часть DCW в форме липидов при культивировании в присутствии глицерола как побочного продукта реакции получения биодизеля, чем при выращивании клеток в присутствии эквивалентных концентраций химически чистого глицерола. На Фиг.12(а) показано, что Scenedesmus armatus аккумулирует большую процентную часть DCW в форме липидов при культивировании в присутствии глицерола как побочного продукта реакции получения биодизеля, чем при выращивании клеток в присутствии эквивалентных концентраций химически чистого глицерола.
Кроме того, многие виды микробов, включая микроводоросли рода Chlorella, Scenedesmus, Navicula и Spirulina, имеют лучшие характеристики как производители биодизеля в присутствии смеси глицерола и глюкозы, чем в присутствии только глюкозы. Таким образом, на Фиг.7 показано, что микробы рода Chlorella могут накапливать большее количество (содержание) липидов на литр культуры в присутствии смеси 1% глицерола/1% глюкозы, чем в присутствии только 2% глюкозы. На Фиг.12(6) показано, что DCW на литр для Scenedesmus armatus выше при его культивировании в присутствии 1% глицерола как побочного продукта реакции получения биодизеля и 1% глюкозы, чем в присутствии только 2% глюкозы. На Фиг.13 показано, что DCW на литр для Navicula pelliculosa выше при его культивировании в присутствии 1% глицерола как побочного продукта реакции получения биодизеля и 1% глюкозы, чем в присутствии только 2% глюкозы.
На Фиг.8 показано, что микробы рода Chlorella накапливают большую процентную часть DCW в форме липидов в присутствии эквимолярной смеси (в вес.%) глицерола и глюкозы, чем при культивировании только в присутствии глюкозы. На Фиг.11(а) показано, что Spirulina platensis может накапливать большую часть DCW в форме липидов при культивировании в присутствии эквимолярной (вес.%) смеси глицерола как побочного продукта получения биодизеля и глюкозы, чем в присутствии только глюкозы. На Фиг.11(б) показано, что Navicula pelliculosa может накапливать большую часть DCW в форме липидов при культивировании в присутствии эквимолярной (вес.%) смеси химически чистого глицерола и глюкозы, а также смеси глицерола как побочного продукта получения биодизеля и глюкозы, чем в присутствии только глюкозы. На Фиг.12(б) показано, что Scenedesmus armatus может накапливать большую часть DCW в форме липидов при культивировании в присутствии эквимолярной (вес.%) смеси глицерола как побочного продукта получения биодизеля и глюкозы, чем в присутствии только глюкозы. Такие способы увеличения содержания липидов в процентах от DCW пригодны для получения биомассы, которая при прямой переэтерификации позволяет получить биодизель с меньшим содержанием гетероатомов, чем биомасса с низким процентным содержанием липидов.
Кроме того, было показано, что добавление глицерола и глюкозы в культуральную среду микробов, включая микроводоросли рода Chlorella, Scenedesmus и Navicula, равно как и смеси разового приготовления глицерола и глюкозы, позволяет дополнительно увеличить выход продукта. Это свойство различных видов микроводорослей из рода Chlorella и множественных штаммов различных видов Chlorella изучают в присутствии глицерола как продукта реакции получения биодизеля, так и химически чистого глицерола.
Так, на Фиг.8 показано, что микробы рода Chlorella могут накапливать большую процентную часть DCW в форме липидов в том случае, когда глицерол добавляют в культуру на первом этапе культивирования, а затем добавляют глюкозу и продолжают культивирование, чем если смесь глицерола и глюкозы добавляют в самом начале эксперимента. Такие способы увеличения содержания липидов в процентах от DCW пригодны для получения биомассы, которая при прямой переэтерификации или другой химической модификации, позволяет получить биодизель или другой продукт с меньшим содержанием гетероатомов, чем биомасса с низким процентным содержанием липидов. На Фиг.9 показано, что микробы рода Chlorella имеют большее процентное содержание липидов на литр культуры, если глицерол и глюкозу добавляют последовательно, а не вводят те же количества глюкозы и глицерола в начале культивирования. Эта тенденция наблюдается при использовании подкисленного глицерола как побочного продукта реакции получения биодизеля, неподкисленного глицерола как побочного продукта реакции получения биодизеля, так и химически чистого глицерола.
На Фиг.10 показано, что четыре различных штамма микроводорослей рода Chlorella двух различных видов микроорганизмов накапливают больший процент DCW на литр культуры в том случае, если глицерол и глюкозу добавляют последовательно, по сравнению с одновременным введением тех же количеств глицерола и глюкозы в начале исследования. Эта тенденция наблюдается при использовании как подкисленного глицерола как побочного продукта реакции получения биодизеля, неподкисленного глицерола как побочного продукта реакции получения биодизеля, так и химически чистого глицерола. На Фиг.14(а) и (б) показано, что в культурах Scenedesmus armatus и Navicula pelliculosa может увеличиваться показатель DCW на литр культуры, когда в культуру сначала добавляют глицерол, являющийся побочным продуктом реакции получения биодизеля, а затем добавляют глюкозу, такого эффекта не наблюдается, если глицерол и глюкозу в тех же количествах вводят в самом начале ферментации.
Таким образом, три различных показателя продуктивности (DCW на литр, количество липидов в граммах на литр и процент DCW в форме липидов) микробов по отношению к продукции липидов улучшаются при использовании побочного продукта реакции получения биодизеля и временного разделения источников углерода.
Стоимость производства биодизелей или других химически-модифицированных липидов также можно уменьшить, если использовать в качестве сырья целлюлозную биомассу. Целлюлозная биомасса (например, солома, такая как кукурузная солома) является недорогим и легкодоступным сырьем; однако попытки использовать этот материал как источник для роста дрожжей провалились. В частности, было показано, что такое сырье ингибирует рост дрожжей, и дрожжи не могут утилизировать 5-углеродные сахара, образующиеся из целлюлозных материалов (например, ксилоза из геми-целлюлозы). В противоположность этому микроводоросли могут расти на обработанных целлюлозных материалах. Соответственно, настоящее изобретение относится к способу культивирования микроводорослей в присутствии целлюлозных материалов и/или 5-углеродных сахаров для продукции липидов, которые могут быть модифицированы в соответствии со способами, описанными в настоящей заявке. К целлюлозным материалам относится целлюлоза (40-60% сухого веса); гемицеллюлоза (20-40% сухого веса); и лигнин (10-30% сухого веса).
Удивительным оказалось открытие, что Chlorella protothecoides имеет больший уровень продуктивности при культивировании в присутствии комбинации глюкозы и ксилозы, чем при культивировании только на глюкозе или только на ксилозе. Такой синергичный эффект имеет существенное преимущество, поскольку позволяет культивировать микробы рода Chlorella на комбинации ксилозы и глюкозы, например, на целлюлозных материалах, как показано на Фиг.15.
Специфические условия культивирования, примеры которых представлены в описании, способствующие увеличению выхода липидов, подходящих для использования в качестве биодизеля, и/или уменьшения стоимости производства, могут использоваться как отдельно, так и в комбинации. Кроме того, настоящее изобретение относится к селекции и/или генной инженерии микробов, таких как микроводоросли, для создания микробов, которые больше подходят для использования в соответствии со способами, описанными выше. Например, использование микробов, имеющих улучшенную способность утилизировать любой из указанных выше источников питания для повышенной пролиферации и/или продукции липидов, также находится в рамках настоящего изобретения.
Стоимость производства биодизелей или других химически-модифицированных липидов также можно уменьшить, если использовать в качестве сырья сахарозу, включая сахарозу, выделенную, например, из сахарного тростника. Способы, заявленные в соответствии с настоящим изобретением, включают использование генно-инженерных штаммов микробов рода Chlorella, которые могут использовать сахарозу в качестве источника углерода. Например, экспрессия транспортера сахарозы и сахарозоинвертазы позволяет микроводорослям рода Chlorella переносить сахарозу из культуральной среды в клетку и осуществлять ее гидролиз с образованием сахарозы и фруктозы. Может также экспрессироваться фруктокиназа, особенно в тех случаях, когда активность эндогенной гексокиназы недостаточна для максимального фосфорилирования фруктозы. Примеры подходящих транспортеров сахарозы включают молекулы, имеющие следующие коды доступа в Генном банке: CAD1334, САВ92307 и САА53390. Примеры подходящих сахарозоинвертаз включают ферменты, имеющие в Генном банке следующие коды: САВ95010, NP_012104 и САА06839. Примерами подходящих фруктокиназ являются ферменты, имеющие следующие коды в Генном банке: Р26984, Р26420 и САА43322. Векторы для трансформации микроводорослей, включая Chlorella, кодирующие один или более из указанных генов, могут быть получены при помощи способа, описанного, например, в международной заявке WO2008/151149.
Секреция сахарозоинвертазы позволяет избежать необходимости экспрессии транспортера, который переносит сахарозу в клетки. Причина заключается в том, что секретируемая инвертаза катализирует конверсию молекулы сахарозы в молекулы глюкозы и фруктозы, которые обе могут переноситься и утилизироваться описанными микроорганизмами. Экспрессия сахарозоинвертазы и сигнальной молекулы обеспечивает активность инвертазы вне клетки. См. Hawkins et al., Current Microbiology Vol.38 (1999); pp.335-341, где описаны примеры сигнальных секреторных молекул, активных у микроводорослей рода Chlorella. Экспрессия таких белков позволяет клеткам, обладающим способностью утилизировать внеклеточную глюкозу в качестве источника энергии, также утилизировать внеклеточную сахарозу в качестве источника энергии. У микроорганизмов, таких как Chlorella protothecoides, описанных в тексте, которые могут использовать как внеклеточную глюкозу, так и внеклеточную глюкозу в качестве источников энергии, секреция инвертазы обеспечивает каталитическую активность, необходимую для использования сахарозы в качестве достаточного и недорогого источника энергии.
Выращивание потенциальных микроорганизмов, экспрессирующих экзогенно секретируемую сахарозоинвертазу, можно продемонстрировать путем добавления инвертазы в культуральную среду Chlorella protothecoides. Добавление инвертазы позволяет клеткам осуществлять ферментацию на источнике сахара, содержащем лигнин (то есть мелассы). Водоросли или другие микроорганизмы при помощи методов генной инженерии могут быть модифицированы, как описано в тексте, таким образом, чтобы хорошо расти на мелассе, так же, как это происходит на чистой глюкозе; при этом использование указанного недорогого продукта переработки сахарного тростника позволяет существенно сэкономить на получении углеводородов. На Фиг.19-20 показан рост клеток на трех источниках мелассы (обозначенных как BS1, BS2 и НТМ) и рост на глюкозе или сахарозе как в присутствии сахарозоинвертазы, так и без нее.
Сахарозоинвертаза также может экспрессироваться внутриклеточно в клетках, которые экспрессируют переносчик сахарозы, а также в клетках, которые экспрессируют любой переносчик углеводородов, который обеспечивает попадание сахарозы внутрь клетки.
В. Конструирование пути обмена липидов
Как описано в тексте, микроорганизмы, пригодные для использования в способах настоящего изобретения, могут быть созданы при помощи методов генной инженерии для экспрессии определенных генов, которые могут быть благоприятными для культивирования микроорганизмов (например, экспрессия гена сахарозоинвертазы для обеспечения утилизации сырья, содержащего сахарозу) или для осуществления способов прямой химической модификации, заявленных в настоящем изобретении (например, экспрессия литического гена, который индуцирует разрушение биомассы, и/или экспрессия гена липазы для катализации реакции переэтерификации). Кроме того, генная инженерия может успешно применяться для конструирования пути обмена липидов в микроорганизме. Указанный путь обмена липидов может быть модифицирован для изменения свойств и/или пропорций продуцируемых липидов и/или для увеличения количества атомов углерода в составе липидов.
1. Изменение свойств и/или пропорций продуцируемых липидов
В случае микроводорослей некоторые клетки дикого типа имеют хорошую способность к росту, но не продуцируют нужные типы липидов в необходимых количествах. К примерам относятся микроводоросли рода Pyrobotrus, Phormidium, Agmenellum, Carteria, Lepocinclis, Pyrobotrus, Nitzchia, Lepocinclis, Anabaena, Euglena, Spirogyra, Chlorococcum, Tetraedron, Ascillatoria, Phagus и Chlorogonium, которые имеют подходящие характеристики роста и могут расти на сырье из городских отходов или сточных вод. Указанные микроорганизмы могут быть модифицированы при помощи генной инженерии для улучшения их способности продуцировать липиды. К желаемым характеристикам относятся оптимизация выхода липидов на единицу объема и/или на единицу времени, длины углеродной цепи (например, для получения биодизеля или для других областей промышленности, использующих углеводородное сырье), уменьшение количества двойных связей или тройных связей, оптимально, до нуля, удаление колец и циклических структур, а также увеличение соотношения водород:углерод в определенных типах липидов или в группе различных липидов. Кроме того, микроводоросли, продуцирующие нужные липиды, могут подвергаться генной инженерии для приобретения дополнительных полезных свойств. Примерами таких водорослей являются микроводоросли рода Chlorella.
Согласно определенным вариантам осуществления изобретения один или более ключевой фермент, контролирующий точки разветвления в метаболизме и синтезе жирных кислот, может подвергаться пониженной (даун-регуляции) или повышенной (ап-регуляции) для улучшения продукции липидов. Ап-регуляция может достигаться, например, путем трансформации клетки конструктами экспрессии, в которых ген, кодирующий нужный фермент, экспрессируется, например, с использованием строгого промотора и/или энхансера, которые увеличивают экспрессию. К таким конструктам относится селектируемый маркер, который действует таким образом, что трансформанты подвергаются селекции, которая приводит к амплификации конструкта и увеличению уровня экспрессии кодируемого фермента. К ферментам, которые могут подвергаться ап-регуляции в соответствии со способами, заявленными в настоящем изобретении, относятся пируватдегидрогеназа, которая участвует в превращении пирувата в ацетил-КоА (примеры ферментов микроводорослей имеют следующие коды Генного банка: NP_415392; AAA53047, Q1XDM1 и CAF05587). Ап-регуляция пируватдегидрогеназы позволяет увеличить продукцию ацетил-КоА и, следовательно, увеличить синтез жирных кислот. Ацетил-КоА-карбоксилаза катализирует первичный этап синтеза жирных кислот. Соответственно, при ап-регуляции этого фермента происходит увеличение синтеза жирных кислот (примеры ферментов микроводорослей имеют следующие коды Генного банка: ВАА94752; ААА75528; ААА81471; YP_537052; YP_536879; NP_045833; и BAA57908). Продукция жирных кислот также может быть повышена путем ап-регуляции ацилнесущего белка (АСР), который переносит растущие кислые цепи во время синтеза жирных кислот (примеры ферментов микроводорослей имеют следующие коды Генного банка: A0T0F8; Р51280; NP_849041; YP_874433). Глицерол-3-фосфатацилтрансфераза катализирует этап синтеза жирных кислот, на котором происходит ограничение скорости синтеза. Ап-регуляция указанного фермента позволяет увеличить продукцию жирных кислот (примеры ферментов микроводорослей имеют следующие коды в Генном банке: ААА74319; ААА33122; ААА37647; Р44857; и АВ094442). Все указанные выше белки являются потенциальными мишенями для экспрессии у микроводорослей, включая микробы из рода Chlorella.
Даун-регуляция нужного фермента может достигаться при помощи, например, антисмысловых каталитических молекул РНК/ДНК, интерференции (иРНК), "нокаута", "нокдауна" или других методик мутагенеза. Экспрессия/функция фермента также может ингибироваться при помощи интраантител. Примерами ферментов, подходящих для даун-регуляции в соответствии со способами, заявленными в настоящем изобретением, являются цитратсинтетаза, которая использует ацетил-КоА в цикле трикарбоновых кислот (ТСА). Даун-регуляция цитратсинтетазы способствует тому, что большее количество ацетил-КоА участвует в синтезе жирных кислот.
Общие регуляторы модулируют экспрессию генов, участвующих в биосинтезе жирных кислот. Соответственно, экспрессия одного или более общего регулятора синтеза жирных кислот может подвергаться как ап-регуляции, так и даун-регуляции для ингибирования или усиления, соответственно, экспрессии множества генов, участвующих в синтезе жирных кислот, и, в конечном итоге, для увеличения продукции липидов. Примеры включают белки SREBPs (от англ. Sterol Regulatory Element Binding Proteins), такие, как SREBP-1a и SREBP-1c (для примеров, см. данные Генного банка, где они имеют следующие коды: NP_035610 и Q9WTN3). Общие регуляторы транскрипции могут подвергаться как ап-регуляции, так и даун-регуляции, как описано выше, в соответствии с регуляцией ключевых ферментов.
Способы, заявленные в соответствии с настоящим изобретением, могут осуществляться с использованием микробов (например, микроводорослей, липогенных дрожжей, бактерий или грибов), которые были модифицированы при помощи генной инженерии для экспрессии одного или более экзогенного гена, кодирующего ферменты цикла обмена липидов, такие как, например, жирная ацил-АСР-тиоэстераза (см. примеры в Таблице 4 и соответствующие учетные номера) или ацилнесущий белок (АСР), который может ускорять отщепление жирных кислот с нужной длиной углеводной цепи от ацилнесущего белка во время синтеза. Жирная ацил-АСР-тиоэстераза может быть выбрана на основе ее специфичности по отношению к жирной кислоте, имеющей определенную длину углеродной цепи. Согласно некоторым вариантам осуществления изобретения жирная ацил-АСР-тиоэстераза может экспресиироваться с гена, функционально связанного с индуцируемым промотором, и/или может экспрессироваться во внутриклеточном компартменте. Согласно некоторым вариантам осуществления изобретения гены, кодирующие жирную ацил-АСР-тиоэстеразу и естественно совместно экспрессируемый АСР могут быть встроены в клетку, возможно с одним или более геном, кодирующим другие ферменты липидного цикла, как описано выше. Согласно другим вариантам осуществления изобретения АСР и жирная ацил-АСР-тиоэстераза могут обладать афинностью по отношению друг к другу, что имеет преимущество при их совместном использовании в микроорганизмах или согласно способам настоящего изобретения, независимо от того, экспрессируются ли они совместно естественным образом или нет, в определенной ткани или организме. Таким образом, способы, заявленные в соответствии с настоящим изобретением, могут осуществляться с использованием клеток, экспрессирующих как естественным образом совместно экспрессируемые пары таких ферментов, так и пары, имеющие афинность по отношению друг к другу и способные взаимодействовать для ускорения отщепления углеродной цепи специфической длины от АСР.
Примеры дополнительных модификаций, подходящих для использования в настоящем изобретении, описаны в отклоненных заявках на патенты США №№ 60/837,839 от 15 августа 2006 и 11/893,364 от 15 августа 2007, включенных в настоящее описание в качестве ссылок. Настоящая заявка описывает генетически сконструированные штаммы микроводорослей для экспрессии одного или более экзогенного гена, один из которых кодирует переносчик фиксированного источника углерода (такой, как сахароза), а другой кодирует фермент сахарозоинвертазу. Полученные таким образом микроорганизмы продуцируют липиды с меньшей коммерческой стоимостью, чем липиды, получаемые при помощи известных ранее способов. Указанные совместно поданные заявки также указывают, что встраивание двух экзогенных генов, описанное выше, может сочетаться с нарушением биосинтеза полисахаридов посредством прямого и/или случайного мутагенеза, что позволяет направить освободившийся поток углерода на синтез липидов. Индивидуально и в комбинации модификация источника питания, генная инженерия для регулирования продукции липидов и обработка экзогенными ферментами позволяют изменить липидную композицию, продуцируемую микроорганизмом. Изменения включают в первую очередь изменение количества продуцируемых липидов, затем изменение количества одного или более липида по отношению к другим липидам и/или изменение типов липидов, продуцируемых микроорганизмом. Например, микроводоросли могут быть модифицированы при помощи генной инженерии для получения большого количества и/или процентного соотношения TAGs или TAGs с высоким пропорциональным содержанием жирных кислот с определенной длиной углеродной цепи.
Жирные ацил-АСР-тиоэстеразы, подходящие для использования в соответствии со способами, заявленными в настоящем изобретении, без ограничений указанными, включают ферменты, представленные в Таблице 4.
Другие подходящие ферменты, которые могут использоваться в соответствии со способами настоящего изобретения, включают ферменты, чья аминокислотная последовательность, по крайней мере, на 70% идентична последовательности белков, представленных в Таблице 4, и которые имеют соответствующую желаемую ферментативную активность (то есть способность отщеплять жирную кислоту от ацилпереносящего белка). Согласно дополнительным вариантам осуществления изобретения ферментативная активность выражена в последовательности, которая, по крайней мере, на 90%, по крайней мере, на 95% или, по крайней мере, на 99% идентична одной из представленных выше последовательностей, которые включены в настоящее описание в качестве ссылок.
Ферменты липидного цикла, описанные выше, полезны для получения различных липидов из микроорганизмов (например, микроводорослей, липогенных дрожжей или грибов) или популяции микроорганизмов, поскольку жирная ацил-АСР-тиоэстераза отщепляет жирную кислоту от ацилнесущего белка (АСР) во время синтеза липидов. Такие ферменты липидного цикла могут обладать специфичностью по отношению к субстрату, который имеет определенное число атомов углерода. Например, жирная ацил-АСР-тиоэстераза может иметь специфичность по отношению к жирным кислотам, имеющим 16 атомов углерода, и отщеплять их от АСР. Таким образом, согласно различным вариантам осуществления изобретения микроб может включать экзогенный ген, который кодирует белок, обладающий специфичностью своих ферментативных свойств (например, способностью отщеплять жирную кислоту от АСР) в зависимости от количества атомов углерода в субстрате. Ферментативная специфичность может согласно различным вариантам осуществления изобретения проявляться по отношению к субстрату, имеющему от 8 до 34 атомов углерода, предпочтительно от 8 до 18 атомов углерода, более предпочтительно от 14 до 18 атомов углерода.
За счет отбора желаемых комбинаций экзогенных генов для последующей экспрессии специалист может изменять липидные компоненты, продуцируемые микробом. Микроб, при культивировании как описано выше, синтезирует жирные кислоты, связанные с АСР, а жирная ацил-АСР-тиоэстераза катализирует отщепление жирной кислоты от АСР с получением через дополнительные ферментативные процессы TAG, включающего молекулу жирной кислоты.
2. Увеличение потока углерода в цикл обмена липидов
Некоторые микроводоросли продуцируют значительное количество нелипидных метаболитов, таких как, например, полисахариды. Поскольку на биосинтез полисахаридов затрачивается существенная часть общей метаболической энергии, доступной клетке, мутагенез липид-продуцирующих клеток с последующим отбором клеток с пониженным или отсутствующим биосинтезом полисахаридов позволяет получить штаммы, позволяющие получать больший выход липидов.
Примеры экспрессии трансгенов микроводорослями Chlorella можно найти в литературе (см., например. Current Microbiology Vol.35 (1997); pp.356-362; Sheng Wu Gong Cheng Xue Bao. 2000 Jul; 16(4):443-6; Current Microbiology Vol.38 (1999), pp.335-341; Appl Microbiol Biotechnol (2006) 72:197-205; Marine Biotechnology 4, 63-73, 2002; Current Genetics 39:5, 365-370(2001); Plant Cell Reports 18:9, 778-780, (1999); Biologia Plantarium 42(2):209-216, (1999); Plant Pathol. J 21(1): 13-20, (2005)). Любая существующая методика введения трансгена в микробы рода Chlorella может применяться для целей настоящего изобретения.
Примеры экспрессии трансгенов у липогенных дрожжей (например, Yarrowia lipolytica) также можно найти в литературе (см., например, Borders et al., J Microbiol Methods, Jun 27 (2007)). Примеры экспрессии трансгенов у грибов (например, Mortierella alpine, Mucor circinelloides и Aspergillus ochraceus) также описаны в литературе (см., например. Microbiology, Jul; 153 (Pt.7):2013-25 (2007); Mol. Genet Genomics, Jun; 271(5):595-602 (2004); Curr Genet, Mar; 21(3):215-23 (1992); Current Microbiology, 30(2):83-86 (1995); Sakuradani, NISR Research Grant, "Studies of Metabolic Engineering of Useful Lipid-producing Microorganisms" (2004); и заявку PCT/JP2004/012021). Примеры экспрессии экзогенных генов у бактерий, таких, как E.coli, хорошо известны, см., например. Molecular Cloning: A Laboratory Manual, Sambrook et al. (3d edition, 2001, Cold Spring Harbor Press).
IV. Способы переэтерификации in situ
Переэтерификация TAGs до сложных алкиловых эфиров жирных кислот in situ в соответствии со способами настоящего изобретения могут осуществляться на биомассе, полученной из микробной культуры, описанной выше. Согласно некоторым вариантам осуществления изобретения биомасса может представлять собой биомассу, состоящую из двух или более культур различных штаммов или видов микроорганизмов. Согласно некоторым вариантам осуществления изобретения различные штаммы или виды микроорганизмов имеют разные глицеролипидные профили, что показано в Примерах 22 и 24.
Согласно некоторым способам настоящего изобретения микробную биомассу сначала выделяют из культуральной среды и высушивают и затем разрушают перед последующей переэтерификацией (последний этап не является обязательным). Согласно другим способам настоящего изобретения микробную биомассу подвергают разрушению перед высушиванием и переэтерификацией. Согласно некоторым способам выделение биомассы включает отделение клеточных компонентов биомассы от воды и клеточной культуральной среды путем, например, пропускания содержимого биореактора через специальный экран или аналогичный фильтровальный аппарат. Согласно некоторым вариантам осуществления изобретения выделение или сбор биомассы включает обработку клеточных компонентов клеточной культуры с получением пасты или композиции с низким содержанием влаги.
А. Способы сушки
Высушивание биомассы, полученной из культивируемых микроорганизмов, описанных в тексте, позволяет удалить воду, которая, в свою очередь, будет доступной в качестве субстрата во время реакции переэтерификации, детально описанной ниже, приводящей к образованию свободных жирных кислот, равно как и желаемых алкиловых эфиров жирных кислот. Степень, до которой биомасса, используемая для in situ переэтерификации, заявленной в соответствии с настоящим изобретением, должна быть высушена, зависит от соотношения спирт: биомасса, которая используется в реакции переэтерификации, стоимости спирта и стоимости и объема других ограничителей, которые помещаются в реакционный сосуд, в котором происходит переэтерификация. Понятно, что все указанные факторы, сбалансированные относительно стоимости высушивания биомассы, определяют "приемлемую сухость" биомассы.
Согласно некоторым вариантам осуществления изобретения биомасса может быть высушена при помощи барабанной сушки, в которой биомасса вращается в барабане и высушивается потоком воздуха, который может нагреваться для ускорения процесса. Согласно другим вариантам осуществления изобретения для сушки биомассы может применяться сушильный шкаф или распылительная сушка. Альтернативно биомасса может быть высушена посредством процесса лиофилизации. Процесс лиофилизации в целом может быть описан как процесс "высушивания замораживанием", при котором биомассу замораживают в специальной камере. Применение вакуума по отношению к камере приводит к сублимации (первичному высушиванию) и десорбции воды из биомассы (вторичное высушивание), что приводит к получению продукта, подходящего для дальнейшей обработки, как описано ниже. Согласно другим вариантам осуществления изобретения для высушивания биомассы могут применяться комбинации указанных способов для получения биомассы, подходящей для дальнейшей обработки в соответствии с заявленными способами.
В. Способы разрушения биомассы
В некоторых случаях осуществления изобретения является желательным разрушить биомассу перед переэтерификацией in situ для того, чтобы внутриклеточное содержимое микроорганизмов было более доступным для воздействия спирта и катализаторов реакции переэтерификации. Это также может способствовать превращению TAGsв алкиловые эфиры жирных кислот или другие молекулы в соответствии со способами настоящего изобретения.
Согласно некоторым вариантам осуществления способов настоящего изобретения разрушение биомассы может осуществляться перед тем, как ее подвергнут одному или более способу сушки, описанному выше. Согласно другим способам разрушение биомассы проводят после ее высушивания. Согласно некоторым способам воду удаляют перед разрушением биомассы или после, при этом биомассу могут подвергать процессу сушки или нет. После выращивания микроорганизмы могут быть выделены из культуральной среды при помощи центрифугирования с получением концентрированной микробной биомассы. Разрушение биомассы может осуществляться путем лизиса микробных клеток с образованием лизата. Лизис клеток может осуществляться любым известным способом, включая лизис, индуцированный нагреванием, введение основания, введение кислоты, ферментативный лизис при помощи таких ферментов, как протеазы, или ферментов разрушения полисахаридов, таких как амилазы, ультразвуковой лизис, механический лизис, лизис посредством осмотического шока, инфицирование литическим вирусом и/или экспрессию одного или более литического гена. Лизис осуществляют для высвобождения внутриклеточных молекул, которые были синтезированы микроорганизмом. Каждый из указанных способов лизиса может применяться самостоятельно или в комбинации с другим способом.
Степень разрушения клеток может контролироваться при помощи микроскопического анализа. При использовании одного или более из указанных здесь способов обычно наблюдается более 70% разрушенных клеток. Предпочтительно, степень разрушения клеток составляет более 80%, более предпочтительно, более 90%, еще более предпочтительно, около 100%.
Согласно определенным вариантам осуществления изобретения микроорганизм лизируют после его выращивания, например, для того, чтобы увеличить количество липидов как субстратов для катализаторов переэтерификации, таких как липаза или химические катализаторы, экспрессируемые как описано ниже. Продолжительность экспрессии липазы (например, при помощи индуцируемого промотора), клеточного лизиса, а также условия реакции переэтерификации (например, удаление воды, добавление спирта и т.д) могут регулироваться для оптимизации выхода эфиров жирных кислот в результате реакции переэтерификации, опосредованной липазой.
Согласно одному варианту осуществления изобретения процесс лизирования микроорганизмов включает нагревание клеточной суспензии, содержащей указанные микроорганизмы. Согласно данному варианту осуществления изобретения культуральную среду (или суспензию микроорганизмов, выделенных из культуральной среды) нагревают до тех пор, пока микроорганизмы, то есть клеточные стенки и мембраны микроорганизмов, не распадутся или разрушатся. Обычно применяемая температура составляет, по крайней мере, 50°С. Высокие температуры, такие как, по крайней мере, 60°С, по крайней мере, 70°С, по крайней мере, 80°С, по крайней мере, 90°С, по крайней мере, 100°С, по крайней мере, 110°С, по крайней мере, 120°С, по крайней мере, 130°С или выше, используются для более эффективного клеточного лизиса.
Согласно другому варианту осуществления изобретения процесс лизирования микроорганизмов включает добавление основания к клеточной суспензии, содержащей микроорганизмы. Основание должно быть достаточно сильным для того, чтобы гидролизовать, по крайней мере, часть белковых соединений используемого микроорганизма. Основания, пригодные для растворения белков, хорошо известны специалистам в области химии. Примерами таких оснований, которые являются полезными в соответствии со способами, заявленными в настоящем изобретении, являются (без ограничений указанными) гидроксиды, карбонаты и бикарбонаты лития, натрия, калия, кальций или их смеси. Предпочтительным основанием является KOH. Согласно другому варианту осуществления изобретения процесс лизирования микроорганизма включает добавление кислоты к клеточной суспензии, содержащей микроорганизмы.
Согласно другому варианту осуществления изобретения процесс лизироваия микроорганизмов включает ферментативное лизирование клеток. К ферментам, подходящим для лизирования микроорганизмов, относятся протеазы и ферменты, разрушающие полисахариды, такие как гемицеллюлаза, пектиназа, целлюлаза и дрицелаза. Фермент, разрушающий полисахариды, желательно из микробов рода Chlorella или вирусов микробов Chlorella, является предпочтительным. Предпочтительной парой ферментов для лизирования биомассы, содержащей липиды, являются алкалаза и маннавэй (Novozymes).
Согласно другому варианту осуществления изобретения процесс лизирования микроорганизма осуществляется при помощи ультразвука, то есть путем разрушения ультразвуком. Клетки также могут быть лизированы при помощи высокочастотных звуковых волн. Звук может генерироваться электронным устройством и через специальную металлическую насадку подаваться непосредственно в концентрированную клеточную суспензию. Обработка ультразвуком (или высокочастотным звуком) нарушает целостность клеток за счет создания полостей в клеточной суспензии.
Согласно другому варианту осуществления изобретения процесс лизирования микроорганизмов осуществляют механическими способами. Клетки могут быть лизированы механически и, возможно, гомогенизированы для усиления переэтерификации липидов. Например, для воздействия на клетки, содержащие липидную массу, может использоваться давление, которое подается через узкий дроссельный клапан. Применяется высокое (вплоть до 1500 бар) давление, после чего осуществляют быстрое расширение через выходящее отверстие. Разрушение клеток сопровождается тремя различными механизмами: удар по клапану, высокий жидкостной сдвиг через отверстие и внезапное падение давление с разгрузкой, что вызывает "взрыв" клетки. Способ позволяет освободить внутриклеточные молекулы. Альтернативно может использоваться шаровая дробилка. В шаровой дробилке клетки перемешивают в суспензию вместе с небольшими абразивными частицами, такими как бусины. Клетки разрушаются за счет сдвигающей силы, перемалывания между бусинами и столкновения с бусинами. Бусины разрушают клетки с высвобождением клеточного содержимого. Клетки также могут быть разрушены при помощи сдвигающих сил, которые возникают при использовании блендера (например, с высокой скоростью или гомогенизатор Уоринга), французского пресса или даже центрифугирования в случае слабой клеточной стенки.
Согласно другому варианту осуществления изобретения процесс лизирования микроорганизмов осуществляют путем применения осмотического шока.
Согласно другому варианту осуществления изобретения процесс лизирования микроорганизмов осуществляют путем обработки паром, то есть путем пропускания пара, находящегося под давлением, через клетки. Обработка микроводорослей паром для разрушения клеток описана в патенте США № 6,750,048,
Согласно другому варианту осуществления изобретения процесс лизирования микроорганизмов осуществляют путем инфицирования микроорганизмов литическим вирусом. Известно большое количество литических вирусов микроорганизмов, подходящих для использования в соответствии с настоящим изобретением; выбор и использование конкретного вируса для определенного микроорганизма находится в компетентности специалистов в данной области. Например, paramecium bursaria chlorella вирус (PBCV-1) является типичным представителем (семейство Phycodnaviridae, род Chlorovirus) большой группы икосаэдрических, бляшкообразующих двуспиральных ДНК-вирусов, которые реплицируются внутри определенных одноклеточных эукариотических подобных Chlorella зеленых водорослях и лизируют их. Соответственно, любая чувствительная микроводоросль, такая как С.protothecoides, может быть лизирована путем инфицирования подходящим вирусом для хлорелл. Способы инфицирования водорослей рода Chlorella специфическими хлорелла-вирусами хорошо известны. Например, см. Adv. Virus Res. 2006; 66:293-336; Virology, 1990 Apr 25;257(1):15-23; Virology, 2004 Jan 5;318(1):214-23; Nucleic Acids Symp. Ser. 2000; (44):161-2; J. Virol. 2006 Mar; 80(5):2437-44; и Annu. Rev. Microbiol. 1999;53:447-94.
Согласно другому варианту осуществления изобретения процесс лизирования микроорганизмов включает аутолиз. Согласно данному варианту осуществления изобретения микроорганизм, пригодный для использования в соответствии с настоящим изобретением, создают при помощи генной инженерии таким образом, что в его геноме имеется литический ген, который при активации приводит к лизису микроорганизма. Этот литический ген может экспрессироваться при помощи индуцируемого промотора, при этом клетки сначала выращивают до достижения нужной плотности культуры, потом собирают и затем индуцируют промотор для экспрессии литического гена, который вызовет лизис клеток. Согласно одному варианту осуществления изобретения литический ген кодирует фермент, разрушающий полисахариды. Согласно определенным вариантам осуществления изобретения литический ген представляет собой ген, выделенный из литического вируса. Таким образом, например, литический ген из вируса хлорелл может экспресироваться в любом микроорганизме рода Chlorella, таком как С.protothecoides.
Экспрессию литического гена предпочтительно осуществляют при помощи индуцируемого промотора, активного у микроводорослей, который индуцируется каким-либо стимулом, таким как наличие малой молекулы, свет, тепло или другой стимул. Литические гены вирусов хлорелла хорошо известны. Например, см. Virology 260, 308-315 (1999); FEMS Microbiology Letters 180 (1999) 45-53; Virology 263, 376-387 (1999); и Virology 230, 361-368 (1997).
Согласно определенному варианту осуществления изобретения микроорганизмы лизируют после выращивания, например, для того, чтобы увеличить количество клеточных липидов, взаимодействующее с катализатором переэтерификации, таким как липаза, как описано ниже, или химический катализатор. Продолжительность экспрессии липазы (например, при помощи индуцируемого промотора), клеточного лизиса, а также условия реакции переэтерификации (например, удаление воды, добавление спирта и т.д) могут регулироваться для оптимизации выхода эфиров жирных кислот в результате реакции переэтерификации, опосредованной липазой.
С. Переэтерификация
Липиды, продуцируемые микроорганизмами, описанными выше, подвергают реакции переэтерификации в соответствии со способами, заявленными в настоящем изобретении, чтобы получить липофильную фазу, содержащую алкиловые эфиры жирных кислот, и гидрофильную фазу, содержащую клеточные материалы и глицерол. Согласно некоторым способам настоящего изобретения липофильную фазу затем отделяют от гидрофильных клеточных материалов.
1. Общий химический процесс
Животные и растительные масла обычно состоят из триацилглицеролов (TAGs), которые представляют собой эфиры свободных жирных кислот и трехатомного спирта, глицерола. Во время переэтерификации глицерол в составе TAG замещается низшим алкиловым спиртом, таким как метанол, этанол или изопропанол. Типичная схема реакции представлена ниже:

Как видно на схеме, спирт депротонируют основанием, чтобы сделать его сильным нуклеофилом. Обычно этанол или метанол используют в существенном избытке (50-кратном). В норме эта реакция происходит чрезвычайно долго или не происходит вообще. Для ускорения реакции применяется тепло, а также кислота или основание. Кислота или основание не участвует в реакции переэтерификации; поэтому они не являются реагентами, а представляют собой катализаторы. Практически все биодизели традиционно получают при помощи способов, включающих использование основания в качестве катализатора, поскольку это требует только низкой температуры и давления и позволяет получить 98% выхода (исходное масло при этом имеет низкую влажность и небольшое содержание свободных жирных кислот).
Частным случаем реакции переэтерификации является глицеролизис или использование глицерола (глицерина) для разрушения химических связей. Реакцию глицеролизиса обычно катализируют путем добавления кислоты или основания. Глицеролизис может осуществляться с простыми эфирами, жирами, свободными жирными кислотами или TAGs, когда метиловые эфиры вступают в реакцию с избыточным количеством глицерола с образованием моно- и/или диглицеридов и метанола как побочного продукта. Моно- и диглицериды могут использоваться как эмульгаторы и обычно добавляются в пищевые продукты.
2. Использование рекомбинантных липаз для переэтерификации
Переэтерификацию также осуществляют экспериментально с использованием фермента, такого как липаза, вместо основания. Катализированная липазой реакция переэтерификации может осуществляться, например, при температуре, которая может варьировать от комнатной до 80°С, и молярном соотношении TAG и низшего спирта более 1:1, предпочтительно, 3:1. Липазы, которые могут использоваться в реакции переэтерификации в соответствии с настоящим изобретением, перечислены в Таблице 5 (без ограничений указанными). Другие примеры липаз, пригодных для переэтерификации, перечислены, например, в патентах США №№4,798,793; 4,490,845; 5,156,963; 5,342,768; 5,776,741 и заявке WO89/01032, которые включены в настоящее описание в качестве ссылок.
Одна из проблем использования липазы для получения сложных эфиров жирных кислот, подходящих для биодизеля, заключается в том, что стоимость липазы в разы выше, чем стоимость гидроксида натрия (NaOH), который традиционно используется в реакции переэтерификации. Эту проблему можно решить за счет использования иммобилизованной липазы, которую можно применять повторно. Однако активность иммобилизованной липазы должна поддерживаться после ее повторного использования, по крайней мере, несколько циклов, только тогда реакция с использованием липазы будет сопоставима по стоимости производства с реакцией, в которой используется основание. Иммобилизованные липазы являются объектами для отравления низшими спиртами, которые обычно используются для переэтерификации. В патенте США № 6,398,707 (от 4 июня 2002, Wu et al.), включенном в настоящее описание в качестве ссылки, описываются способы увеличения активности иммобилизованных липаз и восстановления иммобилизованных липаз с пониженной активностью.
Согласно определенным вариантам осуществления изобретения рекомбинантная липаза экспрессируется в тех же микроорганизмах, которые продуцируют липиды, на которые воздействует указанная липаза. Подходящие рекомбинантные липазы включают ферменты, представленные выше в Таблице 5, и/или липазы, имеющие кодовые номера Генного банка, также представленные в Таблице 5, а также полипептиды, имеющие, по крайней мере, 70% аминокислотную идентичность с одной из липаз, представленной выше в Таблице 5, и обладающие липазной активностью. Согласно дополнительным вариантам осуществления изобретения ферментативная активность выражена последовательностью, которая, по крайней мере, на 75%, по крайней мере, на 80%, по крайней мере, на 85%, по крайней мере, на 90%, по крайней мере, на 95%, или, по крайней мере, приблизительно на 99% идентична описанным выше последовательностям, из которых все включены в настоящее описание в качестве ссылок.
Примерный вектор для экспрессии гена липазы представляет собой микроорганизм, такой как микроводоросль, содержащий ген, кодирующий липазу и находящийся в функциональной связи с промотором, активным у микроводорослей. Альтернативно, если вектор не содержит промотор в функциональной связи с геном липазы, указанный ген может быть трансформирован в клетки таким образом, что он образует такую функциональную связь с эндогенным промотором в точке интеграции вектора. Способ трансформации без промотора был продемонстрирован на микроводорослях (см., например, Plant Journal 14:4, (1998), pp.441-447). Вектор также может содержать второй ген, который кодирует белок, придающий устойчивость к антибиотикам или гербицидам, то есть является селективным маркером. По желанию, за одним или обоими генами следует 3' нетранслируемая последовательность (3'UTR), включающая сигнал полиаденилирования. Экспрессируемая кассета, кодирующая два гена, может быть физически связана в одном векторе или находиться в разных векторах. Ко-трансформация микроводорослей также может использоваться, при ней различные векторные молекулы одновременно применяются для трансформации клеток (см., например, Protist 2004 Dec; 155(4):381-93). Трансформированные клетки могут быть по желанию отобраны на основе их способности расти в присутствии антибиотиков или других селективных маркеров в условиях, при которых клетки, не несущие кассеты устойчивости, расти не будут.
ДНК, кодирующая липазу и селективный маркер, может представлять собой кодон-оптимизированную кДНК. Способы перекодирования генов для экспрессии в микроводорослях описаны в патенте США №7,135,290. Дополнительная информация доступна на сайте www.kazusa.or.jp/codon.
Многие промоторы активны в микроводорослях, включая промоторы, являющиеся эндогенными для трансформируемых водорослей, а также промоторы, которые не являются эндогенными для трансформируемых водорослей (то есть промоторы из других водорослей, промоторы высших растений и промоторы из вирусов растений или вирусов водорослей). Экзогенные и/или эндогенные промоторы, активные в микроводорослях, а также гены устойчивости к антибиотикам, активные в микроводорослях, хорошо известны специалистам в данной области. Промотор, который используется для экспрессии экзогенного гена, может представлять собой промотор, естественно связанный с этим геном, или может быть гетерологичным геном. Другие промоторы являются видоспецифическими. К предпочтительным промоторам относятся такие как RBCS2 из Chlamydomonas reinhardtii, и вирусные промоторы, такие, как промоторы вируса мозаики цветной капусты (CMV) и промоторы вирусов хлорелла, чья активность доказана у многих видов микроводорослей (см., например. Plant Cell Rep. 2005 Mar; 23(10-11):727-35; J Microbiol. 2005 Aug; 43(4):361-5; Mar Biotechnol (NY). 2002 Jan; 4(1):63-73).
Промоторы, молекулы кДНК и 3'UTRs, а также другие элементы векторов, могут быть получены при помощи методик клонирования с использованием фрагментов, выделенных из природных источников (см., например. Molecular Cloning: A Laboratory Manual, Sambrook et al. (3d edition, 2001, Cold Spring Harbor Press; и патент США № 4,683,202). Альтернативно элементы могут быть получены синтетически при помощи известных способов (см., например. Gene 1995 Oct 16; 164(1):49-53).
Согласно определенным вариантам осуществления изобретения липаза экспрессируется индуцируемым и/или целевым образом. Использование индуцируемого промотора для экспрессии гена липазы обеспечивает продукцию липазы после выращивания микроорганизмов, когда, если это необходимо, уже отрегулированы все условия для усиления переэтерификации, например, после разрушения клеток, уменьшения содержания воды в реакционной смеси и/или добавления достаточного количества спирта для запуска конверсии TAGs до сложных эфиров жирных кислот. Индуцируемые промоторы, пригодные для использования в данном изобретении, включат промоторы, опосредующие транскрипцию функционально связанного гена в ответ на стимул, такой как экзогенно введенная малая молекула, изменение температуры (тепло или холод), свет и т.д. Подходящие промоторы могут активировать транскрипцию молчащего гена или ап-регулировать, предпочтительно значительно, транскрипцию функционально связанного гена, который транскрибируется в низкой степени. В последнем случае уровень транскрипции липазы, предпочтительно, не влияет существенным образом на рост микроорганизмов, в которых она экспрессируется.
В определенных вариантах осуществления изобретения является предпочтительным целенаправленная экспрессия липазы в одном или более компартменте клетки, где она изолирована от множества клеточных липидов до начала реакции переэтерификации.
3. Преимущества биомассы с высоким соотношением липидные компоненты:нелипидные компоненты.
Прямая переэтерификация продуктов сельского хозяйства осуществляется, как описано в заявке на патент США №20030229237 (опубликованной 11 декабря 2003) и в заявке 20050020842 (опубликованной 27 января 2005). Указанные способы включают использование материалов, таких как соя, кокосовый орех, пальма, кукуруза, хлопок, лен, рапс/канола, сафлор, подсолнечник или других масличных растений или животных жиров, в качестве субстратов для реакции переэтерификации для получения алкиловых эфиров жирных кислот.
Особенным преимуществом использования микроорганизмов для получения TAGs, пригодных для осуществления переэтерификации в соответствии со способами настоящего изобретения, является возможность регулировать соотношение липидных и нелипидных компонентов в биомассе, что, в свою очередь, дает два существенных полезных свойства. Во-первых, как показано в примерах ниже, при переэтерификации биомассы, имеющей высокое соотношение липидькнедипиды, более эффективно происходит превращение TAGs в алкиловые эфиры жирных кислот. Во-вторых, что также показано в примерах, переэтерификация биомассы, имеющей высокое соотношение липиды:нелипиды, позволяет получить биодизельный продукт с меньшим содержанием нежелательных гетероатомов. В последнем случае липофильная фаза, образующаяся во время переэтерификации, содержит фосфор в количестве, по весу, не более 60 частиц на миллион. Согласно некоторым вариантам осуществления изобретения, количество фосфора по весу в липофильной фазе не превышает 25 частиц на миллион. Согласно некоторым вариантам осуществления изобретения количество фосфора по весу в липофильной фазе не превышает 10 частиц на миллион. Согласно другим вариантам осуществления изобретения количество серы по весу в липофильной фазе не превышает 80 частиц на миллион, а согласно определенным вариантам осуществления изобретения количество серы по весу в липофильной фазе не превышает 60 частиц на миллион. Согласно некоторым вариантам осуществления изобретения количество серы по весу в липофильной фазе не превышает 15 частиц на миллион. Согласно некоторым вариантам осуществления изобретения количество железа по весу в липофильной фазе не превышает 2 части на миллион. Согласно некоторым вариантам осуществления изобретения количество цинка по весу в липофильной фазе не превышает 40 частиц на миллион. Согласно некоторым вариантам осуществления изобретения количество цинка по весу в липофильной фазе не превышает 12 частиц на миллион. Согласно некоторым вариантам осуществления изобретения общее количество магния и кальция по весу в липофильной фазе не превышает 5 частиц на миллион. Согласно некоторым вариантам осуществления изобретения общее количество натрия и калия по весу в липофильной фазе не превышает 50 частиц на миллион. Согласно некоторым вариантам осуществления изобретения общее количество натрия и калия по весу в липофильной фазе не превышает 15 частиц на миллион. При помощи некоторых способов данного изобретения можно получить выход продукта, в котором в липофильной фазе переэтерифицированного материала ограничена концентрация двух и более из указанных гетероатомов или их комбинаций: сера - менее 15 частиц на миллион; фосфор - менее 20,001% от общей массы; общее количество магния и кальция не более 5 частиц на миллион; и общее количество натрия и калия не более 15 частиц на миллион.
Еще одним свойством биомассы с высоким содержанием липидов, выращенной гетеротрофически, в частности биомассы микроводорослей, является количество каротеноидов в липофильной фазе после реакции переэтерификации. Согласно некоторым вариантам осуществления изобретения количество лютеина не превышает 400 микрограмм на грамм липофильной фазы. Согласно некоторым вариантам осуществления изобретения количество лютеина не превышает 200 микрограмм на грамм липофильной фазы. Согласно некоторым вариантам осуществления изобретения количество лютеина не превышает 100 микрограмм на грамм липофильной фазы. Согласно некоторым вариантам осуществления изобретения количество лютеина не превышает 40 микрограмм на грамм липофильной фазы. Согласно некоторым вариантам осуществления изобретения количество лютеина составляет не менее 5 микрограмм на грамм липофильной фазы. Согласно некоторым вариантам осуществления изобретения количество лютеина составляет не менее 10 микрограмм на грамм липофильной фазы. Согласно некоторым вариантам осуществления изобретения количество лютеина составляет не менее 30 микрограмм на грамм липофильной фазы. Согласно некоторым вариантам осуществления изобретения липофильная фаза содержит количество лютеина, которое находится в указанных выше пределах, то есть не более 400 микрограмм на грамм и не менее, по крайней мере, 5 микрограмм на грамм липофильной фазы. Согласно некоторым вариантам осуществления изобретения количество лютеина составляет приблизительно 35 микрограмм на грамм липофильной фазы.
Согласно некоторым вариантам осуществления изобретения количество зеаксантина не превышает 275 микрограмм на грамм липофильной фазы. Согласно некоторым вариантам осуществления изобретения количество зеаксантина не превышает 150 микрограмм на грамм липофильной фазы. Согласно некоторым вариантам осуществления изобретения количество зеаксантина не превышает 75 микрограмм на грамм липофильной фазы. Согласно некоторым вариантам осуществления изобретения количество зеаксантина не превышает 25 микрограмм на грамм липофильной фазы. Согласно некоторым вариантам осуществления изобретения количество зеаксантина составляет не менее 0,5 микрограмм на грамм липофильной фазы. Согласно некоторым вариантам осуществления изобретения количество зеаксантина составляет не менее 10 микрограмм на грамм липофильной фазы. Согласно некоторым вариантам осуществления изобретения количество зеаксантина составляет не менее 20 микрограмм на грамм липофильной фазы. Согласно некоторым вариантам осуществления изобретения липофильная фаза содержит количество зеаксантина, которое находится в указанных выше пределах, то есть не более 275 микрограмм на грамм и не менее, по крайней мере, 0,5 микрограмм на грамм липофильной фазы. Согласно некоторым вариантам осуществления изобретения количество зеаксантина составляет приблизительно 23 микрограмма на грамм липофильной фазы.
Согласно некоторым вариантам осуществления изобретения количество α-Криптоксантина не превышает 8 микрограмм на грамм липофильной фазы. Согласно некоторым вариантам осуществления изобретения количество α-Криптоксантина не превышает 5 микрограмм на грамм липофильной фазы. Согласно некоторым вариантам осуществления изобретения количество α-Криптоксантина не превышает 2 микрограмма на грамм липофильной фазы. Согласно некоторым вариантам осуществления изобретения количество α-Криптоксантина не превышает 0,1 микрограмм на грамм липофильной фазы. Согласно некоторым вариантам осуществления изобретения количество α-Криптоксантина составляет не менее 0,001 микрограмм на грамм липофильной фазы. Согласно некоторым вариантам осуществления изобретения количество α-Криптоксантина составляет не менее 0,01 микрограмм на грамм липофильной фазы. Согласно некоторым вариантам осуществления изобретения количество α-Криптоксантина составляет не менее 0,05 микрограмм на грамм липофильной фазы. Согласно некоторым вариантам осуществления изобретения липофильная фаза содержит количество α-Криптоксантина, которое находится в указанных выше пределах, то есть не более 8 микрограмм на грамм и не менее, по крайней мере, 0,01 микрограмм на грамм липофильной фазы. Согласно некоторым вариантам осуществления изобретения количество α-Криптоксантина составляет приблизительно 0,06 микрограмма на грамм липофильной фазы.
Согласно некоторым вариантам осуществления изобретения количество β-Криптоксантина не превышает 18 микрограмм на грамм липофильной фазы. Согласно некоторым вариантам осуществления изобретения количество β-Криптоксантина не превышает 8 микрограмм на грамм липофильной фазы. Согласно некоторым вариантам осуществления изобретения количество β-Криптоксантина не превышает 4 микрограмм на грамм липофильной фазы. Согласно некоторым вариантам осуществления изобретения количество β-Криптоксантина не превышает 2 микрограмма на грамм липофильной фазы. Согласно некоторым вариантам осуществления изобретения количество β-Криптоксантина составляет не менее 0,1 микрограмм на грамм липофильной фазы. Согласно некоторым вариантам осуществления изобретения количество β-Криптоксантина составляет не менее 1 микрограмма на грамм липофильной фазы. Согласно некоторым вариантам осуществления изобретения количество β-Криптоксантина составляет не менее 1,5 микрограмм на грамм липофильной фазы. Согласно некоторым вариантам осуществления изобретения липофильная фаза содержит количество β-Криптоксантина, которое находится в указанных выше пределах, то есть не более 18 микрограмм на грамм и не менее, по крайней мере, 0,1 микрограмм на грамм липофильной фазы. Согласно некоторым вариантам осуществления изобретения количество β-Криптоксантина составляет приблизительно 1,8 микрограмма на грамм липофильной фазы.
Согласно некоторым вариантам осуществления изобретения количество α-каротена не превышает 1,9 микрограмм на грамм липофильной фазы. Согласно некоторым вариантам осуществления изобретения количество α-каротена не превышает 1 микрограмма на грамм липофильной фазы. Согласно некоторым вариантам осуществления изобретения количество α-каротена не превышает 0,1 микрограмма на грамм липофильной фазы. Согласно некоторым вариантам осуществления изобретения количество α-каротена не превышает 0,09 микрограмм на грамм липофильной фазы. Согласно некоторым вариантам осуществления изобретения количество α-каротена составляет не менее 0,0005 микрограмм на грамм липофильной фазы. Согласно некоторым вариантам осуществления изобретения количество α-каротена составляет не менее 0,01 микрограмм на грамм липофильной фазы. Согласно некоторым вариантам осуществления изобретения количество α-каротена составляет не менее 0,05 микрограмм на грамм липофильной фазы. Согласно некоторым вариантам осуществления изобретения липофильная фаза содержит количество α-каротена, которое находится в указанных выше пределах, то есть не более 1,9 микрограмм на грамм и не менее, по крайней мере, 0,0005 микрограмм на грамм липофильной фазы. Согласно некоторым вариантам осуществления изобретения количество α-каротена составляет приблизительно 0,08 микрограмм на грамм липофильной фазы.
Согласно некоторым вариантам осуществления изобретения количество β-каротена не превышает 14 микрограмм на грамм липофильной фазы. Согласно некоторым вариантам осуществления изобретения количество β-каротена не превышает 10 микрограмм на грамм липофильной фазы. Согласно некоторым вариантам осуществления изобретения количество β-каротена не превышает 4 микрограмм на грамм липофильной фазы. Согласно некоторым вариантам осуществления изобретения количество β-каротена не превышает 1,5 микрограмма на грамм липофильной фазы. Согласно некоторым вариантам осуществления изобретения количество β-каротена составляет не менее 0,1 микрограмма на грамм липофильной фазы. Согласно некоторым вариантам осуществления изобретения количество β-каротена составляет не менее 0,9 микрограмм на грамм липофильной фазы. Согласно некоторым вариантам осуществления изобретения количество β-каротена составляет не менее 1 микрограмма на грамм липофильной фазы. Согласно некоторым вариантам осуществления изобретения липофильная фаза содержит количество β-каротена, которое находится в указанных выше пределах, то есть не более 14 микрограмм на грамм и не менее, по крайней мере, 0,1 микрограмм на грамм липофильной фазы. Согласно некоторым вариантам осуществления изобретения количество β-каротена составляет приблизительно 1,2 микрограмма на грамм липофильной фазы.
Повышенная эффективность, с которой происходит превращение TAGs в алкиловые эфиры жирных кислот, а также сниженное количество гетероатомов в липофильной фазе, что является следствием использования методик заявленных в настоящем изобретении по отношению к биомассе с высоким соотношением липиды:нелипиды, являются существенными преимуществами. Примеры, демонстрирующие повышенную эффективность переэтерификации липидов и пониженное количество гетероатомов в конечном продукте переэтерификации, описаны ниже.
Согласно некоторым вариантам осуществления изобретения соотношение липидов:нелипидных компонентов в высушенной биомассе, которую подвергают реакции переэтерификации или другим способам химической модификации, составляет, по крайней мере, 1:20, по крайней мере, 1:19, по крайней мере, 1:18, по крайней мере, 1:17, по крайней мере, 1:16, по крайней мере, 1:15, по крайней мере, 1:14, по крайней мере, 1:13, по крайней мере, 1:12, по крайней мере, 1:11, по крайней мере, 1:10, по крайней мере, 1:9, по крайней мере, 1:8, по крайней мере, 1:7, по крайней мере, 1:8, по крайней мере, 1:6, по крайней мере, 1:5, по крайней мере, 1:4, по крайней мере, 1:3, по крайней мере, 1:2 или, по крайней мере, 1:1. Согласно другим вариантам осуществления изобретения соотношение липидов:нелипидных компонентов в высушенной биомассе, которую подвергают реакции переэтерификации составляет, по крайней мере, 1,1:1, по крайней мере, 1,2:1, по крайней мере, 1,3:1, по крайней мере, 1,4:1, по крайней мере, 1,5:1, по крайней мере, 1,6:1, по крайней мере, 1,7:1, по крайней мере, 1,8:1, по крайней мере, 1,9:1, по крайней мере, 2:1, по крайней мере, 3:1, по крайней мере, 4:1, по крайней мере, 5:1, по крайней мере, 6:1, по крайней мере, 7:1, по крайней мере, 8:1, по крайней мере, 9:1 или, по крайней мере, 10:1.
V. Другие способы химической модификации липид-содержащей биомассы
Настоящее изобретение также относится к способам химической модификации, отличным от реакции переэтерификации, которые позволяют получить продукты, полезные для использования в промышленных и других целях, к указанным способам относятся гидрогенизация, интерэтерификация, гидроксилирование и гидролиз с дериватизацией. Указанные химические реакции могут осуществляться с биомассой, выделенной из микробной культуры, как описано выше, аналогичным образом, как осуществляется реакция переэтерификации, что также описано выше. Согласно некоторым вариантам осуществления изобретения биомасса может представлять собой биомассу, объединенную из двух и более культур различных штаммов или видов микроорганизмов. Согласно некоторым вариантам осуществления изобретения различные штаммы или виды имеют разные глицеролипидные профили, что показано в Примере 22. Согласно некоторым способам данного изобретения микробную массу сначала выделяют из культуральной среды, после чего подвергают химической реакции, которая позволяет ковалентно модифицировать, по крайней мере, 1% липидов. Согласно некоторым вариантам осуществления изобретения, по крайней мере, 2%, по крайней мере, 3%, по крайней мере, 4%, по крайней мере, 5%, по крайней мере, 6%, по крайней мере, 7%, по крайней мере, 8%, по крайней мере, 9%, по крайней мере, 10%, по крайней мере, 20%, по крайней мере, 30%, по крайней мере, 40%, по крайней мере, 50%, по крайней мере, 60%, по крайней мере, 70%, по крайней мере, 80%, по крайней мере, 90% липидов подвергается модификации в результате химического процесса.
А. Гидрогенизация: Насыщение двойных связей
Гидрогенизация представляет собой добавление водорода к двойным связям жирных кислот как составляющих компонентов глицеролипидов или свободных жирных кислот. Реакция гидрогенизации обеспечивает превращение жидких масел в полутвердые или твердые жиры, которые являются более подходящими для применения в определенных сферах. Гидрогенизация представляет собой хорошо изученный химический процесс, который, в общем, включает взаимодействие смеси с мелкоизмельченным переходным металлом (например, никелем, палладием, платиной или родием) в качестве катализатора при повышенной температуре (например, 140-225°С) в присутствии водорода.
Гидрогенизация биомассы, полученной при помощи способов, описанных в настоящем изобретении, осуществляется в соответствии с одним или более способом и/или материалом, заявленным в изобретении, включая микробную биомассу с процентом DCW в форме липидов, по крайней мере, 20%, для получения определенных продуктов, как описано, например, в следующих ссылках: патенты США №№7,288,278 (пищевые добавки и медикаменты), 5,346,742 (любриканты); 5,475,160 (жирные спирты); 5,091,116 (пищевые масла); 6,808,737 (структурные жиры маргарина и икры); 5,298,637 (низкокалорийные заменители жира); 6,391,815 (катализатор гидрогенизации и сернистый абсорбент); 5,233,099 и 5,233,100 (жирные спирты); 4,584,139 (катализаторы гидрогенизации); 6,057,375 (пеногасители); и 7,118,773 (пищевые икорные эмульсии), каждый из которых включен в настоящее описание в качестве ссылки.
В. Интерэтерификация: взаимозамещение жирных кислот в глицеролипидах
Глицеролипиды, образующиеся в природе, обычно не имеют универсального распределения составляющих их жирных кислот. Что касается масел, интерэтерификация означает обмен ацильных радикалов между двумя эфирами разных глицеролипидов. Реакция интерэтерификации обеспечивает механизм, при помощи которого жирные кислоты в составе смеси глицеролипидов могут быть перегруппированы с изменением характера их распределения. Интерэтерификация представляет собой хорошо изученную химическую реакцию, которая в целом включает нагревание (приблизительно до 200°С) смеси масел в течение определенного периода времени (например, 30 минут) в присутствии катализатора, такого как щелочной металл или алкилат щелочного металла (например, метоксид натрия). Эта реакция может использоваться для рандомизации характера распределения жирных кислот в масляной смеси или может быть направлена на получение желаемого характера распределения. Указанный способ химической модификации может осуществляться на материалах, заявленных в изобретении, таких как микробная биомасса с процентом DCW в форме липидов, по крайней мере, 20%.
Прямая интерэтерификация, при которой происходит специфическое распределение жирных кислот, может осуществляться путем выдерживания масляной смеси при температуре ниже точки плавления некоторых TAGs, которые должны присутствовать в смеси. Это приводит к селективной рекристаллизации указанных TAGs, что позволяет эффективно удалить их из реакционной смеси. Реакция может быть продолжена до тех пор, пока большая часть жирных кислот в масле не преципитируется. Реакция прямой интерэтерификации может использоваться для получения, например, продукта с низкой калорийностью за счет замещения жирных кислот с длинными цепями кислотами с более короткими цепями. Прямая интерэтерификация также может использоваться для получения продукта со смесью жиров, которые имеют желаемые температуры плавления и структурные черты, необходимые некоторым пищевым добавкам или продуктам (например, маргарин), без необходимости гидрогенизации, в результате которой могут образовываться нежелательные трансизомеры.
Интерэтерификация биомассы, полученной при помощи способов, описанных в настоящем изобретении, может осуществляться в соответствии с одним или более способом и/или материалом для получения определенных продуктов, как описано, например, в следующих ссылках: патенты США №№ 6,080, 853 (неусвояемые заменители жира); 4,288,378 (стабилизатор арахисового масла); 5,391,383 (пищевые распыляемые масла); 6,022,577 (пищевые жиры для пищевых продуктов); 5,434,278 (пищевые жиры для пищевых продуктов); 5,268,192 (низкокалорийные продукты на основе орехов); 5,258,197 (низкокалорийные пищевые композиции); 4,335,156 (пищевые жировые продукты); 7,288,278 (пищевые добавки и медикаменты); 7,115,760 (способы фракционирования); 6,808,737 (структурные жиры); 5,888,947 (смазки двигателей); 5,686,131 (пищевые смеси масел); и 4,603,188 (отверждаемые уретановые композиции), каждый из которых включен в настоящее описание в качестве ссылки.
Согласно некоторым вариантам осуществления изобретения интерэтерификация биомассы, как описано выше, осуществляется после взаимодействия переэтерифицированного продукта с полиолом, как описано в патенте США №6,465,642, включенным в настоящее описание в качестве ссылки, для получения сложных полиэфиров полиола и жирных кислот. Переэтерификация также может осуществляться с микробной биомассой, включающей сложные эфиры жирных кислот с короткими цепями, как описано в патенте США № 6,278,006, включенном в настоящее описание в качестве ссылки.
С. Гидроксилирование: насыщение путем добавления воды к двойным связям
Гидрокслирование означает добавление воды к двойным связям, что приводит к их насыщению и включению молекулы гидроксила. Реакция гидроксилирования обеспечивает механизм для превращения одной или более жирной кислоты в составе глицеролипида в жирную оксикислоту. Гидроксилирование может осуществляться, например, как описано в патенте США № 5,576,027, который включен в настоящее описание в качестве ссылки. Гидроксилированные жирные кислоты, включая касторовое масло и его производные, являются полезными компонентами и находят свое применение в различных сферах промышленности, включая пищевые добавки, сурфактанты, увлажнители пигментов, пеногасители, гидроизолирующие добавки, пластификаторы, косметические эмульгаторы и/или дезодорирующие агенты, а также в продукты электронной промышленности, фармацевтические средства, краски, чернила, адгезивы и любриканты.
Гидроксилирование микробной биомассы, полученной при помощи способов, заявленных в настоящем изобретении, может осуществляться в соответствии с одним или более способом и/или материалом для получения определенных продуктов, как описано, например, в следующих ссылках: патенты США №№ 6,590,113 (масляные покрытия и красители); 4,049,724 (реакция гидроксилирования); 6,113,971 (оливковое масло); 4,992,189 (любриканты и смазочные материалы); 5,576,027 (гидроксилированное молоко); и 6,869,597 (косметика), каждый из которых включен в настоящее описание в качестве ссылки.
Гидроксилированные глицеролипиды могут быть превращены в эстолиды. Эстолиды состоят из глицеролипида, в котором жирная оксикислота была этерифицирована с другой молекулой жирной кислоты. Превращение гидроксилированных глицеролипидов в эстолиды может осуществляться путем нагревания смеси глицеролипидов и жирных кислот и взаимодействия указанной смеси с минеральной кислотой, как описано, например, у Isbell et al., JAOCS 71 (2):169-174 (1999), источник литературы включен в настоящее описание в качестве ссылки. Эстолиды могут применяться в различных сферах, включая, без ограничений указанными, примеры, описанные в следующих ссылках: патенты США №№7,196,124 (высокоэластичные материалы и напольные покрытия); 5,458,795 (загущенные масла для высокотемпературных режимов); 5,451,332 (жидкости для технического применения); 5,427,704 (добавки к топливу) и 5,380,894 (любриканты, смазочные вещества, пластификаторы и печатные краски), каждый из которых включен в настоящее описание в качестве ссылки.
D. Гидролиз и дериватизация: отщепление и модификация свободных жирных кислот
Гидролиз жирных кислот в составе глицеролипидов, полученных при помощи способов, заявленных в настоящем изобретении, позволяет получить свободные жирные кислоты, которые могут быть дериватизированы с получением других полезных химических соединений. Гидролиз происходит в присутствии воды и кислотного или основного катализатора. Из освободившихся жирных кислот можно получить различные производные, что описано в следующих ссылках: патенты США №№5,304,664 (высокосульфатированные жирные кислоты); 7,262,158 (моющие композиции); 7,115,173 (кондиционеры для тканей); 6,342,208 (эмульсии для кожи); 7,264,886 (водные репеллентные композиции); 6,924,333 (красящие добавки); 6,695,768 (обогащенное жирами сырье для жвачных животных); и 6,380,410 (сурфактанты для детергентов и моющих средств), каждый из которых включен в настоящее описание в качестве ссылки.
Е. Дополнительные химические реакции модификации содержащей липиды микробной биомассы
Другие химические реакции, которые могут осуществляться с содержащей липиды микробной биомассой, включают взаимодействие триацилглицеролов с агентом для циклопропанирования с целью увеличения текучести и/или окислительной стабильности, как описано в патенте США №6,051,593; получение восков из триацилглицеридов, как описано в патенте США №6,770,104; и эпоксидирование триацилглицеролов, как описано в статье "Влияние композиции жирных кислот на кинетику акриляции эпоксидированных триацилглицеролов" Journal of the American Oil Chemists' Society, 79:1, 59-63 (2001) и Free Radical Biology and Medicine, 37:1, 104-114 (2004); все источники литературы включены в настоящее описание в качестве ссылок.
Согласно некоторым способам первый этап модификации включает гидрогенизацию для насыщения двойных связей, после чего осуществляют деоксилирование при повышенной температуре в присутствии водорода и катализатора. Согласно некоторым способам гидрогенизация и деоксилирование происходят во время одной реакции. Согласно другим способам, деоксилирование осуществляют перед реакцией гидрогенизации. Затем, по выбору, осуществляют реакцию изомеризации, также в присутствии водорода и катализатора. Наконец, если необходимо, удаляют газы и нафта-соединения. Например, см. патенты США №№ 5,475,160 (гидрогенизация триглицеридов), 5,091,116 (деоксигенация, гидрогенизация и удаление газов); 6,391,815 (гидрогенизация); и 5,888,947 (изомеризация), каждый из которых включен в настоящее описание в качестве ссылки.
F. Сапонификация микробной биомассы, содержащей липиды, и экстрагированных масел
1. Общая химия реакции сапонификации
Животные и растительные масла обычно состоят из триацилглицеридов (TAGs), которые представляют собой эфиры жирных кислот и трехатомного спирта, глицерола. В реакции щелочного гидролиза происходит удаление глицерола из TAGs, освобождаются анионы свободных карбоксильных кислот, которые могут связываться с катионами щелочных металлов, такими как катионы натрия или калия, с образованием солей жирных кислот. Ниже представлена типичная схема такой реакции:

Как видно на схеме, карбоксильная кислота в составе триацилглицерола отщепляется от глицерола и замещается гидроксильной группой. Количество основания (например, KOH), которое используется в реакции, определяется нужной степенью сапонификации. Если цель реакции заключается, например, в получении мыла, которое будет содержать некоторые масла, исходно присутствующие в TAG композиции, количество основания, достаточное для превращения всех TAGs в соли жирных кислот, добавляют в реакционную смесь. Обычно данную реакцию осуществляют в водном растворе, проистекает она медленно, однако, скорость можно увеличить, если нагреть реакционную смесь. Преципитация солей жирных кислот может быть усилена путем добавления солей, таких как растворимые в воде галиды щелочных металлов (например, NaCl или KCl). Предпочтительно, основанием является гидроксид щелочного металла, такой как NaOH или KOH. Альтернативно в реакции могут использоваться другие основания, такие как алканоламины, включая, например, триэтаноламин и аминометилпропанол. Согласно некоторым вариантам осуществления изобретения такие альтернативные основания могут использоваться при получении чистых мыльных продуктов.
2. Сапонификация биомассы, содержащей липиды
Сапонификация биомассы, содержащей липиды, может осуществляться в соответствии со способами данного изобретения на интактной биомассе или биомассе, которая перед этим была подвергнута разрушению посредством реакции щелочного гидролиза. В первом случае, интактная микробная биомасса, полученная путем культивирования микроорганизмов, как описано в тексте, взаимодействует с основанием для превращения эфирсодержащих липидных компонентов биомассы в соли жирных кислот. Согласно некоторым вариантам осуществления изобретения вся или часть воды, в которой культивировались микробы, удаляется и биомассу ресуспендируют в водном растворе, содержащем основание в количестве, достаточном для сапонификации необходимой части глицеролипидов и сложноэфирных соединений биомассы. Согласно некоторым вариантам осуществления изобретения менее 100% глицеролипидов и сложных эфиров жирных кислот биомассы превращается в соли жирных кислот.
Согласно некоторым вариантам осуществления изобретения биомассу перед реакцией щелочного гидролиза разрушают. Разрушение биомассы может осуществляться при помощи одного или более способа лизирования клеток, включая тепловой лизис, механический лизис, или другие способы, для того, чтобы внутриклеточное содержимое микроорганизмов стало более доступным для воздействия основания. Это способствует превращению TAGs или сложных эфиров жирных кислот в соли жирных кислот. Также для разрушения биомассы перед сапонификацией может использоваться лизис при помощи кислоты, однако другие способы являются более предпочтительными, поскольку при кислотном лизисе добавленное основание во время реакции щелочного гидролиза будет расходоваться на нейтрализацию оставшейся кислоты, что может влиять на эффективность образования солей жирных кислот. Поскольку применение тепла может увеличивать скорость щелочного гидролиза, тепловой лизис может с успехом применяться до или вовремя реакции сапонификации для получения солей жирных кислот.
Согласно некоторым вариантам осуществления изобретения биомассу не подвергают какой-либо обработке, помимо собственно разрушения, перед реакцией щелочного гидролиза. Согласно некоторым вариантам осуществления изобретения осуществляют предварительное обогащение биомассы для увеличения соотношения липидных и нелипидных компонентов более чем до 50% по весу при помощи способов, описанных в тексте. Согласно другим вариантам осуществления изобретения биомассу подвергают реакции щелочного гидролиза без этапа предварительного обогащения. Согласно некоторым вариантам осуществления изобретения биомасса, которую подвергают реакции щелочного гидролиза, содержит другие компоненты, помимо воды, в тех же относительных пропорциях, что и биомасса на момент сбора. В тех случаях, когда из биомассы удаляют практически всю воду, биомасса содержит клеточную эмульсию или полностью высушенный концентрат такой эмульсии.
Для создания липидсодержащей биомассы для последующего получения сапонифицированных масел может использоваться любой микроорганизм, описанный в тексте. Согласно некоторым вариантам осуществления изобретения микроорганизмы могут также придавать дополнительные характеристики композиции сапонифицированных масел, получаемых при помощи заявленных способов. Например, микроводоросли различных видов, а также микроводоросли, выращенные при различных условиях, различаются по цвету, включая зеленый, желтый, оранжевый, красный и т.п. Небольшое количество соединений, которые придают водорослям этот цвет, можно целенаправленно сохранить, и таким образом полученные композиции сапонифицированных масел будут иметь соответствующий оттенок, полученный естественным путем. Согласно некоторым вариантам осуществления изобретения другие составляющие биомассы, включая каротеноиды и ксантофиллы, также в небольших количествах могут быть сохранены в сапонифицированных масляных композициях.
Степень сапонификации биомассы различается в зависимости от способа, заявленного в настоящем изобретении. Согласно некоторым вариантам осуществления изобретения является желательным получить композицию сапонифицированных масел, которая также будет содержать глицеролипиды биомассы. Подходящее количество основания (например, NaOH) для использования в реакции щелочного гидролиза может быть определено на основании анализа глицеролипидов и эфиров жирных кислот в составе биомассы. Согласно некоторым вариантам осуществления изобретения является предпочтительным использовать избыточное количество основания для прямой сапонификации липидсодержащей биомассы, поскольку некоторое количество основания может вступать в реакцию с другими компонентами биомассы. Согласно некоторым вариантам осуществления изобретения использование основания в избыточном количестве для сапонификации эфирсодержащих липидных компонентов биомассы приводит к образованию сапонифицированной масляной композиции, которая является слишком щелочной. В этом случае композиция может подвергаться очистке для уменьшения ее щелочных свойств путем кипячения в воде и репреципитации солей жирных кислот за счет добавления других солей, таких как NaCl, KCl или подобных. Очищенную мыльную композицию затем подвергают дополнительной обработке, например удаляют излишки воды, вводят различные добавки, придают мылу форму брусков или любую другую и прочее.
Согласно некоторым вариантам осуществления изобретения соли жирных кислот (также обозначаемые как сапонифицированные масла), полученные при помощи описанных способов, могут быть объединены с другими добавками, включая незаменимые масла, ароматические масла, душистые масла, растительные компоненты, экстракты, СО2 экстракты, глину, красители, диоксид титана, слюды, окрашивающие травы, блестки, эксфолианты, семена фруктов, растительные волокна, измельченные зернышки, муку из орехов, семян, масляные капельки, восковые капли, травы, гидрозоли, витамины, молочные порошки, консерванты, антиоксиданты, токоферолы, соли, сахара, овощные масла, воски, глицерин, морские растения, природные масла, увлажняющие масла, овощные твердые жиры, пропиленгликоль, парабены, мед, пчелиный воск, алое, полисорбат, кукурузный крахмал, какао-порошок, коралловый порошок, увлажнители, камеди, эмульгирующие агенты, уплотнители, а также другие добавки, описанные в тексте.
3. Сапонификация экстрагированных масел
Степень сапонификации экстрагированных липидных составляющих биомассы может легко контролироваться, поскольку возможность того, что основание вступит в реакцию с другими компонентами, отличными от глицеролипидов или эфиров жирных кислот, присутствующих в экстрагированном масле, очень невелика. Экстракция липидных компонентов может осуществляться при помощи традиционных методик экстракции с использованием гексана, или при помощи масляной экстракции, или экстракции без использования растворителя.
Традиционная экстракция с использованием гексана (также могут применяться другие подходящие органические растворители) обычно включает взаимодействие биомассы или лизата с гексаном в количестве, достаточном для того, чтобы образовался раствор липидов в гексане в течение достаточного количества времени. Затем полученную смесь фильтруют и гексан удаляют, например, при помощи выпаривания во вращающейся установке. Способы экстракции гексаном хорошо известны из области техники.
Масляная экстракция включает добавление масла непосредственно в лизат, без предварительного разделения компонентов. После добавления масла лизат разделяется на разные слои сам по себе или в результате центрифугирования или подобной обработки. Слои могут включать в порядке уменьшения плотности: осадок твердых частиц, водную фазу, эмульсионную фазу и масляную фазу. Эмульсионная фаза представляет собой эмульсию липидов и водной фазы. В зависимости от количества масла, которое добавляют в лизат (вес/вес или объем/объем), скорости центрифугирования, при ее осуществлении, объема водной среды и других факторов любая из двух или обе, эмульсионная и масляная, фазы могут присутствовать. Инкубацию или обработку клеточного лизата или эмульсионной фазы с маслом осуществляют в течение периода времени, достаточного для того, чтобы липиды, продуцируемые микроорганизмами, полностью растворились в масле с образованием гетерогенной смеси.
Согласно различным вариантам осуществления изобретения масло, которое используется для экстракции, выбрано из группы, включающей соевое масло, рапсовое масло, масло канолы, пальмовое масло, пальмовое косточковое масло, кокосовое масло, кукурузное масло, отработанные овощные масла, китайское масло, оливковое масло, подсолнечное масло, хлопковое масло, куриный жир, говяжий жир, свиной жир, масло из микроводорослей, масло из макроводорослей, масло из растения Cuphea, льняное масло, арахисовое масло, отборный белый жир, сало, рыжиковое масло (Camelina sativa), масло горчичных семян, масло из ореха кешью, овсяное масло, люпиновое масло, масло гибискуса, масло календулы, конопляное масло, кофейное масло, льняное, масло из фундука, масло из молочая, масло тыквенного семени, масло кориандра, ромашки, кунжутное масло, сафлоровое масло, рисовое масло, масло тунгового дерева, масло какао, кокосовое масло, масло из маковых семян, масло клещевины, масло ореха пекан, масло жожоба, масло ятрофы, масло ореха макадамия, масло бразильского ореха и масло авокадо. Количество масла, которое добавляют к лизату, обычно превышает 5% (по весу или объему). Таким образом, предпочтительное соотношение об./об. или вес./вес. составляет более 5%, по крайней мере, 6%, по крайней мере, 7%, по крайней мере, 8%, по крайней мере, 10%, по крайней мере, 20%, по крайней мере 25%, по крайней мере, 30%, по крайней мере, 40%, по крайней мере, 50%, по крайней мере, 60%, по крайней мере, 70%, по крайней мере, 80%, по крайней мере, 90%, по крайней мере, 95% от клеточного лизата.
Липиды также могут быть экстрагированы из лизата при помощи способа экстракции без использования растворителя, то есть без необходимости добавления какого-либо органического растворителя или масла, а за счет охлаждения лизата. При таких способах лизат, предпочтительно, получают путем обработки биомассы кислотой в комбинации с повышением температуры выше комнатной. Также может использоваться обработка ультразвуком, в особенности, если температура находится в пределах от комнатной температуры до 65°С. Такой лизат после центрифугирования или осаждения может быть разделен на слои, один из которых представляет собой слой вода:липиды ("эмульсионный"слой). Другие слои могут включать твердый осадок, водный слой и липидный слой. Липиды могут быть экстрагированы из липидного слоя при помощи замораживания с последующим оттаиванием или просто путем охлаждения эмульсии. При использовании таких способов нет необходимости добавлять какой-либо органический растворитель или масло. Даже если добавляется какой-либо растворитель или масло, его количество может быть ниже 5% по объему или весу лизата.
Разделенные или экстрагированные липиды затем подвергают реакции щелочного гидролиза, как описано выше, в которой количество добавляемого к реакционной смеси основания может титроваться в зависимости от желаемого количества глицеролипидов и сложных эфиров жирных кислот в составе липидной композиции. Точный подсчет количества этерифицированных липидов в композиции может использоваться для определения количества основания, необходимого для сапонификации определенной части липидов, что обеспечивает возможность регулирования количества несапонифицированных масел, оставшихся в конечной композиции. Согласно некоторым вариантам осуществления изобретения, по крайней мере, 1%, по крайней мере, 2%, по крайней мере, 3%, по крайней мере, 4%, по крайней мере, 5%, по крайней мере, 6%, по крайней мере, 7%, по крайней мере, 8%, по крайней мере, 9% или, по крайней мере, 10% масел по весу остается несапонифицированными в конечной композиции. Согласно другим вариантам осуществления изобретения, является желательным сапонифицировать все или практически все масла таким образом, чтобы конечная композиция содержала не более 10%, не более 9%, не более 8%, не более 7%, не более 6%, не более 5%, не более 4%, не более 3%, не более 2%, не более 1% или не более 0,5% несапонифицированных масел по весу.
Согласно различным вариантам осуществления изобретения микробная биомасса или масло может содержать липиды с различной длиной углеводной цепи, а также с различной степенью насыщенности. Свойства липидов обусловлены естественным глицеролипидным профилем одной или более популяции микроорганизмов, используемых для получения биомассы или масла, которые затем подвергают реакции сапонификации, а также могут являться результатом конструирования пути обмена липидов в клетках, как описано в тексте, когда трансгенные штаммы микроорганизмов продуцируют определенных липиды в большем количестве.
Микробная биомасса, которую подвергают переэтерификации или другой химической модификации, как описано в тексте, может, по желанию, также подвергаться реакции предварительного обогащения, который позволяет увеличить количество липидов на сухой вес клетки. Согласно некоторым вариантам осуществления изобретения соотношение липидных и нелипидных компонентов в биомассе увеличивается более чем на 10%, более чем на 20%, более чем на 30%, более чем на 40%, более чем на 50%, более чем на 60%, более чем на 70%, более чем на 80%, более чем на 90% или более чем на 100% по весу. Согласно некоторым способам заявленным в изобретении биомассу подвергают химической реакции без этапа предварительного обогащения или согласно некоторым вариантам осуществления изобретения без этапа предварительного обогащения, который увеличивает соотношение более чем на 50%. Обогащение и увеличение соотношения липидных и нелипидных компонентов может достигаться, например, путем добавления липидов, выделенных из другого источника (например, из второй микробной культуры, из растения или семени масличного растения и подобных источников). Независимо от того, подвергают биомассу обогащению или нет, липидный компонент составляет не более 50%, не более 60%, не более 70%, не более 80%, не более 90%, не более 95% от веса биомассы, которую подвергают химической реакции, предпочтительно, липидный компонент составляет не менее 15%, не менее 20%, не менее 30%, не менее 35%, не менее 40% или не менее 45% от веса биомассы. Согласно некоторым вариантам осуществления изобретения собранная биомасса имеет содержание липидов, составляющее, по крайней мере, 5%, по крайней мере, 10%, по крайней мере, 15%, по крайней мере, 20%, по крайней мере, 25%, по крайней мере, 30%, по крайней мере, 35%, по крайней мере, 40%, по крайней мере, 45%, по крайней мере, 50%, по крайней мере, 55%, по крайней мере, 60%, по крайней мере, 65%, по крайней мере, 70%, по крайней мере, 75%, по крайней мере, 80%, по крайней мере, 85% или, по крайней мере, 90% от DCW.
Согласно некоторым вариантам осуществления изобретения перед тем, как биомассу подвергают сапонификации (или другой химической модификации) из нее удаляют воду. Согласно некоторым вариантам осуществления изобретения микробную биомассу не подвергают какой-либо обработке, кроме как удалению воды и/или лизису, перед реакцией сапонификации (или другой химической модификацией). Согласно некоторым вариантам осуществления изобретения биомасса, которую подвергают химической реакции, содержит другие компоненты помимо воды в тех же относительных пропорциях, что и биомасса на момент ее сбора после ферментации. В данном контексте словосочетание "в тех же относительных пропорциях" означает, что соотношения компонентов остаются практически такими же после подсчета изменений, которые могут быть связаны с удовлетворением потребностей клеток или метаболизмом некоторых компонентов после сбора биомассы, с химическими превращениями некоторых компонентов в самой собранной биомассе (без применения экзогенных реагентов или катализаторов), с выходом газообразных веществ из собранной биомассы и/или подобными изменениями относительных пропорций, которые очень нелегко контролировать. Словосочетание "те же относительные пропорции" также относится к рассчитанной степени экспериментальной вариабельности, например ±5%.
Согласно некоторым вариантам осуществления изобретения ковалентно модифицированные липиды отделяют от других компонентов биомассы после их химической модификации. Согласно некоторым вариантам осуществления изобретения разделение липидов включает фазовую сепарацию, при которой ковалентно модифицированные липиды формируют более легкую безводную фазу, а компоненты биомассы образуют одну или более тяжелую фазы. Более легкая безводная фаза может быть удалена для последующего выделения ковалентно модифицированных липидов. Согласно некоторым вариантам осуществления изобретения, отделение липофильной фазы, содержащей ковалентно модифицированные липиды, от гидрофильного клеточного материала биомассы может осуществляться при помощи центрифугирования или других способов. Соотношение ковалентно модифицированных липидов к весу биомассы, из которой их выделяют, может составлять, от 10% липидов к 90% биомассы, до 90% липидов к 10% биомассы, по сухому весу.
4. Преимущества биомассы с высоким содержанием насыщенных масел и небольшим количеством красящих включений
Несмотря на то, что биомасса и/или экстрагированное масло для последующей сапонификации, описанной здесь, может быть выделена из любого из множества микроорганизмов с различными глицеролипидными профилями и различными соотношениями других компонентов, таких как пигменты, согласно предпочтительному варианту осуществления изобретения биомасса и/или экстрагированное масло имеет относительно высокое соотношение насыщенных жирных кислот в составе TAGs и относительно низкое соотношение компонентов, которые влияют на цвет масла (например, пигментов). Согласно одному варианту осуществления изобретения биомасса и/или экстрагированное масло получают из микроводорослей рода Prototheca.
Степень насыщенности жирных кислот в составе сапонифицированного масла, а также наличие красящих компонентов влияют на сроки хранения композиций, содержащих указанное сапонифицированное масло, а также на их эстетические свойства. Насыщенные жирные кислоты менее склонны к окислению, чем их ненасыщенные аналоги. Таким образом, использование сапонифицированных масел, имеющих относительно высокое соотношение насыщенных и ненасыщенных жирных кислот, в приготовлении мыльных композиций может приводить к увеличению сроков хранения таких композиций и препятствует окислению продукта, которые при окислении обычно приобретают неприятный запах. Аналогично относительно полное отсутствие красящих включений, которые помимо окисления могут приводить к изменению внешнего вида композиций на основе сапонифицированного масла улучшает эстетические свойства композиции и повышают удовлетворение потребителей от купленного продукта, в особенности после продолжительного хранения. Покупатели конечного мыльного продукта часто ассоциируют определенный цвет или отсутствие цвета с определенной маркой мыла и ожидают, что данный продукт будет всегда иметь одинаковый цвет. Недостаточная окраска сапонифицированного масла позволяет получить более однородный по консистенции продукт.
Высокое соотношение насыщенных жирных кислот является особенно предпочтительным при изготовлении сапонифицированных композиций, как описано ниже, в которых часть глицеролипидов в составе биомассы (или экстрагированного масла) остается несапонифицированной. Как обсуждалось выше, процент глицеролипидов может оставаться немодифицированным (несапонифицированным) за счет регулирования количества основания, используемого в реакции сапонификации, что позволяет получить мыльный продукт, в котором сохраняется часть исходных глицеролипидов. Наличие избыточного количества глицеролипидов в реакции сапонификации обычно обозначается термином "пережиривание". Дополнительные масла, остающиеся в продукте после реакции сапонификации, влияют на увлажняющие свойства композиции, однако, как и любые масла, являются объектом реакции окисления, которая может приводить к появлению неприятного запаха. Использование высоких соотношений насыщенных кислот к ненасыщенным в качестве "пережиривающей" добавки реакционной смеси позволяет получить продукт с относительно длительным сроком хранения и свести к минимуму присутствие окисляемых продуктов с неприятным запахом.
Согласно различным вариантам осуществления изобретения насыщенные жирные кислоты составляют от 1 до 100% от эфирсодержащих липидных компонентов микробной биомассы или экстрагированного масла, которые подвергают реакции щелочного гидролиза в соответствии со способами, заявленными в настоящем изобретении. Согласно предпочтительным вариантам осуществления изобретения насыщенные жирные кислоты составляют, по крайней мере, 50%, по крайней мере, 60%, по крайней мере, 70%, по крайней мере, 80%, по крайней мере, 90%, по крайней мере, 95% или, по крайней мере, 99% от эфирсодержащих липидных компонентов в реакции щелочного гидролиза.
Согласно некоторым вариантам осуществления изобретения красящие включения (например, каротеноиды) присутствуют в микробной биомассе или экстрагированном масле в концентрации не более 500 мкг/г, не более 250 мкг/г, не более чем 100 мкг/г, не более чем 75 мкг/г или не более чем 25 мкг/г. К красящим включениям относятся каротеноиды, такие как лютеин, бета-каротен, зеаксантин, астаксантин и хлорофилл. Согласно другим вариантам осуществления изобретения количество хлорофилла, которое присутствует в микробной биомассе или экстрагированном масле, составляет менее 0, 1 мг/кг, менее 0,05 мг/кг или менее 0,01 мг/кг.
Согласно некоторым вариантам осуществления изобретения микробное масло или мыло до или после сапонификации соответственно содержит менее 60 микрограмм, менее 59 микрограмм, менее 58 микрограмм, менее 57 микрограмм, менее 56 микрограмм, менее 55 микрограмм, менее 54 микрограмм, менее 53 микрограмм, менее 54 микрограмм, менее 53 микрограмм, менее 52 микрограмм, менее 51 микрограмм, менее 50 микрограмм, менее 49 микрограмм, менее 48 микрограмм, менее 47 микрограмм, менее 46 микрограмм, менее 45 микрограмм, менее 44 микрограмм, менее 43 микрограмм, менее 42 микрограмм, менее 41 микрограмм, менее 40 микрограмм, менее 39 микрограмм, менее 38 микрограмм, менее 37 микрограмм, менее 36 микрограмм, менее 35 микрограмм, менее 34 микрограмм, менее 33 микрограмм, менее 32 микрограмм, менее 31 микрограмм, менее 30 микрограмм, менее 29 микрограмм, менее 28 микрограмм, менее 27 микрограмм, менее 26 микрограмм, менее 25 микрограмм, менее 24 микрограмм, менее 23 микрограмм, менее 22 микрограмм, менее 21 микрограмм, менее 20 микрограмм, менее 19 микрограмм, менее 18 микрограмм, менее 17 микрограмм, менее 16 микрограмм, менее 15 микрограмм, менее 14 микрограмм, менее 13 микрограмм, менее 12 микрограмм, менее 11 микрограмм, менее 10 микрограмм, менее 9 микрограмм, менее 8 микрограмм, менее 7 микрограмм, менее 6 микрограмм, менее 5 микрограмм или менее 4 микрограмм каротеноидов на грамм сапонифицированного масла.
Микроводоросли рода Ptototheca, включая без ограничений указанными, Prototheca wickerhamii, Prototheca stagnora, Prototheca portoricensis, Prototheca moriformis и Prototheca zopfii, естественным образом продуцируют липиды с высоким соотношением насыщенных кислот, что показано в Примере 28. Кроме того, масла, экстрагированные из микроводорослей рода Prototheca, обычно содержат незначительное количество красящих включений, что позволяет получать бесцветные композиции на основе сапонифицированных масел. Таким образом, использование подобных микроорганизмов в качестве источника биомассы или масла для осуществления сапонификации в соответствии с настоящим изобретением является предпочтительным.
VI. Композиции
Настоящее изобретение также относится к композициям, которые могут быть приготовлены при помощи описанных способов. В каждом случае осуществления композиции, заявленной в настоящем изобретении, микробная биомасса выбрана из группы, включающей бактерии, цианобактерии, эукариотические микроводоросли, липогенные дрожжи и грибы. Согласно некоторым вариантам осуществления изобретения микробная биомасса выбрана из группы, включающей биомассы, полученные из микробов, таких как эукариотические водоросли, представленные в Таблице 1. Согласно некоторым вариантам осуществления изобретения, микробная биомасса получена из микроводорослей рода Chlorella, а согласно определенным вариантам осуществления изобретения биомасса получена из следующих видов микроводорослей: Chlorella fusca, Chlorella protothecoides, Chlorella pyrenoidisa, Chlorella kessleri, Chlorella vulgaris, Chlorella saccharophila, Chlorella sorokiniana и Chlorella ellipsoidea. Согласно одному варианту осуществления изобретения микроорганизм представляет собой Chlorella protothecoides. Согласно некоторым вариантам осуществления изобретения микробная биомасса получена из дрожжей, выбранных из группы, включающей липогенные дрожжи, перечисленные в Таблице 2, либо получена из грибов, выбранных из группы, включающей грибы, представленные в Таблице 3.
Согласно одному варианту своего осуществления настоящее изобретение относится к композиции, включающей более легкую фазу сложных алкиловых эфиров жирных кислот и, по крайней мере, одну более тяжелую фазу, включающую компоненты микробной биомассы.
Согласно различным вариантам осуществления заявленных композиций, по крайней мере, 20% алкиловых эфиров жирных кислот представлены С18. Согласно другим вариантам осуществления изобретения, по крайней мере, 30%, по крайней мере, 40% или, по крайней мере, 50% алкиловых эфиров жирных кислот представлены С18. Согласно некоторым вариантам осуществления изобретения, по крайней мере, 50% сложных алкиловых эфиров жирных кислот представлены С16 или молекулами с более короткими углеродными цепями. Согласно некоторым вариантам осуществления изобретения, по крайней мере, 10% алкиловых эфиров жирных кислот представлено С14 или молекулами с более короткими углеродными цепями. Согласно некоторым вариантам осуществления изобретения, по крайней мере, 20% алкиловых эфиров жирных кислот представляют собой С14 или эфиры с более короткими углеродными цепями.
Согласно некоторым вариантам осуществления изобретения композиции содержат гетероатомы в различных количествах. Согласно некоторым вариантам осуществления изобретения количество магния и кальция совместно по весу в легкой фазе не превышает 5 частиц на миллион. Согласно некоторым вариантам осуществления изобретения количество фосфора в легкой фазе не превышает 0,001% по массе. Согласно некоторым вариантам осуществления изобретения количество серы в легкой фазе не превышает 15 частиц на миллион. Согласно некоторым вариантам осуществления изобретения количество калия и натрия, совместно, по весу не превышает 5 частиц на миллион. Согласно некоторым вариантам осуществления изобретения общее содержание каротеноидов в легкой фазе составляет не более 100 микрограмм каротеноида на грамм.
Согласно другому варианту своего осуществления изобретение относится к композиции, включающей более легкую фазу, содержащую полностью насыщенные липиды, и, по крайней мере, одну тяжелую фазу, содержащую микробную биомассу.
Согласно еще одному варианту своего осуществления настоящее изобретение относится к композиции, включающей более легкую фазу, содержащую липиды, и, по крайней мере, одну более тяжелую фазу, содержащую микробную биомассу, выделенную более чем из одного вида или штамма микроорганизмов. Согласно другому варианту своего осуществления настоящее изобретение относится к композиции, включающей более легкую фазу, содержащую гидроксилированные липиды, и, по крайней мере, одну более тяжелую фазу, содержащую микробную биомассу. Согласно другому варианту настоящее изобретение относится к композиции, содержащей более легкую фазу, включающую свободные жирные кислоты, и, по крайней мере, одну более тяжелую фазу, включающую микробную биомассу.
Согласно еще одному варианту настоящее изобретение относится к композиции, содержащей сапонифицированные масла, выделенные при помощи реакции щелочного гидролиза из биомассы, полученной путем культивирования микробной популяции, как описано выше. Согласно некоторым вариантам осуществления изобретения биомасса, из которой получают сапонифицированные масла, представляет собой смешанную биомассу из двух или более различных штаммов или видов микроорганизмов, которые культивировали отдельно. Согласно одному варианту осуществления изобретения, по крайней мере, два различных штамма или вида микробов, из которых образуют биомассу, имеют два различных глицеролипидных профиля. Согласно разным вариантам осуществления изобретения композиция может быть как твердой (включая порошок), так и жидкой.
Композиции сапонифицированных масел, заявленные в соответствии с настоящим изобретением, могут содержать соли жирных кислот, выделенные из одного или более вида микроорганизмов, как описано в тексте, а также могут содержать каротеноиды или другие компоненты, выделенные непосредственно из биомассы, из которой получают сапонифицированные масла. Согласно некоторым вариантам осуществления изобретения композиции сапонифицированных масел содержат, без ограничений указанными, β-каротен, α-каротен, астаксантин, α-криптоксантин, β-криптоксантин, лютеин, ликопен, фитоен, фитофлуен, и/или зеаксантин. Согласно некоторым вариантам осуществления изобретения композиция сапонифицированных масел включает полисахариды водорослей, например, такие, которые описаны в международной заявке WO 2007/084769, которая включена в настоящее описание в качестве ссылки.
Согласно некоторым вариантам осуществления изобретения композиция сапонифицированного масла содержит различные количества несапонифицированных глицеролипидов, выделенных из биомассы. Согласно различным вариантам осуществления изобретения несапонифицированные глицеролипиды, выделенные из биомассы, составляют, по крайней мере, 2%, по крайней мере, 3%, по крайней мере, 4%, по крайней мере, 5%, по крайней мере, 10%, по крайней мере, 20%, по крайней мере, 30%, по крайней мере, 40% или, по крайней мере, 50% от композиции сапонифицированного масла. Согласно другим вариантам осуществления изобретения несапонифицированные глицеролипиды составляют не более 25%, не более 20%, не более 15%, не более 10%, не более 9%, не более 8%, не более 7%, не более 6%, не более 5%, не более 4%, не более 3%, не более 2% или, не более 1% от композиции сапонифицированного масла.
Согласно различным вариантам осуществления композиций в соответствии с настоящим изобретением сапонифицированное масло составляет, по крайней мере, 5%, по крайней мере, 10%, по крайней мере, 15%, по крайней мере, 20%, по крайней мере, 25%, по крайней мере, 30%, по крайней мере, 35%, по крайней мере, 40%, по крайней мере, 45%, по крайней мере, 50%, по крайней мере, 55%, по крайней мере, 60%, по крайней мере, 65%, по крайней мере, 70%, по крайней мере, 75%, по крайней мере, 80%, по крайней мере, 85%, по крайней мере, 90% или, по крайней мере, 95% от общей массы всей композиции. Согласно некоторым вариантам осуществления изобретения сапонифицированное масло составляет не более 80%, не более 75%, не более 70%, не более 65%, не более 60%, не более 55%, не более 50%, не более 45%, не более 40%, не более 35%, не более 30%, не более 25%, не более 20%, не более 15%, не более 10% или не более 5% от общей массы композиции. Согласно некоторым вариантам осуществления изобретения компоненты, выделенные из биомассы, включая, без ограничений указанными, сапонифицированные масла, несапонифицированные масла, каротеноиды и подобные вещества, составляют, по крайней мере, 5%, по крайней мере, 10%, по крайней мере, 15%, по крайней мере, 20%, по крайней мере, 25%, по крайней мере, 30%, по крайней мере, 35%, по крайней мере, 40%, по крайней мере, 45%, по крайней мере, 50%, по крайней мере, 55%, по крайней мере, 60%, по крайней мере, 65%, по крайней мере, 70%, по крайней мере, 75%, по крайней мере, 80%, по крайней мере, 85%, по крайней мере, 90% или, по крайней мере, 95% от общей массы композиции. Согласно другим вариантам осуществления изобретения компоненты, выделенные из биомассы, составляют не более 80%, не более 75%, не более 70%, не более 65%, не более 60%, не более 55%, не более 50%, не более 45%, не более 40%, не более 35%, не более 30%, не более 25%, не более 20%, не более 15%, не более 10% или не более 5% от общей массы композиции.
Согласно некоторым вариантам осуществления композиций сапонифицированных масел заявленные композиции также содержат, по крайней мере, одно масло, выбранное из группы, включающей соевое масло, рапсовое масло, масло канолы, пальмовое масло, пальмовое косточковое масло, кокосовое масло, кукурузное масло, отработанные овощные масла, китайское масло, оливковое масло, подсолнечное масло, хлопковое масло, куриный жир, говяжий жир, свиной жир, масло из микроводорослей, масло из макроводорослей, масло из растения Cuphea, льняное масло, арахисовое масло, отборный белый жир, сало, рыжиковое масло (Camelina sativa), масло горчичных семян, масло из ореха кешью, овсяное масло, люпиновое масло, масло гибискуса, масло календулы, конопляное масло, кофейное масло, льняное, масло из фундука, масло из молочая, масло тыквенного семени, масло кориандра, ромашки, кунжутное масло, сафлоровое масло, рисовое масло, масло тунгового дерева, масло какао, кокосовое масло, масло из маковых семян, масло клещевины, масло ореха пекан, масло жожоба, масло ятрофы, масло ореха макадамия, масло бразильского ореха и масло авокадо.
Согласно некоторым вариантам воплощения сапонифицированных композиций, с солями жирных кислот объединяют одну или более добавку. Согласно некоторым вариантам осуществления изобретения добавки выбирают для того, чтобы улучшить моющие свойства композиции, если ее планируется использовать, например, в качестве средства для очищения кожи. Согласно другим вариантам осуществления изобретения добавки выбирают с учетом тех свойств, которые она придает композиции, чтобы композиция понравилась потребителям. Согласно некоторым вариантам осуществления изобретения добавки выбирают для улучшения моющих свойств композиции и для улучшения потребительских качеств композиции. Согласно различным вариантам осуществления изобретения добавки выбраны из группы, включающей незаменимые масла, ароматические масла, душистые масла, растительные компоненты, экстракты, CO2 экстракты, глину, красители, диоксид титана, слюды, окрашивающие травы, блестки, эксфолианты, семена фруктов, растительные волокна, измельченные зернышки, муку из орехов, семян, масляные капельки, восковые капли, травы, гидрозоли, витамины, молочные порошки, консерванты, антиоксиданты, токоферолы, соли, сахара, овощные масла, воски, глицерин, морские растения, природные масла, увлажняющие масла, овощные твердые жиры, пропиленгликоль, парабены, мед, пчелиный воск, алое, полисорбат, кукурузный крахмал, какао-порошок, коралловый порошок, увлажнители, камеди, эмульгирующие агенты и уплотнители. Перечисленные добавки являются коммерчески доступными, поскольку являются популярными ингредиентами косметических продуктов для кожи и средств для душа и ванны.
К незаменимым маслам относятся масла, полученные из следующих растительных источников: гвоздика, амирис, корень ангелики, семена аниса, базилик, лавр благородный, бергамот, черный перец, каяпутовое дерево, камфора, кананга, кардамон, семена моркови, кассия, котовник, кедр, ромашка, кора корицы, листья корицы, цитронелла ява, мускатный шалфей, растение Eugenia caryophyllata (clovebud), кориандр, растение Mentha arvensis (cornmint), кипарис, давана (полынь бледная), семена укропа, элеми, эвкалипт, фенхель, пихта, дерево босвеллия, герань видов Geranium burbon и Geranium roast, пелларгоний, имбирь, розовый грейпфрут, грейпфрут, бальзам girjum (Dipterocarpus jourdainii), иссоп, можжевеловые ягоды, лавандин, эфирное масло лаванды, лаванда, лимонный мирт, лимонное чайное дерево, лимон, лемонграсс, лайм, лицеа кубеба, мандарин, майоран, коровяк, мирра, нероли, неролина, ниаули, мускатный орех, апельсин, пальмароза, пачули, перечная мята, петигрен, сосновая хвоя, равенсара душистая, равинтсара, розалина, роза, розмарин, палисандровое дерево, шалфей, сандаловое дерево, мята курчавая, нард, бадьян, мандарин, чайное дерево, чабрец, тулси или священный базилик, вербена, ветивер, иланг-иланг и здравец (болгарская герань), а также их комбинации.
К ароматическим и душистым маслам относятся масла, имеющие запахи со следующими парфюмерными названиями: абсолю тюльпана, миндаль, амаретто, амбра, анаис, яблоко, яблочная корица, пряное яблоко, абрикос, абрикосовый крем, аравийский мускус, азиатская груша, азиатская цветущая слива, осеннее дерево, банан, базилик, базиликовый нектарин, лавровишня, душистый перец, бергамот, ягоды и сливки, праздничный пирог, черемуха, черный чай, ежевичный чай, черная смородина, "голубой Нил", черничное удовольствие, костяничное варенье, коричневый сахар, жевательная резинка, сливочный крем, ириски, калла, мускусная дыня, кармельное яблоко, гвоздика, морковный пирог, масала чай, ромашка, китайский мускус, китайский бобовник, китайский пион, хризантема, корица, кокос, кокосовый крем, сахарная вата, клюква, огурец, огуречная дыня, нарцисс, одуванчик, дельфиниум, ежевика, duice de leche (молочный джем), чай эрл-грей, пасхальный кулич, Эг-ног, египетский мускус, магический лес, английская лаванда, английская груша, хвоя, инжир," франжипани" (красный жасмин), ладан, французская ваниль, свежее яблоко, свежезаваренный кофе, фруктовый пунш, гардения, герань, имбирная лилия, имбирный пряник, виноград, грейпфрут, зеленое яблоко, зеленая трава, зеленый чай, гуава, цветок гуавы, гавайский белый имбирь, гелиотроп, конопля, травянистый запах, праздничный фруктовый пирог, остролист, медовый имбирь, мед, жимолость, жасмин, жасминовый чай, можжевеловые ягоды, киви, лаванда, кожа, лимон, лимонная петрушка, сирень, лайм, логанова ягода, цветущий лотос, магнолия, мандарин, манго, манго и киви, клен, молочный шоколад, мимоза, мятный лайм, шелковица, мирра, нероли, дубовый мох, овсяная мука, океанский дождь, апельсиновый цвет, апельсиновый щербет, апельсиновая ваниль, папайя, маракуйя, пачули, персик, персик и сливки, ягодная груша, перечная мята, индийский жасмин, пина колада, ананас, гранат, тыквенный пирог, изюм и миндаль, малина, жареные орехи, палисандр, шалфей, сандал, сассафрас, морской мох, кунжут, сибирская сосна, снежноягодник, испанский мох, пряности, клубника, сахарная слива, лосьон для загара, сладкая гвоздика, сладкая трава, сладкий горошек, мандарин, тайский кокос, древесина, листья томатов, ваниль, арбуз, белый шоколад, дикая вишня, глициния, "колдовское зелье", иланг-иланг, а также их различные сочетания.
К эксфолиантам относятся частички, которые могут отшелушивать мертвые клетки, загрязнения или другие ненужные вещества с поверхности кожи, к ним относятся, без ограничений указанными, семена фруктов и волокна, зернистые порошки, измельченные орехи и зерна, а также масляные или восковые шарики. К фруктовым волокнам могут относиться материалы, полученные из следующих плодов: черника, клюква, виноград, киви, малина, ежевика, клубника и прочие. К зерновым порошкам относятся овсяная мука и миндальный порошок и подобные вещества, имеющие различную степень измельченности и размер частиц. Полимерные бусинки, изготовленные, например, из полиэтилена или подобных веществ, также могут использоваться. Удаление омертвевших клеток кожи и/или очищение наружного слоя кожи обеспечивает "поле для деятельности" для биоактивных агентов, таких как каротеноиды, которые также могут присутствовать в композиции, заявленной в настоящем изобретении, и могут проникать в более глубокие слои кожи.
К экстрактам и СО2 экстрактам относятся растительные экстракты, полученные при помощи стандартных способов экстракции или при помощи жидкого диоксида углерода. Экстракты могут быть получены из следующих растительных источников: листья алоэ вера, листья альфаальфа, корни алканны, семена аннатто, маранта, корень лопуха, лепестки календулы, корень моркови, цветки ромашки, листья окопника, кукурузные рыльца, голландский синий василек, семена фенхеля, корень имбиря, женьшень, листья зеленого чая, цветки жасмина, можжевеловые ягоды, бутоны лаванды, лимонная цедра, лемонграсс, корень алтея, крапива, стебли овса, апельсиновая цедра, паприка, петрушка, листья мяты перечной, розовые бутоны, розовые лепестки, плоды шиповника, листья розмарина, хвощ, листья мяты кучерявой, а также зверобой и их сочетания.
К красителям и блесткам относятся вещества, имеющие следующие обозначения: зеленый #5, зеленый #8, оранжевый #4, красный #22, красный #33, фиолетовый #2, голубой #1, зеленый #3, красный #40, желтый #5, желтый #6, зеленый #6, красный #17, а также перламутровая слюда и красящие растения, такие как листья сены, сандаловое дерево, куркума, клюква, киви, малина, алкана красильная, аннатто, морковь, крапива, паприка и петрушка.
Согласно различным вариантам осуществления изобретения композиция сапонифицированных масел, содержащая одну или более добавку, как описано выше, предназначена для использования в качестве косметического продукта. Согласно некоторым вариантам осуществления изобретения косметический продукт является средством личной гигиены, таким как очищающее средство для определенных частей тела (например, лица, ног и т.д.).
Согласно одному аспекту своего осуществления настоящее изобретение относится к набору, содержащему композицию сапонифицированного масла, как описано в тексте, и пищевую добавку. Согласно одному варианту своего осуществления пищевая добавка является витамином. Согласно другому варианту осуществления изобретения пищевая добавка является растительным компонентом.
Согласно другому аспекту своего осуществления настоящее изобретение относится к способу применения сапонифицированного масла, полученного из биомассы при помощи реакции щелочного гидролиза, как описано в тексте, который включает смешивание масла с одной или более добавкой, описанной выше, и упаковку готовой композиции как косметического продукта. Согласно одному варианту осуществления изобретения косметический продукт представляет собой очищающее средство (например, средство для очищения лица).
Традиционные способы ДНК анализа могут применяться для определения компонентов, выделенных из микробной биомассы, в соответствии с настоящим изобретением.
Все источники, приведенные в тексте, включая патенты, заявки на патенты и публикации, включены в настоящее описание в качестве ссылок во всей своей полноте независимо от того, были ли они включены ранее в специфические описания. Публикации, которые упоминаются в тексте, включены в него с целью описания и раскрытия различных реагентов, методик и концепций, которые могут применяться в связи с настоящим изобретением. Не стоит истолковывать и допускать, что указанные ссылки являются известным уровнем техники для изобретений, описанных в тексте. В частности, в описание в качестве ссылок во всей своей полноте включены следующие патентные заявки: предварительная заявка на патент США № 60/043,620 от 9 августа 2008 "Прямая химическая модификация микробной биомассы", предварительная заявка на патент США № 61/074,610 от 20 июня 2008 "Мыла и косметические продукты, полученные из содержащей масла микробной биомассы, и масла", международная заявка на патент № WO 2008/151149; и предварительная заявка на патент США 61/112,464 от 7 ноября 2008, "Косметические композиции, содержащие компоненты микроводорослей".
Несмотря на то, что настоящее изобретение описано с учетом специфических вариантов его воплощения, должно быть понятно, что возможны другие его модификации. Различные модификации, варианты использования или адаптации настоящего изобретения с учетом принципов настоящего изобретения и, включая отклонения от изложенных положений, относятся к сфере знаний и общепринятой практике в той области, к которой относится настоящее изобретение, и могут осуществляться специалистами в данной области с учетом незаменимых признаков изобретения, которые изложены в описании и в представленной ниже формуле изобретения. Представленные ниже примеры приведены с иллюстративной целью и никаким образом не ограничивают объем изобретения.
VII. Примеры
Пример 1
Если дополнительно не оговаривается иное, все штаммы, описанные в тексте и в представленных ниже Примерах, получают в Институте коллекций культур водорослей штата Техас (Austin, TX). В настоящем примере изучают способность штаммов рода Chlorella расти на глицероле и глюкозе. Культивируют следующие виды и штаммы микроводорослей рода Chlorella: Chlorella kessleri (штаммы 263,397,398,2228); Chlorella sorokiniana (штаммы 1663,1665, 1669, 1671,1810); Chlorella saccharophila (2911,2469); Chlorella prototheciodes (31, 249, 250, 264). Каждый штамм прививают из твердой среды в 25 мл жидкой основной среды (2 г/л экстракта дрожжей, 2,94 ммоль NaNO3, 0,17 ммоль CaCl2·2H2O, 0,3 ммоль MgSO4*7H2O, 0,4 ммоль K2HPO4, 1,28 ммоль K2HPO4, 0,43 ммоль NaCl) и выращивают, взбалтывая, при 27°С в течение 72 часов при интенсивности света µEm-2s-1. Эти культуры, после достижение плотности культуры 1×105 клеток на мл, прививают в 24-луночный планшет, содержащий (а) только основную среду, (б) основную среду + 0,1% глюкозу и (в) основную среду + 0,5% химически чистого глицерола (ЕМ Science, каталог #GX0185-6) в объеме 2 мл. Планшеты помещают в темноту и культуры выращивают в течение 72 часов при взбалтывании при температуре 27°С. Образцы каждого штамма, выращенного в трех различных условиях, разводят дистиллированной водой в соотношении 1,9:1: поглощение культур было в красном свете при длине волны 600 нм, измеренное на аппарате Molecular Devices SpactraMax 340PC. Все штаммы росли на средах в присутствии глюкозы и глицерола по сравнению с только основной средой.
Пример 2
Штаммы и среда: Первичные культуры Chlorella protothecoides #1 (ШТАММ 250), #2 (ШТАММ 264) и Chlorella kessleri #1 (ШТАММ 398) поддерживают на модифицированной протеозной среде. Модифицированная протеозная среда включает (г/л) 0,25 г NaNO3, 0,09 г K2HPO4, 0,175 г KH2PO4, 0,025 г, 0,025 г CaCl2·2H2O, 0,075 г MgSO4·7Н2О и 2 г дрожжевого экстракта на литр. Глицерол, являющийся побочным продуктом реакции получения биодизеля (окисленный глицерол (AG) и неокисленный глицерол (NAG)), получают в компании Imperial Western Products (Selma, CA, USA). "Очищенный" или "химически чистый" глицерол получают во компании ЕМ Science (отдел Merck KGA), каталог #GX0185-6. Для каждого из штаммов в 24-луночном планшете готовят следующие среды в объеме 1 мл:
1. Протеоза + 1% чистый глицерол.
2. Протеоза + 1% окисленный глицерол.
3. Протеоза + 1% неокисленный глицерол.
4. Протеоза + 1% чистый глицерол + 1% глюкозы (добавляют через 72 ч).
5. Протеоза + 1% окисленный глицерол + 1% глюкозы (добавляют через 72 ч).
6. Протеоза + 1% неокисленный глицерол + 1% глюкозы (добавляют через 72 ч).
Каждый из штаммов вводят в разную среду в концентрации 5×105 клеток на мл. Культуры содержат в темноте и перемешивают при помощи орбитального шейкера Labnet (Berkshire, UK) при 430 об/мин. Через 72 ч первичного роста в образцы #4,5 и 6 добавляют 1% (вес/объем) глюкозу и клетки культивируют в течение 24 ч. Для измерения DCW 1 мл каждой культуры осаждают путем центрифугирования при 5,000 об/мин в течение 5 мин в центрифуге Eppendorf 5415С. После удаления супернатанта клеточный осадок замораживают при -80°С и лиофилизируют в лабораторном лиофилизаторе (Labconco, МО, USA). Результаты представлены на Фиг.1
Пример 3
Штаммы и среда: Первичные культуры Chlorella protothecoides #1 (ШТАММ 250), #3 (ШТАММ 249) и Chlorella kessleri #2 (ШТАММ 397) поддерживают на модифицированной протеозной среде (см. Пример 2). Для каждого из штаммов в 24-луночном планшете готовят следующие среды в объеме 1 мл:
1. Протеоза + 1% чистый глицерол + 1% глюкоза.
2. Протеоза + 1% окисленный глицерол + 1% глюкоза.
3. Протеоза + 1% неокисленный глицерол + 1% глюкоза.
Каждый из штаммов вводят в разную среду в концентрации 5×105 клеток на мл. Культуры содержат в темноте и перемешивают при помощи орбитального шейкера Labnet (Berkshire, UK) при 430 об/мин. Через 96 часов первичного роста измеряют DCW (см. Пример 2). Результаты представлены на Фиг.2.
Пример 4
Штаммы и среда: Первичные культуры Chlorella protothecoides #3 (ШТАММ 249), #4 (ШТАММ 31) и Chlorella kessleri #2 (ШТАММ 397) поддерживают на модифицированной протеозной среде (см. Пример 2). Для каждого из штаммов в 24-луночном планшете готовят следующие среды в объеме 1 мл:
1. Протеоза + 1% чистый глицерол + 1% глюкоза.
2. Протеоза + 1% окисленный глицерол + 1% глюкоза.
3. Протеоза + 1% неокисленный глицерол + 1% глюкоза.
Каждый штамм инокулируют в среду, содержащую различные типы глицерола (чистый, окисленный или неокисленный) в концентрации 5×105 клеток на мл. Культуры содержат в темноте и перемешивают при помощи орбитального шейкера Labnet (Berkshire, UK) при 430 об/мин. Через 96 ч измеряют содержание липидов. Для измерения содержания липидов в клетках 100 мкл каждой культуры собирают, отмывают однократно тем же объемом среды. В каждую пробирку добавляют 5 мкл отмытых клеток и 200 мкл серной кислоты (18 м). Пробирки инкубируют при 90°С на водяной бане в течение 30 минут, после чего добавляют 1 мл реагента фосфорная кислота-ванилин и инкубируют пробирки при 37°С в течение 15 минут. Для приготовления реагента, фосфорная кислота-ванилин, 0,12 г ванилина добавляют к 20 мл воды, после чего объем доводят до 100 мл 85% фосфорной кислотой. Оптическую плотность при 530 нм оценивают в стеклянном кювете против пробирки с 5 мкл воды в качестве образца. Результаты представлены на Фиг.3.
Пример 5
Штаммы и среда: Первичные культуры Chlorella protothecoides #2 (ШТАММ 264) и Chlorella kessleri #1 (ШТАММ 398) поддерживают на модифицированной протеозной среде (см. Пример 2). Для каждого из штаммов в 24-луночном планшете готовят следующие среды в объеме 1 мл:
1. Протеоза + 1% чистый глицерола.
2. Протеоза + 1% неокисленный глицерола.
3. Протеоза + 1% чистый глицерол + 1% глюкоза (добавляют через 72 ч).
4. Протеоза + 1% неокисленный глицерол + 1% глюкоза (добавляют через 72 ч).
Каждый штамм инокулируют в среду, содержащую различные типы глицерола (чистый или неокисленный) в концентрации 5×105 клеток на мл. Культуры содержат в темноте и перемешивают при помощи орбитального шейкера Labnet (Berkshire, UK) при 430 об/мин. Через 72 первичного роста в образцы #3 и #4 добавляют 1% глюкозу и клетки культивируют еще 24 ч. Содержание липидов измеряют во всех образцах (см. Пример 4). Оптическую плотность (OD) при 600 нм также измеряют для того, чтобы проверить неспецифическую абсорбцию и вычитают результат O.D. при 530 для расчета количества липидов. Нормативную кривую строят для Триолеина, растворенного в хлороформе, в диапазоне от 1 до 10 мкг. Результаты представлены на Фиг.4.
Пример 6
Штаммы и среда: Первичные культуры Chlorella protothecoides #3 (ШТАММ 249) и Chlorella kessleri #2 (ШТАММ 397) поддерживают на модифицированной протеозной среде (см. Пример 2). Для каждого из штаммов в 24-луночном планшете готовят следующие среды в объеме 1 мл:
1. Протеоза + 1% чистый глицерол + 1% глюкоза (добавляют через 72 ч).
2. Протеоза + 1% окисленный глицерол + 1% глюкоза (добавляют через 72 ч).
3. Протеоза + 1% неокисленный глицерол + 1% глюкоза (добавляют через 72 ч).
Каждый штамм инокулируют в среду, содержащую различные типы глицерола (чистый, окисленный или неокисленный) в концентрации 5×105 клеток на мл. Культуры содержат в темноте и перемешивают при помощи орбитального шейкера Labnet (Berkshire, UK) при 430 об/мин. Через 72 ч первичного роста добавляют 1% глюкозу и клетки культивируют еще 24 ч. Во всех образцах измеряют DCW и содержание липидов (см. Примеры 2 и 5). Процент липидов рассчитывают путем деления общего количества липидов на DCW. Результаты представлены на Фиг.5.
Пример 7
Штаммы и среда: Первичные культуры Chlorella protothecoides #3 (ШТАММ 249) и Chlorella kessleri #2 (ШТАММ 397) поддерживают на модифицированной протеозной среде (см. Пример 2). Для каждого из штаммов в 24-луночном планшете готовят следующие среды в объеме 1 мл:
1. Протеоза + 1% чистый глицерол + 1% глюкоза (добавляют через 72 ч).
2. Протеоза + 1% неокисленный глицерол + 1% глюкоза (добавляют через 72 ч).
Каждый штамм инокулируют в среду, содержащую 1% чистый глицерол или 1% неокисленный глицерол, в концентрации 5×105 клеток на мл. Культуры содержат в темноте и перемешивают при помощи орбитального шейкера Labnet (Berkshire, UK) при 430 об/мин. Через 72 ч первичного роста добавляют 1% глюкозу и клетки культивируют еще 24 ч. Во всех образцах измеряют DCW и содержание липидов (см. Примеры 1 и 4). Процент липидов рассчитывают путем деления общего количества липидов на DCW. Результаты представлены на Фиг.6.
Пример 8
Штаммы и среда: Первичные культуры Chlorella protothecoides #1 (ШТАММ 250) и Chlorella kessleri #2 (ШТАММ 397) поддерживают на модифицированной протеозной среде (см. Пример 2). Для каждого из штаммов в 24-луночном планшете готовят следующие среды в объеме 1 мл:
1. Протеоза + 2% глюкоза.
2. Протеоза + 1% глицерол + 1% глюкоза.
Каждый штамм вводят в разную среду для культивирования в концентрации 5×105клеток на мл. Культуры содержат в темноте и перемешивают при помощи орбитального шейкера Labnet (Berkshire, UK) при 430 об/мин. Через 96 первичного роста измеряют содержание липидов (см. Пример 5). Результаты представлены на Фиг.7.
Пример 9
Штаммы и среда: Первичные культуры Chlorella protothecoides #3 (ШТАММ 249), #4 (ШТАММ 31) и Chlorella kessleri #1 (ШТАММ 398) поддерживают на модифицированной протеозной среде (см. Пример 2). Для каждого из штаммов в 24-луночном планшете готовят следующие среды в объеме 1 мл:
1. Протеоза + 2% глюкоза.
2. Протеоза + 1% глицерол + 1% глюкоза.
3. Протеоза + 1% глицерол + 1% глюкоза (добавляют через 72 ч).
Каждый штамм вводят в разную среду для культивирования в концентрации 5×105 клеток на мл. Культуры содержат в темноте и перемешивают при помощи орбитального шейкера Labnet (Berkshire, UK) при 430 об/мин. Через 72 ч первичного роста добавляют 1% глюкозу (вес./об.) в среду #3 и клетки культивируют еще 24 ч. Во всех образцах измеряют содержание липидов и DCW (см. Примеры 2 и 4). Процент содержания липидов рассчитывают путем деления общего количества липидов на сухой вес клетки. Результаты представлены на Фиг.8.
Пример 10
Штаммы и среда: Первичные культуры Chlorella protothecoides #1 (ШТАММ 250), #3 (ШТАММ 249) и Chlorella kessleri #2 (ШТАММ 397) поддерживают на модифицированной протеозной среде (см. Пример 2). Для каждого из штаммов в 24-луночном планшете готовят следующие среды в объеме 1 мл:
1. Протеоза + 1% чистый глицерол + 1% глюкоза.
2. Протеоза + 1% чистый глицерол + 1% глюкоза (добавляют через 72 ч).
3. Протеоза + 1% окисленный глицерол + 1% глюкоза.
4. Протеоза + 1% окисленный глицерол + 1% глюкоза (добавляют через 72 ч).
5. Протеоза + 1% неокисленный глицерол + 1% глюкоза.
6. Протеоза + 1% неокисленный глицерол + 1% глюкоза (добавляют через 72 ч).
Каждый штамм вводят в разную среду для культивирования в концентрации 5×105клеток на мл. Культуры содержат в темноте и перемешивают при помощи орбитального шейкера Labnet (Berkshire, UK) при 430 об/мин. Через 72 ч первичного роста, добавляют 1% глюкозу (вес./об.) в среды #2, #4 и #6., и клетки культивируют еще 24 ч. Во всех образцах измеряют содержание липидов (см. Пример 4). Результаты представлены на Фиг.9.
Пример 11
Штаммы и среда: Первичные культуры Chlorella protothecoides #7 (ШТАММ 250), #3 (ШТАММ 249) и Chlorella kessleri #2 (ШТАММ 397) поддерживают на модифицированной протеозной среде (см. Пример 2). Для каждого из штаммов в 24-луночном планшете готовят следующие среды в объеме 1 мл:
1. Протеоза + 1% чистый глицерол + 1% глюкоза.
2. Протеоза + 1% чистый глицерол + 1% глюкоза (добавляют через 72 ч).
3. Протеоза + 1% окисленный глицерол + 1% глюкоза.
4. Протеоза + 1% окисленный глицерол + 1% глюкоза (добавляют через 72 ч).
5. Протеоза + 1% неокисленный глицерол + 1% глюкоза.
6. Протеоза + 1% неокисленный глицерол + 1% глюкоза (добавляют через 72 ч).
Каждый штамм вводят в разную среду для культивирования в концентрации 5×105 клеток на мл. Культуры содержат в темноте и перемешивают при помощи орбитального шейкера Labnet (Berkshire, UK) при 430 об/мин. Через 72 ч первичного роста добавляют 1% глюкозу (вес/об) в среды #2, #4 и #6 и клетки культивируют еще 24 ч. Во всех образцах измеряют DCW (см. Пример 2). Результаты представлены на Фиг.10.
Пример 12
Штаммы и среда: Первичные культуры водорослей рода (a) Spirulina вида Spirulina platensis (UTEX 2340) и рода (б) Navicula вида Navicula pelliculosa (UTEX 667) поддерживают на специальной среде для Spirulina и среде на основе почвенного экстракта (SEM). Среда Spirulina состоит из: 162 ммоль NaHCO3, 38 ммоль Na2CO3, 1,9 ммоль K2HPO4, 29 ммоль NaNO3, 5,75 ммоль K2SO4, 17,1 ммоль NaCl, 0,8 ммоль MgSO4·4H2O, 0,25 ммоль CaCl2·2H2O, 2 ммоль Na2ЭДТА, 0,36 ммоль FeCl3·6Н2О, 0,21 ммоль MnCl2·4H2O, 0,037 ммоль ZnCl2, 0,0085 ммоль CoCl2·6Н2О, 0,017 ммоль NaMoO4·2H2O, 0,78 мкмоль CuSO4·5H2O, 0,15 мкмоль ZnSO4·7H2O, 10 мкмоль Н3ВО3 и 0,001 ммоль витамина В12. Среда на основе почвенного экстракта включает: 2,94 ммоль NaNO3, 0,17 ммоль CaCl2·2H2O, 0,3 ммоль MgSO4·7H2O, 0,43 ммоль K2HPO4, 1,29 ммоль K2HPO4, 0,43 ммоль NaCl и почвенный экстракт. Глицерол, являющийся побочным продуктом реакции получения биодизеля (окисленный глицерол (AG) и неокисленный глицерол (NAG)), получают в компании Imperial Western Products (Selma, CA, USA). Для каждого штамма в 24-луночном планшете приготавливают следующие различные среды в объеме 1 мл:
(а)
7. Spirulina + 2% глюкоза.
8. Spirulina + 2% химический чистый глицерол.
9. Spirulina + 2% неокисленный глицерол.
10. Spirulina + 1% неокисленный глицерол + 1% глюкоза
(б).
1. SEM + 2% глюкоза.
2. SEM + 2% химически чистый глицерол.
3. SEM + 1% химически чистый глицерол + 1% глюкоза.
4. SEM + 2% окисленный глицерол.
5. SEM + 1% окисленный глицерол + 1% глюкоза.
6. SEM + 2% неокисленный глицерол.
7. SEM + 1% неокисленный глицерол + 1% глюкоза.
Каждый штамм вводят в разную среду для культивирования в концентрации 5×105клеток на мл. Культуры содержат в темноте и перемешивают при помощи орбитального шейкера Labnet (Berkshire, UK) при 430 об/мин. Через 96 ч измеряют содержанием липидов. Для измерения содержания липидов в клетках 100 мкл каждой культуры собирают, отмывают однократно тем же объемом среды. В каждую пробирку добавляют 5 мкл отмытых клеток и 200 мкл серной кислоты (18 м). Пробирки инкубируют при 90°С на водяной бане в течение 30 минут, после чего добавляют 1 мл реагента фосфорная кислота-ванилин и инкубируют пробирки при 37°С в течение 15 минут. Для приготовления реагента фосфорная кислота-ванилин 0,12 г ванилина добавляют к 20 мл воды, после чего объем доводят до 100 мл 85% фосфорной кислотой. Оптическую плотность при 530 нм оценивают в стеклянном кювете против пробирки с 5 мкл воды в качестве образца. Нормативную кривую строят для Триолеина, растворенного в хлороформе, в диапазоне от 1 до 10 мкг.
Для измерения DCW 0,5 мл каждой культуры осаждают при помощи центрифугирования при 5000 об/мин в течение 5 минут. После удаления супернатанта клеточный осадок замораживают при -80°С и лиофилизируют в лабораторном лиофилизаторе (Labconco, МО, USA). Процентное содержание липидов рассчитывают путем деления общего количества липидов на сухой вес клетки. Результаты представлены на Фиг.11.
Пример 13
Штаммы и среда: Исходную культуру Scenedesmus armatus (UTEX 2552) поддерживают на модифицированной протеозной среде. Модифицированная протеозная среда включает: (г/д) 0,25 г NaNO3, 0,09 г K2HPO4, 0,175 г KH2PO4, 0,025 г, 0,025 г CaCl2·2H2O, 0,075 г MgSO4·7Н2О и 2 г дрожжевого экстракта на литр. Для каждых условий выращивания в 24-луночном планшете готовят следующие различные среды в объеме 1 мл:
(а), (б)
1. Протеоза + 2% глюкоза.
2. Протеоза + 2% глицерол.
3. Протеоза + 2% окисленный глицерол.
4. Протеоза + 2% неокисленный глицерол.
5. Протеоза+1% неокисленный глицерол + 1% глюкоза.
Scenedesmus armatus (UTEX 2552) в концентрации 5×105 клеток на мл вводят в разные среды. Культуры содержат в темноте и перемешивают при помощи орбитального шейкера Labnet (Berkshire, UK) при 430 об/мин. Через 96 ч измеряют клеточный рост по DCW, а содержание липидов измеряют при помощи фосфор-ванилинового реагента (см. Пример 12). Процентное содержание липидов рассчитывают путем деления общего количества липидов на сухой вес клетки. Результаты представлены на Фиг.12.
Пример 14
Штаммы и среда: Исходные культуры Navicula pelliculosa (UTEX 667) поддерживают на среде на основе почвенного экстракта (см. Пример 12). Для каждых условий выращивания в 24-луночном планшете готовят следующие различные среды в объеме 1 мл:
1. SEM + 2% глюкоза.
2. SEM + 2% глицерол.
3. SEM + 2% окисленный глицерол.
4. SEM + 1% окисленный глицерол + 1% глюкоза.
5. SEM + 2% неокисленный глицерол.
6. SEM + 1% неокисленный глицерол + 1% глюкоза.
Navicula pelliculosa (UTEX 667) в концентрации 5×105 клеток на мл вводят в среду, содержащую глюкозу или различные типы глицерола (чистый, окисленный и неокисленный). Культуры содержат в темноте и перемешивают при помощи орбитального шейкера Labnet (Berkshire, UK) при 430 об/мин. Через 96 ч измеряют клеточный рост по DCW (см. Пример 12). Результаты представлены на Фиг.13.
Пример 15
Штаммы и среда: Исходную культуру Scenedesmus armatus (UTEX 2552) и Navicula pelliculosa (UTEX 667) поддерживают на модифицированной протеозной среде (для Scenedesmus armatus) и среде на основе почвенного экстракта (для Navicula pelliculosa, см. Пример 1). Для каждого штамма в 24-луночном планшете готовят следующие различные среды в объеме 1 мл:
Scenedesmus armatus
5. Протеоза + 1% окисленный глицерол + 1% глюкоза.
6. Протеоза + 1% окисленный глицерол + 1% глюкоза (добавляют через 72 ч).
Navicula pelliculosa
1. SEM + 1% окисленный глицерол + 1% глюкоза.
2. SEM + 1% окисленный глицерол + 1% глюкоза (добавляют через 72 ч).
Каждый штамм в концентрации 5×105 клеток на мл вводят в различные среды. Культуры содержат в темноте и перемешивают при помощи орбитального шейкера Labnet (Berkshire, UK) при 430 об/мин. Через 72 ч первичного роста в образец #2 добавляют 1% глюкозу и клетки культивируют еще 24 ч. Клеточный рост измеряют по DCW (см. Пример 12). Результаты показаны на Фиг.14(а) и (б).
Пример 16
Штаммы и среда: Исходные культуры Chlorella protothecoides (UTEX 31) поддерживают на модифицированной протеозной среде (см. Пример 1). Для каждых условий выращивания в 24-луночном планшете готовят следующие различные среды в объеме 1 мл:
4. Протеоза.
5. Протеоза + 0,5% глюкоза.
6. Протеоза + 0,5% ксилоза.
7. Протеоза + 0,25% глюкоза + 0,25% ксилоза.
Chlorella protothecoides #4 (UTEX 31) в концентрации 3×105 клеток на мл инокулируют в среду, содержащую различные сахара (глюкозу или ксилозу). Культуры содержат в темноте и перемешивают при помощи орбитального шейкера Labnet (Berkshire, UK) при 430 об/мин. Через 72 ч клеточного роста измеряют клеточный рост путем подсчета количества клеток в каждой культуре. Результаты представлены на Фиг.15.
Пример 17
Исходные культуры Chlorella protothecoides #1, #3 и #4 поддерживают на модифицированной протеозной среде (см. Пример 1). Для каждых условий выращивания в 24-луночном планшете готовят следующие различные среды в объеме 1 мл:
1. Протеоза.
2. Протеоза + 1% глюкоза.
3. Протеоза + 1% фруктоза.
Каждый штамм в концентрации 1×106 клеток на мл вводят в среду, содержащую различные сахара (глюкозу или фруктозу). Культуры содержат в темноте и перемешивают при помощи орбитального шейкера Labnet (Berkshire, UK) при 430 об/мин. Через 96 ч клеточного роста измеряют плотность клеток путем подсчета количества клеток в каждой культуре. Результаты представлены на Фиг.16.
Пример 18
Выращивание Chlorella на сахарозе
Chlorella protothecoides (UTEX 249) инокулируют в три колбы объемом 50 мл, содержащие протеозную среду с 1% сахарозой (2,94 ммоль NaNO3, 0,428 ммоль K2HPO4, 1,28 ммоль KH2PO4, 0,427 ммоль NaCl, 0,17 ммоль CaCl2·2H2O, 0,3 ммоль MgSO4·7H2O, протеозопептон 1 г/л) до конечной плотности 4×105 клеток на мл. В две культуры добавляют инвертазу (Sigma #14504) в концентрации 0,01 Ед/мл и 0,0,5 Ед/мл. Все три культуры выращивают в темноте в течение приблизительно 60 ч при перемешивании при 150 об/мин. Конечный подсчет клеток осуществляют во всех трех культурах приблизительно через 60 ч перемешивания в темноте. В контрольной колбе плотность клеток составила 4,4Х×105 клеток на мл, в то время как в колбах, содержащих 0,01 Ед/мл и 0,05 Ед/мл инвертазы, плотность клеток составила 1×108 и 3×108 соответственно. Каждую колбу в конце эксперимента проверяют на предмет загрязненности при помощи электронной микроскопии, все культуры были чистыми.
Пример 19
Выращивание Chlorella protothecoides на мелассе с сахарозоинвертазой
Подготовка клеток Chlorella к инокуляции: 10 мл жидкой культуры Chlorella в качестве будущего инокулята собирают с планшета, содержащего твердую Протеозную среду. Культуры выращивают в условиях света в течение приблизительно 2-х дней при температуре 26°С. Рост измеряют при помощи оптического денситомера (OD) при 750 нм, а также путем определения DCWs.
Приготовление мелассы и исходного раствора сахаров: 5% исходный раствор готовят с глюкозой, сахарозой и тремя различными образцами мелассы (обозначенными, как BS1, BS2 и НТМ), полученными в результате промышленной переработки сахарного тростника, как показано ниже в Таблице 6. Величина рН всех исходных сред устанавливается в пределах 6-6,6, после чего среды автоклавируют.
Приготовление раствора инвертазы: Исходный раствор инвертазы с концентрацией 40 Ед/мл получают путем растворения 1 мг инвертазы в концентрации 400 Ед/мг (Sigma) в 10 миллилитрах дистиллированной воды.
Экспериментальные условия и подготовка: Приготавливают 10 мл культуры, каждая из которых содержит мелассы/сахара в конечной концентрации 1%, 0,05 Ед/мл инвертазы и 1,0е6 клеток Chlorella protothecoides на мл в основной протеазной среде. Культуры номеруют следующим образом: (1) только контрольная среда; (2) 1% НТМ; (3) 1% BS1; (4) 1% BS2; (5) 1% глюкоза; и (6) 1% сахароза. Приготавливают такой же контрольный набор без добавления инвертазы. Культуры выращивают в темноте в течение 5 дней при перемешивании при 250 об/мин при 28°С.
Результаты: Рост Chlorella protothecoides оценивают через пять дней после инокуляции на соответствующем источнике в темноте. Как показано на Фиг.19-20, клетки могут быть выращены на мелассе в присутствии сахарозоинвертазы с выходом, сопоставимым с тем, который можно получить при выращивании на чистой глюкозе.
Пример 20
Получение биомассы с высоким и низким содержанием липидов
Материалы и методы: Биомассу для последующей переэтерификации получают из Chlorella protothecoides #1 (ШТАММ 250), которую выращивают гетеротрофно в присутствии глюкозы в качестве фиксированного источника углерода при периодической ферментации с добавлением субстрата, сущность которой описана в Appl Microbiol Biotechnol 78:29-36 (2008). Образец "LO-1" собирают во время экспоненциального роста (через 60 ч), данный образец имеет содержание липидов, аналогичное тому, которое достигается при фотосинтетическом выращивании. Образец "080020-1" забирают через 115 ч после того, как весь азот в культуре будет употреблен, и клетки войдут в стабильную стадию накопления липидов.
Содержание липидов: Общее содержание липидов (перед переэтерификацией) определяют при помощи HPLC. Приблизительно 10 мг высушенной биомассы смешивают с 1 мл изопропанола, насыщенного KOH, и инкубируют при 80°С в течение 4 ч. Липиды из клеточного осадка экстрагируют и гидролизуют с использованием раствора изопропанола в гидроксиде калия, нагретом до 80°С в течение 4 ч. Экстрагированные образцы анализируют на аппарате для HPLC Anglient 1100 при помощи следующего способа. Образцы дериватизируют бромфенацилбромидом (60 мг/мл) и помещают на колонку 150×2 мм Luna 5u C8(2) (Phenomenex). Образцы элюируют с колонки, используя градиент воды к 100% ацетонитрил: тетрагидрофуран (95:5). Сигнал регистрируют при помощи матричного детектора DAD при длине волны 254 нм.
Образец "LO-1" содержит 8,6% липидов, а образец "080020-1" содержит 28% липидов.
Пример 21
Прямая переэтерификация микробной биомассы
Подготовка образцов: Сырой осадок биомассы с низким содержанием липидов и биомассы с высоким содержанием липидов, соответственно, получают, как описано выше, и лиофилизируют. Высушенную биомассу из образцов измельчают до крупного порошка и высушивают снова в течение ночи при температуре 55°С в условиях вакуума. При помощи анализатора влажности Mettler Toledo определяют процент влажности, который в обоих образцах составляет <3%.
Переэтерификапия: К высушенной биомассе (<3% влаги) в стеклянную колбу с завинчивающейся крышкой добавляют безводный метанол/ IN NaOH в соотношении 1:5 так, чтобы объем добавленного раствора в 4 раза превышал объем биомассы. В колбу помещают магнитную мешалку, после чего колбу тщательно герметизируют. Смесь интенсивно перемешивают при 55°С в течение 7 ч. Затем биомассу фильтруют через бумажный фильтр Ватмана и отмывают метанолом, пока фильтрат не станет чистым. Все промывные воды объединяют в одной колбе с оригинальным фильтратом и метанол отгоняют при помощи роторного вакуумного испарителя. Затем в колбу добавляют хлороформ (1 часть), хорошо перемешивают, после чего переливают в сортировочную воронку. Затем в колбу добавляют метанол (2 части), перемешивают и переливают в сортировочную воронку. Затем в колбу добавляют D1 воду (0,8 объема), перемешивают и переливают в сортировочную воронку. Содержимое сортировочной воронки интенсивно перемешивают (с вентиляцией) и оставляют отделяться. Нижний слой (хлороформ/масло) собирают в предварительно взвешенную колбу, а в первую колбу добавляют свежую порцию хлороформа для вторичной экстракции. Затем хлороформ отгоняют при помощи роторного вакуумного испарителя. Предварительное взвешивание колбы позволяет определить точный выход продукта. Содержание липидов повторно определяют при помощи HPLC, как описано выше. Аналитические измерения каротеноидов в составе переэтерифицированной композиции осуществляют также при помощи HPLC, как описано у Shmid et al., J of Applied Phycology 7:487-494 (1995). Элементный анализ осуществляют при помощи индуктивно связанной плазменной масс-спектрометрии.
Результаты: В Таблице 7 показаны результаты получения переэтерифицированного продукта из биомассы с низким (LO-1-8,6% липидов) и высоким (080020-1-28% липидов) содержанием липидов. Концентрация каротеноидов в липофильной фазе, содержащей метиловые эфиры жирных кислот, выражена в мкг/г.
Пример 22
Культивирование микроводорослей для получения высокого содержания липидов
Штаммы микроводорослей культивируют для получения высокого процентного содержания липидов по DCW. Криосохраненные клетки размораживают при комнатной температуре, 500 мкл клеток добавляют к 4,5 мл среды (4,2 г/л K2HPO4, 3,1 г/л NaH2PO4, 0,24 г/л MgSO4·7H2O, 0,25 г/л моногидрата лимонной кислоты, 0,025 г/л CaCl2·2H2O г/л, 2 г/л дрожжевого экстракта) и 2% глюкозе и выращивают в течение 7 дней при 28°C с перемешиванием (600 об/мин) на 6-луночном планшете. DCWs определяют путем центрифугирования 1 мл культуры при 14000×g в течение 5 минут в предварительно взвешенной пробирке Eppendorf. Супернатант культуры отбрасывают, а полученный клеточный осадок отмывают 1 мл деионизированной воды. Культуру повторно центрифугируют, супернатант отбрасывают, а клеточный осадок помешают в температуру - 80°С до полного замораживания. Затем образцы лиофилизируют в течение 24 ч и рассчитывают DCWs. Для определения общего содержания липидов в культурах забирают 3 мл культуры и подвергают анализу при помощи системы Ankom (Ankom Inc., Macedon, NY) согласно инструкции производителя. Образцы подвергают экстракции растворителем с использованием экстрактора Amkom XT10 согласно инструкции производителя. Общее содержание липидов определяют как разницу масс высушенных образцов после кислого гидролиза и высушенных образцов после экстракции растворителем. Результаты измерений, выраженные в процентах от DCW, представлены в Таблице 8.
Пример 23
Генотипирование микроводорослей с высоким содержанием липидов
Образцы микроводорослей из 23 штаммов, перечисленных в Таблице 8, подвергают генетическому типированию. Геномную ДНК выделяют из биомассы водорослей следующим образом. Клетки (приблизительно 200 мг) центрифугируют из жидкой культуры в течение 5 минут при скорости 14000×g. Затем клетки ресуспендируют в стерильной дистиллированной воде, центрифугируют 5 минут при скорости 14000×g, полученный супернатант исключают. Одну стеклянную бусину ~2 мм в диаметре добавляют к биомассе и пробирки помещают в температуру 80°С, по крайней мере, на 15 минут. Образцы вынимают и добавляют 150 мкл абразивного буфера (1% Саркозил, 0,5 моль сахарозы, 50 ммоль NaCl, 20 ммоль ЭДТА, 100 ммоль Tris-HCl, pH 8,0, РНКаза А 0,5 мкг/мкл). Осадок ресуспендируют путем быстрого встряхивания, после чего добавляют 40 мкл 5 М NaCl. Образцы снова быстро встряхивают, добавляют 66 мкл 5% СТАВ (цетил триметиламмоний бромид) и снова встряхивают. Затем образцы инкубируют при 65°С в течение 10 минут, после чего их центрифугируют при скорости 14000×g в течение 10 минут. Супернатант переносят в чистую пробирку и однократно экстрагируют 300 мкл раствора фенол:хлороформ:изоамиловый спирт 12:12:1, после чего снова центрифугируют при 14000×g в течение 5 минут. Полученную водную фазу переносят в чистую пробирку, на 0,7 объема заполненную изопропанолом (~190 мкл), смешивают, перевернув пробирку, и инкубируют при комнатной температуре в течение 30 минут или в течение ночи при 4°С. ДНК извлекают путем центрифугирования 14000×g в течение 10 минут. Полученный осадок дважды отмывают 70% этанолом и затем 100% этанолом. Осадок высушивают на воздухе в течение 20-30 минут при комнатной температуре, после чего ресуспендируют в 50 мкл 10 ммоль TrisCl, 1 ммоль ЭДТА (рН 8,0).
Пять мкл общей ДНК водорослей, полученной, как описано выше, разводят в соотношении 1:50 в 10 ммоль Tris, рН 8,0. Осуществляют реакции ПЦР, конечный объем 20 мкл, как описано ниже. Десять мкл смеси 2 x iProof HF master (BIO-RAD) добавляют к 0,4 мкл праймера SZ02613 (5'-TGTTGAAGAATGAGCCGGCGAC-3' (SEQ ID NO:1) при исходной концентрации 10 ммоль). Последовательность указанного праймера начинается с позиций 567-588 в Генном банке под кодом L43357 и является высококонсервативной для высших растений и пластидного генома водорослей. Затем добавляют добавляют 0,4 мкл праймера SZ02615 (5'-CAGTGAGCTATTACGCACTC-3' (SEQ ID NO:2) в исходной концентрации 10 мкл). Эта праймерная последовательность комплементарна позициям 1112-1093 в Генном банке под кодом L43357 и является высококонсервативной для высших растений и пластидных геномов водорослей. Затем добавляют 5 мко разведенной общей ДНК и 3,2 мкл дистиллированной H2O. Реакции ПЦР оуществляют следующим образом: 98°C, 45"; 98°C, 8"; 53°C, 12"; 72°С, 20" 35 циклов, затем при 72°С в течение 1 минуты и выдерживают при 25°С. Для очищения ПЦР продуктов 20 мкл 10 ммоль Tris, рН 8,0 добавляют к каждой реакции, после чего экстрагируют 40 мкл раствора фенол:хлороформ:изоамиловый спирт 12:12:1, встряхивают и центрифугируют при 14000×g в течение 5 минут. ПЦР смеси переносят на колонки S-400 (GE Healthcare) и центрифугируют в течение 2 минут при 3000×g. Очищенные ПЦР продукты последовательно клонируют в ТОРО-системе PRC8/GW/TOPO, и позитивные клоны отбирают на планшеты LB/Spec. Очищенную плазмидную ДНК секвенируют в обоих направлениях при помощи М13 форварда и обратных праймеров. Линейные последовательности и некорневые схемы, построенные при помощи программного обеспечения для анализа ДНК, Geneiuos DNA, показаны на Фиг.29a-29i. Последовательности из штаммов 1-23 (описанных в Примере 22, Таблица 8), представлены в списке последовательностей и обозначены SEQ ID NOs:7-29.
Пример 24
Многообразие липидных цепей у различных видов микроводорослей
Получают культуры различных видов микроводорослей, все эксперименты осуществляют на модифицированной протеазной среде, как описано выше в Примере 2. Из каждого штамма 10 мл культуры переносят в 50 мл колбы на следующие среды:
1. Протеазная питательная среда без добавления углерода;
2. Протеазная питательная среда с добавлением 1% глюкозы.
Каждый штамм выращивают при разных условиях, указанных выше, первичная плотность посева составляет 1,0×106 клеток/мл. Культуры хранят в темноте и перемешивают при 250 об/мин в течение 7 дней. Клетки собирают после 7-дневного периода выращивания и оценивают их способность к росту в темноте по сравнению с контролем путем измерения сухого веса клеток. DCWs определяют следующим образом: один мл культуры центрифугируют и полученный осадок промывают водой для удаления солей или остатков среды; затем промытый осадок замораживают при температуре ~ -80°С; и подвергают лиофилизации в течение ночи в системе Freeze Dry System (Labconco, МО, USA). Все виды микроводорослей, перечисленные ниже в Таблице 9, были выращены на глюкозе в качестве источника углерода, в темноте. В отсутствие глюкозы не выросла ни одна клетка (состояние 1). Глицеролипидный профиль определяли, как описано в Примере 20.
Липидный профиль образцов, полученных из набора штаммов, выращенных, как описано в Примере 22, и представленных в Таблице 8, также анализируют при помощи HPLC. Результаты показаны на Фиг.29.
Пример 25
СапониФикация биомассы с высоким содержанием липидов, полученной из Chlorella protothecoides
Биомассу с высоким содержанием липидов получают и анализируют при помощи способов, описанных в Примере 20. Биомасса включает 45% липидов, 20% углеводов, 10% белков, 10% других клеточных компонентов, 10% воды и 5% солей. Согласно одному варианту биомасса также может содержать высушенные целые клетки водорослей, включающие липидные капли, суспендированные в частично обезвоженной клеточной массе.
Получение жидкого клеточного мыла: Биомассу, описанную выше, диспергируют в воде с образованием концентрированной эмульсии типа "масло в клетке". Затем в водном растворе, содержащем биомассу, растворяют избыточное количество КОН, достаточное для превращения нужного количества глицеролипидов и эфиров жирных кислот в соли жирных кислот. Вода, потерянная во время выпаривания, замещается по мере необходимости во время реакционного процесса. В сапонифицированную композицию могут быть включены различные добавки, включая глицерин (для прозрачности и улучшения увлажняющих свойств), этилендиамин (ЭДТА, хелатирующий агент для улучшения качества жесткой воды), кокоамидопропил бетаин (амфотерный сурфактант, используемый для улучшения чистящих и моющих свойств) и ароматизатор для получения мыльного продукта. Согласно некоторым вариантам мыльный продукт представляет собой клеточное мыло, состоящее из компонентов, представленных ниже в Таблице 10.
Клеточные мыла, описанные в настоящем примере, обладают натуральными увлажняющими и смягчающими кожу свойствами, которые обусловлены присутствием углеводов и белков из клеток водорослей, а также антиоксидантыми свойствами благодаря наличию каротеноидов и других компонентов микроводорослей, которые включены в композицию.
Альтернативно органическое основание, такое как триэтаноламин, может использоваться в реакции щелочного гидролиза для получения более прозрачного продукта. Использование триэтаноламина или другого органического основания также позволяет получить более мягкий продукт, менее травмирующий кожу и вызывающий ее раздражение во время использования моющего средства.
При желании, соли жирных кислот могут быть преципитированы из смеси путем добавления таких солей, как NaCl или KCl и выделены для последующего использования в композициях в комбинации с различными добавками, как описано в тексте.
На Фиг.20 представлен микроснимок мыла, сделанного из биомассы Chlorella protothecoides с содержанием липидов 48% по DCW. Мыло содержит 10% по весу биомассы микроводорослей.
Пример 26
Сапонификация экстрагированного гексаном масла, выделенного из биомассы Chlorella protothecoides
Биомассу получают при помощи способа, описанного в Примере 20. Осуществляют традиционную экстракцию липидов из биомассы с использованием гексана. Липиды, экстрагированные гексаном, затем подвергают сапонификации путем смешивания с водным раствором NaOH или KOH, содержащим количество основания, достаточное для превращения нужного количества липидов в соли жирных кислот, при возможном нагревании для увеличения скорости реакции. Соли жирных кислот затем преципитируют путем добавления NaCl или KCl. Композиции сапонифицированных масел, полученных из экстрагированной гексаном биомассы, имеют высокое содержание каротеноидов, поскольку гексан экстрагирует соединения из микробной биомассы очень эффективно.
Пример 27
Сапонификапия масла, экстрагированного без использования растворителя, выделенного из биомассы Chlorella protothecoides
Биомассу получают при помощи способа, описанного в Примере 20. Экстракцию липидов из биомассы без использования растворителя осуществляют путем лизиса и прессования биомассы при помощи физического давления. Экстрагированные липиды сапонифицируют путем смешивания с водным раствором NaOH или КОН, содержащим количество основания, достаточное для превращения нужного количества липидов в соли жирных кислот, при возможном нагревании для увеличения скорости реакции. Соли жирных кислот затем преципитируют путем добавления NaCl или KCl. Композиции сапонифицированных масел, полученные из биомассы в результате экстракции без использования растворителя, содержат относительное небольшое количество каротеноидов по сравнению с композициями, полученными из биомассы в результате экстракции при помощи гексана, поскольку в первом случае используемый способ является менее эффективным.
Пример 28
Глицеролипидный профиль штаммов Prototheca
Пять разных штаммов Prototheca культивируют в среде с 2% глюкозой и выращивают в течение 7 дней при 28°C с перемешиванием (при 200 об/мин) на 6-луночном планшете. Липидный профиль определяют при помощи стандартной HPLC. Липидный профиль определенного штамма существенно не изменялся в зависимости от питательной среды. Результаты представлены ниже в Таблице 11.
Биомассу, полученную из штамма UTEX 1435, подвергают экстракции гексаном. Экстрагированное масло имеет очень слабую окраску. На Фиг.19 показан образец масла из UTEX 1435 в сравнении с маслом, полученным из штамма UTEX 250 Chlorella protothecoides.
Пример 29
Анализ содержания каротеноидов и хлорофилла в масле, экстрагированном из штамма UTEX 1435 Prototheca moriformis.
Экстрагированное гексаном масло, полученное из биомассы Prototheca moriformis (UTEX 1435), получают, как описано в Примере 26, после чего его анализируют на предмет содержания каротеноидов и хлорофилла при помощи HPLC. В целом содержание каротеноидов было существенно ниже, чем в маслах, описанных в Таблице 7. Кроме того, содержание хлорофилла в масле составило менее 0,01 мг/кг. Полученные результаты подтверждают результаты, показанные на Фиг.19, экстрагированное масло из биомассы UTEX 1435 имеет очень слабую окраску. Результаты анализа содержания каротеноидов и хлорофилла в масле, экстрагированном из UTEX 1435, представлены в Таблице 12 ниже.
Пример 30
Геномный ДНК анализ 23S рРНК из 8 штаммов Chlorella protothecoides
Геномную ДНК из 8 штаммов Chlorella protothecoides (UTEX 25, UTEX 249, UTEX 250, UTEX 256, UTEX 264, UTEX 411, ССАР 211/17 и ССАР 211/8d) изолируют и осуществляют геномный ДНК анализ 23S рРНК при помощи способов, описанных выше в Примере 23.
Все штаммы Chlorella protothecoides были идентичны по своим последовательностям, за исключением UTEX 25. Результаты обобщены на кладограмме, представленной на Фиг.21а-21с. Последовательности для всех восьми штаммов SEQ ID NOs:3-4 приведены в прилагаемом списке последовательностей.
Геномную последовательность 23 S рРНК для Prototheca moriformis UTEX 1436 (SEQ ID NO:5) также сравнивают с последовательностями других видов Prototheca и Chlorella protothecoides. Сравнение показало, что геномная последовательность238 рРНК Prototheca moriformis UTEX 1436 отличается от других генотипов Prototheca (SEQ ID NO:6).
Пример 31
Изучение способности утилизировать сорго
Штаммы: Для идентификации штаммов микроводорослей, которые способны утилизировать сорго в качестве единственного источника углерода, были отобраны следующие штаммы: 10 штаммов Chlorella protothecoides (UTEX 25, UTEX 31, UTEX 411, ССАР 221/8D, UTEX 249, UTEX 250, UTEX 256, SAG 211-10D и ССАР 211/17), 6 штаммов Prototheca moriformis (UTEX 1435, UTEX 1437, UTEX 288, UTEX 1439 и SAG 2214), Chlorella kessleri (UTEX 2229), Parachlorella kessleri (SAG 12,80) и Prototheca stagnora (UTEX 1442).
Условия культивирования: Посевные культуры штаммов микроводорослей (идентифицированных выше) в объеме 1 мл инокулируют на 24-луночные планшеты и выращивают автотрофно в течение 48 ч при освещении, с перемешиванием ~ при 350 об/мин. Чистое сорго получают в Maasdam Sorghum Mills (Lynnville, Iowa), углеводный профиль: фруктоза 21,0 вес.%, декстроза 28,0 вес.%, сахароза 16,0 вес.% и мальтоза <0,5 вес.%. Затем культуры переносят в жидкую среду, содержащую 2%, 5% или 7% (об/об) чистого сорго (разведенного чистого источника) в качестве единственного источника углерода, и выращивают гетеротрофно в темноте при перемешивании ~ при 350 об/мин. Образцы культур забирают через 24, 40, 48, 67 и 89 ч и измеряют степень роста на спектрофотометре с использованием считывания А750. Был выявлен рост каждого из тестируемых штаммов, как показано на Фиг.22-27.
Реферат
Группа изобретений относится к микробиологии. Способ химической модификации липидов микроводорослей включает культивирование микроводорослей рода Prototheca с получением биомассы, содержащей по меньшей мере 10 % липидов микроводорослей в расчете на сухой вес клеток и не более 500 мкг/г красящих включений и осуществление химической реакции, в результате которой происходит ковалентная модификация липидов. Культивирование осуществляют при гетеротрофных условиях до тех пор, пока клетки не войдут в фазу накопления липидов. Химическую реакцию выбирают из омыления, переэтерификации, интерэтерификации, гидроксилирования, циклопропанирования, эпоксидирования, гидропроцессинга, дезоксигенации, изомеризации, гидрогенизации или гидролиза. Также предложен способ получения мыла, предусматривающий использование биомассы микроводорослей рода Prototheca, содержащей по меньшей мере 5 % липидов микроводорослей в расчете на сухой вес клеток и не более 500 мкг/г красящих включений, и осуществление омыления липидов микроводорослей. Также предложено мыло, включающее соли жирных кислот. Группа изобретений обеспечивает получение биомассы микроводорослей с высоким содержанием липидов. 3 н. и 14 з.п. ф-лы, 39 ил., 12 табл., 31 пр.
Формула
(а) культивирование популяции микроводорослей рода Prototheca при гетеротрофных условиях до тех пор, пока клетки не войдут в фазу накопления липидов с получением биомассы, содержащей по меньшей мере 10 % липидов микроводорослей в расчете на сухой вес клеток и не более 500 мкг/г красящих включений; и
(b) осуществление химической реакции, в результате которой происходит ковалентная модификация липидов, причем химическая реакция включает омыление, переэтерификацию, интерэтерификацию, гидроксилирование, циклопропанирование, эпоксидирование, гидропроцессинг, дезоксигенацию, изомеризацию, гидрогенизацию или гидролиз.

Комментарии