Моющая композиция, содержащая вариант ксилоглюканазы семейства 44 - RU2525669C2
Код документа: RU2525669C2
Чертежи











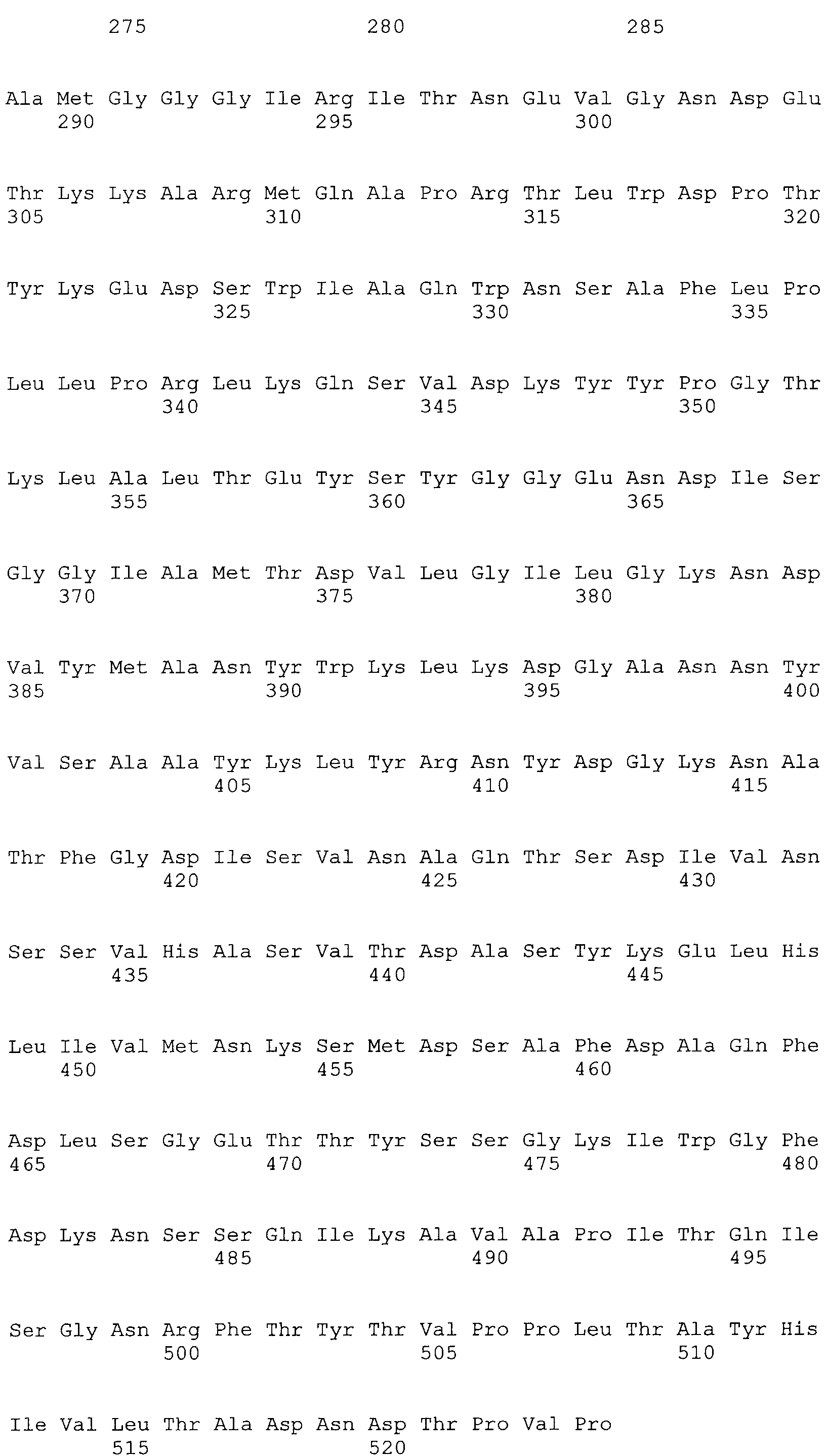


Описание
ОБЛАСТЬ ТЕХНИКИ
Настоящее изобретение относится к моющей композиции, содержащей вариант ксилоглюканазы, принадлежащей к семейству 44 гликозилгидролаз.
ИЗВЕСТНЫЙ УРОВЕНЬ ТЕХНИКИ
Ксилоглюкан является основным структурным полисахаридом в первичной (растущей) клеточной стенке растений. Структурно, ксилоглюканы состоят из целлюлозаподобной бета-1,4-связанной глюкозной основной цепи, которая часто замещена различными боковыми цепями. Считается, что функцией ксилоглюкана в первичной стенке растений является сшивание целлюлозных микрофибрил с образованием целлюлозно-ксилоглюкановой сетки.
Ксилоглюканазы способны катализировать солюбилизацию ксилоглюкана до ксилоглюкановых олигосахаридов. Некоторые ксилоглюканазы проявляют только ксилоглюканазную активность, тогда как другие обладают как ксилоглюканазной, так и целлюлазной активностью. Ксилоглюканазы могут быть классифицированы как ЕС 3.2.1.4 или ЕС 3.2.1.151. Ферменты с ксилоглюканазной активностью описаны, например, в Vincken et al. (1997) Carbohydrate Research 298(4): 299-310, где охарактеризованы три разные эндоглюканазы Endol, EndoV и EndoVI, выделенные из Trichoderma viride (близкий к Т.reesei). Endol, EndoV и EndoVI принадлежат к семействам 5, 7 и 12 гликозилгидролаз, соответственно, см. Henrissat, В., et al. (1991, 1993). WO 94/14953 раскрывает ксилоглюканазу семейства 12 (EG II), клонированную из гриба Aspergillus aculeatus. WO 99/02663 раскрывает ксилоглюканазы семейства 12 и семейства 5, клонированные из Bacillus licheniformis и Bacillus agaradhaerens, соответственно. WO 01/062903 раскрывает ксилоглюканазы семейства 44.
В частности, WO 99/02663 и WO 01/062903 высказывают предположение о том, что ксилоглюканазы могут быть использованы в моющих средствах.
Целью настоящего изобретения является обеспечение композиции моющего средства, содержащей вариант ксилоглюканазы, принадлежащий к семейству 44 гликозилгидролаз, с улучшенными свойствами по сравнению с ее исходным ферментом.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к моющей композиции, содержащей изолированные варианты исходной ксилоглюканазы, содержащие изменения в одном или больше (нескольких) положениях, выбранных из группы, состоящей из номеров позиций 68, 123, 156, 118, 200, 129, 137, 193, 92, 83, 149, 34, 340, 332, 9, 76, 331, 310, 324, 498, 395, 366, 1, 374, 7, 140, 8, 14, 21, 211, 37, 45, 13, 78, 87, 436, 101, 104, 111, 306, 117, 119, 414, 139, 268, 142, 159, 164, 102, 168, 176, 180, 482, 183, 202, 206, 217, 4, 222, 19, 224, 228, 232, 2, 240, 244, 5, 247, 249, 328, 252, 259, 406, 267, 269, 275, 179, 166, 278, 281, 288, 298, 301, 18, 302, 165, 80, 303, 316, 169, 322, 120, 146, 342, 348, 147, 353, 380, 468, 382, 383, 38, 384, 389, 391, 10, 392, 396, 177, 397, 399, 409, 237, 413, 253, 415, 418, 40, 443, 445, 148, 449, 225, 450, 454, 3, 455, 456, 299, 461, 470, 204, 476, 488, 347 и 507, где позиции соответствуют положению в аминокислотной последовательности SEQ ID NO:3 и где изменение (изменения) независимо представляют собой:
i) инсерцию аминокислоты справа от аминокислоты, занимающей данную позицию,
ii) делецию аминокислоты, занимающей данную позицию, или
iii) замещение аминокислоты, занимающей данную позицию, на другую аминокислоту; и
исходная ксилоглюканаза является ксилоглюканазой семейства 44; и вариант обладает ксилоглюканазной активностью.
ДЕТАЛЬНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к моющей композиции, содержащей вариант исходных ксилоглюканаз семейства 44, содержащий изменение, предпочтительно, в форме замещения, и/или инсерции, и/или делеции в одной или больше (нескольких) позициях, где нумерация позиций соответствует нумерации позиций в SEQ ID NO:3. Варианты настоящего изобретения обладают ксилоглюканазной активностью и, потенциально, также целлюлолитической активностью. Варианты настоящего изобретения имеют улучшенные свойства по сравнению с исходной ксилоглюканазой. В одном аспекте, варианты имеют повышенную стабильность в жидких моющих средствах, особенно, жидких композициях моющих средств для стирки.
Определения
Ксилоглюканазная активность: термин "ксилоглюканазная активность" определяется тут как катализированный ферментом гидролиз ксилоглюкана. Реакция включает эндогидролиз 1,4-бета-D-глюкозидных связей в ксилоглюкане. В целях настоящего изобретения, ксилоглюканазную активность определяют с использованием AZCL-ксилоглюкана (фирмы Megazyme) в качестве субстрата реакции. Анализ может проводиться несколькими способами, например, как описано в Примере 2 данной заявки или как описано в WO 01/62903. Единица ксилоглюканазной активности (XyloU) определяется в соответствии с методом анализа, описанным в WO 01/62903, страница 60, строки 3-17.
Целлюлазная активность: термин "целлюлазная активность" определяется тут как катализированный ферментом гидролиз 1,4-бета-D-глюкозидных связей в бета-1,4-глюкане (целлюлозе). В целях настоящего изобретения целлюлазную активность определяют с использованием AZCL-HE-целлюлозы (фирмы Megazyme) в качестве субстрата реакции.
Вариант: термин "вариант" определяется тут как полипептид, обладающий ксилоглюканазной активностью, содержащий изменение, такое как замещение, инсерция и/или делеция, одного или больше (нескольких) аминокислотных остатков в одной или больше (нескольких) конкретных позициях, соответствующих аминокислотным позициям в SEQ ID NO:3. Варианты по изобретению могут также обладать целлюлазной активностью. Измененный полипептид (вариант) получают с вмешательством человека путем модификации полинуклеотидной последовательности, кодирующей исходный фермент. Исходный фермент может кодироваться SEQ ID NO:1, SEQ ID NO:4 или SEQ ID NO:6, или последовательностью, по меньшей мере на 75% идентичной с одной из этих последовательностей. Вариант полипептидной последовательности, предпочтительно, не встречается в природе.
Фермент дикого типа: термин ксилоглюканаза "дикого типа" обозначает ксилоглюканазу, экспрессируемую природным микроорганизмом, таким как бактерии, дрожжи или нитчатый гриб, встречающийся в природе. Термин "дикого типа" может быть использован взаимозаменяемо с термином "встречающийся в природе".
Исходный фермент: термин "исходная" ксилоглюканаза или "родительская" ксилоглюканаза, в используемом тут значении, обозначает ксилоглюканазу, с которой производится модификация, например замещение (замещения), инсерция (инсерции), делеция (делеции) и/или укорачивание (укорачивания), для получения вариантов фермента по настоящему изобретению. Этот термин также относится к полипептиду, с которым осуществляется сравнение и выравнивание варианта. Исходная форма может быть встречающимся в природе (дикого типа) полипептидом, таким как фермент с SEQ ID NO:2, или SEQ ID NO:3, или SEQ ID NO:5, или SEQ ID NO:7. Исходный полипептид, однако, также может быть вариантом встречающегося в природе полипептида, подвергнутого модифицированию или изменению аминокислотной последовательности. Исходная форма также может быть аллельным вариантом, который представляет собой полипептид, кодируемый любой из двух или больше альтернативных форм гена, занимающих один и тот же хромосомный локус.
Изолированный вариант или полипептид: термин "изолированный вариант" или "изолированный полипептид", в используемом тут значении, относится к варианту или полипептиду, выделенному из источника, например клетки-хозяина, которая его экспрессирует, или ферментного комплекса, в котором он нормально присутствует. Предпочтительно, полипептид является чистым по меньшей мере на 40%, более предпочтительно, чистым по меньшей мере на 60%, еще более предпочтительно, чистым по меньшей мере на 80%, наиболее предпочтительно, чистым по меньшей мере на 90%, и еще более предпочтительно, чистым по меньшей мере на 95%, при определении методом SDS-PAGE.
По существу чистый вариант или полипептид: термин "по существу чистый вариант" или "по существу чистый полипептид" обозначает тут препарат полипептида, содержащий не более 10%, предпочтительно, не более 8%, более предпочтительно, не более 6%, более предпочтительно, не более 5%, более предпочтительно, не более 4%, более предпочтительно, не более 3%, еще более предпочтительно, не более 2%, наиболее предпочтительно, не более 1%, и еще более предпочтительно, не более 0,5% мас. другого полипептидного материала, с которым он нативно или рекомбинантно ассоциирован. Таким образом, предпочтительно, чтобы по существу чистый вариант или полипептид был чистым на по меньшей мере 92%, предпочтительно, чистым на по меньшей мере 94%, более предпочтительно, чистым на по меньшей мере 95%, более предпочтительно, чистым на по меньшей мере 96%, более предпочтительно, чистым на по меньшей мере 96%, более предпочтительно, чистым на по меньшей мере 97%, более предпочтительно, чистым на по меньшей мере 98%, еще более предпочтительно, чистым на по меньшей мере 99%, наиболее предпочтительно, чистым на по меньшей мере 99,5%, и еще более предпочтительно, чистым на 100% мас. от общего количества полипептидного материала, присутствующего в препарате. Варианты и полипептиды по настоящему изобретению, предпочтительно, находятся в по существу чистой форме. Это может быть достигнуто, например, путем получения варианта или полипептида хорошо известными рекомбинантными способами или классическими методами очистки.
Зрелый полипептид: термин "зрелый полипептид" определяется тут как полипептид, обладающий ксилоглюканазной активностью, находящийся в своей конечной форме после трансляции и любых посттрансляционных модификаций, таких как N-терминальный процессинг, С-терминальное укорачивание, гликозилирование, фосфорилирование и т.д. Для полипептида, описываемого SEQ ID NO:2, зрелая ксилоглюканазная последовательность может теоретически начинаться с положения 28 SEQ ID NO:2. Зрелая последовательность заканчивается положением 551 SEQ ID NO:2. Теоретическая зрелая ксилоглюканазная последовательность приведена в SEQ ID NO:3.
Последовательность, кодирующая зрелый полипептид: термин "последовательность, кодирующая зрелый полипептид" определяется тут как нуклеотидная последовательность, которая кодирует зрелый полипептид, обладающий ксилоглюканазной активностью. В одном аспекте, последовательность, кодирующая зрелый полипептид, представляет собой нуклеотиды 82-1653 SEQ ID NO:1.
Идентичность: степень сродства двух аминокислотных последовательностей или двух нуклеотидных последовательностей описывается параметром "идентичность".
В целях настоящего изобретения степень идентичности двух аминокислотных последовательностей определяют с использованием алгоритма Нидлмана-Вунша (Needleman and Wunsch, 1970, J. Mol. Biol. 48:443-453), реализованного в программе Needle пакета EMBOSS (EMBOSS: The European Molecular Biology Open Software Suite, Rice et ah, 2000, Trends in Genetics 16: 276-277; http://emboss.org). предпочтительно, версии 3.0.0 или более поздней. Используемыми необязательными параметрами являются штраф за открытие пробела, равный 10, штраф за продолжение пробела, равный 0,5, и матрица замещения EBLOSUM62 (версия BLOSUM62 для EMBOSS). Результат вычислений Needle, называемый "наиболее протяженная идентичность" (longest identity) (получаемый с использованием опции - nobrief), используется в качестве процента идентичности и рассчитывается следующим образом:
(Идентичные остатки × 100) / (Длина выравнивания - Общее число пробелов в выравнивании).
В целях настоящего изобретения., степень идентичности между двумя дезоксирибонуклеотидными последовательностями определяют с использованием алгоритма Нидлмана-Вунша (Needleman and Wunsch, 1970, supra), реализованного в программе Needle пакета EMBOSS (EMBOSS: The European Molecular Biology Open Software Suite, Rice et al., 2000, supra; http://emboss.org). предпочтительно, версии 3.0.0 или более поздней. Используемыми необязательными параметрами являются штраф за открытие пробела, равный 10, штраф за продолжение пробела, равный 0,5, и матрица замещения EDNAFULL (версия NCBI NUC4.4 для EMBOSS). Результат вычислений Needle, называемый "наиболее протяженная идентичность" (longest identity) (получаемый с использованием опции - nobrief), используется в качестве процента идентичности и рассчитывается следующим образом:
(Идентичные дезоксирибонуклеотиды × 100) / (Длина выравнивания - Общее число пробелов в выравнивании).
Функциональный фрагмент: термин "функциональный фрагмент полипептида" используется для описания полипептида, который получен из более длинного полипептида, например зрелого полипептида, и который был укорочен в N-терминальной области или в С-терминальной области или в обоих областях с образованием фрагмента исходного полипептида. Для того, чтобы представлять собой функциональный полипептид, фрагмент должен сохранять по меньшей мере 20%, предпочтительно, по меньшей мере 40%, более предпочтительно, по меньшей мере 50%, более предпочтительно, по меньшей мере 60%, более предпочтительно, по меньшей мере 70%, более предпочтительно, по меньшей мере 80%, еще более предпочтительно, по меньшей мере 90%, наиболее предпочтительно, по меньшей мере 95% и еще более предпочтительно, по меньшей мере 100% ксилоглюканазной активности непроцессированного/зрелого полипептида.
Аллельный вариант: термин "аллельный вариант" обозначает тут любую из двух или больше альтернативнх форм гена, занимающих один и тот же хромосомный локус. Аллельные варианты возникают в природных условиях в результате мутаций и могут приводить к полиморфизму в популяциях. Генные мутации могут быть молчащими (отсутствие изменений в кодированном полипептиде) или могут кодировать полипептиды, имеющие измененные аминокислотные последовательности. Аллельный вариант полипептида представляет собой полипептид, кодированный аллельным вариантом гена.
Изолированный полинуклеотид: термин "изолированный полинуклеотид", в используемом тут значении, относится к полинуклеотиду, который был выделен из источника. В одном аспекте, изолированный полинуклеотид является по меньшей мере на 40% чистым, более предпочтительно, по меньшей мере на 60% чистым, еще более предпочтительно, по меньшей мере на 80% чистым, наиболее предпочтительно, по меньшей мере на 90% чистым и еще более предпочтительно, по меньшей мере на 95% чистым при определении методом электрофореза на агарозе.
По существу чистый полинуклеотид: термин "по существу чистый полинуклеотид", в используемом тут значении, относится к препарату полинуклеотида, не содержащему других посторонних или нежелательных нуклеотидов и находящемуся в форме, пригодной для использования в системах продуцирования модифицированного методами генной инженерии полипептида. Таким образом, по существу чистый полинуклеотид содержит не более 10%, предпочтительно, не более 8%, более предпочтительно, не более 6%, более предпочтительно, не более 5%, более предпочтительно, не более 4%, более предпочтительно, не более 3%, еще более предпочтительно, не более 2%, наиболее предпочтительно, не более 1% и еще более предпочтительно, не более 0,5% мас. другого полинуклеотидного материала, с которым он нативно или рекомбинантно ассоциирован. По существу чистый полинуклеотид может, однако, включать встречающиеся в природе 5'- и 3'-нетранслируемые области, такие как промоторы и терминаторы. Предпочтительно, чтобы по существу чистый полинуклеотид был по меньшей мере на 90% чистым, предпочтительно, по меньшей мере на 92% чистым, более предпочтительно, по меньшей мере на 94% чистым, более предпочтительно, по меньшей мере на 95% чистым, более предпочтительно, по меньшей мере на 96% чистым, более предпочтительно, по меньшей мере на 97% чистым, еще более предпочтительно, по меньшей мере на 98% чистым, наиболее предпочтительно, по меньшей мере на 99% и еще более предпочтительно, по меньшей мере на 99,5% мас. чистым. Полинуклеотиды по настоящему изобретению находятся, предпочтительно, в по существу чистой форме, т.е. препарат полинуклеотида по существу не содержит другого полинуклеотидного материала, с которым он нативно или рекомбинантно ассоциирован. Полинуклеотиды могут быть геномного, кДНК, РНК, полусинтетического, синтетического происхождения или любой их комбинацией.
Кодирующая последовательность: при использовании в данном описании термин "кодирующая последовательность" означает полинуклеотид, который непосредственно определяет аминокислотную последовательность его полипептидного продукта. Границы кодирующей последовательности обычно определяются открытой рамкой считывания, которая обычно начинается с инициирующего кодона ATG или альтернативных инициирующих кодонов, таких как GTG и TTG, и заканчивается терминирующим кодоном, таким как ТАА, TAG и TGA. Кодирующая последовательность может быть ДНК, кДНК, синтетическим или рекомбинантным полинуклеотидом.
Функционально связанный: термин "функционально связанный" обозначает тут конфигурацию, в которой контрольная последовательность размещена в соответствующем положении по отношению к кодирующей последовательности полинуклеотидной последовательности таким образом, чтобы контрольная последовательность направляла экспрессию кодирующей последовательности полипептида.
Клетка-хозяин: термин "клетка-хозяин", в используемом тут значении, включает любой тип клеток, восприимчивый к трансформации, трансфекции, трансдукции и т.п. конструктом нуклеиновой кислоты или вектором, содержащим полинуклеотид по настоящему изобретению. Термин "клетка-хозяин" охватывает любое потомство родительской клетки, не идентичное родительской клетке вследствие мутаций, происходящих при репликации.
Повышенная химическая стабильность: термин "повышенная химическая стабильность" определяется тут как вариант фермента, обладающий способностью к сохранению ферментативной активности после периода инкубации в присутствии химиката или химикатов, будь то встречающихся в природе или синтетических, которые снижают ферментативную активность исходного фермента. Повышенная химическая стабильность может также приводить к вариантам, способным лучше катализировать реакцию в присутствии таких химикатов. В определенном аспекте изобретения повышенная химическая стабильность является повышенной стабильностью в моющем средстве, в частности в жидком моющем средстве. Повышенная стабильность моющего средства обозначает, в частности, повышенную стабильность ксилоглюканазной активности при введении варианта ксилоглюканазы по настоящему изобретению в рецептуру жидкого моющего средства и последующем его хранении при температуре в интервале от 15 до 50°С.
В настоящем изобретении жидкие моющие средства являются особенно пригодными для использования в качестве жидких моющих средств для стирки.
Принятые правила обозначения вариантов
В целях настоящего изобретения аминокислотная последовательность ксилоглюканазы, раскрытая в SEQ ID NO:3, используется для определения соответствующего аминокислотного остатка в другой ксилоглюканазе. Аминокислотная последовательность другой ксилоглюканазы сравнивается путем выравнивания с аминокислотной последовательностью ксилоглюканазы, раскрытой в SEQ ID NO:3, и на основании выравнивания может быть определен номер позиции аминокислоты, соответствующий любому аминокислотному остатку в аминокислотной последовательности ксилоглюканазы, раскрытой в SEQ ID NO:3.
Выравнивание полипептидных последовательностей может быть проведено, например, с использованием "ClustalW" (Thompson, J.D., Higgins, D.G. and Gibson, T.J., 1994, CLUSTAL W: Improving the sensitivity of progressive multiple sequence alignment through sequence weighting, positions-specific gap penalties and weight matrix choice, Nucleic Acids Research 22:4673-4680). Выравнивание ДНК-последовательностей может быть проведено с использованием полипептидного выравнивания в качестве матрицы путем замены аминокислот на соответствующий кодон ДНК-последовательности.
При описании различных вариантов ксилоглюканаз по настоящему изобретению для простоты используется описанная ниже номенклатура. Во всех случаях используются принятые IUPAC однобуквенные или трехбуквенные сокращенные обозначения аминокислот.
Замещения. Для аминокислотных замещений используется следующая номенклатура: исходная аминокислота/положение/замещенная аминокислота. Соответственно, замещение треонина на аланин в положении 226 обозначается как "Thr226Ala" или "Т226А". Множественные мутации разделяются знаками сложения ("+"), например "G205R+S411F" обозначает мутации в положениях 205 и 411 с замещениями глицина (G) на аргинин (R) и серина (S) на фенилаланин (F), соответственно. В тех случаях, когда исходная аминокислота может быть замещена на аминокислоту, выбранную из группы, это обозначается как "K129R,S,A,I,F,Q", указывая на замещение лизина (К) в положении 129 на аминокислоту, выбранную из группы, состоящей из: аргинина (R), серина (S), аланина (А), изолейцина (I), фенилаланина (F) и глутамина (Q). Альтернативно, "K129R,S,A,I,F,Q" может быть записано как K129R, или K129S, или K129A, или K129I, или K129P, или K129Q.
Делеции. Для делеций аминокислот используется следующая номенклатура: исходная аминокислота/положение/символ звездочки (*). Соответственно, делеция глицина в положении 195 обозначается как "Gly195*" или "G195*". Множественные делеций разделены знаками сложения ("+"), например, "G195*+S411*".
Инсерции. Для инсерций аминокислот используется следующая номенклатура: Символ звездочки (*)/положение/строчная буква/вставленная аминокислота, где строчная буква указывает добавление аминокислоты справа от (после) указанного номера позиции. Соответственно, инсерция глутаминовой кислоты (Е) справа от положения 10 обозначается "*10аЕ". Если вторая аминокислота, например валин (V), должна быть вставлена справа от положения 10 после глутаминовой кислоты (Е), она обозначается "*10аЕ+*10bV". Добавления к N-концу полипептида обозначаются как 0 (нуль). Добавление глутаминовой кислоты (Е) и валина (V) к N-концевой аминокислоте полипептида обозначается как *0аЕ+*0bV.
Исходные ксилоглюканазы
В настоящем изобретении исходная ксилоглюканаза является или (а) ксилоглюканазой, принадлежащей к семейству 44 гликозилгидролаз, также называемых ксилоглюканазами семейства 44; или (b) полипептидом, выбранным из группы, состоящей из SEQ ID NO:3, SEQ ID NO:5 и SEQ ID NO:7; или (с) полипептидом, содержащим аминокислотную последовательность, имеющую по меньшей мере 75% идентичности со зрелым полипептидом SEQ ID NO:3; или (d) полипептидом, кодируемым полинуклеотидом, который гибридизуется в условиях по меньшей мере средней жесткости с (i) последовательностью, кодирующей зрелый полипептид SEQ ID NO:1, или SEQ ID NO:4, или SEQ ID NO:6, (ii) последовательностью геномной ДНК, содержащей последовательность, кодирующую зрелый полипептид SEQ ID NO:1, или SEQ ID NO:4, или SEQ ID NO:6 или (iii) непроцессированной комплементарной цепью (i) или (ii); или (е) полипептидом, кодируемым полинуклеотидом, содержащим нуклеотидную последовательность, имеющую по меньшей мере 70% идентичности с последовательностью, кодирующей зрелый полипептид SEQ ID NO:1.
В первом аспекте исходная ксилоглюканаза содержит аминокислотную последовательность, имеющую степень идентичности со зрелым полипептидом SEQ ID NO:3, равную, предпочтительно, по меньшей мере 70%, более предпочтительно, по меньшей мере 75%, более предпочтительно, по меньшей мере 80%, более предпочтительно, по меньшей мере 85%, более предпочтительно, по меньшей мере 90%, более предпочтительно, по меньшей мере 95%, более предпочтительно, по меньшей мере 96%, еще более предпочтительно, по меньшей мере 97%, наиболее предпочтительно, по меньшей мере 98%, или еще более предпочтительно, по меньшей мере 99%, обладающим ксилоглюканазной активностью (тут и далее "гомологичные полипептиды"). В одном аспекте гомологичные полипептиды имеют аминокислотную последовательность, которая отличается на десять аминокислот, предпочтительно, на девять, более предпочтительно, на восемь, более предпочтительно, на семь, более предпочтительно, на шесть, более предпочтительно, на пять аминокислот, более предпочтительно, на четыре аминокислоты, еще более предпочтительно, на три аминокислоты, наиболее предпочтительно, на две аминокислоты и еще более предпочтительно, на одну аминокислоту от зрелого полипептида SEQ ID NO:3.
По существу гомологичные исходные ксилоглюканазы могут иметь одно или больше (несколько) аминокислотных изменений, таких как замещения, делеции и/или инсерции. Эти изменения, предпочтительно, являются незначительными по природе, т.е. консервативными аминокислотными замещениями и другими замещениями, которые существенно не влияют на трехмерную укладку или активность белка или полипептида; маленькими делениями, типично, от одной до примерно 9 аминокислот, предпочтительно, от одной до примерно 15 аминокислот и, наиболее предпочтительно, от одной до примерно 30 аминокислот; и маленькими амино- или карбокситерминальными выступами, такими как аминотерминальный остаток метионина, маленький линкерный пептид, состоящий из от примерно пяти до десяти остатков, предпочтительно, от 10 до 15 остатков и, наиболее предпочтительно, от 20 до 25 остатков, или маленьким выступающим концом, который облегчает очистку (аффинная метка), таким как полигистидиновый тракт, или белок A (Nilsson et al., 1985, EMBO J. 4:1075; Nilsson et al., 1991, Methods Enzymol. 198: 3. См. также, в общем, Ford et al., 1991, Protein Expression and Purification 2:95-107).
Хотя описанные выше изменения, предпочтительно, являются незначительными по природе, такие изменения также могут иметь существенный характер, такой как слияние более крупных полипептидов размером до 300 аминокислот или больше, в виде как амино-, так и карбокситерминальных выступов.
Примеры консервативных замещений принадлежат к группам основных аминокислот (аргинин, лизин и гистидин), кислотных аминокислот (глутаминовая кислота и аспарагиновая кислота), полярных аминокислот (глутамин и аспарагин), гидрофобных аминокислот (лейцин, изолейцин и валин), ароматических аминокислот (фенилаланин, триптофан и тирозин) и малых аминокислот (глицин, аланин, серин, треонин и метионин). Аминокислотные замещения, которые в общем не изменяют специфическую активность, известны специалистам и описаны, например, в: Neurath and Hill, 1979, The Proteins, Academic Press, New York. Наиболее часто встречающимися заменами являются Ala/Ser, Val/Ile, Asp/Glu, Thr/Ser, Ala/Gly, Ala/Thr, Ser/Asn, Ala/Val, Ser/Gly, Tyr/Phe, Ala/Pro, Lys/Arg, Asp/Asn, Leu/Ile, Leu/Val, Ala/Glu и Asp/Gly.
Незаменимые аминокислоты в полипептидах ксилоглюканазы по настоящему изобретению могут быть идентифицированы в соответствии с процедурами, известными специалистам, такими как направленный мутагенез или аланин-сканирующий мутагенез (Cunningham and Wells, Science 244:1081-1085, 1989). В последней методике одиночные аланиновые мутации вводят в каждый остаток молекулы и полученные мутантные молекулы тестируют на биологическую активность (т.е. ксилоглюканазную активность) для идентификации аминокислотных остатков, критических для активности молекулы. См. также Hilton et al., J. Biol. Chem. 271:4699-4708, 1996. Активный сайт фермента или другие биологические взаимодействия также могут быть определены путем физического анализа структуры с использованием таких методик, как ядерный магнитный резонанс, кристаллография, электронная дифракция или фотоаффинное мечение, в сочетании с мутацией предполагаемого контактного сайта аминокислоты. См., например, de Vos et al., Science 255:306-312, 1992; Smith et al., J. Mol. Biol. 224:899-904, 1992; Wlodaver et al., FEBS Lett. 309:59-64, 1992. Точное определение незаменимых аминокислот также может быть проведено на основании анализа гомологии с полипептидами, родственными с полипептидом по изобретению. Кристаллическая структура фермента, принадлежащего к семейству 44 гликозилгидролаз, была опубликована Kitago et. al, J. Biol. Chem. Vol. 282:35703-35711, 2007. На основании этой структуры можно сгенерировать трехмерную структуру исходной ксилоглюканазы (SEQ ID NO:3) in silico (методами компьютерного моделирования). На основании сравнения с опубликованной структурой следующие остатки в SEQ ID NO:3 были идентифицированы как критические для ферментативной функции: Е187 (каталитическая кислота/основание), Е358 (каталитическая - нуклеофильная), Е56 (карбоксилатная группа, координирующая Ca2+) и D154 (карбоксилатная группа, координирующая Са2+). Поэтому эти положения в исходном ферменте, предпочтительно, не должны мутировать.
Исходная ксилоглюканаза, предпочтительно, содержит аминокислотную последовательность SEQ ID NO:3 или ее аллельный вариант; или ее фрагмент, обладающий ксилоглюканазной активностью. В одном аспекте исходная ксилоглюканаза содержит аминокислотную последовательность SEQ ID NO:2. В другом аспекте исходная ксилоглюканаза содержит зрелый полипептид SEQ ID NO:2. В другом аспекте исходная ксилоглюканаза состоит из аминокислотной последовательности SEQ ID NO:3 или ее аллельного варианта; или ее фрагмента, обладающего ксилоглюканазной активностью. В другом аспекте исходная ксилоглюканаза содержит аминокислотную последовательность SEQ ID NO:5, или ее аллельный вариант; или ее фрагмент, обладающий ксилоглюканазной активностью. В другом аспекте исходная ксилоглюканаза содержит аминокислотную последовательность SEQ ID NO:7, или ее аллельный вариант; или ее фрагмент, обладающий ксилоглюканазной активностью.
Фрагмент зрелого полипептида SEQ ID NO:3 представляет собой полипептид, имеющий делеции одной или больше (нескольких) аминокислот из амино- и/или карбоксильного конца этой аминокислотной последовательности, но все еще сохраняющий ксилоглюканазную активность.
Во втором аспекте исходные ксилоглюканазы кодируются полинуклеотидами, которые гибридизуются в условиях очень низкой жесткости, предпочтительно, в условиях низкой жесткости, более предпочтительно, в условиях средней жесткости, более предпочтительно, в условиях средневысокой жесткости, еще более предпочтительно, в условиях высокой жесткости, и наиболее предпочтительно, в условиях очень высокой жесткости, с (i) последовательностью, кодирующей зрелый полипептид SEQ ID NO:1, или SEQ ID NO:4, или SEQ ID NO:6, (ii) последовательностью геномной ДНК, содержащей последовательность, кодирующую зрелый полипептид SEQ ID NO:1, или SEQ ID NO:4, или SEQ ID NO:6, (iii) субпоследовательностью (i) или (ii), или (iv) непроцессированной комплементарной нитью (i), (ii) или (iii) (J. Sambrook, E.F. Fritsch and T. Maniatis, 1989, Molecular Cloning, A Laboratory Manual, 2d edition, Cold Spring Harbor, New York). Субпоследовательность может кодировать полипептидный фрагмент, обладающий ксилоглюканазной активностью. В одном аспекте, комплементарная нить представляет собой непроцессированную комплементарную нить последовательности, кодирующей зрелый полипептид SEQ ID NO:1, или SEQ ID NO:4, или SEQ ID NO:6.
Субпоследовательность кодирующей последовательности зрелого полипептида SEQ ID NO:1, или SEQ ID NO:4, или SEQ ID NO:6, или ее гомолог, представляет собой нуклеотидную последовательность с делениями одного или больше (нескольких) нуклеотидов из 5'- и/или 3'-конца, где полипептид кодируется субпоследовательностью, обладающей ксилоглюканазной активностью.
Исходные ферменты также могут быть аллельными вариантами полипептидов, обладающих ксилоглюканазной активностью.
Полинуклеотид по SEQ ID NO:1, или SEQ ID NO:4, или SEQ ID NO:6; или его субпоследовательность; а также аминокислотная последовательность SEQ ID NO:3, или SEQ ID NO:5, или SEQ ID NO:7; или ее фрагмент; могут быть использованы для конструирования зондов нуклеиновых кислот для идентификации и клонирования ДНК, кодирующей исходные ксилоглюканазы из штаммов разных родов или видов в соответствии со способами, хорошо известными специалистам. В частности, такие зонды могут быть использованы для гибридизации с геномной или кДНК рода или вида, представляющего интерес, в соответствии со стандартными процедурами саузерн-блоттинга, с целью идентификации и выделения их соответствующего гена. Такие зонды могут быть значительно короче целой последовательности, но должны иметь по меньшей мере 14, предпочтительно, по меньшей мере 25, более предпочтительно, по меньшей мере 35 и наиболее предпочтительно, по меньшей мере 70, нуклеотидов в длину. Однако, предпочтительно, чтобы зонд нуклеиновой кислоты имел по меньшей мере 100 нуклеотидов в длину. Например, зонд нуклеиновой кислоты может иметь по меньшей мере 200 нуклеотидов, предпочтительно, по меньшей мере 300 нуклеотидов, более предпочтительно, по меньшей мере 400 нуклеотидов, или наиболее предпочтительно, по меньшей мере 500 нуклеотидов в длину. Могут быть использованы даже более длинные зонды, например зонды нуклеиновой кислоты, имеющие, предпочтительно, по меньшей мере 600 нуклеотидов, более предпочтительно, по меньшей мере 700 нуклеотидов, еще более предпочтительно, по меньшей мере 800 нуклеотидов, предпочтительно, по меньшей мере 900 нуклеотидов в длину, предпочтительно, по меньшей мере 1000 нуклеотидов в длину, предпочтительно, по меньшей мере 1100 нуклеотидов в длину, предпочтительно, по меньшей мере 1200 нуклеотидов в длину, предпочтительно, по меньшей мере 1300 нуклеотидов в длину, предпочтительно, по меньшей мере 1400 нуклеотидов в длину, предпочтительно, по меньшей мере 1500 нуклеотидов в длину или, наиболее предпочтительно, по меньшей мере 1600 нуклеотидов в длину. Могут быть использованы как ДНК, так и РНК зонды. Зонды, типично, метят для детектирования соответствующего гена (например, с использованием32P,3Н,35S, биотина или авидина). Такие зонды входят в объем настоящего изобретения.
Библиотека геномной ДНК, приготовленная из других организмов, может быть подвергнута скринингу на ДНК, которая гибридизуется с описанными выше зондами и кодирует исходную ксилоглюканазу. Геномная или другие ДНК из других организмов могут быть выделены электрофорезом на агарозном или полиакриламидном геле или другими методами разделения. ДНК из библиотек или выделенная ДНК могут быть перенесены на и иммобилизованы на нитроцеллюлозе или других пригодных материалах носителя. Для идентификации клона или ДНК, гомологичных с SEQ ID NO:1 или ее субпоследовательностью, материал носителя используется для проведения саузерн-блоттинга. В целях настоящего изобретения гибридизация указывает, что полинуклеотид гибридизуется с меченым нуклеотидным зондом, соответствующим полинуклеотиду, приведенному в SEQ ID NO:1, его комплементарной нитью, или его субпоследовательностью, в условиях от низкой до очень высокой жесткости. Молекулы, с которыми гибридизуется зонд, могут быть детектированы с использованием, например, рентгеновской пленки или любого другого средства детектирования, известного специалистам.
В одном аспекте зонд нуклеиновой кислоты представляет собой последовательность, кодирующую зрелый полипептид SEQ ID NO:1. В другом аспекте, зонд нуклеиновой кислоты представляет собой нуклеотиды 82-1653 SEQ ID NO:1. В другом аспекте, зонд нуклеиновой кислоты представляет собой полинуклеотидную последовательность, которая кодирует полипептид SEQ ID NO:2, или его субпоследовательность. В другом аспекте, зонд нуклеиновой кислоты представляет собой SEQ ID NO:1.
Для длинных зондов, имеющих по меньшей мере 100 нуклеотидов в длину, условия от очень низкой до очень высокой жесткости определяются как предгибридизация и гибридизация при 42°С в 5×SSPE, 0,3% SDS, 200 микрограмм/мл деградированной в условиях гидродинамического сдвига и денатурированной ДНК спермы лосося и или 25% формамида для очень низкой и низкой жесткости, или 35% формамида для средней и средневысокой жесткости, или 50% формамида для высокой и очень высокой жесткости, в соответствии со стандартной процедурой саузерн-блоттинга, оптимально, в течение 12-24 часов.
Для длинных зондов, имеющих по меньшей мере 100 нуклеотидов в длину, материал носителя в конце промывают трижды, каждый раз в течение 15 минут, с использованием 2×SSC, 0,2% SDS, предпочтительно, при 45°С (очень низкая жесткость), более предпочтительно, при 50°С (низкая жесткость), более предпочтительно, при 55°С (средняя жесткость), более предпочтительно, при 60°С (средневысокая жесткость), еще более предпочтительно, при 65°С (высокая жесткости) и наиболее предпочтительно, при 70°С (очень высокая жесткость).
Для коротких зондов, имеющих от примерно 15 нуклеотидов до примерно 70 нуклеотидов в длину, условия жесткости определяют как предгибридизация, гибридизация и промывка после гибридизации при температуре ниже расчетной Tm на величину от примерно 5°С до примерно 10°С, в соответствии с расчетами Bolton and McCarthy (1962, Proceedings of the National Academy of Sciences USA 48:1390) в 0,9 M NaCl, 0,09 M Tris-HCl, pH 7,6, 6 мМ EDTA, 0,5% NP-40, 1× растворе Денхардта, 1 мМ пирофосфате натрия, 1 мМ первичном кислом фосфате натрия, 0,1 мМ АТР и 0,2 мг РНК дрожжей на мл, в соответствии со стандартными процедурами саузерн-блоттинга, оптимально, в течение 12-24 часов.
Для коротких зондов, имеющих от примерно 15 нуклеотидов до примерно 70 нуклеотидов в длину, материал носителя промывают один раз в 6×SCC плюс 0,1% SDS в течение 15 минут, и дважды, каждый раз по 15 минут, с использованием 6×SSC при температуре, на 5-10°С ниже расчетной Tm.
В третьем аспекте исходная ксилоглюканаза кодируется полинуклеотидом, содержащим или состоящим из нуклеотидной последовательности, имеющей степень идентичности с последовательностью, кодирующей зрелый полипептид SEQ ID NO:1, равной, предпочтительно, по меньшей мере 65%, более предпочтительно, по меньшей мере 70%, более предпочтительно, по меньшей мере 75%, более предпочтительно, по меньшей мере 80%, более предпочтительно, по меньшей мере 85%, еще более предпочтительно, по меньшей мере 90%, наиболее предпочтительно, по меньшей мере 95% и еще более предпочтительно, 96%, 97%, 98% или 99%, которая кодирует активный полипептид. В одном аспекте кодирующая последовательность зрелого полипептида представляет собой нуклеотиды 82-1653 SEQ ID NO:1.
Исходная ксилоглюканаза может быть получена из микроорганизмов любого рода. В одном аспекте исходная ксилоглюканаза секретируется внеклеточно.
В следующем аспекте исходная ксилоглюканаза может быть бактериальной ксилоглюканазой. Например, ксилоглюканаза может быть полипептидом грамположительных бактерий, таких как Bacillus, предпочтительно, из подразделения Bacillus/Lactobacillus, предпочтительно, видов рода Paenibacillus, особенно Paenibacillus polymyxa, например, Paenibacillus polymyxa АТСС 832, предпочтительно, ксилоглюканаза является ксилоглюканазой семейства 44, например, как описано в WO 01/62903, более предпочтительно, ксилоглюканазой SEQ ID NO:5, более предпочтительно, ксилоглюканазой SEQ ID NO:7 и наиболее предпочтительно, ксилоглюканазой SEQ ID NO:2 или ее зрелым полипептидом.
Генерирование вариантов
Варианты исходной ксилоглюканазы могут быть получены в соответствии с любой процедурой мутагенеза, известной специалистам, такой как неспецифический и/или направленный мутагенез, конструирование синтетических генов, конструирование полусинтетических генов, неспецифический мутагенез, перемешивание и т.д.
Конструирование синтетических генов предусматривает in vitro синтез спроектированной полинуклеотидной молекулы, кодирующей полипептидную молекулу, представляющую интерес. Синтез гена может осуществляться с использованием ряда методик, таких как технология на основе мультиплексных микрочипов, описанная Tian et. al. (Tian, et. al., Nature 432:1050-1054), и подобные технологии, в которых олигонуклеотиды синтезируются и собираются на фотопрограммируемых микрожидкостных чипах.
Конструирование полусинтетических генов осуществляется путем объединения аспектов конструирования синтетических генов, и/или направленного мутагенеза, и/или неспецифического мутагенеза, и/или перемешивания. Типичным примером полусинтетического конструирования является способ, использующий синтезируемые полинуклеотидные фрагменты, в комбинации с методами ПЦР. Таким образом, определенные участки генов могут быть синтезированы de novo, в то время как другие участки могут быть амплифицированы с использованием сайт-специфических мутагенных праймеров, а еще другие участки могут быть подвергнуты амплификации методом ошибочно-направленной ПЦР или не-ошибочно-направленной ПЦР. Полинуклеотидные фрагменты затем могут быть перемешаны.
Направленный мутагенез представляет собой методику, в которой одна или несколько мутаций создаются в определенном сайте полинуклеотидной молекулы, кодирующей исходную ксилоглюканазу. Методика может быть осуществлена in vitro или in vivo.
Направленный мутагенез может осуществляться in vitro методом ПЦР с использованием олигонуклеотидных праймеров, содержащих желательную мутацию. Направленный мутагенез также может осуществляться in vitro путем кассетного мутагенеза, предусматривающего расщепление рестрикционным ферментом по сайту плазмиды, содержащему полинуклеотид, кодирующий исходную ксилоглюканазу, и последующее лигирование олигонуклеотида, содержащего мутацию в полинуклеотиде. Обычно плазмида и олигонуклеотид гидролизуются одним и тем же рестрикционным ферментом, что позволяет лигировать друг с другом липкие концы плазмиды и вставки. Дополнительное описание пригодных методик приведено в Sambrook et al. (1989), Molecular cloning: A laboratory manual, Cold Spring Harbor lab., Cold Spring Harbor, NY; Ausubel, F.M. et al. (eds.) "Current Protocols in Molecular Biology". John Wiley and Sons, 1995; Harwood, C.R. and Cutting, S.M. (eds.) "Molecular Biological Methods for Bacillus". John Wiley and Sons, 1990), и WO 96/34946; Scherer and Davis, 1979, Proc. Natl. Acad. Sci. USA 76:4949-4955; и Barton et al., 1990, Nucleic Acids Research 18:7349-4966.
После лигазной реакции лигационная смесь может быть использована для трансформирования клетки-хозяина; в целях клонирования часто используются клетки Е.coli, как описано Ausubel, F.M. et al. Трансформированные клетки Е.coli могут размножаться в жидкой среде или на твердых агаровых пластинах, плазмиды могут быть выделены из трансформированных клеток и использованы для трансформации клеток В.subtilis. Пригодные компетентные клетки Bacillus, такие как МВ1510, 168-производное (например, доступная от BGSC (Bacillus Genetic Stock Center) с номером доступа 1А1 168 trpC2), могут быть трансформированы, как описано в WO 03/095658. Переносимая плазмидой Е.coli интеграционная кассета для конструирования библиотеки может быть использована для трансформации Bacillus. Способ описан детально в WO 03/095658. Альтернативно, может быть использован in vitro амплифицированный продукт PCR-SOE (ПЦР с сочленением фрагментов путем элонгации перекрывающихся участков) (Melnikov and Youngman, Nucleic Acid Research 27, 1056).
Направленный мутагенез может быть осуществлен in vivo способами, известными специалистам. См., например, публикацию патентной заявки США 2004/0171154; Storici et al., 2001, Nature Biotechnology 19: 773-776; Kren et al., 1998, Nat. Med. 4:285-290; и Calissano and Macino, 1996, Fungal Genet. Newslett. 43:15-16.
Любая процедура направленного мутагенеза может быть использована в настоящем изобретении. Имеется множество доступных коммерческих наборов, которые могут быть использованы для получения вариантов исходных ксилоглюканаз.
Одиночные или множественные аминокислотные замещения, делеции и/или инсерции могут быть выполнены и протестированы с использованием известных способов мутагенеза, рекомбинации и/или перемешивания, с последующей соответствующей процедурой скрининга, так как раскрыто Reidhaar-Olson and Sauer, 1988, Science 241:53-57; Bowie and Sauer, 1989, Proc. Natl. Acad. Sci. USA 86:2152-2156; WO 95/17413 или WO 95/22625. Другие методы, которые могут быть использованы, включают ошибочно-направленную ПЦР, фаговый дисплей (например, Lowman et al., 1991, Biochem. 30:10832-10837; патент США №5223409; WO 92/06204) и участок-направленный (region-directed) мутагенез (Derbyshire et al., 1986, Gene 46:145; Ner et al., 1988, DNA 7:127).
Способы мутагенеза/перемешивания, описанные выше, могут быть объединены с высокопроизводительными автоматизированными методами скрининга для детектирования активности клонированных мутированных полипептидов, экспрессируемых клетками-хозяевами, например Bacillus, как описано выше. Мутированные молекулы ДНК, кодирующие полипептиды с ксилоглюканазной активностью, могут быть выделены из клеток-хозяев и быстро секвенированы с использованием стандартных методов, известных специалистам.
Варианты
В настоящем изобретении изолированные варианты исходной ксилоглюканазы содержат изменения в одном или больше (нескольких) положениях, выбранных из группы, состоящей из номеров позиций 68, 123, 156, 118, 200, 129, 137, 193, 92, 83, 149, 34, 340, 332, 9, 76, 331, 310, 324, 498, 395, 366, 1, 374, 7, 140, 8, 14, 21, 211, 37, 45, 13, 78, 87, 436, 101, 104, 111, 306, 117, 119, 414, 139, 268, 142, 159, 164, 102, 168, 176, 180, 482, 183, 202, 206, 217, 4, 222, 19, 224, 228, 232, 2, 240, 244, 5, 247, 249, 328, 252, 259, 406, 267, 269, 275, 179, 166, 278, 281, 288, 298, 301, 18, 302, 165, 80, 303, 316, 169, 322, 120, 146, 342, 348, 147, 353, 380, 468, 382, 383, 38, 384, 389, 391, 10, 392, 396, 177, 397, 399, 409, 237, 413, 253, 415, 418, 40, 443, 445, 148, 449, 225, 450, 454, 3, 455, 456, 299, 461, 470, 204, 476, 488, 347 и 507, где вариант, обладающий ксилоглюканазной активностью, содержит аминокислотную последовательность, имеющую степень идентичности, равную по меньшей мере 70%, более предпочтительно, по меньшей мере 75%, более предпочтительно, по меньшей мере 80%, более предпочтительно, по меньшей мере 85%, еще более предпочтительно, по меньшей мере 90%, более предпочтительно, по меньшей мере 95%, более предпочтительно, по меньшей мере примерно 97%, наиболее предпочтительно, по меньшей мере 98% и еще более предпочтительно - 99% с аминокислотной последовательностью исходной ксилоглюканазы. Нумерация позиций относится к аминокислотной последовательности SEQ ID NO:3. Предпочтительно, варианты, содержащие изменения в одном или нескольких из вышеуказанных положений, имеют повышенную стабильность в моющем средстве, предпочтительно, в жидком моющем средстве по сравнению с исходной ксилоглюканазой.
В предпочтительном варианте исполнения вариант содержит одну или больше (несколько) следующих комбинаций изменений:
V1*+V2*+H3*;
V1Q+*1aE+*1bV;
Н3А;
Н3А+Н436А;
K8A,Q,S;
T9D;
T9D+L34F+A83E+Q149E+H193T+S332P+R340T;
I10V+D33E+M40L+A41T+Q67M+Y73F+S76D+G78A+Q82K+T92A+L102Q+Q137E+I222V+V228I+D249N+S269N+V272A+E333A+I337L+M356L+T374A+S416A+D444Y+A469E+K470T+I473G+T517A+S522*;
I10V+F17S+D33E+M40L+A41T+Q67M+N72S+S76D+G78A+Q82K+Q137E+V219A+D249N+V272A+I337L+M356L+V397A+S416A+T421I+S424N+N441D+D444Y+V450I+K470T+I473S+V477I;
I10V+F17S+D33E+M40L+Q67M+N72S+S76D+G78A+Q82K+T92A+L102Q+Q137E+H164N+N168K+T172A+V219A+I222V+V228I+D249N+S269N+V272A+E333A+I337L+M356L+N415S+T421I+S424H+N441D+D444Y+S522P+P523V+V524E;
I10V+F17S+D33E+M40L+Q67M+N72S+S76D+G78A+Q82K+T92A+L102Q+Q137E+I 22V+V228I+D249N+V272A+I337L+M356L+T374A+V397A+S416A+T421I+S424N+N441 D+D444Y+V450I+A469E+K470T+I473G+T517A+S522P+P523V+V524E;
I10V+F17S+D33E+Q67M+N72S+S76D+G78A+Q82K+T92A+L102Q+Q137E+N168K+T172A+I222V+V228I+D249N+V272A+E333A+I337L+M356L+V397A+S416A+T421I+S424H+N441D+D444Y+A469E+K470T+I473S+V477I+E489A+A490V+T517A+S522*;
I10V+F17S+M40L+Q67M+N72S+S76D+G78A+Q82K+T92A+L102Q+Q137E+I222V+V228I+D249N+S269N+V272A+T320A+I337L+M356L+T374A+V397A+N415S+T421I+S424H+N441D+D444Y+A469E+K470T+I473S+V477I+T517A+S522P+P523V+V524E;
I10V+F17S+Q67M+N72S+S76D+G78A+Q82K+T104A+Q137E+N153K+R156Q+V219A+1222V+V228I+D249N+S269N+V272A+E333A+I337L+M356L+V397A+N415S+D420G+T421I+S424H+N441D+D444Y+V450I+A469E+K470T+I473G+T517A+S522*;
I10V+F17S+Q67M+N72S+S76D+G78A+Q82K+T92A+T104A+Q137E+R156Q+V159A+H164N+N168K+T172A+I222V+V228I+D249N+V272A;
I10V+F17S+Y53H+Q67M+N72S+S76D+G78A+Q82K+T92A+L102Q+Q137E+T172V+A177T+I222V+V228I+D249N+S269N+I337L+M356L+V397A+S416A+T421I+S424H+N441D+D444Y+A469E+K470T+I473G+T517A+S522*;
K13A+K129A;
K13A+Q68H+T92V+K118A+Q137E+R156Y+G200P;
K13A,R;
K18R;
R20A;
K21Q+K129A;
K21Q,R,T;
Q32H+M40L+R49G+D65E+Q67M+N72S+S76D+G78A+Q82K+T92A+L102Q+T104A+Q137E+H164N+K202E+I222V+V228I+D249N+M356L+T374A;
D33V+Q68H+N168H+V450I;
L34F,I,M,V;
L34I+K129A;
D37G,N+K129A+R156Y;
E38I,V;
M40L+A41T+Q67M+N72S+S76D+G78A+Q82K+Q137E+N153K+H164N+D249N+V272A+I337L+M356L+V397A+N415S+T421I+S424N+N441D+V450I+E489A+A490V+T517A+S522*;
M40V;
L45I;
Q68H,M,N;
Q68H+G200P+N331F;
Q68H+K118A+K129A+R156Y+G200P+N331F;
Q68H+K118A+R156V+G200P+N331F;
Q68H+K118A+R156Y+H193T+D366H;
Q68H+K118R+R156F,Y;
Q68H+K118R+R156Y+G200P;
Q68H+K118S+R156F+G200P+G274D+N331F;
Q68H+K129AJ+R156K+G200P+N331F;
Q68H+R156F,V,Y+G200P+N331F;
Q68H+R156Y;
Q68H+R156Y+H193T;
Q68H+R156Y+H193T+D366H;
Q68H+R156Y+H193T+G200P+M310V;
Q68H+S76W+T92V+K118A+Q137E+R156Y+G200P+N331F;
Q68H+T92A,D,I,S,V,Y+K118A+K129A+R156Y+G200P+N331F;
Q68H+T92N+D97N+K118A+K129A+R156Y+G200P+N331F;
Q68H+T92S+K118A+K129A+R156Y+G200P+G274D+N331F;
Q68H+T92V+G200P+M310V;
Q68H+T92V+G200P+M310V+N331F;
Q68H+T92V+K118A+K129A+Q137E+R156Y+G200P+A224P+N331F;
Q68H+T92V+K118A+K129A+Q137E+R156Y+G200P+N331F;
Q68H+T92V+K118A+K129A+Q137E+R156Y+H193T;
Q68H+T92V+K118A+K129A+Q137E+R156Y+H193T+D366H;
Q68H+T92V+K118A+K129A+Q137E+R156Y+H193T+G200P+M310V+E446K;
Q68H+T92V+K118A+K129A+Q137E+R156Y+H193T+N331H,K,Q;
Q68H+T92V+K118A+K129A+R156Y+H193T;
Q68H+T92V+K118A+K129A+R156Y+H193T+D366H;
Q68H+T92V+K118A+K129A+R156Y+H193T+G200P+M310V;
Q68H+T92V+K118A+Q137E+N140F+R156Y+G200P+K470T;
Q68H+T92V+K118A+Q137E+R156Y+G200P+D324N;
Q68H+T92V+K118A+Q137E+R156Y+G200P+K470T;
Q68H+T92V+K118A+Q137E+R156Y+G200P+M310L;
Q68H+T92V+K118A+Q137E+R156Y+G200P+N331F;
Q68H+T92V+K118A,R+R156Y,F;
Q68H+T92V+K118A+S123PJ+K129A+Q137E+R156Y+G200P+N331F;
Q68H+T92V+K118R+R156Y+H193T+D366H;
Q68H+T92V+R156F+G200P+M310V+S484C;
Q68H+T92V+R156F,V,Y+G200P+M310V;
Q68H+T92V+R156F,V,Y+G200P+M310V+N331F;
Q68H+T92V+R156F,Y+H193T;
Q68H+T92V+R156F,Y+H193T+D366H;
Q68H+T92V+R156F,Y+H193T+G200P+M310V;
Q68H+T92V+R156Y;
S76E,I,K,M,R,T,V,W;
S76W+G200P;
S76W+G200P+A224P;
G78A+K118A+K129A+R156Y;
G78A+K118A+K129A+R156Y;
G78A+K118A+K129A+R156Y+G200P+N331F;
G78A+K118A+K129A+R156Y+K169A;
G78A,N,S;
G78A+T92V+K118A+K129A+R156Y;
G78A+T92V+K118A+K129A+R156Y+G200P+N331F;
G78A+T92V+K118A+K129A+R156Y+K169A;
L80V;
A83D,E,H,I,L,N,R,S,T,Y;
K87Q;
K87V+K129A+K169A;
T92I,V;
T92V+K118A+K129A+Q137E+R156Y+G200P+N331F;
T92V+K118A+K129A+R156Y;
T92V+K118A+K129A+R156Y+G200P+N331F;
T92V+K118A+K129A+R156Y+H164N+G200P+N331F;
T92V+K129A+R156Y;
K101A+K129A;
K101R;
K101R+L102I;
T104A+P111Q+A117S+K129A+R156Y;
P111Q;
K118A+K129A;
K118A+K129A+F146L+R156Y+G200P+N331F;
K118A+K129A+Q137E+R156Y+G200P+N331F;
K118A+K129A+R156Y;
K118A+K129A+R156Y+A224P;
K118A+K129A+R156Y+G200P;
K118A+K129A+R156Y+G200P+M310V+N331F;
K118A+K129A+R156Y+G200P+N331F;
K118A+K129A+R156Y+G200P+N331F+N399I;
K118A+K129A+R156Y+K169A+G200P+N331F;
K118A+K129A+R156Y+K470T;
K118A,R;
K118A+R156Y;
K118A+R156Y+G200P;
D119L;
G120A;
S123PJ;
S123T+K129A+R156Y;
K129A,F,I,K,R,S,T;
K129A+K169A;
K129A+K176P;
K129A+K275Q;
K129A+K445S;
K129A+K470T;
K129A+Q137E+R156Y;
K129A+Q137E+R156Y+G200P;
K129A+Q137E+R156Y+K470T;
K129A+Q137E+V139K+N140F+Q147S+R156Y;
K129A+R156Y;
K129A+R156Y+A177T+V179I+A183S;
K129A+R156Y+A328G;
K129A+R156Y+D247G;
K129A+R156Y+D249G,N,S;
K129A+R156Y+D303I,K,S,V;
K129A+R156Y+D324N;
K129A+R156Y+D366H+T374A;
K129A+R156Y+D461N,Q,T;
K129A+R156Y+E288Q;
K129A+R156Y+G200P;
K129A+R156Y+G200P+G204T+R211K;
K129A+R156Y+H164N;
K129A+R156Y+H436Y;
K129A+R156Y+I10V+V14I+D19E;
K129A+R156Y+I222V+A224P+V228I+V232A;
K129A+R156Y+K176P,S;
K129A+R156Y+K275T;
K129A+R156Y+K322I+K454Q;
K129A+R156Y+K406N+N415G;
K129A+R156Y+K454Q;
K129A+R156Y+L380F+N383Y+D384G+N389T;
K129A+R156Y+N298F+E299N+G301T;
K129A+R156Y+N302K+D303L,S;
K129A+R156Y+N331F;
K129A+R156Y+P507A;
K129A+R156Y+R267H;
K129A+R156Y+R409L,T;
K129A+R156Y+S443D+K445S+L449I+V450I+S455N+M456Y;
K129A+R156Y+T244D;
K129A+R156Y+V159M+H164N+F165Y;
K129A+R156Y+V259I+R267K+L268K+S269A;
Q137D,E;
N140F;
K142A,Q,R;
F146C+H164C;
F146K,L;
F146L+K322I;
L148K+N168D;
Q149E;
R156A,D,E,F,I,K,L,M,N,P,Q,R,S,T,V,W,Y;
R156Y+N331F;
V159M;
H164A,N;
L166I;
N168D;
K169A,Q,R;
K176P;
A177E,T;
K180R;
H193A,D,S,T;
R197A,L;
H199A;
G200A,C,D,E,F,H,I,K,L,M,N,P,Q,R,S,T,V,W,Y;
G200P+A224P;
K202N,Q,R;
S214E;
K217A;
A221K;
G225S;
V232A;
G237A,S,V;
K240A,Q,R;
K252A,Q,R;
G253A;
R267A;
L268I;
K275A,Q,R;
L278I;
F281L;
M290R;
R295A;
K306A,R;
K307Q;
M310I,L,V;
M310V+N399I;
R314A;
G316I;
K322A,R;
D324N;
N331A,C,D,E,F,G,H,I,K,L,M,P,Q,R,S,T,V,W,Y;
S332M,P;
S332P+V397I;
R340A,N,T;
K342A;
V345I;
K347A,Q,R;
D348G;
K353Q,R;
D366H;
M373Q;
T374A;
L380F;
K382A;
N383Y;
N389A,F,N,V;
W391V;
K392G,Q;
D395G;
G396P;
V397S;
N3991;
K406N;
G413A,S;
K414A;
N415S;
T417K;
F418I;
V431E;
H436A;
N441G+A442E+S443D;
S443E,K,Q;
K445A,R,S;
K445C+K470C;
Н448А;
K454R;
S467R+G468S+A469T;
G468S,Y;
K470P,R,T;
I473T;
K476Q;
K482A,Q,R;
K488A,Q,R,T;
A490R;
G498A,D,S;
R500A,T,V;
H512A;
T517A+G518D или
G518D;
В одном аспекте общее число изменений аминокислот в вариантах настоящего изобретения составляет, предпочтительно, 55, предпочтительно, 52, более предпочтительно, 50, более предпочтительно, 40, более предпочтительно, 30, более предпочтительно, 20, более предпочтительно, 15, более предпочтительно, десять, более предпочтительно, девять, более предпочтительно, восемь, еще более предпочтительно, семь, еще более предпочтительно, шесть, еще более предпочтительно, пять, еще более предпочтительно, четыре, еще более предпочтительно, три и наиболее предпочтительно, два изменения и наиболее предпочтительно, одно изменение. В другом аспекте общее число изменений составляет одно, предпочтительно, два, более предпочтительно, три, еще более предпочтительно, четыре, еще более предпочтительно, пять, еще более предпочтительно, шесть, еще более предпочтительно, семь, еще более предпочтительно, восемь, еще более предпочтительно, девять, наиболее предпочтительно, десять. Изменение может представлять собой i) инсерцию аминокислоты справа от аминокислоты, занимающей данное положение; ii) делецию аминокислоты, занимающей данное положение, или iii) замещение аминокислоты, занимающей данное положение, на другую аминокислоту. Изменения могут выполняться независимо друг от друга, например в одном положении может быть выполнена инсерция, в то время как во втором положении - замещение, а в третьем положении - делеция, по сравнению с исходной ксилоглюканазой. В предпочтительном варианте исполнения вариант содержит только замещения.
В одном аспекте изобретения положения, в которых должны быть выполнены мутации, идентифицируются на основании анализа консенсусной последовательности. Анализ проводится путем сравнения первичной последовательности SEQ ID NO:3 с SEQ ID NO:5 и SEQ ID NO:7, а также с другими последовательностями из базы данных Uniprot, на 30% идентичных с участком SEQ ID NO:3 гликозилгидролазы семейства 44. Полученные в результате консенсусные последовательности изображены на фигуре 1. Консенсусная последовательность 1 представляет собой последовательность, содержащую наиболее часто встречающиеся аминокислоты в данной позиции из выравнивания, консенсусная последовательность 2 представляет собой последовательность со 2-й наиболее часто встречающейся аминокислотой в данной позиции, и т.д. В одном аспекте изобретения один или больше (несколько) остатков SEQ ID NO:3 заменяют на соответствующий остаток из консенсусной последовательности 1, или консенсусной последовательности 2, или консенсусной последовательности 3, или консенсусной последовательности 4. В одном аспекте настоящего изобретения варианты содержат изменение в одной или больше (нескольких) позициях, выбранных из группы, состоящей из 52 позиций, идентифицированных путем анализа консенсусной последовательности, состоящей из номеров позиций 10, 19, 68, 80, 89, 104, 111, 117, 123, 129, 137, 139, 140, 147, 156, 159, 164, 165, 177, 179, 183, 200, 204, 211, 222, 224, 225, 228, 232, 259, 267, 268, 269, 281, 328, 345, 366, 374, 380, 383, 384, 406, 415, 436, 443, 445, 449, 450, 455, 456, 488 и 507. В предпочтительном варианте исполнения, изменение представляет собой замещение, или несколько замещений, выбранных из группы, состоящей из: I10V, D19E, Q68H, L80V, G89A, Т104А, P111Q, A117S, S123P, K129T, Q137E, V139K, N140F, Q147S, R156Y, V159M, H164N, F165Y, А177Т, V179I, A183S, G200P, G204T, R211K, I222V, А224Р, G225S, V228I, V232A, V259I, R267K, L268K, S269A, F281L, A328G, V345I, D366H, Т374А, L380F, N383Y, D384G, K406N, N415G, H436Y, S443D, K445S, L449I, V450I, S455N, M456Y, K488T и Р507А.
В другом аспекте изобретения вариант генерируется путем изменения тех аминокислот в исходном пептиде, которые имеют положительные заряды и расположены на расстоянии до 20 Å от иона кальция, на нейтральные или отрицательно заряженные аминокислоты. Предпочтительные варианты настоящего изобретения включают варианты, в которых суммарный заряд на расстоянии до 20 Å от иона кальция был сделан более отрицательным. В таких вариантах положительно заряженные аминокислоты могут быть замещены на аминокислоты, являющиеся нейтральными или отрицательно заряженными в условиях применения. В соответствии с этим предпочтительные варианты могут содержать замещения аминокислотного остатка, который является частично или полностью положительно заряженным в условиях "химической стабильности" или применения, т.е. Lys, Arg или His, на отрицательно заряженную или нейтральную аминокислоту. Предпочтительными заменяющими аминокислотами могут быть отрицательно заряженные аминокислоты, такие как Asp и Glu, или нейтральные аминокислоты, такие как Ala, Asn, Gln, Tyr, Trp и Phe. Предпочтительный вариант по настоящему изобретению содержит изменение в одном или нескольких положениях, выбранных из группы, состоящей из номеров позиций 49, 87, 118, 129, 134, 142, 156, 169 и 197. В предпочтительном варианте исполнения, изменения представляют собой замещения в одном или нескольких положениях, выбранных из группы, состоящей из номеров позиций 87, 118, 129, 134, 142, 156 и 169. В предпочтительном варианте исполнения, замещение выбирают из группы, состоящей из: K87A; K129A,S,F,I; K118A; K142A,Q, R156Y,F,V,I,K,W,L,M и K169Q,A.
В одном аспекте вариант исходной ксилоглюканазы содержит изменение в одном или больше (нескольких) положениях, соответствующих позициям 68 или 123 или 156 или 118 или 200 или 129 или 137 или 193 или 92 или 76 или 331. Предпочтительно, вариант содержит замещение в положении 68 и одно или несколько замещений в одной или нескольких дополнительных позициях, выбранных из группы, состоящей из номеров позиций 123, 156, 118, 200, 129, 137, 193,92, 83, 149, 34, 340, 332, 9, 76, 331, 310, 324, 498, 395 и 366.
В другом аспекте вариант содержит замещение в положении 156 и одно или несколько замещений в одном или нескольких дополнительных положениях, выбранных из группы, состоящей из номеров позиций 10, 13, 14, 19, 37, 68, 78, 92, 118, 123, 129, 137, 139, 140, 147, 159, 164, 165, 169, 176, 177, 179, 183, 200, 204, 211, 222, 224, 244, 247, 249, 259, 267, 268, 269, 275, 288, 299, 301, 302, 303, 310, 324, 328, 331, 366, 380, 383, 384, 389, 406, 409, 415, 436, 443, 445, 449, 450, 454, 455, 456, 461, 470 и 507.
В другом аспекте вариант исходной ксилоглюканазы содержит изменения в двух или больше (нескольких) положениях, соответствующих позициям 68, или 123, или 156, или 118, или 200, или 129, или 137, или 193, или 92, или 76, или 331. Предпочтительно, вариант содержит замещение в положении 68, или 123, или 156, или 118, или 200, или 129. Еще более предпочтительно, вариант содержит замещение в положении 129 и положении 156.
В другом аспекте вариант исходной ксилоглюканазы содержит изменения в трех или больше (нескольких) положениях, соответствующих позициям 68, или 123, или 156, или 118, или 200, или 129, или 137, или 193, или 92. или 76, или 331.
В другом аспекте вариант исходной ксилоглюканазы содержит изменения в четырех или больше (нескольких) положениях, соответствующих позициям 68, или 123, или 156, или 118, или 200, или 129, или 137, или 193, или 92, или 76, или 331.
В другом аспекте, вариант исходной ксилоглюканазы содержит изменения в пяти или больше (нескольких) положениях, соответствующих позициям 68 или 123 или 156 или 118 или 200 или 129 или 137 или 193 или 92 или 76 или 331.
В другом аспекте вариант исходной ксилоглюканазы содержит изменения в шести или больше (нескольких) положениях, соответствующих позициям 68, или 123, или 156, или 118, или 200, или 129, или 137, или 193, или 92, или 76, или 331.
В другом аспекте вариант исходной ксилоглюканазы содержит изменения в семи или больше (нескольких) положениях, соответствующих позициям 68, или 123, или 156, или 118, или 200, или 129, или 137, или 193, или 92, или 76, или 331.
В другом аспекте вариант исходной ксилоглюканазы содержит изменения в положениях, соответствующих позициям 129, и 156, и 331, и 200, и 118.
В другом аспекте вариант исходной ксилоглюканазы содержит изменения в положениях, соответствующих позициям 68, и 129, и 156, и 331, и 200, и 118.
В другом аспекте вариант исходной ксилоглюканазы содержит изменения в положениях, соответствующих позициям 68, и 92, и 129, и 156, и 331, и 200, и 118.
В другом аспекте вариант содержит одно или больше (несколько) замещений, выбранных из группы, состоящей из: Q68H,N,L; S123P,T; R156Y,F,V,I,K,W,L,M; K118A,R; G200P,E,S,D; K129T,A,S; Q137E; H193T,S,D; T92V,I,A,S; A83E; Q149E; L34F,I,V; R340T,N; S332P; T9D; S76W,V,I,K,R,T; N331F,C; M310I,V,L; D324N; G498A,D; D395G и D366H. Предпочтительно, замещения выбирают из группы, состоящей из Q68H; S123P; R156Y,F; K118A; G200P,E; K129T,А; Q137E; Н193Т; T92V и N331F. Более предпочтительно, замещения выбирают из группы, состоящей из Q68H; S123P; R156Y,F; K118A; G200P,E; K129T,А; Q137E; T92V и N331F. Более предпочтительно, вариант содержит замещения в девяти или восьми, семи или шести или пяти или четырех или трех или двух или одной позиции (позициях), где замещения выбирают из группы, состоящей из Q68H; S123P; R156Y,F; K118A; G200P,E; K129T,A; Q137E; T92V и N331F.
В следующем аспекте вариант содержит одну или больше (несколько) следующих комбинаций замещений:
Q68H
S123P
R156Y
Q68H+R156Y
K129A+R156Y
S123T+K129A+R156Y
K129A+R156Y+G200P
Q68H+K118R+R156F
Q68H+R156Y+H193T
Q68H+R156F+G200P+N331F
Q68H+T92V+K118A+R156Y
K118A+K129A+R156Y+G200P+N331F
G78A+T92V+K118A+K129A+R156Y
Q68H+K129T+R156K+G200P+N331F
K118A+K129A+R156Y+K169A+G200P+N331F
T92V+K118A+K129A+R156Y+G200P+N331F
G78A+K118A+K129A+R156Y+G200P+N331F
G78A+T92V+K118A+K129A+R156Y+K169A
Q68H+T92V+Q137E+R156Y+G200P+N331F
Q68H+T92V+K118A+Q137E+R156Y+N331F
Q68H+T92V+R156Y+G200P+M310V+N331F
Q68H+K118A+K129A+R156Y+G200P+N331F
Q68H+T92V+K118A+K129A+R156Y+G200P+N331F
Q68H+T92V+K118A+Q137E+R156Y+G200P+N331F
Q68H+T92V+K118A+K129A+R156Y+H193T+D366H
Q68H+T92V+K118A+K129A+Q137E+R156Y+H193T+D366H
Q68H+T92V+K118A+K129A+Q137E+R156Y+G200P+N331F
Q68H+T92V+K118A+S123P,T+K129A+Q137E+R156Y+G200P+N331F
Q68H+T92V+K118A+K129A+Q137E+R156Y+G200P+A224P+N331F
В предпочтительном варианте исполнения все описанные выше варианты являются вариантами исходной ксилоглюканазы, которая принадлежит к семейству 44 гликозилгидролаз, более предпочтительно, исходную ксилоглюканазу выбирают из ксилоглюканазы, имеющей по меньшей мере 75% идентичности с аминокислотной последовательностью SEQ ID NO:3, более предпочтительно, исходную ксилоглюканазу выбирают из группы, состоящей из SEQ ID NO:2, SEQ ID NO:3, SEQ ID NO:5 и SEQ ID NO:7, и наиболее предпочтительно, исходные ксилоглюканазы состоят из SEQ ID NO:3.
Композиции
Настоящее изобретение также относится к композициям, содержащим вариант ксилоглюканазы или полипептид по настоящему изобретению, обладающий ксилоглюканазной активностью. Предпочтительно, композиции обогащены таким вариантом или полипептидом. Термин "обогащенный" указывает, что ксилоглюканазная активность композиции повышена, например, с коэффициентом обогащения, равным 1,1 или больше. Предпочтительно, композиции составляются для обеспечения желательных характеристик, таких как низкий уровень окраски, низкий уровень запаха и приемлемая стабильность при хранении.
Композиция может содержать вариант или полипептид по настоящему изобретению в качестве основного ферментного компонента, например, монокомпонентной композиции. Альтернативно, композиция может содержать множество ферментативных активностей, таких как аминопептидаза, амилаза, карбогидраза, карбоксипептидаза, каталаза, целлюлаза, хитиназа, кутиназа, циклодекстрингликозилтрансфераза, дезоксирибонуклеаза, эстераза, альфа-галактозидаза, бета-галактозидаза, глюкоамилаза, альфа-глюкозидаза, бета-глюкозидаза, галоидпероксидаза, инвертаза, лакказа, липаза, маннозидаза, оксидаза, пектинолитический фермент, пептидоглутаминаза, пероксидаза, фитаза, полифенолоксидаза, протеолитический фермент, рибонуклеаза, трансглутаминаза или ксиланаза.
Полипептидные композиции могут быть получены в соответствии со способами, известными специалистам, и могут иметь форму жидкой или сухой композиции. Например, полипептид может быть приготовлен в форме гранулята или микрогранулята. Вариант или полипептид для включения в композицию может быть стабилизирован в соответствии со способами, известными специалистам. В предпочтительном варианте исполнения, вариант ксилоглюканазы готовится в форме жидкой композиции.
Применение
Настоящее изобретение также касается способов применения вариантов ксилоглюканаз.
Варианты ксилоглюканаз, предпочтительно, включаются в и/или используются вместе с композициями моющих средств, например в композициях моющих средств для стирки, например композициях бытовых моющих средств для стирки, особенно жидких композициях моющих средств для стирки. Моющая композиция, типично, содержит обычные ингредиенты моющего средства, такие как поверхностно-активные вещества (анионные, катионные, неионные, цвиттерионные, амфотерные), добавки для усиления моющего действия, отбеливатели, полимеры, другие ферменты и другие ингредиенты, например, как описано в WO2007/130562 и WO2007/149806, которые настоящим целиком включены сюда в качестве ссылок.
Моющая композиция может находиться в любой форме, такой как твердая, жидкая, гелеобразная или любая их комбинация, предпочтительно, композиция находится в жидкой форме, предпочтительно, в форме жидкой моющей композиции для стирки.
Аспектом изобретения является использование варианта ксилоглюканазы или композиции варианта ксилоглюканазы по изобретению вместе с моющей композицией для придания ткани или предмету одежды полезных эффектов предотвращения скатывания, и/или смягчения ткани, и/или прояснения окраски, и/или удаления загрязнений, и/или предотвращения повторного отложения загрязнений, и/или ингибирования переноса красителей.
Кроме того, изобретение относится к способу стирки тканей, включающему обработку тканей раствором для стирки, содержащим моющую композицию и вариант ксилоглюканазы или композицию варианта ксилоглюканазы по изобретению. Стирка может, например, осуществляться путем машинного способа стирки или ручного способа стирки. Раствор для стирки может, например, быть водным раствором для стирки, содержащим моющую композицию и имеющим рН от 3 до 12.
Во время стирки и использования поверхность тканей или предметов одежды обычно загрязняется оборванными или высвободившимися фрагментами волокон, которые могут придавать ткани полинявший и поношенный вид. Удаление этих поверхностных волокон с ткани частично восстанавливает исходную окраску и внешний вид ткани, приводя к прояснению окраски и улучшению внешнего вида. Вариант ксилоглюканазы или композиция варианта ксилоглюканазы по изобретению могут быть использованы для обеспечения прояснения окраски и/или улучшения внешнего вида путем использования при разовой или при многократных (повторных) циклах стирки.
Кроме того, микрофибрилы, выступающие с поверхности ткани, могут собираться в маленькие шарики, так называемые катышки или узелки, которые цепляются за поверхность и нарушают внешний вид ткани. Вариант ксилоглюканазы или композиция варианта ксилоглюканазы по изобретению могут быть использованы для удаления таких катышков, обеспечивая эффект, который называется депилинг (de-pilling).
Прояснение окраски и удаление катышков могут быть оценены путем визуального осмотра с использованием для проведения испытаний группы экспертов. Эффекты также могут быть измерены методами отражения света или определения ворсистости хлопка путем проведения оптических измерений. Эти методы широко известны специалистам и кратко описаны в Enzymes in Detergency, 1997, опубликованной Marcel Dekker, страницы 139-140.
На поверхности текстильных волокон, особенно, при увеличении числа циклов стирки, накапливаются отложения, которые могут включать дисперсные загрязнения, растворимые загрязнения, красители и пигменты и нерастворимые соли. Это может приводить к визуально воспринимаемому ухудшению чистящей эффективности стирки, например, приводя к сероватому или желтоватому виду ткани. Это можно предотвратить путем использования варианта ксилоглюканазы или композиции варианта ксилоглюканазы по изобретению во время циклов стирки. Этот эффект называется предотвращением повторного отложения или ингибированием переноса красителей или удалением загрязнений и может быть оценен с помощью оптических измерений.
Частицы загрязнений или нерастворимых солей, захватываемые поверхностью ткани и между волокнами, могут приводить к увеличению жесткости ткани. Благодаря использованию варианта ксилоглюканазы или композиции варианта ксилоглюканазы по изобретению в циклах стирки ткань может быть умягчена.
Ткани, подвергаемые обработке способами по настоящему изобретению, могут быть обычным пригодным для стирки бельем, например бытовым бельем для стирки. Предпочтительно, значительная часть белья для стирки представляет собой предметы одежды и ткани, включая вязаные изделия, текстильные изделия, изделия из джинсовой ткани, изделия из пряжи и изделия из ткани для полотенец, изготовленные из хлопка, хлопковых смесей или природных или искусственных целлюлозных материалов (например, на основе древесной целлюлозы) или их смесей. Примерами смесей являются смеси хлопка или искусственного шелка/вискозы с одним или несколькими дополнительными материалами, такими как шерсть, синтетические волокна (например, полиамидные волокна, акриловые волокна, волокна из сложных полиэфиров, волокна из поливинилового спирта, поливинилхлоридные волокна, полиуретановые волокна, полимочевинные волокна, арамидные волокна) и целлюлозасодержащие волокна (например, искусственный шелк/вискоза, рами, льноволокно/льняная пряжа, джут, волокна из ацетата целлюлозы, материал lyocell).
Общепризнанно, что обработка тканей и/или предметов одежды раствором моющего средства, содержащего вариант ксилоглюканазы или композицию варианта ксилоглюканазы по изобретению, может быть особенно пригодной, например, при производстве новых волокон и/или тканей и/или предметов одежды, а также во время стирки поношеных тканей и/или предметов одежды, например при бытовой стирке или промышленной стирке.
Дозировка варианта ксилоглюканазы или композиции варианта ксилоглюканазы по настоящему изобретению и другие условия, в которых используется композиция, включая состав и концентрацию раствора моющего средства, могут быть определены на основании способов, известных специалистам.
Ксилоглюканазы могут быть использованы в композициях по настоящему изобретению для обеспечения удаления загрязнений, содержащих производные целлюлозы или гемицеллюлозы, усиления эффекта предотвращения повторного отложения и улучшения удаления загрязнений. Ксилоглюканазы также могут быть использованы в композициях по настоящему изобретению для придания хлопку грязеотталкивающих свойств при последующей стирке. Грязеотталкивающий эффект наблюдается на хлопчатобумажной ткани и на всех типах тканей, содержащих значительное количество хлопка, таких как смеси хлопок-синтетика (например, сложный полиэфир, полиамид, такой как найлон™ и эластан).
Моющая композиция для стирки
Моющая композиция для стирки по настоящему изобретению содержит изолированный вариант исходной Ксилоглюканазы. Изолированный вариант исходной Ксилоглюканазы детально описан выше. Композиция, предпочтительно, содержит специальный амфифильный алкоксилированный грязеудаляющий полимер. Композиция предпочтительно содержит моющее поверхностно-активное вещество, предпочтительно, имеет низкие уровни содержания моющего поверхностно-активного вещества. Специальный амфифильный алкоксилированный грязеудаляющий полимер описан детальнее ниже. Моющее поверхностно-активное вещество описано детальнее ниже. Композиция, предпочтительно, содержит статистический привитой сополимер. Пригодные статистические привитые сополимеры описаны детальнее ниже.
Предпочтительно, композиция содержит соединение следующей общей структуры: бис((C2H5O)(C2H4O)n)(CH3)-N+-CxH2x-N+-(CH3)-бис((C2H5O)(C2H4O)n), где n = от 20 до 30 и x = от 3 до 8, или его сульфатированные или сульфонированные варианты.
Предпочтительно, композиция содержит микрокапсулы ароматизатора, предпочтительно, ароматизатор инкапсулирован в меламино-формальдегидной пленке.
Моющая композиция, предпочтительно, содержит от примерно 0,00003% мас. до примерно 0,2% мас., от примерно 0,00008% мас. до примерно 0,05% мас. или даже от примерно 0,0001% мас. до примерно 0,04% мас. подцвечивающего агента для тканей. Композиция может содержать от 0,0001% мас. до 0,2% мас. подцвечивающего агента для тканей; это может быть особенно предпочтительным в тех случаях, когда композиция имеет форму пакетика с унифицированной дозой.
Моющая композиция для стирки может находиться в любой форме, такой как твердая, жидкая, гелеобразная или любая их комбинация. Композиция может иметь форму таблетки или пакетика, включая пакетики с несколькими отделениями. Композиция может иметь форму сыпучего порошка, такого как агломерат, высушенный распылительной сушкой порошок, инкапсулированный материал, экструдат, иголки, лентовидный материал, хлопья или любая их комбинация. Однако композиция, предпочтительно, имеет форму жидкости. Дополнительно, композиция находится в изотропной или анизотропной форме. Предпочтительно, композиция, или по меньшей мере ее часть, представляет собой ламеллярную фазу.
Композиция, предпочтительно, имеет низкие уровни содержания воды, такие как от 0,01% мас. до 10% мас., предпочтительно, до 5% мас., предпочтительно, до 4% мас., или до 3% мас., или до 2% мас., или даже до 1% мас. Это является особенно предпочтительным, если композиция имеет форму пакетика, типично, по меньшей мере частично, предпочтительно, полностью заключенного в водорастворимую пленку. Водорастворимая пленка, предпочтительно, содержит поливиниловый спирт.
Композиция может содержать структурообразователь, такой как гидрогенизированное касторовое масло. Один из пригодных типов структурообразующего агента, особенно пригодных для композиций по настоящему изобретению, содержит неполимерные (за исключением обычного алкоксилирования) кристаллические гидроксифункциональные материалы. Такие структурирующие материалы, типично, образуют в жидкой матрице ассоциированую межмолекулярную нитеобразную сеть, типично, кристаллизуясь в матрице in situ. Предпочтительными структурообразователями являются кристаллические гидроксилсодержащие жирные кислоты, сложные эфиры жирных кислот или жирные воска. Пригодные структурообразователи, типично, выбирают из материалов, имеющих следующую формулу:
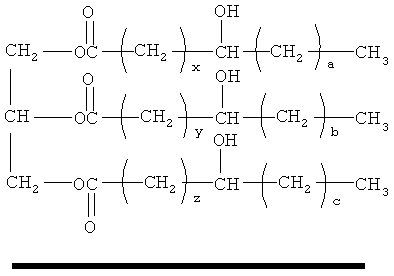
в которой:
(х+а) имеет значение от 11 до 17;
(у+b) имеет значение от 11 до 17 и
(z+с) имеет значение от 11 до 17.
Предпочтительно, в данной формуле x=y=z=10 и/или а=b=с=5. Конкретные примеры предпочтительных кристаллических гидроксилсодержащих структурообразователей включают касторовое масло и его производные. Особенно предпочтительными являются производные гидрогенизированного касторового масла, такие как гидрогенизированное касторовое масло и гидрогенизированный касторовый воск. Коммерчески доступные кристаллические гидроксилсодержащие структурообразователи на основе касторового масла включают THIXCIN производства фирмы Rheox, Inc. (в настоящее время - Elementis).
Композиция также предпочтительно содержит алканоламин для нейтрализации кислотных компонентов. Примерами пригодных алканоламинов являются триэтаноламин и моноэтаноламин. Это особенно предпочтительно в тех случаях, когда композиция содержит стабилизаторы протеазы, такие как борную кислоту, или ее производные, такие как бороновая кислота. Примерами пригодных производных бороновой кислоты являются производные фенилбороновой кислоты следующей формулы:

где R выбирают из группы, состоящей из водорода, гидрокси, C1-C6 алкила, замещенного C1-C6 алкила, C1-C6 алкенила и замещенного C1-C6 алкенила.
Особенно предпочтительным стабилизатором протеазы является 4-формилфенилбороновая кислота. Другие пригодные производные бороновой кислоты, которые могут использоваться в качестве стабилизаторов протеазы, описаны в US 4963655, US 5159060, WO 95/12655, WO 95/29223, WO 92/19707, WO 94/04653, WO 94/04654, US 5442100, US 5488157 и US 5472628.
Композиция может содержать обратимый пептидный ингибитор протеазы. Предпочтительно, обратимый пептидный ингибитор протеазы представляет собой трипептидный ингибитор фермента. Иллюстративные неограничивающие примеры пригодных трипептидных ингибиторов ферментов включают:








Обратимый пептидный ингибитор протеазы может быть получен любым пригодным способом. Иллюстративные неограничивающие примеры пригодных способов производства обратимых пептидных ингибиторов протеазы приведены в патенте США №6165966.
В одном варианте исполнения композиция содержит от примерно 0,00001% до примерно 5%, конкретнее, от примерно 0,00001% до примерно 3%, более конкретно, от примерно 0,00001% до примерно 1%, от веса композиции, обратимого пептидного ингибитора протеазы.
Композиция, предпочтительно, содержит растворитель. Растворитель, типично, является водой или органическим растворителем или их смесью. Предпочтительно, растворитель представляет собой смесь воды и органического растворителя. Если композиция имеет форму пакетика с унифицированной дозой, то, предпочтительно, композиция содержит органический растворитель и менее 10% мас., или 5% мас., или 4% мас., или 3% мас. свободной воды и может даже быть безводной, типично, не содержать целенаправленно добавляемой свободной воды. Свободную воду, типично, измеряют методом титрования по Фишеру (Karl Fischer). Экстрагируют 2 г композиции моющего средства для стирки в 50 мл сухого метанола при комнатной температуре в течение 20 минут и анализируют 1 мл метанола путем титрования по Фишеру.
Композиция может содержать от более 0% мас. до 25% мас., или от более 0% мас. до 20% мас., или от более 0% мас. до 15% мас., или от более 0% мас. до 10% мас., или от более 0% мас. до 8% мас., предпочтительно, от более 0% мас. до 5% мас., наиболее предпочтительно, от более 0% мас. до 3% мас. органического растворителя. Пригодные растворители включают С4-С14 простые эфиры и диэфиры, гликоли, алкоксилированные гликоли, C6-C16 гликолевые простые эфиры, алкоксилированные ароматические спирты, ароматические спирты, алифатические разветвленные спирты, алкоксилированные алифатические разветвленные спирты, алкоксилированные линейные C1-C5 спирты, линейные C1-C5 спирты, амины, C8-C14 алкильные и циклоалкильные углеводороды и галоидуглеводороды и их смеси.
Предпочтительные растворители выбирают из метоксиоктадеканола, 2-(2-этоксиэтокси)этанола, бензилового спирта, 2-этилбутанола и/или 2-метилбутанола, 1-метилпропоксиэтанола и/или 2-метилбутоксиэтанола, линейных C1-С5 спиртов, таких как метанол, этанол, пропанол, бутилдигликолевого простого эфира (BDGE), бутилтригликолевого простого эфира, трет-амилового спирта, глицерина, изопропанола и их смесей. Особенно предпочтительными растворителями, которые могут быть использованы по настоящему изобретению, являются бутоксипропоксипропанол, бутилдигликолевый простой эфир, бензиловый спирт, бутоксипропанол, пропиленгликоль, глицерин, этанол, метанол, изопропанол и их смеси. Другие пригодные растворители включают пропиленгликоль и диэтиленгликоль и их смеси.
Композиция, предпочтительно, содержит от примерно 0,1% до примерно 5%, от веса композиции, секвестранта для связывания кальция, имеющего условную константу устойчивости при рН 8 выше примерно 4. В одном варианте исполнения композиция, предпочтительно, в жидкой форме, может содержать секвестрант для связывания кальция, имеющий условную константу устойчивости при рН 8 выше примерно 4. Секвестрант для связывания кальция с условной константой устойчивости при рН 8 выше примерно 4 способен образовывать растворимые комплексы с ионами Са. В одном варианте исполнения, секвестрант для связывания кальция выбирают из 1-гидроксиэтилиден-1,1-дифосфоновой кислоты (HEDP), диэтилентриаминпентауксусной кислоты (DTPA), нитрилотриуксусной кислоты (NTA) и их комбинаций. Дополнительная информация о секвестрантах для связывания кальция и их константах устойчивости приведена в "Keys to Chelation with Versene Chelating Agents", опубликованной фирмой Dow Company, см. таблицы 4.4, 4.5, 4.6, 4.7, и в Monsanto Technical Bulletin 53-39(E) ME-2.
Твердая моющая композиция для стирки
В одном варианте исполнения настоящего изобретения композиция представляет собой твердую моющую композицию для стирки, предпочтительно, твердую порошкообразную моющую композицию для стирки.
Композиция, предпочтительно, содержит от 0% мас. до 10% мас., или даже до 5% мас., цеолитной добавки для усиления моющего действия. Композиция также предпочтительно содержит от 0% мас. до 10% мас., или даже до 5% мас., фосфатной добавки для усиления моющего действия.
Композиция, типично, содержит анионное моющее поверхностно-активное вещество, предпочтительно, линейный алкилбензолсульфонат, предпочтительно, в комбинации со вспомогательным поверхностно-активным веществом. Предпочтительными вспомогательными поверхностно-активными веществами являются алкилэтоксилированные сульфаты, имеющие среднюю степень этоксилирования от 1 до 10, предпочтительно, от 1 до 3, и/или этоксилированные спирты, имеющие среднюю степень этоксилирования от 1 до 10, предпочтительно, от 3 до 7.
Композиция, предпочтительно, содержит хелатирующее вещество, предпочтительно, композиция содержит от 0,3% мас. до 2,0% мас. хелатирующего вещества. Пригодным хелатирующим веществом является этилендиамин-N,N'-диянтарная кислота (EDDS).
Композиция может содержать целлюлозные полимеры, такие как натриевые или калиевые соли карбоксиметилцеллюлозы, карбоксиэтилцеллюлозы, сульфоэтилцеллюлозы, сульфопропилцеллюлозы, сульфат целлюлозы, фосфорилированную целлюлозу, карбоксиметилгидроксиэтилцеллюлозу, карбоксиметилгидроксипропилцеллюлозу, сульфоэтилгидроксиэтилцеллюлозу, сульфоэтилгидроксипропилцеллюлозу, карбоксиметилметилгидроксиэтилцеллюлозу, карбоксиметилметилцеллюлозу, сульфоэтилметилгидроксиэтилцеллюлозу, сульфоэтилметилцеллюлозу, карбоксиметилэтилгидроксиэтилцеллюлозу, карбоксиметилэтилцеллюлозу, сульфоэтилэтилгидроксиэтилцеллюлозу, сульфоэтилэтилцеллюлозу, карбоксиметилметилгидроксипропилцеллюлозу, сульфоэтилметилгидроксипропилцеллюлозу, карбоксиметилдодецилцеллюлозу, карбоксиметилдодекоил (dodecoyl) целлюлозу, карбоксиметилцианоэтилцеллюлозу и сульфоэтилцианоэтилцеллюлозу. Целлюлоза может быть замещенной целлюлозой, замещенной двумя или больше разными заместителями, такой как метил- и гидроксиэтилцеллюлоза.
Композиция может содержать грязеотталкивающие полимеры, такие как Repel-o-Тех™. Другими пригодными грязеотталкивающими полимерами являются анионные грязеотталкивающие полимеры. Пригодные грязеотталкивающие полимеры описаны детальнее в WO 05123835 А1, WO 07079850 А1 и WO 08110318 А2.
Композиция может содержать высушенный распылительной сушкой порошок. Высушенный распылительной сушкой порошок может содержать силикатную соль, такую как силикат натрия.
Амфифильный алкоксилированный грязеудаляющий полимер
Амфифильные алкоксилированные грязеудаляющие полимеры по настоящему изобретению относятся к любым алкоксилированным полимерам, имеющим сбалансированные гидрофильные и гидрофобные свойства, так чтобы они удаляли частицы жира с тканей и поверхностей. Конкретные варианты исполнения амфифильных алкоксилированных грязеудаляющих полимеров по настоящему изобретению содержат структуру ядра и множество алкоксилатных групп, присоединенных к этой структуре ядра.
Структура ядра может представлять собой полиалкилениминовую структуру, содержащую, в конденсированной форме, повторяющиеся звенья формул (I), (II), (III) и (IV):



где # в каждом случае обозначает половину связи между атомом азота и свободным положением связывания группы А1 двух соседних повторяющихся звеньев формул (I), (II), (III) или (IV); * в каждом случае обозначает половину связи с одной из алкоксилатных групп; и А1 независимо выбирают из линейного или разветвленного С2-С6-алкилена; где полиалкилениминовая структура состоит из 1 повторяющегося звена формулы (I), x повторяющихся звеньев формулы (II), y повторяющихся звеньев формулы (III) и y+1 повторяющихся звеньев формулы (IV), где x и y в каждом случае имеют величину в интервале значений от 0 до примерно 150 и где средний средневзвешенный молекулярный вес (Mw) полиалкилениминовой структуры ядра имеет величину в интервале значений от примерно 60 до примерно 10000 г/моль.
Структура ядра может, альтернативно, содержать полиалканоламиновую структуру, представляющую собой продукты конденсации по меньшей мере одного соединения, выбранного из N-(гидроксиалкил)аминов формул (I.a) и/или (I.b),


где А независимо выбирают из C1-C6-алкилена; R1, R1*, R2, R2*, R3, R3*, R4, R4*, R5и R5* независимо выбирают из водорода, алкила, циклоалкила или арила, где три последние радикала могут быть необязательно замещенными; и R6 выбирают из водорода, алкила, циклоалкила или арила, где три последние радикала могут быть необязательно замещенными.
Множество алкиленоксидных групп, присоединенных к структуре ядра, независимо выбирают из алкиленоксидных звеньев формулы (V)

где * в каждом случае обозначает половину связи с атомом азота повторяющегося звена формулы (I), (II) или (IV); А2 в каждом случае независимо выбирают из 1,2-пропилена, 1,2-бутилена и 1,2-изобутилена; А3 обозначает 1,2-пропилен; R в каждом случае независимо выбирают из водорода и C1-C4-алкила; m имеет среднее значение в интервале от 0 до примерно 2; n имеет среднее значение в интервале от примерно 20 до примерно 50 и p имеет среднее значение в интервале от примерно 10 до примерно 50.
Конкретные варианты исполнения амфифильных алкоксилированных грязеудаляющих полимеров могут быть выбраны из алкоксилированных полиалкилениминов, имеющих внутренний полиэтиленоксидный блок и внешний полипропиленоксидный блок, у которых степень этоксилирования и степень пропоксилирования не выходят за определенные верхние или нижние предельные значения. Конкретные варианты исполнения алкоксилированных полиалкилениминов в соответствии с настоящим изобретением имеют минимальное соотношение полиэтиленовых блоков к полипропиленовым блокам (n/p), равное примерно 0,6, и максимальное, равное примерно 1,5(x+2y+1)1/2. Было обнаружено, что алкоксилированные полиалкиленимины, имеющие соотношение n/p от примерно 0,8 до примерно 1,2(x+2y+1)1/2, обладают особенно полезными свойствами.
Алкоксилированные полиалкиленимины в соответствии с настоящим изобретением имеют основную цепь, состоящую из первичных, вторичных и третичных атомов азота аминов, которые присоединены друг к другу алкиленовыми радикалами А и расположены в случайном порядке. Фрагменты первичных аминов, которые начинают или заканчивают основную цепь и боковые цепи полиалкилениминовой основной цепи, и остальные атомы водорода которых впоследствии замещаются на алкиленоксидные звенья, называются тут повторяющимися звеньями формул (I) или (IV), соответственно. Фрагменты вторичных аминов, оставшийся атом водорода которых впоследствии замещается на алкиленоксидные звенья, называются повторяющимися звеньями формулы (II). Фрагменты третичных аминов, служащие разветвлениями основной цепи и боковых цепей, называются повторяющимися звеньями формулы (III).
Поскольку при образовании полиалкилениминовой основной цепи может происходить циклизация, то в основной цепи также может присутствовать небольшое количество фрагментов циклических аминов. Такие полиалкиленимины, содержащие фрагменты циклических аминов, конечно, являются алкоксилированными таким же образом, как и материалы, состоящие из нециклических фрагментов первичных и вторичных аминов.
Полиалкилениминовая основная цепь, состоящая из атомов азота и групп А1, имеет средний молекулярный вес Mw от примерно 60 до примерно 10000 г/моль, предпочтительно, от примерно 100 до примерно 8000 г/моль, и более предпочтительно, от примерно 500 до примерно 6000 г/моль.
Сумма (х+2y+1) соответствует общему числу алкилениминовых звеньев, присутствующих в одной индивидуальной полиалкилениминовой основной цепи, и, таким образом, прямо связана с молекулярным весом полиалкилениминовой основной цепи. Однако значения, приведенные в описании, относятся к среднечисловому значению для всех полиалкилениминов, присутствующих в смеси. Сумма (х+2y+2) соответствует общему числу аминогрупп, присутствующих в одной индивидуальной полиалкилениминовой основной цепи.
Радикалы А1, соединяющие атомы азота аминов, могут быть одинаковыми или разными, линейными или разветвленными С2-С6-алкиленовыми радикалами, такими как 1,2-этилен, 1,2-пропилен, 1,2-бутилен, 1,2-изобутилен, 1,2-пентандиил, 1,2-гександиил или гексаметилен. Предпочтительным разветвленным алкиленом является 1,2-пропилен. Предпочтительными линейными алкиленами являются этилен и гексаметилен. Более предпочтительным алкиленом является 1,2-этилен.
Атомы водорода первичных и вторичных аминогрупп полиалкилениминовой основной цепи замещаются на алкиленоксидные звенья формулы (V).

В данной формуле переменные, предпочтительно, имеют одно из указанных ниже значений:
А2 в каждом случае выбирают из 1,2-пропилена, 1,2-бутилена и 1,2-изобутилена; предпочтительно, А2 обозначает 1,2-пропилен. А3 обозначает 1,2-пропилен; R в каждом случае выбирают из водорода и С1-С4-алкила, такого как метил, этил, н-пропил, изопропил, н-бутил, изобутил и трет-бутил; предпочтительно, R обозначает водород. Коэффициент m в каждом случае имеет значение от 0 до примерно 2; предпочтительно, m равен 0 или приблизительно 1; более предпочтительно, m равен 0. Коэффициент n имеет среднее значение в интервале от примерно 20 до примерно 50, предпочтительно, в интервале значений от примерно 22 до примерно 40, и более предпочтительно, в интервале значений от примерно 24 до примерно 30. Коэффициент p имеет среднее значение в интервале от примерно 10 до примерно 50, предпочтительно, в интервале значений от примерно 11 до примерно 40, и более предпочтительно, в интервале значений от примерно 12 до примерно 30.
Предпочтительно, алкиленоксидное звено формулы (V) представляет собой нестатистическую последовательность алкоксилатных блоков. Под нестатистической последовательность подразумевается, что [-A2-O-]m прибавляют первым (т.е. ближайшим к связи с атомом азота повторяющегося звена формулы (I), (II), или (III)), [-CH2-CH2-O-]n прибавляют вторым и [-А3-О-]p прибавляют третьим. Такая ориентация обеспечивает алкоксилированный полиалкиленимин с внутренним полиэтиленоксидным блоком и внешним полипропиленоксидным блоком.
Значительная часть этих алкиленоксидных звеньев формулы (V) образована этиленоксидными звеньями -[СН2-СН2-O)]n- и пропиленоксидными звеньями -[СН2-СН2(СН3)-O]p-. Алкиленоксидные звенья могут дополнительно также содержать небольшую часть пропиленоксидных или бутиленоксидных звеньев -[A2-O]m-, т.е. полиалкилениминовая основная цепь, насыщенная атомами водорода, может быть сначала введена в реакцию с небольшими количествами, составляющими до примерно 2 моль, особенно, от примерно 0,5 до примерно 1,5 моль, в частности, от примерно 0,8 до примерно 1,2 моль, пропиленоксида или бутиленоксида на моль присутствующих NH-групп, т.е. подвергнута первичному алкоксилированию.
Такая начальная модификация полиалкилениминовой основной цепи позволяет, при необходимости, снизить вязкость реакционной смеси при алкоксилировании. Однако модификация обычно не влияет на рабочие характеристики алкоксилированного полиалкиленимина и потому не является предпочтительной мерой.
Амфифильные алкоксилированные грязеудаляющие полимеры присутствуют в композициях моющих и чистящих средств по настоящему изобретению в количествах, составляющих от примерно 0,05% до 10% от веса композиции. Варианты исполнения композиций могут содержать от примерно 0,1% до примерно 5% мас. Более конкретно, варианты исполнения могут содержать от примерно 0,25 до примерно 2,5% грязеудаляющего полимера.
Моющее поверхностно-активное вещество
Композиция содержит моющее поверхностно-активное вещество. Моющее поверхностно-активное вещество может быть анионным, неионным, катионным и/или цвиттерионным. Предпочтительно, моющее поверхностно-активное вещество является анионным. Композиции, предпочтительно, содержат от 2% до 50% поверхностно-активного вещества, более предпочтительно, от 5% до 30%, наиболее предпочтительно, от 7% до 20%, моющего поверхностно-активного вещества. Композиция может содержать от 2% до 6% моющего поверхностно-активного вещества. Композиция, предпочтительно, содержит моющее поверхностно-активное вещество в количестве, обеспечивающем от 100 ppm (млн-1) до 5000 ppm моющего поверхностно-активного вещества в растворе для стирки в процессе стирки. Это особенно предпочтительно в тех случаях, когда от 10 г до 125 г жидкой моющей композиции для стирки дозируют в раствор для стирки в процессе стирки. Композиция при контакте с водой, типично, образует раствор для стирки, содержащий от 0,5 г/л до 10 г/л моющей композиции.
Статистический привитой сополимер
Статистический привитой сополимер содержит: (i) гидрофильную основную цепь, содержащую мономеры, выбранные из группы, состоящей из: ненасыщенных C1-C6 карбоновых кислот, простых эфиров, спиртов, альдегидов, кетонов, сложных эфиров, звеньев сахаров, алкоксидных звеньев, малеинового ангидрида, насыщенных многоосновных спиртов, таких как глицерин, и их смесей; и (ii) гидрофобную боковую цепь (цепи), выбранные из группы, состоящей из: C4-C25 алкильной группы, полипропилена, полибутилена, винилового сложного эфира насыщенной С1-С6 монокарбоновой кислоты, C1-C6 алкилового сложного эфира акриловой или метакриловой кислоты и их смесей.
Полимер, предпочтительно, имеет общую формулу
где X, Y и Z представляют собой концевые звенья, независимо выбранные из Н или C1-6 алкила; каждый R1 независимо выбирают из метила и этила; каждый R2 независимо выбирают из Н и метила; каждый R3 независимо обозначает C1-4 алкил и каждый R4 независимо выбирают из пирролидона и фенильных групп.Средневзвешенный молекулярный вес полиэтиленоксидной основной цепи, типично, составляет от примерно 1000 г/моль до примерно 18000 г/моль, или от примерно 3000 г/моль до примерно 13500 г/моль, или от примерно 4000 г/моль до примерно 9000 г/моль. Значения m, n, о, p и q выбирают так, чтобы боковые группы составляли по меньшей мере 50%, или от примерно 50% до примерно 98%, или от примерно 55% до примерно 95%, или от примерно 60% до примерно 90%, от веса полимера. Полимер, пригодный для использования по настоящему изобретению, типично имеет средневзвешенный молекулярный вес от примерно 1000 до примерно 100000 г/моль, или, предпочтительно, от примерно 2500 г/моль до примерно 45000 г/моль, или от примерно 7500 г/моль до примерно 33800 г/моль, или от примерно 10000 г/моль до примерно 22500 г/моль.
Пригодные привитые сополимеры описаны детальнее в WO07/138054, WO06/108856 и WO06/113314.
Пригодные подкрашивающие агенты для тканей
Флуоресцентные оптические осветлители излучают по меньшей мере некоторое количество видимого света. В отличие от них, подкрашивающие агенты для тканей могут изменять оттенок поверхности, поскольку они поглощают по меньшей мере часть спектра видимого света. Пригодные подкрашивающие агенты для тканей включают красители, конъюгаты краситель-глина и пигменты, удовлетворяющие требованиям метода испытаний 1 в разделе Метод испытаний данного описания. Пригодные красители включают красители с малыми молекулами и полимерные красители. Пригодные красители с малыми молекулами включают красители с малыми молекулами, выбранные из группы, состоящей из красителей, относящихся, по классификации цветового индекса (Colour Index, CI), к прямому синему, прямому красному, прямому фиолетовому, кислотному синему, кислотному красному, кислотному фиолетовому, основному синему, основному фиолетовому и основному красному или их смесям, например:
(1) Трис-азо прямые синие красители формулы

где по меньшей мере два из нафтильных колец А, В и С замещены сульфонатной группой, кольцо С может быть замещено в положении 5 группой NH2 или NHPh, X обозначает бензильное или нафтильное кольцо, замещенное до 2 раз сульфонатными группами, и может быть замещено в положении 2 группой ОН и также может быть замещено группой NH2 или NHPh.
(2) Бис-азо прямые фиолетовые красители формулы

где Z обозначает Н или фенил, кольцо А, предпочтительно, замещено метильной и метоксигруппой в положениях, указанных стрелочками, кольцо А также может быть нафтильным кольцом, группа Y обозначает бензильное или нафтильное кольцо, которое замещено сульфатной группой и может быть моно- или дизамещенным метильными группами.
(3) Синие или красные кислотные красители формулы

где по меньшей мере одна из Х и Y должна быть ароматической группой. В одном аспекте обе ароматические группы могут быть замещены бензильной или нафтильной группой, которая может быть замещена не солюбилизирующимися в воде группами, такими как алкильные или алкилокси- или арилоксигруппы, Х и Y не могут быть замещены солюбилизирующимися в воде группами, такими как сульфонаты или карбоксилаты. В другом аспекте Х обозначает нитрозамещенную бензильную группу и Y обозначает бензильную группу.
(4) Красные кислотные красители структуры


где В обозначает нафтильную или бензильную группу, которая может быть замещена не солюбилизирующимися в воде группами, такими как алкильные или алкилокси- или арилоксигруппы, В не может быть замещен солюбилизирующимися в воде группами, такими как сульфонаты или карбоксилаты.
(5) Дис-азокрасители структуры


где Х и Y, независимо друг от друга, обозначают каждый водород, С1-С4 алкил или С1-С4-алкокси, Rα обозначает водород или арил, Z обозначает C1-C4 алкил; C1-C4-алкокси; галоген; гидроксил или карбоксил, n равен 1 или 2 и m равен 0, 1 или 2, а также их соответствующие соли и их смеси.
(6) Трифенилметановые красители следующих структур:





и их смеси. В другом аспекте пригодные красители с малыми молекулами включают красители с малыми молекулами, выбранные из группы, состоящей из соединений с номерами по Colour Index (Society of Dyers and Colourists, Bradford, UK) прямого фиолетового 9, прямого фиолетового 35, прямого фиолетового 48, прямого фиолетового 51, прямого фиолетового 66, прямого синего 1, прямого синего 71, прямого синего 80, прямого синего 279, кислотного красного 17, кислотного красного 73, кислотного красного 88, кислотного красного 150, кислотного фиолетового 15, кислотного фиолетового 17, кислотного фиолетового 24, кислотного фиолетового 43, кислотного красного 52, кислотного фиолетового 49, кислотного синего 15, кислотного синего 17, кислотного синего 25, кислотного синего 29, кислотного синего 40, кислотного синего 45, кислотного синего 75, кислотного синего 80, кислотного синего 83, кислотного синего 90 и кислотного синего 113, кислотного черного 1, основного фиолетового 1, основного фиолетового 3, основного фиолетового 4, основного фиолетового 10, основного фиолетового 35, основного синего 3, основного синего 16, основного синего 22, основного синего 47, основного синего 66, основного синего 75, основного синего 159 и их смесей. В другом аспекте, пригодные красители с малыми молекулами включают красители с малыми молекулами, выбранные из группы, состоящей из соединений с номерами по Colour Index (Society of Dyers and Colourists, Bradford, UK) кислотного фиолетового 17, кислотного фиолетового 43, кислотного красного 52, кислотного красного 73, кислотного красного 88, кислотного красного 150, кислотного синего 25, кислотного синего 29, кислотного синего 45, кислотного синего 113, кислотного черного 1, прямого синего 1, прямого синего 71, прямого фиолетового 51 и их смесей. В другом аспекте, пригодные красители с малыми молекулами включают красители с малыми молекулами, выбранные из группы, состоящей из соединений с номерами по Colour Index (Society of Dyers and Colourists, Bradford, UK) кислотного фиолетового 17, прямого синего 71, прямого фиолетового 51, прямого синего 1, кислотного красного 88, кислотного красного 150, кислотного синего 29, кислотного синего 113 или их смесей.
Пригодные полимерные красители включают полимерные красители, выбранные из группы, состоящей из полимеров, содержащих конъюгированные хромогены (конъюгаты краситель-полимер), и полимеров с хромогенами, сополимеризованными в основную цепь полимера, и их смесей.
В другом аспекте пригодные полимерные красители включают полимерные красители, выбранные из группы, состоящей из субстантивных красящих веществ для тканей, продаваемых под наименованием Liquitint® (Milliken, Spartanburg, South Carolina, USA), конъюгаты краситель-полимер, образованные по меньшей мере одним реакционноспособным красителем и полимером, выбранным из группы, состоящей из полимеров, содержащих фрагмент, выбранный из группы, состоящей из гидроксильной группы, первичной аминогруппы, вторичной аминогруппы, тиольной группы и их смесей. В еще одном аспекте пригодные полимерные красители включают полимерные красители, выбранные из группы, состоящей из Liquitint® (Milliken, Spartanburg, South Carolina, USA) Violet CT, карбоксиметилцеллюлозы (CMC) конъюгированной с реакционноспособным синим, реакционноспособным фиолетовым или реакционноспособным красным красителем, такой как CMC, конъюгированная с С1 реакционноспособным синим 19, продаваемая фирмой Megazyme, Wicklow, Ireland под наименованием AZO-CM-CELLULOSE, код продукта S-ACMC, алкоксилированные трифенилметановые полимерные красящие вещества, алкоксилированные тиофеновые полимерные красящие вещества и их смеси.
Пригодные конъюгаты краситель-глина включают конъюгаты краситель-глина, выбранные из группы, содержащей по меньшей мере один катионный/основный краситель и смектитную глину, и их смесей. В другом аспекте пригодные конъюгаты краситель-глина включают конъюгаты краситель-глина, выбранные из группы, состоящей из одного катионного/основного красителя, выбранного из группы, состоящей из CI основных желтых 1-108, CI основных оранжевых 1-69, CI основных красных 1-118, CI основных фиолетовых 1-51, CI основных синих 1-164, CI основных зеленых 1-14, CI основных коричневых 1-23, CI основных черных 1-11, и глины, выбранной из группы, состоящей из монтмориллонитовой глины, гекторитовой глины, сапонитовой глины и их смесей. В еще одном аспекте пригодные конъюгаты краситель-глина включают конъюгаты краситель-глина, выбранные из группы, состоящей из: конъюгата монтмориллонита и основного синего В7 CI 42595, конъюгата монтмориллонита и основного синего В9 CI 52015, конъюгата монтмориллонита и основного фиолетового V3 CI 42555, конъюгата монтмориллонита и основного зеленого G1 CI 42040, конъюгата монтмориллонита и основного красного R1 CI 45160, конъюгата монтмориллонита и основного черного CI 2, конъюгата гекторита и основного синего В7 CI 42595, конъюгата гекторита и основного синего В9 CI 52015, конъюгата гекторита и основного фиолетового V3 CI 42555, конъюгата гекторита и основного зеленого G1 CI 42040, конъюгата гекторита и основного красного R1 CI 45160, конъюгата гекторита и основного черного CI 2, конъюгата сапонита и основного синего В7 CI 42595, конъюгата сапонита и основного синего В9 CI 52015, конъюгата сапонита и основного фиолетовое V3 CI 42555, конъюгата сапонита и основного зеленого G1 CI 42040, конъюгата сапонита и основного красного R1 CI 45160, конъюгата сапонита и основного черного CI 2 и их смесей.
Пригодные пигменты включают пигменты, выбранные из группы, состоящей из флавантрона, индантрона, хлорированного индантрона, содержащего от 1 до 4 атомов хлора, пирантрона, дихлорпирантрона, монобромдихлорпирантрона, дибромдихлорпирантрона, тетрабромпирантрона, диимида перилен-3,4,9,10-тетракарбоновой кислоты, в котором имидные группы могут быть незамещенными или замещенными C1-С3-алкилом или фенилом или гетероциклическим радикалом, и в котором фенильный и гетероциклический радикалы могут дополнительно нести заместители, не придающие растворимости в воде, амидов антрапиримидинкарбоновой кислоты, виолантрона, изовиолантрона, диоксазиновых пигментов, фталоцианина меди, который может содержать до 2 атомов хлора на молекулу, полихлорфталоцианина меди или полибромхлорфталоцианина меди, содержащих до 14 атомов брома на молекулу, и их смесей.
В другом аспекте пригодные пигменты включают пигменты, выбранные из группы, состоящей из ультрамаринового синего (CI пигментый синий 29), ультрамаринового фиолетового (CI пигментный фиолетовый 15) и их смесей.
Вышеупомянутые подкрашивающие агенты для тканей могут быть использованы в комбинации (может быть использована любая смесь подкрашивающих агентов для тканей). Пригодные подкрашивающие агенты для тканей могут быть закуплены у фирм Aldrich, Milwaukee, Wisconsin, USA; Ciba Specialty Chemicals, Basel, Switzerland; BASF, Ludwigshafen, Germany; Dayglo Color Corporation, Mumbai, India; Organic Dyetuffs Corp., East Providence, Rhode Island, USA; Dystar, Frankfurt, Germany; Lanxess, Leverkusen, Germany; Megazyme, Wicklow, Ireland; Clariant, Muttenz, Switzerland; Avecia, Manchester, UK и/или приготовлены в соответствии с приведенными тут примерами.
Пригодные подцвечивающие агенты описаны детальнее в US 7208459 В2.
Вспомогательные ингредиенты
Пригодные вспомогательные материалы включают, без ограничений, поверхностно-активные вещества, добавки для усиления моющего действия, хелатирующие агенты, агенты, ингибирующие перенос красителей, диспергенты, дополнительные ферменты и стабилизаторы ферментов, каталитические материалы, активаторы отбеливания, перекись водорода, источники перекиси водорода, предварительно подготовленные перкислоты, полимерные диспергенты, агенты для удаления глинистых загрязнений/предотвращения повторного отложения, оптические осветлители, пеногасители, красители, ароматизаторы, агенты эластификации структуры, мягчители тканей, носители, гидротропные вещества, технологические добавки, растворители и/или пигменты. В дополнение к приведенному ниже описанию, пригодные примеры таких других вспомогательных веществ и уровни их использования содержатся в патентах США №№5576282, 6306812 и 6326348.
Настоящее изобретение далее описывается с помощью приведенных ниже примеров, которые не должны истолковываться как ограничивающие объем изобретения.
Примеры
Пример 1 - Получение и очистка вариантов ксилоглюканазы
Варианты ксилоглюканаз по настоящему изобретению получают по стандартным процедурам, вкратце: введение случайных и/или сайтспецифических мутаций в ген, трансформация клеток-хозяев Bacillus subtilis мутированными генами, ферментация трансформированных клеток-хозяев и получение варианта ксилоглюканазы из ферментативного бульона. Эталонную ксилоглюканазу (SEQ ID NO:3) получают рекомбинантно в Bacillus subtilis аналогичным образом.
Ферментацию проводят в культурах во встряхиваемых флаконах при 37°С в течение 4 дней встряхивания 100 мл PS-1 среды, содержащей одну таблетку СаСО3 (0,5 г), в колбе Эрленмейера на 500 мл с перегородками. Композиция среды PS-1 содержит 100 г/л сахарозы, 40 г/л соевой муки, 10 г/л Na2HPO4·12H2O, 0,1 мл/л Dowfax 63N10 и антибиотик в форме 6 мкг/мл хлорамфеникола.
После ферментации клетки из культурального бульона собирают центрифугированием (26000×g, 20 мин). Небольшой объем супернатанта стерильно фильтруют через 0,45 мкм фильтр и хранят в замороженном состоянии. Образцы оттаивают непосредственно перед началом описанных ниже анализов стабильности.
В некоторых случаях, образцы фермента очищают перед их использованием для тестов на стабильность.
Для очистки ферментов супернатанты фильтруют через фильтровальный блок NALGENE 0,2 мкм (№ по каталогу 569-0020) для удаления остатков клеток-хозяев. Величину рН фильтрата 0,2 мкм доводят до рН 5,0 с помощью 20% СН3СООН и фильтрат наносят на колонку XpressLine ProA (UpFront Chromatography A/S), уравновешивают в 50 мМ янтарной кислоты/NaOH, 1 мМ CaCl2, рН 5,0. После тщательной промывки колонки XpressLine ProA уравновешивающим буфером, ксилоглюканазу элюируют методом ступенчатого элюирования с помощью 50 мМ Tris/HCl, рН 9,0. Фракции собирают во время элюирования. Фракции из колонки анализируют на ксилоглюканазную активность (Пример 2) и фракции с активностью объединяют. Величину рН пула доводят до рН 9,0 с помощью 3М Tris-основания и пул разбавляют деминерализованной водой до такой же (или более низкой) проводимости, как у 50 мМ Tris/HCl, рН 9,0. Подготовленный раствор наносят на колонку SOURCE Q (GE Healthcare), уравновешенную в 50 мМ Tris/HCl, рН 9,0. После тщательного промывания колонки SOURCE Q уравновешивающим буфером фермент элюируют с линейным градиентом NaCl (0→0,5 М) в том же буфере, взятом в количестве, соответствующем пяти объемам колонки. Фракции из колонки снова анализируют на ксилоглюканазную активность и активные фракции дополнительно анализируют методом SDS-PAGE. Фракции, в которых наблюдается только одна полоса на окрашенном кумасси геле для SDS-PAGE, объединяют как очищенный препарат.
Пример 2 - Анализ ксилоглюканазы
Ксилоглюканазную активность образцов фермента, например, после очистки измеряют методом анализа с использованием AZCL-ксилоглюкана.
AZCL-ксилоглюкан (Megazyme) инкубируют с ксилоглюканазой и высвобождаемую синюю окраску измеряют при 650 нм. Ксилоглюканазную активность рассчитывают как усиление синей окраски во время инкубации после вычитания соответствующей величины для холостого раствора.
AZCL-ксилоглюкановый субстрат: 4 мг/мл AZCL-ксилоглюкан (Megazyme), гомогенно суспендированный в 0,01% Triton X-100 путем перемешивания.
Температура анализа: 37°С.
Буфер для анализа: 50 мМ янтарная кислота/NaOH, 0,01% Triton X-100, рН 5,0.
Помещают 500 мкл AZCL-ксилоглюканового субстрата на лед в пробирке Эппендорфа. Прибавляют 500 мл буфера для анализа и смесь выдерживают до охлаждения до температуры льда. Прибавляют 20 мл образца фермента (разбавленного 0,01% Triton X-100). Анализ инициируют путем переноса прибирки Эппендорфа в термомиксер Eppendorf, установленный на температуру анализа. Пробирку инкубируют в течение 15 минут на термомиксере Eppendorf при его наибольшей скорости встряхивания (1400 об/мин). Инкубацию останавливают путем переноса пробирки назад на ледяную баню. После того как пробирка охладится до температуры льда, пробирку недолго центрифугировали в охлажденной до температуры льда центрифуге для осаждения непрореагировавшего субстрата. Переносят 200 мл супернатанта на микротитровальный планшет и считывают A650. Холостой результат для буфера (20 мл 0,01% Triton X-100 вместо фермента) включают в анализ и разница между значениями A650 для образца фермента и холостого буфера является мерой ксилоглюканазной активности.
Пример 3 - Стабильность вариантов ксилоглюканазы
Стабильность в моющем средстве вариантов ксилоглюканаз по настоящему изобретению оценивали путем измерения активности вариантов после инкубации в жидком моющем средстве.
Тест на стабильность проводится путем прибавления образца фермента в жидкое моющее средство и выдерживания его при повышенной температуре, например 35°С или 40°С. По истечении заданного времени выдерживания определяют активность фермента и сравнивают с активностью эквивалентного образца, хранившегося при приблизительно -18°С в течение такого же периода времени. Результатом теста на стабильность является активность, определенная для образца, хранившегося при повышенной температуре, выраженная в % от активности, определенной для образца, хранившегося на холоду.
Результаты для вариантов ксилоглюканаз сравнивают с результатом для исходной ксилоглюканазы (SEQ ID NO:3), тестируемой в таких же самых условиях. Соотношение между этими двумя результатами определения стабильности является коэффициентом повышения стабильности (Stability Improvement Factor, SIF).
Варианты, имеющие SIF>1, являются более стабильными в условиях испытаний, чем исходная ксилоглюканаза. Предпочтительными являются варианты, имеющие высокие значения SIF в данном анализе.
Моющее средство
Жидкое моющее средство, использованное для тестов на стабильность, имеет следующую композицию.
Тест на хранение
Образцы фермента, приготовленные в соответствии с Примером 1, оттаивают непосредственно перед началом теста на стабильность при хранении.
Образцы фермента разбавляют до концентрации приблизительно 0,25 мг ферментного белка на мл.
Жидкое моющее средство разливается в стеклянные бутылки объемом приблизительно 12 мл, в количестве 1,0±0,05 грамма моющего средства в каждую бутылку.
Для каждого образца фермента готовят по две параллельные бутылки. Прибавляют в бутылки по 50 мкл разбавленного фермента и маленький стержень магнитной мешалки и плотно закрывают (для предотвращения испарения при хранении). Содержимое перемешивают с помощью стержня магнитной мешалки в течение примерно 5 минут. Одну из бутылок каждой пары помещают в морозильник при приблизительно -18°С. Другую бутылку помещают в пригодный термостат с заданной повышенной температурой, например 35°С или 40°С, для тестирования. По истечении заданного времени хранения бутылок в термостате их переносят в морозильник.
Анализ активности
Активность образцов фермента после выдерживания в моющем средстве измеряют с использованием следующей процедуры.
Материалы и реагенты:
1М фосфатный буфер, рН7:
Растворяют 138 грамм NaH2PO4·H2O в примерно 750 мл воды. Прибавляют 4N NaOH до рН 7,0. Затем доводят конечный объем до 1000 мл.
Буфер для анализа (50 мМ фосфат, рН7):
Смешивают 950 мл воды, 50 мл 1М фосфатного буфера, рН7, и 5 мл Berol 537 (неионное поверхностно-активное вещество, поставляемое фирмой Akzo Nobel). Доводят конечный рН до 7,00±0,02.
Субстрат:
Таблетки Cellazyme С, поставляемые фирмой Megazyme International Ireland Ltd, номер по каталогу T-CCZ. Таблетки содержат сшитую окрашенную НЕ-целлюлозу (гидроксиэтилцеллюлозу).
Процедура
Примерно за 30 минут перед началом анализа бутылки переносят из морозильника в холодильник с температурой приблизительно 4°С.Непосредственно перед началом анализа бутылки вынимают из холодильника, помещают на лабораторный стол и открывают.
Прибавляют 10 мл буфера для анализа (комнатная температура) в каждую открытую бутылку. Бутылки затем переносят на водяную баню с температурой 30°С, оборудованную погружной многопозиционной магнитной мешалкой. Содержимое осторожно перемешивают в течение примерно 5 минут.
Прибавляют по одной таблетке Cellazyme С в каждую бутылку. Продолжают перемешивание при скорости мешалки, достаточной для того, чтобы приводить в движение частицы субстрата, не давая им оседать. Бутылки снимают с водяной бани через 30 минут после прибавления таблетки и затем оставляют стоять при комнатной температуре без перемешивания в течение 15 минут.
С помощью пипетки приблизительно 1 мл практически прозрачного супернатанта из верхней части каждой бутылки переносят в полумикрокювету спектрофотометра. Затем измеряют оптическое поглощение при 590 нм (Abs590) с помощью пригодного спектрофотометра. Все измерения выполняют в течение 15 минут.
В анализ включают холостые образцы, т.е. эквивалентные образцы моющего средства, не содержащие добавленного фермента ксилоглюканазы.
Расчет
Для каждого образца фермента выполняют два измерения величины оптического поглощения (Abs590):
- A590f, которая представляет собой значение Abs590 образца, хранившегося при -18°С,
- A590w, которая представляет собой значение Abs590 образца, хранившегося при повышенной температуре.
Вычитают значение для холостого образца (A590b) из обоих значений - A590f (получая A590f - A590b) и A590w (получая A590w - A590b).
Стабильность рассчитывают как
% стабильности = ((A590w - A590b) / (A590f - A590b)) × 100%.
Для каждого фермента результаты для (A590f - A590b) должны находиться в интервале значений 0,1-1,2. Если значение выходит за пределы этого интервала, то результат для данного фермента должен считаться недостоверным, и тест должен быть повторен для другого разведения образца фермента.
Наконец, коэффициент повышения стабильности (SIF) для каждого варианта фермента рассчитывают следующим образом:
SIF = % стабильности образца фермента / % стабильности исходного фермента (SEQ ID NO:3).
Результаты
Ниже приведены результаты определения стабильности вариантов ксилоглюканазы, испытанных в разных условиях.
Пример 4 - Стабильность вариантов ксилоглюканазы
Стабильность в моющем средстве вариантов ксилоглюканазы в данном примере оценивалась путем измерения активности вариантов после инкубации в жидком моющем средстве.
Тест на стабильность проводили путем прибавления образца фермента в жидкое моющее средство и выдерживания его при повышенной температуре, например, 35°С или 46°С. Через заданный промежуток времени выдерживания активность фермента определяют и сравнивают с активностью идентичного образца, который хранился на холоду при приблизительно +5°С в течение такого же периода времени. Результатом теста на стабильность является активность, определенная для образца, выдержанного при повышенной температуре (подвергнутый стрессу образец), выраженная в % от активности, определенной для эквивалентного образца, хранившегося на холоду (не подвергнутый стрессу образец).
Результаты для вариантов ксилоглюканазы сравнивают с результатом для исходной ксилоглюканазы (SEQ ID NO:3), тестируемой в таких же условиях.
Моющее средство
Жидкое моющее средство, используемое для тестов на стабильность, имело следующий состав:
Тест на хранение
Образцы фермента, приготовленные в соответствии с Примером 1, оттаивали непосредственно перед началом теста на стабильность при хранении.
Образцы фермента использовали без дополнительного разбавления.
Жидкое моющее средство дозировали в круглодонный полистирольный 96-луночный микротитровальный планшет (Планшет 1) по 190 мкл моющего средства на лунку.
Прибавляют в каждую лунку десять мкл образца фермента и маленький стержень магнитной мешалки и планшет плотно закрывают (для предотвращения испарения) с помощью крышек из клейкой алюминиевой фольги (Beckman Coulter). Содержимое перемешивают с помощью стержней магнитной мешалки в течение примерно 30 минут.
Затем из каждой лунки Планшета 1 переносят 20 мкл смеси моющее средство-фермент в новый пустой идентичный планшет (Планшет 2). После этого оба планшета герметично закрывают.
Исходный планшет (Планшет 1) помещают в термостат с заданной повышенной температурой, например, 35°С или 46°С, для тестирования. Другой планшет (Планшет 2) помещают в холодильник при приблизительно 5°С.
После инкубации в течение предварительно заданного периода времени планшеты вынимают из холодильника и термостата. Планшеты помещают на лабораторный стол по меньшей мере на полчаса для того, чтобы все планшеты дошли до комнатной температуры.
После этого 20 мкл из каждой лунки Планшета 1 переносят в новый пустой круглодонный 96-луночный планшет (Планшет 1а).
Планшет 1а теперь содержит 20 мкл подвергнутых стрессу образцов и Планшет 2 содержит 20 мкл не подвергнутых стрессу образцов.
Анализ активности
Активность образцов фермента после выдерживания в моющем средстве измеряют в соответствии со следующей процедурой при комнатной температуре.
Принцип анализа:
Пара-нитрофенол-бета-D-целлотетраозид (pNP-бета-D-целлотетраозид) представляет собой синтетический субстрат, который гидролизуется вследствие каталитического действия определенных ксилоглюканазных ферментов.
Субстрат сам по себе является бесцветным; однако при гидролизе терминальной гликозидной связи редуцирующего конца высвобождается пара-нитрофенол, имеющий желтую окраску в буфере рН8 вследствие сильного поглощения при 405 нм.
Сам pNP-бета-D-целлотетраозид является очень стабильным в данных условиях проведения анализа. Таким образом, увеличение оптического поглощения при 405 нм является характерным признаком ферментативной активности.
Мы обнаружили, что исходная ксилоглюканаза (SEQ ID NO:3) принимала pNP-бета-D-целлотетраозид в качестве субстрата, про что свидетельствует сильное увеличение оптического поглощения при 405 нм.
Материалы и реагенты:
Буфер для анализа: 100 мМ EPPS; 0,01% Tween 20; рН 8,0.
pNP-бета-D-целлотетраозид (CAS-#: 129411-62-7; Toronto Research Chemicals; Canada)
Раствор субстрата: 1 мМ pNP-бета-D-целлотетраозид в буфере для анализа.
Процедура:
Планшет 1а содержит 20 мкл подвергнутых стрессу образцов и Планшет 2 содержит 20 мкл не подвергнутых стрессу образцов.
Образцы разбавляют путем прибавления 50 мкл буфера для анализа во все лунки Планшета 1а и Планшета 2 и перемешивания в течение одного часа с помощью встряхивателя для микротитровального планшета. Затем дополнительно прибавляют по 50 мкл буфера для анализа во все лунки и встряхивание продолжают в течение еще 10 минут.
Переносят 20 мкл образцов с коэффициентом разбавления 6 на прозрачный 384-луночный полистирольный микротитровальный планшет и прибавляют во все лунки 20 мкл раствора субстрата. Образцы перемешивают путем кратковременного встряхивания микротитровального планшета. Немедленно начинают кинетические измерения ферментативной активности путем наблюдения скорости увеличения оптического поглощения при 405 нм с помощью спектрофотометрического ридера для 384-луночных планшетов.
Определяют начальную скорость (Abs/мин) реакции. Начальная скорость реакции является мерой ферментативной активности в образце, что подтверждается линейной калибровочной кривой в соответствующем интервале концентраций фермента.
Расчет:
% остаточной активности рассчитывают как ферментативную активность подвергнутого стрессу образца, деленную на ферментативную активность идентичного не подвергнутого стрессу образца.
% остаточной активности = "Abs/мин (подвергнутый стрессу образец)" / "Abs/мин (не подвергнутый стрессу образец)" × 100%.
Результаты
Ниже приведены результаты определения стабильности вариантов ксилоглюканазы при проведении тестирования в различных условиях.
Жидкие композиции моющих средств для стирки
Композиции 1-8: Жидкие композиции моющих средств для стирки, пригодные для автоматических стиральных машин с передней загрузкой.
Композиции 9-16: Жидкие композиции моющих средств для стирки, пригодные для автоматических стиральных машин с верхней загрузкой.
Композиция 17: Жидкая моющая композиция для стирки в форме пакетика, инкапсулированного в пленку из поливинилового спирта.
Примеры 18-29
Ниже приведены гранулированные композиции моющих средств, изготовленные в соответствии с изобретением, пригодные для стирки тканей.
Размеры и значения величин, раскрытые тут, не следует понимать как строго ограниченные точными указанными численными значениями. Вместо этого, если не указано иное, каждый такой размер должен обозначать как указанное значение, так и функционально эквивалентный интервал, окружающий данное значение. Например, размер, раскрытый как "40 мм", должен обозначать "примерно 40 мм".
Реферат
Изобретение относится к области биотехнологии. Представлена моющая композиция, содержащая изолированный мутантный вариант исходной ксилоглюканазы, от 2 до 50 мас.% поверхностно-активного вещества и вспомогательный ингредиент, где вариант исходной ксилоглюканазы содержит одну из представленных в описании групп изменений; исходная ксилоглюканаза является ксилоглюканазой, имеющей по меньшей мере 90% идентичности с аминокислотной последовательностью SEQ ID NO:3, представленной в описании; и вариант обладает ксилоглюканазной активностью. Предложено применение указанной композиции для придания хлопку грязеотталкивающих свойств в процессе последующей стирки. Изобретение позволяет получить моющую композицию со стабильной ксилоглюканазой для придания хлопку грязеотталкивающих свойств в процессе последующей стирки. 2 н. и 9 з.п. ф-лы, 1 ил., 56 табл., 29 пр.
Формула
i) изолированный вариант исходной ксилоглюканазы, где вариант содержит одну из следующих комбинаций изменений:
*0aE+*0bV;
А221К;
А224Р;
A490R;
A7T+G200P+A224P+G225K+R267K+L268K+S269A;
A83D,E,R;
D119L;
D324N;
D33V+Q68H+N168H+V450I;
D37G+K129A+R156Y;
D37N+K129A+R156Y;
D395G;
E38I,V;
F146C,L;
F146L+K322I;
F281L;
F418I;
G200A,D,E,P,S;
G200P+A224P;
G225S;
G237A,S;
G253A;
G316I;
G36V+D37A+E38*+N39*;
G396P;
G413S;
G468S,Y;
G498A,D,S;
G518D;
G78A+K118A+K129A+R156Y;
G78A+K118A+K129A+R156Y+G200P+N331F;
G78A+K118A+K129A+R156Y+K169A;
G78A+T92V+K118A+K129A+R156Y;
G78A+T92V+K118A+K129A+R156Y+G200P+N331F;
G78A+T92V+K118A+K129A+R156Y+K169A;
H164N+G200A+G225N+R267K;
H164N+V179I+G200A+R211K+G225D+F281L;
H164N+V179I+G200A+R267K;
H193A,D,S,T;
H199A;
H3A;
H3A+H436A;
H436A;
I10V+D33E+M40L+A41T+Q67M+Y73F+S76D+G78A+Q82K+T92A+L102Q+Q137E+I222V+V228I+D249N+S269N+V272A+E333A+I337L+M356L+T374A+S416A+D444Y+A469E+K470T+I473G+T517A+S522*;
I10V+F17S+D33E+M40L+A41T+Q67M+N72S+S76D+G78A+Q82K+Q137E+V219A+D249N+V272A+I337L+M356L+V397A+S416A+T421I+S424N+N441D+D444Y+V450I+K470T+I473S+V477I;
I10V+F17S+D33E+M40L+Q67M+N72S+S76D+G78A+Q82K+T92A+L102Q+Q137E+H164N+N168K+T172A+V219A+I222V+V228I+D249N+S269N+V272A+E333A+I337L+M356L+N415S+T421I+S424H+N441D+D444Y+S522P+P523V+V524E;
I10V+F17S+D33E+M40L+Q67M+N72S+S76D+G78A+Q82K+T92A+L102Q+Q137E+I222V+V228I+D249N+V272A+I337L+M356L+T374A+V397A+S416A+T421I+S424N+N441D+D444Y+V450I+A469E+K470T+I473G+T517A+S522P+P523V+V524E;
I10V+F17S+D33E+Q67M+N72S+S76D+G78A+Q82K+T92A+L102Q+Q137E+N168K+T172A+I222V+V228I+D249N+V272A+E333A+I337L+M356L+V397A+S416A+T421I+S424H+N441D+D444Y+A469E+K470T+I473S+V477I+E489A+A490V+T517A+S522*;
I10V+F17S+M40L+Q67M+N72S+S76D+G78A+Q82K+T92A+L102Q+Q137E+I222V+V228I+D249N+S269N+V272A+T320A+I337L+M356L+T374A+V397A+N415S+T421I+S424H+N441D+D444Y+A469E+K470T+I473S+V477I+T517A+S522P+P523V+V524E;
I10V+F17S+Q67M+N72S+S76D+G78A+Q82K+T104A+Q137E+N153K+R156Q+V219A+I222V+V228I+D249N+S269N+V272A+E333A+I337L+M356L+V397A+N415S+D420G+T421I+S424H+N441D+D444Y+V450I+A469E+K470T+I473G+T517A+S522*;
I10V+F17S+Q67M+N72S+S76D+G78A+Q82K+T92A+T104A+Q137E+R156Q+V159A+H164N+N168K+T172A+I222V+V228I+D249N+V272A;
I10V+F17S+Y53H+Q67M+N72S+S76D+G78A+Q82K+T92A+L102Q+Q137E+T172V+A177T+I222V+V228I+D249N+S269N+I337L+M356L+V397A+S416A+T421I+S424H+N441D+D444Y+A469E+K470T+I473G+T517A+S522*;
I473T;
K101A;
K101A+K129A;
K101R;
K101R+L102I;
K118A,R;
K118A+K129A;
K118A+K129A+F146L+R156Y+G200P+N331F;
K118A+K129A+Q137E+R156Y+G200P+N331F;
K118A+K129A+R156Y;
K118A+K129A+R156Y+A224P;
K118A+K129A+R156Y+G200P;
K118A+K129A+R156Y+G200P+M310V+N331F;
K118A+K129A+R156Y+G200P+N331F;
K118A+K129A+R156Y+G200P+N331F+N399I;
K118A+K129A+R156Y+K169A+G200P+N331F;
K118A+K129A+R156Y+K470T;
K118A+R156Y;
K118A+R156Y+G200P;
K129A,R,S,T;
K129A+K169A;
K129A+K176P;
K129A+K275Q;
K129A+K445S;
K129A+Q137E+R156Y;
K129A+Q137E+R156Y+G200P;
K129A+Q137E+R156Y+K470T;
K129A+Q137E+V139K+N140F+Q147S+R156Y;
K129A+R156Y+A177T+V179I+A183S;
K129A+R156Y+A328G;
K129A+R156Y+D247G;
K129A+R156Y+D249G;
K129A+R156Y+D249N;
K129A+R156Y+D249S;
K129A+R156Y+D303I;
K129A+R156Y+D303K;
K129A+R156Y+D303S;
K129A+R156Y+D303V;
K129A+R156Y+D324N;
K129A+R156Y+D366H+T374A;
K129A+R156Y+D461N;
K129A+R156Y+D461Q;
K129A+R156Y+D461T;
K129A+R156Y+E288Q;
K129A+R156Y+G200P;
K129A+R156Y+G200P+G204T+R211K;
K129A+R156Y+H164N;
К129A+R156Y+H436Y;
K129A+R156Y+I10V+V14I+D19E;
K129A+R156Y+I222V+A224P+V228I+V232A;
K129A+R156Y+K176P;
K129A+R156Y+K176S;
K129A+R156Y+K275T;
K129A+R156Y+K322I+K454Q;
K129A+R156Y+K406N+N415G;
K129A+R156Y+K454Q;
K129A+R156Y+L380F+N383Y+D384G+N389T;
K129A+R156Y+N302K+D303L;
K129A+R156Y+N302K+D303S;
K129A+R156Y+N331F;
K129A+R156Y+P507A;
K129A+R156Y+R267H;
K129A+R156Y+R409L;
K129A+R156Y+R409T;
K129A+R156Y+S443D+K445S+L449I+V450I+S455N+M456Y;
K129A+R156Y+T244D;
K129A+R156Y+V159M+H164N+F165Y;
K129A+R156Y+V259I+R267K+L268K+S269A;
K13A,Q,R;
K13A+K129A;
K13A+Q68H+T92V+K118A+Q137E+R156Y+G200P;
K169A,Q,R;
K176P;
K18A,Q,R;
K206Q;
K217A;
K21A,Q;
K21Q+K129A;
K21R,T;
K220A,Q;
K252A,Q,R;
K275A,Q,R;
K306A,R;
K307Q,R;
K347A,Q,R;
K382A;
K406N;
K414A;
K445C+K470C;
K445R,S;
K454Q,R;
K470P,R,T;
K476A,Q,R;
K482A,Q;
K488A,Q,R,T;
K87Q;
K87V+K129A+K169A;
K8A,Q,S;
L102A+T104V+*104P;
L166I;
L268I;
L278I;
L34F,I,M,V;
L34I+K129A;
L380F;
M290R;
M310I,L,V;
M373Q;
M40L+A41T+Q67M+N72S+S76D+G78A+Q82K+Q137E+N153K+H164N+D249N+V272A+I337L+M356L+V397A+N415S+T421I+S424N+N441D+V450I+E489A+A490V+T517A+S522*;
M40V;
N140F;
N331A,C,D,G,H,M,Q;
N383Y;
N389A;
N399I;
N441G+A442E+S443D;
Q137D;
Q149E;
Q32H+M40L+R49G+D65E+Q67M+N72S+S76D+G78A+Q82K+T92A+L102Q+T104A+Q137E+H164N+K202E+I222V+V228I+D249N+M356L+T374A;
Q68H,L,M,N;
Q68H+T92V+К118A+K129A+R156Y+G200P+N331F;
Q68H+G200P+N331F;
Q68H+K118A+K129A+R156Y+G200P+N331F;
Q68H+K118A+Q137E+R156Y+G200P+N331F;
Q68H+K118A+R156V+G200P+N331F;
Q68H+K118A+R156Y+H193T+D366H;
Q68H+K118R+R156F;
Q68H+K118R+R156Y;
Q68H+K118R+R156Y+G200P;
Q68H+K118S+R156F+G200P+G274D+N331F;
Q68H+K129A+R156K+G200P+N331F;
Q68H+K129T+R156K+G200P+N331F;
Q68H+R156F+G200P+N331F;
Q68H+R156V+G200P+N331F;
Q68H+R156Y;
Q68H+R156Y+G200P+N331F;
Q68H+R156Y+H193T;
Q68H+R156Y+H193T+D366H;
Q68H+R156Y+H193T+G200P+M310V;
Q68H+S76W+T92V+K118A+Q137E+R156Y+G200P+N331F;
Q68H+T92A+K118A+K129A+R156Y+G200P+N331F;
Q68H+T92D+K118A+K129A+R156Y+G200P+N331F;
Q68H+T92I+K118A+K129A+R156Y+G200P+N331F;
Q68H+T92N+D97N+K118A+K129A+R156Y+G200P+N331F;
Q68H+T92S+K118A+K129A+R156Y+G200P+G274D+N331F;
Q68H+T92S+K118A+K129A+R156Y+G200P+N331F;
Q68H+T92V+G200P+M310V;
Q68H+T92V+G200P+M310V+N331F;
Q68H+T92V+K118A+K129A+Q137E+R156Y+G200P+A224P+N331F;
Q68H+T92V+K118A+K129A+Q137E+R156Y+G200P+N331F;
Q68H+T92V+K118A+K129A+Q137E+R156Y+H193T;
Q68H+T92V+K118A+K129A+Q137E+R156Y+H193T+D366H; Q68H+T92V+K118A+K129A+Q137E+R156Y+H193T+G200P+M310V+E446K;
Q68H+T92V+K118A+K129A+Q137E+R156Y+H193T+N331H;
Q68H+T92V+K118A+K129A+Q137E+R156Y+H193T+N331K;
Q68H+T92V+K118A+K129A+Q137E+R156Y+H193T+N331Q;
Q68H+T92V+K118A+K129A+R156Y+G200P+N331F;
Q68H+T92V+K118A+K129A+R156Y+H193T;
Q68H+T92V+K118A+K129A+R156Y+H193T+D366H;
Q68H+T92V+K118A+K129A+R156Y+H193T+G200P+M310V;
Q68H+T92V+K118A+Q137E+G200P+N331F;
Q68H+T92V+K118A+Q137E+N140F+R156Y+G200P+K470T;
Q68H+T92V+K118A+Q137E+R156Y+G200P;
Q68H+T92V+K118A+Q137E+R156Y+G200P+D324N;
Q68H+T92V+K118A+Q137E+R156Y+G200P+K470T;
Q68H+T92V+K118A+Q137E+R156Y+G200P+M310L;
Q68H+T92V+K118A+Q137E+R156Y+G200P+N331F;
Q68H+T92V+K118A+Q137E+R156Y+N331F;
Q68H+T92V+K118A+R156Y;
Q68H+T92V+K118A+S123P+K129A+Q137E+R156Y+G200P+N331F;
Q68H+T92V+K118A+S123T+K129A+Q137E+R156Y+G200P+N331F;
Q68H+T92V+K118R+R156F;
Q68H+T92V+K118R+R156Y+H193T+D366H;
Q68H+T92V+Q137E+R156Y+G200P+N331F;
Q68H+T92V+R156F+G200P+M310V;
Q68H+T92V+R156F+G200P+M310V+N331F;
Q68H+T92V+R156F+G200P+M310V+S484C;
Q68H+T92V+R156F+H193T;
Q68H+T92V+R156F+H193T+D366H;
Q68H+T92V+R156F+H193T+G200P+M310V;
Q68H+T92V+R156V+G200P+M310V;
Q68H+T92V+R156V+G200P+M310V+N331F;
Q68H+T92V+R156Y;
Q68H+T92V+R156Y+G200P+M310V;
Q68H+T92V+R156Y+G200P+M310V+N331F;
Q68H+T92V+R156Y+H193T;
Q68H+T92V+R156Y+H193T+D366H;
Q68H+T92V+R156Y+H193T+G200P+M310V;
Q68H+T92Y+K118A+K129A+R156Y+G200P+N331F;
R156A,E,F,I,K,M,T,V,W;
R156Y+N331F;
R20A;
R267A;
R295A;
R340A;
R340N,T;
R500A;
R500T,V;
S123P,T;
S123T+K129A+R156Y;
S214E;
S332P+V397I;
S443E,K,Q;
S467R+G468S+A469T;
S76E,I,K,M,R,T,V,W;
S76W;
S76W+G200P;
S76W+G200P+A224P;
T104A;
Т104A+P111Q+A117S+K129A+R156Y;
T417K;
T92I,V;
T92V+K118A+K129A+Q137E+R156Y+G200P+N331F;
T92V+K118A+K129A+R156Y;
T92V+K118A+K129A+R156Y+G200P+N331F;
T92V+K118A+K129A+R156Y+H164N+G200P+N331F;
T92V+K118A+Q137E+R156Y+G200P+N331F;
T92V+К129A+R156Y;
T9D;
T9D+L34F+A83E+Q149E+H193T+S332P+R340T;
V1*+V2*+H3*;
V1*+V2*+H3*+G4*+Q5*;
V159M;
V345I;
V397S;
V431E;
W391V;
при этом:
a) нумерация позиций соответствует положению в аминокислотной последовательности SEQ ID NО:3;
b) исходная ксилоглюканаза является ксилоглюканазой, имеющей по меньшей мере 90% идентичности с аминокислотной последовательностью SEQ ID NО:3; и
c) вариант обладает ксилоглюканазной активностью;
ii) от 2 до 50 мас.% поверхностно активного вещества и
iii) вспомогательный ингредиент.
(a) амфифильного алкоксилированного грязеудаляющего полимера;
(b) статистического привитого сополимера, где статистический привитой сополимер содержит:
(i) гидрофильную основную цепь, содержащую мономеры, выбранные из группы, состоящей из: ненасыщенных C1-C6 карбоновых кислот, простых эфиров, спиртов, альдегидов, кетонов, сложных эфиров, звеньев сахаров, алкоксидных звеньев, малеинового ангидрида, насыщенных многоосновных спиртов, таких как глицерин, и их смесей; и
(ii) гидрофобной боковой цепи (цепей), выбранных из группы, состоящей из: C4-C25 алкильной группы, полипропилена, полибутилена, винилового сложного эфира насыщенной C1-C6 монокарбоновой кислоты, C1-С6 алкилового сложного эфира акриловой или метакриловой кислоты и их смесей;
(с) соединения, имеющего следующую общую структуру: бис((С2Н5O)(С2Н4O)n)(СН3)-N+-СхН2х-N+-(СН3)-бис((С2Н5O)(С2Н4O)n), где n = от 20 до 30 и х = от 3 до 8, или его сульфатированных или сульфонированных вариантов.
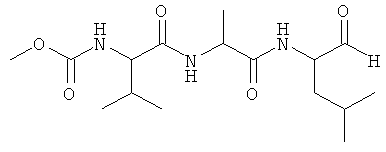

Комментарии