Варианты альфа-амилазы bacillus licheniformis с повышенной термостабильностью и/или сниженной кальциевой зависимостью - RU2469087C2
Код документа: RU2469087C2
Чертежи















Описание
СПИСОК ПОСЛЕДОВАТЕЛЬНОСТЕЙ
Прилагается список последовательностей, включающий SEQ ID NO:1-6, содержание которого включено в данный документ в качестве ссылки в полном объеме.
ОБЛАСТЬ ИЗОБРЕТЕНИЯ
Представлены нуклеиновые кислоты и кодируемые ими полипептиды. Указанные полипептиды имеют альфа-амилазную активность, где полипептид является модифицированной формой альфа-амилазы Bacillus, в частности альфа-амилазы Bacillus licheniformis, и полипептид характеризуется изменением по меньшей мере одного из следующих свойств относительно указанной исходной альфа-амилазы: субстратной специфичности, связывания субстрата, паттерна расщепления субстрата, термостабильности, рН-профиля активности, рН-профиля стабильности, устойчивости к окислению, Са2+-зависимости, уменьшенной и увеличенной pI и улучшенных моющих свойств, специфической активности, стабильности, например, при высоких температурах и/или в условиях низких рН, в частности при низких концентрациях кальция.
Полипептиды, описанные в данном документе, пригодны для обработки крахмала, получения этанола, создания детергента, мойки посуды, чистки твердых поверхностей, расшлихтовки текстильного изделия и/или производства подсластителей.
ПРЕДПОСЫЛКИ
Крахмал состоит из смеси амилозы (15-30% в/в) и амилопектина (70-85% в/в). Амилоза состоит из линейных цепей α-1,4-связанных молекул глюкозы с молекулярным весом (MW) от приблизительно 60000 до приблизительно 800000. Амилопектин представляет собой разветвленный полимер, содержащий те же самые α-1,4-связанные молекулы глюкозы, а также α-1,6 точки разветвления через каждые 24-30 глюкозных остатков; его MW может достигать до 100 миллионов.
Сахара из крахмала в виде концентрированного паточного сиропа на сегодняшний день получают в ходе ферментативного процесса, включающего: (1) разжижение (или уменьшение вязкости) твердого крахмала под действием альфа-амилазы с образованием декстринов, имеющих среднюю степень полимеризации, равную приблизительно 7-10; и (2) осахаривание получаемого разжиженного крахмала, то есть гидролизата крахмала, под действием амилоглюкозидазы (также называемой глюкоамилазой). Получаемый сироп имеет высокое содержание глюкозы. Значительная часть глюкозного сиропа, получаемого промышленным способом, в дальнейшем ферментативно изомеризуется с образованием декстроза-фруктозной смеси, известной как изосироп.
Альфа-амилазы (ЕС 3.2.1.1) гидролизуют крахмал, гликоген и родственные полисахариды путем расщепления внутренних α-1,4-гликозидных связей случайным образом. Эти ферменты имеют ряд важных применений в промышленности, включая разжижение крахмала, расшлихтовку текстильного изделия, модификацию крахмала в бумажной и целлюлозной промышленности, переработку зерна, выпекание и пивоварение. Альфа-амилазы также могут быть использованы в детергентах автоматической мойки посуды и в составе детергента для стирки белья, включая те, которые содержат отбеливатели, для удаления крахмальных пятен во время мойки.
Альфа-амилазы выделяют из огромного числа бактерий, грибов, растений и животных. Многие промышленно важные альфа-амилазы выделяют из видов Bacillus, например Bacillus licheniformis, отчасти из-за высокой способности Bacillus секретировать амилазы в ростовую среду. Хотя альфа-амилазу В. Licheniformis можно получить экономично, этот фермент, как и другие альфа-амилазы, не используется в некоторых сферах применения, несмотря на то, что альфа-амилаза В. Licheniformis имеет значительную структурную гомологию с этими альфа-амилазами. В последние годы были сделаны попытки создания вариантов альфа-амилазы с улучшенными свойствами в связи со специфическим использованием, таким как разжижение крахмала и расшлихтовка текстильного изделия.
В промышленности сохраняется потребность в идентификации и оптимизации амилаз, пригодных для различных сфер применения, включая промышленные процессы разжижения. Эти кислые амилазы второго поколения будут обладать улучшенными технологическими и/или эксплуатационными характеристиками по сравнению с промышленными стандартными ферментами, например, из Bacillus licheniformis. Таким образом, сохраняется потребность в таком варианте альфа-амилазы, который по сравнению с соответствующей исходной альфа-амилазой (то есть не мутированной альфа-амилазой) будет иметь альфа-амилазную активность и характеризоваться изменением по меньшей мере одного из вышеупомянутых свойств относительно указанной исходной альфа-амилазы.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Один из аспектов изобретения относится к варианту исходной альфа-амилазы В. Licheniformis, где данный вариант имеет аминокислотную последовательность, которая по меньшей мере приблизительно на 90% идентична последовательности SEQ ID NO:4 и содержит замену S239, соответствующую SEQ ID NO:4, и где указанный вариант проявляет альфа-амилазную активность. Вариант может содержать SEQ ID NO:2; альтернативно, он может по существу состоять из SEQ ID NO:2 или состоять из SEQ ID NO:2. Вариант может представлять замену S239: либо S239Q, либо S239A. Другой аспект изобретения относится к варианту, который по меньшей мере приблизительно на 95% идентичен последовательности SEQ ID NO:4 или по меньшей мере приблизительно на 98% идентичен данной последовательности.
Другой аспект изобретения относится к варианту, имеющему измененную температуру плавления по сравнению с альфа-амилазой SEQ ID NO:4.
Альтернативно, рассматриваемый вариант не требует дополнительного кальция.
Другой аспект изобретения относится к выделенной нуклеиновой кислоте, кодирующей вариант исходной альфа-амилазы В. Licheniformis, где указанный вариант имеет замену S239, соответствующую SEQ ID NO:4, и по меньшей мере приблизительно на 90% идентичен последовательности SEQ ID NO:4 и где указанный вариант проявляет альфа-амилазную активность. Выделенная нуклеиновая кислота может содержать SEQ ID NO:2 или кодировать любой из вариантов, обсуждаемых выше и здесь. Другой аспект изобретения относится к вектору, содержащему нуклеиновую кислоту в функционально связанном виде. В следующем аспекте изобретения нуклеиновая кислота рассматривается в составе клетки-хозяина, возможно в векторе, содержащем указанную нуклеиновую кислоту в этой клетке-хозяине. Клетка-хозяин может быть бактерией или грибом. Бактерия может быть грамположительной бактерией, выбранной из группы, состоящей из Bacillus subtilis, B. licheniformis, B. lentus, B. brevis, B. stearothermophilus, B. alkalophilus, B. amyloliquefaciens, B. coagulans, B. circulans, B. lautus, B. thuringiensis, Streptomyces lividans и S. murinus; или грамотрицательной бактерией, где указанная грамотрицательная бактерия является Escherichia coli и видом Pseudomonas.
Другой аспект относится к композиции для разжижения крахмала, содержащей вариант, обсуждаемый выше или здесь, и где указанная композиция находится в растворе. Следующий вариант осуществления изобретения относится к способу разжижения крахмала, включающему применение композиции по отношению к молотой кукурузе или крахмальной суспензии в течение времени, достаточного для разжижения указанного крахмала. Композиция может быть добавлена к молотой кукурузе или крахмальной суспензии в концентрации 40-60 мкг/г сухого твердого вещества. Крахмальный раствор может быть раствором кукурузного крахмала. Следующий аспект изобретения относится к разжижению крахмальной суспензии при температуре от приблизительно 85°С до приблизительно 105°С. Альтернативно или в качестве дополнения, крахмальная суспензия может быть разжижена при рН от приблизительно 4,5 до приблизительно 6,5. Продукт разжижения может быть, кроме того, подвергнут брожению для получения этанола. Более того, предполагается то, что этап брожения производит по меньшей мере приблизительно на 2,5% (по объему) этанола больше, чем дикий тип. При этом с коммерческой точки зрения указанные этапы разжижения и брожения могут проводиться одновременно в одном и том же реакционном резервуаре. Это может быть осуществлено в присутствии кальция, но также может быть выполнено без дополнительного кальция, который добавляют в состав реакционной смеси.
Другой аспект относится к композиции для осахаривания крахмала, с использованием любого из вариантов, обсуждаемых выше или здесь. Способ осахаривания крахмала заключается в применении композиции, содержащей вариант, в течение времени, достаточного для осахаривания указанного крахмала. Дополнительный кальций не должен быть добавлен.
Другой аспект изобретения относится к моющей добавке. Моющая добавка может содержать вариант, обсуждаемый выше или здесь. Моющая добавка может дополнительно содержать фермент, выбранный из группы, состоящей из: целлюлазы, протеазы, аминопептидазы, амилазы, карбогидразы, карбоксипептидазы, каталазы, хитиназы, кутиназы, циклодекстринглюканотрансферазы, дезоксирибонуклеазы, эстеразы, α-галактозидазы, β-галактозидазы, глюкоамилазы, α-глюкозидазы, β-глюкозидазы, галопероксидазы, инвертазы, лакказы, липазы, маннозидазы, оксидазы, пектинолитического фермента, пептидоглутаминазы, пероксидазы, фитазы, полифенолоксидазы, протеолитического фермента, рибонуклеазы, трансглутаминазы, ксиланазы, пуллуланазы, изоамилазы, каррагиназы или любой комбинации вышеперечисленного. Моющая добавка может быть, кроме того, в виде не пылящего гранулята, микрогранулята, стабилизированной жидкости или защищенного фермента.
Другой аспект изобретения относится к композиции детергента (для очистки поверхностей, стирки и мойки посуды). Рассматриваемая композиция детергента может содержать моющую добавку, описанную выше и здесь. Она может дополнительно содержать один или несколько ферментов, выбранных из группы, состоящей из целлюлазы, протеазы, аминопептидазы, амилазы, карбогидразы, карбоксипептидазы, каталазы, хитиназы, кутиназы, циклодекстринглюканотрансферазы, дезоксирибонуклеазы, эстеразы, α-галактозидазы, β-галактозидазы, глюкоамилазы, α-глюкозидазы, β-глюкозидазы, галопероксидазы, инвертазы, лакказы, липазы, маннозидазы, оксидазы, пектинолитического фермента, пептидоглутаминазы, пероксидазы, фитазы, полифенолоксидазы, протеолитического фермента, рибонуклеазы, трансглутаминазы, ксиланазы, пуллуланазы, изоамилазы, каррагиназы или любой комбинации вышеперечисленного. Композиция детергента может дополнительно содержать поверхностно-активное вещество в любой комбинации с вышеперечисленным. Композиции детергента могут дополнительно содержать один или несколько поверхностно-активных веществ, моющих компонентов детергента, комплексообразователей, полимеров, систем отбеливания, стабилизаторов, пенообразователей, пеногасителей, антикоррозийных средств, преобразующих грязь в суспензию средств, средств от повторного загрязнения, красителей, бактерицидных средств, гидротропов, оптических отбеливателей, кондиционеров для ткани и отдушек.
Другой аспект изобретения относится к композиции расшлихтовки текстильного изделия, содержащей вариант, обсужденный выше или здесь, в водном растворе и дополнительно содержащей другой фермент. Кроме того, рассматривается способ расшлихтовки текстильного изделия, включающий применение композиции расшлихтовки в течение времени, достаточного для расшлихтовки указанного текстильного изделия. Способ не требует добавления дополнительного кальция.
Следующий аспект изобретения относится к композиции для переработки крахмала, содержащей вариант, обсужденный выше или здесь. Композиция для переработки крахмала может дополнительно содержать глюкоамилазу, изоамилазу, пуллуланазу, фитазу или любую комбинацию вышеуказанного. Композиция для переработки крахмала может быть использована для переработки крахмала путем применения композиции в течение времени, достаточного для переработки указанного крахмала. Не требуется добавлять дополнительный кальций.
Следующий аспект изобретения относится к композиции для выпекания, содержащей вариант, описанный выше или здесь. Другой аспект изобретения относится к способу выпекания с использованием указанной композиции, включающему применение композиции для выпекания.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
Прилагаемые чертежи включены и составляют часть настоящего описания изобретения, иллюстрируют варианты осуществления изобретения. На чертежах:
На Фиг.1 представлена плазмида pHPLT-LAT, используемая для синтеза вариантов LAT S239.
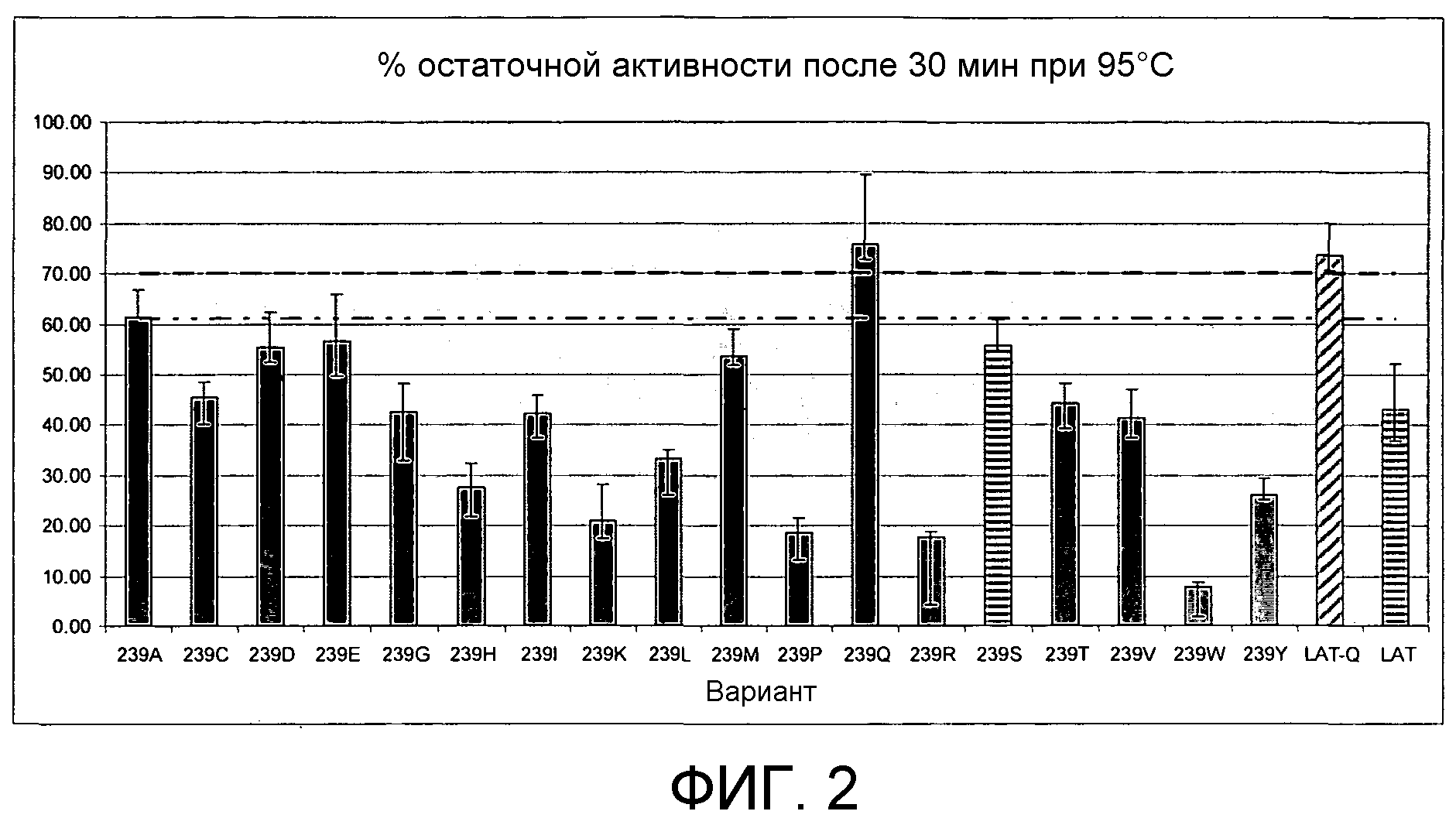
На Фиг.2 представлен процент остаточной активности вариантов LAT S239 после теплового шока при 95°С в течение 30 минут. По вертикальной оси отложен % остаточной активности после теплового шока. Пунктирная линия представляет 2Х и 3Х превышение стандартного отклонения от имеющейся остаточной активности LAT дикого типа. Варианты S239Q и S239A демонстрируют повышенную термостабильность относительно LAT дикого типа. Наблюдаемое повышение термостабильности статистически значимо.
На Фиг.3 представлена остаточная активность варианта LAT S239Q по сравнению с исходной LAT дикого типа в буферах. Чертеж построен путем нанесения % остаточной амилазной активности в зависимости от времени реакции и рН реакции. Относится к Примеру 3.
На Фиг.4 представлена остаточная активность варианта LAT S239Q по сравнению с исходной LAT дикого типа в субстрате. Чертеж построен путем нанесения % остаточной амилазной активности в зависимости от времени реакции и рН реакции. Относится к Примеру 3.
На Фиг.5 представлены рН-профили варианта LAT S239Q по сравнению с исходной LAT дикого типа. Чертеж построен путем нанесения % остаточной амилазной активности в зависимости от рН реакции. Относится к Примеру 3.
На Фиг.6 представлены температурные профили варианта LAT S239Q по сравнению с LAT дикого типа. Чертеж построен путем нанесения общего количества редуцирующих сахаров (как продукта амилазной реакции) в зависимости от температуры реакции. Относится к Примеру 3.
На Фиг.7 представлено нарастание DE общего количества молотой кукурузы, обработанной вариантом LAT S239Q по сравнению с Fred при 108°С и 115°С. Чертеж построен путем нанесения наблюдаемого значения DE в зависимости от времени вторичного разжижения. Относится к Примеру 6.
На Фиг.8 представлено нарастание DE общего количества молотой кукурузы, обработанной вариантом LAT S239Q по сравнению с Fred при различных рН. Чертеж построен путем нанесения наблюдаемого значения DE в зависимости от времени вторичного разжижения. Относится к Примеру 6.
На Фиг.9 представлено нарастание DE общего количества молотой кукурузы, обработанной вариантом LAT S239Q, по сравнению с Fred при рН 5,6 и низком содержании кальция. Чертеж построен путем нанесения наблюдаемого значения DE в зависимости от времени вторичного разжижения. Относится к Примеру 6.
ПОДРОБНОЕ ОПИСАНИЕ
1. Определения и аббревиатуры
В соответствии с настоящим подробным описанием используются следующие аббревиатуры и определения. Следует отметить, что используемая в настоящем документе форма единственного числа включает формы множественного числа, если только в контексте отчетливо не предусмотрено иное. Так, например, ссылка на «полипептид» включает множество таких полипептидов и ссылка на «композицию» включает одну или несколько композиций и эквивалентов вышеуказанного, известных специалистам в данной области техники, и так далее.
Если не определено иное, все технические и научные термины, используемые в данном документе, имеют значения, общепринятые среди специалистов в данной области техники. Ниже представлены следующие термины.
1.1. Определения
«Крахмал» относится к любому веществу, состоящему из сложных полисахаридных карбогидратов растений, состоящих из амилозы и амилопектина, обозначенного формулой (C6H10O5)x, где «Х» может быть любым числом. В частности, термин относится к любому веществу растительного происхождения, включая, помимо прочего, зерновые культуры, травы, клубнеплоды и корнеплоды, в частности пшеницу, ячмень, кукурузу, рожь, рис, сорго, отруби, маниоку, просо и тапиоку.
«Амилаза» означает фермент, который, помимо всего прочего, способен катализировать расщепление крахмала. «Амилаза» включает любую амилазу, такую как глюкоамилазу, альфа-амилазу, β-амилазу и альфа-амилазу дикого типа вида Bacillus, в частности B. licheniformis. Амилазы являются гидролазами, которые расщепляют α-D-(1→4)О-гликозидные связи в крахмале. Как правило, альфа-амилазы (EC 3.2.1.1; α-D-(1→4)-глюкан глюканогидролаза) характеризуются как эндоферменты, расщепляющие α-D-(1→4)О-гликозидные связи в молекуле крахмала случайным образом. Напротив, амилолитические экзоферменты, такие как β-амилазы (EC 3.2.1.2; α-D-(1→4)-глюкан мальтогидролаза), и некоторые продукт-специфичные амилазы, как мальтогенная альфа-амилаза (EC 3.2.1.133), расщепляют молекулу крахмала с нередуцированного конца субстрата. β-амилазы, α-глюкозидаза (EC 3.2.1.20; α-D-гликозид глюкогидролаза), глюкоамилаза (EC 3.2.1.3; α-D-(1→4)-глюкан глюкогидролаза) и продукт-специфические амилазы могут образовывать мальтоолигосахариды определенной длины из крахмала.
«Варианты» относятся как к полипептидам, так и нуклеиновым кислотам. Термин «вариант» может быть использован взаимозаменяемо с термином «мутант». Варианты включают вставки, замены, трансверсии, усечение концов и/или инверсии в одном или нескольких местах в аминокислотной или нуклеотидной последовательностях относительно исходной последовательности. Нуклеиновые кислоты варианта могут включать последовательности, комплементарные последовательности, способные гибридизоваться с нуклеотидными последовательностями, представленными в данном документе. Например, последовательность варианта комплементарна последовательностям, способным гибридизоваться в жестких условиях (например, 50°С и 0,2X SSC {1X SSC = 0,15 M NaCl, 0,015 M цитрат натрия, рН 7,0}) с нуклеотидными последовательностями, представленными в данном документе. В частности, термин вариант подразумевает последовательности, которые комплементарны последовательностям, способным гибридизоваться в условиях высокой жесткости (например, 65°С и 0,1Х SSC) с нуклеотидными последовательностями, представленными в данном документе.
«Изолированный» означает, что последовательность по меньшей мере практически свободна от хотя бы одного компонента, с которым данная последовательность связана самопроизвольным образом и является природной.
«Очищенный» означает, что вещество находится в относительно чистом состоянии, например, имеет по меньшей мере приблизительно 90% чистоты, по меньшей мере приблизительно 95% чистоты, по меньшей мере приблизительно 98% чистоты или по меньшей мере приблизительно 99% чистоты.
«Термостабильный» означает, что фермент термостабильнее фермента сравнения. В настоящей заявке вариант альфа-амилазы термостабильнее альфа-амилазы дикого типа B. licheniformis, если вариант имеет относительно высокую ферментативную активность после определенного интервала времени в тех же экспериментальных условиях, например, при той же температуре, концентрации субстрата и т.д. Альтернативно, более термостабильный фермент имеет более высокую теплоемкость, измеренную дифференциальной сканирующей калориметрией, относительно фермента сравнения.
«Температура плавления» полипептида - это температура, при которой 50% образца полипептида полностью денатурирует.
«Кальциевая зависимость» означает, что существует необходимость добавления дополнительного кальция для использования фермента в указанной заявке.
«Диапазон рН» означает значения рН, при больших или меньших величинах которых фермент проявляет активность.
Используемый в настоящем документе «рН-стабильный» означает, что фермент стабильнее фермента сравнения при определенном значении рН. В настоящей заявке вариант альфа-амилазы рН-стабильнее альфа-амилазы дикого типа B. licheniformis, если вариант имеет относительно высокую активность после определенного интервала времени в тех же экспериментальных условиях, например при том же значении рН и т.д.
«Рекомбинантный» при использовании по отношению к клетке, нуклеиновой кислоте, белку или вектору означает, что данная клетка, нуклеиновая кислота, белок или вектор были модифицированы путем введения гетерологичной нуклеиновой кислоты или белка или путем изменения нативной нуклеиновой кислоты или белка или что данная клетка была получена из клетки, модифицированной таким образом. Так, например, рекомбинантные клетки экспрессируют гены, которых нельзя обнаружить в нативных (не рекомбинантных) клетках, или экспрессируют нативные гены, которые иным образом аномально экспрессируются, мало экспрессируются или не экспрессируются вовсе.
Используемый в данном документе «пищевой продукт» включает как приготовленный пищевой продукт, так и ингредиент пищевого продукта, такой как мука.
Используемый в данном документе «ингредиент пищевого продукта» включает композицию, которая добавляется или может быть добавлена в продукт здорового питания или кормовой продукт, и включает композиции, используемые в небольших количествах в широком наборе продуктов, требующих, например, подкисления или эмульгирования. Ингредиент пищевого продукта может быть в виде раствора или твердого вещества в зависимости от использования, и/или способа применения, и/или способа введения.
Используемый в данном документе «продукт здорового питания» означает способность пищевого продукта обеспечить не только действие питательных веществ и удовлетворение вкуса, но также и любое дополнительное благотворное действие потребителю.
Используемый в данном документе термин «аминокислотная последовательность» является синонимом термина «полипептид» и может быть использован взаимозаменяемо с термином «белок». В некоторых случаях термины «аминокислотная последовательность», «пептид» и «аминокислотная последовательность» и «фермент».
Используемая в данном документе «нуклеотидная последовательность» или «последовательность нуклеиновой кислоты» относится к олигонуклеотидной последовательности или полинуклеотидной последовательности и вариантам, гомологам, фрагментам и их производным. Нуклеотидная последовательность может быть геномного, синтетического или рекомбинантного происхождения и может быть двухцепочечной или одноцепочечной, будь то смысловая или антисмысловая цепь. Используемый в данном документе термин «нуклеотидная последовательность» включает геномную ДНК, кДНК, синтетическую ДНК и РНК.
«Вектор» относится к полинуклеотидной последовательности, сконструированной для введения нуклеиновых кислот в один или несколько типов клеток. Векторы включают векторы для клонирования, экспрессионные векторы, бифункциональные векторы, плазмиды, фаговые частицы, кассеты и тому подобное.
Используемый в данном документе «экспрессионный вектор» означает конструкцию ДНК, содержащую последовательность ДНК, которая функционально связана с подходящей регуляторной последовательностью, обеспечивающей эффективную экспрессию ДНК в подходящем хозяине. Такие регуляторные последовательности могут включать промотор для воздействия на транскрипцию, дополнительную последовательность оператора для регулирования транскрипции, последовательность, кодирующую подходящие сайты связывания рибосом на мРНК, энхансеры и последовательности, регулирующие терминацию транскрипции и трансляции.
«Сигнальная последовательность» означает последовательность аминокислот, связанную с N-концевой частью белка, которая облегчает секрецию зрелой формы белка из клетки. Определение сигнальной последовательности является функциональным. У зрелой формы внеклеточного белка отсутствует сигнальная последовательность, которая отщепляется во время процесса секреции.
«Ген» относится к сегменту ДНК, который участвует в синтезе полипептида и содержит области, предшествующие кодирующим областям и следующие за ними, а также встроенные последовательности (интроны) между отдельными кодирующими сегментами (экзонами).
«Промотор» является регуляторной последовательностью, участвующей в связывании РНК-полимеразы для инициации транскрипции гена. Промотор может быть индуцибельным промотором или конститутивным промотором. Типичным, используемым в настоящем документе промотором является Trichoderma reesei cbh1, который является индуцибельным промотором.
«Находящийся под транскрипционным контролем» является термином, хорошо понятным в данной области техники, который означает, что транскрипция полинуклеотидной последовательности, как правило последовательности ДНК, зависит от ее функциональной связи с элементом, который способствует инициации или активации транскрипции.
«Находящийся под трансляционным контролем» является термином, хорошо понятным в данной области техники, который означает регуляторный процесс, происходящий после образования мРНК.
При описании белков и кодирующих их генов используемое в настоящем документе обозначение гена выделяется курсивом (например, ген, кодирующий amyL (B. licheniformis AA) может быть обозначен как amyL). Обозначение белка, как правило, не выделяется курсивом и первая буква обычно пишется заглавной (например, белок, кодируемый геном amyL, может быть обозначен как AmyL или amyL).
Термин «происходящий» распространяется на термины «происходящий из», «полученный» или «получаемый из» или «выделенный из».
«Функционально связанный» относится к соединению, в котором элементы расположены в определенном порядке, что позволяет им быть функционально связанными. Например, промотор является функционально связанным с кодирующей последовательностью, если он регулирует транскрипцию данной последовательности.
«Селективный маркер» относится к гену, способному экспрессироваться в хозяине, что позволяет без труда отобрать этих хозяев, содержащих введенную нуклеиновую кислоту или вектор. Примерами селективных маркеров являются, помимо прочего, антибактериальные препараты (например, гигромицин, блеомицин или хлорамфеникол) и/или гены, наделяющие метаболическим преимуществом клетку-хозяина, как, например, преимуществом, обусловленным питанием.
«Введенный» в контексте введения нуклеиновой кислоты в клетку означает «трансфекцию», или «трансформацию», или «трансдукцию» и включает ссылку на внедрение последовательности нуклеиновой кислоты в эукариотическую или прокариотическую клетку, в которой последовательность нуклеиновой кислоты может быть встроена в геном данной клетки (например, хромосому, плазмиду, пластиду или митохондриальную ДНК), превращена в автономный репликон или временно экспрессироваться (например, трансфицированная мРНК).
Используемая в настоящем документе «трансформированная клетка» включает клетки, трансформированные с использованием технологий рекомбинантной ДНК. Трансформация обычно происходит путем введения одной или нескольких нуклеотидных последовательностей в клетку. Введенная нуклеотидная последовательность может быть гетерологичной нуклеотидной последовательностью, т.е. последовательностью, не естественной для данной клетки, подлежащей трансформации, как, например химерный белок.
«Хозяйский штамм» или «клетка-хозяин» означает подходящего хозяина для экспрессионного вектора или конструкции ДНК, содержащих полинуклеотид, кодирующий фермент варианта альфа-амилазы в соответствии с описанием изобретения. В частности, хозяйские штаммы могут быть бактериальными клетками. В варианте осуществления изобретения «клетка-хозяин» означает как клетки, так и протопласты, происходящие из клеток микробного штамма, в частности вида Bacillus.
Полинуклеотид или полипептид, имеющий определенный процент (например, по меньшей мере приблизительно 80%, 85%, 90%, 95% или 99%) идентичности с другой последовательностью, означает, что при выравнивании процент оснований или аминокислотных остатков одинаков при сравнении двух последовательностей. Это выравнивание или процент гомологии или идентичность могут быть определены с использованием любой подходящей компьютерной программы, известной в данной области техники, например, тех, что описаны в СОВРЕМЕННЫХ ПРОТОКОЛАХ В МОЛЕКУЛЯРНОЙ БИОЛОГИИ (F. M. Ausubel et al. (eds) 1987, Supplement 30, section 7.7.18). Такие программы могут включать программу GCG Pileup, FASTA (Pearson et al. (1988) Proc. Natl. Acad. Sci USA 85:2444-2448) и BLAST (BLAST Manual, Altschul et al., Nat'l Cent. Biotechnol. Inf., Natl Lib. Med. (NCIB NLM NIH), Bethesda, Md., and Altschul et al., (1997) NAR 25:3389-3402). Другой программой для выравнивания является ALIGN Plus (Научное и Образовательное программное обеспечение, РА) с использованием стандартных параметров. Другой находящей применение компьютерной программой, работающей с последовательностями, является Программа Поиска Данных TFASTA (TFASTA Data Searching Program), доступная в Пакете Программ (Sequence Software Package Version 6.0) (Компьютерная Группа Генетики, Университет Висконсин, Мэдисон, WI).
Специалист в данной области техники считает, что рассматриваемые в данном описании изобретения последовательности могут быть охарактеризованы по способности гибридизоваться в жестких условиях гибридизации с типичной последовательностью amyL (например, SEQ ID NO:7 WO 06/002643). Нуклеиновая кислота способна гибридизоваться с другой последовательностью нуклеиновой кислоты, когда одноцепочечная форма нуклеиновой кислоты может осуществить отжиг с другой нуклеиновой кислотой при подходящих температурных условиях и ионной силе раствора. Условия гибридизации и отмывки хорошо известны в данной области техники (смотри, например, Sambrook (1989) supra, в частности, главы 9 и 11). В некоторых вариантах осуществления изобретения жесткие условия соответствуют Tm, равной 65°С, и 0,1xSSC, 0,1% SDS.
«Культивирование» относится к выравниванию популяции микробных клеток при подходящих условиях в жидкой или твердой среде. В одном из вариантов осуществления изобретения культивирование относится к ферментативной биоконверсии крахмального субстрата, содержащего гранулированный крахмал, в конечный продукт (обычно в резервуаре или реакторе).
«Брожение» представляет собой ферментативный и анаэробный распад органических веществ микроорганизмами с образованием более простых органических соединений. Хотя брожение происходит при анаэробных условиях, не предполагается, что термин ограничивается лишь строгими анаэробными условиями, так как брожение также происходит в присутствии кислорода.
«Контактирование» имеет отношение к расположению соответствующего фермента(ов) в достаточной близости от соответствующего субстрата, чтобы дать возможность ферменту(ам) превратить субстрат в конечный продукт. Специалисты в данной области техники считают, что перемешивание растворов фермента с соответствующими субстратами может воздействовать на контактирование.
«Ферментативная конверсия» обычно имеет отношение к модификации субстрата под действием фермента. Данный термин в настоящем документе также относится к модификациям крахмального субстрата под действием фермента.
Используемый в настоящем документе термин «осахаривание» относится к ферментативной конверсии крахмала в глюкозу.
«Клейстеризация» означает солюбилизацию молекулы крахмала путем тепловой обработки для образования вязкой суспензии.
«Разжижение» имеет отношение к стадии превращения крахмала, в которой клейстеризованный крахмал гидролизуется с образованием низкомолекулярных растворимых декстринов.
«Степень полимеризации (DP)» имеет отношение к числу (n) ангидроглюкопиранозных единиц в данном сахариде. Примерами DP1 являются моносахариды, такие как глюкоза и фруктоза. Примерами DP2 являются дисахариды, такие как мальтоза и сукроза. DP>3 означает полимеры со степенью полимеризации, превышающей 3.
«Конечный продукт» или «ожидаемый конечный продукт» имеют отношение к любому молекулярному продукту, полученному из источника углерода, который ферментативно конвертируется из крахмального субстрата.
Используемый в настоящем документе термин «содержание сухого твердого вещества (ds)» имеет отношение к суммарному твердому веществу в суспензии в % на сухую массу. Термин «суспензия» относится к водной смеси, содержащей нерастворимые твердые вещества.
Термин «остаточный крахмал» относится к сохранившемуся крахмалу (растворимому или нерастворимому), оставшемуся в композиции после брожения крахмалосодержащего субстрата.
«Этап утилизации» имеет отношение к утилизации компонентов сусла, которые могут включать остаточный крахмал, ферменты и/или микроорганизмы для сбраживания субстратов, содержащих крахмал.
Термин «сусло» относится к смеси сбраживаемого источника углерода (карбогидрата) в воде, используемой для образования сброженного продукта, такого как спирт. В некоторых вариантах осуществления изобретения термины «бражка» и «сусло» используются взаимозаменяемо.
«Барда» означает смесь не подвергшегося брожению твердого вещества и воды, которая остается после удаления спирта из подвергшегося брожению сусла.
Термины «высушенное зерно брагоректификационной установки» (DDG) и «высушенное зерно с растворимыми веществами брагоректификационной установки» (DDGS) относятся к используемым побочным продуктам сбраживания зерна.
Используемый в настоящем документе термин «этанологенный микроорганизм» относится к микроорганизму, способному превращать сахар или олигосахариды в этанол. Этанологенный микроорганизм является этанологенным в силу его способности экспрессировать один или несколько ферментов, которые по отдельности или совместно превращают сахар в этанол.
Используемый в настоящем документе «продуцент этанола» или «продуцирующий этанол микроорганизм» относится к любому организму или клетке, способному продуцировать этанол из гексозы или пентозы. Как правило, этанол-продуцирующие клетки содержат алькогольдегидрогеназу и пируватдекарбоксилазу. Примеры этанол-продуцирующих микроорганизмов включают грибковые микроорганизмы, такие как дрожжи.
«Гетерологичный» со ссылкой на полинуклеотид или белок относится к полинуклеотиду или белку, которые не являются естественными для клетки-хозяина.
Используемые в настоящем документе термины «трансформированный», «стабильно трансформированный» и «трансгенный» со ссылкой на клетку означают, что клетка имеет не нативную (например, гетерологичную) последовательность нуклеиновой кислоты, интегрированную в ее геном или в качестве эписомальной плазмиды, сохраняемой на протяжении нескольких поколений.
Используемый в настоящем документе термин «экспрессия» относится к процессу, с помощью которого полипептид синтезируется, исходя из последовательности нуклеиновой кислоты гена. Данный процесс включает как транскрипцию, так и трансляцию.
Используемый в настоящем документе термин «специфическая активность» означает единицу фермента, определенную как число молей субстрата, конвертированного в продукт препаратом фермента в единицу времени при определенных условиях. Специфическая активность выражается в единицах (ед)/мг белка.
«Выход» относится к количеству конечного продукта или ожидаемого конечного продукта, образованного с использованием способов по настоящему описанию изобретения. В некоторых вариантах осуществления изобретения выход продукта больше, чем таковой, получаемый с использованием способов, известных в данной области техники. В некоторых вариантах осуществления изобретения термин относится к объему конечного продукта, а в других вариантах осуществления изобретения термин имеет отношение к концентрации конечного продукта.
Используемый в настоящем документе термин «биологически активный» имеет отношение к последовательности, имеющей структурные, регуляторные или биохимические функции, сходные с таковыми у природной последовательности, хотя не обязательно в той же степени.
«ATCC» относится к Американской Коллекции Типовых Культур, находящейся в Манассасе, Va. 20108 (ATCC).
«NRRL» относится к Службе Сельскохозяйственных Исследований Типовых Культур Национального Центра Сельскохозяйственных Исследований Применения (ранее известного как Северная Региональная Научно-исследовательская Лаборатория USDA), Пеория, III.
1.2. Аббревиатуры
Используются следующие аббревиатуры, если не указано иное:
1.3. Номенклатура
В настоящем описании изобретения и формулах изобретения используются общепринятые однобуквенные и трехбуквенные коды аминокислотных остатков. Для удобства варианты альфа-амилазы данной заявки описаны путем использования следующей номенклатуры:
Исходная аминокислота(ы): положение(и): замещенная аминокислота(ы).
Согласно этой номенклатуре, например, замена серина на аланин в положении 242 показана как:
Ser242Ala или S242A.
Делеция аланина в положении 30 показана как:
Ala30* или A30* или ∆A30
и вставка дополнительного аминокислотного остатка, такого как лизин, показана как:
Ala30AlaLys или A30AK.
Делеция участка последовательных аминокислотных остатков, таких как аминокислотные остатки 30-33, обозначена как:
(30-33)* или ∆(А30-N33) или ∆30-33.
Делеция двух последовательных аминокислот, таких как аминокислотные остатки R180-S181, обозначена как:
∆RS или ∆180-181.
Там, где специфичная альфа-амилаза содержит «делецию» при сравнении с другими альфа-амилазами и делается вставка в таком положении, это обозначено как:
*36Asp или *36D
для вставки аспарагиновой кислоты в положении 36. Множественные мутации разделены знаками плюс, т.е.:
Ala30Asp+Glu34Ser или A30N+E34S,
представляя мутации в положениях 30 и 34, заменяя аланин и глутаминовую кислоту на аспарагин и серин соответственно. Когда один или несколько альтернативных аминокислотных остатков могут быть вставлены в данное положение, это обозначено как:
A30N,E или A30N или A30E.
Более того, когда в данном описании определено положение, подходящее для модификации, и не предлагается какая-либо специфичная модификация, следует понимать, что любой аминокислотный остаток может быть использован вместо аминокислотного остатка, находящегося в данном положении. Так, например, когда упоминается о модификации аланина в положении 30, но она точно не определена, следует понимать, что аланин может быть делетирован или замещен любой другой аминокислотой, то есть любой из:
R, N, D, A, C, Q, E, G, H, I, L, K, M, F, P, S, T, W, Y, V.
Кроме того, «A30X» означает любую из следующих замен:
A30R, A30N, A30D, A30C, A30Q, A30E, A30G, A30H, A30I, A30L, A30K, A30M, A30F, A30P, A30S, A30T, A30W, A30Y или A30V;
или в краткой форме:
A30R, N,D,C,Q,E,G,H,I,L,K,M,F,P,S,T,W,Y,V.
Если исходный фермент, используемый для перечисления, уже имеет исследуемый аминокислотный остаток, подлежащий замене в данном положении, используется следующая номенклатура:
«X30N» или «X30N,V»
в случае, где, например, один из N или V присутствует в диком типе. Таким образом, это означает, что другие соответствующие исходные ферменты замещаются на «Asn» или «Val» в положении 30.
2. Варианты альфа-амилазы
Варианты альфа-амилазы в данном описании изобретения созданы из альфа-амилазы дикого типа B. licheniformis. Представленные варианты могут иметь улучшенную специфическую активность, профиль рН, термостабильность, профиль температурного диапазона, потребность в ионах кальция и другие улучшенные характеристики. Варианты, как правило, содержат одну или несколько модификаций аминокислотной последовательности альфа-амилазы дикого типа B. licheniformis. Альфа-амилаза дикого типа B. licheniformis может быть выделена из природного штамма B. licheniformis.
С целью описания данного изобретения аминокислотные замены могут быть обозначены, например, М15Т. «М15Т» означает, что остаток метионина (М) заменен остатком треонина «Т» в положении 15, причем аминокислоты обозначены однобуквенной аббревиатурой, общеизвестной в данной области техники.
Белковая инженерия альфа-амилазы дикого типа B. licheniformis создает альфа-амилазы варианта, которые могут иметь улучшенные свойства. В одном аспекте изобретения один или несколько аминокислотных остатков фермента варианта модифицируют случайным образом, и влияние модификации определяется дальнейшим анализом рабочих характеристик варианта после экспрессии варианта в клетке-хозяине. В другом аспекте изобретения модификации аминокислотной последовательности варианта вносятся систематично, используя «модельную» альфа-амилазу, имеющую структуру, очень схожую с альфа-амилазой дикого типа B. licheniformis, в качестве ориентира таким образом, что влияние модификаций может быть предсказано. В одном варианте осуществления изобретения модельная альфа-амилаза имеет одну или несколько характеристик, которые улучшены относительно альфа-амилазы дикого типа B. licheniformis. Например, модельная альфа-амилаза может иметь более высокую специфическую активность, рН зависимость, стабильность, время жизни или константу связывания кальция или может иметь особенно подходящую субстратную специфичность и т.п.
Если модельная альфа-амилаза используется в качестве отправной точки при создании аминокислотных замен альфа-амилазы варианта, не обязательно точно знать какие остатки модельной альфа-амилазы вносят вклад в рабочие характеристики фермента. Альтернативно, одну или несколько аминокислот, даже целый набор аминокислот, в альфа-амилазе варианта приводят к соответствующей аминокислоте(ам) модельной альфа-амилазы. «Соответствующая» аминокислота в данном случае определяется не обычным выравниванием первичной аминокислотной последовательности, а 3D-структурным выравниванием полипептидного каркаса двух ферментов. Аминокислоты, подлежащие модификации в варианте, таким образом, могут быть выбраны в виде заряженных остатков на поверхности фермента, остатков активного сайта или остатков, которые вносят вклад в определенные вторичные структурные элементы, уникальные для модельного фермента, например. Остатки, подлежащие модификации, также могут быть выбраны на основании того, что модификация не нарушит консервативные 3D-структуры между двумя ферментами, в частности консервативные вторичные структурные элементы, например, α-спирали, β-складчатые листы, повороты.
Например, известно, что изменение распределения заряженных аминокислот на поверхности фермента, как правило, может изменить его ферментативные свойства. Смотри, например, Russel et al., «Rational modification of enzyme catalysis by engineering surface charge», Nature 328:496-500 (1987). Подобным образом, один или несколько остатков на поверхности альфа-амилазы B. licheniformis могут быть модифицированы для изменения ферментативных свойств альфа-амилазы варианта, в котором выбор модификаций может руководствоваться распределением поверхностных зарядов на модельной альфа-амилазе. С этой целью «поверхностный заряд» определяется заряженной стороной цепи аминокислоты, которая хотя бы частично экспонирована в растворитель.
Остаток альфа-амилазы варианта может быть классифицирован по принадлежности к одному из трех структурных доменов, названных в настоящем документе доменами А, В и С. С целью описания данного изобретения домен А простирается от 2 до 105 остатка и от 208 до 396 остатка; домен В простирается от 106 до 207 остатка; и домен С простирается от 397 остатка до С-конца белка. Аминокислота также может быть классифицирована как остаток активного сайта. Остатки активного сайта расположены по меньшей мере в положениях 49, 52, 163, 167, 170, 172, 187, 188, 190, 238, 262, 264, 293, 297 и 332-334. «Положения» остатков пронумерованы, как показано в последовательности альфа-амилазы B. licheniformis (SEQ ID NO:4).
В альфа-амилазе варианта одна или несколько аминокислот могут быть модифицированы в соответствующую аминокислоту модельной альфа-амилазы. Модификации могут быть сгруппированы доменом, и/или они могут быть сгруппированы аминокислотами, которые заряжены и присутствуют на поверхности фермента. Альтернативно или дополнительно модификации могут быть внесены в один или несколько остатков активного сайта. Таким образом можно сделать множественные модификации аминокислоты, где модификации оказывают предсказуемое действие на рабочие характеристики альфа-амилазы варианта. Например, вариант может иметь любой заряженный остаток поверхности в одном или нескольких доменах, замененный на соответствующий остаток модельной альфа-амилазы. В другом варианте осуществления изобретения, вариант может иметь вставленные или делетированные остатки, например, петля может быть вставлена или делетирована таким образом, что полипептидный каркас варианта становится еще более похожим на структуру модельной альфа-амилазы. В связи с этим вариант может включать 1, 2, 3, 4, 5, 10, 15, 20, 30, 40, 50, 60 или 70 аминокислотных замен, делеций или вставок или любое целое число в этом диапазоне при условии, что вариант сохраняет альфа-амилазную активность. Поверхностный заряд варианта также может быть изменен любым количеством. Например, количество положительно заряженных аминокислотных остатков на поверхности фермента может быть уменьшено на 1, 2, 3, 4, 5, 6, 7 или 8. Такие аминокислотные замены предполагают, помимо всего прочего, изменение изоэлектрической точки (pI) варианта. Другие параметры варианта могут отличаться от фермента дикого типа, как описано ниже.
Вариант альфа-амилазы может также являться рекомбинантным белком или «гибридом» или «химерным белком», включающим полипептидную последовательность, не эндогенную для B. licheniformis. В одном варианте осуществления изобретения полипептидная последовательность облегчает очистку экспрессируемого белка. В другом варианте осуществления изобретения гетерологичная последовательность является полипептидом альфа-амилазы, полученной из отличных от B. licheniformis родов или видов. Например, вариант альфа-амилазы может включать вариант альфа-амилазы B. licheniformis, присоединенный к сигнальному пептиду другой альфа-амилазы Bacillus, такой как, без ограничения, B. stearothermophilus.
2.1. Характеристика вариантов альфа-амилазы.
Варианты фермента могут быть охарактеризованы последовательностями нуклеиновой кислоты и полипептида, их 3D-структурами, как описано выше, и/или их специфической активностью. Дополнительные свойства варианта альфа-амилазы включают время жизни, стабильность при более низких уровнях ионов кальция (Ca2+), диапазон рН, устойчивость к окислению и термостабильность. В одном аспекте изобретения варианты альфа-амилазы в моющих композициях имеют более высокие специфические активности, которые могут быть оценены с использованием стандартных методов, известных специалистам в данной области техники. В другом аспекте изобретения варианты демонстрируют другие улучшенные рабочие характеристики, такие как улучшенная стабильность при высоких температурах (т.е. 70-120°С), и/или крайних значениях рН (т.е. от приблизительно 4,0 до приблизительно 6,0 или от приблизительно 8,0 до приблизительно 11,0), и/или концентрации кальция ниже приблизительно 60 частей на миллион.
Измененная Ca2+-стабильность означает, что стабильность фермента при истощении Ca2+была изменена, т.е. увеличена или уменьшена. Значимые мутации включают таковые, которые изменяют Ca2+-стабильность и потребность, в частности таковые, которые уменьшают Ca2+-зависимость при высоких значениях рН, т.е. от 8,0 до 10,5.
В следующем аспекте изобретения значимые мутации демонстрируют измененную специфическую активность, особенно при температурах от приблизительно 10°С до приблизительно 60°С, в частности от приблизительно 20°С до приблизительно 50°С и конкретнее от приблизительно 30°С до приблизительно 40°С для использования в моющих композициях. Для продуктов выпекания значимые мутации могут проявлять измененную специфическую активность при более высоких диапазонах температур.
Варианты альфа-амилазы также могут иметь измененную устойчивость к окислению, в частности более высокую устойчивость к окислению по сравнению с исходной альфа-амилазой. Например, повышенная устойчивость к окислению предпочтительна в композициях детергента, а пониженная устойчивость к окислению может быть предпочтительной в композициях для разжижения крахмала.
Вариант альфа-амилазы может быть термостабильнее альфа-амилазы дикого типа. Такие варианты альфа-амилазы предпочтительны для использования при выпекании или других процессах, требующих повышенных температур. Например, термостабильный вариант альфа-амилазы может расщеплять крахмал при температурах от приблизительно 55°С до приблизительно 80°С или более. Термостабильный вариант альфа-амилазы может сохранять свою активность после воздействия температур приблизительно до 95°С.
Описанные в настоящем документе полипептиды варианта альфа-амилазы могут также иметь мутации, которые удлиняют время жизни по сравнению с исходным ферментом по меньшей мере приблизительно на 10%, 20%, 30%, 40%, 50%, 60%, 70%, 80%, 90%, 100%, 200% или более, в частности при повышенных температурах, равных по меньшей мере от приблизительно 55°С до приблизительно 95°С или более, в частности приблизительно 80°С. В одном варианте осуществления изобретения вариант альфа-амилазы может быть нагрет в течение 1-10 минут приблизительно до 80°С или выше.
Варианты альфа-амилазы могут иметь экзо-специфичность, измеренную, например, описанными в настоящем документе индикаторами экзо-специфичности. Варианты альфа-амилазы включают таковые, которые имеют более высокую или повышенную экзо-специфичность по сравнению с исходными ферментами или полипептидами, из которых они были получены, как правило, при измерениях в идентичных условиях. Таким образом, например, полипептиды варианта альфа-амилазы могут иметь индекс экзо-специфичности 10%, 20%, 30%, 40%, 50%, 60%, 70%, 80%, 90%, 100%, 150%, 200%, 500%, 1000%, 5000%, 10000% или выше при сравнении с соответствующими исходными полипептидами.
В одном аспекте изобретения полипептид варианта альфа-амилазы, кодируемый нуклеиновой кислотой, имеет ту же рН-стабильность, как у исходной последовательности. В другом аспекте изобретения вариант включает мутацию, которая придает конечному коммерческому целевому ферменту большие пределы рН-стабильности или сдвигает рН-пределы в нужную область. Например, в одном варианте осуществления изобретения вариант может расщеплять крахмал при рН от приблизительно 5,0 до приблизительно 10,5. Полипептид варианта альфа-амилазы может иметь более продолжительное время жизни или более высокую активность (в зависимости от метода) при сравнении с исходным полипептидом в идентичных условиях, или вариант альфа-амилазы может иметь ту же активность, что и исходный полипептид. Полипептид варианта альфа-амилазы также может иметь приблизительно 10%, 20%, 30%, 40%, 50%, 60%, 70%, 80%, 90%, 100%, 200% или более продолжительное время жизни при сравнении с исходным полипептидом в идентичных условиях рН. Альтернативно или в качестве дополнения вариант фермента может иметь более высокую специфическую активность, нежели исходный полипептид при идентичных условиях рН.
В другом аспекте изобретения рассматривается нуклеиновая кислота, комплементарная нуклеиновой кислоте, кодирующей любой из вариантов альфа-амилазы, изложенных в настоящем описании. Дополнительно, приводится нуклеиновая кислота, способная гибридизоваться с комплементом. В других вариантах изобретения последовательность для использования в описанных в настоящем документе способах и композициях является синтетической последовательностью. Она включает, помимо прочего, последовательности, сконструированные с оптимальным использованием кодонов для экспрессии в организмах-хозяевах, таких как метилотрофные дрожжи Pichia и Hansenula.
3. Получение Вариантов Альфа-Амилазы
Последовательность ДНК, кодирующая вариант фермента, полученная описанными в настоящем документе способами или любыми альтернативными способами, известными в данной области техники, может экспрессироваться в виде фермента с использованием экспрессионного вектора, который обычно содержит регуляторные последовательности, кодирующие подходящий промотор, оператор, сайт связывания рибосомы, сигнал инициации трансляции и, как правило, ген репрессора или гены различных активаторов.
3.1. Векторы
Рекомбинантный экспрессионный вектор, несущий последовательность ДНК, кодирующую вариант альфа-амилазы, может быть любым вектором, который подходит для проведения технологий рекомбинантной ДНК, и выбор вектора будет зачастую зависеть от клетки-хозяина, в которую его будут вводить. Таким образом, вектор может быть автономно реплицирующимся вектором, т.е. вектором, существующим как внехромосомная единица, репликация которой не зависит от хромосомной репликации, например плазмидой, бактериофагом или внехромосомным элементом, мини-хромосомой или искусственной хромосомой. Альтернативно, вектор может быть одним из тех, которые при введении в клетку-хозяина встраиваются в геном клетки-хозяина и реплицируются вместе с хромосомой(ами), в которую они были встроены. Встроенный ген может также быть амплифицирован для создания множественных копий данного гена в хромосоме путем использования амплифицируемой конструкции, руководствуясь селекцией антибиотиков или другим давлением отбора, таким как необходимый регуляторный ген, или путем комплементации гена необходимого метаболического пути.
Экспрессионный вектор, как правило, включает компоненты клонирующего вектора, например элемент, позволяющий автономную репликацию вектора в выбранном организме-хозяине, и один или несколько фенотипически определяемых маркеров в селекционных целях. Экспрессионный вектор обычно состоит из регуляторных нуклеотидных последовательностей, кодирующих промотор, оператор, сайт связывания рибосом, сигнал инициации трансляции и, как правило, ген репрессора или один или несколько генов активатора. В одном аспекте изобретения все используемые сигнальные последовательности выявляют вещество в клеточной культуральной среде для облегчения сбора и очистки фермента. Методики, используемые для лигирования конструкции ДНК, кодирующей вариант альфа-амилазы, промотор, терминатор и другие соответствующие элементы, и для их вставки в подходящие векторы, содержащие информацию, необходимую для репликации, хорошо известны специалистам в данной области техники (смотри, например, Sambrook et al., MOLECULAR CLONING: A LABORATORY MANUAL, 2nd ed., Cold Spring Harbor, 1989 and 3rd ed., 2001).
В векторе последовательность ДНК должна быть функционально связана с подходящей последовательностью промотора. Промотором может быть любая последовательность ДНК, демонстрирующая транскрипционную активность в выбранной клетке-хозяине, и он может быть получен из генов, кодирующих белки, либо гомологичные, либо гетерологичные для клетки-хозяина. Примерами подходящих промоторов для управления транскрипцией последовательности ДНК, кодирующей вариант альфа-амилазы, в частности, в бактериальном хозяине, являются промотор lac-оперона E.coli, промоторы dagA или celA гена агаразы Streptomyces coelicolor, промоторы гена альфа-амилазы (amyL) Bacillus licheniformis, промоторы гена мальтогенной амилазы (amyM) Bacillus stearothermophilus, промоторы гена альфа-амилазы (amyQ) Bacillus amyloliquefaciens, промоторы генов xylA и xylB Bacillus subtilis и др. Для транскрипции в грибковом хозяине примерами используемых промоторов являются таковые, которые получены из гена, кодирующего TAKA-амилазу Aspergillus oryzae, аспарагиновую протеиназу Rhizomucor miehei, нейтральную альфа-амилазу Aspergillus niger, кислотоустойчивую альфа-амилазу A. niger, глюкоамилазу A. niger, липазу Rhizomucor miehei, щелочную протеазу A. oryzae, триозофосфатизомеразу A. oryzae или ацетамидазу A. nidulans. Когда ген, кодирующий полипептид варианта альфа-амилазы, экспрессируется в бактериальных видах, таких как E. coli, может быть выбран подходящий промотор, например, из промотора бактериофага, включая Т7 промотор и промотор фага лямбда. Примеры промоторов, подходящих для экспрессии в дрожжевых видах включают, помимо прочего, промоторы Gal 1 и Gal 10 Saccharomyces cerevisiae и промоторы AOX1 или AOX2 Pichia pastoris. Для экспрессии в Trichoderma reesei также может быть использован промотор CBHII.
Экспрессионный вектор может также содержать подходящий терминатор транскрипции и, в эукариотах, последовательности полиаденилирования, соединенные с последовательностью ДНК, кодирующей вариант альфа-амилазы. Последовательности терминации и полиаденилирования могут соответственно быть получены из того же источника, что и промотор. Вектор может, кроме того, содержать последовательность ДНК, дающую возможность вектору реплицироваться в исследуемой клетке-хозяине. Примерами таких последовательностей являются ориджины репликации плазмид pUC19, Pacyc177, pUB110, pE194, pAMB1, pICatH и pIJ702.
Вектор может также включать селектируемый маркер, например ген, продукт которого восполняет дефект в клетке-хозяине, такой как ген dal из B. subtilis или B. licheniformis или как ген, придающий устойчивость к антибиотику, например устойчивость к ампициллину, канамицину, хлорамфениколу или тетрациклину. Более того, вектор может включать маркеры селекции Aspergillus, такие как amdS, argB, niaD и xxsC, маркер, придающий устойчивость к гигромицину, или селекция может быть выполнена путем ко-трансформации, известной в данной области техники. Смотри, например, WO 91/17243.
3.2. Экспрессия варианта и организмы-хозяева
Хотя внутриклеточная экспрессия или твердофазное культивирование могут быть предпочтительными в некоторых отношениях, например, в случае использования определенных бактерий или грибов в качестве клеток-хозяев наиболее предпочтительной, как правило, является экспрессия варианта внеклеточно и в культуральную среду. В большинстве случаев упомянутая в настоящем документе альфа-амилаза Bacillus содержит сигнальную последовательность, которая дает возможность экспрессированной протеазе секретироваться в культуральную среду. Если требуется, эта сигнальная последовательность может быть заменена на другую сигнальную последовательность, что удобно осуществить заменой последовательностью ДНК, кодирующей соответствующую сигнальную последовательность. Сигнальная последовательность в большинстве случаев характеризуется наличием трех доменов, N-концевого домена, H-домена и С-концевого домена, и варьирует по длине в диапазоне от 18 до 35 остатков.
Зрелый белок может изначально находиться в форме гибридного белка с белком-предшественником, полученного из другого вида Bacillus или из того же вида, что и исходная последовательность. Для секреции белков в B. licheniformis зачастую используется сигнальный пептид альфа-амилазы B. licheniformis; однако сигнальные белки из альфа-амилаз других видов Bacillus могут также быть использованы в качестве замены.
Выделенная клетка, содержащая либо конструкцию ДНК, либо экспрессионный вектор, предпочтительно используется в качестве клетки-хозяина для рекомбинантной продукции варианта альфа-амилазы. Клетка может быть трансформирована конструкцией ДНК, кодирующей вариант, путем встраивания конструкции ДНК (в виде одной или нескольких копий) в хромосому хозяина. Данное встраивание обычно рассматривается как предпочтительное, поскольку последовательность ДНК, по всей вероятности, будет стабильнее сохраняться в клетке. Встраивание конструкций ДНК в хромосому хозяина может быть выполнено согласно общепринятым методам, например путем гомологичной или гетерологичной рекомбинации. Альтернативно, клетка может быть трансформирована экспрессионным вектором, как описано выше, с использованием различных типов клеток-хозяев.
Примерами подходящих бактериальных организмов-хозяев являются грамположительные виды бактерий, такие как Bacillaceae, включая B. subtilis, B. Licheniformis,B. lentus, B. brevis, B. stearothermophilus, B. alkalophilus, B. amyloliquefaciens, B. coagulans, B. lautus, B. megaterium и B. thuringiensis; виды Streptomyces, такие как S. murinus, виды молочнокислых бактерий, включая виды Lactococcus, такие как L. lactis; виды Lactobacillus, включая L. reuteri; виды Leuconostoc; виды Pediococcus и виды Streptococcus. Альтернативно, штаммы грамотрицательных видов бактерий, принадлежащие Enterobacteriaceae, включая E. coli, или Pseudomonadaceae, могут быть выбраны в качестве организма-хозяина.
Подходящий дрожжевой организм-хозяин может быть выбран из относящихся к биотехнологии видов дрожжей, таких как, помимо прочего, виды Pichia, виды Hansenula, виды Kluyveromyces, виды Yarrowinia, виды Saccharomyces, включая S. cerevisiae, или виды, принадлежащие Schizosaccharomyces, такие как S. pombe. Штамм видов метилотрофных дрожжей Pichia pastoris может быть использован в качестве организма-хозяина. Альтернативно, организмом-хозяином могут быть виды Hansenula. Подходящие организмы-хозяева среди мицелиальных грибов включают виды Aspergillus, например A. niger, A. oryzae, A. tubigensis, A. awamori или A. nidulans. Альтернативно, штамм вида Fusarium, например Fusarium oxysporum, или вида Rhizomucor, такого как R. miehei, могут быть использованы в качестве организма-хозяина. Другие подходящие дрожжи включают виды Thermomyces и виды Mucor. Грибковые клетки могут быть трансформированы с помощью процесса, включающего образование протопласта и трансформацию протопластов с последующей регенерацией клеточной стенки способом, известным в данной области техники. Соответствующая методика трансформации клеток-хозяев Aspergillus, например, описана в Европейском Патенте № 238023.
В еще одном аспекте изобретения рассматривается метод получения варианта альфа-амилазы, включающий культивирование клетки-хозяина, как описано выше, в условиях, благоприятных для продукции варианта и выделения варианта из клеток и/или культуральной среды. Средой, используемой для культивирования клеток, может быть любая стандартная среда, подходящая для выращивания исследуемой клетки-хозяина и получения экспрессии варианта альфа-амилазы. Подходящая среда и компоненты среды доступны у частных поставщиков или могут быть приготовлены согласно опубликованным прописям, например, как описано в каталогах Американской Коллекции Типовых Культур (АТСС). Типичные культуральные среды включают, помимо прочего, таковые, которые используются для периодической ферментации с добавлением субстрата, выполняемой, например, в трехтысячном литровом (3000 л) реакторе с механическим перемешиванием, который использовался в примерах, приведенных ниже. Используемой средой будет та, что наиболее подходит для культивирования клетки-хозяина, например среда, обсуждаемая ниже для культивирования Bacillus licheniformis. Среда для выращивания в этом случае может состоять из сухого остатка кукурузного экстракта и соевой муки в качестве источников органических веществ наряду с минеральными солями как источников натрия, калия, фосфата, магния и сульфата, так же как и микроэлементов. Обычно источник карбогидрата, такой как глюкоза, также является частью исходной среды. Как только культура адаптировалась и пошла в рост, вводят карбогидрат в реактор для поддержания культуры, как это известно в данной области техники. Регулярно осуществляют отбор образцов из ферментера для измерения титра фермента, с использованием, например, колориметрического метода анализа. Ферментативный процесс прекращается, когда образование фермента перестает увеличиваться согласно измерениям.
Вариант альфа-амилазы, секретируемый клетками-хозяевами, может быть без труда выделен из культуральной среды с помощью хорошо известных методик, включая отделение клеток от среды центрифугированием или фильтрацией и преципитацию белковых компонентов среды посредством соли, такой как сульфат аммония, с последующим использованием хроматографических методов, таких как ионообменная хроматография, аффинная хроматография и т.п.
Клетки-хозяева могут быть культивированы при подходящих условиях, которые обеспечивают экспрессию белков варианта альфа-амилазы. Экспрессия белков может быть конститутивной, при которой идет непрерывное их образование, или индуцибельной, требующей стимул для инициации экспрессии. В случае индуцибельной экспрессии продукция белка может быть инициирована по мере необходимости путем добавления индуцирующего вещества, например дексаметазона, IPTG или Сефарозы, в культуральную среду, например. Полипептиды могут быть также синтезированы рекомбинантно в бесклеточной системе in vitro, такой как система ретикулоцитов кролика TnTTM (Promega).
Клетка-хозяин, экспрессирующая вариант альфа-амилазы, может также быть культивирована в аэробных условиях в подходящей для клетки-хозяина среде. Могут быть обеспечены встряхивание или комбинация перемешивания и аэрации с осуществлением синтеза при подходящей для данного хозяина температуре, например от приблизительно 30°С до приблизительно 75°С, в зависимости от потребностей хозяина и требований при синтезе желаемого варианта альфа-амилазы. Культивирование может происходить от приблизительно 12 до приблизительно 100 часов или более (и любое количество часов в этом диапазоне) или, в частности, от приблизительно 24 до приблизительно 72 часов. Как правило, питательная среда имеет значение рН, равное от приблизительно 5,5 до приблизительно 8,0, опять-таки, в зависимости от условий культивирования, необходимых для клетки-хозяина относительно синтеза варианта альфа-амилазы.
4. Очистка вариантов альфа-амилазы
Методики брожения, фракционирования и концентрирования известны в данной области техники, и общепринятые методы могут быть использованы для приготовления концентрированного раствора, содержащего вариант альфа-амилазы. После брожения получают ферментативный бульон, и микробные клетки и различные суспендированные твердые вещества, включая остаточное сырье материалов брожения, удаляются с помощью общепринятых методик фракционирования для получения раствора амилазы. Обычно используется фильтрация, центрифугирование, микрофильтрация, ротационная вакуумная барабанная фильтрация с последующей ультрафильтрацией, экстракцией или хроматографией и т.п.
Желательно сконцентрировать раствор, содержащий вариант альфа-амилазы, для оптимизации выделения, поскольку использование неконцентрированных растворов требует увеличения времени инкубации для сбора осадка, содержащего очищенный вариант альфа-амилазы. Раствор концентрируют с помощью общепринятых методов до тех пор, пока не будет получен желаемый уровень фермента. Концентрирование раствора, содержащего вариант фермента, может быть достигнуто любой из методик, обсуждавшихся выше. В одном варианте осуществления изобретения используется ротационное вакуумное выпаривание и/или ультрафильтрация. Альтернативно, может быть использована ультрафильтрация.
«Осаждающее вещество» с целью очистки означает соединение, эффективное для осаждения варианта альфа-амилазы из концентрированного раствора варианта фермента в форме твердого вещества, какой бы ни была ее природа, например кристаллизованной, аморфной или смесью того и другого. Осаждение может быть выполнено с использованием, например, галоидного осаждающего вещества. Галоидные осаждающие вещества включают: хлориды щелочных металлов, бромиды щелочных металлов и смеси двух или нескольких данных галоидных соединений. Галоидное соединение может быть выбрано из группы, состоящей из: хлорида натрия, хлорида калия, бромида натрия, бромида калия и смеси двух или нескольких данных галоидных соединений. Подходящие галоидные соединения включают хлорид натрия и хлорид калия, особенно хлорид натрия, который, кроме того, может быть использован в качестве консерванта.
Галоидное осаждающее вещество используется в количестве, эффективном для осаждения варианта альфа-амилазы. Выбор, по крайней мере, эффективного количества и оптимального количества галоидного вещества, способного вызвать осаждение варианта фермента, а также условий осаждения для максимального выделения, включая время инкубации, рН, температуру и концентрацию варианта альфа-амилазы будет очевидным для специалиста в данной области техники после стандартного тестирования.
В большинстве случаев по меньшей мере приблизительно 5% в/о (вес/объем) до приблизительно 25% в/о галоидного вещества добавляется в концентрированный раствор варианта фермента, а обычно по меньшей мере 8% в/о. Как правило, не более чем приблизительно 25% в/о галоидного вещества добавляется в концентрированный раствор варианта фермента и обычно не более чем приблизительно 20% в/о. Оптимальная концентрация галоидного осаждающего вещества будет зависеть, в числе прочих, от природы специфического варианта альфа-амилазы и от его концентрации в концентрированном растворе варианта альфа-амилазы.
Другой альтернативой воздействовать на осаждение фермента является использование органических соединений, которые могут быть добавлены в концентрированный раствор варианта фермента. Органическим осаждающим веществом может быть: 4-гидроксибензойная кислота, соли щелочных металлов 4-гидроксибензойной кислоты, алкиловые эфиры 4-гидроксибензойной кислоты и смесь двух или более этих органических соединений. Добавление органического осаждающего вещества может происходить до добавления, одновременно с добавлением или после добавления галоидного осаждающего вещества, и добавление обоих осаждающих веществ, органического соединения и галоидного соединения, может быть выполнено последовательно или одновременно. Для дальнейшего описания смотри, например, Патент США № 5281526, Genencor.
Как правило, органические осаждающие вещества выбирают из группы, состоящей из солей щелочных металлов 4-гидроксибензойной кислоты, таких как натриевые и калиевые соли, и линейные или разветвленные алкиловые эфиры 4-гидроксибензойной кислоты, в которых алкильная группа содержит от 1 до 12 атомов углерода, и смеси двух или более этих органических соединений. Органические осаждающие вещества могут быть, например, линейными или разветвленными алкиловыми эфирами 4-гидроксибензойной кислоты, в которых алкильная группа содержит от 1 до 10 атомов углерода, или смесью двух или более этих органических соединений. Подходящие органические соединения включают линейные алкиловые эфиры 4-гидроксибензойной кислоты, в которых алкильная группа содержит от 1 до 6 атомов углерода, и смеси двух или более этих органических соединений. Метиловые эфиры 4-гидроксибензойной кислоты, пропиловые эфиры 4-гидроксибензойной кислоты, бутиловые эфиры 4-гидроксибензойной кислоты, этиловые эфиры 4-гидроксибензойной кислоты и смеси двух или более этих органических соединений также могут быть использованы. Дополнительные органические соединения также включают, помимо прочего, метиловый эфир 4-гидроксибензойной кислоты (метил PARABEN) и пропиловый эфир 4-гидроксибензойной кислоты (пропил PARABEN), которые также являются консервантами амилазы.
Добавление органических осаждающих веществ обеспечивает преимущество высокой гибкости условий осаждения в отношении рН, температуры, концентрации варианта альфа-амилазы, концентрации осаждающего вещества и времени инкубации.
Органическое осаждающее вещество используется в количестве, эффективном для улучшения осаждения варианта фермента с помощью галоидного осаждающего вещества. Выбор, по крайней мере, эффективного количества и оптимального количества органического осаждающего вещества, а также условий осаждения для максимального выделения, включая время инкубации, рН, температуру и концентрацию варианта фермента, будет очевиден специалисту в данной области техники в свете настоящего описания изобретения после стандартного тестирования.
В большинстве случаев приблизительно по меньшей мере 0,01% в/о органического осаждающего вещества добавляют в концентрированный раствор варианта фермента, а обычно приблизительно по меньшей мере 0,02% в/о. В большинстве случаев не более чем приблизительно 0,3% в/о органического осаждающего вещества добавляют в концентрированный раствор варианта фермента, а обычно приблизительно не более чем 0,2% в/о.
Концентрированный раствор варианта фермента, содержащий галоидное осаждающее вещество и в одном аспекте изобретения органическое осаждающее вещество, доводят до значения рН, которое, безусловно, будет зависеть от варианта фермента, подлежащего очистке. В большинстве случаев значение рН доводят до уровня, почти равного значению изоэлектрической точки (pI) амилазы. Например, значение рН может быть доведено в пределах: приблизительно на 2,5 единицы рН ниже pI и приблизительно на 2,5 единицы рН выше pI. С целью иллюстрации, когда вариант альфа-амилазы получен из B. licheniformis, концентрированный раствор варианта фермента обычно доводят до значения рН приблизительно в диапазоне от 5,5 до 9,7 и, в частности, до значения рН приблизительно в диапазоне от 6,5 до 9,0. Соответственно, значение рН может быть доведено, если значение pI варианта отличается от pI дикого типа.
Время инкубации, необходимое для получения осадка очищенного варианта фермента, зависит от природы варианта специфического фермента, концентрации фермента и специфических осаждающих веществ(а) и их(его) концентрации. В большинстве случаев время, достаточное для осаждения варианта фермента, находится в диапазоне от приблизительно 1 и до приблизительно 30 часов; обычно оно не превышает приблизительно 25 часов. В присутствии органического осаждающего вещества время инкубации, тем не менее, может быть сокращено до менее чем приблизительно 10 часов, а в большинстве случаев даже приблизительно 6 часов.
Как правило, уровень температуры во время инкубации находится в диапазоне от приблизительно 4°С до приблизительно 50°С. Обычно метод выполняется при температурах от приблизительно 10°С до приблизительно 45°С и, в частности, от приблизительно 20°С до приблизительно 40°С. Оптимальная температура индуцирования осаждения варьирует в зависимости от состояния раствора и варианта фермента или используемых осаждающих(его) веществ(а).
Полное выделение осадка очищенного варианта фермента и эффективность, с которой данный процесс осуществляется, улучшаются путем перемешивания раствора, содержащего вариант фермента, добавленных галоидных и органических соединений. Этап перемешивания проводят как во время добавления галоидного и органического соединения, так и во время последующего периода инкубации. Подходящие способы перемешивания включают механическое взбалтывание или встряхивание, интенсивную аэрацию или любой подобный способ.
После периода инкубации очищенный вариант фермента затем отделяется от диссоциированного пигмента и других примесей и собирается общепринятыми методами фракционирования, такими как фильтрация, центрифугирование, микрофильтрация, ротационная вакуумная фильтрация, ультрафильтрация, фильтрация под давлением, микрофильтрация сквозь мембрану, проточная мембранная микрофильтрация или т.п. Проточная мембранная микрофильтрация может быть одним из используемых методов. Дополнительная очистка осадка очищенного варианта фермента может быть проведена путем промывания осадка водой. Например, осадок очищенного варианта фермента промывается водой, содержащей галоидное осаждающее вещество, водой, содержащей галоидное и органическое осаждающие вещества.
Во время культивирования термостабильная амилаза накапливается внеклеточно в культуральной жидкости. Для выделения и очистки целевого варианта альфа-амилазы культуральную жидкость центрифугируют или фильтруют для удаления клеток, и полученная бесклеточная жидкость используется для очистки фермента. В одном варианте осуществления изобретения бесклеточная жидкость подвергается высаливанию с использованием сульфата аммония приблизительно при 70% насыщении; фракцию 70% насыщения-осаждения затем разводят в буфере и наносят на колонку, такую как колонка Sephadex G-100, и элюируют для выделения фракции активного варианта фермента. Для дополнительной очистки может быть использована общепринятая методика, такая как ионообменная хроматография.
Очищенные варианты фермента пригодны для всех типов применения, в которых обычно используются варианты фермента. Например, они могут быть использованы в детергентах для стирки и пятновыводителях, в пищевой промышленности, в обработке и обжиге крахмала и в фармацевтических композициях в качестве способствующего пищеварению средства. Они могут быть получены в виде конечного продукта, являющегося либо жидкостью (раствором, суспензией), либо твердым веществом (гранулами, порошком).
Альтернативно, продукт фермента может быть выделен, а в среду добавлен флокулент для удаления клеток и клеточного детрита путем фильтрации или центрифугирования без последующей очистки фермента.
Варианты альфа-амилазы, синтезированные и очищенные методами, описанными выше, могут быть использованы в различных полезных сферах применения в промышленности. Варианты обладают ценными свойствами, облегчающими их применение в сфере ухода за текстильными изделиями и домашней утварью (F&HC). Эти варианты пригодны в производстве подсластителей и этанола из крахмала и/или для расшлихтовки текстильного изделия. Варианты альфа-амилазы особенно полезны в процессах гидролиза крахмала, включая процессы разжижения и/или осахаривания крахмала, как описано, например, в WO 2005/111203 и Опубликованной Заявке США № 2006/0014265 (Genencor International, Inc). Варианты также могут быть использованы в качестве компонента композиций детергентов при стирке, мойке посуды и очистке твердых поверхностей. Эти различные способы применения вариантов альфа-амилазы описаны более подробно ниже.
5. Композиции для переработки крахмала и использование
В другом аспекте изобретения композиции с рассматриваемыми вариантами альфа-амилазы могут быть использованы для разжижения и/или осахаривания крахмала. Переработка крахмала пригодна для производства подсластителей, производства спирта для топлива или питья (т.е. спирта для пищевых целей), производства напитков, переработки тростникового сахара или производства целевых органических соединений, например лимонной кислоты, итаконовой кислоты, молочной кислоты, глюконовой кислоты, кетонов, аминокислот, антибиотиков, ферментов, витаминов и гормонов. Гидролиз крахмала с образованием фруктозного сиропа обычно состоит из трех последовательных ферментативных процессов: процесса разжижения, процесса осахаривания и процесса изомеризации. Во время процесса разжижения вариант альфа-амилазы B. licheniformis расщепляет крахмал до декстринов при значении рН в диапазоне от приблизительно 5,5 до приблизительно 6,2 и при температуре, равной от приблизительно 95°С до приблизительно 160°С в течение приблизительно 2 часов. Приблизительно 1 мМ кальция (приблизительно 40 частей на миллион свободных ионов кальция), как правило, добавляют для оптимизации стабильности фермента при этих условиях. Другим вариантам альфа-амилазы могут потребоваться иные условия.
После процесса разжижения декстрины могут превратиться в декстрозу путем добавления глюкоамилазы (например, AMGTM) и, как правило, деветвящего фермента, такого как изоамилаза или пуллуланаза (например, Promozyme®). Перед этим этапом величину рН снижают до значения приблизительно ниже 4,5, поддерживая высокую температуру (свыше 95°С), и разжижающий вариант альфа-амилазы денатурирует. Температуру понижают приблизительно до 60°С, и могут быть добавлены глюкоамилаза и деветвящий фермент. Процесс осахаривания происходит, как правило, в течение от приблизительно 24 до приблизительно 72 часов.
После процесса осахаривания величину рН увеличивают до значения в диапазоне от приблизительно 6,0 до приблизительно 8,0, например рН 7,5, и кальций удаляют ионным обменом. Декстрозный сироп затем превращается в сироп с высоким содержанием фруктозы, используя иммобилизованную изомеразу глюкозы (такую как Sweetzyme®), например.
5.1. Композиции для разжижения и использование
Стандартные процессы гидролиза крахмала, такие как процессы разжижения и осахаривания, описаны, например, в патенте США № 3912590 и в Европейских патентных изданиях №№ 252730 и 63909, включенных в данный документ в качестве ссылки. В варианте осуществления изобретения процесс гидролиза крахмала, расщепляющий крахмал до низкомолекулярных карбогидратных компонентов, таких как сахара или заменитель жира, включает этап деветвения. В случае гидролиза крахмала до сахара крахмал деполимеризуют. Такой процесс деполимеризации состоит из этапа предварительной обработки и двух-трех этапов последовательных процессов, таких как процесс разжижения, процесс осахаривания и, в зависимости от целевого конечного продукта, как правило, процесс изомеризации. Нативный крахмал состоит из микроскопических гранул, которые нерастворимы в воде при комнатной температуре. Когда водную крахмальную суспензию нагревают, гранулы набухают и в конечном итоге разрушаются, диспергируя молекулы крахмала в растворе. Во время этого процесса «клейстеризации» происходит значительное увеличение вязкости. Поскольку в обычном промышленном способе производства уровень твердых веществ составляет 30-40%, крахмал должен быть разбавлен или «разжижен» таким образом, чтобы с ним можно было обращаться. Такое уменьшение вязкости, на сегодняшний день, в основном, достигают путем ферментативного расщепления.
Во время этапа разжижения длинноцепочечный крахмал расщепляется до разветвленных и линейных более коротких молекул (мальтодекстринов) под действием альфа-амилазы. Процесс разжижения выполняют приблизительно при 105-110°С в течение 5-10 минут с последующей инкубацией в течение 1-2 часов приблизительно при 95°С. Значение рН лежит в диапазоне от приблизительно 5,5 до приблизительно 6,2. Для обеспечения оптимальной стабильности фермента при данных условиях добавляют 1 мМ кальция (40 частей на миллион свободных ионов кальция). После этой обработки разжиженный крахмал будет иметь «эквивалент декстрозы» (DE), равный приблизительно 10-15.
Вариант альфа-амилазы может проявить по меньшей мере одно улучшенное ферментативное свойство для проведения процесса разжижения. Например, вариант альфа-амилазы может иметь более высокую активность и/или он может иметь сниженную потребность в кальции. Добавление свободного кальция, как правило, требуется для обеспечения адекватно высокой стабильности альфа-амилазы; однако свободный кальций значительно ингибирует активность изомеразы глюкозы. Соответственно, кальций должен быть удален до этапа изомеризации посредством дорогого типового процесса до такой степени, при которой уровень свободного кальция снижается ниже 3-5 частей на миллион. Таким образом, варианты альфа-амилазы, не требующие ионов кальция, снижают производственные затраты. Таким образом, варианты альфа-амилазы, которые не требуют ионов кальция или имеют сниженную потребность в кальции, особенно предпочтительны. Например, менее кальций-зависимый вариант альфа-амилазы, являющийся стабильным и высоко активным при низких концентрациях свободного кальция (<40 частей на миллион), может быть использован в композициях и методах. Такой вариант альфа-амилазы должен иметь оптимум значений рН в диапазоне от приблизительно 4,5 до приблизительно 6,5, например от приблизительно рН 4,5 до приблизительно рН 5,5. Варианты альфа-амилазы могут быть использованы сами по себе для обеспечения специфического гидролиза или в сочетании с другими амилазами для обеспечения «коктейля» с широким спектром активности.
Подлежащий переработке крахмал может обладать качеством высокой степени очистки, например по меньшей мере 90%, по меньшей мере 95%, по меньшей мере 97% или по меньшей мере 99,5% чистоты. Альтернативно, крахмал может быть менее очищенным крахмалом, содержащим материал, состоящий из молотых цельных зерен, включая не крахмальные фракции, такие как остатки проростков и волокна. Необработанный материал, такой как цельные зерна, измельчают для того, чтобы вскрыть структуру и позволить дальнейшую обработку. Пригодны два процесса измельчения: мокрый и сухой способы помола. Также могут быть использованы кукурузная крупа и измельченная кукурузная крупа. Зерно сухого помола будет содержать значительные количества не крахмальных карбогидратных соединений помимо крахмала. Когда такой гетерогенный материал подвергается тепловой обработке, зачастую достигается только частичная клейстеризация крахмала. Соответственно, варианты альфа-амилазы, обладающие высокой активностью по отношению к не клейстеризованному крахмалу, предпочтительно использовать в процессе, заключающемся в разжижении и/или осахаривании подвергнутого тепловой обработке крахмала сухого помола.
5.2. Композиции для осахаривания и использование
После процесса разжижения мальтодекстрины превращаются в декстрозу путем добавления глюкоамилазы (например, OPTIDEX® L-400) и деветвящего фермента, такого как изоамилаза (Патент США № 4335208) или пуллуланаза. Перед этим этапом величину рН снижают до значения ниже 4,5, поддерживая высокую температуру (свыше 95°С) для инактивации разжижающей альфа-амилазы с целью уменьшения образования коротких олигосахаридов, названных «предшественниками панозы», которые не могут быть правильно гидролизованы деветвящим ферментом. Температуру понижают приблизительно до 60°С и добавляют глюкоамилазу и деветвящий фермент. Процесс осахаривания происходит приблизительно в течение 24-72 часов.
Обычно при денатурации альфа-амилазы после этапа разжижения приблизительно 0,2-0,5% продукта осахаривания является разветвленным трисахаридом Glc pα1-6Glc pα1-4Glc (паноза), который не может быть расщеплен пуллуланазой. Если активная амилаза после этапа разжижения присутствует во время осахаривания (т.е. не денатурированная), этот уровень может составлять приблизительно 1-2%, который крайне нежелателен, поскольку он значительно снижает выход осахаривания.
Когда целевым конечным сахарным продуктом является, например, сироп с высоким содержанием фруктозы, декстрозный сироп может быть превращен во фруктозный. После процесса осахаривания величину рН поднимают до значения в диапазоне приблизительно 6-8, например рН 7,5, и кальций удаляют путем ионного обмена. Декстрозный сироп затем превращают в сироп с высоким содержанием фруктозы, используя, например, иммобилизованную изомеразу глюкозы (такую как Gensweet® IGI-HF).
6. Способы получения этанола
В большинстве случаев получение спирта (этанола) из цельного зерна может быть разделено на 4 основных этапа: помол, разжижение, осахаривание и брожение.
Зерно измельчается для того, чтобы вскрыть структуру и позволить дальнейшую обработку. Используются в основном два процесса: мокрый и сухой помол. При сухом способе помола цельное зерно измельчается и используется в остальной части процесса. Мокрый способ помола обеспечивает очень хорошее разделение семян и муки грубого помола (крахмальных гранул и белка) и применяется, за некоторым исключением, в процессах, где параллельно идет производство сиропов.
В процессе разжижения гранулы крахмала солюбилизируются путем гидролиза до мальтодекстринов обычно со значением DP выше 4. Гидролиз может быть выполнен путем кислотной обработки или ферментативно под действием альфа-амилазы. Гидролиз в кислой среде используется в ограниченном числе случаев. Необработанный материал может быть измельченным цельным зерном или побочной фракцией при переработке крахмала. Ферментативное разжижение, как правило, выполняют как трехэтапный способ обработки горячей суспензии. Суспензию нагревают приблизительно до 60-95°С, как правило, приблизительно до 80-85°С, и добавляют фермент(ы). Затем суспензию подвергают тепловой обработке приблизительно при 95-140°С, как правило, приблизительно при 105-125°С, охлаждают приблизительно до 60-95°С и добавляют еще больше фермента(ов) для осуществления окончательного гидролиза. Процесс разжижения выполняют приблизительно при рН 4,5-6,5, как правило, при величине рН, лежащей в диапазоне от приблизительно 5,0 до приблизительно 6,0. Измельченное и разжиженное зерно также известно под названием сусло.
Для производства низкомолекулярных сахаров DP1-3, которые могут метаболизироваться дрожжами, мальтодекстрины, полученные из этапа разжижения, должны быть дополнительно гидролизованы. Гидролиз, как правило, осуществляют ферментативно с использованием глюкоамилаз, альтернативно альфа-глюкозидаз или кислых альфа-амилаз. Весь этап осахаривания может длиться до 72 часов, однако общепринято выполнять только предварительное осахаривание обычно в течение 40-90 минут и затем завершать осахаривание во время ферментации (SSF). Осахаривание в большинстве случаев выполняют при температуре приблизительно 30-65°С, как правило, приблизительно при 60°С и при рН приблизительно 4,5.
Дрожжи, как правило, вида Saccharomyces добавляют к суслу, и ферментация длится в течение 24-96 часов, как, например, в основном 35-60 часов. Значение температуры лежит приблизительно в диапазоне 26-34°С, как правило, оно равно приблизительно 32°С, и значение рН лежит приблизительно в диапазоне 3-6, как правило, оно равно приблизительно 4-5. Важно отметить, что наиболее широко распространенным процессом являются идущие одновременно процессы осахаривания и брожения (SSF), где отсутствует стадия выдержки для осахаривания, что означает совместное добавление дрожжей и фермента. При выполнении SSF принято вводить этап предварительного осахаривания при температуре свыше 50°С незадолго до брожения.
Вслед за брожением сусло подвергают перегонке для получения спирта. Спирт, получаемый в соответствии с данным процессом описания изобретения, может быть использован в качестве, например, спирта для топлива; спирта для питья, т.е. питьевого спирта без вкусовых добавок, или промышленного спирта. После ферментации остается зерно, которое обычно используется на корм животным либо в жидкой форме, либо в сухом виде. Дополнительные сведения о том, как выполняется разжижение, осахаривание, брожение, перегонка и получение спирта, хорошо известны специалистам в данной области техники. В соответствии с описанием настоящего изобретения осахаривание и брожение могут быть выполнены одновременно или раздельно.
7. Композиции детергента и использование
Обсуждаемые в настоящем документе варианты альфа-амилазы могут входить в состав композиций детергентов для использования при стирке белья, мойки посуды или других моющих композиций.
7.1. Композиции для стирки белья, очистки и мойки посуды и их использование.
В соответствии с одним из вариантов осуществления изобретения один или несколько вариантов альфа-амилазы, как правило, может быть компонентом композиции детергента и/или моющей добавкой. В этой связи он может быть включен в композицию детергента в виде непылящего гранулята, стабилизированного раствора или защищенного фермента. Не пылящий гранулят может быть получен, например, как показано в патентах США №№ 4106991 и 4661452, и может быть покрыт другим материалом с помощью методов, известных в данной области техники. Примерами восковидных материалов для покрытия являются продукты поли(этиленоксида); (полиэтиленгликоль, PEG) со средней молекулярной массой, равной от 1000 до 20000; этоксилированный нонилфенол, имеющий от 16 до 50 единиц этиленоксида; этоксилированные жирные спирты, в которых спирт содержит от 12 до 20 атомов углерода и в состав которых входит от 15 до 80 единиц этиленоксида; жирные спирты; жирные кислоты и моно-, ди- и триглицериды жирных кислот. Примеры пленкообразующих материалов для покрытия, подходящих для применения методами кипящего слоя, представлены, например, в Патенте GB № 1483591. Жидкие препараты фермента могут, например, быть стабилизированы путем добавления полиола, такого как пропиленгликоль, сахара или сахарных спиртов, молочной кислоты или борной кислоты в соответствии с общепринятыми методами. Другие стабилизаторы фермента хорошо известны в данной области техники. Защищенные ферменты могут быть приготовлены в соответствии с методом, представленным в Патенте США № 5879920 (Genencor Int'l, Inc.) или Европейском Патенте № 238216, например. Полиолы долгое время были признаны в качестве стабилизаторов белков, а также для улучшения растворимости белков. Смотри, например, Kaushik et al., «Why is trehalose an exceptional protein stabilizer? An analysis of the thermal stability of proteins in the presence of the compatible osmolyte trehalose» J. Biol. Chem. 278: 26458-65 (2003) и ссылки, перечисленные в данном документе; и M. Conti et al., «Capillary isoelectric focusing: the problem of protein solubility», J. Chromatography 757: 237-245 (1997).
Композиция детергента может быть в любой подходящей форме, например в виде гелей, порошков, гранул, паст или жидкостей. Жидкий детергент может быть водным, обычно содержащим приблизительно до 70% воды и от 0% до приблизительно 30% органического растворителя, он может быть также в форме плотного типа геля, содержащего только приблизительно 30% воды.
Композиция детергента включает одно или несколько поверхностно-активных веществ, каждый из которых может быть анионным, не ионным, катионным или цвиттер-ионным. Детергент, как правило, содержит от 0% до приблизительно 50% анионного поверхностно-активного вещества, такого как линейный алкилбензолсульфанат (LAS); α-олефинсульфонат (AOS); алкилсульфат (сульфат жирного спирта) (AS); этоксисульфат спирта (AEOS или AES); вторичные алкансульфонаты (SAS); метиловые эфиры α-сульфо-жирных кислот; алкил- или алкенил-янтарная кислота или мыло. Композиция может также содержать от 0% до приблизительно 40% не ионного поверхностно-активного вещества, такого как этоксилат спирта (AEO или AE), карбоксилированные этоксилаты спирта, этоксилат нонилфенола, алкилполигликозид, алкилдиметиламиноксид, этоксилированный моноэтаноламид жирных кислот, моноэтаноламид жирных кислот, или полигидрокси-алкил-амид жирных кислот, как описано в WO 92/06154, например.
Композиция детергента может дополнительно включать один или несколько других ферментов, таких как липаза, кутиназа, протеаза, целлюлаза, пероксидаза и/или лакказа в любой комбинации.
Детергент может содержать от приблизительно 1% до приблизительно 65% моющего компонента детергента или комплексообразователя, такого как зеолит, дифосфат, трифосфат, фосфонат, цитрат, нитрилотриуксусная кислота (NTA), этилендиаминтетрауксусная кислота (EDTA), диэтилентриаминпентауксусная кислота (DTMPA), алкил- или алкенил-янтарная, растворимые силикаты или слоистые силикаты (например, SKS-6 из Hoechst). Детергент также может быть не моющим, т.е. фактически не содержащим моющего компонента детергента. Ферменты могут быть использованы в любой композиции, совместимой со стабильностью фермента. Ферменты могут быть защищены, в основном, от повреждающих компонентов с помощью известных видов капсулирования, таких как гранулирование или секвестрация в гидрогели, например. Ферменты и, особенно, альфа-амилазы, либо содержащие, либо не содержащие домены связывания крахмала, не ограничиваются применением при стирке белья или мойке посуды, но могут найти свое применение в очистке поверхностей и производстве спирта из крахмала или биомассы.
Детергент может включать один или несколько полимеров. Примеры включают карбоксиметилцеллюлозу (CMC), поли(винилпирролидон) (PVP), полиэтиленгликоль (PEG), поли(виниловый спирт) (PVA), поликарбоксилаты, такие как полиакрилаты, сополимеры малеиновой/акриловой кислоты и сополимеры лаурилметакрилата/акриловой кислоты.
Детергент может содержать систему отбеливания, которая может включать источник Н2О2, такой как перборат или перкарбонат, как правило, в сочетании с образующим перкислоты активатором отбеливателя, таким как TAED или нонаноилоксибензолсульфонат (NOBS). Альтернативно, система отбеливания может включать перкислоты амидного, имидного или сульфонного типов, например. Система отбеливания также может быть ферментативной отбеливающей системой, где пергидролаза активирует пероксид, как, например, описано в WO 2005/056783.
Ферменты композиции детергента могут быть стабилизированы, используя стандартные стабилизирующие вещества, например, полиол, такой как пропиленгликоль или глицерол; сахар или сахарный спирт; молочную кислоту; борную кислоту или производное борной кислоты, как, например, ароматический борнокислый эфир; и композиция может быть составлена, как описано в WO 92/19709 и WO 92/19708, например.
Детергент может также содержать другие стандартные ингредиенты детергента, такие как кондиционеры для ткани, включая отбельные земли, пенообразователи, пеногасители, антикоррозийные средства, преобразующие грязь в суспензию вещества, средства от повторного загрязнения, красители, бактерицидные средства, оптический отбеливатель или отдушка, например. Значение рН (измеренное в водном растворе при используемой концентрации), как правило, нейтральное или щелочное, например рН от приблизительно 7,0 до приблизительно 11,0.
Вариант альфа-амилазы может быть включен в состав в концентрациях, обычно используемых в детергентах. В настоящее время предполагается, что вариант альфа-амилазы может быть добавлен в композицию детергента в количестве, соответствующем 0,00001-1,0 мг (вычисленное как для беспримесного белка фермента) варианта альфа-амилазы на литр моющего раствора. Особые разновидности композиций детергентов, включающих варианты альфа-амилазы, могут быть составлены, чтобы включать:
(1) Композицию детергента, составленную как гранулят, имеющий объемную массу, равную по меньшей мере 600 г/л, включающий линейный алкилбензолсульфонат (рассчитывается как кислота) от приблизительно 7% до приблизительно 12%; этоксисульфат спирта (например, С12-18 спирта, 1-2 этиленоксида (ЕО)) или алкилсульфат (например, С16-18) от приблизительно 1% до приблизительно 4%; этоксилат спирта (например, С14-15 спирта, 7 ЕО) от приблизительно 5% до приблизительно 9%; карбонат натрия (например, Na2CO3) от приблизительно 14% до приблизительно 20%; растворимый силикат от приблизительно 2% до приблизительно 6%; цеолит (например, NaAlSiO4) от приблизительно 15% до приблизительно 22%; сульфат натрия (например, Na2SO4) от приблизительно 0% до приблизительно 6%; цитрат натрия/лимонную кислоту (например, C6H5Na3O7/C6H8O7) от приблизительно 0% до приблизительно 15%; перборат натрия (например, NaBO3H2O) от приблизительно 11% до приблизительно 18%; TAED от приблизительно 2% до приблизительно 6%; карбоксиметилцеллюлозу (СМС) от приблизительно 0% до приблизительно 2%; полимеры (например, сополимер малеиновой/акриловой кислоты, PVP, PEG) 0-3%; ферменты (рассчитываются как беспримесный фермент) 0,0001-0,1% белка; ингредиенты, вводимые в малых дозах (например, пеногасители, отдушки, оптический отбеливатель, фотоотбеливатель) от 0% до приблизительно 5%.
(2) Композицию детергента, составленную как гранулят, имеющий объемную массу, равную по меньшей мере 600 г/л, включающий линейный алкилбензолсульфонат (рассчитывается как кислота) от приблизительно 6% до приблизительно 11%; этоксисульфат спирта (например, С12-18 спирта, 1-2 ЕО) или алкилсульфат (например, С16-18) от приблизительно 1% до приблизительно 3%; этоксилат спирта (например, С14-15 спирта, 7 ЕО) от приблизительно 5% до приблизительно 9%; карбонат натрия (например, Na2CO3) от приблизительно 15% до приблизительно 21%; растворимый силикат от приблизительно 1% до приблизительно 4%; цеолит (например, NaAlSiO4) от приблизительно 24% до приблизительно 34%; сульфат натрия (например, Na2SO4) от приблизительно 4% до приблизительно 10%; цитрат натрия/лимонную кислоту (например, C6H5Na3O7/C6H8O7) от 0% до приблизительно 15%; карбоксиметилцеллюлозу (СМС) от 0% до приблизительно 2%; полимеры (например, сополимер малеиновой/акриловой кислоты, PVP, PEG) 1-6%; ферменты (рассчитываются как беспримесный белок фермента) 0,0001-0,1%; ингредиенты, вводимые в малых дозах (например, пеногасители, отдушки) от 0% до приблизительно 5%.
(3) Композицию детергента, составленную как гранулят, имеющий объемную массу, равную по меньшей мере 600 г/л, включающий линейный алкилбензолсульфонат (рассчитывается как кислота) от приблизительно 5% до приблизительно 9%; этоксилат спирта (например, С12-15 спирта, 7 ЕО) от приблизительно 7% до приблизительно 14%; мыло в виде жирной кислоты (например, С16-22 жирной кислоты) от приблизительно 1% до приблизительно 3%; карбонат натрия (в виде Na2CO3) от приблизительно 10% до приблизительно 17%; растворимый силикат от приблизительно 3% до приблизительно 9%; цеолит (в виде NaAlSiO4) от приблизительно 23% до приблизительно 33%; сульфат натрия (например, Na2SO4) от 0% до приблизительно 4%; перборат натрия (например, NaBO3H2O) от приблизительно 8% до приблизительно 16%; TAED от приблизительно 2% до приблизительно 8%; фосфонат (например, EDTMPA) от 0% до приблизительно 1%; карбоксиметилцеллюлозу (СМС) от 0% до приблизительно 2%; полимеры (например, сополимер малеиновой/акриловой кислоты, PVP, PEG) 0-3%; ферменты (рассчитываются как беспримесный белок фермента) 0,0001-0,1%; ингредиенты, вводимые в малых дозах (например, пеногасители, отдушка, оптический отбеливатель) от 0% до приблизительно 5%.
(4) Композицию детергента, составленную как гранулят, имеющий объемную массу, равную по меньшей мере 600 г/л, включающий линейный алкилбензолсульфонат (рассчитывается как кислота) от приблизительно 8% до приблизительно 12%; этоксилат спирта (например, С12-15 спирта, 7 ЕО) от приблизительно 10% до приблизительно 25%; карбонат натрия (в виде Na2CO3) от приблизительно 14% до приблизительно 22%; растворимый силикат от приблизительно 1% до приблизительно 5%; цеолит (например, NaAlSiO4) от приблизительно 25% до приблизительно 35%; сульфат натрия (например, Na2SO4) от 0% до приблизительно 10%; карбоксиметилцеллюлозу (СМС) от 0% до приблизительно 2%; полимеры (например, сополимер малеиновой/акриловой кислоты, PVP, PEG) 1-3%; ферменты (рассчитываются как беспримесный белок фермента) 0,0001-0,1%; и ингредиенты, вводимые в малых дозах (например, пеногасители, отдушка) от 0% до приблизительно 5%.
(5) Композицию водного жидкого детергента, включающего линейный алкилбензолсульфонат (рассчитывается как кислота) от приблизительно 15% до приблизительно 21%; этоксилат спирта (например, С12-15 спирта, 7 ЕО или С12-15 спирта, 5 ЕО) от приблизительно 12% до приблизительно 18%; мыло в виде жирной кислоты (например, олеиновой кислоты) от приблизительно 3% до приблизительно 13%; алкенилянтарную кислоту (С12-14) от 0% до приблизительно 13%; аминоэтанол от приблизительно 8% до приблизительно 18%; лимонную кислоту от приблизительно 2% до приблизительно 8%; фосфонат от 0% до приблизительно 3%; полимеры (например, PVP, PEG) от 0% до приблизительно 3%; борат (например, B4O7) от 0% до приблизительно 2%; этанол от 0% до приблизительно 3%; пропиленгликоль от приблизительно 8% до приблизительно 14%; ферменты (рассчитываются как беспримесный белок фермента) 0,0001-0,1%; и ингредиенты, вводимые в малых дозах (например, диспергирующие средства, пеногасители, отдушка, оптический отбеливатель) от 0% до приблизительно 5%.
(6) Композицию водного структурированного жидкого детергента, включающего линейный алкилбензолсульфонат (рассчитывается как кислота) от приблизительно 15% до приблизительно 21%; этоксилат спирта (например, С12-15 спирта, 7 ЕО или С12-15 спирта, 5 ЕО) 3-9%; мыло в виде жирной кислоты (например, олеиновой кислоты) от приблизительно 3% до приблизительно 10%; цеолит (в виде NaAlSiO4) от приблизительно 14% до приблизительно 22%; цитрат калия от приблизительно 9% до приблизительно 18%; борат (например, B4O7) от 0% до приблизительно 2%; карбоксиметилцеллюлозу (СМС) от 0% до приблизительно 2%; полимеры (например, PEG, PVP) от 0% до приблизительно 3%; фиксирующие полимеры (например, сополимер лаурилметакрилата/акриловой кислоты); молярное соотношение 25:1, MW 3800) от 0% до приблизительно 3%; глицерол от 0% до приблизительно 5%; ферменты (рассчитываются как беспримесный белок фермента) 0,0001-0,1%; и ингредиенты, вводимые в малых дозах (например, диспергирующие средства, пеногасители, отдушка, оптические отбеливатели) от 0% до приблизительно 5%.
(7) Композицию детергента, составленную как гранулят, имеющий объемную массу, равную по меньшей мере 600 г/л, включающий сульфат спирта жирного ряда от приблизительно 5% до приблизительно 10%; этоксилированный моноэтаноламид жирных кислот от приблизительно 3% до приблизительно 9%; мыло в виде жирной кислоты 0-3%; карбонат натрия (например, Na2CO3) от приблизительно 5% до приблизительно 10%; растворимый силикат от приблизительно 1% до приблизительно 4%; цеолит (например, NaAlSiO4) от приблизительно 20% до приблизительно 40%; сульфат натрия (например, Na2SO4) от приблизительно 2% до приблизительно 8%; перборат натрия (например, NaBO3H2O) от приблизительно 12% до приблизительно 18%; TAED от приблизительно 2% до приблизительно 7%; полимеры (например, сополимер малеиновой/акриловой кислоты, PEG) от приблизительно 1% до приблизительно 5%; ферменты (рассчитываются как беспримесный белок фермента) 0,0001-0,1%; ингредиенты, вводимые в малых дозах (например, оптический отбеливатель, пеногасители, отдушка) от 0% до приблизительно 5%.
(8) Композицию детергента, составленную как гранулят, включающий линейный алкилбензолсульфонат (рассчитывается как кислота) от приблизительно 8% до приблизительно 14%; этоксилированный моноэтаноламид жирных кислот от приблизительно 5% до приблизительно 11%; мыло в виде жирной кислоты от 0% до приблизительно 3%; карбонат натрия (например, Na2CO3) от приблизительно 4% до приблизительно 10%; растворимый силикат от приблизительно 1% до приблизительно 4%; цеолит (например, NaAlSiO4) от приблизительно 30% до приблизительно 50%; сульфат натрия (например, Na2SO4) от приблизительно 3% до приблизительно 11%; цитрат натрия (например, C6H5Na3O7) от приблизительно 5% до приблизительно 12%; полимеры (например, PVP, сополимер малеиновой/акриловой кислоты) от приблизительно 1% до приблизительно 5%; ферменты (рассчитываются как беспримесный белок фермента) 0,0001-0,1%; и ингредиенты, вводимые в малых дозах (например, пеногасители, отдушка) от 0% до приблизительно 5%.
(9) Композицию детергента, составленную как гранулят, включающий линейный алкилбензолсульфонат (рассчитывается как кислота) от приблизительно 6% до приблизительно 12%; неионное поверхностно-активное вещество от приблизительно 1% до приблизительно 4%; мыло в виде жирной кислоты от приблизительно 2% до приблизительно 6%; карбонат натрия (например, Na2CO3) от приблизительно 14% до приблизительно 22%; цеолит (например, NaAlSiO4) от приблизительно 18% до приблизительно 32%; сульфат натрия (например, Na2SO4) от приблизительно 5% до приблизительно 20%; цитрат натрия (например, C6H5Na3O7) от приблизительно 3% до приблизительно 8%; перборат натрия (например, NaBO3H2O) от приблизительно 4% до приблизительно 9%; активаторы отбеливающего вещества (например, NOBS или TAED) от приблизительно 1% до приблизительно 5%; карбоксиметилцеллюлозу (СМС) от 0% до приблизительно 2%; полимеры (например, поликарбоксилаты или PEG) от приблизительно 1% до приблизительно 5%; ферменты (рассчитываются как беспримесный белок фермента) 0,0001-0,1% белка; и ингредиенты, вводимые в малых дозах (например, оптический отбеливатель, отдушка) от 0% до приблизительно 5%.
(10) Композицию водного жидкого детергента, включающего линейный алкилбензолсульфонат (рассчитывается как кислота) от приблизительно 15% до приблизительно 23%; этоксисульфат спирта (например, С12-15 спирта, 2-3 ЕО) от приблизительно 8% до приблизительно 15%; этоксилат спирта (например, С12-15 спирта, 7 ЕО или С12-15 спирта, 5 ЕО) от приблизительно 3% до приблизительно 9%; мыло в виде жирной кислоты (например, лауриновой кислоты) от 0% до приблизительно 3%; аминоэтанол от приблизительно 1% до приблизительно 5%; цитрат натрия от приблизительно 5% до приблизительно 10%; гидротроп (например, толуенсульфонат) от приблизительно 2% до приблизительно 6%; борат (например, B4O7) от 0% до приблизительно 2%; карбоксиметилцеллюлозу от 0% до приблизительно 1%; этанол от приблизительно 1% до приблизительно 3%; пропиленгликоль от приблизительно 2% до приблизительно 5%; ферменты (рассчитываются как беспримесный белок фермента) 0,0001-0,1%; и ингредиенты, вводимые в малых дозах (например, полимеры, диспергирующие средства, отдушка, оптические отбеливатели) от 0% до приблизительно 5%.
(11) Композицию водного жидкого детергента, включающего линейный алкилбензолсульфонат (рассчитывается как кислота) от приблизительно 20% до приблизительно 32%; этоксилат спирта (например, С12-15 спирта, 7 ЕО или С12-15 спирта, 5 ЕО) 6-12%; аминоэтанол от приблизительно 2% до приблизительно 6%; лимонную кислоту от приблизительно 8% до приблизительно 14%; борат (например, B4O7) от приблизительно 1% до приблизительно 3%; полимер (например, сополимер малеиновой/акриловой кислоты, фиксирующий полимер, такой как сополимер лаурилметакрилата/акриловой кислоты) от 0% до приблизительно 3%; глицерол от приблизительно 3% до приблизительно 8%; ферменты (рассчитываются как беспримесный белок фермента) 0,0001-0,1%; и ингредиенты, вводимые в малых дозах (например, гидротропы, диспергирующие средства, отдушка, оптические отбеливатели) от 0% до приблизительно 5%.
(12) Композицию детергента, составленную как гранулят, имеющий объемную массу, равную по меньшей мере 600 г/л, включающий анионное поверхностно-активное вещество (линейный алкилбензолсульфонат, алкилсульфат α-олефинсульфона, метиловые эфиры α-сульфо-жирных кислот, алкансульфонаты, мыло) от приблизительно 25% до приблизительно 40%; не ионные поверхностно-активные вещества (например, этоксилат спирта) от приблизительно 1% до приблизительно 10%; карбонат натрия (например, Na2CO3) от приблизительно 8% до приблизительно 25%; растворимые силикаты от приблизительно 5% до приблизительно 15%; сульфат натрия (например, Na2SO4) от 0% до приблизительно 5%; цеолит (например, NaAlSiO4) от приблизительно 15% до приблизительно 28%; перборат натрия (например, NaBO3·4H2O) от 0% до приблизительно 20%; активатор отбеливающего средства (TAED или NOBS) от приблизительно 0% до приблизительно 5%; ферменты (рассчитываются как беспримесный белок фермента) 0,0001-0,1%; ингредиенты, вводимые в малых дозах (например, отдушка, оптические отбеливатели) от 0% до приблизительно 3%.
(13) Композиции детергента, как описано выше в композициях 1)-12), где все или часть линейного алкилбензолсульфоната заменено на алкилсульфат (C12-C18).
(14) Композицию детергента, составленную как гранулят, имеющий объемную массу, равную по меньшей мере 600 г/л, включающий алкилсульфат (C12-C18) от приблизительно 9% до приблизительно 15%; этоксилат спирта от приблизительно 3% до приблизительно 6%; амид полигидроксиалкил жирных кислот от приблизительно 1% до приблизительно 5%; цеолит (например, NaAlSiO4) от приблизительно 10% до приблизительно 20%; многослойный дисиликат (например, SK56 из Hoechst) от приблизительно 10% до приблизительно 20%; карбонат натрия (например, Na2CO3) от приблизительно 3% до приблизительно 12%; растворимый силикат от 0% до приблизительно 6%; цитрат натрия от приблизительно 4% до приблизительно 8%; перкарбонат натрия от приблизительно 13% до приблизительно 22%; TAED от приблизительно 3% до приблизительно 8%; полимеры (например, поликарбоксилаты и PVP) от 0% до приблизительно 5%; ферменты (рассчитываются как беспримесный белок фермента) 0,0001-0,1%; и ингредиенты, вводимые в малых дозах (например, оптический отбеливатель, фотоотбеливатель, отдушка, пеногасители) от 0% до приблизительно 5%.
(15) Композицию детергента, составленную как гранулят, имеющий объемную массу, равную по меньшей мере 600 г/л, включающий алкилсульфат (C12-C18) от приблизительно 4% до приблизительно 8%; этоксилат спирта от приблизительно 11% до приблизительно 15%; мыло от приблизительно 1% до приблизительно 4%; цеолит MAP или цеолит А от приблизительно 35% до приблизительно 45%; карбонат натрия (в виде Na2CO3) от приблизительно 2% до приблизительно 8%; растворимый силикат от 0% до приблизительно 4%; перкарбонат натрия от приблизительно 13% до приблизительно 22%; TAED 1-8%; карбоксиметилцеллюлозу (СМС) от 0% до приблизительно 3%; полимеры (например, поликарбоксилаты и PVP) от 0% до приблизительно 3%; ферменты (рассчитываются как беспримесный белок фермента) 0,0001-0,1%; и ингредиенты, вводимые в малых дозах (например, оптический отбеливатель, фосфонат, отдушка) от 0% до приблизительно 3%.
(16) Композиции детергента, как описано выше в 1)-15), которые содержат стабилизированную или капсулированную перкислоту либо в качестве дополнительного компонента, либо в качестве заменителя уже упомянутых систем отбеливания.
(17) Композиции детергента, как описано выше в 1), 3), 7), 9) и 12), где перборат заменен на перкарбонат.
(18) Композиции детергента, как описано выше в 1), 3), 7), 9), 12), 14) и 15), которые дополнительно содержат марганцевый катализатор.
(19) Композицию детергента, составленную в виде неводного жидкого моющего средства, включающего жидкое не ионное поверхностно-активное вещество, такое как, например, линейный алкоксилированный первичный спирт, моющий компонент (например, фосфат), фермент(ы) и щелочь. Детергент также может включать анионное поверхностно-активное вещество и/или систему отбеливания.
В другом варианте осуществления изобретения 2,6-β-D-фруктангидролаза может быть включена в композицию детергента и использована для удаления/очистки биопленки, присутствующей на домашнем и/или техническом текстильном изделии/белье для стирки.
Композиция детергента может, например, быть составлена в виде композиции детергента для ручной или машинной стирки белья, включая композицию добавки для стирки белья, подходящую для предварительной обработки окрашенных текстильных изделий, и композицию добавляемого для ополаскивания мягчителя ткани, или может быть составлена в виде композиции детергента для использования при выполнения основных работ по очистке твердых поверхностей в домашних условиях, или может быть составлена для выполнения работ по ручной или машинной мойке посуды.
В определенном аспекте изобретения композиция детергента может включать 2,6-β-D-фруктангидролазу, один или несколько вариантов альфа-амилазы и один или несколько других очищающих ферментов, таких как протеаза, липаза, кутиназа, карбогидраза, целлюлаза, пектиназа, маннаназа, арабиназа, галактаназа, ксиланаза, оксидаза, лакказа и/или пероксидаза и/или любой комбинации вышеперечисленного. Как правило, свойства выбранного фермента(ов) должны быть совместимы с выбранным детергентом (например, рН-оптимум, совместимость с другими ферментативными и не ферментативными ингредиентами и др.); и фермент(ы) должны находиться в эффективных количествах.
Протеазы: применяемые протеазы включают таковые животного, растительного или микробного происхождения. Также подходят химически модифицированные или белково-инженерные мутанты. Протеаза может быть сериновой протеазой или металлопротеазой, например щелочной микробной протеазой или трипсиноподобной протеазой. Типичными щелочными протеазами являются субтилизины, в частности таковые, полученные из вида Bacillus, например, субтилизин Novo, субтилизин Carlsberg, субтилизин 309 (смотри, например, Патент США № 6287841), субтилизин 147 и субтилизин 168 (смотри, например, WO 89/06279). Типичными трипсиноподобными протеазами являются трипсин (например, свиного или бычьего происхождения) и протеазы Fusarium (смотри, например, WO 89/06270 и WO 94/25583). Типичные протеазы также включают, помимо прочего, варианты, описанные в WO 92/19729 и WO 98/20115. Применяемые коммерчески доступные ферменты протеаз включают Alcalase®, Savinase®, PrimaseTM, DuralaseTM, Esperase® и KannaseTM(Novo Nordisk A/S); Maxatase®, MaxacalTM, MaxapemTM, ProperaseTM, Purafect®, Purafect OxPTM, FN2TM и FN3TM (Genencor Inernational, Inc.).
Липазы: применяемые липазы включают таковые бактериальной или грибковой природы. Включены химически модифицированные или белково-инженерные мутанты. Типичные липазы включают, помимо прочего, липазы из Humicola (синоним Thermomyces), например H. lanuginose (T. lanuginosus) (смотри, например, Европейский Патент №№ 258068 и 305216) и H. insolens (смотри, например, WO 96/13580); липазу Pseudomonas (например, из P. alcaligenes или P. pseudoalcaligenes; смотри, например, Европейский патент № 218272), P. cepacia (смотри, например, Европейский патент № 331376), P. stutzeri (смотри, например, GB 1372034), P. fluorescens, штамм SD 705 вида Pseudomonas (смотри, например, WO 95/06720 и WO 96/27002), P. wisconsinensis (смотри, например, WO 96/12012); липазу Bacillus (например, из B. subtilis; смотри, например, Dartois et al. Biochemica Biophysica Acta, 1131: 253-360 (1993)), B. stearothermophilus (смотри, например, JP 64/744992) или B. pumilus (смотри, например, WO 91/16422). Дополнительные варианты липазы, рассматриваемые для использования в композициях, включают таковые, описанные, например, в: WO 92/05249, WO 94/01541, WO 95/35381, WO 96/00292, WO 95/30744, WO 94/25578, WO 95/14783, WO 95/22615, WO 97/04079, WO 97/07202, Европейский Патент №№ 407225 и 260105. Некоторые коммерчески доступные ферменты липаз включают Lipolase® и Lipolase® Ultra (Novo Nordisk A/S).
Полиэстеразы: применяемые полиэстеразы включают, помимо прочего, таковые, описанные в WO 01/34899 (Genencor International, Inc.) и WO 01/14629 (Genencor International, Inc.), и могут быть включены в любой комбинации с другими ферментами, обсуждаемыми в данном описании изобретения.
Амилазы: Композиции могут быть объединены с другими альфа-амилазами, такими как неизмененная альфа-амилаза. Они могут включать коммерчески доступные амилазы, такие как, помимо прочего, Duramyl®, Termamyl®, Fungamyl® и BANTM (Novo Nordisk A/S), Rapidase® и Purastar® (Genencor International, Inc.).
Целлюлазы: Целлюлазы могут быть добавлены в композиции. Применяемые целлюлазы включают таковые бактериальной или грибковой природы. Включены химически модифицированные или белково-инженерные мутанты. Применяемые целлюлазы включают целлюлазы из вида Bacillus, Pseudomonas, Humicola, Fusarium, Thielavia, Acremonium, например, грибковые целлюлазы, полученные из Humicola insolens, Myceliophthora thermophila и Fusarium oxysporum, представленные в Патенте США №№ 4435307; 5648263; 5691178; 5776757; и WO 89/09259, например.
Типичными целлюлазами, предусмотренными для использования, являются таковые, имеющие благотворное воздействие при уходе за цветными текстильными изделиями. Примерами таких целлюлаз являются целлюлазы, описанные в Европейском Патенте №№ 495257 и 531372; WO 99/25846 (Genencor International, Inc.), WO 96/34108 (Genencor International, Inc.), WO 96/11262; WO 96/29397 и WO 98/08940, например. Другими примерами являются варианты целлюлазы, такие как те, что описаны в WO 94/07998; WO 98/12307; WO 95/24471; PCT/DK98/00299; Европейском Патенте № 531315 (Novo Nordisk); Патенте США №№ 5457046; 5686593 и 5763254. Коммерчески доступные целлюлазы включают Celluzyme® и Carezyme® (Novo Nordisk A/S); ClazinaseTMи Puradax® HA (Genencor International, Inc.); и KAC-500(B)TM(Kao Corporation).
Пероксидазы/Оксидазы: применяемые пероксидазы/оксидазы, предусмотренные для использования в композициях, включают таковые растительного, бактериального или грибкового происхождения. Включены химически модифицированные или белково-инженерные мутанты. Примеры используемых пероксидаз включают пероксидазы из Coprinus, например, из C. cinereus, и варианты вышеперечисленного как те, что описаны в WO 93/24618, WO 95/10602 и WO 98/15257. Коммерчески доступные пероксидазы включают GuardzymeTM (Novo Nordisk A/S), например.
Очищающий фермент(ы) может быть включен в композицию детергента путем добавления отдельных добавок, содержащих один или несколько ферментов, или путем добавления смешанных добавок, включающих все эти ферменты. Моющая добавка, т.е. индивидуальная добавка или смешанная добавка, может быть составлена в виде гранулята, жидкости, суспензии и т.п. Применяемые композиции моющей добавки гранулята включают не пылящие грануляты.
Непылящие грануляты могут быть получены, например, как описано в Патенте США №№ 4106991 и 4661452, и, как правило, могут быть покрыты с помощью методов, известных в данной области техники. Примерами восковидных материалов для покрытия являются продукты поли(этиленоксида) (например, полиэтиленгликоль, PEG) со средней молекулярной массой, равной от 1000 до 20000; этоксилированные нонилфенолы, имеющие от 16 до 50 единиц этиленоксида; этоксилированные жирные спирты, в которых спирт содержит от 12 до 20 атомов углерода и в состав которых входит от 15 до 80 единиц этиленоксида; жирные спирты; жирные кислоты и моно-, ди- и триглицериды жирных кислот. Примеры пленкообразующих материалов для покрытия, подходящих для применения методами кипящего слоя, представлены, например, в Патенте GB № 1483591. Жидкие препараты фермента могут, например, быть стабилизированы путем добавления полиола, такого как пропиленгликоль, сахара или сахарных спиртов, молочной кислоты или борной кислоты в соответствии с общепринятыми методами. Защищенные ферменты могут быть приготовлены в соответствии с методом, представленным в Европейском Патенте № 238216.
Композиция детергента может быть в любой удобной форме, например куска мыла, таблетки, геля, порошка, гранулы, пасты или жидкости. Жидкий детергент может быть водным, как правило, содержащим приблизительно до 70% воды и от 0% до приблизительно 30% органического растворителя. Также рассматриваются компактные гели детергента, содержащие 30% или меньшее количество воды. Композиции детергента включают один или несколько поверхностно-активных веществ, которые могут быть не ионными, включая полуполярные, анионные, катионные или цвиттер-ионные или любую комбинацию вышеперечисленного. Поверхностно-активные вещества, как правило, содержатся в количестве от 0,1% до 60% по весу.
В случае использования в данном изобретении детергент, как правило, содержит от приблизительно 1% до приблизительно 40% анионного поверхностно-активного вещества, такого как линейный алкилбензолсульфанат, α-олефинсульфонат, алкилсульфат (сульфат жирного спирта), этоксисульфат спирта, вторичные алкансульфонаты, метиловые эфиры α-сульфо-жирных кислот; алкил- или алкенил-янтарная кислота или мыло.
В случае использования в данном изобретении детергент, как правило, содержит от приблизительно 0,2% до приблизительно 40% не ионного поверхностно-активного вещества, такого как этоксилат спирта, этоксилат нонилфенола, алкилполигликозид, алкилдиметиламиноксид, этоксилированный моноэтаноламид жирных кислот, моноэтаноламид жирных кислот, полигидрокси-алкил-амид жирных кислот или N-ацил-N-алкил-производные глюкозамина («глюкамиды»).
Детергент может содержать от 0% до приблизительно 65% моющего компонента детергента или комплексообразователя, такого как цеолит, дифосфат, трифосфат, фосфонат, карбонат, цитрат, нитрилотриуксусная кислота, этилендиаминтетрауксусная кислота (EDTA), диэтилентриаминпентауксусная кислота, алкил- или алкенил-янтарная кислота, растворимые силикаты или слоистые силикаты (например, SKS-6 из Hoechst).
Детергент может включать один или несколько полимеров. Примерами являются карбоксиметилцеллюлоза (СМС), поли(винилпирролидон) (PVP), поли(этиленгликоль) (PEG), поли(виниловый спирт) (PVA), поли(винилпиридин-N-оксид), поли(винилимидазол), поликарбоксилаты, например полиакрилаты, сополимеры малеиновой/акриловой кислоты и сополимеры лаурилметакрилата/акриловой кислоты.
Детергент может содержать систему отбеливания, которая может включать источник Н2О2, такой как перборат или перкарбонат, который может быть в сочетании с образующим перкислоты активатором отбеливающего вещества (например, тетраацетилэтилендиамин или нонаноилоксибензолсульфонат). Альтернативно, система отбеливания может включать пероксикислоты (например, пероксикислоты амидного, имидного или сульфонового типа). Система отбеливания может быть также ферментативной системой отбеливания.
Фермент(ы) композиции детергента может быть стабилизирован, используя стандартные стабилизирующие вещества, например полиол (например, пропиленгликоль или глицерол), сахар или сахарный спирт, молочную кислоту, борную кислоту, производное борной кислоты (например, ароматический эфир борной кислоты) или фенильное производное борной кислоты (например, 4-формилфенил борная кислота). Композиция может быть составлена, как описано в WO 92/19709 и WO 92/19708.
Детергент может также содержать другие стандартные ингредиенты детергента, такие как, например, кондиционер для ткани, включая отбельные земли, пенообразователи, пеногасители, антикоррозийные средства, преобразующие грязь в суспензию средства, средства от повторного загрязнения, красители, бактерициды, оптические отбеливатели, гидротропы, ингибиторы потускнения ткани или отдушки.
Предусматривается, что в композициях детергента варианты фермента могут быть добавлены в количестве, соответствующем от приблизительно 0,01 до приблизительно 100 мг белка фермента на литр моющего раствора, в частности от приблизительно 0,05 до приблизительно 5,0 мг белка фермента на литр моющей жидкости или даже, более конкретно, от 0,1 до приблизительно 1,0 мг белка фермента на литр моющей жидкости.
Обсуждаемые в настоящем документе варианты альфа-амилазы могут входить в состав композиции детергента для использования в композициях по очистке посуды или других очищающих композициях, например. Это могут быть гели, порошки или жидкости. Композиции могут включать только один вариант альфа-амилазы, другие амилолитические ферменты, другие очищающие ферменты и другие компоненты, общие для чистящих композиций.
Таким образом, композиция детергента для мойки посуды может включать поверхностно-активное вещество. Поверхностно-активное вещество может быть анионным, не ионным, катионным, амфотерным или смесью этих типов. Детергент может содержать от 0% до приблизительно 90% по весу не ионных поверхностно-активных веществ, таких как малопенящиеся и непенящиеся этоксилированные пропоксилированные спирты с неразветвленной цепью.
В сферах применения детергента варианты альфа-амилазы обычно используются в жидких композициях, содержащих пропиленгликоль. Вариант альфа-амилазы может быть растворен, например, в пропиленгликоле путем циркуляции в 25% (объем/объем) растворе пропиленгликоля, содержащем 10% хлорид кальция.
Композиция детергента для мойки посуды может содержать соли моющего компонента детергента неорганического и/или органического типов. Моющие компоненты детергента могут быть подразделены на содержащие фосфор и не содержащие фосфор типы. Композиция детергента обычно содержит от приблизительно 1% до приблизительно 90% моющего компонента детергента. Примеры содержащих фосфор неорганических щелочных моющих компонентов детергента, будучи в наличии, включают водорастворимые соли, в частности пирофосфаты, ортофосфаты и полифосфаты щелочных металлов. Пример содержащего фосфор органического щелочного моющего компонента детергента, будучи в наличии, включает водорастворимые соли фосфонатов. Примеры не содержащего фосфор неорганического моющего компонента детергента, будучи в наличии, включают водорастворимые карбонаты, бораты и силикаты щелочных металлов, а также различные типы водонерастворимого кристаллина или аморфных алюмосиликатов, среди которых цеолиты являются хорошо известными представителями.
Примеры применяемых органических моющих компонентов включают щелочные металлы; аммоний и замещенный аммоний; цитраты; сукцинаты; малонаты; сульфонаты жирных кислот; карбоксиметоксисукцинаты; полиацетаты аммония; карбоксилаты; поликарбоксилаты; аминополикарбоксилаты; полиацетилкарбоксилаты и полигидроксисульфонаты.
Другие применимые органические моющие компоненты включают высокомолекулярные полимеры и сополимеры, имеющие, как известно, свойства моющего компонента, например соответствующую полиакриловую кислоту, полималеиновую кислоту и сополимеры полиакриловой/полималеиновой кислоты и их соли.
Чистящие композиции могут содержать отбеливающие вещества хлористобромного или кислородного типов. Примерами неорганических хлористобромных отбеливающих веществ являются гипохлорит и гипобромит лития, натрия или кальция, а также хлористый трехзамещенный фосфат натрия. Примерами органических хлористобромных отбеливающих веществ являются гетероциклические N-бром- и N-хлор-имиды, такие как трихлорфульминуровая, трибромфульминуровая, дибромфульминуровая, дихлорфульминуровая кислоты и их соли с водорастворимыми катионами, такими как калий и натрий. Соединения гидантоина также применяются.
Чистящие композиции могут содержать кислородные отбеливающие вещества, например, в виде неорганической персоли, как правило, вместе с исходным материалом отбеливающего вещества или в виде соединений перкислоты. Типичными примерами используемых пероксисоединений отбеливающего вещества являются пербораты щелочных металлов, как тетрагидраты, так и моногидраты, перкарбонаты щелочных металлов, персиликаты и перфосфаты. Применяемые вещества активатора включают тетраацетилэтилендиамин (TAED) и глицерол триацетат. Также могут быть представлены ферментативные системы активации отбеливающего вещества, такие как перборат или перкарбонат, глицерол триацетат и пергидролаза, как рассмотрено, например, в WO 2005/056783.
Чистящие композиции могут быть стабилизированы с использованием стандартных стабилизирующих веществ для фермента(ов), например полиола, такого как, например, пропиленгликоль, сахара или сахарного спирта, молочной кислоты, борной кислоты или производного борной кислоты (например, ароматического борнокислого эфира). Чистящая композиция может также содержать другие стандартные ингредиенты детергента, например дефлокулирующее вещество, наполнитель, подавитель пены, антикоррозийные средства, преобразующее грязь в суспензию средство, комплексообразующее соединение, средство от повторного загрязнения, дегидратирующие средства, красители, бактерициды, флуоресцентные средства, загустители и отдушки.
Наконец, варианты альфа-амилазы могут быть использованы в стандартных детергентах для мойки посуды, например в любом из детергентов, описанных в нижеперечисленных публикациях патентов, с учетом того, что рассмотренные в настоящем документе варианты альфа-амилазы используются вместо или в дополнение к любой альфа-амилазе, рассмотренной в перечисленных патентах и опубликованных заявках: CA 2006687, GB 2200132, GB 2234980, GB 2228945, DE 3741617, DE 3727911, DE 4212166, DE 4137470, DE 3833047, DE 4205071, WO 93/25651, WO 93/18129, WO 93/04153, WO 92/06157, WO 92/08777, WO 93/21299, WO 93/17089, WO 93/03129, Европейский патент №№ 481547, 530870, 533239, 554943, 429124, 346137, 561452, 318204, 318279, 271155, 271156, 346136, 518719, 518720, 518721, 516553, 561446, 516554, 516555, 530635 и 414197 и Патент США №№ 5112518; 5141664 И 5240632.
7.2. Способы оценки композиций детергента
Существует огромное количество методов очистки альфа-амилаз. Типичное описание контрольной очистки заключается в следующем. «Образец» является кусочком материала, такого как текстильное изделие, который вдобавок имеет загрязнение. Материал может быть, например, текстильным изделием из хлопка, полиэстра или натуральных и синтетических волокон. Альтернативно, материал может быть бумагой, такой как фильтровальная бумага или нитроцеллюлоза, или кусочком твердого материала, такого как керамика, металл или стекло. Для альфа-амилаз основа загрязнения состоит из крахмала, но может включать кровь, молоко, чернила, траву, чай, вино, шпинат, соус, шоколадное яйцо, сыр, глину, пигмент, масло или смеси из этих соединений. В одном варианте осуществления изобретения вариант α-амилазы тестируется методом BMI (кровь/молоко/чернила).
«Образец меньшего размера» является кусочком образца, который был нарезан, например, с помощью компостера для одного отверстия или компостера промышленного производства для 96 отверстий, где модель мультидырочного компостера подобрана для стандартных 96-луночных плашек для микротитрования, или был извлечен иным способом из образца. Образец может быть текстильным изделием, бумагой, металлом или другим подходящим материалом. Образец меньшего размера может иметь загрязнение, фиксированное либо перед его размещением, либо после его размещения в лунке 24-, 48- или 96-луночной плашки для микротитрования. Образец меньшего размера также может быть приготовлен путем нанесения загрязнения на небольшой кусочек материала. Например, образец меньшего размера может быть кусочком текстильного изделия с диаметром загрязнения в 5/8" или 0,25". Компостер промышленного производства конструируют таким образом, чтобы он доставлял 96 образцов одновременно во все лунки 96-луночной плашки. Прибор обеспечивает доставку более чем одного образца на лунку путем неоднократной подачи одной и той же 96-луночной плашки. Мультидырочный компостер может быть сконструирован для одновременной доставки образцов в плашки любого формата, включая, помимо прочего, 24-луночные, 48-луночные и 96-луночные плашки. В другом потенциально возможном методе загрязненная тестовая платформа может быть полосой материала, сделанного либо из металла, пластика, стекла, керамики, либо другого подходящего материала, покрытого загрязненным субстратом. Одна или несколько покрытых полосок материала затем размещаются в лунках 96-, 48- или 24-луночных плашек или плашек большего формата, содержащих применяемый буфер или фермент. В этом случае супернатант будет исследован на высвобождение загрязнения либо путем непосредственного измерения оптической плотности, либо после вторичной цветообразующей реакции. Исследование высвобождаемого загрязнения может быть проведено с помощью масс-спектрального анализа.
В одном из вариантов осуществления изобретения протокол условий эксплуатации обеспечивает контроль над степенью фиксации загрязнения. Таким образом, возможно изготовлять образцы, которые, например, высвобождают различные количества загрязнения при промывке в отсутствие тестируемого фермента. Использование фиксированных образцов приводит к значительному улучшению соотношения сигнал/шум в методах промывки. Более того, варьируя степенью фиксации, можно получить загрязнения, дающие оптимальные результаты при различных условиях очистки.
Образцы, имеющие загрязнения известной «интенсивности» на различных типах материала, коммерчески доступны (EMPA, St. Gallen, Switzerland; Testgewebe GmbH, Krefeld Germany; или Центр по Тестированию Материалов, Vlaardingen, The Netherlands) и/или могут быть сделаны специалистом-практиком (Morris and Prato, Textile Research Journal 52(4):280-286, 1982). Образцы могут включать, например, содержащие хлопок текстильные изделия, содержащие загрязнение кровью/молоком/чернилами (BMI), шпинатом, травой или шоколадом/молоком/сажей. Загрязнение BMI может быть фиксировано на хлопке 0,0003% - 0,3% перекисью водорода, например. Другие комбинации включают траву или шпинат, фиксированные 0,001% - 1% глютаральдегидом, желатин и краситель Кумасси, фиксированные 0,001% - 1% глютаральдегидом, или шоколад, молоко и сажу, фиксированные 0,001% - 1% глютаральдегидом.
Образец может также быть перемешан во время инкубации с ферментом и/или композицией детергента. Данные по выполнению отмывки зависят от ориентации образцов в лунках (горизонтальной при сравнении с вертикальной), в частности в 96-луночной плашке. Это означало бы, что перемешивание было бы недостаточным за время периода инкубации. Хотя существует несколько способов обеспечения достаточного перемешивания во время инкубации, может быть сконструирован держатель плашки, в котором плашка для микротитрования лежит между двумя пластинами из алюминия. Проще всего расположить, например, адгезивное приспособление для заклеивания планшетов поверх лунок, прикрепляя затем две алюминиевых пластины к 96-луночной плашке с помощью подходящих, коммерчески доступных зажимов любого типа. Затем держатель может быть закреплен в шейкере-инкубаторе заводского типа. Установка шейкера на приблизительно 400 оборотов в минуту приводит к очень эффективному перемешиванию, в то время как протекание или перекрестное загрязнение эффективно предотвращается с помощью держателя.
Тринитробензолсульфоновая кислота (TNBS) может быть использована для количественного определения концентрации аминогрупп в моющей жидкости. Это служит мерой количества белка, удаленного из загрязнения (смотри, например, Cayot and Tainturier, Anal. Biochem. 249:184-200, 1997). Однако если детергент или образец фермента приводит к образованию чрезвычайно малых пептидных фрагментов (например, вследствие присутствия пептидаз в образце), тогда будет получен больший сигнал TNBS, т.е. больше «шума».
Другой способ измерения выполнения отмывки крови/молока/чернил основан на высвобождении чернил, что может быть количественно оценено путем измерения оптической плотности моющей жидкости. Оптическая плотность может быть измерена при любой длине волны между 350 и 800 нм. В одном из вариантов осуществления изобретения измерения проводятся при длине волны 410 нм или 620 нм. Моющая жидкость может также быть исследована с целью определения выполнения отмывки загрязнений, содержащих траву, шпинат, желатин или краситель Кумасси.
Подходящие длины волн для этих загрязнений включают 670 нм для шпината или травы и 620 нм для желатины или Кумасси. Например, аликвота моющей жидкости (как правило, 100-150 мкл из 96-луночной плашки, например) отбирается и помещается в кювету или мультилуночную микроплашку. Затем она помещается в спектрофотометр и измеряется оптическая плотность при соответствующей длине волны. Система также может быть использована для определения пригодного фермента и/или композиции детергента для мойки посуды, например, используя загрязнение кровью/молоком/чернилами на применяемом субстрате, таком как ткань, пластик или керамика.
В одном из аспектов изобретения загрязнение BMI фиксируется на хлопчатобумажной ткани путем нанесения 0,3% перекиси водорода на BMI/хлопчатобумажный образец в течение 30 минут при 25°С или путем нанесения 0,03% перекиси водорода на BMI/хлопчатобумажный образец в течение 30 минут при 60°С. Образцы меньшего размера приблизительно в 0,25" вырезают из BMI/хлопчатобумажного образца и помещаются в лунки 96-луночной плашки для микротитрования. В каждую лунку помещают известную смесь композиции детергента и фермента, такого как белок варианта. После размещения адгезивного приспособления для заклеивания планшетов поверх плашки для микротитрования плашка для микротитрования прижимается к алюминиевой пластине и перемешивается в орбитальном шейкере при приблизительно 250 оборотах в минуту приблизительно в течение 10-60 минут. К концу этого времени супернатанты переносят в лунки новой плашки для микротитрования и измеряют оптическую плотность чернил при 620 нм. Подобным образом можно провести тесты с загрязнениями шпинатом или травой, фиксированными на хлопчатобумажной ткани путем нанесения 0,01% глютаральдегида на шпинатный/хлопчатобумажный образец или травяной/хлопчатобумажный образец в течение 30 минут при 25°С. То же самое можно сделать с загрязнениями шоколадом, молоком и/или сажей.
8. Композиции для расшлихтовки текстильных изделий и использование
Также рассматриваются композиции и методы по обработке ткани (например, для расшлихтовки текстильного изделия), используя один или несколько вариантов альфа-амилазы. Варианты альфа-амилазы могут быть использованы в любом методе по обработке ткани, которые хорошо известны в данной области техники (смотри, например, Патент США № 6077316). Например, в одном из аспектов изобретения тактильные качества и внешний вид ткани улучшаются методом, включающим взаимодействие ткани с вариантом фермента в растворе. В одном из аспектов изобретения ткань обрабатывается раствором под давлением.
В одном из аспектов изобретения ферменты применяются во время или после плетения текстильного изделия или во время стадии расшлихтовки или одного, или нескольких дополнительных этапов обработки ткани. Во время плетения текстильного изделия нити подвергаются значительному механическому натяжению. До плетения на механических ткацких станках пряжа основы, как правило, покрывается шлихтовочным крахмалом или производными крахмала, чтобы увеличить их предел прочности и предотвратить ломкость. Вариант альфа-амилазы может быть применен для удаления этого шлихтовочного крахмала или производных крахмала. После того как текстильное изделие соткано, ткань может пройти стадию расшлихтовки. Это может быть осуществлено после одного или нескольких дополнительных этапов обработки ткани. Расшлихтовка является процессом удаления шлихты из текстильного изделия. После плетения слой шлихты должен быть удален до дальнейшей обработки ткани, чтобы обеспечить гомогенность и устойчивость к стирке. Также рассматривается метод расшлихтовки, включающий ферментативный гидролиз шлихты под действием варианта фермента.
Вариант альфа-амилазы может быть использован отдельно или совместно с другими химическими реагентами расшлихтовки и/или ферментами расшлихтовки, чтобы расшлихтовать ткань, включая хлопчатобумажную ткань, как и моющими добавками, например, в водных композициях. Вариант альфа-амилазы также может быть использован в композициях и методах получения изношенного внешнего вида на окрашенной в темно-синий цвет джинсовой ткани и одежде. Для фабричного производства одежды ткань может быть нарезана и пошита в виде полотна или одежды, которые впоследствии подвергают отделке. В частности, для производства джинсов были разработаны различные ферментативные методы отделки. Отделка джинсовой одежды обычно начинается с этапа ферментативной расшлихтовки, во время которого одежда подвергается действию амилолитических ферментов, чтобы обеспечить мягкость ткани и сделать хлопчатобумажную ткань доступной для последующих ферментативных этапов отделки. Вариант альфа-амилазы может быть использован в методах отделки джинсовой одежды (например, в «процессе био-изнашивания»), ферментативной расшлихтовки и обеспечения мягкости ткани и/или отделочного процесса.
Это описание изобретения включает дополнительные подробности в нижеприведенных примерах, которые никоим образом не направлены на ограничение объема того, что заявлено. Прилагаемые чертежи являются неотъемлемой частью предоставленного описания изобретения и условных обозначений. Все приводимые ссылки особым образом включены в данный документ в качестве ссылки для всего, что в нем изложено. Приведенные ниже примеры, таким образом, представлены для иллюстрации, но не ограничивают того, что заявлено.
9. Композиции для удаления биопленки и использование
Композиция может содержать вариант альфа-амилазы в качестве главного ферментативного компонента, например моно-компонентная композиция для удаления биопленок. Альтернативно, композиция может содержать множественные ферментативные активности, такие как разнообразные амилазы, или коктейли из ферментов, включая аминопептидазу, амилазу (β- или α- или глюко-амилазу), карбогидразу, карбоксипептидазу, каталазу, целлюлазу, хитиназу, кутиназу, циклодекстрингликозилтрансферазу, дезоксирибонуклеазу, эстеразу, α-галактозидазу, β-галактозидазу, глюкоамилазу, α-глюкозидазу, β-глюкозидазу, галопероксидазу, инвертазу, лакказу, липазу, маннозидазу, оксидазу, пектинолитический фермент, пептидоглутаминазу, пероксидазу, фитазу, полифенолоксидазу, протеолитический фермент, рибонуклеазу, трансглутаминазу и/или ксиланазу или любую комбинацию вышеперечисленного для удаления биопленок. Дополнительный фермент(ы) может быть продуцирован с помощью микроорганизма, принадлежащего к роду Aspergillus, например A. aculeatus, A. awamori, A. niger или A. oryzae; или Trichoderma; Humicola, например H. insolens; или Fusarium, например F. bactridioides, F. cerealis, F. crookwellense, F. culmorum, F. graminearum, F. graminum, F. heterosporum, F. negundi, F. oxysporum, F. reticulatum, F. roseum, F. sambucinum, F. sarcochroum, F. sulphureum, F. toruloseum, F. trichothecioides или F. venenatum.
Вариант альфа-амилазы, включенный в композицию, может быть приготовлен в соответствии с методами, известными в данной области техники, и может быть в виде жидкости или сухой композиции. Например, композиция, содержащая вариант альфа-амилазы, может быть в виде гранулята или микрогранулята. Полипептид, подлежащий включению в композицию, может быть стабилизирован в соответствии с методами, известными в данной области техники.
Ниже приведены примеры использования полипептидных композиций. Доза композиции, содержащей вариант альфа-амилазы, и другие условия, при которых данная композиция используется, могут быть определены на основе методов, известных в данной области техники. Варианты альфа-амилазы дополнительно рассматриваются для использования в композиции наравне с 2,6-β-D-фруктан-гидролазой или ее вариантом.
Одним из аспектов изобретения является разрушение и/или удаление биопленки. Под термином «разрушение», который используется в данном документе, понимают гидролиз полисахаридов в матриксе биопленки, соединяющего и связывающего вместе индивидуальные микробные клетки в биопленке, в результате чего микробные клетки могут быть высвобождены и удалены из биопленки. Биопленка может присутствовать на поверхности; разрушение биопленки может быть достигнуто приведением поверхности в контакт с водной средой, например, путем погружения, обволакивания, разбрызгивания, где водная среда включает вариант альфа-амилазы и при желании один или несколько других ферментов, ответственных за разрушение биопленки, таких как, без ограничения, 2,6-β-D-фруктан-гидролаза. Композиция может быть использована для гидролиза слизи, например, в очищенной от волокнистой массы воде в целлюлозной и бумажной промышленности.
Вариант альфа-амилазы может присутствовать в количестве 0,0001-10000 мг/л, 0,001-1000 мг/л, 0,01-100 мг/л или даже 0,1-10 мг/л. Дополнительные ферменты или варианты ферментов могут присутствовать в подобных количествах или меньших количествах. Процесс может быть выполнен при температурах, равных приблизительно температуре окружающей среды до приблизительно 70°С. Применяемый температурный диапазон лежит в пределах от приблизительно 30°С до приблизительно 60°С, например от приблизительно 40°С до приблизительно 50°С.
Применяемое значение рН для гидролиза биопленок лежит в диапазоне от приблизительно 3,5 до приблизительно 8,5. Наиболее подходящим диапазоном значений рН является от приблизительно 5,5 до приблизительно 8, например от приблизительно 6,5 до приблизительно 7,5. Время контактирования или время реакции для фермента с целью эффективного удаления биопленки может значительно варьировать в зависимости от свойств биопленки и частоты, с которой поверхность обрабатывается определенным вариантом фермента или в сочетании с другими ферментами, такими как 2,6-β-D-фруктан-гидролаза, но подходящее время реакции лежит в диапазоне от приблизительно 0,25 до приблизительно 25 часов. Наиболее подходящее время реакции лежит в диапазоне от приблизительно 1 до приблизительно 10 часов, например приблизительно 2 часа.
Дополнительные ферменты могут быть скомбинированы с вариантами альфа-амилазы и 2,6-β-D-фруктан-гидролазами, включая, без ограничения, целлюлазы, гемицеллюлазы, ксиланазы, другие амилазы, включая другие альфа-амилазы, липазы, протеазы и/или пектиназы. Ферменты могут дополнительно быть комбинированы с антимикробными средствами, такими как ферментативные и не ферментативные биоциды. Ферментативный биоцид может быть композицией, содержащей оксидоредуктазу, например лакказу или пероксидазу, в частности галопероксидазу, и дополнительно активирующее вещество, такое как алкил-сиреневая кислота, как описано, например, в WO 97/42825 и DK 97/1273.
Поверхность, с которой биопленка должна быть удалена и/или очищена, может быть твердой поверхностью, которая по определению относится к любой поверхности, которая фактически непроницаема для микроорганизмов. Примерами являются поверхности, сделанные из металла, например нержавеющей стали, пластиковых/синтетических полимеров, резины, картона, стекла, древесины, бумаги, текстиля, бетона, камня, мрамора, гипса и керамических материалов, которые дополнительно могут быть покрыты красителем, эмалью полимерами и т.п. Соответственно, поверхность может быть составной частью систем удерживания, транспортировки, обработки или контактирования водных растворов, таких как системы водоснабжения, системы обработки пищевых продуктов, системы охлаждения, системы химической обработки, системы фармацевтической обработки или деревообрабатывающая система, такая как встречающаяся в целлюлозной и/или бумажной промышленности. В связи с этим варианты фермента и композиции, содержащие варианты фермента, пригодны для применения в стандартных системах безразборной мойки (C-I-P). Поверхность может быть частью системного блока, такого как радиаторы, резервуары, помпы, мембраны, фильтры, теплообменники, центрифуги, испарители, миксеры, башня с распылительным орошением, клапаны и реакторы. Поверхность может также являться или быть частью инструментов, используемых в медицинской науке и промышленности, таких как контаминированные эндоскопы, протезы или медицинские импланты.
Композиции для удаления биопленки также предусмотрены для предотвращения так называемых биокоррозий, происходящих, когда металлическая поверхность, например трубопровод, подвержена действию микробной биопленки. Композиции разрушают биопленку, тем самым предотвращая создание окружения биопленки микробными клетками биопленки, которое будет подвергать коррозии металлическую поверхность, с которой оно соприкасается.
9.1. Композиции по уходу за полостью рта
Дополнительные применения противобиопленочных композиций включают уход за полостью рта. Поверхности, таким образом, включают зубы с зубным налетом. Соответственно, ферменты варианта могут быть использованы в композициях, например зубной пасте, и процессах создания лекарственного препарата, включающего вариант фермента для разрушения налета, присутствующего на зубах человека или животного. Дополнительным использованием является разрушение биопленки на слизистых оболочках, такой как биопленка в легких у пациентов, страдающих муковисцидозом. Поверхностью также могут быть другие поверхности биологического происхождения, например кожа, зубы, волосы, ногти, или могут быть контаминированные контактные линзы.
Другие ферменты, применяемые в композициях по уходу за полостью рта, включают, без ограничения, 2,6-β-D-фруктан-гидролазу; декстраназу; мутаназу; оксидазы, такие как глюкооксидаза; оксидазу L-аминокислот; пероксидазы, такие как пероксидазы вида Coprinus, описанные в WO 95/10602, или лактопероксидазы; галопероксидазы, в частности галопероксидазу из вида Curvularia, в частности C. verruculosa и C. inaequalis; лакказы; протеазы, такие как папаин; кислую протеазу (например, кислые протеазы, описанные в WO 95/02044); эндогликозидазы; липазы; амилазы, включая амилогликозидазы, такие как AMGTM (из Novo Nordisk A/S); антимикробные ферменты и смеси вышеперечисленного. Продукт по уходу за полостью рта может включать связывающий крахмал домен, как рассмотрено в патенте США № 6207149.
Композиции по уходу за полостью рта могут иметь любую подходящую физическую форму, т.е. быть в виде порошка, пасты, геля, жидкости, мази, таблетки и т.д. «Композиция по уходу за полостью рта» включает композицию, которая может быть использована для поддержания или улучшения гигиены полости рта человека и животных путем предотвращения кариеса зубов, предотвращения образования зубного налета и камня, удаления зубного налета и камня, предотвращения и/или лечения болезней зубов и т.д. Композиции по уходу за полостью рта также включают продукты по очистке протезов, искусственных зубов и т.п. Примеры композиций по уходу за полостью рта включают зубную пасту, зубной крем, гель или зубной порошок, зубной эликсир, композицию ополаскивателя до и после чистки зубной щеткой, жевательную резинку, пастилки и леденцы. Зубные пасты и зубные гели, как правило, включают абразивные полирующие материалы, пенообразующие средства, вкусовые добавки, увлажнители, связующие вещества, загустители, подсластители, средства по осветлению/отбеливанию/удалению окраски, воду и, как дополнение, ферменты. Эликсиры, включающие жидкости по удалению налета, как правило, включают водно-спиртовой раствор, ароматизатор, увлажнитель, подсластитель, пенообразующее средство, краситель и как дополнение ферменты.
Абразивный полирующий материал может также быть в составе композиции по уходу за полостью рта. В связи с этим абразивный полирующий материал может включать алюмооксид и его гидраты, такие как тригидрат α-алюмооксида; трисиликат магния; карбонат магния; каолин; алюмосиликаты, такие как обожженный алюмосиликат и алюмосиликат; карбонат кальция; силикат циркония, а также порошковый пластик, такой как поливинилхлорид; полиамиды; полиметилметакрилат; полистирол; фенол-формальдегидные смолы; меламин-формальдегидные смолы; мочевино-формальдегидные смолы; эпоксидные смолы; порошковый полиэтилен; ксерогели на основе диоксида кремния; гидрогели и аэрогели и т.п.
В качестве абразивных веществ также подходит пирофосфат кальция; водонерастворимые щелочные метафосфаты; дикальцийфосфат и/или его дигидрат, дикальцийортофосфат; трикальцийфосфат; дисперсный гидроксиапатит и т.п. Также возможно использовать смеси этих веществ. В зависимости от композиции по уходу за полостью рта, абразивный продукт может содержаться в количестве от приблизительно 0% до приблизительно 70% по весу, например от приблизительно 1% до приблизительно 70%. Для зубных паст содержание абразивного материала обычно лежит в диапазоне от 10% до 70% по весу готовой зубной пасты.
Увлажнители используются для предотвращения потери воды из зубных паст, например. Увлажнители, пригодные для использования в композициях по уходу за полостью рта, включают глицерол; полиол; сорбитол; полиэтиленгликоли (PEG); пропиленгликоль; 1,3-пропандиол; 1,4-бутандиол; гидрогенизованные, частично гидролизованные, полисахариды и т.п. и смеси из вышеперечисленного. Увлажнители в большинстве случаев содержатся в зубной пасте в количестве от 0% до приблизительно 80% или от приблизительно 5% до приблизительно 70% по весу.
Двуокись кремния, крахмал, трагакантовая камедь, ксантановая камедь, экстракты из ирландского мха, альгинаты, пектин, производные целлюлозы, такие как гидроксиэтилцеллюлоза, карбоксиметилцеллюлозы натриевая соль и гидроксипропилцеллюлоза, полиакриловая кислота и ее соли, поливинилпирролидон, являются примерами применяемых загустителей и связующих веществ, которые помогают стабилизировать средство для чистки зубов. Загустители могут содержаться в кремообразной и гелеобразной зубной пасте в количестве от приблизительно 0,1% до приблизительно 20% по весу, а связующие вещества в количестве от приблизительно 0,01 до приблизительно 10% по весу конечного продукта.
Может быть использовано пенообразующее средство, включая мыло, анионные, катионные, не ионные, амфотерные и/или цвиттер-ионные поверхностно-активные вещества. Они могут содержаться в количествх от 0% до приблизительно 15%, от приблизительно 0,1 до приблизительно 13% или даже от приблизительно 0,25% до приблизительно 10% по весу конечного продукта. Поверхностно-активные вещества используются только в тех случаях, когда они не инактивируют присутствующие ферменты. Поверхностно-активные вещества включают сульфаты жирных спиртов, соли сульфированных моноглицеридов или жирных кислот, имеющих от 10 до 20 атомов углерода, продукты конденсации жирной кислоты/белка, соли амидов жирных кислот и таурина и/или соли жирного сложного эфира изэтионовой кислоты.
Применяемые подсластители включают сахарин для использования в композиции. Ароматизаторы, такие как мята, также обычно присутствуют в незначительных количествах, таких как от приблизительно 0,01% до приблизительно 5% по весу, в частности от приблизительно 0,1% до приблизительно 5%. Осветляющие/отбеливающие средства могут быть ферментом, таким как оксидоредуктаза. Осветляющие/отбеливающие средства включают H2O2 и могут быть добавлены в количестве, меньшем чем около 5 или от приблизительно 0,25 до приблизительно 4%, расчитаном по весу конечного продукта. Примеры используемых ферментов по отбеливанию зубов описаны в WO 97/06775 (Novo Nordisk A/S). Вода обычно добавляется в количестве, придающем композиции, например зубной пасте, жидкотекучую форму. Водорастворимые антибактериальные средства, такие как хлоргексидина биглюконат, гексетидин, алекседин, Triclosan®, антибактериальные соединения четвертичного аммония и водорастворимые источники определенных ионов металлов, таких как цинк, медь, серебро и олово (например, хлорид цинка, меди и олова и нитрат серебра), также могут быть включены. Добавочные соединения, которые могут быть использованы, включают источник флюорида, красители/пигменты, консерванты, витамины, регуляторы рН, противокариозные средства, десенсибилизаторы и др.
Ферменты также используются в композициях по уходу за полостью рта, описанных выше. Ферменты приносят некоторую выгоду, когда используются для очистки ротовой полости. Протеазы расщепляют белки слюны, которые адсорбируются на зубной поверхности и образуют тонкую пленку, первый слой образующегося налета. Протеазы наравне с липазами разрушают бактерии путем лизиса белков и липидов, которые образуют структурные компоненты бактериальной клеточной стенки и мембран. Декстраназа и другие карбогидразы, такие как 2,6-β-D-фруктан-гидролаза, разрушают органическую каркасную структуру, формируемую бактериями, которая образует матрикс для бактериальной адгезии. Протеазы и амилазы не только предотвращают образование налета, но также предотвращают развитие кальциноза путем разрушения карбогидрат-белковых комплексов, связывающих кальций.
Зубная паста может в основном включать следующие ингредиенты (в весовых % от готовой композиции зубной пасты): абразивный материал приблизительно до 70%; увлажнитель: от 0% до приблизительно 80%; загуститель: от приблизительно 0,1% до приблизительно 20%; связующее вещество: от приблизительно 0,01% до приблизительно 10%; подсластитель: от приблизительно 0,1% до приблизительно 5%; пенообразующее средство: от 0% до приблизительно 15%; отбеливатель: от 0% до приблизительно 5%; и ферменты: от приблизительно 0,0001% до приблизительно 20%. В одном из вариантов осуществления изобретения зубная паста имеет значение рН в диапазоне от приблизительно 6,0 до приблизительно 8,0 и включает: от приблизительно 10% до приблизительно 70% абразивного материала; от 0% до приблизительно 80% увлажнителя; от 0,1% до приблизительно 20% загустителя; от 0,01% до приблизительно 10% связующего вещества; от приблизительно 0,1% до приблизительно 5% подсластителя; от 0% до приблизительно 15% пенообразующего средства; от 0% до приблизительно 5% отбеливающего средства и от приблизительно 0,0001% до приблизительно 20% ферментов. Эти ферменты включают варианты альфа-амилазы отдельно или совместно с другими ферментами, такими как 2,6-β-D-фруктан-гидролаза, и дополнительно другие типы ферментов, упомянутых выше.
Эликсир в основном может включать следующие ингредиенты (в весовых % от готовой композиции эликсира): от 0% до приблизительно 20% увлажнителя; от 0% до приблизительно 2% поверхностно-активного вещества; от 0% до приблизительно 5% ферментов; от 0% до приблизительно 20% этанола; от 0% до приблизительно 2% других ингредиентов (например, ароматизатора, активных ингредиентов подсластителя, таких как флюориды). Композиция может также содержать от приблизительно 0% до приблизительно 70% воды. Композиция эликсира может быть забуферена подходящим буфером, например цитратом или фосфатом натрия в диапазоне значений рН, равных от приблизительно 6,0 до приблизительно 7,5. Эликсир может быть в концентрированной форме, т.е. он должен быть разведен перед использованием. Композиции по уходу за полостью рта могут быть получены, используя любой стандартный метод, известный в области техники по уходу за полостью рта.
Примеры
Пример 1 - Конструирование вариантов
Мутация S239Q последовательности дикого типа LAT была получена с использованием метода сайт-направленного мутагенеза. Матрицей для мутагенеза была метилированная pHPLT-LAT (Фиг.1), полученная путем использования dam-метилазы из New England Biolabs (Beverly, MA). Пять основных фосфорилированных прямых и обратных праймеров с комплементарными последовательностями были синтезированы в Integrated DNA Technologies (Coralville, IA) и разбавлены до 50 мкМ в TE-буфере. Мутант был создан с помощью набора Stratagene QuickChange Multi Site-Directed Mutagenesis Kit (Stratagene, La Jolla, CA), используя олигонуклеотидные праймеры, содержащие кодон САА для мутации глутамина, фланкированный выше- и нижерасположенными от 239 остатка последовательностями. Остаток серина(S) в 239 положении был мутирован с образованием глутамина (Q). Праймерами для мутагенеза были:
LAT-S239Q-F: GTCAAACACATTAAATTTCAATTTTTGCGGGATTGGG
LAT-S239Q-R: CCCAATCCCGCAAAAATTGAAATTTAATGTGTTTGAC
Реакция была осуществлена следующим образом:
Реакция быстрой замены:
Реакционная смесь объемом 25 мкл состояла из 13 мкл стерильной дистиллированной H2O, 2,5 мкл 10Х буфера из набора, 1 мкл дНТФ из набора, 0,25 мкл прямого праймера (с исходной концентрацией 50 мкМ), 0,25 мкл обратного праймера (с исходной концентрацией 50 мкМ), 7 мкл плазмидной ДНК pHPLT-LAT в качестве матрицы (приблизительно 98 нг) и 1 мкл ферментной смеси из набора.
Условия проведения циклического режима:
Условия проведения циклического режима были 95°С в течение 1 мин за один цикл, затем 95°С в течение 1 мин, 55°С в течение 1 мин, 65°С в течение 10 мин и 30 с за 30 циклов в термоциклере DNA Engine Dyad (Bio-Rad, Hercules, CA).
После проведения реакции Быстрой Замены 1 мкл Dpn I (10 ед/мкл) был добавлен в реакционную смесь и проведена инкубация при 37°С в течение 18 часов, а затем другие 0,5 мкл были добавлены для дополнительных 3 часов инкубации.
Два микролитра Dpn I-реакционной рестрикционной смеси были использованы в качестве матрицы для амплификации по типу катящегося кольца с использованием набора Templiphi amplification kit (GE Healthcare, Piscataway, NJ), и реакция была выполнена в соответствии с протоколом фирмы-изготовителя. Один микролитр ДНК катящегося кольца был трансформирован в 100 мкл компетентных клеток Bacillus subtilis) (штамм Bacillus subtilis, делетированный по 2 протеазам (∆aprE, ∆nprE, degUHy32, oppA, ∆spoIIE3501, amyE::xylRPxylAcomK-phleo)) и инкубирован в шейкере при 37°С в течение 1 часа. Затем высевали всю суспензию с трансформированными клетками на плашки, содержащие LA среду + 10 частей на миллион неомицина + 1% нерастворимого крахмала (25 мкл на одну плашку, 75 мкл на другую чашку). ПЦР колоний был выполнен с использованием Illustra PureTaq Ready-To-Go PCR beads (GE Healthcare, Piscataway, NJ) и олигонуклеотидных праймеров для ПЦР, фланкирующих 5' и 3' концы гена. Праймеры для ПЦР колоний были разведены до 50 мкМ в ТЕ-буфере (Integrated DNA Technologies, Coralville, IA). Праймерами, использованными для ПЦР колоний, являются:
pHPLT-F1: TACATATGAGTTATGCAGTTTG
pHPLT-R1: GTTATGAGTTAGTTCAAATTCG
Реакционная смесь, состоящая из 24 мкл стерильной дистиллированной H2O, 0,5 мкл прямого праймера (с исходной концентрацией 50 мкМ), 0,5 мкл обратного праймера (с исходной концентрацией 50 мкМ), крайне малого количества интересующих колоний, была перемешана в отдельной пробирке на 1,5 мл. Эта смесь была добавлена к ПЦР-шарикам.
Условия проведения циклического режима для ПЦР колоний:
Условия проведения циклического режима были 95°С в течение 10 мин за один цикл, затем 95°С в течение 1 мин, 53°С в течение 1 мин, 72°С в течение 2 мин за 25 циклов, затем заключительный этап при 72°С в течение 1 мин в термоциклере DNA Engine Dyad (Bio-Rad, Hercules, CA).
Продукт ПЦР был очищен для удаления избытка дНТФ и праймеров с помощью ExoSAP-IT (USB Corp., Cleveland, OH) путем перемешивания 10 мкл продукта ПЦР с 4 мкл ExoSAP-IT с последующей инкубацией при 37°С в течение 15 мин, затем инкубацией при 80°С в течение 15 мин. Очищенный продукт ПЦР колоний был секвенирован в Quintara Biosciences (Berkeley, CA).
LAT-S239 SEL:
Библиотека анализа сайта (SEL) для остатка серина в положении 239 была создана искусственно с помощью DNA 2.0 (Menlo Park, CA). Мутанты были сделаны в плазмиде pHPLT-LAT и трансформированы в клетку-хозяина B. subtilis (делетированная по 2 протеазам (∆aprE, ∆nprE, ∆spoIIE, amyE::xylRPxylAcomK-phleo). Сделанные аминокислотные замены были: A, C, D, E, G, H, I, K, L, M, P, Q, R, S, T, V, W и Y.
Пример 2 - Экспрессия, очистка и характеристика вариантов
Варианты LAT S239 были помещены в 96-луночные плашки для микротитрования, содержащие 125 мкл среды LB + 10 частей на миллион неомицина, и упорядочены в квадруплетном формате с контролями. Плашку для микротитрования с упорядоченными образцами культивировали в течение 6 часов при 37°С и 250 оборотах в минуту. Используя приспособление для создания реплик (Enzyscreen, Leiden, The Netherlands), культуральные плашки для микротитрования были использованы для засева новой плашки для микротитрования (плашки для микротитрования и крышки плашек из Enzyscreen, Leiden, The Netherlands), содержащие 175 мкл среды MBD для экспрессии белка (G. Vogtentanz et al, A Bacillus subtilis fusion protein system to produce soybean Bowman-Birk protease inhibitor, Prot. Expr. & Purif., 55:40-52 (2007)), снабженной неомицином в количестве 10 частей на миллион и 5 мМ CaCl2. Экспрессионные плашки культивировали в течение 64 часов при 37°С, 250 оборотах в минуту и 70% влажности. Экспрессионные культуры, подлежащие скринингу, затем были профильтрованы через плоский микрофильтр (0,22 мкм, Millipore, Billerica, MA).
Ферментации для амилаз были выполнены во встряхиваемых колбах объемом 500 мл, культивируемых при 37°С в течение 60 часов в минимальной культуральной среде MOPS (Neidhardt et al., J. Bacteriol., 119(3):736-747, 1974) c 1% (вес/объем) Soytone.
Вариант S239Q и альфа-амилаза дикого типа (SEQ ID NO: 2 и 4 соответственно) были очищены от ферментативного бульона, используя хроматографию на основе гидрофобного взаимодействия с фенилсефарозой 6 быстрого потока (high sub) (GE healthcare, 17-0973-05). В краткой форме, бульон был сконцентрирован в 10 раз, затем опять разбавлен 50 мМ MES, 2 мМ CaCl2, pH 6,8 c 1 М сульфатом аммония и стерильно профильтрован, используя фильтр из стекловолокна размером 12,5 см (Watman, 1825-125). Образцы затем были нанесены на колонку с фенилсефарозой FF высокой плотности (20×95 мм; Amersham, GE Healthcare Bio-Sciences, Sweden), которая была предварительно уравновешена тем же буфером. Не амилазные белки были смыты 10 объемами колонки того же буфера без сульфата аммония с последующим нанесением 5 объемов колонки воды. Наконец, целевые ферменты были элюированы раствором 50 мМ MES, 2 мМ CaCl2, рН 6,8, содержащим 40% пропиленгликоль.
Концентрации белка были определены либо с помощью стандартной количественной денситометрии в геле SDS-PAGE или методом измерения активности, используя стандартный набор реактивов из Megazyme (Wicklow, Ireland).
Пример 3 - Выявление измененных свойств
Этот пример показывает, что описанные в настоящем документе варианты могут иметь измененное свойство по сравнению с альфа-амилазой дикого типа B. licheniformis. Был выполнен крупномасштабный скрининг термостабильности вариантов.
Условия теплового шока были исследованы и выбраны таким образом, чтобы после теплового шока исходный фермент дикого типа (SEQ ID NO: 4) проявлял приблизительно 40% активности до теплового шока (т.е. активность после теплового шока/активность до теплового шока была приблизительно 0,4). Был проведен скрининг библиотек мутантов четыре раза, и потенциальными лидерами считались те, которые проявляли остаточную активность после теплового шока, которая составляла по меньшей мере на два стандартных отклонения больше, чем средняя остаточная активность исходного фермента дикого типа.
Экспрессия амилазы составляла приблизительно 100 частей на миллион в супернатантах культуры экспрессионных плашек. После 60-65 часов роста при 37°С в увлажняемом шейкере (250 оборотов в минуту и 70% относительной влажности) супернатанты культур были очищены для удаления клеточного материала, используя плоский фильтр. Очищенные супернатанты были разведены в 10 раз в буфере, содержащем 50 мМ NaOAc, 2,6 мМ CaCl2, 0,002% TWEEN 20, pH 5,8, до конечной концентрации, равной приблизительно 10 частей на миллион. Одна аликвота супернатанта была дополнительно разведена до 0,02 частей на миллион, и активность вариантов фермента была определена, как описано ниже, используя субстрат флуоресцентно меченного кукурузного крахмала (Invitrogen, San Diego CA, E33651). Вторая аликвота супернатанта была подвергнута 30-ти минутному тепловому шоку при 95°С в термоциклере перед разведением до 0,02 частей на миллион в 50 мМ NaOAc, 2,6 мМ CaCl2, 0,002% TWEEN 20, pH 5,8 и протестирована на остаточную активность, используя тот же флуоресцентный субстрат и количественный анализ, описанный ниже.
Активность альфа-амилазы была определена с использованием количественного анализа амилазы EnzCheck, в частности, как описано фирмой-производителем (Invitrogen, San Diego CA). Конечная концентрация амилазы в количественном анализе составляла приблизительно 0,02 частей на миллион. Буфером для количественного анализа был 50 мМ NaOAc, 2,6 мМ CaCl2, 0,002% TWEEN 20, pH 5,8. Субстратом являлся флуоресцентный краситель BODIPY, конъюгированный с 100 мкг/мл крахмала DQTM из кукурузы (Invitrogen, Eugene, OR). Увеличенная флуоресценция, указывающая на амилазную активность, была измерена, используя Spectomax M2 (Molecular Devices, Sunnyvale, CA). За реакцией наблюдали при комнатной температуре в течение 5 минут с помощью записывающего устройства в кинетическом режиме. Длина волны возбуждения составляла 485 нм; эмиссию наблюдали при 520 нм с отсекающим фильтром при 515 нм.
LAT дикого типа демонстрировала приблизительно 43-55% остаточной активности после того, как была подвержена тепловому шоку в течение 30 минут при 95°С. Вариант LAT S239Q сохранял приблизительно 73-75% остаточной активности при тех же условиях теплового шока (LAT-Q используется взаимозаменяемо с S239Q или 239Q). Вариант LAT S239A сохранял приблизительно 61% остаточной активности при тех же условиях теплового шока. Смотри Фиг.2. Эти измерения остаточной активности указывают на то, что S239Q и S239A варианты термостабильнее альфа-амилазы дикого типа.
Более того, вариант LAT S239 был охарактеризован биохимически. Стандартный биохимический количественный анализ описан ниже. Ферменты были приготовлены в концентрации 0,2 мг/мл в 50 мМ ацетата натрия при рН 5,8. Субстрат был приготовлен путем смешивания 40 мкл 7,5% (вес/объем) амилопектина из картофеля (Sigma-Fluka 10118) c 10 мкл 250 мМ ацетата натрия при рН 5,8 в пробирочных стрипах ПЦР-типа на 0,2 мл. Ферментативные реакции были запущены путем добавления 10 мкл разведенных образцов фермента к предварительно инкубированному субстрату с кратковременным перемешиванием на вортексе. Инкубации были проведены в нагревательном блоке термоциклера ПЦР-типа, 50°С, с нагретой крышкой (80°С) (Mastercycler Gradient, Eppendorf). Реакции были остановлены ровно через 4 минуты путем добавления 60 мкл 0,1н. NaOH и кратковременным перемешиванием на вортексе. Все реакции были повторены дважды. Общее количество редуцирующих сахаров, присутствующих в реакционной смеси, было определено, используя метод DNS, а именно: 20 мкл образца было смешано с 40 мкл воды в пробирках ПЦР-типа объемом 0,2 мл 96-луночной плашки. Шестьдесят микролитров реагента DNS (2,5н. NaOH, 43,8 мМ 3-5 динитросалициловой кислоты [Sigma D-0550], 1,06 M смешанного виннокислого калия-натрия [Sigma S6170]) были тщательно перемешаны в каждой пробирке с помощью пипетирования вверх и вниз. Плашка была инкубирована в течение 2 минут при 95°С с последующим моментальным охлаждением до 25°С с использованием нагревательного блока термоциклера ПЦР-типа. Сто микролитров смеси из каждой пробирки были перенесены в плоскодонную 96-луночную плашку для микротитрования, и была измерена оптическая плотность всей плашки при 543 нм.
Остаточные активности варианта LAT S239Q и LAT дикого типа были измерены в различных буферах. Десятимикролитровые аликвоты 300 мМ буферов ацетата натрия при рН 3,5, 4,0, 4,5, 5,0, 5,25, 5,5, 5,75 и 6,25 были добавлены в каждую из восьми пробирок на 0,2 мл пробирочного стрипа ПЦР-типа. Четыре таких стрипа были приготовлены для каждого фермента (всего 8 стрипов) и помещены на ледяную баню. Ферменты были приготовлены в концентрации 0,12 мг/мл на воде, содержащей 0,005% TWEEN 80. Пятьдесят микролитров каждого фермента были расфасованы аликвотами по четырем пробирочным стрипам, накрыты крышками и кратковременно перемешаны на вортексе. Для каждого фермента три стрипа были помещены на предварительно нагретый до 85°С нагревательный блок (описано выше). Ровно через 30, 60 и 120 секунд один стрип, представляющий каждый фермент, был удален из блока и возвращен на лед. Активность, присутствующая во всех пробирках, была измерена, используя общее количество редуцирующих сахаров, высвобождаемых методом с использованием 5% амилопектина, описанного выше при 50°С, рН 5,8. Активность, присутствующая в пробирках, которые были подвергнуты нагреванию, была зафиксирована пропорционально активности, присутствующей в пробирках, которые оставались на льду. Хотя оба фермента в концентрации 0,1 мг/мл имели схожую стабильность/остаточную активность после инкубации при 85°С в буфере не более 2 минут при рН 5 или более высоких значениях, вариант LAT S239Q проявлял большую остаточную активность при более низких значениях рН (Фиг.3).
Остаточная активность в субстрате для варианта LAT S239Q и LAT дикого типа была измерена в точности, как описано выше за некоторыми исключениями: были приготовлены пять (5) пробирочных стрипов на фермент (в сумме 10). Сорок микролитров 7,5% амилопектина были смешаны с аликвотами буфера во всех пробирках. Были добавлены десять микролитров фермента в концентрации 0,6 мг/мл в воде, содержащей 0,005% TWEEN 80, размешаны во всех пробирках и помещены на ледяную баню. Пробирки были нагреты, как описано выше, за исключением того, что 4 пробирки на фермент находились при 85°С в течение 1,25, 2,5, 5, 10 минут. Вещество во всех пробирках было разведено 1:10 в 50 мМ ацетата натрия, рН 5,8 до количественного измерения активности с использованием количественного метода Bodipy согласно инструкциям фирмы производителя (Invitrogen). Подобно результатам, описанным выше, вариант LAT S239Q имел более высокую остаточную активность при более низких значениях рН при инкубации в 5% амилопектине, 0,1 мг/мл суммарного белка. Присутствие амилопектина, по-видимому, увеличивает стабильность/остаточную активность (Фиг.4).
Для сравнения рН-профилей между вариантом S239Q и LAT дикого типа 10 микролитров 300 мМ серии буфера, описанной выше, были внесены в каждую из 8 пробирок пробирочных стрипов ПЦР-типа. Сорок микролитров 7,5 % амилопектина были добавлены во все пробирки, кратковременно перемешаны и затем предварительно инкубированы при 85°С, как описано выше. Реакции были запущены добавлением 10 мкл 0,15 мг/мл фермента с незамедлительным кратковременным перемешиванием на вортексе. Реакции были остановлены по истечении 45 секунд, как описано выше. Все реакции были выполнены трижды. Общее количество редуцирующих сахаров было измерено методом DNS, как описано выше. Результаты показали, что вариант LAT S239Q, по-видимому, имеет большую активность при более низких рН<5,0 нежели LAT дикого типа (Фиг.5).
Была проведена оценка температурных профилей как варианта LAT S239Q, так и LAT дикого типа. Десять микролитров 250 мМ ацетата натрия, рН 5,8 были внесены во все шесть пробирок в пробирочный стрип ПЦР-типа на 0,2 мл. Были приготовлены двенадцать стрипов. Сорок микролитров 7,5% амилопектина были смешаны во всех пробирках. Градиентный нагревательный блок ПЦР-типа (Mastercycler Gradient, Eppendorf) был запрограммирован, чтобы приблизиться к температурному диапазону 45-99°С с нарастанием в 5°С. Ферменты были приготовлены в концентрации 0,15 мг/мл в 50 мМ ацетата натрия, рН 5,8; 200 мкл каждого фермента были внесены в 3 из 6 пробирок пробирочного стрипа на 0,2 мл для использования в качестве запаса фермента. Пробирки, содержащие смесь субстрата/буфера, были предварительно инкубированы при необходимой температуре в течение 1-2 минут. Ферментативные реакции были запущены путем добавления 10 мкл каждого фермента из запаса (в результате чего реакция повторялась трижды) и незамедлительного, кратковременного перемешивания. Реакции были остановлены по истечении 30 секунд, как описано выше. Суммарное количество присутствующих редуцирующих сахаров было измерено с использованием количественного анализа DNS, как было описано ранее. При попытках разграничить стабильность фермента и скорость реакции при различных температурах (при которых обнаруживается оптимум рН для стабильности, рН 5,8) был использован кратковременный период инкубации в 30 секунд. К сожалению, такие кратковременные инкубации могут приводить к более высокой дисперсии повторных данных, воспроизводимости. Реакции были выполнены трижды и стандартные отклонения показаны в виде планок погрешностей представленных данных (Фиг.6). Оба фермента практически являлись зеркальным отражением друг друга по их температурному профилю, вариант LAT S239Q, по-видимому, имел более высокую специфическую активность (хотя это, по-видимому, из-за того, что он был очищен и что ферменты были дозированы в равных белковых количествах). Представляет интерес значительное увеличение активности обоих ферментов при 90°С. Кроме того, вариант LAT S239Q, по-видимому, сохраняет большую относительную активность свыше 90°С нежели LAT дикого типа.
Пример 4 - Исследование измененных свойств: ДСК
Вариант S239Q и альфа-амилаза дикого типа (SEQ ID NO: 2 и 4 соответственно) были очищены из ферментативного бульона встряхиваемой колбы (смотри Пример 2), с использованием хроматографии на основе гидрофобного взаимодействия. Белок был элюирован из колонки в очищенной форме, используя 50 мМ MES, pH 6,8, содержащий 40% пропиленгликоль и 2 мМ CaCl2.
Кривая объемов избыточного тепла была оценена с помощью ультрачувствительного сканирующего высокомасштабного микрокалориметра, VP-Cap DSC (MicroCal, Inc., Northampton, MA). Стандартная процедура ДСК-измерений и теоретические основы данной методики были ранее опубликованы (Freire, E. (1995) Differential Scanning Calorimetry, Methods. Mol. Biol. 41, 191-218). Приблизительно 500 мкл 0,5 мг/мл LAT, LAT S239Q и SPEZYME® Fred (Genencor) были просканированы в диапазоне температур 30-125°С в присутствии хлорида кальция различных концентраций (0, 0,1, 0,15, 0,2, 0,5, 1 и 2 мМ). Затем тот же самый образец был повторно сканирован, чтобы проверить обратимость процесса. Для альфа-амилаз процесс термического развертывания был необратим. Используемым буфером был 10 мМ ацетат натрия, рН 5,5. Была использована скорость сканирования 200°С/ч для минимизации любых артефактов, связанных с агрегацией. Температура максимума тепловой денатурации (Tm) кривых ДСК была использована в качестве индикатора термостабильности.
Более того, были сравнены профили термического развертывания варианта LAT S239Q и LAT дикого типа в отсутствие кальция, в присутствии 2 мМ хлорида кальция и в присутствии 2 мМ акарбозы. Акарбоза, субстратный аналог альфа-амилазы, способна имитировать потенциальный стабилизирующий эффект связывания субстрата с альфа-амилазой. Таблица 2 показывает температурные точки плавления для исследованных белков амилазы.
Термическое развертывание для варианта S239Q в отсутствие и в присутствии 2 мМ хлорида кальция показывает значительное увеличение значений точек плавления для варианта при сравнении с таковыми для LAT дикого типа. В отсутствие добавленного хлорида кальция LAT имеет температурную точку плавления 90,1°С; значение Tm для варианта S239Q равно 109,1°С. Таким образом, замена S239Q приводит к увеличению Tmна 19°С.
В присутствии 2 мМ хлорида кальция LAT характеризуется температурной точкой плавления 102,1°С, в то время как Tmдля варианта S239Q равно 110,2°С. Таким образом, в присутствии 2 мМ хлорида кальция оба белка демонстрируют повышенные значения Tm. Повышение Tm для LAT и варианта S239Q было на 12°С и 1,1°С соответственно. Это означает, что стабильность варианта S239Q является менее зависимым от кальция.
В присутствии 2 мМ акарбозы охарактеризованная LAT имеет температурную точку плавления 95,2°С. Tm для S239Q равно 109,8°С. Таким образом, в присутствии 2 мМ акарбозы оба белка демонстрируют повышенные значения Tm, указывая на то, что акарбоза способна структурно стабилизировать альфа-амилазы. Повышение Tm для LAT и варианта S239Q было на 5,1°С и 0,7°С соответственно. Это предполагает, что термостабильность варианта S239Q менее подвержена влиянию присутствия акарбозы.
Это предполагает, что термодинамические свойства варианта S239Q отличаются от таковых LAT, и это согласуется с его улучшенными рабочими характеристиками в прикладных исследованиях (смотри Примеры 5-6). Изменения Tm и кривые связывания кальция указывают на то, что вариант LAT S239Q по существу термостабильнее LAT дикого типа, и его термостабильность менее зависима от кальция нежели таковая LAT дикого типа.
Пример 5 - Профили Активности
Этот пример показывает, что вариант S239Q (SEQ ID NO:2) имеет измененные профили активности относительно не только альфа-амилазы дикого типа (SEQ ID NO:4), но также промышленного стандарта SPEZYME® Fred (Genencor). Определения белка были выполнены на очищенных образцах или образцах в чашках Петри. Альфа-амилазы экспериментального варианта и дикого типа были дозированы в равных белковых концентрациях.
Либо с чашек Петри, либо очищенные варианты были разведены приблизительно до 20 частей на миллион, используя буфер яблочной кислоты, рН 5,6. Субстрат состоял из 15% кукурузного крахмала в том же 50 мМ буфере яблочной кислоты, рН 5,6. Четыреста микролитров крахмальной суспензии было уравновешено при 70°С за 2,5 минуты. Затем 7 мкл разведенного фермента были мгновенно добавлены в уравновешенный крахмал (конечная концентрация белка приблизительно 0,36 частей на миллион). Реакционная смесь была затем помещена в предварительно нагретый до 85°С вибрирующий нагревательный блок и размешена при 300 оборотах в минуту. При заранее заданных временных интервалах реакции были прерваны 50 мкл 125 мМ NaOH. Реакционные пробирки затем были откручены, и супернатант был разведен в 10 раз в 10 мМ NaOH для анализа DP-профиля с помощью HPAEC-PAD, который является чувствительным методом для разделения и количественного анализа полимеров сахаров с градацией размеров величиной приблизительно DP1-DP40.
Реакции были проведены за 4, 10 и 20 минут. Суммарная площадь пика от DP2 до конца запуска HPLC была интегрирована, и площадь была поделена на суммарный белок и время реакции для получения значения, представляющего относительную активность в условных единицах.
4-х минутная реакция предоставляет информацию о том, как быстро фермент начинает расщеплять субстрат; 10-ти минутная реакция предоставляет информацию о ферментативной термической активности и 20-ти минутная реакция предоставляет информацию о ферментативной термоустойчивости. Результаты представлены в Таблице 3.
Пример 6 - Разжижение в пароструйном варочном аппарате
Значение рН крахмальной суспензии с 35% содержанием DC было доведено до величины 5,8 с помощью 20% раствора карбоната натрия. Диоксид серы был добавлен в концентрации 100 частей на миллион без кальция. Суспензия была нагрета до 70°С (158°F), используя воду и водяной пар в снабженном рубашкой котле. Ферменты разжижения, вариант LAT S239Q (SEQ ID NO: 2) и SPEZYME® Fred (Genencor), были добавлены к суспензии для достижения 10 LUs/г DS. Смесь была нагрета до 85°С (185°F) приблизительно в течение 10 минут. После дополнительных 10 минут инкубации при 85°С суспензия была пропущена через пароструйный варочный аппарат, установленный на 108,4°С с 3-х минутным временем поддержания, используя паровое сопло большой экспериментальной установки (оборудованной М103 водонагревателем из Гидротермальной Корпорации, Вокеша, Висконсин). Разжиженный крахмал был собран из парового сопла и помещен на 85°С водяную баню. Вторая доза фермента разжижения была добавлена вне парового сопла. Разжиженный крахмал постоянно перемешивали и держали при температуре 95°С в течение 120 минут. Образцы были собраны на 0, 30, 60, 90 и 120 минуте. Все образцы были протестированы вне парового сопла на DE и вязкость. DE был проверен методом Schoorls (метод предоставляется по запросу).
Наклон нарастания DE для варианта LAT S239Q был сопоставим с Fred, который является промышленным стандартным ферментом, который в значительной степени термостабильнее LAT дикого типа. Температура настольного варочного аппарата была повышена до 115°С для изучения термостабильности варианта LAT S239Q и Fred. Нарастание DE было снижено для Fred и варианта LAT S239Q в сходных пропорциях (50% для Fred и 66% для варианта LAT S239Q, основываясь на времени достижения 10 DE), указывая на сравнимую с Fred термостабильность. Смотри Фиг.7.
Образование DE варианта LAT S239Q было сравнено с Fred с помощью настольного варочного аппарата при различных значениях рН величиной 5,8, 5,5 и 5,2. Никаких различий в нарастании DE для вышеперечисленных значений рН не наблюдали между LAT S239Q и Fred, подтверждая одинаковые стабильности при более низких значениях рН. Смотри Фиг.8.
Чтобы измерить эффект концентрации кальция в крахмальной суспензии, образование DE для LAT S239Q было сравнено с Fred с помощью настольного варочного аппарата при рН 5,6. Использованная крахмальная суспензия была отмыта трижды при рН 3,0 для уменьшения содержания кальция и натрия, и значение рН было доведено до величины 5,6 для исследования. Приблизительно 90% свободного кальция было удалено с помощью этой процедуры отмывки, обеспечивающей уровни свободного кальция величиной приблизительно 3 части на миллион. Результаты, как показано на Фиг.9, указывают на то, что вариант LAT S239Q является по сути таким же, как и Fred при допустимой низкой концентрации кальция и более низком рН (5,6) (условиях, которые были бы губительными для работы LAT дикого типа (данные не показаны)).
Реферат
Изобретение относится к области биотехнологии. Описан вариант альфа-амилазы Bacillus licheniformis, имеющий аминокислотную последовательность, которая по меньшей мере на 90% идентична последовательности SEQ ID NO: 4 и включает замену S239Q, соответствующую SEQ ID NO:4, содержащейся в описании. Представлены: нуклеиновая кислота, кодирующая указанный вариант; экспрессионный вектор, содержащий указанную нуклеиновую кислоту; и клетка-хозяин, содержащая указанные вектор или нуклеиновую кислоту. Описаны композиции, содержащие альфа-амилазу по настоящему изобретению и применяющиеся для разжижения крахмала, осахаривания крахмала, переработки крахмала, расшлихтовки текстильного изделия, выпекания, а также детергентные моющие композиция и добавка. Предложен способ получения этанола, включающий стадии: а) применение композиции для разжижения крахмала по отношению к молотой кукурузе или крахмальной суспензии; b) осахаривание крахмала; с) брожение осахаренного крахмала; d) получение этанола. Изобретение позволяет получить композиции, содержащие альфа-амилазу, имеющую повышенную термостабильность и температуру плавления. 20 н. и 23 з.п. ф-лы, 3 табл., 9 ил., 6 пр.
Формула
a) применение композиции по п.15 по отношению к молотой кукурузе или крахмальной суспензии в течение времени, достаточного для разжижения указанного крахмала;
b) осахаривание крахмала;
c) брожение осахаренного крахмала;
d) получение этанола.

Комментарии